Беременность и аневризма: Беременность, роды и послеродовый период у женщин с артериальными аневризмами головного мозга
Министерство здравоохранения Республики Татарстан
12 января 2018 г., пятница
Жительница Казани Гульнара Абдуллина с супругом в течение нескольких лет мечтали родить второго ребенка. В какой-то момент женщина перенесла инсульт, потом тяжелую операцию, после которой врачи сообщили страшную новость: беременность отныне Гульнаре противопоказана. Однако спустя девять месяцев в семье Абдуллиных родилась абсолютно здоровая дочь. На вопрос, как это возможно, мама малышки спокойно отвечает: «Чудо и замечательная работа врачей».
«Мне долго не удавалось забеременеть, а тут вдруг — пять недель», — вспоминает Гульнара Абдуллина.
Женщина не могла забеременеть в течение шести лет. По всем медицинским показателям Гульнара была здорова, но стать родителями желанного малыша у Абдуллиных никак не получалось.
Вдруг весной 2016 года 36-летняя Гульнара Абдуллина переносит ишемический инсульт.
«Началось все с того, что левый глаз перестал видеть, начались помутнения в глазах. Я обратилась к глазному врачу, меня направили к нейрохирургу. Пришла к неврологу, сделала МРТ головного мозга. Выяснилось, что у меня большая, даже гигантская аневризма головного мозга, которая и вызвала инсульт. После этого направили в МКДЦ. И уже 6 мая прооперировали», — рассказывает женщина.
Я обратилась к глазному врачу, меня направили к нейрохирургу. Пришла к неврологу, сделала МРТ головного мозга. Выяснилось, что у меня большая, даже гигантская аневризма головного мозга, которая и вызвала инсульт. После этого направили в МКДЦ. И уже 6 мая прооперировали», — рассказывает женщина.
Аневризма сосудов головного мозга — это небольшое образование на мозговом кровеносном сосуде, которое быстро увеличивается в размерах и наполняется кровью. По словам врачей, самое опасное — это разрыв аневризмы, в результате которого происходит кровоизлияние в мозг. Аневризма сосудов может возникнуть в любой области головного мозга.
«Операция шла полтора часа, неделю где-то пролежала в больнице, и меня отпустили домой. В июне все пошло своим чередом, а в июле узнала, что беременна — пять недель. Пришла в женскую консультацию № 3, оттуда меня направили на консилиум врачей другой казанской больницы», — делится Гульнара.
По словам врачей, аневризма, которую обнаружили у Гульнары, была не просто большая — она имела критические размеры. И, как заметила заведующая женской консультацией № 3 Казани Луиза Шайхутдинова, историй беременности при столь большой аневризме она еще не встречала.
И, как заметила заведующая женской консультацией № 3 Казани Луиза Шайхутдинова, историй беременности при столь большой аневризме она еще не встречала.
«У меня практика уже 22 года. Ни разу такого случая не было, ни разу женщины с такой большой аневризмой после операции у меня не было. В принципе эта беременность была очень рискованной, она представляла большой риск для плода и здоровья женщины. По всем указам Минздрава, по всему здравому смыслу беременеть и вынашивать ребенка было противопоказано. Беременность положено было прервать», — объясняет Луиза Шайхутдинова.
Однако на врачебном консилиуме Гульнара, выслушав все предостережения и рекомендации медиков о прерывании беременности, написала отказ от аборта.
«Мы беседовали с ней. Я даже мужа вызывала. Говорила об ответственности, предупреждала, что беременность может стоить ей жизни. Женщина говорила, что Бог ей поможет, повторяла, что ей нужен второй ребенок и что она ждала этой беременности шесть лет. Она извинялась, говорила: “Делайте что хотите, но я буду рожать”. Еженедельно вызывали ее, общались с ней, даже с родителями ее беседовали», — рассказывает врач.
Еженедельно вызывали ее, общались с ней, даже с родителями ее беседовали», — рассказывает врач.
Неожиданную беременность врачи объясняют психологическим состоянием Гульнары в послеоперационный период.
«Она настойчиво старалась забеременеть. Здесь, видимо, организм пережил стресс, пациентка отвлеклась от проблемы. Это действительно уникальный случай, это — чудо. Благодаря большому желанию беременной и благодаря тому, что наша медицина на таком высоком уровне находится, что способна помочь женщине», — отмечает Луиза Шайхутдинова.
Прежде чем взяться за ведение столь рискованной беременности, заведующая консультацией определила тактику ведения пациентки с главными специалистами Городской клинической больницы № 7, РКБ, Минздрава РТ и МКДЦ.
«Все принимали участие. Конечно, я понимала, что если бы с ней что-то случилось, я бы на этом месте уже не сидела. Мне бы сказали, что я не умею работать, что я не смогла убедить. Она смотрела на меня и говорила: “Я все это понимала, но аборт делать не буду”. Это было по-человечески неправильно», — делится завконсультацией.
Это было по-человечески неправильно», — делится завконсультацией.
До второй беременности Гульнара работала преподавателем в Казанском государственном энергетическом университете. Первым делом врачи запретили женщине работать, отправив ее на больничный, а дальше начались постоянные обследования.
«И в МКДЦ меня в итоге поддержали. Я вообще очень благодарна врачам — меня отправили на больничный. Постоянно осматривали. Во время беременности постоянно нейрохирург проводил обследования, делали МРТ головного мозга. Ухудшений состояния не было», — рассказывает Гульнара Абдуллина.
Женщина признается, во время беременности страх присутствовал, но родные и близкие не переставали поддерживать.
«Старалась не читать лишний раз ничего о родах в моем положении, старалась не пугать себя. Я очень хотела родить, родить здорового малыша. Родные поддерживали всячески, говорили рожать. Как говорится, если Бог дал ребенка, которого мы не ждали, значит, и родить сможем. Врачи, конечно, всячески отговаривали, боялись очень.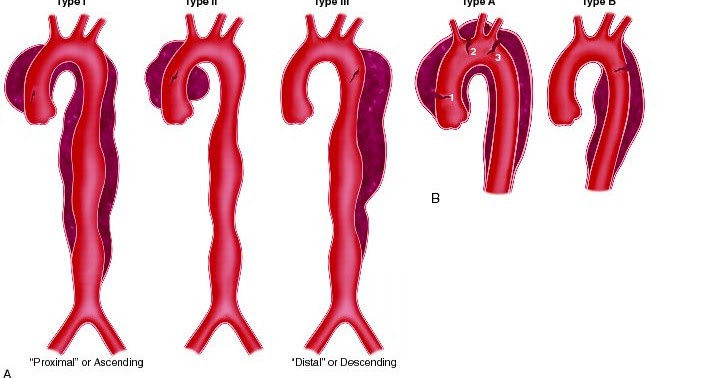 Помню, повторяли, что можно потерять не только ребенка, но и меня. Да, все я понимала», — вздыхает Гульнара Абдуллина.
Помню, повторяли, что можно потерять не только ребенка, но и меня. Да, все я понимала», — вздыхает Гульнара Абдуллина.
По словам заведующей консультацией, за 38 недель — столько длилась вторая беременность Гульнары — врачи провели полное клинико-лабораторное и инструментальное обследование.
В этом году в феврале маленькой дочке Абдуллиных исполнится год. Девочка абсолютно здорова, ее мама идет на поправку, аневризма стремительно уменьшается.
Историю беременности Гульнары Абдуллиной представят на главном медицинском конкурсе Татарстана — «Врач года — Ак чэчэклэр» в номинации «Уникальный случай».
ИА «Татар-информ»
Поделиться:
ЧИТАТЬ ВСЕ НОВОСТИ
Расслаивающая аневризма аорты и беременность » Акушерство и Гинекология
Цель исследования. Ознакомить практических врачей с диагностикой и тактикой лечения пациенток с расслаивающейся аневризмой аорты во время беременности, родов и в послеродовом периоде.
Материал и методы. Проведен анализ двух клинических случаев расслаивающейся аневризмы аорты во время беременности, родов, в послеродовом периоде.
Результаты. В статье проведен анализ двух клинических случаев расслаивающей аневризмы аорты у беременных и родильниц, один из которых закончился трагично. Рассмотрена актуальность проблемы у беременных: частота встречаемости – 0,6%, из них 4,5–6% случаев приходится на синдром Марфана, и 20% – на синдром Лойе–Дитца. При ургентности развития выживаемость не превышает 9–13%. Этапность наблюдения во время беременности согласно действующему приказу
№ 572-н и клиническим рекомендациям в специализированных лечебно-профилактических учреждениях поможет предотвратить материнскую смертность. Даны рекомендации по диагностике, тактике ведения и лечения.
Заключение. Этапность обследования и ведения больных с сердечно-сосудистыми заболеваниями (в данном случае в контексте соединительно-тканных синдромов), причем в специализированных лечебно-профилактических учреждениях, являются залогом успешного ведения и предотвращения фатальных исходов.
Сочетание аневризмы аорты и беременности представляет собой серьезную проблему в виду редкой встречаемости, низкой выявляемости, бессимптомности течения, а в случае развития витальных осложнений – низкой выживаемости. Данных о расслаивающей аневризме аорты (РАА) у беременных крайне мало ввиду редкости и разрозненности случаев.
Наиболее частый механизм РАА – непрерывное поступление крови через поврежденную интиму между слоями стенки аорты.
Частота встречаемости в общей популяции 1 на 10 000 госпитализированных больных, в 1 случае на 400 аутопсий, у 1 из 100 умирающих внезапно и в 3–4% случаев внезапных смертей от сердечно-сосудистых заболеваний. Бессимптомность течения РАА достигает 75%, смертность – 67%, выживаемость не превышает 9–13% [1]. Частота РАА аорты при беременности составляет 4,5–6% случаев при синдроме Марфана1 и до 20% – при синдроме Лойе–Дитца2 [2].
По клиническому течению различают острую РАА (больные погибают в течение нескольких часов/дней, а диагноз ставится в течение 2 недель с момента появления жалоб), подострую (больные остаются в живых без лечения в течение 2 недель с момента появления жалоб) и хроническую (больные живы в течение 2–8 недель и более).
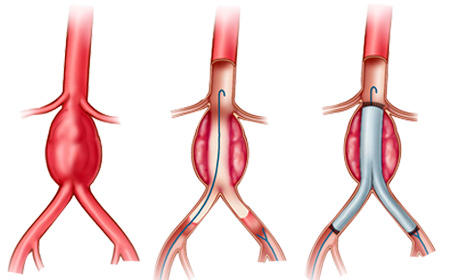
В соответствии с анатомическим расположением РАА имеется две классификации: 1) Де Бейки и 2) Стэнфорда (рисунок). Классификация Де Бейки подразделяет расслоение на три типа: тип I – местом возникновения разрыва является восходящая аорта, а расслоение распространяется на дугу и часто дистальнее – на грудной и брюшной отделы аорты; тип II – разрыв локализуется в восходящей части, расслоение ограничено только восходящей аортой; тип III – разрыв интимы локализуется в нисходящей грудной аорте, распространяется чаще антеградно дистально, по нисходящей аорте на различном протяжении с вовлечением или только всего грудного отдела и/или и грудного, и брюшного отделов и редко – ретроградно на дугу и восходящую аорту.
В классификации Стэнфорда выделяют тип А – характеризуется вовлечением восходящей аорты (включает тип I и II в классификации Де Бейки) и тип В-дистальный или нисходящий (соответствует типу III Де Бейки). Многочисленные попытки дополнительно разделить обе классификации на подтипы не увенчались успехом.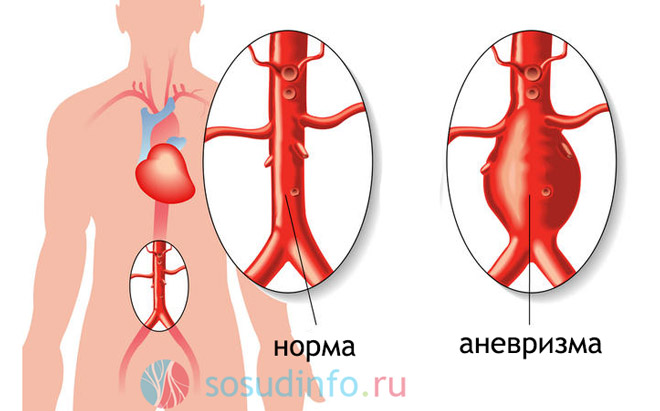
По патофизиологии РАА может протекать с отслоением интимы, с формированием гематомы без разрыва интимы, с разрывом интимы без гематомы, с формированием язвы и др.
Причинами, приводящими к развитию РАА могут быть: врожденные нарушения синтеза и деградации соединительной ткани (синдром Марфана, синдром Эллерса–Данлоса3, Лойе–Дитца), врожденные пороки сердца (двустворчатый клапан), коарктация аорты, синдром Тернера, гигантоклеточный аортит, а также приобретенные заболевания аорты (аортиты, атеросклероз аорты в сочетании с гипертонической болезнью, закрытая травма груди, курение) и др. Риск разрыва аневризмы аорты зависит от размеров аневризматического мешка и увеличивается в 11 раз при увеличении сечения аорты в поперечнике на 1 см [1].
РАА может быть представлена изолированным дефектом, а может быть проявлением генерализованного синдрома (например, Марфана, Эллерса–Данлоса, Лойе–Дитца). Также встречаются семейные случаи РАА. В основе РАА могут лежать различные мутации генов, кодирующие синтез фибриллина (fibrillin-1), коллагена 3-го типа (Col3a1), протеинов, включенных в сигнальный путь – трансформирующего фактора роста-β (TGFβ), белка SMAD3 или протеинов, включенных в синтез контрактильного аппарата гладкомышечных клеток аорты – актина (ACTA2), MYh21 [3].
Из всех случаев РАА 0,6% приходится на беременных. Из них на долю синдрома Марфана (дефектный ген фибриллина) приходится 4–7%, а на синдром Лойе–Дитца (мутация гена ACTA2 – 20%) [2].
Из клинических особенностей следует отметить бессимптомность течения, пока не развивается осложнение, подчас фатальное, когда возникает молниеносный ярко выраженный болевой синдром, клиническая картина которого зависит от уровня локализации аневризмы. Однако специфики ни по характеру, ни по локализации и иррадиации боли при РАА болевой синдром не имеет. Боли могут симулировать дорзалгии, острые ишемические атаки при заболевании сердца и сосудов с иррадиацией в конечность, шею, лопатку и др. При типе А больные жалуются на боль в груди (22%), при типе В – в спине и животе (43%). Также характерны обмороки – 13% [4].
Именно на этом этапе постановка диагноза острой РАА и его дифференциация крайне важны, так как терапия ангинозного приступа – антикоагулянты, антиагреганты, а иногда и фибринолитические средства – строго противопоказаны при острой РАА [4].
Для РАА характерна хронобиологическая модель. Среди 957 пациентов, острая РАА произошла с 6:00 утра до 12:00 дня с пиком возникновения между 8:00 утра и 9:00 утра. В зимние месяцы с октября по январь частота РАА была выше [5, 6].
Имеется зависимость и от возраста пациента. Чем моложе пациент, тем более проксимальней (тип А) будет вероятный уровень локализации РАА (синус Вальсальвы, синотубулярное соединение). У молодых пациентов нет взаимосвязи с артериальной гипертензией (36%), в то время как сочетании РАА с артериальной гипертензией (≥150/90 мм рт. ст) у пожилых больных достигает 70% случаев [7, 8].
Различна и аускультативная картина: пациенты с типом А наиболее часто (в 44% случаев) будут иметь диастолический шум вследствие аортальной недостаточности (наличие двустворчатого клапана), чем пациенты пожилого возраста с типом В (12%) [9, 10].
Если для диагностики РАА брюшного отдела в ряде случаев достаточно ограничиться эхокардиографией (ЭхоКГ), то диагностика РАА грудного отдела крайне трудна.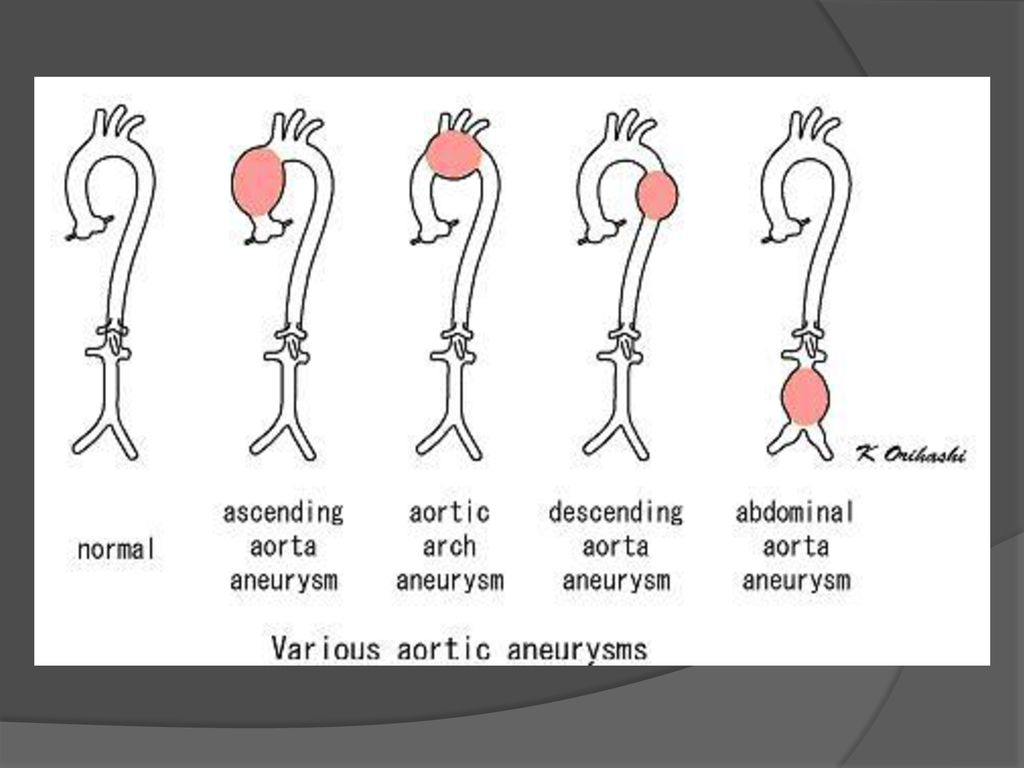
ЭКГ характеристики неспецифичны и могут симулировать острый коронарный синдром, девиации ST-T сегмента неспецифичны. Получение ЭхоКГ- картины может быть затруднено из-за отражающих сигналов костных структур грудной клетки.
Рентгенография в 10–15% случаев может показывать нормальную картину, а в 85% случаев – неспецифичные изменения: расширение тени средостения, деформация аорты, неспецифические изменения плевры. Поэтому рентгенография грудной клетки может служить лишь обоснованием к исследованию для более точной визуализации аорты или отменить это обоснование (уровень доказательности 1C) [11].
Латентность течения, необходимость специальных методов визуализации, ургентность и трагизм манифестации РАА обуславливает серьезную проблему. Беременность сама по себе может представлять серьезный риск для РАА. Этому способствует увеличение объема циркулирующей крови, ударного объема, сердечного индекса, частоты сердечных сокращений, повышение артериального давления (АД), что на фоне генетических изменений (предрасположенности), является провоцирующими факторами к развитию РАА.
В связи с актуальностью проблемы представляем два клинических случая. Обе пациентки – жительницы Москвы, не наблюдались в клинико-диагностическом центре при профилированном по сердечно-сосудистым заболеваниям родильном доме (ГКБ № 15) и поступили, когда уже трагедию нельзя было предотвратить.
Беременная Ф., 23 года, поступила в родильный дом по наряду скорой медицинской помощи с диагнозом: Беременность 37–38 недель. Тазовое предлежание. Дорзопатия грудного отдела позвоночника. Врожденный порок сердца: Открытый артериальный проток. Хирургическая коррекция в 1990 году. Псориаз в стадии ремиссии. Варикозная болезнь. Миопия слабой степени.
Из анамнеза: смерть матери в возрасте 38 лет от РАА.
Жалобы при поступлении: на боли в подлопаточной области больше слева, что и послужило основанием постановки направляющего диагноза дорзопатии.
Объективно по органам и системам без особенностей: состояние удовлетворительное, сознание ясное, положение активное. Правильного телосложения, нормального питания. Рост 170 см, вес 71 кг. Прибавка за беременность – 14 кг равномерно. Кожа и видимые слизистые обычной окраски, отеков нет. Дыхание через нос свободное, при перкуссии – ясный легочный звук, при аускультации – дыхание везикулярное, хрипов нет. Перкуторно – границы сердца в пределах нормы, при аускультации – сердечные тоны ясные, ритмичные, 80 уд. в минуту, шумов нет. Пульс ритмичный, одинаковый на обеих руках, удовлетворительных качеств; АД 110/70 мм рт. ст.; по другим органам и системам – без особенностей.
Рост 170 см, вес 71 кг. Прибавка за беременность – 14 кг равномерно. Кожа и видимые слизистые обычной окраски, отеков нет. Дыхание через нос свободное, при перкуссии – ясный легочный звук, при аускультации – дыхание везикулярное, хрипов нет. Перкуторно – границы сердца в пределах нормы, при аускультации – сердечные тоны ясные, ритмичные, 80 уд. в минуту, шумов нет. Пульс ритмичный, одинаковый на обеих руках, удовлетворительных качеств; АД 110/70 мм рт. ст.; по другим органам и системам – без особенностей.
Наружный акушерский осмотр: матка овоидной формы, в нормотонусе, безболезненная, шевеление плода ощущает хорошо. Окружность живота 91 см, высота дна матки 35 см. Положение плода продольное, предлежит тазовый конец, прижат ко входу в малый таз. Сердцебиение плода в области пупка, ясное, ритмичное, частота сердечных сокращений 140 в минуту.
При влагалищном исследовании: наружные половые органы и влагалище без особенностей. Шейка матки несколько кзади, длиной 1,5 см, цервикальный канал проходим для 1 пальца. Плодный пузырь цел. Предлежит тазовый конец, прижат ко входу в малый таз. Мыс не достижим, экзостозов в малом тазу нет. Выделения слизистые.
Плодный пузырь цел. Предлежит тазовый конец, прижат ко входу в малый таз. Мыс не достижим, экзостозов в малом тазу нет. Выделения слизистые.
Через 1 час от момента поступления в приемный покой родильного дома произошла потеря сознание, падение АД до 50/0 мм рт. ст. с развитием терминального состояния, комой 4, развитием дыхания Чейн–Стокса.
С подозрением на тромбоэмболию легочной артерии, острый инфаркт миокарда беременная интубирована, начато дыхание через мешок АМБУ, непрямой массаж сердца. Одновременно с комплексом реанимационных мероприятий беременная транспортирована в операционную, где при искусственной вентиляции легких аппаратом Drager Fabius Fio2 100% МОД 9л и сатурации кислорода, на фоне инфузионной и инотропной терапии катехоламинами произведена пункция и катетеризация правой подключичной артерии и, учитывая наличие живого плода при сроке беременности 37–38 недель – экстренная нижне-срединная лапаротомия, кесарево сечение. На первой минуте извлечена живая доношенная девочка с оценкой по Апгар 1–4 балла, весом 2830 г, длиной 52 см.
На 7-й минуте после извлечения плода у роженицы развилась стойкая брадикардия с последующей асистолией, которая после непрямого массажа сердца переведена в крупноволновую фибрилляцию. Неоднократные дефибрилляции 100–200–300–300 кДЖ приводили лишь к кратковременным восстановлениям синусового ритма длительностью не более 1–1,5 мин. Одновременно (учитывая данные рентгенографии грудной клетки с диагностированным гемопневмотораксом), аппаратом Cell Saver Hemonetic 5 было эвакуировано 1500 мл аутокрови и возвращено 800 мл с гемотокритом 60% с последующей трансфузией свежезамороженной плазмы из расчета 20 мл/кг. Однако реанимационные мероприятия в течение 105 мин не привели к ожидаемым результатам – констатирована биологическая смерть.
На вскрытии – расслаивающая аневризма дуги аорты, грудного отдела с разрывом в средней трети аорты (фокусы миксоматоза и медианекроза стенки аорты). Диагноз подтвержден морфологически.
Беременная Г., 34 года, поступила в родильный дом с диагнозом: Беременность 38 недель. Головное предлежание. I период родов. Пролапс митрального клапана II ст., митральная регургитация II ст., пролапс трикуспидального плана I ст., трикуспидальная регургитация I ст., аортальная регургитация I ст., расширение синуса Вальсальвы в сроке 7 недель впервые выявленное. Кифосколиоз III–IV степени. Воронкообразная грудная клетка. Синдром Марфана?
Головное предлежание. I период родов. Пролапс митрального клапана II ст., митральная регургитация II ст., пролапс трикуспидального плана I ст., трикуспидальная регургитация I ст., аортальная регургитация I ст., расширение синуса Вальсальвы в сроке 7 недель впервые выявленное. Кифосколиоз III–IV степени. Воронкообразная грудная клетка. Синдром Марфана?
Через 4 часа от начала развития регулярной родовой деятельности и через 1 час от момента поступления в родильный дом излились светлые околоплодные воды и родилась живая доношенная девочка весом 3870 г, длиной 54 см с оценкой по Апгар 8–9 баллов. I период родов составил 6 ч 00 мин, II период – 30 мин, III – 10 мин.
Учитывая нахождение пациентки с подозрением на синдром Марфана в специализированном родильном доме, указание на расширение синуса Вальсальвы во время данной беременности, наличие грубого систолического шума во всех точках аускультации и особенно вдоль левого края грудины, в сочетании с ассиметричной артериальной перфузией верхних конечностей (АД 120/80 и 100/60 мм рт. ст.), а также для уточнения состояния сердца, клапанного аппарата и крупных сосудов, решено было выполнить дообследование родильницы в объеме: ЭКГ, ЭхоКГ, компьютерная томография (КТ), консультация кардиолога.
ст.), а также для уточнения состояния сердца, клапанного аппарата и крупных сосудов, решено было выполнить дообследование родильницы в объеме: ЭКГ, ЭхоКГ, компьютерная томография (КТ), консультация кардиолога.
При ЭхоКГ – в просвете аорты визуализировалась гиперэхогенная линейная структура (отслойка от сино-тубулярного гребня до левой подключичной артерии): Расслаивающая аневризма восходящего отдела аорты. Аортальная недостаточность II–III степени.
При мультиспиральной КТ сосудов аорты от корня до бифуркации на подвздошные артерии в режиме ThorAngio с болюсным введением неионного рентгеноконтрастного препарата от аортального клапана с переходом на дугу, правый плечеголовной ствол и правую подключичную артерию верифицирована расслаивающая аневризма восходящего отдела аорты (аневризматическое расширение корня аорты до 6,5 см) в виде симптома «двойного» контура (тип Дебейки II) без признаков разрыва и затеков контрастного вещества.
Учитывая данные инструментальных методов визуализации, на 1-е сутки после родов в экстренном порядке в условиях искусственного кровообращения и ФХКН выполнена срединная стернотомия, линейное протезирование восходящей аорты с переходом на дугу. При гистологическом исследовании: интима аорты с признаками расслоения без тромботических наложений, на адвентиции – мелкоточечные кровоизлияния, мелкие продольные дефекты стенки.
При гистологическом исследовании: интима аорты с признаками расслоения без тромботических наложений, на адвентиции – мелкоточечные кровоизлияния, мелкие продольные дефекты стенки.
Послеоперационный и послеродовый период протекал без осложнений. Больная выписана в удовлетворительном состоянии на 15-е сутки после II своевременных самопроизвольных родов в затылочном предлежании и на 14-е сутки после стернотомии, линейного протезирования восходящей аорты с переходом на дугу.
Обсуждение
Первая пациентка имела врожденный порок сердца с хирургической коррекцией в детстве и смерть близкого родственника в возрасте 38 лет от РАА. Вторая пациентка имела множественную патологию клапанного аппарата сердца, расширение синуса Вальсальвы на фоне синдрома соединительно-тканной дисплазии (синдром Марфана).
Согласно приказу 572-н от 01.11.2012 г., обеим пациенткам было показано дообследование в сроке до 10–12 недель беременности в специализированном лечебно-профилактическом учреждении, имеющем лицензию на осуществление медицинской деятельности, включая работы (услуги) по «сердечно-сосудистой хирургии» и/или «кардиологии» и «акушерству и гинекологии», с целью решения вопроса о рисках, связанных с пролонгированием беременности [12].
Оперированный в детстве врожденный порок сердца и семейный случай РАА у первой больной являются самостоятельными показаниями к ЭхоКГ [11]. Кроме того, указание на смерть близкого родственника от РАА относится к критерию высокого риска развития РАА и требует обязательного ЭхоКГ – скрининга для выявления семейных случаев аневризм и РАА (уровень доказательности IB) [11].
Наличие синдрома Марфана (или подозрение) во втором случае, также относится к факторам высокого риска развития РАА (уровень доказательности IB) [11], а поэтому является обязательным показанием к ЭхоКГ-скринингу (каждые 6 месяцев), что также выполнено не было.
Кроме того, во втором случае в сроке 16 недель диаметр аорты уже составлял 5,5 см, что на данном сроке беременности являлось показанием к профилактической хирургической коррекции, не говоря уже об обязательном динамическом ЭхоКГ-контроле каждые 1–3 месяца (уровень доказательности IIa) [11].
Согласно Приказу 572-н обе пациентки должны были быть повторно обследованы в сроке 18–22 недели в профилированных учреждениях для уточнения функционального состояния сердечно-сосудистой системы, подбора (коррекции) медикаментозной терапии, оценки состояния плода, а в сроке 27–32 недели – способе и сроках родоразрешения [12].
Первая пациентка не была госпитализирована в специализированную клинику ни во II, ни в III триместре, а была госпитализирована в сроке 35–36 недель беременности в обычный родильный дом с «угрозой прерывания», почему и не была проведена оценка функционального состояния сердечно-сосудистой системы, не была назначена патогенетическая терапия (β-блокаторы). Наличие изменений на ЭКГ в виде резкого отклонения электрической оси сердца, гипертрофии левого желудочка у пациентки 23 лет, блокады передней ветви левой ножки пучка Гиса, не натолкнуло персонал на мысль о расширении спектра обследования и назначении патогенетической терапии β-блокаторами, что и привело к неблагоприятному исходу. Вместе с тем, именно снижение систолического АД до 100–120 мм рт. ст. при сохранении достаточной перфузии – основная цель использования β-блокаторов и вазодилататоров при консервативном лечении аневризм аорты.
Кроме того, в связи с угрозой прерывания в сроке 35–36 недель беременности пациентке были назначены β-адреномиметики, что является абсолютным противопоказанием к их использованию у больных с аневризмами аорты и тем более грудного отдела [11].
Отдельным является вопрос о целесообразности назначения β-адреномиметиков при угрозе преждевременных родов как у беременных, не отягощенных по сердечно-сосудистым заболеваниям, так и тем более у больных с аневризмой аорты. В настоящее время, согласно приказу 572-н, препаратом первой линии при угрозе преждевременных родов является антагонист Са2+ (нифедепин), а использование β-адреномиметиков возможно лишь при непереносимости нифедепина или письменном отказе пациентки использовать данный препарат [12].
Примечательно, что американское общество кардиологов также при наличии противопоказаний к использованию β-блокаторов (брадикардия, астма и др.) рекомендует использование антагонистов Са2+ пациентам при РАА (уровень доказательности IC) [11].
Какие же методы визуализации могут быть использованы у беременных? Методом скрининга является ЭхоКГ. Однако ЭхоКГ-диагностика аневризмы грудного отдела аорты может быть затруднена из-за высокой частоты артефактов, которые могут симулировать расслоение интимы. Тем не менее, метод является первым в диагностике заболевания сердца и аорты, которые могут лежать в основе развития РАА (синдром Марфана, двустворчатый аортальный клапан и др.) (уровень доказательности 1C) [11].
Тем не менее, метод является первым в диагностике заболевания сердца и аорты, которые могут лежать в основе развития РАА (синдром Марфана, двустворчатый аортальный клапан и др.) (уровень доказательности 1C) [11].
Такие методы исследования, как аортография, магнитно-резонансная томография (МРТ), КТ и чрезпищеводная ЭхоКГ могут попеременно обеспечить информацией относительно уровня расположения, степени расслоения и ее классификации, наличия или отсутствия окружающих кровоизлияний [4].
Спиральная КТ – наиболее информативный (чувствительность 97%, специфичность 100%) и наиболее часто используемый метод верификации диагноза РРА [13].
Частота использования чрезпищеводной ЭхоКГ составляет 33% и ограничена наличием аневризмы грудного отдела аорты, за исключением проксимальных и дистальных ее отделов (вследствие расположения трахеи и бронхов). Кроме того, этот метод требует седации и может вызвать приступы брадиаритмии и подъемы АД. Тем не менее, процедура является полуинвазивной, может быть выполнена у нетранспортабельных больных на месте и может быть методом выбора по сравнению с трансторакальной ЭхоКГ при аневризме грудного отдела. Чувствительность метода у пациентов с острой РАА типа А составляет 90%, снижаясь при типе В до 80% [13].
Чувствительность метода у пациентов с острой РАА типа А составляет 90%, снижаясь при типе В до 80% [13].
Частота использования аортографии и МРТ составляет 22 и 19% соответственно. Специфика исследования затрудняет диагностику в ургентных случаях вследствие длительности получения изображения, когда больной недоступен для медицинских работников, а также является противопоказанием при почечной недостаточности. Использование МРТ ограничено имплантируемыми устройствами у пациентов, клипированием аневризмы в анамнезе, наличием других металлических имплантов, а также при клаустрофобии. Тем не менее, МРТ имеет преимущества для диагностики РАА типа А и В, а также интрамуральных гематом и пенетрирующих аневризм аорты [11, 13].
В связи с перечисленным на первом этапе для диагностики РАА должен быть использован ЭхоКГ-скрининг и рентгенография органов грудной клетки, которые в сочетании могут обосновать показания к назначению более инвазивных методов, среди которых спиральная КТ и МРТ являются ведущими.
Выводы
- Наследственные соединительно-тканные синдромы сложны для выявления, поэтому ЭхоКГ – обязательный метод скрининга у всех беременных, имеющих указания на любую сердечно-сосудистую патологию (в том числе в анамнезе), а также имеющих указания на смерть близких родственников от сердечно-сосудистой патологии.
- При выявлении любой патологии сердца и сосудов беременная должна быть направлена для обследования и дальнейшего ведения в лечебно-профилактическое учреждение, имеющее лицензию по профилю «сердечно-сосудистая хирургия» и «акушерство – гинекология».
- Беременным с синдромом Марфана показан ЭхоКГ-скрининг каждые 6 месяцев. Наличие расширения аорты более 4,5 см требует проведения ЭхоКГ каждые 3 месяца и чаще для оценки скорости увеличения аорты.
- Женщинам с синдромом Марфана, планирующим беременность, обосновано профилактическое протезирование корня аорты или восходящей аорты, если ее диаметр превышает 4,0 см.
- При выявлении расширения аорты и угрозе преждевременных родов должны быть использованы не β-адреномиметики, а антагонисты кальция.

- Подбор патогенетической терапии β-блокаторами и антагонистами кальция должен быть решен кардиологом/кардиохирургом в специализированном лечебно-профилактическом учреждении.
Этапность обследования и ведения больных с сердечно-сосудистыми заболеваниями в специализированных лечебно-профилактических учреждениях является залогом успешного ведения и предотвращения фатальных исходов.
Мы неоднократно поднимали вопрос об актуальности знаний врачами акушерами-гинекологами клинического течения особенностей ведения больных при наследственных соединительно-тканных синдромах [14, 15]. Но в связи с тем, что данные синдромы расцениваются как редко встречающиеся, а потому «необязательные» для знания и распознавания, подобные ошибки могут встречаться и в дальнейшем. Остается надеяться, что обязательное безукоризненное выполнение приказа 572-н поможет избежать подобных случаев.
Смольнова Татьяна Юрьевна, д.м.н., доцент кафедры репродуктивной медицины и хирургии ФПДО, МГМСУ; с. н.с. отделения оперативной гинекологии ФГБУ НЦАГиП им. академика В.И. Кулакова. Адрес: 127473, Россия, Москва, ул. Делегатская, д. 20/1. Телефон: 8 (926) 310-80-90. E-mail: [email protected]
н.с. отделения оперативной гинекологии ФГБУ НЦАГиП им. академика В.И. Кулакова. Адрес: 127473, Россия, Москва, ул. Делегатская, д. 20/1. Телефон: 8 (926) 310-80-90. E-mail: [email protected]
Конышева Ольга Владимировна, к.м.н., зам. главного врача по акушерству и гинекологии, ГКБ № 15 им. О.М. Филатова.
Адрес: 111538, Россия, Москва, Вешняковская ул., д. 23. Телефон: 8 (495) 375-28-00. E-mail: [email protected]
Тюлькина Екатерина Евгеньевна, д.м.н., профессор, зав. кафедрой терапии ФПК МР РУДН, главный врач ГКБ № 15 им. О.М. Филатова.
Адрес: 111538, Россия, Москва, Вешняковская ул., д. 23. Телефон: 8 (495) 375-04-41. E-mail: [email protected]
Баяндин Николай Леонардович, д.м.н., профессор кафедры сердечно-сосудистой хирургии и инвазивной кардиологии 1-го МГМУ им. И.М. Сеченова, зав. 5-м кардиохирургическим отделением ГКБ № 15 им. О.М. Филатова. Адрес: 111538, Россия, Москва, Вешняковская ул., д. 23. Телефон: 8 (495) 375-02-11.
E-mail: [email protected]
Михсин Светлана Викторовна, к. м.н., врач акушер-гинеколог, зав. отделением специализированной кардиологической помощи беременным КДЦ ГКБ № 15
м.н., врач акушер-гинеколог, зав. отделением специализированной кардиологической помощи беременным КДЦ ГКБ № 15
им. О.М. Филатова. Адрес: 111538, Россия, Москва, Вешняковская ул., д. 23. Телефон: 8 (495) 786-49-45. E-mail: [email protected]
Разрыв аневризмы головного мозга во время беременности: клинический случай
Turk J Obstet Gynecol. 2019 июнь; 16(2): 136–139.
Опубликовано онлайн 2019 июля 3. DOI: 10.4274/tjod.galenos.2019.23080
, 1, * , 2 , 3 и 1
Информация.
Наиболее частой причиной субарахноидального кровоизлияния в период беременности и послеродового периода является разрыв внутричерепной аневризмы. У беременных встречается в пять раз чаще, чем у небеременных. Данная патология чаще встречается у первородящих женщин и в третьем триместре беременности. У женщины 37-ми лет, поступившей в приемное отделение с внезапно возникшей головной болью и потерей сознания, диагностировано внутричерепное кровоизлияние вследствие разрыва аневризмы средней мозговой артерии. Больная, родившая путем экстренного кесарева сечения, оперирована по поводу субарахноидального кровоизлияния. Случай представлен здесь из-за его редкости.
Больная, родившая путем экстренного кесарева сечения, оперирована по поводу субарахноидального кровоизлияния. Случай представлен здесь из-за его редкости.
Ключевые слова: Внутричерепная аневризма, субарахноидальное кровоизлияние, беременность, послеродовой период, смертность
Частота внутричерепного кровотечения при разрыве аневризмы головного мозга при беременности встречается редко (1,2) . С другой стороны, разрыв внутричерепной аневризмы по-прежнему остается наиболее частой причиной субарахноидального кровоизлияния (САК) во время беременности и послеродового периода (3) . Его распространенность среди беременных женщин в пять раз выше, чем среди небеременных женщин (4) . Заболеваемость SAH имеет тенденцию к увеличению во время беременности, и существует потребность в большем количестве публикаций, документирующих риск. (2) SAH является единственным видом паралича с преобладанием женского пола, что позволяет предположить, что репродуктивные факторы могут играть роль в этиологии (5) . Чаще встречается у первородящих женщин и в последнем триместре беременности. Было обнаружено, что раннее менархе и отсутствие беременности повышают риск САК (6) . Уровень материнской смертности в результате разрыва аневризмы достигает 5–12%. В частности, разрыв внутричерепной аневризмы при беременности может привести к летальному исходу у матери и плода (1) .
Чаще встречается у первородящих женщин и в последнем триместре беременности. Было обнаружено, что раннее менархе и отсутствие беременности повышают риск САК (6) . Уровень материнской смертности в результате разрыва аневризмы достигает 5–12%. В частности, разрыв внутричерепной аневризмы при беременности может привести к летальному исходу у матери и плода (1) .
Здесь мы сообщаем о 37-летней женщине, которая была госпитализирована с внезапно возникшей головной болью и потерей сознания. У нее было диагностировано внутричерепное кровоизлияние из-за разрыва аневризмы средней мозговой артерии (СМА).
37-летняя женщина поступила в отделение неотложной помощи с внезапно возникшей сильной головной болью, рвотой и потерей сознания. При поступлении она была без сознания и интубирована. Шкала комы Глазго (ШКГ) была определена как 5 зрительных реакций (E): 1, вербальных реакций (V): 1 и двигательных реакций (M): 3 при неврологическом обследовании. Световой рефлекс не регистрировался с двух сторон, зрачки были сужены. Получена сгибательная реакция на болевые раздражители. При поступлении установлено, что пациентка беременна. Пациентка G7 P4 A0 D&C 2 не получала акушерской помощи во время беременности. Обнаружен единственный живой плод, совместимый со сроком гестации 34 недели и маловодием. Вагинальное исследование выявило многопаралитическое расширение и отсутствие активного вагинального кровотечения. Артериальное давление было 120/70 мм рт. Общий анализ крови и биохимические показатели в пределах нормы. По результатам консультаций невролога и нейрохирурга было принято решение о проведении черепной компьютерной томографии (КТ) и КТ-ангиографии. Краниальная КТ и КТ-ангиография выполнялись с защитой брюшной полости. В левой сильвиевой борозде обнаружена гематома. Кроме того, имело место кровоизлияние во все желудочки, что было совместимо с САК IV стадии по классификации Фишера (2). Классификация Yasargil была совместима со степенью IV.
Получена сгибательная реакция на болевые раздражители. При поступлении установлено, что пациентка беременна. Пациентка G7 P4 A0 D&C 2 не получала акушерской помощи во время беременности. Обнаружен единственный живой плод, совместимый со сроком гестации 34 недели и маловодием. Вагинальное исследование выявило многопаралитическое расширение и отсутствие активного вагинального кровотечения. Артериальное давление было 120/70 мм рт. Общий анализ крови и биохимические показатели в пределах нормы. По результатам консультаций невролога и нейрохирурга было принято решение о проведении черепной компьютерной томографии (КТ) и КТ-ангиографии. Краниальная КТ и КТ-ангиография выполнялись с защитой брюшной полости. В левой сильвиевой борозде обнаружена гематома. Кроме того, имело место кровоизлияние во все желудочки, что было совместимо с САК IV стадии по классификации Фишера (2). Классификация Yasargil была совместима со степенью IV.
Открыть в отдельном окне
Предоперационная аксиальная компьютерная томография головного мозга пациентки показала кровоизлияние в левый боковой, третий и четвертый желудочки и паренхиму
После оценки клинического состояния матери было принято решение о родоразрешении путем кесарева сечения.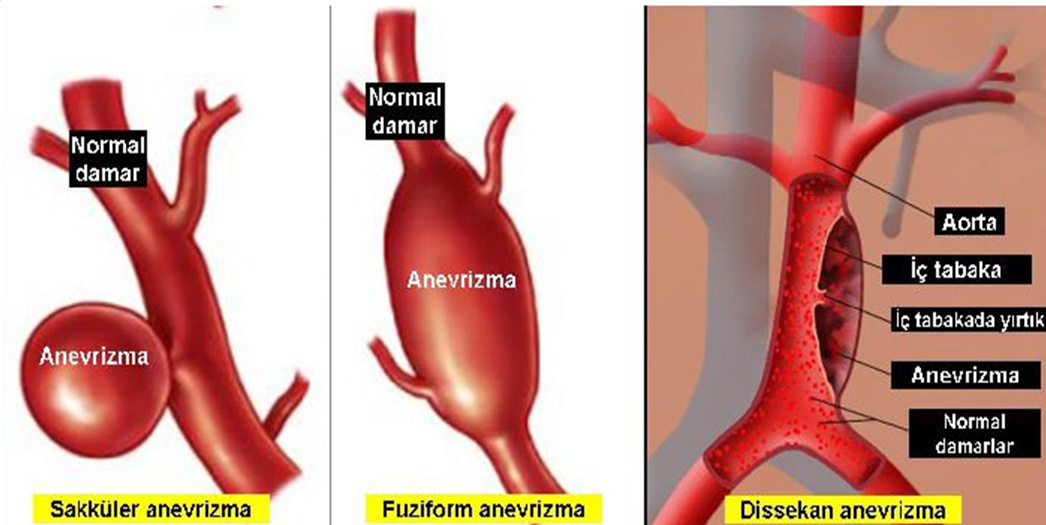 Операция кесарева сечения была проведена в экстренных случаях, и был доставлен живой ребенок мужского пола весом 2520 г с оценкой по шкале Апгар 9-10. Наружное вентрикулярное дренирование выполнено из правой точки Кохера нейрохирургической бригадой по поводу САК пациентки сразу после кесарева сечения. Доступом с левой стороны были достигнуты средние артериальные структуры и сильвиева борозда. В левом тракте СМА обнаружен разрыв аневризмы с активным кровотечением, который был клипирован. После операции больной был доставлен в реанимационное отделение. Клипсы были проверены на контрольной томографии черепа (). К сожалению, пациент умер через четыре дня после операции.
Операция кесарева сечения была проведена в экстренных случаях, и был доставлен живой ребенок мужского пола весом 2520 г с оценкой по шкале Апгар 9-10. Наружное вентрикулярное дренирование выполнено из правой точки Кохера нейрохирургической бригадой по поводу САК пациентки сразу после кесарева сечения. Доступом с левой стороны были достигнуты средние артериальные структуры и сильвиева борозда. В левом тракте СМА обнаружен разрыв аневризмы с активным кровотечением, который был клипирован. После операции больной был доставлен в реанимационное отделение. Клипсы были проверены на контрольной томографии черепа (). К сожалению, пациент умер через четыре дня после операции.
Открыть в отдельном окне
Предоперационная аксиальная компьютерная томография головного мозга с клипсами аневризмы
Материнская смертность является проблемой для акушеров, и она неприемлемо высока. Коэффициент материнской смертности составил 216 случаев на 100 000 живорождений, что на 43,9% ниже по всему миру в 2015 г. по сравнению с результатами 1990 г. (7) . Однако в 2015 году в Турции он составлял 13,7 на 100 000 живорождений (8) . Соотношение материнской смертности, связанной с САК, ко всем материнским смертям составило 2,8% в исследовании, основанном на результатах вскрытия (9) . При оценке этого соотношения следует иметь в виду, что частота вскрытий при материнской смертности очень низкая. В другом обзоре было установлено, что смертность пациенток, у которых во время беременности был диагностирован аневризматический САК, составила 1/10 (10) .
по сравнению с результатами 1990 г. (7) . Однако в 2015 году в Турции он составлял 13,7 на 100 000 живорождений (8) . Соотношение материнской смертности, связанной с САК, ко всем материнским смертям составило 2,8% в исследовании, основанном на результатах вскрытия (9) . При оценке этого соотношения следует иметь в виду, что частота вскрытий при материнской смертности очень низкая. В другом обзоре было установлено, что смертность пациенток, у которых во время беременности был диагностирован аневризматический САК, составила 1/10 (10) .
Аневризмы при беременности возникают после 30 лет и обычно разрываются в последнем триместре (11,12) . Частота распространения внутричерепных аневризм, диагностированных в первом, втором или третьем триместре беременности, составляет 6%, 31% и 55% соответственно, а частота послеродового периода — 8%. В нашем случае пациентка была в возрасте 37 лет и находилась на третьем триместре беременности. В 20% случаев можно обнаружить более одной аневризмы (13) . Гормональные изменения и гемодинамический стресс могут вызывать увеличение риска развития и разрыва аневризмы во время беременности. Такие изменения чаще всего наблюдаются в последние три месяца беременности и в процессе родов (14) . Физиологические последствия беременности могут вызвать задержку воды в организме. Это приводит к увеличению сердечного выброса и объема крови, а также к окончательным изменениям в сосудистых слоях (15) .
В 20% случаев можно обнаружить более одной аневризмы (13) . Гормональные изменения и гемодинамический стресс могут вызывать увеличение риска развития и разрыва аневризмы во время беременности. Такие изменения чаще всего наблюдаются в последние три месяца беременности и в процессе родов (14) . Физиологические последствия беременности могут вызвать задержку воды в организме. Это приводит к увеличению сердечного выброса и объема крови, а также к окончательным изменениям в сосудистых слоях (15) .
Дифференциальный диагноз необходим в случаях неврологического дефицита, включая внезапную острую головную боль и снижение сознания. При дифференциальной диагностике следует учитывать эклампсию, гипофизарную апоплексию, внутриартериальные окклюзии, тромбоз твердой мозговой оболочки, внутричерепные объемные поражения, менингит, энцефалит и демиелинизирующие заболевания (2) . Эклампсия является наиболее частым заболеванием при дифференциальной диагностике САК из-за сходства симптомов, таких как резкое повышение артериального давления, судороги и снижение сознания.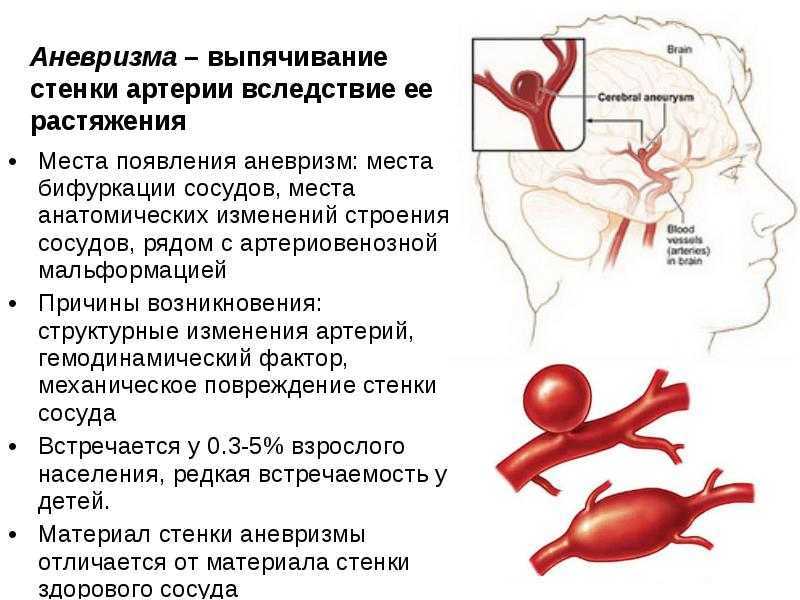 Люмбальная пункция, КТ и МРТ могут рассматриваться как средства диагностики (1) . Диагноз ставится с помощью нейровизуализации (КТ, МРТ и церебральной ангиографии). Хотя компьютерная томография подвергает плод облучению, этим облучением можно пренебречь, поскольку диагноз важнее. По этой причине обследование беременной пациентки, поступившей с головной болью, требует детального неврологического обследования. Люмбальная пункция должна быть выполнена, если клиническое подозрение сохраняется, даже если КТ и МРТ отрицательны (16) . Клинические симптомы и признаки у нашего пациента весьма свидетельствовали о наличии черепной патологии. Соответственно, мы выполнили КТ головного мозга и показали наличие САК, после чего мы выполнили КТ-ангиографию.
Люмбальная пункция, КТ и МРТ могут рассматриваться как средства диагностики (1) . Диагноз ставится с помощью нейровизуализации (КТ, МРТ и церебральной ангиографии). Хотя компьютерная томография подвергает плод облучению, этим облучением можно пренебречь, поскольку диагноз важнее. По этой причине обследование беременной пациентки, поступившей с головной болью, требует детального неврологического обследования. Люмбальная пункция должна быть выполнена, если клиническое подозрение сохраняется, даже если КТ и МРТ отрицательны (16) . Клинические симптомы и признаки у нашего пациента весьма свидетельствовали о наличии черепной патологии. Соответственно, мы выполнили КТ головного мозга и показали наличие САК, после чего мы выполнили КТ-ангиографию.
У пациентов, не получающих лечения, вероятность рецидива кровотечения составляет 33-50%, а материнская смертность составляет от 50% до 68% (2,13) . Показатели внутриутробной смертности ниже у хирургических пациентов, чем у пациентов, получающих только фармакологическую терапию (17) .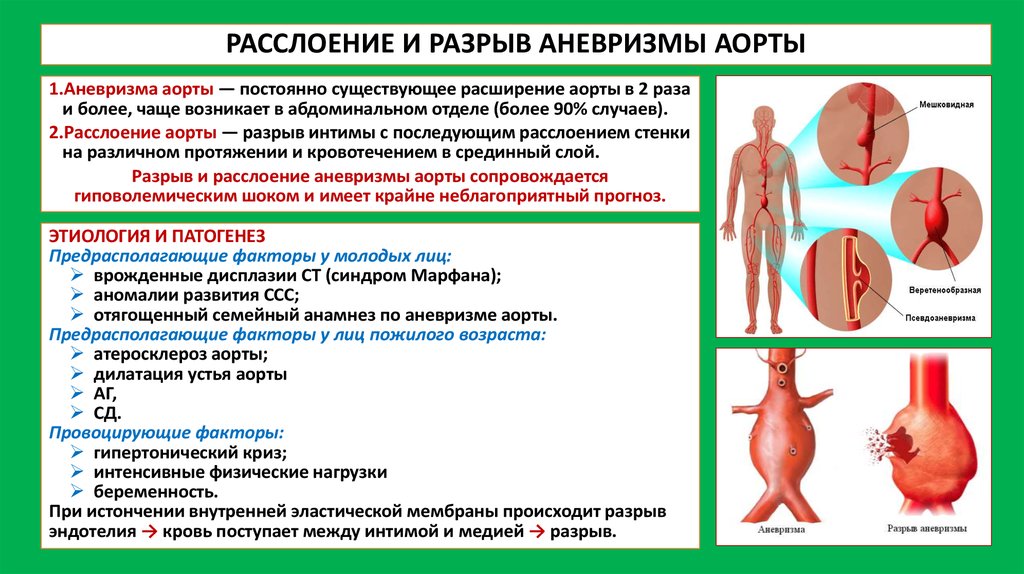 Поэтому хирургическое лечение должно быть произведено как можно скорее (11,12) .
Поэтому хирургическое лечение должно быть произведено как можно скорее (11,12) .
Лечение САК вследствие разрыва аневризмы у беременных женщин должно быть междисциплинарным. Очень важно, чтобы консультация нейрохирурга была предоставлена как можно скорее. Консультация невролога может предсказать исходы для плода и матери или непосредственное лечение. Было показано, что GCS значительно коррелирует с исходами для плода и матери (10) . В нашем случае ШКГ равнялся 5, что можно принять как показатель неблагоприятного прогноза. Ведение САК во время беременности можно разделить на две части. В раннем периоде беременности лечение такое же, как и у небеременных пациенток. В другие периоды беременности перед лечением САК следует провести экстренное кесарево сечение (18) . На ранних сроках беременности при клипировании аневризмы беременность может протекать до срока, приводя к вагинальным родам (19) . Кесарево сечение необходимо выполнять при нескольких обстоятельствах, таких как тяжесть клинического состояния матери (кома, повреждение ствола мозга) и при аневризме, диагностированной в сроке беременности (20) .
При лечении рекомендуется клипирование аневризматического САК. В серии случаев было установлено, что внутрисосудистая эмболизация проводилась во всех случаях, кроме одного; поводом к оперативному лечению явилось наличие выраженного спазма сосудов. Несколько исследований, проведенных в последние годы, продемонстрировали эффективность и безопасность эндоваскулярного койлинга при лечении церебральных аневризм (21) .
Существует множество факторов, влияющих на лечение разрыва внутримозговых аневризм, таких как тип, размер и расположение аневризмы. Может быть применено микрохирургическое клипирование или эндоваскулярная эмболизация, но хирургическое клипирование по-прежнему является наиболее используемой техникой, обеспечивающей превосходную окклюзию аневризмы и позволяющей удалить кровь и сгустки крови из цистерн головного мозга, несмотря на высокую послеоперационную смертность и трудную дилатацию вертебробазилярной системы. . Несмотря на несколько негативных случаев, описанных в литературе, ожидается, что эмболизация станет широко распространенной. В обоих методах используется общая анестезия, и коррелированный риск между обоими методами аналогичен (22) .
В обоих методах используется общая анестезия, и коррелированный риск между обоими методами аналогичен (22) .
Если пациентка стабильна и близка к сроку, следует отдать предпочтение вагинальным родам. Кесарево сечение чаще применяют при неразорвавшейся аневризме, кровоизлиянии в мозговые оболочки во время родов, а также при неблагоприятном клинико-неврологическом статусе пациентки (12) . Если окклюзия внутричерепной аневризмы выполнена до родов, роды могут происходить вагинальным путем без какого-либо риска повторного кровотечения. Хотя нет никаких доказательств того, что кесарево сечение безопаснее для матери или плода, оно часто предпочтительнее из-за его быстроты и простоты наблюдения (14) . Дополнительно возможно клипирование аневризмы сразу после кесарева сечения (11) . В нашем случае было выполнено кесарево сечение, после чего разорвавшиеся аневризмы были клипированы сразу после установления диагноза.
Таким образом, разрыв церебральной аневризмы во время беременности по-прежнему смертелен, несмотря на наличие всех необходимых факторов.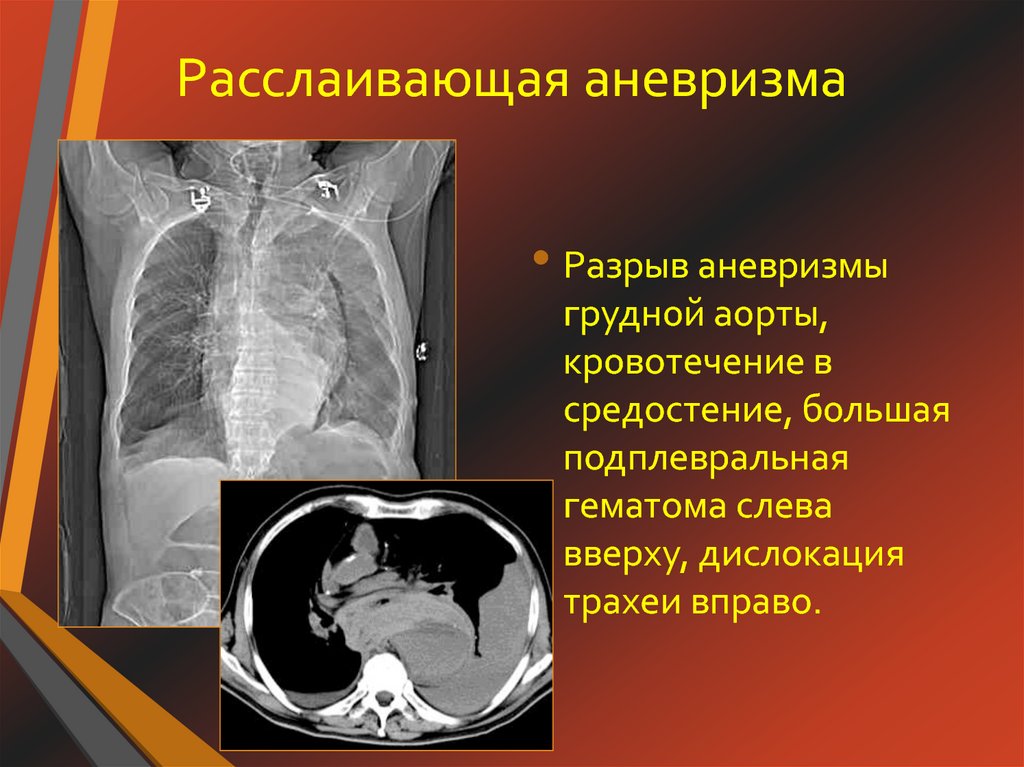 Мы хотели подчеркнуть, что это явление в плане внезапных головных болей и потери сознания должно напоминать нам о других патологиях, наблюдаемых во время беременности.
Мы хотели подчеркнуть, что это явление в плане внезапных головных болей и потери сознания должно напоминать нам о других патологиях, наблюдаемых во время беременности.
Этика
Информированное согласие: Письменное информированное согласие было получено от мужа пациентки.
Проверено экспертами: Проверено внутренними и внешними экспертами.
Предоставлено
Авторские взносы
Хирургическая и медицинская практика: T.O., Ö.Ş.T., İ.S.D., Концепция: T.O., İ.S.D., Дизайн: M.K, Ö.Ş.T., Данные Сбор или обработка: Т.О., О.Ш.Т., Анализ или интерпретация: Т.О., М.К., Поиск литературы: О.Ш.Т., Т.О., Написание: Т.О., М.К.
Конфликт интересов: Авторы сообщают об отсутствии конфликта интересов.
Раскрытие финансовой информации: Авторы заявили, что данное исследование не получало финансовой поддержки.
1. Cho C, Kim Y, Cho K, Lee S, Park B, Cho M. Временные скрытые аневризмы во время беременности: клинический случай. Интерв Нейрорадиол. 2005; 11: 255–9. [Бесплатная статья PMC] [PubMed] [Google Scholar]
2. Диас М.С., Сехар Л.Н. Внутричерепные кровоизлияния из аневризм и артериовенозных мальформаций во время беременности и послеродового периода. Нейрохирургия. 1990;27:855–66. [PubMed] [Google Scholar]
3. Zak IT, Dulai HS, Kish KK. Визуализация неврологических расстройств, связанных с беременностью и послеродовым периодом. Рентгенография. 2007; 27: 95–108. [PubMed] [Google Scholar]
4. Fox MW, Harms RW, Davis DH. Отдельные неврологические осложнения беременности. Мэйо Клин Proc. 1990; 65: 1595–618. [PubMed] [Google Scholar]
5. Gaist D, Pedersen L, Cnattingius S, Sørensen HT. Паритет и риск субарахноидального кровоизлияния у женщин: вложенное исследование случай-контроль, основанное на данных национальных регистров Швеции. Гладить. 2004; 35: 28–32. [PubMed] [Академия Google]
[PubMed] [Академия Google]
6. Окамото К., Хорисава Р., Кавамура Т., Асаи А., Огино М., Такаги Т. и соавт. Менструальные и репродуктивные факторы риска субарахноидального кровоизлияния у женщин: исследование случай-контроль в Нагое, Япония. Гладить. 2001; 32: 2841–4. [PubMed] [Google Scholar]
7. Alkema L, Chou D, Hogan D, Zhang S, Moller AB, Gemmill A, et al. Глобальный, региональный и национальный уровни и тенденции материнской смертности в период с 1990 по 2015 год со сценарными прогнозами до 2030 года: систематический анализ Межведомственной группы ООН по оценке материнской смертности. Ланцет. 2016; 387: 462–74. [Бесплатная статья PMC] [PubMed] [Google Scholar]
8. Энгин-Юстюн Ю., Санисоглу С., Кескин Х.Л., Караахметоглу С., Озкан А., Селен С. и др. Изменение тенденций материнской смертности в Турции с акцентом на прямые и косвенные причины. Eur J Obstet Gynecol Reprod Biol. 2019; 234:21–5. [PubMed] [Google Scholar]
9. Keskin HL, Engin Üstün Y, Sanisoğlu S, Karaahmetoğlu S, Özcan A, Çelen Ş, et al. Значение вскрытия для определения причины материнской смертности в Турции. J Turk Ger Gynecol Assoc. 2018;19:210–4. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Значение вскрытия для определения причины материнской смертности в Турции. J Turk Ger Gynecol Assoc. 2018;19:210–4. [Бесплатная статья PMC] [PubMed] [Google Scholar]
10. Robba C, Bacigaluppi S, Bragazzi NL, Bilotta F, Sekhon MS, Bertuetti R, et al. Аневризматическое субарахноидальное кровоизлияние в серии случаев беременности, обзор и анализ объединенных данных. Мировой нейрохирург. 2016; 88: 383–98. [PubMed] [Google Scholar]
11. Райхман О.Х., Карлман Р.Л. Ягодная аневризма. Surg Clin North Am. 1995; 75: 115–21. [PubMed] [Google Scholar]
12. Stoodley MA, Macdonald RL, Weir BK. Беременность и внутричерепные аневризмы. Нейрохирург Клиника N Am. 1998; 9: 549–56. [PubMed] [Академия Google]
13. Meyers PM, Halbach VV, Malek AM, Phatouros CC, Dowd CF, Lawton MT, et al. Эндоваскулярное лечение аневризм артерий головного мозга во время беременности: отчет о трех случаях. AJNR Am J Нейрорадиол. 2000; 21:1306–11. [Бесплатная статья PMC] [PubMed] [Google Scholar]
14. Shahabi S, Tecco L, Jani J, Pirotte B, Rodesch G, Baurain M, et al. Лечение разрыва аневризмы основной артерии во время беременности. Акта Чир Белг. 2001; 101:193–5. [PubMed] [Google Scholar]
Shahabi S, Tecco L, Jani J, Pirotte B, Rodesch G, Baurain M, et al. Лечение разрыва аневризмы основной артерии во время беременности. Акта Чир Белг. 2001; 101:193–5. [PubMed] [Google Scholar]
15. Vale BP, Albuquerque MG, Brito JNPdO, Portela ALF, Paiva JTd. Разрыв гигантской внутричерепной аневризмы у беременной, пролеченной методом эндоваскулярной эмболизации: клинический случай. Радиол Бюстгальтеры. 2006;39: 237–9. [Google Scholar]
16. Guida M, Altieri R, Palatucci V, Visconti F, Pascale R, Marra M, et al. Аневризматическое субарахноидальное кровоизлияние при беременности: серия случаев. Трансл Мед ЮниСа. 2012;2:59. [Бесплатная статья PMC] [PubMed] [Google Scholar]
17. Lynch JC, Andrade R, Pereira C. Внутричерепная геморрагия у беременных и послеродовых: experiência com quinze casos. Арк Нейропсиквиатр. 2002; 60: 264–8. [PubMed] [Google Scholar]
18. ван Буул Б.Дж., Нейхуис Дж.Г., Слапендель Р., Леру Дж.Г., Баккер-Низен С.Х. Общая анестезия при хирургическом лечении внутричерепной аневризмы во время беременности: влияние на частоту сердечных сокращений плода. Ам Дж. Перинатол. 1993;10:183–186. [PubMed] [Google Scholar]
Ам Дж. Перинатол. 1993;10:183–186. [PubMed] [Google Scholar]
19. Young DC, Leveno KJ, Whalley PJ. Индуцированные роды перед операцией по поводу разрыва аневризмы головного мозга. Акушерство Гинекол. 1983; 61: 749–52. [PubMed] [Google Scholar]
20. Mosiewicz A, Jakiel G, Janusz W, Markiewicz P. Leczenie Tetniaków wewnatrzczaszkowych w okresie ciazy. Польская гинекология. 2001; 72: 86–92. [PubMed] [Google Scholar]
21. Mohan AA, Banode P, Dhomne S. Ретроспективный обзор анализа интервенционной радиологической эндоваскулярной эмболизации спиралью по сравнению с нейрохирургическим клипированием при лечении внутричерепных аневризм. IJRSMS. 2019. [Google Scholar]
22. Piotin M, de Souza Filho CB, Kothimbakam R, Moret J. Эндоваскулярное лечение острого разрыва внутричерепных аневризм у беременных. Am J Obstet Gynecol. 2001; 185:1261–2. [PubMed] [Google Scholar]
Лечение внутричерепных аневризм во время беременности | JAMA
Лечение внутричерепных аневризм во время беременности | ДЖАМА | Сеть ДЖАМА
[Перейти к навигации]
Эта проблема
- Скачать PDF
- Полный текст
Поделиться
Твиттер
Фейсбук
Электронная почта
LinkedIn- Процитировать это
- Разрешения
Артикул
19 апреля 1965 г.
Дж. Лоуренс Пул, MD
Принадлежности автора
Отделение неврологической хирургии, Колледж врачей и хирургов, Колумбийский университет, и Служба неврологической хирургии, Неврологический институт, Пресвитерианская больница, Нью-Йорк.
ДЖАМА. 1965;192(3):209-214. дои: 10.1001/jama.1965.03080160029007
Полный текст
Абстрактный
Из 37 пациенток в хорошем состоянии после субарахноидального кровоизлияния из верифицированной внутричерепной аневризмы, разорвавшейся во время беременности, у 13 развился рецидив кровоизлияния в срок от трех дней до восьми недель, который стал причиной восьми материнских смертей. У 26 пациенток аневризмы были пролечены хирургическим путем во время беременности: у шести путем окклюзии сонных артерий и у 20 путем внутричерепной хирургии, с двумя летальными исходами, тогда как восемь из 11 пациенток, получавших только постельный режим, умерли.