Субклинический гипотиреоз у беременных: Субклинический гипотиреоз в период беременности — фактор риска развития аутизма у будущего ребенка
СУБКЛИНИЧЕСКИЙ ГИПОТИРЕОЗ ВО ВРЕМЯ БЕРЕМЕННОСТИ СВЯЗАН С ПРЕЖДЕВРЕМЕННЫМИ РОДАМИ — Ассоциация гинекологов-эндокринологов России
Subclinical Hypothyroidism in Pregnancy: Link to Premature Delivery
Беременные женщины с субклиническим гипотиреозом демонстрируют повышение риска преждевременных родов на 50%, согласно результатам нового исследования, доложенным на 86-й Ежегодной конференции Американской ассоциации по щитовидной железе. Результаты двух исследований показали снижение некоторых осложнений при назначении лечения левотироксином.
Проблема обследования на субклинический гипотиреоз во время беременности ─ предмет дебатов из-за противоречивых данных о преимуществах такого обследования. Рекомендации Американской ассоциации по щитовидной железе (American Thyroid Association (ATA)) с 2011 г. пришли к заключению, что доказательства недостаточны, чтобы рекомендовать за или против рутинного измерения уровня тиреотропного гормона в первом триместре беременности, таких же рекомендаций придерживается эксперты Американской коллегии акушеров-гинекологов (American College of Obstetrics and Gynecology). Публикация новых рекомендаций ATA по этому вопросу ожидается в ближайшие месяцы.
Публикация новых рекомендаций ATA по этому вопросу ожидается в ближайшие месяцы.
Д-р Lee и его коллеги из Медицинского центра г. Бостона провели исследование с участием более 6000 беременных женщин, наблюдавшихся с января 2003 по май 2014 гг., у которых имелись данные об уровне тиреотропного гормона (ТТГ). Результаты исследования были доложены на 86-й Ежегодной конференции АТА.1 Исследователи констатировали наличие гипотиреоза при следующих концентрациях уровня ТТГ: от 0,1 до 2,5 мМЕ/л в 1-ом, от 0,2 до 3 мМЕ/л во 2-ом и от 0,3 до 3 мМЕ/л в 3-м триместрах беременности. Женщины с установленным диагнозом заболевания щитовидной железы или получавшие лечение по этому поводу не включались в исследование. Данные по антителам к тиреоидной пероксидазе (ТПО) были доступны у 281 женщины, из которых у 5% тест был положительным.
Результаты исследования показали, что повышение уровня ТТГ в любом триместре беременности коррелировало со статистически значимым повышением частоты преждевременных родов (т. е. ранее 37 недель гестации) по сравнению с женщинами с нормальным уровнем этого показателя (отношение шансов, 1,52; 95% ДИ 1,06–2,16; P = 0,02). «В целом, превышение уровня специфического для определенного триместра уровня ТТГ было связано с повышением частоты преждевременных родов на 50%», отметила в своем докладе д-р Lee. Однако более высокая концентрация ТТГ в сыворотке не была связана с повышенным риском каких-либо других пренатальных осложнений.
е. ранее 37 недель гестации) по сравнению с женщинами с нормальным уровнем этого показателя (отношение шансов, 1,52; 95% ДИ 1,06–2,16; P = 0,02). «В целом, превышение уровня специфического для определенного триместра уровня ТТГ было связано с повышением частоты преждевременных родов на 50%», отметила в своем докладе д-р Lee. Однако более высокая концентрация ТТГ в сыворотке не была связана с повышенным риском каких-либо других пренатальных осложнений.
В ходе конференции были доложены, уже опубликованные результаты небольшого исследования, выполненного в Mayo Clinic (Rochester, Minnesota) между январем 2011 и декабрем 2013 гг. с участием 56 ТПО-негативных беременных женщин с субклиническим гипотиреозом.2 Критерием субклинического гипотиреоза авторы считали уровень ТТГ менее 2,5 мМЕ/л в 1-ом и более 3 мМЕ/л во 2-ом и 3-ем триместрах беременности, но менее 10 мМЕ/л. Базовые уровни ТТГ были статистически значимо выше в группе женщин, получавших левотироксин (LT4): средний уровень 4,9 мМЕ/л vs 3,5 мМЕ/л у не получавших лечение женщин (P < 0,001), что и привело к тому, что этим женщинам было предложено лечение, объяснил главный исследователь, д-р Maraka. При сравнении акушерских результатов у получавших лечение LT4 женщин (n = 22) с не получавшими лечения (n = 34) было показано, что на фоне лечения отмечалась более низкая частота преждевременных родов (4,6% vs 23,5%), а также потерь беременности, гипертензии беременных и преэклампсии; однако из-за малого числа участниц различия не достигали статистической значимости. На фоне лечения не отмечено ни одного случая низкого веса новорожденного по сравнению с 14,3% не леченных женщин; однако, опять эта разница не достигала статистической значимости (P = 0,13).
При сравнении акушерских результатов у получавших лечение LT4 женщин (n = 22) с не получавшими лечения (n = 34) было показано, что на фоне лечения отмечалась более низкая частота преждевременных родов (4,6% vs 23,5%), а также потерь беременности, гипертензии беременных и преэклампсии; однако из-за малого числа участниц различия не достигали статистической значимости. На фоне лечения не отмечено ни одного случая низкого веса новорожденного по сравнению с 14,3% не леченных женщин; однако, опять эта разница не достигала статистической значимости (P = 0,13).
«Несмотря на увеличение в 2 раза числа беременных женщин, получающих заместительную терапию левотироксином при субклиническом гипотиреозе после выпуска обновленных рекомендаций (ATA и Эндокринного общества), они не были повсеместно внедрены в клиническую практику. По-видимому, это частично связано с недостатком сильных поддерживающих рекомендации данных, а также ограниченное ознакомление с ними специализированных групп врачей», считают авторы исследования из Mayo Clinic.
Только что на конференции Эндокринологического общества Великобритании в г. Брайтоне (Society for Endocrinology Annual Conference) были доложены результаты исследования д-ра Taylor и его коллег из Университетской клиники г. Кардифф в Уэльсе.3 Когорта участниц включала 13 224 женщин со сроком беременности от 12 до 16 недель, из которых у 340 женщин был выявлен субклинический гипотиреоз, а у 305 женщин ─ изолированная гипотироксинемия (прим. состояние, когда при нормальном уровне ТТГ определяется сниженный уровень Т4). Результаты исследования показали, что назначение левотироксина беременным женщинам с умеренно выраженным гипотиреозом служат профилактикой замершей беременности, рождения плода с низким для своего гестационного возраста весом и необходимости в преждевременном родоразрещении путем кесарева сечения.
Источник:
1. American Thyroid Association (ATA) 2016 Annual Meeting (September 21-23, 2016 Denver, Colorado)
2. Maraka S, Singh Ospina NM, O’Keeffe DT, et al. Effects of Levothyroxine Therapy on Pregnancy Outcomes in Women with Subclinical Hypothyroidism. Thyroid. July 2016, 26(7): 980-986
Maraka S, Singh Ospina NM, O’Keeffe DT, et al. Effects of Levothyroxine Therapy on Pregnancy Outcomes in Women with Subclinical Hypothyroidism. Thyroid. July 2016, 26(7): 980-986
3. Society for Endocrinology Annual Conference. Brighton, United Kingdom. November 7–9, 2016. Abstract OC6.3
Гипотиреоз и беременность.
Нарушение функции щитовидной железы (гипотиреоз, гипертиреоз) диагностируется у 2-5% населения, 12% наблюдается у беременных и у 20% женщин, которые готовятся к экстракорпоральному оплодотворению (ЭКО).
В последние годы возросла распространенность гипотиреоза среди беременных до 15% за счет субклинических форм.
ГИПОТИРЕОЗ — синдром, вызванный длительной и устойчивой недостаточностью гормонов щитовидной железы в организме или снижением их биологических эффектов на тканевом уровне, что ведет к снижению основного обмена, угнетению обменных процессов, нарушению функционального состояния различных органов и систем.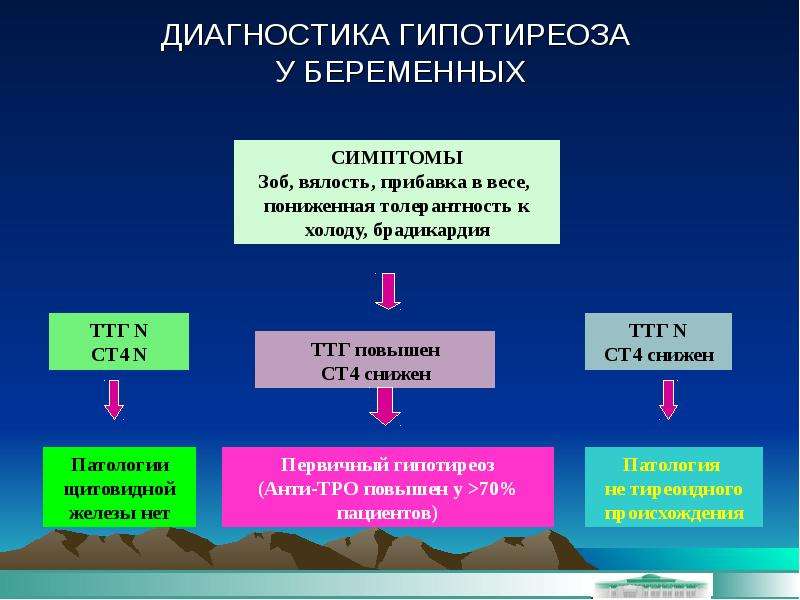
В период внутриутробной жизни под контролем тиреоидных гормонов осуществляются процессы эмбриогенеза, дифференцируются и созревают практически все органы и системы. Никакие другие гормоны не обладают таким влиянием на развитие плода, как тиреоидные гормоны, особенно на формирование центральной нервной системы.
Есть разные формы гипотиреоза в зависимости от стадии, формы гипотиреоза, тяжести течения, уровня ТТГ, продолжительности заболевания.
Хорионический гонадотропин (ХГТ) человека, вырабатываемый плацентой, оказывает стимулирующее действие на щитовидную железу вследствие своей способности взаимодействовать с рецепторами ТТГ. В результате этого в I триместре на пике секреции ХГТ повышается выработка тиреоидных гормонов.
НУЖНО ЛИ ОПРЕДЕЛЯТЬ УРОВЕНЬ ТТГ У ЗДОРОВЫХ БЕРЕМЕННЫХ
В ходе опроса американских врачей 42% респондентов сообщили, что проводят тотальный скрининг беременных на заболевания щитовидной железы, 43% врачей ответили, что проводят только в группах риска и 15% не проводят вообще./113/113.jpg)
Нормальные значения ТТГ для беременных женщин (Американская тиреоидна ассоциация, 2011-2017г.)
| ПЕРИОДЫ БЕРЕМЕННОСТИ | УРОВЕНЬ ТТГ мМО/л |
| І триместр | 0,1-2,5 |
| ІІ триместр | 0,2-3,0 |
| ІІІ триместр | 0,3-3,0 |
КАК ВЛИЯЕТ ГИПОТИРЕОЗ НА ВЫНАШИВАНИЕ БЕРЕМЕННОСТИ
Гипотиреоз влияет на фертильность женщины, течение беременности и на здоровье плода. Например, при субклиническом гипотиреозе выявлено увеличение частоты внутриутробной задержки плода, сниженную массу тела. При удвоении ТТГ вероятность выкидыша увеличивается на 80%. Некомпенсированный гипотиреоз увеличивает риск преждевременных родов, преэклампсии, гестационного сахарного диабета, гипертензии, отслойки плаценты.
Гипотиреоз у беременной наиболее опасен для развития плода и в первую очередь влияет на развитие центральной нервной системы. Это объясняется тем, что в первую половину беременности щитовидная железа плода практически не функционирует и в норме развитие нервной системы проходит под действием материнских гормонов.
Это объясняется тем, что в первую половину беременности щитовидная железа плода практически не функционирует и в норме развитие нервной системы проходит под действием материнских гормонов.
КОГДА НЕОБХОДИМО НАЧАТЬ ЛЕЧЕНИЕ
Правильная тактика лечения и обследования должна проводиться еще до начала наступления беременности, особенно в группах риска. Эффект лечения зависит от срока начала лечения и продолжительности терапии, затраченных на достижение целевого уровня ТТГ.
Частота осложнений уменьшается, если лечение начинать до 12 недель. Контроль адекватности терапии осуществляется по уровню ТТГ, который необходимо определять с интервалом 1 раз в 4 недели в первой половине беременности.
Лечение субклинического гипотиреоза и гипотироксинемии во время беременности
Субклинические заболевания щитовидной железы, манифестирующие во время беременности, ассоциированы с неблагоприятными исходами, в том числе снижением коэффициента интеллекта у потомков.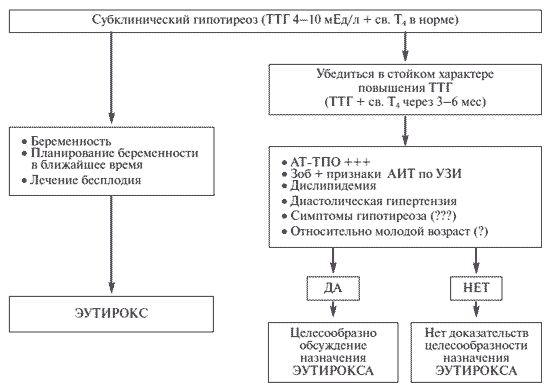
В настоящее время неизвестно влияет ли лечение левотироксином у беременных женщин с субклиническим гипотиреозом или гипотироксинемией на улучшение когнитивных функций у их детей.
Методы
Выполнено обследование женщин с одноплодной беременностью до 20 недели гестации на предмет выявления субклинического гипотиреоидизма (уровень тиреотропного гормона ≥4,0 мЕд/л и нормальный уровень свободного тироксина (0,86-1,90 гг/дл [11-24 пмоль/л]) и гипотироксинемии (нормальный показатель ТТГ (0.08-3.99 мЕД/л) и снижение концентрации свободного T4 (<0.86 нг/дл)).
Беременные были разделены на 2 группы, согласно результатам скрининга и рандомизированы для получения левотироксина или плацебо.
Функция щитовидной железы оценивалась ежемесячно и доза левотироксина повышалась до достижения нормальных показателей ТТГ или свободного тироксина (в зависимости от исследования).
В последующем у детей ежегодно оценивали развитие и поведенческие реакции до достижения 5 лет. Первичной конечной точкой исследования являлся коэффициент интеллекта (IQ) в возрасте 5 лет или смерть в возрасте до 3-х лет.
Результаты
В финальный анализ включены 677 женщин с субклиническим гипотиреозом (средний возраст гестации 16,7 недель) и 526 беременных с гипотироксинемией (средний гестационный возраст 17,8 недель).
- Анализ подгруппы женщин с субклиническим гипотиреозом продемонстрировал, что средний IQ составил 97 (95% CI, 94-99) на фоне назначения левотироксина матерям во время беременности и 94 (95% CI, 92-96) на фоне применения плацебо (P=0.71).
- В исследовании женщин с гипотироксинемией, средний IQ у детей составил 94 (95% CI, 91-95) в группе левотироксина и 91 (95% CI, 89-93) в группе плацебо (P=0.30).
- В каждом исследовании отсутствовали данные о значении IQ у 4% детей. Не было выявлено статистически значимых различий по нейрокогнитивным исходам и исходам беременности, а также частоте нежелательных явлений (процент побочных эффектов был низким в обеих группах).

Заключение
Лечение субклинического гипотиреоидизма и гипотироксинемии, начатое между 8-20 неделями гестации, не ассоциировано с лучшими когнитивными исходами у детей до пяти лет.
Источник: Brian M. Casey, Elizabeth A. Thom, Alan M. Peaceman, et al. N Engl J Med 2017; 376:815-825.
Субклинический гипотиреоз у беременных и детей
По материалам клинических рекомендаций Европейской тиреоидной ассоциации по диагностике и лечению субклинического гипотиреоза у беременных женщин и детей
Осенью этого года вышли в свет клинические рекомендации Европейской тиреоидной ассоциации (ЕТА) по диагностике и лечению субклинического гипотиреоза (СГ) во время беременности и у детей — то есть в двух ситуациях, наиболее проблемных с позиции доказательной базы и единства представлений.
Такое выделение этих двух аспектов, пожалуй, делается впервые: предшествовавшие рекомендации посвящены либо гипотиреозу в целом, либо же в целом патологии щитовидной железы (ЩЖ) во время беременности. Если говорить о рекомендациях ЕТА, которая начала ими активно заниматься несколько лет назад, то предыдущие были посвящены субклиническому гипотиреозу (как раз за исключением беременных и детей) и обсуждались на страницах нашего журнала.
Если говорить о рекомендациях ЕТА, которая начала ими активно заниматься несколько лет назад, то предыдущие были посвящены субклиническому гипотиреозу (как раз за исключением беременных и детей) и обсуждались на страницах нашего журнала.
Кроме того, мы обсуждали практически все рекомендации, посвященные патологии ЩЖ, которые выходили в последние годы, в том числе рекомендации по патологии ЩЖ во время беременности: это были американские рекомендации 2011 и 2012 гг. Забегая вперед, можно сказать, что обсуждаемые здесь европейские рекомендации не привнесут так уж много нового по сравнению с их североамериканскими предшественниками. Тем не менее, на мой взгляд, определенные отличия между американскими и европейскими рекомендациями, как между этими, так и в общем, все-таки есть. Американские рекомендации очень часто чрезмерно педантичны в плане доказательности. По ряду наиболее критичных вопросов они вообще не выражают своего мнения — дескать, доказательности нет, значит, и сказать нечего, либо весьма абстрактны и используют фразы типа «нет данных как за, так и против». Совершенно очевидно, что доказательности нет или она весьма недостаточна во многих вопросах, но ведь, грубо говоря, работать как-то надо! Для этих случаев существует уровень экспертного мнения, но консенсуса в этом мнении достичь порой достаточно сложно, поскольку эксперты амбициозны и любят поспорить. Европейские рекомендации в этом плане ушли недалеко, но, даже если взять для примера последние рекомендации по субклиническому гипотиреозу, они несколько ближе к практике.
Совершенно очевидно, что доказательности нет или она весьма недостаточна во многих вопросах, но ведь, грубо говоря, работать как-то надо! Для этих случаев существует уровень экспертного мнения, но консенсуса в этом мнении достичь порой достаточно сложно, поскольку эксперты амбициозны и любят поспорить. Европейские рекомендации в этом плане ушли недалеко, но, даже если взять для примера последние рекомендации по субклиническому гипотиреозу, они несколько ближе к практике.
Предмет обсуждаемых в этой статье рекомендаций весьма сложен во всех отношениях, если не сказать, что он является самым сложным вопросом клинической тиреоидологии. Возможно, именно в этой связи он выделен в отдельный документ. Чем же определяются эти сложности, которые на самом деле относятся ко всему тому, что касается изучения патологии ЩЖ во время беременности? Давайте это кратко обсудим, прежде чем перейти собственно к рекомендациям (табл.).
| Этические ограничения | Сложность проведения плацебоконтролируемых исследований с участием беременных женщин с субклиническим гипотиреозом |
| Методические сложности | Адекватная оценка уровня интеллекта возможна только у взрослых детей, в связи с чем исследования, оценивающие неблагоприятные влияния дефицитатиреоидных гормонов, должны быть очень длительными |
| Субклинические нарушения функции ЩЖ — вероятно малозначимый фактор риска | В связи с этим исследования по оценке этого фактора риска должны включать очень большое число наблюдений |
| Аутоиммунный генез большинства нарушений функции ЩЖ | Основной причиной СГ является аутоиммунный тиреоидит, при этом сама по себе любая аутоиммунная патология, независимо от функции ЩЖ, сопряжена с повышенным риском неблагоприятного исхода или патологии беременности |
Во-первых, проведение исследований с участием беременных женщин сложно с этических позиций. Доказательств высокого уровня в отношении влияния субклинического гипотиреоза матери на нервно-психическое развитие плода, к сожалению, нет, но многие косвенные данные, в частности многочисленные исследования, изучавшие йодный дефицит, об этом тем или иным образом свидетельствуют. В этой связи беременной женщине с СГ достаточно сложно назначить плацебо, при том что назначение препаратов L-Т4 и дешево, и безопасно в равной мере. Вряд ли сама женщина, ознакомившись с предметом исследования при подписании информированного согласия, согласится в нем участвовать. В связи со сказанным приходится пользоваться данными ретроспективных и эпидемиологических исследований. Так, сужение референсного диапазона для уровня ТТГ у беременных — плод эпидемиологических и лишь в меньшей степени клинических исследований. Действительно, у подавляющего большинства здоровых беременных женщин уровень ТТГ на ранних сроках беременности относительно низок. Тем не менее доказательств высокого уровня о патологическом значении уровня ТТГ в интервале 2,5—4,0 мЕд/л пока нет — они лишь косвенны.
Доказательств высокого уровня в отношении влияния субклинического гипотиреоза матери на нервно-психическое развитие плода, к сожалению, нет, но многие косвенные данные, в частности многочисленные исследования, изучавшие йодный дефицит, об этом тем или иным образом свидетельствуют. В этой связи беременной женщине с СГ достаточно сложно назначить плацебо, при том что назначение препаратов L-Т4 и дешево, и безопасно в равной мере. Вряд ли сама женщина, ознакомившись с предметом исследования при подписании информированного согласия, согласится в нем участвовать. В связи со сказанным приходится пользоваться данными ретроспективных и эпидемиологических исследований. Так, сужение референсного диапазона для уровня ТТГ у беременных — плод эпидемиологических и лишь в меньшей степени клинических исследований. Действительно, у подавляющего большинства здоровых беременных женщин уровень ТТГ на ранних сроках беременности относительно низок. Тем не менее доказательств высокого уровня о патологическом значении уровня ТТГ в интервале 2,5—4,0 мЕд/л пока нет — они лишь косвенны. Тем не менее само понятие референсного диапазона всегда носит эпидемиологический характер, и поэтому его смена для беременных вполне правомерна. Но рекомендация о лечении СГ в этом случае будет неизбежно достаточно слабой.
Тем не менее само понятие референсного диапазона всегда носит эпидемиологический характер, и поэтому его смена для беременных вполне правомерна. Но рекомендация о лечении СГ в этом случае будет неизбежно достаточно слабой.
Помимо этических сложностей в проведении исследований с участием беременных женщин есть немалые сложности методические. Относительно простой задачей является доказательство того, что субклинический гипотиреоз неблагоприятно отражается на течении беременности, и это было уже многократно показано: он сопровождается повышенным риском прерывания беременности, гестоза и гестационного сахарного диабета, а также преждевременных родов. Куда более сложна оценка влияния СГ беременных на нервно-психическое развитие ребенка, как минимум в связи с тем, что она требует времени, поскольку адекватно оценить интеллект ребенка можно в достаточно взрослом возрасте, тогда как изменения, выявленные у совсем маленьких детей при помощи различных тестов, могут быть транзиторными.
Кроме того, если проанализировать имеющиеся публикации, можно заключить, что если СГ является неблагоприятным фактором, то это фактор достаточно слабый. В связи с этим доказательство его значимости требует включения в исследования достаточно больших групп пациентов.
Наконец, еще одна сложность заключается в том, что основной причиной СГ является аутоиммунный тиреоидит (АИТ), при этом хорошо известно, что любые аутоиммунные заболевания, которые зачастую сочетаются, неблагоприятно отражаются на прогнозе беременности, независимо от функции ЩЖ. То есть отделить собственно СГ от неблагоприятного влияния аутоиммунного процесса, который его вызвал, почти невозможно. Все это и определяет то, что сила предлагаемых рекомендаций чаще весьма скромная.
Обсуждаемые рекомендации ЕТА ранжированы по системе GRADE, в соответствии с которой доказательность, базирующаяся на литературных данных, оценивалась как высокая (уровень 1), умеренная (уровень 2) и слабая (уровень 3). По силе выделены строгие (S) и слабые (W) рекомендации. Далее приводим полный перевод текста рекомендаций, которые попытаемся критически осмыслить.
По силе выделены строгие (S) и слабые (W) рекомендации. Далее приводим полный перевод текста рекомендаций, которые попытаемся критически осмыслить.
Диагностика субклинического гипотиреоза во время беременности
РЕКОМЕНДАЦИЯ 1
Во всех антенатальных центрах необходимо использование триместр-специфических референсных диапазонов для уровней ТТГ и Т4 (общего или свободного), которые могут отличаться (2S).
Комментарий. Если для уровня ТТГ эти триместр-специфические диапазоны предлагаются, этого нельзя сказать об уровне общего и свободного Т4.
РЕКОМЕНДАЦИЯ 2
При отсутствии в лаборатории собственных триместр-специфических диапазонов для уровня ТТГ рекомендуется использовать следующие верхние референсные пределы: для первого триместра — 2,5 мЕд/л, для второго — 3,0 мЕд/л, для третьего — 3,5 мЕд/л (2W).
Комментарий. В данном случае в отличие от американских рекомендаций для третьего триместра появилась цифра 3,5 мЕд/л. Есть ли в данном случае разница между 3,0 и 3,5 мЕд/л? Скорее всего нет.
В данном случае в отличие от американских рекомендаций для третьего триместра появилась цифра 3,5 мЕд/л. Есть ли в данном случае разница между 3,0 и 3,5 мЕд/л? Скорее всего нет.
РЕКОМЕНДАЦИЯ 3
Для оценки функции щитовидной железы во время беременности может использоваться определение как общего, так и свободного уровня Т4 (2S).
Комментарий. В литературе опубликовано много дискуссий об этом, чему основанием послужили последние американские рекомендации. Позиция здесь скорее примирительная. В прошлой публикации мы уже дискутировали о том, что на ранних сроках беременности, когда уровень Т4, пожалуй, наиболее значим, можно вполне доверять уровню свободного Т4, который будет постепенно методически занижаться по мере увеличения срока беременности. По мнению автора этой статьи, во время беременности, как и вне ее, в большинстве случаев достаточно оценки одного только ТТГ, если не брать случаи его снижения, то есть ситуации, когда нужно дифференцировать транзиторный гестационный гипертиреоз.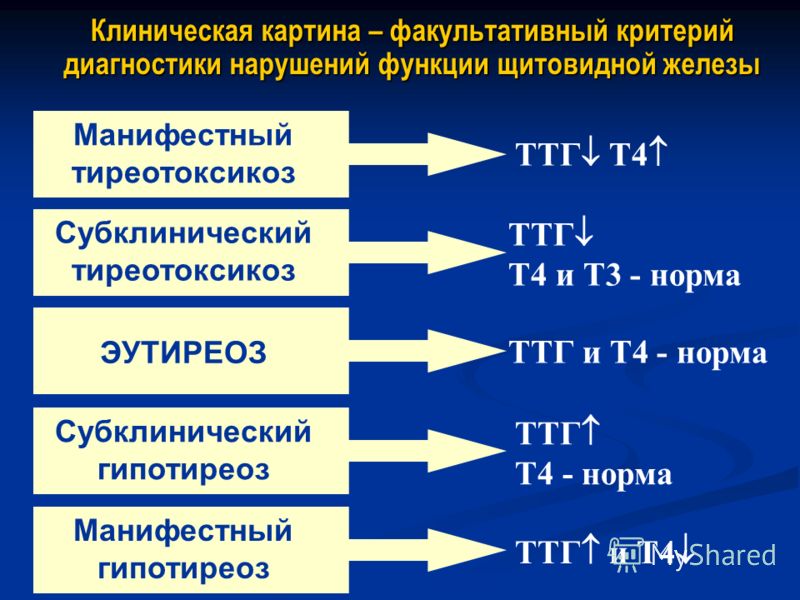
РЕКОМЕНДАЦИЯ 4
В рамках скрининга определение уровня ТТГ следует проводить на ранних сроках беременности. Если ТТГ повышен, определяется уровень св.Т4 и АТ-ТПО. Это позволит дифференцировать субклинический и явный гипотиреоз, а также выделить пациентов с изолированной гипотироксинемией и центральным гипотиреозом (1S).
Комментарий. Если уровень ТТГ повышен, то это уже явно будет не изолированная гипотироксинемия, а пациентки со вторичным гипотиреозом почти все без исключения бесплодны.
РЕКОМЕНДАЦИЯ 5
При повышенном ТТГ и отсутствии АТ-ТПО следует определить уровень АТ-ТГ УЗИ щитовидной железы может быть проведено для выявления эхографических признаков АИТ (2S).
Комментарий. Определение антител и поиск эхографических признаков АИТ нас, конечно, укрепит в необходимости назначить L-Т4, но если мы ничего из этого не найдем, следуя этим же рекомендациям и американским рекомендациям 2012 г. , заместительную терапию все равно нужно назначить. Обходят вопрос такого назначения только американские рекомендации 2011 г., которые говорят, что в этом плане «нет данных как за, так и против назначения L-Т4«, что ставит практического врача в весьма неловкое положение. Надо признать, что в таком подходе есть много правды — ведь если у пациентки гипотиреоз, должны быть признаки заболевания, которое его вызвало, а если их нет — речь может идти об индивидуальной вариации уровня ТТГ, особенно если он находится в интервале 2,5 и 4,0 мЕд/л.
, заместительную терапию все равно нужно назначить. Обходят вопрос такого назначения только американские рекомендации 2011 г., которые говорят, что в этом плане «нет данных как за, так и против назначения L-Т4«, что ставит практического врача в весьма неловкое положение. Надо признать, что в таком подходе есть много правды — ведь если у пациентки гипотиреоз, должны быть признаки заболевания, которое его вызвало, а если их нет — речь может идти об индивидуальной вариации уровня ТТГ, особенно если он находится в интервале 2,5 и 4,0 мЕд/л.
Значение потребления йода при субклиническом гипотиреозе
РЕКОМЕНДАЦИЯ 6
Ежедневное потребление йода у беременных и кормящих женщин должно быть не меньше 250 мкг, но нежелательно, чтобы оно превышало 500 мкг (1S).
РЕКОМЕНДАЦИЯ 7
Достаточное потребление йода обычно обеспечивается за счет его дополнительного приема в виде различных комплексных препаратов для беременных в дозе 150 мкг/день, в идеале до наступления зачатия (1S).
РЕКОМЕНДАЦИЯ 8
Необходимо изучение эффективности и побочных эффектов йодной профилактики, в том числе в комбинации с L-Т4, при субклиническом гипотиреозе у беременных женщин (3S).
Комментарий. Вопрос, который часто задают практические врачи: если у пациентки гипотиреоз, надо ли ей параллельно назначать йодную профилактику? Ответа, основанного на результатах конкретных научных исследований, на этот вопрос нет. Если исходить из доказанного факта безопасности физиологических доз йода, это назначение в регионах йодного дефицита вполне логично, хотя этот вопрос можно обсуждать с многочисленных сторон, хотя бы упомянув, что большая часть препарата L-Т4 состоит из йода и последний при необходимости эффективно отщепляется от тироксина плацентой
Неблагоприятные эффекты субклинического гипотиреоза для матери и плода
ЗАКЛЮЧЕНИЯ
- Имеющиеся данные свидетельствуют о том, что при субклиническом гипотиреозе повышен риск самопроизвольного прерывания беременности, гес-тационного диабета, преэклампсии и преждевременных родов.

- Взаимосвязь субклинического гипотиреоза и нарушения интеллектуального развития плода противоречива.
- Гипотироксинемия у беременной ассоциирована с нарушением нейропсихологического развития плода.
Комментарий. Эти заключения очень четко суммируют результаты имеющихся на сегодняшний день исследований по СГ во время беременности, поэтому они очень ценны. В первом пункте указаны доказанные неблагоприятные эффекты, во втором еще раз подчеркивается, что влияние СГ на интеллект потомства противоречиво. К третьему пункту я бы добавил «гипотироксинемия ранних сроков беременности» или «абсолютная гипотироксинемия», подчеркнув, что на поздних сроках часто встречается изолированная гипотироксинемия, которая является результатом методической погрешности определения уровня св.Т4.
РЕКОМЕНДАЦИЯ 9
Необходимы дальнейшие исследования для более точной оценки влияния субклинического гипотиреоза на исходы беременности, а также на неврологическое и интеллектуальное развитие ребенка (2S).
Эффекты заместительной терапии L-Т
4 при субклиническом гипотиреозе и изолированной гипотироксинемии
РЕКОМЕНДАЦИЯ 10
При субклиническом гипотиреозе, развившемся при планировании и во время беременности, необходима заместительная терапия L-Т4 (2S).
Комментарий. Этот пункт, вкупе с предложенными референсными диапазонами для ТТГ, свидетельствует о том, что в первом триместре заместительная терапия показана при ТТГ выше 2,5 мЕд/л. С формальных позиций при планировании беременности она показана при ТТГ выше 4,0 мЕд/л, поскольку планирование беременности и ее наличие — это не одно и то же.
РЕКОМЕНДАЦИЯ 11
В настоящее время отсутствуют интервенционные исследования, которые бы доказали преимущества заместительной терапии L-Т4 у женщин с гипо-тироксинемией с позиции акушерских осложнений (1S).
Комментарий. Речь идет о выявлении изолированного снижения уровня св. Т4 при нормальном уровне ТТГ, то есть об изолированной гипотироксинемии.
Т4 при нормальном уровне ТТГ, то есть об изолированной гипотироксинемии.
РЕКОМЕНДАЦИЯ 12
Тем не менее терапия L-Т4 может быть рекомендована при изолированной гипотироксинемии, выявленной в первом триместре, поскольку она ассоциирована с нарушением нервно-психологического развития ребенка (ЗW).
Комментарий. В первом триместре изолированное снижение уровня св.Т4 без повышения уровня ТТГ выявляется очень редко.
РЕКОМЕНДАЦИЯ 13
Терапия L-Т4 не рекомендуется при изолированной гипотироксинемии, выявленной во втором и третьем триместрах беременности (3S).
Практические рекомендации по лечению субклинического гипотиреоза во время беременности
РЕКОМЕНДАЦИЯ 14
При гипотиреозе во время беременности рекомендуется назначение L-Т4. Препараты, содержащие L-Т3, или препараты экстрактов щитовидной железы не рекомендуются (1S).
РЕКОМЕНДАЦИЯ 15
Целью лечения L-Т4 является нормализация уровня ТТГ у беременных в соответствии с триместр-специфическими референсными интервалами (1S).
РЕКОМЕНДАЦИЯ 16
При впервые выявленном субклиническом гипотиреозе во время беременности стартовая доза L-Т4 рассчитывается исходя из 1,2 мкг/кг в день (2S).
Комментарий. Исходя из этого, даже при субклиническом (!!!) гипотиреозе во время беременности, то есть при ТТГ выше 2,5 мЕд/л, женщина весом 60 кг должна получить около 75 мкг L-Т4.
РЕКОМЕНДАЦИЯ 17
При субклиническом и явном гипотиреозе во время беременности доза L-Т4 должна быть подобрана таким образом, чтобы уровень ТТГ был ниже 2,5 мЕд/л (2S).
РЕКОМЕНДАЦИЯ 18
Если женщина с гипотиреозом уже получает заместительную терапию, во время беременности дозу L-Т4 необходимо увеличить на 25—50% в зависимоcти от этиологии гипотиреоза и уровня ТТГ до наступления беременности (1S).
РЕКОМЕНДАЦИЯ 19
Уровень ТТГ необходимо определять каждые 4—6 нед в первом триместре и однократно во втором и третьем, при этом доза L-Т4 должна изменяться таким образом, чтобы ТТГ поддерживался на уровне менее 2,5 мЕд/л (2S).
РЕКОМЕНДАЦИЯ 20
После родов дозу Ь-Т4 следует снизить до той, которая принималась до беременности. Если гипотиреоз был диагностирован во время беременности и уровень ТТГ при этом был меньше 5 мЕд/л, при отсутствии АТ-ТПО терапию L-Т4 после родов можно отменить и оценить функцию щитовидной железы через 6 нед (2S).
РЕКОМЕНДАЦИЯ 21
У женщин с субклиническим гипотиреозом, диагностированным во время беременности, спустя 6 мес и год после родов необходимо оценить функцию щитовидной железы для решения вопроса о необходимости продолжения заместительной терапии (2S).
Скрининг нарушений функции щитовидной железы
ЗАКЛЮЧЕНИЯ
- Данные о целесообразности скрининга на субклинический гипотиреоз во время беременности противоречивы.
- Эффективность такого скрининга должна быть изучена в новых высококачественных исследованиях.
- Отсутствуют данные о целесообразности скрининга изолированной гипотироксинемии.
РЕКОМЕНДАЦИЯ 22
Несмотря на позитивное влияние терапии L-Т4 в плане предотвращения акушерских осложнений и то, что оценка функции щитовидной железы только по клиническим показаниям приведет к значительной гиподиагностике гипотиреоза, мы не можем рекомендовать всеобщий скрининг на субклинический гипотиреоз в связи с отсутствием доказательности его эффективности 1-го уровня (2S).
Комментарий. Между строк читается «очень хотели бы, но не можем». Автор этой статьи является сторонником проведения такого скрининга с научных позиций, но у всякого скрининга есть и организационная сторона. В России за последний год родилось 1 млн 700 тыс. детей, прибавьте сюда беременности, которые прервались самопроизвольно не на минимальных сроках (так или иначе в стране ежегодно делается 2—2,5 млн абортов) — то есть представьте, какому количеству женщин нужно провести оценку функции ЩЖ на ранних сроках. Но провести еще полбеды, а как интерпретировать результаты этого скрининга, точнее, кто этим будет заниматься? В стране работает всего только 3 тыс. эндокринологов, к слову, не все из них так уж любят консультировать беременных. Большинство гинекологов не готовы интерпретировать уровень ТТГ у беременных. Тут достаточно вспомнить, что в 20% случаев он снижен и встанет вопрос о дифференциальной диагностике гестационного гипертиреоза; принимать решение о назначении заместительной терапии (при ТТГ более 2,5 мЕд/л) тоже мало кто из гинекологов будет. То есть помимо отсутствия доказательности эффективности такого скрининга как организованного мероприятия у нас реально для этого нет даже кадровых возможностей. Решить этот вопрос, мне кажется, может прогресс лабораторной диагностики, который приведет к более четкой алгоритмизации оценки функции ЩЖ у беременных, как это, например, произошло с диагностикой врожденного гипотиреоза. Тем не менее все это не исключает, а, наоборот, убеждает нас в целесообразности оценки функции ЩЖ у беременных, что называется, «на отдельном рабочем месте», особенно если говорить о контингенте крупных акушерско-гинекологических центров и центров планирования семьи, и включения этого теста в программы обследования женщин в рамках ПМУ.
Но провести еще полбеды, а как интерпретировать результаты этого скрининга, точнее, кто этим будет заниматься? В стране работает всего только 3 тыс. эндокринологов, к слову, не все из них так уж любят консультировать беременных. Большинство гинекологов не готовы интерпретировать уровень ТТГ у беременных. Тут достаточно вспомнить, что в 20% случаев он снижен и встанет вопрос о дифференциальной диагностике гестационного гипертиреоза; принимать решение о назначении заместительной терапии (при ТТГ более 2,5 мЕд/л) тоже мало кто из гинекологов будет. То есть помимо отсутствия доказательности эффективности такого скрининга как организованного мероприятия у нас реально для этого нет даже кадровых возможностей. Решить этот вопрос, мне кажется, может прогресс лабораторной диагностики, который приведет к более четкой алгоритмизации оценки функции ЩЖ у беременных, как это, например, произошло с диагностикой врожденного гипотиреоза. Тем не менее все это не исключает, а, наоборот, убеждает нас в целесообразности оценки функции ЩЖ у беременных, что называется, «на отдельном рабочем месте», особенно если говорить о контингенте крупных акушерско-гинекологических центров и центров планирования семьи, и включения этого теста в программы обследования женщин в рамках ПМУ.
РЕКОМЕНДАЦИЯ 23
Следует заметить, что в настоящее время отсутствуют контролируемые исследования, которые свидетельствуют в пользу всеобщего скрининга, большинство авторов рекомендаций (4 из 6) высказались в его пользу, поскольку положительное влияние заместительной терапии на акушерский исход при явном гипотиреозе очевидно, а оценка функции щитовидной железы только по клиническим показаниям приведет к пропуску значительного числа случаев гипотиреоза (2W).
Субклинический гипотиреоз у детей
ЗАКЛЮЧЕНИЯ
- В общей группе детей и подростков с СГ (ТТГ > 5,5—10 мЕд/л) функция ЩЖ нормализуется более чем в 70% случаев, а в большинстве оставшихся случаев СГ сохраняется на протяжении последующих 5 лет, но редко переходит в явный гипотиреоз.
- Неиммунный (идиопатический) СГ, выявленный при неонатальном скрининге, является гетерогенным расстройством, которое спонтанно проходит в 58% случаев (от 36 до 88%) или остается стойким, но прогрессирует только примерно в 10% случаев, по данным 8-летнего наблюдения.

- СГ в 10 раз чаще встречается у детей с синдромом Дауна по сравнению с общей популяцией. При отсутствии циркулирующих антител к ЩЖ у младенцев и маленьких детей нормализация ее функции при СГ происходит более чем в 70% случаев. У детей старше 8 лет СГ более вероятно связан с АИТ
- При СГ вследствие АИТ функция ЩЖ нормализуется примерно у 34% пациентов, остается стабильной у 42% и ухудшается у 24% детей, по данным 4-летнего наблюдения, при этом в индивидуальных случаях эта вероятность может значительно варьировать и во многом зависит от использованных критериев диагностики СГ.
- У детей с ожирением уровень ТТГ между 5 и 7 мЕд/л, вероятно, является следствием, а не причиной ожирения
- У большинства детей с СГ отсутствуют симптомы и признаки явного гипотиреоза.
- Недостаточно исследований, оценивающих влияние СГ на нейрофизиологическое развитие детей старше 3 лет. Данные в этом плане относительно более старших детей противоречивы.
- СГ у детей не ассоциирован с неблагоприятным влиянием на рост и развитие скелета, но при нем могут определяться измененные сердечно-сосудистые параметры.

- Высококачественные исследования, изучающие эффекты заместительной терапии СГ у детей, отсутствуют.
Комментарий. На мой взгляд, прекрасная подборка тезисов, отражающая сегодняшнее состояние проблемы СГ у детей. Данные о СГ у детей маленького возраста во многом получены на базе скрининговых программ врожденного гипотиреоза и по сути даже для детей младше 3 лет не дают четкого ответа на вопрос о необходимости его заместительной терапии. Очевидно, что АИТ у таких маленьких детей встречается весьма редко, СГ же другого генеза может быть потенциально связан с некими мягкими формами тех нарушений, которые приводят к явному врожденному гипотиреозу, либо с внешними факторами, такими как тяжелый йодный дефицит, который встречается все реже. Таким образом, у детей младше 3 лет, когда эти рекомендации и будут рекомендовать заместительную терапию, СГ встречается весьма редко, чаще носит транзи-торный характер и его патологическое значение остается сомнительным. В отношении детей старше 3 лет — СГ видимо не отражается на их неврологическом развитии и опять же чаще всего является транзиторным, хотя тут по мере увеличения возраста начинает нарастать доля детей с СГ в результате АИТ. Если речь идет о подростках, то здесь идеология диагностики и лечения СГ вряд ли чем-то отличается от принятой у взрослых, за исключением того, что у подростков СГ чаще, чем у взрослых, транзиторен, хотя и среди взрослых с СГ повторное определение уровня ТТГ без каких-либо назначений выявляет спонтанную нормализацию уровня ТТГ примерно в 40% случаев.
В отношении детей старше 3 лет — СГ видимо не отражается на их неврологическом развитии и опять же чаще всего является транзиторным, хотя тут по мере увеличения возраста начинает нарастать доля детей с СГ в результате АИТ. Если речь идет о подростках, то здесь идеология диагностики и лечения СГ вряд ли чем-то отличается от принятой у взрослых, за исключением того, что у подростков СГ чаще, чем у взрослых, транзиторен, хотя и среди взрослых с СГ повторное определение уровня ТТГ без каких-либо назначений выявляет спонтанную нормализацию уровня ТТГ примерно в 40% случаев.
РЕКОМЕНДАЦИЯ 24
У детей в возрасте старше 1 мес, у которых не произошла нормализация уровня ТТГ, рекомендуется терапия L-Т4 до возраста 3 лет, то есть до периода, когда развитие головного мозга уже не будет зависеть от тиреоидных гормонов. В дальнейшем терапия может быть отменена с целью оценки стойкости или транзиторного характера гипотиреоза (2S).
Комментарий. Здесь следует помнить о том, что речь идет о возрастных нормах, которые на протяжении первых полутора лет жизни отличаются от таковых для взрослых.
Здесь следует помнить о том, что речь идет о возрастных нормах, которые на протяжении первых полутора лет жизни отличаются от таковых для взрослых.
РЕКОМЕНДАЦИЯ 25
При стойком повышении уровня ТТГ необходимо проведение визуализации ЩЖ для исключения ее структурных аномалий. Дальнейшее генетическое обследование проводится по показаниям (1S).
РЕКОМЕНДАЦИЯ 26
Детям с СГ старше 3 лет при исходном отсутствии циркулирующих антител к ЩЖ показано динамическое наблюдение с определением уровня ТТГ и АТ-ТПО. Поскольку риск прогрессии СГ достаточно низок, обследование может проводиться один раз в год и еще реже, если отсутствует отрицательная динамика (2S).
РЕКОМЕНДАЦИЯ 27
Периодическая оценка функции ЩЖ необходима всем детям с синдромом Дауна; детали обследования обсуждаются в отдельных рекомендациях (2S).
РЕКОМЕНДАЦИЯ 28
Риск прогрессирования СГ вероятно повышен у детей с признаками АИТ. В связи с этим определение уровня ТТГ при наличии циркулирующих антител к ЩЖ рекомендуется проводить с интервалом 1 раз в 6—12 мес. Более частое обследование может понадобиться пациентам, у которых исходный ТТГ превышает 10 мЕд/л и при этом принято решение не назначать им заместительную терапию (2W).
В связи с этим определение уровня ТТГ при наличии циркулирующих антител к ЩЖ рекомендуется проводить с интервалом 1 раз в 6—12 мес. Более частое обследование может понадобиться пациентам, у которых исходный ТТГ превышает 10 мЕд/л и при этом принято решение не назначать им заместительную терапию (2W).
РЕКОМЕНДАЦИЯ 29
Решение вопроса о том, назначать ребенку с СГ заместительную терапию или нет, должно быть комплексным с учетом соотношения преимуществ и недостатков и должно обсуждаться вместе с его родителями. В настоящее время доказательная база достаточна для того, чтобы рекомендовать заместительную терапию большинству детей с СГ и уровнем ТТГ менее 10 мЕд/л при нормальном уровне Т4
РЕКОМЕНДАЦИЯ зо
Не смотря на то что высококачественных исследований СГ, развившегося после облучения области ЩЖ по поводу опухолей, нет, в таких случаях заместительная терапия представляется целесообразной (2W).
Список литературы:
Фадеев В. В. По материалам клинических рекомендаций Европейской тиреоидной ассоциации по диагностике и лечению субклинического гипотиреоза у беременных женщин и детей // Клиническая и экспериментальная тиреоидология. – 2014. – Т. 10. – № 3. – 20–26с.
В. По материалам клинических рекомендаций Европейской тиреоидной ассоциации по диагностике и лечению субклинического гипотиреоза у беременных женщин и детей // Клиническая и экспериментальная тиреоидология. – 2014. – Т. 10. – № 3. – 20–26с.
Опыт организации скрининга патологии щитовидной железы при беременности в регионе йодного дефицита | Булгакова
1. Приказ Министерства здравоохранения Российской Федерации от 1 ноября 2012 г. № 572н «Об утверждении Порядка оказания медицинской помощи по профилю «акушерство и гинекология (за исключением использования вспомогательных репродуктивных технологий)». Режим доступа: https://base.garant.ru/70352632/
2. Прилуцкий А.С., Глушич С.Ю. Физиологические изменения функции щитовидной железы во время беременности. Международный эндокринологический журнал. 2015;(5):140-146. Режим доступа: http://www. mif-ua.com/ archive/article/41402.
mif-ua.com/ archive/article/41402.
3. Medici М., Korevaar T.I.M., Visser W.E., Visser TJ., Peeters R.P. Thyroid Function in Pregnancy: What Is Normal? Clin Chem. 2015;61(5):704-713. doi: 10.1373/clinchem.2014.236646.
4. Дедов И.И., Бурумкулова Ф.Ф. (ред.). Эндокринные заболевания и беременность в вопросах и ответах. М.: Е-ното; 2015. 272 с.
5. Korevaar T.I.M., Medici M., Visser TJ., Peeters R.P. Thyroid disease in pregnancy: new insights in diagnosis and clinical management. Nat Rev Endocrinol. 2017;13(10):610-622. doi: 10.1038/nrendo.2017.93.
6. Teng W., Shan Z., Patil-Sisodia K., Cooper D.S. Hypothyroidism in pregnancy. Lancet Diabetes Endocrinol. 2013;1(3):228-237. doi: 10. 1016/S2213-8587(13)70109-8.
1016/S2213-8587(13)70109-8.
7. Blumenfeld Z. Maternal thyroid hypofunction and pregnancy outcome. Obstet Gynecol. 2008;112(6):1390-1391. doi: 10.1097/A0G.0b013e3181907811.
8. Yazbeck C.F., Sullivan S.D. Thyroid disorders during pregnancy. Med Clin North Am. 2012;96(2):235-256. doi: 10.1016/j.mcna.2012.01.004.
9. Бахарева И.В. Заболевания щитовидной железы и их влияние на течение беременности. Российский вестник акушера-гинеколога. 2013;13(4):38-44. Режим доступа: https://elibrary.ru/item.asp?id=20189067.
10. Зайдиева Я.З. Беременность при заболеваниях щитовидной железы (обзор литературы). Медицинский алфавит. 2017;1(3):31-38. Режим доступа: https://elibrary.ru/item.asp?id=29358672.
11. li Y., Shan Z., Teng W., Yu X., Li Y., Fan C. et al. Abnormalities of maternal thyroid function during pregnancy affect neuropsychological development of their children at 25-30 months. Clin Endocrinol (Oxf). 2010;72(6):825-829. doi: 10.1111/j.1365-2265.2009.03743.x.
12. Obregon MJ., Calvo R.M., Escobar Del Rey F., Morreale de Escobar G. Ontogenesis of thyroid function and interactions with maternal function. Endocr Dev. 2007;10:86-98. doi: 10.1159/000106821.
13. Hou Y., liu A., li J., Wang H., Yang Y, li Y. et al. Different thyroidal responses to human chorionic gonadotropin under different thyroid peroxidase antibody and/or thyroglobulin antibody positivity conditions during the first half of pregnancy. Thyroid. 2019;29(4):577-585. doi: 10.1089/thy. 2018.0097.
2018.0097.
14. Korevaar T.I., Steegers EA., Pop VJ., Broeren M.A., Chaker L., de Rijke Y.B. et al. Thyroid autoimmunity impairs the thyroidal response to human chorionic gonadotropin: two population-based prospective cohort studies. J Clin Endocrinol Metab. 2017;102(1):69-77. doi: 10.1210/jc.2016-2942.
15. lockwood C.M., Grenache D.G., Gronowski A.M. Serum human chorionic gonadotropin concentrations greater than 400,000 IU/L are invariably associated with suppressed serum thyrotropin concentrations. Thyroid. 2009;19(8):863-868. doi: 10.1089/thy.2009.0079.
16. lazarus J.H. Thyroid function in pregnancy. Br Med Bull. 2011;97:137-148. doi: 10.1093/bmb/ldq039.
17. Олина А.А., Садыкова ПМ. Функциональное состояние щитовидной железы во время беременности: современный взгляд на проблему. Медицинская наука и образование Урала. 2018;19(2):178-181. Режим доступа: https://elibrary.ru/item.asp?id=35190009.
18. Sparre L.S., Brundin J., Carlstrom K., Carlstrom A. Oestrogen and thyroxinebinding globulin levels in early normal pregnancy. Acta Endocrinol (Copenh). 1987;114(2):298-304. doi: 10.1530/acta.0.1140298.
19. Midgley J.E.M., Hoermann R. Measurement of total rather than free thyroxine in pregnancy: the diagnostic implications. Thyroid. 2013;23(3):259-261. doi: 10.1089/thy.2012.0469.
20. Аликенова Л.З., Еспенбетова М.Ж., Амренова К.Ш., Амангельдинова С.Б. Особенности функции щитовидной железы во время беременности: обзор литературы. Наука и здравоохранение. 2015;(1):13-21. Режим доступа: https://elibrary.ru/item.asp?id=25052505.
2015;(1):13-21. Режим доступа: https://elibrary.ru/item.asp?id=25052505.
21. Moleti M., Trimarchi F., Vermiglio F. Thyroid physiology in pregnancy. Endocr Pract. 2014;20(6):589-596. doi: 10.4158/EP13341.RA.
22. Dunn J.T., Delange F. Damaged reproduction: the most important consequence of iodine deficiency. J Clin Endocrinol Metab. 2001;86(6):2360-2363. doi: 10.1210/jcem.86.6.7611.
23. Мельниченко Г.А., Фадеев В.В., Дедов И.И. Заболевания щитовидной железы и беременность. М.: МедЭкспертПресс; 2003. 48 c.
24. Pearce E.N. Assessing iodine intakes in pregnancy: why does this matter? Br J Nutr. 2015;113(8):1179-1181. doi: 10.1017/S0007114515000471.
25. Bath S.C. The effect of iodine deficiency during pregnancy on child development. ProcNutrSoc. 2019;78(2):150-160. doi: 10.1017/S0029665118002835.
Bath S.C. The effect of iodine deficiency during pregnancy on child development. ProcNutrSoc. 2019;78(2):150-160. doi: 10.1017/S0029665118002835.
26. Фадеев В.В., Лесникова С.В., Мельниченко Г.А. Функциональное состояние щитовидной железы у беременных женщин в условиях легкого йодного дефицита. Проблемы эндокринологии. 2003;49(6):23-28. doi: 10.14341/probl11754.
27. Арбатская Н.Ю. Йод-дефицитные заболевания и беременность: профилактика, диагностика и лечение. РМЖ. 2004;(13):755-758. Режим доступа: https://www.rmj.ru/articles/akusherstvo/Yoddeficitnye_zabolevaniya_i_beremennosty_profilaktika_diagnostika_i_lechenie.
28. Аглетдинова Е.М., Моругова Т.В., Денисова СА. Мониторинг проблемы йодного дефицита в Республике Башкортостан. Санитарный врач. 2014;(11):47-53. Режим доступа: https://elibrary.ru/item.asp?id=22554178.
Режим доступа: https://elibrary.ru/item.asp?id=22554178.
29. Glinoer D., Spencer C.A. Serum TSH determinations in pregnancy: how, when and why? Nat Rev Endocrinol. 2010;6(9):526-529. doi: 10.1038/nrendo.2010.91.
30. Lee S.Y., Cabral HJ., Aschengrau A., Pearce E.N. Associations Between Maternal Thyroid Function in Pregnancy and Obstetric and Perinatal Outcomes. J Clin Endocrinol Metab. 2020;105(5):2015-2023. doi: 10.1210/clinem/dgz275.
31. Шестакова Т.П. Субклинический гипотиреоз и беременность. РМЖ. Мать и дитя. 2018;(5-I):56-60. Режим доступа: https://www.rmj.ru/articles/ginekologiya/Subklinicheskiy_gipotireoz_iberemennosty.
32. Maraka S., Ospina N.M., O’Keeffe D.T., De Ycaza A. E.E., Gionfriddo M.R., Erwin PJ. et al. Subclinical hypothyroidism in pregnancy: a systematic review and meta-analysis. Thyroid. 2016;26(4):580-590. doi: 10.1089/thy.2015.0418.
E.E., Gionfriddo M.R., Erwin PJ. et al. Subclinical hypothyroidism in pregnancy: a systematic review and meta-analysis. Thyroid. 2016;26(4):580-590. doi: 10.1089/thy.2015.0418.
33. Фадеев В.В. По материалам клинических рекомендаций по диагностике и лечению заболеваний щитовидной железы во время беременности и в послеродовом периоде Американской тиреоидной ассоциации. Клиническая и экспериментальная тиреоидология. 2012;8(1):7-18. Режим доступа: https://elibrary.ru/item.asp?id=20173927.
34. Alexander E.K., Pearce E.N., Brent G.A., Brown R.S., Chen H., Dosiou Ch. еt al. 2017 Guidelines of the American Thyroid Association for the Diagnosis and Management of Thyroid Disease During Pregnancy and the Postpartum. Thyroid. 2017;27(3):315-389. doi: 10.1089/thy.2016.0457.
Гипотиреоз и изолированная гипотироксинемия во время беременности | Fadeyev
1. Glinoer D., De Nayer P., Delange F. et al. A randomized trial for the treatment of mild iodine deficiency during pregnancy: maternal and neonatal effects // J. Clin. Endocrinol. Metab. 1995. V. 80. P. 258–269.
Glinoer D., De Nayer P., Delange F. et al. A randomized trial for the treatment of mild iodine deficiency during pregnancy: maternal and neonatal effects // J. Clin. Endocrinol. Metab. 1995. V. 80. P. 258–269.
2. Negro R., Soldin O.P., Obregon M.-J., Stagnaro-Green A. Hypothyroxinemia and Pregnancy // Endocrin. Pract. 2011. V. 17. P. 1–24.
3. Abalovich M., Amino N., Barbour L.A. et al. Management of thyroid dysfunction during pregnancy and postpartum: an Endocrine Society Clinical Practice Guideline // J. Clin. Endocrinol. Metab. 2007. V. 92. P. S1–47.
4. Pedersen K.M., Laurberg P., Iversen E. et al. Amelioration of some pregnancy-associated variations in thyroid function induced by iodine supplementation // J. Clin. Endocrinol. Metab. 1993. V. 77. P.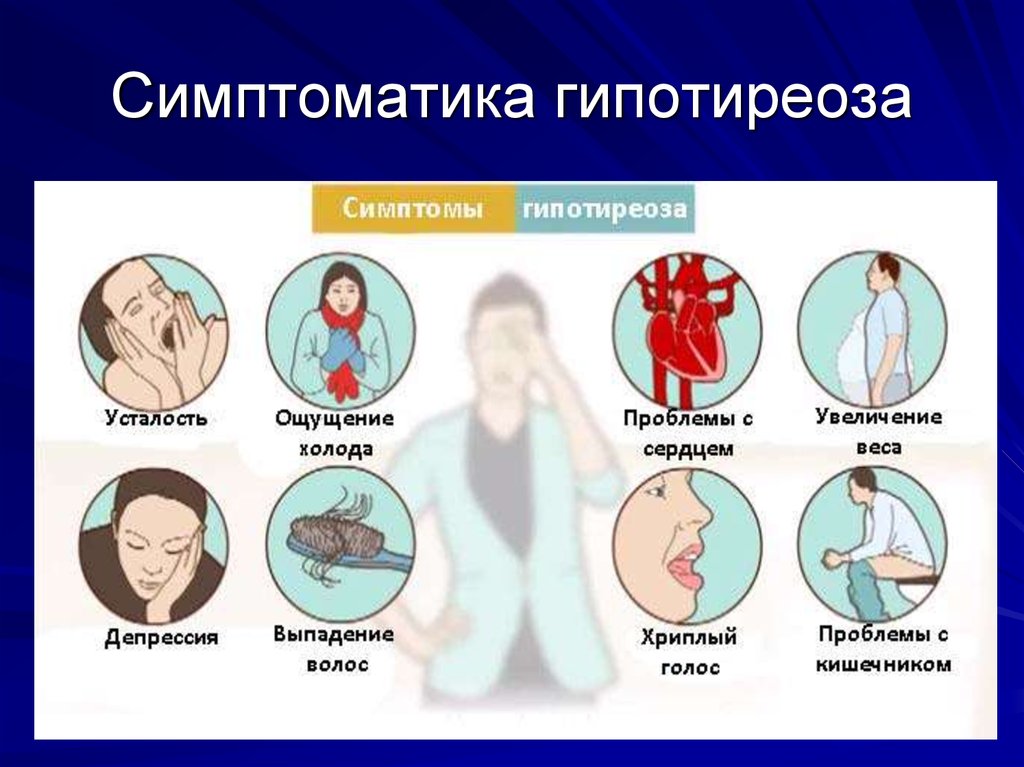 1078–1083.
1078–1083.
5. Romano R., Jannini E.A., Pepe M. et al. The effects of iodoprophylaxis on thyroid size during pregnancy // Am. J. Obstet. Gynecol. 1991. V. 164. P. 482–485.
6. Liesenkötter K.P., Göpel W., Bogner U. et al. Earliest prevention of endemic goiter by iodine supplementation during pregnancy // Eur. J. Endocrinol. 1996. V. 134. P. 443–448.
7. Caldwell K.L., Miller G.A., Wang R.Y. et al. Iodine status of the U.S. population, National Health and Nutrition Examination Survey 2003–2004 // Thyroid. 2008. V. 18. P. 1207–1214.
8. Andersson M., de Benoist B., Delange F., Zupan J. Prevention and control of iodine deficiency in pregnant and lactating women and in children less than 2-years-old: conclusions and recommendations of the Technical Consultation // Public. Health. Nutr. 2007. V. 10. P. 1606–1611.
Health. Nutr. 2007. V. 10. P. 1606–1611.
9. Caron P., Hoff M., Bazzi S. et al. Urinary iodine excretion during normal pregnancy in healthy women living in the southwest of France: correlation with maternal thyroid parameters // Thyroid. 1997. V. 7. P. 749–754.
10. Pearce E.N., Lazarus J.H., Smyth P.P. et al. Perchlorate and thiocyanate exposure and thyroid function in first-trimester pregnant women // J. Clin. Endocrinol. Metab. 2010. V. 95. P. 3207–3215.
11. Elnagar B., Eltom A., Wide L. et al. Iodine status, thyroid function and pregnancy: study of Swedish and Sudanese women // Eur. J. Clin. Nutr. 1998. V. 52. P. 351–355.
12. Sack J., Goldstein A., Charpak N. et al. Postpartum maternal hyperthyrotropinemia in an area in which iodine supplementation is required // Thyroid. 2003. V. 13. P. 959–964.
2003. V. 13. P. 959–964.
13. Moleti M., Lo Presti V.P., Mattina F. et al. Gestational thyroid function abnormalities in conditions of mild iodine deficiency: early screening versus continuous monitoring of maternal thyroid status // Eur. J. Endocrinol. 2009. V. 160. P. 611–617.
14. Moleti M., Lo Presti V.P., Campolo M.C. et al. Iodine prophylaxis using iodized salt and risk of maternal thyroid failure in conditions of mild iodine deficiency // J. Clin. Endocrinol. Metab. 2008. V. 93. P. 2616–2621.
15. Fritz K.S., Wilcox R.B., Nelson J.C. Quantifying spurious free T4 results attributable to thyroxine-binding proteins in serum dialysates and ultrafiltrates // Clin. Chem. 2007. V. 53. P. 985–988.
16. d’Herbomez M., Forzy G., Gasser F. et al. Clinical evaluation of nine free thyroxine assays: persistent problems in particular populations // Clin. Chem. Lab. Med. 2003. V. 41. P. 942–947.
d’Herbomez M., Forzy G., Gasser F. et al. Clinical evaluation of nine free thyroxine assays: persistent problems in particular populations // Clin. Chem. Lab. Med. 2003. V. 41. P. 942–947.
17. Lee R.H., Spencer C.A., Mestman J.H. et al. Free T4 immunoassays are flawed during pregnancy // Am. J. Obstet. Gynecol. 2009. V. 200. P. 260.
18. Sapin R., d’Herbomez M., Schlienger J.L. Free thyroxine measured with equilibrium dialysis and nine immunoassays decreases in late pregnancy // Clin. Lab. 2004. V. 50. P. 581–584.
19. Sapin R., d’Herbomez M. Free thyroxine measured by equilibrium dialysis and nine immunoassays in sera with various serum thyroxine-binding capacities // Clin. Chem. 2003. V. 49. P. 1531–1535.
20. Roti E., Gardini E., Minelli R. et al. Thyroid function evaluation by different commercially available free thyroid hormone measurement kits in term pregnant women and their newborns // J. Endocrinol. Invest. 1991. V. 14. P. 1–9.
Roti E., Gardini E., Minelli R. et al. Thyroid function evaluation by different commercially available free thyroid hormone measurement kits in term pregnant women and their newborns // J. Endocrinol. Invest. 1991. V. 14. P. 1–9.
21. Klee G.G., Post G. Effect of counting errors on immunoassay precision // Clin. Chem. 1989. V. 35. P. 1362–1366.
22. Levinson S.S. Antibody multi-specificity in immunoassay interference // Clin. Biochem. 1992. V. 25. P. 77–87.
23. Ward G., McKinnon L., Badrick T. et al. Heterophilic antibodies remain a problem for the immunoassay laboratory // Am. J. Clin. Pathol. 1997. V. 108. P. 417–421.
24. Toft A.D., Beckett G.J. Measuring serum thyrotropin and thyroid hormone and assessing thyroid hormone transport / In: Braverman L. E., Utiger R.D. (eds): Werner & Ingbar’s The Thyroid: A Fundamental and Clinical Text. Philadelphia: Lippincott Williams and Wilkins, 2005. P. 329–344.
E., Utiger R.D. (eds): Werner & Ingbar’s The Thyroid: A Fundamental and Clinical Text. Philadelphia: Lippincott Williams and Wilkins, 2005. P. 329–344.
25. Negro R., Formoso G., Mangieri T. et al. Levothyroxine treatment in euthyroid pregnant women with autoimmune thyroid disease: effects on obstetrical complications // J. Clin. Endocrinol. Metab. 2006. V. 91. P. 2587–2591.
26. Jonklaas J., Kahric-Janicic N., Soldin O.P., Soldin S.J. Correlations of free thyroid hormones measured by tandem mass spectrometry and immunoassay with thyroid-stimulating hormone across 4 patient populations // Clin. Chem. 2009. V. 55. P. 1380–1388.
27. Kahric-Janicic N., Soldin S.J., Soldin O.P. et al. Tandem mass spectrometry improves the accuracy of free thyroxine measurements during pregnancy // Thyroid. 2007. V. 17. P. 303–311.
2007. V. 17. P. 303–311.
28. Thienpont L.M., van Uytfanghe K., Beastall G. et al. Report of the IFCC working group for standardization of thyroid function tests, part 2: Free thyroxine and free triiodothyronine // Clin. Chem. 2010. V. 56. P. 902–911.
29. Yue B., Rockwood A.L., Sandrock T, La’ulu S.L. Free thyroid hormones in serum by direct equilibrium dialysis and online solidphase extraction-liquid chromatography/tandem mass spectrometry // Clin. Chem. 2008. V. 54. P. 642–651.
30. Haddow J.E., Palomaki G.E., Allan W.C. et al. Maternal thyroid deficiency during pregnancy and subsequent neuropsycological development of the child // N. Engl. J.Med. 1999. V. 34. P. 549–555.
31. Pop V.J., Kuijpens J.L., van Baar A.L. et al. Low maternal free thyroxine concentrations during early pregnancy are associated with impaired psychomotor development in infancy // Clin. Endocrinol. 1999. V. 50. P. 147–148.
32. Pop V.J., Brouwers E.P, Vader H.L. et al. Maternal hypothyroxinemia during early pregnancy and subsequent child development: a 3-year follow-up study // Clin. Endocrinol. 2003. V. 59. P. 282–288.
33. Vermiglio F., Lo Presti V.P., Moleti M. et al. Attention deficit and hyperactivity disorders in the offspring of mothers exposed to mild- moderate iodine deficiency disorder in developed countries // J. Clin. Endocrinol. Metab. 2004. V. 89. P. 6054–6060.
34. Kooistra L., Crawford S., van Baar A.L. et al. Neonatal effects of maternal hypothyroxinemia during early pregnancy // Pediatrics. 2006. V. 117. P. 161–167.
35. Li Y., Shan Z., Teng W. et al. Abnormalities of maternal thyroid function during pregnancy affect neuropsychological development of their children at 25-30 months // Clin. Endocrinol. 2010. V. 72. P. 825–829.
36. Henrichs J., Bongers-Schokking J.J., Schenk J.J. et al. Maternal thyroid function during early pregnancy and cognitive functioning in early childhood: the Generation R study // J. Clin. Endocrinol. Metab. 2010. V. 95. P. 4227–4234.
37. Casey B.M., Dashe J.S., Spong C.Y. et al. Perinatal significance of isolated maternal hypothyroxinemia identified in the first half of pregnancy // Obstet. Gynecol. 2007. V. 109(5). P. 1129–35.
38. Contempré B., Jauniaux E., Calvo R. et al. Detection of thyroid hormone in human embryonic cavities during the first trimester of pregnancy // J. Clin. Endocrinol. Metab. 1993. V. 77. P. 1719–1722.
39. Calvo R.M., Jauniax E., Gulbis B. et al. Fetal tissues are exposed to biologically relevant free thyroxine concentrations during early phases of development // J. Clin. Endocrinol. Metab. 2002. V. 87. P. 1768–1777.
40. Calvo R.M., Obregón M.J., Ruiz de Oña C., Escobar del Rey F., Morreale de Escobar G. Congenital hypothyroidism, as studied in rats: Crucial role of maternal thyroxine but not of 3,5,3’-triiodothyronine in the protection of the fetal brain // J. Clin. Invest. 1990. V. 86. P. 889–899.
41. Obregon M.J., Escobar del Rey F., Morreale de Escobar G. The effects of iodine deficiency on thyroid hormone deiodination // Thyroid. 2005. V. 15. P. 917–929.
42. Morreale de Escobar G., Obregon M.J., Escobar del Rey F. Maternal thyroid hormones early in pregnancy and fetal brain development // Best. Pract. Res. Clin. Endocrinol. Metab. 2004. V. 18. P. 225–248.
43. Kester M.H.A., Martínez de Mena R., Obregón M.J. et al. Iodothyronine levels in the human developing brain: Major regulatory roles of iodothyronine deiodinases in different areas // J. Clin. Endocrinol. Metab. 2004. V. 89. P. 3117–3128.
44. Lavado-Autric R., Ausó E., Garcia-Velasco J.V. et al. Early maternal hypothyroxinemia alters histogenesis and cerebral cortex cytoarchitecture of the progeny // J. Clin. Invest. 2003. V. 111. P. 1073–1082.
45. Ausó E., Lavado-Autric R., Cuevas E. et al. A moderate and transient deficiency of maternal thyroid function at the beginning of fetal neocorticogenesis alters neuronal migration // Endocrinol. 2004. V. 145. P. 4037–4047.
46. Morrreale de Escobar G., Obregуn M.J., Escobar del Rey F. Iodine deficiency and brain development in the first half of pregnancy Public // Health. Nutrit. 2007. V. 10. P. 1554–1570.
47. Morreale de Escobar G., Obregon M.J., Escobar del Rey F. Is neuropsychological development related to maternal hypothyroidism or to maternal hypothyroxinemia? // J. Clin. Endocrinol. Metab. 2000. V. 85. P. 3975–3987.
48. Berbel P., Obregón M.J., Bernal J. et al. Iodine supplementation during pregnancy: a public health challenge // Trends Endocrinol. Metab. 2007. V. 18. P. 338–343.
49. Berbel P., Mestre J.L., Santamaría A. et al. Delayed neurobehavioral development in children born to pregnant women with mild hypothyroxinemia during the first month of gestation: the importance of early iodine supplementation // Thyroid. 2009. V. 19. P. 511–519.
50. Velasco I., Carreira M., Santiago P. et al. Effect of iodine prophylaxis during pregnancy on neurocognitive development of children during the first two years of life // J. Clin. Endocrinol. Metab. 2009. V. 94. P. 3234–3241.
51. Bibbins-Domingo K., Chertow G.M., Coxson P.G. et al. Projected effect of dietary salt reductions on future cardiovascular disease // N. Eng. J. Med. 2010. V. 362. P. 590–599.
52. Soldin O.P., Pearce E.N., Stagnaro-Green A. Dietary salt reductions and cardiovascular disease // N. England. J. Med. 2010. V. 362. P. 2224.
Выраженный гипотиреоз у беременных статья на сайте Преображенской клиники
Выраженный гипотиреоз (сниженная функция щитовидной железы) у женщин, является одной из частых причин бесплодия.
Также, относительно редко дефицит гормонов щитовидной железы встречается и во время беременности, что может отрицательно влиять на течение беременности и формирование плода.
Причины
Во время беременности повышается потребность в тиреоидных гормонах (гормоны щитовидной железы), которые необходимы для нормального формирования плода. Развитию дефицита гормонов щитовидной железы способствует относительная йодная недостаточность, характерная для жителей эндемичных регионов и наличие скрытого (субклинического) гипотиреоза (снижение функции щитовидной железы) до беременности.
Симптомы гипотиреоза при беременности:
Симптомы заболевания неспецифичны и зачастую остаются незамеченными или расцениваются как проявления беременности.
- общая слабость
- сонливость
- сухость кожных покровов
- выпадение волос
- запоры
- частые инфекции
- замедление ритма сердца — менее 60 уд/мин.
Чем опасен гипотиреоз для беременной женщины:
- Неблагоприятное воздействие для развития центральной нервной системы плода и возможному нарушению умственной деятельности ребенка впоследствии.
- Нарушение формирования щитовидной железы плода – врожденный гипотиреоз у ребенка
- Гипотиреоз повышает риск спонтанных абортов и мёртворождений.
- Беременность часто осложняется анемией, преэклампсия
- Слабость родовой деятельности
- Кровотечения в послеродовом периоде
Диагностика гипотиреоза при беременности:
Для диагностики дефицита гормонов щитовидной железы во время беременности (1 раз в триместр)и своевременного лечения необходимо определение уровня тиреотропного гормона – ТТГ. Если уровень ТТГ повышен, то это указывает на пониженную функцию щитовидной железы, что может отрицательно влиять на течение беременности и формирование плода. В данном случае, с целью избежания негативных последствий, рекомендуется консультация врача-эндокринолога, для своевременного лечения.
Лечение
Лечение дефицита гормонов щитовидной железы во время беременности проводится с помощью заместительной терапии тиреоидными гормонами.
Врач-эндокринолог индивидуально подбирает дозу лекарственного препарата с дальнейшим контролем уровня ТТГ и свободного Т4 (гормона щитовидной железы) каждый триместр беременности, что позволяет снизить риск осложнений.
Профилактика
Ранняя диагностика и своевременное лечение гипотиреоза являются профилактикой осложнений беременности и развития плода при дефиците гормонов щитовидной железы.
Когда лечение субклинического гипотиреоза у беременных является оптимальным?
Рочестер, Миннесота — Беременные женщины с субклиническим гипотиреозом столкнулись с трудной дилеммой: с одной стороны, это состояние может вызвать ряд проблем со здоровьем, если его не лечить. Тем не менее, левотироксин, препарат, обычно назначаемый при умеренно недостаточной активности щитовидной железы, был связан с неблагоприятными исходами, связанными с беременностью.
Новое исследование, опубликованное в BMJ , предлагает доказательства того, что отсутствие лечения может иметь худшие последствия, чем наблюдалось ранее, включая потерю беременности.
По словам исследовательской группы, возглавляемой исследователями Mayo Clinic, результаты исследования, наряду с недавно опубликованными руководящими принципами, проясняют путь. Они отмечают, что у беременных женщин уровень тиреотропного гормона (ТТГ) обычно ниже нормы — от 0,4 до 4,0 милли-международных единиц на литр (мМЕ / л).
Когда уровень ТТГ поднимается выше этого уровня, будущие матери могут испытывать субклинический гипотиреоз, и некоторые международные руководства рекомендуют уровень не выше 2.От 5 до 3,0 мМЕ / л во время беременности.
Новое исследование показало, что лечение субклинического гипотиреоза, уровень которого ниже уровня, требующего приема лекарств у небеременных женщин, может снизить риск потери беременности, особенно для тех, у кого уровень ТТГ находится на верхнем пределе нормы или выше. Исследователи отмечают, что это может положительно повлиять на 15% беременностей.
«Недавний анализ 18 исследований показал, что беременные женщины с нелеченным субклиническим гипотиреозом имеют более высокий риск потери беременности, отслойки плаценты, преждевременного разрыва плодных оболочек и неонатальной смерти», — пояснила ведущий автор исследования Спиридула Марака, доктор медицины.
«Казалось вероятным, что лечение субклинического гипотиреоза снизит вероятность этих смертельных случаев. Но мы знаем, что лечение сопряжено с другими рисками, поэтому мы хотели найти точку, в которой преимущества перевешивают риски ».
Используя хранилище данных OptumLabs, исследователи проанализировали информацию о здоровье 5 405 беременных женщин с диагнозом субклинический гипотиреоз. Из них 843 женщины со средней концентрацией ТТГ перед лечением 4,8 мМЕ / л получали гормон щитовидной железы, а остальные 4562 женщины со средней концентрацией ТТГ перед лечением равной 3.3 мМЕ / л не лечили.
Результаты показывают, что по сравнению с группой, не получавшей лечения, женщины, принимавшие лекарства, имели на 38% меньше шансов потерпеть беременность. С другой стороны, у них была большая вероятность преждевременных родов, гестационного диабета или преэклампсии.
В свете этого, команда исследовала уровни ТТГ перед лечением, чтобы определить, есть ли момент, когда лечение будет иметь наибольшую пользу по сравнению с рисками.
«Неудивительно, что мы обнаружили, что женщины с более высоким уровнем ТТГ до лечения — между 4.1 и 10 миллимеждународных единиц на литр — наибольшая польза от лечения, — отмечает Марака. — Это привело к гораздо более низкой вероятности невынашивания беременности в этой группе, и это является хорошим аргументом в пользу обновленных клинических рекомендаций ».
По сути, при лечении женщины с более низким уровнем ТТГ (2,5–4,0 мМЕ / л) имели более высокий риск гестационной гипертензии, которая может привести к преэклампсии, чем у женщин, не получавших лечения. Не было обнаружено различий между леченными женщинами, у которых был более высокий уровень ТТГ — i.е., от 4,1 до 10 мМЕ / л — и у женщин, не получавших лечения.
«Наши результаты заставляют нас думать, что избыточное лечение возможно, — сказал соавтор Хуан Брито Кампана, MBBS. — Если уровни ТТГ находятся в диапазоне 2,5-4,0 [милли-международных единиц на литр], это может быть лучше не лечить субклинический гипотиреоз ».
Брито Кампана подчеркнул, что связь терапии левотироксином и риском связанных с беременностью неблагоприятных исходов, таких как преэклампсия или гестационный диабет, следует рассматривать как предварительные результаты, и призвал к дополнительным исследованиям, оценивающим безопасность терапии левотироксином у беременных с субклиническим гипотиреозом.
В январе Американская тироидная ассоциация опубликовала обновленное руководство по уходу с рекомендациями по лечению для женщин, страдающих заболеванием щитовидной железы во время беременности.
«Щелкните здесь, чтобы вернуться к еженедельным новостям.
Некоторым беременным следует лечить субклинический гипотиреоз
Новое исследование показывает, что женщины, получающие лечение от субклинического гипотиреоза (SCH) во время беременности, реже страдают от потери беременности, но они сталкиваются с более высоким риском таких осложнений, как преждевременные роды, гестационный диабет и преэклампсия. 1
Хотя новое исследование не разрешает продолжающиеся споры вокруг вопроса о том, следует ли беременным женщинам с SCH получать заместительную терапию тиреоидными гормонами, оно может помочь определить момент, когда лечение приводит к общей пользе и снижает риск.
«Продолжение лечения гормонами щитовидной железы для снижения риска потери беременности является разумным для женщин с концентрацией ТТГ 4,1-10,0 мМЕ / л», — сказала ведущий автор исследования Спиридула Марака, M.D., научный сотрудник клиники Мэйо и доцент Университета Арканзаса медицинских наук и системы здравоохранения ветеранов Центрального Арканзаса. «Однако, учитывая меньшую величину эффекта у женщин с более низким уровнем ТТГ 2,5–4,0 мМЕ / л, а также в свете возможного повышенного риска других нежелательных явлений, в этой группе может потребоваться приостановить лечение».
Действительно, учитывая результаты их исследования, опубликованного в The BMJ, Марака и ее соавторы выразили обеспокоенность тем, что беременные женщины, у которых уровень тиреотропного гормона (ТТГ) измеряется в 2.Диапазон 5–4,0 мМЕ / л переоценивается.
Новый набор руководящих принципов, выпущенный Американской тироидной ассоциацией (ATA), подтверждает выводы исследования BMJ . «В свете накопления доказательств того, что неблагоприятные акушерские исходы могут возникать при более низких порогах ТТГ у женщин с положительной реакцией на тиреопероксидазу (ТПО), ATA пересмотрела свои рекомендации 2011 года», — сказала Элизабет Пирс, доктор медицины, доцент медицины Школы медицины Бостонского университета. и сопредседатель рабочей группы ATA по рекомендациям по беременности.
В руководстве рекомендуется учитывать статус антител к ТПО при принятии решения о лечении субклинического гипотиреоза у беременных женщин. Лечение больше не рекомендуется женщинам с отрицательным ТПО с уровнем ТТГ в сыворотке <4,0 мМЕ / л, что отражает обеспокоенность недавнего исследования по поводу чрезмерного лечения женщин с уровнем ТТГ 2,5–4,0 мМЕ / л.
Доктор Пирс, однако, отметил, что недавнее исследование BMJ было наблюдательным и что необходимы рандомизированные контролируемые клинические испытания, чтобы окончательно определить, улучшает ли заместительная терапия щитовидной железы акушерские исходы у беременных женщин с субклиническим гипотиреозом.
В исследовании BMJ приняли участие 5 405 беременных женщин с субклиническим гипотиреозом, определяемым как нелеченные концентрации ТТГ 2,5-10 мМЕ / л, и было установлено, что у тех, кто получал терапию тироидными гормонами, вероятность потери беременности на 38% ниже, чем у тех, кто был не лечится. Но положительный эффект наблюдался только у женщин с уровнем ТТГ до лечения 4,1-10 мМЕ / л.
Снижение риска потери беременности не наблюдалось у тех, у кого уровень ТТГ до лечения составлял 2,5–4.0 мМЕ / л. Кроме того, у этой группы женщин были значительно более высокие шансы на развитие гестационной гипертензии, которая может привести к преэклампсии, чем у женщин с аналогичным уровнем ТТГ, которые не получали лечения.
Субклинический гипотиреоз — по сути, слабоактивная щитовидная железа — определяется как повышенный уровень ТТГ с одновременной нормальной концентрацией гормона щитовидной железы. По оценкам, от этого заболевания страдают до 15% беременностей в США и 14% в Европе.
Гормон щитовидной железы имеет решающее значение во время беременности для здорового развития мозга и нервной системы плода. 2 Исследования обнаружили связь между низким и высоким уровнем свободного тироксина у матери во время беременности и низким IQ у детей; исследователи также заявили, что заместительная терапия щитовидной железы (левотироксин), назначаемая при субклиническом гипотиреозе, может быть фактором риска в связи между высоким уровнем свободного тироксина у матери и низким IQ ребенка. 3 Но эти вопросы остаются нерешенными.
Явный гипотиреоз — когда уровень ТТГ повышен, а уровень свободного тироксина низкий — может вызывать тяжелые симптомы и связан с увеличением числа случаев бесплодия и выкидышей, как у женщин, которые пытаются забеременеть, так и у женщин, которые уже беременны, согласно ATA. . 4 «Совершенно очевидно, что явный гипотиреоз следует лечить заместительной терапией тироидными гормонами, обычно левотироксином».
Последнее обновление 02.12.2020
10 вещей, которые нельзя сказать тем, кто пытается забеременеть
Следует ли женщинам с субклиническим гипотиреозом получать заместительную терапию тиреоидными гормонами до и во время беременности?
РЕЗЮМЕ ИССЛЕДОВАНИЯ
При разработке своих рекомендаций авторы провели систематический поиск литературы по исследованиям английского языка, изучающим явный и субклинический гипотиреоз у беременных, которые были опубликованы в период с 1966 по 2014 год.Качество каждого исследования оценивалось с использованием стандартизированных критериев. Основываясь на своем обзоре, авторы пришли к выводу, что недостаточно доказательств того, что субклинический гипотиреоз связан с бесплодием при использовании ТТГ в диапазоне 2,5-4,0 мМЕ / л; однако имелись достоверные доказательства того, что уровни ТТГ выше 4,0 мМЕ / л были связаны с выкидышем. Также были достоверные доказательства того, что лечение субклинического гипотиреоза заместительной гормональной терапией при уровне ТТГ выше 4.0 мМЕ / л ассоциируется с улучшением частоты беременностей и снижением частоты выкидышей. Но имелись ограниченные доказательства в пользу лечения гормоном щитовидной железы, когда уровень ТТГ до беременности составлял всего от 2,5 до 4 мМЕ / л. В этом случае варианты управления включают либо мониторинг уровней и лечение при превышении ТТГ> 4 мМЕ / л, либо лечение левотироксином для поддержания ТТГ <2,5 мМЕ / л.
КАКОВЫ ПОСЛЕДСТВИЯ ЭТОГО ИССЛЕДОВАНИЯ?
Несмотря на то, что было очень мало опубликованных рандомизированных контролируемых исследований, доступных авторам для обоснования своих рекомендаций, это исследование может помочь врачам в лечении пациентов с субклиническим гипотиреозом, которые либо пытаются забеременеть, либо находятся в первом триместре беременности. .Эти рекомендации предполагают, что заместительная терапия тиреоидными гормонами у женщин с уровнем ТТГ> 4 связана с улучшением показателей беременности и снижением частоты выкидышей.
—Филип Сигал, Мэриленд
ССЫЛКИ НА БРОШЮРУ ДЛЯ ЩИТОВИДНОЙ ЖЕЛЕЗЫ
ATA
Щитовидная железа и беременность: http://www.thyroid.org/thyroid-disease-pregnancy/
Ведение женщин с субклиническим гипотиреозом во время беременности
Основные обучающие моменты
Беременным женщинам не требуется рутинное тестирование функции щитовидной железы для выявления субклинического гипотиреоза (SCH).Если проверяется функция щитовидной железы, не диагностируйте SCH, если тиреотропный гормон находится в пределах нормы для беременности или <4,0 мЕд / л.
Нет убедительных доказательств того, что SCH причиняет вред во время беременности или что лечение тироксином является полезным.
Любое лечение SCH во время беременности в настоящее время основано на доказательствах низкого качества. Можно использовать низкую начальную дозу тироксина (50 мкг), а тесты функции щитовидной железы пересматривать через 4–6 недель, чтобы убедиться в отсутствии вреда от ятрогенного тиреотоксикоза.
Необходимы дополнительные данные для информирования ведения женщин с SCH, у которых обнаружены антитела к щитовидной железе
Введение
Субклинический гипотиреоз (SCH) определяется как повышенная концентрация тиреотропного гормона (TSH) в сочетании с нормальная концентрация свободного тироксина (Т4). Систематический обзор и метаанализ показывают, что замена тироксина у небеременных взрослых с SCH не приносит пользы ни в отношении симптомов, связанных с щитовидной железой, ни в отношении качества жизни.
При беременности для определения SCH необходимы референсные интервалы для ТТГ и Т4, специфичные для гестации, или ТТГ от 4,0 до 10,0 мЕд / л. По оценкам, SCH поражает 3–5% беременных женщин. Хотя явный гипотиреоз считается вредным для беременности и лечением, благоприятным для исхода беременности и развития детства, остается неясным, распространяется ли риск и польза от лечения на субклинический спектр. В этой статье рассматривается влияние беременности на показатели щитовидной железы и функции щитовидной железы.Приведены референсные интервалы для функции щитовидной железы, в том числе новый верхний предел для ТТГ, определенный Американской тироидной ассоциацией в 2017 году. Обсуждаются исходы беременности при SCH и подробно описаны доказательства для замены тироксина.
Влияние беременности на щитовидную железу
Эндокринные и гемодинамические изменения беременности означают, что беременность часто рассматривается как физиологический «стресс-тест» для различных систем органов. Это очевидно в щитовидной железе, где общий эффект…
Смешанные взгляды на лечение субклинического гипотиреоза у беременных
Преимущества лечения явного гипотиреоза у беременных или планирующих беременность женщин очевидны, учитывая его связь с неблагоприятными исходами, включая повышенный риск преждевременных родов, потерю беременности и более низкий IQ потомства. 1 Меньше ясности в отношении материнско-фетальных и неонатальных эффектов субклинического гипотиреоза (SCH), которым, по оценкам, страдают от 4% до 8% женщин репродуктивного возраста. 1 Результаты исследований по этой теме неоднозначны: результаты многочисленных исследований, связывающих SCH с такими исходами, как бесплодие, гестационная гипертензия и низкий вес при рождении, в то время как другие результаты не показывают никаких доказательств неблагоприятных исходов. 1,2
Скрининг и лечение SCH у беременных
Продолжаются дискуссии о необходимости всеобщего скрининга дисфункции щитовидной железы во время беременности и лечения СКГ левотироксином (LT 4 ) у беременных или планирующих беременность женщин.В других взрослых популяциях руководства настоятельно не рекомендуют терапию LT 4 для SCH из-за отсутствия продемонстрированных преимуществ, за исключением пациентов с ТТГ> 20 мМЕ / л и некоторых пациентов с тяжелыми симптомами и / или в возрасте ≤30 лет. 3
У беременных женщин с SCH, различные результаты были обнаружены в исследованиях, посвященных изучению эффектов лечения LT 4 , что дополнительно ставит под сомнение, является ли SCH «заболеванием, требующим лечения, или … просто биохимическим диагнозом без клинических последствий», заявили исследователи. в обзоре 2018 года. 1 Они отметили риски чрезмерного лечения, такие как экзогенный гипертиреоз, и бремя, связанное с лечением, включая финансовые затраты, постоянное использование медицинских услуг и изменение повседневных привычек в качестве факторов, которые следует учитывать. 1
Продолжить чтение
Доказательства, по-видимому, подтверждают лучшие репродуктивные исходы с терапией LT 4 «у женщин с SCH, подвергающихся искусственным репродуктивным методам, но не у тех, кто пытается естественное зачатие», продолжили исследователи, а также более низкий риск преждевременных родов и потеря беременности у женщин с ТТГ> 4.0 мМЕ / л при лечении LT 4 . 1 «Во время консультации клиницисты и пациенты должны внимательно изучить текущие данные в контексте ценностей и предпочтений пациентов, чтобы определить, является ли начало терапии LT 4 лучшим следующим шагом», 1 они отметили.
В 2017 году Американская тироидная ассоциация (ATA) опубликовала обновленные рекомендации по ведению заболеваний щитовидной железы во время беременности. 4 Среди пунктов, касающихся SCH, «верхний предел TSH был повышен с 2.От 5 до 4,0 мМЕ / л, когда нет данных о населении, и всем беременным женщинам с концентрацией ТТГ> 2,5 мМЕ / л была рекомендована оценка [антитела к тироидной пероксидазе (TPOAb)], что повлияло на решение о лечении. . » 5
Из-за отсутствия ясности в отношении преимуществ универсального скрининга на дисфункцию щитовидной железы во время беременности, рекомендации ATA рекомендуют целенаправленное обследование пациентов с определенными факторами риска (например, признаками или симптомами дисфункции щитовидной железы или бесплодием в анамнезе). 4 Рабочая группа по разработке рекомендаций не рекомендовала ни за, ни против универсального скрининга ТТГ, за исключением женщин с известной положительной реакцией на TPOAb и женщин, планирующих пройти вспомогательную репродукцию. Однако более ранние исследования показали, что целевой подход к скринингу, основанный только на критериях высокого риска, может пропустить примерно 55% женщин с аутоиммунным тиреоидитом или гипотиреозом. 6
Различные руководящие принципы и методы
Рекомендации ATA по скринингу отличаются от рекомендаций других профессиональных обществ, в том числе рекомендаций 2012 года от Общества эндокринологов, которые рекомендовали терапию LT 4 для всех беременных с SCH независимо от статуса TPOAb и руководств 2015 года Американской коллегии акушеров и гинекологов. , при котором не рекомендовалось универсальное обследование во время беременности. 5
границ | Влияние материнского субклинического гипотиреоза на ранних сроках беременности, диагностированное по различным критериям, на неблагоприятные перинатальные исходы у китайских женщин с отрицательным TPOAb
Введение
Несмотря на хорошо известные вредные эффекты явного гипотиреоза на исходы беременности у женщин детородного возраста (1–3), влияние субклинического гипотиреоза (SCH), характеризующегося повышенным уровнем тиреотропного гормона (TSH) с нормальным тироксином (fT4 ), о неблагоприятных акушерских исходах пока четко не выявлено.Некоторые исследования показали, что SCH был связан с несколькими акушерскими осложнениями, включая преэклампсию, преждевременные роды и отслойку плаценты (4-6), тогда как другие показали, что SCH не приводил к плохим исходам беременности (7, 8). к различиям диагностических критериев SCH (разные пороговые значения ТТГ) в разных исследованиях. Поэтому в последние годы все активнее обсуждается вопрос о том, как определить SCH при беременности.
В «Руководстве Американской тироидной ассоциации (ATA) по диагностике и лечению заболеваний щитовидной железы во время беременности и в послеродовой период» 2011 г. рекомендовано, чтобы идеальный верхний предел сывороточного ТТГ составлял 2.5 мМЕ / л на ранних сроках беременности (9). Однако в последние годы несколько ученых обнаружили, что диагноз СКГ может быть гипердиагностирован у значительной части беременных, что может вызывать беспокойство у беременных женщин и, таким образом, усиливать их психологический стресс (10–12). Кроме того, активно обсуждаются результаты относительно того, может ли умеренно повышенная концентрация ТТГ привести к неблагоприятным исходам беременности (8, 13, 14). Соответственно, руководящие принципы ATA от 2017 года рекомендуют более либеральный верхний предел ТТГ на уровне 4,0 мМЕ / л для здоровых беременных женщин (15).
Однако исследований по сравнению эффектов SCH, диагностированных в рекомендациях ATA 2011 и 2017 гг. По неблагоприятным перинатальным исходам, крайне мало. И все еще недостаточно данных о текущих исследованиях, применимы ли рекомендации ATA 2017 года к китайским беременным женщинам. Таким образом, одной из целей нашего исследования было сравнение и оценка влияния различных материнских SCH, определенных критериями ATA 2011 и 2017, соответственно, в течение первого триместра, на разнообразные неблагоприятные материнские и неонатальные исходы у китайских беременных женщин с отрицательными результатами. антитела против тиреопероксидазы (TPOAbs).Кроме того, мы также исследовали, может ли умеренно повышенная концентрация ТТГ в первом триместре увеличить риск акушерских исходов.
Материалы и методы
Популяция исследования
Это было перекрестное исследование с данными из нашего предыдущего исследования (16). Вкратце, в качестве потенциальных участников были собраны 4178 беременных женщин, родивших в акушерском отделении Шестой народной больницы Шанхайского университета ЦзяоТун с января по декабрь 2016 года.Во-первых, 1542 кандидата без результатов теста функции щитовидной железы в течение 10–12 недель, 373 кандидата без результатов перорального теста на толерантность к глюкозе (OGTT) в течение 24–28 недель и 86 женщин с неполными данными были удалены. Во-вторых, также были исключены два кандидата с аномалиями анатомии репродуктивной системы и 92 кандидата с известными хроническими и аутоиммунными заболеваниями, такими как ранее существовавший диабет и хроническая гипертензия. В-третьих, в оставшихся 2083 случаях 527 кандидатов были последовательно исключены на основании последних рекомендаций ATA (9, 17), согласно которым беременные женщины с (1) известными или клинически предродовыми заболеваниями щитовидной железы и зобом, (2) текущим или предыдущим лечением антитиреоидными препаратами. или левотироксин (LT4), (3) история терапии йодом-131 или тиреоидэктомии, (4) использование лекарств, которые могут влиять на функцию щитовидной железы, (5) семейный анамнез заболеваний щитовидной железы, (6) история внешней лучевой терапии головы и шеи, (7) Концентрация ТТГ ниже нижнего предела референсного диапазона, предусмотренного тестовым набором (0.27 мМЕ / л в этом исследовании) или выше 10 мМЕ / л, (8) FT4 вне допустимого диапазона (12–22 пмоль / л в этом исследовании) и (9) уровни анти-TPOAb выше верхнего предела эталонного значения (35 KIU / L в этом исследовании). В конечном итоге к нашему исследованию присоединились 1556 беременных, отрицательных по TPOAb.
Согласно критериям ATA 2011 и 2017 гг. (9, 15) пациенты были разделены на две группы, включая эутиреоз (ЭТ) и SCH. Кроме того, чтобы проанализировать влияние умеренно повышенной концентрации ТТГ на неблагоприятные исходы беременности, все пациентки были дополнительно разделены на три группы в соответствии со значениями материнского ТТГ 0.27-2,5 мМЕ / л (нормальная группа ТТГ, n = 971), 2,5-4,0 мМЕ / л (группа с умеренно повышенным ТТГ, n = 433) и 4,0-10 мМЕ / л (ТТГ значительно повышенная группа, п = 152). Наше исследование было одобрено этическим комитетом Шестой народной больницы Шанхайского университета Цзяотун, и индивидуальное письменное согласие было получено от субъектов.
Сбор данных
Были получены подробные данные о возрасте матери, росте и массе тела до беременности, первородстве, количестве беременностей и предыдущих родов, гестационном возрасте, прибавке в весе во время беременности, поле новорожденного, массе и росте при рождении, показателях Апгар, а также о неблагоприятных исходах беременности из их медицинских карт.Индекс массы тела до беременности (ИМТ) был равен весу, разделенному на квадрат роста (кг / м 2 ).
Лабораторные исследования
Образец крови был взят у каждого участника после ночного голодания в течение 10–12 недель. TSH, FT4 и TPOAb измеряли с помощью хемилюминесцентного иммуноанализа (Roche Cobas 6000; Roche Ltd., Базель, Швейцария). Стандартный OGTT 75 г проводился на 24–28 неделе беременности после 8–10-часового голодания.
Результаты и диагностические критерии
В наших результатах были получены исходы как для матери, так и для новорожденного.А гипертензия, вызванная беременностью (PIH), преэклампсия, GDM, кесарево сечение (CS), преждевременные роды, послеродовое кровотечение, предлежание и отслойка плаценты и дистоция были показаны в наших исходах для матери, и одно или несколько из вышеперечисленных осложнений привели к общие неблагоприятные исходы для матери. Более того, низкая масса тела при рождении, преждевременные роды, макросомия, дистресс плода, асфиксия плода, деформации плода и мертворождение проявлялись в наших неонатальных исходах, и один или несколько вышеперечисленных признаков привели к общим неблагоприятным неонатальным исходам.Приведенные выше определения уже были определены в нашем раннем исследовании [(16), дополнительная таблица 1].
Рекомендации ATA 2011 определяют SCH во время беременности как ТТГ> 2,5 мЕд / л при нормальном уровне FT4 (9), а беременные женщины с TSH> 4,0 мЕ / л с нормальным уровнем FT4 были определены как SCH в соответствии с рекомендациями ATA 2017 г. (15 ). Кроме того, в этом исследовании нормальные контрольные диапазоны уровней FT4 и анти-TPOAb, обеспечиваемые тестовым набором, составляли 12–22 пмоль / л и 35 KIU / л соответственно.
Статистический анализ
Данные были проанализированы с помощью SPSS 19.0 программное обеспечение. Данные были представлены в виде среднего значения ± стандартное отклонение или медианы с межквартильным размахом или частотой в соответствии с приведенными ниже правилами. Сначала была проверена нормальность для непрерывных переменных. Был использован тест t , и переменные были представлены как среднее ± стандартное отклонение, если данные показали нормальное распределение, тогда как использовался тест Манна-Уитни U , и переменные были представлены как медиана с межквартильным размахом, если нет. Во-вторых, использовался тест χ 2 , и переменные были продемонстрированы в виде абсолютных чисел (процентов) по категориальным переменным.Кроме того, для оценки различий в категориальных переменных была проведена бинарная логистическая регрессия. P <0,05 (двусторонний) считался статистически значимым, тогда как P <0,10 (двусторонний) считался очевидным для статистических тенденций.
Результаты
Основные характеристики беременных женщин и их потомков по различным стандартам SCH
Из всех 1556 женщин, включенных в исследование, средний возраст составлял 29 (27–33) лет, а средний ИМТ до беременности был 21.48 (19,56–24,34) кг / м 2 . А основные характеристики беременных женщин и их новорожденных по разным стандартам SCH показаны в таблице 1. Согласно критериям ATA 2011 года 971 женщина входила в группу ET, а 585 женщин — в группу SCH, а женщины с диагнозом SCH имели значительно более низкий возраст матери, ИМТ перед беременностью и более высокий срок беременности по сравнению с этими субъектами ET (все P <0,05). Согласно критериям ATA 2017, было 1404 беременных женщины с ET и 152 SCH, а у женщин с SCH на ранних сроках беременности были более низкие ИМТ перед беременностью и масса новорожденных при рождении, а также более высокий возраст гестации по сравнению с женщинами с ET (все P <0.05).
Таблица 1 . Характеристика беременных и их потомков по разным стандартам СЧЗ.
Ассоциация материнской SCH и неблагоприятных исходов беременности по стандартам ATA 2011
Как показано в таблице 2, на основе рекомендаций ATA 2011 г., по сравнению с группой ET, распространенность и риски PIH [3,8 против 1,5%, отношение шансов (OR) = 4,27, 95% доверительный интервал (CI) = 1,95 –9,33], преэклампсии (2,1 против 0,5%, OR = 7,40, 95% ДИ = 2,08–26,35) и младенцев с низкой массой тела при рождении (4.3 по сравнению с 2,7%, OR = 1,93, 95% CI = 1,02–3,62) были значительно выше в группе SCH после учета вмешивающихся факторов. В группе SCH наблюдалась тенденция к росту рисков КС (36,9 против 36,4%, OR = 1,25, 95% CI = 0,98–1,59) и предлежания плаценты (1,9 против 1,3%, OR = 2,21, 95%). CI = 0,92–5,32) в отличие от группы ET. Однако не было обнаружено явных различий в частоте GDM, преждевременных родов, послеродового кровотечения, отслойки плаценты, дистоции, макросомии, дистресса плода, асфиксии плода, деформаций плода, мертворождения и общих неблагоприятных исходов для матери и новорожденного.
Таблица 2 . Связь материнского SCH и неблагоприятных исходов беременности согласно стандарту ATA 2011.
Ассоциация материнской SCH и неблагоприятных исходов беременности в соответствии со стандартами ATA 2017
Как показано в таблице 3, согласно руководящим принципам ATA 2017, беременные женщины с SCH чаще имели PIH (6,6 против 1,9%, OR = 5,16, 95% CI = 2,30–11,54), преэклампсию (5,3 против 0,6 %, OR = 10,91, 95% CI = 3,72–32,01), CS (42,1 против 36%, OR = 1.68, 95% ДИ = 1,16–2,42), преждевременные роды (53,9 против 47,2%, ОШ = 1,65, 95% ДИ = 1,16–2,37) и предлежание плаценты (3,3 против 1,4%, ОШ = 4,12, 95% ДИ = 1,42–11,97), чем дети с ЭТ, и их младенцы были более склонны к более низкой массе тела при рождении (5,9 против 3%, OR = 2,19, 95% ДИ = 1,00–4,80) и испытывали дистресс плода (3,9 против 1,9%). , OR = 2,27, 95% ДИ = 0,89–5,78). Более того, мы наблюдали, что распространенность и риски общих неблагоприятных исходов для матери (69,1 против 62,5%, OR = 1,61, 95% ДИ = 1,10–2,34) и неонатальных исходов (58.6 по сравнению с 51,5%, OR = 1,71, 95% CI = 1,19–2,44) у женщин, у которых была диагностирована SCH, продемонстрировал заметный рост по сравнению с женщинами с ET даже после поправки на соответствующие факторы. Однако не было значительных различий в распространенности ГСД, послеродового кровотечения, отслойки плаценты, дистоции, макросомии, асфиксии плода, деформаций плода и мертворождения между двумя группами.
Таблица 3 . Связь материнского SCH и неблагоприятных исходов беременности согласно стандарту ATA 2017.
Сравнение основных характеристик и частоты неблагоприятных исходов беременности между SCH, определенными стандартами ATA 2011 и 2017 годов
Основные характеристики и частота материнских и неонатальных исходов сравниваются между SCH, определенными стандартами ATA 2011 и 2017 (Таблица 4). Между стандартами ATA 2011 и 2017 гг. Разницы в основных характеристиках не было. Распространенность преэклампсии у женщин с СКГ, диагностированной по стандартам АТА 2017 г., составила 5%.3%, что было значительно выше, чем у женщин с SCH, диагностировали стандарты ATA 2011 года на уровне 2,1% даже с учетом других традиционных факторов риска. И мы также обнаружили, что у женщин с SCH, определенных стандартами ATA 2017 года, наблюдались повышенные тенденции в распространенности CS (42,1 против 36,9%), преждевременных родов (53,9 против 47,4%), общего количества неблагоприятных материнских заболеваний (69,1 против 62,2%) и исходы новорожденных (58,6 против 51,1%), чем те, которые определены стандартами АТА 2011 г., хотя между ними не наблюдалось статистически значимых различий.Однако распространенность других неблагоприятных исходов беременности существенно не различалась между двумя группами.
Таблица 4 . Сравнение основных характеристик и частоты неблагоприятных исходов беременности между SCH, определенными стандартами ATA 2011 и 2017 гг.
Ассоциация материнского уровня ТТГ и неблагоприятных исходов беременности
В таблице 5 показаны ассоциации уровней ТТГ у матери и неблагоприятных исходов беременности, классифицированные по значениям ТТГ матери.Во-первых, за исключением PIH (2,8 против 1,5%, OR = 2,99, 95% CI = 1,24–7,23), почти не наблюдалось корреляции между неблагоприятными исходами беременности между группой с нормальным уровнем ТТГ (0,27–2,5 мМЕ / л) и умеренной группа с повышенным уровнем ТТГ (2,5–4,0 мМЕ / л) после поправки на возможные факторы, влияющие на результат. Во-вторых, по сравнению с группой с умеренно повышенным ТТГ и группой с нормальным ТТГ, группа со значительно повышенным ТТГ (4,0-10 мМЕ / л) демонстрировала значительно более высокие уровни заболеваемости и риска ПВГ (6,6 против 2,8 против 1,5%), преэклампсии (5 .3 против 0,9 против 0,5%), КС (42,1 против 35,1 против 36,4%), преждевременных родов (53,9 против 45 против 48,2%) и общей неблагоприятной материнской (58,6 против 48,5 против 52,8%) и исходы новорожденных (69,1 против 60 против 63,5%). В-третьих, по сравнению с группой с нормальным ТТГ, в группе со значительно повышенным ТТГ были значительно увеличены показатели и риски предлежания плаценты (3,3 против 1,3%, OR = 4,79, 95% ДИ = 1,53–14,93) и низкой массы тела при рождении (5,9 против 1,3%). 2,7%, OR = 2,64, 95% CI = 1,14–6,14), тогда как при сравнении с группой с умеренно повышенным уровнем ТТГ таких различий обнаружено не было.Наконец, не было обнаружено статистически значимых различий в распространенности и рисках ГСД, послеродового кровотечения, отслойки плаценты, дистоции, макросомии, дистресса плода, асфиксии плода, деформаций плода и мертворождения среди этих трех групп.
Таблица 5 . Связь материнского ТТГ с неблагоприятными исходами беременности.
Обсуждение
Чрезвычайно высокие уровни циркулирующего хорионического гонадотропина человека вместе с повышенным синтезом тироксин-связывающего глобулина в первом триместре могут вызвать изменение материнских гормонов щитовидной железы и привести к различным заболеваниям щитовидной железы (18).В некоторых исследованиях обнаружено неблагоприятное влияние аномальных заболеваний щитовидной железы у матери на исходы беременности (1, 19, 20). Тем не менее, связь между материнским SCH во время беременности и неблагоприятными акушерскими исходами все еще остается неясной, что в последнее время также вызывает все большую озабоченность эндокринологов и гинекологов. Поэтому мы провели настоящее исследование, чтобы оценить и сравнить влияние материнской SCH, диагностированной в соответствии с рекомендациями ATA 2011 и 2017 годов, на неблагоприятные перинатальные исходы на ранних сроках беременности у беременных женщин, отрицательных по TPOAb.Насколько нам известно, это первый случай систематического сравнения распространенности и рисков неблагоприятных исходов для матери и плода с помощью различных диагностических критериев SCH в здоровой популяции беременных.
В текущем исследовании беременные женщины с SCH, которым был поставлен диагноз в соответствии с рекомендациями ATA 2011 и 2017 годов, последовательно демонстрировали значительно более высокие уровни заболеваемости и риска PIH и преэклампсии в первом триместре по сравнению с беременными женщинами с эутиреозом. Что еще более интересно, мы обнаружили, что частота преэклампсии, но не ПВГ, была значительно выше у женщин с СКГ, определенных руководящими принципами АТА 2017 года, чем у женщин с СКГ, диагностированных в соответствии с руководящими принципами АТА 2011 года, после учета различных сопутствующих факторов, которые показали, что повышенная концентрация ТТГ может быть связано с тяжестью гестационной гипертензии.В соответствии с нами, Wu et al. (21) обнаружили, что у китайских беременных женщин с диагнозом СКГ в первом и втором триместрах вероятность развития гипертонических расстройств во время оставшейся части беременности выше. Подобно нам, другое популяционное исследование с участием 24883 латиноамериканских женщин показало, что частота гипертонии в группе SCH, определенная по уровням ТТГ более 4,13 мМЕ / л, составляла 10,9%, что было значительно выше, чем в группе эутиреоидов (6).2% (4), в то время как отличается от нас и Wu et al. (21). Была единственная оставшаяся значимая связь между SCH и тяжелой преэклампсией после поправки на смешивающие факторы в их исследовании. Возможное объяснение различия заключалось в том, что последний не учитывал время скрининга функции щитовидной железы и статус TPOAb. Механизм заметной связи между SCH и связанной с беременностью гипертензией был частично прояснен молекулярным исследованием, которое продемонстрировало, что люди с SCH характеризовались нарушением связанной с эндотелием вазодилатации из-за снижения доступности оксида азота, и это изменение может быть обращено вспять. добавлением LT4 (22).
Еще одним интересным и неожиданным открытием было то, что женщины с SCH, определенные критериями ATA 2017 года, демонстрировали значительно более высокие риски развития CS, предлежания плаценты, преждевременных родов и общих неблагоприятных исходов беременности по сравнению с эутиреоидными женщинами, тогда как у женщин не наблюдалось таких заметных ассоциаций. с SCH, диагностированным по критериям ATA 2011. Риски вышеуказанных осложнений беременности в отношении материнской SCH были ранее изучены с противоречивыми выводами о том, что несколько исследований показали положительную связь SCH с неблагоприятными исходами беременности (5, 23), тогда как другие не продемонстрировали повышенных рисков между ними (7, 21). .Например, Su et al. (5) обнаружили, что SCH, определяемый как уровень ТТГ, превышающий 95-й процентиль (не менее 3,77 мМЕ / л) в первые 20 недель беременности, может привести к 3,32 (1,22–9,05) -кратному риску преждевременных родов. Но Ву и др. (21) сообщили, что не было отмечено статистических различий в преждевременных родах между женщинами с SCH (ТТГ выше 95-го перцентиля) и эутиреоидными женщинами в первом триместре. Следовательно, разные пороговые значения и определения SCH, приводящие к разным перинатальным исходам среди одной и той же группы в нашем настоящем исследовании, могут хорошо объяснить эти расхождения.В соответствии с нашими выводами, Nazarpour et al. (24) обнаружили, что LT4 может точно снизить риск преждевременных родов с использованием порогового значения TSH ≥4,0 мМЕ / л, в то время как не было положительного эффекта от терапии LT4 в снижении этого осложнения у женщин с SCH с отрицательным TPOAb с пороговым значением TSH 2,5. мМЕ / л.
Кроме того, мы также обнаружили, что женщины с SCH, диагностированным в соответствии со стандартами ATA 2011 года, подвергались значительно большему риску родов с низкой массой тела, как и результаты, полученные Leung et al.(25). Но такой связи не обнаружено среди женщин с SCH, диагностированным по стандартам ATA 2017; даже частота случаев низкой массы тела при рождении среди женщин с SCH, диагностированной по стандартам ATA 2011 г., была почти в два раза выше, чем у эутиреоидных женщин, что позволяет предположить, что SCH, диагностированная по стандартам ATA 2011 г., может предсказать небольшую часть неблагоприятных исходов беременности, и вмешательства, необходимые для уменьшения этих нежелательных явлений, все еще заслуживают дальнейшего изучения.
Однако мы не обнаружили, что SCH, диагностированный в соответствии с рекомендациями ATA 2011 или 2017, увеличивал риск GDM, послеродового кровотечения, отслойки плаценты, дистоции, макросомии, асфиксии плода, дистресса плода, деформаций плода и развития мертворождения.Тудела и др. (26) документально подтвердили, что вероятность ГСД заметно возрастает с повышенным уровнем ТТГ, но, как и у нас, не наблюдалось значительной связи у пациентов с СКГ после поправки на вмешивающиеся факторы. Аналогичным образом Krassas et al. (27) и Matalon et al. (28) выявили отсутствие связи между SCH и послеродовым кровотечением, хотя Feldthusen et al. (23) наблюдали значительно более высокую распространенность послеродовых кровотечений у женщин с SCH, чем у эутиреоидных женщин в первом триместре, без корректировки мешающих факторов, таких как ИМТ.Кроме того, значимая связь SCH с отслойкой плаценты наблюдалась только в одном исследовании (29), тогда как в нашем и других исследованиях этого не было обнаружено (30, 31). Chen et al. (31) также показали, что не было отмечено значительных различий в отношении GDM, отслойки плаценты, дистресса плода, мертворождения и пороков развития между группами SCH и эутиреоидом в первом триместре. Wu et al. (21) также сообщили, что не было статистических различий в GDM, дистрессе плода, перинатальной смертности и массе тела при рождении более 4000 г между группами SCH и эутиреоидными в первом триместре после контроля мешающих параметров.
В настоящее время остается спорным вопрос о том, связана ли умеренно повышенная концентрация ТТГ с акушерскими осложнениями. В некоторых исследованиях сообщается, что умеренно повышенный уровень ТТГ положительно коррелирует с множественными возможными гестационными осложнениями, такими как самопроизвольный аборт, GDM (26, 32). Например, проспективное исследование, проведенное Negro et al. На беременных женщинах южной Италии с отрицательным TPOAb. (32) обнаружили значительно более высокий уровень спонтанной потери плода у беременных с уровнем ТТГ между 2.5 и 5 мМЕ / л в первом триместре по сравнению с таковыми с ТТГ <2,5 мМЕ / л. Однако Ли и др. (14) и Rosario et al. (13) утверждали, что не было никакой связи между TPOAb-отрицательными женщинами с концентрацией ТТГ от 2,5 до 4,0 мМЕ / л в течение первых триместров и частотой зарегистрированных неблагоприятных исходов беременности без учета других факторов. В соответствии с исследованиями Li et al. (14) и Rosario et al. (13), до внесения поправки на потенциальные факторы риска наши результаты показали, что не наблюдалось статистической значимости между умеренно повышенной концентрацией ТТГ и различными акушерскими осложнениями у китайских беременных женщин, отрицательных по TPOAb.Тем не менее, мы обнаружили значительную связь между умеренно повышенным уровнем ТТГ и ИПГ после корректировки на другие факторы, что позволило предположить, что эти дополнительные переменные могут действовать как факторы сложения. Когда мы их скорректировали, связь между слегка повышенным ТТГ и PIH была очевидна. Таким образом, наше текущее исследование также предоставило доказательства того, что умеренно повышенная концентрация ТТГ заметно связана только с небольшой частью неблагоприятных исходов беременности.
Напротив, мы обнаружили, что беременные с ТТГ> 4.0 мМЕ / л имел значительно более высокую частоту и риски ПВГ, преэклампсии, КС, преждевременных родов и общих неблагоприятных исходов для матери и новорожденного по сравнению с пациентами с ТТГ <2,5 мМЕ / л и ТТГ от 2,5 до 4 мМЕ / л. А у женщин с ТТГ> 4,0 мМЕ / л наблюдались значительно более высокие показатели и риски предлежания плаценты и родов с низкой массой тела по сравнению с женщинами с ТТГ <2,5 мМЕ / л. Эти результаты показали, что беременные женщины с ТТГ> 4,0 мМЕ / л значительно связаны с большей частью неблагоприятных исходов беременности.Как и мы, Arbib et al. (33) показали, что женщины с ТТГ 2,5–4,0 мМЕ / л и> 4,0 мМЕ / л последовательно имели риск преждевременных родов в 1,81 и 2,33 раза даже при учете других традиционных факторов риска. Исследование Carty et al. (8) также продемонстрировали, что женщины с ТТГ> 5 мЕд / л рожали младенцев с более низкой массой тела при рождении, чем у женщин с ТТГ <2,5 мЕд / л. Однако в их исследовании не было различий по преэклампсии, КС, преждевременным родам, что отличалось от нашего и может быть объяснено тем фактом, что беременные женщины в нашем исследовании имели более высокую распространенность КС, чем в исследовании Carty et al.(8). Кроме того, женщины с уровнем ТТГ> 5 мЕд / л в исследовании Carty et al. включены некоторые женщины с уровнем FT4 ниже референсного диапазона небеременных (9–21 пмоль / л). Таким образом, наши вышеупомянутые результаты дополнительно подкрепляют и расширяют текущую совокупность доказательств, предполагающих, что SCH, диагностированный в соответствии со стандартами ATA 2017 года, был склонен к скринингу китайских беременных женщин с высоким риском по сравнению с руководящими принципами ATA 2011 года.
Кроме того, наши результаты были получены от китайских беременных женщин с отрицательным TPOAb, что предоставило надежные доказательства в поддержку мнения Rotondi et al.(34). Они считали, что в рекомендациях ATA от 2017 года чрезмерно подчеркивается статус аутоантител к щитовидной железе, и рекомендовалось лечение LT4 у беременных женщин с уровнем ТТГ в диапазоне от верхнего предела референсного диапазона до 10,0 мкМЕ / мл независимо от их статуса антител к щитовидной железе. И наше настоящее исследование также подтвердило, что некоторые пагубные эффекты материнской SCH могут действительно присутствовать даже у женщин с отрицательными тестами на TPOAb. Это можно объяснить тем фактом, что антитела к щитовидной железе могут быть ложноотрицательными во время беременности и что хронический аутоиммунный тиреоидит с отрицательными сывороточными аутоантителами к щитовидной железе является хорошо известной клинической картиной даже вне беременности (35, 36).
Наше исследование имеет некоторые ограничения. Во-первых, исследуемая популяция этих результатов — китайцы, и, следовательно, могут потребоваться дополнительные исследования, чтобы проверить, можно ли распространить эти результаты на другие группы населения. Во-вторых, долгосрочные результаты у потомства, такие как IQ, не рассматриваются в нашем исследовании, поскольку мы проводим исследования только для изучения акушерских исходов. В-третьих, мы не рассматривали влияние антител к тиреоглобулину на исход беременности и не оценивали влияние SCH в разных триместрах на материнский и перинатальный исходы.
Выводы
В целом, наши результаты расширили и улучшили предыдущую работу и показали, что материнский SCH, диагностированный в соответствии с рекомендациями ATA 2017 г., увеличивает риск множественных неблагоприятных исходов беременности, тогда как материнский SCH, диагностированный в соответствии с рекомендациями ATA 2011 г., был связан только с небольшой частью неблагоприятных исходов беременности исходы у китайских здоровых беременных женщин с отрицательным TPOAb на ранних сроках беременности. Более того, наше текущее исследование также предоставило доказательства того, что умеренно повышенная концентрация ТТГ заметно связана с ИПГ даже после корректировки.Наши результаты показывают, что рекомендации ATA 2017 года могут быть более применимы к китайским беременным женщинам для скрининга воздействия SCH на большинство неблагоприятных исходов у матери и новорожденного, тогда как рекомендации ATA 2011 года более подходят для оценки воздействия SCH на небольшую часть неблагоприятных исходов. исходы беременности, такие как ПВГ, преэклампсия и низкая масса тела при рождении.
Заявление о доступности данных
Необработанные данные, подтверждающие выводы этой статьи, будут предоставлены авторами без излишних оговорок.
Заявление об этике
Исследования с участием людей были рассмотрены и одобрены Шестой народной больницей Шанхайского университета Цзяо-Тонг. Пациенты / участники предоставили письменное информированное согласие на участие в этом исследовании.
Авторские взносы
L-XL разработал исследование, отредактировал и отредактировал рукопись. Л.М. вела акушерско-хирургическую клиническую практику. YZ, T-PY и J-FK собрали образцы и клинические данные.YL провел статистический анализ. M-FL и Q-MF работали вместе и написали рукопись. Все авторы отредактировали рукопись и одобрили окончательную рукопись.
Финансирование
Эта работа финансировалась грантами Национального плана ключевых исследований и разработок (2018YFC1314900 и 2018YFC1314905) и Национального фонда естественных наук Китая (81170759, 81770813 и 81502316).
Конфликт интересов
Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могут быть истолкованы как потенциальный конфликт интересов.
Дополнительные материалы
Дополнительные материалы к этой статье можно найти в Интернете по адресу: https://www.frontiersin.org/articles/10.3389/fendo.2020.580380/full#supplementary-material
Список литературы
1. Назарпур С., Рамезани Т.Ф., Симбар М., Азизи Ф. Дисфункция щитовидной железы и исходы беременности. Иран J Reprod Med. (2015) 13: 387–96.
PubMed Аннотация | Google Scholar
2. Брайант С.Н., Нельсон Д.Б., Макинтайр Д.Д., Кейси Б.М., Каннингем Ф.Г.Анализ популяционного пренатального скрининга явного гипотиреоза. Am J Obstet Gynecol. (2015) 213: 565.e1–6. DOI: 10.1016 / j.ajog.2015.06.061
PubMed Аннотация | CrossRef Полный текст | Google Scholar
3. Донг А.С., Стагнаро-Грин А. Различия в диагностических критериях скрывают истинную распространенность заболеваний щитовидной железы у беременных: систематический обзор и метаанализ. Щитовидная железа. (2019) 29: 278–89. DOI: 10.1089 / th.2018.0475
PubMed Аннотация | CrossRef Полный текст | Google Scholar
4.Уилсон К.Л., Кейси Б.М., Макинтайр Д.Д., Халворсон Л.М., Каннингем Ф.Г. Субклинические заболевания щитовидной железы и частота гипертонии у беременных. Obstet Gynecol. (2012) 119: 315–20. DOI: 10.1097 / AOG.0b013e318240de6a
PubMed Аннотация | CrossRef Полный текст | Google Scholar
5. Су ПЙ, Хуан К., Хао Дж. Х., Сюй У., Янь С. К., Ли Т. и др. Функция щитовидной железы матери в первые двадцать недель беременности и последующее развитие плода и младенца: проспективное популяционное когортное исследование в Китае. J Clin Endocrinol Metab. (2011) 96: 3234–41. DOI: 10.1210 / jc.2011-0274
PubMed Аннотация | CrossRef Полный текст | Google Scholar
6. Фан Х, Ву Л. Влияние аномалий щитовидной железы во время беременности на последующее нейропсихологическое развитие потомства: метаанализ. J Matern Fetal Neonatal Med. (2016) 29: 3971–6. DOI: 10.3109 / 14767058.2016.1152248
PubMed Аннотация | CrossRef Полный текст | Google Scholar
7.Клири-Голдман Дж., Мэлоун Ф. Д., Ламберт-Мессерлиан Дж., Салливан Л., Каник Дж., Портер Т. Ф. и др. Гипофункция щитовидной железы матери и исход беременности. Obstet Gynecol. (2008) 112: 85–92. DOI: 10.1097 / AOG.0b013e3181788dd7
PubMed Аннотация | CrossRef Полный текст | Google Scholar
8. Карти Д.М., Дуган Ф., Уэлш П., Доминичак А.Ф., Деллес С. Тиреотропный гормон (ТТГ) ≥2,5 мЕд / л на ранних сроках беременности: распространенность и последующие исходы. евро J Obstet Gynecol Reprod Biol .(2017) 210: 366–69. DOI: 10.1016 / j.ejogrb.2017.01.048
PubMed Аннотация | CrossRef Полный текст | Google Scholar
9. Стагнаро-Грин А., Абалович М., Александр Э., Азизи Ф., Местман Дж., Негр Р. и др. Рекомендации Американской ассоциации щитовидной железы по диагностике и лечению заболеваний щитовидной железы во время беременности и в послеродовом периоде. Щитовидная железа . (2011) 21: 1081–125. DOI: 10.1089 / th.2011.0087
PubMed Аннотация | CrossRef Полный текст | Google Scholar
10.Ли Ц, Шань З., Мао Дж., Ван В., Се Х, Чжоу В. и др. Оценка функции щитовидной железы во время беременности в первом триместре: каков рациональный верхний предел сывороточного ТТГ в первом триместре у китайских беременных женщин? Дж. Клин Эндокринол Метаб . (2014) 99: 73–79. DOI: 10.1210 / jc.2013-1674
PubMed Аннотация | CrossRef Полный текст | Google Scholar
13. Rosario PW, Carvalho M, Calsolari MR. Референсные значения ТТГ в первом триместре беременности и корреляция между материнским ТТГ и акушерскими и неонатальными исходами: проспективное бразильское исследование. Метаб эндокринола Arch . (2016) 60: 314–8. DOI: 10.1590 / 2359-3997000000132
PubMed Аннотация | CrossRef Полный текст | Google Scholar
14. Li P, Lin S, Li L, Cui J, Zhou S, Fan J. Влияние слегка повышенного тиреотропного гормона в первом триместре на неблагоприятные исходы беременности. BMC Endocr Disord . (2018) 18:64. DOI: 10.1186 / s12902-018-0294-7
PubMed Аннотация | CrossRef Полный текст | Google Scholar
15. Александр EK, Пирс EN, Brent GA, Brown RS, Chen H, Dosiou C, et al.Рекомендации Американской ассоциации щитовидной железы по диагностике и лечению заболеваний щитовидной железы во время беременности и в послеродовом периоде от 2017 г. Щитовидная железа . (2017) 27: 315–89. DOI: 10.1089 / th.2016.0457
PubMed Аннотация | CrossRef Полный текст | Google Scholar
16. Li MF, Ma L, Yu TP, Zhu Y, Chen MY, Liu Y, et al. Неблагоприятные исходы для беременных и новорожденных с нарушением метаболизма глюкозы. Diabetes Res Clin Pract. (2020) 161: 108085. DOI: 10.1016 / j.diabres.2020.108085
PubMed Аннотация | CrossRef Полный текст | Google Scholar
17. Гарбер Дж. Р., Кобин Р. Х., Гариб Х., Хеннесси Дж. В., Кляйн И., Механик Дж. И. и др. Руководство по клинической практике гипотиреоза у взрослых: при поддержке Американской ассоциации клинических эндокринологов и Американской ассоциации тиреоидов. Щитовидная железа . (2012) 22: 1200–35. DOI: 10.1089 / th.2012.0205
PubMed Аннотация | CrossRef Полный текст | Google Scholar
18.Feldt-Rasmussen U, Mathiesen ER. Эндокринные нарушения при беременности: физиологические и гормональные аспекты беременности. Best Practices Clin Endocrinol Metab . (2011) 25: 875–84. DOI: 10.1016 / j.beem.2011.07.004
PubMed Аннотация | CrossRef Полный текст | Google Scholar
19. Budenhofer BK, Ditsch N, Jeschke U, Gärtner R, Toth B. (дис-) функция щитовидной железы при нормальной и нарушенной беременности. Arch Gynecol Obstet . (2013) 287: 1–7. DOI: 10.1007 / s00404-012-2592-z
PubMed Аннотация | CrossRef Полный текст | Google Scholar
20.Кумру П., Эрдогду Э., Арисой Р., Демирчи О., Озкорал А., Ардик С. и др. Влияние дисфункции щитовидной железы и аутоиммунитета на исходы беременности в популяции с низким риском. Arch Gynecol Obstet . (2015) 291: 1047–54. DOI: 10.1007 / s00404-014-3533-9
PubMed Аннотация | CrossRef Полный текст | Google Scholar
21. Wu MQ, Liu J, Wang YQ, Yang Y, Yan CH, Hua J. Влияние субклинического гипотиреоза на неблагоприятные перинатальные исходы и роль скрининга щитовидной железы во время беременности. Передний эндокринол . (2019) 10: 522. DOI: 10.3389 / fendo.2019.00522
PubMed Аннотация | CrossRef Полный текст | Google Scholar
22. Таддеи С., Караччио Н., Вирдис А., Дардано А., Версари Д., Гиадони Л. и др. Нарушение эндотелий-зависимой вазодилатации при субклиническом гипотиреозе: положительный эффект терапии левотироксином. Дж. Клин Эндокринол Метаб . (2003) 88: 3731–7. DOI: 10.1210 / jc.2003-030039
PubMed Аннотация | CrossRef Полный текст | Google Scholar
23.Фельдтхузен А.Д., Ларсен Дж., Педерсен П.Л., Тофт Кристенсен Т., Кветни Дж. Вызванные беременностью изменения митохондриальной функции у эутиреоидных беременных женщин и беременных с субклиническим гипотиреозом; отношение к неблагоприятному исходу. Дж. Клин Транс Эндокринол . (2013) 1: e13–7. DOI: 10.1016 / j.jcte.2013.12.003
PubMed Аннотация | CrossRef Полный текст | Google Scholar
24. Назарпур С., Рамезани Теграни Ф., Симбар М., Тохиди М., Минои С., Рахмати М. и др. Влияние левотироксина на беременных с субклиническим гипотиреозом, отрицательным по антителам к тироидной пероксидазе. Дж. Клин Эндокринол Метаб . (2018) 103: 926–35. DOI: 10.1210 / jc.2017-01850
PubMed Аннотация | CrossRef Полный текст | Google Scholar
26. Тудела С.М., Кейси Б.М., Макинтайр Д.Д., Каннингем Ф.Г. Связь субклинического заболевания щитовидной железы с частотой гестационного диабета. Акушерский гинекол . (2012) 119: 983–8. DOI: 10.1097 / AOG.0b013e318250aeeb
PubMed Аннотация | CrossRef Полный текст | Google Scholar
28. Маталон С., Шейнер Э., Леви А., Мазор М., Визнитцер А.Взаимосвязь лечения гипотиреоза матери и перинатального исхода. Дж Репрод Мед . (2006) 51: 59–63.
PubMed Аннотация | Google Scholar
29. Кейси Б.М., Даше Дж.С., Уэллс С.Е., Макинтайр Д.Д., Берд В., Левено К.Дж. и др. Субклинический гипотиреоз и исходы беременности. Акушерский гинекол . (2005) 105: 239–45. DOI: 10.1097 / 01.AOG.0000152345.99421.22
PubMed Аннотация | CrossRef Полный текст | Google Scholar
30. Männistö T, Vääräsmäki M, Pouta A, Hartikainen AL, Ruokonen A, Surcel HM, et al.Дисфункция щитовидной железы и аутоантитела во время беременности как прогностические факторы осложнений беременности и материнской заболеваемости в более позднем возрасте. Дж. Клин Эндокринол Метаб . (2010) 95: 1084–94. DOI: 10.1210 / jc.2009-1904
PubMed Аннотация | CrossRef Полный текст | Google Scholar
31. Chen LM, Du WJ, Dai J, Zhang Q, Si GX, Yang H, et al. Влияние субклинического гипотиреоза на материнские и перинатальные исходы во время беременности: одноцентровое когортное исследование китайского населения. PLOS ONE . (2014) 9: e109364. DOI: 10.1371 / journal.pone.0109364
PubMed Аннотация | CrossRef Полный текст | Google Scholar
32. Negro R, Schwartz A, Gismondi R, Tinelli A, Mangieri T., Stagnaro-Green A. Повышенная частота выкидышей у женщин с отрицательными антителами к щитовидной железе с уровнем ТТГ от 2,5 до 5,0 в первом триместре беременности. Дж. Клин Эндокринол Метаб . (2010) 95: E44–8. DOI: 10.1210 / jc.2010-0340
PubMed Аннотация | CrossRef Полный текст | Google Scholar
33.Арбиб Н., Хадар Э., Снех-Арбиб О., Чен Р., Визницер А., Габбай-Бензив Р. Гормон, стимулирующий щитовидную железу в первом триместре, как независимый фактор риска неблагоприятного исхода беременности. J Matern Fetal Neonatal Med . (2017) 30: 2174–8. DOI: 10.1080 / 14767058.2016.1242123
PubMed Аннотация | CrossRef Полный текст | Google Scholar
34. Ротонди М., Чиовато Л., Пачини Ф., Барталена Л., Витти П. Ведение субклинического гипотиреоза во время беременности: комментарий итальянского общества эндокринологов и итальянской ассоциации щитовидной железы к руководящим принципам Американской ассоциации щитовидной железы 2017 г. — «Итальянский путь» ». Щитовидная железа. (2018) 28: 551–5. DOI: 10.1089 / th.2017.0424
PubMed Аннотация | CrossRef Полный текст | Google Scholar
35. Glinoer D, Riahi M, Grün JP, Kinthaert J. Риск субклинического гипотиреоза у беременных с бессимптомными аутоиммунными заболеваниями щитовидной железы. J Clin Endocrinol Metab. (1994) 79: 197–204. DOI: 10.1210 / jcem.79.1.8027226
PubMed Аннотация | CrossRef Полный текст | Google Scholar
36. Смит П.П., Виджеяратне С.Н., Калуарачи В.Н., Смит Д.Ф., Премавардхана ЛДКЕ, Паркс А.Б. и др.Последовательные исследования антител к щитовидной железе во время беременности. Щитовидная железа. (2005) 15: 474–77. DOI: 10.1089 / th.2005.15.474
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Субклинический гипотиреоз у женщин, планирующих зачатие и во время беременности: кого и как лечить? | Журнал эндокринного общества
Абстрактные
Субклинический гипотиреоз (SCH), легкая форма гипотиреоза, определяемая как повышенный уровень ТТГ при нормальном уровне свободного тироксина, является распространенным диагнозом среди женщин репродуктивного возраста.В некоторых, но не во всех исследованиях, это было связано с бесплодием, повышенным риском неблагоприятных исходов беременности и новорожденных и, возможно, с повышенным риском нейрокогнитивного дефицита у потомства. Несмотря на хорошо разработанные рекомендации по лечению беременных женщин с явным гипотиреозом, пока не достигнуто единого мнения о том, следует ли лечить женщин с SCH. Этот обзор посвящен изучению доказательств, подтверждающих клиническую стратегию использования левотироксина (LT4) у женщин с SCH во время беременности и у тех, кто планирует зачатие.Важнейшим первым шагом является точная диагностика SCH с использованием соответствующего эталонного диапазона для популяции. Для беременных женщин, если это недоступно, рекомендуемый верхний предел нормы ТТГ составляет 4,0 мМЕ / л. Имеются данные, подтверждающие снижение риска потери беременности и преждевременных родов у беременных с ТТГ> 4,0 мМЕ / л, получающих терапию LT4. Лечение LT4 было связано с лучшими репродуктивными результатами у женщин с SCH, подвергшихся искусственным репродуктивным методам, но не у тех, кто пытается зачать ребенка естественным путем.Функциональные тесты щитовидной железы необходимо повторять на протяжении всей беременности, чтобы контролировать терапию LT4. Помимо потенциального вреда, LT4 усложняет лечение. Во время консультации клиницисты и пациенты должны внимательно изучить текущие данные в контексте ценностей и предпочтений пациентов, чтобы определить, является ли начало терапии LT4 лучшим следующим шагом.
Субклинический гипотиреоз (SCH) — это легкая форма гипотиреоза, определяемая как повышенная концентрация ТТГ в сочетании с нормальным уровнем свободного тироксина (FT4) [1].Это распространенный диагноз среди женщин репродуктивного возраста (от 4% до 8%), и поэтому он может повлиять на женщин, планирующих зачатие, и беременных [2]. Из-за неспецифического характера симптомов, связанных с гипотиреозом (, например, , утомляемость), диагноз SCH основывается на лабораторных исследованиях [1].
В отличие от известного негативного воздействия явного гипотиреоза на зачатие и беременность (, например, , повышенный риск потери беременности, преждевременные роды, более низкий коэффициент интеллекта потомства), при котором уровень ТТГ повышен, а уровень FT4 ниже нормы, влияние SCH остается неясным.В некоторых исследованиях это было связано с бесплодием [3], повышенным риском неблагоприятных исходов беременности и новорожденных [4–14] и, возможно, с повышенным риском нейрокогнитивного дефицита у потомства [15]. Однако другие исследования не обнаружили связи SCH с неблагоприятными исходами [16–19].
Рекомендуемым лечением явного гипотиреоза у матери является пероральный прием левотироксина (LT4). Клиницисты должны ответить на следующий вопрос: является ли SCH также заболеванием, требующим лечения, или это просто биохимический диагноз без клинических последствий? Хотя существует несколько обсервационных исследований, подтверждающих положительный эффект лечения LT4 у беременных с SCH [20], результаты крупных рандомизированных исследований свидетельствуют об обратном [21, 22].
В этом обзоре обсуждаются доказательства, подтверждающие клиническую стратегию использования LT4 у женщин с SCH во время беременности и тех, кто планирует зачатие, с акцентом на преимущества и риски лечения. Также мы рассматриваем вопросы, связанные с контролем и продолжительностью лечения.
1. Источники и критерии отбора
ссылок было обнаружено в результате поиска публикаций, перечисленных в PubMed, Ovid MEDLINE, Кокрановском регистре контролируемых исследований, Ovid EMBASE, Web of Science и Scopus с момента создания каждой базы данных до января 2018 года.Контролируемый словарный запас, дополненный ключевыми словами, использовался для поиска исследований SCH у женщин, планирующих зачатие, и во время беременности. Ссылки были также найдены в соответствующих обзорных статьях и в результате поиска в файлах авторов. Мы включили рандомизированные и обсервационные исследования, опубликованные на английском языке, уделяя приоритетное внимание исследованиям с низким риском систематической ошибки, а также метаанализы, обзоры и клинические руководства по гипотиреозу и беременности.
2. Определение и распространенность SCH
Решающее значение в биохимической диагностике SCH имеет использование соответствующих контрольных диапазонов, которые должны основываться на контрольных значениях лабораторных значений для местного населения [23].Для небеременных взрослых верхний предел нормы ТТГ обычно составляет от 4,2 до 4,5 мМЕ / л. Повторный тест, по крайней мере, через 6-8 недель, показывающий стойкое повышение ТТГ выше нормального предела при нормальном FT4, представляет собой диагноз SCH. Сообщается о распространенности SCH у небеременных женщин детородного возраста от 4% до 8% [2, 24].
Контрольные значения лаборатории щитовидной железы будут варьироваться в зависимости от условий, таких как беременность, где контрольные значения меняются в каждом триместре [1]. Чтобы удовлетворить повышенные метаболические потребности во время беременности, существуют изменения в физиологии щитовидной железы, которые отражаются в измененных тестах функции щитовидной железы и более низком диапазоне нормы ТТГ, чем у небеременных взрослых.Во время беременности повышение уровня тироксинсвязывающего глобулина приводит к увеличению общего уровня Т4. Кроме того, из-за гомологии между хорионическим гонадотропином человека (ХГЧ) и ТТГ, что приводит к перекрестной реактивности, ХГЧ может связываться с рецептором ТТГ и стимулировать выработку гормонов щитовидной железы, что в совокупности приводит к снижению секреции ТТГ гипофизом, особенно в первый триместр [25]. Рекомендации, опубликованные Американской тироидной ассоциацией (ATA) в 2011 г., рекомендовали установить лабораторный референсный диапазон для триместра для ТТГ [26].Если он недоступен, можно использовать эталонный диапазон для населения [26]. Однако, поскольку часто это было невозможно, ATA рекомендовала нормальный эталонный диапазон ТТГ от 0,1 до 2,5 мМЕ / л для первого триместра, от 0,2 до 3,0 мМЕ / л для второго триместра и от 0,3 до 3,0 мМЕ / л для третий триместр [26]. Аналогичные рекомендации были опубликованы Эндокринным обществом годом позже [27]. На основе этих диагностических критериев с использованием фиксированного верхнего предела порогового значения ТТГ, если референсные диапазоны на уровне населения были недоступны, распространенность SCH в Соединенных Штатах была оценена как ~ 15% [28] по сравнению с исторически зарегистрированной распространенностью в 2 раза. % до 3% до того, как эти критерии были установлены [29].Однако дальнейшие исследования показали, что эти референсные диапазоны ТТГ, вероятно, не действительны во всем мире. Значения могут варьироваться в зависимости от географического региона и этнического происхождения [30–32]. Анализируя 14 достаточно масштабных популяционных исследований референсных диапазонов [33], было отмечено, что, хотя референсные диапазоны различаются в зависимости от популяционных характеристик, таких как йодный статус, этническая принадлежность и индекс массы тела, 12 из этих исследований (n = 63 362 участника) сообщили специфический для верхнего триместра предел ТТГ (определяемый как среднее + 2 SD), который был> 2.5 или 3,0 мМЕ / л. Эти данные убедительно свидетельствуют о том, что значительная часть женщин во всем мире будет иметь гипердиагностику SCH, если будут использоваться фиксированные верхние пределы ТТГ 2,5 или 3,0 мМЕ / л вместо эталонных диапазонов для популяции.
Чтобы преодолеть это ограничение, обновленные рекомендации ATA, опубликованные в 2017 году [1], по-прежнему настоятельно рекомендуют использовать лабораторный или популяционный референсный диапазон ТТГ, специфичный для беременности. Однако, когда это недоступно, с учетом последних результатов рекомендуется верхний предел нормы ТТГ, равный 4.0 мМЕ / л, что обычно соответствует снижению на ~ 0,5 мМЕ / л по сравнению с эталонным диапазоном ТТГ у небеременных.
3. Скрининг и причины SCH
Основываясь на исчерпывающем обзоре литературы, группа экспертов пришла к выводу, что нет достаточных доказательств, чтобы рекомендовать или против универсального скрининга дисфункции щитовидной железы на ранних сроках беременности или до зачатия, за исключением женщин, планирующих вспомогательное оплодотворение, или тех, у кого установлена тиреоидная пероксидаза. антитела (TPOAb) положительные [1].Вместо этого рекомендуется, чтобы все пациентки, желающие забеременеть, или только что беременные, прошли клиническое обследование и при наличии любого из 11 факторов риска (, например, , симптомы / признаки дисфункции щитовидной железы, диабет 1 типа или другие аутоиммунные нарушения, бесплодие в анамнезе) при выявлении дисфункции щитовидной железы рекомендуется анализ сывороточного ТТГ. Предыдущие исследования показали, что при выявлении случаев заболевания с использованием факторов риска, предложенных в рекомендациях ATA 2011 г. и эндокринном обществе 2007 г., можно пропустить до 60% женщин, нуждающихся в лечении [34–36].Недавнее исследование [37] также показало, что симптомы и признаки на ранних сроках беременности не помогут врачу выявлять женщин с риском гипофункции щитовидной железы.
В развитых странах основной причиной первичного гипотиреоза является аутоиммунный тиреоидит [38]. Аутоантитела к щитовидной железе обнаруживаются примерно у половины беременных с SCH. В рекомендациях ATA 2017 г. рекомендуется обследовать всех беременных женщин с концентрацией ТТГ> 2,5 мМЕ / л на предмет определения статуса TPOAb [1]. Однако важно отметить, что из-за подавления иммунной системы во время беременности [39] титры антител к щитовидной железе снижаются в среднем на 60% во второй половине беременности; таким образом, используемые в настоящее время пороговые значения для положительности TPOAb, основанные на установленном референсном диапазоне у небеременных, могут быть слишком высокими [40].Роль УЗИ щитовидной железы в диагностике аутоиммунного тиреоидита у беременных не установлена. В развивающихся странах основной причиной первичного гипотиреоза является дефицит йода [38]. Это привело к тому, что многие организации рекомендуют всем женщинам, планирующим беременность, беременным и кормящим грудью, получать ежедневные добавки йода [1, 27, 41, 42]. Всем беременным женщинам следует принимать ~ 250 мкг йода в день. Чтобы обеспечить ежедневное потребление 250 мкг йода, стратегии, возможно, придется варьировать в зависимости от страны происхождения.В большинстве регионов, включая США, женщинам, планирующим беременность или беременным в настоящее время, рекомендуется дополнить свой рацион ежедневной пероральной добавкой, содержащей 150 мкг йодида калия, оптимально за 3 месяца до планируемой беременности [1].
4. Воздействие СЧ
A. О зачатии
Нормальное функционирование щитовидной железы необходимо для успешного зачатия и беременности [43]. Женщины с гипотиреозом с концентрацией ТТГ> 15 мМЕ / л имеют высокий уровень нерегулярных менструаций (68%) по сравнению с 12% нарушений менструального цикла, о которых сообщают эутиреоидные женщины [44].В отличие от явного гипотиреоза, где большинство доказательств подтверждают связь с повышенным риском бесплодия, данные по SCH менее ясны. Проспективное исследование [45] с участием 538 женщин показало, что средний уровень ТТГ был статистически выше у бесплодных женщин (1,3 мМЕ / л) по сравнению с контрольной группой (1,1 мМЕ / л), но это различие не оказалось клинически значимым. Кроме того, исследование не обнаружило разницы в распространенности ТТГ> 4,2 мМЕ / л в бесплодной группе по сравнению с контрольной группой.Точно так же перекрестное исследование [46] проанализировало сыворотки 704 женщин, проходящих лечение от бесплодия, и обнаружило только 16 с повышенным уровнем ТТГ (2,3%), что аналогично показателям в общей популяции. Более того, проспективное когортное исследование показало, что среди здоровых плодовитых женщин с выкидышами в анамнезе уровень ТТГ ≥2,5 мМЕ / л не был связан с плодовитостью, потерей беременности или рождением живого ребенка [47]. Однако другие исследователи предположили, что SCH более распространен (от 0,7% до 10,2%) у бесплодных женщин (особенно при овуляторной дисфункции) [48, 49].Например, ретроспективное исследование [3] 394 женщин обнаружило значительно более высокую частоту SCH, поражающую 13,9% бесплодных женщин, по сравнению с контрольной группой (3,9%). Кроме того, Датское общее исследование населения пригородов с перекрестным дизайном с использованием биохимических результатов и самостоятельного опроса продемонстрировало, что SCH ассоциирован с риском не иметь детей и риском не забеременеть [50]. В целом, данные, оценивающие влияние SCH на фертильность, ограничены из-за различных определений SCH (разные пороговые значения TSH) и отсутствия адекватных контрольных групп.В 2015 году Американское общество репродуктивной медицины нашло недостаточно доказательств, чтобы сделать вывод о том, что SCH связан с бесплодием [51].
B. О беременности и неонатальных исходах
В большом проспективном исследовании> 16 000 беременных женщин с SCH был выше риск отслойки плаценты и преждевременных родов по сравнению с эутиреоидными женщинами [4]. Кроме того, их потомство с большей вероятностью попадало в отделение интенсивной терапии новорожденных и имело респираторный дистресс-синдром [4].Другие крупные исследования, сравнивающие женщин с SCH и женщин с нормальной функцией щитовидной железы во время беременности, также показали связь SCH с выкидышем [9, 14, 52], преждевременными родами [7, 52], гестационным диабетом [11], гестационной гипертензией [5] , 6], эклампсия [5], преждевременный разрыв плодных оболочек [14], ограничение внутриутробного развития [13] и низкая масса тела при рождении [16]. Присутствие TPOAb, по-видимому, играет синергетическую роль с повышенными концентрациями ТТГ в повышении риска осложнений беременности.Недавнее крупное проспективное исследование, проведенное в Китае [8], показало, что у беременных женщин с более высоким уровнем ТТГ вероятность выкидыша в 3,4 раза выше, чем у эутиреоидных женщин, и этот риск утроился, когда у этих женщин также был положительный TPOAb. С другой стороны, два крупных проспективных исследования в США [16] и Финляндии [17, 18] не обнаружили никакого влияния SCH на исходы беременности. Метаанализ [53] 18 когортных исследований, в которых изучались 3995 беременных с SCH, показал, что беременные женщины с SCH имели вдвое больше шансов потерять беременность и 2.Вероятность смерти новорожденного в 6 раз выше, чем у эутиреоидных женщин. У них также был более высокий риск отслойки плаценты и преждевременного разрыва плодных оболочек. Было отмечено, что включенные исследования имели риск систематической ошибки от низкого до умеренного, в основном из-за ограничений в репрезентативности выборок исследований, отсутствия слепоты при оценке результатов и отсутствия поправки на искажающие факторы.
C. О нейрокогнитивных функциях потомства
Гормоны щитовидной железы необходимы для раннего развития мозга [54].Материнские гормоны щитовидной железы необходимы плоду до тех пор, пока его собственная щитовидная железа не начнет функционировать примерно на 14–18 неделе беременности [55, 56]. Ретроспективное исследование Haddow et al. [15] первоначально сообщил, что IQ детей, рожденных от нелеченных матерей с преимущественно явным гипотиреозом, был значительно ниже, чем у детей контрольной группы. Однако средние значения IQ и IQ <85 существенно не различались по сравнению с детьми, рожденными от матерей, которые получали лечение или нет ( P = 0.20 и P = 0,90 соответственно), хотя группы лечения были небольшими. С тех пор в нескольких исследованиях сообщалось, что более высокие уровни ТТГ у матери во время беременности могут быть связаны с негативным влиянием на нейрокогнитивную функцию потомства [10, 57–60], но это не было подтверждено другими [61–63]. Недавний метаанализ [64], включающий 11 обсервационных исследований, показал, что по сравнению с нормальной функцией щитовидной железы материнский SCH был связан с показателями умственной отсталости у потомства (OR, 2.14; 95% ДИ, от 1,20 до 3,83; P = 0,01).
В целом, противоречивые результаты между SCH и неблагоприятными исходами могут частично объясняться переменными пороговыми значениями TSH, используемыми в исследованиях для определения SCH, путем совместного анализа случаев TPOAb + и TPOAb —, а также различия в сроках оценки функции щитовидной железы. Кроме того, функция щитовидной железы может измениться во время беременности, и в результате у женщины с диагнозом СКГ в начале беременности может развиться явный гипотиреоз [65] или спонтанно вернуться к эутиреозу [31].Однако в обсервационных исследованиях не всегда проводится последовательное отслеживание беременных женщин с серийными измерениями уровня ТТГ для определения их тироидного статуса на протяжении всей беременности. Следовательно, из-за всех ограничений наблюдательных исследований любые выявленные ассоциации (или их отсутствие) следует рассматривать с осторожностью.
5. Лечение СЧ
A. Диагностика до зачатия
Не проводилось рандомизированного контролируемого исследования, в котором изучалась бы, улучшает ли терапия LT4 исходы для бесплодных женщин с SCH, не подвергающихся вспомогательным репродуктивным методикам.Ретроспективное исследование терапии LT4 на 69 бесплодных женщинах показало, что 84% из них забеременели в результате лечения, хотя у 29% впоследствии был выкидыш [66]. Недостаточно доказательств в пользу или против рутинной терапии LT4, способствующей зачатию у женщин с бесплодием, отрицательным по аутоантителам, с SCH, которым не выполняются методы искусственной репродукции [1]. Однако ATA выпустила слабую рекомендацию о том, что введение LT4 может быть рассмотрено в этих условиях, учитывая его способность предотвращать прогрессирование до явного гипотиреоза после наступления беременности [1].
У пациентов, подвергающихся искусственным репродуктивным методам, данные рандомизированных контролируемых исследований показывают, что терапия LT4 улучшает показатели беременности и выкидышей у женщин с SCH. В одном исследовании женщины с SCH (ТТГ> 4,0 мМЕ / л), перенесшие оплодотворения in vitro (ЭКО) / интрацитоплазматическую инъекцию сперматозоидов, были рандомизированы для лечения 50 мкг LT4 с целью нормализации ТТГ перед ЭКО или плацебо (35 женщин в каждой группе) [67]. В группе LT4 частота выкидышей была ниже (9% против 13% для контроля, P = 0.03) и более высокий коэффициент живорождения (26% против 3% для контроля, P = 0,02). Сходные результаты были получены в другом рандомизированном контрольном исследовании 64 бесплодных женщин с SCH (ТТГ> 4,5 мМЕ / л), которым проводилось ЭКО / интрацитоплазматическая инъекция сперматозоидов [68]. У 32 женщин, рандомизированных для получения 50 мкг LT4 с целью достижения и поддержания уровня ТТГ <2,5 мМЕ / л, была более низкая частота выкидышей (0% против 33%, P = 0,02) и более высокая частота живорождений (53% против 25%, P = 0,04) по сравнению с контрольной группой.Недавнее рандомизированное контролируемое исследование показало, что лечение LT4, титрованное для поддержания уровня ТТГ на уровне <2,5 мМЕ / л и <3,0 мМЕ / л в первом и втором-третьем триместрах, соответственно, не принесло пользы эутиреоидным женщинам (ТТГ от 0,50 до 4,78 мМЕ / л. / L) с положительным TPOAb, подвергающимся ЭКО [69]. Стратифицированный анализ по уровню ТТГ> 4,0 мМЕ / л не выявил каких-либо преимуществ в отношении прерывания беременности между леченными и нелеченными женщинами; Однако важно отметить, что по плану исследования было только 17 женщин с ТТГ> 4.0 мМЕ / л. Наконец, большое проспективное исследование 270 пациентов с SCH, подвергшихся ЭКО, которые получали терапию LT4, показало схожую частоту выкидышей и живорождений между теми, кто достиг целевого уровня ТТГ от 0,2 до 2,5 мМЕ / л по сравнению с уровнем ТТГ от 2,5 до 4,2 мМЕ / л. L [70]. Эти данные свидетельствуют о том, что строгий контроль уровня ТТГ (<2,5 мМЕ / л) может оказаться бесполезным для женщин с SCH, получающих терапию LT4 и проходящих вспомогательные репродуктивные технологии.
Б.Диагноз во время беременности
Несмотря на хорошо разработанные клинические руководства по лечению беременных женщин с явным гипотиреозом [1], пока не достигнуто единого мнения о том, следует ли лечить женщин с SCH. Американский конгресс акушеров и гинекологов в 2007 г. обнаружил недостаточно доказательств, чтобы рекомендовать лечение SCH во время беременности [71]. Затем ATA в 2011 г. рекомендовала лечить беременных с SCH, но только при положительном уровне TPOAb [26]. Год спустя Эндокринное общество опубликовало свою рекомендацию об универсальном лечении всех беременных с SCH, признав, что эта рекомендация основана на доказательствах низкого качества [27].Недавняя оценка всех клинических руководств по лечению гипотиреоза во время беременности [72] показала, что их качество сильно варьируется, и что рекомендация ATA 2017 получила в целом самый высокий рейтинг, в основном благодаря достижению наивысших баллов в областях охвата и цель, строгость разработки и редакционная независимость. В исследовании сделан вывод о том, что эти руководящие принципы нуждаются в существенном улучшении, особенно в части строгости разработки и областей применимости.
Результаты проспективного исследования Negro et al. [73] сильно повлиял на рекомендации, опубликованные в 2011–2012 годах. В этом исследовании ~ 4500 женщин были рандомизированы к 11-й неделе беременности для всеобщего скрининга на дисфункцию щитовидной железы, а не на выявление случаев заболевания на основе наличия факторов риска заболевания щитовидной железы. Все беременные на всеобщем скрининге были проверены на дисфункцию щитовидной железы и начали лечение при подтверждении. Из группы выявления случаев были проверены только женщины из группы высокого риска, в то время как из группы низкого риска проверили сохраненную сыворотку в конце беременности; поэтому эти женщины никогда не получали терапии.LT4 был начат при гипотиреозе, определяемом как ТТГ> 2,5 мМЕ / л и положительный TPOAb, поэтому по определению были включены женщины с явным гипотиреозом, что было одним из ограничений исследования. Первичным результатом исследования была совокупная конечная точка из 18 акушерских и неонатальных осложнений различной степени важности, что затрудняло интерпретацию результатов. Не было значимой разницы между общим количеством неблагоприятных исходов в группе универсального скрининга и в группе выявления случаев.Рассматривая только когорты женщин с низким уровнем риска, осложнения были менее вероятны у женщин в группе «универсального скрининга», чем у женщин в группе «выявления случаев» (OR, 0,43; 95% ДИ, 0,26–0,70). события, которые произошли с невыявленными и нелеченными пациентами с гипотиреозом (неблагоприятные исходы с меньшей вероятностью возникли при универсальном и выявлении случаев низкого риска, но нет разницы в высоком риске). Однако группа, не получавшая лечения, была значительно меньшей группой (n = 34), поэтому исследование было недостаточно мощным.
В проспективном исследовании, проведенном в Китае, беременным с SCH рекомендовалось лечение LT4 [14]. При сравнении 28 женщин, которые фактически предпочли лечиться, и 168 женщин, которые не получали лечения, не было никакой разницы в показателях выкидышей [относительный риск (ОР), 0,46; ДИ от 0,12 до 1,84], преждевременные роды (ОР 0,31; ДИ от 0,02 до 5,13), гестационная гипертензия (ОР 3,00; ДИ от 0,28 до 31,99), низкая масса тела при рождении (ОР 0,65; ДИ от 0,04 до 11,71), или низкий балл по шкале Апгар (ОР 0,65; ДИ 0.С 04 по 11.71). Это исследование было ограниченным из-за его наблюдательного дизайна и небольшого размера выборки, что привело к неточным результатам и противоречивым результатам.
В 2012 г. были опубликованы результаты исследования Controlled Antenatal Thyroid Screening (CATS) [22]. Это было многоцентровое рандомизированное исследование Lazarus et al. , где 21 846 женщин были рандомизированы на сроке ~ 12 недель беременности в группу скрининга на дисфункцию щитовидной железы или в контрольную группу. Лечение 150 мкг LT4 было начато на сроке примерно 13+ недель беременности, когда у женщины в группе скрининга был обнаружен ТТГ> 97.5-й процентиль, FT4 <2,5-го процентиля или и то, и другое. Исследование не обнаружило разницы в IQ детей в возрасте 3 лет (средний IQ лечения 99 по сравнению со средним IQ без лечения 100) и процент детей с IQ <85. Анализ подгрупп, включающий только женщин, отвечающих критериям SCH, дал аналогичные результаты. Исследование подверглось критике за позднее начало терапии LT4 (возможно, слишком поздно в сроке беременности, чтобы иметь большое влияние на развитие мозга) и за относительно высокие фиксированные дозы LT4.Более того, был задан вопрос, можем ли мы точно оценить IQ у 3-летнего ребенка. Однако недавно опубликованные данные исследования CATS-II показали, что терапия LT4 не улучшила когнитивные способности ребенка в возрасте 9,5 лет, что подтверждает долгосрочные результаты исследования CATS [74]. Наконец, возможно, что исследование было недостаточно мощным для выявления тонких когнитивных различий, поскольку расчет мощности был основан на разнице IQ в 6 баллов, как было обнаружено Haddow et al. [15].
Ретроспективное одноцентровое исследование [75] показало, что терапия LT4 беременных женщин с SCH была связана с меньшим риском низкой массы тела при рождении и низким баллом по шкале Апгар, но не было статистически значимых различий в других неблагоприятных исходах беременности и новорожденных.Хотя имеющиеся данные о множестве потенциальных факторов, в первую очередь социально-экономических показателях и сопутствующих акушерских состояниях, позволили провести скорректированный анализ, это исследование было ограничено его ретроспективным характером и риском выбора и систематической ошибки направления. В другом исследовании Ma et al. На [76] более низкие шансы выкидыша и макросомии были зарегистрированы у беременных с SCH, получавших лечение LT4 (OR, 0,34; ДИ, 0,21–0,56 и OR, 0,46; ДИ, 0,28–0,74, соответственно). Это исследование также было ограничено высоким риском систематической ошибки отбора.
Недавно было завершено многоцентровое рандомизированное исследование, финансируемое Национальным институтом здравоохранения [21]. Беременные женщины с ТТГ> 4,0 мМЕ / л и нормальным уровнем FT4 были рандомизированы для лечения LT4 по сравнению с плацебо. Исследование не обнаружило каких-либо преимуществ лечения LT4 в отношении показателя IQ потомства через 5 лет, отдельных неблагоприятных исходов беременности (преждевременные роды, гестационная гипертензия, преэклампсия, гестационный диабет, отслойка плаценты) и неблагоприятных исходов для новорожденных (смерть новорожденных, низкая Оценка по шкале Апгар, поступление в реанимацию новорожденных, низкая масса тела при рождении, врожденные пороки развития).Апостериорный анализ не обнаружил значимого взаимодействия по уровню TPOAb. Однако, как и в исследовании Lazarus et al. [22], терапия LT4 фактически была начата во втором триместре беременности, в среднем на 17 неделе беременности. Из-за поздней рандомизации исследование не смогло адекватно оценить исход потери беременности.
Недавно были опубликованы результаты первого национального исследования в США [20]. Используя обширную национальную базу данных, 843 беременных с SCH, которые получали лечение гормонами щитовидной железы, сравнивали с 4562 женщинами, которые этого не сделали.У пролеченных женщин риск потери беременности был на 38% меньше, чем у нелеченных. Однако лечение гормонами щитовидной железы было связано с повышенным риском преждевременных родов, диабета и преэклампсии. Стратифицированный анализ по группам ТТГ показал, что у женщин, получавших лечение, с более высоким уровнем ТТГ было меньше потерь от беременности, а не у женщин с более умеренным повышением ТТГ. Это отсутствие пользы вместе с отмеченным риском нежелательных явлений вызвало опасения по поводу возможного чрезмерного лечения женщин с уровнем ТТГ между 2.5 и 4,0 мМЕ / л. Это исследование было ограничено его ретроспективным дизайном наблюдения и использованием данных административных требований, в частности, возможностью неправильной классификации лечения и искажающих факторов, отсутствием клинических подробностей (, например, , гестационный возраст на момент начала терапии LT4, статус TPOAb) и выбор предубеждения, связанные с регистрацией в плане медицинского страхования, диагностическим тестированием и выбором лечения.
В поддержку этих выводов были результаты недавнего слепого рандомизированного исследования, проведенного Nazarpour et al. [77]. Несмотря на отсутствие положительного эффекта терапии LT4 в снижении преждевременных родов у SCH TPOAb — женщин с ТТГ от 2,5 до 10,0 мМЕ / л, анализ подгрупп показал, что LT4 может уменьшить это осложнение с использованием недавно рекомендованного порогового значения ТТГ ≥4,0 мМЕ / л. L (ОР 0,38; 95% ДИ от 0,15 до 0,98; P = 0,04). Точно так же Тегеранское исследование щитовидной железы показало снижение на 70% и 83% случаев преждевременных родов и госпитализаций новорожденных, соответственно, у беременных женщин, получавших лечение LT4, которые имели TPOAb + [78].Благоприятный эффект лечения LT4 в основном наблюдался среди женщин с TPOAb + с ТТГ ≥4,0 мМЕ / л.
Принимая во внимание последние результаты, рекомендации ATA по лечению SCH у беременных были изменены в недавно выпущенных руководствах [1]. В частности, из-за отмеченного аддитивного риска наличия положительного TPOAb рекомендации были стратифицированы по статусу антител. В настоящее время лечение LT4 рекомендуется беременным женщинам с положительным результатом на TPOAb, когда уровень ТТГ выше 4.0 мМЕ / л (сильная рекомендация; доказательства среднего качества) и может рассматриваться для беременных женщин с положительным результатом на ТПОАb, если ТТГ> 2,5 мМЕ / л (слабая рекомендация; доказательства низкого качества), или для женщин с ТПОАb —, когда ТТГ составляет 4,0 до 10,0 мМЕ / л (слабая рекомендация; доказательства низкого качества). На основании всех имеющихся данных, продолжение лечения гормонами щитовидной железы для снижения риска выкидыша и преждевременных родов у беременных с концентрацией ТТГ> 4,0 мМЕ / л является разумным.
6. Мониторинг и поддержание терапии LT4
A. Дозировка LT4
А-1. Для женщин, начавших лечение до зачатия
Женщинам, которые начали принимать LT4 до зачатия, часто требуется более высокая доза LT4 во время беременности, чтобы оставаться эутиреоидными из-за повышенных метаболических требований. Исследование на уровне сообщества показало, что у большинства женщин, получавших LT4, уровень ТТГ на ранних сроках беременности превышает рекомендуемые целевые значения, что повышает риск выкидыша [79].Текущие руководящие принципы клинической практики рекомендуют недавно беременным пациенткам с гипотиреозом, леченным LT4, самостоятельно увеличивать дозу LT4 на ~ 25–30% без предварительного измерения уровня ТТГ в сыворотке при пропущенном менструальном цикле или положительном результате теста на беременность и незамедлительно уведомлять своего опекуна [ 1]. Однако исследование Verga et al. [80] показали, что этого увеличения может быть недостаточно, поскольку их пациентам необходимо увеличить дозу LT4 с 45% до 70%. Степень увеличения дозы LT4, по-видимому, зависит от этиологии гипотиреоза: женщинам с атиреозом требуется большее увеличение дозы (увеличение примерно на 50%) по сравнению с женщинами с раком щитовидной железы (увеличение на 21%) и аутоиммунным гипотиреозом (увеличение на 16%) [81].Поэтому было высказано предположение, что для достижения оптимальных уровней ТТГ на очень ранних сроках беременности необходимо оптимизировать тироидный статус по LT4 еще до того, как женщина забеременеет [82]. В недавно опубликованном исследовании напрямую сравнивались два алгоритма корректировки дозы LT4 у беременных женщин с гипотиреозом (эмпирическое увеличение дозы с последующей корректировкой с использованием подхода по таблеткам в неделю по сравнению с постоянной корректировкой только с использованием подхода микрограмм в день) и продемонстрировало, что оба алгоритма сохраняются материнский ТТГ в пределах нормы для каждого триместра на протяжении большей части беременности [83].Более того, исследование показало, что у трех женщин с беременностью двойней не наблюдалось более выраженного подавления ТТГ и не требовалось больше изменений дозы LT4 по сравнению с общей когортой исследования [83].
А-2. Для женщин с диагнозом СКГ, начавших лечение во время беременности
Для женщин, которым был поставлен диагноз SCH во время беременности, нет официальных рекомендаций относительно начальной дозы LT4. Клинические (, например, , вес) или биохимические характеристики ( e.грамм. Уровни , TSH или TPOAb) потенциально могут играть роль в необходимой дозировке LT4; однако доказательства отсутствуют. Представляется разумным начинать с низкой дозы 50 мкг LT4 и при необходимости титровать [1].
B. Цели и мониторинг
ATA рекомендует лечение материнского гипотиреоза до достижения материнской концентрации ТТГ <2,5 мМЕ / л [1]. ATA также предлагает повторять тесты функции щитовидной железы не реже одного раза в 4 недели в течение первой половины беременности и еще раз не реже одного раза около 30 недель беременности [1].В качестве альтернативы, Общество эндокринологов предлагает повторять тесты функции щитовидной железы каждые 4–6 недель на протяжении всей беременности [27] и, как и в случае с ATA, рекомендует корректировку дозы LT4 для поддержания ТТГ в пределах целевых диапазонов для каждого триместра.
После родов LT4 следует уменьшить до дозы пациента до зачатия. Дополнительное тестирование функции щитовидной железы следует проводить примерно через 6 недель после родов [1]. Для женщин, которые начали прием LT4 во время беременности, прием LT4 потенциально может быть прекращен, особенно когда доза LT4 составляет <50 мкг.Решение о прекращении приема LT4, при желании, должно быть принято пациентом и ее врачом. Если прием LT4 прекращен, уровень ТТГ в сыворотке необходимо оценить примерно через 6 недель [1]. Ретроспективное одноцентровое исследование [75] показало, что 54% беременных женщин с SCH, которым была начата добавка LT4, прекратили лечение после родов / выкидыша.
7. Безопасность и бремя лечения
Что касается безопасности LT4, чрезмерное лечение, приводящее к экзогенному гипертиреозу, может происходить чаще, чем считается.Во время беременности ХГЧ стимулирует материнскую щитовидную железу, как обсуждалось ранее, но, в отличие от ТТГ, выработка ХГЧ не регулируется посредством отрицательной обратной связи от FT4. Следовательно, лечение LT4 во время беременности может привести к высоким уровням FT4, особенно когда лечение начинается до пика ХГЧ (примерно через 10 недель). Действительно, в исследовании CATS, где начальная доза LT4 составляла 150 мкг, 10% лечившихся женщин нуждались в снижении дозы [22]. Высокая функция щитовидной железы также связана с преэклампсией и снижением массы тела при рождении [33], что указывает на необходимость дополнительных данных о влиянии высоких уровней гормонов щитовидной железы и лечения LT4.Однако было высказано предположение, что обычно небольшие дозы, необходимые для лечения SCH, не должны причинять никакого физического вреда. Хотя возможно, что чрезмерное лечение может привести к снижению уровня ТТГ и увеличению риска аритмий, исследования не обнаружили каких-либо существенных различий между леченными и нелеченными беременными женщинами [20, 21].
Помимо потенциального вреда, LT4 усложняет лечение. Прием этого препарата часто требует изменения повседневных привычек, например, дозирования за 30–60 минут до еды, отслеживания эффектов, а также посещения клиники и лабораторий.Это также может усилить тревогу у здоровой будущей матери и привести к увеличению финансовых затрат для пациента. LT4 стал препаратом, который чаще всего назначают в Соединенных Штатах, и третьим по частоте назначения препаратом в Соединенном Королевстве [84]. Плата за 3-месячный период лечения LT4 для пациентов в США значительно варьируется: от 4 до 100 долларов. Помимо стоимости рецепта на LT4, при оценке экономического бремени терапии LT4 также следует принимать во внимание затраты для пациентов и других плательщиков на тестирование щитовидной железы, последующие клинические посещения и возможное пожизненное наблюдение.Исследование, оценивающее точку зрения пациентов, может дать больше информации о степени бремени лечения в этой популяции.
8. Исследования будущего
Первой проблемой для лечения SCH является определение нормальных диапазонов ТТГ и распознавание уровня, который связан с неблагоприятными исходами. Хотя рекомендуются эталонные диапазоны ТТГ для конкретных популяций или лабораторий, большинство пациентов будут получать помощь с фиксированными пороговыми уровнями ТТГ. Крайне важно проводить исследования, которые могут помочь клиницистам оказывать помощь с использованием соответствующих нормальных диапазонов.
Несмотря на то, что доступны рандомизированные клинические испытания, оценивающие влияние терапии LT4 на клинические исходы пациентов с SCH, выявление пациентов, которым лечение будет выгодно, все еще является проблемой, в основном из-за ограничений этих исследований. Одним из важных ограничений этих исследований является начало терапии LT4 в среднем после органогенеза. Можно ожидать, что если LT4 повлияет на ранние неблагоприятные исходы беременности (, например, , выкидыш), эту терапию следует начинать как можно ближе к зачатию.Кроме того, в эти исследования были включены в основном здоровые пациенты; возможно, что лечение принесет пользу тем, кто подвержен более высокому риску осложнений. Наконец, текущая совокупность доказательств определила важные предикторы неблагоприятных исходов у пациентов с SCH, такие как аутоиммунный статус щитовидной железы и степень повышения уровня ТТГ. Чтобы улучшить качество доказательств для лечения SCH во время беременности, потребуются крупные многоцентровые рандомизированные клинические испытания, в которых LT4 начинается на ранней стадии, с заранее запланированным анализом подгрупп, основанным на рисках осложнений, чтобы определить не только наличие положительного эффекта от Терапия LT4, но у каких пациентов больше шансов получить пользу.Несмотря на наличие клинических данных, мало что известно о физиологическом механизме, с помощью которого легкая дисфункция щитовидной железы может привести к неблагоприятным исходам беременности, или о том, как терапия LT4 приведет к лучшим результатам. Пока не будут получены дополнительные доказательства, клиницисты и пациенты должны обсудить необходимость терапии LT4, а инструменты, которые могут поддержать этот разговор, могут помочь поддержать ориентированную на пациента помощь в условиях неопределенности.
9. Заключение
SCH ассоциируется с множественными неблагоприятными исходами беременности и новорожденных.Лечение LT4 было связано с лучшими репродуктивными результатами у женщин, подвергающихся искусственным репродуктивным методам, и снижению риска потери беременности и преждевременных родов, когда ТТГ> 4,0 мМЕ / л. Однако в этой области все еще необходимы хорошо проведенные крупные рандомизированные испытания с вмешательством LT4 на ранней стадии беременности или до зачатия для уточнения имеющейся информации. Между тем, как клиницисты, так и пациенты с SCH во время беременности все еще сталкиваются с неопределенностью в отношении влияния лечения гормонами щитовидной железы на исходы у матери и новорожденного.Во время консультации клиницисты и пациенты должны провести долгое и тщательное рассмотрение имеющихся данных в контексте ценностей и предпочтений пациентов, чтобы определить, является ли начало терапии LT4 лучшим следующим шагом [85].
Сокращения:
ATA
Американская тиреоидная ассоциация
CATS
Контролируемый антенатальный скрининг щитовидной железы
FT4
24
04 FT4
24
04 hCG
hCG человеческий
RR
SCH
субклинический гипотиреоз
TPOAb
антитела к тироидной пероксидазе
Сокращения:
Благодарности
Финансовая поддержка: Эта работа была частично поддержана Арканзасским институтом биологических наук, основным исследовательским компонентом Закона о доходах от табачных операций в Арканзасе от 2000 года.
Краткое раскрытие информации: Авторам нечего раскрывать.
Ссылки и примечания
1.
Alexander
EK
,
Pearce
EN
,
Brent
GA
,
Brown
RS
,
Chen
H
,
Dosiou
man
man
,
Laurberg
P
,
Lazarus
JH
,
Mandel
SJ
,
Peeters
RP
,
Sullivan
S
.
2017 Рекомендации Американской тироидной ассоциации по диагностике и лечению заболеваний щитовидной железы во время беременности и в послеродовой период
.
Щитовидная железа
.
2017
;
27
(
3
):
315
—
389
. 2.
Canaris
GJ
,
Manowitz
NR
,
Mayor
G
,
Ridgway
EC
.
Исследование распространенности заболеваний щитовидной железы в Колорадо
.
Arch Intern Med
.
2000
;
160
(
4
):
526
—
534
. 3.
Абалович
M
,
Mitelberg
L
,
Allami
C
,
Gutierrez
S
,
Alcaraz
G
000
000 Otero
000
000
000 Otero4000
Субклинический гипотиреоз и аутоиммунитет щитовидной железы у женщин с бесплодием
.
Гинекол Эндокринол
.
2007
;
23
(
5
):
279
—
283
. 4.
Кейси
BM
,
Даше
JS
,
Уэллс
CE
,
McIntire
DD
,
Byrd
W
,
000 KJ
000 C Leveno
Субклинический гипотиреоз и исходы беременности
.
Акушерский гинекол
.
2005
;
105
(
2
):
239
—
245
. 5.
Wilson
KL
,
Casey
BM
,
McIntire
DD
,
Halvorson
LM
,
Cunningham
FG
.
Субклиническая болезнь щитовидной железы и частота гипертонии у беременных
.
Акушерский гинекол
.
2012
;
119
(
2 балла 1
):
315
—
320
.6.
Chen
LM
,
Du
WJ
,
Dai
J
,
Zhang
Q
,
Si
GX
,
Yang
EL
,
Chen
QS
,
Yu
LC
,
Zhang
C
,
Lu
XM
.
Влияние субклинического гипотиреоза на материнские и перинатальные исходы во время беременности: одноцентровое когортное исследование китайского населения
.
PLoS One
.
2014
;
9
(
10
):
e109364
.7.
Кореваар
TI
,
Schalekamp-Timmermans
S
,
de Rijke
YB
,
Visser
WE
,
Visser
SM
9000 W 9000 Murama7
Hofman
A
,
Ross
HA
,
Hooijkaas
H
,
Tiemeier
H
,
Bongers-Schokking
JJser
JJser
,
,
Steegers
EA
,
Medici
M
,
Peeters
RP
.
Гипотироксинемия и положительность антител к ТПО являются факторами риска преждевременных родов: исследование поколения R
.
J Clin Endocrinol Metab
.
2013
;
98
(
11
):
4382
—
4390
.8.
Liu
H
,
Shan
Z
,
Li
C
,
Mao
J
,
Xie
X
,
Wang
9000 9000
W4
Wang
H
,
Zhang
H
,
Han
C
,
Wang
X
,
Liu
X
,
Вентилятор
Y
,
Teng
Вт
.
Субклинический гипотиреоз у матери, аутоиммунитет щитовидной железы и риск выкидыша: проспективное когортное исследование
.
Щитовидная железа
.
2014
;
24
(
11
):
1642
—
1649
. 9.
Negro
R
,
Schwartz
A
,
Gismondi
R
,
Tinelli
A
,
Mangieri
T
-Green
Stagnaro.
Повышенная частота выкидышей у женщин с отрицательными антителами к щитовидной железе с уровнем ТТГ от 2,5 до 5,0 в первом триместре беременности
.
J Clin Endocrinol Metab
.
2010
;
95
(
9
):
E44
—
E48
.10.
Su
PY
,
Huang
K
,
Hao
JH
,
Xu
YQ
,
Yan
SQ
,
Li
Y
Тао
FB
.
Функция щитовидной железы матери в первые двадцать недель беременности и последующее развитие плода и младенца: проспективное популяционное когортное исследование в Китае
.
J Clin Endocrinol Metab
.
2011
;
96
(
10
):
3234
—
3241
. 11.
Tudela
CM
,
Casey
BM
,
McIntire
DD
,
Cunningham
FG
.
Связь субклинического заболевания щитовидной железы с частотой гестационного диабета
.
Акушерский гинекол
.
2012
;
119
(
5
):
983
—
988
.12.
Casey
BM
,
Dashe
JS
,
Spong
CY
,
McIntire
DD
,
Leveno
KJ
,
000
000 Cunning4ham
Перинатальное значение изолированной материнской гипотироксинемии, выявленной в первой половине беременности
.
Акушерский гинекол
.
2007
;
109
(
5
):
1129
—
1135
. 13.
Feldthusen
AD
,
Larsen
J
,
Pedersen
PL
,
Toft Kristensen
T
,
Kvetny
J
.
Вызванные беременностью изменения митохондриальной функции у эутиреоидных беременных женщин и беременных женщин с субклиническим гипотиреозом; отношение к неблагоприятному исходу
.
Дж. Клин Транс Эндокринол
.
2013
;
1
(
1
):
e13
—
e17
. 14.
Wang
S
,
Teng
WP
,
Li
JX
,
Wang
WW
,
Shan
ZY
.
Влияние материнского субклинического гипотиреоза на акушерские исходы на ранних сроках беременности
.
Дж Эндокринол Инвест
.
2012
;
35
(
3
):
322
—
325
.15.
Haddow
JE
,
Palomaki
GE
,
Allan
WC
,
Williams
JR
,
Knight
GJ
,
Gagnon
CE
,
Mitchell
ML
,
Hermos
RJ
,
Waisbren
SE
,
Faix
JD
,
Klein
RZ
.
Дефицит щитовидной железы матери во время беременности и последующее нейропсихологическое развитие ребенка
.
N Engl J Med
.
1999
;
341
(
8
):
549
—
555
. 16.
Клири-Голдман
J
,
Мэлоун
FD
,
Ламберт-Мессерлиан
G
,
Салливан
L
,
Canick
D
,
Брутто
S
,
Bianchi
DW
,
D’Alton
ME
.
Гипофункция щитовидной железы матери и исход беременности
.
Акушерский гинекол
.
2008
;
112
(
1
):
85
—
92
. 17.
Männistö
T
,
Vääräsmäki
M
,
Pouta
A
,
Hartikainen
AL
,
Ruokonen
000
Surkonen
A4000
Ярвелин
MR
,
Suvanto
E
.
Дисфункция щитовидной железы и аутоантитела во время беременности как прогностические факторы осложнений беременности и материнской заболеваемости в более позднем возрасте
.
J Clin Endocrinol Metab
.
2010
;
95
(
3
):
1084
—
1094
. 18.
Männistö
T
,
Vääräsmäki
M
,
Pouta
A
,
Hartikainen
AL
,
Ruokonen
000
Ярвелин
MR
,
Суванто-Луукконен
E
.
Перинатальный исход детей, рожденных от матерей с дисфункцией щитовидной железы или антителами: проспективное популяционное когортное исследование
.
J Clin Endocrinol Metab
.
2009
;
94
(
3
):
772
—
779
, 19.
Саху
MT
,
Das
V
,
Mittal
S
,
Agarwal
A
,
Саху
M
.
Явная и субклиническая дисфункция щитовидной железы среди индийских беременных женщин и ее влияние на исход для матери и плода
.
Arch Gynecol Obstet
.
2010
;
281
(
2
):
215
—
220
.20.
Maraka
S
,
Mwangi
R
,
McCoy
RG
,
Yao
X
,
Sangaralingham
ee LR
,
0004 DT
,
De Ycaza
AE
,
Rodriguez-Gutierrez
R
,
Coddington
CC
III,
Stan
MN
,
Brito
JP4.
Лечение гормонами щитовидной железы беременных с субклиническим гипотиреозом: национальная оценка в США
.
BMJ
.
2017
;
356
:
i6865
. 21.
Кейси
BM
,
Thom
EA
,
Peaceman
AM
,
Varner
MW
,
Sorokin
Y
,
Hirtz
000
000
000 U
Wapner
RJ
,
Thorp
JM
Jr,
Saade
G
,
Tita
AT
,
Rouse
DJ
,
9000 BAMS
9000 Iams
Mercer
BM
,
Tolosa
J
,
Caritis
SN
,
VanDorsten
JP
;
Юнис Кеннеди Шрайвер Национальный институт детского здоровья и человеческого развития Сеть отделений материнско-фетальной медицины
.
Лечение субклинического гипотиреоза или гипотироксинемии при беременности
.
N Engl J Med
.
2017
;
376
(
9
):
815
—
825
. 22.
Lazarus
JH
,
Bestwick
JP
,
Channon
S
,
Paradice
R
,
Maina
A
,
Rees
,
Rees
Джон
R
,
Guaraldo
V
,
George
LM
,
Perona
M
,
Dall’Amico
D
,
Parkes
Parkes
,
Wald
NJ
.
Антенатальный скрининг щитовидной железы и когнитивные функции у детей
.
N Engl J Med
.
2012
;
366
(
6
):
493
—
501
. 23.
Aoki
Y
,
Belin
RM
,
Clickner
R
,
Jeffries
R
,
Phillips
L
,
Mahaffey
.
ТТГ в сыворотке и общий Т4 в популяции США и их связь с характеристиками участников: Национальное исследование здоровья и питания (NHANES 1999–2002)
.
Щитовидная железа
.
2007
;
17
(
12
):
1211
—
1223
. 24.
Hollowell
JG
,
Staehling
NW
,
Flanders
WD
,
Hannon
WH
,
Gunter
EW
,
CA
ТТГ в сыворотке, T 4 и антитела к щитовидной железе у населения США (1988–1994): Национальное обследование здоровья и питания (NHANES III)
.
J Clin Endocrinol Metab
.
2002
;
87
(
2
):
489
—
499
0,25.
Глинер
D
.
Регуляция функции щитовидной железы при беременности: пути эндокринной адаптации от физиологии к патологии
.
Endocr Ред.
.
1997
;
18
(
3
):
404
—
433
0,26.
Стагнаро-Грин
A
,
Абалович
M
,
Александр
E
,
Азизи
F
,
Mestman
J
,
000 Nix4
Negro
000
,
Pearce
EN
,
Soldin
OP
,
Sullivan
S
,
Wiersinga
W
;
Целевая группа Американской тироидной ассоциации по заболеваниям щитовидной железы во время беременности и в послеродовой период
.
Рекомендации Американской тироидной ассоциации по диагностике и лечению заболеваний щитовидной железы во время беременности и в послеродовой период
.
Щитовидная железа
.
2011
;
21
(
10
):
1081
—
1125
. 27.
Де Гроот
L
,
Абалович
M
,
Александр
EK
,
Amino
N
,
Barbour
L
,
J Cobin
Eastman
Eastman ,
Lazarus
JH
,
Luton
D
,
Mandel
SJ
,
Mestman
J
,
Rovet
J
,
0004 Sullivan
000
Ведение дисфункции щитовидной железы во время беременности и в послеродовом периоде: руководство по клинической практике эндокринного общества
.
J Clin Endocrinol Metab
.
2012
;
97
(
8
):
2543
—
2565
. 28.
Blatt
AJ
,
Nakamoto
JM
,
Kaufman
HW
.
Национальный статус тестирования на гипотиреоз во время беременности и в послеродовом периоде
.
J Clin Endocrinol Metab
.
2012
;
97
(
3
):
777
—
784
, 29.
Абалович
M
,
Amino
N
,
Barbour
LA
,
Cobin
RH
,
De Groot
LJ
,
Glinoer
,
Стагнаро-Зеленый
А
.
Управление дисфункцией щитовидной железы во время беременности и в послеродовом периоде: Руководство по клинической практике эндокринного общества
.
J Clin Endocrinol Metab
.
2007
;
92
(
8
,
Доп.
):
S1
—
S47
. 30.
Korevaar
TI
,
Medici
M
,
de Rijke
YB
,
Visser
W
,
de Muinck Keizer-Schrama
SM
doe
SM
A
,
Ross
HA
,
Visser
WE
,
Hooijkaas
H
,
Steegers
EA
,
Tiemeier
000
000 Jongking,
000
000 Jongking Visser
TJ
,
Peeters
RP
.
Этнические различия в параметрах щитовидной железы матери во время беременности: исследование поколения R
.
J Clin Endocrinol Metab
.
2013
;
98
(
9
):
3678
—
3686
. 31.
Li
C
,
Shan
Z
,
Mao
J
,
Wang
W
,
Xie
X
,
Zhou
9000 9000 W4 9000 Li
Xu
B
,
Bi
L
,
Meng
T
,
Du
J
,
Zhang
S
,
Gao
Z
,
,
Ян
L
,
Вентилятор
C
,
Teng
W
.
Оценка функции щитовидной железы во время беременности в первом триместре: каков рациональный верхний предел сывороточного ТТГ в первом триместре у китайских беременных женщин
?
J Clin Endocrinol Metab
.
2014
;
99
(
1
):
73
—
79
. 32.
Marwaha
RK
,
Chopra
S
,
Gopalakrishnan
S
,
Sharma
B
,
Kanwar
S
Singh
Установление референсного диапазона гормонов щитовидной железы у здоровых беременных индийских женщин
.
BJOG
.
2008
;
115
(
5
):
602
—
606
. 33.
Medici
M
,
Korevaar
TI
,
Visser
WE
,
Visser
TJ
,
Peeters
RP
.
Функция щитовидной железы при беременности: что такое
?
Clin Chem
.
2015
;
61
(
5
):
704
—
713
. 34.
Vaidya
B
,
Anthony
S
,
Bilous
M
,
Shields
B
,
Drury
J
,
9000 Butch4ison
Выявление дисфункции щитовидной железы на ранних сроках беременности: универсальный скрининг или целенаправленное выявление случаев высокого риска
?
J Clin Endocrinol Metab
.
2007
;
92
(
1
):
203
—
207
0,35.
Horacek
J
,
Spitalnikova
S
,
Dlabalova
B
,
Malirova
E
,
Vizda
J
as
000
000
Sv.
Mc Grath
C
,
Maly
J
.
Универсальный скрининг выявляет в два раза больше заболеваний щитовидной железы на ранних сроках беременности, чем при целенаправленном выявлении случаев высокого риска
.
евро J Эндокринол
.
2010
;
163
(
4
):
645
—
650
0,36.
Jiskra
J
,
Bartáková
J
,
Holinka
Š
,
Límanová
Z
,
Springer
D
čová
000
čov
M
č
M
Potluková
E
.
Низкая распространенность женщин с клинически высоким риском и патологическое ультразвуковое исследование щитовидной железы среди беременных, положительных при всеобщем скрининге на заболевания щитовидной железы
.
Exp Clin Endocrinol Diabetes
.
2011
;
119
(
9
):
530
—
535
0,37.
Pop
VJ
,
Broeren
MA
,
Wiersinga
WM
,
Stagnaro-Green
A
.
Симптомы заболевания щитовидной железы на ранних сроках беременности не позволяют выявить женщин с гипофункцией щитовидной железы, которых следует лечить
.
Клин Эндокринол (Oxf)
.
2017
;
87
(
6
):
838
—
843
.38.
Garber
JR
,
Cobin
RH
,
Gharib
H
,
Hennessey
JV
,
Klein
I
,
000
000 POLACK
000, Polack
000
R
,
Singer
PA
,
Woeber
KA
;
Целевая группа Американской ассоциации клинических эндокринологов и Американской тироидной ассоциации по гипотиреозу у взрослых
.
Клинические рекомендации по лечению гипотиреоза у взрослых: при поддержке Американской ассоциации клинических эндокринологов и Американской тироидной ассоциации
.
Endocr Pract
.
2012
;
18
(
6
):
988
—
1028
. 39.
Еленков
IJ
,
Wilder
RL
,
Бакалов
VK
,
Ссылка
AA
,
Димитров
MA
,
9000 Crane 9000 9000 Crane
Каник
КС
,
Хрусос
GP
.
IL-12, TNF-α и гормональные изменения на поздних сроках беременности и в раннем послеродовом периоде: влияние на активность аутоиммунных заболеваний в эти периоды
.
J Clin Endocrinol Metab
.
2001
;
86
(
10
):
4933
—
4938
.40.
Кореваар
TIM
,
Pop
VJ
,
Chaker
L
,
Goddijn
M
,
de Rijke
YB
,
000
Bisschop,
Bisschop ,
Jaddoe
VW
,
Meddici
M
,
Visser
TJ
,
Steegers
EA
,
Vrijkotte
TG
.
Зависимость от дозы и функциональный предел для определения положительности антител к ТПО во время беременности
.
J Clin Endocrinol Metab
.
2018
;
103
(
2
):
778
—
789
. 41.
Rogan
WJ
,
Paulson
JA
,
Baum
C
,
Brock-Utne
AC
,
Brumberg
HL
0007,
CC4000
000 CC4000
,
Lowry
JA
,
Osterhoudt
KC
,
Sandel
MT
,
Spanier
A
,
Trasande
L
;
Совет по гигиене окружающей среды
.
Дефицит йода, загрязняющие химические вещества и щитовидная железа: новая информация по старой проблеме
.
Педиатрия
.
2014
;
133
(
6
):
1163
—
1166
.42.
Obican
SG
,
Jahnke
GD
,
Soldin
OP
,
Scialli
AR
.
Позиционный документ комитета по связям с общественностью по тератологии: дефицит йода при беременности
.
Врожденные дефекты Res A Clin Mol Teratol
.
2012
;
94
(
9
):
677
—
682
. 43.
Ямамото
Дж
,
Донован
LE
.
Ведение заболеваний щитовидной железы у женщин, планирующих беременность
.
CMAJ
.
2017
;
189
(
28
):
E940
. 44.
Krassas
GE
,
Pontikides
N
,
Kaltsas
T
,
Papadopoulou
P
,
Paunkovic
J
000
000 Paunkovic
000
000
000 Paunkovic
000
000 Paunkovic
000
000
Нарушения менструального цикла при гипотиреозе
.
Клин Эндокринол (Oxf)
.
1999
;
50
(
5
):
655
—
659
. 45.
Poppe
K
,
Glinoer
D
,
Van Steirteghem
A
,
Tournaye
H
,
Devroey
P
cat4 9000 9000 Jiet70007 .
Дисфункция щитовидной железы и аутоиммунитет у бесплодных женщин
.
Щитовидная железа
.
2002
;
12
(
11
):
997
—
1001
. 46.
Линкольн
SR
,
Ke
RW
,
Kutteh
WH
.
Скрининг гипотиреоза у бесплодных женщин
.
Дж Репрод Мед
.
1999
;
44
(
5
):
455
—
457
.47.
Plowden
TC
,
Schisterman
EF
,
Sjaarda
LA
,
Zarek
SM
,
Perkins
NJ Silver
NJ Серебро
,
NJ Серебро
,
ДеЧерни
AH
,
Мамфорд
SL
.
Субклинический гипотиреоз и аутоиммунитет щитовидной железы не связаны с плодовитостью, потерей беременности или рождением живого ребенка
.
J Clin Endocrinol Metab
.
2016
;
101
(
6
):
2358
—
2365
. 48.
Arojoki
M
,
Jokimaa
V
,
Juuti
A
,
Koskinen
P
,
Irjala
K
,
.
Гипотиреоз среди бесплодных женщин в Финляндии
.
Гинекол Эндокринол
.
2000
;
14
(
2
):
127
—
131
.49.
Strickland
DM
,
Whitted
WA
,
Wians
FH
Jr.
Скрининг бесплодных женщин на предмет субклинического гипотиреоза
.
Am J Obstet Gynecol
.
1990
;
163
(
1 балл 1
):
262
—
263
.50.
Feldthusen
AD
,
Pedersen
PL
,
Larsen
J
,
Toft Kristensen
T
,
Ellervik
C
J,
,
Нарушение фертильности, связанное с субклиническим гипотиреозом и аутоиммунитетом щитовидной железы: Датское общее исследование населения пригородов
.
J Беременность
.
2015
;
2015
:
132718
. 51.
Комитет практики Американского общества репродуктивной медицины
.
Субклинический гипотиреоз у женщин с бесплодием: рекомендации
.
Fertil Steril
.
2015
;
104
(
3
):
545
—
553
.52.
Schneuer
FJ
,
Nassar
N
,
Tasevski
V
,
Morris
JM
,
Roberts
CL
.
Связь и точность прогноза высоких уровней ТТГ в сыворотке крови в первом триместре и неблагоприятных исходов беременности
.
J Clin Endocrinol Metab
.
2012
;
97
(
9
):
3115
—
3122
. 53.
Maraka
S
,
Ospina
NM
,
O’Keeffe
DT
,
Espinosa De Ycaza
AE
,
Gionfriddo
000 MR
000 MR
000
CC
III,
Stan
MN
,
Murad
MH
,
Montori
VM
.
Субклинический гипотиреоз у беременных: систематический обзор и метаанализ
.
Щитовидная железа
.
2016
;
26
(
4
):
580
—
590
. 54.
Бернал
Дж
,
Нуньес
Дж
.
Гормоны щитовидной железы и развитие мозга
.
евро J Эндокринол
.
1995
;
133
(
4
):
390
—
398
.55.
Ахмед
OM
,
Эль-Гарейб
AW
,
Эль-Бакри
AM
,
Абд Эль-Таваб
SM
,
Ахмед
RG
.
Состояния гормонов щитовидной железы и взаимодействие с развитием мозга
.
Инт Дж. Дев Neurosci
.
2008
;
26
(
2
):
147
—
209
. 56.
Циммерманн
МБ
.
Дефицит йода
.
Endocr Ред.
.
2009
;
30
(
4
):
376
—
408
. 57.
Li
Y
,
Shan
Z
,
Teng
W
,
Yu
X
,
Li
Y
,
Вентилятор
0004 C
,
Guo
R
,
Wang
H
,
Li
J
,
Chen
Y
,
Wang
W
,
Chawinga
M
,
Ян
L
,
Zhao
Y
,
Hua
T
.
Нарушения функции щитовидной железы матери во время беременности влияют на нейропсихологическое развитие их детей в возрасте 25–30 месяцев
.
Клин Эндокринол (Oxf)
.
2010
;
72
(
6
):
825
—
829
. 58.
Klein
RZ
,
Sargent
JD
,
Larsen
PR
,
Waisbren
SE
,
Haddow
JE
,
Mit
Связь тяжести материнского гипотиреоза с когнитивным развитием потомства
.
J Средний экран
.
2001
;
8
(
1
):
18
—
20
. 59.
Päkkilä
F
,
Männistö
T
,
Hartikainen
AL
,
Ruokonen
A
,
Surcel
Ярвелин
MR
,
Мойланен
I
,
Suvanto
E
.
Функция щитовидной железы матери и ребенка, интеллект и успеваемость ребенка
.
Щитовидная железа
.
2015
;
25
(
12
):
1363
—
1374
.60.
Williams
F
,
Watson
J
,
Ogston
S
,
Hume
R
,
Willatts
P
,
Visser
9000;
Шотландская группа по охране щитовидной железы недоношенных
.
Легкая материнская дисфункция щитовидной железы при родах младенцев, рожденных ≤34 недель, и исходы нервного развития в возрасте 5,5 лет
.
J Clin Endocrinol Metab
.
2012
;
97
(
6
):
1977
—
1985
.61.
Smit
BJ
,
Kok
JH
,
Vulsma
T
,
Briët
JM
,
Boer
K
,
Wiersinga
Неврологическое развитие новорожденных и детей раннего возраста в связи с функцией щитовидной железы матери
.
Acta Paediatr
.
2000
;
89
(
3
):
291
—
295
0,62.
Henrichs
J
,
Bongers-Schokking
JJ
,
Schenk
JJ
,
Ghassabian
A
,
Schmidt
000
000
000
000
000
000
000 HG4000
,
от Muinck Keizer-Schrama
SM
,
Hofman
A
,
Jaddoe
VV
,
Visser
W
,
Steegers
EA
0007,
Steegers
EA
,
Rijke
YB
,
Tiemeier
H
.
Функция щитовидной железы матери на ранних сроках беременности и когнитивные функции в раннем детстве: исследование поколения R
.
J Clin Endocrinol Metab
.
2010
;
95
(
9
):
4227
—
4234
.63.
Chen
LM
,
Chen
QS
,
Jin
GX
,
Si
GX
,
Zhang
Q
,
Y
Ye
,
Y
,
Cai
LQ
,
Peng
MM
,
Lin
ZZ
,
Yu
LC
,
Zhang
C
,
Lu
XM
.
Влияние гестационного субклинического гипотиреоза на раннее развитие нервной системы потомства
.
Дж Перинатол
.
2015
;
35
(
9
):
678
—
682
.64.
Thompson
W
,
Russell
G
,
Baragwanath
G
,
Matthews
J
,
Vaidya
B
9-
Coin
,
Co
Недостаточность гормонов щитовидной железы у матери во время беременности и риск нарушений развития нервной системы у потомства: систематический обзор и метаанализ
.
Клин Эндокринол (Oxf)
.
2018
;
88
(
4
):
575
—
584
0,65.
Glinoer
D
,
Riahi
M
,
Grün
JP
,
Kinthaert
J
.
Риск субклинического гипотиреоза у беременных с бессимптомными аутоиммунными заболеваниями щитовидной железы
.
J Clin Endocrinol Metab
.
1994
;
79
(
1
):
197
—
204
.66.
Йошиока
W
,
Amino
N
,
Ide
A
,
Канг
S
,
Kudo
T
,
Nishihara
Nishihara
,
Накамура
H
,
Miyauchi
A
.
Лечение тироксином может быть полезным при субклиническом гипотиреозе у пациенток с женским бесплодием
.
Endocr J
.
2015
;
62
(
1
):
87
—
92
0,67.
Абдель Рахман
AH
,
Али Аббасси
H
,
Abbassy
AA
.
Улучшение результатов экстракорпорального оплодотворения после лечения субклинического гипотиреоза у бесплодных женщин
.
Endocr Pract
.
2010
;
16
(
5
):
792
—
797
0,68.
Kim
CH
,
Ahn
JW
,
Kang
SP
,
Kim
SH
,
Chae
HD
,
Kang
BM
BM
.
Влияние лечения левотироксином на экстракорпоральное оплодотворение и исход беременности у бесплодных женщин с субклиническим гипотиреозом, подвергшихся экстракорпоральному оплодотворению / интрацитоплазматической инъекции сперматозоидов
.
Fertil Steril
.
2011
;
95
(
5
):
1650
—
1654
0,69.
Wang
H
,
Gao
H
,
Chi
H
,
Zeng
L
,
Xiao
W
,
Wang
Y
Лю
P
,
Ван
C
,
Тиан
Q
,
Чжоу
Z
,
Ян
J
,
Лю
,
Liu
,
Мол
BWJ
,
Hong
T
,
Qiao
J
.
Влияние левотироксина на выкидыш среди женщин с нормальной функцией щитовидной железы и аутоиммунитетом щитовидной железы, подвергающихся экстракорпоральному оплодотворению и переносу эмбрионов: рандомизированное клиническое исследование
.
JAMA
.
2017
;
318
(
22
):
2190
—
2198
.70.
Cai
Y
,
Zhong
L
,
Guan
J
,
Guo
R
,
Niu
B
,
Ma
Y
Y 9000
Результат экстракорпорального оплодотворения у женщин с субклиническим гипотиреозом
.
Репрод Биол Эндокринол
.
2017
;
15
(
1
):
39
. 71.
Комитет по безопасности пациентов и повышению качества Комитет по профессиональной ответственности
.
Заключение комитета ACOG No. 381: субклинический гипотиреоз при беременности
.
Акушерский гинекол
.
2007
;
110
(
4
):
959
—
960
.72.
Клык
Y
,
Yao
L
,
Sun
J
,
Zhang
J
,
Li
Y
,
Yang
Rang
R
,
Тиан
L
.
Оценка клинических рекомендаций по ведению гипотиреоза у беременных с использованием инструмента Appraisal of Guidelines for Research and Evaluation II
.
Эндокринная
.
2018
;
60
(
1
):
4
—
14
. 73.
Negro
R
,
Schwartz
A
,
Gismondi
R
,
Tinelli
A
,
Mangieri
T
-Green
Stagnaro.
Универсальный скрининг и выявление случаев для выявления и лечения гормональной дисфункции щитовидной железы во время беременности
.
J Clin Endocrinol Metab
.
2010
;
95
(
4
):
1699
—
1707
.74.
Hales
C
,
Taylor
PN
,
Channon
S
,
Paradice
R
,
McEwan
K
,
Zhang
ed
ed
ed
ed
Бахш
А
,
Окосиеме
О
,
Мюллер
I
,
Драман
MS
,
Грегори
JW
,
H0007
L0007
Даян
Rees
DA
,
Ludgate
M
.
Контролируемый антенатальный скрининг щитовидной железы II: влияние лечения субоптимальной функции щитовидной железы матери на познавательные способности ребенка
.
J Clin Endocrinol Metab
.
2018
;
103
(
4
):
1583
—
1591
.75.
Maraka
S
,
Singh Ospina
NM
,
O’Keeffe
DT
,
Rodriguez-Gutierrez
R
,
Espinosa
000 Espinosa De Ycaza
Juhn
YJ
,
Coddington
CC
III,
Montori
VM
,
Stan
MN
.
Влияние терапии левотироксином на исходы беременности у женщин с субклиническим гипотиреозом
.
Щитовидная железа
.
2016
;
26
(
7
):
980
—
986
.76.
Ма
L
,
Ци
H
,
Чай
X
,
Цзян
F
,
Мао
S
,
Лю
Z4
Lian
X
,
Sun
X
,
Wang
D
,
Ren
J
,
Yan
Q
.
Влияние скрининга и вмешательства субклинического гипотиреоза на исходы беременности: проспективное многоцентровое простое слепое рандомизированное контролируемое исследование скринингового теста функции щитовидной железы во время беременности
.
J Matern Fetal Neonatal Med
.
2016
;
29
(
9
):
1391
—
1394
.77.
Назарпур
S
,
Рамезани Тегерани
F
,
Simbar
M
,
Tohidi
M
,
Minooee
S
, M
,
, 9000.
Влияние левотироксина на беременных с субклиническим гипотиреозом, отрицательное по антителам к тироидной пероксидазе
.
J Clin Endocrinol Metab
.
2018
;
103
(
3
):
926
—
935
0,78.
Назарпур
S
,
Рамезани Тегерани
F
,
Simbar
M
,
Tohidi
M
,
Alavi Majd
H 9000iz7,
H 9000iz7
Влияние лечения левотироксином на исходы беременности у беременных с аутоиммунным заболеванием щитовидной железы
.
евро J Эндокринол
.
2017
;
176
(
2
):
253
—
265
0,79.
Тейлор
PN
,
Минассиан
C
,
Рехман
A
,
Икбал
A
,
Драман
MS
,
D
000, Hamilton
Робинсон
A
,
Vaidya
B
,
Lazarus
JH
,
Thomas
S
,
Dayan
CM
,
Okosieme
9000.
Уровни ТТГ и риск выкидыша у женщин, длительно принимающих левотироксин: исследование на уровне сообщества
.
J Clin Endocrinol Metab
.
2014
;
99
(
10
):
3895
—
3902
.80.
Verga
U
,
Bergamaschi
S
,
Cortelazzi
D
,
Ronzoni
S
,
Marconi
AM
, 9000co4 Beck
, 9000co4 Beck
Корректировка заместительной терапии L-T4 у беременных с субклиническим, явным или постаблативным гипотиреозом
.
Клин Эндокринол (Oxf)
.
2009
;
70
(
5
):
798
—
802
.81.
Loh
JA
,
Wartofsky
L
,
Jonklaas
J
,
Burman
KD
.
Степень увеличения потребности в левотироксине у беременных с гипотиреозом зависит от этиологии гипотиреоза
.
Щитовидная железа
.
2009
;
19
(
3
):
269
—
275
.82.
Абалович
M
,
Алькарас
G
,
Клейман-Рубинштейн
J
,
Павлове
MM
,
Cornelio
C
Levalle
.
Взаимосвязь между уровнями тиреотропина до зачатия и потребностями в повышении дозы левотироксина во время беременности у женщин с первичным гипотиреозом
.
Щитовидная железа
.
2010
;
20
(
10
):
1175
—
1178
,83.
Салливан
SD
,
Даунс
E
,
Поповенюк
G
,
Zeymo
A
,
Jonklaas
J
,
0004 Burman
Рандомизированное исследование, сравнивающее два алгоритма коррекции дозы левотироксина у беременных с первичным гипотиреозом
.
J Clin Endocrinol Metab
.
2017
;
102
(
9
):
3499
—
3507
.84.
Родригес-Гутьеррес
R
,
Maraka
S
,
Ospina
NS
,
Montori
VM
,
Brito
JP
.
Чрезмерное употребление левотироксина: время для беспокойства
?
Ланцет, диабет, эндокринол
.
2017
;
5
(
4
):
246
—
248
.85.
Родригес-Гутьеррес
R
,
Гионфриддо
MR
,
Ospina
NS
,
Maraka
S
,
Tamhane
JP
.
Совместное принятие решений в эндокринологии: настоящее и будущее
.
Ланцет, диабет, эндокринол
.
2016
;
4
(
8
):
706
—
716
.
Авторские права © 2018 Эндокринное общество
.
