Синдром кушинга у детей: Синдром Иценко-Кушинга у детей — причины, симптомы, диагностика и методы лечения гиперкортицизма в клинике для детей и подростков «СМ-Клиника»
Диагностика болезни Иценко-Кушинга у детей
Болезнь Иценко—Кушинга (БИК) — тяжелое нейроэндокринное заболевание, развивающееся вследствие повышения продукции АКТГ гипофизом, в большинстве случаев обусловлено наличием кортикотропиномы передней доли гипофиза. Гиперсекреция АКТГ вызывает двустороннюю гиперплазию коры надпочечников, гиперпродукцию кортизола и надпочечниковых андрогенов, что и определяет клиническую картину болезни.
Эпидемиологические данные. В литературе достаточно широко описаны клинико-лабораторные и патогенетические особенности БИК у взрослых. Данных литературы, касающихся этой проблемы у детей, значительно меньше. Как правило, существующие обзоры представляют собой уникальный опыт работы специализированных национальных центров, где концентрируются такие пациенты. Наибольший опыт в лечении детей с БИК имеют Национальный Институт Здоровья США и больница святого Варфоломея в Лондоне. В нашей стране таким центром является Эндокринологический научный центр Минздравсоцразвития РФ. С 1935 по 1999 г. в СССР и РФ описано 317 случаев данной патологии у детей [1—5]. Среди всех форм гиперкортицизма у детей на долю БИК приходится 75—80% [6]. В подавляющем большинстве случаев АКТГ-секретирующие опухоли у детей представлены микроаденомами (менее 5 мм в диаметре) [7]; макроаденомы у детей наблюдаются редко (от 3 до 6%) [8, 9]. БИК может быть диагностирована в любой возрастной группе, но пик заболеваемости приходится на подростковый период. В зарубежной литературе [10, 11] описано несколько случаев развития данного заболевания у детей в возрасте до 1 года. H. Storr и соавт. [12] проанализировали 50 больных с БИК в возрасте от 6 до 30 лет. Эти авторы нашли, что в допубертатный период БИК чаще встречается у мальчиков, в пубертате встречаемость болезни среди мальчиков и девочек одинакова, а в зрелом возрасте увеличивается процентное соотношение женщин.
С 1935 по 1999 г. в СССР и РФ описано 317 случаев данной патологии у детей [1—5]. Среди всех форм гиперкортицизма у детей на долю БИК приходится 75—80% [6]. В подавляющем большинстве случаев АКТГ-секретирующие опухоли у детей представлены микроаденомами (менее 5 мм в диаметре) [7]; макроаденомы у детей наблюдаются редко (от 3 до 6%) [8, 9]. БИК может быть диагностирована в любой возрастной группе, но пик заболеваемости приходится на подростковый период. В зарубежной литературе [10, 11] описано несколько случаев развития данного заболевания у детей в возрасте до 1 года. H. Storr и соавт. [12] проанализировали 50 больных с БИК в возрасте от 6 до 30 лет. Эти авторы нашли, что в допубертатный период БИК чаще встречается у мальчиков, в пубертате встречаемость болезни среди мальчиков и девочек одинакова, а в зрелом возрасте увеличивается процентное соотношение женщин.
Клинические проявления БИК у детей. БИК в детском возрасте до настоящего время диагностируется с опозданием. В ряде случаев заболевание манифестирует неспецифическими признаками (задержка роста, прибавка массы тела), что приводит к выбору наблюдательной тактики и отсутствию своевременного лечения. По данным M. Savage и соавт. [7], средняя продолжительность времени от появления симптомов до постановки диагноза составляет 2,5 года (от 0,5 до 6,6 года), сходные данные описаны и в отечественной литературе [5].
В ряде случаев заболевание манифестирует неспецифическими признаками (задержка роста, прибавка массы тела), что приводит к выбору наблюдательной тактики и отсутствию своевременного лечения. По данным M. Savage и соавт. [7], средняя продолжительность времени от появления симптомов до постановки диагноза составляет 2,5 года (от 0,5 до 6,6 года), сходные данные описаны и в отечественной литературе [5].
Рост и костный возраст. Снижение скорости роста у детей с БИК чаще всего является первым и долгое время единственным симптомом [13]. Длительно существующий гиперкортицизм приводит к истинной низкорослости (<–2 SDS). На момент диагностики заболевания низкорослость (рост < –2 SDS) наблюдается у 40—42% детей. У подавляющего большинства детей с БИК (82—97%) рост оценивается ниже среднего [14]. Чем меньше возраст ребенка и больше продолжительность заболевания, тем более выражено отставание в росте [14]. Хронический гиперкортицизм подавляет созревание костей. Костный возраст в большинстве случаев отстает от паспортного. Однако сопутствующее повышение уровня андрогенов создает потенциальный резерв для ростового скачка после ликвидации гиперкортицизма.
Однако сопутствующее повышение уровня андрогенов создает потенциальный резерв для ростового скачка после ликвидации гиперкортицизма.
Ожирение и нарушение углеводного обмена. Характерная особенность течения БИК у детей — резкое замедление скорости роста с параллельным увеличением массы тела. Поэтому важно оценивать не столько сам рост, сколько его скорость и динамику прибавки массы тела. Внимательное и тщательное мониторирование основных антропометрических показателей у ребенка с регулярной фиксацией их на специальных перцентильных кривых позволяет вовремя заподозрить патологию и своевременно начать лечение. Увеличение массы тела и/или ожирение является одним из наиболее типичных проявлений БИК у детей: жалобы на избыточную массу тела, по данным разных авторов [2, 5, 14], встречаются в 61,3—98% случаев. Если границей между избыточной массой тела и ожирением рассматривать SDS ИМТ=+2, то собственно ожирение у детей с БИК встречается в 49—75% случаев [6, 14]. Центральное ожирение играет особо важную роль в развитии метаболических осложнений и является фактором риска сердечно-сосудистых осложнений. Нарушение толерантности к глюкозе наблюдается у 64—85% больных [2].
Нарушение толерантности к глюкозе наблюдается у 64—85% больных [2].
Артериальная гипертензия. Одним из постоянных признаков БИК является артериальная гипертензия; ее выявляют у половины больных детей и подростков, страдающих этим заболеванием [15]. В 1997 г. M. Magiakou и соавт. [16] изучили показатели артериального давления у детей с эндогенным гиперкортицизмом до и после транссфеноидальной аденомэктомии (ТСА). Через 1 год после ТСА все пациенты имели нормальное диастолическое АД (ДАД) и только у 3,2% сохранялась систолическая артериальная гипертензия. Гипертония рассматривается как один из наиболее частых и мощных факторов риска внутримозговых кровоизлияний. В 2008 г. впервые появилось описание ишемического инфаркта головного мозга у 10-летнего мальчика с БИК после ТСА [17]. Американские исследователи проанализировали случаи синдрома Кушинга у детей (в 74% БИК) до и через 1 год после хирургического лечения. Отмечено значительное снижение систолического артериального давления (САД) в ближайшем послеоперационном периоде. Через 1 год после ТСА у детей с БИК частота систолической и диастолической гипертензии составила 16 и 4% соответственно. При этом у 68% пациентов уровень кортизола был в пределах нормы, 32% получали заместительную терапию по поводу вторичного гипокортицизма. Эти данные позволили предположить, что сохраняющаяся после ТСА артериальная гипертензия является следствием ремоделирования сосудистого русла на фоне длительного гиперкортицизма [18].
Через 1 год после ТСА у детей с БИК частота систолической и диастолической гипертензии составила 16 и 4% соответственно. При этом у 68% пациентов уровень кортизола был в пределах нормы, 32% получали заместительную терапию по поводу вторичного гипокортицизма. Эти данные позволили предположить, что сохраняющаяся после ТСА артериальная гипертензия является следствием ремоделирования сосудистого русла на фоне длительного гиперкортицизма [18].
Остеопороз. Системный остеопороз представляет собой распространенное и нередко тяжелое проявление эндогенного гиперкортицизма. По данным разных авторов [2, 5, 19], частота остеопороза у детей с БИК колеблется от 80 до 100%. Остеопения поясничного отдела позвоночника и проксимального отдела бедренной кости у детей с БИК выявляется в 38 и 23% соответственно. Снижение МПКТ обратимо [20—22]. Однако C. Di Somma и соавт. [19] показали, что МПКТ и концентрация биохимических маркеров костной резорбции и костеобразования на фоне ремиссии БИК не достигают контрольных показателей. Основной задачей при лечении стероидного остеопороза у детей являются устранение причины гиперкортицизма и адекватная заместительная терапия гипопитуитаризма, который может возникать после любого метода лечения БИК у детей.
Основной задачей при лечении стероидного остеопороза у детей являются устранение причины гиперкортицизма и адекватная заместительная терапия гипопитуитаризма, который может возникать после любого метода лечения БИК у детей.
Изменения кожи. Патогномоничным симптомом гиперкортицизма является появление на коже багрово-синюшных полос растяжения (стрий). Частота возникновения стрий у детей с БИК колеблется от 40 до 70% [2, 5, 6, 14]. Отсутствие данного симптома у детей не исключает наличия гиперкортицизма. Угри и себорея являются проявлением гиперандрогении и встречаются у 42—47% детей с БИК [2, 6].
Половое созревание. Половое созревание при БИК часто нарушено [6, 14]. У допубертатных детей повышенный синтез андрогенов корой надпочечников приводит к развитию синдрома «неправильного пубертата». При этом наблюдается появление лобкового оволосения при допубертатном объеме яичек у мальчиков и допубертатном состоянии молочных желез у девочек. Частота адренархе у детей с БИК колеблется от 34 до 100% [5, 6, 14]. Подавляющее действие избытка надпочечниковых андрогенов на гонадотрофы гипофиза обусловливает снижение уровня гонадотропинов в крови [6]. При этом как у мальчиков, так и у девочек часто наблюдается задержка полового развития. У девочек нарушения менструального цикла по типу аменореи и олигоменореи развиваются в 73—100% случаев [5, 6].
Подавляющее действие избытка надпочечниковых андрогенов на гонадотрофы гипофиза обусловливает снижение уровня гонадотропинов в крови [6]. При этом как у мальчиков, так и у девочек часто наблюдается задержка полового развития. У девочек нарушения менструального цикла по типу аменореи и олигоменореи развиваются в 73—100% случаев [5, 6].
Психоневрологические нарушения. В клинической картине БИК у детей ведущими являются эндокринные, а не неврологические нарушения. Вероятно, это обусловлено тем, что причиной БИК у детей практически всегда являются микроаденомы. Головная боль выявляется в 33—74% случаев [23]. Психические изменения наблюдаются довольно часто. К ним относятся расстройства сна (6—11%) [2, 6, 23], эмоциональная лабильность, эйфория или психическая астения (12—53%) [2, 14]. Тяжелые психические нарушения у детей с БИК встречаются крайне редко, но своевременная адекватная психотропная терапия обязательна.
Диагностика. До настоящего времени не существует международного консенсуса в отношении диагностики и лечения эндогенного гиперкортицизма у детей. Детские эндокринологи используют рекомендации, принятые для взрослых, с учетом возрастных особенностей [24, 25]. Прежде всего необходимо получить лабораторное подтверждение гиперкортицизма. Для этого применяют различные диагностические тесты и методы: ночной подавляющий тест с 1 мг дексаметазона, 48-часовой подавляющий тест с 2 мг дексаметазона, определение содержания свободного кортизола в суточной моче, определение кортизола в слюне, исследование ночного уровня кортизола в крови, объединенный 2-дневный тест с 2 мг дексаметазона и кортикотропин-рилизинг-гормоном (КРГ), а также тест с десмопрессином. В нашей стране препараты КРГ и десмопрессина не зарегистрированы.
Детские эндокринологи используют рекомендации, принятые для взрослых, с учетом возрастных особенностей [24, 25]. Прежде всего необходимо получить лабораторное подтверждение гиперкортицизма. Для этого применяют различные диагностические тесты и методы: ночной подавляющий тест с 1 мг дексаметазона, 48-часовой подавляющий тест с 2 мг дексаметазона, определение содержания свободного кортизола в суточной моче, определение кортизола в слюне, исследование ночного уровня кортизола в крови, объединенный 2-дневный тест с 2 мг дексаметазона и кортикотропин-рилизинг-гормоном (КРГ), а также тест с десмопрессином. В нашей стране препараты КРГ и десмопрессина не зарегистрированы.
48-часовой подавляющий тест с 2 мг дексаметазона (ПТД 2) (классический малый тест Лиддла) и ночной подавляющий тест с 1 мг дексаметазона (ПТД 1). У здоровых лиц введение глюкокортикоидов подавляет секрецию АКТГ и синтез кортизола по механизму обратной связи. При назначении низких доз дексаметазона в условиях эндогенного гиперкортицизма любого генеза этого подавления не происходит [26]. У детей с массой тела больше 40 кг используется взрослый протокол ПТД 2, а за порог нормального подавления принимаются уровни кортизола в крови менее 50 нмоль/л (1,8 мг/дл). Для детей с массой тела меньше 40 кг расчетная доза дексаметазона составляет 30 мкг/кг/сут [27]. При использовании указанного критерия подавления чувствительность теста у детей составляет 94% [28]. При снижении порога кортизола до 38 нмоль/л (1,4 мг/дл) чувствительность снижается до 90% [29]. Однако в некоторых исследованиях [30, 31] отмечается невысокая диагностическая точность данного теста.
У детей с массой тела больше 40 кг используется взрослый протокол ПТД 2, а за порог нормального подавления принимаются уровни кортизола в крови менее 50 нмоль/л (1,8 мг/дл). Для детей с массой тела меньше 40 кг расчетная доза дексаметазона составляет 30 мкг/кг/сут [27]. При использовании указанного критерия подавления чувствительность теста у детей составляет 94% [28]. При снижении порога кортизола до 38 нмоль/л (1,4 мг/дл) чувствительность снижается до 90% [29]. Однако в некоторых исследованиях [30, 31] отмечается невысокая диагностическая точность данного теста.
ПТД 1 легко выполним даже в амбулаторных условиях. Хотя данный тест используется для скрининга эндогенного гиперкортицизма, достоверных данных о его точности и интерпретации у детей нет. С целью исключения ложноположительных и ложноотрицательных результатов некоторые авторы [32] предлагают проводить одновременное измерение кортизола и дексаметазона.
Содержание свободного кортизола в суточной моче (СКМ). СКМ отражает суммарную экскрецию кортизола за сутки. В норме с мочой выделяется не более 1% кортизола [33]. При проведении данного исследования измеряется свободный, т.е. биологически активный кортизол, не связанный с транскортином. Поскольку уровень СКМ у пациентов с БИК достаточно вариабелен, необходим, как минимум, двукратный сбор мочи. Некоторые авторы [34] рекомендуют трехкратное проведение теста у детей. Можно использовать нормальные значения показателя для взрослых лиц, так как у большинства подростков с БИК масса тела превышает 45 кг [35]. Ряд авторов [34] предлагают рассчитывать СКМ у детей на площадь поверхности тела. В норме она должна быть меньше 70 мкг/м2 (193 нмоль/сут) [36]. Ложноположительные результаты определения СКМ возможны при повышенном потреблении жидкости (более 5 л/сут) [37], ложноотрицательные — при снижении почечной фильтрации и нарушении правил сбора мочи. Нормальный уровень СКМ отмечается у некоторых пациентов с мягким течением гиперкортицизма; в таких случаях целесообразнее определять ночной уровень кортизола в слюне [38].
СКМ отражает суммарную экскрецию кортизола за сутки. В норме с мочой выделяется не более 1% кортизола [33]. При проведении данного исследования измеряется свободный, т.е. биологически активный кортизол, не связанный с транскортином. Поскольку уровень СКМ у пациентов с БИК достаточно вариабелен, необходим, как минимум, двукратный сбор мочи. Некоторые авторы [34] рекомендуют трехкратное проведение теста у детей. Можно использовать нормальные значения показателя для взрослых лиц, так как у большинства подростков с БИК масса тела превышает 45 кг [35]. Ряд авторов [34] предлагают рассчитывать СКМ у детей на площадь поверхности тела. В норме она должна быть меньше 70 мкг/м2 (193 нмоль/сут) [36]. Ложноположительные результаты определения СКМ возможны при повышенном потреблении жидкости (более 5 л/сут) [37], ложноотрицательные — при снижении почечной фильтрации и нарушении правил сбора мочи. Нормальный уровень СКМ отмечается у некоторых пациентов с мягким течением гиперкортицизма; в таких случаях целесообразнее определять ночной уровень кортизола в слюне [38].
Ночной уровень кортизола в слюне (КС). Биологически активный (свободный) кортизол в крови находится в равновесии с кортизолом в слюне; его концентрация не зависит от количества слюны. Изменения уровня кортизола в крови сопровождаются аналогичными изменениями его концентрации в слюне уже через несколько минут [39]. Тест прост в выполнении, безболезнен, не вызывает негативной реакции со стороны ребенка и служит хорошей альтернативой определению кортизола в плазме у детей. Для адекватной оценки теста рекомендуется 2—3-кратное его повторение [40]. Для измерения кортизола в слюне используются методы с различными диапазонами референсных значений, что отражается на чувствительности и специфичности методов [41—43]. Данный показатель у детей обладает высокой диагностической ценностью при гиперкортицизме (чувствительность: 92—100%, специфичность: 93—100%) [41, 42]. Показана высокая чувствительность (100%) и специфичность (95,2%) теста при проведении дифференциальной диагностики гиперкортицизма и ожирения у детей [44].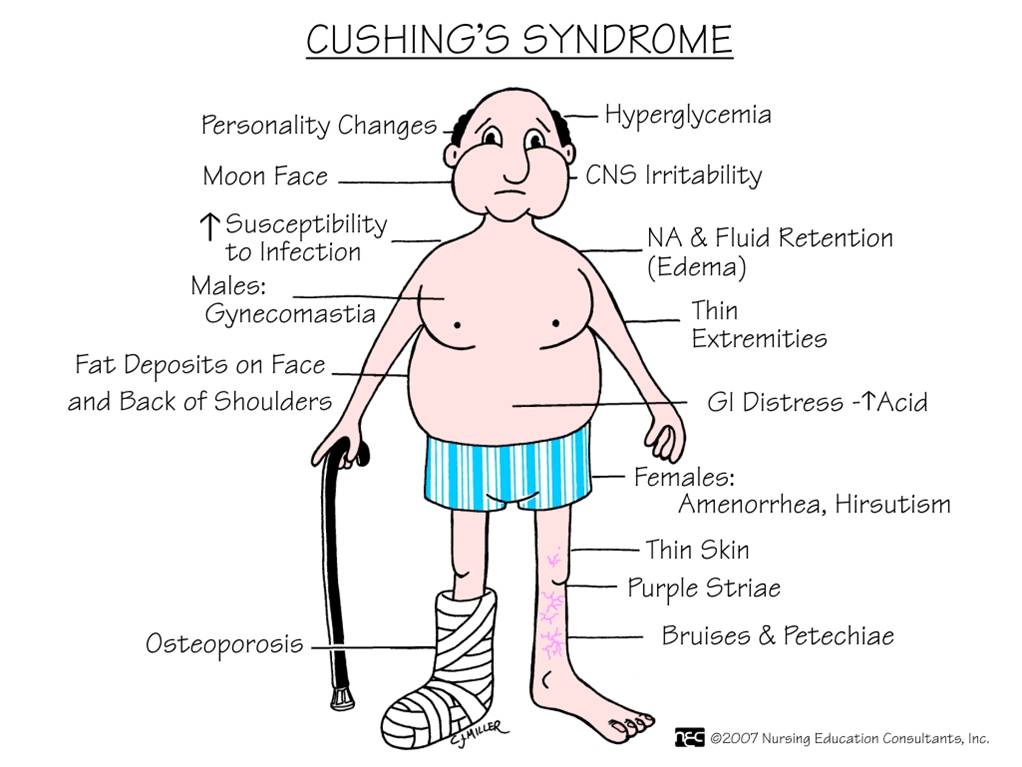
Ночной уровень кортизола. Определение ночного уровня кортизола во время сна впервые предложили в 1995 г. J. Newell-Price и соавт. [45]. У детей с гиперкортицизмом этот способ обладает большей чувствительностью, чем СКМ (99% против 88%) [37]. У пациентов с нормальным СКМ и отрицательным тестом с дексаметазоном уровень ночного кортизола во время сна более 1,8 мг/дл (50 нмоль/л) или уровень вечернего кортизола во время бодрствования более 7,5 мг/дл (207 нмоль/л) увеличивает вероятность наличия гиперкортицизма [45]. В таких условиях уровень ночного кортизола во время сна менее 1,8 мг/дл делает диагноз эндогенного гиперкортицизма маловероятным [31]. Определение уровня ночного кортизола в сыворотке во время сна применяется для исключения гиперкортицизма (при уровне менее 1,8 мг/дл) при ложноположительных результатах подавляющего теста с дексаметазоном на фоне приема антиконвульсантов [46]. Определение уровня ночного кортизола во время сна производится редко. Тем не менее применение этого метода увеличивает точность диагностики [47].
Ночной (вечерний) уровень кортизола во время бодрствования. Метод проще предыдущего. В некоторых исследованиях [48] продемонстрирована его высокая чувствительность (более 96%) при уровне кортизола более 7,5 мг/дл (более 207 нмоль/л). Для повышения специфичности рядом авторов [49] были предложены более жесткие диагностические критерии, что, однако, сопровождается снижением чувствительности: при уровне кортизола более 8,3—12 мг/дл чувствительность составляет 90—92%, специфичность — 96%. Чтобы избежать ложноположительных результатов, необходима предварительная госпитализация пациента. Возможен также забор крови через заранее установленный катетер [40]. У маленьких детей (в связи с особенностями режима сна и бодрствования) наименьший уровень кортизола в норме наблюдается в более раннее время, и возможен более ранний забор крови [40]. Учитывая все это, определение ночного уровня кортизола в плазме (согласно консенсусу 2008 г.) рекомендуется только в качестве дополнительного метода диагностики [50]. Несмотря на высокую точность, ни один из предложенных тестов в отдельности не является универсальным для окончательной диагностики гиперкортицизма. При положительных результатах двух тестов переходят ко второму этапу диагностики.
Несмотря на высокую точность, ни один из предложенных тестов в отдельности не является универсальным для окончательной диагностики гиперкортицизма. При положительных результатах двух тестов переходят ко второму этапу диагностики.
Определение причины гиперкортицизма. После лабораторного подтверждения гиперкортицизма необходимо провести дифференциальную диагностику между его формами. С этой целью применяют несколько методов. Большинство из них основано на разделении АКТГ-зависимого и АКТГ-независимого гиперкортицизма. Для подтверждения центрального генеза гиперкортицизма необходимо проведение не менее двух тестов. Топическая диагностика (МРТ головного мозга, КТ или УЗИ надпочечников) позволяет визуализировать патологический процесс и подтвердить данные лабораторного обследования.
Уровень АКТГ в плазме. Оценка уровня АКТГ в плазме позволяет выяснить, является ли процесс АКТГ-зависимым или АКТГ-независимым. Уровни АКТГ более 15 пг/мл почти всегда отражают АКТГ-зависимый гиперкортицизм. В то же время нормальная концентрация АКТГ в крови может наблюдаться как при БИК, так и при опухолях надпочечников [51] и, таким образом, пограничные значения АКТГ от 5 до 15 пг/мл трудно интерпретировать. По данным D. Batista и соавт. [34], при использовании в качестве критерия уровня АКТГ 29 пг/мл (6 пмоль/л) специфичность метода составляет 100%, а чувствительность — 70%. Нарушение суточного ритма секреции встречается у 100% детей с БИК [34]. Несмотря на редкость АКТГ-эктопированного синдрома у детей и учитывая возможность получения спорных пограничных показателей, измерение уровня АКТГ является не единственным способом дифференциальной диагностики причины гиперкортицизма.
В то же время нормальная концентрация АКТГ в крови может наблюдаться как при БИК, так и при опухолях надпочечников [51] и, таким образом, пограничные значения АКТГ от 5 до 15 пг/мл трудно интерпретировать. По данным D. Batista и соавт. [34], при использовании в качестве критерия уровня АКТГ 29 пг/мл (6 пмоль/л) специфичность метода составляет 100%, а чувствительность — 70%. Нарушение суточного ритма секреции встречается у 100% детей с БИК [34]. Несмотря на редкость АКТГ-эктопированного синдрома у детей и учитывая возможность получения спорных пограничных показателей, измерение уровня АКТГ является не единственным способом дифференциальной диагностики причины гиперкортицизма.
Большая проба с дексаметазоном (БДП). Эта проба была разработана Лиддлом (Liddl) и в настоящее время в силу своей простоты широко используется. Тест основан на различной чувствительности аденомы гипофиза и периферических опухолей к глюкокортикостероидам. Единственное отличие БДП от ПТД 2 заключается в использовании более высокой дозы дексаметазона. В ходе 2-дневного теста вместо 0,5 мг дексаметазона назначают 2 мг каждые 6 ч. Для детей с массой тела меньше 40 кг расчетная доза дексаметазона составляет 120 мкг/кг/сут. Примерно в 80% случаев у больных с БИК уровень свободного кортизола в моче снижается более чем на 50% [47]. По данным D. Batista и соавт. [34], у детей чувствительность метода составляет 97,5% при специфичности 100%, если критерием служит снижение уровня кортизола на 20% от базального. Данный тест прост, не требует специальных навыков и оборудования. Однако он часто не позволяет четко разграничить БИК и эктопированный АКТГ-синдром у детей [52]. Кроме того, недавно показано, что результаты БДП сходны с таковыми ПТД 2, что явилось причиной отказа от проведения БДП в ряде зарубежных клиник [14].
В ходе 2-дневного теста вместо 0,5 мг дексаметазона назначают 2 мг каждые 6 ч. Для детей с массой тела меньше 40 кг расчетная доза дексаметазона составляет 120 мкг/кг/сут. Примерно в 80% случаев у больных с БИК уровень свободного кортизола в моче снижается более чем на 50% [47]. По данным D. Batista и соавт. [34], у детей чувствительность метода составляет 97,5% при специфичности 100%, если критерием служит снижение уровня кортизола на 20% от базального. Данный тест прост, не требует специальных навыков и оборудования. Однако он часто не позволяет четко разграничить БИК и эктопированный АКТГ-синдром у детей [52]. Кроме того, недавно показано, что результаты БДП сходны с таковыми ПТД 2, что явилось причиной отказа от проведения БДП в ряде зарубежных клиник [14].
Тест с кортиколиберином (КРГ). КРГ стимулирует синтез АКТГ кортикотрофами гипофиза. При БИК чувствительность кортикотрофов к КРГ сохранена, и обычно регистрируется нормальный или даже повышенный ответ АКТГ и кортизола на введение КРГ. У детей чувствительность метода составляет 81%, если критерием служит повышение уровня АКТГ более чем на 35%, и 74%, если критерием служит повышение уровня кортизола более чем на 20% [34].
У детей чувствительность метода составляет 81%, если критерием служит повышение уровня АКТГ более чем на 35%, и 74%, если критерием служит повышение уровня кортизола более чем на 20% [34].
Топическая диагностика. МРТ головного мозга.В большинстве случаев АКТГ-секретирующие опухоли при БИК у детей — микроаденомы (менее 5 мм в диаметре), поэтому их визуализация с помощью МРТ затруднена. По данным разных авторов [34, 40], аденома при БИК у детей визуализируется в 55—63% случаев. Отмечается низкая предикторная ценность определения местоположения аденомы с помощью МРТ по сравнению с данными операции. Данные МРТ совпадали с результатами операции у 9 (52%) из 17 детей [40]. Таким образом, нормальная картина МРТ не исключает БИК. Более того, инциденталомы гипофиза встречаются у 10% здоровых людей [40] и у 8% детей с гиперкортицизмом надпочечникого генеза [34], что требует более тщательной дифференциальной диагностики. В то же время МРТ в комплексе с другими методами является важным компонентом диагностики БИК.
Изменения надпочечников при БИК. Изменения надпочечников при БИК могут быть выявлены с помощью УЗИ или КТ. Наиболее частым вариантом является диффузная двусторонняя гиперплазия, как правило, умеренно выраженная. По данным D. Batista и соавт. [34], двусторонняя гиперплазия надпочечников наблюдается у 53% детей с БИК.
Двусторонняя катетеризация нижнего каменистого синуса (ДКНКС) с определением АКТГ на фоне стимуляции КРГ. Техника ДКНКС была разработана в 80-е годы прошлого века в США и стала рутинным методом диагностики у взрослых больных. С помощью этого метода решаются две задачи: 1) проводится дифференциальная диагностика БИК с АКТГ-эктопированным синдромом и 2) определяется локализация аденомы гипофиза [53]. У детей АКТГ-эктопированный синдром встречается крайне редко и главная цель ДКНКС — определение положения аденомы (если она не выявляется при МРТ). Исследование должно выполняться опытным нейрохирургом. Для повышения диагностической точности процедуры применяют стимуляцию КРГ. Считается, что у детей данная методика позволяет лучше определить местоположение аденомы, чем МРТ [54]. Первый опыт использования ДКНКС в педиатрической практике опубликован в США [6]; предикторная ценность метода составила 75—80%. По данным M. Savage и соавт. [7], латерализация опухоли наблюдалась в 79% случаев. Данные ДКНКС совпадали с результатами операции у 20 (83%) детей. Ремиссия наблюдалась у 18 (75%) детей. В то же время недавнее исследование показывает, что данные ДКНКС совпадают с результатами операции лишь в 58% случаев. Это лишает применение данной методики необходимости [9]. Однако в том же исследовании процент латерализации возрос до 70 после исключения 22 пациентов с центрально расположенными аденомами гипофиза. Причиной ложноотрицательных результатов может быть влияние пролактина на концентрацию АКТГ [55]. В отсутствие КРГ можно использовать десмопрессин. Для определения причины гиперкортицизма необходимо выполнение по крайней мере двух из предложенных методов. С их помощью в настоящее время в подавляющем большинстве случаев удается точно установить причину патологического процесса.
Считается, что у детей данная методика позволяет лучше определить местоположение аденомы, чем МРТ [54]. Первый опыт использования ДКНКС в педиатрической практике опубликован в США [6]; предикторная ценность метода составила 75—80%. По данным M. Savage и соавт. [7], латерализация опухоли наблюдалась в 79% случаев. Данные ДКНКС совпадали с результатами операции у 20 (83%) детей. Ремиссия наблюдалась у 18 (75%) детей. В то же время недавнее исследование показывает, что данные ДКНКС совпадают с результатами операции лишь в 58% случаев. Это лишает применение данной методики необходимости [9]. Однако в том же исследовании процент латерализации возрос до 70 после исключения 22 пациентов с центрально расположенными аденомами гипофиза. Причиной ложноотрицательных результатов может быть влияние пролактина на концентрацию АКТГ [55]. В отсутствие КРГ можно использовать десмопрессин. Для определения причины гиперкортицизма необходимо выполнение по крайней мере двух из предложенных методов. С их помощью в настоящее время в подавляющем большинстве случаев удается точно установить причину патологического процесса.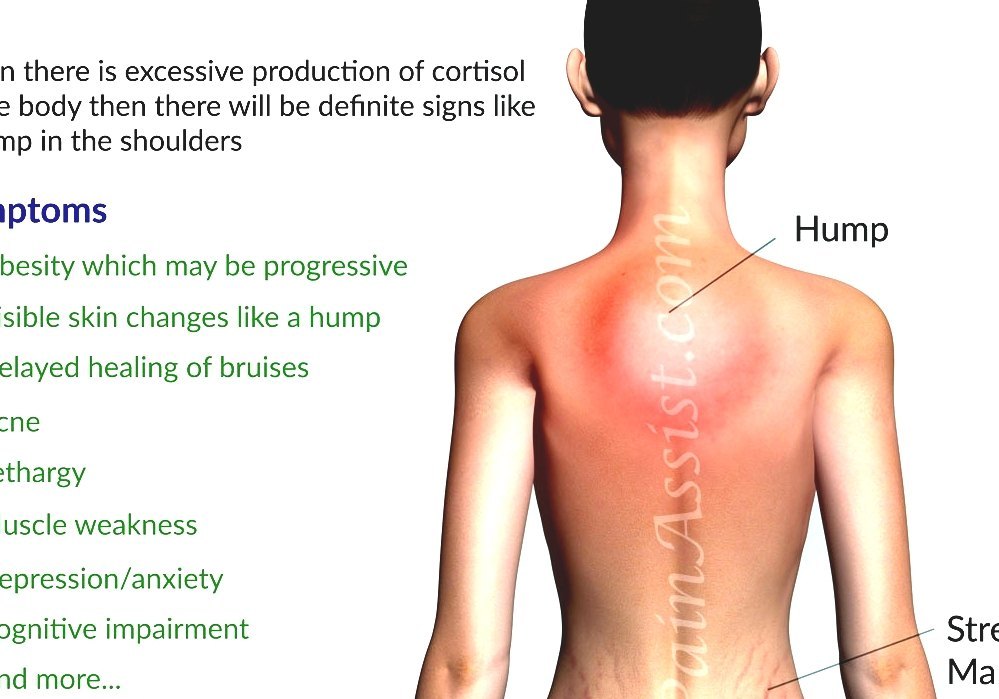
Заключение
У детей с БИК значительным изменениям подвергаются практически все органы и системы. В основе нарушений, степень которых определяется тяжестью и длительностью процесса, лежат многие факторы, связанные с гиперкортицизмом. Современные диагностические возможности позволяют в короткие сроки выявить данное заболевание и выбрать для каждого больного наиболее рациональный метод лечения. Своевременная диагностика и успешное лечение БИК у детей — залог высокого качества жизни в будущем.
ᐈ Как вылечить синдром Кушинга? ~【Диагностика в Киеве】
Синдром Кушинга — это группа клинических симптомов, возникающих в результате повышения в организме уровня глюкокортикостероидов (ГКС — гормоны, вырабатываемые корой надпочечников). Наиболее важным из них является кортизол, который влияет на метаболические изменения.
Секреция ГКС корой надпочечников регулируется гипофизом. Он производит гормон под названием адренокортикотропин (АКТГ), который стимулирует надпочечники вырабатывать кортизол. Высокий уровень кортизола подавляет выработку АКТГ, а низкий уровень увеличивает выработку этих гормонов. Гиперкортицизм возникает вследствие использования пероральных кортикостероидов или при повышенном уровне кортизола в организме.
Высокий уровень кортизола подавляет выработку АКТГ, а низкий уровень увеличивает выработку этих гормонов. Гиперкортицизм возникает вследствие использования пероральных кортикостероидов или при повышенном уровне кортизола в организме.
Відкрити
Згорнути
Классификация синдрома Кушинга
Существует 2 формы синдрома Кушинга:
- АКТГ-зависимая форма. В кровь пациента попадает слишком много кортикотропина, который является гормоном гипофиза. Причина — опухоль самого гипофиза. Болезнь Кушинга может быть следствием секреции АКТГ из опухоли, которая располагается за пределами самого гипофиза, например, в щитовидной или поджелудочной железе.
- АКТГ-независимая форма. Высокий уровень кортизола в организме может быть результатом гиперплазии или опухоли надпочечников.
Відкрити
Згорнути
Этиология синдрома Иценко-Кушинга
Причины синдрома Кушинга
- Экзогенные — вызванные поступлением внешних глюкокортикостероидов.
 Это следствие длительного использования стероидов в терапевтических целях при многих болезнях.
Это следствие длительного использования стероидов в терапевтических целях при многих болезнях. - Эндогенные — кортизол вырабатывается организмом в количествах, превышающих физиологические нормы на фоне онкологии.
Среди провоцирующих факторов болезни Иценко-Кушинга встречаются инфекционные поражения мозга, травмы и длительная интоксикация. Также проявление болезни иногда связывают с половым созреванием, климаксом или родами.
Відкрити
Згорнути
Патогенез заболевания
Синдром Кушинга, признаки которого довольно специфичны, образуется при избытке кортизола. Хотя этот гормон и способствует развитию патологии, он также участвует в метаболических процессах (регулирует метаболизм глюкозы, жиров и белков).
Важным фактором в развитии и эффективном лечении заболевания является причина гормональных нарушений. Наилучший прогноз имеют пациенты, у которых опухоль гипофиза или надпочечника была удалена в результате операции. При злокачественном новообразовании по окончанию лечения пациент должен находиться под наблюдением эндокринолога и проходить регулярные осмотры. Способы предотвращения болезни пока неизвестны.
При злокачественном новообразовании по окончанию лечения пациент должен находиться под наблюдением эндокринолога и проходить регулярные осмотры. Способы предотвращения болезни пока неизвестны.
Відкрити
Згорнути
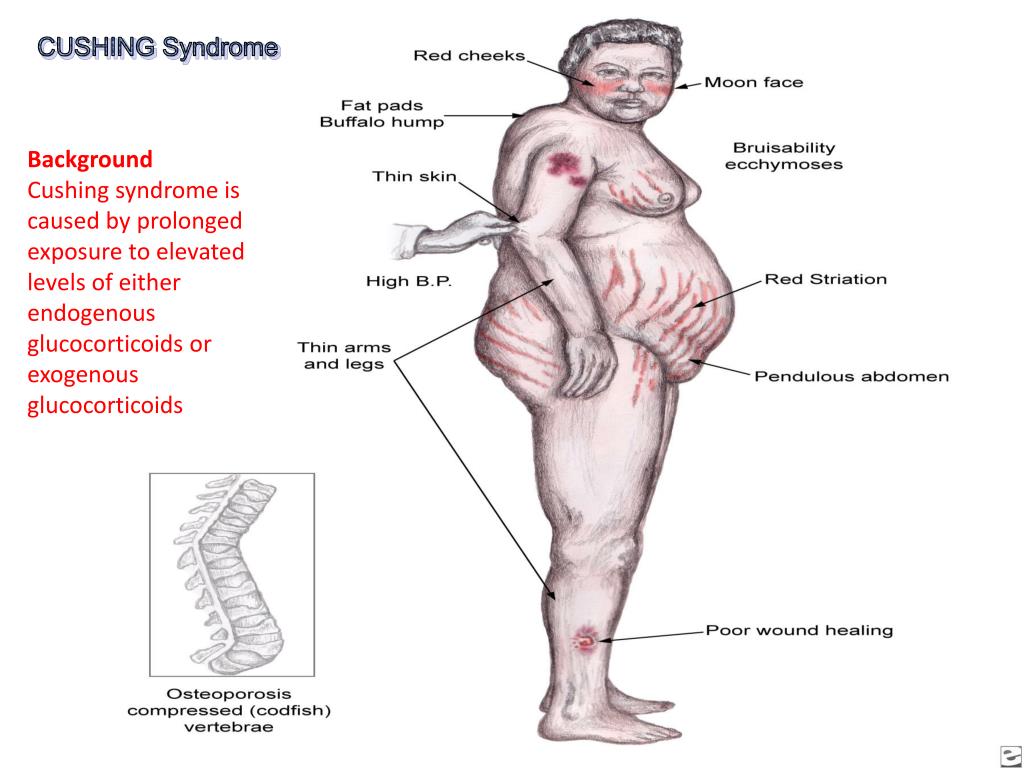
Синдром Иценко-Кушинга: клинические проявления
Симптомы синдрома Кушинга:
- повышение аппетита;
- склонность к появлению синяков и отеков;
- проблемы с цветом лица;
- широкие красные или голубоватые растяжки;
- постепенная атрофия мышц конечностей;
- подверженность частым инфекциям;
- нарушения менструального цикла у женщин, импотенция у мужчин;
- покраснение, связанное с истончением кожи и расширением сосудов;
- скопление жировой ткани вокруг живота, шеи (так называемая шея буйвола) и над ключицами.
Відкрити
Згорнути
Кроме того у больных происходит разрушение костной системы, приводящее к остеопорозу, появляются признаки воспалительных состояний слизистой желудка.
Также специфическим симптомом синдрома Кушинга является лунообразная форма лица пациента.
Відкрити
Згорнути
Особенности течения медицинской проблемы у беременных
Диагностировать болезнь Иценко-Кушинга при беременности часто бывает проблематично. Уровень общего кортизола и АКТГ в таких случаях всегда выше. Симптомом заболевания у беременных является увеличение массы тела, непропорциональное сроку беременности. Другие признаки — высокое артериальное давление и легкие синяки. При стабильном течении заболевания необходимо придерживаться симптоматического лечения, а специализированную медикаментозную терапию применять после родов.
Відкрити
Згорнути
Особенности синдрома Кушинга у детей
Дети, страдающие синдромом Иценко-Кушинга, начинают медленнее расти и быстрее набирать вес. Чтобы распознать появление симптомов болезни, рекомендуется регулярно измерять и взвешивать ребенка. Многое в патогенезе зависит от возраста и от того, секретируется ли гормон стресса непрерывно или циклически.
Внешне синдром Кушинга у детей проявляется характерной бычьей шее, округлым лицом. Также приблизительно у 50 % больных детей с синдромом Кушинга наблюдается усталость, высокое артериальное давление и растяжки.
Відкрити
Згорнути
Осложнения синдрома Кушинга
Последствия синдрома Кушинга связаны с формированием гипертонии, ИБС, диабета и язвенной болезни. Также увеличивается риск остеопороза и склонность к переломам костей. Часто диагностируются психические расстройства (депрессия или когнитивные нарушения).
Відкрити
Згорнути
Диагностика синдрома Кушинга
Базой диагностики болезни Иценко-Кушинга является сбор анамнеза. При наличии визуальных симптомов возникает подозрение на наличие патологического процесса. Ключевыми в постановке диагноза становятся лабораторные исследования мочи и крови, а также анализ слюны на наличие кортизола.
Кроме того, диагностика болезни Иценко-Кушинга требует направления пациента на компьютерную томографию или МРТ, чтобы определить причину нарушений.
Відкрити
Згорнути
Лечение синдрома Иценко-Кушинга
Лечение синдрома Кушинга зависит от причины заболевания. Если диагностирована опухоль, то требуется операция. Дополнительно необходимо лечить сопутствующие заболевания, например, гипертонию.
Как вылечить синдром Кушинга?
- Применять медикаментозную терапию, которая направлена на блокаду избыточной выработки кортикостероидов и АКТГ.
- Использовать лучевую терапию, снижающую активность гипофиза.
- При длительном приеме кортикостероидов — сократить дозу.
При лечении синдрома Кушинга следует учесть индивидуальность каждого случая, что подразумевает выбор наиболее подходящей терапии.
Відкрити
Згорнути
Операции при синдроме Кушинга
Опухоли гипофиза и надпочечников удаляют хирургическим путем. Если процедура будет проведена радикально, скорее всего исчезнут симптомы болезни. Если пациенту удалили надпочечники, потребуется пожизненная заместительная терапия специальным гормоном. Когда позволяет ситуация, хирург старается применить миниинвазивные методы.
Когда позволяет ситуация, хирург старается применить миниинвазивные методы.
Відкрити
Згорнути
Контроль излеченности
Независимо от вида применявшегося лечения, пациенты с синдромом Иценко-Кушинга нуждаются в длительном динамическом наблюдении. При контрольных обследованиях необходимо оценить:
- эффективность проведенного лечения;
- наличие / отсутствие рецидива заболевания;
- состояние гипофизарных функций.
Наиболее часто после проведенного лечения выпадает функция СТГ, реже — развивается вторичный гипотиреоз, а также появляется нарушение менструальной функции у женщин.
Відкрити
Згорнути
Профилактика
Первичная профилактика синдрома Кушинга не разработана.
Цель вторичной профилактики — предотвратить рецидив болезни. При этом важно соблюдать рекомендации врача, выработать правильный режим дня и пересмотреть рацион питания. Боли в суставах и мышцах лучше снимать с помощью горячей ванны или массажа. Нельзя игнорировать приступы депрессии.
Нельзя игнорировать приступы депрессии.
Відкрити
Згорнути
Советы и рекомендации
У людей с синдромом Кушинга часто имеются проблемы в виде диабета или плохой толерантности к глюкозе. Поэтому в основе диеты должны быть макаронные изделия, рис и крупы. Стоит ограничить потребление простых углеводов: сладостей, фруктов, сухофруктов и меда.
Рекомендуемый прием пищи 3-4 раза в день, но не чаще, чем каждые 4 часа. Это позволит избежать постоянной стимуляции поджелудочной железы.
Глюкокортикоиды, которые обычно используют при лечении синдрома Кушинга, увеличивают выведение кальция, цинка и калия. Чтобы восполнить их нехватку, стоит включить в рацион семечки, шпинат, фундук, рыбу и мак.
Відкрити
Згорнути
Статья носит информационно-ознакомительный характер. Пожалуйста, помните: самолечение может вредить вашему здоровью.
Відкрити
Згорнути
Источники
- Medscape
- Mayo Clinic
Відкрити
Згорнути
Автор статьи:
Марунчин Наталья Андреевна
Врач-эндокринолог второй категории, кандидат медицинских наук
Эксперт по направлению:
Кваченюк Андрей Николаевич
Врач-хирург-эндокринолог высшей категории, доктор медицинских наук
Какой врач лечит синдром Кушинга?
Тревожные симптомы, характерные для синдрома Кушинга, являются основанием для направления пациента к эндокринологу. Квалифицированное лечение синдрома Кушинга в Киеве предоставляет наша клиника МЕДИКОМ. Почему стоит обратиться именно к нам? Потому что центры МЕДИКОМ удобно расположены в двух районах столицы — Оболонь и Печерск, специалисты отличаются профессионализмом, новейшая аппаратура позволяет точно диагностировать синдром Кушинга и другие заболевания. Обращайтесь к нам — и будете здоровы!
Квалифицированное лечение синдрома Кушинга в Киеве предоставляет наша клиника МЕДИКОМ. Почему стоит обратиться именно к нам? Потому что центры МЕДИКОМ удобно расположены в двух районах столицы — Оболонь и Печерск, специалисты отличаются профессионализмом, новейшая аппаратура позволяет точно диагностировать синдром Кушинга и другие заболевания. Обращайтесь к нам — и будете здоровы!
Показать еще
Сертификаты
Отзывы
26.11.2020 13:53
Карим Галбацов
Понимаю, что нужна операция, но начну с диеты. Спасибо за такой высококлассный материал и помощь в осознании проблемы и советах по ее устранению!
30.09.2020 18:36
Леонид Данилов
Понравилась подача, все четко и по делу, особенно для таких профанов, как я, которые нуждаются в качественной информации.
12.09.2020 20:13
Анастасия Семена
Очень все подробно, отлично структурировано. Вся прочитанная информация была понятна, почерпнула для себя пару моментов.
16.07.2020 08:52
Ярослав Бойко
Очень лаконично. В отличие от многих других статей, где вода с водой и с минимумом полезной инфы, эта выделяется. Мне актуально, как никогда, так что сохранил.
03.05.2020 11:21
Ольга Вячеславовна
В моем случае мне помогут только ингибиторы, но все равно ищу всевозможные статьи. Ваша статья максимально хорошо скомплектована, без воды и завлекаловки. Всем здоровья ! Не болейте, радуйтесь жизни.
18.04.2020 15:40
Яна Видякина
Спасибо за статью в которой информация по лечению донесена понятно без заумщины.
23.02.2020 21:38
Наталья Волчкова
Статья как и всегда информативна и максимально полезна!
Показать еще 3
Всего 7 отзывов
оставить отзыв
Синдром Кушинга у детей | Кедры-Синай
ОБ
ПРИЧИНЫ
ДИАГНОЗ
ЛЕЧЕНИЕ
СЛЕДУЮЩИЕ ШАГИ
Что такое синдром Кушинга у детей?
Синдром Кушинга — гормональное расстройство. Это вызвано высоким уровнем гормона кортизола в течение длительного времени. Синдром Кушинга встречается довольно редко. Чаще всего им страдают взрослые в возрасте от 20 до 50 лет. Но это может произойти и у детей. Иногда его называют гиперкортицизмом.
Это вызвано высоким уровнем гормона кортизола в течение длительного времени. Синдром Кушинга встречается довольно редко. Чаще всего им страдают взрослые в возрасте от 20 до 50 лет. Но это может произойти и у детей. Иногда его называют гиперкортицизмом.
Что вызывает синдром Кушинга у ребенка?
Синдром Кушинга возникает, когда в организме слишком много кортизола. Расстройство часто начинается с гипофиза. Опухоль в железе вырабатывает слишком много адренокортикотропного гормона (АКТГ). Это заставляет надпочечники вырабатывать слишком много кортикостероидов.
Другой основной причиной является прием глюкокортикоидов, таких как преднизолон, в течение длительного времени. Они иногда используются для лечения хронических заболеваний, таких как астма. Другие причины включают в себя:
- Некоторые виды рака
- Опухоль надпочечника
- Наследственное эндокринное заболевание
- Определенные хронические состояния, такие как воспалительное заболевание кишечника, волчанка или ревматоидный артрит
Каковы симптомы синдрома Кушинга у ребенка?
Синдром Кушинга может вызвать:
- Избыточное увеличение веса, особенно в верхней части тела, лица и шеи
- Жировой слой на задней части шеи
- Красные полосы (стрии) на животе (животе)
- Тонкие руки и ноги
- Медленный рост
- Высокое кровяное давление
- Хрупкая и тонкая кожа
- Затемненный цвет кожи
- Акне
- Синяк
- Растяжки на животе, бедрах, ягодицах, руках и груди
- Костная и мышечная слабость
- Сильная усталость
- Высокий уровень сахара в крови
- Раздражительность и тревожность
- У девочек: чрезмерный рост волос и нерегулярный менструальный цикл или его отсутствие
- У мальчиков: низкое половое влечение и бесплодие
Симптомы синдрома Кушинга могут быть такими же, как и при других заболеваниях. Убедитесь, что ваш ребенок посещает своего лечащего врача для постановки диагноза.
Убедитесь, что ваш ребенок посещает своего лечащего врача для постановки диагноза.
Как диагностируется синдром Кушинга у ребенка?
Медицинский работник спросит об истории болезни вашего ребенка и проведет его медицинский осмотр. Вашему ребенку также могут потребоваться анализы, такие как:
- Анализы крови. Это делается для измерения уровня кортизола.
- Анализы мочи. Это также делается для измерения уровня кортизола.
- Рентген. В этом тесте используется небольшое количество радиации для получения изображений внутренней части тела.
- 24-часовой анализ мочи. Моча собирается в течение 24 часов для анализа на кортизол.
- Компьютерная томография. В этом тесте используется серия рентгеновских лучей и компьютер для получения подробных изображений внутренней части тела. Компьютерная томография показывает изображения любой части тела, включая кости, мышцы, жир и органы.

- МРТ. В этом тесте используются большие магниты, радиоволны и компьютер для получения подробных изображений внутренней части тела.
- Тест на подавление дексаметазона. Этот тест показывает, является ли избыток кортизола источником гипофиза или опухолей в других местах.
- Тест стимуляции кортикотропин-высвобождающего гормона (CRH). Этот тест показывает, является ли причиной опухоль гипофиза или опухоль надпочечников.
Как лечится синдром Кушинга у ребенка?
Лечение будет зависеть от симптомов, возраста и общего состояния здоровья вашего ребенка. Это также будет зависеть от того, насколько тяжелым является состояние.
Лечение может включать:
- Изменение дозы препарата глюкокортикоидного гормона или переход на другой препарат
- Операция по удалению опухоли надпочечника или гипофиза
- Операция по удалению надпочечников
- Лекарства, блокирующие избыточную выработку кортизола
- Лучевая терапия гипофиза
- Химиотерапевтические или иммунотерапевтические препараты
Какие возможны осложнения синдрома Кушинга у ребенка?
При отсутствии лечения синдром Кушинга может вызывать:
- Аномальный рост и развитие, особенно половое развитие
- Высокое кровяное давление
- Нарушение иммунной системы
- Диабет
- Бесплодие
Как помочь ребенку с синдромом Кушинга?
Синдром Кушинга может повлиять на рост, развитие и самооценку ребенка. Своевременное лечение может помочь уменьшить проблемы. Обязательно поработайте с поставщиками медицинских услуг вашего ребенка над планом ухода, который работает для вашего ребенка.
Своевременное лечение может помочь уменьшить проблемы. Обязательно поработайте с поставщиками медицинских услуг вашего ребенка над планом ухода, который работает для вашего ребенка.
Когда мне следует позвонить лечащему врачу моего ребенка?
Позвоните лечащему врачу вашего ребенка, если у вашего ребенка есть какие-либо симптомы синдрома Кушинга.
Ключевые моменты синдрома Кушинга у детей
- Синдром Кушинга — это редкое заболевание, вызванное высоким уровнем кортизола в течение длительного времени.
- Вызывается опухолью гипофиза или надпочечника или приемом некоторых лекарств.
- Синдром Кушинга может вызывать избыточный вес, медленный рост и проблемы с половым развитием.
- Лечение может включать медикаментозное или хирургическое вмешательство.
- Синдром Кушинга может повлиять на рост, развитие и самооценку ребенка. Своевременное лечение может помочь уменьшить проблемы.
Дальнейшие действия
Советы, которые помогут вам получить максимальную отдачу от визита к поставщику медицинских услуг вашего ребенка:
- Знайте причину визита и то, что вы хотите, чтобы произошло.

- Перед посещением запишите вопросы, на которые вы хотите получить ответы.
- При посещении запишите название нового диагноза и любые новые лекарства, методы лечения или тесты. Также запишите все новые инструкции, которые ваш поставщик дает вам для вашего ребенка.
- Знайте, почему прописывается новое лекарство или лечение и как оно поможет вашему ребенку. Также знайте, каковы побочные эффекты.
- Спросите, можно ли лечить состояние вашего ребенка другими способами.
- Знайте, почему рекомендуется тест или процедура и что могут означать результаты.
- Знайте, чего ожидать, если ваш ребенок не примет лекарство или не пройдет тест или процедуру.
- Если у вашего ребенка запланирована повторная встреча, запишите дату, время и цель этой встречи.
- Знайте, как вы можете связаться с врачом вашего ребенка в нерабочее время. Это важно, если ваш ребенок заболел и у вас есть вопросы или вам нужен совет.
Синдром Кушинга (для родителей) — Nemours KidsHealth
Что такое синдром Кушинга?
Прокладка
Синдром — это редкое состояние, которое возникает, когда в организме слишком много гормона кортизола .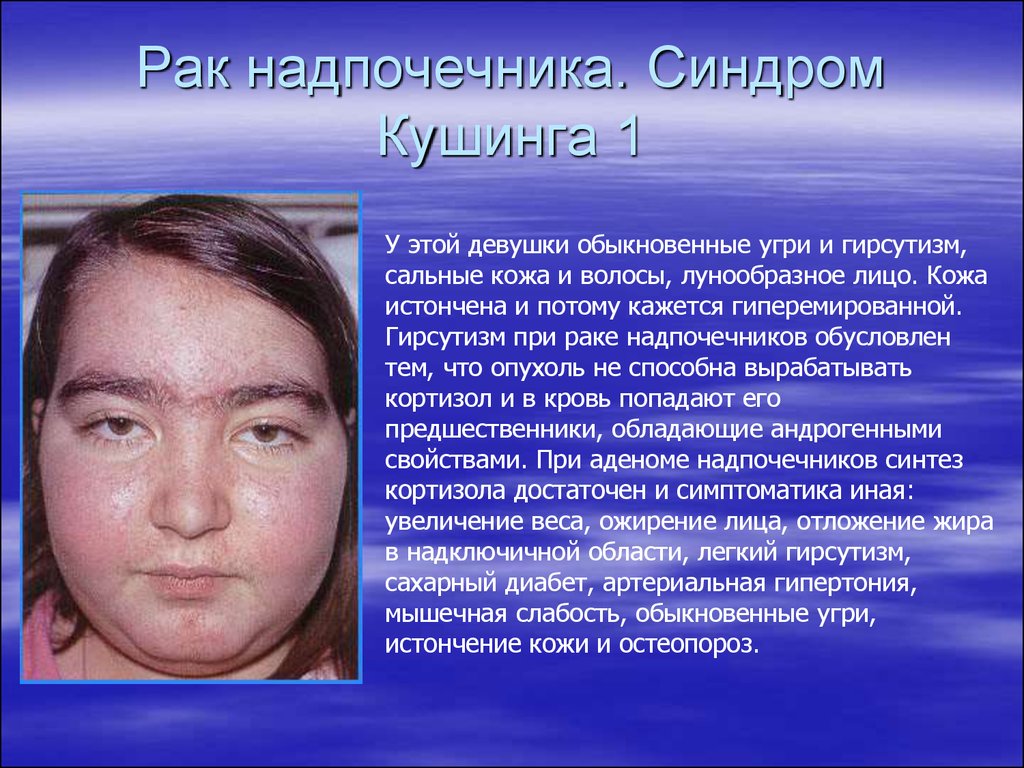 Его также называют гиперкортицизмом .
Его также называют гиперкортицизмом .
Большинство случаев синдрома Кушинга возникает у взрослых в возрасте от 25 до 40 лет, чаще у женщин, чем у мужчин.
Что такое кортизол?
Кортизол (KOR-tih-sol) представляет собой разновидность глюкокортикоидного (gloo-koh-KOR-tih-koyd) гормона, вырабатываемого двумя
надпочечники. Надпочечники — это небольшие органы, расположенные над почками.
Кортизол, вырабатываемый организмом:
- преобразует сахар, жир и белок в энергию
- стимулирует
производство глюкозы - регулирует кровяное давление
- помогает предотвратить отек и воспаление
- подавляет реакции иммунной системы
Его часто называют «гормоном стресса », потому что кортизол дает нашему телу энергию для борьбы со стрессом, таким как лихорадка, болезнь, травма или опасная ситуация (реакция «бей или беги»). Он сигнализирует телу ускорить
метаболизм накопленных сахаров, жиров и белков, превращая их в энергию.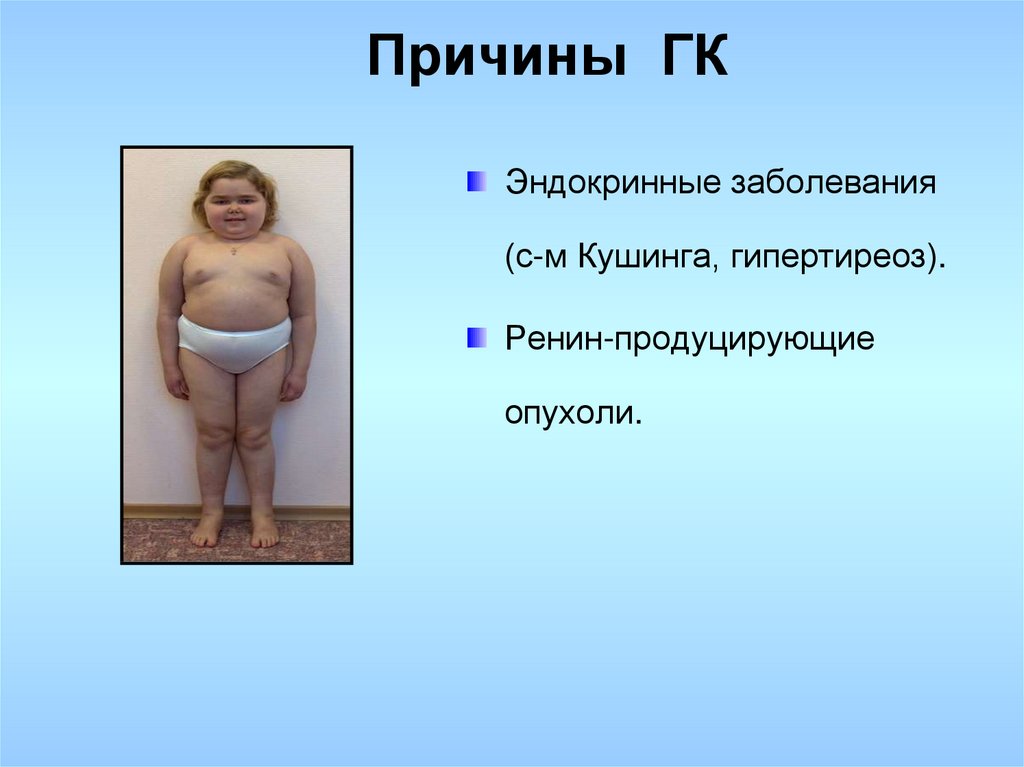
Врачи используют искусственный кортизол или гидрокортизон для лечения астмы, аллергии и воспалений.
Каковы признаки и симптомы синдрома Кушинга?
Для развития симптомов синдрома Кушинга могут потребоваться месяцы. Они могут включать:
- круглое лицо
- жировой горб между плечами и шеей
- прибавка в весе
- проблемы роста
- красные или пурпурные растяжки
- тонкая кожа, на которой легко образуются синяки
- усталость
- акне
- высокое кровяное давление
- сахарный диабет 2 типа
- более густые и заметные волосы на лице у девочек (гирсутизм)
- проблемы с костями
- мышечная слабость
- изменения поведения
Что вызывает синдром Кушинга?
Синдром Кушинга может возникнуть, если кто-то принимает большое количество кортикостероидных препаратов, таких как преднизолон.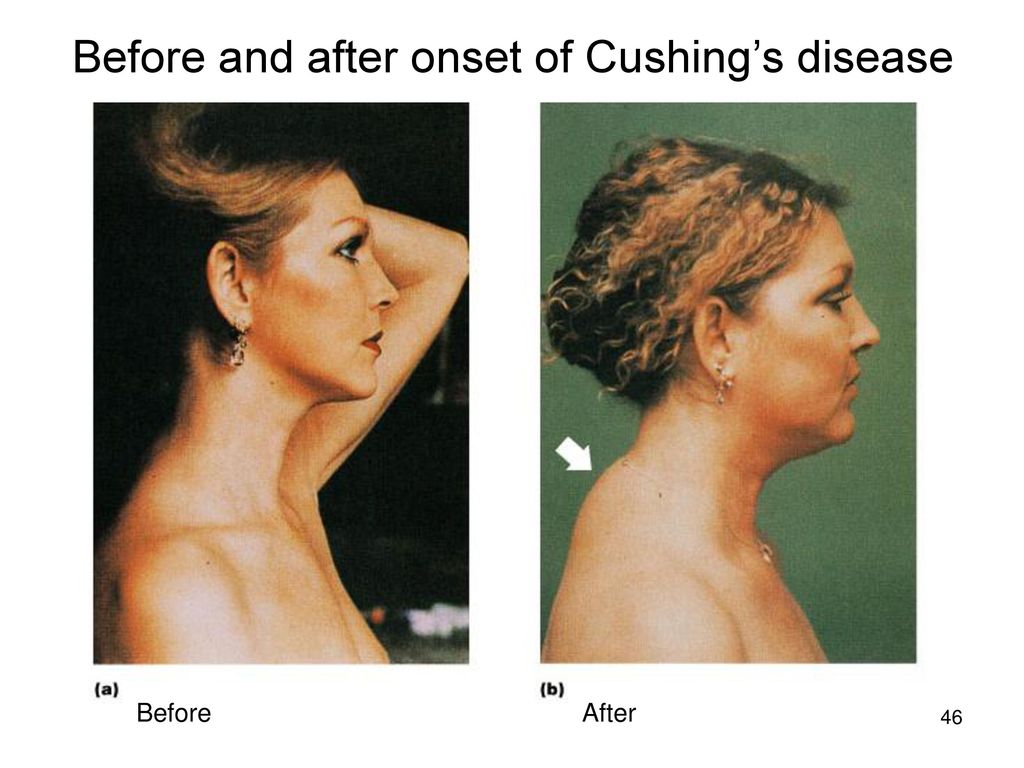 Это известно как экзогенный (ek-SAH-jeh-nis) синдром Кушинга.
Это известно как экзогенный (ek-SAH-jeh-nis) синдром Кушинга.
Кто-то может принимать пероральные кортикостероиды (таблетки, принимаемые внутрь) для:
- для лечения воспалительных заболеваний, таких как ревматоидный артрит, волчанка или астма
- предотвращает отторжение пересаженного органа
Реже кортикостероид, нанесенный на кожу (например, для лечения экземы) или вдыхаемый (для лечения астмы), может привести к синдрому Кушинга при использовании в очень высоких дозах.
Синдром Кушинга также может возникнуть, если организм вырабатывает слишком много кортизола. Это известно как эндогенный (en-DAH-jeh-nis) синдром Кушинга.
Синдром Кушинга у детей обычно возникает из-за:
- проблемы в надпочечниках, из-за которой они вырабатывают слишком много кортизола
- проблема в
гипофиз - надпочечник
опухоль (большинство из них не раковые)
Как диагностируется синдром Кушинга?
Врач может заподозрить синдром Кушинга, если у человека есть явные признаки, такие как округлое лицо, жировая ткань между плечами, тонкая кожа с синяками и растяжками, а также плохой рост.
У детей врачи могут заподозрить синдром Кушинга, когда ребенок набирает вес, но не растет должным образом.
Врач проведет медицинский осмотр и спросит, принимает ли ребенок кортикостероиды в течение длительного времени. Детям, не принимающим кортикостероиды, врачи могут назначить анализы. Сюда могут входить:
- 24-часовой тест на свободный кортизол в моче: анализ мочи, который собирает мочу (мочу) в течение 24 часов для измерения уровня гормонов
- суточный тест на кортизол: измерение кортизола в образце крови или слюны (слюны)
- супрессивный тест с низкими дозами дексаметазона: проведение анализа крови для определения уровня кортизола после приема ребенком глюкокортикоидов
- Тест на стимуляцию КРГ: повторные заборы крови в течение нескольких часов для измерения уровня кортизола после того, как ребенку сделали прививку кортикотропин-высвобождающего гормона
Как лечится синдром Кушинга?
Детский эндокринолог будет наблюдать за уходом за ребенком с синдромом Кушинга.