Миастения у детей: Миастения у детей — симптомы, диагностика и лечение
Миастения гравис у ребенка (клиническое наблюдение) | Вороширина К.А., Гранкин Е.В.
Введение
Миастения — относительно редкое заболевание. Его частота составляет 10 случаев на 1 млн населения в год, а распространенность — от 4,8 до 17,5 случая на 100 тыс. населения [1–3]. Дети и подростки составляют 9–15% больных миастенией. По современным представлениям миастения — это аутоиммунное заболевание, сопровождающееся выработкой антител, повреждающих рецепторы к ацетилхолину (АХР) на постсинаптической мембране. В 10–20% случаев данные антитела не выявляются. Из 20% миастеников без антител к АХР половина обладают антителами к мышечно-специфической тирозинкиназе, а меньший процент — антителами к белку 4, связанному с рецепторами липопротеинов низкой плотности (LRP4) [4, 5]. Провоцирующими факторами развития аутоиммунного процесса могут быть перенесенные инфекции, хирургические вмешательства, беременность и роды, стресс, интенсивные физические нагрузки. Концентрация антител к АХР в крови коррелирует с уровнем продукции их В-лимфоцитами тимуса. Таким образом, тимус рассматривается как место выработки антител к АХР нервно-мышечного синапса [6], а патология вилочковой железы — в качестве одного из пусковых механизмов развития миастении.
Таким образом, тимус рассматривается как место выработки антител к АХР нервно-мышечного синапса [6], а патология вилочковой железы — в качестве одного из пусковых механизмов развития миастении.
Клиническая картина заболевания характеризуется прогрессирующей мышечной слабостью лица и конечностей, усиливающейся после нагрузки. Чаще всего поражаются: глазодвигательные мышцы с развитием диплопии, офтальмоплегии; мышцы проксимальных отделов конечностей; дыхательная и ротоглоточная мускулатура с развитием бульбарных нарушений. Наиболее опасным осложнением является поражение дыхательной мускулатуры, требующее проведения искусственной вентиляции легких (ИВЛ). При выявлении клинических признаков миастении необходимо проведение дополнительных диагностических мероприятий — определения антихолинэстеразных антител, выполнения электронейромиографии (ЭНМГ), в диагностически сложных случаях проводится морфологическое исследование мышечного биоптата. По результатам дообследования антитела у детей выявляются в 60–80% случаев, ЭНМГ фиксирует снижение амплитуды м-ответа по миастеническому типу. Дифференциальная диагностика миастении проводится с рассеянным склерозом, неопластическим поражением головного и спинного мозга, синдромом Миллера — Фишера, врожденными и приобретенными миопатиями, ботулизмом, дифтерийной полинейропатией. В лечении используют ингибиторы холинэстеразы, кортикостероиды и иную иммуносупрессивную терапию (азатиоприн, метотрексат, циклоспорин), внутривенное введение иммуноглобулинов, плазмаферез. Не рекомендована тим-эктомия у детей в раннем возрасте ввиду последующей иммуносупрессии [7].
Дифференциальная диагностика миастении проводится с рассеянным склерозом, неопластическим поражением головного и спинного мозга, синдромом Миллера — Фишера, врожденными и приобретенными миопатиями, ботулизмом, дифтерийной полинейропатией. В лечении используют ингибиторы холинэстеразы, кортикостероиды и иную иммуносупрессивную терапию (азатиоприн, метотрексат, циклоспорин), внутривенное введение иммуноглобулинов, плазмаферез. Не рекомендована тим-эктомия у детей в раннем возрасте ввиду последующей иммуносупрессии [7].
Представляем описание клинического наблюдения подростка 13 лет с генерализованной формой миастении, осложненной быстрым развитием дыхательной недостаточности с остановкой дыхания, что потребовало применения четкого алгоритма диагностики и лечения с проведением неспецифических и специфических лечебных мероприятий.
Клиническое наблюдение
Пациент В., 13 лет. За три дня до госпитализации утром появились жалобы на вялость, слабость, чувство кома в горле, из-за которого не мог глотать пищу.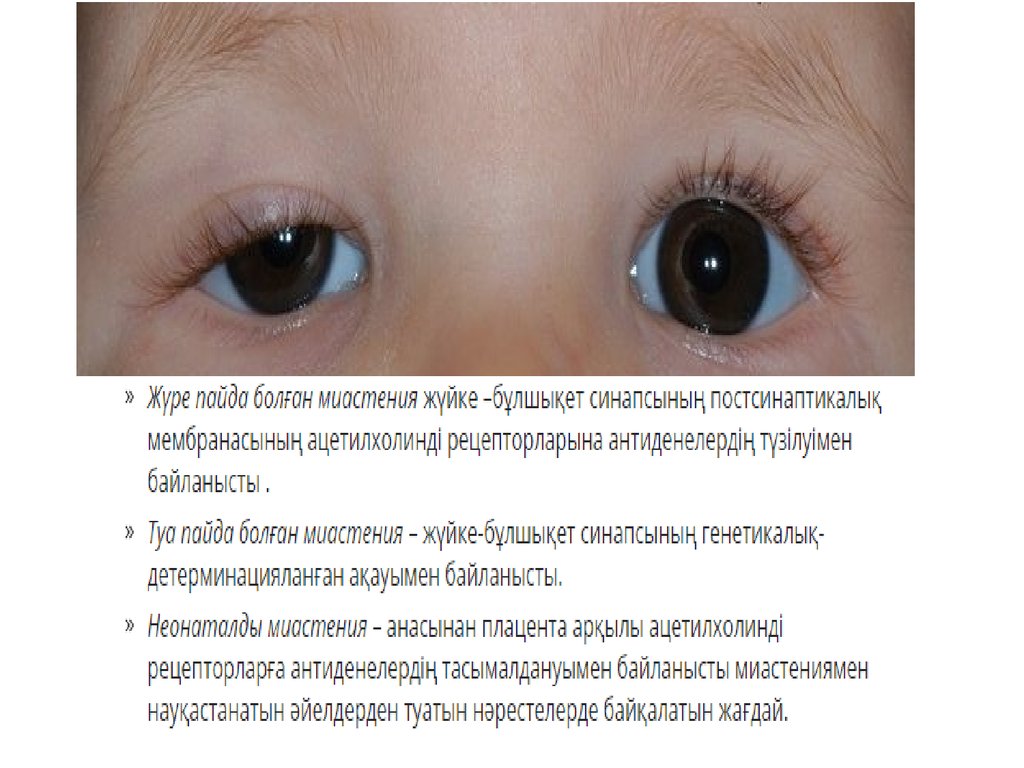 На следующий день родители обратились к педиатру по месту жительства. Был выставлен диагноз «катаральная ангина», назначена антибактериальная терапия, но состояние ухудшилось, появились нарушения речи, ребенок перестал сглатывать слюну, самостоятельно передвигаться. На следующие сутки в связи с нарастанием симптомов была вызвана бригада СМП, пациента госпитализировали в городскую больницу в отделение анестезиологии и реанимации. При поступлении состояние тяжелое за счет неврологической симптоматики: выраженной мышечной слабости, бульбарных нарушений. В сознании, на осмотр реагирует адекватно. Самостоятельно не сидит, не ходит. Речь тихая, бульбарная дизартрия, дисфагия, слюнотечение. МРТ головного мозга патологии не выявила. В общем анализе крови незначительный лейкоцитоз. Результаты остальных методов обследования (биохимический анализ крови, ЭКГ, УЗИ органов брюшной полости, ЭхоКГ) без особенностей. Для дальнейшего лечения и обследования пациент переведен в неврологическое отделение ГАУЗ ОДКБ, по тяжести состояния помещен в отделение реанимации и интенсивной терапии.
На следующий день родители обратились к педиатру по месту жительства. Был выставлен диагноз «катаральная ангина», назначена антибактериальная терапия, но состояние ухудшилось, появились нарушения речи, ребенок перестал сглатывать слюну, самостоятельно передвигаться. На следующие сутки в связи с нарастанием симптомов была вызвана бригада СМП, пациента госпитализировали в городскую больницу в отделение анестезиологии и реанимации. При поступлении состояние тяжелое за счет неврологической симптоматики: выраженной мышечной слабости, бульбарных нарушений. В сознании, на осмотр реагирует адекватно. Самостоятельно не сидит, не ходит. Речь тихая, бульбарная дизартрия, дисфагия, слюнотечение. МРТ головного мозга патологии не выявила. В общем анализе крови незначительный лейкоцитоз. Результаты остальных методов обследования (биохимический анализ крови, ЭКГ, УЗИ органов брюшной полости, ЭхоКГ) без особенностей. Для дальнейшего лечения и обследования пациент переведен в неврологическое отделение ГАУЗ ОДКБ, по тяжести состояния помещен в отделение реанимации и интенсивной терапии.
Из анамнеза жизни: рос и развивался соответственно возрасту. Аллергологический анамнез не отягощен, операций не было. В августе 2008 г. получил закрытую черепно-мозговую травму, лечился амбулаторно, беспокоили головные боли. При МРТ головного мозга в 2017 г. выявлена ретроцеребеллярная арахноидальная киста, на МР-томограмме шейного отдела позвоночника картина асимметрии позвоночных артерий. Был консультирован нейрохирургом, рекомендовано консервативное лечение. Часто беспокоили головная боль, быстрая утомляемость, по поводу чего неоднократно проходил курс стационарного лечения в неврологическом отделении по месту жительства.
При поступлении: состояние тяжелое, сознание ясное, положение пассивное. Кожные покровы чистые, умеренно бледные. Температура тела 36,7 °C. Грудная клетка соответствует конституции. Дыхание самостоятельное, проводится во все отделы, хрипов нет. Частота дыхательных движений 22 в минуту. Тоны сердца ясные, ритмичные, ЧСС 98 в минуту. Живот свободно доступен пальпации. Паренхиматозные органы не увеличены. Мочится по катетеру.
Живот свободно доступен пальпации. Паренхиматозные органы не увеличены. Мочится по катетеру.
Неврологический статус: сознание ясное. Ориентирован в пространстве, времени, собственной личности. Речь дизартричная, голос тихий, глухой. Глазные щели D=S, зрачки D=S. Фотореакция прямая живая, обратная живая. Отмечается ограничение движений левого глазного яблока кверху. Лицо симметричное. Дисфагия, дизартрия, гиперсаливация. Глоточный рефлекс ослаблен. Температурная и тактильная чувствительность не нарушена. Сухожильные рефлексы с верхних конечностей D=S, высокие, с нижних конечностей D=S, живые. Мышечный тонус: диффузная мышечная гипотония. Сила мышц снижена до 2 баллов в верхних и нижних конечностях. Голову удерживает, самостоятельно не садится из положения лежа, не сидит, не стоит, не ходит. Сохранены активные движения в кистях, больше в левой. Патологический стопный рефлекс Бабинского с двух сторон.
Диагноз при поступлении: миастения, генерализованная форма, прогрессирующее течение. Объемное образование ствола мозга, шейного отдела спинного мозга? Рассеянный склероз?
Объемное образование ствола мозга, шейного отдела спинного мозга? Рассеянный склероз?
Проведено комплексное обследование пациента.
Данные лабораторных анализов при поступлении: лейкоцитоз 16,4×109/л, тромбоцитоз 325×109/л, СОЭ 22 мм/ч, повышение уровня фибриногена до 4,49 г/л, С-реактивного белка до 18,7 мг/л, прокальцитонина до 0,3 нг/мл. В динамике отмечалось снижение лейкоцитоза до 12,0×109/л, тромбоцитоза до 254×109/л, уменьшение СОЭ до 17 мм/ч, снижение уровня фибриногена до 4,29 г/л. Иммуноферментный анализ показал антитела класса G к вирусу Эпштейна — Барр: индекс позитивности 21,3. Антитела класса М к капсидному антигену вируса Эпштейна — Барр не обнаружены. Выполнен анализ спинномозговой жидкости: бесцветная, прозрачная, белок 0,213 г/л, глюкоза 4,3 ммоль/л, хлор 105,0 ммоль/л, цитоз 4 клетки в 11 мм3, реакция Панди отрицательная. Результаты микроскопического исследования: на фоне небольшого количества эритроцитов встречаются единичные нейтрофилы и лимфоциты.
Рентгенография органов грудной клетки: данных за активный процесс в легких не выявлено.
Компьютерная томография (КТ) органов грудной клетки с внутривенным контрастированием: на серии снимков органов грудной клетки с толщиной среза 1,25 мм видимые отделы скелета не изменены. Магистральные сосуды не изменены. Анатомия трахеобронхиального дерева не нарушена. Пневматизация легких неравномерная: центральный и периферический интерстиций средней доли утолщен (645 HU), левое легкое эмфизематозно вздуто (-890 HU). Очаговых и инфильтративных теней в легких нет. Жидкости в плевральных полостях нет. Стенки бронхов не утолщены, просвет бронхов не расширен, не деформирован. Междолевая плевра не утолщена. Средостение расположено по средней линии. В пищеводе отмечается зонд. Лимфатические узлы не увеличены. Сердце имеет обычную конфигурацию, нормальных размеров. Печень увеличена: краниокаудальный размер 201,5 мм. Заключение: неравномерная пневматизация легких.
Ультразвуковое исследование органов брюшной полости и почек: без особенностей.
Электрокардиография: электрическая ось сердца вертикальная. Выраженная синусовая брадиаритмия 88–59 уд/мин. Нарушение проведения по системе правой ножки пучка Гиса. Синдром ранней реполяризации миокарда желудочков. Нагрузка на левое предсердие и левый желудочек.
Эхокардиоскопия: умеренно увеличена полость левого желудочка. Сократительная способность миокарда сохранена. Фракция выброса 68%. Легочная артерия расширена с регургитацией 1-й степени. Пролапс трикуспидального клапана с регургитацией 1-й степени. Пролапс митрального клапана 1-й степени с регургитацией 1-й степени. Диагональная трабекула в полости левого желудочка.
Магнитно-резонансная томография шейного отдела позвоночника: на серии МР-томограмм, взвешенных по Т1 и Т2, в трех проекциях лордоз сохранен. Соотношение в атланто-аксиальном сочленении не нарушено. Высота межпозвонковых дисков исследуемой зоны сохранена, сигналы от дисков шейного отдела по Т2 не изменены. Дорсальных грыж дисков не выявлено. Просвет позвоночного канала обычный, спинной мозг структурен, сигнал от него (по Т1 и Т2) не изменен. Форма и размеры тел позвонков обычные, МР-сигнал от костного мозга не изменен. Заключение: данных за патологические изменения в шейном отделе позвоночника не получено.
Просвет позвоночного канала обычный, спинной мозг структурен, сигнал от него (по Т1 и Т2) не изменен. Форма и размеры тел позвонков обычные, МР-сигнал от костного мозга не изменен. Заключение: данных за патологические изменения в шейном отделе позвоночника не получено.
Выполнена стимуляционная ЭНМГ: признаков нарушения нервно-мышечной передачи не выявлено. Антитела к АХР не обнаружены. Проведена медикаментозная проба с прозерином: результат слабоположительный.
Ребенок проконсультирован узкими специалистами.
Окулист: при исследовании глазного дна обоих глаз диск зрительного нерва розовый, чуть бледнее с назальной стороны, узкий миопический конус, контуры четкие. Сосуды не изменены. В макулярной зоне и на периферии без патологии. Эндокринолог: на момент обследования данных за патологию со стороны эндокринной системы нет. Кардиолог: дисплазия сердца — пролапс митрального клапана 1-й степени, пролапс трикуспидального клапана 1-й степени, феномен укороченного РQ. Нефролог: признаков почечного повреждения нет. Генетик: миастения, генерализованная форма, прогрессирующее течение. В динамике дважды консультирован инфекционистом: инфекционное поражение ЦНС исключено.
Нефролог: признаков почечного повреждения нет. Генетик: миастения, генерализованная форма, прогрессирующее течение. В динамике дважды консультирован инфекционистом: инфекционное поражение ЦНС исключено.
С учетом клинической картины и результатов дополнительных методов исследования выставлен диагноз: миастения, генерализованная форма, прогрессирующее течение. Начата антибактериальная терапия, гормональная терапия дексаметазоном (0,64 мг/кг/сут). На 4-е сутки госпитализации отмечена отрицательная динамика в виде полной утраты активных движений в конечностях, речи. При перемене положения тела произошла остановка спонтанного дыхания, в связи с чем ребенок переведен на аппаратную ИВЛ.
Продолжена терапия высокими дозами преднизолона внутривенно капельно (6 мг/кг/сут), вводился внутривенный иммуноглобулин человеческий в курсовой дозе 0,4 мг/кг/курс, также получал нейропротективную и антибактериальную терапию. На 12-е сутки госпитализации отмечена положительная динамика в виде увеличения объема движений в стопах, левой кисти.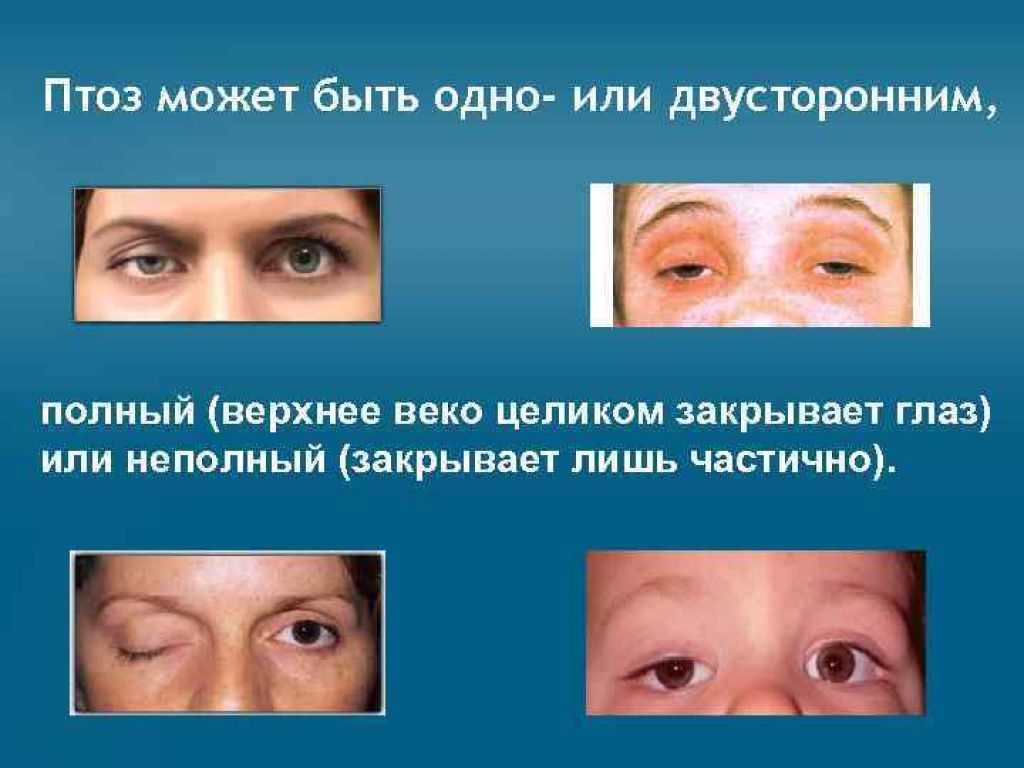 На 16-е сутки ребенок экстубирован, подведен увлажненный кислород через лицевую маску. Дыхание самостоятельное, адекватное. Увеличился объем движений: пишет левой рукой, переворачивается в постели. С 20-х суток ребенок разговаривает, удерживает предметы в руках. На 25-е сутки восстановились движения в коленных суставах и акт глотания, меняет положение головы. Самостоятельно глотает пищу и жидкость небольшими порциями, пища усваивается. На 28-е сутки в связи с положительной динамикой переведен из реанимационного отделения в неврологическое. В лечении продолжена терапия высокими дозами метилпреднизолона (2,5 мг/кг/сут) внутривенно капельно. С 30-х суток с согласия матери в терапию введен пиридостигмина бромид в таблетированной форме в стартовой дозировке 0,1 мг/кг/сут с последующим увеличением до 1 мг/кг/сут в 3 приема. На фоне лечения улучшился акт жевания и глотания, стала более внятной речь, начал сидеть с поддержкой, ходить с поддержкой за обе руки. На 45-е сутки госпитализации ребенок переведен для дальнейшей реабилитации на санаторное лечение.
На 16-е сутки ребенок экстубирован, подведен увлажненный кислород через лицевую маску. Дыхание самостоятельное, адекватное. Увеличился объем движений: пишет левой рукой, переворачивается в постели. С 20-х суток ребенок разговаривает, удерживает предметы в руках. На 25-е сутки восстановились движения в коленных суставах и акт глотания, меняет положение головы. Самостоятельно глотает пищу и жидкость небольшими порциями, пища усваивается. На 28-е сутки в связи с положительной динамикой переведен из реанимационного отделения в неврологическое. В лечении продолжена терапия высокими дозами метилпреднизолона (2,5 мг/кг/сут) внутривенно капельно. С 30-х суток с согласия матери в терапию введен пиридостигмина бромид в таблетированной форме в стартовой дозировке 0,1 мг/кг/сут с последующим увеличением до 1 мг/кг/сут в 3 приема. На фоне лечения улучшился акт жевания и глотания, стала более внятной речь, начал сидеть с поддержкой, ходить с поддержкой за обе руки. На 45-е сутки госпитализации ребенок переведен для дальнейшей реабилитации на санаторное лечение. На контрольном осмотре у невролога через 6 мес. на фоне постоянного приема пиридостигмина бромида отмечено полное восстановление моторных и речевых навыков без каких-либо побочных реакций на прием препарата.
На контрольном осмотре у невролога через 6 мес. на фоне постоянного приема пиридостигмина бромида отмечено полное восстановление моторных и речевых навыков без каких-либо побочных реакций на прием препарата.
Обсуждение
Особенностью данного клинического наблюдения было тяжелое течение заболевания, а также быстрое прогрессирование симптомов на фоне отсутствия специфических изменений по результатам дополнительных методов исследования. В ходе обследования пациента был проведен дифференциальный диагноз с неопластическим синдромом головного и спинного мозга, рассеянным склерозом, инфекционным поражением ЦНС, синдромом Гийена — Барре.
Изменения в общем анализе крови и повышенный уровень прокальцитонина свидетельствуют о наличии воспалительного процесса в организме, однако не являются специфичными признаками. Острое начало заболевания с появления неврологических расстройств, отсутствие общемозговой симптоматики, синдрома интоксикации, изменений в спинномозговой жидкости, а также развитие апноэ без предшествующих признаков дыхательной недостаточности — эти особенности указывали на отсутствие инфекционного поражения ЦНС. Проведение МРТ позволило исключить структурные изменения в шейном отделе спинного мозга, инфекционный и демиелинизирующий процессы. КТ органов средостения с внутривенным контрастированием исключила тимому, наличие которой может быть одной из причин развития аутоиммунного процесса при миастении. Отсутствие специфических изменений по результатам стимуляционной ЭНМГ также не позволило достоверно подтвердить диагноз.
Проведение МРТ позволило исключить структурные изменения в шейном отделе спинного мозга, инфекционный и демиелинизирующий процессы. КТ органов средостения с внутривенным контрастированием исключила тимому, наличие которой может быть одной из причин развития аутоиммунного процесса при миастении. Отсутствие специфических изменений по результатам стимуляционной ЭНМГ также не позволило достоверно подтвердить диагноз.
В настоящее время в России диагностика и лечение детей с миастенией проводятся в соответствии с клиническими рекомендациями Союза педиатров России 2016 г. Учитывая, что в основе заболевания лежит аутоиммунный процесс, в лечении применяются препараты, обладающие иммуносупрессивным эффектом: глюкокортикостероиды, цитостатики, иммуноглобулины в высоких дозах. Однако долгосрочное лечение данными препаратами недопустимо из-за существенных побочных эффектов (избыточная масса тела, лейкопения, остеопороз, нарушения поведения и др.), поэтому они применяются для стабилизации состояния в острый период. Таким образом, препаратами выбора при долгосрочной терапии являются ингибиторы холин-эстеразы — пиридостигмина бромид и неостигмина метилсульфат, которые противопоказаны в возрасте до 18 лет и назначаются строго с согласия пациента или его официальных представителей.
Таким образом, препаратами выбора при долгосрочной терапии являются ингибиторы холин-эстеразы — пиридостигмина бромид и неостигмина метилсульфат, которые противопоказаны в возрасте до 18 лет и назначаются строго с согласия пациента или его официальных представителей.
В представленном клиническом наблюдении внутривенное введение иммуноглобулинов класса G и высоких доз глюкокортикостероидов позволило стабилизировать состояние пациента, а назначение специфической терапии ускорило его выздоровление и существенно повысило качество жизни после выписки из стационара.
Заключение
Ключевую роль в оказании помощи пациентам с миастенией играет ранняя диагностика. Знание клинического полиморфизма, грамотное проведение дифференциальной диагностики, а также применение дополнительных методов исследования позволяют сократить сроки до начала спе-цифической патогенетической терапии, что положительно влияет на исход заболевания.
The Neuromuscular Junction (free ebook) – Mac Keith Press
£0. 00
00
Количество товара Myasthenia in Children — Chapter 1: The Neuromuscular Junction (free ebook)
Глава 1. Нервно-мышечное соединение Педро М. Родригес Крус и Дэвид Бисон из Миастения у детей
Нервно-мышечное соединение (НМС) представляет собой высокоспециализированный синапс между моторным нейроном и мышечным волокном, который необходим для нервно-мышечной передачи. В этой главе будут рассмотрены наиболее фундаментальные аспекты организации СНС, структуры и физиологии, биологии и физиологии. Это обеспечит основу для понимания физиопатологии и клинических проявлений миастенических расстройств, как аутоиммунных (myasthenia gravis), так и генетических (врожденные миастенические синдромы).
О полной книге
Миастения — редкое, но плохо диагностируемое и иногда опасное для жизни заболевание у детей. Не существует руководств по диагностике и лечению этих детей, особенно детей с врожденной миастенией, недавно признанным генетическим заболеванием, но в последние годы произошли значительные изменения в выявлении и лечении миастении. Эта книга поможет клиницистам и семьям детей с этим редким заболеванием эффективно направлять лечение.
Эта книга поможет клиницистам и семьям детей с этим редким заболеванием эффективно направлять лечение.
Миастения у детей описывает различные генотипы и фенотипы врожденных миастенических синдромов, их клинические особенности и лечение. Также охвачены аутоиммунная миастения и недавно выявленные миопатии с дефектами нервно-мышечной передачи. Книга включает точку зрения клиента и полна практических советов от лиц, осуществляющих уход, пользователей услуг и терапевтов с широким междисциплинарным подходом к лечению. Эта книга послужит руководством по комплексному лечению этого редкого, но изменяющего жизнь состояния некоторых детей и их семей в будущем.
- Единственная книга, посвященная этому редкому заболеванию детей
- Включает последние разработки по врожденной миастении, недавно признанному заболеванию.
- Использует целостный междисциплинарный терапевтический подход для достижения наилучших результатов у детей с этим заболеванием.
- Включает в себя самые современные подходы к лечению
- Включает практическую информацию по ведению семей и молодых людей с этим заболеванием, причем одна глава написана семьей ребенка с миастенией.

Читательская аудитория
Педиатры, детские неврологи и смежные медицинские работники, включая физиотерапевтов, эрготерапевтов, психологов и специализированных медсестер.
Почему бы и нет?
- Посетите наш бесплатная библиотека электронных книг чтобы загрузить больше бесплатных игр.
- Подпишитесь на нашу рассылку чтобы быть в курсе новых выпусков.
- Найти нас на Твиттер.
Клиники развивающей медицины
Вы смотрите: Миастения у детей – Глава 1: Нервно-мышечное соединение (бесплатная электронная книга)
£0.00
В корзину
Myasthenia Gravis (для родителей) — Nemours KidsHealth
Что такое Myasthenia Gravis?
Myasthenia gravis (или миастения) — это состояние, вызывающее слабость произвольных мышц (мышц, которыми мы можем управлять). Слабость может приходить и уходить и варьироваться от легкой до тяжелой.
Myasthenia gravis (my-ess-THEE-nee-uh GRAV-iss) возникает, когда блокируются связи между нервами и мышцами. У детей это состояние называется ювенильная миастения гравис или JMG.
Каковы признаки и симптомы миастении?
Myasthenia gravis обычно представляет собой глазную (глазную) миастению или генерализованную миастению gravis.
Глазная миастения
Глазная миастения может поражать один или оба глаза. Вызывает:
- птоз (TOE-siss): опущение века
- двоение в глазах: когда один глаз медленнее другого
Окулярная миастения может распространяться и становиться генерализованной миастенией. Это менее вероятно, если лечить глазную миастению.
Генерализованная миастения
Генерализованная миастения поражает мышцы всего тела. Часто вызывает:
- неуклюжесть
- частые падения
- проблемы с речью, жеванием или глотанием
Myasthenia gravis может быть опасной для жизни, если поражает:
- дыхательные мышцы
- мышцы горла и языка, помогающие удерживать открытыми дыхательные пути от носа и рта к легким
Это называется миастенический криз . Некоторые вещи могут усугубить симптомы и вызвать миастенический криз. К ним относятся болезни, операции, плохой сон и некоторые лекарства, в том числе обычные антибиотики.
Некоторые вещи могут усугубить симптомы и вызвать миастенический криз. К ним относятся болезни, операции, плохой сон и некоторые лекарства, в том числе обычные антибиотики.
Что вызывает тяжелую миастению?
Центральная нервная система тела посылает сигналы через двигательных нервов , которые заставляют мышцы сокращаться (двигаться). Двигательные нервы достигают мышц в точках, называемых нервно-мышечными соединениями (НМС) . Двигательные нервы содержат ацетилхолин (АХ), химическое вещество, которое заставляет мышцы сокращаться.
Миастения — аутоиммунное заболевание. Вместо борьбы с микробами иммунная система вырабатывает антитела, которые атакуют нервные рецепторы мышц. Антитела прилипают к НМС мышцы, блокируя сигнал нерва к мышце.
Каждая мышца имеет множество нервно-мышечных соединений. Таким образом, некоторые из них могут не блокироваться, позволяя сигналу нерва пройти к нескольким участкам мышцы. Мышца сокращается, но не в полную силу.
Кто болеет миастенией?
Миастения может начаться в любом возрасте. У человека больше шансов заболеть этим заболеванием, если он есть у близкого члена семьи или есть другое аутоиммунное заболевание (например, ревматоидный артрит, склеродермия или волчанка).
Как диагностируется миастения?
Если у ребенка младше 2 лет есть симптомы, а мышечная слабость то появляется, то проходит, врачи могут заподозрить миастению.
Чтобы выяснить это, врач проведет осмотр и назначит анализы, такие как:
- Титр антител: Этот анализ крови проверяет наличие антител, которые могут прилипать к НМС.
- электромиография (ЭМГ): проверяет, хорошо ли работают нервы и здоровы ли мышцы.
- Тенсилона: Тенсилон — это лекарство, которое замедляет нормальный распад ацетилхолина, поэтому его больше возле нервно-мышечного соединения. Если использование Tensilon в этом тесте восстанавливает некоторую мышечную силу, проблема почти наверняка связана с миастенией.

- стимулированная одноволоконная ЭМГ: врачи делают эту специальную ЭМГ, если другие тесты не дают четкого ответа.
Тест
Как лечится миастения?
Лечение миастении гравис обычно направлено на:
- снижение активности иммунной системы, чтобы она вырабатывала меньше антител
- помогает нервно-мышечному синапсу передавать сигналы от нерва к мышце
Иммуносупрессия
Снизить активность иммунной системы можно несколькими способами. Иногда они используются вместе. Врачи будут корректировать лечение таким образом, чтобы человек получал наибольшую силу с наименьшим количеством побочных эффектов.
К иммунодепрессантам относятся:
- лекарства, которые можно принимать внутрь, например преднизолон
- дополнительные антитела доноров крови, называемые внутривенными иммуноглобулинами (ВВИГ)
- плазмаферез, который удаляет некоторые антитела из крови
- операция по удалению вилочковой железы (тимэктомия).
 Эта железа помогает иммунной системе развиваться. Его удаление может сделать иммунную систему менее активной и облегчить симптомы миастении.
Эта железа помогает иммунной системе развиваться. Его удаление может сделать иммунную систему менее активной и облегчить симптомы миастении.
Помощь NMJ
Лекарства могут удерживать больше АХ вблизи нервно-мышечного синапса. Затем, когда нерв высвобождает свой АХ, мышца, скорее всего, получит сигнал.
Что еще я должен знать?
Цель лечения — полная ремиссия. Это означает, что все симптомы миастении исчезают, и человек может прекратить прием лекарств. Но полная ремиссия бывает не часто.
Большинство детей с этим заболеванием должны продолжать лечение в подростковом и взрослом возрасте. Тем, у кого была тимэктомия, может потребоваться меньше лекарств, и у них больше шансов на полную ремиссию.
Если у вашего ребенка миастения, сообщите об этом заболевании любому врачу, ухаживающему за вашим ребенком, даже если кажется, что проблема с ним не связана.
Поговорите с другими родителями, у которых ребенок с миастенией. Попросите своего врача порекомендовать местную группу поддержки или посмотрите в Интернете по телефону:
- Myasthenia Gravis Foundation of America
Проверка: Mena T. Scavina, DO
Scavina, DO
Дата проверки: январь 2020 г.
Myasthenia Gravis | Бостонская детская больница
Как диагностируется миастения?
Первым шагом в диагностике этого состояния является медицинский осмотр, во время которого лечащий врач вашего ребенка изучит полную историю болезни вашего ребенка и может спросить о вашей семейной истории.
Врач также может заказать один или несколько из следующих тестов:
- Тесты на титр антител , чтобы определить, атакуют ли антитела нервно-мышечную систему вашего ребенка. Если эти тесты положительны, вполне вероятно, что у вашего ребенка тяжелая миастения.
- Повторяющаяся стимуляция нерва — еще один способ диагностики состояния. Это выполняется во время электромиографического исследования (ЭМГ) и включает стимуляцию определенных нервов и изучение аномальных движений мышц.
- Тесты Tensilon иногда используются для подтверждения диагноза миастении.
 Во время этого теста вашему ребенку сделают инъекцию небольшого количества лекарства под названием Тенсилон. Если у вашего ребенка миастения гравис, будет немедленное кратковременное повышение мышечного тонуса.
Во время этого теста вашему ребенку сделают инъекцию небольшого количества лекарства под названием Тенсилон. Если у вашего ребенка миастения гравис, будет немедленное кратковременное повышение мышечного тонуса. - Стимулированная одноволоконная ЭМГ (SSFEMG) — это специализированный тест, который также проводится в лаборатории ЭМГ. Иногда его используют, когда другие тесты отрицательны или неубедительны.
Какие существуют методы лечения миастении?
Хотя миастению нельзя вылечить, существует несколько вариантов лечения, которые могут помочь укрепить мышцы, справиться с симптомами и продлить бессимптомные периоды.
В зависимости от конкретных потребностей вашего ребенка, он или она могут получать один или несколько видов лечения.
Лекарства
Для облегчения симптомов миастении используются несколько видов лекарств.
- Ингибиторы ацетилхолинэстеразы: Эти препараты хорошо действуют на некоторых детей с легкими симптомами.

- Иммуномодулирующая терапия: Эти препараты помогают уменьшить количество вредных антител в организме. Они могут включать плазмаферез, внутривенный иммуноглобин (ВВИГ) и стероиды.
Хирургия
Детям, чьи симптомы не улучшаются при приеме лекарств, или тем, кто сильно зависит от лекарств, может помочь операция, называемая тимэктомией. Это удаление вилочковой железы, железы в груди, связанной с выработкой вредных антител.
Эта процедура может работать очень хорошо в некоторых, но не во всех случаях. У некоторых детей, перенесших эту операцию, действительно наблюдается значительное улучшение.
Экспертная помощь при миастении
Наш персонал в Бостонской детской больнице Нервно-мышечный центр занимается лечением детей с миастенией и разработкой наилучших планов лечения этого состояния. Наша команда всемирно известных специалистов в области детской неврологии , ортопедии , генетики и офтальмологии занимается лечением широкого спектра редких заболеваний, включая тяжелую миастению.
