Хилоторакс у новорожденных: Идиопатический хилоторакс у новорожденных: клинические случаи
Хилоторакс у детей Текст научной статьи по специальности «Клиническая медицина»
СЛУЧАЙ ИЗ ПРАКТИКИ
Д. А. Андреев, О. И. Вербин
Кафедра детской хирургии ВолГМУ
ХИЛОТОРАКС У ДЕТЕЙ
УДК 616.25-003.24-053.2
Хилоторакс является редким заболеванием у детей. Может иметь травматическое и нетравматическое происхождение. Проведен анализ лечения 15 детей с хилотораксом. Показана высокая эффективность консервативного лечения (сандостатин, полное парентеральное питание). Рассмотрены показания и сроки хирургического лечения хилоторакса.
Ключевые слова: хилоторакс, дети, плевральный выпот, лечение.
D. A. [21]. Хилоторакс у детей чаще всего является послеоперационным осложнением торакальных вмешательств, катетеризаций подключичных вен [1, 5, 6, 12]. Реже он может быть следствием порока развития лимфатической системы легких или грудной полости. Часто сопровождает генетические пороки — синдромы Дауна, №опап, Castleman, Gorham [23, 24]. В то же время, как и у взрослых, хилоторакс может быть проявлением злокачественного процесса, травмы шеи или грудной полости. Встречается в любом возрасте с частотой до 2,5 % от общего числа торакальных больных [6, 8], а в периоде новорожденности отмечается 1 случай на 15000 новорожденных, составляя 8 % от всех случаев хилоторакса у детей. Хилоторакс сопровождается высокой летальностью 15—50 % [7].
[21]. Хилоторакс у детей чаще всего является послеоперационным осложнением торакальных вмешательств, катетеризаций подключичных вен [1, 5, 6, 12]. Реже он может быть следствием порока развития лимфатической системы легких или грудной полости. Часто сопровождает генетические пороки — синдромы Дауна, №опап, Castleman, Gorham [23, 24]. В то же время, как и у взрослых, хилоторакс может быть проявлением злокачественного процесса, травмы шеи или грудной полости. Встречается в любом возрасте с частотой до 2,5 % от общего числа торакальных больных [6, 8], а в периоде новорожденности отмечается 1 случай на 15000 новорожденных, составляя 8 % от всех случаев хилоторакса у детей. Хилоторакс сопровождается высокой летальностью 15—50 % [7].
Определение лимфатического характера плеврального содержимого достаточно хорошо отражено в литературе [2, 3, 21]. На возможные
ошибки в определении характера выпота у детей обращают внимание некоторые авторы, которые резонно считают, что длительное и сложное лечение хилоторакса требует точной диагностики [8, 14].
Остаются не до конца разработанными подходы к лечению хилоторакса у детей. Показания к консервативному и хирургическому подходам, сроки и способы оперативных вмешательств весьма разнообразны [12].
ЦЕЛЬ РАБОТЫ
Используя собственный опыт, представить основные этапы диагностики и лечения хилоторак-са у детей.
МЕТОДИКА ИССЛЕДОВАНИЯ
За 25 лет (1982—2008 гг.) в клинике детской хирургии Волгоградского государственного медицинского университета было 15 больных с хилотораксом. 10 мальчиков и 4 девочки в возрасте от 5 дней до 14 лет. Хилоторкс возник у новорожденных с атрезией пищевода (1 больной), диафраг-мальными грыжами (2 больных), идеопатический
(3 детей), у детей при острой пневмонии (5 больных), бронхогенной кисте средостения (2 больных), бронхоэктатической болезни (1 больной), гидронефрозе (1 пациент).
Диагноз хилоторакса был подтвержден лабораторными исследованиями содержимого плевральной полости. Определяли количество отделяемого, уровень в нем триглицеридов, белка, глюкозы, клеточный состав. Исследования проводили в динамике. Оценивали уровень белка плазмы, электролиты в плазме и эритроцитах, липидов, общий анализ крови, показатели коагуляции.
Следует обратить внимание на то, что только 6 больных поступили в клинику с наличием жидкости в плевральной полости. Пятерым из них выполнялись плевральные пункции на доклиническом этапе. На рентгенограммах грудной клетки у них отмечалось интенсивное затемнение гемиторакса со смещением средостения. Состояние детей было расценено как тяжелое за счет выраженной дыхательной недостаточности и интоксикации. У всех детей была выраженная тахикардия, но снижение насыщения крови кислородом отмечено только у двоих. При плевральной пункции у всех было получено значительное количество жидкости — от 40 мл у новорожденного до 100 мл у детей 1—3 лет жизни.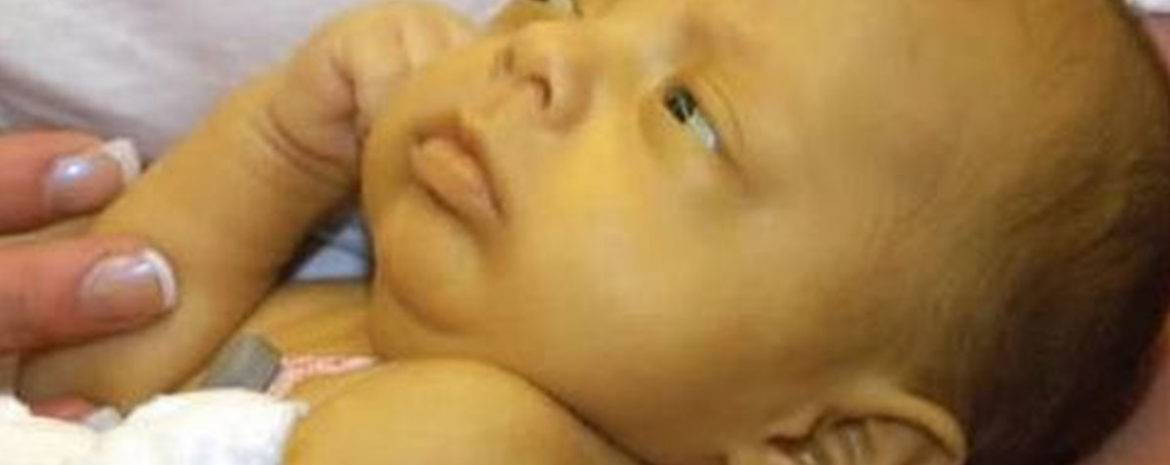
К этой группе относились и трое новорожденных с установлением диагноза в возрасте от 3 дней до 2 недель. Ни у одного из этих детей скопления жидкости в плевральной полости не было выявлено внутриутробно. Ни один из детей не имел генетически обусловленных синдромов и множественных пороков развития. Двое имели двустороннее поражение. Вскоре после рождения у всех детей отмечены явления дыхательной недостаточности и на рентгенограммах обнаружено скопление жидкости в плевральных полостях. При плевральных пункциях была получена и удалена жидкость, расцененная как серозная. Однако в течение последующих дней жидкость вновь накапливалась в грудной полости, что потребовало повторных пункций и лабораторного исследования содержимого. Выполненное дренирование плевральных полостей позволило удалять ежедневно от 40 до 100 мл. До выявления гидроторакса только одному из детей была выполнена катетеризация центральной вены.
У одного новорожденного с диагнозом атре-зия пищевода в возрасте 20 дней на 17-й день после операции отмечено ухудшение состояния за счет тромбоза верхней полой вены.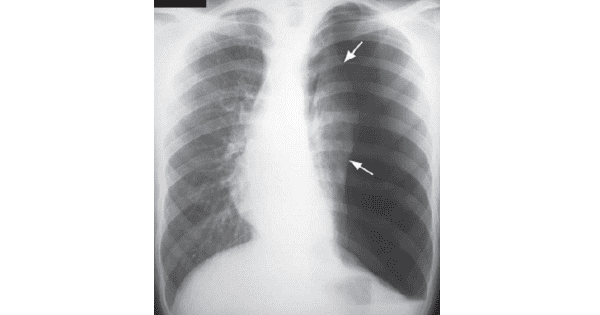 Через 2 дня отмечено новое ухудшение состояния и массивное затемнение гемиторакса справа на рентгенограмме со смещением средостения влево. При плевральной пункции получено до 80 мл молочно-белого содержимого, что ошибочно было принято за проявление несостоятельности пищеводного анастомоза. Плевральная полость была дренирована. Ежедневно по
Через 2 дня отмечено новое ухудшение состояния и массивное затемнение гемиторакса справа на рентгенограмме со смещением средостения влево. При плевральной пункции получено до 80 мл молочно-белого содержимого, что ошибочно было принято за проявление несостоятельности пищеводного анастомоза. Плевральная полость была дренирована. Ежедневно по
дренажу выделялось до 80—90 мл. Только через 5 дней выполненный анализ выпота показал его хилезный характер. Больной погиб от прогрессирующей пневмонии. На секции подтвержден диагноз тромбоза верхней полой вены в месте впадения грудного лимфатического протока.
У 6 больных (хроническая пневмония, киста средостения, пневмония, гидронефроз слева) хи-лоторакс явился непосредственным осложнением катетеризации подключичной вены. Причем у 4 это было следствием катетеризации слева, а у 2 — справа. Вскоре после нее у больных отмечали некоторое ухудшение состояния за счет появления дыхательных расстройств, а на рентгенограммах отмечали скопление жидкости в плевральной полости слева.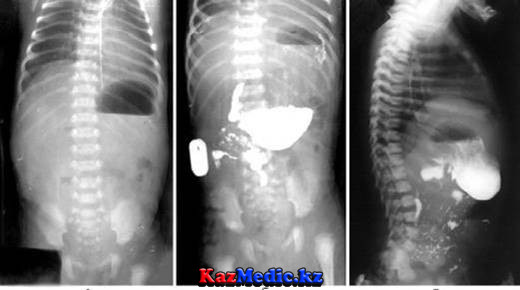 Полученный при плевральной пункции выпот потребовал анализа, подтвердившего причину гидроторакса. Таким образом, только у 6 больных выпот носил выраженный «молочный» характер.
Полученный при плевральной пункции выпот потребовал анализа, подтвердившего причину гидроторакса. Таким образом, только у 6 больных выпот носил выраженный «молочный» характер.
Всем больным после выявления хилоторакса начинали лечение с консервативных мероприятий. У всех детей было выполнено дренирование плевральной полости, назначалась диета с уменьшением количества жиров (7 детей), сухоедение (2 больных), среднецепочечные триглицериды (1 больной). Полное парентеральное питание потребовалось изначально у 4 больных, а у 3 переход на него был произведен в связи с продолжа-ющейцся лимфореей через 3—4 суток. У 5 больных в консервативные лечебные мероприятия был включен сандостатин.
Консервативные мероприятия были эффективны у 13 больных. Одному больному выполнялся плевродез с помощью введения внутриплевраль-но йод-поливинилпирролидонового комплексного раствора. Одному пациенту после безуспешного консервативного лечения в течение 14 дней, включая полное парентеральное питание и постоянное введение сандостатина в течение 7 дней, выполнена супрадиафрагмальная перевязка грудного лимфатического протока справа.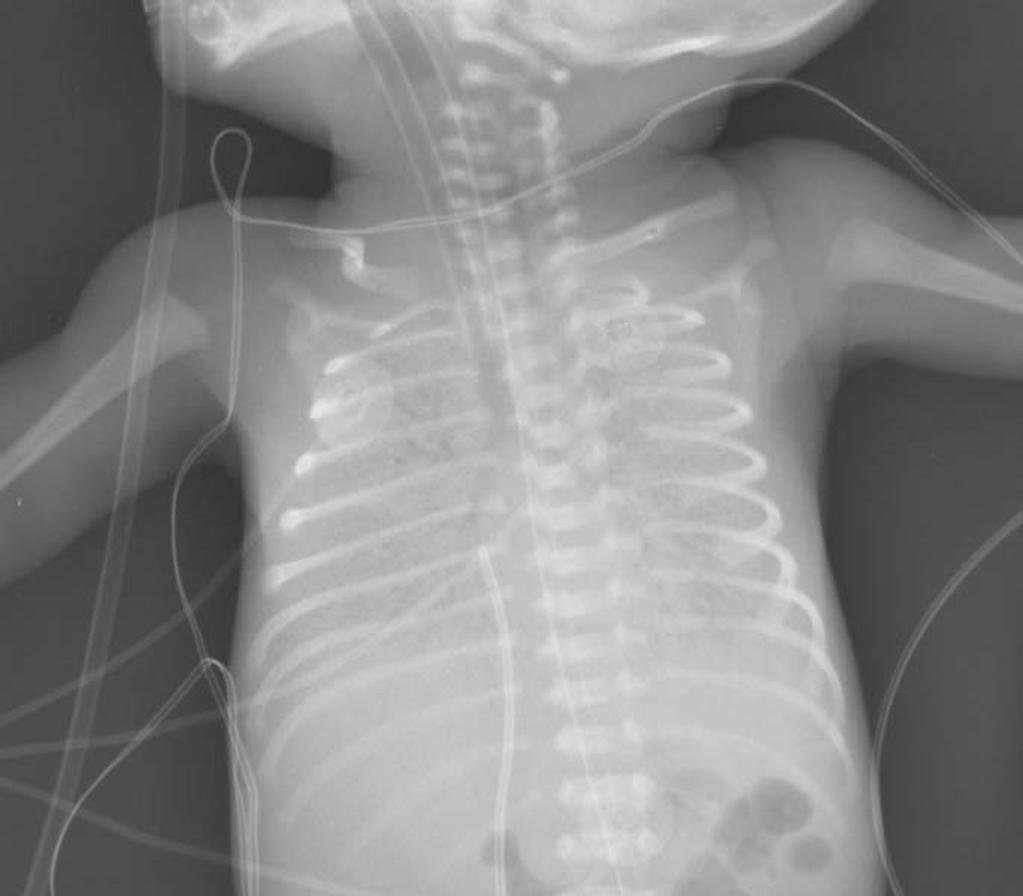
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ИХ ОБСУЖДЕНИЕ
Согласно литературным данным [6, 22], хи-лоторакс возникает у новорожденных и детей по целому ряду причин — ятрогенные воздействия (внутригрудные операции и инвазивные процедуры на сердце, легких, пищеводе и средостении, травма в родах, катетеризация центральных вен в бассейне верхней полой вены), повышение давления в системе верхней полой вены (включая тромбоз последней), пороки развития лимфатической системы, генетические пороки, воспалительные процессы. Превалирующими считаются ятро-генные причины, причем считается, что хилоторак-сом осложняется от 1 до 2 % всех торакальных операций и манипуляций. По нашим данным, таких больных было большинство (10 из 15).
Только трое новорожденных со спонтанным хилотораксом и двое с диафрагмальной грыжей составили другую группу. Такие проявления хилото-ракса описаны значительно реже. Чаще всего они связываются с врожденными аномалиями лимфатических сосудов и генетически обусловленными синдромами Дауна, №опап, Castleman, Gorham, Jaffe-Companacci [13]. Появление хилоторакса при врожденных диафрагмальных грыжах также пытаются объяснить порочно развитыми кровеносными и лимфатическими сосудами гипоплазированных легких и высоким давлением в верхней полой вене, что в комплексе способствует проникновению лимфы в плевральную полость [16]. В нашем случае на ультразвуковом исследовании грудной полости до операции у больных было выявлено большое количество жидкости в плевральной полости слева, которая продолжала выделяться по дренажу в течение более трех суток после пластики диафрагмы и была идентифицирована как лимфа.
Чаще всего они связываются с врожденными аномалиями лимфатических сосудов и генетически обусловленными синдромами Дауна, №опап, Castleman, Gorham, Jaffe-Companacci [13]. Появление хилоторакса при врожденных диафрагмальных грыжах также пытаются объяснить порочно развитыми кровеносными и лимфатическими сосудами гипоплазированных легких и высоким давлением в верхней полой вене, что в комплексе способствует проникновению лимфы в плевральную полость [16]. В нашем случае на ультразвуковом исследовании грудной полости до операции у больных было выявлено большое количество жидкости в плевральной полости слева, которая продолжала выделяться по дренажу в течение более трех суток после пластики диафрагмы и была идентифицирована как лимфа.
Нами ни в одном случае не был установлен генетически обусловленный синдром. У всех больных основанием для подозрения на хилезный характер содержимого плевральной полости было получение при плевральной пункции или по дренажу экссудата, причем только у 9 больных он носил выраженный молочный характер. Именно эта характеристика, описанная еще в 17 веке, по мнению большинства авторов [21], ясно указывает на происхождение жидкости. Еще в 1902 г. Бергман и Микулич [4] указывали, что такое бывает не всегда, и рекомендовали лабораторное исследование выпота.
Именно эта характеристика, описанная еще в 17 веке, по мнению большинства авторов [21], ясно указывает на происхождение жидкости. Еще в 1902 г. Бергман и Микулич [4] указывали, что такое бывает не всегда, и рекомендовали лабораторное исследование выпота.
Для хилоторакса характерно большое содержание в плевральной жидкости триглицеридов (более 1,1 ммол/л), лимфоцитов (более 80 %), общего количества клеток (более 1000/мкл). Однако эти данные получены при анализе выпота у взрослых больных. У наших больных в двух случаях уровень триглицеридов был ниже указанного уровня (0,8 и 0,6 ммоль/л).
В обоих случаях это были новорожденные с идеопатическим хилотораксом и диафрагмальной грыжей, которые не получали первоначально энте-ральное питание. У остальных 12 детей уровень триглицеридов был более диагностически значимого уровня, но все они, включая новорожденных, получали энтеральное кормление.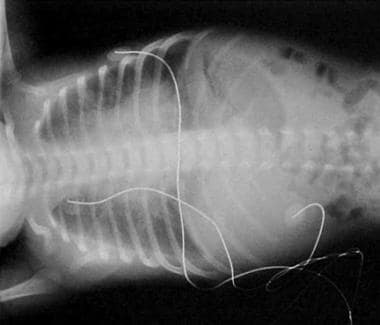 Назначение же кормления одному из новорожденных с низким исходным уровнем триглицеридов в выпоте сразу же привело к количественному и качественному изменению содержимого, подтвердившего диагноз хилоторакса. Можно согласиться с мнением V. ВиШкег, et а1. (1999) [8], что у новорожденных, не получавших жиры через рот, трудно и часто невозможно установить хилезную природу плеврального выпота. Кроме того, исследованиями Maldonado Р и со-авт. (2009) показано, что до 14 % хилотораксов не диагностируются по аналогичным причинам.
Назначение же кормления одному из новорожденных с низким исходным уровнем триглицеридов в выпоте сразу же привело к количественному и качественному изменению содержимого, подтвердившего диагноз хилоторакса. Можно согласиться с мнением V. ВиШкег, et а1. (1999) [8], что у новорожденных, не получавших жиры через рот, трудно и часто невозможно установить хилезную природу плеврального выпота. Кроме того, исследованиями Maldonado Р и со-авт. (2009) показано, что до 14 % хилотораксов не диагностируются по аналогичным причинам.
При исследовании клеточного состава плеврального выпота у всех наших больных выявлено значительное преобладание лимфоцитов. У 10 детей их число составило 80 %, у 4 — более 50 %. У 4 детей определяли общее число клеток в выпоте и оно у всех превысило показатель1000 клеток/ мкл. Однако у одного больного с типичным молочным характером выпота преобладающими клетками были нейтрофилы. Этот факт с возможностью формирования транссудативного хилоторакса (тромбоз верхней полой вены, цирроз печени и т. п.) оставляет вероятность ошибочной диагностики.
п.) оставляет вероятность ошибочной диагностики.
В лечении детей с хилотораксом до настоящего времени отсутствуют четкие установки. Используются консервативные и оперативные методы. Относительно метода выбора и даже последовательности и сроков применяемых способов существуют противоречивые данные [8, 9, 20].
Чаще всего начинают с торакоцентеза путем повторных пункций или дренирования. Нами повторные пункции в качестве начальной терапии применялись у 7 детей в течение 2—4 дней и показали свою полную неэффективность, так как всем больным в результате пришлось выполнять дренирование плевральной полости. Двум новорожденным дренирование выполнялось с двух сторон. После этого по дренажам выделялось от 50 до 300 мл в сутки в течение первых 3 дней с постепенным уменьшением объема в ответ на проводимое лечение у 10 детей. У двоих больных в возрасте 10 мес. и 5 лет сохранялось длительное выделение лимфы ( до 15 и 20 дней) в объеме 30— 50 мл/день, потребовавшем оперативного лечения.
Длительное дренирование плевральной полости при хилотораксе приводит к выраженным потерям жидкости, белка, электролитов, развитию септических осложнений [1, 18]. Для уменьшения продукции лимфы широко используются изменения питания больных за счет уменьшения потребления жидкости и жиров [11], включения в рацион среднецепочечных триглицеридов, расщепляющихся предуоденальной липазой. В результате всасывание образующихся среднецепочечных жирных кислот может происходить уже в слизистой желудка, а дальнейшее их проникновение в воротную вену не требует предварительного поглощения лимфатической системой, как это происходит с другими жирами. Нами использовались синтетические триглицериды (MCT Oil 1QT производства США) только у одного больного 10 месяцев — без существенного эффекта.
Несомненный прогресс в лечении хилоторакса у детей наметился при использовании сомато-статина и его синтетического аналога октреотида [10, 15, 17]. Нами использован сандостатин в лечении пяти детей. У четверых больных он показал свою эффективность. Трое из них были новорожденными, однако препарат применялся в комплек-
се других лечебных мероприятий и трудно говорить о его исключительной роли.
Значительно чаще мы применяли полное парентеральное питание (12 детей) на срок от 5 до 20 дней. Кроме того, в интенсивную терапию детей с хилотораксом включали коррекцию электролитных и белковых расстройств, симптоматическую терапию. Эффект консервативного лечения у наших больных выражен в прекращении отделяемого по дренажу, а контрольные ультразвуковые и рентгенологические исследования говорили об исчезновении жидкости в плевральной полости.
Отсутствие эффекта от консервативного лечения в течении более 2 недель или ежедневные потери плеврального выпота более 100 мл/год жизни являются показанием к операции [8]. Однако есть мнение, что больные с хилотораксом после хирургических вмешательств нуждаются в более агрессивной лечебной тактике [22]. Хирургическое лечение хилоторакса заключается в наложении лимфовенозного анастомоза, плевродезе, плевро-перитонеальном шунтировании, перевязке грудного лимфатического протока.
Однако есть мнение, что больные с хилотораксом после хирургических вмешательств нуждаются в более агрессивной лечебной тактике [22]. Хирургическое лечение хилоторакса заключается в наложении лимфовенозного анастомоза, плевродезе, плевро-перитонеальном шунтировании, перевязке грудного лимфатического протока.
Нами применялся в одном случае плевродез путем введения в плевральную полость через дренаж йод-поливинилпирралидонового комплексного раствора Braunol (фирма Braun Melsungen AG) с положительным эффектом, который проявился в прогрессивном снижении количества выпота в течение 5 дней. Однако нельзя не согласиться с тем, что большое количество осложнений, длительное и непредсказуемое образование адгезивного процесса в грудной полости делает эти вмешательства плохоуправляемыми [7, 19].
Перевязка грудного лимфатического протока (ГЛП), впервые использованная в лечении хилоторакса в 1948 г. , выполняется наиболее часто, а в последнее время преимущественно торакоскопичес-ки [9]. Для выявления места повреждения ГЛП применяются различные виды лимфографии. Нами оперирован один больной в возрасте 10 месяцев с левосторонним хилотораксом, возникшим после пункции подключичной вены, выполненной для проведения урографии. После безуспешных консервативных мероприятий, включая среднецепочечные триг-лицериды и сандостатин в течение 15 дней при ежедневной потере 100—120 мл хилезного выпота, была произведена операция. Использованное для идентификации лимфатических путей, как рекомендуют некоторые авторы [8, 9 ], введение до операции через рот метиленового синего оказалось малоэффективным. Выполненная перевязка ГЛП справа привела к немедленному прекращению лимфореи.
, выполняется наиболее часто, а в последнее время преимущественно торакоскопичес-ки [9]. Для выявления места повреждения ГЛП применяются различные виды лимфографии. Нами оперирован один больной в возрасте 10 месяцев с левосторонним хилотораксом, возникшим после пункции подключичной вены, выполненной для проведения урографии. После безуспешных консервативных мероприятий, включая среднецепочечные триг-лицериды и сандостатин в течение 15 дней при ежедневной потере 100—120 мл хилезного выпота, была произведена операция. Использованное для идентификации лимфатических путей, как рекомендуют некоторые авторы [8, 9 ], введение до операции через рот метиленового синего оказалось малоэффективным. Выполненная перевязка ГЛП справа привела к немедленному прекращению лимфореи.
ЗАКЛЮЧЕНИЕ
Таким образом, наши данные свидетельствуют о высокой эффективности консервативных ме-
роприятий при лечении хилоторакса. При отсутствии эффекта от консервативных мероприятий в течении 7—10 дней и значительных потерях лимфы показано хирургическое лечение. Методом выбора является лигирование ГЛП. Своевременная диагностика, комплексное консервативное и хирургическое лечение позволяют добиться положительных результатов в большинстве случаев.
При отсутствии эффекта от консервативных мероприятий в течении 7—10 дней и значительных потерях лимфы показано хирургическое лечение. Методом выбора является лигирование ГЛП. Своевременная диагностика, комплексное консервативное и хирургическое лечение позволяют добиться положительных результатов в большинстве случаев.
ЛИТЕРАТУРА
1. Ашкрафт К. У., Холдер Т. М. Детская хирургия. — СПб., 1996. — Т. 1. — С. 220—221.
2. Лайт Р. У. Болезни плевры. — М.: Медицина, 1986. —
370 с.
3. Маланичев С. Л, Шилкин Г. М. // РМЖ. — 1998. — Т. 6. — № 1. — С. 23—26.
4. Руководство практической хирургии / Под ред. Е. фон Бергмана, П. фон Брунса и И. Микулича. — М.: Издание А. А. Карцева. — 1902. — Т. 2. — С. 679—680.
А. Карцева. — 1902. — Т. 2. — С. 679—680.
5. Спиридонов А. А., Аракелян В. С., Малинин А. А, Пирц-халаишвили З. К., Абалмасов К. Г. // Анналы хирургии. — 2003. — № 2. — C. 44—45.
6. Beghetti M., La Scala G., Belli D., et al. // J. Pediatr. — 2000. — Vol. 136, № 5. — P. 653—658.
7. Brissaud O., Desfrere L., Mohsen R., et al. // Arch. Dis. Child. Fetal. Neonatal. — 2003, — Vol. 88. — P. F531—F533.
8. Büttiker V., Fanconi S., BurgerR. // Chest. — 1999, — Vol. 116, № 3. — P. 682—687.
9. Christodoulou M., Ris H-B., Pezzetta E. // Eur. J. Cardiothorac. Surg. — 2006. — Vol. 29. — P. 810—814.
10. Cannizzaro V., Frey B., Bernet-Buettiker V. // Eur. J. Cardiothorac. Surg. — 2006. — Vol. 30, № 1. — P. 49—53.
— Vol. 30, № 1. — P. 49—53.
11. Densupsoontorn N. S., Jirapinyo P., Wongarn R., et al. // Asia Pac. J. Clin. Nutr. — 2005. — Vol. 14, № 2. — P. 182—187.
12. Fahimi Н, et al. // Ann. Thorac. Surg. — 2001. — Vol. 71. — P. 448—450.
13. Fernandez C., Segura I., Salinas F., Abizanda S. // An. Pediatr (Barc). — 2008. — Vol. 68, № 3. — P. 224—231
14. Hillerdal G. // Eur. Respir. J. — 1997. — Vol. 10, № 5. — P. 157—1162.
15. Huang Q., Ge B. J., Liu L. M., et al. // Chin. Med. J. (Engl). — 2007. — Vol. 120, № 20. — P. 1847—1849.
16. Gonzalez R., Bryner B. S., Teitelbaum D. H, et al. // J. Pediatr. Surg. — 2009. — Vol. 44, № 6. — P. 1181—1185.
17. Goto M., Kawamata K, Kitano M., et al. // J. Perinatol. — 2003. — Vol. 23, № 7. — P. 563—564.
Goto M., Kawamata K, Kitano M., et al. // J. Perinatol. — 2003. — Vol. 23, № 7. — P. 563—564.
18. Kurekci E, Kaye R., Koehler M. // J. Pediatr. — 1998. — Vol. 132, № 6. — P. 1064—1066.
19. Light R. W., Aelony.Y., Laniado-Laboren R. // Chest. — 2003. — Vol.123, №4. — P. 1318—1319.
20. Lumbreras F. J., Sánchez D. J. // An. Pediatr. (Barc). — 2009. — Vol. 70, № 3. — P. 223—229.
21. Maldonado F, et al. // Mayo Clinic Proceedings. — 2009. — Vol. 84, № 2. — P. 129—133.
22. Nath D. S., Savla J., Khemani R. G., et al. // Ann. Thorac. Surg. — 2009. — Vol. 88, № 1. — P. 246—2451.
23. Patsouras D. J., Argiri O., Sideris D. A. // Hellenic. J. Cardiol. — 2002. — Vol. 4, № 170. — P. 173—200.
173—200.
24. Riantawan P., Tansupasawasdikul S., Subhannachart P. // Thorax. — 1996. — Vol. 51. — P. 1277—1278.
Страница статьи : Российский педиатрический журнал
Doerr C.H., Allen M.S., Nichols F.C., Ryu J.H. Etiology of chylotorax in 203 patients. Mayo Clin Proc. 2005; 80(7): 867-70. DOI: http://doi.org/10.4065/80.7.867
Hermon M., Tenner E., Burda G., Strohmaier W., Schlager G., Golej J. Chylothorax and chylous-like diseases in children: clinical management. Front. Pediatr. 2019; 7: 258. DOI: http://doi.org/10.3389/fped.2019.00258
Белов Ю.В., Миланов Н.О., Степаненко А.Б., Гасанов А.Ф. Хилоторакс в торакальной хирургии. Хирургия. Журнал им. Н.И. Пирогова. 2012; (10): 61-4.
Кучеров Ю.И., Яшина Е.В., Жиркова Ю.В., Чеботаева Л.И., Москвитина Л.Н. Лечение новорожденного с хилотораксом, хилоперикардом и хилоперитонеумом. Российский вестник детской хирургии, анестезиологии и реаниматологии. 2016; 6(1): 95-9.
Российский вестник детской хирургии, анестезиологии и реаниматологии. 2016; 6(1): 95-9.
Bialkowski A., Poets C.F., Franz A.R. Congenital chylothorax: a prospective nationwide epidemiological study in Germany. Arch. Dis. Child. Fetal Neonatal Ed. 2015; 100(2): F169-72. DOI: http://doi.org/10.1136/archdischild-2014-307274
Attar M.A., Donn S.M. Congenital chylotorax. Semin. Fetal Neonatal Med. 2017; 22(4): 234-9. DOI: http://doi.org/10.1016/j.siny.2017.03.005
Bellini C., De Angelis L.C., Bellini T. Octreotide treatment for neonatal chylothorax. World J. Pediatr. 2018; 14(6): 623. DOI: http://doi.org/10.1007/s12519-018-0184-0
Wasmuth-Pietzuch A., Hansmann M., Bartmann P., Heep A. Congenital chylothorax: lymphopenia and high risk of neonatal infections. Acta Paediatr. 2004; 93(2): 220-4. DOI: http://doi.org/10.1080/ 08035250310007312
Dorsi M., Giuseppi A. , Lesage F., Stirnemann J., De Saint Blanquat L., Nicloux M., et al. Prenatal factors associated with neonatal survival of infants with congenital chylotorax. J. Perinatol. 2018; 38(1): 31-4. DOI: http://doi.org/10.1038/jp.2017.150
, Lesage F., Stirnemann J., De Saint Blanquat L., Nicloux M., et al. Prenatal factors associated with neonatal survival of infants with congenital chylotorax. J. Perinatol. 2018; 38(1): 31-4. DOI: http://doi.org/10.1038/jp.2017.150
Tutor J.D. Chylothorax in infants and children. Pediatrics. 2014; 133(4): 722-33. DOI: http://doi.org/10.1542/peds.2013-2072
Bellini C., Ergaz Z., Radicioni M., Forner-Cordero I., Witte M., Perotti G., et al. Congenital fetal and neonatal visceral chylous effusions: neonatal chylotorax and chylous ascites revisited. A multicenter retrospective study. Lymphology. 2012; 45(3): 91-102.
Cormack B.E., Wilson N.J., Finucane K., West T.M. Use of monogen for pediatric postoperative chylothorax. Ann. Thorac. Surg. 2004; 77(1): 301-5. DOI: http://doi.org/10.1016/s0003-4975(03)01189-5
Neumann L., Springer T., Nieschke K., Kostelka M., Dähnert I. ChyloBEST: chylothorax in infants and nutrition with low-fat breast milk.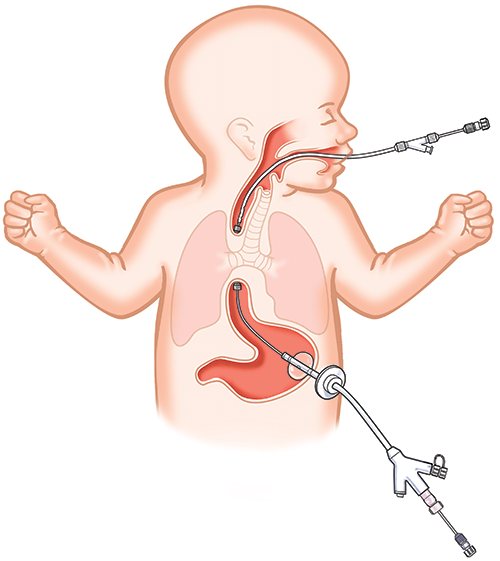 Pediatr. Cardiol. 2020; 41(1): 108-13. DOI: http://doi.org/10.1007/s00246-019-02230-z
Pediatr. Cardiol. 2020; 41(1): 108-13. DOI: http://doi.org/10.1007/s00246-019-02230-z
Gray M., Kovatis K.Z., Stuart T., Enlow E., Itkin M., Keller M.S., et al. Treatment of congenital pulmonary lymphangiectasia using ethiodized oil lymphangiography. J. Perinatol. 2014; 34(9): 720-2. DOI: http://doi.org/10.1038/jp.2014.71
Dori Y. Novel lymphatic imaging techniques. Tech. Vasc. Interv. Radiol. 2016; 19(4): 255-61. DOI: http://doi.org/10.1053/j.tvir.2016.10.002
Shibasaki J., Hara H., Mihara M., Adachi S., Uchida Y., Itani Y. Evaluation of lymphatic dysplasia in patients with congenital pleural effusion and ascites using indocyanine green lymphography. J. Pediatr. 2014; 164(5): 1116-20.e1. DOI: http://doi.org/10.1016/j.jpeds.2013.12.052
Reiterer F., Grossauer K., Morris N., Uhrig S., Resch B. Congenital pulmonary lymphangiectasis. Paediatr. Respir. Rev. 2014; 15(3): 275-80. DOI: http://doi.org/10.1016/j.prrv.2014.05.002
Mallman M.R., Graham V., Rosing B. Thoracoamniotic shunting for fetal hydrothorax: predictors of intrauterine course and postnatal outcome. Fetal Diagn. Ther. 2017; 41(1): 58-65. DOI: http://doi.org/10.1159/000446110
Norton M.E., Chauhan S.P., Dashe J.S. Society for Maternal-Fetal Medicine (SMFM) clinical guideline #7: nonimmune hydrops fetalis. Am. J. Obstet. Gynecol. 2015; 212(2): 127-39. DOI: http://doi.org/10.1016/j.ajog.2014.12.018
Lee C.J., Tsao P.N., Chen C.Y., Hsieh W.S., Liou J.Y., Chou H.C. Prenatal therapy improves the survival of premature infants with congenital chylothorax. Pediatr. Neonatol. 2016; 57(2): 127-32. DOI: http://doi.org/10.1016/j.pedneo.2015.07.001
Deurloo K., Devlieger R., Lopriore E., Klumper F., Oepkes D. Isolated fetal hydrothorax with hydrops: a systematic review of prenatal treatment options. Prenat. Diagn. 2007; 27(10): 893-9. DOI: http://doi.org/10.1002/pd.1808
Prenat. Diagn. 2007; 27(10): 893-9. DOI: http://doi.org/10.1002/pd.1808
Hoskote A.U., Ramaiah R.N., Cale C.M., Hartley J.C., Brown K.L. Role of immunoglobulin supplementation for secondary immunodeficiency associated with chylothorax after pediatric cardiothoracic surgery. Pediatr. Crit. Care Med. 2012; 13(5): 535-41. DOI: http://doi.org/10.1097/PCC.0b013e318241793d
Kocel S.L., Russell J., O’Connor D.L. Fat-modified breast milk resolves chylous pleural effusion in infants with postsurgical chylothorax but is associated with slow growth. JPEN J. Parenter. Enteral Nutr. 2016; 40(4): 543-51. DOI: http://doi.org/10.1177/0148607114566464
Fogg K.L., DellaValle D.M., Buckley J.R., Graham E.M., Zyblewski S.C. Feasibility and efficacy of defatted human milk in the treatment for chylothorax after cardiac surgery in infunts. Pediatr. Cardiol. 2016; 37(6): 1072-7. DOI: http://doi.org/10.1007/s00246-016-1393-8
Costa K. M., Saxena A.K. Surgical chylothorax in neonates: management and outcomes. World J. Pediatr. 2018; 14(2): 110-5. DOI: http://doi.org/10.1007/s12519-018-0134-x
M., Saxena A.K. Surgical chylothorax in neonates: management and outcomes. World J. Pediatr. 2018; 14(2): 110-5. DOI: http://doi.org/10.1007/s12519-018-0134-x
Касьянова Н.Ю., Аракелян В.С., Малинин А.А., Гидаспов Н.А., Бокерия Л.А. Медикаментозное лечение хилоторакса. Физиологические аспекты. Клиническая физиология кровообращения. 2016; 13(2): 85-92
Laforgia N., Schettini F., De Mattia D., Martinelli D., Ladisa G., Favia V. Lymphatic malformation in newborns as the first sign of diffuse lymphangiomatosis: successful treatment with sirolimus. Neonatology. 2015; 109(1): 52-5. DOI: http://doi.org/10.1159/000440939
Heiwegen K., van Rooij I.A.L.M., van Heijst A., de Blaauw I., Botden S.M.B.I. Surgical complications in children with CDH: a multivariate analysis. World J. Surg. 2020; 44(6): 2042-8. DOI: http://doi.org/10.1007/s00268-020-05387-4
Хилоторакс у новорожденных | Русский Анестезиологический Сервер
Баландина Н. А., Беляева И.Д., Степаненко С.М.,
А., Беляева И.Д., Степаненко С.М.,
Жиркова Ю.В., Цветков И.О.
ДГКБ №13 им. Н.Ф.Филатова,
Кафедра детской хирургии
Хилоторакс — это патологическое состояние,
связанное с накоплением лимфатической
жидкости в плевральной полости. Эта
патология встречается достаточно редко,
однако является серьезным и часто
угрожающим жизни заболеванием, приводящим
к глубоким респираторным, обменным и
иммунологическим нарушениям. Встречается в
любой возрастной группе, в том числе и в
период новорожденности. Сообщения о
неонатальном хилотораксе малочисленны и
описывают от единичных до нескольких
десятков наблюдений.
За период 1998-1999 годов в отделении
реанимации Филатовской больницы
наблюдалось 3 детей с послеоперационным
хилотораксом.
Особенности анамнеза
|
Фамилия пациента
|
Срок гестации
|
Течение беременности
|
Основной диагноз
|
Сопутствующий диагноз
|
|
Кузнецова Вика
|
36 недель
|
Угроза прерывания беременности,маточное
|
Множественные пороки развития,
|
Задержка внутриутробного развития,
|
|
Кириулиш-вили
(девочка)
|
37 недель
|
Анемия, водянка беременных
|
Левосторонняя диафрагмальная грыжа
|
НМК, синдром угнетения ЦНС
|
|
Соколов (мальчик)
|
36-37 недель
|
Хронический пиелонефрит, водянка
|
Левосторонняя диафрагмальная грыжа
|
Внутриутробная пневмония, ДН ІІІ
|
Всем детям в первую неделю жизни был
поставлен диагноз — врожденная
диафрагмальная грыжа. По поводу чего были
По поводу чего были
переведены в отделение реанимации и затем в
течение недели прооперированы. Операция
заключалась в проведении пластики купола
диафрагмы, дренирования плевральной
полости.
У всех детей были катетеризированы вены
бассейна нижней полой вены.
Со вторых суток после операции стали
получать большое количество выпота по
плевральным дренажам порядка 30 мл/кг/сут.
После начала энтерального питания жидкость
стала молочного цвета.
Диагноз хилоторакса ставился на
основании клинической картины (отделяемое
из плевральной полости с характерной
молочной окраской) и лабораторных данных (сходство
биохимических анализов плеврального
выпота и крови пациента).
Сравнение б/х показателей крови и лимфы
|
Кириулишвили
|
Кузнецова Вика
| |||
|
Кровь
|
Лимфа
|
Кровь
|
Лимфа
| |
|
К?ммоль/л
Nа?ммоль/л
Са??ммоль/л
Белок г/л
|
8,77
105,8
1,25
45
|
7,03
104,1
1,27
29
|
5,59
126,1
1,26
40
|
3,83
125,6
1,43
24
|
После установления диагноза хилоторакс
была полностью отменена энтеральная
нагрузка, проводилось полное
парентеральное питание по методу
гипералиментации с добавлением
необходимых витаминов, микроэлементов.
Наряду с этим проводилась посиндромная
терапия.
На 10 послеоперационные сутки в результате
больших потерь у детей стали развиваться
грубые водно — электролитные нарушения в
виде гиперкалиемии в плазме (6,35 — 7,94 ммоль/л),
гипонатриемии (105,8 — 124,2 ммоль/л),
гипопротеинемии (32 — 41 г/л).
Электролитные нарушения в плазме
|
Показатели
|
Клинические данные
|
Норма
|
|
Калий (ммоль/л)
Натрий (ммоль/л)
Белок (г/л)
|
6,35 — 7,94 ммоль/л
105,8-124,2 ммоль/л
32-41 г/л
|
4,5-5,5 ммоль/л
135-145 ммоль/л
55-73 г/л
|
Одновременно по данным ЭКГ отмечалась
внутриклеточная гипокалиемия на фоне
диффузных изменений миокарда. Следует
Следует
отметить, что подобные нарушения
достаточно трудно было скоррегировать,
несмотря на большой объем инфузионной
терапии.
Сохранявшиеся массивные жидкостные
потери потребовали выполнения
хирургического вмешательства — перевязки
грудного лимфатического протока. Одному
ребенку перевязку протока пришлось
выполнить дважды.
Сроки и название выполненного
оперативного вмешательства
|
Фамилия пациента
|
Сроки выполнения
|
Название операции
|
|
Кузнецова Вика
Кириулишвили
Соколов
|
16 п/о сутки
16 п/о сутки
21(5) п/о сутки
15 п/о сутки
|
Перевязка ГЛП *справа
Перевязка ГЛП слева
Перевязка ГЛП справа
Перевязка ГЛП слева
|
*ГЛП — грудной
лимфатический проток
У двоих детей после повторной операции
появилась положительная динамика в виде
уменьшения отделяемого по дренажам,
восстановления водно — электролитного
равновесия, стабилизации гемодинамики и
сердечной деятельности. Один ребенок
Один ребенок
несмотря на удачную перевязку
лимфатического протока от нарастающих
явлений сердечно — сосудистой и дыхательной
недостаточности умер на 35 сутки жизни.
Мы проанализировали порядка 90 источников,
сообщающих о неонатальном хилотораксе и
описывающих от единичных до нескольких
десятков наблюдений.
Количество наблюдений
- Engum SA Indianapolis 1996 — 1998гг. 7
новорожденных - Kavvadia V London 6
- Naik S London 3
- Bond SJ Louisville 1980 — 1990гг. 15
- Stringel G 1976 — 1983гг. 7 (после
операции) - Van Straaten HL Dania 1992г. 11
- Mercer S 1986г. 5 (после ВДГ*)
- Echeverria Lecuona, San Sebastian 1978 — 1998гг.
10 (врожденные) - Van Aerde J за 22 года 12 (спонтанный)
- Browse NL 1956-1986 гг. 20
- Gonzales de Dios J Madrid 1975-1990 гг.
3
*ВДГ — врожденная
диафрагмальная грыжа
Как видно из таблицы, наблюдения
действительно малочисленные, и, в основном,
касаются новорожденных со спонтанным,
врожденным и послеоперационным
хилотораксом.
В настоящее время нет единой точки зрения
на патогенез возникновения хилоторакса.
Расценивая хилоторакс в основном как
осложнение, зарубежные авторы указывают на
следующие этиопатогенетические факторы.
Причины возникновения хилоторакса у
новорожденных
- ятрогенные причины (кардиоторакальные
операции, пункции центральных вен системы
верхней полой вены, травма в родах) - повышение давления в
системе ВПВ* (в частности при тромбозе ВПВ) - диафрагмальная грыжа
- пороки развития
лимфатической системы (рассыпной тип,
гипоплазия сосудов или сосудистой стенки) - лимфангиоматоз
- генетические пороки (синдром
Дауна, Gorham`s син — м, Noonan
син — м) - врожденная ЦМВ — инфекция
- воспалительный процесс
*ВПВ — верхняя полая вена
Во-первых, это ятрогенные причины -
повреждение лимфатических сосудов при
кардиоторакальных операциях, пункциях
центральных вен и травма в родах. Отмечено,
Отмечено,
что при повреждении лимфатического протока
выше 6 грудного позвонка обычно развивается
левосторонний хилоторакс; ниже -
правосторонний хилоторакс.
Во-вторых — повышение венозного давления в
системе верхней полой вены приводит к
развитию патологической гипертензии в
системе грудного лимфатического протока,
так как лимфа не поступает в большой круг
кровообращения. Повышение давления может
быть связано с тромбозами системы верхней
полой вены, перегрузками правых отделов
сердца.
Возникновение хилоторакса у больных с
врожденной диафрагмальной грыжей
преимущественно обусловлено порочным
развитием легкого и отделов сердца на
стороне поражения и, соответственно,
кровеносных и лимфатических сосудов этой
области. Одним из патогномоничных
симптомов ВДГ является легочная
гипертензия и перегрузка правых отделов
сердца. А повышение давления в системе
верхней полой вены в условиях порочно
развитой стенки лимфатического сосуда или
рассыпного типа строения может привести к
повышенному пропотеванию лимфы через
стенку сосуда или даже к его разрыву.
Так же описано
возникновение хилоторакса при пороках
лимфатической системы, лимфангиоматозе
кожи, плевры, генетических пороках, таких
как болезнь Дауна, синдромы Noonan и
Gorham’s, и при ЦМВ-инфекции.
Диагностика хилоторакса основана на
оценке клинических и лабораторных
признаков. В нашем случае оценивался только
молочный оттенок выпота и схожесть б/х
состава с плазмой. Однако при отсутствии
энтерального питания молочными смесями
соответственно нет и молочного оттенка
выпота.
Поэтому необходимо использовать более
точные критерии для диагностики. По данным
зарубежной литературы для постановки
диагноза используется подсчет общего
количества клеток, % содержание лимфоцитов
в хилезной жидкости, уровень триглицеридов,
лимфангиография, а также сцинтиграфия с
радиоизотопом йода. Последние два метода
также используют для точной локализации
повреждения.
Для хилоторакса характерно высокое
содержание в плевральном выпоте лимфоцитов
выше 90 %, липидов выше 1,1 ммоль/л и превышение
общего количества клеток более 1000 в мкл.
Эти данные являются статистически
достоверными.
Сравнение состава хилезного выпота и
нехилезного
|
|
хилезный выпот
|
нехилезный выпот
|
|
общее количество клеток
% содержание
уровень триглицеридов
|
более 1000 /мкл
более 90 %
более 1,1 ммоль/л
|
20 — 1400 /мкл
до 60 %
0,1 — 0,71ммоль/л
|
Оптимальное решение этой проблемы до
настоящего времени не определено, так как
медикаментозная терапия часто оказывается
неэффективной. Хирургическое лечение
хилоторакса остается основным методом
терапии. Однако несмотря на это,
практически все авторы начинают лечение с
консервативных методов.
Консервативное лечение
- Периодический торакоцентез или
установка постоянного плеврального
дренажа
- Диета
- Парентеральное питание
- Массивная инфузионная терапия
Консервативное лечение начинают с
периодического торакоцентеза или
установки постоянного плеврального
дренажа для эвакуации хилезной жидкости и
предотвращения развития дыхательных
расстройств.
Далее, существует несколько подходов в
лечебной тактике: 1)энтеральная нагрузка не
отменяется, однако полностью исключаются
жиры; при отсутствии положительного
результата отменяется энтеральное питание,
пациент переводится на полное
парентеральное питание с последующим
хирургическим вмешательством при наличии
показаний; 2)энтеральное питание не
отменяется, жиры вводятся парентерально; 3)энтеральное
питание так же не отменяется, назначается
диета, обогащенная белками, углеводами,
часть необходимых элементов вводится
парентерально. Исследования физиологии
всасывания в желудочно-кишечном тракте
позволили не отменять жиры, которые
вводятся в расщепленном состоянии — в виде
среднецепочечных триглицеридов перорально.
Из стенки кишечника среднецепочечные
триглицериды попадают в кровеносное русло
минуя лимфу. Аминокислоты необходимо
назначать в более высоких дозах, чем обычно
для восполнения суточной потребности и
коррекции имеющейся гипопротеинемии.
Проводится инфузионная терапия в больших
объемах для восполнения потерь жидкости с
плевральным выпотом.
Отсутствие положительного результата или
превышение объема выпота 1,5 л/день у
взрослых пациентов и 100 мл/на год жизни в
день у детей является показанием к
оперативному вмешательству. У
новорожденных эти показатели в настоящее
время еще не определены.
К основным методам оперативного
вмешательства относятся: наложение
плевроперитонеального шунта, перевязка
грудного лимфатического протока, плевродез,
наложение анастомоза между лимфатическим
протоком и v.azygos.
Плевроперитонеальное шунтирование
считается одним из наиболее простых,
эффективных и минимально инвазивных
методов хирургического лечения
хилоторакса. Длительность стояния
плевроперитонеального шунта по данным
зарубежных авторов от нескольких дней до
года.
Некоторые авторы сделали вывод, что
длительное консервативное лечение снижает
вероятность хирургического вмешательства,
но продлевает время пребывания ребенка в
стационаре. И наоборот, раннее
хирургическое лечение (до 3 недель)
сокращает сроки выздоровления.
Несмотря на хорошо разработанные
принципы терапии хилоторакса, по данным
зарубежных авторов летальность составляет
от 30 до 50 %.
И в заключении: существует много методов
лечения, однако при этом сохраняется
высокая летальность. Поэтому существует
необходимость дальнейшего изучения этой
проблемы. Что касается нашей тактики, она
заключается, во-первых, в отмене
энтерального питания и переводе на полное
парентеральное питание без применения
жиров, во-вторых, в установке плеврального
дренажа и при наличии показаний дальнейшее
оперативное лечение. Изучив литературные
данные, возможно следует несколько
изменить тактику ведения больных с
хилотораксом в отношении энтерального
питания, использования жиров и новых
методов хирургического лечения.
Please enable JavaScript to view the comments powered by Disqus.
blog comments powered by
симптомы, причины, лечение, профилактика, осложнения
Причины
Хилоторакс является проявлением серьёзного осложнения, связанного с патологией грудного лимфатического потока. Причинами возникновения заболевания могут быть:
- врождённые аномалии;
- перенесённые травмы;
- нетравматические причины.
Врождённая патология может наблюдаться у младенцев, что обусловлено наследственной атрезией лимфатического протока грудной полости, которая сопровождается многочисленными плевропотоковыми фистулами. Кроме того, данная патология у детей может стать следствием перенесённой во время родов травмы.
Хилоторакс травматического характера у новорожденных может стать следствием полученной травмы закрытого типа либо перенесённого ранения в область грудной клетки и шеи проникающего характера, а также может быть следствием повреждения протока во время проведения оперативных вмешательств или диагностических процедур.
Причиной нетравматической патологии являются чаще всего злокачественные и доброкачественные опухоли, затрагивающие систему лимфов в области средостения и шеи (лимфолейкоз, рак лёгкого, лимфома Ходжкина).
Симптомы
Бессимптомное течение болезни наблюдается крайне редко. Первым проявлением данного заболевания у новорожденных может быть респираторный дистресс острого типа, проявляющий себя в виде тахипноэ и цианоза. При более детальном обследовании наблюдается:
- набухание грудной клетки на месте поражения;
- смещение в противоположную сторону толчка сердца;
- ослабленное дыхание;
- укорочение перкуторного звука.
Дальнейшее прогрессирование болезни и длительная потеря лимфы могут привести к таким тяжёлым последствиям, как:
- ацидоз метаболический;
- гипопротеинемия;
- иммунные нарушения;
- электролитные расстройства;
- нарушения питания.
Диагностика хилоторакса у новорожденных
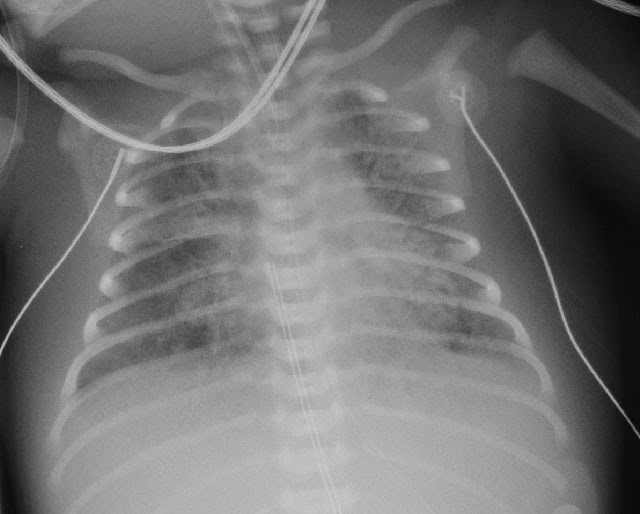
Диагностика хилоторакса у новорожденного осуществляется рентгенограммой лёгких, с помощью которой определяют образовавшийся выпот в плевральной полости, изменение положения средостения и зажатие лёгкого. С целью установления причин патологии проводят:
- ультразвуковое доплерографическое исследование лимфатических сосудов;
- компьютерную томографию грудной клетки;
- лимфосцинтиграфию;
- лимфангиографию.
На основе полученных результатов и данных ультразвукового исследования проводят диагностическую плевральную пункцию.
Осложнения
Прогноз при данной патологии у новорожденных в настоящее время весьма благоприятный. В большинстве случаев при проведении консервативного лечения удаётся достичь существенных результатов и остановить лимфорею. При поражении грудной клетки в следствие травм стоит помнить о том, что существует достаточно высокая степень опасности повреждения лимфатического протока грудной полости.
Иногда после проведения хирургических вмешательств возможны рецидивы, что является следствием отсутствия клапанов, основное предназначение которых заключается в препятствии ретроградному току лимфы в области грудного протока среднего отдела, а также вариабельностью анатомического строения этого протока и его коллатералей.
Неблагоприятным фактором в клинической картине течения болезни является сочетание хилоторакса со злокачественными опухолевыми образованиями грудной полости.
При своевременно диагностике и комплексном подходе в лечении удаётся достичь положительных результатов.
Лечение
Что можете сделать Вы
Лечение хилоторакса у новорожденного начинают с назначения диеты, основным компонентом которой являются триглицериды. Такая диета направлена на снижение лимфатических образований, что способствует нормализации работы всей лимфатической системы.
Перевод новорожденного на такое питание приводит к исчезновению протечек лимфы и, как следствие, способствует выздоровлению ребёнка.
Что делает врач
Лечение хилоторакса у новорожденного, как правило, проводят консервативным путём. Консервативное лечение включает в себя проведение плевральной пункции, а также дренирование плевральной полости с целью удаления лимфы, стабилизации средостения и нормализации лёгкого.
Если проведение плевральных пункций не даёт ожидаемого эффекта, назначают дренирование плевральной полости с установкой постоянного дренажа. В особо тяжёлых случаях назначается проведение временного плевроперитонеального шунтирования.
Хирургическое вмешательство назначается только в том случае, если консервативное лечение не привело к положительному результату, и процесс протечки лимфы продолжается. Оперативные манипуляции в данном случае заключаются в перевязке грудного протока выше и ниже области протечки лимфы. Операция эффективна во многих случаях.
Профилактика
Профилактика заболевания у новорожденного заключается в следующем:
- профессиональное проведение диагностических и оперативных вмешательств;
- строгое соблюдение правил по проведению инвазивных лечебных процедур;
- своевременное лечение заболеваний, которые могут стать причиной лимфатического протока грудной полости.
Оцените материал:
спасибо, ваш голос принят
Вооружайтесь знаниями и читайте полезную информативную статью о заболевании хилоторакс у новорожденных детей. Ведь быть родителями – значит, изучать всё то, что поможет сохранять градус здоровья в семье на отметке «36,6».
Узнайте, что может вызвать недуг хилоторакс у новорожденных детей, как его своевременно распознать. Найдите информацию о том, каковы признаки, по которым можно определить недомогание. И какие анализы помогут выявить болезнь и поставить верный диагноз.
В статье вы прочтёте всё о методах лечения такого заболевания, как хилоторакс у новорожденных детей. Уточните, какой должна быть эффективная первая помощь. Чем лечить: выбрать лекарственные препараты или народные методы?
Также вы узнаете, чем может быть опасно несвоевременное лечение недуга хилоторакс у новорожденных детей, и почему так важно избежать последствий. Всё о том, как предупредить хилоторакс у новорожденных детей и не допустить осложнений. Будьте здоровы!
Хилоторакс — причины, симптомы и лечение
Общая информация
Хилус (млечный сок) – беловатая жидкость, которая образуется в процессе пищеварения. Его основным элементом являются жиры (липиды), в частности хиломикроны – транспортные формы триглицеридов, которые синтезируются эпителиальными клетками кишечника. Также в него входят лимфа, белки, электролиты, форменные элементы крови и так далее.
Из мелких лимфатических сосудов хилус попадает в грудной проток – основной лимфатический коллектор организма человека, который начинается между XI грудным и II поясничным позвонками, проходит через грудную полость, шею и вливается в левую внутреннюю яремную вену. За сутки по нему в венозную систему поступает 1,5 – 3 литра хилуса.
В случае нарушения целостности грудного протока млечный сок начинает истекать в полость плевры, и развивается хилоторакс, который приводит к ряду респираторных, иммунологических и обменных нарушений. Заболевание может возникнуть в любом возрасте, в том числе в период новорожденности. Впервые оно было описано в 1633 году Фабрициусом Бартолетом.
Причины
Причины хилоторакса могут быть врожденными, травматическими, нетравматическими и смешанными.
Врожденный хилоторакс возникает вследствие:
- внутриутробной атрезии (заращивания) грудного протока;
- плевропротоковой фистулы – свища между нижним отрезком протока и плевральной полостью;
- лимфангиэктазий (очень редко).
Кроме того, хилоторакс у новорожденных может развиться в результате родовой травмы.
Травматические причины заболевания:
- закрытые травмы либо проникающие ранения грудной клетки и шеи;
- повреждение протока или его ветвей во время хирургических вмешательств либо диагностических процедур.
К хилотораксу могут привести операции на шее, грудной клетке (торакальные), нисходящей аорте, пищеводе, средостении, легких, животе, пояснице. Среди диагностических манипуляций с высоким риском разрыва грудного протока сопряжены транслюмбальная артериография, катетеризация сердца и пункция подключичной вены.
Факторы, вызывающие нетравматический хилоторакс:
- новообразования, прорастающие в лимфатическую систему в зоне средостения и шеи – лимфома Ходжкина, рак легкого, лимфолейкоз;
- патологии, приводящие к сдавливанию или закупорке протока – поликистоз средостения, аневризма аорты, гельминтоз, тромбоз подключичной вены;
- синдром верхней полой вены – разрыв грудного протока происходит при резком скачке венозного давления;
- туберкулез;
- саркоидоз;
- лимфангит;
- амилоидоз;
- диафрагмальная грыжа;
- медиастинит и так далее.
У курильщиков с многолетним стажем может возникнуть идиопатический хилоторакс. Его причина – спонтанный разрыв лимфатического сосуда во время приступа кашля.
Патогенез
После образования дефекта в грудном протоке начинается истечение хилуса в клетчатку средостения. В результате его накопления образуется медиастинальная хилома, прогрессирование размеров которой приводит к разрыву плевры и поступлению млечного сока в плевральную область.
Вследствие накопления хилуса в плевральной полости возникают следующие патологические процессы:
- млечный сок пропитывает межфасциальное пространство и клетчатку;
- плевра отекает и теряет эластичность;
- легкое сдавливается, при длительном течении заболевания – становится ригидным и плохо расправляется;
- органы средостения смещаются;
- полые вены перегибаются;
- нарастает венозное давление, провоцирующее более активный синтез лимфы.
Поскольку в хилусе содержатся жизненно важные элементы, в том числе белки, жиры, лимфоциты и эозинофилы, его потеря приводит к истощению организма и нарушениям в работе иммунитета.
Симптомы
Симптомы хилоторакса начинают проявляться через 3-5 дней после разрыва грудного протока. Как правило, за этот период в плевральной полости накапливается более 200 мл хилуса. При возникновении заболевания после операции латентный период может продлиться 7-10 дней, это связано с постельным режимом и диетическим питанием пациента.
Хилоторакс сопровождается следующими признаками:
- одышка, усиливающаяся при физических нагрузках, в запущенных случаях развивается дыхательная недостаточность;
- тяжесть в той полове грудной клетки, куда произошел хилезный выпот;
- тахикардия;
- гипотония.
При прогрессировании заболевания и обильной лимфорее (1,5-3 л в сутки) появляются такие симптомы, как:
- общая слабость;
- потеря веса;
- постоянное чувство голода;
- бледность (синюшность) и сухость кожи;
- гиповолемия – снижение объема крови;
- увеличение объема нижнего отдела грудины на пораженной стороне.
Правосторонний хилоторакс, возникающий при разрыве нижнего отрезка грудного протока, характеризуется более выраженной клинической картиной, чем левосторонний, который развивается в результате повреждения верхней части лимфатического коллектора.
Диагностика
Хилоторакс диагностируется пульмонологом на основании:
- клинических симптомов;
- аускультации и перкуссии грудной клетки – на пораженной стороне обнаруживаются слабое дыхание и невыраженный перкуторный звук;
- рентгенографии легких – позволяет визуализировать наличие жидкости в плевральной области, компрессию легкого и смещение средостения;
- плевральной пункции – в результате проколола плевры и аспирации ее содержимого обнаруживается хилус – маслянистый белый экссудат;
- лимфографии (контрастной рентгенографии лимфатических сосудов) – дает возможность установить уровень повреждения протока и его локализацию.
Кроме того, для оценки общего состояния осуществляются анализы крови:
- клинический – демонстрирует лимфопению;
- биохимический – показывает гиполипопротеинемию (снижение уровня белков и жиров).
Для определения причин хилоторакса проводятся УЗИ брюшной и плевральной полостей, КТ, биопсия лимфоузла, плевры или ткани легкого, торакоскопия и так далее.
Хилоторакс у плода можно предположить при наличии у него водянки в сочетании с нормальной работой сердца. Для уточнения диагноза может быть проведена плевральная пункция под контролем УЗИ, но целесообразность этого метода ставится большинством специалистов под сомнение.
Лечение
Консервативное лечение хилоторакса показано при малосимптомном (легком) течении. Основные направления:
- удаление хилуса из плевральной полости посредством пункций или дренирования;
- переход на парентеральное питание;
- компенсирование потерь лимфы с помощью введения белковых препаратов и регидратационных растворов;
- снижение венозного давления;
- введение в плевру склерозирующих веществ для облитерации (заращивания) плевральной полости;
- внутривенные инфузии гормона соматостатина, которые способствуют ускорению рассасывания выпота.
Дополнительные методы лечения хилоторакса зависит от его причин. Например, при туберкулезе применяются противотуберкулезные препараты, а при опухолях – лучевая терапия.
Продолжительной лечения – 2-3 недели. При увеличении этого срока высок риск инфицирования плевральной области, а также истощения организма.
Если в течение 7 дней консервативной терапии состояние пациента не улучшилось, назначают операцию. Кроме того, срочное хирургическое лечение показано в тяжелых случаях хилоторакса.
Суть вмешательства состоит в перевязке грудного протока выше или ниже места повреждения. После этого не наблюдаются функциональные расстройства, поскольку развиваются коллатеральные пути и дополнительные соустья. Перед операцией пациенту следует выпить 100-200 мл растительного масла или сливок. Это облегчает определение местонахождения дефекта протока.
Помимо перевязки протока, могу быть проведены:
- плевроперитональное шунтирование;
- облитерация полости плевры тальком или биоклеем;
- наложение лимфовенозного анастомоза.
Прогноз
Прогноз при хилотораксе у новорожденных и пациентов других возрастных групп относительно благоприятный. В 50% удается достичь прекращения лимфореи благодаря консервативным методам. Эффективность оперативного лечения достаточно высока.
Неблагоприятным прогностическим фактором является сочетание хилоторакса с опухолевыми заболеваниями.
Профилактика
Основные меры профилактики хилоторакса:
- соблюдение правил проведения медицинских манипуляций;
- своевременное лечение заболеваний, которые могут спровоцировать повреждение грудного протока;
- отказ от курения.
Хилоторакс у новорожденных детей: лечение, причины, симптомы, признаки
Соотношение мальчики: девочки= 2:1, преимущественно правосторонний.
У детей выделяют врожденный (нетравматический) и приобретенный (травматический) хилоторакс.
Причины хилоторакса у новорожденных детей
Предположительные причины врожденного хилоторакса — «врожденная слабость грудного лимфатического протока» (стенки протока не способны устоять обычному стрессу в родах), врожденная внутрипротоковая обструкция, лимфангиоматоз, аномалии развития (рассыпной тип) и врожденные свищи протока, инфекция (токсоплазмоз, краснуха, цитомегаловирус, герпес), генетические синдромы (Нонне, Турнера, Горам), различные хромосомные аномалии.
Расценивая хилоторакс, как осложнение, выделяют причины его возникновения: ятрогенное повреждение грудного протока (родовая травма, кардиоторакальные операции, удаление внутригрудных опухолей, операция по поводу диафрагмальной грыжи), повышение давления в системе верхней полой вены при тромбозе.
Патогенез хилоторакса у новорожденных детей
- Повышенное системное или легочное давление (часто в комбинации с гипопротеинемией).
- При врожденном заболевании вероятно наличие фистулы в полости плевры.
- Тромбоз верхней полой вены, но также и нижней полой вены.
- Прямое механическое раздражение или повреждение грудного протока (внутриутробная обструкция, кардиохирургическое вмешательство, оперативное закрытие артериального протока).
Дифференциальный диагноз: инфузионный гидроторакс при ЦВК (в пунктате отсутствует лимфоцитоз).
Диагностика хилоторакса у новорожденных детей
Пункция после УЗИ и/или рентгенологического обследования с целью опорожнения и диагностики высокое содержание белка и липидов при относительном лимфоцитозе. Возможна постановка дренажа (максимального размера).
Характер плеврального выпота определяют при диагностической пункции плевральной полости, при которой получают хилезную жидкость, по цвету напоминающую разведенное молоко. У детей на ППП без энтерального кормления молочный цвет жидкости отсутствует.
Лечение у новорожденных детей
Внимание: значительные потери лимфоцитов, жидкости, компонентов белка и жиров. Поэтому часто требуется возмещение.
Питание:
- При доказанном хилотораксе прежде всего отказ от энтерального кормления на 1—2-3 недели с полным парентеральным питанием.
- При становлении энтерального питания использовать смеси со среднецепочечными жирами (например, Basic F) с целью минимизации торакального лимфатического потока (среднецепочечные жиры резорбируются в портальную систему). Не использовать энтерально длинноцепочечные жиры. В начале — по возможности мало белка.
- Специальные смеси.
В настоящее время является дискуссионным, соматостатин или аналог соматостатина (Octreotid):
- Начинать с 3,3 мкг/кг/час, дозу увеличивать до 15 мкг/кг/час, вводить в течение 6 дней.
Осторожно: все еще является экспериментальным методом; эффект описан в единичных случаях.
При средних потерях (более 100 мл/кг/день) и/или отсутствии положительной динамики в течение 2 недель, равно как и при развитии угрожающих проблем с питанием должны рассматриваться механические попытки с фибриновым клеем, облитерация плевральной полости (плевродез) с помощью склерозирующих веществ (G 50 % или тетрациклин), плевроперитонеальный шунт или лигирование грудного протока.
Общий прогноз благоприятный (около 15 % умирают и около 65 % отвечают на торакоцентез). Проблему представляет при длительном уходе плохая прибавка массы тела ввиду недостаточности питания, а также гипопротеинемия и лимфоцитопения.
Консервативное лечение
В комплексном лечении хилоторакса большинство специалистов рекомендуют начинать лечение с консервативных мероприятий.
Снижение продукции лимфы добиваются использованием препаратов с преобладанием жиров в виде МСТ, применением ППП, низкожировой диеты. Среднецепочечные триглицериды не только снижают внутрипротоковое давление, но и поддерживают адекватное питание. После абсорбции в тонкой кишке они попадают непосредственно в систему полой вены, минуя лимфоток. Таким образом, давление в лимфатической системе не повышается, образование хилуса уменьшается, что приводит к уменьшению хилореи. Длительную низкожировую диету детям не рекомендуют, поскольку она имеет малую энергетическую ценность, мало белка, эссенциальных жирных кислот, необходимых для нормального роста ребенка.
В последние годы в комплексном консервативном лечении используют соматостатин или его синтетический аналог — Октреотид, который у новорожденных применяют в непрерывной инфузии в средней дозе 1—Юмкгна 1 кг массы тела в час. Поданным ряда авторов его использование у новорожденных позволяет повысить эффективность консервативного лечения, которая по данным некоторых авторов достигает 80%.
Хирургическое лечение
Показание к операции у новорожденных — лимфорея, продолжающаяся несмотря на дренирование плевральной полости и проводимое консервативное лечение. Если объем хилезной жидкости остается значительным и существует угроза истощения, следует прибегать к операции ввиду возможного вторичного инфицирования. Установить строго определенные сроки продолжительности консервативного лечения затруднительно. В каждом случае их определяют индивидуально с учетом объема лимфы и состояния больного.
Основные операции — наложение плевроперитонеального шунта, плевродез, плеврэктомия, лигирование грудного протока.
Торакоскопическое клипирование грудного протока — один из наиболее эффективных методов хирургического лечения хилоторакса у детей. Операция заключается в торакоскопии, ревизии и клипировании грудного протока в месте его дефекта. Если он не обнаружен, проток клипируют над диафрагмой металлическими (титановыми) клипсами.
Торакоскопическое клипирование грудного лимфатического протока
Техника операции. Оператор и ассистент располагаются слева от ребенка.
Первый троакар диаметром 3,5 мм для телескопа вводят в V—VI межреберье по лопаточной линии и инсуффлируют углекислый газ под давлением 4—6 мм рт.ст. Второй троакар используют для введения диссектора, третий — атрав-матического окончатого зажима, ирригатора и клип-аппликатора.
Через 3—10 мин после инсуффляции углекислого газа правое легкое колабируется и виден задний синус плевральной полости. Методом монополярной коагуляции рассекают медиастинальную плевру и производят диссекцию клетчатки средостения двумя зажимами (KELLY, окончатые щипцы) между диафрагмой, позвоночным столбом и аортой. В клетчатке между позвоночным столбом, непарной веной и аортой выделяют грудной проток и клипируют металлическими клипсами (Ethicon Titanium-Clips, medium) с помощью клип-аппликатора, введенного через троакар диаметром 5 мм. Иногда визуализировать грудной проток сложно ввиду анатомического его расположения между аортой и левой стенкой позвоночного столба. При этом необходима более широкая мобилизация клетчатки средостения и аорты. Использование 30-градусной стержне-линзовой оптики позволяет осмотреть левую стенку позвоночного столба и визуализировать грудной проток. При отсутствии магистрального ствола грудного протока, что возможно при рассыпном типе его строения, необходимо выполнить клипирование клетчатки средостения на протяжении несколькими клипсами. По окончании операции плевральную полость дренируют через отверстие троакара диаметром 5 мм. Конец плеврального дренажа подводят к зоне операции. После раздувания правого легкого из плевральной полости аспирируют углекислый газ, удаляют троакары и склеивают лейкопластырем разрезы кожи на грудной стенке.
Нетравматический хилоперикард и хилоторакс у недоношенных новорожденных
Хилезная жидкость представляет собой особый тип серозного выпота с неспецифическими клиническими проявлениями и разнообразной этиологией [1]. Частота хилезного выпота у новорожденных составляет 1 случай на 15 000 родов и сопровождается высокой летальностью 15-50% [2]. Среди известных причин, указанных в литературе, наиболее частой является развитие травматического (ятрогенного, постоперационного) хилоперикарда (ХП) и/или хилоторакса (ХТ) в результате инвазивных торакальных воздействий (катетеризация центральных вен, операция на сердце и пищеводе, травма) [2-5]. Реже накопление хилезной жидкости в плевральной полости и/или сердечной сумке связано с пороками развития лимфатической системы в грудной полости [4, 6], опухолью [7, 8], воспалением серозных листков (врожденная цитомегаловирусная инфекция) [9] с формированием так называемого спонтанного (медицинского) ХТ/ХП [2, 9]. Наиболее редкими являются врожденный (идиопатический) ХТ и ХП, причина которых не ясна [2]. Во многих случаях ведущим патогенетическим звеном являются перегрузка правых отделов сердца и повышение давления в верхней полой вене [9].
Представляем случаи нетравматических ХП и ХТ, имеющих танатогенетическое значение, возникших в раннем неонатальном периоде у 3 новорожденных с экстремально низкой массой тела. В анамнезе заболевания у этих младенцев имелись преждевременные роды на сроке 28-29 нед; тяжелая асфиксия в родах; синдром задержки внутриутробного развития плода по гипопластическому типу 1-2-й степени; генерализованная внутриутробная инфекция; выраженный синдром дыхательных расстройств, требующий искусственной вентиляции легких; наличие центрального венозного катетера, дистальный конец которого свободно располагался в полости правого предсердия; парентеральное питание; крайне тяжелое общее состояние с рождения. Смерть всех детей наступила на 4-е сутки жизни. Необходимо отметить, что хилезный характер выпота клинически не был установлен, факты ХП и ХТ явились неожиданной находкой на аутопсии. Макроскопически выпот представлял собой мутную жидкость молочного цвета. Высушенная капля исследуемой жидкости была окрашена по Павловскому для дифференциальной диагностики хилезной жидкости и псевдохилезного экссудата. При цитологическом исследовании в материале определялись эритроциты и лимфоциты в умеренном количестве, единичные активные нейтрофильные лейкоциты или нейтрофильные тельца, а также немногочисленные эпителиальные клетки при отсутствии гнойно-некротического детрита и/или клеток в состоянии жировой дистрофии [10], как при хилоподобном выпоте. Кроме того, во всех полях зрения визуализировались многочисленные мелкие, бесструктурные частицы серого цвета, дающие положительную окраску суданом черным, в отличие от хилоподобного выпота, при котором взвешенные частицы не являются жировыми и не окрашиваются соответствующими красителями [11].
Первый случай спонтанного ХП был связан с врожденной аномалией развития мелких периферических лимфатических сосудов миокарда. При патологоанатомическом исследовании грудной полости обнаружена тампонада полости перикарда (рис. 1)Рисунок 1. Тампонада сердца хилезной жидкостью. хилезным транссудатом (5 мл). При внешнем осмотре на эпикарде грудино-реберной и диафрагмальной поверхности сердца выявлены точечные меловидные участки с петехиальными кровоизлияниями в этих зонах. При вскрытии полостей сердца в толще миокарда правого желудочка и межжелудочковой перегородки в проекции меловидных участков находились темно-красные западающие зоны размером 0,3×0,1 см, гистологически представляющие собой расширенные лимфатические сосуды (рис. 2)Рисунок 2. Многочисленные расширенные лимфатические сосуды в миокарде. Окраска гематоксилином и эозином. ×100.. При бактериологическом исследовании хилезной жидкости флора не выделена. Таким образом, в танатогенезе имело значение повышение давления в лимфатической системе сердца с повреждением сосудов лимфатической мальформации, развитием ХП и тампонады сердца.
Второй случай нетравматического ХП явился следствием врожденной аномалии развития крупных внесердечных лимфатических сосудов: слепо заканчивающихся левым лимфатическим коллектором сердца и гипоплазией грудной части ductus thoracicus. При аутопсии в полости перикарда содержалось 2 мл хилезной жидкости, которая, по результатам бактериологического исследования, была стерильной. Под эпикардом четко визуализировались контуры аневризматически расширенного левого лимфатического коллектора сердца, протяженностью 0,9 см, шириной 1 см, располагающегося у левого края легочного ствола. Этот коллектор выходил сзади кверху у корня правого легкого и впадал в слепо оканчивающееся мешотчатое образование размером 1,5×1 см, содержащее лимфу. Правый лимфатический коллектор сердца располагался субэпикардиально по задней межжелудочковой борозде и впадал в коронарный синус. Ductus thoracicus был протяженностью 6 см и периметром 0,2-0,3 см. Микроскопически в миокарде выявлены выраженный межуточный отек и расширение миокардиальных лимфатических сосудов; незрелый, некомпактный миокард. В танатогенезе также основную роль сыграло повышение давления в грудном лимфатическом протоке и правых отделах сердца.
Третий случай ХТ и ХП имел инфекционную этиологию. При изучении органов грудной полости найдено 2 мл хилезной жидкости в полости перикарда без тампонады и 3 мл в левой плевральной полости. При бактериологическом исследовании экссудата зафиксирован скудный рост Acinetobacter lwoffii (представитель нозокомиальной флоры [12]). При изучении органометрических параметров сердца и гистологически выявлены признаки декомпенсированной кардиомиопатии с признаками перегрузки обоих желудочков. Кроме того, гистологически в межуточном веществе миокарда правого желудочка найден очаг скопления клеток моноцитарного ряда с фибриноидным набуханием волокон стромы в этой зоне и стенки близлежащего сосуда как проявление альтерации с нарушением проницаемости стенки сосуда. На основании вышеизложенного в танатогенезе основную роль сыграло сочетание декомпенсированной кардиомиопатии у плода с повышением давления в верхней полой вене и инфицирования внутрибольничной флорой по центральному венозному катетеру.
Описанные клинические случаи иллюстрируют танатогенетическое значение и полиэтиологичность нетравматических ХП и ХТ.
Конфликт интересов отсутствует.
Врожденный хилоторакс новорожденных с водянкой плода, леченный октреотидом
Судан J Paediatr. 2013; 13 (1): 43–48.
(1) и (2)
Абделакарим Ибрагим
(1)
Отделение неонатологии, Отделение педиатрии, Госпиталь Короля Фахда, Альбаха, Саудовская Аравия
Али Саед Даммас
(2)
Отделение педиатрии, отделение педиатрии, больница короля Фахда, Альбаха, Саудовская Аравия
(1)
Отделение неонатологии, Отделение педиатрии, Госпиталь Короля Фахда, Альбаха, Саудовская Аравия
(2)
Отделение педиатрии, отделение педиатрии, больница короля Фахда, Альбаха, Саудовская Аравия
Автор, ответственный за переписку.
Соответствует: Абделькариму Ибрагиму, Отделение неонатологии, Отделение педиатрии, Госпиталь Короля Фахда, Альбаха, Саудовская Аравия
Copyright © Суданская ассоциация педиатров.
Abstract
Врожденный идиопатический хилоторакс — наиболее частая форма плеврального выпота у новорожденных. Это происходит из-за скопления лимфатической жидкости в плевральной полости вторичного по отношению к утечке из грудного протока или одного из его основных притоков. Хилоторакс, осложненный водянкой плода у недоношенного или доношенного ребенка, представляет собой редкую серьезную клиническую проблему.Мы сообщаем о двух случаях врожденного хилоторакса, которые лечились октреотидом. Один из пациентов хорошо отреагировал на лечение октреотидом, а другой — нет. Мы пришли к выводу, что октреотид следует рассматривать при лечении хилоторакса новорожденных.
Ключевые слова: Хилоторакс, водянка плода, октреотид, недоношенные, торакостомия
Введение
Хилоторакс, осложненный водянкой плода у недоношенных или доношенных детей, является редкой и серьезной клинической проблемой.Это относится к скоплению лимфатической жидкости в плевральной полости, вызванной утечкой из грудного протока или одного из его основных притоков. Распространенность врожденного типа встречается редко, тогда как при посткардиоторакальной хирургии он достигает 1%, при отсутствии расовых различий и соотношении мужчин и женщин 2: 1. Врожденный идиопатический хилоторакс — наиболее частая форма плеврального выпота у новорожденных. Сообщалось о значительной долгосрочной заболеваемости и смертности из-за иммунологических, метаболических и пищевых осложнений у новорожденных.Многие методы консервативной медикаментозной терапии оказались неэффективными при лечении идиопатического врожденного хилоторакса. Хотя первоначальной терапией первой линии при лечении хилоторакса является дренаж из торакостомии, октреотид, аналог соматостатина длительного действия, который действует на рецепторы соматостатина в чревной области, чтобы уменьшить продукцию лимфатической жидкости, был использован при хилотораксе у новорожденных с приемлемыми результатами [ 1,2]. Здесь мы сообщаем о двух случаях врожденного хилоторакса, которые лечились октреотидом.Один из двух случаев хорошо отреагировал на лечение октреотидом, а другой — нет. Мы пришли к выводу, что октреотид следует рассматривать при лечении хилоторакса новорожденных.
Отчеты о случаях
Случай 1
Поздний недоношенный новорожденный мужского пола был доставлен на 34 неделе беременности путем кесарева сечения из-за многоводия и уменьшения шевеления плода с двух дней. Матери была назначена хорошая дородовая помощь. Ей было 29 лет. Группа крови О, резус отрицательный.Раньше она не получала анти-D. Между родителями не было кровного родства. В ее предыдущем акушерском анамнезе был один самопроизвольный аборт и двое здоровых детей. Антенатальное ультразвуковое исследование плода показало отечность ребенка, поэтому была проведена эхокардиография плода, которая показала нормальное сердце плода. Ребенок родился плоским, его оценка по шкале Апгар составила 3 и 5 баллов на 1 и 5 минуте соответственно. Его реанимировали, интубировали и перевели в отделение интенсивной терапии новорожденных (NICU). У него была сильная отечность, тяжелая респираторная недостаточность, требующая высоких настроек вентилятора.Таким образом, торакостомические трубки были установлены с обеих сторон, сразу же было удалено 400 мл серозной жидкости. Затем был проведен парацентез и дренировано еще 300 мл серозной жидкости, после чего гипоксемия была исправлена, настройки вентилятора упали до минимума и состояние ребенка стабилизировалось. Клиническое обследование выявило отечного ребенка без дисморфизма, ограниченного поступления воздуха с обеих сторон с отдаленными сердечными тоном и без неврологических нарушений. При поступлении пациенту назначили сурфактант по поводу респираторного дистресс-синдрома.Был введен катетер в пупочную вену (UVC), и он получил инотропную поддержку (дофамин и добутамин). Был проведен септический скрининг, и ему начали давать ампициллин и гентамицин, которые были прекращены, когда посевы оказались отрицательными. Ребенку экстубировали до постоянного давления в дыхательных путях через нос (NCPAP), и в течение одной недели он был лишен кислорода. Кормление начинали в трехдневном возрасте, а ребенок достигал полноценного кормления в возрасте одной недели. Опять же, у него развился респираторный дистресс, и рентген грудной клетки показал воспоминания о плевральном выпоте с обеих сторон.Дренирование торакостомической трубки выполнено из-за стойкого плеврального выпота после повторных торакоцентеза. Большое количество плевральной жидкости беловатого цвета было дренировано, проанализировано и выявлено: триглицерид 3,1 ммоль / л, холестерин 3,22 ммоль / л, ЛДГ 216 МЕ / л, белок 40 г / л, глюкоза 7,1 ммоль / л, эритроциты 190 × 10 3 / дл, лейкоциты 9,5 × 10 3 / дл: лимфоциты 95% и нейтрофилы 5%. Микроорганизмов в культуре не обнаружено. Компьютерная томография (КТ) грудной клетки в норме. Пероральное кормление было заменено общим родительским питанием (TPN) и интралипидами, поскольку пероральная диета с ограничением жиров, дополненная (моногенная формула) триглицеридами со средней длиной цепи (MCT), недоступна.Ему начали инфузию октреотида 1 мкг / кг / час и титровали до 10 мкг / кг / час с контролем уровня сахара в крови. Сбор хилуса в плевральной полости в течение трех недель не производился, но когда инфузия октреотида была прекращена и пациенту дали нормальное молоко, хилус снова собрался в плевральной полости, поэтому пациент был переведен в больницу вооруженных сил короля Фахда, Джидда для хирургического вмешательства. вмешательство.
Случай 2
Доношенный мальчик родился на 38 неделе беременности.Он был доставлен путем кесарева сечения из-за затрудненных родов. Матери 32 года, беременность 5, аборт пара 3 + 1. У нее был бруцеллез во время беременности, лечили антибиотиками, и у нее не было других хронических заболеваний. Она не была забронирована. При поступлении УЗИ плода показало отечность ребенка. Группа крови была положительной.
Ребенок родился плоским, сильно отечным, с оценкой по шкале Апгар 0 через 1 минуту, поэтому его немедленно интубировали и потребовалась длительная реанимация из-за стойкой брадикардии.Был введен пупочный катетер, ему были введены все реанимационные препараты, затем частота сердечных сокращений увеличилась до 120 ударов в минуту.
Ребенок был доставлен в отделение интенсивной терапии и подключен к ИВЛ. Его вес при рождении составлял 4 кг, рост — 55 см, окружность головы — 35 см. Насыщение кислородом 80%. Клиническое обследование выявило вялого отечного ребенка без признаков дисморфизма, который был гипотоническим и гипорефексическим (). Поступление воздуха было заметно уменьшено с обеих сторон с отдаленными слабыми звуками сердца.Газы артериальной крови в возрасте 30 минут показали PH 6,85, PCO2 58 и HCO3 5. Его группа крови была A + с положительным прямым тестом на гребенку. Был выполнен дренаж через двустороннюю торакостомическую трубку, из нее слили 480 мл серозной жидкости. Также был проведен парацентез и дренировано 350 мл трубки. Вентиляция улучшилась при насыщении кислородом> 95%. Из-за высокого индекса подозрения на хилоторакс был проведен анализ плевральной жидкости, в которой преобладали лимфоциты 96%. Общий анализ крови показал 12 лейкоцитов.7 × 10 3 / дл, Hb 15 г / л, тромбоциты 153 × 10 3 / дл, количество ретикулоцитов 6,5% и никаких индикаторов гемолиза. Электролиты и функциональные тесты печени были нормальными, за исключением высокого креатинина 140 мкмоль / л и низкого альбумина 18 г / л. В первый час у пациента развился генерализованный приступ, который контролировался фенобарбитоном.
Детское изображение пациента, показывающее генерализованный отек, асцит и массивный двусторонний плевральный выпот.
В возрасте 5 дней кормление грудью было начато через орогастральный зонд и постепенно увеличивалось, достигая полного кормления в течение одной недели.В тот момент дренаж торакостомической трубки превратился в жидкость молочного цвета с лимфоцитарным плеоцитозом и повышенным уровнем триглицеридов, содержание в ней триглицеридов составляло 1,51 ммоль / л, содержание холестерина составляло 0,86 ммоль / л, а соотношение холестерина в плевральной жидкости к триглицеридам было, следовательно, менее 1, что указывает на хилоторакс или хилоторакс ().
Дренаж через торакостомическую трубку показывает жидкость молочного цвета (хилус).
Пероральное питание было заменено на парентеральное питание и интралипид. Пациент имел двусторонний пневмоторакс с дренированием грудной клетки ().Затем ему начали инфузию октреотида 1 мкг / кг / час и титровали ежедневно до 10 мкг / кг / час к 10-му дню, затем продолжали в течение трех недель. Дренирование торакостомии прекратилось к третьему дню начала инфузии октреотида, и трубки были удалены. К концу третьей недели повторная рентгенограмма грудной клетки не показала плеврального выпота в двусторонних грудных полостях (). Инфузия октреотида была прекращена, пероральное питание возобновлено до тех пор, пока он не будет полностью энтерально питаться без скопления хилуса в плевральной полости.Его выписали домой после недели полноценного кормления. При наблюдении в неонатальной амбулатории было обнаружено, что он чувствует себя хорошо, без рецидива хилоторакса.
Рентген грудной клетки до лечения: Двусторонний пневмоторакс.
Рентген грудной клетки после лечения: утечки жидкости или воздуха нет.
Обсуждение
Первоначальное лечение хилоторакса — медикаментозное, но в случае продолжения дренирования, несмотря на 2-5 недель полового парентерального питания, рекомендуются альтернативные варианты, такие как хирургическая перевязка грудного протока, плевроперитонеальный шунт, плеврэктомия или химическая хирургия. плевроз [3–5].Хилоторакс в нашем первом случае не ответил на инфузионную терапию октреотидом, и дренирование торакостомии было продолжено через четыре недели.
Хилоторакс новорожденных — это необычная, серьезная клиническая проблема, обычно осложняющаяся внутриутробной водянкой плода, которая вызывает значительную заболеваемость и периодическую смертность. У наших пациентов у обоих была сильная водянка, осложненная асфиксией второго рода. Не было известных предрасполагающих факторов риска, которые могли бы привести к врожденному хилотораксу у наших пациентов.Мы рассматриваем это как идиопатический врожденный хилоторакс, потому что этиология неизвестна. Неонатальный хилоторакс обычно является преходящим заболеванием и разрешается спонтанно с прекращением лимфотока в лимфатический проток на некоторое время. Это достигается за счет начала парентерального питания, отказа от перорального кормления и начала инфузии октреотида. Октреотид представляет собой синтетический аналог соматостатина, который действует на рецепторы соматостатина в внутреннем кровообращении и снижает выработку лимфатической жидкости за счет множества известных ингибирующих эффектов на желудочно-кишечный тракт [6].К ним относятся подавление секреции поджелудочной железы, снижение сократимости желчного пузыря, замедление времени прохождения через кишечник, ингибирование абсорбции глюкозы и аминокислот и ингибирование секреции пептидного гормона GI [7,8]. В свою очередь, торакостомия может привести к потере лимфоцитов, белков, факторов свертывания и антител, а также лимфатической жидкости, что приводит к повышенному риску возникновения таких осложнений, как гипопротеинемия, коагулопатия, лимфопения, гипогаммаглобулинемия, сепсис и повреждение легких, связанное с искусственной вентиляцией легких [ 3–5].Если дренаж торакостомии сохраняется более пяти недель, как в случае 1, следует рассмотреть альтернативные варианты лечения октреотидом и направить пациента на операцию. Во втором случае хилоторакс полностью разрешился инфузионной терапией октреотидом. Быстрое исчезновение плеврального дренажа было достигнуто при введении октреотида в обоих случаях без побочных эффектов, таких как гипотензия или гипергликемия, на протяжении всего периода лечения. Во втором случае, который был выписан домой раньше, чем первый, которому потребовалось хирургическое вмешательство, не было рецидива.
Некоторые дети со стойким хилотораксом (15%) в конечном итоге умирают, обычно из-за осложнений терапии. Стандартное лечение хилоторакса новорожденных обычно влечет за собой длительную госпитализацию и часто требует хирургического вмешательства. Введение октреотида во втором случае привело к более быстрому разрешению плеврального дренажа, отсутствию рецидива и ранней выписке из больницы. Октреотид немедленно уменьшил продукцию хилуса без наблюдаемых побочных эффектов, но его использование в качестве терапии хилоторакса новорожденных заслуживает дальнейшего изучения.
Ссылки
1. Аль-Зубайри С.А., Аль-Джазайри А.С. Октреотид как терапевтический вариант для лечения хилоторакса. Энн Фармакотер
2003; 37: 679–682. [PubMed] [Google Scholar] 2. Гоял А., Смит Н.П., Джесудасон Е.К., Керр С., Лости П.Д.
Октреотид для лечения хилоторакса после пластики врожденной диафрагмальной грыжи. J Pediatr Surg
2003; 38: e19 – e2. [PubMed] [Google Scholar] 3. Ау М., Вебер Т.Р., Флеминг Р.Э.
Успешное применение соматостатина при хилотораксе новорожденных. J Pediatr Surg
2003; 38: 1106–1107.[PubMed] [Google Scholar] 4. Чеунг Й., Люн депутат, Ип М.
Октреотид для лечения послеоперационного хилоторакса. J Педиатр
2001; 139: 157–159. [PubMed] [Google Scholar] 5. Rismensberger PC, Müler-Schenker B, Kalangos A, Beghetti M.
Лечение стойкого послеоперационного хилоторакса соматостатином. Энн Торак Сург
1998; 66: 253–254. [PubMed] [Google Scholar] 6. Рименсбергер П.К., Мюллер-Сценкер Б., Калангос А., Бегетти М.
Лечение стойкого послеоперационного хилоторакса соматостатином. Энн Торак Сург
1998: 253–254.[PubMed] 7. Маркхэм К.М., Гловер Дж.Л., Валлийский Р.Дж., Лукас Р.Дж., Бендик П.Дж.
Октреотид в лечении повреждений грудных протоков. Американский хирург. 2000; 1165–1167. [PubMed] 8. Чунг И-Ф, Люн М.П., Ип М-М.
Октреотид для лечения послеоперационного хилоторакса. J Педиатр
2001; 157–159. [PubMed]
Врожденный хилоторакс новорожденных с водянкой плода, леченный октреотидом
Судан J Paediatr. 2013; 13 (1): 43–48.
(1) и (2)
Абделакарим Ибрагим
(1)
Отделение неонатологии, Отделение педиатрии, Госпиталь Короля Фахда, Альбаха, Саудовская Аравия
Али Саед Даммас
(2)
Отделение педиатрии, отделение педиатрии, больница короля Фахда, Альбаха, Саудовская Аравия
(1)
Отделение неонатологии, Отделение педиатрии, Госпиталь Короля Фахда, Альбаха, Саудовская Аравия
(2)
Отделение педиатрии, отделение педиатрии, больница короля Фахда, Альбаха, Саудовская Аравия
Автор, ответственный за переписку.
Соответствует: Абделькариму Ибрагиму, Отделение неонатологии, Отделение педиатрии, Госпиталь Короля Фахда, Альбаха, Саудовская Аравия
Copyright © Суданская ассоциация педиатров.
Abstract
Врожденный идиопатический хилоторакс — наиболее частая форма плеврального выпота у новорожденных. Это происходит из-за скопления лимфатической жидкости в плевральной полости вторичного по отношению к утечке из грудного протока или одного из его основных притоков. Хилоторакс, осложненный водянкой плода у недоношенного или доношенного ребенка, представляет собой редкую серьезную клиническую проблему.Мы сообщаем о двух случаях врожденного хилоторакса, которые лечились октреотидом. Один из пациентов хорошо отреагировал на лечение октреотидом, а другой — нет. Мы пришли к выводу, что октреотид следует рассматривать при лечении хилоторакса новорожденных.
Ключевые слова: Хилоторакс, водянка плода, октреотид, недоношенные, торакостомия
Введение
Хилоторакс, осложненный водянкой плода у недоношенных или доношенных детей, является редкой и серьезной клинической проблемой.Это относится к скоплению лимфатической жидкости в плевральной полости, вызванной утечкой из грудного протока или одного из его основных притоков. Распространенность врожденного типа встречается редко, тогда как при посткардиоторакальной хирургии он достигает 1%, при отсутствии расовых различий и соотношении мужчин и женщин 2: 1. Врожденный идиопатический хилоторакс — наиболее частая форма плеврального выпота у новорожденных. Сообщалось о значительной долгосрочной заболеваемости и смертности из-за иммунологических, метаболических и пищевых осложнений у новорожденных.Многие методы консервативной медикаментозной терапии оказались неэффективными при лечении идиопатического врожденного хилоторакса. Хотя первоначальной терапией первой линии при лечении хилоторакса является дренаж из торакостомии, октреотид, аналог соматостатина длительного действия, который действует на рецепторы соматостатина в чревной области, чтобы уменьшить продукцию лимфатической жидкости, был использован при хилотораксе у новорожденных с приемлемыми результатами [ 1,2]. Здесь мы сообщаем о двух случаях врожденного хилоторакса, которые лечились октреотидом.Один из двух случаев хорошо отреагировал на лечение октреотидом, а другой — нет. Мы пришли к выводу, что октреотид следует рассматривать при лечении хилоторакса новорожденных.
Отчеты о случаях
Случай 1
Поздний недоношенный новорожденный мужского пола был доставлен на 34 неделе беременности путем кесарева сечения из-за многоводия и уменьшения шевеления плода с двух дней. Матери была назначена хорошая дородовая помощь. Ей было 29 лет. Группа крови О, резус отрицательный.Раньше она не получала анти-D. Между родителями не было кровного родства. В ее предыдущем акушерском анамнезе был один самопроизвольный аборт и двое здоровых детей. Антенатальное ультразвуковое исследование плода показало отечность ребенка, поэтому была проведена эхокардиография плода, которая показала нормальное сердце плода. Ребенок родился плоским, его оценка по шкале Апгар составила 3 и 5 баллов на 1 и 5 минуте соответственно. Его реанимировали, интубировали и перевели в отделение интенсивной терапии новорожденных (NICU). У него была сильная отечность, тяжелая респираторная недостаточность, требующая высоких настроек вентилятора.Таким образом, торакостомические трубки были установлены с обеих сторон, сразу же было удалено 400 мл серозной жидкости. Затем был проведен парацентез и дренировано еще 300 мл серозной жидкости, после чего гипоксемия была исправлена, настройки вентилятора упали до минимума и состояние ребенка стабилизировалось. Клиническое обследование выявило отечного ребенка без дисморфизма, ограниченного поступления воздуха с обеих сторон с отдаленными сердечными тоном и без неврологических нарушений. При поступлении пациенту назначили сурфактант по поводу респираторного дистресс-синдрома.Был введен катетер в пупочную вену (UVC), и он получил инотропную поддержку (дофамин и добутамин). Был проведен септический скрининг, и ему начали давать ампициллин и гентамицин, которые были прекращены, когда посевы оказались отрицательными. Ребенку экстубировали до постоянного давления в дыхательных путях через нос (NCPAP), и в течение одной недели он был лишен кислорода. Кормление начинали в трехдневном возрасте, а ребенок достигал полноценного кормления в возрасте одной недели. Опять же, у него развился респираторный дистресс, и рентген грудной клетки показал воспоминания о плевральном выпоте с обеих сторон.Дренирование торакостомической трубки выполнено из-за стойкого плеврального выпота после повторных торакоцентеза. Большое количество плевральной жидкости беловатого цвета было дренировано, проанализировано и выявлено: триглицерид 3,1 ммоль / л, холестерин 3,22 ммоль / л, ЛДГ 216 МЕ / л, белок 40 г / л, глюкоза 7,1 ммоль / л, эритроциты 190 × 10 3 / дл, лейкоциты 9,5 × 10 3 / дл: лимфоциты 95% и нейтрофилы 5%. Микроорганизмов в культуре не обнаружено. Компьютерная томография (КТ) грудной клетки в норме. Пероральное кормление было заменено общим родительским питанием (TPN) и интралипидами, поскольку пероральная диета с ограничением жиров, дополненная (моногенная формула) триглицеридами со средней длиной цепи (MCT), недоступна.Ему начали инфузию октреотида 1 мкг / кг / час и титровали до 10 мкг / кг / час с контролем уровня сахара в крови. Сбор хилуса в плевральной полости в течение трех недель не производился, но когда инфузия октреотида была прекращена и пациенту дали нормальное молоко, хилус снова собрался в плевральной полости, поэтому пациент был переведен в больницу вооруженных сил короля Фахда, Джидда для хирургического вмешательства. вмешательство.
Случай 2
Доношенный мальчик родился на 38 неделе беременности.Он был доставлен путем кесарева сечения из-за затрудненных родов. Матери 32 года, беременность 5, аборт пара 3 + 1. У нее был бруцеллез во время беременности, лечили антибиотиками, и у нее не было других хронических заболеваний. Она не была забронирована. При поступлении УЗИ плода показало отечность ребенка. Группа крови была положительной.
Ребенок родился плоским, сильно отечным, с оценкой по шкале Апгар 0 через 1 минуту, поэтому его немедленно интубировали и потребовалась длительная реанимация из-за стойкой брадикардии.Был введен пупочный катетер, ему были введены все реанимационные препараты, затем частота сердечных сокращений увеличилась до 120 ударов в минуту.
Ребенок был доставлен в отделение интенсивной терапии и подключен к ИВЛ. Его вес при рождении составлял 4 кг, рост — 55 см, окружность головы — 35 см. Насыщение кислородом 80%. Клиническое обследование выявило вялого отечного ребенка без признаков дисморфизма, который был гипотоническим и гипорефексическим (). Поступление воздуха было заметно уменьшено с обеих сторон с отдаленными слабыми звуками сердца.Газы артериальной крови в возрасте 30 минут показали PH 6,85, PCO2 58 и HCO3 5. Его группа крови была A + с положительным прямым тестом на гребенку. Был выполнен дренаж через двустороннюю торакостомическую трубку, из нее слили 480 мл серозной жидкости. Также был проведен парацентез и дренировано 350 мл трубки. Вентиляция улучшилась при насыщении кислородом> 95%. Из-за высокого индекса подозрения на хилоторакс был проведен анализ плевральной жидкости, в которой преобладали лимфоциты 96%. Общий анализ крови показал 12 лейкоцитов.7 × 10 3 / дл, Hb 15 г / л, тромбоциты 153 × 10 3 / дл, количество ретикулоцитов 6,5% и никаких индикаторов гемолиза. Электролиты и функциональные тесты печени были нормальными, за исключением высокого креатинина 140 мкмоль / л и низкого альбумина 18 г / л. В первый час у пациента развился генерализованный приступ, который контролировался фенобарбитоном.
Детское изображение пациента, показывающее генерализованный отек, асцит и массивный двусторонний плевральный выпот.
В возрасте 5 дней кормление грудью было начато через орогастральный зонд и постепенно увеличивалось, достигая полного кормления в течение одной недели.В тот момент дренаж торакостомической трубки превратился в жидкость молочного цвета с лимфоцитарным плеоцитозом и повышенным уровнем триглицеридов, содержание в ней триглицеридов составляло 1,51 ммоль / л, содержание холестерина составляло 0,86 ммоль / л, а соотношение холестерина в плевральной жидкости к триглицеридам было, следовательно, менее 1, что указывает на хилоторакс или хилоторакс ().
Дренаж через торакостомическую трубку показывает жидкость молочного цвета (хилус).
Пероральное питание было заменено на парентеральное питание и интралипид. Пациент имел двусторонний пневмоторакс с дренированием грудной клетки ().Затем ему начали инфузию октреотида 1 мкг / кг / час и титровали ежедневно до 10 мкг / кг / час к 10-му дню, затем продолжали в течение трех недель. Дренирование торакостомии прекратилось к третьему дню начала инфузии октреотида, и трубки были удалены. К концу третьей недели повторная рентгенограмма грудной клетки не показала плеврального выпота в двусторонних грудных полостях (). Инфузия октреотида была прекращена, пероральное питание возобновлено до тех пор, пока он не будет полностью энтерально питаться без скопления хилуса в плевральной полости.Его выписали домой после недели полноценного кормления. При наблюдении в неонатальной амбулатории было обнаружено, что он чувствует себя хорошо, без рецидива хилоторакса.
Рентген грудной клетки до лечения: Двусторонний пневмоторакс.
Рентген грудной клетки после лечения: утечки жидкости или воздуха нет.
Обсуждение
Первоначальное лечение хилоторакса — медикаментозное, но в случае продолжения дренирования, несмотря на 2-5 недель полового парентерального питания, рекомендуются альтернативные варианты, такие как хирургическая перевязка грудного протока, плевроперитонеальный шунт, плеврэктомия или химическая хирургия. плевроз [3–5].Хилоторакс в нашем первом случае не ответил на инфузионную терапию октреотидом, и дренирование торакостомии было продолжено через четыре недели.
Хилоторакс новорожденных — это необычная, серьезная клиническая проблема, обычно осложняющаяся внутриутробной водянкой плода, которая вызывает значительную заболеваемость и периодическую смертность. У наших пациентов у обоих была сильная водянка, осложненная асфиксией второго рода. Не было известных предрасполагающих факторов риска, которые могли бы привести к врожденному хилотораксу у наших пациентов.Мы рассматриваем это как идиопатический врожденный хилоторакс, потому что этиология неизвестна. Неонатальный хилоторакс обычно является преходящим заболеванием и разрешается спонтанно с прекращением лимфотока в лимфатический проток на некоторое время. Это достигается за счет начала парентерального питания, отказа от перорального кормления и начала инфузии октреотида. Октреотид представляет собой синтетический аналог соматостатина, который действует на рецепторы соматостатина в внутреннем кровообращении и снижает выработку лимфатической жидкости за счет множества известных ингибирующих эффектов на желудочно-кишечный тракт [6].К ним относятся подавление секреции поджелудочной железы, снижение сократимости желчного пузыря, замедление времени прохождения через кишечник, ингибирование абсорбции глюкозы и аминокислот и ингибирование секреции пептидного гормона GI [7,8]. В свою очередь, торакостомия может привести к потере лимфоцитов, белков, факторов свертывания и антител, а также лимфатической жидкости, что приводит к повышенному риску возникновения таких осложнений, как гипопротеинемия, коагулопатия, лимфопения, гипогаммаглобулинемия, сепсис и повреждение легких, связанное с искусственной вентиляцией легких [ 3–5].Если дренаж торакостомии сохраняется более пяти недель, как в случае 1, следует рассмотреть альтернативные варианты лечения октреотидом и направить пациента на операцию. Во втором случае хилоторакс полностью разрешился инфузионной терапией октреотидом. Быстрое исчезновение плеврального дренажа было достигнуто при введении октреотида в обоих случаях без побочных эффектов, таких как гипотензия или гипергликемия, на протяжении всего периода лечения. Во втором случае, который был выписан домой раньше, чем первый, которому потребовалось хирургическое вмешательство, не было рецидива.
Некоторые дети со стойким хилотораксом (15%) в конечном итоге умирают, обычно из-за осложнений терапии. Стандартное лечение хилоторакса новорожденных обычно влечет за собой длительную госпитализацию и часто требует хирургического вмешательства. Введение октреотида во втором случае привело к более быстрому разрешению плеврального дренажа, отсутствию рецидива и ранней выписке из больницы. Октреотид немедленно уменьшил продукцию хилуса без наблюдаемых побочных эффектов, но его использование в качестве терапии хилоторакса новорожденных заслуживает дальнейшего изучения.
Ссылки
1. Аль-Зубайри С.А., Аль-Джазайри А.С. Октреотид как терапевтический вариант для лечения хилоторакса. Энн Фармакотер
2003; 37: 679–682. [PubMed] [Google Scholar] 2. Гоял А., Смит Н.П., Джесудасон Е.К., Керр С., Лости П.Д.
Октреотид для лечения хилоторакса после пластики врожденной диафрагмальной грыжи. J Pediatr Surg
2003; 38: e19 – e2. [PubMed] [Google Scholar] 3. Ау М., Вебер Т.Р., Флеминг Р.Э.
Успешное применение соматостатина при хилотораксе новорожденных. J Pediatr Surg
2003; 38: 1106–1107.[PubMed] [Google Scholar] 4. Чеунг Й., Люн депутат, Ип М.
Октреотид для лечения послеоперационного хилоторакса. J Педиатр
2001; 139: 157–159. [PubMed] [Google Scholar] 5. Rismensberger PC, Müler-Schenker B, Kalangos A, Beghetti M.
Лечение стойкого послеоперационного хилоторакса соматостатином. Энн Торак Сург
1998; 66: 253–254. [PubMed] [Google Scholar] 6. Рименсбергер П.К., Мюллер-Сценкер Б., Калангос А., Бегетти М.
Лечение стойкого послеоперационного хилоторакса соматостатином. Энн Торак Сург
1998: 253–254.[PubMed] 7. Маркхэм К.М., Гловер Дж.Л., Валлийский Р.Дж., Лукас Р.Дж., Бендик П.Дж.
Октреотид в лечении повреждений грудных протоков. Американский хирург. 2000; 1165–1167. [PubMed] 8. Чунг И-Ф, Люн М.П., Ип М-М.
Октреотид для лечения послеоперационного хилоторакса. J Педиатр
2001; 157–159. [PubMed]
Врожденный хилоторакс новорожденных с водянкой плода, леченный октреотидом
Судан J Paediatr. 2013; 13 (1): 43–48.
(1) и (2)
Абделакарим Ибрагим
(1)
Отделение неонатологии, Отделение педиатрии, Госпиталь Короля Фахда, Альбаха, Саудовская Аравия
Али Саед Даммас
(2)
Отделение педиатрии, отделение педиатрии, больница короля Фахда, Альбаха, Саудовская Аравия
(1)
Отделение неонатологии, Отделение педиатрии, Госпиталь Короля Фахда, Альбаха, Саудовская Аравия
(2)
Отделение педиатрии, отделение педиатрии, больница короля Фахда, Альбаха, Саудовская Аравия
Автор, ответственный за переписку.
Соответствует: Абделькариму Ибрагиму, Отделение неонатологии, Отделение педиатрии, Госпиталь Короля Фахда, Альбаха, Саудовская Аравия
Copyright © Суданская ассоциация педиатров.
Abstract
Врожденный идиопатический хилоторакс — наиболее частая форма плеврального выпота у новорожденных. Это происходит из-за скопления лимфатической жидкости в плевральной полости вторичного по отношению к утечке из грудного протока или одного из его основных притоков. Хилоторакс, осложненный водянкой плода у недоношенного или доношенного ребенка, представляет собой редкую серьезную клиническую проблему.Мы сообщаем о двух случаях врожденного хилоторакса, которые лечились октреотидом. Один из пациентов хорошо отреагировал на лечение октреотидом, а другой — нет. Мы пришли к выводу, что октреотид следует рассматривать при лечении хилоторакса новорожденных.
Ключевые слова: Хилоторакс, водянка плода, октреотид, недоношенные, торакостомия
Введение
Хилоторакс, осложненный водянкой плода у недоношенных или доношенных детей, является редкой и серьезной клинической проблемой.Это относится к скоплению лимфатической жидкости в плевральной полости, вызванной утечкой из грудного протока или одного из его основных притоков. Распространенность врожденного типа встречается редко, тогда как при посткардиоторакальной хирургии он достигает 1%, при отсутствии расовых различий и соотношении мужчин и женщин 2: 1. Врожденный идиопатический хилоторакс — наиболее частая форма плеврального выпота у новорожденных. Сообщалось о значительной долгосрочной заболеваемости и смертности из-за иммунологических, метаболических и пищевых осложнений у новорожденных.Многие методы консервативной медикаментозной терапии оказались неэффективными при лечении идиопатического врожденного хилоторакса. Хотя первоначальной терапией первой линии при лечении хилоторакса является дренаж из торакостомии, октреотид, аналог соматостатина длительного действия, который действует на рецепторы соматостатина в чревной области, чтобы уменьшить продукцию лимфатической жидкости, был использован при хилотораксе у новорожденных с приемлемыми результатами [ 1,2]. Здесь мы сообщаем о двух случаях врожденного хилоторакса, которые лечились октреотидом.Один из двух случаев хорошо отреагировал на лечение октреотидом, а другой — нет. Мы пришли к выводу, что октреотид следует рассматривать при лечении хилоторакса новорожденных.
Отчеты о случаях
Случай 1
Поздний недоношенный новорожденный мужского пола был доставлен на 34 неделе беременности путем кесарева сечения из-за многоводия и уменьшения шевеления плода с двух дней. Матери была назначена хорошая дородовая помощь. Ей было 29 лет. Группа крови О, резус отрицательный.Раньше она не получала анти-D. Между родителями не было кровного родства. В ее предыдущем акушерском анамнезе был один самопроизвольный аборт и двое здоровых детей. Антенатальное ультразвуковое исследование плода показало отечность ребенка, поэтому была проведена эхокардиография плода, которая показала нормальное сердце плода. Ребенок родился плоским, его оценка по шкале Апгар составила 3 и 5 баллов на 1 и 5 минуте соответственно. Его реанимировали, интубировали и перевели в отделение интенсивной терапии новорожденных (NICU). У него была сильная отечность, тяжелая респираторная недостаточность, требующая высоких настроек вентилятора.Таким образом, торакостомические трубки были установлены с обеих сторон, сразу же было удалено 400 мл серозной жидкости. Затем был проведен парацентез и дренировано еще 300 мл серозной жидкости, после чего гипоксемия была исправлена, настройки вентилятора упали до минимума и состояние ребенка стабилизировалось. Клиническое обследование выявило отечного ребенка без дисморфизма, ограниченного поступления воздуха с обеих сторон с отдаленными сердечными тоном и без неврологических нарушений. При поступлении пациенту назначили сурфактант по поводу респираторного дистресс-синдрома.Был введен катетер в пупочную вену (UVC), и он получил инотропную поддержку (дофамин и добутамин). Был проведен септический скрининг, и ему начали давать ампициллин и гентамицин, которые были прекращены, когда посевы оказались отрицательными. Ребенку экстубировали до постоянного давления в дыхательных путях через нос (NCPAP), и в течение одной недели он был лишен кислорода. Кормление начинали в трехдневном возрасте, а ребенок достигал полноценного кормления в возрасте одной недели. Опять же, у него развился респираторный дистресс, и рентген грудной клетки показал воспоминания о плевральном выпоте с обеих сторон.Дренирование торакостомической трубки выполнено из-за стойкого плеврального выпота после повторных торакоцентеза. Большое количество плевральной жидкости беловатого цвета было дренировано, проанализировано и выявлено: триглицерид 3,1 ммоль / л, холестерин 3,22 ммоль / л, ЛДГ 216 МЕ / л, белок 40 г / л, глюкоза 7,1 ммоль / л, эритроциты 190 × 10 3 / дл, лейкоциты 9,5 × 10 3 / дл: лимфоциты 95% и нейтрофилы 5%. Микроорганизмов в культуре не обнаружено. Компьютерная томография (КТ) грудной клетки в норме. Пероральное кормление было заменено общим родительским питанием (TPN) и интралипидами, поскольку пероральная диета с ограничением жиров, дополненная (моногенная формула) триглицеридами со средней длиной цепи (MCT), недоступна.Ему начали инфузию октреотида 1 мкг / кг / час и титровали до 10 мкг / кг / час с контролем уровня сахара в крови. Сбор хилуса в плевральной полости в течение трех недель не производился, но когда инфузия октреотида была прекращена и пациенту дали нормальное молоко, хилус снова собрался в плевральной полости, поэтому пациент был переведен в больницу вооруженных сил короля Фахда, Джидда для хирургического вмешательства. вмешательство.
Случай 2
Доношенный мальчик родился на 38 неделе беременности.Он был доставлен путем кесарева сечения из-за затрудненных родов. Матери 32 года, беременность 5, аборт пара 3 + 1. У нее был бруцеллез во время беременности, лечили антибиотиками, и у нее не было других хронических заболеваний. Она не была забронирована. При поступлении УЗИ плода показало отечность ребенка. Группа крови была положительной.
Ребенок родился плоским, сильно отечным, с оценкой по шкале Апгар 0 через 1 минуту, поэтому его немедленно интубировали и потребовалась длительная реанимация из-за стойкой брадикардии.Был введен пупочный катетер, ему были введены все реанимационные препараты, затем частота сердечных сокращений увеличилась до 120 ударов в минуту.
Ребенок был доставлен в отделение интенсивной терапии и подключен к ИВЛ. Его вес при рождении составлял 4 кг, рост — 55 см, окружность головы — 35 см. Насыщение кислородом 80%. Клиническое обследование выявило вялого отечного ребенка без признаков дисморфизма, который был гипотоническим и гипорефексическим (). Поступление воздуха было заметно уменьшено с обеих сторон с отдаленными слабыми звуками сердца.Газы артериальной крови в возрасте 30 минут показали PH 6,85, PCO2 58 и HCO3 5. Его группа крови была A + с положительным прямым тестом на гребенку. Был выполнен дренаж через двустороннюю торакостомическую трубку, из нее слили 480 мл серозной жидкости. Также был проведен парацентез и дренировано 350 мл трубки. Вентиляция улучшилась при насыщении кислородом> 95%. Из-за высокого индекса подозрения на хилоторакс был проведен анализ плевральной жидкости, в которой преобладали лимфоциты 96%. Общий анализ крови показал 12 лейкоцитов.7 × 10 3 / дл, Hb 15 г / л, тромбоциты 153 × 10 3 / дл, количество ретикулоцитов 6,5% и никаких индикаторов гемолиза. Электролиты и функциональные тесты печени были нормальными, за исключением высокого креатинина 140 мкмоль / л и низкого альбумина 18 г / л. В первый час у пациента развился генерализованный приступ, который контролировался фенобарбитоном.
Детское изображение пациента, показывающее генерализованный отек, асцит и массивный двусторонний плевральный выпот.
В возрасте 5 дней кормление грудью было начато через орогастральный зонд и постепенно увеличивалось, достигая полного кормления в течение одной недели.В тот момент дренаж торакостомической трубки превратился в жидкость молочного цвета с лимфоцитарным плеоцитозом и повышенным уровнем триглицеридов, содержание в ней триглицеридов составляло 1,51 ммоль / л, содержание холестерина составляло 0,86 ммоль / л, а соотношение холестерина в плевральной жидкости к триглицеридам было, следовательно, менее 1, что указывает на хилоторакс или хилоторакс ().
Дренаж через торакостомическую трубку показывает жидкость молочного цвета (хилус).
Пероральное питание было заменено на парентеральное питание и интралипид. Пациент имел двусторонний пневмоторакс с дренированием грудной клетки ().Затем ему начали инфузию октреотида 1 мкг / кг / час и титровали ежедневно до 10 мкг / кг / час к 10-му дню, затем продолжали в течение трех недель. Дренирование торакостомии прекратилось к третьему дню начала инфузии октреотида, и трубки были удалены. К концу третьей недели повторная рентгенограмма грудной клетки не показала плеврального выпота в двусторонних грудных полостях (). Инфузия октреотида была прекращена, пероральное питание возобновлено до тех пор, пока он не будет полностью энтерально питаться без скопления хилуса в плевральной полости.Его выписали домой после недели полноценного кормления. При наблюдении в неонатальной амбулатории было обнаружено, что он чувствует себя хорошо, без рецидива хилоторакса.
Рентген грудной клетки до лечения: Двусторонний пневмоторакс.
Рентген грудной клетки после лечения: утечки жидкости или воздуха нет.
Обсуждение
Первоначальное лечение хилоторакса — медикаментозное, но в случае продолжения дренирования, несмотря на 2-5 недель полового парентерального питания, рекомендуются альтернативные варианты, такие как хирургическая перевязка грудного протока, плевроперитонеальный шунт, плеврэктомия или химическая хирургия. плевроз [3–5].Хилоторакс в нашем первом случае не ответил на инфузионную терапию октреотидом, и дренирование торакостомии было продолжено через четыре недели.
Хилоторакс новорожденных — это необычная, серьезная клиническая проблема, обычно осложняющаяся внутриутробной водянкой плода, которая вызывает значительную заболеваемость и периодическую смертность. У наших пациентов у обоих была сильная водянка, осложненная асфиксией второго рода. Не было известных предрасполагающих факторов риска, которые могли бы привести к врожденному хилотораксу у наших пациентов.Мы рассматриваем это как идиопатический врожденный хилоторакс, потому что этиология неизвестна. Неонатальный хилоторакс обычно является преходящим заболеванием и разрешается спонтанно с прекращением лимфотока в лимфатический проток на некоторое время. Это достигается за счет начала парентерального питания, отказа от перорального кормления и начала инфузии октреотида. Октреотид представляет собой синтетический аналог соматостатина, который действует на рецепторы соматостатина в внутреннем кровообращении и снижает выработку лимфатической жидкости за счет множества известных ингибирующих эффектов на желудочно-кишечный тракт [6].К ним относятся подавление секреции поджелудочной железы, снижение сократимости желчного пузыря, замедление времени прохождения через кишечник, ингибирование абсорбции глюкозы и аминокислот и ингибирование секреции пептидного гормона GI [7,8]. В свою очередь, торакостомия может привести к потере лимфоцитов, белков, факторов свертывания и антител, а также лимфатической жидкости, что приводит к повышенному риску возникновения таких осложнений, как гипопротеинемия, коагулопатия, лимфопения, гипогаммаглобулинемия, сепсис и повреждение легких, связанное с искусственной вентиляцией легких [ 3–5].Если дренаж торакостомии сохраняется более пяти недель, как в случае 1, следует рассмотреть альтернативные варианты лечения октреотидом и направить пациента на операцию. Во втором случае хилоторакс полностью разрешился инфузионной терапией октреотидом. Быстрое исчезновение плеврального дренажа было достигнуто при введении октреотида в обоих случаях без побочных эффектов, таких как гипотензия или гипергликемия, на протяжении всего периода лечения. Во втором случае, который был выписан домой раньше, чем первый, которому потребовалось хирургическое вмешательство, не было рецидива.
Некоторые дети со стойким хилотораксом (15%) в конечном итоге умирают, обычно из-за осложнений терапии. Стандартное лечение хилоторакса новорожденных обычно влечет за собой длительную госпитализацию и часто требует хирургического вмешательства. Введение октреотида во втором случае привело к более быстрому разрешению плеврального дренажа, отсутствию рецидива и ранней выписке из больницы. Октреотид немедленно уменьшил продукцию хилуса без наблюдаемых побочных эффектов, но его использование в качестве терапии хилоторакса новорожденных заслуживает дальнейшего изучения.
Ссылки
1. Аль-Зубайри С.А., Аль-Джазайри А.С. Октреотид как терапевтический вариант для лечения хилоторакса. Энн Фармакотер
2003; 37: 679–682. [PubMed] [Google Scholar] 2. Гоял А., Смит Н.П., Джесудасон Е.К., Керр С., Лости П.Д.
Октреотид для лечения хилоторакса после пластики врожденной диафрагмальной грыжи. J Pediatr Surg
2003; 38: e19 – e2. [PubMed] [Google Scholar] 3. Ау М., Вебер Т.Р., Флеминг Р.Э.
Успешное применение соматостатина при хилотораксе новорожденных. J Pediatr Surg
2003; 38: 1106–1107.[PubMed] [Google Scholar] 4. Чеунг Й., Люн депутат, Ип М.
Октреотид для лечения послеоперационного хилоторакса. J Педиатр
2001; 139: 157–159. [PubMed] [Google Scholar] 5. Rismensberger PC, Müler-Schenker B, Kalangos A, Beghetti M.
Лечение стойкого послеоперационного хилоторакса соматостатином. Энн Торак Сург
1998; 66: 253–254. [PubMed] [Google Scholar] 6. Рименсбергер П.К., Мюллер-Сценкер Б., Калангос А., Бегетти М.
Лечение стойкого послеоперационного хилоторакса соматостатином. Энн Торак Сург
1998: 253–254.[PubMed] 7. Маркхэм К.М., Гловер Дж.Л., Валлийский Р.Дж., Лукас Р.Дж., Бендик П.Дж.
Октреотид в лечении повреждений грудных протоков. Американский хирург. 2000; 1165–1167. [PubMed] 8. Чунг И-Ф, Люн М.П., Ип М-М.
Октреотид для лечения послеоперационного хилоторакса. J Педиатр
2001; 157–159. [PubMed]
Врожденный хилоторакс новорожденных с водянкой плода, леченный октреотидом
Судан J Paediatr. 2013; 13 (1): 43–48.
(1) и (2)
Абделакарим Ибрагим
(1)
Отделение неонатологии, Отделение педиатрии, Госпиталь Короля Фахда, Альбаха, Саудовская Аравия
Али Саед Даммас
(2)
Отделение педиатрии, отделение педиатрии, больница короля Фахда, Альбаха, Саудовская Аравия
(1)
Отделение неонатологии, Отделение педиатрии, Госпиталь Короля Фахда, Альбаха, Саудовская Аравия
(2)
Отделение педиатрии, отделение педиатрии, больница короля Фахда, Альбаха, Саудовская Аравия
Автор, ответственный за переписку.
Соответствует: Абделькариму Ибрагиму, Отделение неонатологии, Отделение педиатрии, Госпиталь Короля Фахда, Альбаха, Саудовская Аравия
Copyright © Суданская ассоциация педиатров.
Abstract
Врожденный идиопатический хилоторакс — наиболее частая форма плеврального выпота у новорожденных. Это происходит из-за скопления лимфатической жидкости в плевральной полости вторичного по отношению к утечке из грудного протока или одного из его основных притоков. Хилоторакс, осложненный водянкой плода у недоношенного или доношенного ребенка, представляет собой редкую серьезную клиническую проблему.Мы сообщаем о двух случаях врожденного хилоторакса, которые лечились октреотидом. Один из пациентов хорошо отреагировал на лечение октреотидом, а другой — нет. Мы пришли к выводу, что октреотид следует рассматривать при лечении хилоторакса новорожденных.
Ключевые слова: Хилоторакс, водянка плода, октреотид, недоношенные, торакостомия
Введение
Хилоторакс, осложненный водянкой плода у недоношенных или доношенных детей, является редкой и серьезной клинической проблемой.Это относится к скоплению лимфатической жидкости в плевральной полости, вызванной утечкой из грудного протока или одного из его основных притоков. Распространенность врожденного типа встречается редко, тогда как при посткардиоторакальной хирургии он достигает 1%, при отсутствии расовых различий и соотношении мужчин и женщин 2: 1. Врожденный идиопатический хилоторакс — наиболее частая форма плеврального выпота у новорожденных. Сообщалось о значительной долгосрочной заболеваемости и смертности из-за иммунологических, метаболических и пищевых осложнений у новорожденных.Многие методы консервативной медикаментозной терапии оказались неэффективными при лечении идиопатического врожденного хилоторакса. Хотя первоначальной терапией первой линии при лечении хилоторакса является дренаж из торакостомии, октреотид, аналог соматостатина длительного действия, который действует на рецепторы соматостатина в чревной области, чтобы уменьшить продукцию лимфатической жидкости, был использован при хилотораксе у новорожденных с приемлемыми результатами [ 1,2]. Здесь мы сообщаем о двух случаях врожденного хилоторакса, которые лечились октреотидом.Один из двух случаев хорошо отреагировал на лечение октреотидом, а другой — нет. Мы пришли к выводу, что октреотид следует рассматривать при лечении хилоторакса новорожденных.
Отчеты о случаях
Случай 1
Поздний недоношенный новорожденный мужского пола был доставлен на 34 неделе беременности путем кесарева сечения из-за многоводия и уменьшения шевеления плода с двух дней. Матери была назначена хорошая дородовая помощь. Ей было 29 лет. Группа крови О, резус отрицательный.Раньше она не получала анти-D. Между родителями не было кровного родства. В ее предыдущем акушерском анамнезе был один самопроизвольный аборт и двое здоровых детей. Антенатальное ультразвуковое исследование плода показало отечность ребенка, поэтому была проведена эхокардиография плода, которая показала нормальное сердце плода. Ребенок родился плоским, его оценка по шкале Апгар составила 3 и 5 баллов на 1 и 5 минуте соответственно. Его реанимировали, интубировали и перевели в отделение интенсивной терапии новорожденных (NICU). У него была сильная отечность, тяжелая респираторная недостаточность, требующая высоких настроек вентилятора.Таким образом, торакостомические трубки были установлены с обеих сторон, сразу же было удалено 400 мл серозной жидкости. Затем был проведен парацентез и дренировано еще 300 мл серозной жидкости, после чего гипоксемия была исправлена, настройки вентилятора упали до минимума и состояние ребенка стабилизировалось. Клиническое обследование выявило отечного ребенка без дисморфизма, ограниченного поступления воздуха с обеих сторон с отдаленными сердечными тоном и без неврологических нарушений. При поступлении пациенту назначили сурфактант по поводу респираторного дистресс-синдрома.Был введен катетер в пупочную вену (UVC), и он получил инотропную поддержку (дофамин и добутамин). Был проведен септический скрининг, и ему начали давать ампициллин и гентамицин, которые были прекращены, когда посевы оказались отрицательными. Ребенку экстубировали до постоянного давления в дыхательных путях через нос (NCPAP), и в течение одной недели он был лишен кислорода. Кормление начинали в трехдневном возрасте, а ребенок достигал полноценного кормления в возрасте одной недели. Опять же, у него развился респираторный дистресс, и рентген грудной клетки показал воспоминания о плевральном выпоте с обеих сторон.Дренирование торакостомической трубки выполнено из-за стойкого плеврального выпота после повторных торакоцентеза. Большое количество плевральной жидкости беловатого цвета было дренировано, проанализировано и выявлено: триглицерид 3,1 ммоль / л, холестерин 3,22 ммоль / л, ЛДГ 216 МЕ / л, белок 40 г / л, глюкоза 7,1 ммоль / л, эритроциты 190 × 10 3 / дл, лейкоциты 9,5 × 10 3 / дл: лимфоциты 95% и нейтрофилы 5%. Микроорганизмов в культуре не обнаружено. Компьютерная томография (КТ) грудной клетки в норме. Пероральное кормление было заменено общим родительским питанием (TPN) и интралипидами, поскольку пероральная диета с ограничением жиров, дополненная (моногенная формула) триглицеридами со средней длиной цепи (MCT), недоступна.Ему начали инфузию октреотида 1 мкг / кг / час и титровали до 10 мкг / кг / час с контролем уровня сахара в крови. Сбор хилуса в плевральной полости в течение трех недель не производился, но когда инфузия октреотида была прекращена и пациенту дали нормальное молоко, хилус снова собрался в плевральной полости, поэтому пациент был переведен в больницу вооруженных сил короля Фахда, Джидда для хирургического вмешательства. вмешательство.
Случай 2
Доношенный мальчик родился на 38 неделе беременности.Он был доставлен путем кесарева сечения из-за затрудненных родов. Матери 32 года, беременность 5, аборт пара 3 + 1. У нее был бруцеллез во время беременности, лечили антибиотиками, и у нее не было других хронических заболеваний. Она не была забронирована. При поступлении УЗИ плода показало отечность ребенка. Группа крови была положительной.
Ребенок родился плоским, сильно отечным, с оценкой по шкале Апгар 0 через 1 минуту, поэтому его немедленно интубировали и потребовалась длительная реанимация из-за стойкой брадикардии.Был введен пупочный катетер, ему были введены все реанимационные препараты, затем частота сердечных сокращений увеличилась до 120 ударов в минуту.
Ребенок был доставлен в отделение интенсивной терапии и подключен к ИВЛ. Его вес при рождении составлял 4 кг, рост — 55 см, окружность головы — 35 см. Насыщение кислородом 80%. Клиническое обследование выявило вялого отечного ребенка без признаков дисморфизма, который был гипотоническим и гипорефексическим (). Поступление воздуха было заметно уменьшено с обеих сторон с отдаленными слабыми звуками сердца.Газы артериальной крови в возрасте 30 минут показали PH 6,85, PCO2 58 и HCO3 5. Его группа крови была A + с положительным прямым тестом на гребенку. Был выполнен дренаж через двустороннюю торакостомическую трубку, из нее слили 480 мл серозной жидкости. Также был проведен парацентез и дренировано 350 мл трубки. Вентиляция улучшилась при насыщении кислородом> 95%. Из-за высокого индекса подозрения на хилоторакс был проведен анализ плевральной жидкости, в которой преобладали лимфоциты 96%. Общий анализ крови показал 12 лейкоцитов.7 × 10 3 / дл, Hb 15 г / л, тромбоциты 153 × 10 3 / дл, количество ретикулоцитов 6,5% и никаких индикаторов гемолиза. Электролиты и функциональные тесты печени были нормальными, за исключением высокого креатинина 140 мкмоль / л и низкого альбумина 18 г / л. В первый час у пациента развился генерализованный приступ, который контролировался фенобарбитоном.
Детское изображение пациента, показывающее генерализованный отек, асцит и массивный двусторонний плевральный выпот.
В возрасте 5 дней кормление грудью было начато через орогастральный зонд и постепенно увеличивалось, достигая полного кормления в течение одной недели.В тот момент дренаж торакостомической трубки превратился в жидкость молочного цвета с лимфоцитарным плеоцитозом и повышенным уровнем триглицеридов, содержание в ней триглицеридов составляло 1,51 ммоль / л, содержание холестерина составляло 0,86 ммоль / л, а соотношение холестерина в плевральной жидкости к триглицеридам было, следовательно, менее 1, что указывает на хилоторакс или хилоторакс ().
Дренаж через торакостомическую трубку показывает жидкость молочного цвета (хилус).
Пероральное питание было заменено на парентеральное питание и интралипид. Пациент имел двусторонний пневмоторакс с дренированием грудной клетки ().Затем ему начали инфузию октреотида 1 мкг / кг / час и титровали ежедневно до 10 мкг / кг / час к 10-му дню, затем продолжали в течение трех недель. Дренирование торакостомии прекратилось к третьему дню начала инфузии октреотида, и трубки были удалены. К концу третьей недели повторная рентгенограмма грудной клетки не показала плеврального выпота в двусторонних грудных полостях (). Инфузия октреотида была прекращена, пероральное питание возобновлено до тех пор, пока он не будет полностью энтерально питаться без скопления хилуса в плевральной полости.Его выписали домой после недели полноценного кормления. При наблюдении в неонатальной амбулатории было обнаружено, что он чувствует себя хорошо, без рецидива хилоторакса.
Рентген грудной клетки до лечения: Двусторонний пневмоторакс.
Рентген грудной клетки после лечения: утечки жидкости или воздуха нет.
Обсуждение
Первоначальное лечение хилоторакса — медикаментозное, но в случае продолжения дренирования, несмотря на 2-5 недель полового парентерального питания, рекомендуются альтернативные варианты, такие как хирургическая перевязка грудного протока, плевроперитонеальный шунт, плеврэктомия или химическая хирургия. плевроз [3–5].Хилоторакс в нашем первом случае не ответил на инфузионную терапию октреотидом, и дренирование торакостомии было продолжено через четыре недели.
Хилоторакс новорожденных — это необычная, серьезная клиническая проблема, обычно осложняющаяся внутриутробной водянкой плода, которая вызывает значительную заболеваемость и периодическую смертность. У наших пациентов у обоих была сильная водянка, осложненная асфиксией второго рода. Не было известных предрасполагающих факторов риска, которые могли бы привести к врожденному хилотораксу у наших пациентов.Мы рассматриваем это как идиопатический врожденный хилоторакс, потому что этиология неизвестна. Неонатальный хилоторакс обычно является преходящим заболеванием и разрешается спонтанно с прекращением лимфотока в лимфатический проток на некоторое время. Это достигается за счет начала парентерального питания, отказа от перорального кормления и начала инфузии октреотида. Октреотид представляет собой синтетический аналог соматостатина, который действует на рецепторы соматостатина в внутреннем кровообращении и снижает выработку лимфатической жидкости за счет множества известных ингибирующих эффектов на желудочно-кишечный тракт [6].К ним относятся подавление секреции поджелудочной железы, снижение сократимости желчного пузыря, замедление времени прохождения через кишечник, ингибирование абсорбции глюкозы и аминокислот и ингибирование секреции пептидного гормона GI [7,8]. В свою очередь, торакостомия может привести к потере лимфоцитов, белков, факторов свертывания и антител, а также лимфатической жидкости, что приводит к повышенному риску возникновения таких осложнений, как гипопротеинемия, коагулопатия, лимфопения, гипогаммаглобулинемия, сепсис и повреждение легких, связанное с искусственной вентиляцией легких [ 3–5].Если дренаж торакостомии сохраняется более пяти недель, как в случае 1, следует рассмотреть альтернативные варианты лечения октреотидом и направить пациента на операцию. Во втором случае хилоторакс полностью разрешился инфузионной терапией октреотидом. Быстрое исчезновение плеврального дренажа было достигнуто при введении октреотида в обоих случаях без побочных эффектов, таких как гипотензия или гипергликемия, на протяжении всего периода лечения. Во втором случае, который был выписан домой раньше, чем первый, которому потребовалось хирургическое вмешательство, не было рецидива.
Некоторые дети со стойким хилотораксом (15%) в конечном итоге умирают, обычно из-за осложнений терапии. Стандартное лечение хилоторакса новорожденных обычно влечет за собой длительную госпитализацию и часто требует хирургического вмешательства. Введение октреотида во втором случае привело к более быстрому разрешению плеврального дренажа, отсутствию рецидива и ранней выписке из больницы. Октреотид немедленно уменьшил продукцию хилуса без наблюдаемых побочных эффектов, но его использование в качестве терапии хилоторакса новорожденных заслуживает дальнейшего изучения.
Ссылки
1. Аль-Зубайри С.А., Аль-Джазайри А.С. Октреотид как терапевтический вариант для лечения хилоторакса. Энн Фармакотер
2003; 37: 679–682. [PubMed] [Google Scholar] 2. Гоял А., Смит Н.П., Джесудасон Е.К., Керр С., Лости П.Д.
Октреотид для лечения хилоторакса после пластики врожденной диафрагмальной грыжи. J Pediatr Surg
2003; 38: e19 – e2. [PubMed] [Google Scholar] 3. Ау М., Вебер Т.Р., Флеминг Р.Э.
Успешное применение соматостатина при хилотораксе новорожденных. J Pediatr Surg
2003; 38: 1106–1107.[PubMed] [Google Scholar] 4. Чеунг Й., Люн депутат, Ип М.
Октреотид для лечения послеоперационного хилоторакса. J Педиатр
2001; 139: 157–159. [PubMed] [Google Scholar] 5. Rismensberger PC, Müler-Schenker B, Kalangos A, Beghetti M.
Лечение стойкого послеоперационного хилоторакса соматостатином. Энн Торак Сург
1998; 66: 253–254. [PubMed] [Google Scholar] 6. Рименсбергер П.К., Мюллер-Сценкер Б., Калангос А., Бегетти М.
Лечение стойкого послеоперационного хилоторакса соматостатином. Энн Торак Сург
1998: 253–254.[PubMed] 7. Маркхэм К.М., Гловер Дж.Л., Валлийский Р.Дж., Лукас Р.Дж., Бендик П.Дж.
Октреотид в лечении повреждений грудных протоков. Американский хирург. 2000; 1165–1167. [PubMed] 8. Чунг И-Ф, Люн М.П., Ип М-М.
Октреотид для лечения послеоперационного хилоторакса. J Педиатр
2001; 157–159. [PubMed]
Хилоторакс | Детская больница Филадельфии
Хилоторакс — редкое заболевание, при котором лимфатическая жидкость просачивается в пространство между легким и грудной стенкой. Когда эта жидкость накапливается в легких, это может вызвать сильный кашель, боль в груди и затрудненное дыхание.
Хилоторакс — это нарушение лимфатического кровотока. Для этой группы заболеваний характерно нарушение циркуляции лимфатической жидкости. Лимфатические сосуды переносят лимфатическую жидкость в вены, где она возвращается в кровоток, играя решающую роль в иммунной функции и транспорте жиров и белков.
Травма грудного протока (главного лимфатического сосуда), врожденные аномалии или чрезмерно высокое венозное давление могут привести к проблемам с лимфатическим потоком и утечке лимфатической жидкости в грудную клетку, брюшную полость или другие полости тела.
У хилоторакса много потенциальных причин, в том числе:
- Повреждения центральной лимфатической системы в результате хирургического вмешательства или травмы (это также известно как травматический хилоторакс)
- Врожденные лимфатические аномалии, такие как лимфангиоматоз
- Опухоли
- Системные заболевания или инфекции, такие как туберкулез
- Врожденные синдромы, такие как синдромы Горхэма-Стаута, Нунана и Тернера
- Повышенное венозное давление вследствие сердечной недостаточности, легочной гипертензии или врожденной хирургии сердца
Первоначально хилоторакс вызывает мало симптомов.Когда накапливается достаточное количество жидкости, у пораженных людей будет затрудненное дыхание, кашель и дискомфорт в груди.
Врачи используют комбинацию методов визуализации для диагностики хилоторакса. Обследования могут включать рентген, КТ, УЗИ или МРТ. Диагноз хилоторакса ставится, когда эти тесты демонстрируют наличие жидкости в плевральных полостях.
Врач вашего ребенка также может проверить жидкость, скопившуюся после слива, чтобы определить, не из лимфатической системы.Кроме того, методы лимфатической визуализации, такие как интранодальная лимфангиография и динамическая контрастная магнитно-резонансная лимфангиография, могут использоваться для определения точного источника лимфатической утечки.
Лечение хилоторакса зависит от его причины. В Детской больнице Филадельфии пациентов лечит команда экспертов, которые специализируются на лимфатической визуализации и вмешательствах в рамках программы лимфатической визуализации и вмешательства. Команда определит лучший подход к лечению для каждого состояния пациента.
При обнаружении лимфатических утечек их можно закрыть с помощью двух аналогичных интервенционных лимфатических процедур:
- Эмболизация грудного протока, при которой весь грудной проток эмболизируется или герметизируется
- Избирательная эмболизация лимфатических протоков, более целенаправленная процедура, при которой эмболизируются только определенные протоки, при сохранении грудного протока
Узнайте больше об этих процедурах визуализации и вмешательства.
Долгосрочный прогноз для многих пациентов с хилотораксом очень хороший.Практически все пациенты с травмой грудного протока излечимы. Эксперты CHOP также увидели обнадеживающие результаты при лечении пациентов с другими типами хилоторакса. Лечение часто обеспечивает долгосрочное излечение.
Большая часть последующего лечения будет осуществляться вашим лечащим врачом или лечащим врачом вашего ребенка в координации с нашей командой для особых потребностей, связанных с процедурой или лимфатическим заболеванием. Это может включать рекомендации относительно новых лекарств, отлучения от приема лекарств или рекомендации по диете.
Эксперты сотрудничают в исследованиях, направленных на лучшее понимание лимфатической системы, разработку новых интервенционных лимфатических процедур и улучшение методов визуализации лимфатической системы.
Наша команда имеет самый большой в мире опыт лечения детей и взрослых с хилотораксом. Мы разработали множество инновационных методов визуализации и интервенционных вмешательств, которые улучшили возможности минимально инвазивного лечения, доступные пациентам.
Долгосрочное наблюдение за детьми с врожденным хилотораксом
В редакцию:
Врожденный хилоторакс, определяемый как скопление лимфатической жидкости в плевральной полости, является редким заболеванием новорожденных.Тем не менее врожденный хилоторакс является наиболее частой причиной плеврального выпота у плодов и новорожденных [1]. Из-за редкости этого расстройства в литературе сообщается лишь о нескольких сериях случаев, а текущие рекомендации по лечению основаны только на индивидуальных отчетах или сериях случаев [2–5]. Диагноз хилоторакса считается, если уровень триглицеридов в плевральной жидкости> 1,1 ммоль · л -1 и общее количество клеток> 1000 клеток на мл с> 80% лимфоцитов.Без перорального приема жира хиломикроны, которые часто являются показанием для диагностики хилоторакса, отсутствуют в плевральной жидкости, и различие между хилезным и нехилезным выпотом может быть затруднено [6]. Однако долгосрочное наблюдение за детьми с врожденным хилотораксом было документально подтверждено только в четырех исследованиях [7–10], и ни одно из них не включало исследование функции легких. Мы описываем клиническое течение и отдаленные результаты младенцев с врожденным хилотораксом, включая наблюдение за развитием нервной системы и исследование функции легких.
В этом исследовании представлены данные всех детей, которые были зарегистрированы в местной базе данных Отделения неонатологии (педиатрический факультет, Медицинский университет Граца, Грац, Австрия) с диагнозом врожденный хилоторакс в период с 1 января 1995 г. по 31 декабря. 2009 г. были проанализированы ретроспективно. Врожденный хилоторакс диагностировали с помощью торакоцентеза и биохимического анализа аспирированной жидкости (лимфоциты> 80% от общего числа клеток или наличие хиломикронов у новорожденных с предшествующим энтеральным питанием).Новорожденные, страдавшие послеоперационным или ятрогенным хилотораксом, были исключены из анализа. Были проанализированы клинические, радиологические и лабораторные данные, включая пол, гестационный возраст, оценку по шкале Апгар, локализацию плеврального выпота, сопутствующие пороки развития, хромосомные аномалии, продолжительность выпота, продолжительность искусственной вентиляции легких, возникновение внутрибольничных инфекций, пренатальное и послеродовое лечение и продолжительность госпитализации.
С апреля по август 2010 года было проведено проспективное последующее обследование, включающее опрос по структурированной анкете (развитие ребенка, включая данные из нашей амбулаторной клиники по последующему наблюдению за развитием нервной системы, медицинским проблемам, госпитализациям, лекарствам и проблемам дыхательных путей). последующий медицинский осмотр и исследование функции легких.Исследование функции легких включало спирометрию и бодиплетизмографию (MasterLab, Jaeger, Würzburg, Германия) и проводилось в соответствии со стандартами Европейского респираторного общества (ERS) и Американского торакального общества (ATS) [11]. Исследование было одобрено местным этическим комитетом (№ 21-182 от 09/10).
Восемь детей с диагнозом врожденный хилоторакс были зарегистрированы в базе данных, и двое пришлось исключить (один с ятрогенной причиной хилоторакса, а другой без биохимического анализа плевральной жидкости), таким образом, шесть детей были признаны имеющими врожденный хилоторакс. что привело к возникновению 4.6: 100 000 доставок в нашем регионе. Неонатальные данные обобщены в таблице 1. Три пациента получали лечение октреотидом в течение 27, 29 и 31 дня соответственно, а один требовал хирургического вмешательства на 54 день. Сопутствующие аномалии включали врожденный порок сердца (дефект межпредсердной перегородки, стеноз легочной артерии). в сочетании с синдромом Нунана и интерстициальным заболеванием легких (легочный эозинофильный васкулит). Все младенцы страдали гипоальбуминемией, электролитным дисбалансом, дисфункцией свертывания крови, лимфопенией, анемией и иммунной недостаточностью из-за хронической потери иммуноглобулинов.
Таблица 1–
Перинатальные данные шести случаев с диагнозом врожденный хилоторакс
Долгосрочное наблюдение в среднем возрасте 7 (3,5–12) лет не выявило рецидивов хилоторакса. Все дети, за исключением случая с диагнозом синдрома Нунана, достигли нормального роста и веса в соответствии с их возрастом (таблица 2). Четверо детей были повторно госпитализированы в основном из-за инфекционных заболеваний, а у троих были рецидивирующие инфекции дыхательных путей (таблица 2). Одному ребенку с диагнозом астма требовалось регулярное лечение флутиказона пропионатом.У одного ребенка развился высокофункциональный аутизм с задержкой нервного развития и мышечной гипотонией, у другого ребенка в возрасте 7 лет была задержка речевого развития из-за глухоты обоих родителей, таким образом, пять из шести детей были классифицированы как нормально развивающиеся.
Таблица 2–
Данные последующего наблюдения, включая результаты неврологического развития и исследование функции легких в шести случаях с диагнозом врожденный хилоторакс.
Исследование функции легких у пяти детей показало незначительные отклонения от нормы у трех из них (пограничное рестриктивное заболевание легких и умеренное повышение сопротивления дыхательных путей в первом случае с интерстициальным заболеванием легких; умеренная криволинейность кривой максимального потока-объема в случае, в остальном здоровом, два. и легкая обструкция дыхательных путей со значительной бронхолитической реакцией в случае 5).Спирометрия в случае пяти была нормальной, но в случае шести спирометрия была невозможна. Подробности представлены в таблице 2.
Мы впервые сообщаем о результатах тестирования функции легких, выявляющих лишь незначительные отклонения от нормы, которые могут быть частично объяснены сопутствующими заболеваниями (таблица 2). Из-за сложного неонатального течения болезни, включая длительную потребность в искусственной вентиляции легких и дополнительном кислороде, можно заподозрить легочное повреждение. Но во всех случаях результаты исследования функции легких в целом показывают нормальные результаты.Это важный вопрос для консультирования родителей в неонатальном отделении в течение первых недель жизни, когда врожденный хилоторакс связан со многими осложнениями. Интеркуррентные инфекции верхних и нижних дыхательных путей и два случая пневмонии, по-видимому, не повлияли на результаты исследования функции легких. Наши результаты несколько ограничены небольшим количеством случаев, связанных с редкостью врожденного хилоторакса. Исход нервного развития, по-видимому, в первую очередь зависит от связанных аномалий и / или недоношенности и в пяти из шести случаев был нормальным и соответствовал возрасту.Эргаз и др. . [8], которые наблюдали за семью из 11 случаев в среднем (диапазоне) в возрасте 30 (14–96) месяцев, диагностировали у пяти из них нормальное развитие. Остальные двое детей включали одного ребенка, страдающего врожденным легочным лимфангиэктазом, которому требовалась искусственная вентиляция легких через трахеостомию , и у него были серьезные моторные и когнитивные нарушения, включая глухоту и подозрение на корковую слепоту, а также еще один ребенок с диагнозом синдрома Клайнфельтера, который регулярно посещал небольшой класс специального образования. школа.Таким образом, результаты подтверждают, что исход развития нервной системы в основном зависит от ассоциированных аномалий или крайне недоношенных детей в анамнезе.
Из 32 детей почти у половины из них была диагностирована астма при среднем сроке наблюдения 7 лет, включая четырех недоношенных новорожденных (32–34 недели) с рецидивирующими инфекциями дыхательных путей [7]. В среднесрочном периоде наблюдения авторы не наблюдали рецидивов врожденного хилоторакса. В исследовании Mussat et al .[9] трое из 11 детей имели отклонения на рентгенограмме грудной клетки при длительном наблюдении. Согласно нашим результатам исследования функции легких, патологии на рентгенограммах не позволяют прогнозировать функциональные остатки врожденного хилоторакса. В других исследованиях также сообщалось о полном выздоровлении, за исключением случаев с сопутствующими аномалиями [8, 10].
В заключение, преобладающее осложненное неонатальное течение болезни привело к общему возрастному результату неврологического развития в нашей серии случаев без серьезных легочных нарушений, продемонстрированных тестированием легочной функции.
Сноски
Заявление о заинтересованности
Не заявлено.
Врожденный хилоторакс: современные перспективы и тенденции
1 Новорожденный Монаш, Детская больница Монаш, 2 Отделение педиатрии, Университет Монаша, Мельбурн, Виктория, Австралия
Резюме: Врожденная хилотора самая частая причина плеврального выпота в перинатальном периоде. Этиология в большинстве случаев неизвестна.Однако в некоторых случаях это может быть связано с различными синдромами и генетическими состояниями. CC ассоциируется с высоким уровнем смертности. Большинство клинических проявлений являются вторичными по отношению к эффектам давления (гипоплазия легких) и потере белка и лимфатической жидкости (водянка, недоедание). Консервативное лечение в неонатальном периоде эффективно до 80% случаев и включает плевральный дренаж, парентеральное питание / энтеральное питание на основе среднецепочечных триглицеридов и лекарства, такие как октреотид.В устойчивых случаях может потребоваться хирургическое вмешательство (плевродез, лигирование / эмболизация грудного протока, плевроперитонеальный шунт). Универсального консенсуса по ведению CC не существует, а данные о безопасности использования лекарств для CC у новорожденных немногочисленны.
Введение
Врожденный хилоторакс (ВХ) — редкое, но важное клиническое состояние в перинатальном периоде, лечение которого в тяжелых случаях может быть затруднительным. Не существует общепринятых рекомендаций по ведению CC.За последнее десятилетие был достигнут незначительный прогресс в лечении CC, и основное внимание уделялось лекарствам для лечения CC. Этот обзор призван обобщить текущую литературу, касающуюся патофизиологии, клинических проявлений и вариантов лечения CC.
Определение, распространенность и ассоциации
Хилоторакс, который определяется как накопление лимфы в плевральной полости, является наиболее частой формой плеврального выпота, встречающейся в перинатальном периоде.Это редкое явление, которое, по оценкам, затрагивает 1 из 10 000 рождений, а уровень смертности колеблется от 20% до 60%. 1–4 Если хилоторакс связан с водянкой плода, смертность может достигать 98%. 1 Наиболее серьезными последствиями хилоторакса плода являются гипоплазия легких, застойная сердечная недостаточность и водянка. 1,2,5
CC может быть изолированным проявлением или может быть связано с генетическими состояниями, такими как трисомия 21 (которая связана с 4.9% изолированных плевральных выпотов), моносомия X, 1,2 Тернера, 4,6,7 и синдромы Нунана 4,6,7 (Таблица 1). Врожденная лимфангиэктазия может возникать как часть этих состояний. Сопутствующие аномалии и пороки развития могут присутствовать до 80% случаев, которые часто трудно поддаются лечению или не поддаются лечению. 8 Лимфатические аномалии развития, связанные с хилотораксом, могут ограничиваться легкими или поражать другие системы органов. 9 Другие синдромы, связанные с хилотораксом, включают Х-сцепленную миотубулярную миопатию, 10 миссенс-мутацию интегрина α 9 β 1 , 11,12 и синдром Горхэма – Стаута. 13
Таблица 1 Причины CC Сокращение: CC, врожденный хилоторакс. |
Хилоторакс также может возникать вторично по отношению к разрыву или разрыву грудного протока в результате внезапного чрезмерного растяжения шеи или растяжения грудной стенки во время родов, 14,15 после операций с вовлечением структур шеи и грудная клетка 16–18 , например сосудистые кольца, 19 и диафрагмальная грыжа. 20 У детей частота развития хилоторакса после кардиоторакальной операции составляет от 0,85% до 6,6%. 16,21 Они называются вторичным хилотораксом и не рассматриваются в данном обзоре.
Патофизиология
Лимфатическая система человека выполняет три основные функции: транспортировка липидов и жирорастворимых витаминов в системный кровоток, сбор и возврат избыточной жидкости и экстравазированных белков из межклеточного пространства в кровоток и возврат лимфоцитов в кровообращение. тираж. 14,15
Хил (от греческого слова «сок» 22 ) — это жидкость тела молочного цвета, которая не имеет воспалительного, щелочного и бактериостатического действия, в основном состоит из жира (эмульгированные / свободные жирные кислоты, холестерин) и электролитов. , белки, глюкоза и обильные лимфоциты. Он образуется в тонком кишечнике во время переваривания жирной пищи и поглощается лимфатическими сосудами, известными как млечные сосуды. Содержание белка в хилсе обычно> 3 г / л, а состав электролита аналогичен составу сыворотки. 23 Абсолютное количество клеток> 1000 клеток / л, а количество лимфоцитов колеблется от 400 до 6800 / мм 3 , большинство из которых составляют Т-лимфоциты. 15,24 По грудному протоку ежедневно транспортируется от 1,5 до 2,5 л хилуса (максимум 4 л / день у здорового взрослого человека). Поток через грудной проток может широко варьироваться от 14 мл / час натощак до более 100 мл / час в постпрандиальном состоянии. Отток грудного протока связан с реакцией гладкой мускулатуры стенки протока на внутреннюю стимуляцию и стимуляцию блуждающего нерва.Серотонин, норэпинефрин, гистамин, дофамин и ацетилхолин усиливают сокращение грудных протоков и отток хилуса. 25
Примерно 10% жидкости, экстравазированной из интерстициального пространства, попадает в слепые лимфатические капилляры и становится лимфой. Эти капилляры соединяются с более крупными лимфатическими сосудами, которые разветвляются в грудном протоке. Грудной проток — самый большой лимфатический сосуд в организме, расположенный дорсальнее аорты и вентральнее грудных позвонков. Он возвращает лимфу в сосудистую систему, попадая в венозную систему на стыке левой внутренней яремной и подключичной вен (рис. 1).Это поддерживает баланс жидкости и предотвращает отек тканей, возвращая интерстициальную жидкость в сосудистую систему. 26 Лимфатическая система играет ключевую роль во многих иммунных функциях организма, включая образование иммунных клеток и защиту организма от инфекций. Грудной проток действует как канал, а также точка входа в большой круг кровообращения. 27 Пищевые жиры абсорбируются кишечными энтероцитами в форме хиломикронов, которые преимущественно состоят из триглицеридов, а также содержат фосфолипиды, холестерин и другие белки.После того, как они выходят из энтероцитов, они собираются в ворсинчатых млечных сосудах и в конечном итоге попадают в цистерну хили, которая простирается краниально как грудной проток.
Рисунок 1 Формирование, ход и окончание грудного протока. Перепечатано с разрешения Earth’s Lab., Dr Joseph H Volker. 104 Сокращение: SVC, верхняя венакава. |
Клинические проявления
Хилезный плевральный выпот нарушает нормальное развитие легких плода под действием давления и может привести к гипоплазии легких.Это также может привести к смещению средостения и нарушению кровообращения (рис. 2).
Рисунок 2 Врожденный хилоторакс: клинические эффекты. |
CC является одной из причин неиммунной водянки плода (NIHF). Основным механизмом образования гидропса плода является нарушение баланса выработки интерстициальной жидкости и возврата лимфы. Плод особенно подвержен накоплению интерстициальной жидкости из-за его большей проницаемости капилляров, эластичных интерстициальных отделов и уязвимости к венозному давлению на возврат лимфатических сосудов.Повышенное венозное давление способствует отеку и излиянию за счет увеличения гидростатического давления в капиллярах и уменьшения лимфатического возврата, что приводит к накоплению интерстициальной жидкости. Нарушение функции почек вызывает олигурию или анурию, а затем и водянку. 28 При CC, NIHF может развиваться в результате комбинации повышенной скорости капиллярной фильтрации (вызванной повышенным гидростатическим давлением в капиллярах) и снижением лимфатического клиренса, которое возникает при повышенном центральном венозном давлении, вторичном по отношению к обструкции полой вены или из-за нарушения сердечной функции, вызванного: массовый эффект хилезного выпота. 29,30 Это также может быть результатом снижения осмотического давления капилляров, вызванного потерей альбумина с хилусом в плевральную полость. 29
Лимфангиэктазия и другие врожденные лимфатические аномалии (синдром лимфатической дисплазии, лимфангиомы, шейные или кистозные гигромы) также могут проявляться хилотораксом / двусторонним плевральным выпотом и NIHF в результате обструкции лимфатического потока. 31–33 Кистозные гигромы обычно связаны со сложными аберрациями лимфатических сосудов и вызывают эффекты сжатия массы, которые затрудняют лимфодренаж и венозный возврат к сердцу. 34
В послеродовой период хилезный плевральный выпот может привести к постоянным эффектам давления, препятствующим адекватной вентиляции легких. На легочную оксигенацию также влияет повышение венозного давления и надвигающаяся сердечная недостаточность. Терапевтические меры, такие как торакоцентез и дренаж плевры, могут привести к потере жидкости и электролитов, что приведет к истощению объема и дисбалансу электролитов. Потеря альбумина может привести к обострению отека, а истощение питательных веществ может произойти из-за потери белка и жира.Новорожденный с ХК подвержен риску заражения вторичным иммунодефицитом из-за потери лимфоцитов в хилезной жидкости.
Управление
Целями лечения хилоторакса являются дренирование хилезной плевральной жидкости, сдерживание ее повторного накопления и определение основной причины, чтобы ее можно было лечить, а также поддерживать питание и баланс жидкости.
Пренатальное ведение
Пренатальная диагностика с использованием ультразвука позволяет дифференцировать изолированный гидроторакс и водянку плода.Хилоторакс диагностируется путем анализа плевральной жидкости (абсолютное количество клеток> 1000 / л, количество лимфоцитов более 80%). 1,2,5
Младенцы, у которых хилоторакс диагностирован на сроке <34 недель беременности и которые впоследствии получают пренатальную терапию, имеют лучшее перинатальное состояние и демонстрируют улучшенные постнатальные исходы. 35 Плоды с РС подвержены высокому риску хромосомных аномалий, и быстрая диагностика кариотипа плода 36 и любых других связанных пороков имеет важное значение для дальнейшего лечения и прогноза.Лечебные мероприятия в пренатальном периоде включают изменение диеты матери, 37 повторный торакоцентез, 1,5,38 торакоамниотическое шунтирование, 39 и плевродез с помощью OK-432. 40–44 Диета матери с низким содержанием жиров и высоким содержанием среднецепочечных триглицеридов (МСТ) может помочь отсрочить необходимость торакоцентеза в случаях хилоторакса плода. 37
Успех пренатального вмешательства посредством торакоцентеза и / или дренирования плевроамниотической жидкости зависит от ранней диагностики, объема и повторного появления хилезного выпота, степени компрессии легких и наличия водянки. 45 До 24 недель беременности существует высокий риск развития гипоплазии легких. После этого этапа, если выпот небольшой и нет смещения средостения, достаточно выжидательной тактики с контрольным ультразвуковым исследованием. 3,45,46
Торакоамниотическое шунтирование было впервые описано в исследовании Rodeck et al. 47 как метод декомпрессии гидроторакса плода, позволяющий более нормальное развитие легких плода, тем самым снижая общую неонатальную смертность.Чрескожное внутриматочное плевроамниотическое шунтирование показано при тяжелом или рецидивирующем хилотораксе, нарушающем развитие легких плода и предотвращающем сердечную недостаточность. Выживаемость после неонатального периода (период, не определяемый во всех исследованиях) после введения плевроамниотического шунта для дренирования плеврального выпота, как сообщается, составляет от 47% до 70%, 48-53 , хотя тяжесть выпота и лежащая в основе патология может варьироваться в зависимости от исследования. Немецкая серия случаев 78 плодов с гидротораксом, леченных плевроамниотическим шунтом, показала, что многоводие, водянка плаценты, интервал между шунтирующими родами <4 недель и низкая гестация при рождении были связаны со смертностью.Разрешение водянки после вмешательства было связано с улучшением выживаемости. 53 Смещение шунта в грудную клетку плода может произойти из-за увеличения размера грудной клетки, движений плода или неправильного размещения устройства и может произойти в 23% случаев. 54 Серия случаев показала, что повторное введение шунта потребовалось в 6–8%, 49,50 и потеря плода составила около 10%. 48
ОК-432 (Пицибанил) — лиофилизированный препарат низковирулентного штамма Streptococcus pyogenes человеческого происхождения группы А, который используется в качестве склерозирующего агента.Имеются сообщения об успешном использовании плевродеза ОК-432 в терапии плода при КХ. 40–44 Считается, что механизм действия OK-432 является клеточным и опосредованным цитокинами. Повышенные уровни цитокинов, вероятно, увеличивают проницаемость эндотелия сосудов и ускоряют отток накопленной лимфы. 55 Полная аспирация плевральной жидкости перед инстилляцией OK-432 и последующая ультразвуковая демонстрация спаек — два требования для успешного исхода. 42
Постнатальное ведение
Первоначальное лечение состоит из дренирования плевральной жидкости, адекватной вентиляции, полного парентерального питания, изменения диеты, замены альбумина и приема лекарств. Следует рассмотреть возможность хирургического вмешательства для пациентов, которые не прошли эти начальные шаги или у которых возникают такие осложнения, как дисбаланс электролитов и жидкости, недостаточность питания или иммунодефицит. Правильное планирование родов в медицинском центре очень важно. Новорожденным с хилотораксом часто требуется реанимация и респираторная поддержка при рождении, если хилоторакс тяжелый, плохо контролируется во время беременности или связан с гипоплазией легких.Важно исключить другие специфические причины водянки плода, а также хромосомный или синдромный диагноз. Было описано, что маленькие хилотораксы спонтанно рассасываются. 56 Торакостомическая трубка устанавливается для непрерывного дренирования, если хилус повторно накапливается и / или требует частых периодических аспираций, чтобы плевральная полость оставалась пустой.
Стратегии лечения CC
- Дренирование хилуса из плевральной полости (торакоцентез, непрерывный отсасывающий дренаж)
- Уменьшение объема хилуса с помощью модификаций диеты (низкожировая диета, МСТ) или медикаментов (октреотид)
- Поддержание питание, баланс жидкости и электролитов
- Перенаправление хилуса в другие части тела для облегчения респираторного дистресса (плевроперитонеальный шунт и диафрагмальная фенестрация)
- Препятствие оттоку хилуса в грудную клетку (лигирование грудного протока или эмболизация грудного протока [TDE])
Дренирование хилоторакса
Первоначальный подход к лечению хилоторакса включает дренирование плевральной полости с помощью дренажной трубки плевральной полости (рис. 3).Непрерывный аспирационный дренаж помогает снизить давление хилуса на легкие и повторно расширить частично спавшиеся легкие, а также позволяет точно измерить выработку хилуса. Значительные объемы сливаемой жидкости следует заменять, уделяя внимание жидкостному и электролитному балансу. Реакция на дренирование плевральной полости зависит от тяжести хилоторакса и лежащей в основе его этиологии.
Рисунок 3 Двусторонний CC, до ( A ) и после ( B ) установки межреберного дренажа. Сокращение: CC, врожденный хилоторакс. |
Лекарства от хилоторакса
В последнее десятилетие новые стратегии лечения с помощью лекарств в основном ограничивались октреотидом, чтобы уменьшить объем образования хилуса (таблица 2).
Таблица 2 Лекарства, используемые при лечении CC Сокращения: CC, врожденный хилоторакс; цГМФ, циклический гуанозинмонофосфат; НЭК, некротический энтероколит. |
Октреотид
Об использовании октреотида для лечения СС впервые сообщил Янг и др. 57 из Канады. Октреотид — это аналог соматостатина, который использовался для лечения различных состояний у взрослых и детей старшего возраста, включая акромегалию, карциноидную опухоль, острое кровотечение из варикозно расширенных вен, желудочно-кишечные свищи и трудноизлечимую диарею. 58 У новорожденных октреотид используется для лечения стойких состояний гиперинсулинемии. 59 Механизм действия октреотида при хилотораксе неясен. Предполагается, что октреотид вызывает легкое сужение сосудов внутренних органов, включая венозный кровоток в печени. Это приводит к снижению секреции желудка, поджелудочной железы и кишечника, а также к кишечной абсорбции. Эти механизмы в совокупности уменьшают отток хилуса. 60
В Кокрановском обзоре Даса и Шаха 61 были рассмотрены опубликованные на сегодняшний день данные об использовании октреотида.Несмотря на то, что имеется несколько отчетов о случаях, которые обычно демонстрируют разрешение хилоторакса с октреотидом, время начала, доза, продолжительность и частота доз значительно различаются у разных авторов, и рандомизированных контролируемых испытаний не выявлено. Они пришли к выводу, что «практические рекомендации не могут быть сделаны на основе доказательств, выявленных и предложенных для многоцентрового рандомизированного контролируемого исследования для оценки безопасности и эффективности октреотида в лечении хилоторакса у новорожденных.”
Октреотид используется либо подкожно в дозе 10–70 мкг / кг / день с введением 6–24-часовых доз, либо в виде непрерывной внутривенной инфузии от 0,3 до 10 мкг / кг / час. Продолжительность приема в случаях успешного разрешения колеблется от 4 до 21 дня и в основном определяется ответом на терапию. 61 Безопасность и эффективность октреотида при лечении хилоторакса у новорожденных не были оценены должным образом. Редкость состояния — главный ограничивающий шаг шаг. Октреотид связан с такими побочными эффектами, как аритмия, гипергликемия, 62 преходящее нарушение функции печени, преходящий гипотиреоз и некротический энтероколит, 63 гипоксемия и легочная гипертензия у недоношенных новорожденных. 64 Тем не менее, в отсутствие серьезных / долгосрочных побочных эффектов октреотид по-прежнему используется в качестве лекарственного средства не по назначению при лечении СС.
Силденафил
Маллеске и Йодер 65 сообщили об успешном применении силденафила при РХ у позднего недоношенного ребенка, связанного с легочными лимфангиэктазами, когда применение октреотида было неэффективным. 65 В этом случае силденафил использовался для лечения легочной гипертензии, связанной с лимфангиэктазией, и было обнаружено, что при неэффективности октреотида он благоприятствовал КК.Механизм, с помощью которого силденафил может способствовать разрешению СС и лимфатических мальформаций, включает образование новых лимфатических сосудов. Рост и функция лимфатических сосудов регулируются циклическим гуанозинмонофосфатом (цГМФ), который опосредует пролиферацию лимфатических эндотелиальных клеток, миграцию и образование трубок. Силденафил предотвращает деградацию цГМФ путем селективного ингибирования фосфодиэстеразы-5 67 и, таким образом, может способствовать росту и / или ремоделированию лимфатических сосудов, позволяя разрешить лимфатическую обструкцию и хилоторакс.
Сиролимус
Сиролимус, также известный как рапамицин, является ингибитором мишени рапамицина у млекопитающих (mTOR), экспрессия которого повышается при ряде сосудистых аномалий, особенно при атипичной лимфатической патологии. В отчетах о случаях заболевания документально подтверждено эффективное лечение хилоторакса, связанного с лимфатической мальформацией, с помощью сиролимуса у взрослых и детей старшего возраста. 68,69 Однако информация о дозировке остается очень ограниченной, особенно для новорожденных и младенцев.Недавнее исследование Mizuno et al. 70 выявило соответствующие возрасту режимы дозирования для новорожденных и младенцев. Прежде чем рассматривать его в популяции новорожденных, необходима дальнейшая оценка.
Поддерживающая терапия
Вентиляция
Большинству новорожденных со значительным хилотораксом и водянкой плода требуется постоянная искусственная вентиляция легких до тех пор, пока хилоторакс не исчезнет. Адекватное расширение легких необходимо для поддержания эффекта тампонады и предотвращения повторного накопления хилоторакса.Вентиляция должна включать стратегии защиты легких, и использование высокочастотной вентиляции является полезным.
Nutrition
Использование полного парентерального питания с последующим восстановлением кормов с использованием молочных смесей на основе МСТ помогает устранить необходимость в энтеральном переваривании жиров и поддержании питания. MCT из 8–12 углеродных цепей непосредственно всасываются в систему воротной вены, минуя лимфатический дренаж. Существует несколько формул для энтерального введения с высоким содержанием МСТ, таких как моноген, пептамен и портаген.Смесь, приготовленная из сухого обезжиренного молока с добавлением кокосового масла (богатого MCT), может быть дешевой и эффективной альтернативой для обеспечения низкожирных и высокопротеиновых калорий у пациентов с CC в условиях ограниченных ресурсов, где коммерческие формулы, такие как Monogen, недоступны. . 71 Было обнаружено, что использование обогащенного обезжиренного грудного молока терапевтически эквивалентно специальным смесям для младенцев и может быть дополнительным терапевтическим вариантом для успешного лечения младенцев с хилотораксом. 72
Результат
Обычно состояние разрешается в первые несколько недель (2–6 недель) при консервативном лечении. 21,73 Консервативный менеджмент имеет процент успеха 75–80%. 1,21 В обзоре 204 случаев хилоторакса водянка была единственным наиболее важным прогностическим фактором неблагоприятного исхода при РС. 74 Период времени, в течение которого консервативное управление следует рассматривать как неудачное, точно не определен. Некоторые центры используют ежедневный дренаж в качестве ориентира для клинического улучшения или неудачи у педиатрических пациентов (<10 мл / кг / день плеврального дренажа считается улучшением;> 10 мл / кг / день плеврального дренажа считается неудачным после 4 недели консервативного лечения). 21 Мнения относительно продолжительности периода консервативного управления расходятся. Продолжительный период консервативного лечения может привести к серьезным иммунологическим нарушениям и нарушениям питания. 75
Хирургическое лечение
Хирургические варианты следует рассматривать, когда медицинское лечение CC не привело к снижению хилотока. Нет единого мнения о сроках операции. 15 Большинство из них рекомендуют длительный период (3-4 недели) консервативного лечения в педиатрической популяции, прежде чем переходить к хирургическому лечению. 21,76 Другие считают определенный объем, например> 100 мл в год у детей, показанием к операции. 77–79 Нет единого мнения о продолжительности консервативного лечения в популяции новорожденных до рассмотрения хирургических вариантов. Если есть хорошо идентифицированное место утечки хилуса и высокий поток, который препятствует самопроизвольному заживлению, можно сделать более раннюю операцию. 80 Успешное хирургическое вмешательство может сократить время госпитализации и снизить риск недоедания и иммуносупрессии. 15
Хирургические варианты включают торакоскопический плевродез, плевроперитонеальный шунт, лигирование грудного протока (торакоскопией или торакотомией), TDE, анастомоз грудного протока и азиготной вены и трансплантацию легкого (лимфангио-лейомиоз). Облитерация плевральной полости (плевродез) может производиться химическим или хирургическим путем. Химический плевродез может быть предпочтительнее хирургического вмешательства, учитывая риск потери крови, связанной с плеврэктомией у новорожденных.Различные агенты, такие как повидон-йод (бетадин), тетрациклин, тальк, блеомицин и фибриновый клей, использовались в педиатрических и взрослых пациентах. 81–83 У новорожденных есть сообщения об успешном использовании повидон-йода 82,84 и ОК-432 для плевродеза.
Химический плевродез
Повидон-йод (Бетадин)
Brissaud et al. 82 лечили четырех новорожденных с CC путем внутриплевральной инстилляции повидон-йода через дренажную трубку.Эта процедура была успешной в трех из четырех случаев и, по-видимому, хорошо переносилась. Использовались скраб 4% бетадин (три случая) и 10% дерма бетадин. Бетадин 10% дермы был разбавлен физиологическим раствором (3 мл бетадина 10% дермы +7 мл физиологического раствора), а скраб Бетадин 4% использовался без разбавления. При использовании обоих продуктов плевральная дренажная трубка очищалась после инъекции 10-15 мл физиологического раствора непосредственно перед окклюзией плевральной дренажной трубки. Продолжительность окклюзии дренажной трубки была эмпирической и варьировалась от 3 до 5 часов.Улучшение происходило постепенно, трубка была удалена через 6–16 дней после процедуры. Скоттони и др. 84 также сообщили об успешном излечении стойкого хилоторакса у четырех из пяти новорожденных при однократном введении 2 мл / кг 4% раствора повидон-йода в плевральную полость. Среднее время разрешения составляло 4 дня. Ни у одного из пациентов не было длительных побочных эффектов лечения. Эти результаты являются многообещающими, и повидон-йодный плевродез можно рассматривать как вариант лечения рефрактерного хилоторакса у новорожденных.
Механизм действия повидон-йода, по-видимому, связан с усилением склероза, 73 , хотя точный механизм действия остается неясным. Йод обладает сильными окислительными и цитотоксическими свойствами, что вызывает сильную воспалительную реакцию в стенке любой содержащей жидкость структуры. Более того, повидон-йод может обладать антиэкссудативными свойствами, связанными с хелатированием белков. 73 Однако частое применение местного кожного повидон-йода у новорожденных может вызвать аллергическую сенсибилизацию и нарушение функции щитовидной железы. 85 Боль в груди, метаболический ацидоз, гипотензия, дыхательная и почечная недостаточность наблюдались ранее у взрослых и детей, которые получали высокие дозы повидон-йода, применяемые местно при лечении ожогов или после непрерывной ирригации средостения. Сообщалось о почечной недостаточности после применения повидон-йода у новорожденных. 82,86 Предполагается, что определенные состояния, такие как диффузный врожденный лимфангиэктаз, могут вызывать массивное всасывание йода и интоксикацию. 86
ОК-432 (Пицибанил)
ОК-432 широко используется для лечения послеоперационного хилоторакса и кистозной лимфангиомы у детей. 87,88 Сообщалось, что интраплевральное введение OK-432 имело благоприятные результаты в лечении хилоторакса плода. 40–43 Kim et al. 89 и Matsukuma et al 90 сообщили об эффективном использовании OK-432 в неонатальных случаях (по два случая в каждом), резистентных к консервативному лечению. Сообщенные побочные эффекты — лихорадка, продолжающаяся 2–4 дня, и местная воспалительная реакция, продолжающаяся 3–7 дней. 91 Однако, поскольку количество сообщений о случаях ограничено, потребуется проспективное рандомизированное исследование в популяции новорожденных, чтобы доказать его эффективность, а также установить побочные эффекты и безопасность использования.
Окситетрациклин
В недавнем отчете Utture et al. 92 показано, что окситетрациклин эффективен после того, как двусторонний КК не реагирует на октреотид. Окситетрациклин с 2% лигнокаином вводили в плевральную полость (на 20 день) в дозе 20 мг / кг через межреберный дренаж (ICD), и ICD зажимали на 2 часа.Из-за отсутствия адекватного ответа через 48 часов была введена вторая доза. Через 2 дня выход ICD стал нулевым. Побочных эффектов отмечено не было. Окситетрациклин применялся у взрослых со злокачественным хилотораксом в дозе 20 мг / кг. 93 Механизм действия окситетрациклина заключается в инициировании воспалительного каскада мезотелиальными клетками после контакта с химическим агентом, что приводит к активации каскада коагуляции плевры, привлечению, активации и пролиферации фибробластов и отложению коллагена. 94
Тальк
Hodges et al. 95 сообщили о случае стойкого КК, связанного с шейной лимфатической мальформацией, успешно вылеченного торакоскопическим плевродезом с использованием аэрозольного талька. В этом случае адъювантная терапия (сиролимус и склеротерапия) была направлена на лечение макрокистозной лимфатической мальформации.
Эмболизация грудного протока
Ретроспективный обзор 34 пациентов для оценки технического и клинического успеха TDE при нетравматических хилезных выпотах показал, что TDE был наиболее успешным в случаях окклюзии грудного протока и экстравазации.Частота клинического успеха составила 16% (один из шести) при нормальном грудном протоке, 75% (15 из 20 пациентов) при окклюзии грудного протока. 96 Лимфангиография важна для определения причины хилезного выпота и выбора пациентов, которым TDE может принести наибольшую пользу. Однако эмболизация лимфатических каналов может быть технически сложной задачей в популяции новорожденных. 96 Itkin et al. 97 сообщили о двух случаях (6-месячный и 1-месячный) с послеоперационными хилезными утечками, которые были успешно вылечены чрескожным TDE с использованием n -бутилцианоакрилата в разведении 1: 2 в этиодированное масло мака.
Ведение трудноизлечимых или устойчивых случаев
Случаи, устойчивые к консервативному лечению и плевродезу, включают в себя врожденные аномалии лимфатических сосудов, хромосомные аномалии и структурные аномалии. Магнитно-резонансная (МРТ) визуализация, включая неконтрастную МР-лимфангиографию и МР-лимфангиографию с динамическим контрастом, поможет визуализировать анатомию лимфатической системы и динамику потока. 98 Лимфосцинтиграфия позволяет выявить повреждение грудного протока, аплазию / гипоплазию лимфатических сосудов. 99 Для диагностики врожденного лимфангиэктаза может потребоваться биопсия легкого. Длительное парентеральное питание может быть необходимо в дополнение к хирургическим вмешательствам, таким как плевроперитонеальное шунтирование и перевязка грудного протока.
Осложнения
Несколько осложнений могут возникнуть в связи с развитием СС. К ним относятся гипоплазия легких из-за длительного хилоторакса в утробе матери, недоедание, гипонатриемия, дисбаланс жидкости, повышенный риск тромбоза, 100 и вторичный иммунодефицит.
Заболеваемость внутрибольничными инфекциями у пациентов с ХК примерно в три раза выше, чем у других новорожденных. 101 Продолжительный дренаж больших объемов хилезной жидкости приводит к истощению лимфоцитов, что подвергает новорожденных риску инфицирования. Хилоторакс может привести к гипогаммаглобулинемии и лимфопении. 101–103 Лимфопения достоверно коррелировала с продолжительностью лимфодренажа. 101 Внутривенный иммуноглобулин применялся у новорожденных в послеоперационном периоде либо с профилактической целью после развития хилоторакса, либо на ранних стадиях сепсиса. 101 В более позднем исследовании восьми детей с гипогаммаглобулинемией и лимфопенией, обусловленной хилотораксом, внутривенное введение иммуноглобулина G не привело к заметной защите от инфекционных осложнений. 103
Заключение
CC — редкое, но серьезное заболевание у новорожденных. Ранняя диагностика и вмешательство в дородовой период способствуют улучшению постнатального исхода. Послеродовое ведение включает дренирование плевральной жидкости, изменение диеты, медикаментозную терапию и, в редких случаях, хирургическое вмешательство.Не существует общепринятых рекомендаций по применению лекарств при этом состоянии и продолжительности консервативного лечения. В целом, исход заболевания зависит от основного генетического состояния и связанных с ним пороков развития.
Раскрытие информации
Авторы сообщают об отсутствии конфликта интересов в этой работе.
Ссылки
1. | Аль-Тавил К., Ахмед Г., Аль-Хатал М., Аль-Джараллах И., Кэмпбелл Н.Врожденный хилоторакс. Ам Дж. Перинатол . 2000. 17 (3): 121–126. | |
2. | De Beer HG, Mol MJ, Janssen JP. Хилоторакс. Нет Дж. Мед. . 2000. 56 (1): 25–31. | |
3. | Дендейл Дж., Комета П, Амрам Д. и др. Le chylothorax de découverte anténatale. [Пренатальная диагностика хилоторакса]. Арк Педиатр . 1999. 6 (8): 867–871. Французский. | |
4. | Дубин П.Дж., Кинг И.Н., Галлахер П.Г. Врожденный хилоторакс. Curr Opin Pediatr . 2000. 12 (5): 505–509. | |
5. | Ван Страатен Х.Л., Герардс Л.Дж., Кредит ТГ. Хилоторакс в неонатальном периоде. Eur J Pediatr . 1993. 152 (1): 2–5. | |
6. | Роча Г. Плевральные выпоты у новорожденных. Curr Opin Pulm Med . 2007. 13 (4): 305–311. | |
7. | Ван Аэрде Дж., Кэмпбелл А.Н., Смит Дж. А., Ллойд Д., Брайан М. Х. Спонтанный хилоторакс у новорожденных. Ам Дж. Дис Детский . 1984. 138 (10): 961–964. | |
8. | Дауни Л., Саси А., Малхотра А. Врожденный хилоторакс: ассоциации и исходы новорожденных. J Детский педиатр . 2014. 50 (3): 234–238. | |
9. | Attar M, Donn S.Врожденный хилоторакс. Semin Fetal Neonatal Med . 2017; 22 (4): 234–239. | |
10. | Смец К. Х-сцепленная миотубулярная миопатия и хилоторакс. Нервно-мышечное расстройство . 2008. 18 (2): 183–184. | |
11. | Хуанг XZ, Ву Дж. Ф., Феррандо Р. и др. Смертельный двусторонний хилоторакс у мышей, лишенных интегрина alpha9beta1. Молекулярная биология . 2000. 20 (14): 5208–5215. | |
12. | Ма GC, Liu CS, Chang SP и др. Повторяющаяся миссенс-мутация ITGA9 у плодов человека с тяжелым хилотораксом: возможная корреляция с плохим ответом на терапию плода. Пренат Диагностика . 2008. 28 (11): 1057–1063. | |
13. | Brodszki N, Lansberg JK, Dictor M, et al. Новый подход к лечению педиатрического синдрома Горхэма-Стаута с хилотораксом. Акта Педиатр . 2011. 100 (11): 1448–1453. | |
14. | Репетитор JD. Хилоторакс у младенцев и детей. Педиатрия . 2014; 133 (4): 722–733. | |
15. | Сото-Мартинес М., Масси Дж. Хилоторакс: диагностика и лечение у детей. Педиатр Респир Ред. . 2009. 10 (4): 199–207. | |
16. | Чан С.И., Лау В., Вонг ВГ, Ченг ЛК, Чау АК, Чунг Ю.Ф.Хилоторакс у детей после операций на сердце. Энн Торак Хирург . 2006. 82 (5): 1650–1656. | |
17. | Хили Ф., Ханна Б.Д., Зинман Р. Легочные осложнения врожденного порока сердца. Педиатр Респир Ред. . 2012; 13 (1): 10–15. | |
18. | Милонакис М., Чатзис А.С., Джаннопулос Н.М. и др. Этиология и лечение хилоторакса после операций на сердце у детей. J Card Surg . 2009. 24 (4): 369–373. | |
19. | Chun K, Colombani PM, Dudgeon DL, Haller JA Jr. Диагностика и лечение врожденных сосудистых колец: 22-летний опыт. Энн Торак Хирург . 1992. 53 (4): 597–602. обсуждение 602–603. | |
20. | Naik S, Greenough A, Zhang YX, Davenport M. Прогнозирование заболеваемости в младенчестве после пластики врожденной диафрагмальной грыжи. Дж. Педиатр Хирургия . 1996. 31 (12): 1651–1654. | |
21. | Beghetti M, La Scala G, Belli D, Bugmann P, Kalangos A, Le Coultre C. Этиология и лечение детского хилоторакса. Дж. Педиатр . 2000. 136 (5): 653–658. | |
22. | Mosby-Year Book Inc. Словарь Мосби по медицине, сестринскому делу и смежным вопросам здравоохранения . Четвертое изд. Мэриленд-Хайтс, Миссури: Мосби-Год Бук Инк; 1994: 335. | |
23. | Williams KR, Burford TH. Лечение хилоторакса. Энн Сург . 1964; 160: 131–140. | |
24. | Teba L, Dedhia HV, Bowen R, Alexander JC. Обзор хилоторакса. Crit Care Med . 1985. 13 (1): 49–52. | |
25. | Фергюсон М., Шагинян Х., Мичеласси Ф. Лимфатические реакции гладких мышц на лейкотриены, гистамин и фактор активации тромбоцитов. J Surg Res . 1988. 44 (2): 172–177. | |
26. | Мариеб Э., Хоэн К. Анатомия и физиология человека . 8 изд. Сан-Франциско, Калифорния: Бенджамин и Каммингс; 2010. | |
27. | Киндт Т., Голдсби Р., Осборн Б. и др. Куби Иммунология . Нью-Йорк: W.H. Фримен; 2007. | |
28. | Bellini C, Hennekam R.Неиммунный водянка плода: краткий обзор этиологии и патофизиологии. Ам Дж. Мед Генет А . 2012. 158А (3): 597–605. | |
29. | De Hann TR, Oepkes D, Beersma MF и др. Этиология, диагностика и лечение водянки плода. Curr Pediatr Ред. . 2005; 1: 63–72. | |
30. | Ayida GA, Soothil PW, Rodeck CH. Выживание при неиммунной водянке плода без хромосомных аномалий после инвазивного лечения. Диагностика плода . 1995; 10: 101–105. | |
31. | Хуанг Х.Р., Цай П.К., Чианг М.С., Лиен Р., Чжоу Й. Факторы прогноза и клинические особенности у живорожденных новорожденных с водянкой плода. Ам Дж. Перинатол . 2007; 24: 33–38. | |
32. | Prasad C, Rupar CA. Неиммунная водянка: генетические и метаболические причины. Перинатология . 2006. 8: 164–174. | |
33. | Джонс, округ Колумбия. Неиммунная водянка плода: диагностика и акушерство. Семин Перинатол . 1995; 19: 447–461. | |
34. | Fahnenstich H, Schmid G, Haverkamp F и др. Неиммунный водянка плода — анализ случаев живорожденных. Педиатр Рев Коммуна . 1992; 6: 231–241. | |
35. | Ли CJ, Tsao PN, Chen CY, Hsieh WS, Liou JY, Chou HC.Пренатальная терапия улучшает выживаемость недоношенных детей с врожденным хилотораксом. Педиатр Неонатол . 2016; 57 (2): 127–132. | |
36. | Chen CP. Терапия плода и цитогенетическое тестирование: пренатальное обнаружение хромосомных аберраций во время торакоцентеза по поводу врожденного хилоторакса путем кариотипирования из плевральной жидкости и обзор литературы. Генет Коунс . 2005. 16 (3): 301–305. | |
37. | Барта Дж. Л., Комино-Дельгадо Р. Реакция хилоторакса плода на диетическое лечение матери. Акушерский гинекол . 2001. 97 (5, п. 2): 820–823. | |
38. | Chen C, Chang T, Wang W. Разрешение двустороннего хилоторакса и асцита плода после двух односторонних торакоцентеза. Ультразвуковой акушерский гинеколь . 2001; 18: 401–406. | |
39. | Пиконе О, Беначи А, Мандельброт Л., Руано Р., Думес Й, Доммергес М.Торакоамниотическое шунтирование плевральных выпотов с водянкой. Ам Дж. Обстет Гинеколь . 2004. 191 (6): 2047–2050. | |
40. | Okawa T, Takano Y, Fujimori K, Yanagida K, Sato A. Новая терапия плода при хилотораксе: плевродез с помощью OK-432. Ультразвуковой акушерский гинеколь . 2001. 18 (4): 376–377. | |
41. | Танемура М., Нисикава Н., Кодзима К., Сузуки Ю., Сузумори К.Случай успешного лечения плода по поводу врожденного хилоторакса внутриплевральным введением ОК-432. Ультразвуковой акушерский гинеколь . 2001. 18 (4): 371–375. | |
42. | Jorgensen C, Brocks V, Bang J, Jorgensen FS, Rønsbro L. Лечение тяжелого хилоторакса плода, связанного с выраженной водянкой, с помощью внутриплевральной инъекции OK-432. Ультразвуковой акушерский гинеколь . 2003. 21 (1): 66–69. | |
43. | Цукихара А., Танемура М., Сузуки Ю., Сато Т., Танака Т., Сузумори К. Уменьшение плеврального выпота с помощью ОК-432 у плода, осложненного врожденным гидротораксом. Диагностика плода . 2004. 19 (4): 327–331. | |
44. | Chen M, Chen CP, Shih JC, et al. Антенатальное лечение хилоторакса и кистозной гигромы с помощью OK-432 при неиммунной водянке плода. Диагностика плода . 2005. 20 (4): 309–315. | |
45. | Рис Э., Гольдштейн И., Хоббинс Дж. Основы акушерского и гинекологического УЗИ . Стэмфорд, штат Коннектикут. Эпплтон и Ланге; 1994. | |
46. | Watson WJ, Munson DP, Christensen MW. Двусторонний хилоторакс плода: результаты односторонней внутриутробной терапии. Ам Дж. Перинатол . 1996. 13 (2): 115–117. | |
47. | Rodeck CH, Fisk NM, Fraser DI, et al.Длительное внутриутробное дренирование гидроторакса плода. N Engl J Med . 1988. 319 (17): 1135–1138. | |
48. | Smith RP, Illanes S, Denbow ML, et al. Исход плеврального выпота после лечения торакоамниотическим шунтированием. Ультразвуковой акушерский гинеколь . 2005. 26 (1): 63–66. | |
49. | Nicolaides KH, Azar GB. Торако-амниотическое шунтирование. Диагностика плода .1990. 5 (3–4): 153–164. | |
50. | Thompson PJ, Greenough A, Nicolaides KH. Дыхательная функция в младенчестве после плевроамниотического шунтирования. Диагностика плода . 1993. 8 (2): 79–83. | |
51. | Wilson RD, Baxter JK, Johnson MP, et al. Торакоамниотические шунты: лечение плода при плевральных выпотах и врожденных кистозно-аденоматозных пороках. Диагностика плода .2004. 19 (5): 413–420. | |
52. | Mussat P, Dommergues M, Parat S, et al. Врожденный хилоторакс с водянкой: послеродовой уход и исход после антенатальной диагностики. Акта Педиатр . 1995. 84 (7): 749–755. | |
53. | Маллманн М., Грэм В., Розинг Б. и др. Торакоамниотическое шунтирование при гидротораксе плода: предикторы внутриутробного течения и постнатального исхода. Диагностика плода . 2017; 41: 58–65. | |
54. | Сепульведа В., Галиндо А., Соса А., Диас Л., Флорес X, де ла Фуэнте П. Внутригрудное смещение плевроамниотического шунта. Три клинических случая с долгосрочным наблюдением. Диагностика плода . 2005; 20 (2): 102–105. | |
55. | Сэмюэл М., Маккарти Л., Бодди С.А. Эффективность и безопасность склеротерапии ОК-432 при гигантской кистозной гигроме у новорожденного. Диагностика плода . 2000. 15 (2): 93–96. | |
56. | Левин С. Первичные поражения лимфатических сосудов — единое понятие. Дж. Педиатр Хирургия . 1989. 24 (3): 233–240. | |
57. | Young S, Dalgleish S, Eccleston A, Akierman A, McMillan D. Тяжелый врожденный хилоторакс, обработанный октреотидом. Дж Перинатол . 2004. 24 (3): 200–202. | |
58. | Lamberts SW, van der Lely AJ, de Herder WW, et al. Октреотид. N Engl J Med . 1996. 334 (4): 246–254. | |
59. | Glaser B, Hirsch HJ, Landau H. Стойкая гиперинсулинемическая гипогликемия младенчества: длительное лечение октреотидом без панкреатэктомии. Дж. Педиатр . 1993. 123 (4): 644–650. | |
60. | Rasiah SV, Oei J, Lui K.Октреотид в лечении врожденного хилоторакса. J Детский педиатр . 2004. 40 (9–10): 585–588. | |
61. | Das A, Shah P. Октреотид для лечения хилоторакса у новорожденных. Кокрановская база данных Syst Rev . 2010; (9): CD006388. | |
62. | Mohseni-Bod H, Macrae D, Slavik Z. Аналог соматостатина (октреотид) в лечении неонатального послеоперационного хилоторакса: это безопасно? Pediatr Crit Care Med .2004. 5 (4): 356–357. | |
63. | Reck-Burneo CA, Parekh A, Velcek FT. Является ли октреотид фактором риска некротического энтероколита? Дж. Педиатр Хирургия . 2008. 43 (6): 1209–1210. | |
64. | Arevalo RP, Bullabh P, Krauss AN, Auld PA, Spigland N. Октреотид-индуцированная гипоксемия и легочная гипертензия у недоношенных новорожденных. Дж. Педиатр Хирургия . 2003. 38 (2): 251–253. | |
65. | Маллеске Д.Т., Йодер Б.А. Врожденный хилоторакс, леченный пероральным силденафилом: описание случая и обзор литературы. Дж Перинатол . 2015; 35 (5): 384–386. | |
66. | Kajiya K, Huggenberger R, Drinnenberg I, Ma B, Detmar M. Оксид азота опосредует активацию лимфатических сосудов через воздействие растворимой гуанилатциклазы alpha1beta1 на воспаление. FASEB J .2008. 22 (2): 530–537. | |
67. | Jeon Y, Heo Y, Kim C и др. Фосфодиэстераза: обзор белковых структур, потенциальных терапевтических применений и последних достижений в разработке лекарств. Cell Mol Life Sci . 2005. 62 (11): 1198–1220. | |
68. | Hammill AM, Wentzel M, Gupta A, et al. Сиролимус для лечения осложненных сосудистых аномалий у детей. Рак крови у детей . 2011. 57 (6): 1018–1024. | |
69. | Маккормик А., Розенберг С., Триер К. и др. Случай центральной проводящей лимфатической аномалии, реагирующей на сиролимус. Педиатрия . 2016; 137 (1). | |
70. | Мизуно Т., Фукуда Т., Эмото С. и др. Фармакокинетика развития сиролимуса: значение для точного дозирования у новорожденных и младенцев со сложными сосудистыми аномалиями. Рак крови у детей . Epub 2017 16 февраля; 64 (8). | |
71. | Гупта В., Махендри Н.В., Тете П., Сантанам С. Приготовление обезжиренного молока при лечении врожденного хилоторакса. Индийский педиатр . 2014. 51 (2): 146–148. | |
72. | Лопес Г. Использование обогащенного обезжиренного грудного молока для кормления младенцев с послеоперационным хилотораксом. Научная Арка . 2015: 3658. | |
73. | Cohan RH, Saeed M, Schwab SJ, Perlmutt LM, Dunnick NR. Повидон-йодный склероз лимфоцеле малого таза: проспективное исследование. Урол Радиол . 1988. 10 (4): 203–206. | |
74. | Aubard Y, Derouineau I, Aubard V, Chalifour V, Preux PM. Первичный гидроторакс плода: обзор литературы и предлагаемая антенатальная клиническая стратегия. Диагностика плода .1998. 13: 325–333. | |
75. | Engum SA, Rescorla FJ, West KW, Scherer LR 3rd, Grosfeld JL. Использование плевроперитонеальных шунтов в лечении стойкого хилоторакса у младенцев. Дж. Педиатр Хирургия . 1999. 34 (2): 286–290. | |
76. | Buttiker V, Fanconi S, Burger R. Хилоторакс у детей: рекомендации по диагностике и лечению. Сундук . 1999. 116 (3): 682–687. | |
77. | Харгус Э.П., Карсон С.Д., МакГрат Р.Л., Вулф Р.Р., Кларк Д.Р. Хилоторакс и тампонада хилоперикарда после анастомоза Блалока-Тауссига. J Thorac Cardiovasc Surg . 1978. 75 (4): 642–645. | |
78. | Мерфи М.С., Ньюман Б.М., Роджерс Б.М. Плевроперитонеальные шунты в лечении стойкого хилоторакса. Энн Торак Хирург . 1989. 48 (2): 195–200. | |
79. | Stringel G, Mercer S, Bass J. Хирургическое лечение стойкого послеоперационного хилоторакса у детей. Банка J Surg . 1984. 27 (6): 543–546. | |
80. | Сото-Мартинес, М.Э., Клиффорд В., Кларнет Т., Ранганатан С., Мэсси Р.Дж. Спонтанный хилоторакс у ребенка 2 лет. Med J Aust . 2009. 190 (5): 262–264. | |
81. | Аоки М., Като Ф, Сайто Х и др. Успешное лечение хилоторакса блеомицином при болезни Горама. Clin Orthop Relat Res . 1996; (330): 193–197. | |
82. | Бриссо О., Десфрер Л., Мохсен Р. и др. Врожденный идиопатический хилоторакс у новорожденных: химический плевродез повидон-йодом (Бетадин). Arch Dis Child Fetal Neonatal Ed . 2003; 88 (6): F531 – F533. | |
83. | Stenzl W, Rigler B, Tscheliessnigg KH, Beitzke A, Metzler H. Лечение послеоперационного хилоторакса фибриновым клеем. Торакальная кардиоваскулярная хирургия . 1983; 13 (1): 35–36. | |
84. | Скоттони Ф, Фузаро Ф, Конфорти А, Морини Ф, Баголан П. Плевродез с повидон-йодом при рефрактерном хилотораксе у новорожденных: личный опыт и обзор литературы. Дж. Педиатр Хирургия . 2015; 50 (10): 1722–1725. | |
85. | Ancona A, Suarez de la TR, Macotela E. Аллергический контактный дерматит, вызванный повидон-йодом. Контактный дерматит . 1985. 13 (2): 66–68. | |
86. | Митанчес Д., Вальтер-Николет Е., Саломон Р. и др. Врожденный хилоторакс: какова лучшая стратегия? Arch Dis Child Fetal Neonatal Ed . 2006; 91 (2): F153 – F154. | |
87. | Окадзаки Т., Иватани С., Янаи Т. и др. Лечение лимфангиомы у детей: наш опыт 128 случаев. Дж. Педиатр Хирургия . 2007. 42 (2): 386–389. | |
88. | Катаньювонг П., Деарани Дж., Дрисколл Д. Роль плевродеза в лечении хилезного плеврального выпота после операции по поводу врожденного порока сердца. Педиатр Кардиол . 2009. 30 (8): 1112–1116. | |
89. | Kim JE, Lee C, Park KI, Park MS, Namgung R, Park IK. Успешный плевродез с применением ОК-432 у недоношенных новорожденных с постоянным плевральным выпотом. Корейский J Pediatr . 2012; 55 (5): 177–180. | |
90. | Matsukuma E, Aoki Y, Sakai M, et al. Лечение стойким врожденным хилотораксом у новорожденных, резистентных к октреотиду, с помощью OK-432. Дж. Педиатр Хирургия . 2009; 44 (3): e37 – e39. | |
91. | Огита С., Цуто Т., Накамура К., Дегучи Э., Иваи Н. Терапия OK-432 у 64 пациентов с лимфангиомой. Дж. Педиатр Хирургия . 1994. 29 (6): 784–785. | |
92. | Utture A, Kodur V, Mondkar J. Химический плевродез с окситетрациклином при врожденном хилотораксе. Индийская педиатрия . 2016. 53 (12): 1105–1106. | |
93. | Walker-Renard PB, Vaughan LM, Sahn SA.Химический плевродез при злокачественных плевральных выпотах. Энн Интерн Мед. . 1994. 120 (1): 56–64. | |
94. | Энтони В.Б., Ротфус К.Дж., Годби С.В., Спаркс Дж. А., Хотт Дж. В.. Механизм плевродеза, вызванного тетрациклина гидрохлоридом. Стимулированные тетрациклином гидрохлоридом мезотелиальные клетки продуцируют активность фибробластов, подобную фактору роста. Am Rev Respir Dis . 1992. 146 (4): 1009–1013. | |
95. | Hodges MM, Crombleholme TM, Meyers M, et al. Массивный хилоторакс плода успешно лечится с помощью послеродового талькового плевродеза: отчет о болезни и обзор литературы. J Pediatr Surg Case Rep . 2016; 9 (приложение C): 1–4. | |
96. | Надольски Г.Дж., Иткин М. Эмболизация грудного протока при нетравматическом хилезном выпоте: опыт у 34 пациентов. Сундук . 2013. 143 (1): 158–163. | |
97. | Иткин М., Кришнамурти Г., Наим М.Ю., Берд Г.Л., Келлер М.С. Чрескожная эмболизация грудного протока как лечение внутригрудной утечки хилуса у младенцев. Педиатрия . 2011; 128 (1): e237 – e241. | |
98. | Дори Ю. Новые методы лимфатической визуализации. Техника Vasc Interv Radiol . 2016; 19 (4): 255–261. | |
99. | Bellini C, Boccardo F, Campisi C.Лимфатические дисплазии у новорожденных и детей: роль лимфосцинтиграфии. Дж. Педиатр . 2008. 152 (4): 587–589. | |
100. | Бернет-Буэттикер В., Вальдфогель К., Канниццаро В., Альбисетти М. Активность антитромбина у детей с хилотораксом. Eur J Cardiothorac Surg . 2006. 29: 406–409. | |
101. | Wasmuth-Pietzuch A, Hansmann M, Bartmann P, Heep A.Врожденный хилоторакс: лимфопения и высокий риск неонатальных инфекций. Акта Педиатр . 2004. 93 (2): 220–224. | |
102. | Гарти Б.З., Левинсон А.И., Данон Ю.Л., Уилмотт Р., Дуглас С.Д. Субпопуляции лимфоцитов у детей с нарушением лимфатического кровообращения. J Allergy Clin Immunol . 1989; 84: 515–520. | |
103. | Orange J, Geha R, Bonilla F. |

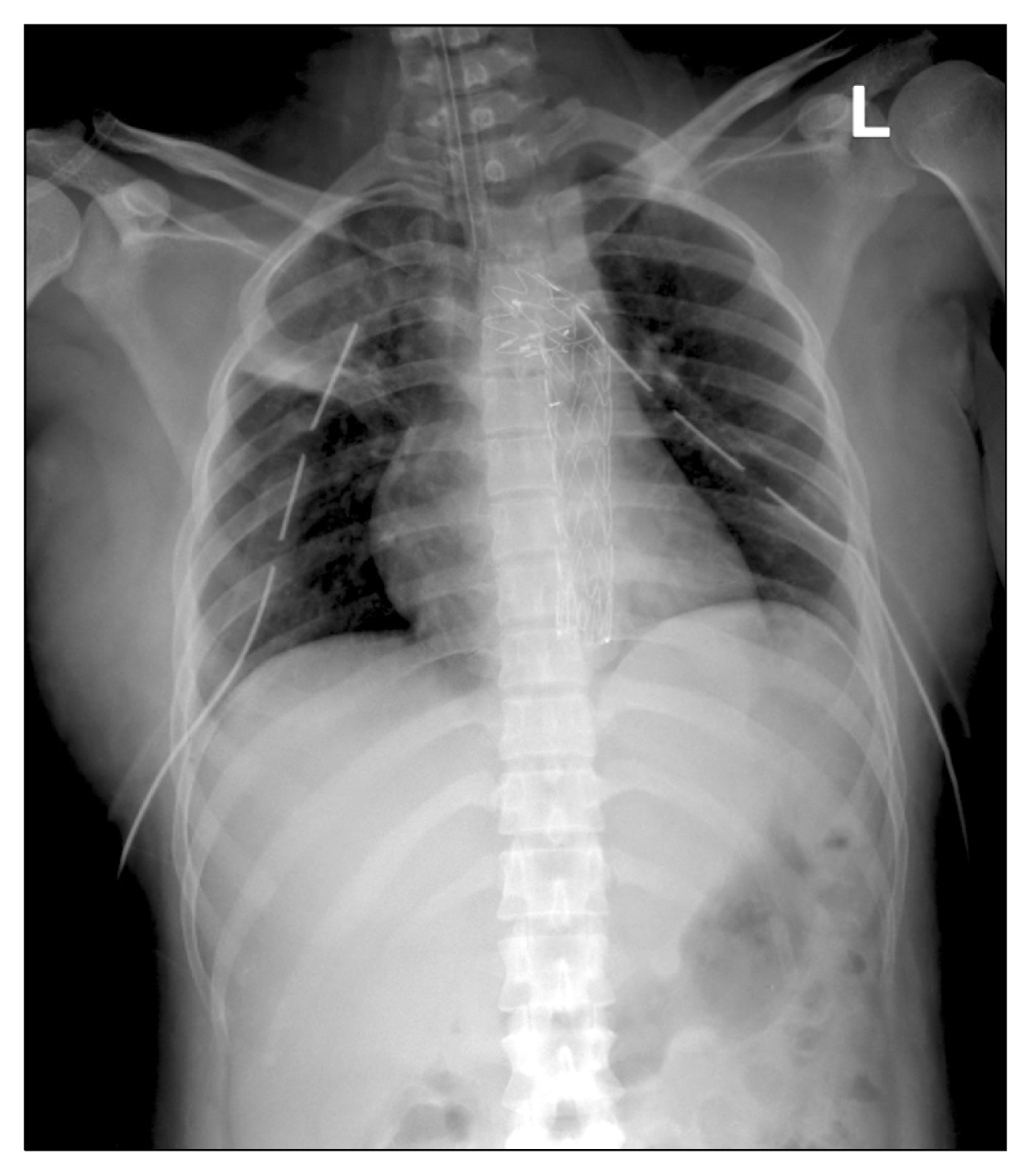 06.1998г.
06.1998г.