Гипертрофия плода: Гипотрофия | Симптомы | Диагностика | Лечение
Задержка роста и гипотрофия плода при многоплодной беременности
Несмотря на многочисленные исследования, направленные на совершенствование диагностики, тактики ведения беременности и родов, пациентки с многоплодной беременностью продолжают представлять группу высокого риска развития перинатальных осложнений, что вызывает постоянный научный и практический интерес [1]. Поскольку эволюционно организм женщины приспособлен для вынашивания одного плода, многоплодная беременность — это классическая модель фетоплацентарной недостаточности [2].
Цель исследования — выявление частоты случаев задержки роста и гипотрофии плода при многоплодной беременности с целью своевременной профилактики перинатальных потерь.
Материал и методы
В исследование были включены 202 беременные женщины, из которых были сформированы две клинические группы: 1-ю (основную) группу составила 51 беременная с многоплодием, наступившим после экстракорпорального оплодотворения (ЭКО) и переноса эмбриона; 2-ю группу (сравнения) — 151 женщина со спонтанно наступившей беременностью двойней.
Морфогистологическое исследование плаценты включало органо-, макро- и гистометрию. Первым этапом исследования плаценты явилось определение органометрических показателей.
При органометрии плаценты производили определение ее массы путем взвешивания без оболочек, с культей пуповины не более 1 см. Объем измеряли по вытесненной воде в мерном цилиндре. Площадь ее определяли по контуру отпечатка материнской поверхности с помощью миллиметровой бумаги. Высчитывали плацентарно-плодовый коэффициент (ППК) — отношение массы плаценты к массе плода.
При макрометрии плаценты визуально оценивали ткань свежей плаценты, определяли процентное соотношение видимых нерабочих зон, т. е. инфарктов, кровоизлияний или кист, известковых отложений по отношению к нормальной ткани плаценты.
С целью гистометрии взятие кусочков плаценты производили по следующей схеме: в случайном порядке через всю ее толщину брали по два образца ткани размером 1,5×0,8 см из центральной, парацентральной и краевой зон таким образом, чтобы в одном из них обязательно были хориальная пластинка, слой ворсинчатого хориона и материнская поверхность. Фиксацию проводили в 10% водном растворе формалина. Потом образцы проводили по общепринятым методикам с последующей заливкой в парафин. Гистологические срезы окрашивали гематоксилином и эозином.
Фиксацию проводили в 10% водном растворе формалина. Потом образцы проводили по общепринятым методикам с последующей заливкой в парафин. Гистологические срезы окрашивали гематоксилином и эозином.
Статистическую обработку данных осуществляли с помощью программы Statistiсa 6.0 с применением основных методов описательной статистики. Статистические гипотезы проверяли путем выявления различий между сравниваемыми группами с применением критерия Стьюдента, точного критерия Фишера, критерия χ2. При всех статистических расчетах критический уровень ошибки (p) принимали равным 0,05.
Результаты и обсуждение
В группе женщин с индуцированным многоплодием в 32—34 нед беременности при ультразвуковом исследовании (УЗИ) выявлена задержка роста плодов (ЗРП) в 29,4% (15) случаев, а гипотрофия новорожденных отмечена в 19,6% (22) наблюдений, из них I степени — в 72,7% (16) и II степени — в 13,6% (3), III степени — в 13,6% (3) случаев. При трихориальной триамниотической тройне среди 30 новорожденных ЗРП выявлена в 26,7% (8) случаев, среди 64 детей при дихориальной двойне — в 17,2% (11), а среди 18 новорожденных при монохориальной двойне — в 16,7% (3) случаев. У этих женщин течение беременности осложнялось угрозой прерывания беременности в 27,5% (15), анемией — в 13,7% (7), преэклампсией — в 17,6% (9) случаев.
У этих женщин течение беременности осложнялось угрозой прерывания беременности в 27,5% (15), анемией — в 13,7% (7), преэклампсией — в 17,6% (9) случаев.
При УЗИ была диагностирована ЗРП плодов у беременных группы сравнения (спонтанное многоплодие) в 28,5% (43) случаев. Гипотрофия новорожденных в этой группе наблюдалась в 25,2% (76) случаев, причем I степени — в 68,4% (52), II степени — в 22,4% (17) и III — в 9,2% (7) случаев. При анализе показателей у новорожденных с гипотрофией получены статистически значимые различия между основной группой и группой сравнения (р<0,01).
При дихориальном типе плацентации среди 162 новорожденных группы сравнения ЗРП различной степени тяжести выявлена в 25,9% (42) случаев. При монохориальном типе из 140 новорожденных данное осложнение имелось в 24,3% (34) случаев (р>0,05).
В обеих группах с многоплодием гипотрофия плода, как правило, носила асимметричный характер и была диагностирована по данным УЗИ. Лишь в нескольких случаях была диагностирована симметричная (гипопластическая) ЗРП. У этих пациенток беременность также протекала на фоне угрозы прерывания в 23,2% (35), преэклампсии — в 13,9% (21), анемии — в 12,6% (19), в 10,6% (16) случаев во время беременности было диагностировано диссоциированное развитие плодов.
У этих пациенток беременность также протекала на фоне угрозы прерывания в 23,2% (35), преэклампсии — в 13,9% (21), анемии — в 12,6% (19), в 10,6% (16) случаев во время беременности было диагностировано диссоциированное развитие плодов.
В основной группе при индуцированном многоплодии в 32—33 нед беременности было выявлено диссоциированное развитие плодов в 29,4% (15) случаев и встречалось при трихориальной триамниотической тройне у 4 обследуемых из 10, при монохориальном типе плацентации у 3 из 9, при дихориальном типе плацентации из 32 случаев в 8 (25%). Разница в массе тела новорожденных составляла при монохориальной двойне от 580 до 1200 г, а при трихориальной триамниотической тройне — от 550 до 1300 г. При осложненном течении беременности с ростом гестационного срока степень диссоциации плодов увеличивалась.
В группе сравнения диссоциированное развитие плодов выявлено также в 32—33 нед в 18,5% (28) случаев, из них при дихориальном типе плацентации в 15 (18,5%) из 81 наблюдения, при монохориальном из 70 наблюдений — у 13 (18,6%) обследуемых.
Оценить степень и характер плацентарных нарушений невозможно без анализа гистоморфологических данных. Исследованы плаценты, полученные в результате преждевременных родов в сроки 33,7±2,6 нед в основной группе при индуцированном многоплодии и в группе сравнения при преждевременных родах в сроки 35,1±1,1 нед.
Органометрические показатели плацент (масса плаценты, ее объем и площадь, плацентарно-плодовый коэффициент) у пациенток обследуемых групп находились в пределах нормы. Масса плаценты при дихориальном типе плацентации в основной группе составила 417,6±192,1 г, в группе сравнения — 356,6±99,2 г, площадь материнской поверхности — 472,0±93,5 и 390,3±21,9 см2 соответственно. При монохориальном типе плацентации масса плаценты была одинаковой в обеих группах — 703,1±145,6 г.
Масса, площадь материнской поверхности плацент в основной группе и группе сравнения не имели статистически достоверных различий. Плаценты с такими параметрами способны полностью обеспечить внутриутробное развитие плода.
Главной особенностью гистологического строения плацент было наличие неравномерного созревания отдельных котиледонов. Наряду с нормальными, хорошо васкуляризированными ворсинами, встречались хаотичные зоны склерозированных ворсин с малым количеством капилляров. Относительная незрелость ворсинчатого дерева выражалась в двух формах: преждевременном созревании ворсин и диссоциированном их развитии.
Нарушение созревания ворсин отмечено в 13,7% (7) случаев в основной и 5,96% (9) в группе сравнения. Нарушение созревания ворсин диагностировано у пациенток с экстрагенитальной патологией, с осложненным течением беременности (угроза прерывания беременности, преэклампсия, анемия).
Преждевременное созревание ворсин диагностировали при невынашивании беременности, когда в плаценте в гестационные сроки 32—33 нед доминировали терминальные ворсины с узкими капиллярами, не формирующими синцитиокапиллярные мембраны. Диссоциированное развитие ворсин имелось только при многоплодной беременности: в основной группе — у 5 (13,9%) пациенток, в группе сравнения — у 9 (9,4%) и проявлялось в распространенном сочетании котиледонов с персистенцией тех или иных типов незрелых ворсин с участками зрелого строения.
Анализ течения беременности у этих пациенток выявил наличие большого числа осложнений во всех триместрах: угроза прерывания, преэклампсия, анемии, соматические заболевания. Возраст этих женщин колебался от 31 года до 38 лет. У каждой был отягощен акушерско-гинекологический анамнез наличием медицинских и самопроизвольных абортов, хронических воспалительных заболеваний органов малого таза, миомы матки.
В исследуемых плацентах в 27,8% (10) наблюдений в основной группе и в 14,6% (14) наблюдений в группе сравнения отмечались признаки воспаления (децидуит, виллузит, хориоамнионит). У этих пациенток в анамнезе и во время беременности диагностировались инфекции, передаваемые половым путем, сифилис, заболевания мочеполовой системы: гестационные и хронические пиелонефриты, мочекаменная болезнь. В родах отмечались дородовое излитие околоплодных вод, слабость родовой деятельности, фетоплацентарная недостаточность, внутриутробное инфицирование плодов.
Таким образом, результаты проведенного исследования показывают, что при многоплодной беременности как индуцированной, так и спонтанно наступившей, определяется высокая частота задержки роста диссоциированного развития плодов, гипотрофии новорожденных, что обусловлено в большой степени неравномерным созреванием и диссоциированным развитием ворсин. Все перечисленное свидетельствует о необходимости проведения мероприятий по профилактике перинатальных потерь при многоплодной беременности. Проведение прегравидарной подготовки, предупреждение многоплодной беременности в программе ЭКО, ранняя диагностика многоплодной беременности и предупреждение ее осложнений, выбор рационального метода родоразрешения с учетом гестационного срока являются важным резервом в снижении перинатальной и материнской заболеваемости и смертности.
Все перечисленное свидетельствует о необходимости проведения мероприятий по профилактике перинатальных потерь при многоплодной беременности. Проведение прегравидарной подготовки, предупреждение многоплодной беременности в программе ЭКО, ранняя диагностика многоплодной беременности и предупреждение ее осложнений, выбор рационального метода родоразрешения с учетом гестационного срока являются важным резервом в снижении перинатальной и материнской заболеваемости и смертности.
Выводы
1. В результате проведенного исследования установлено, что при многоплодной беременности как индуцированной, так и спонтанно наступившей определяется высокая частота задержки роста плодов, диссоциированного развития плодов и гипотрофии новорожденных.
2. Особенностью гистологического строения плаценты (плацент) при многоплодной беременности является неравномерное созревание отдельных котиледонов, обусловленное как преждевременным созреванием ворсин, так и диссоциированным их развитием, что лежит в основе фетоплацентарной недостаточности.
3. Мероприятиями по профилактике перинатальных потерь при многоплодной беременности могут служить следующие: проведение прегравидарной подготовки, предупреждение многоплодия при использовании программ экстракорпорального оплодотворения, ранняя диагностика многоплодной беременности и предупреждение ее осложнений, выбор рационального метода родоразрешения с учетом срока беременности.
Как выявить задержку роста и внутриутробного развития плода
Получить результаты анализов
- Главная
- Как распознать болезнь
- Беременность и роды
- Задержка внутриутробного развития плода
Подробнее о враче
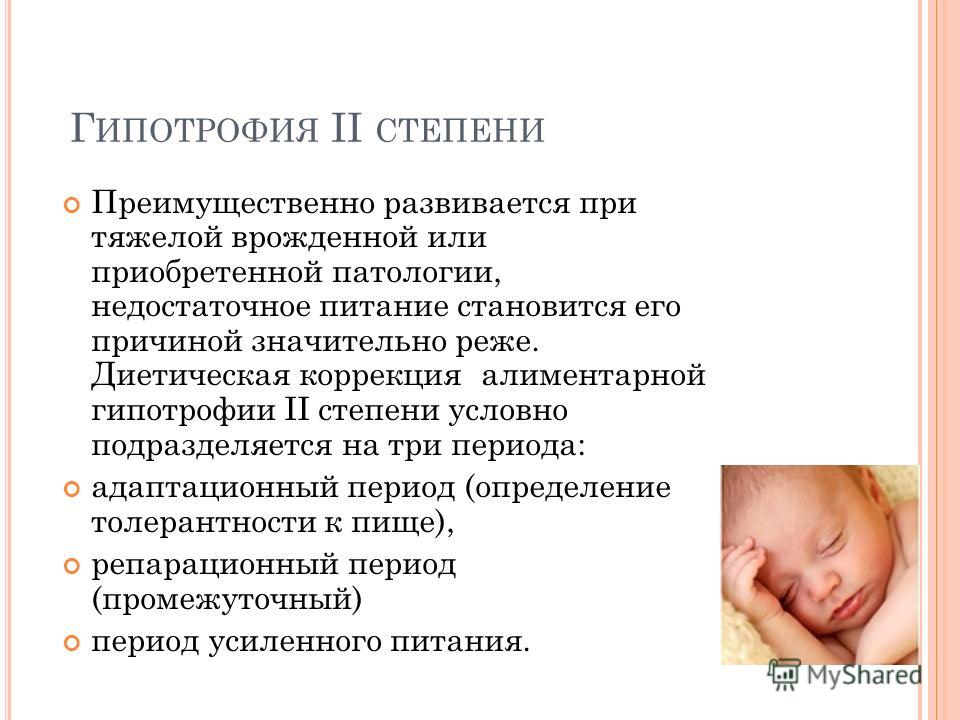
Задержка внутриутробного развития (ЗВУР, гипотрофия) – отставание плода в физическом развитии. Это ситуация, когда фетометрические показатели не соответствуют конкретному сроку гестации. Чаще всего отклонения возникают в третьем триместре беременности и могут привести к гипоксии плода, порокам внутренних органов и даже его гибели.
Чаще всего отклонения возникают в третьем триместре беременности и могут привести к гипоксии плода, порокам внутренних органов и даже его гибели.
Причины и патогенез
Основная причина – нарушение поступления питательных веществ и кислорода в организм малыша. Вызвать ухудшение трофики и оксигенации могут различные патологии.
- Соматические и инфекционные болезни матери. Это могут быть патологии крови, заболевания, сопровождающиеся спазмом сосудов, гинекологические проблемы, острые инфекции и эндокринопатии.
- Врожденные аномалии плода. Некоторые генетически обусловленные пороки не позволяют ребенку в полном объеме усваивать питательные вещества.
- Внутриутробная инфекция. Вирусы (краснухи, герпеса, ВИЧ и др.) и внутриклеточные паразиты (токсоплазма, микоплазма) становятся причиной врожденных аномалий и задержки внутриутробного развития.
- Патологии плаценты и оболочек. Инфаркт плаценты, ее преждевременная отслойка и инволюция приводят к фетоплацентарной недостаточности и становятся причиной кислородного голодания плода.
 Кроме того, задержку внутриутробного развития могут спровоцировать патологии пуповины, маловодие, амниотические перетяжки и др.
Кроме того, задержку внутриутробного развития могут спровоцировать патологии пуповины, маловодие, амниотические перетяжки и др. - Резус-конфликт и другие проблемы в системе «мать-ребенок». Несовместимость крови матери и плода по резус-фактору или по группе приводит к гемолизу эритроцитов, в результате чего образуется токсичный непрямой билирубин. Чаще всего при этом страдают транспортная функция крови и способность тканей усваивать питательные вещества.
- Погрешности питания беременной. Недостаток витаминов, минералов, а также дисбаланс в соотношении белков, жиров и углеводов плохо сказываются на состоянии плода.
- Негативное внешнее воздействие. Сюда можно отнести профвредности, неблагоприятную экологическую обстановку, вредные привычки, прием некоторых лекарственных препаратов, стрессы.
- Отягощенный акушерско-гинекологический анамнез. Нарушение менструального цикла, выкидыши, преждевременные роды и даже бесплодие в прошлом могут стать причиной гипотрофии плода.
 Кроме того, проблемы с внутриутробным развитием могут возникнуть при многоплодной беременности, когда появляется фетоплацентарная недостаточность.
Кроме того, проблемы с внутриутробным развитием могут возникнуть при многоплодной беременности, когда появляется фетоплацентарная недостаточность.
По данным статистики задержку внутриутробного развития регистрируют при каждой десятой беременности.
Симптомы задержки роста и развития плода
Выявить гипотрофию можно при прохождении планового УЗИ. Ярких клинических симптомов у патологии нет. Заподозрить задержку внутриутробного развития можно по медленной прибавке в весе будущей мамы и незначительному увеличению окружности живота.
В случае развития фитоплацентарной недостаточности и выраженной гипоксии снижается двигательная активность плода, что также является неблагоприятным признаком.
Диагностика задержки роста плода
Первые подозрения появляются уже на этапе акушерского осмотра, включающего измерение окружность живота и высоту стояния дна матки. При отставании показателей на 2 см можно говорить о гипотрофии. Далее беременной необходимо пройти:
- УЗИ плаценты.
 Исследование помогает определить ее степень зрелости, размеры, структуру, местоположение и выявить повреждения. Специалисты рекомендуют дополнительно при этом сделать допплерографию маточно-плацентарного кровотока для обнаружения очагов инфаркта и патологий сосудистого русла.
Исследование помогает определить ее степень зрелости, размеры, структуру, местоположение и выявить повреждения. Специалисты рекомендуют дополнительно при этом сделать допплерографию маточно-плацентарного кровотока для обнаружения очагов инфаркта и патологий сосудистого русла. - Фетометрия плода. Измерение размеров плода (окружности головы, груди, живота, длины конечностей и пр.) во время сонографии. Полученные данные сравнивают с нормой и делают соответствующее заключение.
- Кардиотокография и фонокардиография. Исследование сердцебиения плода. При ЗВУР на кардиотокограмме будут видны нарушения ритма и учащенное сердцебиение, что свидетельствует о фетоплацентарной недостаточности.
Достоверными лабораторными показателями, подтверждающими задержку внутриутробного развития, являются:
- накопление ингибиторов клеточного роста в плаценте — соединений, которые угнетают факторы роста, отвечающие за формирование плаценты;
- снижение концентрации инсулиноподобного фактора роста (ИФР) – вещества, участвующего в гормональной регуляции процессов роста и развития плода;
- повышение уровня сосудисто-эндотелиального фактора роста (СЭФР) – компенсаторного механизма, благодаря которому при развивающейся гипоксии плода активизируется процесс образования новых кровеносных сосудов в плаценте.
Все эти данные можно получить только при кордоцентезе – заборе крови из сосудов пуповины во время беременности. Но поскольку эта процедура является инвазивной и может привести к серьезным осложнениям, ее практически не проводят в ходе скрининга. Выполняют данный анализ только после рождения ребенка, извлекая все факторы непосредственно из плаценты.
Лечение
Выбор врачебной тактики зависит от степени гипотрофии плода и выраженности фетоплацентарной недостаточности. Лечение проходит под контролем УЗИ. При этом обязательно делают фетометрию плода, допплерографию плацентарного кровотока и кардиотокографию. Беременной назначают:
- Средства, улучшающие кровоснабжение плода. Сюда входят ангиопротекторы, препараты, влияющие на реологические свойства крови и токолитики, снимающие тонус матки.
- Противогипоксические и мембраностабилизирующие лекарства. Эта группа состоит из препаратов, улучшающих трофику, кровообращение и метаболизм, а также антиоксидантов и общеукрепляющих средств.
.pptx_images/187-distrofii(1).pptx_11.jpg)
Если благодаря лечению удается стабилизировать состояние плода, беременность пролонгируют до 37 недель. В случае неэффективности проводимой терапии или при ухудшении общего состояния ребенка проводят досрочное родоразрешение путем кесарева сечения.
Диагностика и прогноз кардиомиопатий плода: обзор
Обзор
. 2010;16(26):2929-34.
дои: 10.2174/138161210793176428.
Маурицио Монжиови
1
, Власта Фесслова, Джованни Фацио, Джузеппе Барбаро, Сальваторе Пипитоне
принадлежность
- 1 Отделение кардиологии, Больница Каса-дель-Соле, Палермо. [email protected]
PMID:
20632954
DOI:
10.
 2174/138161210793176428
2174/138161210793176428
Обзор
Maurizio Mongiovì et al.
Курр Фарм Дез.
2010.
. 2010;16(26):2929-34.
дои: 10.2174/138161210793176428.
Авторы
Маурицио Монжиови
1
, Власта Фесслова, Джованни Фацио, Джузеппе Барбаро, Сальваторе Пипитоне
принадлежность
- 1 Кардиологическое отделение больницы Каса-дель-Соле, Палермо. [email protected]
PMID:
20632954
DOI:
10.2174/138161210793176428
Абстрактный
Кардиомиопатии (КМ) — очень редкое заболевание плода с очень неблагоприятным исходом. Сообщалось только об отдельных случаях и небольших сериях случаев. Согласно опубликованным исследованиям, мы будем описывать КМ плода, начиная с их эхокардиографической картины: дилатационная кардиомиопатия (ДКМП) с дилатацией одного или обоих желудочков и нарушением функции желудочков и гипертрофическая кардиомиопатия (ГКМП) с различной степенью непропорциональной гипертрофии стенок миокарда. Термин «неуплотнение» миокарда левого желудочка используется в случаях ДКМП с признаками многочисленных выраженных трабекул с глубокими карманами миокарда. В ряду новорожденных и младенцев ВМ встречается примерно у 2-7%, но, вероятно, во внутриутробном периоде распространенность выше: 6%-11%. Высокая внутриутробная потеря, происходящая у одной трети пораженных плодов, вероятно, объясняет эти различия. Фетальная эхокардиография в режимах B и M является основным диагностическим инструментом и полезна для терапевтической ориентации и определения неонатального исхода. Гемодинамическую оценку можно выполнить в допплеровском режиме.
Сообщалось только об отдельных случаях и небольших сериях случаев. Согласно опубликованным исследованиям, мы будем описывать КМ плода, начиная с их эхокардиографической картины: дилатационная кардиомиопатия (ДКМП) с дилатацией одного или обоих желудочков и нарушением функции желудочков и гипертрофическая кардиомиопатия (ГКМП) с различной степенью непропорциональной гипертрофии стенок миокарда. Термин «неуплотнение» миокарда левого желудочка используется в случаях ДКМП с признаками многочисленных выраженных трабекул с глубокими карманами миокарда. В ряду новорожденных и младенцев ВМ встречается примерно у 2-7%, но, вероятно, во внутриутробном периоде распространенность выше: 6%-11%. Высокая внутриутробная потеря, происходящая у одной трети пораженных плодов, вероятно, объясняет эти различия. Фетальная эхокардиография в режимах B и M является основным диагностическим инструментом и полезна для терапевтической ориентации и определения неонатального исхода. Гемодинамическую оценку можно выполнить в допплеровском режиме. Систолическая и диастолическая функция сердца плода стала частью рутинной оценки сердца плода. Кардиомиопатии могут быть изолированными или ассоциированными с другими сердечными и несердечными пороками развития. Все исследования подтверждают большую вариабельность ДКМП в фетальном возрасте по анатомо-функциональным формам, этиологии и гемодинамическому влиянию с различным конечным исходом. Генетические, метаболические, инфекционные и сердечные заболевания могут проявляться ДКМП. Желудочковая дисфункция может прогрессировать внутриутробно и после рождения, но возможность улучшения или даже нормализации левожелудочковой дисфункции известна при всех формах ДКМП, «идиопатических», постинфекционных или при неуплотнении левого желудочка. Исход хуже при наличии водянки плода, выраженной недостаточности атриовентрикулярного клапана, в более раннем возрасте при поступлении и когда диастолическая дисфункция сочетается с систолической дисфункцией. Этиологически первичная ГКМП плода представляет собой гетерогенное состояние, которое может быть результатом как внутренней патологии плода, так и внешних факторов.
Систолическая и диастолическая функция сердца плода стала частью рутинной оценки сердца плода. Кардиомиопатии могут быть изолированными или ассоциированными с другими сердечными и несердечными пороками развития. Все исследования подтверждают большую вариабельность ДКМП в фетальном возрасте по анатомо-функциональным формам, этиологии и гемодинамическому влиянию с различным конечным исходом. Генетические, метаболические, инфекционные и сердечные заболевания могут проявляться ДКМП. Желудочковая дисфункция может прогрессировать внутриутробно и после рождения, но возможность улучшения или даже нормализации левожелудочковой дисфункции известна при всех формах ДКМП, «идиопатических», постинфекционных или при неуплотнении левого желудочка. Исход хуже при наличии водянки плода, выраженной недостаточности атриовентрикулярного клапана, в более раннем возрасте при поступлении и когда диастолическая дисфункция сочетается с систолической дисфункцией. Этиологически первичная ГКМП плода представляет собой гетерогенное состояние, которое может быть результатом как внутренней патологии плода, так и внешних факторов. Он может быть концентрическим или асимметричным. Прогноз у младенцев с ГКМП, связанной с диабетом матери, благоприятный, в то время как у плодов, не страдающих диабетом, сообщается о плохом прогнозе. ГКМП может быть эволюционным, в основном после рождения; в противном случае также бывают случаи полного улучшения или регресса. К сожалению, в большинстве случаев наблюдается плохой исход, особенно при ДКМП, при наличии лишь нескольких доступных терапевтических вариантов. Детальная оценка состояния плода и матери дает прогностическую информацию для пренатального консультирования и может привести к улучшению исхода, по крайней мере, некоторых беременностей с патологией.
Он может быть концентрическим или асимметричным. Прогноз у младенцев с ГКМП, связанной с диабетом матери, благоприятный, в то время как у плодов, не страдающих диабетом, сообщается о плохом прогнозе. ГКМП может быть эволюционным, в основном после рождения; в противном случае также бывают случаи полного улучшения или регресса. К сожалению, в большинстве случаев наблюдается плохой исход, особенно при ДКМП, при наличии лишь нескольких доступных терапевтических вариантов. Детальная оценка состояния плода и матери дает прогностическую информацию для пренатального консультирования и может привести к улучшению исхода, по крайней мере, некоторых беременностей с патологией.
Похожие статьи
Кардиомиопатии плода: патогенетические механизмы, гемодинамические данные и клинический исход.
Педра С.Р., Смоллхорн Дж.Ф., Райан Г., Читаят Д., Тейлор Г.П., Хан Р., Абдолелл М., Хорнбергер Л.К.

Педра С.Р. и др.
Тираж. 2002 г., 30 июля; 106 (5): 585–91. doi: 10.1161/01.cir.0000023900.58293.fe.
Тираж. 2002.PMID: 12147541
У плода и новорожденного неуплотненный желудочковый миокард: расширение клинического спектра.
Менон С.К., О’Лири П.В., Райт Г.Б., Риос Р., Маклеллан-Тоберт С.Г., Кабалка А.К.
Менон С.К. и соавт.
J Am Soc Эхокардиогр. 2007 Декабрь; 20 (12): 1344-50. doi: 10.1016/j.echo.2007.04.028. Epub 2007 30 августа.
J Am Soc Эхокардиогр. 2007.PMID: 17764900
Индекс Tei для оценки работы миокарда плода у больных плодов.
Ичидзука К., Мацуока Р., Хасэгава Дж., Ширато Н., Джимбо М., Оцуки К., Секидзава А., Фарина А., Окаи Т.
Ичизука К. и др.
Ранний Хам Дев. 2005 март; 81 (3): 273-9. doi: 10.1016/j.earlhumdev.2004.07.003.
doi: 10.1016/j.earlhumdev.2004.07.003.
Ранний Хам Дев. 2005.PMID: 15814209
Фетальная вентрикулярная гипертрабекуляция / отсутствие уплотнения: клиническая картина, генетика, сопутствующие сердечные и экстракардиальные аномалии и исход.
Стёльбергер К., Вегнер К., Финстерер Дж.
Stöllberger C, et al.
Педиатр Кардиол. 2015 окт; 36 (7): 1319-26. doi: 10.1007/s00246-015-1200-y. Epub 2015 27 мая.
Педиатр Кардиол. 2015.PMID: 26008764
Обзор.
Клинические аспекты диастолической функции левого желудочка, оцененные с помощью допплерэхокардиографии после острого инфаркта миокарда.
Поульсен С.Х.
Поульсен Ш.
Дэн Мед Булл. 2001 ноябрь;48(4):199-210.
Дэн Мед Булл. 2001.PMID: 11767125
Обзор.
Посмотреть все похожие статьи
Цитируется
Фетальная гипертрофическая кардиомиопатия с повышенной пиковой систолической скоростью средней мозговой артерии (MCA PSV): потенциально мрачная ассоциация.

Келлер Н.А., Брасеро Л.А., Коуба И., Талвар Р., Блиц М.Дж.
Келлер Н.А. и соавт.
Clin Case Rep. 23 апреля 2023 г .; 11 (4): e7270. doi: 10.1002/ccr3.7270. Электронная коллекция 2023 апр.
Представитель Clin Case, 2023 г.PMID: 37102103
Бесплатная статья ЧВК.Секвенирование РНК выявило новую сеть коэкспрессии LncRNA/mRNAs, связанную с опосредованным пуэрарином ингибированием гипертрофии сердца у мышей.
Йе С, Чен В, Оу С, Чен М.С.
Йе С и др.
Пир Дж. 2022 5 апр; 10:e13144. doi: 10.7717/peerj.13144. Электронная коллекция 2022.
Пир Дж. 2022.PMID: 35402096
Бесплатная статья ЧВК.Клинические и эхокардиографические картины и исходы суданских детей с кардиомиопатией.
Мамун А., Али С.
Мамун А.
 и др.
и др.
Судан J Педиатр. 2021;21(2):131-136. doi: 10.24911/SJP.106-1600099020.
Судан J Педиатр. 2021.PMID: 35221424
Бесплатная статья ЧВК.Диабетическая беременность и материнская диета с высоким содержанием жиров нарушают митохондриальный динамизм в развивающемся эмбриональном сердце крысы с помощью специфических для пола механизмов.
Ларсен Т.Д., Саби К.Х., Кнутсон А.Дж., Ганди ТСТ, Луваги Э.Дж., Лаутербок Л., Мдаки К.С., Баак М.Л.
Ларсен ТД и соавт.
Int J Mol Sci. 2019 25 июня; 20 (12): 3090. дои: 10.3390/ijms20123090.
Int J Mol Sci. 2019.PMID: 31242551
Бесплатная статья ЧВК.Различия в сократительной функции миофибрилл в эмбриональных стволовых клетках кардиомиоцитов человека по сравнению с желудочковыми миофибриллами взрослых связаны с различными изоформами саркомерных белков.

Йорга Б., Шванке К., Вебер Н., Вендланд М., Гретен С., Пип Б., Дос Ремедиос К.Г., Мартин У., Цвайгердт Р., Крафт Т., Бреннер Б.
Йорга Б. и др.
Фронт Физиол. 2018 19 января; 8:1111. doi: 10.3389/fphys.2017.01111. Электронная коллекция 2017.
Фронт Физиол. 2018.PMID: 29403388
Бесплатная статья ЧВК.
Просмотреть все статьи «Цитируется по»
Типы публикаций
термины MeSH
Ультразвуковое и генетическое выявление гипертрофической кардиомиопатии плода во втором триместре беременности
Текст статьи
Меню статьи
- Статья
Текст - Артикул
информация - Цитата
Инструменты - Поделиться
- Быстрое реагирование
- Артикул
метрика - Оповещения
Изображения в…
Ультразвуковое и генетическое выявление гипертрофической кардиомиопатии плода во втором триместре беременности
Бесплатно
- Селия Соареш1,
- Катя Лоуренсо1,
- Розете Новаис Ногейра2,3 и
- Ана Каррико4
- 901 93 1 Акушерство и гинекология, Centro Hospitalar de Vila Nova de Gaia Espinho EPE, Vila Nova de Gaia , Порту, Португалия
- 2 Патология, CGC Genetics Centro de Genetica Clinica, Порту, Португалия
- 3 Патология, Universidade do Minho Instituto de Investigacao em Ciencias da Vida e Saude, Брага, Португалия
- 4 Детская кардиология, Centro Hospitalar de Vila Nova de Gaia Espinho EPE, Vila Nova de Gaia, Порту, Португалия
- Переписка с доктором Селией Соареш; celia.
 cmsoares{at}gmail.com
cmsoares{at}gmail.com
http://dx.doi.org/10.1136/bcr-2020-239773
Статистика с сайта Altmetric.com
Запрос разрешений
приведет вас к службе RightsLink Центра защиты авторских прав. Вы сможете получить быструю цену и мгновенное разрешение на повторное использование контента различными способами.
- беременность
- сердечно-сосудистые препараты
- препараты для матери и плода
- здоровье новорожденных
Описание
Кардиомиопатии (КМ) — это заболевания миокарда, которые приводят к нарушению функции сердца различной степени тяжести. Эти заболевания очень редко встречаются у плодов человека. Многие ВМ являются идиопатическими, и только 33–43% имеют идентифицируемые генетические, семейные, инфекционные или метаболические причины.1, 2 Около 76% случаев гипертрофической ВМ (ГКМП) связаны с диабетом матери и трансфузионным синдромом от близнеца к близнецу. ВМ, связанный с этими состояниями, часто бывает обратимым. 2
2
ГКМП, вызванная семейными генетическими вариантами, встречается редко, но приводит к низкой выживаемости плода2 или серьезным долгосрочным клиническим последствиям, включая повышенный риск внезапной сердечной смерти.3 4 Пренатальная диагностика ГКМП является редкой и сложной, сообщается о заболеваемости 6,2 на 100 000.2 Насколько нам известно, сообщалось только об отдельных случаях и небольших сериях случаев ГКМП, диагностированных во время внутриутробного развития. самопроизвольных выкидышей в триместре) без гестационного диабета была направлена в наше отделение пренатальной диагностики на 23 неделе беременности из-за семейного анамнеза ГКМП, диагностированного во время настоящей беременности. Генетическое исследование больного члена семьи (матери беременной с диагнозом ГКМП в возрасте 53 лет) выявило вариант с.559.A>G (p.Asn187Asp) в гетерозиготности по гену MYH7 (NM_0002547.4). Наличие семейного варианта у беременной женщины было неизвестно, и ее эхокардиограмма оказалась нормальной. Эхокардиограмма плода (в 23 недели) показала симметричное утолщение стенок бивентрикулярного сердца плода и межжелудочковой перегородки размером около 5 мм и 4,5 мм соответственно. Сохраненная сердечная функция, нормальная венозная и артериальная допплерография и отсутствие препятствий в тракте оттока желудочков (рис. 1). Остальная морфология плода была нормальной. Кариотип плода в норме. Семейный вариант в гетерозиготности по гену MYH7 обнаружен у плода путем секвенирования ДНК. Пациентка приняла решение о прерывании беременности в сроке 24 недели гестации.
Эхокардиограмма плода (в 23 недели) показала симметричное утолщение стенок бивентрикулярного сердца плода и межжелудочковой перегородки размером около 5 мм и 4,5 мм соответственно. Сохраненная сердечная функция, нормальная венозная и артериальная допплерография и отсутствие препятствий в тракте оттока желудочков (рис. 1). Остальная морфология плода была нормальной. Кариотип плода в норме. Семейный вариант в гетерозиготности по гену MYH7 обнаружен у плода путем секвенирования ДНК. Пациентка приняла решение о прерывании беременности в сроке 24 недели гестации.
Рисунок 1
Эхокардиограмма плода (23 недели) показала нормальный размер сердца, симметричное утолщение бивентрикулярных стенок и межжелудочковой перегородки размером около 5 мм и 4,5 мм соответственно.
Вскрытие подтвердило плод с 20-недельной биометрией, сердцем с нормальной массой, но с концентрической бивентрикулярной гипертрофией (рис. 2) и отсутствием других морфологических аномалий.
Рисунок 2
(A) Проекция сердца in situ.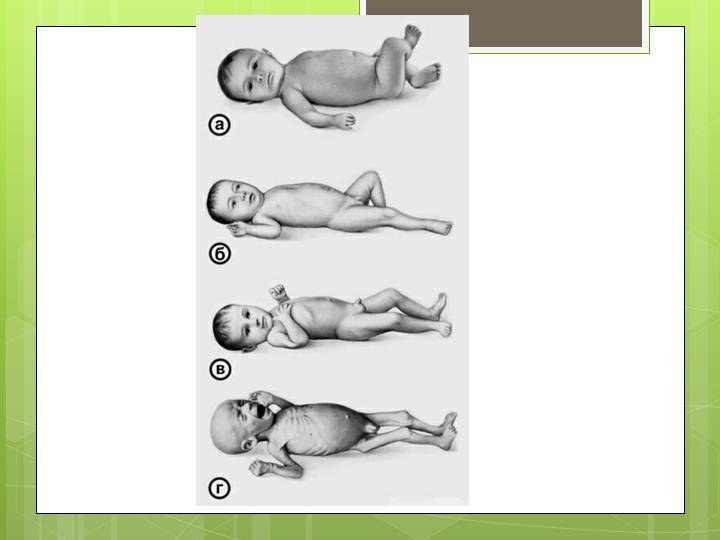 (B) Серийный срез, показывающий бивентрикулярную гипертрофию и гипертрофию перегородки. Толщина правого желудочка (ПЖ) 5 мм; толщина левого желудочка (ЛЖ) 4 мм; толщина перегородки (S) 3–5 мм. Предоставлено CGC Genetics, Лаборатория эмбриональной патологии.
(B) Серийный срез, показывающий бивентрикулярную гипертрофию и гипертрофию перегородки. Толщина правого желудочка (ПЖ) 5 мм; толщина левого желудочка (ЛЖ) 4 мм; толщина перегородки (S) 3–5 мм. Предоставлено CGC Genetics, Лаборатория эмбриональной патологии.
Детальная диагностика типа ВМ у плода очень сложна, и возможна только начальная оценка этих нарушений на основании сонографического изображения миокарда. Кроме того, пренатальная диагностика ГКМП затруднена, особенно на ранней стадии, из-за ее сильно изменчивой экспрессии и непредсказуемой эволюции.1–3
немногочисленные исследования этого состояния.2 Следует отметить, что некоторые авторы сообщали о нормальных результатах сканирования в 20 недель5 или только что выявили ГКМП в 30+ недель.3 Своевременная диагностика ГКМП и точное прогнозирование функциональных исходов имеют первостепенное значение для ведения беременности, особенно когда прекращение является вариантом, и должны соблюдаться установленные законом сроки (например, 24 недели в Португалии).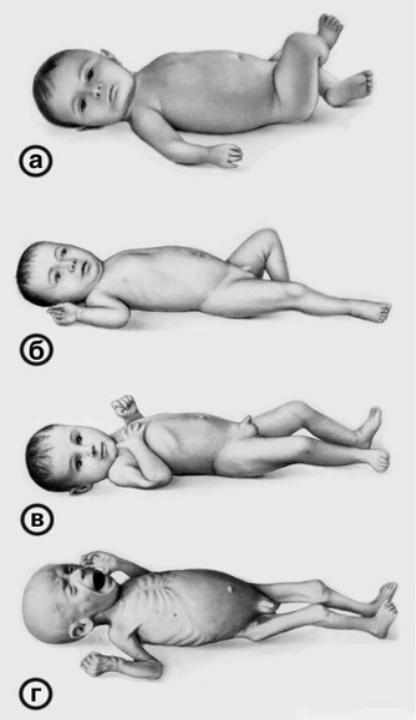
В представленном случае наблюдалось морфологическое изменение сердца, включающее утолщение желудочков с нормальной функцией, что соответствует одному из наиболее важных исследований ГКМП. генетический вариант, была проведена целенаправленная этиологическая оценка.
Ключевым открытием, представленным в этом отчете, является вариант MYH7 (NM_000257.4):c.559A>G (p.Asn187Asp), который описан впервые и, вероятно, является патогенным. Этот специфический вариант не был описан у здоровых людей в gnomAD v3.1, и прогностическое программное обеспечение предпочло классифицировать его как патогенный.6,7,
Генетическое тестирование варианта гена тяжелой цепи сердечного β-миозина (MYH7) использовалось при клинической оценке фетальных кавернозных мальформаций.2 8 Фактически, патогенные варианты MYH7 были обнаружены пренатально в неуплотненных кавернозных мальформациях6 и расширенных кавернозных мальформациях.2 Тем не менее, есть только один отчет о пренатальном диагнозе ГКМП, указывающий на вариант MYH7 в качестве причины5, но включающий другой вариант MYH7, чем описано здесь.
Сообщается, что прогноз фетального CM крайне неблагоприятный с высоким риском перинатальной гибели.2 Тяжесть ГКМП, по-видимому, тесно связана с фенотипическими и функциональными проявлениями, и более неблагоприятные перинатальные исходы наблюдаются в случаях с ранними эхокардиографическими данными.2
Точки обучения
У плода возможна только начальная оценка кардиомиопатии (КМ), основанная на сонографическом изображении миокарда.
Пренатальная диагностика гипертрофического ВМ (ГКМП) проводится редко. Из-за его очень вариабельной экспрессии и непредсказуемой эволюции сложно своевременно диагностировать ВМ во время беременности.
Вариант MYH7 может быть причиной ГКМП, диагностированной пренатально.
Каталожные номера
- ↵
- Pedra SRFF,
- Smallhorn JF,
- Ryan G, et al
. Кардиомиопатии плода: патогенетические механизмы, гемодинамические данные и клинический исход.
 Тираж 2002 г.; ↵
Тираж 2002 г.; ↵- Вебер Р,
- Кантор П.,
- Читаят Д. и др.
. Спектр и исход первичных кардиомиопатий, диагностированных во время внутриутробного развития. Сердечная недостаточность JACC 2014;2:403–11.doi:10.1016/j.jchf.2014.02.010pmid:http://www.ncbi.nlm.nih.gov/pubmed/25023818
- ↵ 9 0181
- Холм MG,
- Сехон М.К.,
- Рид К.Л. и др.
. Внутриутробное лечение плода с семейной гипертрофической кардиомиопатией, вторичной по отношению к мутации MYH7. Pediatr Cardiol 2015;36:1774–7.doi:10.1007/s00246-015-1250-1pmid:http://www.ncbi.nlm.nih.gov/pubmed/26337809
- Колан С.Д.,
- Липшульц С.Е.,
- Лоу А.М. и др.
. Эпидемиология и причинно-специфические исходы гипертрофической кардиомиопатии у детей: данные Реестра детской кардиомиопатии. Тираж 2007 г.; 181
 и др.
и др.. Пренатальная молекулярная диагностика гипертрофической кардиомиопатии: отчет о первом случае. Prenat Diagn 2004;24:701–3.doi:10.1002/pd.969pmid:http://www.ncbi.nlm.nih.gov/pubmed/15386449
- Kar czewski KJ,
- Francioli LC,
- Тиао Г. и др.
. Спектр мутационных ограничений количественно определен по вариациям у 141 456 человек. Nature 2020;581:434–43.doi:10.1038/s41586-020-2308-7pmid:http://www.ncbi.nlm.nih.gov/pubmed/32461654
- Копанос С.,
- Циолкас В.,
- Коурис А. и др.
. VarSome: поисковая система геномных вариантов человека. Биоинформатика 2019;35:1978–80.doi:10.1093/bioinformatics/bty897
- Hoedemaekers YM,
- Cohen-Overb eek TE,
- Frohn-Mulder IME, et al
. Пренатальная ультразвуковая диагностика некомпактной кардиомиопатии MYH7.
