Чем гестоз опасен для плода: Чем опасен гестоз при беременности
Гестоз при беременности
Гестоз при беременности
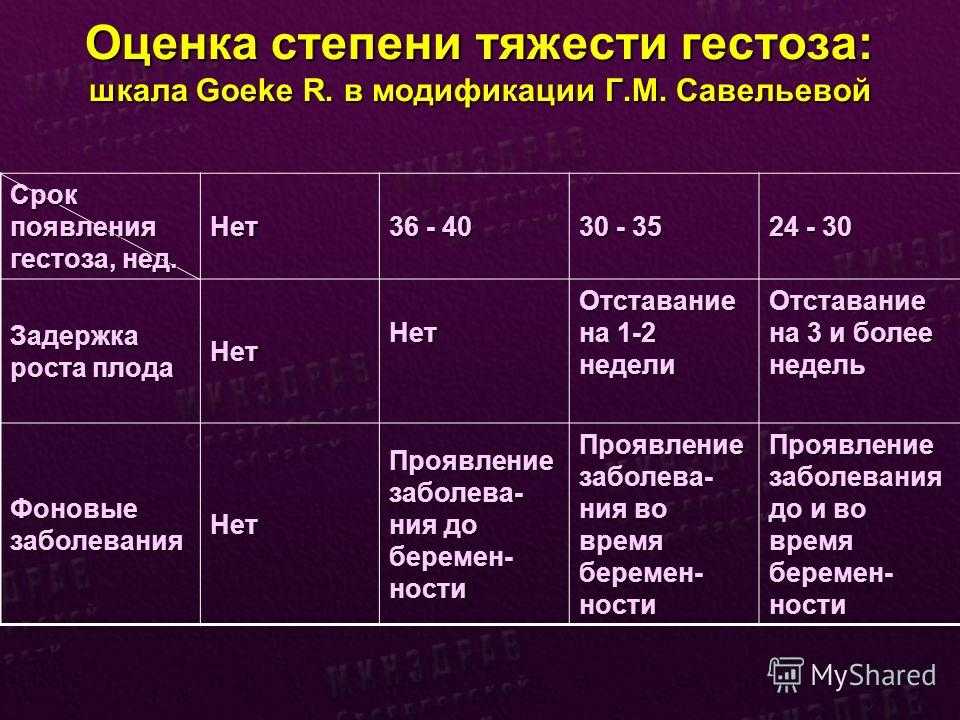
Гестоз при беременности на поздних сроках диагностируют у 15 % женщин. Основной причиной возникновения такого осложнения считают спазм артерий матки. При этом поражается их внутренняя оболочка и в кровь выбрасываются вещества, повышающие ее вязкость.
Отзывы пациенток о гестозе
Чем опасен гестоз, можно понять, рассмотрев влияние механизма его развития на внутренние органы. Спазм сосудов способствует уменьшению объема циркулирующей крови в организме, а ее густота становится причиной образования микротромбов. Органы испытывают недостаток в кислороде и питательных веществах в связи с нарушением кровоснабжения, что приводит к сбоям в их работе. Сначала изменения затрагивают клетки мозга, сердца, почек и печени, а при отсутствии своевременного лечения, патологический процесс распространяется на плаценту.
Стоимость лечения гестоза в нашей клинике
Поздний гестоз характеризуется следующими осложнениями:
почечная недостаточность
отек легких, приводящий к проблемам с дыханием
потеря зрения вследствие отслойки сетчатки
кома беременной
кровоизлияние в мозг и внутренние органы
смерть плода
артериальная гипертензия
инсульт
гипоксия плода, ведущая к задержке в его развитии
отслойка плаценты
летальный исход бермененной
жировой гепатоз
геморрагический шок
преждевременные роды
Самыми опасными последствиями являются смерть плода, кома и летальный исход беременной.
Поэтому женщинам при вынашивании ребенка необходимо регулярно сдавать анализы, которые помогут выявить признаки патологических изменений на ранних стадиях. Это позволит своевременно провести лечебные процедуры и не допустить развития опасных осложнений.
Спросите о лечении гестоза по WhatsApp 💬
Ведение беременности
Такие симптомы не всегда появляются одновременно, но наличие хотя бы одного из них является поводом заподозрить начальную стадию патологических изменений.
Повышенное давление при беременности может свидетельствовать о различных нарушениях, но его проявление в совокупности с вышеперечисленными симптомами указывает на позднюю стадию гестоза.
Самым первым признаком, возникающим на 22 неделе беременности, считают избыточную прибавку в весе. Еженедельно масса тела женщины увеличивается более, чем на 300-400г.
Протеинурия и отеки при беременности возникают вследствие превышения концентрации натрия в организме и снижение уровня белка в крови. Такие изменения обусловлены нарушением работы почек. Сначала отеки появляются на ногах, а затем распространяются по всему телу. При этом у женщины наблюдают следующие симптомы:
Такие изменения обусловлены нарушением работы почек. Сначала отеки появляются на ногах, а затем распространяются по всему телу. При этом у женщины наблюдают следующие симптомы:
частое мочеиспускание по ночам;
снижение количества выделяемой урины в сравнении с объемом выпитой жидкости;
пальцы распухают, и кольца привычного размера уже невозможно надеть.
Давление при беременности повышается на сроке в 29 недель. При увеличении его цифр до 140/90 и выше женщину обязательно госпитализируют.
Ведение беременности клинике ►
Стадии гестоза
Медики выделяют 4 этапа развития патологического состояния:
Беременность
Водянка
Характеризуется появлением скрытых отеков, которые постепенно приобретают явную форму. Увеличивается сверх нормы еженедельная прибавка в весе, кольца начинают сдавливать пальца или вовсе не одеваются, а резинки от носков оставляют существенные следы на щиколотках. Отеки на теле появляются в следующей последовательности: стопы – голени – живот – руки – лицо. 4 стадия водянки характеризуется отечностью всего тела.
Отеки на теле появляются в следующей последовательности: стопы – голени – живот – руки – лицо. 4 стадия водянки характеризуется отечностью всего тела.Нефропатия
Развивается вследствие нарушения работы почек. При этом у женщины наблюдаются все признаки гестоза. При отсутствии лечения нефропатия быстро переходит в следующую стадию патологического состояния.Преэклампсия
Является предпоследним этапом течения гестоза, характеризующимся нарушением мозгового кровообращения и сбоем в работе нервной системы. Женщины дополнительно жалуются на тошноту, боли в области затылка или висков, рвоту, частые перемены в психоэмоциональном состоянии, одышку, жар, сухой кашель, потемнение в глазах и снижение зрения. Риск преэклампсии высокий у беременных с наличием различных хронических патологий в анамнезе, поэтому такие женщины находятся под особым контролем у гинеколога.Эклампсия
Сопровождается судорогами, возникающими по причине разных раздражителей (неловкое движение, громкие звуки). Приступ начинается с подергивания лицевых мышц. Через некоторое время судороги распространяются по всему телу, и женщина теряет сознание. Наиболее опасной является эклампсия, когда на фоне повышенного давления беременная впадает в кому.
Приступ начинается с подергивания лицевых мышц. Через некоторое время судороги распространяются по всему телу, и женщина теряет сознание. Наиболее опасной является эклампсия, когда на фоне повышенного давления беременная впадает в кому.
Последняя стадия гестоза характеризуется высоким риском развития опасных осложнений, нередко приводящих к гибели женщины или плода.
Диагностика и лечение
Токсикоз при беременности
Ранний токсикоз при беременности возникает вследствие перестройки организма и считается нормальным явлением. Если такое состояние развивается во второй половине срока, то женщине проводят полное обследование и подбирают схему лечения на основании полученных результатов.
Для диагностики гестозов используют следующие методы:
Контроль еженедельной прибавки веса.
Осмотр глазного дна.
Анализы крови, по которым определяется уровень тромбоцитов, гепарина и лимфоцитов.
 Уменьшение этих показателей до определенных значений свидетельствует о развитии гестоза.
Уменьшение этих показателей до определенных значений свидетельствует о развитии гестоза.Измерение давления в различных позах через каждые 5 мин. Диагноз подтверждается при изменении нижней цифры более, чем на 20 пунктов.
По доплерографии определяют уровень кровотока в плаценте.
Анализ мочи на наличие белка.
Подсчет соотношения количества выделенной мочи к объему выпитой жидкости за сутки.
При подтверждении диагноза женщина должна регулярно проходить осмотр у узких специалистов и ультразвуковую допплерографию для оценки состояния плода.
Методика лечения гестоза при беременности зависит от стадии его течения. При легкой степени длительность ее проведения составляет 10 дней, при средней – 5, а при тяжелой – не более 6 ч. Женщину направляют в стационар и назначают медикаменты следующего действия, которые она принимает под строгим контролем врача:
Профилактика гестоза
Если терапия не приносит положительных результатов, то беременную готовят к родам. При тяжелой стадии процедуру осуществляют путем кесарева сечения. После операции лечение направлено на полное восстановление нормального функционирования пораженных органов.
При тяжелой стадии процедуру осуществляют путем кесарева сечения. После операции лечение направлено на полное восстановление нормального функционирования пораженных органов.
Профилактика
Предупредить развитие гестоза возможно не всегда, особенно если беременная относится к группе риска. Но с помощью следующих действий можно значительно снизить риск его возникновения:
посещение врача в строго указанное время;
отказ от курения и алкоголя;
лечение хронических патологий;
соблюдение принципов рационального питания;
обогащения меню витаминизированной пищей.
VIVI.clinicгинеколог, Гинекология, gyn1, rss, services_ginecology16 Comments
ГЕСТОЗ У БЕРЕМЕННЫХ Вопросы диагностики и акушерской тактики | #09/03
Является ли гестоз беременных самостоятельным заболеванием?
От чего зависит течение гестоза?
Какие степени нефропатии принято различать?
Какую патогенетическую терапию назначают при гестозе беременных?
Гестоз беременных представляет собой синдром полиорганной функциональной недостаточности, который развивается в результате беременности или обостряется в связи с беременностью. Основные его симптомы: патологическое увеличение массы тела, отеки, артериальная гипертензия, протеинурия, приступы судорог и/или кома. Гестоз беременных — не самостоятельное заболевание, это синдром, обусловленный несоответствием возможностей адаптационных систем организма матери адекватно обеспечить потребности развивающегося плода. Реализуется это несоответствие через различную степень выраженности перфузионно-диффузионной недостаточности плаценты.
Основные его симптомы: патологическое увеличение массы тела, отеки, артериальная гипертензия, протеинурия, приступы судорог и/или кома. Гестоз беременных — не самостоятельное заболевание, это синдром, обусловленный несоответствием возможностей адаптационных систем организма матери адекватно обеспечить потребности развивающегося плода. Реализуется это несоответствие через различную степень выраженности перфузионно-диффузионной недостаточности плаценты.
Выделяя отдельно гипертонию и протеинурию в группе гестозов, большинство зарубежных авторов при сочетании симптомов (отеки, протеинурия, гипертензия), независимо от степени их выраженности, определяют подобное состояние как преэклампсию. Таким образом подчеркивается трудность определения степени тяжести гестоза.
В нашей стране принята классификация, включающая четыре клинические формы гестоза: водянку, нефропатию, преэклампсию и эклампсию. Некоторые авторы признают существование еще одной моносимптомной клинической формы — гипертонии беременных, а также делят поздний гестоз на «чистый» и «сочетанный», т. е. развивающийся на фоне существовавших до беременности хронических заболеваний.
е. развивающийся на фоне существовавших до беременности хронических заболеваний.
Распространенность гестоза остается высокой (около 12—27%) и не имеет тенденции к снижению. Его течение во многом зависит от предшествующих заболеваний, в связи с чем выделяют неосложненные и сочетанные (осложненные) формы гестоза.
Тяжело и с неблагоприятными последствиями для плода и новорожденного протекает гестоз на фоне заболеваний почек. В последние годы отмечен рост числа случаев почечной патологии у беременных. Так, гестационный пиелонефрит определяется у 6—8% беременных, гломерулонефрит — у 0,1-0,2%.
Гестоз на фоне заболеваний почек развивается с 18—22 недели беременности. Раннее начало гестоза всегда должно настораживать — речь может идти о сочетанной форме заболевания. Наличие этого диагноза следует уточнить, так как лечение сочетанных форм имеет свои, очень существенные особенности. У беременных с заболеваниями почек и гестозом, особенно при выраженной гипертензии, нередко (5-6%) отмечается преждевременная отслойка нормально расположенной плаценты с тяжелыми последствиями для здоровья матери и плода.
Как правило, тяжело протекает гестоз на фоне гипертонической болезни. Даже нейроциркуляторная дистония по гипертоническому типу в сочетании с гестозом у некоторых женщин определяет тяжелое течение заболевания.
Гестоз, видимо, развивается в результате дисбаланса между материнскими антителами и антигенной структурой плода. При беременности, осложненной гестозом, увеличивается выработка антител и количество циркулирующих иммунных комплексов. Отложение этих комплексов на поверхности эндотелия вызывает агрегацию тромбоцитов, повреждение тканей, отложение фибрина. Кроме прямого повреждающего действия антител, они снижают синтез простациклина и тем самым нарушают способность сосудистой стенки предупреждать сосудистый спазм, агрегацию тромбоцитов и внутрисосудистый тромбоз. Снижение простациклина происходит параллельно повреждению эндотелиальных клеток. Возникают иммунные васкулиты с хориондецидуальными повреждениями, высвобождением тканевого тромбопластина, фибрина, фибриногена. Повреждение эндотелия вызывает ряд негативных последствий, которые наиболее ярко проявляются в виде гипертензии, протеинурии и отеков. Повреждение эндотелия довольно распространено, что позволяет отнести тяжелый гестоз в группу заболеваний эндотелия и обосновать неизбежность развития полиорганной недостаточности при этой патологии беременности.
Повреждение эндотелия вызывает ряд негативных последствий, которые наиболее ярко проявляются в виде гипертензии, протеинурии и отеков. Повреждение эндотелия довольно распространено, что позволяет отнести тяжелый гестоз в группу заболеваний эндотелия и обосновать неизбежность развития полиорганной недостаточности при этой патологии беременности.
Способность эндотелиальных клеток вырабатывать простациклин уменьшается при гипертонической болезни, сахарном диабете, ожирении, поэтому гестоз быстрее возникает на фоне сопутствующей экстрагенитальной патологии и всегда сопровождается тяжелой полиорганной недостаточностью. У беременных с пиелонефритом повышается уровень эндотоксина в крови с одновременным снижением антиэндотоксиновых антител. На фоне иммунного васкулита снижается выработка простациклина и увеличивается количество тромбоксана, что с ростом легочного и периферического сосудистого сопротивления ведет к повышению тонуса артериол, спазму сосудов головного мозга, агрегации тромбоцитов и ДВС-синдрому.
Существенный момент — определение степени тяжести гестоза. Не вызывает сомнения, что сочетанная форма гестоза может считаться наиболее тяжелой. Раннее начало гестоза и его наличие в течение более чем трех недель должны учитываться как неблагоприятные прогностические признаки.
Принято различать III степени нефропатии. При I степени возникают отеки ног, артериальное давление повышено на 25—30% (около 150/90 мм рт. ст.), отмечается умеренная протеинурия (до 1,0 г/л). При II степени заболевания выявляются выраженные отеки ног, брюшной стенки, артериальное давление повышается на 40% по отношению к начальному уровню (170/100 мм рт. ст.), протеинурия более выражена (от 1,0 до 3,0 г/л). Для III степени характерны резко выраженные отеки ног, брюшной стенки, лица, повышение артериального давления по отношению к его начальному уровню более чем на 40% (выше 170/100 мм рт. ст.) и выраженная протеинурия с содержанием белка в моче (более 3,0 г/л). Это деление не всегда оправдывает себя на практике, так как и при нефропатии II степени (а иногда и I степени) возможны тяжелые осложнения и развитие в преэклампсии и эклампсии. Поэтому многие акушеры выделяют легкую и тяжелую формы нефропатии. Тяжелая нефропатия может рассматриваться как преэклампсия; больные при этом нуждаются в интенсивной терапии, а при недостаточной ее эффективности — в немедленном родоразрешении.
Поэтому многие акушеры выделяют легкую и тяжелую формы нефропатии. Тяжелая нефропатия может рассматриваться как преэклампсия; больные при этом нуждаются в интенсивной терапии, а при недостаточной ее эффективности — в немедленном родоразрешении.
Классическая «триада» симптомов наблюдается в 28—50% случаев. В настоящее время клиническое течение гестоза характеризуют стертость течения и увеличение числа малосимптомных, атипичных форм заболевания. Однако эти формы гестозов не менее опасны, чем осложнение с выраженными симптомами.
Диагноз заболевания и определение степени его тяжести должны быть основаны на оценке изменений сердечно-сосудистой системы, функции печени, почек, легких, нервной системы и состояния плода. Основной признак гестоза — гипертензивный синдром. Важны не абсолютные цифры максимального и минимального артериального давления, а повышение давления по сравнению с исходным, а также изучение его в динамике.
Особое значение имеют повышение диастолического и уменьшение пульсового давления (до 30 мм рт. ст. и ниже). Выявлена зависимость между тяжестью гестоза и степенью асимметрии артериального давления: чем выраженнее асимметрия, тем тяжелее протекает гестоз. Уже при нетяжелом течении гестоза существенно нарушается центральная гемодинамика. Снижается объем циркулирующей крови, центральное и периферическое венозное давление, уменьшается величина сердечного выброса, повышается периферическое сосудистое сопротивление, отмечаются метаболические нарушения в миокарде. Высокие показатели гематокрита (более 0,42 мг/л) свидетельствуют о тяжелой степени гестоза.
ст. и ниже). Выявлена зависимость между тяжестью гестоза и степенью асимметрии артериального давления: чем выраженнее асимметрия, тем тяжелее протекает гестоз. Уже при нетяжелом течении гестоза существенно нарушается центральная гемодинамика. Снижается объем циркулирующей крови, центральное и периферическое венозное давление, уменьшается величина сердечного выброса, повышается периферическое сосудистое сопротивление, отмечаются метаболические нарушения в миокарде. Высокие показатели гематокрита (более 0,42 мг/л) свидетельствуют о тяжелой степени гестоза.
О степени тяжести гестоза можно судить по нарушению функции почек. Для определения выраженности протеинурии целесообразно исследование суточной порции мочи, так как выделение белка в течение суток может значительно варьировать. Раньше других страдает концентрационная функция почек. Параллельно нарастанию тяжести гестоза снижается суточный диурез. О нарушении азотовыделительной функции почек при гестозе судят по повышению концентрации мочевины и креатинина в крови.
Наиболее характерными признаками поражения печени является нарушение ее белково-образовательной и антитоксической функции. Количество белка в плазме крови у больных с гестозом значительно снижается, так же как и величина коллоидно-онкотического давления плазмы. Наиболее резко уменьшается содержание альбумина. Гипопротеинемия является не только следствием нарушения белково-образовательной функции печени, но и зависит от потери белка во внеклеточное пространство и выделения его с мочой за счет повышенной проницаемости сосудистой стенки.
Изменения центральной и периферической нервной системы могут возникать периодически и быстро исчезать, но в ряде случаев они носят стойкий патологический характер. Головная боль, нарушение зрения, тошнота, рвота, различной степени нарушения сознания являются признаками гипертензивной энцефалопатии.
Прогрессирующий гестоз с длительным нарушением микроциркуляции в конечном счете приводит к развитию внутричерепной гипертензии, острым нарушениям мозгового кровообращения, появлению судорожной готовности, развитию эклампсии и коматозного состояния.
У больных с тяжелыми формами гестоза наблюдаются нарушения функции дыхания, причем при эклампсии может развиться острая дыхательная недостаточность, проявляющаяся двигательным возбуждением, цианозом, одышкой, расстройством ритма дыхания.
Тромбоцитопения разной степени тяжести отмечается почти у 1/3 беременных с гестозом. Более того, тромбоцитопения может на несколько недель «опережать» другие проявления этого осложнения. Чем тяжелее гестоз, тем более выражено уменьшение количества тромбоцитов. Тромбоцитопения может отмечаться и при отсутствии выявляемых изменений в системе свертывания. Поэтому рекомендуется обязательно сделать анализ на содержание тромбоцитов в рамках общего обследования с целью оценки состояния беременных и ухода за ними в поздние сроки беременности. Степень тромбоцитопении соответствует степени риска для плода, независимо от тяжести клинического состояния больной.
Характерные для гестоза сосудистые нарушения влекут за собой ухудшение доставки кислорода и других метаболитов к тканям матери и плода. Отмечается прямая зависимость между степенью нарушения кислородного снабжения тканей, состоянием плода и тяжестью гестоза. Наблюдаются выраженные дистрофические изменения эндотелия сосудов (облитерирующий ангиит), отек и склероз стромы ворсин, а также тромбоз их сосудов и межворсинчатого пространства, ишемические нефриты, кровоизлияния в децидуальную оболочку и строму ворсин, ретроплацентарная гематома, некроз отдельных ворсин, утолщение базальной мембраны трофобласта. Одновременно в плаценте снижается содержание эстрогенных гормонов и прогестерона, что, вероятно, обусловлено ее гипоксией (при выраженной ишемии плаценты синтез прогестерона блокируется). Наряду с деструктивными поражениями в плаценте при гестозе обнаруживаются такие компенсаторно-приспособительные изменения, как гиперваскуляризация, полнокровие ворсин, пролиферация эпителия, развитие новых ворсин. Однако, несмотря на увеличение массы плаценты, в полной мере эти изменения предупредить гипоксию плода не могут.
Отмечается прямая зависимость между степенью нарушения кислородного снабжения тканей, состоянием плода и тяжестью гестоза. Наблюдаются выраженные дистрофические изменения эндотелия сосудов (облитерирующий ангиит), отек и склероз стромы ворсин, а также тромбоз их сосудов и межворсинчатого пространства, ишемические нефриты, кровоизлияния в децидуальную оболочку и строму ворсин, ретроплацентарная гематома, некроз отдельных ворсин, утолщение базальной мембраны трофобласта. Одновременно в плаценте снижается содержание эстрогенных гормонов и прогестерона, что, вероятно, обусловлено ее гипоксией (при выраженной ишемии плаценты синтез прогестерона блокируется). Наряду с деструктивными поражениями в плаценте при гестозе обнаруживаются такие компенсаторно-приспособительные изменения, как гиперваскуляризация, полнокровие ворсин, пролиферация эпителия, развитие новых ворсин. Однако, несмотря на увеличение массы плаценты, в полной мере эти изменения предупредить гипоксию плода не могут.
При гестозах наблюдается активация процессов перекисного окисления липидов (ПОЛ). Продукты ПОЛ являются высокотоксичными веществами, повреждающими мембраны. Известно, что имеющаяся при гестозе гипоксия матери и плода создает благоприятные условия для так называемого оксигеназного пути утилизации кислорода. Кроме того, гестоз сопровождается снижением содержания таких эндогенных антиоксидантов, как витамины, особенно витамина Е. Поэтому в комплексную терапию гестоза целесообразно включать витамины.
Продукты ПОЛ являются высокотоксичными веществами, повреждающими мембраны. Известно, что имеющаяся при гестозе гипоксия матери и плода создает благоприятные условия для так называемого оксигеназного пути утилизации кислорода. Кроме того, гестоз сопровождается снижением содержания таких эндогенных антиоксидантов, как витамины, особенно витамина Е. Поэтому в комплексную терапию гестоза целесообразно включать витамины.
Диффузионная недостаточность плаценты в основном связана с утолщением синцитикапиллярной мембраны (отек, воспалительная инфильтрация), что, безусловно, затрудняет газообмен через плаценту и существенно ухудшает ее негазообменные функции (барьерную, фильтрационно-очистительную, терморегуляционную, метаболическую, эндокринную, иммунную и др.) либо изменяет физико-химические характеристики ткани, входящей в состав плацентарной мембраны (фиброз и т. д.). Нарушения перфузии и диффузии тесно связаны друг с другом. Но существует и плацентарная перфузионно-диффузионная недостаточность с синдромом мозаичного поражения плаценты, с тромбозом и ишемией на одном участке, с геморрагией и отеком — на другом.
Важным аспектом являются показания к родоразрешению беременных с различной степенью тяжести гестоза. Длительное течение гестоза часто оказывается более неблагоприятным фактором для матери и плода, чем выраженность его клинических проявлений. При длительном течении заболевания неизбежны хроническая гипоксия, хронические нарушения периферического кровообращения с развитием синдрома ДВС. Чем тяжелее заболевание, тем менее длительным должно быть его лечение, тем раньше нужно ставить вопрос о родоразрешении. Нередко родоразрешение является основным методом лечения гестоза, а иногда и единственной возможностью спасения матери и плода.
Родоразрешение для больных с гестозом представляет дополнительную нагрузку, в связи с чем больную следует готовить к нему, применяя интенсивную терапию и тщательно оценивая ее эффективность. Нужно помнить, что родоразрешение является одним из элементов комплексной терапии и осуществляется гораздо бережнее при соответствующей подготовке.
Немедленное родоразрешение необходимо обеспечить при эклампсии, тяжелых осложнениях гестоза (эклампсическая кома, острая почечно-печеночная недостаточность, кровоизлияние в мозг, отслойка сетчатки глаза).
Срочное родоразрешение показано при отсутствии эффекта от интенсивной терапии преэклампсии в течение 4—6 ч, тяжелой нефропатии — 1-2 дней, нефропатии средней тяжести — 5—7 дней, легкой нефропатии — 12—14 дней. Дополнительным показанием к родоразрешению являются признаки фетоплацентарной недостаточности (внутриутробная гипоксия и гипотрофия плода). При необходимости родоразрешения у беременных с нефропатией и готовности организма к родам (при биологической «зрелости» шейки матки) методом выбора является родовозбуждение после амниотомии. При отсутствии родовой деятельности в течение 2-3 ч после амниотомии следует приступить к родовозбуждению путем внутривенного капельного введения окситоцина, простагландина или их сочетания. При «незрелой» шейке матки для родовозбуждения целесообразнее использовать простагландины. При невозможности вызвать роды вопрос решается в пользу абдоминального родоразрешения.
При невозможности вызвать роды вопрос решается в пользу абдоминального родоразрешения.
У некоторых больных с гестозом оперативное родоразрешение путем кесарева сечения наиболее целесообразно. При решении вопроса о производстве кесарева сечения у больных с тяжелыми формами гестоза следует тщательно оценивать состояние матери, плода, эффективность интенсивной терапии. Кесарево сечение целесообразно производить у женщин с тяжелой нефропатией при неподготовленных родовых путях, при отсутствии эффекта от интенсивной терапии в течение суток. Оно показано также при отсутствии эффекта от родовозбуждения у больной с тяжелой нефропатией, а также при возникновении аномалий родовой деятельности; у больной с эклампсией в родах при отсутствии условий для быстрого родоразрешения через естественные родовые пути. Кесарево сечение является методом выбора при преэклампсии, не поддающейся интенсивной терапии в течение 3-5 ч, при невозможности родоразрешения через естественные родовые пути.
Во время родов течение гестоза, как правило, усугубляется, и нетяжелая нефропатия может приобретать признаки тяжелой с сомнительным прогнозом и возможностью тяжелых осложнений. В связи с этим особого внимания заслуживают детали ведения родов у больных гестозом.
При родах необходимо проводить тщательный контроль за состоянием гемодинамики, дыхания, функции почек, печени и биохимических показателей, родовой деятельности и состоянием плода.
В случае утомления роженицы и недостаточной эффективности родовой деятельности показано применение лечебного акушерского сна.
Частью патогенетической терапии является обезболивание родов, которое должно быть тщательным и адекватным. Выбор способа обезболивания родов зависит от степени тяжести гестоза. При нефропатии I степени достаточно использование промедола в сочетании со спазмолитическими и седативными средствами. При нефропатии II-III степени методом выбора является длительная перидуральная анестезия.
Опасность возникновения эклампсии, кровоизлияния в мозг, сетчатку глаза особенно увеличиваются во втором периоде родов в связи с резко возрастающей во время потуг физической и эмоциональной нагрузкой, ведущей к повышению артериального и внутричерепного давления. Для обезболивания во втором периоде родов можно применять ингаляцию закисью азота с кислородом и пудендальную анестезию.
Применяющиеся с целью лечения гестозов седативные, аналгезирующие, ганглиоблокирующие и спазмолитические средства одновременно регулируют сократительную деятельность матки, поскольку приводят к нормализации нарушенных нейродинамических процессов в высших отделах ЦНС, являющихся одной из основных причин аномалии родовых сил. В то же время нужно помнить, что чрезмерное использование большого количества седативных и наркотических средств может стать причиной нарушения ауторегуляции с последующим ухудшением таких жизненно важных процессов, как гемодинамика, дыхание, эндокринная регуляция и др. Подобное состояние на современном этапе трудно контролировать. С целью снижения внутриматочного и внутрибрюшного давления показано раннее вскрытие плодного пузыря.
Подобное состояние на современном этапе трудно контролировать. С целью снижения внутриматочного и внутрибрюшного давления показано раннее вскрытие плодного пузыря.
Гипотензивная терапия при родах осуществляется внутривенным введением серно-кислого магния, дибазола, спазмолитических препаратов. По мере развития родовой деятельности гипотензивную терапию следует проводить более интенсивно, поскольку артериальное давление имеет тенденцию к повышению.
При подъеме артериального давления и отсутствии эффекта от примененных ранее гипотензивных средств целесообразно использование ганглиоблокаторов под постоянным контролем артериального давления. Снижение артериального давления под воздействием ганглиоблокаторов является следствием увеличения сосудистого русла. В результате уменьшения периферического сопротивления происходит перераспределение крови в мелкие сосуды большого круга кровообращения.
Появление неврологической симптоматики (головная боль, тошнота, рвота), нечувствительность роженицы к медикаментозной терапии, признаки угрожающей асфиксии плода являются показаниями к окончанию родов с помощью акушерских щипцов или экстракции плода за тазовый конец (при мертвом плоде — плодоразрушающей операции) под наркозом. При гестозе не используют вакуум-экстракцию плода, так как она не отвечает основной цели — исключению потуг — и может привести к травматизации плода.
При гестозе не используют вакуум-экстракцию плода, так как она не отвечает основной цели — исключению потуг — и может привести к травматизации плода.
В настоящее время расширены показания к кесареву сечению при эклампсии. К ним относятся — отсутствие быстрого эффекта от применения комплексной интенсивной терапии у беременных и рожениц в первом периоде родов (в течение 1-2 ч), неподготовленные родовые пути у беременных даже при наличии достаточного эффекта от проведения комплексной интенсивной терапии, осложненное течение родов (нарушение сократительной деятельности матки, острая гипоксия плода и др.).
При подготовленных родовых путях и доношенной беременности возможно родовозбуждение путем амниотомии и введения окситоцина и простагландинов. Во втором периоде показано выключение потуг с помощью акушерских щипцов. При незрелом плоде решение об оптимальном времени родоразрешения беременной с эклампсией проводиться с учетом определения степени риска недоношенности и, с другой стороны, опасности продолжения беременности как для матери, так и для плода.
В последние годы тактика превентивного кесарева сечения у беременных с эклампсией пересматривается благодаря наличию методов мониторного контроля за функциональным состоянием жизненно важных органов и систем матери и плода. Установлено, что сократительная деятельность матки после перенесенных судорожных припадков у большинства женщин не нарушается, следовательно, проведение родов через естественные родовые пути на фоне вспомогательной вентиляции и комплексной интенсивной терапии возможно.
Противосудорожная и гипотензивная терапия с применением адекватной аналгезии должна продолжаться на протяжении всего родового акта. Больной необходимо находиться в положении на боку для профилактики развития синдрома нижней полой вены. Перидуральная анестезия может быть использована только при необходимости и проводиться лишь опытным анестезиологом.
В третьем периоде и сразу после родов артериальное давление часто повышается вследствие увеличения периферического сопротивления, вызванного прекращением маточно-плацентарного кровотока и аутотрансфузией крови в матке. Для предотвращения осложнений в течение первых 60 мин после родов всех больных с тяжелой формой гипертензии необходимо обследовать; величину АД и частоту сердечных сокращений следует измерять каждые 15 мин. При тенденции к артериальной гипертензии дозу гипотензивных препаратов повышают и продолжают антисудорожную терапию в течение 24 ч после родоразрешения.
Для предотвращения осложнений в течение первых 60 мин после родов всех больных с тяжелой формой гипертензии необходимо обследовать; величину АД и частоту сердечных сокращений следует измерять каждые 15 мин. При тенденции к артериальной гипертензии дозу гипотензивных препаратов повышают и продолжают антисудорожную терапию в течение 24 ч после родоразрешения.
С практической точки зрения опасна не степень тяжести артериальной гипертензии, а связанные с резкими колебаниями АД осложнения, которые и являются причиной смерти плода, отставания его в развитии, гипоксии, преждевременных родов, преждевременной отслойки нормально расположенной плаценты. Поэтому при выявлении стойкой гипертензии беременных госпитализируют и назначают следующее лечение:
- постельный режим в положении на боку во избежании аортокавальной гипотензии и провокации ишемии почек;
- седативные препараты, которые оказывают успокаивающее действие, подавляют чувство тревоги, внутренней напряженности, снижают повышенную возбудимость;
- гипотензивные препараты, применяемые в комплексе со средствами, улучшающими внутриплацентарную перфузию.

В. Н. Кузьмин, доктор медицинских наук, профессор
МГМСУ, Москва
Отеки во время беременности. Что делать
Сайт предоставляет справочную информацию. Адекватная диагностика и лечение болезни возможны под наблюдением добросовестного врача. У любых препаратов есть противопоказания. Необходима консультация специалиста, а также подробное изучение инструкции!
Во время беременности количество жидкости в организме женщины увеличивается в 2 раза. Сердце, почки и сосуды не подготовлены к таким нагрузкам. В связи с этим с 30-й недели у многих беременных появляются отеки. При развитии позднего токсикоза (гестоза) женщины отмечают развитие отеков с 18-й недели. Невысокие женщины больше страдают от отеков в силу особенностей строения тела.
Признаками отеков могут быть появление мешков под глазами, одутловатость лица, следы от резинок, оставленных носками, увеличение объема пальцев. Также женщина может замечать, что стало сложно снимать кольца, а привычная обувь стала тесной. Все это признаки задержки жидкости, которая скапливается между клетками в тканях и органах. Под действием силы тяжести вода опускается вниз, поэтому в первую очередь страдают нижние отделы тела – стопы и лодыжки. Со временем отечность может распространиться на другие органы – лицо, руки, кожу живота и поясницы, слизистые оболочки носа и половых органов.
Все это признаки задержки жидкости, которая скапливается между клетками в тканях и органах. Под действием силы тяжести вода опускается вниз, поэтому в первую очередь страдают нижние отделы тела – стопы и лодыжки. Со временем отечность может распространиться на другие органы – лицо, руки, кожу живота и поясницы, слизистые оболочки носа и половых органов.
Причины отеков во время беременности
Почему возникают отеки у беременных? Появление отеков может быть связано с физиологическими (нормальными) изменениями в организме или указывать на проблемы со здоровьем. В связи с этим врачи разделяют физиологические и патологические отеки.
Причины физиологических отеков во время беременности
Даже у здоровых женщин при нормальном протекании беременности значительно повышается вероятность развития отеков. Этому способствуют естественные изменения, проходящие в период вынашивания ребенка:
- Дополнительная нагрузка на сердце.
 Во время беременность объем крови увеличивается на 50%, что создает дополнительную нагрузку. Часто сердце не в состоянии прокачать кровь к отдаленным участкам тела, например, к стопам или кистям рук. Это приводит к застою крови в венах и нарушению ее оттока из тканей, что вызывает отечность.
Во время беременность объем крови увеличивается на 50%, что создает дополнительную нагрузку. Часто сердце не в состоянии прокачать кровь к отдаленным участкам тела, например, к стопам или кистям рук. Это приводит к застою крови в венах и нарушению ее оттока из тканей, что вызывает отечность. - Нарушения работы сосудов. Стенки сосудов становятся более проницаемыми, и через них в межклеточное пространство выходит больше жидкости. Изменение эластичности и тонуса сосудов негативно влияет на их работу, ухудшает кровообращение и отведение крови и лимфы от тканей.
- Увеличение нагрузки на почки. Во время беременности почки работают интенсивнее, чтобы очистить от токсинов кровь матери и плода. Случается, что работа почек нарушается, и часть жидкости, которая должна была вывестись с мочой, выходит обратно в кровь.
- Изменение водно-солевого баланса. Повышенная концентрация в организме натрия (составляющей поваренной соли) вызывает задержку жидкости в тканях, что приводит к отечности.
 Увеличение концентрации натрия возникает при токсикозе или при потреблении соленых продуктов.
Увеличение концентрации натрия возникает при токсикозе или при потреблении соленых продуктов. - Гормональные изменения. Высокий уровень прогестерона может сопровождаться склонностью к отекам. В последние недели беременности физиологические отеки расцениваются, как подготовка организма к родам, когда за счет задержки жидкости увеличивается объем крови.
- Увеличение потребления жидкости. Беременные женщины потребляют больше воды, чем требуется, особенно в жаркие дни. А излишек воды к вечеру скапливается между клетками в тканях.
- Крупный плод или многоплодная беременность практически всегда сопровождаются обширными физиологическими отеками.
Физиологические отеки не несут опасности для матери и плода, хотя причиняют некоторые неудобства. Они появляются у 80% беременных женщин, и проходят без лечения. Отличительные особенности физиологических отеков:
- Не распространяются более чем на 1-2 участка тела;
- Выражены незначительно;
- Самостоятельно проходят к утру.

Нормальный анализ мочи – главный признак того, что нет причин для опасения.
Причины патологических отеков во время беременности:
- Заболевания почек. Почечные отеки начинаются с мешков под глазами, затем переходят на овал лица, после чего распространяются на руки и ноги.
- Болезни сердца – отеки сопровождаются одышкой, учащенным сердцебиением, синюшностью губ, повышенной утомляемостью.
- Многоводие – увеличение количества амниотической жидкости. Проявляется отечностью брюшной стенки, сильным токсикозом (тошнотой, рвотой), болью в паху и животе, увеличением объема живота, увеличением количества околоплодных вод по результатам УЗИ.
- Сосудистые патологии. Спазм артерий и расширение вен приводят к нарушению оттока крови от участков тела, удаленных от сердца, и к нарушению питания тканей, что может негативно сказаться на состоянии здоровья матери и развитии плода.

- Гестоз – поздний токсикоз беременных, приводящий к серьезным нарушениям работы почек, сердца и сосудов. Выявляется у 15-20% беременных после 20-й недели. Обширные отеки распространяются на все тело, включая внутренние органы, их сопровождает повышение давления (верхнего на 30 мм.рт.ст, а нижнего на 15 мм.рт.ст) и появление белка в моче. Задержка жидкости в тканях приводит к уменьшению объема циркулирующей крови и ухудшению питания всех органов матери и плода.
Патологические отеки всегда связаны с нарушением здоровья. Их отличительными признаками является:
- Увеличение отеков в утреннее время после ночного сна;
- Резкая прибавка в весе на третьем триместре;
- Уменьшение количества отделяемой за день мочи;
- Одышка и учащенное сердцебиение;
- Появление мешков под глазами.
Отеки на ногах во время беременности
Отеки стоп и лодыжек – самая частая жалоба, которую приходится слышать гинекологу от беременных женщин. В большинстве случаев это не опасные физиологические отеки, появляющиеся после 30-й недели. Их признаки:
В большинстве случаев это не опасные физиологические отеки, появляющиеся после 30-й недели. Их признаки:
- Следы от носков и швов одежды подолгу заметны на лодыжках;
- После надавливания пальцем на голень остается ямка;
- Ноги отекают во вторую половину дня;
- Отеки не поднимаются выше колен;
- Отечность сходит после ночного сна.
Повод для консультации с врачом:
- Отеки на ногах после ночного сна. Во время сна в горизонтальном положении тонус сосудов улучшается и облегчается работа сердца. Если в таких условиях отечность не прошла, то необходимо найти причину.
- Асимметричные отеки ног у беременных говорят о проблемах с венами. Отек, более заметный на одной ноге – повод обратиться к врачу-флебологу. Возможно, растущая матка сдавливает вены с одной стороны тела.
- Плотные отеки на ногах в конце дня, которые сопровождаются слабостью, повышенной утомляемостью, головокружением и одышкой – признак того, что сердцу сложно обеспечить нормальное кровообращение.

Подпишитесь на Здоровьесберегающий видеоканал
Отеки рук во время беременности
Отеки рук довольно часто возникают у женщин на разных этапах беременности, особенно в 3-м триместре. Преимущественно отечность развивается к концу дня, если руки находились в одном положении, что бывает при работе за компьютером или при занятии рукоделием.
Признаки отеков на руках:
- Видимое увеличение объема пальцев и кистей, которое можно заметить по следам от колец или резинок одежды;
- Сложности со сниманием и надеванием колец;
- Трудности при попытке сжать руку в кулак;
- Покалывание и чувство онемения в пальцах, возникающее из-за сдавливания нерва отечными тканями.
Патологические отеки рук имеют характерные проявления:
- Отек кистей рук в сочетании с отеком лица может говорить о заболевании почек.
- Отек рук после 20-й недели. В ряде случаев гестоз вызывает скрытые отеки, которые могут быть не заметны визуально.
 Об их развитии можно судить только по патологической прибавке в весе и отекам пальцев.
Об их развитии можно судить только по патологической прибавке в весе и отекам пальцев.
Отеки на лице во время беременности
Физиологическая отечность лица – частое явление перед родами. Лицо выглядит одутловатым, подбородок, нос и губы несколько увеличиваются в объеме, однако нет мешков под глазами. Это состояние может расстраивать женщину, но не причиняет дискомфорта. Незначительные изменения формы лица, связанные с общим увеличением веса, появляются у всех беременных на поздних сроках.
Признаки патологических отеков:
- Припухлость век – кожа здесь тонкая, а мышц мало, поэтому появление воды между клетками приводит к заметным изменениям и образованию мешков под глазами. Утренние отеки век – ранний признак болезни почек.
- Распространение отеков с лица на другие органы. При отсутствии лечения через несколько дней почечные отеки распространяются на шею, кисти рук и другие участки тела. Ухудшается общее самочувствие, появляются головная боль, слабость и тошнота.
 Почечные отеки более выражены утром, чем в вечерние часы.
Почечные отеки более выражены утром, чем в вечерние часы.
Утренние отеки, начинающиеся с лица, могут быть признаком проблем с почками. Нарушения в сосудистых клубочках почек приводят к повышению проницаемости их сосудистой мембраны. В связи с этим часть жидкости, которая должна была вывестись с мочой, отправляется обратно в кровь. А в мочу из крови попадают молекулы белка и эритроциты.
Нефрозы и нефриты, которые проявляются отеками на лице у беременных, опасны не только задержкой жидкости в организме. При болезнях почек из организма не выводятся токсины, образовавшиеся в результате жизнедеятельности матери и плода. Эти вещества оказывают отравляющее действие, негативно влияют на развитие ребенка и здоровье женщины.
Отеки кожи и слизистых во время беременности
Отеки кожи и слизистых у беременных связаны с нарушением баланса прогестерона и эстрогенов. Из-за гормональных нарушений происходит накопление жидкости между клетками кожи и слизистых оболочек. Такие отеки могут появиться в любом периоде, но чаще беспокоят женщину в первом и третьем триместре. Их проявления:
Такие отеки могут появиться в любом периоде, но чаще беспокоят женщину в первом и третьем триместре. Их проявления:
- Кожа становится рыхлой и грубой, поры более глубокими;
- При нажатии пальцем на кожу остается ямка, которая может быть заметна или чувствоваться только на ощупь;
- Появляется заложенность носа, не связанная с простудными заболеваниями или аллергией;
- Усиливаются прозрачные выделения из носа;
- Отек слизистых половых органов проявляется обильными слизистыми выделениями из половых путей.
Отек слизистых оболочек носа и половых органов не опасен. Он сойдет самостоятельно, когда гормональный фон придет в норму. Однако отечные слизистые больше подвержены развитию инфекции, поскольку на этих участках снижается местный иммунитет. Поэтому необходимо уделять особое внимание гигиене и профилактике развития инфекций.
Для облегчения дыхания желательно пользоваться каплями на натуральных эфирных маслах. Рекомендовано промывать нос солевым раствором. Его можно купить в аптеке или приготовить самостоятельно (1 ч.л. соли на литр кипяченой воды). Также помогает массаж крыльев носа. Он улучшает кровообращение и способствует устранению отечности. Использовать сосудосуживающие капли можно только с разрешения врача и, желательно, в детской дозировке.
Его можно купить в аптеке или приготовить самостоятельно (1 ч.л. соли на литр кипяченой воды). Также помогает массаж крыльев носа. Он улучшает кровообращение и способствует устранению отечности. Использовать сосудосуживающие капли можно только с разрешения врача и, желательно, в детской дозировке.
Патологические отеки кожи у беременных:
- Отек кожи на обширных участках, особенно выше колен и локтей, может говорить о гестозе. Вмятина, образующаяся на коже после надавливания пальцем, которая не исчезает на протяжении 15-20 секунд – повод для консультации у гинеколога. Гестоз опасен осложнениями для матери и плода. Это состояние лечат в стационаре, поэтому не стоит отказываться от госпитализации, если есть подозрение развитие позднего токсикоза.
Общие отеки во время беременности
Общие (генерализованные) отеки называют водянкой беременных. Это состояние возникает в том случае, если плазма крови выходит в межклеточное пространство. Как следствие, изменяются свойства крови, что со временем может привести к гипоксии плода.
Как следствие, изменяются свойства крови, что со временем может привести к гипоксии плода.
Общие отеки могут быть явными и скрытыми. Первые заметны визуально, а вторые можно определить по патологической прибавке в весе. Если во время беременности женщина поправилась на 18 и более килограмм, то врачи считают, что у нее есть отеки.
Общие отеки при многоплодной беременности на сроке после 27 недель развиваются у большинства женщин. Такое состояние не требует специального лечения.
Распространенные отеки на фоне высокого давления и протеинурии (наличии белка в моче) указывают на развитие гестоза. Его признаками являются:
- Отеки всего тела, усиливающиеся к вечеру;
- Отек поясницы и брюшной стенки, которые мешают наклониться вперед независимо от размеров живота;
- При надавливании на кожу живота или поясницы остаются заметные вмятины;
- Количество выделяемой мочи значительно меньше объема выпитой жидкости;
- Слабость, тошнота.

При развитии гестоза беременную направляют на лечение в стационар.
Диагностика отеков у беременных
В некоторых случаях бывает сложно отличить физиологические отеки, которые не требуют лечения, от патологических. В этом случае применяют дополнительные способы диагностики:
- Анализ мочи – общий и суточный. При патологических отеках, связанных с заболеванием почек, в моче обнаруживается белок.
- Измерение соотношения потребляемой жидкости и выделяемой мочи. Количество мочи должно составлять не менее 80% от выпитого. Уменьшение количества мочи и редкое мочеиспускание говорят о том, что жидкость накапливается в тканях.
- Биохимический анализ крови. Определение уровня электролитов, белка, мочевины, креатинина позволяет узнать, насколько хорошо почки и другие внутренние органы выполняют свои функции.
- Еженедельное взвешивание. На появление скрытых отеков и накопление жидкости в тканях указывает прибавка более 300 грамм в неделю.

- Осмотр глазного дна. Состояние вен глазного дна отражает состояние сосудов мозга и всего организма. Расширение вен говорит о застое в них крови и нарушении кровообращения.
- Измерение артериального давления на обеих руках. Значительная разница показателей говорит о сосудистом спазме. Значительное повышение давления указывает на развитие гестоза.
- Волдырная проба. В кожу предплечья вводят 0,2 мл физиологического раствора. На склонность к отекам указывает волдырь, который не рассасывается более 60 минут.
- Измерение окружности голени. Беременной еженедельно измеряют окружность голеностопного сустава. Увеличение на 1 см и более говорит о развитии отеков.
- Внешний осмотр. При водянке беременных, вызванной нарушением водно-солевого баланса, кожа женщины становится глянцевой. При проблемах с почками отмечается характерная бледность, а при болезнях сердца кожа приобретает синюшный оттенок.

Как избавиться от отеков во время беременности
Беременной женщине под силу избавиться от физиологических отеков и предотвратить их развитие. А вот патологические отеки, которые сопровождаются появлением белка в моче и повышением артериального давления, требуют специального лечения, которое может назначить только врач.
Для лечения отеков беременным необходимо:
- придерживаться молочно-растительной диеты – потреблять творог, кисломолочные напитки, овощи и фрукты, а также курицу, нежирное мясо и рыбу;
- потреблять продукты, обладающие мягким мочегонным действием – арбуз, дыню, яблоки, клубнику, клюкву, бруснику, ежевику, гранаты, цитрусовые, абрикосы, курагу, морковь, свеклу, огурцы;
- уменьшить потребление соли до 1,5 г/сутки;
- полностью исключить соленья, консервы, копченые и маринованные продукты, чипсы и фаст-фуд, которые содержат много соли. Снижение концентрации натрия позволит избежать задержки жидкости в тканях, и лишняя вода будет выводиться почками.

- Питьевой режим
Беременная женщина должна пить не менее 1-1,5 литра воды в день, если врач не установил другую норму. При этом исключают соленые минеральные воды и сладкие газированные напитки. Наилучшим вариантом будет чистая вода.
Не стоит пытаться избавиться от отеков, потребляя жидкости меньше нормы. Вода необходима для пополнения амниотической жидкости, удаления продуктов обмена и подготовки организма к родам.
Многих женщин интересует вопрос: «что пить от отеков во время беременности?». Врачи рекомендуют беременным от отеков толокнянку, бруснику, клюкву, чай с цикорием или ромашкой.
При почечных отеках беременным назначают препараты Фитолизин и Канефрон. Эти средства на растительной основе улучшают работу почек, способствуя выведению жидкости. Однако они имеют противопоказания, и их не стоит использовать для самолечения.
Для улучшения тонуса сосудов беременной рекомендуют проводить больше времени в лежачем положении. Это облегчает работу сердца и помогает улучшить циркуляцию крови. При отеках на ногах под них стоит подложить подушку, чтобы они находились выше корпуса, на возвышении около 30 см над уровнем кровати. Отдых на левом боку также способствует уменьшению отеков.
Это облегчает работу сердца и помогает улучшить циркуляцию крови. При отеках на ногах под них стоит подложить подушку, чтобы они находились выше корпуса, на возвышении около 30 см над уровнем кровати. Отдых на левом боку также способствует уменьшению отеков.
Прогулки для беременных так же важны, как сон и еда. Во время ходьбы улучшается циркуляция крови, опорожняются расширенные вены и улучшается лимфодренаж. Продолжительность прогулки должна составлять более получаса.
Компрессионный трикотаж – специальное белье, которое позволяет уменьшить отеки, связанные с нарушением работы сосудов.
Надевать компрессионные чулки или колготки нужно после ночного сна лежа в постели, пока вены ног не переполнились кровью. Компрессионный трикотаж поможет избежать застоя крови в венах ног, предотвратит варикозное расширение, уменьшит отечность и чувство тяжести в ногах. Перед покупкой компрессионного трикотажа нужно проконсультироваться с врачем-флебологом, поскольку такой метод борьбы с варикозом имеет свои недостатки.
Умеренные физические нагрузки уменьшают отечность на 50%. Прогулки и гимнастика помогают улучшить кровообращение, поскольку сокращающиеся мышцы выталкивают кровь из вен, предупреждая их переполнение, тем самым облегчая работу сердца.
При малоподвижном образе жизни беременным желательно уделять упражнениям по 5-10 минут каждые 2 часа. Лучшие виды активности – гимнастика для беременных, упражнения на фитболе, йога, плавание.
Противопоказанием к занятиям гимнастикой являются повышенный тонус матки и тяжелая стадия гестоза.
Витамины улучшают обмен веществ, свойства крови и состояние сосудов, а также являются профилактикой развития гестоза. Поэтому прием витаминных комплексов, назначенных врачом, поможет уменьшить отечность.
Если не удалось избежать появления отеков, а указанные выше меры не помогают снять отечность, то стоит сообщить о проблеме своему гинекологу. При не резко выраженных отеках лечение проводят амбулаторно, учитывая основное заболевание. Назначают препараты, поддерживающие функцию почек и сердца.
Назначают препараты, поддерживающие функцию почек и сердца.
Для лечения патологических отеков врач может рекомендовать лечь в стационар. Внутривенно капельно вводятся препараты, которые улучшают внутримозговое кровообращение, циркуляцию крови и устраняют гипоксию плода. Лечение также направлено на очищение крови от токсинов и облегчение работы почек.
Отеки во время беременности – очень распространенное явление, и они не всегда говорят о болезни. Однако беременная женщина должна внимательно и ответственно относиться к своему здоровью, чтобы не пропустить появление патологических отеков, требующих лечения.
К концу дня вы чувствуете тяжесть и боль в ногах, а привычная обувь будто становится мала? Отеки возникают почти у 80% беременных. Узнаем причины и методы профилактики отечности при беременности.
8 из 10 беременных женщин сталкиваются с проблемой отеков. Ноги не помещаются в привычную обувь, приходится снимать обручальное кольцо, под глазами появляются мешки и припухлости. Даже заложенность носа, так называемый ринит беременных, не что иное, как отек слизистой.
Даже заложенность носа, так называемый ринит беременных, не что иное, как отек слизистой.
Многие считают, что с этим состоянием нужно просто смириться и пережить, как многие другие неприятные симптомы вынашивания. Но в некоторых случаях отечность может быть признаком серьезных нарушений в работе организма. Разберемся, почему возникают отеки при беременности, как их можно предотвратить, и когда они представляют опасность.
Патология или физиология
Наш организм больше, чем на 70% состоит из воды, а в теле беременной циркулирующей жидкости становится еще больше. 3 литра воды приходится на сам плод, его кровеносную систему и околоплодные воды, которые полностью меняются каждые 3 часа. Еще 3-4 литра необходимы для увеличения объема крови будущей матери, для роста матки и молочных желез. Такое «наводнение» обусловлено развитием малыша, ведь он получает все питательные вещества и воду из крови матери. Удерживать воду в крови помогает белок альбумин и соли натрия. Именно поэтому беременную так часто тянет на солененькое.
Отеки представляют собой избыточное скопление жидкости в межтканевом пространстве. В большинстве случаев они абсолютно физиологичны. Возникают после длительного нахождения на ногах или в статичной позе, если затрудняется кровообращение. Часто наблюдаются и в жару, когда организм нуждается в еще большем количестве воды из-за активного потоотделения, и поэтому запасается ею. Поэтому стоит следить за питьевым режимом в жаркое время года.
Что делать при отеках?
Итак, небольшая отечность при беременности – это нормально. Однако это не значит, что вы не можете облегчить свое состояние. Соблюдайте несложные правила, чтобы предупредить или минимизировать избыточное скопление жидкости в тканях:
- Исключите из рациона жареную, копченую, острую и маринованную пищу. Питайтесь правильно и сбалансированно. Диеты, если они не назначены специалистом при каком-либо системном заболевании, только вредят беременным.
- Следите за количеством соли. Исключать ее полностью не нужно, она необходима для нормального функционирования организма и водного баланса.
 Однако максимально допустимая порция добавленной соли в день – 5 граммов.
Однако максимально допустимая порция добавленной соли в день – 5 граммов. - Избегайте длительного пребывания на жаре или в душных помещениях.
- Откажитесь от тесной одежды и обуви на высоком каблуке.
- Ходьба, плавание и гимнастика для беременных – отличная профилактика отеков.
Не рекомендуем сокращать количество выпиваемой жидкости. Обезвоживание, как ни парадоксально, приводит к еще большим отекам и в целом негативно влияет на состояние здоровья.
Когда отеки становятся признаком патологии
- Если сопровождаются повышенным артериальным давлением, головной болью, болезненными судорогами, одышкой и учащенным сердцебиением;
- наблюдаются с самого утра, не спадают после ночного отдыха; распространяются выше уровня голеней;
- становятся сильными и даже чрезмерными – вы не можете сжать руку в кулак, надеть какую-либо обувь, открыть без усилий глаза;
- им сопутствует тошнота или рвота после 12 недели беременности.
Если беременная следит за весом, то она отметит резкую прибавку – более 1 кг в неделю. Насторожить должны и редкие позывы к мочеиспусканию, особенно если моча приобрела темный оттенок. В этом случае отеки требуют незамедлительного обращения к специалисту.
Насторожить должны и редкие позывы к мочеиспусканию, особенно если моча приобрела темный оттенок. В этом случае отеки требуют незамедлительного обращения к специалисту.
Почему возникает отечность
Рассмотрим распространенные причины патологических состояний.
Нарушения в работе щитовидной железы
Отеки на ранних сроках могут быть одним из признаков гипотериоза – недостаточного синтеза гормонов щитовидки. Другими его симптомами являются повышение артериального давления, чрезмерная сухость кожи, дефицит или избыток массы тела, усталость, склонность к запорам. Своевременно вывить гипотериоз помогает анализ крови на гормоны, который сдают в первом триместре беременности.
Заболевания почек
Нарушения в работе мочевыделительной системы могут приводить к образованию отеков. Поэтому так важно регулярно сдавать анализы мочи во время беременности. Высокий уровень лейкоцитов, эритроцитов или белка – срочный повод обратиться к урологу и исключить инфекцию в почках.
Варикозное расширение вен
О раннем развитии варикоза во время беременности организм вас предупредит венозными звездочками, отеками, тяжестью и болью в ногах. Обязательно проконсультируйтесь со специалистом при появлении этих симптомов. На ранних стадиях вам помогут несложные упражнения, массаж, контрастный душ, ношение компрессионного белья.
Чем опасны отеки
Патологическая отечность на поздних сроках – один из возможных симптомов гестоза беременных. Его причины еще не до конца изучены, но совершенно точно известно, что он вызывает кислородное голодание, преждевременные роды и отслойку плаценты, задержку развития и гибели ребенка. Для женщины гестоз чреват тромбозом, сердечной и почечной недостаточностью, отеком легких и головного мозга.
Как развивается гестоз?
- Стенки кровеносных сосудов становятся более проницаемыми, поэтому жидкая фракция крови покидает русло и накапливается в тканях. В результате отекают руки и ноги, а также матка и плацента.
 Живот быстро увеличивается, женщина резко прибавляет в весе.
Живот быстро увеличивается, женщина резко прибавляет в весе. - Из-за того, что кровь густеет, растет риск тромбообразования и увеличивается артериальное давление.
- В силу повышенной проницаемости стенок кровеносных сосудов, в том числе и в почках, в мочу попадает белок. Это еще один симптом гестоза.
Лечение проводится исключительно в условиях стационара. Это либо поддерживающая терапия, либо стимуляция родов, если сроки вынашивания позволяют.
Как избежать патологии
О профилактике отеков нужно задуматься еще на этапе подготовки к беременности. Сдайте анализы и проконсультируйтесь со специалистом, если вы входите в группу риска:
- пациентки с болезнями сердца и сосудов, печени или почек, эндокринными нарушениями, в том числе с сахарным диабетом и гипотиреозом;
- если вам меньше 18 или больше 35 лет;
- женщины, имеющие наследственную предрасположенность, или у которых наблюдались сильные отеки в предыдущую беременность;
- если между беременностями прошел небольшой промежуток времени или в анамнезе есть аборты.

Кроме того, к патологическим отекам во время беременности предрасположены курящие и проживающие в неблагоприятных, с точки зрения экологии, регионах.
Во время беременности лучшим способом предупреждения отеков является сбалансированное питание, достаточная физическая активность и полноценный отдых. Следите за прибавкой в весе и регулярно посещайте гинеколога. Не забывайте сдавать анализ мочи перед каждым визитом. Эти рутинные действия помогают вовремя диагностировать осложнения на фоне отеков при беременности.
Советы специалистов
Чтобы справиться с отеками, никогда не применяйте мочегонные средства без совета гинеколога или терапевта. Большинство из них не рекомендовано при беременности. Даже «безобидные» травы могут привести к обратному эффекту и лишь усилить отечность.
Чаще всего свое самочувствие можно улучшить с помощью физической активности. Плавайте, занимайтесь йогой. Отдыхайте с приподнятыми ногами. Устраивайте для ног контрастный душ. Не увлекайтесь соленым и забудьте о фастфуде. Если отеки не спадают или сопровождаются другими тревожными симптомами, обязательно обратитесь к врачу.
Если отеки не спадают или сопровождаются другими тревожными симптомами, обязательно обратитесь к врачу.
Доверьте ведение беременности специалистам Медицинского женского центра. Наши гинекологи имеют многолетний успешный опыт наблюдения пациенток с различными патологиями. Индивидуальные программы позволяют вовремя диагностировать возможные отклонения и не допустить развития осложнений.
акушер-гинеколог, гемостазиолог, профессор, доктор медицинских наук, эксперт международного уровня по проблемам тромбозов и нарушений свертывания крови
При возникновении дополнительных вопросов, неясностей и сложностей, а также для записи на консультацию обращайтесь к специалисту Медицинского женского центра – Бицадзе Виктории Омаровне – по номеру телефона
С отеками в большей или меньшей степени сталкивается каждая беременная женщина. Чаще всего они никак не влияют на здоровье матери и ребенка, но врачи акушеры-гинекологи строго контролируют количество отеков, так как они могут стать показателем патологических процессов в организме женщины.
Что такое отеки
Отек — это скопление жидкости в межтканевом пространстве. Он возникает, когда почки не могут вывести всю воду из организма из-за нарушения водно-солевого баланса. Обычно такое состояние возникает после употребления соленой пищи или алкоголя. На следующий день человек замечает припухлости на лице, руках и ногах.
Во время беременности пальцы рук и лодыжки отекают из-за накопления натрия в сосудах, который препятствует нормальному выведению жидкости из организма. Особенно заметно это становится в третьем триместре, так как растущая матка сдавливает сосуды, это приводит к задержке воды в организме.
Скрытые отеки при беременности
Кроме явных отеков на лице, руках и ногах, у беременной женщины могут развиваться скрытые отеки внутренних органов. Они представляют опасность для ребенка, так как мешают нормальной доставке кислорода и питательных веществ к плаценте.
Задержка жидкости в организме может быть симптомом заболеваний мочевыводящей, эндокринной или сердечно-сосудистой системы. Также она может указывать на гестоз – поздний токсикоз беременных, который угрожает жизни матери и ребенка.
Также она может указывать на гестоз – поздний токсикоз беременных, который угрожает жизни матери и ребенка.
Чтобы не допустить такого состояния, врачи внимательно следят за состоянием беременной женщины. Во время каждого посещения женской консультации проводят взвешивания, измерение давления и проверку анализа мочи. Набор веса больше 1 кг в неделю указывает на задержку жидкости в организме. В сочетании с появлением белка в моче и повышенным давлением это говорит о гестозе. В этом случае врач рекомендует госпитализацию.
Патологические состояния
Физиологические отеки возникают у каждой беременной женщины и не доставляют ей дискомфорта, кроме недовольства своим внешним видом. Приходится снимать кольца и не носить их вплоть до родов. Обувь становится маленькой, некоторые женщины покупают сапоги и ботинки на размер больше. Это нормальное состояние, вся лишняя вода выводится из организма самостоятельно в течение недели после родов.
Патологией считается гестоз. Первый его симптом – сильные отеки голени, увеличение объема ноги более, чем на 1 см в неделю.
Другие симптомы гестоза:
- белок в анализе мочи;
- рвота или тошнота;
- повышенное давление;
- головные боли;
- судороги.
Существует несколько стадий гестоза, при регулярном посещении женской консультации врачи диагностируют его на раннем этапе и сразу принимают меры. Если не посещать врача и не соблюдать рекомендации по профилактике гестоза, это может привести к ухудшению состояния, появлению судорог и отказу почек.
Поэтому уже на ранних стадиях гестоза врачи рекомендуют обращаться в Центр гинекологии к опытному акушеру-гинекологу. Там предпринимают меры по выведению лишней воды и стимуляции работы почек. Если ничего не помогает, делают экстренное кесарево сечение. Младенца после этого выхаживают в инкубаторе, а женскому организму помогают восстановить работу почек.
Когда нужно обратиться в гинекологию
Самые частые признаки отеков – кольца и ремешки на обуви начинают сильно давить и доставлять неудобства. В этом случае рекомендуется купить более свободную обувь, а кольца не надевать до конца беременности. Небольшой отек лица, верхних и нижних век появляется обычно в утренние часы и к вечеру проходит самостоятельно.
Небольшой отек лица, верхних и нижних век появляется обычно в утренние часы и к вечеру проходит самостоятельно.
К врачу следует обратиться в случае:
- резкого набора веса, больше 500 грамм в неделю;
- если отеки не проходят в течение дня;
- онемение, покалывание в отекших кистях рук или стопах;
- если пальцы рук трудно или невозможно согнуть, а на ноги больно наступать;
- одышки, учащенного сердцебиения.
Проверить наличие отека можно надавив на кожу пальцем. Если следа не останется, все нормально. Если остается бледная ямка, которая медленно выравнивается, нужно сходить к врачу.
Профилактика и лечение отеков
Во второй половине беременности рекомендуется ограничить потребление соли, отказаться от консервов и соленостей домашнего приготовления. В соли содержится натрий, который препятствует выведения воды из организма.
Чем ближе дата родов, тем более здоровым должно становиться питание. Это убережет младенца от аллергии, а полезные привычки облегчат женщине переход на диету для грудного вскармливания. Рекомендуется убрать из рациона жирную, жареную пищу, исключить сладости и мучное. По согласованию с врачом можно проводить разгрузочные дни 1 раз в неделю.
Рекомендуется убрать из рациона жирную, жареную пищу, исключить сладости и мучное. По согласованию с врачом можно проводить разгрузочные дни 1 раз в неделю.
Из-за гормональных изменений беременных женщин часто мучает жажда. Не стоит ограничивать потребление жидкости, лучше заменить чай и кофе на обычную воду. В день следует выпивать 1-1,5 литра воды, не считая супов и фруктов. Для уменьшения отеков можно пить клюквенный морс, но нее стоит принимать мочегонные чаи без консультации с врачом.
Прогулки и легкая гимнастика не только полезны для ребенка, они помогают уменьшить отеки. Монотонная сидячая работа провоцирует задержку жидкости, а также вызывает кислородное голодание плода. Женщине рекомендуется гулять каждый день как минимум полчаса. Также полезно плавание, йога, легкая гимнастика.
Во время отдыха или сидячей работы ноги нужно приподнимать в горизонтальное положение. Чтобы пальцы не отекали от рукоделия или работы за компьютером, каждые полчаса нужно делать перерыв и разминку.
Если с отеками на ногах стали заметны вены, тем более при появлении боли, нужно получить консультацию флеболога. Варикоз часто сопровождает беременность, для его лечения можно носить компрессионные чулки.
Небольшая отечность сопровождает каждую беременность. Не стоит беспокоиться, так как они уйдут во время или сразу после родов. Важно соблюдать меры профилактики, а при появлении патологических состояний сразу обращаться к гинекологу.
Выбор здоровой пищи крайне важен для беременных женщин. Правильная диета по максимуму обеспечивает плод питательными веществами, необходимыми для роста и развития. Также диета играет важную роль для общего здоровья любого человека, помогая организму эффективно функционировать и снижая риск некоторых заболеваний.
Правильное питание должно включать много фруктов, овощей, цельного зерна, нежирного белка и полезных жиров. В этой статье мы расскажем, почему так важно есть фрукты во время беременности. Также рассмотрим, какие фрукты есть лучше всего и каких продуктов нужно избегать.
Преимущества употребления фруктов во время беременности
Соблюдение здоровой, разнообразной диеты особенно важно во время беременности, так как многие питательные вещества необходимы для роста и развития плода. Увеличенное потребление витаминов и минералов поможет беременной женщине поддерживать тело в хорошей физической форме.
Свежие фрукты содержат много необходимых витаминов и питательных веществ, а также являются хорошим источником клетчатки. Что очень важно, практически все витамины и минералы, поступающие из фруктов, находятся в доступной для человеческого организма форме.
Лучшие фрукты во время беременности
Фрукты могут стать отличным перекусом и заменой для кондитерских изделий, которые рекомендуется полностью исключить из питания. Ниже перечислим 12 лучших фруктов, которые можно включить в здоровое питание для беременных.
1. Абрикосы
Абрикосы содержат: витамины А, С и Е, кальций, железо, калий, бета-каротин, фосфор, кремний. Все эти питательные вещества помогают развитию и росту ребенка. Железо предотвращает анемию, а кальций укрепляет кости и зубы.
Железо предотвращает анемию, а кальций укрепляет кости и зубы.
2. Апельсины
Апельсины — отличный источник: фолиевой кислоты, витамина С, воды. Апельсины отлично подходят для поддержания здоровья, увлажнения кожи и насыщения влагой организма человека.
Витамин С предотвращает повреждение клеток и способствует усвоению железа.
Фолиевая кислота помогает предотвратить дефекты невральной трубки, которые вызывают аномалии головного и спинного мозга у ребенка. Дефекты невральной трубки могут вызывать такие состояния, как расщепление позвоночника, когда спинной мозг не развивается должным образом, и анэнцефалия, при которой отсутствует значительная часть головного мозга и черепа.
3. Манго
Манго богаты витаминами А и С. Одна чашка нарезанного манго обеспечивает 100 процентов рекомендуемой суточной нормы витамина C и более трети суточной нормы витамина A.
Ребенок, родившийся с дефицитом витамина А, будет иметь низкий иммунитет и высокий риск послеродовых осложнений, таких как респираторные инфекции.
4. Груши
Груши содержат значительное количество пищевых волокон, калия, фолиевой кислоты.
Употребление большого количества клетчатки в рационе беременных улучшает работу кишечника. Клетчатка — натуральное средство для профилактики запора — распространенного симптома беременности.
Калий очень полезен для здоровья сердца женщины и ребенка. Он также стимулирует регенерацию клеток.
5. Гранаты
Гранаты содержат большое количество витамина К, кальция, фолиевой кислоты, железа, белка и пищевых волокон. Плотные питательные вещества, содержащиеся в гранате также являются хорошим источником энергии, а их высокое содержание железа помогает предотвратить дефицит железа.
Витамин К также необходим для поддержания здоровья костей. Исследования показывают, что употребление гранатового сока может помочь снизить риск повреждения плаценты.
6. Авокадо
Авокадо является отличным источником витаминов С, Е и К, мононенасыщенных жирных кислот, витаминов группы В, калия и меди.
Этот фрукт содержит полезные жиры, которые обеспечивают энергией, стимулируют клетки, отвечающие за формирование кожи и тканей головного мозга развивающегося ребенка.
Калий в авокадо облегчает судороги ног — еще один симптом, который часто встречается во время беременности, особенно в третьем триместре.
7. Гуава
Гуава содержит витамин Е и фолат, что делает его идеальным фруктом для беременных.
Гуава — отличный выбор фруктов для людей, которые хотят получить больше следующих питательных веществ: витамины С и Е, полифенолы, каротиноиды, изофлавоноиды. Гуава содержит разнообразную комбинацию питательных веществ, что делает ее идеальной.
Употребление гуавы во время беременности расслабляет мышцы, улучшает пищеварение и уменьшает запоры.
8. Бананы
Бананы содержат высокий уровень витамина С, калия, витамина В-6. Высокое содержание клетчатки в бананах помогает при запорах, связанных с беременностью. Есть свидетельства того, что витамин B6 уменьшает тошноту и рвоту на ранних сроках беременности.
9. Виноград
В винограде содержатся очень важные для организма человека вещества — витамины С и К, пектин, органические кислоты, антиоксиданты.
Питательные вещества в винограде облегчают биологические изменения, которые происходят во время беременности. Они содержат иммуностимулирующие антиоксиданты, которые также помогают предотвратить инфекции.
10. Шиповник
Плоды шиповника — хороший источник витамина С. Они положительно влияют на углеводный обмен. Ягоды также содержат много воды, поэтому являются отличным источником увлажнения.
Витамин С помогает усваивать железо и повышает иммунную систему организма.
11. Яблоки
Яблоки богаты витаминами А и С, калием, клетчаткой. Исследования показывают, что употребление яблок во время беременности может снизить впоследствии вероятность развития астмы и аллергии у ребенка.
12. Сухофрукты
Сухофрукты богаты витаминами и минералами, клетчаткой. Они содержат все те же питательные вещества, что и свежие фрукты. Таким образом, беременные женщины могут получить свою суточную норму витаминов и минералов, съев порцию сухофруктов, которая по весу будет меньше, чем эквивалентное количество в свежих фруктах.
Таким образом, беременные женщины могут получить свою суточную норму витаминов и минералов, съев порцию сухофруктов, которая по весу будет меньше, чем эквивалентное количество в свежих фруктах.
Тем не менее, важно помнить, что сухофрукты могут содержать много сахара и не содержат воды, которая есть в свежих фруктах. Это означает, что они не помогают пищеварению.
Есть сухофрукты при беременности можно в умеренных количествах, а цукатов вообще лучше избегать. Вообще лучше есть сухофрукты в дополнение к свежим фруктам, а не вместо них.
Сколько фруктов нужно есть во время беременности?
Для беременных женщин рекомендуется употреблять не менее пяти порций свежих фруктов и овощей каждый день и максимально менять их ассортимент. Фрукты могут быть свежими, консервированными, замороженными или сушеными.
Как правило, порция фруктов это:
- один фрукт, для фруктов, которые больше, чем размер теннисного мяча;
- одна чашка нарезанных фруктов
Потребление большого количества фруктов и овощей во время беременности обеспечивает беременных женщин достаточным питанием для поддержки развивающегося ребенка.
Есть ли какие-либо фрукты, которые женщина должна избегать во время беременности?
Нет особых фруктов, которых беременным нельзя есть. Тем не менее важно знать размер порции, так как некоторые фрукты имеют высокое содержание сахара. Важно учитывать, что соки и сухофрукты, часто содержат значительно больше сахара и калорий, чем их свежие аналоги.
- Покупка органических натуральных фруктов гарантирует, что они не вступали в контакт с удобрениями и пестицидами, которые могут повредить их качеству.
- В любом случае, если фрукты не из личного сада, важно удалить любые пестициды и бактерии с их поверхности. Достаточно тщательно промыть их перед употреблением.
- Не стоит употреблять фрукты с видимыми повреждениями, которые с большей вероятностью содержат бактерии. Нельзя покупать уже нарезанные продукты.
- Хранить фрукты необходимо в отдельном контейнере в холодильнике.
Выводы
Фрукты являются отличным источником питательных веществ, которые необходимы во время беременности. Они содержат витамины, фолиевую кислоту, клетчатку и многое другое, что помогает сохранить здоровье женщины и ребенка. Эти питательные вещества также могут помочь облегчить некоторые общие симптомы беременности.
Они содержат витамины, фолиевую кислоту, клетчатку и многое другое, что помогает сохранить здоровье женщины и ребенка. Эти питательные вещества также могут помочь облегчить некоторые общие симптомы беременности.
Беременные женщины должны стремиться потреблять как минимум пять разных порций фруктов и овощей каждый день. При этом следует ограничивать потребление сухофруктов и фруктовых соков, поскольку они могут содержать больше сахара и калорий, чем свежие фрукты.
Составить диету, основанную на индивидуальных характеристиках организма, можно у опытного акушера-гинеколога в Центре гинекологии на Шуваловском (СПБ).
чем опасен, последствия для матери и ребенка
Обычно ранние гестозы принято называть токсикозом беременных, это классические его признаки с тошнотой и рвотой, непереносимостью резких запахов, слабостью и сильной сонливостью.Однако, токсикозы врачи считают не столь опасными для плода, как развитие так называемых поздних гестозов.
Гестозами беременности или токсикозами, называются болезненные изменения в течении беременности, вызванные гормональными колебаниями, различными патологиями и заболеваниями. По времени, когда может возникнуть проблема, выделяется ранний гестоз при беременности и поздний.
По времени, когда может возникнуть проблема, выделяется ранний гестоз при беременности и поздний.
Причины гестоза у беременных
Хотя проявления гестозов изучаются уже давно, но до сегодняшнего дня не удалость выявить точных причин возникновения данной патологии. Зачастую от гестозов страдают беременные с нарушениями работы нервной системы и головного мозга, при проблемах с сердцем и давлением. Выявлены связи с патологиями почек и развитием гестоза, с наличием аллергии, эндокринными и обменными сбоями, а также наличием вредных привычек до зачатия.
От гестозов чаще страдают очень юные будущие мамочки или возрастные – это объясняют или незрелостью или возрастными изменениями тела, а также те, кто носит двойню, кто имеет лишний вес и давление, или у кого по женской линии также были в роду гестозы.
По степени выраженности проявлений и тяжести течения принято в позднем гестозе выделять три степени.
Гестоз 1 степени при беременности
Обычно гестозы лёгкой степени при беременности принято называть водянкой беременных. Это начальные, относительно лёгкие проявления. При этом формируются выраженные, достаточно серьёзные отёки по всему телу они дают большие прибавки массы тела. Отёки видны на конечностях, на теле и даже на лице, они усиливаются к вечеру, прогрессируют и плохо поддаются коррекции. На фоне водянки могут присоединяться явления нефропатии – поражения почек, когда они не справляются со своими задачами.
Это начальные, относительно лёгкие проявления. При этом формируются выраженные, достаточно серьёзные отёки по всему телу они дают большие прибавки массы тела. Отёки видны на конечностях, на теле и даже на лице, они усиливаются к вечеру, прогрессируют и плохо поддаются коррекции. На фоне водянки могут присоединяться явления нефропатии – поражения почек, когда они не справляются со своими задачами.
Гестоз 2 степени при беременности
Именно развитие нефропатии (поражение почек) с прогрессированием отёков и повышением артериального давления, проявлением белка в моче относят уже к гестозу тяжелой степени. Такие изменения говорят о том, что организм не справляется с нагрузками, которые на него возлагает беременность, и дает сбои. Постепенно при прогрессировании процесса могут возникать крайне тяжёлые проявления гестоза – преэклампсия и эклампсия. Это серьёзные поражения нервной системы на фоне всех происходящих изменений – отечности, давления, потери почками белка. Эти изменения дают самые тяжёлые и опасные для жизни последствия гестоза при беременности.
Чем опасен гестоз на поздних сроках беременности
Гестозы развиваются исключительно у беременных – они связаны непосредственно с вынашиванием плода. После родов гестозы обычно проходят, но зачастую, при тяжелом течении последствия гестоза остаются даже после родов. Однако, гестозы опасны именно во время беременности, особенно в третьем триместре. Они могут привести к эклампсии – тяжёлым судорогам, которые опасны для жизни. При них зашкаливает давление, отказывают почки, отекает всё тело. Это состояние требует немедленной реанимации и рождения малыша, чтобы спасти жизнь обоим.
Последствия гестоза для матери
Но зачастую даже после родоразрешения, в результате тяжёлых осложнений беременности возникают серьёзные последствия гестоза для матери после родов. Это могут быть сильные послеродовые кровотечения, приводящие к анемии, а также такие осложнения, как развитие инсультов или поражений головного мозга на фоне судорог, необратимые повреждения почек с развитием их недостаточности, нарушения зрения, постоянные головные боли из-за высокого давления и многое другое.
Последствия гестоза для ребёнка
Естественно, что при тяжёлом состоянии матери развивающийся малыш будет страдать вместе с нею. Развитие гестоза при беременности не менее опасно и последствиями для ребенка. Естественно, что самым опасным осложнением будет внутриутробная гибель плода в результате гипоксии и дефицита питательных веществ. Это происходит за счёт сильного отека плаценты или её отслойки, кровотечения и преждевременных родов.
Выражено влияние гестоза у матери на развитие плода. Такие дети ослаблены, они страдают от хронической гипоксии, отстают в росте и развитии, могут часто и длительно болеть после рождения.
Учитывая необходимость при развитии патологии проводить роды ранее срока, можно добавить сюда же ещё ответ — чем опасен гестоз для плода. При рождении ребёнка гораздо ранее срока, он совершенно не готов к самостоятельной жизни и требует особого ухода, может иметь отклонения в здоровье и задержку развития.
Теги по теме:
ранний гестоз при беременностигестоз лёгкой степени при беременностигестоз тяжёлой степеничем опасен гестоз на поздних срокахгестоз при беременности последствияпоследствия гестоза после родовпоследствия гестоза для матери после родовгестоз при беременности последствия для ребёнкачем опасен гестоз для плодавлияние гестоза у матери на плод
Оцените материал:
Гестоз при беременности | Mammyclub
Гестоз – одно из самых тяжелых осложнений второй половины беременности. К сожалению, предвидеть возникновение этого состояния практически невозможно, гарантированных способов предотвращения развития гестоза на сегодняшний день также не существует.
К сожалению, предвидеть возникновение этого состояния практически невозможно, гарантированных способов предотвращения развития гестоза на сегодняшний день также не существует.
Единственный эффективный способ «лечения» гестоза – завершение беременности на любом сроке. Известно, что в основе гестоза лежит массивный спазм сосудов, который угрожает жизни и матери, и малыша. Давайте попробуем разобраться, что представляет из себя гестоз, и почему он так опасен.
Что такое гестоз?
Спазм (или сужение) сосудов приводит к повышению артериального давления, что само по себе может резко ухудшить состояние женщины. Но главная проблема состоит в том, что сосудистый криз происходит одновременно во многих органах и серьезно нарушает их работу.
Наибольшую опасность при гестозе представляет неспособность почек выполнять свою главную работу – выводить продукты обмена из организма женщины.
Это приводит к накоплению в организме беременной ненужных, отработанных (по сути – отравляющих!) веществ. Естественно, эти вещества попадают и к малышу.
Естественно, эти вещества попадают и к малышу.
С другой стороны, спазм сосудов в плаценте значительно нарушает снабжение ребенка кислородом и питательными веществами.
Иногда сужение сосудов происходит мгновенно и состояние будущей мамы ухудшается буквально «на глазах». Иногда это «завуалированный», растянутый во времени процесс, практически незаметный ни для будущей мамы, ни для медицинских работников.
В последнем случае ребенок более-менее длительное время испытывает кислородное голодание, дефицит поступления питательных веществ, «атаку» токсичными продуктами обмена, поэтому его рост и развитие замедляются.
Есть еще несколько крайне проблемных моментов гестоза. В суженных сосудах дыижение крови замедляется, могут образовываться тромбы, которые окончательно «выключают» сосуд из работы. В зависимости от локализации заблокированного сосуда(-ов) в какой-то конкретной зоне (области) организма нарушается кровоснабжение.
На медицинском языке это называется «ишемический инсульт». Тяжелейшими проявлениями ишемического инсульта являются судороги и потеря сознания. По своей природе организм человека – саморегулирующаяся система. Поэтому, как только начинают образовываться тромбы в суженных сосудах, в работу включается «защита» — противосвертывающая система. Вязкость крови снижается, кровь становится более жидкой и перестает сворачиваться. На этом этапе развития гестоза резко возрастает риск обильного кровотечения.
Тяжелейшими проявлениями ишемического инсульта являются судороги и потеря сознания. По своей природе организм человека – саморегулирующаяся система. Поэтому, как только начинают образовываться тромбы в суженных сосудах, в работу включается «защита» — противосвертывающая система. Вязкость крови снижается, кровь становится более жидкой и перестает сворачиваться. На этом этапе развития гестоза резко возрастает риск обильного кровотечения.
Вряд ли надо кому-то объяснять, что массивное кровотечение – это прямая угроза жизни человека.
Учитывая коварность гестоза, с момента постановки диагноза до момента родоразрешения женщины в идеале должно проходить не более трех суток. При возникновении гестоза родоразрешение проводят в любом сроке беременности. Даже если до предполагаемой даты родов еще далеко, в условиях гестоза жизнь и здоровье ребенка находятся под прямой угрозой. Поэтому малыша лучше «забрать» из агрессивной среды материнского организма, и выходить в условиях кювеза.
Еще раз подчеркнем, что когда речь идет о жизни матери и ребенка, срок беременности в момент родоразрешения значения не имеет. В современных условиях даже очень рано родившиеся детки имеют возможность быть здоровыми, а их мамы – счастливым. Как правило, развитие гестоза приходится на достаточно большие сроки беременности – после 30-32 недель. Но бывают, безусловно, и исключения.
В современных условиях даже очень рано родившиеся детки имеют возможность быть здоровыми, а их мамы – счастливым. Как правило, развитие гестоза приходится на достаточно большие сроки беременности – после 30-32 недель. Но бывают, безусловно, и исключения.
Чем в более раннем сроке беременности развивается гестоз, тем тяжелее он протекает, и тем больше реабилитационных мероприятий будет показано и маме, и малышу.
Гестоз при беременности. Кто подвержен риску?
Как показывают наблюдения специалистов, гестозы чаще случаются весной или осенью. Возможно, играют роль перепады атмосферного давления, весенний авитаминоз или осенняя склонность некоторых женщин к депрессивному восприятию жизни.
Конечно, для того, чтобы сократить количество случаев проявления гестоза, врачи стараются выделить так называемую «группу риска» по развитию гестоза. Для этого, специалисты, буквально с самого первого приема в женской консультации, стараются «нарисовать портрет» будущей мамы, задавая ей массу вопросов о состоянии здоровья и образе жизни.
Более высокий риск по сравнению с другими беременными женщинами имеют:
- женщины с избыточной массой тела или ожирением;
- женщины с исходно высокими цифрами артериального давления или страдающие гипертонической болезнью;
- женщины с болезнями почек;
- будущие мамы, страдающие сахарным диабетом (в том числе гестационным диабетом) или другими заболеваниями эндокринной системы;
- женщины с аутоиммунными заболеваниями (антифосфолипидный синдром, системная красная волчанки, ревматические болезни, болезни соединительной ткани и т.д.)
- женщины с лабильной психикой, расстройствами в работе нервной системы;
- одинокие будущие мамы и будущие мамы старшего возраста;
- женщины, у ближайших кровных родственников которых были инсульты, инфаркты, тромбозы;
- ранее рожавшие женщины, у которых рождались крупные дети или случались мертворождения. Также те женщины, которые перенесли гестоз в предыдущих беременностях;
- женщины, у которых случались самопроизвольные аборты (особенно несколько).

Но и эта «группа риска» весьма условна. Большинство женщин, имеющих вышеперечисленные проблемы, при полноценном обследовании и грамотном лечении основного заболевания (желательно ДО планируемой беременности!) благополучно выносят своих детей и никогда не узнают, что такое гестоз. С другой стороны, это опасное осложнение может развиться у исходно абсолютно здоровой женщины, не имеющей никаких факторов риска.
Это еще раз подчеркивает непрогнозируемость и коварство гестоза.
Как определить начало гестоза при беременности?
Устанавливает появление позднего токсикоза только врач. Он может диагностировать начало заболевания по опасному симптому, — присутствию белка в анализах мочи.
Не забывайте, что анализ мочи нужно собирать правильно, иначе выделения из влагалища могут показать ложное наличие белка в моче.
Чтобы результат оказался верным, необходимо промыть промежность, а затем закрыть вход во влагалище ватным тампоном и собрать среднюю порцию мочи. Посуда для анализа должна быть чистой (можно прокипятить в течение 2-3 минут), а еще лучше купить в аптеке стерильный стакан.
Посуда для анализа должна быть чистой (можно прокипятить в течение 2-3 минут), а еще лучше купить в аптеке стерильный стакан.
Также, во время каждого визита к доктору не зря производятся замеры артериального давления. Показатели выше 130/80 мм.рт ст. также свидетельствуют о начале гестоза.
Еще два важных симптома, которые нельзя упускать из виду — резкое увеличение массы тела и появление отеков. Но не каждые отеки диагностируются, как гестоз. Увеличенная матка давит на все внутренние органы и в том числе на сосуды, перегоняющие кровь. Естественно, что из-за чрезмерного давления, этот процесс способствует задержке жидкости в организме. Но, если отек возникает резко и начинает прогрессировать — это может говорить о действительном начале гестоза.
Вы должны помнить, что вовремя не диагностированный гестоз, вызывает следующие осложнения:
- преждевременная отслойка плаценты и маточные кровотечения;
- кровотечение во время родов, вызванное нарушением свертывающей системы;
- отслойка сетчатки глаза;
- кислородная недостаточность плода, отставание в развитии.

Признаки гестоза при беременности
Если подытожить все вышесказанное, то основные признаки гестоза это:
- появление белка в моче,
- повышение давления,
- патологическая прибавка в весе,
- резкое появление отеков.
Симптомы могут появляться все сразу или в разной последовательности, это зависит от того, какой внутренний орган женщины страдает больше всего. «Придумывать себе гестоз» самостоятельно не стоит, но любой из вышеперечисленных признаков — обязательный повод побеседовать со своим врачом.
Лечение гестоза при беременности на ранней стадии
Как мы уже говорили выше, единственным лечением истинного гестоза является срочное родоразрешение. То, что врачи рекомендуют на ранних сроках, можно считать профилактикой возникновения гестоза. В первую очередь, специалисты советуют пересмотреть режим питания беременной, в частности:
- применить диету, богатую белками.
- исключить жаренную, острую и соленую пищу.

- если в начале беременности женщина страдала ранним токсикозом, на более поздних сроках ей необходимо удалить из рациона продукты, ранее вызывающие рвоту.
- заменить концентрированные бульоны легкими овощными супами.
- соблюдать водный баланс. Это не значит, что пить нужно мало, нет, подобное воздержание, наоборот, вызывает еще больший застой жидкости. 30 мл на каждый киллограм веса — счиатется достаточной нормой. Вы должны контролировать работу выделительной системы организма и следить затем, чтобы количество выпитой жидкости не было меньше выделенной. Вопрос о том, сколько пить, что именно пить, как пить, и тд, — довольно объемный, поэтому он вынесен в отдельную статью Сколько пить беременным.
К сожалению, если анализы, сданные беременной женщиной в динамике не показывают улучшения, ее госпитализируют в роддом.
При любых обстоятельствах и проблемах необходимо правильно и качественно питаться в течении всей беременности и стараться заниматься спортом (даже просто ходьбой). Для этого в Мамином Магазине стоит обратить внимание на специализированные продукты питания для беременных и кормящих, а так же купить удобную одежду и аксессуары леггинсы, майки, футболки, шорты, купальники, дородовый бандаж и напузник для путешествий или умеренных занятий спортом.
Для этого в Мамином Магазине стоит обратить внимание на специализированные продукты питания для беременных и кормящих, а так же купить удобную одежду и аксессуары леггинсы, майки, футболки, шорты, купальники, дородовый бандаж и напузник для путешествий или умеренных занятий спортом.
Примечание. Возврат продуктов питания и косметических средств возможен только при неповрежденной упаковке.
Последствия гестоза при беременности
Гестоз вызывает очень опасное для беременной женщины состояние, которое в медицине принято называть эклампсия. Для эклампсии характерно критическое повышение артериального давления и появление судорожного припадка, который начинается с подергивания лицевых мышц. Затем присоединяются судороги всего тела, возникает отек мозга и легких, наступает кома. Женщина рискует погибнуть от кровоизлияния в мозг, а ребенок от кислородной недостаточности.
При диагностике эклампсии врачи срочно направляют женщину в стационар и проводят досрочное родоразрешение (экстренное кесарево сечение), чтобы спасти и маму и малыша.
Осложнения гестоза, которые могут навредить ребенку
Мы много писали о том, насколько проявления позднего токсикоза — гестоза опасны для беременной женщины, однако, это не означает, что не страдает малыш. В данной ситуации сбой дает самая главная система: Мама — Плацента — Ребенок.
Гестоз вызывает спазм мелких сосудов всех органов, в результате сужается количество крови, которая несет малышу питательные вещества. Ухудшается и функция плаценты, она становится тоньше, ее площадь увеличивается, появляются участки с кровоизлияниями. В такой ситуации плацента уже не может защитить плод от негативных воздействий и обеспечить его кислородом.
Малыш становится уязвимым, его системы и внутренние органы начинают отставать в развитии. В тяжелых случаях гестоз вызывает преждевременные роды, а в критических ситуациях — гибель плода.
Во время беременности вы должны помнить о том, что теперь вы и малыш — это одно целое, поэтому при обнаружении позднего гестоза сохраняйте спокойствие, соблюдайте все рекомендации врачей и не отказывайтесь от госпитализации. Существует масса примеров, когда даже при постановке такого сложного и опасного диагноза, как поздний токсикоз, после родоразрешения и мама, и малыш чувствовали себя абсолютно здоровыми.
Существует масса примеров, когда даже при постановке такого сложного и опасного диагноза, как поздний токсикоз, после родоразрешения и мама, и малыш чувствовали себя абсолютно здоровыми.
При покупках в Мамином магазине мы гарантируем приятное и быстрое обслуживание .
Что такое преэклампсия и чем она опасна
21 января 2021ЛикбезЗдоровье
Это заболевание может навредить и беременной, и ребёнку.
Поделиться
0
Что такое преэклампсия
ПреэклампсияPreeclampsia — это заболевание, при котором у беременных повышается артериальное давление, а в моче появляется белок. Такое бывает приблизительно у 8% будущих мам и реже — в первые недели после родов. Это состояние может привести к тяжёлым осложнениям у матери или ребёнка, а иногда угрожает их жизни.
Многие акушеры‑гинекологи в России и соседних странах называютКакой классификации гестозов (преэклампсии) должен придерживаться врач в повседневной работе? преэклампсию гестозом, что создаёт путаницу. Но не стоит переживать. Это не признак некомпетентности врача, а просто особенности исторического развития медицины в странах бывшего СССР, где часто продолжают использовать устаревшие названия болезней.
Но не стоит переживать. Это не признак некомпетентности врача, а просто особенности исторического развития медицины в странах бывшего СССР, где часто продолжают использовать устаревшие названия болезней.
Чем опасна преэклампсия
Заболевание протекает в лёгкой, средней или тяжёлой форме. Любая из них может привести к осложнениям. К ним относятсяPreeclampsia: Clinical features and diagnosis, Preeclampsia:
- задержка внутриутробного развития плода, из‑за чего ребёнок появляется на свет с весом ниже нормы;
- преждевременные роды, причём риск выше, если преэклампсия возникла до 34‑й недели беременности;
- преждевременная отслойка плаценты, которая сопровождается сильным кровотечением;
- инсульт у беременной;
- отёк лёгких;
- почечная или печёночная недостаточность;
- нарушение свёртываемости крови.
У беременной иногда появляются судороги, она теряет сознание — это опасное состояние, которое говорит о переходе преэклампсии в эклампсиюPreeclampsia: Clinical features and diagnosis.
Если срочно не вызвать скорую помощь, женщина может впасть в кому или умереть.
Чтобы этого не произошло, нужно внимательно следить за появлением первых признаков болезни.
Каковы симптомы преэклампсии
Заболевание даёт о себе знать после 20 недель беременности. Обычно первое, что замечают женщины, — появление отёков. Это связано с тем, что почки усиленно выводят с мочой белок, который в норме должен задерживать воду в кровеносном русле. Из‑за отёков на ногах обувь надевается с трудом, а если надавить на голень пальцем, на коже останутся ямки. Когда отекают кисти рук, невозможно снять кольцо. Иногда жидкость скапливается под кожей лица, особенно после ночи, поэтому под глазами заметны мешки.
Отёки могут быть скрытыми, тогда их нельзя увидеть на коже. Но можно заподозрить, если прибавкаPreeclampsia веса за неделю — больше 900 грамм.
Другой признак преэклампсии — повышенное артериальное давление. При этом беременная чувствует головную боль, головокружение, слабость, а зрение становится мутным или мелькают пятна перед глазами.
Следующий важный симптом — белок в моче. Но это можно заметить, только сдав анализы. Именно поэтому мочу беременных проверяют перед каждым их посещением акушера‑гинеколога.
Для любой степени тяжести недуга характерны перечисленные выше симптомыPreeclampsia, только выражены они по‑разному. Но если болезнь переходит в тяжёлуюPreeclampsia форму, то появляются дополнительные признаки:
- затруднённое дыхание;
- боль, напоминающая изжогу, посередине живота или под рёбрами справа;
- тошнота и рвота;
- редкое мочеиспускание;
- временная слепота или чувствительность глаз к свету.
Почему возникает преэклампсия
Врачи точно не знаютPreeclampsia, откуда берётся преэклампсия. Но есть факторыPreeclampsia: Clinical features and diagnosis, которые значительно увеличивают риск развития заболевания. Вот они:
- ПреэклампсияPreeclampsia: Can I Lower My Risk? или повышенное давление в прошлую беременность.

- Сахарный диабет.
- Артериальная гипертензия, которая возникла до зачатия. При этом риск возрастаетPreeclampsia: Clinical features and diagnosis в пять раз.
- Аутоиммунные заболевания, например системная красная волчанка и антифосфолипидный синдром.
- Лишний вес или ожирение. Причём чем больше масса тела, тем выше шанс развития преэклампсии.
- Хронические болезни почек. Часто они сопровождаются повышенным давлением и могут спровоцировать преэклампсию.
- Вынашивание нескольких детей.
- Первая беременность у женщины.
- Возраст больше 35 лет.
- Плацентарная недостаточность в прошлую беременность.
- Проведение ЭКО.
- Наследственность. Если у мамы была преэклампсия, риск такого нарушения у дочери увеличивается.
Как лечат преэклампсию
Единственный способ избавиться от преэклампсии — родить ребёнка. Если срок большой или состояние позволяетPreeclampsia: Clinical features and diagnosis, женщина рожает сама. В тяжёлых случаях делают кесарево сечение.
В тяжёлых случаях делают кесарево сечение.
Но если срок беременностиPreeclampsia — до 37 недель, акушеры‑гинекологи стараются улучшить состояние женщины и предотвратить появление осложнений. Есть несколько способов.
Изменение образа жизни
Будущей маме врачи советуют соблюдать постельныйPreeclampsia: Can I Lower My Risk? режим и больше отдыхать, лежать на правом боку, дышать свежим воздухом. Стрессы способны повышать артериальное давление, поэтому женщине нельзя волноваться по пустякам.
При лёгкой форме можноPreeclampsia делать специальные упражнения для беременных. Например, наклоны в стороны, круговые движения руками, махи ногами. Иногда рекомендуют заниматься на фитболе, плавать и ходить.
Соблюдение диеты
Женщинам с преэклампсией важно питаться сбалансированно. Им, как и всем беременным, рекомендуютEating Right During Pregnancy:
- Есть продукты, богатые простым белком. При преэклампсии он теряется с мочой, поэтому нужно восстанавливать его уровень при помощи питания.

- Употреблять нежирное мясо, птицу или рыбу, бобовые.
- Ежедневно есть овощи и фрукты. Они — источник витаминов и микроэлементов, клетчатки, поэтому помогают поддерживать работу кишечника и нормальный вес.
- Избегать алкоголя, кофе и других напитков, богатых кофеином, фастфуда, жирной пищи.
- Меньше есть сладкого.
- Включать в меню кисломолочные продукты, орехи, растительные масла.
- УменьшитьPreeclampsia: Can I Lower My Risk? в рационе количество соли.
Приём лекарств
Чтобы улучшить состояние беременной и ребёнка, врач может назначить лекарства. Например, для снижения давления и предотвращения появления судорог используют препараты магнияWhat are the treatments for preeclampsia, eclampsia, & HELLP syndrome?.
Если есть риск преждевременных родов, беременной назначают глюкокортикоидныеWhat are the treatments for preeclampsia, eclampsia, & HELLP syndrome? гормоны. Они помогут ускорить созревание лёгких плода и улучшат его адаптацию после рождения.
Как избежать преэклампсии
Стопроцентных способов предотвратить преэклампсию нет. Но можно снизить риски. Ещё до беременности для этого нужноPreeclampsia:
- похудеть, если индекс массы тела больше нормы;
- лечить артериальную гипертензию и контролировать давление;
- делать физические упражнения.
А во время беременности, если женщина входит в группу риска по развитию преэклампсии, врач может назначить ацетилсалициловуюPreeclampsia: Can I Lower My Risk? кислоту начиная с 12‑й недели.
Читайте также 🤰💊👶
- Чем опасна анемия при беременности и как её лечат
- Чем опасен резус-конфликт при беременности и что с этим делать
- Почему при беременности появляется симфизит и как его лечат
- Почему при беременности бывает токсикоз и как его лечить
- Чем опасна внематочная беременность и как её вовремя распознать
Гестоз, токсикоз беременных
Гестоз относится к нарушениям беременности, симптомы которых часто включают высокое кровяное давление и мутную мочу.
Обзор
Гестоз относится к нарушениям беременности, симптомы которых часто включают высокое кровяное давление и мутную мочу. Предположительно, они вызваны изменениями, связанными с беременностью, в сочетании с различными факторами риска, такими как ожирение, курение или высокое кровяное давление. Осмотры беременных важны для раннего выявления таких проблем.
Симптомы
На ранних сроках беременности (ранний гестоз)
- Тошнота и рвота по утрам (утренняя тошнота)
- Со 2-го по 4-й месяцы беременности
- Обычные, в основном безвредные
- Исчезает сам по себе
- Редко: обильная и опасная рвота.
- Обезвоживание, лихорадка
- Нарушение функции почек и печени, дезориентация
- Иногда увеличение слюноотделения
Гестоз редко встречается во втором триместре беременности
Гестоз в третьем триместре беременности (поздний гестоз)
- Основной симптом: повышенное артериальное давление (гипертония) выше 140/90 мм рт.
 ст.
ст.- Показания: головные боли и нарушения зрения (мерцание, затуманенное зрение)
- Выделение белка с мочой (протеинурия)
- Указывает на нарушение функции почек
- Отек (общий отек)
- В частности, в ножках
- В сочетании с избыточной массой тела
- Может также случиться с беременными женщинами, которые в остальном здоровы
- Другие симптомы: тошнота и рвота, а также боль в животе, тревога, дезориентация
Преэклампсия
- Основные симптомы: гипертензия и протеинурия
- Потенциально угрожающее состояние матери и ребенка
- Если не лечить, это может привести к эклампсии (см. ниже)
Эклампсия
- Немедленно угрожающая жизни, наиболее тяжелая форма позднего гестоза
- Судороги с потерей сознания
- До, во время или после рождения
- Приступ похож на эпилептический припадок (длится около 1 минуты)
- После потери сознания (от часов до дней)
HELLP-синдром
- Возникает как полная неожиданность или как часть эклампсии
- Может возникнуть и после рождения
- Острая почечная и печеночная недостаточность с желтухой, кровотечением и тромбозом
- Возможна потеря плацентарной функции
- Последствие: преждевременные роды или мертворожденный ребенок
Причины и лечение
Причины
- Точные причины неизвестны
Считается, что определенную роль играют различные факторы (список не является исчерпывающим):
- Беременность как физически и психически «ненормальная ситуация»
- Первая беременность (особенно у очень молодых или пожилых женщин)
- Многоплодная беременность
- Гестоз во время предыдущей беременности
- Семейная предрасположенность
- Ранее существовавшие заболевания
- Высокое кровяное давление
- Сахарный диабет (сахарный диабет)
- Нарушение функции поджелудочной железы, печени и почек
- Сосудистые и другие повреждения
- Недоедание или дефицит питательных веществ
- Ожирение
Дальнейшее лечение у врача / в больнице
Возможные анализы
- Круглосуточный мониторинг артериального давления
- Анализ мочи
- Анализ крови (функция печени и почек, общий анализ крови)
- УЗИ (сонография)
- КТГ (кардиотокография) для оценки сердцебиения плода
Возможные методы лечения
- Госпитализация
- Лечение артериального давления
- Магний (для профилактики эклампсии)
- Преждевременные роды
- Единственный способ лечения причин
- В зависимости от состояния матери и ребенка
- От индукции родов до экстренного кесарева сечения
Что я могу сделать сам?
- Ходите на регулярные осмотры беременных
- Сбалансированное питание
- Достаточное количество витаминов и минералов (в частности, кальция и железа)
- При высоком кровяном давлении: диета с низким содержанием соли, без снижения потребления жидкости
- Избегайте стресса, делайте регулярные перерывы на отдых
- Без алкоголя и никотина (обычно во время беременности)
- Чтобы поднять ноги, поднимите изножье кровати
- Контроль веса:
- Прибавка в весе индивидуальная
- Женщины с недостаточным весом набирают пропорционально больше веса, чем женщины с избыточным весом
- Как правило, избегайте потери веса во время беременности
Когда обратиться к врачу?
- Для регулярных осмотров беременных (для раннего выявления осложнений)
- В промежутках между регулярными проверками, если возникают такие проблемы, как:
- Высокое кровяное давление
- Головные боли
- Нарушения зрения
- Мутная моча
- Вагинальное кровотечение
- Прибавка в весе более 600 г в неделю
- В первую очередь проявляется отеком (припухлостью) на ногах
Дополнительная информация
Selbsthilfe Schweiz (Поддержка самопомощи в Швейцарии)
www. selbsthilfeschweiz.ch
selbsthilfeschweiz.ch
Журнал «Wir eltern» (Родители)
www.wireltern.ch
Синонимы
токсикоз беременных, гестоз, эклампсия и HELLP-синдром, EPH-гестоз, HELLP-синдром, преэклампсия
Что такое гестоз? Признаки, симптомы и решения • FamilyApp
Элизабет Джонсон
Гестоз — это общий термин для обозначения ряда заболеваний, связанных с беременностью. Если вы заметили какие-либо признаки этого состояния, примите меры как можно скорее, чтобы свести к минимуму риск для матери и будущего ребенка. Вот что нужно искать:
Что такое гестоз?
Гестоз — это общий термин для различных заболеваний, возникающих только во время беременности. Некоторые называют это токсемией или типом отравления беременных, поскольку оно вызывает симптомы, включая высокое кровяное давление и гипертонию. Мы не знаем, что именно вызывает преэклампсию или токсикоз, и симптомы могут варьироваться от человека к человеку. Эти симптомы могут возникнуть впервые во время беременности или из-за ранее существовавших состояний у беременной женщины .
Мы не знаем, что именно вызывает преэклампсию или токсикоз, и симптомы могут варьироваться от человека к человеку. Эти симптомы могут возникнуть впервые во время беременности или из-за ранее существовавших состояний у беременной женщины .
Существует разница между тем, возникают ли ваши симптомы до или после 20-недельного срока. Ранние признаки включают легкую и тяжелую утреннюю тошноту . К поздним гестозам относятся преэклампсия (ранее называвшаяся токсемия ) и тяжелые формы эклампсии, сопровождающиеся повышением артериального давления, протеинурией, задержкой воды, нарушением функции печени и почек.
Гестоз включает тяжелое утреннее недомогание
Почти все беременные женщины склонны страдать от утреннего недомогания в первом триместре, которое проявляется тошнотой и периодической рвотой. Однако по сравнению с «нормальным» утренняя тошнота с, гиперемезис беременных гораздо тяжелее. Симптомы включают сильную чувствительность к запахам и позывы к рвоте, чувствительность к свету, чувство слабости и учащенное сердцебиение. Страдающие чрезмерной рвотой воспринимают ее как тяжелое испытание. Частая рвота может вызвать симптомы дефицита и нарушения водно-минерального баланса. В крайних случаях могут потребоваться инфузии, чтобы гарантировать, что беременная женщина получает все необходимые жидкости и питательные вещества.
Страдающие чрезмерной рвотой воспринимают ее как тяжелое испытание. Частая рвота может вызвать симптомы дефицита и нарушения водно-минерального баланса. В крайних случаях могут потребоваться инфузии, чтобы гарантировать, что беременная женщина получает все необходимые жидкости и питательные вещества.
Преэклампсия является классификацией гестоза
Типичными симптомами преэклампсии являются повышенное кровяное давление и задержка воды. Это состояние обычно появляется только во второй половине беременности. Преэклампсия очень редко возникает в первой половине беременности.
Преэклампсия может протекать в различной степени тяжести. Преэклампсия легкой степени встречается довольно часто, т.е. е. у одной из десяти первородящих матерей он есть. Будущие мамы практически не замечают легкой формы. гинеколог может выявить симптомы преэклампсии. По этой причине артериальное давление и моча проверяются на содержание белка при каждом обследовании. Лечение варьируется в зависимости от тяжести преэклампсии. Регулярный контроль артериального давления необходим для всех форм. Если повышение артериального давления слишком сильное, врачи назначают лекарства для снижения артериального давления. В случае тяжелой преэклампсии будущую маму госпитализируют для тщательного наблюдения .
Лечение варьируется в зависимости от тяжести преэклампсии. Регулярный контроль артериального давления необходим для всех форм. Если повышение артериального давления слишком сильное, врачи назначают лекарства для снижения артериального давления. В случае тяжелой преэклампсии будущую маму госпитализируют для тщательного наблюдения .
Эклампсия – опасная форма гестоза
Это редкое, но опасное состояние, сопровождающееся судорогами, угрожающими здоровью будущего ребенка и матери. Эклампсия может возникать во время беременности и родов, а также в последующие дни. Будущая мать должна немедленно обратиться в больницу , так как это состояние может вызвать такие осложнения, как острая почечная недостаточность, отек головного мозга, тромбозы, повреждение сетчатки, кровотечение, плацентарная недостаточность. Признаки и симптомы эклампсии включают мерцание зрения, дискомфорт, сильные головные боли и судороги .
HELLP-синдром – форма гестоза, требующая неотложной помощи
Долгое время HELLP-синдром считался наиболее тяжелым осложнением гестоза. Однако, согласно последним данным, симптомы могут возникать внезапно без предшествующих признаков гестоза. Луи Вайнштейн использовал термин HELLP-синдром в 1982 году для описания следующих симптомов:0016
Однако, согласно последним данным, симптомы могут возникать внезапно без предшествующих признаков гестоза. Луи Вайнштейн использовал термин HELLP-синдром в 1982 году для описания следующих симптомов:0016
Полностью развившийся HELLP-синдром угрожает жизни матери и ее будущего ребенка. Именно поэтому в большинстве случаев врачи принимают решение о проведении кесарева сечения без промедления. Во многих случаях мать должна быть помещена в реанимацию. На сегодняшний день точно не выяснено, что запускает HELLP-синдром. Он обычно развивается в течение нескольких часов с болью в правой верхней части живота и появлением отека и задержки жидкости в конечностях и/или на лице. Другие симптомы, которые могут указывать на синдром HELLP, включают:
- Нарушение зрения Желтое изменение цвета кожиВнезапная тошнотаПоносРвотаИли сильный зуд кожи
В настоящее время профилактических мер не существует. К счастью, HELLP-синдром — это редкое состояние, которое по статистике встречается только в 0,2–0,85% всех беременностей.
Важные скрининговые тесты на гестозы
Поскольку на сегодняшний день не существует эффективной профилактики различных гестозов, особенно важно воспользоваться преимуществами пренатальные скрининговые тесты . Информацию о медицинском обслуживании во время беременности и после родов можно получить в Центрах по контролю и профилактике заболеваний. В руководящих принципах предлагаются тип и объем необходимой медицинской помощи, а также приводятся отчеты о большинстве процедур скрининга, которые проводят врачи.
Несмотря на то, что эти процедуры могут показаться слишком сложными, помните, что вы не одиноки! Друзья, семья и группы поддержки также могут предоставить вам отличную информацию и поддержку во время беременности. Но если у вас есть дополнительные медицинские вопросы, обязательно обратитесь к своему врачу за оптимальной медицинской помощью.
Категории Здоровье взрослых, Беременность
Collagen and glycosaminoglycans of Wharton’s jelly and their alterations in EPH-gestosis
ScienceDirect
Corporate sign inSign in / register
View PDF
- Access through your institution
Volume 66, Issue 2, June 1996 , Страницы 109-117
https://doi. org/10.1016/0301-2115(96)02390-1Получить права и содержание
org/10.1016/0301-2115(96)02390-1Получить права и содержание
Некоторые внутриутробные патологические процессы могут быть обусловлены биохимическими и морфологическими изменениями в пуповине (ЯП). . ЭПГ-гестоз является наиболее частым патологическим процессом, ассоциированным с беременностью. По этим причинам роль коллагена и гликозаминогликанов (ГАГ) ЯК в патобиохимии этого синдрома представляется важной. Изучали гистологию компонентов внеклеточного матрикса, количество, растворимость и молекулярный полиморфизм коллагена, пропорциональные соотношения между различными типами коллагена, количество ГАГ и пропорциональные соотношения между ними в вартоновом желе контрольных новорожденных, рожденных здоровыми матерями и родившимися матерями с ЭПГ-гестоз. Мы обнаружили, что желе Уортона богато коллагеном и ГАГ. Этот коллаген очень нерастворим и устойчив к действию деполимеризующих агентов (4% EDTA-Na 2 , пепсин). Были выделены и количественно определены коллагены I, III и V типов. Гиалуроновая кислота составляет около 70%, тогда как сульфатированные ГАГ составляют около 30% от общего количества ГАГ. ЭПГ-гестоз сопровождается значительным повышением соотношения сульфатированные ГАГ: гиалуроновая кислота. Изменения в вартоновом желе, связанные с ЭПГ-гестозом, соответствуют «преждевременному старению» этой ткани.
Гиалуроновая кислота составляет около 70%, тогда как сульфатированные ГАГ составляют около 30% от общего количества ГАГ. ЭПГ-гестоз сопровождается значительным повышением соотношения сульфатированные ГАГ: гиалуроновая кислота. Изменения в вартоновом желе, связанные с ЭПГ-гестозом, соответствуют «преждевременному старению» этой ткани.
Ссылки (20)
- К. Такечи и др.
Ультраструктурные и иммуногистохимические исследования клеток вартонова желе пуповины
Плацента
(1993)
- К. Мурата и др.
Изменения типов коллагена в различных слоях аорты человека и их изменения при атеросклеротическом процессе
Атеросклероз
(1986)
- D.W. Prockop и др.
Специфический метод анализа гидроксипролина в тканях и моче
Anal Biochem
(1960)
- R.K. Серебро и др.
Размер пуповины и объем амниотической жидкости при переношенной беременности
Am J Obstet Gynecol
(1987)
- J.
 Klein et al.
Klein et al. Структура ткани и макромолекулярная диффузия в пуповине. Иммобилизация эндогенной гиалуроновой кислоты
Biochim Biophys Acta
(1983)
- F.A. Meyer et al.
Доказательства механического соединения микрофибрилл гликопротеина с фибриллами коллагена в Вартоновом желе
Biochim Biophys Acta
(1983)
- R.B. Howard
Контроль плацентального кровотока человека
Med Hypoth
(1987)
- J. Ryynanen ET.
Экспрессия гена коллагена типа VII в ткани и клетках пуповины человека
Lab Invest
(1993)
- J.F. Tavares-Fortuna et al.
Коарктация пуповины: причина внутриутробной гибели плода
Int J Gynaecol Obstet
(1978)
- L.A. Virgilio et al.
Смерть плода вследствие сужения и перекрута пуповины
Лаборатория Arch Pathol Med
(1978)
В полной текстовой версии этой статьи доступно больше ссылок.
Исследование безопасности аллогенной терапии мезенхимальными стволовыми клетками на животных моделях
2022, Регенеративная терапия
Сообщается, что внутривенное (IV) вливание мезенхимальных стволовых клеток (МСК) из зарождающихся тканей, таких как Wharton’s Jelly из пуповины, обеспечивает терапевтический эффект против хронических заболеваний. Однако токсикологические данные, необходимые для клинического применения этих клеток, ограничены. Таким образом, это исследование было направлено на определение безопасности внутривенного вливания МСК, полученных из Wharton’s Jelly (WJ-MSC), у крыс. Пятнадцать самцов крыс Sprague-Dawley были рандомизированы в контрольную группу или экспериментальную группу. Каждая группа получала равный объем физиологического раствора или WJ-MSC (10 × 10 6 клеток/кг) соответственно. У животных оценивали физические, биохимические и гематологические изменения на 0, 2, 4, 8 и 12 неделе в течение 12-недельного исследования.
 Острую токсичность определяли в течение 2-й недели, а субхроническую токсичность — в течение 12-й недели. В конце исследования рассчитывали относительный вес органов и выполняли гистологию легких, печени, селезенки и почек. Данные физикального исследования, биохимии сыворотки и общего анализа крови не показали статистически значимых различий между группами. Тем не менее, патологоанатомическая оценка выявила незначительное воспаление в легких для всех групп, но видимое заживление и разрешение воспаления наблюдались только в группе лечения. Кроме того, гистологические изображения группы лечения показали значительно улучшенные легочные структуры по сравнению с контрольной группой. Таким образом, внутривенное введение WJ-MSC было безопасным для крыс. Необходимы дальнейшие исследования для определения долгосрочной безопасности WJ-MSC как на здоровых, так и на больных моделях животных.
Острую токсичность определяли в течение 2-й недели, а субхроническую токсичность — в течение 12-й недели. В конце исследования рассчитывали относительный вес органов и выполняли гистологию легких, печени, селезенки и почек. Данные физикального исследования, биохимии сыворотки и общего анализа крови не показали статистически значимых различий между группами. Тем не менее, патологоанатомическая оценка выявила незначительное воспаление в легких для всех групп, но видимое заживление и разрешение воспаления наблюдались только в группе лечения. Кроме того, гистологические изображения группы лечения показали значительно улучшенные легочные структуры по сравнению с контрольной группой. Таким образом, внутривенное введение WJ-MSC было безопасным для крыс. Необходимы дальнейшие исследования для определения долгосрочной безопасности WJ-MSC как на здоровых, так и на больных моделях животных.Дивергентные изменения содержания и активности ММП-26 и ТИМП-4 в тканях пуповины человека, связанные с преэклампсией
2018, Европейский журнал акушерства, гинекологии и репродуктивной биологии беременность.
 Наши более ранние результаты выявили значительное увеличение количества матриксной металлопротеиназы-26 (матрилизин 2; ММП-26) в преэклампсии пуповинной крови. Роль MMP-26 в преэклампсии в ткани пуповины полностью не выяснена. В некоторых сообщениях указано, что экспрессия матрилизина 2 и тканевого ингибитора матриксной металлопротеиназы 4 (ТИМП-4) координировано регулируется во время прогрессирования различных заболеваний.
Наши более ранние результаты выявили значительное увеличение количества матриксной металлопротеиназы-26 (матрилизин 2; ММП-26) в преэклампсии пуповинной крови. Роль MMP-26 в преэклампсии в ткани пуповины полностью не выяснена. В некоторых сообщениях указано, что экспрессия матрилизина 2 и тканевого ингибитора матриксной металлопротеиназы 4 (ТИМП-4) координировано регулируется во время прогрессирования различных заболеваний.Поэтому мы решили оценить экспрессию и активность MMP-26 и TIMP-4 в нормальных и преэклампсиальных тканях пуповины — артериях пуповины (UCA), вене (UCV) и Вартоновом желе (WJ). Ткани, полученные из 10 нормальных (контрольный материал) и 10 преэклампсии пуповины, оценивали с помощью иммуноферментного анализа, вестерн-иммуноблотинга, обратной транскриптазно-полимеразной цепной реакции и флуорометрического определения активности ферментов.
Все ткани пуповины, как контрольные, так и преэклампсии, экспрессировали ММР-26 и ТИМП-4 в макромолекулярных комплексах.
 Преэклампсия индуцировала достоверное повышение содержания и фактической активности ММП-26 при ЯКВ и СС по сравнению с контролем. Содержание ТИМП-4 при преэклампсии ЯКВ и СС было снижено. Содержание мРНК ММР-26 было ниже при НКА и ЯКВ, тогда как при преэклампсии выше в ЗЯ.
Преэклампсия индуцировала достоверное повышение содержания и фактической активности ММП-26 при ЯКВ и СС по сравнению с контролем. Содержание ТИМП-4 при преэклампсии ЯКВ и СС было снижено. Содержание мРНК ММР-26 было ниже при НКА и ЯКВ, тогда как при преэклампсии выше в ЗЯ.Дивергентные изменения в экспрессии мРНК и белка MMP-26 свидетельствуют о различии факторов, контролирующих синтез матрилизина у здоровых и страдающих преэклампсией субъектов. Снижение содержания TIMP-4 при преэклампсии UCV может быть основной причиной значительно более высокой фактической активности MMP-26 в этой ткани. Только в преэклампсии Вартоновского студня изменения были сопоставимы по содержанию и активности ММП-26 и ТИМП-4. Не исключено, что подобные изменения могут наблюдаться для всей сосудистой системы новорожденных, рожденных матерями с преэклампсией.
Опыт использования плодных оболочек: настоящее и новые перспективы
2018, Материалы по трансплантации
Плацента является доступным источником тканей для трансплантации.
 Плацентарные трансплантаты использовались для лечения ран из-за основной функции плаценты, ее питательных свойств и структуры.
Плацентарные трансплантаты использовались для лечения ран из-за основной функции плаценты, ее питательных свойств и структуры.Целью данной работы является представление клинического применения плодных оболочек, в том числе амниона человека, на основе опыта ожогового центра. Описано клиническое применение амниона и различных видов трансплантации плаценты. Представлены первые результаты исследований в рамках проекта MEDPIG по применению плаценты трансгенных свиней в качестве источника тканей для трансплантации.
С августа 2011 г. по март 2017 г. в нашем банке тканей было подготовлено 252 592 см 90 498 2 90 499 биостатических трансплантатов амниона человека. За этот период они были трансплантированы 528 больным, в том числе 10 пациентам с синдромом Лайелла.
Были проведены первоначальные исследования, в ходе которых плаценты были собраны у 5 трансгенных свиней и из них было приготовлено 27 426 см 90 498 2 90 499 амниотических трансплантатов.
Собственный опыт авторов, а также данные литературы подтверждают исключительную эффективность трансплантатов, приготовленных из тканей плаценты, особенно из амниотической оболочки.

Клинические эффекты подтверждают эффективность использования амниона человека при лечении ран. Амниотическая трансплантация является новым стандартом лечения токсического эпидермального некролиза ТЭН (синдром Лайелла), который нашел подтверждение в очень хороших клинических результатах.
Собранные плаценты от трансгенных животных позволили приготовить значительно больше трансплантатов, чем в случае человеческого материала, что является большим преимуществом этого источника плаценты перед тканями человека.
Регенерация ишемического сердечно-сосудистого повреждения с использованием вартонова желе в качестве неограниченного источника терапевтических стволовых клеток
2018, Перинатальные стволовые клетки: исследования и терапия
Сердечно-сосудистые заболевания (ССЗ) являются причиной смерти номер один во всем мире. Несмотря на существенный и очевидный прогресс, сердечно-сосудистые заболевания остаются нерешенной медицинской проблемой. Регенеративная заместительная клеточная терапия становится наиболее многообещающим подходом для будущих стандартных методов лечения сердечно-сосудистых заболеваний.
 В этой главе мы обобщаем информацию об использовании мезенхимальных стволовых клеток Wharton gellly при сердечно-сосудистых заболеваниях и размышляем о будущем их клинического применения.
В этой главе мы обобщаем информацию об использовании мезенхимальных стволовых клеток Wharton gellly при сердечно-сосудистых заболеваниях и размышляем о будущем их клинического применения.Мезенхимальные стромальные клетки из вартонова желе (WJ-MSC)
2018, Перинатальные стволовые клетки: исследования и терапия
Среди потенциальных источников клеток, привлекательных для регенеративной медицины, в последние годы большое внимание уделяется перинатальным тканям. . Пуповина (UC) является основной частью плаценты, органом, обеспечивающим взаимодействие плода и матери во время беременности. Зрелый ЯК состоит из трех сосудов, одной вены и двух артерий, которые входят в сеть, образованную зрелой слизистой соединительной тканью, называемой вартоновым желе (WJ). Недавние данные, полученные от исследовательских групп со всего мира, показали, что стромальные клетки WJ обладают уникальными свойствами как с точки зрения способности к дифференциации, так и с точки зрения иммуномодуляции.
 Эти свойства желательны для приложений клеточной терапии, тем самым расширяя число возможных клинических применений этих клеток. В этой главе мы даем представление об истории развития клеток WJ и последних разработках в области их использования как в «замещающем», так и в «поддерживающем» применении регенеративной медицины при ключевых заболеваниях.
Эти свойства желательны для приложений клеточной терапии, тем самым расширяя число возможных клинических применений этих клеток. В этой главе мы даем представление об истории развития клеток WJ и последних разработках в области их использования как в «замещающем», так и в «поддерживающем» применении регенеративной медицины при ключевых заболеваниях.Изготовление трехмерного губчатого каркаса с использованием внеклеточного матрикса, полученного из желе Уортона, для заживления ран
2017, Материаловедение и инженерия C
Желе Уортона (WJ) содержит значительное количество компонентов внеклеточного матрикса (ECM) и богатый источник эндогенных факторов роста. В этом исследовании мы разработали новый биомиметический губчатый каркас из децеллюляризованного ECM, полученного из WJ, и использовали его в качестве заменителя кожи. Гистологический анализ и биохимические анализы показали, что биоактивные молекулы сохраняются в изготовленных каркасах и что каркасы имеют сильно взаимосвязанную пористую структуру.
 Цитотоксичность и механическая оценка каркаса показали, что он нетоксичен и имеет соответствующие механические свойства. Анализ МТТ, СЭМ и гистологический анализ фибробластов человека, посеянных на каркасы, подтвердили клеточную жизнеспособность, прикрепление, проникновение и пролиферацию. Эффективность каркасов, полученных из WJ, в регенерации полнослойной раны оценивали с помощью in vivo эксперимент. Наши результаты показали, что каркасы хорошо интегрировались в ткани мыши и абсорбировали экссудаты через одну неделю. В отличие от контроля, в группе WJ наблюдалось не только полное закрытие раны и исчезновение струпа, но и полная реэпителизация, новообразованные эпидермальные слои и придатки через 12 дней после имплантации. В совокупности наши результаты показывают, что каркасы, полученные из WJ, способны улучшать прикрепление, проникновение и рост клеток фибробластов и ускорять процессы заживления, что обеспечивает надлежащий кожный трансплантат для заживления ран.
Цитотоксичность и механическая оценка каркаса показали, что он нетоксичен и имеет соответствующие механические свойства. Анализ МТТ, СЭМ и гистологический анализ фибробластов человека, посеянных на каркасы, подтвердили клеточную жизнеспособность, прикрепление, проникновение и пролиферацию. Эффективность каркасов, полученных из WJ, в регенерации полнослойной раны оценивали с помощью in vivo эксперимент. Наши результаты показали, что каркасы хорошо интегрировались в ткани мыши и абсорбировали экссудаты через одну неделю. В отличие от контроля, в группе WJ наблюдалось не только полное закрытие раны и исчезновение струпа, но и полная реэпителизация, новообразованные эпидермальные слои и придатки через 12 дней после имплантации. В совокупности наши результаты показывают, что каркасы, полученные из WJ, способны улучшать прикрепление, проникновение и рост клеток фибробластов и ускорять процессы заживления, что обеспечивает надлежащий кожный трансплантат для заживления ран.
Посмотреть все цитирующие статьи в Scopus
Исследовательская статья
Сравнительный анализ двух методов децеллюляризации почек свиньи для поддержания функциональной сосудистой архитектуры
Acta Biomaterialia, Volume 75, 2018, pp.
 в настоящее время является единственным окончательным решением для лечения терминальной стадии почечной недостаточности (ESRD), однако трансплантация сильно ограничена из-за нехватки доступных донорских почек. Недавний прогресс в инженерии целых органов, основанный на методах децеллюляризации/рецеллюляризации, позволил провести доклинические in vivo исследования на моделях мелких животных; однако эти исследования in vivo были ограничены краткосрочными оценками. Ранее мы разработали систему децеллюляризации, которая эффективно удаляет клеточные компоненты из свиных почек. В то время как функциональная реэндотелизация на каркасе цельной почки свиньи была способна улучшить проходимость сосудов, по сравнению с каркасом только почки продолжительность проходимости длилась всего несколько часов. В этом исследовании мы предположили, что значительное повреждение микроциркуляторного русла в почечном каркасе привело к прекращению кровотока, и что необходимо тщательное исследование для точной оценки сосудистой целостности почечного каркаса.
в настоящее время является единственным окончательным решением для лечения терминальной стадии почечной недостаточности (ESRD), однако трансплантация сильно ограничена из-за нехватки доступных донорских почек. Недавний прогресс в инженерии целых органов, основанный на методах децеллюляризации/рецеллюляризации, позволил провести доклинические in vivo исследования на моделях мелких животных; однако эти исследования in vivo были ограничены краткосрочными оценками. Ранее мы разработали систему децеллюляризации, которая эффективно удаляет клеточные компоненты из свиных почек. В то время как функциональная реэндотелизация на каркасе цельной почки свиньи была способна улучшить проходимость сосудов, по сравнению с каркасом только почки продолжительность проходимости длилась всего несколько часов. В этом исследовании мы предположили, что значительное повреждение микроциркуляторного русла в почечном каркасе привело к прекращению кровотока, и что необходимо тщательное исследование для точной оценки сосудистой целостности почечного каркаса. Два протокола децеллюляризации [додецилсульфат натрия (SDS) с ДНКазой (SDS+DNase) или Triton X-100 с SDS (TRX+SDS)] использовали для оценки и оптимизации уровней целостности сосудов в каркасе почки. Результаты исследований сосудистого анализа с использованием коррозионного литья сосудов и ангиограмм показали, что метод TRX+SDS способен лучше поддерживать неповрежденные и функциональные структуры микрососудов, такие как клубочки, в бесклеточном матриксе, чем при обработке SDS+ДНКазой. Важно, in vitro перфузия крови реэндотелиализованной почечной конструкции показала улучшение сосудистой функции каркаса при обработке TRX+SDS по сравнению с SDS+DNase. Наши результаты показывают, что оптимизированный метод децеллюляризации TRX+SDS сохраняет почечные микроциркуляторные сосуды и может способствовать долгосрочной сосудистой проходимости после имплантации.
Два протокола децеллюляризации [додецилсульфат натрия (SDS) с ДНКазой (SDS+DNase) или Triton X-100 с SDS (TRX+SDS)] использовали для оценки и оптимизации уровней целостности сосудов в каркасе почки. Результаты исследований сосудистого анализа с использованием коррозионного литья сосудов и ангиограмм показали, что метод TRX+SDS способен лучше поддерживать неповрежденные и функциональные структуры микрососудов, такие как клубочки, в бесклеточном матриксе, чем при обработке SDS+ДНКазой. Важно, in vitro перфузия крови реэндотелиализованной почечной конструкции показала улучшение сосудистой функции каркаса при обработке TRX+SDS по сравнению с SDS+DNase. Наши результаты показывают, что оптимизированный метод децеллюляризации TRX+SDS сохраняет почечные микроциркуляторные сосуды и может способствовать долгосрочной сосудистой проходимости после имплантации.Трансплантация почки является единственным радикальным методом лечения пациентов с терминальной стадией почечной недостаточности (ТХПН).
 Однако в Соединенных Штатах предложение донорских почек удовлетворяет менее одной пятой потребности; и те пациенты, которые получают донорскую почку, нуждаются в пожизненной иммуносупрессивной терапии, чтобы избежать отторжения органа. За последние два десятилетия регенеративная медицина и тканевая инженерия стали привлекательной альтернативой для преодоления этих ограничений.
Однако в Соединенных Штатах предложение донорских почек удовлетворяет менее одной пятой потребности; и те пациенты, которые получают донорскую почку, нуждаются в пожизненной иммуносупрессивной терапии, чтобы избежать отторжения органа. За последние два десятилетия регенеративная медицина и тканевая инженерия стали привлекательной альтернативой для преодоления этих ограничений.В 2013 г. Song et al. опубликовали первую экспериментальную ортотопическую трансплантацию биоинженерной почки грызунам. В этом исследовании они продемонстрировали признаки регенерации почечной ткани и частичного восстановления функции. Несмотря на эти первоначальные многообещающие результаты, по-прежнему существует много проблем, связанных с достижением долгосрочной перфузии крови без тромбоза трансплантата. В этой статье мы продемонстрировали, что перфузия детергентов через почечную артерию почек свиньи повреждает микроархитектонику клубочков, а также перитубулярные капилляры. Изменяя динамические параметры, такие как скорость потока, концентрация детергента и время децеллюляризации, мы смогли установить оптимизированный протокол децеллюляризации без признаков нарушения микроархитектуры клубочков.
 В качестве доказательства концепции мы рецеллюляризировали почечные каркасы эндотелиальными клетками и in vitro успешно перфузировал цельную свиную кровь в течение 24 часов без признаков тромбоза.
В качестве доказательства концепции мы рецеллюляризировали почечные каркасы эндотелиальными клетками и in vitro успешно перфузировал цельную свиную кровь в течение 24 часов без признаков тромбоза.Исследовательская статья
Белковые маркеры злокачественного потенциала при склерозе полового члена и вульвы
Журнал урологии, том 190, выпуск 2, 2013 г., стр. 399-406 области у мужчин и женщин, которые связаны с плоскоклеточным раком. Однако данных о роли биомаркеров в прогнозировании прогрессирования склероатрофического лихена в плоскоклеточный рак недостаточно. Мы сосредоточились на ранних белковых маркерах плоскоклеточной карциномы и их экспрессии при склероатрофическом лихене, чтобы улучшить механистическое и диагностическое понимание склероатрофического лихена.
Мы провели обширный поиск в PubMed® и MEDLINE® белковых маркеров, обнаруженных на ранних стадиях плоскоклеточной карциномы вульвы и полового члена, и их распространенность в ассоциированных поражениях склероатрофического лихена.

В последние годы несколько маркеров были задействованы в качестве маркеров-предшественников злокачественной трансформации склероатрофического лихена в плоскоклеточную карциному, включая p53, Ki-67, γ-h3AX, MCM3 и циклин D1. Эти белки активируются при склероатрофическом лихене вульвы/пениса и плоскоклеточной карциноме. Различные уровни доказательств показывают связь между склероатрофическим лишаем и плоскоклеточным раком. p16 избыточно экспрессируется при плоскоклеточной карциноме полового члена и вульвы, связанной с инфекцией вирусом папилломы человека, но существуют противоречивые сообщения о его экспрессии при склерозирующем лихене. Маркеры ангиогенеза, фактор роста эндотелия сосудов и циклооксигеназа-2, экспрессируются на более высоких уровнях, а плотность микрососудов повышена при склероатрофическом лихене вульвы и плоскоклеточной карциноме, что указывает на возможную подобную связь при склероатрофическом лихене полового члена.
Лишь небольшая часть случаев склероатрофического лихена связана с плоскоклеточным раком.
 Однако терапевтические последствия диагноза плоскоклеточной карциномы серьезны. Клинически нам не хватает понимания того, как отделить вялотекущие случаи склероатрофического лихена от тех, которые находятся под угрозой прогрессирования в плоскоклеточную карциному. Несколько белковых маркеров обещают дальнейшее определение патобиологии склероатрофического лихена и потенциальной злокачественной трансформации в плоскоклеточный рак.
Однако терапевтические последствия диагноза плоскоклеточной карциномы серьезны. Клинически нам не хватает понимания того, как отделить вялотекущие случаи склероатрофического лихена от тех, которые находятся под угрозой прогрессирования в плоскоклеточную карциному. Несколько белковых маркеров обещают дальнейшее определение патобиологии склероатрофического лихена и потенциальной злокачественной трансформации в плоскоклеточный рак.Исследовательская статья
МикроРНК-21 опосредует индуцированное рапамицином подавление пролиферации и миграции эндотелия
FEBS Letters, Volume 587, Issue 4, 2013, pp. приводит к задержке повторной эндотелизации в стентах с рапамициновым покрытием, которые используются у пациентов с ишемической болезнью сердца. Поскольку микроРНК (миР) играют важную роль в эндотелиальном ангиогенезе, мы проверили гипотезу о том, что рапамицин индуцирует эндотелиальную супрессию, частично посредством путей, которые включают миР. Лечение рапамицином увеличивало экспрессию миР-21 в HUVEC.
 Подавление миР-21 ингибиторами устраняло негативные эффекты рапамицина на рост и подвижность эндотелиальных клеток. Было подтверждено, что RhoB является прямым геном-мишенью miR-21. Нокдаун Raptor с помощью siRNA имитировал эффекты рапамицина на экспрессию miR-21. Наше исследование дает новое объяснение механизма опосредованного рапамицином ингибирования эндотелиальной пролиферации и миграции.
Подавление миР-21 ингибиторами устраняло негативные эффекты рапамицина на рост и подвижность эндотелиальных клеток. Было подтверждено, что RhoB является прямым геном-мишенью miR-21. Нокдаун Raptor с помощью siRNA имитировал эффекты рапамицина на экспрессию miR-21. Наше исследование дает новое объяснение механизма опосредованного рапамицином ингибирования эндотелиальной пролиферации и миграции.Исследовательская статья
Высокая региональная вариабельность уретропластики в США
Журнал урологии, том 193, выпуск 1, 2015 г., стр. 179-183
Мы определили клинические и региональные факторы, связанные с использованием уретропластика по сравнению с повторным эндоскопическим лечением стриктур уретры.
Мы проанализировали заявления пациентов в возрасте от 18 до 65 лет в базе данных MarketScan® Commercial Claims and Encounters за 2007–2011 годы с диагнозом стриктуры уретры. Первичным исходом было лечение с помощью уретропластики по сравнению с повторным эндоскопическим лечением, определяемым как более чем 2 расширения или внутренняя уретротомия с прямым визуальным контролем.
 Вероятность проведения пластики уретры по сравнению с повторным эндоскопическим лечением определялась для каждого крупного мегаполиса США. Для выявления факторов, связанных с уретропластикой, была проведена многофакторная логистическая регрессия.
Вероятность проведения пластики уретры по сравнению с повторным эндоскопическим лечением определялась для каждого крупного мегаполиса США. Для выявления факторов, связанных с уретропластикой, была проведена многофакторная логистическая регрессия.Мы выявили 41 056 пациентов со стриктурой уретры, что дало показатель диагноза 296 мужчин на 100 000 в MarketScan. Повторное эндоскопическое лечение и уретропластика были выполнены у 2700 и 1444 пациентов соответственно. По сравнению с пациентами, получавшими повторное эндоскопическое лечение, пациенты с уретропластикой были моложе (средний возраст 44 года против 54 лет) и с большей вероятностью имели 0 баллов по шкале Чарлсона (84% против 77%), выезжали за пределы мегаполиса для лечения. 34% против 17%) и имеют на лечении реконструктивного уролога столичного региона (76% и 62%, каждый p<0,001). При контроле возраста и сопутствующих заболеваний по шкале Чарлсона выезжайте за пределы мегаполиса (ОШ 2,7, 9).5% ДИ 2,2–3,3) и реконструктивный уролог в столичном регионе (ОШ 2,0, 95% ДИ 1,7–2,5) были связаны с большей вероятностью пластики уретры по сравнению с повторным эндоскопическим лечением.

Несмотря на общепризнанные преимущества уретропластики по сравнению с повторным эндоскопическим лечением, во многих регионах США существует сильная предвзятость в пользу повторного эндоскопического лечения.
Научная статья
Феноменология энтропии q-пути для кривых фазового пространства
Physica A: Статистическая механика и ее приложения, том 490, 2018, стр. 1522-1531
Мы описываем феноменологию классической энтропии q-пути кривой фазового пространства. Это позволяет раскрыть механизм, подобный энтропийной силе, который способен имитировать некоторые феноменологические аспекты сильного взаимодействия, такие как ограничение, жесткое ядро и асимптотическая свобода.
Исследовательская статья
Критический обзор результатов, о которых сообщили пациенты после пластики передней уретры у мужчин
Журнал урологии, том 189, выпуск 1, 2013 г., стр. 182-188
Стриктура уретры у мужчин может быть рецидивирующей и изнурительной.
 Целью любого вмешательства является возвращение мужчин к нормальному состоянию мочеиспускания при сохранении хорошего качества жизни. Был проведен систематический обзор литературы для оценки использования инструментов, сообщаемых пациентами, после пластики передней уретры у мужчин.
Целью любого вмешательства является возвращение мужчин к нормальному состоянию мочеиспускания при сохранении хорошего качества жизни. Был проведен систематический обзор литературы для оценки использования инструментов, сообщаемых пациентами, после пластики передней уретры у мужчин.Обзор PubMed® был проведен для выявления исследований, в которых использовалась оценка исхода, сообщаемая пациентом, для оценки исхода после открытой хирургической коррекции мужских стриктур. Предпочтение отдавалось исследованиям, в которых использовался инструмент в предоперационных и послеоперационных условиях. Однако использование критерия исхода исключительно в послеоперационном периоде также было принято. После выбора статьи 8 атрибутов, рекомендованных Научным консультативным комитетом, были использованы для анализа характеристик измерения результатов, о которых сообщил каждый пациент.
Всего было найдено 15 исследований, включавших инструмент для оценки пациентов со стриктурами передней уретры.
 В исследованиях использовались разные инструменты для неоднородной оценки стриктур передней уретры. В четырех исследованиях использовали инструмент симптомов нижних мочевыводящих путей, в 8 использовали инструмент сексуальной/эякуляторной дисфункции, а в 3 использовали инструмент симптомов нижних мочевыводящих путей и сексуальной/эякуляторной функции. Был только 1 отчет, в котором описывалась разработка инструмента для конкретных результатов уретропластики.
В исследованиях использовались разные инструменты для неоднородной оценки стриктур передней уретры. В четырех исследованиях использовали инструмент симптомов нижних мочевыводящих путей, в 8 использовали инструмент сексуальной/эякуляторной дисфункции, а в 3 использовали инструмент симптомов нижних мочевыводящих путей и сексуальной/эякуляторной функции. Был только 1 отчет, в котором описывалась разработка инструмента для конкретных результатов уретропластики.Необходимы постоянные усилия по разработке мощного инструмента для оценки результатов, о которых сообщают пациенты, после пластики уретры у мужчин. Важность перспективы пациента жизненно важна для понимания успеха открытой реконструкции уретры.
Просмотр полного текста
Copyright © 1996 Опубликовано Elsevier Ireland Ltd.
гестоз беременных
гестоз
Оформление концепции
Гестоз – это заболевание, характерное для беременных, которое проявляется изменением определения этого заболевания повышением артериального давления и/или выделениями яичного белка в моче и/или водными включениями (отеками). В прошлом это было выражение для всех заболеваний, связанных с беременностью. Вы тогда предположили, что болезнь спровоцирована особым ядом. Поэтому и приходят понятия отравление беременностью или гестоз. Название отек-протеинурия-гипертонический гестоз, эти симптомы отеки, выделение яичного белка с мочой (протеинурия) и высокое кровяное давление (гипертония) также является производным, до сих пор используется. Сегодня используются новые названия: «гипертоническая болезнь беременных» (ГЭК) или «гипертензия, вызванная беременностью» (СИГ). Эти представления ориентируются на то, что повышение артериального давления является наиболее важным и наиболее частым признаком этого условного заболевания беременности более 140/9.0 мм рт.ст.
В прошлом это было выражение для всех заболеваний, связанных с беременностью. Вы тогда предположили, что болезнь спровоцирована особым ядом. Поэтому и приходят понятия отравление беременностью или гестоз. Название отек-протеинурия-гипертонический гестоз, эти симптомы отеки, выделение яичного белка с мочой (протеинурия) и высокое кровяное давление (гипертония) также является производным, до сих пор используется. Сегодня используются новые названия: «гипертоническая болезнь беременных» (ГЭК) или «гипертензия, вызванная беременностью» (СИГ). Эти представления ориентируются на то, что повышение артериального давления является наиболее важным и наиболее частым признаком этого условного заболевания беременности более 140/9.0 мм рт.ст.
В зависимости от времени их возникновения различают две формы гестозов:
- Ранний гестоз: при первой беременности третьей
- Нарушение поздних сроков беременности: при последней беременности третий
При второй беременности гестозы не появляются при третьей, как обычно. Один говорит о так называемой стадии толерантности. Большинство гестозов являются поздними нарушениями беременности.
Один говорит о так называемой стадии толерантности. Большинство гестозов являются поздними нарушениями беременности.
Причины
Точные причины гестоза неизвестны. Несколько патологических событий, по-видимому, перекрываются. Под подозрением: недостаточная адаптация организма к беременности, особенно матки, недостаточное увеличение количества жидкости в крови, нарушение биохимического обмена, острая недостаточность нутриентов.
Симптом болезни
- Повышение артериального давления выше 140/90 мм рт.ст.
- Выделение белка с мочой (протеинурия; выделение яичного белка 300 мг за 24 часа в норме, говорят о тяжелом нарушении выделения яичного белка при более 3 г за 24 часа).
- Водяные включения с твердыми припухлостями на лодыжках, голенях, кистях рук и на лице, которые могут ходить с прибавкой в весе более 1-1,5 кг/неделю. При этом надо учитывать, что некоторые госпожи Вассер хранят, правда, без гестоза. Просто бывают гестозы без слишком больших водяных включений.

Клинические картины
Настаивает на том, что помимо высокого кровяного давления также можно говорить о повышенном выделении белка при преэклампсии. Это представляет очень высокий риск для будущего. Это может привести к задержке роста ребенка и преждевременному отделению плаценты. Если эпилептические припадки у матери появляются, то это самая тяжелая форма гестоза – эклампсия. Ощущение головокружения, головные боли, гиперкинезы и дефекты зрения уходят вперед. Это проявление гестоза может привести к полиорганным поражениям с летальным исходом. Симптомы могут быть распознаны и вылечены в полном объеме благодаря осмотрам.
Доходит до ишемии матки при гестозе. Это вызывает изменения тканей плаценты, что приводит к так называемой плацентарной недостаточности. Поэтому даже легкий гестоз представляет серьезную опасность для будущего ребенка. Он часто рождается недоношенным или маловесным для настоящего времени ребенком. Детская смертность увеличивается во время и после рождения. Наиболее частой причиной преждевременных родов является гестоз.
Наиболее частой причиной преждевременных родов является гестоз.
Группы риска
Гестозы появляются в большом количестве:
- Женщины, страдающие от высокого кровяного давления в семье,
- Многоплодная беременность,
- очень молодые или старые первородящие,
- существующие сосудистые заболевания матери (при хронических заболеваниях почек, повышенном артериальном давлении, сахарном диабете, злоупотреблении никотином),
- Беременные с избыточной массой тела и женщины, плохо питающиеся (белковая недостаточность).
Терапия гестоза
Поскольку точная причина гестоза неизвестна, можно проводить только терапию симптомов. При гипертонии (высоком кровяном давлении) встречаются лекарства, снижающие артериальное давление, с такими мерами, как избегание стресса, постельный режим и другие. Их необходимо компенсировать потерями яичного белка. Диета с низким содержанием натрия и жидкости (рисово-фруктовые дни) не рекомендуется, мочегонные средства (так называемые диуретики) сегодня уже не используются. Вы усиливаете только дефицит объема крови и сгущение крови. При легких формах гестоза симптомы заболевания купируются постельным режимом и питанием, богатым белками. Если этого не происходит, обращение беременной в клинику неизбежно. За состоянием будущего ребенка тщательно следят. Часто требуется преждевременное прерывание беременности путем кесарева сечения, так как за плодом уже недостаточно ухаживают и угрожающая эклампсия должна быть отвернута от матери.
Вы усиливаете только дефицит объема крови и сгущение крови. При легких формах гестоза симптомы заболевания купируются постельным режимом и питанием, богатым белками. Если этого не происходит, обращение беременной в клинику неизбежно. За состоянием будущего ребенка тщательно следят. Часто требуется преждевременное прерывание беременности путем кесарева сечения, так как за плодом уже недостаточно ухаживают и угрожающая эклампсия должна быть отвернута от матери.
Эта информация ни в коем случае не может рассматриваться как замена медицинской консультации. Содержимое сайта health-illness.com не может и не может быть использовано ни в одном случае для самостоятельной постановки диагноза или проведения самолечения.
Клиническая картина преэклампсии и диагностическая ценность белков и продуктов их метилирования в качестве биомаркеров у беременных женщин с преэклампсией и их новорожденных
На этой странице0003
Преэклампсия (ПЭ) — это заболевание, которым страдают от 1 до 10% беременных женщин во всем мире. Он характеризуется артериальной гипертензией и протеинурией на поздних сроках гестации и может приводить к материнской и перинатальной заболеваемости и смертности. Помимо рождения плода и удаления плаценты, на сегодняшний день не существует терапевтических подходов к лечению или профилактике ПЭ. Таким образом, снизить смертность от ТЭЛА можно только путем раннего выявления, тщательного мониторинга и лечения симптомов. По этим причинам поиск неинвазивных биохимических маркеров, переносимых кровью или мочой, которые можно было бы использовать для скрининга, досимптомной диагностики и прогнозирования развития ТЭЛА, является крайне актуальным. До сих пор был предложен ряд биомаркеров для прогнозирования ТЭЛА на основе патофизиологических наблюдений, но в большинстве случаев они оказались ненадежными и противоречивыми в разных исследованиях. Клиническая картина ПЭ и данные, собранные для биохимических маркеров плацентарного фактора роста (PlGF), растворимой кошачьей саркомы МакДоноу (fms-), подобной тирозинкиназе-1 (sFlt-1), асимметричному диметиларгинину (ADMA) и метиллизину пересматриваются с целью обеспечения как клинического, так и биохимического понимания того, как эти биомаркеры могут помочь в диагностике ПЭ или указать на ее тяжесть.
Он характеризуется артериальной гипертензией и протеинурией на поздних сроках гестации и может приводить к материнской и перинатальной заболеваемости и смертности. Помимо рождения плода и удаления плаценты, на сегодняшний день не существует терапевтических подходов к лечению или профилактике ПЭ. Таким образом, снизить смертность от ТЭЛА можно только путем раннего выявления, тщательного мониторинга и лечения симптомов. По этим причинам поиск неинвазивных биохимических маркеров, переносимых кровью или мочой, которые можно было бы использовать для скрининга, досимптомной диагностики и прогнозирования развития ТЭЛА, является крайне актуальным. До сих пор был предложен ряд биомаркеров для прогнозирования ТЭЛА на основе патофизиологических наблюдений, но в большинстве случаев они оказались ненадежными и противоречивыми в разных исследованиях. Клиническая картина ПЭ и данные, собранные для биохимических маркеров плацентарного фактора роста (PlGF), растворимой кошачьей саркомы МакДоноу (fms-), подобной тирозинкиназе-1 (sFlt-1), асимметричному диметиларгинину (ADMA) и метиллизину пересматриваются с целью обеспечения как клинического, так и биохимического понимания того, как эти биомаркеры могут помочь в диагностике ПЭ или указать на ее тяжесть.
1. Введение
Преэклампсия (ПЭ) представляет собой мультисистемное специфическое для беременных заболевание, характеризующееся развитием артериальной гипертензии и протеинурии (повышенный уровень белка в моче) после 20 недель беременности [1]. ПЭ является ведущей причиной материнской, перинатальной (с 20-й недели беременности до 4-й недели после рождения), а также фетальной/неонатальной смертности и заболеваемости во всем мире [2, 3].
ПЭ — очень серьезное заболевание, которое осложняет от 2 до 5% беременностей в Европе и Америке и может достигать до 10% беременностей в развивающихся странах, в основном из-за отсутствия или неадекватности неотложной помощи [2]. Также ПЭ связана с повышенным риском отслойки плаценты, преждевременных родов, задержки внутриутробного развития плода (ЗВУР), острой почечной недостаточности, цереброваскулярных и сердечно-сосудистых осложнений, диссеминированного внутрисосудистого свертывания и материнской смерти [4]. Поэтому способность обеспечить раннюю диагностику ТЭЛА имеет жизненно важное значение.
2. Клиническая картина, диагностика и патофизиология ТЭЛА
Клинически ТЭЛА проявляется впервые возникшей артериальной гипертензией у ранее нормотензивной женщины с показателями систолического и диастолического артериального давления ≥140 и ≥90 мм рт. случаи с интервалом не менее 6 часов, а также протеинурия, развивающаяся после 20 недель беременности [5–7].
Это заболевание может иметь раннее начало (ПЭ начинается до 34 недель беременности) или позднее начало (после 34 недель беременности) и может быть классифицировано как легкое или тяжелое, в зависимости от тяжести присутствующих симптомов [2] (табл. 1). В случае тяжелой ТЭЛА отмечаются более значительные подъемы АД и большая степень протеинурии. Другие симптоматические признаки тяжелой ТЭЛА, которые могут присутствовать, включают олигурию (менее 500 мл мочи за 24 часа), церебральные или зрительные нарушения, а также отек легких или цианоз [8, 9].].
Кроме того, клиническая картина ТЭЛА может быть либо скрытой, либо молниеносной, поскольку у некоторых женщин симптомы могут быть бессимптомными на начальном этапе, даже после того, как будут отмечены гипертония и протеинурия, в то время как у других с самого начала могут проявляться симптомы тяжелой ТЭЛА [1]. Наконец, это состояние может проявляться только как материнское заболевание, при котором происходит нормальный рост плода, или же оно может привести к задержке внутриутробного развития или внезапному дистрессу плода [2].
Наконец, это состояние может проявляться только как материнское заболевание, при котором происходит нормальный рост плода, или же оно может привести к задержке внутриутробного развития или внезапному дистрессу плода [2].
Гипертензивные нарушения беременности являются наиболее частыми осложнениями, наблюдаемыми у акушеров [10], и все они связаны с более высокими показателями материнской и внутриутробной смертности и заболеваемости [11]. Эта категория расстройств включает хроническую гипертензию, ПЭ, ПЭ, наложенную на хроническую гипертензию, и гестационную гипертензию [9].]. Этиология и патология этих расстройств различаются, и, таким образом, диагностика ПЭ становится менее сложной, если врачи способны дифференцировать ПЭ от других гипертензивных расстройств беременных (рис. 1).
При хронической артериальной гипертензии повышенное артериальное давление может возникать до беременности, отмечаться до 20 недель беременности или наблюдаться через 12 недель после родов [9]. Это контрастирует с ПЭ, которая определяется наличием повышенного артериального давления и протеинурии после 20 недель беременности. В тяжелых случаях ТЭЛА может перерасти в эклампсию — тяжелое осложнение, характеризующееся впервые возникшими эпилептическими припадками (генерализованными судорогами) вследствие ангиоспазмов в головном мозге и отека мозга [13], у женщины с ТЭЛА [1]. . Эклампсия обычно возникает во второй половине беременности и является серьезной причиной материнской смертности, чаще всего в результате кровоизлияния в мозг [14].
Это контрастирует с ПЭ, которая определяется наличием повышенного артериального давления и протеинурии после 20 недель беременности. В тяжелых случаях ТЭЛА может перерасти в эклампсию — тяжелое осложнение, характеризующееся впервые возникшими эпилептическими припадками (генерализованными судорогами) вследствие ангиоспазмов в головном мозге и отека мозга [13], у женщины с ТЭЛА [1]. . Эклампсия обычно возникает во второй половине беременности и является серьезной причиной материнской смертности, чаще всего в результате кровоизлияния в мозг [14].
ПЭ, наложенная на хроническую гипертензию, характеризуется вновь возникшей протеинурией (или внезапным повышением уровня белка, если протеинурия уже имела место), острым повышением артериального давления (при условии, что протеинурия уже существует) или развитием HELLP (гемолиз, повышенный уровень печеночных ферментов, низкий уровень тромбоцитов) синдром [8]. Наконец, гестационную гипертензию можно отличить от ПЭ, так как она характеризуется наличием повышенного артериального давления после 20 недель беременности, которое нормализуется в течение 12 недель после родов при отсутствии протеинурии [8].
Медицинские состояния, которые потенциально могут вызывать заболевания микроциркуляторного русла, включая сахарный диабет, хроническую гипертензию, заболевания сосудов и соединительной ткани, а также антифосфолипидный синдром и нефропатию, являются факторами риска развития ТЭЛА. Ряд других факторов риска развития ТЭЛА, которые могут быть связаны с самой беременностью или с клиническими особенностями матери или отца плода, представлен на рис. 2 [8, 12, 15].
Хотя патофизиология ПЭ до конца не изучена, проблемы имплантации плаценты и уровень трофобластической инвазии, как следствие эндотелиальной дисфункции, по-видимому, играют центральную роль в развитии и прогрессировании этого заболевания. Во время нормальной беременности цитотрофобласты, происходящие от плода, проникают в спиральные артерии матки матери и реконструируют их таким образом, что эти артерии малого диаметра с высоким сопротивлением превращаются в сосуды с высокой пропускной способностью и низким сопротивлением [16]. Этот процесс завершается в середине беременности, чтобы оптимизировать распределение материнской крови и гарантировать, что развивающаяся маточно-плацентарная единица получает адекватную доставку кислорода и питательных веществ из материнского кровообращения (Рамси и Доннер (19).80) как указано в [3]).
Этот процесс завершается в середине беременности, чтобы оптимизировать распределение материнской крови и гарантировать, что развивающаяся маточно-плацентарная единица получает адекватную доставку кислорода и питательных веществ из материнского кровообращения (Рамси и Доннер (19).80) как указано в [3]).
Считается, что ПЭ развивается в два этапа. Первая, бессимптомная стадия ПЭ включает нарушение инвазии трофобласта в децидуальную оболочку (плацентарное ложе матери), что, по-видимому, связано с локальными, аномальными фетально-материнскими иммунными взаимодействиями в стенке матки [2, 17, 18]. Эта аномальная поверхностная плацентация снижает перфузию маточно-плацентарной крови и, следовательно, приводит к локальной плацентарной гипоксии. Было показано, что этот окислительный стресс еще больше ухудшает сосудистую функцию в плаценте [19].], что впоследствии приводит к недостаточной перфузии крови, воспалению, апоптозу и структурным повреждениям [17, 20–23].
На втором этапе плацентарные переносимые кровью факторы, выбрасываемые в материнский кровоток из плохо перфузируемой плаценты, вместе с аберрантной экспрессией провоспалительных, антиангиогенных и ангиогенных факторов могут активировать материнский эндотелий и в конечном итоге вызывать эндотелиальную дисфункцию, которая приводит к основным клиническим симптомам ТЭЛА: артериальной гипертензии и протеинурии [14, 24]. Отмечено, что величина дефектной трофобластической инвазии спиральных артерий коррелирует с тяжестью ТЭЛА [25].
Отмечено, что величина дефектной трофобластической инвазии спиральных артерий коррелирует с тяжестью ТЭЛА [25].
Хотя ТЭЛА нельзя предотвратить, смертность от ТЭЛА можно снизить за счет раннего выявления и тщательного мониторинга ТЭЛА [1]. Кроме того, женщины с прогрессирующей или тяжелой ПЭ должны быть госпитализированы на ранней стадии, чтобы обеспечить тщательный мониторинг состояния здоровья матери и плода.
3. Биомаркеры ПЭ
Поиск неинвазивных биомаркеров, передающихся с кровью или мочой, которые можно было бы использовать для скрининга и диагностики этого опасного для жизни нарушения беременности, имеет первостепенное значение. Такие биомаркеры могут предсказать развитие ПЭ или помочь в ее обнаружении, что, в свою очередь, может оказать жизненно важное влияние на ведение беременных женщин и их будущих детей [2].
Что наиболее важно, скрининг беременных женщин с использованием биохимических маркеров ПЭ может обеспечить досимптомную диагностику, которая, в свою очередь, уменьшит ненужные страдания и затраты на здравоохранение, связанные с этим заболеванием [26]. Постановка более раннего диагноза позволяет более тщательно отслеживать прогрессирование заболевания, а также состояние здоровья матери и плода, что позволяет оптимизировать сроки родов с целью снижения числа преждевременных родов или других осложнений, связанных с ПЭ. 27]. Такие биохимические маркеры могут также позволить классифицировать женщин с ПЭ в соответствии с тяжестью симптомов и/или исходом беременности, что еще больше улучшит их клиническое ведение [28].
Постановка более раннего диагноза позволяет более тщательно отслеживать прогрессирование заболевания, а также состояние здоровья матери и плода, что позволяет оптимизировать сроки родов с целью снижения числа преждевременных родов или других осложнений, связанных с ПЭ. 27]. Такие биохимические маркеры могут также позволить классифицировать женщин с ПЭ в соответствии с тяжестью симптомов и/или исходом беременности, что еще больше улучшит их клиническое ведение [28].
Были исследованы многочисленные биохимические маркеры ПЭ, которые были выбраны на основе патофизиологических наблюдений, наблюдаемых в случаях ПЭ, таких как плацентарная и/или эндотелиальная дисфункция (таблица 2). Однако надежность этих маркеров в прогнозировании ТЭЛА была противоречивой в разных исследованиях [2]. Следовательно, в этом обзоре основное внимание будет уделено тем биохимическим маркерам ПЭ, которые, по отдельности или в комбинации, представляются наиболее клинически значимыми для диагностики ПЭ, а также их способности указывать на тяжесть этого нарушения, а именно плацентарные маркеры. фактора роста (PlGF), растворимой кошачьей саркомы МакДоноу (fms-), подобной тирозинкиназе-1 (sFlt-1) и асимметричному диметиларгинину (ADMA), а также введение возможности скрининга метиллизина в белках, связанных с беременностью .
фактора роста (PlGF), растворимой кошачьей саркомы МакДоноу (fms-), подобной тирозинкиназе-1 (sFlt-1) и асимметричному диметиларгинину (ADMA), а также введение возможности скрининга метиллизина в белках, связанных с беременностью .
3.1. Плацентарный фактор роста (PlGF) и растворимая fms-подобная тирозинкиназа-1 (sFlt-1)
PlGF принадлежит к семейству белков сосудисто-эндотелиального фактора роста (VEGF) и на 53 % идентично тромбоцитарному фактору роста. как область VEGF [29]. На основании этой гомологии с VEGF предполагалось, что PlGF является ангиогенным фактором [29–31]. Фактически, было замечено, что PlGF обладает сильными ангиогенными и митогенными свойствами, которые способны индуцировать пролиферацию, миграцию и активацию эндотелиальных клеток [32, 33].
Экспрессия матричной РНК (мРНК) PlGF, по-видимому, ограничена плацентой, трофобластическими опухолями и культивируемыми эндотелиальными клетками человека [29–31]. По существу, PlGF обнаруживается в больших количествах в плаценте, но он также экспрессируется на низком уровне при нормальных физиологических условиях в некоторых других органах, включая сердце, легкие, скелетные мышцы и жировую ткань [34-40].
Проангиогенная активность представителей семейства белков VEGF, в том числе PlGF, достигается за счет связывания и активации тирозинкиназных рецепторов [41, 42]. Наиболее важными рецепторами, которые, как было обнаружено, связывают семейство белков VEGF с высокой аффинностью, являются fms-подобный тирозинкиназный рецептор (Flt-1, также называемый VEGF рецептором 1, VEGFR1) и область киназного домена (KDR или VEGFR2). ) [43, 44]. Эти рецепторы состоят из одной сигнальной последовательности, трансмембранного домена, 7 иммуноглобулиноподобных доменов в их внеклеточном домене (лиганд-связывающий домен) и внутриклеточного тирозинкиназного домена [45].
Однако было отмечено, что кДНК в эндотелиальных клетках пупочной вены человека в плаценте кодирует укороченную форму Flt-1, которая образуется в результате альтернативного сплайсинга мРНК. Эта растворимая изоформа Flt-1 (sFlt-1) лишена седьмого иммуноглобулиноподобного домена, цитоплазматического домена и трансмембранной последовательности [45].
3.1.1. PlGF и sFlt-1 при болезненных состояниях и беременности
Одним из наиболее важных свойств эндотелиальных клеток сосудов является их способность к пролиферации и формированию сети капилляров посредством процесса, называемого ангиогенезом [33]. У нормального взрослого человека процесс ангиогенеза строго регулируется и ограничивается эндометрием и яичниками в разные фазы менструального цикла, а также сердцем и скелетными мышцами после травм, вызванных длительными и постоянными физическими нагрузками [134]. Этот процесс особенно заметен во время эмбрионального развития (Ramsey & Donner (19).80) и Gilbert (1988), как указано в [33]), поскольку ангиогенез необходим для правильного развития эмбриона и постнатального роста [134].
Сложное взаимодействие между некоторыми членами семейства белков VEGF, включая PlGF, и родственными им рецепторами, особенно Flt-1, необходимо для возникновения ангиогенеза [2]. С другой стороны, растворимый вариант сплайсинга Flt-1, sFlt-1, секретируется в кровоток и действует как антиангиогенный фактор, поскольку он противодействует и нейтрализует PlGF и VEGF, связываясь с ними и ингибируя их взаимодействие с эндотелиальными рецепторами на клеточной поверхности [36, 45, 57].
PlGF присутствует на ранних стадиях эмбрионального развития и на всех стадиях беременности, поскольку он сильно экспрессируется плацентой. Было высказано предположение, что присутствие этого проангиогенного фактора служит контролем роста и дифференцировки трофобласта [31, 37], что, в свою очередь, подразумевает, что PlGF играет роль в инвазии трофобласта в материнскую децидуальную оболочку [135]. В то же время, хотя sFlt-1 секретируется в небольших количествах эндотелиальными клетками и моноцитами, плацента, по-видимому, служит основным источником sFlt-1 в кровотоке во время беременности. Этот вывод подчеркивается значительным падением уровня циркулирующего sFlt-1 после рождения плаценты [47].
У беременной женщины с нормальным артериальным давлением уровень PlGF в кровотоке матери постепенно увеличивается в течение первых двух триместров и достигает пика в середине беременности, а затем снова снижается по мере наступления срока беременности. С другой стороны, уровень sFlt-1 у беременных с нормотензией остается относительно стабильным в течение первых двух триместров, после чего он неуклонно повышается до срока [45, 47, 53]. Это гестационное изменение можно наблюдать в результатах, представленных в таблицах ниже, которые были получены в проспективном многоцентровом исследовании: диагностика преэклампсии (исследование Roche № CIM RD000556/X06P006). В этом исследовании уровни PlGF и sFlt-1 измерялись у женщин с нормальным артериальным давлением из стран Европы, у которых была одноплодная беременность и в дальнейшем были нормальные исходы беременности (без ПЭ/HELLP и без ЗВУР) (рис. 3 и 4).
Это гестационное изменение можно наблюдать в результатах, представленных в таблицах ниже, которые были получены в проспективном многоцентровом исследовании: диагностика преэклампсии (исследование Roche № CIM RD000556/X06P006). В этом исследовании уровни PlGF и sFlt-1 измерялись у женщин с нормальным артериальным давлением из стран Европы, у которых была одноплодная беременность и в дальнейшем были нормальные исходы беременности (без ПЭ/HELLP и без ЗВУР) (рис. 3 и 4).
Уровни этих биомаркеров также были исследованы в материнском кровотоке пациентов с ПЭ. Имеются убедительные доказательства снижения количества свободного биоактивного PlGF вместе с более высокой плацентарной экспрессией sFlt-1 и, следовательно, повышенным уровнем циркулирующего sFlt-1 у пациенток с преэклампсией во время активного заболевания по сравнению с беременными женщинами с нормотензией [46, 47]. , 50, 53, 55, 67].
В крупном поперечном исследовании, сравнивавшем женщин того же гестационного возраста с активной ПЭ и нормотензивной беременностью, уровни PlGF были ниже, а уровни sFlt-1 выше в группе с преэклампсией (средний уровень PlGF 137 пг/мл по сравнению с 669пг/мл; средний уровень sFlt-1 4382 пг/мл по сравнению с 1643 пг/мл) [53]. Считается, что снижение уровней PlGF связано с повышением концентрации циркулирующего sFlt-1 с 33 по 36 недель беременности и, следовательно, увеличением связывания PlGF с sFlt-1, а не снижением уровня PlGF, вызванным снижением продукции PlGF. 53].
Считается, что снижение уровней PlGF связано с повышением концентрации циркулирующего sFlt-1 с 33 по 36 недель беременности и, следовательно, увеличением связывания PlGF с sFlt-1, а не снижением уровня PlGF, вызванным снижением продукции PlGF. 53].
В 2003 г. Maynard et al. вводили экзогенный sFlt-1 беременным крысам, и, что примечательно, это приводило к снижению уровня PlGF, гипертензии и протеинурии, симптомам, аналогичным наблюдаемым у пациентов с ПЭ [47]. Это открытие привело к мысли о том, что материнская эндотелиальная дисфункция, отмечаемая у пациенток с преэклампсией, обусловлена дисбалансом уровней про- и антиангиогенных факторов в материнском кровотоке. Имеются многочисленные подтверждающие данные, свидетельствующие о том, что антагонизм sFlt-1 к PlGF может быть причиной эндотелиальной дисфункции при ПЭ [59]., 60].
Дефицит PlGF и избыток sFlt-1, наблюдаемые у пациенток с преэклампсией, также могут быть связаны с плацентарной гипоксией, связанной с неполным ремоделированием спиральных артерий матери. Эта дефектная плацентация в результате неполного ремоделирования артерий обеспечивает постоянно высокое сопротивление кровотоку в маточных артериях, что, в свою очередь, может предрасполагать к разрыву сосудов в плацентарном ложе, особенно после начала гипертензии [136, 137]. Однако необходимы дополнительные доказательства, чтобы определить, являются ли измененные уровни этих про- и антиангиогенных факторов следствием или причиной дефекта плаценты у женщин с ПЭ.
Эта дефектная плацентация в результате неполного ремоделирования артерий обеспечивает постоянно высокое сопротивление кровотоку в маточных артериях, что, в свою очередь, может предрасполагать к разрыву сосудов в плацентарном ложе, особенно после начала гипертензии [136, 137]. Однако необходимы дополнительные доказательства, чтобы определить, являются ли измененные уровни этих про- и антиангиогенных факторов следствием или причиной дефекта плаценты у женщин с ПЭ.
Исследования показали, что уровень материнского PlGF был более значительно снижен у пациенток с тяжелыми симптомами ПЭ по сравнению с беременными женщинами с нормальным артериальным давлением и женщинами с симптомами легкой ПЭ. С другой стороны, в случае материнских уровней sFlt-1 было показано, что повышенные уровни коррелируют с тяжестью ПЭ, при этом средние уровни sFlt-1 колеблются от 1,50 ± 0,22 нг/мл у беременных с нормальным артериальным давлением до 3,28 ± 0,83 нг/мл. нг/мл у женщин с легкой ПЭ и до 7,64 ± 1,5 нг/мл у женщин с тяжелой ПЭ [47, 48]. Кроме того, было отмечено, что вариации PlGF и sFlt-1 более выражены при ПЭ с ранним началом по сравнению с ПЭ с поздним началом, а также у женщин, перенесших ПЭ и позже родивших новорожденных с малым размером для гестационного возраста (SGA) [53, 56]. Результаты, полученные Levine et al. [53], которые показывают эти различия, представлены на рисунках 5 и 6.
Кроме того, было отмечено, что вариации PlGF и sFlt-1 более выражены при ПЭ с ранним началом по сравнению с ПЭ с поздним началом, а также у женщин, перенесших ПЭ и позже родивших новорожденных с малым размером для гестационного возраста (SGA) [53, 56]. Результаты, полученные Levine et al. [53], которые показывают эти различия, представлены на рисунках 5 и 6.
В исследовании Levine et al. также сообщалось, что повышение уровня sFlt-1 в кровотоке у пациентов с ТЭЛА соответствует снижению уровня свободного PlGF [53]. Кроме того, было также замечено, что изменения уровней этих факторов предшествуют клиническому диагнозу на несколько недель. Фактически важным открытием в этом исследовании было то, что повышенный уровень sFlt-1 может быть обнаружен в материнской сыворотке за 5 недель до появления клинических симптомов ПЭ, в то время как сниженный уровень PlGF может быть обнаружен с 13 до 16 недель беременности у женщин. женщин, у которых впоследствии развивается ПЭ. Позднее этот факт был отмечен рядом других исследований [20, 53, 58, 62–66, 68–72, 138].
Эти данные свидетельствуют о том, что измерение PlGF и sFlt-1 можно использовать для прогнозирования развития ПЭ за несколько недель до появления клинических симптомов этого заболевания (рис. 7). Комбинированное измерение PlGF и sFlt-1 также позволило отличить женщин, у которых впоследствии развилась ПЭ, от женщин, у которых впоследствии развилась гестационная гипертензия, у которых родились дети SGA, или у которых была нормальная, здоровая доношенная беременность [47, 52].
Согласно некоторым исследованиям, измененные уровни sFlt-1 специфичны для ТЭЛА, так как у женщин, родивших в последующем новорожденных с ЗВВ или беременность которых осложнилась ЗВУР, изменений не выявлено по сравнению с нормотензивными женщинами с нормальными исходами беременности [51, 58] . Однако в выбранной группе пациенток с аномальной перфузией матки с последующей ЗВУР другие исследования выявили аналогичные изменения уровней PlGF и sFlt-1 во втором триместре [139].].
Комбинация значений sFlt-1 и PlGF в виде отношения, как показано в проспективном многоцентровом исследовании: диагностика преэклампсии (исследование Roche № CIM RD000556/X06P006) (рис. 8), также использовалась в качестве предиктор ТЭЛА. В проспективном исследовании Rana et al. [61] было высказано предположение, что отношение sFlt-1 к PlGF, по-видимому, является лучшим предиктором ПЭ, чем любое измерение по отдельности. Ким и др. [24] показали, что отношение sFlt-1 к PlGF у женщин с преэклампсией было значительно выше по сравнению с нормальным контролем, поскольку медиана отношения log [sFlt-1/PlGF] у женщин с преэклампсией составляла 1,6 (диапазон 1,0–2,9).), в то время как среднее значение в нормотензивном контроле составляло 1,2 (диапазон 0,5–1,9). В этом исследовании использовалось пороговое значение 1,4, поскольку оно показало чувствительность 80,4% и специфичность 78%, при этом женщины, имеющие материнские значения отношения log [sFlt-1/PlGF] более 1,4, имели более высокий риск развития ПЭ. Таким образом, это соотношение является надежным маркером общего риска ТЭЛА и может быть использовано для разграничения нормально протекающей беременности и беременности, осложненной ТЭЛА, а также для определения степени тяжести ТЭЛА [2, 140].
8), также использовалась в качестве предиктор ТЭЛА. В проспективном исследовании Rana et al. [61] было высказано предположение, что отношение sFlt-1 к PlGF, по-видимому, является лучшим предиктором ПЭ, чем любое измерение по отдельности. Ким и др. [24] показали, что отношение sFlt-1 к PlGF у женщин с преэклампсией было значительно выше по сравнению с нормальным контролем, поскольку медиана отношения log [sFlt-1/PlGF] у женщин с преэклампсией составляла 1,6 (диапазон 1,0–2,9).), в то время как среднее значение в нормотензивном контроле составляло 1,2 (диапазон 0,5–1,9). В этом исследовании использовалось пороговое значение 1,4, поскольку оно показало чувствительность 80,4% и специфичность 78%, при этом женщины, имеющие материнские значения отношения log [sFlt-1/PlGF] более 1,4, имели более высокий риск развития ПЭ. Таким образом, это соотношение является надежным маркером общего риска ТЭЛА и может быть использовано для разграничения нормально протекающей беременности и беременности, осложненной ТЭЛА, а также для определения степени тяжести ТЭЛА [2, 140].
Измерение PlGF и sFlt-1 лишь изредка применялось к младенцам, родившимся в результате преэклампсии. В 2005 г. Стафф и соавт. измеряли уровни PlGF и sFlt-1 у нормотензивных и преэклампсии беременных женщин и их новорожденных [49]. Результаты, полученные для матерей, отражали те же результаты, полученные в исследованиях, упомянутых в предыдущих разделах, с более низкими уровнями PlGF и более высокими уровнями sFlt-1, отмеченными в группе с преэклампсией. В этом исследовании образцы пуповины, полученные от всех новорожденных, имели уровни PlGF, которые были ниже концентрации самого низкого стандарта набора ELISA, использованного в исследовании (15,6 пг/мл), и, таким образом, сравнение между контрольными группами с преэклампсией и нормотензией не могло быть проведено. достигнуто. С другой стороны, медиана концентрации sFlt-1, полученная для плодов, рожденных от матерей с ПЭ, оказалась значительно выше, чем медианная концентрация, полученная для плодов, рожденных от матерей с нормальным давлением (246 пг/мл, 95% ДИ для медианы 163–255 по сравнению с 163 пг/мл, 95% ДИ для медианы 136–201).
В то же время, хотя уровни sFlt-1 были отмечены как более высокие у плодов, рожденных от матерей с ПЭ, концентрации sFlt-1, измеренные в пробах из пуповины, оказались очень низкими по сравнению с материнскими концентрациями sFlt-1. Это открытие свидетельствует о том, что плод не вносит значительного вклада в повышение материнской концентрации sFlt-1 при ПЭ, что еще больше подтверждает предположение о том, что повышение концентрации циркулирующего sFlt-1 у матерей с ПЭ происходит главным образом из плаценты [49].]. Этот вывод также согласуется с идеей о том, что у плодов не возникает гипертензия или протеинурия, как у их матерей с преэклампсией, потому что они не подвергаются воздействию высоких концентраций антиангиогенных факторов, включая sFlt-1, который, хотя и имеет плацентарное происхождение, должен в первую очередь ограничиваться материнская сосудистая сеть [141].
3.2. Продукты метилирования белков
Метилирование белков представляет собой посттрансляционную модификацию (ПТМ), которая включает перенос метильных групп с S-аденозил-L-метионина (SAM) на определенный остаток белка под контролем определенных ферментов метилтрансфераз [142]. Это приводит к образованию метилированного субстрата и побочного продукта, S-аденозил-L-гомоцистеина (SAH), который затем расщепляется ферментом S-аденозилгомоцистеингидролазой с образованием аденозина и гомоцистеина [143] (рис. 9).). Такие PTM преимущественно нацелены на боковые цепи аргинина и лизина, но было показано, что другие аминокислотные остатки, включая гистидин, аспарагин, глутамин и цистеин, служат второстепенными мишенями для метилирования.
Это приводит к образованию метилированного субстрата и побочного продукта, S-аденозил-L-гомоцистеина (SAH), который затем расщепляется ферментом S-аденозилгомоцистеингидролазой с образованием аденозина и гомоцистеина [143] (рис. 9).). Такие PTM преимущественно нацелены на боковые цепи аргинина и лизина, но было показано, что другие аминокислотные остатки, включая гистидин, аспарагин, глутамин и цистеин, служат второстепенными мишенями для метилирования.
3.2.1. Асимметричный диметиларгинин (ADMA)
Различные типы метиларгинина синтезируются после метилирования аргинина, который представляет собой PTM атома азота, входящего в состав гуанидиногруппы аргининовой (R) группы в белках. Белки, которые подвергаются метилированию аргинина, участвуют в ряде различных клеточных процессов, включая регуляцию транскрипции, метаболизм РНК и репарацию повреждений ДНК [144]. Этот процесс включает присоединение одной или двух метильных групп, полученных из S-аденозилметионина (SAM) [145], к гуанидиновому атому азота аргинина и достигается с помощью ферментов белковой аргинин-N-метилтрансферазы (PRMT), которые относятся к родственное по последовательности семейство метилтрансфераз [146]. Гуанидиногруппа аргинина может быть метилирована тремя различными способами с образованием ω -NG-монометиларгинин (ММА), ω -NG,N’G-симметричный диметиларгинин (SDMA) или ω -NG,NG-асимметричный диметиларгинин (ADMA) [144] (рис. 10).
Гуанидиногруппа аргинина может быть метилирована тремя различными способами с образованием ω -NG-монометиларгинин (ММА), ω -NG,N’G-симметричный диметиларгинин (SDMA) или ω -NG,NG-асимметричный диметиларгинин (ADMA) [144] (рис. 10).
АДМА частично выводится с мочой, но в основном метаболизируется путем гидролитического расщепления до цитруллина и диметиламина. Эта метаболическая реакция катализируется ферментом NG-диметиларгининдиметиламиногидролазой (DDAH) [147] (рис. 11). Существует 2 изоформы DDAH: DDAH-1 и DDAH-2. Ткани, экспрессирующие нейрональную синтазу оксида азота (NOS), обычно содержат DDAH-1, в то время как ткани, содержащие эндотелиальную изоформу NOS (eNOS), преимущественно содержат DDAH-2 [148]. Таким образом, было замечено, что DDAH-1 обнаруживается в больших количествах в почках и печени, тогда как DDAH-2 является наиболее распространенной изоформой в эндотелии [145].
(1) ADMA при болезненных состояниях и беременности . В 1992 г. сообщалось, что ADMA является эндогенным конкурентным ингибитором NOS [149]. NOS отвечает за синтез оксида азота в эндотелиальных клетках, поскольку катализирует превращение L-аргинина в L-цитруллин и NO [150]. ADMA является аналогом L-аргинина, который также синтезируется и высвобождается эндотелиальными клетками.
В 1992 г. сообщалось, что ADMA является эндогенным конкурентным ингибитором NOS [149]. NOS отвечает за синтез оксида азота в эндотелиальных клетках, поскольку катализирует превращение L-аргинина в L-цитруллин и NO [150]. ADMA является аналогом L-аргинина, который также синтезируется и высвобождается эндотелиальными клетками.
NO играет несколько ролей в сердечно-сосудистой системе [144]. Это мощный вазоактивный медиатор, который высвобождается в ответ на стресс [151] и важен для поддержания эндотелиального гомеостаза [145]. Помимо индукции вазодилатации для регуляции сосудистого тонуса и кровотока в тканях [150–152], эндотелиальный NO также ингибирует агрегацию тромбоцитов [153], ингибирует адгезию лейкоцитов и моноцитов к эндотелию [154] и ингибирует пролиферацию гладкомышечных клеток [155]. .
Было отмечено, что снижение уровня или ингибирование DDAH, фермента, катализирующего гидролиз АДМА, приводит к повышению уровня АДМА в кровотоке и вызывает постепенную вазоконстрикцию [156]. Это происходит потому, что повышенный уровень АДМА в кровотоке приводит к обратимому ингибированию эндогенного синтеза NO, что, в свою очередь, может привести к эндотелиальной дисфункции [157]. Низкий уровень NO приводит к повышению системного сосудистого сопротивления и артериального давления [75]. Высокие уровни ADMA наблюдались у лиц с сердечно-сосудистыми заболеваниями, включая атеросклероз, гипертонию и гиперхолестеринемию, а также у лиц с хронической почечной недостаточностью [145]. Обычные сердечно-сосудистые факторы риска могут снижать активность DDAH за счет усиления окислительного стресса, что, в свою очередь, также приводит к повышению уровня ADMA [148, 158–160].
Это происходит потому, что повышенный уровень АДМА в кровотоке приводит к обратимому ингибированию эндогенного синтеза NO, что, в свою очередь, может привести к эндотелиальной дисфункции [157]. Низкий уровень NO приводит к повышению системного сосудистого сопротивления и артериального давления [75]. Высокие уровни ADMA наблюдались у лиц с сердечно-сосудистыми заболеваниями, включая атеросклероз, гипертонию и гиперхолестеринемию, а также у лиц с хронической почечной недостаточностью [145]. Обычные сердечно-сосудистые факторы риска могут снижать активность DDAH за счет усиления окислительного стресса, что, в свою очередь, также приводит к повышению уровня ADMA [148, 158–160].
В исследовании, проведенном в 1998 г. Holden et al. [73] было установлено, что у беременных женщин концентрация АДМА в кровотоке ниже, чем у небеременных женщин. Их результаты показали, что в то время как средняя концентрация АДМА у небеременных женщин составляла 0,82 ± 0,31 μ моль/л, средние значения АДМА у беременных находились в диапазоне 0,40 ± 0,15 μ моль/л в первом триместре. 0,52 ± 0,20 μ моль/л во втором триместре и 0,56 ± 0,22 μ моль/л в третьем триместре. Аналогичное наблюдение позже было сделано Maeda et al. [79] которые также отметили более низкие средние концентрации АДМА у беременных женщин (0,29 ± 0,05 μ моль/л в первом и третьем триместрах и 0,32 ± 0,05 μ моль/л в сроке) по сравнению со средними уровнями АДМА у небеременных женщин ( 0,41 ± 0,06 мк моль/л). В то же время результаты, полученные Holden et al. выявили, что, хотя средние уровни ADMA ниже у беременных женщин, они имеют тенденцию к увеличению в течение нормального гестационного периода [73]. Этот вывод не отражен в результатах, полученных Maeda et al. поскольку в последней группе не было отмечено изменения средних уровней АДМА от первого к третьему триместру (0,29± 0,05 90 817 μ 90 818 моль/л в первом и третьем триместрах), при этом единственное увеличение отмечается в доношенный срок (0,32 ± 0,05 90 817 μ 90 818 моль/л в срок) [79]. В качестве альтернативы, повышение среднего уровня ADMA во время беременности наблюдалось позже в исследовании Rizos et al.
0,52 ± 0,20 μ моль/л во втором триместре и 0,56 ± 0,22 μ моль/л в третьем триместре. Аналогичное наблюдение позже было сделано Maeda et al. [79] которые также отметили более низкие средние концентрации АДМА у беременных женщин (0,29 ± 0,05 μ моль/л в первом и третьем триместрах и 0,32 ± 0,05 μ моль/л в сроке) по сравнению со средними уровнями АДМА у небеременных женщин ( 0,41 ± 0,06 мк моль/л). В то же время результаты, полученные Holden et al. выявили, что, хотя средние уровни ADMA ниже у беременных женщин, они имеют тенденцию к увеличению в течение нормального гестационного периода [73]. Этот вывод не отражен в результатах, полученных Maeda et al. поскольку в последней группе не было отмечено изменения средних уровней АДМА от первого к третьему триместру (0,29± 0,05 90 817 μ 90 818 моль/л в первом и третьем триместрах), при этом единственное увеличение отмечается в доношенный срок (0,32 ± 0,05 90 817 μ 90 818 моль/л в срок) [79]. В качестве альтернативы, повышение среднего уровня ADMA во время беременности наблюдалось позже в исследовании Rizos et al. в 2012 г., которые показали, что средние уровни АДМА у беременных увеличились с 0,51 ± 0,14 90 817 мк 90 818 моль/л в первом триместре до 0,52 ± 0,13 90 817 мк 90 818 моль/л во втором триместре и, наконец, до 0,58 ± 0,16 90 817 мк моль/л в третьем триместре [81] (рис. 12). Такие данные свидетельствуют о том, что ADMA может играть роль в расширении сосудов и регуляции артериального давления во время беременности [73].
в 2012 г., которые показали, что средние уровни АДМА у беременных увеличились с 0,51 ± 0,14 90 817 мк 90 818 моль/л в первом триместре до 0,52 ± 0,13 90 817 мк 90 818 моль/л во втором триместре и, наконец, до 0,58 ± 0,16 90 817 мк моль/л в третьем триместре [81] (рис. 12). Такие данные свидетельствуют о том, что ADMA может играть роль в расширении сосудов и регуляции артериального давления во время беременности [73].
Во многих исследованиях измеряли уровень АДМА у беременных женщин, чтобы определить, существует ли значительная разница в концентрациях АДМА в кровотоке у женщин с ТЭЛА по сравнению с женщинами с неосложненной беременностью.
Наблюдались противоречивые результаты. В отдельных исследованиях в 1998, оба Holden et al. [73] и Петтерссон и соавт. [80] наблюдали повышенные средние уровни АДМА в третьем триместре у пациенток с преэклампсией (1,17 ± 0,42 μ моль/л и 0,55 ± 0,02 μ моль/л соответственно) по сравнению с контрольной группой беременных с нормальным давлением в течение того же гестационного периода. (0,56 ± 0,22 µ моль/л и 0,36 ± 0,01 µ моль/л соответственно). Точно так же исследование Rizos et al. [81] также показали повышенный средний уровень АДМА в течение всех трех триместров у пациенток с преэклампсией (0,58 ± 0,10 90,63 ± 0,14 μ моль/л во втором триместре и 0,68 ± 0,11 μ моль/л в третьем триместре) по сравнению с женщинами с неосложненной беременностью (0,51 ± 0,14). 90 817 μ 90 818 моль/л в первом триместре, 0,52 ± 0,13 90 817 μ 90 818 моль/л во втором триместре и 0,58 ± 0,16 90 817 μ 90 818 моль/л в третьем триместре). Однако в ряде других исследований, несмотря на то, что средние уровни ADMA демонстрировали аналогичную тенденцию к увеличению у пациенток с преэклампсией, эти результаты не были статистически значимыми [74, 76, 77].
(0,56 ± 0,22 µ моль/л и 0,36 ± 0,01 µ моль/л соответственно). Точно так же исследование Rizos et al. [81] также показали повышенный средний уровень АДМА в течение всех трех триместров у пациенток с преэклампсией (0,58 ± 0,10 90,63 ± 0,14 μ моль/л во втором триместре и 0,68 ± 0,11 μ моль/л в третьем триместре) по сравнению с женщинами с неосложненной беременностью (0,51 ± 0,14). 90 817 μ 90 818 моль/л в первом триместре, 0,52 ± 0,13 90 817 μ 90 818 моль/л во втором триместре и 0,58 ± 0,16 90 817 μ 90 818 моль/л в третьем триместре). Однако в ряде других исследований, несмотря на то, что средние уровни ADMA демонстрировали аналогичную тенденцию к увеличению у пациенток с преэклампсией, эти результаты не были статистически значимыми [74, 76, 77].
Кроме того, у беременных женщин, у которых развилась ПЭ, были отмечены повышенные концентрации АДМА. Эта повышенная концентрация АДМА была отмечена до развития клинических признаков и симптомов ТЭЛА [82, 83], что позволяет предположить, что АДМА может играть роль в патогенезе этого состояния. Поскольку известно, что оксид азота играет важную роль в поддержании кровотока и тонуса сосудов как у матери, так и у плода, а также в поддержании кровообращения плода, было высказано предположение, что повышенный уровень АДМА во время беременности, а также последующее снижение уровня NO в кровотоке , может способствовать патофизиологическим особенностям ТЭЛА [75, 79].
Поскольку известно, что оксид азота играет важную роль в поддержании кровотока и тонуса сосудов как у матери, так и у плода, а также в поддержании кровообращения плода, было высказано предположение, что повышенный уровень АДМА во время беременности, а также последующее снижение уровня NO в кровотоке , может способствовать патофизиологическим особенностям ТЭЛА [75, 79].
Измерение уровня АДМА в образцах пуповинной крови может иметь важное значение для объяснения механизмов регуляции системы кровообращения в перинатальный период [84]. Однако данные об уровне АДМА у новорожденных ограничены. В ранее упомянутом исследовании Maeda et al. [79] также было отмечено, что уровень АДМА, измеренный в пуповинной крови, был значительно выше материнского уровня, который был самым высоким в доношенном возрасте (1,02 ± 0,18 мк моль/л против 0,32 ± 0,05 9 моль/л).0817 мк моль/л соответственно). Это открытие позже наблюдал Tsukahara et al. [84], которые отметили, что уровни АДМА, измеренные в пуповинной крови контрольных новорожденных (новорожденных, рожденных от матерей с нормальным артериальным давлением после неосложненной беременности), были примерно в два раза выше, чем уровни АДМА, измеренные у кормящих женщин, здоровых детей и здоровых взрослых (1,71 ± 0,47 μ моль/л против 0,71 ± 0,06 μ моль/л, 0,71 ± 0,11 μ моль/л и 0,52 ± 0,12 μ моль/л соответственно).
При сравнении уровней ADMA, измеренных в пуповинной крови новорожденных контрольной группы и новорожденных, рожденных от матерей с ПЭ, Tsukahara et al. [84] не обнаружили существенной разницы между ними, поскольку их соответствующие средние значения составляли 1,71 ± 0,47 μ моль/л и 1,66 ± 0,33 μ моль/л. Однако в недавнем исследовании Gumus et al. [78] было отмечено, что медианные значения ADMA в пуповинной крови новорожденных, рожденных от матерей с ПЭ, были значительно выше, чем у контрольных новорожденных (8,344 нг/л против 4,603 нг/л). Также было отмечено, что уровень АДМА, измеренный в образце пуповинной крови, коррелировал с тяжестью преэклампсии.
3.2.2. Метил-лизин
В случае метилирования лизина специфические протеинлизинметилтрансферазы (КМТ) катализируют перенос одной, двух или трех метильных групп от SAM на эпсилон ( ε )-аминогруппу боковой цепи конкретного остатка лизина [142]. Это приводит к образованию различных форм метилированных лизинов, а именно монометил-, диметил- и триметиллизинов соответственно [142] (рис. 13). Некоторые белковые КМТ специфичны для одной или двух из этих модификаций, в то время как другие могут приводить к образованию всех трех производных [161]. Таким образом, было показано, что эти ферменты проявляют специфичность продукта, поскольку тип образующегося метиллизина зависит от конкретного фермента, катализирующего реакцию [162].
13). Некоторые белковые КМТ специфичны для одной или двух из этих модификаций, в то время как другие могут приводить к образованию всех трех производных [161]. Таким образом, было показано, что эти ферменты проявляют специфичность продукта, поскольку тип образующегося метиллизина зависит от конкретного фермента, катализирующего реакцию [162].
Было идентифицировано девять функциональных членов семейства PRMT (PRMT1-9), и специфичность этих ферментов в отношении белковых субстратов различается и, как правило, намного шире, чем у KMT. Например, было показано, что PRMT1, 2, 3, 4, 6 и 8 катализируют асимметричное диметилирование остатков аргинина, в то время как фермент PRMT5 катализирует симметричное диметилирование, а PRMT7 может катализировать только монометилирование [163–165].
Большинство ферментов метилтрансфераз сгруппированы в соответствии с их структурными особенностями в три больших семейства, а именно семь бета ( β ) strand [166], SET ( s подавитель пестроты 3-9 (Su(var)3-9), e nhancer zeste (E(z)) и t риторакс (Trx )) домен-содержащие [167] и SPOUT-домен-содержащие [168] ферменты. Однако, хотя все PRMT принадлежат к семицепочечному семейству ферментов β , большинство KMT содержат консервативный домен SET [169], который несет в себе ферментативную активность этих белков [170], и, следовательно, принадлежат к домену SET. содержащее семейство [171, 172]. Кроме того, растет число ферментов, принадлежащих к семи 9Было показано, что семейство нитей 0817 β катализирует сходные реакции метилирования [173–176]. Таким образом, KMT можно в целом разделить в соответствии с их ферментативным доменом на белки, содержащие домен SET, и белки, не содержащие домен SET.
Однако, хотя все PRMT принадлежат к семицепочечному семейству ферментов β , большинство KMT содержат консервативный домен SET [169], который несет в себе ферментативную активность этих белков [170], и, следовательно, принадлежат к домену SET. содержащее семейство [171, 172]. Кроме того, растет число ферментов, принадлежащих к семи 9Было показано, что семейство нитей 0817 β катализирует сходные реакции метилирования [173–176]. Таким образом, KMT можно в целом разделить в соответствии с их ферментативным доменом на белки, содержащие домен SET, и белки, не содержащие домен SET.
KMT, содержащие домен SET, были классифицированы в ряд семейств в соответствии с мотивами последовательности, окружающими домен SET. Члены одного и того же семейства имеют сходные мотивы последовательностей, окружающие домен SET, и часто также имеют более высокий уровень сходства в домене SET. Известно семь основных семейств, в том числе подавитель пестроты (Su(var)) 3-9.(SUV39), SET1, SET2, энхансер zeste (E(z)), взаимодействующий с ретинобластомой белок цинкового пальца (RIZ), SET и белок, содержащий домен Myeloid-Nervy-DEAF1 (MYND) (SMYD), и супрессор пестрые (Su(var)) 4-20 (SUV4-20) семейств. Эти семейства сопровождаются SET7/9 и SET8 (также известными как PR-SET7), которые представляют собой KMT, содержащие домен SET, но не вписываются в ранее упомянутые семейства [177]. Табличный список KMT, обнаруженных у людей, которые принадлежат к каждому семейству KMT, а также SET7/9.и SET8 вместе с их свойствами были представлены Dillon et al. [177].
Эти семейства сопровождаются SET7/9 и SET8 (также известными как PR-SET7), которые представляют собой KMT, содержащие домен SET, но не вписываются в ранее упомянутые семейства [177]. Табличный список KMT, обнаруженных у людей, которые принадлежат к каждому семейству KMT, а также SET7/9.и SET8 вместе с их свойствами были представлены Dillon et al. [177].
Хотя подавляющее большинство КМТ содержат домен SET, множество других белков, которые не содержат домен SET, включая d isruptor o f t elomeric silencing (DOT) 1-подобный (DOT1L) [169 , 178] и белки семейства метилтрансферазоподобных (METTL) [179], также обладают лизинметилтрансферазной активностью.
(1) Метилирование лизина при болезненных состояниях и беременности. 908–18 За прошедшие годы были идентифицированы многочисленные КМТ и лизиндеметилазы (КДМ), и сообщалось, что их активность играет важную роль в нескольких биологических процессах, включая регуляцию экспрессии генов, ход клеточного цикла, репликацию ДНК и дифференцировку [180–180]. 185]. В нормальных, здоровых состояниях метилирование лизина строго контролируется, а баланс в метилировании лизина поддерживается противоположными действиями KMT и KDM [186]. В то же время паттерны экспрессии генов должны быть способны реагировать на потребности развития и изменения окружающей среды, чтобы поддерживать здоровое состояние [187].
185]. В нормальных, здоровых состояниях метилирование лизина строго контролируется, а баланс в метилировании лизина поддерживается противоположными действиями KMT и KDM [186]. В то же время паттерны экспрессии генов должны быть способны реагировать на потребности развития и изменения окружающей среды, чтобы поддерживать здоровое состояние [187].
Нарушение регуляции ПТМ в виде неадекватной экспрессии (включение или элиминация), а также мутации многочисленных КМТ и КДМ могут быть критическими детерминантами различных заболеваний, включая старение и рак [186–191]. На самом деле считается, что потеря этого соответствующего баланса метилирования во взрослых стволовых клетках способствует снижению функции ткани с возрастом [192]. Исследования также показали, что аберрантное метилирование связано с повышенной заболеваемостью различными видами рака и плохой выживаемостью [19].3, 194]. Например, метилтрансфераза, ответственная за триметилирование лизина 27 гистона 3 (h4K27me3), активируется при раке предстательной железы [195], раке молочной железы [196] и лимфомах [197].
Геном человека кодирует более 200 метилтрансфераз [198], и хотя большинство исследований было сосредоточено на метилировании гистонов, в ряде сообщений было обнаружено, что эти ферменты также ответственны за регуляцию метилирования негистоновых белков [199]. Было замечено, что ряд негистоновых белков подвергается метилированию остатков лизина, что, в свою очередь, приводит к изменениям в функции и/или стабильности этих негистоновых белков [19].9, 200]. Сообщалось о доказательствах зависимой от метилирования лизина регуляции постоянно растущего числа негистоновых белков, и в некоторых случаях эти изменения также могут иметь отношение к стрессу, гипертонии и ПЭ, как описано ниже.
Лизин Метилирование p53 . Белок-супрессор опухоли p53 функционирует как специфичный к последовательности фактор транскрипции, который регулирует важные клеточные процессы, включая остановку клеточного цикла, репарацию ДНК, апоптоз и старение в ответ на сигналы стресса. В нормальных условиях уровень р53 в клетке поддерживается низким; однако р53 быстро стабилизируется и активируется в ответ на клеточные стрессы, такие как повреждение ДНК и гипоксические состояния [143].
Было показано, что апоптоз трофобластов в плаценте человека усиливается в течение гестационного периода [201]. Кроме того, при беременности, осложненной ПЭ, отмечается нарушение регуляции клеточного обмена, что приводит к усилению апоптоза [202–204] и уменьшению площади синцитиотрофобласта [205]. Влияние чрезмерного апоптоза на плацентарную патологию в случаях ПЭ неясно; однако это может в конечном итоге предотвратить восполнение синцитиотрофобласта, способствовать дегенерации синцития и привести к высвобождению вазоактивных или воспалительных факторов в кровоток матери [206]. Поскольку р53 является жизненно важным регулятором пути апоптоза, его уровень был измерен в случаях ПЭ, и было замечено, что на уровне белка уровень р53 значительно повышен в плацентах, полученных от беременностей, осложненных ПЭ [207]. . Это увеличение экспрессии р53 было также отмечено в случаях ЗВУР плода [208, 209].]. Кроме того, повышение уровня р53 было связано с повышенной экспрессией нижестоящих элементов пути апоптоза, включая уровень нижестоящего эффекторного белка р21 [207].
Метилирование p53 с помощью SET7 (KMT7) было первым сообщением о KMT-опосредованном метилировании негистонового белка [210]. С тех пор ряд других KMT, включая SET9 (KMT5), SMYD2 (KMT3C) и SET 8 (KMT5A), которые метилируют p53 по специфическим С-концевым лизинам, вместе с лизиноспецифической деметилазой KDM1 (LSD1), которая опосредует деметилирование р53, также были идентифицированы [143] (рис. 14).
P53 подвергается множественным PTM, включая метилирование лизина, которое регулирует его стабильность, белок-белковые взаимодействия и транскрипционную активность. Фактически транскрипционная активность р53 усиливается или подавляется в зависимости от сайта метилирования. Кроме того, взаимодействие p53 с его коактиватором p53-связывающим белком 1 (53BP1) для индукции апоптоза опосредуется действием лизиндеметилазы KDM1. Баланс между метилированием и деметилированием в сочетании с другими PTM важен для ответа p53 на клеточные стрессы, поскольку его активность важна для предотвращения образования опухолей [143].
Метилирование лизина белка теплового шока (HSP) 70 . HSP в первую очередь известны как внутриклеточные белки, обладающие молекулярными шаперонными и цитопротекторными функциями [211] и необходимые для восстановления клеток, выживания и поддержания гомеостаза [212]. Белки HSP70 являются вездесущими, зависимыми от аденозинтрифосфата (АТФ) молекулярными шаперонами, которые составляют одно из наиболее эволюционно консервативных семейств белков [213]. Внеклеточный HSP70 может способствовать развитию аутоиммунного заболевания и может свидетельствовать о состоянии врожденной иммунной системы [214–216]. У человека эти белки кодируются 13 генами и либо индуцируются в ответ на стресс (например, тепловой шок), либо конститутивно экспрессируются [217]. Белки HSP70 участвуют в многочисленных биологических процессах, включая межбелковые взаимодействия, деградацию белков и транслокацию через мембраны [218].
Было показано, что HSP70 повышен в случаях ТЭЛА [212, 219]. Парк и др. [220] предположили, что повышенные уровни системного HSP70 у пациенток с преэклампсией происходят из синцитиотрофобластов и эндотелиальных клеток ворсинок преэклампсии плаценты, поскольку было показано, что они имеют более высокие уровни белков HSP70 по сравнению с плацентами при нормальной, здоровой беременности. Другие исследования также выявили более высокие уровни HSP70 в плацентарных тканях пациенток с преэклампсией [221, 222]. Это увеличение HSP70 в сыворотке отражает системное воспаление и окислительный стресс, которые отмечаются при ТЭЛА [212, 219].]. Первоначально экспрессия HSP70 играет защитную роль против плацентарного окислительного стресса; однако сверхэкспрессия HSP70 может приводить к межворсинчатой эндотелиальной дисфункции и может играть роль в патогенезе ПЭ [220].
[220] предположили, что повышенные уровни системного HSP70 у пациенток с преэклампсией происходят из синцитиотрофобластов и эндотелиальных клеток ворсинок преэклампсии плаценты, поскольку было показано, что они имеют более высокие уровни белков HSP70 по сравнению с плацентами при нормальной, здоровой беременности. Другие исследования также выявили более высокие уровни HSP70 в плацентарных тканях пациенток с преэклампсией [221, 222]. Это увеличение HSP70 в сыворотке отражает системное воспаление и окислительный стресс, которые отмечаются при ТЭЛА [212, 219].]. Первоначально экспрессия HSP70 играет защитную роль против плацентарного окислительного стресса; однако сверхэкспрессия HSP70 может приводить к межворсинчатой эндотелиальной дисфункции и может играть роль в патогенезе ПЭ [220].
Было показано, что HSP70 может быть посттрансляционно модифицирован различными способами, и сообщалось о многочисленных метилированных лизинах (рис. 15). Например, сообщалось, что остаток лизина K561, обнаруженный в нескольких белках HSP70 человека, может быть метилирован. Лизиновое метилирование белков HSP70 является физиологически значимым, особенно в онкогенезе. В частности, диметилирование K561 HSP70 с помощью SETD1A регулирует субклеточную локализацию этого белка и способствует пролиферации раковых клеток за счет его взаимодействия с Aurora Kinase B (AURKB) [143, 223].
Лизиновое метилирование белков HSP70 является физиологически значимым, особенно в онкогенезе. В частности, диметилирование K561 HSP70 с помощью SETD1A регулирует субклеточную локализацию этого белка и способствует пролиферации раковых клеток за счет его взаимодействия с Aurora Kinase B (AURKB) [143, 223].
Метилирование лизина рецептора фактора роста эндотелия сосудов 1 (VEGFR-1) и 2 (VEGFR-2). Как было описано в предыдущих разделах, VEGFR-1 (или Flt-1) и VEGFR-2 представляют собой мембранные рецепторы, принадлежащие к подсемейству рецепторных тирозинкиназ (RTK). VEGRF-1 способен прочно связываться со своими лигандами, VEGF (включая VEGF-A) и PlGF, но обладает слабой тирозинкиназной активностью и, следовательно, генерирует в целом более слабый сигнал, чем другие RTK [224]. Благодаря взаимодействию со своими лигандами VEGFR-1 играет важную роль как в физиологическом, так и в патологическом ангиогенезе, процессе, посредством которого новые кровеносные сосуды образуются из ранее существовавших сосудов [43, 225, 226]. Ангиогенез имеет решающее значение для нормальных физиологических функций тканей, но он также важен для прогрессирования некоторых заболеваний, включая рак и воспаление [227, 228].
Ангиогенез имеет решающее значение для нормальных физиологических функций тканей, но он также важен для прогрессирования некоторых заболеваний, включая рак и воспаление [227, 228].
Было также показано, что VEGFR-1 играет важную роль в регуляции васкулогенеза, который представляет собой процесс образования новых кровеносных сосудов из клеток-предшественников во время раннего эмбриогенеза [225]. В 1995 г. Фонг и соавт. [229] продемонстрировали, что мутантные мыши, не экспрессирующие VEGFR-1 (Flt-1-null, Flt-1-/- мыши), погибают внутриутробно из-за неконтролируемого роста эндотелиальных клеток сосудов и дезорганизации кровеносных сосудов, что указывает на то, что VEGFR-1 может играть негативную регулирующую роль в ангиогенезе на ранних стадиях эмбриогенеза.
VEGFR-1 вместе со своим лигандом VEGF и другими рецепторами VEGF экспрессируется в плаценте на протяжении всего гестационного периода и необходим для развития сосудов эмбриона [34, 35]. Во время нормальной неосложненной беременности VEGFR-1 может быть в первую очередь обнаружен в плацентарных синцитиотрофобластах [230]. Изменение уровня VEGF и его рецепторов во время беременности может приводить к нарушению ангиогенеза, что приводит к плацентарной недостаточности и эндотелиальной дисфункции, которые отмечаются при беременности, осложненной ПЭ [231]. В исследовании Helske et al. [230], экспрессия VEGFR-1 повышалась в синцитиотрофобластах плацент, полученных в ряде случаев ПЭ, но не во всех.
Изменение уровня VEGF и его рецепторов во время беременности может приводить к нарушению ангиогенеза, что приводит к плацентарной недостаточности и эндотелиальной дисфункции, которые отмечаются при беременности, осложненной ПЭ [231]. В исследовании Helske et al. [230], экспрессия VEGFR-1 повышалась в синцитиотрофобластах плацент, полученных в ряде случаев ПЭ, но не во всех.
VEGFR-1 подвергается метилированию по нескольким остаткам лизина, и было замечено, что это метилирование важно для регуляции активности VEGFR-1 (фиг. 16). Например, было показано, что VEGFR-1 является негистоновой мишенью метилтрансферазы SMYD3, поскольку лизин 831 VEGFR-1 метилируется SMYD3 in vitro [232]. Это метилирование VEGFR-1 усиливает его киназную активность, поскольку лизин 831 расположен в киназном домене этого RTK.
VEGFR-2 является мощным ангиогенным RTK, что делает его одним из наиболее важных RTK в эндотелиальных клетках [233, 234]. Было отмечено, что активность VEGFR-2 важна как для васкулогенеза, так и для патологического ангиогенеза при раке и нейроваскуляризации глаза [226].
Следовательно, экспрессия и функция VEGFR-2 строго регулируются, поскольку повышенный ангиогенез играет важную роль в прогрессировании рака и других заболеваний, включая возрастную дегенерацию желтого пятна, тогда как недостаточный ангиогенез был связан с ишемической болезнью сердца и задержкой заживление ран [234]. VEGFR-2 подвергается метилированию по нескольким остаткам лизина, и было показано, что это метилирование важно для регуляции активности VEGFR-2 [233]. Фактически, Hartsough et al. [233] также определили, что метилирование лизина 1043 необходимо для контроля активации VEGFR-2, поскольку эта реакция метилирования важна для фосфорилирования тирозина этого RTK. Следовательно, вмешательство в это метилирование VEGFR-2 приводит к неспособности VEGFR-2 стимулировать ангиогенез.
4. Заключение
Как и для всех биомаркеров, их эффективность определяется возможностью диагностировать заболевание задолго до появления клинических симптомов, а преимущество заключается в том, что изменения можно выявить с помощью малоинвазивных анализов крови, выполняемых как часть плановых проверок. До сих пор PlGF и sFlt-1, по отдельности или в комбинации, не только продемонстрировали многообещающие результаты для ранней диагностики ПЭ, но также показали, что они хорошо коррелируют с тяжестью этого состояния, при этом данные из разных когорт сопоставимы. Точно так же скрининг на ADMA выявил интересные тенденции, и его можно считать полезным кандидатом в биомаркеры, также основываясь на знании его роли в биохимии NO. Наша лаборатория также заинтересована в изучении метилирования лизина в сочетании с вышеупомянутыми потенциальными биомаркерами, чтобы расширить понимание роли, которую играет метилирование белка в нормальной биохимии и биохимии ПЭ. Помимо выбранных биомаркеров, конечной целью является улучшение течения и исхода беременности, а также снижение рисков как для матери, так и для плода. Этого можно достичь только путем раскрытия и лучшего понимания механизмов, лежащих в основе преэклампсии.
До сих пор PlGF и sFlt-1, по отдельности или в комбинации, не только продемонстрировали многообещающие результаты для ранней диагностики ПЭ, но также показали, что они хорошо коррелируют с тяжестью этого состояния, при этом данные из разных когорт сопоставимы. Точно так же скрининг на ADMA выявил интересные тенденции, и его можно считать полезным кандидатом в биомаркеры, также основываясь на знании его роли в биохимии NO. Наша лаборатория также заинтересована в изучении метилирования лизина в сочетании с вышеупомянутыми потенциальными биомаркерами, чтобы расширить понимание роли, которую играет метилирование белка в нормальной биохимии и биохимии ПЭ. Помимо выбранных биомаркеров, конечной целью является улучшение течения и исхода беременности, а также снижение рисков как для матери, так и для плода. Этого можно достичь только путем раскрытия и лучшего понимания механизмов, лежащих в основе преэклампсии.
Конфликт интересов
Авторы заявляют об отсутствии конфликта интересов в связи с публикацией этой статьи.
Ссылки
Л. К. Вагнер, «Диагностика и лечение преэклампсии», American Family Physician , vol. 70, нет. 12, pp. 2317–2324, 2004.
Посмотреть по адресу:
Google Scholar
S. Grill, C. Rusterholz, R. Zanetti-Dällenbach et al., «Потенциальные маркеры преэклампсии — обзор», Репродуктивная биология и эндокринология , том. 7, арт. 70, 2009.
Посмотреть по адресу:
Сайт издателя | Google Scholar
А. Редди, С. Сури, И. Л. Сарджент, К. В. Г. Редман и С. Муттукришна, «Материнские циркулирующие уровни активина А, ингибина А, sFlt-1 и эндоглина при родах при нормальной беременности и преэклампсии », PLoS ONE , vol. 4, нет. 2, ID статьи e4453, 2009 г.
Посмотреть по адресу:
Сайт издателя | Академия Google
А.
 П. Маккей, С. Дж. Берг и Х. К. Атраш, «Смертность, связанная с беременностью, от преэклампсии и эклампсии», Акушерство и гинекология , том. 97, нет. 4, стр. 533–538, 2001.
П. Маккей, С. Дж. Берг и Х. К. Атраш, «Смертность, связанная с беременностью, от преэклампсии и эклампсии», Акушерство и гинекология , том. 97, нет. 4, стр. 533–538, 2001.Посмотреть по адресу:
Сайт издателя | Google Scholar
К. Браекке, П. М. Уеланд, Н. К. Харсем и А. С. Стафф, «Асимметричный диметиларгинин в кровообращении матери и плода при преэклампсии», Pediatric Research , vol. 66, нет. 4, стр. 411–415, 2009 г..
Посмотреть по адресу:
Сайт издателя | Google Scholar
C. W. Redman and I. L. Sargent, «Последние достижения в понимании преэклампсии», Science , vol. 308, нет. 5728, стр. 1592–1594, 2005.
Посмотреть по адресу:
Сайт издателя | Google Scholar
B. SIBAI, G. DEKKER и M.
 KUPFERMINC, «Pre-eclampsia», The Lancet , vol. 365, нет. 9461, стр. 785–799, 2005.
KUPFERMINC, «Pre-eclampsia», The Lancet , vol. 365, нет. 9461, стр. 785–799, 2005.Посмотреть по адресу:
Сайт издателя | Академия Google
Бюллетени комитета ACOG по практике — Акушерство, «Практический бюллетень ACOG. Диагностика и лечение преэклампсии и эклампсии», Акушерство и гинекология , том. 99, нет. 1, стр. 159–167, 2002.
Посмотреть по адресу:
Сайт издателя | Google Scholar
E. J. Roccella, «Отчет рабочей группы национальной программы обучения высокому кровяному давлению о высоком кровяном давлении во время беременности», American Journal of Obstetrics & Gynecology , том. 183, нет. 1, стр. S1–S22, 2000.
Посмотреть по адресу:
Сайт издателя | Google Scholar
С. Грима, М.
 Велла и К. Савона-Вентура, «Гипертензивные расстройства во время беременности у женщин с диабетом до беременности», Мальтийский медицинский журнал , том. 22, нет. 2, стр. 15–18, 2010.
Велла и К. Савона-Вентура, «Гипертензивные расстройства во время беременности у женщин с диабетом до беременности», Мальтийский медицинский журнал , том. 22, нет. 2, стр. 15–18, 2010.Просмотр по адресу:
Google Scholar
А. Диас Перес, А. Рока Перес, Г. Оньяте Диас, П. Кастро Хиль и Э. Наварро Кирос, « Взаимодействие и динамика этих факторов риска при гипертензивных расстройствах беременности: пилотное исследование», Salud Uninorte , vol. 33, нет. 1, стр. 27–38, 2017 г.
Посмотреть по адресу:
Сайт издателя | Google Scholar
Г. Деккер и Б. Сибай, «Первичная, вторичная и третичная профилактика преэклампсии», The Lancet , vol. 357, нет. 9251, стр. 209–215, 2001.
Посмотреть по адресу:
Сайт издателя | Google Scholar
H.
 Lipstein, C. C. Lee и R. S. Crupi, «Современная концепция эклампсии», The American Journal of Emergency Medicine , том. 21, нет. 3, стр. 223–226, 2003 г.
Lipstein, C. C. Lee и R. S. Crupi, «Современная концепция эклампсии», The American Journal of Emergency Medicine , том. 21, нет. 3, стр. 223–226, 2003 г.Посмотреть по адресу:
Сайт издателя | Google Scholar
E. Nexø, «Клиническая биохимия», FEBS Letters , vol. 375, нет. 3, стр. 312-313, 1995.
Посмотреть по адресу:
Сайт издателя | Google Scholar
К. Дакитт и Д. Харрингтон, «Факторы риска преэклампсии при дородовом обследовании: систематический обзор контролируемых исследований», British Medical Journal , vol. 330, нет. 7491, с. 565, 2005.
Посмотреть по адресу:
Сайт издателя | Google Scholar
Дж. П. Уоррингтон, Э. М. Джордж, А. С. Палей, Ф. Т. Спрэдли и Дж. П. Грейнджер, «Недавние достижения в понимании патофизиологии преэклампсии», Гипертония , том.
 62, нет. 4, стр. 666–673, 2013 г.
62, нет. 4, стр. 666–673, 2013 г.Посмотреть по адресу:
Сайт издателя | Google Scholar
Т.-Х. Хунг, Дж. Н. Скеппер, Д. С. Чарнок-Джонс и Г. Дж. Бертон, «Гипоксия-реоксигенация: мощный индуктор апоптотических изменений в плаценте человека и возможный этиологический фактор преэклампсии», Исследование тиражей , vol. 90, нет. 12, стр. 1274–1281, 2002.
Посмотреть по адресу:
Сайт издателя | Google Scholar
N. Soleymanlou, I. Jurisica, O. Nevo et al., «Молекулярные доказательства плацентарной гипоксии при преэклампсии», The Journal of Clinical Endocrinology & Metabolism , vol. 90, нет. 7, стр. 4299–4308, 2005.
Посмотреть по адресу:
Сайт издателя | Google Scholar
Дж. Робертс, «Является ли окислительный стресс связующим звеном в двухэтапной модели преэклампсии?» Ланцет , том.
 354, нет. 9185, стр. 788-789.
354, нет. 9185, стр. 788-789.Посмотреть по адресу:
Сайт издателя | Google Scholar
У. Д. Андерсон, М. Г. Олссон, С. Рутардттир и др., «Фетальный гемоглобин и α 1-микроглобулин как прогностические биомаркеры преэклампсии в первом и начале второго триместра», Американский журнал акушерства и гинекологии , том. 204, нет. 6, стр. 520–e5, 2011.
Посмотреть по адресу:
Сайт издателя | Академия Google
G. J. Burton and E. Jauniaux, «Окислительный стресс», Best Practice & Research Clinical Obstetrics & Gynecology , vol. 25, нет. 3, стр. 287–299, 2011.
Посмотреть по адресу:
Сайт издателя | Google Scholar
K. May, L. Rosenlöf, MG Olsson et al., «Перфузия человеческой плаценты гемоглобином приводит к травмам, подобным преэклампсии, которые предотвращаются α 1-микроглобулином», Placenta , vol.
 32, нет. 2011. Т. 4. С. 323–332.
32, нет. 2011. Т. 4. С. 323–332.Посмотреть по адресу:
Сайт издателя | Google Scholar
А. Х. Шеннан, Л. Постон, Л. К. Чаппелл и П. Т. Сид, «Предотвращение преэклампсии», The Lancet , vol. 357, нет. 9267, с. 1534, 2001.
Посмотреть по адресу:
Сайт издателя | Google Scholar
С.-Ю. Ким, Х.-М. Рю, Дж.-Х. Yang et al., «Увеличение отношения sFlt-1 к PlGF у женщин, у которых впоследствии развилась преэклампсия», Journal of Korean Medical Science , том. 22, нет. 5, стр. 873–877, 2007.
Посмотреть по адресу:
Сайт издателя | Google Scholar
Р. Мадазли, Э. Будак, З. Калай и М. Ф. Аксу, «Корреляция между результатами биопсии плацентарного ложа, молекулой адгезии сосудистых клеток и уровнями фибронектина при преэклампсии», BJOG: Международный журнал Акушерство и гинекология , том.
 107, нет. 4, стр. 514–518, 2000.
107, нет. 4, стр. 514–518, 2000.Посмотреть по адресу:
Сайт издателя | Академия Google
Н. Хадкер, С. Гарг, К. Костанцо и др., «Финансовые последствия нового диагностического теста на преэклампсию по сравнению со стандартной практикой: анализ аналитического моделирования принятия решений с точки зрения плательщика медицинских услуг в Великобритании», Journal of Medical Экономика , вып. 13, нет. 4, стр. 728–737, 2010.
Посмотреть по адресу:
Сайт издателя | Google Scholar
У. Д. Андерсон, М. Г. Олссон, К. Х. Кристенсен, Б. Окерстрём и С. Р. Ханссон, «Обзор: биохимические маркеры для прогнозирования преэклампсии», стр. 9.0817 Плацента , том. 33, стр. S42–S47, 2012.
Посмотреть по адресу:
Сайт издателя | Google Scholar
P.
 von Dadelszen, L. A. Magee и JM Roberts, «Subclassification of Preeclampsia», Hypertension in Pregnancy , vol. 22, нет. 2, стр. 143–148, 2003 г.
von Dadelszen, L. A. Magee и JM Roberts, «Subclassification of Preeclampsia», Hypertension in Pregnancy , vol. 22, нет. 2, стр. 143–148, 2003 г.Посмотреть по адресу:
Сайт издателя | Google Scholar
D. Maglione, V. Guerriero, G. Viglietto, P. Delli-Bovi и M.G. Persico, «Выделение кДНК плаценты человека, кодирующей белок, связанный с фактором проницаемости сосудов», Труды Национальной академии наук Соединенных Штатов Америки , том. 88, нет. 20, стр. 9267–9271, 1991.
Посмотреть по адресу:
Сайт издателя | Google Scholar
С. Хаузер и Х. А. Вейх, «Гепарин-связывающая форма плацентарного фактора роста (plGF-2) экспрессируется в эндотелиальных клетках пупочной вены человека и в плаценте», Growth Factors , vol. 9, нет. 4, стр. 259–268, 1993.
Посмотреть по адресу:
Сайт издателя | Академия Google
D.
 Maglione, V. Guerriero, G. Viglietto et al., «Две альтернативные мРНК, кодирующие ангиогенный фактор, фактор роста плаценты (PlGF), транскрибируются из одного гена хромосомы 14», Oncogene , том. 8, нет. 4, стр. 925–931, 1993.
Maglione, V. Guerriero, G. Viglietto et al., «Две альтернативные мРНК, кодирующие ангиогенный фактор, фактор роста плаценты (PlGF), транскрибируются из одного гена хромосомы 14», Oncogene , том. 8, нет. 4, стр. 925–931, 1993.Посмотреть по адресу:
Google Scholar
Y. Cao, W.-R. Цзи, П. Ци, О. Розин и Ю. Цао, «Фактор роста плаценты: идентификация и характеристика новой изоформы, генерируемой альтернативным сплайсингом РНК», Сообщения о биохимических и биофизических исследованиях , vol. 235, нет. 3, стр. 493–498, 1997.
Посмотреть по адресу:
Сайт издателя | Google Scholar
Дж. Э. Парк, Х. Х. Чен, Дж. Винер, К. А. Хоук и Н. Феррара, «Фактор роста плаценты. Потенцирование биологической активности фактора роста эндотелия сосудов in vitro и in vivo и связывание с высокой аффинностью с Flt-1, но не с Flk-1/KDR», The Journal of Biological Chemistry , vol.
 269, нет. 41, стр. 25646–25654, 1994.
269, нет. 41, стр. 25646–25654, 1994.Посмотреть по адресу:
Google Scholar
A. Ahmed, X. F. Li, C. Dunk, M. J. Whittle, D. I. Rushton, and T. Rollason, «Colocalisation of vasysendothelial growth factor and its flt-1 рецептор в плаценте человека», Факторы роста , vol. 12, нет. 3, стр. 235–243, 1995.
Посмотреть по адресу:
Сайт издателя | Google Scholar
Д. Е. Кларк, С. К. Смит, А. М. Шарки и Д. С. Чарнок-Джонс, «Локализация VEGF и экспрессия его рецепторов flt и KDR в плаценте человека на протяжении всей беременности», Репродукция человека , vol. 11, нет. 5, стр. 1090–1098, 1996.
Посмотреть по адресу:
Сайт издателя | Google Scholar
Д. Э. Кларк, С. К. Смит, Д. Лайсенс, А. Л. Эванс и Д.
 С. Чарнок-Джонс, «Сравнение паттернов экспрессии фактора роста плаценты, фактора роста эндотелия сосудов (VEGF), VEGF-B и VEGF-C». в плаценте человека на протяжении всей беременности», Journal of Endocrinology , vol. 159, нет. 3, стр. 459–467, 1998.
С. Чарнок-Джонс, «Сравнение паттернов экспрессии фактора роста плаценты, фактора роста эндотелия сосудов (VEGF), VEGF-B и VEGF-C». в плаценте человека на протяжении всей беременности», Journal of Endocrinology , vol. 159, нет. 3, стр. 459–467, 1998.Просмотр:
Сайт издателя | Google Scholar
А. Халик, X. Ф. Ли, М. Шамс и др., «Локализация фактора роста плаценты (PIGF) в терминальной плаценте человека», Факторы роста , том. 13, нет. 3–4, стр. 243–250, 1996.
Посмотреть по адресу:
Сайт издателя | Google Scholar
М. Г. Персико, В. Винченти и Т. ДиПальма, «Структура, экспрессия и свойства связывания рецепторов плацентарного фактора роста (PlGF)», в Факторы роста сосудов и ангиогенез , том. 237 of Current Topics in Microbiology and Immunology , стр. 31–40, Springer Berlin Heidelberg, Berlin, Heidelberg, 1999.

Посмотреть по адресу:
Сайт издателя | Google Scholar
G. Viglietto, D. Maglione, M. Rambaldi et al., «Повышение уровня фактора роста эндотелия сосудов (VEGF) и снижение уровня фактора роста плаценты (P1GF), связанное со злокачественными новообразованиями в опухолях щитовидной железы человека и клеточных линиях. , Онкоген , т. 11, нет. 8, стр. 1569–1579, 1995.
Посмотреть по адресу:
Google Scholar
Г. Ворос, Э. Макуа, Д. Демельмейстер, Н. Клеркс, Д. Коллен и Х. Р. Лийнен, «Модуляция ангиогенеза во время развития жировой ткани». в мышиных моделях ожирения», Endocrinology , vol. 146, нет. 10, стр. 4545–4554, 2005.
Посмотреть по адресу:
Сайт издателя | Google Scholar
C. De Vries, J.
 A. Escobedo, H. Ueno, K. Houck, N. Ferrara и L. T. Williams, «Fms-подобная тирозинкиназа, рецептор фактора роста эндотелия сосудов», Наука , том. 255, нет. 5047, стр. 989–991, 1992.
A. Escobedo, H. Ueno, K. Houck, N. Ferrara и L. T. Williams, «Fms-подобная тирозинкиназа, рецептор фактора роста эндотелия сосудов», Наука , том. 255, нет. 5047, стр. 989–991, 1992.Посмотреть по адресу:
Сайт издателя | Google Scholar
Б. И. Терман, М. Догер-Вермазен, М. Э. Каррион и др., «Идентификация тирозинкиназы KDR как рецептора фактора роста эндотелиальных клеток сосудов», Biochemical and Biophysical Research Communications , vol. 187, нет. 3, стр. 1579–1586, 1992.
Посмотреть по адресу:
Сайт издателя | Академия Google
M. Shibuya, S. Yamaguchi, A. Yamane et al., «Нуклеотидная последовательность и экспрессия нового гена тирозинкиназы рецепторного типа человека (flt), тесно связанного с семейством fms», Oncogene , vol. 5, нет. 4, pp. 519–524, 1990.
Посмотреть по адресу:
Google Scholar
Терман Б.
 И., Каррион М.Е., Ковач Э., Расмуссен Б.А., Эдди Р.Л. Тирозинкиназа рецептора фактора роста», Oncogene , том. 6, нет. 9, pp. 1677–1683, 1991.
И., Каррион М.Е., Ковач Э., Расмуссен Б.А., Эдди Р.Л. Тирозинкиназа рецептора фактора роста», Oncogene , том. 6, нет. 9, pp. 1677–1683, 1991.Просмотр по адресу:
Google Scholar
Кендалл Р.Л. и Томас К.А. Ингибирование активности фактора роста эндотелиальных клеток эндогенно кодируемым растворимым рецептором. Национальная академия наук Соединенных Штатов Америки , том. 90, нет. 22, стр. 10705–10709, 1993.
Посмотреть по адресу:
Сайт издателя | Google Scholar
Р. Дж. Левин и С. А. Каруманчи, «Циркулирующие ангиогенные факторы при преэклампсии», стр. 9.0817 Клиническое акушерство и гинекология , вып. 48, нет. 2, стр. 372–386, 2005 г.
Посмотреть по адресу:
Сайт издателя | Google Scholar
SE Maynard, JY Min, J.
 Merchan et al., «Избыток плацентарной растворимой fms-подобной тирозинкиназы 1 (sFlt1) может способствовать гипертензии эндотелиальной дисфункции и протеинурии при преэклампсии», The Journal of Clinical Следствие , т. 111, нет. 5, стр. 649–658, 2003.
Merchan et al., «Избыток плацентарной растворимой fms-подобной тирозинкиназы 1 (sFlt1) может способствовать гипертензии эндотелиальной дисфункции и протеинурии при преэклампсии», The Journal of Clinical Следствие , т. 111, нет. 5, стр. 649–658, 2003.Посмотреть по адресу:
Сайт издателя | Академия Google
С. Дж. Робинсон, Д. Д. Джонсон, Е. Ю. Чанг, Д. М. Армстронг и В. Ван, «Оценка уровней фактора роста плаценты и растворимых Fms-подобных тирозинкиназных рецепторов 1 при легкой и тяжелой преэклампсии», Американский журнал акушерства и Гинекология , вып. 195, нет. 1, стр. 255–259, 2006 г.
Посмотреть по адресу:
Сайт издателя | Google Scholar
A.C. Staff, K. Braekke, N.K. Harsem, T. Lyberg и M.R. Holthe, «Циркуляционные концентрации sFlt1 (растворимая fms-подобная тирозинкиназа 1) в сыворотке плода и матери во время преэклампсии», Европейский журнал акушерства, гинекологии и репродуктивной биологии , том.
 122, нет. 1, стр. 33–39, 2005 г.
122, нет. 1, стр. 33–39, 2005 г.Посмотреть по адресу:
Сайт издателя | Google Scholar
В. Цацарис, Ф. Гоффин, К. Муно и др., «Сверхэкспрессия рецептора растворимого сосудистого эндотелиального фактора роста у пациентов с преэклампсией: патофизиологические последствия», Журнал клинической эндокринологии и метаболизма , том . 88, нет. 11, стр. 5555–5563, 2003.
Посмотреть по адресу:
Сайт издателя | Google Scholar
К.-А. Ватен, Э. Тутти, У.-Х. Stenman et al., «Рецептор-1 эндотелиального фактора роста сосудов, растворимого в сыворотке матери, на ранних сроках беременности, закончившейся преэклампсией или задержкой внутриутробного развития», The Journal of Clinical Endocrinology & Metabolism , vol. 91, нет. 1, стр. 180–184, 2006 г.
Посмотреть по адресу:
Сайт издателя | Google Scholar
N.
 A. Bersinger и R. A. Ødegård, «Уровни плацентарных белков во втором и третьем триместре беременности при преэклампсии и беременности с малым сроком беременности», Acta Obstetricia et Gynecologica Scandinavica , vol. 83, нет. 1, стр. 37–45, 2004 г.
A. Bersinger и R. A. Ødegård, «Уровни плацентарных белков во втором и третьем триместре беременности при преэклампсии и беременности с малым сроком беременности», Acta Obstetricia et Gynecologica Scandinavica , vol. 83, нет. 1, стр. 37–45, 2004 г.Посмотреть по адресу:
Сайт издателя | Google Scholar
RJ Levine, SE Maynard, C. Qian et al., «Циркулирующие ангиогенные факторы и риск преэклампсии», The New England Journal of Medicine , vol. 350, нет. 7, стр. 672–683, 2004.
Посмотреть по адресу:
Сайт издателя | Google Scholar
T. Chaiworapongsa, R. Romero, J. Espinoza et al., «Доказательства, подтверждающие роль блокады системы фактора роста эндотелия сосудов в патофизиологии преэклампсии: Young Investigator Award», Американский журнал акушерства и гинекологии , том. 190, нет.
 6, стр. 1541–1550, 2004.
6, стр. 1541–1550, 2004.Посмотреть по адресу:
Сайт издателя | Google Scholar
Ж.-Ю. Chung, Y. Song, Y. Wang, R. R. Magness и J. Zheng, «Дифференциальная экспрессия сосудистого эндотелиального фактора роста (VEGF), эндокринных желез, производных VEGF, и рецепторов VEGF в плацентах человека при нормальной и преэклампсии при беременности», Журнал клинической эндокринологии и метаболизма , том. 89, нет. 5, стр. 2484–2490, 2004.
Посмотреть по адресу:
Сайт издателя | Google Scholar
А.-К. Викстрем, А. Ларссон, У. Дж. Эрикссон, П. Нэш, С. Норден-Линдеберг и М. Оловссон, «Фактор роста плаценты и растворимая FMS-подобная тирозинкиназа-1 при ранней и поздней преэклампсии», Акушерство и гинекологии , том. 109, нет. 6, стр. 1368–1374, 2007.
Посмотреть по адресу:
Сайт издателя | Google Scholar
T.
 Chaiworapongsa, R. Romero, YM Kim et al., «Концентрация рецептора-1 растворимого сосудистого эндотелиального фактора роста в плазме повышена до клинической диагностики преэклампсии», Журнал материнско-фетальной и неонатальной медицины , том. 17, нет. 1, стр. 3–18, 2005 г.
Chaiworapongsa, R. Romero, YM Kim et al., «Концентрация рецептора-1 растворимого сосудистого эндотелиального фактора роста в плазме повышена до клинической диагностики преэклампсии», Журнал материнско-фетальной и неонатальной медицины , том. 17, нет. 1, стр. 3–18, 2005 г.Посмотреть по адресу:
Сайт издателя | Google Scholar
Р. Ромеро, Дж. К. Ниен, Дж. Эспиноза и др., «Продольное исследование ангиогенных (плацентарный фактор роста) и антиангиогенных (растворимый эндоглин и растворимый рецептор сосудистого эндотелиального фактора роста-1) факторов в нормальная беременность и пациенты, у которых предрасположенность к развитию преэклампсии и рождению новорожденного с малым весом для гестационного возраста» Журнал медицины матери и плода и новорожденного , том. 21, нет. 1, стр. 9–23, 2009 г.
Посмотреть по адресу:
Сайт издателя | Google Scholar
М.
 Саймон, Х.-Дж. Гроун, О. Джорен и др., «Экспрессия сосудистого эндотелиального фактора роста и его рецепторов в почечном онтогенезе человека и во взрослой почке», Американский журнал физиологии — почечная жидкость и физиология электролитов , том. 268, нет. 2, стр. F240–F250, 1995.
Саймон, Х.-Дж. Гроун, О. Джорен и др., «Экспрессия сосудистого эндотелиального фактора роста и его рецепторов в почечном онтогенезе человека и во взрослой почке», Американский журнал физиологии — почечная жидкость и физиология электролитов , том. 268, нет. 2, стр. F240–F250, 1995.Посмотреть по адресу:
Сайт издателя | Google Scholar
M. Simon, W. Röckl, C. Hornig et al., «Рецепторы фактора роста эндотелия сосудов/фактора проницаемости сосудов (VEGF/VPF) в почках плода и взрослого человека: локализация и [125I]VEGF сайты связывания», Journal of the American Society of Nephrology , vol. 9, нет. 6, pp. 1032–1044, 1998.
Посмотреть по адресу:
Google Scholar
С. Рана, К. Э. Пау, С. Салахуддин и др., «Ангиогенные факторы и риск неблагоприятных исходов у женщин с подозрением на преэклампсия» Тираж , том.
 125, нет. 7, стр. 911–919, 2012.
125, нет. 7, стр. 911–919, 2012.Посмотреть по адресу:
Сайт издателя | Google Scholar
R. Thadhani, WP Mutter, M. Wolf et al., «Плацентарный фактор роста первого триместра и растворимая fms-подобная тирозинкиназа 1 и риск преэклампсии», The Journal of Clinical Endocrinology & Metabolism , об. 89, нет. 2, стр. 770–775, 2004.
Посмотреть по адресу:
Сайт издателя | Академия Google
B. M. Polliotti, A. G. Fry, D. N. Saller Jr., R. A. Mooney, C. Cox и R. K. Miller, «Плацентарный фактор роста материнской сыворотки второго триместра и фактор роста эндотелия сосудов для прогнозирования тяжелой преэклампсии с ранним началом», Obstetrics & Гинекология , вып. 101, нет. 6, стр. 1266–1274, 2003.
Посмотреть по адресу:
Сайт издателя | Google Scholar
L.
 C. Y. Poon, N. A. Kametas, N. Maiz, R. Akolekar и K. H. Nicolaides, «Прогнозирование гипертензивных расстройств у беременных в первом триместре», стр. Гипертония , том. 53, нет. 5, стр. 812–818, 2009 г.
C. Y. Poon, N. A. Kametas, N. Maiz, R. Akolekar и K. H. Nicolaides, «Прогнозирование гипертензивных расстройств у беременных в первом триместре», стр. Гипертония , том. 53, нет. 5, стр. 812–818, 2009 г.Посмотреть по адресу:
Сайт издателя | Google Scholar
YN Su, CN Lee, WF Cheng, WY Shau, SN Chow и FJ Hsieh, «Уменьшение фактора роста материнской сыворотки плаценты в начале второго триместра и преэклампсии», Obstetrics & Gynecology , vol. 97, нет. 6, стр. 898–904, 2001.
Посмотреть по адресу:
Сайт издателя | Google Scholar
Л. Дж. Ваттен, А. Эскильд, Т. И. Л. Нильсен, С. Джинссон, П. А. Дженум и А. С. Стафф, «Изменения уровня циркулирующих ангиогенных факторов с первого по второй триместр как предикторы преэклампсии», Американский журнал акушерства и гинекологии , том.
 196, нет. 3, стр. 239–e6, 2007 г.
196, нет. 3, стр. 239–e6, 2007 г.Посмотреть по адресу:
Сайт издателя | Google Scholar
Д. С. Торри, Х.-С. Ван, Т.-Х. Ван, М. Р. Кодл и Р. Дж. Торри, «Преэклампсия связана со сниженным уровнем фактора роста плаценты в сыворотке», American Journal of Obstetrics & Gynecology , vol. 179, нет. 6 I, стр. 1539–1544, 1998.
Посмотреть по адресу:
Сайт издателя | Академия Google
Р. Аколекар, Э. Сарагоса, Л. С. Ю. Пун, С. Пепес и К. Х. Николаидес, «Плацентарный фактор роста материнской сыворотки на 11 + 0 до 13 + 6 недель беременности в прогнозировании преэклампсии», УЗИ в акушерстве и гинекологии , том. 32, стр. 732–773, 2009.
Посмотреть по адресу:
Сайт издателя | Google Scholar
Т. Краусс, Х.
 Пауэр и Х. Г. Огюстен, «Проспективный анализ концентрации плацентарного фактора роста (PlGF) в плазме женщин с нормальной беременностью и беременностями, осложненными преэклампсией», Гипертония при беременности , vol. 23, нет. 1, стр. 101–111, 2004 г.
Пауэр и Х. Г. Огюстен, «Проспективный анализ концентрации плацентарного фактора роста (PlGF) в плазме женщин с нормальной беременностью и беременностями, осложненными преэклампсией», Гипертония при беременности , vol. 23, нет. 1, стр. 101–111, 2004 г.Посмотреть по адресу:
Сайт издателя | Google Scholar
Р. Н. Тейлор, Дж. Гримвуд, Р. С. Тейлор, М. Т. Макмастер, С. Дж. Фишер и Р. А. Норт, «Продольные концентрации плацентарного фактора роста в сыворотке: доказательства аномального плацентарного ангиогенеза при патологической беременности», Американский журнал акушерства и гинекологии , том. 188, нет. 1, стр. 177–182, 2003.
Просмотр:
Сайт издателя | Google Scholar
S. C. Tidwell, H. Ho, W. Chiu, R. J. Torry и D. S. Torry, «Низкий уровень фактора роста плаценты в материнской сыворотке как предвестник клинической преэклампсии», American Journal of Obstetrics & Gynecology , об.
 184, нет. 6, стр. 1267–1272, 2001.
184, нет. 6, стр. 1267–1272, 2001.Посмотреть по адресу:
Сайт издателя | Google Scholar
M. L. Tjoa, J. M. G. van Vugt, M. A. M. Mulders, R. B. H. Schutgens, C. B. M. Oudejans, and I. J. van Wijk, «Уровни фактора роста плаценты в плазме крови в середине триместра беременности», стр. Акушерство и гинекология , том. 98, нет. 4, стр. 600–607, 2001.
Посмотреть по адресу:
Сайт издателя | Google Scholar
Д. П. Холден, С. А. Фиклинг, Г. С. Уитли и С. С. Насси, «Концентрация асимметричного диметиларгинина в плазме, природного ингибитора синтазы оксида азота, при нормальной беременности и преэклампсии», , Американский журнал акушерства и гинекологии, , об. 178, нет. 3, стр. 551–556, 1998.
Посмотреть по адресу:
Сайт издателя | Google Scholar
Ю.
 Дж. Ким, Х. С. Парк, Х. Ю. Ли и др., «Снижение уровня L-аргинина и снижение активности плацентарной eNOS при преэклампсии», Placenta , vol. 27, нет. 4–5, стр. 438–444, 2006 г.
Дж. Ким, Х. С. Парк, Х. Ю. Ли и др., «Снижение уровня L-аргинина и снижение активности плацентарной eNOS при преэклампсии», Placenta , vol. 27, нет. 4–5, стр. 438–444, 2006 г.Посмотреть по адресу:
Сайт издателя | Google Scholar
M. Laskowska и J. Oleszczuk, «Оценка уровней ADMA у женщин с беременностью, осложненной тяжелой преэклампсией», Archives of Perinatal Medicine , том. 17, нет. 1, стр. 33–36, 2011 г.
Посмотреть по адресу:
Google Scholar
Р. Маас, Р. Х. Бегер, Э. Шведхельм и др., «Концентрации асимметричного диметиларгинина (АДМА) в плазме у колумбийских женщин с Преэклампсия [4]», Journal of the American Medical Association , vol. 291, нет. 7, стр. 823-824, 2004.
Посмотреть по адресу:
Сайт издателя | Google Scholar
М.
 Нурбахш, М. Кианпур и М. Нематбахш, «Сывороточные уровни асимметричного диметиларгинина, фактора роста эндотелия сосудов и метаболитов оксида азота у пациентов с преэклампсией», стр. МСРН Акушерство и гинекология , том. 2013, стр. 1–5, 2013.
Нурбахш, М. Кианпур и М. Нематбахш, «Сывороточные уровни асимметричного диметиларгинина, фактора роста эндотелия сосудов и метаболитов оксида азота у пациентов с преэклампсией», стр. МСРН Акушерство и гинекология , том. 2013, стр. 1–5, 2013.Посмотреть по адресу:
Сайт издателя | Google Scholar
Э. Гумус, М. А. Аталай, Б. Четинкая Демир и Э. Сахин Гунес, «Возможная роль асимметричного диметиларгинина (АДМА) в прогнозировании перинатального исхода при преэклампсии и задержке роста плода, связанной с преэклампсией», Журнал материнско-фетальной и неонатальной медицины , том. 29, нет. 23. С. 3806–3811, 2016.
Просмотр:
Сайт издателя | Google Scholar
Т. Маэда, Т. Йошимура и Х. Окамура, «Асимметричный диметиларгинин, эндогенный ингибитор синтазы оксида азота, в кровообращении матери и плода», J.
 Soc. Гинекол. Расследование , том. 10, с. 24, 2003.
Soc. Гинекол. Расследование , том. 10, с. 24, 2003.Просмотр по адресу:
Google Scholar
А. Петтерссон, Т. Хеднер и И. Милсом, «Увеличение концентрации циркулирующего асимметричного диметиларгинина (АДМА, эндогенного ингибитора синтеза оксида азота, в преэклампсия» Acta Obstet. Гинекол. Сканд , том. 77, стр. 808–813, 1998.
Посмотреть по адресу:
Сайт издателя | Google Scholar
D. Rizos, M. Eleftheriades, E. Batakis et al., «Уровни асимметричного диметиларгинина во время нормальной беременности и беременностей, осложненных преэклампсией, или беременностей с малым весом для гестационного возраста», The Journal of Maternal -Фетальная и неонатальная медицина , том. 25, нет. 8, стр. 1311–1315, 2012.
Посмотреть по адресу:
Сайт издателя | Google Scholar
P.
 D. Speer, R. W. Powers, M. P. Frank, G. Harger, N. Markovic и J. M. Roberts, «Повышенные асимметричные концентрации диметиларгинина предшествуют клинической преэклампсии, но не беременности с маленькими для гестационного возраста младенцами». Американский журнал акушерства и гинекологии , том. 198, нет. 1, стр. 112.e1–112.e7, 2008.
D. Speer, R. W. Powers, M. P. Frank, G. Harger, N. Markovic и J. M. Roberts, «Повышенные асимметричные концентрации диметиларгинина предшествуют клинической преэклампсии, но не беременности с маленькими для гестационного возраста младенцами». Американский журнал акушерства и гинекологии , том. 198, нет. 1, стр. 112.e1–112.e7, 2008.Посмотреть по адресу:
Сайт издателя | Google Scholar
M. D. Savvidou, A. D. Hingorani, D. Tsikas, JC Frölich, P. Vallance и K. H. Nicolaides, «Эндотелиальная дисфункция и повышенные концентрации асимметричного диметиларгинина в плазме у беременных женщин, у которых впоследствии развивается преэклампсия», Ланцет , том. 361, нет. 9368, стр. 1511–1517, 2003.
Посмотреть по адресу:
Сайт издателя | Google Scholar
H. Tsukahara, N. Ohta, S. Tokuriki et al.
 , «Определение асимметричного диметиларгинина, эндогенного ингибитора синтазы оксида азота, в пуповинной крови», Metabolism — Clinical and Experimental , vol. 57, нет. 2, стр. 215–220, 2008 г.
, «Определение асимметричного диметиларгинина, эндогенного ингибитора синтазы оксида азота, в пуповинной крови», Metabolism — Clinical and Experimental , vol. 57, нет. 2, стр. 215–220, 2008 г.Посмотреть по адресу:
Сайт издателя | Google Scholar
A. Jeyabalan, S. McGonigal, C. Gilmour, C.A. Hubel и A. Rajakumar, «Концентрация циркулирующего и плацентарного эндоглина при беременности, осложненной задержкой внутриутробного развития и преэклампсией», Плацента , том. 29, нет. 6, стр. 555–563, 2008 г.
Посмотреть по адресу:
Сайт издателя | Google Scholar
С. Дж. Робинсон и Д. Д. Джонсон, «Растворимый эндоглин как маркер преэклампсии во втором триместре», , Американский журнал акушерства и гинекологии, , том. 197, нет. 2, стр. 174.e1–174.e5, 2007.
Посмотреть по адресу:
Сайт издателя | Google Scholar
R.
 J. Levine, C. Lam, C. Qian et al., «Растворимый эндоглин и другие циркулирующие антиангиогенные факторы при преэклампсии», Медицинский журнал Новой Англии , том. 355, нет. 10, стр. 992–1005, 2006.
J. Levine, C. Lam, C. Qian et al., «Растворимый эндоглин и другие циркулирующие антиангиогенные факторы при преэклампсии», Медицинский журнал Новой Англии , том. 355, нет. 10, стр. 992–1005, 2006.Посмотреть по адресу:
Сайт издателя | Google Scholar
С. Рана, С. А. Каруманчи, Р. Дж. Левин и др., «Последовательные изменения антиангиогенных факторов на ранних сроках беременности и риск развития преэклампсии», Гипертония , том. 50, нет. 1, стр. 137–142, 2007 г.
Посмотреть по адресу:
Сайт издателя | Google Scholar
Х. Степан, Т. Кремер и Р. Фабер, «Концентрация растворимого эндоглина в плазме матери при беременности с задержкой внутриутробного развития», Журнал клинической эндокринологии и метаболизма , том. 92, нет. 7, стр. 2831–2834, 2007.
Посмотреть по адресу:
Сайт издателя | Google Scholar
Х.
 Степан, А. Гейпель, Ф. Шварц, Т. Кремер, Н. Вессель и Р. Фабер, «Циркуляторный растворимый эндоглин и его прогностическое значение для преэклампсии во втором триместре беременности с аномальной маточной перфузией» », Американский журнал акушерства и гинекологии , vol. 198, нет. 2, стр. 175–e6, 2008.
Степан, А. Гейпель, Ф. Шварц, Т. Кремер, Н. Вессель и Р. Фабер, «Циркуляторный растворимый эндоглин и его прогностическое значение для преэклампсии во втором триместре беременности с аномальной маточной перфузией» », Американский журнал акушерства и гинекологии , vol. 198, нет. 2, стр. 175–e6, 2008.Посмотреть по адресу:
Сайт издателя | Google Scholar
С. Венкатеша, М. Топорсян, К. Лам и др., «Опечатка: Растворимый эндоглин способствует патогенезу преэклампсии (Nature Medicine (2006) 12, (642-649)»), Nature Медицина , вып. 12, нет. 7, с. 862, 2006.
Посмотреть по адресу:
Google Scholar
O. Burger, E. Pick, J. Zwickel et al., «Плацентарный белок 13 (PP-13): влияние на культивируемые трофобласты и его обнаружение в жидкостях организма человека при нормальной и патологической беременности» Плацента , том.
 25, нет. 7, стр. 608–622, 2004.
25, нет. 7, стр. 608–622, 2004.Посмотреть по адресу:
Сайт издателя | Google Scholar
B. Huppertz, M. Sammar, I. Chefetz, P. Neumaier-Wagner, C. Bartz и H. Meiri, «Продольное определение сывороточного плацентарного белка 13 во время развития преэклампсии», Fetal Diagnosis и Therapy , vol. 24, нет. 3, стр. 230–236, 2008 г.
Посмотреть по адресу:
Сайт издателя | Google Scholar
I. Chafetz, I. Kuhnreich, M. Sammar et al., «Скрининг плацентарного белка 13 в первом триместре беременности на преэклампсию и задержку внутриутробного развития», Американский журнал акушерства и гинекологии , том. 197, нет. 1, стр. 35.e1–35.e7, 2007.
Посмотреть по адресу:
Сайт издателя | Google Scholar
A. Khalil, NJ Cowans, K.
 Spencer, S. Goichman, H. Meiri и K. Harrington, «Плацентарный белок 13 материнской сыворотки первого триместра для прогнозирования преэклампсии у женщин с априорным высокий риск», Prenatal Diagnosis , vol. 29, нет. 8, стр. 781–789, 2009.
Spencer, S. Goichman, H. Meiri и K. Harrington, «Плацентарный белок 13 материнской сыворотки первого триместра для прогнозирования преэклампсии у женщин с априорным высокий риск», Prenatal Diagnosis , vol. 29, нет. 8, стр. 781–789, 2009.Посмотреть по адресу:
Сайт издателя | Академия Google
К. Х. Николаидес, Р. Биндра, О. М. Туран и др., «Новый подход к скринингу в первом триместре ранней преэклампсии, сочетающий сыворотку PP-13 и допплерографию», Ультразвук в акушерстве и гинекологии , том . 27, нет. 1, стр. 13–17, 2006 г.
Посмотреть по адресу:
Сайт издателя | Google Scholar
K. Spencer, NJ Cowans, I. Chefetz, J. Tal, I. Kuhnreich, and H. Meiri, «Допплеровский индекс пульсации маточной артерии во втором триместре беременности и материнская сыворотка PP13 как маркеры преэклампсии, Пренатальная диагностика , том.
 27, нет. 3, стр. 258–263, 2007 г.
27, нет. 3, стр. 258–263, 2007 г.Посмотреть по адресу:
Сайт издателя | Google Scholar
K. Spencer, NJ Cowans, I. Chefetz, J. Tal, and H. Meiri, «РР-13 материнской сыворотки в первом триместре, PAPP-A и доплеровский индекс пульсации маточной артерии во втором триместре беременности как маркеры» преэклампсии», Ультразвук в акушерстве и гинекологии , том. 29, нет. 2, стр. 128–134, 2007 г.
Посмотреть по адресу:
Сайт издателя | Академия Google
Р. Ромеро, Дж. П. Кусанович, Н. Г. Тан и др., «РР13 материнской сыворотки в первом триместре в оценке риска преэклампсии», Американский журнал акушерства и гинекологии , том. 199, нет. 2, стр. 122–e11, 2008 г.
Посмотреть по адресу:
Сайт издателя | Google Scholar
Х.
 Аксой, Ю. Кумтепе, Ф. Акчай и А. К. Йилдирим, «Корреляция Р-селектина и липопротеина (а) и других параметров липидов при преэклампсии», Клиническая и экспериментальная медицина , том. 2, нет. 1, стр. 39–43, 2002 г.
Аксой, Ю. Кумтепе, Ф. Акчай и А. К. Йилдирим, «Корреляция Р-селектина и липопротеина (а) и других параметров липидов при преэклампсии», Клиническая и экспериментальная медицина , том. 2, нет. 1, стр. 39–43, 2002 г.Посмотреть по адресу:
Сайт издателя | Google Scholar
I. Banzola, A. Farina, M. Concu et al., «Работа панели маркеров материнской сыворотки в прогнозировании преэклампсии на 11-15 неделе беременности», Prenatal Diagnose , vol. 27, нет. 11, стр. 1005–1010, 2007.
Посмотреть по адресу:
Сайт издателя | Google Scholar
F. Bretelle, F. Sabatier, D. Desprez et al., «Циркулирующие микрочастицы: маркер прокоагулянтного состояния при нормальной беременности и беременности, осложненной преэклампсией или задержкой внутриутробного развития», Тромбоз и гемостаз , vol. 89, нет.
 3, стр. 486–492, 2003.
3, стр. 486–492, 2003.Посмотреть по адресу:
Сайт издателя | Google Scholar
A. Halim, N. Kanayama, E. El Maradny et al., «P-селектин плазмы (GMP-140) и гликокалицин повышены при преэклампсии и эклампсии: их значение», American Journal of Obstetrics & Гинекология , вып. 174, нет. 1, стр. 272–277, 1996.
Посмотреть по адресу:
Сайт издателя | Академия Google
W. Heyl, S. Handt, F. Reister et al., «Повышение растворимых молекул адгезии у женщин с преэклампсией», European Journal of Obstetrics & Gynecology and Reproductive Biology , vol. 86, нет. 1, стр. 35–41, 1999.
Посмотреть по адресу:
Сайт издателя | Google Scholar
C. A. R. Lok, R. Nieuwland, A. Sturk et al., «Р-селектин, связанный с микрочастицами, отражает активацию тромбоцитов при преэклампсии», Тромбоциты , том.
 18, нет. 1, стр. 68–72, 2007.
18, нет. 1, стр. 68–72, 2007.Посмотреть по адресу:
Сайт издателя | Google Scholar
T. Chaiworapongsa, R. Romero, J. Yoshimatsu et al., «Профиль растворимых молекул адгезии при нормальной беременности и преэклампсии», The Journal of Maternal-Fetal & Neonatal Medicine , vol. 12, нет. 1, стр. 19–27, 2009 г.
Посмотреть по адресу:
Сайт издателя | Google Scholar
P. Bosio, S. Cannon, P. McKenna, C. O’Herlihy, R. Conroy, and H. Brady, «Р-селектин плазмы повышается в первом триместре у женщин, у которых впоследствии развивается пре -эклампсия» BJOG: Международный журнал акушерства и гинекологии , том. 108, нет. 7, стр. 709–715, 2001.
Посмотреть по адресу:
Сайт издателя | Google Scholar
М.
 Э. Чаваррия, Л. Лара-Гонсалес, Ю. Гарсия-Палета, В. С. Витал-Рейес и А. Рейес, «Изменения молекул адгезии на 20-й неделе беременности при беременности, осложненной преэклампсией», Европейский журнал Акушерство, гинекология и репродуктивная биология , том. 137, нет. 2, стр. 157–164, 2008.
Э. Чаваррия, Л. Лара-Гонсалес, Ю. Гарсия-Палета, В. С. Витал-Рейес и А. Рейес, «Изменения молекул адгезии на 20-й неделе беременности при беременности, осложненной преэклампсией», Европейский журнал Акушерство, гинекология и репродуктивная биология , том. 137, нет. 2, стр. 157–164, 2008.Посмотреть по адресу:
Сайт издателя | Google Scholar
А. А. Сенна, М. Зедан, Г. Э. Абд Эль Салам и А. И. Эль Машад, «Изучение уровня адреномедуллина в плазме при нормальной беременности и преэклампсии», Медицинский журнал Medscape , том. 10, нет. 2, статья №. 29, 2008.
Посмотреть по адресу:
Google Scholar
J. Laigaard, T. Sørensen, S. Placecing et al., «Reduction of the disintegrin and metalloprotease ADAM12 in preeclampsia», Акушерство и гинекология , том. 106, нет. 1, стр. 144–149, 2005 г.

Посмотреть по адресу:
Сайт издателя | Google Scholar
К. Х. Николаидес, Л. К. Ю. Пун, Т. Челемен, О. Гранвиллано и И. Пандева, «Материнская сыворотка а-дезинтегрин и металлопротеаза 12 (ADAM12) в первом триместре беременности и неблагоприятный исход беременности», Акушерство и гинекология , том. 112, нет. 5, стр. 1082–1090, 2008.
Посмотреть по адресу:
Сайт издателя | Академия Google
K. Spencer, NJ Cowans и A. Stamatopoulou, «ADAM12 в материнской сыворотке как потенциальный маркер преэклампсии», Prenatal Diagnose , vol. 28, нет. 3, стр. 212–216, 2008 г.
Посмотреть по адресу:
Сайт издателя | Google Scholar
I. Cetin, V. Cozzi, F. Pasqualini et al., «Повышенные материнские уровни длинного пентраксина 3 (PTX3) при преэклампсии и задержке внутриутробного развития», American Journal of Obstetrics & Gynecology , том.
 194, нет. 5, стр. 1347–1353, 2006.
194, нет. 5, стр. 1347–1353, 2006.Посмотреть по адресу:
Сайт издателя | Google Scholar
П. Ровере-Кверини, С. Антоначчи, Г. Дел’Антонио и др., «Плазменная и тканевая экспрессия длинного пентраксина 3 во время нормальной беременности и преэклампсии», Акушерство и гинекология , том. 108, нет. 1, стр. 148–155, 2006 г.
Посмотреть по адресу:
Сайт издателя | Google Scholar
Н. Дж. Коуэнс и К. Спенсер, «Первый триместр ADAM12 и PAPP-A как маркеры задержки внутриутробного развития плода благодаря их роли в системе инсулиноподобного фактора роста», Пренатальная диагностика , том. 27, нет. 3, стр. 264–271, 2007 г.
Посмотреть по адресу:
Сайт издателя | Google Scholar
C. Y. T. Ong, A. W. Liao, K.
 Spencer, S. Munim и K. H. Nicolaides, «Первый триместр материнской сыворотки, свободный от β хорионического гонадотропина человека и связанного с беременностью белка плазмы а как предикторы осложнений беременности», Британский журнал акушерства и гинекологии , том. 107, нет. 10. С. 1265–1270, 2000.
Spencer, S. Munim и K. H. Nicolaides, «Первый триместр материнской сыворотки, свободный от β хорионического гонадотропина человека и связанного с беременностью белка плазмы а как предикторы осложнений беременности», Британский журнал акушерства и гинекологии , том. 107, нет. 10. С. 1265–1270, 2000.Посмотреть по адресу:
Сайт издателя | Google Scholar
К. Спенсер, Н. Дж. Коуэнс и К. Х. Николаидес, «Низкие уровни PAPP-A в материнской сыворотке в первом триместре и риск преэклампсии», Prenatal Diagnosis , vol. 28, нет. 1, стр. 7–10, 2008 г.
Посмотреть по адресу:
Сайт издателя | Google Scholar
Y. Yaron, S. Heifetz, Y. Ochshorn, O. Lehavi и A. Orr-Urtreger, «Снижение РАРР-А в первом триместре является предиктором неблагоприятного исхода беременности», Пренатальная диагностика , том.
 22, нет. 9, стр. 778–782, 2002.
22, нет. 9, стр. 778–782, 2002.Посмотреть по адресу:
Сайт издателя | Google Scholar
Л. Дугофф, Дж. К. Хоббинс, Ф. Д. Мэлоун и др., «Концентрация РАРР-А в материнской сыворотке в первом триместре беременности, концентрация свободного бета-субъединицы человеческого хорионического гонадотропина и прозрачность воротникового пространства связаны с акушерскими осложнениями: популяционный анализ скрининговое исследование (испытание FASTER)», American Journal of Obstetrics & Gynecology , vol. 191, нет. 4, стр. 1446–1451, 2004.
Посмотреть по адресу:
Сайт издателя | Google Scholar
D. Krantz, L. Goetzl, JL Simpson et al., «Ассоциация чрезмерного содержания хорионического гонадотропина человека в первом триместре беременности- β , связанного с беременностью белка A плазмы и прозрачности воротникового пространства с задержкой внутриутробного развития» и другие неблагоприятные исходы беременности», American Journal of Obstetrics & Gynecology , vol.
 191, нет. 4, стр. 1452–1458, 2004.
191, нет. 4, стр. 1452–1458, 2004.Посмотреть по адресу:
Сайт издателя | Google Scholar
К. Спенсер, Н. Дж. Коуэнс, Ф. Молина, К. О. Каган и К. Х. Николаидес, «Ультразвуковое исследование первого триместра и биохимические маркеры анеуплоидии и прогнозирование преждевременных или ранних преждевременных родов», Ультразвук в акушерстве и Гинекология , вып. 31, нет. 2, стр. 147–152, 2008 г.
Посмотреть по адресу:
Сайт издателя | Google Scholar
N. Tul, S. Pusenjak, J. Osredkar, K. Spencer и Z Novak-Antolic, «Прогнозирование осложнений беременности с использованием материнской сыворотки в первом триместре, свободной от бета-CG, PAPP-A и ингибина-A». », Пренатальная диагностика , том. 23, нет. 12, стр. 990–996, 2003.
Посмотреть по адресу:
Сайт издателя | Google Scholar
Г.
 К. Смит, Э. Дж. Стенхаус, Дж. А. Кроссли, Д. А. Эйткен, А. Д. Кэмерон и Дж. М. Коннор, «Уровни белка А плазмы, ассоциированного с беременностью, на ранних сроках беременности и риск ограничения внутриутробного роста, преждевременных родов, преэклампсии и Мертворождение», The Journal of Clinical Endocrinology & Metabolism , vol. 87, нет. 4, стр. 1762–1767, 2002.
К. Смит, Э. Дж. Стенхаус, Дж. А. Кроссли, Д. А. Эйткен, А. Д. Кэмерон и Дж. М. Коннор, «Уровни белка А плазмы, ассоциированного с беременностью, на ранних сроках беременности и риск ограничения внутриутробного роста, преждевременных родов, преэклампсии и Мертворождение», The Journal of Clinical Endocrinology & Metabolism , vol. 87, нет. 4, стр. 1762–1767, 2002.Посмотреть по адресу:
Сайт издателя | Google Scholar
W. Hu, Z. Wang, H. Wang, H. Huang, and M. Dong, «Уровни висфатина в сыворотке крови на поздних сроках беременности и при преэклампсии», Acta Obstetricia et Gynecologica Scandinavica , vol. 87, нет. 4, стр. 413–418, 2008 г.
Посмотреть по адресу:
Сайт издателя | Google Scholar
А. Фарина, А. Секизава, М. Ивасаки, Р. Мацуока, К. Ичидзука и Т. Окаи, «Распределение общей внеклеточной ДНК (ген β -глобина) в материнской плазме при второй триместр: новые перспективы скрининга преэклампсии» 9.
 0817 Пренатальная диагностика , том. 24, нет. 9, стр. 722–726, 2004.
0817 Пренатальная диагностика , том. 24, нет. 9, стр. 722–726, 2004.Посмотреть по адресу:
Сайт издателя | Google Scholar
A. Sekizawa, A. Farina, K. Koide et al., «ДНК β -глобина в материнской плазме как молекулярный маркер преэклампсии», Prenatal Diagnosis , vol. 24, нет. 9, стр. 697–700, 2004.
Посмотреть по адресу:
Сайт издателя | Google Scholar
D.W. Swinkels, JB De Kok, JCM Hendriks, E. Wiegerinck, P.L.M. Zusterzeel, and E.A.P. Steegers, «Гемолиз, повышенный уровень ферментов печени и синдром низкого количества тромбоцитов (HELLP) как осложнение преэклампсии у беременных женщин». увеличивает количество внеклеточной фетальной и материнской ДНК в материнской плазме и сыворотке» Клиническая химия , том. 48, нет. 4, pp. 650–653, 2002.
Посмотреть по адресу:
Google Scholar
Ю.
 М. Д. Ло, М. С. Тейн, Т. К. Лау и др., «Количественный анализ ДНК плода в материнской плазме и сыворотке: последствия для пренатальная диагностика», American Journal of Human Genetics , vol. 62, нет. 4, стр. 768–775, 1998.
М. Д. Ло, М. С. Тейн, Т. К. Лау и др., «Количественный анализ ДНК плода в материнской плазме и сыворотке: последствия для пренатальная диагностика», American Journal of Human Genetics , vol. 62, нет. 4, стр. 768–775, 1998.Посмотреть по адресу:
Сайт издателя | Google Scholar
X. Y. Zhong, H. Laivuori, J. C. Livingston et al., «Повышение концентрации внеклеточной циркулирующей дезоксирибонуклеиновой кислоты матери и плода в плазме беременных женщин с преэклампсией», Американский журнал акушерства и гинекологии , том. 184, нет. 3, стр. 414–419, 2001.
Посмотреть по адресу:
Сайт издателя | Google Scholar
R. J. Levine, C. Qian, E. S. Leshane et al., «Двухэтапное повышение уровня бесклеточной ДНК плода в материнской сыворотке перед началом преэклампсии», American Journal of Obstetrics & Gynecology , vol.
 190, нет. 3, стр. 707–713, 2004.
190, нет. 3, стр. 707–713, 2004.Посмотреть по адресу:
Сайт издателя | Академия Google
Р. М. Сильвер, Л. Мятт, Дж. К. Хаут и др., «Общая бесклеточная ДНК и ДНК плода в материнской сыворотке первого триместра и последующее развитие преэклампсии», , Американский журнал перинатологии, , том. 34, нет. 2, стр. 191–198, 2017.
Посмотреть по адресу:
Сайт издателя | Google Scholar
X. Y. Zhong, W. Holzgreve и S. Hahn, «Уровни внеклеточной циркулирующей ДНК плода в материнской плазме повышены до начала преэклампсии» 9.0817 Гипертония при беременности , vol. 21, нет. 1, стр. 77–83, 2002.
Посмотреть по адресу:
Сайт издателя | Google Scholar
Н. Леунг Це, Джун Чжан, К. Цзе, Ю. С. Лиза и Ю. М. Деннис Ло, Повышение концентрации ДНК плода в материнской плазме у женщин, у которых в конечном итоге развивается преэклампсия.
 Клиническая химия , вып. 47, «Увеличение концентрации ДНК плода в материнской плазме у женщин, у которых в конечном итоге развивается преэклампсия». Клиническая химия 47 (1, 137–39)., 2001.
Клиническая химия , вып. 47, «Увеличение концентрации ДНК плода в материнской плазме у женщин, у которых в конечном итоге развивается преэклампсия». Клиническая химия 47 (1, 137–39)., 2001.С. Де Фалько, «Открытие фактора роста плаценты и его биологической активности», Experimental & Molecular Medicine , vol. 44, нет. 1, с. 1, 2012.
Посмотреть по адресу:
Сайт издателя | Google Scholar
П. Вуорела, Э. Хатва, А. Лимбуссаки и др., «Экспрессия фактора роста эндотелия сосудов и фактора роста плаценты в плаценте человека», Biology of Reproduction , vol. 56, нет. 2, стр. 489–49.4, 1997.
Посмотреть по адресу:
Сайт издателя | Google Scholar
Дж. Доммисс и А. Дж. Тилтман, «Биопсия плацентарного ложа при отслойке плаценты», , Международный журнал акушерства и гинекологии , том.
 99, нет. 8, стр. 651–654, 1992.
99, нет. 8, стр. 651–654, 1992.Посмотреть по адресу:
Сайт издателя | Google Scholar
Т. К. Эскес, «Отслойка плаценты», , Европейский журнал акушерства, гинекологии и репродуктивной биологии, , том. 75, нет. 1, с. 63–70, 1997.
Посмотреть по адресу:
Сайт издателя | Google Scholar
Р. Тадхани, Дж. Л. Экер, В. П. Муттер и др., «Инсулинорезистентность и изменения в ангиогенезе: аддитивные инсульты, которые могут привести к преэклампсии», Hypertension , vol. 43, нет. 5, стр. 988–992, 2004.
Посмотреть по адресу:
Сайт издателя | Google Scholar
Х. Степан, А. Унверсухт, Н. Вессель и Р. Фабер, «Прогностическая ценность материнских ангиогенных факторов во втором триместре беременности с аномальной маточной перфузией», Гипертония , том.
 49, нет. 4, стр. 818–824, 2007 г.
49, нет. 4, стр. 818–824, 2007 г.Посмотреть по адресу:
Сайт издателя | Google Scholar
C. S. Buhimschi, E. R. Norwitz, E. Funai et al., «Мочевые ангиогенные факторы объединяют гипертензивные расстройства и выявляют женщин с тяжелой преэклампсией», American Journal of Obstetrics & Gynecology , vol. 192, нет. 3, стр. 734–741, 2005.
Посмотреть по адресу:
Сайт издателя | Google Scholar
А. С. Стафф, К. Браекке, Г. М. Джонсен, С. А. Каруманчи и Н. К. Харсем, «Циркуляционные концентрации растворимого эндоглина (CD105) в сыворотке плода и матери и в амниотической жидкости при преэклампсии», Американский журнал акушерства и гинекологии , том. 197, нет. 2, стр. 176–e6, 2007 г.
Посмотреть по адресу:
Сайт издателя | Google Scholar
BC Smith и JM Denu, «Химические механизмы модификаций гистонов, лизина и аргинина», Biochimica et Biophysica Acta (BBA) — Gene Regulatory Mechanisms , vol.
 1789, нет. 1, стр. 45–57, 2009 г.
1789, нет. 1, стр. 45–57, 2009 г.Посмотреть по адресу:
Сайт издателя | Google Scholar
А. Скуман и X. Чен, «Метилирование белка: новый механизм регуляции опухолевого супрессора p53», Гистология и гистопатология , том. 23, нет. 9, pp. 1143–1149, 2008.
Посмотреть по адресу:
Google Scholar
М. Т. Бедфорд и С. Ричард, «Метилирование аргинина: новый регулятор функции белка», Molecular Cell , vol. 18, нет. 3, стр. 263–272, 2005.
Посмотреть по адресу:
Сайт издателя | Google Scholar
Л. Сибал, С. К. Агарвал, П. Д. Хоум и Р. Х. Богер, «Роль асимметричного диметиларгинина (АДМА) в эндотелиальной дисфункции и сердечно-сосудистых заболеваниях», Current Cardiology Reviews , vol. 6, нет.
 2, стр. 82–90, 2010.
2, стр. 82–90, 2010.Посмотреть по адресу:
Сайт издателя | Google Scholar
С. Г. Кларк, «Метилирование белков на поверхности и в глубине: мысли вне гистоновой коробки», Trends in Biochemical Sciences , vol. 38, нет. 5, стр. 243–252, 2013 г.
Посмотреть по адресу:
Сайт издателя | Google Scholar
Т. Огава, М. Кимото и К. Сасаока, «Появление нового фермента, катализирующего прямое превращение NG, NG-диметил-L-аргинина в L-цитруллин у крыс», Сообщения о биохимических и биофизических исследованиях , vol. 148, нет. 2, стр. 671–677, 1987.
Посмотреть по адресу:
Сайт издателя | Google Scholar
A. Ito, PS Tsao, S. Adimoolam, M. Kimoto, T. Ogawa, and JP Cooke, «Новый механизм эндотелиальной дисфункции: дисрегуляция диметиларгининдиметиламиногидролазы», Circulation , vol.
 99, нет. 24, стр. 3092–3095, 1999.
99, нет. 24, стр. 3092–3095, 1999.Посмотреть по адресу:
Сайт издателя | Академия Google
P. Vallance, A. Leone, A. Calver, J. Collier и S. Moncada, «Накопление эндогенного ингибитора синтеза оксида азота при хронической почечной недостаточности», The Lancet , vol. 339, нет. 8793, стр. 572–575, 1992.
Посмотреть по адресу:
Сайт издателя | Google Scholar
М. С. Голигорский, «Дисфункция эндотелиальных клеток: не могу с этим жить, как жить без этого», American Journal of Physiology-Renal Physiology , vol. 288, нет. 5, стр. F871–F880, 2005.
Посмотреть по адресу:
Сайт издателя | Google Scholar
J. P. Cooke, E. Rossitch Jr., N. A. Andon, J. Loscalzo, and VJ Dzau, «Flow активирует эндотелиальный калиевый канал для высвобождения эндогенного нитровазодилататора», The Journal of Clinical Investigation , vol.
 88, нет. 5, стр. 1663–1671, 1991.
88, нет. 5, стр. 1663–1671, 1991.Посмотреть по адресу:
Сайт издателя | Google Scholar
RF Furchgott и JV Zawadzki, «Обязательная роль эндотелиальных клеток в расслаблении артериальных гладких мышц ацетилхолином», Природа , том. 288, нет. 5789, стр. 373–376, 1980.
Посмотреть по адресу:
Сайт издателя | Google Scholar
A. Wolf, C. Zalpour, G. Theilmeier et al., «Пищевая добавка L-аргинина нормализует агрегацию тромбоцитов у людей с гиперхолестеринемией», Journal of the American College of Cardiology , vol. 29, нет. 3, стр. 479–485, 1997.
Посмотреть по адресу:
Сайт издателя | Google Scholar
П. Кубес, М. Судзуки и Д. Н. Грейнджер, «Окись азота: эндогенный модулятор адгезии лейкоцитов», Труды Национальной академии наук Соединенных Штатов Америки , том.
 88, нет. 11, стр. 4651–4655, 1991.
88, нет. 11, стр. 4651–4655, 1991.Посмотреть по адресу:
Сайт издателя | Google Scholar
R. H. Böger, «Асимметричный диметиларгинин, эндогенный ингибитор синтазы оксида азота, объясняет «парадокс L-аргинина» и действует как новый фактор сердечно-сосудистого риска», Journal of Nutrition , vol. 134, нет. 10, стр. 2842S–2847S, 2004.
Просмотр:
Сайт издателя | Google Scholar
Р. Дж. Макаллистер, Х. Парри, М. Кимото и др., «Регулирование синтеза оксида азота диметиларгининдиметиламиногидролазой», British Journal of Pharmacology , vol. 119, нет. 8, стр. 1533–1540, 1996.
Посмотреть по адресу:
Сайт издателя | Google Scholar
M.C. Stühlinger, R.K. Oka, E.E. Graf et al., «Эндотелиальная дисфункция, вызванная гипергомоцист(е)инемией: роль асимметричного диметиларгинина», Тираж , том.
 108, pp. 933–938, 2003.
108, pp. 933–938, 2003.Просмотр по адресу:
Google Scholar
K. Y. Lin, A. Ito, T. Asagami et al., «Нарушение пути синтеза оксида азота при сахарном диабете: роль асимметричного диметиларгинин и диметиларгининдиметиламиногидролаза», Circulation , vol. 106, нет. 8, стр. 987–992, 2002.
Посмотреть по адресу:
Сайт издателя | Google Scholar
М. Вейс, Т. Н. Кледал, К. Ю. Лин и др., «Цитомегаловирусная инфекция нарушает путь синтазы оксида азота: роль асимметричного диметиларгинина в трансплантационном артериосклерозе», стр. Тираж , том. 109, нет. 4, стр. 500–505, 2004 г.
Посмотреть по адресу:
Сайт издателя | Google Scholar
М. К. Штюлингер, П. С. Цао, Дж.-Х. Her, M. Kimoto, R. F. Balint и J.
 P. Cooke, «Гомоцистеин нарушает путь синтазы оксида азота: роль асимметричного диметиларгинина», Circulation , vol. 104, нет. 21, стр. 2569–2575, 2001.
P. Cooke, «Гомоцистеин нарушает путь синтазы оксида азота: роль асимметричного диметиларгинина», Circulation , vol. 104, нет. 21, стр. 2569–2575, 2001.Посмотреть по адресу:
Сайт издателя | Google Scholar
Ж.-Ф. Couture, LMA Dirk, JS Brunzelle, RL Houtz и RC Trievel, «Структурное происхождение специфичности продукта метилтрансфераз домена SET», Труды Национальной академии наук Соединенных Штатов Америки , том. 105, нет. 52, стр. 20659–20664, 2008.
Посмотреть по адресу:
Сайт издателя | Google Scholar
X. Zhang и T. C. Bruice, «Ферментативный механизм и специфичность продукта протеин-лизинметилтрансфераз SET-домена», Proceedings of the National Academy of Sciences of the United States of America , vol. 105, нет. 15, стр. 5728–5732, 2008.
Просмотр:
Сайт издателя | Google Scholar
М.
 Т. Бедфорд и С. Г. Кларк, «Метилирование аргинина белка у млекопитающих: кто, что и почему», Molecular Cell , vol. 33, нет. 1, стр. 1–13, 2009 г.
Т. Бедфорд и С. Г. Кларк, «Метилирование аргинина белка у млекопитающих: кто, что и почему», Molecular Cell , vol. 33, нет. 1, стр. 1–13, 2009 г.Посмотреть по адресу:
Сайт издателя | Google Scholar
Й. Ян и М. Т. Бедфорд, «Protein arginine methyltransferases and Cancer», Nature Reviews Cancer , vol. 13, нет. 1, стр. 37–50, 2013 г.
Посмотреть по адресу:
Сайт издателя | Академия Google
C.I. Zurita-Lopez, T. Sandberg, R. Kelly, and S.G. Clarke, «Человеческий белок аргининметилтрансфераза 7 (PRMT7) представляет собой фермент типа III, образующий ω -NG-монометилированные остатки аргинина», The Journal биологической химии , вып. 287, нет. 11, стр. 7859–7870, 2012.
Посмотреть по адресу:
Сайт издателя | Google Scholar
H.
 L. Schubert, R. M. Blumenthal, and X. Cheng, «Many paths to methyltransfer: A Chronicle of Convergence», Тенденции в биохимических науках , vol. 28, нет. 6, стр. 329–335, 2003.
L. Schubert, R. M. Blumenthal, and X. Cheng, «Many paths to methyltransfer: A Chronicle of Convergence», Тенденции в биохимических науках , vol. 28, нет. 6, стр. 329–335, 2003.Посмотреть по адресу:
Сайт издателя | Google Scholar
П. А. дель Риццо и Р. К. Тривел, «Субстратная и продуктовая специфичность метилтрансфераз домена SET», Epigenetics , vol. 6, нет. 9, стр. 1059–1067, 2011.
Посмотреть по адресу:
Сайт издателя | Google Scholar
К. Л. Ткачук, С. Дунин-Хоркавич, Э. Пурта и Дж. М. Буйницки, «Структурная и эволюционная биоинформатика надсемейства метилтрансфераз SPOUT», BMC Биоинформатика , том. 8, статья 73, 2007 г.
Посмотреть по адресу:
Сайт издателя | Google Scholar
Q.
 Feng, H. Wang, HH Ng et al., «Метилирование h4-лизина 79 опосредуется новым семейством HMTases без домена SET», Current Biology , vol. 12, нет. 12, стр. 1052–1058, 2002.
Feng, H. Wang, HH Ng et al., «Метилирование h4-лизина 79 опосредуется новым семейством HMTases без домена SET», Current Biology , vol. 12, нет. 12, стр. 1052–1058, 2002.Посмотреть по адресу:
Сайт издателя | Google Scholar
К. Цянь и М.-М. Чжоу, «Протеин-лизинметилтрансферазы домена SET: структура, специфичность и катализ», Клеточные и молекулярные науки о жизни , vol. 63, нет. 23, стр. 2755–2763, 2006.
Посмотреть по адресу:
Сайт издателя | Google Scholar
Т. С. Петросян и С. Г. Кларк, «Открытие человеческой метилтрансферасомы», Molecular & Cellular Proteomics , vol. 10, нет. 1, 2011.
Посмотреть по адресу:
Сайт издателя | Google Scholar
В. М. Ришон, Д. Джонстон, С. Дж.
 Снирингер и др., «Хемогенетический анализ метилтрансфераз белка человека», Химическая биология и разработка лекарств , том. 78, нет. 2, стр. 199–210, 2011.
Снирингер и др., «Хемогенетический анализ метилтрансфераз белка человека», Химическая биология и разработка лекарств , том. 78, нет. 2, стр. 199–210, 2011.Посмотреть по адресу:
Сайт издателя | Google Scholar
С. Кернсток, Е. Давыдова, М. Якобссон и др., «Лизиновое метилирование VCP членом нового семейства протеинметилтрансфераз человека», Nature Communications , vol. 3, статья №. 1038, 2012.
Посмотреть по адресу:
Сайт издателя | Google Scholar
Р. Маньяни, Л. М. А. Дирк, Р. К. Тривел и Р. Л. Хаутц, «Кальмодулинметилтрансфераза — эволюционно законсервированный фермент, который триметилирует Lys-115 в кальмодулине», Nature Communications , vol. 1, нет. 4, 2010.
Посмотреть по адресу:
Сайт издателя | Google Scholar
А.
 Т. Нгуен и Ю. Чжан, «Разнообразные функции метилирования Dot1 и h4K79», Genes & Development , vol. 25, нет. 13, стр. 1345–1358, 2011.
Т. Нгуен и Ю. Чжан, «Разнообразные функции метилирования Dot1 и h4K79», Genes & Development , vol. 25, нет. 13, стр. 1345–1358, 2011.Посмотреть по адресу:
Сайт издателя | Google Scholar
К. Дж. Уэбб, К. Аль-Хадид, К. И. Зурита-Лопес, Б. Д. Янг, Р. С. Липсон и С. Г. Кларк, «Выступ рибосомы L1 у дрожжей метилирован по остатку лизина, катализируемому семи- β -нитевая метилтрансфераза», The Journal of Biological Chemistry , vol. 286, нет. 21, стр. 18405–18413, 2011.
Посмотреть по адресу:
Сайт издателя | Google Scholar
S. C. Dillon, X. Zhang, R. C. Trievel и X. Cheng, «Суперсемейство белков SET-домена: протеин-лизинметилтрансферазы», Genome Biology , vol. 6, нет. 8, статья №. 227, 2005.
Посмотреть по адресу:
Сайт издателя | Академия Google
T.
 Shimazu, J. Barjau, Y. Sohtome, M. Sodeoka и Y. Shinkai, «Аналог S-аденозилметионина на основе селена показывает, что семибета-цепочечная метилтрансфераза млекопитающих METTL10 представляет собой лизинметилтрансферазу EF1A1», PLoS ONE , том. 9, нет. 8, ID статьи e105394, 2014 г.
Shimazu, J. Barjau, Y. Sohtome, M. Sodeoka и Y. Shinkai, «Аналог S-аденозилметионина на основе селена показывает, что семибета-цепочечная метилтрансфераза млекопитающих METTL10 представляет собой лизинметилтрансферазу EF1A1», PLoS ONE , том. 9, нет. 8, ID статьи e105394, 2014 г.Посмотреть по адресу:
Сайт издателя | Google Scholar
П. Клотье, М. Лавалле-Адам, Д. Фобер, М. Бланшетт и Б. Куломб, «Недавно открытая группа отдаленно родственных лизинметилтрансфераз преимущественно взаимодействует с молекулярными шаперонами для регуляции их активности». PLoS Genetics , vol. 9, нет. 1, ID статьи e1003210, 2013 г.
Посмотреть по адресу:
Сайт издателя | Google Scholar
Дж. К. Блэк, К. Ван Рехем и Дж. Р. Уетстин, «Динамика метилирования лизина гистонов: установление, регулирование и биологическое воздействие», Molecular Cell , vol.
 48, нет. 4, стр. 491–507, 2012 г.
48, нет. 4, стр. 491–507, 2012 г.Посмотреть по адресу:
Сайт издателя | Google Scholar
Дж. К. Эйссенберг и А. Шилатифард, «Метилирование лизина 4 гистона h4 (h4K4) в развитии и дифференцировке», Биология развития , том. 339, нет. 2, стр. 240–249, 2010.
Посмотреть по адресу:
Сайт издателя | Google Scholar
Р. А. Гринберг, «Гистоновые хвосты: направление реакции хроматина на повреждение ДНК», FEBS Letters , vol. 585, нет. 18, стр. 2883–2890, 2011.
Посмотреть по адресу:
Сайт издателя | Google Scholar
Т. Кузаридес, «Хроматиновые модификации и их функция», Cell , vol. 128, нет. 4, стр. 693–705, 2007.
Посмотреть по адресу:
Сайт издателя | Google Scholar
A.
 Nottke, M. P. Colaiácovo и Y. Shi, «Роли гистоновых лизиновых деметилаз в развитии», Development , vol. 136, нет. 6, стр. 879–889, 2009.
Nottke, M. P. Colaiácovo и Y. Shi, «Роли гистоновых лизиновых деметилаз в развитии», Development , vol. 136, нет. 6, стр. 879–889, 2009.Посмотреть по адресу:
Сайт издателя | Google Scholar
М. Т. Педерсен и К. Хелин, «Гистоновые деметилазы в развитии и заболевании», Trends in Cell Biology , vol. 20, нет. 11, стр. 662–671, 2010.
Посмотреть по адресу:
Сайт издателя | Google Scholar
Дж. К. Блэк и Дж. Р. Уетстин, «Нарушение баланса метилирования лизина при заболевании», Biopolymers , vol. 99, нет. 2, стр. 127–135, 2013 г.
Посмотреть по адресу:
Сайт издателя | Google Scholar
Э. Л. Грир и Ю. Ши, «Метилирование гистонов: динамическая метка в здоровье, болезни и наследственности», Nature Reviews Genetics , vol.
 13, нет. 2012. Т. 5. С. 343–357.
13, нет. 2012. Т. 5. С. 343–357.Посмотреть по адресу:
Сайт издателя | Google Scholar
Р. А. Коупленд, М. П. Мойер и В. М. Ришон, «Нацеливание на генетические изменения в протеинметилтрансферазах для персонализированной терапии рака», Oncogene , vol. 32, нет. 8, стр. 939–946, 2013.
Посмотреть по адресу:
Сайт издателя | Google Scholar
С. Хейк, А. Сяо и К. Аллис, «Связывание эпигенетического «языка» ковалентных модификаций гистонов с раком», British Journal of Cancer , vol. 90, нет. 4, стр. 761–769, 2004.
Посмотреть по адресу:
Сайт издателя | Google Scholar
H. Ü. Канискан и Дж. Джин, «Химические исследования гистон-лизинметилтрансфераз», ACS Chemical Biology , vol. 10, нет.
 1, стр. 40–50, 2015 г.
1, стр. 40–50, 2015 г.Посмотреть по адресу:
Сайт издателя | Google Scholar
Р. А. Варье и Х. Т. М. Тиммерс, «Пути метилирования и деметилирования лизина гистонов при раке», Biochimica et Biophysica Acta (BBA) — Обзоры рака , vol. 1815, нет. 1, стр. 75–89, 2011 г.
Посмотреть по адресу:
Сайт издателя | Google Scholar
Е. А. Поллина и А. Брюнет, «Эпигенетическая регуляция старения стволовых клеток», Oncogene , vol. 30, нет. 28, стр. 3105–3126, 2011.
Посмотреть по адресу:
Сайт издателя | Google Scholar
М. Альберт и К. Хелин, «Гистонметилтрансферазы при раке», Семинары по клеточной биологии и биологии развития , том. 21, нет. 2, стр. 209–220, 2010.
Посмотреть по адресу:
Сайт издателя | Google Scholar
П.
 Чи, К. Д. Аллис и Г. Г. Ван, «Ковалентные модификации гистонов — неправильно написанные, неправильно истолкованные и неправильно стертые при раке человека», Nature Reviews Cancer , vol. 10, нет. 7, стр. 457–469, 2010.
Чи, К. Д. Аллис и Г. Г. Ван, «Ковалентные модификации гистонов — неправильно написанные, неправильно истолкованные и неправильно стертые при раке человека», Nature Reviews Cancer , vol. 10, нет. 7, стр. 457–469, 2010.Посмотреть по адресу:
Сайт издателя | Google Scholar
С. Варамбалли, С. М. Дханасекаран, М. Чжоу и др., «Белок группы поликомб EZh3 участвует в прогрессировании рака предстательной железы», Природа , том. 419, нет. 6907, стр. 624–629, 2002.
Посмотреть по адресу:
Сайт издателя | Google Scholar
C.G. Kleer, Q. Cao, S. Varambally et al., «EZh3 является маркером агрессивного рака молочной железы и способствует неопластической трансформации эпителиальных клеток молочной железы», Proceedings of the National Academy of Sciences of the United States. Штаты Америки , том.
 100, нет. 20, стр. 11606–11611, 2003.
100, нет. 20, стр. 11606–11611, 2003.Посмотреть по адресу:
Сайт издателя | Академия Google
H. P. J. Visser, M. J. Gunster, H. C. Kluin-Nelemans et al., «Белок группы Polycomb EZh3 активируется при пролиферирующей культивируемой лимфоме клеток мантийной зоны человека», British Journal of Hematology , vol. 112, нет. 4, стр. 950–958, 2001.
Посмотреть по адресу:
Сайт издателя | Google Scholar
Чен Р., Тан Ю., Ван М. и др., «Разработка безметочного метода на основе захвата гликопротеинов для высокопроизводительного скрининга дифференциальных гликопротеинов при гепатоцеллюлярной карциноме», Молекулярный ##hssm###38; Клеточная протеомика , том. 10, нет. 7, ID статьи M110.006445, 2011.
Посмотреть по адресу:
Сайт издателя | Google Scholar
Р.
 Хамото, В. Салура и Ю. Накамура, «Критическая роль метилирования лизина негистонового белка в онкогенезе человека», Nature Reviews Cancer , vol. 15, нет. 2, стр. 110–124, 2015 г.
Хамото, В. Салура и Ю. Накамура, «Критическая роль метилирования лизина негистонового белка в онкогенезе человека», Nature Reviews Cancer , vol. 15, нет. 2, стр. 110–124, 2015 г.Посмотреть по адресу:
Сайт издателя | Google Scholar
С. Ко, Дж. Ан, К. С. Сонг, С. Ким, К. Кнапчик-Створа и Б. Чаттерджи, «Метилирование лизина и функциональная модуляция рецептора андрогена с помощью set9метилтрансфераза», Molecular Endocrinology , vol. 25, нет. 3, стр. 433–444, 2011.
Посмотреть по адресу:
Сайт издателя | Google Scholar
С. К. Смит, П. Н. Бейкер и Э. М. Саймондс, «Апоптоз плаценты при нормальной беременности человека», , Американский журнал акушерства и гинекологии, , том. 177, нет. 1, стр. 57–65, 1997.
Посмотреть по адресу:
Сайт издателя | Google Scholar
A.
 D. Allaire, K.A. Ballenger, S.R. Wells, M.J. McMahon и B.A. Lessey, «Апоптоз плаценты при преэклампсии», стр. 9.0817 Акушерство и гинекология , том. 96, нет. 2, стр. 271–276, 2000.
D. Allaire, K.A. Ballenger, S.R. Wells, M.J. McMahon и B.A. Lessey, «Апоптоз плаценты при преэклампсии», стр. 9.0817 Акушерство и гинекология , том. 96, нет. 2, стр. 271–276, 2000.Посмотреть по адресу:
Сайт издателя | Google Scholar
А. Е. П. Хизелл, Х. Р. Баттл, П. Н. Бейкер и И. П. Крокер, «Измененная экспрессия регуляторов активности каспаз в трофобласте нормальных беременностей и беременностей, осложненных преэклампсией», Reproductive Sciences , vol. 15, нет. 10, стр. 1034–1043, 2008.
Посмотреть по адресу:
Сайт издателя | Академия Google
Д. Н. Леунг, С. К. Смит, К. То, Д. С. Сахота и П. Н. Бейкер, «Увеличение апоптоза плаценты при беременности, осложненной преэклампсией», , Американский журнал акушерства и гинекологии, , том. 184, нет. 6, стр. 1249-1250, 2001.
Посмотреть по адресу:
Сайт издателя | Google Scholar
Б.
 Хупперц и Дж. С. П. Кингдом, «Апоптоз в трофобласте — роль апоптоза в морфогенезе плаценты», Журнал Общества гинекологических исследований , том. 11, нет. 6, стр. 353–362, 2004.
Хупперц и Дж. С. П. Кингдом, «Апоптоз в трофобласте — роль апоптоза в морфогенезе плаценты», Журнал Общества гинекологических исследований , том. 11, нет. 6, стр. 353–362, 2004.Посмотреть по адресу:
Сайт издателя | Google Scholar
А. Н. Шарп, А. Э. Хизелл, И. П. Крокер и Г. Мор, «Плацентарный апоптоз в норме и заболевании», , Американский журнал репродуктивной иммунологии, , том. 64, нет. 3, стр. 159–169, 2010.
Посмотреть по адресу:
Сайт издателя | Google Scholar
А. Н. Шарп, А. Э. П. Хизелл, Д. Бачик и др., «Преэклампсия связана с изменениями пути р53 в ворсинчатом трофобласте», PLoS ONE , vol. 9, нет. 1, ID статьи e87621, 2014 г.
Посмотреть по адресу:
Сайт издателя | Google Scholar
T.
 Hung, S. Chen, L. Lo et al., «Увеличенная аутофагия в плацентах при беременности с задержкой внутриутробного развития», PLoS ONE , vol. 7, нет. 7, с. e40957, 2012.
Hung, S. Chen, L. Lo et al., «Увеличенная аутофагия в плацентах при беременности с задержкой внутриутробного развития», PLoS ONE , vol. 7, нет. 7, с. e40957, 2012.Посмотреть по адресу:
Сайт издателя | Google Scholar
R. Levy, S.D. Smith, K. Yusuf et al., «Апоптоз трофобластов при беременностях, осложненных задержкой роста плода, связан с повышенной экспрессией p53», Американский журнал акушерства и гинекологии , том. 186, нет. 5, стр. 1056–1061, 2002.
Посмотреть по адресу:
Сайт издателя | Google Scholar
С. Чуйков, Дж. К. Кураш, Дж. Р. Уилсон и др., «Регулирование активности р53 посредством метилирования лизина», Nature , vol. 432, нет. 7015, стр. 353–360, 2004.
Посмотреть по адресу:
Сайт издателя | Google Scholar
J.
 Oyake, M. Otaka, T. Matsuhashi et al., «Сверхэкспрессия белка теплового шока массой 70 кДа обеспечивает защиту от индуцированного монохлорамином повреждения клеток слизистой оболочки желудка», Науки о жизни , том. 79, нет. 3, стр. 300–305, 2006 г.
Oyake, M. Otaka, T. Matsuhashi et al., «Сверхэкспрессия белка теплового шока массой 70 кДа обеспечивает защиту от индуцированного монохлорамином повреждения клеток слизистой оболочки желудка», Науки о жизни , том. 79, нет. 3, стр. 300–305, 2006 г.Посмотреть по адресу:
Сайт издателя | Google Scholar
S. Jirecek, M. Hohlagschwandtner, C. Tempfer, M. Knöfler, P. Husslein и H. Zeisler, «Сывороточные уровни белка теплового шока 70 у пациентов с преэклампсией: экспериментальное исследование». Wiener Klinische Wochenschrift , vol. 114, нет. 15–16, стр. 730–732, 2002.
Посмотреть по адресу:
Google Scholar
J. Hageman, M.A.W.H. van Waarde, A. Zylicz, D. Walerych и H.H. машина HSP70 млекопитающих демонстрирует отчетливую шапероноподобную активность» Биохимический журнал , том.
 435, нет. 1, стр. 127–142, 2011.
435, нет. 1, стр. 127–142, 2011.Посмотреть по адресу:
Сайт издателя | Google Scholar
E. L. Davies, M. M. F. V. G. Bacelar, M. J. Marshall et al., «Белки теплового шока образуют часть сигнального каскада опасности в ответ на липополисахарид и GroEL», Clinical & Experimental Immunology , vol. 145, нет. 1, стр. 183–189, 2006 г.
Посмотреть по адресу:
Сайт издателя | Академия Google
X. Luo, X. Zuo, B. Zhang et al., «Высвобождение белка теплового шока 70 и влияние внеклеточного белка теплового шока 70 на выработку IL-10 в фибробластоподобных синовиоцитах», Cell Stress and Сопровождающие , том. 13, нет. 3, стр. 365–373, 2008 г.
Посмотреть по адресу:
Сайт издателя | Google Scholar
Д.
 Г. Миллар, К. М. Гарза, Б. Одерматт и др., «Hsp70 способствует функции антиген-презентирующих клеток и преобразует толерантность Т-клеток в аутоиммунитет in vivo», Природная медицина , том. 9, нет. 12, стр. 1469–1476, 2003.
Г. Миллар, К. М. Гарза, Б. Одерматт и др., «Hsp70 способствует функции антиген-презентирующих клеток и преобразует толерантность Т-клеток в аутоиммунитет in vivo», Природная медицина , том. 9, нет. 12, стр. 1469–1476, 2003.Посмотреть по адресу:
Сайт издателя | Google Scholar
HH Kampinga, J. Hageman, MJ Vos et al., «Руководство по номенклатуре белков теплового шока человека», Cell Stress and Chaperones , vol. 14, нет. 1, стр. 105–111, 2009 г.
Посмотреть по адресу:
Сайт издателя | Google Scholar
Х. Х. Кампинга и Э. А. Крейг, «Машина шаперона HSP70: J-белки как драйверы функциональной специфичности», Nature Reviews Молекулярно-клеточная биология , том. 11, нет. 8, стр. 579–592, 2010.
Посмотреть по адресу:
Сайт издателя | Google Scholar
А.
 Фукусима, Х. Кавахара и К. Исуруги, «Изменения сывороточных уровней белка теплового шока 70 при преждевременных родах и преэклампсии», Journal of Obstetrics and Gynecology Research , vol. 31, нет. 1, стр. 72–77, 2005 г.
Фукусима, Х. Кавахара и К. Исуруги, «Изменения сывороточных уровней белка теплового шока 70 при преждевременных родах и преэклампсии», Journal of Obstetrics and Gynecology Research , vol. 31, нет. 1, стр. 72–77, 2005 г.Посмотреть по адресу:
Сайт издателя | Google Scholar
Дж. К. Парк, Т. Г. Канг, М. Ю. Канг и др., «Повышенная экспрессия NFAT5 стимулирует транскрипцию Hsp70 в преэклампсии плаценты», Плацента , том. 35, нет. 2, стр. 109–116, 2014 г.
Посмотреть по адресу:
Сайт издателя | Google Scholar
F. Barut, A. Barut, B. Dogan Gun et al., «Экспрессия белка теплового шока 70 и эндотелиальной синтазы оксида азота в плацентарной ткани преэклампсии и беременности с задержкой внутриутробного развития», Патология — Исследования и практика , том. 206, нет. 9, стр. 651–656, 2010.

Посмотреть по адресу:
Сайт издателя | Академия Google
Y. Liu, N. Li, L. You, X. Liu, H. Li и X. Wang, «HSP70 связан с эндотелиальной активацией при плацентарных сосудистых заболеваниях», Molecular Medicine , vol. 14, нет. 9–10, стр. 561–566, 2008 г.
Посмотреть по адресу:
Сайт издателя | Google Scholar
Х.-С. Чо, Т. Симадзу, Г. Тоёкава и др., «Усиленное метилирование лизина HSP70 способствует пролиферации раковых клеток посредством активации киназы Aurora B», Nature Communications , том. 3, статья 1072, 2012 г.
Посмотреть по адресу:
Сайт издателя | Google Scholar
A. Sawano, T. Takahashi, S. Yamaguchi, M. Aonuma и M. Shibuya, «Тирозинкиназа Flt-1, но не KDR/Flk-1 является рецептором фактора роста плаценты, который связанных с фактором роста эндотелия сосудов», Cell Growth & Differentiation , vol.
 7, нет. 2, pp. 213–221, 1996.
7, нет. 2, pp. 213–221, 1996.Просмотр по адресу:
Google Scholar
Феррара Н. и Кербель Р.С. Ангиогенез как терапевтическая цель, стр. Природа , том. 438, нет. 7070, стр. 967–974, 2005.
Посмотреть по адресу:
Сайт издателя | Google Scholar
Н. Рахими, «Рецепторы фактора роста эндотелия сосудов: молекулярные механизмы активации и терапевтические возможности», Experimental Eye Research , vol. 83, нет. 5, стр. 1005–1016, 2006.
Посмотреть по адресу:
Сайт издателя | Google Scholar
Д. Ханахан и Дж. Фолкман, «Схемы и возникающие механизмы ангиогенного переключения во время онкогенеза», Ячейка , т. 86, нет. 3, стр. 353–364, 1996.
Посмотреть по адресу:
Сайт издателя | Google Scholar
W.
 Risau, «Механизмы ангиогенеза», Nature , vol. 386, нет. 6626, стр. 671–674, 1997.
Risau, «Механизмы ангиогенеза», Nature , vol. 386, нет. 6626, стр. 671–674, 1997.Посмотреть по адресу:
Сайт издателя | Google Scholar
Г.-Х. Фонг, Дж. Россант, М. Герценштейн и М.Л. Брейтман, «Роль тирозинкиназы рецептора Flt-1 в регуляции сборки эндотелия сосудов», Природа , том. 376, нет. 6535, стр. 66–70, 1995.
Посмотреть по адресу:
Сайт издателя | Google Scholar
С. Хельске, П. Вуорела, О. Карпен, К. Хорниг, Х. Вейх и Э. Халмесмяки, «Экспрессия рецепторов фактора роста эндотелия сосудов 1, 2 и 3 в плацентах от нормальных и осложненных беременности», Molecular Human Reproduction , vol. 7, нет. 2, стр. 205–210, 2001.
Посмотреть по адресу:
Сайт издателя | Академия Google
Y.
 Zhou, M. McMaster, K. Woo et al., «Лиганды и рецепторы фактора роста эндотелия сосудов, которые регулируют выживаемость цитотрофобласта человека, не регулируются при тяжелой преэклампсии и гемолизе, повышенных ферментах печени и синдроме низкого уровня тромбоцитов», Американский журнал патологии , том. 160, нет. 4, ID статьи 62567, стр. 1405–1423, 2002 г.
Zhou, M. McMaster, K. Woo et al., «Лиганды и рецепторы фактора роста эндотелия сосудов, которые регулируют выживаемость цитотрофобласта человека, не регулируются при тяжелой преэклампсии и гемолизе, повышенных ферментах печени и синдроме низкого уровня тромбоцитов», Американский журнал патологии , том. 160, нет. 4, ID статьи 62567, стр. 1405–1423, 2002 г.Посмотреть по адресу:
Сайт издателя | Google Scholar
М. Кунизаки, Р. Хамото, Ф. П. Сильва и др., «Лизин 831 рецептора 1 сосудистого эндотелиального фактора роста является новой мишенью метилирования с помощью SMYD3», Исследование рака , том. 67, нет. 22, стр. 10759–10765, 2007.
Посмотреть по адресу:
Сайт издателя | Google Scholar
E. J. Hartsough, R. D. Meyer, V. Chitalia et al., «Метилирование лизина способствует активации VEGFR-2 и ангиогенезу», Science Signaling , vol.
 6, нет. 304, ID статьи ra104, 2013.
6, нет. 304, ID статьи ra104, 2013.Посмотреть по адресу:
Сайт издателя | Google Scholar
Н. Рахими и К. Э. Костелло, «Новая роль посттрансляционных модификаций в передаче сигнала и ангиогенезе», Протеомика , том. 15, нет. 2–3, стр. 300–309, 2015 г.
Посмотреть по адресу:
Сайт издателя | Google Scholar
Copyright
Copyright © 2018 Мария Портелли и Байрон Барон. Это статья с открытым доступом, распространяемая в соответствии с лицензией Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии надлежащего цитирования оригинальной работы.
Maternofetal
Появление повышенного артериального давления во время беременности у ранее нормотензивной женщины называется гипертензией, вызванной беременностью (PIH). Его наиболее важными формами являются преэклампсия и эклампсия, рассмотренные в этой статье. Его более легкая форма, гестационная гипертензия, характеризуется лишь случайными и небольшими подъемами артериального давления, которые уменьшаются в покое.
Его наиболее важными формами являются преэклампсия и эклампсия, рассмотренные в этой статье. Его более легкая форма, гестационная гипертензия, характеризуется лишь случайными и небольшими подъемами артериального давления, которые уменьшаются в покое.
В 2013 г. сотрудники отдела гипертонии у беременных Американского колледжа акушерства и гинекологии (ACOG) внесли некоторые изменения, чтобы унифицировать диагностику и лечение этого состояния. Намерение состоит в том, чтобы уменьшить одно из наиболее важных осложнений заболевания, недоношенность, вызванную прерыванием беременности до 37-й недели; аналогичным образом, стремятся уменьшить количество показаний к антигипертензивным препаратам (лекарства выше 150/100: лабеталол, метилдопа и нифедипин являются выбором), избегать использования сульфата магния в нетяжелых случаях и избегать постельного режима.
Что означает преэклампсия?
В двух словах это означает то, что предшествует или происходит до эклампсии (преэклампсии). Это возникновение исключительно во время беременности высокого кровяного давления ( гипертония) при наличии изменений в почках ( протеинурия : чрезмерная потеря белка с мочой) и накопление или «задержка жидкости» в форме отека или отека В настоящее время ACOG не считает наличие протеинурии необходимым для постановки диагноза преэклампсии при наличии других состояний
Это возникновение исключительно во время беременности высокого кровяного давления ( гипертония) при наличии изменений в почках ( протеинурия : чрезмерная потеря белка с мочой) и накопление или «задержка жидкости» в форме отека или отека В настоящее время ACOG не считает наличие протеинурии необходимым для постановки диагноза преэклампсии при наличии других состояний
Преэклампсия — это заболевание, которое возникает только во время беременности, а беременность является источником, является одним из заболеваний, входящих в состав общей гипертензии, вызванной беременностью (ГИЭ), в конце беременности заболевание исчезает, и преэклампсия не может существуют, если нет беременности. Эта проблема возникает у 2-7% всех здоровых беременных женщин и ее частота значительно выше при наличии у пациентки каких-либо предшествующих заболеваний, особенно почек. В популяции здоровых женщин преэклампсия чаще наблюдается у первородящих.
Гестоз, токсикоз беременных, гипертензия, вызванная беременностью, какова его связь с преэклампсией?
Это синонимы. В настоящее время наиболее часто используется преэклампсия как одна из форм гипертензии, вызванной беременностью
В настоящее время наиболее часто используется преэклампсия как одна из форм гипертензии, вызванной беременностью
Каково происхождение преэклампсии?
Мы не знаем. Но есть подозрение, что существует дефект в развитии плаценты внутри материнской матки, что приводит к ряду сосудистых изменений, которые приводят к обратимому повреждению почек (9).0261 Гломерулоэндотелиоз ), повышение артериального давления у матери, плохое орошение кровью матки и недостаточное снабжение плода питательными веществами и кислородом в среднесрочном периоде.
Каковы симптомы?
У значительной части пациентов отсутствуют какие-либо симптомы. К ним относятся данные о тяжести и/или осложнениях, наличие нарушений зрения (мерцание скотомы), боли в животе в устье желудка, значительные отеки в области стоп, кистей и лица; головная боль, головокружение, тошнота и рвота, снижение шевеления плода, генитальные кровотечения и судороги.
Как диагностируется преэклампсия?
Диагноз достаточно прост, но для его постановки пациентке необходимо регулярно посещать пренатальный контроль, поскольку в большинстве случаев преэклампсия протекает бессимптомно и выявляется только при рутинных измерениях артериального давления. Когда симптоматика интенсивна, это обычно указывает на серьезную проблему с непосредственными возможными судорогами (эклампсия). Элементы, которые мы используем для постановки диагноза: Артериальное давление равно или выше 140/9.0 мм рт. ст. по крайней мере с одним дополнительным критерием:
Критерии 2013 г., ACOG, Целевая группа по гипертензии при беременности: преэклампсия
- Артериальное давление выше или равно 140/90 после 20-й недели с любым из следующих элементов.
- Текущая протеинурия:
- > 300 мг за 24 часа (урожай за один полный день) или
- Индекс белок/креатинин> 0,3 или
- Отсутствие протеинурии: недавнее появление любого из следующих элементов:
- Тромбоциты менее 100 000
- Креатинин более 1,1 мг/дл (почечная недостаточность)
- Трансаминазы повышены более чем в два раза по сравнению с нормальным верхним значением (SGPT, SGOT)
- Отек легких без известной причины
- Симптомы поражения головного мозга (головная боль) или типичные зрительные симптомы (скотомы)
Существуют ли степени тяжести этого заболевания?
Традиционная классификация основана на уровне артериального давления и ухудшении функции почек, а также неврологической симптоматике и наличии судорог. Таким образом, у нас есть легкая преэклампсия, тяжелая преэклампсия и эклампсия, умеренной реэклампсии не бывает. Проблема этого заболевания в том, что оно может переходить из одной степени в другую без предупреждения и даже проявляться в тяжелой или осложненной форме ничем и не пройдя через более легкие формы. Чем больше тяжесть и раннее начало (очень близко к 20-й неделе), тем больше вероятность осложнений.
Таким образом, у нас есть легкая преэклампсия, тяжелая преэклампсия и эклампсия, умеренной реэклампсии не бывает. Проблема этого заболевания в том, что оно может переходить из одной степени в другую без предупреждения и даже проявляться в тяжелой или осложненной форме ничем и не пройдя через более легкие формы. Чем больше тяжесть и раннее начало (очень близко к 20-й неделе), тем больше вероятность осложнений.
Критерии 2013, ACOG, Целевая группа по гипертензии у беременных: тяжелая преэклампсия
- Артериальное давление больше или равно 160/110 плюс любое из следующего
- Тромбоциты менее 100 000 или
- Поражение печени: повышенный уровень трансаминаз или необъяснимая боль в эпигастрии/ правом подреберье, которая не поддается обычному лечению (антациды, общие анальгетики)
- Прогрессирующая почечная недостаточность
- Отек легких
- Церебральные или визуальные симптомы недавнего появления
- HELLP-синдром (см.
 рамку справа, включает несколько элементов)
рамку справа, включает несколько элементов)
Осложнения у матери
Наиболее опасными осложнениями у матери являются эклампсия, острое поражение печени (синдром HELLP), острый отек легких, почечная недостаточность, кровотечение, инсульт, кома и смерть. Мы также должны учитывать личные и семейные последствия экстренного кесарева сечения, возможного поступления в реанимацию взрослых, высокие затраты и психологические издержки для больной матери и ее ребенка.
Осложнения внутриутробного развития
Наиболее опасным риском является внутриутробная гибель, а наиболее частым риском является недоношенность, вызванная преждевременными родами или необходимостью прерывания беременности из-за невозможности контролировать заболевание. С другой стороны, плацентарная недостаточность (плацентарная недостаточность) приводит к рождению детей с низкой массой тела и в некоторых случаях к неврологическим повреждениям с серьезными моторными и интеллектуальными последствиями.
Помогает ли дородовой уход?
Да. Хотя это не предотвращает его на 100% (есть некоторые стратегии, которые могли бы, но не дают результатов) или излечивает, вы можете установить риск каждого пациента, диагностировать проблему на ранней стадии, внимательно следить за матерью и ее ребенком и контролировать ситуацию в наилучшим образом. Хороший контроль позволил значительно снизить неонатальную смертность. Доплеровское исследование маточных артерий позволяет прогнозировать появление ГИЭ у бессимптомных женщин задолго до появления высоких цифр АД.
Кто подвержен риску преэклампсии?
Хотя во многих случаях мы не знаем, кто будет страдать, следующие состояния подвергают пациента особому риску:
Первенцы (первородки), преэклампсия в семейном анамнезе или персонале, ожирение (ИМТ > 30), хроническая гипертензия, заболевание почек, Многоплодная беременность, сахарный диабет, аутоиммунные заболевания, низкое социально-экономическое положение, употребление кокаина, амфетаминов и др. , Экстракорпоральное оплодотворение Оплодотворение
, Экстракорпоральное оплодотворение Оплодотворение
Я страдаю некоторыми из этих заболеваний: хронической артериальной гипертензией, сахарным диабетом или хронической болезнью почек. Что я должен делать?
Вы должны заранее спланировать свою следующую беременность и посетить пренатальный контроль до того, как забеременеете: контроль перед зачатием. Вы должны держать свое заболевание под контролем и сообщить своему врачу-специалисту о своем намерении забеременеть, чтобы он мог внести необходимые коррективы, в том числе заменить некоторые противопоказания во время беременности и при отсутствии противопоказаний для беременности. К сожалению, беременность может ускорить течение ранее существовавшего заболевания и привести к значительному ухудшению качества вашей жизни. В ряде случаев мы видели необходимость противопоказания к беременности или даже необходимость ее прерывания в связи с ускоренным ухудшением состояния здоровья матери: во многих из этих случаев причиной было появление гестоза, повреждающего жизненно важные органы матери или усугубляющего течение основного и поставила под угрозу его жизнь, не было другого выхода, кроме как прервать беременность. Хорошей новостью является то, что это происходит довольно редко, но вы должны приложить много усилий для контроля над своей болезнью, чтобы этого не произошло.
Хорошей новостью является то, что это происходит довольно редко, но вы должны приложить много усилий для контроля над своей болезнью, чтобы этого не произошло.
Можно ли это предотвратить?
Можно свести к минимуму количество случаев и ограничить их неблагоприятные последствия, изменив некоторые негативные аспекты образа жизни, контролируя хронические заболевания и начав адекватный и ранний пренатальный контроль, предпочтительно до беременности. В худшем случае мы могли бы, по крайней мере, обнаружить его на ранней стадии и принять более строгие меры пренатального контроля, чтобы смягчить последствия болезни для матери и плода. Самые последние исследования (Werner et al., American College) указывают на гораздо более широкое использование аспирина и примерно на 20% снижают первоначальный риск:
АСПИРИН 81 мг: 1 таблетка в день в течение всей беременности, начиная с 16-й недели (с 12 по 20 неделю), если вы страдаете ОДИН из следующих состояний:
- Хроническая гипертензия
- Многоплодная беременность
- Сахарный диабет
- Преэклампсия в анамнезе
- Болезнь почек
- Аутоиммунное заболевание
или
ДВА или более из следующих:
- Нулипарность
- Ожирение (ИМТ > 30)
- Более 35 лет
- Черная раса
- Семейный анамнез преэклампсии
- Последняя беременность более 10 лет назад
- Дети с задержкой роста
(Показания ASA: Канадские институты исследований в области здравоохранения)
Некоторые исследования показывают, что использование витамина Е и витамина С может предотвратить его у отдельных пациентов, но отчеты показывают очень разную эффективность.
Можете ли вы предсказать?
Зная анамнез пациентки, мы можем заподозрить, кто из них будет более подвержен риску развития преэклампсии, но 100% точного метода прогнозирования не существует, однако допплерографическое исследование материнского кровообращения (маточных артерий) может предсказать возникновение преэклампсии до 50% больных с подозрительными находками.
Это можно вылечить?
Да. Но единственный способ вылечить это прервать беременность . Как и при всех заболеваниях неизвестного происхождения, лечение неэффективно и обычно не излечивает и не устраняет неблагоприятное состояние. Единственное, что нам известно на данный момент, это то, что преэклампсия лечится прерыванием беременности, но поскольку это не всегда полезно для ребенка (из-за недоношенности), мы должны контролировать ситуацию с помощью лекарств и общих мер, пока мы не сможем извлечь ребенка. с некоторой безопасностью.
У меня уже была преэклампсия при первой беременности, буду ли я страдать при следующей?
В этом случае повышается риск рецидива заболевания; таким образом, у вас есть приблизительный риск повторного развития преэклампсии в 20 % (диапазон 5–80 %) в зависимости от тяжести предыдущего эпизода и таких факторов, как остаточная гипертензия, диабет, многоплодная беременность и т. д.
Если у меня отек, сделайте У меня преэклампсия?
Не обязательно, чтобы поставить диагноз преэклампсии, опухоль (отек) должна быть ненормальной и сопровождаться гипертензией и потерей белка с мочой. Воспаление лодыжек (отек) является нормальным явлением при беременности, особенно в конце дня.
Мне говорят не есть соль. Должен ли я оставить это?
Нет. Это старая и неправильная концепция решения проблемы. Это совсем не улучшает течение болезни и может привести к нежелательным последствиям.
