Беременность и глаукома: Глаукома И Беременность: Что Нужно Знать Будущей Маме
Особенности течения и лечения глаукомы в период беременности | Чернякова
1. Razeghinejad M.R. Glaucoma medications in pregnancy. Oman. J. Ophthalmol. 2018;11(3):195–9. doi: 10.4103/ojo.OJO_212_2017
2. Razeghimejad M.R., Tania Tai T.Y., Fudemberg S.J. Pregnancy and glaucoma. Surv. Ophthalmol. 2011;56(4)324–335. doi: 10.1016/j.survophthal.2010.11.008. PubMed PMID: 21620430
3. Киселева О.А., Якубова Л.В., Косакян С.М., Василенкова Л.В. Влияние гипотензивных препаратов на течение беременности у пациенток с глаукомой: данные экспериментальных и клинических наблюдений. Эффективная фармакотерапия. Офтальмология. 2018;28(3):20–6.
4. Efe Y.K., Ugurbas S.C., Alpay A., Ugurbas S.H. The course of corneal and intraocular pressure changes during pregnancy. Can. J. Ophthalmol. 2012;47(2):150–4. doi: 10.1016/j.jcjo.2012.01.004. Epub 2012 Mar 10
5. Qureshi I.A., Xi X.R., Wu X.D. Intraocular pressure trends in pregnancy and in the third trimester hypertensive patients. Acta Obstet. Gynecol. Scand. 1996;75(9):816–9. doi: 10.3109/00016349609054709. PubMed PMID: 8931505
Gynecol. Scand. 1996;75(9):816–9. doi: 10.3109/00016349609054709. PubMed PMID: 8931505
6. Akar Y., Yucel I., Akar M.E. et al. Effect of pregnancy on intraobserver and intertechnique agreement in intraocular pressure mea surements. Ophthalmologica. 2005;219(1):36–42. doi: 10.1016/j.jcjo.2012.01.004
7. Brauner S.C., Hutchinson B.T., Chang M.A. The course of glaucoma during pregnancy: a retrospective case series. Arch. Ophtalmol. 2006;124(8):1089–94. doi: 10.1001/ archopht.124.8.1089. PubMed PMID: 16908810
8. Vaideanu D., Fraser S. Glaucoma management in pregnancy: A questionnaire survey. Eye. 2007;21(3):341–3. doi: 10.1016/j.survophthal.2010.11.008. PubMed PMID: 21620430
9. Razeghinejad M.R., Masoumpour M., Eghbal M.H. et al. Glaucoma surgery in pregnancy: a case series and literature review. Iran J. Med. Sci. 2016;41(5):437–45.
10. Flach A.J. The importance of eyelid closure and nasolacrimal occlusion following the ocular instillation of topical glaucoma medications, and the need for the universal inclusion of one of these techniques in all patient treatments and clinical studies Trans. Am. Ophthalmol. Soc. 2008;106:138–48.
Am. Ophthalmol. Soc. 2008;106:138–48.
11. Coleman A.L., Mosaed S., Kamal D. Medical therapy in pregnancy. J. Glaucoma. 2005;14(5):414–6. doi: 10.1097/01.ijg.0000177214.39244.da PubMed PMID: 16148592
12. Sethi H.S., Naik M., Gupta V.S. Management of glaucoma in pregnancy: risks or choices, a dilemma? Int.. J Ophthalmol. 2016;9(11):1684–90. doi:10.18240/ijo.2016.11.24
13. Rezai S., LoBue S., LoBue T.D. et al. Ophthalmic Complications and ocular changes in pregnancy – a review. Obstet. Gynecol. In.t J. 2016;4(1):93. doi: 10.15406/ogij.2016.04.00093
14. Киселева О.А., Якубова Л.В., Бессмертный А.М. Бета-блокаторы в современной терапии глаукомы. Обзор. Офтальмология. 2013;10(2):20–3. doi: 10.18008/1816-5095-2013-2-20-23
15. Coleman AL. Advances in glaucoma treatment and management: surgery. Invest. Ophthalmol. Vis. Sci. 2012;53(5):2491–4. doi: 10.1167/iovs.12-9483l
16. Mendez-Hernandez C., Garcia-Feijoo J., Saenz-Frances F. et al. Topical intraocular pressure therapy effects on pregnancy.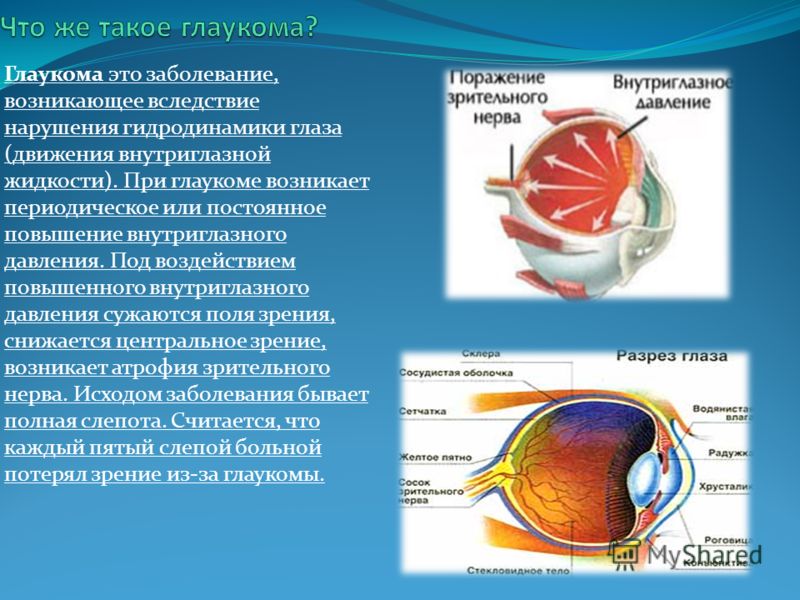 J. Clin. Ophthalmol. 2012;6:1629–32. doi: 10.2147/OPTH.S36712
J. Clin. Ophthalmol. 2012;6:1629–32. doi: 10.2147/OPTH.S36712
17. Netland P. Glaucoma medical therapy: principles and management. 2nd ed. Ophthalmology Monographs 13. New York: Oxford University Press; 2008; 83–101.
18. Ho J-D., Hu C-C., Lin H-C. Antiglaucoma medications during pregnancy and the risk of low birth weight: A population-based study. Br. J. Ophtalmol. 2009;93(10):1283–6. doi: 10.1136/bjo.2008.157123.
19. Ozawa H., Azuma E., Shindo K. Transient renal tubular acidosis in a neonate following transplacental acetazolamide. Eur. J. Pediatr. 2001;160(5):321–2. doi: 10.1007/pl00008441
20. Da Silva Dal Pizzol T., Knop F.P., Mengue S.S. Prenatal exposure to misoprostol and congenital anomalies: systematic review and meta-analysis. Reprod. Toxicol. 2006;22(4):666–71. doi: 10.1016/j.reprotox.2006.03.015
21. Pellegrino М., D’Oria L., De Luca С. et al. Glaucoma drug therapy in pregnancy: literature review and teratology information service (TIS) case series. Current. Drug. Safety. 2018;13(1):3–11. doi:10.2174/1574886312666171030125804
Current. Drug. Safety. 2018;13(1):3–11. doi:10.2174/1574886312666171030125804
22. De Santis M., Lucchese A., Carducci B. et al. Latanoprost exposure in pregnancy. Am. J. Ophthalmol. 2004;138(2):305–6. doi: 10.1016/j.ajo.2004.03.002
23. Omori Y., Endo T., Hara Y. Absorption, distribution and excretion of 14C-pilocarpine following oral administration to rats. Arzneimittelforschung. 2004;54(3):171–8. doi: 10.1055/s-0031-1296955
24. Výborný P., Sičáková S., Flórová Z., Sováková I. Selective laser trabeculoplasty — implication for medicament glaucoma treatment interruption in pregnant and breastfeeding women. Cesk. Slov. Oftalmol. 2017;73(2):61–3.
25. Park M.H., Moon J.I. Selective laser trabeculoplasty in fertile women with open angle glaucoma or ocular hypertension. J. Kor. Ophthalmol. Soc. 2007;48(11):1494–9. doi: 10.3341/jkos.2007.48.11.1494
26. Gazizova I., Avdeev R., Aleksandrov A. et al. Multicenter study of intraocular pressure level in patients with moderate and advanced primary open-angle glaucoma on treatment. Invest. Ophthalmol. Vis. Sci. 2016;57(12):6470. doi: 10.17816/OV2015143-60
Invest. Ophthalmol. Vis. Sci. 2016;57(12):6470. doi: 10.17816/OV2015143-60
27. Little B.B. Drugs and pregnancy, a handbook. Oxford University Press Inc., 2006.
28. Salim S. Glaucoma in pregnancy. Curr. Opin. Ophthalmol. 2014;25(2):93–7. doi: 10.1097/ICU.0000000000000029
29. Chan J.E., Netland P.A. EX-PRESS Glaucoma filtration device: efficacy, safety and predictability. Med. Devices. (Auckl). 2015;8:381–8. doi: 10.2147/MDER.S63350
Глаукома у детей. / Детская городская поликлиника №58
- Главная
- Информация для населения
- Школы здоровья
- Глаукома у детей.
Болезнь, что зрение крадёт. Глаукома у детей
Глаукома – одно из самых опасных заболеваний офтальмологической практики. Характеризуется повышением внутриглазного давления (ВГД), за счет нарушения при оттоке внутриглазной влаги. Повышенное ВГД оказывает негативное влияние на зрительный нерв, вызывая его атрофию и концентрическое постепенное сужение полей зрения, приводя постепенно к необратимой слепоте. Заболевание чаще, безусловно, проявляется у пациентов старше 45-50 лет, но, тем не менее, часто может диагностироваться и у деток.
Заболевание чаще, безусловно, проявляется у пациентов старше 45-50 лет, но, тем не менее, часто может диагностироваться и у деток.
Даже новорожденные не застрахованы от проявлений глаукомы, как свидетельствует статистика, глаукома обнаруживается в 1 случае на 10-20 тысяч новорожденных детей.
В детском возрасте патологию можно разделить на такие виды:
Врожденная. Заболевание диагностируется у деток до года. Считается, что основная причина – наследственная предрасположенность. Однако, так же выделяют травматическое поражение органа зрения во время прохождения ребенка по родовым путям матери или поражение эмбриона во внутриутробном периоде.
Причина внутриутробного поражения может быть, как инфекционное заболевание матери, так и воздействие триггерных факторов: курение, алкоголь, наркомания, отравление, прием препаратов, в особенности в первом триместре, когда происходит закладка органа зрения у будущего ребенка.
Инфантильная. Встречается у деток от двух до десяти лет. Причиной могут быть врожденные дефекты, которые проявляют себя отсрочено.
Встречается у деток от двух до десяти лет. Причиной могут быть врожденные дефекты, которые проявляют себя отсрочено.
Ювенильная или юношеская глаукома. Чаще всего вторичная и является результатом приобретенных заболеваний, диагностируется у детей после 10 лет.
Чаще всего заболевания, приводящие к развитию глаукомы: близорукость, травматическое поражение глаза, патология эндокринной, нервной, сердечно-сосудистой системы и так далее.
Может передаваться наследственно, является доминантным признаком, чаще проявляется у мальчиков. Соответственно, у детей может быть, как врожденная, так и приобретенная глаукома. Так же заболевание может быть первичным, то есть развиваться непосредственно в результате патологии глаза, анатомических дефектов. А также глаукома может быть вторичной: на фоне миопии глаз, травмы, на фоне патологий других систем и органов, инфекционного поражения и так далее.
Важно! Врожденная глаукома — заболевание, которое может сделать ребенка инвалидом; чем раньше удается поставить диагноз и провести лечение, тем больше шансов получит ребенок на нормальную, здоровую и полноценную жизнь. Заметить первые признаки заболевания можно на первой неделе жизни ребенка, но иногда они проявляются только спустя несколько месяцев, а то и лет.
Заметить первые признаки заболевания можно на первой неделе жизни ребенка, но иногда они проявляются только спустя несколько месяцев, а то и лет.
Причина возникновения и развития врожденной глаукомы новорожденного кроется в патологических состояниях матери при беременности, особенно в первом ее триместре:
- Различные инфекции и заболевания, перенесенные будущей матерью: паротит (свинка), краснуха, полиомиелит, сифилис, авитаминоз витамина А;
- Пищевые или любые другие отравления;
- Влияние вредных привычек: курение, а особенно злоупотребление алкоголем;
- Гипоксия в утробе, а также патологии развития нервной, эндокринной и сердечно-сосудистой систем;
- Радиация и облучение.
При врожденной глаукоме у детей симптомы проявляются следующим образом:
- Младенец рождается с большими, «выразительными» глазами, достаточно быстро прогрессирует последующее увеличение глазного яблока;
- Происходит быстрое увеличение диаметра роговицы до 20 мм, развивается ее помутнение и отек;
- Повышается внутриглазное давление;
- Появляется замедление реакций зрачка, развивается светобоязнь и слезотечение, ребенок постоянно моргает, глаза часто краснеют.

Врожденная глаукома всегда сопровождается развитием патологических процессов и в других органах: у ребенка может проявиться микроцефалия, глухота, порок сердца. В глазах может появиться такое заболевание, как катаракта, аниридия.
Вторичная глаукома развивается в первые месяцы после рождения малыша и отличается симптомами заболевания: отсутствует светобоязнь и слезотечение, размеры и оттенок пораженного глаза практически не отличаются от здорового.
Инфантильная (по-другому юношеская или ювенильная) форма встречается у детей старше 3 лет и может развиться у человека в возрасте до 35 лет.
Причины развития данной формы заболевания делятся на три группы:
- Старение — изменяется строение радужной оболочки глаза, не изменяя лимб, склеру и оболочку; увеличивается давление жидкости в глазу и резко ухудшается зрение;
- Патология передней области глаза, которая может быть врожденной. Симптомы практически отсутствуют, диагностировать можно только при применении специального обследования;
- Глаукома возникает по причине развивающейся миопии — близорукости.

Иногда глаукома у детей может возникнуть при травме глазного яблока, после воспалительных и инфекционных заболеваний глаз.
Важно! Глазную болезнь глаукому у детей необходимо начинать лечить как можно раньше, чтобы повысить шансы ребенка на нормальное зрение в будущем, так как недуг прогрессирует очень быстро.
При многих формах детской глаукомы консервативное лечение недостаточно эффективно. Обычно его назначают в виде попытки стабилизировать внутриглазное давление перед хирургическим вмешательством.
Профилактика глаукомы у детей
Лучшим профилактическим средством считается обнаружение болезни в начале ее развития. Это позволяет избежать инвалидности. Один раз в 12 месяцев нужно организовать осмотр ребенка у офтальмолога. Если вы обнаружили у ребенка какие-либо проблемы со зрением, нужно обратиться к врачу, строго придерживаться его рекомендаций.
Ребенок или подросток должен вести здоровый образ жизни. Рекомендуется достаточная двигательная активность. Следует рационально питаться. Врачи не советуют долго находиться с наклоном головы вперед. Уменьшите количество стрессов в жизни ребенка, нормализуйте полноценный его отдых. Врачи для избежания проблем с глазами советуют не поднимать тяжести весом от 10 кг. Спать нужно минимум 8 часов в сутки, а детям дошкольного возраста – еще больше. При плохом освещении нельзя читать, седеть за компьютером и смотреть телевизор, а также работать с мелкими деталями (лепить из пластилина, вышивать и пр.). Если врач назначил ребенку очки/линзы, не стоит от них отказываться. Работая за компьютером, ребенок должен каждые 45 минут делать перерыв минимум на 15 минут. Нельзя залпом пить много жидкости, советуют в среднем употреблять 1 стакан воды каждый час. Не рекомендуется носить рубашки и тенниски с тугими воротниками, которые негативно влияют на кровообращение.
Рекомендуется достаточная двигательная активность. Следует рационально питаться. Врачи не советуют долго находиться с наклоном головы вперед. Уменьшите количество стрессов в жизни ребенка, нормализуйте полноценный его отдых. Врачи для избежания проблем с глазами советуют не поднимать тяжести весом от 10 кг. Спать нужно минимум 8 часов в сутки, а детям дошкольного возраста – еще больше. При плохом освещении нельзя читать, седеть за компьютером и смотреть телевизор, а также работать с мелкими деталями (лепить из пластилина, вышивать и пр.). Если врач назначил ребенку очки/линзы, не стоит от них отказываться. Работая за компьютером, ребенок должен каждые 45 минут делать перерыв минимум на 15 минут. Нельзя залпом пить много жидкости, советуют в среднем употреблять 1 стакан воды каждый час. Не рекомендуется носить рубашки и тенниски с тугими воротниками, которые негативно влияют на кровообращение.
Диагностика зрения при беременности
Все 9 месяцев беременности организм женщины работает за двоих, многие органы и системы вынуждены адаптироваться к новым условиям и функционировать иначе.
Получение разрешения на самостоятельные роды
Исключение осложнений в послеродовом периоде
Профилактика заболеваний сетчатки глаза
Когда назначаются самостоятельные роды
Решение о способе родоразрешения принимает врач-офтальмолог (лазерный хирург) на основании заключения о патологии глазного дна. Самостоятельные роды не разрешены в случае обнаружения изменений в сетчатке глаза (у пациентов с близорукостью, дальнозоркостью, нормальной рефракцией).
Главным критерием в решении вопроса о естественных родах является состояние глазного дна, учитываются и дистрофические изменения сетчатки (разрывы и истончения). При таких изменениях самостоятельное родоразрешение может привести к такому осложнению, как отслоение сетчатки.
Каждой женщине, планирующей беременность или ожидающей малыша, необходимо запланировать посещение врача-офтальмолога.

Прием специалиста поможет избежать ухудшения зрения у будущей мамы.
Особенно важно пройти офтальмологическое обследование тем женщинам, кто имеет хронические заболевания органа зрения, рефракционные нарушения, а также хронические заболевания сердца, сосудов, эндокринной системы, печени, почек и других органов. Даже женщинам с хорошим зрением специалисты рекомендуют во время беременности проходить диагностику зрения как минимум дважды:
- 10-14 неделя беременности;
- 34-36 неделя беременности.
Как проходит прием специалиста
Во время посещения врача-офтальмолога вам будут проведены: оценка остроты зрения, осмотр глазного дна, проверка полей зрения, измерение внутриглазного давления.
Внимание! Осмотр глазного дна проводится на расширенном зрачке при помощи щелевой лампы. Эта процедура не причинит какого-то дискомфорта, однако после нее некоторое время зрачки еще остаются расширенными, поэтому садиться за руль, читать или заниматься мелкой работой в этот период не рекомендуется. В зависимости от особенностей применявшихся глазных капель, зрение придет в норму через 2 или 3 часа. Будущую маму обычно волнует вопрос самостоятельных родов. Поэтому важно отметить, что миопия (близорукость) любых степеней без осложнений не является противопоказанием к естественным родам.
В зависимости от особенностей применявшихся глазных капель, зрение придет в норму через 2 или 3 часа. Будущую маму обычно волнует вопрос самостоятельных родов. Поэтому важно отметить, что миопия (близорукость) любых степеней без осложнений не является противопоказанием к естественным родам.
Естественные роды опасны при:
- быстром прогрессировании близорукости высокой степени;
- сочетании близорукости высокой степени и другой экстрагенитальной (например, пневмония, неопластические или опухолевые заболевания, анемия, гестанционная гипертензия, диабет, гипертиреоз, пиелонефрит и пр.), либо акушерской патологии;
- высокой степени близорукости на единственном глазу;
- выявлении во время беременности на глазном дне патологических изменений (отека зрительного нерва, кровоизлияний в сетчатку глаза, отслойки или дистрофии сетчатки глаза, изменений на ранее оперированном глазу по поводу отслойки сетчатки, глаукомы и пр.).
Когда назначаются самостоятельные роды
Решение о способе родоразрешения принимает врач-офтальмолог (лазерный хирург) на основании заключения о патологии глазного дна. Самостоятельные роды не разрешены в случае обнаружений изменений в сетчатке глаза (у пациентов с близорукостью, дальнозоркостью, нормальной рефракцией). Главным критерием в решении вопроса о естественных родах является состояние глазного дна, учитываются и степень близорукости, и дистрофические изменения сетчатки (разрывы и истончения). При таких изменениях самостоятельное родоразрешение может привести к такому осложнению, как отслоение сетчатки.
Самостоятельные роды не разрешены в случае обнаружений изменений в сетчатке глаза (у пациентов с близорукостью, дальнозоркостью, нормальной рефракцией). Главным критерием в решении вопроса о естественных родах является состояние глазного дна, учитываются и степень близорукости, и дистрофические изменения сетчатки (разрывы и истончения). При таких изменениях самостоятельное родоразрешение может привести к такому осложнению, как отслоение сетчатки.
Проведение лазеркоагуляции (укрепления сетчатки глаза)
Если в процессе офтальмологического обследования будущей мамы выявлены разрывы и истончения сетчатки, врач-офтальмолог (лазерный хирург) рекомендует профилактическое лазерное укрепление сетчатки (ППЛК). Процедура назначается на сроке 12 — 32 недели, в это время она абсолютно безопасна для плода.
Лазерное лечение направлено на укрепление сетчатки, предотвращение ее отслойки в родах, а также дает возможность рожать естественным образом. ППЛК проводится под капельной анестезией и на расширенном зрачке. Спустя 14 дней после лазерного лечения пациентка проходит осмотр врача, который выносит решение о способе родоразрешения.
ППЛК проводится под капельной анестезией и на расширенном зрачке. Спустя 14 дней после лазерного лечения пациентка проходит осмотр врача, который выносит решение о способе родоразрешения.
Тем не менее, решение о тактике родов зависит от многих факторов: срока давности хирургического вмешательства, изменений глазного дна, возраста женщины, количества удачных родов. Решение должно быть принято совместно с гинекологом.
Профилактика осложнений
Итак, для сохранения здоровья, пациентка проходит консультацию врача-офтальмолога спустя несколько месяцев после проведения родов. Сроки динамического наблюдения определяются врачом после осмотра.
Важно! Важно проходить диагностику зрения своевременно, чтобы при выявлении патологии вы успели пройти лечение и получить разрешение на самостоятельные роды. Ведь сделанная вовремя несложная процедура по укреплению сетчатки глаза способна предотвратить проведение кесарева сечения.
ЗАПИСАТЬСЯ НА ПРИЕМ
Все отзывыВиктория
Первый раз была на приёме у Ларисы Олеговны еще в Москве.
 Очень понравилось. Всё объяснила, сделала назначение. Очень благодарна ей.
Очень понравилось. Всё объяснила, сделала назначение. Очень благодарна ей.Беседина Валентина Стефановна
Спасибо доктору и медицинским сестрам за прекрасное обслуживание . Добрые, уважительные люди!
Богдасарова Н.Б.
Хочу поблагодарить Чудовского А. Д. за высокий профессионализм, внимательный осмотр. А также медсестру Погосян Элину. Спасибо огромное, очень довольна обслуживанием.
Дошлакиева Р.А.
Я, Дошлакиева Р.А., пациентка, хочу выразить огромную благодарность Герговой Рузане за ее чуткое внимание к больным и терпение. Спасибо вам, а ей особенно. Поздравляем с наступающим Новым годом, пусть у Клинеки «Ленар» побольше таких будет, как Рузана специалистов. Удачи всем!
Воронина
Огромное вам спасибо за ваши золотые руки. Мы старые люди, нам хочется чтобы с нами общались повежливее.
 Очень были добрыми и вежливыми дай Бог Вам всем доброе доброе здоровье. Мы Вас очень уважаем. Да хранит Вас Всех Господь.
Очень были добрыми и вежливыми дай Бог Вам всем доброе доброе здоровье. Мы Вас очень уважаем. Да хранит Вас Всех Господь.Анна Федоровна
Прошла диагностику, проводила ее Погосян Элина. Это настоящий профессионал своего дела, внимательная, отзывчивая, сразу видно, что очень любит свое дело и пациентов! Спасибо!
Татьяна Олейникова
Большое спасибо всему коллективу клиники «ЛЕНАР» за чуткое, внимательное отношение у нам, больным. Низкий поклон всему коллективу!
Прием ведут
Жгенти
Ирина Николаевна
Врач-офтальмолог, лазерный хирург
- кандидат медицинских наук
- врач высшей категории
- стаж работы — 31 год
Ростов-на-Дону
Коркмазова
Динара Аслановна
Врач-офтальмолог,
рефракционный хирург
- врач I категории
- заместитель главного врача по клинико-экспертной работе
- стаж работы — 10 лет
Нальчик
Пятигорск
Назрань
Едзоева
Виктория Асланбековна
Врач-офтальмолог, лазерный хирург
- врач I категории
- заведующая взрослым лечебно-диагностическим, детским лечебно-диагностическим и консультативно-поликлиническим отделениями
- стаж работы — 12 лет
Пятигорск
Хасауова
Лейля Мухарбиевна
Врач-офтальмолог
- кандидат медицинских наук
- врач высшей категории
- заместитель главного врача по лечебной части
- стаж работы — 22 года
Нальчик
Часто задаваемые вопросы
Почему нужно проходить диагностику при беременности?
Под влиянием различных факторов в период беременности может произойти дегенерация или дистрофические изменения сетчатой оболочки глаза, что при естественных родовых нагрузках может привести к серьезным проблемам со зрением.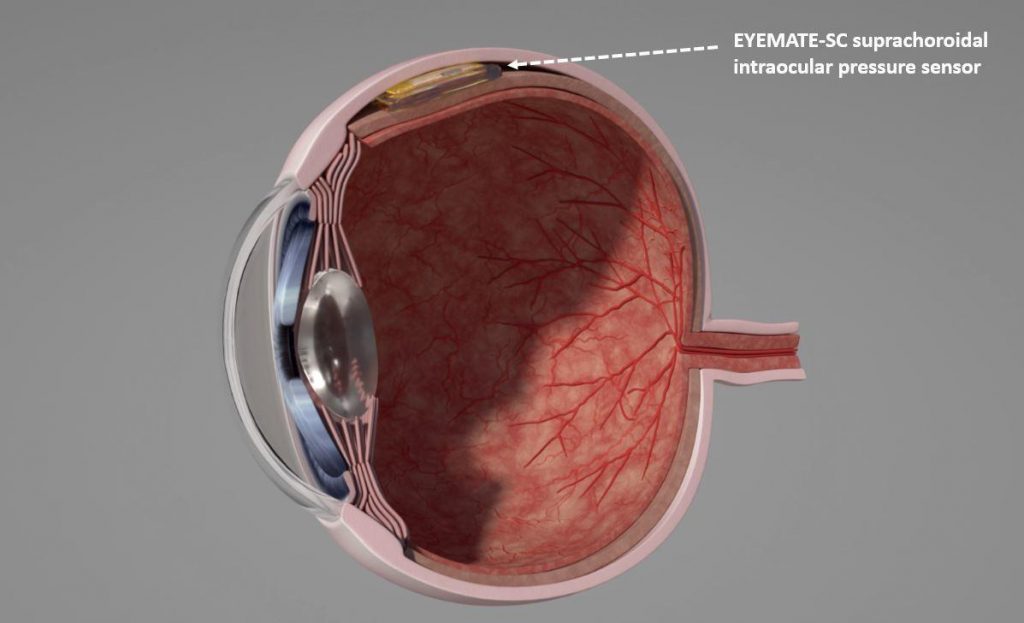
ИМЕЮТСЯ ПРОТИВОПОКАЗАНИЯ. НЕОБХОДИМА КОНСУЛЬТАЦИЯ СПЕЦИАЛИСТА.
Будь в курсе
Подпишись на наши обновления, чтобы узнавать о действующих акциях и последних новостях из жизни клиники «ЛЕНАР»! Нажимая на кнопку «Подписаться» вы соглашаетесь на обработку персональных данных, а также c условиями подписки.
Следуй за нами в социальных сетях!
Не нашли на сайте нужную информацию? Звоните в нашу бесплатную горячую линию!
8 800 500 70 27
Лекарства от глаукомы при беременности — PMC
Оман J Офтальмол. 2018 сен-декабрь; 11(3): 195–199.
doi: 10.4103/ojo.OJO_212_2017
Информация об авторе Информация об авторских правах и лицензии Отказ от ответственности
Глаукома — это хроническое прогрессирующее заболевание зрительного нерва, которое относительно редко встречается в детородном возрасте; однако его управление представляет собой реальную проблему. Хотя внутриглазное давление снижается во время беременности, многие пациенты с глаукомой продолжают нуждаться в лечении.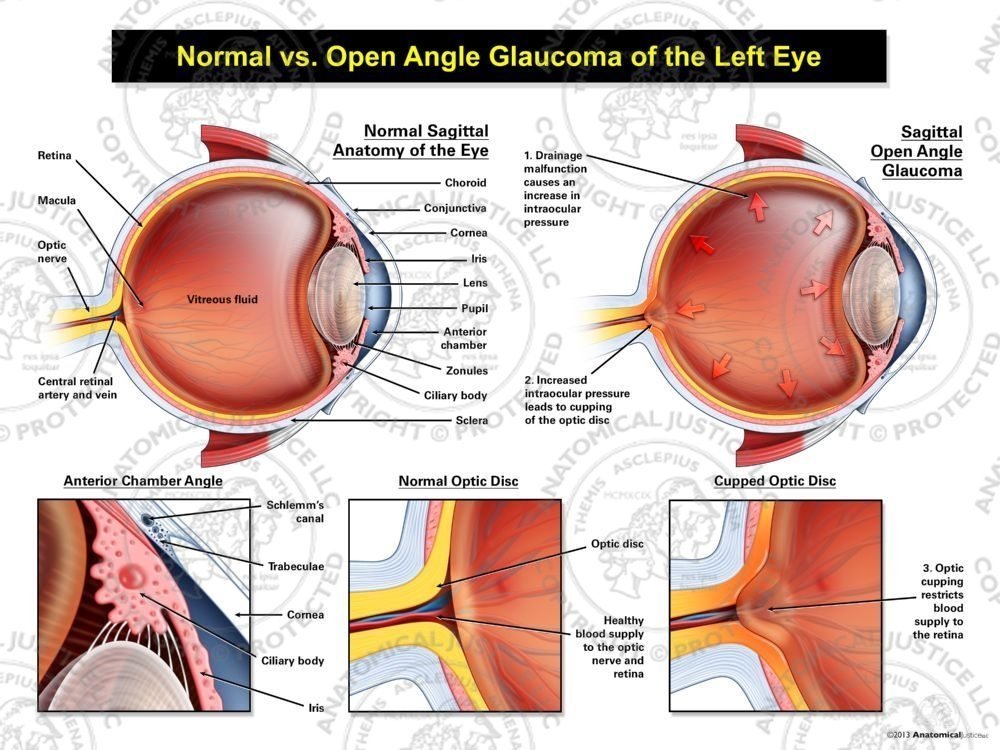 Помимо побочного действия противоглаукомных препаратов на мать, необходимо учитывать возможное побочное действие препаратов на плод. Единственным лекарством против глаукомы, отнесенным к категории B, является бримонидин, а все остальные относятся к категории C. Большинство данных о лекарствах от глаукомы при беременности получены из отчетов об отдельных случаях или исследований на животных с ограничениями, которые они накладывают. Теоретически лекарства от глаукомы могут повредить плод; однако они могут не иметь существенного клинического значения при рутинных дозировках, и никакие местные антиглаукомные средства не имеют убедительных доказательств безопасности для плода, основанных на исследованиях на людях. При обсуждении возможных вариантов лечения глаукомы с беременной пациенткой важно подчеркнуть отсутствие окончательных исследований, и пациентка может быть вовлечена в процесс принятия терапевтических решений.
Помимо побочного действия противоглаукомных препаратов на мать, необходимо учитывать возможное побочное действие препаратов на плод. Единственным лекарством против глаукомы, отнесенным к категории B, является бримонидин, а все остальные относятся к категории C. Большинство данных о лекарствах от глаукомы при беременности получены из отчетов об отдельных случаях или исследований на животных с ограничениями, которые они накладывают. Теоретически лекарства от глаукомы могут повредить плод; однако они могут не иметь существенного клинического значения при рутинных дозировках, и никакие местные антиглаукомные средства не имеют убедительных доказательств безопасности для плода, основанных на исследованиях на людях. При обсуждении возможных вариантов лечения глаукомы с беременной пациенткой важно подчеркнуть отсутствие окончательных исследований, и пациентка может быть вовлечена в процесс принятия терапевтических решений.
Ключевые слова: Агонисты альфа-2, бета-блокаторы, ингибиторы карбоангидразы, глаукома, препараты против глаукомы, беременность, простагландины
Совпадение глаукомы и беременности считается редким; однако нам необходимо улучшить наше понимание лечения глаукомы у этой очень сложной группы пациентов. В настоящее время для женщин стало обычным делом создавать семьи в более позднем возрасте; таким образом, частота глаукомы во время беременности, по-видимому, возрастает. Ведение беременной женщины с глаукомой требует баланса между риском лечения для плода и матери. Внутриглазное давление (ВГД) обычно снижается во время беременности; тем не менее, многие пациенты с глаукомой по-прежнему нуждаются в медикаментозном лечении глаукомы, а у некоторых может наблюдаться повышение ВГД во время беременности, в то время как до зачатия у них была контролируемая глаукома. типах глаукомы ВГД оставалось контролируемым без каких-либо изменений поля зрения на 16 глазах. На пяти глазах наблюдалось прогрессирование в поле зрения при стабильном или повышенном уровне ВГД, на пяти глазах уровень ВГД повысился; однако изменений в поле зрения не было. Данные двух пациентов были неубедительными. Лекарства от глаукомы использовались для контроля ВГД у 13 из 15 пациентов.[3] У 28-летней женщины было контролируемое ВГД с помощью латанопроста в течение 5 лет, но после зачатия ВГД увеличилось до 30 мм рт.
В настоящее время для женщин стало обычным делом создавать семьи в более позднем возрасте; таким образом, частота глаукомы во время беременности, по-видимому, возрастает. Ведение беременной женщины с глаукомой требует баланса между риском лечения для плода и матери. Внутриглазное давление (ВГД) обычно снижается во время беременности; тем не менее, многие пациенты с глаукомой по-прежнему нуждаются в медикаментозном лечении глаукомы, а у некоторых может наблюдаться повышение ВГД во время беременности, в то время как до зачатия у них была контролируемая глаукома. типах глаукомы ВГД оставалось контролируемым без каких-либо изменений поля зрения на 16 глазах. На пяти глазах наблюдалось прогрессирование в поле зрения при стабильном или повышенном уровне ВГД, на пяти глазах уровень ВГД повысился; однако изменений в поле зрения не было. Данные двух пациентов были неубедительными. Лекарства от глаукомы использовались для контроля ВГД у 13 из 15 пациентов.[3] У 28-летней женщины было контролируемое ВГД с помощью латанопроста в течение 5 лет, но после зачатия ВГД увеличилось до 30 мм рт. ст. даже после добавления тимолола и дорзоламида и лазерной трабекулопластики [4]. Существует общий уровень неопределенности в отношении медикаментозного лечения среди офтальмологов при ведении беременной пациентки с глаукомой.[5] При опросе офтальмологов в Великобритании 26% ранее лечили беременных женщин с глаукомой. Интересно, что 31% не знали, как лечить беременную женщину с неконтролируемым ВГД; 40% использовали местное лечение. Из тех, кто назначал лечение, 45% сначала использовали местные бета-блокаторы, 33% сначала использовали местные аналоги простагландина, а 22% сначала использовали другие лекарства. В этом обзоре побочные эффекты и меры предосторожности при приеме лекарств от глаукомы во время беременности обсуждаются на основе информации, полученной в результате поиска литературы в базе данных PubMed, включая все соответствующие исследования.
ст. даже после добавления тимолола и дорзоламида и лазерной трабекулопластики [4]. Существует общий уровень неопределенности в отношении медикаментозного лечения среди офтальмологов при ведении беременной пациентки с глаукомой.[5] При опросе офтальмологов в Великобритании 26% ранее лечили беременных женщин с глаукомой. Интересно, что 31% не знали, как лечить беременную женщину с неконтролируемым ВГД; 40% использовали местное лечение. Из тех, кто назначал лечение, 45% сначала использовали местные бета-блокаторы, 33% сначала использовали местные аналоги простагландина, а 22% сначала использовали другие лекарства. В этом обзоре побочные эффекты и меры предосторожности при приеме лекарств от глаукомы во время беременности обсуждаются на основе информации, полученной в результате поиска литературы в базе данных PubMed, включая все соответствующие исследования.
Классификация безопасности лекарственных средств для беременных Управления по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) включает:
Категория A: Безопасность, установленная с помощью исследований на людях
Категория B: Предполагаемая безопасность, основанная на исследованиях на животных, но не на людях
Категория C: Неопределенная безопасность, без исследований на людях и животных, показывающих неблагоприятное воздействие
Категория D: Небезопасно; доказательства риска, который в определенных клинических обстоятельствах может быть оправданным
Категория X: Определенно небезопасно, риск использования превышает любую возможную пользу.

В целом, <20% всех препаратов, классифицированных FDA, попадают в категории A или B. Большинство местных антиглаукомных препаратов относятся к категории C, и ни один из них не относится к категории A или X.[6] Категория A означает, что контролируемые исследования с участием женщин не выявили риска для плода, а лекарства имеют низкий риск причинения вреда плоду, в то время как категория X определенно небезопасна. Единственными лекарствами от глаукомы, относящимися к категории B, являются бримонидин и дипивефрин. Предполагаемая безопасность бримонидина и дипивефрина основана только на исследованиях на животных.[6] Окклюзия носослезных путей, закрытие век или промокание избыточных капель во время введения, а также своевременное затыкание следует обсудить с беременными женщинами, получающими местные антиглаукомные препараты.[7] Используя точечную окклюзию после применения лекарства, количество лекарства, которое всасывается в кровь, может быть уменьшено до двух третей. Для безопасности плода следует использовать наименьшее количество капель, наименьшую концентрацию и наименьшее количество раз в день.
Для безопасности плода следует использовать наименьшее количество капель, наименьшую концентрацию и наименьшее количество раз в день.
Тимолол, картеолол, левобунолол и метипранолол являются неселективными бета-блокаторами, а бетаксолол является бета-1-блокатором. В некоторых сообщениях утверждается, что, хотя бета-блокаторы обладают тератогенным действием, акушерам удобнее всего использовать их перорально для контроля гипертонии во время беременности.[8] Если пациенту дают тимолол 0,5% 1 раз в день и вся капля всасывается, общая суточная системная экспозиция составит приблизительно 300 мкг. Таким образом, системная нагрузка при применении 0,5% тимолола на оба глаза один раз в день составляет <3% от пероральной дозы 20 мг тимолола [9].] В одном сообщении описаны аритмия и брадикардия у плода беременной пациентки с глаукомой, принимавшей тимолол. У ребенка развилась послеродовая аритмия, и авторы предположили, что причиной дефекта сердечной проводимости был тимолол.[10] Тем не менее, в других сообщениях не было выявлено особых проблем у новорожденных женщин, получавших местно тимолол. при рождении, гипогликемия и гипербилирубинемия.[12]
при рождении, гипогликемия и гипербилирубинемия.[12]
В ходе популяционного исследования 244 беременных женщины, получавших местные антиглаукомные препараты, сравнивались с 1952 беременными женщинами, сопоставимыми по возрасту, году родов, гипертензии у матери и гестационному диабету. Большинству беременных (77,5%) назначались бета-адреноблокаторы. Не было существенной разницы в риске рождения детей с низкой массой тела при рождении между матерями, которым были назначены бета-блокаторы, и контрольной группой; однако риск рождения ребенка с низкой массой тела при рождении был выше у матерей, которым назначались местные антиглаукомные препараты, отличные от бета-блокаторов. Авторы пришли к выводу, что бета-блокаторы могут быть препаратами первой линии при рассмотрении вопроса о медикаментозном лечении глаукомы у беременных женщин.[13] Что касается имеющихся данных, то нет четких доказательств ограничения использования бета-блокаторов во время беременности. Имеются сообщения о респираторных проблемах у новорожденных, получавших системные бета-блокаторы перед родами.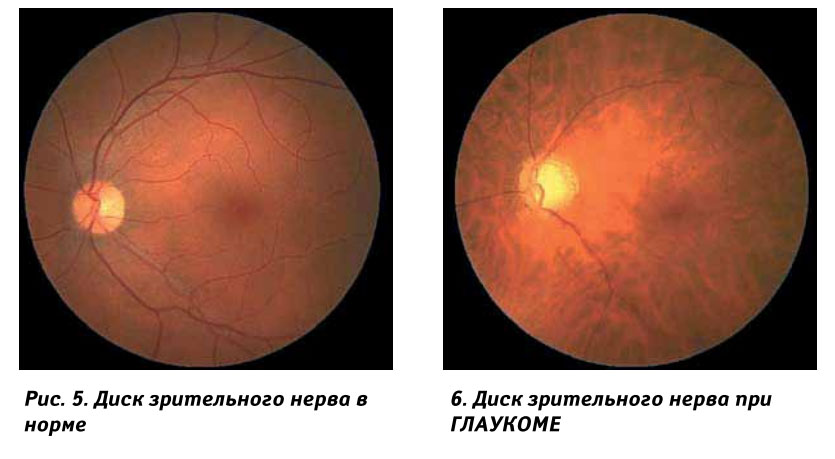 Таким образом, новорожденные, подвергшиеся воздействию тимолола до рождения, должны находиться под пристальным наблюдением в течение первых 2 дней после рождения на предмет брадикардии и других симптомов [14,15]. Прием этих препаратов следует прекратить за 2–3 дня до родов, чтобы избежать бета-блокады у младенца. [16]
Таким образом, новорожденные, подвергшиеся воздействию тимолола до рождения, должны находиться под пристальным наблюдением в течение первых 2 дней после рождения на предмет брадикардии и других симптомов [14,15]. Прием этих препаратов следует прекратить за 2–3 дня до родов, чтобы избежать бета-блокады у младенца. [16]
Холинергические препараты действуют либо непосредственно, стимулируя холинергические рецепторы (пилокарпин и карбахол), либо опосредованно, ингибируя фермент холинэстеразу (эхотиофат и демекарий). Эти лекарства отнесены FDA к группе C для использования во время беременности. Хотя пилокарпин и карбахол продемонстрировали тератогенное и неблагоприятное воздействие на плод у животных [17], крупное совместное исследование по изучению применения системных холинергических препаратов не выявило связи между их применением в течение первых 4 месяцев беременности и врожденными аномалиями [18]. Холинергические агенты были связаны с гипертермией новорожденных, беспокойством, судорогами и потливостью при введении женщинам в ближайшем будущем и имитировали признаки менингита [19]. ,20] Что касается местных и системных побочных эффектов этого класса противоглаукомных препаратов и появления более сильнодействующих препаратов с меньшим количеством местных и системных побочных эффектов, это не лучший выбор для лечения беременных с глаукомой.
,20] Что касается местных и системных побочных эффектов этого класса противоглаукомных препаратов и появления более сильнодействующих препаратов с меньшим количеством местных и системных побочных эффектов, это не лучший выбор для лечения беременных с глаукомой.
Местное применение
Дорзоламид и бринзоламид относятся к категории C для применения при беременности. Хотя есть сообщения о связи между применением пероральных ингибиторов карбоангидразы, крестцово-копчиковой тератомой и транзиторным ацидозом почечных канальцев у новорожденных [21, 22], о побочных эффектах, связанных с применением местных ингибиторов карбоангидразы во время беременности, не сообщалось. В единственном опубликованном исследовании с участием пяти беременных пациенток, получавших дорзоламид, у новорожденных не наблюдалось проблем в течение 2 лет после рождения [7]. В ходе исследования у двух из семи матерей, принимавших местные ингибиторы карбоангидразы (28,6%), вес новорожденных был ниже, чем в контрольной группе (6,2%). [13] Однако у девяти пациенток, получавших местные ингибиторы карбоангидразы, побочных эффектов на плод не наблюдалось [3,7] 9.0003
[13] Однако у девяти пациенток, получавших местные ингибиторы карбоангидразы, побочных эффектов на плод не наблюдалось [3,7] 9.0003
Пероральный
Доступными пероральными формами ингибиторов карбоангидразы являются ацетазоламид и метазоламид. Оба относятся к категории C для использования во время беременности. Хотя есть сообщения, указывающие на связь между применением пероральных ингибиторов карбоангидразы, крестцово-копчиковой тератомой и транзиторным ацидозом почечных канальцев у новорожденных [21, 22], не было обнаружено никаких доказательств связи с большими или малыми аномалиями плода у новорожденных в возрасте 1024 лет. женщины, подвергшиеся воздействию ацетазоламида в любой период беременности.[23] В исследовании на крысах введение ацетазоламида в >20 раз по сравнению с обычной терапевтической дозой ассоциировалось с деформациями передних конечностей. Необъяснимым аспектом этой работы была односторонность (правая сторона) поражения в 95% участников. Только у 5% были двусторонние поражения, но никогда не было только левостороннего поражения. [24] В исследовании с участием 12 беременных, получавших ацетазоламид по поводу псевдоопухоли головного мозга, неблагоприятных исходов беременности не наблюдалось.[25] Хотя многие предлагают избегать применения ацетазоламида во время беременности, особенно в первом триместре, существует мало клинических данных, подтверждающих эту рекомендацию, и она может иметь скорее судебно-медицинское, чем медицинское обоснование. Эллисон и Марен продемонстрировали признаки истощения запасов калия у крыс, получавших ацетазоламид, и пришли к выводу, что заместительная терапия калием приводила к частичной или полной защите развивающихся эмбрионов.[26] Понятно, что результаты исследований тератогенеза на лабораторных животных нельзя экстраполировать на человека, но для предотвращения возможной гипокалиемии плода или новорожденного, ацидоза и риска тератогенеза рекомендуется контролировать уровень калия в плазме при изменении диеты у беременных на этих животных. агенты. Если клиническая ситуация оправдывает использование ацетазоламида, возможно, его можно будет назначать с соответствующего информированного согласия [25].
[24] В исследовании с участием 12 беременных, получавших ацетазоламид по поводу псевдоопухоли головного мозга, неблагоприятных исходов беременности не наблюдалось.[25] Хотя многие предлагают избегать применения ацетазоламида во время беременности, особенно в первом триместре, существует мало клинических данных, подтверждающих эту рекомендацию, и она может иметь скорее судебно-медицинское, чем медицинское обоснование. Эллисон и Марен продемонстрировали признаки истощения запасов калия у крыс, получавших ацетазоламид, и пришли к выводу, что заместительная терапия калием приводила к частичной или полной защите развивающихся эмбрионов.[26] Понятно, что результаты исследований тератогенеза на лабораторных животных нельзя экстраполировать на человека, но для предотвращения возможной гипокалиемии плода или новорожденного, ацидоза и риска тератогенеза рекомендуется контролировать уровень калия в плазме при изменении диеты у беременных на этих животных. агенты. Если клиническая ситуация оправдывает использование ацетазоламида, возможно, его можно будет назначать с соответствующего информированного согласия [25].
Доступны следующие аналоги простагландинов: латанопрост, травопрост, биматопрост и унопростон. Аналоги простагландинов относятся к категории С при беременности. Ни в одном из клинических испытаний не было зарегистрировано системных побочных эффектов, связанных с топическими простагландинами. Это может быть связано с коротким периодом полувыведения, составляющим 17 минут [9, 27, 28, 29]. Производитель не сообщал о каких-либо неблагоприятных эффектах на эмбрион при воздействии до 15 раз превышающей дозу для человека [30]. Из 10 беременных, получавших латанопрост в I триместре, у одной пациентки произошел выкидыш. Пациентка была 46-летней первобеременной женщиной с повышенным репродуктивным риском, связанным с ее преклонным возрастом. Все остальные девять пациенток имели нормальное течение беременности и исход без пороков развития новорожденных.[31] Теоретически простагландины повышают тонус матки и могут привести к преждевременным родам. Интересно, что доза, используемая для стимуляции аборта, будет эквивалентна 400 мл глазной формы латанопроста [9]. ] В настоящее время ведутся споры относительно применения этой группы препаратов при беременности. Утверждается, что глазные аналоги простагландинов содержат недостаточно активных ингредиентов, чтобы вызвать неблагоприятное воздействие на плод.[32] Однако некоторые считают, что его использование противопоказано беременным женщинам. [33,34] Нет убедительных доказательств отказа от этой группы препаратов у беременных с глаукомой. Поскольку простагландины повышают тонус матки и могут вызвать снижение перфузии плода, рекомендуется соблюдать осторожность.
] В настоящее время ведутся споры относительно применения этой группы препаратов при беременности. Утверждается, что глазные аналоги простагландинов содержат недостаточно активных ингредиентов, чтобы вызвать неблагоприятное воздействие на плод.[32] Однако некоторые считают, что его использование противопоказано беременным женщинам. [33,34] Нет убедительных доказательств отказа от этой группы препаратов у беременных с глаукомой. Поскольку простагландины повышают тонус матки и могут вызвать снижение перфузии плода, рекомендуется соблюдать осторожность.
Осмотические агенты включают маннит, мочевину, изосорбид и глицерин. Изосорбид для перорального применения больше не доступен. Маннитол и глицерин отнесены к категории С при беременности. Не сообщалось об исследованиях этих агентов на животных, и нет исследований на беременность у человека.[9] Однако среди медикаментозных методов стимуляции второго триместра аборт — внутриамниотическое введение маннитола и мочевины.[35] Маннитол и глицерин можно использовать во время беременности, когда преимущества перевешивают риски.
Доступные клинически агонисты альфа-2 включают клонидин, апраклонидин и бримонидин.[9] Бримонидин относится к категории B для использования во время беременности. Однако в исследовании 20 беременных пациенток с глаукомой, получавших бримонидин, у двоих (10%) были дети с низкой массой тела при рождении.[13] Существуют предупреждения об использовании бримонидина у младенцев и детей младшего возраста, поскольку он оказывает некоторые эффекты на центральную нервную систему, такие как апноэ и гипотензия.[20] Таким образом, если этот препарат используется во время беременности, мудрым решением будет прекратить прием препарата за несколько дней до родов, поскольку он проникает через плаценту и гематоэнцефалический барьер и может привести к угнетению центральной нервной системы новорожденного.
Наиболее часто используемым консервантом в рецептурах глазных капель является хлорид бензалкония. Двумя другими консервантами, используемыми в препаратах от глаукомы, являются SofZia и Purite. SofZia — это ионный буфер, содержащий борат, сорбит, пропиленгликоль и цинк, которые после нанесения распадаются на безвредные компоненты. Он используется в качестве консерванта в Travatan-Z. Purite, стабилизированный оксихлоркомплекс, представляет собой консервант окислительного типа, используемый в Alphagan-p, и разрушается при контакте с воздухом. Хотя пурит является химическим окислителем, in vivo или in vitro свидетельствуют о его мутагенности или канцерогенности. [36,37] Бензалкония хлорид вызывает бронхоконстрикцию за счет комбинации активации тучных клеток и стимуляции нервных путей, особенно у пациентов, которые получают более одного препарата против глаукомы. 38] Для пациентов, которым требуется более одного местного антиглаукомного средства, препараты с фиксированной комбинацией предлагают меньшее воздействие консервантов. Значения концентрации тимолола в плазме были на 20% ниже в группе лечения фиксированной комбинацией тимолола/бримонидина, чем в группе только тимолола.
SofZia — это ионный буфер, содержащий борат, сорбит, пропиленгликоль и цинк, которые после нанесения распадаются на безвредные компоненты. Он используется в качестве консерванта в Travatan-Z. Purite, стабилизированный оксихлоркомплекс, представляет собой консервант окислительного типа, используемый в Alphagan-p, и разрушается при контакте с воздухом. Хотя пурит является химическим окислителем, in vivo или in vitro свидетельствуют о его мутагенности или канцерогенности. [36,37] Бензалкония хлорид вызывает бронхоконстрикцию за счет комбинации активации тучных клеток и стимуляции нервных путей, особенно у пациентов, которые получают более одного препарата против глаукомы. 38] Для пациентов, которым требуется более одного местного антиглаукомного средства, препараты с фиксированной комбинацией предлагают меньшее воздействие консервантов. Значения концентрации тимолола в плазме были на 20% ниже в группе лечения фиксированной комбинацией тимолола/бримонидина, чем в группе только тимолола. Это открытие было связано с более медленным всасыванием тимолола из-за разницы в концентрации хлорида бензалкония [39].] Фиксированная комбинация тимолола/бримонидина может быть подходящей схемой лечения для пациентов, которым необходимо использовать два препарата, включая бета-блокатор. Не установлено, может ли бензалкония хлорид влиять на созревание легких плода. В исследовании на крысах после воздействия хлорида бензалкония наблюдалось дозозависимое увеличение резорбции плода, гибель и уменьшение размера и веса приплода. Тем не менее, это не было связано с какими-либо заметными висцеральными пороками развития, хотя небольшие дефекты грудины возникали у плодов, подвергшихся однократной дозе 100 и 200 мг/кг [40]. Концентрация BAK в глазных каплях против глаукомы ничтожно мала по сравнению с вышеприведенным исследованием. Доступны формы следующих антиглаукомных препаратов без консервантов, которые, по-видимому, являются лучшим выбором для беременных пациенток по сравнению с соединениями, содержащими консерванты: тимолол, дорзоламид-тимолол и тафлупрост.
Это открытие было связано с более медленным всасыванием тимолола из-за разницы в концентрации хлорида бензалкония [39].] Фиксированная комбинация тимолола/бримонидина может быть подходящей схемой лечения для пациентов, которым необходимо использовать два препарата, включая бета-блокатор. Не установлено, может ли бензалкония хлорид влиять на созревание легких плода. В исследовании на крысах после воздействия хлорида бензалкония наблюдалось дозозависимое увеличение резорбции плода, гибель и уменьшение размера и веса приплода. Тем не менее, это не было связано с какими-либо заметными висцеральными пороками развития, хотя небольшие дефекты грудины возникали у плодов, подвергшихся однократной дозе 100 и 200 мг/кг [40]. Концентрация BAK в глазных каплях против глаукомы ничтожно мала по сравнению с вышеприведенным исследованием. Доступны формы следующих антиглаукомных препаратов без консервантов, которые, по-видимому, являются лучшим выбором для беременных пациенток по сравнению с соединениями, содержащими консерванты: тимолол, дорзоламид-тимолол и тафлупрост.
Самый высокий риск повреждения плода приходится на первый триместр, и, поскольку женщины часто в течение нескольких недель не знают, беременны они или нет, крайне важно информировать пациенток с глаукомой о незапланированной беременности. У женщин детородного возраста с глаукомой, по возможности, план лечения должен быть обсужден до наступления беременности, что позволяет обсудить варианты лечения и возможные риски. С помощью этой стратегии можно предотвратить неблагоприятные эффекты лекарств в период органогенеза. Кроме того, до начала беременности можно изучить или применить альтернативные эффективные методы снижения ВГД, включая хирургическое вмешательство.
Каждая женщина в общей популяции имеет 3–5%-ный риск рождения ребенка с врожденным дефектом или когнитивными нарушениями. Воздействие наркотиков и химических веществ во время беременности составляет лишь около 1% врожденных пороков развития.[41] Все больные глаукомой всю жизнь боятся слепоты, а когда женщина беременеет, к стрессам матери добавляется проблема со здоровьем ребенка.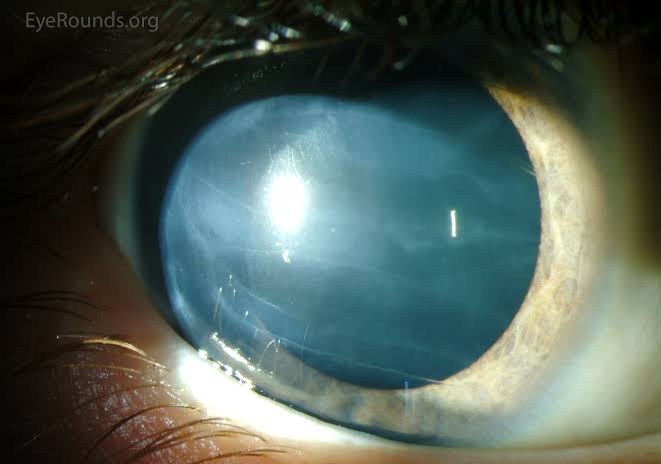 Популяционная выборка матерей показала, что материнский жизненный стресс во время беременности может быть распространенным фактором риска ухудшения здоровья ребенка.[42] Начало медикаментозной терапии должно включать обсуждение с пациенткой преимуществ, рисков и более распространенных потенциальных побочных эффектов терапии, особенно в течение первых 12 недель беременности (органогенез) [43]. Последний месяц беременности также важен, потому что лекарства проходят через плаценту и попадают в кровоток плода и могут повлиять на функции сердечной, дыхательной и нервной систем новорожденного. Ни один из местных антиглаукомных препаратов не имеет убедительных доказательств безопасности для плода, основанных на исследованиях на людях.[1] Большинство доказательств получено из отчетов об отдельных случаях или исследований на животных с ограничениями, которые они налагают. При обсуждении возможных вариантов лечения глаукомы у беременных важно подчеркнуть отсутствие окончательных исследований. Пациент может быть вовлечен в процесс принятия терапевтических решений.
Популяционная выборка матерей показала, что материнский жизненный стресс во время беременности может быть распространенным фактором риска ухудшения здоровья ребенка.[42] Начало медикаментозной терапии должно включать обсуждение с пациенткой преимуществ, рисков и более распространенных потенциальных побочных эффектов терапии, особенно в течение первых 12 недель беременности (органогенез) [43]. Последний месяц беременности также важен, потому что лекарства проходят через плаценту и попадают в кровоток плода и могут повлиять на функции сердечной, дыхательной и нервной систем новорожденного. Ни один из местных антиглаукомных препаратов не имеет убедительных доказательств безопасности для плода, основанных на исследованиях на людях.[1] Большинство доказательств получено из отчетов об отдельных случаях или исследований на животных с ограничениями, которые они налагают. При обсуждении возможных вариантов лечения глаукомы у беременных важно подчеркнуть отсутствие окончательных исследований. Пациент может быть вовлечен в процесс принятия терапевтических решений.
Финансовая поддержка и спонсорство
Нет.
Конфликт интересов
Конфликт интересов отсутствует.
1. Разегинеджад М.Р., Таня Тай Т.Ю., Фудемберг С.Дж., Кац Л.Дж. Беременность и глаукома. Сурв Офтальмол. 2011;56:324–35. [PubMed] [Google Scholar]
2. Разегинеджад М.Р., Масумпур М., Эгбал М.Х., Майерс Дж.С., Мостер М.Р. Хирургия глаукомы во время беременности: серия случаев и обзор литературы. Иран J Med Sci. 2016;41:437–45. [Бесплатная статья PMC] [PubMed] [Google Scholar]
3. Brauner SC, Chen TC, Hutchinson BT, Chang MA, Pasquale LR, Grosskreutz CL, et al. Течение глаукомы во время беременности: серия ретроспективных наблюдений. Арка Офтальмол. 2006; 124:1089–94. [PubMed] [Google Scholar]
4. Пикеринг Т. Лечение глаукомы во время беременности. Глаукома сегодня. 2009 март;: 18–20. [Google Scholar]
5. Vaideanu D, Fraser S. Ведение глаукомы во время беременности: Анкетный опрос. Глаз (Лондон) 2007; 21: 341–3. [PubMed] [Google Scholar]
6. Классификация лекарств FDA по тератогенному риску. комитет по связям с общественностью тератологического общества. Тератология. 1994;49:446–7. [PubMed] [Google Scholar]
Классификация лекарств FDA по тератогенному риску. комитет по связям с общественностью тератологического общества. Тератология. 1994;49:446–7. [PubMed] [Google Scholar]
7. Разегинеджад М.Р., Новруззаде М.Х. Воздействие антиглаукомных препаратов во время беременности: обсервационное исследование и обзор литературы. Clin Exp Optom. 2010;93:458–65. [PubMed] [Google Scholar]
8. Уайд-Свенсон Д., Монталь С., Ингемарссон И. Как шведские акушеры справляются с гипертензией во время беременности. Анкетное исследование. Acta Obstet Gynecol Scand. 1994; 73: 619–24. [PubMed] [Google Scholar]
9. Нетланд П. Медицинская терапия глаукомы: принципы и управление. Нью-Йорк: Издательство Оксфордского университета; 2008. С. 31–155. [Академия Google]
10. Вагенвоорт А.М., ван Вугт Дж.М., Соботка М., ван Гейн Х.П. Местная терапия тимололом при беременности: безопасно ли это для плода? Тератология. 1998; 58: 258–62. [PubMed] [Google Scholar]
11. Блаул Г. Местные бета-адреноблокаторы при беременности. Клин Monbl Augenheilkd. 1981; 179: 128–9. [PubMed] [Google Scholar]
Клин Monbl Augenheilkd. 1981; 179: 128–9. [PubMed] [Google Scholar]
12. Рубин ПК. Современные представления: Бета-блокаторы при беременности. N Engl J Med. 1981; 305: 1323–6. [PubMed] [Google Scholar]
13. Ho JD, Hu CC, Lin HC. Препараты против глаукомы во время беременности и риск низкого веса при рождении: популяционное исследование. Бр Дж Офтальмол. 2009 г.;93:1283–6. [PubMed] [Google Scholar]
14. Олсон Р.Дж., Бромберг Б.Б., Циммерман Т.Дж. Приступы апноэ, связанные с терапией тимололом у новорожденных. Am J Офтальмол. 1979; 88: 120–2. [PubMed] [Google Scholar]
15. Williams T, Ginther WH. Опасность офтальмологического тимолола. N Engl J Med. 1982; 306: 1485–6. [PubMed] [Google Scholar]
16. Шарма С., Вунтакал Р., Ананд А., Шарма Т.К., Дауни Г. Беременность и глаза. Акушерство Гинекол. 2006; 8: 141–6. [Google Scholar]
17. Уолтер Л. Тератогенная активность пилокарпина, пилокарпидина и их изомеров с особым акцентом на важность стерической конфигурации.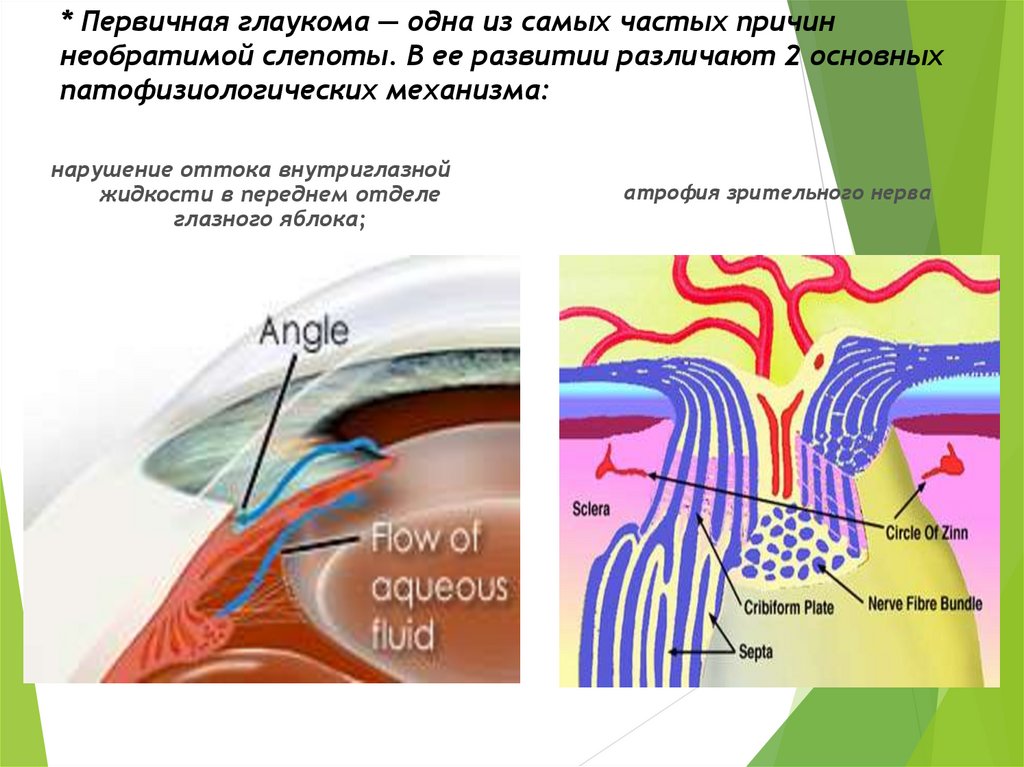 Джей Эксп Зоол. 1956;132:39–50. [Google Scholar]
Джей Эксп Зоол. 1956;132:39–50. [Google Scholar]
18. Кунер К.С., Циммерман Т.Дж. Антиглаукоматозная терапия во время беременности – Часть II. Энн Офтальмол. 1988; 20: 208–11. [PubMed] [Google Scholar]
19. Samples JR, Meyer SM. Использование офтальмологических препаратов у беременных и кормящих женщин. Am J Офтальмол. 1988; 106: 616–23. [PubMed] [Google Scholar]
20. Rick E, Bendel MS. Принципы и осложнения медикаментозной терапии глаукомы. В: Циммерман Т.Дж., Кунер К.С., редакторы. Клинические пути при глаукоме. Нью-Йорк: Тиме; 2001. стр. 427–55. [Академия Google]
21. Озава Х., Адзума Э., Синдо К., Хигасигава М., Мукохара Р., Комада Ю. и др. Транзиторный почечный тубулярный ацидоз у новорожденного после трансплацентарного введения ацетазоламида. Eur J Педиатр. 2001; 160:321–2. [PubMed] [Google Scholar]
22. Worsham F, Jr, Beckman EN, Mitchell EH. Крестцово-копчиковая тератома у новорожденного. Ассоциация с использованием матерью ацетазоламида.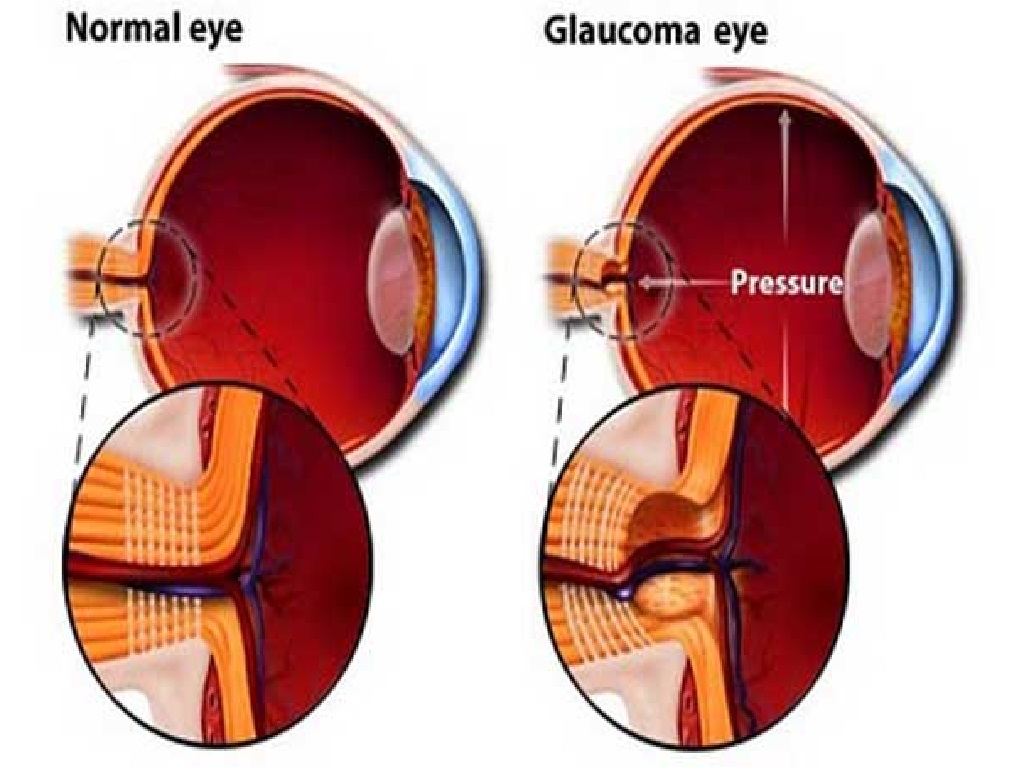 ДЖАМА. 1978; 240: 251–2. [PubMed] [Google Scholar]
ДЖАМА. 1978; 240: 251–2. [PubMed] [Google Scholar]
23. Heinonen OP, Slone D, Shapiro S. Врожденные дефекты и лекарства при беременности. Массачусетс, Литтлтон, Массачусетс: Publishing Sciences Group; 1977. стр. 372–441. [Google Scholar]
24. Layton WM, Jr, Hallesy DW. Деформация передних конечностей у крыс: связь с высокими дозами ацетазоламида. Наука. 1965; 149: 306–8. [PubMed] [Google Scholar]
25. Lee AG, Pless M, Falardeau J, Capozzoli T, Wall M, Kardon RH, et al. Применение ацетазоламида при идиопатической внутричерепной гипертензии во время беременности. Am J Офтальмол. 2005; 139: 855–9. [PubMed] [Google Scholar]
26. Эллисон А.С., Марен Т.Х. Влияние метаболизма калия на тератогенез, вызванный ацетазоламидом. Медицинский центр Джона Хопкинса J. 1972;130:105–15. [PubMed] [Google Scholar]
27. Alm A, Stjernschantz J. Влияние на внутриглазное давление и побочные эффекты 0,005% латанопроста, применяемого один раз в день, вечером или утром. Сравнение с тимололом. Скандинавская группа по изучению латанопроста. Офтальмология. 1995; 102:1743–52. [PubMed] [Google Scholar]
Скандинавская группа по изучению латанопроста. Офтальмология. 1995; 102:1743–52. [PubMed] [Google Scholar]
28. Friström B. Шестимесячное рандомизированное двойное слепое сравнение латанопроста с тимололом у пациентов с открытоугольной глаукомой или глазной гипертензией. Acta Ophthalmol Scand. 1996;74:140–4. [PubMed] [Google Scholar]
29. Thomas R, Parikh R, Sood D, Vijaya L, Sekhar GC, Sood NN, et al. Эффективность и безопасность латанопроста для лечения глаукомы: трехмесячное многоцентровое исследование в Индии. Индийский Дж. Офтальмол. 2005; 53: 23–30. [PubMed] [Google Scholar]
30. Информация производителя офтальмологического раствора Ксалатан® латанопрост. Пуэр: Pfizer; 2009. Jan, [Google Scholar]
31. De Santis M, Lucchese A, Carducci B, Cavaliere AF, De Santis L, Merola A, et al. Воздействие латанопроста при беременности. Am J Офтальмол. 2004; 138:305–6. [PubMed] [Академия Google]
32. Фискелла Р.Г., Дженсен М.К. Меры предосторожности при применении и обращении с травопростом. Am J Health Syst Pharm. 2003; 60: 484–5. [PubMed] [Google Scholar]
Am J Health Syst Pharm. 2003; 60: 484–5. [PubMed] [Google Scholar]
33. Coppens G, Stalmans I, Zeyen T. Лекарства от глаукомы во время беременности и кормления грудью. Bull Soc Belge Ophtalmol. 2010; 314:33–6. [PubMed] [Google Scholar]
34. Джонсон С.М., Мартинес М., Фридман С. Лечение глаукомы при беременности и кормлении грудью. Сурв Офтальмол. 2001; 45: 449–54. [PubMed] [Google Scholar]
35. Топпозада М., Исмаил А.А. Внутриматочное введение препаратов для прерывания беременности во втором триместре. Baillieres Clin Obstet Gynaecol. 1990;4:327–49. [PubMed] [Google Scholar]
36. Каур И.П., Лал С., Рана С., Каккар С., Сингх Х. Глазные консерванты: сопутствующие риски и новые варианты. Кутан Окул Токсикол. 2009; 28:93–103. [PubMed] [Google Scholar]
37. Purite, вкладыш в пакет. Норман, Оклахома: Bio-Cide International Inc; 1998. С. 1–3. [Google Scholar]
38. Baudouin C, Labbé A, Liang H, Pauly A, Brignole-Baudouin F. Консерванты в глазных каплях: хорошие, плохие и безобразные. Прога Retin Eye Res. 2010;29:312–34. [PubMed] [Академия Google]
Прога Retin Eye Res. 2010;29:312–34. [PubMed] [Академия Google]
39. Монография о препаратах Комбиган. Оттава: Канадская ассоциация фармацевтов; 2007. Справочник по фармацевтическим препаратам и специальностям. [Google Scholar]
40. Буттар Х.С. Эмбриотоксичность хлорида бензалкония у крыс, получавших вагинальное лечение. J Appl Toxicol. 1985; 5: 398–401. [PubMed] [Google Scholar]
41. Брент Р.Л., Бекман Д.А. Экологические тератогены. Бюлл. Н.Ю. акад. мед. 1990;66:123–63. [Бесплатная статья PMC] [PubMed] [Google Scholar]
42. Тегетхофф М., Грин Н., Олсен Дж., Шаффнер Э., Майнлшмидт Г. Стресс во время беременности и педиатрические заболевания у потомства: национальное когортное исследование. Перспектива охраны окружающей среды. 2011;119: 1647–52. [Бесплатная статья PMC] [PubMed] [Google Scholar]
43. Коулман А.Л., Мосаед С., Камаль Д. Медикаментозная терапия при беременности. J Глаукома. 2005; 14:414–6. [PubMed] [Google Scholar]
Лечение глаукомы во время беременности: риски или выбор, дилемма?
Int J Офтальмол. 2016; 9 (11): 1684–1690.
2016; 9 (11): 1684–1690.
Опубликовано в Интернете 18 ноября 2016 г. doi: 10.18240/ijo.2016.11.24
Информация об авторе Примечания к статье Информация об авторских правах и лицензии Отказ от ответственности матери против потенциального вреда плоду или новорожденному. Большинство препаратов против глаукомы ( , то есть , бета-блокаторы, аналоги простагландинов, ингибиторы карбоангидразы для местного и системного применения, холинергические средства, антихолинэстеразы и апраклонидин) считаются агентами категории С, и офтальмологи обычно ограничиваются лечением пациентов препаратами категории В, такими как бримонидин и дипивефрин. Бримонидин обычно является предпочтительным препаратом первой линии в первом, втором и начале третьего триместра. В конце третьего триместра следует прекратить прием бримонидина, поскольку он может вызвать депрессию центральной нервной системы у новорожденных, при этом оптимальным выбором могут быть топические ингибиторы карбоангидразы. Хирургическое вмешательство при глаукоме можно проводить с осторожностью во втором и третьем триместре, если у пациенток есть серьезные показания к этой процедуре. Тем не менее, анестетики, седативные средства и антиметаболиты по-прежнему имеют потенциальный риск для плода. Аргоновая лазерная трабекулопластика (АЛТ) или селективная лазерная трабекулопластика (СЛТ) — это альтернативное лечение, которое можно проводить во всех триместрах. Ингибиторы карбоангидразы и бета-блокаторы сертифицированы Американской академией педиатрии для использования во время кормления грудью. Однако следует учитывать низкие дозы этих препаратов при использовании в период грудного вскармливания. Оптимальное лечение глаукомы во время беременности нельзя откладывать, чтобы предотвратить дальнейшее ухудшение прогрессирующей потери зрения и качества жизни.
Тем не менее, анестетики, седативные средства и антиметаболиты по-прежнему имеют потенциальный риск для плода. Аргоновая лазерная трабекулопластика (АЛТ) или селективная лазерная трабекулопластика (СЛТ) — это альтернативное лечение, которое можно проводить во всех триместрах. Ингибиторы карбоангидразы и бета-блокаторы сертифицированы Американской академией педиатрии для использования во время кормления грудью. Однако следует учитывать низкие дозы этих препаратов при использовании в период грудного вскармливания. Оптимальное лечение глаукомы во время беременности нельзя откладывать, чтобы предотвратить дальнейшее ухудшение прогрессирующей потери зрения и качества жизни.
Ключевые слова: глаукома, беременность, бримонидин, аргоновый лазер трабекулопластика селективная лазерная трабекулопластика возраст. Эта ситуация претерпевает изменения, поскольку достижения в области репродуктивных технологий позволяют женщинам зачать ребенка во все более старшем возрасте. Глаукома обычно возникает у взрослых старше 40 лет, но иногда может встречаться и у женщин детородного возраста. Часто у пациентов может быть предсуществующая глаукома, которая первоначально началась в детстве (9).0063 т.е. . дисгенезия переднего сегмента или врожденная глаукома) или глаукома, вторичная по отношению к увеиту, диабету, и т. д. . Глаукома не только выявляется, но также выявляются подозрения на глаукому в более молодом возрасте благодаря наличию новых диагностических возможностей и повышению клинической осведомленности о заболевании.
Часто у пациентов может быть предсуществующая глаукома, которая первоначально началась в детстве (9).0063 т.е. . дисгенезия переднего сегмента или врожденная глаукома) или глаукома, вторичная по отношению к увеиту, диабету, и т. д. . Глаукома не только выявляется, но также выявляются подозрения на глаукому в более молодом возрасте благодаря наличию новых диагностических возможностей и повышению клинической осведомленности о заболевании.
Женщины в возрасте 35 лет и старше, как правило, осознают, что их возраст может увеличить риск врожденных дефектов у их ребенка, и поэтому они могут быть более мотивированы, чем более молодые пациентки, чтобы снизить риск, связанный с приемом любых лекарств. В некоторых случаях пациентки настолько не решаются принимать лекарства во время беременности, что частота несоблюдения режима лечения резко возрастает, а некоторые пациентки прекращают прием лекарств. В действительности большинство известных тератогенных препаратов повышают риск серьезных врожденных дефектов только на 1-3% [1].
Как правило, лечение показано пациентам с глаукомой или подозрением на глаукому, у которых существует риск развития функциональных нарушений или снижения качества жизни, связанного со зрением, вследствие заболевания. Скорость прогрессирования заболевания имеет фундаментальное значение при лечении пациентов с глаукомой. Лечение обычно показано, когда риск прогрессирования заболевания превышает риск и потенциальные побочные эффекты лечения , т.е. . для пациентов с окончательной глаукоматозной потерей поля зрения, особенно в обстоятельствах, когда было определено, что такая потеря прогрессирует с измеримой скоростью. Изменения зрительного нерва и/или слоя нервных волокон сетчатки (RNFL), характерные для глаукомы, позволяют прогнозировать функциональную потерю зрения при глаукоме, и, таким образом, пациентов с такими документально подтвержденными структурными признаками прогрессирующего повреждения обычно следует лечить терапией, снижающей внутриглазное давление (ВГД).
Нет ни опубликованных данных, ни каких-либо клинических исследований о воздействии на плод обычно используемых лекарств от глаукомы, и маловероятно, что испытания будут проводиться. Испытание по установлению «безопасности и эффективности» офтальмологических растворов при беременности трудно провести пилотным из-за судебно-медицинских ограничений и ограниченного размера выборки.
Испытание по установлению «безопасности и эффективности» офтальмологических растворов при беременности трудно провести пилотным из-за судебно-медицинских ограничений и ограниченного размера выборки.
Лечение глаукомы во время беременности и в период беременности представляет собой уникальную задачу балансирования риска потери зрения для матери и потенциального вреда для плода или новорожденного. В этой статье описываются трудности, присущие лечению беременных с глаукомой, и рассказывается, как свести к минимуму риск для плода при сохранении зрения матери.
Эпидемиология
Сообщается, что глаукома встречается примерно у 2-3% беременных взрослых старше 40 лет, хотя распространенность заметно увеличивается с возрастом для всех рас и этнических групп. Существует мало данных о распространенности глаукомы в возрасте до 40 лет, особенно у женщин детородного возраста. В одном японском исследовании распространенность открытоугольной глаукомы, определяемой дефектом поля зрения наряду с подтверждающими изменениями диска зрительного нерва, составила 0,48%, 0,42% и 0,73% среди женщин в возрасте 15–24, 25–34 и 35–44 лет. соответственно[2]. Кроме того, женщины детородного возраста могут заболеть глаукомой в раннем детстве (врожденная глаукома, дисгенезия переднего сегмента или глаукома после образования катаракты) или глаукомой, возникшей в результате сосуществующих состояний, проявляющихся в раннем возрасте, т.е. увеит или диабет.
соответственно[2]. Кроме того, женщины детородного возраста могут заболеть глаукомой в раннем детстве (врожденная глаукома, дисгенезия переднего сегмента или глаукома после образования катаракты) или глаукомой, возникшей в результате сосуществующих состояний, проявляющихся в раннем возрасте, т.е. увеит или диабет.
ВГД снижается во время беременности. Подсчитано, что во время беременности ВГД снижается до 10%, причем это снижение отмечается в третьей четверти. Уменьшение происходит не только на протяжении всей беременности, но и сохраняется в течение нескольких месяцев после родов. Это снижение ВГД в первую очередь связано с колебаниями уровня двух важных гормонов: β-хорионического гонадотропина человека (В-ХГЧ) и прогестерона.
В одном исследовании беременных женщин среднее ВГД у пациенток в первом триместре было в среднем на 2 мм рт. ст. выше, чем у пациенток в третьем триместре[3]*. Вероятный риск врожденных дефектов в сочетании с опасениями пациентов побуждает офтальмологов приостановить прием препаратов против глаукомы во время беременности. Фактически, это может свидетельствовать о том, что глаукома во время беременности остается стабильной, и поэтому пациенты не получают лечения во время беременности [4]–[5]. Исследования здоровых женщин по сравнению с женщинами с офтальмогипертензией показали, что ВГД снижалось по мере развития беременности, а исследования продемонстрировали статистически значимое снижение давления с первого по третий триместр [4]–[5]. Потенциальные механизмы такого снижения ВГД включали усиление увеосклерального оттока жидкости из-за гормональных изменений, индуцированную гормонами блокаду глазного гипертензивного эффекта эндогенных кортикостероидов, снижение эписклерального венозного давления в результате снижения венозного давления в верхних конечностях и легкий метаболический ацидоз в результате беременности. В частности, повышенный уровень прогестерона и релаксина может снижать ВГД и повышать коэффициент легкости оттока водянистой влаги во время беременности [3]–[5].
Фактически, это может свидетельствовать о том, что глаукома во время беременности остается стабильной, и поэтому пациенты не получают лечения во время беременности [4]–[5]. Исследования здоровых женщин по сравнению с женщинами с офтальмогипертензией показали, что ВГД снижалось по мере развития беременности, а исследования продемонстрировали статистически значимое снижение давления с первого по третий триместр [4]–[5]. Потенциальные механизмы такого снижения ВГД включали усиление увеосклерального оттока жидкости из-за гормональных изменений, индуцированную гормонами блокаду глазного гипертензивного эффекта эндогенных кортикостероидов, снижение эписклерального венозного давления в результате снижения венозного давления в верхних конечностях и легкий метаболический ацидоз в результате беременности. В частности, повышенный уровень прогестерона и релаксина может снижать ВГД и повышать коэффициент легкости оттока водянистой влаги во время беременности [3]–[5].
Однако до сих пор остается загадкой, в какой степени эти изменения ВГД следует экстраполировать на беременность с уже существующей глаукомой [6]. Эволюция глаукомы во время беременности вариабельна, несмотря на так называемый теоретический фактор гормональной защиты. Большинство пациенток обычно остаются стабильными во время беременности, хотя у небольшого процента (около 10%) наблюдается повышение ВГД или прогрессирование заболевания [7].
Эволюция глаукомы во время беременности вариабельна, несмотря на так называемый теоретический фактор гормональной защиты. Большинство пациенток обычно остаются стабильными во время беременности, хотя у небольшого процента (около 10%) наблюдается повышение ВГД или прогрессирование заболевания [7].
Исследования, демонстрирующие связь между беременностью и более низким ВГД, однако, не включали беременных женщин, у которых была установлена глаукома. Кроме того, ни в одном крупном исследовании не анализировалось внутриглазное давление у беременных с глаукомой. Крупнейшим таким исследованием является ретроспективная серия случаев, проведенная Гарвардской медицинской школой, в которой рассматривались беременные женщины с ранее существовавшей глаукомой и сообщалось, что 57% глаз имели стабильные ВГД и поля зрения во время беременности, в то время как 18% глаз имели повышенное ВГД, несмотря на стабильные поля зрения. Фактически, в 18% случаев наблюдалось прогрессирующее выпадение полей зрения со стабильным или повышенным ВГД. Хотя пациенты, у которых наблюдались изменения ВГД, нуждались в дополнительных гипотензивных препаратах, никому из них не потребовалось хирургического вмешательства. Исследователи пришли к выводу, что течение глаукомы во время беременности сильно варьирует, и далее подтвердили, что беременных женщин следует тщательно контролировать на предмет изменений ВГД и потери полей зрения [7]–[8].
Хотя пациенты, у которых наблюдались изменения ВГД, нуждались в дополнительных гипотензивных препаратах, никому из них не потребовалось хирургического вмешательства. Исследователи пришли к выводу, что течение глаукомы во время беременности сильно варьирует, и далее подтвердили, что беременных женщин следует тщательно контролировать на предмет изменений ВГД и потери полей зрения [7]–[8].
Цели лечения
Целевое ВГД — это диапазон ВГД, при котором, по мнению офтальмологов, предполагаемая скорость прогрессирования вряд ли повлияет на качество жизни пациента. Несмотря на то, что это рекомендуется большинством экспертов, недостаточно доказательств того, что использование целевого ВГД связано с лучшими клиническими исходами. Определение целевого ВГД основано на учете степени существующего повреждения глаукомы, скорости прогрессирования, ВГД, при котором произошло повреждение, ожидаемой продолжительности жизни пациента и других факторов, включая состояние парного глаза и семьи.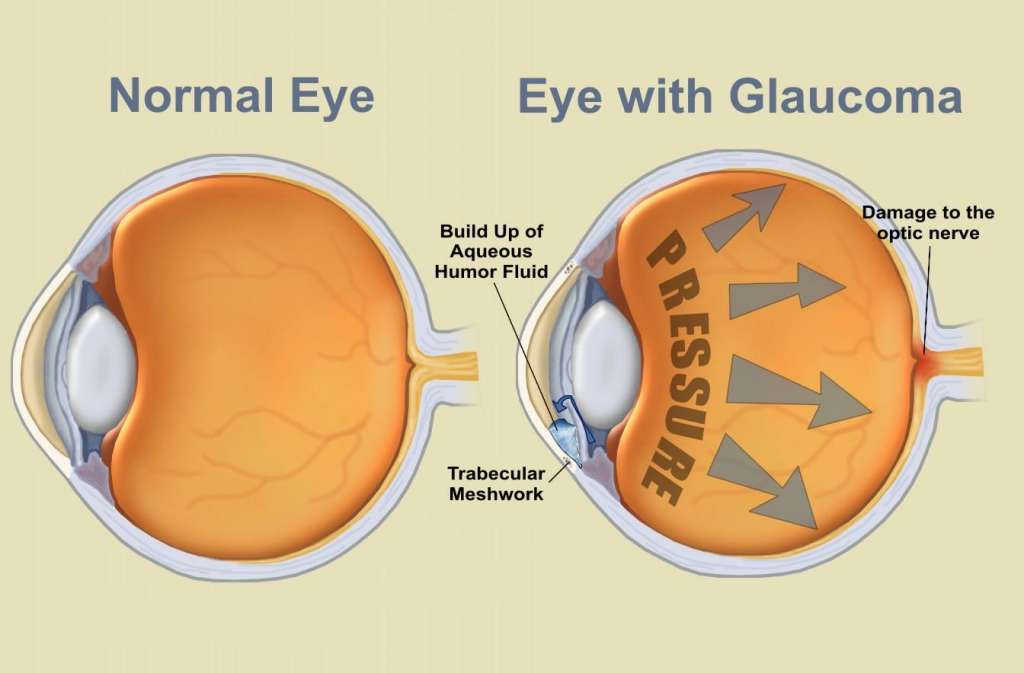 история тяжелой глаукомы [3]-[8].
история тяжелой глаукомы [3]-[8].
Использование целевого ВГД при глаукоме требует постоянной переоценки и корректировки. Преимущества и недостатки эскалации лечения для достижения целевого ВГД должны стремиться к равновесию. Неопределенности в отношении краткосрочных и долгосрочных изменений ВГД, точности показаний тонометра, ожидаемой продолжительности жизни пациента, приверженности терапии и расчетной скорости прогрессирования остаются нерешенными. Цели лечения включают ВГД, зрительную функцию и структурные (диск зрительного нерва, СНВС) исходы и качество жизни. Риски, связанные с воздействием местных и системных препаратов на плод и новорожденного, должны быть сбалансированы с риском потери зрения у матери [3]–[8].
Бета-блокаторы
Пероральные β-блокаторы относятся к категории препаратов класса С при беременности. Для топических β-адреноблокаторов нет конкретной классификации. Местные блокаторы β-адренорецепторов, такие как тимолол, бетаксолол, картеолол, левобунол и метипранол, уменьшают продукцию водянистой влаги и впоследствии снижают ВГД [9]–[10].
Бета-блокаторы для местного применения являются эффективными средствами для снижения ВГД. Все неселективные β-адреноблокаторы обладают сопоставимой эффективностью снижения ВГД. Однако местные и системные β-адреноблокаторы плохо сочетаются друг с другом в отношении снижения ВГД. Хотя некоторые β-блокаторы обладают внутренней симпатомиметической активностью (ISA) или α-блокирующими свойствами, их клинические свойства аналогичны таковым у других неселективных β-антагонистов. Тем не менее, ISA может уменьшить респираторные и сердечно-сосудистые побочные эффекты, связанные с β-блокаторами. Тимолол и, возможно, все другие β-адреноблокаторы имеют минимальную эффективность снижения ВГД во время сна. Неселективные топические β-адреноблокаторы противопоказаны пациентам с астмой, хронической обструктивной болезнью легких (эмфизема и бронхит), некоторыми случаями застойной сердечной недостаточности, брадикардией и блокадой сердца [9].]–[10].
Бетаксолол относительно безопаснее, чем неселективный β-адреноблокатор у пациентов с известным реактивным заболеванием дыхательных путей. Однако эффективность бетаксолола в отношении снижения ВГД, несмотря на то, что он является относительно селективным β-1-блокатором, меньше, чем у неселективных β-блокаторов.
Однако эффективность бетаксолола в отношении снижения ВГД, несмотря на то, что он является относительно селективным β-1-блокатором, меньше, чем у неселективных β-блокаторов.
Хотя офтальмологи могут неохотно назначать этот класс препаратов беременным пациенткам с глаукомой, большинство акушеров довольно комфортно относятся к этому типу терапии, потому что они без колебаний назначают пероральные β-блокаторы для контроля гипертонии во время беременности. Системное применение блокаторов β-адренорецепторов в ближайшем будущем может привести к брадикардии, аритмии, гипотензии и гипогликемии у плода и новорожденного [11]–[12]. Также сообщалось о респираторном дистрессе и апноэ после внутриутробного воздействия. Данные о безопасности прекращения лечения за 24-48 часов до родов противоречивы [9].]–[12]. Когда сообщается, неонатальные симптомы, связанные с β-блокадой, обычно слабо выражены и исчезают в течение 48 часов. Однако ни о каких побочных эффектах не сообщалось при приеме низких доз тимолола (, т. е. 0,1%) в виде геля.
е. 0,1%) в виде геля.
Альфа-агонисты
Агонисты адренергических рецепторов снижают внутриглазное давление за счет уменьшения образования водянистой влаги и увеличения оттока. Они также могут влиять на эписклеральное венозное давление. Адреномиметики противопоказаны младенцам и детям из-за повышенной склонности к системным побочным эффектам. ВГД-снижающая эффективность адреномиметиков меньше, чем у тимолола. Этот класс часто сочетается с аналогами простагландинов, но не с неселективными β-блокаторами. Местные побочные эффекты включают гиперемию и блефароконъюнктивит. Системные сосудистые эффекты включают сухость во рту, сонливость и тахиаритмии [13].
Бримонидин классифицируется FDA как лекарство категории B. Однако не проводилось хорошо контролируемых исследований на людях, чтобы исключить потенциальные тератогенные эффекты. Кроме того, бримонидин представляет значительный риск для новорожденных, поскольку, как сообщается, вызывает угнетение центральной нервной системы и апноэ. Препарат проникает через гематоэнцефалический гематоэнцефалический барьер, может проникать через гематоплацентарный барьер и, возможно, выделяться в грудное молоко, создавая реальный риск апноэ или гипотензии у новорожденных и детей грудного возраста. Таким образом, несмотря на его статус препарата категории B, даже если бримонидин используется во время беременности, его следует прекратить до родов и во время грудного вскармливания, чтобы предотвратить потенциальное апноэ плода [14]–[15].
Препарат проникает через гематоэнцефалический гематоэнцефалический барьер, может проникать через гематоплацентарный барьер и, возможно, выделяться в грудное молоко, создавая реальный риск апноэ или гипотензии у новорожденных и детей грудного возраста. Таким образом, несмотря на его статус препарата категории B, даже если бримонидин используется во время беременности, его следует прекратить до родов и во время грудного вскармливания, чтобы предотвратить потенциальное апноэ плода [14]–[15].
Буназозин, несмотря на то, что он является селективным антагонистом α1A, увеличивает увеосклеральный отток. Несмотря на хорошую переносимость, гипотензивная эффективность местного буназозина слабее, чем у местного тимолола.
Аналоги простагландина
Аналоги простагландина (АПГ) являются наиболее эффективными препаратами для снижения внутриглазного давления среди всех местных препаратов против глаукомы и, как правило, являются терапией первой линии. Аналоги простагландинов, такие как латанопрост, биматопрост, травопрост и тафлупрост, снижают ВГД за счет увеличения увеосклерального оттока водянистой влаги. Общие побочные эффекты капель-аналогов простагландина включают гиперемию конъюнктивы, обратимое увеличение длины-толщины-пигментации ресниц, необратимое увеличение пигментации радужной оболочки и усиление пигментации кожи век [16].
Общие побочные эффекты капель-аналогов простагландина включают гиперемию конъюнктивы, обратимое увеличение длины-толщины-пигментации ресниц, необратимое увеличение пигментации радужной оболочки и усиление пигментации кожи век [16].
Аналоги простагландина классифицируются как препараты категории С и связаны с заметной частотой выкидышей в исследованиях на животных. Простагландины, будучи окситоцинами и лютеолитиками, могут повышать тонус матки и стимулировать сокращения матки, вызывая преждевременные роды. Поскольку они могут действовать как аборты, есть опасения по поводу их использования во время беременности. Фактически, травопрост представляет собой пролекарство, которое будет гидролизоваться в роговице с образованием флупростенола, типа простагландина, обладающего высокой селективностью в отношении рецепторов F2α, который используется для индуцирования аборта у животных путем сокращения гладкой мускулатуры матки [16]–[19].].
Воздействие латанопроста во время беременности не было связано с повышенным риском врожденных пороков развития или самопроизвольного аборта у подвергшихся воздействию младенцев.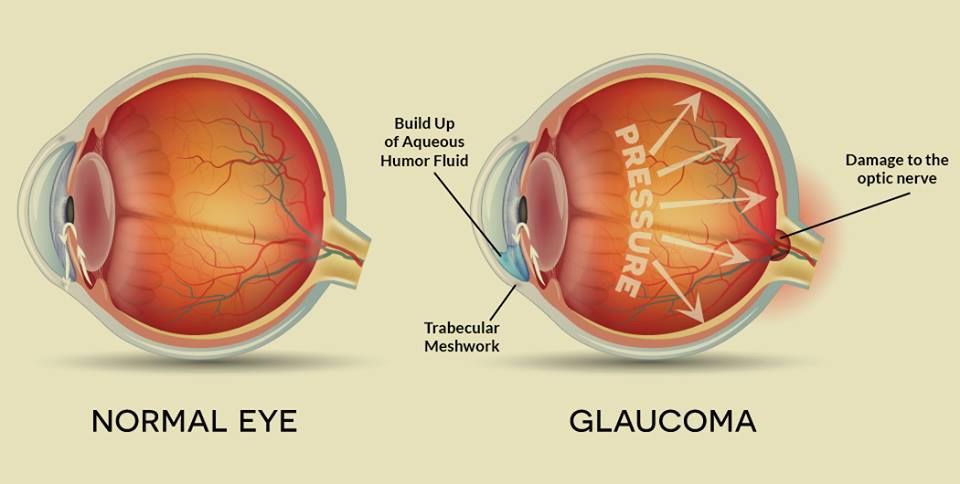 Было обнаружено, что низкая масса тела при рождении чаще встречается у детей, подвергавшихся воздействию латанопроста, чем у детей контрольной группы, не подвергавшихся воздействию, однако других различий между группами не наблюдалось [18]. Нет опубликованных данных о применении биматопроста или травопроста во время беременности.
Было обнаружено, что низкая масса тела при рождении чаще встречается у детей, подвергавшихся воздействию латанопроста, чем у детей контрольной группы, не подвергавшихся воздействию, однако других различий между группами не наблюдалось [18]. Нет опубликованных данных о применении биматопроста или травопроста во время беременности.
Кроме того, систематический обзор задокументировал, что пероральное или вагинальное применение мизопростола во время беременности связано с повышенным риском синдрома Мебиуса и терминальных поперечных дефектов конечностей [20], хотя неясно, являются ли очень низкие концентрации препарата, используемые в офтальмологических препаратах простагландина достаточно, чтобы вызвать этот побочный эффект. В то время как некоторые фармакологи утверждают, что латанопрост и травопрост имеют недостаточно активных ингредиентов, чтобы вызвать неблагоприятное воздействие на плод, другие считают, что использование простагландинов обычно противопоказано беременным женщинам [17], [19]. ]. Поэтому эти препараты следует использовать с осторожностью.
]. Поэтому эти препараты следует использовать с осторожностью.
Ингибиторы карбоангидразы
Ингибиторы карбоангидразы (CAI) являются эффективными средствами для снижения ВГД. CAI снижают внутриглазное давление путем подавления продукции водянистой влаги за счет ингибирования изофермента карбоангидразы II в цилиарном теле. CAI являются единственной категорией препаратов, имеющихся в продаже как для местного, так и для системного применения, для снижения внутриглазного давления. Для системных CAI основные побочные эффекты включают парестезии, недомогание, желудочно-кишечные расстройства, почечную недостаточность, дискразию крови и метаболический ацидоз. Для местных CAI побочные эффекты включают жжение в глазах, покалывание, горечь, поверхностную точечную кератопатию, нечеткость зрения, слезотечение, головную боль и преходящую близорукость. CAI могут увеличить скорость глазной крови; однако нет достаточных доказательств какой-либо клинической пользы этого эффекта для пациентов с глаукомой. Системные ингибиторы кальциневрина противопоказаны при аллергии на сульфаниламиды, при сниженном уровне натрия и/или калия в крови и при метаболическом ацидозе. Местные CAI и системные CAI плохо аддитивны в отношении снижения ВГД [21]–[23].
Системные ингибиторы кальциневрина противопоказаны при аллергии на сульфаниламиды, при сниженном уровне натрия и/или калия в крови и при метаболическом ацидозе. Местные CAI и системные CAI плохо аддитивны в отношении снижения ВГД [21]–[23].
Бринзоламид классифицируется как лекарство категории С при беременности. В исследованиях на животных наблюдалось статистически более низкое значение массы тела плода при пероральном приеме препарата (в 375 раз больше, чем при офтальмологической дозе для человека). Однако даже при такой высокой дозе пороков развития органов не наблюдалось [24]. Дорзоламид также относится к препаратам категории С. У кроликов, подвергшихся воздействию дорзоламида во время беременности, наблюдались пороки развития тел позвонков, что позволяет предположить, что бринзоламид может быть лучшей альтернативой. Нет контролируемых сообщений о применении бринзоламида или дорзоламида при беременности у человека. Таким образом, его можно использовать во время беременности с осторожностью, когда возможная польза для матери превышает теоретический риск для плода. Неясно, выделяются ли эти препараты с грудным молоком, поэтому их безопасность при грудном вскармливании неизвестна [24]–[26].
Неясно, выделяются ли эти препараты с грудным молоком, поэтому их безопасность при грудном вскармливании неизвестна [24]–[26].
Ацетазоламид классифицируется как лекарство категории C. Ацетазоламид может привести к потенциальным метаболическим осложнениям у новорожденного или ребенка, находящегося на грудном вскармливании. Системные высокие дозы ингибиторов карбоангидразы у крыс могут привести к аномалиям передних конечностей, что может свидетельствовать о тератогенности этого препарата [27]–[29]. Сообщалось об одном случае неонатальной крестцово-копчиковой тератомы у беременной женщины, принимавшей ацетазоламид перорально [30]. В 1989 г. у новорожденного развился метаболический ацидоз, гипокальциемия и гипомагниемия, поскольку мать лечилась ацетазоламидом, пилокарпином и тимололом от глаукомы на протяжении всей беременности [31]. Концентрация ацетазоламида в крови связана с уровнем углекислого газа в сыворотке крови и концентрацией ионов хлора, которые являются индикаторами метаболического ацидоза, особенно у пациентов с почечной дисфункцией [32]–[33]. В 2000 г. был зарегистрирован еще один случай трансплацентарного проникновения ацетазоламида, который привел к транзиторному неонатальному канальцевому ацидозу и низкой массе тела при рождении во время лечения материнской глаукомы пероральным ацетазоламидом [24]. С другой стороны, у 12 беременных женщин, принимавших перорально ацетазоламид для лечения идиопатической внутричерепной гипертензии, не было побочных эффектов на плод [34]. Также в другом отчете о случаях продемонстрировано, что уровни ацетазоламида в плазме были низкими у младенцев, подвергшихся воздействию препарата через грудное молоко [25]. Поэтому ацетазоламид одобрен Американской академией педиатрии для использования во время кормления грудью [8]. Таким образом, данные, на которых можно основывать оценку безопасности ацетазоламида при беременности человека, ограничены. Доклинические исследования продемонстрировали тератогенный риск, однако имеющиеся данные о беременности человека не указывают на значительно повышенный риск врожденных пороков развития или самопроизвольного аборта после воздействия.
В 2000 г. был зарегистрирован еще один случай трансплацентарного проникновения ацетазоламида, который привел к транзиторному неонатальному канальцевому ацидозу и низкой массе тела при рождении во время лечения материнской глаукомы пероральным ацетазоламидом [24]. С другой стороны, у 12 беременных женщин, принимавших перорально ацетазоламид для лечения идиопатической внутричерепной гипертензии, не было побочных эффектов на плод [34]. Также в другом отчете о случаях продемонстрировано, что уровни ацетазоламида в плазме были низкими у младенцев, подвергшихся воздействию препарата через грудное молоко [25]. Поэтому ацетазоламид одобрен Американской академией педиатрии для использования во время кормления грудью [8]. Таким образом, данные, на которых можно основывать оценку безопасности ацетазоламида при беременности человека, ограничены. Доклинические исследования продемонстрировали тератогенный риск, однако имеющиеся данные о беременности человека не указывают на значительно повышенный риск врожденных пороков развития или самопроизвольного аборта после воздействия. Пока что трудно делать выводы на основании имеющихся данных, поскольку в настоящее время они слишком ограничены, чтобы исключить какое-либо увеличение риска. Использование ацетазоламида на поздних сроках беременности статистически связано с дисбалансом электролитов у новорожденных и метаболическим ацидозом. Следовательно, после воздействия рекомендуется мониторинг неонатальных электролитов наряду с мониторингом терапевтической дозы концентрации ацетазоламида в крови в качестве средства предотвращения передозировки и серьезных побочных эффектов [24], [31], [35].
Пока что трудно делать выводы на основании имеющихся данных, поскольку в настоящее время они слишком ограничены, чтобы исключить какое-либо увеличение риска. Использование ацетазоламида на поздних сроках беременности статистически связано с дисбалансом электролитов у новорожденных и метаболическим ацидозом. Следовательно, после воздействия рекомендуется мониторинг неонатальных электролитов наряду с мониторингом терапевтической дозы концентрации ацетазоламида в крови в качестве средства предотвращения передозировки и серьезных побочных эффектов [24], [31], [35].
Метазоламид также классифицируется как лекарство категории С. Сообщалось о пороках развития скелета у крыс, но при дозе, в 40 раз превышающей дозу для человека. Контролируемых исследований на беременных женщинах не проводилось. Сведения о том, проникает ли препарат в грудное молоко, неизвестны.
Доставка лекарств
Все глазные капли имеют потенциальные системные побочные эффекты, которых можно было бы избежать или, по крайней мере, свести к минимуму, уменьшив системную абсорбцию лекарства. Простая носослезная окклюзия и закрытие век являются удобными методами, которые могут уменьшить эти системные побочные эффекты [36]. Кроме того, как носослезная окклюзия, так и закрытие век могут увеличить время контакта препарата с глазами, что приводит к более высоким внутриглазным концентрациям препарата и меньшей системной абсорбции. Закупорка точек может уменьшить отток слезы и улучшить средний уровень слезного мениска, что снижает системную абсорбцию препарата [36]–[37]. Однако прямых исследований системной абсорбции лекарств от глаукомы с закупоркой точек не проводилось. Тем не менее, эти варианты следует обсудить с женщинами, решившими продолжить местную гипотензивную терапию во время беременности и во время нее.
Простая носослезная окклюзия и закрытие век являются удобными методами, которые могут уменьшить эти системные побочные эффекты [36]. Кроме того, как носослезная окклюзия, так и закрытие век могут увеличить время контакта препарата с глазами, что приводит к более высоким внутриглазным концентрациям препарата и меньшей системной абсорбции. Закупорка точек может уменьшить отток слезы и улучшить средний уровень слезного мениска, что снижает системную абсорбцию препарата [36]–[37]. Однако прямых исследований системной абсорбции лекарств от глаукомы с закупоркой точек не проводилось. Тем не менее, эти варианты следует обсудить с женщинами, решившими продолжить местную гипотензивную терапию во время беременности и во время нее.
Роль аргоновой лазерной трабекулопластики и селективной лазерной трабекулопластики
Аргоновая лазерная трабекулопластика (АЛТ) или селективная лазерная трабекулопластика (СЛТ) может быть рассмотрена у беременных женщин для отмены или уменьшения количества необходимых безопасных лекарств. Это позволяет поддерживать ВГД в пределах целевых значений при меньшем количестве гипотензивных препаратов.
Это позволяет поддерживать ВГД в пределах целевых значений при меньшем количестве гипотензивных препаратов.
Лазерная трабекулопластика может быть хорошим вариантом лечения, если это позволяет морфология угла. Это нечасто встречается при типах глаукомы, проявляющихся у женщин репродуктивного возраста. Он не очень эффективен в случаях, связанных с угловыми изменениями, присущими заболеванию, или наличием угловых синехий. Воспалительная или врожденная глаукома или глаукома, развившаяся в младенчестве из-за деформаций передней камеры, таких как синдром Петерса-Ригера или синдром Аксенфельда или аниридия, часто нарушают угол, и поэтому результаты АЛТ или СЛТ более ограничены.
К сожалению, АЛТ менее эффективен в поддержании контроля ВГД у молодых пациентов [28]. Ретроспективное исследование аргоновой лазерной трабекулопластики показало, что у 60% пациентов, подвергшихся лазерной терапии, наблюдалось неконтролируемое внутриглазное давление, и им потребовалась операция по поводу глаукомы в течение двух лет после АЛТ [38]. Тем не менее, учитывая короткие сроки беременности, трабекулопластика может быть рассмотрена у этих пациенток.
Тем не менее, учитывая короткие сроки беременности, трабекулопластика может быть рассмотрена у этих пациенток.
Роль хирургического вмешательства при глаукоме
Если у женщины развилась глаукома и повысилось давление, несмотря на прием нескольких лекарств, перед зачатием следует серьезно подумать о хирургическом вмешательстве. После зачатия хирургическое лечение глаукомы может быть рассмотрено во время беременности, если глаукома прогрессирует и адекватное ВГД не может быть достигнуто, несмотря на лазерную трабекулопластику и использование максимально безопасных препаратов. Однако существуют определенные риски хирургического лечения глаукомы у беременных, в том числе риски местной и общей анестезии, а также потребность в послеоперационных лекарствах. Кроме того, фильтрующая хирургия глаукомы у беременных может иметь относительно более высокий риск неудачи из-за молодого возраста пациента и противопоказаний к использованию антиметаболитов [39].]–[40]. Перибульбарное или субтеноновое введение лидокаина представляется безопасным для плода.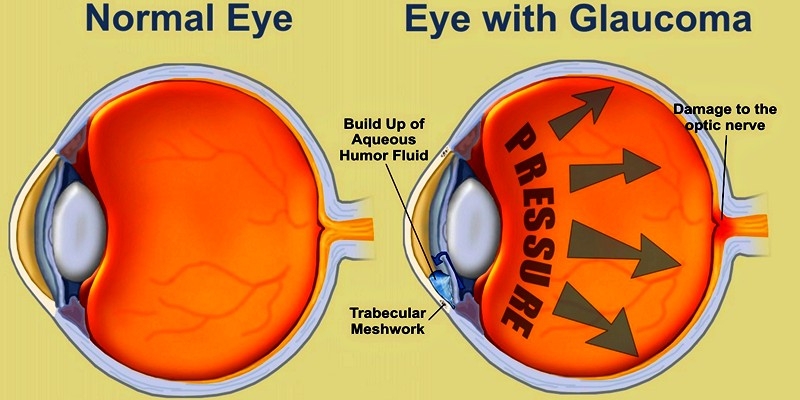 Желательно отложить операцию до второго триместра беременности, чтобы свести к минимуму воздействие на плод этих потенциально тератогенных анестетиков.
Желательно отложить операцию до второго триместра беременности, чтобы свести к минимуму воздействие на плод этих потенциально тератогенных анестетиков.
Роль криохирургии
Криохирургия может проводиться под местной анестезией и может быть повторена, если ВГД недостаточно контролируется. Анатомические различия в морфологии и положении цилиарного тела необходимо учитывать при врожденной и детской глаукоме, а также возможные осложнения у больных с тонкой склерой или воспалительной глаукомой. В этих случаях хирургическая трудность выше, потому что часто обнаруживаются пациенты, которым несколько раз выполнялись вмешательства, и у которых есть угловой компромисс, который ограничивает тип операции. Фактически циклодеструкция диодным лазером при проведении под местной анестезией может быть безопасной и ценной альтернативой фильтрующей хирургии при беременности.
Поскольку большинство препаратов против глаукомы ( т.е. β-блокаторы, аналоги простагландинов, местные и системные ингибиторы кальциневрина, холинергические средства, антихолинэстеразные средства и апраклонидин) отнесены FDA к категории С, офтальмологи обычно ограничиваются лечением пациентов препаратами категории В. бримонидина и дипивефрина.
бримонидина и дипивефрина.
Офтальмологи избегают лечения беременных женщин препаратами категории С, за исключением случаев, когда потенциальная польза для пациентки оправдывает риск для плода. Мягким исключением из этого правила является использование β-адреноблокаторов.
До зачатия
В идеале обсуждение плана лечения глаукомы у женщины должно начинаться до начала беременности. Таким образом, побочные эффекты лекарств можно предотвратить в течение первого триместра, когда происходит большая часть органогенеза. Кроме того, до начала беременности можно изучить или применить альтернативные эффективные методы снижения ВГД (включая, при необходимости, хирургическое вмешательство). Известные пациенты с глаукомой детородного возраста должны немедленно сообщить своему врачу, если они подозревают, что беременны, или планируют ли они завести или пополнить свою семью.
Первый триместр
Подробное обсуждение рисков, связанных с приемом лекарств, и наилучшей стратегии снижения ВГД следует проводить сразу же после выявления беременности, поскольку органогенез часто начинается при первом выявлении беременности, а лекарства, принимаемые во время органогенеза, могут привести к врожденным дефектам . Обсуждения беременности должны включать обсуждение концентрации/дозировки лекарств, методов минимизации системной абсорбции лекарств и возможности отмены лекарств на некоторые периоды беременности.
Обсуждения беременности должны включать обсуждение концентрации/дозировки лекарств, методов минимизации системной абсорбции лекарств и возможности отмены лекарств на некоторые периоды беременности.
Бримонидин, препарат категории B, может быть самым безопасным вариантом для первого триместра. Следует по возможности избегать приема других препаратов против глаукомы, таких как β-блокаторы, простагландины и ингибиторы карбоангидразы, в первом триместре, чтобы уменьшить потенциальные тератогенные эффекты или преждевременный аборт. Обсуждения с пациентом могут включать наблюдение вне лечения в этот критический период.
При хирургическом лечении глаукомы анестетики, седативные средства и антиметаболиты являются возможными тератогенными агентами. Таким образом, отказ от операции в первом триместре может снизить риск тератогенного действия и самопроизвольного аборта.
Второй триместр
Во втором триместре можно применять бримонидин и β-блокаторы с регулярным мониторингом частоты сердечных сокращений плода и его роста. Если используются аналоги простагландинов, пациентке следует описать симптомы и признаки преждевременных родов, а при появлении таких симптомов следует прекратить прием препарата. Когда местные или пероральные ингибиторы карбоангидразы используются в качестве адъювантной терапии, можно рассмотреть возможность наблюдения за задержкой роста плода.
Если используются аналоги простагландинов, пациентке следует описать симптомы и признаки преждевременных родов, а при появлении таких симптомов следует прекратить прием препарата. Когда местные или пероральные ингибиторы карбоангидразы используются в качестве адъювантной терапии, можно рассмотреть возможность наблюдения за задержкой роста плода.
Третий триместр
Бримонидин, β-блокатор или местные ингибиторы карбоангидразы можно использовать с осторожностью. Отказ от простагландинов может снизить риск преждевременных родов, что особенно важно в начале третьего триместра. В конце третьего триместра следует прекратить прием бримонидина, поскольку он может вызвать угнетение центральной нервной системы у новорожденных. Топические ингибиторы карбоангидразы могут быть оптимальным выбором в этот период.
Хирургическое вмешательство при глаукоме можно проводить с осторожностью во втором и третьем триместре, если у пациенток есть серьезные показания к этой процедуре. Тем не менее, анестетики, седативные средства и антиметаболиты по-прежнему имеют потенциальный риск для плода.
АЛТ или СЛТ — это альтернативное лечение глаукомы, которое можно проводить во всех триместрах. АЛТ или СЛТ могут быть менее эффективными для долгосрочного контроля ВГД, но могут привести к кратковременному контролю ВГД до конца беременности.
Послеродовой
Ингибиторы карбоангидразы и β-блокаторы сертифицированы Американской академией педиатрии для использования во время кормления грудью. Однако следует учитывать низкие дозы этих препаратов при использовании в период грудного вскармливания. Бримонидин противопоказан к применению кормящим матерям из-за риска угнетения центральной нервной системы у новорожденного.
На сегодняшний день опубликовано очень мало данных для оценки истинного риска применения глазных препаратов во время беременности. Этот недостаток может объясняться несколькими причинами. Во-первых, небольшое количество беременных связывают значительное неблагоприятное воздействие на плод с местным введением офтальмологических препаратов. Во-вторых, для выявления тератогенности лекарств необходим широкомасштабный надзор за населением. Наконец, исследователи могут не захотеть вкладывать время, деньги и энергию в исследования, которые, скорее всего, дадут отрицательную связь между двумя изучаемыми переменными. Тем не менее врачи всегда должны быть особенно осторожны при назначении лекарств беременным женщинам. Общий уровень доказательности риска назначения офтальмологических препаратов беременным женщинам низок. В этом аспекте не хватает мета-анализов и рандомизированных контролируемых исследований. Большая часть имеющихся доказательств основана только на отдельных отчетах о случаях и исследованиях на животных.
Наконец, исследователи могут не захотеть вкладывать время, деньги и энергию в исследования, которые, скорее всего, дадут отрицательную связь между двумя изучаемыми переменными. Тем не менее врачи всегда должны быть особенно осторожны при назначении лекарств беременным женщинам. Общий уровень доказательности риска назначения офтальмологических препаратов беременным женщинам низок. В этом аспекте не хватает мета-анализов и рандомизированных контролируемых исследований. Большая часть имеющихся доказательств основана только на отдельных отчетах о случаях и исследованиях на животных.
Нелеченая или недостаточно леченная глаукома потенциально может привести к потере зрения; и хотя оценка риска для беременной пациентки с глаукомой затруднена из-за отсутствия данных о безопасности, потенциальная польза от лечения, вероятно, перевешивает любое увеличение риска как для матери, так и для плода. Оптимальное лечение глаукомы во время беременности нельзя откладывать, чтобы предотвратить дальнейшее ухудшение прогрессирующей потери зрения и качества жизни.
Как правило, следует по возможности избегать приема всех препаратов в первом триместре, поскольку риск тератогенного действия препарата на плод в этот период наиболее высок, чем в любое другое время. Тем не менее опасения по поводу неопределенной тератогенности препарата не должны отпугивать врачей от назначения лечения, когда считается, что ожидаемая польза для матери превышает риск для плода.
Метод поиска литературы
Мы систематически просматривали литературу, чтобы определить все способы лечения глаукомы у беременных в период лактации. Мы провели поиск в PubMed.gov, используя термины «глаукома», «беременность», «ВГД при беременности», «противоглаукомные препараты при беременности», «АЛТ и СЛТ при беременности», «трабекулэктомия при беременности» и «выбор препараты против глаукомы при беременности». Затем были проанализированы все имеющиеся соответствующие статьи, относящиеся к этой теме.
Конфликт интересов: Sethi HS, Нет; Найк М, Нет; Гупта В.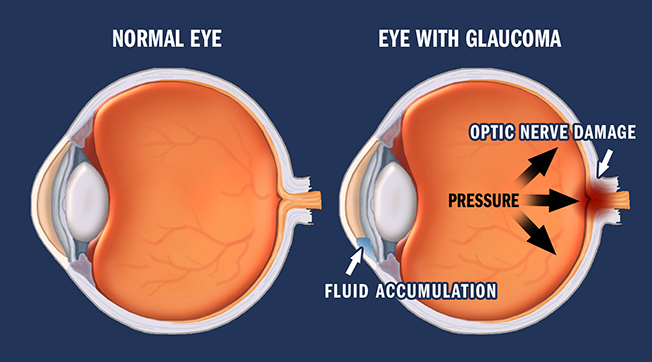 С., Нет.
С., Нет.
1. Ван П.И., Чонг С.Т., Килар А.З., Келли А.М., Кнопп У.Д., Мазза М.Б., Гудситт М.М. Визуализация беременных и кормящих пациентов: часть 1, обзор доказательной медицины и рекомендации. AIR Am J Рентгенол. 2012;198(4):778–784. [PubMed] [Google Scholar]
2. Капетанакис В.В., Чан М.П., Фостер П.Дж., Кук Д.Г., Оуэн К.Г., Рудницка А.Р. Глобальные вариации и временные тенденции распространенности первичной открытоугольной глаукомы (ПОУГ): систематический обзор и метаанализ. Бр Дж Офтальмол. 2016;100(1):86–93. [Бесплатная статья PMC] [PubMed] [Google Scholar]
3. Гарг П., Аггарвал П. Изменения глаз во время беременности. Непал J Офтальмол. 2012;4(1):150–161. [PubMed] [Google Scholar]
4. Chawla S, Chaudhary T, Aggarwal S, Maiti GD, Jaiswal K, Yadav J. Офтальмологические соображения при беременности. Мед J вооруженных сил Индии. 2013;69(3):278–284. [бесплатная статья PMC] [PubMed] [Google Scholar]
5. Дима AM. Глаз и беременность. Офтальмология. 2012;56(1):20–26. [PubMed] [Академия Google]
2012;56(1):20–26. [PubMed] [Академия Google]
6. Самра К.А. Глаза и зрительная система при беременности, чего ожидать? Углубленный обзор. Оман Дж. Офтальмол. 2013;6(2):87–91. [Бесплатная статья PMC] [PubMed] [Google Scholar]
7. Mendez-Hernandez C, Garcia-Feijoo J, Saenz-Frances F, Santos Bueso E, Martinez-de-la-Casa JM, Megias AV, Fernández-Vidal AM, Гарсия-Санчес Дж. Влияние терапии местного внутриглазного давления на беременность. Клин Офтальмол. 2012; 6: 1629–1632. [Бесплатная статья PMC] [PubMed] [Google Scholar]
8. Razeghinejad MR, Tania Tai TYT, Fudemberg SJ, Katz LJ. Беременность и глаукома. Сурв Офтальмол. 2011;56(4):324–335. [PubMed] [Академия Google]
9. Информационная служба тератологии Великобритании. Монография о препаратах, блокирующих бета-адренорецепторы, при беременности, 2010 г. Получено с http://www.toxbase.org. Последний доступ 29 декабря 2015 г.
10. Ведение глаукомы во время беременности и после родов. Интернет-приложение Американской академии офтальмологии. Последнее обновление: сентябрь 2014 г. Доступно по адресу http://eyewiki.aao.org/Glaucoma_management_in_pregnancy_and_post-partum.
Последнее обновление: сентябрь 2014 г. Доступно по адресу http://eyewiki.aao.org/Glaucoma_management_in_pregnancy_and_post-partum.
11. Разегинеджад М.Р., Новруззаде М.Х. Воздействие антиглаукомных препаратов во время беременности: обсервационное исследование и обзор литературы. Clin Exp Optom. 2010;93(6):458–465. [PubMed] [Google Scholar]
12. Салим С. Глаукома при беременности. Курр Опин Офтальмол. 2014;25(2):93–97. [PubMed] [Google Scholar]
13. Feke GT, Bex PJ, Taylor CP, Rhee DJ, Turalba AV, Chen TC, Wand M, Pasquale LR. Влияние бримонидина на ауторегуляцию сосудов сетчатки и кратковременную зрительную функцию при глаукоме нормального напряжения. Am J Офтальмол. 2014;158(1):105–112.эл. [Бесплатная статья PMC] [PubMed] [Google Scholar]
14. Cantor LB. Бримонидин в лечении глаукомы и глазной гипертензии. Ther Clin Risk Manag. 2006;2(4):337–346. [Бесплатная статья PMC] [PubMed] [Google Scholar]
15. Рахман М.К., Рамаеш К., Монтгомери Д.М. Бримонидин при глаукоме. Экспертное заключение Drug Safe. 2010;9(3):11–15. [Google Scholar]
Экспертное заключение Drug Safe. 2010;9(3):11–15. [Google Scholar]
16. Russo A, Riva I, Pizzolante T, Noto F, Quaranta L. Офтальмологический раствор латанопроста при лечении открытоугольной глаукомы или повышенного внутриглазного давления: обзор. Клин Офтальмол. 2008;2(4):897–905. [PMC free article] [PubMed] [Google Scholar]
17. Denis P, Covert D, Realini A. Травопрост в лечении открытоугольной глаукомы и глазной гипертензии. Клин Офтальмол. 2007;1(1):11–24. [Бесплатная статья PMC] [PubMed] [Google Scholar]
18. Де Сантис М., Луккезе А., Кардуччи Б., Кавальер А.Ф., Де Сантис Л., Мерола А., Страфас Г., Карузо А. Воздействие латанопроста при беременности. Am J Офтальмол. 2004;138(2):305–306. [PubMed] [Google Scholar]
19. Aptel F, Chiquet C, Romanet JP. Комбинированная терапия аналогами простагландинов для снижения внутриглазного давления. Наркотики. 2012;72(10):1355–1371. [PubMed] [Google Scholar]
20. да Силва Даль Пиццоль Т., Кноп Ф.П., Менге С. С. Пренатальное воздействие мизопростола и врожденные аномалии: систематический обзор и метаанализ. Репродуктивная токсикология. 2006;22(4):666–671. [PubMed] [Академия Google]
С. Пренатальное воздействие мизопростола и врожденные аномалии: систематический обзор и метаанализ. Репродуктивная токсикология. 2006;22(4):666–671. [PubMed] [Академия Google]
21. Ли А.Г., Плесс М., Фалардо Дж., Капоццоли Т., Уолл М., Кардон Р.Х. Применение ацетазоламида при идиопатической внутричерепной гипертензии во время беременности. Am J Офтальмол. 2005;139(5):855–859. [PubMed] [Google Scholar]
22. Scozzafava A, Supuran CT. Глаукома и применение ингибиторов карбоангидразы. Субклеточная биохимия. 2014;75:349–359. [PubMed] [Google Scholar]
23. Nakakura S, Tabuchi H, Baba Y, Maruiwa F, Ando N, Kanamoto T, Kiuchi Y. Сравнение латанопроста 0,005%/тимолола 0,5% + бринзоламида 1% и дорзоламида 1% /тимолол 0,5% + латанопрост 0,005%: 12-недельное рандомизированное открытое исследование. Клин Офтальмол. 2012;6:369–375. [Бесплатная статья PMC] [PubMed] [Google Scholar]
24. Ozawa H, Azuma E, Shindo K, Higashigawa M, Mukouhara R, Komada Y. Преходящий почечный тубулярный ацидоз у новорожденного после трансплацентарного введения ацетазоламида. Eur J Педиатр. 2001;160(5):321–322. [PubMed] [Google Scholar]
Eur J Педиатр. 2001;160(5):321–322. [PubMed] [Google Scholar]
25. Мартинес А., Санчес-Салорио М. Сравнение долгосрочных эффектов 2% дорзоламида и 1% бринзоламида, каждый из которых добавлялся к тимололу 0,5%, на ретробульбарную гемодинамику и внутриглазное давление в больных открытоугольной глаукомой. J Ocul Pharmacol Ther. 2009 г.;25(3):239–248. [Бесплатная статья PMC] [PubMed] [Google Scholar]
26. Цукамото Х., Нома Х., Мацуяма С., Икеда Х., Мисима Х.К. Эффективность и безопасность местного применения бринзоламида и дорзоламида при добавлении к комбинированной терапии латанопростом и бета-блокатором у пациентов с глаукомой. J Ocul Pharmacol Ther. 2005;21(2):170–173. [PubMed] [Google Scholar]
27. Дату А.Р., Накамура Х., Ясуда М. Патогенез деформации передних конечностей у мышей, вызванной ацетазоламидом: электронно-микроскопическое исследование. Тератология. 1985;31(2):253–263. [PubMed] [Google Scholar]
28. Холмс Л.Б., Каваниши Х., Муноз А. Ацетазоламид: материнская токсичность, характер пороков развития и эффект помета. Тератология. 1988;37(4):335–342. [PubMed] [Google Scholar]
Тератология. 1988;37(4):335–342. [PubMed] [Google Scholar]
29. Weaver TE, Scott WJ, Jr Тератогенез ацетазоламида: взаимодействие материнского метаболического и респираторного ацидоза в индукции эктродактилии у мышей C57BL/6J. Тератология. 1984;30(2):195–202. [PubMed] [Google Scholar]
30. Worsham F, Jr, Beckman EN, Mitchell EH. Крестцово-копчиковая тератома у новорожденных в связи с приемом матерью ацетазоламида. ДЖАМА. 1978;240(3):251–252. [PubMed] [Google Scholar]
31. Мерлоб П., Литвин А., Мор Н. Возможная связь между приемом ацетазоламида во время беременности и метаболическими нарушениями у новорожденных. Eur J Obstet Gynecol Reprod Biol. 1990;35(1):85–88. [PubMed] [Google Scholar]
32. Guerra-Hernández N, Matos-Martínez M, Ordaz-López KV, Camargo-Muñiz MD, Medeiros M, Escobar-Pérez L. Клинические и биохимические данные у мексиканских пациентов с дистальными почечными канальцами ацидоз. Rev Invest Clin. 2014;66(5):386–39.2. [PubMed] [Google Scholar]
33. Chapron DJ, Gomolin IH, Sweeney KR. Концентрации ацетазоламида в крови чрезмерны у пожилых людей: склонность к ацидозу и связь с функцией почек. Дж. Клин Фармакол. 1989;29(4):348–353. [PubMed] [Google Scholar]
Chapron DJ, Gomolin IH, Sweeney KR. Концентрации ацетазоламида в крови чрезмерны у пожилых людей: склонность к ацидозу и связь с функцией почек. Дж. Клин Фармакол. 1989;29(4):348–353. [PubMed] [Google Scholar]
34. Falardeau J, Lobb BM, Golden S, Maxfield SD, Tanne E. Использование ацетазоламида во время беременности у пациентов с внутричерепной гипертензией. J Нейроофтальмол. 2013;33(1):9–12. [PubMed] [Google Scholar]
35. Soderman P, Hartvig P, Fagerlund C. Экскреция ацетазоламида в грудное молоко человека. Бр Дж. Клин Фармак. 1984;17(5):599–600. [Бесплатная статья PMC] [PubMed] [Google Scholar]
36. Maul EA, Friedman DS, Quigley HA, Jampel HD. Влияние закрытия век на эффект снижения внутриглазного давления простагландинов: рандомизированное контролируемое исследование. Бр Дж Офтальмол. 2012;96(2):250–253. [PubMed] [Google Scholar]
37. Марсет М.М., Штейн Р.М., Брэдли Э.А., Дэн С.Х., Мейер Д.Р., Билык Дж.Р., Йен М.Т., Ли В.Б., Маун Л.А. Безопасность и эффективность пробок слезоотводящей системы при синдроме сухого глаза: отчет Американской академии офтальмологии. Офтальмология. 2015;122(8):1681–1687. [PubMed] [Академия Google]
Офтальмология. 2015;122(8):1681–1687. [PubMed] [Академия Google]
38. Лю Ю, Бирт CM. Аргоновая трабекулопластика по сравнению с селективной лазерной трабекулопластикой у более молодых пациентов: результаты за 2 года. J Глаукома. 2012;21(2):112–115. [PubMed] [Google Scholar]
39. Нилфорушан Н., Ядгари М., Киш С.К., Нассири Н. Субконъюнктивальный бевацизумаб против митомицина С в дополнение к трабекулэктомии. Am J Офтальмол. 2012;153(2):352–357.эл. [PubMed] [Google Scholar]
40. Olali C, Rotchford AP, King AJ. Исход повторных трабекулэктомий. Клин Эксперимент Офтальмол. 2011;39(7):658–664. [PubMed] [Академия Google]
Лечение глаукомы во время беременности и в послеродовой период
Содержание
- 1 Резюме
- 2 Введение
- 3 Эпидемиология
- 4 Изменения ВГД и течение заболевания
- 5 Лечение
- 5.1 Бета-блокаторы
- 5.2 Агонисты альфа-2
- 5.3 Аналоги простагландинов
- 5.
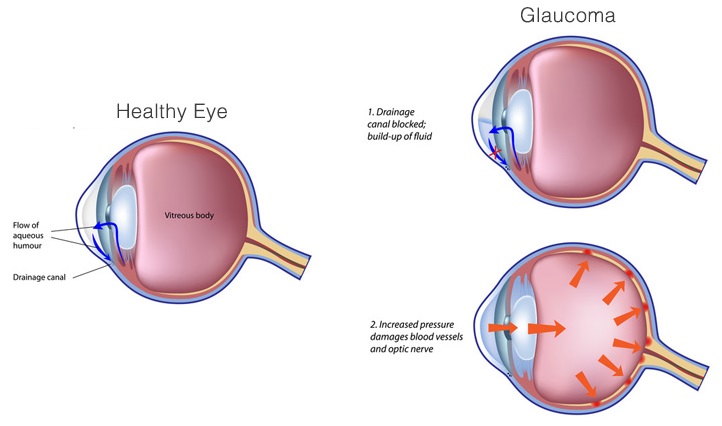 4 Ингибиторы карбоангидразы для местного применения
4 Ингибиторы карбоангидразы для местного применения - 5.5 Пероральные ингибиторы карбоангидразы
- 5.6 Ингибитор Rho-киназы
- 5.7 Минимизация системной абсорбции глазных капель
- 6 Роль лазера
- 7 Хирургия
- 7.1 Хирургические опции
- 7.2 Анестезиологические аспекты хирургии
- 7.3 Хирургическое позиционирование
- 7.4 Интра- и периоперационные лекарства
- 8 стадий беременности
- 8.1 До зачатия
- 8.2 Первый триместр
- 8.3 Второй триместр
- 8.4 Третий триместр 90 022
- 8.5 Труд
- 8.6 Послеродовой период
- 9 Каталожные номера
Лечение глаукомы во время беременности и кормления грудью представляет собой уникальную проблему. Некоторые лекарства от глаукомы могут оказывать неблагоприятное воздействие на плод или младенца, находящегося на грудном вскармливании. Применение этих препаратов следует рассматривать только после тщательного сопоставления потенциальной опасности для плода или младенца с риском ухудшения глаукомы у матери. При медикаментозном лечении следует свести к минимуму системную абсорбцию путем окклюзии носослезного протока или закупорки точек. Следует рассмотреть альтернативы медикаментозному лечению, включая лазерную трабекулопластику или наблюдение за медикаментозным лечением.
При медикаментозном лечении следует свести к минимуму системную абсорбцию путем окклюзии носослезного протока или закупорки точек. Следует рассмотреть альтернативы медикаментозному лечению, включая лазерную трабекулопластику или наблюдение за медикаментозным лечением.
Операции по поводу глаукомы во время беременности следует избегать, особенно в первом триместре, когда риск аборта и тератогенного действия анестетиков, седативных средств и антиметаболитов наиболее высоки. Если хирургическое лечение глаукомы рассматривается во время беременности, следует уделить особое внимание использованию антиметаболитов, положению пациента и типу применяемой анестезии.
Глаукома чаще всего возникает у взрослых старше 40 лет, но иногда встречается у женщин детородного возраста. Часто у женщин уже имеется глаукома, которая первоначально началась в детстве (т. е. врожденная глаукома или дисгенезия переднего сегмента), или глаукома, вторичная по отношению к увеиту, диабету и т. д. Лечение глаукомы во время и во время беременности представляет собой уникальную задачу балансирования риска. потери зрения у матери с потенциальным вредом для плода или новорожденного.
потери зрения у матери с потенциальным вредом для плода или новорожденного.
Здесь мы обсудим лечение глаукомы во время беременности и во время нее. Особое внимание будет уделено периоду до зачатия, стадии беременности и периоду лактации. Кроме того, будут обсуждаться уникальные риски медикаментозного и хирургического лечения глаукомы, а также терапевтические альтернативы и модификации стандартного лечения.
Сообщалось, что глаукома возникает примерно у 2-3% взрослых старше 40 лет, хотя распространенность существенно увеличивается с возрастом для всех рас и этнических групп. Существует мало данных о распространенности глаукомы в возрасте до 40 лет, особенно у женщин детородного возраста. В одном японском исследовании распространенность открытоугольной глаукомы, определяемой по дефекту поля зрения наряду с подтверждающими изменениями зрительного нерва, составила 0,48%, 0,42% и 0,73% среди женщин в возрасте 15–24, 25–34 и 35–44 лет. , соответственно. [1] Кроме того, у женщин детородного возраста может быть глаукома, приобретенная в раннем детстве (врожденная глаукома, дисгенезия переднего сегмента или глаукома после образования катаракты), или глаукома, возникшая в результате сосуществующих состояний, проявляющихся в раннем возрасте, например, увеита или диабета.
Внутриглазное давление обычно снижается во время беременности. В одном исследовании беременных женщин среднее внутриглазное давление у пациенток первого триместра было в среднем на 2 мм рт. ст. выше, чем у пациенток третьего триместра. [2] Потенциальные механизмы такого снижения ВГД включают усиление оттока водянистой влаги из-за гормональных изменений, снижение эписклерального венозного давления из-за снижения венозного давления в верхних конечностях и метаболический ацидоз в результате беременности. [3] [4] В частности, повышенные уровни прогестерона и релаксина могут снижать внутриглазное давление и повышать коэффициент легкости оттока внутриглазной жидкости во время менструального цикла и беременности. Однако степень, в которой эти изменения ВГД следует ожидать у женщин с ранее существовавшей глаукомой, неясна.
Одно небольшое исследование с участием 15 женщин изучало прогрессирование глаукомы во время беременности. Авторы не обнаружили увеличения ВГД или прогрессирования поля зрения у 57% пациентов. Однако у 18% женщин наблюдалось прогрессирующее уменьшение поля зрения, а еще у 18% наблюдалось повышение ВГД без прогрессирования поля зрения. Среди женщин с повышением ВГД среднее повышение составило 10 мм рт. ст. (от 1,3 до 22,5 мм рт. ст.). Многим женщинам из этой второй группы требовалось дополнительное лечение для контроля ВГД. [5]
Однако у 18% женщин наблюдалось прогрессирующее уменьшение поля зрения, а еще у 18% наблюдалось повышение ВГД без прогрессирования поля зрения. Среди женщин с повышением ВГД среднее повышение составило 10 мм рт. ст. (от 1,3 до 22,5 мм рт. ст.). Многим женщинам из этой второй группы требовалось дополнительное лечение для контроля ВГД. [5]
Учитывая колебания ВГД, беременным следует наблюдаться не реже одного раза в триместр для мониторинга.
Безопасность препаратов от глаукомы при беременности была классифицирована Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) на основе данных, полученных в результате исследований на людях и животных.
- Препараты категории А имеют убедительные доказательства безопасности, основанные на исследованиях на людях.
- Препараты категории B имеют различные и/или противоречивые данные о людях и животных. Например, лекарство может быть отнесено к классу B, если исследования на животных показали некоторый вред, но исследования на людях показали безопасность, или если исследования на животных показали безопасность, а исследования на людях не проводились.

- Категория C используется для описания лекарственных средств, которые показали побочные эффекты на животных моделях или в отношении которых имеются неадекватные исследования на животных и людях.
- Препараты категории D указывают на то, что исследования на людях показали риск для плода.
- Препараты категории X демонстрируют убедительные признаки врожденных дефектов.
Обратите внимание, что в настоящее время ни одно из доступных лекарств от глаукомы не имеет рейтинга Категории А, что означает, что все пациенты должны быть осведомлены о потенциальных рисках лекарств от глаукомы в период беременности, и терапия должна проводиться в сотрудничестве с акушер-неонатолог пациента.
Кроме того, новые лекарства от глаукомы нетарсудил (Rhopressa) и латанопростен бунод (Vyzulta) еще не получили категорию FDA из-за отсутствия доступных данных исследований. [6]
Бета-блокаторы
Пероральные бета-блокаторы относятся к категории препаратов класса С при беременности. Для топических бета-блокаторов нет конкретной классификации. Тимолол может проникать через плацентарный барьер, что приводит к брадикардии плода и сердечной аритмии. Кроме того, бета-блокаторы могут секретироваться в грудное молоко и вызывать аналогичные эффекты у новорожденных. Действительно, одно исследование применения тимолола у детей показало, что уровни тимолола в плазме колеблются от 3,5 нг/мл у пятилетнего ребенка до 34 нг/мл у трехнедельного ребенка. [7] В том же исследовании также сообщалось, что средняя часовая концентрация тимолола в плазме снижалась приблизительно на 40% при выполнении точечной окклюзии. Ни в одном официальном исследовании не изучались относительные эффекты различных концентраций тимолола или рекомендаций по дозированию. Однако минимальная разница в снижении ВГД была отмечена для 0,25% тимолола по сравнению с 0,5% тимолола, а также для 0,5% тимолола, принимаемого один раз в день, по сравнению с приемом два раза в день.
Для топических бета-блокаторов нет конкретной классификации. Тимолол может проникать через плацентарный барьер, что приводит к брадикардии плода и сердечной аритмии. Кроме того, бета-блокаторы могут секретироваться в грудное молоко и вызывать аналогичные эффекты у новорожденных. Действительно, одно исследование применения тимолола у детей показало, что уровни тимолола в плазме колеблются от 3,5 нг/мл у пятилетнего ребенка до 34 нг/мл у трехнедельного ребенка. [7] В том же исследовании также сообщалось, что средняя часовая концентрация тимолола в плазме снижалась приблизительно на 40% при выполнении точечной окклюзии. Ни в одном официальном исследовании не изучались относительные эффекты различных концентраций тимолола или рекомендаций по дозированию. Однако минимальная разница в снижении ВГД была отмечена для 0,25% тимолола по сравнению с 0,5% тимолола, а также для 0,5% тимолола, принимаемого один раз в день, по сравнению с приемом два раза в день.
Агонисты альфа-2
Бримонидин классифицируется FDA как лекарство категории B. Однако не проводилось хорошо контролируемых исследований на людях, чтобы исключить потенциальные тератогенные эффекты. Бримонидин представляет значительный риск для новорожденных, поскольку, как сообщается, вызывает угнетение центральной нервной системы и апноэ. Препарат проникает через гематоэнцефалический барьер, может проникать через плаценту и, возможно, выделяться в грудное молоко, создавая реальный риск апноэ или гипотензии у младенцев. Таким образом, даже если бримонидин используется во время беременности, его следует прекратить до родов и во время грудного вскармливания, чтобы предотвратить потенциальное апноэ плода у младенца.
Однако не проводилось хорошо контролируемых исследований на людях, чтобы исключить потенциальные тератогенные эффекты. Бримонидин представляет значительный риск для новорожденных, поскольку, как сообщается, вызывает угнетение центральной нервной системы и апноэ. Препарат проникает через гематоэнцефалический барьер, может проникать через плаценту и, возможно, выделяться в грудное молоко, создавая реальный риск апноэ или гипотензии у младенцев. Таким образом, даже если бримонидин используется во время беременности, его следует прекратить до родов и во время грудного вскармливания, чтобы предотвратить потенциальное апноэ плода у младенца.
Аналоги простагландина
Аналоги простагландина классифицируются как препараты категории C и связаны с высокой частотой выкидышей в исследованиях на животных. Кроме того, систематический обзор показал, что пероральное или вагинальное применение мизопростола во время беременности связано с повышенным риском развития синдрома Мебиуса и терминальных поперечных дефектов конечностей. [8] Простагландины также могут стимулировать сокращения матки, вызывая преждевременные роды, хотя неясно, достаточны ли очень низкие системные концентрации препарата, используемые в офтальмологических препаратах простагландинов, для возникновения этого побочного эффекта. Поэтому эти препараты следует использовать с осторожностью. В одной небольшой серии обследовали 10 женщин, получавших латанопрост в первом триместре. Нормальные роды произошли через 9женщин без пороков развития новорожденного, с одним самопроизвольным абортом, отмеченным у женщины 46 лет. [9] Тем не менее, учитывая теоретический риск преждевременных родов, аналоги простагландинов не являются препаратами первой линии при беременности.
[8] Простагландины также могут стимулировать сокращения матки, вызывая преждевременные роды, хотя неясно, достаточны ли очень низкие системные концентрации препарата, используемые в офтальмологических препаратах простагландинов, для возникновения этого побочного эффекта. Поэтому эти препараты следует использовать с осторожностью. В одной небольшой серии обследовали 10 женщин, получавших латанопрост в первом триместре. Нормальные роды произошли через 9женщин без пороков развития новорожденного, с одним самопроизвольным абортом, отмеченным у женщины 46 лет. [9] Тем не менее, учитывая теоретический риск преждевременных родов, аналоги простагландинов не являются препаратами первой линии при беременности.
Латанопростен бунод (Визульта) — новый препарат от глаукомы, которому в настоящее время не присвоена категория FDA. Он состоит из комбинации аналога простагландина и фрагмента оксида азота и должен рассматриваться в той же категории риска, что и другие аналоги простагландина. [6] Компонент оксида азота, вероятно, не увеличивает риск неблагоприятных событий для плода, и фактически исследования показали, что оксид азота может усиливать кровоток матки и плода.
[6] Компонент оксида азота, вероятно, не увеличивает риск неблагоприятных событий для плода, и фактически исследования показали, что оксид азота может усиливать кровоток матки и плода.
Ингибиторы карбоангидразы для местного применения
Бринзоламид классифицируется как препарат категории C для беременных. В исследованиях на животных наблюдалось статистически более низкое значение массы тела плода при пероральном приеме препарата (в 375 раз больше, чем при офтальмологической дозе для человека). Однако даже при такой высокой дозе пороков развития органов не наблюдалось. [10]
Дорзоламид также относится к категории лекарств C. У кроликов, подвергшихся воздействию дорзоламида во время беременности, наблюдались пороки развития тел позвонков, что позволяет предположить, что бринзоламид может быть лучшей альтернативой. [11]
Нет контролируемых сообщений о применении бринзоламида или дорзоламида при беременности у человека. Таким образом, его можно использовать во время беременности с осторожностью, когда возможная польза для матери превышает теоретический риск для плода. Неясно, выделяются ли эти препараты с грудным молоком, поэтому их безопасность при грудном вскармливании неизвестна.
Таким образом, его можно использовать во время беременности с осторожностью, когда возможная польза для матери превышает теоретический риск для плода. Неясно, выделяются ли эти препараты с грудным молоком, поэтому их безопасность при грудном вскармливании неизвестна.
Пероральные ингибиторы карбоангидразы
Ацетазоламид классифицируется как лекарство категории C. Системное введение высоких доз ингибиторов карбоангидразы крысам может привести к аномалиям передних конечностей. [12] Также сообщалось о случае неонатальной крестцово-копчиковой тератомы у беременной женщины, принимавшей ацетазоламид. [13] С другой стороны, у 12 беременных женщин, принимавших перорально ацетазоламид для лечения идиопатической внутричерепной гипертензии, не было побочных эффектов на плод. [14]
Существует сообщение об одном случае перорального применения ацетазоламида во время беременности с пересечением плаценты, что вызвало преходящий почечный канальцевый ацидоз у новорожденного. [15] Однако в другом отчете о клиническом случае было показано, что уровни ацетазоламида в плазме были низкими у младенцев, подвергшихся воздействию препарата через грудное молоко. [16] Таким образом, ацетазоламид одобрен Американской академией педиатрии (AAP) для использования во время кормления грудью. [17]
[15] Однако в другом отчете о клиническом случае было показано, что уровни ацетазоламида в плазме были низкими у младенцев, подвергшихся воздействию препарата через грудное молоко. [16] Таким образом, ацетазоламид одобрен Американской академией педиатрии (AAP) для использования во время кормления грудью. [17]
Метазоламид также классифицируется как лекарство категории C. Сообщалось о пороках развития скелета у крыс, но при дозе, в 40 раз превышающей дозу для человека. [18] Контролируемых исследований на беременных женщинах не проводилось. Сведения о том, проникает ли препарат в грудное молоко, неизвестны.
Ингибитор Rho-киназы
Нетарсудил (Rhopressa) — новый препарат для лечения глаукомы, которому не присвоена категория FDA. Хотя исследования на животных не показали явного тератогенного действия, существует множество нижестоящих мишеней фермента киназы rho, ингибирование которых может привести к неблагоприятным событиям у плода. [6]
[6]
Минимизация системной абсорбции глазных капель
Все глазные капли обладают потенциальными системными побочными эффектами, которых можно было бы избежать или, по крайней мере, свести к минимуму за счет снижения системной абсорбции препарата. Носослезная окклюзия и закрытие век являются простыми методами, которые могут уменьшить системные побочные эффекты. [19] Носослезная окклюзия выполняется с помощью кончиков пальцев, оказывающих давление на точки и канальцы в течение 5 или более минут, чтобы закупорить носослезный дренаж. В одном исследовании системная абсорбция тимолола для местного применения снижалась на 67% при окклюзии носослезных путей и на 65% при закрытии век. [20]
Кроме того, носослезная окклюзия и закрытие век могут увеличивать время контакта препарата с глазами, что приводит к более высоким внутриглазным концентрациям препарата и меньшей системной абсорбции. [20] Закупорка точек может уменьшить отток слезы и улучшить средний уровень слезного мениска, что снижает системную абсорбцию лекарственного средства. [21] [22]
[21] [22]
Однако прямых исследований системной абсорбции лекарств от глаукомы с закупоркой точек не проводилось. Тем не менее, этот вариант следует обсудить с женщинами, решившими продолжить местную гипотензивную терапию во время беременности и во время нее.
Аргоновая лазерная трабекулопластика (АЛТ) или селективная лазерная трабекулопластика (СЛТ) могут быть рассмотрены беременными женщинами для устранения или уменьшения количества необходимых лекарств и безопасны для выполнения во время беременности. Лазерная периферическая иридотомия и лазерная иридопластика считаются одинаково безопасными. Другие лазерные процедуры, включая эндоциклофотокоагуляцию, также могут быть рассмотрены, если их можно проводить под местной анестезией. [6]
АЛТ менее эффективен в снижении ВГД у молодых пациентов. [23] Ретроспективное исследование аргоновой лазерной трабекулопластики показало, что у 60% пациентов, подвергшихся лазерной трабекулопластике, наблюдалось неконтролируемое внутриглазное давление, и им потребовалось хирургическое вмешательство по поводу глаукомы в течение двух лет после АЛТ. [23] Однако, учитывая короткие сроки беременности, трабекулопластика может быть разумным вариантом для этих пациенток.
[23] Однако, учитывая короткие сроки беременности, трабекулопластика может быть разумным вариантом для этих пациенток.
Одно исследование продемонстрировало снижение ВГД после циклофотокоагуляции у беременной пациентки с увеитной глаукомой. [24]
Хирургические варианты
Хирургическое вмешательство при глаукоме может быть рассмотрено во время беременности, если у пациентки наблюдается прогрессирование глаукомы, несмотря на применение максимально безопасных препаратов. Однако существуют дополнительные риски операции по поводу глаукомы, которые следует учитывать беременным, в том числе риски местной и общей анестезии и потребность в послеоперационных лекарствах. Кроме того, фильтрующая хирургия глаукомы у беременных может иметь относительно более высокий риск неудачи из-за более молодого возраста пациента 90–485 [25] и противопоказания к применению антиметаболитов (например, митомицина С).
Если хирургическое вмешательство считается необходимым, второй триместр обычно считается временем, когда потенциальные риски для матери и ребенка оптимально сбалансированы. [6] Недавнее появление устройств для минимально инвазивной хирургии глаукомы (MIGS) может обеспечить некоторое снижение риска по сравнению с инцизионной хирургией глаукомы, поскольку некоторые MIGS теоретически могут выполняться с местной анестезией, меньшими разрезами и более коротким временем операции. [6]
[6] Недавнее появление устройств для минимально инвазивной хирургии глаукомы (MIGS) может обеспечить некоторое снижение риска по сравнению с инцизионной хирургией глаукомы, поскольку некоторые MIGS теоретически могут выполняться с местной анестезией, меньшими разрезами и более коротким временем операции. [6]
Проблемы с анестезией при хирургии
Хирургическая анестезия во время беременности представляет опасность как для матери, так и для плода. Материнская физиология изменяется таким образом, что объем плазмы и сердечный выброс увеличиваются, а периферическое сосудистое сопротивление снижается, что приводит к снижению артериального давления. Кроме того, положение на спине во втором и третьем триместре может вызвать глубокую гипотензию из-за сдавления маткой аорты и полых вен. В идеале беременных женщин следует укладывать на левый бок, хотя это может усложнить позиционирование глаза во время операции. Перед индукцией анестезии пациентка должна быть хорошо гидратирована и оксигенирована, чтобы предотвратить материнскую гипотензию и гипоксию. [26]
[26]
При беременности увеличивается минутная вентиляция легких и потребление кислорода, а функциональная остаточная емкость снижается. Таким образом, у беременных быстрее развиваются гипоксия и гиперкапния. Кроме того, обеспечение проходимости дыхательных путей затруднено у беременных с увеличением груди, увеличением массы тела и отеком гортани. [26] Риск аспирации желудочного сока при индукции анестезии повышается у беременных, поскольку тонус желудочно-пищеводного сфинктера и перистальтика кишечника снижены. Чтобы снизить риск аспирации желудочного сока, необходимо соблюдать меры предосторожности при полном желудке. [26] В случаях общей анестезии на плод могут воздействовать наркотики, парализующие средства и ингаляционные анестетики. Тиопентал является наркотическим средством, не обладающим тератогенным эффектом в исследованиях на животных и людях. [26] Сукцинилхолин — паралитическое средство, которое часто применяют перед интубацией. Воздействие высоких доз этого агента может вызвать нервно-мышечный паралич у новорожденных. [26] Галотан и закись азота являются ингаляционными анестетиками, которые, согласно исследованиям на животных, вызывают задержку роста и врожденные аномалии. Однако нет хорошо контролируемых исследований на людях, в которых сообщалось бы о тератогенных эффектах этих агентов. [26] Побочные эффекты этих препаратов делают местную анестезию более предпочтительной, если вообще возможной.
Воздействие высоких доз этого агента может вызвать нервно-мышечный паралич у новорожденных. [26] Галотан и закись азота являются ингаляционными анестетиками, которые, согласно исследованиям на животных, вызывают задержку роста и врожденные аномалии. Однако нет хорошо контролируемых исследований на людях, в которых сообщалось бы о тератогенных эффектах этих агентов. [26] Побочные эффекты этих препаратов делают местную анестезию более предпочтительной, если вообще возможной.
Что касается местной анестезии, то сообщалось о брадикардии плода при применении бупивакаина во время беременности, однако лидокаин не вызывал каких-либо побочных эффектов у плода. [27] Если кормящим больным необходимо провести операцию по поводу глаукомы, лидокаин следует ввести сразу после кормления, чтобы уменьшить количество лидокаина в грудном молоке. [28]
Хирургическое позиционирование
Положение на спине во втором и третьем триместре беременности может вызвать глубокую системную гипотензию из-за сдавления маткой аорты и полых вен. Следует уделить внимание вращению бедер, живота и бедер пациента при сохранении нормального положения головы для проведения офтальмологических операций.
Следует уделить внимание вращению бедер, живота и бедер пациента при сохранении нормального положения головы для проведения офтальмологических операций.
В целях безопасности матери следует рассмотреть возможность смещения матки для предотвращения системной гипотензии. Из-за снижения тонуса желудочно-пищеводного сфинктера у беременных следует проводить меры предосторожности на полный желудок, чтобы снизить риск аспирации желудочного сока.
Интраоперационный неинвазивный мониторинг плода следует рассматривать при обширных хирургических вмешательствах, но он может не потребоваться при кратковременных операциях по поводу глаукомы. Тератогенные эффекты анестетиков или седативных средств остаются возможным риском. Отказ от хирургического вмешательства в первом триместре может снизить риск тератогенного действия и самопроизвольного аборта. [29]
Риск преждевременных родов или аборта увеличивается при хирургическом вмешательстве во время беременности. Топографический мониторинг в послеоперационном периоде позволяет выявить преждевременные роды. [30] Мониторинг сердечного ритма плода является хорошим методом выявления асфиксии плода во время операции. [30] Кроме того, ультразвуковое исследование плода до и сразу после операции целесообразно для изучения грубых анатомических аномалий плода.
[30] Мониторинг сердечного ритма плода является хорошим методом выявления асфиксии плода во время операции. [30] Кроме того, ультразвуковое исследование плода до и сразу после операции целесообразно для изучения грубых анатомических аномалий плода.
Интра- и периоперационные препараты
Митомицин С является антифибротическим средством, которое часто применяется в хирургии глаукомы, однако он относится к категории X FDA. Уменьшение среднего размера приплода и массы тела и увеличение экзэнцефалии у мышей были связаны с применением митомицина. [31] Нет исследований, сообщающих о тератогенном действии этого препарата на плод человека, хотя механизм действия препарата убедительно свидетельствует о возможном тератогенном риске.
Фторурацил является антиметаболитом, который также относится к категории X FDA и связан с несколькими врожденными аномалиями у матерей, которые получали 5-фторурацил внутривенно в первом триместре. [31] Риск субконъюнктивального введения неизвестен.
Следует избегать использования антиметаболитов для хирургии глаукомы у беременных женщин из-за потенциальных тератогенных эффектов. [32]
Местные антибиотики обычно используются после операции по поводу глаукомы, и описаны риски многих антибиотиков во время беременности, в основном при пероральном применении.
Эритромицин — старейший из макролидов, плохо проходит через плаценту. Этот препарат относится к категории В. Нет исследований, касающихся эритромицина и врожденных аномалий. Также нет сообщений о побочных эффектах макролидов при грудном вскармливании. [33] Тетрациклины классифицируются как препараты категории D, которые могут быстро проникать через плаценту. Они могут вызывать изменение цвета молочных зубов на коричневый цвет и подавлять рост костей при применении после пятнадцати недель беременности, однако данных об изменении цвета зубов при их применении у кормящих матерей нет. [33]
Аминогликозиды относятся к препаратам категории D. Гентамицин, неомицин и тобрамицин являются аминогликозидами, которые быстро проникают через плаценту. Нет никаких доказательств того, что аминогликозиды вызывают тератогенные эффекты у плода, за исключением возможного повреждения восьми черепных нервов. [26] Тобрамицин может быть обнаружен только в ограниченных количествах в материнском молоке. [33]
Гентамицин, неомицин и тобрамицин являются аминогликозидами, которые быстро проникают через плаценту. Нет никаких доказательств того, что аминогликозиды вызывают тератогенные эффекты у плода, за исключением возможного повреждения восьми черепных нервов. [26] Тобрамицин может быть обнаружен только в ограниченных количествах в материнском молоке. [33]
Хлорамфеникол не рекомендуется для использования во время беременности, поскольку он связан с синдромом серого ребенка [26]
Фторхинолоны относятся к препаратам категории С. Ципрофлоксацин, левофлоксацин, гатифлоксацин и моксифлоксацин являются фторхинолонами, проникающими через плаценту. Исследования на животных показали, что хинолон может вызывать повреждение хрящей плода. Тем не менее, одно исследование беременных женщин в первом триместре, получавших фторхинолоны, не показало значительного увеличения врожденных аномалий. [33] Что касается грудного вскармливания, нет сообщений о попадании левофлоксацина, гатифлоксацина и моксифлоксацина в грудное молоко. В экспериментах на животных хинолон может повредить хрящ сустава. [33]
В экспериментах на животных хинолон может повредить хрящ сустава. [33]
Таким образом, эритромицин, по-видимому, оказывает меньше побочных эффектов при беременности и в период лактации, и его следует настоятельно рассматривать как антибиотик выбора после операции по поводу глаукомы у беременных или кормящих женщин.
Кортикостероиды классифицируются как препараты категории С. Местные кортикостероиды почти всегда используются после операции по поводу глаукомы. Все системные глюкокортикоиды проникают через плаценту. Преднизолон и метилпреднизолон реже проникают через плаценту, чем бетаметазон и дексаметазон, и могут оказывать меньшее влияние на плод. [33] Были опубликованы некоторые исследования, предполагающие отсутствие тератогенного действия пероральных стероидов на плод. [32] Учитывая сильную тенденцию к использованию местных стероидов после операции по поводу глаукомы и отсутствие явных осложнений, связанных с этими лекарствами, эти лекарства можно использовать беременным или кормящим женщинам.
Атропин классифицируется как лекарство категории С. Местный атропин иногда используется в послеоперационном периоде при хирургии глаукомы. Атропин может влиять на частоту сердечных сокращений плода, хотя эффект может быть менее вероятным при офтальмологической дозе. [26]
Для всех местных препаратов, используемых в сочетании с хирургическим вмешательством по поводу глаукомы, следует рассмотреть окклюзию точек и закрытие век для снижения системной абсорбции препарата.
До зачатия
В идеале обсуждение плана лечения глаукомы у женщины должно начинаться до начала беременности. Таким образом, побочные эффекты лекарств можно предотвратить в течение первого триместра, когда происходит большая часть органогенеза. Кроме того, до начала беременности можно изучить или применить альтернативные эффективные методы снижения ВГД (включая, при необходимости, хирургическое вмешательство). Женщины детородного возраста должны немедленно сообщить своему врачу, если они подозревают, что беременны, или если они планируют завести или увеличить свою семью.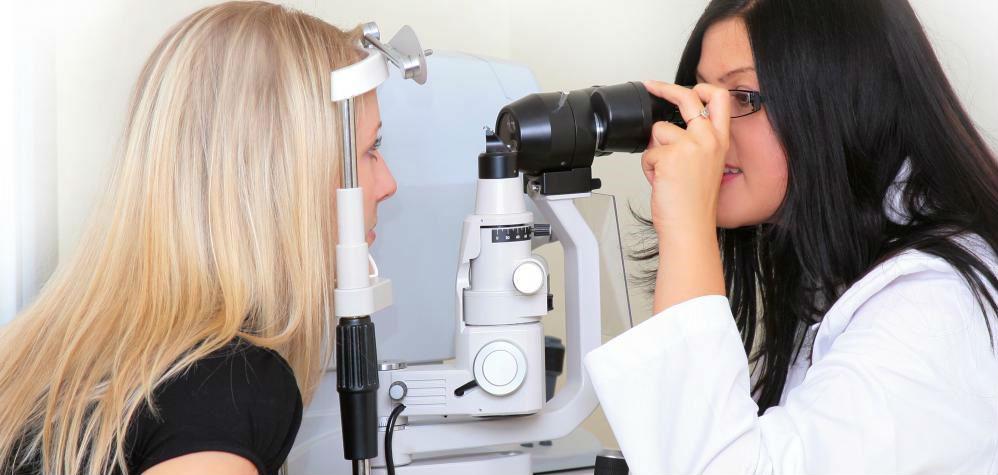
Первый триместр
Обсуждение рисков медикаментозного лечения и наилучшей стратегии снижения ВГД следует проводить сразу после выявления беременности, поскольку органогенез часто начинается при первом выявлении беременности, а лекарства, принимаемые во время органогенеза, могут привести к рождению ребенка. дефекты. Обсуждения беременности должны включать обсуждение концентрации/дозировки лекарств, методов минимизации системной абсорбции лекарств, а также возможности отмены лекарств на некоторые периоды беременности. Первые 8 недель являются наиболее важными для основного органогенеза, поэтому плод наиболее уязвим в течение первого триместра.
Бримонидин, препарат категории B, может быть самым безопасным вариантом для первого триместра. Следует по возможности избегать приема других препаратов против глаукомы, таких как бета-блокаторы, простагландины и ингибиторы карбоангидразы, в первом триместре, чтобы уменьшить потенциальные тератогенные эффекты или преждевременный аборт. Обсуждения с пациентом могут включать наблюдение за лечением в этот критический период.
Обсуждения с пациентом могут включать наблюдение за лечением в этот критический период.
При хирургическом лечении глаукомы анестетики, седативные средства и антиметаболиты являются возможными тератогенными агентами. Таким образом, отказ от операции в первом триместре может снизить риск тератогенного действия и самопроизвольного аборта.
Второй триместр
Во втором триместре бримонидин по-прежнему считается препаратом первой линии. Бета-блокаторы можно использовать с регулярным мониторингом частоты сердечных сокращений плода и его роста. Если используются аналоги простагландинов, пациентке следует описать симптомы и признаки преждевременных родов, а при появлении таких симптомов прием препарата следует прекратить. При применении местных или пероральных ингибиторов карбоангидразы можно рассмотреть возможность наблюдения за задержкой роста плода.
Третий триместр
Бримонидин, бета-блокаторы или местные ингибиторы карбоангидразы можно использовать с осторожностью.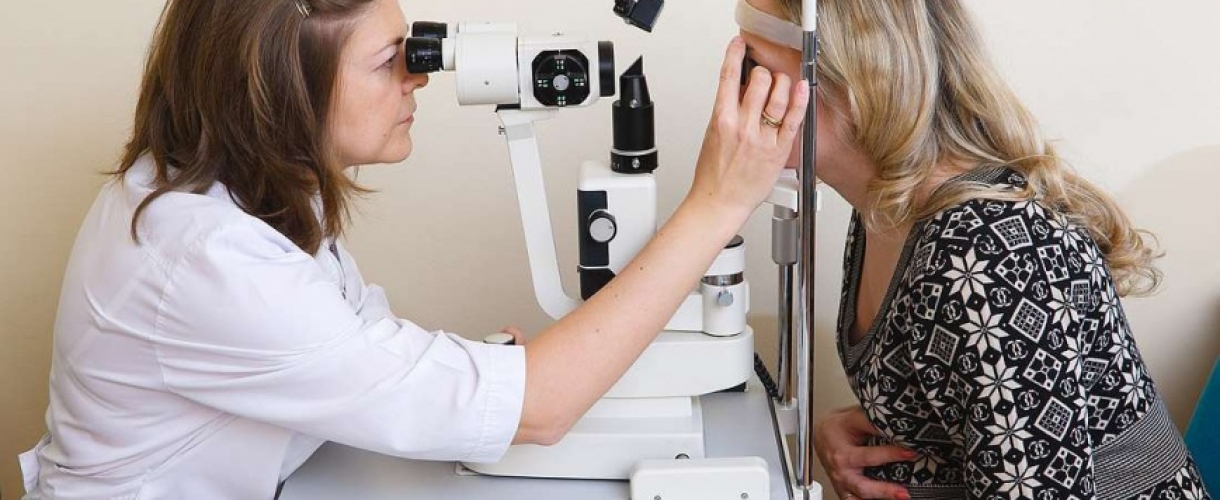 Отказ от простагландинов может снизить риск преждевременных родов, что особенно важно в начале третьего триместра. В конце третьего триместра следует прекратить прием бримонидина, поскольку он может вызвать угнетение центральной нервной системы у новорожденных. Бета-блокаторы следует использовать с тщательным мониторингом роста плода и частоты сердечных сокращений. Местные ингибиторы карбоангидразы следует использовать при тщательном мониторинге статуса ацидоза. [6]
Отказ от простагландинов может снизить риск преждевременных родов, что особенно важно в начале третьего триместра. В конце третьего триместра следует прекратить прием бримонидина, поскольку он может вызвать угнетение центральной нервной системы у новорожденных. Бета-блокаторы следует использовать с тщательным мониторингом роста плода и частоты сердечных сокращений. Местные ингибиторы карбоангидразы следует использовать при тщательном мониторинге статуса ацидоза. [6]
Латанопростен, бунод и нетарсудил имеют теоретический риск остановки родов, и их следует по возможности избегать в послеродовом периоде. [6]
Операция по поводу глаукомы может проводиться с осторожностью во втором и третьем триместре, если у пациенток есть серьезные показания к операции. Тем не менее, анестетики, седативные средства и антиметаболиты по-прежнему имеют потенциальный риск для плода. Кроме того, необходимо выполнить смещение матки, чтобы предотвратить гипотонию матери, которая может вызвать асфиксию плода.
Аргоновая лазерная трабекулопластика (АЛТ) или селективная лазерная трабекулопластика (СЛТ) — это альтернативный метод лечения глаукомы, который можно проводить во всех триместрах. АЛТ или СЛТ могут быть менее эффективными для долгосрочного контроля ВГД, но могут привести к кратковременному контролю ВГД до конца беременности.
Роды
Существуют теоретические опасения, что Вальсава, связанная с родами, вызывает повышение ВГД у матери, однако не было доказано, что нормальные вагинальные роды изменяют ВГД у здоровых женщин. [6] Пациентки с глаукомой должны проходить стандартную акушерскую помощь во время родов и родоразрешения, так как нет доказательств в поддержку рекомендации кесарева сечения (кесарева сечения) или планового прерывания беременности именно по поводу глаукомы. Исключением являются пациенты в раннем послеоперационном периоде после операции на трубе или трабекулэктомии, и для этих пациентов кесарево сечение следует обсудить с акушером пациента.
Послеродовой
Ингибиторы карбоангидразы и бета-блокаторы сертифицированы Американской академией педиатрии для использования во время кормления грудью. Однако при применении в период грудного вскармливания следует учитывать наименьшую эффективную дозу этих препаратов. Бримонидин противопоказан к применению кормящим матерям из-за риска угнетения центральной нервной системы у новорожденного.
- ↑ Йошидаа М., Окадаа Э. и Мизукиб Н. Возрастная распространенность открытоугольной глаукомы и ее связь с рефракцией среди более чем 60 000 бессимптомных японцев. Дж. Клин Эпи 2001; 54: 1151-1158.
- ↑ Calbert IP, Sheila MG. Глазной гипотензивный эффект поздних сроков беременности с высоким кровяным давлением и без него. Бр Дж. Офтальмол 1985; 69: 117–119.
- ↑ Беккер Б., Фриденвальд Дж. С. Клинический водянистый отток. Arch Ophthalmol 1953; 50: 557–71.
- ↑ Джиллиан Д.П., Стивен Дж.Х. М. Влияние гормонов на простую глаукому. Предварительный отчет.
 Бр J Офтальмол 1963;47:129-137.
Бр J Офтальмол 1963;47:129-137. - ↑ Стейси К.Б., Тереза К.С., Томас Х. и др. Течение глаукомы при беременности. Arch Ophthalmol 2006; 124:1089-1094.
- ↑ 6.0 6.1 6,2 6,3 6,4 6,5 6.6 6.7 6.6 6.7 6.6 6.7 6.6 6.7 6.6. Курр Опин Офтальмол. 2020 март; 31(2):114-122. doi: 10.1097/ICU.0000000000000641. PMID: 31922978.
- ↑ Пассо М.С., Палмер Э.А., Ван Баскирк Э.М. Плазменный тимолол у больных глаукомой. Офтальмология. 1984 ноября; 91 (11): 1361-3.
- ↑ Татьяна да Силва Даль Пиццоль, Флавия Поццобон Кноп и Сотеро Серрат Менге. Пренатальное воздействие мизопростола и врожденные аномалии: систематический обзор и метаанализ. Репродуктивная токсикология 2006; 22:666–671.
- ↑ Марко Де С., Анжела Л., Бриджида С. и др. Воздействие латанопроста при беременности. Ам Дж.
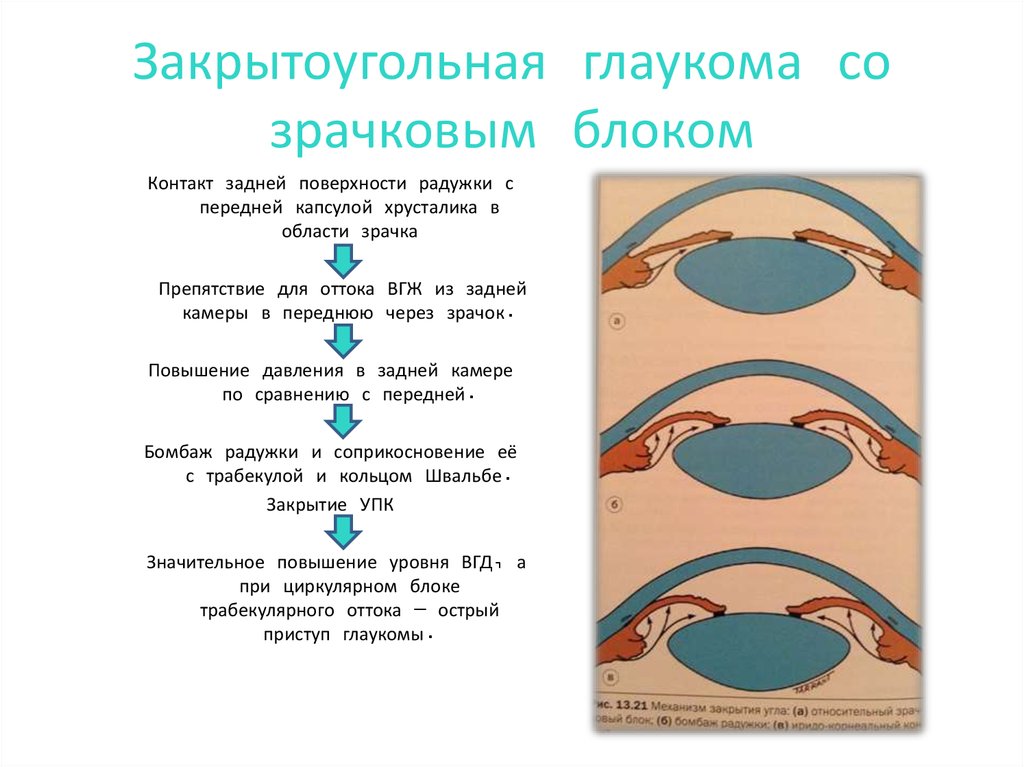 Офтальмол 2004; 138:305-306.
Офтальмол 2004; 138:305-306. - ↑ Информация производителя: монография на продукцию Азопт. Техас: Alcon Ophthalmics, Форт-Уэрт, апрель 1998 г.
- ↑ Информация производителя: монография на продукцию Трусопт. Пенсильвания: Merck & Co Inc., Вест-Пойнт, февраль 1999 г.
- ↑ Холмс Л.Б., Каваниши Х., Муньос А. Ацетазоламид: материнская токсичность, характер пороков развития и эффект помета. Тератология 1988; 37: 335–342.
- ↑ Уоршам Ф. мл., Бекман Э. Н., Митчелл Э. Х. Крестцово-копчиковая тератома у новорожденных в связи с приемом матерью ацетазоламида. ЯМА 1978; 240: 251–252.
- ↑ Lee AG, Pless M, Falardeau J, Capozzoli T, Wall M, Kardon RH. Применение ацетазоламида при идиопатической внутричерепной гипертензии во время беременности. Ам Дж. Офтальмол 2005; 139: 855–859.
- ↑ Ozawa H, Azuma E, Shindo K, Higashigawa M, Mukouhara R, Komada Y. Транзиторный ацидоз почечных канальцев у новорожденного после трансплацентарного введения ацетазоламида.
 Eur J Pediatr 2001;160:321-2.
Eur J Pediatr 2001;160:321-2. - ↑ Содерман П., Хартвиг Ф. Экскреция ацетазоламида в грудное молоко человека. Br J clin Pharmac 1984; 17:599-600.
- ↑ Комитет по лекарствам Американской академии педиатрии: перенос лекарств и других химических веществ в грудное молоко [опубликованная опечатка появляется в Pediatrics 1990 May;85(5):847] [см. комментарии]. Педиатрия 84:924–36, 1989 г.
- ↑ Информация производителя: Метазоламид. Грузия: лаборатории Effcon, INC.
- ↑ Флач Эй Джей. Важность закрытия век и носослезной окклюзии после закапывания в глаза местных препаратов от глаукомы и необходимость универсального включения одного из этих методов во все виды лечения пациентов и клинические исследования Trans Am Ophthalmol Soc. 2008 декабрь; 106: 138–148.
- ↑ 20.0 20.1 Циммерман Т.Дж., Кунер К.С., Кандаракис А.С. Улучшение терапевтического индекса глазных препаратов местного применения. Арка Офтальмол 1984;102:551-553.

- ↑ Lindén C, Alm A. Влияние уменьшения оттока слезы на концентрацию флуоресцеина в роговице и воде. Acta ophthalmol 1990;68:633-8,
- ↑ Берджесс П.И., Коай П. и Кларк П. SmartPlug в сравнении с силиконовой пробкой для лечения сухости глаз: проспективное рандомизированное исследование. Роговица 2008;27:391-4.
- ↑ 23,0 23,1 Сафран М.Дж., Робин А.Л., Поллак И.П. Аргонлазерная трабекулопластика у молодых пациентов с первичной открытоугольной глаукомой. Am J Офтальмол. 1984;97:292-295.
- ↑ М. Вертхейм, округ Колумбия, Бродвей. Циклодиодная лазерная терапия для контроля внутриглазного давления во время беременности. Бр Дж. Офтальмол 2002; 86: 1318-1319.
- ↑ The Advanced Glaucoma Intervention Study (AGIS) 11. Факторы риска неудачи трабекулэктомии и аргоновой лазерной трабекулопластики. Ам Дж. Офтальмол 2002; 134:481-489.
- ↑ 26,0 26,1 26,2 26,3 26,4 26,5 28,6 9044 80486 26,8 Маленький ВВ.

