Беременность и аденома гипофиза: Гиперпролактинемия и беременность (обзор литературы)
Гиперпролактинемия и беременность (обзор литературы)
Беременность сопровождается значительными гормональными преобразованиями. Гипофиз является одним из наиболее вовлеченных в процесс гормональной перестройки органов, что проявляется в течение беременности его структурными и функциональными изменениями. В связи с этим затруднена оценка гормонального профиля, который в значительной степени отличается от показателей, предшествующих беременности. Аденомы гипофиза могут приводить к нарушениям гормональной секреции, отрицательно влияющим на мать и плод.
В течение различных периодов онтогенеза наблюдаются изменения размеров гипофиза. В течение первых двух декад жизни отмечается его усиленный рост, и к репродуктивному возрасту гипофиз достигает 10 мм в длину, 5—10 мм в высоту и 10—15 мм в ширину. У женщин в детородном периоде отмечается тенденция к увеличению размеров гипофиза, у беременных увеличение размеров гипофиза выявляется всегда. Это происходит в результате процессов гиперплазии и гипертрофии лактотрофов вследствие стимулирующего воздействия на них эстрогенов и прогестерона [10].
Однако при беременности физиологическое увеличение размеров гипофиза в некоторых случаях необходимо дифференцировать от патологических состояний. Дифференциальный диагноз у беременных женщин представляет определенные сложности, поскольку магнитно-резонансная томография (МРТ) гипофиза не является достаточно специфичным методом исследования и имеет строгие показания к назначению в течении беременности. При ее выполнении следует обратить внимание на такие изменения, как асимметричное увеличение размеров гипофиза и отклонение ножки гипофиза, не встречающиеся при физиологическом увеличении и указывающие на наличие аденомы. Высота гипофиза, превышающая в течение беременности показатели 9—10 мм, а в первые дни после родов — 12 мм, также может свидетельствовать о патологии [2, 10].
Гипофиз и его тропные гормоны при беременности являются ключевым звеном в системе регуляции лактации. Основная роль в этом процессе отводится влиянию пролактина. Воздействие пролактина на молочные железы заключается в обеспечении их развития (маммогенез), синтеза молока (лактогенез) и поддержании секреции молока (галактопоэз). Стимуляция соответствующей стадии развития секреторного аппарата молочных желез достигается совместно с воздействием эстрогенов, прогестерона, плацентарного лактогена, инсулина, кортизола, тиреоидных гормонов, гормона роста и ряда других ростовых факторов. Особо важную роль пролактин играет в послеродовом периоде, существенно влияя на секрецию молока в первые несколько недель после родов [1].
Стимуляция соответствующей стадии развития секреторного аппарата молочных желез достигается совместно с воздействием эстрогенов, прогестерона, плацентарного лактогена, инсулина, кортизола, тиреоидных гормонов, гормона роста и ряда других ростовых факторов. Особо важную роль пролактин играет в послеродовом периоде, существенно влияя на секрецию молока в первые несколько недель после родов [1].
У женщин репродуктивного возраста (не беременных и не кормящих) среднее содержание пролактина не намного превышает его уровень у мужчин. При беременности у женщины происходит прогрессирующее увеличение уровня пролактина параллельно с повышением уровня эстрогенов. В I триместре его концентрация обычно не превышает 30 нг/мл. Максимальный уровень пролактина (200 нг/мл и более) отмечается непосредственно перед родами [10].
Высокие концентрации прогестерона, эстрогенов и плацентарного лактогена в течение беременности подавляют лактацию. Резкое снижение уровня эстрогенов после родов способствует «разблокированию» рецепторов к пролактину в молочных железах: сохраняющаяся при этом гиперпролактинемия инициирует лактацию.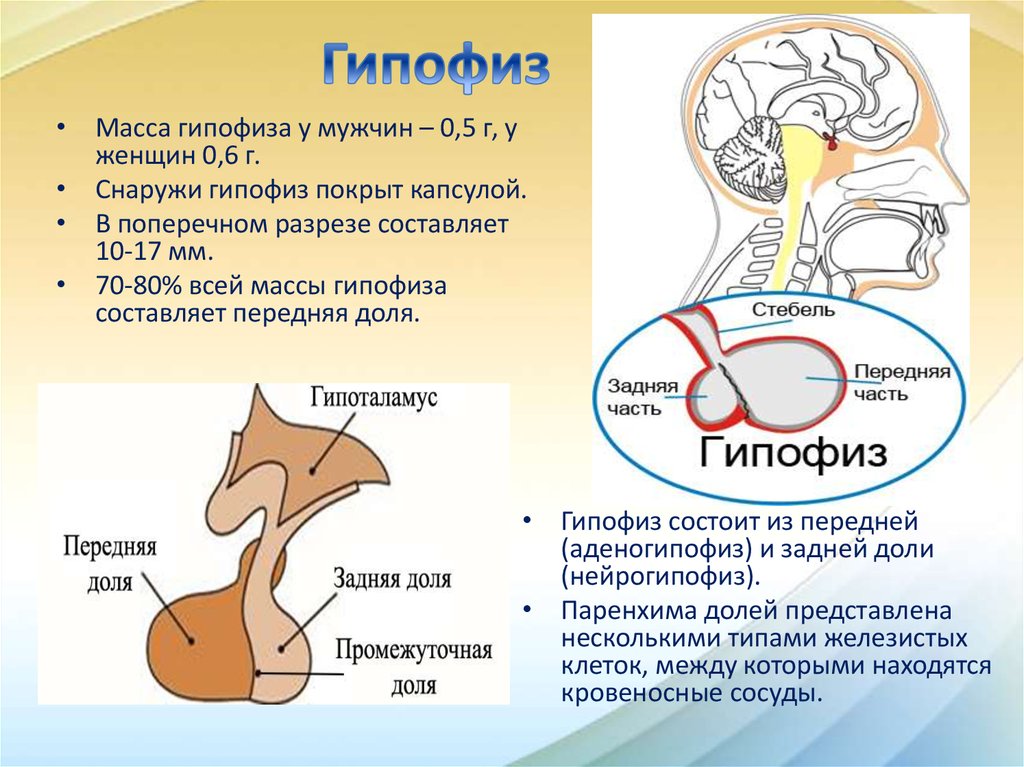 Далее в течение 1-й недели после родов содержание пролактина у кормящих матерей быстро уменьшается. В последующие 2—3 нед после родов его концентрация снижается до исходного уровня, предшествовавшего беременности. Акт сосания является триггером, инициирующим повышение содержания пролактина в 3—5 раз при каждом эпизоде прикладывания ребенка к груди [1].
Далее в течение 1-й недели после родов содержание пролактина у кормящих матерей быстро уменьшается. В последующие 2—3 нед после родов его концентрация снижается до исходного уровня, предшествовавшего беременности. Акт сосания является триггером, инициирующим повышение содержания пролактина в 3—5 раз при каждом эпизоде прикладывания ребенка к груди [1].
Синтез и секреция пролактина в гипофизе плода начинаются с 5-й недели онтогенеза. С 10-й недели содержание гормона в крови плода возрастает, достигая максимума к концу беременности. В последние недели гестации его уровень в пупочной вене плода выше, чем у матери. К концу 1-й недели постнатального периода концентрация пролактина в крови новорожденного резко снижается. Предполагается, что физиологическая значимость пролактина для плода заключается в процессах осморегуляции и созревания легочной ткани [1].
В течение гестационного периода интенсивный синтез пролактина осуществляется не только лактотрофами аденогипофиза, но и децидуальной тканью.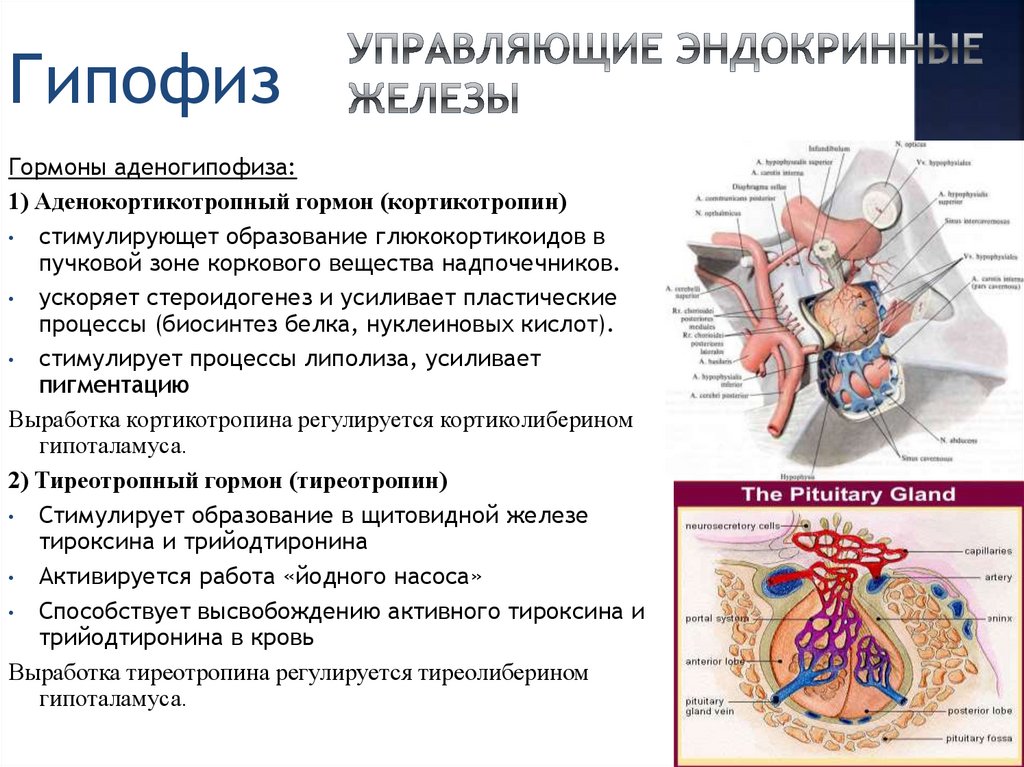 Пролактин, содержащийся в околоплодных водах, не связан с его поступлением из крови женщины и не подвержен ингибирующему действию дофамина и его агонистов. Концентрация гормона в амниотической жидкости в 5—10 раз превышает его содержание в сыворотке крови беременной. Роль экстрагипофизарного пролактина до конца не изучена, однако предполагается, что он принимает участие в осморегуляции амниотической жидкости и совместно с децидуальным релаксином влияет на сократительную способность матки в родах [3, 10].
Пролактин, содержащийся в околоплодных водах, не связан с его поступлением из крови женщины и не подвержен ингибирующему действию дофамина и его агонистов. Концентрация гормона в амниотической жидкости в 5—10 раз превышает его содержание в сыворотке крови беременной. Роль экстрагипофизарного пролактина до конца не изучена, однако предполагается, что он принимает участие в осморегуляции амниотической жидкости и совместно с децидуальным релаксином влияет на сократительную способность матки в родах [3, 10].
Помимо физиологического увеличения уровня пролактина выделяют и патологическую гиперпролактинемию. Пролактиномы (микро- и макроаденомы) являются одной из наиболее частых причин стойкой гиперпролактинемии и выявляются в 50% всех случаев определения гормонально-активных опухолей гипофиза [10].
Реже причинами патологической гиперпролактинемии являются неактивные опухоли гипофиза, синдром «пустого» турецкого седла, лучевые и другие травмирующие воздействия, системные заболевания, симптоматическая гиперпролактинемия (медикаментозная, алкогольная, психогенная, вследствие поражения периферических эндокринных желез) , а также идиопатическая гиперпролактинемия [1].
Наличие избыточной продукции пролактина у пациентов ведет к развитию гиперпролактинемического гипогонадизма.
Клиническая картина при гиперпролактинемическом гипогонадизме отличается от таковой у женщин в постменопаузе тем, что в первом случае не отмечается развития атрофии морфологических структур молочных желез и увеличения уровня гонадотропинов [10].
Под влиянием избыточной продукции пролактина снижается продукция гонадотропин-рилизинг-гормонов (ГнРГ) в гипоталамусе, в связи с чем происходит подавление синтеза и секреции гонадотропинов — ЛГ и ФСГ, уменьшается пульсовая активность ЛГ, характерная для нормального функционирования репродуктивной системы. Гиперпролактинемия также блокирует эффекты гонадотропинов на уровне органов-мишеней (гонад), что приводит к гипоэстрогенемии, уменьшает синтез прогестерона, стимулирует секрецию надпочечниками андрогенов [20].
Хроническая гиперпродукция пролактина приводит, таким образом, к нарушениям менструального цикла, ановуляции и бесплодию, галакторее и увеличению массы тела. Для гиперпролактинемического гипогонадизма характерна нормогонадотропная ановуляция, при этом вызванное им бесплодие излечимо [3].
Для гиперпролактинемического гипогонадизма характерна нормогонадотропная ановуляция, при этом вызванное им бесплодие излечимо [3].
По данным некоторых зарубежных исследователей [15], гиперпролактинемия довольно часто является причиной нарушений менструального цикла и встречается у 9% женщин с аменореей, у 25% — с галактореей и у 70%, имеющих оба эти симптома.
В настоящее время в лечении нарушений менструального цикла и бесплодия успешно применяются препараты агонистов дофамина. Восстановление овуляторного менструального цикла наблюдается у 70—80% пациенток, получающих лечение бромокриптином и хинаголидом, и более чем у 90% — при терапии каберголином. При первом назначении терапии агонистами дофамина женщины должны быть предупреждены, что восстановление овуляции и фертильности может произойти немедленно (даже до их первой физиологической менструации) [2].
Так, при длительном (в течение 24 мес) наблюдении за 207 пациентками с гиперпролактинемией вследствие микро- и макроденом, а также гиперпролактинемии неопухолевого генеза на фоне лечения каберголином отмечались более выраженные улучшения при нормализации уровня пролактина и уменьшении объемов опухоли как при макропролактиномах (82,1% против 46,4%), так и при микропролактиномах (90% против 56,8%), чем на фоне приема бромокриптина [18].
В рандомизированном двойном слепом исследовании, выполненном J. Webster и соавт. [21], проводилось наблюдение за 459 женщинами с гиперпролактинемической аменореей по причине микропролактином и идиопатической гиперпролактинемии в течение 24 нед приема агонистов дофамина. На фоне приема каберголина также наблюдалась более выраженная тенденция к нормализации уровня пролактина (83% против 59%) и степень восстановления овуляторных циклов и наступления беременности (72% против 52%), чем на фоне приема бромокриптина. При увеличении же продолжительности приема каберголина до 40 нед восстановление овуляции и/или наступление беременности отмечалось у 90% пациенток. Также переносимость бромокриптина хуже по сравнению с таковой каберголина.
Желательно применять контрацептивные меры при лечении препаратами агонистов дофамина даже у женщин, желающих забеременеть. В этом случае применение механической контрацепции рекомендуется в первые 2—3 менструальных цикла после начала терапии, что позволяет определить межменструальный интервал, вовремя заподозрить беременность, провести ее биохимическое подтверждение для дальнейшего точного расчета возраста плода [2].
В международных клинических практических рекомендациях по диагностике и лечению гиперпролактинемии рекомендована отмена агонистов дофамина у женщин с пролактиномами при установлении факта беременности. У некоторых пациенток с макроаденомами, забеременевших на фоне приема агонистов дофамина и не подвергавшихся ранее хирургическому лечению или радиотерапии по поводу аденомы гипофиза, возможно продолжение приема препаратов агонистов дофамина в течение беременности, особенно если опухоль имеет тенденцию к инвазивному росту или воздействует на хиазму зрительных нервов. Поскольку агонисты дофамина проникают через плаценту, препарат в большинстве случаев необходимо отменять в первые 4 нед после зачатия. Препараты агонистов дофамина не обладают эмбриотоксичностью, и отмена их обусловлена тем, что во время беременности повышенный уровень пролактина является физиологичным [3, 12].
Безопасность применения бромокриптина у женщин с идиопатической или вызванной аденомами гипофиза гиперпролактинемией в течение I триместра беременности доказана и широко подтверждена множеством зарубежных исследований [3, 12, 19, 21].
При динамическом наблюдении более чем за 6000 беременностей у пациенток, принимавших бромокриптин по поводу гиперпролактинемии, не отмечалось увеличения частоты возникновения внутриутробных пороков развития или преждевременного прекращения беременности [13].
По данным других зарубежных исследований [5, 6, 11], также не выявлено тератогенного воздействия препарата на плод. Прием бромокриптина на ранних сроках беременности не был ассоциирован с увеличением частоты возникновения спонтанных абортов, внематочной и многоплодной беременности, преждевременных родов.
Также, по данным J. Raymond и соавт. [17], при длительном (с рождения и до 9 лет) наблюдении за детьми, матери которых принимали бромокриптин в течение беременности, не установлено отрицательного влияния препарата на их умственное и физическое развитие.
В настоящее время в клинической практике для лечения гиперпролактинемии активно используется селективный агонист дофамина пролонгированного действия — каберголин. На фоне приема каберголина отмечается меньшее количество побочных эффектов и, как следствие этого, — лучшая переносимость препарата по сравнению с бромокриптином, что связано с большей селективностью по отношению к D-2 дофаминовым рецепторам более длинным периодом полувыведения препарата и незначительными колебаниями концентрации препарата в плазме крови пациенток [21].
На фоне приема каберголина отмечается меньшее количество побочных эффектов и, как следствие этого, — лучшая переносимость препарата по сравнению с бромокриптином, что связано с большей селективностью по отношению к D-2 дофаминовым рецепторам более длинным периодом полувыведения препарата и незначительными колебаниями концентрации препарата в плазме крови пациенток [21].
Каберголин также подтвердил свою безопасность при лечении нарушений фертильности у женщин с гиперпролактинемией и применении его при беременности [12].
По данным M. Ono и соавт. [16], в проспективном исследовании с участием 85 женщин (из них 29 — с макропролактиномами и 56 — с микропролактиномами), получавших высокие дозы каберголина в связи с гиперпролактинемическим гипогонадизмом, нормализация уровня пролактина и восстановление овуляторных циклов наблюдались у всех пациенток. У 80 (94%) из них на фоне приема каберголина развилась беременность. Препарат был отменен в течение первых 4 нед гестации, все дети родились здоровыми, у матерей при этом не отмечалось симптомов роста размеров опухоли, а именно: ухудшения зрения или возникновения головной боли.
G. Stalldecker и соавт. [19] провели наблюдение за течением и исходами 103 беременностей у 90 женщин с гиперпролактинемией. Зачатие во всех случаях возникало на фоне приема каберголина. Прием препарата осуществлялся по показаниям в течение периода от 3 до 25 нед гестации. 96,9% женщин получали каберголин в течение I триместра беременности, остальные — до конца II триместра. При этом не отмечалось значимых осложнений беременности на фоне приема препарата. У 7 женщин наблюдалось развитие спонтанного аборта на ранних сроках беременности, что не отличалось от показателей предыдущих исследований и не превышало частоты развития данного осложнения в общей популяции. Преждевременные роды зарегистрированы у 8 (8,8%) женщин, что также соответствует показателям общей популяции. Неонатальные пороки развития отмечались в 3,6% случаев: 1 существенный — синдром Дауна и 2 незначительных порока — пупочная и паховая грыжи. Однако частота возникновения данных пороков развития на фоне приема каберголина не превышала таковую для общей популяции.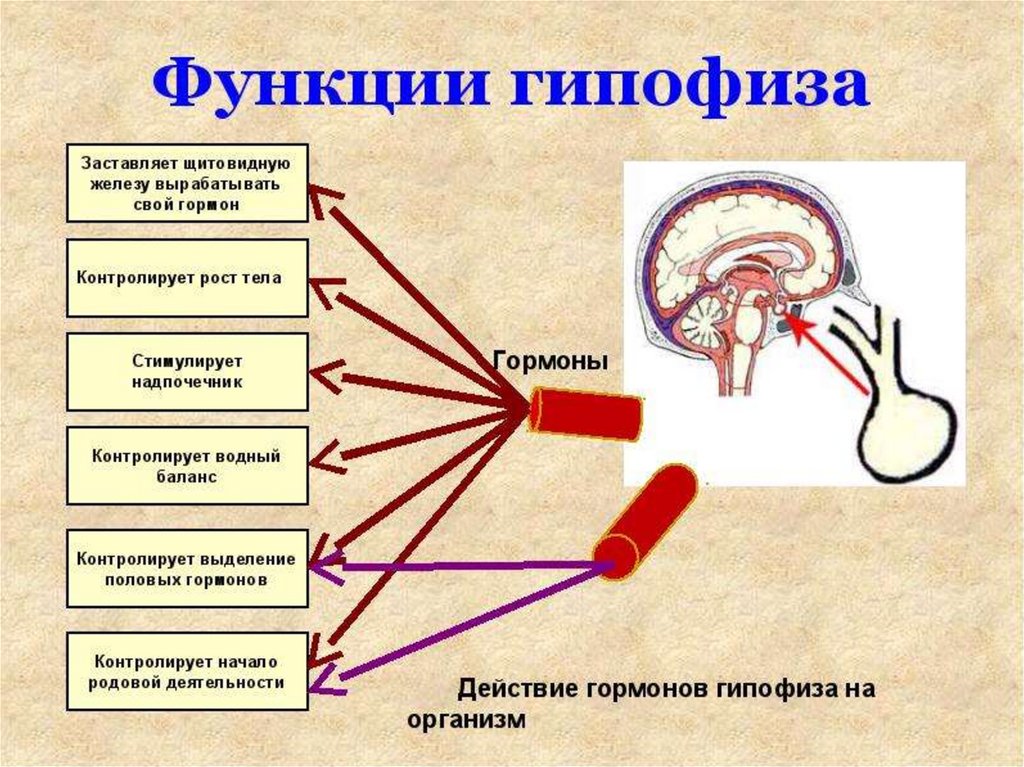
В работе G. Stalldecker и соавт. [19] приведен анализ зарубежных исследований безопасности применения каберголина во время беременности, при этом не выявлено увеличения частоты самопроизвольных абортов по сравнению с данными показателями в общей популяции. При оценке частоты возникновения преждевременных родов приводятся противоречивые данные — от 1 до 18% случаев, однако сами исследователи зарегистрировали 8,8% случаев преждевременных родов, что соответствует показателям в общей популяции. В исследованиях не отмечается увеличения риска рождения детей с низкой массой тела и риска развития врожденных аномалий на фоне приема каберголина, а также увеличения риска нарушений умственного и физического развития детей в постнатальном периоде.
Частота таких осложнений беременности, как преждевременное излитие околоплодных вод, слабость родовой деятельности, гипоксия плода, практически не отличается от частоты этих осложнений в аналогичной возрастной группе здоровых женщин [2].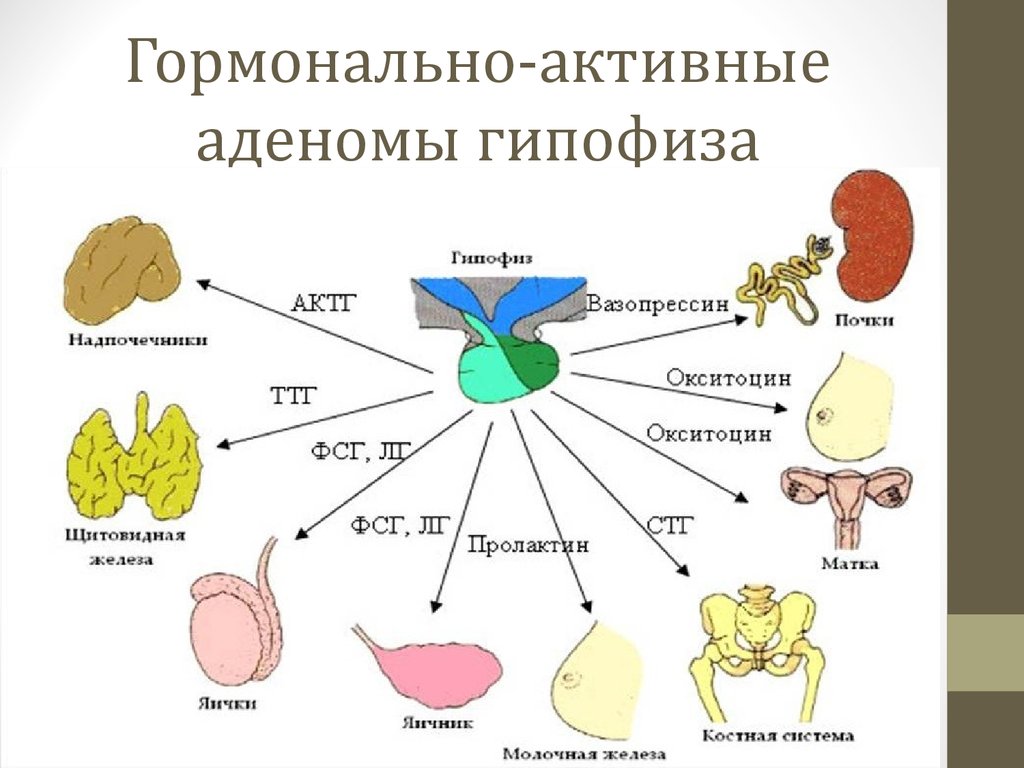
Применение хинаголида во время беременности не показано в связи с наблюдавшимися в ряде исследований [4] увеличением случаев осложнений беременности и возникновением внутриутробных пороков развития на фоне приема препарата.
Как уже было описано, в норме во время беременности отмечается 10-кратное повышение уровня пролактина, происходит увеличение размеров гипофиза под влиянием эстрогенов. При прекращении приема агонистов дофамина на фоне беременности у пациенток с гиперпролактинемией происходит увеличение уровня пролактина в сыворотке крови. При этом последующее повышение уровня пролактина достоверно не отражает изменений в росте и активности опухоли. Более того, уровень пролактина увеличивается в течение беременности не у всех пациенток с пролактиномами. На фоне беременности может отмечаться улучшение течения гиперпролактинемии, поскольку уровень пролактина в послеродовом периоде часто ниже, чем показатели до зачатия. У некоторых пациенток гиперпролактинемия может нивелироваться после беременности.
В международных практических клинических рекомендациях проведение МРТ у пациенток с микроаденомами и интраселлярными аденомами гипофиза в течение беременности не рекомендовано, за исключением случаев, когда имеются явные клинические признаки роста опухоли, такие как изменение полей зрения [12].
Под влиянием высокого уровня эстрогенов в течение беременности стимулирование гиперплазии лактотрофов и их увеличение может вызывать выход опухоли за пределы турецкого седла. Также гиперэстрогенемия может стимулировать увеличение лактотрофов самой пролактиномы [8].
В большинстве случаев микропролактиномы и макропролактиномы, локализованные в пределах турецкого седла, не имеют тенденции к росту в течение беременности. В обзоре зарубежных исследований рост опухоли у 457 беременных женщин с микропролактиномами наблюдался в 2,6% случаев. При применении технических средств визуализации опухоли риск роста опухоли составлял 4,5—5%. Учитывая низкую вероятность прогрессирующего роста микропролактином, у данной группы пациенток рекомендовано рутинное проведение клинического обследования в каждом триместре без применения технических средств визуализации опухоли [7].
Подобные результаты наблюдаются и у пациенток с макропролактиномами, ранее подвергавшимися хирургическому лечению или воздействию радиотерапии, — клинически значимое увеличение роста опухоли в данной группе отмечается в 2,8% случаев, в связи с чем проведение МРТ в течение беременности таким пациенткам также не показано [12].
Однако у пациенток с макропролактиномами без предшествующего хирургического или радиолечения риск увеличения опухоли возрастает до 31%. Появление или ухудшение течения уже существующей головной боли, а также снижение остроты зрения и сужение полей зрения служит показанием к исследованию полей зрения и последующему проведению МРТ без применения контрастных веществ. При непереносимости бромокриптина или развитии резистентности к препарату возможно применение каберголина. При отсутствии улучшения клинической симптоматики и уменьшения размеров опухоли проводится хирургическое удаление пролактиномы. На больших сроках беременности целесообразно инициировать искусственные роды до проведения нейрохирургического вмешательства [12].
Пациенткам с макропролактиномами целесообразно планировать беременность после нормализации уровня пролактина сыворотки крови и значительного уменьшения размеров опухоли с тем, чтобы избежать или уменьшить риск роста опухоли во время беременности. По современным рекомендациям, продолжительность лечения у пациенток с макропролактиномами должна составлять более 2 лет [2].
Если у пациенток с макропролактиномами лечение агонистами дофамина не привело к уменьшению размеров опухоли, рекомендовано решение вопроса о целесообразности проведения нейрохирургического лечения до зачатия [12].
По данным M. Molitch [2, 14], в период лактации под влиянием естественного вскармливания не выявлено прогрессирования роста аденом гипофиза. Женщинам, желающим кормить грудью своих младенцев, не следует назначать лечение агонистами дофамина, поскольку подавление уровня пролактина сыворотки будет угнетать лактацию. Комплексное клинико-рентгенологическое обследование пациенток с гиперпролактинемией непосредственно после родов и после окончания кормления ребенка грудью не выявило отрицательной динамики заболевания.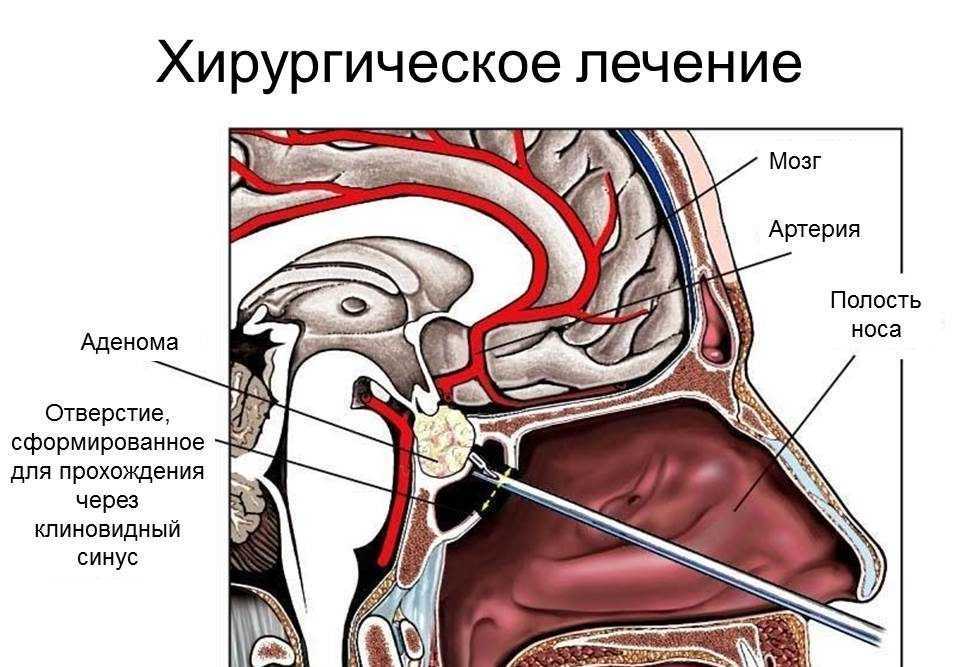
Таким образом, при наличии у пациенток макропролактиномы всегда имеется настороженность в отношении возможной вероятности роста опухоли в течение беременности. Для микропролактином во время беременности увеличение размеров опухоли не характерно. Однако при отмене агонистов дофамина на фоне беременности возможно возвращение размеров опухоли к первоначальным, отмечавшимся до начала терапии препаратами [9]. Исследование уровня пролактина в течение беременности у пациенток с пролактиномами не рекомендуется, поскольку это не отражает истинной картины течения заболевания и может привести к диагностическим ошибкам [10, 12].
Как уже указывалось, максимальная стимуляция лактотрофов гипофиза происходит во время беременности, поэтому, если за это время клинически значимого роста аденомы гипофиза не зафиксировано, то его выявление в послеродовом периоде также маловероятно. Как правило, нет необходимости контроля уровня пролактина и МРТ-картины аденомы гипофиза до окончания грудного вскармливания. Но некоторыми авторами [2] рекомендуется не превышать социально приемлемую продолжительность грудного вскармливания, т.е. 6—12 мес.
Но некоторыми авторами [2] рекомендуется не превышать социально приемлемую продолжительность грудного вскармливания, т.е. 6—12 мес.
клиническое наблюдение – Вестник интенсивной терапии имени А.И. Салтанова
Статьи
Редактор
А.Ю. Лубнин1, П.Л. Калинин1, Д.В. Фомичев1, К.Н. Ахвледиани2, Н.М. Елисеева1, О.Ф. Тропинская1, Л.И. Астафьева1
1ФГАУ «НИИ нейрохирургии им. Н.Н. Бурденко» МЗ РФ, Москва
2ГБУЗ МО «Московский областной научно-исследовательский институт акушерства и гинекологии», Москва
Для корреспонденции: Лубнин Андрей Юрьевич — руководитель отдела анестезиологии, реанимации и интенсивной терапии ФГАУ «НИИ нейрохирургии им. Н.Н. Бурденко» МЗ РФ; e-mail: lubnin@nsi. ru
ru
Для цитирования: Лубнин А.Ю., Калинин П.Л., Фомичев Д.В., Ахвледиани К.Н., Елисеева Н.М., Тропинская О.Ф., Астафьева Л.И. Аденома гипофиза у беременной с выраженным снижением зрения: клиническое наблюдение. Вестник интенсивной терапии. 2016;4:67–71.
Приведено описание клинического наблюдения аденомы гипофиза (пролактиномы), которая манифестировала быстрым снижением зрения из-за апоплексии в ткань опухоли. Особенностью этого наблюдения является то, что вся эта клиническая ситуация развилась на фоне недоношенной беременности. Это потребовало принятия нестандартного решения — оперировать пациентку на гипофизе на фоне сохраненной беременности, что и было успешно реализовано. В обсуждении рассматриваются вопросы встречаемости опухолей мозга у беременных пациенток и тактика их ведения. Отдельно рассмотрен вопрос анестезиологического обеспечения в таких ситуациях и возможного тератогенного эффекта анестетиков.
Ключевые слова: аденома гипофиза, беременность, тактика ведения, анестезиологическое обеспечение
Поступила: 05. 11.2016
11.2016
Литература
- Астафьева Л.И., Кадашев Б.А., Калинин П.Л. и др. Клиническая картина, диагностика и результаты первичной медикаментозной терапии больших и гигантских пролактинсекретирующих аденом гипофиза. Вопр. нейрохир. 2008; 4: 36–39. [Astaf’eva L.I., Kadashev B.A., Kalinin P.L. et al. Klinicheskaya kartina, diagnostika i rezul’taty pervichnoi medikamentoznoi terapii bol’shih i gigantskih prolaktinsekretiruyuschih adenom gipofiza. Vopr. neirohir. 2008; 4: 36–39. (In Russ)]
- Кадашев Б.А. Аденомы гипофиза. Тверь: Триада, 2007. [Kadashev B.A. Adenomy gipofiza. Tver: Triada, 2007. (In Russ)]
- Калинин П.Л., Фомичев Д.В., Кадашев Б.А. и др. Методика эндоскопической эндоназальной транссфеноидальной аденомэктомии. Вопр. нейрохир. 2007; 4: 42–45. [Kalinin P.L., Fomichev D.V., Kadashev B.A. et al. Metodika endoskopicheskoi endonazal’noi transsfenoidal’noi adenomektomii.
 Vopr. neirohir. 2007; 4: 42–45. (In Russ)]
Vopr. neirohir. 2007; 4: 42–45. (In Russ)] - Калинин П.Л., Фомичев Д.В., Кутин М.А. и др. Эндоскопическая эндоназальная хирургия аденом гипофиза (опыт 1700 операций). Вопр. нейрохир. 2012; 3: 26–33. [Kalinin P.L., Fomichev D.V., Kutin M.A. et al. Endoskopicheskaya endonazal’naya hirurgiya adenom gipofiza (opyt 1700 operatsii). Vopr. neirohir. 2012; 3: 26–33. (In Russ)]
- Салова Е.М., Лубнин А.Ю., Цейтлин А.М. и др. Мониторинг глубины анестезии у нейрохирургических больных. Анест. и реан. 2011; 4: 22–27. [Salova E.M., Lubnin A.Yu., Tseitlin A.M. et al. Monitoring glubiny anestezii u heirohirurgicheskih bol’nyh. Anest. i rean. 2011; 4: 22–27. (In Russ)]
- Barlas O., Bayindir C., Hepgul K. et al. Bromocriptine-induced cerebrospinal fluid fistula in patiemts with macroprolactinomas: report of three cases and a review of the literature.
 Neurol. 1994; 41: 486–489.
Neurol. 1994; 41: 486–489. - Cappell M.S. Sedation and analgesia for gastrointestinal endoscopy during pregnancy. Endosc. Clin. N. Am. 2006; 16: 1–31.
- Chen M.M., Coakley F.V., Kaimal A. et al. Guidelines for computer tomography and magnetic resonance imaging use during pregnancy and lactation. Gunecol. 2008; 112: 333–340.
- Chiodini I., Losa M., Pavone G. et al. Pregnancy in a Cushing’s disease shortly after treatment by gamma-knife radiosurgery. Endocrinol. Invest. 2004; 27: 954–956.
- Dyamanna D.N., Bhakta P., Chouhan R.S. et al. Anesthetic management of a patient with pituitary adenoma for cesarean section. J. Obstet. Anesth. 2010; 19: 460–461. doi: 10.1016/j.ijoa.2010.04.006.
- Gist R.S., Beilin Y. The effect of anesthetic drugs on the developing fetus: considerations in nonobstetric surgery. In: Ginosar Y.F., Halpern R.S., Weiner C.P. (Eds.) Anesthesia and the fetus. UK: Wiley-Blackwell, 2013: 156–164.

- Grinberg M.S. Handbook of Neurosurgery, 7th Ch. 21. NY: Thieme, 2010: 582–749.
- Jezkova J., Marek J., Hana V. et al. Gamma knife radiosurgery for acromegaly — long-term experience. Endocrinol. 2006; 64: 588–595. doi: 10.1007/s11102-014-0584-7.
- Jezkova J., Hana V., Krsek M. et al. Use of the Leksell gamms knife in the treatment of prolactinoma patients. Endocrinol. 2009; 70: 732–741. doi: 10.1111/j.1365-2265.2008.03384.x.
- Karabulut A.K., Reisli R., Uysal I.I. et al. An investigation of non-depolarizing muscle relaxants on embryonic development in cultured rat embryos. J. Anaesthesiol. 2004; 21: 715–724.
- Kurdoglu Z., Cetin O., Gulsen I. et al. Intracranial meningeoma diagnosed during pregnancy caused maternal death. Case Rep. Med. 2014; 2014: 158326. doi: 10.1155/2014/158326.
- Landolt A.M., Lomax N. Gamma knife radiosurgery for prolactinomas. Neurosurg. 2000; 93(Suppl3): 14–18.
 doi: 10.3171/jns.2000.93.supplement.
doi: 10.3171/jns.2000.93.supplement. - Leong K.S., Foy P.M., Swift A.C. et al. CSF rhinorrhea following treatment with dopamine agonists for massive invasive prolactinomas. Endocrinol. 2000; 52: 43–49.
- Martin L.V., Jurand A. The absence of teratogenic effects of some analgesics used in anesthesia. Additional evidence from a mouse model. Anaesthesia. 1992; 47: 473–476.
- Moscovici S., Fraifeld S., Cohen J.E. et al. Parasellar meningeomas in pregnancy: surgical results and visual outcomes. World Neurosurg. 2014; 82: e503–e512. doi: 10.1016/j.wneu.2013.06.019.
- Nosek E., Ekstein M., Rimon E. et al. Neurosurgery and pregnancy. Acta Neurochir. 2011; 153: 1727–1735. doi: 10.1007/s10143-015-0608-4.
- Nosek E., Ekstein M., Barklay G. et al. Visual deterioration during pregnancy due skull base tumors compressing the optic apparatus. Rev. 2015; 38: 473–479.
- Olivi A., Brem R.F., McPherson R., Brem H.
 Brain Tumors in pregnancy, In: Goldstein P.J., Stern B.J. (Eds.) Neurological disorders of pregnancy, 2nd NY: Futura Publishing Co., 1992: 85–105.
Brain Tumors in pregnancy, In: Goldstein P.J., Stern B.J. (Eds.) Neurological disorders of pregnancy, 2nd NY: Futura Publishing Co., 1992: 85–105. - Palamisamy A. Maternal anesthesia and fetal neurodevelopment. Int. J. Obstet. Anesth. 2012; 21: 152–162. doi: 10.1016/j.ijoa.2012.01.005.
- Powel M. Pituitary tumors and pregnancy. Acta Neurochir. 2011; 153: 1737–1738.
- Shah P.N., Sonawane D., Appukutty J. Anaesthetic management for cesarean section in a case of previously operated with residual pituitary tumor. Indian J. Anaesth. 2011; 55: 618–620. doi: 10.4103/0019-5049.90623.
- Terry A.R., Barker F.G., Leffelt L. et al. Outcomes of hospitalization in pregnant women with CNS neoplasms: a population based study. 2012; 14: 768–776. doi: 10.1093/neuonc/nos078.
- Wu J., Ma Y.-A., Wang T.-L. Glioma in the third trimester of pregnancy: Two cases and review of the literature. Lett. 2013; 5: 943–946. doi: 10.
 3892/ol.2013.1106.
3892/ol.2013.1106. - Zhang N., Pan L., Dai J. et al. Gamma knife radiosurgery as a primary surgical treatment for hypersrcreting pituitary adenomas. Funct. Neurosurg. 2000; 75: 123–128.
Tagged аденома гипофизаанестезиологическое обеспечениебеременностьтактика ведения
Опухоли гипофиза и беременность — PubMed
Сохранить цитату в файл
Формат:
Резюме (текст)PubMedPMIDAbstract (текст)CSV
Добавить в коллекции
- Создать новую коллекцию
- Добавить в существующую коллекцию
Назовите свою коллекцию:
Имя должно содержать менее 100 символов
Выберите коллекцию:
Не удалось загрузить вашу коллекцию из-за ошибки
Повторите попытку
Добавить в мою библиографию
- Моя библиография
Не удалось загрузить делегатов из-за ошибки
Повторите попытку
Ваш сохраненный поиск
Название сохраненного поиска:
Условия поиска:
Тестовые условия поиска
Эл. адрес:
адрес:
(изменить)
Который день?
Первое воскресеньеПервый понедельникПервый вторникПервая средаПервый четвергПервая пятницаПервая субботаПервый деньПервый рабочий день
Который день?
ВоскресеньеПонедельникВторникСредаЧетвергПятницаСуббота
Формат отчета:
РезюмеРезюме (текст)АбстрактАбстракт (текст)PubMed
Отправить максимум:
1 шт. 5 шт. 10 шт. 20 шт. 50 шт. 100 шт. 200 шт.
Отправить, даже если нет новых результатов
Необязательный текст в электронном письме:
Создайте файл для внешнего программного обеспечения для управления цитированием
Полнотекстовые ссылки
Эльзевир Наука
Полнотекстовые ссылки
Обзор
. 2003 г., 13 августа, Приложение A:S38-44.
2003 г., 13 августа, Приложение A:S38-44.
doi: 10.1016/s1096-6374(03)00054-6.
Марк Е Молитч
1
принадлежность
- 1 Центр эндокринологии, метаболизма и молекулярной медицины, Медицинская школа им. Файнберга, Северо-Западный университет, Чикаго, Иллинойс, США. [email protected]
PMID:
12914726
DOI:
10.1016/s1096-6374(03)00054-6
Обзор
Марк Э Молич.
Гормон роста IGF Res.
2003 авг.
. 2003 г., 13 августа, Приложение A:S38-44.
дои: 10.1016/s1096-6374(03)00054-6.
Автор
Марк Э Молитч
1
принадлежность
- 1 Центр эндокринологии, метаболизма и молекулярной медицины, Медицинская школа им. Файнберга, Северо-Западный университет, Чикаго, Иллинойс, США. [email protected]
PMID:
12914726
DOI:
10.1016/s1096-6374(03)00054-6
Абстрактный
Опухоли различаются по тому, как они влияют на беременность, в зависимости от секретируемого гормона. Некоторые синдромы гиперсекреции гормонов необходимо контролировать, чтобы беременность протекала без чрезмерных осложнений для матери и плода (болезнь Кушинга и гипертиреоз), в то время как лечение других опухолей во время беременности не требуется. Наблюдение за ростом опухоли во время беременности необходимо в первую очередь для пролактином. Был проведен поиск литературы для выявления влияния беременности на ранее существовавшие опухоли гипофиза и влияние на исход беременности из-за гиперсекреции гормонов опухолями гипофиза. Результаты показывают, что гиперпролактинемия и болезнь Кушинга могут влиять на фертильность и обычно требуют контроля, чтобы обеспечить зачатие. Синдром Кушинга, акромегалия и гипертиреоз, вторичные по отношению к гиперсекреции тиреотропного гормона (ТТГ), могут увеличить заболеваемость матери (гестационный диабет, артериальная гипертензия), а также заболеваемость и смертность плода. Вмешательство оправдано для удаления опухоли, которая секретирует адренокортикотропный гормон (АКТГ) во время беременности, чтобы снизить риск потери плода и контролировать гипертиреоз.
Некоторые синдромы гиперсекреции гормонов необходимо контролировать, чтобы беременность протекала без чрезмерных осложнений для матери и плода (болезнь Кушинга и гипертиреоз), в то время как лечение других опухолей во время беременности не требуется. Наблюдение за ростом опухоли во время беременности необходимо в первую очередь для пролактином. Был проведен поиск литературы для выявления влияния беременности на ранее существовавшие опухоли гипофиза и влияние на исход беременности из-за гиперсекреции гормонов опухолями гипофиза. Результаты показывают, что гиперпролактинемия и болезнь Кушинга могут влиять на фертильность и обычно требуют контроля, чтобы обеспечить зачатие. Синдром Кушинга, акромегалия и гипертиреоз, вторичные по отношению к гиперсекреции тиреотропного гормона (ТТГ), могут увеличить заболеваемость матери (гестационный диабет, артериальная гипертензия), а также заболеваемость и смертность плода. Вмешательство оправдано для удаления опухоли, которая секретирует адренокортикотропный гормон (АКТГ) во время беременности, чтобы снизить риск потери плода и контролировать гипертиреоз. Напротив, хирургическое вмешательство или медикаментозная терапия аденом, секретирующих гормон роста (GH), и клинически нефункционирующих аденом во время беременности не показаны. Беременность может вызвать увеличение размера опухолей, секретирующих пролактин (ПРЛ), особенно макроаденом, поэтому показано тщательное наблюдение, и может потребоваться повторное назначение терапии бромокриптином для лечения такого увеличения размера опухоли. Увеличение размеров других видов опухолей при беременности встречается очень редко.
Напротив, хирургическое вмешательство или медикаментозная терапия аденом, секретирующих гормон роста (GH), и клинически нефункционирующих аденом во время беременности не показаны. Беременность может вызвать увеличение размера опухолей, секретирующих пролактин (ПРЛ), особенно макроаденом, поэтому показано тщательное наблюдение, и может потребоваться повторное назначение терапии бромокриптином для лечения такого увеличения размера опухоли. Увеличение размеров других видов опухолей при беременности встречается очень редко.
Похожие статьи
Как беременность влияет на пациентов с аденомами гипофиза: исследование 113 беременностей в Турции.
Караджа З., Ярман С., Озбас И., Кадиоглу П., Актюрк М., Киличли Ф., Докметас Х.С., Чолак Р., Атмаджа Х., Кантюрк З., Алтунташ Й., Озбей Н., Хатипоглу Н., Танриверди Ф., Унлухизарджи К., Келестимур Ф.
Караджа З. и др.
и др.
Дж Эндокринол Инвест. 2018 Январь; 41(1):129-141. дои: 10.1007/s40618-017-0709-8. Epub 2017 20 июня.
Дж Эндокринол Инвест. 2018.PMID: 28634705
Макропролактиномы и нефункционирующие аденомы гипофиза и исходы беременности.
Ламберт К., Рис К., Сид П.Т., Дханджал М.К., Найт М., Макканс Д.Р., Уильямсон К.
Ламберт К. и др.
Акушерство Гинекол. 2017 Январь; 129(1):185-194. doi: 10.1097/AOG.0000000000001747.
Акушерство Гинекол. 2017.PMID: 27926659
Медикаментозное лечение аденом гипофиза: частный случай ведения беременной.
Бронштейн, доктор медицины, Сальгадо Л.Р., де Кастро Мусолино Н.Р.
Бронштейн М.Д. и соавт.
гипофиз. 2002;5(2):99-107. дои: 10.1023/а:1022364514971.
гипофиз. 2002.
PMID: 12675507
Обзор.
Диагностика и лечение аденом гипофиза.
Шансон П., Саленаве С.
Чансон П. и др.
Минерва Эндокринол. 2004 декабрь; 29 (4): 241-75.
Минерва Эндокринол. 2004.PMID: 15765032
Обзор.
Лечение аденом гипофиза.
Мезоси Э., Немес О.
Мезози Э. и др.
Орв Хетил. 2009 27 сентября; 150 (39): 1803-10. doi: 10.1556/OH.2009.28584.
Орв Хетил. 2009.PMID: 19758960
Обзор.
Венгерский.
Посмотреть все похожие статьи
Цитируется
Заболевания гипофиза при беременности: особенности диагностики и лечения?
Петерсенн С.
 , Крист-Крейн М., Дросте М., Финке Р., Флитч Дж., Крайчманн-Андермар И., Люгер А., Шополь Дж., Сталла Г.
, Крист-Крейн М., Дросте М., Финке Р., Флитч Дж., Крайчманн-Андермар И., Люгер А., Шополь Дж., Сталла Г.
Петерсенн С. и соавт.
Geburtshilfe Frauenheilkd. 2019 апр;79(4):365-374. дои: 10.1055/а-0794-7587. Epub 2019 6 марта.
Geburtshilfe Frauenheilkd. 2019.PMID: 31000881
Бесплатная статья ЧВК.Беременность способствует развитию опухолей гипофиза за счет увеличения скорости клеточного цикла.
Инь Ц, Ци Х.
Инь С. и др.
Онкол Летт. 2017 Октябрь; 14 (4): 4873-4877. doi: 10.3892/ol.2017.6756. Epub 2017 16 августа.
Онкол Летт. 2017.PMID: 29085495
Бесплатная статья ЧВК.Как беременность влияет на пациентов с аденомами гипофиза: исследование 113 беременностей в Турции.
Караджа З., Ярман С., Озбас И.
 , Кадиоглу П., Актюрк М., Киличли Ф., Докметас Х.С., Чолак Р., Атмаджа Х., Кантюрк З., Алтунташ Й., Озбей Н., Хатипоглу Н., Танриверди Ф., Унлухизарджи К., Келестимур Ф.
, Кадиоглу П., Актюрк М., Киличли Ф., Докметас Х.С., Чолак Р., Атмаджа Х., Кантюрк З., Алтунташ Й., Озбей Н., Хатипоглу Н., Танриверди Ф., Унлухизарджи К., Келестимур Ф.
Караджа З. и др.
Дж Эндокринол Инвест. 2018 Январь; 41(1):129-141. doi: 10.1007/s40618-017-0709-8. Epub 2017 20 июня.
Дж Эндокринол Инвест. 2018.PMID: 28634705
Стратегии лечения неопластических и сосудистых поражений головного мозга, возникающих во время беременности: серия из 29 пациентов.
Перейра К.Э., Линч Дж.К.
Перейра К.Э. и соавт.
Сург Нейрол Инт. 2017 20 фев; 8:27. doi: 10.4103/2152-7806.200575. Электронная коллекция 2017.
Сург Нейрол Инт. 2017.PMID: 28303207
Бесплатная статья ЧВК.Обзор представлений, диагностики и лечения опухолей гипофиза во время беременности.

Ламберт К., Уильямсон К.
Ламберт К. и др.
Акушерство Мед. 2013 март;6(1):13-19. doi: 10.1258/OM.2012.120022. Epub 2013 1 марта.
Акушерство Мед. 2013.PMID: 27757146
Бесплатная статья ЧВК.Обзор.
Просмотреть все статьи «Цитируется по»
Типы публикаций
термины MeSH
Полнотекстовые ссылки
Эльзевир Наука
Укажите
Формат:
ААД
АПА
МДА
НЛМ
Добавить в коллекции
- Создать новую коллекцию
- Добавить в существующую коллекцию
Назовите свою коллекцию:
Имя должно содержать менее 100 символов
Выберите коллекцию:
Не удалось загрузить вашу коллекцию из-за ошибки
Повторите попытку
Отправить по телефону
Лечение опухолей гипофиза во время беременности
Обзор
. 2011 май;7(5):301-10.
2011 май;7(5):301-10.
doi: 10.1038/nrendo.2011.38.
Epub 2011 15 марта.
Марчелло Д. Бронштейн
1
, Дайан Б. Параиба, Ракель С. Джаллад
принадлежность
- 1 Нейроэндокринное отделение, Отделение эндокринологии и обмена веществ, Клинический госпиталь, Медицинская школа Университета Сан-Паулу, Avenida 9 de Julho 3858, 01406-100 São Paulo, SP, Бразилия. [email protected]
PMID:
21403665
DOI:
10.1038/nrendo.2011.38
Обзор
Marcello D Bronstein et al.
Нат Рев Эндокринол.
2011 май.
. 2011 май;7(5):301-10.
doi: 10.1038/nrendo.2011.38.
Epub 2011 15 марта.
Авторы
Марчелло Д. Бронштейн
1
, Дайан Б. Параиба, Ракель С. Джаллад
принадлежность
- 1 Нейроэндокринное отделение, Отделение эндокринологии и обмена веществ, Клинический госпиталь, Медицинская школа Университета Сан-Паулу, Avenida 9 de Julho 3858, 01406-100 São Paulo, SP, Бразилия. [email protected]
- PMID:
21403665
DOI:
10.
 1038/nrendo.2011.38
1038/nrendo.2011.38
Абстрактный
Опухоли гипофиза, обычно аденомы, составляют около 10-15% всех внутричерепных опухолей. Их лечение, которое включает в себя хирургию, медикаментозное лечение или лучевую терапию, изолированную или комбинированную, направлено на остановку роста опухоли или ее уменьшение, а также на контроль гиперсекреции гормонов или обеспечение заместительной гормональной терапии. Такие подходы сделали возможной беременность женщин с аденомами гипофиза. Медикаментозная терапия агонистами допамина является методом выбора для большинства пациентов с пролактиномами, а хирургическое вмешательство предназначено для лиц, устойчивых к лекарствам. С другой стороны, операция до зачатия показана в качестве подхода первой линии у пациентов с акромегалией, болезнью Кушинга или клинически нефункционирующими макроаденомами гипофиза. В этих группах пациентов медикаментозная терапия аналогами соматостатина (акромегалия) или препаратами, воздействующими на надпочечники, такими как метирапон и кетоконазол (болезнь Кушинга), должна быть зарезервирована для тех, у кого хирургическое вмешательство неэффективно или противопоказано.
Похожие статьи
Диагностика и лечение аденом гипофиза.
Шансон П., Саленаве С.
Чансон П. и др.
Минерва Эндокринол. 2004 декабрь; 29 (4): 241-75.
Минерва Эндокринол. 2004.PMID: 15765032
Обзор.
Медикаментозное лечение аденом гипофиза: частный случай ведения беременной.
Бронштейн, доктор медицинских наук, Сальгадо Л.Р., де Кастро Мусолино Н.Р.
Бронштейн М.Д. и соавт.
гипофиз. 2002;5(2):99-107. дои: 10.1023/а:1022364514971.
гипофиз. 2002.PMID: 12675507
Обзор.
Диагностика и лечение аденом гипофиза: обзор.
Молич МЭ.
Молич М. Е.
Е.
ДЖАМА. 2017 7 февраля; 317 (5): 516-524. дои: 10.1001/jama.2016.19699.
ДЖАМА. 2017.PMID: 28170483
Обзор.
Лечение аденом гипофиза.
Мезоси Э., Немес О.
Мезози Э. и др.
Орв Хетил. 2009 27 сентября; 150 (39): 1803-10. doi: 10.1556/OH.2009.28584.
Орв Хетил. 2009.PMID: 19758960
Обзор.
Венгерский.Медикаментозное лечение пролактинсекретирующих аденом гипофиза.
Молич МЭ.
Молич М.Е.
гипофиз. 2002;5(2):55-65. дои: 10.1023/а:1022375429083.
гипофиз. 2002.PMID: 12675502
Обзор.
Посмотреть все похожие статьи
Цитируется
Тиреотропинома с молчащей соматотрофной и лактотрофной аденомой при беременности.

Ву Ю.Ф., Нг Х.И., Намбудири Д., Льюис Д., Дэвидсон А., Чемпион Б., Преда В.
Ву Ю.Ф. и соавт.
Endocrinol Diabetes Metab Case Rep. 2022 Sep 1; 2022: 21-0194. doi: 10.1530/EDM-21-0194. Онлайн перед печатью.
Endocrinol Diabetes Metab Case Rep. 2022.PMID: 36137189
Бесплатная статья ЧВК.Клиническая биология аденомы гипофиза.
Мелмед С., Кайзер У.Б., Лопес М.Б., Бертерат Дж., Сиро Л.В., Раверо Г., Рейнке М., Йоханнссон Г., Беккерс А., Флесериу М., Джустина А., Васс Д.А.Х., Хо ККИ.
Мелмед С. и др.
Endocr Rev. 2022 25 ноября; 43 (6): 1003-1037. doi: 10.1210/endrev/bnac010.
Эндокр Ред. 2022.PMID: 35395078
Бесплатная статья ЧВК.Обзор.
Эволюция ландшафта длинных некодирующих РНК в спинномозговой жидкости: ключевая роль от диагностики до терапии опухолей головного мозга.

Сюй К., Цзян С., Аристон Габриэль А.Н., Ли С., Ван Ю., Сюй С.
Сюй К. и др.
Front Cell Dev Biol. 2021 7 окт;9:737670. doi: 10.3389/fcell.2021.737670. Электронная коллекция 2021.
Front Cell Dev Biol. 2021.PMID: 34692695
Бесплатная статья ЧВК.Обзор.
Лечение селлярных и параселлярных опухолей, проявляющихся симптомами во время беременности: практический алгоритм, основанный на многоцентровом опыте и систематическом обзоре литературы.
Золи М., Гуаральди Ф., Зоя С., Ла Корте Э., Асиоли С., Бонжетта Д., Рустичи А., Маццатента Д.
Золи М. и др.
гипофиз. 2021 апр; 24(2):269-283. doi: 10.1007/s11102-020-01107-2. Epub 2020 17 ноября.
гипофиз. 2021.PMID: 33200305
Бесплатная статья ЧВК.Показания к хирургическому лечению опухолей гипофиза во время беременности: обзор литературы.

Грайон Т., Кюни Т., Кастинетти Ф., Курбьер Б., Кузен М., Альбарель Ф., Мранж И., Брудер Н., Брю Т., Дюфур Х.
Грайон Т. и др.
гипофиз. 2020 апр; 23(2):189-199. doi: 10.1007/s11102-019-01004-3.
гипофиз. 2020.PMID: 31691893
Обзор.
Просмотреть все статьи «Цитируется по»
использованная литература
J Clin Endocrinol Metab. 1988 июнь; 66 (6): 1171-80
—
пабмед
J Clin Endocrinol Metab. 1990 января; 70 (1): 215-21
—
пабмед
Педиатр рез.

