Атомы и молекулы упражнение: Упражнение «Молекулы»
6. Упражнение «Молекулы и атомы».
Представим
себя атомами. Они выглядят так (тренер
показывает,
согнув руки в локтях и прижав кисти к
плечам). Атомы двигаются
по комнате, пока тренер не назовет
какое-либо число. Тогда
все объединяются в молекулу из названного
числа атомов. «Атомы»
стоят в молекуле лицом друг к другу в
кругу, касаясь предплечьями.
Не называются числа, при которых один
участник группы
может остаться один вне молекулы. В
конце упражнения
тренер называет число, равное количеству
участников группы.
7.
Психотехническое упражнение «Комплимент».
Участники
садятся по кругу. Ведущий берет мяч и
бросает одному
из участников, говоря комплимент.
Получивший мяч выбирает
любого в круге и говорит свой комплимент
любому из круга.
Игра продолжается до тех пор, пока мяч
не побывает у каждого
участника. Комплимент должен быть
коротким, лучше — в одно
слово.
8.
Упражнение
«Самореклама».
За 25 —
30 минут написать работодателю письмо
с предложением
своих услуг и описанием своих
психологических особенностей,
способностей, склонностей, успехов.
Автор подписывает письмо
и сдает его ведущему. Ведущий собирает
все письма, а затем, не
называя автора, читает письма вслух.
Проводится обсуждение писем
в круге. Участники круга пытаются угадать
автора.
9.
Подведение
итогов.
10.
Домашнее задание.
Ответить
письменно на вопросы (см. 1 занятие)
Занятие 3. Мое видение будущей профессии
Цель занятия: сформировать
более подробное
представление о различных профессиях.
Приветствие
ведущего и вопрос об актуальном
состоянии
каждого
участника группы: физическом и
психологическом.Обсуждение домашнего задания.
Психотехническое упражнение «Стража».
Необходимо нечетное
количество участников. Все рассчитываются
на «первый—второй». Вторые номера сидят
на стульях, первые
стоят за спинками стульев. Оставшийся
без пары участник
группы стоит за спинкой свободного
стула. Его задача, используя
только неречевые средства общения,
переманить к себе на
стул кого-нибудь из участников. Задача
тех, кто стоит за спинками
— удержать своих «подопечных», успев
положить руку на
плечо того человека, который сидит на
их стуле, в тот момент, когда
они заметили его намерение пересесть.
Постоянно держать руку над плечом
«подопечного» не стоит.
4. Упражнение «Покажи, кто он?».
На доске
записывают 10—12 нравящихся участникам
группы профессий.
Ведущий называет каждую из выбранных
профессий и
говорит: «Покажи, кто он?». Все показывают
на того, кому больше
всего подходит данная профессия.
5. Упражнение «Выступление у микрофона».
Представитель
одного из профессиональных учебных
заведений (начальных, средних специальных,
высших) предлагает выпускникам средней
школы получить стоящую профессию.
Слушатели могут задавать
вопросы в конце выступления. Представителем
по очереди становятся все участники.
Обсуждение представленных профессий.
6. Психотехническое упражнение «Бип».
Группа
сидит по кругу. Один из участников с
завязанными глазами
ходит внутри круга, периодически садясь
к сидящим на колени.
Его задача — угадать, к кому он сел.
Ощупывать руками не
разрешается, садиться надо спиной к
сидящему, так, как будто
садишься на стул. Сидящий должен сказать:
«Бип», желательно,
«не своим голосом», чтобы его не узнали.
Если водящий угадал, на чьих коленях он
сидит, то этот участник тренинга начинает
водить, а предыдущий садится на его
место.
7.
Психотехническое
упражнение «Сядем вместе, сядем рядом».
Все
участники обнимаются за плечи и
одновременно медленно
садятся лицом к центру круга. Затем
встают, также держась за
плечи друг друга.
Актуальное состояние участников.
Итоги дня. Вопросы участников.
Домашнее
задание.
Занятие
4. Профессии на «языке тела» или ни
слова о профессиях!
Цель занятия:
получить знания,
обходясь без слов. Обострить внимание
к своим ощущениям, чувствам групповой
сплоченности,
взаимного доверия.
Приветствие ведущего.
Упражнение «Мое внутреннее состояние».
Бросая друг другу мяч,
называют имя того, кому бросают. Тот,
кто
получает мяч, принимает позу, отражающую
его внутреннее состояние,
а все остальные, воспроизводя эту позу,
стараются почувствовать,
понять состояние этого человека.
Вопрос:
«Как вам кажется, какое состояние у
каждого из нас?»
После того, как относительно каждого
высказывается несколько
гипотез, следует обратиться к самому
человеку с тем, чтобы он сказал, какое
у него состояние.
Обсуждение домашнего
задания.Упражнение «Надпись на спине».
Ведущий
прикрепляет карточку с названием
профессии одному из участников.
Остальным участникам необходимо
изобразить эту профессию так,
чтобы участник с карточкой на спине
угадал, что написано на
листочке.
5.
Упражнение
«Скульптор».
Работа
в парах. «Скульптор» «лепит» из участника
группы представителя
той профессии, которая, с его точки
зрения, наиболее соответствует
данному человеку. Затем — обмен ролями.
Обсуждение: «Что помогало справиться
с задачей? Какие были затруднения?
6.
Упражнение
«Крокодил».
Группа
разделяется на две команды. Первая —
загадывает какую-либо
профессию, а вторая делегирует своего
участника (с его
согласия) или игроки первой группы могут
сами назвать того,
кому они сообщат загаданную профессию.
Последнему нужно изобразить ее только
с помощью жестов и мимики, а его команда
пытается понять, что было загадано.
Команды загадывают профессии
по очереди.
Обсуждение:
что помогло справиться с поставленной
задачей и
что затрудняло ее выполнение?
7.
Упражнение
«Барьер».
Каждый
из участников тренинга мысленно
представляет то, что
является препятствием — барьером на
пути достижения ближайшей
профессиональной цели. Этот барьер
представляется в виде
членов группы, которые, сжав в кольцо
участника, мешают выбраться ему из
круга. Прорыв означает преодоление
препятствия.
Участник может выйти из круга, уговорив
одного из препятствующих.
Обсуждение.
8.
Упражнение
«Укачивание».
Участник
группы ложится на стулья (на пол). В этом
горизонтальном
положении его поднимают и раскачивают
вверх — вниз. Эту процедуру повторяют
по очереди с каждым. Перед упражнением
ведущий делает следующее замечание:
«Очень важно испытать
доверие, а также нашу зависимость от
других членов группы.
Следующее упражнение даст нам такую
возможность».
9.Актуальное состояние участников.
Итоги дня.
Домашнее задание.
Тренинг с подростками, направленный на профилактику употребления наркотиков и других психоактивных веществ
Тренинг с подростками, направленный на профилактику употребления наркотиков и других психоактивных веществ
1 2 3 4 5 6 7 8 9 … 22
1 2 3 4 5 6 7 8 9 … 22 База данных защищена авторским правом ©psihdocs.ru 2023 | Главная страница Автореферат Анализ Анкета Бизнес-план Биография Бюллетень Викторина Выпускная работа Глава Диплом Дипломная работа |
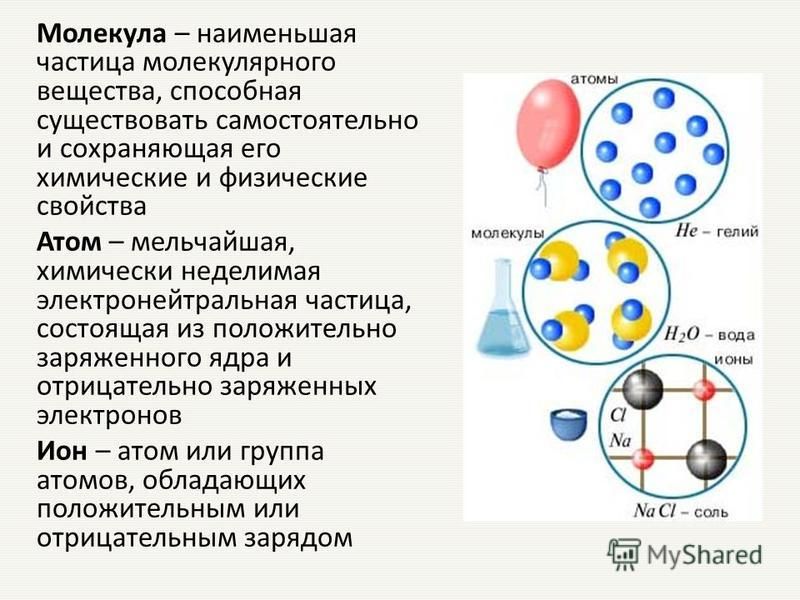
NCERT Solutions for Class 9 Science Chapter 3 Atoms and Molecules
Abhishek
Вы найдете NCERT Solutions for Class 9 Science Chapter 3 Atoms and Molecules , которые являются точными и подробными, с помощью которых вы можете подготовить свои собственные ответы, воспользовавшись помощью. Эти решения NCERT являются полезными ресурсами, которые могут помочь вам не только охватить всю учебную программу, но и предоставить глубокий анализ тем. Глава 3 Класс 9 Наука Решения NCERT дадут хороший опыт и дадут возможность узнать что-то новое.
Эти решения NCERT являются полезными ресурсами, которые могут помочь вам не только охватить всю учебную программу, но и предоставить глубокий анализ тем. Глава 3 Класс 9 Наука Решения NCERT дадут хороший опыт и дадут возможность узнать что-то новое.
Вы можете выяснить последнюю схему выставления оценок и подготовить ответы в соответствии с требованиями. Глава 3 Атомы и молекулы NCERT Вопросы и ответы помогают в создании отличной основы концепций и облегчают учащимся понимание основ. Студенты могут перепроверить свои ответы, а также правильно ли они усвоили материал.
Решения NCERT для науки 9 класса Глава 3 Атомы и молекулы
Эти Решения NCERT для науки 9 класса поможет вам хорошо разбираться в различных темах и поможет учащимся исключительно хорошо сдать экзамены CBSE. Эти решения NCERT курируются экспертами в комплексе, который может помочь мгновенно развеять ваши сомнения. Это будет полезно для расширения кругозора учащихся, поскольку охватывает множество вопросов.
In Text Questions
Номер страницы: 32
1. В ходе реакции 5,3 г карбоната натрия вступили в реакцию с 6 г этановой кислоты. Продуктов было 2,2 г углекислого газа, 0,9г воды и 8,2 г этаноата натрия. Покажите, что эти наблюдения согласуются с законом сохранения массы.
Карбонат натрия + этановая кислота → этаноат натрия + диоксид углерода + вода
Ответ
В данной реакции карбонат натрия реагирует с этановой кислотой с образованием этаноата натрия, диоксида углерода и воды.
Карбонат натрия + Этановая кислота → этаноат натрия + диоксид углерода + вода
Масса карбоната натрия = 5,3 г (Дано)
Масса этановой кислоты = 6 г (Данная)
Масса этаноата натрия = 8,2 г (Данная)
Масса диоксида углерода = 2,2 г (Данная)
Масса воды = 0,9 г (Данная)
Теперь общая масса до реакция = (5,3 + 6) г
= 11,3 г
А, общая масса после реакции = (8,2 + 2,2 + 0,9) г
= 11,3 г
∴ Общая масса до реакции = Общая масса после реакции
Следовательно, данные наблюдения согласуются с законом сохранения массы.
Страница №: 33
2. Водород и кислород соединяются в соотношении 1:8 по массе, образуя воду. Какая масса газообразного кислорода потребуется для полной реакции с 3 г газообразного водорода?
Ответ
Дано, что массовая доля водорода и кислорода в воде составляет 1:8.
Тогда масса газообразного кислорода, необходимая для полной реакции с 1 г газообразного водорода, составляет 8 г.
Таким образом, масса газообразного кислорода, необходимая для полной реакции с 3 г газообразного водорода, составляет 8 × 3 г = 24 г.
3. Какой постулат теории атома Дальтона является следствием закона сохранения массы?
Ответ
Постулат Дальтона: «Атомы — неделимые частицы, которые не могут образоваться или разрушиться в результате химической реакции» является следствием закона сохранения массы.
4. Какой постулат теории атома Дальтона может объяснить закон определенных пропорций?
Ответ
Постулат Дальтона «Относительное число и виды атомов в данном соединении постоянны» может объяснить закон определенных пропорций.
Номер страницы: 35
1. Дайте определение единице атомной массы.
Ответ
Единица массы, равная ровно одной двенадцатой массы одного атома углерода-12, называется одной атомной единицей массы. Пишется как «у».
2. Почему невозможно увидеть атом невооруженным глазом?
Ответ
Размер атома настолько мал, что его невозможно увидеть невооруженным глазом. Кроме того, атом элемента не существует независимо.
Page No: 39
1. Write down the formulae of
(i) sodium oxide
► Na 2 O
(ii) aluminium chloride
► AlCl 3
(iii) сульфид натрия
► Na 2 S
(iv) гидроксид магния
► Mg(OH) 2
2. Запишите названия соединений, представленных следующими формулами:
(i) Al 2 (SO 4 ) 3
► Сульфат алюминия
(ii) CaCl 2
► Хлорид кальция
(iii) K 2 SO 4
► Сульфат калия
(iv) KNO 3
► Нитрат калия
(v) CaCO 3
► Карбонат кальция
3. Что означает термин «химическая формула»?
Что означает термин «химическая формула»?
Ответ
Химическая формула соединения является символическим представлением его состава.
4. Сколько атомов входит в состав молекулы
(i) H 2 S и иона
(ii) PO 4 3-?
Ответ
(i) В молекуле H 2 S присутствуют три атома; два из водорода и один из серы.
(ii) В ионе PO 4 3- присутствует пять атомов; один из фосфора и четыре из кислорода.
Стр. №: 40
1. Рассчитайте молекулярные массы H 2 , O 2 , CL 2 , CO 2 , CH 4 , C 2 H 6 , C 2 H 6 , C. 2 H 4 , NH 3 , CH 3 ОН.
Ответ
► Молекулярная масса H 2 = 2 × атомная масса H
= 2 × 1
= 2 u
► = 3 5 Молекулярная масса O 2 901 2 × 16
= 32 х
► Молекулярная масса Cl 2 = 2 × атомная масса Cl
= 2 × 35,5
= 71 u
► Молекулярная масса CO 2 = атомная масса C + 2 × атомная масса35 = 900 12 + 2 × 16
= 44 ед.
► Молекулярная масса CH 4 = Атомная масса C + 4 × Атомная масса H
= 12 + 4 × 1
= 16 ед.
► Молекулярная масса 1C 9011 2 H 6 = 2× атомная масса C + 6× атомная масса H
= 2 × 12 + 6 × 1
= 30 u
► Молекулярная масса C 2 H 4 = 2 x атомная масса C + 4 × атомная масса H
= 2 × 12 + 4 × 1
= 28 u
► Молекулярная масса NH 2 900 = Атомная масса N + 3 × Атомная масса H
= 14 + 3×1
= 17 u
► Молекулярная масса CH 3 OH = Атомная масса C + 3 × Атомная масса H + Атомная масса O + Атомная масса H
= 12 + 3×1 + 8 + 1
= 24 u
2. Рассчитайте формулу удельных масс ZnO, Na 2 O, K 2 CO 3 , при атомных массах Zn = 65 ед., Na = 23 ед., K = 39 ед., C = 12 ед. и O = 16 ед.
Ответ
► Формула единицы массы ZnO = атомная масса Zn + атомная масса O
= 65 + 16
= 81 u
► Формула единицы массы Na Na + Атомная масса O
= 2 × 23 + 16
= 62 u
► Масса формульной единицы K 2 CO 3 = 2 × Атомная масса K + Атомная масса C + 3 × Атомная масса О
= 2 × 39 + 12 + 3 × 16
= 78 + 12 + 48
= 122 u
Номер страницы: 42
1. Если один моль атомов углерода весит 12 граммов, какова масса (в граммах) 1 атома углерода?
Если один моль атомов углерода весит 12 граммов, какова масса (в граммах) 1 атома углерода?
Ответ
Один моль атомов углерода весит 12 г (Дано)
т. е. масса 1 моля атомов углерода = 12 г
Тогда масса 6,022 × 10 23 число атомов углерода = 15 г 9003 Следовательно, масса 1 атома углерода = 12 ÷ (6,022 × 10 23 )
= 1,9926 x 10 -23 г
2. Что имеет большее число атомов, 100 г натрия или 100 г железа (данные, атомная масса Na = 23 ед., Fe = 56 ед.)?
Ответ
Атомная масса Na = 23 ед. (Дано)
Тогда грамм атомной массы Na = 23 г
Теперь 23 г Na содержит = 6,022 × 10 23 г число атомов,
Таким образом,
100 г Na содержит = 6,022 × 10 23 / 23 × 100 число атомов
= 2,6182 × 10 24 число атомов
Снова атомная масса Fe = 56 ед. (Дано)
Тогда грамм атомная масса Fe = 56 г
Теперь 56 г Fe содержит = 6,022 × 10 23 г число атомов
Таким образом, 100 г Fe содержит = 6,022 × 10 23 / 56 × 100 число атомов
= 1,0753 × 10 24 число атомов
Следовательно, 100 граммов натрия содержат большее число атомов, чем 100 граммов железа. .
.
Номер страницы: 43
Упражнения
1. В пробе соединения кислорода и бора массой 0,24 г анализом установлено, что она содержит 0,096 г бора и 0,144 г кислорода. Рассчитайте процентный состав соединения по массе.
Ответ
Общая масса соединения = 0,24 г (данные)
Масса бора = 0,096 г (данные)
Масса кислорода = 0,144 г (данные)
Таким образом, процентное содержание бора в соединении по массе = 0,096 / 0,24 × 100 % = 40 %
И процент кислорода по весу в соединении = 0,144 / 0,24 × 100% = 60%
2. При сгорании 3,0 г углерода в 8,00 г кислорода образуется 11,00 г двуокиси углерода. Какая масса углекислого газа образуется при сгорании 3,00 г углерода в 50,00 г кислорода? Какой закон химических соединений будет определять ваш ответ?
Ответ
3,0 г углерода соединяется с 8,0 г кислорода, образуя 11,0 г углекислого газа.
Если сжечь 3 г углерода в 50 г кислорода, то 3 г углерода прореагируют с 8 г кислорода. Оставшиеся 42 г кислорода останутся нереакционноспособными.
В этом случае также образуется только 11 г углекислого газа.
Приведенный выше ответ подчиняется закону постоянных пропорций.
Номер страницы: 44
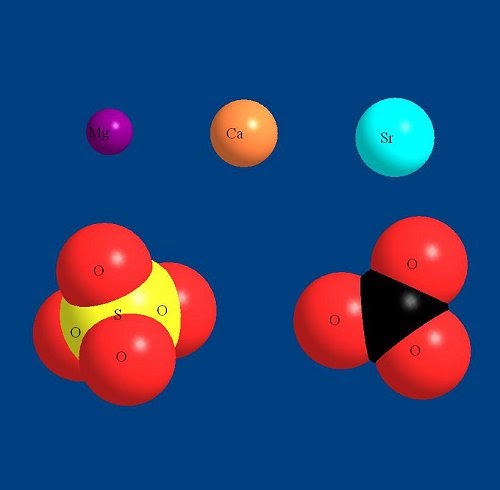
3. Что такое многоатомные ионы? Приведите примеры?
Ответ
Многоатомный ион – это группа атомов, несущих заряд (положительный или отрицательный). Например, нитрат (NO 3 — ) , гидроксид-ион (OH — ).
4. Напишите химические формулы следующих веществ:
(а) Хлорид магния
► MgCl 2
(b) Оксид кальция
► CaO
(c) Нитрат меди
► Cu (NO 3 ) 2
(d) Хлорид алюминия
► AlCl 3
(e) Карбонат кальция
► CaCO 3
5. Назовите элементы, входящие в состав следующих соединений:
Назовите элементы, входящие в состав следующих соединений:
(a) Негашеная известь
► Кальций и кислород
(b) Бромид водорода
► Водород и бром
(c) Разрыхлитель
► Натрий, водород, углерод и кислород
(d) Сульфат калия
► Калий, сера и кислород
6 900 Рассчитать молярная масса следующих веществ:
(a) Этин, C 2 H 2
(b) Молекула серы, S 8
►Молярная масса молекулы серы, S 8 = 8×32 = 256 г
(c) Молекула фосфора, P 4 (атомная масса фосфора = 31)
► Молярная масса молекулы фосфора, P 4 = 4 × 31 = 125 г 904 г 904
(d) Соляная кислота, HCl
► Молярная масса соляной кислоты, HCl = 1 + 35,5 = 36,5 г + 14 + 3×16 = 63 г
7. Какова масса-
(а) 1 моль атомов азота?
(b) 4 моля атомов алюминия (Атомная масса алюминия = 27)?
(c) 10 молей сульфита натрия (Na 2 SO 3 )?
Ответ
а) Масса 1 моля атомов азота равна 14 г.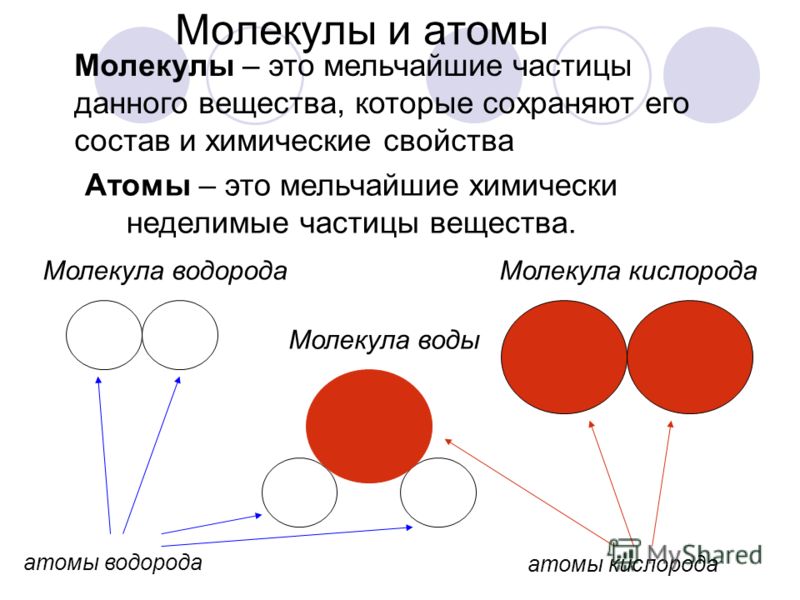
(б) Масса 4 молей атомов алюминия равна (4 × 27) г = 108 г
(в) Масса 10 молей сульфита натрия (Na 2 SO 3 ) равна
10 × [2 ×23 + 32 + 3×16] г = 10×126 г = 1260 г
8. Перевести в моль.
(a) 12 г газообразного кислорода
(b) 20 г воды
(c) 22 г углекислого газа
Ответ
(a) 32 г газообразного кислорода = 1 моль
Тогда, 12 г газообразного кислорода = 12/32 моль = 0,375 моль
(b) 18 г воды = 1 моль
Тогда 20 г воды = 20/18 моль = 1,111 моль
(c) 44 г диоксида углерода = 1 моль
Тогда 22 г углекислого газа = 22/44 моля = 0,5 моля
9. Какова масса:
(а) 0,2 моля атомов кислорода?
(б) 0,5 моль молекул воды?
Ответ
(a) Масса одного моля атомов кислорода = 16 г
Тогда масса 0,2 моля атомов кислорода = 0,2 × 16 г = 3,2 г
(b) Масса одного моля молекулы воды = 18 г
Тогда масса 0,5 моль молекул воды = 0,5 × 18 г = 9 г
10. Рассчитайте количество молекул серы (S 8 ), присутствующих в 16 г твердой серы.
Рассчитайте количество молекул серы (S 8 ), присутствующих в 16 г твердой серы.
Ответ
1 моль твердой серы (S 8 ) = 8 × 32 г = 256 г
т. е. в 256 г твердой серы содержится = 6,022 × 10 23 молекул
Тогда в 16 г твердой серы содержится = 6,022 × 10 23 / 2156 молекул =
= 3,76375 × 10 22 молекул
11. Рассчитайте количество ионов алюминия, содержащихся в 0,051 г оксида алюминия.
(Подсказка: масса иона равна массе атома того же элемента. Атомная масса Al = 27 ед.)
Ответ
Моль оксида алюминия (Al 2 O 3 ) = 2×27 + 3×16 = 102 г
т.е. 2 O 3
Then, 0.051 g of Al 2 O 3 contains = 6.022 × 10 23 / 102 × 0.051 molecules
= 3.011×10 20 molecules of Al 2 O 3
Количество ионов алюминия (Al 3+ ), присутствующих в одной молекуле оксида алюминия, равно 2,
Следовательно, число ионов алюминия (Al 3+ ), присутствующих в 3,011 × 10 20 молекул (0,051 г) оксида алюминия (Al 2 O 3 ) = 2 0 2 3,011 × 10 10
= 6,022 × 10 20
Возвращайтесь к растворам NCERT для NCERT для класса
Глава 3 и молосовые растворы.
 Класс 9Решения Science NCERT резко улучшат ваши навыки осознания, и вы сможете легко запоминать больше вещей точно. Подробное объяснение, представленное под каждым решением, поможет лучше понять концепции. Это резко улучшит ваши навыки осознания, и вы сможете легко запоминать больше вещей точно.
Класс 9Решения Science NCERT резко улучшат ваши навыки осознания, и вы сможете легко запоминать больше вещей точно. Подробное объяснение, представленное под каждым решением, поможет лучше понять концепции. Это резко улучшит ваши навыки осознания, и вы сможете легко запоминать больше вещей точно.
Темы главы
• Законы химического соединения
→ Закон сохранения массы
→ Закон постоянных пропорций
• Что такое атом?
→ Каковы современные символы атомов различных элементов?
→ Атомная масса
→ Как существуют атомы?
• Что такое молекула?
→ Молекулы элементов
→ Молекулы соединений
→ Что такое ион?
• Написание химических формул
→ Формулы простых соединений
• Молекулярная масса и понятие молей
→ Молекулярная масса
→ Формула Единица массы
→ Mole Concept
Решения NCERT для 9-го класса подготовлены в соответствии с последними рекомендациями CBSE, поэтому вы можете получить максимальные оценки. Его можно использовать для обогащения знаний и сделать уроки для учащихся более увлекательными. Эти решения , посвященные главе 3, классу 9, позволят учащимся оценить свое обучение почти сразу. Эти вопросы и ответы NCERT намного упрощают запоминание тем быстрее и формулируют лучшие ответы.
Его можно использовать для обогащения знаний и сделать уроки для учащихся более увлекательными. Эти решения , посвященные главе 3, классу 9, позволят учащимся оценить свое обучение почти сразу. Эти вопросы и ответы NCERT намного упрощают запоминание тем быстрее и формулируют лучшие ответы.
Решения NCERT для класса 9Естествознание Глава 3 Атомы и молекулы PDF
Решения NCERT для класса 9 Естествознание Глава 3 Атомы и молекулы PDF
NCERT Solutions for Class 9 Science Chapter 3 Atoms and Molecules загрузить в файле PDF, обновленном для академической сессии 2022–2023 годов на хинди и английском языке на основе новых книг NCERT и в соответствии с новой учебной программой CBSE.
NCERT Solutions for Class 9 Science Chapter 3
Учащиеся UP Board High School могут скачать UP Board Solutions на хинди Medium здесь.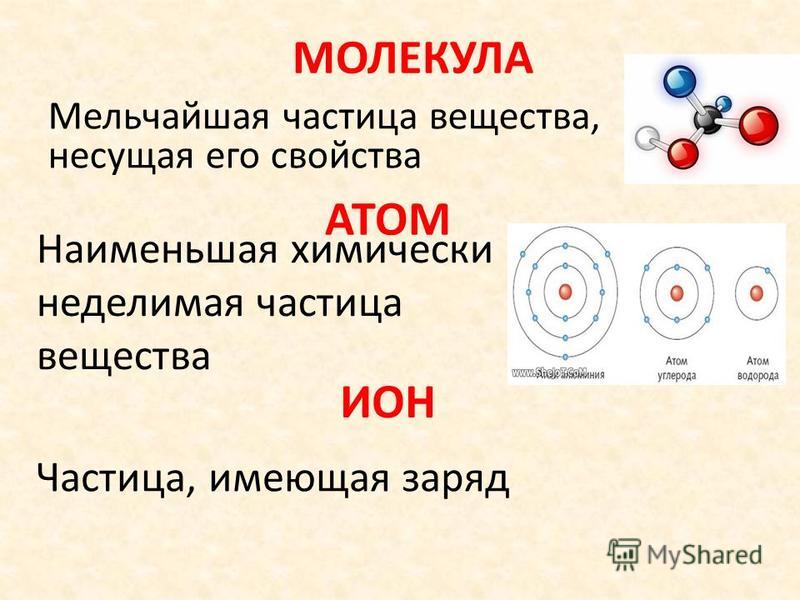 9Научная глава 3, стр. 32, стр. 33, стр. 35, стр. 39, стр. 40, стр. 42 и ответы на упражнения с объяснением на английском языке Medium или стр. 36 ke Uttar, Page 40 ke Uttar, Page 44 ke Uttar, Page 46 ke Uttar, Страница 48 ке Уттар и Абхьяас ке Уттар на хинди Medium бесплатно для изучения онлайн или в формате PDF для использования в автономном режиме.
9Научная глава 3, стр. 32, стр. 33, стр. 35, стр. 39, стр. 40, стр. 42 и ответы на упражнения с объяснением на английском языке Medium или стр. 36 ke Uttar, Page 40 ke Uttar, Page 44 ke Uttar, Page 46 ke Uttar, Страница 48 ке Уттар и Абхьяас ке Уттар на хинди Medium бесплатно для изучения онлайн или в формате PDF для использования в автономном режиме.
Загрузить NCERT Solutions 2022-23 и приложения NCERT Solutions для других предметов в том же формате. Все содержимое обновлено для новой сессии на основе последней учебной программы CBSE 2022-2023.
| Class: 9 | Science (English and Hindi Medium) |
| Contents: | NCERT Solutions and Important Questions |
| Chapter 3: | Atoms and Molecules |
9th Science Chapter 3 Answers in English & Hindi Medium
NCERT Solutions for Class 9 Science Chapter 3 Atoms and Molecules Упражнения и внутренние вопросы всех страниц приведены ниже для бесплатной загрузки в формате PDF. Все содержимое можно скачать без логина и пароля.
Мы обновили все содержание для новой сессии 2022-23 для CBSE, UP Board, MP Board и т. д., которые следуют книгам NCERT 2022-2023 и последней программе CBSE 2022-23.
д., которые следуют книгам NCERT 2022-2023 и последней программе CBSE 2022-23.
Дополнительные вопросы по 9-й научной главе 3
Почему катион так назван?
Когда электрический ток проходит через раствор соли, такой как хлорид натрия (NaCl), положительный ион (Na+) мигрирует к катоду (отрицательному электроду). Поэтому его называют катионом. Запомни это:
(i) Положительный ион, мигрирующий к катоду при прохождении электрического тока, известен как катион.
(ii) Отрицательный ион, мигрирующий к аноду при прохождении электрического тока, известен как анион.
Атомная масса элемента выражена в дробях. Что это значит?
Если атомная масса элемента в дробях, это означает, что он существует в виде изотопов. Атомная масса является средней атомной массой и обычно является дробной.
Почему химические реакции подчиняются закону сохранения массы?
Во всех химических реакциях происходит только обмен реагентами при образовании продуктов.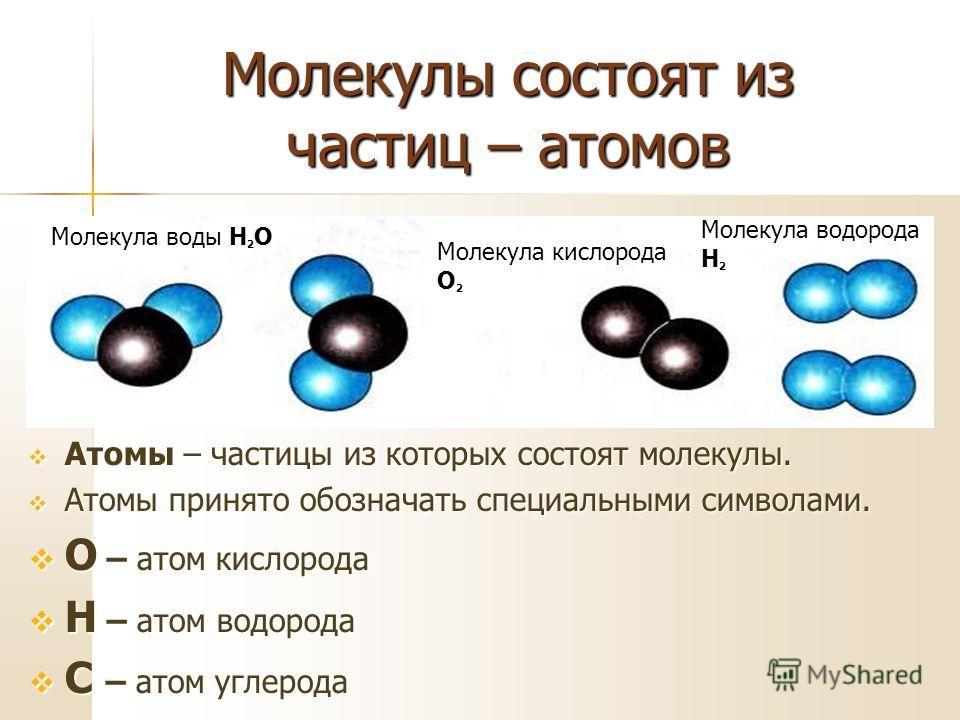 Поскольку нет ни потери, ни увеличения массы, химические реакции идут по закону сохранения массы.
Поскольку нет ни потери, ни увеличения массы, химические реакции идут по закону сохранения массы.
Приведите одно ограничение закона постоянной композиции.
Закон постоянного состава не выполняется, когда в образовании того или иного соединения участвуют разные изотопы элемента. Например,
В двуокиси углерода (CO2)
При использовании изотопов C-12 соотношение C : O составляет 12 : 32.
При использовании изотопов C-14 соотношение C : O составляет 14 : 32.
Это означает, что два соотношения не совпадают.
Из атомов и молекул, которые могут существовать независимо?
Молекулы могут существовать независимо. Однако атомы благородных газов (He, Ne, Ar, Kr, Xe) могут существовать и самостоятельно.
Практические вопросы по девятой науке Глава 3
Вопрос 1
В каком отношении атомная теория Дальтона верна и сегодня?
Ответ 1: Было обнаружено, что атом
состоит из субатомных частиц, таких как электроны, протоны и нейтроны.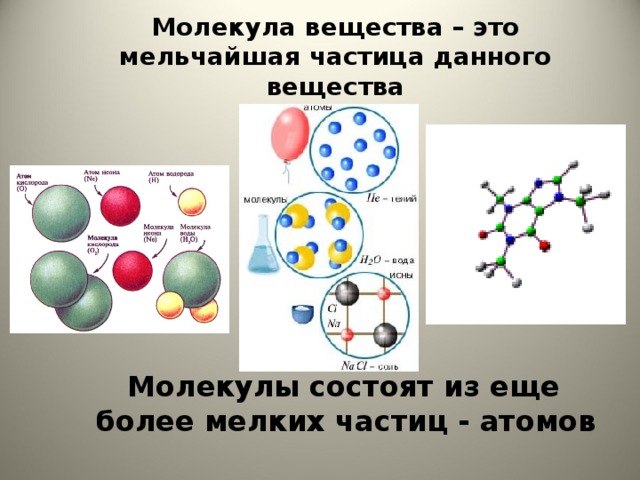 Но это все же мельчайшая частица материи, которая может принимать участие в химическом соединении.
Но это все же мельчайшая частица материи, которая может принимать участие в химическом соединении.
Вопрос 2:
Почему необходимо сбалансировать химическое уравнение?
Ответ 2:
Химическое уравнение должно быть сбалансировано, чтобы удовлетворять закону сохранения массы. Согласно закону, при переходе реакции в производство масса не меняется. Следовательно, химическое уравнение должно быть сбалансировано.
Вопрос 3:
В чем принципиальная разница между атомами и молекулами?
Ответ 3:
Атомы, за исключением атомов благородных или инертных газов, не могут существовать сами по себе.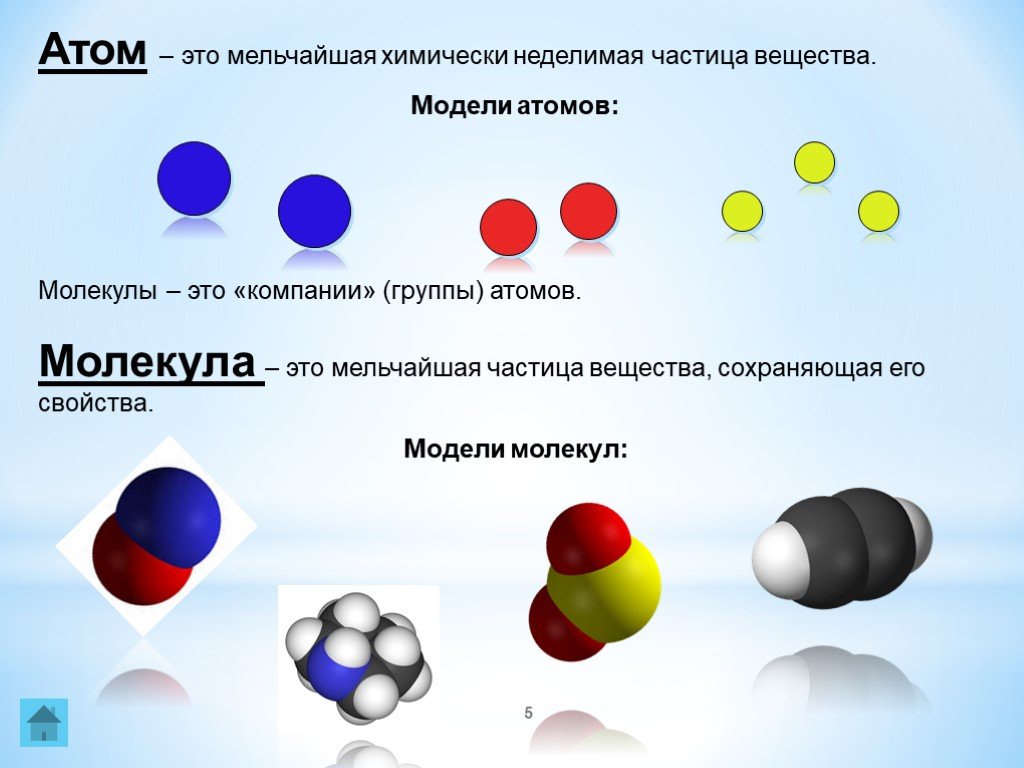 Однако все молекулы могут иметь независимое существование.
Однако все молекулы могут иметь независимое существование.
Практические вопросы
Важные вопросы по 9-й главе науки 3
При сгорании 3,0 г углерода в 8,00 г кислорода образуется 11,00 г углекислого газа. Какая масса углекислого газа образуется при сгорании 3,00 г углерода в 50,00 г кислорода? Какой закон химических соединений будет определять ваш ответ?
Углерод + Кислород → Двуокись углерода 3 г углерода реагирует с 8 г кислорода с образованием 11 г двуокиси углерода. Если сжечь 3 г углерода в 50 г кислорода, то 3 г углерода вступит в реакцию с 8 г кислорода.

 В ходе некоторых упражнений ведущему приходится выполнять роль игрока, что дает ему преимущество общения «на равных» с подростками.
В ходе некоторых упражнений ведущему приходится выполнять роль игрока, что дает ему преимущество общения «на равных» с подростками.
 00. 13 психология развития, акмеология
00. 13 психология развития, акмеология