У новорожденных лимфангиома: Лечение лимфангиомы у ребенка в Москве — все симптомы, диагностика, врачи
Диагностика и лечение лимфгемангиомы больших размеров у новорожденного Текст научной статьи по специальности «Клиническая медицина»
УДК 616-006.314.03-07-08-053.31
С. А. МИРОШНИЧЕНКО1, Н. П. СЕДОВА1, Л. В. ФУРСОВА1, О. И. ЧЕПОВА1, Л. В. МОГИЛЬНИЦКАЯ1,
И. В. ФИЛЬЧЕНКОВА1, А. В. НЕВЕРОВА О. Д. КОНСТАНТИНОВА2, Л. М. ДЕМИНА2, М. А. КОНДРАТЬЕВА3
ДИАГНОСТИКА И ЛЕЧЕНИЕ ЛИМФГЕМАНГИОМЫ БОЛЬШИХ РАЗМЕРОВ У НОВОРОЖДЕННОГО
1 — Областная клиническая больница № 2, перинатальный центр, Оренбург
2 — ФГБОУ ВО «Оренбургский государственный медицинский университет» Минздрава России
3 — Оренбургский центр детской хирургии, Оренбург
S. A. MIROSHNICHENKO1, N. P. SEDOVA1, L. V. FURSOVA1, O. I. CHEPOVA1, L. V. MOGYLNISZKAYA1, I. V. FYLCHENKOVA1 A. V. NEVEROVM O. D. KONSTANTINOVA2, L. M. DEMINA2, M. A. KONDRATIEVA3
A. MIROSHNICHENKO1, N. P. SEDOVA1, L. V. FURSOVA1, O. I. CHEPOVA1, L. V. MOGYLNISZKAYA1, I. V. FYLCHENKOVA1 A. V. NEVEROVM O. D. KONSTANTINOVA2, L. M. DEMINA2, M. A. KONDRATIEVA3
DIAGNOSIS AND MANAGEMENT OF INFANTILE LYMPHHEMANGIOMA
1 — Regional Clinical Hospital № 2, Perinatal Center, Orenburg
2 — Orenburg State Medical University
3 — Orenburg Children’s Surgery Center, Orenburg
РЕЗЮМЕ
В статье описывается клинический случай обширной лимфгемангиомы у новорожденного. Данная опухоль выявлена при ультразвуковом исследовании антенатально. Родоразрешение -операцией кесарево сечение. Диагноз подтвержден у новорожденного. Хирургическое удаление опухоли проведено в два этапа ребенку в возрасте 1 месяца.
Мирошниченко Светлана Андреевна — врач-неонатолог (I категория) перинатального центра ООКБ № 2
Седова Наталья Петровна — врач-неонатолог, заведующая отделением новорожденных перинатального центра ООКБ № 2
Фурсова Людмила Владимировна — врач-неонатолог (высшая категория) перинатального центра ООКБ № 2
Чепова Ольга Ивановна — врач-неонатолог (высшая категория) перинатального центра ООКБ № 2
Могильницкая Людмила Васильевна — врач-неонатолог (II категория) перинатального центра ООКБ № 2
Фильченкова Ирина Владимировна — врач-неонатолог (высшая категория) перинатального центра ООКБ № 2
Неверова Анна Владимировна — врач — детский реаниматолог перинатального центра ООКБ № 2
Константинова Ольга Дмитриевна — д. м.н., профессор, зав. кафедрой акушерства и гинекологии ОрГМУ; тел. 8 (3532) 31-02-01; e-mail: [email protected]
м.н., профессор, зав. кафедрой акушерства и гинекологии ОрГМУ; тел. 8 (3532) 31-02-01; e-mail: [email protected]
Демина Людмила Михайловна — к.м.н., доцент кафедры акушерства и гинекологии ОрГМУ; e-mail: [email protected]
Кондратьева Мария Александровна — врач — детский хирург, ОЦДХ
КЛЮЧЕВЫЕ СЛОВА: ЛИМФГЕМАНГИОМА, ГЕМАНГИОМА, ЛИМФАНГИОМА, ОПУХОЛЬ ТУЛОВИЩА РЕБЕНКА.
SUMMARY
This article describes the clinical case of extensive lymphhemangioma in a newborn. The tumor was identified by antenatal ultrasound examination. C-section was performed. The diagnosis was confirmed in the early neonatal period. Two- stage tactics of surgical treatment was made to performe lymphhemangiomectomy at aged infant one month.
KEY WORDS: LYMPHHEMANGIOMA, HEMANGIOMA, LYMPHHANGIOMA, TUMOR OF INFANT BODY.
Среди опухолей и опухолевидных образований у новорожденных детей наибольший удельный вес составляют различные виды гемангиом. Геман-гиома — доброкачественная сосудистая опухоль, частота возникновения — 45,7% от всех опухолей кожи и мягких тканей. Лимфангиома — доброкачественная опухоль, развивающаяся из лимфатических сосудов, встречается значительно реже, чем гемангиомы, — 10-12%. Смешанная опухоль -лимфгемангиома — составляет 13,3% [1-4].
Лимфгемангиома — это доброкачественная сосудистая опухоль, образующаяся из стенок
кровеносных и лимфатических сосудов. Часто возникает в период внутриутробного развития, нередко выявляется при ультразвуковом скрининге антенатально или на первом году жизни ребенка. Локализация новообразования может быть на лице, шее, в ротовой полости, за ушными раковинами, в подмышечных впадинах, в органах средостения, брюшной полости и т. д. В зависимости от глубины поражения опухоль может обнаруживаться в виде припухлости. Кожа может приобретать синеватый оттенок из-за близости к поверхности полости с лимфой, а также в связи с вовлечением в процесс кровеносных сосудов могут быть образования с красным оттенком, иногда в опухоли видны разветвленные и расширенные сосуды.
д. В зависимости от глубины поражения опухоль может обнаруживаться в виде припухлости. Кожа может приобретать синеватый оттенок из-за близости к поверхности полости с лимфой, а также в связи с вовлечением в процесс кровеносных сосудов могут быть образования с красным оттенком, иногда в опухоли видны разветвленные и расширенные сосуды.
Лимфгемангиомы нередко представляют опасность для жизненно важных органов и систем, так как часто локализуются не только в коже, но и в полостях организма (средостение, гортань, брюшная полость). В большинстве случаев лимфгемангиомы сообщаются с крупными сосудами, так же как и гемангиомы, могут проникать в окружающие их ткани и органы.
В данной статье представлен клинический случай из областного перинатального центра ООКБ № 2 лимфгемангиомы туловища больших размеров у новорожденного.
Беременная Л.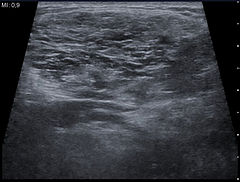 , 39 лет, потупила в родильное отделение с диагнозом «III беременность 39-40 недель. ВПР плода: лимфгемангиома туловища плода слева больших размеров». Женщина соматически здорова, наследственность не отягощена. В I триместре беременная получала лечение по поводу угрозы прерывания. При втором ультразвуковом скрининге в 20 недель беременности диагностирована лимфгемангиома туловища плода больших размеров. Проведен перинатальный консилиум. Определен метод родоразрешения. В плановом порядке проведено родоразрешение операцией кесарево сечение. При операции кесарево сечение извлечен мальчик массой 3260 г, ростом 53 см, с оценкой по шкале Апгар 7/7 баллов. Состояние ребенка при рождении тяжелое за счет порока развития. На осмотр реагирует громким
, 39 лет, потупила в родильное отделение с диагнозом «III беременность 39-40 недель. ВПР плода: лимфгемангиома туловища плода слева больших размеров». Женщина соматически здорова, наследственность не отягощена. В I триместре беременная получала лечение по поводу угрозы прерывания. При втором ультразвуковом скрининге в 20 недель беременности диагностирована лимфгемангиома туловища плода больших размеров. Проведен перинатальный консилиум. Определен метод родоразрешения. В плановом порядке проведено родоразрешение операцией кесарево сечение. При операции кесарево сечение извлечен мальчик массой 3260 г, ростом 53 см, с оценкой по шкале Апгар 7/7 баллов. Состояние ребенка при рождении тяжелое за счет порока развития. На осмотр реагирует громким
криком. Движения хаотичные, физиологические рефлексы неустойчивые. Головка округлая, большой родничок 2,0×2,0 см. На левой боковой поверхности грудной клетки с переходом на поясничную область, в левую подмышечную область обнаружена лимфгемангиома больших размеров 20x10x5 см мягкоэластической консистенции с участками уплотнения и размягчения, кожа над ней розовая, с участками бурого и голубоватого цвета. В центральной части опухоли отмечен участок мацерации кожи 2,5×2,5 см коричневого цвета, сухой, без мокнутия. Форма грудной клетки асимметрична за счет порока развития. Дыхание в легких прослушивается по задним полям, проводится во все отделы, хрипов нет, ЧД — 42 в минуту. Тоны сердца ритмичные, ЧСС — 138 в минуту. Печень и селезенка не увеличены. Живот мягкий, доступен пальпации во всех отделах. Перистальтика выслушивается. Половые органы развиты по мужскому типу, левосторонний крипторхизм. Физиологические отправления в норме. Ребенок переведен в отделение реанимации и интенсивной терапии новорожденных, выхаживался в открытой реанимационной системе. Новорожденному выставлен диагноз «ВПР: лимфгемангиома туловища слева больших размеров. Церебральная ишемия I степени, острый период. Синдром угнетения. Кожно-геморрагический синдром. Левосторонний крипторхизм».
В центральной части опухоли отмечен участок мацерации кожи 2,5×2,5 см коричневого цвета, сухой, без мокнутия. Форма грудной клетки асимметрична за счет порока развития. Дыхание в легких прослушивается по задним полям, проводится во все отделы, хрипов нет, ЧД — 42 в минуту. Тоны сердца ритмичные, ЧСС — 138 в минуту. Печень и селезенка не увеличены. Живот мягкий, доступен пальпации во всех отделах. Перистальтика выслушивается. Половые органы развиты по мужскому типу, левосторонний крипторхизм. Физиологические отправления в норме. Ребенок переведен в отделение реанимации и интенсивной терапии новорожденных, выхаживался в открытой реанимационной системе. Новорожденному выставлен диагноз «ВПР: лимфгемангиома туловища слева больших размеров. Церебральная ишемия I степени, острый период. Синдром угнетения. Кожно-геморрагический синдром. Левосторонний крипторхизм».
Ребенку проведено обследование. Рентгенография грудной клетки. Заключение. Легочный рисунок обогащен в прикорневых зонах, контуры куполов диафрагмы четкие, синусы свободные. Тень средостения не смещена. Увеличена правая доля вилочковой железы. Сердце не расширено. Петли кишечника пневматизированы. Заключение по ЭКГ — синусовый ритм, ЧСС — 140 в мин. ЭОС отклонена резко вправо, увеличена нагрузка на правое предсердие. Результаты лабораторных исследований (биохимия крови, ОАК, ОАМ) без патологии.
Тень средостения не смещена. Увеличена правая доля вилочковой железы. Сердце не расширено. Петли кишечника пневматизированы. Заключение по ЭКГ — синусовый ритм, ЧСС — 140 в мин. ЭОС отклонена резко вправо, увеличена нагрузка на правое предсердие. Результаты лабораторных исследований (биохимия крови, ОАК, ОАМ) без патологии.
Ребенок консультирован врачом-генетиком. Диагноз подтвержден — «лимфгемангиома туловища слева больших размеров». Консультирован
детским хирургом — рекомендован перевод в центр детской хирургии г. Оренбурга для оперативного лечения.
Из отделения реанимации ребенок транспортирован в центр детской хирургии, где была проведена компьютерная томография органов грудной и брюшной полости. Заключение: в мягких тканях левой боковой поверхности туловища, от I межреберья до середины крыла подвздошной кости, прилегая к поверхности ребер, определяется крупное кистозное образование размерами 130x110x30 мм, с плотностью содержимого 7-25 едН, а также до 100 едН парасептально в области множественных перегородок, которые накапливают контрастное вещество, с единичными включениями известковой плотности, размерами 2-3 мм. Рекомендовано оперативное лечение в возрасте 1 мес.
Рекомендовано оперативное лечение в возрасте 1 мес.
Лечение лимфгемангиомы индивидуально, зависит от характера опухоли, локализации, распространенности процесса, а также результатов лабораторных и инструментальных исследований. При локализации на закрытых участках тела предпочтительнее радикальное хирургическое лечение. Лечение заключается в иссечении лимфгемангиомы в пределах здоровых тканей. Лимфгемангиомы, подверженные воспалительным процессам, лечат по общим принципам лечения больных с гнойными процессами, вскрывая и дренируя их, возможно применение гормональной и лучевой терапии. Оперативное лечение проводят после купирования воспалительного процесса. В некоторых случаях, при небольших лимфгемангиомах, локализующихся в области носа, губ, околоушной области, проводят склерозирующую терапию, СВЧ-криодеструкцию.
В данном случае в связи с распространенностью и сложной анатомической локализацией опухолевидного процесса было выполнено хирургическое лечение — удаление лимфгемангиомы в два этапа.
В возрасте одного месяца мальчик Л. в плановом порядке поступил в центр детской хирургии г. Оренбурга с диагнозом «смешанная лимфгемангиома подмышечной области слева,
грудной клетки, передней брюшной стенки. Левосторонний крипторхизм. Водянка оболочек правого яичка».
Проведено ультразвуковое исследование. При сканировании мягких тканей передней поверхности грудной клетки и туловища (от подключичной до паховой области), боковой (до лопаточной области), задней поверхности (ниже VI межреберья до поясничной области) определяется кистозное образование больших размеров (структура в виде крупных анэхогенных полостей без кровотока).
Нейросонография: постгипоксические изменения головного мозга. Ликвородинамические нарушения по наружному типу.
Операция по удалению опухоли проведена в два этапа. Во время первого этапа операции проведено частичное удаление образования туловища, без осложнений. Заживление послеоперационной раны первичным натяжением. В послеоперационном периоде проведено УЗИ: при сканировании мягких тканей по боковой поверхности грудной клетки слева на глубине 5-7 мм определяется обширное скопление жидкости в виде полоски шириной до 7,5 мм (между подкожной клетчаткой и мышцами). По боковой поверхности живота слева определяются множественные кистозные образования неправильной формы размером до 3 см. Во время второго этапа операции удалена часть смешанной лимфгемангиомы передней брюшной стенки, без осложнений. Иссеченные участки подкожной клетчатки были направлены на па-тогистологическое исследование. Заключение: смешанная лимфгемангиома.
Во время первого этапа операции проведено частичное удаление образования туловища, без осложнений. Заживление послеоперационной раны первичным натяжением. В послеоперационном периоде проведено УЗИ: при сканировании мягких тканей по боковой поверхности грудной клетки слева на глубине 5-7 мм определяется обширное скопление жидкости в виде полоски шириной до 7,5 мм (между подкожной клетчаткой и мышцами). По боковой поверхности живота слева определяются множественные кистозные образования неправильной формы размером до 3 см. Во время второго этапа операции удалена часть смешанной лимфгемангиомы передней брюшной стенки, без осложнений. Иссеченные участки подкожной клетчатки были направлены на па-тогистологическое исследование. Заключение: смешанная лимфгемангиома.
Через десять дней после операции при осмотре ребенка в левой паховой области выявлено плотное болезненное образование. По данным УЗИ: яичко в паховом канале отечное, в два раза увеличено в размере по сравнению с правым. Нельзя исключить заворот яичка в левом паховом канале. Проведено оперативное вмешательство: ревизия пахового канала слева, устранение заворота левого яичка, устранение водянки правого яичка. Послеоперационный период протекал без осложнений. Ребенок выписан домой в удовлетворительном состоянии.
Нельзя исключить заворот яичка в левом паховом канале. Проведено оперативное вмешательство: ревизия пахового канала слева, устранение заворота левого яичка, устранение водянки правого яичка. Послеоперационный период протекал без осложнений. Ребенок выписан домой в удовлетворительном состоянии.
Таким образом, лимфгемангиома — смешанная сосудистая опухоль, нередко встречающаяся у детей, может успешно быть диагностирована при ультразвуковом исследовании антенатально.
В периоде новорожденности диагноз подтверждается, определяется лечебная тактика. Оперативное лечение данных опухолей возможно радикальное с сохранением жизни и здоровья ребенка.
ЛИТЕРАТУРА:
1. Волков, А. Е. Поверхностные лимфангиомы: опыт пренатальной ультразвуковой диагностики и обзор литературы / А. Е. Волков // Прена-тальная диагностика.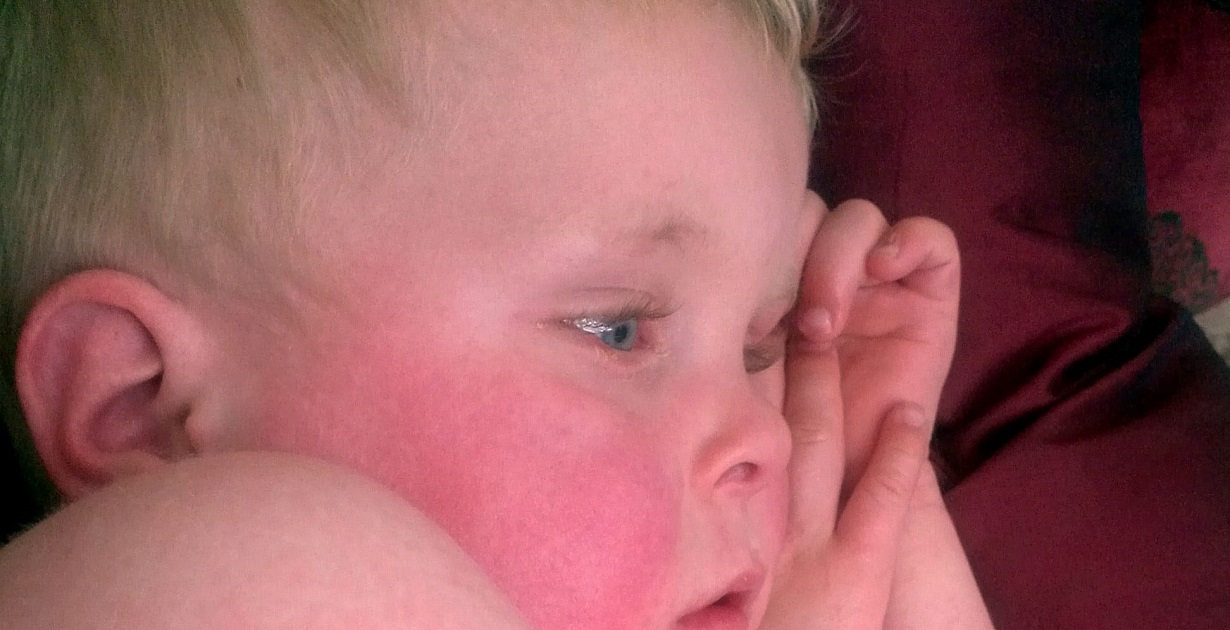 — 2006. — № 4. — С. 270-279.
— 2006. — № 4. — С. 270-279.
2. Грона, В. Н. Опухоли и опухолеподобные образования у детей / В. Н. Грона, В. К. Литовка, И. П. Журило, К. В. Латышов. — Донецк : Норд-Пресс, 2010. — 364 с.
3. Ежова, В. В. /В. В. Ежова, Л. И. Павленко, А. А. Во-инцева, Е. Г. Бакулина // Пренатальная диагностика. — 2011. — № 10. — С. 340-343.
4. Литовка, В. К. / В. К. Литовка, И. П. Журило, С. В. Веселый, К. В. Латышов //Здоровьеребенка. -2012. — № 7. — С. 127-129.
УДК 616.8-056.76
А. Ю. РЯБЧЕНКО, Н. Е. ВАГНЕР, В. С. БОГДАНОВ, А. Е. КОЗЛОВА
КЛИНИЧЕСКОЕ НАБЛЮДЕНИЕ ПАЦИЕНТКИ С РЕДКОЙ ФОРМОЙ ЛЕЙКОЭНЦЕФАЛОПАТИИ С ПОРАЖЕНИЕМ СТВОЛА ГОЛОВНОГО МОЗГА И СПИННОГО МОЗГА С ПОВЫШЕННЫМ СОДЕРЖАНИЕМ ЛАКТАТА ПО МРТ СПЕКТРОСКОПИИ
ФГБОУ ВО «Оренбургский государственный медицинский университет» Минздрава России
A. YU. RYABCHENKO, N. E. WAGNER, V. S. BOGDANOV, A. E. KOZLOVA
YU. RYABCHENKO, N. E. WAGNER, V. S. BOGDANOV, A. E. KOZLOVA
CLINICAL OBSERVATION OF A PATIENT WITH A RARE FORM OF LEUKOENCEPHALOPATHY WITH PREDOMINANT LESION OF THE BRAIN STEM, SPINAL CORD AND HIGH BLOOD LACTATE IN THE MR SPECTROSCOPY
Orenburg State Medical University
РЕЗЮМЕ
В статье приводится клиническое описание редкой формы лейкоэнцефалопатии с поражением
Рябченко Александр Юрьевич — к.м.н., доцент кафедры неврологии, медицинской генетики; тел. 8-912-849-78-66; е-шаП: [email protected]
Вагнер Николай Евгеньевич — ассистент кафедры неврологии, медицинской генетики; е-шаИ: [email protected]
Богданов Виктор Сергеевич — ассистент кафедры неврологии, медицинской генетики; е-шаИ: oliversaks@yandex. ru
ru
Козлова Анастасия Евгеньевна — студентка 6-го курса педиатрического факультета; е-шаИ: [email protected]
ствола головного мозга и спинного мозга с повышенным содержанием лактата по МРТ спектроскопии. Особенностью клинического случая является поздний дебют заболевания и несоответствие между грубыми изменениями, выявленными при магнитно-резонансной томографии головного мозга, и относительно малосимптом-ным клиническим течением.
КЛЮЧЕВЫЕ СЛОВА: ЛЕЙКОЭНЦЕФАЛОПАТИЯ, ЛАКТАТ, МАГНИТНО-РЕЗОНАНСНАЯ ТОМОГРАФИЯ, ГЕНЕТИЧЕСКОЕ ТЕСТИРОВАНИЕ.
Врачи Морозовской больницы спасли новорожденную девочку с огромной опухолью шеи
Диагноз «объемное образование шеи» маленькой пациентке был поставлен еще внутриутробно — патологию обнаружили во время дополнительного ультразвукового исследования будущей мамы на 39-й неделе беременности.
На вторые сутки после рождения, малышка была доставлена бригадой скорой медицинской помощи в неонатологическое отделение Морозовской детской больницы Департамента здравоохранения Москвы.
— При поступлении ребенка в отделение, было выявлено объемное образование мягкой консистенции размером 17×6 см в области шеи слева, которое затрудняло дыхание и кормление, — рассказала Анастасия Яковлева, лечащий врач ребенка.
Ребенку провели полное обследование, в том числе анализы крови на онкомаркеры, УЗИ образования, компьютерную томографию шеи и грудной клетки с внутривенным контрастированием. Врачи диагностировали трехкамерную опухоль поверхности шеи — предположительно лимфангиому, непроникающую в грудную полость.
Кроме того, коллективу неонатологического отделения потребовалось провести предоперационную подготовку, включающую респираторную поддержку, организацию энтерального и парентерального питания, а также профилактику инфицирования.
На седьмые сутки после рождения ребенка бригада челюстно-лицевых хирургов в составе заведующей отделением, Ирины Базиной, врача челюстно-лицевого хирурга Дениса Полуэктова и врача-анестезиолога Юлии Тарановой прооперировала маленькую пациентку. Врачи удалили образование шеи, располагающееся под кивательной мышцей и платизмой. Операция длилась полтора часа и прошла успешно – образование было удалено без нарушения целостности оболочек.
Гистологическое исследование подтвердило диагноз — лимфангиома. Лимфангиома или лимфатическая мальформация – это порок эмбрионального развития лимфатической системы, составляющая от 1 до 10% всех пороков развития сосудов у детей.
— Своевременное оперативное лечение избавило девочку от врожденного порока и позволило нормализовать питание и дыхание. Теперь ребенок может развиваться без ограничений и в дальнейшем вести полноценный образ жизни, — отметила Ирина Базина, заведующая отделением челюстно-лицевой хирургии Морозовской больницы.
После кратковременного пребывания в отделении реанимации для хирургических больных, ребенок был переведен в неонатологическое отделение, где находился уже совместно с мамой. Полностью завершив обследование и лечение, наладив кормление ребенка, добившись прибавки в массе, на десятые сутки пациентке сняли швы. Рана зажила быстро и с минимальными внешними изменениями.
Ребенок выписан домой в удовлетворительном состоянии под наблюдение педиатра по месту жительству.
Лимфангиома плода различной локализации. Опыт Центра за 14-летний период
ФГБУ «Национальный медицинский исследовательский центр акушерства, гинекологии и перинатологии имени академика В.И. Кулакова» Минздрава России, Москва, Россия
Цель. Совершенствование внутриутробной диагностики лимфангиомы плода различной локализации и оценка постнатального исхода для новорожденного.
Материалы и методы. С 2006 по 2019 гг. были выявлены 54 лимфангиомы плода. Наиболее часто встречались лимфангиомы шеи – 51,8%, абдоминальные – 11,1%, средостения – 11,1% и подмышечной области – 9,3%, бедра и голени – 9,3%, реже – грудной клетки и передней брюшной стенки – 5,6%, множественные – 1,9%.
Результаты. При эхографии лимфангиома выявлялась как объемное жидкостное образование различных размеров с множественными перегородками без зон васкуляризации. Беременность завершилась родами в 50 наблюдениях, 49 детей для дальнейшего лечения поступили в отделение хирургии новорожденных, у 1 плода внутриутробно произошло исчезновение опухоли. Прерывание беременности проведено в 3 наблюдениях. Интранатальная гибель плода произошла в 1 случае. Оперативное лечение проведено у 33 детей, у всех – с благоприятным исходом.
Заключение. Применение эхографии позволяет диагностировать внутриутробно такую редкую патологию, как лимфангиома. При отсутствии сопутствующей патологии прогноз для новорожденного благоприятный.
эхография
плод
лимфангиома
пренатальная диагностика
- Перельман М.И., Юсупов И.А., Седова Т.Н. Хирургия грудного протока. М.: Медицина; 1984: 136 с.
- Lu D., Wang Y., Zeng W., Peng B. Giant fetal lymphangioma at chest wall and prognosis: case report and literature review. Taiwan. J. Obstet. Gynecol. 2015; 54(1): 62-5. https://dx.doi.org/10.1016/j.tjog.2014.11.009.
- Masood S.N., Masood M.F. Case report of fetal aхillo-thoraco-abdominal cystic hygroma. Arch. Gynecol. Obstet. 2010; 281(1): 111-5. https://dx.doi.org/10.1007/s00404-009-1068-2.
- Temizkan O., Abike F., Ayvaci H., Demigar E., Görücü Y., Isik E. Fetal axillary cystic hygroma: a case report and review. Rare Tumors. 2011; 3(4): e39. https://dx.doi.org/10.4081/rt.2011.e39.
- Tanaka H., Masumoto K., Aoyama T., Sanmoto Y., Ono K., Sakamoto N. et al. Prenatally diagnosed large mediastinal lymphangioma: a case report. Clin. Case Rep. 2018; 6(9): 1880-4. https://dx.doi.org/10.1002/ccr3.1760.
- Tongsong Th., Luewan S., Khorana J., Sirilert S., Charoenratana C. Natural course of fetal axillary lymphangioma based on prenatal ultrasound studies. J. Ultrasound Med. 2018; 37(5): 1273-81. https://dx.doi.org/10.1002/jum.14473.
- Исаков Ю.Ф., Володин Н.Н., Гераськин А.В., ред. Неонатальная хирургия. М.: Династия; 2011. 680 с.
- Chen Y.N., Chen Ch.P., Lin Ch.J., Chen S.W. Prenatal ultrasound evaluation and outcome of pregnancy with fetal cystic hygromas and lymphangiomas. J. Med. Ultrasound. 2017; 25(1): 12-5. https://dx.doi.org/10.1016/j.jmu.2017.02.001.
- Adaletli I., Towbin A.J., Ozbayrak M., Madazli R. Anterior mediastinal limphangioma: pre- and postnatal sonographic findings. J. Clin. Ultrasound. 2013; 41(6): 383-5. https://dx.doi.org/10.1002/jcu.21960.
- Дженти П., Гонсалвес Л.Ф. Аномалии развития органов шеи и грудной полости. В кн.: Флейшер А., Мэнинг Ф., Дженти П., Ромеро Р., ред. Эхография в акушерстве и гинекологии. Теория и практика. ч. 1. Пер. с англ. М.: Издательский дом Видар-М; 2005: 423-44.
- Ersoy A.O., Oztas E., Saridogan E., Ozler S., Danisman N. An unusual origin of fetal lymphangioma filling right axilla. J. Clin. Diagn. Res. 2016; 10(3): QD09-11. https://dx.doi.org/10.7860/JCDR/2016/18516.7513.
- Медведев М.В. Пренатальная эхография. Дифференциальный диагноз и прогноз. М.: Реал Тайм; 2009. 368 c.
- Mikovic Z., Simic R., Egic A., Opincal T.S., Koprivsek K., Stanojevic D. et al. Intrauterine treatment of large fetal neck lymphangioma with OK-432. Fetal Diagn. Ther. 2009; 26(2): 102-6. https://dx.doi.org/10.1159/000238111.
- Jiao-Ling L., Hai-Ying W., Wei Z., Jin-Rong L., Kun-Shan C., Qian F. Treatment and prognosis of fetal lymphangioma. Eur. J. Obstet. Gynecol. Reprod. Biol. 2018; 231: 274-9. https://dx.doi.org/10.1016/j.ejogrb.2018.10.031.
- Goldstein I., Leibovitz Z., Noi-Nizri M. Prenatal diagnosis of fetal chest lymphangioma. J. Ultrasound Med. 2006; 25(11): 1437-40. https://dx.doi.org/ 10.7863/jum.2006.25.11.1437.
- Reichler A., Bronshtein M. Early prenatal diagnosis of axillary cystic hygroma. J. Ultrasound Med. 1995; 14(8): 581-4. https://dx.doi.org/ 10.7863/jum.1995.14.8.581.
- Martinez R., Heredia F. Axillary hemangiolymphangioma. 2002. Available at: www.thefetus.net/
- Baytur Y.B., Ulkumen B.A., Pala H.G. Foetal axillary lymphangioma with ipsilateral pes equinovarus: pitfalls in sonographic differential diagnosis (axillary lymphangioma and pes equinovarus). J. Obstet. Gynaecol. 2015; 35(6): 647-9. https://dx.doi.org/10.3109/01443615.2014.992872.
- Niwa Y., Imai K., Kotani T., Nakano T., Ushida T., Moriyama Y. et al. A pitfall in diagnosing fetal abdominal lymphangioma: a report of two cases. J. Clin. Ultrasound. 2019; 47(8): 494-6. https://dx.doi.org/10.1002/jcu.22756.
- Deshpande P., Twining P., O’Neill D. Prenatal diagnosis of fetal abdominal lymphangioma by ultrasonography. Ultrasound Obstet. Gynecol. 2001; 17(5): 445-8. https://dx.doi.org/10.1046/j.1469-0705.2001.00367.x.
- Santo S.F., Marques J.P., Veca P., Melo A., Graça L.M. Prenatal ultrasonographic diagnosis of abdominal cystic lymphangioma: a case report. J. Matern. Fetal Neonatal Med. 2008; 21(8): 565-6. https://dx.doi.org/10.1080/14767050802165927.
- York D.G., Wolfe H., von Allmen D. Fetal abdomino-perineal lymphangioma: differential diagnosis and management. Prenat. Diagn. 2006; 26(8): 692-5. https://dx.doi.org/10.1002/pd.1481.
- Медведев М.В., Юдина Е.В., Сыпченко Е.В. Исчезающие аномалии у плода при динамическом эхографическом наблюдении. Ультразвуковая диагностика. 1997; 1: 71-4.
- Стыгар А.М., Демидов В.Н. Ультразвуковая оценка состояния органов пищеварительной системы плода. В кн.: Митьков В.В., Медведев М.В., ред. Клиническое руководство по ультразвуковой диагностике. т. 2. М.: Издательский дом Видар-М; 1996: 181-204.
- Malpas T.J., MacLachlan N., Dyres E., Kiely E.M. Prenatal intestinal perforation and intra-abdominal lymphangioma. Prenat. Diagn. 2007; 27(9): 882-3. https://dx.doi.org/10.1002/pd.1794.
- Sung E.R., Jae Y.B., Kim H.H., Shin J.C., Ahn H.Y., Kim D.C. et al. Prenatal sonographic and MRI imaging findings of extensive fetal lymphangioma: a case report. Korean J. Radiol. 2003; 4(4): 260-3. https://dx.doi.org/10.3348/kjr.2003.4.4.260.
- Dionisio A.C., Gomes R., Cernadas E., Caballero I., Semião M., Branco V. et al. Giant cystic mediastinal lymphangioma. Eur. J. Case Rep. Intern. Med. 2019; 7(1): 001323. https://dx.doi.org/ 10.12890/2019_001323.
- Adaletli I., Towbin A.J., Ozbayrak M., Madazli R. Anterior mediastinal limphangioma: pre- and postnatal sonographic findings. J. Clin. Ultrasound. 2013; 41(6): 383-5. https://dx.doi.org/10.1002/jcu.21960.
- Varlet F., Guye E., Varlet M.N., Tronchet M., Mariat G., Chene G. Isolated mediastinal lymphangioma: prenatal diagnosis and thoracoscopic treatment. Surg. Sci. 2010; 1: 20-3. https://dx.doi.org/10.4236/ss.2010.11004.
- Демидов В.Н., Машинец Н.В. Ультразвуковая диагностика больших размеров нетипичной локализации лимфангиом плода. Пренатальная диагностика. 2007: 6(3): 193-7.
- Демидов В.Н., Машинец Н.В. Изолированная лимфангиома средостения больших размеров у плода с летальным исходом: обзор литературы и собственное наблюдение. Пренатальная диагностика. 2016; 15(2): 155-9.
- Машинец Н.В., Демидов В.Н., Подуровская Ю.Л., Дорофеева Е.И. Абдоминальная лимфангиома плода: обзор литературы и собственные наблюдения. Пренатальная диагностика. 2017; 16(4): 334-9.
- Демидов В.Н., Машинец Н.В., Подуровская Ю.Л., Дорофеева Е.И., Панин А.П. Лимфангиома подмышечной области гигантских размеров: обзор литературы и собственные наблюдения. Пренатальная диагностика. 2017; 16(4): 319-24.
Поступила 28.05.2020
Принята в печать 14.09.2020
Машинец Наталья Валериевна, к.м.н., с.н.с. отделения ультразвуковой и функциональной диагностики, ФГБУ «НМИЦ АГиП им. В.И. Кулакова» Минздрава России.
Тел.: +7(906)795-66-47. E-mail: [email protected]. 117997, Россия, Москва, ул. Академика Опарина, д. 4.
Демидов Владимир Николаевич, д.м.н., профессор отделения ультразвуковой и функциональной диагностики, ФГБУ «НМИЦ АГиП им. В.И. Кулакова»
Минздрава России. Тел.: +7(910)451-25-68. E-mail: [email protected]. 117997, Россия, Москва, ул. Академика Опарина, д. 4.
Дорофеева Елена Игоревна, к.м.н., врач детский хирург, заведующая по клинической работе отделением хирургии новорожденных, ФГБУ «НМИЦ АГиП
им. В.И. Кулакова» Минздрава России. Тел.: +7(916)114-21-18. E-mail: [email protected].
Подуровская Юлия Леонидовна, к.м.н., руководитель отделения хирургии новорожденных, ФГБУ «НМИЦ АГиП им. В.И. Кулакова» Минздрава России.
Тел.: +7(916)107-13-88. E-mail: [email protected]. 117997, Россия, Москва, ул. Академика Опарина, д. 4.
Панин Андрей Петрович, к.м.н., врач детский хирург отделения хирургии новорожденных, ФГБУ «НМИЦ АГиП им. В.И. Кулакова» Минздрава России.
Тел.: +7(495)531-44-44. E-mail: [email protected]. 117997, Россия, Москва, ул. Академика Опарина, д. 4.
Никифоров Денис Викторович, врач анестезиолог-реаниматолог отделения хирургии новорожденных, ФГБУ «НМИЦ АГиП им. В.И. Кулакова» Минздрава России.
Тел.: +7(495)531-44-44. E-mail: dennik2009@mail.» «
На правах рукописи
Дорвло Теодор
ХИРУРГИЧЕСКОЕ ЛЕЧЕНИЕ ЛИМФАНГИОМ У ДЕТЕЙ (Экспериментально-клиническое исследование)
14.00.35 -детская хирургия
Автореферат диссертации на соискание ученой степени кандидата медицинских наук
— 1 опт 2009
Ростов-на-Дону, 2009
003478187
Работа выполнена в Государственном образовательном учреждении высшего профессионального образования «Ростовский государственный медицииский университет Федерального агентства по здравоохранению и социальному
развитию»
Научный руководитель -
Заслуженный деятель науки РФ, доктор медицинских наук, профессор
Чспурной Геннадий Иванович
Официальные оппоненты:
Доктор медицинских наук, профессор Бабич Игорь Иванович
Кандидат мидицнпскнх наук Франциянц Капуст Геворкович
Ведущая организация
Кубанский государственный медицинский университет
Защита состоится
<¿0» У Ю_2009 г. часов на
заседании диссертационного совета Д 208.082.04 при ГОУ ВПО Ростовском государственном медицинском университете (344022, Ростов-на-Дону, переулок Нахичеванский, 29).
С диссертацией можно ознакомиться в библиотеке ГОУ ВПО Ростовского государственного медицинского университета.
Автореферат разослан « ли оУ
2009 г.
Ученый секретарь диссертационного совета, доктор медицинских наук, профессор
И.П.Чумбуридзе
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность проблемы
Лимфангиомы возникают в результате порочного развития лимфатической системы у эмбриона, начиная с 6-недельного срока беременности (W.Eigler, 1926; J.Petteri et al.,1953). Они относятся к зрелым, доброкачественным опухолям, исходящим из лимфатических сосудов, Лимфангиомы могут быть наружными (шейными, шейно-подмышечно-грудиыми) и внутренними (средостенными, внутренних органов, забрюшиннмми, тазовыми). Наиболее частыми являются лимфангиомы шейной локализации — от 74% до 82% (З.В.Гольберт, Г.А.Лавникова, 1965; Л.А.Дурнов, 1984; J.Maslrobattista, R.Andres, 2000), шейно-подмышечно-грудные лимфангиомы встречаются у 6% больных (Ш.Р.Хасанов, Ц.С.Хутиев, 1990; B.Lakhkar, D.Shetiy, 2000), средостенной локализации — у 10-16% больных (Э.А.Степанов, 1966; H.Matsui, S.Andou, A.Satake, 1993; Y.Fujita, Y.Sato, K.Togashi, 1994), в органах брюшной полости — 1-2% (В.ИЛкушин, И.Н.Макаров, Н.Е.Черняховская, 1981; T.Merrot, K.Chaumoitre, 1999; A.Kwon, H.Inui, K.Tsuji, 2001), забрюшинного расположения — y 1-2% пациентов (К.Н.Селезнева, А.С.Князева, 1980; E.Freud, U.Farkash, R.Cassella, 1999; J.Fernandez, J.Moran, 2001), тазовой локализации — y 1-2% пациентов (J.Hoeffel, A .Marchai, E.Pierre, 1990).
Вследствие генетического родства лимфангиом к кровеносным сосудам, в частности, к венозной системе, представляет определенные трудности их радикальное удаление, где они близко располагаются к магистральным сосудам шеи, подмышечной области, средостения и других локализаций. В этой связи трудно удапимая, а потому остающаяся на крупных сосудистых стволах лимфангиоматозная ткань служит источником рецидивов опухоли, которые встречаются от 6,4% (И.М.Воронцов, 1972; В.В.Приходченко, 1986) до 7,6% (А.П.Малинин, 1974).
Кроме этого нет единого мнения по вопросу этапности иссечения лимфангиом. Если ни у кого не вызывает сомнений в отношении рациональности одномоментного хирургического вмешательства при удалении внутриполостных локализаций лимфангиом, то в отношении поверхностных лимфангиом, особенно имеющих крупные размеры, существуют 2 точки зрения. Одна группа хирургов считает целесообразным одномоментное удаление опухоли (Ю.Ф.Исаков, Э.А.Степанов, 1978), другая группа хирургов придерживается этапности выполнения операции (П.П.Кузьмичев, Е.А.Баженов, А.Д.Ниман, 1995; Г.И.Чепурной с соавт., 2007). Практически не существует работ, поднимающих вопрос о косметологической стороне хирургических вмешательств, предпринимаемых при удалении лимфангиом (В.В.Приходченко, 1986).
В этой связи нами предприняты исследования по разрешению наиболее дискутабельных вопросов проблемы хирургического лечения лимфангиом у детей.
Цель исследования. Улучшить результаты хирургического лечения детей с лимфангиомами различной локализации.
Задачи исследования.
1.Разработать способ обработки остающихся во время хирургического вмешательства участков лимфангиоматозной ткани на жизненно важных анатомических образованиях, исключающий возможность рецидива опухоли.
2. Доказать целесообразность этапнрсти выполнения хирургического вмешательства при обширных поверхностных лимфангиомах, захватывающих разные анатомические области.
3. Показать необходимость выполнения космстологических элементов во время иссечения лимфангиом и пластических операций в отдаленные сроки послеоперационного периода.
Научная новизна.
1. Разработан способ механической и химической деструкции фрагментов лимфангиоматозной ткани, оставляемых на жизненно важных анатомических образованиях и органах (крупных магистральных сосудах, трахее, бронхах, перикарде и др.) ввиду значительного риска их повреждения при манипуляциях, связанных с удалением опухоли со стенок этих образований. Эффективность этого способа доказана в экспериментально-клинических исследованиях.
2. Клинически доказана целесообразность разделения хирургического вмешательства на этапы в зависимости от объема лимфангиомы и сложности анатомических областей ее локализации.
3. Подтверждена необходимость соблюдения принципов косметологической хирургии во время выполнения самого хирургического вмешательства по удалению лимфангиоматозной опухоли, а также целесообразность проведения реконструктивно-восстановительных и пластических операций в отдаленные сроки послеоперационного периода.
Практическая значимость.
1.Внедрение разработанного способа механической и химической деструкции лимфангиоматозной ткани в клиническую практику позволяет до минимума сократить рецидивы лимфангиом даже гигантских размеров и сложной анатомической локазации. Этот способ используется как дополнительный, основным же по-прежнему остается хирургическое иссечение лимфангиоматозной ткани. Он должен быть безупречно использован особенно при удалении лимфангиом из переднего средостения, так как эта операция осуществляется одномоментно.
2.При объемных лимфангиомах, распространяющихся на несколько сложных анатомических областей, рекомендуемое планирование выполнения хирургического вмешательства по удалению опухоли в 2-3 этапа (по времени) просто необходимо. Это позволяет более тщательно и радикально
провести операцию, разобраться хирургу в анатомически сложных условиях, не повредив при этом важных анатомических структур. Учитывая доброкачественный характер лимфангиом, такое деление операции на этапы вполне реально.
З.Значение косметологического подхода к иссечению лимфангиом преимущественно шейной и шейно-подчелюстно-лицевой области трудно переоценить. Не только направление кожных разрезов имеет значение в этом отношении, но и повреждение ветвей различных нервов диктует в последующем необходимость выполнения пластических операций. Хирургические доступы должны обеспечить полное сохранение функции тех областей, откуда иссекалась опухоль.
Основные положения, выносимые на защиту.
1.Разработанный способ механической и химической деструкции лимфангиоматозной ткани путем соскабливания эндотелиальной выстилки кистозных стенок опухоли и их последующей обработки 96° спиртом научно обоснован в экспериментальных исследованиях; эффективность его подтверждена клиническими наблюдениями.
2.При удалении обширных поверхностных лимфангиом, распространяющихся на сложные анатомические области, целесообразно деление хирургического вмешательства на 2-3 этапа, что позволяет более радикально удалить опухоль, не повредив важных анатомических структур.
3.Несомненно важное значение имеет косметологическая сторона хирургического вмешательства по удалению наружных лимфангиом. Принципов пластической хирургии необходимо придерживаться как во время удаления самой лимфангиомы, так и для устранения морфологических и функциональных нарушений, возникающих в результате выполнения хирургического вмешательства.
Апробация работы
Основные положения диссертации доложены на IV научной сессии РостГМУ (Ростов-на-Дону, 2005), на заседании Ростовского областного научного общества хирургов (Ростов-на-Дону, 2009).
Публикации
По теме диссертации опубликовано 3 научные работы.
Внедрение результатов работы в практику
Основные результаты работы внедрены в клиническую практик)’ кафедры детской хирургии и ортопедии ГОУ ВПО Ростовского государственного медицинского университета, работу детских хирургических отделений больницы № 20 г. Ростова-на-Дону и Ростовской областной детской клинической больницы.
Основные положения диссертации, опубликованные в печати, используются при чтении лекций и проведении практических занятий со студентами
лечебного и педиатрического факультетов ГОУ ВПО Ростовского государственного медицинского университета, на цикле «детская хирургия» ФПК и ППС РостГМУ.
Объем и структура диссертации
Диссертационный материал изложен на 99 страницах компьютерного текста, состоит из введения, обзора литературы, материалов и методов исследования, 4 глав собственных экспериментальных и клинических исследований, заключения, выводов и практических рекомендаций. Список литературы включает 177 источников отечественных и зарубежных авторов. Диссертация иллюстрирована 39 рисунками и 8 таблицами.
СОДЕРЖАНИЕ РАБОТЫ Материал и методы исследования
Работа носит экспериментально-клинический характер. Эксперименты выполнены на 9 беспородных кроликах весом от 2 до 3 кг. Забор операционного материала осуществляли в сроки 7, 14 и 28 суток после хирургического вмешательства на шее (табл. 1).
Таблица 1. Общая характеристика экспериментальных исследований
Серия эксперимента Сроки изъятия материала после операции Количество животных
I (первая) Через 7 дней 3
II (вторая) Через 14 дней 3
III (третья) Через 28 дней 3
Итого через 7,14,28 дней 9
Как видно из таблицы, животные были распределены на 3 серии, по 3 кролика в каждой серии.
Экспериментальная часть диссертации выполнена на кафедре оперативной хирургии и клинической анатомии ФУВ и ППС РостГМУ (зав. — проф. В.К.Татьянченко). Гистологические исследования проведены на кафедре микробиологии РостГМУ (зав. — проф. П.А. Хлопонин). Гистопрепараты окрашивали гематоксилин-эозином, а также пикрофуксином по Ван Гизон и в дальнейшем изучали с помощью световой микроскопии под 100-400-кратным увеличением микроскопа.
Клинический материал (74 больных) набран в одном лечебном учреждении г. Ростова-на-Дону — горбольнице № 20 за период с 1982 по 2009 годы.
Все дети были в возрасте от 3 суток до 5 лет. Среди 74 пациентов мальчиков было 42 (56,7%), девочек — 32 (43,3%). С шейной локализацией лимфангиом было 62 (84%), с шейно-подмышечно-грудной локализацией — 6
(8%) и с медиастинальным расположением — также 6 (8%) больных (табл. 2). В диссертационный материал были отобраны эти 3 типа локализации лимфангиом, хотя в клинике встречались и другие типы расположения опухоли (плечо, бедро, подлопаточная область), но они были единичны, небольших размеров, имели смешанную лимфгемангиоматозную структуру и никаких особенностей при их удалении не представляли.
Таблица 2. Общая характеристика больных
Локализация лимфангиом Возраст, мес Пол Всего
0-3 3-7 7-12 >12 м ж абс. %
Шейная 4 24 23 И 37 25 62 84
Шейно-подмышеч-но-грудная — 4 2 — 2 4 6 8
Медиастинапьная — 5 1 — 3 3 6 8
Итого 4 33 26 11 42 32 74 100
Как видно из таблицы, большинство детей (59 человек; 80%) было в возрасте от 3 до 12 месяцев и преобладала шейная локализация лимфангиом (62 ребенка; 84%).
Как правило, дети поступали в плановом порядке (67 человек; 90,5%), лишь небольшая часть из них (7 человек; 9,5%) поступили в клинику по ургентной помощи с основным синдромом заболевания — приступом нарастающего удушья.
Всем детям, независимо от локализации лимфангиом, проводилось, кроме общеклинического, рентгенологическое обследование (рентгенография органов грудной клетки в двух проекциях), позволявшее выявить связь шейной или шейно-подмышечно-грудной лимфангиом с загрудинным пространством.
Лечение пациентов состояло в хирургическом удалении лимфангиом, интраоперационной обработки оставленной на магистральных сосудистых и нервных стволах, а также жизненно важных органах (трахее, бронхах, перикарде и др.) лимфангиоматозной ткани методом соскабливания и последующей обработки 96° спиртом. Отдаленные результаты операций оценивали по клиническому состоянию больных, лабораторному и рентгенологическому (по показаниям) исследованиям.
СОБСТВЕННЫЕ РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Экспериментальные исследования
Принимая во внимание родство генеза лимфатической и венозной систем организма, нами были проведены экспериментальные исследования на 9 кроликах. Цель эксперимента состояла в том, чтобы выяснить, какие морфологические изменения происходят в местах соскабливания внутренних слоев венозной стенки и обработки этих мест 96° спиртом. Такая ситуация возникает у больных, когда невозможно удалить лимфангиома-
тозную ткань со стенок крупных сосудистых (в основном венозных) стволов и приходится оставлять участки патологических тканей на них, соскабливая скальпелем внутреннюю выстилку оставленной лимфангиомагозной ткани и протирая эти участки марлевым шариком, смоченным 96° спиртом.
Эксперимент заключался в следующем (рис. 1). У кролика выстригали и выбривали шерсть в области правой половины шеи и обрабатывали кожу 5% спиртовым раствором иода. Под масочным эфирным наркозом после премедикации (атропин — 0,3 мл; димедрол — 1,0 мл; анальгин — 2,0мл в/м) разрезом вдоль правой m. sternocleidomastoideus рассекали мягкие ткани до основного сосудистого пучка шеи. Выделяли v. jugularis int. на протяжении 2 см и лигировали ее в 2 местах: у места ветвления ее у угла нижней челюсти и у грудины. Перевязку вены осуществляли синей нитью пролена 4/0. Между лигатурами вскрывали просвет вены продольным сечением ее стенки. Края рассеченной стенки подшивали к паравазальным тканям в центральных местах сечения, выворачивая венозный просвет интимой наружу.
Каудально от этих боковых швов до грудинной лигатуры скальпелем соскабливали внутренние слои с венозной стенки вплоть до адвентиции сосуда и обрабатывали это место в течение 2-3 сек марлевым шариком,
Рис. 1. Выделена внутренняя яремная вена кролика (А): 1 — краниальная лигатура; 2 — каудальная лигатура; 3 — линия рассечения венозной стенки. Изолированный участок вены разбортован интимой наружу (Б): 1 — швы, фиксирующие края венозной стенки к паравазальным тканям; 2 — участок вены с удаленной интимой; 3 — участок вены с сохраненной интимой.
б
смоченным спиртом. Краниальная половина вскрытой вены оставалась интактной и служила в качестве контроля.
Сшивали подкожную клетчатку и кож)’ шеи узловыми швами. Линию швов обрабатывали спиртовой настойкой иода.
Через 7, 14 и 28 дней выполняли повторную операцию, которая состояла в том, что обнажали первоначальную зону хирургического вмешательства, иссекали отрезок вены между лигатурами, которые определяли по синему цвету, с паравазальными тканями, и препарат отправляли на гистологическое исследование.
Летальных исходов среди оперированных животных не было. После повторных хирургических вмешательств кролики оставались живыми и использовались для проведения других экспериментов.
При гистологическом изучении установлено следующее.
На 7-е сутки после проведения операции был отмечен резкий отек стенки сосуда. Эндотелий отсутствовал. Внутренняя оболочка сосуда была отечна. В ней выявлялись зоны отложения нейтральных мукополисахаридов, выявляемых при ШИК-реакции, и обширные участки фибриноидного некроза. Отмечалась выраженная плазморрагия с выходом форменных элементов крови в стенку сосуда и за ее пределы. В сохранившемся наружном слое стенки вены имелась диффузная лимфогистиоцитарная инфильтрация.
Общая гистологическая картина измененной стенки вены на 7-е сутки после операции соответствовала деструктивно-экссудативному васкулиту.
Признаки сращения сосудистой стенки с окружающими тканями отсутствовали, хотя в окружающих тканях присутствовал выраженный отек и диффузная лимфогистиоцитарная инфильтрация.
Таким образом, при гистологическом исследовании выявлено, что механическое повреждение (удаление) внутренних слоев стенки вены вплоть до адвентиции в эксперименте в ранние сроки приводит к пропитыванию оставшейся части венозной стенки компонентами плазмы, фибрина, форменными элементами крови, развитию отека сосудистой ткани и плазмор-рагии вплоть до фибриноидного некроза.
В контрольной группе строение венозной стенки не было нарушено. Просвет вены широкий. Внутренняя оболочка представлена эндотелием и тонким, рыхлым субэпителиальным слоем, отграниченным со стороны эндотелия слабо развитой внутренней эластической мембраной. Средняя оболочка тонкая, содержит коллагеновые волокна, межуточную субстанцию и гладкомышечные клетки. Последние имеют вытянутую форму, вытянутые ядра, и напоминают фибробласты.Наружная оболочка содержит адвентици-альную соединительную ткань, систему vasa vasorum и перицитарные клеточные элементы. Вену окружает жировая клетчатка, состоящая из комплексов (долек) адипозоцитов, окруженных прослойками рыхлой соединительной ткани.
При гистологическом исследовании стенки вены на 14-й день после операции отек стенки вены в области операции сохраняется. В оставшейся части стенки вены отмечается увеличение числа клеток, усиление синтеза и
отложение внеклеточного матрикса. Отмечаются признаки пролиферации гладкомышечных клеток. Сосуды микроциркуляторного русла расширены .
Деструктивно-экссудативный васкулит, имевший место в более ранние сроки, сменяется пролиферативным васкулитом. Регенерации эндотелия не наступает. Воспалительная инфильтрация с наружной оболочки стенки вены, распространяясь на окружающую соединительную ткань и жировую клетчатку, к 14-м суткам от начала эксперимента приводит к формированию сращения между ними за счет наличия молодой созревающей соединительной ткани с большим количеством фибробластов и признаками диф-ференцировки сосудов. В ней видны тонкие новообразованные коллагеновые волокна. Границы между наружной венозной стенкой и окружающей тканью практически не различимы. Просвег сосуда незначительно деформирован и сужен. Отмечается пролиферация клеточных элементов наружной оболочки сосудистой стенки (перицитов и адвентициапьных гистиоцитов) при сохранении инфильтрации ее мононуклеарными клеточными элементами гематогенного происхождения — макрофагами и лимфоцитами.
Таким образом, к 14-м суткам после операции в стенке зены деструктивно-экссудативный васкулит сменяется пролиферативным васкулитом. Регенерации эндотелия не наступает. Отмечается начало процесса сращения наружного слоя венозной стенки с окружающими тканями.
В контрольной зоне в эти сроки стенка вены имеет обычное строение. Признаки воспалительного процесса и сращения вены с окружающими тканями отсутствуют.
При гистологическом исследовании стенки вены на 28-й день после операции обнаружены признаки деформации венозного просвета. В оставшейся части венозной стенки отмечается склероз и гиалиноз. Эндотелиальная выстилка отсутствует. Граница между венозной стенкой и окружающей тканью не визуализируется за счет наличия плотного сращения между ними. Сращение обусловлено развитием плотной волокнистой соединительной ткани с большим количеством коллагеновых волокон, немногочисленными сосудами, располагающимися среди клеточных элементов. При этом преобладающими клеточными элементами являются фибробласты и фиброциты (рис. 2).
Рис. 2. 28-е сутки после операции. Сращение стенки вены с окружающими тканями посредством зрелой соединительной ткани. Окраска гематоксилиеном и эозином. Увеличение 100.
В контрольной зоне в эти сроки имеются признаки воспалительного процесса, сращения вены с окружающими тканями отсутствуют.
Таким образом, к 28-м суткам после операции оставшаяся после хирургического вмешательства часть венозной стенки окружена соединительной тканью. Просвет сосуда деформирован. Эндотелиапьная выстилка отсутствует. Стенка сосуда и окружающие ткани плотно сращены между собой.
Итак, с помощью экспериментальных исследований было установлено, что спустя 4 недели после соскабливания интимы венозной стенки и последующей обработки ее марлевым шариком со спиртом происходит склерозирование вены за счет разрастания мезенхимальной ткани как в самой венозной стенке, так и в паравазальной ткани. Отсутствие регенерации эндо-телиальной выстилки сосуда с лимфопродуцирующей функцией применительно к лимфангиомам имеет существенное значение для хирурга. Потеря структурных очертаний сосуда служит основанием для клинического использования этого метода в лимфангиоматозных участках, оставляемых на магистральных сосудистых стволах. Отдаленные результаты клинического применения этой методики подтвердили правильность такого суждения.
Клинические исследования
Хирургическое лечение лимфа/¡гиом шейной локализации
Как уже было отмечено ранее, лимфангиомы шейной локализации имели место у 62 детей (84%). Диагноз устанавливали сразу после рождения ребенка. Величина опухоли варьировала в пределах: от 8x6x4 см до гигантских размеров, превышающих голову ребенка в 4-5 раз и достигающих объема более 4 литров, что и определяло характер родоразрешения. Большинство детей (58 человек; 93,5%) родились естественным путем, лишь незначительная часть пациентов (4 человека; 6,5%) — с помощью кесарева сечения.
Диагноз не представлял затруднений: припухлость овальной конфигурации с покрывающей ее неизмененной кожей, тугоэластической консистенции, безболезненная, с ограниченной подвижностью. В задачу хирургов входило обнаружение или исключение связи ее с загрудинным пространством, а также установление сопутствующей патологии со стороны других органов, могущих повлиять на сроки хирургического удаления лимфангиомы.
В возрастном аспекте: от 0 до 1 мес было 2, от 1 до 3 мес — 2, от 3 до 7 мес — 24, от 7 до 12 мес — 23, старше года — 11 детей. Мальчиков было 37, девочек 25. Из города Ростова-на-Дону поступило 36 больных, из городов и сельских районов Ростовской области — 26 пациентов. Все дети в сопровождении родителей поступали в клинику в плановом порядке, лишь один больной с гигантской лимфангиомой шеи был переправлен машиной скорой помощи сразу после рождения из родильного дома в реанимационное отделение клиники. У 62 больных лимфангиомы шеи не имели связи с загрудинным пространством, что выявляли рентгенологически; у ряда больных были обнаружены сопутствующие пороки развития (табл. 3).
Таблица 3. Сопутствующие пороки развития у больных с шейными лимфаигиомами_________
Пол
Сопутствующие пороки развития Количество детей м ж
Дефект межпредсердной перегородки 2 1 1
Дефект межжелудочковой перегородки 1 1 -
Врожденный гидронефроз (односторонний) 1 — 1
Дисплазия тазобедренного сустава 2 — 2
Итого….. 6. 2 4
Из представленной таблицы видно, что сопутствующие пороки развития обнаружены у 6 пациентов, что составило 9,7%, причем у девочек (4) они зарегистрированы в 2 раза чаще, чем у мальчиков (2).
Сроки выполнения хирургического вмешательства подбирались с учетом многих факторов, характеризующих состояние ребенка, но принципиальное положение — не оперировать ребенка в периоде новорожденное™ — неукоснительно соблюдали почти у всех больных. Лишь у 3 пациентов (5%) операция была выполнена в диапазоне 4-13 дней и была связана либо с гигантскими размерами опухоли, либо с быстрым ее увеличением.
Из 62 больных опухоли больших размеров и внедряющиеся в подчелюстную область имели место у 17 пациентов, что составило 25,8% (табл. 4).
У большинства больных операция была выполнена в один этап. Только у б детей проведено 2-этапное вмешательство с интервалом 4-7 дней, при лимфангиомах, внедряющихся в подчелюстную область, когда удаление опухоли было сопряжено с выделением многих важных анатомических структур: мышц, сосудов, нервов, повреждение которых было связано с иивалидиза-цией ребенка в функциональном и косметологическом отношениях.распространяющихся лимфангиом шейной локализации у всех пациентов заканчивалось благополучно, и рецидивы опухоли не имели места за весь период выполнения хирургических вмешательств: как до 2005 г., так и после этого срока. Среди 11 больных, имеющих шейные лимфангиомы больших размеров, распространяющихся на подчелюстную область и оперированных одномоментно, у 4 детей зарегистрированы рецидивы опухоли, потребовавшие повторных операций. Эти пациенты были оперированы до 2005 г. У 9 больных с аналогичными опухолями, но онерированеных после 2005 г., т. е. 2-этапно и с применением дополнительной обработки оставляемой лимфангиоматозной ткани, рецидивы опухоли отсутствовали.
Единственным недостатком таких обширных хирургических вмешательств следует признать пересечение нижних ветвей лицевого нерва. Анализируя такие клинические наблюдения, мы пришли к убеждению, что лучше оставлять часть лимфангиомы в зоне выхода налицо лицевого нерва и удаление этого участка опухоли предоставлять нейрохирургам, имеющим опыт по скелетированию ветвей лицевого нерва из окружающих патологических тканей, либо использовать склерозирующую терапию. Стремление во что бы то ни стало выполнить операцию радикально нередко приводит к инвалидизации больного и необходимости выполнения в дальнейшем хирургических вмешательств пластического характера на лице.
Лимфангиомы, достигающие гигантских размеров, но располагающиеся поверхностно, не являются противопоказанием для выполнения корреги-рующих хирургических вмешательств. В отдаленные сроки послеоперационного периода необходимо лишь обеспечить пациенту косметологическую часть операции, что в наши дни развития пластической хирургии вполне реально. К счастью, такой контингент больных встречается исключительно редко. Возможность рождения таких детей живыми в настоящее время стала реальностью благодаря успехам многих областей медицинских и биологических знаний, и в первую очередь, научным и практическим достижениям акушерства, гинекологии, анестезиологии, реаниматологии, УЗИ-диаг-ностики, детской хирургии.
В радикальности удаления шейных лимфангиом первостепенное значение, безусловно, имеют хирургические приемы, используемые для полного иссечения опухоли. В этом отношении такие операции трудоемки, длительны по времени и требуют тщательности исполнения. Мы оставляем островки лимфангиоматозной ткани действительно в тех местах, где их иссечение таит в себе угрозу повреждения жизненно важных анатомических структур: крупные сосуды, трахея, пищевод, крупные нервные стволы и др. Оставленную в таких местах опухолевую ткань соскабливаем скальпелем и обрабатываем спиртом, чтобы вызвать ее склерозирование и тем самым подавить лимфопродукцию. Этот прием, разработанный в эксперименте, предотвращает рецидив заболевания.
У оперированных 62 больных летальных исходов не было. Такие результаты стали возможны благодаря разработке этапности хирургических
вмешательств, радикальности их выполнения в результате применения комплексного воздействия на лимфангиому. Считаем ценным также и то, что в процессе выполнения подобных операций выработана хирургическая тактика в отношении фрагментов лнмфангиом, локализующихся в зоне п. facialis, что, несомненно, считаем важным в косметологическом плане.
Хирургическое лечение лимфангиом шейпо-подмышечно-грудной локализации
На нашем материале лимфангиомы шейно-подмышечно-грудной локализации встретились у 6 больных, что составило 8%. Эти опухоли были значительной величины и распространенности, занимали анатомические области со сложной сосудисто-нервной структурой, а потому имели свои особенности хирургического лечения и решения многочисленных вопросов тактического плана. Возраст детей колебался от 3 до 12 месяцев (табл. 5). Мальчиков было 2, девочек — 4. Все больные поступали в плановом порядке.
Таблица 5. Характеристика больных с лимфангиомами шейно-подмышечно-грудной локализации
Характер операции Возраст, мес Пол Всего больных Реци див
м ж
Одномоментное хирургическое удаление опухоли без применения вспомогательных вмешательств 3-12 1 2 3 3
Поэтапное хирургическое удаление опухоли с применением вспомогательных вмешательств 3-8 1 2 3 -
Итого…………….. 3-12 2 4 6 3
* под вспомогательным вмешательством подразумевается соскабливание скальпелем лимфангиоматозных участков, оставленных на крупных сосудах, нервах, трахее, с последующим протиранием этих мест марлевым шариком с 96° спиртом.
У половины больных шейная часть лимфангиомы распространялась кроме боковой, но и на заднюю поверхность шеи, заходя в межмышечные клет-чаточные пространства. Такое распространение опухоли требовало тщательного иссечения лимфангиоматозной ткани из этих щелей, а оставление части ее в этих образованиях послужило причиной рецидивирования лимфангиом у 3 больных. Возобновление роста опухоли касалось именно этих мест задней поверхности шеи.
Пять опухолей этой локализации были с левой стороны, что, вероятно, имеет какую-то связь с местом впадения в венозный угол йипсш {утрИаИсия Мо-гаслсиБ. О заинтересованности этого структурного образования свидетельствует также и то, что наиболее выраженной в лимфангиоме данной локализации была именно надключичная часть опухоли, от которой, как из центра,
шли периферические ветви лимфангиоматозных разрастаний. Второй конгломерат опухолевой ткани располагался в подмышечной ямке, окружая сосу-дисго-нервный пучок этой области. Из этой зоны отроги лимфангиоматоз-ной ткани переходили на переднее-боковую поверхность грудной стенки, распространяясь в подкожножировой клетчатке, но и заходя в межмышечные клетчаточные пространства большой и малой грудных мышц.
Безусловно, такая распространенность лимфангиомы требовала от хирургов не одномоментного ее удаления, а этапности в выполнении такого типа хирургических вмешательств. Как правило, операцию осуществляли в 3 этапа: первым этапом иссекали шейный фрагмент опухоли, вторым этапом -подмышечный фрагмент и третьим этапом — торакальную часть лимфангиомы. Интервал между этапами составлял, как правило, 4-7 суток и зависел ог состояния пациента, лабораторных данных, особенностей предыдущих этапов операции.
Рассечение кожи планируем таким образом, чтобы было не только удобно доставать все отроги удаляемого фрагмента опухоли, но и свести до минимума ограничения, связанные с возможным возникновением рубцовых контрактур плечевого сустава. Поэтому подмышечный фрагмент лимфангиомы мы удаляем из разреза, идущего в передне-заднем направлении. Шейную часть опухоли удаляем из волнообразного разреза, проходящего по шейной кожной складке и переходящего на надключичную область. Грудную часть опухоли удаляем из разреза, проходящего по наружному краю большой грудной мышцы. Все 3 разреза обычно не сливаются между собой, между ними остаются кожные мостики, обеспечивающие подвижность рубцов.
Не вызывает сомнений тот факт, что наиболее сложным в техническом плане был этап удаления лимфангиомы из подмышечной области. Здесь мы стремились к максимальному иссечению стенок поликистозного лимфоидно-го образования, оставляя часть из них на магистральных сосудистых стволах с их крупными ветвями, а также нервах. Если подмышечный фрагмент опухоли удаляли первым этапом, то операцию заканчивали пересечением и ли-гированием отрогов лимфангиоматозной ткани, уходящих на шею и на грудную стенку. Сшиваем кожу операционной раны после дренирования ее резиновой полоской с последующим введением ватно-марлевого валика в подмышечную впадину с целью устранения раневой полости и создания условий для соприкосновения раневых поверхностей и последующего их сращения. Для фиксации руки в прижатом к туловищу положении применяем повязку Дезо. У двух больных мы удалили фрагменты лимфангиомы из подкрыльцовой впадины и на грудной стенке одновременно, т.к. опухоль этих областей представляла собой единый конгломерат без четких анатомически различимых разграничений. При этом удаление грудной части лимфангиомы проводили, все время заботясь о сохранности п. thoracalis longus et a. thoracalis lateralis.
Обращаясь еще раз к таблице 5, следует отметить, что лимфангиомы (3) с распространением на шейную, подмышечную и грудную области, оперированные одномоментно до 2005 г., все рецидивировали за счет шейного
фрагмента опухоли. Потребовались повторные хирургические вмешательства у 2 больных и один ребенок оперирован трижды, чтобы полностью удалить опухоль. 3-этапное иссечение аналогичных лимфангиом у 3 больных с дополнительной обработкой оставляемой опухолевой ткани, что осуществлялось после 2005 г., закончилось без рецидива опухоли.
Таким образом, поэтапное удаление наружных лимфангиом больших размеров и распространяющихся на несколько анатомических областей с соскабливанием и обработкой 96° спиртом оставляемой лимфангиоматозной ткани явились факторами, способствующими получению благоприятных отдаленных результатов.
Хирургическое лечение лимфангиом медиастиналыюй локализации
Лимфангиомы передне-верхнего средостения имели место у 6 больных, что составило 8%. Возрастной и половой состав детей с этой локализацией лимфангиом отражен в таблице 6.
Таблица 6. Характеристика больных с лимфангиомами медиастималь-ной локализации
Сроки госпитализации больных с лимфангиомами средостения Кол-во больных Пол Возраст, мес.
м ж
В экстренном порядке 1 — 1 12
В плановом порядке 5 3 2 3-4
Итого ………….. 6 3 3 3-12
Как видно из таблицы, возраст детей колебался от 3 до 12 месяцев. Среди них мальчиков было 3, девочек — 3. В экстренном порядке был госпитализирован один ребенок. В плановом порядке было госпитализировано 5 больных.
Основная часть лимфангиом медиастинальной локализации располагается за грудиной в переднем средостении, и лишь небольшой фрагмент ее выступает в области вырезки грудины на переднюю поверхность шеи. Второй фрагмент опухоли располагается обычно в левой надключичной области, в зоне впадения ductus lymphaticus thoracicus в венозный угол, образованный v.jugularis int. и v.subclavia sin. Здесь локализуется видимая «на глаз» припухлость, тугоэластической консистенции, с неизмененной кожей над нею, мало подвижная. Эта опухоль, сдавливая трахею, вызывает инспираторную одышку, а сдавливая верхнюю полую вену, вызывает одутловатость головы и шеи с синюшным оттенком их кожных покровов, связанную с затрудненным оттоком венозной крови от этих частей тела ребенка.
Естественно, основная симптоматика исходит из места расположения опухоли в загрудинном пространстве с его взаимоотношением с сердцем,
крупными сосудистыми стволами, трахеей, главными бронхами, вилочковой железой. Кистозные полости оказывают давление на эти важные анатомические образования, уменьшая просвет в первую очередь венозных стволов (tr. ven. brachiocephalicus dexl. et sin., vena cava sup.) и трахеи, вызывая у больных затруднение дыхания инспираторного типа, тахипноэ, симптом Стокса.
Появление такой симптоматики заставляет в первую очередь произвести рентгенографию органов грудной клетки в фасной и боковой проекциях, на которых видно расширение тени средостения и расположение патологического образования в верхне-переднем средостении. Более четкая картина выявляется при компьютерной томографии. На томограммах визуализируется многокамерное образование, располагающееся в передне-верхнем загрудинном пространстве, хорошо определяются границы лимфангиомы, характер изменения просветов крупных венозных стволов и трахеи. По продольным срезам можно представить вертикальные и передне-задние размеры опухоли, по поперечным срезам — ее ширину, а также характер распространения опухоли на шее.
С помощью катетеризации подключичной вены регистрировали высокие цифры центрального венозного давления.
Течение заболевания носило прогрессирующий характер, что и объясняет госпитализацию детей не в ближайшие дни или недели после рождения, а в возрасте 2-3 месяцев.
Обычно не удается зарегистрировать каких-либо существенных изменений в функции основных жизненно важных систем организма, кроме дыхательной, и больные после кратковременной (до 2 суток) подготовки подвергались хирургическому лечению.
В нашей клинике мы выполняем частичную стернотомию в виде перевернутой буквы Т. Продольное рассечение грудины распространяется, как правило, на 3-4 межреберья, затем пересекаем грудину в поперечном направлении на уровне III или IV межреберья . С помощью ранорасширителя разводим в стороны края грудины и обнажаем передне-верхнее средостение. После этого сразу улучшаются вентиляционные и гемодинамические параметры в состоянии больного, что обычно регистрируют анестезиологи.
Обычно вилочковая железа вовлечена в лимфангиоматозную ткань, и мы ее убираем вместе с опухолью. Стремимся полностью удалить лимфангиоматозную ткань и лишь там, где это не удается сделать (крупные сосудистые стволы, трахея, перикард), оставляем участки стенки кист, соскабливая внутреннюю поверхность с них скальпелем и обрабатывая эти места марлевым шариком, смоченным 96° спиртом. Безусловно, удаляем и шейные части опухоли, локализующиеся, как правило, в зоне подключичных сосудов.
При удалении лимфангиом у всех 6 пациентов нам удалось избежать массивного кровотечения. Гемостаз осуществлйем с помощью лигирования сосудов и диатермокоагуляции. Зону хирургического вмешательства дренируем тефлоновой трубкой с множеством боковых отверстий, которую укладываем от вырезки грудины до нижнего угла операционной раны; далее про-
водим ее через туннель, создаваемый в передне-нижнем средостении, и выводим на кожу под мечевидным отростком. В послеоперационном периоде к концу трубки подсоединяем резиновую грушу, создавая дренаж по Редону. Сверху трубки сшиваем грудину капроновыми узловыми швами, затем накладываем швы на подкожную клетчатку и кожу, используя обычно проленовую нить (Prolen 4/0). Дренажную трубку фиксируем к коже одним швом и удаляем ее обычно на 10-15-е сутки послеоперационного периода после полного прекращения сецернации раневой жидкости.
Если в процессе хирургического вмешательства повреждаем плевральные листки, то эти повреждения ушиваем в конце операции. Заканчиваем операцию пункцией плевральной полости на стороне поврежденной плевры через межреберье с эвакуацией воздуха до вакуума.
Как правило, послеоперационный период протекал гладко. Дренажную трубку удаляем на 10-15-е сутки с наложением одного шва на кожный разрез. Выписывали детей на 16-18-е сутки после операции.
Попытка удалить лимфангиому средостения эндоскопическим путем — это безумие! Трудно себе представить возможность эндоскопического иссечения лимфангиоматозной ткани из всех участков ее распространения, в том числе сиять ее со стенок крупных венозных и артериальных стволов, трахеи, главных бронхов, перикарда. Лимфангиомы медиастинальной локализации должны убираться только открытым способом; для этого достаточно 2-3 часов интенсивной работы.
Из особенностей течения послеоперационного периода следует отметить следующее — из загрудинного пространства серозно-геморрагическая жидкость продолжала выделяться в течение 10-15 суток, так что дренажную трубку приходилось удалять в этот период, накладывая один кожный шов. Выполняем контрольную рентгенограмму органов грудной полости в фасной проекции и выписываем ребенка из отделения.
За последние 5 лет (с 2005 г.) мы оперировали 3 детей с лимфангиомами медиастинальной локализации. До 2005 г. в клинике находилось на лечении также 3 детей с лимфангиомами переднего средостения. Анализируя исходы хирургического лечения этого вида опухолей (табл. 7), следует отметить, что среди детей, оперированных до 2005 г. один ребенок умер во время операции. При этом следует заметить, что повреждений жизненно важных анатомических образований переднего средостения в процессе хирургичекого вмешательства не было. Возможно, имели место какие-то погрешности в анестезиологическом пособии. Аутопсия не производилась, поэтому причина смерти ребенка осталась на уровне догадок и предположений.
Таблица 7. Исходы различных способов хирургического лечения детей с лимфаигимами средостения
Исходы
Характер хирургического Всего здоро- лета- смерть неиз-
лечения больных боль- вы льный в отда вестен
ных ленном
п/о пер
Хирургическое иссечение опухоли без
дополнительной обработки оставляемой 3 — 1 1 1
опухолевой ткани
Хирургическое иссечение опухоли с до-
полнительной обработкой оставляемой 3 3 — — -
опухолевой ткани
Итого ………. 6 3 1 1 1
Один ребенок умер через 3 месяца после выписки из клиники также от невыясненной причины. Судьба третьего пациента оказалась невыясненной, так как родители его поменяли после операции место жительства, таким образом, связь с больным была утеряна.
Трое детей, оперированных позже 2005 г., живы по настоящее время и находятся под динамическим (3 раза в год) наблюдением у сотрудников клиники. При контрольном обследовании выполняются общеклинические, лабораторные и рентгенологические исследования. Отдаленные результаты оценивали через 1-4 года после операции. Все дети жалоб не предъявляли, росли и развивались нормально. Клинически — не страдали одышкой, болей за грудиной не ощущали, были довольны косметическими результатами. Рентгенологически — теней патологических образований в переднем средостении не обнаруживалось. В анализах крови отклонений от нормы не регистрировали. В последние годы приняли за правило — снимать с контрольного обследования пациентов, достигших 10-летнего срока после операции.
Таким образом, особенности хирургического лечения медиастинальных лимфангиом состоят в следующем. Во-первых, эта локализация лимфангиом требует одноэтапности удаления опухоли, что связано с травматичностыо доступа к переднему средостению. Во-вторых, анатомическая сложность и наличие многих жизненно важных структурных образований в зоне расположения опухоли требует от хирурга тщательности и особой осторожности хирургических манипуляций в этой области. Мы стремимся максимально удалить лимфангиоматозную ткань из переднего средостения обычно вместе с тканью вилочковой железы, оставляя ее лишь на крупных сосудистых стволах, стенках трахеи и главных бронхов, перикарде. Соскабливание скальпелем поверхностных слоев с этих участков и последующее их протирание марлевым шариком, смоченным 96° спиртом, требует также осторожности и тщательности, а, следовательно, времени.
Особой осторожности и внимания требует обработка оставленных кистозных стенок на крупных сосудах, особенно венах. Хотя у нас не было ранений венозных стволов, однако нетрудно себе представить такое осложнение с возникновением сразу критического состояния больного в результате одномоментно возникшего массивного кровотечения и трудностей по ушиванию сосудистой стенки. Вскрытие просветов трахеи, главных бронхов и перикарда представляет меньшую опасность, хотя также нежелательно и считается серьезным осложнением операции. В-третьих, существенное значение имеют вопросы восстановления анатомии области хирургического вмешательства. Здесь нужно отметить, что, хотя частичная стернотомия и не создает чрезмерной подвижности грудины, однако ее сшивание все-таки требует скрупулезной тщательности. Немаловажное значение придаем также и вопросам обеспечения длительного дренирования средостения в послеоперационном периоде. Тщательное выполнение всех элементов этого сложного многочасового хирургического вмешательства определяет его уникальность и необходимость выполнения в торакальных отделениях крупных лечебных учреждений областного или краевого подчинения.
ВЫВОДЫ
1. Разработанный в эксперименте способ соскабливания внутренних слоев сосудистых образований с последующей обработкой их 96° спиртом, примененный в клинических условиях к кистозным стенкам при хирургическом иссечении лимфангиом, позволил в течение 4-летнего срока наблюдения за больными исключить их рецидивы, и прежде всего при медиастиналыюй локализации опухоли, что особенно важно, так как эти операции выполняются одномоментно.
2. При выполнении операций по удалению наружных лимфангиом, распространяющихся на несколько сложных анатомических областей, целесообразно разделение их на 2-3 этапа, позволяющих радикально выполнить каждый из них и, благодаря тщательности оперирования, сохранить анатомические структуры с важными функциями для организма.
3. При удалении обширных лимфангиом как наружной, так и внутренней локализации, необходимо использовать принципы косметологической хирургии, заботясь не только о сохранении функциональной активности тех областей, откуда иссекается опухоль, но и об эстетичности операционных рубцов.
ПРАКТИЧЕСКИЕ РЕКОМЕНДАЦИИ
1.Внедрение разработанного способа хирургического иссечения, соскабливания и обработки 96° спиртом лимфангиоматозной ткани в клиническую практику позволяет до минимума сократить рецидивы лимфангиом даже гигантских размеров и сложной анатомической локазации. Он должен быть использован при всех локализациях лимфангиом, но особенно при удалении лимфангиом из переднего средостения, так как эта операция осуществляется одномоментно.
2.При объемных лимфангиомах, распространяющихся на несколько сложных анатомических областей, рекомендуемое планирование хирургического вмешательства по удалению опухоли в 2-3 этапа (но времени) просто необходимо. Это позволяет более тщательно и радикально провести операцию, разобраться хирургу в анатомически сложных условиях, не повредив при этом важных анатомических структур. Учитывая доброкачественный характер лимфангиом, такое деление операции на этапы вполне реально.
З.Значение косметологического подхода к иссечению лимфангиом преимущественно шейной и шейно-подчелюстно-лицевой области трудно переоценить. Не только направление кожных разрезов имеет значение в этом отношении, но и повреждение ветвей различных нервов диктуют в последующем необходимость выполнения пластических операций. Хирургические доступы должны обеспечить полное сохранение функции тех областей, откуда иссекалась опухоль.
СПИСОК РАБОТ, ОПУБЛИКОВАННЫХ ПО ТЕМЕ ДИССЕРТАЦИИ
1. Чепурной Г.И., Дорвло Т., Ветрянская В.В., Дадаян А.Г., Розин Б.Г. Особенности хирургического лечения лимфангиом у детей. // Сб.: Новое в теории и практике стоматологии. — Ставрополь, 2008. — С. 321-325.
2. Чепурной Г.И., Дорвло Т., Татьянченко В.К. и др. Принципы хирургического лечения лимфангиом у детей. // Детская хирургия. — 2009. — № 5. — С. 4-7
3. Дорвло Т. Экспериментальная модель повышения радикальности хирургического удаления лимфангиом. Мат. Российского конгресса «Современные технологии в педиатрии и детской хирургии». М., 2009, с. 132-133.
Сдано в набор 11.09.2009. Подписано в печать 14.09.2009 г. Бумага офсетная. Ротапринт. Гарнитура Times News Romans. Формат 60х 84 1/16. Объем 1,0 п. л. Тираж 100 экз. Заказ № 0022
Отпечатано в типографии «АртИкс», г. Ростов-на-Дону, пр. Ворошиловский, 78, тел. 290-46-42
Лимфангиома:Причины,Симптомы,Лечение | doc.ua
Причины
В настоящее время причинами возникновения лимфангиомы называются два различных варианта:
- первый – лимфангиома является настоящей, истинной опухолью;
- второй – лимфангиома является следствием заболевания лимфатической системы человека.
В большинстве случаев данная доброкачественная опухоль появляется еще до рождения ребенка – это врожденная патология. Нередко заболевание одновременно развивается с другими отклонениями в развитии организма.
Симптомы
Чаще всего опухоль проявляется в полости рта, на шее или руках; возможно появление ее и на других частях тела. При капиллярной лимфангиоме образуется большое количество маленьких пузырьков, в которых содержится жидкость с желтоватым оттенком, иногда – пурпурным. В том случае, если причиной образования лимфангиомы служит лимфостаз, то она выглядит как пятно или постепенно разрастающаяся эритематозная бляшка.
Диагностика
Лимфангиома в 90% случаев проявляется в первый год жизни ребенка. Увеличивающиеся утолщения у лимфатических узлов могут расти вместе с ребенком, но могут и резко изменять свои размеры. Простые лимфангиомы представляют собой холмистые утолщения кожного покрова, выделяющиеся не резко. Поверхность кожи может быть влажной – это называется «лимфорея».
Кистозная лимфангиома выглядит как упругое образование, которое покрывает растянутая кожа. В некоторых случаях сквозь кожный покров заметно образование синего оттенка. Чаще всего встречается эта опухоль у детей на шее. Кистозные лимфангиомы в своих размерах увеличиваются медленно, но во время своего роста могут сдавливать внутренние органы, трахеи, нервы, которые располагаются поблизости.
Лимфангиому кавернозного типа определяют по присутствию припухлостей; очертания ее нечеткие, расплывчатые. При надавливании такая лимфангиома уменьшается в объеме, а затем постепенно объем восстанавливает. Чаще всего встречается на губах, языке, шее, околоушных областях, щеках.
Лечение
В основном, лечение лимфангиомы осуществляется с помощью хирургического способа – ее иссечения. Однако каждый конкретный случай сначала исследуется на предмет длительности заболевания, наличия клинических симптомов, а также возможной деформации скелета – в большинстве случаев скелета лица.
С помощью хирургического вмешательства удаляются лимфангиомы на шее, в полости рта или на лице. Полное удаление опухоли может быть произведено только при лимфангиоме ограниченного типа. В части случаев после операции лимфангиома больше не появляется, но возможно ее повторное возникновение, наполнение пузырьков жидкостью.
Если не помогает хирургический способ или он невозможен в конкретном варианте, то применяются и другие методы для борьбы с таким заболеванием как лимфангиома. Лечение осуществляется с помощью общеукрепляющей терапии; терапии с помощью лекарственных (антигистаминных) средств; производится пункция с последующим удалением содержимого опухоли; терапия лекарственными препаратами с целью уменьшения проницаемости стенок сосудов; гирудотерапия; использование антибактериальных препаратов; уменьшение интоксикации с помощью приведения в нормальное значение водно-солевого баланса.
Лимфангиома кожи: кистозная форма
Перед нами ребенок с разрозненными высыпаниями в области коленей, появившиеся относительно недавно. На лице у матери один вопрос – что у моего чада?
Совместный консилиум с отличным клиницистом нашего диспансера Федосовой Жанной Александровной, перед осмотром доцента Ермошиной Н.П.. Перед нами ребенок с разрозненными высыпаниями в области коленей, появившиеся относительно недавно. На лице у матери один вопрос – что у моего чада? Ответ чрезвычайно прост это лимфангиома кожи. На мой взгляд это одна из немногих доброкачественных опухолей кожного покрова, которая не требует дифференциального диагноза. Перепутать визуальные характеристики лимфангиомы кожи с другими новообразованиями архи сложно. Особенно это сложно сделать, когда из случайно травмированных пациентом опухолей начинается лимфорея.
Лимфангиома в данном случае является первичной, т.к. анамнестических указаний на какой либо патологический процесс, протекавший ранее в данном участке кожи и сопровождавшийся лимфостазом, у этого ребенка не было. Лимфангиома является доброкачественной опухолью растущей из лимфатических сосудов (как правило, дермы). Клинически лимфангиому подразделяют на три типа.
Капиллярная лимфангиома – сложно диагностируемая клинически опухоль, дебютирующая с появления макулезного элемента, над которым не сохранена дерматоглифика и кожа не собирается в складки, со временем розово-красный оттенок сменяется на цвет кистозной формы и тогда у клинициста появляется шанс диагностировать опухоль. В клинике нашего диспансера мы наблюдали такую пациентку. Капиллярная форма лимфангиомы кожи, не смотря на сложности диагностики, является, по нашему мнению, наиболее курабельной опухолью кожи. Удалить ее в силу «компактности» патологического процесса проще остальных. У данной пациентки было произведено электродессикационное удаление очага с фульгурацией дна эрозии. Спешу поделиться своим маленьким «дерматохирургическим секретом» с начинающими дерматологами … при удалении капиллярных лимфангиом, если таковые встретятся в вашей работе, рекомендую запомнить две вещи. Во-первых, используйте хорошие электрокаутеры, что бы иметь возможность «играть» мощьностью прибора и устанавливать различные режимы работы. А, во-вторых, никогда не начинайте удаление капиллярной лимфангиомы в режиме коагуляции, всегда устанавливайте режим «секции» (т.е. разреза). Этот режим вызывает минимальные перифокальные повреждения тканей и позволит Вам контролировать полноту удаления опухоли. Дело в том, что если проводить удаление в режимах коагуляции или фульгурации можно оставить часть опухоли недеструктированной, но узнаете Вы об этом только спустя пару дней, когда через струп и серозно-геморрагические крусты в ране после коагуляции будет «сочиться» лимфа. Режим «секции» позволяет контролировать глубину деструкции и недоудаленные зоны опухоли дадут «о себе знать» визуально определяемой лимфореей сразу в операционной.
Кавернозная лимфангиома встречается крайне редко. Клинически она представлена множенными нодулярными эффлоресценциями на отечном основании.
В отличии от этих двух клинических форм лимфангиомы кожи, кистозная форма, представленная на этом клиническом примере, достаточно просто диагностируется. К сожалению, для нашего юного пациента и ее мамы, кистозную форму лимфангиомы возможно удалить только путем хирургической эксцизии с широким захватом, в пределах здоровых тканей. Все другие дерматохирургические пособия (радиоволновая хирургия, дермабразия и др.) имеют крайне неблагоприятный прогноз в плане раннего рецидива опухоли.
14. Лимфангиома у детей. Классификация. Клинические проявления. Дифференциальная диагностика. Осложнения. Лечение.
Лимфангиома
Лимфангиома
— доброкачественная опухоль врождённого
характера, микроскопическая структура
которой напоминает тонкостенные
кисты различных размеров от узелков
диаметром от 0,2—0,3 см до крупных
образований. Лимфангиомы встречаются
значительно реже, чем гемангиомы, и
составляют примерно 10—12% всех
доброкачественных образований у детей
(рис. 11-6).
Патоморфологическая
и клиническая классификации лимфанги-
ом и гемангиом в основном совпадают.
Различают простые, кавернозные и
кистозные лимфангиомы.
Простая
лимфангиома представляет собой
разрастание лимфатических сосудов
ограниченных участков кожи и подкожной
клетчатки.
Кавернозная
лимфангиома — наиболее частая форма,
наблюдаемая у детей. Структура её
представлена неравномерно наполненными
лимфой
полостями, образованными из
■соединительнотканной губчатой основы,
содержащей гладкие мышечные волокна,
эластический каркас и мелкие лимфатические
сосуды, выстланные эпителием.
Кистозная
лимфангиома может состоять из одной
или множества кист величиной от 0,3
см до размера головы ребёнка, которые
могут сообщаться между собой. Внутренняя
поверхность кист выстлана эндотелием,
а стенки содержат плотную соединительную
ткань. Могут существовать переходные
элементы лимфангиом, возможно сочетание
разных форм.
Лимфангиомы
чаще всего обнаруживают в первый год
жизни ребёнка (до 90% ной лимфангиомой
шеи. случаев), реже — в первые 2—3 года.
Ло кализуются они там, где бывают
скопления регионарных лимфатических
узлов: в подмышечной области, на шее,
щеках, губах, языке, в паховой области,
реже в области корня брыжейки, забрюшинном
пространстве, средостении.
Растут
лимфангиомы относительно медленно,
чаще синхронно с ростом ребёнка, но
иногда лимфангиомы резко увеличиваются
независимо от возраста.
Клиническая
картина и диагностика
Простая
лимфангиома представляет собой утолщение
кожи, слегка бугристое, нерезко
очерченное, как правило, с небольшой
подкожной частью. Иногда на коже
наблюдают разрастания элементов
лимфангиомы в виде небольших узелков.
Поверхность лимфангиомы может быть
несколько влажной (лимфорея).
Кавернозную
лимфангиому диагностируют по наличию
припухлости, нерезким очертаниям,
мягкой консистенции. Часто ощущается
флюктуация. Кожа может быть спаяна с
образованием, но не изменена или мало
изменена. При надавливании опухоль
может сжиматься, затем медленно
наполняться вновь. Смещаемость опухоли
незначительна. Рост достаточно
медленный. Наиболее характерная
локализация кавернозных лимфангиом
— шея, околоушная область, щёки, язык,
губы. Весьма характерны частые
воспалительные процессы, развивающиеся
в лимфангиоме. Иногда в результате
воспалений лимфангиома останавливает
свой рост и даже исчезает.
Кистозная
лимфангиома представляет собой эластичное
образование, покрытое растянутой
кожей, которая, как правило, не изменена.
Отмечается отчётливая флюктуация.
Иногда через истончённую кожу просвечивает
синеватое образование. При пальпации
можно уловить неровность стенки кист.
Наиболее часто эти лимфангиомы встречаются
на шее (причём одна часть опухоли может
находиться в средостении в виде «песочных
часов»). При этом целесообразно выполнять
рентгенографию грудной клетки с целью
выявления узла опухоли такой локализации.
Кистозные лимфангиомы растут довольно
медленно, но при своём росте могут
сдавливать сосуды, нервы, а при расположении
вблизи трахеи и пищевода — эти органы,
что требует порой экстренных
оперативных вмешательств.
Диагностика
лимфангиомы не вызывает затруднений.
Клиническая картина довольно
характерна, тем не менее для уточнения
диагноза, а чаще для уточнения
анатомических вариантов расположения
выполняют лимфографию. Для этой цели
опухоль пунктируют и вводят
водорастворимое контрастное вещество
10—20% концентрации. После выполнения
исследования контрастное вещество
удаляют и полости, куда вводилось
контрастное вещество, промывают
изотоническим раствором хлорида
натрия. Рентгеновские снимки выполняют
в двух проекциях, что даёт представление
о расположении и анатомических
взаимоотношениях опухоли.
Дифференциальная
диагностика
Дифференциальную
диагностику лимфангиомы проводят с
брахи- огенными кистами шеи, кистами из
остатков щитовидноподъязычного
протока, дермоидами, спинномозговыми
грыжами, липомами, тератомами,
лимфаденитами шеи. Внимательный осмотр
больного помогает различить эти
заболевания. Шейные кисты располагаются
по срединной линии, не достигают больших
размеров, связаны с трахеей и слегка
смещаются при глотании. Брахиогенные
кисты располагаются по краю
грудино-ключично-сосцевидной мышцы.
Дермоиды
единичны, плотной консистенции, чётко
отграничены, чаще правильной округлой
формы, без тенденции к быстрому росту.
Воспалительные изменения в лимфатических
узлах характеризуются отёчностью,
гиперемией, болезненностью, повышением
местной температуры. Липомы обычно
не флюктуируют, имеют нечёткие границы,
кожа над ними не изменена.
Очень
важна дифференциальная диагностика со
спинномозговыми грыжами, которые
располагаются строго медиально, не
проявляют тенденции к увеличению,
довольно часто сопровождаются
неврологическими расстройствами
разной степени выраженности. При
рентгенографии выявляется порок развития
позвонков.
От
крестцово-копчиковой тератомы лимфангиому
отличают мягкость консистенции,
наличие флюктуации, просвечивающая
через кожу жидкость. Использование для
уточнения диагноза рентгенографии
позволяет выявить включения, характерные
для тератомы и не наблюдаемые при
лимфангиомах.
Лечение
Лечение
лимфангиомы в основном хирургическое.
Однако в некоторых случаях при
небольших лимфангиомах, локализующихся
в области носа, губ, околоушной области,
проводят склерозирующую терапию, как
при гемангиомах.
Хирургическое
лечение заключается в иссечении
лимфангиомы в пределах неизменённых
тканей. Подобные вмешательства легче
осуществляются при кистозных
лимфангиомах. Кавернозные лимфангиомы
часто распространяются в межфасциальные
пространства, бывают спаяны с окружающими
органами и тканями, и их полное иссечение
не всегда возможно. В этих случаях
оставшиеся участки лимфангиомы прошивают
шёлковыми или капроновыми нитями. Весьма
эффективна высокочастотная коагуляция
(электрокоагуляция) оставшихся
участков опухоли в плане предотвращения
реци- дивирования. Иногда для долечивания
используют склерозирую- щую терапию.
Реже
применяют отсасывание содержимого
опухоли посредством пункции. Такой
способ лечения более рационален у
новорождённых при наличии больших
лимфангиом на шее, когда затруднены
дыхание, глотание, сосание. Это
позволяет временно улучшить состояние
больного и подготовить его к операции.
Лимфангиомы,
подверженные воспалительным процессам,
лечат по общим принципам лечения больных
с гнойными процессами. Лимф- ангиому
вскрывают, дренируют. Иногда в результате
воспалительного процесса лимфангиома
может значительно уменьшиться или даже
исчезнуть. Оперативное лечение проводят
по стихании воспалительного процесса.
Оперативные вмешательства по поводу
лимфангиом могут быть весьма длительными
и тяжёлыми, поэтому целесообразно,
если нет экстренных показаний, оперировать
детей после первого полугодия жизни.
Хирургия
новорожденных
1.
***Организация хирургической помощи
новорожденным с пороками развития.
Значение антенатальной диагностики
патологии плода, роль медико-генетических
консилиумов. Ранжирование пороков
развития по частоте встречаемости,
вероятности полноценной коррекции,
исходам и качеству жизни пациента и
семьи.
И
2.
Пороки развития пищевода, сопровождающиеся
синдромом дыхательных расстройств:
атрезия пищевода, трахеопищеводные
свищи. Анатомические варианты. Клинические
проявления. Комплекс диагностики на
этапе родильного дома, отделения
реанимации специализированного
стационара. Предоперационная подготовка.
Принципы оперативного лечения. Ведение
ближайшего и отдаленного послеоперационного
этапа.
Атрезия
пищевода
Атрезия
пищевода — тяжёлый порок развития, при
котором верхняя часть пищевода
заканчивается слепо, а нижняя часть
чаще всего сообщается с трахеей. Варианты
атрезии пищевода представлены на рис.
4-35. Часто атрезия пищевода сочетается
с другими пороками развития —
врождёнными пороками сердца, ЖКТ,
мочеполовой системы и др. В 5% случаев
атрезию пищевода наблюдают при
хромосомных болезнях. Частота атрезии
пищевода 0,3:1000. Соотношение мужского
и женского пола 1:1.
Развитие
порока связано с нарушениями в ранних
стадиях эмбриогенеза. Известно, что
трахея и пищевод возникают из одного
зачатка — головного конца передней
кишки. На самых ранних стадиях трахея
широко сообщается с пищеводом. Их
разделение происходит на 4—5-й неделе
внутриутробного развития. При
несоответствии направления и скорости
роста трахеи и пищевода, а также процессов
вакуолизации, которую пищевод проходит
вместе с другими образованиями
кишечной трубки в сроки от 20-годо 40-го
дня, возможно развитие атрезии пищевода.
Для анамнеза беременности типичны
многоволис и угроза выкидыша в I триместре.
Клиническая
картина и диагностика
Признаки
атрезии пищевода отчётливо проявляются
в первые часы после рождения ребёнка.
Верхний слепой отрезок пищевода и
носоглотка переполняются слизью, у
ребёнка появляются обильные пенистые
выделения изо рта. Часть слизи новорождённый
аспирирует, возникают приступы цианоза.
После отсасывания содержимого носоглотки
цианоз вскоре появляется вновь. Очень
быстро в лёгких появляются хрипы,
нарастает одышка.
Диагноз
уточняют путём катетеризации пищевода
тонким уретральным катетером с
закруглённым концом. Катетер вводя
через нос Пройдя
на глубину 6-8 см, катетер упирается в
слепой конец пищевода, либо,
заворачиваясь, выходит через рот ребёнка.
Через катетер отсасывают слизь. Воздух,
введённый в слепой конец пищевода, с
шумом выделяется из носоглотки
(положительный симптом элефан- та
[слона]).
Учитывая
огромную важность ранней диагностики
атрезии (до возникновения аспирационной
пневмонии), зондирование пищевода
целесообразно проводить всем младенцам
с синдромом дыхательных расстройств
сразу после рождения.
Клиническая
картина может иметь некоторые особенности
в зависимости от формы атрезии. При
наиболее частой форме атрезии с дистальным
трахеопищеводным свищом выявляют
вздутие живота, особенно в эпигастральной
области. Выраженность аспирационного
синдрома зависит от диаметра
трахеопищеводного соустья.
Окончательный
диагноз ставят после рентгенологического
исследования. После введения катетера
в пищевод до упора выполняют обзорную
рентгенограмму органов грудной клетки
и брюшной полости. При атрезии
рентгеноконтрастный катетер отчётливо
виден в слепом отрезке пищевода (рис.
4-36). Наличие воздуха в желудке и кишечнике
указывает на свищ между трахеей и
абдоминальным отрезком пищевода.
При бессвищевых формах на фоне запавшего
живота отмечают полное затемнение
брюшной полости. У детей со свищевыми
формами атрезии о длине диастаза между
концами пищевода можно в какой-то степени
судить по боковой рентгенограмме.
Использование для диагностики
рентгеноконтрастных растворов, особенно
бариевой взвеси, крайне нежелательно
из-за риска аспирационной пневмонии.
В
1973 г. описана ассоциация VATER,
в состав которой входит атрезия
пищевода. Данное название образовано
от первых букв соответствующих
английских терминов (Vfertebral
defects,
Anal
atresia.
Tracheoesophageal
fistula,
Esophageal
atresia.
Radial
dysplasy
— врождённые пороки позвонков,
атрезия ануса, трахеоэзофагеальный
свищ или атрезия пищевода, пороки
развития почек или дефекты лучевой
кости). Если у ребёнка выявлены также
пороки сердца (Cardiac
malformations),
такое сочетание пороков обозначают
аббревиатурой VACTER.
В этом случае прогноз чаше бывает
неблагоприятным Нередко при атрезии
пищевода встречают аномалии конечностей
(Limb
anomalies),
тогда патологию обозначают как VAC
1 ERL.
Для детей с VACTER
L-ассоциаиией,
как правило, характерны высокая атрезия
пищевода, осложнённое течение заболевания
и высокая летальность. При наличии у
ребёнка одной из аномалий, входящих в
эту ассоциа
цию, следует искать и другие. По данным
разных авторов, частота ассоциации
широко варьирует. Так, полная
VATER-ассоциация
может встречаться в 1,5% случаев среди
новорождённых с атрезией пищевода,
а три компонента VACTER-ассоциации
— в 17,5%.
Лечение
Только
раннее оперативное вмешательство может
спасти жизнь ребёнку с атрезией
пищевода. Уже в родильном доме необходимо
начать предоперационную подготовку,
включающую аспирацию содержимого
рото- и носоглотки каждые 15-20 мин,
оксигенотерагшю, полное исключение
кормления через рот. Транспортировку
следует проводить в сопровождении
специализированной бригады в максимально
короткий срок. Общая длительность
предоперационной подготовки зависит
от тяжести нарушений гомеостаза и
гемодинамики, дыхательной недостаточности,
степени дегидратации. При явных признаках
аспирации, нарушения дыхания, а тем
более при пневмонии или ателектазе
лёгких необходимо как можно раньше
прибегнуть к прямой ларингоскопии
с катетеризацией трахеи и аспирацией
содержимого из дыхательных путей. При
неэффективности последней под наркозом
проводят бронхоскопию или интубацию
трахеи с тщательной аспирацией
содержимого. Ребёнка помещают в кувез,
где обеспечивают непрерывную подачу
кислорода, аспирацию содержимого
ротоглотки, согревание тела ребёнка.
Назначают инфузионную, антибактериальную,
симптоматическую терапию.
Выбор
метода оперативного вмешательства
зависит от формы атрезии и состояния
больного. При наиболее частой форме
атрезии с дистальным трахеопищеводным
свищом у детей с малым операционным
риском (доношенных, без сочетанных
пороков жизненно важных органов и
симптомов внутричерепной родовой
травмы) целесообразно начинать с
торакотомии и разделения трахеопищеводного
свища. Если диастаз между концами
пищевода не превышает 1,5—
см,
накладывают прямой анастомоз. При
большом диастазе отрезков пищевода
накладывают шейную эзофагостому и
гастростому по Кадеру. При несвищевых
формах из-за значительного диастаза
выполняют операцию гастростомии и
эзофагостомии. У больных с высоким
операционным риском оперативное
вмешательство чаще начинают с
наложения двойной гастростомы (первая
— для кормления через зонд, заведённый
в двенадцатиперстную кишку, вторая —
для декомпрессии желудка и уменьшения
аспирации). Второй этап операции
выполняют после улучшения состояния,
через 2—4 дня.
В
послеоперационном периоде продолжают
начатую интенсивную терапию. Кормление
ребёнка проводят через зонд, установленный
ин- траоперационно через анастомоз либо
введённый в гастростому после
восстановления пассажа по кишечнику.
На 6—7-е сутки исследуют состоятельность
анастомоза. Под контролем рентгеновского
экрана через рот ребёнка вводят 1—2 мл
водорастворимого контрастного вещества.
Оценивают проходимость зоны анастомоза,
исключают затёки контрастного
вещества. При отсутствии осложнений
ребёнка начинают кормить через рот.
Через 2—3 нед после операции проводят
контрольную фиброэзофагогастроскопию
с оценкой степени проходимости зоны
анастомоза, состояния кардии, симптомов
эзофагита. При сужении анастомоза,
выявляемом в 30—40% случаев, необходимо
бужирование (бужи №22—24). Длительность
бужирования контролируют эзофагоскопией.
В
послеоперационном периоде ребёнку в
течение первого года жизни необходимо
постоянное диспансерное наблюдение.
Возможны явления дисфагии, осложняющиеся
непроходимостью в области анастомоза,
что требует срочной эзофагоскопии. В
связи с этим детей на первом году жизни
рекомендуют кормить гомогенизированной
пищевой массой. Недостаточность
кардии и желудочно-пищеводный рефлюкс,
нередко осложняющий послеоперационный
период, клинически проявляются
ночными регургитациями, повторными
пневмониями, срыгиваниями; в этом
случае необходима своевременная
диагностика. В ближайшие 6—12 мес у детей
возможна осиплость голоса в связи с
операционной травмой возвратного
гортанного нерва.
После
эзофаго- и гастростомии детям в возрасте
от 2—3 мес до
Врождённый
трахеопищеводный свищ
Изолированный
врождённый трахеопищеводный свищ
относят к редким порокам развития:
частота его составляет 3—4% всех аномалий
пищевода. Соустье обычно располагается
высоко — на уровне VII шейного или I
грудного позвонка.
Диаметр
свища, как правило, 2—4 мм. Обычно свищ
имеет косое направление от передней
стенки пищевода кверху по диагонали к
мембранозной части трахеи. Трахеопищеводный
свищ может быть локализован на любом
уровне (от перстневидного хряща до
бифуркации трахеи), но чаще отходит
от нижнешейной или верхнегрудной части
трахеи. В литературе существуют описания
случаев, когда у больного были одновременно
два и даже три свища.
Выделяют
три вида трахеопищеводных свищей: узкий
и длинный, короткий и широкий (встречают
наиболее часто), и отсутствие разделения
между пищеводом и трахеей на большом
протяжении.
Клиническая
картина и диагностика
Выраженность
симптомов зависит от диаметра и угла
впадения свища в трахею. Характерные
симптомы: приступы кашля и цианоза,
возникающие во время кормления, более
выраженные в горизонтальном положении
ребёнка. При узких и длинных свищах
возможно лишь покашливание ребёнка
при кормлении. При изменении положения
симптоматика уменьшается. Ребёнок часто
болеет пневмонией. Наиболее яркую
клиническую картину наблюдают при
широких соустьях, когда уже в начале
кормления молоко легко проникает в
трахеобронхиальное дерево. Быстро
развивается острый воспалительный
процесс в лёгких с ателектазами.
Диагностика
трахеопищеводного свища трудна, особенно
при узких свищах. Комплекс исследований
включает рентгенологические и
инструментальные методы. Рентгенографию
выполняют в горизонтальном положении
ребёнка. Через зонд, введённый в начальный
отдел пищевода, под контролем рентгеноскопии
вводят раствор водорастворимого
контрастного вещества. Затекание его
в трахею указывает на наличие свища.
Информативность этого метода невелика.
Большее диагностическое значение имеет
трахеоскопия. Трахею осматривают на
всём протяжении — от голосовой щели до
бифуркации. Свищ щелевидной формы
располагается по задней поверхности
трахеи.
Дифференциальную
диагностику проводят с атрезией пищевода,
ахалазией кардии, желудочно-пищеводным
рефлюксом, сужением пищевода, дисфагией,
связанной с травмой голосовых связок
при проведении реанимации в родах,
дисфагией центрального генеза.
Лечение
Лечение
только оперативное. Предоперационная
подготовка заключается в санации
трахеобронхиального дерева, лечении
аспирационной пневмонии. С этой целью
выполняют санационную бронхоскопию,
назначают УВЧ-терапию, антибактериальное
лечение, инфузионную терапию. Полностью
исключают кормление через рог. Ребёнка
кормят через зонд, заведённый в желудок.
Операцию
мобилизации, перевязки и пересечения
соустья выполняют правосторонним
шейным доступом, реже выполняют
заднебоковую торакотомию. При
своевременной диагностике прогноз
благоприятный.
И
У217
3.
Пороки развития желудочно-кишечного
тракта. Пилоростеноз. Этиология.
Патогенез. Клиника. Современные методы
диагностики. Дифференциальная диагностика.
Предоперационная подготовка. Особенности
оперативного лечения. Осложнения.
Прогноз.
Врождённый
пилоростеноз
В
основе заболевания лежит нарушение
проходимости пилорического отдела
желудка. Популяционная частота 0,5-3 на
1000. Преобладающий пол мужской (4:1).
Генетические
аспекты. Патологию расценивают как
имеющую многофакторную природу (vs.
9t).
Причина неясна; в пилорическом отделе
при заболевании отсутствует нейральная
форма синтетазы окиси азота (163731).
Клиническая
картина
Первые
симптомы заболевания обычно появляются
с конца 2-й или начала 3-й недели жизни
ребёнка. Сначала отмечают рвоту
«фонтаном», возникающую между
кормлениями. Рвотные массы имеют
застойный характер, их объём превышает
объём однократного кормления, они
содержат створоженное молоко с кислым
запахом. Ребёнок начинает худеть,
появляются признаки обезвоживания,
сопровождающиеся уменьшением частоты
мочеиспусканий и скудным стулом. При
острой форме заболевания симптоматика
развивается быстро, бурно, в течение
недели. Преобладают симптомы острой
дегидратации II—III степени и
декомпенсированного метаболического
алкалоза. При подострой форме симптомы
развиваются постепенно: срыгивания,
однократная или двукратная рвота, затем
учащающаяся и приводящая к гипотрофии.
Эта форма не сопровождается грубыми
водно-электролитными нарушениями.
Диагностика
Диагноз
заболевания подтверждают на основании
клинического, лабораторного,
ультразвукового, инструментального и
рентгенологического исследований.
При
осмотре больного обращают внимание на
степень гипотрофии, эксикоза, при
осмотре живота — на вздутие эпигастральной
области, усиленную перистальтику желудка
с появлением симптома «песочных часов»
(рис. 5-18). Пальпаторно в части случаев
удаётся определить гипертрофированный
привратник.
Данные
лабораторных исследований указывают
на метаболический алкалоз, гипокалиемию,
гипохлоремию, снижение ОЦК, содержания
гемоглобина, гематокрита.
Для
уточнения диагноза используют УЗИ.
После введения в желудок жидкости
осматривают зону пилорического канала.
Последний плотно сомкнут, не раскрывается,
не пропускает содержимое в двенадцатиперстную
кишку. Циркулярный мышечный жом резко
утолщён (рис. 5-19).
Для
диагностики пилоростеноза применяют
фиброэзофагогаст- роскопию. При этом
виден расширенный складчатый антральный
отдел желудка, а просвет пилорического
канала резко сужен до величины
булавочной головки, не раскрывается
при раздувании воздухом (в отличие
от пилороспазма). Кроме того, фиброскопия
даёт возможность осмотреть пищевод,
определить степень выраженности
рефлюкс-эзофагита, часто сопровождающего
пилоростеноз.
При
рентгенологическом исследовании
обращают внимание на размеры желудка,
наличие уровня жидкости натощак, снижение
газона- полнения кишечных петель (по
обзорной рентгенограмме), время начала
первичной эвакуации бариевой взвеси
из желудка (рентгеноконтрастное
исследование). После приёма ребёнком
контрастного вещества (5% водной взвеси
сульфата бария в грудном молоке в объёме
разового кормления) через 30—40 мин
выявляют сегментирующую перистальтику
желудка и отсутствие первичной эвакуации
в двенадцатиперстную кишку. На
рентгенограмме в боковой проекции виден
суженный пилорический канал — симптом
«клюва» (рис. 5-20). Все рентгенограммы
необходимо выполнять в вертикальном
положении ребёнка. Как правило, дальнейшего
обследования не требуется.
Дифференциальная
диагностика
Дифференциальную
диагностику проводят с пилороспазмом,
псевдопилоростенозом (сольтеряющая
форма адре ноге читального синдрома —
синдром Дебре—Фибигера), желудочно-пищеводным
рефлюксом, стенозом двенадцатиперстной
кишки выше большого сосочка
двенадцатиперстной кишки. Дифференциальная
диагностика основана на разнице во
времени и характере клинических проявле
ний, данных лабораторных исследований,
рентгенологической и эндоскопической
картины.
Для
адреногенитального синдрома характерны
примесь жёлчи в рвотных массах, полиурия,
периодически разжиженный стул, гипер-
калиемия, гипонатриемия, метаболический
ацидоз. Эндоскопически и рентгенологически
привратник хорошо проходим.
При
желудочно-пищеводном рефлюксе типичны
начало заболевания с рождения, рвота
и регургитация в горизонтальном
положении. Эндоскопически выявляют
фибринозно-язвенный эзофагит, зияние
кардии, рентгенологически — наличие
желудочно-пищеводного рефлюкса.
Для
высокой частичной кишечной непроходимости
двенадцатиперстной кишки специфично
появление симптомов с первых дней жизни.
Рентгенологически обнаруживают наличие
двух уровней жидкости в желудке и
двенадцатиперстной кишке, её расширение.
Лечение
При
пилоростенозе показано оперативное
лечение. Вмешательству предшествует
предоперационная подготовка, направленная
на коррекцию гиповолемии, алкалоза
и гипокалиемии. Выполняют внесли- зистую
пилоромиотомию по Фреде—Рамштедту. В
ходе операции устраняют анатомическое
препятствие и восстанавливают
проходимость привратника.
Через
3—6 ч после операции ребёнка начинают
поить 5% раствором глюкозы, затем —
молоком по 5—10 мл через каждые 2 ч. В
последующие сутки количество молока
ежедневно увеличивают на 100 мл (10 мл на
одно кормление). К 6-м суткам увеличивают
объём кормления до 60—70 мл с интервалом
3 ч, после чего ребёнка переводят на
обычное кормление. В первые дни после
операции дефицит жидкости, электролитов,
белка и других ингредиентов восполняют
за счёт инфузионной терапии и
вспомогательного парентерального
питания.
Прогноз
Прогноз
благоприятный. Детям необходимо
диспансерное наблюдение с целью
дальнейшего лечения гипотрофии, анемии
и гиповитаминоза.
У
325
4.
Пороки развития желудочно-кишечного
тракта. Врожденная непроходимость
кишечника. Классификация. Клиника и
диагностика высокой и низкой кишечной
непроходимости. Дифференциальная
диагностика. Сроки и качество
предоперационной подготовки. Выбор
способа оперативной коррекции в
зависимости от вида непроходимости
кишечника. Осложнения. Принципы дальнейшей
реабилитации.
Врожденная
кишечная непроходимость —
состояние, возникающее при пороках
желудочно-кишечного тракта и вызывает
нарушение проходимости пищеварительной
трубки.
Пороки,
сопровождающиеся врожденной кишечной
непроходимостью:
•
Пороки развития собственно кишечной
трубки (атрезии, стенозы).
•
Пороки развития, приводящие к сдавлению
кишечной трубки извне (кольцевидная
поджелудочная железа, аберрантных
сосуд, ентерокистомы).
•
Пороки развития кишечной стенки
(аганглиоз, нейрональная дисплазия,
гипоганглиоз — болезнь Гиршпрунга).
•
Недостатки, вызывающие обтурацию
просвета кишки вязким меконием.
•
Недостатки поворота кишечника и фиксации
брыжейки (синдром Ледда, изолированный
заворот средней кишки, заворот
изолированной кишечной петли). Принято
различать уровни кишечной непроходимости
по уровню двенадцатиперстной кишки:
•
Высокая кишечная непроходимость
•
Низкая кишечная непроходимость.
Классификация
кишечной непроходимости за Ю. Ф.
Исаковым:
процедур лечения лимфатической мальформации | Детская Миннесота
Что вызывает лимфатическую мальформацию?
Лимфатические мальформации — это результат проблем, которые развиваются до рождения в сосудах лимфатической системы, которая играет центральную роль в защите организма от инфекций и болезней. Сосуды отводят водянистую жидкость (лимфу) из тканей и транспортируют ее к лимфатическим узлам, где уничтожаются бактерии, вирусы и другие вредные патогены. Затем сосуды отправляют очищенную жидкость обратно в кровоток.
Лимфатическая мальформация возникает, когда сосуды не формируются должным образом, закупориваются и расширяются. Затем в них накапливается лимфа, что приводит к образованию кист, заполненных жидкостью. Кисты обычно становятся больше по мере роста будущего ребенка, хотя иногда они спонтанно уменьшаются или даже исчезают.
Когда лимфатическая мальформация обнаруживается на очень ранних сроках беременности, она может быть связана с хромосомной аномалией, такой как синдром Дауна (трисомия 21), синдром Тернера или синдром Нунана.Это также может быть связано с другими врожденными дефектами, такими как порок сердца. По этим причинам рекомендуется тщательное последующее ультразвуковое наблюдение.
Как диагностируется лимфатическая мальформация?
Лимфатические мальформации, которые проявляются на ранних сроках беременности, обычно образуются между 9 и 16 неделями беременности и часто диагностируются во время обычного пренатального ультразвукового исследования или генетического скринингового обследования. Вас направят к генетику, поскольку ранние лимфатические аномалии могут быть связаны с хромосомными аномалиями.Подробное ультразвуковое исследование также будет рекомендовано на более поздних сроках беременности, чтобы оценить анатомию вашего ребенка, поскольку ранняя лимфатическая мальформация также может указывать на наличие другого врожденного дефекта. Часть этой оценки будет проводиться детским кардиологом, который оценит анатомию сердца ребенка.
Лимфатические мальформации, которые проявляются на более поздних сроках беременности, могут быть обнаружены во время обычного УЗИ, или ваш врач может отметить, что ваш живот кажется больше, чем ожидалось для ваших недель беременности, и назначить УЗИ.Если ваш врач подозревает наличие одного из этих пороков развития с помощью ультразвукового исследования, он или она может порекомендовать дополнительные визуализационные тесты, такие как магнитно-резонансная томография плода (МРТ), чтобы оценить степень порока развития и любое возможное влияние, которое оно может оказывать на развитие внутренних органов малыша.
Как лечить лимфатическую мальформацию до рождения?
Пренатальное ведение детей с лимфатическими аномалиями начинается со сбора информации о тяжести состояния и возможной связи с хромосомной аномалией.Для сбора этой информации мы можем использовать несколько различных технологий, включая ультразвуковое исследование плода с высоким разрешением, МРТ плода, эхокардиографию плода, амниоцентез и биопсию ворсин хориона (CVS). Специалист-генетик проконсультирует вас по различным вариантам выявления хромосомных аномалий, а специалист по материнству и плоду обсудит визуализацию и последующее наблюдение.
Что такое УЗИ плода с высоким разрешением?
Ультразвуковое исследование плода с высоким разрешением — это неинвазивный тест, выполняемый одним из наших ультразвуковых специалистов.В тесте используются отраженные звуковые волны для создания изображений ребенка в утробе матери. Мы будем использовать ультразвуковое исследование, чтобы следить за ростом лимфатической мальформации вашего ребенка — и за любым влиянием, которое она может оказывать на внутренние органы вашего ребенка — на протяжении всей беременности.
Что такое магнитно-резонансная томография плода (МРТ)?
МРТ плода — еще один неинвазивный тест. Он использует большой магнит, импульсы радиоволн и компьютер для создания подробных изображений органов и других структур вашего ребенка в утробе матери.Эта процедура включает сканирование мамы и ребенка, частично находясь внутри нашего аппарата МРТ. Тест немного громкий, но занимает всего около 30 минут и не вызывает дискомфорта.
Что такое эхокардиограмма плода?
Эхокардиография плода (сокращенно «эхо») проводится в нашем центре детским кардиологом (врачом, специализирующимся на пороках сердца плода). Эта неинвазивная ультразвуковая процедура с высоким разрешением конкретно исследует структуру и функционирование сердца ребенка в утробе матери.Этот тест важен, потому что лимфатические аномалии иногда связаны с пороками сердца.
Что такое амниоцентез?
Амниоцентез проводится для анализа околоплодных вод вокруг вашего ребенка. Эта жидкость будет содержать некоторые из клеток вашего ребенка, которые предоставят нам полный набор хромосом вашего ребенка для анализа. Затем мы можем оценить, связана ли причина лимфатической мальформации с хромосомной аномалией. Процедура амниоцентеза проста и может быть проведена в нашей клинике.Для взятия пробы жидкости необходимо ввести небольшую иглу в брюшную полость матери и в амниотический мешок. Получение окончательных результатов теста в нашей лаборатории обычно занимает несколько дней. Эта информация будет очень важна для составления вашего плана ухода и помощи неонатологу в уходе за вашим младенцем после рождения.
Что такое биопсия ворсин хориона (CVS)?
Этот тест включает взятие небольшого образца ткани плаценты, которая прикрепляется к матке.Затем некоторые плацентарные клетки проверяются на наличие признаков хромосомной аномалии. Образец получают одним из двух способов: путем введения тонкой трубки (катетера) через шейку матки в матку или путем введения иглы в брюшную полость матери. Используется местная анестезия, и трубка или игла подводятся к плаценте с помощью ультразвука. БВХ можно проводить немного раньше, чем амниоцентез, обычно между 10 и 14 неделями беременности.
Что произойдет после завершения моей оценки?
После того, как мы соберем всю анатомическую и диагностическую информацию из тестов, вся наша команда встретится с вами, чтобы обсудить результаты.Лимфатические мальформации обычно нельзя вылечить до рождения ребенка. Тем не менее, мы будем активно подходить к лечению этого заболевания во время вашей беременности. Мы будем очень внимательно следить за матерью и ребенком, наблюдая за тем, как растет порок, и за любыми возможными осложнениями, которые могут развиться. Мы также будем следить, чтобы увидеть, уменьшится ли и / или исчезнет ли порок, как это иногда бывает.
Иногда лимфатическая аномалия давит на пищевод и препятствует глотанию плода.Если это произойдет, может возникнуть избыточное количество околоплодных вод (многоводие ) . В этих случаях может потребоваться удаление излишков околоплодных вод — процедура, называемая амниоредукцией, — чтобы помочь матери чувствовать себя более комфортно. Амниоредукция похожа на амниоцентез. В амниотический мешок под контролем ультразвука вводится небольшая игла, а затем часть жидкости сливается.
Лимфатическая аномалия может также давить на дыхательные пути ребенка. Если есть подозрение на это, ваша медицинская бригада может обсудить особый вид родов, который называется EXIT (Ex-utero Intrapartum Treatment).Процедура EXIT — это специализированный вид кесарева сечения. Ребенок частично рождается, оставаясь прикрепленным к плаценте. Это позволяет ребенку получать кислород и питательные вещества от матери, в то время как хирург вставляет дыхательную трубку в дыхательные пути ребенка. Как только трубка установлена, ребенок может полностью родиться.
Если лимфатическая деформация находится в другом месте внутри ребенка, мы будем внимательно следить за этой конкретной областью, чтобы убедиться, что нет повреждений. При необходимости нам может потребоваться обсудить варианты досрочной или специализированной доставки.
Как лечится лимфатическая мальформация после рождения?
Наша цель будет состоять в том, чтобы роды вашего ребенка произошли как можно ближе к сроку родов, но младенцев с большой лимфатической мальформацией иногда необходимо рожать раньше и с помощью кесарева сечения. Ваш ребенок родится в Центре матери и ребенка в Эбботт Северо-Западный и Детский Миннесота в Миннеаполисе или в Центре матери и ребенка в Юнайтед и Детском Миннесоте в Сент-Поле. Детский Миннесота — один из немногих центров по всей стране, где родильный центр расположен на территории больничного комплекса.Это означает, что ваш ребенок родится всего в нескольких футах от нашего отделения интенсивной терапии новорожденных (NICU). Кроме того, многие врачи, с которыми вы уже встречались, будут присутствовать во время или сразу после рождения вашего ребенка, чтобы помочь сразу же позаботиться о нем.
Вашему ребенку может потребоваться специализированная медицинская помощь после рождения, и поэтому он может быть доставлен в наше отделение интенсивной терапии. Например, если лимфатическая деформация давит на дыхательные пути ребенка, можно использовать механический дыхательный аппарат (вентилятор), чтобы помочь ребенку дышать.Если рост мешает вашему ребенку кормить грудью или брать бутылочку, вашего ребенка также могут поместить на специальные внутривенные (IV) линии для доставки необходимых питательных веществ и лекарств.
Ваш ребенок будет проходить дополнительные тесты после рождения, чтобы помочь нам поставить окончательный диагноз степени порока развития и определить возможные методы лечения. Эти тесты будут включать передовые методы визуализации, такие как ультразвук, МРТ и специальный вид рентгеновского излучения, известный как сканирование компьютерной томографии (КТ).КТ-изображения более детализированы, чем стандартные рентгеновские снимки.
После того, как будет проведена тщательная оценка состояния вашего ребенка, ваша бригада комплексного ухода в Центре ухода за плодами Среднего Запада объяснит вам полученные результаты и объяснит, что они означают с точки зрения лечения. Варианты лечения, которые лучше всего подходят для вашего ребенка, будут зависеть от размера и местоположения лимфатической мальформации, а также от других факторов, включая общее состояние здоровья вашего ребенка, способность вашего ребенка переносить определенные лекарства и процедуры и ваше общее состояние. предпочтения.
Доступно несколько подходов к лечению, в том числе следующие:
- Смотреть и ждать. В некоторых случаях, особенно если киста небольшого размера или не угрожает дыхательным путям, лучший подход к лечению — просто держать порок развития под наблюдением. Лимфатические мальформации иногда спонтанно истощаются и уменьшаются.
- Чрескожный дренаж. С помощью этой процедуры делается надрез лимфатической мальформации и сливается жидкость, обычно через небольшую трубку (катетер).Чрескожный дренаж обычно проводится в сочетании со склеротерапией или хирургическим вмешательством.
- Это лечение, которое проводится, когда ребенок находится под общим наркозом, включает в себя введение специального лекарства в порок развития. Врач будет использовать ультразвуковое исследование, чтобы направить инъекцию лекарства в нужное место. Лекарство удаляет (разрушает) кисту, разрушая ее стенки. Затем жидкость сливают через дренажную трубку. Может потребоваться повторение процедур склеротерапии.Ваш ребенок останется в больнице до тех пор, пока лечение не будет завершено и пока не исчезнут признаки отека дыхательных путей (если порок развития находится в области шеи или груди).
- Лазерная терапия. При этом лечении, которое проводится под общим наркозом, кисты разрушаются сильным светом. Обычно требуется несколько сеансов лечения, растянутых на многие месяцы. Лазерная терапия чаще всего используется для лечения лимфатических мальформаций, затрагивающих кожу или слизистые оболочки (тонкий слой кожи, выстилающий нос, рот и другие полости тела и выделяющий слизь для предотвращения высыхания этих полостей).
- Удаление хирургическое. Хирургическое вмешательство может использоваться для удаления некоторых лимфатических мальформаций, особенно небольших и не окружающих важные части тела и органы.
- Лечебная терапия. В некоторых случаях лекарства используются для лечения лимфатических мальформаций. Одним из таких лекарств является сиролимус, лекарство, используемое пациентами с трансплантацией органов, чтобы их иммунная система не отторгала их новый орган. Одним из эффектов, которые сиролимус оказывает на организм, является подавление неконтролируемого роста кровеносных сосудов в лимфатической системе.Подавляя этот рост, лекарство сокращает существующие лимфатические мальформации и предотвращает образование новых. Если вашему ребенку рекомендована эта терапия, в вашу команду будет входить детский гематолог из центра сосудистых аномалий в Детской Миннесоте.
Каков прогноз моего ребенка?
При отсутствии генетических аномалий прогноз для детей, рожденных с лимфатическими аномалиями, отличный. У них нормальная, активная, счастливая жизнь.Результаты более разнообразны для детей, рожденных с генетическими аномалиями. Их прогноз зависит от степени аномалии.
Потребуется ли моему ребенку долгосрочное наблюдение?
Из-за потенциальных проблем со здоровьем, связанных с лимфатическими пороками, и из-за того, что лечение необходимо часто повторять, вашему ребенку, вероятно, потребуется долгосрочное наблюдение. В Детском центре Миннесоты мы будем работать с вами, чтобы разработать подробный план ухода за вашим ребенком. План вашего ребенка будет реализован комплексной командой специалистов под общей координацией педиатра.
Свяжитесь с нами
Требуется направление или дополнительная информация? Вы или ваш поставщик можете позвонить в Центр ухода за плодами Среднего Запада по телефону 855-693-3815.
Лимфангиома: Диагностика и лечение
Лимфангиома — это опухоль или новообразование, возникающее в основном в области головы, шеи и рта.
Лимфангиомы являются результатом врожденного заболевания и обычно проявляются при рождении или, по крайней мере, к тому времени, когда человеку исполняется 2 года.
Поделиться на PinterestЛимфатическая система помогает выводить токсичные вещества и отходы из организма.Лимфангомия вызвана заболеванием лимфатической системы.
Лимфангиома может поражать любую часть тела, но обычно возникает на голове, шее или рту. Отек состоит из одного или нескольких мешочков, заполненных жидкостью, что вызвано проблемами с лимфатической системой.
Лимфатическая система является частью иммунной системы и состоит из сети трубок, известных как лимфатические сосуды. Эти сосуды транспортируют жидкость, называемую лимфой, по телу и в кровоток.
Лимфатические узлы, расположенные вокруг лимфатической системы, помогают избавить организм от инфекций и воспалений.
Лимфангиомы и некоторые другие типы новообразований, относящиеся к лимфатической системе, известны как лимфатические мальформации. Эти опухоли или образования доброкачественные и не связаны с раком.
Поделиться на PinterestНекоторые осложнения лимфангиомы включают затруднение или боль при глотании и проблемы с дыханием.
Лимфангиомы возникают в результате аномального развития лимфатической системы, но почему именно это происходит, неизвестно.
Лимфангиома описывается как «соматическая мутация», что означает, что она влияет на гены, но не является наследственным заболеванием.
Лимфангиомы также могут возникать как часть другого заболевания, в том числе:
Лимфатические мальформации могут возникать как у мужчин, так и у женщин любой расы. Это редкое заболевание, которым страдает примерно 1 из 4000 новорожденных.
Лимфангиомы обычно возникают в одной локализованной области. Иногда они могут распространяться по всему телу.
Хотя опухоль часто присутствует при рождении, сначала она может быть слишком маленькой, чтобы ее можно было увидеть. В этих случаях лимфатическая аномалия растет по мере роста ребенка.
Внешний вид лимфангиом может варьироваться от небольших пятен до больших опухолей, в зависимости от того, сколько жидкости они содержат.
Существует три типа лимфатических мальформаций:
- Макрокистоз : большой заполненный жидкостью карман или карманы под кожей. Кожа кажется красной или синеватой. Макрокистозные лимфатические мальформации имеют диаметр более 2 сантиметров (см) и обычно возникают на шее. Они также могут поражать грудь, подмышки или пах.
- Микрокистоз : Группа небольших заполненных жидкостью мешочков, которые могут образовываться в любом месте тела.Кожа красная или голубоватая, и масса увеличивается пропорционально ребенку.
- Смешанный : комбинация макрокистозных и микрокистозных лимфатических мальформаций.
В целом лимфангиомы не вызывают никаких медицинских проблем. Однако из-за того, что они выступают на лице и шее, они могут влиять на внешний вид человека.
Также могут возникнуть более серьезные осложнения, в том числе:
- боль
- инфекция
- проблемы с дыханием при отеках в шее давление на дыхательные пути
- затруднение глотания или речи
- воспаление или целлюлит
- кровотечение
- двоение в глазах при поражении глазницы
- свистящее дыхание и боль в груди при поражении грудной клетки
Диагностика лимфангиом обычно не представляет трудностей и часто может быть выполнена до рождения с помощью пренатального ультразвукового исследования.
После рождения ребенка лимфангиому можно определить во время медицинского осмотра. Обычно это выглядит как мягкая, неопределенная масса, заполненная жидкостью, которая перемещается под кожей при надавливании.
Использование ультразвука, компьютерной томографии (КТ) или магнитно-резонансной томографии (МРТ) также может помочь идентифицировать образование.
Поделиться на PinterestХирургия — это возможный вариант лечения. Если лимфатическая масса находится близко к нервам или мышцам, это может усложнить операцию.
Лечение лимфангиом различается от случая к случаю и часто требует совместной работы группы специалистов, чтобы определить наилучший курс действий.
Местоположение, тип и симптомы новообразования будут влиять на решение, какое лечение использовать. Если лимфангиома не вызывает особых проблем ни с медицинской точки зрения, ни с точки зрения внешнего вида, то зачастую лечение не требуется.
При необходимости лечения наиболее распространенными типами являются:
- Хирургия : Хирургическое удаление может быть сложной процедурой, если лимфатическая деформация распространилась по нервам и мышцам.
- Склеротерапия : В опухоль вводится раствор, чтобы она сморщилась или схлопнулась.
- Радиочастотная абляция : высокочастотный ток, подаваемый через иглу, разрушает патологическую ткань.
- Дермабразия : Для лечения рубцов на лице можно использовать технику шлифовки кожи.
- Чрескожный дренаж : Делается разрез лимфатической мальформации и сливается жидкость.
- Медикаментозное лечение : Сиролимус, обычно связанный с лечением рака, уменьшает лимфатические аномалии.Однако клинические испытания все еще определяют его эффективность.
К сожалению, во многих случаях лимфангиомы после удаления могут рецидивировать.
Дальнейшее лечение также может потребоваться, если опухоль повлияла на дыхание, питание или речь человека.
В целом, долгосрочные перспективы для людей с лимфангиомами хорошие.
Однако, если их не лечить, они могут существенно повлиять на качество жизни человека. Это воздействие включает такие осложнения, как обезображивание, которое может быть особенно неприятным в случае лимфатических мальформаций на лице.
Части тела или органы, расположенные рядом с лимфангиомой, также могут быть поражены.
Простые образования, которые полностью удалены, обычно не повторяются. Однако более сложные образования, которые полностью удалены, повторяются в 10–27 процентах случаев.
От 50 до 100 процентов людей, у которых сложная масса удалена лишь частично, будут повторяться.
(PDF) Альвеолярная лимфангиома у младенцев: отчет о двух случаях
младенец находился под пристальным наблюдением стоматологической бригады, поскольку он оставался на стационарном лечении.
Три недели спустя три из четырех повреждений начали развиваться. У них
уменьшились в размерах и менее напряжены при пальпации. Их голубоватый оттенок исчез
, а поражения приобрели вид слизистой оболочки, которая лопнула
. Однако одно из поражений увеличилось в размерах, и мать пациентки
испытывала некоторые опасения по этому поводу. Ее успокоили, и было составлено
планов осмотреть его через две недели. В этом обзоре, когда пациенту
было 10 недель, четвертое поражение начало развиваться, а другие
исчезли.Пациент был выписан на той неделе, и не было сочтено необходимым для дальнейшего наблюдения за его случаем.
Обсуждение
Альвеолярная лимфангиома была впервые описана в 1976 г.
1
, но не сообщалось о
в научной стоматологической литературе до 1986 г.2 Сообщается, что
встречается у 2,2–4% здоровых черных младенцев, и он не встречается ни в какой другой расовой группе
.3,4 Он имеет соотношение мужчин и женщин 2: 1.
4
Клинически поражения
напоминают слизистую оболочку слизистой оболочки или кисту с сыпью.Они имеют размер от
от 1 до 9 мм в диаметре (в среднем 3-4 мм) и имеют голубовато-куполообразный вид
, наполненный жидкостью. Лимфангиомы имеют предпочтительный характерный участок
, находящийся в области первого первичного моляра развивающегося альвеолярного гребня
. Они расположены на гребне верхнечелюстного гребня, а на
— на язычной поверхности нижнечелюстного гребня.1 У большинства пораженных младенцев наблюдается
множественных поражений, наиболее частым из которых являются двусторонние поражения
на слизистой оболочке нижней челюсти.1 Как правило, только одно поражение обнаруживается в квадранте
, хотя есть один отчет о случае, в котором множественные поражения
были обнаружены в одном квадранте. 2 При биопсии эти поражения сообщаются в
, легко разрушаясь, выделяя прозрачную жидкость. .
4
Гистологически эти поражения
интерпретированы как лимфангиомы.1,2,4,5 Микроскопия показывает доброкачественную пролиферацию
лимфатических структур, выстланных эндотелием, свободно поддерживаемых
тонкими волокнистыми сердцевинами соединительной ткани.Лимфатические каналы могут быть
, которые содержат разбросанные лимфоциты и мелкофибриллярный материал.1,2
Могут быть обнаружены остатки зубного эпителия, но они не считаются значимыми для
. Поражения не связаны с прорезыванием зубов, и, поскольку гребень
альвеолярного гребня не содержит ткани слюнных желез, они не являются феноменом удержания слизистой
. Этиология альвеолярной лимфангиомы
неизвестна. Связь между альвеолярной лимфангиомой
и другими врожденными дефектами неизвестна.Расовая специфичность
и двусторонняя сайт-специфичность предполагают онтогенетическую,
, возможно, генетическую этиологию. Лечение, как правило, консервативное, что позволяет спонтанно регрессировать
, что может занять несколько месяцев.1,4 Было предложено хирургическое удаление
, но только в тех случаях, когда
поражений мешают кормлению.5 Как правило, для постановки диагноза удаление не требуется. , как и
, клинические признаки достаточно отличительны, чтобы можно было отличить
от других поражений полости рта, таких как киста зубной пластинки, киста с сыпью, слизистая оболочка
и врожденный эпулис новорожденного.
Стоматологи, практикующие в Ирландии, вряд ли столкнулись бы с
альвеолярной лимфангиомой в прошлом, но с увеличением иммиграции в
Ирландию из Африки, теперь вполне возможно, что ребенок с одним или несколькими из них
поражения могут быть представлены стоматологу общего профиля. Многие широко используемые учебники по стоматологии и детской стоматологии
не содержат упоминания об альвеолярной лимфангиоме
и редко упоминаются в научной литературе
.Таким образом, для многих практиков это может стать диагностической дилеммой.
К счастью, никакого вмешательства не требуется, и как только эти очаги
распознаны и диагностированы, единственное необходимое лечение — успокоение родителей по
с мониторингом поражения.
Ссылки
1. Левин, Л.С., Йоргенсон, Р.Дж., Джарви, Б.А. Лимфангиомы альвеолярных отростков
новорожденных. Педиатрия 1976; 58 (6): 881-884.
2. Уилсон, С., Gould, A.R., Wolff, C. Множественные лимфангиомы альвеолярного гребня
у новорожденного: тематическое исследование. Педиатр Дент 1986; 8 (3): 231-234.
3. Друг, Г.В., Харрис, Э.Ф., Минсер, Х.Х., Фонг, Т.Л., Каррут, К.Р. Оральный
аномалии у новорожденных, по расе и полу, в городских условиях. Педиатр Дент
1990; 12 (3): 157-161.
4. Йоргенсон, Р.Дж., Шапиро, С.Д., Салинас, К.Ф., Левин, Л.С. Внутриротовые находки и
аномалий у новорожденных. Педиатрия 1982; 69 (5): 577-582.
5. Киттл П.Э., Уивер Р.М. Лимфангиомы альвеолярного гребня у новорожденного:
отчет о случае. ASDC J Dent Child 1987; 54 (4): 277-279.
SCIENTIFIC
Том 55 (3): июнь / июль 2009 г. 145
Журнал Ирландской стоматологической ассоциации
РИСУНОК 1: Фотография правого нижнечелюстного альвеолярного гребня, показывающая поражение на
язычной части гребня (случай 1) .
РИСУНОК 2: Фотография правого нижнечелюстного альвеолярного гребня, показывающая поражение на
язычной стороне гребня (Случай 2).
РИСУНОК 3: Фотография левого альвеолярного гребня верхней челюсти, показывающая поражение на стыке
гребня и язычной части гребня (Случай 2).
JIDA_JuneJuly09_AW 05.06.2009 16:08 Page 145
Большая кистозная гигрома шейки матки у младенцев: отчет о двух случаях
Аннотация
Кистозные лимфангиомы также называются кистозными гигромами и являются доброкачественными врожденными пороками развития
лимфатической системы и, как сообщается, в 90% случаев возникает в области головы и шеи.Это отчет
в двух случаях больших кистозных гигром на шее в обоих случаях, а во втором случае также
задействовано лицо вместе с шеей. Первый случай был 45-дневным мужчиной, и он был госпитализирован с большой опухолью.
на правой стороне шеи, в то время как вторым пациентом была 3-месячная девочка, и она была госпитализирована с большим
опухоль охватила правую сторону шеи и лица, а также у нее был легкий респираторный дистресс. Оба
были исследованы с помощью УЗИ (УЗИ) и компьютерной томографии (КТ) опухолей, которые
показали множественные кистозные гигромы.В обоих случаях полное хирургическое удаление кистозных гигром.
было успешно выполнено. Ближайший послеоперационный период в обоих случаях протекал без осложнений. Во-первых
В этом случае наблюдение, проведенное через 3 месяца после хирургического удаления кистозной гигромы, было хорошим, и пациент чувствовал себя хорошо. В
во втором случае наблюдение проводилось через месяц хирургического удаления кистозной гигромы, и у нее были признаки
нейропраксия нижней челюсти правого лицевого нерва, и ожидалось, что со временем она пройдет.
Введение
Лимфангиомы — доброкачественные, врожденные аномалии лимфатической системы с выраженными
склонность к областям головы и шеи и, как сообщается, в 90% случаев встречается в области головы и шеи
площадь [1,2].В некоторых случаях большие кистозные лимфангиомы в области шеи могут препятствовать
глотка / пищевод и может проявляться дисфазией, или он может затруднять и сжимать дыхательные пути
и приводит к респираторному дистресс-синдрому, что требует немедленного / раннего хирургического вмешательства.
[3,4]. Послеродовое обследование лимфангиом включает: УЗИ, КТ и магнитный резонанс
визуализация (МРТ) опухоли [1-6]. Хирургическое удаление остается стандартным методом лечения кисты.
лимфангиомы, хотя другие методы, такие как склеротерапия и другие, также используются с их
собственные достоинства и недостатки [1-8].
Отчеты о случаях
Case One
Мальчик 45 дней поступил с отеком большого размера на правой стороне
шея с рождения. Он родился доношенным нормально. Антенатальный период был нерегулярным, УЗИ
не было сделано. При клиническом обследовании опухоли было установлено, что это единичная опухоль размером 10 x
8 см, занимают переднюю, боковую и заднюю часть правой стороны шеи (рис. 1а). Это было
от мягкого до твердого, без чувствительности и кистозности.Другое системное обследование было в пределах нормы, и
Никаких других сопутствующих аномалий при клиническом обследовании не выявлено.
Рис. 1a: Предоперационная клиническая фотография, показывающая припухлость на правой стороне шеи.
УЗИ опухоли выявило мультикистозную природу и зарегистрировано как кистозная гигрома.
шеи. Его компьютерная томография области шеи показала наличие большого кистозного поражения с множеством ячеек.
измерение 7.8 x 3,8 x 7 см, включая правое заднее шейное пространство, переднюю и боковую стороны
шеи, а также видны толстые перегородки (рис. 1b). Он также смещал правую грудинно-сосцевидную мышцу.
мышца сбоку и смещает трахею, ротоглотку и другие правые магистральные сосуды
по направлению к середине. Результаты КТ соответствовали большой кистозной лимфангиоме шейки матки.
Рис. 1b: Компьютерная томография шеи, показывающая множественное кистозное поражение с перегородками на правой стороне шеи.
Полное хирургическое иссечение очага поражения выполнено за один сеанс без каких-либо трудностей.
(Рисунок 1c и Рисунок 1d). Его послеоперационный период протекал без осложнений. Иссеченный образец был
представили на гистологическое исследование и сообщили, что размер кист варьирует от 0,5 до 5
см в максимальном диаметре. Вырезанный участок кисты заполнен прозрачной серозной жидкостью и имеет толщину стенки.
варьируется от 1 мм до 3 мм. Гистологическая картина свидетельствует о лимфангиоме. Следовать за
через 3 месяца после хирургического иссечения кистозной гигромы он чувствовал себя хорошо (рис. 1e).
Рис. 1c: Операционная фотография, на которой видна частично иссеченная кистозная гигрома.
Рис. 1d: Операционная фотография, показывающая полное удаление поражения.
Рисунок 1e: Фотография, на которой показан иссеченный образец.
Корпус 2
Трехмесячная девочка поступила с большой опухолью правой стороны шеи и
лицо с рождения.Она была доношенной нормальной родившей девочкой. Ее антенатальный период был нормальным, хотя
В антенатальном периоде УЗИ не проводилось. Клинически у нее также был легкий респираторный дистресс. Клиническое обследование опухоли показало, что опухоль занимала правую сторону.
сторона шеи и лица (рис. 2а и рис. 2b). Это было мягко, кистозно,
безболезненный, и тест на просвечивание также был положительным (рис. 2с).
Рис. 2a: Предоперационная клиническая фотография (вид спереди), показывающая большую опухоль, затрагивающую правую сторону шеи и лица.
Рис. 2b: Предоперационная клиническая фотография (вид сбоку), показывающая большую опухоль, затрагивающую правую сторону шеи и лица.
Рис. 2c: Предоперационная клиническая фотография, показывающая положительный результат трансиллюминационного теста.
УЗИ области шеи показало поликистозно-кистозную гигрому. CT
сканирование шеи показало наличие большого многоочувствительного кистозного
поражение размером 9,1 х 9.8 x 8 см, занимает правую заднюю часть
шейное пространство, нижнечелюстное пространство, предвертебральное пространство и заглоточное пространство
пространство, а также имел тонкие перегородки (рис. 2г). Это было
также смещение правой грудино-сосцевидной мышцы к заднебоковью, и
смещение трахеи, ротоглотки, языка и правых магистральных сосудов
по направлению к середине.
Рис. 2d: Компьютерная томография припухлости (правая сторона шеи), показывающая поликистозное поражение с тонкими перегородками.
Она была направлена на хирургическое иссечение очага поражения после полного
работают, но дважды откладывались из-за невозможности интубации.Она также
имел легкий респираторный дистресс и решил частично аспирировать
кистозная жидкость. Под седативным действием было выделено 250 мл желтоватой прозрачной жидкости.
аспирированный (рисунок 2e), который был зарегистрирован как лимфатическая жидкость, показывающая
лимфоциты. Эта аспирация кистозной жидкости помогла ей облегчить
респираторный дистресс.
Рис. 2e: Прозрачная желтоватая жидкость отсасывается из кистозной гигромы.
Через неделю ее снова отправили на операцию, и в это время можно было легко интубировать.Разрез кожи делали параллельно
правая нижняя челюсть и наиболее заметная часть поражения. В течение
хирургическое иссечение очага, кистозная жидкость частично аспирирована
вне. Выполнено полное хирургическое удаление кистозного поражения.
без всяких сложностей. Названные основные кровеносные сосуды или нервные волокна
не были принесены в жертву во время операции (рис. 2f, рис. 2g и рис.
2ч). Немедленное послеоперационное выздоровление было отличным. Обрезанный
образец был отправлен на гистологическое исследование, которое было
сообщается как единая уже разрезанная сероватая ткань размером 7 x 5.5 х 2
см. Кисты размером от 0,5 до 2,5 см, максимальный диаметр.
при толщине стенки кисты от 1 мм до 3 мм. Гистологический
результаты сообщаются как фиброколлагеновая строма, показывающая множественные
тонкостенные сосуды среднего и большого размера, выстланные плоским эндотелием,
строма показала разбросанные лимфоциты и лимфоидные скопления.
Гистологическая картина свидетельствует о лимфангиоме / кистозной болезни.
гигрома (рис. 2i). Последующее наблюдение было проведено через месяц хирургического вмешательства.
иссечение кистозной гигромы. У нее были черты нейропраксии /
парез с вовлечением нижней челюсти правого лицевого нерва, и
ожидалось, что то же самое со временем разрешится, поскольку не было очевидных
повреждение нерва, наблюдаемое при хирургическом удалении.
Рис. 2f: Операционная фотография с разрезом кожи.
Рисунок 2g: Операционная фотография, показывающая большое поражение.
Рисунок 2h: Операционная фотография, показывающая полное удаление кистозной гигромы.
Рисунок 2i: Гистология иссеченного образца соответствует кистозной лимфангиоме.
Обсуждение
Лимфангиомы доброкачественные, врожденные гемароматозные
порок развития лимфатической системы.Гигрома — греческое слово
что означает «опухоль, содержащая воду». Лимфангиомы отмечены
пристрастие к областям головы и шеи, особенно к задним
треугольник шеи. Другими участками кистозных гигром являются подмышечные впадины,
средостение, пах, грудь и полость рта. Девяносто процентов
кистозные лимфангиомы поражали область головы и шеи [1,2,7]. В
наиболее приемлемая теория для объяснения возникновения лимфангиомы
в том, что он возникает из-за секвестрации лимфатических тканей / сосудов
которые не могут установить соединения с обычными дренажными сосудами во время
внутриутробная жизнь [1,4,5,7].
Лимфангиомы лучше всего классифицировать как простые лимфангиомы.
(капиллярные), кавернозные лимфангиомы и кистозные лимфангиомы.
Кистозные лимфангиомы также называют кистозными гигромами. Они есть
также классифицируется на основе размера включенных лимфатических кист
внутри него как микрокистозные (капиллярные), макрокистозные и смешанные
лимфангиомы. При микрокистозных поражениях лимфатические кисты меньше 2 см, при макрокистозных кистах больше.
более 2 см, а в случае смешанных лимфангиом размеры варьируют [1,2,7,8].
Клинически кистозная гигрома в области шеи может проявляться как
отек, обезображивание или его осложнение и кровотечение,
разрыв, инфекция и т. д., и, прежде всего, являются показанием к терапии, так как
хорошо. Они в основном большие, кистозные, безболезненные, а также
положительный тест на просвечивание [1-8]. Некоторые из больших гигром
вовлекающие область шеи достаточно велики, чтобы сжать дыхательные пути и
может вызвать респираторный дистресс, а также потребовать неотложной помощи.
хирургическое вмешательство [1,4,5].Возможно обнаружение, документирование и
диагностировать шейные лимфангиомы на антенатальном УЗИ уже
в последней фазе первого триместра беременности [5]. Послеродовой
исследования шейных лимфангиом включают УЗИ, компьютерную томографию.
и МРТ. МРТ не только очерчивает детали отека, но и
его связь с большими сосудами и другими важными структурами в
подробнее [1-7].
Хирургическое иссечение остается лучшим вариантом лечения больших кистозных гигром шеи.Возможно полное удаление
кистозные гигромы в большинстве случаев. Поскольку это доброкачественная аномалия
поэтому следует избегать деструктивной хирургической резекции, а резекция
поэтапное удаление кистозных гигром — лучший вариант, если это необходимо [1,3,4,6-8].
Хирургическое удаление связано с осложнениями и может привести к
паралич лицевого нерва, синдром Горнера и др. [4,6]. Другие условия для
лечат лимфангиомы стероидами, склеротерапией, лазаром, блеомицином,
радиация, ОК 432, со своими достоинствами и недостатками [1,2,5,8].О рецидивах также сообщается в 5-15% случаев, и может потребоваться
другое хирургическое удаление или другие методы лечения.
Настоящее сообщение, у обоих младенцев были большие кистозные гигромы.
шея и лицо также были задействованы у второго младенца. Второй младенец
также имел легкий респираторный дистресс. Произведено хирургическое иссечение
успешно у обоих младенцев. При контрольном наблюдении через месяц после
после хирургического иссечения рецидивов не было, но у второго ребенка не было
особенности нейропраксии / пареза нижнечелюстной ветви
правого лицевого нерва и, как ожидалось, со временем рассосется, так как
при хирургическом удалении очевидного повреждения нерва не наблюдалось.
Заключение
Большие кистозные гигромы в области шеи не являются необычным явлением и
может проявляться респираторной недостаточностью. Хирургическое удаление остается лучшим
возможность управлять большими кистозными гигромами. Перед хирургическим удалением
иногда необходимо аспирировать кистозную жидкость, чтобы предотвратить или
пережить обструктивные симптомы.
Список литературы
- Fonkalsrud EW. Лимфатические расстройства. В: Grosfeld Jay L, O’Neill JA, Fonkalsrud EW, Coran AG, редакторы.Детская хирургия. США: Mosby Inc. 2006; 2137-2146.
- Grasso DL, Pelizzo G, Zocconi E, Schleef J. Лимфангиомы головы и
шея у детей. Acta Otorhinolaryngol Ital. 2008; 28: 17-20. - Гурупрасад Й, Чаухан Д.С. Кистозная гигрома шейки матки. J. Maxillofac Oral Surg.
2012; 11: 333-336. - Sannoh S, Quezada E, Merer DM, Moscatello A, Golombek SG. Кистозный
гигрома и потенциальная обструкция дыхательных путей у новорожденного: описание случая и обзор литературы. Cases J. 2009; 2: 48. - Рохилла М., Калпдев А., Канауджия R2, Джайн В., Калра J1. Может ли кистозно крупного плода
введение гигромы вагинально? J Obstet Gynaecol India. 2013; 63: 420-423. - Wu J, Liu Y, Duan M, Tong B, Zhu W. Клинический анализ 15 случаев кистозного
лимфангиомы, расположенные в области головы и шеи у детей. Лин Чунг Эр Би Ян Хоу Тоу Цзин Вай Кэ За Чжи. 2011; 25: 97-99, 102. - Ghritlaharey RK1. Лечение гигантской кистозной лимфангиомы у младенца. J
Clin Diagn Res. 2013; 7: 1755-1756. - Уго де Оливейра Олимпио, Хоаким Бусторф-Силва, Антонио Гонсалвес де
Оливейра Филью, Kleber Cursino de Araujo. Поперечное исследование, сравнивающее различные терапевтические методы лечения кистозных лимфангиом у детей. Клиники 2014; 69: 505–508.
Лимфангиома: история вопроса, патофизиология, этиология
Патель Г.А., Зиперштейн Р.Д., Раги Г., Шварц Р.А. Опоясывающий лишай опоясывающий лишай. Acta Dermatovenerol Alp Panonica Adriat .2009 г., 18 (4): 179-82. [Медлайн].
Колай С.К., Парвани Р., Ванджари С., Сингхал П. Лимфангиомы полости рта — клинические и гистопатологические отношения: серия случаев с различными клиническими проявлениями, проанализированная иммуногистохимически. J Oral Maxillofac Pathol . 2018, 22 января (Приложение 1): S108-S111. [Медлайн].
Курудэ А.А., Фиске М.М., Колекар К.К., Наяк ЧС. Лимфангиомы: редкие проявления в полости рта и мошонке в детской возрастной группе. Indian J Dermatol Venereol Leprol . 2020 март-апрель. 86 (2): 230. [Медлайн].
Verma SB. Лимфангиэктазии кожи: жертвы запутанной номенклатуры. Клин Эксп Дерматол . 2009 июл. 34 (5): 566-9. [Медлайн].
Whimster IW. Патология циркумскриптум лимфангиомы. Br J Dermatol . 1976 Май. 94 (5): 473-86. [Медлайн].
Itakura E, Yamamoto H, Oda Y, Furue M, Tsuneyoshi M.VEGF-C и VEGFR-3 в серии лимфангиом: является ли поверхностная лимфангиома истинной лимфангиомой ?. Арка Вирхова . 2009 Март 454 (3): 317-25. [Медлайн].
Эрсой А.О., Озтас Э., Саридоган Э., Озлер С., Данисман Н. Необычное происхождение лимфангиомы плода, заполняющей правую подмышечную впадину. Дж. Клиническая Диагностика . 2016 10 марта (3): QD09-11. [Медлайн].
Чанг МБ, Ньюман СС, Дэвис Мэриленд, Леман Дж. С.. Приобретенная лимфангиоэктазия (окружающая лимфангиома) вульвы: клинико-патологическое исследование 11 пациентов из одного учреждения и 67 из литературы. Инт Дж Дерматол . 2016 9 марта. [Medline].
Wong R, Melnyk M, Tang SS, Nguan C. Лимфангиоматоз мошонки: описание случая. Кан Урол Assoc J . 2012 6 февраля (1): E11-4. [Медлайн]. [Полный текст].
Багери А., Амухашеми Н., Салур Х., Яздани С. Лимфангиома слезной железы: отчет о случае и обзор литературы. Орбита . 2012 16 февраля [Medline].
Шах А., Микок Л., Мор Б., Чандран Х.Лимфангиома полового члена: редкая аномалия. Педиатр Хирург Инт . 2005 21 апреля (4): 329-30. [Медлайн].
Li E, Yoda RA, Keene CD, Moe KS, Chambers C, Zhang MM. Нослезная лимфангиома, проявляющаяся гемолакрией. Ophthalmic Plast Reconstr Surg . 2020 24 февраля. [Medline].
Мехта В., Наяк С., Балачандран С., Монга П., Рао Р. Обширная врожденная лимфангиома вульвы, имитирующая остроконечные кондиломы. Индийский J Dermatol .2010. 55 (1): 121-2. [Медлайн]. [Полный текст].
Saccone G, Di Meglio L, Di Meglio L, Zullo F, Locci M, Zullo F и др. Пренатальная ультразвуковая диагностика кистозной лимфангиомы грудной стенки плода: серия клинических случаев в Италии. Eur J Obstet Gynecol Reprod Biol . 2019 18 марта. 236: 139-142. [Медлайн].
Ротанг К.Н., Каджал П., Кадиан Ю.С., Гупта Р. Кровоизлияние при лимфангиоме мошонки у ребенка: редкость. Afr J Paediatr Surg . 2009 июль-дек.6 (2): 110-1. [Медлайн].
Emanuel PO, Lin R, Silver L, Birge MB, Shim H, Phelps RG. Дабская опухоль, возникающая при лимфангиоме околосклеротической области. Дж. Кутан Патол . 2008, январь, 35 (1): 65-9. [Медлайн].
Zhu L, Zhu X, Zhou B, Mao WB, Wu Y, Cheng F. Множественные простые кистозные метастазы в боковой шее при обращении с папиллярной микрокарциномой щитовидной железы: отчет о клиническом случае. Медицина (Балтимор) . 2021 29 января. 100 (4): e23866.[Медлайн].
Núñez EC, Peñaranda JM, Alonso MS, Ortiz-Rey JA. Приобретенная лимфангиома вульвы: серия случаев с упором на расширение клинического контекста. Int J Gynecol Pathol . 2014 27 марта. [Medline].
Horn LC, Kuhndel K, Pawlowitsch T., Leo C, Einenkel J. Приобретенная лимфангиома в области вульвы, имитирующая остроконечные кондиломы. Eur J Obstet Gynecol Reprod Biol . 2005 г. 1. 123 (1): 118-20. [Медлайн].
Аггарвал К., Гупта С., Джайн В.К., Марва Н.Врожденная лимфангиома окружности вульвы. Индийский педиатр . 2009 Май. 46 (5): 428-9. [Медлайн].
Гуде Г., Гупта П., Шарма Р.К., Раджванши А. Первичная лимфангиома окружности вульвы, проявляющаяся в виде бородавок. Australas J Dermatol . 2019 27 февраля. [Medline].
Cestaro G, De Rosa M, Gentile M, Massaron S. Случай ВПЧ и приобретенной генитальной лимфангиомы: общие клинические признаки. Энн Итал Чир .2015 25 марта. 86: [Medline].
Пирс Дж. М., Гриффин Д., Кэмпбелл С. Кистозные гигроматы при трисомии 18 и 21. Prenat Diagn . 1984 сентябрь-октябрь. 4 (5): 371-5. [Медлайн].
Marchese C, Savin E, Dragone E, et al. Кистозная гигрома: пренатальная диагностика и генетическое консультирование. Пренат Диагностика . 1985 май-июнь. 5 (3): 221-7. [Медлайн].
Park SH, Moon SK, Sung JY. Сонографические данные в случае лимфангиомы мошонки. J Clin Ультразвук . 2014 май. 42 (4): 234-6. [Медлайн].
Amini S, Kim NH, Zell DS, Oliviero MC, Rabinovitz HS. Дермоскопическая-гистопатологическая корреляция кожной лимфангиомы околосклеротической области. Арка Дерматол . 2008 декабрь 144 (12): 1671-2. [Медлайн].
Arpaia N, Cassano N, Vena GA. Дермоскопические особенности кожной лимфангиомы околосклеротической области. Dermatol Surg . 2006 июн. 32 (6): 852-4. [Медлайн].
Масса А.Ф., Менезеш Н., Баптиста А., Морейра А.И., Феррейра Е.О.Кожная ограниченная лимфангиома — дерматоскопические особенности. Бюстгальтеры Dermatol . 2015 март-апрель. 90 (2): 262-4. [Медлайн]. [Полный текст].
Jha AK, Lallas A, Sonthalia S. Дерматоскопия кожной лимфангиомы околосклеротической области. Концепция Dermatol Pract . 2017 Апрель 7 (2): 37-38. [Медлайн].
Озэки М., Фукао Т., Кондо Н. Пропранолол для трудноизлечимого диффузного лимфангиоматоза. N Engl J Med . 2011, 7 апреля. 364 (14): 1380-2.[Медлайн].
Дженкинсон Х.А., Вильмас К.М., Силапунт С. Тетрадецилсульфат натрия: обзор клинического использования. Dermatol Surg . 19 апреля 2017 г. [Medline].
Вернер Дж. А., Эйвази Б., Фольц Б. Дж., Дюнне А. А.. [Современное состояние классификации, диагностики и лечения шейно-лицевых гемангиом и сосудистых мальформаций]. Ларингориноотология . 2006 декабрь 85 (12): 883-91. [Медлайн].
Экелем С., Томас Л., Ван Хал М., Вальдебран М., Лотфизаде А., Млинек К. и др.Радиочастотная терапия и некосметические кожные заболевания. Dermatol Surg . 18 марта 2019 г. [Medline].
Мирза Б., Иджаз Л., Салим М., Шейх А. Различные методы, используемые для лечения сопутствующей лимфангиомы грудной стенки и мошонки. Дж. Кутан Эстет Сург . 2010 Сентябрь 3 (3): 189-90. [Медлайн]. [Полный текст].
Порвал П.К., Дубей К.П., Мори А., Сингх Х., Пуджа С., Боз А. Склеротерапия блеомицином при лимфангиомах головы и шеи: проспективное исследование 8 случаев. Indian J Otolaryngol Head Neck Surg . 2018 Март 70 (1): 145-148. [Медлайн].
Emer J, Gropper J, Gallitano S, Levitt J. Случай лимфангиомы околоскрескрипта, успешно вылеченный с помощью электродесикации после отказа импульсного лазера на красителе. Dermatol Online J . 2013 15 марта. 19 (3): 2. [Медлайн].
Haas AF, Narurkar VA. Упорная лимфангиома груди с околососковой областью, обработанная углекислотным лазером UltraPulse. Dermatol Surg . 1998 24 августа (8): 893-5. [Медлайн].
Сасаки Р., Негиси К., Акита Х., Судзуки К., Мацунага К. Успешное лечение врожденной лимфангиомы циркумскрипта вульвы с помощью CO2 и длинноимпульсных лазеров Nd: YAG. Корпус Rep Dermatol . 2014 6 января (1): 1-4. [Медлайн]. [Полный текст].
Торезан Л.А., Карета М.Ф., Осорио Н. Внутриротовая лимфангиома успешно вылечена с помощью фракционного углекислотного лазера. Dermatol Surg .2013 22 февраля [Medline].
Bikowski JB, Dumont AM. Лимфангиома циркумскриптума: лечение склеротерапией гипертоническим солевым раствором. J Am Acad Dermatol . 2005 Сентябрь 53 (3): 442-4. [Медлайн].
Ан SJ, Chang SE, Choi JH, Moon KC, Koh JK, Kim DY. Случай неоперабельной лимфангиомы в области вульвы, успешно вылеченный с помощью OK-432 в детстве. J Am Acad Dermatol . 2006 ноябрь 55 (5 приложение): S106-7. [Медлайн].
Окадзаки Т., Иватани С., Янаи Т. и др. Лечение лимфангиомы у детей: наш опыт 128 случаев. Дж. Педиатр Хирургия . 2007 Февраль 42 (2): 386-9. [Медлайн].
Юн К.Р., Мо AJ, Park SH, Na YS, Park ST. Карвенозная лимфангиома вульвы. Акушерская Гинекология . 2015 Январь 58 (1): 77-9. [Медлайн]. [Полный текст].
Кац М.С., Финк С.М., Шварц М.З., Моронт М.Л., Прасад Р., Тиммапури С.Дж. и др.Закрытие с помощью вакуума в лечении обширных лимфангиом у детей. Дж. Педиатр Хирургия . 2012 Февраль 47 (2): 367-70. [Медлайн].
Истории успеха лимфангиомы | Детская больница Колорадо
34-недельное УЗИ должно было стать обычным делом — чтобы убедиться, что с Ноем все в порядке. Мой живот начал измеряться впереди, и мы знали, что он перевернулся. Ультразвук даст нам знать, как мы продвигаемся. Мы просто не были готовы к тому, что обнаружим.
Во время УЗИ техник обнаружил нечто неприятное: в груди нашего сына было значительное скопление жидкости. После того, как специалист по материнству и плоду просмотрел копию ультразвуковых изображений, нас сразу же записали на прием на следующий день в Детскую больницу Колорадо, чтобы выяснить, что вызывает излияние в теле нашего сына. Оказавшись там, мы прошли ряд тестов — МРТ, эхокардиограмму плода, еще несколько ультразвуковых исследований — и все это за один день.
Ною был поставлен диагноз лимфангиома шейки матки (кисты в лимфатической системе) и врожденный гидроторакс, который вызывал значительное скопление жидкости в его груди и приводил к осложнениям со стороны иммунной системы.За один день мы перешли от мысли, что беременность протекала нормально, к пониманию того, что нашему будущему ребенку, возможно, потребуется хирургическое вмешательство сразу после родов.
Лечение лимфангиомы в Центре ухода за плодами Колорадо
За моими успехами и лечением Ноя будут наблюдать хирурги, врачи и эксперты по эмбрионированию в результате совместных усилий детской больницы Колорадо и больницы Университета Колорадо. Хотя команда профессионально, но дружелюбно рассказывала о диагнозе и вариантах лечения, помогая установить доверительные отношения с нашей семьей, мы по-прежнему опасались за нашего сына.Это одновременно пугает и сюрреалистично осознавать, что то, что вы считали здоровой беременностью, на самом деле было ребенком с небольшими шансами на выживание. Это ужасно с места и глубины, о которой я даже не подозревал. Вы хотите верить, что опыта врачей и сильной жизненной силы вашего ребенка будет достаточно, но вы должны лицом к лицу столкнуться с тем, что значит выйти из больницы без ребенка.
Из-за аномалии плода мои роды должны были произойти в отделении по уходу за матерями и плодами Детского отделения Колорадо, а после рождения Ной должен был находиться в отделении интенсивной терапии новорожденных (ОИТН) на длительный срок.Я никогда не думала, что меня побудят, но команда отделения материнского плода проделала потрясающую работу, заставив неидеальную ситуацию чувствовать себя особенной и максимально комфортной. Сразу после рождения Ноя срочно отправили в отделение интенсивной терапии. Тот факт, что эта многопрофильная команда была настолько подготовлена к лечению его состояния и была готова действовать сразу же после его рождения, сделало разницу между нашим ребенком, имеющим шанс на борьбу, и, вероятно, вообще не иметь ребенка, чтобы забрать его домой.
С Ноа в отделении интенсивной терапии следующие недели были чередой тестов, лабораторных работ, молитв и ожиданий.Наблюдать, как из груди нашего ребенка течет жидкость с угрожающей скоростью, было самой ужасной вещью, через которую я когда-либо проходил — совсем не то, как мы планировали приветствовать нашего первого ребенка в мире. После недели медикаментозной терапии, чтобы попытаться остановить его состояние, нам сказали, что иммунная система Ноя дает сбой. Медицинская бригада дала понять, что его система полностью выйдет из строя, если мы не предпримем более сложных мер.
Наш сын борется за свою жизнь
Наша хирургическая бригада под руководством доктора Кеннета Лихти закрыла кисту на лимфатическом узле (склеротерапия).Команда выполнила плевродез, хирургическую процедуру, которая предотвращает дальнейшее накопление жидкости вокруг легких, что было нашей единственной надеждой на его выздоровление.
Когда он уехал на операцию, я буквально часами следил за секундами на часах. Когда доктор наконец вернулся и сообщил нам, что Ной оправился от анестезии, это было все равно, что прыгнуть в лужу облегчения. В течение почти недели мы не знали, сработала ли операция, — и я колебался между желанием наблюдать за ним каждую секунду каждого дня и желанием изгнать себя, потому что я не мог выдержать постоянный стресс ожидания. чтобы увидеть, не замедляется ли его лимфатическая утечка.Я до сих пор помню момент, когда хирургическая бригада вернулась в нашу комнату, чтобы убедиться, что плевральная дренажная трубка установлена правильно — по их словам, операция, похоже, полностью купила симптомы. Думаю, это был момент, когда мое сердце снова начало биться. Необходимы последующие меры, но они выразили оптимизм. Я начал думать, что, возможно, Ной участвовал в этом, чтобы выиграть.
С этого момента опасная для жизни тьма начала рассеиваться, и появилась возможность, что Ной выздоровеет. И он это сделал.На выздоровление маленькому телу Ноя потребовался почти месяц, и каждый шаг его врачи встречали с осторожным оптимизмом, сверхбдительностью и творческим подходом к решению проблем. Наша команда врачей проделала потрясающую работу, расставив приоритеты в наших заботах, одновременно поддерживая и честно оценивая серьезность его ситуации. Для нашей семьи было подарком судьбы, что наш хирург успешно вылечил случай, подобный случаю Ноя, раньше, знал, что искать, и понимал, какие вмешательства работают.
По дороге домой
Наш хирург д-р.Лихти любит говорить нам, что это «черепашьи бега» — и это правда. Из-за тяжелого состояния Ноя у нас есть месяцы и, вероятно, годы амбулаторных посещений и бдительности с нашей стороны, чтобы следить за любыми признаками дополнительно необходимого лечения. Между тем, после более чем месяца в отделении интенсивной терапии (через полтора месяца после поступления в больницу) слова «иду домой» никогда не были слаще.
Ной не смог бы выздороветь, если бы не компетентность и сотрудничество между многими разными командами — неонатологами, гематологами, генетиками и хирургами.Когда на кону стояла жизнь нашего ребенка, эти врачи нашли время, чтобы лично поговорить с нашей семьей, ответить на трудные вопросы и убедиться, что мы справляемся с реалиями ситуации — в то же время помогая нам справиться с тем, чем мы были. чувство стресса тяжелобольного ребенка. Мы бесконечно благодарны.
Что касается нашего маленького бойца, Ной превзошел все ожидания на каждом шагу — что я могу отнести только к его бунтарскому духу и заботе его врачей. Он такой сильный, но даже через несколько месяцев я не могу представить, через что он прошел, чтобы получить шанс в жизни, не разрываясь.Ной никогда не вспомнит, что он был так болен. Он не узнает, что был так близок к возможности смерти, и за это я тоже ему благодарен.
Думаю, я понесу его с собой достаточно для нас двоих.
Кистозная лимфангиома брюшной полости у новорожденного
Durand CH, Pigney J-P, Liscia F (1963) Lymphangiome kystique du mésentère chez un nouveau-né de neuf jours. Intervention et guérison. Анн Педиатр [Suppl Semin Hôp Paris] 39: 4911
Google Scholar
Esoturgie RJA, Van Beek MWPM (1980) Брыжеечные кисты. З Киндерчир 32: 223–230
Google Scholar
Ferran JL, Galifer RB, Pous JG (1976) Intérêt de l’opacification corporéale dans le Diagnostic des lymphangiomes kystiques abdominaux de l’enfant. Decription d’un nouveau signe: le signe de la cloison. Анн Радиол (Париж) 19: 769–774
Google Scholar
Fish JC, Fair WR, Canby JP (1965) Кишечная непроходимость у новорожденного: необычный случай из-за кисты брыжейки. Arch Surg 90: 317–319
Google Scholar
Галифер Р.Б., Поус Дж. Г., Юскевски С., Паски М., Гоберт Дж. (1978) Кистозные лимфангиомы брюшной полости в детстве. Прогр Педиатр Хирург 11: 173–238
Google Scholar
Hertig H (1955) Über Mesenterialzysten.Langenbecks Arch Chir 280: 294
Google Scholar
Hoffman E (1965) Мультикистозная забрюшинная лимфангиома, проявляющаяся как непрямая грыжа у новорожденного. Am Surg 31: 525–527
Google Scholar
Koltai I, Menardi G (1975) Mesenterialzysten in Neugeborenenund Kindesalter. З Киндерчир 17: 35–38
Google Scholar
Lister J (1978) Опухоли брюшной полости. В: Rickham PP, Lister J, Iwing IM (eds) Неонатальная хирургия. Баттервортс.

