У грудничка нарушение венозного оттока: Проблемы венозной недостаточности у младенцев
Проблемы венозной недостаточности у младенцев
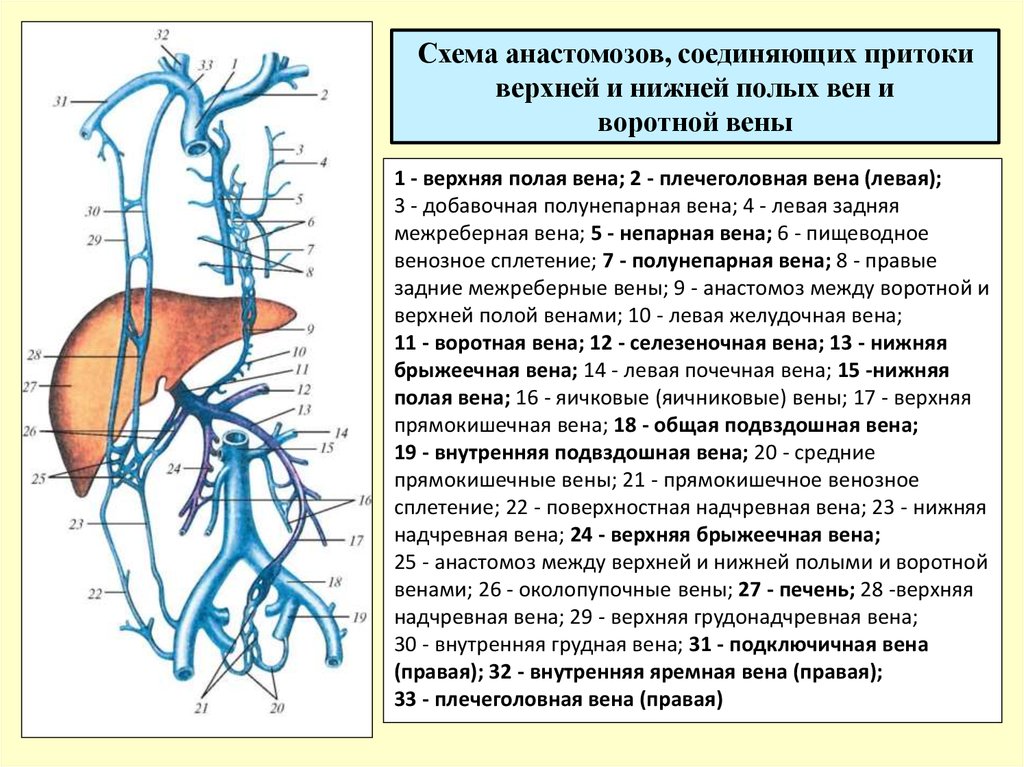
Институт Коррекционной Педагогики РАО, Москва. Клинический метод неврологического исследования в сочетании с диагностическими методами обеспечивает постановку правильного диагноза. Клиническая картина различных форм сосудистых заболеваний головного мозга во многом определяется дисфункцией венозного кровообращения, причем часто течение и исход заболевания зависят именно от венозных нарушений, поэтому их выявление имеет теоретическое и практическое значение. Венозная система головы анатомически сложна, в ее формировании принимает участие экстракраниальная венозная сеть, диплоические вены, синусы и вены твердой мозговой оболочки, имеющие много анастомозов.
Среди перинатальной патологии гипертензионно-гидроцефальный синдром занимает одно из первых мест. Симптомы повышения внутричерепного давления и расширение ликворных пространств мозга отражают ишемически — гипоксическое, травматическое поражение головного мозга в интра- и перинатальном периоде /Б. В. Лебедев, Л.М. Кузенкова, О.И. Маслова, 1990/.
В. Лебедев, Л.М. Кузенкова, О.И. Маслова, 1990/.
Проявления внутричерепной гипертензии в младенчестве нередко носит скрытый характер, что объясняется наличием у детей хорошо развитых адаптационных механизмов. Внутричерепное давление определяется не столько формой гидроцефалии, сколько стадией развития заболевания /П. Вецка, Хр. Цеков, 1982/. У пациентов часто устанавливается нарушение венозного оттока. Ликворная, внутрижелудочковая гипертензия не является обязательным компонентом синдрома внутричерепной гипертензии. Ликворное давление непрерывно меняется в зависимости от степени сохранности адаптационных механизмов мозга в связи с нарушением равновесия между отдельными составляющими внутричерепного жидкостного объема.
Термин «доброкачественная» внутричерепная гипертензия (псевдотумор мозга) применяется в современной литературе для обозначения синдрома повышения внутричерепного давления при отсутствии объемного церебрального процесса. Дети жалуются на головную боль / в анамнезе не было травм головы и воспалительных заболеваний нервной системы/, нарушение зрения, есть глазодвигательные расстройства. Анальгетики не облегчают боль. Отмечен положительный эффект дегидратационной терапии /Е.М. Бурцев, Е.В. Малецкая,1997/.
Анальгетики не облегчают боль. Отмечен положительный эффект дегидратационной терапии /Е.М. Бурцев, Е.В. Малецкая,1997/.
Эхоэнцефалография /ЭХОЭГ/ — метод диагностики внутричерепных поражений с помощью ультразвука. Применение ЭХОЭГ не имеет противопоказаний, обеспечивает высокую точность, обладает рядом дифференциально-диагностических возможностей (в том числе- выявление гипертензионно-гидроцефального синдрома). За последние три года /1996-1998 гг./ в консультативно-диагностическом Центре ИКП РАО и городской детской поликлинике N34 г.Москвы /главный врач Л.К. Дроздова/ нами обследовано 63 младенца в возрасте от 2-х месяцев до 2-х лет /27 девочек и 36 мальчиков/.
У большинства пациентов был диагноз» гипертензионно-гидроцефальный синдром»,»внутричерепная гипертензия», «невротические реакции». У матерей часто отмечалась патология течения беременности: угроза невынашивания, токсикоз второй половины беременности. Роды были быстрыми или затяжными, многим проводили кесарево сечение. Недоношенными /7-8 мес./ были чаще мальчики. Из жалоб родителей: плохой /непродолжительный/ сон младенцев, гиперактивность, плач, невротические реакции, увеличенный размер головы, задержки физического и психического развития (недоразвитие речи к 2 г.).
Недоношенными /7-8 мес./ были чаще мальчики. Из жалоб родителей: плохой /непродолжительный/ сон младенцев, гиперактивность, плач, невротические реакции, увеличенный размер головы, задержки физического и психического развития (недоразвитие речи к 2 г.).
ЭХОЭГ проводили с помощью эхоэнцефалографа ЭЭС-12. Степень внутричерепной гипертензии устанавливали определяя ширину III желудочка, выраженность по количеству и амплитуде латеральных эхосигналов, пульсации М- ЭХА. Дополнительными патологическими признаками являются смещения латеральных эхосигналов. При расширении боковых желудочков эхосигналы от медиальных стенок смещаются медиально, а от латеральных — латерально. Вычисляли индекс мозгового плаща. ИМП=a/b, где a-расстояние от М-эхо до конечного комплекса; b — расстояние от эха бокового желудочка до конечного комплекса. Патологическими считаются индексы> 2,3 /Л.Р. Зенков, М.А. Ронкин, 1991/.
I группа младенцев от 2 мес. до 12 мес. / n=23; 16 мальчиков и 6 девочек /.
В ЭХОЭГ значимых смещений /сдвиги на +0,5 мм.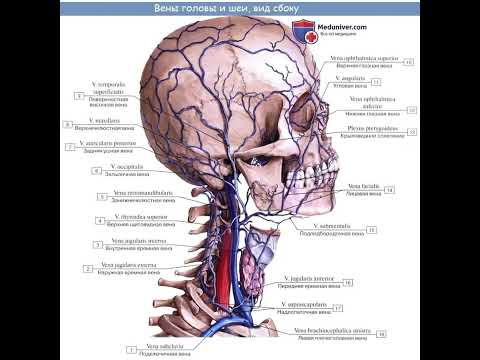 не учитывали/ срединных структур мозга не выявлено: Мd=58,4 мм.; Мs=58,4 мм. /от 50 до 66 мм./. М-эхо у всех было расщеплено, что характерно для детей. Ширина III желудочка всех детей соответствовала возрастной норме /5 мм./, кроме двух мальчиков, у которых ширина была увеличена на 1 мм. /6 мм./.
не учитывали/ срединных структур мозга не выявлено: Мd=58,4 мм.; Мs=58,4 мм. /от 50 до 66 мм./. М-эхо у всех было расщеплено, что характерно для детей. Ширина III желудочка всех детей соответствовала возрастной норме /5 мм./, кроме двух мальчиков, у которых ширина была увеличена на 1 мм. /6 мм./.
У большинства младенцев /70 %/ латеральные эхосигналы были выраженными по количеству и амплитуде, у остальных — умеренно выраженными. Пульсации эхосигналов у трети пациентов были выраженными, свыше 50 % (у двух — свыше 60 %), у остальных — до 50 % /граница нормы/. ИМП был выраженно увеличен у 80 % обследованных и составил в среднем: ИМПs=3,1+0,1; ИМПd=3,0+0,1 /от 2,9 до 4,0; хуже слева/. У остальных ИМП=2,7+0,1 /от 2,6 до 2,8/, при норме <2,3. У трех детей (с диагнозом «невротические реакции») ЭХОЭГ была вариантом возрастной нормы: латеральные эхосигналы умеренно выражены по количеству и амплитуде, пульсации М-эха до 40%, ИМП = 2,3, ширина III желудочка = 5 мм. II группа младенцев от 1 года до 2 лет/n=41;21 мальч.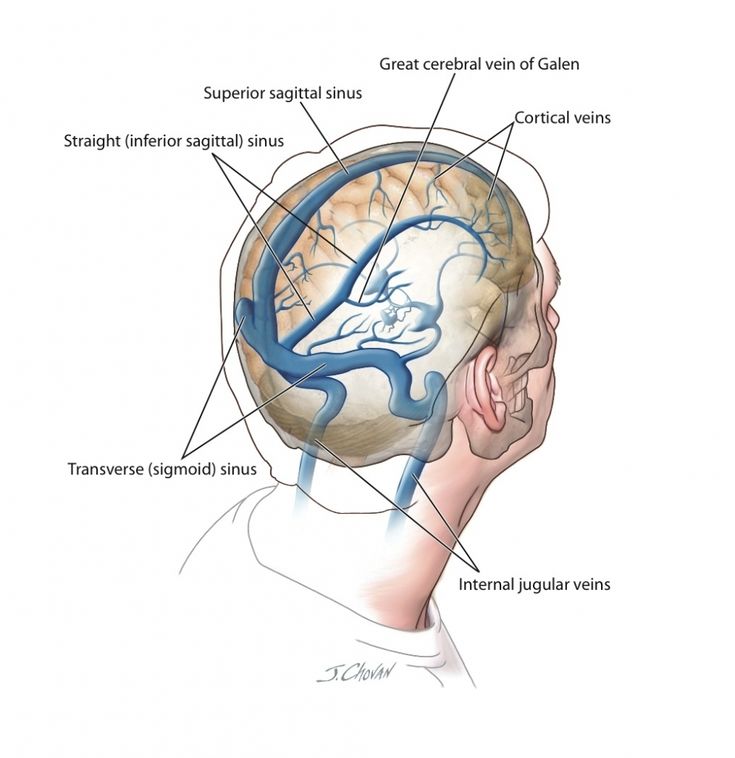 и 20 девоч.
и 20 девоч.
В ЭХОЭГ значимых смещений срединных структур мозга не выявлено: Мd=66,3 мм; Мs=66.3 мм /от 62 до 72 мм./. М-эхо у всех было расщеплено. Ширина III желудочка у трети пациентов была увеличена на 1 мм. по сравнению с нормой и составила 6 мм. У остальных детей эта величина была в норме /5 мм./.
У большинства младенцев /80 %/ латеральные эхосигналы были выраженными по количеству и амплитуде, у остальных — умеренно выраженными. Пульсации эхосигналов у большинства пациентов были до 50 % /граница нормы/ , у одного — свыше 50 %; у двух — свыше 60 %. ИМП был выраженно увеличен у 75 % обследованных и составил в среднем: ИМПs=3,0+0,1; ИМПd=2,9 /от 2,8 до 3,2; хуже слева/. У остальных ИМП=2,6+0,1 /от 2,5 до 2,7/.
У четырех обследованных детей (с диагнозом «невротические реакции) ЭХОЭГ была вариантом возрастной нормы.
Таким образом, большинство обследованных детей /до 80 %/ по данным ЭХОЭГ имели внутричерепную гипертензию. Примерно 10 % обследованных младенцев имели ЭХОЭГ в пределах возрастной нормы и 10 % — негрубые признаки внутричерепной гипертензии.
Дегидратационная терапия давала положительную динамику, особенно сразу после курса лечения. Однако спустя 3-6 месяцев нередко появлялись признаки внутричерепной гипертензии.
С трехлетнего возраста некоторым детям (особенно при повторном обследовании) проводили ЭХОЭГ и РЭГ (реоэнцефалограмма). Затруднение венозного оттока проявляется на РЭГ выпуклостью нисходящей части волны (катакроте). Инцизура и дополнительные волны придают «зазубренный» вид- «петушиные» гребни. Признаки затруднения венозного оттока выявляли часто на фоне не достаточного (сохраненного), а сниженного пульсового кровенаполнения сосудов мозга. В.В. Шток, М.А. Ронкин, В.Л. Анзимиров (1996) определяют эти изменения как типы венозной недостаточности второй и третьей степени. На ЭХОЭГ регистрировали увеличение количества и амплитуды латеральных эхосигналов.
Таким образом:
- Методы ЭХОЭГ и РЭГ являются достаточно информативными для оценки ликворно-венозной циркуляции у младенцев.
- Исследование показало, что мальчики хуже переносят пренатальную, натальную и постнатальную патологию, медленнее «созревают»,чаще подвергаются травмам по сравнению с девочками.
- Дегидратационная терапия (кроме острых состояний) должна применяться в щадящих дозах с учетом индивидуальных особенностей младенцев.
Нарушение венозного оттока крови – НейроСпектр
Один из важных центров оттока — яремные вены, через которые из ЦНС выводится 90% крови. Также большое значение имеет состояние шейного отдела позвоночника, который очень тесно связан с состоянием системы кровоснабжения. Нарушение венозного оттока серьезно влияет на качество жизни.
В здоровом организме кровь свободно циркулирует. За это отвечает артериальная и венозная системы, которые находятся по всему организму, в том числе в центральной нервной системе (ЦНС). Для обеспечения правильной работы ЦНС важен как достаточный артериальный приток, обеспечивающий доставку кислорода, питательных веществ, необходимых для правильной работы мозга, так и венозный отток, который выводит продукты обмена веществ из ЦНС. Обмен веществ в нервной системе намного быстрее, чем в большинстве тканях организма.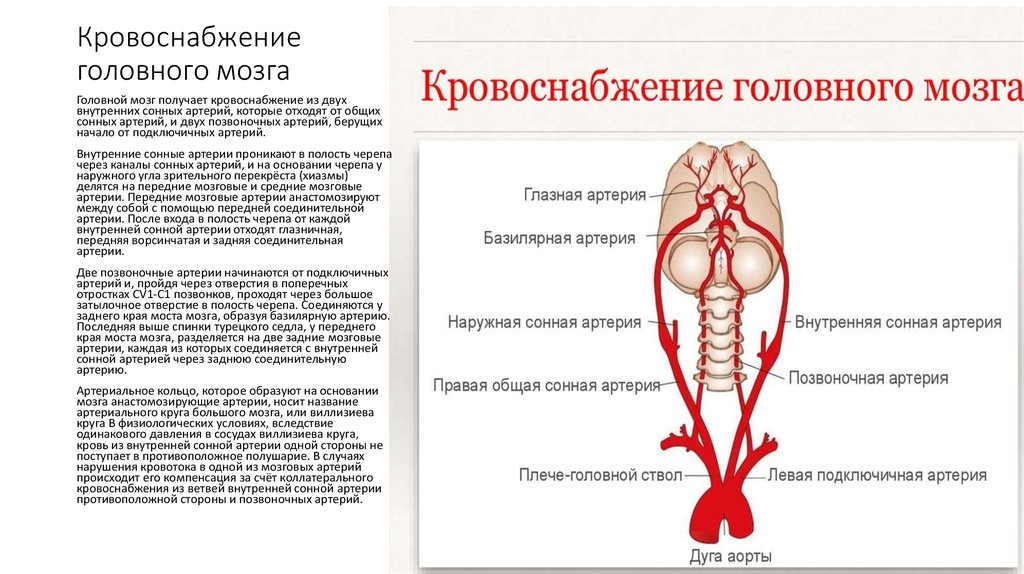 Поэтому обеспечение правильного и достаточного оттока крови является значимым для здоровья.
Поэтому обеспечение правильного и достаточного оттока крови является значимым для здоровья.
Признаки нарушения
При нарушении венозного оттока у детей проявляются следующие признаки:
- ухудшение сна;
- беспокойство;
- снижение внимания;
- задержка психоречевого развития;
- выраженная венозная сетка на голове
Ребенок с такими нарушениями быстро утомляется, не может сосредоточиться. Внимание рассеивается, активность падает. У взрослого человека нарушения венозного оттока также оказывают негативное влияние на сон, самочувствие, активность.
С возрастом у ребенка, имеющего такие проблемы, могут проявиться другие симптомы: нарушение координации, эмоциональная нестабильность, судороги, тремор конечностей, головокружения, потемнение в глазах, шум и звон в ушах.
Причины заболевания
Причины нарушения венозного оттока бывают разными. Заболевание может быть связано с травмами, в том числе родовыми, что является наиболее частой причиной у детей с нарушениями тонуса сосудов, мышечными нарушениями, например, врожденная или установочная кривошея. Проблемы отмечаются при воспалении вен, образовании грыж, остеохондрозе позвоночного отдела. Таким нарушениям у детей может способствовать длительное пребывание в неудобной позе, гиподинамия, перенапряжение, простудные заболевания сопровождающиеся кашлем, неудобная одежда с тугими воротничками.
Проблемы отмечаются при воспалении вен, образовании грыж, остеохондрозе позвоночного отдела. Таким нарушениям у детей может способствовать длительное пребывание в неудобной позе, гиподинамия, перенапряжение, простудные заболевания сопровождающиеся кашлем, неудобная одежда с тугими воротничками.
Чтобы точно определить причину нарушений, стоит обратиться к неврологу и пройти обследования по назначению врача. Для выявления заболевания достаточно сделать УЗИ сосудов головы и шеи. Процедура позволяет поставить точный диагноз на любой стадии расстройства. Всего отмечается три стадии развития заболевания: ранняя (латентная), застойная и хроническая. На третьей стадии у ребенка развиваются сильно выраженные застойные явления приводящие к энцефалопатии (нарушения структуры мозгового вещества).
Энцефалопатия излечима, однако желательно выявить заболевание на более ранних стадиях. В этом случае вероятность более тяжелых нарушений минимальны.
Лечение
На начальных этапах часто можно обойтись без лекарств, с помощью дополнительных немедикаментозных воздействий. Возможно назначение физиотерапевтических процедур, остеопатия, рефлексотерапии Результаты лечения оцениваются с помощью УЗИ.
Возможно назначение физиотерапевтических процедур, остеопатия, рефлексотерапии Результаты лечения оцениваются с помощью УЗИ.
Но первым шагом, который нужно сделать для лечения нарушения венозного оттока — обратиться к неврологу. При серьезных нарушениях и наличии осложнений лечение начинается с медикаментозной терапии. Требуется восстановление нервной системы, повышение тонуса сосудов, устранение компрессии вен. Лечение лекарственными препаратами проводится параллельно с немедикаментозным лечением.. Поэтому параллельно пациенту назначают посещение остеопата, физиотерапевтические сеансы.
Лечение продолжается до тех пор, пока проблема не будет устранена. Это может занять несколько недель или месяцев в зависимости от тяжести заболевания, индивидуальных особенностей организма.
Понимание нарушения яремного венозного оттока
1.
Прайс Эй Джей, Райт Флорида, Грин Дж и др. Различия в факторах риска для 3 типов инсульта: проспективное исследование в Великобритании и метаанализы.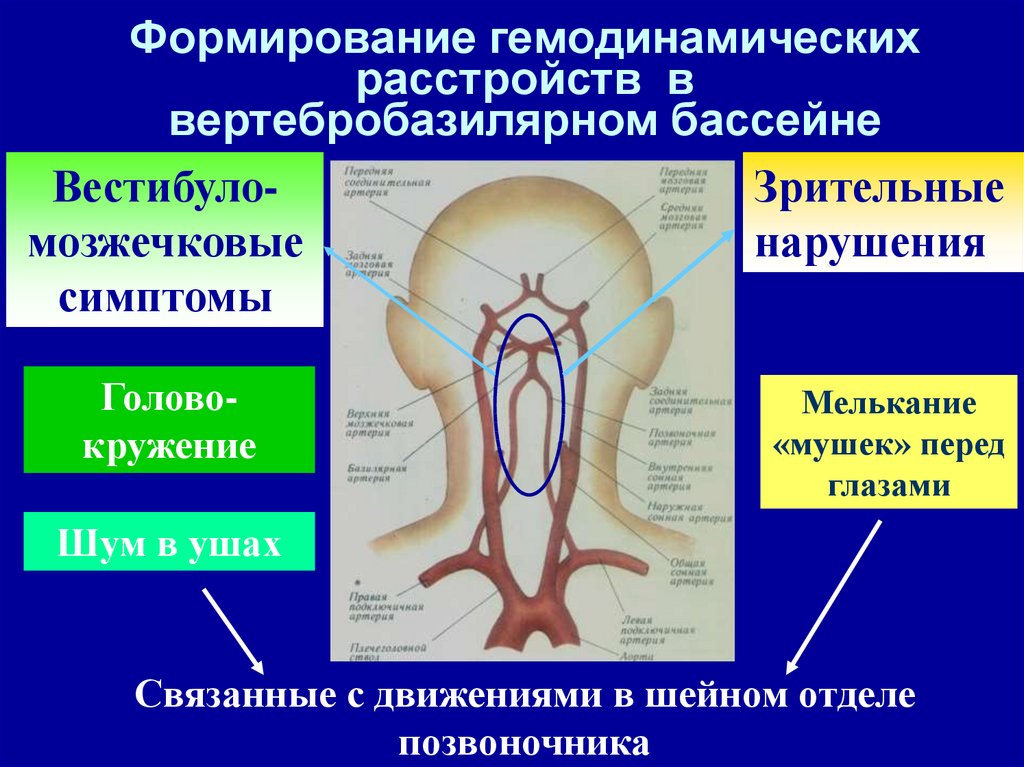 Неврология. 2018;90:e298-e306. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Неврология. 2018;90:e298-e306. [Бесплатная статья PMC] [PubMed] [Google Scholar]
2.
Чжоу Д., Мэн Р., Ли С. и соавт. Прогрессирование хронической недостаточности мозгового кровообращения. ЦНС Neurosci Ther. 2018;24:5-17. [Бесплатная статья PMC] [PubMed] [Google Scholar]
3.
Ху И, Мэн Р, Чжан С и др. Специфическая для нейронов сыворотки энолаза может быть маркером для прогнозирования тяжести и исхода церебрального венозного тромбоза. Дж Нейрол. 2018;265:46-51. [PubMed] [Академия Google]
4.
Мэн Р., Ван Х, Хуссейн М. и др. Оценка D-димера плюс фибриногена в плазме для прогнозирования острого ЦВСТ. Инт J Инсульт. 2014;9:166-173. [Бесплатная статья PMC] [PubMed] [Google Scholar]
5.
Менг Р., Дорнбос Д., Менг Л. и соавт. Клинические различия между острым CVST и нетромботическим CVSS. Клиника Нейрол Нейрохирург. 2012;114:1257-1262. [PubMed] [Google Scholar]
6.
Борхани Хагиги А., Эджелл Р.С., Круз-Флорес С. и соавт. Смертность от церебрального венозно-синусового тромбоза в большой национальной выборке.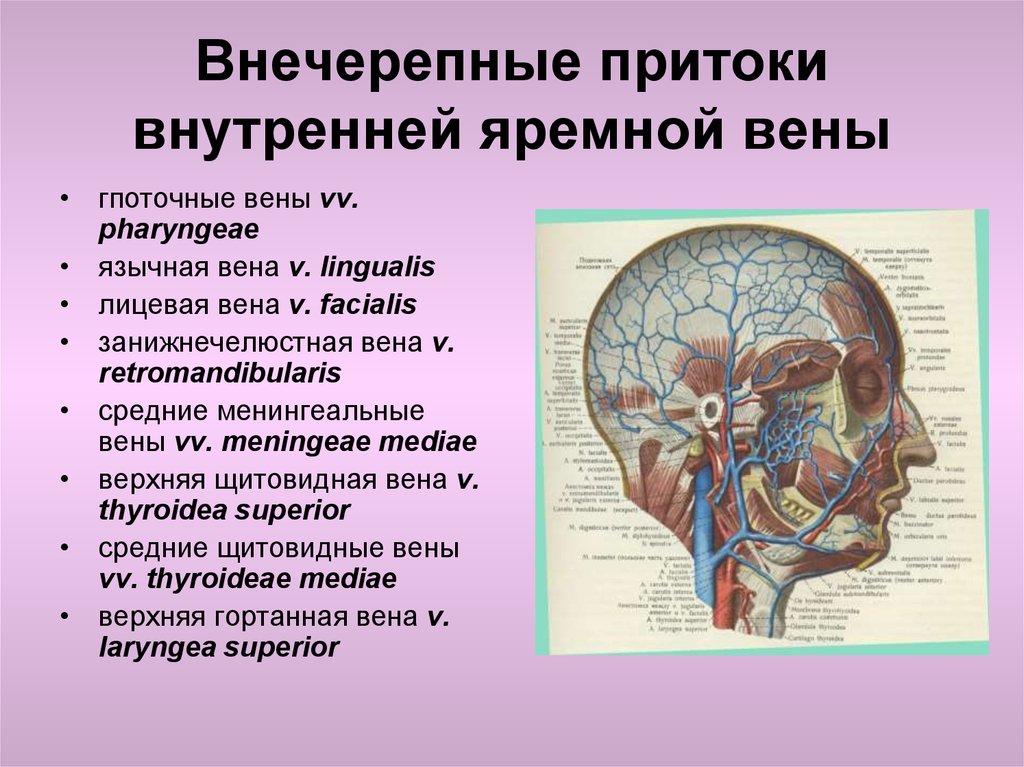 Гладить. 2012;43:262-264. [PubMed] [Академия Google]
Гладить. 2012;43:262-264. [PubMed] [Академия Google]
7.
Чжоу Д., Мэн Р., Чжан С. и др. Внутричерепная гипертензия, вызванная стенозом внутренней яремной вены, может быть устранена с помощью стентирования. Евр Дж Нейрол. 2018;25:365–e13. [PubMed] [Google Scholar]
8.
Chung CP, Hsu HY, Chao AC, Sheng WY, Soong BW, Hu HH. Транзиторная глобальная амнезия: нарушение церебрального венозного оттока — понимание аномальных паттернов кровотока во внутренней яремной вене. Ультразвук Медицина Биол. 2007;33:1727-1735. [PubMed] [Google Scholar]
9.
Сехас С., Сиснерос Л.Ф., Лагос Р., Зук С., Америсо С.Ф. Несостоятельность клапана внутренней яремной вены широко распространена при транзиторной глобальной амнезии. Гладить. 2010;41:67-71. [PubMed] [Академия Google]
10.
Замбони П., Галеотти Р., Менегатти Э. и соавт. Хроническая цереброспинальная венозная недостаточность у больных рассеянным склерозом. J Neurol Нейрохирург Психиатрия. 2009;80:392-399. [Бесплатная статья PMC] [PubMed] [Google Scholar]
11.
Замбони П., Галеотти Р., Менегатти Э. и соавт. Проспективное открытое исследование эндоваскулярного лечения хронической цереброспинальной венозной недостаточности. J Vasc Surg. 2009;50:1348-1358. e1341-1343. [PubMed] [Google Scholar]
12.
Chung CP, Chao AC, Hsu HY, Lin SJ, Hu HH. Снижение растяжимости яремных вен при мигрени. Ультразвук Медицина Биол. 2010;36:11-16. [PubMed] [Академия Google]
13.
Лю М., Сюй Х., Ван Ю и др. Закономерности хронической венозной недостаточности дуральных синусов и экстракраниальных дренирующих вен и их взаимосвязь с гиперинтенсивностью белого вещества у больных болезнью Паркинсона. J Vasc Surg. 2015;61:1511–1520. e1511 [бесплатная статья PMC] [PubMed] [Google Scholar]
14.
Беггс С., Чанг С.П., Бергсланд Н. и соавт. Яремный венозный рефлюкс и объемы паренхимы головного мозга у пожилых пациентов с легкими когнитивными нарушениями и болезнью Альцгеймера. БМК Нейрол. 2013;13:157. [Бесплатная статья PMC] [PubMed] [Google Scholar]
15.
Хсу Х.И., Чао А.С., Чен Ю.Ю. и др. Рефлюкс яремных и ретробульбарных вен при транзиторной монокулярной слепоте. Энн Нейрол. 2008;63:247-253. [PubMed] [Google Scholar]
16.
Чанг С.П., Ченг С.Ю., Зивадинов Р. и соавт. Яремный венозный рефлюкс и эндотелин-1 плазмы связаны с кашлевым обмороком: пилотное исследование случай-контроль. БМК Нейрол. 2013;13:9. [Бесплатная статья PMC] [PubMed] [Google Scholar]
17.
Филипо Р., Чичарелло Ф., Аттанасио Г. и др. Хроническая цереброспинальная венозная недостаточность у больных болезнью Меньера. Eur Arch Оториноларингол. 2015;272:77-82. [PubMed] [Академия Google]
18.
Ли А.Б., Ларедо Дж., Невилл Р. Эмбриологический фон трункулярной венозной мальформации в экстракраниальных венозных путях как причина хронической цереброспинальной венозной недостаточности. Инт Ангиол. 2010;29:95-108. [PubMed] [Google Scholar]
19.
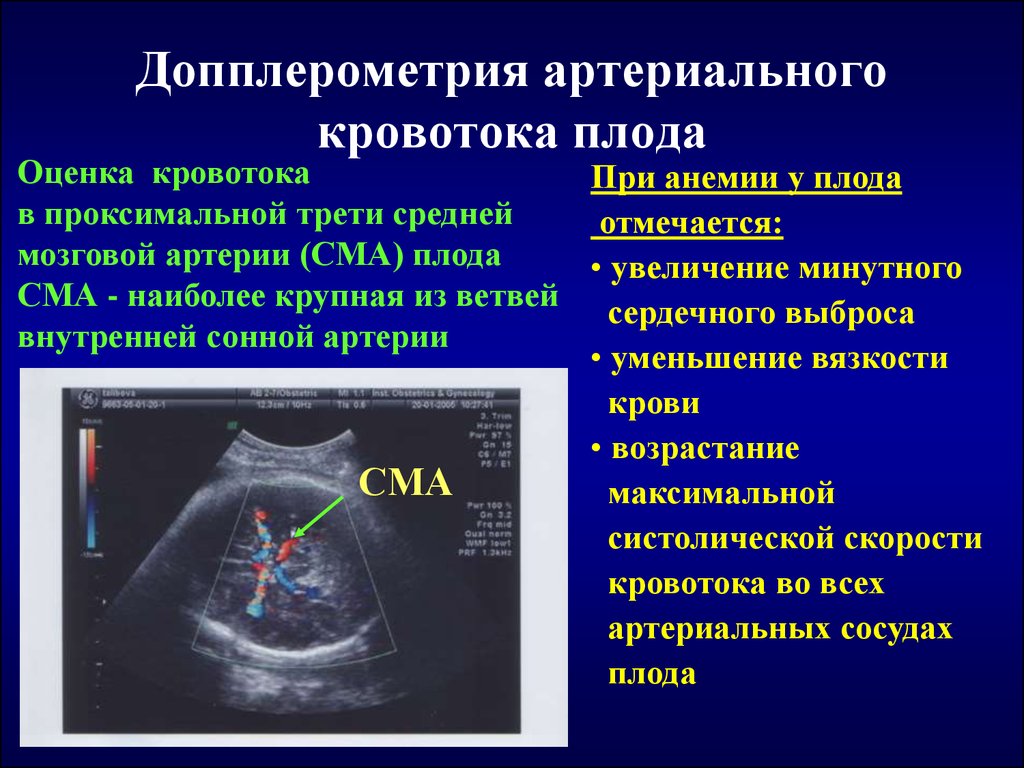
Склафани С.Дж. Внутрисосудистое ультразвуковое исследование в диагностике и лечении хронической цереброспинальной венозной недостаточности.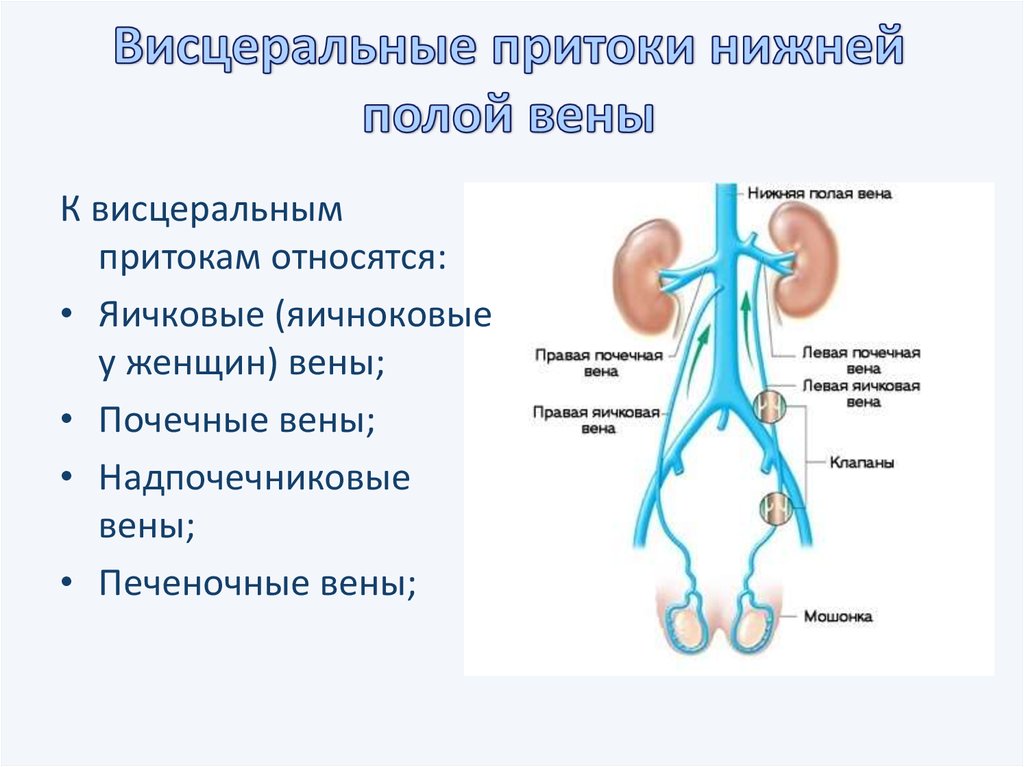 Tech Vasc Interv Radiol. 2012;15:131-143. [PubMed] [Google Scholar]
Tech Vasc Interv Radiol. 2012;15:131-143. [PubMed] [Google Scholar]
20.
Кармон Ю., Зивадинов Р., Вайншток-Гуттман Б. и соавт. Сравнение внутрисосудистого УЗИ с традиционной венографией для выявления экстракраниальных венозных аномалий, свидетельствующих о хронической цереброспинальной венозной недостаточности. J Vasc Interv Radiol. 2013;24:1487-1498. e1481 [PubMed] [Google Scholar]
21.
Scalise F, Farina M, Manfredi M, Auguadro C, Novelli E. Оценка яремных эндоваскулярных пороков развития при хронической цереброспинальной венозной недостаточности: цветное допплеровское сканирование и катетерная венография по сравнению с внутрисосудистым ультразвуком. Флебология. 2013;28:409-417. [PubMed] [Google Scholar]
22.
Зивадинов Р., Чанг С.П. Потенциальное участие экстракраниальной венозной системы в заболеваниях центральной нервной системы и старении. БМС Мед. 2013;11:260. [Бесплатная статья PMC] [PubMed] [Google Scholar]
23.
Биннебозель М., Громмес Дж., Юнге К. , Гёбнер С., Шумпелик В., Труонг С. Тромбоз внутренней яремной вены, проявляющийся болезненным образованием на шее из-за спонтанного смещения катетера подключичного порта как долгосрочное осложнение: клинический случай. Кейс Дж. 2009; 2:7991. [Бесплатная статья PMC] [PubMed] [Google Scholar]
, Гёбнер С., Шумпелик В., Труонг С. Тромбоз внутренней яремной вены, проявляющийся болезненным образованием на шее из-за спонтанного смещения катетера подключичного порта как долгосрочное осложнение: клинический случай. Кейс Дж. 2009; 2:7991. [Бесплатная статья PMC] [PubMed] [Google Scholar]
24.
Дашти С.Р., Накаджи П., Ху Ю.С. и соавт. Стилоидогенный синдром компрессии яремных вен: диагностика и лечение: клинический случай. Нейрохирургия. 2012;70:E795‐E799. [PubMed] [Академия Google]
25.
Хиггинс Дж. Н., Гарнетт М. Р., Пикард Дж. Д., Аксон П. Р. Оценка стилоидэктомии как дополнения или альтернативы яремному стентированию при идиопатической внутричерепной гипертензии и нарушениях краниального венозного оттока. J Neurol Surg B Основание черепа. 2017;78:158-163. [Бесплатная статья PMC] [PubMed] [Google Scholar]
26.
Ан С.С., Миллер Т.Дж., Чен С.В., Чен Дж.Ф. Стеноз внутренней яремной вены часто встречается у пациентов с нейрогенным синдромом грудной апертуры. Энн Васк Сург. 2014;28:946-950. [PubMed] [Google Scholar]
2014;28:946-950. [PubMed] [Google Scholar]
27.
Эсфахани Д.Р., Аларадж А., Бирк Д.М., Талборн К.Р., Чарбель Ф.Т. Стеноз перед тромбозом: внутричерепная гипертензия из-за стеноза яремного отверстия, вторичного по отношению к почечной остеодистрофии. Мировой нейрохирург. 2018;109:129-133. [PubMed] [Google Scholar]
28.
Торо Э.Ф., Мюллер Л.О., Кристини М., Менегатти Э., Замбони П. Влияние функции клапана яремной вены на церебральную венозную гемодинамику. Курр Нейроваск Рез. 2015;12:384-397. [PubMed] [Академия Google]
29.
Чанг С.П., Беггс С., Ван П.Н. и соавт. Яремный венозный рефлюкс и аномалии белого вещества при болезни Альцгеймера: экспериментальное исследование. Дж. Альцгеймера Дис. 2014;39:601-609. [PubMed] [Google Scholar]
30.
Chung CP, Wang PN, Wu YH и соавт. Более выраженные изменения белого вещества у пожилых людей с яремным венозным рефлюксом. Энн Нейрол. 2011;69:553-559. [PubMed] [Google Scholar]
31.
Долич К., Вайншток-Гуттман Б., Марр К. и соавт. Факторы риска хронической цереброспинальной венозной недостаточности (ХЦВН) у большой группы добровольцев. ПЛОС ОДИН. 2011;6:e28062. [Бесплатная статья PMC] [PubMed] [Google Scholar]
и соавт. Факторы риска хронической цереброспинальной венозной недостаточности (ХЦВН) у большой группы добровольцев. ПЛОС ОДИН. 2011;6:e28062. [Бесплатная статья PMC] [PubMed] [Google Scholar]
32.
Долич К., Вайншток-Гуттман Б., Марр К. и соавт. Заболевания сердца, избыточный вес и курение сигарет связаны с повышенной распространенностью экстракраниальных венозных аномалий. Нейрол Рез. 2012;34:819-827. [PubMed] [Google Scholar]
33.
Доепп Ф., Шрайбер С.Дж., фон Мюнстер Т., Радемахер Дж., Клингебиль Р., Вальдуэза Дж.М. Как кровь покидает мозг? Систематический ультразвуковой анализ венозного оттока головного мозга. Нейрорадиология. 2004;46:565-570. [PubMed] [Академия Google]
34.
Таноуэ С., Киёсуэ Х., Сагара Ю. и др. Венозные структуры в краниоцервикальном соединении: анатомические вариации, оцененные с помощью мультидетекторной КТ. Бр Дж Радиол. 2010;83:831‐840. [Бесплатная статья PMC] [PubMed] [Google Scholar]
35.
Andeweg J. Анатомия коллатерального венозного оттока от головного мозга и его значение в этиологической интерпретации внутричерепной патологии.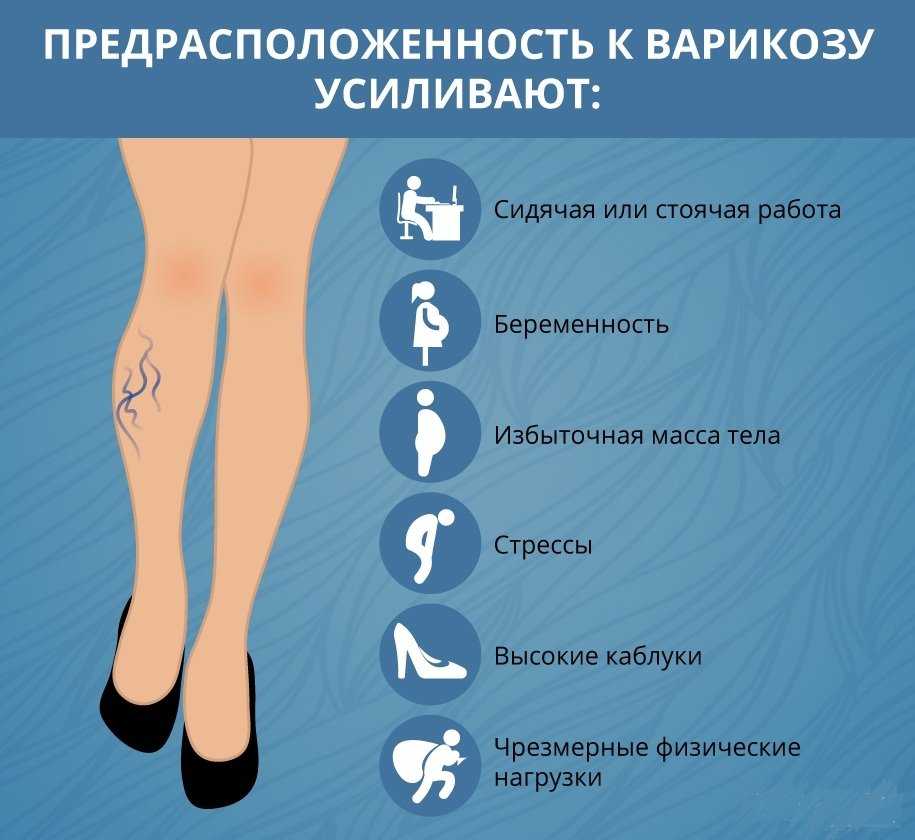 Нейрорадиология. 1996;38:621-628. [PubMed] [Google Scholar]
Нейрорадиология. 1996;38:621-628. [PubMed] [Google Scholar]
36.
Zamboni P, Menegatti E, Weinstock-Guttman B, et al. Гипоперфузия паренхимы головного мозга связана с тяжестью хронической цереброспинальной венозной недостаточности у пациентов с рассеянным склерозом: предварительный отчет о перекрестном срезе. БМС Мед. 2011;9:22. [Бесплатная статья PMC] [PubMed] [Google Scholar]
37.
Гарачи Ф.Г., Марциали С., Мескини А. и соавт. Гемодинамические изменения головного мозга, связанные с хронической цереброспинальной венозной недостаточностью, не являются специфичными для рассеянного склероза и не увеличивают его тяжесть. Радиология. 2012;265:233-239. [PubMed] [Google Scholar]
38.
Zamboni P, Menegatti E, Cittanti C, et al. Фиксация яремного кровотока уменьшает объем желудочка и улучшает перфузию головного мозга. J Vasc Surg Заболевание венозной лимфатической системы. 2016;4:434-445. [PubMed] [Академия Google]
39.
Мияти Т., Масе М., Касаи Х. и соавт. Неинвазивная МРТ-оценка внутричерепной податливости при идиопатической гидроцефалии с нормальным давлением. J Magn Reson Imaging. 2007;26:274-278. [PubMed] [Google Scholar]
J Magn Reson Imaging. 2007;26:274-278. [PubMed] [Google Scholar]
40.
Зивадинов Р., Марр К., Каттер Г. и соавт. Распространенность, чувствительность и специфичность хронической цереброспинальной венозной недостаточности при РС. Неврология. 2011;77:138-144. [PubMed] [Google Scholar]
41.
Беггс КБ. Венозная гемодинамика при неврологических расстройствах: аналитический обзор с гидродинамическим анализом. БМС Мед. 2013;11:142. [Бесплатная статья PMC] [PubMed] [Google Scholar]
42.
Замбони П., Менегатти Э., Бартоломеи И. и др. Внутричерепная венозная гемодинамика при рассеянном склерозе. Курр Нейроваск Рез. 2007;4:252-258. [PubMed] [Google Scholar]
43.
Schaller B, Graf R. Церебральный венозный инфаркт: патофизиологическая концепция. Цереброваскулярная дис. 2004;18:179-188. [PubMed] [Google Scholar]
44.
Поредос П., Езовник М.К. Эндотелиальная дисфункция и венозный тромбоз. Ангиология. 2017;23:e000331971773223
10.1177/0003319717732238. [PubMed] [CrossRef] [Академия Google]
45.
Дзиковска-Дидух О., Доменик-Карлович Дж., Горска Э., Демков Ю., Прущик П., Кострубец М. Е-селектин и sICAM-1, биомаркеры эндотелиальной функции, предсказывают рецидив венозной тромбоэмболии. Рез. Тромб. 2017;157:173-180. [PubMed] [Google Scholar]
46.
Ван С.С., Ли Ч., Чжан С.Дж., Ван Р.М. Исследование механизма образования дуральных артериовенозных фистул, вызванных высоким внутричерепным венозным давлением, на модели кролика. БМС Нейроски. 2014;15:101. [Бесплатная статья PMC] [PubMed] [Google Scholar]
47.
Зивадинов Р., Полони Г.У., Марр К. и соавт. Снижение видимости венозных сосудов головного мозга при венографии с взвешенной по восприимчивости визуализацией у пациентов с рассеянным склерозом связано с хронической цереброспинальной венозной недостаточностью. БМК Нейрол. 2011;11:128. [Бесплатная статья PMC] [PubMed] [Google Scholar]
48.
Zamboni P, Menegatti E, Weinstock-Guttman B, et al. Тяжесть хронической цереброспинальной венозной недостаточности у больных рассеянным склерозом связана с изменением ликвородинамики. Функция Нейрол. 2009 г.;24:133-138. [PubMed] [Google Scholar]
Функция Нейрол. 2009 г.;24:133-138. [PubMed] [Google Scholar]
49.
Зивадинов Р., Магнано С., Галеотти Р. и соавт. Изменения динамики спинномозговой жидкости у пациентов с рассеянным склерозом, получавших чрескожную транслюминальную ангиопластику: исследование случай-контроль. J Vasc Interv Radiol. 2013;24:829-838. [PubMed] [Google Scholar]
50.
Beggs CB, Magnano C, Shepherd SJ и соавт. На пульсацию ликвора в водопроводе у здоровых лиц влияет нарушение мозгового венозного оттока. J Magn Reson Imaging. 2014;40:1215-1222. [PubMed] [Академия Google]
51.
Сюй С., Ван Б., Рен С. и др. Возрастные нарушения структуры и функций сосудов. Старение Дис. 2017;8:590-610. [Бесплатная статья PMC] [PubMed] [Google Scholar]
52.
Magnano C, Belov P, Krawiecki J, Hagemeier J, Beggs C, Zivadinov R. Увеличение площади поперечного сечения внутренней яремной вены связано со старением у здоровых людей. ПЛОС ОДИН. 2016;11:e0149532. [Бесплатная статья PMC] [PubMed] [Google Scholar]
53.
Cleves-Bayon C. Идиопатическая внутричерепная гипертензия у детей и подростков: обновление. Головная боль. 2018;58:485-493. [PubMed] [Google Scholar]
54.
Бедди П., Геохеган Т., Рамеш Н. и др. Вальсальва и гравитационная изменчивость внутренней яремной и общей бедренной вен: ультразвуковая оценка. Евр Дж Радиол. 2006;58:307-309. [PubMed] [Google Scholar]
55.
Лагана М.М., Ди Риенцо М., Риццо Ф. и соавт. Кардиальные, дыхательные и постуральные влияния на венозный возврат внутренних яремных и позвоночных вен. Ультразвук Медицина Биол. 2017;43:1195-1204. [PubMed] [Google Scholar]
56.
Николаидес А.Н., Морович С., Менегатти Э., Визельнер Г., Замбони П. Скрининг хронической цереброспинальной венозной недостаточности (ХЦВН) с помощью ультразвука: рекомендации по протоколу. Функция Нейрол. 2011;26:229-248. [Бесплатная статья PMC] [PubMed] [Google Scholar]
57.
Макдональд С., Айстон Дж. Б. Применение ультразвуковой допплерографии в диагностике хронической цереброспинальной венозной недостаточности.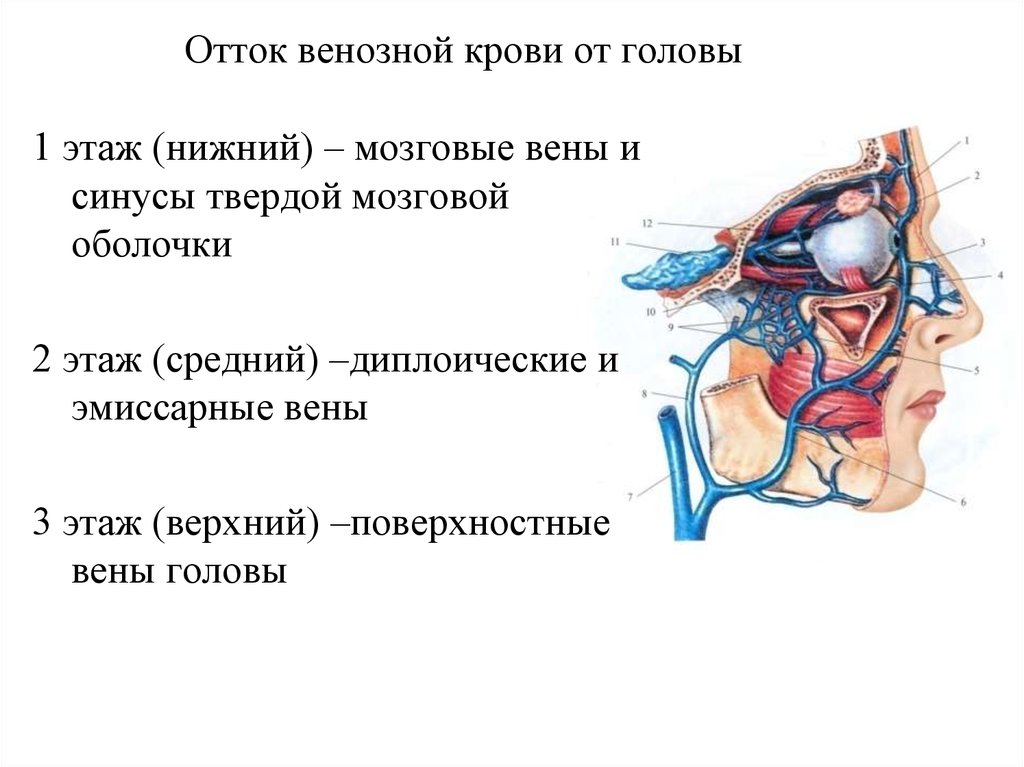 Tech Vasc Interv Radiol. 2012;15:113-120. [PubMed] [Google Scholar]
Tech Vasc Interv Radiol. 2012;15:113-120. [PubMed] [Google Scholar]
58.
Заневски М., Костецкий Дж., Кучмик В. и соавт. Ультразвуковая дуплексная допплерография шеи для оценки хронической цереброспинальной венозной недостаточности у больных рассеянным склерозом. Флебология. 2013;28:24-31. [PubMed] [Академия Google]
59.
Клементс Э., Бонфилд М., Сассано А. Влияние положения тела на разработку ультразвуковых критериев для оценки внутренней яремной вены. УЗИ. 2015;23:85-89. [Бесплатная статья PMC] [PubMed] [Google Scholar]
60.
Брасс П., Хельмих М., Колодзей Л., Шик Г., Смит А.Ф. Ультразвуковой контроль в сравнении с анатомическими ориентирами для катетеризации внутренней яремной вены. Системная версия базы данных Cochrane
2015;1:Cd006962. [Бесплатная статья PMC] [PubMed] [Google Scholar]
61.
Хойнацки Д., Замбони П., Лопес-Сориано А. и соавт. Использование магнитно-резонансной венографии шеи, допплерографии и селективной венографии для диагностики хронической цереброспинальной венозной недостаточности: пилотное исследование у пациентов с рассеянным склерозом и здоровых лиц. Инт Ангиол. 2010;29: 127-139. [PubMed] [Google Scholar]
Инт Ангиол. 2010;29: 127-139. [PubMed] [Google Scholar]
62.
Хааке Э.М., Фенг В., Утриайнен Д. и соавт. У пациентов с рассеянным склерозом со структурными венозными аномалиями на МРТ выявляется аномальное распределение кровотока по внутренним яремным венам. J Vasc Interv Radiol. 2012;23:60‐68. е61-63. [PubMed] [Google Scholar]
63.
Де Вис Дж. Б., Лу Х., Рави Х., Хендрикс Дж., Лю П. Пространственное распределение потока и оксигенации в церебральной венозной дренажной системе. J Magn Reson Imaging. 2018;47:1091-1098. [Бесплатная статья PMC] [PubMed] [Google Scholar]
64.
Паолетти М., Германи Г., Де Икко Р., Астеджиано С., Замбони П., Бастианелло С. Внутричерепная и экстракраниальная МР-венография: технические примечания, клиническое применение и разработка изображений. Поведение Нейрол. 2016;2016:2694504. [Бесплатная статья PMC] [PubMed] [Google Scholar]
65.
Стокварт-Эльсанкари С., Леманн П., Виллетт А. и соавт. Фазово-контрастное МРТ исследование физиологического венозного кровотока головного мозга.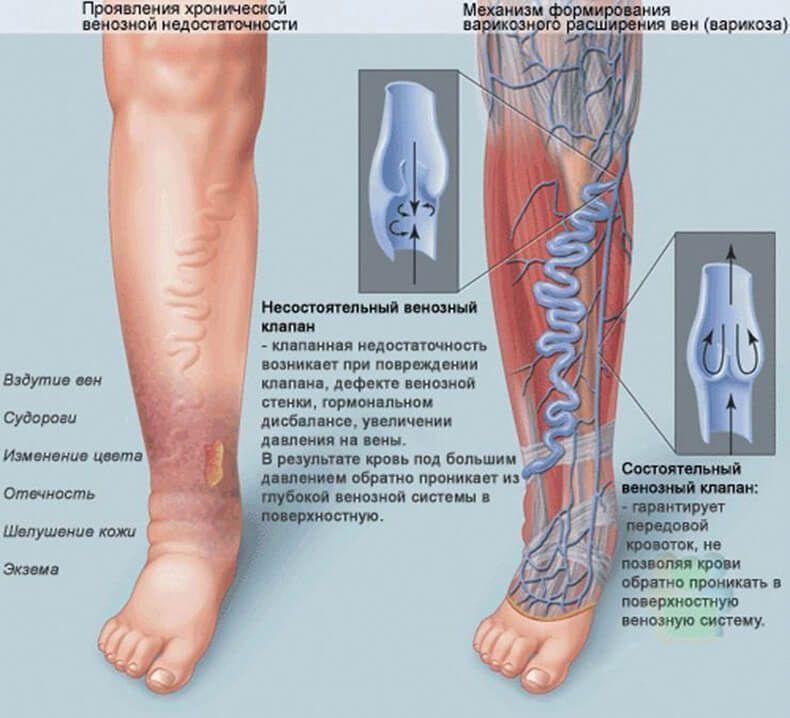 J Cereb Blood Flow Metab. 2009;29:1208-1215. [PubMed] [Академия Google]
J Cereb Blood Flow Metab. 2009;29:1208-1215. [PubMed] [Академия Google]
66.
Macgowan CK, Chan KY, Laughlin S, Marrie RA, Banwell B. Церебральный артериальный и венозный кровоток у подростков с рассеянным склерозом и контрольная группа соответствующего возраста с использованием фазово-контрастной МРТ. J Magn Reson Imaging. 2014;40:341-347. [PubMed] [Google Scholar]
67.
Кефаяти С., Аманс М., Фараджи Ф. и соавт. Проявление вихревого и вторичного кровотока в церебральном венозном оттоке: исследование велосиметрии МР in vivo. Дж. Биомех. 2017;50:180-187. [Бесплатная статья PMC] [PubMed] [Google Scholar]
68.
Сиддики А.Х., Зивадинов Р., Бенедикт Р.Х. и соавт. Проспективное рандомизированное исследование венозной ангиопластики при РС (PREMiSe). Неврология. 2014;83:441-449. [Бесплатная статья PMC] [PubMed] [Google Scholar]
69.
Zamboni P, Menegatti E, Conforti P, Shepherd S, Tessari M, Beggs C. Оценка церебрального венозного возврата с помощью нового метода плетизмографии. J Vasc Surg. 2012;56:e671. [PubMed] [Google Scholar]
J Vasc Surg. 2012;56:e671. [PubMed] [Google Scholar]
70.
Beggs C, Shepherd S, Zamboni P. Сопротивление церебральному венозному оттоку и интерпретация данных шейной плетизмографии в отношении диагностики хронической цереброспинальной венозной недостаточности. Флебология. 2014;29: 191-199. [PubMed] [Google Scholar]
71.
Петров И., Гроздинский Л., Канинский Г., Илиев Н., Илоска М., Радев А. Профиль безопасности эндоваскулярного лечения хронической цереброспинальной венозной недостаточности у больных рассеянным склерозом. J Endovasc Ther. 2011;18:314-323. [PubMed] [Google Scholar]
72.
Веру П., Джаквинта А., Перриконе Д. и соавт. Отток внутренних яремных вен у больных рассеянным склерозом: катетерное флебографическое исследование. J Vasc Interv Radiol. 2013;24:1790-1797. [PubMed] [Академия Google]
73.
Трабулси А.Л., Нокс К.Б., Мачан Л. и др. Распространенность экстракраниального венозного сужения при катетерной венографии у людей с рассеянным склерозом, их братьев и сестер и неродственного здорового контроля: слепое исследование случай-контроль.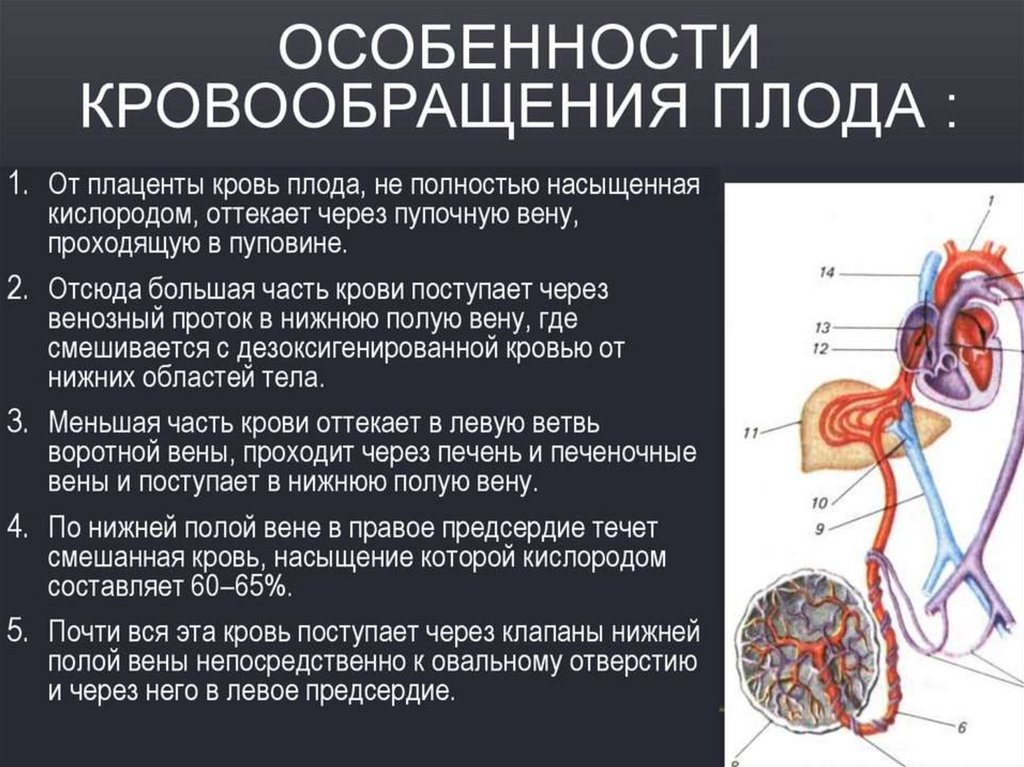 Ланцет. 2014; 383:138-145. [PubMed] [Google Scholar]
Ланцет. 2014; 383:138-145. [PubMed] [Google Scholar]
74.
Ян К., Дуань Дж., Фан З. и др. Раннее выявление и количественная оценка церебрального венозного тромбоза с помощью магнитно-резонансной томографии тромбов черной крови. Гладить. 2016;47:404-409. [Бесплатная статья PMC] [PubMed] [Google Scholar]
75.
Фард М.А., Фахри С., Абди П., Хассанпур Н., Субраманиан П.С. Количественная оценка перипапиллярного общего объема сетчатки при псевдопапилледеме и легком отеке диска зрительного нерва с использованием спектральной оптической когерентной томографии. Am J Офтальмол. 2014;158:136-143. [PubMed] [Google Scholar]
76.
Ли Б.Б., Берган Дж., Гловицки П. и соавт. Диагностика и лечение венозных мальформаций. Консенсусный документ Международного союза флебологов (IUP)-2009. Инт Ангиол. 2009;28:434-451. [PubMed] [Академия Google]
77.
Редаэлли де Зинис Л.О., Гаспаротти Р., Камповекки К., Аннибале Г., Бареццани М.Г. Тромбоз внутренней яремной вены, ассоциированный с острым мастоидитом в детском возрасте.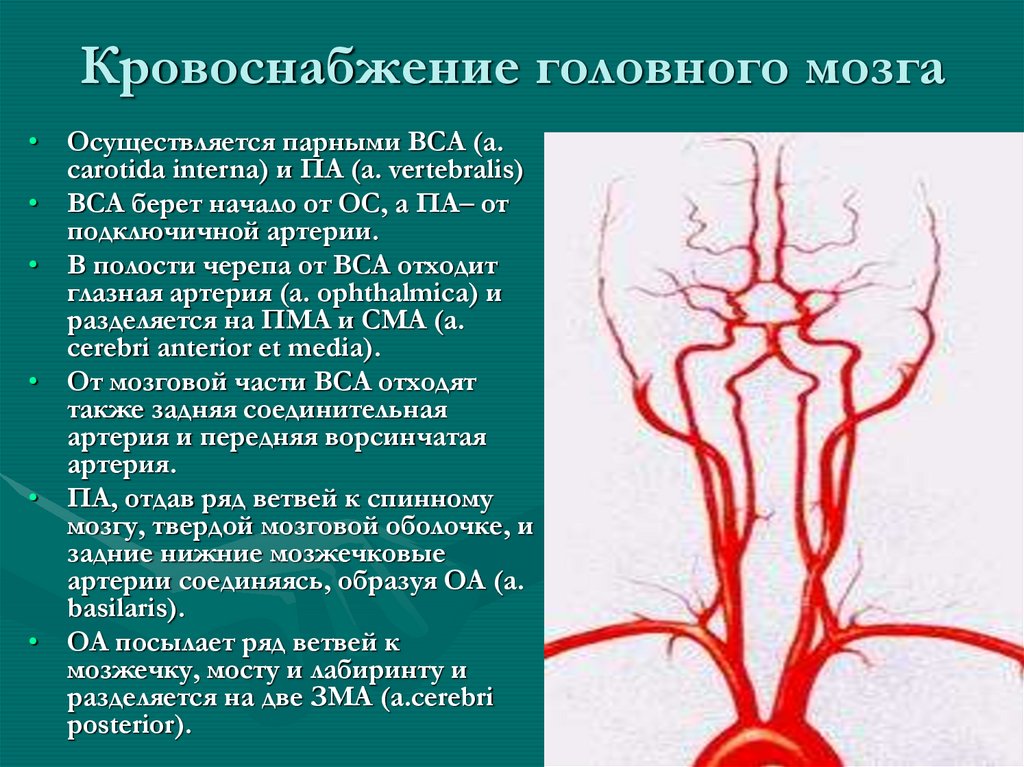 Отол Нейротол. 2006;27:937-944. [PubMed] [Google Scholar]
Отол Нейротол. 2006;27:937-944. [PubMed] [Google Scholar]
78.
Габек М., Петравич Д., Озретич Д., Бринар В.В. Синдром Горнера вследствие тромбоза яремной вены (синдром Лемьера). BMJ Case Rep. 2009; 2009: bcr2007124479. [Бесплатная статья PMC] [PubMed] [Google Scholar]
79.
Ферро Дж. М., Буссер М. Г., Канхао П. и соавт. Руководство Европейской организации по борьбе с инсультом по диагностике и лечению церебрального венозного тромбоза, одобренное Европейской академией неврологии. Евр Дж Нейрол. 2017;24:1203-1213. [PubMed] [Академия Google]
80.
Лупаттелли Т., Беллагамба Г., Риги Э. и соавт. Целесообразность и безопасность эндоваскулярного лечения хронической цереброспинальной венозной недостаточности у больных рассеянным склерозом. J Vasc Surg. 2013;58:1609-1618. [PubMed] [Google Scholar]
81.
Scalise F, Novelli E, Farina M, Barbato L, Spagnolo S. Изменение степени тяжести венозной гемодинамической недостаточности после эндоваскулярного лечения хронической цереброспинальной венозной недостаточности.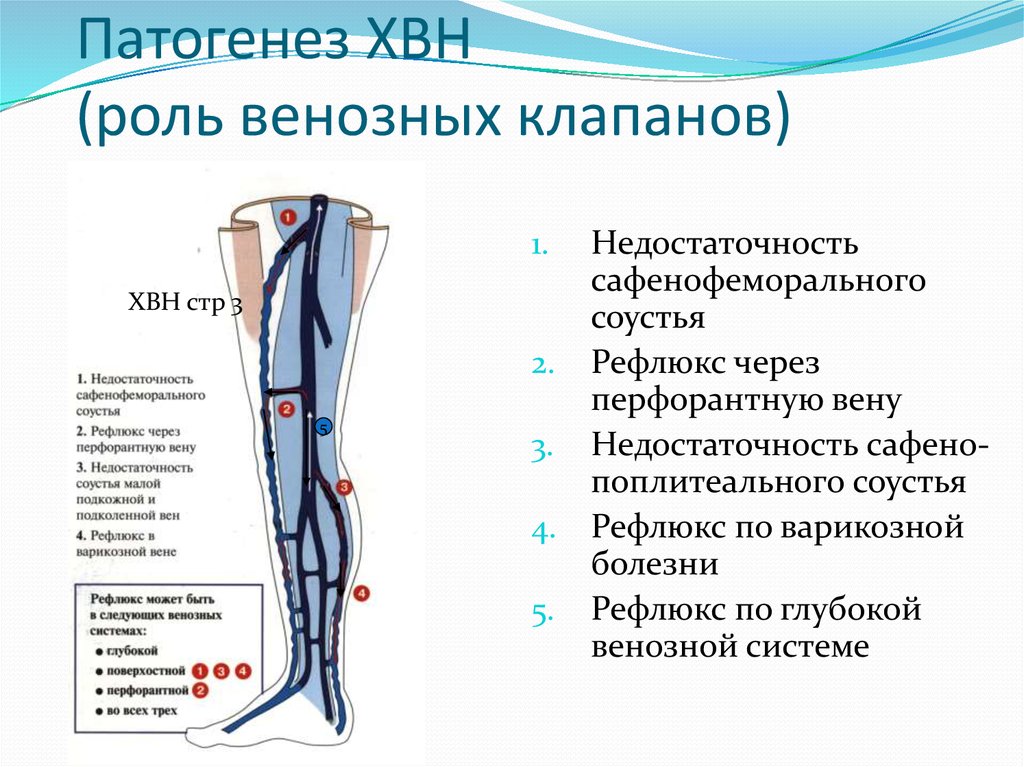 Флебология. 2015;30:250-256. [PubMed] [Академия Google]
Флебология. 2015;30:250-256. [PubMed] [Академия Google]
82.
Замбони П., Тисато В., Менегатти Э. и соавт. Ультраструктура дефектных клапанов внутренней яремной вены. Флебология. 2015;30:644-647. [Бесплатная статья PMC] [PubMed] [Google Scholar]
83.
Замбони П., Тесио Л., Галимберти С. и соавт. Эффективность и безопасность ангиопластики экстракраниальных вен при рассеянном склерозе: рандомизированное клиническое исследование. ДЖАМА Нейрол. 2018;75:35-43. [Бесплатная статья PMC] [PubMed] [Google Scholar]
84.
Джаяраман М.В., Боксерман Дж.Л., Дэвис Л.М., Хаас Р.А., Рогг Дж.М. Частота случаев внешней компрессии внутренней яремной вены у неотобранных пациентов, перенесших КТ-ангиографию. AJNR Am J Нейрорадиол. 2012;33:1247-1250. [Бесплатная статья PMC] [PubMed] [Google Scholar]
85.
Anzeljc AJ, Frias P, Hayek BR, Canter Weiner N, Wojno TH, Kim HJ. 15-летний обзор вторичной и третичной фенестрации оболочки зрительного нерва при идиопатической внутричерепной гипертензии.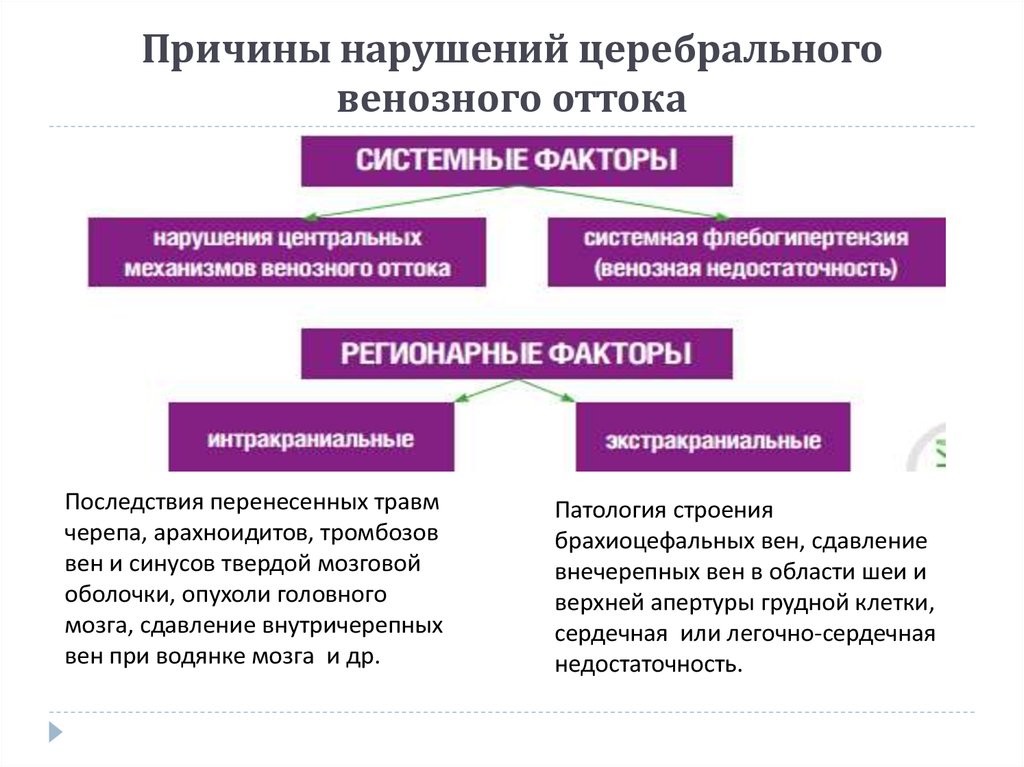 Орбита. 2018;1-7. 10.1080/01676830.2017.1423337. [PubMed] [CrossRef] [Google Scholar]
Орбита. 2018;1-7. 10.1080/01676830.2017.1423337. [PubMed] [CrossRef] [Google Scholar]
86.
Бруно А., Наполитано М., Калифано Л. и соавт. Распространенность хронической цереброспинальной венозной недостаточности при болезни Меньера: 24-месячное наблюдение после ангиопластики. J Vasc Interv Radiol. 2017;28:388-391. [PubMed] [Академия Google]
87.
Хань К., Чао А.С., Чанг Ф.К. и др. Обструкция венозного оттока связана с преходящей глобальной амнезией. ПЛОС ОДИН. 2015;10:e0132893. [Бесплатная статья PMC] [PubMed] [Google Scholar]
88.
Кан И, Ким Э, Ким Дж. Х. и др. Времяпролетная МР-ангиография ставит под сомнение связь между транзиторной глобальной амнезией и внутричерепным яремным венозным рефлюксом. Евро Радиол. 2015;25:703-709. [PubMed] [Google Scholar]
89.
Chung CP, Hsu HY, Chao AC, Cheng CY, Lin SJ, Hu HH. Яремный венозный рефлюкс влияет на глазную венозную систему при транзиторной монокулярной слепоте. Цереброваскулярная дис. 2010;29: 122-129. [PubMed] [Google Scholar]
90.
Cheng CY, Chang FC, Chao AC, Chung CP, Hu HH. Аномалии внутренних яремных вен при транзиторной монокулярной слепоте. БМК Нейрол. 2013;13:94. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Врожденные пороки сердца. Факты о легочной атрезии
Нажмите здесь, чтобы увеличить изображение
Нажмите здесь, чтобы увеличить изображение ПУЛЛ-мун-эйри а-ТРИ-ша) сердца, где вообще не формируется клапан, контролирующий ток крови от сердца к легким. У младенцев с этим дефектом кровь плохо течет к легким, чтобы забрать кислород для тела.
Что такое легочная атрезия?
Щелкните здесь, чтобы увеличить изображение
Легочная атрезия — это врожденный дефект клапана легочной артерии, который регулирует поток крови из правого желудочка (нижняя правая камера сердца) в главную легочную артерию (кровеносную артерию). сосуд, несущий кровь от сердца к легким). Легочная атрезия — это когда этот клапан вообще не сформировался, и кровь не может идти из правого желудочка сердца в легкие. Поскольку ребенку с легочной атрезией вскоре после рождения может потребоваться хирургическое вмешательство или другие процедуры, этот врожденный порок считается критическим врожденным пороком сердца (критическим врожденным пороком сердца). Врожденный означает присутствующий при рождении.
Поскольку ребенку с легочной атрезией вскоре после рождения может потребоваться хирургическое вмешательство или другие процедуры, этот врожденный порок считается критическим врожденным пороком сердца (критическим врожденным пороком сердца). Врожденный означает присутствующий при рождении.
У ребенка без врожденного порока сердца правая сторона сердца перекачивает бедную кислородом кровь от сердца к легким через легочную артерию. Кровь, возвращающаяся из легких, богата кислородом, и ее можно перекачивать в остальные части тела. У младенцев с легочной атрезией клапан легочной артерии, обычно контролирующий ток крови через легочную артерию, не сформирован, поэтому кровь не может попасть прямо из правого желудочка в легкие.
При легочной атрезии, поскольку кровь не может напрямую течь из правого желудочка сердца в легочную артерию, кровь должна использовать другие пути в обход несформировавшегося клапана легочной артерии. Овальное отверстие, естественное отверстие между правой и левой верхними камерами сердца во время беременности, которое обычно закрывается после рождения ребенка, часто остается открытым, чтобы обеспечить приток крови к легким.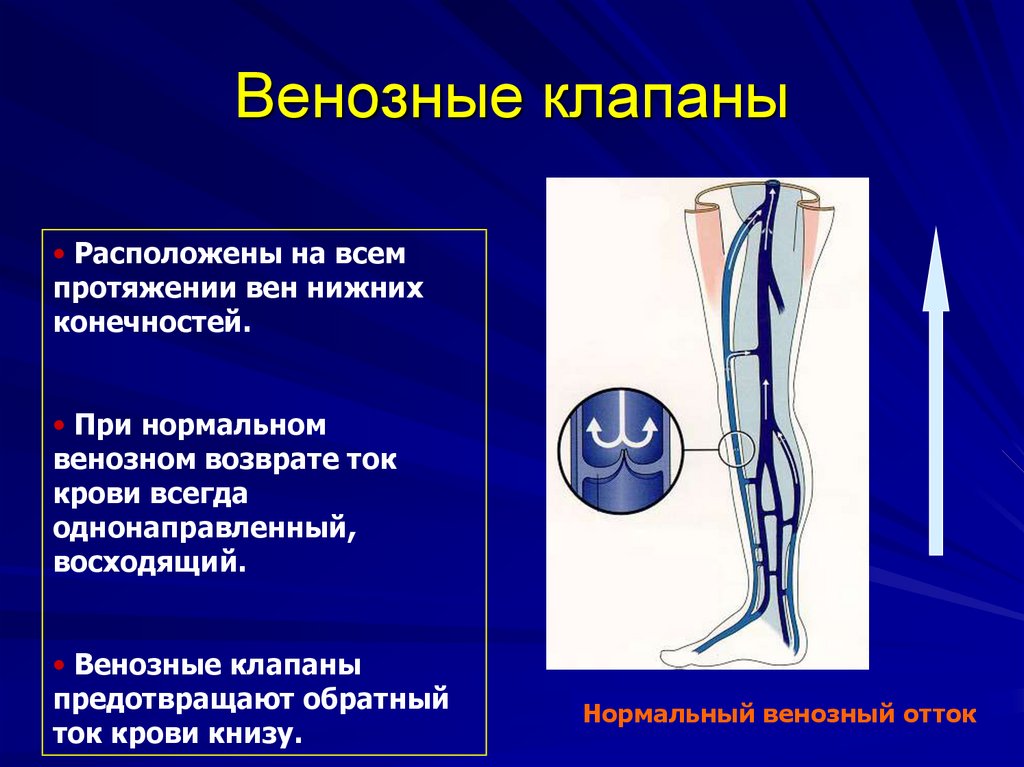 Кроме того, врачи могут дать ребенку лекарство, чтобы сохранить его открытый артериальный проток открывается после рождения ребенка. Открытый артериальный проток — это кровеносный сосуд, который позволяет крови перемещаться по легким ребенка до его рождения, и он также обычно закрывается после рождения.
Кроме того, врачи могут дать ребенку лекарство, чтобы сохранить его открытый артериальный проток открывается после рождения ребенка. Открытый артериальный проток — это кровеносный сосуд, который позволяет крови перемещаться по легким ребенка до его рождения, и он также обычно закрывается после рождения.
Узнайте больше о том, как работает сердце »
Типы легочной атрезии
Обычно различают два типа легочной атрезии в зависимости от наличия у ребенка дефекта межжелудочковой перегородки (отверстия в стенке, разделяющей два нижние камеры или желудочки сердца):
- Легочная атрезия с интактной межжелудочковой перегородкой: При этой форме легочной атрезии стенка или перегородка между желудочками остается цельной и интактной. Во время беременности, когда сердце развивается, очень мало крови поступает в правый желудочек (ПЖ) или из него, и поэтому ПЖ развивается не полностью и остается очень маленьким. Если ПЖ недоразвит, у сердца могут возникнуть проблемы с перекачкой крови в легкие и тело.
 Артерия, обычно несущая кровь из правого желудочка, главная легочная артерия (МЛА), остается очень маленькой, так как легочный клапан (ЛВ) не формируется.
Артерия, обычно несущая кровь из правого желудочка, главная легочная артерия (МЛА), остается очень маленькой, так как легочный клапан (ЛВ) не формируется. - Легочная атрезия с дефектом межжелудочковой перегородки: При этой форме легочной атрезии дефект межжелудочковой перегородки (ДМЖП) позволяет крови попадать в правый желудочек (ПЖ) и выходить из него. Таким образом, кровь, поступающая в правый желудочек, может способствовать развитию желудочка во время беременности, поэтому он, как правило, не такой маленький, как при легочной атрезии с интактной межжелудочковой перегородкой. Легочная атрезия при ДМЖП похожа на другое состояние, называемое тетрадой Фалло. Однако при тетраде Фалло клапан легочной артерии (ЛВ) все же формируется, хотя он небольшого размера и кровь через него плохо течет — это называется стенозом клапана легочной артерии. Таким образом, легочная атрезия при ДМЖП является как бы очень тяжелой формой тетрады Фалло.
Возникновение
Исследование, проведенное в 2019 году с использованием данных систем наблюдения за врожденными дефектами в Соединенных Штатах за 2010–2014 годы, показало, что каждый год около 550 детей в Соединенных Штатах рождаются с легочной атрезией. Другими словами, примерно 1 из каждых 7100 детей, рождающихся в Соединенных Штатах каждый год, рождается с легочной атрезией. 1
Другими словами, примерно 1 из каждых 7100 детей, рождающихся в Соединенных Штатах каждый год, рождается с легочной атрезией. 1
Причины и факторы риска
Причины пороков сердца, таких как легочная атрезия, у большинства детей неизвестны. У некоторых детей пороки сердца возникают из-за изменений в их генов или хромосом . Также считается, что пороки сердца вызываются комбинацией генов и других факторов, таких как вещи, с которыми мать контактирует в окружающей среде, или то, что мать ест или пьет, или определенные лекарства, которые она принимает.
Подробнее о работе CDC по причинам и факторам риска »
Диагностика
Легочная атрезия может быть диагностирована во время беременности или вскоре после рождения ребенка.
Во время беременности
Во время беременности проводятся скрининговые тесты (также называемые пренатальными тестами) для выявления врожденных дефектов и других заболеваний. Легочную атрезию можно увидеть во время УЗИ (которое создает изображения тела). Некоторые результаты УЗИ могут натолкнуть врача на подозрение, что у ребенка может быть атрезия легких. Если это так, поставщик медицинских услуг может запросить плод эхокардиограмма для подтверждения диагноза. Эхокардиограмма плода — это ультразвуковое исследование сердца и основных кровеносных сосудов ребенка, которое проводится во время беременности. Этот тест может показать проблемы со структурой сердца и то, насколько хорошо оно работает.
Некоторые результаты УЗИ могут натолкнуть врача на подозрение, что у ребенка может быть атрезия легких. Если это так, поставщик медицинских услуг может запросить плод эхокардиограмма для подтверждения диагноза. Эхокардиограмма плода — это ультразвуковое исследование сердца и основных кровеносных сосудов ребенка, которое проводится во время беременности. Этот тест может показать проблемы со структурой сердца и то, насколько хорошо оно работает.
После рождения ребенка
У детей, рожденных с легочной атрезией, симптомы проявляются при рождении или вскоре после него. У них может быть синеватый цвет кожи, называемый цианозом, потому что их кровь не переносит достаточно кислорода. У младенцев с легочной атрезией могут быть дополнительные симптомы, такие как:
- Проблемы с дыханием
- Пепельный или синеватый цвет кожи
- Плохое питание
- Экстремальная сонливость
Во время медицинского осмотра врач может увидеть такие симптомы, как синюшность кожи или проблемы с дыханием.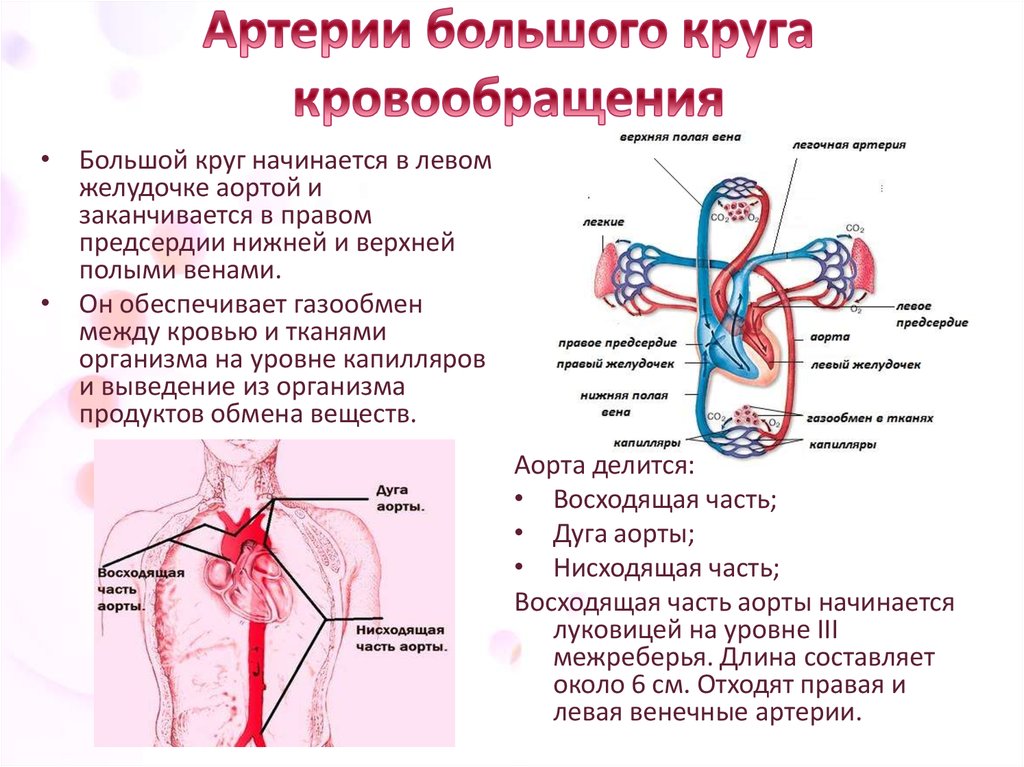 С помощью стетоскопа врач проверит шумы в сердце (аномальный «свистящий» звук, вызванный нарушением тока крови). Однако нередко шумы в сердце отсутствуют сразу при рождении.
С помощью стетоскопа врач проверит шумы в сердце (аномальный «свистящий» звук, вызванный нарушением тока крови). Однако нередко шумы в сердце отсутствуют сразу при рождении.
Если врач подозревает наличие проблемы, он может запросить один или несколько тестов для подтверждения диагноза легочной атрезии. Самый распространенный тест — эхокардиограмма . Этот тест представляет собой УЗИ сердца ребенка, которое может показать проблемы со структурой сердца, такие как отверстия в стенках между камерами и любой нерегулярный кровоток. Катетеризация сердца (введение тонкой трубки в кровеносный сосуд и направление ее к сердцу) также может подтвердить диагноз путем осмотра внутренней части сердца и измерения артериального давления и уровня кислорода. Электрокардиограмма (ЭКГ), которая измеряет электрическую активность сердца, и другие медицинские тесты также могут использоваться для постановки диагноза.
Легочная атрезия — это критический врожденный порок сердца (критическая ИБС), который может быть обнаружен при скрининге новорожденных с использованием пульсоксиметрии (также известной как пульсоксиметрия). Пульсоксиметрия — это простой прикроватный тест для оценки количества кислорода в крови ребенка. Низкий уровень кислорода в крови может быть признаком критической ИБС. Скрининг новорожденных с использованием пульсоксиметрии может выявить некоторых младенцев с критической ИБС, такой как легочная атрезия, до того, как у них появятся какие-либо симптомы.
Пульсоксиметрия — это простой прикроватный тест для оценки количества кислорода в крови ребенка. Низкий уровень кислорода в крови может быть признаком критической ИБС. Скрининг новорожденных с использованием пульсоксиметрии может выявить некоторых младенцев с критической ИБС, такой как легочная атрезия, до того, как у них появятся какие-либо симптомы.
Лечение
Большинству детей с легочной атрезией требуется медикаментозное лечение, чтобы держать артериальный проток открытым после рождения. Если этот кровеносный сосуд останется открытым, это поможет притоку крови к легким до тех пор, пока не будет восстановлен клапан легочной артерии.
Лечение атрезии легких зависит от ее тяжести.
- В некоторых случаях кровоток можно улучшить с помощью катетеризации сердца (введение тонкой трубки в кровеносный сосуд и направление ее к сердцу). Во время этой процедуры врачи могут расширить клапан с помощью баллона или установить стент (небольшую трубку), чтобы держать артериальный проток открытым.

- В большинстве случаев легочной атрезии ребенку может потребоваться операция вскоре после рождения. Во время операции врачи расширяют или заменяют легочный клапан и расширяют проход к легочной артерии. Если у ребенка есть дефект межжелудочковой перегородки, врач также поместит заплату на дефект межжелудочковой перегородки, чтобы закрыть отверстие между двумя нижними камерами сердца. Эти действия улучшат приток крови к легким и остальным частям тела. Если у ребенка с легочной атрезией недоразвит правый желудочек, ему или ей могут потребоваться поэтапные хирургические процедуры, аналогичные хирургическим вмешательствам при синдроме гипоплазии левых отделов сердца.
Большинству детей с легочной атрезией необходимы регулярные последующие визиты к кардиологу (кардиологу), чтобы следить за их прогрессом и проверять наличие других заболеваний, которые могут развиться по мере взросления. Во взрослом возрасте им может потребоваться больше операций или медицинской помощи для решения других возможных проблем.
Ссылки
- Кара Т. Май, Дженнифер Л. Изенбург, Марк А. Кэнфилд, Роберт Э. Мейер, Адольфо Корреа, Клинтон Дж. Алверсон, Филип Дж. Лупо, Тиффани Риле-Коларуссо, Сук Джа Чо, Дипа Аггарвал , Рассел С. Кирби. Национальные популяционные оценки основных врожденных дефектов, 2010–2014 гг. БДР окт 2019.
Изображения находятся в общественном достоянии и поэтому не подпадают под какие-либо ограничения авторского права. Из вежливости мы просим, чтобы поставщик контента (Центры по контролю и профилактике заболеваний, Национальный центр врожденных дефектов и нарушений развития) был указан и уведомлен о любом публичном или частном использовании этого изображения.
Изображения находятся в общественном достоянии и поэтому не подпадают под какие-либо ограничения авторского права. Из вежливости мы просим, чтобы поставщик контента (Центры по контролю и профилактике заболеваний, Национальный центр врожденных дефектов и нарушений развития) был указан и уведомлен о любом публичном или частном использовании этого изображения.