Транзиторное повышение температуры: симптомы, причины, диагностика и лечение транзиторной гипертермии
Лихорадка | Дидковский Н.А., Танасова А.Н.
Лихорадка – повышение температуры тела в результате неспецифической защитно–приспособительной реакции организма, характеризующейся перестройкой процессов терморегуляции и возникающей в ответ на воздействие патогенных раздражителей. Различают лихорадку инфекционно–воспалительной природы (вирусы, бактерии, внутриклеточные паразиты) и неинфекционного генеза (аутоиммунные процессы, аллергические заболевания, опухоли, нарушение процессов обмена веществ, применение некоторых препаратов и др.) [2]. Регуляция температуры тела осуществляется при сложном взаимодействии нервной, эндокринной и иммунной систем. Наиболее часто пусковым звеном в развитии гипертермии являются экзогенные пирогены (бактерии, вирусы, токсины и т.д), которые при попадании в организм стимулируют выработку клетками крови эндогенных пирогенов [4].
Рис.1. Механизм развития лихорадки под действием экзогенных и эндогенных пирогенов. ACTH- АКТГ, CRF — кортикотропин-релизинг фактор, PGE2 — простагландин Е2 (CECIL Textbook of Medicine , 19 h edition).
ACTH- АКТГ, CRF — кортикотропин-релизинг фактор, PGE2 — простагландин Е2 (CECIL Textbook of Medicine , 19 h edition).
В настоящее время известно 11 цитокинов, обладающих пирогенной активностью, наиболее важными из которых являются интерлейкины – ИЛ–1 и ИЛ–6, а также фактор некроза опухоли – ФНО–a [4]. Эндогенные пирогены продуцируются стимулированными моноцитами и макрофагами. Свойствами пирогенов обладают также a–, b– и g–интерфероны. ИЛ–1 и ФНО–a транспортируются с током крови к клеткам–мишеням, несущим специфические рецепторы к этим цитокинам, и воздействуют на термочувствительные нейроны преоптической области гипоталамуса через усиление синтеза простагландина (ПГ) Е2 и ПГF2a из арахидоновой кислоты.
Рис. 2. Метаболизм арахидоновой кислоты (по А.А. Ярилину) [3]. Использованы международные сокращенные обозначения простагландинов (PG), лейкотриенов (LT) и тромбоксанов (Tx).
Точный механизм «переключения» центра терморегуляции под действием ПГ до настоящего времени не установлен. Не исключается непосредственное влияние цитокинов на нервную ткань. Повышение температуры тела активирует обменные процессы, функции нервной, эндокринной, иммунной системы (увеличение выработки антител, интерферона, повышение хемотаксиса, фагоцитарной и бактерицидной активности нейтрофилов), повышается антитоксическая функция печени, увеличивается почечный кровоток. ИЛ–1 и ФНО–a способны усиливать иммунный ответ за счет активации Т–клеток и стимуляции выработки ИЛ–2. Под действием ИЛ–1 усиливается пролиферация В–клеток, что сопровождается увеличением антителообразования. Важно отметить, что наиболее интенсивно эти процессы протекают при температуре 39°С. Под действием эндогенных пирогенов стимулируется синтез печенью белков «острой фазы» (фибриноген, С–реактивный белок, фракции комплемента В, С 3–4, альфа–гликопротеин, сывороточный амилоид А, ингибиторы протеиназ), играющих важную роль в специфической и неспецифической защите. Гипертермия сопровождается снижением в сыворотке крови уровня железа, цинка и меди, что тормозит рост и размножение микроорганизмов.
Гипертермия сопровождается снижением в сыворотке крови уровня железа, цинка и меди, что тормозит рост и размножение микроорганизмов.
При типичном течении лихорадка проходит следующие фазы или периоды – продромальный период, период подъема температуры, период относительной стабильности, период снижения температуры тела, каждый из которых сопровождается определенными вегетативными реакциями. Какие изменения сопутствуют развитию лихорадки?
1) Тахикардия. При повышении температуры тела на 1°С происходит учащение ЧСС на 10–15 ударов в минуту.
2) Возможно развитие экстрасистолии, что обусловлено как непосредственным токсическим действием бактерий и вирусов, так и активацией симпато–адреналовой системы под влиянием цитокинов.
3) В фазе подъема температуры возможно повышение артериального давления, а в фазе снижения температуры – падение АД до коллаптоидного состояния на фоне снижения ОПС.
4) При достижении максимальной температуры тела значительно возрастает процесс потоотделения (возможно отделение до 1 литра пота за сутки), что может способствовать снижению ОЦК и приводить к ухудшению состояния больных с патологией сердечно–сосудистой системы. Потери жидкости усиливаются также за счет компенсаторного возрастания частоты дыхания на высоте лихорадки.
Потери жидкости усиливаются также за счет компенсаторного возрастания частоты дыхания на высоте лихорадки.
5) На высоте лихорадки и даже после нормализации температуры возможно транзиторное появление в моче белка, цилиндров и повышения уровня креатинина. Эти изменения связывают с непосредственным повреждающим действием лихорадки.
6) Лихорадка влияет на деятельность различных отделов ЖКТ, что проявляется нарушением секреции пищеварительных соков, нарушением моторики и процессов всасывания. Вследствие этого возможно снижение аппетита, развитие синдрома нарушенного всасывания и запоров (последнее особенно неблагоприятно сказывается на больных пожилого возраста). Потеря аппетита при лихорадке связана как с функциональными нарушениями деятельности ЖКТ, так и с непосредственным влиянием цитокинов. Так, при длительном воздействии высоких концентраций ФНО–a (имеющего в западной литературе второе название – «кахектин») и частично ИЛ–1 возможно развитие истощения в связи с подавлением чувства голода/аппетита (что наиболее характерно для хронических инфекций и онкологических процессов).
7) На фоне лихорадки резко усиливаются обменные процессы в клетках (при повышении температуры тела на 0,6°С уровень базального обмена возрастает приблизительно на 10%), ускоряются окислительно–восстановительные процессы, растет потребление кислорода. Гипертермия может способствовать повышению уровня глюкозы в крови, повышается катаболизм белка (отрицательный азотный баланс). Возможна потеря белка до 300–400 грамм за сутки. Снижение диуреза на фоне сниженного ОЦК может приводить к развитию метаболического ацидоза.
8) Изменение сознания (от незначительного до развития делириозного состояния) связывают с высвобождением b–эндорфинов под влиянием ФНО–a и ИЛ–1. В группу риска входят дети младшего возраста, пожилые, больные с патологией сердечно–сосудистой системы, а также лица, злоупотребляющие алкоголем.
9) В связи с незрелостью ЦНС и несовершенством системы терморегуляции у детей в возрасте до 5 лет возможно развитие фебрильных судорог.
10) Повышение температуры тела может приводить к активации латентной герпесвирусной инфекции (ВПГ–1). По неясным до конца причинам наиболее часто герпетические высыпания сопровождают заболевания, вызванные пиогенной бактериальной инфекцией (пневмококки, стрептококки, менингококки), малярию, риккетсиозы. Назолабиальный герпес является маркером снижения клеточного иммунитета. Важно отметить, что субъективные ощущения при лихорадке носят различный характер. Некоторые пациенты чувствительны даже к небольшим колебаниям температуры тела, в то время как другие не испытывают дискомфорта при значительном ее повышении (например, при туберкулезе легких). Однако в большинстве случаев больные жалуются на наличие слабости и недомогания, головной боли, болей в мышцах и суставах, познабливание или повышенную потливость, что «подталкивает» врача к назначению жаропонижающих средств. При решении вопроса о необходимости назначения нестероидных противовоспалительных препаратов (НПВП) необходимо учитывать как положительные, так и потенциально опасные проявления лихорадки. Необходимо помнить, лихорадка, как и всякая защитно–приспособительная реакция, при истощении компенсаторных механизмов или при гиперэргическом варианте может стать причиной развития патологических состояний.
По неясным до конца причинам наиболее часто герпетические высыпания сопровождают заболевания, вызванные пиогенной бактериальной инфекцией (пневмококки, стрептококки, менингококки), малярию, риккетсиозы. Назолабиальный герпес является маркером снижения клеточного иммунитета. Важно отметить, что субъективные ощущения при лихорадке носят различный характер. Некоторые пациенты чувствительны даже к небольшим колебаниям температуры тела, в то время как другие не испытывают дискомфорта при значительном ее повышении (например, при туберкулезе легких). Однако в большинстве случаев больные жалуются на наличие слабости и недомогания, головной боли, болей в мышцах и суставах, познабливание или повышенную потливость, что «подталкивает» врача к назначению жаропонижающих средств. При решении вопроса о необходимости назначения нестероидных противовоспалительных препаратов (НПВП) необходимо учитывать как положительные, так и потенциально опасные проявления лихорадки. Необходимо помнить, лихорадка, как и всякая защитно–приспособительная реакция, при истощении компенсаторных механизмов или при гиперэргическом варианте может стать причиной развития патологических состояний.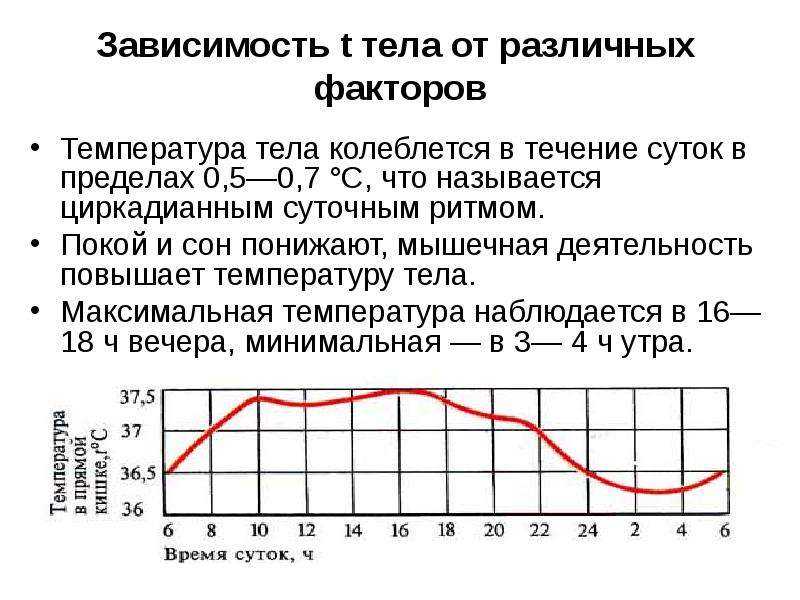 Так, чрезмерное повышение температуры приводит к торможению иммунных реакций, нарушению функции паренхиматозных органов, развитию фебрильных судорог, функциональным и дистрофическим нарушениям в сердечно–сосудистой и ЦНС. Критическое снижение температуры тела может способствовать развитию коллапса за счет резкого падения общего периферического сопротивления и утяжелять состояние больных с патологией сердечно–сосудистой системы.
Так, чрезмерное повышение температуры приводит к торможению иммунных реакций, нарушению функции паренхиматозных органов, развитию фебрильных судорог, функциональным и дистрофическим нарушениям в сердечно–сосудистой и ЦНС. Критическое снижение температуры тела может способствовать развитию коллапса за счет резкого падения общего периферического сопротивления и утяжелять состояние больных с патологией сердечно–сосудистой системы.
Так в каком же случае необходимо применение жаропонижающих средств?
Повышение температуры тела в пределах 3°С не оказывает повреждающего действия на организм человека, однако ее повышение более чем на 6°С (т.е. более 42,2°С) приводит к необратимым изменениям в структурах головного мозга, что является состоянием, несовместимым с жизнью. При решении вопроса о необходимости назначения НПВП необходимо учитывать возраст больного, тяжесть основного и сопутствующих заболеваний, а также субъективную переносимость лихорадки.
В настоящее время НПВП широко используются в симптоматическом лечении лихорадки при ОРВИ. Однако мало внимания отводится немедикаментозным (физическим) методам снижения температуры тела, что особенно важно в педиатрической практике. Хочется напомнить, что физические методы снижения температуры (такие как обтирание тела слабым раствором уксуса, прикладывания холода на область крупных артерий, влажное обертывание, теплая (не холодная!) ванна, клизма с водой комнатной температуры) рекомендуются не только в отечественной, но и в современной зарубежной литературе, могут быть достаточно эффективными и не имеют побочных эффектов. Необходимо помнить о таких правилах ухода за больными с лихорадкой, как адекватный питьевой режим, щадящая диета, обязательное проветривание помещения, запрещение «укутывать» больного, так как последнее препятствует теплоотдаче.
Однако мало внимания отводится немедикаментозным (физическим) методам снижения температуры тела, что особенно важно в педиатрической практике. Хочется напомнить, что физические методы снижения температуры (такие как обтирание тела слабым раствором уксуса, прикладывания холода на область крупных артерий, влажное обертывание, теплая (не холодная!) ванна, клизма с водой комнатной температуры) рекомендуются не только в отечественной, но и в современной зарубежной литературе, могут быть достаточно эффективными и не имеют побочных эффектов. Необходимо помнить о таких правилах ухода за больными с лихорадкой, как адекватный питьевой режим, щадящая диета, обязательное проветривание помещения, запрещение «укутывать» больного, так как последнее препятствует теплоотдаче.
При лихорадочных состояниях на фоне инфекционно–воспалительных заболеваний в качестве жаропонижающего, противовоспалительного и болеутоляющнго средства используются ректальные свечи Цефекон Н. Суппозитории Цефекон Н представлябт собой уникальную комбинацию напроксена, кофеина и салициламида, благодаря чему обеспечивается высокая жаропонижающая, анальгетическая активность. Цефекон Н имеет ряд преимуществ перед пероральными НПВП.
Цефекон Н имеет ряд преимуществ перед пероральными НПВП.
Прежде чем попасть в системный кровоток, лекарственные вещества должны пройти желудок, тонкий кишечник, печень, в которой они в определенной (иногда значительной) степени разрушаются и адсорбируются, что может привести к повреждению этого органа. Даже в случае приема натощак лекарства попадают в большой круг кровообращения в среднем не раньше чем через 30 мин. При пероральном приеме лекарств в виде порошков и особенно таблеток имеется наибольшая вероятность их местного раздражающего действия на слизистую оболочку желудка.
При ректальном пути введения поступление адсорбированных в прямой кишке веществ осуществляется одновременно через кровеносную и лимфатическую системы, имеющие в этой области особенное развитие. При этом незначительная часть адсорбированных препаратов поступает в воротную вену, несущую кровь от внутренних органов к печени. Более того, биодоступность со слизистой прямой кишки для ряда лекарственных средств приравнивается к таковой после внутривенного введения. Таким образом, введение НПВП в суппозиториях позволяет уменьшить риск побочных эффектов со стороны ЖКТ и гарантировать поступление полной дозы лекарства вне зависимости от приема пищи и сопутствующей терапии (например, антацидами). В связи с этим использование НПВП в виде ректальных суппозиториев (Цефекон Н) представляется весьма перспективным направлением.
Таким образом, введение НПВП в суппозиториях позволяет уменьшить риск побочных эффектов со стороны ЖКТ и гарантировать поступление полной дозы лекарства вне зависимости от приема пищи и сопутствующей терапии (например, антацидами). В связи с этим использование НПВП в виде ректальных суппозиториев (Цефекон Н) представляется весьма перспективным направлением.
Несмотря на то, что в понимании больного лихорадка часто является нежелательным проявлением заболевания, врач, определяя стратегию лечения больного, должен учитывать положительные факторы гипертермической реакции. Более того, ликвидация лихорадки не должна являться главной целью проводимой терапии (что часто имеет место при наличии ОРВИ). Общеизвестно, что течение инфекционного заболевания без температурной реакции может свидетельствовать о наличии у больного иммунодефицитного состояния и является неблагоприятным прогностическим фактором.
1. Лучшева Ю., Простуда. Как с ней бороться. Эффективность препаратов симптоматической терапии при ОРВИ// Фармацевтический вестник №37 (236), 2001.
Лучшева Ю., Простуда. Как с ней бороться. Эффективность препаратов симптоматической терапии при ОРВИ// Фармацевтический вестник №37 (236), 2001.
2. НПВП : роль ректальных суппозиториев.//Русский медицинский журнал , том 10, №21(165), 2002, стр 982–986.
3. Ярилин А.А., Основы иммунологии, М.»Медицина», 1999,стр.163–168.
4. Bruce Beutler, Steven M.Beutler, The Pathogenesis of Fever// CECIL Textbook of Medicine,19 th edition, 1994, p.1568–1571.
5. Cranswick N, Coghlan D., Paracetamol efficacy and safety in children : the first 40 years// Am J Ther,2000, 7(2): 135–41.
6. Glasow.J.F.T., Middleton B., Reye syndrome – insights on causation and prognosis// Arch Dis Child, 2001, 85, 351–353.
Фенилкетонурия
Первые симптомы: частое срыгивание, рвота, экземы, судороги, исходящий от мочи и кожи запах плесени. Ребенок может был вялым либо, наоборот, гиперактивным. Отстает в психомоторном развитии, наблюдаются признаки олигофрении. Диагноз может быть поставлен в родильном доме. Все дети с фенилкетонурией безусловно получают статус «ребенок-инвалид».
Диагноз может быть поставлен в родильном доме. Все дети с фенилкетонурией безусловно получают статус «ребенок-инвалид».
Лечение заболевания заключено в соблюдении специальной низкобелковой диете, не содержащей продукты с ФА.
Определение заболевания
Фенилкетонурия ― это врожденная, генетическая патология, подразумевающая нарушения гидроксилирования фенилаланина. Характеризуется накоплением в организме аминокислоты и продуктов ее метаболизма, что ведет к тяжелым поражениям центральной нервной системы. Впервые заболевание было описано норвежским врачом И. А. Феллингом в 1934 году.
Изучая болезнь специалисты установили, что за наличие болезни отвечает единственный ген фенилаланингидроксилазы. Первое успешное лечение было разработано и проведено в 1950 году в Англии.
В неонатальном периоде клиника отсутствует. Патология проявляется в первые полгода жизни ребенка. В дальнейшем накопление вещества приводит к тяжелым нарушениям развития. Поэтому крайне важно сразу после рождения выявить дефект и не допустить употребление продуктов, содержащих фенилаланин. Более позднее соблюдение диеты не устранит полученные нарушения, но не допустит развития новых.
Патология проявляется в первые полгода жизни ребенка. В дальнейшем накопление вещества приводит к тяжелым нарушениям развития. Поэтому крайне важно сразу после рождения выявить дефект и не допустить употребление продуктов, содержащих фенилаланин. Более позднее соблюдение диеты не устранит полученные нарушения, но не допустит развития новых.
Патология одинаково часто встречается среди лиц обоих полов. Расовых особенностей не выявлено. Большое количество больных в таких странах как Китай, Турция, Ирландия. В среднем по России с фенилкетонурией рождается каждый 7-ми тысячный ребенок.
Причины фенилкетонурии
Существует три типа генетического отклонения, первый считается классическим, поскольку диагностируется в более чем 90% случаев. Второй и третий ― более редкая форма патологии. Симптоматика схожа во всех типах, заболевание приводит к умственной отсталости. При классической форме фенилкетонурии избежать этого можно диетотерапией, но атипичные варианты, к сожалению, коррекции не подлежат.
- Классическая фенилкетонурия (I тип) ― это низкая выработка фенилаланингидроксилазы (ФАГ), что приводит к собиранию в естественных жидкостях организма фенилаланина и продуктов его расщепления. Патология вызвана мутированным геном РАН.
- Фенилкетонурия II типа ― недостаток дигидроптеридинредуктазы, что препятствует преобразованию фенилаланина в тирозин. Патология из-за мутации гена QDPR.
- Фенилкетонурия III типа ― недостаток 6-пирувоилтетрагидроптеринсинтазы, нужной для синтеза тетрагидробиоптерина. Патология вызвана мутированным PTS-геном.
Все формы заболевания наследуются по аутосомно-рецессивной форме. Это означает, что генетический дефект может быть унаследован у одного из родителей. Половая принадлежность родителя и ребенка не играет роли.
Классификация
Фенилкетонурия в настоящее время не имеет общепризнанной мировой классификации. Над этим вопросом ведутся дебаты, наравне с изучением заболевания. Чуть ранее, до расшифровки генов, считалось, что степень поражения интеллектуальных способностей зависит от степени активности фермента. Поэтому текущая квалификация признана устаревшей. Не учитывает она и другие симптоматические факторы.
Над этим вопросом ведутся дебаты, наравне с изучением заболевания. Чуть ранее, до расшифровки генов, считалось, что степень поражения интеллектуальных способностей зависит от степени активности фермента. Поэтому текущая квалификация признана устаревшей. Не учитывает она и другие симптоматические факторы.
При диагностировании ставят:
-
I тип (дефицит ФАГ) ― концентрация ФА больше 20 мг/дл. -
Средняя форма ФКУ ― ФА от 8,1 до 20 мг/дл. -
Легкая форма ГФА-уровень ― ФА от 2,1 до 8,0 мг/дл.
При уровне до 8,0 мг/дл фенилкетонурию считают доброкачественной. Она не требует специального лечения, но необходимо наблюдение первый год жизни ребенка. Контролирует состояние врач-педиатр, невролог, генетик.
Выделяют также еще одну форму фенилкетонурии, не требующую коррекции. Это транзиторная форма ГФА в период новорожденности. Возникает, как правило, при недоношенности, что обусловлено функциональной незрелостью организма. Транзиторная фенилкетонурия ― это временное повышение ФА-уровня, способное подняться до критических значений. При этом клиника отсутствует либо проявления весьма незначительны. Через несколько месяцев биохимические показатели приходя в норму.
Возникает, как правило, при недоношенности, что обусловлено функциональной незрелостью организма. Транзиторная фенилкетонурия ― это временное повышение ФА-уровня, способное подняться до критических значений. При этом клиника отсутствует либо проявления весьма незначительны. Через несколько месяцев биохимические показатели приходя в норму.
Патогенез
Механизм зарождения и развития фенилкетонурии связан с нарушением обмена органического соединения ― аминокислоты фенилаланина. Метаболический блок препятствует преобразованию фенилаланина в тирозин. Аминокислота не только не преобразуется, а накапливается в виде токсичных метаболитов:
-
фенилмолочная кислота; -
фенилпировиноградная кислота; -
фенилуксусная кислота; -
фенилэтиламин и прочее.
Скопление фенил-веществ оказывает токсическое действие на ЦНС. В настоящий момент механизм еще до конца не изучен, врачам не известен патогенез дисфункции головного мозга.
В настоящий момент механизм еще до конца не изучен, врачам не известен патогенез дисфункции головного мозга.
Существуют предположения, что поражение нервной системы является результатом ряда факторов. Среди них как прямое токсического воздействие фенилаланина, так и нарушение обмена белков, липопротеидов и гликопротеидов, сбой гормонального метаболизма и мембранного транспорта аминокислот. Все это в комплексе имеет важное значение для созревания и правильного функционирования ЦНС.
Симптомы
I тип. Первые признаки у ребенка проявляются в возрасте от 2 месяцев до полугода.
-
Апатичность либо, наоборот, повышенная раздражительность. -
Отсутствие интереса к окружению, людям, предметам, обстановке. -
Частое срыгивание. -
Аллергический дерматит. -
Нарушение мышечного тонуса. -
Пониженное давление.
-
Судороги. -
Иногда развивается микроцефалия (малый размер черепа относительно других частей тела) и гидроцефалия (избыточная жидкость, омывающая головной мозг).
К характерным симптомам относятся гипопигментация кожи, волос, радужной оболочки глаз. Моча имеет специфический запах плесени или его еще называют «мышиным» запахом. Эпилептические припадки наблюдаются у половины больных, часто является первым выраженным клиническим симптомом. Приступ характеризуется «салаамовыми» судорогами, напоминающими кивки. Они случаются часто, плохо поддаются антиконвульсантному лечению.
Если не корректировать концентрацию ФА, болезнь прогрессирует. Как правило, уровень IQ у таких детей не превышает 20, при норме от 85. Умственная отсталость настолько сильная, что отсутствуют эмоциональные реакции, наблюдаются психопатии и шизофреноподобные расстройства.
II тип.
 Первая симптоматика проявляется на первом году жизни.
Первая симптоматика проявляется на первом году жизни.
-
Повышенная возбудимость. -
Задержка развития. -
Обильное слюнотечение. -
Сниженное артериальное давление. -
Частое повышение температуры тела. -
Сухожильная гиперрефлексия (повышение рефлексов) или спастический тетрапарез (обессиливание всех четырех конечностей). -
Миоклоническая эпилепсия (генерализованные приступы, преимущественно возникающие после пробуждения). -
Микроцефалия.
Отличительная особенность второго типа ― гибель нейронов, нарушение метаболизма фолатов, а также кальцификация в различных отделах головного мозга. Болезнь быстро прогрессирует, может привести к смерти ребенка в течение 2 — 3 лет.
III тип. Симптомы дефицита пирувоилтетрагидроптеринсинтетазы схож с проявлениями болезни Паркинсона:
-
Постуральная нестабильность и трудности походки. Сложно либо невозможно поддерживать определенное положение всего тела или конечностей.
Сложно либо невозможно поддерживать определенное положение всего тела или конечностей. -
Гипокинезия (низкая двигательная активность, ограниченный темп и объем движений). -
Гиперсаливация (повышенное слюноотделение). -
Нарушения глотания. -
Окулогирные кризы (симметричное отклонение обоих глаз, обычно направленное вверх).
В 80% случаев этот тип заболевания сопровождается снижением количества биогенных аминов в ликворе. Лечение затруднено тем, что раннее снижение концентрации ФА может вызвать серьезные патологические изменения. Несоблюдение диетотерапии приведет к замедлению развития речи, низкому интеллекту, проблемам с памятью.
Диагностика
Выявить фенилкетонурию можно в первые дни после рождения до появления какой-либо симптоматики. Для определение концентрации фениламина в крови проводят:
-
микробиологический тест; -
хроматографию; -
флюориметрию; -
масс-спектрометрию.
Во всех случаях биологическим материалом выступают сухие пятна капиллярной крови младенца.
С недавнего времени анализ на фенилкетонурию входит в программу неонатального скрининга. Его проводят всем новорожденным, особенно важно исследование для недоношенных детей. Критерий диагностирования ― повышенная концентрация фенилаланина при норме 0 — 2 мг/дл. Повышенный уровень требует проведения уточняющей диагностики. Потребуется установить сам факт наличия фенилкетонурии и выявить ее причину.
Если скрининг-тест показал высокие результаты уровня ФА, дополнительно может быть назначено:
- Фенилаланин-нагрузочная диагностика для выявления нозологической формы заболевания.
-
Молекулярно-генетический анализ для установления формы: классическая, II или III тип. -
Секвенирование гена РАН, если молекулярно-генетическая диагностика дала отрицательный результат по гену ФАГ.
-
Анализ на птерины в урине для исключения птерин-зависимых форм.
Дифференциальное диагностирование фенилкетонурии проводят с такими патологиями, как нарушение функции печени, галактоземия и с другими заболеваниями.
Лечение
Симптоматическая терапия при любой формой фенилкетонурии неэффективна. Существует только один способ предотвратить негативные последствия заболевания ― диетотерапия. Из рациона исключают высокобелковые и содержащие фенилаланин продукты. Недостающее количество белка восполняют специализированным лечебным питанием, с максимально низким содержанием аминокислоты ФА или полностью ее лишенным. Следует учитывать, что эффективность терапии напрямую зависит от времени начала коррекции и уже произошедших патологических изменений.
Цель лечебного питания при классической форме заболевания ― это предотвращение развития нарушений ЦНС, физического и умственного развития. Легкая форма ГФА допускает расширение диеты под строгим наблюдением врача за состоянием ребенка и биохимическими показателями. Под запретом: мясо, рыба, орехи, шоколад и бобовые, все виды яиц, творог и сыры. Также следует исключить продукты, содержащие искусственный подсластитель аспартам.
Легкая форма ГФА допускает расширение диеты под строгим наблюдением врача за состоянием ребенка и биохимическими показателями. Под запретом: мясо, рыба, орехи, шоколад и бобовые, все виды яиц, творог и сыры. Также следует исключить продукты, содержащие искусственный подсластитель аспартам.
Критерий эффективности лечения ― уровень ФА в крови.
Прогноз и профилактика
Проведения массового скрининга в родильных домах позволяет своевременно выявить генетическое отклонение. Вовремя начать соблюдение диетотерапии и, как следствие, предотвратить тяжелые последствия. В противном случае прогноз в отношении умственного развития неблагоприятный.
Классическая ФКУ имеет благоприятный прогноз если диагностирована в первые недели жизни ребенка и соблюдаются все требования врачей. Такие дети ходят в обычные школы, способны получить высшее образовании и вести нормальный образ жизни.
Во время подготовки к беременности пара должна пройти предварительное генетическое тестирование на наличие мутаций в гене РАН. Если у одного из родителей есть дефектный ген, шанс родить ребенка с ФКУ 1:4 и 100% если оба родителя больны.
Женщины с установленной фенилкетонурией при беременности и грудном вскармливании должны соблюдать строгую диету. Высокая концентрация аминокислоты в крови и околоплодных водах оказывает серьезное тератогенное воздействие на плод.
Преимущества АО «СЗЦДМ»
Сдать анализ на уровень ФА можно в подразделениях АО «СЗЦДМ» Здесь вас ждет:
-
квалифицированных и доброжелательный персонал; -
новейшее оборудование, отправка результатов исследований по эл. почте; -
несколько вариантов получения данных анализов; -
удобное расположение терминалов; -
отсутствие очередей, условия конфиденциальности.
Лаборатории находятся в Санкт-Петербурге и других города Ленинградской области, а также в Великом Новгороде, Новгородской обл., Пскове, Калининграде.
Синдром периодической лихорадки
Что такое синдромы периодической лихорадки?
Синдромы периодической лихорадки относятся к заболеваниям, которые вызывают периодическую (эпизодическую) лихорадку, не имеющую инфекционной (вирусной, бактериальной) причины. В целом дети с этими синдромами хорошо себя чувствуют между эпизодами. Многие из этих синдромов являются наследственными (передаются от родителей) и возникают в результате мутации (дефекта или ошибки) в гене (это код, определяющий структуру наших белков). Синдромы определяются несколькими факторами, в том числе:
- Дефект гена
- Клинические признаки синдрома
- Части тела, пораженные помимо лихорадки
- Возраст ребенка, когда начинается синдром
- Этническая принадлежность (район мира, откуда родом ребенок или родители) ребенка и родителей
Многие из этих синдромов требуют специального лечения, часто основанного на понимании проблемы, вызванной генетическим дефектом.
Семейная средиземноморская лихорадка
Семейная средиземноморская лихорадка (ССЛ) является наиболее распространенным синдромом периодической лихорадки. Больных беспокоят повторяющиеся эпизоды лихорадки, сопровождающиеся болями в животе, грудной клетке и суставах, отечностью. Болезнь обычно поражает людей средиземноморского и ближневосточного происхождения, как правило, евреев-сефардов, турок, арабов и армян. С момента обнаружения дефекта гена его диагностируют чаще, даже среди групп населения, где он считался очень редким, например, у итальянцев, греков и евреев-ашкеназов. Эпизоды ССЛ начинаются в возрасте до 20 лет примерно в 9 лет.0 процентов больных. Более чем у половины из них заболевание проявляется в возрасте до 10 лет.
Что вызывает ССЛ?
ССЛ — генетическое заболевание. Ответственный ген называется геном MEFV, названным в честь Средиземного моря, и он влияет на белок пирин , который играет роль в естественном контроле воспаления. Когда этот ген имеет дефект, регуляция воспаления не может осуществляться должным образом, и у пациентов возникают эпизоды лихорадки и других симптомов. Инфекция, травма, менструации (менструации) или психологический стресс могут спровоцировать эпизоды.
Когда этот ген имеет дефект, регуляция воспаления не может осуществляться должным образом, и у пациентов возникают эпизоды лихорадки и других симптомов. Инфекция, травма, менструации (менструации) или психологический стресс могут спровоцировать эпизоды.
Как наследуется ССЛ?
ССЛ наследуется как аутосомно-рецессивное заболевание (это означает, что хотя ребенок может иметь заболевание, ни у одного из родителей не должно быть симптомов заболевания). В этом случае ребенок получает два мутировавших гена, один от матери, а другой от отца. Тогда родителей называют носителями. Часто кто-то в расширенной семье болеет этим заболеванием. Если у одного ребенка есть заболевание, а родители являются носителями, существует 25-процентная вероятность того, что другой ребенок заразится ССЛ. Если у одного из детей есть ССЛ, а также у одного из родителей есть ССЛ, существует 50-процентная вероятность того, что другой ребенок заразится ССЛ.
Заразен ли лихорадочный микоз?
Лихорадка FMF не заразна.
Каковы основные симптомы ССЛ?
Основными симптомами болезни являются:
- Возвратная лихорадка
- Боль в животе
- Боль в груди
- Боль в суставах
Не у всех детей проявляются все симптомы, и симптомы могут меняться со временем. Эпизоды разрешаются без лечения и обычно длятся от одного до четырех дней. Большинство детей совершенно нормальны между приступами, но у некоторых детей приступы случаются настолько часто, что они не полностью выздоравливают или не растут должным образом. Некоторые приступы могут быть настолько болезненными, что больной или члены его семьи обращаются за медицинской помощью в отделение неотложной помощи. Например, тяжелые абдоминальные приступы могут имитировать острый аппендицит, поэтому некоторым пациентам может быть проведена абдоминальная хирургия, например аппендэктомия. Боль в груди может быть настолько сильной, что может быть трудно дышать глубоко.
Обычно одновременно поражается только один сустав, чаще всего голеностопный или коленный. Сустав может быть настолько опухшим и болезненным, что ребенок не может ходить. Примерно у трети этих пациентов над пораженным суставом появляется красная сыпь. У некоторых детей единственным признаком заболевания могут быть эпизоды боли и припухлости в суставах, которые ошибочно принимают за острую ревматическую лихорадку или ювенильный идиопатический артрит. Обычно припухлость сустава проходит в течение 5–14 дней. Примерно в 5-10% случаев поражение суставов может стать хроническим. Некоторые дети жалуются на мышечные боли в ногах.
Сустав может быть настолько опухшим и болезненным, что ребенок не может ходить. Примерно у трети этих пациентов над пораженным суставом появляется красная сыпь. У некоторых детей единственным признаком заболевания могут быть эпизоды боли и припухлости в суставах, которые ошибочно принимают за острую ревматическую лихорадку или ювенильный идиопатический артрит. Обычно припухлость сустава проходит в течение 5–14 дней. Примерно в 5-10% случаев поражение суставов может стать хроническим. Некоторые дети жалуются на мышечные боли в ногах.
В редких случаях у детей наблюдается рецидивирующий перикардит (воспаление наружной оболочки сердца), миозит (воспаление мышц), менингит (воспаление оболочки, окружающей головной и спинной мозг) и орхит (воспаление яичек). Частые приступы могут повлиять на жизнь ребенка и семьи, в том числе на посещение школы.
Наиболее тяжелым осложнением ССЛ при отсутствии лечения является развитие амилоидоза. Амилоид представляет собой белок, который откладывается в определенных органах у детей с хроническими воспалительными заболеваниями, которые плохо контролируются. Чаще всего поражается почка, но амилоид может откладываться в кишечнике, коже и сердце. В конце концов, амилоид вызывает потерю функции, особенно почек. Дети, получающие надлежащее лечение (см. ниже в разделе «Лекарства»), защищены от риска развития этого опасного для жизни осложнения.
Чаще всего поражается почка, но амилоид может откладываться в кишечнике, коже и сердце. В конце концов, амилоид вызывает потерю функции, особенно почек. Дети, получающие надлежащее лечение (см. ниже в разделе «Лекарства»), защищены от риска развития этого опасного для жизни осложнения.
Может ли FMF появляться или быть активным у взрослых?
Да, но часто заболевание протекает мягче и менее очевидно (поэтому его труднее диагностировать), чем у детей. Риск амилоидоза ниже у взрослых.
Как диагностируется ССЛ?
Несмотря на то, что известно, что ССЛ является генетическим заболеванием, генетическая мутация обнаруживается не у всех детей с ССЛ. Поэтому диагноз ССЛ по-прежнему основывается на клинических признаках. ССЛ подозревают у детей с эпизодической лихорадкой типичного для ССЛ этнического происхождения и/или с семейным анамнезом ССЛ или необъяснимой почечной недостаточностью. Часто у детей сначала возникают эпизоды лихорадки без других симптомов, поэтому требуется тщательное наблюдение, пока не будет поставлен диагноз. Семьи должны вести дневник, документируя эпизоды и описывая, что происходит. Поскольку не у всех детей есть типичные эпизоды, может потребоваться много времени, чтобы заподозрить ССЛ и поставить диагноз. Полезны осмотр ребенка во время приступа и получение лабораторных анализов, показывающих признаки воспаления (таких как тесты на скорость оседания или общий анализ крови). Как правило, эти тесты становятся положительными во время эпизода и возвращаются к норме или почти к норме после окончания эпизода. Образец мочи также проверяется на наличие белка. Пациенты с амилоидозом будут иметь высокий уровень белка в анализах мочи. Это предупреждает врача о необходимости провести дополнительные анализы, чтобы убедиться, что белок в моче не связан с амилоидозом.
Семьи должны вести дневник, документируя эпизоды и описывая, что происходит. Поскольку не у всех детей есть типичные эпизоды, может потребоваться много времени, чтобы заподозрить ССЛ и поставить диагноз. Полезны осмотр ребенка во время приступа и получение лабораторных анализов, показывающих признаки воспаления (таких как тесты на скорость оседания или общий анализ крови). Как правило, эти тесты становятся положительными во время эпизода и возвращаются к норме или почти к норме после окончания эпизода. Образец мочи также проверяется на наличие белка. Пациенты с амилоидозом будут иметь высокий уровень белка в анализах мочи. Это предупреждает врача о необходимости провести дополнительные анализы, чтобы убедиться, что белок в моче не связан с амилоидозом.
У детей с подозрением на ССЛ будет проведен генетический тест для выявления генной мутации. Если эти тесты положительны (гомозиготы , , что означает, что дефект гена обнаружен в обеих копиях гена, по одной от каждого родителя), диагноз ССЛ является определенным. Однако возможно иметь FMF с дефектом только в одной копии гена (называемой гетерозиготой ) или даже без какого-либо дефекта гена, поскольку генетический тест рассматривает только часть всего гена FMF. В Соединенных Штатах более 30 процентов пациентов с ССЛ не имеют мутаций в обеих копиях гена. В этом случае реакция на специфическое лечение лихорадки колхицином будет определять диагноз. Весьма вероятно, что дети болеют ССЛ, если у них нет эпизодов или их количество значительно меньше во время лечения колхицином. Обычно пациенту дается пробный шестимесячный курс лечения.
Однако возможно иметь FMF с дефектом только в одной копии гена (называемой гетерозиготой ) или даже без какого-либо дефекта гена, поскольку генетический тест рассматривает только часть всего гена FMF. В Соединенных Штатах более 30 процентов пациентов с ССЛ не имеют мутаций в обеих копиях гена. В этом случае реакция на специфическое лечение лихорадки колхицином будет определять диагноз. Весьма вероятно, что дети болеют ССЛ, если у них нет эпизодов или их количество значительно меньше во время лечения колхицином. Обычно пациенту дается пробный шестимесячный курс лечения.
Как лечить ССЛ?
FMF нельзя вылечить, но его можно хорошо контролировать с помощью пожизненного применения колхицина. Таким способом обычно можно предотвратить эпизоды (полностью предотвратить у 60 % пациентов, частично предотвратить у 33 % и примерно у 5 % колхицин не эффективен), а амилоидоз можно предотвратить у 100 % пациентов. Если пациент прекращает прием препарата, эпизоды (часто после пропуска только одной дозы) и риск развития амилоидоза могут вернуться. Соблюдение режима (прием лекарства в соответствии с рекомендациями) очень важно. Если колхицин принимать регулярно, ребенок может жить нормальной жизнью с нормальной продолжительностью жизни. Пациент или родители не должны изменять дозу лекарства без предварительного обсуждения этого с врачом. Некоторым детям изначально нужна психологическая поддержка при заболевании, что означает прием лекарств на протяжении всей жизни. Колхицин предотвращает начало эпизодов, но не лечит эпизод, который уже начался. Поэтому дозу колхицина не следует увеличивать во время уже активного эпизода.
Соблюдение режима (прием лекарства в соответствии с рекомендациями) очень важно. Если колхицин принимать регулярно, ребенок может жить нормальной жизнью с нормальной продолжительностью жизни. Пациент или родители не должны изменять дозу лекарства без предварительного обсуждения этого с врачом. Некоторым детям изначально нужна психологическая поддержка при заболевании, что означает прием лекарств на протяжении всей жизни. Колхицин предотвращает начало эпизодов, но не лечит эпизод, который уже начался. Поэтому дозу колхицина не следует увеличивать во время уже активного эпизода.
Каковы побочные эффекты лечения ССЛ?
Колхицин является безопасным препаратом с незначительными побочными эффектами, которые обычно купируются снижением дозы или другими методами лечения. Наиболее частым побочным эффектом является диарея. Некоторые дети не переносят данную дозу из-за частого водянистого стула. В этих случаях дозу следует снижать до тех пор, пока она не станет переносимой, а затем медленно увеличивать до соответствующей дозы. Другие методы включают сокращение потребления молока или молочных продуктов, а иногда необходимо давать лекарство для лечения диареи (например, Имодиум®). Другими побочными эффектами являются тошнота, рвота и спазмы в животе. В редких случаях это может вызвать мышечную слабость. Анализ крови (лейкоциты, эритроциты и тромбоциты) может иногда снижаться, но восстанавливается при снижении дозы. Дети, принимающие колхицин, растут нормально. Снижение количества сперматозоидов в более позднем возрасте встречается очень редко. Женщинам не нужно прекращать прием колхицина во время беременности или кормления грудью, но рекомендуется амниоцентез (взятие образца жидкости, окружающей плод). Дети, получающие колхицин, должны сдавать анализы крови и мочи не реже двух раз в год.
Другие методы включают сокращение потребления молока или молочных продуктов, а иногда необходимо давать лекарство для лечения диареи (например, Имодиум®). Другими побочными эффектами являются тошнота, рвота и спазмы в животе. В редких случаях это может вызвать мышечную слабость. Анализ крови (лейкоциты, эритроциты и тромбоциты) может иногда снижаться, но восстанавливается при снижении дозы. Дети, принимающие колхицин, растут нормально. Снижение количества сперматозоидов в более позднем возрасте встречается очень редко. Женщинам не нужно прекращать прием колхицина во время беременности или кормления грудью, но рекомендуется амниоцентез (взятие образца жидкости, окружающей плод). Дети, получающие колхицин, должны сдавать анализы крови и мочи не реже двух раз в год.
Каковы отдаленные исходы и течение ССЛ?
При правильном лечении колхицином на протяжении всей жизни дети с ССЛ живут нормальной жизнью. При запоздалой постановке диагноза или несоблюдении режима лечения повышается риск развития амилоидоза. Детям, у которых развивается амилоидоз, в конечном итоге может потребоваться диализ или пересадка почки. Никаких ограничений в повседневной жизни ребенка нет.
Детям, у которых развивается амилоидоз, в конечном итоге может потребоваться диализ или пересадка почки. Никаких ограничений в повседневной жизни ребенка нет.
Периодический синдром, ассоциированный с рецептором фактора некроза опухоли (TRAPS)
Что такое периодический синдром, ассоциированный с рецептором фактора некроза опухоли (TRAPS)?
Периодический синдром, ассоциированный с рецептором фактора некроза опухоли (TRAPS) — это генетическое заболевание с аутосомно-доминантным (достаточно одного дефекта гена, чтобы привести к заболеванию) наследованием. Это означает, что либо один из родителей болен вариантом заболевания, либо дефект гена образовался у ребенка с заболеванием впервые (мутация de novo). Помимо эпизодов лихорадки, другие симптомы могут включать:
- Боль в животе
- Диарея
- Мигрирующие (перемещающиеся с одного места на другое) болезненные красные кожные высыпания
- Боль в мышцах
- Отек вокруг глаза
Дефект гена был обнаружен совсем недавно. Прежнее название этого синдрома — семейная гибернианская лихорадка.
Прежнее название этого синдрома — семейная гибернианская лихорадка.
Насколько распространены ЛОВУШКИ?
TRAPS — редкое заболевание, но с тех пор, как был обнаружен дефект гена, было выявлено больше пациентов с различными клиническими признаками. Таким образом, реальная частота пока неизвестна. Он поражает мужчин и женщин в равной степени, и начало, по-видимому, приходится на позднее детство или взрослую жизнь. Первые случаи были зарегистрированы у пациентов ирландско-шотландского происхождения; однако это заболевание также было выявлено почти во всех этнических группах.
Является ли TRAPS заразным?
TRAPS не является заразным заболеванием. Это генетическое заболевание.
Что вызывает TRAPS?
TRAPS вызывается дефектом гена белка, называемого рецептором фактора некроза опухоли (TNFR), который приводит к усилению нормальной воспалительной реакции пациента. Белок, вызывающий воспаление, называемый фактором некроза опухоли (ФНО), действует слишком активно, поскольку рецептор (ФНО), который обычно связывается с ФНО, не контролирует его активность. Инфекция, травма или психологический стресс могут спровоцировать эпизоды. Однако не каждый человек с генным дефектом будет иметь клинические признаки TRAPS.
Инфекция, травма или психологический стресс могут спровоцировать эпизоды. Однако не каждый человек с генным дефектом будет иметь клинические признаки TRAPS.
Каковы основные симптомы TRAPS?
Основными симптомами являются повторяющиеся эпизоды лихорадки, обычно длящиеся две или три недели, сопровождающиеся ознобом и сильной мышечной болью в туловище и верхних конечностях. Типичная сыпь красная и болезненная, что свидетельствует о скрытом воспалении кожи и мышц. Сыпь перемещается с одного места на другое на теле, обычно с рук и ног на туловище. Большинство больных ощущают в начале приступа схваткообразную мышечную боль, которая постепенно нарастает по силе, а также переходит с одной части тела на другую. Часто наблюдаются боли в животе с тошнотой и рвотой. Воспаление мембраны, покрывающей переднюю часть глаза (конъюнктиву), и/или отек вокруг глаза является обычным явлением. Другие менее распространенные признаки включают боль в груди из-за воспаления плевры (оболочки, окружающей легкие) или перикарда (оболочки, окружающей сердце). Как и ССЛ (см. выше), амилоидоз является наиболее тяжелым поздним осложнением TRAPS и часто приводит к большому количеству белков в моче и почечной недостаточности.
Как и ССЛ (см. выше), амилоидоз является наиболее тяжелым поздним осложнением TRAPS и часто приводит к большому количеству белков в моче и почечной недостаточности.
Симптомы заболевания варьируются от человека к человеку, а также продолжительность эпизодов и время между эпизодами. Причины этих различий частично основаны на различиях в конкретном генном дефекте.
Как диагностируется TRAPS?
Врач-эксперт заподозрит TRAPS на основании:
- Клинических симптомов
- Медицинский осмотр
- История болезни семьи
Анализы крови покажут признаки воспаления во время приступа. Диагноз подтверждается только генетическими тестами, показывающими генетический дефект в гене TNFR. Врач, вероятно, проведет тест на другие типы синдромов периодической лихорадки.
Как лечить TRAPS?
До сих пор не существует проверенного окончательного лечения для предотвращения или лечения болезни. Неспецифические противовоспалительные средства, включая использование стероидов, помогают облегчить симптомы, но длительное использование стероидов приводит к серьезным побочным эффектам. Применение препарата, подобного рецептору ФНО, под названием Энбрел® (препарат, применяемый для лечения ювенильного идиопатического артрита), оказалось эффективным для некоторых пациентов при назначении в начале приступа или даже в качестве профилактического средства.
Применение препарата, подобного рецептору ФНО, под названием Энбрел® (препарат, применяемый для лечения ювенильного идиопатического артрита), оказалось эффективным для некоторых пациентов при назначении в начале приступа или даже в качестве профилактического средства.
Как долго продержится TRAPS?
Пациенты с TRAPS будут иметь эпизоды симптомов на протяжении всей жизни.
Каковы отдаленные исходы и течение TRAPS?
Трудно предсказать результат у какого-либо одного пациента, поскольку амилоидоз проявляется лишь у меньшинства пациентов. Этот риск частично зависит от генетического дефекта и других неясных факторов окружающей среды.
Синдром гипериммуноглобулина D (HIDS), также называемый синдромом периодической лихорадки, ассоциированной с мевалонаткиназой
Что такое синдром гипериммуноглобулина D (HIDS)?
HIDS, также называемый синдромом периодической лихорадки, ассоциированной с мевалонаткиназой, является аутосомно-рецессивным (что означает, что во время болезни ребенка ни один из родителей не должен проявлять симптомы заболевания) генетическим синдромом, который приводит к эпизодической высокой лихорадке с кожной сыпью, отеком лимфатические узлы (железы, которые являются частью иммунной системы) в области шеи, боль в животе, рвота и диарея. Заболевание начинается в раннем младенчестве. Название этого заболевания происходит от того факта, что у большинства пациентов очень высокое количество иммуноглобулинов (белков, входящих в состав иммунной системы) типа D . Самая тяжелая форма этого заболевания начинается с рождения и называется мевалоновой ацидурией. Эти пациенты также имеют неврологическое заболевание (нервная система) и страдают от плохого роста. Форма этого состояния, которая описана ниже, является легкой формой, потому что это единственный тип, который начинается с эпизодов лихорадки.
Заболевание начинается в раннем младенчестве. Название этого заболевания происходит от того факта, что у большинства пациентов очень высокое количество иммуноглобулинов (белков, входящих в состав иммунной системы) типа D . Самая тяжелая форма этого заболевания начинается с рождения и называется мевалоновой ацидурией. Эти пациенты также имеют неврологическое заболевание (нервная система) и страдают от плохого роста. Форма этого состояния, которая описана ниже, является легкой формой, потому что это единственный тип, который начинается с эпизодов лихорадки.
Насколько распространен HIDS?
HIDS — очень редкое заболевание. Заболевание в основном встречается в Западной Европе, особенно в Нидерландах и во Франции, но описано во всех этнических группах. В равной степени страдают мальчики и девочки. Симптомы обычно начинаются в раннем детстве, чаще всего на первом году жизни.
Является ли HIDS заразным?
Нет, лихорадка HIDS не заразна.
Каковы причины HIDS?
HIDS — это генетическое заболевание. Дефект гена находится в белке, называемом мевалоновой киназой (MVK). MVK представляет собой белок, облегчающий химическую реакцию в организме (фермент), участвующий в процессе выработки холестерина. При HIDS фермент MVK активен только в пределах от 1 до 10 процентов от нормальной активности фермента. До сих пор неизвестно, почему дефект гена вызывает лихорадку. Эпизоды могут быть вызваны инфекцией, стрессом и вакцинацией или без какого-либо очевидного триггера. HIDS наследуется по аутосомно-рецессивному типу (это означает, что пока ребенок болен, ни у одного из родителей не должно быть симптомов заболевания). В этом случае ребенок получает два мутировавших гена, один от матери, а другой от отца. Тогда родителей называют носителями. Часто кто-то в расширенной семье болеет этим заболеванием. Если у одного ребенка есть заболевание, а родители являются носителями, существует 25-процентная вероятность того, что другой ребенок заразится HIDS.
Дефект гена находится в белке, называемом мевалоновой киназой (MVK). MVK представляет собой белок, облегчающий химическую реакцию в организме (фермент), участвующий в процессе выработки холестерина. При HIDS фермент MVK активен только в пределах от 1 до 10 процентов от нормальной активности фермента. До сих пор неизвестно, почему дефект гена вызывает лихорадку. Эпизоды могут быть вызваны инфекцией, стрессом и вакцинацией или без какого-либо очевидного триггера. HIDS наследуется по аутосомно-рецессивному типу (это означает, что пока ребенок болен, ни у одного из родителей не должно быть симптомов заболевания). В этом случае ребенок получает два мутировавших гена, один от матери, а другой от отца. Тогда родителей называют носителями. Часто кто-то в расширенной семье болеет этим заболеванием. Если у одного ребенка есть заболевание, а родители являются носителями, существует 25-процентная вероятность того, что другой ребенок заразится HIDS.
Каковы основные симптомы HIDS?
Эпизоды лихорадки являются основным симптомом, длящимся от трех до семи дней и повторяющимся каждые две-двенадцать недель. Приступы начинаются внезапно, часто с дрожащего озноба. Дополнительные общие симптомы могут включать:
Приступы начинаются внезапно, часто с дрожащего озноба. Дополнительные общие симптомы могут включать:
- Головная боль
- Боль в животе
- Потеря аппетита
- Гриппоподобные симптомы
Симптомы и тяжесть заболевания могут различаться у разных пациентов. Большинство пациентов испытывают такие симптомы, как:
- Тошнота
- Рвота
- Диарея
- Кожная сыпь
- Болезненные язвы во рту
- Боль в суставах
Одним из самых ярких признаков этого состояния является увеличение лимфатических узлов на шее и других частях тела.
Как диагностируется HIDS?
Обычно для диагностики HIDS требуется врач-специалист по этому заболеванию. Заболевание подозревают у пациентов с перечисленными выше симптомами. Анализы крови, показывающие признаки воспаления во время эпизода, обычно видны. Большинство (но не все, особенно очень молодые пациенты) имеют повышенный уровень иммуноглобулина D. Во время эпизодов анализ мочи на органическую кислоту (это кислоты в организме, содержащие атом углерода) покажет высокий уровень мевалоновой кислоты. Диагноз будет подтвержден генетическим тестом, выявляющим генетический дефект в белке MVK или обнаруживающим низкий уровень активности MVK в клетках крови.
Во время эпизодов анализ мочи на органическую кислоту (это кислоты в организме, содержащие атом углерода) покажет высокий уровень мевалоновой кислоты. Диагноз будет подтвержден генетическим тестом, выявляющим генетический дефект в белке MVK или обнаруживающим низкий уровень активности MVK в клетках крови.
Можно ли вылечить HIDS?
HIDS нельзя вылечить. Эффективного лечения для предотвращения приступов не существует. Проводятся исследования для поиска эффективных методов лечения. Во время эпизода частично могут помочь нестероидные противовоспалительные препараты (такие как ибупрофен, напроксен) или стероиды.
Как долго продлится HIDS и каков результат?
HIDS — это пожизненное расстройство, но эпизоды обычно становятся более легкими и менее частыми с течением времени, часто разрешаясь в более позднем возрасте. У некоторых больных развивается артрит. За исключением амилоидоза в очень редких случаях, HIDS не приводит к тяжелым органным поражениям.
Что такое мультисистемное воспалительное заболевание новорожденных (NOMID)?
Мультисистемное воспалительное заболевание новорожденных (NOMID) — редкое генетическое заболевание, вызывающее эпизоды лихорадки. В Европе это состояние называется хроническим воспалительным неврологическим кожно-суставным (CINCA) синдромом и родственными заболеваниями. Симптомы этого состояния начинаются с рождения или наблюдаются в течение первых недель жизни. Первыми симптомами обычно являются кожная сыпь и лихорадка. У младенцев также наблюдаются неврологические симптомы, такие как хронический менингит (воспаление оболочек, окружающих головной мозг), потеря слуха и зрения. Примерно у 50% детей позже развивается тяжелое поражение суставов и значительные аномалии роста. Два других менее тяжелых заболевания, вызванных дефектами того же гена NOMID, называются синдромом Макла-Уэллса (MWS) и семейным холодовым аутовоспалительным синдромом, также называемым семейным синдромом холодовой крапивницы (FCAS). Эти заболевания начинаются в более позднем возрасте. Всю группу этих заболеваний теперь называют криопирин-ассоциированными аутовоспалительными заболеваниями.
В Европе это состояние называется хроническим воспалительным неврологическим кожно-суставным (CINCA) синдромом и родственными заболеваниями. Симптомы этого состояния начинаются с рождения или наблюдаются в течение первых недель жизни. Первыми симптомами обычно являются кожная сыпь и лихорадка. У младенцев также наблюдаются неврологические симптомы, такие как хронический менингит (воспаление оболочек, окружающих головной мозг), потеря слуха и зрения. Примерно у 50% детей позже развивается тяжелое поражение суставов и значительные аномалии роста. Два других менее тяжелых заболевания, вызванных дефектами того же гена NOMID, называются синдромом Макла-Уэллса (MWS) и семейным холодовым аутовоспалительным синдромом, также называемым семейным синдромом холодовой крапивницы (FCAS). Эти заболевания начинаются в более позднем возрасте. Всю группу этих заболеваний теперь называют криопирин-ассоциированными аутовоспалительными заболеваниями.
Насколько распространен НОМИД?
НОМИД — очень редкое заболевание. MWS и FCAS, вероятно, встречаются чаще, но все еще редко.
MWS и FCAS, вероятно, встречаются чаще, но все еще редко.
Заразен ли НОМИД?
Нет, лихорадка НОМИДА не заразна.
Каковы причины НОМИДА?
НОМИД — генетическое заболевание. Заболевание наследуется по аутосомно-доминантному типу. Это означает, что либо один из родителей болен вариантом заболевания, либо у больного ребенка новообразованный дефект гена (мутация de novo ) . Генетический дефект обнаруживается только у 50 процентов пациентов. Дефект гена находится в белке под названием криопирин, который выполняет важную задачу контроля воспаления в организме. NOMID встречается в равной степени у мужчин и женщин. Это наблюдалось во многих этнических группах. Сезонного влияния нет.
Каковы основные симптомы НОМИДА?
Некоторые дети с НОМИД рождаются недоношенными. Младенцы часто имеют признаки инфекции (лихорадка, сыпь) при рождении, но инфекции не обнаруживают. Сыпь напоминает крапивницу (крапивницу), но не зудит. Сыпь усиливается при лихорадке. У пациентов возникают неврологические проблемы из-за хронического менингита (воспаление оболочек, окружающих головной мозг). Это может привести к проблемам со зрением, потере слуха и другим неврологическим проблемам. Глаза часто выпучены, у детей часто бывают приступы рвоты. Череп немного увеличен в размерах. У некоторых детей происходит замедленное закрытие переднего родничка (мягкая часть черепа младенцев, где кости черепа соединяются друг с другом). Позднее дети могут жаловаться на головные боли. Позже, обычно после 1 года, у больных появляются боли в суставах и припухлость. В тяжелых случаях может наблюдаться разрастание хрящей и эпифизов костей (концов костей), особенно в области колена. Разрастание костей может привести к деформации суставов. Эти костные изменения видны на рентгеновских снимках. Наблюдается задержка роста, и дети с НОМИД часто очень маленького роста. У детей старшего возраста руки кажутся короткими и широкими, может наблюдаться «дубинка» (расширение) кончиков пальцев рук и ног.
У пациентов возникают неврологические проблемы из-за хронического менингита (воспаление оболочек, окружающих головной мозг). Это может привести к проблемам со зрением, потере слуха и другим неврологическим проблемам. Глаза часто выпучены, у детей часто бывают приступы рвоты. Череп немного увеличен в размерах. У некоторых детей происходит замедленное закрытие переднего родничка (мягкая часть черепа младенцев, где кости черепа соединяются друг с другом). Позднее дети могут жаловаться на головные боли. Позже, обычно после 1 года, у больных появляются боли в суставах и припухлость. В тяжелых случаях может наблюдаться разрастание хрящей и эпифизов костей (концов костей), особенно в области колена. Разрастание костей может привести к деформации суставов. Эти костные изменения видны на рентгеновских снимках. Наблюдается задержка роста, и дети с НОМИД часто очень маленького роста. У детей старшего возраста руки кажутся короткими и широкими, может наблюдаться «дубинка» (расширение) кончиков пальцев рук и ног. Не у всех детей есть все эти симптомы.
Не у всех детей есть все эти симптомы.
Как диагностируется НОМИД?
По клиническим признакам подозревается NOMID. Диагноз подтверждается генетическим тестом. Однако у 50 процентов детей нет генетической мутации.
Как лечится НОМИД?
До недавнего времени не существовало эффективного лечения НОМИДА. Пациентов лечили лекарствами для уменьшения симптомов, такими как нестероидные противовоспалительные препараты, стероиды или метотрексат. Недавние исследования показали, что лекарства, нацеленные на определенные молекулы, участвующие в воспалительном процессе, усиливающемся при NOMID из-за генетического дефекта, могут быть очень эффективными для лечения NOMID. Первоначальные исследования показали, что большинство пациентов с НОМИД резко реагируют на лечение Кинеретом®. Тем не менее, это лечение должно продолжаться неопределенно долго, поскольку нет известного лекарства от NOMID.
Физиотерапия, шины и другие вспомогательные средства необходимы для лечения деформаций суставов, если они возникают. Также могут понадобиться шины и вспомогательные средства для ходьбы. Иногда для исправления этих деформаций требуется хирургическое вмешательство. Слуховые аппараты необходимы для детей с глухотой.
Также могут понадобиться шины и вспомогательные средства для ходьбы. Иногда для исправления этих деформаций требуется хирургическое вмешательство. Слуховые аппараты необходимы для детей с глухотой.
Каков долгосрочный результат NOMID?
Исход NOMID в прошлом был плохим, с тяжелыми нарушениями роста. У многих пациентов развились тяжелые деформации суставов и неврологические нарушения, в основном ушей и глаз. Были также случаи смерти от повреждения головного мозга. Новое лечение, возможно, изменило этот неблагоприятный исход. Планируется, что дальнейшие исследования ответят на этот вопрос.
Синдром Макла-Уэллса и семейный холодовой аутовоспалительный синдром
Что такое синдром Макла-Уэллса и семейный холодовой аутовоспалительный синдром?
Эти синдромы связаны с генными дефектами одного и того же гена криопиринового белка, вызывающего NOMID. Как и в случае с NOMID, примерно у 50% пациентов не обнаруживается никаких генных дефектов. Эти синдромы возникают в более позднем возрасте, чем NOMID, и протекают в более легкой форме. При семейном простудном аутовоспалительном синдроме холод и, возможно, другие триггеры окружающей среды вызывают появление крапивницы (крапивницы).
Эти синдромы возникают в более позднем возрасте, чем NOMID, и протекают в более легкой форме. При семейном простудном аутовоспалительном синдроме холод и, возможно, другие триггеры окружающей среды вызывают появление крапивницы (крапивницы).
При синдроме Макла-Уэллса также развиваются эпизодическая лихорадка и глухота. При обоих синдромах у нелеченных больных часто развивается амилоидоз. Амилоид представляет собой белок, который откладывается в определенных органах у детей с хроническими воспалительными заболеваниями, которые плохо контролируются. Чаще всего поражается почка, но амилоид может откладываться в кишечнике, коже и сердце. В конечном итоге амилоид вызывает потерю функции, особенно почек. Как и в случае НОМИДА, недавние исследования показали, что применение Кинерета® при этих синдромах очень эффективно.
Периодическая лихорадка, афтозный стоматит, фарингит, аденит (PFAPA) синдром
Что такое периодическая лихорадка, афтозный стоматит, фарингит, аденит (PFAPA) синдром?
Этот синдром включает повторяющиеся эпизоды лихорадки с афтозным стоматитом (язвы во рту), фарингитом (боль в горле с покраснением, а иногда и горло с белым налетом – экссудатом – как в горле при стрептококковой инфекции). PFAPA поражает детей в раннем детстве, обычно в возрасте от 2 до 4 лет. Эпизоды обычно уменьшаются по частоте и проходят после 10 лет. Впервые это заболевание было распознано в 1987 и назывался Marshall’s.
PFAPA поражает детей в раннем детстве, обычно в возрасте от 2 до 4 лет. Эпизоды обычно уменьшаются по частоте и проходят после 10 лет. Впервые это заболевание было распознано в 1987 и назывался Marshall’s.
Насколько распространен синдром PFAPA?
Частота PFAPA неизвестна, но заболевание встречается чаще, чем принято считать.
Что вызывает синдром PFAPA?
Ответ на этот вопрос пока неизвестен. При PFAPA дефекта гена обнаружено не было, хотя в некоторых случаях это заболевание встречается у более чем одного члена семьи. Инфекционная причина PFAPA не обнаружена, поэтому это не заразное заболевание. Понятно, что воспалительный процесс активизируется во время эпизодов, но неясно, почему он запускается.
Каковы основные симптомы синдрома PFAPA?
Основными симптомами PFAPA являются:
- Эпизодические лихорадки
- Боль в горле
- Язвы во рту
- Увеличенные шейные лимфатические узлы (шейные железы, важная часть иммунной системы)
Приступы лихорадки начинаются внезапно и длятся от трех до семи дней. Во время приступов ребенок выглядит очень больным и жалуется как минимум на один из трех вышеперечисленных симптомов. Эпизоды лихорадки повторяются каждые несколько недель, и часто семьи знают точный день, когда начнется приступ. В день начала лихорадки ребенок почувствует себя немного плохо перед приступом, и семья знает, что приступ вот-вот начнется. Не у всех детей есть все симптомы, особенно язвы во рту. У некоторых детей есть другие симптомы, например:
Во время приступов ребенок выглядит очень больным и жалуется как минимум на один из трех вышеперечисленных симптомов. Эпизоды лихорадки повторяются каждые несколько недель, и часто семьи знают точный день, когда начнется приступ. В день начала лихорадки ребенок почувствует себя немного плохо перед приступом, и семья знает, что приступ вот-вот начнется. Не у всех детей есть все симптомы, особенно язвы во рту. У некоторых детей есть другие симптомы, например:
- Боль в суставах
- Боль в животе
- Головная боль
- Рвота
- Диарея
Как диагностируется синдром PFAPA?
Не существует лабораторных тестов или процедур визуализации, специфичных для диагностики PFAPA. Заболевание будет диагностировано на основании результатов медицинского осмотра и других симптомов. Воспалительные анализы крови, такие как количество лейкоцитов, скорость оседания эритроцитов и С-реактивный белок, увеличиваются во время приступов. Перед подтверждением диагноза важно исключить все другие заболевания, которые могут проявляться сходными симптомами (особенно стрептококковая инфекция горла). Резкий ответ на лечение (см. ниже) также помогает диагностировать PFAPA.
Резкий ответ на лечение (см. ниже) также помогает диагностировать PFAPA.
Как лечится синдром PFAPA?
Специального лечения PFAPA не существует. Целью лечения является контроль симптомов во время эпизодов лихорадки, сокращение продолжительности эпизодов и, у некоторых детей, предотвращение приступов. У большинства детей заболевание проходит само по себе без лечения, обычно после 10 лет. Лихорадка обычно плохо поддается лечению Тайленолом® или нестероидными противовоспалительными препаратами. Было показано, что однократная доза стероидов (обычно преднизолона), введенная при появлении первых симптомов, сокращает длительность эпизода, а иногда даже прекращает его. Однако интервал между эпизодами также может быть сокращен при таком лечении, и следующий эпизод может произойти раньше, чем ожидалось. У некоторых пациентов прием циметидина (препарат, применяемый для лечения язвы желудка) может предотвратить возникновение приступов. У пациентов с очень частыми приступами может быть рассмотрена тонзиллэктомия (удаление миндалин хирургическим путем).
Каковы исход и течение синдрома PFAPA?
Заболевание может длиться несколько лет. Со временем интервалы между эпизодами будут увеличиваться и обычно после 10 лет проходят сами по себе. Дети с PFAPA продолжают нормально расти и развиваться.
Типы лихорадки Дифференциальная диагностика
25 ноября 2015 г.
Лихорадка (также известная как лихорадка, высокая температура или высокая температура) является нормальной реакцией организма на различные состояния, наиболее частым из которых является инфекция, и является очень распространенным медицинским признаком. Лихорадка возникает, когда температура тела повышается в результате того, что термостат тела сбрасывается на более высокую, чем обычно, температуру. Лихорадка является одним из естественных способов защиты организма от бактерий и вирусов, которые не могут жить при более высоких температурах. Таким образом, субфебрилитет обычно не лечится, если нет других тревожных симптомов. Лихорадка является лишь частью болезни и, как правило, не более важна, чем другие симптомы, такие как кашель, боль в горле или утомляемость.
Лихорадка является лишь частью болезни и, как правило, не более важна, чем другие симптомы, такие как кашель, боль в горле или утомляемость.
У меня жар?
У разных людей наблюдаются нормальные колебания температуры тела, поэтому не существует единого значения, определяемого как лихорадка. Однако в зависимости от того, как и где измеряется температура, обычно считаются лихорадочными следующие температуры:
- Ректальная температура выше 100,4°F (38°C)
- Температура полости рта выше 100°F (37,8°C)
- Подмышечная (подмышечная) температура выше 99°F (37,2°C)
- Температура уха (барабанной перепонки) выше 100,4°F (38°C) в ректальном режиме или 99,5°F (37,5°) в оральном режиме
- Температура лба (височная артерия) выше 100,4°F (38°C)
Когда температура слишком высока?
Лихорадка 104°F (40°C) или выше может быть опасна и требует немедленного лечения на дому и срочной медицинской помощи, поскольку она может привести к делирию или фебрильным судорогам, особенно у маленьких детей и младенцев.
Лихорадку не следует путать с гипертермией, которая представляет собой дефект реакции вашего организма на тепло (терморегуляция), вызванный внешними источниками, такими как нахождение в жаркой среде.
Что вызывает лихорадку?
Дифференциальная диагностика лихорадки обширна, поскольку она может возникать при многих заболеваниях, но ее сочетание с другими симптомами, включая озноб, потливость, кашель или боль в горле, может помочь сузить дифференциальную диагностику, и в большинстве случаев ее причина связана с повседневными заболевания, включая грипп или фарингит, которые можно лечить с помощью самопомощи в течение нескольких дней с последующим наблюдением, чтобы увидеть, улучшаются ли симптомы. Если симптомы продолжают ухудшаться или появляются другие симптомы, такие как ригидность затылочных мышц, светобоязнь или боль в животе, следует немедленно обратиться за медицинской помощью.
Дифференциальный диагноз лихорадки
Различные типы лихорадки
Необходимо учитывать характер или тип лихорадки и ее продолжительность, поскольку существует много типов, которые могут помочь сузить дифференциальный диагноз, который вы рассматриваете. .
.
Непрерывная лихорадка: Когда температура остается выше нормы в течение 24-часового периода и не колеблется более чем на 1° Цельсия в течение 24 часов. Этот тип лихорадки встречается при крупозной пневмонии, брюшном тифе, инфекциях мочевыводящих путей, инфекционном эндокардите, бруцеллезе и сыпном тифе.
Ремиттирующая лихорадка: Температура остается выше нормы в течение дня и колеблется более чем на 2° по Цельсию в течение 24 часов. Этот тип наблюдается у больных брюшным тифом и инфекционным эндокардитом.
Лихорадка Пеля Эбштейна: Характерно регулярное чередование повторяющихся приступов лихорадки и афебрильных периодов. Температура может повышаться в течение 3 дней, оставаться высокой в течение 3 дней, а затем спадает в течение 3 дней. Затем пациент может находиться в состоянии апирексии в течение 9 дней.
Перемежающаяся лихорадка: В течение 24 часов температура присутствует только в течение нескольких часов дня, а в остальное время она нормальная. Всплеск может происходить в одно и то же время каждый день, через день или каждые несколько дней, но обычно имеет повторяющийся характер. Примерами некоторых заболеваний, сопровождающихся перемежающейся лихорадкой, являются малярия, пиемия и септицемия.
Всплеск может происходить в одно и то же время каждый день, через день или каждые несколько дней, но обычно имеет повторяющийся характер. Примерами некоторых заболеваний, сопровождающихся перемежающейся лихорадкой, являются малярия, пиемия и септицемия.
Септическая лихорадка: Очень высокая температура, которая не улучшается при приеме жаропонижающих средств, может указывать на септическую лихорадку, и пациента следует срочно осмотреть и осмотреть, чтобы предотвратить дальнейшее ухудшение состояния его здоровья.
Циклические возвратные лихорадки или периодические лихорадки: Это рецидивы лихорадки, которые длятся от нескольких дней до нескольких недель и разделены бессимптомными интервалами. Этот тип лихорадки может быть вызван рецидивирующей инфекцией, злокачественными новообразованиями или неинфекционными воспалительными заболеваниями. Приступы лихорадки, которые следуют одному и тому же течению, обычно имеют неинфекционную причину, такую как болезнь Стилла, ревматоидный артрит, болезнь Крона и синдром Беше. Семейная история периодической лихорадки может указывать на семейную средиземноморскую лихорадку или синдром гипер-IgD.
Семейная история периодической лихорадки может указывать на семейную средиземноморскую лихорадку или синдром гипер-IgD.
Если вы не знаете, что это за лихорадка
Лихорадка неизвестного происхождения определяется как:
- Температура выше 101°F или 38,3°C в нескольких случаях
- Продолжительность более 3 недель
- При невозможности установить диагноз, несмотря на 1 неделю стационарного обследования
Лихорадка неизвестного происхождения, которая продолжается и не имеет других симптомов, таких как потеря веса, как правило, свидетельствует о более серьезном прогрессирующем состоянии.
Примеры причин лихорадки неизвестного происхождения:
Лихорадка неизвестного происхождения Причины
история болезни пациента, в том числе выезжали ли они за границу, а затем исключать и исключать заболевания при дифференциальном диагнозе, выполняя любые необходимые клинические тесты. Диагностика лихорадки неизвестного происхождения может быть полезна для привлечения внимания к недиагностированному состоянию. Лечение лихорадки неизвестного происхождения сильно различается и зависит от основной причины. В 30% случаев больной выписывается без окончательного диагноза, и во многих случаях лихорадка неясного генеза со временем проходит.
Диагностика лихорадки неизвестного происхождения может быть полезна для привлечения внимания к недиагностированному состоянию. Лечение лихорадки неизвестного происхождения сильно различается и зависит от основной причины. В 30% случаев больной выписывается без окончательного диагноза, и во многих случаях лихорадка неясного генеза со временем проходит.
Лихорадка у пациентов является сложной проблемой и одним из наиболее распространенных симптомов. Если она возникает с какими-либо другими симптомами, то по комбинации часто помогает определить, какое заболевание у больного. Когда это происходит само по себе, важно регулярно измерять лихорадку в течение определенного периода времени. Тогда можно определить, есть ли закономерности, снижается ли жаропонижающими средствами, насколько высока температура по сравнению с исходной температурой больного? Это с тщательным обследованием и сбором анамнеза определит, каким должен быть следующий курс действий.
Если вы пациент и не уверены в своих симптомах лихорадки, поместите их в бесплатную программу проверки симптомов Isabel для пациентов.
