Судороги после акдс: Вакцинация у детей, фебрильные судороги и эпилепсия
Вакцинация у детей, фебрильные судороги и эпилепсия
Вакцинация детей, несомненно, является эффективным методом предотвращения многих заболеваний. Но как только болезни, профилактируемые вакцинацией, стали редкими сразу возник вопрос о ее побочных эффектах. Наряду с острыми аллергическими реакциями родителей волнует возможность неврологических осложнений, например фебрильных судорог (ФС) и эпилепсии [1]. Не только многие родители, но и врачи боятся усугубления неврологических проблем в результате вакцинации, а развитие эпилепсии, совпадающее с ней по времени, только увеличивает эти опасения. В результате родители либо откладывают сроки вакцинации своих детей, либо вообще от нее отказываются, что приводит к вспышкам таких серьезных заболеваний, как корь.
Конечно, невролог не должен решать вопросы: проводить или не проводить вакцинацию, чем конкретно вакцинировать ребенка. Согласно Приказу Минздрава России № 125н от 21.03.14 (ред. от 13.04.17) «Об утверждении национального календаря профилактических прививок и календаря профилактических прививок по эпидемическим показаниям», «вакцинацию осуществляют медицинские работники, прошедшие обучение по вопросам применения иммунобиологических лекарственных препаратов для иммунопрофилактики инфекционных болезней, организации проведения вакцинации, техники проведения вакцинации, а также по вопросам оказания медицинской помощи в экстренной или неотложной форме»1.
Однако никто из неврологов не проходил подобного обучения, и решение проблемы вакцинации целиком ложится на плечи педиатра. Задача невролога — точно сформулировать неврологический диагноз. Но в сложившейся клинической практике педиатры очень часто просят заключение невролога по поводу возможности вакцинации. Кроме того, родители пациентов (в частности, страдающих эпилепсией) задают много вопросов по этому поводу, им необходимы более или менее подробные разъяснения.
В настоящей работе источники литературы, посвященной этой проблеме, сгруппированы по трем тематическим направлениям: вакцино-индуцированные судороги, вакцинация ребенка с ФС, вакцинация ребенка с эпилепсией.
Вакцино-индуцированные судороги. В инструкциях ко многим вакцинам описан такой побочный эффект, как судороги: например, к вакцинам против кори, паротита и краснухи (КПК), гепатита А, полиомиелита, менингококковой инфекции, гриппа типа В, адсорбированной коклюшно-дифтерийно-столбнячной вакцине (АКДС), вакцине против тифа и болезни Лайма [2]. Как правило, судороги ассоциированы с повышением температуры, т. е. являются фебрильными.
Как правило, судороги ассоциированы с повышением температуры, т. е. являются фебрильными.
Вакцино-индуцированные ФС, как правило, развиваются в течение 72 ч после вакцинации. Причем некоторые вакцины более, чем другие, ассоциированы с ФС: АКДС (особенно неинактивированная) и КПК (особенно в совокупности с вакциной против ветряной оспы) [3]. Вакцина против ветряной оспы производится только за рубежом, но довольно часто применяется и в Российской Федерации. В вакцине АКДС наиболее реактогенным считается коклюшный компонент [4]. После введении комбинированной вакцины КПК ФС развиваются не в течение 3 сут, а между 7-ми и 14-ми сутками [3]. Реже упоминается, что вакцины против гриппа и пневмококка также могут сопровождаться повышенным риском ФС [4, 5].
Точные эпидемиологические данные по частоте развития ФС после вакцинаций не известны. Эксперты ВОЗ приводят величину 0,08 на 1000 прививок АКДС2, что в 70 раз ниже частоты ФС, вызванных осложнениями инфекций, против которых направлена вакцина, и в 500 раз меньше частоты обычных ФС. S. David и соавт. [6] провели анкетирование родителей 15 069 детей первого года жизни, получавших неинактивированную вакцину АКДС, и 13 069 детей, получавших инактивированную вакцину АКДС. При этом ФС отмечались редко и только после 4-й иммунизации (0,06% при неинактивированной вакцине и 0,02% при инактивированной). Частота развития ФС была одинаковой у детей с ФС в анамнезе и без них [3]. Оценка частоты и риска развития ФС при вакцинации против гриппа затруднена наличием большого количества типов и партий противогриппозных вакцин, по всей видимости, обладающих различной реактогенностью [4].
S. David и соавт. [6] провели анкетирование родителей 15 069 детей первого года жизни, получавших неинактивированную вакцину АКДС, и 13 069 детей, получавших инактивированную вакцину АКДС. При этом ФС отмечались редко и только после 4-й иммунизации (0,06% при неинактивированной вакцине и 0,02% при инактивированной). Частота развития ФС была одинаковой у детей с ФС в анамнезе и без них [3]. Оценка частоты и риска развития ФС при вакцинации против гриппа затруднена наличием большого количества типов и партий противогриппозных вакцин, по всей видимости, обладающих различной реактогенностью [4].
Следует помнить, что при развитии осложнений наличие временно́й связи не обязательно свидетельствует о связи причинно-следственной, что, в частности, подтверждается результатами двойного слепого исследования [7], в котором частота ФС при введении комбинированной вакцины КПК сравнивалась с плацебо. По данным исследования, у 6% детей лихорадка развилась при применении плацебо, а у 88% детей с лихорадкой из группы вакцинированных она не была связана с вакцинацией. Таким образом, возможно, риск возникновения вакцино-индуцированных ФС сильно преувеличен.
Таким образом, возможно, риск возникновения вакцино-индуцированных ФС сильно преувеличен.
Точные механизмы развития ФС при вакцинации пока не известны [4]. Однако установлено, что ФС любой этиологии в значительной мере обусловлены генетическими факторами. Так, результаты исследования B. Feenstra и соавт. [8] показали, что у детей с вакцино-индуцированными ФС есть генетическая склонность к иммунологическим нарушениям и к лихорадке, а не к судорогам. У 929 пациентов с ФС после вакцинации были описаны частые хромосомные варианты в генах IFI44L (ген, индуцированный интерфероном) и в генах рецепторов к вирусу кори CD46. В то же время в группах 1070 детей с ФС, не связанных с вакцинацией, были обнаружены другие частые хромосомные варианты с локусами, ассоциированными с судорогами (SCN1A, SCN2A, TMEM16), и локусом, который ассоциирован с уровнем магния.
Интересно также исследование S. Auvin и соавт. [9], продемонстрировавшее четкий провоспалительный профиль моноцитов с увеличением IL-1β, IL-6, TNF-α у пациентов с синдромом Драве после вакцинации по сравнению с контрольной группой.
[9], продемонстрировавшее четкий провоспалительный профиль моноцитов с увеличением IL-1β, IL-6, TNF-α у пациентов с синдромом Драве после вакцинации по сравнению с контрольной группой.
Считается, что одновременное введение нескольких вакцин может увеличивать риск развития ФС. В международной практике вакцину КПК иногда совмещают с вакцинированием против ветряной оспы. Такое совмещение в 2 раза повышает частоту вакцино-индуцированных ФС [4]. Ранний детский возраст (до 2 лет) ранее относили к фактору риска развития Ф.С. Но попытка отложить вакцинацию до более старшего возраста с целью уменьшения риска не увенчалась успехом. Более того, результаты исследования M. Daley и соавт. [10] выявили, что если отложить срок вакцинации против кори, паротита и краснухи до возраста ребенка старше 15 мес, то это увеличит риск развития Ф.С. Таким образом, откладывание срока вакцинации до более старшего возраста ребенка не снижает риск развития ФС, т. е. нецелесообразно [10, 11].
Вакцинация и эпилепсия. Считается, что вакцинация увеличивает риск ФС, но не увеличивает риск развития афебрильных эпилептических приступов [3, 4, 11]. Так, M. Griffin и соавт. [12] провели анализ 38 171 вакцинации АКДС и статистически достоверно показали увеличение числа ФС, но не нашли связи с афебрильными приступами. По данным S. Shorvon и A. Berg [13], риск развития афебрильного приступа после вакцинации составляет 1 на 76 133. Результаты исследования S. Håberg и соавт. [14] выявили, что противогриппозная вакцина не увеличивает риск развития эпилепсии: были обследованы более 500 тыс. детей, у которых вакцинация не привела к увеличению числа новых случаев эпилепсии. По данным ВОЗ, вероятность развития афебрильных эпилептических приступов, осложняющих прививку АКДС, составляет 0,06 на 1000 детей, что в 333 раз меньше, чем вероятность развития афебрильных приступов в результате осложнениях этих инфекций. Таким образом, причинная связь вакцинации с развитием эпилепсии не доказана [4].
Считается, что вакцинация увеличивает риск ФС, но не увеличивает риск развития афебрильных эпилептических приступов [3, 4, 11]. Так, M. Griffin и соавт. [12] провели анализ 38 171 вакцинации АКДС и статистически достоверно показали увеличение числа ФС, но не нашли связи с афебрильными приступами. По данным S. Shorvon и A. Berg [13], риск развития афебрильного приступа после вакцинации составляет 1 на 76 133. Результаты исследования S. Håberg и соавт. [14] выявили, что противогриппозная вакцина не увеличивает риск развития эпилепсии: были обследованы более 500 тыс. детей, у которых вакцинация не привела к увеличению числа новых случаев эпилепсии. По данным ВОЗ, вероятность развития афебрильных эпилептических приступов, осложняющих прививку АКДС, составляет 0,06 на 1000 детей, что в 333 раз меньше, чем вероятность развития афебрильных приступов в результате осложнениях этих инфекций. Таким образом, причинная связь вакцинации с развитием эпилепсии не доказана [4].
Не обнаружено корреляций между вакцинацией и развитием специфического эпилептического синдрома, кроме того, считается, что не увеличивается и риск развития эпилептических энцефалопатий [3]. Существует временно́е совпадение сроков активной ревакцинации ребенка первого года жизни и пика дебюта синдрома Веста (около 5—7 мес жизни), но причинно-следственная связь не подтверждается. В отдельных странах специально сдвигались сроки вакцинации, но это не изменило частоту синдрома Веста [3].
Существует временно́е совпадение сроков активной ревакцинации ребенка первого года жизни и пика дебюта синдрома Веста (около 5—7 мес жизни), но причинно-следственная связь не подтверждается. В отдельных странах специально сдвигались сроки вакцинации, но это не изменило частоту синдрома Веста [3].
Однако синдром Драве (синоним — тяжелая миоклоническая эпилепсия младенчества) и связь с вакцинацией заслуживают отдельного обсуждения. Синдром Драве — это ранняя эпилептическая энцефалопатия, при которой самыми частыми клиническими проявлениями являются фебрильный статус и/или пролонгированные Ф.С. Впервые о связи введения АКДС и приступов сообщили S. Bercovic и соавт. [15] в 2006 г. — у 11 из 14 пациентов с аллергической вакцинной энцефалопатией была обнаружена мутация в гене SCN1A. Из обследованных пациентов только 8 имели четко очерченный клинико-генетический синдром Драве, у остальных были диагностированы «пограничный» (borderline) синдрома Драве и синдром Леннокса—Гасто. Публикация вызвала бурное обсуждение. В сообщениях имеются данные о тесной временно́й связи между прививкой и эпилепсией — от 1 до 14 сут, хотя эпидемиологические исследования пока не подтверждают эту связь. Возможно, что вакцинация вызывает лихорадку, которая провоцирует клинические проявления, но в этом случае вакцина сама по себе не может являться причиной [3].
Публикация вызвала бурное обсуждение. В сообщениях имеются данные о тесной временно́й связи между прививкой и эпилепсией — от 1 до 14 сут, хотя эпидемиологические исследования пока не подтверждают эту связь. Возможно, что вакцинация вызывает лихорадку, которая провоцирует клинические проявления, но в этом случае вакцина сама по себе не может являться причиной [3].
N. Zamponi и соавт. [16] провели сравнение частоты вакцино-ассоциированных судорог (в том числе после АКДС) у 72 пациентов с мутациями в гене SCN1A (с фенотипом синдрома Драве и генерализованной эпилепсии/ФС плюс) и у 11 пациентов с аналогичными фенотипами, но без мутаций. Вакцино-индуцированные судороги отмечались у 25% пациентов с мутацией и у 18% пациентов без нее (статистическая разница не была получена). При наличии мутаций судороги далеко не всегда были фебрильными (только в 1/3 случаев). Было показано, что у пациентов, у которых приступы начинались в первые 48 ч после вакцинации, в дальнейшем наблюдались более раннее начало афебрильных приступов и более высокая частота эпилептического статуса (по сравнению с началом приступов после 48 ч). Другой разницы между группами не было, в том числе, что очень важно, по когнитивным функциям. Авторы [16] пришли к выводу, что вакцинация не оказывает существенного эффекта на течение синдрома Драве и генерализованной эпилепсии/ФС плюс, обусловленных мутациями в гене SCN1A.
Другой разницы между группами не было, в том числе, что очень важно, по когнитивным функциям. Авторы [16] пришли к выводу, что вакцинация не оказывает существенного эффекта на течение синдрома Драве и генерализованной эпилепсии/ФС плюс, обусловленных мутациями в гене SCN1A.
Вакцинация ребенка с ФС. Согласно Федеральному закону и Методическим указаниям 2002 г.3, а также более новому документу (Письмо Минздрава России от 23.08.17 № 15−2/10/2−58964), абсолютным противопоказанием к вакцинации является сильная реакция или поствакцинальное осложнение на ее предыдущее введение. К сильным реакциям на прививку со стороны ЦНС относится развитие вакцино-ассоциированных энцефалита и полиомиелита; поражения ЦНС с генерализованными или фокальными остаточными проявлениями, приводящими к инвалидности (энцефалопатия, серозный менингит, неврит, полиневрит), а «также афебрильные судороги» (цит. по Письму Минздрава России, 2017), т. е. имеются в виду доказанные случаи развития вакцино-индуцированной эпилепсии, вероятность которой чрезвычайно мала. Все исследователи едины в том, что прививать ребенка с ФС необходимо. К сожалению, эта рекомендация имеет средний, а не высокий класс доказательности (III), т. е. данные были получены в результате хорошо спланированных нерандомизированных исследований), но, скорее всего, будущие исследования ничего в ней не изменят (уровень рекомендации высокий — А) [3]. Родители ребенка с ФС должны быть информированы о том, что некоторые вакцины ассоциированы с температурными реакциями, особенно в раннем детском возрасте. Японские неврологи считают, что вакцинацию лучше провести через некоторый временно́й интервал после ФС (через 3 мес), но такая тактика носит эмпирический характер [17]. Согласно Приказу Минздрава России № 125н от 21.03.14 наличие ФС, развившихся при предыдущем вакцинировании АКДС, не является противопоказанием к следующему введению дозы АКДС. Однако после ее применения целесообразно назначение парацетамола (10—15 мг/кг 3—4 раза в сутки) в течение 1—2 сут (пункт 7.3).
Все исследователи едины в том, что прививать ребенка с ФС необходимо. К сожалению, эта рекомендация имеет средний, а не высокий класс доказательности (III), т. е. данные были получены в результате хорошо спланированных нерандомизированных исследований), но, скорее всего, будущие исследования ничего в ней не изменят (уровень рекомендации высокий — А) [3]. Родители ребенка с ФС должны быть информированы о том, что некоторые вакцины ассоциированы с температурными реакциями, особенно в раннем детском возрасте. Японские неврологи считают, что вакцинацию лучше провести через некоторый временно́й интервал после ФС (через 3 мес), но такая тактика носит эмпирический характер [17]. Согласно Приказу Минздрава России № 125н от 21.03.14 наличие ФС, развившихся при предыдущем вакцинировании АКДС, не является противопоказанием к следующему введению дозы АКДС. Однако после ее применения целесообразно назначение парацетамола (10—15 мг/кг 3—4 раза в сутки) в течение 1—2 сут (пункт 7.3).
Вакцинация ребенка с эпилепсией. Проводить вакцинацию у пациента с эпилепсией также необходимо. Итальянские детские неврологи [3] считают, что не существует повышенного риска развития побочных эффектов после вакцинации у детей с идиопатической или симптоматической эпилепсией. Тем не менее у этой рекомендации также средняя степень доказательности на фоне ее высокого класса (уровень доказательности III, класс рекомендаций А). Те же авторы пишут, что вакцинация не противопоказана детям с эпилептическими энцефалопатиями, синдромами Драве и Веста (уровень доказательности III, класс рекомендаций А), и вероятный риск эпилептической энцефалопатии не должен заставлять родителей отказываться от вакцинации (уровень доказательности III, класс рекомендаций А). При этом родители пациентов с синдромом Драве должны быть информированы о рисках вакцинации и о возможной их профилактике с помощью противоэпилептических препаратов. Пациентам с мутацией в гене SCN1A показана ранняя и более агрессивная терапия (антипиретики и/или бензодиазепины на короткий период до и после вакцинации) в сочетании с ранней противосудорожной терапией, которая может предотвратить последующие вакцино-индуцированные приступы (уровень доказательности III, класс рекомендаций D, т.
Проводить вакцинацию у пациента с эпилепсией также необходимо. Итальянские детские неврологи [3] считают, что не существует повышенного риска развития побочных эффектов после вакцинации у детей с идиопатической или симптоматической эпилепсией. Тем не менее у этой рекомендации также средняя степень доказательности на фоне ее высокого класса (уровень доказательности III, класс рекомендаций А). Те же авторы пишут, что вакцинация не противопоказана детям с эпилептическими энцефалопатиями, синдромами Драве и Веста (уровень доказательности III, класс рекомендаций А), и вероятный риск эпилептической энцефалопатии не должен заставлять родителей отказываться от вакцинации (уровень доказательности III, класс рекомендаций А). При этом родители пациентов с синдромом Драве должны быть информированы о рисках вакцинации и о возможной их профилактике с помощью противоэпилептических препаратов. Пациентам с мутацией в гене SCN1A показана ранняя и более агрессивная терапия (антипиретики и/или бензодиазепины на короткий период до и после вакцинации) в сочетании с ранней противосудорожной терапией, которая может предотвратить последующие вакцино-индуцированные приступы (уровень доказательности III, класс рекомендаций D, т. е. слабая степень рекомендации) [3].
е. слабая степень рекомендации) [3].
В отечественной медицине традиционно считается, что коклюшный компонент противопоказан пациентам с эпилепсией (т.е. вакцина АКДС). Вакцины АДС, АДС-м и АД-м постоянных противопоказаний не имеют, при эпидемиологической необходимости их можно применять даже на фоне обострения заболевания. В случае сильной реакции на предыдущую дозу этих вакцин рекомендуется проводить повторную вакцинацию на фоне применения стероидов (преднизолон внутрь 1—1,5 мг/кг в сутки за сутки до и сразу после прививки). Американские рекомендации по применению АКДС (2018) [18] менее жесткие. Они относят прогрессирующие и нестабильные неврологические нарушения, включая инфантильные спазмы, неконтролируемые судороги или прогрессирующую энцефалопатию к разделу состояний, при которых необходима предосторожность при вакцинации АКДС, т. е. выгода для пациента от вакцинации должна превышать возможные риски, и это соотношение выгоды и рисков оценивается индивидуально в каждом конкретном случае. Выходом могло бы быть введение инактивированной коклюшной вакцины, но пока отсутствуют отечественные рекомендации по возможности ее применения у пациентов с эпилепсией.
Выходом могло бы быть введение инактивированной коклюшной вакцины, но пока отсутствуют отечественные рекомендации по возможности ее применения у пациентов с эпилепсией.
Существуют противоречия по вопросам вакцинации детей и ее возможных осложнений между врачами и родителями пациентов. Существует так называемое «антивакцинное» лобби, которое сеет страх и сомнения в умах родителей, доказывая, что причинной развития тяжелых неврологических заболеваний, в том числе эпилепсии, является вакцинация. Часто родители, имея ребенка с тяжелой эпилепсией, убеждены, что именно вакцина вызвала у него судороги. Наличие мифов в отношении вакцинации приводит к росту прослойки невакцинированных детей и к вспышкам инфекций (например, кори) даже в развитых странах [19].
Однако, как видно из приведенного обзора, риск развития вакцино-индуцированных ФС невысок, а их прогноз абсолютно благоприятен, а опасения родителей, а иногда и врачей, в отношении неврологических осложнений вакцинации сильно преувеличены. Риск развития ФС и возможность развития эпилепсии значительно выше при самих инфекционных заболеваниях, чем при прививках от них. Кроме того, следует помнить об успехах совершенствования вакцинации и появлении большого числа инактивированных вакцин, что также снижает риск неврологических осложнений после вакцинации. Для того чтобы предотвратить потенциально возможное развитие энцефалопатии у пациентов с определенными генными мутациями, необходимо более ясное представление о взаимодействии вакцины и генной мутации. Это не значит, что данная группа пациентов не должна прививаться — прививки им показаны, но врачам следует подходить к вакцинации индивидуально и выбирать вакцины, которые ассоциированы с наименьшим риском развития судорог.
Риск развития ФС и возможность развития эпилепсии значительно выше при самих инфекционных заболеваниях, чем при прививках от них. Кроме того, следует помнить об успехах совершенствования вакцинации и появлении большого числа инактивированных вакцин, что также снижает риск неврологических осложнений после вакцинации. Для того чтобы предотвратить потенциально возможное развитие энцефалопатии у пациентов с определенными генными мутациями, необходимо более ясное представление о взаимодействии вакцины и генной мутации. Это не значит, что данная группа пациентов не должна прививаться — прививки им показаны, но врачам следует подходить к вакцинации индивидуально и выбирать вакцины, которые ассоциированы с наименьшим риском развития судорог.
1. Некоторые вакцины (АКДС и ассоциированная вакцина КПК) обладают риском развития Ф.С. Они, вероятно, могут провоцировать ФС, но не являются их причиной. Откладывание срока вакцинации до более старшего возраста ребенка не снижает риск развития ФС, т. е. нецелесообразно.
е. нецелесообразно.
2. Вакцины не увеличивают риск развития эпилепсии и синдрома Веста. Вакцинация АКДС, вероятно, может способствовать более раннему развитию приступов при синдроме Драве, но не оказывает существенного эффекта на его течение.
3. Наличие Ф.С. в анамнезе не является противопоказанием для вакцинации. Родители ребенка с ФС должны быть информированы о том, что некоторые вакцины ассоциированы с температурными реакциями.
4. Наличие эпилепсии не является противопоказанием к вакцинации в целом. Согласно отечественному законодательству, из вакцинации должен быть исключен коклюшный компонент.
5. Для пациентов с эпилептическими энцефалопатиями существуют международные рекомендации по необходимости прививок (согласно отечественному законодательству, из вакцинации должен быть также исключен коклюшный компонент). Родители пациентов с синдромом Драве должны быть информированы о рисках вакцинации и о возможной их профилактике с помощью противоэпилептических препаратов.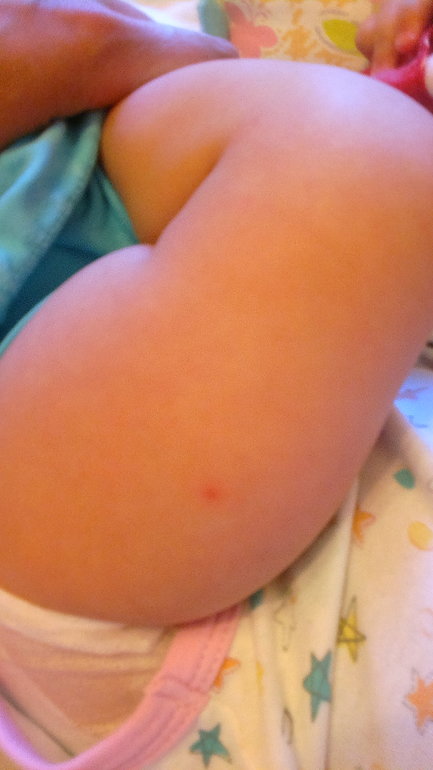
Авторы заявляют об отсутствии конфликта интересов.
e-mail: [email protected]
1http://legalacts.ru/doc/prikaz-minzdrava-rossii-ot-21032014-n-125n/#100005
2WHO Global Vaccine Safety Essential Medicines & Health Products 20, Avenue Appia, CH-1211, Geneva 27, Switzerland. INFORMATION SHEET OBSERVED RATE OF VACCINE REACTIONS DIPHTHERIA, PERTUSSIS, TETANUS, 2014 VACCINES http://www.who.int/vaccine_safety/initiative/tools/DTP_vaccine_rates_information_sheet.pdf
3Медицинские противопоказания к проведению профилактических прививок препаратами национального календаря прививок. Методические указания МУ 3.3.1.1095—02 Минздрав России, 2002.
4Письмо Минздрава России от 23.08.17 № 15−2/10/2−5896 Методические рекомендации «Противопоказания к вакцинации». http://www.consultant.ru/document/cons_doc_LAW_222956/
Поствакцинальные фебрильные судороги
Фебрильные судороги – повод отказаться от вакцинации?
Фебрильные судороги у детей не так уж и редки. Педиатрам они известны хорошо, родителям – хуже. И когда возникают на фоне поствакцинальной лихорадки, могут послужить причиной отказа родителей от прививок в дальнейшем. Одни ссылаются на непереносимость их ребенком вакцин, другие во всем винят примеси в вакцинных препаратах.
Педиатрам они известны хорошо, родителям – хуже. И когда возникают на фоне поствакцинальной лихорадки, могут послужить причиной отказа родителей от прививок в дальнейшем. Одни ссылаются на непереносимость их ребенком вакцин, другие во всем винят примеси в вакцинных препаратах.
С целью уточнения рациональности отказа от прививок из-за фебрильных судорог, в Австралии, в 2013-2014 годах было проведено масштабное клиническое исследование. Оценивался судорожный фебрильный синдром, как показание к госпитализации детей, в привязке к вакцинации и без оной.
Эпидемиология
Фебрильные судороги (ФС) встречаются у 3-5% детей возрастом от 6 месяцев до 6 лет. Пик заболеваемости приходится на 2 год жизни. В качестве провоцирующих факторов (кроме, собственно гипертермии), рассматриваются наследственная предрасположенность, неблагоприятная экологическая обстановка и другие, частные явления.
Чаще всего ФС возникают на пике лихорадки при острых вирусных инфекциях, когда температура повышается резко и на значительные цифры.
Первый эпизод фебрильных судорог, особенно у младенца, может сильно напугать родителей и, как правило, становится поводом к неотложному обращению в больницу. Статистика утверждает, что у 30% детей такие припадки повторяются. С предсказуемой реакцией родителей. Сразу отметим, что все исследования и наблюдения показывают полное благополучие со стороны здоровья таких детей в дальнейшем: даже не единичные эпизоды ФС не приводят к развитию эпилепсии. Равно, как и не снижают интеллект, успеваемость, и не способствуют поведенческим расстройствам.
Роль вакцин
Ряд клинических наблюдений свидетельствуют о провоцирующей роли вакцинных препаратов в плане ФС. Так, эпизоды фебрильных судорог чаще встречаются после применения определенных препаратов. К таковым относятся:
- цельноклеточные коклюшные;
- корьсодержащие вакцины;
- пневмококковые;
- некоторые противогриппозные вакцины.
То есть, большая вероятность развития ФС связана с высокой иммуногенностью вакцины, тем же самым фактором, который сам по себе вызывает лихорадку с высокими цифрами.
Методика исследования
Был проведен статистический анализ 1022 случаев госпитализации детей, от 6 месяцев до 6 лет от роду, по поводу фебрильных судорог, наступивших впервые. При этом случай ФС учитывался, как связанный с вакцинацией при соблюдении трех условий:
- Возникал в период 0-2 суток с момента вакцинации инактивированной вакцины.
- Возникал в период 5-14 суток с момента введения живой ослабленной вакцины.
- Возникал в период 0-14 суток после применения комбинации живой и инактивированной вакцины.
Остальные случаи рассматривались, как фебрильные судороги, не связанные с вакцинацией.
Результаты исследования
Установить связь фебрильных судорог с вакцинацией удалось всего у 67 (6%) детей, взятых в исследование. А 94% или 955 пациентов, имели эпизод, не связанный с применением каких-либо вакцин.
Из выявленных 67 случаев “вакцинального” генеза, 52 детям (78%), фебрильные судороги дали противокоревые препараты:
- 40 детям применялась комбинированный препарат против кори, паротита, краснухи, Haemophilus influenzae типа b и конъюгата менингококка C;
- 12 эпизодов пришлись на применение вакцины от кори, эпидемического паротита, краснухи и ветрянки.

4 случая были реакцией на прививку от дифтерии, столбняка, бесклеточный коклюш и инактивированный полиомиелит.
Оставшиеся 11 “разделили” между собой вакцины от дифтерии/столбняка/бесклеточного коклюша, гемофильной палочки типа b, гепатита B и инактивированной комбинированной вакцины против полиомиелита с 13-валентной пневмококковой конъюгатной вакциной и ротавирусом (7 детей), ветряная оспа (2 ребенка), поливакцина DTaP/IPV/Hib/HepB (1 случай) и противогриппозная прививка (1 случай).
Выводы и заключения
Больше всего эпизодов поствакцинальных ФС возникало на 9 день от проведения прививки. По тяжести, “вакцинные” случаи никак не отличались от “невакцинных”, что в очередной раз подтверждает исключительно лихорадочный генез судорог.
В заключение, исследователи обращают внимание на такой фактор, как сопутствующая инфекция. Так, у 12% детей с ФС имелись симптомы инфекционного процесса: тошнота, боль в животе, кашель, ринит, уретрит. С оглядкой на этот критерий, и так скудное число поствакцинных фебрильных судорог, сокращается еще больше, так как лихорадка у таких детей могла вызываться инфекцией, а не прививкой.
Для педиатров: детей с фебрильными судорогами поствакцинального генеза, следует вести так же, как и пациентов с подобным диагнозом, не имеющих привязки к прививке.
Для родителей: эпизод фебрильных судорог, даже если он возник после прививки, не должен быть поводом к отказу от последующей вакцинации. Потому что, заболев предотвратимой инфекцией, ребенок снова может дать эпизод фебрильных судорог. И с гораздо большей вероятностью, чем в результате прививки.
На основе информации Американской академии педиатрии.
Информационное заявление о вакцине против дифтерии, столбняка и коклюша | CDC
Текущая редакция Дата: 06.08.2021
- Печать VIS [2 страницы]
- RTF-файл [3 страницы]
(Для использования в электронных системах) - ВИС на других языках
- Дополнительная информация о:
- Вакцинация против дифтерии
- Прививка от столбняка
- Вакцинация против коклюша
DTaP также входит в состав комбинированной вакцины VIS, «Первые вакцины для вашего ребенка»
- Зачем делать прививку?
- Вакцина DTaP
- Поговорите со своим лечащим врачом
- Риски реакции на вакцину
- Что делать, если возникла серьезная проблема?
- Национальная программа возмещения вреда, причиненного вакциной
- Как я могу узнать больше?
Вакцина DTaP может предотвратить дифтерию , столбняк и коклюш .
Дифтерия и коклюш передаются от человека к человеку. Столбняк попадает в организм через порезы или раны.
- ДИФТЕРИЯ (D) может привести к затрудненному дыханию, сердечной недостаточности, параличу или смерти.
- СТОЛБНЯК (T) вызывает болезненное напряжение мышц. Столбняк может привести к серьезным проблемам со здоровьем, включая неспособность открыть рот, проблемы с глотанием и дыханием или смерть.
- PERTUSSIS (aP) , также известный как «коклюш», может вызывать неконтролируемый, сильный кашель, который затрудняет дыхание, прием пищи или питье. Коклюш может быть чрезвычайно серьезным, особенно у младенцев и детей младшего возраста, вызывая пневмонию, судороги, повреждение головного мозга или смерть. У подростков и взрослых это может привести к потере веса, потере контроля над мочевым пузырем, потере сознания и переломам ребер из-за сильного кашля.
DTaP предназначен только для детей младше 7 лет.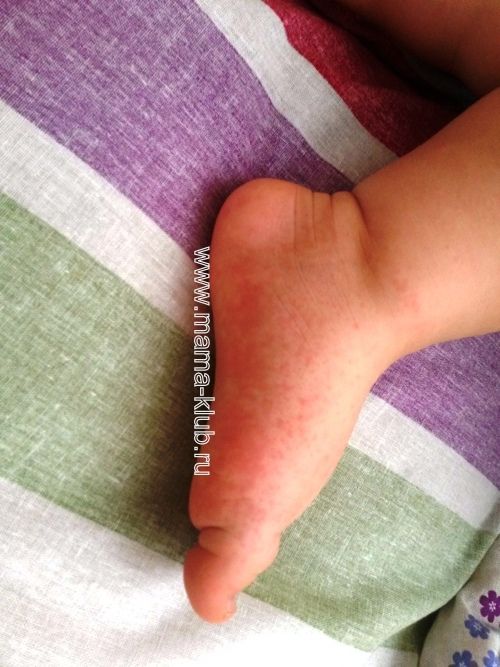 Для детей старшего возраста, подростков и взрослых доступны различные вакцины против столбняка, дифтерии и коклюша (Tdap и Td).
Для детей старшего возраста, подростков и взрослых доступны различные вакцины против столбняка, дифтерии и коклюша (Tdap и Td).
Рекомендуется, чтобы дети получали 5 доз DTaP, обычно в следующем возрасте:
- 2 месяца
- 4 месяца
- 6 месяцев
- 15–18 месяцев
- 4–6 лет
DTaP можно вводить как отдельную вакцину или как часть комбинированной вакцины (тип вакцины, в которой более одной вакцины объединены в одну инъекцию).
DTaP можно вводить одновременно с другими вакцинами.
Сообщите своему поставщику услуг по вакцинации, если человек, получающий вакцину:
- У него была аллергическая реакция после предыдущей дозы любой вакцины, защищающей от столбняка, дифтерии или коклюша , или у него тяжелая, опасная для жизни аллергия
- У него была кома, снижение уровня сознания или длительные судороги в течение 7 дней после предыдущей дозы любой противококлюшной вакцины (АКДС или АКДС)
- Имеет судороги или другое заболевание нервной системы
- Имели когда-либо Синдром Гийена-Барре (также называемый «СГБ»)
- Испытывал сильную боль или отек после предыдущей дозы любой вакцины, защищающей от столбняка или дифтерии
В некоторых случаях лечащий врач вашего ребенка может принять решение отложить вакцинацию DTaP до следующего визита.
Дети с легкими заболеваниями, такими как простуда, могут быть вакцинированы. Детям со средним или тяжелым заболеванием обычно следует подождать, пока они не выздоровеют, прежде чем делать вакцину DTaP.
Лечащий врач вашего ребенка может предоставить вам дополнительную информацию.
- Болезненность или припухлость в месте укола, лихорадка, нервозность, чувство усталости, потеря аппетита и рвота иногда возникают после вакцинации DTaP.
- Более серьезные реакции, такие как судороги, непрекращающийся плач в течение 3 часов и более или высокая температура (более 105°F) после прививки DTaP случаются гораздо реже. В редких случаях за вакцинацией следует отек всей руки или ноги, особенно у детей старшего возраста, когда они получают четвертую или пятую дозу.
Как и в случае с любым лекарством, существует очень малая вероятность того, что вакцина вызовет тяжелую аллергическую реакцию, другие серьезные травмы или смерть.
Аллергическая реакция может возникнуть после того, как вакцинированный человек покинет клинику. Если вы видите признаки тяжелой аллергической реакции (крапивница, отек лица и горла, затрудненное дыхание, учащенное сердцебиение, головокружение или слабость), позвоните по номеру 9-1-1 и доставьте пострадавшего в ближайшую больницу.
Если вы видите признаки тяжелой аллергической реакции (крапивница, отек лица и горла, затрудненное дыхание, учащенное сердцебиение, головокружение или слабость), позвоните по номеру 9-1-1 и доставьте пострадавшего в ближайшую больницу.
Если вас беспокоят другие симптомы, позвоните своему врачу.
О побочных реакциях следует сообщать в Систему отчетности о побочных эффектах вакцин (VAERS). Обычно этот отчет подает ваш лечащий врач, или вы можете сделать это самостоятельно. Посетите веб-сайт VAERS или позвоните по телефону 1-800-822-7967 . VAERS предназначен только для сообщения о реакциях, и сотрудники VAERS не дают медицинских консультаций.
Национальная программа компенсации ущерба от вакцин (VICP) — это федеральная программа, созданная для выплаты компенсаций людям, которые могли пострадать от определенных вакцин. Претензии в отношении предполагаемых травм или смерти в результате вакцинации имеют срок подачи, который может составлять всего два года. Посетите веб-сайт VICP или позвоните по телефону 1-800-338-2382 , чтобы узнать о программе и о подаче заявления.
Посетите веб-сайт VICP или позвоните по телефону 1-800-338-2382 , чтобы узнать о программе и о подаче заявления.
- Спросите своего поставщика медицинских услуг.
- Позвоните в местный или государственный отдел здравоохранения.
- Посетите веб-сайт Управления по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA), чтобы найти вкладыш в упаковку вакцины и дополнительную информацию.
- Обратитесь в Центры по контролю и профилактике заболеваний (CDC):
- Позвоните по номеру 1-800-232-4636 ( 1-800-CDC-INFO ) или
- Посетите веб-сайт вакцин CDC.
Многие информационные бюллетени о вакцинах доступны на испанском и других языках. См. http://www.immunize.org/vis.
Информационный бюллетень о вакцине (промежуточный) § 300aa-26
Департамент здравоохранения и социальных служб
Центры по контролю и профилактике заболеваний
Только для использования в офисе
К началу страницы
Информация о безопасности вакцин против дифтерии, столбняка и коклюша | Безопасность вакцин
ДеСильва М. , Васкес-Бенитес Г., Нордин Д.Д., Липкинд Х.С., Ромитти П.А., ДеСтефано Ф., Харбанда Э.О. Вакцинация Tdap во время беременности и микроцефалия и другие структурные врожденные дефекты у потомства. ЯМА . 1 ноября 2016 г .; 316(17): 1823-1825.
, Васкес-Бенитес Г., Нордин Д.Д., Липкинд Х.С., Ромитти П.А., ДеСтефано Ф., Харбанда Э.О. Вакцинация Tdap во время беременности и микроцефалия и другие структурные врожденные дефекты у потомства. ЯМА . 1 ноября 2016 г .; 316(17): 1823-1825.
Беренсон А.Б., Хирт Дж.М., Рахман М., Лаз Т.Х., Рупп Р.Э., Сарпонг К.О. Материнские и младенческие исходы среди женщин, вакцинированных против коклюша во время беременности. Hum Вакцина Иммунотер . 2 августа 2016 г .; 12(8): 1965-1971. Epub 2016 Mar 22.
Petousis-Harris H, Walls T, Watson D, Paynter J, Graham P, Turner N. Безопасность вакцины Tdap у беременных женщин: обсервационное исследование. BMJ Открытый . 2016 18 апреля; 6(4): e010911.
Моро П.Л., Краган Дж., Теппер Н., Жетеева Ю., Мусеру О., Льюис П., Бродер К. Расширенный надзор за столбнячным анатоксином, редуцированным дифтерийным анатоксином и бесклеточной коклюшной вакциной (Tdap) при беременности в Системе отчетности о побочных эффектах вакцины ( ВАЕРС), 2011-2015 гг. Вакцина . 2016 29 апреля; 34(20): 2349-53. Epub 2016, 22 марта.
Вакцина . 2016 29 апреля; 34(20): 2349-53. Epub 2016, 22 марта.
Regan AK, Tracey LE, Blyth CC, Richmond PC, Effler PV. Проспективное когортное исследование по оценке реактогенности вакцин против коклюша и гриппа, вводимых во время беременности. Вакцина . 2016 29 апреля; 34(20): 2299-304. Epub 2016, 31 марта.
Харбанда Э.О., Васкес-Бенитес Г., Липкинд Х.С., Кляйн Н.П., Читам Т.К., Нейлуэй А.Л., Ли Г.М., Хэмбидж С., Джексон М.Л., Омер С.Б., Маккарти Н., Нордин Д.Д. Вакцинация матерей Tdap: охват и неотложные результаты безопасности в канале данных по безопасности вакцин, 2007–2013 гг. Вакцина . 2016 10 февраля; 34(7): 968-73. Epub 2016 Jan 4.
Walls T, Graham P, Petousis-Harris H, Hill L, Austin N. Исходы для младенцев после воздействия вакцины Tdap во время беременности: обсервационное исследование. BMJ Открытый . 2016 6 января; 6(1): e009536.
Сукумаран Л., Маккарти Н.Л., Харбанда Э.О., Вайнтрауб Э.С., Васкес-Бенитес Г. , Макнейл М.М., Ли Р., Кляйн Н.П., Хэмбидж С.Дж., Налевей А.Л., Лугг М.М., Джексон М.Л., Кинг Д.П., ДеСтефано Ф., Омер С.Б., Оренштейн ВА. Безопасность столбнячного анатоксина, редуцированного дифтерийного анатоксина и бесклеточных вакцин против коклюша и гриппа при беременности. Акушерство Гинекол . 2015 ноябрь; 126(5): 1069-74.
, Макнейл М.М., Ли Р., Кляйн Н.П., Хэмбидж С.Дж., Налевей А.Л., Лугг М.М., Джексон М.Л., Кинг Д.П., ДеСтефано Ф., Омер С.Б., Оренштейн ВА. Безопасность столбнячного анатоксина, редуцированного дифтерийного анатоксина и бесклеточных вакцин против коклюша и гриппа при беременности. Акушерство Гинекол . 2015 ноябрь; 126(5): 1069-74.
Сукумаран Л., Маккарти Н.Л., Харбанда Э.О., Макнейл М.М., Нейлуэй А.Л., Кляйн Н.П., Джексон М.Л., Хэмбидж С.Дж., Лагг М.М., Ли Р., Вайнтрауб Э.С., Беднарчик Р.А., Кинг Д.П., ДеСтефано Ф., Оренштейн В.А., Омер С.Б. Ассоциация вакцинации Tdap с острыми событиями и неблагоприятными исходами родов среди беременных женщин с предшествующими вакцинациями против столбняка. ЯМА . 2015 20 октября; 314(15): 1581-7.
Морган Д.Л., Баггари С.Р., Макинтайр Д.Д., Шеффилд Д.С. Исходы беременности после дородовой вакцинации против столбняка, дифтерии и бесклеточного коклюша. Акушерство Гинекол . 2015 июнь; 125(6): 1433-1438.
Харбанда Э. О., Васкес-Бенитес Г., Липкинд Х.С., Кляйн Н.П., Читам Т.К., Нейлуэй А., Омер С.Б., Хэмбидж С.Дж., Ли Г.М., Джексон М.Л., Маккарти Н.Л., ДеСтефано Ф., Нордин Д.Д. Оценка связи вакцинации матери против коклюша с акушерскими событиями и исходами родов. ЯМА . 2014 12 ноября; 312(18): 1897-904.
О., Васкес-Бенитес Г., Липкинд Х.С., Кляйн Н.П., Читам Т.К., Нейлуэй А., Омер С.Б., Хэмбидж С.Дж., Ли Г.М., Джексон М.Л., Маккарти Н.Л., ДеСтефано Ф., Нордин Д.Д. Оценка связи вакцинации матери против коклюша с акушерскими событиями и исходами родов. ЯМА . 2014 12 ноября; 312(18): 1897-904.
Донеган К., Кинг Б., Брайан П. Безопасность вакцинации беременных против коклюша в Великобритании: наблюдательное исследование. БМЖ. 11 июля 2014 г .; 349: g4219.
Шакиб Дж. Х., Коргенски К., Шэн Х., Варнер М. В., Павия А. Т., Байингтон CL. Столбняк, дифтерия, бесклеточная вакцина против коклюша во время беременности: беременность и последствия для здоровья младенцев. J Педиатр . 2013 ноябрь; 163(5): 1422-6.e1-4. Epub 2013 26 июля.
Чанг С., О’Коннор П.М., Слэйд Б.А., Ву Э.Дж. Постлицензионный надзор США за безопасностью вакцин против столбняка, дифтерии и бесклеточного коклюша у подростков и взрослых: 2005–2007 гг. Вакцина . 2013 27 февраля; 31(10): 1447-52. Epub 2012 8 ноября.
Epub 2012 8 ноября.
Жетеева Ю.А., Моро П.Л., Теппер Н.К., Расмуссен С.А., Бараш Ф.Е., Ревзина Н.В., Киссин Д., Льюис П.В., Юэ Х., Хабер П., Токарс Д.И., Веллоцци С., Бродер К.Р. Сообщения о нежелательных явлениях после введения столбнячного анатоксина, редуцированного дифтерийного анатоксина и бесклеточной вакцины против коклюша у беременных женщин. Am J Obstet Gynecol . 2012 июль; 207(1): 59.e1-7. Epub 2012 May 14.
Moro PL, Yue X, Lewis P, Haber P, Broder K. Нежелательные явления после введения столбнячного анатоксина, редуцированного дифтерийного анатоксина и бесклеточной вакцины против коклюша (Tdap) у взрослых в возрасте 65 лет и старше, о которых сообщалось в Система отчетности о побочных эффектах вакцин (VAERS), 2005–2010 гг. Вакцина . 2011 21 ноября; 29(50): 9404-8. Epub 2011, 13 сентября.
Nordin JD, Yih WK, Kulldorff M, Weintraub E. Tdap и GBS (письмо). Вакцина . 2011 1 февраля; 29(6): 1122.
Talbot EA, Brown KH, Kirkland KB, Baughman AL, Halperin SA, et al. Безопасность иммунизации столбнячно-дифтерийно-бесклеточной коклюшной вакциной (Tdap) менее чем через 2 года после предыдущей вакцинации против столбняка: опыт кампании массовой вакцинации медицинского персонала во время вспышки респираторного заболевания. Вакцина . 2010 ноябрь; 28(50): 8001-7. Epub 2010, 25 сентября.
Безопасность иммунизации столбнячно-дифтерийно-бесклеточной коклюшной вакциной (Tdap) менее чем через 2 года после предыдущей вакцинации против столбняка: опыт кампании массовой вакцинации медицинского персонала во время вспышки респираторного заболевания. Вакцина . 2010 ноябрь; 28(50): 8001-7. Epub 2010, 25 сентября.
Кляйн Н.П., Хансен Дж., Льюис Э., Лайон Л., Нгуен Б. и др. Постмаркетинговая оценка безопасности столбнячного анатоксина, редуцированного дифтерийного анатоксина и трехкомпонентной бесклеточной коклюшной вакцины, вводимой группе подростков в организации по поддержанию здоровья США. Pediatr Infect Dis J . 2010 июль; 29(7): 613-7.
Джексон Л.А., Ю.О., Нельсон Дж., Белонгия Э.А., Хэмбидж С.Дж. и др. Риск местных реакций, сопровождаемых медицинским обслуживанием, после вакцин, содержащих дифтерийный анатоксин, у подростков и молодых людей: исследование Datalink по безопасности вакцин. Вакцина . 2009 г., 6 августа; 27(36): 4912-6.
