Si это что: Si | это… Что такое Si?
Si | это… Что такое Si?
| Кремний/Silicium (Si) | |
|---|---|
| Атомный номер | 14 |
| Внешний вид простого вещества | В аморфной форме — коричневый порошок, в кристаллической — тёмно-серый, слегка блестящий |
| Свойства атома | |
| Атомная масса (молярная масса) | 28,0855 а. е. м. (г/моль) |
| Радиус атома | 132 пм |
| Энергия ионизации (первый электрон) | 786,0(8,15) кДж/моль (эВ) |
| Электронная конфигурация | [Ne] 3s2 3p2 |
| Химические свойства | |
| Ковалентный радиус | 111 пм |
| Радиус иона | 42 (+4e) 271 (-4e) пм |
| Электроотрицательность (по Полингу) | 1,90 |
| Электродный потенциал | 0 |
| Степени окисления | +4, −4, +2 |
| Термодинамические свойства простого вещества | |
| Плотность | 2,33 г/см³ |
| Удельная теплоёмкость | 19,8 Дж/(K·моль) |
| Теплопроводность | 149 Вт/(м·K) |
| Температура плавления | 1688 K |
| Теплота плавления | 50,6 кДж/моль |
| Температура кипения | 2623 K |
| Теплота испарения | 383 кДж/моль |
| Молярный объём | 12,1 см³/моль |
| Кристаллическая решётка простого вещества | |
| Структура решётки | алмаз |
| Период решётки | 5,430 Å |
| Отношение c/a | n/a |
| Температура Дебая | 625,00 K |
| Si | 14 |
| 28,0855 | |
| 3s²3p² | |
| Кремний | |
Содержание
|
История
Схема атома кремния
В чистом виде кре́мний был выделен в 1811 году французскими учеными Жозефом Луи Гей-Люссаком и Луи Жаком Тенаром.
Происхождение названия
В 1825 году шведский химик Йёнс Якоб Берцелиус действием металлического калия на фтористый кремний SiF4 получил чистый элементарный кремний. Новому элементу было дано название «силиций» (от лат. silex — кремень). Русское название «кремний» введено в 1834 году российский химиком Германом Ивановичем Гессом. В переводе c греческого kremnos — «утес, гора».
Нахождение в природе
По распространённости в земной коре кремний среди всех элементов занимает второе место (после кислорода). Масса земной коры на 27,6—29,5 % состоит из кремния. Кремний входит в состав нескольких сотен различных природных силикатов и алюмосиликатов. Больше всего распространен кремнезём — многочисленные формы диоксида кремния (IV) SiO2 (речной песок, кварц, кремень и др.), составляющий около 12 % земной коры (по массе). В свободном виде кремний в природе не встречается, хотя одна четвертая земли состоит из кремния.
Кремний входит в состав нескольких сотен различных природных силикатов и алюмосиликатов. Больше всего распространен кремнезём — многочисленные формы диоксида кремния (IV) SiO2 (речной песок, кварц, кремень и др.), составляющий около 12 % земной коры (по массе). В свободном виде кремний в природе не встречается, хотя одна четвертая земли состоит из кремния.
Получение
В промышленности кремний получают, восстанавливая расплав SiO2коксом при температуре около 1800 °C в дуговых печах. Чистота полученного таким образом кремния составляет около 99,9 %. Так как для практического использования нужен кремний более высокой чистоты, полученный кремний хлорируют. Образуются соединения состава SiCl4 и SiCl3H. Эти хлориды далее очищают различными способами от примесей и на заключительном этапе восстанавливают чистым водородом. Возможна также очистка кремния за счет предварительного получения силицида магния Mg2Si. Далее из силицида магния с помощью соляной или уксусной кислот получают летучий моносилан SiH4. Моносилан очищают далее ректификацией, сорбционными и др. методами, а затем разлагают на кремний и водород при температуре около 1000 °C. Содержание примесей в получаемом этими методами кремнии снижается до 10-8-10-6% по массе.
Моносилан очищают далее ректификацией, сорбционными и др. методами, а затем разлагают на кремний и водород при температуре около 1000 °C. Содержание примесей в получаемом этими методами кремнии снижается до 10-8-10-6% по массе.
Способ получения кремния в чистом виде разработан Николаем Николаевичем Бекетовым. Крупнейшим производителем кремния в России является ОК Русал[1] — кремний производится на заводах в г. Каменск-Уральский (Свердловская область) и г. Шелехов (Иркутская область).
Физические свойства
Кристаллическая структура кремния.
Кристаллическая решетка кремния кубическая гранецентрированная типа алмаза, параметр а = 0,54307 нм (при высоких давлениях получены и другие полиморфные модификации кремния), но из-за большей длины связи между атомами Si—Si по сравнению с длиной связи С—С твердость кремния значительно меньше, чем алмаза. Кремний хрупок, только при нагревании выше 800 °C он становится пластичным веществом. Интересно, что кремний прозрачен к инфракрасному излучению, начиная с длины волны 1.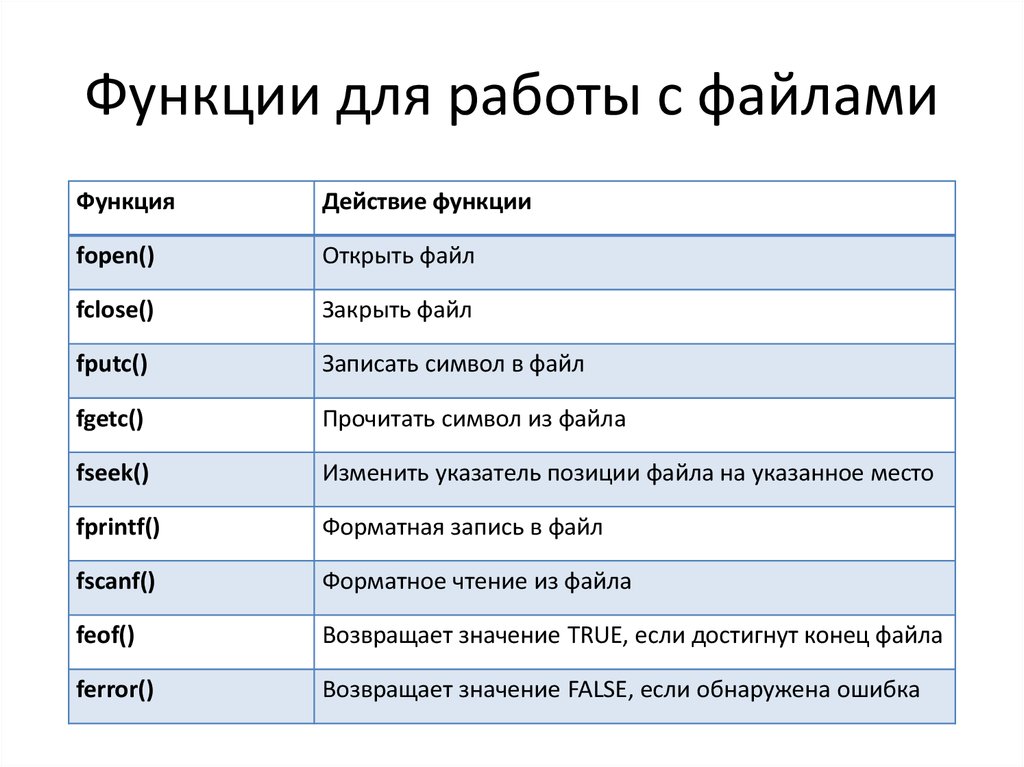 1 микрометр.
1 микрометр.
Схематическое изображение зонной структуры кремния [1]
Электрофизические свойства
Элементарный кремний — типичный непрямозонный полупроводник. Ширина запрещенной зоны при комнатной температуре 1,12 эВ, а при Т = 0 К составляет 1,21 эВ [2]. Концентрация носителей заряда в кремнии с собственной проводимостью при комнатной температуре 1,5·1016м-3. На электрофизические свойства кристаллического кремния большое влияние оказывают содержащиеся в нем микропримеси. Для получения монокристаллов кремния с дырочной проводимостью в кремний вводят добавки элементов III-й группы — бора, алюминия, галлия и индия, с электронной проводимостью — добавки элементов V-й группы — фосфора, мышьяка или сурьмы. Электрические свойства кремния можно варьировать, изменяя условия обработки монокристаллов, в частности, обрабатывая поверхность кремния различными химическими агентами.
Подвижность электронов 1400 см²/(в*c).
Химические свойства
В соединениях кремний склонен проявлять степень окисления +4 или −4, так как для атома кремния более характерно состояние sp³-гибридизации орбиталей.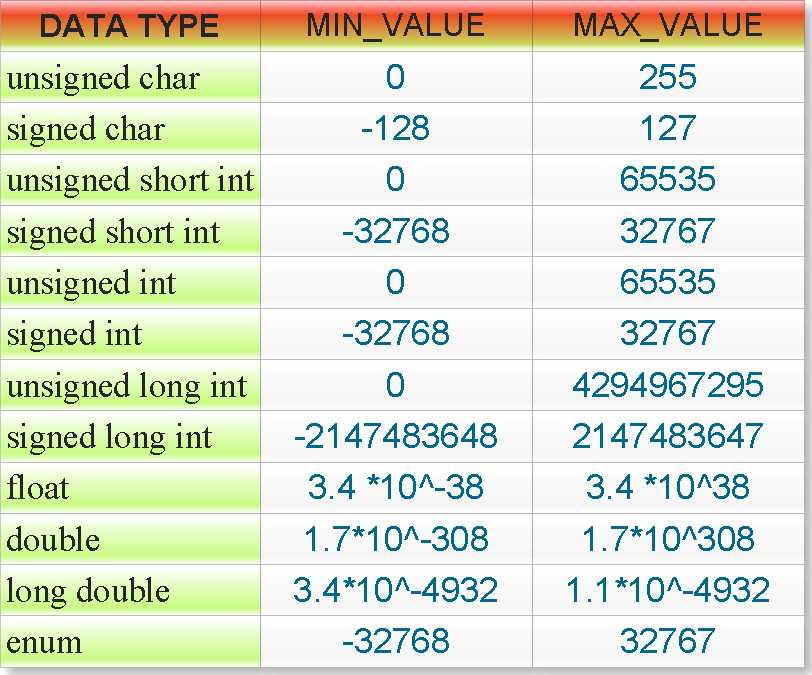 Поэтому во всех соединениях, кроме оксида кремния (II) SiO, кремний четырёхвалентен.
Поэтому во всех соединениях, кроме оксида кремния (II) SiO, кремний четырёхвалентен.
Химически кремний малоактивен. При комнатной температуре реагирует только с газообразным фтором, при этом образуется летучий тетрафторид кремния SiF4. При нагревании до температуры 400—500°C кремний реагирует с кислородом с образованием диоксида SiO2, с хлором, бромом и иодом — с образованием соответствующих легко летучих тетрагалогенидов SiHal4.
С водородом кремний непосредственно не реагирует, соединения кремния с водородом — силаны с общей формулой SinH2n+2 — получают косвенным путем. Моносилан SiH4 (его часто называют просто силаном) выделяется при взаимодействии силицидов металлов с растворами кислот, например:
Ca2Si + 4HCl → 2CaCl2 + SiH4↑.
Образующийся в этой реакции силан SiH4 содержит примесь и других силанов, в частности, дисилана Si2H6 и трисилана Si3H8, в которых имеется цепочка из атомов кремния, связанных между собой одинарными связями (—Si—Si—Si—).
С азотом кремний при температуре около 1000 °C образует нитрид Si3N4, с бором — термически и химически стойкие бориды SiB3, SiB6 и SiB12. Соединение кремния и его ближайшего аналога по таблице Менделеева — углерода — карбид кремния SiC (карборунд) характеризуется высокой твердостью и низкой химической активностью. Карборунд широко используется как абразивный материал.
При нагревании кремния с металлами возникают силициды. Силициды можно подразделить на две группы: ионно-ковалентные (силициды щелочных, щелочноземельных металлов и магния типа Ca2Si, Mg2Si и др.) и металлоподобные (силициды переходных металлов). Силициды активных металлов разлагаются под действием кислот, силициды переходных металлов химически стойки и под действием кислот не разлагаются. Металлоподобные силициды имеют высокие температуры плавления (до 2000 °C). Наиболее часто образуются металлоподобные силициды составов MeSi, Me3Si2, Me2Si3, Me5Si3 и MeSi2. Металлоподобные силициды химически инертны, устойчивы к действию кислорода даже при высоких температурах.
Металлоподобные силициды химически инертны, устойчивы к действию кислорода даже при высоких температурах.
При восстановлении SiO2 кремнием при высоких температурах образуется оксид кремния (II) SiO.
Для кремния характерно образование кремнийорганических соединений, в которых атомы кремния соединены в длинные цепочки за счет мостиковых атомов кислорода —О—, а к каждому атому кремния, кроме двух атомов О, присоединены еще два органических радикала R1 и R2 = CH3, C2H5, C6H5, CH2CH2CF3 и др.
Применение
Микроконтроллер 1993 года с УФ стиранием памяти 62E40 европейской фирмы
В настоящее время кремний — основной материал для электроники и солнечной энергетики.
Монокристаллический кремний — материал для зеркал газовых лазеров.
Иногда кремний (технической чистоты) и его сплав с железом (ферросилиций) используется для производства водорода в полевых условиях.
Соединения металлов с кремнием — силициды, являются широкоупотребляемыми в промышленности (например электронной и атомной) материалами с широким спектром полезных химических, электрических и ядерных свойств (устойчивость к окислению, нейтронам и др.), а также силициды ряда элементов являются важными термоэлектрическими материалами.
Кремний применяется в металлургии при выплавке чугуна, сталей, бронз, силумина и др. (как раскислитель и модификатор, а также как легирующий компонент).
Соединения кремния служат основой для производства стекла и цемента. Производством стекла и цемента занимается силикатная промышленность. Она также выпускает силикатную керамику — кирпич, фарфор, фаянс и изделия из них.
Широко известен силикатный клей, преимущественно применяемый для склеивания бумаги.
Последнее время очень широко применяются полимеры на основе кремния — силиконы.
Биологическая роль
Для некоторых организмов кремний является важным биогеным элементом. Он входит в состав опорных образований у растений и скелетных — у животных. В больших количествах кремний концентрируют морские организмы — диатомовые водоросли, радиолярии, губки. Большие количества кремния концентрируют хвощи и злаки, в первую очередь — подсемейства Бамбуков и Рисовидных, в том числе — рис посевной. Мышечная ткань человека содержит (1-2)·10-2% кремния, костная ткань — 17·10-4%, кровь — 3,9 мг/л. С пищей в организм человека ежедневно поступает до 1 г кремния.
Он входит в состав опорных образований у растений и скелетных — у животных. В больших количествах кремний концентрируют морские организмы — диатомовые водоросли, радиолярии, губки. Большие количества кремния концентрируют хвощи и злаки, в первую очередь — подсемейства Бамбуков и Рисовидных, в том числе — рис посевной. Мышечная ткань человека содержит (1-2)·10-2% кремния, костная ткань — 17·10-4%, кровь — 3,9 мг/л. С пищей в организм человека ежедневно поступает до 1 г кремния.
Соединения кремния относительно нетоксичны. Но очень опасно вдыхание высокодисперсных частиц как силикатов, так и диоксида кремния, образующихся, например, при взрывных работах, при долблении пород в шахтах, при работе пескоструйных аппаратов и т. д. Микрочастицы SiO2, попавшие в лёгкие, кристаллизуются в них, а возникающие кристаллики разрушают лёгочную ткань и вызывают тяжёлую болезнь — силикоз. Чтобы не допустить попадания в лёгкие опасной пыли, следует использовать для защиты органов дыхания респиратор.
См. также
- Категория: Соединения кремния
- Пористый кремний
- Кристаллический кремний
- Германий
- Кремнийорганические соединения
Ссылки
- Кремний на Webelements
- Кремний в Популярной библиотеке химических элементов
Литература
- Самсонов. Г. В. Силициды и их использование в технике. Киев, Изд-во АН УССР, 1959. 204 стр. с илл.
- Алёшин Е. П., Алёшин Н. Е. Рис. Москва, 1993. 504 стр. 100 рис.
Примечания
- ↑ Р Смит., Полупроводники: Пер. с англ. — М.: Мир, 1982. — 560 с, ил.
- ↑ Зи С., Физика полупроводниковых приборов: В 2-х книгах. Кн. 1. Пер. с англ. — М.: Мир, 1984. — 456 с, ил.
Периодическая система химических элементов Д. И. Менделеева
| H | He | ||||||||||||||||||||||
| Li | Be | B | C | N | O | F | Ne | ||||||||||||||||
| Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||||||||
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | ||||||
| Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | ||||||
| Cs | Ba | * | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | ||||||
| Fr | Ra | ** | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Uub | Uut | Uuq | Uup | Uuh | Uus | Uuo | ||||||
| Uue | Ubn | ||||||||||||||||||||||
| * | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | ||||||||
| ** | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | ||||||||
Wikimedia Foundation.
2010.
Si | это… Что такое Si?
| Кремний/Silicium (Si) | |
|---|---|
| Атомный номер | 14 |
| Внешний вид простого вещества | В аморфной форме — коричневый порошок, в кристаллической — тёмно-серый, слегка блестящий |
| Свойства атома | |
| Атомная масса (молярная масса) | 28,0855 а. е. м. (г/моль) |
| Радиус атома | 132 пм |
| Энергия ионизации (первый электрон) | 786,0(8,15) кДж/моль (эВ) |
| Электронная конфигурация | [Ne] 3s2 3p2 |
| Химические свойства | |
| Ковалентный радиус | 111 пм |
| Радиус иона | 42 (+4e) 271 (-4e) пм |
| Электроотрицательность (по Полингу) | 1,90 |
| Электродный потенциал | 0 |
| Степени окисления | +4, −4, +2 |
| Термодинамические свойства простого вещества | |
| Плотность | 2,33 г/см³ |
| Удельная теплоёмкость | 19,8 Дж/(K·моль) |
| Теплопроводность | 149 Вт/(м·K) |
| Температура плавления | 1688 K |
| Теплота плавления | 50,6 кДж/моль |
| Температура кипения | 2623 K |
| Теплота испарения | 383 кДж/моль |
| Молярный объём | 12,1 см³/моль |
| Кристаллическая решётка простого вещества | |
| Структура решётки | алмаз |
| Период решётки | 5,430 Å |
| Отношение c/a | n/a |
| Температура Дебая | 625,00 K |
| Si | 14 |
| 28,0855 | |
| 3s²3p² | |
| Кремний | |
Содержание
|
История
Схема атома кремния
В чистом виде кре́мний был выделен в 1811 году французскими учеными Жозефом Луи Гей-Люссаком и Луи Жаком Тенаром.
Происхождение названия
В 1825 году шведский химик Йёнс Якоб Берцелиус действием металлического калия на фтористый кремний SiF4 получил чистый элементарный кремний. Новому элементу было дано название «силиций» (от лат. silex — кремень). Русское название «кремний» введено в 1834 году российский химиком Германом Ивановичем Гессом. В переводе c греческого kremnos — «утес, гора».
Нахождение в природе
По распространённости в земной коре кремний среди всех элементов занимает второе место (после кислорода). Масса земной коры на 27,6—29,5 % состоит из кремния. Кремний входит в состав нескольких сотен различных природных силикатов и алюмосиликатов. Больше всего распространен кремнезём — многочисленные формы диоксида кремния (IV) SiO2 (речной песок, кварц, кремень и др.), составляющий около 12 % земной коры (по массе). В свободном виде кремний в природе не встречается, хотя одна четвертая земли состоит из кремния.
Кремний входит в состав нескольких сотен различных природных силикатов и алюмосиликатов. Больше всего распространен кремнезём — многочисленные формы диоксида кремния (IV) SiO2 (речной песок, кварц, кремень и др.), составляющий около 12 % земной коры (по массе). В свободном виде кремний в природе не встречается, хотя одна четвертая земли состоит из кремния.
Получение
В промышленности кремний получают, восстанавливая расплав SiO2коксом при температуре около 1800 °C в дуговых печах. Чистота полученного таким образом кремния составляет около 99,9 %. Так как для практического использования нужен кремний более высокой чистоты, полученный кремний хлорируют. Образуются соединения состава SiCl4 и SiCl3H. Эти хлориды далее очищают различными способами от примесей и на заключительном этапе восстанавливают чистым водородом. Возможна также очистка кремния за счет предварительного получения силицида магния Mg2Si. Далее из силицида магния с помощью соляной или уксусной кислот получают летучий моносилан SiH4.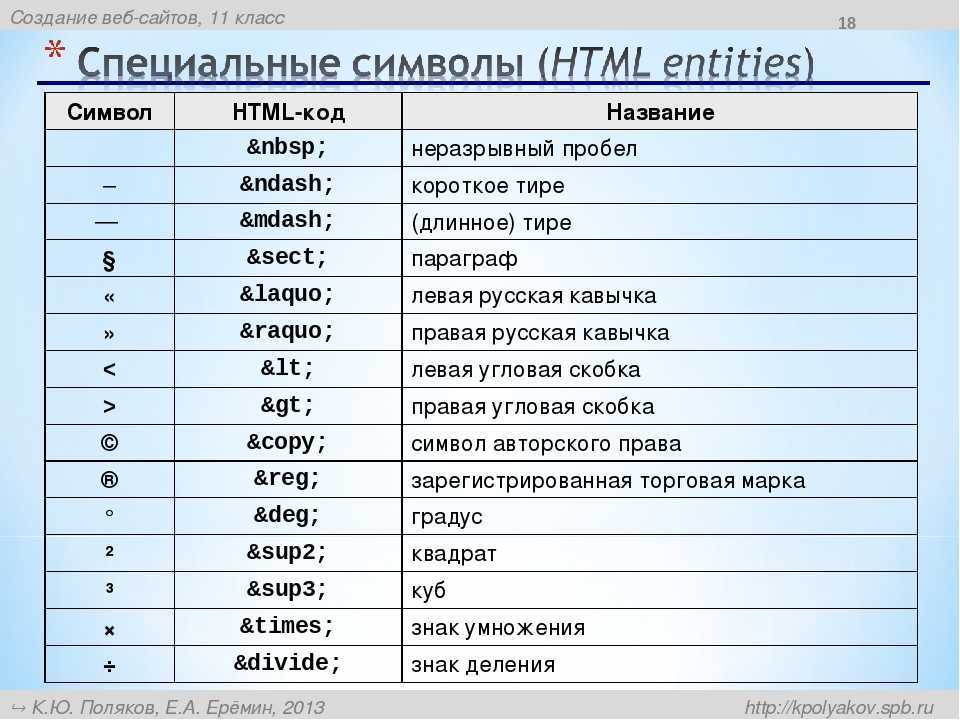 Моносилан очищают далее ректификацией, сорбционными и др. методами, а затем разлагают на кремний и водород при температуре около 1000 °C. Содержание примесей в получаемом этими методами кремнии снижается до 10-8-10-6% по массе.
Моносилан очищают далее ректификацией, сорбционными и др. методами, а затем разлагают на кремний и водород при температуре около 1000 °C. Содержание примесей в получаемом этими методами кремнии снижается до 10-8-10-6% по массе.
Способ получения кремния в чистом виде разработан Николаем Николаевичем Бекетовым. Крупнейшим производителем кремния в России является ОК Русал[1] — кремний производится на заводах в г. Каменск-Уральский (Свердловская область) и г. Шелехов (Иркутская область).
Физические свойства
Кристаллическая структура кремния.
Кристаллическая решетка кремния кубическая гранецентрированная типа алмаза, параметр а = 0,54307 нм (при высоких давлениях получены и другие полиморфные модификации кремния), но из-за большей длины связи между атомами Si—Si по сравнению с длиной связи С—С твердость кремния значительно меньше, чем алмаза. Кремний хрупок, только при нагревании выше 800 °C он становится пластичным веществом. Интересно, что кремний прозрачен к инфракрасному излучению, начиная с длины волны 1. 1 микрометр.
1 микрометр.
Схематическое изображение зонной структуры кремния [1]
Электрофизические свойства
Элементарный кремний — типичный непрямозонный полупроводник. Ширина запрещенной зоны при комнатной температуре 1,12 эВ, а при Т = 0 К составляет 1,21 эВ [2]. Концентрация носителей заряда в кремнии с собственной проводимостью при комнатной температуре 1,5·1016м-3. На электрофизические свойства кристаллического кремния большое влияние оказывают содержащиеся в нем микропримеси. Для получения монокристаллов кремния с дырочной проводимостью в кремний вводят добавки элементов III-й группы — бора, алюминия, галлия и индия, с электронной проводимостью — добавки элементов V-й группы — фосфора, мышьяка или сурьмы. Электрические свойства кремния можно варьировать, изменяя условия обработки монокристаллов, в частности, обрабатывая поверхность кремния различными химическими агентами.
Подвижность электронов 1400 см²/(в*c).
Химические свойства
В соединениях кремний склонен проявлять степень окисления +4 или −4, так как для атома кремния более характерно состояние sp³-гибридизации орбиталей. Поэтому во всех соединениях, кроме оксида кремния (II) SiO, кремний четырёхвалентен.
Поэтому во всех соединениях, кроме оксида кремния (II) SiO, кремний четырёхвалентен.
Химически кремний малоактивен. При комнатной температуре реагирует только с газообразным фтором, при этом образуется летучий тетрафторид кремния SiF4. При нагревании до температуры 400—500°C кремний реагирует с кислородом с образованием диоксида SiO2, с хлором, бромом и иодом — с образованием соответствующих легко летучих тетрагалогенидов SiHal4.
С водородом кремний непосредственно не реагирует, соединения кремния с водородом — силаны с общей формулой SinH2n+2 — получают косвенным путем. Моносилан SiH4 (его часто называют просто силаном) выделяется при взаимодействии силицидов металлов с растворами кислот, например:
Ca2Si + 4HCl → 2CaCl2 + SiH4↑.
Образующийся в этой реакции силан SiH4 содержит примесь и других силанов, в частности, дисилана Si2H6 и трисилана Si3H8, в которых имеется цепочка из атомов кремния, связанных между собой одинарными связями (—Si—Si—Si—).
С азотом кремний при температуре около 1000 °C образует нитрид Si3N4, с бором — термически и химически стойкие бориды SiB3, SiB6 и SiB12. Соединение кремния и его ближайшего аналога по таблице Менделеева — углерода — карбид кремния SiC (карборунд) характеризуется высокой твердостью и низкой химической активностью. Карборунд широко используется как абразивный материал.
При нагревании кремния с металлами возникают силициды. Силициды можно подразделить на две группы: ионно-ковалентные (силициды щелочных, щелочноземельных металлов и магния типа Ca2Si, Mg2Si и др.) и металлоподобные (силициды переходных металлов). Силициды активных металлов разлагаются под действием кислот, силициды переходных металлов химически стойки и под действием кислот не разлагаются. Металлоподобные силициды имеют высокие температуры плавления (до 2000 °C). Наиболее часто образуются металлоподобные силициды составов MeSi, Me3Si2, Me2Si3, Me5Si3 и MeSi2. Металлоподобные силициды химически инертны, устойчивы к действию кислорода даже при высоких температурах.
Металлоподобные силициды химически инертны, устойчивы к действию кислорода даже при высоких температурах.
При восстановлении SiO2 кремнием при высоких температурах образуется оксид кремния (II) SiO.
Для кремния характерно образование кремнийорганических соединений, в которых атомы кремния соединены в длинные цепочки за счет мостиковых атомов кислорода —О—, а к каждому атому кремния, кроме двух атомов О, присоединены еще два органических радикала R1 и R2 = CH3, C2H5, C6H5, CH2CH2CF3 и др.
Применение
Микроконтроллер 1993 года с УФ стиранием памяти 62E40 европейской фирмы
В настоящее время кремний — основной материал для электроники и солнечной энергетики.
Монокристаллический кремний — материал для зеркал газовых лазеров.
Иногда кремний (технической чистоты) и его сплав с железом (ферросилиций) используется для производства водорода в полевых условиях.
Соединения металлов с кремнием — силициды, являются широкоупотребляемыми в промышленности (например электронной и атомной) материалами с широким спектром полезных химических, электрических и ядерных свойств (устойчивость к окислению, нейтронам и др.), а также силициды ряда элементов являются важными термоэлектрическими материалами.
Кремний применяется в металлургии при выплавке чугуна, сталей, бронз, силумина и др. (как раскислитель и модификатор, а также как легирующий компонент).
Соединения кремния служат основой для производства стекла и цемента. Производством стекла и цемента занимается силикатная промышленность. Она также выпускает силикатную керамику — кирпич, фарфор, фаянс и изделия из них.
Широко известен силикатный клей, преимущественно применяемый для склеивания бумаги.
Последнее время очень широко применяются полимеры на основе кремния — силиконы.
Биологическая роль
Для некоторых организмов кремний является важным биогеным элементом. Он входит в состав опорных образований у растений и скелетных — у животных. В больших количествах кремний концентрируют морские организмы — диатомовые водоросли, радиолярии, губки. Большие количества кремния концентрируют хвощи и злаки, в первую очередь — подсемейства Бамбуков и Рисовидных, в том числе — рис посевной. Мышечная ткань человека содержит (1-2)·10-2% кремния, костная ткань — 17·10-4%, кровь — 3,9 мг/л. С пищей в организм человека ежедневно поступает до 1 г кремния.
Он входит в состав опорных образований у растений и скелетных — у животных. В больших количествах кремний концентрируют морские организмы — диатомовые водоросли, радиолярии, губки. Большие количества кремния концентрируют хвощи и злаки, в первую очередь — подсемейства Бамбуков и Рисовидных, в том числе — рис посевной. Мышечная ткань человека содержит (1-2)·10-2% кремния, костная ткань — 17·10-4%, кровь — 3,9 мг/л. С пищей в организм человека ежедневно поступает до 1 г кремния.
Соединения кремния относительно нетоксичны. Но очень опасно вдыхание высокодисперсных частиц как силикатов, так и диоксида кремния, образующихся, например, при взрывных работах, при долблении пород в шахтах, при работе пескоструйных аппаратов и т. д. Микрочастицы SiO2, попавшие в лёгкие, кристаллизуются в них, а возникающие кристаллики разрушают лёгочную ткань и вызывают тяжёлую болезнь — силикоз. Чтобы не допустить попадания в лёгкие опасной пыли, следует использовать для защиты органов дыхания респиратор.
См. также
- Категория: Соединения кремния
- Пористый кремний
- Кристаллический кремний
- Германий
- Кремнийорганические соединения
Ссылки
- Кремний на Webelements
- Кремний в Популярной библиотеке химических элементов
Литература
- Самсонов. Г. В. Силициды и их использование в технике. Киев, Изд-во АН УССР, 1959. 204 стр. с илл.
- Алёшин Е. П., Алёшин Н. Е. Рис. Москва, 1993. 504 стр. 100 рис.
Примечания
- ↑ Р Смит., Полупроводники: Пер. с англ. — М.: Мир, 1982. — 560 с, ил.
- ↑ Зи С., Физика полупроводниковых приборов: В 2-х книгах. Кн. 1. Пер. с англ. — М.: Мир, 1984. — 456 с, ил.
Периодическая система химических элементов Д. И. Менделеева
| H | He | ||||||||||||||||||||||
| Li | Be | B | C | N | O | F | Ne | ||||||||||||||||
| Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||||||||
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | ||||||
| Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | ||||||
| Cs | Ba | * | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | ||||||
| Fr | Ra | ** | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Uub | Uut | Uuq | Uup | Uuh | Uus | Uuo | ||||||
| Uue | Ubn | ||||||||||||||||||||||
| * | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | ||||||||
| ** | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | ||||||||
Wikimedia Foundation.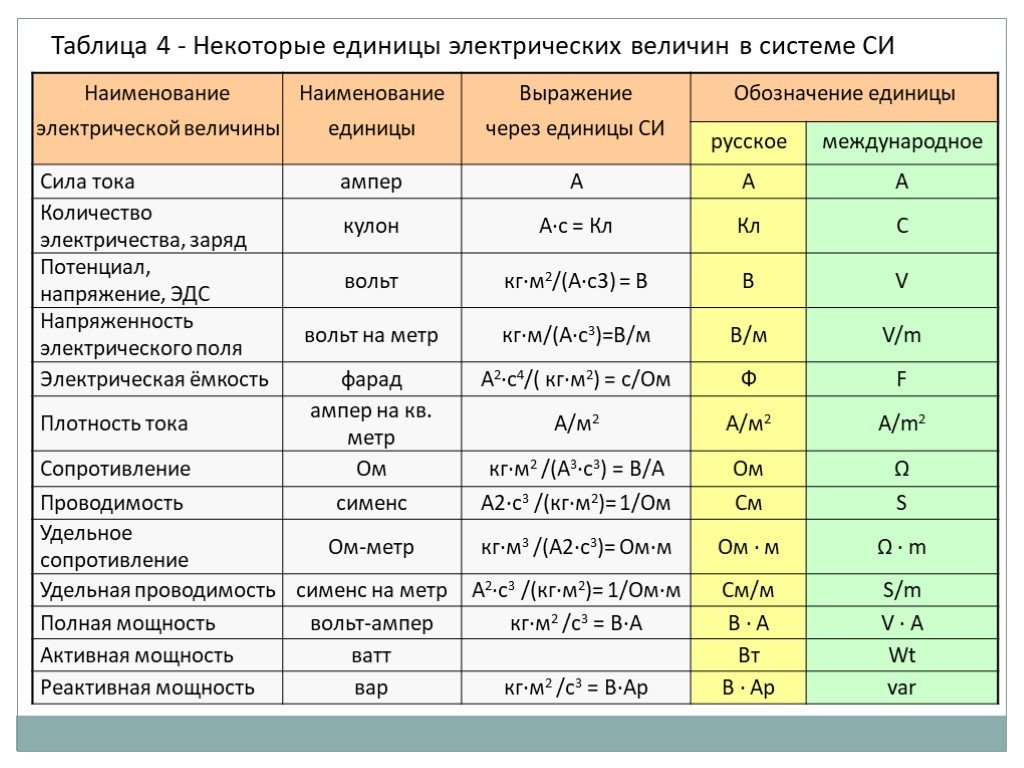
2010.
Международная система единиц (СИ) | Единицы измерения, факты и определения
- Связанные темы:
- крот
килограмм
второй
метр
кельвин
Просмотреть весь связанный контент →
Резюме
Прочтите краткий обзор этой темы
Знакомство с Международной системой единиц и ее семью основными единицами СИ
Посмотреть все видео к этой статье
Международная система единиц (СИ) , французский Système International d’Unités , международная десятичная система мер и весов, производная от метрической системы единиц и расширяющая ее. Принятая 11-й Генеральной конференцией по мерам и весам (CGPM) в 1960 году, на всех языках она обозначается аббревиатурой SI.
Быстрый прогресс науки и техники в 19-м и 20-м веках способствовал развитию нескольких перекрывающихся систем единиц измерения, поскольку ученые импровизировали, чтобы удовлетворить практические потребности своих дисциплин.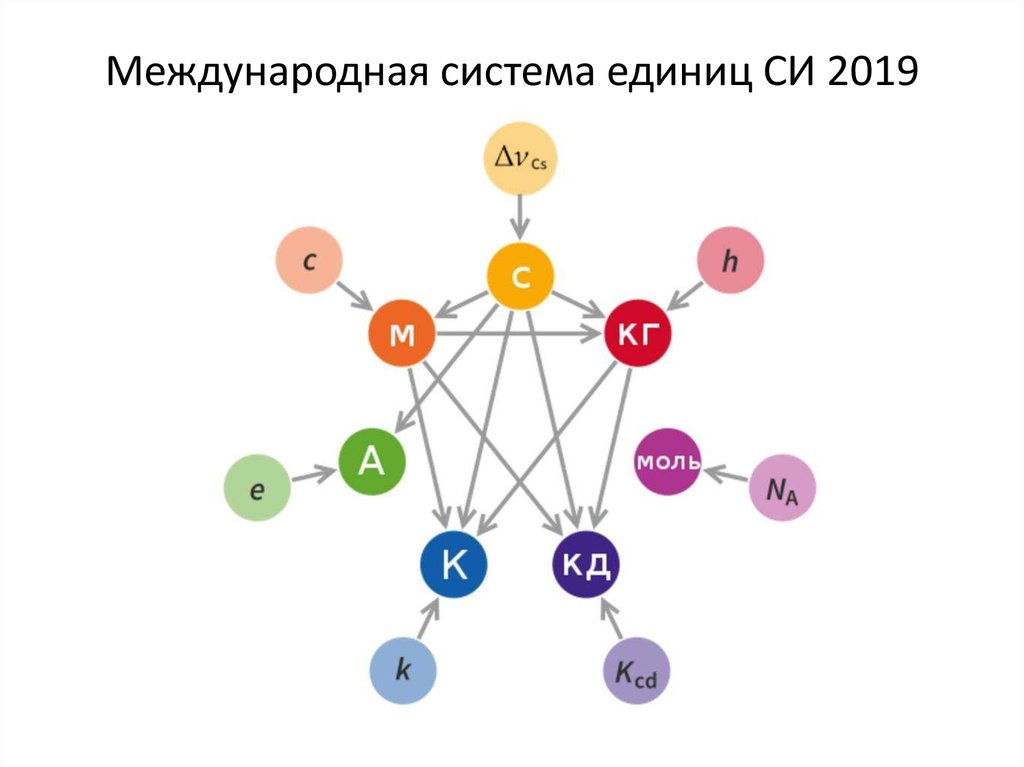 Ранняя международная система, разработанная для исправления этой ситуации, называлась системой метр-килограмм-секунда (МКС). CGPM добавила три новых подразделения (среди прочих) в 1948: единица силы (ньютон), определяемая как сила, сообщающая массе в один килограмм ускорение один метр в секунду в секунду; единица энергии (джоуль), определяемая как работа, совершаемая при смещении точки приложения силы ньютона на один метр в направлении действия силы; и единица мощности (ватт), которая представляет собой мощность, которая за одну секунду дает энергию в один джоуль. Все три подразделения названы в честь выдающихся ученых.
Ранняя международная система, разработанная для исправления этой ситуации, называлась системой метр-килограмм-секунда (МКС). CGPM добавила три новых подразделения (среди прочих) в 1948: единица силы (ньютон), определяемая как сила, сообщающая массе в один килограмм ускорение один метр в секунду в секунду; единица энергии (джоуль), определяемая как работа, совершаемая при смещении точки приложения силы ньютона на один метр в направлении действия силы; и единица мощности (ватт), которая представляет собой мощность, которая за одну секунду дает энергию в один джоуль. Все три подразделения названы в честь выдающихся ученых.
Понимать концепцию производных единиц измерения
Посмотреть все видео к этой статье
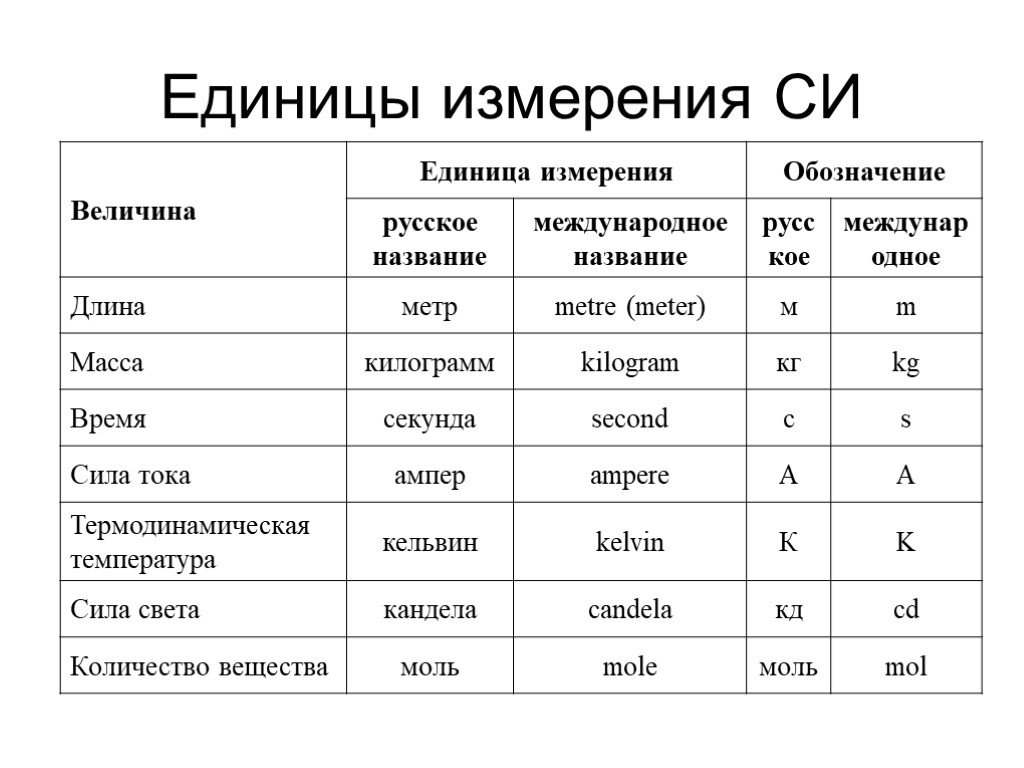
Международная система 1960 года основана на системе MKS. Его семь основных единиц, из которых получены другие единицы, были определены следующим образом: для длины — метр, определяемый как расстояние, пройденное светом в вакууме за 1/299 792 458 секунды; для массы — килограмм, равный 1000 граммам в соответствии с международным прототипом килограмма платино-иридиевого сплава, хранящимся в Международном бюро мер и весов в Севре, Франция; за время, секунда, продолжительность 9,192 631 770 периодов излучения, связанных с указанным переходом атома цезия-133; для электрического тока — ампер, то есть ток, который, если его поддерживать в двух проводах, расположенных на расстоянии одного метра друг от друга в вакууме, будет производить силу 2 × 10 -7 ньютонов на метр длины; для силы света — кандела, определяемая как сила в заданном направлении источника, испускающего излучение с частотой 540 × 10 12 герц и имеющего силу излучения в этом направлении 1 / 683 ватт на стерадиан; для количества вещества — моль, определяемый как содержащий столько элементарных частиц вещества, сколько атомов содержится в 0,012 кг углерода-12; а для термодинамической температуры — кельвин.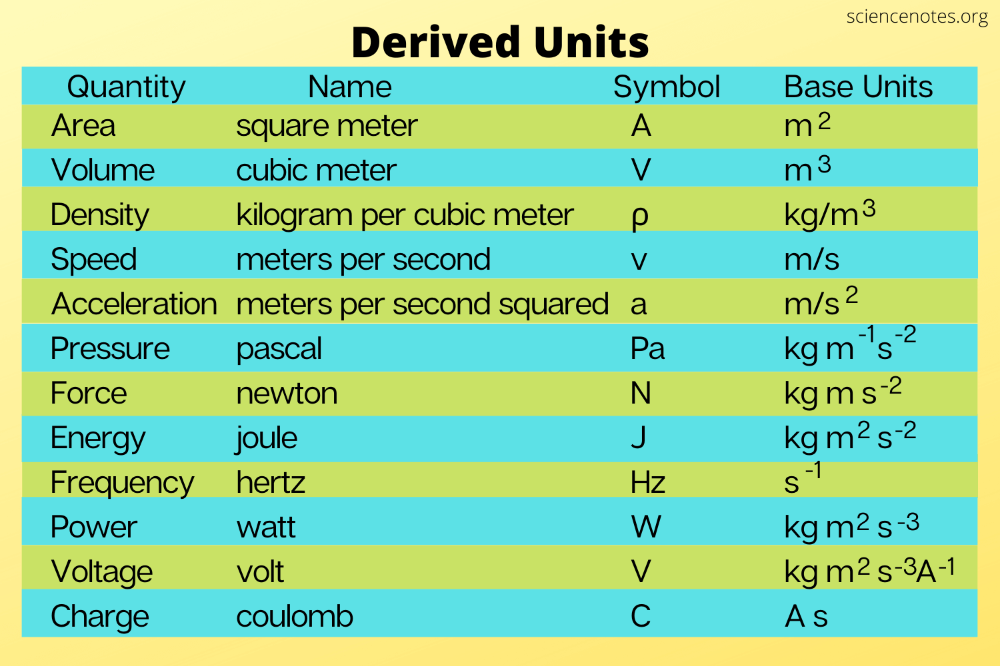
20 мая 2019 года CGPM переопределила килограмм, ампер, моль и кельвин с точки зрения фундаментальных физических констант. Для килограмма в качестве константы была выбрана постоянная Планка, которая определяется как равная 6,62607015 × 10 −34 джоулей в секунду. Один джоуль равен одному килограмму, умноженному на квадратный метр на секунду в квадрате. Поскольку секунда и метр уже были определены, килограмм можно было бы определить путем точных измерений постоянной Планка. Ампер был переопределен таким образом, что элементарный заряд равен 1,602176634 × 10 -19 кулонов. Кельвин был переопределен таким образом, что постоянная Больцмана равна 1,380649 × 10 −23 джоулей на кельвин, а моль был переопределен таким образом, что постоянная Авогадро стала равной 6,02214076 × 10 23 на моль.
Широко используемые единицы в системе СИ
Список широко используемых единиц в системе СИ приведен в таблице.
Ед. изм изм | Сокращенное название | физическое количество | ||
|---|---|---|---|---|
| Базовые единицы | метр | м | длина | |
| второй | с | время | ||
| килограмм | кг | масса | ||
| ампер | А | электрический ток | ||
| кельвин | К | термодинамическая температура | ||
| кандела | CD | интенсивность света | ||
| крот | моль | количество вещества | ||
Ед. изм изм | Сокращенное название | количество метров | приблизительный эквивалент в США | |
| Длина | километр | км | 1000 | 0,62 мили |
| сантиметр | см | 0,01 | 0,39 дюйма | |
| миллиметр | мм | 0,001 | 0,039 дюйма | |
| микрометр | мкм | 0,000001 | 0,000039 дюйма | |
| нанометр | нм | 0,000000001 | 0,000000039 дюймов | |
Ед. изм изм | Сокращенное название | количество квадратных метров | приблизительный эквивалент в США | |
| Область | квадратный километр | км2, или км 2 | 1 000 000 | 0,3861 квадратных миль |
| га | га | 10 000 | 2,47 акра | |
| находятся | а | 100 | 1190,60 квадратных ярдов | |
| квадратный сантиметр | кв см или см 2 | 0,0001 | 0,155 квадратных дюйма | |
Ед. изм изм | Сокращенное название | количество кубических метров | приблизительный эквивалент в США | |
| Объем | кубический метр | м 3 | 1 | 1,307 кубических ярдов |
| кубический сантиметр | куб см, см 3 , или куб.см | 0,000001 | 0,061 куб. дюйм | |
| Ед. изм | Сокращенное название | количество литров | приблизительный эквивалент в США | |
| Вместимость | килолитр | кл | 1000 | 1,31 кубических ярда |
| литр | л | 1 | 61,02 кубических дюйма | |
| сантилитр | кл | 0,01 | 0,61 куб. дюйм дюйм | |
| миллилитр | мл | 0,001 | 0,061 куб. дюйм | |
| микролитр | мкл | 0,000001 | 0,000061 кубический дюйм | |
| Ед. изм | Сокращенное название | количество граммов | приблизительный эквивалент в США | |
| Масса и вес | метрическая тонна | т | 1 000 000 | 1,102 коротких тонны |
| грамм | грамм | 1 | 0,035 унции | |
| сантиграмм | сг | 0,01 | 0,154 гран | |
| миллиграмм | мг | 0,001 | 0,015 гран | |
| микрограмм | мкг | 0,000001 | 0,000015 зерна | |
Ед.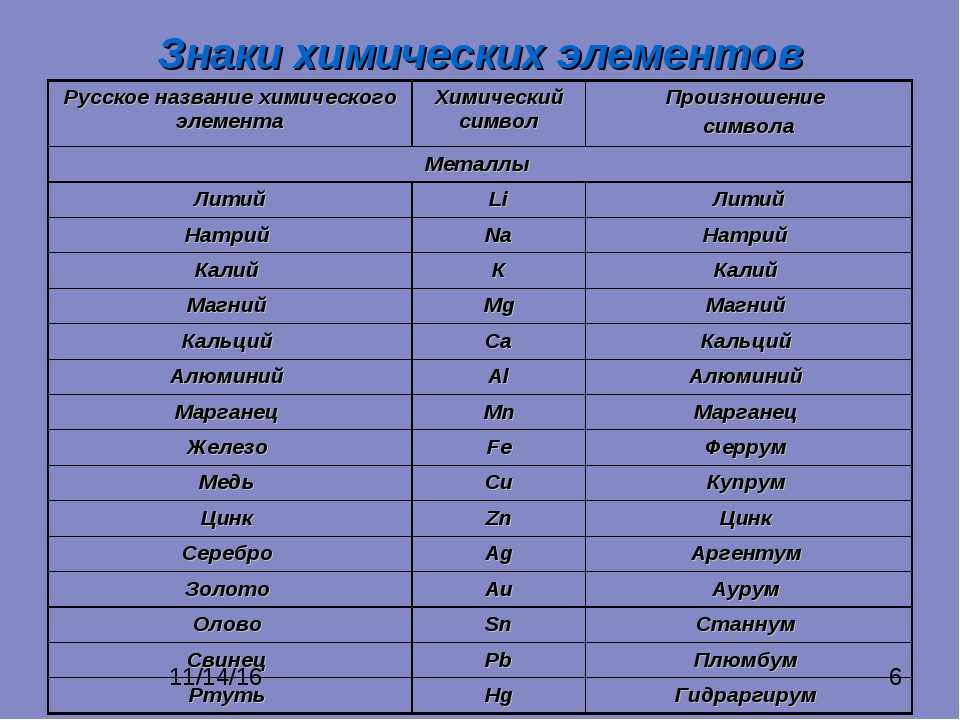 изм изм | символ | физическое количество | выражено в базовых единицах | |
| Энергия | герц | Гц | частота | 1/с |
| ньютон | Н | сила, вес | (м × кг)/с 2 | |
| джоуль | Дж | работа, энергия, количество теплоты | (м 2 × кг)/с 2 | |
| паскаль | Па | давление, стресс | кг/(м × с 2 ) | |
| ватт | Вт | сила | (м 2 × кг)/с 3 | |
| кулон | С | электрический заряд | с × А | |
| вольт | В | разность электрических потенциалов | (м 2 × кг)/(с 3 × А) | |
| фарада | Ф | электрическая емкость | (с 2 × с 2 × А 2 )/(м 2 × кг) | |
| Ом | Ом | электрическое сопротивление, реактивное сопротивление | (м 2 × кг)/(с 3 × А 2 ) | |
| Сименс | С | электрическая проводимость | (s 3 × A 2 )/(m 2 × кг) | |
| Вебер | Вб | магнитный поток | (м 2 × кг)/(с 2 × А) | |
| тесла | Т | магнитная индукция | кг/(с 2 × А) | |
| Генри | ЧАС | индуктивность | (м 2 × кг)/(с 2 × А 2 ) | |
| просвет | лм | световой поток | кд × ср | |
| люкс | люкс | освещенность | (кд × ср)/м 2 | |
Метрические преобразования
Список метрических преобразований приведен в таблице.
Оформите подписку Britannica Premium и получите доступ к эксклюзивному контенту.
Подпишитесь сейчас
| приблизительные общие эквиваленты | |
|---|---|
| *Общий термин, не используемый в СИ. | |
| **Точный. | |
| Источник: Настенная диаграмма Национального бюро стандартов. | |
| 1 дюйм | = 25 миллиметров |
| 1 фут | = 0,3 метра |
| 1 ярд | = 0,9 метра |
| 1 миля | = 1,6 км |
| 1 квадратный дюйм | = 6,5 квадратных сантиметров |
| 1 квадратный фут | = 0,09 квадратных метра |
| 1 квадратный ярд | = 0,8 квадратных метра |
| 1 акр | = 0,4 га* |
| 1 кубический дюйм | = 16 кубических сантиметров |
| 1 кубический фут | = 0,03 куб. м. м. |
| 1 кубический ярд | = 0,8 куб.м. |
| 1 кварта (жидкость) | = 1 литр* |
| 1 галлон | = 0,004 куб.м. |
| 1 унция (avdp) | = 28 грамм |
| 1 фунт (авдп) | = 0,45 кг |
| 1 лошадиная сила | = 0,75 кВт |
| 1 миллиметр | = 0,04 дюйма |
| 1 метр | = 3,3 фута |
| 1 метр | = 1,1 ярда |
| 1 километр | = 0,6 мили (статут) |
| 1 квадратный сантиметр | = 0,16 квадратных дюйма |
| 1 квадратный метр | = 11 квадратных футов |
| 1 квадратный метр | = 1,2 квадратных ярда |
| 1 га* | = 2,5 акра |
| 1 кубический сантиметр | = 0,06 куб.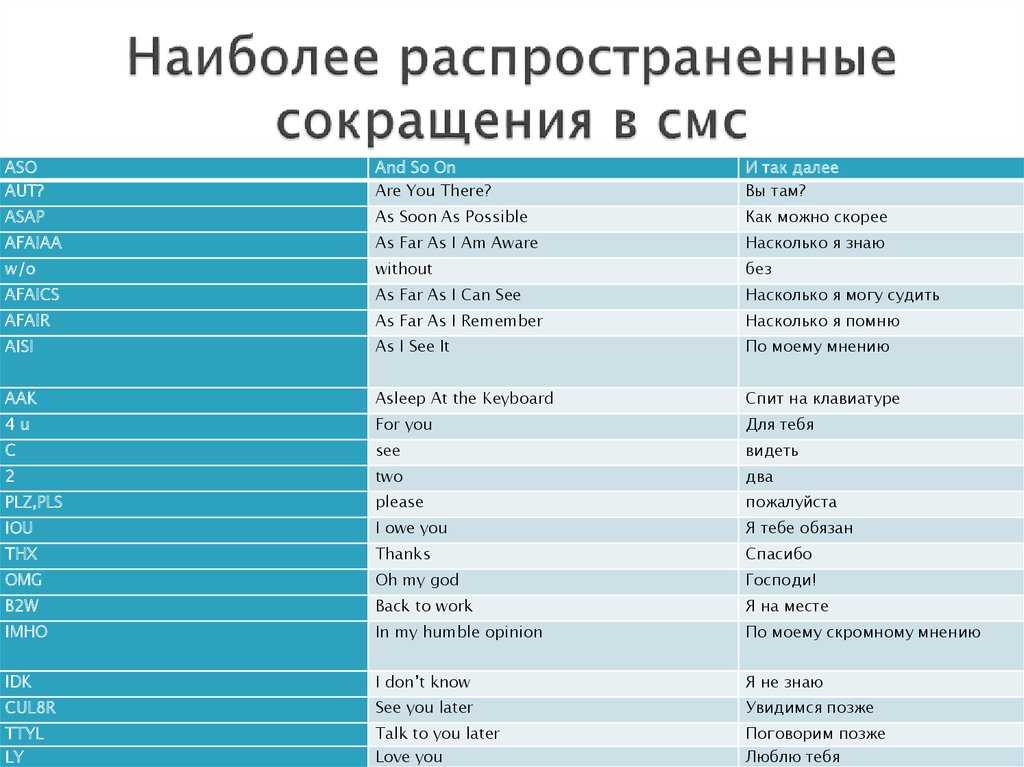 дюйма дюйма |
| 1 кубический метр | = 35 кубических футов |
| 1 кубический метр | = 1,3 кубических ярда |
| 1 литр* | = 1 кварта (жидкость) |
| 1 кубический метр | = 264 галлона |
| 1 грамм | = 0,035 унции (avdp) |
| 1 килограмм | = 2,2 фунта (avdp) |
| 1 киловатт | = 1,3 лошадиных силы |
| преобразование с точностью до 10 частей на миллион | |
| дюймов × 25,4** | = миллиметры |
| футов × 0,3048** | = метры |
| ярдов × 0,9144** | = метры |
| мили × 1,60934 | = километры |
| квадратные дюймы × 6,4516** | = квадратные сантиметры |
| квадратные футы × 0,0929030 | = квадратные метры |
| квадратные ярды × 0,836127 | = квадратные метры |
| акров × 0,404686 | = гектары |
| кубические дюймы × 16,3871 | = кубические сантиметры |
| кубический фут × 0,0283168 | = кубические метры |
| кубический ярд × 0,764555 | = кубические метры |
| кварты (жидкости) × 0,946353 | = литры |
| галлонов × 0,00378541 | = кубические метры |
| унции (avdp) × 28,3495 | = граммы |
| фунтов (avdp) × 0,453592 | = килограммы |
| лошадиная сила × 0,745700 | = киловатты |
| миллиметры × 0,0393701 | = дюймы |
| метров × 3,28084 | = ноги |
| метров × 1,09361 | = ярды |
| километров × 0,621371 | = мили (статут) |
| квадратные сантиметры × 0,155000 | = квадратные дюймы |
| квадратных метров × 10,7639 | = квадратные футы |
| квадратных метров × 1,19599 | = квадратные ярды |
| га × 2,47105 | = акры |
| кубические сантиметры × 0,0610237 | = кубические дюймы |
| кубический метр × 35,3147 | = кубические футы |
| кубический метр × 1,30795 | = кубические ярды |
| литров × 1,05669 | = кварт (liq) |
| кубический метр × 264,172 | = галлоны |
| грамм × 0,0352740 | = унции (avdp) |
| килограмм × 2,20462 | = фунты (avdp) |
| киловатт × 1,34102 | = лошадиная сила |
Редакторы Encyclopaedia Britannica
Эта статья была недавно отредактирована и обновлена Эриком Грегерсеном.
Единицы СИ | НИСТ
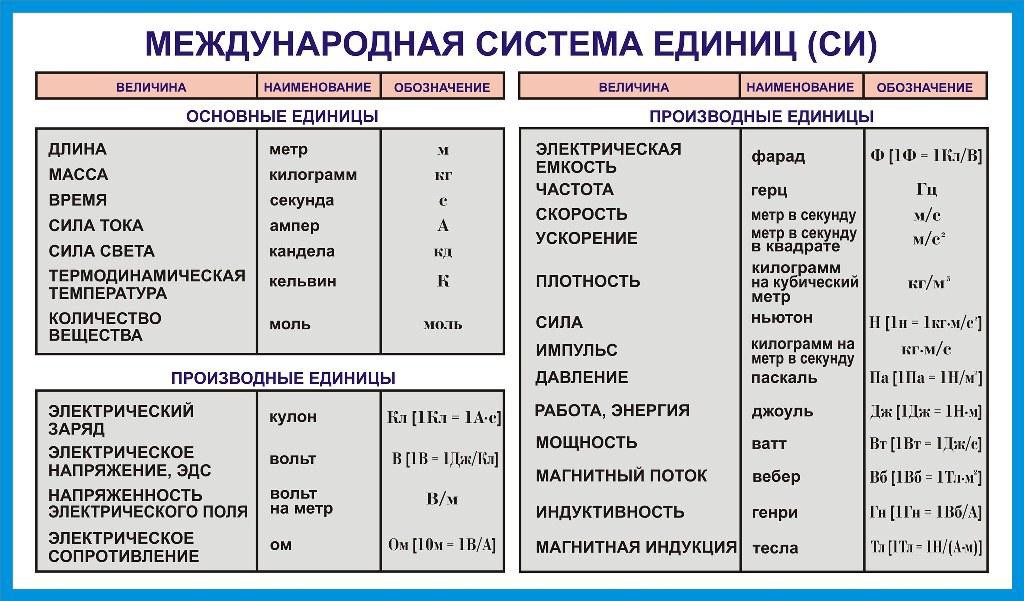
SI основывается на семи (7) определяющих константах: частота сверхтонкого расщепления цезия, скорость света в вакууме, постоянная Планка, элементарный заряд (то есть заряд протона), постоянная Больцмана, Авогадро постоянная и световая отдача указанного монохроматического источника. Определения всех семи (7) базовых единиц СИ выражаются с использованием явно-константной формулировки и экспериментально реализуются с использованием конкретной mises en pratique (практическая техника).
Семь основных единиц СИ, которые состоят из:
- Длина — метр (м)
- Время — секунды (с)
- Количество вещества — моль (моль)
- Электрический ток — ампер (А)
- Температура в градусах Кельвина (К)
- Сила света — кандела (кд)
- Масса — килограмм (кг)
Международная система единиц (СИ), широко известная как метрическая система, является международным стандартом измерения.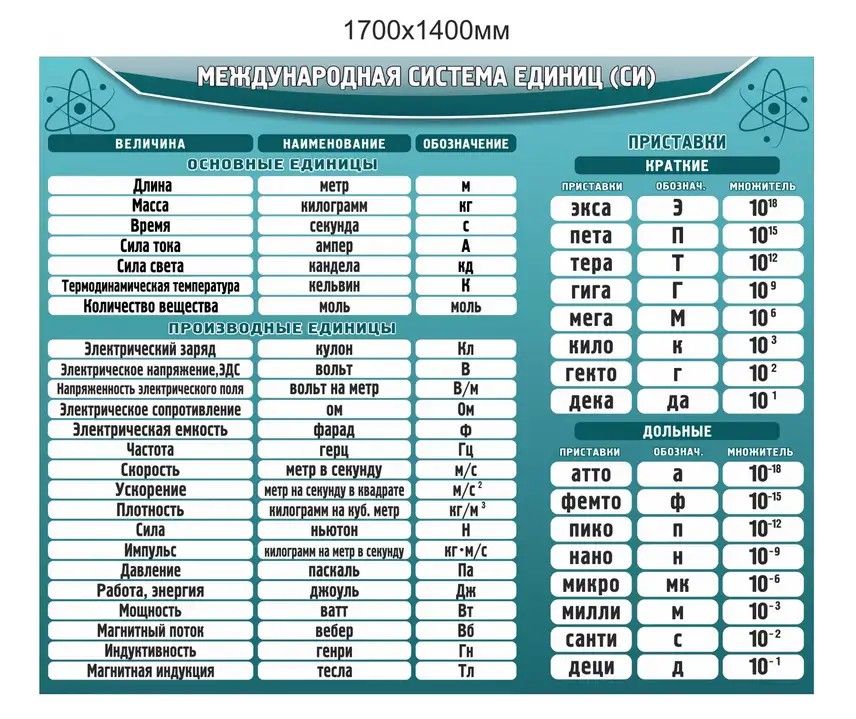 Международный договор по метрологии был подписан в Париже 20 мая 1875 года семнадцатью странами, включая США, и в настоящее время отмечается во всем мире как Всемирный день метрологии. NIST обеспечивает официальное представительство США в различных международных органах, учрежденных Метрической конвенцией: CGPM — Генеральная конференция по мерам и весам; CIPM – Международный комитет мер и весов; и BIPM – Международное бюро мер и весов.
Международный договор по метрологии был подписан в Париже 20 мая 1875 года семнадцатью странами, включая США, и в настоящее время отмечается во всем мире как Всемирный день метрологии. NIST обеспечивает официальное представительство США в различных международных органах, учрежденных Метрической конвенцией: CGPM — Генеральная конференция по мерам и весам; CIPM – Международный комитет мер и весов; и BIPM – Международное бюро мер и весов.
Система СИ состоит из 7 основных единиц, которые определяют 22 производные единицы со специальными именами и символами, которые проиллюстрированы в NIST SP 1247, Плакате о взаимосвязи базовых единиц СИ. SI играет важную роль в международной торговле и широко используется в научных и технологических исследованиях и разработках. Узнайте больше об СИ в NIST SP 330 и SP 811.
Таблица основных единиц СИ.
Кредит:
НИСТ
Ресурсы для студентов и преподавателей
- Новое определение SI.
 В ноябре 2018 года мировые эксперты по измерениям проголосовали и единогласно одобрили пересмотр SI, который устанавливает систему измерения, полностью основанную на физических константах природы. Изменения вступили в силу во Всемирный день метрологии, 20 мая 2019 г. (NIST)
В ноябре 2018 года мировые эксперты по измерениям проголосовали и единогласно одобрили пересмотр SI, который устанавливает систему измерения, полностью основанную на физических константах природы. Изменения вступили в силу во Всемирный день метрологии, 20 мая 2019 г. (NIST) - Узнайте больше о Пути к пересмотренной СИ. Узнайте больше о переопределении СИ. (НИСТ)
- Документальный фильм «Последний артефакт» и сопутствующие образовательные ресурсы для учащихся с 5 по 12 классы, в которых задокументирована работа, которая велась за кулисами по модернизации Международной системы единиц (СИ). (Монтана PBS)
- NIST SP 1247 Плакат о взаимосвязях базовых единиц СИ — красочный плакат, иллюстрирующий взаимосвязь между производными единицами Международной системы единиц (СИ) со специальными названиями и символами и семью традиционными базовыми единицами. (НИСТ)
- Метрическая викторина. Что вы знаете о метрической системе (СИ)? Попробуйте онлайн-викторину NIST Metric Trivia Quiz или воспользуйтесь навыком Alexa, чтобы проверить свои знания и стать на путь к метрике мышления! (НИСТ)
- SI Education and Training — изучите образовательные ресурсы NIST по метрической системе, которые помогут вам познакомиться с системой измерения SI и свободно владеть ею.
.

 1 Электрофизические свойства
1 Электрофизические свойства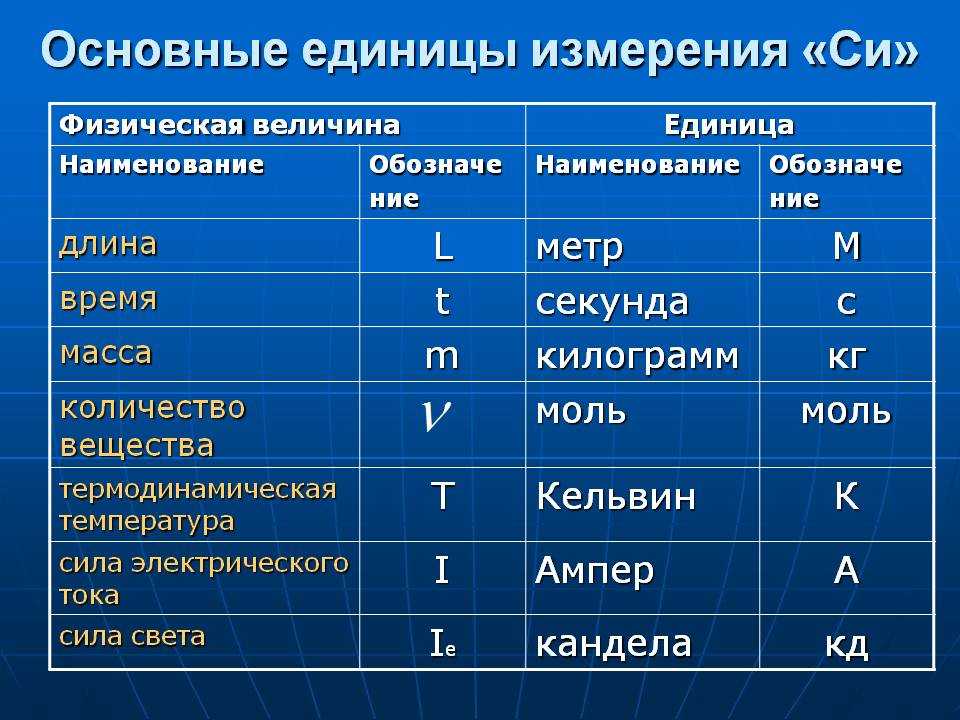 1 Электрофизические свойства
1 Электрофизические свойства