Опыты с йодом 3 класс окружающий мир: Окружающий мир 3 кл.Как определить есть ли крахмал в продуктах?Какие опыты?
Разнообразие веществ — Плешаков 3 класс 1 часть. Рабочая тетрадь
Опубликовано автором okr
- ГДЗ к рабочей тетради Плешакова. 3 класс 1 часть
- ГДЗ к рабочей тетради Плешакова. 3 класс 2 часть
- Все ГДЗ (Главная страница сайта)
1. Наш любознательный Попугай составил для тебя кроссворд. Разгадай его, и ты убедишься, что не так уж мало знаешь о веществах.
По горизонтали:
1. Вещество, из которого состоят озёра, реки, моря (вода).
2. Вещество, которое есть в конфетах и шоколадках (сахар).
3. Вещества, имеющие кислый вкус (кислота).
4. Виноградный сахар (глюкоза).
По вертикали:
1. Вещество, которым можно отмывать посуду, полоскать горло; его же добавляют в тесто (сода).
2. Вещество, из которого делают проволоку и некоторые предметы посуды (алюминий).
3. Вещество, из которого состоит гвоздь (железо).
4. Вещество, которого много в картошке и киселе (крахмал).
5. Вещество, которое мы всегда видим на обеденном столе, но никогда не добавляем в чай (соль).
2. Практическая работа «Исследуем продукты на содержание крахмала».
Цель работы: определить, есть ли крахмал в исследуемых продуктах.
Оборудование: продукты, выданные учителем; разбавленная настойка йода, пипетка.
Ход работы:
- Проведи опыты: с помощью пипетки нанеси каплю настойки йода на каждый из исследуемых продуктов.
- По ходу работы заполняй таблицу.
Оценка выполненной работы (достигнута ли цель): цель достигнула, теперь я с лёгкостью могу узнавать в каких продуктах содержится крахмал, а в каких нет.
Презентация: сообщи классу о результатах своей работы, выслушай и оцени другие сообщения.
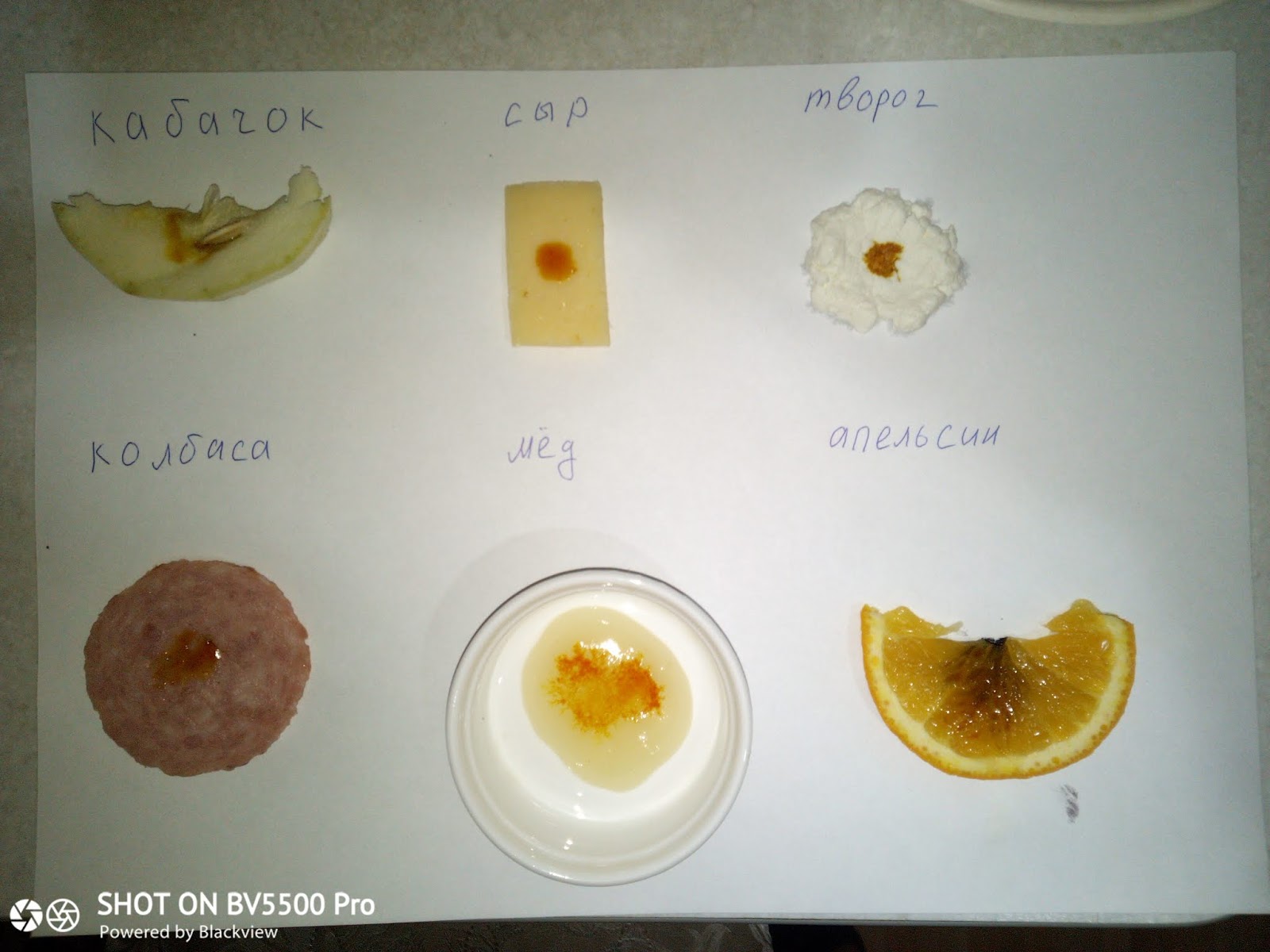
Для выполнения практической работы я подготовил следующее оборудование: баночку с йодом, пипетку , тарелку, телефон с фотокамерой, кусочек хлеба, макаронные изделия, несколько кусочков полукопченой колбасы и нарезанное дольками яблоко.
Разложив на тарелке продукты я капнул на каждый из них из пипетки по капельке йода. Результаты не заставили себя ждать. На хлебе и на «макарошке» мгновенно появились темно-синие пятна от йода. А вот колбаса и яблоко остались без изменений.
Затем я сфотографировал каждый участвующий в эксперименте продукт для таблицы.
Вывод: много крахмала содержится в хлебе и макаронных изделиях, а в полукопченой колбасе и яблоках йода нет.
- ГДЗ к рабочей тетради Плешакова. 3 класс 1 часть
- ГДЗ к рабочей тетради Плешакова. 3 класс 2 часть
- Все ГДЗ (Главная страница сайта)
Ответы по окружающему миру 3 класс
1 часть, 2018, 3 класс, ГДЗ, готовая домашняя работа, окр. мир, Окружающий мир, ответы, Плешаков, Просвещение, рабочая тетрадь, решебник, ФГОС, Школа России
мир, Окружающий мир, ответы, Плешаков, Просвещение, рабочая тетрадь, решебник, ФГОС, Школа России
Страница 91 — ГДЗ по Биологии для 6 класса Учебник Пасечник (решебник)
Вопросы к &16
1. Какие условия необходимы для образования крахмала в листе?
Для образования крахмала в листе необходимы: углекислый газ, вода и свет.
2. Какой опыт можно провести, чтобы доказать, что для образования крахмала в листьях необходим свет?
Возьмем какое-нибудь комнатное растение, например, примулу или герань, поместим его на трое суток в темный шкаф, чтобы произошел отток питательных веществ из листьев. Вырежем на конверте из черной бумаги какую-либо фигуру или слово, например “свет”. Через трое суток вынем растение из шкафа и поместим в этот конверт один из листьев. Затем поставим растение на солнечный свет или под электрическую лампочку. Через 9-10 часов лист срежем. Снимем бумагу. Опустим лист в кипящую воду, а затем на несколько минут в горячий спирт, в котором хлорофилл хорошо растворяется. Когда спирт окрасится в зеленый цвет, а лист обесцветится, промоем его водой, расправим на тарелке и обольем слабым раствором йода. На обесцвеченном листе появятся синие буквы. Известно, что крахмал синеет от йода. Буквы появятся в той части листа, на которую падал свет. Значит, в освещенной части листа образовался крахмал.
Когда спирт окрасится в зеленый цвет, а лист обесцветится, промоем его водой, расправим на тарелке и обольем слабым раствором йода. На обесцвеченном листе появятся синие буквы. Известно, что крахмал синеет от йода. Буквы появятся в той части листа, на которую падал свет. Значит, в освещенной части листа образовался крахмал.
3. Почему раствор йода не окрашивает в синий цвет белую каемку листа герани окаймленной?
Потому что органические вещества образуются только в клетках с хлоропластами.
4. Из каких веществ образуется сахар в зелёных листьях растений?
В зеленых листьях растений сахар образовывается из воды и углекислого газа.
5. Какой опыт показывает, что наземные растения на свету поглощают углекислый газ и выделяют кислород?
Возьмем две большие стеклянные банки и опустим в них стаканы с водой, в которые поставлены веточки с зелеными листьями какого-нибудь растения или небольшие комнатные растения в цветочном горшке. Наполним банки с углекислым газом и плотно закроем, чтобы не проникал воздух. Первую выставим на яркий свет, вторую оставим в темноте, например, поставим в темный шкаф.
Первую выставим на яркий свет, вторую оставим в темноте, например, поставим в темный шкаф.
Через сутки откроем банки и опустим в них горящие лучинки. В первой банке лучинка не гаснет, а продолжает ярко гореть. Значит, в этой банке появился какой-то газ, поддерживающий горение. Поддерживает горение только кислород. Зеленые листья растения поглотили значительную часть углекислого газа и выделил некоторое количество кислорода.
Опущенная во вторую банку горящая лучинка потухнет. Значит, в этой емкости нет кислорода, поддерживающего горение. Следовательно, зеленые растения выделяют кислород только на свету.
Подумайте
1. Можно ли утверждать, что строение листа приспособлено к осуществлению фотосинтеза?
Можно утверждать, что лист полностью приспособлен к поглощению солнечного света, воды. Площадь листа позволяет улавливать больше света, потому как листовая пластина располагается под прямым углом, а хлоропласты, отвечающие за максимальное улавливание света, сосредоточены на верхней поверхности. Наличие устьиц, открывающих замыкающие клетки, обеспечивает газообмен растения.
Наличие устьиц, открывающих замыкающие клетки, обеспечивает газообмен растения.
2. Как вы думаете, выделяют ли кислород водные растения?
Водные растения выделяют кислород, поступающий в воду и использующийся для дыхания всеми обитателями водоемов.
Задания к &16
Составьте план параграфа.
1. Что такое фотосинтез. Понятие фотосинтеза.
2. Условия, которые необходимы для фотосинтеза.
3. Необходимость фотосинтеза в природе. Продукты фотосинтеза.
4. Значение для растений фотосинтеза. Вывод.
Задания для любознательных
1. Попробуйте получить какое-либо изображение на листе примулы, пеларгонии или другого комнатного растения, воспользовавшись описанием опыта в этом параграфе.
На листе комнатного растения с помощью опыта мы можем получить надпись «Свет» или изображение геометрических фигур.
2. Соберите прибор, показанный на рисунке 70. В банку налейте воду, насыщенную углекислым газом. Поставьте банку на яркий свет.
 Наблюдайте за выделением газа веточками элодеи. Когда газ полностью вытеснит воду из пробирки, убедитесь с помощью горящей лучинки, что этот газ — кислород. Сделайте вывод.
Наблюдайте за выделением газа веточками элодеи. Когда газ полностью вытеснит воду из пробирки, убедитесь с помощью горящей лучинки, что этот газ — кислород. Сделайте вывод.
Водные растения способны выделять кислород, использующийся в природе для дыхания водными обитателями.
Демонстрационный метод реакции часов с йодом | Эксперимент
- Четыре из пяти
Познакомьте учащихся со скоростью реакции и кинетикой реакции с йодом «часы». Смешайте раствор перекиси водорода с йодидом калия, крахмалом и тиосульфатом натрия, чтобы увидеть, как бесцветный раствор внезапно становится темно-синим
Эту демонстрацию можно использовать на уровне среднего образования в качестве введения в некоторые идеи кинетики. Его можно использовать для стимулирования дискуссии о том, какие факторы влияют на скорость реакции. Это также является полезной отправной точкой для студенческого расследования.
Это также является полезной отправной точкой для студенческого расследования.
Посмотрите видео этой демонстрации
Этот эксперимент представлен в нашем Get set … демонстрация видео. Версия эксперимента для учащихся используется в нашем видеоролике «Оценка реакции» для детей 16–18 лет вместе со вспомогательными ресурсами, включая иллюстрированные технические заметки, вопросы, рабочие листы и многое другое.
Процедура, описанная ниже, описывает этот эксперимент как демонстрацию, которую лучше всего проводить в большом масштабе для получения наибольшего визуального эффекта. Сама демонстрация занимает менее одной минуты. Для студенческого исследования требуемое количество будет меньше, и им придется довольно точно измерять количество, например, с помощью одноразовых пластиковых шприцев.
Оборудование
Аппарат
- Защита глаз
- Баланс (1 или 2 знака после запятой)
- Стакан (1 дм 3 )
- Стакан (250 см 3 )
- Колбы мерные (1 дм 3 ) x2
- Мерный цилиндр (50 см 3 )
- Мерные цилиндры (100 см 3 ) x2
- Стержень для перемешивания или магнитная мешалка и толкатель (дополнительно)
- Секундомер/таймер
Химикаты
- Вода деионизированная или дистиллированная, 2 дм 3 .

- Раствор А (примечание 1):
- Крахмал растворимый, 0,2 г
- Этаноат натрия безводный (ацетат натрия), 4,1 г
- Йодид калия, 50 г
- Тиосульфат натрия–5–вода, 9,4 г
- Раствор Б (примечание 1):
- Ледяная (концентрированная) этановая кислота (КОРРОЗИОННОЕ), 30 см 3 (примечание 2)
- Раствор перекиси водорода, объем 20 (РАЗДРАЖАЮЩИЙ), 500 см 3 (примечание 2)
Химические примечания
- Растворы A и B должны быть приготовлены до демонстрации. Растворы хранятся в течение ночи, но наилучшие результаты получаются, если растворы готовятся в течение дня. Тиосульфат натрия будет реагировать с кислотами с образованием диоксида серы и осадка серы, поэтому тиосульфат натрия и этановая кислота разделяются в растворах А и Б соответственно.
- Если у вас есть доступ к 1 М разбавленной этановой кислоте, используйте 500 см 3 из него приготовить раствор B.
 Смешайте 500 см 3 20 объемов перекиси водорода с 500 см 3 1 М этановой кислоты.
Смешайте 500 см 3 20 объемов перекиси водорода с 500 см 3 1 М этановой кислоты.
Примечания по охране труда и технике безопасности
- Ознакомьтесь с нашим стандартным руководством по охране труда и технике безопасности
- Используйте защитные очки.
- Этаноат натрия безводный, CH 3 CO 2 Na(s) – см. карточку опасности CLEAPSS HC038a.
- Йодид калия, KI(s) – см. карточку опасности CLEAPSS HC047a.
- Тиосульфат натрия–5–вода, Na 2 S 2 O 3 .5H 2 O(s) – см. CLEAPSS Hazcard HC095.
- Этановая кислота, CH 3 CO 2 H(l), (КОРРОЗИОННОЕ) – см. карточку опасности CLEAPSS HC038a и книгу рецептов CLEAPSS RB039. Работа с ледяной этановой кислотой требует осторожности и должна выполняться в вытяжном шкафу с использованием перчаток и средств защиты глаз.
- Перекись водорода, H 2 O 2 (водн.
 ) (РАЗДРАЖАЮЩЕЕ СРЕДСТВО) – см. CLEAPSS Hazcard HC050 и CLEAPSS Сборник рецептов RB045.
) (РАЗДРАЖАЮЩЕЕ СРЕДСТВО) – см. CLEAPSS Hazcard HC050 и CLEAPSS Сборник рецептов RB045.
Процедура
Раствор A готовится следующим образом
- Сделайте пасту из 0,2 г растворимого крахмала с несколькими каплями воды в стакане. Налейте на это примерно 100 см 3 кипятка и перемешайте.
- Налейте полученный раствор в химический стакан вместимостью 1 дм 3 и разбавьте примерно до 800 см 3 .
- Добавьте 4,1 г этаноата натрия, 50 г йодида калия и 9,4 г тиосульфата натрия. Перемешивайте, пока все твердые вещества не растворятся, и дайте остыть до комнатной температуры.
- Смесь перелить в мерную колбу вместимостью 1 дм 3 и довести до объема 1 дм 3 водой.
Раствор В готовят следующим образом
- В мерной колбе объемом 1 дм 3 смешивают в мерной колбе 500 см 3 20 объемов перекиси водорода с 30 см 3 ледяной этановой кислоты и разбавить до 1 дм 3 с водой.

Демонстрация
- Размер 100 см 3 раствора А и 100 см 3 раствора В в отдельных мерных цилиндрах по 100 см 3 .
- Оба раствора бесцветны, хотя раствор А будет слегка мутным.
- Налейте оба раствора одновременно в 250-см химический стакан 3 и перемешайте. Обеспечьте тщательное перемешивание с помощью мешалки или магнитной мешалки.
- Примерно через 20 секунд при комнатной температуре смесь внезапно станет темно-синей. Появление синего цвета может быть синхронизировано – ассистент или ученик может запускать и останавливать таймер.
Дополнительные примечания
- Перекись водорода способна окислять ионы тиосульфата до ионов тетратионата, но реакция протекает слишком медленно, чтобы повлиять на эту демонстрацию.
- Этановая кислота/этаноат натрия добавляют для буферизации pH.
- Кислота будет медленно реагировать с тиосульфатом натрия с образованием мутной суспензии серы и выделением диоксида серы, который ЯВЛЯЕТСЯ ТОКСИЧНЫМ – см.
 карточку опасности CLEAPSS HC097. Во избежание этого кислоту и тиосульфат натрия разделяют в растворах А и Б.
карточку опасности CLEAPSS HC097. Во избежание этого кислоту и тиосульфат натрия разделяют в растворах А и Б. - Руководство CLEAPSS L195 «Более безопасные химические вещества, более безопасные реакции» содержит полезную информацию о том, как более безопасно проводить эксперименты по скорости с использованием смесей кислоты/тиосульфата.
Учебные заметки
Белый фон поможет не потерять эффект внезапного и эффектного изменения цвета. Увеличение объемов смешиваемого раствора может помочь в большой комнате. Нет предупреждения о том, когда появится синий цвет.
Это может помочь понять, если учащиеся уже знакомы с реакциями крахмала и йода, йода и тиосульфата натрия, поэтому, возможно, стоит продемонстрировать их заранее.
Основная реакция:
H 2 O 2 (водн.) + 2I – (водн.) + 2H + (водн.) → I 2 (a р) + 2Н 2 О (l)
(Для более продвинутых обсуждений или исследований – эта реакция является стадией, определяющей скорость, и имеет первый порядок как по H 2 O 2 , так и по I – . )
)
Как только йод образуется, он реагирует с тиосульфатом с образованием тетратионат-ионов и рециклирует йодид-ионы по быстрой реакции:
2S 2 O 3 2– (водн.) + I 2 (водн.) → S 4 O 6 2– (водн.) + 2 I – (водн.)
Как только весь тиосульфат израсходован, свободный йод (или, строго говоря, I 3 — ионы) остается в растворе и реагирует с крахмалом, образуя знакомый сине-черный комплекс.
Время появления синего цвета можно регулировать, изменяя количество тиосульфата в растворе А, чтобы можно было получить «часы» с любым желаемым временным интервалом.
Дополнительная информация
Это ресурс проекта «Практическая химия», разработанного Фондом Наффилда и Королевским химическим обществом. Эта коллекция из более чем 200 практических заданий демонстрирует широкий спектр химических концепций и процессов. Каждое задание содержит исчерпывающую информацию для учителей и техников, включая полные технические примечания и пошаговые инструкции. Практические занятия по химии сопровождают практические занятия по физике и практической биологии.
Практические занятия по химии сопровождают практические занятия по физике и практической биологии.
© Фонд Наффилда и Королевское химическое общество
Проверка здоровья и безопасности, 2016 г.
- Четыре из пяти
Экзотермическая окислительно-восстановительная реакция цинка с йодом | Эксперимент
Используя экзотермическую окислительно-восстановительную реакцию между цинком и йодом, ученик приготовит йодид цинка. Это можно обратить вспять, используя электролиз для разложения соединения 9.0017
Этот эксперимент включает синтез соли металла путем прямой реакции металла и неметалла. Цинковый порошок добавляют к раствору йода в этаноле. Происходит экзотермическая окислительно-восстановительная реакция с образованием йодида цинка, который можно получить путем выпаривания растворителя.
Zn + I 2 → ZnI 2
Эксперимент можно расширить, чтобы показать разложение соединения на его элементы.
Этот эксперимент можно использовать для иллюстрации различий между металлическими и неметаллическими элементами и их реакции с образованием соединения — соли металла — с новыми свойствами.
Реакцию можно легко обратить вспять с помощью электролиза, чтобы разложить соединение обратно на его элементы. Их легко узнать по характерному внешнему виду.
Обе части эксперимента можно проводить как в виде демонстрации, так и в виде классового эксперимента. Каждая часть должна занять около 10 минут в качестве демонстрации; дольше в качестве классового эксперимента.
Оборудование
Аппарат
- Защита глаз
Для каждой группы (или демонстрации) требуется:
- Пробирки (100 x 16 мм) x3
- Пробка для пробирок
- Штатив для пробирок
- Мерный цилиндр (10 см 3 )
- Малая воронка для фильтра
- Фильтровальная бумага
- Соска-пипетка
- Термометр (0–100 °C)
- Шпатель
- Стекло для часов
- Лодочка для взвешивания или подходящий контейнер для цинкового порошка
Для наращивания:
- Стакан (100 см 3 )
- Пара графитовых электродов в резиновой пробке
- Электрические провода и зажимы типа «крокодил»
- Источник 3–6 В пост.
 тока, батарея или блок питания
тока, батарея или блок питания - Лампа фонарика в подходящем патроне
- Шпатель
Химические препараты
Химические препараты предназначены для одной демонстрации или одной группы учащихся:
- Йод (ВРЕДНЫЙ), около 0,5 г (примечание 1)
- Цинковый порошок (ЛЕГКО ОГНЕОПАСНЫЙ), около 0,5 г (примечание 2)
- Этанол (ЛЕГКО ВОСПЛАМЕНЯЕМЫЙ) или IDA (технический денатурированный спирт) (ЛЕГКИЙ ВОСПЛАМЕНЯЕМЫЙ, ВРЕДНЫЙ) около 5 см 3
Для наращивания:
- Дистиллированная вода, около 20 см 3
- Разбавленная соляная кислота, 1 М, или серная кислота, 1 М (РАЗДРАЖАЮЩЕЕ СРЕДСТВО), около 20 см 3
Химические примечания
- Твердый йод следует измельчить в ступке в вытяжном шкафу. Для проведения классного опыта каждой группе учащихся должна быть предоставлена закупоренная пробирка с 0,5 г порошкообразного йода.
- Для классного эксперимента каждой группе учащихся необходимо предоставить предварительно взвешенный образец порошка цинка массой 0,5 г в лодочке для взвешивания или в пробирке.

Примечания по охране труда и технике безопасности
- Ознакомьтесь с нашим стандартным руководством по охране труда и технике безопасности
- Используйте защитные очки.
- Йод, I 2 (s), (ВРЕДЕН, ОПАСЕН ДЛЯ ОКРУЖАЮЩЕЙ СРЕДЫ) — см. CLEAPSS Hazcard HC054.
- Порошок цинка, Zn(s), (ЛЕГКО ВОСПЛАМЕНЯЕМЫЙ, ОПАСНЫЙ ДЛЯ ОКРУЖАЮЩЕЙ СРЕДЫ) – см. карточку опасности CLEAPSS HC107.
- Этанол, C 2 H 5 OH(l), (ЛЕГКО ОГНЕОПАСНО или ЛЕГКО ВОСПЛАМЕНЯЕМО и ВРЕДНО при использовании IDA) – см. CLEAPSS Hazcard HC040a.
- Йодид цинка, ZnI 2 (s), (РАЗДРАЖАЮЩЕЕ СРЕДСТВО) – см. карточку опасности CLEAPSS HC054.
- Разбавленная соляная кислота, HCl (водн.) или разбавленная серная кислота, H 2 SO 4 (водн.) (РАЗДРАЖАЮЩЕЕ СРЕДСТВО) – см. CLEAPSS Hazcard HC047a.
Процедура
Синтез йодида цинка
- Отмерить 5 см 3 этанола с помощью мерного цилиндра.
 Поместите термометр в этанол и запишите температуру.
Поместите термометр в этанол и запишите температуру. - Добавьте этанол к 0,5 г порошкообразного йода в пробирке. Тщательно перемешайте, используя термометр, чтобы растворить йод. Раствор должен быть темно-коричневого цвета. Обратите внимание на температуру.
- Когда весь йод растворится, медленно добавьте цинковый порошок с помощью шпателя и перемешайте смесь термометром. Температура должна подняться, что указывает на экзотермическую реакцию. Когда реакция завершится, окраска йода должна поблекнуть и останется избыток цинка. Если нет, добавьте еще небольшое количество порошка цинка и перемешайте, пока не исчезнет коричневый цвет из-за йода.
- Профильтруйте раствор в другую пробирку. Используя сосковую пипетку, перенесите несколько капель фильтрата на часовое стекло и дайте растворителю испариться. Это можно ускорить, поместив часовое стекло на стакан с горячей водой. Иодид цинка останется в виде белого твердого вещества.
Разложение
- Налейте остаток раствора, содержащего йодид цинка, в 100-см химический стакан 3 .
 Добавьте около 20 см 3 дистиллированной воды и перемешайте.
Добавьте около 20 см 3 дистиллированной воды и перемешайте. - Закрепите пробку с двумя графитовыми электродами над стаканом так, чтобы нижняя часть электродов была как можно глубже погружена в раствор. Может быть проще просто положить пробку в стакан так, чтобы электроды касались дна.
- С помощью проводов и зажимов типа «крокодил» последовательно подключите электроды и лампу, а затем к источнику питания, как показано на схеме на этой странице. Лампочка должна светиться, показывая, что цепь замкнута и происходит электролиз.
- Если лампочка не светится, поднимите пробку из раствора и проверьте соединения, прикоснувшись металлической лопаткой к обоим электродам одновременно. Если лампочка загорится, поместите электроды обратно в раствор. Если признаков электролиза по-прежнему нет, добавьте в раствор небольшое количество йодида цинка из часового стекла и перемешайте. Повторяйте, пока лампочка не начнет светиться.
- Позвольте электролизу продолжаться в течение нескольких минут.
 Обратите внимание на любые изменения, происходящие вокруг электродов в растворе – в растворе вокруг положительного электрода должен появиться коричневый цвет (из-за йода). На отрицательном электроде может наблюдаться некоторое вскипание.
Обратите внимание на любые изменения, происходящие вокруг электродов в растворе – в растворе вокруг положительного электрода должен появиться коричневый цвет (из-за йода). На отрицательном электроде может наблюдаться некоторое вскипание. - Отключите питание. Поднимите электроды из раствора. Помойте их под краном. Нижняя часть отрицательного электрода должна быть покрыта серебристо-серым слоем металлического цинка.
- Отложение цинка можно проверить (и удалить), погрузив кончик электрода в небольшое количество разбавленной кислоты. Он реагирует и растворяется, выделяя бесцветный газ (водород).
Источник: Королевское химическое общество
Установка электролиза для разложения йодида цинка.
Учебные заметки
Эта реакция демонстрирует синтез соединения из двух элементов, каждый из которых имеет свой отличительный внешний вид и свойства. Практический рабочий лист может включать в себя составление таблицы свойств (тип элемента, внешний вид и т.
