Митохондриальная дисфункция у детей: Митохондриальная патология у детей | #01/16
Нарушение митохондриального обмена у детей с расстройствами аутистического спектра: обзор литературы и собственные данные
SOVREMENNAYA PEDIATRIYA.2017.8(88):111-119; doi 10.15574/SP.2017.88.111
Кирилова Л. Г., Мирошников А. А., Ткачук Л. И., Юзва А. А., Силаева Л. Ю., Михайлец Л. П., Ленчевская Л. К.
ГУ «Институт педиатрии, акушерства и гинекологии НАМН Украины», г. Киев
В современном обществе отмечается стремительный рост заболеваемости расстройствами аутистического спектра (РАС). Окончательно этиологические и патогенетические факторы этих заболеваний не установлены. В настоящем исследовании рассматриваются нарушения функционирования митохондрий как один из возможных патогенетических факторов формирования РАС.
Цель: определить особенности биохимических показателей митохондриальной дисфункции и ее распространенность среди детей с РАС.
Материалы и методы. Обследовано 25 детей с РАС и 15 здоровых детей группы контроля в возрасте 1,5–5,5 г. (средний возраст — 3,5 г.). Мальчиков было 18 (72%), девочек — 7 (18%). У детей проводили определение концентрации лактата и пирувата.
(средний возраст — 3,5 г.). Мальчиков было 18 (72%), девочек — 7 (18%). У детей проводили определение концентрации лактата и пирувата.
Результаты. Выявлено повышение концентрации лактата натощак у 18 детей (72,0%) с РАС. У детей данной группы в основном отмечался умеренно выраженный лактат4ацидоз, при котором концентрация лактата превышала референтные значения на 25–50%. Повышение концентрации лактата в пределах 25% отмечалось у 2 (8%) детей, а выше на 50% — у 7 (16,0%) детей. Также обнаружено снижение соотношения лактат/пируват у 19 (76,0%) детей с РАС.
Выводы. У детей с РАС виявлены высокие показатели распространенности и выраженности митохондриальной дисфункции, которую можно считать важным патогенетическим фактором регрессивных форм РАС. Раннее выявление митохондриальной дисфункции является критически важным и требует немедленного лечения. Предложено скрининговое определение уровня лактата, пирувата и их соотношения натощак у всех детей с РАС.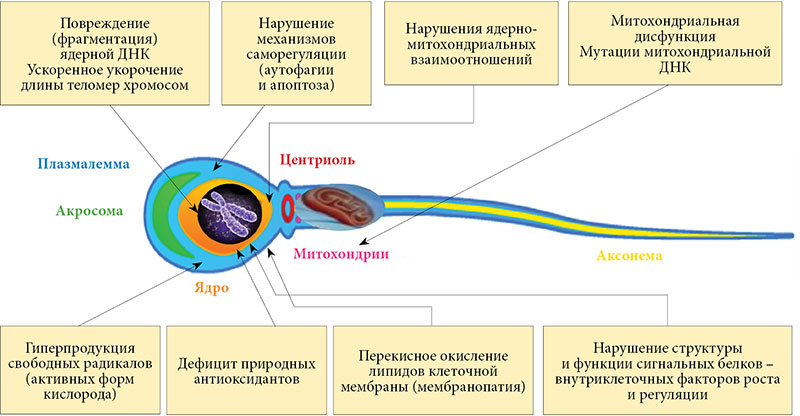
Ключевые слова: митохондриальная дисфункция, расстройства аутистического спектра, лактат, пируват, дыхательная цепь.
Литература
1. Батышева Т.Т., Трепилец В.М., Ахадова Л.Я., Голосная Г.С. (2015). Синдром Альперса-Хуттенлохера. Эпилепсия и пароксизмальные состояния. 7(1): 46—55.
2. A modern approach to the treatment of mitochondrial disease / Parikh S. [et al.] // Curr Treat Options Neurol. — 2009. — Vol.11(6). — P.414—30. https://doi.org/10.1007/s11940-009-0046-0; PMid:19891905 PMCid:PMC3561461
3. A proton spectroscopy study of white matter in children with autism / Hardan A.Y., Fung L.K., Frazier T. [et al.] // Prog Neuro Psychopharmacology Biol Psychiatry. — 2015. — Vol.66. — P.48—53. https://doi.org/10.1016/j.pnpbp.2015.11.005; PMid:26593330 PMCid:PMC4728039
4. Alterations in mitochondrial DNA copy number and the activities of electron transport chain complexes and pyruvate dehydrogenase in the frontal cortex from subjects with autism / Gu F. , Chauhan V., Kaur K. [et al.] // Transl Psychiatry. — 2013. — Vol.3. — P.299. https://doi.org/10.1038/tp.2013.68; PMid:24002085 PMCid:PMC3784762
, Chauhan V., Kaur K. [et al.] // Transl Psychiatry. — 2013. — Vol.3. — P.299. https://doi.org/10.1038/tp.2013.68; PMid:24002085 PMCid:PMC3784762
5. An MRI and proton spectroscopy study of the thalamus in children with autism / Hardan A.Y., Minshew N.J., Melhem N.M. [et al.] // Psychiatry Res Neuroimaging. — 2008. — Vol.163. — P.97—105. https://doi.org/10.1016/j.pscychresns.2007.12.002; PMid:18508243 PMCid:PMC2467447
6. Brain region-specific deficit in mitochondrial electron transport chain complexes in children with autism / Chauhan A., Gu F., Essa M.M. [et al.] // J. Neurochem. — 2011. Vol.117. — P.209—220. https://doi.org/10.1111/j.1471-4159.2011.07189.x; PMid:21250997 PMCid:PMC4839269
7. Chan D.C. Mitochondria: Dynamic Organelles in Disease, Aging, and Development / D.C. Chan // Cell. — 2006. — Vol.125. — P.1241—1252. https://doi.org/10.1016/j.cell.2006.06.010; PMid:16814712
8. Cohen R.D. Lactic acidosis: some physiological and clinical considerations / R. D. Cohen, R.A. Iles // Clin Sci Mol Med. Nov. — 1977. — Vol.53(5). — P.405—10.
D. Cohen, R.A. Iles // Clin Sci Mol Med. Nov. — 1977. — Vol.53(5). — P.405—10.
9. Finsterer J. Mitochondrial toxicity of antiepileptic drugs and their tolerability in mitochondrial disorders / J. Finsterer, S.Z. Mahjoub // Expert Opinion on Drug Metabolism & Toxicology. — 2012. — Vol. 8(1). — P.71—9. https://doi.org/10.1517/17425255.2012.644535; PMid:22149023
10. Frye R.E. 15q11.2-13 duplication, mitochondrial dysfunction, and developmental disorders / R.E. Frye // J. Child Neurol. — 2009. — Vol.24(10). — P.1316—20. https://doi.org/10.1177/0883073809333531; PMid:19535813 PMCid:PMC2919279
11. Frye R.E. Metabolic and mitochondrial disorders associated with epilepsy in children with autism spectrum disorder / R.E. Frye // Epilepsy Behav. — 2015. — Vol.47. — P.147—57. https://doi.org/10.1016/j.yebeh.2014.08.134. Epub 2014 Nov 4.
12. Homo sapiens mitochondrion, complete genome. «Revised Cambridge Reference Sequence (rCRS): accession NC-012920», National Center for Biotechnology Information. Retrieved on 30 January 2016.
Retrieved on 30 January 2016.
13. Lombard J. Autism: a mitochondrial disorder? / J. Lombard // Med Hypotheses. — 1998. Vol.50(6). — P.497—500. https://doi.org/10.1016/S0306-9877(98)90270-5
14. Manzi B. Autism and metabolic diseases / B. Manzi // J. Child Neurol. — 2008. — Vol.23(3). — P.307—14. https://doi.org/10.1177/0883073807308698; PMid:18079313
15. Mitochondrial abnormalities in temporal lobe of autistic brain / Tang G., Rios P.G., Kuo S.H. [et al.] // Neurobiol Dis. — 2009. — Vol.54. — P.349—361. https://doi.org/10.1016/j.nbd.2013.01.006; PMid:23333625 PMCid:PMC3959772
16. Mitochondrial disease criteria: diagnostic applications in children / Morava E., van den Heuvel L., Hol F. [et al.] // Neurology. — 2006. — Vol. 67(10). — P.1823—6. https://doi.org/10.1212/01.wnl.0000244435.27645.54; PMid:17130416
17. Mitochondrial disease in autism spectrum disorder patients: a cohort analysis / Weissman J.R., Kelley R.I., Bauman M.L. [et al.] // PLoS One. — 2008. — Vol. 3(11). — P.3815. https://doi.org/10.1371/journal.pone.0003815; PMid:19043581 PMCid:PMC2584230
— 2008. — Vol. 3(11). — P.3815. https://doi.org/10.1371/journal.pone.0003815; PMid:19043581 PMCid:PMC2584230
18. Mitochondrial disease: a practical approach for primary care physicians / Haas R.H., Parikh S., Falk M.J. [et al.]// Pediatrics. Dec. — 2007. — Vol.120(6). — P.1326—33. https://doi.org/10.1016/j.mito.2007.04.005; https://doi.org/10.1016/j.mito.2007.03.008; PMid:17485245
19. Mitochondrial diseases associated with cerebral folate deficiency / Garcia-Cazorla A., Quadros E.V., Nascimento A. [et al.] // Neurology. — 2008. — Vol. 70(16). — P.1360—2. https://doi.org/10.1212/01.wnl.0000309223.98616.e4; PMid:18413591
20. Mitochondrial DNA haplogroup K is associated with a lower risk of Parkinson’s disease in Italians / Ghezzi D. [et al.] // European Journal of Human Genetics. — 2005. — Vol.13. — P. 748—752. https://doi.org/10.1038/sj.ejhg.5201425; PMid:15827561
21. Mitochondrial Dysfunction in Autism Spectrum Disorders /Siddiqui M. [et al.] // Autism Open Access. — 2016. — Vol.27. — P. 6(5).
— 2016. — Vol.27. — P. 6(5).
22. Mitochondrial dysfunction in schizophrenia: evidence for compromised brain metabolism and oxidative stress / Prabakaran S., Swatton J.E., Ryan M.M. [et al.] // Mol Psychiatry. — 2004. — P.684—697., 643. [PubMed] https://doi.org/10.1038/sj.mp.4001532; https://doi.org/10.1038/sj.mp.4001511
23. Mitochondrial Medicine Society’s Committee on Diagnosis. Review The in-depth evaluation of suspected mitochondrial disease / Haas R.H., Parikh S., Falk M.J. [et al.] // Mol Genet Metab. — 2008 — Vol. 94(1). — P.16—37. https://doi.org/10.1016/j.ymgme.2007.11.018; PMid:18243024 PMCid:PMC2810849
24. Molecular evidence for mitochondrial dysfunction in bipolar disorder / Konradi C., Eaton M., MacDonald M.L. [et al.] // Arch Gen Psychiatry. — 2004. — Vol.61. — P.300—308. [PubMed] https://doi.org/10.1001/archpsyc.61.3.300; PMid:14993118
25. Multiple presentation of mitochondrial disorders / Nissenkorn A., Zeharia A., Lev D. [et al.] // Arch Dis Child. — 1999. — Vol.81(3). — P.209—14. https://doi.org/10.1136/adc.81.3.209; PMid:10451392 PMCid:PMC1718054
— 1999. — Vol.81(3). — P.209—14. https://doi.org/10.1136/adc.81.3.209; PMid:10451392 PMCid:PMC1718054
26. Naviaux R.K. Developing a systematic approach to the diagnosis and classification of mitochondrial disease / R.K. Naviaux // Mitochondrion. — 2004. — Vol.4. — P.351—361. https://doi.org/10.1016/j.mito.2004.07.002; PMid:16120397
27. Naviaux R.K. The Spectrum of Mitochondrial Disease, in Mitochondrial and Metabolic Disorders: A Primary Care Physician’s Guide / R.K. Naviaux. — 2nd ed., 2003.
28. Neurology of the Infant / Francesco Guzzetta (Ed.), John Libbey Eurotext. — Montrouge, 2009. — P.162.
29. Ohta S. Dysfunction of mitochondria and oxidative stress in the pathogenesis of Alzheimer’s disease: on defects in the cytochrome c oxidase complex and aldehyde detoxification / S. Ohta, I. Ohsawa // J. Alzheimers Dis. — 2006. — Vol.9. — P.155—166. https://doi.org/10.3233/JAD-2006-9208; PMid:16873963
30. Palmieri L. Mitochondrial dysfunction in autism spectrum disorders: Cause or effect? / L. Palmieri, A.M. Persico // Biochim Biophys Acta. — 2010. — Vol.1797. — P.1130—1137. https://doi.org/10.1016/j.bbabio.2010.04.018; PMid:20441769
Palmieri, A.M. Persico // Biochim Biophys Acta. — 2010. — Vol.1797. — P.1130—1137. https://doi.org/10.1016/j.bbabio.2010.04.018; PMid:20441769
31. Pathogenic Mitochondrial DNA Mutations Are Common in the General Population / Elliot H., Samuels D. [et al.] // The American Journal of Human Genetics. — 2008. — Vol.83(2). —P. 254—260. https://doi.org/10.1016/j.ajhg.2008.07.004; PMid:18674747 PMCid:PMC2495064
32. Reanalysis and revision of the Cambridge reference sequence for human mitochondrial DNA / Andrews R. [et al.] // Nat Genet. — 1999. — Vol.23 (2). — P.147. https://doi.org/10.1038/13779; PMid:10508508
33. Richard I. Kelley, MD, PhD Evaluation and Treatment of Patients with Autism and Mitochondrial Disease [Electronic resource]. — URL: http://mitomedical.com.
34. Rossignol D.A Mitochondrial dysfunction in autism spectrum disorders: a systematic review and meta_analysis / D.A. Rossignol // Mol Psychiatry. — 2012. — Vol.17(3). — P. 290—314. https://doi. org/10.1038/mp.2010.136; PMid:21263444 PMCid:PMC3285768
org/10.1038/mp.2010.136; PMid:21263444 PMCid:PMC3285768
35. Smigrodzki R. M. Mitochondrial Microheteroplasmy and a Theory of Aging and Age_Related Disease / R. M. Smigrodzki, S. M. Khan // Rejuvenation Research. — 2005. — Vol.8 (3). — P.172—198. https://doi.org/10.1089/rej.2005.8.172; PMid:16144471
36. Trushina E. Oxidative stress and mitochondrial dysfunction in neurodegenerative diseases / E. Trushina, C.T. McMurray // Neuroscience. — 2007. — Vol.145. — P.1233—1248 [PubMed] https://doi.org/10.1016/j.neuroscience.2006.10.056; PMid:17303344
37. Valproic acid metabolism and its effects on mitochondrial fatty acid oxidation: a review / Silva M.F., Aires C.C., Luis P.B. [et al.] // J. Inherit Metab Dis. — 2008. — Vol.31. — P.205—216. https://doi.org/10.1007/s10545-008-0841-x; PMid:18392741
38. Zeviani M. Mitochondrial disorders / M. Zeviani, S. Di Donato // Brain. — 2004. — Vol.127 (10). — P.2153—2172. https://doi.org/10.1093/brain/awh359; PMid:15358637
Главная — Журнал нефрология и диализ
Для повышения доступности профессиональной информации и расширения читательской аудитории с апреля 2023 года руководством РДО принято решение о публикации материалов журнала «Нефрология и Диализ» в свободном доступе
Дорогие авторы и читатели нашего журнала! Редакция рада сообщить вам, что в ответ на наш запрос главный ученый секретарь ВАК при Минобрнауки И И. Мацкевич письменно подтвердил, что публикации в журнале «Нефрология и Диализ» будут засчитываться соискателю ученой степени как публикации в журнале категории К1 (письмо ВАК от 21.03.2023 N 02-368).
Мацкевич письменно подтвердил, что публикации в журнале «Нефрология и Диализ» будут засчитываться соискателю ученой степени как публикации в журнале категории К1 (письмо ВАК от 21.03.2023 N 02-368).
В последнем номере:
- Клинические Практические Рекомендации KDIGO 2022 по тактике ведения диабета при хронической болезни почек 29
Козловская Н.Л., Пыриков Д.Ю., Столяревич Е.С. и соавт., 
Трудности дифференциальной диагностики гранулематозного тубулоинтерстициального нефрита 19Салихова К.А., Герасимчук Р.П., Сабодаш А.Б. и соавт., 
Раздельное и совмещенное проведение стандартного теста перитонеального равновесия (ПЭТ) и мини-ПЭТ 14Шабунин А.
 В., Шутов Е.В., Долидзе Д.Д. и соавт., 
В., Шутов Е.В., Долидзе Д.Д. и соавт., 
Вторичный гиперпаратиреоз. Специфика, сложности, особенности лечения. Обзор литературы. Часть I 13Морель Иоганн, Стаховска-Пьетка Джоанна, Эберг Карл и соавт., 
Рекомендации международного общества перитонеального диализа по оценке дисфункции перитонеальной мембраны у взрослых: классификация, методы оценки, интерпретация и обоснования для вмешательства 13Баркова Ю.В., Манченко О.В., Ковалев А.И. и соавт., 
Эмболический инфаркт почки как клиническая манифестация доброкачественной опухоли сердца 13Постникова Г.
 А., Симонова О.В., Столяревич Е.С., 
А., Симонова О.В., Столяревич Е.С., 
Клинико-морфологические особенности АНЦА-ассоциированного гломерулонефрита 11Фролова Н.Ф., Сайфуллин Р.Ф., Артюхина Л.Ю. и соавт., 
Клинический случай тяжелой ветряной оспы с летальным исходом у пациента с трансплантированной почкой 11Демьянова К.А., Козловская Н.Л., Захарова Е.В. и соавт., 
Беременность при ХБП 4 стадии: серия наблюдений специализированного нефрологического центра 9Захарова Е.
 В., Шубин А.А., Араблинский А.В. и соавт., 
В., Шубин А.А., Араблинский А.В. и соавт., 
Мультифокальный атеросклероз и атеросклеротическая реноваскулярная болезнь — возможности и трудности реваскуляризации 9
Наиболее читаемые статьи
Руководство по клинической практике перии послеоперационного ухода за артериовенозными фистулами и сосудистыми протезами для гемодиализа у взрослых пациентов. Краткий обзор рекомендаций Европейской наилучшей клинической практики в нефрологи (ERBP)
9830
Клинические Практические Рекомендации KDIGO 2012 по Диагностике и Лечению Хронической Болезни Почек
7799
Заместительная терапия больных с хронической почечной недостаточностью в Российской Федерации в 1998-2011 гг.
 (Отчет по данным Российского регистра заместительной почечной терапии. Часть первая)
(Отчет по данным Российского регистра заместительной почечной терапии. Часть первая)
Бикбов Б.Т., Томилина Н.А.7210
детей с аутизмом имеют митохондриальную дисфункцию, результаты исследования — ScienceDaily
Дети с аутизмом гораздо чаще имеют дефицит в своей способности производить клеточную энергию, чем обычно развивающиеся дети, как показало новое исследование, проведенное учеными из Калифорнийского университета в Дэвисе. Исследование, опубликованное в журнале Американской медицинской ассоциации (JAMA), показало, что кумулятивное повреждение и окислительный стресс в митохондриях, производящих клеточную энергию, могут влиять как на начало, так и на тяжесть аутизма, что указывает на сильную связь между аутизмом и митохондриальные дефекты.
После сердца мозг является самым прожорливым потребителем энергии в организме. Авторы предполагают, что дефицит способности питать нейроны головного мозга может привести к некоторым когнитивным нарушениям, связанным с аутизмом. Митохондрии являются основным источником производства энергии в клетках и несут свой собственный набор генетических инструкций, митохондриальную ДНК (мтДНК), для осуществления аэробного дыхания. Дисфункция митохондрий уже связана с рядом других неврологических состояний, включая болезнь Паркинсона, болезнь Альцгеймера, шизофрению и биполярное расстройство.
«Дети с митохондриальными заболеваниями могут проявлять непереносимость физической нагрузки, судороги и снижение когнитивных функций, среди прочего. У некоторых проявляются симптомы заболевания, а у некоторых проявляются спорадические случаи», — сказала Сесилия Джуливи, ведущий автор исследования и профессор кафедры молекулярной медицины. Биологические науки в Школе ветеринарной медицины Калифорнийского университета в Дэвисе.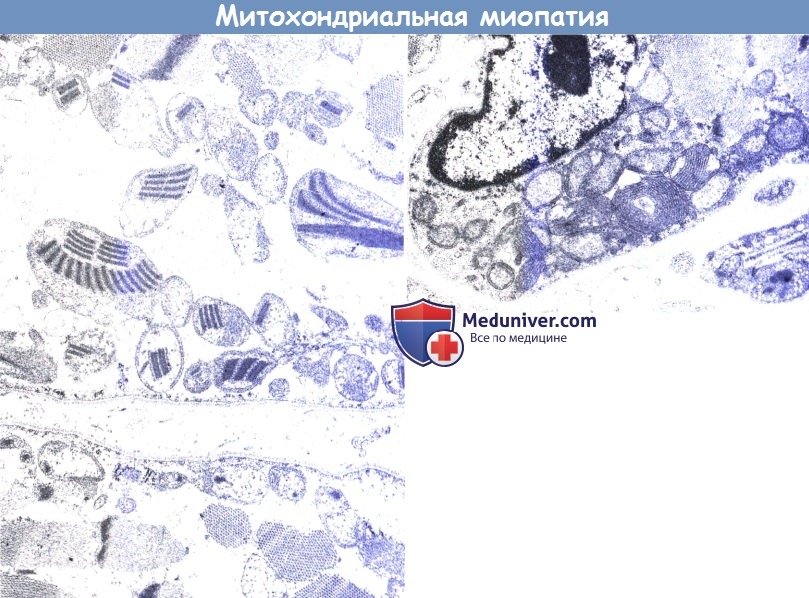 «Многие из этих характеристик присущи детям с аутизмом». По данным Центров США Контроль и профилактика заболеваний.
«Многие из этих характеристик присущи детям с аутизмом». По данным Центров США Контроль и профилактика заболеваний.
В то время как предыдущие исследования выявили намеки на связь между аутизмом и митохондриальной дисфункцией, эти сообщения были либо анекдотичными, либо касались тканей, которые могли не отражать нейронный метаболизм.
«Примечательно, что в крови этих маленьких детей с аутизмом были обнаружены признаки митохондриальной дисфункции и изменения в митохондриальной ДНК», — сказала Джеральдин Доусон, главный научный сотрудник организации Autism Speaks, которая предоставила финансирование для исследования. «Одна из проблем заключалась в том, что было трудно диагностировать митохондриальную дисфункцию, потому что для этого обычно требуется биопсия мышц. Если бы мы могли выявить эти метаболические проблемы с помощью анализа крови, это было бы большим шагом вперед».
Для исследования Джуливи и ее коллеги набрали 10 аутичных детей в возрасте от 2 до 5 лет и 10 нормально развивающихся детей того же возраста из аналогичного окружения. Дети были случайным образом отобраны из субъектов Северной Калифорнии, которые ранее участвовали в исследовании риска детского аутизма из-за генетики и окружающей среды (CHARGE) с участием 1600 участников и которые также согласились вернуться для последующего исследования, известного как CHARGE-BACK, проведенного Калифорнийским университетом. Центр экологического здоровья детей и профилактики заболеваний Дэвиса.
Дети были случайным образом отобраны из субъектов Северной Калифорнии, которые ранее участвовали в исследовании риска детского аутизма из-за генетики и окружающей среды (CHARGE) с участием 1600 участников и которые также согласились вернуться для последующего исследования, известного как CHARGE-BACK, проведенного Калифорнийским университетом. Центр экологического здоровья детей и профилактики заболеваний Дэвиса.
Дети с аутизмом соответствовали строгим диагностическим критериям аутизма, определенным двумя наиболее широко используемыми и строгими инструментами оценки. Хотя общее число исследованных детей было небольшим, оно, как правило, репрезентативно для гораздо большей когорты CHARGE, и это повышает значимость результатов исследования, говорят авторы.
Исследователи взяли образцы крови у каждого ребенка и проанализировали метаболические пути митохондрий в иммунных клетках, называемых лимфоцитами. В предыдущих исследованиях отбирали образцы митохондрий, полученных из мышц, но митохондриальная дисфункция иногда не проявлялась в мышцах. Мышечные клетки могут генерировать большую часть своей энергии за счет анаэробного гликолиза, в котором не участвуют митохондрии. Напротив, лимфоциты и в большей степени нейроны головного мозга в большей степени полагаются на аэробное дыхание, осуществляемое митохондриями.
Мышечные клетки могут генерировать большую часть своей энергии за счет анаэробного гликолиза, в котором не участвуют митохондрии. Напротив, лимфоциты и в большей степени нейроны головного мозга в большей степени полагаются на аэробное дыхание, осуществляемое митохондриями.
Исследователи обнаружили, что митохондрии детей с аутизмом потребляют гораздо меньше кислорода, чем митохондрии детей из контрольной группы, что является признаком пониженной митохондриальной активности. Например, потребление кислорода одним важным комплексом митохондриальных ферментов, НАДН-оксидазой, у детей с аутизмом составляло лишь треть от того, что наблюдалось у детей из контрольной группы.
«Снижение на 66% — это очень много», — сказал Джуливи. «Когда эти уровни ниже, у вас меньше возможностей производить АТФ (аденозинтрифосфат) для оплаты клеточной работы. Даже если это снижение считается умеренным, дефицит митохондриальной энергии не нужно сбрасывать со счетов, поскольку он может усугубиться или ухудшиться. проявляются в перинатальном периоде, но проявляются субклинически во взрослом возрасте».
проявляются в перинатальном периоде, но проявляются субклинически во взрослом возрасте».
Снижение функции митохондриальных ферментов оказалось широко распространенным среди детей, страдающих аутизмом. Восемьдесят процентов имели более низкую активность НАДН-оксидазы, чем контрольная группа, в то время как 60, 40 и 30 процентов имели низкую активность сукцинатоксидазы, АТФазы и цитохром-с-оксидазы соответственно. Исследователи продолжили изолировать происхождение этих дефектов, оценив активность каждого из пяти ферментных комплексов, участвующих в митохондриальном дыхании. Комплекс I был местом наиболее распространенного дефицита, обнаруженного у 60 процентов аутичных субъектов, и встречался в пяти из шести случаев в сочетании с комплексом V. У других детей были проблемы с комплексами III и IV.
Уровни пирувата, сырья, которое митохондрии трансформируют в клеточную энергию, также были повышены в плазме крови детей, страдающих аутизмом. Это говорит о том, что митохондрии детей с аутизмом неспособны перерабатывать пируват достаточно быстро, чтобы удовлетворить потребность в энергии, что указывает на новый дефицит на уровне фермента, называемого пируватдегидрогеназой.
Митохондрии также являются основным внутриклеточным источником свободных радикалов кислорода. Свободные радикалы — это очень реактивные виды, которые могут повредить клеточные структуры, включая ДНК. Клетки способны восстанавливать типичные уровни такого окислительного повреждения. Джуливи и ее коллеги обнаружили, что уровень перекиси водорода у детей, страдающих аутизмом, в два раза выше, чем у здоровых детей. В результате клетки детей с аутизмом подвергались более высокому окислительному стрессу.
Митохондрии часто реагируют на окислительный стресс, создавая дополнительные копии собственной ДНК. Стратегия помогает гарантировать, что некоторые нормальные гены присутствуют, даже если другие были повреждены окислением. Исследователи обнаружили более высокое число копий мтДНК в лимфоцитах половины детей с аутизмом. Эти дети несли такое же большое количество наборов мтДНК в своих гранулоцитах, другом типе иммунных клеток, демонстрируя, что эти эффекты не ограничивались конкретным типом клеток. Двое из пяти детей также имели делеции в генах мтДНК, тогда как ни у одного из детей контрольной группы делеций не было.
Двое из пяти детей также имели делеции в генах мтДНК, тогда как ни у одного из детей контрольной группы делеций не было.
Взятые вместе, различные аномалии, дефекты и уровни сбоев, измеренные в митохондриях аутичных детей, указывают на то, что окислительный стресс в этих органеллах может влиять на возникновение аутизма.
«Различные дисфункции, которые мы измеряли, вероятно, еще более выражены в клетках мозга, которые полагаются исключительно на митохондрии для получения энергии», — сказал Исаак Песса, директор Центра детского экологического здоровья и профилактики заболеваний, исследователь и профессор Института MIND Калифорнийского университета в Дэвисе. молекулярной биологии в Школе ветеринарной медицины Калифорнийского университета в Дэвисе.
Джуливи предупреждает, что эти результаты не равнозначны установлению причины аутизма.
«Мы сделали снимок митохондриальной дисфункции, когда детям было от 2 до 5 лет. Произошло ли это до их рождения или после, это исследование не может сказать нам», — сказала она. «Тем не менее, исследование способствует пониманию аутизма по нескольким направлениям и может, если его повторить, помочь врачам диагностировать проблему на более ранних стадиях».
«Тем не менее, исследование способствует пониманию аутизма по нескольким направлениям и может, если его повторить, помочь врачам диагностировать проблему на более ранних стадиях».
«Педиатры должны знать об этой проблеме, чтобы они могли задавать правильные вопросы, чтобы определить, есть ли у детей с аутизмом проблемы со зрением или слухом или миопатии», — сказал Джуливи. Непереносимость физической нагрузки в виде мышечных судорог при интенсивных физических нагрузках является одной из характеристик митохондриальных миопатий.
Химические отпечатки митохондриальной дисфункции также могут иметь потенциал в качестве диагностического инструмента. Джуливи и его коллеги в настоящее время более тщательно изучают митохондриальную ДНК своих испытуемых, чтобы выявить более точные различия между аутичными и неаутичными детьми.
«Если мы найдем какой-то маркер крови, который соответствует и уникален для детей с аутизмом, возможно, мы сможем изменить способ диагностики этого трудно поддающегося оценке состояния», — сказала она.
Исследование также помогает уточнить причины возникновения аутизма.
«Настоящая задача сейчас состоит в том, чтобы попытаться понять роль митохондриальной дисфункции у детей с аутизмом», — сказал Песса. «Например, многие факторы стресса окружающей среды могут вызвать повреждение митохондрий. В зависимости от того, когда ребенок подвергся воздействию, в материнском или неонатальном периоде, и насколько серьезным было это воздействие, это может объяснить диапазон симптомов аутизма».
«Это важное исследовательское исследование строго рассматривает возникающую гипотезу о потенциальной митохондриальной дисфункции и аутизме», — сказала Синди Лоулер, программный директор Национального института наук об окружающей среде (NIEHS), который предоставил финансирование для исследования. «Дополнительные исследования в этой области могут в конечном итоге привести к усилиям по профилактике или вмешательству в отношении этого серьезного нарушения развития».
Другими авторами исследования являются Йи-Фан Чжан, Алисия Оманска-Клусек, Кэтрин Росс-Инта, Сара Вонг, Ирва Герц-Пиччиотто и Флора Тассоне из Калифорнийского университета в Дэвисе.
Финансирование исследования было предоставлено грантом на пилотные исследования Института MIND Калифорнийского университета в Дэвисе, Национальным институтом наук об окружающей среде (NIEHS), Агентством по охране окружающей среды США и организацией Autism Speaks, включая премию «Новатор в области окружающей среды» от Autism Speaks.
Дети с редкими заболеваниями получают митохондрии от матери
В далеком далеком прошлом Земли две отдельные одноклеточные формы жизни — археон и бактерия — объединились в акте либо симбиоза, либо порабощения, в зависимости от того, какого микробиолога вы спросите.
И в течение следующих 2 миллиардов или около того лет эти бактерии превратились в митохондрии, питающие почти каждую клетку человеческого тела. Эти капсулообразные органеллы не просто превращают кислород и питательные вещества в химическую энергию. Они также метаболизируют холестерин и синтезируют гормоны и нейротрансмиттеры. Благодаря им мы можем подниматься по лестнице, бегать на большие расстояния, прыгать и плавать, смеяться и любить. Без них мы бы до сих пор топтались где-нибудь в первозданном грязевом котле.
Без них мы бы до сих пор топтались где-нибудь в первозданном грязевом котле.
реклама
Вот почему, когда что-то идет не так с митохондриями, последствия часто бывают катастрофическими. Один из возможных вариантов — спонтанное исчезновение большого участка митохондриальной ДНК между поколениями. Это все равно, что потерять главу в руководстве по подключению силовой установки клетки. Возникающие в результате митохондриальные делеционные расстройства, известные как SLSMD, обычно проявляются в течение второго десятилетия жизни ребенка как прогрессирующие полисистемные нарушения, включая потерю слуха и зрения, мышечную слабость, желудочно-кишечные и сердечные проблемы, деменцию и раннюю смерть.
В настоящее время лекарства не существует. Но в течение последних семи лет группа врачей и исследователей в Израиле работала над потенциальным лечением, которое использует постоянную способность митохондрий перемещаться между клеточными формами жизни. Он включает в себя аугментацию гемопоэтических стволовых клеток пациентов, дающих начало различным типам клеток крови, здоровыми митохондриями, пожертвованными их матерями. В среду израильская команда сообщила в Science Translational Medicine, что подход, впервые опробованный на шести детях, оказался безопасным и показал небольшие, но значительные признаки улучшения симптомов.
В среду израильская команда сообщила в Science Translational Medicine, что подход, впервые опробованный на шести детях, оказался безопасным и показал небольшие, но значительные признаки улучшения симптомов.
«Эти дети чрезвычайно слабы по сравнению со своими сверстниками», — сказал Элад Джейкоби, детский гематолог из Медицинского центра Шиба в Тель-Авиве, который руководил исследованием. Одного 6-летнего мальчика пришлось возить по больнице в коляске, другая девочка была прикована к постели и не могла даже сидеть. Через несколько недель после лечения она смогла стоять. Мальчик начал бегать и бодрствовать достаточно долго, чтобы больше есть и прибавлять в весе.
реклама
«Это очень мягкие меры, о которых трудно сообщить, но мы действительно наблюдали значительное улучшение качества жизни почти у всех этих детей», — сказал Джейкоби.
Если результаты клинических испытаний, которые, как ожидается, начнутся в следующем году, подтвердятся, митохондриальная аугментационная терапия, также известная как митохондриальная трансплантация, может предоставить способ лечения не только редких генетических заболеваний, но и длинного списка других состояний и травм, возникающих в результате митохондриальной трансплантации. повреждать.
повреждать.
«Это хорошее первое исследование, показывающее, что митохондриальная трансплантация безопасна для пациентов с этими нарушениями делеции генов», — сказал Джеймс Маккалли, кардиохирург из Бостонской детской больницы и научный сотрудник Гарвардской медицинской школы, который не участвовал в исследовании. «Приятно видеть, что эту работу делает кто-то другой; это показывает, что вся область движется вперед».
В 2009 году группа под руководством Маккалли впервые на кроликах представила доказательства того, что митохондриальная трансплантация может помочь поврежденному сердцу восстановиться после травмы. На протяжении десятилетий он наблюдал, что происходит с пациентами, когда прекращается кровоснабжение их сердца. Что бы он и другие хирурги ни пытались сделать, чтобы защитить их, митохондрии в этих голодающих по кислороду тканях были повреждены без возможности восстановления. В результате сердца так и не восстановились полностью, даже после восстановления кровоснабжения.
Однажды он задался вопросом, что произойдет, если ввести несколько здоровых митохондрий из других частей тела в поврежденное сердце. Они попробовали это на свинье, и через несколько минут ее сердце восстановило свои силы — забилось быстрее и протолкнуло больше крови через тело животного. «Это было довольно драматично, — сказал Маккалли. «Но если бы не этот видимый отклик, я не уверен, что это прижилось бы».
Когда команда Маккалли опубликовала результаты, многие ученые не верили, что митохондрии могут проникнуть в новые клетки и попасть в их конвейеры по сборке энергии.
«10 лет назад это была очень спорная идея, — сказала Натали Йивги-Охана. Именно тогда биохимик израильского происхождения начал искать инвесторов для поддержки новой компании, занимающейся разработкой лекарств на основе митохондрий. Она прошла обучение на эмбриолога и видела, как объединение митохондрий из одной яйцеклетки с генетическим материалом другой — метод, который иногда называют ЭКО с участием трех родителей, — открыло путь к предотвращению митохондриальных заболеваний. В 2012 году она стала соучредителем Minovia, чтобы продвигать идею о том, что вы также можете использовать митохондрии для лечат таких расстройства.
В 2012 году она стала соучредителем Minovia, чтобы продвигать идею о том, что вы также можете использовать митохондрии для лечат таких расстройства.
Первоначально биотехнологическая компания из Хайфы планировала проверить концепцию, вводя митохондрии непосредственно в глаза людям с наследственным заболеванием глаз, известным как наследственная оптическая нейропатия Лебера. Но в 2016 году к ней обратилась семья маленького мальчика с синдромом Пирсона — чрезвычайно редким синдромом митохондриальной делеции, которым страдают менее 100 человек во всем мире. Он возникает рано, обычно на первом году жизни, и приводит к тяжелой недостаточности костного мозга, что требует от пациентов частых переливаний крови. Поскольку это вызвано спонтанно возникающей делецией, в отличие от многих других митохондриальных заболеваний, матери таких пациентов не являются носителями мутации. Это дало возможность использовать их в качестве митохондриальных доноров.
Миновия обратилась в больницу, где лечился пациент, в Медицинский центр Шиба, который специализируется на заболеваниях Пирсона и других митохондриальных заболеваниях, по поводу проведения исследования. Регистрация началась в середине 2019 года. Но тем временем компания работала с Джейкоби и другими членами медицинской бригады Шибы, чтобы попытаться вылечить мальчика в рамках программы сострадательного использования с помощью экспериментальной терапии.
Регистрация началась в середине 2019 года. Но тем временем компания работала с Джейкоби и другими членами медицинской бригады Шибы, чтобы попытаться вылечить мальчика в рамках программы сострадательного использования с помощью экспериментальной терапии.
В 2017 году врачи взяли гемопоэтические стволовые клетки из его костного мозга и кровь его матери. Они вскрыли стенки ее лейкоцитов и с помощью центрифуги отделили митохондрии от цитоплазматического сладжа. Затем они уговорили стволовые клетки мальчика поглотить митохондрии посредством естественного процесса, называемого пиноцитозом. Как только клетки были дополнены дополнительными митохондриями, их снова ввели ребенку. Он был первым, но за ним последовали еще пятеро детей — трое с болезнью Пирсона и двое с другим делеционным заболеванием, называемым синдромом Кернса-Сейра.
Примечательно, что команда врачей Шибы решила пропустить кондиционирование — процесс, при котором проблемные гемопоэтические стволовые клетки пациента удаляются, чтобы освободить место для модифицированных, и шаг, который обычно выполняется во многих клеточных терапиях. Это решение было принято, сказал Джейкоби, потому что у этих детей есть проблемы с выработкой достаточного количества энергии, чтобы справиться даже с легкими инфекциями, и они часто страдают от тяжелых осложнений. Взрыв тканей, производящих лейкоциты, считался слишком рискованным.
Это решение было принято, сказал Джейкоби, потому что у этих детей есть проблемы с выработкой достаточного количества энергии, чтобы справиться даже с легкими инфекциями, и они часто страдают от тяжелых осложнений. Взрыв тканей, производящих лейкоциты, считался слишком рискованным.
Из-за этого выбора, а также из-за того, что донорские органеллы были получены от собственных матерей пациентов, исследователям было гораздо труднее измерить, насколько хорошо работает увеличение митохондрий. «Мы хотели бы иметь возможность показать точное приживление каждого пациента, но мы просто не можем хорошо отслеживать их [донорские митохондрии] у пациентов после трансплантации», — сказал Джейкоби.
Вместо этого они измерили соотношение нормальной митохондриальной ДНК к удаленной ДНК (которое увеличилось после трансплантации), общее количество молекул митохондриальной ДНК (которое также увеличилось) и способность клеток производить энергию. (Это тоже улучшилось.) Данные вселили в Джейкоби оптимизм, что донорские митохондрии выжили и вносят свой вклад в их новые клеточные дома. «Но это все косвенные меры», — сказал он.
«Но это все косвенные меры», — сказал он.
Джейкоби надеялся, что клинические испытания предоставят такие данные. В июне 2019 года компания Minovia начала вводить пациентам материнские стволовые клетки, обогащенные митохондриями, в рамках исследования фазы I/II в Шибе. Большинство из пяти пациентов живут за пределами Израиля, и когда разразилась пандемия, они не смогли вернуться в Тель-Авив для последующих посещений. Ожидается, что результаты будут опубликованы в следующем году. «Я думаю, мы поняли, что можно попытаться бороться с очень редкими заболеваниями с помощью новых идей», — сказал Джейкоби. «Но на данный момент мы узнали больше о проблемах в этом процессе, чем об ответах».
Йивги-Охана согласился с тем, что остается еще много срочных открытых вопросов, требующих дальнейшего изучения. Потребуется ли пациентам более одной дозы? Пациенты Джейкоби сразу же почувствовали улучшение, но через год некоторые из этих изменений стали уменьшаться. Может ли кондиционирование сделать лечение более эффективным? А с готовым продуктом, какой уровень подбора доноров потребуется? «Это захватывающее время, но это все еще только начало», — сказала она.
Minovia планирует начать новое испытание готовой версии своего лечения, состоящего из гемопоэтических стволовых клеток, обогащенных митохондриями, извлеченными из донорской плаценты, у пациентов Пирсона в 2023 году, также в Шибе. Компания также намерена открыть производственное предприятие за пределами Бостона в следующем году, стремясь расширить свое клиническое и исследовательское сотрудничество в США.0005
«Если они смогут перенести это в более крупное исследование с большим количеством пациентов, это будет большой скачок вперед», — сказал Маккалли. В настоящее время он и его коллеги ведут переговоры с Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США, чтобы попытаться начать собственное ключевое испытание, чтобы проверить, насколько хорошо митохондриальная трансплантация может помочь пациентам с пересаженным сердцем восстановиться после операции.
В прошлом году его команда из Boston Children’s опубликовала результаты первого клинического применения митохондриальной трансплантации в группе младенцев с врожденными пороками сердца.
