Лейкоцитоз у новорожденных: Лейкоциты в крови — норма по возрасту, причины повышенных, пониженных показателей лейкоцитов у ребенка, женщин, мужчин
ЛЕЙКОЦИТОЗ У ДЕТЕЙ — Extempore
Клиническая интерпретация
Лейкоцитоз – одно из наиболее часто встречающихся отклонений в показателях общего анализа крови, оценка которого является неотъемлемой частью рутинной работы врача любой специальности
При этом важно не только уметь выявить лейкоцитоз и охарактеризовать его, но и объяснить причину таких изменений у данного конкретного больного. С учетом многообразия причин повышения уровня лейкоцитов в крови, такая задача не всегда может оказаться простой. А в педиатрической практике необходимо также учитывать и физиологические колебания содержания лейкоцитов в различные возрастные периоды. Так, нужно помнить, что абсолютное число лейкоцитов и нейтрофилов у новорождённых младше 1 недели жизни в норме существенно выше, чем у детей старшего возраста и взрослых, а после пятидневного возраста и до шести лет относительное и абсолютное содержание лимфоцитов в периферической крови значительно выше такового у взрослых. Игнорирование возрастных особенностей лейкоцитарной формулы у детей может приводить к назначению ненужных диагностических, а иногда и лечебных мероприятий.
Игнорирование возрастных особенностей лейкоцитарной формулы у детей может приводить к назначению ненужных диагностических, а иногда и лечебных мероприятий.
Патофизиология
Лейкоцитоз может быть реакцией на различные инфекционные, воспалительные, аллергические, метаболические, неопластические и, в некоторых случаях, физиологические процессы (например, стресс, физические нагрузки). Эта реакция опосредуется рядом молекул, которые высвобождаются или активируются в ответ на стимуляцию. К таким молекулам относятся факторы роста (гранулоцитарный колониестимулирующий фактор, гранулоцитарно-макрофагальный колониестимулирующий фактор, c-kit-лиганд), молекулы адгезии (например, CD11b/CD18) и различные цитокины (интерлeйкины 1, 3, 5, 6, 8, фактор некроза опухоли).
Количество лейкоцитов в периферической крови определяется несколькими механизмами, в том числе:
1) количеством клеток-предшественников и депонированных в костном мозге миелоидных и лимфоидных клеток;
2) количеством высвобождаемых из костного мозга клеток;
3) количеством клеток, находящихся в состоянии маргинации (краевое стояние) и мигрировавших в ткани;
4) количеством клеток, которые разрушаются в тканях (т. е. клеточными потерями).
е. клеточными потерями).
Факторы роста, молекулы адгезии и цитокины управляют всеми этими четырьмя механизмами. Нарушение любого из указанных механизмов может приводить к изменению уровня лейкоцитов в крови.
Классификация
В зависимости от степени повышения количества лейкоцитов, различают (1) собственно, лейкоцитоз – повышение уровня лейкоцитов выше верхней границы референтных значений для данного возраста; (2) лейкемоидную реакцию – повышение количества лейкоцитов в периферической крови более 30 Г/л (30 000 кл в 1 мкл) в ответ на внешние факторы, например инфекцию; и (3) гиперлейкоцитоз – содержание лейкоцитов в периферической крови, превышающее 100 Г/л или 100 000 кл в 1 мкл.
Гиперлейкоцитоз отмечается при лейкозах и миелопролиферативных заболеваниях и обусловлен автономной способностью к неконтролируемому росту злокачественных клеток. Гиперлейкоцитоз нередко вызывает сосудистую окклюзию, приводя к ишемии, кровоизлияниям и отеку в пораженных органах. Наиболее часто эта проблема наблюдается при остром миелобластном лейкозе, т. к. миелоидных клеток обычно больше, чем лимфобластов, и они обладают большей адгезивностью. Гиперлейкоцитоз может стать причиной изменений ментального статуса, инсульта, почечной или легочной недостаточности.
Наиболее часто эта проблема наблюдается при остром миелобластном лейкозе, т. к. миелоидных клеток обычно больше, чем лимфобластов, и они обладают большей адгезивностью. Гиперлейкоцитоз может стать причиной изменений ментального статуса, инсульта, почечной или легочной недостаточности.
С практической точки зрения удобно классифицировать лейкоцитоз в зависимости от тех клеток белой крови, которые вносят свой вклад в увеличение общего количества лейкоцитов. Т. е. лейкоцитоз может быть вызван увеличением количества (1) нейтрофилов (нейтрофилез), (2) лимфоцитов (лимфоцитоз), (3) моноцитов (моноцитоз), (4) эозинофилов (эозинофилия), (5) базофилов (базофилия) или (6) бластов. Кроме того, возможны комбинации любых из вышеупомянутых нарушений. Далее мы рассмотрим причины каждого из них.
Нейтрофилез – состояние, когда количество нейтрофилов в периферической крови превышает верхнюю границу возрастного диапазона (табл. 1). Основные причины нейтрофилеза следующие:
- Инфекция – наиболее частая причина.
 Нейтрофилез характерен для инфекций, вызванных кокковой флорой, бациллами, некоторыми грибками (Coccidioides immitis, Candida albicans), спирохетами, вирусами (например, вирусом бешенства, полиомиелита, varicella-zoster) и риккетсиями. Уровень лейкоцитов при острых бактериальных инфекциях – обычно в пределах 15–25 Г/л, нейтрофилез сопровождается сдвигом формулы влево. Токсическая зернистость нейтрофилов – обычная находка при инфекциях.
Нейтрофилез характерен для инфекций, вызванных кокковой флорой, бациллами, некоторыми грибками (Coccidioides immitis, Candida albicans), спирохетами, вирусами (например, вирусом бешенства, полиомиелита, varicella-zoster) и риккетсиями. Уровень лейкоцитов при острых бактериальных инфекциях – обычно в пределах 15–25 Г/л, нейтрофилез сопровождается сдвигом формулы влево. Токсическая зернистость нейтрофилов – обычная находка при инфекциях.
— Совсем немного бактериальных инфекций не сопровождается нейтрофилезом. Так, при брюшном тифе отмечается лейкопения и/или нейтропения. Кроме того, нейтропения может иметь место при инфекциях, вызванных золотистым стафилококком, бруцеллезе, туляремии, риккетсиозах, туберкулезе, эрлихиозе и лейшманиозе. У недоношенных детей, а также у детей раннего возраста (особенно до 3 мес.) количество депонированных в костном мозге нейтрофилов относительно небольшое. Поэтому при серьезных инфекциях, когда потребность в нейтрофилах существенно повышается, а возможности их высвобождения весьма ограничены, в периферической крови может наблюдаться нейтропения.
— Нейтрофилез (изолированный или в сочетании с палочкоядерным сдвигом) имел вариабельную чувствительность и специфичность в многочисленных исследованиях, которые изучали этот показатель как предиктор бактериемии у детей раннего возраста с лихорадкой. Исследование Lee и Harper (1998) отличалось от других тем, что в него были отобраны дети в возрасте 3–36 месяцев с лихорадкой (³39°C), которые после осмотра в приемном отделении были отправлены домой, т. к. их состояние было оценено как удовлетворительное [2]. Целью такого отбора было выделение группы детей со скрытой бактериемией, которая так и не реализовалась в какой-то воспалительный очаг. Исследование показало значительную положительную корреляцию между частотой выделения Streptococcus pneumoniae из крови этих детей и абсолютным количеством лейкоцитов и нейтрофилов в периферической крови.
— Инфекции мочевых путей и пневмония, вызванная не пневмококком, а другими микроорганизмами, обычно сопровождаются менее выраженным лейкоцитозом, чем пневмококковая инфекция [3]. Это нужно учитывать при обследовании детей раннего возраста с лихорадкой.
Это нужно учитывать при обследовании детей раннего возраста с лихорадкой.
— В целом, большинство исследователей сходятся во мнении, что лейкоцитоз и нейтрофилез недостаточно чувствительные и специфичные предикторы бактериальной инфекции. Т. е. повышение числа нейтрофилов не всегда связано с бактериальной инфекцией, так же, как и нормальные показатели лейкоцитарной формулы не исключают наличия бактериальной инфекции у ребенка с лихорадкой.
— Вирусные инфекции обычно не вызывают повышения уровня нейтрофилов в крови, но, тем не менее, на ранних стадиях заболевания возможно появление кратковременного нейтрофилеза (обычно, относительного).
- Воспаление, не связанное с инфекцией. К таким состояниям относятся воспалительные заболевания кишечника (НЯК, болезнь Крона), ревматоидный артрит, системные васкулиты (например, синдром Кавасаки), острая ревматическая лихорадка, гломерулонефриты, ожоги, а также состояния после операции.
- Метаболические причины нейтрофилеза включают кетоацидоз и уремию (особенно уремический перикардит).

- Экстремально низкая масса тела при рождении. Сообщалось о более высокой частоте лейкемоидных реакций (более 30 000 нейтрофилов в 1 мкл) у детей, рожденных с массой тела £1000 г, как не имевших очевидных причин лейкоцитоза, так и получавших длительную вентиляционную поддержку с высокой частотой развития бронхолегочной дисплазии [4]. Другое проспективное исследование недоношенных младенцев продемонстрировало существенную корреляцию между лейкемоидной реакцией у ребенка (более 40 000 нейтрофилов в 1 мкл) и наличием гистологически подтвержденного хорионамнионита [5]. В этом исследовании частота развития бронхолегочной дисплазии была значительно выше у детей с лейкемоидными реакциями по сравнению с детьми без лейкемоидных реакций.
- Простагландин Е1 (PGE1). У новорожденных с дуктус-зависимыми врожденными пороками сердца назначение PGE1 вызывало обратимое повышение количества нейтрофилов в крови, в среднем до 6000 клеток в 1 мкл [6].
- Литий. Применение карбоната лития (с целью лечения депрессии или биполярного расстройства) вызывает умеренный нейтрофильный лейкоцитоз (обычно не выше, чем в 2 раза выше нормы) за счет увеличения выработки нейтрофилов [7].

- Гепарин. Обычно применение гепарина вызывает лимфоцитарный лейкоцитоз, но иногда также отмечается и нейтрофилез.
- Другие лекарственные препараты. Нейтрофилез может сопровождать реакции гиперчувствительности на некоторые лекарственные препараты, которые также характеризуются появлением сыпи, эозинофилии и системными проявлениями (DRESS-синдром). К таким препаратам относятся противосудорожные средства (карбамазепин, фенобарбитал, фенитоин) и миноциклин, который обычно используется для лечения акне. В такой ситуации нейтрофилез и лейкоцитоз вторичны по отношению к реакции гиперчувствительности на препарат, поэтому отмечаются не всегда: у некоторых пациентов регистрировался лимфоцитоз, у других – лейкопения. Антипсихотический препарат клозапин, как известно, может вызывать агранулоцитоз, но также при его применении описывали случаи дозозависимого повышения уровня нейтрофилов в крови.
- Отравления. Нейтрофилез может наблюдаться при отравлениях свинцом, ртутью, сердечными гликозидами, камфорой, антипирином, фенацетином, хинидином, ядами насекомых.
 Сообщалось также о нейтрофилезе, связанном с воздействием табачного дыма.
Сообщалось также о нейтрофилезе, связанном с воздействием табачного дыма. - Острое кровотечение. Кровоизлияния в полости тела (брюшную, плевральную), в суставы, под мозговые оболочки обычно сопровождаются нейтрофильным лейкоцитозом, что связано как с активацией симпато-адреналовой системы в ответ на боль, так и с развитием местного воспаления вследствие сдавления и некроза тканей. Ранний (первые 1–3 часа) нейтрофилез при острой кровопотере обусловлен перемещением пристеночных нейтрофилов в просвет сосудов, а в последующие 3–6 часов повышается выход нейтрофилов из костного мозга. Наконец, нейтрофилез нередко наблюдается при остром гемолизе.
- Семейный холодовой аутовоспалительный синдром (семейная холодовая крапивница) характеризуется появлением уртикариаподобной сыпи (обильные, зудящие, возвышающиеся над поверхностью кожи эритематозные пятна) через несколько часов после воздействия холода, сопровождающейся лихорадкой, ознобом, артралгиями с последующим повышением уровня лейкоцитов и нейтрофилов.
 Заболевание наследуется по аутосомно-доминантному типу.
Заболевание наследуется по аутосомно-доминантному типу. - Злокачественные опухоли и миелопролиферативные заболевания– редкие причины нейтрофилеза у детей:
— При лимфоме Ходжкина обычно отмечается умеренный нейтрофилез.
— Для пациентов с хронической фазой хронического миелолейкоза взрослого типа, позитивных по Филадельфийской хромосоме, характерен нейтрофилез со сдвигом влево, а также эозинофилия, базофилия и тромбоцитоз.
— Ювенильный миеломоноцитарный лейкоз проявляется лейкоцитозом с нейтрофилезом и моноцитозом, при этом моноциты могут иметь причудливую форму.
— У детей с синдромом Дауна нередко отмечается нейтрофильный лейкоцитоз со сдвигом влево и появлением незрелых форм (бластов) в крови в постнатальном периоде. В большинстве случаев, эти изменения являются транзиторными (транзиторный миелопролиферативный синдром), однако, у некоторых детей развивается острый лейкоз.
— При некоторых солидных опухолях (чаще всего карциноме легкого, недифференцированной карциноме) опухолевые клетки вызывают нейтрофилез – паранеопластическую лейкемоидную реакцию. Это редко встречается у детей, но хорошо описано у взрослых. Предполагаемый механизм – продукция цитокинов, таких как гранулоцитарный колониестимулирующий фактор и макрофагально-гранулоцитарный колониестимулирующий фактор, клетками самой опухоли или метастатическими клетками. Однако, у некоторых пациентов, повышения уровня данных цитокинов обнаружено не было.
Это редко встречается у детей, но хорошо описано у взрослых. Предполагаемый механизм – продукция цитокинов, таких как гранулоцитарный колониестимулирующий фактор и макрофагально-гранулоцитарный колониестимулирующий фактор, клетками самой опухоли или метастатическими клетками. Однако, у некоторых пациентов, повышения уровня данных цитокинов обнаружено не было.
- Уменьшенный выход нейтрофилов из кровотока. Как уже упоминалось, уровень нейтрофилов в крови определяется балансом между уровнем их продукции, выходом в кровоток из костного мозга и скоростью разрушения в сосудистом русле и миграции в ткани. Состояния, при которых нарушается процесс перемещения нейтрофилов в ткани, обычно сопровождаются нейтрофилезом. К ним относятся:
— назначение кортикостероидов;
— состояние после спленэктомии – обычно отмечается постоянный лейкоцитоз и тромбоцитоз;
— дефицит молекул адгезии лейкоцитов (Leukocyte adhesion molecule deficiency – LAD). Данное врожденное иммунодефицитное заболевание имеет 3 подтипа (LAD1, LAD2, LAD3) и характеризуется задержкой отделения пупочного остатка с развитием омфалита, рецидивирующими затяжными бактериальными инфекционными поражениями кожи, периодонтитом и нейтрофилезом. Характерной особенностью поражений кожи и слизистых оболочек при LAD является отсутствие гноя и длительно незаживающие раны. Уровень нейтрофилов в крови в интеркуррентном периоде повышен до 15 000 клеток в 1 мкл, а в период инфекций может достигать 50 000 – 100 000 клеток в 1 мкл. В основе заболевания – аномалии рецепторов необратимой адгезии CD11/CD18 (интегринов). В отсутствие молекул адгезии лейкоциты не могут покинуть кровеносное русло и мигрировать в очаг воспаления. LAD1 вызван мутацией в гене ITGB2, кодирующем b2 (CD18) субъединицу, ответственную за мембранную экспрессию лейкоцитарных интегринов. Диагностически значимым является отсутствие CD11b/CD18 на лейкоцитах пациента в проточной цитометрии. Пациенты с LAD3 помимо повышенной склонности к инфекциям, имеют также аномальную кровоточивость.
Характерной особенностью поражений кожи и слизистых оболочек при LAD является отсутствие гноя и длительно незаживающие раны. Уровень нейтрофилов в крови в интеркуррентном периоде повышен до 15 000 клеток в 1 мкл, а в период инфекций может достигать 50 000 – 100 000 клеток в 1 мкл. В основе заболевания – аномалии рецепторов необратимой адгезии CD11/CD18 (интегринов). В отсутствие молекул адгезии лейкоциты не могут покинуть кровеносное русло и мигрировать в очаг воспаления. LAD1 вызван мутацией в гене ITGB2, кодирующем b2 (CD18) субъединицу, ответственную за мембранную экспрессию лейкоцитарных интегринов. Диагностически значимым является отсутствие CD11b/CD18 на лейкоцитах пациента в проточной цитометрии. Пациенты с LAD3 помимо повышенной склонности к инфекциям, имеют также аномальную кровоточивость.
- Снижение количества нейтрофилов, находящихся в состоянии маргинации – своеобразное перераспределение нейтрофилов внутри сосудистого русла – отмечается при назначении кортикостероидов, адреналина, при физических упражнениях и других стрессовых ситуациях.

— Нейтрофилез, обусловленный этим механизмом (перераспределением) – кратковременный – от нескольких минут до нескольких часов.
— Преходящее, но существенное повышение уровня нейтрофилов было описано после безлихорадочных судорог, включая эпилептический статус, и умеренной травмы головы с оценкой по шкале Глазго – 15.
— Транзиторный нейтрофильный лейкоцитоз также может наблюдаться в период абдоминальной атаки у пациентов с наследственным ангионевротическим отёком, при этом при отеках других локализаций лейкоцитоза не регистрируют.
- Повышенный выход нейтрофилов из костного мозга в кровоток происходит при инфекциях, стрессе и гипоксии, а также при назначении стероидов и стимуляции эндотоксинами.
- Мутация в гене CSF3R – семейный нейтрофилез (£22 900/мкл) вследствие мутации в трансмембранной части рецептора (T617N).
- Повторные инъекции (с лечебной целью) пегилированного гранулоцитарного колониестимулирующего фактора (ГКСФ) или ГКСФ-индуцированный гиперлейкоцитоз.

— Лимфоцитозом традиционно считают уровень лимфоцитов в крови, превышающий 4 Г/л (4000 клеток в 1 мкл). Однако, у детей младше 5 лет такое, и даже большее, количество лимфоцитов считается нормальным (табл. 1). Верхняя граница нормы содержания лимфоцитов в периферической крови у здоровых детей этой возрастной все еще окончательно не определена. Далее мы рассмотрим наиболее частые причины лимфоцитоза у детей.
- Выраженный лимфоцитоз отмечается у больных коклюшем (абсолютное число лейкоцитов может повышаться до 40–50 Г/л и более).
- Лимфоцитоз характерен для вирусной инфекции. Он может быть абсолютным или относительным, сочетаться или не сочетаться с нейтропенией. Наиболее типичные примеры таких инфекций: инфекционный мононуклеоз, ЦМВ, респираторно-синцитиальная инфекция, вирусный гепатит. С другой стороны, на ранних стадиях вирусной инфекции может наблюдаться нейтрофилез (обычно – относительный), нередко со сдвигом влево.
- Лимфолейкоз. Хронический лимфолейкоз, который обычно характеризуется высоким лимфоцитозом, чрезвычайно редок в детском возрасте и при дифференциальной диагностике лимфоцитоза, как правило, не рассматривается.
 При остром лимфобластном лейкозе даже в случаях выраженного лейкоцитоза количество зрелых лимфоцитов в крови может быть нормальным или умеренно повышенным, а преобладающим форменным элементом становятся бластные клетки.
При остром лимфобластном лейкозе даже в случаях выраженного лейкоцитоза количество зрелых лимфоцитов в крови может быть нормальным или умеренно повышенным, а преобладающим форменным элементом становятся бластные клетки.
Эозинофилия – содержание эозинофилов в периферической крови более 0,45 Г/л (450 клеток в 1 мкл). Далее рассмотрим основные причины эозинофилии.
- Аллергия и медикаментозная гиперчувствительность. Эти состояния включают бронхиальную астму, аллергический ринит, поллинозы, крапивницу и отек Квинке, атопический дерматит и экзему, DRESS-синдром (лекарственно-индуцированную сыпь с эозинофилией и системными проявлениями), обычно развивающийся на 3–8-й неделе приема антиконвульсантов, другие системные аллергические реакции на лекарственные вещества, эозинофильный эзофагит, эозинофильный энтерит и др.
- Паразитарные инвазии. Выраженная эозинофилия характерна для висцеральной формы larva migrans. Larva migrans – гельминтоз, обусловленный мигрирующими в коже и (или) во внутренних органах личинками не свойственных человеку гельминтов животных, как правило, не достигающих в нем половой зрелости.

Висцеральную форму larva migrans у нас наиболее часто вызывает Toxocara canis. Кроме того, более или менее выраженная эозинофилия может наблюдаться при аскаридозе, шистосомозе, трихинеллезе, стронгилоидозе, фасциолезе, парагонимозе и других инвазиях, особенностью которых является внедрение паразитов или их личинок в ткани.
- Другие инфекции. Эозинофилия может наблюдаться в периоде реконвалесценции при скарлатине, вирусных инфекциях, а также при хламидийной инфекции.
- Кожные заболевания: герпетиформный дерматит, пемфигус, многоформная эритема, чесотка, токсическая эритема новорожденных.
- Хроническая надпочечниковая недостаточность. Дефицит глюкокортикоидов приводит к повышению уровня эозинофилов в крови (обычно, без лейкоцитоза).
- Неопластические процессы:
— Эозинофилия нередко бывает связана с болезнью Ходжкина, особенно при нодулярно-склерозирующем и смешанно-клеточном субтипах заболевания, которые чаще всего встречаются в педиатрической практике.
— Эозинофилия может быть неспецифической реакцией на солидные злокачественные опухоли, например, карциному легких, желудка, кишечника, но эти опухоли в детском возрасте встречаются крайне редко.
— Сочетание лейкоцитоза, эозинофилиии и гепатоспленомегалии характерно для эозинофильного лейкоза – очень редкого заболевания, при котором персистирующая торпидная эозинофилия сопровождается наличием умеренного количества бластных клеток в периферической крови и костном мозге.
- Сочетание эозинофилии с легочной инфильтрацией и/или легочными симптомами может иметь место при синдроме Леффлера, аллергическом бронхопульмональном аспергиллезе, васкулите Churg-Strauss.
- Гиперэозинофильный синдром – состояние, характеризующееся повышением количества эозинофилов в периферической крови более 1500/мкл в течение более чем 6 месяцев с поражением различных органов (вследствие инфильтрации эозинофилами и повреждения их энзимами) и отсутствием других причин эозинофилии, а также отсутствием бластных клеток в костном мозге.
 По сути это – диагноз исключения. У детей встречается крайне редко.
По сути это – диагноз исключения. У детей встречается крайне редко.
О мoноцитозе говорят при уровне моноцитов в крови, превышающем 0,95 Г/л (950 клеток в 1 мкл). Основные состояния, которые могут сопровождаться моноцитозом, представлены ниже.
- Бактериальные инфекции, такие как туберкулез, подострый бактериальный эндокардит и бруцеллез.
- Другие инфекции: сифилис, вирусные инфекции (например, инфекционный мононуклеоз), протозойные и риккетсиозные инфекции.
- Злокачественные неоплазии: хронический миеломоноцитарный лейкоз, моноцитарный лейкоз, болезнь Ходжкина, миелопролиферативный синдром. У взрослых моноцитоз также может быть проявлением паранеопластических лейкемоидных реакций при метастатической карциноме, раке легкого и других злокачественных опухолях.
- Моноцитоз может наблюдаться в фазе восстановления нейтропении или острой инфекции.
- Аутоиммунные заболевания и васкулиты: системная красная волчанка, ревматоидный артрит, неспецифический язвенный колит, болезнь Крона.
- К редким причинам моноцитоза относят саркоидоз и болезни накопления липидов.
Базофилия – уровень базофилов в крови, превышающий 0,10–0,15 Г/л (100–150 клеток в 1 мкл), редко приводит к повышению количества лейкоцитов. Сочетание лейкоцитоза и базофилии встречается лишь при хроническом миелолейкозе (взрослый тип) – см. выше.
Таким образом, при выявлении лейкоцитоза необходим взвешенный и дифференцированный подход к оценке общего анализа крови с учетом возможных физиологических колебаний его параметров, а также исходя из имеющейся клинической ситуации. Такой подход поможет выбрать оптимальную дальнейшую тактику обследования и избежать ошибок в лечении пациента.
Список литературы
находится в редакции.
4. Возрастные изменения количества лейкоцитов и лейкоцитарной формулы у детей
В
кровотоке плода единичные лейкоциты
впервые появляются в конце 3 месяца.
У
новорождённых содержание лейкоцитов
повышено – физиологический лейкоцитоз.
Через час после рождения концентрация
лейкоцитов в крови составляет 18 тыс. в
мм3.
Иногда приходится встречаться с
лейкоцитозом, достигающим 30-35 тыс. В
последующем либо лейкоцитоз медленно
“угасает” без каких видимых патологических
проявлений (физиологический), либо
спустя 2-4 дня развивается клиническая
картина токсико-септического состояния.
У детей грудного возраста количество
лейкоцитов колеблется от 6 до 12 тыс. в
мм2.
После года жизни ребёнка количество
лейкоцитов постепенно снижается и
достигает нормы взрослого человека
после 15 лет.
Для
лейкоцитов новорождённых характерна
выраженная осмотическая устойчивость
(велико содержание незрелых форм).
Двигательная активность лейкоцитов у
детей раннего возраста ниже, чем у
взрослых.
Для
детей характерны “ножницы” в содержании
количества нейтрофилов и лимфоцитов.
В 1 день после рождения нейтрофилы
составляют 68 %; лимфоциты – 25 % (как у
взрослых). Со 2 дня количество нейтрофилов
снижается, а лимфоцитов, наоборот
возрастает. В возрасте 5-6 дня жизни
В возрасте 5-6 дня жизни
содержание нейтрофилов и лимфоцитов
выравнивается, составляя 43-44 % (первый
физиологический перекрест). В дальнейшем
количество нейтрофилов уменьшается, а
лимфоцитов – увеличивается. На 2-3 месяце
количество лимфоцитов максимально
(60-63 %), а нейтрофилов – минимально (25-27
%). Затем количество лимфоцитов начинает
уменьшаться, а нейтрофилов – увеличиваться.
В возрасте 5-6 лет их количество вновь
выравнивается (второй физиологический
перекрест). К 12-13 годам лейкоцитарная
формула ребёнка приобретает вид взрослого
человека.
5. Физиологический лейкоцитоз новорождённых (механизмы развития). Особенности свертывающей системы крови у детей
ФИЗИОЛОГИЧЕСКИЙ
ЛЕЙКОЦИТОЗ У НОВОРОЖДЁННЫХ (МЕХАНИЗМЫ
РАЗВИТИЯ)
1. Стероидный
лейкоцитоз. С 34-36 недели гестации от
матери к плоду с помощью транспортных
белков все в больших количествах начинает
поступать кортизол. К этому сроку
интенсифицируется функция собственных
надпочечников плода. Суммарная доля
Суммарная доля
кортизола обеспечивает плоду выраженный
лейкопоэтический и лейкоцитозмобилизующий
эффект. Это основной механизм возникновения
лейкоцитоза, который определяется у
новорождённого в 1-3 сутки жизни. Затем
содержание лейкоцитов быстро уменьшается,
что может происходить либо равномерно,
либо между 4-9 днем, когда отмечается
небольшое увеличение.
2. К
нейтрофильному лейкоцитозу приводит
“наводнение” организма бактериальными
эндотоксинами (липополисахаридами),
механизм действия которых реализуется
через систему гипоталамус-гипофиз-надпочечники,
хотя допустимо прямое (колониестимулирующее)
действие непосредственно на кроветворные
клетки костного мозга.
3. В
некоторых случаях к нейтрофильному
лейкоцитозу ведет длительное травматическое
раздражение системы
гипоталамус-гипофиз-надпочечники.
Диагностическим
критерием стероидного лейкоцитоза
является посуточная убыль лейкоцитов.
Поскольку после пересечения пуповины
поступление стероидов от матери к плоду
прекращается. В это же время происходит
В это же время происходит
интенсивная инволюция фетальной зоны
коры надпочечников новорождённого,
приводящая к снижению кортизола в крови
ребёнка до критического уровня и
соответственно, к резкому ослаблению
лейкопоэтического и лейкоцитозмобилизирующего
эффекта кортикостероидов. В этих условиях
быстро отмирает прежняя, короткоживущая
популяция лейкоцитов при заторможенном
восстановительном процессе. Посуточная
убыль лейкоцитов колеблется от 1,5 до 3
тыс. в мм3.
Обычно чем выше исходный уровень
лейкоцитов, тем более высокая их
посуточная убыль.
Особенности
свертывающей системы крови у детей.
Кровь
плода до 4-5 месяцев лишена способности
к свертыванию из-за отсутствия в плазме
крови фибриногена.
В
период новорождённости концентрация
факторов свертывания II, VII, IX, X, XI, XIII
ниже, чем у взрослых. Время свертывания
у новорождённых примерно такое же, как
у взрослых (5-5,5 минут по способу Бюркера).
Продолжительность кровотечения примерно
соответствует норме взрослых (2-4 минуты
по способу Дюка).
В
течение 1 года после рождения содержание
большинства факторов свертывания
увеличивается. У детей от года до 7 лет
уровень протромбина соответствует
уровню взрослых (87-120 %). Концентрация
факторов V (76 %) и VII (89 %) у ребёнка ниже,
чем у взрослых. Количество фибриногена
в плазме крови составляет 2,6 г/л.
Концентрация
прокоагулянтов и антиагулянтов,
свойственная взрослым, устанавливается
лишь к концу подросткового возраста.
Скорость
свертывания крови у детей всех возрастов
мало отличается от скорости взрослых.
6-недельный ребенок мужского пола со стойким лейкоцитозом | Педиатрия и здоровье детей
Фильтр поиска панели навигации
Педиатрия и здоровье детейЭтот выпускПедиатрияКнигиЖурналыOxford Academic
Мобильный телефон Введите поисковый запрос
Закрыть
Фильтр поиска панели навигации
Педиатрия и здоровье детейЭтот выпускПедиатрияКнигиЖурналыOxford Academic
Введите поисковый запрос
Расширенный поиск
Журнальная статья
Получить доступ
Райан Мэтьюз, бакалавр наук,
Райан Мэтьюз, бакалавр наук
Ищите другие работы этого автора на:
Оксфордский академический
Google Scholar
Томас В. Маклин, доктор медицины,
Маклин, доктор медицины,
Томас В. Маклин, доктор медицины
Ищите другие работы этого автора на:
Оксфордский академический
Google Scholar
Дэвид Д. Гриер, доктор медицины,
Дэвид Д Гриер, доктор медицины
Ищите другие работы этого автора на:
Оксфордский академический
Google Scholar
Авинаш К. Шетти, Мэриленд
Авинаш К. Шетти, доктор медицины
Ищите другие работы этого автора на:
Оксфордский академический
Google Scholar
Педиатрия и здоровье детей , том 25, выпуск 3, апрель 2020 г., страницы 131–133, https://doi.org/10.1093/pch/pxz010
Опубликовано:
08 апреля 2019 г.
История статьи
Получено:
31 августа 2018 г.
Принято:
31 декабря 2018 г.
Опубликовано:
08 апреля 2019 г.
Фильтр поиска панели навигации
Педиатрия и здоровье детейЭтот выпускПедиатрияКнигиЖурналыOxford Academic
Мобильный телефон Введите поисковый запрос
Закрыть
Фильтр поиска панели навигации
Педиатрия и здоровье детейЭтот выпускПедиатрияКнигиЖурналыOxford Academic
Введите поисковый запрос
Расширенный поиск
Раздел выдачи:
Уголок врача
В настоящее время у вас нет доступа к этой статье.
Скачать все слайды
Войти
Получить помощь с доступом
Получить помощь с доступом
Доступ для учреждений
Доступ к контенту в Oxford Academic часто предоставляется посредством институциональных подписок и покупок. Если вы являетесь членом учреждения с активной учетной записью, вы можете получить доступ к контенту одним из следующих способов:
Доступ на основе IP
Как правило, доступ предоставляется через институциональную сеть к диапазону IP-адресов. Эта аутентификация происходит автоматически, и невозможно выйти из учетной записи с IP-аутентификацией.
Войдите через свое учреждение
Выберите этот вариант, чтобы получить удаленный доступ за пределами вашего учреждения. Технология Shibboleth/Open Athens используется для обеспечения единого входа между веб-сайтом вашего учебного заведения и Oxford Academic.
- Щелкните Войти через свое учреждение.
- Выберите свое учреждение из предоставленного списка, после чего вы перейдете на веб-сайт вашего учреждения для входа.
- Находясь на сайте учреждения, используйте учетные данные, предоставленные вашим учреждением. Не используйте личную учетную запись Oxford Academic.
- После успешного входа вы вернетесь в Oxford Academic.
Если вашего учреждения нет в списке или вы не можете войти на веб-сайт своего учреждения, обратитесь к своему библиотекарю или администратору.
Войти с помощью читательского билета
Введите номер своего читательского билета, чтобы войти в систему. Если вы не можете войти в систему, обратитесь к своему библиотекарю.
Члены общества
Доступ члена общества к журналу достигается одним из следующих способов:
Войти через сайт сообщества
Многие общества предлагают единый вход между веб-сайтом общества и Oxford Academic. Если вы видите «Войти через сайт сообщества» на панели входа в журнале:
Если вы видите «Войти через сайт сообщества» на панели входа в журнале:
- Щелкните Войти через сайт сообщества.
- При посещении сайта общества используйте учетные данные, предоставленные этим обществом. Не используйте личную учетную запись Oxford Academic.
- После успешного входа вы вернетесь в Oxford Academic.
Если у вас нет учетной записи сообщества или вы забыли свое имя пользователя или пароль, обратитесь в свое общество.
Вход через личный кабинет
Некоторые общества используют личные учетные записи Oxford Academic для предоставления доступа своим членам. См. ниже.
Личный кабинет
Личную учетную запись можно использовать для получения оповещений по электронной почте, сохранения результатов поиска, покупки контента и активации подписок.
Некоторые общества используют личные учетные записи Oxford Academic для предоставления доступа своим членам.
Просмотр учетных записей, вошедших в систему
Щелкните значок учетной записи в правом верхнем углу, чтобы:
- Просмотр вашей личной учетной записи и доступ к функциям управления учетной записью.
- Просмотр институциональных учетных записей, предоставляющих доступ.
Выполнен вход, но нет доступа к содержимому
Oxford Academic предлагает широкий ассортимент продукции. Подписка учреждения может не распространяться на контент, к которому вы пытаетесь получить доступ. Если вы считаете, что у вас должен быть доступ к этому контенту, обратитесь к своему библиотекарю.
Ведение счетов учреждения
Для библиотекарей и администраторов ваша личная учетная запись также предоставляет доступ к управлению институциональной учетной записью. Здесь вы найдете параметры для просмотра и активации подписок, управления институциональными настройками и параметрами доступа, доступа к статистике использования и т. д.
д.
Покупка
Стоимость подписки и заказ этого журнала
Варианты покупки книг и журналов в Oxford Academic
Краткосрочный доступ
Чтобы приобрести краткосрочный доступ, пожалуйста, войдите в свой личный аккаунт выше.
У вас еще нет личного кабинета? регистр
6-недельный младенец мужского пола со стойким лейкоцитозом — круглосуточный доступ
ЕВРО €36,00
32 фунта стерлингов
39 долларов США.
Реклама
Цитаты
Альтметрика
Дополнительная информация о метриках
Оповещения по электронной почте
Оповещение об активности статьи
Предварительные уведомления о статьях
Оповещение о новой проблеме
Получайте эксклюзивные предложения и обновления от Oxford Academic
Ссылки на статьи по телефону
Последний
Самые читаемые
Самые цитируемые
Кратковременное парентеральное введение антибиотиков у детей раннего возраста с инфекциями мочевыводящих путей
Уроки последнего года жизни трансгендерного подростка
Сотрясение головного мозга и проверка тела у детей и подростков, связанные со спортом: оценка, лечение и последствия для политики
Генно-медикаментозная терапия у детей
Фармакотерапия генов
Академический патологоанатом/гистолог
, Юта
Директор вычислительного отдела клинических исследований (CRCU) (постоянные старшие звания профессорско-преподавательского состава)
Филадельфия, Пенсильвания
Патологоанатом и медицинский директор CLIA Лидерские возможности Сеть здравоохранения Университета Вермонта
, Вермонт
АКАДЕМИЧЕСКИЙ ХИРУРГИЧЕСКИЙ ПАТОЛОГ
, Вермонт
Просмотреть все вакансии
Реклама
Лейкемоидная реакция при коклюше у младенцев: есть ли место для гидроксимочевины? История болезни
Исходная информация
Bordetella pertussis — это всемирная бактерия, доступная только человеку и впервые выделенная в 1906 году Жюлем Борде.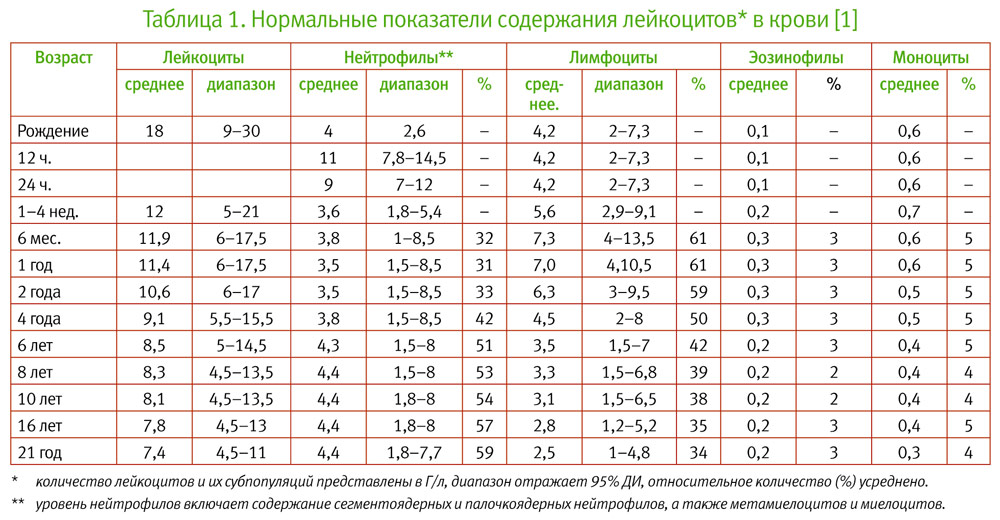 По оценкам Всемирной организации здравоохранения (ВОЗ), этот патоген был обнаружен в 16 миллионах инфекционных заболеваний во всем мире и вызвал 195000 смертей в 2008 г., 95% из которых произошли в развивающихся странах (1). В Швейцарии в период с 2010 по 2014 год ежегодно выявлялось около 8700 случаев (декларирование в нашей стране является обязательным), несмотря на рекомендуемую национальную программу вакцинации. В настоящее время ежегодно госпитализируют около 30 детей, в основном младенцев, и за последние 15 лет было зарегистрировано четыре случая смерти от коклюша (2).
По оценкам Всемирной организации здравоохранения (ВОЗ), этот патоген был обнаружен в 16 миллионах инфекционных заболеваний во всем мире и вызвал 195000 смертей в 2008 г., 95% из которых произошли в развивающихся странах (1). В Швейцарии в период с 2010 по 2014 год ежегодно выявлялось около 8700 случаев (декларирование в нашей стране является обязательным), несмотря на рекомендуемую национальную программу вакцинации. В настоящее время ежегодно госпитализируют около 30 детей, в основном младенцев, и за последние 15 лет было зарегистрировано четыре случая смерти от коклюша (2).
Злокачественный коклюш, самая тяжелая форма, характеризуется выраженным лейкоцитозом, рефрактерной гипоксемией, легочной гипертензией и сердечно-легочной недостаточностью, с высокой заболеваемостью и смертностью. Проспективное исследование в США показало 10-кратное увеличение риска смерти при лейкоцитозе >50 г/л. Также была выявлена четкая связь между высоким средним числом лейкоцитов, механической вентиляцией легких и легочной гипертензией (3). В этой когорте большинству пациентов было меньше 3 месяцев.
В этой когорте большинству пациентов было меньше 3 месяцев.
Лейкоцитоз вызывает синдром повышенной вязкости с лейкостазом, который может осложняться внутричерепными кровоизлияниями и легочной гипертензией (4). Таргетная антибактериальная терапия является терапией первой линии в сочетании с поддерживающей терапией (инвазивная вентиляция легких, оксигенация, нутритивная поддержка). Лейкаферез или обменное переливание являются дополнительными методами лечения, предлагаемыми для уменьшения лейкоцитоза и его неблагоприятных последствий (4–6).
Гидроксимочевина используется для снижения показателей крови при некоторых онкологических и гематологических заболеваниях, таких как острый миелоидный лейкоз, полицитемия, тромбоцитемия и серповидно-клеточная анемия. Насколько нам известно, гидроксимочевина никогда не применялась при злокачественном коклюше. Мы сообщаем о случае младенца со злокачественным коклюшем и лейкемоидной реакцией, получавшего лечение гидроксимочевиной.
Представление клинического случая
Младенец в возрасте 73 дней, родившийся недоношенным на сроке 34 1/7 недели гестации, с массой тела при рождении 1765 г (P 10-25), поступил по поводу респираторно-синцитиального вирусного бронхиолита с насморком и снижением аппетита.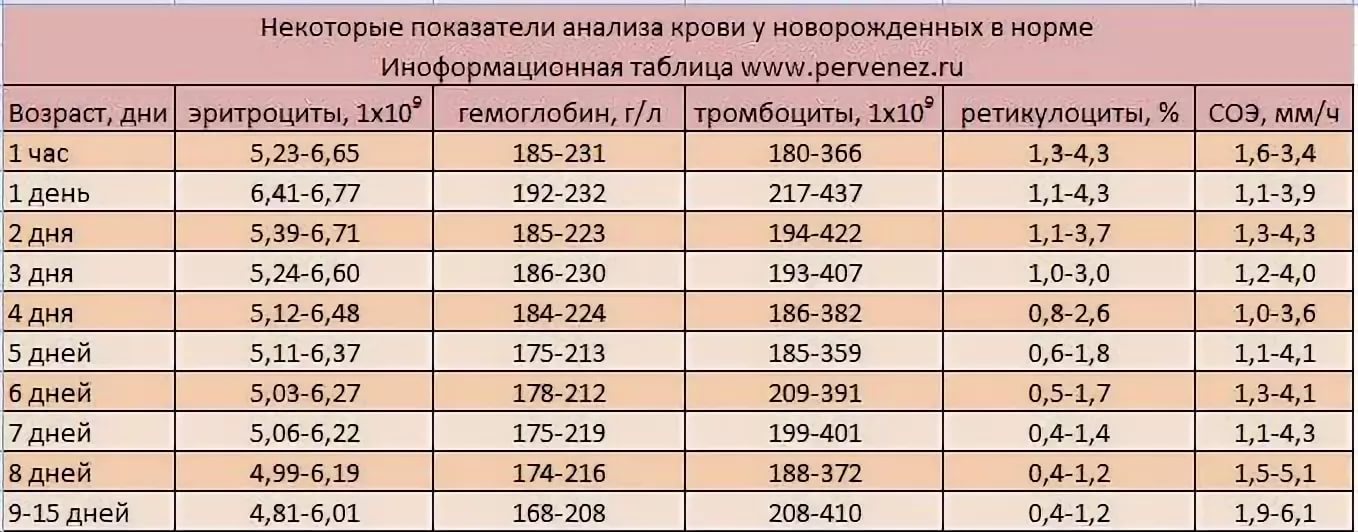 прием. Она была вакцинирована в соответствии со швейцарскими рекомендациями (Инфанрикс пентавалент ® / Превенар ® ) в возрасте 2 месяцев. Ее родители не были привиты против ВР .
прием. Она была вакцинирована в соответствии со швейцарскими рекомендациями (Инфанрикс пентавалент ® / Превенар ® ) в возрасте 2 месяцев. Ее родители не были привиты против ВР .
На 4-й день госпитализации у нее развился тяжелый респираторный дистресс. Рентгенограмма грудной клетки показала инфильтрат правой верхней доли легкого. В анализе крови выявлено повышение уровня С-реактивного белка (СРБ 210 мг/л) и гиперлейкоцитоз (64 г/л) (дифференциальный анализ крови изначально не проводился). В связи с клинической дыхательной недостаточностью и гиперкапнией была начата неинвазивная вентиляция легких. Несмотря на это лечение, гиперкапния ухудшилась, и ребенку потребовалась искусственная вентиляция легких, и он был переведен в наше педиатрическое отделение интенсивной терапии (PICU). Из-за ухудшения дыхания, связанного с нарастанием воспалительных параметров, заподозрено бактериальную инфекцию и начата внутривенная антибиотикотерапия цефтриаксоном 100 мг/кг/сут.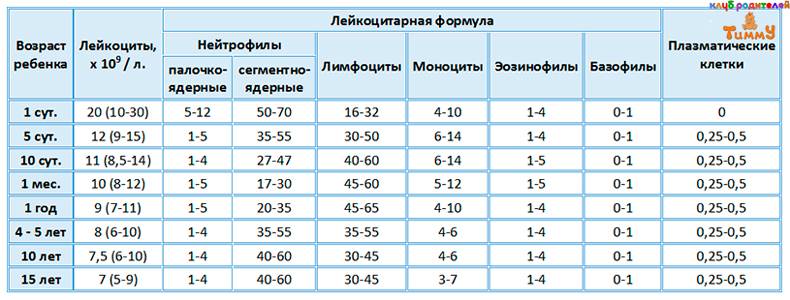 Последующее обследование показало положительный результат Streptococcus pneumoniae в моче и положительная ПЦР Bordetella pertussis в назальном образце. BP был специально обследован из-за тяжелого гиперлейкоцитоза, связанного с лимфоцитозом, и к цефтриаксону был добавлен внутривенный кларитромицин в дозе 20 мг/кг/день.
Последующее обследование показало положительный результат Streptococcus pneumoniae в моче и положительная ПЦР Bordetella pertussis в назальном образце. BP был специально обследован из-за тяжелого гиперлейкоцитоза, связанного с лимфоцитозом, и к цефтриаксону был добавлен внутривенный кларитромицин в дозе 20 мг/кг/день.
Ребенку требовались высокие параметры вентиляции и до 100% кислорода. Несмотря на эту вентиляционную поддержку, гиперкапния сохранялась. Эхокардиограмма показала легочную гипертензию, но сохранную функцию правого желудочка. Лейкоцитоз вначале уменьшился, вероятно, за счет инфузионной терапии и последующей гемодилюции. На 6-й день лейкоцитоз усилился (рис. 1), но лейкаферез еще не был четко показан. Так как респираторный статус не улучшался, было принято решение ввести гидроксимочевину (Литалир ® ) в начальной дозе 10 мг/кг/день. Это лечение постепенно увеличивали до 30 мг/кг/день с последующим снижением количества лейкоцитов (рис. 1). На 10-й день лейкоциты снизились до 34 г/л, и лечение гидроксимочевиной было прекращено во избежание ятрогенной лейкопении (табл. 1). Одновременно улучшилось состояние органов дыхания, и на 13-й день удалось экстубировать ребенка. Оба антибиотика были отменены после 7-го дня лечения. До 25-х суток требовалась оксигенотерапия. Ребенок выписан домой на 29-е сутки.без всяких осложнений.
1). На 10-й день лейкоциты снизились до 34 г/л, и лечение гидроксимочевиной было прекращено во избежание ятрогенной лейкопении (табл. 1). Одновременно улучшилось состояние органов дыхания, и на 13-й день удалось экстубировать ребенка. Оба антибиотика были отменены после 7-го дня лечения. До 25-х суток требовалась оксигенотерапия. Ребенок выписан домой на 29-е сутки.без всяких осложнений.
Рисунок 1 . Эволюция лейкоцитов во время госпитализации и представление различных методов лечения. NIV, неинвазивная вентиляция.
Таблица 1 . Дифференциальный анализ крови и тромбоциты во время пребывания в отделении интенсивной терапии.
Обсуждение
Коклюш и лейкемоидная реакция
У этого пациента тяжелая форма злокачественного коклюша и вторичная лейкемоидная реакция. Эта гематологическая реакция, возникающая на фоне ВР впервые была описана более века назад и имеет диагностическое значение с 1898 г. (7). У младенцев обычно наблюдается такая реакция, характеризующаяся количеством лейкоцитов более 50 г/л с выраженным лимфоцитозом. Эта реакция отличается от гиперлейкоцитоза, возникающего при онкологических заболеваниях и определяемого количеством лейкоцитов более 100 г/л в периферической крови (8).
Эта реакция отличается от гиперлейкоцитоза, возникающего при онкологических заболеваниях и определяемого количеством лейкоцитов более 100 г/л в периферической крови (8).
Лейкемоидная реакция вызывается токсином BP , но конкретные механизмы еще не совсем понятны. Одним из предполагаемых механизмов может быть ингибирование экстравазации лимфоцитов в инфицированный участок и облегчение миграции лимфоцитов из селезенки и костного мозга, что приводит к лейкоцитозу. Фенотипический анализ показывает, что коклюшный лейкоцитоз состоит из увеличения популяции нормальных наивных клеток, а не пролиферации активированных клеток (7). Другим эффектом коклюшного токсина является инактивация многих G-белков, участвующих в механизмах клеточной регуляции. Некоторые из этих G-белков оказывают защитное действие на кардиореспираторную систему, и их инактивация объясняет быстрое увеличение частоты сердечных сокращений и дыхания, наблюдаемое в этих ситуациях. Одна из гипотез состоит в том, что лейкоцитоз является маркером активности токсина, а ингибирование G-белков в сердце и легких может быть причиной смерти (9). ).
).
Несколько исследований показали значительную связь между лейкемоидной реакцией и фатальным исходом либо в отношении абсолютного значения лейкоцитоза, либо в отношении скорости его прогрессирования (3, 9–14). Хотя большинство согласны с тем, что неблагоприятный прогноз сильно коррелирует с лейкоцитозом > 100 Г/л, также было показано отрицательное влияние на выживаемость числа лейкоцитов > 55 Г/л (15). Другими выявленными факторами неблагоприятного прогноза являются низкая масса тела при рождении, гестационный возраст, судороги во время инфекции и легочная гипертензия (3). Пациент, которого мы описываем, соответствует нескольким из этих факторов, а именно: низкий вес при рождении, недоношенность и легочная артериальная гипертензия.
Срочная потребность в снижении количества лейкоцитов
Гипервязкость и лейкостаз, вызванные увеличением циркулирующих лейкоцитов, могут привести к серьезным осложнениям, таким как внутричерепное кровотечение и легочная недостаточность с гипоксией и гиперкапнией. Большинство посмертных анализов выявляют наличие тромбов в венозных, артериальных и лимфатических легочных сосудах (4, 16–19). В этом контексте развитие легочной артериальной гипертензии представляется многофакторным: повышение легочного сопротивления за счет повышенной вязкости на фоне лейкоцитоза и тромбов; вазоконстрикция, вызванная гипоксией у детей раннего возраста, у которых реактивность легочных сосудов повышена; и, как упоминалось выше, прямое воздействие токсина на сердце и легкие (14, 19). Воздействие на лейкоцитоз необходимо для ограничения гемодинамических последствий и использования сердечной и респираторной поддержки, такой как экстракорпоральная мембранная оксигенация (ЭКМО), которая имеет высокий уровень смертности без сопутствующей лейкоредукции.
Большинство посмертных анализов выявляют наличие тромбов в венозных, артериальных и лимфатических легочных сосудах (4, 16–19). В этом контексте развитие легочной артериальной гипертензии представляется многофакторным: повышение легочного сопротивления за счет повышенной вязкости на фоне лейкоцитоза и тромбов; вазоконстрикция, вызванная гипоксией у детей раннего возраста, у которых реактивность легочных сосудов повышена; и, как упоминалось выше, прямое воздействие токсина на сердце и легкие (14, 19). Воздействие на лейкоцитоз необходимо для ограничения гемодинамических последствий и использования сердечной и респираторной поддержки, такой как экстракорпоральная мембранная оксигенация (ЭКМО), которая имеет высокий уровень смертности без сопутствующей лейкоредукции.
В настоящее время для экстренной циторедукции в тяжелых или симптоматических случаях, кроме химиотерапии, используются два способа лечения гиперлейкоцитоза: лейкаферез и обменное переливание. Лейкаферез является методом выбора в случаях повышенной вязкости с гемодинамическим воздействием, но у этой методики есть некоторые ограничения: трудный сосудистый доступ у детей раннего возраста, риски, связанные с антикоагулянтной терапией, плохой опыт или недоступность процедуры (8). В серии случаев из 102 детей с острым лейкозом и гиперлейкоцитозом, получавших лейкаферез, Abla et al. описал частоту осложнений 86%. Большинство осложнений в этом исследовании были метаболическими нарушениями, гемодинамической нестабильностью и коагулопатией (20). Обменное переливание — полезная и более безопасная альтернатива, поскольку она широко используется при других заболеваниях. Осложнения такие же, как и при любых трансфузиях (4). Несколько исследований показали быстрое уменьшение гипоксемии после лейкодеплементной терапии при коклюшной инфекции, будь то лейкаферез или обменное переливание крови. Исследование Rowlands et al. продемонстрировали преимущество стратегии быстрой лейкоредукции у 10 пациентов младше 3 месяцев с синдромом гипервязкости во время коклюшной инфекции и с последующими сердечно-сосудистыми, легочными и неврологическими последствиями (21). С 2005 по 2009 год5 пациентов подверглись лейкаферезу под ЭКМО, а еще 5 — только обменным переливанием крови. Глобальная выживаемость составила 90%.
В серии случаев из 102 детей с острым лейкозом и гиперлейкоцитозом, получавших лейкаферез, Abla et al. описал частоту осложнений 86%. Большинство осложнений в этом исследовании были метаболическими нарушениями, гемодинамической нестабильностью и коагулопатией (20). Обменное переливание — полезная и более безопасная альтернатива, поскольку она широко используется при других заболеваниях. Осложнения такие же, как и при любых трансфузиях (4). Несколько исследований показали быстрое уменьшение гипоксемии после лейкодеплементной терапии при коклюшной инфекции, будь то лейкаферез или обменное переливание крови. Исследование Rowlands et al. продемонстрировали преимущество стратегии быстрой лейкоредукции у 10 пациентов младше 3 месяцев с синдромом гипервязкости во время коклюшной инфекции и с последующими сердечно-сосудистыми, легочными и неврологическими последствиями (21). С 2005 по 2009 год5 пациентов подверглись лейкаферезу под ЭКМО, а еще 5 — только обменным переливанием крови. Глобальная выживаемость составила 90%. Аналогичное исследование, проведенное между 2001 и 2004 годами у 9 пациентов, в том числе 6, получавших ЭКМО, без какой-либо техники снижения лейкоцитов, показало выживаемость 55% (21). В нескольких других небольших сериях случаев, в которых сообщалось об опыте обменного переливания крови при злокачественном коклюше, показатели выживаемости составляли от 54 до 92% (4, 22–25). Некоторые авторы указывают, что обменное переливание следует предпочесть методам лейкодеплеции, поскольку оно одновременно удаляет коклюшный токсин (9).).
Аналогичное исследование, проведенное между 2001 и 2004 годами у 9 пациентов, в том числе 6, получавших ЭКМО, без какой-либо техники снижения лейкоцитов, показало выживаемость 55% (21). В нескольких других небольших сериях случаев, в которых сообщалось об опыте обменного переливания крови при злокачественном коклюше, показатели выживаемости составляли от 54 до 92% (4, 22–25). Некоторые авторы указывают, что обменное переливание следует предпочесть методам лейкодеплеции, поскольку оно одновременно удаляет коклюшный токсин (9).).
Альтернатива инвазивным процедурам?
У нашего пациента была дыхательная недостаточность с рефрактерной гипоксемией и гиперкапнией, несмотря на высокую респираторную поддержку, легочная гипертензия без кардиальной реперкуссии и без неврологической симптоматики. Даже если количество лейкоцитов увеличилось тревожным образом, оно остается ниже 100 г/л. В связи с отсутствием в литературе четких критериев в пользу лейкафереза и с учетом рисков этой процедуры мы искали альтернативную терапию для снижения лейкоцитоза. По аналогии с его использованием в онкологическом контексте, лечение гидроксимочевиной не по прямому назначению (Литалир ® ).
По аналогии с его использованием в онкологическом контексте, лечение гидроксимочевиной не по прямому назначению (Литалир ® ).
Гидроксимочевина, или гидроксикарбамид, является старым лекарственным средством, ингибирующее действие которого на лейкоциты известно с конца 1860-х гг. С 1960-х годов хорошо описана эффективность гидроксимочевины при гиперлейкоцитозе, связанном с острым миелоидным лейкозом, особенно при быстром уменьшении количества бластных клеток, что предотвращает осложнения гиперлейкоцитоза (26, 27). Его использование распространилось на другие виды рака (рак головы или шеи), а также на некоторые неопухолевые патологии, такие как ВИЧ-инфекция или серповидноклеточная анемия. Гидроксимочевина является антипролиферативным препаратом, препятствующим синтезу ДНК. Цитостатический эффект обусловлен ингибированием рибонуклеотидредуктазы и, таким образом, остановкой клеточного цикла в отсутствие достаточного количества нуклеотидов (28). Всасывание через пищеварительную систему быстрое, пики в плазме достигаются в течение 1 часа. Гидроксимочевина особенно накапливается в клетках крови, особенно в белой линии. Прохождение через гематоэнцефалический барьер легкое. Проникновение в клетки — пассивное явление с быстрым уравновешиванием концентрации между различными тканями и кровью (28, 29).).
Гидроксимочевина особенно накапливается в клетках крови, особенно в белой линии. Прохождение через гематоэнцефалический барьер легкое. Проникновение в клетки — пассивное явление с быстрым уравновешиванием концентрации между различными тканями и кровью (28, 29).).
При серповидноклеточной анемии гидроксимочевина улучшает патофизиологию и, по-видимому, является единственным методом лечения с доказанной эффективностью. Это лечение уменьшает острые осложнения, такие как болезненные вазоокклюзионные явления и острый торакальный синдром, а также потребность в переливаниях крови и госпитализациях. Выживаемость взрослых и детей также улучшается (30). В этом случае гидроксимочевина увеличивает выработку фетального гемоглобина за счет образования оксида азота и снижает адгезию эритроцитов к эндотелию сосудов (31).
При ВИЧ-инфекции гидроксимочевина оказывает ингибирующее действие на репликацию вируса. Бенито и др. изучали влияние in vitro на пролиферацию и активацию Т-клеток. Показано дозозависимое влияние на пролиферацию Т-клеток со снижением среднего числа митозов. Также было продемонстрировано влияние на экспрессию различных маркеров активации Т-клеток (32).
Показано дозозависимое влияние на пролиферацию Т-клеток со снижением среднего числа митозов. Также было продемонстрировано влияние на экспрессию различных маркеров активации Т-клеток (32).
Этот механизм действия может объяснить потенциальное преимущество гидроксимочевины в снижении лимфоцитоза при коклюше, который в основном увеличивает количество лимфоцитов. Тем не менее, как обсуждалось ранее, лейкоцитоз при коклюше является экспансией наивных клеток, а не пролиферацией новых клеток. Другим механизмом, вызывающим эффект гидроксимочевины, убивающий клетки, может быть производство окислительного стресса и индукция прекращения цитокинеза, как показывают некоторые исследования (31). Ни один из известных механизмов действия гидроксимочевины сам по себе, по-видимому, не нейтрализует эффекты коклюшного токсина, но могут быть задействованы многие из этих механизмов. Хотя действие гидроксимочевины на лейкоцитоз, вызванный коклюшным токсином, еще не выяснено, ее действие у нашего пациента было положительным. Мы обнаружили разрешение лейкемоидной реакции через 5 дней лечения без развития синдрома лизиса или других узнаваемых побочных реакций. Мы предполагаем, что часть лейкоцитоза, наблюдаемого при злокачественном коклюше, может быть связана с перепроизводством новых лейкоцитов, которое затем снижается при лечении гидроксимочевиной. Тем не менее, учитывая, что 50% пациентов спонтанно выздоравливают только при поддерживающей терапии, текущий исход у пациента может быть не следствием терапии гидроксимочевиной.
Мы обнаружили разрешение лейкемоидной реакции через 5 дней лечения без развития синдрома лизиса или других узнаваемых побочных реакций. Мы предполагаем, что часть лейкоцитоза, наблюдаемого при злокачественном коклюше, может быть связана с перепроизводством новых лейкоцитов, которое затем снижается при лечении гидроксимочевиной. Тем не менее, учитывая, что 50% пациентов спонтанно выздоравливают только при поддерживающей терапии, текущий исход у пациента может быть не следствием терапии гидроксимочевиной.
Предполагаемый риск лечения гидроксимочевиной заключается в последовательной миелосупрессии, лейкопении, тромбоцитопении и анемии, но в литературе нет четких данных о тяжелых осложнениях при стандартной дозировке (от 10 до 30 мг/кг/день).
Новые экспериментальные методы лечения, такие как моноклональные антитела против коклюшного токсина или других мишеней для уменьшения поражения легких, находятся в стадии изучения. Эти подходы кажутся многообещающими на моделях мышей, но нуждаются в дальнейшей оценке (33, 34).
Заключительные замечания
В настоящее время не существует эффективного лечения злокачественного коклюша. Ведение этих пациентов в основном поддерживающее. Лейкаферез, обменное переливание крови и ЭКМО-терапия связаны с высокой смертностью и осложнениями (17). Злокачественный коклюш — это старое, хорошо известное заболевание, и, возможно, старый препарат, такой как гидроксимочевина, может быть новой стратегией лечения в этой ситуации. Этот неинвазивный подход требует дальнейших исследований, но профилактическое использование гидроксимочевины может предотвратить сердечную недостаточность или неврологическую симптоматику и последующую потребность в инвазивных процедурах лейкоредукции и связанных с ними осложнениях.
Заявление об этике
Родители дали письменное информированное согласие на публикацию этого отчета о болезни.
Вклад авторов
В.А. и M-HP разработали концепцию работы. GM и DS проанализировали данные. GM и DS составили проект, а JN, DL, TF, MD, SD, M-HP и VA редактировали эту рукопись. Все авторы одобрили окончательный вариант и согласились нести ответственность за содержание работы.
Все авторы одобрили окончательный вариант и согласились нести ответственность за содержание работы.
Заявление о конфликте интересов
Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могли бы быть истолкованы как потенциальный конфликт интересов.
Сокращения
BP , Bordetella pertussis ; WBC, белые кровяные тельца; ЭКМО, экстракорпоральная мембранная оксигенация; РСВ, респираторно-синцитиальный вирус; PICU, педиатрическое отделение интенсивной терапии.
Ссылки
1. Всемирная организация здравоохранения. Иммунизация, вакцины и биологические препараты коклюш . Женева: Всемирная организация здравоохранения (2008 г.).
2. Федеральное государственное управление Санте. Заболевания трансмиссивные, Инфекционные заболевания, Coqueluche . Берн (2017).
3. Berger JT, Carcillo JA, Shanley TP, Wessel DL, Clark A, Holubkov R, et al. Критический коклюш у детей: многоцентровое проспективное когортное исследование. Pediatr Crit Care Med . (2013) 14:356–65. doi: 10.1097/PCC.0b013e31828a70fe
Критический коклюш у детей: многоцентровое проспективное когортное исследование. Pediatr Crit Care Med . (2013) 14:356–65. doi: 10.1097/PCC.0b013e31828a70fe
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
4. Куперман А., Хоффман Ю., Гликман Д., Даббах Х., Зонис З. Тяжелый коклюш и гиперлейкоцитоз: пора менять на обмен? Переливание (2014) 54:1630–3. doi: 10.1111/trf.12519
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
5. Оноро Г., Салидо А.Г., Мартинес И.М., Кабеса Б., Гиллен М., де Азагра А.М. Лейкоредукция у больных тяжелым коклюшем с гиперлейкоцитозом. Pediatr Infect Dis J. (2012) 31:873–6. doi: 10.1097/INF.0b013e31825ba6cf
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
6. Martinez M, Rochat I, Corbelli R, Tissières P, Rimensberger PC, Barazzone-Argiroffo C. Раннее переливание крови при злокачественном коклюше: клинический случай. Pediatr Crit Care Med . (2011) 12:e107–9. doi: 10.1097/PCC.0b013e3181f3a189
(2011) 12:e107–9. doi: 10.1097/PCC.0b013e3181f3a189
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
7. Карбонетти Н.Х. Коклюшный лейкоцитоз: механизмы, клиническое значение и лечение. Патог Дис . (2016) 74:ftw087. doi: 10.1093/femspd/ftw087
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
8. Джайн Р., Бансал Д., Марваха Р.К. Гиперлейкоцитоз: неотложная помощь. Индийский J Педиатр. (2013) 80:144–8. doi: 10.1007/s12098-012-0917-3
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
9. Винтер К., Зипприч Дж., Гарриман К., Мюррей Э.Л., Горнбейн Дж., Хаммер С.Дж. и др. Факторы риска, связанные с младенческой смертностью от коклюша: исследование случай-контроль. Клин Infect Dis . (2015) 61:1099–106. doi: 10.1093/cid/civ472
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
10. Pierce C, Klein N, Peters M. Является ли лейкоцитоз предиктором смертности при тяжелой коклюшной инфекции? Медицинская интенсивная терапия . (2000) 26:1512–4. doi: 10.1007/s001340000587
(2000) 26:1512–4. doi: 10.1007/s001340000587
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
11. Surridge J, Segedin ER, Grant CC. Коклюш, требующий интенсивной терапии. Arch Dis Child (2007) 92: 970–5. doi: 10.1136/adc.2006.114082
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
12. Джентиле А., Романин В.С., Хуарес Мдель В., Люсион М.Ф., Маркес Мде Л., Мищенко А.С. Эпидемиология Bordetella pertussis в детской больнице. Arch Argent Pediatr. (2014) 112:26–32. doi: 10.5546/aap.2014.26
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
13. Борги А., Мениф К., Белхадж С., Гали Н., Салмен Л., Хамди А. Предикторы смертности при коклюше в критическом состоянии на искусственной вентиляции легких в стране с низким уровнем дохода. Mediterr J Hematol Infect Dis . (2014) 6:e2014059. doi: 10.4084/MJHID.2014.059
PubMed Abstract | Полный текст перекрестной ссылки | Академия Google
14. Murray EL, Nieves D, Bradley JS, Gargas J, Mason WH, Lehman D, et al. Характеристики тяжелой инфекции Bordetella pertussis среди младенцев в возрасте ≤ 90 дней, поступивших в педиатрические отделения интенсивной терапии — Южная Калифорния, сентябрь 2009 г. — июнь 2011 г. J Pediatric Infect Dis Soc . 2:1–6 (2013) doi: 10.1093/jpids/pis105
Murray EL, Nieves D, Bradley JS, Gargas J, Mason WH, Lehman D, et al. Характеристики тяжелой инфекции Bordetella pertussis среди младенцев в возрасте ≤ 90 дней, поступивших в педиатрические отделения интенсивной терапии — Южная Калифорния, сентябрь 2009 г. — июнь 2011 г. J Pediatric Infect Dis Soc . 2:1–6 (2013) doi: 10.1093/jpids/pis105
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
15. Микелова Л.К., Гальперин С.А., Шайфеле Д., Смит Б., Форд-Джонс Э., Водри В. и другие. Предикторы смерти у младенцев, госпитализированных с коклюшем: исследование случай-контроль 16 смертей от коклюша в Канаде. J Педиатр . (2003) 143:576–81. doi: 10.1067/S0022-3476(03)00365-2
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
16. Уильямс Г.Д., Нума А., Сокол Дж., Тобиас В., Даффи Б.Дж. ECLS при коклюше: играет ли она роль? Медицинская интенсивная терапия . (1998) 24:1089–92.
Реферат PubMed | Google Scholar
17. Халаса Н.Б., Барр Ф.Е., Джонсон Дж.Е., Эдвардс К.М. Фатальная легочная гипертензия, связанная с коклюшем у младенцев: играет ли роль экстракорпоральная мембранная оксигенация? Педиатрия (2003) 112 (6 ч. 1), 1274–8.
Халаса Н.Б., Барр Ф.Е., Джонсон Дж.Е., Эдвардс К.М. Фатальная легочная гипертензия, связанная с коклюшем у младенцев: играет ли роль экстракорпоральная мембранная оксигенация? Педиатрия (2003) 112 (6 ч. 1), 1274–8.
Реферат PubMed | Google Scholar
18. Pooboni S, Roberts N, Westrope C, Jenkins DR, Killer H, Pandya HC, et al. Экстракорпоральное жизнеобеспечение при коклюше. Детский пульмонол. (2003) 36:310–5. doi: 10.1002/ppul.10351
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
19. Пэддок Д., Санден Г.Н., Черри Д.Д., Гал А.А., Лэнгстон С., Татти К.М. и др. Патология и патогенез летального исхода Bordetella pertussis инфекции у детей раннего возраста. Clin Infect Dis. (2008) 47:328–38. doi: 10.1086/589753
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
20. Abla O, Angelini P, Di Giuseppe G, Kanani MF, Lau W, Hitzler J, et al. Ранние осложнения гиперлейкоцитоза и лейкафереза при острых лейкозах у детей. J Pediatr Hematol Oncol. (2016) 38:111–7. doi: 10.1097/MPH.0000000000000490
J Pediatr Hematol Oncol. (2016) 38:111–7. doi: 10.1097/MPH.0000000000000490
PubMed Abstract | Полный текст перекрестной ссылки | Академия Google
21. Rowlands HE, Goldman AP, Harrington K, Karimova A, Brierley J, Cross N, et al. Влияние быстрой лейкодеплеции на исход тяжелого клинического коклюша у детей раннего возраста. Педиатрия (2010) 126:e816–27. doi: 10.1542/peds.2009-2860
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
22. Romano MJ, Weber MD, Weisse ME, Siu BL. Коклюшная пневмония, гипоксемия, гиперлейкоцитоз и легочная гипертензия: улучшение оксигенации после обменного переливания двойного объема. Педиатрия (2004) 114:e264–6. doi: 10.1542/peds.114.2.e264
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
23. Доносо Ф., Крусес П.И., Камачо Дж.Ф., Леон Дж.А., Конг Дж.А. Обменное переливание для купирования тяжелого кардиогенного шока, вызванного коклюшем. Pediatr Infect Dis J. (2006) 25:846–8. doi: 10.1097/01.inf.0000232630.70138.a2
(2006) 25:846–8. doi: 10.1097/01.inf.0000232630.70138.a2
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
24. Grzeszczak MJ, Churchwell KB, Edwards KM, Pietsch J. Лейкоферез для лечения тяжелого детского коклюша с миокардиальной и легочной недостаточностью. Pediatr Crit Care Med. (2006) 7:580–2. doi: 10.1097/01.PCC.0000235253.19315.56
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
25. Лашкари Х.П., Каруппасвами С., Халифа К. Гиперлейкоцитоз, связанный с коклюшем: роль гипергидратации и обменного переливания крови. Клин Педиатр. (2012) 51:987–90. doi: 10.1177/0009922811410971
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
26. Грунд Ф.М., Армитаж Дж.О., Бернс П. Гидроксимочевина в профилактике последствий лейкостаза при остром лейкозе. Arch Intern Med. (1977) 137:1246–7.
Реферат PubMed | Google Scholar
27. Шварц Дж. Х., Каннеллос Г. П. Гидроксимочевина в лечении гематологических осложнений хронического гранулоцитарного лейкоза. Кровь (1975) 46:11–6.
П. Гидроксимочевина в лечении гематологических осложнений хронического гранулоцитарного лейкоза. Кровь (1975) 46:11–6.
Реферат PubMed | Google Scholar
28. Наварра П., Прециози П. Гидроксимочевина: новое понимание старого препарата. Crit Rev Oncol Hematol. (1999) 29:249–55.
Реферат PubMed | Академия Google
29. Gwilt PR, Tracewell WG. Фармакокинетика и фармакодинамика гидроксимочевины. Клин Фармакокинетика. (1998) 34:347–58. doi: 10.2165/00003088-199834050-00002
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
30. McGann PT, Ware RE. Гидроксимочевина для лечения серповидноклеточной анемии. Экспертное заключение по лекарственным препаратам. (2015) 14:1749–58. doi: 10.1517/14740338.2015.1088827
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
31. Сингх А., Сюй Ю.Дж. Механизмы уничтожения клеток гидроксимочевиной. Гены (2016) 7:E99. doi: 10.

 org/10.1093/pch/pxz010
org/10.1093/pch/pxz010