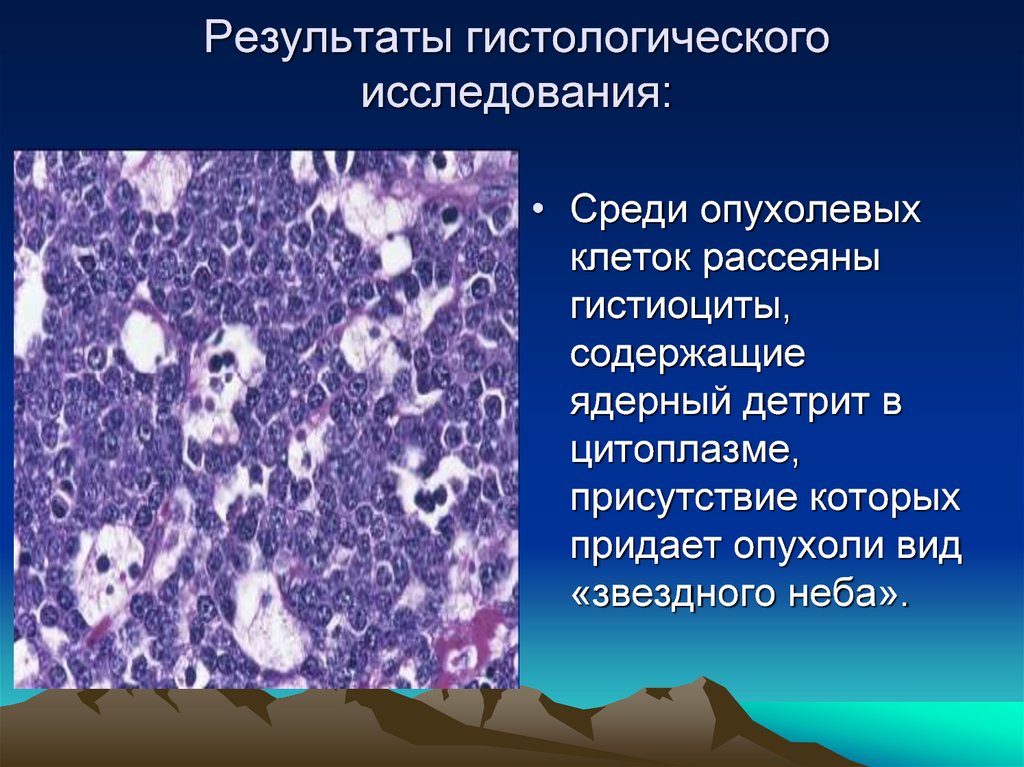
Гистологическое исследование: Гистологическое исследование — Клиника Формула здоровья
Сдать анализ: Гистологическое исследование (операционного материала) – 1 блок
Код: 4702
Время:
10 раб.дн.
Цена в Киев
1150,00 грн
Описание анализа:
Гистологическое исследование (операционного материала) – лабораторное исследование, основное предназначение которого — диагностика онкологических заболеваний. При анализе изучаются частицы тканей пациента, удаленных во время оперативного хирургического вмешательства.
Эти образцы называются операционным материалом и могут принадлежать к любым органам и тканям. На анализ берутся ткани костного мозга, кожи, желез внутренней секреции (щитовидная и предстательная железы), желудка, кишечника, печени, почек, легких, лимфоузлов, матки, костей или хрящей и пр. Исключение представляют собой лишь слизь, кровь, экссудат (жидкость, выделяемая при воспалительном процессе) и образцы тканей размером менее 1 милиметра – они не являются полноценными объектами для гистологического исследования.
Исключение представляют собой лишь слизь, кровь, экссудат (жидкость, выделяемая при воспалительном процессе) и образцы тканей размером менее 1 милиметра – они не являются полноценными объектами для гистологического исследования.
Состояние полученного операционного материала фиксируется с помощью специальных растворов (зачастую, это формалин) и подвергается дальнейшей обработке. Затем образец разрезается на ультратонкие срезы, которые размещаются на предметных стеклах и исследуются.
Такая процедура обработки операционного материала необходима для сохранения структуры клеток образца, максимально близкой к прижизненной. Исследование проводится врачом при помощи микроскопа: каждый из срезов тщательно изучается на предмет возможных отклонений от нормы.
Показания к гистологическому исследованию операционного материала
Анализ, в большинстве случаев, назначается при подозрении на развитии опухолевого процесса. Показаниями к гистологическому исследованию являются:
- дифференциальная диагностика предопухолевых, опухолевых и неопухолевых состояний;
- подтверждение или исключение онкологических болезней;
- определение тактики дальнейшего лечения.

Операционный материал, полученный и обработанный соответствующим образом, может сохраняться, используясь в случае необходимости для повторного анализа.
Интерпретация результатов
В результате обследования формируется описание проведенного микроскопического исследования, а пациенту выдается бланк, где описаны выявленные изменения и признаки патологий. Эти данные ложатся в основу диагноза, который ставит врач. Гистологический диагноз позволяет оценить, насколько злокачественна опухоль, на какой стадии находится заболевание и насколько распространен патологический процесс.
При неспецифических морфологических изменениях (которые могут быть характерны для широкого спектра состояний) гистологическое заключение ограничивается описательной частью.
Заключение по итогам гистологического исследования формируется в соответствии с медицинской номенклатурой и гистологическим классификациями Всемирной организации здравоохранения.
Подготовка к гистологическому исследованию
Никакой подготовки со стороны пациента не требуется – материал отбирается во время хирургического вмешательства.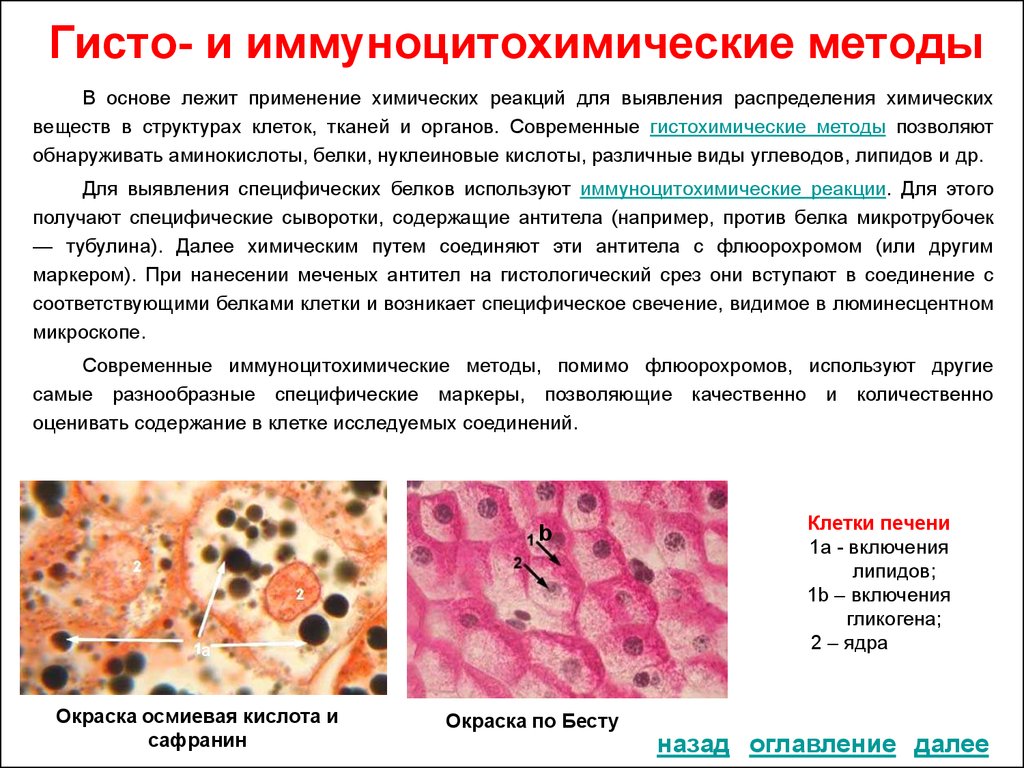 Последнее, в свою очередь, может требовать подготовки, о специфике которой расскажет хирург, который будет проводить операцию.
Последнее, в свою очередь, может требовать подготовки, о специфике которой расскажет хирург, который будет проводить операцию.
Материал для исследования: операционный материал.
Метод исследования: гистологический.
Срок проведения исследования: 10 рабочих дней.
Гистологическое исследование биопсийного материала (рутинные окраски) (ООО «НЦКМД»)
Артикул: 2007
Анализ доступен:
Медицинский центр на площади Стачек, 5Медицинский центр на Богатырском пр. , 4Лабораторный терминал на пр. Александровской Фермы, 8Лабораторный терминал на пр. Наставников, 36к2Лабораторный терминал на ул. Будапештская, 6Медицинский центр на Пулковском шоссе, 28А Медицинский центр на Кондратьевском пр., 62к3Медицинский центр на пр. Просвещения, 14к4Медицинский центр на ул. Моисеенко, 5Лабораторный терминал на ул. Олеко Дундича, 8, к. 2Лабораторный терминал на ул. Пестеля, 25АМедицинский центр на Ленинском пр., 88Лабораторный терминал на ул. Турку, 5/13г. Санкт-Петербург, Выездная службаМедицинский центр на ул. Савушкина, д. 14
, 4Лабораторный терминал на пр. Александровской Фермы, 8Лабораторный терминал на пр. Наставников, 36к2Лабораторный терминал на ул. Будапештская, 6Медицинский центр на Пулковском шоссе, 28А Медицинский центр на Кондратьевском пр., 62к3Медицинский центр на пр. Просвещения, 14к4Медицинский центр на ул. Моисеенко, 5Лабораторный терминал на ул. Олеко Дундича, 8, к. 2Лабораторный терминал на ул. Пестеля, 25АМедицинский центр на Ленинском пр., 88Лабораторный терминал на ул. Турку, 5/13г. Санкт-Петербург, Выездная службаМедицинский центр на ул. Савушкина, д. 14
Цена:
2 310 ₽
В корзину
Цена указывается без учета стоимости
взятия биоматериала
Гистологический анализ – это прижизненное микроскопическое исследование образцов тканей, специально обработанных для этих целей. Анализ позволяет установить диагноз, исходя из состояния клеток и тканей, оценить прогноз и решить вопрос тактики лечения. Гистологическое исследование обязательно проводят при подозрениях на опухолевые заболевания, чтобы на раннем сроке определить тип опухоли, риск перерождения и наличие метастазов.
Что такое анализ на гистологию – это забор образцов тканей из очага поражения органа путём биопсии. Подобное исследование отличается минимальной травматичностью, что позволяет назначать его практически без противопоказаний.
Биопсийный материал обрабатывают специальным образом, нарезают на слои толщиной в несколько микрон и для лучшей визуализации клеток и клеточных структур окрашивают рутинными красками – эозином и гематоксилином, или специфичными красителями при необходимости. После этого биоптаты изучают под микроскопом.
Что показывает анализ гистологии? Изменённые тканевые структуры, атипичные клетки, клеточные органеллы, другие элементы поражённого органа, по которым можно судить о типе и степени патологического процесса.
Метод определения
Гистологический.
Исследуемый материал
Исследуют образцы тканей в виде биоптатов в 10 % формалине, которые хранят в специальных контейнерах.
Срок исполнения
Сколько дней делается в итоге анализ опухоли на гистологию? В среднем проводится за семь дней.
Показания
Чаще всего гистологический анализ назначают при новообразованиях, чтобы подтвердить или опровергнуть предварительный диагноз, провести дифференциальную диагностику в случае схожих проявлений болезни, а также уточнить наличие атипичных клеток и степень злокачественности, в случае выбора терапевтического или хирургического лечения. Также анализ может понадобиться для отслеживания динамики процесса – рост опухоли, рецидив, и для оценки проведенной терапии.
Подготовка к анализу
Биопсию рекомендуют делать утром натощак. Процедура контролируется УЗИ и проводится под местным обезболиванием. Противопоказаний к взятию биоматериала почти нет: процедура не показана при проблемах со свёртываемостью крови, аллергиях на анестетики, тяжелой сердечной недостаточности. При угрозе выкидыша во время беременности биопсию также не проводят.
При угрозе выкидыша во время беременности биопсию также не проводят.
Биоптаты собирают в специальные контейнеры и отправляют в лабораторию.
Оборудование: А/Е/Н
Гистологическое исследование биоптатов выглядит как описание структуры ткани и клеток органа. Результат должен оценивать врач, исходя из анамнеза, типа патологии, симптоматики и данных других методов диагностики.
* актуальную информацию уточняйте в контактном центре по тел. 8 (812) 600-42-00
Биоптаты конкретных органов медработниками стационаров и поликлиник собираются в стерильные контейнеры
Гистология, окрашивание — StatPearls — NCBI Bookshelf
Введение
Медицинская гистология — это микроскопическое исследование тканей и органов путем создания срезов, окрашивания и исследования этих срезов под микроскопом. Часто называемая микроскопической анатомией и гистохимией, гистология позволяет визуализировать структуру ткани и характерные изменения, которые могут произойти в ткани. Из-за этого он используется в медицинской диагностике, научных исследованиях, вскрытии и судебно-медицинской экспертизе. После того, как образец ткани подвергся фиксации, обработке, заливке, разрезанию и окрашиванию, он может быть подвергнут анализу с помощью микроскопии, а результаты интерпретированы патологоанатомом. Выбор гистологических красителей для данного образца зависит от поставленного исследовательского вопроса. Усовершенствованная интерпретация гистологического препарата в сочетании с историей болезни пациента может оказать неоценимое влияние на ход лечения и прогноз.
Из-за этого он используется в медицинской диагностике, научных исследованиях, вскрытии и судебно-медицинской экспертизе. После того, как образец ткани подвергся фиксации, обработке, заливке, разрезанию и окрашиванию, он может быть подвергнут анализу с помощью микроскопии, а результаты интерпретированы патологоанатомом. Выбор гистологических красителей для данного образца зависит от поставленного исследовательского вопроса. Усовершенствованная интерпретация гистологического препарата в сочетании с историей болезни пациента может оказать неоценимое влияние на ход лечения и прогноз.
Вопросы, вызывающие озабоченность
Базовые знания о подготовке тканей, включая окрашивание, важно знать при интерпретации отчетов о патологии как при стационарной, так и при амбулаторной биопсии. Не всегда интерпретирующий патологоанатом тщательно проанализировал образец ткани, включив соответствующее гистологическое окрашивание, и этот недостаток может замедлить постановку точного диагноза.
Структура
Четыре основных типа тканей человека можно окрашивать и просматривать с помощью различных гистологических методов. Эпителий, соединительная ткань, мышечная ткань и нервная ткань имеют общие черты, но после окрашивания выглядят очень различно структурно. Каждое пятно существует, чтобы выделить важную особенность или компонент в пределах типа ткани. Например, один из наиболее распространенных красителей, гематоксилин, представляет собой основной краситель, который окрашивает белки в синий цвет, а эозин окрашивает белки в розовый цвет. Эти два красителя обычно используются вместе для определения внутриклеточных органелл и белков. Из-за разнообразия существующих белков были созданы некоторые красители, чтобы выделить конкретный белок, который будет обсуждаться в следующих разделах этого обзора. Преимущество использования специального красителя заключается в том, что он очень хорошо выделяет конкретный белок. Однако из-за своей специфики другие структуры не будут видны. По этой причине из данного образца часто создается несколько слайдов, чтобы можно было выполнить несколько окрашиваний для сбора всего спектра необходимой информации.
По этой причине из данного образца часто создается несколько слайдов, чтобы можно было выполнить несколько окрашиваний для сбора всего спектра необходимой информации.
Функция
Почти все окрашивания тканей выполняются на тканях, которые были удалены с тела. Однако в редких случаях очень специализированные пятна, называемые жизненными пятнами, могут воздействовать на ткани, оставшиеся в организме. Эти пятна используются для идентификации определенных типов тканей и идентификации аномальной ткани, поэтому последующая биопсия может быть более точной при получении аномальной ткани.
Подготовка тканей
Прежде чем можно будет получить специфическое окрашивание, образцы тканей должны пройти следующие этапы подготовки: фиксация, обработка, встраивание, создание срезов и иногда поиск антигена. В современных гистологических лабораториях большинство этих этапов автоматизированы.
Фиксация: Фиксация использует химические вещества для сохранения структуры ткани в ее естественной форме и защищает ее от деградации за счет необратимо сшивающих белков. Хотя доступно несколько специализированных фиксаторов, нейтральный забуференный формалин является обычным выбором для этого этапа. Этап фиксации жизненно важен для остальной части процедуры гистологического окрашивания, потому что, сохраняя химический состав ткани, образец затвердевает и облегчает фазу срезов. Еще одним эффективным фиксатором является парафиноформалин. Его преимущество в том, что он является предпочтительным фиксатором для иммуноокрашивания; однако это требует подготовки во время фиксации. Буэн — это фиксатор, используемый для исследования эмбрионов и мозговой ткани из-за превосходной сохранности нежных ядер и гликогена. Его недостатком является то, что он плохо сохраняет ткани почек, а также искажает структуру митохондрий.[1]
Хотя доступно несколько специализированных фиксаторов, нейтральный забуференный формалин является обычным выбором для этого этапа. Этап фиксации жизненно важен для остальной части процедуры гистологического окрашивания, потому что, сохраняя химический состав ткани, образец затвердевает и облегчает фазу срезов. Еще одним эффективным фиксатором является парафиноформалин. Его преимущество в том, что он является предпочтительным фиксатором для иммуноокрашивания; однако это требует подготовки во время фиксации. Буэн — это фиксатор, используемый для исследования эмбрионов и мозговой ткани из-за превосходной сохранности нежных ядер и гликогена. Его недостатком является то, что он плохо сохраняет ткани почек, а также искажает структуру митохондрий.[1]
Дегидратация: Добавление этанола завершает дегидратацию образца. Он удалил воду из образца и дополнительно затвердел ткань для возможной световой микроскопии. После применения этанола и после завершения обезвоживания ткани для удаления этанола используется ксилол.
Заливка: Заливка — это процесс помещения образца в парафиновый воск или пластиковую смолу для улучшения процесса извлечения клеточных структур. Этот шаг следует выполнять с осторожностью, если целью является иммуноокрашивание, поскольку парафиновый воск будет препятствовать проникновению антител и приведет к ложному результату.[1]
Секционирование: Срезирование включает в себя установку образца на микротом и разрезание его на срезы. Предпочтительная толщина составляет 4-5 микрометров, чтобы ее можно было окрасить и нанести на предметное стекло для исследования.[1]
Извлечение антигена: Этот шаг предназначен для извлечения антигенов, которые могли быть охвачены на этапах фиксации и встраивания. Если перекрестное связывание белков скрывает участки антигена, иммуногистохимический ответ может быть не таким сильным. Извлечение антигена достигается с помощью нагревания и протеолитических методов для разрушения поперечных связей и выявления эпитопов и антигенов, которые ранее были покрыты. Хотя на этом этапе существует риск денатурации как фиксатора, так и самих антигенов, успешный метод извлечения антигена может привести к гораздо более эффективной интенсивности иммунного окрашивания.
Хотя на этом этапе существует риск денатурации как фиксатора, так и самих антигенов, успешный метод извлечения антигена может привести к гораздо более эффективной интенсивности иммунного окрашивания.
Гистохимия и цитохимия
Гематоксилин и эозин
Как следует из названия, это два окрашивания, выполненные на последовательных этапах. Гематоксилин представляет собой основной краситель, окрашивающий кислые структуры. Полученный цвет имеет пурпурно-синий оттенок, а структуры, на которые нацелен этот краситель, называются базофильными. Базофильные структуры включают ДНК в ядрах клеток, РНК в рибосомах и шероховатый эндоплазматический ретикулум.[1]
Эозин – это контрастное окрашивание после гематоксилина, кислотный краситель, воздействующий на основные структуры. Полученный цвет имеет розово-красный оттенок, а структуры, привлекающие эозин, называются эозинофильными.[1] Цитоплазма является примером эозинофильной структуры.
Окрашивание по Граму
Окрашивание по Граму — это метод последовательного окрашивания, разработанный для дифференциации видов бактерий. Его основная полезность заключается в определении возбудителя бактериальной инфекции путем окрашивания клеточной стенки.[2] Хотя не все бактерии имеют клеточную стенку и, следовательно, не могут быть окрашены этим методом, это все же очень полезное и часто выполняемое окрашивание. Бактериальный образец можно зафиксировать нагреванием и подвергнуть окрашиванию по Граму, выполнив следующие четыре этапа: первичное окрашивание кристаллическим фиолетовым, вторичное окрашивание грамм-йодом, обесцвечивание спиртом или ацетоном и контрастное окрашивание сафранином. Грамположительные бактерии содержат толстый слой пептидогликана, из-за чего они сохраняют фиолетовую окраску и кажутся фиолетовыми. С другой стороны, грамотрицательные бактерии имеют тонкий слой пептидогликана и больше липидов в клеточной стенке, поэтому этап обесцвечивания сильнее вымывает фиолетовый цвет, и образец выглядит розовым.[2]
Его основная полезность заключается в определении возбудителя бактериальной инфекции путем окрашивания клеточной стенки.[2] Хотя не все бактерии имеют клеточную стенку и, следовательно, не могут быть окрашены этим методом, это все же очень полезное и часто выполняемое окрашивание. Бактериальный образец можно зафиксировать нагреванием и подвергнуть окрашиванию по Граму, выполнив следующие четыре этапа: первичное окрашивание кристаллическим фиолетовым, вторичное окрашивание грамм-йодом, обесцвечивание спиртом или ацетоном и контрастное окрашивание сафранином. Грамположительные бактерии содержат толстый слой пептидогликана, из-за чего они сохраняют фиолетовую окраску и кажутся фиолетовыми. С другой стороны, грамотрицательные бактерии имеют тонкий слой пептидогликана и больше липидов в клеточной стенке, поэтому этап обесцвечивания сильнее вымывает фиолетовый цвет, и образец выглядит розовым.[2]
Краситель Гимзы
Окрашивание по Гимзе широко используется в гематологии благодаря его превосходной способности окрашивать костный мозг, плазматические клетки и тучные клетки. Он также очень популярен для выявления паразитов крови.[3] Окрашивание по Гимзе также может помочь визуализировать хромосомные аномалии с помощью «полосатости по Гимзе» или наблюдения за чередованием более темных и светлых участков нуклеотидов на хромосомах во время митоза.
Он также очень популярен для выявления паразитов крови.[3] Окрашивание по Гимзе также может помочь визуализировать хромосомные аномалии с помощью «полосатости по Гимзе» или наблюдения за чередованием более темных и светлых участков нуклеотидов на хромосомах во время митоза.
Периодическая кислотная реакция Шиффа
Окрашивание реакцией Шиффа с периодической кислотой, часто называемое окрашиванием PAS, представляет собой способ исследования структур, содержащих большое количество молекул углеводов, таких как щеточная кайма кишечника, клетки почечных канальцев, слизь и ретикулярные волокна соединительной ткани. [4] Гликоген, гликопротеин, гликолипиды и муцины окрашиваются в красный или пурпурный цвет, когда окрашивание завершено. Периодическая кислота, сильно окисленный йод, окисляет гидроксильные группы соседних молекул сахара с образованием альдегидов. После этого шага реагент Шиффа присоединяется к альдегиду и образует красно-пурпурный цвет для визуализации.
Трихром Массона
Masson’s Trichrome Stain — это краситель, который может дать многоцветный результат на ткани. Несмотря на то, что он имеет красные контрастные пятна, он популярен благодаря своей способности окрашивать волокна коллагена в синий цвет. Трихром Массона может идентифицировать сердечный фиброз, легочный фиброз, хроническое заболевание почек и мышечную дистрофию.[7]
Несмотря на то, что он имеет красные контрастные пятна, он популярен благодаря своей способности окрашивать волокна коллагена в синий цвет. Трихром Массона может идентифицировать сердечный фиброз, легочный фиброз, хроническое заболевание почек и мышечную дистрофию.[7]
Красный Конго
Конго красный — водорастворимый синий краситель, образующий красный раствор при рН 3,0–5,0. Его многочисленные ароматические кольца могут складываться вместе посредством гидрофобных взаимодействий и накапливаться в тканях. В частности, конго красный может окрашивать амилоидные волокна в красный и оранжевый цвет, что делает его полезным для изучения при амилоидозе. При просмотре в поляризованном свете под микроскопом ткани с высоким содержанием амилоида, окрашенные конго-красным, будут иметь яркое двойное лучепреломление «яблочно-зеленого цвета». PMID: [8]
Берлинская лазурь
Окрашивание берлинской лазурью полезно для определения запасов железа в организме. [7][9] Краситель работает, сначала окрашивая ткань соляной кислотой, а затем наблюдая, как ионы трехвалентного железа реагируют с образованием нерастворимого ярко-синего пигмента. Это полезно для диагностики состояний накопления железа, таких как гемохроматоз или гемосидероз, путем окрашивания ткани печени и наблюдения за накоплением железа вблизи перипортальных гепатоцитов или вдоль синусоидальной выстилки. Переизбыток запасов железа в костном мозге может сигнализировать о неэффективном эритропоэзе, например, при анемии хронического заболевания. С другой стороны, отсутствие реакции на окрашивание берлинской лазурью может указывать на низкий уровень железа, как при железодефицитной анемии.
[7][9] Краситель работает, сначала окрашивая ткань соляной кислотой, а затем наблюдая, как ионы трехвалентного железа реагируют с образованием нерастворимого ярко-синего пигмента. Это полезно для диагностики состояний накопления железа, таких как гемохроматоз или гемосидероз, путем окрашивания ткани печени и наблюдения за накоплением железа вблизи перипортальных гепатоцитов или вдоль синусоидальной выстилки. Переизбыток запасов железа в костном мозге может сигнализировать о неэффективном эритропоэзе, например, при анемии хронического заболевания. С другой стороны, отсутствие реакции на окрашивание берлинской лазурью может указывать на низкий уровень железа, как при железодефицитной анемии.
Муцикармин
Муцикармин окрашивает муцин, секрет, вырабатываемый клетками эпителия и соединительной ткани.[12] Алюминий и кармин объединяются, образуя положительно заряженный хелатирующий комплекс. Новый положительный заряд связывает муцин, окрашивает его в красный цвет и позволяет визуализировать. Это полезно для выявления потенциальных карцином и воспалительных состояний, при которых наблюдается избыточная продукция муцина.[12] В хирургии окрашивание муцикармином также может определить первичную локализацию опухоли путем окрашивания секретирующего слизь эпителия в участке, не содержащем клеток, продуцирующих муцин.[13] Муцикармин также окрашивает студенистую капсулу грибов Криптококк .[12]
Это полезно для выявления потенциальных карцином и воспалительных состояний, при которых наблюдается избыточная продукция муцина.[12] В хирургии окрашивание муцикармином также может определить первичную локализацию опухоли путем окрашивания секретирующего слизь эпителия в участке, не содержащем клеток, продуцирующих муцин.[13] Муцикармин также окрашивает студенистую капсулу грибов Криптококк .[12]
Черный Судан
Краситель Судан Черный окрашивает липидсодержащие структуры, такие как триглицериды и липопротеины, в темно-черный или коричневый цвет. быть окрашенным. Его можно использовать для диагностики атеросклероза путем окрашивания атеросклеротических бляшек и аутосомно-доминантной лейкодистрофии путем окрашивания макрофагов в белом веществе после посмертной биопсии головного мозга.
Масляно-красный O
Подобно красителю суданскому черному, Oil Red O является наиболее распространенным красителем, используемым для гидрофобных жиров или липидов, веществ, которые традиционно трудно окрашивать. Oil Red O очень полезен для визуализации атеросклеротических бляшек и накопления липидов в печени и мышцах.[7][6][14]
Oil Red O очень полезен для визуализации атеросклеротических бляшек и накопления липидов в печени и мышцах.[7][6][14]
Серебряное пятно
Окрашивание серебром представляет собой большую категорию окрашиваний, используемых для гистопатологического исследования заболеваний, связанных с аккумуляцией, в неврологии. Существует несколько методов окрашивания серебром, в том числе по Бильшовскому, Галлиасу, Бодиану и Кэмпбеллу-Свитцеру. Выбранный метод окрашивания зависит от рассматриваемого неврологического поражения, поскольку каждый метод говорит о различной чувствительности и специфичности. Как правило, эти методы связывают ионы серебра или комплексы солей с тканью-мишенью. Затем они должны быть восстановлены на месте, а последующие частицы серебра накапливаются и могут быть проанализированы.[15] Недавно было использовано фторирование, когда флуорогенный полупроводник высвобождает небольшие наночастицы размером 6 нм в отложениях серебра и создает цвета. Диапазон диаметров образующихся частиц серебра соответствует разным цветам. Например, диапазоны от 10 до 20 нм дают желтый цвет, тогда как диаметры, превышающие 100 нм, дают черный цвет.[16]
Например, диапазоны от 10 до 20 нм дают желтый цвет, тогда как диаметры, превышающие 100 нм, дают черный цвет.[16]
Окрашивание серебром хорошо известно для обнаружения бета-амилоидного белка (Aß) при болезни Альцгеймера и телец Пика при болезни Пикса. При окрашивании амилоидные бляшки становятся темнее. Они могут варьироваться от желтого до черного, в зависимости от размера или количества амилоидных бляшек.[15]
Краситель Ниссля
Окрашивание по Нисслю, также известное как окраска крезил-виолет, использует основной анилиновый краситель для изучения структуры нейронов в головном и спинном мозге. Нейропил окрашивается в голубовато-фиолетовые и зернистые пятна. Вещество Ниссля имеет большое количество рибосомной РНК, поэтому оно притягивает краситель, выглядит темно-синим и делает цитоплазму пятнистой. Преимущество использования окраски Ниссля для оценки патологии нейронов заключается в том, что она будет распознаваемо окрашивать цитоплазму нейронов, не окрашивая перикарионы других клеточных структур, таких как астроциты. [17]
[17]
Краситель Папаниколау
Окрашивание по Папаниколау, в просторечии называемое мазком Папаниколау, представляет собой метод цитологического окрашивания, наиболее известный для выявления рака шейки матки у пациенток. Клетки для окрашивания собирают из гинекологических мазков, образцов мокроты, соскобов, материалов для тонкоигольной аспирации и смывов. Мультихроматическое окрашивание включает пять красителей: гематоксилин для ядра, оранжевый G для кератина, эозин для поверхностных структур, светло-зеленый SF для цитоплазмы и коричневый бисмарк [18]. В условиях скрининга рака шейки матки берут мазок Папаниколау, полученную окраску клеток эпителия переходной зоны шейки матки подвергают анализу на предраковые и раковые процессы. Часто готовят второй слайд для иммуноокрашивания биомаркером p16INK4a для выявления дисплазии [19].]
Микроскопия световая
Световой микроскоп, также называемый оптическим микроскопом, можно использовать для просмотра живых или мертвых образцов. Увеличение ниже, чем у электронных микроскопов в 1500 раз. Метод освещения — это освещение микроскопа, а не пучок электронов.[20] Световой микроскоп используется для большинства пятен, описанных в этой статье, таких как окрашивание по Граму, окрашивание H & E и окрашивание по Гимзе.
Увеличение ниже, чем у электронных микроскопов в 1500 раз. Метод освещения — это освещение микроскопа, а не пучок электронов.[20] Световой микроскоп используется для большинства пятен, описанных в этой статье, таких как окрашивание по Граму, окрашивание H & E и окрашивание по Гимзе.
Микроскопия, электронная
Электронный микроскоп полезен для просмотра внутриклеточных компонентов, невидимых при световой микроскопии, что помогает уточнить биологию аномальных тканей и клеток. Электронная микроскопия обычно увеличивает в 100–300 раз больше, чем самое большое увеличение световой микроскопии.[20] Как правило, срезы должны быть ультратонкими, чтобы обеспечить адекватное проникновение электронов. Наиболее полезными для электронной микроскопии являются гистологические красители с солями тяжелых металлов, поскольку они создают фазовый контраст, необходимый для визуализации структур.[21] Трансмиссионные электронные микроскопы лучше подходят для исследования внутриклеточных структур, в то время как сканирующие электронные микроскопы обычно лучше подходят для изучения поверхностных структур.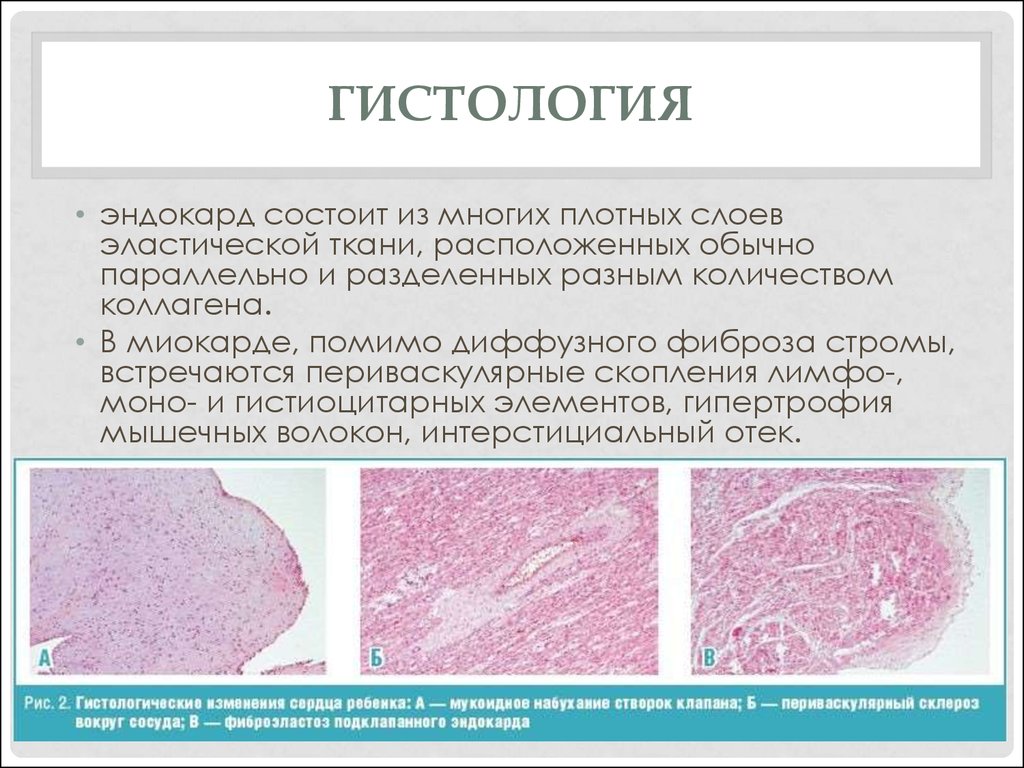
Патофизиология
Использование специальных красителей для тканей не только помогает различить структурные изменения тканей, но также предупреждает врача об изменениях функции тканей, имеющих большое значение для постановки диагноза, таких как аномальное отложение железа или аномальное отложение белка [амилоидоз , парапротеинемия и т. д., аномальное накопление гликогена или других углеводов и аномальное накопление жира. Высокоспециализированное окрашивание может обнаружить многие другие изменения в клеточной физиологии.
Клиническое значение
Гистологическое окрашивание и исследование имеют очень большое клиническое значение в медицинской диагностике и лечении практически во всех областях медицины. Гистологическое исследование является золотым стандартом диагностики многих патологических заболеваний, для которых окраска является обязательным компонентом. Гистохимический анализ образца ткани позволяет патологоанатому не только поставить диагноз, но и определить тяжесть заболевания и дать прогноз.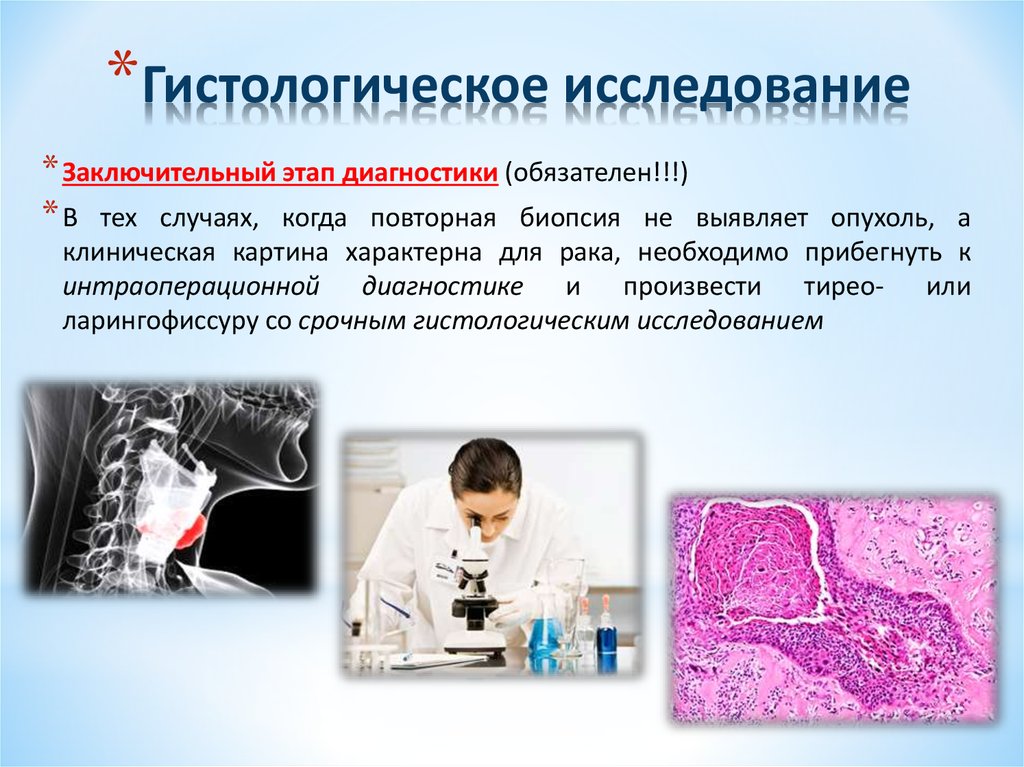
Контрольные вопросы
Получите доступ к бесплатным вопросам с несколькими вариантами ответов по этой теме.
Комментарий к этой статье.
Ссылки
- 1.
Алтуркистани Х.А., Ташканди Ф.М., Мохаммедсалех З.М. Гистологические пятна: обзор литературы и тематическое исследование. Глоб Дж. Науки о здоровье. 2015 25 июня; 8 (3): 72-9. [Бесплатная статья PMC: PMC4804027] [PubMed: 26493433]
- 2.
Brown RC, Hopps HC. Окрашивание бактерий в срезах тканей: надежный метод окрашивания по Граму. Ам Джей Клин Патол. 1973 августа; 60(2):234-40. [PubMed: 4124318]
- 3.
Долан М. Роль окраски Гимзы в цитогенетике. Биотехнологический гистохим. 2011 апрель; 86 (2): 94-7. [PubMed: 21395494]
- 4.
Аль Дрис А., Салах Халил М., Солиман М. Гистологическая и иммуногистохимическая основа влияния аминогуанидина на почечные изменения, связанные с геморрагическим шоком на крысиной модели.
 Acta Histochem Cytochem. 2017 февраль 28;50(1):11-19. [Бесплатная статья PMC: PMC5374099] [PubMed: 28386146]
Acta Histochem Cytochem. 2017 февраль 28;50(1):11-19. [Бесплатная статья PMC: PMC5374099] [PubMed: 28386146]- 5.
Грин Дж., Луи Дж., Коростинска О., Мейсон А. Современные методы анализа гликогена скелетных мышц у спортсменов – необходимость новых неинвазивных методов. Биосенсоры (Базель). 23 февраля 2017 г., 7(1) [бесплатная статья PMC: PMC5371784] [PubMed: 28241495]
- 6.
Prats C, Gomez-Cabello A, Nordby P, Andersen JL, Helge JW, Dela F, Baba O , Ploug T. Оптимизированный гистохимический метод оценки запасов гликогена и липидов в скелетных мышцах выявил две метаболически различные популяции мышечных волокон I типа. ПЛОС Один. 2013;8(10):e77774. [Бесплатная статья PMC: PMC3813758] [PubMed: 24204959]
- 7.
Вютей Т., Эррера Г., Додеро В.И. Красители и красители: от молекулярной структуры до гистологического применения. Front Biosci (Landmark Ed). 2014 01 января; 19 (1): 91-112. [PubMed: 24389174]
- 8.
Якупова Е.И., Бобылева Л.Г., Вихлянцев ИМ, Бобылев АГ. Конго красный и амилоиды: история и взаимосвязь. Отчет Biosci, 31 января 2019 г., 39(1) [бесплатная статья PMC: PMC6331669] [PubMed: 30567726]
- 9.
McGavin MD. Факторы, влияющие на видимость ткани-мишени на гистологических срезах. Вет Патол. 2014 янв;51(1):9-27. [PubMed: 24395975]
- 10.
Пармли Р.Т., Гилберт С.С., Уайт Д.А., Бартон Дж.К. Ультраструктурное усиление серебром реактивного железа с берлинской лазурью в гемопоэтических и кишечных клетках. J Гистохим Цитохим. 1988 г., апрель; 36 (4): 433–40. [PubMed: 2450121]
- 11.
Кларк П., Бриттон Л.Дж., Пауэлл Л.В. Диагностика и лечение наследственного гемохроматоза. Clin Biochem Rev. 2010 Feb;31(1):3-8. [Бесплатная статья PMC: PMC2826266] [PubMed: 20179792]
- 12.
Дапсон РВ. История, химия и способы действия кармина и родственных красителей. Биотехнологический гистохим.
 2007 г., август; 82 (4–5): 173–87. [PubMed: 18074265]
2007 г., август; 82 (4–5): 173–87. [PubMed: 18074265]- 13.
Куфе Д.В. Муцины при раке: функция, прогноз и терапия. Нат Рев Рак. 2009 г., декабрь 9(12):874-85. [Статья бесплатно PMC: PMC2951677] [PubMed: 19935676]
- 14.
Mehlem A, Hagberg CE, Muhl L, Eriksson U, Falkevall A. Визуализация нейтральных липидов с помощью масляного красного O для анализа метаболического статуса в организме и болезни. Нат Проток. 2013 Июн;8(6):1149-54. [PubMed: 23702831]
- 15.
Учихара Т. Серебряный диагноз в невропатологии: принципы, практика и пересмотренная интерпретация. Акта Нейропатол. 2007 май; 113(5):483-99. [Бесплатная статья PMC: PMC1868652] [PubMed: 17401570]
- 16.
Бруше М., Моронн М., Джин П., Вайс С., Аливисатос А.П. Полупроводниковые нанокристаллы как флуоресцентные биологические метки. Наука. 1998 г., 25 сентября; 281(5385):2013-6. [PubMed: 9748157]
- 17.
Кадар А.
 , Виттманн Г., Липозитс З., Фекете С. Усовершенствованный метод сочетания иммуноцитохимии и окрашивания по Нисслю. J Neurosci Методы. 2009 30 октября; 184 (1): 115-8. [Бесплатная статья PMC: PMC2753838] [PubMed: 19615409]
, Виттманн Г., Липозитс З., Фекете С. Усовершенствованный метод сочетания иммуноцитохимии и окрашивания по Нисслю. J Neurosci Методы. 2009 30 октября; 184 (1): 115-8. [Бесплатная статья PMC: PMC2753838] [PubMed: 19615409]- 18.
Chantziantoniou N, Donnelly AD, Mukherjee M, Boon ME, Austin RM. Зарождение и развитие метода окраски по Папаниколау. Акта Цитол. 2017;61(4-5):266-280. [PubMed: 28384641]
- 19.
Trunk MJ, Dallenbach-Hellweg G, Ridder R, Petry KU, Ikenberg H, Schneider V, von Knebel Doeberitz M. Морфологические характеристики p16INK4a-положительных клеток в образцах цитологии шейки матки. Акта Цитол. 2004 г., ноябрь-декабрь; 48(6):771-82. [В паблике: 15581161]
- 20.
Chen X, Zheng B, Liu H. Оптические и цифровые микроскопические методы визуализации и их применение в патологии. Анальный клеточный патол (Амст). 2011;34(1-2):5-18. [PMC бесплатная статья: PMC3310926] [PubMed: 21483100]
- 21.
КАРНОВСКИЙ М.Ю. Простые методы «окрашивания свинцом» при высоких значениях рН в электронной микроскопии. J Биофиз Биохим Цитол. 1961 г., декабрь; 11 (3): 729-32. [Статья бесплатно PMC: PMC2225134] [PubMed: 14454024]
Гистологическое исследование повреждения сосудов, вызванного устройствами для тромбэктомии стент-ретривер
Текст статьи
Меню статьи
- Статья
Текст - Артикул
инфо - Цитата
Инструменты - Поделиться
- Быстрое реагирование
- Артикул
Метрика - Оповещения
Ишемический инсульт
Оригинальное исследование
Гистологическое исследование повреждений сосудов, вызванных устройствами для тромбэктомии стент-ретривер
- Daisuke Arai,
- Akira Ishii,
- Hideo Chihara,
- Hiroyuki Ikeda,
- Susumu Miyamoto
- Department of Neurosurgery, Kyoto University Graduate School of Medicine, Kyoto, Japan
- Переписка с
Д-р Д.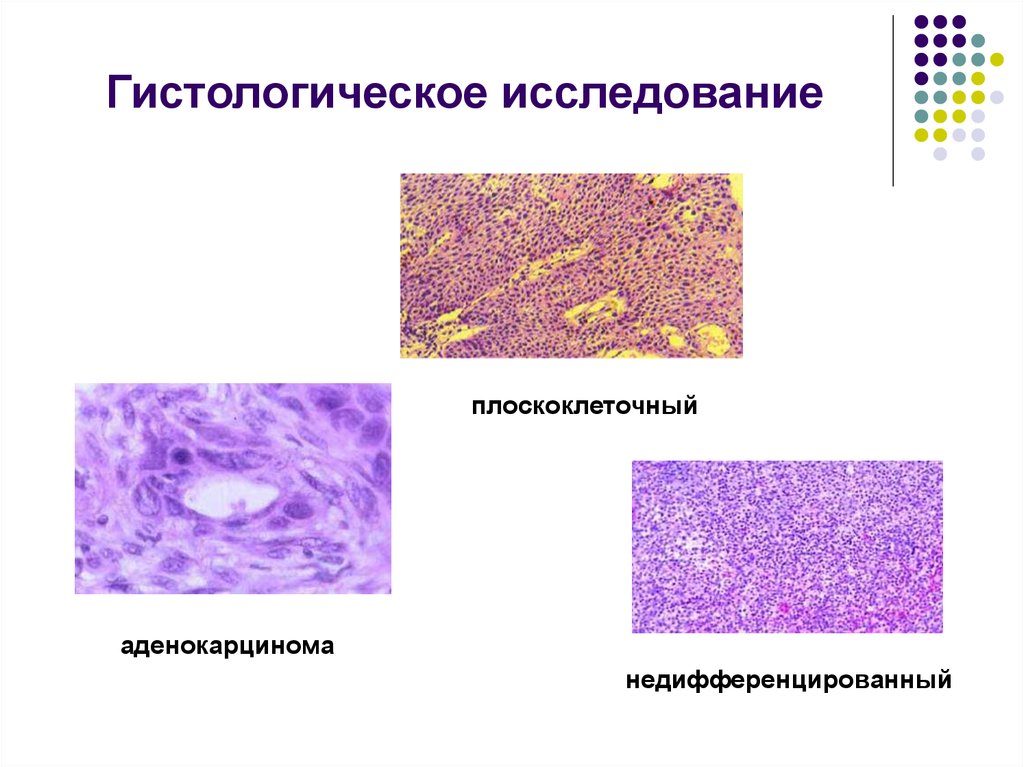 Араи, отделение нейрохирургии, Высшая школа медицины Киотского университета, 54 Shogoin Kawahara-cho Sakyo-ku, Киото 606-8507, Япония; adaisuke1981{at}gmail.com, adaisuke{at}kuhp.kyoto-u.ac.jp
Араи, отделение нейрохирургии, Высшая школа медицины Киотского университета, 54 Shogoin Kawahara-cho Sakyo-ku, Киото 606-8507, Япония; adaisuke1981{at}gmail.com, adaisuke{at}kuhp.kyoto-u.ac.jp
Резюме
Предпосылки и цели Несмотря на то, что недавно появившиеся на рынке устройства для тромбэктомии стент-ретривер продемонстрировали высокую скорость реканализации и благоприятные клинические результаты, существуют опасения по поводу риска повреждения интимы при извлечении стента в развернутом положении. В этом исследовании система восстановления потока Solitaire и ретривер Trevo использовались для гистопатологического сравнения сосудистых повреждений, вызванных устройствами для тромбэктомии стент-ретриверами.
Методы Сонные артерии кроликов использовали в экспериментах с устройствами для тромбэктомии стент-ретривер. Образцы сонных артерий брали через 1 или 2 недели после операции для гистологического исследования.
Результаты Гистологические изменения, вызванные использованием стент-ретриверных устройств для тромбэктомии, наблюдались от интимы к медиальному слою.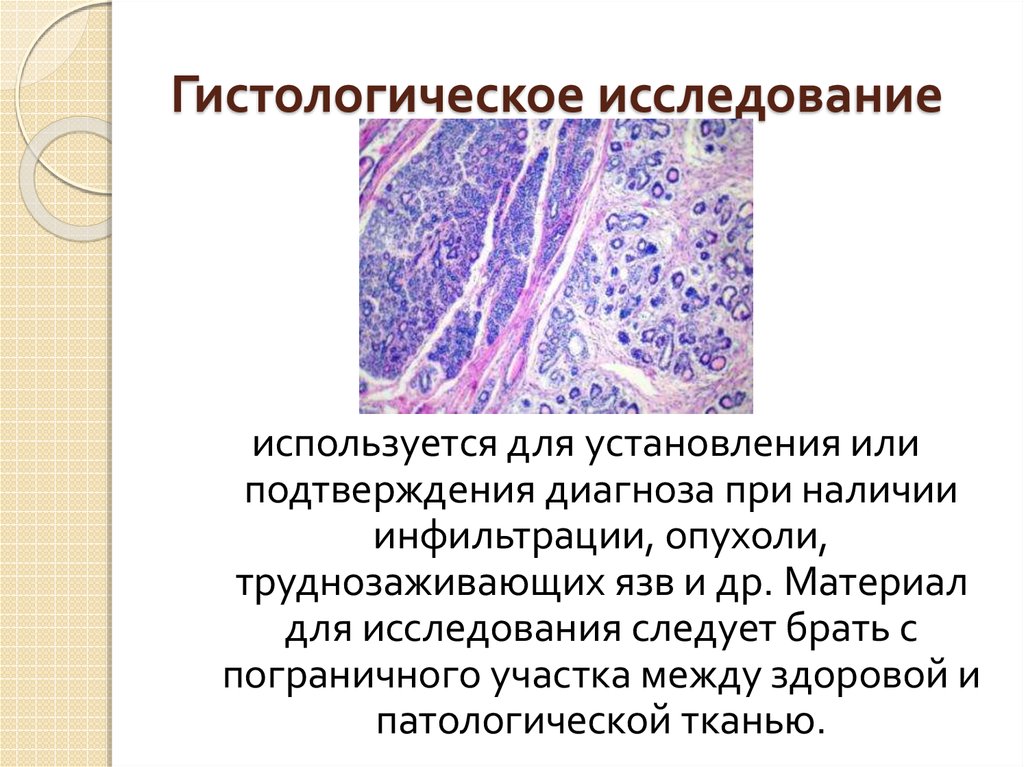 При использовании Solitaire FR 4 мм утолщение интимы и медии наблюдалось через 1 неделю после операции, а прогрессирование утолщения интимы наблюдалось через 2 недели после операции. Степень утолщения интимы, как правило, была больше при использовании Solitaire FR 6 мм, чем при использовании Solitaire FR 4 мм, но эта разница не была значимой. По сравнению с Solitaire FR 4 мм, Trevo имел значительно меньшую площадь утолщения интимы.
При использовании Solitaire FR 4 мм утолщение интимы и медии наблюдалось через 1 неделю после операции, а прогрессирование утолщения интимы наблюдалось через 2 недели после операции. Степень утолщения интимы, как правило, была больше при использовании Solitaire FR 6 мм, чем при использовании Solitaire FR 4 мм, но эта разница не была значимой. По сравнению с Solitaire FR 4 мм, Trevo имел значительно меньшую площадь утолщения интимы.
Выводы Несмотря на некоторые различия между устройствами, результаты этого исследования показывают, что устройства для тромбэктомии стент-ретривер вызывают повреждение сосудов, которое распространяется на медиальный слой.
- Вмешательство
- Необходимость
- Тромбэктомия
http://dx.doi.org/10.1136/neurintsurg-2015-011968
СТАТИСТИКА. всю эту статью, пожалуйста, используйте приведенную ниже ссылку, которая приведет вас к сервису RightsLink Центра защиты авторских прав. Вы сможете получить быструю цену и мгновенное разрешение на повторное использование контента различными способами.

