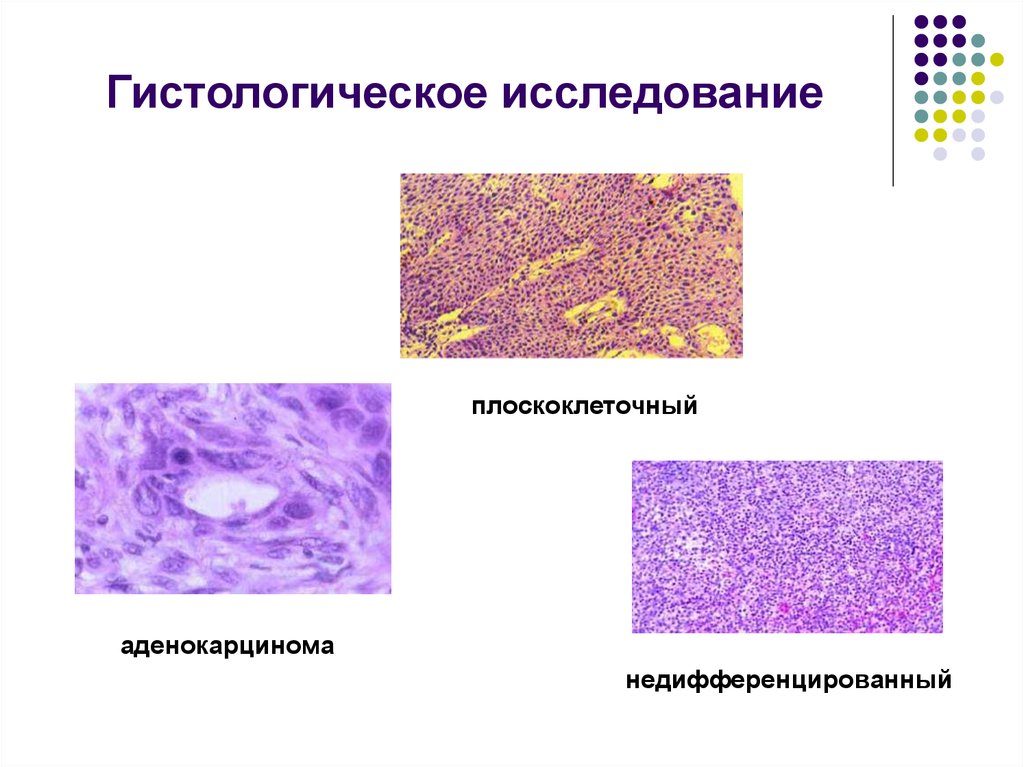
Гистологическое исследование это что: Гистологические исследования в медицинском центре Гарантия
Эндоскопия — Гистологическое исследование
Гистологическое исследование в современной клинике
Гистологическое исследование – это исследование крошечного объема ткани внутренних органов. Предварительно происходит забор материала – частички органа. Чаще всего гистологическое исследование материала проводят для подтверждения у больного диагноза онкологии, и исследуют именно часть опухоли на ее злокачественность. В случае диагноза раковой опухоли, гистологическое исследование является обязательным, как самый точный метод диагностики, и как метод, который дает результат на самых ранних стадиях заболевания.
В Харькове лучше всего сделать гистологическое исследование в медицинском центре Докарт – тысячи Харьковчан выбрали его за надежность и добросовестность.
Техника гистологического исследования
Техника гистологического исследования состоит из нескольких этапов:
- Забор материала
- Фиксация образца. Делается, чтобы ткань органа не «умерла».
 Это могут быть различные растворы или кислоты, состоящие из одного или нескольких компонентов. «Купание» частички ткани может происходить несколько часов, а может и несколько суток. Это зависит как от фиксатора, так и от образца материала.
Это могут быть различные растворы или кислоты, состоящие из одного или нескольких компонентов. «Купание» частички ткани может происходить несколько часов, а может и несколько суток. Это зависит как от фиксатора, так и от образца материала. - Образец ткани промывает в воде, после этого обезвоживается. Это делается для последующей заливки парафином, потому что он в воде не растворяется.
- Взятый материал заливается жидким парафином, затем проводится ряд процедур для его полного застывания. Далее ткань, окруженную парафином, формируют в блоки.
- Делаются ультратонкие срезы специальным ножом – микротомом, блоки разрезаются на платины.
- Из пластин удаляется парафин, и они окрашиваются, для четких очертаний клеток.
- Опять промывают и обезвоживают. И уже после длительной предварительной подготовки этого кладут на стекло микроскопа, смазанное бальзамом. Изучают строение ткани, и врач выносит заключение.
В Харькове в лаборатории Докарт, при проведении гистологического исследования, на всех его этапах соблюдаются все мировые нормы и стандарты.
Методы гистологических исследований
Существует два метода гистологического исследования – стандартный и срочный. Стандартный метод заключается в прохождении всей цепочки длительной подготовки материала. Срочный метод применяется, когда результат нужно узнать в течение часа, и при необходимости немедленно сделать операцию. В таком случае материал замораживается, производятся тончайшие разрезы и изучаются под микроскопом. Также есть много разных методов гистологических исследований, которые классифицируются по модели микроскопа, раствора – фиксатора, способу окрашивания и самой краске.
В медицинском центре Докарт в Харькове гистологическое исследование проводят двумя этими методами. Также в Докарт вам окажут экстренную помощь, если лечение потребуется незамедлительно по результатам исследования.
Гистологического исследование биопсийного материала
Наиболее распространенный метод забора образцов материала для гистологического исследования – это биопсия. Взятие материала производится специальной и иглой, которая вводится через кожу, всасывает ткань в шприц, и затем образец отправляется на анализ. Биопсия позволяет получить образец ткани без хирургического вмешательства.
Взятие материала производится специальной и иглой, которая вводится через кожу, всасывает ткань в шприц, и затем образец отправляется на анализ. Биопсия позволяет получить образец ткани без хирургического вмешательства.
Гистологическое исследование печени – чаще всего именно эту процедуру проходят пациенты Докарт. И в настоящее время это не удивительно. Сегодня печень страдает больше других органов нашего организма, ведь она принимает на себя самый сильный удар. На ее патологии влияют такие обыденный для нас вещи, как алкоголь, жирная вредная пища, антибиотики, противозачаточные и другие гормональные препараты.
Стоимость гистологического исследования в центре Докарт в Харькове указана на нашем сайте. Сверхточная диагностика рака – это гистологическое исследование, цена на него не может быть настолько высокой, чтоб рисковать своим здоровьем. Телефон медицинского центра Докарт указан в разделе контакты, как и наш адрес.
Гистология: что это за анализ?
Взятие биологического материала и его тщательный гистологический анализ очень значимы во многих отраслях медицины.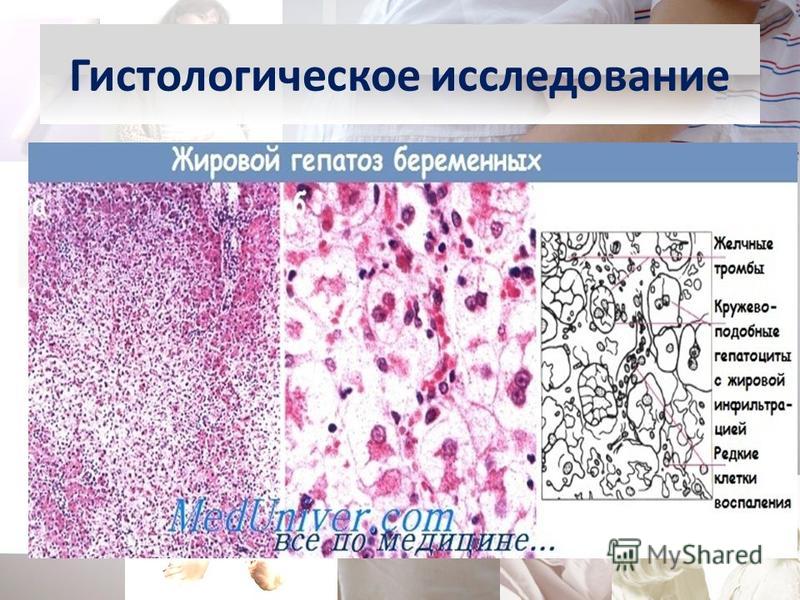 С целью выявления патологии может назначаться, например, гистология родинки, шейки матки, органов пищеварительного тракта, эндокринной системы и так далее. На наши вопросы о гистологии ответил врач — онколог-маммолог «Клиники Эксперт» Воронеж Сергей Викторович Ежов.
С целью выявления патологии может назначаться, например, гистология родинки, шейки матки, органов пищеварительного тракта, эндокринной системы и так далее. На наши вопросы о гистологии ответил врач — онколог-маммолог «Клиники Эксперт» Воронеж Сергей Викторович Ежов.
Взятие биологического материала и его тщательный гистологический анализ очень значимы во многих отраслях медицины. С целью выявления патологии может назначаться, например, гистология родинки, шейки матки, органов пищеварительного тракта, эндокринной системы и так далее. На наши вопросы о гистологии ответил врач — онколог-маммолог «Клиники Эксперт» Воронеж Сергей Викторович Ежов.
— Сергей Викторович, расскажите, что это за анализ — гистология? В чём его суть?
— Гистологический анализ — это высокоточный метод исследования, позволяющий определить патологическое отклонение в строении ткани. Данный метод используется во многих областях медицины, но его основная суть заключается в том, что с помощью этого метода можно диагностировать наличие злокачественных образований, определить их структуру, а также стадию патологического процесса.
— Что может являться биоматериалом для гистологического исследования?
— Биоматериалом может служить та или иная подозрительная ткань (кожа, слизистая оболочка, мышца, кость), взятая при помощи биопсии, либо препарат, полученный в результате хирургического вмешательства.
— Когда назначается гистология?
— Как я уже говорил, гистологическое исследование может применяться во многих направлениях медицины, но особенная его ценность заключается в определении природы и характера изменений в ткани при малейшем подозрении на онкологический процесс. Также это исследование проводят перед назначением противоопухолевой терапии для разработки плана лечения и во время лечения с целью контроля его эффективности.
— Что показывает гистология?
— Гистологический анализ даёт возможность обнаружить воспалительные процессы в ткани, установить природу того или иного новообразования (т. е. доброкачественное оно или злокачественное), определить уровень злокачественности, а также выявить локализацию первичного опухолевого очага. Надо понимать, что расшифровкой результатов гистологического исследования должен заниматься только специалист. Я бы не рекомендовал пациентам делать это самостоятельно.
Надо понимать, что расшифровкой результатов гистологического исследования должен заниматься только специалист. Я бы не рекомендовал пациентам делать это самостоятельно.
Биопсия
— Как сдать анализ на гистологию? Нужна ли специальная подготовка?
— Перед тем, как провести гистологическое исследование, необходимо выполнить биопсию и отправить полученный при этом материал (биоптат) на анализ. Как таковой подготовки биопсия не требует, существует лишь ряд ограничений и рекомендаций, которых нужно придерживаться пациенту накануне и во время забора биоптата. Важно поставить врача в известность обо всех принимаемых препаратах. Накануне исследования необходимо отказаться от лекарственных средств, влияющих на свёртываемость крови (по согласованию с доктором, назначившим их), а также сообщить врачу, который будет выполнять биопсию, о наличии аллергии. Нежелательно проведение данной манипуляции у женщин в дни менструации. Противопоказано употребление алкоголя.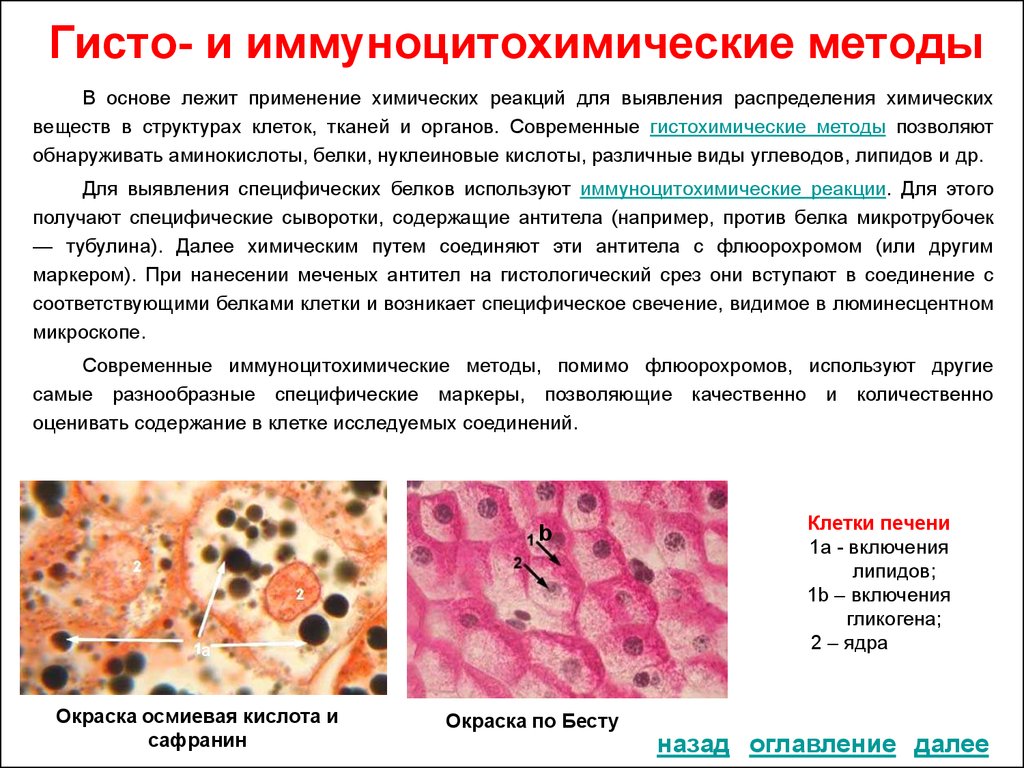
— Как проводится гистология?
— Полученный при биопсии материал помещается в формалин и направляется на гистологическое исследование в патоморфологический центр. Там материал заливается парафином (чаще всего). После остывания, отвердевания делаются тонкие срезы, на которые наносятся различные реактивы для детального изучения ткани под микроскопом врачом-патоморфологом.
— Сколько делается гистологический анализ?
— Если результат очевидный и не вызывает сомнений, выдача заключения производится в среднем через 7-10 дней. При возникающих сомнениях, подозрениях в точности поставленного диагноза препарат могут изучать дольше.
— Бывают ли ошибки в результатах гистологии?
— К сожалению, особенно в небольших населённых пунктах, могут возникать проблемы с качеством проведения гистологического анализа. Это связано с разными причинами (отсутствие врачей, оборудования, расходных материалов). Но в случае появления сомнений в правильности гистологического заключения обычно назначается пересмотр готовых препаратов в другом патоморфологическом центре.
Хотите больше узнать о других видах анализов? Читайте статьи в нашей рубрике
Записаться на приём к онкологу можно здесь
ВНИМАНИЕ: услуга доступна не во всех городах
Беседовала Марина Воловик
Редакция рекомендует:
Предрак: бояться или не обращать внимания?
У страха глаза велики. Так ли опасна миома?
Рак груди — не приговор!
Для справки:
Ежов Сергей Викторович
В 2007 году окончил лечебный факультет Курского государственного медицинского университета.
2007 — 2009 гг. — клиническая ординатура по специальности «Онкология» в Медицинском радиологическом научном центре РАМН г. Обнинск (сегодня — МРНЦ им. А.Ф. Цыба — филиал ФГБУ «НМИЦ радиологии» Минздрава России).
В настоящее время — врач — онколог-маммолог в «Клинике Эксперт» Воронеж.
Приём ведёт по адресу: ул. Пушкинская, 11.
Эндоскопия — гистологическое исследование
Гистологическое исследование в современной клинике
Гистологическое исследование — это исследование небольшого объема ткани внутренних органов. Предварительно берется материал, представляющий собой частички органа.
Предварительно берется материал, представляющий собой частички органа.
Чаще всего проводится гистологическое исследование материала для подтверждения диагноза онкологии у пациента, причем исследуется именно та часть опухоли
за его злокачественность. В случае онкологического диагноза обязательно гистологическое исследование, как наиболее точный метод диагностики и как метод, дающий результат в
самые ранние стадии болезни.
В Харькове гистологическое исследование лучше всего делать в медицинском центре ОК Центр, так как тысячи харьковчан выбрали его за его надежность и
честность.
Методика гистологического исследования
Методика гистологического исследования состоит из нескольких этапов:
- Забор материала
- Фиксация образца, которая делается для того, чтобы ткань органа не «умерла». Это могут быть различные растворы или кислоты, состоящие из одного или нескольких компонентов. «купальная» ткань
частицы могут возникать в течение нескольких часов, а может быть и нескольких дней. Это зависит как от фиксатора, так и от образца материала.
Это зависит как от фиксатора, так и от образца материала. - Образец ткани промывают водой, затем обезвоживают. Это делается для последующей заливки парафином, потому что он не растворяется в воде.
- Взятый материал заливают жидким парафином, затем проводят ряд процедур до его полного затвердевания. Далее ткань, окруженная парафином, формируется в
блоки. - Ультратонкие срезы делают специальным ножом, называемым микротомом, блоки разрезают на пластины.
- С планшетов удаляют парафин и их окрашивают для получения четкого контура клеток.
- Их еще раз промывают и обезвоживают. И после длительной предварительной подготовки их кладут на стекло микроскопа, смазанное бальзамом. Структура ткани
изучается и врач делает заключение.
В Харькове, в лаборатории Центра ОК, при проведении гистологического исследования на всех его этапах соблюдаются все мировые нормы и стандарты.
Методы гистологических исследований
Существует два метода гистологического исследования: стандартный и срочный. Стандартный метод – пройти всю цепочку длительной подготовки материала. срочно
Стандартный метод – пройти всю цепочку длительной подготовки материала. срочно
метод применяют, когда результат нужно узнать в течение часа, а при необходимости сразу же провести операцию. В этом случае материал замораживается; самые тонкие порезы
изготавливают и исследуют под микроскопом. Существует также множество различных методов гистологических исследований, которые классифицируются по модели микроскопа, раствора
или закрепитель, способ окрашивания и сама краска.
В Центре ОК в Харькове гистологическое исследование проводится этими двумя методами. Также в OK Center вам будет предоставлен
неотложная помощь, если лечение требуется немедленно по результатам обследования.
Гистологическое исследование биопсийного материала
Наиболее распространенным методом забора материала для гистологического исследования является биопсия. Материал берется специальной иглой, которая вводится через кожу, отсасывает
ткани в шприц, после чего образец отправляется на анализ. Биопсия позволяет получить образец ткани без хирургического вмешательства.
Биопсия позволяет получить образец ткани без хирургического вмешательства.
Гистологическое исследование печени – наиболее частая процедура, которую пациенты проходят в Центре ОК. И это неудивительно в настоящее время. Сегодня печень
страдает больше, чем другие органы нашего тела, потому что принимает на себя самые сильные удары. На его патологию влияют такие обыденные вещи, как алкоголь, жирная нездоровая пища, антибиотики,
противозачаточные и другие гормональные препараты.
Стоимость гистологического исследования в ОК Центре в Харькове указана на нашем сайте. Сверхточная диагностика рака – это гистологическое исследование,
цена на него не может быть настолько высока, чтобы подвергать риску ваше здоровье. Телефон ОК Центра указан в
раздел контакты, а также наш адрес.
Анализ гистопатологических изображений: обзор
1. Мендес А.Дж., Таосес П.Г., Ладо М.Дж., Соуто М., Видал Дж.Дж. Компьютерная диагностика: автоматическое обнаружение злокачественных образований на оцифрованных маммограммах. мед. физ. 1998 июнь; 25: 957–64. [PubMed] [Google Scholar]
мед. физ. 1998 июнь; 25: 957–64. [PubMed] [Google Scholar]
2. Tang J, Rangayyan R, Xu J, El Naqa I, Yang Y. Компьютерное обнаружение и диагностика рака молочной железы с помощью маммографии: последние достижения. IEEE Trans Inf Technol Biomed. 2009 20 января; [PubMed] [Академия Google]
3. Рубин Р., Страйер Д., Рубин Э., Макдональд Дж. Патология Рубина: клинико-патологические основы медицины. Липпинкотт Уильямс и Уилкинс; 2007. [Google Scholar]
4. Weind KL, Maier CF, Rutt BK, Moussa M. Инвазивные карциномы и фиброаденомы молочной железы: сравнение распределения микрососудов – последствия для методов визуализации. Радиология. 1998 г., август; 208: 477–83. [PubMed] [Google Scholar]
5. Bartels PH, Thompson D, Bibbo M, Weber JE. Байесовские сети доверия в количественной гистопатологии. Анальный Quant Cytol Histol. 1992 декабря; 14: 459–73. [PubMed] [Google Scholar]
6. Hamilton PW, Anderson N, Bartels PH, Thompson D. Поддержка экспертной системы с использованием байесовских сетей доверия в диагностике тонкоигольной аспирационной биопсии молочной железы. Джей Клин Патол. 1994 г., апрель; 47: 329–36. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Джей Клин Патол. 1994 г., апрель; 47: 329–36. [Бесплатная статья PMC] [PubMed] [Google Scholar]
7. Allsbrook WC, Jr., Mangold KA, Johnson MH, Lane RB, Lane CG, Epstein JI. Межнаблюдательная воспроизводимость оценки Глисона карциномы предстательной железы: общий патологоанатом. Хум Патол. 2001 янв.; 32:81–88. [PubMed] [Академия Google]
8. Кинг К.Р., Лонг Дж.П. Ошибки классификации биопсии простаты: проблема отбора проб? Инт Джей Рак. 2000 г., 20 декабря; 90: 326–30. [PubMed] [Google Scholar]
9. Джаван Б., Кадески К., Клопух Б., Марбергер М., Рерборн К.Г. Шкала Глисона при биопсии предстательной железы, полученная с помощью биопсийных игл 18-го калибра, плохо предсказывает оценку Глисона в образцах, полученных при радикальной простатэктомии. Евр Урол. 1998; 33: 261–70. [PubMed] [Google Scholar]
10. Ruijter E, van Leenders G, Miller G, Debruyne F, van de Kaa C. Ошибки гистологической классификации образцов биопсии предстательной железы: частота и предрасполагающие факторы. Джей Патол. 2000 окт; 192: 229–33. [PubMed] [Google Scholar]
Джей Патол. 2000 окт; 192: 229–33. [PubMed] [Google Scholar]
11. Egevad L, Allsbrook WC, Jr., Epstein JI. Текущая практика оценки Глисона среди патологов мочеполовой системы. Хум Патол. 2005 г., янв.; 36: 5–9. [PubMed] [Google Scholar]
12. Ladekarl M. Объективная оценка злокачественности: обзор, подчеркивающий беспристрастную стереологию, применяемую к опухолям молочной железы. Дополнение АПМИС. 1998; 79:1–34. [PubMed] [Google Scholar]
13. Daniel MG, Luthringer J. Gleason Grade Migration: Изменения в степени рака простаты в современную эпоху. 9.3. Отделы патологии и медицины; Cedars-Sinai, Лос-Анджелес: 2001. Перепечатано из PCRI Insights. [Google Scholar]
14. Стами Ф. С. Ф. Томас А., Макнил Джон Э., Редвин Элиз А., Уиттемор Элис С., Шмид Ханс-Питер. Локализованный рак простаты. Отношение объема опухоли к клиническому значению для лечения рака предстательной железы. Рак. 1993; 71: 933–938. [PubMed] [Google Scholar]
15. Giger ML, Chan HP, Boone J. Юбилейная статья: История и статус CAD и количественного анализа изображений: роль медицинской физики и AAPM. мед. физ. 2008 дек;35:5799–820. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Юбилейная статья: История и статус CAD и количественного анализа изображений: роль медицинской физики и AAPM. мед. физ. 2008 дек;35:5799–820. [Бесплатная статья PMC] [PubMed] [Google Scholar]
16. Haygood TM, Whitman GJ, Atkinson EN, Nikolova RG, Sandoval SY, Dempsey PJ. Результаты опроса по цифровой скрининговой маммографии: распространенность, эффективность и использование вспомогательных диагностических средств. J Am Coll Radiol. 2008 г., апрель; 5: 585–92. [PubMed] [Google Scholar]
17. Шульц-Вендтланд Р., Герман К.П., Вакер Т., Баутц В. [Текущая ситуация и будущие перспективы цифровой маммографии] Radiologe. 2008 г., апрель; 48: 324–34. [PubMed] [Академия Google]
18. Азари А., Никзад С. Компьютерная имплантология: история и потенциальные результаты – обзор. Int J Med Robot. 2008 г., июнь; 4: 95–104. [PubMed] [Google Scholar]
19. Sardanelli F, Giuseppetti GM, Canavese G, Cataliotti L, Corcione S, Cossu E, Federico M, Marotti L, Martincich L, Panizza P, Podo F, Rosselli Del Turco M, Zuiani С, Альфано С, Баццокки М, Белли П, Бьянки С, Чилотти А, Калабрезе М, Карбонаро Л, Кортези Л, Ди Маджио С, Дель Маскио А, Эссериду А, Фаусто А, Дженнаро М, Джирометти Р, Иенци Р, Луини А. , Манукян С., Морассатт С., Морроне Д., Нори Дж., Орлаккио А., Пане Ф., Панзарола П., Понцоне Р., Симонетти Г., Торричелли П., Валери Г. Показания к магнитно-резонансной томографии груди. Консенсусный документ «Attualita in senologia», Флоренция, 2007 г. Radiol Med. 2008 декабрь; 113: 1085–1095. [PubMed] [Google Scholar]
, Манукян С., Морассатт С., Морроне Д., Нори Дж., Орлаккио А., Пане Ф., Панзарола П., Понцоне Р., Симонетти Г., Торричелли П., Валери Г. Показания к магнитно-резонансной томографии груди. Консенсусный документ «Attualita in senologia», Флоренция, 2007 г. Radiol Med. 2008 декабрь; 113: 1085–1095. [PubMed] [Google Scholar]
20. Дои К. Компьютерная диагностика в медицинской визуализации: исторический обзор, текущее состояние и потенциал в будущем. Comput Med Imaging Graph. 2007 г., июнь-июль; 31: 198–211. [Бесплатная статья PMC] [PubMed] [Google Scholar]
21. Sakka E, Prentza A, Koutsouris D. Алгоритмы классификации микрокальцификации на маммограммах (обзор) Oncol Rep. 2006;15:1049–55. Спец. номер [PubMed] [Google Scholar]
22. Zhu LR, Zhang Y, Wang XY, Liao QP. [Оценка магнитно-резонансной томографии в предоперационной стадии рака эндометрия] Пекин Да Сюэ Сюэ Бао. 2006 18 июня; 38:249–51. [PubMed] [Google Scholar]
23. Roque AC, Andre TC. Маммография и компьютеризированные системы принятия решений: обзор. Энн Н.Ю. Академия наук. 2002 г., декабрь; 980: 83–94. [PubMed] [Google Scholar]
Энн Н.Ю. Академия наук. 2002 г., декабрь; 980: 83–94. [PubMed] [Google Scholar]
24. Фокс Х. Подходит ли морфология H&E к концу? Британский медицинский журнал. 2000;53:38. [Бесплатная статья PMC] [PubMed] [Google Scholar]
25. Camp R, Chung G, Rimm D. Автоматизированная субклеточная локализация и количественная оценка экспрессии белков в тканевых микроматрицах. Природная медицина. 2002; 8: 1323–1328. [PubMed] [Академия Google]
26. Кан А., Белло М., Тао Х., Гердес М., Суд А., Монтальто М., Гинти Ф. Анализ микроскопических изображений для медико-биологических исследований. Артек Хаус; 2008. Методы клеточного количественного определения биомаркеров рака. [Google Scholar]
27. Ginty F, Adak S, Can A, Gerdes M, Larsen M, Cline H, Filkins R, Pang Z, Li Q, Montalto M. Относительное распределение мембранных и цитоплазматических Met является прогностическим индикатором при раке толстой кишки I и II стадии. Клинические исследования рака. 2008;14:3814. [PubMed] [Академия Google]
28. Прайс Дж., Гудакр А., Хан К., Ходжсон Л., Хантер Э., Краевски С., Мерфи Р., Рабинович А., Рид Дж., Хейнен С. Достижения в области молекулярной маркировки, высокопроизводительной визуализации и машинного интеллекта предвещают мощную функциональную клеточную биохимию инструменты. Журнал клеточной биохимии. 2002; 87: 194–210. [PubMed] [Google Scholar]
Прайс Дж., Гудакр А., Хан К., Ходжсон Л., Хантер Э., Краевски С., Мерфи Р., Рабинович А., Рид Дж., Хейнен С. Достижения в области молекулярной маркировки, высокопроизводительной визуализации и машинного интеллекта предвещают мощную функциональную клеточную биохимию инструменты. Журнал клеточной биохимии. 2002; 87: 194–210. [PubMed] [Google Scholar]
29. Can A, Bello M, Cline HE, Tao X, Ginty F, Sood A, Gerdes M, Montalto M. Мультимодальная визуализация гистологических срезов тканей. Биомедицинская визуализация: от нано к макро, 2008 г. ISBI 2008; 5-й Международный симпозиум IEEE, 2008 г. стр. 288–29.1. [Google Scholar]
30. Шуберт В., Боннеко Б., Поммер А., Филипсен Л., Бокельманн Р., Малых Ю., Голлник Х., Фриденбергер М., Боде М., Дресс А. Анализ топологии и функции протеома с помощью автоматизированной многомерной флуоресцентной микроскопии. . Природная биотехнология. 2006; 24:1270–1278. [PubMed] [Google Scholar]
31. Ньюберг Дж., Мерфи Р. Структура автоматизированного анализа субклеточных паттернов в изображениях атласа белков человека. Дж. Протеом Рез. 2008;7:2300–2308. [PubMed] [Академия Google]
Дж. Протеом Рез. 2008;7:2300–2308. [PubMed] [Академия Google]
32. Рабинович А., Агарвал С., Ларис С., Прайс Дж., Белонги С. Неконтролируемое цветовое разложение гистологически окрашенных образцов ткани. Достижения в области нейронных систем обработки информации. 16: 667–674. [Google Scholar]
33. Fernandez D, Bhargava R, Hewitt S, Levin I. Инфракрасная спектроскопия для гистопатологического распознавания. Природная биотехнология. 2005; 23: 469–474. [PubMed] [Google Scholar]
34. Блаут Э., Филдс М. Об инфракрасных спектрах нуклеиновых кислот и некоторых их компонентов. Наука. 1948;107:252–252. [PubMed] [Google Scholar]
35. Blout ER, Mellors RC. Инфракрасные спектры тканей. Наука. 1949; 110: 137–138. [PubMed] [Google Scholar]
36. Woernley D. Кривые инфракрасного поглощения для нормальных и неопластических тканей и родственных биологических веществ. Исследования рака. 1952; 12:516. [PubMed] [Google Scholar]
37. Холлингворт В., Медина Л., Ленкински Р. , Шибата Д., Бернал Б., Зураковски Д., Комсток Б., Ярвик Дж. Надежность интеррейтера при оценке качества исследований диагностической точности с использованием предварительной оценки QUADAS ToolA . Академическая радиология. 2006; 13:803–810. [PubMed] [Академия Google] 91$H МР-спектроскопия опухолей и образований головного мозга. ЯМР Биомед. 2003; 16: 123–131. [PubMed] [Google Scholar]
, Шибата Д., Бернал Б., Зураковски Д., Комсток Б., Ярвик Дж. Надежность интеррейтера при оценке качества исследований диагностической точности с использованием предварительной оценки QUADAS ToolA . Академическая радиология. 2006; 13:803–810. [PubMed] [Академия Google] 91$H МР-спектроскопия опухолей и образований головного мозга. ЯМР Биомед. 2003; 16: 123–131. [PubMed] [Google Scholar]
39. McIntosh LM, Mansfield JR, Crowson AN, Mantsch HH, Jackson M. Анализ и интерпретация инфракрасных микроскопических карт: визуализация и классификация компонентов кожи с помощью цифрового окрашивания и многомерного анализа. Биоспектроскопия. 1999; 5: 165–269. [Google Scholar]
40. Макинтош Л., Саммерс Р., Джексон М., Манч Х., Мэнсфилд Дж., Хоулетт М., Кроусон А., Тул Дж. На пути к неинвазивному скринингу кожных поражений с помощью спектроскопии в ближнем инфракрасном диапазоне. Журнал исследовательской дерматологии. 2001; 116: 175–181. [PubMed] [Академия Google]
41. Frank C, Redd D, Gansler T, McCreery R. Характеристика образцов биопсии груди человека с помощью рамановской спектроскопии в ближней ИК области. Аналитическая химия. 1994;66:319–326. [PubMed] [Google Scholar]
Характеристика образцов биопсии груди человека с помощью рамановской спектроскопии в ближней ИК области. Аналитическая химия. 1994;66:319–326. [PubMed] [Google Scholar]
42. Huang Z, McWilliams A, Lui H, McLean D, Lam S, Zeng H. Рамановская спектроскопия в ближней инфракрасной области для оптической диагностики рака легких. Междунар. Дж. Рак. 2003; 107:1047–1052. [PubMed] [Google Scholar]
43. Чоудари М., Кумар К., Куриен Дж., Мэтью С., Кришна С. Различение нормальных, доброкачественных и злокачественных тканей молочной железы с помощью рамановской спектроскопии. Биополимеры. 2006; 83: 556–569.. [PubMed] [Google Scholar]
44. Robichaux-Viehoever A, Kanter E, Shappell H, Billheimer D, Jones H, III, Mahadevan-Jansen A. Характеристика рамановских спектров, измеренных in vivo, для обнаружения дисплазии шейки матки. Прикладная спектроскопия. 2007; 61: 986–993. [PubMed] [Google Scholar]
45. Wang T, Triadafilopoulos G, Crawford J, Dixon L, Bhandari T, Sahbaie P, Friedland S, Soetikno R, Contag C. Обнаружение эндогенных биомолекул в пищеводе Барретта с помощью инфракрасной спектроскопии с преобразованием Фурье. . Труды Национальной академии наук. 2007; 104: 158–64. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Обнаружение эндогенных биомолекул в пищеводе Барретта с помощью инфракрасной спектроскопии с преобразованием Фурье. . Труды Национальной академии наук. 2007; 104: 158–64. [Бесплатная статья PMC] [PubMed] [Google Scholar]
46. Oliveira A, Bitar R, Silveira L, Jr, Zangaro R, Martin A. Рамановская спектроскопия в ближней инфракрасной области для диагностики карциномы полости рта. Фотомедицина и лазеротерапия. 2006; 24: 348–353. [PubMed] [Google Scholar]
47. Левенсон Р. Перспектива спектральной визуализации цитомики. Цитометрия, часть A. 2006; 69A: 592–600. [PubMed] [Google Scholar]
48. Раджпут К., Раджпут Н. Труды. 2004. Гиперспектральная классификация клеток ткани толстой кишки. [Google Scholar]
49. Вульф Ф., Маджиони М., Дэвис Г., Уорнер Ф., Койфман Р., Цукер С. Гиперспектральное микроскопическое различение биопсии нормальной и раковой толстой кишки. 2007.
50. Boucheron L, Bi Z, Harvey N, Manjunath B, Rimm D. Использование мультиспектральной визуализации для ядерной классификации рутинных клинических гистопатологических изображений. Клеточная биология BMC. 2007;8:S8. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Клеточная биология BMC. 2007;8:S8. [Бесплатная статья PMC] [PubMed] [Google Scholar]
51. Масуд К., Раджпут Н. Классификация изображений гиперспектральной биопсии толстой кишки: достаточно ли двумерного пространственного анализа? Анналы БМВА. 2008 [Google Scholar]
52. Stadlbauer A, Gruber S, Nimsky C, Fahlbusch R, Hammen T, Buslei R, Tomandl B, Moser E, Ganslandt O. Предоперационная оценка глиом с использованием количественного определения метаболитов с высоким пространственным разрешением. Протонная МР-спектроскопия. Радиология. 2006 1 марта 238:958–969. [PubMed] [Google Scholar]
53. Тивари П., Мадабхуши А., Розен М. Труды. 2007. Иерархическая неконтролируемая схема спектральной кластеризации для обнаружения рака предстательной железы с помощью магнитно-резонансной спектроскопии (МРС) с. 278. [Бесплатная статья PMC] [PubMed] [Google Scholar]
54. Ян Л., Меер П., Форан Д. Неконтролируемая сегментация на основе надежной оценки и моделей активного контура цвета. IEEE Transactions по информационным технологиям в биомедицине. 2005; 9: 475–486. [PubMed] [Академия Google]
IEEE Transactions по информационным технологиям в биомедицине. 2005; 9: 475–486. [PubMed] [Академия Google]
55. Narasimha-Iyer H, Can A, Roysam B, Stewart V, Tanenbaum H, Majerovics A, Singh H. Надежное обнаружение и классификация продольных изменений в цветных изображениях глазного дна сетчатки для мониторинга диабетической ретинопатии. Биомедицинская инженерия, транзакции IEEE. 2006; 53:1084–1098. [PubMed] [Google Scholar]
56. Bello M, Can A, Tao X. Точная регистрация и обнаружение сбоев в изображениях микрочипов тканей. Биомедицинская визуализация: от нано к макро, 2008 г. ISBI 2008; 5-й Международный симпозиум IEEE, 2008 г. стр. 368–371. [Академия Google]
57. Глисон Д.Ф. Гистологическая классификация рака предстательной железы: перспектива. Хум Патол. 1992 март; 23: 273–9. [PubMed] [Google Scholar]
58. Alexe G, Dalgin GS, Scanfeld D, Tamayo P, Mesirov JP, DeLisi C, Harris L, Barnard N, Martel M, Levine AJ, Ganesan S, Bhanot G. Высокая экспрессия Ассоциированные с лимфоцитами гены при HER2+ раке молочной железы без лимфоцитов коррелируют с более низкой частотой рецидивов.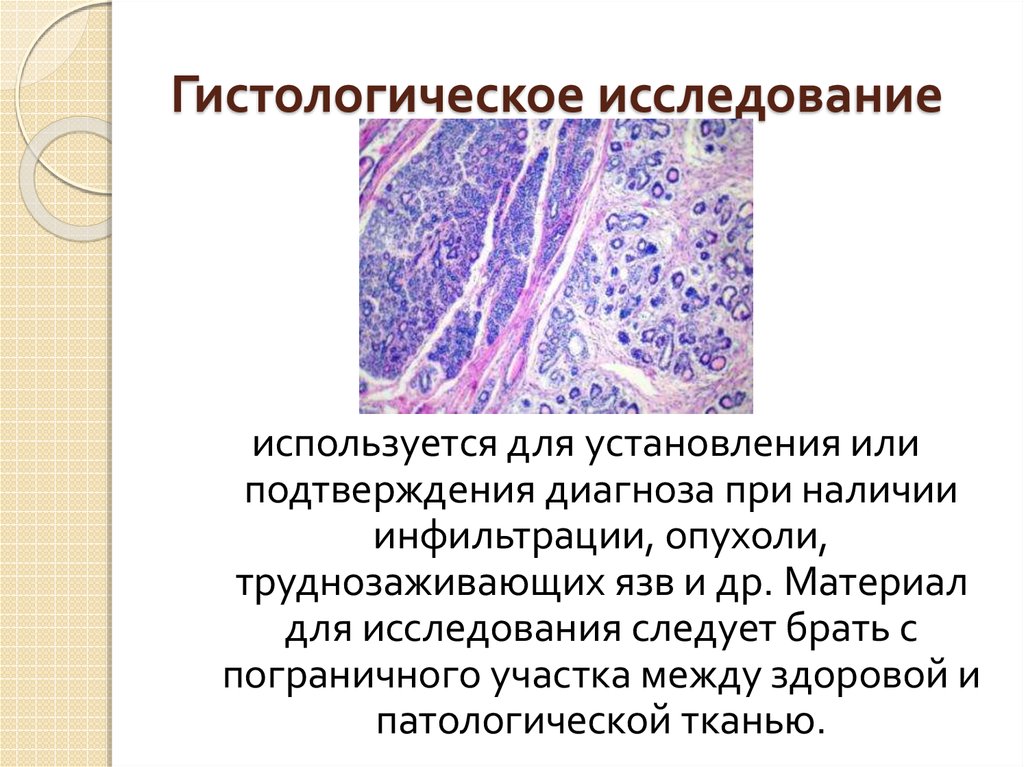 Рак Рез. 2007 г., 15 ноября; 67: 10669–76. [PubMed] [Google Scholar]
Рак Рез. 2007 г., 15 ноября; 67: 10669–76. [PubMed] [Google Scholar]
59. Bibbo M, Kim DH, Pfeifer T, Dytch HE, Galera-Davidson H, Bartels PH. Гистометрические признаки рака предстательной железы. Анальный Quant Cytol Histol. 1991 фев; 13:61–68. [PubMed] [Google Scholar]
60. Belien JA, Baak JP, van Diest PJ, van Ginkel AH. Подсчет митозов путем обработки изображений в окрашенных по Фельгену срезах рака молочной железы: влияние разрешения. Цитометрия. 1997 1 июня; 28: 135–40. [PubMed] [Google Scholar]
61. Маркевич Т., Осовский С., Патера Дж., Козловски В. Обработка изображений для точного распознавания клеток и подсчета на гистологических препаратах. Анальный Quant Cytol Histol. 2006 окт; 28: 281–91. [PubMed] [Google Scholar]
62. Kim YJ, Romeike BF, Uszkoreit J, Feiden W. Автоматическая сегментация ядер при определении индекса мечения Ki-67 в менингиомах. Клин Нейропатол. 2006 март-апрель; 25:67–73. [PubMed] [Академия Google]
63. Сонт Дж.К., Де Бур В. И., ван Шадевийк В.А., Грюнберг К., ван Крикен Дж.Х., Хиемстра П.С., Стерк П.Дж. Полностью автоматизированная оценка количества воспалительных клеток и экспрессии цитокинов в бронхиальной ткани. Am J Respir Crit Care Med. 2003 г., 1 июня; 167: 1496–503. [PubMed] [Google Scholar]
И., ван Шадевийк В.А., Грюнберг К., ван Крикен Дж.Х., Хиемстра П.С., Стерк П.Дж. Полностью автоматизированная оценка количества воспалительных клеток и экспрессии цитокинов в бронхиальной ткани. Am J Respir Crit Care Med. 2003 г., 1 июня; 167: 1496–503. [PubMed] [Google Scholar]
64. Найк С., Дойл С., Мадабхуши А., Томашевески Дж., Фельдман М. Семинар по микроскопическому анализу изображений с приложениями в биологии. Пискатауэй. Нью-Джерси: 2007. Автоматизированная сегментация железы и оценка гистологии простаты по Глисону путем интеграции информации низкого, высокого уровня и информации, специфичной для предметной области. [Академия Google]
65. Карвелис П.С., Фотиадис Д.И., Георгиу И., Сырроу М. Метод сегментации на основе водораздела для классификации мультиспектральных изображений хромосом. Conf Proc IEEE Eng Med Biol Soc. 2006; 1:3009–12. [PubMed] [Google Scholar]
66. Петуши С., Гарсия Ф.У., Хабер М.М., Катсинис С., Тозерен А. Крупномасштабные вычисления на гистологических изображениях показывают параметры, дифференцирующие степень рака молочной железы. BMC Med Imaging. 2006; 6:14. [Бесплатная статья PMC] [PubMed] [Google Scholar]
BMC Med Imaging. 2006; 6:14. [Бесплатная статья PMC] [PubMed] [Google Scholar]
67. Fernandez DC, Bhargava R, Hewitt SM, Levin IW. Инфракрасная спектроскопия для гистопатологического распознавания. Нац биотехнолог. 2005 апр;23:469–74. [PubMed] [Google Scholar]
68. Boucheron LE, Bi Z, Harvey NR, Manjunath B, Rimm DL. Полезность мультиспектральной визуализации для ядерной классификации обычных изображений клинической гистопатологии. BMC клеточная биология. 2007;8(Приложение 1):S8. [Бесплатная статья PMC] [PubMed] [Google Scholar]
69. Сингх С.С., Какиш Б., Джонсон Дж.Л., Форд О.Х., 3-й, Фоли Дж.Ф., Мэйгарден С.Дж., Молер Дж.Л. Стратегия отбора проб для микрочипов ткани предстательной железы для Ki-67 и биомаркеров рецепторов андрогенов. Анальный Quant Cytol Histol. 2004 авг; 26:194–200. [PubMed] [Google Scholar]
70. Weaver DL, Krag DN, Manna EA, Ashikaga T, Harlow SP, Bauer KD. Сравнение обнаруженного патологоанатомом и автоматизированного компьютерного анализа изображений выявило микрометастазы в сигнальных лимфатических узлах при раке молочной железы. Мод Патол. 2003 ноябрь; 16: 1159–63. [PubMed] [Google Scholar]
Мод Патол. 2003 ноябрь; 16: 1159–63. [PubMed] [Google Scholar]
71. Glotsos D, Spyridonos P, Petalas P, Cavouras D, Ravazoula P, Dadioti PA, Lekka I, Nikiforidis G. Компьютерная оценка злокачественности астроцитом с использованием классификатора опорных векторов, Система классификации ВОЗ и регулярная процедура диагностического окрашивания гематоксилин-эозином. Анальный Quant Cytol Histol. 2004 г., апрель; 26:77–83. [PubMed] [Академия Google]
72. Уолби С., Синторн И.М., Эрландссон Ф., Боргефорс Г., Бенгтссон Э. Объединение информации об интенсивности, краях и форме для 2D- и 3D-сегментации ядер клеток в срезах тканей. Дж Микроск. 2004 г., июль; 215: 67–76. [PubMed] [Google Scholar]
73. Korde VR, Bonnema GT, Xu W, Krishnamurthy C, Ranger-Moore J, Saboda K, Slayton LD, Salasche SJ, Warneke JA, Alberts DS, Barton JK. Использование оптической когерентной томографии для оценки повреждений кожи от солнца и предраковых состояний. Лазерная хирургия Мед. 2007 окт; 39: 687–95. [Бесплатная статья PMC] [PubMed] [Google Scholar]
[Бесплатная статья PMC] [PubMed] [Google Scholar]
74. Gurcan M, Pan T, Shimada H, Saltz JH. APIIII 2006 Ванкувер, Британская Колумбия. 2006. Анализ изображений для классификации нейробластомы: пороговое значение гистерезиса для сегментации клеток. [Google Scholar]
75. Гуркан М.Н., Пан Т., Шимада Х., Зальц Дж. Анализ изображений для классификации нейробластомы: сегментация ядер клеток. Conf Proc IEEE Eng Med Biol Soc. 2006; 1:4844–7. [PubMed] [Google Scholar]
76. Бэмфорд П., Ловелл Б. Метод точной неконтролируемой сегментации клеточного ядра. Инженерное общество медицины и биологии, 2001 г .; Материалы 23-й ежегодной международной конференции IEEE.2001. стр. 2704–2708. [Академия Google]
77. Бегельман Г., Печук М., Ривлин Э., Сабо Э. Система для компьютерной диагностики микроскопических патологий с мультиразрешением. Системы компьютерного зрения, 2006 ICVS ’06; Международная конференция IEEE, 2006 г. стр. 16–16. [Google Scholar]
78. Найк С., Дойл С.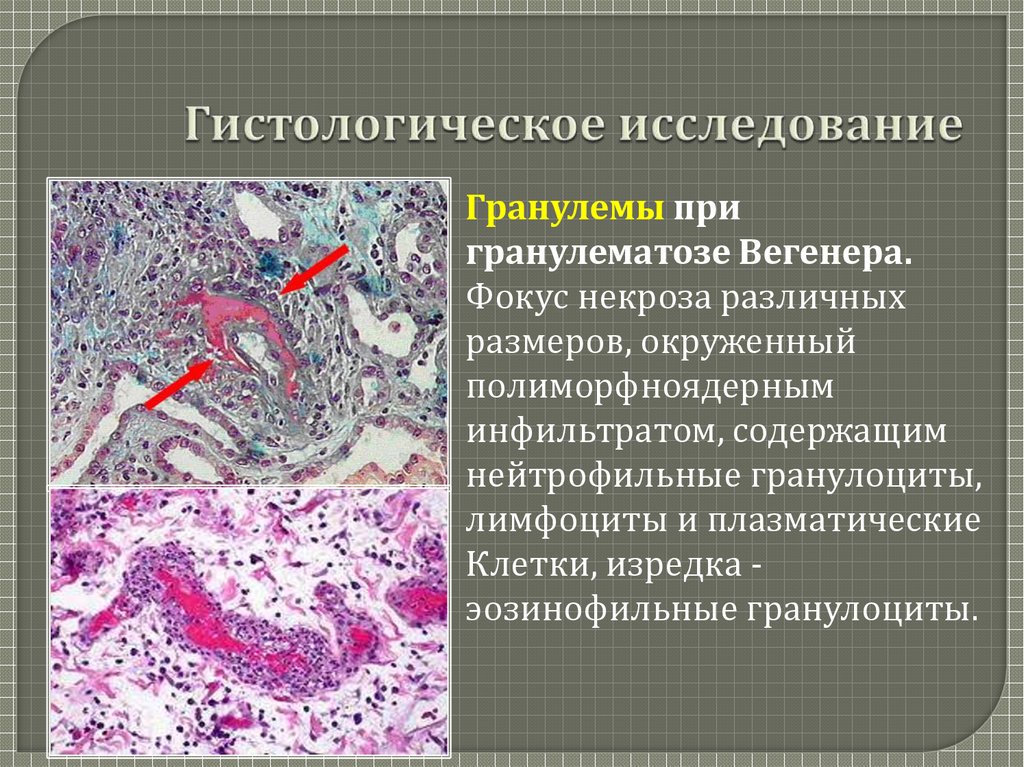 , Агнер С., Мадабхуши А., Томашевески Дж., Фельдман М. Специальный семинар ISBI по вычислительной гистопатологии (CHIP) IEEE; Париж, Франция: 2008 г. Автоматизированная сегментация желез и ядер для классификации гистопатологов рака предстательной железы и молочной железы; стр. 284–287. [Академия Google]
, Агнер С., Мадабхуши А., Томашевески Дж., Фельдман М. Специальный семинар ISBI по вычислительной гистопатологии (CHIP) IEEE; Париж, Франция: 2008 г. Автоматизированная сегментация желез и ядер для классификации гистопатологов рака предстательной железы и молочной железы; стр. 284–287. [Академия Google]
79. Сетхиан Дж.А. Методы набора уровней: развитие интерфейсов в геометрии, гидромеханике, компьютерном зрении и материаловедении. Первое изд. Издательство Кембриджского университета; 1996. [Google Scholar]
80. Kong J, Shimada H, Boyer K, Saltz JH, Gurcan M. Анализ изображений для автоматизированной оценки степени дифференцировки нейробластов. Международный симпозиум IEEE по биомедицинской визуализации (ISBI) 2007 г.; Метро Вашингтон, округ Колумбия. 12-15 апреля 2007 г. 2007 г. [Google Scholar]
81. Роденакер К., Бенгтссон Э. Набор функций для цитометрии оцифрованных микроскопических изображений. Аналитическая клеточная патология. 2003; 25:1–36. [Бесплатная статья PMC] [PubMed] [Google Scholar]
82. Sims AJ, Bennett MK, Murray A. Анализ изображений можно использовать для обнаружения пространственных изменений в гистопатологии опухолей поджелудочной железы. Физика в медицине и биологии. 2003; 48: N183–N191. [PubMed] [Google Scholar]
Sims AJ, Bennett MK, Murray A. Анализ изображений можно использовать для обнаружения пространственных изменений в гистопатологии опухолей поджелудочной железы. Физика в медицине и биологии. 2003; 48: N183–N191. [PubMed] [Google Scholar]
83. Gil J, Wu H, Wang BY. Анализ изображений и морфометрия в диагностике рака молочной железы. Микроскопические исследования и техника. 2002; 59: 109–118. [PubMed] [Google Scholar]
84. Boucheron LE. Кандидатская диссертация. 2008. Количественный анализ мультиспектральных гистопатологических изображений на объектном и пространственном уровне для обнаружения и характеристики рака. [Академия Google]
85. Sertel O, Kong J, Catalyurek U, Lozanski G, Saltz J, Gurcan M. Анализ гистопатологического изображения с использованием промежуточных представлений на основе модели и цветовой текстуры: классификация фолликулярной лимфомы. Журнал систем обработки сигналов. 2009 (в печати) [Google Scholar]
86. Фалуцос М., Фалуцос П., Фалуцос К.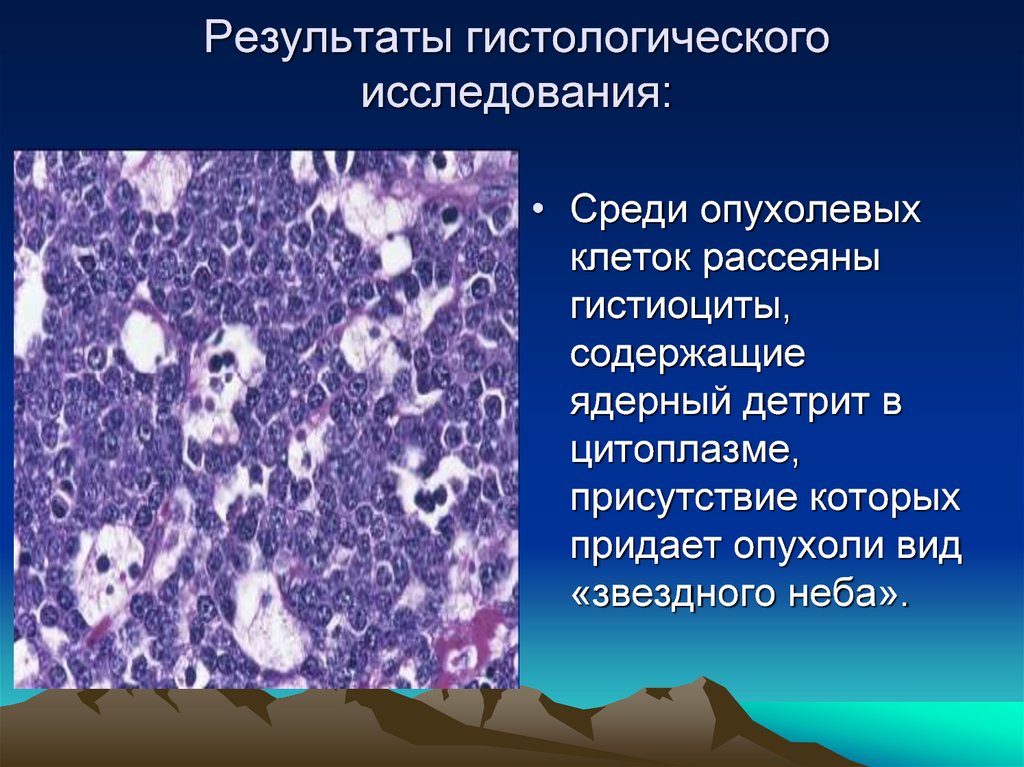 О степенных отношениях топологии Интернета. 1999. С. 251–262.
О степенных отношениях топологии Интернета. 1999. С. 251–262.
87. Уоттс Д., Строгац С. Коллективная динамика сетей малого мира. Природа. 1998;393: 440–442. [PubMed] [Google Scholar]
88. Wuchty S, Ravasz E, Barabasi A. Архитектура биологических сетей. Комплексные системы в биомедицине. 2003 [Google Scholar]
89. Альберт Р., Шиндевольф Т., Бауманн И., Хармс Х. Обработка трехмерных изображений для морфометрического анализа срезов эпителия. Цитометрия. 1992; 13: 759–765. [PubMed] [Google Scholar]
90. Билгин С., Демир С., Наги С., Йенер Б. Анализ клеточных графов для моделирования и классификации тканей молочной железы. 2007. стр. 5311–5314. [ПубМед]
91. Билгин С., Буллоу П., Плоппер Г., Йенер Б. Анализ клеточных графов с учетом ECM для моделирования и анализа костной ткани. Технический отчет RPI по компьютерным наукам 08-07. 2008 [бесплатная статья PMC] [PubMed] [Google Scholar]
92. Gunduz C, Yener B, Gultekin S. Клеточные графики рака. Биоинформатика.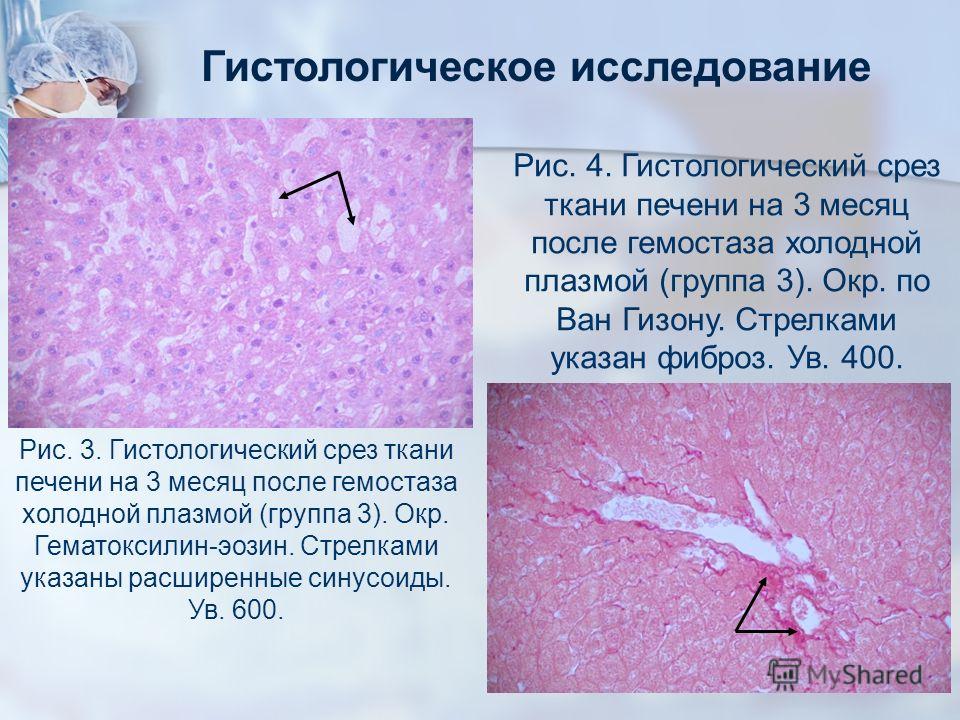 2004;20 [PubMed] [Google Scholar]
2004;20 [PubMed] [Google Scholar]
93. Дойл С., Хванг М., Шах К., Мадабхуши А., Фельдман М., Томашевски Дж. ISBI. 2007. Автоматизированная оценка рака предстательной железы с использованием архитектурных и текстурных особенностей изображения; стр. 1284–1287. [Академия Google]
94. Kong J, Sertel O, Shimada H, Boyer K, Saltz J, Gurcan M. Компьютерная оценка нейробластомы на гистологических изображениях всего предметного стекла: классификация степени дифференцировки нейробластов. Распознавание образов. 2009;42:1080–1092. [Бесплатная статья PMC] [PubMed] [Google Scholar]
95. Sertel O, Kong J, Shimada H, Catalyurek U, Saltz J, Gurcan MN. Компьютерный прогноз нейробластомы по изображениям всего предметного стекла: Классификация стромального развития. Распознавание образов. 2009;42:1093–1103. [Бесплатная статья PMC] [PubMed] [Google Scholar]
96. Берт П., Адельсон Э. Пирамида Лапласа как компактный код изображения. Транзакции IEEE в коммуникациях. 1983; 31: 532–540. [Google Scholar]
[Google Scholar]
97. Дойл С., Мадабхуши А., Фельдман М., Томашевески Дж. Бустерный каскад для автоматического обнаружения рака предстательной железы по оцифрованной гистологии. Конспект лекций по информатике. 2006;4191:504. [PubMed] [Google Scholar]
98. Пудил П., Нововичков Дж., Киттлер Дж. Плавающие методы поиска при выборе признаков. Письма распознавания образов. 1994;15:1119–1125. [Google Scholar]
99. Джайн А., Зонгкер Д. Выбор функций: оценка, применение и производительность на малых выборках. IEEE Transactions по анализу образов и машинному интеллекту. 1997; 19: 153–158. [Google Scholar]
100. Freund Y, Shapire RE. Теоретическое обобщение онлайн-обучения и приложение к бустингу. Журнал компьютерных и системных наук. 1997; 55: 119–139. [Google Scholar]
101. Perkins S, Lacker K, Theiler J. Grafting: Fast, Incremental Feature Selection by Gradient Descent in Function Space. Журнал исследований машинного обучения. 2003;3:1333–1356. [Академия Google]
102. Куреши Х., Сертел О., Раджпут Н., Уилсон Р., Гуркан М. Вычисление медицинских изображений и компьютерное вмешательство – MICCAI 2008. 2008. Адаптивное дискриминантное вейвлет-преобразование и локальные бинарные шаблоны для классификации подтипов менингиомы; стр. 196–204. [PubMed] [Google Scholar]
Куреши Х., Сертел О., Раджпут Н., Уилсон Р., Гуркан М. Вычисление медицинских изображений и компьютерное вмешательство – MICCAI 2008. 2008. Адаптивное дискриминантное вейвлет-преобразование и локальные бинарные шаблоны для классификации подтипов менингиомы; стр. 196–204. [PubMed] [Google Scholar]
103. Джоллифф И. Анализ главных компонентов. 2002.
104. Мартинес А., Как А. Пца против ИДА. IEEE Transactions по анализу образов и машинному интеллекту. 2001; 23: 228–233. [Академия Google]
105. Хюваринен А., Оя Э. Анализ независимых компонентов: алгоритмы и приложения. Нейронные сети. 2000;13:411–430. [PubMed] [Google Scholar]
106. Раджпут Н., Ариф М., Бхалерао А. Труды. 2007. Неконтролируемое обучение многообразиям формы. [Google Scholar]
107. Койфман Р., Лафон С., Ли А., Маджиони М., Надлер Б., Уорнер Ф., Цукер С. Геометрические диффузии как инструмент гармонического анализа и определения структуры данных: диффузионные карты. Труды Национальной академии наук. 2005; 102:7426–7431. [Бесплатная статья PMC] [PubMed] [Google Scholar]
2005; 102:7426–7431. [Бесплатная статья PMC] [PubMed] [Google Scholar]
108. Кунчева Л.И., Уитакер С.Дж. Меры разнообразия ансамблей классификаторов и их связь с точностью ансамбля. Машинное обучение. 2003; 51: 181–207. [Google Scholar]
109. Дойл С., Хван М., Шах К., Мадабхуши А., Томашевески Дж., Фельдман М. Автоматическая оценка рака простаты с использованием архитектурных и текстурных особенностей изображения. Международный симпозиум по биомедицинской визуализации; Вашингтон. 2007. стр. 1284–87. [Google Scholar]
110. Rajpoot K, Rajpoot N. Вычисление медицинских изображений и компьютерное вмешательство – MICCAI 2004. 2004. Оптимизация SVM для гиперспектральной классификации клеток ткани толстой кишки; стр. 829–837. [Google Scholar]
111. Дойл С., Родригес С., Мадабхуши А., Томашевески Дж., Фельдман М. Выявление аденокарциномы предстательной железы с помощью оцифрованной гистологии с использованием многомасштабного иерархического подхода к классификации. Конференция IEEE «Инженерия в медицине и биологии»; Нью-Йорк, штат Нью-Йорк. 2006. стр. 4759–62. [PubMed] [Google Scholar]
Конференция IEEE «Инженерия в медицине и биологии»; Нью-Йорк, штат Нью-Йорк. 2006. стр. 4759–62. [PubMed] [Google Scholar]
112. Виола П., Джонс М.Дж. Надежное распознавание лиц в реальном времени. Международный журнал компьютерного зрения. 2004 г., май; 57: 137–154. [Google Scholar]
113. Демир С., Йенер Б. Автоматическая диагностика рака на основе гистопатологических изображений: систематический обзор. Политехнический институт Ренсселера, Троя. : NY2006. [Академия Google]
114. Гундуз С., Йенер Б., Гюльтекин Ш.Х. Клеточные графики рака. Биоинформатика. 2004 г., 4 августа; 20 (Приложение 1): i145–51. [PubMed] [Google Scholar]
115. Джафари-Хузани К., Солтанян-Заде Х. Мультивейвлетная градация патологических изображений простаты. IEEE Trans Biomed Eng. 2003 г., июнь; 50: 697–704. [PubMed] [Google Scholar]
116. Weyn B, Wouver G, Daele A, et al. Автоматизированная диагностика и классификация опухолей молочной железы на основе описания текстуры вейвлет-хроматина. Цитометрия. 1998; 33:32–40. [PubMed] [Академия Google]
Цитометрия. 1998; 33:32–40. [PubMed] [Академия Google]
117. Ван де Ваувер Г., Вейн Б., Шеундерс П., Джейкоб В., Ван Марк Э., ВАН Д. Вейвлеты как дескрипторы текстуры хроматина для автоматической идентификации неопластических ядер. Журнал микроскопии. 2000;197:25. [PubMed] [Google Scholar]
118. Табеш А., Теверовский М., Панг Х.И., Кумар В.П., Вербель Д., Коцианти А., Саиди О. Многофункциональная диагностика рака предстательной железы и оценка гистологических изображений по шкале Глисона. IEEE Trans Med Imaging. 2007 окт.; 26:1366–78. [PubMed] [Академия Google]
119. Эсгиар А.Н., Нагиб Р.Н., Шариф Б.С., Беннетт М.К., Мюррей А. Анализ изображений под микроскопом для количественного измерения и идентификации признаков нормальной и раковой слизистой оболочки толстой кишки. IEEE Trans Inf Technol Biomed. 1998 г., сен; 2: 197–203. [PubMed] [Google Scholar]
120. Кинан С., Даймонд Дж., Гленн Макклаггедж В., Бхаруча Х., Томпсон Д., Бартелс П., Гамильтон П. Автоматическая система машинного зрения для гистологической оценки цервикальной интраэпителиальной неоплазии (CIN) Дж. Патол. 2000;192 [PubMed] [Google Scholar]
Патол. 2000;192 [PubMed] [Google Scholar]
121. Камбазоглу Б., Сертель О., Конг Дж., Зальц Дж.Х., Гуркан М.Н., Каталюрек У.В. Эффективная обработка патологических изображений с помощью сетки: Компьютерный прогноз нейробластомы. Материалы Пятого международного семинара по проблемам больших приложений в распределенных средах; Монтерей Бэй, Калифорния. 2007. С. 35–41. [Google Scholar]
122. Руиз А., Сертель О., Уджалдон М., Каталюрек У.В., Зальц Дж., Гуркан М.Н. Анализ патологического изображения с использованием графического процессора: классификация стромы для нейробластомы. IEEEBIBM’07. 2007 [Google Академия]
123. Гуркан М.Н., Чан Х.П., Сахинер Б., Хаджийский Л., Петрик Н., Хелви М.А. Выбор оптимальной архитектуры нейронной сети: улучшение компьютерного обнаружения микрокальцинатов. Академ Радиол. 2002 апр; 9: 420–9. [PubMed] [Google Scholar]
124. Чаппелоу Дж., Вишванат С., Мадабхуши А., Розен М., Томашевески Дж., Фельдман М. Медицинская визуализация SPIE. Сан-Диего, Калифорния: 2008. Повышение точности контролируемой классификации с использованием нежесткой мультимодальной регистрации изображений: компьютерное обнаружение рака предстательной железы на МРТ ex vivo. [Академия Google]
Сан-Диего, Калифорния: 2008. Повышение точности контролируемой классификации с использованием нежесткой мультимодальной регистрации изображений: компьютерное обнаружение рака предстательной железы на МРТ ex vivo. [Академия Google]
125. Чаппелоу Дж., Мадабхуши А., Розен М., Томашевески Дж., Фельдман М. Медицинская визуализация SPIE. 1. Том. 6512. Сан-Диего: 2007. Мультимодальная регистрация изображений МРТ предстательной железы 4 Тесла ex vivo с гистологией всего препарата для обнаружения рака; стр. С1 – С12. [Google Scholar]
126. Ourselin S, Roche A, Subsol G, Pennec X, Ayache N. Реконструкция трехмерной структуры из серийных гистологических срезов. Вычисление изображения и зрения. 2001; 19: 25–31. [Google Scholar]
127. Мадабхуши А., Фельдман М., Метаксас Д., Томашевески Дж., Чут Д. Автоматическое обнаружение аденокарциномы предстательной железы с помощью МРТ высокого разрешения Ex Vivo. IEEE Trans Med Imaging. 2005; 24:1611–25. [PubMed] [Академия Google]
128. Теверовский М., Венгренюк Ю., Табеш А., Сапир М., Фогараси С., Хо-Юен П., Хан Ф.М., Хаманн С., Каподиечи П., Клейтон М., Ким Р., Фернандес Г., Меса-Техада Р., Донован М.Дж. Автоматическая локализация и количественная оценка белковых мультиплексов с помощью мультиспектральной флуоресцентной визуализации. Биомедицинская визуализация: от нано к макро, 2008 г. ISBI 2008; 5-й Международный симпозиум IEEE, 2008 г. стр. 300–303. [Google Scholar]
Теверовский М., Венгренюк Ю., Табеш А., Сапир М., Фогараси С., Хо-Юен П., Хан Ф.М., Хаманн С., Каподиечи П., Клейтон М., Ким Р., Фернандес Г., Меса-Техада Р., Донован М.Дж. Автоматическая локализация и количественная оценка белковых мультиплексов с помощью мультиспектральной флуоресцентной визуализации. Биомедицинская визуализация: от нано к макро, 2008 г. ISBI 2008; 5-й Международный симпозиум IEEE, 2008 г. стр. 300–303. [Google Scholar]
129. Glory E, Murphy RF. Автоматическое определение субклеточного местоположения и высокопроизводительная микроскопия. Развивающая ячейка. 2007; 12:7–16. [PubMed] [Академия Google]
130. Лессманн Б., Дегенхард А., Кессар П., Пойнтон Л., Хазен М., Лич М., Натткемпер Т. Искусственные нейронные сети: Биологическое вдохновение – ICANN 2005. 2005. Вейвлет-фильтрация на основе SOM для исследования медицинских изображений; стр. 671–676. [Google Scholar]
131. Иглесиас-Розас Дж. Р., Хопф Н. Гистологическая гетерогенность глиобластом человека, исследованная с помощью неконтролируемой нейронной сети (SOM) Histol Histopathol.

 Это могут быть различные растворы или кислоты, состоящие из одного или нескольких компонентов. «Купание» частички ткани может происходить несколько часов, а может и несколько суток. Это зависит как от фиксатора, так и от образца материала.
Это могут быть различные растворы или кислоты, состоящие из одного или нескольких компонентов. «Купание» частички ткани может происходить несколько часов, а может и несколько суток. Это зависит как от фиксатора, так и от образца материала.