Гипотиреоз субклинический и беременность: Аптека Ригла – забронировать лекарства в аптеке и забрать самовывозом по низкой цене в Москва г.
Диагностика и лечение субклинического гипотиреоза при планировании и во время беременности: современный подход к проблеме | Шилова
1. Lazarus J, Brown RS, Daumerie C et al. 2014 European thyroid association guidelines for the management of subclinical hypothyroidism in pregnancy and in children. Eur Thyroid J. 2014;3(2):76-94. doi: 10.1159/000362597
2. Alexander EK, Pearce EN, Brent GA, et al. 2017 Guidelines of the American Thyroid Association for the diagnosis and management of thyroid disease during pregnancy and the postpartum. Thyroid. 2017;27:315-89. doi: 10.1089/thy.2016.0457
3. Maraka S, Ospina NM, O’Keeffe DT et al. Subclinical Hypothyroidism in Pregnancy: A Systematic Review and Meta-Analysis. Thyroid. 2016;26(4):580-90. doi: 10.1089/thy.2015.0418
4. Korevaar TIM, Derakhshan A, Taylor PN, et al. Association of Thyroid Function Test Abnormalities and Thyroid Autoimmunity With Preterm Birth. JAMA. 2019;322(7):632. doi: https://doi.org/10.1001/jama.2019. 10931
10931
5. Chen L, Hu R. Thyroid autoimmunity and miscarriage: a meta-analysis. Clinical Endocrinology. 2011;74(4):513-519. doi: 10.1111/j.1365-2265.2010.03974.x
6. Liu H, Shan Z, Li,C, et al. Maternal Subclinical Hypothyroidism, Thyroid Autoimmunity, and the Risk of Miscarriage: A Prospective Cohort Study. Thyroid. 2014;24(11):1642-1649. doi: 10.1089/thy.2014.0029
7. Seungdamrong A, Steiner AZ, Gracia CR, et al. Eunice Kennedy Shriver National Institute of child health and human development reproductive medicine network. Preconceptional antithyroid peroxidase antibodies, but not thyroid-stimulating hormone, are associated with decreased live birth rates in infertile women. Fertil Steril. 2017;108:843-50. doi: 10.1016/j.fertnstert.2017.08.026
8. Thangaratinam S, Tan A, Knox E, et al. Association between thyroid autoantibodies and miscarriage and preterm birth: metaanalysis of evidence. BMJ. 2011;342:d2616. doi: 10.1136/bmj.d2616.
9. Van den Boogaard E, Vissenberg R, Land JA, et al. Significance of (sub)clinical thyroid dysfunction and thyroid autoimmunity before conception and in early pregnancy: a systematic review. Human Reproduction Update. 2011;17(5):605-619. doi: 10.1093/humupd/dmr024
Significance of (sub)clinical thyroid dysfunction and thyroid autoimmunity before conception and in early pregnancy: a systematic review. Human Reproduction Update. 2011;17(5):605-619. doi: 10.1093/humupd/dmr024
10. Negro R. Thyroid autoimmunity and pre-term delivery: brief review and meta-analysis. J Endocrinol Invest. 2011; 34:155-158. doi: 10.1007/BF03347047.
11. He X, Wang P, Wang Z, He X, et al. Thyroid antibodies and risk of preterm delivery: a metaanalysis of prospective cohort studies. Eur J Endocrinol. 2012;167:455-464. doi: 10.1530/EJE-12-0379.
12. Korevaar TM, Pop VJ, Chaker L, et al. Dose dependency and a functional cutoff for TPO-antibody positivity during pregnancy. J Clin Endocrinol Metab. 2018;103:778-789. doi: 10.1210/jc.2017-01560
13. Дедов И.И., Мельниченко Г.А. и др. Клинические рекомендации Российской ассоциации эндокринологов. Гипотиреоз (проект). 2019. Доступно по: https://www.endocrincentr.ru/sites/default/files/specialists/science/clinic-recomendations/gipotireoz. proekt.klin_.rek_3.pdf Ссылка активна на 05.10.20 г.
proekt.klin_.rek_3.pdf Ссылка активна на 05.10.20 г.
14. Soldin OP, Tractenberg RE, Hollowell JG, et al. Trimester-Specific Changes in Maternal Thyroid Hormone, Thyrotropin, and Thyroglobulin Concentrations During Gestation: Trends and Associations Across Trimesters in Iodine Sufficiency. Thyroid. 2004;14(12):1084-1090. doi: 10.1089/thy.2004.14.1084
15. Haddow JE, McClain M, Lambert-Messerlian G, et al. Variability in thyroid stimulating hormone suppression by human chronic gonadotropin during early pregnancy. J Clin Endocrinol Metab. 2008;93:3341- 3347. doi: 10.1210/jc.2008-0568
16. Garber JR, Cobin RH, Gharib H, et al. American Association of Clinical Endocrinologists and American Thyroid Association Taskforce on Hypothyroidism in Adults. Clinical practice guidelines for hypothyroidism in adults: cosponsored by the American Association of Clinical Endocrinologists and the American Thyroid Association. Endocr Pract. 2012;18(6):988-1028. doi: 10.4158/EP12280.GL
17. Elenkov IJ, Wilder RL, Bakalov VK,et al. IL-12, TNF-a, and hormonal changes during late pregnancy and early postpartum: implications for autoimmune disease activity during these times. J Clin Endocrinol Metab. 2001;86(10):4933-4938. doi: 10.1210/jcem.86.10.7905
Elenkov IJ, Wilder RL, Bakalov VK,et al. IL-12, TNF-a, and hormonal changes during late pregnancy and early postpartum: implications for autoimmune disease activity during these times. J Clin Endocrinol Metab. 2001;86(10):4933-4938. doi: 10.1210/jcem.86.10.7905
18. Zimmermann MB. The effects of iodine deficiency in pregnancy and infancy. Paediatr. Perinat Epidemiol. 2012;26(1):108-117. doi: 10.1111/j.1365-3016.2012.01275.x.
19. Соболева Д.Е., Дора С.В., Волкова А.Р. и др. Йодообеспечение беременных женщин Санкт-Петербурга. Эффективность профилактики развития йододефицитных заболеваний // Проблемы женского здоровья. — 2015. — № 2. — Т. 10. — С. 25-31.
20. Benhadi N, et al. Ethnic differences in TSH but not in free T4 concentrations or TPO antibodies during pregnancy. Clin. Endocrinol. (Oxf.). 2007;66:765-770. doi: 10.1111/j.1365-2265.2007.02803.x
21. Korevaar TI, Steegers EA, de Rijke YB. et al. Hypothyroxinemia and TPO-antibody positivity are risk factors for premature delivery: the generation R study. Clin. Endocrinol. Metab. 2013;98:4382-4390. doi: 10.1210/jc.2013-2855
Clin. Endocrinol. Metab. 2013;98:4382-4390. doi: 10.1210/jc.2013-2855
22. Han C, et al. High body mass index is an indicator of maternal hypothyroidism, hypothyroxinemia, and thyroid-peroxidase antibody positivity during early pregnancy. Biomed. Res. Int. 2015;321831. doi: 10.1155/2015/351831
23. Mosso L, et al. Early pregnancy thyroid hormone reference ranges in Chilean women: the influence of body mass index. Clin. Endocrinol. (Oxf.). 2016;85:942-948. doi: 10.1111/cen.13127
24. Korevaar TI, Steegers EAP, Pop VJ, et al. Thyroid autoimmunity impairs the thyroidal response to human chorionic gonadotropin: two population-based prospective cohort studies. J. Clin. Endocrinol. Metab. 2017;102:69-77. doi: 10.1210/jc.2016-2942
25. Hou Y, Liu A, Li J, et al. Different Thyroidal Responses to Human Chorionic Gonadotropin Under Different Thyroid Peroxidase Antibody and/or Thyroglobulin Antibody Positivity Conditions During the First Half of Pregnancy. Thyroid. 2019 Apr; 29(4):577-585. doi: 10.1089/thy.2018.0097
doi: 10.1089/thy.2018.0097
26. Korevaar TI, Steegers EA, de Rijke YB, et al. Placental angiogenic factors are associated with maternal thyroid function and modify hCG-mediated FT4 stimulation. J. Clin. Endocrinol. Metab. 2015;100:E1328-E2334. doi: 10.1210/jc.2015-2553
27. Stagnaro-Green A, Abalovich M, Alexander E, et al. Guidelines of the American Thyroid Association for the Diagnosis and Management of Thyroid Disease During Pregnancy and Postpartum. Thyroid. 2011;21(10):1081-1125. doi:10.1089/thy.2011.0087
28. Canovi S, Vezzani S, Polese A, et al. Pregnancy-related reference intervals for serum thyrotropin based on real-life clinical data. Gynecol Endocrinol. 2020;322(7):1-4. doi: https://doi.org/10.1080/09513590.2020.1756251
29. Blatt AJ, Nakamoto JM, Kaufman HW. National status of testing for hypothyroidism during pregnancy and postpartum. J Clin Endocrinol Metab. 2012;97:777-784. doi: 10.1210/jc.2011-2038
30. Li C, Shan Z, Mao J, et al. Assessment of Thyroid Function During First-Trimester Pregnancy: What Is the Rational Upper Limit of Serum TSH During the First Trimester in Chinese Pregnant Women? The Journal of Clinical Endocrinology & Metabolism. 2014;9(1):73-79. doi: 10.1210/jc.2013-1674
2014;9(1):73-79. doi: 10.1210/jc.2013-1674
31. Medici M, Korevaar TI, Visser WE, et al. Thyroid function in pregnancy: what is normal? Clin Chem. 2015;61(5):704-713. doi: 10.1373/clinchem.2014.236646
32. Попова П.В., Шилова Е.С., Ткачук А.С., и др. Референтные значения показателей функции щитовидной железы в первом триместре беременности и риск развития гестационного сахарного диабета у женщин Санкт-Петербурга // Сахарный диабет. — 2018. — Т. 21. — №1. — С. 34-41. doi: 10.14341/DM9283
33. Krassas GE, Pontikides N, Kaltsas T, et al. Disturbances of menstruation in hypothyroidism. Clin Endocrinol (Oxf). 1999;50(5):655-659. doi: 10.1046/j.1365-2265.1999.00719.x
34. Arojoki M, Jokimaa V, Juuti A, et al. Hypothyroidism among infertile women in Finland. Gynecol Endocrinol. 2000;14(2):127-131. doi: 10.3109/09513590009167671
35. Abalovich M, Mitelberg L, Allami C, et al. Subclinical hypothyroidism and thyroid autoimmunity in women with infertility. Gynecol Endocrinol. 2007;23(5):279-283. doi: 10.1080/09513590701259542
2007;23(5):279-283. doi: 10.1080/09513590701259542
36. Feldthusen AD, Pedersen PL, Larsen J, et al. Impaired fertility associated with subclinical hypothyroidism and thyroid autoimmunity: the Danish General Suburban Population Study. J Pregnancy. 2015;2015:132718. doi: 10.1155/2015/132718
37. Poppe K, Glinoer D, Van Steirteghem A, et al. Thyroid dysfunction and autoimmunity in infertile women. Thyroid. 2002;12(11):997-1001. doi: 10.1089/105072502320908330
38. Plowden TC, Schisterman EF, Sjaarda LA, et al. Subclinical hypothyroidism and thyroid autoimmunity are not associated with fecundity, pregnancy loss, or live birth. J Clin Endocrinol Metab. 2016;101(6):2358-2365. doi: 10.1210/jc.2016-1049
39. Practice Committee of the American Society for Reproductive Medicine. Subclinical hypothyroidism in the infertile female population: a guideline. Fertil Steril. 2015;104(3):545-553. doi: 10.1016/j.fertnstert.2015.05.028
40. Dhillon-Smith RK, Middleton LJ, Sunner KK, et al. Levothyroxine in Women with Thyroid Peroxidase Antibodies before Conception. N Engl J Med. 2019;380(14):1316-1325. doi: 10.1056/NEJMoa1812537.
Levothyroxine in Women with Thyroid Peroxidase Antibodies before Conception. N Engl J Med. 2019;380(14):1316-1325. doi: 10.1056/NEJMoa1812537.
41. Kim CH, Ahn JW, Kang SP, et al. Effect of levothyroxine treatment on in vitro fertilization and pregnancy outcome in infertile women with subclinical hypothyroidism undergoing in vitro fertilization/intracytoplasmic sperm injection. Fertil Steril. 2011;95(5):1650-1654. doi: 10.1016/j.fertnstert.2010.12.004.
42. Wang H, Gao H, Chi H, et al. Effect of levothyroxine on miscarriage among women with normal thyroid function and thyroid autoimmunity undergoing in vitro fertilization and embryo transfer: a randomized clinical trial. JAMA. 2017;318(22):2190-2198. doi: 10.1001/jama.2017.18249.
43. Dong AC, Stephenson MD, Stagnaro-Green AS. The Need for Dynamic Clinical Guidelines: A Systematic Review of New Research Published After Release of the 2017 ATA Guidelines on Thyroid Disease During Pregnancy and the Postpartum. Frontiers in Endocrinology. 2020;11. doi: 10.3389/fendo.2020.00193
2020;11. doi: 10.3389/fendo.2020.00193
44. Andersen SL, Andersen S, Liew Z, Vestergaard P, Olsen J. Maternal thyroid function in early pregnancy and neuropsychological performance of the child at 5 years of age. J Clin Endocrinol Metab. 2018;103:660-70. doi: 10.1210/jc.2017-02171
45. Andersen SL, Andersen S, Vestergaard P, Olsen J. Maternal thyroid a Danish Nationwide Case-Cohort Study. Thyroid. 2018;28:537-46. doi: 10.1089/thy.2017.0425
46. Yang J, Liu Y, Liu H, et al. Associations of maternal iodine status and thyroid function with adverse pregnancy outcomes in Henan Province of China. J Trace Elem Med Biol. 2018;47:104-10. doi: 10.1016/j.jtemb.2018.01.013
47. Negro R, Schwartz A, Gismondi R, et al. Increased Pregnancy Loss Rate in Thyroid Antibody Negative Women with TSH Levels between 2.5 and 5.0 in the First Trimester of Pregnancy. The Journal of Clinical Endocrinology & Metabolism. 2010;95(9):E44-E48. doi:10.1210/jc.2010-0340
48. Schneuer FJ, Nassar N, Tasevski V, et al. Association and predictive accuracy of high TSH serum levels in first trimester and adverse pregnancy outcomes. J Clin Endocrinol Metab. 2012;97(9):3115-3122. doi: 10.1210/jc.2012-1193
Association and predictive accuracy of high TSH serum levels in first trimester and adverse pregnancy outcomes. J Clin Endocrinol Metab. 2012;97(9):3115-3122. doi: 10.1210/jc.2012-1193
49. Wang S, Teng WP, Li JX, et al. Effects of maternal subclinical hypothyroidism on obstetrical outcomes during early pregnancy. J Endocrinol Invest. 2012;35(3):322-325. doi: 10.3275/7772
50. Lopez-Tinoco C, Rodriguez-Mengual A, Lara-Barea A, et al. Impact of positive thyroid autoimmunity on pregnant women with subclinical hypothyroidism. Endocrinol Diabetes Nutr. 2018;65:150-5. doi: 10.1016/j.endien.2017.11.020
51. Arbib N, Hadar E, Sneh-Arbib O, et al. First trimester thyroid stimulating hormone as an independent risk factor for adverse pregnancy outcome. J Matern Fetal Neonatal Med. 2017;30:2174-8. doi: 10.1080/14767058.2016.1242123
52. Derakhshan A, Peeters RP, Taylor PN, et al. Association of maternal thyroid function with birthweight: a systematic review and individual-participant data meta-analysis. The Lancet Diabetes & Endocrinology. 2020;8(6):501-510. doi: 10.1016/s2213-8587(20)30061-9
The Lancet Diabetes & Endocrinology. 2020;8(6):501-510. doi: 10.1016/s2213-8587(20)30061-9
53. Chen LM, Du WJ, Dai J, et al. Effects of subclinical hypothyroidism on maternal and perinatal outcomes during pregnancy: a single-center cohort study of a Chinese population. PLoS One. 2014;9(10):e109364. doi: 10.1371/journal.pone.0109364
54. Wilson KL, Casey BM, McIntire DD, et al. Subclinical thyroid disease and the incidence of hypertension in pregnancy. Obstet Gynecol. 2012;119(2Pt1):315-320. doi: 10.1097/AOG.0b013e318240de6a
55. Tudela CM, Casey BM, McIntire DD, et al. Relationship of subclinical thyroid disease to the incidence of gestational diabetes. Obstet Gynecol. 2012;119(5):983-988. doi: 10.1097/AOG.0b013e318250aeeb
56. Nelson SM, Haig C, McConnachie A, et al. Maternal thyroid function and child educational attainment: prospective cohort study. BMJ. 2018;360:k452. doi: 10.1136/bmj.k452
57. Maraka S, Mwangi R, McCoy RG, et al. Thyroid hormone treatment among pregnant women with subclinical hypothyroidism: US national assessment.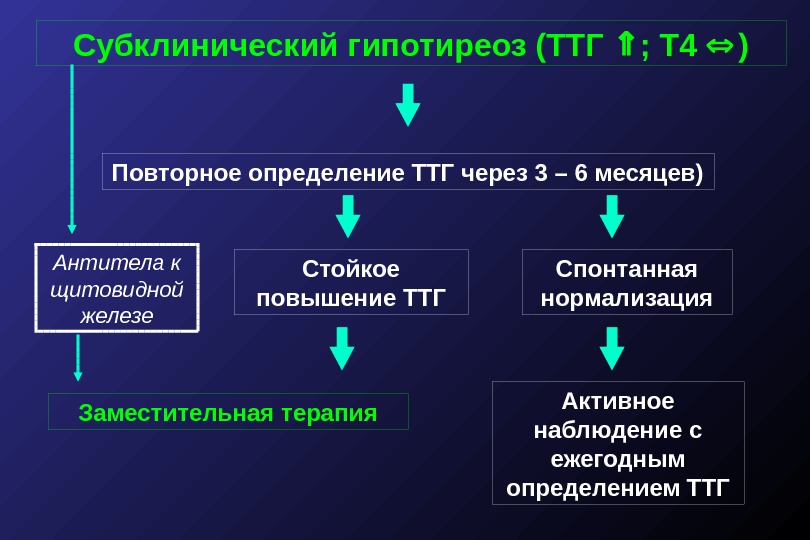 BMJ. 2017;356:i6865. doi: 10.1136/bmj.i6865
BMJ. 2017;356:i6865. doi: 10.1136/bmj.i6865
58. Nazarpour S, Ramezani Tehrani F, Simbar M, et al. Effects of levothyroxine on pregnant women with subclinical hypothyroidism, negative for thyroid peroxidase antibodies. J Clin Endocrine Metab. 2018;103:926-35. doi: 10.1210/jc.2017-0185
59. Casey BM, Thom EA, Peaceman AM, et al. Treatment of Subclinical Hypothyroidism or Hypothyroxinemia in Pregnancy. New England Journal of Medicine. 2017;376(9):815-825. doi: 10.1056/nejmoa1606205
60. Lazarus JH, Bestwick JP, Channon S et al. Antenatal thyroid screening and childhood cognitive function. N Engl J Med. 2012;366(6):493-501. doi: 10.1056/NEJMoa1106104
61. Zhao L, Jiang G, Tian X, et al. Initiation timing effect of levothyroxine treatment on subclinical hypothyroidism in pregnancy. Gynecol Endocrinol. 2018;34:845-8. doi: 10.1080/09513590.2018.1451836
62. Toloza FJK, Singh Ospina NM, Rodriguez-Gutierrez R, et al. Practice Variation in the Care of Subclinical Hypothyroidism During Pregnancy: A National Survey of Physicians in the United States. J Endocr Soc. 2019;3(10):1892-1906. doi: https://doi.org/10.1210/js.2019-00196
J Endocr Soc. 2019;3(10):1892-1906. doi: https://doi.org/10.1210/js.2019-00196
63. Долгушина Н.В., Артымук Н.В., Белокриницкая Т.Е. и др. Клинические рекомендации Российского общества акушеров-гинекологов. Нормальная беременность. 2019. Доступно по: https://docviewer.yandex.ru/view/0/?*=nKnu28OZjp5ygElEAiA07g8NBZt7InVybCI6InlhLWRpc2stcHVibGljOi8vVzZJSFh2VWpLdERmSlRIb1IxSjk2UHQvdGRIL1ovL3VXM1dCUFV1WCsrMXVCTkJBVC9mVW9OSjA4VXZaYVJTMnEvSjZicG1SeU9Kb25UM1ZvWG5EYWc9PSIsInRpdGxlIjoi0J3QvtGA0LzQsNC70YzQvdCw0Y8g0LHQtdGA0LXQvNC10L3QvdC%2B0YHRgtGMLmRvY3giLCJub2lmcmFtZSI6ZmFsc2UsInVpZCI6IjAiLCJ0cyI6MTYwMTg5NDU1MDkwOCwieXUiOiI1Mzk2NjAyOTMxNTk5MDMzNjQzIn0%3D Ссылка активна на 05.10.20 г.
СУБКЛИНИЧЕСКИЙ ГИПОТИРЕОЗ ВО ВРЕМЯ БЕРЕМЕННОСТИ СВЯЗАН С ПРЕЖДЕВРЕМЕННЫМИ РОДАМИ — Ассоциация гинекологов-эндокринологов России
Главная » СУБКЛИНИЧЕСКИЙ ГИПОТИРЕОЗ ВО ВРЕМЯ БЕРЕМЕННОСТИ СВЯЗАН С ПРЕЖДЕВРЕМЕННЫМИ РОДАМИ
Subclinical Hypothyroidism in Pregnancy: Link to Premature Delivery
Беременные женщины с субклиническим гипотиреозом демонстрируют повышение риска преждевременных родов на 50%, согласно результатам нового исследования, доложенным на 86-й Ежегодной конференции Американской ассоциации по щитовидной железе. Результаты двух исследований показали снижение некоторых осложнений при назначении лечения левотироксином.
Результаты двух исследований показали снижение некоторых осложнений при назначении лечения левотироксином.
Проблема обследования на субклинический гипотиреоз во время беременности ─ предмет дебатов из-за противоречивых данных о преимуществах такого обследования. Рекомендации Американской ассоциации по щитовидной железе (American Thyroid Association (ATA)) с 2011 г. пришли к заключению, что доказательства недостаточны, чтобы рекомендовать за или против рутинного измерения уровня тиреотропного гормона в первом триместре беременности, таких же рекомендаций придерживается эксперты Американской коллегии акушеров-гинекологов (American College of Obstetrics and Gynecology). Публикация новых рекомендаций ATA по этому вопросу ожидается в ближайшие месяцы.
Д-р Lee и его коллеги из Медицинского центра г. Бостона провели исследование с участием более 6000 беременных женщин, наблюдавшихся с января 2003 по май 2014 гг. , у которых имелись данные об уровне тиреотропного гормона (ТТГ). Результаты исследования были доложены на 86-й Ежегодной конференции АТА.1 Исследователи констатировали наличие гипотиреоза при следующих концентрациях уровня ТТГ: от 0,1 до 2,5 мМЕ/л в 1-ом, от 0,2 до 3 мМЕ/л во 2-ом и от 0,3 до 3 мМЕ/л в 3-м триместрах беременности. Женщины с установленным диагнозом заболевания щитовидной железы или получавшие лечение по этому поводу не включались в исследование. Данные по антителам к тиреоидной пероксидазе (ТПО) были доступны у 281 женщины, из которых у 5% тест был положительным.
, у которых имелись данные об уровне тиреотропного гормона (ТТГ). Результаты исследования были доложены на 86-й Ежегодной конференции АТА.1 Исследователи констатировали наличие гипотиреоза при следующих концентрациях уровня ТТГ: от 0,1 до 2,5 мМЕ/л в 1-ом, от 0,2 до 3 мМЕ/л во 2-ом и от 0,3 до 3 мМЕ/л в 3-м триместрах беременности. Женщины с установленным диагнозом заболевания щитовидной железы или получавшие лечение по этому поводу не включались в исследование. Данные по антителам к тиреоидной пероксидазе (ТПО) были доступны у 281 женщины, из которых у 5% тест был положительным.
Результаты исследования показали, что повышение уровня ТТГ в любом триместре беременности коррелировало со статистически значимым повышением частоты преждевременных родов (т.е. ранее 37 недель гестации) по сравнению с женщинами с нормальным уровнем этого показателя (отношение шансов, 1,52; 95% ДИ 1,06–2,16; P = 0,02). «В целом, превышение уровня специфического для определенного триместра уровня ТТГ было связано с повышением частоты преждевременных родов на 50%», отметила в своем докладе д-р Lee. Однако более высокая концентрация ТТГ в сыворотке не была связана с повышенным риском каких-либо других пренатальных осложнений.
Однако более высокая концентрация ТТГ в сыворотке не была связана с повышенным риском каких-либо других пренатальных осложнений.
В ходе конференции были доложены, уже опубликованные результаты небольшого исследования, выполненного в Mayo Clinic (Rochester, Minnesota) между январем 2011 и декабрем 2013 гг. с участием 56 ТПО-негативных беременных женщин с субклиническим гипотиреозом.2 Критерием субклинического гипотиреоза авторы считали уровень ТТГ менее 2,5 мМЕ/л в 1-ом и более 3 мМЕ/л во 2-ом и 3-ем триместрах беременности, но менее 10 мМЕ/л. Базовые уровни ТТГ были статистически значимо выше в группе женщин, получавших левотироксин (LT4): средний уровень 4,9 мМЕ/л vs 3,5 мМЕ/л у не получавших лечение женщин (P < 0,001), что и привело к тому, что этим женщинам было предложено лечение, объяснил главный исследователь, д-р Maraka. При сравнении акушерских результатов у получавших лечение LT4 женщин (n = 22) с не получавшими лечения (n = 34) было показано, что на фоне лечения отмечалась более низкая частота преждевременных родов (4,6% vs 23,5%), а также потерь беременности, гипертензии беременных и преэклампсии; однако из-за малого числа участниц различия не достигали статистической значимости. На фоне лечения не отмечено ни одного случая низкого веса новорожденного по сравнению с 14,3% не леченных женщин; однако, опять эта разница не достигала статистической значимости (P = 0,13).
На фоне лечения не отмечено ни одного случая низкого веса новорожденного по сравнению с 14,3% не леченных женщин; однако, опять эта разница не достигала статистической значимости (P = 0,13).
«Несмотря на увеличение в 2 раза числа беременных женщин, получающих заместительную терапию левотироксином при субклиническом гипотиреозе после выпуска обновленных рекомендаций (ATA и Эндокринного общества), они не были повсеместно внедрены в клиническую практику. По-видимому, это частично связано с недостатком сильных поддерживающих рекомендации данных, а также ограниченное ознакомление с ними специализированных групп врачей», считают авторы исследования из Mayo Clinic.
Только что на конференции Эндокринологического общества Великобритании в г. Брайтоне (Society for Endocrinology Annual Conference) были доложены результаты исследования д-ра Taylor и его коллег из Университетской клиники г. Кардифф в Уэльсе.3 Когорта участниц включала 13 224 женщин со сроком беременности от 12 до 16 недель, из которых у 340 женщин был выявлен субклинический гипотиреоз, а у 305 женщин ─ изолированная гипотироксинемия (прим. состояние, когда при нормальном уровне ТТГ определяется сниженный уровень Т4). Результаты исследования показали, что назначение левотироксина беременным женщинам с умеренно выраженным гипотиреозом служат профилактикой замершей беременности, рождения плода с низким для своего гестационного возраста весом и необходимости в преждевременном родоразрещении путем кесарева сечения.
состояние, когда при нормальном уровне ТТГ определяется сниженный уровень Т4). Результаты исследования показали, что назначение левотироксина беременным женщинам с умеренно выраженным гипотиреозом служат профилактикой замершей беременности, рождения плода с низким для своего гестационного возраста весом и необходимости в преждевременном родоразрещении путем кесарева сечения.
Источник:
1. American Thyroid Association (ATA) 2016 Annual Meeting (September 21-23, 2016 Denver, Colorado)
2. Maraka S, Singh Ospina NM, O’Keeffe DT, et al. Effects of Levothyroxine Therapy on Pregnancy Outcomes in Women with Subclinical Hypothyroidism. Thyroid. July 2016, 26(7): 980-986
3. Society for Endocrinology Annual Conference. Brighton, United Kingdom. November 7–9, 2016. Abstract OC6.3
28 ноября 2016
Субклинический гипотиреоз и исходы беременности. PDF-файл для сохранения и печати
ГИПОТИРЕОЗ
Субклинический гипотиреоз и исходы беременности
ПРЕДПОСЫЛКИ
Явный гипотиреоз возникает при повышении ТТГ и Т 4 низкий уровень. Субклинический гипотиреоз определяется повышенным ТТГ, но нормальным Т 4 . Понятно, что явный гипотиреоз необходимо лечить, особенно если он диагностирован во время беременности у матери. Невыполнение этого требования приводит к проблемам во время беременности и препятствует нормальному развитию ребенка. Менее очевидны преимущества лечения субклинического гипотиреоза, так же как и вопрос о том, могут ли возникнуть какие-либо проблемы с беременностью, если мать не лечится. Однако лечение субклинического гипотиреоза у матери во время беременности было рекомендовано в недавно опубликованных рекомендациях Американской ассоциации щитовидной железы, а также в предыдущих рекомендациях Эндокринного общества и Европейской ассоциации щитовидной железы. В текущем исследовании изучались вред и польза, связанные с лечением субклинического гипотиреоза во время беременности.
Субклинический гипотиреоз определяется повышенным ТТГ, но нормальным Т 4 . Понятно, что явный гипотиреоз необходимо лечить, особенно если он диагностирован во время беременности у матери. Невыполнение этого требования приводит к проблемам во время беременности и препятствует нормальному развитию ребенка. Менее очевидны преимущества лечения субклинического гипотиреоза, так же как и вопрос о том, могут ли возникнуть какие-либо проблемы с беременностью, если мать не лечится. Однако лечение субклинического гипотиреоза у матери во время беременности было рекомендовано в недавно опубликованных рекомендациях Американской ассоциации щитовидной железы, а также в предыдущих рекомендациях Эндокринного общества и Европейской ассоциации щитовидной железы. В текущем исследовании изучались вред и польза, связанные с лечением субклинического гипотиреоза во время беременности.
ПОЛНОЕ НАЗВАНИЕ СТАТЬИ:
Марака С. и др. Лечение гормонами щитовидной железы беременных женщин с субклиническим гипотиреозом: национальная оценка США. БМЖ 2017;356:i6865.
БМЖ 2017;356:i6865.
РЕЗЮМЕ ИССЛЕДОВАНИЯ
Данные для этого исследования были собраны из базы данных участников, застрахованных в частном порядке и пользующихся льготами Medicare, на всей территории Соединенных Штатов. В исследование были включены женщины в возрастной группе от 18 до 55 лет с уровнем ТТГ от 2,5 до 10 мкМ/л. Все женщины имели нормальный уровень Т4. Лечение было связано со снижением риска потери беременности у женщин с уровнем ТТГ от 4,1 до 10, но не с уровнем ТТГ от 2,5 до 4.
Всего выявлено 5405 женщин с субклиническим гипотиреозом; 843 (15,6%) начали лечение левотироксином со средней дозы 50 мкг, 7 (0,8%) с препаратами экстракта щитовидной железы и 4 (0,5%) с комбинацией левотироксина и лиотиронина. Остальные 4562 женщины (84,4%) не получали лечения гормонами щитовидной железы. Процент женщин, прошедших лечение, увеличился с 12% в 2010 г. до 19% в 2014 г. Из 843 женщин, прошедших лечение, 719 (85,3%) прошли как минимум один контрольный анализ ТТГ, а у 130 (18,0%) концентрация ТТГ была выше 3 мЕд/л.
Лечение было связано с более низким риском невынашивания беременности, но более высоким риском преждевременных родов, диабета и высокого кровяного давления во время беременности и высокой частоты сердечных сокращений.
КАКОВЫ ПОСЛЕДСТВИЯ ЭТОГО ИССЛЕДОВАНИЯ?
Это исследование предполагает, что лечение субклинического гипотиреоза было связано с более низким риском невынашивания беременности, особенно у женщин с концентрацией ТТГ от 4,1 до 10 мЕд/л до лечения. Также наблюдалось легкое повышение артериального давления, частоты сердечных сокращений и диабета во время беременности. Это исследование предоставляет дополнительную информацию, которая поможет определить необходимость лечения женщин с диагнозом субклинический гипотиреоз во время беременности.
— Vibhavasu Sharma, MD
ATA THYROID BROCHURE LINKS
Заболевания щитовидной железы и беременность: http://www.thyroid.org/thyroid-disease-pregnancy/
Функциональные тесты щитовидной железы: http://www.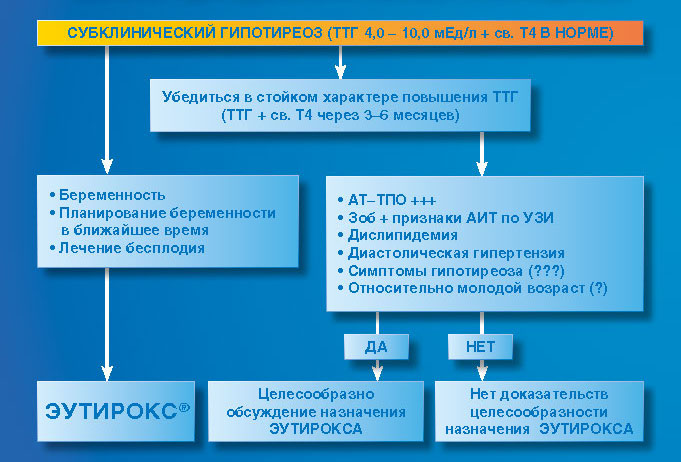 thyroid.org/ thyroid-function-tests/
thyroid.org/ thyroid-function-tests/
СОКРАЩЕНИЯ И ОПРЕДЕЛЕНИЯ
Субклинический гипотиреоз: легкая форма гипотиреоза, при которой единственным патологическим уровнем гормона является повышенный уровень ТТГ. Существуют разногласия относительно того, следует ли это лечить
Антитела к ТПО: это антитела, которые атакуют щитовидную железу вместо бактерий и вирусов. Они являются маркером аутоиммунного заболевания щитовидной железы, которое является основной причиной гипотиреоза и гипертиреоза в Соединенных Штатах.
ТТГ: тиреотропный гормон — вырабатывается гипофизом и регулирует функцию щитовидной железы; также лучший скрининговый тест, чтобы определить, нормально ли функционирует щитовидная железа.
Тироксин (T 4 ): основной гормон, вырабатываемый щитовидной железой. Т 4 превращается в активный гормон Т 3 в различных тканях организма. Свободный T 4 – доля этого гормона, не связанного с белком в крови.
Содержание | PDF-файл для сохранения и печати
Ведение женщин с субклиническим гипотиреозом во время беременности
Текст статьи
Меню статьи
- Статья
Текст - Артикул
информация - Цитата
Инструменты - Поделиться
- Быстрое реагирование
- Артикул
Метрика - Оповещения
Обзор
Ведение женщин с субклиническим гипотиреозом во время беременности
- Кейт Уайлс, MSc MRCP, научный сотрудник NIHR
- Департамент здоровья женщин и детей, Королевский колледж Лондона и фонд NHS Foundation Trust Гая и Св. Томаса, Лондон SE1 7EH, Великобритания
- Для корреспонденции kate.wiles{at}kcl.ac.uk
http://dx.doi.org/10.1136/dtb.2018.000010
Статистика с сайта Altmetric.com
Запрос разрешений
вас к службе RightsLink Центра защиты авторских прав. Вы сможете получить быструю цену и мгновенное разрешение на повторное использование контента различными способами.
Вы сможете получить быструю цену и мгновенное разрешение на повторное использование контента различными способами.
Основные моменты обучения
Беременным женщинам не требуется рутинное исследование функции щитовидной железы при субклиническом гипотиреозе (SCH). Если проверяется функция щитовидной железы, не диагностируйте SCH, если уровень тиреотропного гормона находится в пределах нормального референтного диапазона для беременности или <4,0 мЕд/л.
Нет убедительных доказательств того, что SCH причиняет вред беременным или что лечение тироксином полезно.
Любое лечение SCH во время беременности в настоящее время основано на доказательствах низкого качества. Можно использовать низкую начальную дозу тироксина (50 мкг) и пересмотреть тесты функции щитовидной железы через 4–6 недель, чтобы убедиться в отсутствии вреда от ятрогенного тиреотоксикоза.
Необходимы дополнительные данные для информирования тактики ведения женщин с СКГ, у которых обнаружены антитела к щитовидной железе
Введение нормальная концентрация свободного тироксина (Т4).
 Систематический обзор и метаанализ показывают, что заместительная терапия тироксином у небеременных взрослых с СГ не дает никаких преимуществ ни в отношении симптомов, связанных со щитовидной железой, ни в качестве жизни.
Систематический обзор и метаанализ показывают, что заместительная терапия тироксином у небеременных взрослых с СГ не дает никаких преимуществ ни в отношении симптомов, связанных со щитовидной железой, ни в качестве жизни.
При беременности для определения SCH требуются референтные интервалы ТТГ и Т4, характерные для беременности, или ТТГ от 4,0 до 10,0 мЕд/л. По оценкам, SCH поражает 3–5% беременных женщин. В то время как явный гипотиреоз признан вредным для беременности, а лечение положительно влияет на исход беременности и развитие ребенка, остается неясным, распространяются ли риск и польза от лечения на субклинический спектр. В данной статье рассматривается влияние беременности на щитовидную железу и функциональные тесты щитовидной железы. Описаны контрольные интервалы для функции щитовидной железы, включая новый верхний предел ТТГ, определенный Американской тиреоидной ассоциацией в 2017 г.
Влияние беременности на щитовидную железу
Эндокринные и гемодинамические изменения во время беременности означают, что ее часто рассматривают как физиологический «стресс-тест» для различных систем органов.
