Гипоксия сердца: Диагностика и лечение гипоксии миокарда
Найден способ избежать повреждений сердца при нехватке кислорода — Газета.Ru
Найден способ избежать повреждений сердца при нехватке кислорода — Газета.Ru | Новости
Еврокомиссия активно обсуждает вопрос принятия уклоняющихся от мобилизации граждан РФ
13:59
Джордж Клуни совершил редкий выход в свет с молодой женой
13:58
Глава Минобороны Литвы Анушаускас заявил о передаче Украине нового вооружения
13:58
В ОЭСР улучшили прогноз по уменьшению ВВП России в 2022 году до 5,5%
13:57
Пресс-секретарь Зеленского уточнил слова президента Украины о поставках NASAMS…
13:57
Американец несколько лет мочился на могилу бывшей жены и оставлял фекалии…
13:57
Глава Минздрава России Мурашко вылетел в Ижевск, где произошла стрельба в школе
13:52
Ольга Орлова рассказала, как старший сын отреагировал на ее беременность
13:49
Опубликовано видео испытаний первого в мире «автомобиля…
13:48
Сенатор Клишас призвал уделить внимание вопросам соцподдержки мобилизованных граждан
13:47
Наука
close
100%
Ученые из Института молекулярной биологии имени В. А. Энгельгардта совместно с коллегами-медиками обнаружили, что производные глутатиона, участвующего в защите организма от окислительного стресса, восстанавливают работу сердца, нарушенную нехваткой кислорода. Применение этих веществ поможет дополнительно защитить сердечную мышцу при кардиохирургических операциях и в перспективе позволит улучшить профилактику заболеваний сердца. Работа опубликована в журнале Scientific Reports. Исследования поддержаны грантом Российского научного фонда.
А. Энгельгардта совместно с коллегами-медиками обнаружили, что производные глутатиона, участвующего в защите организма от окислительного стресса, восстанавливают работу сердца, нарушенную нехваткой кислорода. Применение этих веществ поможет дополнительно защитить сердечную мышцу при кардиохирургических операциях и в перспективе позволит улучшить профилактику заболеваний сердца. Работа опубликована в журнале Scientific Reports. Исследования поддержаны грантом Российского научного фонда.
Гипоксия миокарда (недостаточное поступление кислорода к сердечной мышце) – частое состояние, возникающее как при сердечно-сосудистых заболеваниях, так и при некоторых методах их лечения: при ишемической болезни, инфаркте миокарда, операциях на открытом сердце, при хранении донорского органа перед трансплантацией. В результате происходит нарушение сократительной функции. Несмотря на то, что за последние десятилетия медицинская наука шагнула вперед, до сих пор не решены задачи, касающиеся защиты сердца при резком изменении уровня кислорода.
В своей работе исследователи выяснили, что производные глутатиона предотвращают повреждение кардиомиоцитов (клеток сердца) крыс в условиях гипоксии. Трипептид глутатион – один из главных регуляторов окислительно-восстановительного баланса клетки, он участвует в защите внутриклеточных белков от окислительного повреждения активными формами кислорода (АФК). Образование АФК увеличивается при острой гипоксии и еще сильнее возрастает при последующем восстановлении нормального уровня кислорода (реоксигенации). Окислительное повреждение систем ионного транспорта приводит к тому, что кардиомиоциты теряют способность к нормальному ритмичному сокращению. Производные глутатиона предотвращают необратимое окисление систем ионного транспорта, а также корректируют их активность, что позволяет сохранить нормальную сократимость кардиомиоцитов и сердечный ритм. Вещество, продемонстрировавшее лучшее защитное действие на изолированных кардиомиоцитах, в экспериментах на целом сердце более чем на треть ускорило восстановление его сократительной активности до нормального уровня после гипоксии.
Полученные данные позволили разработать метод защиты клеток от повреждения при гипоксии и ишемии с помощью производных глутатиона, защищающих системы ионного транспорта клеток от необратимого окисления и изменения их активности. Этот метод позволяет увеличить продолжительность нормальной сократимости клеток сердца в условиях острой гипоксии более чем в пять раз.
«В настоящее время производные глутатиона, показавшие свою эффективность на кардиомиоцитах и модели изолированного сердца крыс, проходят дальнейшее тестирование в Национальном медицинском исследовательском центре кардиологии Минздрава России. Целью исследования стало снижение повреждения ткани миокарда при кратковременной ишемии. В перспективе такие соединения могут быть использованы для повышения эффективности консервации донорских органов, в частности сердца. Добавление этих веществ в защитные растворы, применяемые при операциях на остановленном сердце, таких как коррекция пороков сердца, аорто-коронарное шунтирование и трансплантация, позволит уменьшить степень повреждения органа при восстановлении тока крови, снизить частоту постоперационных аритмий. Мы рассчитываем, что производные глутатиона можно будет применять для профилактики ишемической болезни, инфаркта миокарда и хронической сердечной недостаточности», – рассказывает Ирина Петрушанко, кандидат физико-математических наук, ведущий научный сотрудник Института молекулярной биологии имени В. А. Энгельгардта Российской академии наук.
Мы рассчитываем, что производные глутатиона можно будет применять для профилактики ишемической болезни, инфаркта миокарда и хронической сердечной недостаточности», – рассказывает Ирина Петрушанко, кандидат физико-математических наук, ведущий научный сотрудник Института молекулярной биологии имени В. А. Энгельгардта Российской академии наук.
Подписывайтесь на «Газету.Ru» в Новостях, Дзен и Telegram.
Чтобы сообщить об ошибке, выделите текст и нажмите Ctrl+Enter
Новости
Дзен
Telegram
Картина дня
Военная операция ВС России на Украине. День 215-й
Онлайн-трансляция военной спецоперации РФ на Украине — 215-й день
Патроны, свастика и два пистолета: на школу в Ижевске напал бывший ученик
Число жертв стрельбы в школе №88 Ижевска увеличилось до 13 человек
Референдумы в ДНР, ЛНР, Херсонской и Запорожской областях. День четвертый
День четвертый
В Донбассе, Запорожье и Херсонщине четвертый день идут референдумы о вхождении в Россию
Песков: Путин скорбит о произошедшем в Ижевске
Лукашенко отреагировал на выезд из России мужчин призывного возраста фразой «пусть бегут»
В Кремле ответили на вопрос об ошибках при призыве мобилизованных
Минтруд заявил, что для мобилизованных сотрудников приостановят срочный трудовой договор
Новости и материалы
Еврокомиссия активно обсуждает вопрос принятия уклоняющихся от мобилизации граждан РФ
Джордж Клуни совершил редкий выход в свет с молодой женой
Глава Минобороны Литвы Анушаускас заявил о передаче Украине нового вооружения
В ОЭСР улучшили прогноз по уменьшению ВВП России в 2022 году до 5,5%
Пресс-секретарь Зеленского уточнил слова президента Украины о поставках NASAMS из США
Американец несколько лет мочился на могилу бывшей жены и оставлял фекалии около надгробия
Глава Минздрава России Мурашко вылетел в Ижевск, где произошла стрельба в школе
Ольга Орлова рассказала, как старший сын отреагировал на ее беременность
Опубликовано видео испытаний первого в мире «автомобиля с крыльями» Seaglider
Сенатор Клишас призвал уделить внимание вопросам соцподдержки мобилизованных граждан
54-летняя Джулия Робертс появилась на публике в мини
Для упрощенных автомобилей УАЗ создали отдельную комплектацию
Мостовой назвал нового спортивного директора «Спартака» Эшуорта человеком из ниоткуда
В PlayStation 5 обнаружили новый процессор
В Кремле пересмотрят эффективность охраны школ на фоне стрельбы в Ижевске
Россиянина обвинили в нападении на подростка, который заметил попытку кражи батареек
В Кремле отреагировали на победу правоцентристской коалиции в Италии
Труппа Русского театра в Молдавии протестует из-за увольнения директора
Все новости
«Мы всегда поддерживали дело Украины». Правые пришли к власти в Италии
Правые пришли к власти в Италии
Правоцентристская коалиция победила на выборах в Италии
«Мы полны решимости». Блинкен предупредил Россию о последствиях ядерного удара
Госсекретарь Блинкен: у США есть план, если Россия применит ядерное оружие
«Я встречалась с лучшим другом своего мужа»: 6 историй о женских изменах
Россиянки рассказали об изменах своим мужьям и объяснили, почему пошли на такой шаг
Референдумы объявили состоявшимися. Зеленский исключил переговоры с Москвой после их завершения
Референдумы по вхождению ЛНР и ДНР в состав России признали состоявшимся
Квартира в амбаре и вилла у океана: где живут мировые звезды
Кто помогает знаменитостям обустроить жилище
Вашингтон предупредил Москву о катастрофических последствиях применения ядерного оружия
Салливан: США и союзники дадут решительный ответ на применение ядерного оружия Россией
Мужчины прощаются с семьями. Как проходит мобилизация в России
Сербия не признает результаты референдумов. Белоруссия еще думает
В МИД Сербии отказались признавать итоги референдумов в Донбассе и регионах Украины
Нужны ли советские мультфильмы современным детям: мнение читательницы
Педагог из Новосибирска – о минусах «старых добрых» советских мультфильмов
Как в Израиле. В России предложили призывать новых граждан в армию
Глава СПЧ заявил, что необходимо увеличить до 50 лет призывной возраст натурализованных граждан
«Конфликт на Украине угрожает поджечь Европу». На Западе испугались ядерной войны
В Daily Mail призвали закончить конфликт на Украине после слов Путина о ядерном оружии
Армии Китая приказали быть готовой к боевым действиям
Эксперт Леонков рассказал, как реформируется двухмиллионная китайская армия
«Необходимо исправить ошибку». В Госдуме разберутся со случаями нарушений при мобилизации
Володин заявил о необходимости исправления ошибок при частичной мобилизации
Георгий Бовт
Реакционеры на страже любви, правды и мира
О временах, когда Россия была общеевропейской «рукой Божественного Провидения»
Алена Солнцева
Подражать не обязательно
О свободе от массового сознания в эпоху массовой культуры
Анастасия Миронова
Прыжок в бочку с формалином
О том, почему эмиграция консервирует людей и делает их старомодными
Мария Дегтерева
Только квартирный вопрос испортил их!
О съемном жилье в Москве
Марина Ярдаева
Дети вместо кошек
О том, что значит «заработать на декрет»
—>
Читайте также
Найдена ошибка?
Закрыть
Спасибо за ваше сообщение, мы скоро все поправим.
Продолжить чтение
Биоэнергетика миокарда в условиях гипоксии: возрастные аспекты
Биоэнергетика миокарда в условиях гипоксии: возрастные аспекты
Третьякова О. С.
С.
Медицинская академия им. С.И. Георгиевского ФГАОУ ВО «Крымский федеральный университет им. В.И. Вернадского», Симферополь, Россия
Заднипряный И.В.
Медицинская академия им. С.И. Георгиевского ФГАОУ ВО «Крымский федеральный университет им. В.И. Вернадского», Симферополь, Россия
Биоэнергетика миокарда в условиях гипоксии: возрастные аспекты
Журнал:
Оперативная хирургия и клиническая анатомия. 2020;4(1): 52‑62
DOI
10.17116/operhirurg2020401152
Как цитировать
Третьякова О.С., Заднипряный И.В.
Биоэнергетика миокарда в условиях гипоксии: возрастные аспекты. Оперативная хирургия и клиническая анатомия.
2020;4(1):52‑62.
Tretyakova OS, Zadnipryanyi IV. Myocarde bioenergy under hypoxia: age-related aspects. Russian Journal of Operative Surgery and Clinical Anatomy. 2020;4(1):52‑62. (In Russ.).
2020;4(1):52‑62. (In Russ.).
https://doi.org/10.17116/operhirurg2020401152
Авторы:
Третьякова О.С.
Медицинская академия им. С.И. Георгиевского ФГАОУ ВО «Крымский федеральный университет им. В.И. Вернадского», Симферополь, Россия
Все авторы (2)
Читать метаданные
В статье представлен обзор литературы, посвященный энергетическому обмену в миокарде в физиологических условиях и в условиях гипоксии. Освещены особенности биоэнергетики сердечной мышцы у новорожденных. Воздействие гипоксии приводит к развитию ишемии кардиомиоцитов с выраженным нарушением процессов энергообразования, дисметаболизму сердечной мышцы, повреждению клеточных структур миокарда, особенно после возобновления поставки кислорода, т.е. реперфузии. В адаптации кардиомиоцитов к гипоксии важная роль принадлежит митохондриям и факторам, регулирующим метаболическую и функциональную активность клетки (ATP-sensitiveK+ channels, Big-conductanceCa2+-activatedK+ channel). Переключение на анаэробные метаболические пути приводит к снижению запасов АТФ, т.к. он превращается в АДФ и АМФ с ограниченной возможностью рефосфорилирования. Эти метаболические последствия ишемии носят компенсаторный характер и направлены на защиту клеточного метаболизма, ресурсов клеток от быстрого использования. Однако при более тяжелом и более длительном дефиците кислорода поддержание достаточных уровней АТФ становится невозможным. Значительная часть энергозависимых процессов замедляется или прекращается. По сути при глубокой ишемии клетки впадают в состояние гибернации, основная цель которой — обеспечение жизнеспособности клеток в ожидании возможного восстановления кровотока.
Переключение на анаэробные метаболические пути приводит к снижению запасов АТФ, т.к. он превращается в АДФ и АМФ с ограниченной возможностью рефосфорилирования. Эти метаболические последствия ишемии носят компенсаторный характер и направлены на защиту клеточного метаболизма, ресурсов клеток от быстрого использования. Однако при более тяжелом и более длительном дефиците кислорода поддержание достаточных уровней АТФ становится невозможным. Значительная часть энергозависимых процессов замедляется или прекращается. По сути при глубокой ишемии клетки впадают в состояние гибернации, основная цель которой — обеспечение жизнеспособности клеток в ожидании возможного восстановления кровотока.
Ключевые слова:
гипоксия
ишемия
биоэнергетика миокарда
особенности у новорожденных
Авторы:
Третьякова О.С.
Медицинская академия им. С.И. Георгиевского ФГАОУ ВО «Крымский федеральный университет им. В.И. Вернадского», Симферополь, Россия
Заднипряный И.В.
Медицинская академия им. С.И. Георгиевского ФГАОУ ВО «Крымский федеральный университет им. В.И. Вернадского», Симферополь, Россия
С.И. Георгиевского ФГАОУ ВО «Крымский федеральный университет им. В.И. Вернадского», Симферополь, Россия
Список литературы:
- Лукьянова Л.Д. Современные проблемы адаптации к гипоксии. Сигнальные механизмы и их роль в системной регуляции. Патологическая физиология и экспериментальная терапия. 2011;1:3-19.
- Райвио К.О., Антонов А.Г., Сафонова Т.Я. Биохимические параметры гипоксии плода и новорожденного. Гипоксия плода и новорожденного. М.: Медицина. 1984.
- Хаткевич А.Н., Дворянцев С.Н., Капелько В.И., Рууге Э.К. Защитный эффект ишемической предпосылки (прекондиционирования): влияние длительности ишемии. Кардиология. 1998;5:4-8.
- Новиков В.С. Гипоксия: адаптация, патогенез, клиника. СПб.: ЭЛБИ; 2000.
- Заднипряный И.В., Третьякова О.С., Сатаева Т.П. Особенности развития митохондриальной дисфункции при гипоксических состояниях. International scientific review. 2016;12(2).
- Зарубина И.В. Современные представления о патогенезе гипоксии и ее фармакологической коррекции.
 Обзоры по клинической фармакологии и лекарственной терапии. 2011;9(3):31-48.
Обзоры по клинической фармакологии и лекарственной терапии. 2011;9(3):31-48. - Лукьянова Л.Л. Современные проблемы гипоксии. Вестник РАМН. 2002;9:3-12.
- Нарыжная Н. В., Лишманов Ю.Б., Колар Ф., Маслов Л.Н., Жанг И., Портниченко А.Г. Внутриклеточные механизмы кардиопротекции при адаптации к гипоксии. Триггеры и киназные каскады. Российский физиологический журнал им. И.М. Сеченова. 2011;97(9):923-938.
- Калюжин В.В., Тепляков А.Т., Беспалова И.Д., Калюжина Е.В. К вопросу об ишемической дисфункции миокарда. Бюллетень сибирской медицины. 2014;(6).
- Baker JE, Holman P, Kalyanaraman B, Griffith OW, Pritchard KA, jr. Adaptation to chronic hypoxia confers tolerance to subsequent myocardial ischemia by increased nitric oxide production. Ann NY Acad Sci. 1999;874: 236-253.
- Zadnipryany IV, Tretiakova OS, Sataieva TP, Zukow W. Experimental review of cobalt induced cardiomyopathy. Russian Open Medical Journal.
 2017;6(1):103-107.
2017;6(1):103-107. - Немков А.С., Яковлев Д.А., Борисов А.И., Белый С.А. Гибернация и станнинг — особые формы существования миокарда при ишемической болезни сердца Часть I. Гибернация. Регионарное кровообращение и микроциркуляция. 2011;10(2)(38):5-12.
- Немков А.С., Яковлев Д.А., Борисов А.И., Белый С.А. Гибернация и станнинг — особые формы существования миокарда при ишемической болезни сердца Часть II. Станнинг. Регионарное кровообращение и микроциркуляция. 2011;10(3)(39):4-9.
- Третьякова О.С., Заднипряный И.В. Перинатальная гипоксия и феномен «оглушенного» миокарда новорожденных. Современная педиатрия. 2007;17(4):177-180.
- Бережанская С.Б., Лукьянова Е.А. Уровень биогенных аминов в крови детей с перинатальным гипоксически-ишемическим и травматическим поражением ЦНС. Педиатрия. 2002;1:23-26.
- Прахов А.В., Гапоненко В.А., Игнашина Е.Г. Болезни сердца плода и новорожденного ребенка. Н. Новгород: Изд. 2001.
- Прахов А.
 В. Коррекция транзиторной постгипоксической ишемии миокарда у новорожденных. Педиатрия. 1998;(5):38-42.
В. Коррекция транзиторной постгипоксической ишемии миокарда у новорожденных. Педиатрия. 1998;(5):38-42. - Заднипряный И.В., Третьякова О.С., Сатаева Т.П. Триггерные факторы апоптоза кардиомиоцитов у новорожденных. МиД. 2014;(2).
- Третьякова О.С. Энергетический обмен в гипоксически поврежденном миокарде новорожденных. Украинский медицинский журнал. 2003;(5):107-116.
- Tretyakova O.S., Zadnipryanyi I.V. Clinical and morphological aspects of hypoxic damage of conductive system of newborn’s heart. Tavricheskiy Mediko-Biologicheskiy Vestnik. 2007;10(3):96-99.
- Vinogradova I.V., Ivanov D.O. Transient myocardial ischemia in newborn. Arterial’naya Gipertenziya (Arterial Hypertension). 2013;19(4):343-347. https://doi.org/10.18705/1607-419X-2013-19-4-343-347
- Галенко-Ярошевский П.А., Гацура В.В. Экспериментальные аспекты оптимизации фармакотерапии острой ишемии миокарда. М.: Медицина; 2000.
- Gatsura V.V., Leonidov N.B. Substrates and enzymes of energy metabolism as inotropic agents. J Mol Cell Cardiol. 1998;30(5):173.
- Ленинджер А. АТФ-цикл и биоэнергетика клетки. Основы биохимии. М.: Мир; 1985.
- Ишемия миокарда: от понимания механизмов к адекватному лечению (кр. стол). Кардиология. 2000;9:106-119.
- Poole-Wilson P. Mechanism of cell death in heart muscle after hypoxia or ischemia. In: Miocardial ischemia and protection. New York; 1983.
- Frohlich E.D. Vascular effects of the Krebs intermediate metabolites. Am J Physiol. 1985;208(1):149-153.
- Opie L. Myocardial energy metabolism. Adv Cardiol (Basel). 1974;12:70-83.
- Opie L. Cardiac metabolism in ischemic heart disease. Arch Mal Coeur Vaiss. 1999;92(12):1755-1760.
- Opie L. Role of carnitine in fatty acid metabolism of normal and ischemic myocardium. Am Heart J. 1979;3:375-388.

- Jennings R.B., Hawkins H.K. Ultrastructural changes of acute miocardial ischemia. Degradative Process in heart and Sceletal Mascle. Amsterdam: Elsevier; 1980.
- Петровский Б.В., Ефуни С.Н. Основы гипербарической оксигенации. М.; 1976.
- Меерсон Ф.З., Пшенникова М.Г. Адаптация к стрессорным ситуациям и физическим нагрузкам. М.: Медицина; 1988.
- Третьякова О.С., Заднiпряний І.В. Вторинна мiтохондрiальна недостатнiсть кардiомiоцитiв як маркер енергетичної неспроможностi мiокардаза умов перинатальної гiпоксiї. Перинатология и педиатрия. 2002;4:15-17.
- Полтавченко Г.М., Евсеев В.В., Аксенова Н.В. Участие адениновых нуклеотидов и производных аденозина в механизмах адаптации к гипоксии. Фармакологическая коррекция гипоксических состояний. М.; 1988.
- Cmoller J., Thielsen B., Schaible T.F., Reiss I., Kohl M. Value of myocardial hypoxia markers (creatine kinase and its MB-fraction (troponin-T, QT-intervals) and serum creatinine for the retrospective diagnosis of perinatal asphyxia.
 Biol Neonate.1998;73(6):367-374.
Biol Neonate.1998;73(6):367-374. - Andrieu-Abadie N., Jaffrezou J-P., Hatem S. L-carnitine prevents doxorubocin-induced apoptosis of cardiac myocytes: role of inhibition of an acid sphingomyelinase-derived ceramide generation. J Mol Cell Cardiol. 1999;(6):A71-A71.
- Шамсиев Ф.С., Мухамедова Х.Т., Сердешнова И.А., Хасанова Г.С Клинико-патогенетическое обоснование применения солкосерила у новорожденных с перинатальной гипоксией. Российский педиатрический журнал. 2001;4:53-56.
- Гунько И.Н. Роль процессов свободнорадикального окисления в развитии эндотелиальной дисфункции и гемореологических нарушений у больных с острым коронарным синдромом. Український медичний часопис. 2002;31(5):138-141.
- Третьякова О.С., Казак С.С., Заднiпряний I.В. Корекцiя дисметаболiзму гiпоксично ушкодженого мiокарда новонароджених. Современная педиатрия. 2006;11(2):177-180.
- Толейкис А.И., Вавржинкова Х.А., Гуттерова Н.И. Роль карнитина в знергетическом обмене митохондрий и миокардиальной клетки при ишемии и постишемической реперфузии.
 Вопросы медицинской химии. 1986;32(6):106-110.
Вопросы медицинской химии. 1986;32(6):106-110. - Скулачев В.П. Трансформация энергии в биомембранах. М.: Наука; 1972.
- Borchi E., Parri M., Papucci L., Becatti M., Nassi N, Nassi P., Nediani C. Role of NADPH oxidase in H9c2 cardiac muscle cells exposed to simulated ischemia-reperfusion. J Cell Mol Med. 2009;13(8B):2724-2735.
- Gatsura V.V., Sernov L.N. Influence of glycolysis activators and Krebs cycle internediates on early postocclusive arrhythmias. J Mol Cell Cardiol. 1989;21(4):82.
- Lambert A., Brand M.D. Inhibitors of the quinone-binding site allow rapid superoxide production from mitochondrial NADH: ubiquinone oxidoreductase (complex I). J Bul Chem. 2004;279(39):414-420.
- Borger D.R., Gavrilescu L.C., Bucur M.C., Ivan M., DeCaprio J.A. AMP-activated protein kinase is essential for survival in chronic hypoxia. Biochem Biophys Res Commun. 2008;370(2):230-234.
- De Wolf D.
 , Rondia G., Verhaaren H., Matthys D. Adenosine triphosphate treatment for supraventricular tachycardia in infants. Eur J Pediatr. 1994;9:668-671.
, Rondia G., Verhaaren H., Matthys D. Adenosine triphosphate treatment for supraventricular tachycardia in infants. Eur J Pediatr. 1994;9:668-671. - Yuan G., Nanduri J., Khan S., Semenza G.L., Prabhakar N.R. InductionpfHIF-1a expression by intermittent hypoxia: involvement of NADPH oxidase, Ca2+ signaling, prolyl hydroxylases and mTOR. J Cell Physiol. 2008;217:674-685.
- Wong A.K., Howie J., Petrie J.R., Lang C.C. AMP-activated protein kinase pathway: a potential therapeutic target in cardiometabolic disease. Clin Sci (Lond.). 2009;8(116) 607-620.
- Шабанов П.Д., Зарубина И.В., Новиков В.Е., Цыган В.Н. Метаболические корректоры гипоксии. СПб.; 2010.
- Bartelds B, Knoester I, Beaufort Krol GC, Smid GB, Tokens J. Myocardial lactate metabolism in fetal and newborn lambs. Circulation. 1999;14:1892-1897.
- Samaja M., Allibardi S., Margonato V. Effects of trimetazidine on rat heart post ischemic recovery.
 Mol Cell Cardiol. 1998;30(5):9.
Mol Cell Cardiol. 1998;30(5):9. - Kruger K., Hallberg B., Blennow M., Kublickas M., Westgren M. Predictive value of fetal scalp blood lactate concentration and pH as markers of neurologic disability. Am J Obstet Gynecol. 1999;181(5):1072-1078.
- Guzy R.D., Schumacker P.T. Oxygen sensing by mitochondria at complex III: the paradox of increased reactive oxygen species during hypoxia. Exp Physiol. 2006;91:807-819.
- Poderoso J.J., Carreras M.C., Lisdero C., Riobo N., Schopfer F., Boveris A. Nitric oxide inhibits electron transfer and increases superoxide radical production in rat heart mitochondria and submitochondrial particles. Arch Biochem Biophys. 1996;328:85-92.
- Low J.A., Victory R., Derrick E.J. Predictive value of electronic fetal monitoring for intrapartum fetal asphyxia with metabolic acidosis. Obstet Gynecol. 1999;93(2):285-291.
- Schlotter C.M. Pre-pathologic cardiotocographic pattern in second stage of labor.
 Analysis of the incidence of acidosis and recommendations for fetal blood gas analysis. Zentralbl Gynakol. 1997;119(3):117-122.
Analysis of the incidence of acidosis and recommendations for fetal blood gas analysis. Zentralbl Gynakol. 1997;119(3):117-122. - Надеев А.Д., Гончаров Н.В. Активные формы кислорода в клетках сердечно-сосудистой системы. Комплексные проблемы сердечно-сосудистых заболеваний. 2014;(4).
- Nakanishi T., Seguchi M., Rsuchiya T., Yasukouchi S., Takao A. Effect of acidosis on intracellular pH and calcium conctntration in the newborn and adult rabbit myocardium. Circ Res. 1990;1:111-123.
- Толоткова С.А., Козырев О.А., Молотков А.О., Хохлова Ю.А. Основные ишемические синдромы: современное состояние проблемы. Вестник Смоленской государственной медицинской академии. 2017;2.
- Заднипряный И.В., Третьякова О.С., Сатаева Т.П. Морфологический субстрат вторичной митохондриальной дисфункции при транзиторной ишемии миокарда у крысят. Таврический медико-биологический вестник. 2013;16(3-1):174-178.
- Ягудин Т.А., Шабанова А.
 Т., Лиу Хонг-Ю. Новые аспекты в механизмах ишемического и реперфузионного повреждения миокарда. Креативная хирургия и онкология. 2018;(3).
Т., Лиу Хонг-Ю. Новые аспекты в механизмах ишемического и реперфузионного повреждения миокарда. Креативная хирургия и онкология. 2018;(3). - Галагудза М.М., Сонин Д.Л., Александров И.В. Гибернация миокарда: молекулярные механизмы, клиническая значимость и методы диагностики. Регионарное кровообращение и микроциркуляция. 2019;18(3):9-15. https://doi.org/10.24884/1682-6655-2019-18-3-9-15
- Зоров Д.Б., Исаев Н.К., Плотников Е.Ю., Силачев Д.Н. Перспективы митохондриальной медицины. Биохимия. 2013;78(9):1251-1264.
- Cameron JS, Baghdady R. Role of ATP sensitive potassium channels in long term adaptation to metabolic stress. Cardiovasc Res. 1994;28:788-796.
- Newcomb E.W., Lukyanov Y., Schnee T. Noscapine inhibits hypoxia-mediated HIF-1alpha expression and angiogenesis in vitro: a novel function for an old drug. Int J Oncol. 2006;28(5):1121-1131.
- Crawford R.M., Jovanovic S., Budas G.R., Davies A.M., Lad H., Wenger R.
 H., Robertson K.A., Roy D.J., Ranki H.J., Jovanovic A. Chronic mild hypoxia protects heart-derived H9c2 cells against acute hypoxia/reoxygenation by regulating expression of the SUR2A subunit of the ATP-sensitive K+ channel. J Biol Chem. 2003;278(33):31 444-31 455.
H., Robertson K.A., Roy D.J., Ranki H.J., Jovanovic A. Chronic mild hypoxia protects heart-derived H9c2 cells against acute hypoxia/reoxygenation by regulating expression of the SUR2A subunit of the ATP-sensitive K+ channel. J Biol Chem. 2003;278(33):31 444-31 455. - Zhang Z., Yan J., Chang Y. Hypoxia Inducible Factor-1 as a target for neurodegenerative diseases. Cur Med Chem. 2011;18(28):4335-4343.
- Zhu H.F., Dong J.W., Zhu W-Zh., Ding H.L., Zhou Zh.N. ATP-dependent potassium channels involved in the cardiac protection induced by intermittent hypoxia against ischemia/reperfusion injury. Life Sci. 2003;73(10):1275-1287.
- Semenza G.L. Regulation of oxygen homeostasis by hypoxia-inducible factor 1. Physiology (Bethesda). 2009;24:97-106.
- Новиков В.Е., Левченкова О.С. Гипоксией индуцированный фактор (HIF-1α) как мишень фармакологического воздействия. Обзоры по клинической фармакологии и лекарственной терапии.
 2013;2:8-16.
2013;2:8-16. - Kroemer G., Galluzzi L., Brenner C. Mitochondrial membrane permeabilization in cell death. Physiol Rev. 2007;87(1):99-163.
- Oskarsson H., Coppey L., Weiss R., Li W.G. Antioxidants attenuate myocyte apoptosis in the remote non-infarcted myocardium following large myocardial infarction. Cardiovasc Res. 2000;45(3):679-687.
- Xu W, Liu Y, Wang S, McDonald T, Van Eyk JE, Sidor A, P’ Rourke B. Cytoprotective role of Ca2+-activated K+ channels in the cardiac inner mitochondrial membrane. Science. 2002;298:1029-1033.
- Crompton M, Ellinger H, Coati A. Inhibition by cyclosporine A of a Ca2+-dependent pore in heart mitochondria activated by inorganic phosphate and oxidative stress. Biochem J. 1988;255(1):357-360.
- Пожилова Е.В., Новиков В.Е., Левченкова О.С. Регуляторная роль митохондриальной поры и возможности ее фармакологической модуляции. Обзоры по клинической фармакологии и лекарственной терапии.
 2014;(3).
2014;(3). - Левченкова О.С., Новиков В.Е., Пожилова Е.В. Митохондриальная пора как мишень фармакологического воздействия. Вестник Смоленской государственной медицинской академии. 2014;(4).
- Stewart S., Lesnefsky E.J., Chen Q. Reversible blockade of electron transport with amobarbital at the onset of reperfusion attenuates cardiac injury. Transl Res. 2009;153(5):224-231.
- Vanden Hoek T.L., Li C., Shao Z., Schumacker P.T., Becker L.B. Significant levels of oxidants are generated by isolated cardiomyocytes during ischemia prior to reperfusion. J Mol Cell Cardiol. 1997;29(9):2581-2583.
- Новиков В.Е., Левченкова О.С., Пожилова Е.В. Роль активных форм кислорода в физиологии и патологии клетки и их фармакологическая регуляция. Обзоры по клинической фармакологии и лекарственной терапии. 2014;(4).
- Сазонтова Т.Г., Анчишкина Н.А., Жукова А.Г., Бедарева И.В., Пылаева Е.А., Кривенцова Н.А., Полянская А.А., Юрасов А.
 Р., Архипенко Ю.В. Роль активных форм кислорода и редокс-сигнализации при адаптации к изменению содержания кислорода. Физиологический журнал. 2009;54(2):18-32.
Р., Архипенко Ю.В. Роль активных форм кислорода и редокс-сигнализации при адаптации к изменению содержания кислорода. Физиологический журнал. 2009;54(2):18-32. - Levraut J., Iwase H., Shao Z.H., VandenHoek T.L., Schumacker P.T. Cell death during ischemic relationship to mitochondrial depolarization and ROS generation. Am J Physiol Heart Circ Physiol. 2000;284(2):H549-H558.
- Верещагин И.Е., Тарасов Р.С., Верещагин Е.И., Ганюков В.И. Методы кардиопротекции при инфаркте миокарда. Современное состояние вопроса. Комплексные проблемы сердечно-сосудистых заболеваний. 2016;(4).
- Kersten J., Pagel P., Chilian W., Warltier D. Multifactorial basis for coronary collateralization: a complex adaptive response to ischemia. Cardiovasc Res. 1999;43(1):44-57.
- Sabatino G., Ramenghi L.A., Verrotti A., Gerboni S., Chiarelli F. Persistently low cardiac output predicts high mortality in newborns with cardiogenic shock. Panminerva Med.
 1998;40(1):28-32.
1998;40(1):28-32. - Нарыжная Н.В., Некар Я., Маслов Л.Н., Лишманов Ю.Б., Колар Ф., Ласукова Т.В. Роль сарколеммальных и митохондриальных КАТФ-каналов в реализации кардиопротекторного и антиаритмического эффектов разных режимов гипобарической адаптации. Российский физиологический журнал им. И.М. Сеченова. 2009;95(8):837-849.
- Yang L, Korge P, Weiss JN, Qu Z. Mitochondrial oscillations and waves in cardiac myocytes: insights from computational models. Biophys J. 2010;98(8):1428-1438.
- Зотова И.В., Затейщиков Д.А., Сидоренко Б.А. Синтез оксида азота и развитие атеросклероза. Кардиология. 2002;4:58-57.
- Корж А.Н., Евлахова А.И. Нарушение функционального состояния эндотелия при ишемической болезни сердца: пути фармакологической коррекции. Украинский кардиологический журнал. 1999;2:11-14.
- Hare JM. Nitric oxide and excitation-contraction coupling. J Mol Cell. Cardiol. 2003;35:719-729.

- Barnucz E, Veres G, Hegedűs P. Prolylhydroxylase inhibition preserves endothelial cell function in a rat model of vascular ischemia reperfusion injury. J Pharmacol Exp Ther. 2013;345(1):25-31.
- Новиков В.Е., Левченкова О.С., Пожилова Е.В. Митохондриальная синтаза оксида азота и ее роль в механизмах адаптации клетки к гипоксии. Обзоры по клинической фармакологии и лекарственной терапии. 2016;(2).
- Nisoli E., Clementi E., Paolucci C., Cozzi V., Tonello C., Sciorati C., Bracale R., Valerio A., Francolini M., Moncada S., Carruba M.O. Mitochondrial biogenesis in mammals: the role of endogenous nitric oxide. Science. 2003;299:896-899.
- Sato T., Saito T., Saegusa N., Nakaya H. Mitochondrial Ca2+-activated K+ channels in cardiac myocytes: a mechanism of the cardioprotective effect and modulation by protein kinase A. Circulation. 2005;111:198-203.
- Sato T., Arita M., Kiyosue T. Differential mechanism of block of palmitoyllysophosphatidylcholine and palmitoylcarnitine on inward rectifier K channels of guinea pig ventricular myocytes.
 Cardiovasc Drug Ther. 1993;7:575-584.
Cardiovasc Drug Ther. 1993;7:575-584. - Jennings R.B., Reimer K.A. Lethal myocardial ischemic injury. Am J Pathol. 1982;122:219-231.
- Портниченко В.И., Носарь В.И., Портниченко А.Г. Фазовые изменения энергетического метаболизма. Фізіол. журн. 2012;58(4):3-20.
- Van der Vusse G., Van Bilsen M., Glatz J. Cardiac fatty acid uptake and transport in health and disease. Cardiovasc Res. 2000;45(2):279-293.
- Berry G.J., Masek M. The pathology of hibernating myocardium. Nucl Med Commun. 2002;23(4):303-309.
- Heidbreder M., Naumann A., Tempel K., Dominiak P., Dendorfer A. Remote vs. ischaemic preconditioning: the differential role of mitogen-activated protein kinase pathways. Cardio Vasc Res. 2008;78(1):108-115.
- Genade S., Moolman J.A., Marais E., Lochner A. Ishaemic preconditioning (PC): are the opioids involved? J Mol Cell Cardiol. 1999;31(6):95.
- Shahbudin H., Rahimtoola M.B. Concept and evaluation of hibernating myocardium. J Ann Rev Med. 1999;50:75-86.
Закрыть метаданные
Проблема влияния гипоксии на сердечную мышцу, адаптации миокарда к ее воздействию, а также вызываемые ею последствия не утрачивает своей актуальности и продолжает оставаться предметом исследований на протяжении многих десятилетий [1—8]. Это обусловлено тем, что многие заболевания и состояния, возникающие как в терапевтической (хроническая обструктивная болезнь легких, апноэ во сне, ишемическая болезнь сердца и др.), так и в педиатрической практике (перинатальная гипоксия, врожденные пороки сердца и т.д.), сопровождаются ограничением поступления кислорода, что, с одной стороны, может привести к развитию заболеваний, а с другой — повышает устойчивость организма к последующим воздействиям кислорододефицита [1, 3, 9—15].
Особый интерес вызывает исследование распространенных патологических состояний перинатального периода — внутриутробной гипоксии плода и асфиксии новорожденного [14—20]. Среди их последствий, проявляющихся реакцией внутренних органов, поражение сердечно-сосудистой системы занимает 2-е место после патологии почек и, по мнению зарубежных исследователей, встречается в 25%, а по данным отечественных авторов — в 40—70% случаев развития кислорододефицита [16, 21]. При этом установлено, что возникающая в результате дефицита кислорода транзиторная ишемия миокарда связана с временным уменьшением или прекращением кровообращения в отдельных участках мышцы сердца, вызывающим снижение ее функциональной активности [17, 19]. Продолжительность таких преходящих периодов острой ишемии миокарда может колебаться от 10 до 25 мин в час и зависит от тяжести перенесенной гипоксии [17].
Среди их последствий, проявляющихся реакцией внутренних органов, поражение сердечно-сосудистой системы занимает 2-е место после патологии почек и, по мнению зарубежных исследователей, встречается в 25%, а по данным отечественных авторов — в 40—70% случаев развития кислорододефицита [16, 21]. При этом установлено, что возникающая в результате дефицита кислорода транзиторная ишемия миокарда связана с временным уменьшением или прекращением кровообращения в отдельных участках мышцы сердца, вызывающим снижение ее функциональной активности [17, 19]. Продолжительность таких преходящих периодов острой ишемии миокарда может колебаться от 10 до 25 мин в час и зависит от тяжести перенесенной гипоксии [17].
Общепризнано, что основной причиной возникновения ишемии миокарда у новорожденных является снижение энергообразования в миокардиальной клетке вследствие перинатальной «гипоксической травмы» и относительной коронарной недостаточности, которая обусловлена несоответствием имеющегося коронарного кровотока функциональным потребностям сердца, возникающим в результате высокой гемодинамической нагрузки на миокард желудочков в период послеродовой адаптации кровообращения [16, 17]. Развитие кислородного голодания приводит к возникновению тканевой гипоксии, обусловленной нарушением механизмов утилизации кислорода в клетках сердца, которые, как известно, в силу высокой функциональной нагрузки очень чувствительны к дефициту кислорода [22, 23].
Развитие кислородного голодания приводит к возникновению тканевой гипоксии, обусловленной нарушением механизмов утилизации кислорода в клетках сердца, которые, как известно, в силу высокой функциональной нагрузки очень чувствительны к дефициту кислорода [22, 23].
Биоэнергетика миокарда в физиологических условиях. Особенности у новорожденных
Сердечная мышца является самым кислородозависимым органом организма человека: потребление миокардом кислорода превышает средний уровень его потребления другими тканями организма человека в среднем в 25—36 раз [22]. Миокард, как плода, так и взрослого, потребляет примерно одинаковое количество кислорода в пересчете на 1 г ткани [22]. Известно, что сердце человека в состоянии покоя вырабатывает 65—104 кал/мин [24]. Такое энергообразование требует доставки 13—21 мл кислорода ежеминутно. Необходимое количество кислорода наряду с высоким коэффициентом его экстракции миокардом (до 12—15 мл О2 из 100 мл крови) доставляется благодаря интенсивному кровоснабжению сердца, что в условиях мышечного покоя составляет 75—85 мл на 100 г/мин (около 5% минутного объема крови) и при нагрузке на сердце может увеличиваться примерно в 3 раза (до 225—255 мл на 100 г/мин) [22]. Способность сердца обеспечивать кровоснабжение тканей организма адекватно их потребностям определяется уровнем миокардиального кровотока и комплексом биохимических явлений, которые начинаются с момента поступления окисляемых субстратов в клетки сердечной мышцы и заканчиваются взаимодействием ряда контрактильных протеинов, что ведет к сокращению миофибрилл [24, 25].
Способность сердца обеспечивать кровоснабжение тканей организма адекватно их потребностям определяется уровнем миокардиального кровотока и комплексом биохимических явлений, которые начинаются с момента поступления окисляемых субстратов в клетки сердечной мышцы и заканчиваются взаимодействием ряда контрактильных протеинов, что ведет к сокращению миофибрилл [24, 25].
Сократительная функция сердца устойчиво поддерживается в течение всей жизни [22, 26]. Это происходит благодаря тесному сопряжению процесса сокращения с энергетическим обменом. Биоэнергетика миокарда в физиологических условиях определяется темпом окисления субстратов (прежде всего молочной и пировиноградной кислот) в цикле трикарбоновых кислот (Кребса), что обеспечивает выход36 моль аденозинтрифосфата (АТФ) на 1 моль глюкозы [24, 27]. Однако этот энергетический цикл в условиях дефицита кислорода нарушается, и молочная кислота не утилизируется. Еще один вариант энергообеспечения витальных функций миокарда, реализующийся в цикле Эмбдена-Мейергофа при адекватной доставке кислорода, играет лишь вспомогательную роль, т. к. в ходе окисления 1 моля глюкозы синтезируются лишь 2 молекулы АТФ [22]. Существует еще один путь —прямое окисление глюкозы (пентозный цикл Варбурга), который является высокоэкономичным и может давать достаточное количество энергии, ввиду того, что из одной молекулы глюкозы образуется около 117 молекул АТФ [22, 24].
к. в ходе окисления 1 моля глюкозы синтезируются лишь 2 молекулы АТФ [22]. Существует еще один путь —прямое окисление глюкозы (пентозный цикл Варбурга), который является высокоэкономичным и может давать достаточное количество энергии, ввиду того, что из одной молекулы глюкозы образуется около 117 молекул АТФ [22, 24].
Основными энергетическими субстратами для миокарда взрослых и детей более старшего возраста в условиях аэробного метаболизма служат преимущественно жирные кислоты (40—60%), удельный вес углеводов составляет лишь 35—45% [22]. Сердце же плода и новорожденного ребенка в качестве основного источника энергии использует глюкозу и основной продукт его метаболизма — молочную кислоту [16]. Энергетическая метаболизация миокардом жирных кислот, свойственная детям старшего возраста и взрослым, у них практическиотсутствует. Такой тип биоэнергетики обусловлен тем, что при метаболизации глюкозы эффективность преобразования энергии выше, чем жирных кислот: на 1 моль кислорода при ипользовании глюкозы синтезируется АТФ на 14% больше, чем при метаболизации жирных кислот [16, 22]. Помимо этих субстратов кардиомиоциты (КМ) могут использовать и другие метаболиты, циркулирующие в сосудистом русле (кетоновые тела, лактат, аминокислоты и т.д.), благодаря чему поддерживается устойчивый уровень деятельности сердечной мышцы в отличие от скелетных мышц, которые могут использовать только жирные кислоты или глюкозу. Примечательно, что аминокислоты покрывают лишь 5—7% всех энергозатрат КМ [22].
Помимо этих субстратов кардиомиоциты (КМ) могут использовать и другие метаболиты, циркулирующие в сосудистом русле (кетоновые тела, лактат, аминокислоты и т.д.), благодаря чему поддерживается устойчивый уровень деятельности сердечной мышцы в отличие от скелетных мышц, которые могут использовать только жирные кислоты или глюкозу. Примечательно, что аминокислоты покрывают лишь 5—7% всех энергозатрат КМ [22].
Соотношение потребления миокардом различных субстратов зависит от интенсивности механической работы миокарда, концентрации этих веществ и содержания кислорода в артериальной крови. Механическая активность сердечной мышцы линейно связана со скоростью поглощения кислорода миокардом, что в состоянии покоя составляет ежеминутно около 30 мкл О2на 1 г сырой ткани миокарда [28]. При повышении сократительной активности сердечной мышцы пропорционально увеличивается и потребление О2, которое может возрастать в десятки раз и достигать 300 мкл/мин на 1 г сырой ткани [29].
Скорость расхода энергии тесно связана со скоростью синтеза АТФ. Для поддержания насосной функции сердца человека в течение всей жизни организм вырабатывает ежесуточно около 36 кг АТФ [22]. Более 90% его образуется при окислительном фосфорилировании в митохондриях, при этом продукты окисления глюкозы и жирных кислот как бы сгорают в клетке, давая ей тепло и АТФ [30]. Из митохондрий АТФ поступает в цитоплазму и превращается в креатинфосфат (КФ). Его молекулы являются оптимальными для транспортировки к структурам, которые являются потребителями энергии. Здесь КФ снова превращается в АТФ. Именно АТФ и КФ представляют собой энергетические запасы КМ, которые непосредственно ими используются [24].
Согласно современным представлениям [22] энергия КМ расходуется на следющие процессы:
— сокращение в миофибриллах, где под влиянием повышенной концентрации Са2+ образуются актомиозиновые связи, обеспечивающие сокращение сердечной мышцы;
— работу кальциевого насоса в саркоплазматическом ретикулуме: эта структура способна выделять ионы кальция, активирующие миофибриллы, и поглощать их обратно против концентрационного градиента, на что нужна энергия АТФ, т. е. поддержка работы кальциевого насоса является энергозависимым процессом;
е. поддержка работы кальциевого насоса является энергозависимым процессом;
— работу мембранного натрий-калиевого насоса, транспортирующего ионы натрия наружу, а ионы калия внутрь клетки против концентрационного градиента, что также требует энергетических затрат;
— обеспечение функционирования специальных калиевых каналов (АТФ-зависимых калиевых каналов — КАТФ-каналов и Са2+-зависимых К+-каналов), которые, присоединяя молекулы АТФ, закрываются, что препятствует выходу ионов калия из этих каналов;
— обеспечение синтетических процессов.
Вся эта энергия используется в соответствии с суммарным количеством АТФазной активности, находящейся в клеточных органеллах. Миофибриллы, которые имеют наибольшую суммарную АТФазную активность, используют примерно 80% энергетических запасов, на ионный транспорт приходится еще 15% и на синтетические процессы — около 5% всей энергии, используемой КМ [22].
В энергетике сердца выделяют 3 фазы [22]:
Фаза образования энергии включает освобождение ионизированного кислорода — прежде всего из окисляемых углеводов, в минимальной степени из жирных кислот и аминокислот — в основном цикле трикарбоновых кислот и его окисление до воды при участии катализаторов транспорта электронов [23];
Фаза кумуляции и транспорта энергии связана с ее депонированием в форме энергии АТФ, образованием КФ и переносом макроэргической фосфатной связи на аденозиндифосфат (АДФ) миофибрилл;
Фаза использования энергии обусловлена трансформацией энергии, образованной при дефосфорилировании АТФ, в сокращение актомиозина и работу миофибрилл. В ходе клеточного метаболизма АТФ распадается до АДФ и аденозинмонофосфата (АМФ), которые, в свою очередь, в физиологических условиях рефосфорилируются в АТФ [22].
В ходе клеточного метаболизма АТФ распадается до АДФ и аденозинмонофосфата (АМФ), которые, в свою очередь, в физиологических условиях рефосфорилируются в АТФ [22].
При этом все макроэргические фосфатные соединения находятся в попарном равновесии между собой [24]. Молекулярные механизмы, лежащие в основе сокращения, являются результатом строго детерминированного взаимодействия контрактильных мышечных белков актина и миозина, образующих соответственно тонкие и толстые нити миофибрилл, и регуляторных протеинов — тропомиозина и тропонина. В мышцах регуляторные белки связаны с актином. Акцептором кальция является кальцийсвязанный протеин — тропонин. При связывании кальция с последним конформационные изменения тропомиозина устраняют стерическую блокаду актиновых центров, и при взаимодействии актина с миозином образуются актинмиозиновые мостики, тянущая сила которых определяет сокращение мышц [24]. Фаза образования и кумуляции энергии проходит в митохондриях. Фаза утилизации (сопряжения и сокращения) реализуется в ретикулуме и миофибриллах.
Гликолитической энергопродукции принадлежит важная роль в поддержании основных процессов гомеостаза миокардиальной клетки, что обеспечивает функционирование кальциевого насоса ретикулума, транспорт макроэргов к контрактильным белкам за счет активации цитоплазматической креатинфосфокиназы, подготовку аминокислот для вовлечения в цикл трикарбоновых кислот, поддержку физиологической продолжительности потенциала действия КМ [28]. АТФ, образованному в процессе гликолиза, отводится важная роль в энергообеспечении физиологической продолжительности потенциала действия мембраны КМ [24]. Дефицит АТФ существенно повышает опасность развития фибрилляции желудочков, что получило подтверждение в условиях эксперимента. С гликолитической продукцией АТФ связан синтез КФ в цитоплазме [22, 28, 31].
Энергетический обмен гипоксически поврежденного миокарда
Существует множество определений термина «гипоксия». С позиции биоэнергетики гипоксия рассматривается как нарушение окислительных путей генерации в клетках, т. е. форма гипоэргоза [4]. Эта дефиниция была предложена С.Н. Эфуни и В.А. Шпектором для обозначения энергетической патологии клетки [32].
е. форма гипоэргоза [4]. Эта дефиниция была предложена С.Н. Эфуни и В.А. Шпектором для обозначения энергетической патологии клетки [32].
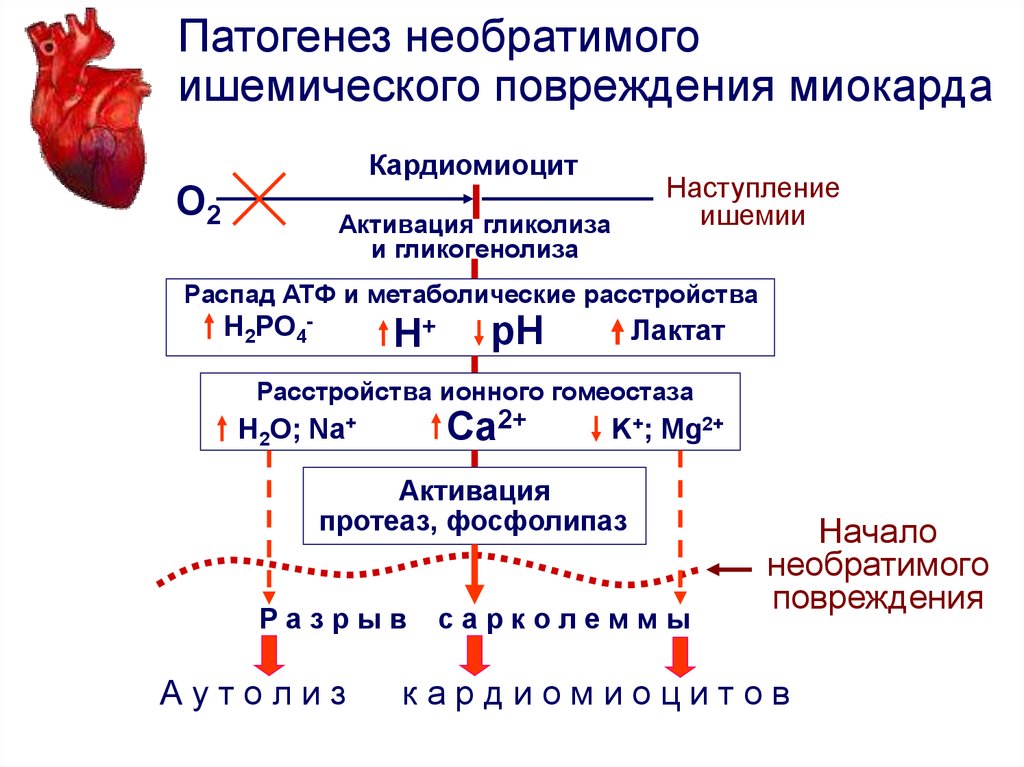
Доказано, что гипоксия, быстро нарушающая синтез АТФ в митохондриях и сопровождающаяся при этом снижением сократительной функции сердца, является первым по времени и основным по значению фактором развития ишемии, которая вызывает ряд глубоких нарушений в метаболизме кардиомиоцитов [24, 27].
В основе развития гипоксии лежит усиление несоответствия между снабжением кислорода клеток и тканей и резким ростом потребности в нем организма в результате интенсификации аэробного обмена на системном уровне, особенно у новорожденных [33, 34]. Для удовлетворения потребностей метаболизма в условиях недостаточного снабжения кислородом тканей развивается цепь биохимических и физиологических изменений, цель которых — обеспечить оптимальное функционирование и, по возможности, восстановление организма на исходном уровне по окончании периода кислородной недостаточности [7, 35].
В условиях ишемии прекращение доставки кислорода к миокарду мобилизует свободный (около 0,07 мл О2 на 100 г ткани) и остаточный кислород сердечной мышцы, главным образом связанный с миоглобином, содержание которого — около 0,5 г на 100 г ткани [23]. В физиологических условиях функция миоглобина как акцептора кислорода, заключается в обеспечении непрерывности поступления кислорода в митохондрии при резком снижении коронарного кровотока в период систолы. Однако это не решает проблему, так как этого количества кислорода достаточно для энергообеспечения лишь 6—7 сердечных сокращений [22]. При гипоксии происходит быстрое истощение резерва кислорода, связанного с гемоглобином и миоглобином, снижается уровень субстратов окисления в тканях, падает активность ферментов. Вследствие этого в митохондриях нарушаются процессы окислительного фосфорилирования, а также транспорт АТФ из митохондрий к местам его использования [23, 24]. Это приводит к снижению концентрации АТФ и КФ и накоплению продуктов метаболизма макроэргов. При этом скорость снижения концентрации КФ существенно больше, чем АТФ, что обусловлено быстрым расходом его на образование АТФ и нарушением транспорта из митохондрий [22, 23]. Характерно, что темп потерь КФ опережает скорость деградации АТФ. Представляет интерес, что в условиях ишемии сердечной мышцы отмечается повышение количества КФ в зоне, граничащей с участком ишемии, носящее компенсаторный характер [36].
При этом скорость снижения концентрации КФ существенно больше, чем АТФ, что обусловлено быстрым расходом его на образование АТФ и нарушением транспорта из митохондрий [22, 23]. Характерно, что темп потерь КФ опережает скорость деградации АТФ. Представляет интерес, что в условиях ишемии сердечной мышцы отмечается повышение количества КФ в зоне, граничащей с участком ишемии, носящее компенсаторный характер [36].
Несмотря на усиление гликолитической энергопродукции, острая ишемия резко тормозит темп синтеза макроэргов, что ведет к нарушению энергообеспечения функций и гомеостаза ишемизированных КМ [22]. Одновременно с нарушением синтеза АТФ в митохондриях и накоплением восстановленных форм компонентов дыхательной цепи в ишемизированной ткани происходит мобилизация аварийных компенсаторных механизмов энергообеспечения, в частности, гликолитической продукции макроэргов [37].
При длительной и тяжелой гипоксии происходит переход метаболизма на анаэробный путь с увеличением утилизации различных субстратов и прекращение синтетических процессов, о чем свидетельствует интенсификация процессов перекисного окисления липидов (ПОЛ) [38—40]. Ранний переход от окислительного метаболизма к анаэробной продукции энергии обеспечивается активацией фосфорилазы и повышением транспорта глюкозы в ишемизированных клетках миокарда.
Ранний переход от окислительного метаболизма к анаэробной продукции энергии обеспечивается активацией фосфорилазы и повышением транспорта глюкозы в ишемизированных клетках миокарда.
Однако усиление анаэробного гликолиза, которое можно рассматривать как компенсаторную реакцию, направленную на восполнение энергозатрат в условиях гипоксии, является неэффективным механизмом, поскольку это дает очень малый выход энергии: из одной молекулы глюкозы образуются только две молекулы АТФ [24].
Известно, что в начальной стадии ишемии наблюдается универсальная первичная реакция митохондрий — эффект «мягкого разобщения» [22]. В случае уменьшения напряжения кислорода в сердечной мышце ниже 3—5 мм рт.ст. тормозится не только окисление субстратов цикла трикарбоновых кислот, но и связанное с ним фосфорилирование, причем его скорость резко падает. При длительной ишемии снижается способность митохондрий КМ использовать NAD·H-зависимые субстраты [22, 41]. Накопление NAD·Н, лактата и протонов приводит к ингибированию ферментов гликолиза и нарушению энергообеспечения процессов поддержания гомеостаза в ишемизированных КМ. К концу 60-й минуты ишемии гликолиз тормозится полностью, содержание адениновых нуклеотидов при этом падает на 69%, а АТФ — на 94% [22]. В свою очередь транспорт и использование АТФ, который производится в цикле Эмбдена-Мейергофа вследствие торможения активности цитоплазматических изоформ КФ, блокирует падение рН менее 6,6 [23].
К концу 60-й минуты ишемии гликолиз тормозится полностью, содержание адениновых нуклеотидов при этом падает на 69%, а АТФ — на 94% [22]. В свою очередь транспорт и использование АТФ, который производится в цикле Эмбдена-Мейергофа вследствие торможения активности цитоплазматических изоформ КФ, блокирует падение рН менее 6,6 [23].
Снижение содержания окисленной формы никотинамидных коферментов является «ахиллесовой пятой» при гипоксии, потому что, выполняя функцию переносчиков водорода, NAD, NADP и их восстановленные формы участвуют в процессах клеточного дыхания, которые при дефиците кислорода нарушаются в первую очередь [22, 42—45]. Изменение соотношения окисленных и восстановленных их форм, в свою очередь, может служить одной из причин нарушений окислительно-восстановительных процессов в цикле трикарбоновых кислот и сопряженного с ним окислительного фосфорилирования, окисления жирных кислот и других путей обмена веществ, участвующих в адаптации организма к гипоксии [24]. Кроме того что АТФ служит непосредственным источником энергии для большинства клеточных метаболических процессов, он также регулирует активность многих ферментов. Достаточная внутриклеточная концентрация АТФ — необходимое условие для обеспечения клеточной функции и выживания, однако для метаболической регуляции не менее важно соотношение АТФ и других адениновых нуклеотидов («адениновый заряд энергии» или «потенциал фосфорилирования») [2].
Достаточная внутриклеточная концентрация АТФ — необходимое условие для обеспечения клеточной функции и выживания, однако для метаболической регуляции не менее важно соотношение АТФ и других адениновых нуклеотидов («адениновый заряд энергии» или «потенциал фосфорилирования») [2].
При гипоксии снижается энергетический заряд, поскольку фосфорилирование АДФ в АТФ нарушено [46—49]. Это ведет к увеличению концентрации АМФ, который образуется из АДФ при участии аденилаткиназы. Другое следствие — снижение общего пула адениновых нуклеотидов вследствие стимуляции катаболизма нуклеотидов. Это происходит посредством участия АМФ-дезаминазы — фермента, активирующегося при снижении энергетического заряда. Продуктами этого нарушенного пути являются инозинмонофосфат (ИМФ), инозин, гипоксантин, ксантин и мочевая кислота. Альтернативным вариантом катаболизма АМФ является первичное дефосфорилирование аденозина в инозин. Значение этого пути заключается в том, что аденозин является сильнодействующим вазодилататором и, как было установлено, играет роль в защитной реакции миокарда на гипоксию [2, 50, 51]. Адениновые нуклеотиды и ИМФ остаются внутри клетки, тогда как пуриновые нуклеозиды (аденозин, инозин) и производные (гипоксантин, ксантин, мочевая кислота) выходят в экстрацелюлярное пространство [35]. Небольшое количество АМФ дефосфорилируется в аденозин, далее из миоцита поступает в эндотелиальную клетку, где необратимо метаболизируется до гипоксантина, который затем под действием ксантиндегидрогеназы превращается в мочевую кислоту и выводится почками [4].
Адениновые нуклеотиды и ИМФ остаются внутри клетки, тогда как пуриновые нуклеозиды (аденозин, инозин) и производные (гипоксантин, ксантин, мочевая кислота) выходят в экстрацелюлярное пространство [35]. Небольшое количество АМФ дефосфорилируется в аденозин, далее из миоцита поступает в эндотелиальную клетку, где необратимо метаболизируется до гипоксантина, который затем под действием ксантиндегидрогеназы превращается в мочевую кислоту и выводится почками [4].
В отличие от адениннуклеотидов аденозин может выходить из клетки и в обычных условиях. Его молекула как бы осуществляет обратную связь, с помощью которой клетка сама регулирует свое кровоснабжение. Если содержание АТФ уменьшается, то аденозин образуется в избыточном количестве и, диффундируя к артериолам, увеличивает капиллярный кровоток, вследствие чего КМ получает достаточное количество кислорода [41, 47]. В условиях ишемии эта молекула выступает как природный ингибитор адренорецепторов КМ, клетки становятся невосприимчивыми к симпатической стимуляции, что, несомненно, сохраняет их энергию, в результате чего увеличивается жизнеспособность клеток в неблагоприятных условиях [52].
По завершению гипоксии отношение концентрации нуклеотидов — быстро, а размеры их пулов — более медленно, возобновляются. На этой стадии аденозин и гипоксантин могут быть утилизированы для синтеза нуклеотидов («спасительный путь») при меньших энергетических затратах, чем синтез пуринов de novo [24].
Как известно, при активации гликолиза вследствие накопления недоокисленных продуктов образуется лактат и повышается концентрация ионов водорода [51, 53—55]. В аэробных условиях продукты метаболизма обычно используются в митохондриях, однако при выключении функции этих клеточных органелл в условиях ишемии недоокисленные продукты накапливаются. Таким образом, происходит смещение реакции среды КМ в кислую сторону, что приводит к развитию внутриклеточного ацидоза [56—59].
По данным литературы, снижение рН на 0,5—1,7 после 30-минутной ишемии вызывает падение механической функции сердца на 30—100% [22]. Доказано, что жесткий ацидоз (рН менее 6,6) является инициирующим фактором клеточной альтерации. В миокарде повышается концентрация свободного кальция, а наличие неорганического фосфата способствует его перемещению к митохондриям [24], активирует освобождение «миокардиальных» катехоламинов, повышает активность фосфолипаз, активирует кислые лизосомальные протеазы, индуцирует развитие так называемого пероксидного стресса (накопление Н2О2, стимуляция перекисного окисления липидов). Это еще более увеличивает энергетическую недостаточность сердечной мышцы, что приводит к необратимым изменениям в ишемизированном миокарде [42, 60—62].
В миокарде повышается концентрация свободного кальция, а наличие неорганического фосфата способствует его перемещению к митохондриям [24], активирует освобождение «миокардиальных» катехоламинов, повышает активность фосфолипаз, активирует кислые лизосомальные протеазы, индуцирует развитие так называемого пероксидного стресса (накопление Н2О2, стимуляция перекисного окисления липидов). Это еще более увеличивает энергетическую недостаточность сердечной мышцы, что приводит к необратимым изменениям в ишемизированном миокарде [42, 60—62].
Как известно, ацидоз подавляет АТФазную активность миозина [56]. Он вызывает нарушениезахвата Са2+саркоплазматическим ретикулумом [22]. Повышение концентрации протонов ухудшает взаимодействие Са2+ с тропонином и процесс его депонирования в саркоплазматическом ретикулуме [59]. Одновременно внутриклеточный ацидоз сопровождается деградацией миозина за счет диссоциации его легких цепей и диффузии их в кровь [22]. Увеличение концентрации Са2+ в сократительных белках приводит к тому, что отсоединение «головок» миозина от центров актина становится невозможным, нарушается процесс диастолического расслабления, развивается контрактура, характерная для гипоксии [33]. Ухудшению сократимости миокарда способствует и накопление фосфатов в клетке, образующегося в результате неконтролируемого распада АТФ до АДФ И АМФ. Накопление фосфатов наряду с ацидозом снижает чувствительность миофибрилл к ионам кальция.
Увеличение концентрации Са2+ в сократительных белках приводит к тому, что отсоединение «головок» миозина от центров актина становится невозможным, нарушается процесс диастолического расслабления, развивается контрактура, характерная для гипоксии [33]. Ухудшению сократимости миокарда способствует и накопление фосфатов в клетке, образующегося в результате неконтролируемого распада АТФ до АДФ И АМФ. Накопление фосфатов наряду с ацидозом снижает чувствительность миофибрилл к ионам кальция.
Поскольку кислород является акцептором электронов на конечном этапе электроннотранспортной цепи, снижение содержания кислорода в митохондриях ниже «критического давления кислорода» (1—2 мм рт.ст.) приводит к замедлению скорости всего процесса. В результате этого начинает накапливаться АДФ, поскольку он больше не превращается в АТФ. НАДФ перестает реокисляться, и отношение НАД/НАДФ в митохондриях начинает снижаться [2].
Существовавшее ранее представление о митохондриях как о специализированных органеллах, контролирующих исключительно энергетический обмен, в настоящее время дополнено сведениями о них как об органеллах, содержащих факторы, определяющие судьбу клетки [8, 63, 64]. Доказано, что митохондрии ответственны за функционирование и регулирование большого числа сигнальных путей, которые обеспечивают не только митохондриальный биогенез и пролиферацию клеток, но и, наоборот, запрограммированную гибель клетки посредством ограничения окислительно-восстановительных реакций [8].
Доказано, что митохондрии ответственны за функционирование и регулирование большого числа сигнальных путей, которые обеспечивают не только митохондриальный биогенез и пролиферацию клеток, но и, наоборот, запрограммированную гибель клетки посредством ограничения окислительно-восстановительных реакций [8].
В настоящее время достаточно изученным из митохондриальных факторов, регулирующих метаболическую и функциональную активность клетки, является митохондриальный АТФ-зависимый калиевый канал (КАТФ-канал; ATP-sensitiveK+ channels). Установлено, что воздействие хронической гипоксии приводит к активации митохондриальных КАТФ-каналов в миокарде [65], которые вне гипоксии при наличии достаточного количества молекул АТФ закрыты. Если же количество молекул АТФ уменьшается, то калиевые каналы открываются и ионы калия выходят во внеклеточную среду. При этом, как известно, потери ионов калия приводят к тому, что КМ утрачивает способность к возбуждению.
Доказано, что умеренная хроническая гипоксия приводит к увеличению синтеза белка SUR2Aт (регуляторная субъединица КАТФ-канала) и возрастанию плотности этих каналов на мембранах кардиомиоцитов по механизму, который не зависит от HIF-1α (hypoxia inducible factor 1 alpha) [66, 67]. Последний, как известно, представляет собой субъединицу гетеродимерного белка HIF-1, причем, в отличие от его β-субъединицы, экспрессируемой постоянно, α-субъединица регулируется уровнем кислорода [68—70]. В состоянии кислорододефицита белковая молекула HIF-1α не гидроксилируется, остается стабильной, происходит их накопление. В последующем эти субъединицы (HIF-1α, HIF-1β) объединяются, и образовавшийся в результате этого транскрипционный белок HIF-1 в ядре клетки связывается с особыми последовательностями ДНК в генах, экспрессия которых индуцируется гипоксией [67, 68, 71].
Последний, как известно, представляет собой субъединицу гетеродимерного белка HIF-1, причем, в отличие от его β-субъединицы, экспрессируемой постоянно, α-субъединица регулируется уровнем кислорода [68—70]. В состоянии кислорододефицита белковая молекула HIF-1α не гидроксилируется, остается стабильной, происходит их накопление. В последующем эти субъединицы (HIF-1α, HIF-1β) объединяются, и образовавшийся в результате этого транскрипционный белок HIF-1 в ядре клетки связывается с особыми последовательностями ДНК в генах, экспрессия которых индуцируется гипоксией [67, 68, 71].
Активация КАТФ-каналов в условиях хронической гипоксии приводит к увеличению устойчивости пор, регулирующих проницаемость митохондрий — МРТ-пор (mitochondrial transition pore). Открытие этих пор провоцирует набухание митохондрий, приводит к разобщению окислительного фосфорилирования и выходу из митохондрий цитохрома С и белка AIF (apoptosis-inducing factor) [72]. Именно эти вещества катализируют превращение неактивной прокаспазы-9 в активную каспазу-9; последняя, в свою очередь, активирует превращение прокаспазы-3 в каспазу-3, что в конечном итоге приводит к апоптозу [73].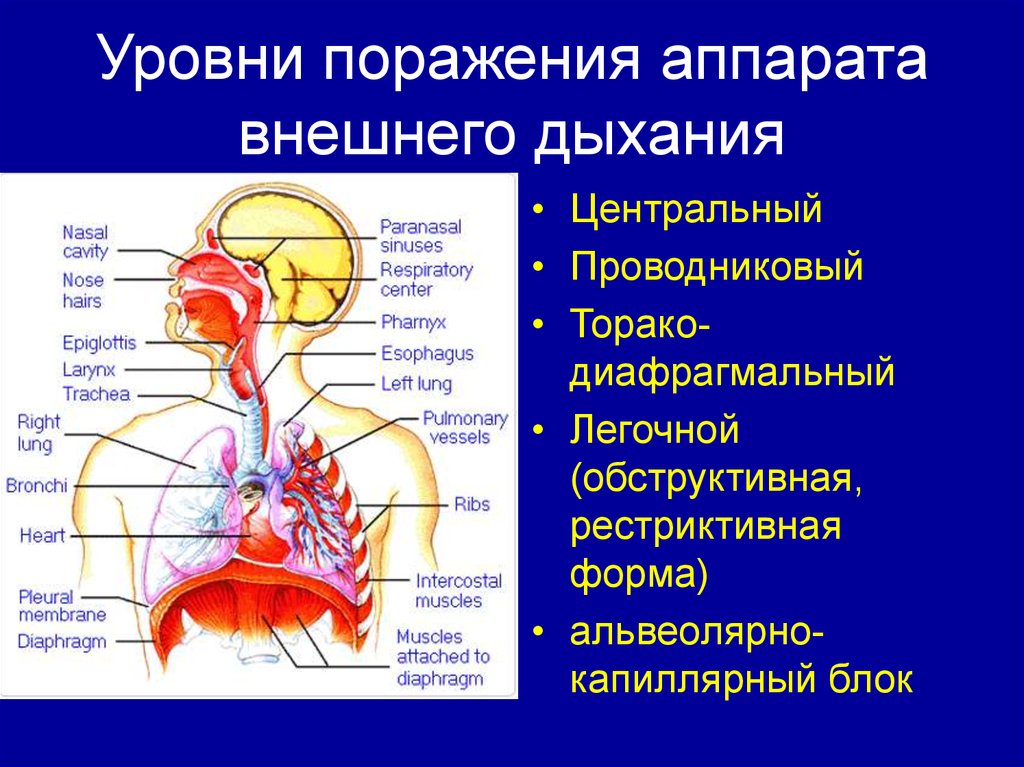
МРТ-пора, ответственная за проницаемость митохондрий, модулируется еще одним К+-каналом: Са2+-зависимым К+-каналом митохондрий (BKCa Big-conductance Ca2+-activated K+ channel) [74—77]. Установлено, что открытие этих каналов сопровождается увеличением продукции O2—*.
Как известно, цитохромы дыхательной цепи митохондрий — это кислород-чувствительные ферменты и основные источники активных форм кислорода (АФК) в клетке [78, 79]. При развитии ишемии увеличение продукции АФК компонентами электронно-транспортной цепи возрастает лавинообразно [79, 80]. Примечательно, что наибольшее содержание АФК регистрируется в миокарде при длительной (более 30 мин) ишемии, характеризующейся очень низким уровнем кислорода в ткани миокарда [54, 79]. Предполагается, что гипоксия сопровождается увеличением количества восстановленных форм переносчиков дыхательной цепи (НАД, коэнзим Q и др.), подвергающиеся аутоокислению с образованием АФК даже при низких концентрациях кислорода [54].
Трудно недооценить роль АФК в развитии ишемии миокарда [78—81]. Установлено, что АФК выступают важным фактором ишемического повреждения миокарда [82—85] и аритмогенеза [86, 87].
Немаловажную роль в предотвращении нарушений микроциркуляции, развивающихся при ишемии, отводится состоятельности регулирующей системы «NO-синтаза (NOS) — оксид азота» [88—92]. Помимо вазомоторных эффектов радикала оксида азота (NO*) в настоящее время открыто множество его внутриклеточных функций. Установлено, что NO* может конкурентно ингибировать цитохромоксидазу, тем самым участвуя в регуляции выработки супероксидного радикала и перекиси водорода [55]. Оксид азота способен активировать митохондриальные АТФ-чувствительные К+-каналы, предупреждать образование MPT-пор и регулировать митохондриальный биогенез [93]. Оксид азота активирует растворимую гуанилатциклазу, что ведет к выработке цГМФ с последующей активацией протеинкиназы С и ее регуляторного каскада [90].
Метаболические расстройства, развивающиеся при ишемии, можно охарактеризовать как накопление ионов водорода и фосфата, а также увеличенный выход аденозина и ионов калия из клетки [89, 94—101]. Эти метаболические последствия ишемии фактически направлены на защиту клеточного метаболизма, ресурсов клеток от быстрого использования. По сути при глубокой ишемии клетки впадают в состояние гибернации, основная цель которой — обеспечить жизнеспособность клеток в ожидании возможного восстановления кровотока. По даннымS. Rahimtoola, давшего название этому феномену в 1984 г. [102]: «Гибернация миокарда — это тонкий механизм регуляции, адаптирующий функциональную активность миокарда к конкретным условиям кровоснабжения, т.е. это защитная реакция страдающего сердца». Быстрая реперфузия, т.е. восстановление кровотока к исходному уровню в таком гибернированном сердце, устраняет этот метаболический защитный механизм и способна возродить сократительную функцию миокарда [83]. По образному выражению L. Opie [29]: «Участки пораженного миокарда находятся как бы в уснувшем состоянии, но способны проснуться после восстановления кровотока». При этом степень и качество его восстановления зависят прежде всего от продолжительности ишемического периода.
Эти метаболические последствия ишемии фактически направлены на защиту клеточного метаболизма, ресурсов клеток от быстрого использования. По сути при глубокой ишемии клетки впадают в состояние гибернации, основная цель которой — обеспечить жизнеспособность клеток в ожидании возможного восстановления кровотока. По даннымS. Rahimtoola, давшего название этому феномену в 1984 г. [102]: «Гибернация миокарда — это тонкий механизм регуляции, адаптирующий функциональную активность миокарда к конкретным условиям кровоснабжения, т.е. это защитная реакция страдающего сердца». Быстрая реперфузия, т.е. восстановление кровотока к исходному уровню в таком гибернированном сердце, устраняет этот метаболический защитный механизм и способна возродить сократительную функцию миокарда [83]. По образному выражению L. Opie [29]: «Участки пораженного миокарда находятся как бы в уснувшем состоянии, но способны проснуться после восстановления кровотока». При этом степень и качество его восстановления зависят прежде всего от продолжительности ишемического периода. Восстановление энергетического метаболизма после кратковременной ишемии (не более 5 мин) происходит полностью. Более того, КМ приобретают повышенную резистентность к следующему ишемическому воздействию [3, 100, 101]. Однако, если кровоток восстанавливается после периода длительной ишемии, то сократительная функция сердца может возобновиться и в условиях неполного энергетического ресурса клетки. Для такого состояния в литературе используется термин «оглушенный» или реперфузионный миокард [99, 101, 102]. Основной проблемой этого состояния является продолжение повреждения внутриклеточных структур, которое в значительной степени обусловлено действием свободных радикалов кислорода, образующихся в большом количестве при реперфузии поврежденного участка, которая возвращает кислород в ишемизированные клетки [3, 85].
Восстановление энергетического метаболизма после кратковременной ишемии (не более 5 мин) происходит полностью. Более того, КМ приобретают повышенную резистентность к следующему ишемическому воздействию [3, 100, 101]. Однако, если кровоток восстанавливается после периода длительной ишемии, то сократительная функция сердца может возобновиться и в условиях неполного энергетического ресурса клетки. Для такого состояния в литературе используется термин «оглушенный» или реперфузионный миокард [99, 101, 102]. Основной проблемой этого состояния является продолжение повреждения внутриклеточных структур, которое в значительной степени обусловлено действием свободных радикалов кислорода, образующихся в большом количестве при реперфузии поврежденного участка, которая возвращает кислород в ишемизированные клетки [3, 85].
Причиной длительного снижения контрактильности миокарда принято считать реперфузионное повреждение [3, 101]. Миокард в стадии реперфузии, даже после кратковременной, обратимой ишемии выявляет длительное угнетение контрактильной функции, что является следствием ультраструктурных, метаболических, сосудистых, электрофизиологических и других нарушений [3, 84].
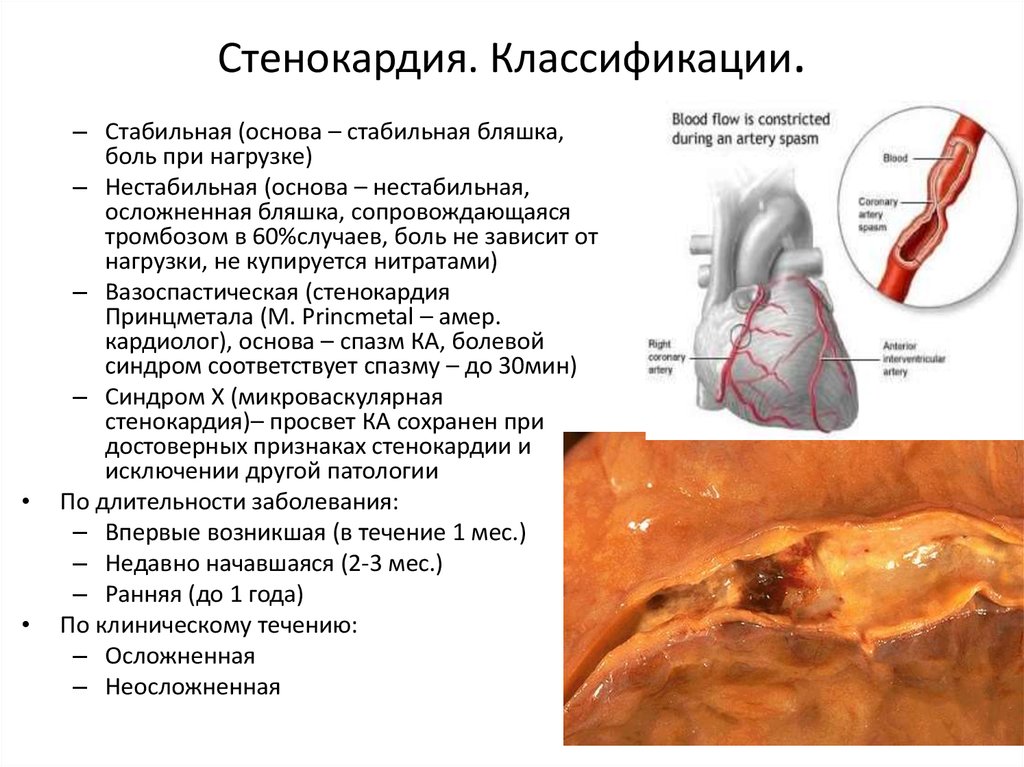
Исходя из этого следует различать понятие «спящий»/ «гибернирующий» (hibernating myocardium) и «оглушенный»/ «реперфузионный» (miocardial stunning) миокард. «Спящий» миокард возникает при хронической ишемии, «оглушенный» — в ходе реперфузии, после непостоянной ишемии (см. таблицу).
Основные дифференциально-диагностические отличия функционального состояния миокарда при гибернации и «оглушенности»
При «спящем» миокарде кровоток хронически снижен, при «оглушенном» — нормальный или почти нормальный [14]. Это наиболее важные различия. Функция левого желудочка в обоих случаях снижена. При «спящем» миокарде сохраняется соответствие между изменением его функции и нарушением кровотока, при «оглушенном» этого соответствия нет: функция левого желудочка и сократимость нарушены, развивается ишемическая дисфункция, в то же время кровоток отстается нормальным или почти нормальным [63, 99]. При «оглушенном» миокарде наблюдается спонтанное постепенное восстановление функции сердечной мышцы. Глубокое угнетение его функции при «спящем» миокарде продолжается неопределенно долго, и если коронарный кровоток не улучшается, то происходит прогрессирование изменений вплоть до некроза сердечной мышцы. Функция левого желудочка восстанавливается только при нормализации кровотока [14].
Глубокое угнетение его функции при «спящем» миокарде продолжается неопределенно долго, и если коронарный кровоток не улучшается, то происходит прогрессирование изменений вплоть до некроза сердечной мышцы. Функция левого желудочка восстанавливается только при нормализации кровотока [14].
Таким образом, ишемия приводит к выраженным нарушениям процессов энергообразования и повреждению клеточных структур миокарда, особенно после возобновления поставки кислорода, т.е. реперфузии. Переключение на анаэробные метаболические пути приводит к тому, что запасы АТФ снижаются, т.к. последний превращается в АДФ и АМФ с ограниченной возможностью рефосфорилирования. При более тяжелом или более длительном дефиците кислорода поддержание достаточных уровней богатых энергией фосфатных соединений, особенно АТФ, становится невозможным. Большая часть энергозависимых процессов замедляется или прекращается. Это ведет к более глубоким нарушениям клеточной функции, неспособности поддерживать ионное равновесие и, в конечном итоге, к гибели клетки.
Авторы заявляют об отсутствии конфликта интересов.
Гипоксия, что за болезнь, симптомы, диагностика, лечение
Американская
медицинская клиника
Санкт-Петербург, набережная реки Мойки, д. 78.
+7 (812) 740-20-90
Содержание:
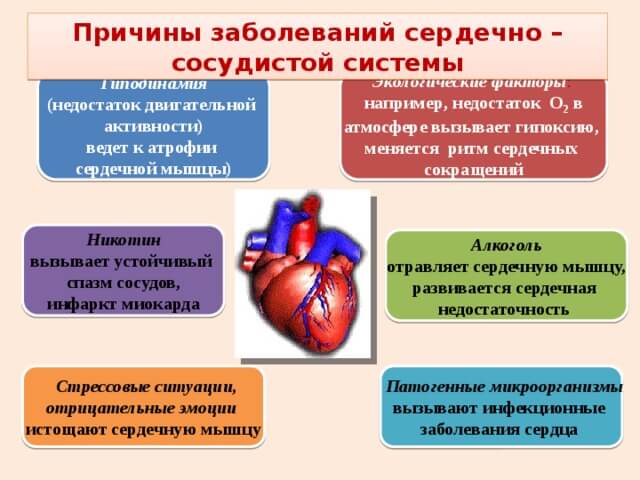
Гипоксия — заболевание, которое возникает в результате нехватки кислорода при его недостаточном поступлении к органам и тканям.
Симптомы гипоксии
Кислород — один из важнейших элементов, который обеспечивает обменные процессы всего организма. Тяжелее всего его нехватку переносит мозг. Поэтому гипоксия мозга может иметь серьезные последствия. Она имеет следующую симптоматику:
-
Первый этап:-
повышенная возбудимость — излишняя энергичность, беспричинное состояние эйфории -
проблема координации движений — шаткая походка, бесконтрольные сокращения мышц -
неестественность кожного покрова — излишняя бледность и синюшность, либо наоборот чрезмерное покраснение
-
-
Второй этап:-
заторможенность — в связи со снижением активной нервной системы -
тошнота и сильная рвота -
головокружение -
потемнение в глазах и потеря сознания
-
В наиболее тяжелых случаях происходит отёк мозга. В этом случае последствия гипоксии могут быть самыми тяжёлыми. Больной теряет условные и безусловные рефлексы, органы прекращают свою нормальную работу, что в итоге приводит к глубокому комовому состоянию.
В этом случае последствия гипоксии могут быть самыми тяжёлыми. Больной теряет условные и безусловные рефлексы, органы прекращают свою нормальную работу, что в итоге приводит к глубокому комовому состоянию.
Проконсультируйтесь с терапевтом
Не откладывайте лечение
Записаться
Я принимаю условия пользовательского соглашения и даю согласие на обработку персональных данных в соответствии с требованиями «152-ФЗ»
Гипоксия плода
Когда ребенок находится в утробе, его легкие еще не сформированы, однако ему все равно требуется кислород. Его он получает через материнскую плаценту.
Поэтому гипоксия плода развивается на фоне проблем со здоровьем матери:
-
дефицит железа или анемия — приводят к снижению гемоглобина, что в свою очередь снижает количество кислорода в крови женщины, а значит и поступление его плоду -
плацентарная недостаточность — ухудшает обмен необходимыми питательными веществами (в том числе и кислородом) между женщиной и плодом -
употребление алкоголя и табака — никотин и алкоголь сужают сосуды и тем самым блокируют поступление кислорода к плоду -
сердечно — сосудистые заболевания женщины -
нервозные состояния и стрессы -
гестоз, перенашивание, многоплодие и многоводие
Установить гипоксию плода может сама мама.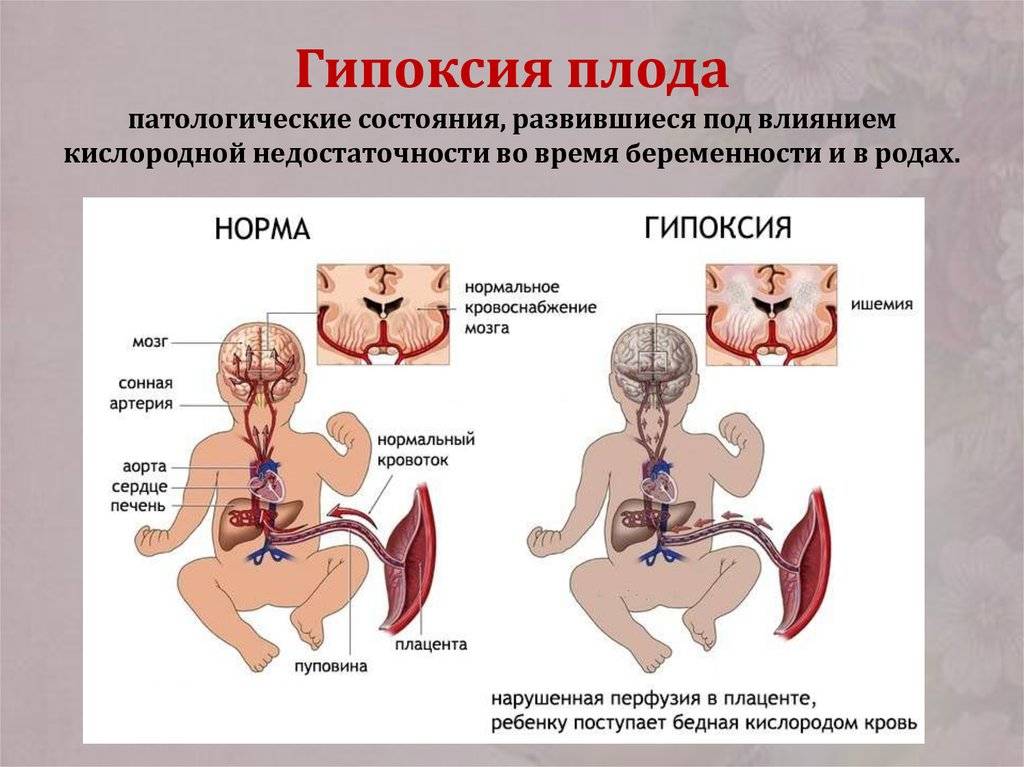 Если Вы заметили резкое снижение активности шевеления, его общую вялость, то это повод обратиться к врачу за обследованием!
Если Вы заметили резкое снижение активности шевеления, его общую вялость, то это повод обратиться к врачу за обследованием!
Последствия гипоксии плода — на ранних стадиях беременности — неправильное формирование органов ребенка, замедленное развитие эмбриона. На более поздних — поражение центральной нервной системы, отклонения в физическом развитии, тяжелое привыкание к жизни вне материнской утробы — плохой аппетит, нарушения вегетативной нервной системы.
Проконсультируйтесь с акушером-гинекологом
Не откладывайте лечение
Записаться
Я принимаю условия пользовательского соглашения и даю согласие на обработку персональных данных в соответствии с требованиями «152-ФЗ»
Почему стоит выбрать Американскую Медицинскую Клинику?
-
Команда профессионалов. В клинике 24 часа в сутки 7 дней в неделю работают кандидаты и доктора медицинских наук, профессора и доценты кафедр ведущих вузов, врачи первой и высшей квалификационной категории. Мы трудимся без праздников и выходных для того, чтобы вы были здоровы и счастливы.
Мы трудимся без праздников и выходных для того, чтобы вы были здоровы и счастливы. -
Регулярное повышение квалификации. Каждый врач на регулярной основе проходит курсы повышения квалификации, посещает семинары, ездит на стажировки, участвует в конференциях, проходит обучение за границей. Это помогает поддерживать квалификацию врачей на высшем уровне. На сегодняшний день подготовка докторов АМК позволяет им обучать молодых докторов, выступая в качестве экспертов на семинарах европейского уровня. -
Передовые технологии. Мы регулярно инвестируем средства не только в обучение и профессиональное развитие персонала, но и в приобретение самого современного оборудования ведущих европейских производителей. -
Ценность времени. В Американской Медицинской Клинике созданы все условия для комфортного проведения комплексного обследования и диагностики пациента в день обращения. -
Доверие со стороны клиентов. За 25 лет безупречной работы свое здоровье нам доверили более чем 500 000 пациентов. Более 80% пациентов рекомендуют нас своим родным и близким.
За 25 лет безупречной работы свое здоровье нам доверили более чем 500 000 пациентов. Более 80% пациентов рекомендуют нас своим родным и близким. -
Гарантии. Мы несем 100 % ответственность за качество предоставляемых услуг, высокий уровень которых подтвержден многолетним опытом работы. Внимание и чуткое отношение врачей с более чем десятилетним стажем медицинской практики дают устойчивый положительный результат.
Смотрите также:
-
Эндоскопия желудка -
Платные операции на желчном пузыре -
Операции по гинекологии -
Платная операция паховой грыжи
Наши врачи class= class= class= class= class=
Зерцалова Елена Николаевна
Врач высшей квалификационной категории
Маркович Александр Леонидович
Кардиолог, врач общей практики
Мищук Марина Викторовна
Заместитель главного врача по клинико-экспертной работе
Окользина Татьяна Ридовна
Врач терапевт, визовый осмотр
Гипоксия миокарда сердца: симптомы, причины, последствия, лечение
Сердце представляет собой самый главный орган человека, который необходимо беречь и оберегать. Но что делать, если с ним проблемы? Так ли опасна гипоксия миокарда, и чем она грозит?
Но что делать, если с ним проблемы? Так ли опасна гипоксия миокарда, и чем она грозит?
Диагноз гипоксии слышат сейчас многие, но особенности патологии мало кто знает. Что же такое гипоксия сердца и как её лечить?
Гипоксия – это недостаточное получение кислорода тем или иным органом организма, иными словами, просто кислородная недостаточность. Существует множество видов данной патологии. Что касается гипоксии сердца, её ещё называют гипоксией миокарда — это когда сердечная мышца сердца миокарда ощущает дефицит кислорода. Заболевание может развиться при наличии стенокардии, ишемической болезни сердца, при инфаркте миокарда и при других проблемах сердца.
При наступлении кислородного голодания сильно нарушаются функции клеток сердечной мышцы, они перестают дышать, что приводит их к гибели. А гибель клеток миокарда в свою очередь является началом некроза (отмирание клеток) миокарда. По степени тяжести патология подразделяется на лёгкую, умеренную гипоксию миокарда, тяжёлую или критическую.
Что такое гипоксия миокарда?
В первую очередь больной начинает страдать от учащённого сердцебиения, такое состояние называется тахикардия. Почему это происходит? Очень просто, потому что сердце, которому не хватает кислорода, пытается компенсировать этот дефицит, ускоряя свою работу. Сердечная мышца испытывает необоснованную нагрузку и начинает слабеть. Отсюда возникают сбои в работе самого органа и аритмии. Итог подобного состояния может быть совсем не утешительным, вплоть до фибрилляции желудочков.
Давление в ходе кислородного недостатка может повыситься, но потом оно резко снижается. При молниеносной форме данной патологии выше перечисленных признаков может и не быть. Имеет место мгновенный летальный исход при остановке сердца.
Признаки гипоксии миокарда
Симптомы гипоксии сердца бывают разными и практически всегда зависят от стадии заболевания, длительности воздействия и причин развития.
Острая гипоксия отличается более яркой картиной и тяжёлыми быстро развивающимися последствиями для организма, которые часто являются необратимыми. Признаки умеренной гипоксии миокарда или хронической говорят о медленном развитии заболевания, позволяют организму больного адаптироваться к ней, поэтому такие больные, испытывая хронические лёгочные заболевания, живут долгое время без серьёзных приступов. Хотя эта стадия заболевания тоже приводит к необратимым последствиям.
Признаки умеренной гипоксии миокарда или хронической говорят о медленном развитии заболевания, позволяют организму больного адаптироваться к ней, поэтому такие больные, испытывая хронические лёгочные заболевания, живут долгое время без серьёзных приступов. Хотя эта стадия заболевания тоже приводит к необратимым последствиям.
Причины гипоксии миокарда
Причины гипоксия сердца требуют тщательного рассмотрения и подразделяются на две группы. К первой относится ряд сопутствующих заболеваний:
- стенокардия;
- атеросклероз;
- ишемическая болезнь и др.
Вторая группа это не специфические факторы, которые провоцируют заболевание. К примеру, излишние физические нагрузки, а также курение, малоактивный образ жизни.
У гипоксии есть несколько классификаци, например, гипоксическое состояние — это состояние, характеризующееся понижением давления при вдохе, при затрудненном приникновении кислорода в кровь через дыхательные пути и при расстройстве дыхательного процесса.
Лечение гипоксии миокарда
Что делать, если подобная нехватка кислорода дала о себе знать? Лечение гипоксии сердца должно быть направлено на устранение провоцирующих факторов, борьбу с дефицитом кислорода, коррекцию изменений в системе гомеостаза. Иногда достаточно обычного проветривания помещения или прогулок на свежем воздухе. В случаях кислородного голодания, которое явилось следствием заболеваний сердца, лёгких, крови или отравлений, необходимы более действенные меры.
- При гипоксической (экзогенной) гипоксии применяют кислородное оборудование (кислородные маски, баллончики, подушки и т.д.).
- Если наблюдается дыхательный (респираторный) недостаток кислорода, специалисты используют бронхорасширяющие препараты, антигипоксанты, дыхательные аналептики, а также концентраторы кислорода или централизованную подачу кислорода вплоть до искусственной вентиляции лёгких. При хронической форме данного заболевания лечение кислородом становится одним из главных пунктов врачебного вмешательства.
- При гемической переливают кровь, стимулируют кроветворение, лечат кислородом.
- Коррегирующие операции на сердце и сосудах осуществляют при циркуляторной гипоксии, добавляя сердечные гликозиды и прочие средства с кардиотропным эффектом. Антиагреганты, антикоагуллянты с целью улучшения микроциркуляции. Нередко используется кислородотерапия.
- Для гистоксической (тканевой) прописывают антидоты при отравлении, искусственную вентиляцию лёгких, препараты, которые улучшают утилизацию кислорода тканями, гипербарическую оксигенацию.
Как понятно из вышеперечисленного, почти при всех типах гипоксии применяют лечение кислородом от концентратора вещества до искусственной вентиляции лёгких. Кроме того, для борьбы с патологией прибегают к помощи препаратов, позволяющих восстановить кислотно-щелочное равновесие в крови, нейро и кардиопротекторы .
Гипоксия миокарда левого желудочка
Гипоксия миокарда желудочков может привести к ишемии, что особенно опасно.
Часто подобное кислородное голодание называют гипоксией левого желудочка сердца, поскольку максимальной чувствительностью к возникновению данной патологии обладает именно левый желудочек, менее значительной — соответственно, правый, что обусловлено содержанием миозина и актина. Миозина в желудочке сердца больше, нежели в предсердиях, а актина больше в левом желудочке в сравнении с правым.
Теги по теме:
гипоксия сердца причиныпризнаки умеренной гипоксии миокардагипоксия сердцачто это такоеумеренная гипоксия миокардагипоксия сердца симптомыгипоксия сердца лечениегипоксия левого желудочка сердцагипоксия миокарда желудочков
Оцените материал:
Гипоксия плода при беременности – признаки, причины, симптомы, диагностика и лечение в «СМ-Клиника»
Лечением данного заболевания занимается Гинеколог
Записаться онлайн
Заказать звонок
- О заболевании и признаки гипоксии у плода
- Виды
- Симптомы внутриутробной гипоксии плода
- Причины
- Диагностика гипоксии плода
- Лечение
- Профилактика
- Реабилитация
- Вопросы и ответы
- Мнение эксперта
- Врачи
О заболевании и признаки гипоксии у плода
Признаки гипоксии плода при беременности могут определяться с помощью аускультации, допплерометрии (ультразвуковой оценки кровотока) и оценки биофизического профиля.
Аускультативными признаками гипоксии считается изменение частоты сердечных сокращений плода. В норме они должны быть в диапазоне 110-170 ударов в минуту. Учащение (более 170 ударов в минуту) и урежение (менее 110 ударов в минуту) могут свидетельствовать о нарушении кислородного обеспечения плодового организма. Аускультативные критерии диагностики гипоксии могут быть применены в клинической практике, начиная с 20-й недели гестации.
Биофизический профиль плода предполагает комплексную (балльную) оценку основных жизненных показателей (дыхания, тонуса, сердечной деятельности, двигательной активности и объема околоплодных вод). Определение этих параметров проводится с помощью УЗИ и фонокардиотокографии (ФКТГ). Для диагностики гипоксии плода биофизический профиль может применяться не ранее 30-й недели гестации.
Допплерометрическая оценка кровотока в пуповинной артерии позволяет косвенно оценить плодовую гемодинамику. На начальную гипоксию может указывать замедленный кровоток (в фазу расслабления сердца кровь медленно движется по сосудам), а также нулевой и отрицательный. При нулевом – перекачка крови в момент сердечного расслабления (в диастолу) останавливается, а при отрицательном – кровь движется не к органам плода, а в обратном направлении. Это критически сказывается на его состоянии.
При нулевом – перекачка крови в момент сердечного расслабления (в диастолу) останавливается, а при отрицательном – кровь движется не к органам плода, а в обратном направлении. Это критически сказывается на его состоянии.
Виды
Гипоксия плода делится на 2 вида:
-
возникшая во время беременности;
-
развившаяся в родах.
По активности патологического процесса выделяют острую и хроническую кислородную недостаточность.
В зависимости от активности адаптационных механизмов гипоксия бывает компенсированной, субкомпенсированной и декомпенсированной.
Симптомы внутриутробной гипоксии плода
Симптомы гипоксии плода во время беременности в первую очередь проявляются изменением двигательной активности ребенка. В ответ на дефицит кислорода сначала происходит усиление движений, а затем их замедление. В этой ситуации рекомендуется выпить стакан сока или съесть что-то сладкое.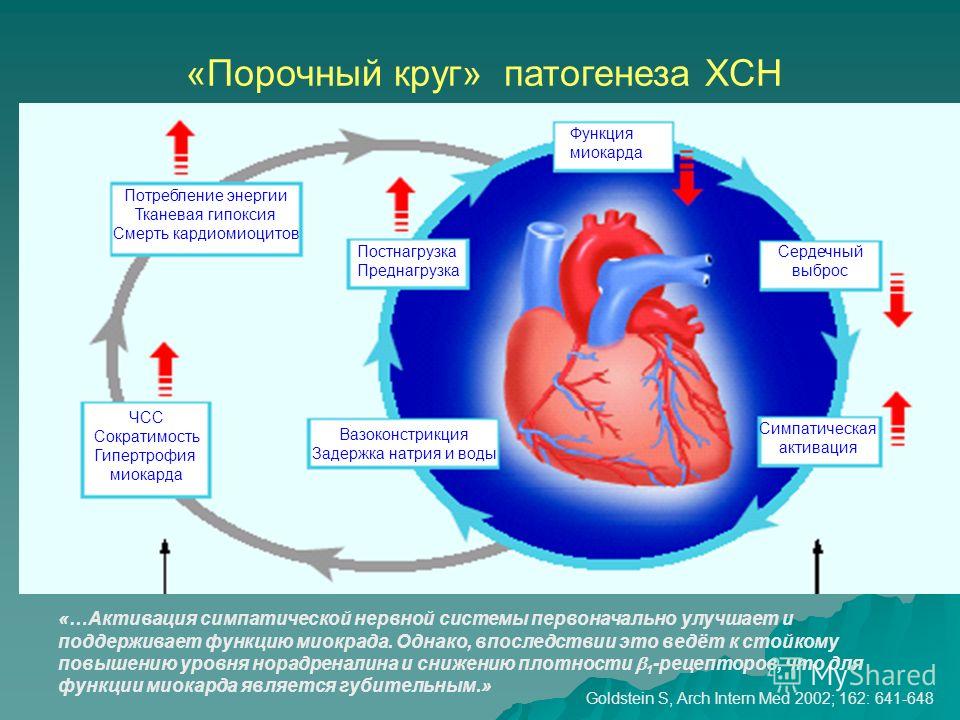 При удовлетворительном состоянии плода двигательная активность восстанавливается до прежнего уровня. Если же ситуация в течение нескольких минут не изменяется, рекомендуется незамедлительно посетить акушера-гинеколога. Дополнительные методы диагностики помогут разобраться в клинической ситуации.
При удовлетворительном состоянии плода двигательная активность восстанавливается до прежнего уровня. Если же ситуация в течение нескольких минут не изменяется, рекомендуется незамедлительно посетить акушера-гинеколога. Дополнительные методы диагностики помогут разобраться в клинической ситуации.
Гипоксия плода в родах в первую очередь выявляется по изменению частоты сердечных сокращений, которая выходит за пределы установленных нормативов. В современных клиниках роды проводят под постоянным кардиотокографическим мониторингом, что позволяет выявлять возможный дистресс плода на самых ранних стадиях. С помощью КТГ осуществляется комплексная оценка состояния плода – учитывается реакция сердечной деятельности в момент схватки, после ее окончания и в промежутке между очередными маточными сокращениями.
После разрыва плодного пузыря на гипоксию может указывать зеленое окрашивание околоплодных вод. Оно обусловлено примесью мекония, который выделяется из кишечника плода в результате расслабления анального сфинктера в ответ на кислородное голодание.
Причины
Причины гипоксии плода делятся на 3 категории.
-
К материнским факторам относятся любые соматические заболевания, анемия, значительная потеря крови и падение артериального давления вследствие шока разной природы. -
Плодовыми факторами считаются гемолитическая болезнь плода, внутриутробные пороки сердца, сдавление пуповины. -
Плацентарная природа гипоксии чаще всего встречается в клинической практике. Различные варианты плацентарной недостаточности, в т.ч. при преждевременной отслойке плаценты, на определенном этапе могут приводить к острому или хроническому дефициту кислорода в организме плода.
Получить консультацию
Если у Вас наблюдаются подобные симптомы, советуем записаться на прием к врачу. Своевременная консультация предупредит негативные последствия для вашего здоровья.
Узнать подробности о заболевании, цены на лечение и записаться на консультацию к специалисту Вы можете по телефону:
+7 (495) 292-39-72
Заказать обратный звонок
Записаться онлайн
Почему «СМ-Клиника»?
1
Лечение проводится в соответствии с клиническими рекомендациями
2
Комплексная оценка характера заболевания и прогноза лечения
3
Современное диагностическое оборудование и собственная лаборатория
4
Высокий уровень сервиса и взвешенная ценовая политика
Диагностика гипоксии плода
Для выявления возможной гипоксии плода акушер-гинеколог при каждой консультации выслушивает сердечную деятельность внутриутробного ребенка с помощью стетоскопа, начиная с 20 недель. Если неоднократно и при изменении положения беременной будет определено сердцебиение менее 110 и более 170 ударов в минуту, то для комплексной оценки плода проводится УЗИ и кардиотокография (с учетом гестационного срока).
Если неоднократно и при изменении положения беременной будет определено сердцебиение менее 110 и более 170 ударов в минуту, то для комплексной оценки плода проводится УЗИ и кардиотокография (с учетом гестационного срока).
Обнаружение по данным допплерометрии патологического пуповинного кровотока является показанием для срочной госпитализации в стационар третьего уровня. Дальнейшая тактика ведения беременности будет определена в зависимости от результатов динамической оценки состоянии плода и срока беременности. В некоторых случаях может потребоваться экстренное родоразрешение путем кесарева сечения.
Мнение эксперта
Изменение характера сердцебиения плода – это важный критерий его внутриутробного состояния. Однако стоит учитывать, что к концу второго триместра матка существенно увеличена и может сдавливать нижнюю полую вену в материнском организме (в положении лежа). Такое изменение гемодинамики предрасполагает к транзиторному расстройству плодового кровообращения. Чтобы разобраться в акушерской ситуации, регистрацию сердечной деятельности плода проводят не только в положении лежа, но и на левом боку.
Чтобы разобраться в акушерской ситуации, регистрацию сердечной деятельности плода проводят не только в положении лежа, но и на левом боку.
Аскольская Светлана Ивановна
Врач акушер-гинеколог высшей категории, д.м.н.
Лечение
Лечение внутриутробной гипоксии плода определяется степенью тяжести патологического состояния. При относительной компенсации возможно пролонгирование беременности. Если же статус плода ухудшается, то показано родоразрешение. При этом врачи также учитывают срок беременности. Так, до 30 недель наиболее приемлема беременность-сохраняющая тактика, т.к. органы и системы плода из-за своей незрелости плохо адаптируются к внеутробным условиям жизни. После 30 недель при сохраняющемся дистрессе плода оптимальным вариантом лечения является родоразрешение.
Консервативное лечение
Консервативное лечение предполагает достаточный уровень компенсации заболеваний, которые привели к развитию плодовой гипоксии. Так, при низком уровне гемоглобина показана противоанемическая терапия, при артериальной гипертензии – гипотензивная терапия и т.д. За состоянием плода проводится поэтапное динамическое наблюдение (аускультация, УЗИ, фонокардиотокография). При ухудшении самочувствия внутриутробного ребенка тактика ведения беременности пересматривается.
Так, при низком уровне гемоглобина показана противоанемическая терапия, при артериальной гипертензии – гипотензивная терапия и т.д. За состоянием плода проводится поэтапное динамическое наблюдение (аускультация, УЗИ, фонокардиотокография). При ухудшении самочувствия внутриутробного ребенка тактика ведения беременности пересматривается.
Хирургическое лечение
Сохраняющийся нулевой и отрицательный кровоток в пуповинной артерии является показанием для срочного родоразрешения путем кесарева сечения. Операция также показана при остро возникшем дистрессе, когда значительно замедлено сердцебиение и временами опускается до очень низких показателей.
При внутриутробной гипоксии, развившейся в родах, рекомендуется восполнить объем циркулирующей плазмы и по возможности устранить действие причинного фактора. Если эти мероприятия не приносят желаемого результата, то требуется ускорить родоразрешение. С этой целью в первом периоде родов проводится кесарево сечение, а во втором, если головка опустилась достаточно низко, может выполняться вакуум-экстракция (проведенная по правилам эта манипуляция считается достаточно бережливой по отношению к плоду).
Профилактика
Профилактика острой и хронической гипоксии плода может быть направлена на следующие мероприятия:
-
рациональное чередование труда и отдыха;
-
полноценный ночной сон длительностью не менее 7-8 часов;
-
отказ от курения, употребления алкоголя;
-
устранение (по возможности) факторов риска, которые могут привести к гипоксии.
Реабилитация
После кесарева сечения рекомендуется как можно более ранняя активация женщины. Вставать и ходить по палате разрешено в первые сутки (под контролем медицинского персонала). Новорожденного следует прикладывать к груди, как закончиться действие обезболивающих препаратов. Раннее прикладывание является мощным стимулом для становления полноценной лактации.
Дети, перенесшие гипоксию во время беременности или в родах, нуждаются в пристальном наблюдении неонататолога и детского невролога. Дефицит кислорода может негативно сказаться на состоянии головного мозга, особенно если имела место асфиксия (удушье). Динамический контроль за развитием нервной системы позволит выявить ранние признаки и провести соответствующую коррекцию.
Дефицит кислорода может негативно сказаться на состоянии головного мозга, особенно если имела место асфиксия (удушье). Динамический контроль за развитием нервной системы позволит выявить ранние признаки и провести соответствующую коррекцию.
Вопросы и ответы
Выявлением и лечением дистресса плода занимается акушер-гинеколог.
Для этого на живот беременной женщины надеваются датчики, которые фиксируются ремнями. Прибор регистрирует в виде графика характер сердечной деятельности плода.
Эти приборы помогают оценить частоту сердечного ритма плода и могут использоваться для рутинного наблюдения за его состоянием. При урежениии или учащении сердцебиения требуется срочная консультация акушера-гинеколога. Только врач может установить окончательный диагноз, исключив или подтвердив гипоксию, и составить программу дальнейшего ведения беременности.
Допплерометрия, в акушерстве: критический взгляд / М. В. Хитров [и др.] // Ультразвуковая диагностика в акушерстве, гинекологии и педиатрии. — 2000. — №1. — С. 49-53.
В. Хитров [и др.] // Ультразвуковая диагностика в акушерстве, гинекологии и педиатрии. — 2000. — №1. — С. 49-53.
Салдусова, О.А. Интранатальная гипоксия плода при фетоплацентарной недостаточности: автореф. дис… канд. мед. наук: 14.00.01 / Салдусова Ольга Анатольевна – М., 2006, –С. 17.
Цидвинцева, Л. Н. Определение информативности автоматизированной КТГ в оценке состояния плода во время родов / Л. Н. Цидвинцева // VI Росс. форум «Мать и дитя»: матер.конгр. – Москва, – 2004. – С. 249.
>
Заболевания по направлению гинекология
Вульводиния
Аденомиоз матки
Аднексит (сальпингоофорит)
Аменорея
Анэмбриония
Апоплексия яичника
Бактериальный вагиноз (дисбактериоз влагалища)
Бартолинит
Вагинит
Вагиноз бактериальный
Вирус папилломы человека (ВПЧ)
Внематочная беременность
Внутриматочные спайки (синехии)
Воспаление придатков матки
Воспаление шейки матки
Вульвит
Выкидыш на ранних сроках
Выпадение матки и влагалища
Гарднереллез
Гематометра
Гестоз
Гидросальпинкс
Гиперплазия эндометрия
Гиперпролактинемия
Гипертонус матки
Гиперэстрогения
Гипоплазия матки
Гипоплазия эндометрия
Головное предлежание плода
Двурогая матка
Диарея при беременности
Дисплазия шейки матки
Дисфункция яичников
Железистая гиперплазия эндометрия
Заболевания передающиеся половым путем (ЗППП)
Замершая беременность
Кандидоз вагинальный («молочница»)
Киста бартолиновой железы
Киста шейки матки
Киста яичника
Кольпит
Кондиломы
Крауроз вульвы
Кровотечение при беременности
Лейкоплакия вульвы
Лейкоплакия шейки матки
Лейомиома матки
Маловодие при беременности
Маточное кровотечение
Маточное кровотечение при климаксе
Меноррагия
Метрит
Микоплазмоз
Миома матки
Многоводие при беременности
Многоплодная беременность
Молочница
Молочница при беременности
Наружный эндометриоз
Непроходимость маточных труб
Низкое расположение плаценты при беременности
Овуляторный синдром
Оофорит
Опухоли яичников
Опущение влагалища
Опущение матки
Параметрит
Параовариальная киста яичника
Перекрут кисты яичника
Пиометра
Подтекание околоплодных вод
Поликистоз яичников
Полип цервикального канала (полип шейки матки)
Полип эндометрия
Полипы матки
Постменопауза
Преждевременная отслойка плаценты
Преэклампсия
Пузырный занос
Рак шейки матки
Рак яичников
Ретрохориальная гематома
Рубец на матке
Сальпингит
Серозометра
Симфизит
Синдром токсического шока (СТШ)
Спаечный процесс в малом тазу
Сухость влагалища
Тазовое предлежание плода
Токсикоз беременных
Трихомониаз
Фиброма матки
Фригидность
Хронический цервицит
Цервицит
Цистит (у женщин)
Цистоцеле
Эклампсия у беременных
Эктопия шейки матки
Эндокринное бесплодие
Эндометриоз
Эндометриоидная киста яичника
Эндометрит
Эндоцервицит
Эрозия шейки матки
Все врачи
м.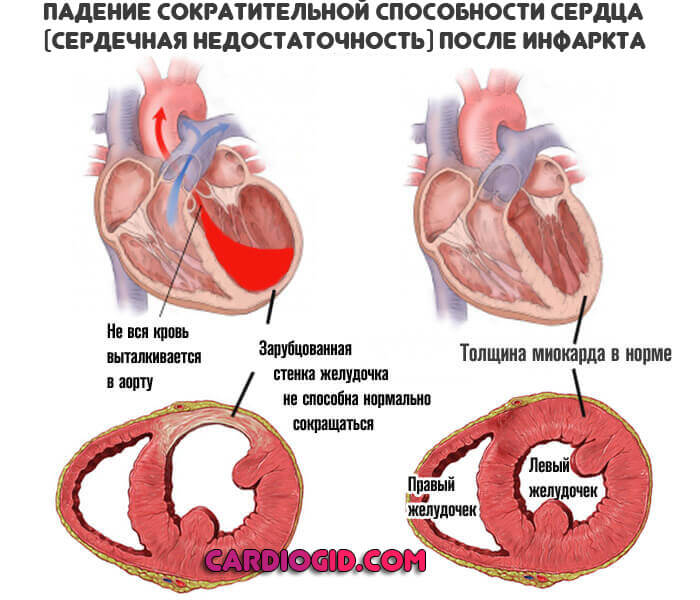 ВДНХ
ВДНХ
м. Белорусская
ул. Лесная, д. 57, стр. 1
Переулок Расковой, д. 14/22
м. Молодёжная
м. Текстильщики
м. Динамо
м. Курская
м. Севастопольская
м. Чертановская
м. Крылатское
м. Войковская
Старопетровский проезд, 7А, стр. 22
ул. Клары Цеткин, д. 33 корп. 28
м. Балтийская
м. Марьина Роща
м. Новые Черёмушки
м. Водный стадион
м. Улица 1905 года
Все врачи
Загрузка
Лицензии
Перейти в раздел лицензииПерейти в раздел правовая информация
Врач назвал 10 простых способов продлить жизнь
О том, как продлить жизнь и что делать, чтобы наши родные жили как можно дольше и легче, рассказывает заместитель руководителя Центра медицинской профилактики министерства здравоохранения края Андрей Сахаров.
– Здоровье человека зависит от многих факторов: наследственность, атмосфера, уровень и уклад жизни. Все это может повлиять на причины заболеваний, старения и даже смерти, – сказал Андрей Сахаров.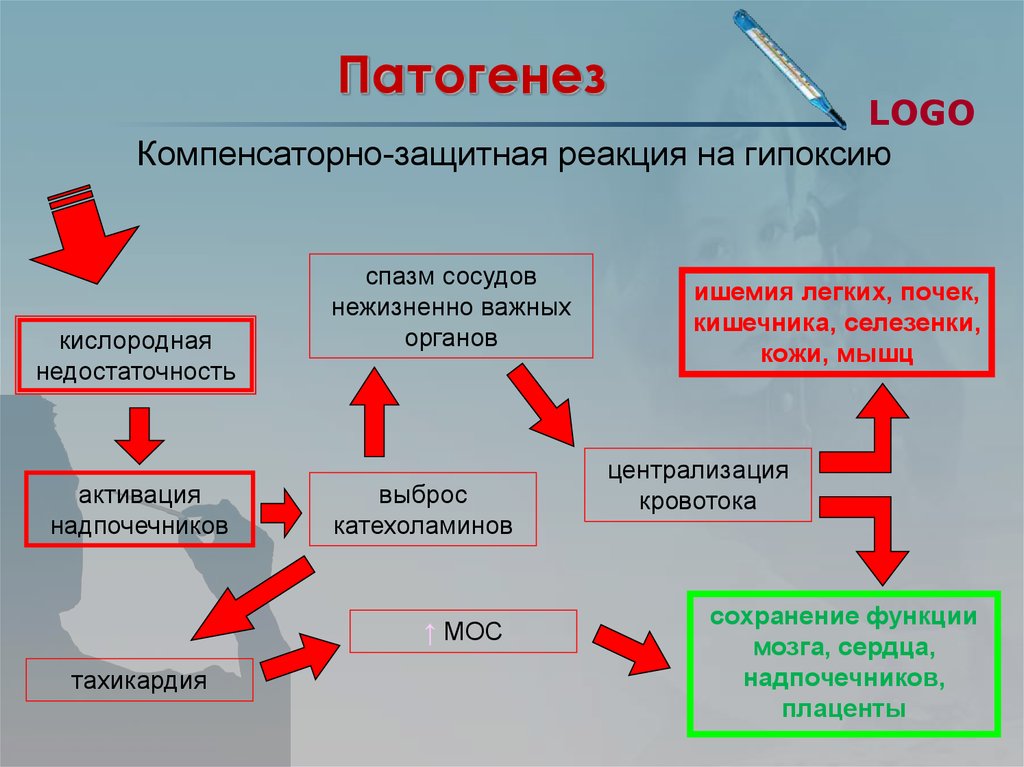 – Хотя старости нельзя избежать, но возможно ее задержать. Здоровый образ жизни и непрерывный прогресс науки продлят жизнь. Рассмотрим наиболее распространенные проблемы со здоровьем у людей зрелого и пожилого возраста.
– Хотя старости нельзя избежать, но возможно ее задержать. Здоровый образ жизни и непрерывный прогресс науки продлят жизнь. Рассмотрим наиболее распространенные проблемы со здоровьем у людей зрелого и пожилого возраста.
Снижение иммунитета
К этому приводит естественное старение физической функции организма. Он становится более уязвимым для различных вирусов и патогенных бактерий.
Сердечно-сосудистые заболевания и заболевания сосудов головного мозга
Сюда входят гиперлипидемия, гипертензия, стенокардия, инфаркт сердечной мышцы, инфаркт головного мозга, слабоумие. Их главные характеристики – высокая частота возникновения, высокая частота инвалидности, огромное влияние на качество жизни. Катализаторами сердечно-сосудистых заболеваний и заболеваний сосудов головного мозга являются высокий холестерин, сахарный диабет, курение, избыточный вес, стресс. По статистике Всемирной организации здравоохранения, в развитых странах расходы на лечение заболеваний сердечно-сосудистой системы и заболеваний сосудов головного мозга занимают до 10 процентов от средств на здравоохранение.
Гипоксия сердца (учащение сердцебиения, чувство давления в груди, одышка, стенокардия) и гипоксия головного мозга (головокружение и рябь в глазах, снижение памяти, потеря сознания, общая заторможенность организма, упадок сил, онемение рук и ног).
Причины возникновения гипоксии:
-
загрязнение окружающей среды; -
снижение кислорода в воздухе; -
биологические процессы старения сосудов, которые ведут к снижению количества кислорода, а нехватка кислорода создает основу для возникновения заболеваний сердца, печени, мозга и почек человека.
Устойчивость организма к гипоксии ограничена. Если превысить ее предел устойчивости, то это может привести к патологическим изменениям в организме (особенно восприимчивы к этому головной мозг и сердце). Заболевания сосудов сердца и головного мозга приводят к усилению гипоксии тканей, поэтому организму наносится необратимый вред.
К гипоксии предрасположены лица преклонного возраста, работники умственного труда, лица, страдающие сердечно-сосудистыми заболеваниями и заболеваниями сосудов головного мозга.
Заболевания желудка и кишечника
Пациенты, страдающие такими заболеваниями, не только испытывают физическую боль, в их организме скапливаются вредные вещества, снижается иммунитет.
По статистике Всемирной организации здравоохранения, среди страдающих заболеваниями желудочно-кишечного тракта 70 процентов – это люди среднего возраста и пожилые. Наиболее распространенные заболевания – анорексия, метеоризм, боли в животе, нарушения выделения желудочного сока, запоры.
В зрелом возрасте органы стареют, физические функции становятся ниже, это в полной мере касается системы пищеварения. Поэтому часто появляется ощущение дискомфорта в желудке и кишечнике.
Важно!
Преждевременное старение организма происходит также из-за лишнего веса, вредных привычек, неправильного питания. Жизнеспособность постепенно падает, что вызывает замедление процесса синтезирования питательных веществ, ткани плохо регенерируются, снижается функциональность внутренних органов и систем. Старение клеток и тканей ведет к тому, что они теряют свои качества. Например, ученые доказали, что мозг к старости уменьшается в весе, а извилины становятся более тонкими.
Жизнеспособность постепенно падает, что вызывает замедление процесса синтезирования питательных веществ, ткани плохо регенерируются, снижается функциональность внутренних органов и систем. Старение клеток и тканей ведет к тому, что они теряют свои качества. Например, ученые доказали, что мозг к старости уменьшается в весе, а извилины становятся более тонкими.
Внимание: желудочно-кишечные заболевания – источник сотен других болезней! Злокачественные изменения желудочно-кишечного тракта – тайный враг организма. Если не провести своевременное и эффективное лечение этих заболеваний, то они могут вызвать эрозию слизистой оболочки желудка, язву и даже рак. Факторы окружающей среды, прием лекарств, употребление алкоголя, крепкого чая, излишне холодной, горячей, острой пищи, загрязненная вода, остатки ядохимикатов и удобрений – все это очень серьезно влияет на слизистую оболочку желудка и кишечника.
Только организм со здоровыми кишечником и желудком всасывает питательные вещества и одновременно благополучно выделяет вредные вещества и шлаки.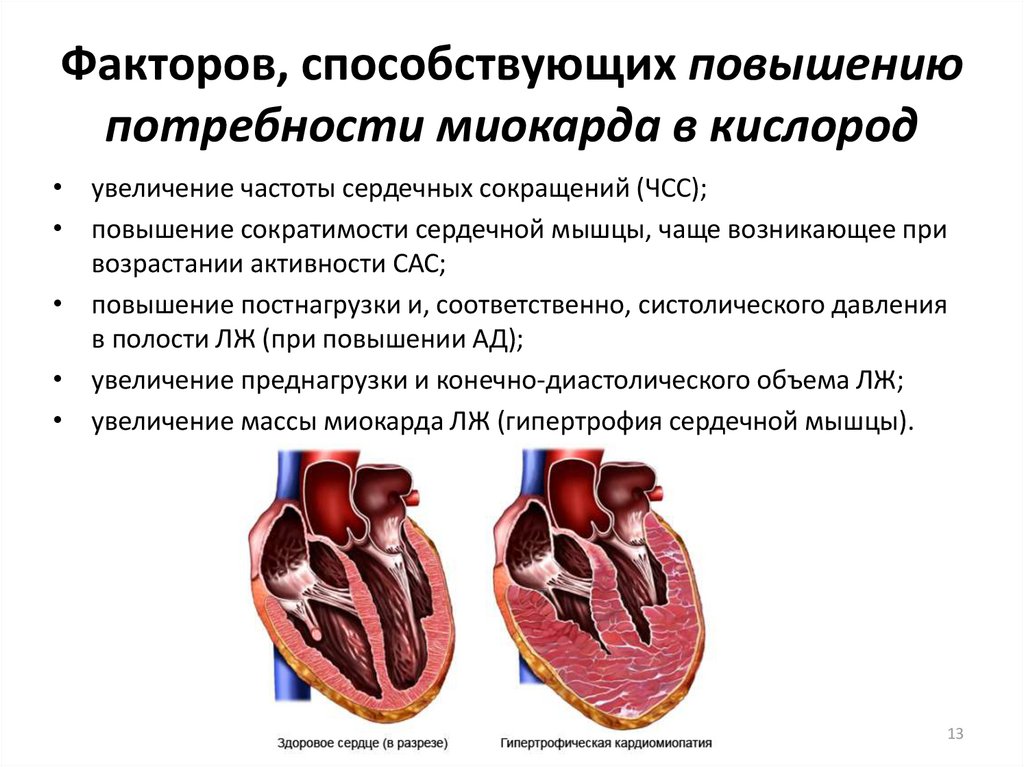
Заболевания органов дыхания
Болезни органов дыхания у пожилых людей также протекают по-особенному. Чем старше пациент, тем сложнее распознать пневмонию, так как температура не повышается, отсутствуют колющие боли в области грудной клетки и озноб. Клиническая картина представлена симптомами общего характера: потерей аппетита, недомоганием и слабостью, апатией. Нередко пациенты теряют ориентацию в пространстве, у них возникают другие признаки интоксикации. Затяжному течению пневмонии, а затем и переходу ее в хроническую форму могут способствовать снижение иммунитета, наличие хронического бронхита (особенно если человек курит), изменения сосудов в легких.
Нарушение сна
Сон играет очень важную роль в жизни людей. Сон – это физиологическая потребность организма. Провести более 5 суток без сна смертельно для человека. В пожилом возрасте необходим полноценный сон, длящийся не менее 7-8 часов. Организму требуется это время, чтобы хорошо отдохнуть и полностью восстановить силы.
К сожалению, нарушение сна очень вредит пожилым людям и с возрастом становится явным. Из-за нездорового сна возникает масса неприятностей для здоровья: снижение иммунитета, высокое давление, гиперлипидемия, сердечно-сосудистые заболевания, головная боль, головокружения, вялость, ухудшение памяти, неврастения, депрессия, раннее старение.
Если беспокоит бессонница, поможет прием успокоительных средств и прогулки перед сном.
Нарушение психического здоровья
Психика в престарелом возрасте очень страдает от того, что люди бывают ограничены в свободе передвижения. Их беспокоят постоянные боли, а также и то, что они всецело зависимы от ухаживающих за ними родных. Дополнительный негатив приносит смерть кого-либо из близких людей, а также инвалидность или резкая перемена материального и социального статуса в связи с выходом на пенсию.
Медики прослеживают тесную взаимосвязь между физическим и психическим здоровьем. Соматические нарушения у пожилых людей ведут к депрессивным состояниям. Если из этого состояния человека не вывести, то заболевание будет только прогрессировать.
Соматические нарушения у пожилых людей ведут к депрессивным состояниям. Если из этого состояния человека не вывести, то заболевание будет только прогрессировать.
К сожалению, нередко можно встретить и неподобающее обращение с представителями старшего поколения. Это может серьезно подорвать их психосоматическое состояние, а иногда и привести к депрессии и деменции. Поэтому врачи советуют стараться как можно больше внимания оказывать своим пожилым родственникам. Чуткая забота поможет им обрести уверенность в будущем и позитивно настроиться на дальнейшую жизнь. А государство должно, в свою очередь, принимать меры по охране здоровья пожилых людей.
Как поддерживать физическое здоровье пожилых людей
Не секрет, что человек стареет на протяжении всей жизни. О своем собственном организме необходимо заботиться самому. Состояние здоровья пожилых людей напрямую зависит от того, какой образ жизни они вели, будучи молодыми. Преждевременно наступает старость, а в некоторых случаях и смерть, если человек много курил, принимал алкоголь, питался неполноценной и несбалансированной едой, мало двигался.
Такой негативный фон способствует развитию множества хронических заболеваний. В Европе около 77 процентов всех патологических состояний и примерно 86 процентов смертей приходятся на диабет, болезни сердца и сосудов, онкологию, хронические заболевания верхних дыхательных путей, а также нарушения психики. Еще тяжелее дело обстоит в неблагополучных социальных слоях.
Всемирная организация здравоохранения представила новейшие стандарты определения возраста:
• молодые люди – до 44 лет;
• люди зрелого возраста – от 45 до 59 лет;
• люди пожилого возраста – от 60 до 74 лет;
• старики – от 75 до 90 лет;
• долгожители – от 90 лет и старше.
Советы по здоровья для пожилых людей очень просты. Помните, что никогда не поздно начать вести здоровый образ, исключив вредные привычки. В этом случае угроза преждевременной смерти сразу снизится до 50 процентов, а качество жизни существенно улучшится.
Проведенные исследования показали, что пожилые люди, которые регулярно выполняют посильные физические упражнения, меньше подвержены соматическим заболеваниям, приводящим к ранней смерти от ишемической болезни сердца, гипертонии, инсульта, диабета, рака толстой кишки и молочной железы.
У людей с активной жизненной позицией, которые внимательно относятся к своему телу, вес и уровень кардиореспираторных и мышечных состояний приближены к идеальным. А биомаркеры в этом случае приобретают структуру, благоприятную для укрепления костной ткани и профилактики болезней сердца, сосудов и диабета. При условии ведения здорового образа жизни риск возникновения диабета 2-го типа снижается до минимума.
10 правил долголетия:
-
Сохраняйте молодость ума. Исследования показывают, что если человек продолжает умственную работу, то процессы старения в его организме могут замедляться. Такие люди менее подвержены старческому слабоумию и, по статистике, обладают более высоким уровнем здоровья.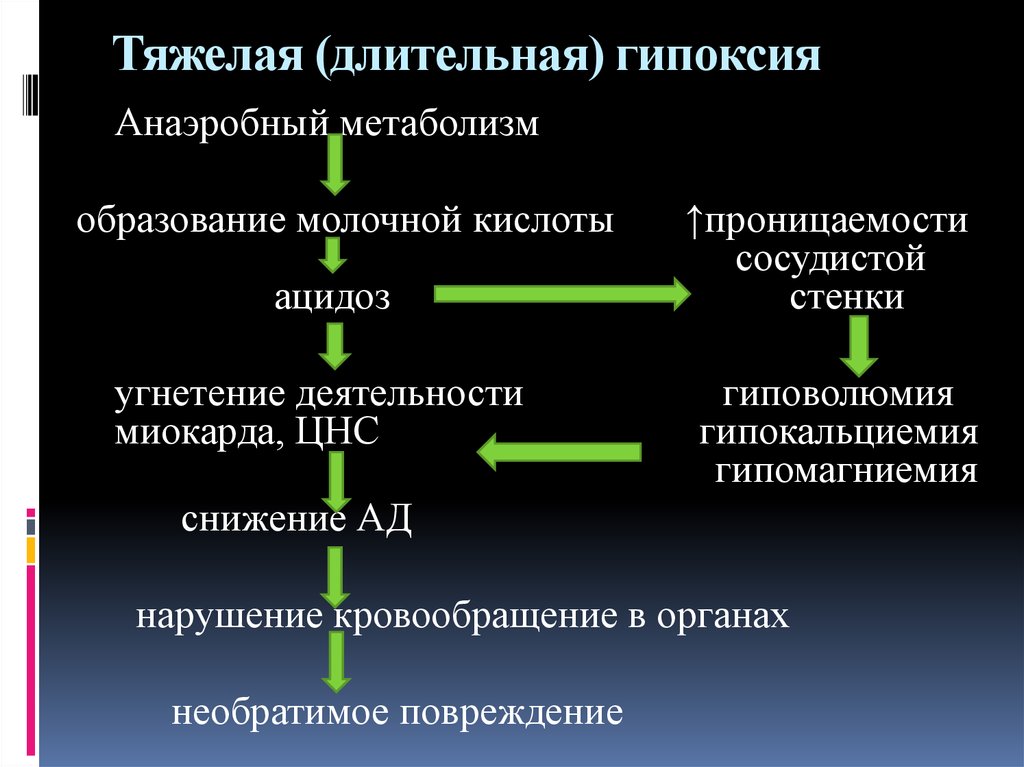 Поэтому читайте, интересуйтесь новостями, узнавайте что-то новое, занимайтесь творчеством, играйте в шахматы – продолжайте развиваться как личность.
Поэтому читайте, интересуйтесь новостями, узнавайте что-то новое, занимайтесь творчеством, играйте в шахматы – продолжайте развиваться как личность.
-
Мыслите позитивно. Не стоит притягивать к себе многочисленные болезни, выискивать симптомы заболеваний и бояться старости. Все знают выражение «мысль материальна», так и в случае с болезнями существует так называемый эффект плацебо. Он заключается в том, что если человек в чем-то убежден, то в его организме начинают происходить именно те изменения, в которых он уверен, в результате одной только силы мысли. Поэтому, если вы будете думать о болезнях, будьте уверены: вы их надумаете. -
Сохраняйте физическую активность. Оказывается, от многих болезней можно «убежать» в прямом смысле этого слова. Это будет хорошей тренировкой для вашей сердечно-сосудистой системы и профилактикой инфарктов и инсультов – самых грозных заболеваний в пожилом возрасте. Физическую активность можно повышать при помощи прогулок, оздоровительной ходьбы и бега, поездок на велосипеде, занятий в группах лечебной физкультуры, плавания и многого другого.
Физическую активность можно повышать при помощи прогулок, оздоровительной ходьбы и бега, поездок на велосипеде, занятий в группах лечебной физкультуры, плавания и многого другого.
-
Откажитесь от вредных привычек. Они являются факторами риска многих опасных заболеваний, которые наиболее часто встречаются в пожилом возрасте. -
Вовремя обращайтесь к врачу. Если вы заметили у себя какие-то непонятные симптомы, не затягивайте с визитом к доктору. Многие заболевания гораздо легче поддаются лечению на начальных стадиях. -
Контролируйте свои болезни. Если вам назначено лечение, не игнорируйте его, соблюдайте режим прием лекарств. Многие нюансы болезней может знать только врач, поэтому не занимайтесь самолечением. Не отменяйте назначенные препараты самостоятельно – у многих из них существует эффект отмены, когда симптомы заболевания возвращаются в более агрессивном варианте. Контролируйте уровень своего артериального давления. При правильном и постоянном контроле болезни можно свести риск последствий к минимуму.
Контролируйте уровень своего артериального давления. При правильном и постоянном контроле болезни можно свести риск последствий к минимуму.
-
Правильно питайтесь. С возрастом пищеварительные процессы замедляются, поэтому от питания зависит очень многое. Если зашлаковывать свой кишечник вредными продуктами, то будет снижаться иммунитет, появится отечность под глазами, изменится цвет кожи, будут появляться морщины. Кроме того, общее самочувствие тоже будет снижено. Поэтому в вашем рационе должно присутствовать больше овощей и круп, которые содержат клетчатку и способствуют нормальному пищеварению и очищению кишечника. Предпочитайте здоровую пищу, не содержащую красителей, консервантов и всяческих добавок. Помните также о том, что с возрастом скорость обмена веществ замедляется, поэтому калорийность рациона должна быть ниже, чем в молодости, иначе это может привести к избыточному отложению жира. Для людей старше 60 лет суточная калорийность рациона должна составлять не более 2300 калорий у мужчин и не более 2100 калорий у женщин.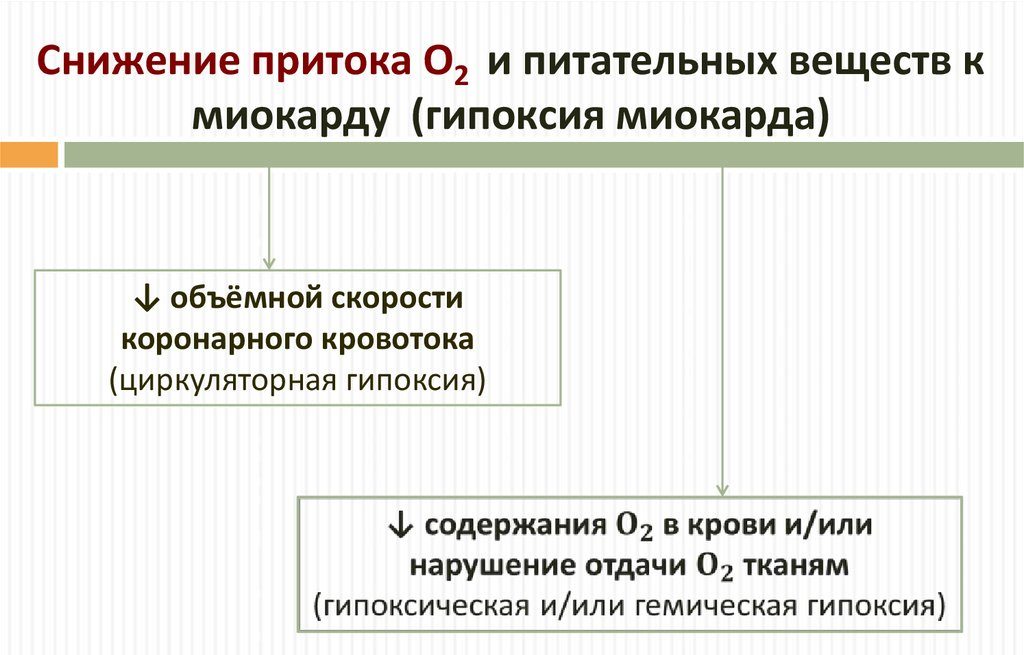
-
Соблюдайте режим дня. Ваш сон не должен быть менее 7-8 часов в сутки. Организм должен отдыхать и восстанавливать силы. -
Принимайте витамины и биологически активные добавки, специально разработанные для пожилых, которые направлены именно на возрастные изменения и позволяют восполнить дефицит микроэлементов. -
Будьте социально активны. Общайтесь с родными и друзьями, посещайте выставки, клубы по интересам. Сохраняйте свою значимость – это очень важно для психического здоровья и настроения.
ПЭТ-визуализация сердечной гипоксии: выявление гипоксии там, где это больно
Недавно опубликованные статьи, представляющие особый интерес, были отмечены как: • важные •• очень важные
1. De Boer RA, Pinto YM, Van Veldhuisen DJ. Дисбаланс между потребностью и снабжением кислородом как потенциальный механизм в патофизиологии сердечной недостаточности: роль микрососудистого роста и аномалий. Микроциркуляция. 2003;10(2):113–126. дои: 10.1080/713773607. [PubMed] [CrossRef] [Академия Google]
Микроциркуляция. 2003;10(2):113–126. дои: 10.1080/713773607. [PubMed] [CrossRef] [Академия Google]
2. Lanza GA, Crea F. Первичная коронарная микрососудистая дисфункция: клиническая картина, патофизиология и лечение. Тираж. 2010;121(21):2317–2325. doi: 10.1161/CIRCULATIONAHA.109.
1. [PubMed] [CrossRef] [Google Scholar]
3. Джордано Ф.Дж. Кислородный окислительный стресс, гипоксия и сердечная недостаточность. Джей Клин Инвест. 2005;115(3):500–508. doi: 10.1172/JCI200524408. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
4. Semenza GL. Индуцируемый гипоксией фактор 1 и сердечно-сосудистые заболевания. Annu Rev Physiol. 2014;76(1):39–56. doi: 10.1146/annurev-physiol-021113-170322. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
5. Hilfiker-Kleiner D, Landmesser U, Drexler H. Молекулярные механизмы при сердечной недостаточности: акцент на сердечной гипертрофии, воспалении, ангиогенезе и апоптозе. J Am Coll Кардиол. 2006;48(9, Приложение):A56–A66. doi: 10.1016/j.jacc.2006.07.007. [CrossRef] [Google Scholar]
doi: 10.1016/j.jacc.2006.07.007. [CrossRef] [Google Scholar]
6. Leung DY, Leung M. Неинвазивная/инвазивная визуализация: значение и оценка коронарной микрососудистой дисфункции. Сердце. 2011;97(7):587–595. doi: 10.1136/hrt.2009.183327. [PubMed] [CrossRef] [Google Scholar]
7. Camici PG, Crea F. Коронарная микрососудистая дисфункция. N Engl J Med. 2007;356(8):830–840. doi: 10.1056/NEJMra061889. [PubMed] [CrossRef] [Google Scholar]
8. Cohn JN, Quyyumi AA, Hollenberg NK, Jamerson KA. Суррогатные маркеры сердечно-сосудистых заболеваний: функциональные маркеры. Тираж. 2004;109(25 Приложение 1):IV31–IV46. [PubMed] [Google Scholar]
9. Schachinger V, Britten MB, Zeiher AM. Прогностическое влияние дисфункции коронарных сосудов на неблагоприятный отдаленный исход ишемической болезни сердца. Тираж. 2000;101(16):1899–1906. doi: 10.1161/01.CIR.101.16.1899. [PubMed] [CrossRef] [Google Scholar]
10. Owan TE, Hodge DO, Herges RM, Jacobsen SJ, Roger VL, Redfield MM. Тенденции распространенности и исходов сердечной недостаточности с сохраненной фракцией выброса. N Engl J Med. 2006;355(3):251–259. doi: 10.1056/NEJMoa052256. [PubMed] [CrossRef] [Google Scholar]
Тенденции распространенности и исходов сердечной недостаточности с сохраненной фракцией выброса. N Engl J Med. 2006;355(3):251–259. doi: 10.1056/NEJMoa052256. [PubMed] [CrossRef] [Google Scholar]
11. Борлауг Б.А. Патофизиология сердечной недостаточности с сохраненной фракцией выброса. Нат Рев Кардиол. 2014;11(9):507–515. doi: 10.1038/nrcardio.2014.83. [PubMed] [CrossRef] [Академия Google]
12. Октай А.А., Шах С.Дж. Диагностика и лечение сердечной недостаточности с сохраненной фракцией выброса: 10 ключевых уроков. Curr Cardiol Rev. 2015;11(1):42–52. doi: 10.2174/1573403X09666131117131217. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
13. Giamouzis G, Schelbert EB, Butler J. Растущие доказательства связи микрососудистой дисфункции с сердечной недостаточностью с сохраненной фракцией выброса. Ассоциация J Am Heart. 2016;5(2):e003259. doi: 10.1161/JAHA.116.003259. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
14. Kato S, Saito N, Kirigaya H, Gyotoku D, Iinuma N, Kusakawa Y, Iguchi K, Nakachi T, Fukui K, Futaki M, Iwasawa T, Kimura K, Umemura S. Нарушение коронарного резерва оценивается фазоконтрастная киномагнитно-резонансная томография у больных сердечной недостаточностью с сохраненной фракцией выброса. Ассоциация J Am Heart. 2016;5(2):e002649. doi: 10.1161/JAHA.115.002649. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Нарушение коронарного резерва оценивается фазоконтрастная киномагнитно-резонансная томография у больных сердечной недостаточностью с сохраненной фракцией выброса. Ассоциация J Am Heart. 2016;5(2):e002649. doi: 10.1161/JAHA.115.002649. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
15. Sinusas AJ. Возможности визуализации миокарда с маркерами гипоксии. Семин Нукл Мед. 1999;29(4):330–338. doi: 10.1016/S0001-2998(99)80020-8. [PubMed] [CrossRef] [Google Scholar]
16. Li D, Dhawale P, Rubin PJ, Haacke EM, Gropler RJ. Миокардиальный сигнальный ответ на дипиридамол и добутамин: демонстрация ЖИРНОГО эффекта с использованием последовательности градиент-эхо двойного эха. Магн Резон Мед. 1996;36(1):16–20. doi: 10.1002/mrm.1
0105. [PubMed] [CrossRef] [Google Scholar]
17. Huang TY, Liu YJ, Stemmer A, Poncelet BP. Измерение T2 человеческого миокарда с использованием последовательности TrueFISP с переходным состоянием, подготовленной для T2. Магн Резон Мед. 2007;57(5):960–966. doi: 10.1002/mrm.21208. [PubMed] [CrossRef] [Google Scholar]
doi: 10.1002/mrm.21208. [PubMed] [CrossRef] [Google Scholar]
18. Seddon BM, Honess DJ, Vojnovic B, Tozer GM, Workman P. Измерение оксигенации опухоли: сравнение in vivo люминесцентного волоконно-оптического датчика и полярографического электрода в опухоль р22. Радиационное разрешение 2001;155(6):837–46. https://doi.org/10.1667/0033-7587(2001)155[0837:MOTOIV]2.0.CO;2. [PubMed]
19. Tran LB, Bol A, Labar D, Jordan B, Magat J, Mignion L, et al. Визуализация гипоксии с помощью нитроимидазольного индикатора 18F-FAZA PET: сравнение с OxyLite, ЭПР-оксиметрией и 19F-МРТ релаксометрия. Радиотер Онкол. 2012;105(1):29–35. doi: 10.1016/j.radonc.2012.04.011. [PubMed] [CrossRef] [Google Scholar]
20. Machac J. Позитронно-эмиссионная томография сердца. Семин Нукл Мед. 2005;35(1):17–36. doi: 10.1053/j.semnuclmed.2004.09.002. [PubMed] [CrossRef] [Google Scholar]
21. Кудо Т. Метаболическая визуализация с использованием ПЭТ. Eur J Nucl Med Mol Imaging. 2007; 34 (Приложение 1): S49–S61. doi: 10.1007/s00259-007-0440-3. [PubMed] [CrossRef] [Google Scholar]
doi: 10.1007/s00259-007-0440-3. [PubMed] [CrossRef] [Google Scholar]
22. Coort SL, Bonen A, van der Vusse GJ, Glatz JF, Luiken JJ. Поглощение сердечным субстратом и метаболизм при ожирении и диабете 2 типа: роль переносчиков субстрата сарколеммы. Мол Селл Биохим. 2007;299(1–2):5–18. doi: 10.1007/s11010-005-9030-5. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
23. Southworth R. Взаимодействие гексокиназы и митохондрий в сердечной ткани: влияние на поглощение сердечной глюкозы, 18FDG-константа и защита сердца. J Биоэнергетическая биомембрана. 2009;41(2):187–193. doi: 10.1007/s10863-009-9207-9. [PubMed] [CrossRef] [Google Scholar]
24. Feher A, Sinusas AJ. Количественная оценка функции коронарных микрососудов: динамическая однофотонная эмиссионная компьютерная томография, позитронно-эмиссионная томография, УЗИ, компьютерная томография, магнитно-резонансная томография. Циркулярная кардиоваскулярная визуализация. 2017;10(8):e006427. doi: 10.1161/ОБЪЕМНОЕ ИЗОБРАЖЕНИЕ. 117.006427. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
117.006427. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
25. Handley MG, Medina RA, Nagel E, Blower PJ, Southworth R. ПЭТ-визуализация сердечной гипоксии: возможности и проблемы. Дж Мол Селл Кардиол. 2011;51(5):640–650. doi: 10.1016/j.yjmcc.2011.07.005. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
26. Valencia A, Burgess JH. Артериальная гипоксемия после острого инфаркта миокарда. Тираж. 1969; 40(5):641–652. doi: 10.1161/01.CIR.40.5.641. [PubMed] [CrossRef] [Google Scholar]
27. Des Tombe AL, Van Beek-Harmsen BJ, Lee-De Groot MB, Van Der Laarse WJ. Калиброванная гистохимия применительно к потреблению и снабжению кислородом в гипертрофированном миокарде крыс. Микроск Рес Тех. 2002;58(5):412–420. doi: 10.1002/jemt.10153. [PubMed] [CrossRef] [Академия Google]
28. Крон К.А., Линк Дж.М., Мейсон Р.П. Молекулярная визуализация гипоксии. Дж Нукл Мед. 2008; 49 (Прил. 2): 129–148 с. doi: 10.2967/jnumed.107.045914. [PubMed] [CrossRef] [Google Scholar]
29. Strauss HW, Nunn A, Linder K. Нитроимидазолы для визуализации гипоксического миокарда. J Нукл Кардиол. 1995;2(5):437–445. doi: 10.1016/S1071-3581(05)80031-5. [PubMed] [CrossRef] [Google Scholar]
Strauss HW, Nunn A, Linder K. Нитроимидазолы для визуализации гипоксического миокарда. J Нукл Кардиол. 1995;2(5):437–445. doi: 10.1016/S1071-3581(05)80031-5. [PubMed] [CrossRef] [Google Scholar]
30. Nunn A, Linder K, Strauss HW. Нитроимидазолы и визуализация гипоксии. Eur J Nucl Med. 1995;22(3):265–280. doi: 10.1007/BF01081524. [PubMed] [CrossRef] [Академия Google]
31. Дирлинг Дж. Л., Льюис Дж. С., Маллен Дж. Э., Уэлч М. Дж., Блоуэр П. Дж. Комплексы бис(тиосемикарбазона) меди как агенты визуализации гипоксии: взаимосвязь структура-активность. J Biol Inorg Chem: JBIC. 2002;7(3):249–259. doi: 10.1007/s007750100291. [PubMed] [CrossRef] [Google Scholar]
32. Fujibayashi Y, Taniuchi H, Yonekura Y, Ohtani H, Konishi J, Yokoyama A. Медь-62-ATSM: новый агент для визуализации гипоксии с высокой проницаемостью мембран и низким окислительно-восстановительным потенциалом. потенциал. Дж Нукл Мед. 1997;38(7):1155–1160. [PubMed] [Академия Google]
33. Чиа К., Флеминг И. Н., Блоуэр П.Дж. Визуализация гипоксии с помощью ПЭТ: какие индикаторы и почему? Nucl Med Commun. 2012;33(3):217–222. doi: 10.1097/MNM.0b013e32834eacb7. [PubMed] [CrossRef] [Google Scholar]
Н., Блоуэр П.Дж. Визуализация гипоксии с помощью ПЭТ: какие индикаторы и почему? Nucl Med Commun. 2012;33(3):217–222. doi: 10.1097/MNM.0b013e32834eacb7. [PubMed] [CrossRef] [Google Scholar]
34. Sutherland FJ, Hearse DJ. Выделенная кровь и перфузионная жидкость перфузировали сердце. Фармакол рез. 2000;41(6):613–627. doi: 10.1006/phrs.1999.0653. [PubMed] [CrossRef] [Google Scholar]
35. Yabe T, Mitsunami K, Inubushi T, Kinoshita M. Количественные измерения метаболитов сердечного фосфора при ишемической болезни сердца с помощью магнитно-резонансной спектроскопии 31P. Тираж. 1995;92(1):15–23. doi: 10.1161/01.CIR.92.1.15. [PubMed] [CrossRef] [Google Scholar]
36. Buchthal SD, den Hollander JA, Merz CN, Rogers WJ, Pepine CJ, Reichek N, et al. Аномальная спектроскопия ядерного магнитного резонанса фосфора-31 в миокарде у женщин с болью в груди, но нормальные коронарные ангиограммы. N Engl J Med. 2000;342(12):829–835. doi: 10.1056/NEJM200003233421201. [PubMed] [CrossRef] [Google Scholar]
37. Smith CS, Bottomley PA, Schulman SP, Gerstenblith G, Weiss RG. Изменение кинетики креатинкиназы аденозинтрифосфата в недостаточности гипертрофированного миокарда человека. Тираж. 2006;114(11):1151–1158. doi: 10.1161/CIRCULATIONAHA.106.613646. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Smith CS, Bottomley PA, Schulman SP, Gerstenblith G, Weiss RG. Изменение кинетики креатинкиназы аденозинтрифосфата в недостаточности гипертрофированного миокарда человека. Тираж. 2006;114(11):1151–1158. doi: 10.1161/CIRCULATIONAHA.106.613646. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
38. Ранкин Э.Б., Джачча А.Дж. Гипоксический контроль метастазирования. Наука. 2016;352(6282):175–180. doi: 10.1126/science.aaf4405. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
39. Barker HE, Paget JT, Khan AA, Harrington KJ. Микроокружение опухоли после лучевой терапии: механизмы резистентности и рецидива. Нат Рев Рак. 2015;15(7):409–425. doi: 10.1038/nrc3958. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
40. Ballinger JR. Визуализация гипоксии в опухолях. Семин Нукл Мед. 2001;31(4):321–329.. doi: 10.1053/snuc.2001.26191. [PubMed] [CrossRef] [Google Scholar]
41. Rasey JS, Koh WJ, Evans ML, Peterson LM, Lewellen TK, Graham MM, et al. Количественная оценка регионарной гипоксии в опухолях человека с помощью позитронно-эмиссионной томографии [18F] фтормизонидазола: предтерапевтическое исследование 37 пациентов. Int J Radiat Oncol Biol Phys. 1996;36(2):417–428. doi: 10.1016/S0360-3016(96)00325-2. [PubMed] [CrossRef] [Google Scholar]
Количественная оценка регионарной гипоксии в опухолях человека с помощью позитронно-эмиссионной томографии [18F] фтормизонидазола: предтерапевтическое исследование 37 пациентов. Int J Radiat Oncol Biol Phys. 1996;36(2):417–428. doi: 10.1016/S0360-3016(96)00325-2. [PubMed] [CrossRef] [Google Scholar]
42. Martin GV, Cerqueira MD, Caldwell JH, Rasey JS, Embree L, Krohn KA. Фторомизонидазол. Метаболический маркер гипоксии миоцитов. Цирк Рез. 1990;67(1):240–244. doi: 10.1161/01.RES.67.1.240. [PubMed] [CrossRef] [Google Scholar]
43. Шелтон М.Е., Денс С.С., Хванг Д.Р., Уэлч М.Дж., Бергманн С.Р. Миокардиальная кинетика фтор-18 мизонидазола: маркер гипоксического миокарда. Дж Нукл Мед. 1989;30(3):351–358. [PubMed] [Google Scholar]
44. Шелтон М.Э., Денс К.С., Хванг Д.Р., Эрреро П., Уэлч М.Дж., Бергманн С.Р. Очерчивание in vivo гипоксии миокарда во время коронароокклюзии с использованием фтор-18-фтормизонидазола и позитронно-эмиссионной томографии: потенциальный подход к идентификации миокарда, подвергающегося опасности. J Am Coll Кардиол. 1990;16(2):477–485. doi: 10.1016/0735-1097(90)
J Am Coll Кардиол. 1990;16(2):477–485. doi: 10.1016/0735-1097(90)
- -P. [PubMed] [CrossRef] [Google Scholar]
- Скачать PDF
- Полный текст
Поделиться
Твиттер
Фейсбук
Эл. адрес
адрес
LinkedIn- Процитировать это
- Разрешения
- Кислотная основа, электролиты, жидкости
- Наркомания
- Аллергия и клиническая иммунология
- Анестезиология
- Антикоагулянты
- Искусство и изображения в психиатрии
- Кровотечение и переливание крови
- Кардиология
- Уход за тяжелобольным пациентом
- Проблемы клинической электрокардиографии
- Клинический вызов
- Поддержка принятия клинических решений
- Клинические последствия базовой нейронауки
- Клиническая фармация и фармакология
- Дополнительная и альтернативная медицина
- Заявления о консенсусе
- Коронавирус (COVID-19)
- Медицина интенсивной терапии
- Культурная компетенция
- Стоматология
- Дерматология
- Диабет и эндокринология
- Интерпретация диагностических тестов
- Разнообразие, равенство и инклюзивность
- Разработка лекарств
- Электронные медицинские карты
- Неотложная медицинская помощь
- Конец жизни
- Гигиена окружающей среды
- Этика
- Пластическая хирургия лица
- Гастроэнтерология и гепатология
- Генетика и геномика
- Геномика и точное здоровье
- Гериатрия
- Глобальное здравоохранение
- Справочник по статистике и медицине
- Рекомендации
- Заболевания волос
- Модели медицинского обслуживания
- Экономика здравоохранения, страхование, оплата
- Качество медицинской помощи
- Реформа здравоохранения
- Медицинская безопасность
- Медицинские работники
- Различия в состоянии здоровья
- Несправедливость в отношении здоровья
- Информатика здравоохранения
- Политика здравоохранения
- Гематология
- История медицины
- Гуманитарные науки
- Гипертония
- Изображения в неврологии
- Наука внедрения
- Инфекционные болезни
- Инновации в оказании медицинской помощи
- Инфографика JAMA
- Право и медицина
- Ведущее изменение
- Чем меньше, тем лучше
- ЛГБТК
- Образ жизни
- Медицинское кодирование
- Медицинские приборы и оборудование
- Медицинское образование
- Медицинское образование и обучение
- Медицинские журналы и публикации
- Меланома
- Мобильное здравоохранение и телемедицина
- Оспа обезьян
- Нарративная медицина
- Нефрология
- Неврология
- Неврология и психиатрия
- Примечательные примечания
- Сестринское дело
- Питание
- Питание, Ожирение, Упражнения
- Ожирение
- Акушерство и гинекология
- Гигиена труда
- Онкология
- Офтальмологические изображения
- Офтальмология
- Ортопедия
- Отоларингология
- Лекарство от боли
- Патология и лабораторная медицина
- Уход за пациентами
- Информация для пациентов
- Педиатрия
- Повышение производительности
- Показатели эффективности
- Периоперационный уход и консультация
- Фармакоэкономика
- Фармакоэпидемиология
- Фармакогенетика
- Фармация и клиническая фармакология
- Физическая медицина и реабилитация
- Физиотерапия
- Руководство врачей
- Поэзия
- Здоровье населения
- Профилактическая медицина
- Профессиональное благополучие
- Профессионализм
- Психиатрия и поведенческое здоровье
- Общественное здравоохранение
- Легочная медицина
- Радиология
- Регулирующие органы
- Исследования, методы, статистика
- Реанимация
- Ревматология
- Управление рисками
- Научные открытия и будущее медицины
- Совместное принятие решений и общение
- Медицина сна
- Спортивная медицина
- Трансплантация стволовых клеток
- Хирургия
- Хирургические инновации
- Хирургические жемчужины
- Обучаемый момент
- Технологии и финансы
- Искусство JAMA
- Искусство и медицина
- Рациональное клиническое обследование
- Табак и электронные сигареты
- Токсикология
- Травмы и травмы
- Приверженность лечению
- УЗИ
- Урология
- Руководство пользователя по медицинской литературе
- Вакцинация
- Венозная тромбоэмболия
- Здоровье ветеранов
- Насилие
- Женское здоровье
- Рабочий процесс и процесс
- Уход за ранами, инфекция, заживление
- Исследования
- Открытый доступ
- Опубликовано:
- Changming Tan 1 ,
- Jianming LI 1 ,
- Zhaoshun Yuan 1 и
- …
954 доступа
1 Цитаты
1 Альтметрический
Детали показателей
- H/R:
Повреждение сердца с гипоксией/реоксигенацией
- циркРНК:
Циркулярная РНК
- РЦ:
Обратные транскрипции
Kealey A. Ишемическая болезнь сердца и инфаркт миокарда во время беременности: обзор эпидемиологии, диагностики, медикаментозного и хирургического лечения. Может Джей Кардиол. 2010;26(6):185–9. doi: https://doi.org/10.1016/s0828-282x(10)70397-4.
Артикул
пабмедGoogle ученый
Клейнбонгард П., Хойш Г., Шульц Р. ФНО-альфа при атеросклерозе, ишемии/реперфузии миокарда и сердечной недостаточности. Фармакол Тер. 2010;127(3):295–314. doi: https://doi.org/10.1016/j.pharmthera.2010.05.002.
КАС
Статья
пабмедGoogle ученый
«>Saaby L, Poulsen TS, Diederichsen AC, Hosbond S, Larsen TB, Schmidt H et al. Смертность при инфаркте миокарда 2 типа: наблюдения в невыбранной когорте госпиталей. Am J Med. 2014;127(4):295–302. doi: https://doi.org/10.1016/j.amjmed.2013.12.020.
Артикул
пабмедGoogle ученый
Wei J, Rooks C, Ramadan R, Shah AJ, Bremner JD, Quyyumi AA et al. Метаанализ ишемии миокарда, вызванной психическим стрессом, и последующих сердечных событий у пациентов с ишемической болезнью сердца.
 Ам Джей Кардиол. 2014; 114(2):187–9.2. doi: https://doi.org/10.1016/j.amjcard.2014.04.022.
Ам Джей Кардиол. 2014; 114(2):187–9.2. doi: https://doi.org/10.1016/j.amjcard.2014.04.022.Артикул
пабмед
ПабМед ЦентральныйGoogle ученый
Wald DS, Morris JK, Wald NJ, Chase AJ, Edwards RJ, Hughes LO et al. Рандомизированное исследование превентивной ангиопластики при инфаркте миокарда. N Engl J Med. 2013;369(12):1115–23. doi: https://doi.org/10.1056/NEJMoa1305520.
КАС
Статья
пабмедGoogle ученый
Ян К., Хэ Г.В., Андервуд М.Дж., Ю. К.М. Клеточные и молекулярные механизмы эндотелиальной ишемии/реперфузионного повреждения: перспективы и последствия для постишемической защиты миокарда. Am J Transl Res. 2016;8(2):765–77.
КАС
пабмед
ПабМед ЦентральныйGoogle ученый
Zhou X, Xia N, Lv B, Tang T, Nie S, Zhang M и др.
 Интерлейкин 35 улучшает ишемию-реперфузию миокарда, активируя ось gp130-STAT3. FASEB J. 2020;34(2):3224–38. Дои: https://doi.org/10.1096/fj.201
Интерлейкин 35 улучшает ишемию-реперфузию миокарда, активируя ось gp130-STAT3. FASEB J. 2020;34(2):3224–38. Дои: https://doi.org/10.1096/fj.2018RR.
КАС
Статья
пабмедGoogle ученый
Чжао Д., Ян Дж., Ян Л. Взгляд на окислительный стресс и передачу сигналов mTOR при ишемии миокарда/реперфузионном повреждении при диабете. Оксид Мед Селл Лонгев. 2017;2017:6437467. doi: https://doi.org/10.1155/2017/6437467.
КАС
Статья
пабмед
ПабМед ЦентральныйGoogle ученый
Чен ЛЛ. Биогенез и новые роли кольцевых РНК. Nat Rev Mol Cell Biol. 2016;17(4):205–11. doi: https://doi.org/10.1038/nrm.2015.32.
КАС
Статья
пабмедGoogle ученый
Sun Z, Yu T, Jiao Y, He D, Wu J, Duan W et al. Профили экспрессии и онтологический анализ кольцевых РНК на мышиной модели ишемии/реперфузионного повреждения миокарда.
 Биомед Рез Инт. 2020;2020:2346369. Дои: https://doi.org/10.1155/2020/2346369.
Биомед Рез Инт. 2020;2020:2346369. Дои: https://doi.org/10.1155/2020/2346369.КАС
Статья
пабмед
ПабМед ЦентральныйGoogle ученый
Коллинг М., Сигер Х., Хаддад Г., Кистлер А., Новак А., Фаулхабер-Вальтер Р. и другие. Циркулярная РНК ciRs-126 предсказывает выживаемость пациентов в критическом состоянии с острым повреждением почек. Kidney Int Rep. 2018;3(5):1144–52. doi: https://doi.org/10.1016/j.ekir.2018.05.012.
Артикул
пабмед
ПабМед ЦентральныйGoogle ученый
Huang Z, Wu S, Kong F, Cai X, Ye B, Shan P et al. МикроРНК-21 защищает от повреждения сердечной гипоксии/реоксигенации путем ингибирования чрезмерной аутофагии в клетках H9c2 посредством пути Akt/mTOR. J Cell Mol Med. 2017;21(3):467–74. doi: https://doi.org/10.1111/jcmm.12990.
КАС
Статья
пабмедGoogle ученый
«>Кёллинг М., Сигер Х., Хаддад Г., Кистлер А., Новак А., Фаулхабер-Вальтер Р. и другие. Циркулярная РНК ciRs-126 предсказывает выживаемость пациентов в критическом состоянии с острым повреждением почек. Kidney Int Rep. 2018;3(5):1144–52. doi: https://doi.org/10.1016/j.ekir.2018.05.012.
Артикул
пабмед
ПабМед ЦентральныйGoogle ученый
Liu W, Chen H, Wong N, Haynes W, Baker CM, Wang X. Псевдогипоксия, индуцированная дезактивацией миР-126, способствует миграции и терапевтической резистентности при почечно-клеточной карциноме.
 Письма Рак. 2017; 394:65–75. doi: https://doi.org/10.1016/j.canlet.2017.02.025.
Письма Рак. 2017; 394:65–75. doi: https://doi.org/10.1016/j.canlet.2017.02.025.КАС
Статья
пабмед
ПабМед ЦентральныйGoogle ученый
Gur G, Rubin C, Katz M, Amit I, Citri A, Nilsson J et al. LRIG1 ограничивает передачу сигналов фактора роста, усиливая убиквитинирование и деградацию рецептора. Журнал ЕМБО. 2004;23(16):3270–81. doi: https://doi.org/10.1038/sj.emboj.7600342.
КАС
Статья
пабмед
ПабМед ЦентральныйGoogle ученый
Отделение сердечно-сосудистой хирургии, Вторая больница Сянъя, Центральный южный университет, No.139 Middle Renmin Road, 410011, Чанша, Хунань, Китай
Changming Tan, Jianming Li & Zhaoshun Yuan
Департамент медицины, Университет Калифорнии, La Jolla, CA, Сан -Диего, США
Yongxin MU
- Jianming Li
Просмотр публикаций автора
Вы также можете искать этого автора в
PubMed Google Академия - Чжаошун Юань
Посмотреть публикации автора
Вы также можете искать этого автора в
PubMed Google Scholar - Yongxin Mu
Просмотр публикаций автора
Вы также можете искать этого автора в
PubMed Google Scholar Хан Р. и Шеппард Р. Фиброз при сердечных заболеваниях: понимание роли трансформирующего фактора роста-бета в кардиомиопатии, заболеваниях клапанов и аритмии. Иммунология 118 , 10–24 (2006).
КАС
СтатьяGoogle ученый
Саббах Х. Н., Шаров В. Г., Леш М. и Гольдштейн С. Прогрессирование сердечной недостаточности: роль интерстициального фиброза. Мол. Cell Biochem 147 , 29–34 (1995).
КАС
СтатьяGoogle ученый
Fan, D., Takawale, A., Lee, J. & Kassiri, Z. Сердечные фибробласты, фиброз и ремоделирование внеклеточного матрикса при заболеваниях сердца. Фиброген.
 Tissue Repair 5 , 15 (2012).
Tissue Repair 5 , 15 (2012).КАС
СтатьяGoogle ученый
Льюис, Г. А. и др. Биологические фенотипы сердечной недостаточности с сохраненной фракцией выброса. Дж. Ам. Сб. Кардиол. 70 , 2186–2200 (2017).
Артикул
Google ученый
Ассомулл, Р. Г. и др. Сердечно-сосудистый магнитный резонанс, фиброз и прогноз при дилатационной кардиомиопатии. Дж. Ам. Сб. Кардиол. 48 , 1977–1985 (2006).
Артикул
Google ученый
Аоки Т. и др. Прогностическое влияние интерстициального фиброза миокарда при неишемической сердечной недостаточности. -Сравнение сердечной недостаточности с сохраненной и сниженной фракцией выброса. Обр. J. 75 , 2605–2613 (2011).
КАС
СтатьяGoogle ученый
«>Kuruvilla, S., Adenaw, N., Katwal, A.B., Lipinski, M.J., Kramer, C.M. & Salerno, M. Позднее усиление гадолиния при магнитном резонансе сердца предсказывает неблагоприятные сердечно-сосудистые исходы при неишемической кардиомиопатии: систематический обзор и метаданные. -анализ. Циркуляр. Кардиоваскулярная визуализация 7 , 250–258 (2014).
Артикул
Google ученый
Нарендорф, М. и др. Заживающий миокард последовательно мобилизует два подмножества моноцитов с расходящимися и взаимодополняющими функциями. Дж. Экспл. Мед. 204 , 3037–3047 (2007).
КАС
СтатьяGoogle ученый
«>Манн, Д. Л. Медиаторы воспаления и сердечно-сосудистые заболевания: прошлое, настоящее и обозримое будущее. Обр. Рез. 91 , 988–998 (2002).
КАС
СтатьяGoogle ученый
Финкель, М.С., Оддис, К.В., Джейкоб, Т.Д., Уоткинс, С.К., Хаттлер, Б.Г. и Симмонс, Р.Л. Отрицательное инотропное действие цитокинов на сердце, опосредованное оксидом азота. Наука 257 , 387–389 (1992).
ОБЪЯВЛЕНИЕ
КАС
СтатьяGoogle ученый
Eltzschig, HK & Carmeliet, P.
 Гипоксия и воспаление. Н. англ. Дж. Мед. 364 , 656–665 (2011).
Гипоксия и воспаление. Н. англ. Дж. Мед. 364 , 656–665 (2011).КАС
СтатьяGoogle ученый
Мердок С., Джанноудис А. и Льюис С.Е. Механизмы, регулирующие привлечение макрофагов в гипоксические области опухолей и других ишемизированных тканей. Кровь 104 , 2224–2234 (2004).
КАС
СтатьяGoogle ученый
Wang, G.L. & Semenza, G.L. Общее участие фактора 1, индуцируемого гипоксией, в транскрипционном ответе на гипоксию. Проц. Натл акад. науч. США 90 , 4304–4308 (1993).
ОБЪЯВЛЕНИЕ
КАС
СтатьяGoogle ученый
Weidemann, A. & Johnson, R.S. Биология HIF-1alpha. Смерть клеток. 15 , 621–627 (2008).
КАС
СтатьяGoogle ученый
«>Jiang, B.H., Semenza, G.L., Bauer, C. & Marti, H.H. Уровни фактора 1, индуцируемого гипоксией, изменяются экспоненциально в пределах физиологически значимого диапазона напряжения O2. утра. Дж. Физиол. 271 , C1172–C1180 (1996).
КАС
СтатьяGoogle ученый
Келин В. Г. и Рэтклифф П. Дж. Чувство кислорода метазоями: центральная роль пути гидроксилазы HIF. Мол. Ячейка 30 , 393–402 (2008).
КАС
СтатьяGoogle ученый
«>Bruick, R. K. & McKnight, S. L. Консервативное семейство пролил-4-гидроксилаз, модифицирующих HIF. Наука 294 , 1337–1340 (2001).
ОБЪЯВЛЕНИЕ
КАС
СтатьяGoogle ученый
Epstein, A.C. et al. C. elegans EGL-9 и гомологи млекопитающих определяют семейство диоксигеназ, которые регулируют HIF путем гидроксилирования пролила. Cell 107 , 43–54 (2001).
КАС
СтатьяGoogle ученый
Маэмура, К. и др. Генерация доминантно-негативного мутанта эндотелиального белка 1 домена PAS путем делеции сильного С-концевого домена трансактивации. Дж. Биол. хим.
 274 , 31565–31570 (1999).
274 , 31565–31570 (1999).КАС
СтатьяGoogle ученый
Такеда, Н. и др. Дифференциальная активация и антагонистическая функция изоформ HIF-{альфа} в макрофагах необходимы для гомеостаза NO. Гены Дев. 24 , 491–501 (2010).
КАС
СтатьяGoogle ученый
Семба, Х. и др. Активный гликолиз, индуцированный осью HIF-1альфа-PDK1, играет важную роль в способности макрофагов к миграции. Нац. коммун. 7 , 11635 (2016).
ОБЪЯВЛЕНИЕ
КАС
СтатьяGoogle ученый
Seki, E. et al. TLR4 усиливает передачу сигналов TGF-бета и фиброз печени. Нац. Мед. 13 , 1324–1332 (2007).
КАС
СтатьяGoogle ученый
«>Нарендорф М. и Свирски Ф. К. Неоднородность моноцитов и макрофагов в сердце. Обр. Рез. 112 , 1624–1633 (2013).
КАС
СтатьяGoogle ученый
Hilgendorf, I. et al. Моноциты Ly-6Chigh зависят от Nr4a1, чтобы сбалансировать как воспалительную, так и репаративную фазы в инфарктном миокарде. Циркуляр. Рез. 114 , 1611–1622 (2014).
КАС
СтатьяGoogle ученый
Такубо, К. и др. Регуляция уровня HIF-1альфа необходима для гемопоэтических стволовых клеток. Cell Stem Cell 7 , 391–402 (2010).

КАС
СтатьяGoogle ученый
Cramer, T. et al. HIF-1альфа необходим для воспаления, опосредованного миелоидными клетками. Cell 112 , 645–657 (2003).
КАС
СтатьяGoogle ученый
Clausen, B.E., Burkhardt, C., Reith, W., Renkawitz, R. & Förster, I. Условное нацеливание генов в макрофагах и гранулоцитах с использованием мышей LysMcre. Трансгенный рез. 8 , 265–277 (1999).
КАС
СтатьяGoogle ученый
Kretzschmar, M., Liu, F., Hata, A., Doody, J. & Massagué, J. Медиатор семейства TGF-бета Smad1 фосфорилируется непосредственно и функционально активируется киназой рецептора BMP. Гены Дев. 11 , 984–995 (1997).
КАС
СтатьяGoogle ученый
«>Юэ, Дж., Фрей, Р. С. и Малдер, К. М. Перекрестные помехи между сигнальными путями Smad1 и Ras/MEK для TGFbeta. Онкоген 18 , 2033–2037 (1999).
КАС
СтатьяGoogle ученый
Гао, С. и др. Убиквитинлигаза Nedd4L нацелена на активацию Smad2/3, чтобы ограничить передачу сигналов TGF-бета. Мол. Сотовый 36 , 457–468 (2009).
КАС
СтатьяGoogle ученый
Kretzschmar, M., Doody, J. & Massague, J. Противоположные сигнальные пути BMP и EGF сходятся на медиаторе семейства TGF-бета Smad1. Природа 389 , 618–622 (1997).

ОБЪЯВЛЕНИЕ
КАС
СтатьяGoogle ученый
Kim, J. E., Nakashima, K. & de Crombrugghe, B. Трансгенные мыши, экспрессирующие лиганд-индуцируемую рекомбиназу cre в остеобластах и одонтобластах: новый инструмент для изучения физиологии и заболеваний постнатальных костей и зубов. утра. Дж. Патол. 165 , 1875–1882 (2004).
КАС
СтатьяGoogle ученый
Wang, Y. et al. Специфическое действие онкостатина М на рецепторную субъединицу в клетках печени и его модуляция фактором, ингибирующим лейкемию. Дж. Биол. хим. 275 , 25273–25285 (2000).
КАС
СтатьяGoogle ученый
Кубин Т. и др. Онкостатин М является основным медиатором дедифференцировки и ремоделирования кардиомиоцитов. Cell Stem Cell 9 , 420–432 (2011).

КАС
СтатьяGoogle ученый
Lörchner, H. et al. Заживление миокарда требует Reg3β-зависимого накопления макрофагов в ишемизированном сердце. Нац. Мед. 21 , 353–362 (2015).
Артикул
Google ученый
Айер, С.В., Харпаз, Р., ЛеПенду, П., Бауэр-Мехрен, А. и Шах, Н.Х. Анализ клинического текста для выявления сигналов о неблагоприятных лекарственных взаимодействиях. Дж. Ам. Мед. Поставить в известность. доц. 21 , 353–362 (2014).
Артикул
Google ученый
West, N.R. et al. Онкостатин М снижает воспаление кишечника и предсказывает ответ на терапию, нейтрализующую фактор некроза опухоли, у пациентов с воспалительным заболеванием кишечника. Нац. Мед. 23 , 579–589 (2017).
КАС
СтатьяGoogle ученый
«>Ван Ройен, Н. и Сандерс, А. Устранение, блокирование и активация макрофагов: три вида? Дж. Лейкок. биол. 62 , 702–709 (1997).
Артикул
Google ученый
Нисимура, С. и др. ИЛ-1альфа индуцирует тромбопоэз посредством разрыва мегакариоцитов в ответ на острую потребность в тромбоцитах. J. Cell Biol. 209 , 453–466 (2015).
КАС
СтатьяGoogle ученый
Кафедра сердечно-сосудистой медицины Высшей школы медицины Токийского университета, 7-3-1 Hongo, Bunkyo-ku, Tokyo, 113-8655, Japan
Hajime Abe , Норихико Такэда, Хироаки Семба, Тацуюки Сато, Кацура Сома, Кацухиро Кояма, Масаки Вакэ, Манами Като и Иссей Комуро
Школа сердечно-сосудистой медицины и наук, Королевский колледж Лондона Центр передового опыта Британского фонда сердца, Лондон, SE5 9NU, UK
Hajime Abe & Kinya Otsu
PRESTO, JST, 4-1-8 Honcho Kawaguchi, Saitama, 332-0012, Japan
Norihiko Takeda & Satoshi Nishimura
Graduate School of Biomedical Science, Университет Нагасаки, 1-7-1сакамото, Нагасаки, 852-8501, Япония
Такаюки Исагава и Кодзи Маэмура
Кафедра сердечно-сосудистой медицины, Институт сердечно-сосудистых заболеваний, 3-2-19 Нисиазабу, Минато-ку, Токио, 106 -00031, Япония
Hiroaki Semba & Takeshi Yamashita
Center for Molecular Medicine, Jichi Medical University, 3311-1 Yakushiji, Shimotsuke-shi, Tochigi, 329-0498, Japan
Satoshi Nishimura
Depertment of Bioinformatics, Medical Research Institute, Tokyo Medical and Dental University, 1-5-45 Yushima, Bunkyoku, Tokyo, 113–8510, Japan
Masaki Suimye Morioka
Факультет педиатрии, Высшая школа медицины, Университет Токио, 7-3 -1 Хонго, Бункё-ку, Токио, 113-8655, Япония
Ю Накагама и Рё Инузука
Кафедра патобиологии, Высшая школа фармацевтических наук, Городской университет Нагоя, 3-1 Танабэ-дори, Мизухо-ку, Нагоя, 467-8603, Япония
Масатака Асагири 5 0609 9000
Факультет биологических наук Техасского университета в Далласе, 800 Вт.
 Campbell Road FO 3.704G, Richardson, TX, 75080, USA
Campbell Road FO 3.704G, Richardson, TX, 75080, USAMichael L. Neugent & Jung-whan Kim
Институт анатомии Цюрихского университета, Цюрих, CH-8057, Швейцария
Christian Stockmann
Онкологический исследовательский центр Цюриха, Winterthurerstrasse 190, CH-8057, Zurich, Switzerland
Christian Stockmann
Центр терапевтических инноваций, Центр исследований генов, Центр наук о жизни Frontakier University, Нагас Школа биомедицинских наук, 1-12-14 Сакамото, Нагасаки, 852-8523, Япония
Томо Йонезава
Кафедра акушерства и гинекологии Высшей школы медицины Токийского университета, 7-3-1 Хонго, Бункё-ку, Токио, 113-8655, Япония
Yasushi Hirota
Кафедра биологии болезней и молекулярной медицины, Высшая школа медицины, Университет Тиба, 1-8-1 Inohana, Chuo-ku, Chiba-shi, Chiba, 260-8670, Japan
Ichiro Manabe
Медицинский университет Jichi, 3311-1 Yakushiji, Shimotsuke-Shi, Tochigi-Ken, Tochigi, 329-0498, Japan
Ryozo Nagai
- Норихико Такэда
Посмотреть публикации автора
Вы также можете искать этого автора в
PubMed Google Scholar - Takayuki Isagawa
Посмотреть публикации автора
Вы также можете искать этого автора в
PubMed Google Scholar - Hiroaki Semba
Просмотр публикаций автора
Вы также можете искать этого автора в
PubMed Google Scholar - Satoshi Nishimura
Посмотреть публикации автора
Вы также можете искать этого автора в
PubMed Google Scholar - Masaki Suimye Morioka
Посмотреть публикации автора
Вы также можете искать этого автора в
PubMed Google Scholar - Yu Nakagama
Просмотр публикаций автора
Вы также можете искать этого автора в
PubMed Google Scholar - Тацуюки Сато
Просмотр публикаций автора
Вы также можете искать этого автора в
PubMed Google Scholar - Katsura Soma
Просмотр публикаций автора
Вы также можете искать этого автора в
PubMed Google Scholar - Katsuhiro Koyama
Просмотр публикаций автора
Вы также можете искать этого автора в
PubMed Google Scholar - Masaki Wake
Посмотреть публикации автора
Вы также можете искать этого автора в
PubMed Google Scholar - Manami Katoh
Просмотр публикаций автора
Вы также можете искать этого автора в
PubMed Google Scholar - Масатака Асагири
Посмотреть публикации автора
Вы также можете искать этого автора в
PubMed Google Scholar - Michael L.
 Neugent
NeugentПосмотреть публикации автора
Вы также можете искать этого автора в
PubMed Google Scholar - Jung-whan Kim
Просмотр публикаций автора
Вы также можете искать этого автора в
PubMed Google Scholar - Christian Stockmann
Просмотр публикаций автора
Вы также можете искать этого автора в
PubMed Google Scholar - Tomo Yonezawa
Посмотреть публикации автора
Вы также можете искать этого автора в
PubMed Google Scholar - Ryo Inuzuka
Просмотр публикаций автора
Вы также можете искать этого автора в
PubMed Google Scholar - Yasushi Hirota
Просмотр публикаций автора
Вы также можете искать этого автора в
PubMed Google Scholar - Koji Maemura
Просмотр публикаций автора
Вы также можете искать этого автора в
PubMed Google Академия - Такеши Ямасита
Посмотреть публикации автора
Вы также можете искать этого автора в
PubMed Google Scholar - Kinya Otsu
Просмотр публикаций автора
Вы также можете искать этого автора в
PubMed Google Scholar - Ichiro Manabe
Просмотр публикаций автора
Вы также можете искать этого автора в
PubMed Google Scholar - Ryozo Nagai
Просмотр публикаций автора
Вы также можете искать этого автора в
PubMed Google Scholar - Issei Komuro
Просмотр публикаций автора
Вы также можете искать этого автора в
PubMed Google Scholar Сердечные фибробласты регулируют развитие сердечной недостаточности через ось Htra3-TGF-β-IGFBP7.
- Тосиюки Ко
- Сейтаро Номура
- Иссей Комуро
Nature Communications (2022)
Кардиоселезеночная ось: прогностическая роль селезенки при сердечной недостаточности
- Хироаки Хираива
- Такахиро Окумура
- Тойоаки Мурохара
Обзоры сердечной недостаточности (2022)
Множественные роли сердечных макрофагов в сердечном гомеостазе и сердечной недостаточности
- Анета Москалик
- Юстина Нидерла-Белинска
- Анна Ратайска
Обзоры сердечной недостаточности (2022)
Мезенхимальные стволовые клетки ослабляют фиброз печени путем нацеливания на макрофаги Ly6Chi/lo посредством активации цитокин-паракринного и апоптотического путей.

- Юань-хуэй Ли
- Шуан Шен
- Цзянь-чжун Шао
Обнаружение гибели клеток (2021)
Электроиммунология и сердечная аритмия
- Яна Груне
- Масахиро Ямазоэ
- Матиас Нарендорф
Обзоры природы Кардиология (2021)
45. Mateo J, Izquierdo-Garcia D, Badimon JJ, Fayad ZA, Fuster V. Неинвазивная оценка гипоксии при прогрессирующем атеросклерозе кроликов с использованием позитрона (1)(8)F-фтормизонидазола эмиссионная томография. Циркулярная кардиоваскулярная визуализация. 2014;7(2):312–320. doi: 10.1161/ОБЪЕМНОЕ ИЗОБРАЖЕНИЕ.113.001084. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
46. Манабэ О., Хирата К., Шозо О., Шига Т., Утияма Й., Кобаяси К., Ватанабэ С., Тойонага Т., Кикути Х., Ояма-Манабэ Н. , Tamaki N. ПЭТ с 18F-фтормизонидазолом (FMISO) может иметь потенциал для выявления сердечного саркоидоза. J Нукл Кардиол. 2017;24(1):329–331. doi: 10.1007/s12350-016-0495-2. [PubMed] [CrossRef] [Google Scholar]
47. Joshi FR, Manavaki R, Fryer TD, Figg NL, Sluimer JC, Aigbirhio FI, Davenport AP, Kirkpatrick PJ, Warburton EA, Rudd JHF. На визуализацию сосудов с помощью позитронно-эмиссионной томографии с 18F-фтордезоксиглюкозой влияет гипоксия. J Am Coll Кардиол. 2017;69(14):1873–1874. doi: 10.1016/j.jacc.2017.01.050. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
J Am Coll Кардиол. 2017;69(14):1873–1874. doi: 10.1016/j.jacc.2017.01.050. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
48. van der Valk FM, Sluimer JC, Voo SA, Verberne HJ, Nederveen AJ, Windhorst AD, et al. In vivo визуализация гипоксии в атеросклеротических бляшках у человека. JACC Cardiovasc Imaging. 2015;8(11):1340–1341. doi: 10.1016/j.jcmg.2014.12.015. [PubMed] [CrossRef] [Академия Google]
49. Силвола Дж.М., Сарасте А., Форсбак С., Лайне В.Дж., Саукко П., Хейнонен С.Е. и др. Обнаружение гипоксии с помощью [18F]EF5 в атеросклеротических бляшках у мышей. Артериосклеры Тромб Васк Биол. 2011;31(5):1011–1015. doi: 10.1161/ATVBAHA.110.221440. [PubMed] [CrossRef] [Google Scholar]
50. Медина Р.А., Мариотти Э., Павлович Д., Шоу К.П., Эйкин Т.Р., Блоуэр П.Дж. и соавт. 64Cu-CTS: перспективный радиофармпрепарат для выявления слабой сердечной гипоксии с помощью ПЭТ. Дж Нукл Мед. 2015;56(6):921–926. doi: 10.2967/jnumed.114.148353. [PubMed] [CrossRef] [Google Scholar]
51. Handley MG, Medina RA, Mariotti E, Kenny GD, Shaw KP, Yan R, et al. Визуализация сердечной гипоксии: аналоги 64Cu-ATSM второго поколения. Дж Нукл Мед. 2014;55(3):488–494. doi: 10.2967/jnumed.113.129015. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Handley MG, Medina RA, Mariotti E, Kenny GD, Shaw KP, Yan R, et al. Визуализация сердечной гипоксии: аналоги 64Cu-ATSM второго поколения. Дж Нукл Мед. 2014;55(3):488–494. doi: 10.2967/jnumed.113.129015. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
52. Handley MG, Medina RA, Paul RL, Blower PJ, Southworth R. Демонстрация удержания 64Cu-ATSM в сердечных миоцитах с использованием новой инкубационной камеры для скрининга гипоксически зависимых радиофармпрепаратов. Nucl Med Commun. 2013;34(10):1015–1022. дои: 10.1097/МНМ.0b013e328363f25e. [PubMed] [CrossRef] [Google Scholar]
53. Fujibayashi Y, Cutler CS, Anderson CJ, McCarthy DW, Jones LA, Sharp T, Yonekura Y, Welch MJ. Сравнительные исследования Cu-64-ATSM и C-11-ацетата в модели острого инфаркта миокарда: ex vivo визуализация гипоксии у крыс. Нукл Мед Биол. 1999;26(1):117–121. doi: 10.1016/S0969-8051(98)00049-3. [PubMed] [CrossRef] [Google Scholar]
54. Shaughnessy F, Mariotti E, Shaw KP, Eykyn TR, Blower PJ, Siow R, et al. Модификация статуса внутриклеточного глутатиона не изменяет кардиальный захват (64)Cu(ATSM) EJNMMI Res. 2014;4(1):40. doi: 10.1186/s13550-014-0040-8. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Модификация статуса внутриклеточного глутатиона не изменяет кардиальный захват (64)Cu(ATSM) EJNMMI Res. 2014;4(1):40. doi: 10.1186/s13550-014-0040-8. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
55. Wada K, Fujibayashi Y, Tajima N, Yokoyama A. Cu-ATSM, внутриклеточно доступный комплекс меди, подобный супероксиддисмутазе (SOD): оценка в модели ишемически-реперфузионного повреждения. Биол Фарм Бык. 1994;17(5):701–704. doi: 10.1248/bpb.17.701. [PubMed] [CrossRef] [Google Scholar]
56. Такахаши Н., Фудзибаяси Ю., Йонекура Ю., Уэлч М.Дж., Ваки А., Цучида Т., Садато Н., Сугимото К., Накано А., Ли Дж. Д., Ито Х. Коппер-62 АТСМ как маркер гипоксической ткани при ишемии миокарда. Энн Нукл Мед. 2001;15(3):293–296. doi: 10.1007/BF02987849. [PubMed] [CrossRef] [Google Scholar]
57. Nie X, Randolph GJ, Elvington A, Bandara N, Железняк A, Gropler RJ, et al. Визуализация гипоксии в атеросклеротических бляшках мышей с помощью (64) Cu-ATSM. Нукл Мед Биол. 2016;43(9):534–542. doi: 10.1016/j.nucmedbio.2016.05.011. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
doi: 10.1016/j.nucmedbio.2016.05.011. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
58. Nie X, Laforest R, Elvington A, Randolph GJ, Zheng J, Voller T, Abendschein DR, Lapi SE, Woodard PK. ПЭТ/МРТ гипоксического атеросклероза с использованием 64Cu-ATSM на модели кролика. Дж Нукл Мед. 2016;57(12):2006–2011. дои: 10.2967/номер.116.172544. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
59. Lee ST, Scott AM. Позитронно-эмиссионная томография гипоксии с 18f-фтормизонидазолом. Семин Нукл Мед. 2007;37(6):451–461. doi: 10.1053/j.semnuclmed.2007.07.001. [PubMed] [CrossRef] [Google Scholar]
60. Peeters SG, Zegers CM, Lieuwes NG, van Elmpt W, Eriksson J, van Dongen GA, et al. Сравнительное исследование ПЭТ-трассеров гипоксии [(1)(8)F]HX4, [(1)(8)F]FAZA и [(1)(8)F]FMISO на доклинической модели опухоли. Int J Radiat Oncol Biol Phys. 2015;91(2):351–359. doi: 10.1016/j.ijrobp.2014.09.045. [PubMed] [CrossRef] [Google Scholar]
61. Fujibayashi Y, Matsumoto K, Yonekura Y, Konishi J, Yokoyama A. Новый генератор цинка-62/меди-62 в качестве источника меди-62 для ПЭТ-радиофармацевтических препаратов. Дж Нукл Мед. 1989; 30 (11): 1838–1842. [PubMed] [Google Scholar]
Новый генератор цинка-62/меди-62 в качестве источника меди-62 для ПЭТ-радиофармацевтических препаратов. Дж Нукл Мед. 1989; 30 (11): 1838–1842. [PubMed] [Google Scholar]
62. Дорогой Дж. Л., Packard AB. Некоторые мысли о механизме клеточного захвата Cu(II)-АТСМ. Нукл Мед Биол. 2010;37(3):237–243. doi: 10.1016/j.nucmedbio.2009.11.004. [PubMed] [CrossRef] [Академия Google]
63. Maurer RI, Blower PJ, Dilworth JR, Reynolds CA, Zheng Y, Mullen GE. Изучение механизма гипоксической селективности радиофармпрепаратов на основе бис(тиосемикарбазона) меди. J Med Chem. 2002;45(7):1420–1431. doi: 10.1021/jm0104217. [PubMed] [CrossRef] [Google Scholar]
64. Патерсон Б.М., Доннелли П.С. Медные комплексы бис(тиосемикарбазонов): от химиотерапевтических средств к диагностическим и лечебным радиофармпрепаратам. Chem Soc Rev. 2011;40(5):3005–3018. doi: 10.1039/c0cs00215a. [PubMed] [CrossRef] [Академия Google]
65. Ип С., Блоуэр П.Дж., Гох В., Ландау Д.Б., Кук Г.Дж. Молекулярная визуализация гипоксии при немелкоклеточном раке легкого. Eur J Nucl Med Mol Imaging. 2015;42(6):956–976. doi: 10.1007/s00259-015-3009-6. [PubMed] [CrossRef] [Google Scholar]
Eur J Nucl Med Mol Imaging. 2015;42(6):956–976. doi: 10.1007/s00259-015-3009-6. [PubMed] [CrossRef] [Google Scholar]
66. McQuade P, Martin KE, Castle TC, Went MJ, Blower PJ, Welch MJ, Lewis JS. Исследование 64Cu-меченых комплексов Bis(селеносемикарбазон) и Bis(тиосемикарбазон) в качестве визуализирующих агентов гипоксии. Нукл Мед Биол. 2005;32(2):147–156. doi: 10.1016/j.nucmedbio.2004.10.004. [PubMed] [CrossRef] [Академия Google]
67. Дирлинг Дж. Л., Льюис Дж. С., Маллен Дж. Э., Рэй М. Т., Цвейт Дж., Блоуэр П. Дж. Дизайн радиофармпрепаратов, нацеленных на гипоксию: селективное поглощение комплексов меди-64 гипоксическими клетками in vitro. Eur J Nucl Med. 1998;25(7):788–792. doi: 10.1007/s0025
283. [PubMed] [CrossRef] [Google Scholar]
68. Brown OC, Baguna Torres J, Holt KB, Blower PJ, Went MJ. Комплексы меди с диссимметрично замещенными бис(тиосемикарбазоновыми) лигандами как основа ПЭТ-радиофармпрепаратов: контроль окислительно-восстановительного потенциала и липофильности. Далтон Транс. 2017;46(42):14612–14630. дои: 10.1039/C7DT02008B. [PubMed] [CrossRef] [Google Scholar]
Далтон Транс. 2017;46(42):14612–14630. дои: 10.1039/C7DT02008B. [PubMed] [CrossRef] [Google Scholar]
69. Таркин Дж.М., Джоши Ф.Р., Радд Дж.Х. ПЭТ-визуализация воспаления при атеросклерозе. Нат Рев Кардиол. 2014;11(8):443–457. doi: 10.1038/nrcardio.2014.80. [PubMed] [CrossRef] [Google Scholar]
70. Moss AJ, Adamson PD, Newby DE, Dweck MR. Позитронно-эмиссионная томография коронарного атеросклероза. Футур Кардиол. 2016;12(4):483–496. doi: 10.2217/fca-2016-0017. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
71. Джозеф П., Тавакол А. Визуализация атеросклероза с помощью позитронно-эмиссионной томографии. Европейское сердце J. 2016; 37 (39): 2974–2980. doi: 10.1093/eurheartj/ehw147. [PubMed] [CrossRef] [Google Scholar]
72. Росс Р. Атеросклероз — воспалительное заболевание. N Engl J Med. 1999;340(2):115–126. doi: 10.1056/NEJM199
3400207. [PubMed] [CrossRef] [Google Scholar]
73. Либби П., Ридкер П.М., Мазери А. Воспаление и атеросклероз. Тираж. 2002;105(9):1135–1143. doi: 10.1161/hc0902.104353. [PubMed] [CrossRef] [Академия Google]
Тираж. 2002;105(9):1135–1143. doi: 10.1161/hc0902.104353. [PubMed] [CrossRef] [Академия Google]
74. Радд Дж. Х., Уорбертон Э. А., Фрайер Т. Д., Джонс Х. А., Кларк Дж. К., Антоун Н., Джонстрем П., Давенпорт А. П., Киркпатрик П. Дж., Арч Б. Н., Пикард Д. Д., Вайсберг П. Л. Визуализация воспаления атеросклеротических бляшек с помощью позитронно-эмиссионной томографии с [18F]-фтордезоксиглюкозой. Тираж. 2002;105(23):2708–2711. doi: 10.1161/01.CIR.0000020548.60110.76. [PubMed] [CrossRef] [Google Scholar]
75. Тавакол А., Мигрино Р.К., Башиан Г.Г., Бедри С., Вермилен Д., Кьюри Р.С., Йейтс Д., Ламуралья Г.М., Фьюри К., Хаузер С., Гевирц Х., Мюллер Дж.Е., Брэди Т.Дж., Фишман А.Дж. Позитронно-эмиссионная томография с 18F-фтордезоксиглюкозой in vivo обеспечивает неинвазивное измерение воспаления каротидной бляшки у пациентов. J Am Coll Кардиол. 2006;48(9): 1818–1824 гг. doi: 10.1016/j.jacc.2006.05.076. [PubMed] [CrossRef] [Google Scholar]
76. Rudd JH, Narula J, Strauss HW, Virmani R, Machac J, Klimas M, et al. Визуализация воспаления атеросклеротических бляшек с помощью фтордезоксиглюкозы с позитронно-эмиссионной томографией: готовы к прайм-тайму? J Am Coll Кардиол. 2010;55(23):2527–2535. doi: 10.1016/j.jacc.2009.12.061. [PubMed] [CrossRef] [Google Scholar]
Визуализация воспаления атеросклеротических бляшек с помощью фтордезоксиглюкозы с позитронно-эмиссионной томографией: готовы к прайм-тайму? J Am Coll Кардиол. 2010;55(23):2527–2535. doi: 10.1016/j.jacc.2009.12.061. [PubMed] [CrossRef] [Google Scholar]
77. Уильямс Г., Колодный Г.М. Подавление поглощения миокардом 18F-FDG путем подготовки пациентов к диете с высоким содержанием жиров и низким содержанием углеводов. AJR Am J Рентгенол. 2008;190 (2): В151–В156. doi: 10.2214/AJR.07.2409. [PubMed] [CrossRef] [Google Scholar]
78. de Groot M, Meeuwis AP, Kok PJ, Corstens FH, Oyen WJ. Влияние уровня глюкозы в крови, возраста и периода голодания на непатологическое поглощение ФДГ сердцем и кишечником. Eur J Nucl Med Mol Imaging. 2005;32(1):98–101. doi: 10.1007/s00259-004-1670-2. [PubMed] [CrossRef] [Google Scholar]
79. Rogers IS, Nasir K, Figueroa AL, Cury RC, Hoffmann U, Vermylen DA, Brady TJ, Tawakol A. Возможности FDG-визуализации коронарных артерий: сравнение острого коронарный синдром и стабильная стенокардия. JACC Cardiovasc Imaging. 2010;3(4):388–39.7. doi: 10.1016/j.jcmg.2010.01.004. [PubMed] [CrossRef] [Google Scholar]
JACC Cardiovasc Imaging. 2010;3(4):388–39.7. doi: 10.1016/j.jcmg.2010.01.004. [PubMed] [CrossRef] [Google Scholar]
80. Heughan C, Niinikoski J, Hunt TK. Напряжение кислорода в очагах экспериментального атеросклероза кроликов. Атеросклероз. 1973;17(3):361–367. doi: 10.1016/0021-9150(73)
-0. [PubMed] [CrossRef] [Google Scholar]
81. Бьорнхеден Т., Левин М., Эвалдссон М., Виклунд О. Доказательства гипоксических областей в артериальной стенке in vivo. Артериосклеры Тромб Васк Биол. 1999;19(4):870–876. дои: 10.1161/01.ATV.19.4.870. [PubMed] [CrossRef] [Google Scholar]
82. Sluimer JC, Gasc JM, van Wanroij JL, Kisters N, Groeneweg M, Sollewijn Gelpke MD, Cleutjens JP, van den Akker LH, Corvol P, Wouters BG, Daemen MJ , Бийненс А.П.Дж. Гипоксия, фактор транскрипции, индуцируемый гипоксией, и макрофаги в атеросклеротических бляшках человека коррелируют с внутрибляшечным ангиогенезом. J Am Coll Кардиол. 2008;51(13):1258–1265. doi: 10.1016/j.jacc.2007.12.025. [PubMed] [CrossRef] [Google Scholar]
83. Folco EJ, Sheikine Y, Rocha VZ, Christen T, Shvartz E, Sukhova GK, et al. Гипоксия, но не воспаление, увеличивает поглощение глюкозы макрофагами человека: последствия для визуализации атеросклероза с помощью позитронно-эмиссионной томографии с 2-дезокси-D-глюкозой, меченной 18 фтором. J Am Coll Кардиол. 2011;58(6):603–614. doi: 10.1016/j.jacc.2011.03.044. [PubMed] [CrossRef] [Академия Google]
Folco EJ, Sheikine Y, Rocha VZ, Christen T, Shvartz E, Sukhova GK, et al. Гипоксия, но не воспаление, увеличивает поглощение глюкозы макрофагами человека: последствия для визуализации атеросклероза с помощью позитронно-эмиссионной томографии с 2-дезокси-D-глюкозой, меченной 18 фтором. J Am Coll Кардиол. 2011;58(6):603–614. doi: 10.1016/j.jacc.2011.03.044. [PubMed] [CrossRef] [Академия Google]
Роль сигналинга гипоксии в патогенезе сердечно-сосудистых заболеваний
1)
Вест Джей Би.
Энергетика сердца и потребление кислорода миокардом. Физиологические основы врачебной практики. Уильямс и Уилкинс;
Балтимор, Мэриленд, США:
1991: 250-260 [Google Scholar]
2)
Браунвальд Э.
Коронарный кровоток и ишемия миокарда. Болезни сердца: Учебник сердечно-сосудистой медицины. В.Б. Компания Сондерс;
Филадельфия, Пенсильвания, США:
2001: 1161-1183 [Google Scholar]
3)
Тудер Р.М., Флук Б.Е., Воелкель Н.Ф.
Повышенная экспрессия генов vegf и рецепторов vegf kdr/flk и flt в легких, подвергшихся острой или хронической гипоксии. Модуляция экспрессии генов оксидом азота. Джей Клин Инвест.
Модуляция экспрессии генов оксидом азота. Джей Клин Инвест.
1995 год; 95: 1798-1807 [бесплатная статья PMC] [PubMed] [Google Scholar]
4)
Семенза Г.Л., Ван Г.Л.
Ядерный фактор, индуцируемый гипоксией посредством синтеза белка de novo, связывается с энхансером гена эритропоэтина человека в месте, необходимом для активации транскрипции. Мол Селл Биол.
1992; 12: 5447-5454 [бесплатная статья PMC] [PubMed] [Google Scholar]
5)
Ким Ю.В., Чернышев И., Семенза Г.Л., Данг К.В.
Hif-1-опосредованная экспрессия киназы пируватдегидрогеназы: метаболический переключатель, необходимый для клеточной адаптации к гипоксии. Метаболизм клеток. 2006 г.; 3: 177-185 [PubMed] [Google Scholar]
6)
Макклелланд ГБ, Брукс Г.А.
Изменения экспрессии mct 1, mct 4 и ldh тканеспецифичны у крыс после длительной гипобарической гипоксии. Журнал прикладной физиологии (Bethesda, Мэриленд: 1985). 2002 г.; 92: 1573-1584 [PubMed] [Google Scholar]
7)
Мелилло Г., Муссо Т., Сика А., Тейлор Л.С., Кокс Г. В., Варесио Л.
В., Варесио Л.
Чувствительный к гипоксии элемент опосредует новый путь активации промотора индуцибельной синтазы оксида азота. J Эксперт Мед.
1995 год; 182: 1683-1693 [бесплатная статья PMC] [PubMed] [Google Scholar]
8)
Тиан Х, Макнайт С.Л., Рассел Д.В.
Эндотелиальный белок домена pas 1 (epas1), фактор транскрипции, селективно экспрессируемый в эндотелиальных клетках. Гены Дев.
1997 год; 11: 72-82 [PubMed] [Google Scholar]
9)
Ван Г.Л., Семенза Г.Л.
Общее участие фактора 1, индуцируемого гипоксией, в транскрипционном ответе на гипоксию. Proc Natl Acad Sci U S A. 1993; 90: 4304-4308 [бесплатная статья PMC] [PubMed] [Google Scholar]
10)
Maxwell PH, Wiesener MS, Chang GW, Clifford SC, Vaux EC, Cockman ME, Wykoff CC, Pugh CW, Maher ER, Ratcliffe PJ.
Белок-супрессор опухоли vhl нацелен на факторы, индуцируемые гипоксией, для кислородзависимого протеолиза. Природа. 1999 г.; 399: 271-275 [PubMed] [Google Scholar]
11)
Ху CJ, Ван Л.И., Ходош Л.А., Кит Б., Саймон М. С.
С.
Дифференциальные роли индуцируемого гипоксией фактора 1альфа (hif-1alpha) и hif-2alpha в регуляции гипоксического гена. Мол Селл Биол.
2003 г.; 23: 9361-9374 [бесплатная статья PMC] [PubMed] [Google Scholar]
12)
Шодел Дж., Ойкономопулос С., Рагуссис Дж., Пью К.В., Рэтклифф П.Дж., Моул Д.Р.
Полногеномное картирование сайтов связывания hif с высоким разрешением с помощью чип-сек. Кровь. 2011 г.; 117: e207-217 [бесплатная статья PMC] [PubMed] [Google Scholar]
13)
Либби П.
Воспаление при атеросклерозе. Природа. 2002 г.; 420: 868-874 [PubMed] [Google Scholar]
14)
Gautier EL, Huby T, Witztum JL, Ouzilleau B, Miller ER, Saint-Charles F, Aucouturier P, Chapman MJ, Lesnik P.
Апоптоз макрофагов оказывает разное влияние на атерогенез в зависимости от стадии поражения. Тираж. 2009 г.; 119: 1795-1804 [PubMed] [Google Scholar]
15)
Ридкер ПМ.
Клиническое применение С-реактивного белка для выявления и профилактики сердечно-сосудистых заболеваний. Тираж. 2003 г.; 107: 363-369 [PubMed] [Google Scholar]
16)
Биасуччи Л. М., Лиуццо Г., Фантуцци Г., Калиджури Г., Ребуцци А.Г., Джиннетти Ф., Динарелло К.А., Мазери А.
М., Лиуццо Г., Фантуцци Г., Калиджури Г., Ребуцци А.Г., Джиннетти Ф., Динарелло К.А., Мазери А.
Повышение уровней интерлейкина (ил)-1ra и ил-6 в течение первых 2 дней госпитализации по поводу нестабильной стенокардии связано с повышенным риском госпитальных коронарных событий. Тираж. 1999; 99: 2079-2084 [PubMed] [Google Scholar]
17)
Валджимигли М., Чекони К., Малагутти П., Мерли Э., Сухомовская О., Франколини Г., Чиккителли Г., Оливарес А., Парринелло Г., Перкоко Г., Гуардильи Г., Меле Д., Пирани Р., Феррари Р.
Рецептор 1 фактора некроза опухоли-альфа является основным предиктором смертности и впервые возникшей сердечной недостаточности у пациентов с острым инфарктом миокарда: исследование активации цитокинов и долгосрочного прогноза при инфаркте миокарда (с-альфа). Тираж. 2005 г.; 111: 863-870 [PubMed] [Google Scholar]
18)
Пулламсетти С.С., Савай Р.
Регуляция макрофагов во время ремоделирования сосудов: значение для терапии легочной гипертензии. Американский журнал респираторных клеток и молекулярной биологии. 2017; 56: 556-558 [PubMed] [Google Scholar]
2017; 56: 556-558 [PubMed] [Google Scholar]
19)
Фудзю К., Ван Дж., Нагаи Р.
Кардиопротекторная функция сердечных макрофагов. Кардиовасц Рез.
2014; 102: 232-239 [PubMed] [Google Scholar]
20)
Дофино В., Рош Ф., Косовский М.П., Шотт А.М., Пишо В., Гаспоз Дж.М., Госсе П., Бартелеми Дж.К.
Влияние С-реактивного белка на впервые возникшую гипертензию у здорового населения в возрасте 65 лет: доказательное исследование. Журнал гипертонии. 2009 г.; 27: 736-743 [PubMed] [Google Scholar]
21)
Mattace-Raso FU, Verwoert GC, Hofman A, Witteman JC.
Воспаление и изолированная систолическая гипертензия у пожилых людей: Роттердамское исследование. Журнал гипертонии. 2010 г.; 28: 892-895 [PubMed] [Google Scholar]
22)
Дорфмюллер П., Перрос Ф., Балабанян К., Гумберт М.
Воспаление при легочной артериальной гипертензии. Европейский респираторный журнал. 2003 г.; 22: 358-363 [PubMed] [Google Scholar]
23)
Умбер М., Монти Г., Брено Ф., Ситбон О., Портье А., Гранжо-Керос Л. , Дюру П., Галано П., Симонно Г., Эмили Д.
, Дюру П., Галано П., Симонно Г., Эмили Д.
Повышение концентрации интерлейкина-1 и интерлейкина-6 в сыворотке крови при тяжелой первичной легочной гипертензии. Американский журнал респираторной и интенсивной терапии. 1995; 151: 1628-1631 [PubMed] [Google Scholar]
24)
Сун Э., Холмс А.М., Трейси К.М., Даути Н.Дж., Саутгейт Л., Мачадо Р.Д., Трембат Р.К., Дженнингс С., Баркер Л., Никлин П., Уокер С., Бадд Д.С., Пепке-Заба Дж., Моррелл Н.В.
Повышенные уровни воспалительных цитокинов предсказывают выживаемость при идиопатической и семейной легочной артериальной гипертензии. Тираж. 2010 г.; 122: 920-927 [PubMed] [Google Scholar]
25)
Raymond RJ, Dehmer GJ, Theoharides TC, Deliargyris EN.
Повышенный уровень интерлейкина-6 у пациентов с бессимптомной систолической дисфункцией левого желудочка. Am Heart J. 2001; 141: 435-438 [PubMed] [Google Scholar]
26)
Космала В., Держко Р., Пшевлоцка-Космала М., Орда А., Мазурек В.
Плазменные уровни tnf-альфа, ИЛ-6 и ИЛ-10 и их взаимосвязь с диастолической функцией левого желудочка у пациентов со стабильной стенокардией и сохраненной систолической функцией левого желудочка. Ишемическая болезнь сердца. 2008 г.; 19: 375-382 [PubMed] [Google Scholar]
Ишемическая болезнь сердца. 2008 г.; 19: 375-382 [PubMed] [Google Scholar]
27)
Уильямс Э.С., Шах С.Дж., Али С., На Б.Я., Шиллер Н.Б., Вули М.А.
С-реактивный белок, диастолическая дисфункция и риск сердечной недостаточности у пациентов с ишемической болезнью сердца: исследование сердца и души. Европейский журнал сердечной недостаточности. 2008 г.; 10:63-69[Бесплатная статья PMC] [PubMed] [Google Scholar]
28)
Торре-Амионе Г., Кападиа С., Бенедикт С., Орал Х., Янг Д.Б., Манн Д.Л.
Уровни провоспалительных цитокинов у пациентов с пониженной фракцией выброса левого желудочка: отчет об исследованиях дисфункции левого желудочка (solvd). Журнал Американского колледжа кардиологов. 1996 год; 27: 1201-1206 [PubMed] [Google Scholar]
29)
Цутамото Т., Хисанага Т., Вада А., Маэда К., Ониши М., Фукаи Д., Мабучи Н., Саваки М., Киношита М.
Распространение интерлейкина-6 в периферическом кровообращении увеличивается с тяжестью сердечной недостаточности, а высокий уровень интерлейкина-6 в плазме является важным прогностическим признаком у пациентов с застойной сердечной недостаточностью. Журнал Американского колледжа кардиологов. 1998; 31: 391-398 [PubMed] [Google Scholar]
Журнал Американского колледжа кардиологов. 1998; 31: 391-398 [PubMed] [Google Scholar]
30)
Роиг Э., Орус Дж., Паре С., Аскета М., Филелья Х., Перес-Вилья Ф., Эрас М., Санс Г.
Сывороточный интерлейкин-6 при застойной сердечной недостаточности, вторичной по отношению к идиопатической дилатационной кардиомиопатии. Ам Джей Кардиол.
1998 год; 82: 688-690, a688 [PubMed] [Google Scholar]
31)
Левин Б., Калман Дж., Майер Л., Филлит Х.М., Пакер М.
Повышенный уровень циркулирующего фактора некроза опухоли при тяжелой хронической сердечной недостаточности. N Engl J Med.
1990 г.; 323: 236-241 [PubMed] [Google Scholar]
32)
Миеттинен К.Х., Лассус Дж., Харьола В.П., Сиирила-Варис К., Мелин Дж., Пуннонен К.Р., Ниеминен М.С., Лааксо М., Пеухкуринен К.Дж.
Прогностическая роль про- и противовоспалительных цитокинов и их полиморфизмов при острой декомпенсированной сердечной недостаточности. Европейский журнал сердечной недостаточности. 2008 г.; 10: 396-403 [PubMed] [Google Scholar]
33)
Ананд И. С., Латини Р., Флореа В.Г., Кусковски М.А., Ректор Т., Массон С., Синьорини С., Мокарелли П., Хестер А., Глейзер Р., Кон Дж.Н.
С., Латини Р., Флореа В.Г., Кусковски М.А., Ректор Т., Массон С., Синьорини С., Мокарелли П., Хестер А., Глейзер Р., Кон Дж.Н.
С-реактивный белок при сердечной недостаточности: прогностическое значение и эффект валсартана. Тираж. 2005 г.; 112: 1428-1434 [PubMed] [Google Scholar]
34)
Бонечини-Алмейда М.Г., Читале С., Буцикакис И., Гэн Дж., Ду Х., Хе С., Хо Дж.Л.
Индукция активности человеческих макрофагов против микобактерий туберкулеза in vitro: потребность в интерферон-гамма и примированных лимфоцитах. Дж Иммунол.
1998 год; 160: 4490-4499 [PubMed] [Google Scholar]
35)
Гордон С.
Альтернативная активация макрофагов. Нат Рев Иммунол.
2003 г.; 3: 23-35 [PubMed] [Google Scholar]
36)
Мантовани А., Сика А., Соццани С., Аллавена П., Векки А., Локати М.
Система хемокинов в различных формах активации и поляризации макрофагов. Тренды Иммунол.
2004 г.; 25: 677-686 [PubMed] [Google Scholar]
37)
Моссер Д.М., Эдвардс Дж.П.
Изучение полного спектра активации макрофагов. Нат Рев Иммунол.
Нат Рев Иммунол.
2008 г.; 8: 958-969 [бесплатная статья PMC] [PubMed] [Google Scholar]
38)
Комохара Ю., Фудзивара Ю., Ониши К., Шираиси Д., Такея М.
Вклад поляризации макрофагов в метаболические заболевания. Журнал атеросклероза и тромбоза. 2016; 23: 10-17 [PubMed] [Google Scholar]
39)
Эль Касми К.С., Куаллс Дж.Э., Пеше Дж.Т., Смит А.М., Томпсон Р.В., Энао-Тамайо М., Басараба Р.Дж., Кониг Т., Шлейхер У., Ку М.С., Каплан Г., Фицджеральд К.А., Туоманен Э.И., Орме И.М., Каннеганти Т.Д., Богдан С. , Винн Т.А., Мюррей П.Дж.
Индуцированная толл-подобным рецептором аргиназа 1 в макрофагах препятствует эффективному иммунитету против внутриклеточных патогенов. Природная иммунология. 2008 г.; 9: 1399-1406 [бесплатная статья PMC] [PubMed] [Google Scholar]
40)
Бонелло С., Зарингер С., БелАиба Р.С., Джорджевич Т., Хесс Дж., Михилс С., Китцманн Т., Горлах А.
Активные формы кислорода активируют промотор hif-1alpha через функциональный сайт nfkappab. Артериосклероз, тромбоз и сосудистая биология. 2007 г.; 27: 755-761 [PubMed] [Google Scholar]
2007 г.; 27: 755-761 [PubMed] [Google Scholar]
41)
Риус Дж., Гума М., Шахтруп С., Акассоглу К., Зинкернагель А.С., Низет В., Джонсон Р.С., Хаддад Г.Г., Карин М.
Nfkappab связывает врожденный иммунитет с реакцией на гипоксию посредством регуляции транскрипции hif-1alpha. Природа. 2008 г.; 453: 807-811 [бесплатная статья PMC] [PubMed] [Google Scholar]
42)
Пейссонно С., Сехудо-Мартин П., Доденс А., Зинкернагель А.С., Джонсон Р.С., Низе В.
Передний край: Существенная роль индуцируемого гипоксией фактора-1альфа в развитии липополисахарид-индуцированного сепсиса. Дж Иммунол.
2007 г.; 178: 7516-7519 [PubMed] [Google Scholar]
43)
Такеда Н., О’Ди Э.Л., Доденс А., Ким Дж.В., Вайдеманн А., Стокманн С., Асагири М., Саймон М.С., Хоффманн А., Джонсон Р.С.
Дифференциальная активация и антагонистическая функция изоформ hif-{альфа} в макрофагах необходимы для отсутствия гомеостаза. Гены Дев.
2010 г.; 24:491-501 [бесплатная статья PMC] [PubMed] [Google Scholar]
44)
Крамер Т. , Яманиши Ю., Клаузен Б.Е., Форстер И., Павлински Р., Макман Н., Хаазе В.Х., Йениш Р., Корр М., Низе В., Файрштейн Г.С., Гербер Х.П., Феррара Н., Джонсон Р.С.
, Яманиши Ю., Клаузен Б.Е., Форстер И., Павлински Р., Макман Н., Хаазе В.Х., Йениш Р., Корр М., Низе В., Файрштейн Г.С., Гербер Х.П., Феррара Н., Джонсон Р.С.
Hif-1альфа необходим для воспаления, опосредованного миелоидными клетками. Клетка. 2003 г.; 112: 645-657 [бесплатная статья PMC] [PubMed] [Google Scholar]
45)
MacMicking JD, Nathan C, Hom G, Chartrain N, Fletcher DS, Trumbauer M, Stevens K, Xie QW, Sokol K, Hutchinson N, et al.
Измененные реакции на бактериальную инфекцию и эндотоксический шок у мышей с отсутствием индуцируемой синтазы оксида азота. Клетка. 1995; 81: 641-650 [PubMed] [Google Scholar]
46)
Маттила П.К., Лаппалайнен П.
Филоподии: молекулярная архитектура и клеточные функции. Обзоры природы. Молекулярно-клеточная биология. 2008 г.; 9: 446-454 [PubMed] [Google Scholar]
47)
Панталони Д., Ле Клейнш С., Карлье М.Ф.
Механизм актиновой подвижности. Наука. 2001 г.; 292: 1502-1506 [PubMed] [Google Scholar]
48)
Де Бок К., Джорджиаду М., Кармелье П.
Роль метаболизма эндотелиальных клеток в прорастании сосудов. Метаболизм клеток. 2013; 18: 634-647 [PubMed] [Google Scholar]
49)
Лич Р.М., Тричер Д.Ф.
Кислородный транспорт-2. Тканевая гипоксия. BMJ (Клинические исследования под ред.). 1998 год; 317: 1370-1373 [бесплатная статья PMC] [PubMed] [Google Scholar]
50)
Вебстер К.А.
Эволюция координационной регуляции генов гликолитических ферментов при гипоксии. Журнал экспериментальной биологии. 2003 г.; 206: 2911-2922 [PubMed] [Google Scholar]
51)
Семба Х., Такеда Н., Исагава Т., Сугиура Ю., Хонда К., Уэйк М., Миядзава Х., Ямагути Ю., Миура М., Дженкинс Д.М., Чой Х., Ким Дж.В., Асагири М., Кауберн А.С., Абэ Х., Сома К., Кояма К. , Като М., Саяма К., Года Н., Джонсон Р.С., Манабэ И., Нагаи Р., Комуро И.
Активный гликолиз, индуцированный осью Hif-1alpha-pdk1, играет важную роль в способности макрофагов к миграции. Нац коммун.
2016; 7: 11635. [Бесплатная статья PMC] [PubMed] [Google Scholar]
52)
Де Бок К., Джорджиаду М. , Шурс С., Кучнио А., Вонг Б.В., Кантельмо А.Р., Квегебеур А., Гескьер Б., Каувенбергс С., Илен Г., Фнг Л.К., Бетц И., Тембуйсер Б., Брепоэлс К., Велти Дж., Геденс И., Сегура И., Кройс Б., Бифари Ф., Десимо И., Бланко Р., Винс С., Вангиндертаэль Дж., Роча С., Коллинз Р.Т., Мунк С., Дэлеманс Д., Имамура Х., Девлигер Р., Райдер М., Ван Вельдховен П.П., Шуит Ф., Бартронс Р. , Хофкенс Дж., Фрайзл П., Теланг С., Деберардинис Р.Дж., Шунджанс Л., Винкиер С., Чесни Дж., Герхардт Х., Деверчин М., Кармелиет П.
, Шурс С., Кучнио А., Вонг Б.В., Кантельмо А.Р., Квегебеур А., Гескьер Б., Каувенбергс С., Илен Г., Фнг Л.К., Бетц И., Тембуйсер Б., Брепоэлс К., Велти Дж., Геденс И., Сегура И., Кройс Б., Бифари Ф., Десимо И., Бланко Р., Винс С., Вангиндертаэль Дж., Роча С., Коллинз Р.Т., Мунк С., Дэлеманс Д., Имамура Х., Девлигер Р., Райдер М., Ван Вельдховен П.П., Шуит Ф., Бартронс Р. , Хофкенс Дж., Фрайзл П., Теланг С., Деберардинис Р.Дж., Шунджанс Л., Винкиер С., Чесни Дж., Герхардт Х., Деверчин М., Кармелиет П.
Роль гликолиза, управляемого pfkfb3, в прорастании сосудов. Клетка. 2013; 154: 651-663 [PubMed] [Google Scholar]
53)
Шираиши Т., Вердоне Дж. Э., Хуанг Дж., Калерт УД., Эрнандес Дж. Р., Торга Дж., Зариф Дж. К., Эпштейн Т., Гейтенби Р., Маккартни А., Элиссефф Дж. Х., Муни С. М., Ан СС, Пьента К. Дж.
Гликолиз является основным биоэнергетическим путем для подвижности клеток и ремоделирования цитоскелета в клетках рака предстательной железы и молочной железы человека. Онкотаргет. 2015 г. ; 6: 130-143 [бесплатная статья PMC] [PubMed] [Google Scholar]
; 6: 130-143 [бесплатная статья PMC] [PubMed] [Google Scholar]
54)
Бьорнхеден Т., Бонджерс Г.
Потребление кислорода тканью аорты у кроликов с атеросклерозом, вызванным диетой. Артериосклероз (Даллас, Техас). 1987; 7: 238-247 [PubMed] [Google Scholar]
55)
Sluimer JC, Gasc JM, van Wanroij JL, Kisters N, Groeneweg M, Solleewijn Gelpke MD, Cleutjens JP, van den Akker LH, Corvol P, Wouters BG, Daemen MJ, Bijnens AP.
Гипоксия, фактор транскрипции, индуцируемый гипоксией, и макрофаги в атеросклеротических бляшках человека коррелируют с внутрибляшечным ангиогенезом. Журнал Американского колледжа кардиологов. 2008 г.; 51: 1258-1265 [PubMed] [Google Scholar]
56)
Гао Л., Чен Ц., Чжоу С., Фан Л.
Роль индуцируемого гипоксией фактора 1 в развитии атеросклероза. Журнал клинической патологии. 2012 г.; 65: 872-876 [PubMed] [Google Scholar]
57)
Халтен Л.М., Левин М.
Роль гипоксии при атеросклерозе. Современное мнение в липидологии. 2009 г.; 20: 409-414 [PubMed] [Google Scholar]
58)
Crucet M, Wust SJ, Spielmann P, Luscher TF, Wenger RH, Matter CM.
Гипоксия усиливает поглощение липидов макрофагами: роль рецепторов-мусорщиков lox1, sra и cd36. Атеросклероз. 2013; 229: 110-117 [PubMed] [Google Scholar]
59)
Steinberg D, Parthasarathy S, Carew TE, Khoo JC, Witztum JL.
Помимо холестерина. Модификации липопротеинов низкой плотности, повышающие их атерогенность. N Engl J Med.
1989; 320: 915-924 [PubMed] [Google Scholar]
60)
Чен М., Масаки Т., Савамура Т.
Lox-1, рецептор окисленного липопротеина низкой плотности, идентифицированный из эндотелиальных клеток: значение эндотелиальной дисфункции и атеросклероза. Фармакология и терапия. 2002 г.; 95: 89-100 [PubMed] [Google Scholar]
61)
Драуде Г., Хрботицки Н., Лоренц Р.Л.
Экспрессия лектиноподобного рецептора окисленного липопротеина низкой плотности (lox-1) на гладкомышечных клетках и моноцитах сосудов человека и его подавление ловастатином. Биохимическая фармакология. 1999; 57: 383-386 [PubMed] [Google Scholar]
62)
Йошида Х., Кондратенко Н., Грин С., Стейнберг Д. , Квенбергер О.
, Квенбергер О.
Идентификация лектиноподобного рецептора окисленного липопротеина низкой плотности в макрофагах человека и его потенциальная роль в качестве рецептора-мусорщика. Биохимический журнал. 1998 год; 334 (Pt 1): 9-13 [бесплатная статья PMC] [PubMed] [Google Scholar]
63)
Чаудхари С.М., Слуимер Дж.С., Кох М., Тилен Т.Л., Манти Х.Д., Буш М., Кабальеро-Франко С., Фогель Ф., Кочейн С., Пелисек Дж., Даемен М.Дж., Лутц М.Б., Горлах А., Кисслер С., Германнс Х.М., Зернеке А.
Дефицит hif1-альфа в антигенпрезентирующих клетках усугубляет атеросклероз и реакцию Т-хелперов 1 типа у мышей. Артериосклероз, тромбоз и сосудистая биология. 2015 г.; 35: 2316-2325 [бесплатная статья PMC] [PubMed] [Google Scholar]
64)
Арнольд В.П., Миттал К.К., Кацуки С., Мурад Ф.
Оксид азота активирует гуанилатциклазу и повышает уровень гуанозин-3′:5′-циклического монофосфата в различных тканевых препаратах. Proc Natl Acad Sci U S A. 1977; 74: 3203-3207 [бесплатная статья PMC] [PubMed] [Google Scholar]
65)
Деннингер Дж. В., Марлетта М.А.
В., Марлетта М.А.
Гуанилатциклаза и сигнальный путь No/cgmp. Биохимика и биофизика акта. 1999 г.; 1411: 334-350 [PubMed] [Google Scholar]
66)
Хуссейн М.Б., Хоббс А.Дж., Макаллистер Р.Дж.
Ауторегуляция передачи сигналов растворимой в оксиде азота гуанилатциклазы-циклического gmp в грудной аорте мыши. Британский журнал фармакологии. 1999; 128: 1082-1088 [бесплатная статья PMC] [PubMed] [Google Scholar]
67)
Чжао И, Ванхутт П.М., Леунг С.В.
Сосудистый оксид азота: Beyond enos. Журнал фармакологических наук. 2015 г.; 129: 83-94 [PubMed] [Google Scholar]
68)
Коуберн А.С., Такеда Н., Бутин А.Т., Ким Дж.В., Стерлинг Дж.К., Накасаки М., Саутвуд М., Голдрат А.В., Джамора С., Низет В., Чилверс Э.Р., Джонсон Р.С.
Изоформы Hif в коже по-разному регулируют системное артериальное давление. Proc Natl Acad Sci U S A. 2013; 110: 17570-17575 [бесплатная статья PMC] [PubMed] [Google Scholar]
69)
Стенмарк КР, Абман Ш.
Развитие сосудов легких: значение для патогенеза бронхолегочной дисплазии. Ежегодный обзор физиологии. 2005 г.; 67: 623-661 [PubMed] [Google Scholar]
Ежегодный обзор физиологии. 2005 г.; 67: 623-661 [PubMed] [Google Scholar]
70)
Карбоне Р., Боссоне Э., Боттино Г., Монселиз А., Рубенфайр М.
Вторичная легочная гипертензия — диагностика и лечение. Европейский обзор медицинских и фармакологических наук. 2005 г.; 9: 331-342 [PubMed] [Google Scholar]
71)
Наейе Р.
Легочная гипертензия и правожелудочковая недостаточность при хронической обструктивной болезни легких. Труды Американского торакального общества. 2005 г.; 2: 20-22 [PubMed] [Google Scholar]
72)
Гилрой Дж., Кэхалан Дж.Л., Берман Р., Ньюман М.
Кардиальные и легочные осложнения при прогрессирующей мышечной дистрофии Дюшенна. Тираж. 1963 год; 27: 484-493 [PubMed] [Google Scholar]
73)
Ариас-Стелла Дж., Салдана М.
Конечная часть легочного артериального дерева у людей, живущих на больших высотах. Тираж. 1963 год; 28: 915-925 [PubMed] [Google Scholar]
74)
Коуберн А.С., Кросби А., Масиас Д., Бранко С., Колако Р.Д., Саутвуд М., Тошнер М., Кротти Александр Л. Е., Моррелл Н.В., Чилверс Э.Р., Джонсон Р.С.
Е., Моррелл Н.В., Чилверс Э.Р., Джонсон Р.С.
Ось Hif2альфа-аргиназы необходима для развития легочной гипертензии. Proc Natl Acad Sci U S A. 2016; 113: 8801-8806 [бесплатная статья PMC] [PubMed] [Google Scholar]
75)
Чо Х, Ду Х, Рицци Дж. П., Либерзон Э., Чакраборти А. А., Гао В., Карво И., Синьоретти С., Бруик Р. К., Джози Дж. А., Уоллес Э. М., Каэлин В. Г.
Целевая эффективность антагониста hif-2альфа в доклинических моделях рака почки. Природа. 2016; 539: 107-111 [бесплатная статья PMC] [PubMed] [Google Scholar]
76)
Чен В., Хилл Х., Кристи А., Ким М.С., Холломан Э., Павия-Хименес А., Хомаюн Ф., Ма И, Патель Н., Йелл П., Хао Г., Юсуф К., Джойс А., Педроса И., Гейгер Х., Чжан Х., Чанг Дж., Гарднер К.Х., Брюик Р.К., Ривз С., Хван Т.Х., Кортни К., Френкель Э., Сан Х., Зоджвалла Н., Вонг Т., Рицци Дж.П., Уоллес Э.М., Джози Дж.А., Се И., Се XJ, Капур П., Маккей Р.М. , Бругаролас Дж.
Борьба с почечно-клеточным раком с помощью антагониста hif-2. Природа. 2016; 539: 112-117 [бесплатная статья PMC] [PubMed] [Google Scholar]
77)
Индестад А. , Дамас Дж.К., Ойе Э., Уэланд Т., Гуллестад Л., Аукруст П.
, Дамас Дж.К., Ойе Э., Уэланд Т., Гуллестад Л., Аукруст П.
Роль воспаления в прогрессировании сердечной недостаточности. Текущие кардиологические отчеты. 2007 г.; 9: 236-241 [PubMed] [Google Scholar]
78)
Анкер С.Д., фон Хэлинг С.
Медиаторы воспаления при хронической сердечной недостаточности: обзор. Сердце (Британское кардиологическое общество). 2004 г.; 90: 464-470 [бесплатная статья PMC] [PubMed] [Google Scholar]
79)
Рауххаус М., Денер В., Фрэнсис Д.П., Давос С., Кемп М., Либенталь С., Нибауэр Дж., Хупер Дж., Фольк Х.Д., Коутс А.Дж., Анкер С.Д.
Цитокиновые параметры плазмы и смертность у больных с хронической сердечной недостаточностью. Тираж. 2000 г.; 102: 3060-3067 [PubMed] [Google Scholar]
80)
Сета Ю., Шан К., Бозкурт Б., Орал Х., Манн Д.Л.
Основные механизмы сердечной недостаточности: цитокиновая гипотеза. Журнал сердечной недостаточности. 1996 год; 2: 243-249 [PubMed] [Google Scholar]
81)
Аззави М., Кан С.В., Хиллиер В., Йонан Н., Хатчинсон И.В. , Хаслтон П.С.
, Хаслтон П.С.
Распределение сердечных макрофагов при ишемии миокарда и кардиомиопатии. Гистопатология. 2005 г.; 46: 314-319 [PubMed] [Google Scholar]
82)
Франгояннис НГ.
Иммунная система и восстановление сердца. Фармакологическое исследование. 2008 г.; 58: 88-111 [бесплатная статья PMC] [PubMed] [Google Scholar]
83)
Франгояннис НГ.
Воспалительная реакция при повреждении, репарации и ремоделировании миокарда. Обзоры природы. Кардиология. 2014; 11: 255-265 [бесплатная статья PMC] [PubMed] [Google Scholar]
84)
Кон Дж. Н., Феррари Р., Шарп Н.
Ремоделирование сердца — концепции и клинические последствия: согласованный документ международного форума по ремоделированию сердца. От имени международного форума по ремоделированию сердца. Журнал Американского колледжа кардиологов. 2000 г.; 35: 569-582 [PubMed] [Google Scholar]
85)
Хильгендорф И., Герхардт Л.М., Тан Т.К., Винтер К., Холдеррид Т.А., Чустерман Б.Г., Ивамото Ю., Ляо Р., Зирлик А., Шерер-Кросби М., Хедрик К. С., Либби П., Нарендорф М., Вайследер Р., Свирски Ф.К.
С., Либби П., Нарендорф М., Вайследер Р., Свирски Ф.К.
Моноциты Ly-6chigh зависят от nr4a1, чтобы сбалансировать как воспалительную, так и репаративную фазы в инфарктном миокарде. Цирк Рез.
2014; 114: 1611-1622 [бесплатная статья PMC] [PubMed] [Google Scholar]
86)
Нарендорф М., Свирски Ф.К., Айкава Э., Стангенберг Л., Вурдингер Т., Фигейредо Дж.Л., Либби П., Вайследер Р., Питте М.Дж.
Заживающий миокард последовательно мобилизует два подмножества моноцитов с расходящимися и взаимодополняющими функциями. J Эксперт Мед.
2007 г.; 204: 3037-3047 [бесплатная статья PMC] [PubMed] [Google Scholar]
87)
Нарендорф М., Питте М.Дж., Свирски Ф.К.
Моноциты: Протагонисты инфарктного воспаления и восстановления после инфаркта миокарда. Тираж. 2010 г.; 121: 2437-2445 [бесплатная статья PMC] [PubMed] [Google Scholar]
88)
Манн Д.Л., МакМюррей Дж.Дж., Пакер М., Сведберг К., Борер Дж.С., Колуччи В.С., Джиан Дж., Дрекслер Х., Фельдман А., Кобер Л., Крам Х., Лю П., Ниеминен М., Тавацци Л. , ван Вельдхуйзен Д.Дж., Вальденстрем А., Уоррен М., Вестхейм А., Заннад Ф., Флеминг Т.
, ван Вельдхуйзен Д.Дж., Вальденстрем А., Уоррен М., Вестхейм А., Заннад Ф., Флеминг Т.
Таргетная антицитокиновая терапия у пациентов с хронической сердечной недостаточностью: результаты всемирной рандомизированной оценки этанерцепта (обновление). Тираж. 2004 г.; 109: 1594-1602 [PubMed] [Google Scholar]
89)
Чанг Э.С., Пакер М., Ло К.Х., Фасанмаде А.А., Виллерсон Дж.Т., Исследователи A-TTACHF
Рандомизированное, двойное слепое, плацебо-контролируемое, пилотное исследование инфликсимаба, химерного моноклонального антитела к фактору некроза опухоли-альфа, у пациентов с сердечной недостаточностью средней и тяжелой степени: результаты анти-TNF-терапии при застойной сердечной недостаточности (приложить ) пробный. Тираж. 2003 г.; 107: 3133-3140 [PubMed] [Google Scholar]
90)
Кнапп Ф.Дж., Гудман М., Каллахан А., Кирш Г.
Радиойодированная 15-(п-иодофенил)-3,3-диметилпентадекановая кислота: полезный новый агент для оценки поглощения миокардом жирных кислот. Дж Нукл Мед.
1986; 27: 521-531 [PubMed] [Google Scholar]
91)
Стэнли В. , Лопащук Г., Холл Дж., МакКормак Дж.
, Лопащук Г., Холл Дж., МакКормак Дж.
Регуляция углеводного обмена миокарда в норме и при ишемии. Возможности для фармакологических вмешательств. Кардиовасц Рез.
1997 год; 33: 243-257 [PubMed] [Google Scholar]
92)
Двиведи Г., Аль-Шехри Х., деКемп Р.А., Али И., Альгамди А.А., Кляйн Р., Скаллион А., Радди Т.Д., Бинлендс Р.С., Чоу Б.Дж.
Визуализация рубцов с помощью мультиспиральной компьютерной томографии по сравнению с метаболической визуализацией с помощью позитронно-эмиссионной томографии f-18 fdg: пилотное исследование. Int J Кардиол.
2013; 168: 739-745 [PubMed] [Google Scholar]
93)
Абэ Х., Игучи Н., Утанохара Ю., Иноуэ К., Такамисава И., Секи А., Танидзаки К., Такеда Н., Тохбару Т., Асано Р., Нагаяма М., Такаяма М., Умемура Дж., Сумиёси Т., Томоике Х.
Неинвазивная диагностика ишемической болезни сердца с помощью двойной спектроскопии миокарда 123i-bmipp/201tlcl у пациентов с сердечной недостаточностью. Int J Кардиол.
2014; 176: 969-974 [PubMed] [Google Scholar]
94)
Сано М. , Минамино Т., Токо Х., Мияучи Х., Оримо М., Цинь Ю., Акадзава Х., Татено К., Каяма Ю., Харада М., Симидзу И., Асахара Т., Хамада Х., Томита С., Молкентин Д.Д., Дзо Ю., Комуро И. .
, Минамино Т., Токо Х., Мияучи Х., Оримо М., Цинь Ю., Акадзава Х., Татено К., Каяма Ю., Харада М., Симидзу И., Асахара Т., Хамада Х., Томита С., Молкентин Д.Д., Дзо Ю., Комуро И. .
Р53-индуцированное ингибирование hif-1 вызывает сердечную дисфункцию при перегрузке давлением. Природа. 2007 г.; 446: 444-448 [PubMed] [Google Scholar]
95)
Shyu KG, Liou JY, Wang BW, Fang WJ, Chang H.
Карведилол предотвращает гипертрофию сердца и гиперэкспрессию индуцируемого гипоксией фактора-1альфа и фактора роста эндотелия сосудов в перегруженном давлением сердце крысы. J биомедицинских наук.
2005 г.; 12: 409-420 [PubMed] [Google Scholar]
96)
Вэй Х., Беджа Д., Коитабаши Н., Син Д., Чен Дж., Фокс-Талбот К., Руф Р., Чен С., Стинберген С., Хармон Дж.В., Дитц Х.К., Габриэльсон К.Л., Касс Д.А., Семенца Г.Л.
Эндотелиальная экспрессия фактора 1, индуцируемого гипоксией, защищает сердце и аорту мышей от перегрузки давлением путем подавления передачи сигналов tgf-бета. Proc Natl Acad Sci U S A. 2012; 109: E841-850 [бесплатная статья PMC] [PubMed] [Google Scholar]
97)
Кришнан Дж. , Сутер М., Виндак Р., Кребс Т., Фелли А., Монтессуит С., Токарска-Шлаттнер М., Аасум Э., Богданова А., Перриард Э., Перриард Дж. К., Ларсен Т., Педраццини Т., Крек В.
, Сутер М., Виндак Р., Кребс Т., Фелли А., Монтессуит С., Токарска-Шлаттнер М., Аасум Э., Богданова А., Перриард Э., Перриард Дж. К., Ларсен Т., Педраццини Т., Крек В.
Активация оси hif1-альфа-парагамма лежит в основе интеграции гликолитических и липидных анаболических путей при патологической кардиальной гипертрофии. Метаболизм клеток. 2009 г.; 9: 512-524 [PubMed] [Google Scholar]
Как измерить сердечную гипоксию?
Мы беседуем с Акшитой Рао, студенткой Университета Тафтса, о ее биомедицинских инженерных исследованиях человеческого сердца во время этого подкаста Pulsar, предоставленного вам #MOSatHome. Мы задаем вопросы, присланные слушателями, поэтому, если у вас есть вопрос, который вы хотели бы задать эксперту, отправьте его нам по адресу [email protected].
ЭРИК: В течение средней жизни человеческое сердце сокращается около двух миллиардов раз. Инженеры-биомедики создают и совершенствуют устройства, которые могут помочь нам понять и поддержать сложную биологию человеческого тела, такую как электрические токи, которые стоят за каждым из этих сердечных сокращений.
Сегодня в программе Pulsar мы поговорим со студенткой, изучающей биомедицинскую инженерию, о том, что нужно для того, чтобы придумать и создать эти устройства. Я твой хозяин, Эрик. Спасибо Facebook Boston за поддержку этого эпизода Pulsar.
У меня в гостях Акшита Рао, студентка бакалавриата по специальности «Механическая и биомедицинская инженерия» в Университете Тафтса, которая заканчивает учебу в этом году. Акшита, спасибо, что присоединился ко мне.
АКШИТА: Да, я очень рада быть здесь сегодня и немного рассказать о своем исследовании.
ЭРИК: Некоторые из наших слушателей, возможно, уже встречали вас в музее в последние несколько лет.
АКШИТА: Да, я и Музей Науки давным-давно. Я начал работать волонтером на втором курсе старшей школы, и я прошел свой путь вверх, и я работал там на неполный рабочий день до моего второго года обучения в колледже.
ЭРИК: Когда мы спрашиваем наших слушателей, какие у них есть вопросы по какой-то теме, часто они хотят узнать больше о том, что это за тема на самом деле. Итак, не могли бы вы немного рассказать о том, что такое биомедицинская инженерия?
Итак, не могли бы вы немного рассказать о том, что такое биомедицинская инженерия?
АКШИТА: Конечно, да. Так что это звучит как очень тяжелый термин. Так что, если бы вы просто погуглили, вы, вероятно, получили бы ответ, что биомедицинская инженерия — это смесь биологии и медицины с большим количеством инженерных технологий.
И это совершенно верно. Таким образом, BME, которая является просто сокращенной формой биомедицинской инженерии, фокусируется на развитии здравоохранения и улучшении здоровья человека с использованием процесса инженерного проектирования и других методов исследования.
И, на мой взгляд, что делает BME таким уникальным, так это то, что это такой широкий спектр дисциплин в самой области. Итак, у вас есть так много инженеров в этой области, которые разрабатывают медицинские устройства или протезы, которые в основном представляют собой имплантаты, которые люди носят на человеческом теле.
А еще у вас есть биомедицинская обработка сигналов. И даже больше на наноуровне, у вас есть даже инженерия тканей и стволовых клеток. Таким образом, BME действительно охватывает все аспекты науки и медицины, а также включает в себя широкий спектр инженерных навыков.
И даже больше на наноуровне, у вас есть даже инженерия тканей и стволовых клеток. Таким образом, BME действительно охватывает все аспекты науки и медицины, а также включает в себя широкий спектр инженерных навыков.
ЭРИК: В биомедицинской инженерии и так много инженерной дисциплины. Так почему вы решили также изучать машиностроение?
AKSHITA: Сначала я поступил в Tufts с намерением получить специальность инженера-биомедика, потому что биология была моим любимым предметом в старшей школе. Но мне всегда очень нравился практический аспект машиностроения, поэтому я также был частью команды робототехники.
И, я не знаю, мне всегда нравилось проектировать и возиться с инструментами. Я прошел пару курсов BME на первом и втором курсе, а также несколько занятий по инженерии начального уровня, которые пересекались с факультетом машиностроения.
И я думаю, что в середине второго года обучения я понял, что на самом деле мне нравятся уроки машиностроения чуть больше, чем уроки биологии.
И я понял это, потому что меня всегда интересовало, как работают устройства и как они функционируют. Отдел машиностроения здесь действительно сосредоточился на создании и проектировании устройств, которые меня интересовали.
ЭРИК: И почему ты решил оставить и то, и другое вместо того, чтобы переключиться на машиностроение?
AKSHITA: Я не хотел полностью бросать BME, потому что мне до сих пор нравится изучать различные биологические приложения и все такое. Специализация в области машиностроения действительно дала мне возможность познакомиться со всей механикой и конструкционными материалами, которые вы изучаете, изучая машиностроение.
ЭРИК: Как вы думаете, изучение обоих даст вам уникальный подход к проблемам биомедицинской инженерии?
AKSHITA: Я думаю, что это дало мне больше информации о BME. Поэтому я обычно склонен делать наброски. И я думаю, что многие специалисты в области биологии и BME думают о вещах концептуально, а не проектируют и проходят через процесс инженерного проектирования.
Я думаю, что это более крутая характеристика машиностроения.
ЭРИК: В подкасте мы общаемся со многими учеными и инженерами, которые работают на стыке нескольких дисциплин. Можете ли вы рассказать нам, как это может усилить проект, над которым работает много людей?
AKSHITA: Прошлым летом я стажировался в компании Insulet, производящей медицинское оборудование, где они разрабатывают диабетические инсулиновые помпы. И это было действительно интересно, потому что в команде у нас был широкий круг инженеров, которые изучали BME, машиностроение и даже информатику.
Кросс-функциональный аспект всех этих различных видов инженерии пересекался в том, что именно компания стремилась создать прототип в конце лета. Я думаю, что это действительно здорово, когда мы говорим о инженерии, это такой широкий спектр различных наук и методов, которые вы изучаете.
Суть биомедицинской инженерии заключается в том, что вы изучаете определенные приемы, которые ученый-компьютерщик не стал бы рассказывать на своих занятиях.
Я думаю, что пересечение различных инженерных специальностей важно для успеха команды.
ЭРИК: Исследование, в котором вы недавно участвовали, включает изучение сердечной ткани. Итак, вы можете дать нам некоторую предысторию?
AKSHITA: Сердечная дисфункция представляет собой одну из основных причин естественной смерти в Соединенных Штатах. Но благодаря достижениям регенеративной медицины и биотехнологий было создано множество устройств для замены дефектных тканей сердца.
Сердечные пластыри использовались для лечения поврежденных тканей сердца после сердечных приступов. По сути, они засеяны в ткань сердца и на трехмерные каркасы. А затем их имплантируют внутрь пациента, чтобы заменить поврежденную ткань.
ЭРИК: Существуют ли какие-либо ограничения для этого типа тканевых имплантатов?
AKSHITA: Врач не может получить обратную связь, чтобы увидеть, восстанавливается ли сердце пациента после сердечного приступа, потому что нет надлежащей электронной интеграции. Так что, как только он имплантирован, он просто там. И вам остается только предположить, что это сработает к лучшему.
Так что, как только он имплантирован, он просто там. И вам остается только предположить, что это сработает к лучшему.
Цель нашего исследования состояла в том, чтобы попытаться создать устройство для фармацевтических компаний и врачей, чтобы увидеть, как некоторые анализы лекарств действительно работают в сердечной ткани. Таким образом, они получат лучшее представление о том, как они могут улучшить клиническое лечение наших сердечных пациентов в будущем.
Итак, для моего исследования мы сосредоточились на создании чего-то, что называется 32-канальной многоэлектродной матрицей. Так что я буду называть это MEA для краткости. Но в основном это небольшие чипы, позволяющие измерять электрическую активность сердца на поверхностном уровне тканей.
ЭРИК: Итак, это исследование было посвящено измерению электричества нашего тела.
AKSHITA: По сути, в нашем теле есть несколько клеток, которые создают электрические токи. И они создают изменения напряжения, известные как потенциалы действия. И цель этих чипов, по сути, состоит в том, чтобы собирать эти изменения напряжения.
И цель этих чипов, по сути, состоит в том, чтобы собирать эти изменения напряжения.
И устройства создадут эти графики, показывающие изменение напряжения во времени.
По сути, когда вы добавляете какой-то стресс или подвергаете сердечные клетки такому состоянию, как гипоксия, где нет кислорода, вы ожидаете увидеть изменения в этих записях биения.
Это просто облегчает врачам понимание того, как сердечная ткань будет реагировать на определенные условия стимуляции сердца.
ЭРИК: Как все прошло, на самом деле построить это сердце на чипе?
AKSHITA: Было много проб и ошибок этих устройств и попыток уменьшить шум от сигналов, которые мы собирали.
Но да, в конце концов, к концу исследования мы смогли сделать вывод, что эти MEA выполнили свою задачу по сбору точных показаний в реальном времени из сердечной ткани.
ЭРИК: И потом, это не улучшало существующее устройство. На самом деле это означало взять нерешенный медицинский вопрос и создать совершенно новое устройство, чтобы попытаться получить ответ.
АКШИТА: Точно, верно. И я думаю, что самое классное в исследованиях то, что это не идея, которая пришла мне в голову однажды. Потребовалось много предварительных исследований и чтение большого количества предыдущей литературы, в которой говорилось о будущих идеях, которые можно было бы реализовать.
И я думаю, что мы взяли первоначальную идею из статьи, в которой говорилось, что мы могли бы сделать это в будущем. Я такой: хорошо, почему бы нам не попытаться решить это?
Так что да, поэтому я думаю, что многие исследования основаны на предыдущей работе, которая уже была проведена в этой области.
ЭРИК: Так что дальше с этим исследованием? Какой следующий шаг?
AKSHITA: В этом году я работаю над дипломной работой с отличием. Так что я собираюсь продолжить работу, которую я делал. Итак, в основном, эти чипы, которые мы создали, являются двумерными.
Итак, мы хотим посмотреть, сможем ли мы преобразовать эти каналы в создание трехмерных устройств. Таким образом, вы могли бы просто собрать более точные показания, потому что человеческое тело трехмерно, а не двухмерно.
Таким образом, вы могли бы просто собрать более точные показания, потому что человеческое тело трехмерно, а не двухмерно.
На этот раз мы хотим сделать устройство более гибким. И поэтому мы можем использовать его на нервной ткани, то есть на клетках мозга. Потому что нейроны также обмениваются потенциалами действия и имеют изменения напряжения. Поэтому мы хотим убедиться, что наши устройства применимы к различным типам клеток в организме человека.
Наша следующая цель — сделать его гибким трехмерным устройством. И лучшая модель для этого — трехмерная модель мозга. Да, так что мы медленно переходим от сердца к мозгу и используем ту же идею сбора сигналов от клеток мозга.
ЭРИК: И, наконец, как вы думаете, почему так важно продолжать улучшать медицинские технологии и разрабатывать новые устройства?
АКШИТА: Я определенно предвзят, когда говорю, что медицинские технологии — это, безусловно, самая крутая вещь. И я думаю, что это действительно здорово, потому что это всегда улучшает и меняет будущее здравоохранения.
Я всегда хотел помогать людям. Вот почему я присоединился к инженерному делу и хотел учиться в колледже.
И я думаю, что именно создание устройств, способных улучшить качество жизни, является одним из главных преимуществ создания инноваций в медицинской технике. И особенно медицинские устройства, многие пациенты используют их, чтобы прожить более долгую жизнь и стараются не проводить столько времени в больнице.
Поэтому я думаю, что всегда важно не только создавать новые технологии, но и улучшать то, что у нас есть. И я просто думаю, особенно в такие времена, как сейчас во время пандемии, мы так много использовали медицинские технологии, чтобы попытаться вылечить пациентов как можно скорее.
Так что не знаю. Я просто думаю, что очень важно подчеркнуть, насколько важно, чтобы ученые-медики и врачи просто постоянно проводили исследования и тестировали новые процедуры для разработки таких вещей, как вакцины, которые также считаются медицинской технологией.
Я просто думаю, что это действительно важная область, и мне не терпится увидеть, как она продолжит расти в будущем.
ЭРИК: Ну, мы очень рады видеть, что вы будете делать. Акшита, большое спасибо, что поговорили со мной сегодня.
АКШИТА: Да, большое спасибо, что пригласили меня.
ЭРИК: Узнать больше о биологии человеческого организма можно в зеленом крыле Музея науки в нашем Зале человеческой жизни. Посетите сайтEngineet.mos.org, чтобы поддержать Музей науки и MOS дома.
До следующего раза, продолжайте задавать вопросы.
Эффект сердечной денервации при гипоксии и гиперкапнии: влияние тотальной денервации на сердечно-сосудистые реакции | JAMA Surgery
Эффект денервации сердца при гипоксии и гиперкапнии: влияние тотальной денервации на сердечно-сосудистые реакции | ДЖАМА Хирургия | Сеть ДЖАМА
[Перейти к навигации]
Эта проблема
Артикул
Ноябрь 1963 г.
ЛАЗАР Дж. ГРИНФИЛД, MD ; ПОЛ А. ЭБЕРТ, MD
Принадлежности автора
BALTIMORE
Хирургическое отделение Университета и больницы Джона Хопкинса.
Арка Сур. 1963;87(5):717-721. doi:10.1001/archsurg.1963.01310170003002
Полный текст
Абстрактный
Влияние гипоксии на систему кровообращения, включая изменения частоты сердечных сокращений, сердечного выброса и артериального давления, привлекло значительное внимание. Большинство исследований было проведено на интактных анестезированных собаках путем изменения газовой смеси, используемой для вентиляции животного, и изменения в сердечной функции были связаны как с прямым влиянием дефицита кислорода на сердце, так и с рефлекторными нейрогенными стимулами. Исследования с использованием отдельных систем перфузии для системного и сердечного кровообращения показали незначительный первоначальный эффект на перфузируемое сердце с умеренно гипоксической кровью, тогда как изолированная перфузия каротидных рецепторов десатурированной кровью приводит к брадикардии в период гипоксии хеморецепторов. 3 Точно так же Austen и коллеги 1 показали, что системная гипоксия может вызвать тяжелую сердечную аритмию, даже когда сердце получает полностью насыщенную кислородом кровь. Первоначально Харрисон и его коллеги 9 показали, что грудная симпатэктомия не
Исследования с использованием отдельных систем перфузии для системного и сердечного кровообращения показали незначительный первоначальный эффект на перфузируемое сердце с умеренно гипоксической кровью, тогда как изолированная перфузия каротидных рецепторов десатурированной кровью приводит к брадикардии в период гипоксии хеморецепторов. 3 Точно так же Austen и коллеги 1 показали, что системная гипоксия может вызвать тяжелую сердечную аритмию, даже когда сердце получает полностью насыщенную кислородом кровь. Первоначально Харрисон и его коллеги 9 показали, что грудная симпатэктомия не
Полный текст
Добавить или изменить учреждение
Сохранить настройки
Политика конфиденциальности | Условия использования
Циркулярная РНК ciRs-126 способствует гипоксии/реоксигенации сердечного повреждения, возможно, через миР-21 | Журнал тромбоза
9599995979959959959959795959959795959959959795959959795959959959795959595959595959595959597979н.
Журнал тромбоза
том 20 , Номер статьи: 2 (2022)
Процитировать эту статью
Abstract
Background
Это исследование было направлено на анализ роли кольцевой РНК ciRs-126 в гипоксическом/реоксигенационном повреждении сердца (H/R).
Методы
Экспрессию ciRs-126 и miR-21 в образцах плазмы пациентов с H/R и здоровых контролей определяли с помощью RT-qPCR. Корреляции анализировали с помощью линейной регрессии. Сверхэкспрессия ciRs-126 и miR-21 была достигнута в кардиомиоцитах для изучения их перекрестных помех. Роль ciRs-126 и miR-21 в H/R-индуцированном апоптозе кардиомиоцитов анализировали с помощью анализа клеточного апоптоза.
Результаты
CiRs-126 активировалась, а miR-21 подавлялась у пациентов с H/R. Они обратно коррелировали между образцами плазмы пациентов с H/R. В кардиомиоцитах H/R экспрессия ciRs-126 повышалась, а экспрессия miR-21 подавлялась. В кардиомиоцитах сверхэкспрессия ciRs-126 снижала уровень miR-21 и уменьшала ингибирующие эффекты сверхэкспрессии miR-21 на H/R-индуцированный клеточный апоптоз.
Выводы
Циркулярная РНК ciRs-126 может подавлять экспрессию miR-21, способствуя повреждению сердца H/R.
История вопроса
Повреждение сердца, вызванное гипоксией/реоксигенацией (H/R), также известное как ишемия миокарда или сердечная ишемия, вызвано снижением кровотока [1]. H/R обычно вызывается атеросклерозом, тромбом и спазмом коронарных артерий [2]. При развитии Г/Р могут возникать инфаркт, аритмия, сердечная недостаточность, приводящие к высокой смертности [3, 4]. В тяжелых случаях 15% пациентов с Г/Р умирают до госпитализации, а 15% — во время госпитализации. Хуже того, около 10% выживших умирают в течение одного года после выписки [5, 6]. H/R обычно лечат с помощью ангиопластики или шунтирования [7], в то время как повреждения обычно необратимы. Таким образом, новые подходы к лечению по-прежнему необходимы.
Предыдущие исследования H/R выявили значительные молекулярные факторы, участвующие в инициации и развитии H/R [8,9,10]. Более глубокое понимание молекулярного механизма H/R облегчает разработку новых подходов к лечению [9, 10]. Циркулярные РНК (цирРНК) представляют собой класс кольцевых РНК с ковалентно замкнутыми 3’- и 5’-концами [11]. Предыдущие исследования определили критические функции circRNA в различных патологических и физиологических процессах, включая H/R [12]. Недавнее исследование показало, что circRNA ciRs-126 способствует острому повреждению почек [13], тогда как ее роль в H/R неизвестна. Мы провели предварительный анализ глубокого секвенирования и обнаружили измененную экспрессию ciRs-126 в H/R и ее обратную корреляцию с miR-21, которая играет защитную роль в H/R [14]. Поэтому это исследование было проведено для анализа перекрестных помех между ciRs-126 и miR-21 в H/R.
Предыдущие исследования определили критические функции circRNA в различных патологических и физиологических процессах, включая H/R [12]. Недавнее исследование показало, что circRNA ciRs-126 способствует острому повреждению почек [13], тогда как ее роль в H/R неизвестна. Мы провели предварительный анализ глубокого секвенирования и обнаружили измененную экспрессию ciRs-126 в H/R и ее обратную корреляцию с miR-21, которая играет защитную роль в H/R [14]. Поэтому это исследование было проведено для анализа перекрестных помех между ciRs-126 и miR-21 в H/R.
Методы
Пациенты и контрольная группа
В это исследование было включено в общей сложности 60 пациентов с H/R (группа H/R, 30 мужчин и 30 женщин) и 60 здоровых людей из контрольной группы (30 мужчин и 30 женщин) во Второй больнице Сянъя. , Центральный Южный университет с мая 2019 года по май 2020 года. Все участники были в возрасте от 38 до 66 лет, в среднем 52,1 ± 6,7 года для пациентов и 52,0 ± 6,8 года для контрольной группы. Диагноз всем пациентам был поставлен на основании практических рекомендаций ACC/AHA/ESC/WHF. В таблице 1 представлена подробная клиническая информация о пациентах. H/R у 60 больных был обусловлен образованием тромбов в артериях. Пациенты были разделены на 5 групп стадии в зависимости от времени после инфаркта, а именно: <4 ч, 4–6 ч, 6–8 ч, 8–10 ч и 10–12 ч. Количество пациентов с H/R в каждой группе составило 11, 12, 11, 16 и 10 соответственно. Пациенты с болью в груди продолжительностью более 12 часов и пациенты с повреждением сердца, вызванным факторами, отличными от H/R, были исключены. Все здоровые контроли прошли системные физиологические обследования, и все физиологические функции были в пределах нормы. Пациенты с другими тяжелыми заболеваниями, такими как рак и диабет, были исключены. Это исследование было одобрено Комитетом по этике Второй больницы Сянъя Центрального Южного Университета. Все пациенты и контрольная группа подписали информированное согласие.
Диагноз всем пациентам был поставлен на основании практических рекомендаций ACC/AHA/ESC/WHF. В таблице 1 представлена подробная клиническая информация о пациентах. H/R у 60 больных был обусловлен образованием тромбов в артериях. Пациенты были разделены на 5 групп стадии в зависимости от времени после инфаркта, а именно: <4 ч, 4–6 ч, 6–8 ч, 8–10 ч и 10–12 ч. Количество пациентов с H/R в каждой группе составило 11, 12, 11, 16 и 10 соответственно. Пациенты с болью в груди продолжительностью более 12 часов и пациенты с повреждением сердца, вызванным факторами, отличными от H/R, были исключены. Все здоровые контроли прошли системные физиологические обследования, и все физиологические функции были в пределах нормы. Пациенты с другими тяжелыми заболеваниями, такими как рак и диабет, были исключены. Это исследование было одобрено Комитетом по этике Второй больницы Сянъя Центрального Южного Университета. Все пациенты и контрольная группа подписали информированное согласие.
Таблица 1 Клинические параметры субъектов исследования
Полная таблица
Плазма и клетки
пациенты и контрольная группа после того, как они голодали в течение более 8 часов и были приготовлены в виде образцов плазмы путем центрифугирования в течение 15 минут при 1200 g. Образцы плазмы перед использованием хранили в жидком азоте.
Образцы плазмы перед использованием хранили в жидком азоте.
Первичные кардиомиоциты (C-12,810, Sigma-Aldrich, США) культивировали в среде для роста миоцитов (Sigma-Aldrich) в инкубаторе с 5% CO 2 при 37 ºC в соответствии с инструкциями поставщика. Для всех экспериментов использовали клетки с 3-го по 5-й пассажи.
Трансфекции клеток
Вектор, экспрессирующий ciRs-126, был сконструирован с использованием мини-вектора pcDNA3.1(+) CircRNA (Addgene) в качестве основы. МиРНК miR-21 и отрицательный контроль (NC) были приобретены у Sigma-Aldrich (США). Кардиомиоциты трансфицировали 40 нМ микроРНК или 1 мкг вектора экспрессии с использованием липофектамина 2000 (Invitrogen). Для проведения экспериментов с NC клетки трансфицировали пустым вектором или микроРНК NC. Контрольные (С) клетки представляли собой нетрансфицированные клетки. Клетки инкубировали со смесями для трансфекции в течение 6 ч и в свежей среде в течение 48 ч перед последующими анализами.
Модель H/R
После трансфекции (включая группы C и NC) кардиомиоциты культивировали в условиях гипоксии (1% O 2 , 95% N 2 и 5% CO 2 ) в течение 2 ч при 37 °C и в нормоксической культуральной среде в течение 3 ч при 37 °C для достижения реоксигенации.
Препараты РНК
РНК из плазмы и кардиомиоцитов экстрагировали с использованием RNAzol (Sigma-Aldrich). После обработки ДНКазой I (Invitrogen) в течение 2 часов при 37 °C для удаления геномной ДНК чистоту и целостность РНК проверяли с помощью соотношений OD260/280 и 6% мочевин-ПААГ.
RT-qPCRs
Для синтеза образцов кДНК образцы РНК удовлетворительного качества подвергали обратной транскрипции (ОТ) с использованием системы SS-III-RT (Invitrogen). Экспрессию CiRs-126 определяли с помощью количественной ПЦР с использованием SYBR Green Master Mix (Bio-Rad) с GAPDH, 18 S рРНК или β-актином в качестве внутреннего контроля. Уровень зрелой miR-21 определяли с использованием набора реагентов All-in-One™ miRNA qRT-PCR (GeneCopoeia). Для эффективного выполнения обратной транскрипции было выполнено добавление поли(А) к зрелым миРНК (метод полиА-хвоста), после чего были проведены ОТ миРНК и кПЦР с использованием RPL30 и 18 S рРНК в качестве внутреннего контроля. Все шаги были выполнены в соответствии с инструкциями производителя. Стоит отметить, что аналогичные результаты были получены при использовании различных внутренних эндогенных контролей. КПЦР проводили в 95 ºC в течение 1 мин, затем 40 циклов по 10 с при 95 ºC и 48 с при 58 ºC.
Стоит отметить, что аналогичные результаты были получены при использовании различных внутренних эндогенных контролей. КПЦР проводили в 95 ºC в течение 1 мин, затем 40 циклов по 10 с при 95 ºC и 48 с при 58 ºC.
Все количественные ПЦР проводились с тремя техническими повторами. Использовали значения Ct генов-мишеней, нормализованные по отношению к внутреннему контролю с использованием метода 2 -ΔΔCt . В дополнительной таблице 1 перечислены все последовательности праймеров.
Анализы двойной люциферазы
Система анализа люциферазы Dual-GloR (Promega, США) использовалась для проведения анализов двойной люциферазы. Вкратце, промотор miR-21 амплифицировали с использованием пары праймеров Fr-TGTAAAACGACGGCCAGT и Re-CAGGAAACAGCTATGACC и клонировали в вектор pmirGLO. Кардиомиоциты трансфицировали репортерной плазмидой и с/без ciRs-126. Через 2 дня клетки промывали, обрабатывали трипсином и собирали центрифугированием в течение 3 мин при 5000 g. Затем клеточные белки экстрагировали, используя 100 мкл буфера для лизиса. 50 мкл белковых супернатантов добавляли к 96-луночный измерительный планшет и смешали по очереди с 50 мкл реагента люциферазы и реагента Stop & Glo. Активность люциферазы светлячка измеряли на Centro LB960 с люциферазой renilla в качестве внутреннего эталона для корректировки эффективности трансфекции.
50 мкл белковых супернатантов добавляли к 96-луночный измерительный планшет и смешали по очереди с 50 мкл реагента люциферазы и реагента Stop & Glo. Активность люциферазы светлячка измеряли на Centro LB960 с люциферазой renilla в качестве внутреннего эталона для корректировки эффективности трансфекции.
Вестерн-блоттинг
Суммарные белки экстрагировали из трансфицированных клеток. После определения концентрации белка с помощью набора BCA Protein Assay Kit такое же количество белков разделяли с помощью SDS-PAGE и переносили на мембраны. Уровни белка определяли с помощью антител против каспазы-3 (1:1000; sc-65,49).7), Bax (1:1000; sc-7480), Bcl-2 (1:1000; sc-7382) и GAPDH (TA-09) (Yatai hengxin. Пекин, Китай) и конъюгированные с пероксидазой хрена (HRP). козий антикроличий IgG (1:1000; sc-2004, Санта-Крус, Калифорния).
Анализ клеточного апоптоза
После трансфекции клеток и моделирования H/R кардиомиоциты собирали, промывали охлажденным льдом PBS и ресуспендировали в буфере для связывания аннексина до достижения конечной плотности 10 5 клеток на мл (Dojindo). После этого клетки окрашивали аннексином V-FITC и PI (Dojindo) в темноте в течение 12 мин. Затем апоптотические клетки анализировали с помощью проточной цитометрии. В каждый эксперимент включали три биологические повторности.
После этого клетки окрашивали аннексином V-FITC и PI (Dojindo) в темноте в течение 12 мин. Затем апоптотические клетки анализировали с помощью проточной цитометрии. В каждый эксперимент включали три биологические повторности.
Статистический анализ
Уровни экспрессии генов в образцах плазмы выражали как средние значения трех технических повторностей и сравнивали с использованием непарного t-критерия. Данные трех биологических повторов групп трансфекции клеток выражали в виде средних значений ± стандартное отклонение и сравнивали с помощью критерия Тьюки ANOVA. P <0,05 считалось статистически значимым.
Результаты
Изменения экспрессии ciRs-126 и miR-21 наблюдались у пациентов с H/R
Для определения экспрессии ciRs-126 и miR-21 у пациентов с H/R были взяты образцы плазмы ( n = 60) и контроли ( n = 60), а экспрессию ciRs-126 и miR-21 определяли с помощью RT-qPCR. По сравнению с контрольной группой, ciRs-126 была значительно сверхэкспрессирована в группе H/R (рис. 1 A, p <0,001), в то время как miR-21 была значительно снижена в группе H/R (рис. 1B, ). р <0,001). Экспрессия ciRs-126 и miR-21 положительно и отрицательно коррелировала с различными стадиями пациентов с H/R соответственно (рис. 1 C и рис. 1D, , стр. 9).0932 <0,05). Кроме того, также была проведена корреляция между экспрессией Cir-126, CK-MB и cTnT в образцах H/R. Результаты показывают, что экспрессия Cir-126 коррелировала с количеством CK-MB и cTnT (дополнительная фигура-1). Наши данные свидетельствуют о том, что измененная экспрессия ciRs-126 и miR-21 может быть связана с H/R.
1 A, p <0,001), в то время как miR-21 была значительно снижена в группе H/R (рис. 1B, ). р <0,001). Экспрессия ciRs-126 и miR-21 положительно и отрицательно коррелировала с различными стадиями пациентов с H/R соответственно (рис. 1 C и рис. 1D, , стр. 9).0932 <0,05). Кроме того, также была проведена корреляция между экспрессией Cir-126, CK-MB и cTnT в образцах H/R. Результаты показывают, что экспрессия Cir-126 коррелировала с количеством CK-MB и cTnT (дополнительная фигура-1). Наши данные свидетельствуют о том, что измененная экспрессия ciRs-126 и miR-21 может быть связана с H/R.
Рис. 1
В H/R наблюдалась измененная экспрессия ciRs-126 и miR-21. Для определения экспрессии ciRs-126 и miR-21 при H/R образцы плазмы были собраны у пациентов с H/R (9).1039 n = 60) и контроля ( n = 60) с последующим определением экспрессии ciRs-126 ( A ) и miR-21 ( B ) с помощью RT-qPCR. Экспрессия ciRs-126 и miR-21 у пациентов на разных стадиях H/R была подробно описана в ( C ) и ( D ). Уровни экспрессии генов в образцах плазмы выражали как средние значения трехкратной технической повторности. «1» указывает родственное выражение по сравнению с GAPDH. **, р <0,05; ***, p <0,001
Уровни экспрессии генов в образцах плазмы выражали как средние значения трехкратной технической повторности. «1» указывает родственное выражение по сравнению с GAPDH. **, р <0,05; ***, p <0,001
Полноразмерное изображение
Значимая и обратная корреляция между ciRs-126 и miR-21 наблюдалась в образцах плазмы пациентов с H/R
Корреляции между ciRs-126 и miR-21 в образцах плазмы обоих Пациенты H/R и здоровые контроли были проанализированы с помощью линейной регрессии. Было замечено, что ciRs-126 и miR-21 обратно пропорционально и достоверно коррелировали друг с другом в образцах плазмы от пациентов с H/R (рис. 2 A). Однако существенной корреляции между ciRs-126 и miR-21 не наблюдалось в образцах плазмы здоровых людей (рис. 2B). Следовательно, ciRs-126 и miR-21 могут взаимодействовать друг с другом при H/R, и их перекрестные помехи, вероятно, опосредованы определенными патологическими факторами, связанными с H/R.
Рис. 2
2
Значимая и обратная корреляция между ciRs-126 и miR-21 наблюдалась в образцах плазмы пациентов с H/R. Корреляции между ciRs-126 и miR-21 в образцах плазмы пациентов с H/R ( A ) и здоровых людей ( B ) анализировали с помощью линейной регрессии
21 в модели клеток H/R, но не в клетках, не обработанных H/R
Наш биоинформатический анализ и предыдущее исследование показали, что ciRs-126 и miR-21 могут образовывать только пары из 8 оснований. Следовательно, ciRs-126 может быть недостаточно для губки miR-21. Затем был проведен анализ люциферазы для исследования промоторной активности miR-21 под влиянием ciRs-126 в кардиомиоцитах, и результаты не показали различий между трансфекцией ciRs-126 и контрольными группами (дополнительная фигура-2). Чтобы исследовать перекрестные помехи между ciRs-126 и miR-21, вектор экспрессии ciRs-126 или миметик miR-21 трансфицировали в кардиомиоциты, обработанные H/R, и кардиомиоциты, не обработанные H/R. Сверхэкспрессия ciRs-126 и miR-21 была подтверждена с помощью RT-qPCR (рис. 3 A, 9).1039 р <0,05). Было обнаружено, что сверхэкспрессия ciRs-126 снижала уровень миР-21 в модели клеток H/R, но не в клетках, не обработанных H/R (рис. 3B, p <0,05). Однако сверхэкспрессия miR-21 не смогла значительно изменить экспрессию ciRs-126 как в обработанных H/R, так и в необработанных кардиомиоцитах (рис. 3 C). Следовательно, ciRs-126, вероятно, является условно зависимым ингибитором miR-21 выше по течению в H/R.
3 A, 9).1039 р <0,05). Было обнаружено, что сверхэкспрессия ciRs-126 снижала уровень миР-21 в модели клеток H/R, но не в клетках, не обработанных H/R (рис. 3B, p <0,05). Однако сверхэкспрессия miR-21 не смогла значительно изменить экспрессию ciRs-126 как в обработанных H/R, так и в необработанных кардиомиоцитах (рис. 3 C). Следовательно, ciRs-126, вероятно, является условно зависимым ингибитором miR-21 выше по течению в H/R.
Рис. 3
Сверхэкспрессия CiRs-126 снижала экспрессию miR-21 в модели клеток H/R, но не в клетках, не обработанных H/R. Чтобы исследовать перекрестные помехи между ciRs-126 и miR-21, вектор экспрессии ciRs-126 или миметик miR-21 трансфицировали в кардиомиоциты, обработанные H/R, и кардиомиоциты, не обработанные H/R. Сверхэкспрессия ciRs-126 и miR-21 была подтверждена с помощью RT-qPCR ( А ). Влияние сверхэкспрессии ciRs-126 на экспрессию miR-21 ( B ) и влияние сверхэкспрессии miR-21 на ciRs-126 ( C ) как в кардиомиоцитах, обработанных H/R, так и в кардиомиоцитах, не обработанных H/R. также анализировали с помощью RT-qPCR. Экспрессию цирРНК или микроРНК в «С» необработанных клеток устанавливали как «1» и использовали для нормализации экспрессии в других группах. Данные трех биологических повторов групп трансфекции клеток выражали как среднее ± стандартное отклонение. *, р <0,05
также анализировали с помощью RT-qPCR. Экспрессию цирРНК или микроРНК в «С» необработанных клеток устанавливали как «1» и использовали для нормализации экспрессии в других группах. Данные трех биологических повторов групп трансфекции клеток выражали как среднее ± стандартное отклонение. *, р <0,05
Изображение с полным размером
Сверхэкспрессия ciRs-126 ослабляла ингибирующий эффект миР-21 на H/R-индуцированный апоптоз кардиомиоцитов . Результаты показали, что модель клеток H/R демонстрирует значительно повышенную экспрессию ciRs-126 (рис. 4 A,
p <0,05) и недостаточную экспрессию миР-21 по сравнению с необработанными клетками (рис. 4B, p <0,05). Таким образом, роль ciRs-126 и miR-21 в регуляции H/R-индуцированного апоптоза кардиомиоцитов была проанализирована с использованием анализа клеточного апоптоза. Сверхэкспрессия CiRs-126 значительно увеличивала клеточный апоптоз, в то время как сверхэкспрессия miR-21 снижала клеточный апоптоз. Кроме того, сверхэкспрессия ciRs-126 снижала ингибирующее действие сверхэкспрессии miR-21 на H/R-индуцированный клеточный апоптоз и экспрессию связанных с апоптозом белков (рис. 4C-D, 9).1039 р <0,05).
4C-D, 9).1039 р <0,05).
Рис. 4
Сверхэкспрессия CiRs-126 ослабляла ингибирующий эффект miR-21 на H/R-индуцированный апоптоз кардиомиоцитов. Кардиомиоциты подвергали обработке H/R с последующим измерением уровней экспрессии ciRs-126 ( A ) и miR-21 ( B ) с помощью RT-qPCR. Анализ клеточного апоптоза проводили для анализа роли ciRs-126 и miR-21 в регуляции апоптоза кардиомиоцитов, индуцированного H/R ( C ). Вестерн-блот-анализ каспазы 3, Bax и Bcl-2 из кардиомиоцитов, индуцированных H/R ( Д ). Данные трех биологических повторов групп трансфекции клеток выражали как среднее ± стандартное отклонение. *, p <0,05
Изображение полного размера
Обсуждение
В этом исследовании в основном изучалось участие ciRs-126 и миР-21 в H/R и изучались их перекрестные помехи. Мы обнаружили, что ciRs-126 сверхэкспрессирован в H/R. Кроме того, ciRs-126 может подавлять миР-21, чтобы способствовать апоптозу кардиомиоцитов, индуцированному H/R.
Функция ciRs-126 изучалась только при остром повреждении почек и синдроме поликистозных яичников [13, 15]. Было замечено, что ciRs-126 была значительно сверхэкспрессирована у пациентов с острым повреждением почек и могла использовать miR-126-5p для участия в прогрессировании заболевания [13]. При синдроме поликистозных яичников ciRs-126 подавляется и нацелен на ось miR-21-PDCD4-ROS для подавления пролиферации гранулезных клеток яичников [15]. В этом исследовании впервые сообщается об усилении ciRs-126 в H/R. Кроме того, сверхэкспрессия ciRs-126 значительно увеличивала апоптоз кардиомиоцитов, индуцированный H/R. Следовательно, ciRs-126 может способствовать повреждениям H/R, способствуя клеточному апоптозу. Более того, обработка H/R повышала уровень экспрессии ciRs-126 в кардиомиоцитах. Таким образом, H/R-индуцируемые ciRs-126 способствуют повреждению сердца за счет усиления клеточного апоптоза.
Хуанг и др. недавно показали, что miR-21 значительно недоэкспрессируется в модели H/R, а сверхэкспрессия miR-21 подавляет клеточный апоптоз и аутофагическую активность при повреждении сердца, возможно, посредством пути AKT/mTOR [14]. Соответственно, в нашем исследовании наблюдалось снижение активности miR-21 у пациентов с H/R и кардиомиоцитов после лечения H/R [14]. Кроме того, сверхэкспрессия miR-21 снижала апоптоз кардиомиоцитов, индуцированный H/R. Таким образом, наше исследование дополнительно подтвердило защитную роль miR-21 при H/R.
Соответственно, в нашем исследовании наблюдалось снижение активности miR-21 у пациентов с H/R и кардиомиоцитов после лечения H/R [14]. Кроме того, сверхэкспрессия miR-21 снижала апоптоз кардиомиоцитов, индуцированный H/R. Таким образом, наше исследование дополнительно подтвердило защитную роль miR-21 при H/R.
Сообщалось, что ciRs-126 может губить miR-21 для подавления роли miR-21 в пролиферации и апоптозе гранулезных клеток яичников [15]. Однако, основываясь на нашем биоинформатическом анализе и этом исследовании, ciRs-126 и miR-21 могут образовывать только спаривание из 8 оснований, чего может быть недостаточно для ciRs-126, чтобы губить miR-21. В этом исследовании результаты анализа люциферазы показали отсутствие прямой регуляции между miR-21 и ciRs-126. Мы показали, что ciRs-126 может подавлять миР-21 в моделях H/R, но не в клетках без обработки H/R. Следовательно, связанные с H/R факторы могут опосредовать перекрестные помехи между ciRs-126 и miR-21. Результаты показали существование других условно зависимых механизмов регуляции для ciRs-126 и miR-2. Наш результат согласуется с предыдущим исследованием клеток острого повреждения почек, а именно, круговая РНК-губка miR-126 (или ciRs-126) была наиболее изменены по сравнению со здоровым контролем и контролем заболевания [16]. Независимо от клеток H / R или острого повреждения почек, губка между ciRs-126 и miR-21 была усилена в гипоксических клетках. Одним из вероятных объяснений является то, что miR-126, как было показано, контролирует передачу сигналов гипоксии, а ciRs-126 может быть частью сигнальных каскадов, включающих LRIG (лайнерная форма ciRs-126) и miR-126. Связанные сигнальные пути включают семейство EGFR, тирозин-протеинкиназу Met и протоонкоген RET [17, 18]. Может быть много сигнальных перекрестных помех и петель обратной связи для регулирования гомеостаза между ciRs-126 и miR-126. Более подробные работы необходимо выполнить в будущем. Кроме того, уровни ciRs-126 также были тесно связаны с уровнями CK-MB и cTnT, которые указывают на мертвые/умирающие кардиомиоциты, показали, что ciRs-126 также высвобождается из таких клеток, и указывали на повреждение клеток, вызванное гипоксия.
Наш результат согласуется с предыдущим исследованием клеток острого повреждения почек, а именно, круговая РНК-губка miR-126 (или ciRs-126) была наиболее изменены по сравнению со здоровым контролем и контролем заболевания [16]. Независимо от клеток H / R или острого повреждения почек, губка между ciRs-126 и miR-21 была усилена в гипоксических клетках. Одним из вероятных объяснений является то, что miR-126, как было показано, контролирует передачу сигналов гипоксии, а ciRs-126 может быть частью сигнальных каскадов, включающих LRIG (лайнерная форма ciRs-126) и miR-126. Связанные сигнальные пути включают семейство EGFR, тирозин-протеинкиназу Met и протоонкоген RET [17, 18]. Может быть много сигнальных перекрестных помех и петель обратной связи для регулирования гомеостаза между ciRs-126 и miR-126. Более подробные работы необходимо выполнить в будущем. Кроме того, уровни ciRs-126 также были тесно связаны с уровнями CK-MB и cTnT, которые указывают на мертвые/умирающие кардиомиоциты, показали, что ciRs-126 также высвобождается из таких клеток, и указывали на повреждение клеток, вызванное гипоксия. В совокупности условное существование ciRs-126/миР-21 в кардиомиоцитах H/R указывает на то, что активация ciRs-126 и негативная регуляция миР-21 могут быть парой потенциальных биомаркеров ишемии миокарда, особенно на ранней стадии. . В будущем необходимы дополнительные исследования.
В совокупности условное существование ciRs-126/миР-21 в кардиомиоцитах H/R указывает на то, что активация ciRs-126 и негативная регуляция миР-21 могут быть парой потенциальных биомаркеров ишемии миокарда, особенно на ранней стадии. . В будущем необходимы дополнительные исследования.
Выводы
В заключение, ciRs-126 сверхэкспрессируется в H/R и может подавлять миР-21, чтобы способствовать апоптозу кардиомиоцитов, индуцированному H/R.
Доступность данных и материалов
Наборы данных, использованные и/или проанализированные в ходе текущего исследования, можно получить у соответствующего автора по обоснованному запросу.
Сокращения
Ссылки
- «>
Хаусенлой Д.Дж., Йеллон Д.М. Ишемически-реперфузионное повреждение миокарда: забытая терапевтическая цель. Джей Клин Инвест. 2013;123(1):92–100. doi: https://doi.org/10.1172/JCI62874.
КАС
Статья
пабмед
ПабМед Центральный
Google ученый
Odenstedt J, Linderoth B, Bergfeldt L, Ekre O, Grip L, Mannheimer C et al. Влияние стимуляции спинного мозга на ишемию миокарда, размер инфаркта, желудочковую аритмию и неинвазивную электрофизиологию в модели ишемии-реперфузии свиньи. Ритм сердца. 2011;8(6):892–8. Дои: https://doi.org/10.1016/j.hrthm.2011.01.029.
Артикул
пабмед
Google ученый
Lu J, Xue Y, Wang Y, Ding Y, Zou Q, Pan M et al. CiRS-126 ингибирует пролиферацию клеток гранулезы яичников посредством нацеливания на ось миР-21-PDCD4-ROS в модели синдрома поликистозных яичников. Сотовые Ткани Res. 2020;381(1):189–201. doi: https://doi.org/10.1007/s00441-020-03187-9.
КАС
Статья
пабмед
Google ученый
Ссылки на скачивание
Благодарности
Неприменимо.
Финансирование
Неприменимо.
Информация об авторе
Авторы и организации
Авторы
- 9059.
 Cantming Publication
Cantming Publication5.
Вы также можете искать этого автора в
PubMed Google Scholar
Contributions
Все авторы внесли свой вклад в разработку концепции и дизайна исследования. Подготовку материала, сбор данных и анализ выполняли CMT, JML, ZSY и YXM. Первый черновик рукописи был написан CMT, и все авторы прокомментировали предыдущие версии рукописи. Все авторы читали и одобрили окончательный вариант рукописи.
Автор, ответственный за переписку
Чанмин Тан.
Декларация этики
Одобрение этики и согласие на участие
Это исследование было одобрено Комитетом по этике Второй больницы Сянъя Центрального Южного Университета. Все пациенты подписали информированное согласие.
Согласие на публикацию
Неприменимо.
Конкурирующие интересы
Авторы заявляют об отсутствии конкурирующих интересов.
Дополнительная информация
Примечание издателя
Springer Nature остается нейтральной в отношении юрисдикционных претензий в опубликованных картах и институциональной принадлежности.
Дополнительная информация
Дополнительный файл 1.
Доп. файл 2:
Дополнение Рис. 1. Корреляционный анализ между экспрессией Cir-126, CK-MB и cTnT в образцах H/R. Результаты линейного регрессионного анализа экспрессии Cir-126 и концентрации CK-MB ( A ) и cTnT( B ) в образцах H/R. Коэффициент корреляции Пирсона составляет 0,910 и 0,905 соответственно.
Коэффициент корреляции Пирсона составляет 0,910 и 0,905 соответственно.
Дополнительный файл 3:
Дополнение Рис. 2. Анализ люциферазы. Обнаружение активности люциферазы с помощью двухрепортерного анализа люциферазы после обработки кардиомиоцитов с/без H/R. Затем трансфицировали Cir-126 и репортерный вектор промотора miR-21, затем исследовали активность люциферазы (1,01 ± 0,02 VS 0,93 ± 0,02; 10,84 ± 0,07 VS 0,16 ± 0,01, p > 0,5, df = 2). Студенты Для сравнения разных групп был проведен тест. Все данные представлены как среднее ± стандартное отклонение на каждом рисунке. п =3.
Права и разрешения
Открытый доступ Эта статья находится под лицензией Creative Commons Attribution 4.0 International License, которая разрешает использование, совместное использование, адаптацию, распространение и воспроизведение на любом носителе или в любом формате, при условии, что вы укажете соответствующую ссылку на оригинальный автор(ы) и источник, предоставьте ссылку на лицензию Creative Commons и укажите, были ли внесены изменения. Изображения или другие сторонние материалы в этой статье включены в лицензию Creative Commons на статью, если иное не указано в кредитной строке материала. Если материал не включен в лицензию Creative Commons статьи, а ваше предполагаемое использование не разрешено законом или выходит за рамки разрешенного использования, вам необходимо получить разрешение непосредственно от правообладателя. Чтобы просмотреть копию этой лицензии, посетите http://creativecommons.org/licenses/by/4.0/. Отказ Creative Commons от права на общественное достояние (http://creativecommons.org/publicdomain/zero/1.0/) применяется к данным, представленным в этой статье, если иное не указано в кредитной линии данных.
Изображения или другие сторонние материалы в этой статье включены в лицензию Creative Commons на статью, если иное не указано в кредитной строке материала. Если материал не включен в лицензию Creative Commons статьи, а ваше предполагаемое использование не разрешено законом или выходит за рамки разрешенного использования, вам необходимо получить разрешение непосредственно от правообладателя. Чтобы просмотреть копию этой лицензии, посетите http://creativecommons.org/licenses/by/4.0/. Отказ Creative Commons от права на общественное достояние (http://creativecommons.org/publicdomain/zero/1.0/) применяется к данным, представленным в этой статье, если иное не указано в кредитной линии данных.
Перепечатки и разрешения
Об этой статье
Передача сигналов гипоксии макрофагов регулирует сердечный фиброз с помощью Онкостатина М
Резюме
Фиброзная реакция в тканевых фибробластах определяется балансом между сигналами активации и репрессии от тканевого микроокружения. В то время как молекулярные пути, с помощью которых трансформирующий фактор роста-1 (TGF-β1) активирует профиброгенные механизмы, были тщательно изучены и признаны критическими во время развития фиброза, факторы, регулирующие передачу сигналов TGF-β1, плохо изучены. Здесь мы показываем, что передача сигналов гипоксии макрофагами подавляет чрезмерный фиброз в сердце посредством секреции онкостатина-м (OSM). Во время ремоделирования сердца Ly6C hi моноцитов/макрофагов накапливаются в зонах гипоксии за счет фактора, индуцируемого гипоксией (HIF)-1α, и подавляют активацию сердечных фибробластов. В качестве основного молекулярного механизма мы идентифицируем OSM, часть семейства цитокинов интерлейкина 6, в качестве гена-мишени HIF-1α, который непосредственно ингибирует опосредованную TGF-β1 активацию сердечных фибробластов посредством внеклеточного регулируемого сигналом киназы 1/2-зависимого фосфорилирования. линкерной области SMAD. Эти результаты демонстрируют, что передача сигналов гипоксии макрофагами регулирует активацию фибробластов посредством секреции OSM in vivo.
В то время как молекулярные пути, с помощью которых трансформирующий фактор роста-1 (TGF-β1) активирует профиброгенные механизмы, были тщательно изучены и признаны критическими во время развития фиброза, факторы, регулирующие передачу сигналов TGF-β1, плохо изучены. Здесь мы показываем, что передача сигналов гипоксии макрофагами подавляет чрезмерный фиброз в сердце посредством секреции онкостатина-м (OSM). Во время ремоделирования сердца Ly6C hi моноцитов/макрофагов накапливаются в зонах гипоксии за счет фактора, индуцируемого гипоксией (HIF)-1α, и подавляют активацию сердечных фибробластов. В качестве основного молекулярного механизма мы идентифицируем OSM, часть семейства цитокинов интерлейкина 6, в качестве гена-мишени HIF-1α, который непосредственно ингибирует опосредованную TGF-β1 активацию сердечных фибробластов посредством внеклеточного регулируемого сигналом киназы 1/2-зависимого фосфорилирования. линкерной области SMAD. Эти результаты демонстрируют, что передача сигналов гипоксии макрофагами регулирует активацию фибробластов посредством секреции OSM in vivo.
Введение
Ремоделирование сердца происходит после инфаркта миокарда или перегрузки давлением. Во время процессов ремоделирования активированные фибробласты (миофибробласты) вызывают развитие кардиального фиброза в зонах инфаркта миокарда для поддержания структуры сердца 1,2,3 . Сердечный фиброз также возникает при ремоделировании сердца, вызванном перегрузкой давлением, что приводит к развитию сердечной недостаточности с сохраненной фракцией выброса (HFpEF), формы застойной сердечной недостаточности, при которой фракция крови, выбрасываемая из левого желудочка, находится в пределах нормальных порогов (> 50%) 4 . Как при инфаркте миокарда, так и при сердечном фиброзе, вызванном перегрузкой давлением, степень интерстициального фиброза коррелирует со смертностью и частотой серьезных сердечно-сосудистых осложнений у пациентов с сердечной недостаточностью 5,6,7,8 . Таким образом, выяснение молекулярных процессов, посредством которых фибробласты активируются или дезактивируются, имеет решающее значение для разработки терапевтических подходов к лечению сердечного фиброза.
Во время фиброгенеза в сердце рекрутируются несколько подмножеств моноцитов/макрофагов (MΦ), включая как провоспалительные (Ly6C hi ) и противовоспалительным (Ly6C lo ) MΦ 9 и играют решающую роль в ремоделировании тканей. Степень воспаления значительно коррелирует с тяжестью сердечной недостаточности 10,11,12 . Примечательно, что локальная концентрация кислорода в воспаленных областях имеет тенденцию к снижению, что приводит к тканевой гипоксии 13,14 . Фактор транскрипции, индуцируемый гипоксией фактор (HIF)-1α и HIF-2α стабилизируются в условиях гипоксии. В своей стабильной форме HIF-α индуцируют экспрессию генов-мишеней посредством их связывания с элементами ответа на гипоксию (HRE) генов-мишеней 15,16,17,18,19,20,21,22,23 . Ранее мы показали, что HIF-1α и HIF-2α сильно экспрессируются в провоспалительных и противовоспалительных MΦ соответственно 24 . Во время миграции клеток цитозольный АТФ быстро расходуется в филоподиях или ламеллоподиях. Недавно мы обнаружили, что гликолитическое перепрограммирование, опосредованное HIF-1α, играет ключевую роль в мобилизации MΦ в сторону гипоксической ткани -25-. Пируваткиназа мышечного типа, гликолитический фермент, способный продуцировать АТФ, локализуется в филоподиях и ламеллоподиях, что может объяснять полезную роль гликолитического метаболизма в миграции МФ.
Недавно мы обнаружили, что гликолитическое перепрограммирование, опосредованное HIF-1α, играет ключевую роль в мобилизации MΦ в сторону гипоксической ткани -25-. Пируваткиназа мышечного типа, гликолитический фермент, способный продуцировать АТФ, локализуется в филоподиях и ламеллоподиях, что может объяснять полезную роль гликолитического метаболизма в миграции МФ.
Однако роль MΦ в фиброзе тканей полностью не выяснена 9,26 . В текущем исследовании изучается роль MΦ в сердечном фиброзе с использованием мышиной модели ремоделирования сердца. Результаты демонстрируют, что Ly6C hi MΦ накапливаются в зонах гипоксии и подавляют чрезмерный фиброз в сердечной ткани за счет секреции цитокина Онкостатин-М (OSM) in vivo.
Результаты
Ly6C
hi/lo MΦ накапливается в сердце после процедуры TAC
TAC является широко используемой экспериментальной моделью для индуцирования сердечного фиброза. Чтобы идентифицировать популяцию сердечных воспалительных клеток, которые накапливаются в ткани сердца, мы провели анализ тканей сердца с помощью флуоресцентно-активированной сортировки клеток (FACS) после проведения операции TAC. В этом исследовании мы определили MΦ сердца как CD11b + , F4/80 + , Ly6G — мононуклеарных клеток 27 . Сердечные МФ резко, но временно накапливаются в сердце после ТАК (рис. 1а). Ly6C известен как поверхностный маркер для определения субпопуляций MΦ сердца 28 . Затем мы выделили два подмножества MΦ, включая Ly6C hi MΦ и Ly6C lo MΦ (дополнительный рисунок 1) 9,29 . Сердечный LY6C HI Mφ Высоко экспрессия Интерлейкин 1 Beta ( IL1B ) и C-C-рецептор-рецептор 2 ( CCR2 ), при этом LY6C LO 6 MR 2 ), а LY6C LO 6 м. М.2.1119, а также RECTER 66 MR. ) и аргиназа 1 ( Arg1 ) (дополнительный рисунок 2). Большинство клеток, рекрутированных на 3-й день, представляли собой Ly6C9.0595- МО, а на 7 или 14 день Ly6C -10 МО (рис. 1b).
В этом исследовании мы определили MΦ сердца как CD11b + , F4/80 + , Ly6G — мононуклеарных клеток 27 . Сердечные МФ резко, но временно накапливаются в сердце после ТАК (рис. 1а). Ly6C известен как поверхностный маркер для определения субпопуляций MΦ сердца 28 . Затем мы выделили два подмножества MΦ, включая Ly6C hi MΦ и Ly6C lo MΦ (дополнительный рисунок 1) 9,29 . Сердечный LY6C HI Mφ Высоко экспрессия Интерлейкин 1 Beta ( IL1B ) и C-C-рецептор-рецептор 2 ( CCR2 ), при этом LY6C LO 6 MR 2 ), а LY6C LO 6 м. М.2.1119, а также RECTER 66 MR. ) и аргиназа 1 ( Arg1 ) (дополнительный рисунок 2). Большинство клеток, рекрутированных на 3-й день, представляли собой Ly6C9.0595- МО, а на 7 или 14 день Ly6C -10 МО (рис. 1b).
Рис. 1
Кардиальная инфильтрация МФ после операции ТАК. a Данные представляют сердечную инфильтрацию MΦ (CD11b + , F4/80 + , Ly6G — мононуклеарных клеток) после операции TAC. b Данные представляют сердечную инфильтрацию Ly6C hi MΦ и Ly6C lo MΦ после операции TAC. *Ly6C до MΦ. † Ly6C 9от 0595 до MΦ. Для статистического анализа использовали критерий Крускала-Уоллиса. (Рисунок a , b ; n = 5 в дни 0, 3, 7, 14 и 28). c Область гипоксии была визуализирована у мышей, оперированных TAC (через 3 дня после TAC), с использованием LOX-1 (красный). Сосуды и ядра были помечены изолектином (зеленый) и Hoechst 33342 (синий) (слева). Масштабная линейка = 50 мкм. Интенсивность сигнала LOX-1 рассчитывали у ложно оперированных мышей или мышей TAC (справа). (ROI номер 180, имитация мыши и мышь, оперированная TAC, соответственно). d MΦ после операции TAC окрашивали пимонидазолом (Pimo). Показана популяция Pimo-позитивных клеток в Ly6C hi MΦ (3-й день, n = 5) и Ly6C lo MΦ (7-й день, n = 5).
a Данные представляют сердечную инфильтрацию MΦ (CD11b + , F4/80 + , Ly6G — мононуклеарных клеток) после операции TAC. b Данные представляют сердечную инфильтрацию Ly6C hi MΦ и Ly6C lo MΦ после операции TAC. *Ly6C до MΦ. † Ly6C 9от 0595 до MΦ. Для статистического анализа использовали критерий Крускала-Уоллиса. (Рисунок a , b ; n = 5 в дни 0, 3, 7, 14 и 28). c Область гипоксии была визуализирована у мышей, оперированных TAC (через 3 дня после TAC), с использованием LOX-1 (красный). Сосуды и ядра были помечены изолектином (зеленый) и Hoechst 33342 (синий) (слева). Масштабная линейка = 50 мкм. Интенсивность сигнала LOX-1 рассчитывали у ложно оперированных мышей или мышей TAC (справа). (ROI номер 180, имитация мыши и мышь, оперированная TAC, соответственно). d MΦ после операции TAC окрашивали пимонидазолом (Pimo). Показана популяция Pimo-позитивных клеток в Ly6C hi MΦ (3-й день, n = 5) и Ly6C lo MΦ (7-й день, n = 5). e Сердечная инфильтрация Ly6C hi MΦ и Ly6C lo MΦ у миелоид-специфических мышей с условным нокаутом HIF-1α ( mHIF-1α CKO: HIF-1α flox/flox
e Сердечная инфильтрация Ly6C hi MΦ и Ly6C lo MΦ у миелоид-специфических мышей с условным нокаутом HIF-1α ( mHIF-1α CKO: HIF-1α flox/flox
2
2; +/− ) анализировали через 3 или 7 дней после операции TAC. Cre-отрицательные однопометники использовались в качестве контроля (продолжение). День 3, продолжение ( n = 6) и mHIF-1α CKO ( n = 4). День 7, продолжение ( n = 3) и mHIF-1α CKO ( n = 4). Для сравнения различий использовали U-критерий Манна-Уитни ( c , d , e ). Планка погрешности представляет собой стандартное отклонение. нс не является статистически значимым. * или † , p < 0,05
Изображение полного размера
Ly6C
hi MΦ накапливаются в гипоксических областях
Хемокиновый (мотив C-C) лиганд 2 (Ccl2) и хемокиновый (мотив C-X3-C) лиганд 1 являются хемокинами, которые могут рекрутировать Ly6C hi и Ly6C lo MΦ соответственно 9 . В то время как рекрутируемый MΦ предположительно модулирует сердечный фиброз, на процесс его миграции значительно влияет оксигенация тканей 14,25 . Чтобы проверить, развиваются ли области гипоксии во время ремоделирования сердца, мы провели двухфотонный микроскопический анализ in vivo с использованием фосфоресцирующего зонда гипоксии, LOX-1. Через 3 дня после операции ТАК наблюдалось резкое усиление сигнала LOX-1, отражающее тканевую гипоксию (рис. 1с). Мы использовали другой зонд гипоксии, пимонидазол (Pimo), для дальнейшего изучения статуса оксигенации тканей сердца 30 . Окрашивание Пимо было визуализировано во всей области сердца через 3 дня после ТАС (дополнительный рисунок 3). Для выяснения молекулярной связи между механическим стрессом и тканевой гипоксией были выделены первичные кардиомиоциты и измерена скорость потребления кислорода (СПК) с помощью анализатора потока (XF24, Agilent Technologies, США). OCR кардиомиоцитов увеличился на 3-й день после операции TAC (дополнительная рис.
В то время как рекрутируемый MΦ предположительно модулирует сердечный фиброз, на процесс его миграции значительно влияет оксигенация тканей 14,25 . Чтобы проверить, развиваются ли области гипоксии во время ремоделирования сердца, мы провели двухфотонный микроскопический анализ in vivo с использованием фосфоресцирующего зонда гипоксии, LOX-1. Через 3 дня после операции ТАК наблюдалось резкое усиление сигнала LOX-1, отражающее тканевую гипоксию (рис. 1с). Мы использовали другой зонд гипоксии, пимонидазол (Pimo), для дальнейшего изучения статуса оксигенации тканей сердца 30 . Окрашивание Пимо было визуализировано во всей области сердца через 3 дня после ТАС (дополнительный рисунок 3). Для выяснения молекулярной связи между механическим стрессом и тканевой гипоксией были выделены первичные кардиомиоциты и измерена скорость потребления кислорода (СПК) с помощью анализатора потока (XF24, Agilent Technologies, США). OCR кардиомиоцитов увеличился на 3-й день после операции TAC (дополнительная рис. 4). Эти результаты свидетельствуют о гипотезе о том, что повышенная потребность кардиомиоцитов в кислороде лежит в основе возникновения тканевой гипоксии в перегруженном давлением сердце.
4). Эти результаты свидетельствуют о гипотезе о том, что повышенная потребность кардиомиоцитов в кислороде лежит в основе возникновения тканевой гипоксии в перегруженном давлением сердце.
Затем мы измерили сигналы Pimo в сердечной MΦ. Ly6C hi MΦ показал более высокую интенсивность сигнала Pimo, чем Ly6C hi MΦ, что позволяет предположить, что Ly6C hi MΦ действительно накапливается в гипоксических областях in vivo (рис. 1d). Чтобы проверить роль передачи сигналов HIF-1α в распределении сердечной MΦ, мы создали миелоид-специфических мышей с нокаутом HIF-1α ( HIF-1α flox/flox ; LysM-cre +/- , mHIF-1α). ККО) 31,32 . Эффективность делеции гена HIF-1α на уровне мРНК составила более 65% как у Ly6C hi MΦ и Ly6C lo MΦ в сердце (дополнительный рис. 5). Исходная сердечная функция у мышей mHIF-1α CKO не изменилась по сравнению с cre-отрицательным контролем (дополнительная фигура 6). Затем мы выполнили процедуру TAC у мышей mHIF-1α CKO. Результаты показали, что накопление Ly6C до MΦ в сердце на 3-й день было поразительно уменьшено при CKO mHIF-1α, тогда как накопление Ly6C до MΦ не было затронуто (рис. 1e). Эти результаты показывают, что передача сигналов HIF-1α играет неотъемлемую роль в привлечении Ly6C hi MΦ в гипоксическую область сердца, но не Ly6C lo MΦ.
Затем мы выполнили процедуру TAC у мышей mHIF-1α CKO. Результаты показали, что накопление Ly6C до MΦ в сердце на 3-й день было поразительно уменьшено при CKO mHIF-1α, тогда как накопление Ly6C до MΦ не было затронуто (рис. 1e). Эти результаты показывают, что передача сигналов HIF-1α играет неотъемлемую роль в привлечении Ly6C hi MΦ в гипоксическую область сердца, но не Ly6C lo MΦ.
Сердечный фиброз развивается у мышей с нокаутом HIF-1α
Затем мы измерили площадь фиброза и обнаружили, что она была значительно больше у мышей mHIF-1α CKO по сравнению с контрольной группой (рис. 2a). В то время как количество CD31-позитивных клеток оставалось неизменным, количество альфа-актин-гладких мышц (αSMA)-позитивных миофибробластов было увеличено у мышей mHIF-1α CKO (рис. 2b, дополнительная рис. 7). Количество TdT-опосредованного мечения концов dUTP (TUNEL)-положительных клеток не увеличивалось у мышей mHIF-1α CKO (дополнительная рис. 8), что указывает на то, что потеря HIF-1α, специфичного для миелоидных клеток, не влияла на выживаемость кардиомиоцитов in vivo. . Хотя эти результаты указывают на антифиброзную активность Ly6C hi MΦ роль Ly6C lo MΦ в сердечном фиброзе все еще оставалась неясной. Поэтому мы инъецировали липосомы клодроната внутрибрюшинно для дальнейшего истощения Ly6C -10 MΦ мышам mHIF-1α CKO. Инъекция клодронатных липосом не влияла на степень сердечного фиброза (дополнительная рис. 9). Эти результаты предполагают, что Ly6C hi MΦ передача сигналов гипоксии играет основную роль в регуляции кардиального фиброза in vivo. Кроме того, у мышей mHIF-1α CKO значительно снизилась фракция выброса левого желудочка наряду с увеличением массы сердца (рис. 2c, d и дополнительные рис. 10, 11), а также заметно снизилась выживаемость после процедуры TAC (рис. 2e). Эти данные указывают на то, что передача сигналов гипоксии MΦ играет кардиозащитную роль в модели TAC. Чтобы дополнительно изучить роль передачи сигналов MΦ HIF-1α в развитии заместительного фиброза, мы выполнили модель инфаркта миокарда с использованием мышей mHIF-1α CKO.
8), что указывает на то, что потеря HIF-1α, специфичного для миелоидных клеток, не влияла на выживаемость кардиомиоцитов in vivo. . Хотя эти результаты указывают на антифиброзную активность Ly6C hi MΦ роль Ly6C lo MΦ в сердечном фиброзе все еще оставалась неясной. Поэтому мы инъецировали липосомы клодроната внутрибрюшинно для дальнейшего истощения Ly6C -10 MΦ мышам mHIF-1α CKO. Инъекция клодронатных липосом не влияла на степень сердечного фиброза (дополнительная рис. 9). Эти результаты предполагают, что Ly6C hi MΦ передача сигналов гипоксии играет основную роль в регуляции кардиального фиброза in vivo. Кроме того, у мышей mHIF-1α CKO значительно снизилась фракция выброса левого желудочка наряду с увеличением массы сердца (рис. 2c, d и дополнительные рис. 10, 11), а также заметно снизилась выживаемость после процедуры TAC (рис. 2e). Эти данные указывают на то, что передача сигналов гипоксии MΦ играет кардиозащитную роль в модели TAC. Чтобы дополнительно изучить роль передачи сигналов MΦ HIF-1α в развитии заместительного фиброза, мы выполнили модель инфаркта миокарда с использованием мышей mHIF-1α CKO. Площадь фиброза в модели инфаркта миокарда была значительно больше у мышей mHIF-1α CKO по сравнению с контролем (дополнительная фигура 12).
Площадь фиброза в модели инфаркта миокарда была значительно больше у мышей mHIF-1α CKO по сравнению с контролем (дополнительная фигура 12).
Рис. 2
Сердечный фиброз развивается у мышей с миелоид-специфическим нокаутом HIF-1α. a Окрашивание трихромом по Массону проводили с использованием сердечной ткани миелоид-специфических мышей с условным нокаутом HIF-1α ( mHIF-1α CKO: HIF-1α flox/flox ; LysM-cre
+/– ) через 14 дней после операции TAC. Cre-отрицательные однопометники использовались в качестве контроля (продолжение). Площадь фиброза рассчитывали по сравнению с общей площадью поверхности (SA). продолжение ( n = 10) и mHIF-1α CKO ( n = 9). Масштабная линейка = 100 мкм. b Среднее количество α-актин-гладких мышц (αSMA) положительных клеток через 14 дней после операции TAC подсчитывали в пяти полях. Cont ( n = 5) и mHIF-1α CKO ( n = 5). c Данные представляют собой фракцию выброса через 28 дней после операции TAC у мышей группы ( n = 13) и мышей mHIF-1α CKO ( n = 14). d Данные представляют массу сердца (желудочков) на массу тела (‰) через 28 дней после операции TAC в продолжении ( n = 13) и мыши mHIF-1α CKO ( n = 14). U-критерий Манна-Уитни использовали для сравнения различий между mHIF-αCKO и продолжением ( a , b , c , d ). e Кривые выживаемости Каплана-Мейера для контрольных мышей ( n = 8) и мышей mHIF-1α CKO ( n = 17). Для статистического анализа использовали логарифмический ранговый критерий. Планка погрешности представляет собой стандартное отклонение. * p < 0,05
d Данные представляют массу сердца (желудочков) на массу тела (‰) через 28 дней после операции TAC в продолжении ( n = 13) и мыши mHIF-1α CKO ( n = 14). U-критерий Манна-Уитни использовали для сравнения различий между mHIF-αCKO и продолжением ( a , b , c , d ). e Кривые выживаемости Каплана-Мейера для контрольных мышей ( n = 8) и мышей mHIF-1α CKO ( n = 17). Для статистического анализа использовали логарифмический ранговый критерий. Планка погрешности представляет собой стандартное отклонение. * p < 0,05
Полноразмерное изображение
Онкостатин М, полученный из МФ, подавляет активацию фибробластов. перитонеальные макрофаги (TEPM). TGF-β1 индуцирует экспрессию мРНК
αSMA в клетках C3H/10T1/2, которая известна как маркер активации фибробластов. В то время как культуральный супернатант TEPM, хранившийся в нормоксических условиях, не изменял экспрессию αSMA мРНК, культуральный супернатант TEPM, хранившийся в условиях гипоксии, значительно подавлял экспрессию αSMA мРНК (рис. 3a). Основываясь на этом открытии, мы предположили, что гипоксия стимулирует секрецию некоторых неизвестных факторов в TEPM, которые подавляют активацию фибробластов.
3a). Основываясь на этом открытии, мы предположили, что гипоксия стимулирует секрецию некоторых неизвестных факторов в TEPM, которые подавляют активацию фибробластов.
Рис. 3
Онкостатин М из гипоксического МФ ингибирует активацию фибробластов. a Супернатанты были собраны из перитонеальных макрофагов, индуцированных тиогликолатом (TEPM), в условиях нормоксии или гипоксии. После предварительной обработки супернатантами клетки C3H/10T1/2 стимулировали TGF-β1 (2,5 нг на мл, 12 ч) и относительную экспрессию 9Было рассчитано 1039 мРНК αSMA (справа). Для статистического анализа использовали односторонний ANOVA и критерий множественных сравнений Даннета (F (2, 6) = 6,019). b Мы провели анализ транскриптома в изолированных первичных TEPM от гемопоэтических/эндотелиально-специфических мышей с условным нокаутом HIF-1α ( HIF-1α flox/flox ; Tie2-cre +/- мышей; HIF-1α КО) или cre отрицательный контроль однопометников. На блок-схеме показана стратегия выявления секреторных факторов, индуцируемых гипоксией (слева). Таблица иллюстрирует идентифицированные 11 секреторных факторов, индуцирующих гипоксию (справа). c Исследовали влияние каждого индуцируемого гипоксией секреторного фактора на активацию фибробластов (20 нг на мл для CTGF, CXCL2, CXCL3, LIF и 10 нг на мл для OSM). Через тридцать минут после предварительной обработки секреторными факторами, индуцируемыми гипоксией, клетки C3H/10T1/2 стимулировали TGF-β1 (2,5 нг на мл, 12 ч) и рассчитывали относительную экспрессию мРНК αSMA. Для статистического анализа использовали односторонний ANOVA и критерий множественных сравнений Даннета (F (5, 12) = 68,07). д Исследовано влияние онкостатина М (OSM) (10 нг на мл) на первичную активацию сердечных фибробластов. Через тридцать минут после предварительной обработки OSM (10 нг на мл, 12 часов) клетки C3H/10T1/2 стимулировали TGF-β1 (2,5 нг на мл, 12 часов) и рассчитывали относительную экспрессию мРНК αSMA.
На блок-схеме показана стратегия выявления секреторных факторов, индуцируемых гипоксией (слева). Таблица иллюстрирует идентифицированные 11 секреторных факторов, индуцирующих гипоксию (справа). c Исследовали влияние каждого индуцируемого гипоксией секреторного фактора на активацию фибробластов (20 нг на мл для CTGF, CXCL2, CXCL3, LIF и 10 нг на мл для OSM). Через тридцать минут после предварительной обработки секреторными факторами, индуцируемыми гипоксией, клетки C3H/10T1/2 стимулировали TGF-β1 (2,5 нг на мл, 12 ч) и рассчитывали относительную экспрессию мРНК αSMA. Для статистического анализа использовали односторонний ANOVA и критерий множественных сравнений Даннета (F (5, 12) = 68,07). д Исследовано влияние онкостатина М (OSM) (10 нг на мл) на первичную активацию сердечных фибробластов. Через тридцать минут после предварительной обработки OSM (10 нг на мл, 12 часов) клетки C3H/10T1/2 стимулировали TGF-β1 (2,5 нг на мл, 12 часов) и рассчитывали относительную экспрессию мРНК αSMA. Для статистического анализа использовали двусторонний t -критерий с поправкой Уэлча (t = 10,89, df = 2,208). Данные показывают среднее значение и стандартное отклонение (планка погрешности) технических трехкратных повторений репрезентативного эксперимента. e Иммуногистологическое окрашивание проводили с использованием сердечных тканей мышей, оперированных ТАС (3-й день). OSM (слева), CD11b (справа). Масштабная линейка = 50 мкм. * p < 0,05
Для статистического анализа использовали двусторонний t -критерий с поправкой Уэлча (t = 10,89, df = 2,208). Данные показывают среднее значение и стандартное отклонение (планка погрешности) технических трехкратных повторений репрезентативного эксперимента. e Иммуногистологическое окрашивание проводили с использованием сердечных тканей мышей, оперированных ТАС (3-й день). OSM (слева), CD11b (справа). Масштабная линейка = 50 мкм. * p < 0,05
Изображение с полным размером
Чтобы идентифицировать стимулированные гипоксией факторы секреции, обладающие антифибротическим потенциалом, мы выделили первичные TEPMs от гемопоэтически/эндотелиально-специфических мышей с нокаутом HIF-1α ( HIF-1α флокс/флокс Tie2-cre +/- мышей ; HIF-1α KO) или cre-отрицательные контрольные однопометники. Впоследствии мы провели анализ транскриптома и искали любые секреторные факторы, которые сильно экспрессируются в условиях гипоксии, зависимым от HIF-1α образом (рис. 3b, слева). Этот беспристрастный подход выявил 11 секреторных факторов, в том числе фактор роста соединительной ткани ( Ctgf ), хемокин ( мотив C-X-C ), лиганд 2, ( Cxcl2 9 Lexcluk
3b, слева). Этот беспристрастный подход выявил 11 секреторных факторов, в том числе фактор роста соединительной ткани ( Ctgf ), хемокин ( мотив C-X-C ), лиганд 2, ( Cxcl2 9 Lexcluk
фактор, ингибитор Cxcluk ),0932 ( Lif ) и Osm (рис. 3б, справа). Чтобы проверить их влияние на активацию фибробластов, мы обработали клетки C3H/10T1/2 10 идентифицированными секреторными факторами, которые мы могли получить на коммерческой основе, и проверили их влияние на активацию фибробластов. Благодаря этому подходу мы обнаружили, что OSM, член семейства цитокинов типа IL6, значительно подавляет экспрессию мРНК αSMA в клетках C3H/10T1/2 (рис. 3c, дополнительная рис. 13). OSM также подавлял активацию изолированных первичных сердечных фибробластов мыши (рис. 3d). Далее мы проверили экспрессию OSM в сердце и определили, что OSM сильно экспрессируется в MΦ сердца мышей (рис. 3e).
OSM индуцируется при гипоксии зависимым от HIF-1α образом
Мы культивировали TEPM дикого типа или макрофаги, полученные из костного мозга, при концентрации кислорода 1% и обнаружили, что уровни мРНК Osm были значительно повышены при гипоксии (рис. 4a, Дополнительный рис. 14). Повышение экспрессии гена Osm , вызванное гипоксией, было значительно подавлено в HIF-1α KO TEPM, что указывает на то, что количество мРНК Osm увеличивается HIF-1α-зависимым образом. Чтобы изучить молекулярные механизмы, с помощью которых HIF-1α индуцирует экспрессии гена Osm , мы затем провели анализ иммунопреципитации хроматина (ChIP) с антителом против HIF-1α. Результаты показали прямое связывание HIF-1α с последовательностью HRE на 4 т.п.н. выше сайта начала транскрипции Osm (рис. 4b). Чтобы оценить роль последовательности HRE Osm в ее активации транскрипции, мы создали репортерную конструкцию, содержащую последовательность HRE Osm . Совместная трансфекция HIF-1α и ядерного транслокатора рецептора арилуглеводородов значительно повышала люциферазную активность репортерной конструкции, содержащей последовательностей Osm HRE (дополнительный рисунок 15). В совокупности эти результаты демонстрируют, что экспрессия Osm напрямую индуцируется при гипоксии зависимым от HIF-1α образом.
4a, Дополнительный рис. 14). Повышение экспрессии гена Osm , вызванное гипоксией, было значительно подавлено в HIF-1α KO TEPM, что указывает на то, что количество мРНК Osm увеличивается HIF-1α-зависимым образом. Чтобы изучить молекулярные механизмы, с помощью которых HIF-1α индуцирует экспрессии гена Osm , мы затем провели анализ иммунопреципитации хроматина (ChIP) с антителом против HIF-1α. Результаты показали прямое связывание HIF-1α с последовательностью HRE на 4 т.п.н. выше сайта начала транскрипции Osm (рис. 4b). Чтобы оценить роль последовательности HRE Osm в ее активации транскрипции, мы создали репортерную конструкцию, содержащую последовательность HRE Osm . Совместная трансфекция HIF-1α и ядерного транслокатора рецептора арилуглеводородов значительно повышала люциферазную активность репортерной конструкции, содержащей последовательностей Osm HRE (дополнительный рисунок 15). В совокупности эти результаты демонстрируют, что экспрессия Osm напрямую индуцируется при гипоксии зависимым от HIF-1α образом.
Рис. 4
Экспрессия гена OSM индуцируется при гипоксии зависимым от HIF-1α образом. a Вызванные тиогликолятом перитонеальные макрофаги (TEPM) были выделены из гемопоэтически/эндотелиально-специфичных мышей с нокаутом HIF-1α (HIF-1α KO) или cre-отрицательных однопометников в качестве контроля (продолжение). TEPM подвергались воздействию гипоксии (1% O 2 ), и был проанализирован относительный уровень экспрессии мРНК Osm . Для статистического анализа использовали односторонний ANOVA и критерий множественных сравнений Даннета (F (2, 6) = 90,20). † p < 0,05 по сравнению с 0 ч. Двусторонний ANOVA и критерий множественного сравнения Сидака были выполнены для статистического анализа (F (2, 12) = 94,66). * p < 0,05 по сравнению с продолж. Связывание HIF-1α b с промотором гена Osm изучали методом иммунопреципитации хроматина в сочетании с детектированием методом количественной ПЦР. Наборы праймеров 1 и 2 были разработаны для обнаружения промоторного легиона (-500 и -170 п.н.) ген Pgk1 . Наборы праймеров 3 и 4 были разработаны для обнаружения элемента ответа на гипоксию (HRE, -4 т.п.н.) гена Osm . Данные показывают среднее значение и стандартное отклонение (планка усилий) технических трехкратных повторений репрезентативного эксперимента. Количественный ПЦР-анализ повторяли не менее чем в трех независимых экспериментах. Для статистического анализа использовали двусторонний t -критерий с поправкой Уэлча (Праймер 1 (t = 1,527, df = 3,863), Праймер 2 (t = 93,69, df = 2,011), Праймер 3 (t = 197,7, df = 3,202), Праймер 4 (t = 75,41, df = 2,505)). нс не является статистически значимым. * p < 0,05
Наборы праймеров 1 и 2 были разработаны для обнаружения промоторного легиона (-500 и -170 п.н.) ген Pgk1 . Наборы праймеров 3 и 4 были разработаны для обнаружения элемента ответа на гипоксию (HRE, -4 т.п.н.) гена Osm . Данные показывают среднее значение и стандартное отклонение (планка усилий) технических трехкратных повторений репрезентативного эксперимента. Количественный ПЦР-анализ повторяли не менее чем в трех независимых экспериментах. Для статистического анализа использовали двусторонний t -критерий с поправкой Уэлча (Праймер 1 (t = 1,527, df = 3,863), Праймер 2 (t = 93,69, df = 2,011), Праймер 3 (t = 197,7, df = 3,202), Праймер 4 (t = 75,41, df = 2,505)). нс не является статистически значимым. * p < 0,05
Изображение с полным размером
OSM ингибирует сигнальный путь SMAD
Далее мы исследовали молекулярные процессы, с помощью которых OSM снижает уровень экспрессии мРНК αSMA в клетках C3H/10T1/2 и первичных сердечных фибробластах. В то время как OSM подавлял опосредованное TGF-β1 увеличение экспрессии мРНК αSMA , IL6 не влиял на его содержание (рис. 5a, дополнительная рис. 16), что позволяет предположить, что антифибротический эффект специфичен для OSM, а не является общей чертой Семейство цитокинов IL6. Передача сигналов TGF-β1 в основном опосредована каноническим сигнальным путем SMAD. Было показано, что опосредованное внеклеточной сигнальной киназой 1/2 (ERK1/2) фосфорилирование линкерной области SMAD подавляет ее ядерную транслокацию 33,34,35,36,37 . В этом исследовании мы обнаружили, что OSM активирует передачу сигналов ERK в клетках C3H/10T1/2 (рис. 5b). Кроме того, OSM вызывает фосфорилирование линкерной области SMAD2 (Ser245/250/255), которое было устранено U0126, селективным ингибитором MEK1/2. Примечательно, что IL6 не влияет на фосфорилирование линкерной области SMAD2. Затем мы извлекли ядерные фракции и исследовали фосфорилирование C-конца SMAD2 (Ser465/467), маркер активации передачи сигналов SMAD2.
В то время как OSM подавлял опосредованное TGF-β1 увеличение экспрессии мРНК αSMA , IL6 не влиял на его содержание (рис. 5a, дополнительная рис. 16), что позволяет предположить, что антифибротический эффект специфичен для OSM, а не является общей чертой Семейство цитокинов IL6. Передача сигналов TGF-β1 в основном опосредована каноническим сигнальным путем SMAD. Было показано, что опосредованное внеклеточной сигнальной киназой 1/2 (ERK1/2) фосфорилирование линкерной области SMAD подавляет ее ядерную транслокацию 33,34,35,36,37 . В этом исследовании мы обнаружили, что OSM активирует передачу сигналов ERK в клетках C3H/10T1/2 (рис. 5b). Кроме того, OSM вызывает фосфорилирование линкерной области SMAD2 (Ser245/250/255), которое было устранено U0126, селективным ингибитором MEK1/2. Примечательно, что IL6 не влияет на фосфорилирование линкерной области SMAD2. Затем мы извлекли ядерные фракции и исследовали фосфорилирование C-конца SMAD2 (Ser465/467), маркер активации передачи сигналов SMAD2. OSM значительно подавлял накопление активированного SMAD2 в ядре (рис. 5c). В соответствии с нашей гипотезой U0126 ослаблял ингибирующее действие OSM на 9Экспрессия гена 1039 αSMA в клетках C3H/10T1/2 и первичных сердечных фибробластах (рис. 5d, дополнительная рис. 17). Эти результаты показывают, что OSM оказывает свое антифибротическое действие частично за счет ERK1/2-опосредованного фосфорилирования линкерной области SMAD2.
OSM значительно подавлял накопление активированного SMAD2 в ядре (рис. 5c). В соответствии с нашей гипотезой U0126 ослаблял ингибирующее действие OSM на 9Экспрессия гена 1039 αSMA в клетках C3H/10T1/2 и первичных сердечных фибробластах (рис. 5d, дополнительная рис. 17). Эти результаты показывают, что OSM оказывает свое антифибротическое действие частично за счет ERK1/2-опосредованного фосфорилирования линкерной области SMAD2.
Рис. 5
OSM подавляет сигнализацию SMAD. a После предварительной обработки OSM (10 нг на мл) или IL6 (20 нг на мл) клетки C3H/10T1/2 стимулировали TGF-β1 (2,5 нг на мл, 12 ч) и определяли относительный уровень экспрессии 9Рассчитано 1039 мРНК αSMA . Для статистического анализа использовали односторонний ANOVA и критерий множественных сравнений Даннета (F (2, 6) = 97,35). b Иммуноблот-анализ фосфо-ERK1/2, общей ERK1/2, линкера фосфо-SMAD2 (Ser245/250/255) и общего белка SMAD2. Через тридцать минут после предварительной обработки U0126 (20 нМ) клетки C3H/10T1/2 стимулировали OSM (10 нг на мл) или IL6 (20 нг на мл) в течение 30 минут. и собрал для анализа. U0126: селективный ингибитор MEK1/2. с Иммуноблот-анализ C-конца фосфо-SMAD2 (Ser465/467) и ламина A/C. Через тридцать минут после предварительной обработки OSM (10 нг на мл) клетки C3H/10T1/2 стимулировали TGF-β1 (2,5 нг на мл, 12 ч) и собирали в указанные моменты времени. d После предварительной обработки U0126 (20 мкМ, 60 мин) и OSM (10 нг на мл, 30 мин) клетки C3H/10T1/2 стимулировали TGF-β1 (2,5 нг на мл, 12 ч) и относительной рассчитывали уровень экспрессии мРНК αSMA . Двухвостый т 9Для статистического анализа использовали критерий 0932 с поправкой Уэлча (t = 3,212, df = 3,172). Данные показывают среднее значение и стандартное отклонение (планка погрешности) трех технических повторов репрезентативного эксперимента ( a , d ). * p < 0,05
и собрал для анализа. U0126: селективный ингибитор MEK1/2. с Иммуноблот-анализ C-конца фосфо-SMAD2 (Ser465/467) и ламина A/C. Через тридцать минут после предварительной обработки OSM (10 нг на мл) клетки C3H/10T1/2 стимулировали TGF-β1 (2,5 нг на мл, 12 ч) и собирали в указанные моменты времени. d После предварительной обработки U0126 (20 мкМ, 60 мин) и OSM (10 нг на мл, 30 мин) клетки C3H/10T1/2 стимулировали TGF-β1 (2,5 нг на мл, 12 ч) и относительной рассчитывали уровень экспрессии мРНК αSMA . Двухвостый т 9Для статистического анализа использовали критерий 0932 с поправкой Уэлча (t = 3,212, df = 3,172). Данные показывают среднее значение и стандартное отклонение (планка погрешности) трех технических повторов репрезентативного эксперимента ( a , d ). * p < 0,05
Изображение с полным размером
OSM подавляет сердечный фиброз in vivo
Следует отметить, что OSM подавлял активацию фибробластов, тогда как IL6 этого не делал. В то время как OSM и IL6 имеют общий gp130 в качестве корецептора для передачи сигналов, мышиный рецептор OSM (OSMR) специфически активируется OSM, но не IL6. Чтобы проверить влияние OSM на сердечные фибробласты in vivo, мы создали специфические для фибробластов Мыши с нокаутом Osmr ( OSMR flox/flox ; Col1a1-creERT , fOSMR CKO) 38 . Степень исходного сердечного фиброза или масса сердца остаются неизменными у мышей fOSMR CKO (дополнительная фигура 18). Затем мы провели операцию TAC на мышах у мышей fOSMR CKO и cre-отрицательных однопометников или мышей, не получавших тамоксифен, в качестве контроля. Сердечный фиброз был более выражен у мышей fOSMR CKO, чем у контрольной группы (рис. 6а). Чтобы дополнительно определить роль OSM in vivo, мы ввели нейтрализующее антитело OSM и измерили площадь сердечного фиброза в мышиной модели TAC. Результаты показали, что ингибирование OSM значительно увеличивает развитие сердечного фиброза (рис.
В то время как OSM и IL6 имеют общий gp130 в качестве корецептора для передачи сигналов, мышиный рецептор OSM (OSMR) специфически активируется OSM, но не IL6. Чтобы проверить влияние OSM на сердечные фибробласты in vivo, мы создали специфические для фибробластов Мыши с нокаутом Osmr ( OSMR flox/flox ; Col1a1-creERT , fOSMR CKO) 38 . Степень исходного сердечного фиброза или масса сердца остаются неизменными у мышей fOSMR CKO (дополнительная фигура 18). Затем мы провели операцию TAC на мышах у мышей fOSMR CKO и cre-отрицательных однопометников или мышей, не получавших тамоксифен, в качестве контроля. Сердечный фиброз был более выражен у мышей fOSMR CKO, чем у контрольной группы (рис. 6а). Чтобы дополнительно определить роль OSM in vivo, мы ввели нейтрализующее антитело OSM и измерили площадь сердечного фиброза в мышиной модели TAC. Результаты показали, что ингибирование OSM значительно увеличивает развитие сердечного фиброза (рис. 6b). В совокупности эти данные свидетельствуют о том, что OSM напрямую подавляет активацию сердечных фибробластов как in vitro, так и in vivo. Наконец, мы исследовали экспрессию OSM в образцах сердца человека, полученных от пациентов с сердечной недостаточностью. Примечательно, что количество OSM-положительных клеток в образце сердца человека обратно пропорционально площади сердечного фиброза (рис. 6c, дополнительная рис. 19).), что согласуется с антифиброзной функцией OSM.
6b). В совокупности эти данные свидетельствуют о том, что OSM напрямую подавляет активацию сердечных фибробластов как in vitro, так и in vivo. Наконец, мы исследовали экспрессию OSM в образцах сердца человека, полученных от пациентов с сердечной недостаточностью. Примечательно, что количество OSM-положительных клеток в образце сердца человека обратно пропорционально площади сердечного фиброза (рис. 6c, дополнительная рис. 19).), что согласуется с антифиброзной функцией OSM.
Рис. 6
OSM подавляет сердечный фиброз in vivo. Окрашивание трихромом по Массону проводили с использованием сердечной ткани нокаутных мышей Osmr , специфичных для фибробластов ( OSMR flox/flox ; Col1a1-creERT , Cre(+)) через 14 дней после операции TAC. Cre-отрицательные однопометники (Cre(-)) или однопометники, не получавшие тамоксифен, использовались в качестве контроля. Площадь фиброза рассчитывали по сравнению с общей площадью поверхности (SA) (справа). Для статистического анализа использовали критерий Крускала-Уоллиса. (Кре (-), тамоксифен (-): n = 8, Cre(+), тамоксифен(-): n = 7, Cre(-), тамоксифен(+): n = 7, Cre(+), тамоксифен(+): n = 8). Масштабная линейка = 100 мкм. b Исследовали влияние нейтрализующих антител к OSM на сердечный фиброз. Нейтрализующее антитело к OSM (100 мкг) или контрольный IgG (100 мкг) вводили внутривенно через 3 дня после операции ТАК. Окрашивание трихромом по Массону проводилось на ткани сердца через 14 дней после операции ТАК. Площадь фиброза рассчитывали по сравнению с общей площадью поверхности (SA). U-критерий Манна-Уитни использовали для сравнения различий между контрольными IgG ( n = 8) и группа антител OSM ( n = 11). Данные показывают среднее значение и стандартное отклонение (полоса погрешности). Масштабная линейка = 100 мкм. c Исследовали корреляцию между площадью сердечного фиброза и количеством OSM-позитивных клеток. Линейный регрессионный анализ использовали для корреляции между процентом площади фиброза и количеством OSM-позитивных клеток в образцах сердца пациентов с сердечной недостаточностью ( n = 18).
Для статистического анализа использовали критерий Крускала-Уоллиса. (Кре (-), тамоксифен (-): n = 8, Cre(+), тамоксифен(-): n = 7, Cre(-), тамоксифен(+): n = 7, Cre(+), тамоксифен(+): n = 8). Масштабная линейка = 100 мкм. b Исследовали влияние нейтрализующих антител к OSM на сердечный фиброз. Нейтрализующее антитело к OSM (100 мкг) или контрольный IgG (100 мкг) вводили внутривенно через 3 дня после операции ТАК. Окрашивание трихромом по Массону проводилось на ткани сердца через 14 дней после операции ТАК. Площадь фиброза рассчитывали по сравнению с общей площадью поверхности (SA). U-критерий Манна-Уитни использовали для сравнения различий между контрольными IgG ( n = 8) и группа антител OSM ( n = 11). Данные показывают среднее значение и стандартное отклонение (полоса погрешности). Масштабная линейка = 100 мкм. c Исследовали корреляцию между площадью сердечного фиброза и количеством OSM-позитивных клеток. Линейный регрессионный анализ использовали для корреляции между процентом площади фиброза и количеством OSM-позитивных клеток в образцах сердца пациентов с сердечной недостаточностью ( n = 18). * р < 0,05
* р < 0,05
Увеличить
Обсуждение
Кардиальные фибробласты активируются не только при инфаркте миокарда, но и при гипертрофии сердца, вызванной перегрузкой давлением. Несмотря на тот факт, что MΦ может подавлять сердечный фиброз 9 , его регуляторные сигналы полностью не выяснены. Здесь мы использовали датчик гипоксии in vivo и продемонстрировали, что тканевая гипоксия развивается при ремоделировании сердца, вызванном перегрузкой давлением. Далее мы обнаружили, что гипоксический МФ, но не нормоксический МФ, подавляет активацию фибробластов за счет секреции OSM. Хотя и OSM, и IL6 передают свои сигналы через gp130, OSMR специфически взаимодействует с трансформирующим белком C1 (SHC1), содержащим домен гомологии 2 src 9 39 . Это, по-видимому, объясняет опосредованную OSM активацию передачи сигналов ERK, что способствует его антифибротическим свойствам. Было также показано, что OSM оказывает защитное действие на ишемизированный миокард 40,41 , таким образом, Ly6C hi MΦ-производный OSM оказывает кардиозащитное действие как на кардиомиоциты, так и на сердечные фибробласты. Наши результаты демонстрируют функциональную связь между стерильным воспалением и сердечным фиброзом.
Наши результаты демонстрируют функциональную связь между стерильным воспалением и сердечным фиброзом.
В модели инфаркта миокарда, Ly6C hi и Ly6C lo MΦ последовательно накапливаются в сердце 9 . Также было показано, что CCL2 или 3β, происходящий из регенерирующих островков (Reg3β), обладает сильным потенциалом рекрутировать Ly6C hi MΦ в поврежденное сердце 42 . В нашей модели экспрессия Ccl2 , но не Reg3β , сильно индуцируется на 3-й день после TAC (дополнительная рис. 20). Хотя неясно, вызывают ли Ly6C hi и Ly6C lo MΦ различные субпопуляции макрофагов в сердце, результаты нашего исследования согласуются с открытием, что Ly6C hi MΦ рекрутируются в поврежденное сердце через ось CCL2-CCR2 9 .
Результаты этого исследования выявили антифибротический эффект OSM (дополнительный рисунок 21). Нам по-прежнему необходимо соблюдать осторожность при использовании OSM или агониста OSMR для лечения сердечного фиброза, поскольку он может вызывать воспаление кишечника 43 . Следовательно, избирательная доставка OSM в сердце, такая как инъекция коронарной артерии, кажется необходимой для эффективного лечения сердечного фиброза. Следует также отметить, что процессы активации фибробластов в модели ТАС могут сильно отличаться от таковых при инфаркте миокарда. Таким образом, дальнейшее исследование поможет более подробно понять процессы активации сердечного фиброза, зависящие от контекста.
Следовательно, избирательная доставка OSM в сердце, такая как инъекция коронарной артерии, кажется необходимой для эффективного лечения сердечного фиброза. Следует также отметить, что процессы активации фибробластов в модели ТАС могут сильно отличаться от таковых при инфаркте миокарда. Таким образом, дальнейшее исследование поможет более подробно понять процессы активации сердечного фиброза, зависящие от контекста.
Методы
Мыши и хирургические процедуры
Все эксперименты на животных были одобрены Комитетом по этике экспериментов на животных Токийского университета или Комитетом по этической проверке Королевского колледжа Лондона и Министерством внутренних дел Великобритании (лицензия на проект № PPL70/7260). Процедуры строго соблюдаются в соответствии с руководящими принципами экспериментов на животных Токийского университета или Законом о руководстве по эксплуатации животных (научные процедуры) 1986 г. (Министерство внутренних дел Великобритании). Мыши C57BL/6 были приобретены у Crea Japan (Токио, Япония) или Envigo (Blackthorn, Великобритания). В6.129-Hif1a tm3Rsjo/J (HIF-1α flox/fox ) мыши, B6; )мыши Ifo/J (LysM-cre), мыши B6.Cg-Tg(Tek-cre)12Flv/J (Tie2-cre) и мыши B6.Cg-Tg(Col1a1-cre/ERT2)1Crm/J (Col1a1- creERT) были приобретены в лаборатории Джексона (Бар-Харбор, штат Мэн, США). Мышей HIF-1α flox/fox , LysM-Cre и Tie2-cre подвергали обратному скрещиванию с фоном C57BL/6. Мышей содержали в отдельном помещении, свободном от патогенов, с циклом 12-часовой свет/12-часовой темноты. Тамоксифен (1 мг) (Sigma-Aldrich, Сент-Луис, США) вводили внутрибрюшинно в течение 7 дней, чтобы вызвать кремопосредованную рекомбинацию у мышей Col1a1-creERT. В контрольных группах вводили кукурузное масло. Через семь дней после прекращения введения тамоксифена животных подвергали процедуре ТАС. Самцов мышей в возрасте 7–12 недель использовали для операции TAC. Операция TAC проводилась следующим образом: игла 27-го калибра помещалась рядом с дугой аорты, шов был прочно завязан два раза вокруг иглы 27-го размера и аорты, и игла была удалена 34 .
В6.129-Hif1a tm3Rsjo/J (HIF-1α flox/fox ) мыши, B6; )мыши Ifo/J (LysM-cre), мыши B6.Cg-Tg(Tek-cre)12Flv/J (Tie2-cre) и мыши B6.Cg-Tg(Col1a1-cre/ERT2)1Crm/J (Col1a1- creERT) были приобретены в лаборатории Джексона (Бар-Харбор, штат Мэн, США). Мышей HIF-1α flox/fox , LysM-Cre и Tie2-cre подвергали обратному скрещиванию с фоном C57BL/6. Мышей содержали в отдельном помещении, свободном от патогенов, с циклом 12-часовой свет/12-часовой темноты. Тамоксифен (1 мг) (Sigma-Aldrich, Сент-Луис, США) вводили внутрибрюшинно в течение 7 дней, чтобы вызвать кремопосредованную рекомбинацию у мышей Col1a1-creERT. В контрольных группах вводили кукурузное масло. Через семь дней после прекращения введения тамоксифена животных подвергали процедуре ТАС. Самцов мышей в возрасте 7–12 недель использовали для операции TAC. Операция TAC проводилась следующим образом: игла 27-го калибра помещалась рядом с дугой аорты, шов был прочно завязан два раза вокруг иглы 27-го размера и аорты, и игла была удалена 34 . Мышей с ложным оперированием подвергали той же процедуре, но без сужения. За мышами внимательно наблюдали и быстро усыпляли в гуманной конечной точке (отсутствие движений или потеря массы тела более 20% от исходной массы тела).
Мышей с ложным оперированием подвергали той же процедуре, но без сужения. За мышами внимательно наблюдали и быстро усыпляли в гуманной конечной точке (отсутствие движений или потеря массы тела более 20% от исходной массы тела).
Клетки, реагенты, рекомбинантные белки и антитела
Клетки линии мезенхимальных стволовых клеток C3h20T1/2 были приобретены в Американской коллекции типовых культур. Клетки C3h20T1/2 выращивали в среде DMEM (Dulbecco’s Modified Eagle Medium), содержащей 10% фетальной телячьей сыворотки (HyClone, GE Healthcare Japan, Tokyo, Japan) в инкубаторе при 37 °C (5% CO 2 ). TEPM собирали из брюшной полости через 4 дня после внутрибрюшинной инъекции 3% раствора тиогликолята (Fluka, Sigma-Aldrich, Сент-Луис, Миссури, США) с использованием самок мышей. TEPM выращивали в среде RPMI1640 (GIBCO, Life Technologies, Карлсбад, Калифорния, США), содержащей 10% фетальной бычьей сыворотки (HyClone), в инкубаторе при 37°C (5% CO 2 ). Взрослых самцов мышей в возрасте 6–8 недель использовали для выделения и культивирования сердечных фибробластов 44 . Два или три сердца желудочков были изолированы и быстро измельчены на мелкие кусочки. После инкубации при 37 °С в течение 30 минут с DMEM, содержащей либеразу TH (25 мкг на мл, Sigma-Aldrich) и эластазу (1,2 ед. на мл, Worthington Biochemical Corporation, Фрихолд, штат Нью-Джерси, США), клеточные суспензии осаждали и промывали. с ПБС(-). Все клеточные суспензии высевали на чашки с коллагеновым покрытием (Cosmo Bio, Токио, Япония) в среде DMEM с добавлением 10% эмбриональной бычьей сыворотки. После инкубации в течение ночи неприкрепившиеся клетки удаляли, а прикрепившиеся клетки культивировали. Для экспериментов использовали первичные фибробласты на пассаже 1 или 2.
Два или три сердца желудочков были изолированы и быстро измельчены на мелкие кусочки. После инкубации при 37 °С в течение 30 минут с DMEM, содержащей либеразу TH (25 мкг на мл, Sigma-Aldrich) и эластазу (1,2 ед. на мл, Worthington Biochemical Corporation, Фрихолд, штат Нью-Джерси, США), клеточные суспензии осаждали и промывали. с ПБС(-). Все клеточные суспензии высевали на чашки с коллагеновым покрытием (Cosmo Bio, Токио, Япония) в среде DMEM с добавлением 10% эмбриональной бычьей сыворотки. После инкубации в течение ночи неприкрепившиеся клетки удаляли, а прикрепившиеся клетки культивировали. Для экспериментов использовали первичные фибробласты на пассаже 1 или 2.
Рекомбинантный мышиный OSM (каталожный номер 495-MO-025), мышиный IL6 (каталожный номер 406-ML-005) и TGF-β1 человека (каталожный номер 240-B-010) были приобретены у R&D Systems. (Миннеаполис, Миннесота, США). Рекомбинантный мышиный CTGF (номер по каталогу RPA010MU01) был приобретен у Cloud-Clone Corp. (Katy, TX, USA). Рекомбинантный мышиный CXCL2 (каталожный номер 582502), мышиный LIF (каталожный номер 554002) и мышиный CXCL3 (каталожный номер 5
Рекомбинантный мышиный CXCL2 (каталожный номер 582502), мышиный LIF (каталожный номер 554002) и мышиный CXCL3 (каталожный номер 5
) были приобретены у Bio Legend (Сан-Диего, Калифорния, США). Все рекомбинантные белки, использованные в клеточной культуре, разводили в 0,5% растворе БСА (Sigma, № по каталогу A8806-1G).
APC-CD11b (M1/70) (разведение 1:1000, 17-0112-82; eBioscience, PE-F4/80 (BM8) (разведение 1:1000, 123110; BioLegend, FITC-Ly6C (HK1.4) (разведение 1:1000, 128006; BioLegend, Pacific Blue-Ly6G (1A8) (разведение 1:1000, 127612; BioLegend) использовали для анализа FACS. Мышиное антитело OSM (AF-495-NA; R&D) или нормальный козий IgG контроль (AB-108-C; R&D) использовали в качестве нейтрализующего антитела или контрольного IgG in vivo Человеческое антитело OSM (разведение 1:500, NBP1-87768; R&D) и мышиное антитело OSM (разведение 1:500, bs-5095р; BIS) использовали для окрашивания OSM в тканях сердца человека и мыши соответственно. Мышиное антитело к CD11b (разведение 1:2000, ab133357; Abcam, Кембридж, Великобритания) использовали для окрашивания CD11b в тканях сердца мышей.
Воздействие на клеточные культуры гипоксии (1% O 2 ) проводили на гипоксической рабочей станции In Vivo 2 500 (Ruskinn Technology, Бридженд, Великобритания). Бессывороточную культуральную среду TEPM заменяли через 12 часов после воздействия гипоксии. После этого TEPM подвергали гипоксии в течение 12 ч, а их супернатант собирали и использовали для анализа активации фибробластов.
Получение клодронатных липосом
Клодронатные липосомы получали следующим образом 45 . После растворения 8 мг холестерина в 10 мл хлороформа добавляли 0,86 мл раствора фосфатидилхолина (содержащего 86 мг фосфатидилхолина). Фазу хлороформа удаляли выпариванием с вращением в низком вакууме (1,257 × г ). Фосфолипидную пленку диспергировали в 10 мл водного раствора, содержащего 0,6 М клодроната, путем осторожного вращения при комнатной температуре. Молочно-белую суспензию выдерживали при комнатной температуре в течение 2 часов в атмосфере азота. Суспензию обрабатывали ультразвуком на водяной бане в течение 3 мин и выдерживали в течение ночи при 4°С. После центрифугирования (10 000 × г в течение 15 мин), раствор под белой полосой липосом удаляли пипеткой Пастера. Клодронатные липосомы трижды промывали стерилизованным PBS (центрифугирование при 25 000 × g в течение 30 мин). Наконец, осадок ресуспендировали в 4 мл стерилизованного PBS.
Суспензию обрабатывали ультразвуком на водяной бане в течение 3 мин и выдерживали в течение ночи при 4°С. После центрифугирования (10 000 × г в течение 15 мин), раствор под белой полосой липосом удаляли пипеткой Пастера. Клодронатные липосомы трижды промывали стерилизованным PBS (центрифугирование при 25 000 × g в течение 30 мин). Наконец, осадок ресуспендировали в 4 мл стерилизованного PBS.
Проточная цитометрия
Все проточные цитометрические анализы и сортировка проводились с использованием FACS aria II (BD) и программного обеспечения FlowJo (Tree Star). Для выделения клеток из сердец целое сердце разрезали на мелкие кусочки в среде DMEM (содержащей 10% фетальной бычьей сыворотки). Собранную ткань инкубировали в течение 2 часов с коллагеназой типа I (1 мг на мл, Worthington Biochemical Corporation) и эластазой (0,74 ед. на мл, Worthington Biochemical Corporation) в забуференном солевом растворе Хэнкса (HBSS). Суспензию пропускали через иглу 22-го калибра и промывали ледяным PBS(-), содержащим 5% фетальной бычьей сыворотки. После удаления любых эритроцитов с помощью BD PharmLyse (BD) образцы подвергали проточному цитометрическому анализу.
После удаления любых эритроцитов с помощью BD PharmLyse (BD) образцы подвергали проточному цитометрическому анализу.
Образцы сердца были получены через 45 мин. после внутрибрюшинного введения пимонидазола (Pimo, 60 мг на кг) (HPI, Берлингтон, Массачусетс, США). Внутриклеточное включение Pimo анализировали с помощью многоцветной FACS с конъюгированным с флуоресцеином (FITC) антителом против Pimo (разведение 1:1000, HPI)
Прижизненная визуализация гипоксических сигналов в сердце
Гипоксическое состояние визуализируется с помощью двухфотонной микроскопии и фосфоресценции зонд, LOX-1 (Scivax Life Sciences, Токио, Япония) 46 . Мышам под наркозом и на искусственной вентиляции легких вводили Hoechst 33342 (10 мг на кг, Invitrogen (Thermofisher), синий), меченый флуоресцеином лектин I Griffonia Simplicifolia (GSL I), изолектин B4 (зеленый, Vector Laboratories, FL-1201, 50 мкг для каждая мышь) и гипоксические зонды LOX-1 (100 мкг для каждой мыши, красный цвет). Изображение живого сердца выполняли с помощью двухфотонного микроскопа (Nikon-A1RMP, Nikon), фемтосекундных инфракрасных лазеров (Chameleon Vision-II, Coherent) и водно-иммерсионного объектива ×40 (NA1.15, Nikon). Интенсивность сигнала для LOX-1 автоматически определяли количественно и статистически анализировали с помощью программного обеспечения NIS-elements (Nikon).
Изображение живого сердца выполняли с помощью двухфотонного микроскопа (Nikon-A1RMP, Nikon), фемтосекундных инфракрасных лазеров (Chameleon Vision-II, Coherent) и водно-иммерсионного объектива ×40 (NA1.15, Nikon). Интенсивность сигнала для LOX-1 автоматически определяли количественно и статистически анализировали с помощью программного обеспечения NIS-elements (Nikon).
Выделение РНК и количественная ОТ-ПЦР
Для анализа экспрессии генов тотальную РНК очищали из культивируемых клеток с использованием наборов RNeasy (Qiagen, Токио, Япония) в соответствии с инструкциями производителя. Комплементарную ДНК синтезировали с использованием системы синтеза первой нити SuperScript III (Life Technologies). Количественный анализ ПЦР в реальном времени (ОТ-ПЦР) проводили с использованием системы LightCycler (Roche Diagnostic, Токио, Япония) с использованием 18S рРНК в качестве внутреннего контроля. Последовательности праймеров проанализированных генов мыши показаны в дополнительной таблице 1.
Вестерн-блоттинг
Клеточные экстракты разделяли на акриламидном наборе TGX FastCast, 7,5% (BIO RAD Laboratories Inc.), а затем переносили на мембрану PVDF (Millipore, Бедфорд, Массачусетс, США). После блокировки в 5% сухом молоке в трис-буферном солевом растворе с твином 20 (0,1%) (TBS-T) мембрану инкубировали с первичными антителами (1:1000) с последующей инкубацией со вторичными антителами, конъюгированными с пероксидазой хрена (1:1000). 2000). Детекцию проводили с помощью ECL Prime (GE Healthcare, Логан, Юта, США) в соответствии с инструкциями производителя. Использовали следующие антитела: SMAD2 (#5339, Cell Signaling Technology, Дэнверс, Массачусетс, США), Phospho-SMAD2 (Ser245/250/255) (#3104, Cell Signaling Technology, Дэнверс, Массачусетс, США), Phospho-SMAD2 (Ser465/467) (#3108, Cell Signaling Technology, Дэнверс, Массачусетс, США), Lamin A/C (#2032, Cell Signaling Technology, Дэнверс, Массачусетс, США), ERK (#4695, Cell Signaling Technology, Дэнверс, Массачусетс, США), Phospho-ERK (# 4370, Cell Signaling Technology, Дэнверс, Массачусетс, США), козий антикроличий IgG — HRP (#7074, Cell Signaling Technology, Дэнверс, Массачусетс, США). После воздействия С-концевым антителом фосфо ERK1/2 или фосфора SMAD2 та же самая мембрана подвергалась воздействию антитела против ERK или ламина А/С. Полные изображения изображений вестерн-блоттинга показаны на дополнительных рисунках. 22–24.
После воздействия С-концевым антителом фосфо ERK1/2 или фосфора SMAD2 та же самая мембрана подвергалась воздействию антитела против ERK или ламина А/С. Полные изображения изображений вестерн-блоттинга показаны на дополнительных рисунках. 22–24.
Анализ ChIP
TEPM сшивали в течение 10 мин 1% параформальдегидом. После нейтрализации с использованием 0,2 М раствора глицина TEPM собирали и суспендировали в буфере для лизиса SDS с полным коктейлем ингибиторов протеазы (1873580, Roche). Образцы подвергали фрагментации с использованием Sonifier (Branson, Dansbury, USA). Обработанные ультразвуком образцы подвергали иммунопреципитации с использованием антитела HIF-1α (NB100-134, Novus Biologicals). Образцы ChIP количественно определяли с помощью ОТ-ПЦР с использованием определенных пар праймеров (дополнительная таблица 1).
Анализ секвенирования РНК (RNA-seq)
TEPM были выделены из HIF-1α KO или cre-отрицательных контрольных однопометников. Мы подвергали TEPM воздействию гипоксии (1% O 2 ) или нормоксии и собирали общую РНК через 4 часа и 12 часов, а затем проводили анализ транскриптома (РНК-секвенция). Библиотеки одноконцевой РНК-секвенции готовили с использованием набора для подготовки образцов РНК TruSeq (Illumina, Сан-Диего, Калифорния). Секвенирование выполняли на Illumina Genome Analyzer IIx (Illumina, Сан-Диего, Калифорния, США). Чтения были выровнены по mm9геном мыши с использованием TopHat (версия 2.0.0). Генерация данных об экспрессии генов, процессы нормализации и аннотации генов были выполнены с использованием Genomatix Genome Analyzer (Genomatix, Мюнхен, Германия). Нормализованное значение экспрессии (NE-значение) рассчитывали следующим образом: количество прочтений на ген × 10 7 на количество картированных прочтений в длине генома × гена.
Библиотеки одноконцевой РНК-секвенции готовили с использованием набора для подготовки образцов РНК TruSeq (Illumina, Сан-Диего, Калифорния). Секвенирование выполняли на Illumina Genome Analyzer IIx (Illumina, Сан-Диего, Калифорния, США). Чтения были выровнены по mm9геном мыши с использованием TopHat (версия 2.0.0). Генерация данных об экспрессии генов, процессы нормализации и аннотации генов были выполнены с использованием Genomatix Genome Analyzer (Genomatix, Мюнхен, Германия). Нормализованное значение экспрессии (NE-значение) рассчитывали следующим образом: количество прочтений на ген × 10 7 на количество картированных прочтений в длине генома × гена.
Идентификация секреторных факторов, индуцируемых гипоксией
Для идентификации секреторных факторов, индуцируемых гипоксией, мы выполнили следующие процедуры. Первоначально мы отобрали гены со значением NE более 0,01 в любой момент времени (аналитические гены: 11 000 генов). Во-вторых, мы выбрали гены, максимальное значение NE-vale которых активировалось более чем в 2 раза при гипоксии (гены с активацией гипоксии: 866 генов). В-третьих, мы выбрали гены, в которых гипоксическая индукция их экспрессии отменена в HIF-1α KO TEPM (зависимые от HIF-1α гены: 614 генов)). Наконец, были выделены гены, которые имеют термины генной онтологии (GO) «активность цитокинов», «активность хемокинов» или «активность факторов роста» (http://www.geneontology.org/) (гипоксия-индуцируемые секреторные факторы: 11 генов). ).
В-третьих, мы выбрали гены, в которых гипоксическая индукция их экспрессии отменена в HIF-1α KO TEPM (зависимые от HIF-1α гены: 614 генов)). Наконец, были выделены гены, которые имеют термины генной онтологии (GO) «активность цитокинов», «активность хемокинов» или «активность факторов роста» (http://www.geneontology.org/) (гипоксия-индуцируемые секреторные факторы: 11 генов). ).
Гистологические исследования тканей сердца мыши и человека
От всех участников получено письменное информированное согласие. Протокол исследования был одобрен Этическим комитетом Института сердечно-сосудистых заболеваний (Токио, Япония) и строго соответствовал этическим нормам. Ткани сердца получали от пациентов с сердечной недостаточностью, перенесших операцию на сердце или эндомиокардиальную биопсию. Исключались пациенты с предшествующим инфарктом миокарда в анамнезе. В каждом образце проводили иммуногистохимию. Окрашивание трихромом по Массону и окрашивание Sirius Red/Fast Green проводили для расчета периваскулярной и интерстициальной фиброзной зоны.
Статистический анализ
Все данные представлены как средние с SD. Сравнение между двумя группами анализировали с помощью непарного двустороннего t -критерия с поправкой Уэлча. Различия между более чем двумя группами были проанализированы с использованием однофакторного или двустороннего дисперсионного анализа с последующим тестом множественных сравнений Даннетта или тестом множественных сравнений Сидака или тестом Крускала-Уоллиса. P — значения менее 0,05 считались статистически значимыми. Анализ Каплана-Мейера с последующим тестом длинного ранга использовали для анализа выживаемости мышей. Линейный регрессионный анализ был использован для корреляции между процентом площади фиброза и количеством OSM-позитивных клеток в тканях сердца. Все статистические анализы проводились с использованием Prism 6 для Windows (версия 6.07, GraphPad, Сан-Диего, Калифорния, США).
Доступность данных
Все данные, содержащиеся в рукописи, можно получить у соответствующего автора по обоснованному запросу. Данные секвенирования РНК перитонеальных макрофагов были депонированы в DDBJ BioProject под регистрационным номером DRA008230.
Данные секвенирования РНК перитонеальных макрофагов были депонированы в DDBJ BioProject под регистрационным номером DRA008230.
Ссылки
Гулати, А. и др. Ассоциация фиброза со смертностью и внезапной сердечной смертью у больных с неишемической дилатационной кардиомиопатией. JAMA 309 , 896–908 (2013).
КАС
Статья
Google ученый
Левин, Б., Калман, Дж., Майер, Л., Филлит, Х.М. и Пакер, М. Повышенные циркулирующие уровни фактора некроза опухоли при тяжелой хронической сердечной недостаточности. Н. англ. Дж. Мед. 323 , 236–241 (1990).
КАС
Статья
Google ученый
Wang, G.L., Jiang, B.H., Rue, E.A. & Semenza, G.L. Фактор 1, индуцируемый гипоксией, представляет собой гетеродимер основной спирали-петли-спирали-PAS, регулируемый клеточным напряжением O2. Проц. Натл акад. науч. США 92 , 5510–5514 (1995).
ОБЪЯВЛЕНИЕ
КАС
Статья
Google ученый
Семенца Г.Л. Гипоксия-индуцируемые факторы в физиологии и медицине. Cell 148 , 399–408 (2012).
КАС
Статья
Google ученый
Swirski, F.K. et al. Моноциты Ly-6Chi доминируют в ассоциированном с гиперхолестеринемией моноцитозе и дают макрофаги в атеромах. Дж. Клин. Инвестируйте 117 , 195–205 (2007).
КАС
Статья
Google ученый
Kretzschmar, M., Doody, J., Timokhin, I. & Massagué, J. Механизм подавления передачи сигналов TGFbeta/Smad онкогенным Ras. Гены Дев. 13 , 804–816 (1999).
КАС
Статья
Google ученый
Frangogiannis, N.G. et al. Критическая роль моноцитарного хемоаттрактантного белка-1/СС-хемокинового лиганда 2 в патогенезе ишемической кардиомиопатии. Тираж 115 , 584–592 (2007).
КАС
Статья
Google ученый
Ссылки на скачивание
Благодарности
Авторы благодарны Минори Фукумото и Норико Яманака за техническую помощь. Это исследование было поддержано грантом на научные исследования от Японского общества содействия науке (JSPS, Япония) (до N. T. 16K09).493, к Н.Т. Х.С. 18H02360, 18H04122, H.A. 17K15990, до MA 16K10900), Грант на научные исследования в инновационных областях (до NT 26111003) и JST PRESTO (до NT JPMJPR 14M4). Это исследование также было поддержано Японским обществом содействия развитию науки (JSPS) в рамках Программы финансирования ведущих мировых инновационных исследований и разработок в области науки и технологий (FIRST Program), инициированной Советом по научно-технической политике (CSTP). К.О. был поддержан Британским фондом сердца (RG/16/15/32294). Х.С. был поддержан Мемориальным фондом Уэхары.
T. 16K09).493, к Н.Т. Х.С. 18H02360, 18H04122, H.A. 17K15990, до MA 16K10900), Грант на научные исследования в инновационных областях (до NT 26111003) и JST PRESTO (до NT JPMJPR 14M4). Это исследование также было поддержано Японским обществом содействия развитию науки (JSPS) в рамках Программы финансирования ведущих мировых инновационных исследований и разработок в области науки и технологий (FIRST Program), инициированной Советом по научно-технической политике (CSTP). К.О. был поддержан Британским фондом сердца (RG/16/15/32294). Х.С. был поддержан Мемориальным фондом Уэхары.
Информация об авторе
Авторы и организации
Abulars 9000 9000 99999999999999999999999999999999999999999999999999999999999999999999999 999999999999999999999999999999999999999999999999999 . H. Норихико Такэда. Н.Т. получил грантовую поддержку от DAIICHI SANKYO COMPANY. LIMITED, Bayer Yakuhin, Ltd и Astra Zeneca K.K. Остальные авторы заявляют об отсутствии конкурирующих интересов. Информация о рецензировании: Nature Communications благодарит Мерри Линдси и других анонимных рецензентов за их вклад в рецензирование этой работы. Примечание издателя: Springer Nature остается нейтральной в отношении юрисдикционных претензий в опубликованных картах и институциональной принадлежности. также ищите этого автора в
также ищите этого автора в
PubMed Google Академия Contributions
 A., N.T. и Т.И. разработали исследование и участвовали во всех аспектах экспериментов при технической помощи М.А., М.Л.Н., Дж.В.-Х., К.С. и К.О. и написал рукопись. С.Н. выполнил анализ изображений гипоксии. М.С.М. выполнили РНК-секвенный анализ. К.К. и Ю.Н. участвовали в анализе методом проточной цитометрии. К.С., М.В., М.К. и Т.С. участвовали в исследованиях in vivo. Х.С., Ю.Х., Т.Ю. и И.М. разработали исследование и участвовали в гистологических исследованиях. Ю.Н., М.К. и RI измеряли потребление кислорода кардиомиоцитами. Т.И., Т.Ю. и К.М. провел репортерский анализ. Р.Н. и И.К. разработал исследования и руководил общим проектом.
A., N.T. и Т.И. разработали исследование и участвовали во всех аспектах экспериментов при технической помощи М.А., М.Л.Н., Дж.В.-Х., К.С. и К.О. и написал рукопись. С.Н. выполнил анализ изображений гипоксии. М.С.М. выполнили РНК-секвенный анализ. К.К. и Ю.Н. участвовали в анализе методом проточной цитометрии. К.С., М.В., М.К. и Т.С. участвовали в исследованиях in vivo. Х.С., Ю.Х., Т.Ю. и И.М. разработали исследование и участвовали в гистологических исследованиях. Ю.Н., М.К. и RI измеряли потребление кислорода кардиомиоцитами. Т.И., Т.Ю. и К.М. провел репортерский анализ. Р.Н. и И.К. разработал исследования и руководил общим проектом. Автор, ответственный за переписку
Декларации этики
Конкурирующие интересы
Дополнительная информация

Дополнительная информация
Дополнительная информация
Права и разрешения
Открытый доступ Эта статья находится под лицензией Creative Commons Attribution 4.0 International License, которая разрешает использование, совместное использование, адаптацию, распространение и воспроизведение на любом носителе или в любом формате. , при условии, что вы укажете первоначальных авторов и источник, предоставите ссылку на лицензию Creative Commons и укажите, были ли внесены изменения. Изображения или другие сторонние материалы в этой статье включены в лицензию Creative Commons для статьи, если иное не указано в кредитной строке материала. Если материал не включен в лицензию Creative Commons статьи, а ваше предполагаемое использование не разрешено законом или превышает разрешенное использование, вам необходимо получить разрешение непосредственно от правообладателя. Чтобы просмотреть копию этой лицензии, посетите http://creativecommons.org/licenses/by/4.0/.
Чтобы просмотреть копию этой лицензии, посетите http://creativecommons.org/licenses/by/4.0/.
Перепечатка и разрешения
Об этой статье
Эту статью цитирует
Комментарии
Отправляя комментарий, вы соглашаетесь соблюдать наши Условия и Правила сообщества.

