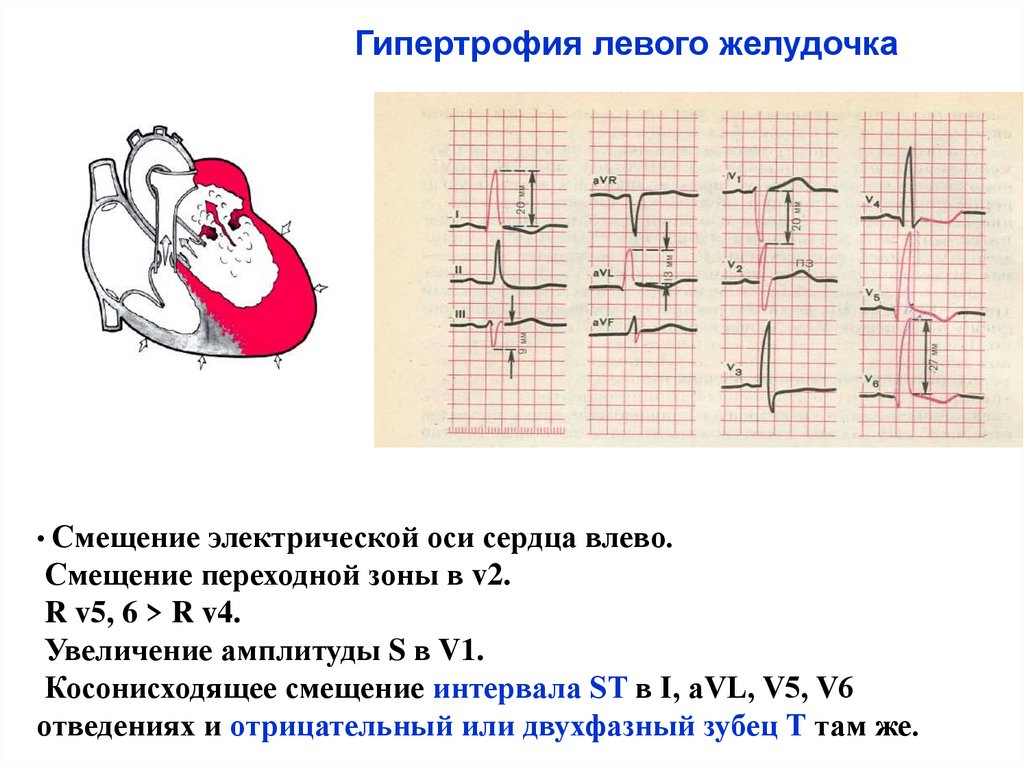
Гипертрофия плода: Гипотрофия | Симптомы | Диагностика | Лечение
Отделение фетальной хирургии | ЦПСиР
ЦПСиР, являясь ведущим акушерским стационаром города, в течение 20 лет оказывает специализированную помощь пациенткам с иммуноконфликтной беременностью.
В составе ЦПСиР имеется консультативно – диагностическое отделение, где ведут прием высококвалифицированные врачи акушеры — гинекологи, к которым из женских консультаций города Москвы, Московской области, а также различных регионов страны направляются беременные с резус-сенсибилизацией. У большинства из этих пациенток развивается гемолитическая болезнь плода (ГБП). Диагностика гемолитической болезни плода основывается на результатах комплексного обследования состояния матери и плода, которое включает изучение анамнеза, определение титра резус-антител, эхографию с фето-и и плацентометрию, исследование сердечной деятельности и биофизического профиля плода (БФПП), околоплодных вод, крови плода, полученной с помощью кордоцентеза. Тактика ведения беременности при иммунологической несовместимости крови матери и плода направлена на раннюю диагностику ГБП, выявление степени сенсибилизации, проведение лечебных мероприятий и определение оптимальных сроков родоразрешения.
Коноплянников Александр Георгиевич
Главный акушер — гинеколог города Москвы. Доктор медицинских наук, профессор кафедры акушерства и гинекологии РНИМУ им. Н.И. Пирогова, врач высшей категории
Кордоцентез
Обследование беременных с указанной акушерской патологией в ЦПСиР целесообразно начинать с 20 недель гестации. Однако, пациенткам с отягощенным акушерским анамнезом (антенатальной гибелью детей от гемолитической болезни, рождением детей с тяжелыми формами этого заболевания) необходимо обращаться в центр уже в 18 недель. Именно в этом сроке специалисты центра при ультразвуковом сканировании могут выявить первые признаки гемолитической болезни плода, своевременно поставить диагноз. Однако более точным методом выявления ГБП и определения ее тяжести является исследование крови плода, полученной путем кордоцентеза – пункции пуповины. Эта диагностическая манипуляция производится врачами ЦПСиР в дневном стационаре с 24 недель беременности. Показаниями к кордоцентезу являются наличие ультразвуковых маркеров ГБП, титр антител 1:16 и выше, отягощенный анамнез. Полученную кровь плода исследуют для определения группы крови и резус принадлежности, уровня гемоглобина и гематокрита, эритроцитов и билирубина, кислотно-щелочного равновесия. На основании полученных данных определяется дальнейшая тактика ведения беременности. При резус-отрицательной крови у плода дальнейшее наблюдение за беременной продолжается в амбулаторных условиях как за несенсибилизированной пациенткой и для ее родоразрешения не требуется госпитализация в специализированный стационар. При резус положительной крови плода и наличии данных, свидетельствующих и наличии ГБП, необходимо начинать патогенетическое лечение этого заболевания.
Показаниями к кордоцентезу являются наличие ультразвуковых маркеров ГБП, титр антител 1:16 и выше, отягощенный анамнез. Полученную кровь плода исследуют для определения группы крови и резус принадлежности, уровня гемоглобина и гематокрита, эритроцитов и билирубина, кислотно-щелочного равновесия. На основании полученных данных определяется дальнейшая тактика ведения беременности. При резус-отрицательной крови у плода дальнейшее наблюдение за беременной продолжается в амбулаторных условиях как за несенсибилизированной пациенткой и для ее родоразрешения не требуется госпитализация в специализированный стационар. При резус положительной крови плода и наличии данных, свидетельствующих и наличии ГБП, необходимо начинать патогенетическое лечение этого заболевания.
К сожалению, традиционные методы терапии этой патологии (десенсибилизирующая терапия, гемосорбция и плазмоферез, внутривенное введение растворов иммуноглобулинов) являются неэффективными, и их применение часто приводят к потери времени для проведения патогенетического лечения, развитию тяжелых некурабельных форм заболевания. В настоящее время единственным эффективным методом лечения тяжелых форм гемолитической болезни плода является операция внутриутробного переливания крови, которое с успехом в течение многих лет производят специалисты ЦПСиР. Для проведения этой операции беременную госпитализируют в отделение патологии центра. Целью данной манипуляции является повышение уровня гематокрита, снижение риска развития отечной формы ГБП, дальнейшее пролонгирование беременности на 2 -3 недели (время функционирования введенных эритроцитов). Показаниями к внутриутробному переливанию крови плоду является снижение в пуповинной крови показателей гемоглобина и гематокрита на 15% и более по сравнению с гестационной нормой. Нередко указанную манипуляцию проводят несколько раз на протяжении беременности. Необходимость повторных переливаний крови плоду определяется сроком беременности и уровнем посттрансфузионного гематокрита, поскольку при ГБП скорость снижения гематокрита составляет в среднем 1% в сутки. Внутриутробные переливания крови допустимо проводить до 32 недель беременности.
В настоящее время единственным эффективным методом лечения тяжелых форм гемолитической болезни плода является операция внутриутробного переливания крови, которое с успехом в течение многих лет производят специалисты ЦПСиР. Для проведения этой операции беременную госпитализируют в отделение патологии центра. Целью данной манипуляции является повышение уровня гематокрита, снижение риска развития отечной формы ГБП, дальнейшее пролонгирование беременности на 2 -3 недели (время функционирования введенных эритроцитов). Показаниями к внутриутробному переливанию крови плоду является снижение в пуповинной крови показателей гемоглобина и гематокрита на 15% и более по сравнению с гестационной нормой. Нередко указанную манипуляцию проводят несколько раз на протяжении беременности. Необходимость повторных переливаний крови плоду определяется сроком беременности и уровнем посттрансфузионного гематокрита, поскольку при ГБП скорость снижения гематокрита составляет в среднем 1% в сутки. Внутриутробные переливания крови допустимо проводить до 32 недель беременности. После этого срока решается вопрос о досрочном родоразрешении.
После этого срока решается вопрос о досрочном родоразрешении.
В ЦПСиР накоплен большой опыт проведения данной операций: ежегодно в центре проводится от 70 до 80 внутриутробных переливаний крови. Этот метод лечения гемолитической болезни является уникальным и в городе Москве производится только специалистами ЦПСиР.
Преждевременные роды – это проблема, которая часто сопровождает иммуноконфликтную беременность. В структуре ЦПСиР важное место занимает детская реанимация, располагающая возможностью выхаживать не только детей с эсктримально низкой массой тела, но и недоношенных детей с тяжелыми формами гемолитической болезни новорожденных. Эти дети получают комплексное лечение ГБ, включающее гематрансфузию в условиях операционной сразу после проведенной их матерям операции кесарева сечения, далее заменное переливания крови в условиях детской реанимации, а также инфузионную и фототерапию.
Алгоритм обследования и лечения пациенток и резус сенсибилизацией, разработанный и внедренный в ЦПСиР, позволил снизить перинатальные потери в 1,5 раза, сократить число преждевременно родившихся детей, количество детей с тяжелыми формами гемолитической болезни, уменьшить частоту и кратность применения заменного переливания крови у новорожденных с ГБ, а также позволил добиться рождения здоровых детей с пациенток с большим количеством перинатальных потерей, обусловленных резус сенсибилизацией и ГБ.
Однако проблема резус сенсибилизации до настоящего времени не является решенной. Врачи консультативно – диагностического отделения ЦПСиР ежедневно принимают новых пациенток, страдающих этой акушерской патологией. Это связано с отсутствием проведения профилактических мероприятий в других лечебных учреждениях, несмотря на то, что меры профилактики всем известны и давно внедрены в практику лечебной работы ЦПСиР.
В ЦПСиР всем пациенткам с резус отрицательной кровью и отсутствием резус-антител в сыворотке крови при сроке гестации 28 недель, при угрозе прерывания беременности, сопровождающейся кровяными выделениями из половых путей, независимо от срока гестации, после инвазивных процедур (биопсия хориона, амниоцентеза, кордоцентеза), самопроизвольного или искусственного прерывания беременности, внематочной беременности, а также после родов резус положительным плодом, вводят антирезус иммуноглобулин.
Бугеренко Андрей Евгеньевич
Кандидат медицинских наук. Доцент кафедры акушерства и гинекологии факультета фундаментальной медицины МГУ
Доцент кафедры акушерства и гинекологии факультета фундаментальной медицины МГУ
Cиндром фето-фетальной трансфузии
Желанная беременность – радость для будущих родителей. Беременность двойней – двойная радость. Но для акушера это даже не двойные проблемы, а проблемы в квадрате. Особенно это касается монохориальной двойни. Хотя частота таких беременностей невелика, зато помимо проблем, присущих многоплодной беременности как таковой, имеются серьезные осложнения, присущие исключительно монохориальному типу плацентации.
Одним из таких тяжелых осложнений монохориальной двойни является синдром фето-фетальной трансфузии (СФФТ). Возникновение этого осложнения, как правило, заканчивается гибелью обоих плодов до сроков, в которых возможно выхаживание преждевременно родившихся детей.
Cиндром фето-фетальной трансфузии, известный также как фето-фетальный трансфузионный синдром ( twin-to-twin transfusion syndrome, TTTS) возникает в связи с наличием сосудистых плацентарных анастомозов, соединяющих кровеносные системы плодов между собой. Частота возникновения СФФТ по данным разных авторов колеблется от 5 до 25% от числа беременностей с монохориальным типом плацентации. Дисбаланс обмена крови по анастомозам приводит к оттоку крови от одного близнеца (донора) к другому (реципиенту). Это тяжелая патология, при которой вероятность интранатальной гибели плодов достигает 80-100%.
Частота возникновения СФФТ по данным разных авторов колеблется от 5 до 25% от числа беременностей с монохориальным типом плацентации. Дисбаланс обмена крови по анастомозам приводит к оттоку крови от одного близнеца (донора) к другому (реципиенту). Это тяжелая патология, при которой вероятность интранатальной гибели плодов достигает 80-100%.
СФФТ впервые в 1882 году описал немецкий акушер Friedrich Schatz. Но несмотря на такую длительную историю, для подавляющего большинства врачей поликлинического звена здравоохранения как диагностика, так и тактика ведения пациенток с проявлениями СФФТ является «terra incognita», что приводит в результате к неблагоприятному завершению беременности.
Кратко о патогенезе развития СФФТ:
Дисбаланс обмена крови по анастомозам приводит к оттоку крови от одного близнеца (донора) к другому (реципиенту). У близнеца-донора развивается гипоксия (вследствие недостаточности плацентарного кровообращения), гиповолемия со снижением артериального давления. Вследствие этих факторов задерживается внутриутробное развитие, снижается объем околоплодных вод, и часто развивается выраженная анемия с уровнем гемоглобина менее 80 г/л. Наиболее частым следствием тяжелой антенатальной гипоксии является формирование, так называемой, скрытой сердечной недостаточности, когда показатели ударного и минутного объемов кровообращения существенно не меняются, но ряд индексов диастолической функции свидетельствуют о поражении миокарда плода. Плод-реципиент, напротив, получает слишком много крови, у него развивается гиперволемия, что увеличивает пред- и постнагрузку на сердце, это может привести в дальнейшем к сердечной недостаточности. В условиях гиперволемии у плода-реципиента появляются отёки, повышается артериальное давление, развивается гипертрофия миокарда. Организм плода в ответ на увеличение объема циркулирующей крови (ОЦК) выделяет избыточное количество воды через органы мочевыводящей системы, что приводит к выраженному многоводию. Из-за высокого содержания в крови эритроцитов появляется высокий риск развития тромбозов.
Вследствие этих факторов задерживается внутриутробное развитие, снижается объем околоплодных вод, и часто развивается выраженная анемия с уровнем гемоглобина менее 80 г/л. Наиболее частым следствием тяжелой антенатальной гипоксии является формирование, так называемой, скрытой сердечной недостаточности, когда показатели ударного и минутного объемов кровообращения существенно не меняются, но ряд индексов диастолической функции свидетельствуют о поражении миокарда плода. Плод-реципиент, напротив, получает слишком много крови, у него развивается гиперволемия, что увеличивает пред- и постнагрузку на сердце, это может привести в дальнейшем к сердечной недостаточности. В условиях гиперволемии у плода-реципиента появляются отёки, повышается артериальное давление, развивается гипертрофия миокарда. Организм плода в ответ на увеличение объема циркулирующей крови (ОЦК) выделяет избыточное количество воды через органы мочевыводящей системы, что приводит к выраженному многоводию. Из-за высокого содержания в крови эритроцитов появляется высокий риск развития тромбозов.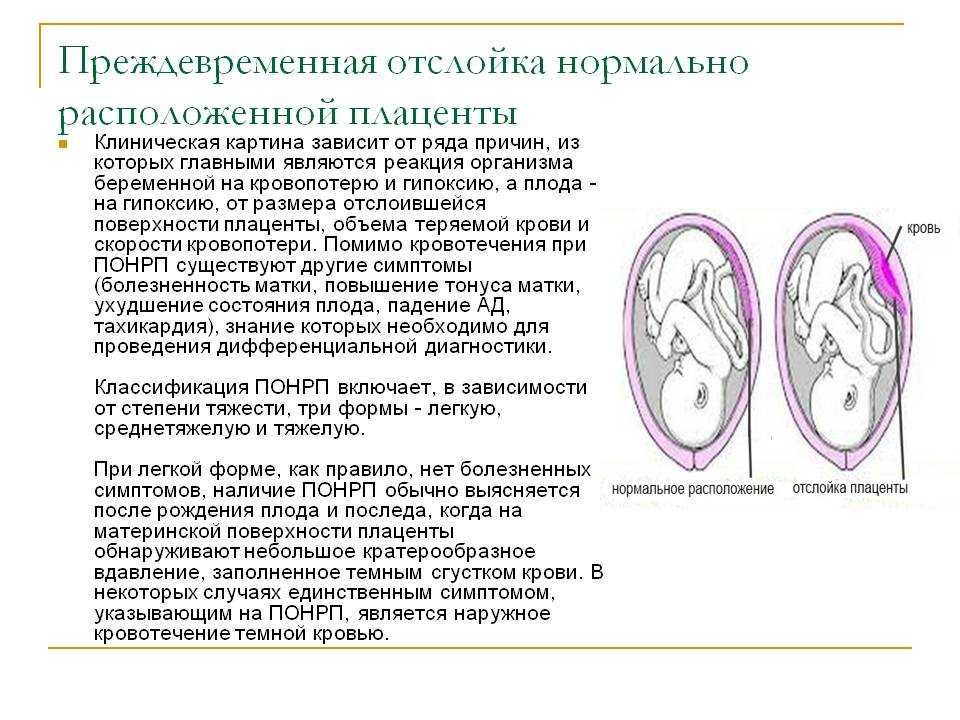 Полицитемия у близнеца-реципиента обуславливает повышенный гематокрит, составляющий 60% и более или уровень гемоглобина выше 220 г/л в любой момент на первой неделе жизни новорожденного. Близнецу с полицитемией угрожают расстройства дыхания, сердечной деятельности, поражение центральной нервной системы.
Полицитемия у близнеца-реципиента обуславливает повышенный гематокрит, составляющий 60% и более или уровень гемоглобина выше 220 г/л в любой момент на первой неделе жизни новорожденного. Близнецу с полицитемией угрожают расстройства дыхания, сердечной деятельности, поражение центральной нервной системы.
При внутриутробной гибели одного плода при СФФТ с вероятностью 25% существует риск развития осложнений другого плода. Подобные осложнения в виде некрозов головного мозга и паренхиматозных органов считаются следствием острой ишемии и гипотензии, возникающими из-за шунтирования крови от живого плода умирающему. Перинатальная смертность плода-реципиента после смерти плода-донора составляет около 50% при сроке беременности до 34.
Для своевременной диагностики СФФТ необходимо прежде всего правильно определить тип плацентации на ранних сроках беременности, когда это не представляет трудности. Наличие Т-признака (в отличие от λ-признака при бихориальной беременности) является поводом для пристального УЗ-мониторирования данной беременности в сроки манифестации СФФТ (с 14 недель). Характерными ультразвуковыми признаками развития СФФТ являются: нарастающее многоводие в амниотической полости реципиента, определяющееся как вертикальный размер наибольшего водного кармана от 8 см и более до 20 недель гестации, и превышающий 10 см с 20 по 26 неделю; для донора характерно олигоурическое маловодие или агидрамнион и отсутствие эхо-тени мочевого пузыря. Могут возникнуть трудности в дифференциальной диагностике СФФТ с другим серьезным осложнением монохориальной двойни — синдромом изолированной задержки роста плода (иЗРП), но это уже является прерогативой специализированного акушерско-гинекологического стационара.
Характерными ультразвуковыми признаками развития СФФТ являются: нарастающее многоводие в амниотической полости реципиента, определяющееся как вертикальный размер наибольшего водного кармана от 8 см и более до 20 недель гестации, и превышающий 10 см с 20 по 26 неделю; для донора характерно олигоурическое маловодие или агидрамнион и отсутствие эхо-тени мочевого пузыря. Могут возникнуть трудности в дифференциальной диагностике СФФТ с другим серьезным осложнением монохориальной двойни — синдромом изолированной задержки роста плода (иЗРП), но это уже является прерогативой специализированного акушерско-гинекологического стационара.
Единственным патогенетически оправданным методом лечения СФФТ является фетоскопическая лазерная коагуляция анастомозов (ФЛКА). Методика заключается в фетоскопическом (через оптическую систему малого диаметра) трансабдоминальном введении лазерного световода в амниотическую полость плода-реципиента под контролем УЗИ. Эндоскопическая лазерная коагуляция позволяет осуществлять обследование плаценты вдоль всей межплодовой перегородки, выявить и произвести коагуляцию анастомозирующих сосудов. Таким образом, поступление крови от одного близнеца другому прекращается, баланс поступления крови к обоим плодам восстанавливается, и близнецы в дальнейшем развиваются нормально. Операция заканчивается дренированием околоплодных вод до нормализации их количества. Эффективность эндоскопической лазеркоагуляционной терапии СФФТ (рождение хотя бы одного живого ребёнка) составляет от 80 до 90 %, возможно пролонгирование беременности в среднем на 10-12 недель, что приводит к снижению внутриутробной гибели плодов.
Таким образом, поступление крови от одного близнеца другому прекращается, баланс поступления крови к обоим плодам восстанавливается, и близнецы в дальнейшем развиваются нормально. Операция заканчивается дренированием околоплодных вод до нормализации их количества. Эффективность эндоскопической лазеркоагуляционной терапии СФФТ (рождение хотя бы одного живого ребёнка) составляет от 80 до 90 %, возможно пролонгирование беременности в среднем на 10-12 недель, что приводит к снижению внутриутробной гибели плодов.
В Центре планирования семьи и репродукции ДЗ Москвы фетоскопические операции проводятся с 2005 года, на данный момент выполнено более 100 вмешательств. Наличие специального оборудования позволяет проводить ФЛКА в сроки беременности от 15 до 25 недель при стадии ФФТС вплоть до 4.
Вмешательство мы проводим под регионарной анестезией. Тщательно осматриваются плоды, амниотическая перегородка и особенно пересекающие её сосуды на плодовой поверхности плаценты. Такие сосуды прослеживаются до их концевых ветвей, которые, собственно, и могут соединятся с аналогичными ветвями со стороны второго плода. Оценивается не только количество, но и характер, а самое главное – диаметр анастомозов. Это очень важно для правильного порядка коагуляции. Сначала «перекрывается» кровоток в крупных артерио-венозных и артерио-артериальных анастомозах. Затем – коагулируются более мелкие и мельчайшие анастомозы. За время операции по ним часть крови возвращается к донору, улучшая его прогноз.
Оценивается не только количество, но и характер, а самое главное – диаметр анастомозов. Это очень важно для правильного порядка коагуляции. Сначала «перекрывается» кровоток в крупных артерио-венозных и артерио-артериальных анастомозах. Затем – коагулируются более мелкие и мельчайшие анастомозы. За время операции по ним часть крови возвращается к донору, улучшая его прогноз.
Важно выявить и коагулировать абсолютно все анастомозы, даже самые маленькие, иначе при прогрессировании беременности их диаметр увеличится и к 28-30 неделям беременности может произойти рецидив фетофетального синдрома.
При правильно и без осложнений выполненной лазерной коагуляции анастомозов прогноз благоприятный у подавляющего количества пациенток. В настоящее время эффективность наших фетоскопических операций аналогична данным мировой литературы (благоприятный исход беременности в 80-85% наблюдений).
Абдоминальная декомпрессия
В нашей женской консультации проводится абдоминальная декомпрессия.
Абдоминальная декомпрессия – это физиотерапевтическая процедура, выполняемая путем лечебного воздействия пониженным (отрицательным) давлением воздуха на нижнюю часть тела.
Процедуры абдоминальной декомпрессии применяются для лечения угрозы прерывания беременности, вызванных беременностью отеков и гипертензии; гипотрофии и гипоксии плода, воспалительных заболеваний внутренних половых органов, дисменореи, инфантилизма, бесплодия, с одновременной профилактикой варикозного расширения вен нижних конечностей.
Абдоминальная декомпрессия позволяет:
Преимущество, перед традиционными методами лечения:
Важный фактор локальной декомпрессии – усиление транспорта кислорода и метаболитов, обеспечивающее нормализацию функции плаценты и снятие гипоксии плода.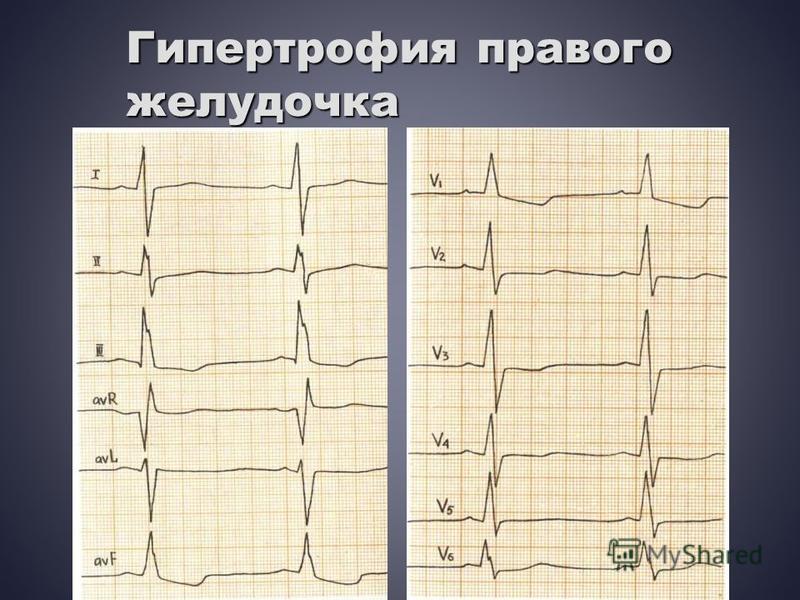 При этом изменение объемного кровотока в органах брюшной полости снимает сосудистый спазм, обусловленный гипертензией. Лечебный эффект достигается также в результате улучшения кровоснабжения почек.
При этом изменение объемного кровотока в органах брюшной полости снимает сосудистый спазм, обусловленный гипертензией. Лечебный эффект достигается также в результате улучшения кровоснабжения почек.
Лечащий врач акушер-гинеколог осмотрит Вас, определит показания и противопоказания к проведению абдоминальной декомпрессии.
Показания для лечения методом абдоминальной декомпрессии:
Противопоказания:

Процедура проводится следующим образом. Женщину помещают горизонтально в специальный аппарат, напоминающий герметичную куполообразную камеру таким образом, что в камере находится нижняя часть туловища до уровня груди. Верхняя часть тела и голова удобно располагаются на кушетке. Посредством контроля специально разработанной компьютерной программы, внутри камеры создается отрицательное, пульсирующее давление. Врач индивидуально подбирает комплекс всех необходимых показателей для достижения оптимального эффекта от процедуры. Время проведения процедуры составляет 20-30 минут.
Направление для проведения абдоминальной декомпрессии дает участковый врач акушер-гинеколог женской консультации или лечащий врач в отделении патологии беременности. Дату и время процедуры Вам назначит врач, проводящий абдоминальную декомпрессию.
Абдоминальная декомпрессия проводится в женской консультации, в кабинете №16
(2 этаж) ежедневно кроме субботы и воскресения.
Время проведения процедуры: с 10 часов до 14 часов.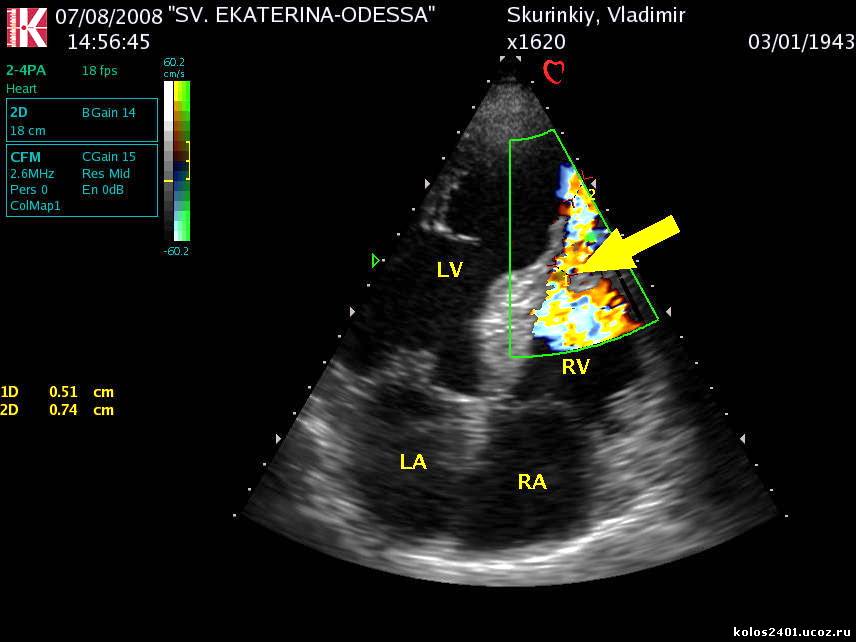
При себе необходимо иметь направление от врача, сменную обувь, хлопчатобумажные носочки и брюки.
Внутриутробное лечение плода с семейной гипертрофической кардиомиопатией, вторичной по отношению к мутации MYH7
Pediatr Cardiol. 2015 г.; 36 (8): 1774–1777.
Опубликовано онлайн 2015 сентябрь 4. DOI: 10.1007/S00246-015-1250-1
, MBBS, , MD, , MD, , RDMS, , BS RDMS, , MD, и RDMS, , BS RDMS, , MD, и RDMS, BS RDMS, , MD, и RDMS, BS RDMS, , MD, и RDMS, BS RDMS, , MD, , MD
Информация об авторе Примечания к статье Информация об авторских правах и лицензиях Заявление об ограничении ответственности
Нет четкого консенсуса в отношении оптимального ведения плодов, пораженных семейной гипертрофической кардиомиопатией (ГКМП). Внутриутробное лечение этого состояния каким-либо стандартизированным способом не предпринималось. Мы сообщаем о случае плода, получавшего лечение пропранололом матери в третьем триместре после того, как на эхокардиограмме плода была диагностирована гипертрофия перегородки и диастолическая дисфункция. Беременность протекала успешно, и до родов было отмечено уменьшение гипертрофии перегородки плода.
Мы сообщаем о случае плода, получавшего лечение пропранололом матери в третьем триместре после того, как на эхокардиограмме плода была диагностирована гипертрофия перегородки и диастолическая дисфункция. Беременность протекала успешно, и до родов было отмечено уменьшение гипертрофии перегородки плода.
Ключевые слова: Гипертрофическая кардиомиопатия плода, мутация бета-миозина, пропранолол, эхокардиография плода недели после родов. В редких случаях ГКМП плода может быть вторичной по отношению к семейной генетической мутации, в классическом случае мутации одного из сократительных белков сердечного саркомера. В этой ситуации состояние может иметь серьезные долгосрочные клинические последствия [5].
Мы сообщаем о внутриутробном течении и ведении девочки, родившейся от 30-летней матери с G6P2, которая первоначально обратилась за дородовой помощью на 7 неделе беременности. В анамнезе матери не было сахарного диабета, и скрининг гестационного диабета, проведенный во время беременности, был нормальным.
Семейный анамнез
Отец ребенка и два старших брата являются носителями семейной мутации тяжелой цепи β-миозина — MYH7 Lys657Gln (K657Q), приводящей к ГКМП. У отца в детстве была диагностирована ГКМП, и в возрасте 33 лет ему была проведена трансплантация сердца. У двух братьев ГКМП была диагностирована в новорожденном после нормальных эхокардиограмм плода без признаков ГКМП плода. Их начальная перегородка Z — баллы в 1-дневном возрасте были +3,7 (самый старший) и +3,0 (второй брат). Они оба начали принимать пропранолол в неонатальном возрасте и с тех пор поддерживали дозу 3 мг/кг/день, разделенную на три ежедневных дозы. У обоих мальчиков отмечено уменьшение утолщения перегородки с нормализацией септальных Z -баллов к 9 мес.
Внутриутробно/фетальный анамнез
На 30 недель беременности подозревается ГКМП плода. В это время эхокардиограмма плода выявила легкое утолщение межжелудочковой перегородки в диастолу (4,7 мм; норма 2,5–9 мм).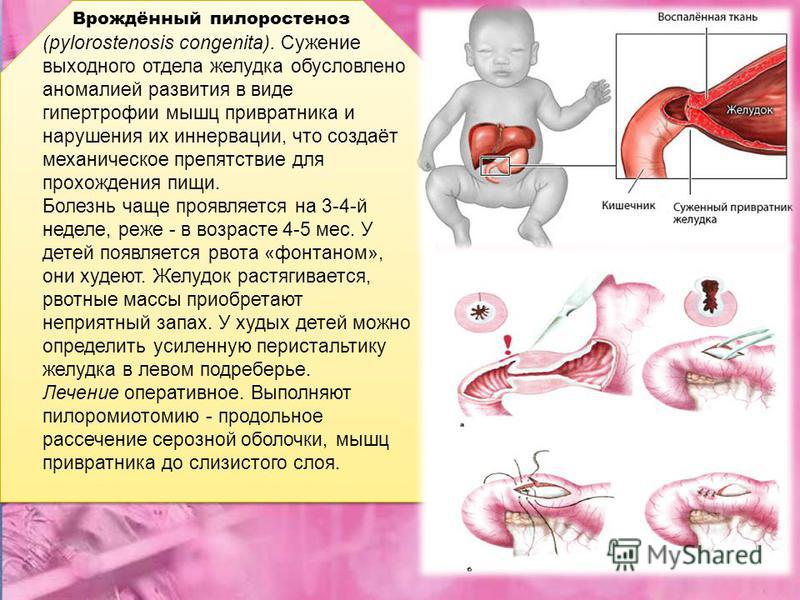 7,5% = 1,8–3,6 мм) [3]. Повторная эхокардиография плода в течение следующих нескольких недель выявила прогрессирующее утолщение перегородки с максимальным размером перегородки на 35-й неделе беременности 8,8 мм ( Z -балл + 11,3; норма = 2,3–4,2 мм) [3] (рис. ). Аномальная форма волны венозного протока также была отмечена на 35 неделе беременности со снижением поздней диастолической скорости во время а-волны 15 см/сек (нормальный диапазон в 35 недель примерно 30-60 см/сек) [4]. (Инжир. ). Мы решили начать внутриутробное лечение на основании двух факторов: (1) диастолической дисфункции плода и (2) семейного анамнеза улучшения утолщения перегородки (потенциально связанного с лечением бета-блокаторами), отмеченного у двух предыдущих детей с ГКМП. Поэтому было начато введение матери пропранолола (10 мг перорально три раза в день). В течение следующих нескольких недель повторные эхокардиограммы плода выявили уменьшение толщины перегородки: 7,8 мм на 37 неделе беременности и 7,6 мм на 38 неделе.
7,5% = 1,8–3,6 мм) [3]. Повторная эхокардиография плода в течение следующих нескольких недель выявила прогрессирующее утолщение перегородки с максимальным размером перегородки на 35-й неделе беременности 8,8 мм ( Z -балл + 11,3; норма = 2,3–4,2 мм) [3] (рис. ). Аномальная форма волны венозного протока также была отмечена на 35 неделе беременности со снижением поздней диастолической скорости во время а-волны 15 см/сек (нормальный диапазон в 35 недель примерно 30-60 см/сек) [4]. (Инжир. ). Мы решили начать внутриутробное лечение на основании двух факторов: (1) диастолической дисфункции плода и (2) семейного анамнеза улучшения утолщения перегородки (потенциально связанного с лечением бета-блокаторами), отмеченного у двух предыдущих детей с ГКМП. Поэтому было начато введение матери пропранолола (10 мг перорально три раза в день). В течение следующих нескольких недель повторные эхокардиограммы плода выявили уменьшение толщины перегородки: 7,8 мм на 37 неделе беременности и 7,6 мм на 38 неделе. Однако форма волны венозного протока существенно не изменилась и осталась ненормальной.
Однако форма волны венозного протока существенно не изменилась и осталась ненормальной.
Открыть в отдельном окне
Эхокардиограмма плода на 35-й неделе предполагаемого гестационного возраста — межжелудочковая перегородка в диастоле — размером 8,8 мм ( Z — оценка +11,3)
Открыть в отдельном окне — неделя предполагаемого гестационного возраста, демонстрирующая аномальную форму волны со сниженной скоростью в диастолу. Эти результаты согласуются с диастолической дисфункцией плода.
История рождения/неонатальный анамнез
Девочка была рождена путем повторного кесарева сечения в возрасте 39 лет.недели и весил 3470 г, длина 49 см и имел оценку по шкале Апгар 9 и 9. Начальная эхокардиограмма в первый день жизни показала размер диастолической перегородки 7,9 мм ( Z — оценка +3,35). Также был отмечен небольшой мышечный ДМЖП. Она чувствовала себя хорошо, была начата терапия пропранололом и выписана домой на третий день жизни. Она продолжала принимать пропранолол (3 мг/кг/день в три приема в день), и, как и у ее братьев, гипертрофия перегородки регрессировала, и теперь размеры перегородки нормальные (таблица ; рис. ). Генетическое тестирование подтвердило, что она имеет ту же мутацию тяжелой цепи β-миозина — MYH7 Lys657Gln (K657Q), что и ее отец и братья.
). Генетическое тестирование подтвердило, что она имеет ту же мутацию тяжелой цепи β-миозина — MYH7 Lys657Gln (K657Q), что и ее отец и братья.
Таблица 1
Изменение толщины межжелудочковой перегородки в диастолу (IVSd) при лечении пропранололом для индексного случая. Оценка IVSd Z была рассчитана с использованием базы данных Детройта на сайте www.parameterz.com. Fetal Z -scores were calculated from 2.5th to 97.5th percentiles in [3]
| 35 weeks GA | 1 day | 1–2 weeks | 3–7 weeks | 3 months | 5 месяцев | 7–8 месяцев | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Исходное значение | Z -оценка | Исходное значение | Z -оценка | Исходное значение | Z -оценка | Исходное значение | Z -оценка | Исходное значение | Z -оценка | Исходное значение | Z -оценка | Исходное значение | Z -счет | |
| BG | ||||||||||||||
| IVSd (мм) | 8./90.jpg) 8 8 | 11.5 | 7.9 | 3.75 | 7.5 | 3.32 | 8.2 | 3.66 | 7.0 | 2.63 | 4.0 | -0.21 | 5.4 | 1.06 |
Open в отдельном окне
Открыть в отдельном окне
На этом рисунке показано изменение показателей IVSd Z индексного случая с течением времени при лечении пропранололом. Также показана оценка IVSd Z для индексного случая на 35-й неделе гестационного возраста (ГВ)
Гипертрофическая кардиомиопатия является наиболее распространенным семейным заболеванием сердца, встречающимся примерно у 1/500 молодых людей [6]. Гипертрофическая кардиомиопатия наследуется по аутосомно-доминантному типу и имеет серьезные клинические последствия, включая риск внезапной сердечной смерти. Распространенность и клиническое значение ГКМП плода неизвестны. При ГКМП систолическая функция желудочков обычно гипердинамическая, но релаксация желудочков нарушена. Повышенное диастолическое давление наполнения желудочков может уменьшить приток пупочной вены и венозного протока к сердцу плода и связано с повышенным центральным венозным давлением плода, что может привести к выпотам, асциту и гибели плода [9].]. Диастолическая дисфункция плода была связана с неблагоприятными исходами, включая водянку плода [5, 9]. Мы наблюдали случай семейной ГКМП плода с диастолической дисфункцией, о чем свидетельствует аномальная форма волны венозного протока. В связи с риском водянки и предыдущим семейным анамнезом положительного ответа на бета-блокаторы мы выбрали лечение материнским пропранололом.
Гипертрофическая кардиомиопатия наследуется по аутосомно-доминантному типу и имеет серьезные клинические последствия, включая риск внезапной сердечной смерти. Распространенность и клиническое значение ГКМП плода неизвестны. При ГКМП систолическая функция желудочков обычно гипердинамическая, но релаксация желудочков нарушена. Повышенное диастолическое давление наполнения желудочков может уменьшить приток пупочной вены и венозного протока к сердцу плода и связано с повышенным центральным венозным давлением плода, что может привести к выпотам, асциту и гибели плода [9].]. Диастолическая дисфункция плода была связана с неблагоприятными исходами, включая водянку плода [5, 9]. Мы наблюдали случай семейной ГКМП плода с диастолической дисфункцией, о чем свидетельствует аномальная форма волны венозного протока. В связи с риском водянки и предыдущим семейным анамнезом положительного ответа на бета-блокаторы мы выбрали лечение материнским пропранололом.
Лечение бета-блокаторами рекомендуется при лечении детей и взрослых с симптоматической ГКМП [2], но никаких рекомендаций или предыдущих отчетов по лечению ГКМП плода не публиковалось. Бета-адреноблокаторы снижают частоту сердечных сокращений, уменьшают расход миокарда и оказывают отрицательное инотропное действие. Показано, что бета-блокаторы улучшают эхокардиографические параметры диастолической функции ЛЖ [1]. Лечение бета-адреноблокаторами у бессимптомных пациентов с ГКМП не установлено; тем не менее, мы выбрали лечение, вторичное по отношению к наблюдаемым аномальным параметрам диастолической функции плода и риску водянки/гибели плода.
Бета-адреноблокаторы снижают частоту сердечных сокращений, уменьшают расход миокарда и оказывают отрицательное инотропное действие. Показано, что бета-блокаторы улучшают эхокардиографические параметры диастолической функции ЛЖ [1]. Лечение бета-адреноблокаторами у бессимптомных пациентов с ГКМП не установлено; тем не менее, мы выбрали лечение, вторичное по отношению к наблюдаемым аномальным параметрам диастолической функции плода и риску водянки/гибели плода.
Хотя специфический ответ на лечение бета-блокаторами в настоящее время не является задокументированным признаком ГКМП MYH7, лечение бета-блокаторами ГКМП у детей было связано с уменьшением гипертрофии сердца и улучшением выживаемости [8]. Было высказано предположение, что быстрый рост сердца в детстве может предоставить благоприятную возможность для медикаментозного лечения ГКМП [8]. Это также может относиться к быстро растущему сердцу плода.
Применение бета-блокаторов во время беременности не лишено опасений. Бета-блокаторы относятся к категории C FDA из-за зарегистрированных рисков внутриутробного воздействия, что приводит к задержке роста плода, порокам сердца, брадикардии плода и новорожденного, гипогликемии новорожденного и угнетению дыхания новорожденного.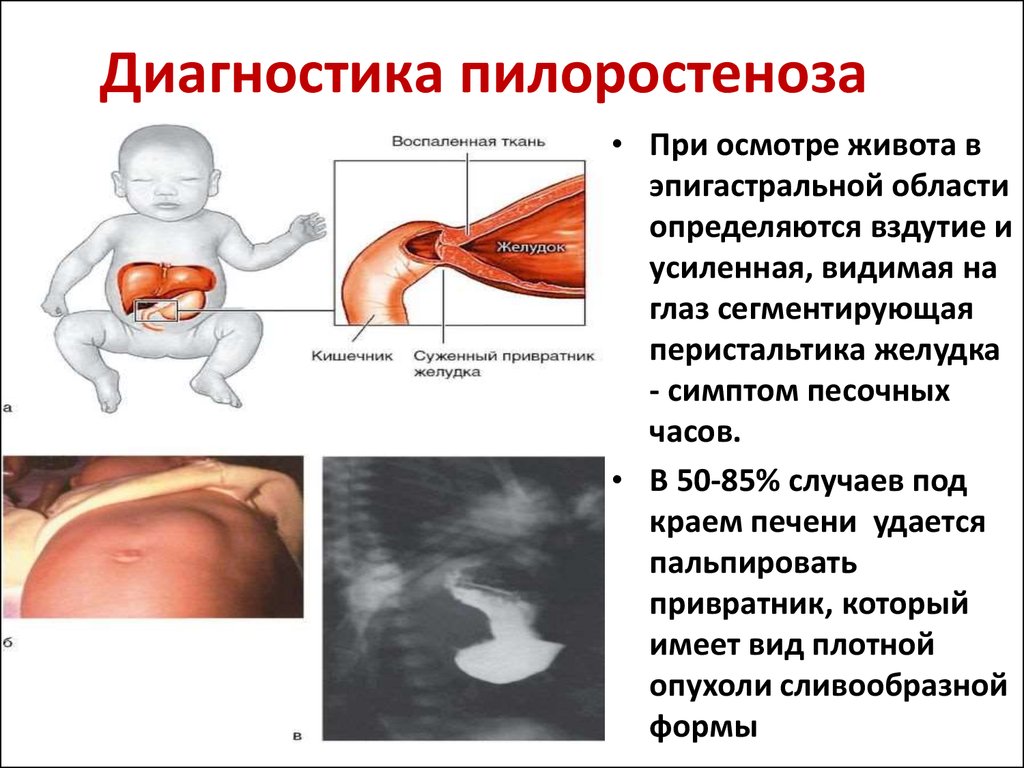 К счастью, мы не наблюдали ни одного из этих осложнений у плода или новорожденного.
К счастью, мы не наблюдали ни одного из этих осложнений у плода или новорожденного.
Хотя интересно размышлять об обнадеживающих ранних результатах лечения бета-блокаторами в этой семье с мутацией MYH7, было отмечено, что прогностические корреляции генотип-фенотип ГКМП затруднены. Это объясняется тем, что ГКМП представляет собой «чрезвычайно сложную биологическую сущность с обширной генетической гетерогенностью» [7].
Было бы трудно провести клинические испытания лечения ГКМП плода, но мы воодушевлены результатами, отмеченными в этом случае, и рекомендуем рассмотреть возможность внутриутробного лечения бета-блокаторами плода с подозрением на семейную ГКМП и признаками диастолической дисфункции.
Авторы заявляют об отсутствии конфликта интересов.
1. Бурмаян С., Разави А., Фурнье С. и соавт. Влияние пропранолола на расслабление левого желудочка при гипертрофической кардиомиопатии: эхографическое исследование. Am Heart J. 1985; 109 (6): 1311–1316. doi: 10. 1016/0002-8703(85)-6. [PubMed] [CrossRef] [Google Scholar]
1016/0002-8703(85)-6. [PubMed] [CrossRef] [Google Scholar]
2. Gersh BJ, Maron BJ, Bonow RO, et al. Руководство ACCF/AHA 2011 г. по диагностике и лечению гипертрофической кардиомиопатии: резюме: отчет Целевой группы Фонда Американского колледжа кардиологов/Американской кардиологической ассоциации по практическим рекомендациям. Тираж. 2011; 124(24):2761–279.6. doi: 10.1161/CIR.0b013e318223e230. [PubMed] [CrossRef] [Google Scholar]
3. Goldberg BB, McGahan JP. Атлас ультразвуковых измерений. 2. Филадельфия, Пенсильвания: Mosby, Elsevier; 2006. [Google Scholar]
4. Hecher K, Campbell S, Snijders R, Nicolaides K. Референтные диапазоны параметров венозного и атриовентрикулярного кровотока плода. УЗИ Акушерство Гинекол. 1994;4(5):381–390. doi: 10.1046/j.1469-0705.1994.04050381.x. [PubMed] [CrossRef] [Google Scholar]
5. Hinton RB, Michelfelder EC, Marino BS, Bove KE, Ware SM. Плод с гипертрофической кардиомиопатией, рестриктивной и одножелудочковой физиологией и мутацией тяжелой цепи бета-миозина. J Педиатр. 2010;157(1):164–166. doi: 10.1016/j.jpeds.2010.02.044. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
J Педиатр. 2010;157(1):164–166. doi: 10.1016/j.jpeds.2010.02.044. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
6. Марон Б.Дж., Гардин Дж.М., Флэк Дж.М., Гиддинг С.С., Куросаки Т.Т., Bild DE. Распространенность гипертрофической кардиомиопатии в общей популяции молодых людей. Эхокардиографический анализ 4111 участников исследования CARDIA. Развитие риска коронарной артерии у (молодых) взрослых. Тираж. 1995;92(4):785–789. doi: 10.1161/01.CIR.92.4.785. [PubMed] [CrossRef] [Google Scholar]
7. Maron BJ, Maron MS, Semsarian C. Генетика гипертрофической кардиомиопатии через 20 лет: клинические перспективы. J Am Coll Кардиол. 2012;60(8):705–715. doi: 10.1016/j.jacc.2012.02.068. [PubMed] [CrossRef] [Академия Google]
8. Остман-Смит И., Веттрелл Г., Ризенфельд Т.А. Когортное исследование гипертрофической кардиомиопатии у детей: улучшение выживаемости после лечения высокими дозами антагонистов бета-адренорецепторов. J Am Coll Кардиол. 1999;34(6):1813–1822. doi: 10.1016/S0735-1097(99)00421-0. [PubMed] [CrossRef] [Google Scholar]
doi: 10.1016/S0735-1097(99)00421-0. [PubMed] [CrossRef] [Google Scholar]
9. Pedra SR, Smallhorn JF, Ryan G, et al. Кардиомиопатии плода: патогенетические механизмы, гемодинамические данные и клинический исход. Тираж. 2002;106(5):585–591. doi: 10.1161/01.CIR.0000023900.58293.ФЭ. [PubMed] [CrossRef] [Google Scholar]
10. Veille JC, Sivakoff M, Hanson R, Fanaroff AA. Толщина межжелудочковой перегородки у плодов матерей с сахарным диабетом. Акушерство Гинекол. 1992;79(1):51–54. [PubMed] [Google Scholar]
11. Зелинский П. Роль пренатальной эхокардиографии в изучении гипертрофической кардиомиопатии у плода. Эхокардиография. 1991;8(6):661–668. doi: 10.1111/j.1540-8175.1991.tb01029.x. [PubMed] [CrossRef] [Google Scholar]
Выявление гипертрофии сердца у плода путем аппроксимации диполя тока с помощью магнитокардиографии
Выявление гипертрофии сердца у плода путем аппроксимации диполя тока с помощью магнитокардиографии
Скачать PDF
Скачать PDF
- Опубликовано:
- Хитоши Хоригоме 1 ,
- Дзюнко Шионо 1 ,
- Sadahiko Shigemitsu 2 ,
- Mitsuhiro Asaka 2 ,
- Akira Matsui 1 ,
- Akihiko Kandori 3 ,
- Tsuyoshi Miyashita 3 &
- …
- Keiji Tsukada 3
Педиатрические исследования
том 50 , страницы 242–245 (2001 г.)Процитировать эту статью
785 доступов
36 цитирований
Сведения о показателях
Abstract
Чтобы определить изменения тока миокарда в процессе развития плода и оценить клиническую полезность магнитокардиографии для пренатальной диагностики гипертрофии или увеличения сердца, мы аппроксимировали величину однотокового диполя сердца плода, используя магнитокардиография (фМКГ). Всего 9В исследование были включены 5 плодов со сроком гестации 20–40 недель. fMCG была записана с помощью девятиканальной сверхпроводящей системы устройств квантовой интерференции в комнате с магнитным экраном. Величина диполя (Q) была рассчитана с использованием уравнения, основанного на амплитуде fMCG, полученной на животе матери, и расстоянии между поверхностью матери и сердцем плода, измеренном с помощью ультразвукового исследования. При неосложненной беременности значение Q значимо коррелировало с гестационным возрастом, отражая увеличение величины миокардиального тока, т.е. масса миокарда. Кроме того, значения Q у плодов с кардиомегалией, обусловленной различными сердечно-сосудистыми аномалиями, имели тенденцию к превышению нормальных значений. Несмотря на некоторые ограничения методологии, основанной на модели полупространства, и ориентация плода может влиять на величину диполя, делая его меньше, fMCG, зарегистрированная с помощью многоканальной сверхпроводящей квантовой интерференционной системы, является клинически полезным инструментом для неинвазивного пренатального исследования.
Всего 9В исследование были включены 5 плодов со сроком гестации 20–40 недель. fMCG была записана с помощью девятиканальной сверхпроводящей системы устройств квантовой интерференции в комнате с магнитным экраном. Величина диполя (Q) была рассчитана с использованием уравнения, основанного на амплитуде fMCG, полученной на животе матери, и расстоянии между поверхностью матери и сердцем плода, измеренном с помощью ультразвукового исследования. При неосложненной беременности значение Q значимо коррелировало с гестационным возрастом, отражая увеличение величины миокардиального тока, т.е. масса миокарда. Кроме того, значения Q у плодов с кардиомегалией, обусловленной различными сердечно-сосудистыми аномалиями, имели тенденцию к превышению нормальных значений. Несмотря на некоторые ограничения методологии, основанной на модели полупространства, и ориентация плода может влиять на величину диполя, делая его меньше, fMCG, зарегистрированная с помощью многоканальной сверхпроводящей квантовой интерференционной системы, является клинически полезным инструментом для неинвазивного пренатального исследования. и электрическая оценка гипертрофии сердца плода.
и электрическая оценка гипертрофии сердца плода.
Основная
С момента первого клинического применения МКГ для диагностики сердечного ритма плода Кариниеми и соавт. (1) в 1974 году, магнитное поле, генерируемое сердцем плода, было измерено неинвазивно с удовлетворительными формами волны. МКГ не требует приклеивания электродов к поверхности тела плода и совершенно неинвазивна как для плода, так и для матери. Считается, что на сигналы МКГ от сердца плода минимально влияют свойства электропроводности ткани вокруг сердца (2, 3). Фактически временные интервалы могут быть получены с удовлетворительным соотношением сигнал/шум даже после развития первородной смазки во второй половине беременности. В ряде исследований, в том числе и в нашем, определялись изменения развития и нормальные диапазоны различных временных интервалов на фМКГ при неосложненной беременности (4–6). Однако амплитуда волны fMCG не была полностью исследована (7), хотя это еще одна важная переменная, используемая для диагностики пороков сердца плода.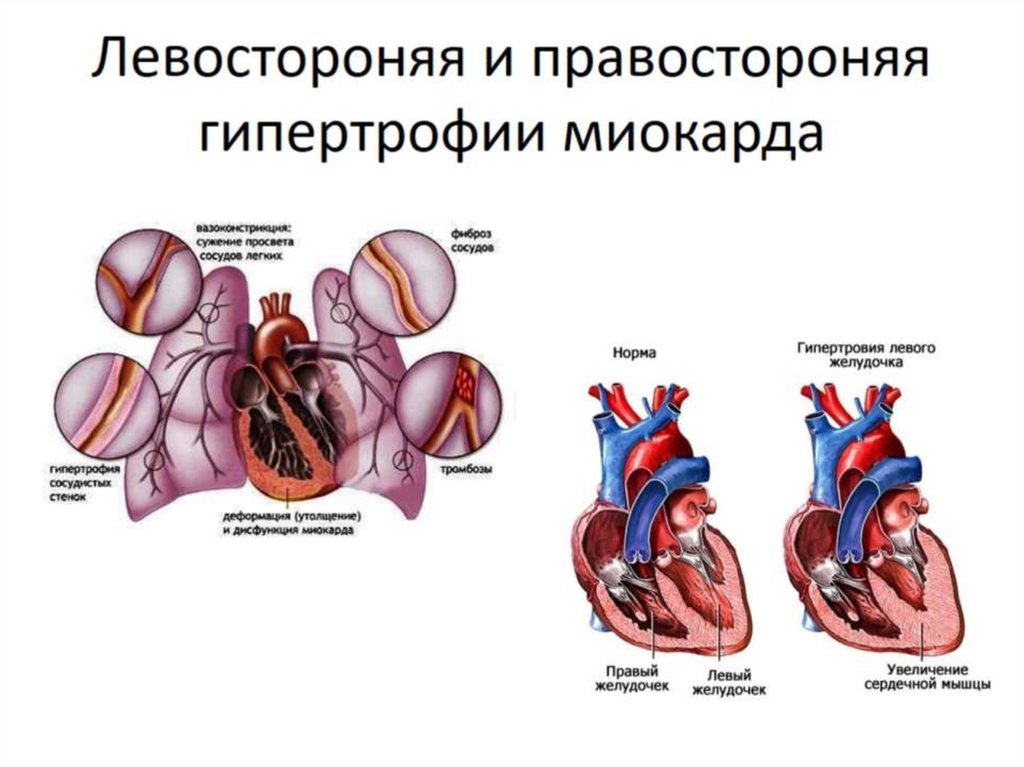 Одной из причин такого редкого применения является то, что амплитуда fMCG, измеренная на животе матери, не обязательно отражает максимальное значение миокардиального тока из-за влияния глубины и ориентации сердца. Кроме того, эти погрешности нелегко исправить, поскольку плод может двигаться во время измерения.
Одной из причин такого редкого применения является то, что амплитуда fMCG, измеренная на животе матери, не обязательно отражает максимальное значение миокардиального тока из-за влияния глубины и ориентации сердца. Кроме того, эти погрешности нелегко исправить, поскольку плод может двигаться во время измерения.
Мы попытались аппроксимировать величину однотокового диполя сердца плода на основе максимального значения данных fMCG, полученных с помощью многоканальной СКВИД-системы, и глубины сердца плода, определенной с помощью эхокардиографии при нормальной беременности. Затем мы использовали эти контрольные значения для оценки аномалий величины у плодов с кардиомегалией в результате чрезмерной объемной нагрузки в желудочках сердца. Используя оба набора данных, мы оценили полезность этой технологии для электрической диагностики гипертрофии сердца у плода.
МЕТОДЫ
Исследуемая популяция.
Всего было исследовано 95 плодов со сроком гестации 20–40 недель. Среди них у 88 не было осложнений со стороны матери или плода при сборе анамнеза, физикальном обследовании матери и УЗИ плода (группа I) (таблица 1). В остальных семи случаях кардиомегалия была диагностирована с помощью эхокардиографии плода (группа II) (табл. 2). Поперечный диаметр сердца плода в четырехкамерной проекции при эхокардиографии во II группе колебался от 32 до 54 мм (значения ТКД у всех семи плодов были >95 -й -й процентиль нормального значения) (8). С помощью эхокардиографии плода были определены следующие причины кардиомегалии: три плода были реципиентами с трансфузионным синдромом близнецов, у двух был артериовенозный шунт через мальформацию Галена и у двух был дефект эндокардиальной подушки с атриовентрикулярной регургитацией (табл. 2). Протокол исследования был одобрен Комитетом по обзору этики человека Медицинской школы Университета Цукуба, и перед началом исследования от родителей была получена подписанная форма согласия.
В остальных семи случаях кардиомегалия была диагностирована с помощью эхокардиографии плода (группа II) (табл. 2). Поперечный диаметр сердца плода в четырехкамерной проекции при эхокардиографии во II группе колебался от 32 до 54 мм (значения ТКД у всех семи плодов были >95 -й -й процентиль нормального значения) (8). С помощью эхокардиографии плода были определены следующие причины кардиомегалии: три плода были реципиентами с трансфузионным синдромом близнецов, у двух был артериовенозный шунт через мальформацию Галена и у двух был дефект эндокардиальной подушки с атриовентрикулярной регургитацией (табл. 2). Протокол исследования был одобрен Комитетом по обзору этики человека Медицинской школы Университета Цукуба, и перед началом исследования от родителей была получена подписанная форма согласия.
Таблица 1 Максимальная амплитуда fMCG, измеренная на животе матери ( B ), и расчетная величина текущего диполя ( Q ) у нормальных плодов
Полноразмерная таблица
токовый диполь (Q) у плодов с кардиомегалией
Полноразмерная таблица
Аппаратура и измерения.
fMCG была зарегистрирована с помощью девятиканальной системы SQUID, которая расположена в магнитно-экранированном помещении университетской больницы Цукуба. Датчики были круглой формы, тонкопленочные диаметром 20 мм и располагались в девяти точках квадрата со стороной 60 мм с постоянным интервалом 30 мм. Базовое расстояние или интервал между двумя встречно намотанными катушками градиентометра первого порядка было установлено равным 60 мм. fMCG регистрировали с частотой дискретизации 1000 Гц в каждом случае. Применялись полосовой фильтр 0,1–100 Гц и фильтр помех от сети 50 Гц. Детали системы SQUID были описаны в предыдущем отчете (9).). Непосредственно перед записью фМКГ с помощью УЗИ определяли кратчайшее расстояние от поверхности живота матери до передней поверхности желудочка сердца плода (d 1 ). Вид четырех сердечных камер на эхокардиограммах плода также использовался для выявления любых структурных сердечных аномалий, а также для измерения ТКД. fMCG регистрировали одновременно в девяти точках в течение не менее 2 минут, размещая сенсорную решетку как можно ближе к поверхности живота матери. Когда точка максимума не находилась в центре первой нанесенной на карту области и предполагалось, что она находится за пределами области картины магнитного распределения, массив датчиков перемещался на несколько сантиметров до тех пор, пока не было обнаружено пиковое значение. Из записей среди девяти каналов выбирали не менее 20 ударов с максимальной амплитудой и одинаковой полярностью формы волны. Затем было применено усреднение сигнала данных, запускаемых пиком комплекса QRS, для улучшения отношения сигнал/шум. По методике, описанной Вильямсоном и Кауфманом (10), рассчитывали величину однотокового диполя сердца плода, исходя из данных fMCG и глубины сердца плода, по следующему уравнению: где d 1 — расстояние между катушкой датчика и стенкой желудочка плода, μ 0 — константа магнитной проницаемости, B — нормальная (z) составляющая максимальной магнитной силы во время деполяризации желудочка среди девяти каналов, Q — текущий диполь, который необходимо оценить (11).
Когда точка максимума не находилась в центре первой нанесенной на карту области и предполагалось, что она находится за пределами области картины магнитного распределения, массив датчиков перемещался на несколько сантиметров до тех пор, пока не было обнаружено пиковое значение. Из записей среди девяти каналов выбирали не менее 20 ударов с максимальной амплитудой и одинаковой полярностью формы волны. Затем было применено усреднение сигнала данных, запускаемых пиком комплекса QRS, для улучшения отношения сигнал/шум. По методике, описанной Вильямсоном и Кауфманом (10), рассчитывали величину однотокового диполя сердца плода, исходя из данных fMCG и глубины сердца плода, по следующему уравнению: где d 1 — расстояние между катушкой датчика и стенкой желудочка плода, μ 0 — константа магнитной проницаемости, B — нормальная (z) составляющая максимальной магнитной силы во время деполяризации желудочка среди девяти каналов, Q — текущий диполь, который необходимо оценить (11).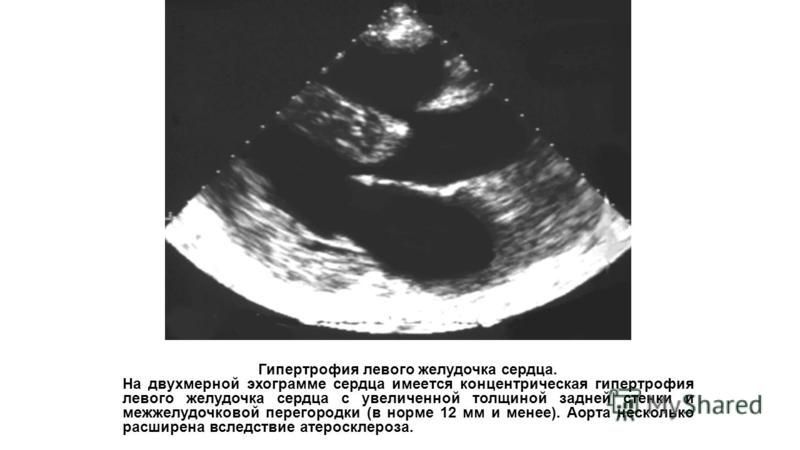 Для градиентометра первого порядка с базовой линией L (60 мм в настоящей системе) уравнение (а) можно преобразовать в следующее уравнение (б): Таким образом, МАТЕМАТИЧЕСКАЯ где d 2 = d 1 + L.
Для градиентометра первого порядка с базовой линией L (60 мм в настоящей системе) уравнение (а) можно преобразовать в следующее уравнение (б): Таким образом, МАТЕМАТИЧЕСКАЯ где d 2 = d 1 + L.
Следовательно, величина текущего диполя (Q) просто оценивается с использованием двух параметров, т. е. максимальной магнитной силы, измеренной на животе матери (B), и глубины сердца плода, определенной с помощью эхокардиографии плода ( д 1 ). Корреляцию значений B и Q с гестационным возрастом анализировали с помощью простой линейной регрессии.
РЕЗУЛЬТАТЫ
В группе I глубина (d 1 , расстояние от поверхности живота матери до стенки желудочка плода) колебалась от 22 до 75 мм (среднее ± SD: 45,0 ± 10,9).), а максимальное значение поверхностного магнитного поля среди девяти каналов (В) варьировалось от 1,9 до 10,8 пТл (пико-Тесла). Расчетное значение предполагаемого токового диполя (Q) составило 41–650 нАм (наноамперметр) (среднее значение: 234 ± 121). Эти данные также были разделены на четыре группы по гестационному возрасту, как представлено в таблице 1. Значения Q, но не B, значимо коррелировали с гестационным возрастом (рис. 1).
Эти данные также были разделены на четыре группы по гестационному возрасту, как представлено в таблице 1. Значения Q, но не B, значимо коррелировали с гестационным возрастом (рис. 1).
Рисунок 1
Совокупность всех 95 исследований fMCG, проведенных на нормальных плодах и плодах с кардиомегалией. Величина предполагаемого диполя (Q) у 88 нормальных плодов ( закрытых кружка ) достоверно коррелировало с гестационным возрастом ( r = 0,37, p = 0,0004). В шести из семи случаев с кардиомегалией ( закрытых квадрата ) значение Q больше, чем среднее значение + 2 SD нормальных плодов.
Изображение в натуральную величину
Значение Q во II группе колебалось от 291 до 1330 нАм. У шести плодов значение Q было выше среднего + 2 SD контроля для каждого соответствующего гестационного возраста (таблица 2, рис. 2). В частности, значение Q у плода с самым большим сердцем в этом исследовании, возникшем в результате массивного артериовенозного шунтирования через мальформацию Галена, достигло 1330 нАм, что было максимальным значением в настоящем исследовании (рис. 2).
2).
Рисунок 2
Кривые PQRST fMCG после усреднения сигнала у нормального плода с гестационным возрастом 36 недель ( A ) и у плода с выраженной кардиомегалией в результате порока развития Галена со сроком беременности 36 недель ( B ) . Масштабы амплитуды фМКГ одинаковы для обоих случаев. Пиковые магнитные поля (B) составляют 5,0 пТл ( A ) и 15,0 пТл ( B ).
Изображение в натуральную величину
ОБСУЖДЕНИЕ
Настоящее исследование показало, что приблизительная величина текущего диполя сердца плода в возрасте >20 недель беременности увеличивается пропорционально гестационному возрасту. Считается, что эта тенденция отражает увеличение количества электрического тока миокарда или массы миокарда параллельно с ростом плода. Кроме того, эта взаимосвязь аналогична положительной линейной корреляции между временем внутрижелудочкового проведения плода (интервал QRS) и гестационным возрастом в течение жизни плода, о которой сообщалось в предыдущих исследованиях (4–6). Менендес и др. (7) сообщили, что магнитная сила, измеренная на поверхности живота матери, была больше на поздних сроках, чем на ранних сроках беременности, даже без поправки на глубину сердца. Отчасти это связано с тем, что среднее значение расстояния между сердцем плода и сенсорной катушкой одинаково на разных стадиях беременности, как показано в нашем исследовании. Однако магнитная сила до поправки на глубину диполя (B) не показала значительной корреляции с гестационным возрастом в настоящем исследовании. Только после коррекции значения B по глубине (d 1 ) оказалось, что величина хорошо коррелирует с гестационным возрастом. Следовательно, амплитуда магнитного поля должна быть скорректирована на глубину сердца плода, когда мы сравниваем значение среди плодов.
Менендес и др. (7) сообщили, что магнитная сила, измеренная на поверхности живота матери, была больше на поздних сроках, чем на ранних сроках беременности, даже без поправки на глубину сердца. Отчасти это связано с тем, что среднее значение расстояния между сердцем плода и сенсорной катушкой одинаково на разных стадиях беременности, как показано в нашем исследовании. Однако магнитная сила до поправки на глубину диполя (B) не показала значительной корреляции с гестационным возрастом в настоящем исследовании. Только после коррекции значения B по глубине (d 1 ) оказалось, что величина хорошо коррелирует с гестационным возрастом. Следовательно, амплитуда магнитного поля должна быть скорректирована на глубину сердца плода, когда мы сравниваем значение среди плодов.
Гипертрофия или увеличение сердца плода диагностируется с помощью эхокардиографии плода. ТКД, измеренная в стандартной четырехкамерной проекции на эхокардиограмме плода, является простым показателем для выявления кардиомегалии (8). Известно, что среднее значение ТКД составляет около цифры соответствующего гестационного возраста. В настоящем исследовании мы отобрали плоды с увеличенным сердцем (значение ТКД >95-й процентиль нормы) с очевидной структурной аномалией сердечно-сосудистой системы, чтобы подтвердить полезность этого метода для обнаружения электрической гипертрофии. Следовательно, шесть из семи плодов с кардиомегалией показали большую величину диполя, чем среднее значение + 2 SD нормальных плодов соответствующего возраста. Эти результаты показывают, что fMCG можно использовать для неинвазивной и электронной оценки гипертрофии сердца плода, а также для временных интервалов, точно так же, как использование MCG после рождения (12) или в стандартной электрокардиографии. Подобно ТКД, было бы интересно сравнить толщину стенки желудочка, измеренную с помощью эхокардиографии, с амплитудой диполя или последовательно измерить величину диполя у одного и того же плода на протяжении всей беременности для клинической оценки.
Известно, что среднее значение ТКД составляет около цифры соответствующего гестационного возраста. В настоящем исследовании мы отобрали плоды с увеличенным сердцем (значение ТКД >95-й процентиль нормы) с очевидной структурной аномалией сердечно-сосудистой системы, чтобы подтвердить полезность этого метода для обнаружения электрической гипертрофии. Следовательно, шесть из семи плодов с кардиомегалией показали большую величину диполя, чем среднее значение + 2 SD нормальных плодов соответствующего возраста. Эти результаты показывают, что fMCG можно использовать для неинвазивной и электронной оценки гипертрофии сердца плода, а также для временных интервалов, точно так же, как использование MCG после рождения (12) или в стандартной электрокардиографии. Подобно ТКД, было бы интересно сравнить толщину стенки желудочка, измеренную с помощью эхокардиографии, с амплитудой диполя или последовательно измерить величину диполя у одного и того же плода на протяжении всей беременности для клинической оценки. Необходимы дальнейшие исследования, чтобы оценить полезность нашего метода.
Необходимы дальнейшие исследования, чтобы оценить полезность нашего метода.
Мы аппроксимировали величину диполя, используя простые уравнения, основанные на амплитуде fMCG и расстоянии между приемной катушкой системы SQUID и сердцем плода, определенному с помощью УЗИ. Основой для уравнений является модель полупространства, которая, как известно, имеет определенные ограничения в оценке дипольного момента при применении в клинических условиях (13). Действительно, материнское тело состоит из сложных проводников, включая первородную смазку, амниотическую жидкость и жировые слои, которые могут влиять, по крайней мере, в определенной степени на сигналы fMCG. Кроме того, при обнаружении сигналов fMCG мы могли наблюдать сигналы только от токов, параллельных плоскости приемных катушек. Хотя важно, чтобы метод можно было легко применять в каждом конкретном случае в клинических условиях, массив датчиков градиентометра располагали параллельно поверхности живота матери независимо от предлежания плода (14). В результате величина диполя, оцениваемая по нормальной (z) составляющей fMCG, неизбежно зависит от ориентации сердца или направления диполя, что делает его меньше. Другими словами, если бы можно было измерить все компоненты (x, y, z) fMCG для расчета величины диполя, оценочное значение было бы больше. На самом деле, как показано в таблице 2, существует заметная разница в величине диполя между случаями 5 и 6, в которых гестационный возраст и ТКД идентичны. Мы не смогли определить точную причину различий, но ориентация плода, движения плода и сложные проводники вокруг сердца плода могли повлиять на результаты. Сердце в случае 5 находилось в вертикальном положении верхушкой вниз, тогда как в случае 6 сердце находилось в горизонтальном положении верхушкой вправо.
В результате величина диполя, оцениваемая по нормальной (z) составляющей fMCG, неизбежно зависит от ориентации сердца или направления диполя, что делает его меньше. Другими словами, если бы можно было измерить все компоненты (x, y, z) fMCG для расчета величины диполя, оценочное значение было бы больше. На самом деле, как показано в таблице 2, существует заметная разница в величине диполя между случаями 5 и 6, в которых гестационный возраст и ТКД идентичны. Мы не смогли определить точную причину различий, но ориентация плода, движения плода и сложные проводники вокруг сердца плода могли повлиять на результаты. Сердце в случае 5 находилось в вертикальном положении верхушкой вниз, тогда как в случае 6 сердце находилось в горизонтальном положении верхушкой вправо.
Этот тип ошибки должен быть исправлен, если это возможно, для угла диполя к плоскости матрицы датчиков. Однако такую коррекцию трудно осуществить, так как плод может двигаться и менять ориентацию после эхографического исследования. Чтобы частично компенсировать это ограничение методики, мы использовали многоканальную СКВИД-систему и выбрали трассу, показывающую максимальную амплитуду среди девяти каналов. Когда полярность или амплитуда колебались даже на одной и той же записи с самой четкой формой волны среди девяти каналов, мы принимали комплексы с самой высокой амплитудой QRS на том же канале для усреднения сигнала. Кроме того, мы также оценили величину диполя у достаточного количества нормальных плодов в разном гестационном возрасте, и результаты сравнили с результатами увеличенных сердец, чтобы подтвердить полезность метода для электронного обнаружения сердечной гипертрофии. Следует подчеркнуть, что с помощью этой процедуры мы могли электронно отличить кардиомегалию от сердца нормального размера.
Чтобы частично компенсировать это ограничение методики, мы использовали многоканальную СКВИД-систему и выбрали трассу, показывающую максимальную амплитуду среди девяти каналов. Когда полярность или амплитуда колебались даже на одной и той же записи с самой четкой формой волны среди девяти каналов, мы принимали комплексы с самой высокой амплитудой QRS на том же канале для усреднения сигнала. Кроме того, мы также оценили величину диполя у достаточного количества нормальных плодов в разном гестационном возрасте, и результаты сравнили с результатами увеличенных сердец, чтобы подтвердить полезность метода для электронного обнаружения сердечной гипертрофии. Следует подчеркнуть, что с помощью этой процедуры мы могли электронно отличить кардиомегалию от сердца нормального размера.
В заключение, настоящее исследование показало, что fMCG, зарегистрированная с помощью многоканальной системы SQUID, клинически полезна для определения величины миокардиального тока и обнаружения пренатальной гипертрофии или увеличения сердца плода с помощью электронных средств. Однако для детальной оценки миокардиального тока желательно разработать процедуру постобработки для коррекции угла диполя к плоскости матрицы датчиков и смещения ориентации плода во время измерения.
Однако для детальной оценки миокардиального тока желательно разработать процедуру постобработки для коррекции угла диполя к плоскости матрицы датчиков и смещения ориентации плода во время измерения.
Сокращения
- ФМКГ:
магнитокардиограмма плода
- МКГ:
магнитокардиограмма
- СКВИД:
сверхпроводящее квантовое интерференционное устройство
- ТКД:
общий сердечный размер
Ссылки
Kariniemi V, Ahopelto J, Karp PJ, Katila TE 1974 Магнитокардиограмма плода. J Perinat Med 2 : 214–216
Артикул
КАСGoogle Scholar
Cohen D, Edelsack EA, Zimmerman JE 1970 Магнитокардиограммы, полученные в экранированной комнате сверхпроводящим точечным магнитометром.
 Appl Phys Lett 16 : 278–280
Appl Phys Lett 16 : 278–280Артикул
Google Scholar
Cuffin BN 1978 Об использовании электрических и магнитных данных для определения электрических источников в объемном проводнике. Ann Biomed Eng 6 : 173–193
Артикул
КАСGoogle Scholar
Куинн А., Вейр А., Шахани У., Бейн Р., Маас П., Дональдсон Г. 1994 Антенатальная магнитокардиография плода: новый метод наблюдения за плодом?. Br J Obstet Gynaecol 101 : 866–870
Артикул
КАСGoogle Scholar
Leuthold A, Wakai R, Martin CB 1999 Неинвазивная внутриутробная оценка интервалов PR и QRS по магнитокардиограмме плода. Early Hum Dev 54 : 235–243
Артикул
КАСGoogle Scholar
Horigome H, Takahashi MI, Asaka M, Shigemitsu S, Kandori A, Tsukada K 2000 Магнитокардиографическое определение изменений в развитии интервалов PQ, QRS и QT у плода.
 Acta Pædiatr 89 : 64–67
Acta Pædiatr 89 : 64–67Артикул
КАСGoogle Scholar
Menèndez T, Achenbach S, Moshage W, Flug M, Beinder E, Kollert A, Bittel A, Bachmann K 1998 Prenatale Registrierung fetaler Herzaktionen mit Magnetocardiography. Z Kardiol 87 : 111–118
Артикул
Google Scholar
Вейль Дж. К., Хэнсон Р., Сивакофф М., Хоэн Х., Бен-Ами М. 1993 Размер сердца плода при нормальной беременности, задержке внутриутробного развития и диабетической беременности. Am J Перинатол 10 : 275–279
Артикул
КАСGoogle Scholar
Цукада К., Харута Й., Адачи А., Огата Х., Комуро Т., Ито Т., Такада Й., Кандори А., Нода Й., Терада Й., Мицуи Т. 1995 Многоканальная СКВИД-система, обнаруживающая тангенциальные компоненты магнитных полей сердца.
 Rev Sci Instrum 66 : 5085–5091
Rev Sci Instrum 66 : 5085–5091Артикул
КАСGoogle Scholar
Уильямсон С.Дж., Кауфман Л. 1981 «Биомагнетизм». J Magn Magn Mater 22 : 129–201
Артикул
Google Scholar
Кандори А., Мияшита Т., Цукада К., Хоригоме Х., Асака М., Шигемицу С., Такахаши М.И., Терада Ю., Мицуи Т. 1999 Чувствительность магнитокардиограмм плода в зависимости от недели беременности. Med Biol Eng Comput 37 : 545–548
Статья
КАСGoogle Scholar
Horigome H, Tsukada K, Kandori A, Shiono J, Matsui A, Terada Y, Mitsui T 1999 Визуализация региональной деполяризации миокарда путем картирования тангенциального компонента на магнитокардиограмме у детей. Int J Card Imaging 15 : 331–337
Артикул
КАСGoogle Scholar
Peters MJ, Stinstra JG, van den Broek SP, Huirne JAF, Quartero HWF, ter Brake HJM, Rogalla H 1998 На магнитокардиограмме плода.
 Биоэлектрохим Биоэнергия 47 : 273–281
Биоэлектрохим Биоэнергия 47 : 273–281Артикул
КАСGoogle Scholar
Wakai R, Wang M, Martin CB 1994 Пространственно-временные свойства магнитокардиограммы плода. Am J Obstet Gynecol 170 : 770–776
Артикул
КАСGoogle Scholar
Ссылки на скачивание
Информация о авторе
Авторы и принадлежности
Департамент педиатрики, Институт клинической медицины, Университет Цукуба, Tsukuba, Mats
HITOSHI, HOURIGOM2,
HITOSHI, HOURIGOM2. акушерства и гинекологии, Институт клинической медицины, Университет Цукуба, Цукуба, Япония
Садахико Шигемицу и Мицухиро Асака
Hitachi Ltd., Центральная исследовательская лаборатория, Токио, Япония
Akihiko Kandori, Tsuyoshi Miyashita & Keiji Tsukada
.
