Гипертрофическая кардиомиопатия у детей: Журнал «Педиатрия» имени Г.Н.Сперанского
Медсовет для врачей | Remedium.ru
13.09.2022
Альтернативные виды терапии рецидивирующего цистита у женщин в менопаузе
Е.В. Кульчавеня1,2,3, Л.С. Трейвиш3, Е.В. Телина3; 1 Новосибирский научно-исследовательский институт туберкулеза, 2 Новосибирский государственный медицинский университет, 3 Медицинский центр «Авиценна»
Инфекции мочевыводящих путей (ИМП)…
Подробнее
09.09.2022
Сравнительная оценка результатов терапии акне легкой степени
И.М. Хисматулина, Е. В. Файзуллина, Е.С. Гусарова, Р.Р. Набиева; Казанский государственный медицинский университет
В. Файзуллина, Е.С. Гусарова, Р.Р. Набиева; Казанский государственный медицинский университет
Введение. Акне легкой степени является самой недооцененной формой заболевания.
Цель исследования – сравнить результаты наружной комбинированной терапии…
Подробнее
08.09.2022
Иридоциклит и другие увеиты
Увеит, процесс внутриглазного воспаления, может быть вызван многими причинами. Направление к специалисту-офтальмологу показано для диагностики и лечения большинства пациентов с симптомами, указывающими на воспаление сосудистой оболочки глаза. Увеит характеризуется воспалением сосудистой оболочки глаза,…
Подробнее
07. 09.2022
09.2022
Аудиологический скрининг школьников: международный опыт и рекомендации
С.С. Чибисова1, И. Альшарджаби2, А.С. Зюзин1, Е.Р. Цыганкова1, В.И. Попадюк2, Г.А. Таварткиладзе1, И.М. Кириченко2; 1 Российская медицинская академия непрерывного профессионального образования, 2 Российский университет дружбы народов
Нарушение слуха в детском возрасте затрудняет…
Подробнее
06.09.2022
Что исследуют с помощью щелевой лампы?
Щелевая лампа представляет собой бинокулярный микроскоп, который обеспечивает исследователю стереоскопическое (т. е. трехмерное) изображение глаза. Он мало изменился с момента его разработки Гольдманом в 1937 году. Однако существуют альтернативные методы исследования глаза с использованием портативных…
е. трехмерное) изображение глаза. Он мало изменился с момента его разработки Гольдманом в 1937 году. Однако существуют альтернативные методы исследования глаза с использованием портативных…
Подробнее
05.09.2022
Вопросы терапии поствоспалительной гиперпигментации постакне
Л.С. Круглова, Н.В. Грязева; ЦГМА
Введение. Поствоспалительная гиперпигментация постакне наиболее часто формируется у пациентов со среднетяжелой и тяжелой степенью акне. Пигментация постакне может носить стойкий характер и сохраняться от месяцев до нескольких лет, что оказывает отрицательное влияние…
Подробнее
02.09.2022
Ангина у детей
Ангина – общепринятое название острого тонзиллита у детей. Это патологический процесс, который в первую очередь лечат педиатры и врачи первичной медико-санитарной помощи, остается одним из самых распространенных инфекционных заболеваний среди населения в целом, в основном среди детского. В обзоре обсуждается…
Это патологический процесс, который в первую очередь лечат педиатры и врачи первичной медико-санитарной помощи, остается одним из самых распространенных инфекционных заболеваний среди населения в целом, в основном среди детского. В обзоре обсуждается…
Подробнее
01.09.2022
Сопоставление результатов пункционных биопсий узлов щитовидной железы и ультразвуковой стратификации рисков рака щитовидной железы по системе TIRADS с результатами гистологического исследования
Aleksandr A. Shchegolev1,2, Aleksandr A. Larin1, Andrey S. Slobodyanik2*, Evgeniy V. Svetlov2, Rinat R. Shafigullin2; 1 Pirogov Russian National Research Medical University, 2 Inozemtsev City Clinical Hospital of the Department of Health of Moscow
. ..
..
Подробнее
30.08.2022
Почему возникает осенняя депрессия?
Действительно ли существует состояние, когда «лапы ломит и хвост отваливается» только по причине смены времени года? Да, это реальная патология. Термин «сезонное аффективное расстройство» (САР) описывает эпизоды большой депрессии, мании или гипомании, которые регулярно возникают в определенное время…
Подробнее
29.08.2022
Коронавирусная инфекция и псориаз: взаимосвязь и последствия
К.В. Каткова1, Е.В. Денисова1,2, А.Г. Соболева2,3, Е.А. Печатникова4, О.В. Жукова1, В.В. Соболев2, И.М. Корсунская1,2; 1 МНПЦДК, 2 ЦТП ФХФ, 3 НИИМЧ, 4 РНИМУ им. Н.И. Пирогова
Н.И. Пирогова
Как показывают многочисленные научные данные, несмотря на то что пациенты с тяжелым псориазом имеют высокие риски заражения …
Подробнее
Загрузить еще
первые симптомы болезни, причины возникновения заболевания, лечение и способы профилактики
Кардиомиопатия — это изменение мышцы сердца часто невыясненной причины.
Условием постановки диагноза «кардиомиопатия» является отсутствие (или исключение после обследования) врожденных аномалий развития, клапанных пороков сердца, поражения, обусловленного системными заболеваниями сосудов, артериальной гипертонии, перикардита, а также некоторых редких вариантов поражения проводящей системы сердца.
Причины
Существует три группы основных причин развития первичной кардиомиопатии: врожденная, смешанная, и приобретенная. К вторичным относятся кардиомиопатии вследствие какого-либо заболевания.
К вторичным относятся кардиомиопатии вследствие какого-либо заболевания.
Врождённая патология сердца развивается вследствие нарушения закладки тканей миокарда во время эмбриогенеза. Причин очень много, начиная от вредных привычек будущей матери и заканчивая стрессами и неправильным питанием. Так же известны кардиомиопатии беременных и воспалительные кардиомиопатии, которые по существу можно назвать миокардитом.
К вторичным формам относятся следующие виды:
- Кардиомиопатия накопленная или инфильтративная. Для нее характерно накопление между клетками или в клетках патологических включений.
- Токсическая кардиомиопатия.
- Эндокринная кардиомиопатия (метаболическая кардиомиопатия, дисметаболическая кардиомиопатия) возникает вследствие нарушения обмена веществ в сердечной мышце.
- Алиментарная кардиомиопатия образуется в результате нарушения питания, а в частности при длительных диетах с ограничением мясных продуктов или голодании.

Проявления ГКМП многообразны и зависят от ряда факторов: степени гипертрофии миокарда, наличия и величины градиента давления, недостаточности митрального клапана, нередко встречающейся у больных, степени уменьшения полости левого желудочка и тяжести нарушения насосной и диастолической функций сердца и др. Жалобы часто отсутствуют.
Различают 3 группы КМП:
Гипертрофическую.
Дилатационную (застойную).
Рестриктивную.
Симптомы дилатационной кардиомиопатии:
- Нарастающая сердечная недостаточность.
- Одышка при физической нагрузке.
- Быстрая утомляемость.
- Отеки на ногах.
- Бледность кожи.
- Посинение кончиков пальцев.
Симптомы гипертрофической кардиомиопатии:
- Одышка.
- Боли в грудной клетке.
- Склонность к обморокам, сердцебиению.

Симптомы рестриктивной кардиомиопатии:
- Отеки.
- Одышка.
Основным инструментальным методом диагностики всех видов кардиомиопатий является УЗИ сердца.
Суточное холтеровское мониторирование электрокардиограммы позволяет оценить частоту и выраженность нарушений ритма сердца и внутрисердечных блокад, а так же эффективность проводимого лечения. Лабораторная диагностика важна для контроля эффективности проводимой терапии в оценке состояния водно-солевого баланса, для исключения некоторых побочных эффектов препаратов, а также для выявления вторичных причин поражения сердца.
Профилактика
Так как причины кардиомиопатии не до конца известны, специальной профилактики на данный момент не существует. Необходимо своевременно лечить заболевания сердца.
Подробнее о детской кардиологии в клинике «ЮгМед»
Оставляя свои персональные данные, Вы даете добровольное согласие на обработку своих персональных данных. Под персональными данными понимается любая информация, относящаяся к Вам, как субъекту персональных данных (ФИО, дата рождения, город проживания, адрес, контактный номер телефона, адрес электронной почты, род занятости и пр). Ваше согласие распространяется на осуществление Общество с ограниченной ответственностью Научно-производственное объединение «Волгоградский центр профилактики болезней «ЮгМед» любых действий в отношении ваших персональных данных, которые могут понадобиться для сбора, систематизации, хранения, уточнения (обновление, изменение), обработки (например, отправки писем или совершения звонков) и т.п. с учетом действующего законодательства. Согласие на обработку персональных данных даётся без ограничения срока, но может быть отозвано Вами (достаточно сообщить об этом в Общество с ограниченной ответственностью Научно-производственное объединение «Волгоградский центр профилактики болезней «ЮгМед»). Пересылая в Общество с ограниченной ответственностью Научно-производственное объединение «Волгоградский центр профилактики болезней «ЮгМед» свои персональные данные, Вы подтверждаете, что с правами и обязанностями в соответствии с Федеральным законом «О персональных данных» ознакомлены.
Под персональными данными понимается любая информация, относящаяся к Вам, как субъекту персональных данных (ФИО, дата рождения, город проживания, адрес, контактный номер телефона, адрес электронной почты, род занятости и пр). Ваше согласие распространяется на осуществление Общество с ограниченной ответственностью Научно-производственное объединение «Волгоградский центр профилактики болезней «ЮгМед» любых действий в отношении ваших персональных данных, которые могут понадобиться для сбора, систематизации, хранения, уточнения (обновление, изменение), обработки (например, отправки писем или совершения звонков) и т.п. с учетом действующего законодательства. Согласие на обработку персональных данных даётся без ограничения срока, но может быть отозвано Вами (достаточно сообщить об этом в Общество с ограниченной ответственностью Научно-производственное объединение «Волгоградский центр профилактики болезней «ЮгМед»). Пересылая в Общество с ограниченной ответственностью Научно-производственное объединение «Волгоградский центр профилактики болезней «ЮгМед» свои персональные данные, Вы подтверждаете, что с правами и обязанностями в соответствии с Федеральным законом «О персональных данных» ознакомлены.
Синкопальные состояния у детей с гипертрофической кардиомиопатией | Леонтьева
1. Elliott P.M., Anastasakis A., Borger M.A. et al. 2014 ESC Guidelines on diagnosis and management of hypertropliic cardiomyopathy The Task Force for the Diagnosis and Management of Hypertrophic Cardiomyopathy of the European Society of Cardiology. Eur Heart J 2014; doi:10.1093/eurheartj/ehu284. www escardio.org/ guidelines.
2. Gersh B.J., Maron B.J., Bonow R.O. et al. ACCF/AHA Guideline for the diagnosis and treatment of hypertrophic cardiomyopathy: a report of the American college of cardiology foundation/American Heart Association Task Force on Practice Guidelines. Circulation 2011; 124: 213—260.
3. Efthimiadis G., Pagourelias E., Gossios Т., Zegkos T. Hypertrophic cardiomyopathy in 2013: Current speculations and future perspectives. World J Cardiol 2014; 6: 2: 26—37.
4. Biagini E., Coccolo F., Ferlito M. et al. Dilated-hypokinetic evolution of hypertrophic cardiomyopathy: prevalence, incidence, risk factors and prognostic implications in pediatric and adult patients. J Am Coll Cardiol 2005; 46: 1543—1550.
J Am Coll Cardiol 2005; 46: 1543—1550.
5. Maron В., Spirito P., Ackerman M. Prevention of Sudden Cardiac Death With Implantable Cardioverter-Defibrfflators in Children and Adolescents With Hypertrophic Cardiomyopathy. J Am Coll Cardiol 2013; 61: 14: 1527—1535.
6. Ostman-Smith I. Hypertrophic cardiomyopathy in childhood and adolescence — strategies to prevent sudden death. Fundam Clin Pharmacol 2010; 24: 637—652.
7. Ostman-Smith I., Wettrell G., Keeton B. et al. Age-and gender specific mortality rates in childhood hypertrophic cardiomyopathy. Eur Heart J 2008; 29: 1160—1167.
8. Maron B.J. Risk Stratification and Role of Implantable Deibrillators for Prevention of Sudden Death in Patients With Hypertrophic Cardiomyopathy. Circ J 2010; 74: 2271—2282.
9. Deccker J., Rossano J., Smith O. Risk factors and mode of death in isolated hypertrophic cardiomyopathy in children Am Coll Cardiol 2009; 54: 3: 250—254.
10. Anastasakis A., Theopistou A., Rigopoulos A., Kotsiopoulou С Sudden Cardiac Death: Investigation of the Classical Risk Factors in a Community-Based Hypertrophic Cardiomyopathy Cohort. Hellenic J Cardiol 2013; 54: 281—288.
Hellenic J Cardiol 2013; 54: 281—288.
11. Elliott P.M., Gimeno J.R., Tome M.T. et al. Left ventricular outflow tract obstruction and sudden death risk in patients with hypertrophic cardiomyopathy. Eur Heart J 2006; 27: 1933-1941.
12. MoyaA., Sutton R, Ammirati F. et al. Guidelines for the diagnosis and management of syncope (version 2009): the Task Force for the Diagnosis and Management of Syncope of the European Society of Cardiology (ESC). Eur Heart J 2009; 30: 2631-2671.
13. Olivotto I., Cecchi F., Casey S.A. et al. Impact of atrial fibrillationon the clinical course of hypertrophic cardiomyopathy. Circulation 2001; 104: 2517—2524.
14. Bookstall K., Link M. A primer on arrhythmias in patients with hypertrophic Cardiomyopathy. Curr Cardiol Rep 2012; 14: 552-562.
15. Barriales-VillaR., Centurion-IndaR., Fernandez-FernandezX. et al. Severe cardiac conduction disturbances and pacemaker implantation in patients with hypertrophic cardiomyopathy. Rev Esp Cardiol 2010; 63: 985-988.
16. Bahl A., Saikia U., Talwar K. Familial conduction system disease associated with hypertrophic cardiomyopathy. Int J Cardiol 2008; 125: 44-47.
17. Prasad K., Williams L., Campbell R. et al. Episodic syncope in hypertrophic cardiomyopathy: evidence for inappropriate vasodilation. Heart 2008; 94: 1312—1317.
18. Dimitrow P.P., Chojnowska L., Rudzinski T.S. et al. Sudden death in hypertrophic cardiomyopathy: old risk factors reassessed in a new model of maximalized follow-up. Eur Heart J 2010; 31: 3084-3093.
19. Efthimiadis G.K., Parcharidou D.G., Giannakoulas G. et al. Left ventricular out flow tract obstruction as a risk factor for sudden cardiac death in hypertrophic cardiomyopathy. Am J Cardiol 2009; 104: 695-699.
20. Gimeno J.R., Tome-Esteban M., Lofiego C. et al. Exercise-induced ventricular arrhythmias and risk of sudden cardiac death in patients with hypertrophic cardiomyopathy. Eur Heart J 2009; 30: 2599-2605.
21. Pettersen M.D., Wei D., Skeens M. E., Humes R.A. Regression equations for calculation of Z scores of cardiac structures in a large cohort of healthy infants, children, and adolescents: An echocardiographic study. J Am Soc Echocardiogr 2008; 21: 8: 922-934.
E., Humes R.A. Regression equations for calculation of Z scores of cardiac structures in a large cohort of healthy infants, children, and adolescents: An echocardiographic study. J Am Soc Echocardiogr 2008; 21: 8: 922-934.
22. BaurA., MalikM., Schmidt G. Heart rate turbulence: standards of measurement, physiological interpretation and clinical use. Amer Coll Cardiol 2008; 52: 17: 1353-1365.
23. Макарова В.А., Леонтьева И.В. Турбулентность ритма сердца как маркер электрической нестабильности миокарда. Рос вестн перинатол и педиат 2014; 4: 64—68. (Makarova V.A., Leontyeva I.V. Heart rate turbulence as a marker of myocardial electrical instability in children with hypertrophic cardiomyopathy. Ros vest perinatol i pediat 2014; 4: 65—68.)
24. Shah J.S., Esteban M.T., Thaman R. et al. Prevalence of exercise-induced left ventricular outflow tract obstruction in symptomatic patients with non-obstructive hypertrophic cardiomyopathy. Heart 2008; 94: 1288—1294.
25. Monserrat L. , Elliott P., Gimeno J. Non-Sustained Ventricular Tachycardia in Hypertrophic Cardiomyopathy: An Independent Marker of Sudden Death Risk in Young Patients J Am Coll Cardiol 2003; 42: 5: 873-878.
, Elliott P., Gimeno J. Non-Sustained Ventricular Tachycardia in Hypertrophic Cardiomyopathy: An Independent Marker of Sudden Death Risk in Young Patients J Am Coll Cardiol 2003; 42: 5: 873-878.
26. Gilligan DM., Nihoyannopoulos P., Chan W.L., Oakley CM. Investigation of a hemodynamic basis for syncope in hypertrophic cardiomyopathy. Use of a head-up tilt test. Circulation 1992; 85: 2140-2148.
27. Kawasaki Т., Sakai C, Harimoto K. Holter monitoring and long-term prognosis in hypertrophic Cardiomyopathy. Cardiology 2012; 122:44-54.
28. American Heart Association/American College of Cardiology Foundation/. Heart rhythm society scientific statement on noninvasive risk stratification techniques for identifying patients at risk for sudden cardiac death. Circulation 2008; 118: 1497-1518.
29. Shiozak A, Senra Т., Arteaga E. Myocardial fibrosis detected by cardiac CT predicts ventricular fibrillation/ventricular tachycardia events in patients withhypertrophic cardiomyopathy JCardiovasc ComputTomogr2013; 7: 3: 173—181.
30. Schmidt G., Malik M., Barthel P. et al. Heart rate turbulence after ventricular premature beats as predictor of mortality after acute myocardial infarction. Lancet 1999; 353: 130—196.
31. Kowalewski M. Heart rate turbulence in children — age and heart rate relationships. Pediat Res 2007; 62: 6: 710—714.
32. Комолятова B.H. Характеристика проаритмогенных маркеров электрической нестабильности миокарда у детей и подростков: Автореф. дисс. … канд. мед. наук. М2009; 22. (KomolyatovaV.N. Featureproarrhythmogenic markers myocardial electrical instability in children and adolescents: Avtoref. dis. … kand. med. nauk. Moscow 2009; 22.)
33. Brignole M., Auricchio A., Baron-Esquivias G. et al. ESC Guidelines on cardiac pacing and cardiac resynchronization therapy: the Task Force on cardiac pacing and resynchronization therapy of the European Society of Cardiology (ESC). Developed in collaboration with the European Heart Rhythm Association (EHRA). Eur Heart J 2013; 34: 2281-2329.
Обструктивная гипертрофическая кардиомиопатия трансплантированного сердца: клинический случай | Головина
Гипертрофическая кардиомиопатия (ГКМП) — генетически обусловленное заболевание миокарда, характеризующееся гипертрофией левого желудочка (ЛЖ) (ГЛЖ) (>1,5 см) и/или правого желудочка, чаще асимметрического характера за счёт утолщения межжелудочковой перегородки (МЖП), что не может объясняться исключительно повышением нагрузки давлением, и возникающее при отсутствии другого сердечного или системного заболевания, метаболического или полиорганного синдрома, связанного с ГЛЖ [1]. Несмотря на хорошую осведомлённость кардиологов об этой форме кардиомиопатии, она продолжает преподносить немало сюрпризов. Мы представляем случай развития классического фенотипа ГКМП с клинической симптоматикой, обусловленной латентной обструкцией выходного тракта ЛЖ (ВТЛЖ), у пациента 66 лет спустя 5 лет после ортотопической трансплантации сердца (ОТС).
Пациенту Н. в возрасте 61 года 19. 04.2015 выполнена ОТС по поводу терминальной стадии ишемической кардиомиопатии. На момент ОТС пациент страдал гипертонической болезнью 1 степени с хорошим контролем артериального давления. Донором была 43-летняя женщина, эхокардиографическое (ЭхоКГ) исследование патологии донорского сердца не выявило. Посттрансплантационная иммуносупрессия состояла из такролимуса 3,0 мг/сут. с поддержанием целевого уровня в крови 5-10 нг/мл, микофенолата мофетила 2000 мг/сут. и метилпреднизона 4 мг/сут.
04.2015 выполнена ОТС по поводу терминальной стадии ишемической кардиомиопатии. На момент ОТС пациент страдал гипертонической болезнью 1 степени с хорошим контролем артериального давления. Донором была 43-летняя женщина, эхокардиографическое (ЭхоКГ) исследование патологии донорского сердца не выявило. Посттрансплантационная иммуносупрессия состояла из такролимуса 3,0 мг/сут. с поддержанием целевого уровня в крови 5-10 нг/мл, микофенолата мофетила 2000 мг/сут. и метилпреднизона 4 мг/сут.
Наблюдение за пациентом проводилось в соответствии с клиническими рекомендациями по ведению пациентов, перенесших трансплантацию сердца [2]. Трансторакальное ЭхоКГ выполнялось на аппаратах Acuson Simens SC 2000 и PHILIPS IE 33 согласно стандартному протоколу.
После ОТС состояние пациента было удовлетворительным. Спустя год после ОТС пациента начали беспокоить головокружения при переходе в ортостаз, одышка при подъёме на третий этаж, быстрая утомляемость. Толерантность к физическим нагрузкам постепенно снижалась. С 2019г пациент жаловался на нарушение зрения, головокружение и желание лечь после перехода в вертикальное положение или через несколько шагов после вставания, одышку при ходьбе через 50-100 м. В 2020г пациент периодически отмечал отёки стоп и нижних третей голеней, удушье после перехода в горизонтальное положение, одышка возникала при ходьбе через 50 м, сохранялись симптомы ортостатической интолерантности.
С 2019г пациент жаловался на нарушение зрения, головокружение и желание лечь после перехода в вертикальное положение или через несколько шагов после вставания, одышку при ходьбе через 50-100 м. В 2020г пациент периодически отмечал отёки стоп и нижних третей голеней, удушье после перехода в горизонтальное положение, одышка возникала при ходьбе через 50 м, сохранялись симптомы ортостатической интолерантности.
При физикальном обследовании в январе 2021г выявлены избыточная масса тела с индексом массы тела 29 кг/м2 (рост 170 см, вес 86 кг), малоинтенсивный систолический шум в точке Боткина. Активная ортостатическая проба была в норме, дистанция шестиминутной ходьбы составила 180 м.
Электрокардиограмма у пациента после ОТС была без отклонений, с января 2021г регистрировалась преходящая атриовентрикулярная блокада 1 степени (PQ 200-240 мс).
Параметры ЭхоКГ в период 2015-2021гг представлены в таблицах 1 и 2. Анализ динамики показателей ЭхоКГ в этот период показал постепенное развитие умеренной ГЛЖ, преимущественно в базальной части МЖП до 17 мм, уменьшение полости ЛЖ, сохранную сократительную функцию ЛЖ (фракция выброса ЛЖ 60-64%), увеличение левого предсердия. С июня 2015г определялось передне-систолическое движение краёв створок и хорд передней створки (ПС) митрального клапана (МК), а с мая 2016г — митрально-септальный контакт ПС МК. Обструкция ВТЛЖ в покое была зарегистрирована однократно в 2016г (максимальный градиент давления в ВТЛЖ составил 47 мм рт.ст.), однако при последующих исследованиях в покое обструкция не определялась вплоть до 2021г. Наблюдалось развитие диастолической дисфункции по псевдонормальному типу, что сопровождалось увеличением скорости пика раннего диастолического наполнения движения боковой части кольца МК (Ем), соотношения пика раннего диастолического наполнения к пику раннего диастолического наполнения движения боковой части кольца МК (Е/Ем). Правые отделы сердца за этот период наблюдения не претерпели заметных изменений: размеры правого предсердия остались на верхней границе нормы (в четырёхкамерном сечении 36- 41 на 51-52 мм в 2015г, 40 на 51 мм в 2021г), размеры правого желудочка в 2015г и 2021г составили 26 мм, регургитация на трикуспидальном клапане лёгкой степени регистрировалась в 2015г и 2021г, клапан лёгочной артерии без выраженной гипертензии по Д-потоку в 2015г и в 2021г, систолическое давление в лёгочной артерии составляло 28 мм рт.
С июня 2015г определялось передне-систолическое движение краёв створок и хорд передней створки (ПС) митрального клапана (МК), а с мая 2016г — митрально-септальный контакт ПС МК. Обструкция ВТЛЖ в покое была зарегистрирована однократно в 2016г (максимальный градиент давления в ВТЛЖ составил 47 мм рт.ст.), однако при последующих исследованиях в покое обструкция не определялась вплоть до 2021г. Наблюдалось развитие диастолической дисфункции по псевдонормальному типу, что сопровождалось увеличением скорости пика раннего диастолического наполнения движения боковой части кольца МК (Ем), соотношения пика раннего диастолического наполнения к пику раннего диастолического наполнения движения боковой части кольца МК (Е/Ем). Правые отделы сердца за этот период наблюдения не претерпели заметных изменений: размеры правого предсердия остались на верхней границе нормы (в четырёхкамерном сечении 36- 41 на 51-52 мм в 2015г, 40 на 51 мм в 2021г), размеры правого желудочка в 2015г и 2021г составили 26 мм, регургитация на трикуспидальном клапане лёгкой степени регистрировалась в 2015г и 2021г, клапан лёгочной артерии без выраженной гипертензии по Д-потоку в 2015г и в 2021г, систолическое давление в лёгочной артерии составляло 28 мм рт. ст. в 2015г и 26 мм рт.ст. в 2021г.
ст. в 2015г и 26 мм рт.ст. в 2021г.
Таблица 1
Параметры ЭхоКГ пациента Н. в период 2015-2021гг
Сокращения: ВТЛЖ — выходной тракт левого желудочка, ЗС — задняя стенка, КДР — конечный диастолический размер, КДО — конечный диастолический объем, КСО — конечный систолический объём, ЛЖ — левый желудочек, ЛП — левое предсердие, МЖП — межжелудочковая перегородка, ФВ — фракция выброса.
Таблица 2
Показатели диастолической функции пациента Н. в период 2015-2021гг
Сокращения: МК — митральный клапан, пик А — пик позднего диастолического наполнения, пик Е — пик раннего диастолического наполнения, пик Em — ранняя диастолическая скорость движения кольца митрального клапана, DT — время замедления пика раннего диастолического наполнения, Е/Еm — соотношение
пиков раннего диастолического наполнения к ранне-диастолическому смещению тканей боковой части митрального кольца, IVRT — время изволюметрического
расслабления.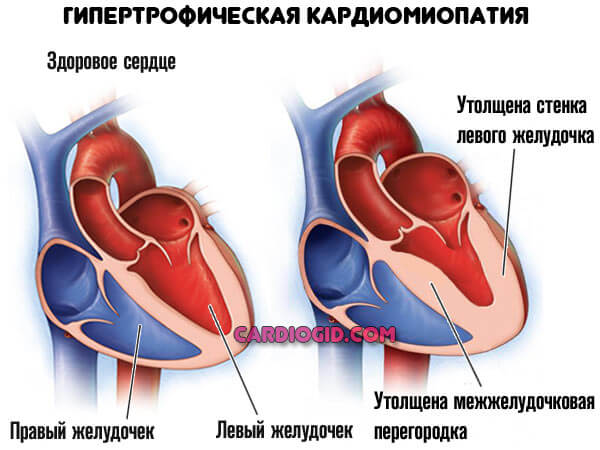
При ЭхоКГ в январе 2021г определялись умеренная ГЛЖ асимметрического характера за счёт утолщения МЖП, преимущественно в базальной части до 1,7 см (рис. 1), дилатация левого предсердия, митрально-септальный контакт ПС МК и хорд МК, обструкция ВТЛЖ, диастолическая дисфункция по псевдонормальному типу, митральная регургитация (табл. 3). Соотношение МЖП/задней стенки ЛЖ 17/11=1,5 (>1,3). Обструкция ВТЛЖ носила латентный характер. Значимый градиент давления в ВТЛЖ в покое был зарегистрирован однократно и составил 177 мм рт.ст. При повторных ЭхоКГ исследованиях градиент давления в ВТЛЖ в покое был в пределах нормы (максимальный 20 23 мм рт.ст.), возрастая после желудочковых экстрасистол до 75-125 мм рт.ст. (рис. 2), а при выполнении пробы Вальсальвы до 30- 40 мм рт.ст. (рис. 3).
Таблица 3
Параметры трансторакальной ЭхоКГ у пациента Н. в январе 2021г
Сокращения: ВТЛЖ — выходной тракт левого желудочка, ЗС — задняя стенка, КДР — конечный диастолический размер, КДО — конечный диастолический объем, КСО — конечный систолический объём, ЛЖ — левый желудочек, ЛП — левое предсердие, МЖП — межжелудочковая перегородка, МК — митральный клапан, ФВ — фракция выброса.
По данным коронароангиографии, включая исследование в январе 2021г, гемодинамически значимых препятствий кровотоку в коронарных артериях не было выявлено. Эндомиокардиальные биопсии проводились в соответствии с установленным протоколом. У пациента наблюдался один эпизод острого клеточного отторжения степенью 2R в мае 2015г, купированный внутривенной пульс-терапией кортикостероидами. Гистологические и иммуногистохимические признаки отторжения отсутствовали. Последняя эндомиокардиальная биопсия была выполнена в июле 2016г. Результаты эндомиокардиальных биопсий были пересмотрены в январе 2021г, однако признаков, характерных для ГКМП, в имеющихся образцах ткани из области верхушки правого желудочка не было выявлено.
Таким образом, у пациента в течение 5 лет после трансплантации сердца развилась асимметрическая ГЛЖ, преимущественно за счёт базального отдела МЖП, сопровождающаяся возникновением обструкции на уровне ВТЛЖ и обратимой митральной недостаточности при физических нагрузках, провокационных пробах.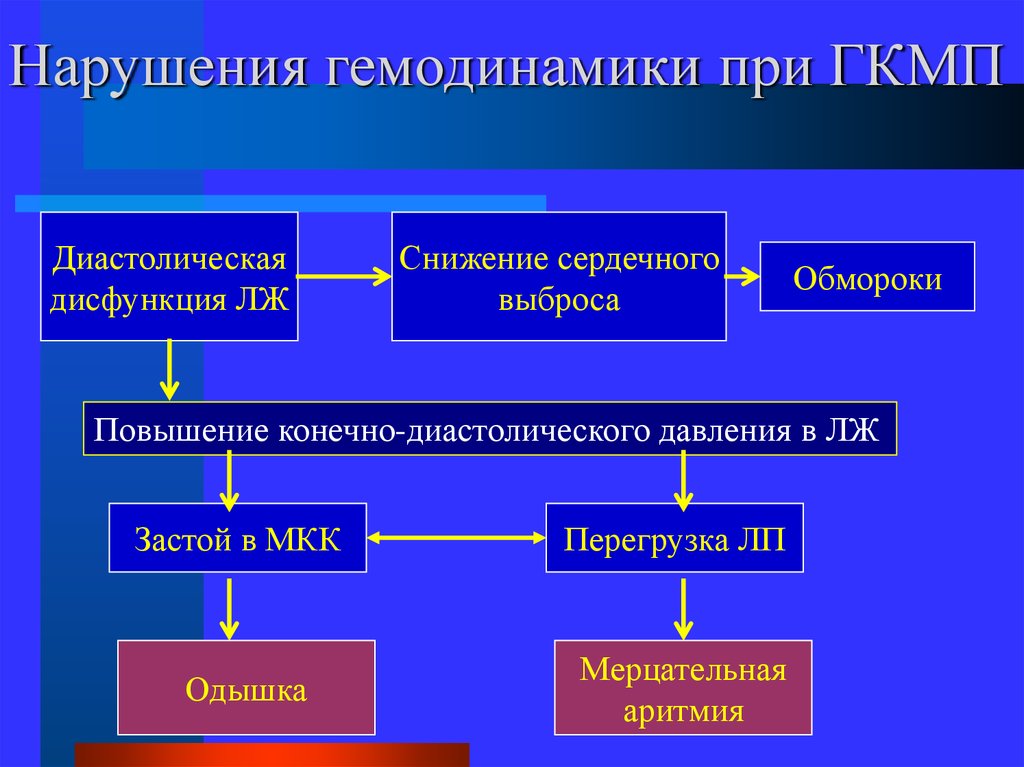 Пациенту выставлен диагноз асимметрической формы ГКМП донорского сердца с латентной обструкцией ВТЛЖ.
Пациенту выставлен диагноз асимметрической формы ГКМП донорского сердца с латентной обструкцией ВТЛЖ.
Рис. 1. В-режим. Парастернальная позиция по длинной оси ЛЖ. Асимметричная гипертрофия миокарда ЛЖ с утолщением миокарда в базальном сегменте.
Рис. 2. В-режим + CW-режим. Апикальная 5-камерная позиция. Исследование кровотока в ВТЛЖ в постоянно-волновом доплеровском режиме (CW-допплер): в покое обструкция отсутствует, во время экстрасистолы повышение градиента давления до 125 мм рт.ст.
Рис. 3. В-режим + CW-режим. Апикальная 5-камерная позиция. Исследование кровотока в ВТЛЖ при поведении пробы Вальсальвы. Прирост систолического градиента, максимальный систолический градиент 82,8 мм рт.ст.
Обсуждение
ГКМП считается наиболее распространенным наследственным сердечно-сосудистым заболеванием (рис. 4) [5][6]. Она характеризующееся гипертрофией преимущественно ЛЖ с отсутствием дилатации камер сердца без признаков другой кардиальной патологии или системных заболеваний, ответственных за развитие гипертрофии. Имеющаяся у нашего пациента артериальная гипертония первой степени хорошо контролировалась гипотензивной терапией и не могла объяснить развитие ГЛЖ. Также у нашего пациента в анамнезе отсутствовали заболевания, которые могли бы вызвать развитие ГЛЖ как часть синдрома.
Имеющаяся у нашего пациента артериальная гипертония первой степени хорошо контролировалась гипотензивной терапией и не могла объяснить развитие ГЛЖ. Также у нашего пациента в анамнезе отсутствовали заболевания, которые могли бы вызвать развитие ГЛЖ как часть синдрома.
Рис. 4. Распространённость ГКМП в общей популяции взрослых людей.
Примечание: * — 1:200 взрослых людей — минимальная распространённость мутантных генов саркомера в общей популяции, 1:500 взрослых людей — распространённость необъяснимой ГЛЖ как главного фенотипического проявления ГКМП, определяемая ЭхоКГ [3]. ** — 1:3000 — распространённость симптомной ГКМП у взрослых в США [4].
Сокращения: ГКМП — гипертрофическая кардиомиопатия, ГЛЖ — гипертрофия левого желудочка, ЭхоКГ — эхокардиография.
Известно, что приём такролимуса может быть причиной ГЛЖ у детей и взрослых. У детей симметричная ГЛЖ развивалась в сроки от 2-3 мес. до четырёх лет после начала приёма такролимуса по поводу трансплантации печени и/или кишечника, почки [7-11]. ГКМП у взрослых реципиентов, получающих такролимус, посвящены описания отдельных случаев и специально спланированные исследования [12-15]. Как у детей, так и у взрослых ГКМП вследствие приёма такролимуса отличали симметрический характер ГЛЖ, как правило без обструкции ВТЛЖ, и её обратимость после отмены такролимуса. У нашего же пациента имелся морфологически иной тип гипертрофии донорского сердца.
ГКМП у взрослых реципиентов, получающих такролимус, посвящены описания отдельных случаев и специально спланированные исследования [12-15]. Как у детей, так и у взрослых ГКМП вследствие приёма такролимуса отличали симметрический характер ГЛЖ, как правило без обструкции ВТЛЖ, и её обратимость после отмены такролимуса. У нашего же пациента имелся морфологически иной тип гипертрофии донорского сердца.
За время наблюдения у нашего пациента развился “классический фенотип” ГКМП донорского сердца с симптомами, обусловленными латентной обструкцией ВТЛЖ. Электрокардиография после ОТС длительное время была без патологии, что наблюдается у 5-25% пациентов с ГКМП. Асимметрическая ГЛЖ с небольшим утолщением стенок и более выраженной гипертрофией единичных сегментов, как в нашем случае, встречается у 1/3 пациентов с ГКМП [16]. Латентный характер обструкции ВТЛЖ в покое у симптомных пациентов с ГКМП продемонстрирован не только в течение нескольких дней между ЭхоКГ исследованиями, но и в течение нескольких минут во время катетеризации сердца [17-19]. По данным исследования Geske JB, et al. (2011), вариабельность спонтанного градиента в ВТЛЖ составила 49,0±53,1 мм рт.ст. в диапазоне от 0 до 210,8 мм рт.ст., а вариабельность градиента в ВТЛЖ после желудочковых экстрасистол значительно коррелировала с вариабельностью градиента ВТЛЖ в покое [19].
По данным исследования Geske JB, et al. (2011), вариабельность спонтанного градиента в ВТЛЖ составила 49,0±53,1 мм рт.ст. в диапазоне от 0 до 210,8 мм рт.ст., а вариабельность градиента в ВТЛЖ после желудочковых экстрасистол значительно коррелировала с вариабельностью градиента ВТЛЖ в покое [19].
На момент проведения ОТС ЭхоКГ донорского сердца не выявила его структурной патологии, что можно объяснить особенностями фенотипических проявлений при ГКМП. В настоящее время определены более тысячи мутаций примерно в 30 генах, ответственных за развитие ГКМП [20]. Большинство форм ГКМП наследуются по аутосомно-доминантному типу, но также описаны митохондриальные и аутосомно-рецессивные паттерны [21-23]. Следствием выраженной генетической гетерогенности является клиническая гетерогенность ГКМП с широким спектром проявлений от носительства мутантных генов (генотип-позитивные-фенотип-негативные лица), бессимптомной ГЛЖ до клинических синдромов сердечной недостаточности, аритмий и внезапной смерти. Например, проспективное исследование Maron BJ, et al. (2001) продемонстрировало разнообразие фенотипических проявлений ГКМП у лиц с мутацией миозин-связывающего протеина С (MYBCP), а также возможность манифестации заболевания в среднем возрасте [24]. Неполная пенетрантность заболевания с отсутствием ГЛЖ во взрослом возрасте наиболее характерна для мутаций гена MYBCP, гена тяжёлых цепей миозина (MYN7) и гена тропонина Т [24-26]. В медицинской литературе уже описан случай, когда, несмотря на адекватный скрининг донора, у женщины 66 лет спустя 19 лет после трансплантации сердца развилась идиопатическая ГКМП со средне-желудочковой обструкцией [27]. В то же время, несмотря на типичную клинико-морфологическую картину обструктивной ГКМП в нашем случае, нельзя полностью исключить влияние такролимуса, хотя в литературе до настоящего времени не описано развитие асимметрической гипертрофии при его применении. Запланирован перевод пациента на эверолимус.
Например, проспективное исследование Maron BJ, et al. (2001) продемонстрировало разнообразие фенотипических проявлений ГКМП у лиц с мутацией миозин-связывающего протеина С (MYBCP), а также возможность манифестации заболевания в среднем возрасте [24]. Неполная пенетрантность заболевания с отсутствием ГЛЖ во взрослом возрасте наиболее характерна для мутаций гена MYBCP, гена тяжёлых цепей миозина (MYN7) и гена тропонина Т [24-26]. В медицинской литературе уже описан случай, когда, несмотря на адекватный скрининг донора, у женщины 66 лет спустя 19 лет после трансплантации сердца развилась идиопатическая ГКМП со средне-желудочковой обструкцией [27]. В то же время, несмотря на типичную клинико-морфологическую картину обструктивной ГКМП в нашем случае, нельзя полностью исключить влияние такролимуса, хотя в литературе до настоящего времени не описано развитие асимметрической гипертрофии при его применении. Запланирован перевод пациента на эверолимус.
Заключение
Данный клинический случай демонстрирует постепенное развитие асимметрической ГКМП донорского сердца с латентной обструкцией ВТЛЖ в течение 5 лет после трансплантации.
С учётом высокой распространённости в общей популяции мутантных генов, ответственных за развитие ГКМП, неполной пенетрантности и наличия догипертрофической стадии ГКМП, необходимо быть готовым встретиться с этой патологией у реципиентов сердечного трансплантата.
Отношения и деятельность: все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
1. Габрусенко С.А., Гудкова А.Я., Козиолова Н.А. и др. Гипертрофическая кардиомиопатия. Клинические рекомендации 2020. Российский кардиологический журнал. 2021;26(5):4541. doi:10.15829/1560-4071-2021-4541.
2. Готье С.В., Шевченко А.О., Попцов В.Н. Пациент с трансплантированным сердцем. Руководство для врачей по ведению пациентов, перенесших трансплантацию сердца. М. Тверь: Триада, 2014. c. 143. ISBN 978-5-94789-648-0.
3. Semsarian C, Ingles J, Maron MS, Maron BJ. New perspectives on the prevalence of hypertrophic cardiomyopathy. J Am Coll Cardiol. 2015;65(12):1249-54.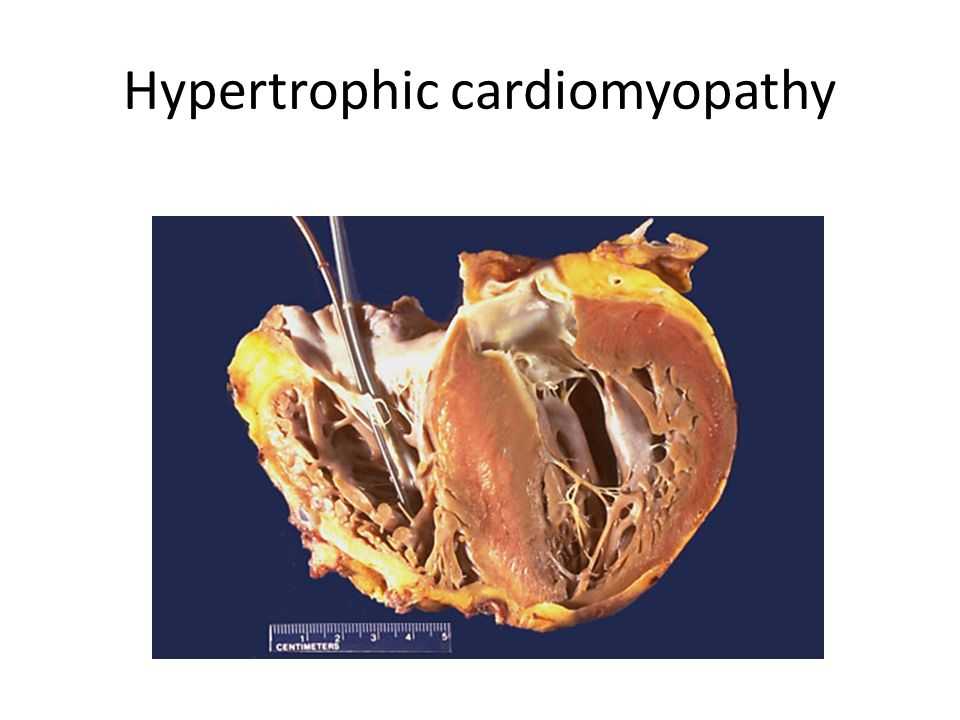 doi:10.1016/j.jacc.2015.01.019.
doi:10.1016/j.jacc.2015.01.019.
4. Maron MS, Hellawell JL, Lucove JC, et al. Occurrence of clinically diagnosed hypertrophic cardiomyopathy in the United States. Am J Cardiol. 2016;117:1651-4. doi:10.1016/j.amjcard.2016.02.044.
5. Martinez HR, Beasley GS, Miller N, et al. Clinical insights into heritable cardiomyopathies. Front Genet. 2021;12:663450. doi:10.3389/fgene.2021.663450.
6. Maron BJ, Rowin EJ, Maron MS. Global Burden of Hypertrophic Cardiomyopathy. JACC Heart Fail. 2018;6(5):376-8. doi:10.1016/j.jchf.2018.03.004.
7. Atkison P, Joubert G, Barron A, et al. Hypertrophic cardiomyopathy associated with tacrolimus in paediatric transplant patients. Lancet. 1995;345(8954):894-6. doi:10.1016/s0140-6736(95)90011-x.
8. Turska-Kmieć A, Jankowska I, Pawłowska J, et al. Reversal of tacrolimus-related hypertrophic cardiomyopathy after conversion to rapamycin in a pediatric liver transplant recipient. Pediatr Transplant. 2007;11(3):319-23. doi:10.1111/j.1399-3046. 2006.00633.x.
2006.00633.x.
9. Jarzembowski TM, John E, Panaro F, et al. Reversal of tacrolimus-related hypertrophic obstructive cardiomyopathy 5 years after kidney transplant in a 6-year-old recipient. Pediatr Transplant. 2005;9(1):117-21. doi:10.1111/j.1399-3046.2005.00260.x.
10. Pappas PA, Weppler D, Pinna AD, et al. Sirolimus in pediatric gastrointestinal transplantation: the use of sirolimus for pediatric transplant patients with tacrolimus-related cardiomyopathy. Pediatr Transplant. 2000;4(1):45-9. doi:10.1034/j.1399-3046.2000.00083.x.
11. Dehghani SM, Haghighat M, Imanieh MH, et al. Tacrolimus related hypertrophic cardiomyopathy in liver transplant recipients. Arch Iran Med. 2010;13(2):116-9.
12. Coley KC, Verrico MM, McNamara DM, et al. Lack of tacrolimus-induced cardiomyopathy. Ann Pharmacother. 2001;35(9):985-9. doi:10.1345/aph.10299.
13. Seino Y, Hori M, Sonoda T. Multicenter prospective investigation on cardiovascular adverse effects of tacrolimus in kidney transplantations. Cardiovasc Drugs Ther. 2003;17(2):141-9. doi:10.1023/a:1025339819051.
Cardiovasc Drugs Ther. 2003;17(2):141-9. doi:10.1023/a:1025339819051.
14. Liu T, Gao Y, Gao YL, et al. Tacrolimus-related hypertrophic cardiomyopathy in an adult cardiac transplant patient. Chin Med J (Engl). 2012;125(7):1352-4. doi:10.3760/cma.j.issn.0366-6999.2012.07.030.
15. Kushwaha SS, Raichlin E, Sheinin Y, et al. Sirolimus affects cardiomyocytes to reduce left ventricular mass in heart transplant recipients. Eur Heart J. 2008;29(22):2742-50. doi:10.1093/eurheartj/ehn407.
16. Maron BJ. Hypertrophic cardiomyopathy: a systematic review. JAMA. 2002;287(10):1308- 20. doi:10.1001/jama.287.10.1308.
17. Kizilbash AM, Heinle SK, Grayburn PA. Spontaneous variability of left ventricular outflow tract gradient in hypertrophic obstructive cardiomyopathy. Circulation. 1998;97:461-6. doi:10.1161/01.cir.97.5.461.
18. Geske JB, Sorajja P, Ommen SR, Nishimura RA. Left ventricular outflow tract gradient variability in hypertrophic cardiomyopathy. Clin Cardiol. 2009;32:397-402. doi:10.1002/clc.20594.
doi:10.1002/clc.20594.
19. Geske JB, Sorajja P, Ommen SR, Nishimura RA. Variability of left ventricular outflow tract gradient during cardiac catheterization in patients with hypertrophic cardiomyopathy. JACC Cardiovasc Interv. 2011;4(6):704-9. doi:10.1016/j.jcin.2011.02.014.
20. Roma-Rodrigues C, Fernandes AR. Genetics of hypertrophic cardiomyopathy: advances and pitfalls in molecular diagnosis and therapy. Appl Clin Genet. 2014;7:195-208. doi:10.2147/TACG.S49126.
21. Jarcho JA, McKenna W, Pare JA, et al. Mapping a gene for familial hypertrophic cardiomyopathy to chromosome 14q1. N Engl J Med. 1989;321(20):1372-8. doi:10.1056/NEJM198911163212005.
22. Konno T, Chang S, Seidman JG, Seidman CE. Genetics of hypertrophic cardiomyopathy. Curr Opin Cardiol. 2010;25(3):205-9. doi:10.1097/HCO.0b013e3283375698.
23. Gersh BJ, Maron BJ, Bonow RO, et al. 2011 ACCF/AHA guideline for the diagnosis and treatment of hypertrophic cardiomyopathy: a report of the American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines. Circulation. 2011;124:e783-831. doi:10.1161/CIR.0b013e318223e2bd.
Circulation. 2011;124:e783-831. doi:10.1161/CIR.0b013e318223e2bd.
24. Maron BJ, Niimura H, Casey SA, et al. Development of left ventricular hypertrophy in adults in hypertrophic cardiomyopathy caused by cardiac myosin-binding protein C gene mutations. J Am Coll Cardiol. 2001;38(2):315-21. doi:10.1016/s0735-1097(01)01386-9.
25. Maass A, Konhilas JP, Stauffer BL, Leinwand LA. From sarcomeric mutations to heart disease: understanding familial hypertrophic cardiomyopathy. Cold Spring Harb Symp Quant Biol. 2002;67:409-15. doi:10.1101/sqb.2002.67.409.
26. Moolman JC, Corfield VA, Posen B, et al. Sudden death due to troponin T mutations. J Am Coll Cardiol. 1997;29(3):549-55. doi:10.1016/s0735-1097(96)00530-x.
27. Abbasi SA, Cheezum MK, Ghosh N, et al. Multimodality imaging of hypertrophic cardiomyopathy in a transplanted heart. Circulation. 2014;130(12):1010-3. doi:10.1161/CIRCULATIONAHA.114.01080
Первичная гипертрофическая кардиомиопатия у детей
Первичная гипертрофическая кардиомиопатия (I 42.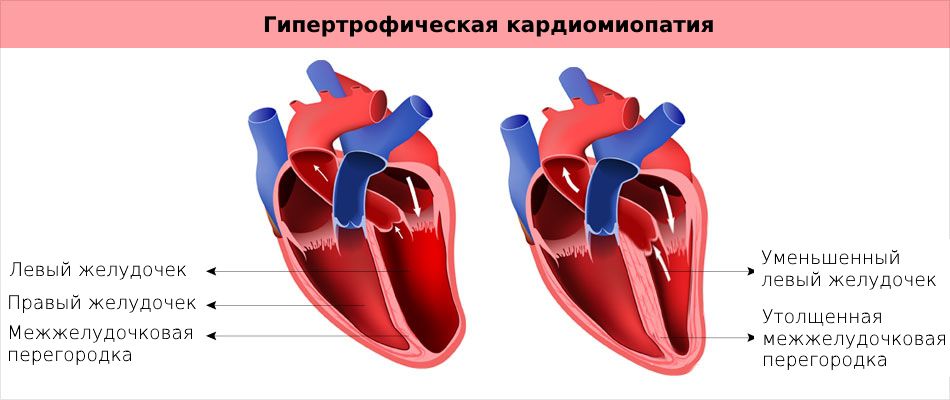 1, I 42.2), согласно определению, приведенному в приказе Министерства здравоохранения (МЗ) Украины № 362 от 19.07.2005 г. «Диагностика и лечение кардиоревматологических заболеваний у детей», — симметричная или асимметричная гипертрофия левого желудочка (ЛЖ), при которой в большей степени поражается межжелудочковая перегородка, чем стенки желудочков, с обструкцией или без обструкции путей оттока крови от желудочков, как правило, не сопровождающаяся расширением полости левого желудочка. При первичной гипертрофической кардиомиопатии (ПГКМП) страдает прежде всего диастолическое расслабление миокарда. Считается генетически обусловленным заболеванием [3].
1, I 42.2), согласно определению, приведенному в приказе Министерства здравоохранения (МЗ) Украины № 362 от 19.07.2005 г. «Диагностика и лечение кардиоревматологических заболеваний у детей», — симметричная или асимметричная гипертрофия левого желудочка (ЛЖ), при которой в большей степени поражается межжелудочковая перегородка, чем стенки желудочков, с обструкцией или без обструкции путей оттока крови от желудочков, как правило, не сопровождающаяся расширением полости левого желудочка. При первичной гипертрофической кардиомиопатии (ПГКМП) страдает прежде всего диастолическое расслабление миокарда. Считается генетически обусловленным заболеванием [3].
Актуальность проблемы ПГКМП обусловлена неблагоприятным прогнозом вследствие высокого риска развития внезапной сердечной смерти, которая достигает, по данным О.А. Мутафьяна, 4–6 % [8], прогрессирования сердечной недостаточности, возникновения жизнеугрожающих нарушений ритма сердца и проводимости, инфаркта миокарда, инсульта.
Согласно результатам исследования G. S. Soor et al. [18], первичная гипертрофическая кардиомиопатия встречается у детей с частотой 5 случаев на 1 миллион. Заболевание диагностируется преимущественно на первом году жизни или в подростковом периоде в зависимости от степени прогрессирования заболевания, наличия или отсутствия обструкции выводного тракта левого желудочка [1, 2, 4, 5, 8, 20]. Мальчики болеют в 2 раза чаще, чем девочки [4, 8, 10].
S. Soor et al. [18], первичная гипертрофическая кардиомиопатия встречается у детей с частотой 5 случаев на 1 миллион. Заболевание диагностируется преимущественно на первом году жизни или в подростковом периоде в зависимости от степени прогрессирования заболевания, наличия или отсутствия обструкции выводного тракта левого желудочка [1, 2, 4, 5, 8, 20]. Мальчики болеют в 2 раза чаще, чем девочки [4, 8, 10].
У 35 % новорожденных и пациентов первого года жизни ПГКМП протекает бессимптомно, поводом для обследования является наличие при аускультации систолического шума в области сердца, у 25 % — признаков сердечной недостаточности II–III степени [1, 8]. У детей старше одного года заболевание может протекать бессимптомно и выявляться случайно при проведении медицинского осмотра или вследствие возникновения жалоб на предобморочные или обморочные состояния, боль в области сердца, сердцебиение, одышку и быструю утомляемость при физической нагрузке, которые являются поводом для углубленного обследования. После появления обструкции выводного отдела левого желудочка наблюдается быстрое прогрессирование симптомов заболевания [3, 4, 20].
После появления обструкции выводного отдела левого желудочка наблюдается быстрое прогрессирование симптомов заболевания [3, 4, 20].
Изолированную гипертрофию миокарда невыясненной природы впервые описали во второй половине XIX века французские патологоанатомы Н. Lionville (1869) и L. Hallopeau (1869) [1]. Исследования 60–70-х годов ХХ века были посвящены главным образом изучению клинических и гемодинамических аспектов субаортальной обструкции, и в Великобритании данная патология впервые была названа обструктивной кардиомиопатией. Под этим названием заболевание вошло в первую классификацию кардиомиопатий J. Goodwin (1964) [1]. Вопрос об этиологии и патогенезе данного заболевания остается дискутабельным. На сегодняшний день описано более 400 мутаций в генах, кодирующих белки миофибриллярного аппарата, предположительно приводящих к ПГКМП. Идентифицировано 12 генов, каждый из которых кодирует компоненты протеина сердечного саркомера и может индуцировать развитие ПГКМП. К ним относят гены b-миозина, миозинсвязывающего белка С, сердечных тропонинов Т, С, I, легких цепей миозина, сердечного a-актина, тайтина, а также протеинкиназы А, гена калиевых потенциалзависимых каналов [15, 18, 20].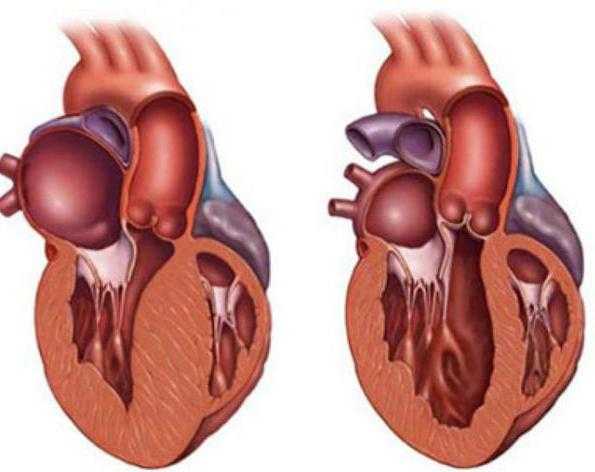 ПГКМП в 40–49 % случаев носит семейный характер, при этом у 70 % родителей и их детей обнаруживаются идентичные формы заболевания. Многие кровные родственники (чаще мужчины) больных ПГКМП погибают от инфаркта миокарда и внезапной остановки сердца в молодом возрасте [4].
ПГКМП в 40–49 % случаев носит семейный характер, при этом у 70 % родителей и их детей обнаруживаются идентичные формы заболевания. Многие кровные родственники (чаще мужчины) больных ПГКМП погибают от инфаркта миокарда и внезапной остановки сердца в молодом возрасте [4].
В генезе первичной гипертрофической кардиомиопатии наряду с генетическими особенностями доказано пролонгированное токсическое кардиодепрессивное влияние соединений металлов (кадмия, свинца, ртути, сурьмы, меди, кобальта, цинка и др.) [7, 13, 14, 16, 19]. В настоящее время наиболее полно изучено влияние дефицита селена на возникновение гипертрофии миокарда, получившее название «болезнь Кешана». При микроскопическом исследовании в миокарде при этом заболевании выявляют множественные очаги некроза с гибелью кардиомиоцитов и прогрессирующий фиброз [7, 21].
Патофизиологические нарушения при данном заболевании представлены на рис. 1 [6].
Диагностические критерии первичной гипертрофической кардиомиопатии включают жалобы, данные анамнеза заболевания и жизни, результаты объективного и дополнительных методов обследования.
Пациенты с ПГКМП наиболее часто предъявляют жалобы на одышку, кардиалгии при физической нагрузке и/или в покое; ощущение усиленного и/или учащенного сердцебиения, перебоев в работе сердца; головокружение; синкопальные и пресинкопальные состояния при резкой перемене положения тела, физической нагрузке.
В анамнезе жизни обращает внимание наличие среди близких родственников больного жизнеугрожающих нарушений ритма сердца и проводимости, случаев внезапной смерти, инфарктов, инсультов в молодом возрасте.
При объективном осмотре следует отметить усиленный разлитой верхушечный толчок, смещенный влево, тахикардию различной степени выраженности, смещение границ сердца влево и вверх, систолический шум на верхушке и в 3–4-м межреберьях слева у края грудины, тенденцию к снижению систолического и пульсового артериального давления [1, 3, 8, 9, 16, 18].
Диагноз ПГКМП устанавливается по данным эхокардиографии (ЭхоКГ). Дополнительными методами обследования являются: электрокардиография, рентгенография органов грудной клетки, магнитно-резонансная томография (МРТ), катетеризация полостей сердца, радионуклидные исследования, сердечно-легочные нагрузочные пробы, эндомиокардиальная биопсия, генетическое исследование [9, 11, 15, 18].
Лечение ПГКМП осуществляется согласно приказу МЗ Украины № 362 от 19.07.2005 г. «Диагностика и лечение кардиоревматологических заболеваний у детей» [3] и соответствует рекомендациям T.R. Harrison [16], G.S. Soor et al. [18]:
1. Ограничение физических нагрузок.
2. Прием b-адреноблокаторов.
3. При наличии противопоказаний к приему b-адреноблокаторов возможно применение антагонистов кальция (верапамил), однако данная группа препаратов обладает выраженными вазодилататорными свойствами и должна применяться с крайней осторожностью у пациентов с обструктивной ГКМП (при соответствующем мониторинге).
4. Сердечные гликозиды и другие кардиотонические средства противопоказаны, так как они путем повышения частоты сердечных сокращений могут приводить к нарастанию степени обструкции в систолу.
5. Показана вторичная профилактика инфекционного эндокардита.
6. При нарушениях сердечного ритма рекомендуется соответствующее лечение.
7. При наличии сердечной недостаточности — назначение ингибиторов АПФ и диуретиков. Однако, согласно данным T.R. Harrison [16], G.S. Soor et al. [18], ингибиторы АПФ должны быть исключены у пациентов с обструкцией выводного отдела левого желудочка, так как они могут провоцировать или усиливать левожелудочковую обструкцию выносящего тракта.
Однако, согласно данным T.R. Harrison [16], G.S. Soor et al. [18], ингибиторы АПФ должны быть исключены у пациентов с обструкцией выводного отдела левого желудочка, так как они могут провоцировать или усиливать левожелудочковую обструкцию выносящего тракта.
8. Пациентам с обструктивной ПГКМП при наличии градиента давления более 45 мм рт.ст. или неэффективности консервативной терапии показано хирургическое лечение [3, 16, 18].
Так как данное заболевание может протекать длительное время бессимптомно, одна нормальная эхокардиограмма у ребенка из семьи, где у одного из родителей диагностирована первичная гипертрофическая кардиомиопатия, не исключает наличия заболевания. Диспансерное наблюдение за детьми из группы риска следует осуществлять путем проведения эхокардиографии каждые 12–24 месяца, если не представляется возможным сделать генетическое обследование [16]. Дети с установленным диагнозом первичной гипертрофической кардиомиопатии находятся под диспансерным наблюдением участкового педиатра или семейного врача и кардиоревматолога пожизненно, осмотр в первые 4 месяца после выписки из стационара проводится 1 раз в месяц, затем — каждые 3 месяца, со 2-го года наблюдения — 1 раз в 6 месяцев [3].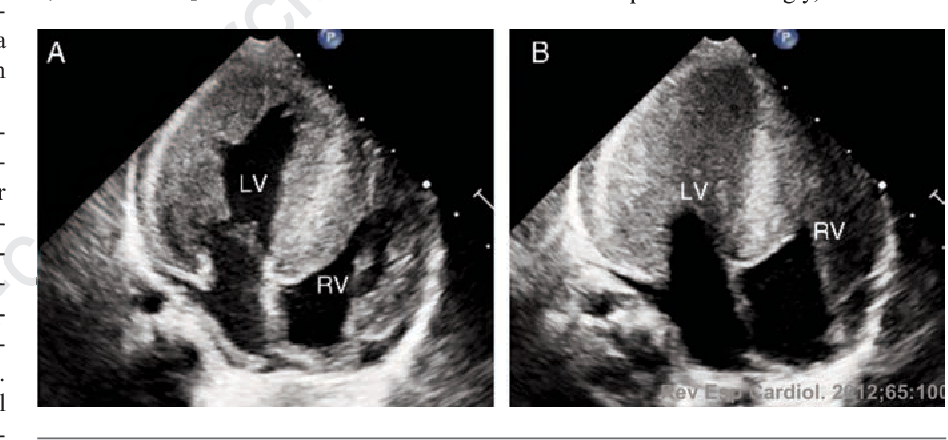
В качестве иллюстрации к вышеизложенному приводим собственное наблюдение.
Ребенок Сергей Т., 13 лет, находился в отделении детской кардиологии, кардиохирургии и реабилитации Государственного учреждения «Институт неотложной и восстановительной хирургии им. В.К. Гусака НАМН Украины» (ИНВХ) в марте — апреле 2011 г.
При поступлении мальчик предъявлял жалобы на одышку при физической нагрузке (подъем на 4-й этаж). Из анамнеза известно, что самочувствие ухудшилось за две недели до госпитализации, когда без видимой причины мальчик впервые потерял сознание. Ребенок помнит себя до момента потери сознания (получал костюмы для участия в театральном представлении, стоял у стены) и спустя сутки в реанимационном отделении областной детской клинической больницы (ОДКБ) г. Донецка. Со слов лиц, находившихся в момент синкопе рядом с мальчиком, синкопальное состояние сопровождалось судорогами, многократной рвотой, непроизвольным мочеиспусканием, психомоторным возбуждением, которое потребовало введения сибазона. Ребенку выполняли искусственное дыхание, непрямой массаж сердца, внутривенно вводили кордиамин, адреналин, дексаметазон. Мальчик в течение 9 суток находился в реанимационном отделении, затем в течение 5 суток — в неврологическом отделении ОДКБ г. Донецка, где причина данного состояния была определена как преходящее нарушение мозгового кровообращения, впервые было проведено ЭхоКГ: выявлена выраженная гипертрофия миокарда левого желудочка; снижение насосной и сократительной функции миокарда левого желудочка; нарушение диастолической функции левого желудочка; недостаточность митрального, аортального клапанов и клапана легочной артерии 1-й степени. На основании полученных результатов впервые установлен диагноз: идиопатическая гипертрофическая кардиомиопатия, в связи с чем ребенок был направлен для дальнейшего обследования и лечения в отделение детской кардиологии, кардиохирургии и реабилитации ИНВХ.
Ребенку выполняли искусственное дыхание, непрямой массаж сердца, внутривенно вводили кордиамин, адреналин, дексаметазон. Мальчик в течение 9 суток находился в реанимационном отделении, затем в течение 5 суток — в неврологическом отделении ОДКБ г. Донецка, где причина данного состояния была определена как преходящее нарушение мозгового кровообращения, впервые было проведено ЭхоКГ: выявлена выраженная гипертрофия миокарда левого желудочка; снижение насосной и сократительной функции миокарда левого желудочка; нарушение диастолической функции левого желудочка; недостаточность митрального, аортального клапанов и клапана легочной артерии 1-й степени. На основании полученных результатов впервые установлен диагноз: идиопатическая гипертрофическая кардиомиопатия, в связи с чем ребенок был направлен для дальнейшего обследования и лечения в отделение детской кардиологии, кардиохирургии и реабилитации ИНВХ.
Изменения в сердце впервые выявлены у ребенка в 7-месячном возрасте, когда педиатр выслушал систолический шум над предсердечной областью, заподозрил врожденный порок сердца и рекомендовал консультацию кардиолога. На ЭКГ была зарегистрирована синусовая тахикардия с частотой сердечных сокращений (ЧСС) 160 уд/мин, замедление внутрижелудочковой проводимости, нарушение процессов реполяризации. Ребенок был осмотрен кардиологом и поставлен на диспансерный учет с диагнозом «функциональная кардиопатия. Врожденный порок сердца?» Рекомендованная ЭхоКГ не проведена. О дальнейшем наблюдении за мальчиком медицинской документации нет. На рентгенограмме органов грудной клетки в возрасте 10 лет имела место митральная конфигурация сердца, в 13 лет — шарообразная форма сердца, дальнейший диагностический поиск выявленных изменений не был продолжен. В неврологическом отделении в марте 2011 г. выполнена фоновая электроэнцефалография (ЭЭГ), по данным которой исключен эписиндром. На МРТ головного мозга обнаружено умеренное расширение подоболочечных пространств в лобно-теменных областях, незначительное расширение передних рогов и тел боковых желудочков, кистозное расширение большой цистерны мозга. Мальчик воспитывался в школе-интернате и был доставлен в отделение без родственников.
На ЭКГ была зарегистрирована синусовая тахикардия с частотой сердечных сокращений (ЧСС) 160 уд/мин, замедление внутрижелудочковой проводимости, нарушение процессов реполяризации. Ребенок был осмотрен кардиологом и поставлен на диспансерный учет с диагнозом «функциональная кардиопатия. Врожденный порок сердца?» Рекомендованная ЭхоКГ не проведена. О дальнейшем наблюдении за мальчиком медицинской документации нет. На рентгенограмме органов грудной клетки в возрасте 10 лет имела место митральная конфигурация сердца, в 13 лет — шарообразная форма сердца, дальнейший диагностический поиск выявленных изменений не был продолжен. В неврологическом отделении в марте 2011 г. выполнена фоновая электроэнцефалография (ЭЭГ), по данным которой исключен эписиндром. На МРТ головного мозга обнаружено умеренное расширение подоболочечных пространств в лобно-теменных областях, незначительное расширение передних рогов и тел боковых желудочков, кистозное расширение большой цистерны мозга. Мальчик воспитывался в школе-интернате и был доставлен в отделение без родственников. Из анамнеза жизни, согласно амбулаторной карте, известно, что ребенок от 1-й беременности, протекавшей с токсикозом первой половины. Родился в срок с массой тела 2700 г, оценкой по шкале Апгар 7-7 баллов, задержкой внутриутробного развития, множественными стигмами дизэмбриогенеза. К груди приложен на 2-е сутки в связи с асфиксией в родах. С месячного возраста находился на искусственном вскармливании. На первом году жизни наблюдался по поводу гипотрофии II ст. и рахита, отставал в статомоторном и психоэмоциональном развитии. Ребенок вакцинирован по календарю. В 5 лет перенес ветряную оспу. С 2006 года состоит на диспансерном учете у окулиста по поводу внутреннего косоглазия, глубокой амблиопии.
Из анамнеза жизни, согласно амбулаторной карте, известно, что ребенок от 1-й беременности, протекавшей с токсикозом первой половины. Родился в срок с массой тела 2700 г, оценкой по шкале Апгар 7-7 баллов, задержкой внутриутробного развития, множественными стигмами дизэмбриогенеза. К груди приложен на 2-е сутки в связи с асфиксией в родах. С месячного возраста находился на искусственном вскармливании. На первом году жизни наблюдался по поводу гипотрофии II ст. и рахита, отставал в статомоторном и психоэмоциональном развитии. Ребенок вакцинирован по календарю. В 5 лет перенес ветряную оспу. С 2006 года состоит на диспансерном учете у окулиста по поводу внутреннего косоглазия, глубокой амблиопии.
Семейный анамнез отягощен: у отца неуточненное заболевание сердца (медицинской документации нет). Второй ребенок в семье инвалид, отстает в умственном развитии, имеет хромосомные нарушения. Третий ребенок здоров.
Самочувствие мальчика при поступлении удовлетворительное, состояние средней степени тяжести, обусловленное признаками сердечной недостаточности. Подросток несколько заторможен, с опозданием отвечает на вопросы, интеллект снижен. Астенического телосложения, пониженного питания. Череп уплощен с боков, имеет место асимметрия глазных щелей, S < D. Выраженное сходящееся косоглазие, нистагмоидное подергивание глазных яблок. Легкая девиация языка вправо. Мышечный тонус в руках нормальный; рефлексы с рук S > D; коленные и ахилловы повышены, D > S. Пальцы кистей и стоп длинные, выражена сандалевидная щель, неполная синдактилия второго и третьего пальцев стоп, высокий свод стопы. На передней поверхности брюшной стенки слева имеется фиброзный узелок диаметром до 0,5 см, плотный, спаянный с подкожно-жировой клетчаткой, безболезненный. Кожа сухая, бледная, ангулярный хейлит. Выраженный диспластический рост зубов. Миндалины с гипертрофией I степени, рыхлые. Грудная клетка узкая, уплощена в переднезаднем размере. Сколиоз грудного отдела позвоночника I степени. Над легкими перкуторно легочный звук, аускультативно жесткое дыхание, частота дыхания — 18/мин, хрипов нет.
Подросток несколько заторможен, с опозданием отвечает на вопросы, интеллект снижен. Астенического телосложения, пониженного питания. Череп уплощен с боков, имеет место асимметрия глазных щелей, S < D. Выраженное сходящееся косоглазие, нистагмоидное подергивание глазных яблок. Легкая девиация языка вправо. Мышечный тонус в руках нормальный; рефлексы с рук S > D; коленные и ахилловы повышены, D > S. Пальцы кистей и стоп длинные, выражена сандалевидная щель, неполная синдактилия второго и третьего пальцев стоп, высокий свод стопы. На передней поверхности брюшной стенки слева имеется фиброзный узелок диаметром до 0,5 см, плотный, спаянный с подкожно-жировой клетчаткой, безболезненный. Кожа сухая, бледная, ангулярный хейлит. Выраженный диспластический рост зубов. Миндалины с гипертрофией I степени, рыхлые. Грудная клетка узкая, уплощена в переднезаднем размере. Сколиоз грудного отдела позвоночника I степени. Над легкими перкуторно легочный звук, аускультативно жесткое дыхание, частота дыхания — 18/мин, хрипов нет. Границы сердца расширены в поперечнике: правая на 1 см кнаружи от правого края грудины, верхняя — второе ребро, левая — передняя аксиллярная линия. Тоны сердца ослаблены, при переходе в горизонтальное положение выслушивается ритм галопа. Верхушечный толчок усилен, систолический шум в I и V точках. ЧСС в вертикальном положении — 90 уд/мин, ЧСС в горизонтальном положении — 82 уд/мин. Артериальное давление (АД) на левой руке — 100/60 мм рт.ст., на правой руке — 90/50 мм рт.ст. Живот доступен глубокой пальпации, болезненный в правом подреберье. Печень на 2 см ниже края реберной дуги, отмечается болезненность в точке Кера. Селезенка не пальпируется. Периферических отеков нет. Стул регулярный. Мочеиспускание не нарушено.
Границы сердца расширены в поперечнике: правая на 1 см кнаружи от правого края грудины, верхняя — второе ребро, левая — передняя аксиллярная линия. Тоны сердца ослаблены, при переходе в горизонтальное положение выслушивается ритм галопа. Верхушечный толчок усилен, систолический шум в I и V точках. ЧСС в вертикальном положении — 90 уд/мин, ЧСС в горизонтальном положении — 82 уд/мин. Артериальное давление (АД) на левой руке — 100/60 мм рт.ст., на правой руке — 90/50 мм рт.ст. Живот доступен глубокой пальпации, болезненный в правом подреберье. Печень на 2 см ниже края реберной дуги, отмечается болезненность в точке Кера. Селезенка не пальпируется. Периферических отеков нет. Стул регулярный. Мочеиспускание не нарушено.
Ребенку были выполнены следующие обследования.
Клинический анализ крови при поступлении: эритроциты — 3,6 Т/л, ретикулоциты — 4 %, плазматические клетки — 31, гемоглобин — 128 г/л, цветовой показатель — 1,0, лейкоциты — 4,9 Г/л, эозинофилы — 2 %, палочкоядерные нейтрофилы — 2 %, сегментоядерные нейтрофилы — 59 %, лимфоциты — 30 %, моноциты — 7 %, скорость оседания эритроцитов (СОЭ) — 8 мм/час.
Глюкоза крови — 4,04 ммоль/л.
Общий анализ мочи при поступлении: уд. вес — 1013, реакция кислая, белок — 0,05 г/л, сахара нет, лейкоциты — 3–5 в п/зр, эпителий — ед. в п/зр.
При повторном общем анализе мочи через 14 дней от момента поступления: уд. вес — 1017, реакция кислая, белка, сахара нет, лейкоциты — 2–4 в п/зр, эпителий — ед. в п/зр.
Соскоб на энтеробиоз — отрицательный. Яйца гельминтов, простейшие не обнаружены.
С-реактивный белок — 4 мг/л, орозомукоид — 0,16 усл.ед., АСТ — 1,02 ммоль/л, АЛТ — 1,16 ммоль/л, билирубин общий — 15 ммоль/л, прямой — 3,75 ммоль/л, непрямой — 11,25 ммоль/л, остаточный азот — 1,42 ммоль/л, мочевина — 3,05 ммоль/л, креатинин — 0,045 ммоль/л (все показатели в пределах нормы).
Проведено качественное определение мозгового натрийуретического пептида с помощью CITO TEST — результат положительный.
Тропонин Т: 0,25 мг/мл (норма 0–0,01 нг/мл).
Электролиты крови: натрий — 144 ммоль/л, калий — 4,2 ммоль/л (норма).
При проведении спектрального многоэлементного анализа волос был выявлен резкий дефицит макроэлемента калия (в 2 раза ниже нормы), выраженный дефицит микроэлементов селена (в 3 раза ниже нормы), кобальта (в 2 раза ниже нормы), хрома (в 2 раза ниже нормы), умеренный дефицит марганца (на 70 % ниже нормы), содержание железа у нижней границы нормы.
При оценке исходного вегетативного тонуса — симпатикотония.
Стандартная ЭКГ при поступлении: ритм синусовый, ЧСС 90 уд/мин, отклонение электрической оси сердца влево (угол a — 11°), p-mitrale во II отведении, высокий комплекс QRS в V5-V6, элевация ST во всех отведениях.
ЭхоКГ при поступлении: выраженная гипертрофия межжелудочковой перегородки без значимой обструкции выводного тракта левого желудочка (градиент давления — 20 мм рт.ст.), гипокинезия межжелудочковой перегородки, увеличение левых отделов сердца, снижение сократительной способности миокарда. Коронарные артерии отходят обычно.
При проведении суточного мониторирования ЭКГ и АД в марте 2011 г. в течение времени наблюдения регистрировался синусовый ритм. Тахикардия ночью. ЧСС днем в пределах нормы (минимальная — 76 уд/мин, максимальная — 108 уд/мин, средняя — 90 уд/мин). Циркадный индекс ЧСС — 1,13 (снижен) за счет тахикардии ночью. Наджелудочковая и желудочковая эктопическая активность не обнаружена. Зарегистрированы ишемические изменения в сердце: элевация сегмента ST-T на 3 мм в отведениях, характеризующих потенциалы переднебоковой и заднебоковой стенок левого желудочка. Значимых изменений интервала QT в течение суток не выявлено. Вариабельность ритма сердца сохранена. Цифры диастолического давления в течение суток характерны для гипотензии, цифры систолического давления — в пределах нормы. Циркадный индекс систолического давления — 10 %, циркадный индекс диастолического давления — 20 %. Снижение систолического и диастолического давления ночью в пределах нормы. Вариабельность систолического и диастолического давления в течение суток в пределах нормы.
в течение времени наблюдения регистрировался синусовый ритм. Тахикардия ночью. ЧСС днем в пределах нормы (минимальная — 76 уд/мин, максимальная — 108 уд/мин, средняя — 90 уд/мин). Циркадный индекс ЧСС — 1,13 (снижен) за счет тахикардии ночью. Наджелудочковая и желудочковая эктопическая активность не обнаружена. Зарегистрированы ишемические изменения в сердце: элевация сегмента ST-T на 3 мм в отведениях, характеризующих потенциалы переднебоковой и заднебоковой стенок левого желудочка. Значимых изменений интервала QT в течение суток не выявлено. Вариабельность ритма сердца сохранена. Цифры диастолического давления в течение суток характерны для гипотензии, цифры систолического давления — в пределах нормы. Циркадный индекс систолического давления — 10 %, циркадный индекс диастолического давления — 20 %. Снижение систолического и диастолического давления ночью в пределах нормы. Вариабельность систолического и диастолического давления в течение суток в пределах нормы.
Спиральная компьютерная томография головного мозга в марте 2011 г. : умеренно расширены подоболочечные пространства в лобно-теменных областях (в т.ч. сильвиевы щели). Незначительно расширены передние рога и тела боковых желудочков. Расширена большая цистерна мозга 2,0 ґ 2,2 см.
: умеренно расширены подоболочечные пространства в лобно-теменных областях (в т.ч. сильвиевы щели). Незначительно расширены передние рога и тела боковых желудочков. Расширена большая цистерна мозга 2,0 ґ 2,2 см.
Фоновая ЭЭГ в марте 2011 г.: диффузные изменения без признаков локальной патологии. Признаков пароксизмальной активности не обнаружено.
Рентгенография органов грудной клетки в феврале 2011 г.: неоднородное затемнение правого легкого в виде разнокалиберных очаговых и фокусных теней. Слева — эмфизематозность. Сердце расширено в поперечнике, шаровидной формы, кардиоторакальный объем — 60. Средостение и синусы в норме.
Ультразвуковая допплерография сосудов головы и шеи в марте 2011 г.: снижение скорости по мозговым артериям до 15 %. Дефицит кровотока по интракраниальному сегменту левой позвоночной артерии до 40 %. Признаки затруднения венозного оттока из полости черепа. Признаки умеренной внутричерепной гипертензии, дистония яремных вен.
Ребенок консультирован окулистом: диагностирована частичная атрофия зрительных нервов, сходящееся косоглазие.
Проведенное углубленное обследование позволяет установить диагноз: первичная асимметричная гипертрофическая кардиомиопатия, субаортальный гипертрофический стеноз с невыраженной обструкцией выводного тракта левого желудочка (градиент давления — 20 мм рт.ст.), ХСН IIА, недифференцированная дисплазия соединительной ткани 1-й (максимальной) степени: сколиоз грудного отдела позвоночника, диспластический рост зубов, искривление носовой перегородки, сходящееся косоглазие, гиперметропия слабой степени, выраженная сандалевидная щель, неполная синдактилия второго и третьего пальцев стоп, высокий свод стопы, крипторхизм.
Мальчик получал в отделении следующее лечение: диета № 5, поляризующая смесь в/в капельно (5% р-р глюкозы — 200,0 мл, 5% р-р аспаркама — 5,0 мл, 5% р-р милдроната — 5,0 мл в/в струйно в конце инфузии) со дня поступления в течение 10 суток, анаприлин по 10 мг 3 раза/сутки под контролем ЧСС и АД с 5-х суток пребывания в стационаре в течение 3 дней, а с 9-х суток — по 10 мг утром и в обед, 20 мг — вечером; милдронат по 1 таб. 3 раза/сутки, аспаркам по 1 таб. 3 раза/сутки.
3 раза/сутки, аспаркам по 1 таб. 3 раза/сутки.
В течение времени пребывания в отделении под воздействием проводимого лечения отмечена положительная динамика в самочувствии и состоянии ребенка: уменьшилась выраженность одышки, повысилась толерантность к физической нагрузке. При выписке были даны рекомендации: диспансерное наблюдение у участкового педиатра и кардиолога, домашнее обучение, анаприлин по 20 мг 3 раза в сутки, тиотриазолин 0,1 по 1 таблетке 3 раза в сутки в течение 1 месяца, ЭКГ 1 раз в неделю, ЭхоКГ повторить через 3 месяца, консультация в клинике через 1 месяц. С учетом резкого дефицита калия после выписки из стационара пациенту была рекомендована диета, богатая калием (курага, чернослив, изюм, бананы и др.), панангин по 1 таб. 3 раза/сутки в течение 2 месяцев с повторным спектральным анализом волос. Выраженный дефицит селена и кобальта послужил основанием для назначения цефаселя по 1 таб. 2 раза в сутки и нейровитана по 1 таб. 3 раза в сутки в течение 1 месяца.
Катамнез наблюдения за мальчиком составил 12 месяцев, на протяжении которых он отмечал удовлетворительное самочувствие, продолжал принимать анаприлин в дозе 60 мг/сут (1,8 мг/кг) в 3 приема под контролем самочувствия, ЧСС и АД, через 6 месяцев получил повторный курс кардиотрофической терапии (тиотриазолин по 1 таблетке 3 раза в сутки). Сохранялась незначительная одышка (до 25 дыханий в минуту) при физической нагрузке. ЭКГ и ЭхоКГ без отрицательной динамики.
Сохранялась незначительная одышка (до 25 дыханий в минуту) при физической нагрузке. ЭКГ и ЭхоКГ без отрицательной динамики.
Прогноз для жизни и для выздоровления мальчика был неблагоприятным вследствие очень высокого риска внезапной сердечной смерти (ВСС) [1, 4, 11, 17, 22], критериями оценки которого являлись: молодой возраст пациента (до 14 лет), синкопальное состояние в анамнезе, наличие тахикардии ночью по результатам суточного мониторирования ЭКГ, смерть отца в молодом возрасте от неустановленного заболевания сердца. Летом 2012 года во время купания в реке мальчик утонул. Обстоятельства гибели ребенка неизвестны. Причиной смерти могло стать синкопальное состояние, остановка сердца. Результаты патологоанатомического вскрытия подтвердили клинический диагноз: асимметричная гипертрофическая кардиомиопатия, субаортальный гипертрофический стеноз с невыраженной обструкцией выводного тракта левого желудочка.
Таким образом, гипертрофическая кардиомиопатия характеризуется неблагоприятным прогнозом для жизни и выздоровления вследствие высокого риска развития жизнеугрожающих нарушений ритма сердца и проводимости, инфаркта миокарда, инсульта, внезапной сердечной смерти, неуклонного прогрессирования симптомов сердечной недостаточности. Дети с установленным диагнозом нуждаются в углубленном обследовании и пожизненном динамическом наблюдении, а их родственникам необходимо проведение ЭхоКГ ежегодно. Особенностями данного клинического случая являются отставание мальчика в статомоторном и психоэмоциональном развитии на первом году жизни, длительное бессимптомное течение заболевания, первыми признаками которого явилось синкопальное состояние у ребенка, что послужило поводом для углубленного обследования и установления диагноза. Данный случай демонстрирует, что поздняя диагностика и отсутствие своевременного лечения способствуют прогрессированию заболевания и ухудшению прогноза, увеличивая риск внезапной сердечной смерти.
Дети с установленным диагнозом нуждаются в углубленном обследовании и пожизненном динамическом наблюдении, а их родственникам необходимо проведение ЭхоКГ ежегодно. Особенностями данного клинического случая являются отставание мальчика в статомоторном и психоэмоциональном развитии на первом году жизни, длительное бессимптомное течение заболевания, первыми признаками которого явилось синкопальное состояние у ребенка, что послужило поводом для углубленного обследования и установления диагноза. Данный случай демонстрирует, что поздняя диагностика и отсутствие своевременного лечения способствуют прогрессированию заболевания и ухудшению прогноза, увеличивая риск внезапной сердечной смерти.
Bibliography
1. Белозеров Ю.М. Детская кардиология / Ю.М. Белозеров. — М.: МЕДпресс-информ, 2004. — 600 с.: ил.
2. Кардіологія дитячого і підліткового віку: Наук.-практ. посіб. / П.С. Мощич, Ю.В. Марушко, С.О. Бабко та ін. / За ред. П.С. Мощича, Ю.В. Марушка. — К.: Вища шк., 2006. — 422 с.
— К.: Вища шк., 2006. — 422 с.
3. Клінічні протоколи надання медичної допомоги (Педіатрія): Нормативне виробниче видання. — К.: МНІАЦ медичної статистики; МВЦ «Медінформ», 2005. — C. 332-333.
4. Леонтьева И.В. Лекции по кардиологии детского возраста / И.В. Леонтьева. — М.: ИД «Медпрактика», 2005. — 536 с.
5. Лимаренко М.П. Случай гипертрофической кардиомиопатии у больного 16 лет / М.П. Лимаренко, Ю.Ю. Ткаченко, Т.В. Смирнова // Здоровье ребенка. — 2008. — № 3 (12). — С. 96-99.
6. Майданник В.Г. Педиатрия: Учебник для студентов III–IV уровней аккредитации. — 2-е изд., испр. и доп. / В.Г. Майданник. — Харьков: Фолио, 2002. — 1125 с.
7. Медицинская токсикология: диагностика и лечение отравлений у человека: В 2 томах / Под ред. Метьюдж-Элленхорн. — М.: Медицина, 2003. — Т. 2. — 578 с.
8. Мутафьян О.А. Кардиомиопатии у детей и подростков / О.А. Мутафьян. — СПб.: Диалект, 2003. — 272 с.
9. Острополец С.С. Миокард. Структура и функция в норме и патологии / С. С . Острополец. — Донецк: Норд пресс, 2007. — 242 с.
С . Острополец. — Донецк: Норд пресс, 2007. — 242 с.
10. Практическое руководство по детским болезням: В 3 томах / Под ред. В.Ф. Коколиной, А.Г. Румянцева. — М.: Медпрактика-М, 2004. — Т. 3. — 744 с.
11. Современные подходы к лечению больных гипертрофической кардиомиопатией / С.А. Габрусенко, Ю.В. Сафрыгина, В.Г. Наумов и др. // Лечащий врач. — 2004. — № 2. — С. 32-37.
12. Шиляев Р.Р. Дисплазия соединительной ткани и ее связь с патологией внутренних органов у детей и взрослых / Р.Р. Шиляева, С.Н. Шальнова // Вопросы современной педиатрии. — 2003. — Т. 2, № 5. — С. 61-67.
13. Cadmium toxicity related to cysteine metabolism and glutathione levels in frog Rana ridibunda tissues / P. Sura, N. Ristic, P. Bronowicka. et al. // Comp. Biochem. Physiol. Toxicol. Pharmacol. — 2006. — Vol. 142, № 1–2. — P. 128-135.
14. Evaluation of toxic metals in biological samples (scalp hair, blood and urine) of steel mill workers by electrothermal atomic absorption spectrometry / H. I. Afridi, T.G. Kazi, M.K. Jamali et al. // Toxicol. Ind. Health. — 2006. — Vol. 22, № 9. — P. 381-393.
I. Afridi, T.G. Kazi, M.K. Jamali et al. // Toxicol. Ind. Health. — 2006. — Vol. 22, № 9. — P. 381-393.
15. Gajewski K.K. Sudden cardiac death in children and adolescents (excluding Sudden Infant Death Syndrome) / K.K. Gajewski, J.P. Saul // Ann. Pediatr. Cardiol. — 2010. — Vol. 3, № 2. — P. 107-112.
16. Harrison T.R. Harrison’s Princepls of internal medicine 17th edition / Mc graw hill medical/ — 2008. — 3352 p.
17. Hess O.M. Risk stratification in hypertrophic cardiomyopathy / O.M. Hess // J. Am. Coll. Cardiol. — 2003. — Vol. 42, № 5. — P. 880-881.
18. Hypertrophic cardiomyopathy: current understanding and treatment objectives / G.S. Soor, A. Luk, E. Ahn et al. // Journal of Clinical Pathology. — 2009. — Vol. 62 (3). — P. 226-235.
19. Marked Elevation of Myocardial Trace Elements in Idiopathic Dilated Cardiomyopathy Compared With Secondary Cardiac Dysfunction / A. Frustaci, G.S. Soor, A. Luk et al. // JACC. — 1999. — Vol. 33, № 6. — P. 1578-583.
20. RAAS gene polymorphisms influence progression of pediatric hypertrophic cardiomyopathy / B.D. Kaufman, S. Auerbach, S. Reddy et al. // Hum Genet. — 2007. — Vol. 122, № 5. — P. 515-523.
21. Selenium deficiency and miscarriage: a possible link / J.W. Barrington, P. Lindsay, D. James et al. // Br. J. Obstet. Gynaecolol. — 1996. — Vol. 103. — P. 130-132.
22. Sudden death in hypertrophic cardiomyopathy. Identification of high risk patients / P.M. Elliott, J. Poloniecki, S. Dickie et al. // J. Am. Coll. Cardiol. — 2000. — Vol. 36, № 7. — P. 2212-2218.
Гипертрофическая кардиомиопатия / Заболевания / Клиника ЭКСПЕРТ
Что такое гипертрофическая кардиомиопатия?
Гипертрофическая кардиомиопатия (ГКМП) — аутосомно-доминантное заболевание, характеризующееся гипертрофией (утолщением) стенки левого и/или (изредка) правого желудочка. Это приводит к жесткости стенок сердца и аорты и способствует тому, что передняя створка митрального клапана оказывается близко к поверхности перегородки и поток крови подтягивает её к ней благодаря эффекту Вентури, создавая таким образом препятствие выбросу крови.
Симптомы гипертрофической кардиомиопатии
Многие люди с ГКМП не имеют либо никаких признаков болезни, либо только незначительные симптомы, и живут нормальной жизнью. У других же пациентов симптомы могут прогрессировать и обостряться, ухудшая тем самым работу сердца. Симптомы гипертрофической кардиомиопатии могут возникнуть в любом возрасте и включают в себя:
- боль или давление в груди (происходит обычно при физической нагрузке на организм, но также может произойти во время отдыха или после еды)
- затруднённое дыхание (одышка)
- усталость (чувство чрезмерной усталости)
- обморок (возникающий в связи с нерегулярными сердечными ритмами, неправильной работой кровеносных сосудов, или вовсе без какой либо причины)
- учащенное сердцебиение (из-за нарушения ритма сердца, обычно — желудочковые экстрасистолы, пароксизмы желудочковой тахикардии, часты также наджелудочковые нарушения ритма)
- внезапная смерть (примерно 30% больных вообще не предъявляют жалоб, внезапная смерть может быть первым и единственным проявлением заболевания.

Причины гипертрофической кардиомиопатии
ГКМП может быть как наследственной болезнью, связанной с мутацией генов, кодирующих синтез сократительных белков, так и болезнь, появляющаяся в процессе старения или из-за высокого кровяного давления. В некоторых случаях причины остаются неизвестными.
Диагностика гипертрофической кардиомиопатии
ГКМП диагностируется как на основе истории болезни (симптомы и семейная история), так и на основе медицинского осмотра и клинических анализов, таких как анализы крови, ЭКГ, рентген грудной клетки, эхокардиография (УЗИ сердца), стресс-тест, катетеризация сердца, КТ и МРТ.
Лечение гипертрофической кардиомиопатии
Лечение ГКМП показано лишь при наличии клиники либо факторов риска внезапной смерти. Лечение направлено на предотвращение симптомов и осложнений, и включает в себя выявление рисков, изменения образа жизни, приём лекарств. Также, по мере необходимости, врач кардиолог может назначить вам различные процедуры.
Рекомендации
Диета
Употребление большого количества жидкости имеет очень важное значение. Выпивайте по крайней мере от 6 до 8 стаканов воды в день. В жаркую погоду, следует увеличить потребление жидкости. Жидкость и ограничения в употреблении соли, необходимы для пациентов с сердечной недостаточностью. Посоветуйтесь с вашим лечащим врачом о принципах воздействия на ваш организм конкретных жидкостей и диетических напитков, включая информацию о воздействии алкоголя и кофеина.
Физические упражнения
Ваш врач подскажет, рекомендуется ли вам заниматься спортом или нет. Большинству людей с кардиомиопатией предлагаются легкие занятия аэробикой. Тем не менее, ваш врач, основываясь на симптомах и тяжести вашей болезни, может попросить вас воздержаться от каких либо физических нагрузок. Так же, как и при дилатационной кардиомиопатии, не рекомендуется поднятие тяжестей
Регулярное посещение врача
Пациенты с ГКМП минимум раз в год должны посещать врача кардиолога и контролировать свое состояние. Посещения врача могут быть более частыми, в том случае, когда гипертрофическая кардиомиопатия была диагностирована впервые.
Посещения врача могут быть более частыми, в том случае, когда гипертрофическая кардиомиопатия была диагностирована впервые.
Какие препараты используются для лечения гипертрофической кардиомиопатией?
Препараты, используемые для лечения симптомов и предотвращения дальнейшего осложнения ГКМП, снимают нагрузку с сердца и уменьшают препятствия для эффективной циркуляции крови в организме. При лечении гипертрофической кардиомиопатии используются также лекарства, в основе которых лежат бета-адреноблокаторы, способные снижать нагрузку на сердце за счет снижения давления и пульса, уменьшая гипертрофию миокарда. Также бета-блокаторы обладают антиаритмическим действием, в том числе способны уменьшить риск развития фатальных аритмий и внезапной смерти.
Врач может попросить вас избежать применения некоторых лекарственных препаратов, таких, как нитраты (они понижают кровяное давление) или дигоксин (он увеличивает силу сокращений сердца).
Ваш врач посоветует, какие лекарства вам больше всего подходят.
Хирургические процедуры, используемые для лечения гипертрофической кардиомиопатии
Хирургические методы, используемые для лечения ГКМП включают в себя:
Чрезаортальная септальная миэктомия. Данная методика предполагает уменьшение обструкции путем уменьшения толщины межжелудочковой перегородки.
Транскатетерная септальная алкогольная абляция. Введение склерозирующих веществ типа спиртовых растворов, создание в межжелудочковой перегородке зон инфаркта.
Имплантация искусственного митрального клапана сердца. Этот тип операции предлагается пациентам с высоким риском опасных для жизни аритмий и внезапной сердечной смерти. Митральный клапан постоянно отслеживает сердечный ритм. Когда он обнаруживает неправильный, очень быстрый ритм сердца, поставляя энергию в сердечную мышцу, он заставляет сердце биться в нормальном ритме.
Внезапная смерть и эндокардит при гипертрофической кардиомиопатии
Небольшое количество людей с HCM, подвержены повышенному риск внезапной сердечной смерти. Люди, которые входят в эту группу риска:
Люди, которые входят в эту группу риска:
- родственники умерших от внезапной сердечной смерти
- молодые люди с ГКМП с несколькими эпизодами потери сознания
- пациенты с повышенным кровяным давлением и аритмией
- больные с тяжелыми симптомами и сердечной недостаточностью
Если у вас присутствуют два или более факторов риска внезапной сердечной смерти, врач пропишет вам лекарства для предотвращения аритмии. У большинства пациентов с ГКМП риск внезапной сердечной смерти невелик. Поговорите со своим врачом о всех проблемах, с которыми вы можете столкнутся при гипертрофической кардиомиопатии.
Как предотвратить эндокардит?
Люди с обструктивным ГКМП могу быть подвержены повышенному риску инфекционного эндокардита, потенциально опасного для жизни состояния. Чтобы защитить себя, говорите на приёме у любого врача, в том числе у стоматолога, что у вас есть заболевание сердца.
Позвоните своему врачу, если у вас появились симптомы инфекции (боль в горле, слабость, лихорадка).
Позаботьтесь о ваших зубах и деснах, чтобы защититься от инфекций.
Принимайте антибиотики перед тем как подвергнуться каким-либо процедурам, которые могут вызвать кровотечение, таких как: стоматологическая помощь, анализы (любые анализы, которые могут быть связаны со сбором крови или которые могут вызвать кровотечение), хирургические операции. Проконсультируйтесь со своим врачом о типе и количестве антибиотика, который вам следует принять.
Гипертрофическая кардиомиопатия (ГКМП) | Детская кардиомиопатия
Что такое гипертрофическая кардиомиопатия (ГКМП)?
Гипертрофическая кардиомиопатия (ГКМП) представляет собой заболевание сердечной мышцы, при котором происходит ее утолщение (гипертрофия). Это утолщение обычно происходит в нижней левой камере сердца, называемой левым желудочком. Утолщение сердечной мышцы может происходить в области перегородки (мышечной стенки, разделяющей левую и правую части сердца), задней стенки или свободной стенки (наружная стенка левого желудочка), верхушки (дна сердца) или на всем протяжении левого желудочка.
 Когда мышца утолщается, это может затруднить приток и отток крови в сердце, особенно во время физических упражнений. В некоторых случаях утолщение мышцы может блокировать ток крови из левого желудочка в аорту. Это называется «обструкцией выходного тракта».
Когда мышца утолщается, это может затруднить приток и отток крови в сердце, особенно во время физических упражнений. В некоторых случаях утолщение мышцы может блокировать ток крови из левого желудочка в аорту. Это называется «обструкцией выходного тракта».
Кардиомиоциты (клетки сердечной мышцы) у людей с ГКМП имеют характерные особенности. Под микроскопом клетки кажутся неорганизованными и неправильными (беспорядок миоцитов). Этот беспорядок может вызвать изменения в электрических сигналах, проходящих через нижние камеры сердца, и привести к желудочковым аритмиям (аномальному сердечному ритму). Гипертрофическая кардиомиопатия поражает от 600 000 до 1,5 миллионов американцев, или одного из 500 человек.
Симптомы гипертрофической кардиомиопатии
Многие люди с ГКМП не испытывают никаких симптомов. Для тех, у кого есть сердечная недостаточность или желудочковые аритмии, симптомы могут включать:
Дети старшего возраста и взрослые
- Одышка и усталость
- Ощущение головокружения или предобморочного состояния
- Обморок или потеря сознания (обморок)
- Боль в груди
- Сердцебиение (ощущение ненормального сердцебиения)
Новорожденные и младенцы
- Чрезмерная потливость
- Проблемы с кормлением или плохой рост
Несмотря на то, что у некоторых людей может быть ГКМП без каких-либо симптомов, они все же могут подвергаться риску осложнений заболевания. Наиболее серьезным осложнением ГКМП является внезапная остановка сердца. Внезапная остановка сердца — это внезапная потеря функции сердца, вызванная опасно быстрым сердечным ритмом, называемым желудочковой тахикардией. Если неотложная помощь, включая сердечно-легочную реанимацию и дефибрилляцию, не будет начата немедленно, может наступить внезапная сердечная смерть. Большинство людей с ГКМП имеют низкий риск внезапной сердечной смерти. Тем не менее, ГКМП является наиболее частой причиной внезапной сердечной смерти у людей в возрасте до 30 лет. По этой причине важно, чтобы любой человек, относящийся к группе риска, наблюдался у кардиолога, имеющего опыт ухода за людьми с ГКМП.
Наиболее серьезным осложнением ГКМП является внезапная остановка сердца. Внезапная остановка сердца — это внезапная потеря функции сердца, вызванная опасно быстрым сердечным ритмом, называемым желудочковой тахикардией. Если неотложная помощь, включая сердечно-легочную реанимацию и дефибрилляцию, не будет начата немедленно, может наступить внезапная сердечная смерть. Большинство людей с ГКМП имеют низкий риск внезапной сердечной смерти. Тем не менее, ГКМП является наиболее частой причиной внезапной сердечной смерти у людей в возрасте до 30 лет. По этой причине важно, чтобы любой человек, относящийся к группе риска, наблюдался у кардиолога, имеющего опыт ухода за людьми с ГКМП.
Причины гипертрофической кардиомиопатии
ГКМП в значительной степени является генетическим заболеванием. Когда у человека диагностируют ГКМП, существует вероятность от 40 до 70 процентов, что будет выявлена основная генетическая причина. Чаще всего генетическая причина приводит к состоянию, которое передается в семье и влияет только на сердце. Вполне возможно, что родители, братья и сестры и даже тети/дяди или двоюродные братья человека с диагнозом ГКМП также могут иметь это заболевание сердечной мышцы. Если у них не было кардиологического скрининга, члены семьи могут не знать, что они больны. Существуют и другие генетические причины ГКМП, которые могут быть связаны с другими проблемами со здоровьем. К ним относятся генетические синдромы, метаболические и митохондриальные нарушения.
Вполне возможно, что родители, братья и сестры и даже тети/дяди или двоюродные братья человека с диагнозом ГКМП также могут иметь это заболевание сердечной мышцы. Если у них не было кардиологического скрининга, члены семьи могут не знать, что они больны. Существуют и другие генетические причины ГКМП, которые могут быть связаны с другими проблемами со здоровьем. К ним относятся генетические синдромы, метаболические и митохондриальные нарушения.
Гипертрофия может быть приобретенной и не всегда является генетической. Например, гипертрофия может возникнуть в результате высокого кровяного давления, которое не лечили или плохо контролировали в течение определенного периода времени. У спортсменов, занимающихся выносливостью, также может развиться гипертрофия. У некоторых людей причина ГКМП неизвестна.
Диагностика гипертрофической кардиомиопатии
Диагноз ГКМП основывается на семейном анамнезе, истории болезни, медицинском осмотре и кардиологических исследованиях.
- Семейный анамнез: Генеалогическое древо должно быть построено с особым вниманием к кардиомиопатии, нарушениям ритма, внезапной сердечной или необъяснимой смерти, кардиохирургическим вмешательствам или наличию других сердечных заболеваний у родственников.
- Медицинский анамнез: важно наличие в анамнезе симптомов сердечной недостаточности, нарушений ритма и потери сознания.
- Физикальное обследование: Особое внимание следует уделить сердечной и скелетно-мышечной системам.
- Кардиологическое исследование: эхокардиограмма является наиболее распространенным первым тестом, используемым для диагностики
ГКМП, так как на эхокардиограмме обычно видно характерное утолщение стенок сердца. Для дальнейшего определения аномалии мышц и определения наличия рубца в сердце может быть назначена магнитно-резонансная томография (МРТ) сердца. Другие тесты: также могут быть рекомендованы анализы крови, электрокардиограмма (ЭКГ), эхо-тест с физической нагрузкой и катетеризация сердца.
Управление и лечение
Лечение пациентов с ГКМП различно для каждого человека и основано на ряде особенностей, включая наличие обструкции выводного тракта (кровь не может покинуть левый желудочек из-за утолщения мышцы), функцию сердце (насколько хорошо оно сжимается), наличие каких-либо симптомов, возраст и уровень активности больного, наличие нарушений сердечного ритма и семейный анамнез. Лечение направлено на минимизацию или предотвращение симптомов и снижение риска осложнений, таких как сердечная недостаточность и внезапная остановка сердца.
Люди с ГКМП должны регулярно наблюдаться у кардиолога. Лекарства используются для лечения симптомов и предотвращения дальнейших осложнений. Лекарства, такие как бета-блокаторы и блокаторы кальциевых каналов, расслабляют сердечную мышцу, позволяя ей работать более эффективно. Другие лекарства могут быть назначены по мере необходимости для контроля частоты сердечных сокращений или уменьшения частоты аритмий.
Некоторым людям рекомендуется изменить образ жизни. В частности, участие в соревнованиях или видах спорта на выносливость подвергает людей более высокому риску возникновения проблем с сердечным ритмом и не рекомендуется для людей с ГКМП. Медицинская процедура может потребоваться, если сердечная мышца становится слишком толстой или если обнаружена проблема с ритмом.
У большинства людей с ГКМП низкий риск внезапной сердечной смерти. Однако важно выявить небольшое количество пациентов с ГКМП, которые имеют более высокий риск внезапной остановки сердца, чтобы можно было принять превентивные меры. Врач может оценить индивидуальный риск и назначить профилактическое лечение, такое как антиаритмические препараты или имплантируемый кардиовертер-дефибриллятор (ИКД), чтобы снизить вероятность внезапной сердечной смерти.
Генетическое тестирование и семейный скрининг
Поговорите со своим врачом о том, подходят ли генетическое тестирование и рутинный кардиологический скрининг для вашего ребенка и вашей семьи. Узнайте больше о генетическом тестировании и скрининге кардиомиопатии для семей.
Узнайте больше о генетическом тестировании и скрининге кардиомиопатии для семей.
Ресурсы для семей
Ассоциация кардиомиопатии: www.cardiomyopathy.org
Фонд детской кардиомиопатии: www.childrenscardiomyopathy.org
Фонд гипертрофической кардиомиопатии: www.4hcm.org
Свяжитесь с нами
Чтобы записаться на прием или узнать больше о лечении гипертрофической кардиомиопатии в детской больнице Цинциннати, позвоните по телефону 844-227-7307 или воспользуйтесь нашей онлайн-формой.
Скачать лист условий
Загрузите копию этой страницы для печати:
- Гипертрофическая кардиомиопатия (ГКМП)
Федерация детского сердца | Гипертрофическая кардиомиопатия
Загрузите этот информационный бюллетень в формате PDF
Целью этого информационного бюллетеня является объяснение того, что такое гипертрофическая кардиомиопатия, какое влияние она оказывает на ребенка и как ее можно лечить.
Что такое гипертрофическая кардиомиопатия?
Гипертрофический означает утолщение. Кардио средства сердца. Миопатия – это любое заболевание мышц. Гипертрофическая кардиомиопатия (ГКМП) означает утолщение сердечной мышцы.
ГКМП обычно вызывается мутацией (генетической ошибкой). Состояние может привести к утолщению стенок сердечной мышцы. Это утолщение происходит при отсутствии какого-либо другого фактора или структурного нарушения в сердце. В некоторых областях сердца мышечные клетки могут оказаться «дезорганизованными» (неорганизованными).
ВПВ: Верхняя полая вена PV: легочный клапан НПВ: нижняя полая вена PA: Легочная артерия
Как ГКМП может повлиять на моего ребенка?
Когда сердце бьется, оно сокращается, чтобы перекачивать кровь в тело и легкие, и расслабляется, чтобы снова наполниться кровью. На функцию сердца влияет ГКМП.
Левый желудочек (насосная камера) перекачивает недостаточно крови. Этому есть две причины.
Во-первых, утолщенная мышца вокруг него делает желудочек меньше. Это означает, что оно не удерживает столько крови, сколько в нормальном сердце.
Это означает, что оно не удерживает столько крови, сколько в нормальном сердце.
Во-вторых, утолщенная мышца не может сильно расслабиться, поэтому меньше крови может попасть в желудочек.
- Если утолщение находится в разделительной стенке (перегородке) между левым и правым желудочками, оно может сузить выходной тракт левого желудочка (отверстие в аорту, главный кровеносный сосуд, несущий кровь от сердца). Это уменьшает количество крови, выкачиваемой из сердца.
- Утолщенная сердечная мышца может повлиять на функцию сердечных клапанов. В частности, митральный клапан может стать «протекающим», если он не может правильно закрыться.
- Состояние может привести к тому, что сердцебиение станет быстрым или неустойчивым. Это известно как аритмия.
ГКМП поражает примерно 1 человека из 500 населения.
Большинство случаев гипертрофической кардиомиопатии вызваны мутациями (ошибками) в генах. Дети обычно не страдают от симптомов, пока они не станут подростками, но у некоторых симптомы проявляются, когда они еще маленькие. Было подсчитано, что дети составляют только около 10% случаев ГКМП. Большинство случаев являются наследственными, поэтому скрининг рекомендуется только для близких родственников первой степени родства.
Было подсчитано, что дети составляют только около 10% случаев ГКМП. Большинство случаев являются наследственными, поэтому скрининг рекомендуется только для близких родственников первой степени родства.
Не у всех с ГКМП будут какие-либо симптомы. Симптомы могут развиться на любом этапе жизни и не отражают тяжести состояния.
Возможные симптомы включают:
- одышку (одышку), обычно при физической нагрузке
- боль в груди: причина боли не ясна, но она может быть связана с недостаточным поступлением крови и кислорода к утолщенной сердечной мышце
- учащенное сердцебиение: может быть вызвано аномалиями сердечного ритма. Это может быть учащенное сердцебиение или пропущенные удары
- головокружение и приступы обморока: это может произойти из-за меньшего, чем обычно, количества крови, перекачиваемого сердцем, или из-за аритмии (учащенного сердцебиения). Любой необъяснимый обморок следует немедленно расследовать.
- HCM может вызвать внезапную смерть у небольшого числа пострадавших; однако риск этого очень мал, если состояние диагностируется, контролируется и лечится.

Как диагностируется ГКМП?
У вашего ребенка можно заподозрить ГКМП, поскольку это заболевание было диагностировано у родственника. ГКМП может возникать вместе с другими генетическими состояниями, такими как синдром Нунан или митохондриальные нарушения. Иногда ГКМП является врожденной проблемой, что означает, что она возникает во время развития плода, но причина может быть неясной. После того, как состояние было диагностировано, врачи проводят дальнейшее расследование, чтобы определить, есть ли основная причина.
При подозрении на проблемы с сердцем могут использоваться следующие тесты:
- пульс, кровяное давление, температура и количество вдохов, которые ребенок делает в минуту
- прослушивание стетоскопом изменений тонов сердца
- монитор насыщения кислородом, чтобы увидеть, сколько кислорода попадает в кровь
- рентген грудной клетки для определения размера и положения сердца
- ЭКГ (электрокардиограмма) для проверки электрической активности сердца
- ультразвуковое исследование (эхокардиограмма), чтобы увидеть структуру сердца и то, как кровь движется через сердце
- проверка химического баланса в крови и моче
- Круглосуточный мониторинг сердечного ритма для выявления нарушений сердечного ритма
- МРТ, чтобы показать структуру и функцию сердца и более внимательно изучить структуру утолщения
- тест с физической нагрузкой, чтобы увидеть, как сердце и кровяное давление реагируют на физическую нагрузку
- иногда требуется катетерный тест, чтобы посмотреть на изменения внутри сердца, измерить давление в сердечных камерах и проверить электрическую активность, которая регулирует сердцебиение.

Как осуществляется мониторинг HCM?
ГКМП — очень изменчивое состояние. У кого-то симптомы легкие, у кого-то тяжелые. Иногда симптомы прогрессируют, но часто, когда утолщение прекращается, оно остается довольно стабильным. Независимо от симптомов, они будут нуждаться в регулярном наблюдении. Это будет включать ЭКГ, эхокардиограммы и 24-часовой мониторинг. Частота и необходимые тесты зависят от симптомов, которые есть у вашего ребенка, и результатов предыдущих тестов.
Обратитесь к кардиологу, если у вашего ребенка наблюдаются какие-либо из следующих симптомов:
- усиление одышки, мешающее нормальной деятельности
- головокружение
- боль в груди
- обморок
Как лечить ГКМП?
ГКМП можно улучшить и контролировать с помощью лечения, включающего:
- препараты для контроля нарушений сердечного ритма и расслабления сердца, что позволяет ему легче наполняться
- имплантация дефибриллятора, если есть риск внезапной смерти из-за нарушения сердечного ритма
- у небольшого числа пациентов может потребоваться хирургическое вмешательство.
 Хирургия может включать удаление части перегородки, которая блокирует тракт оттока. Если требуется операция, кардиолог вашего ребенка подробно обсудит ее с вами.
Хирургия может включать удаление части перегородки, которая блокирует тракт оттока. Если требуется операция, кардиолог вашего ребенка подробно обсудит ее с вами.
Доказательства и источники информации для этого информационного бюллетеня CHF можно получить по телефону:
(1) Национальный институт здравоохранения и передового опыта. Имплантируемые кардиовертеры-дефибрилляторы и сердечная ресинхронизирующая терапия при аритмиях и сердечной недостаточности. Руководство ТА314. 901:15 Лондон: НИЦЦА; 2017 г. Доступно по адресу:
https://www.nice.org.uk/guidance/ta314
(2) Кардиомиопатия, Великобритания. Кардиомиопатия Брошюра Великобритании: «Жизнь с кардиомиопатией». Лондон: Кардиомиопатия, Великобритания; 2017 г. Доступно по адресу:
www.cardiomyopathy.org
(3) British Heart Foundation. Гипертрофическая кардиомиопатия. Лондон: BHF; 2017 г. Доступно по адресу:
https://www. bhf.org.uk/heart-health/conditions/cardiomyopathy/hypertrophic-cardiomyopathy
bhf.org.uk/heart-health/conditions/cardiomyopathy/hypertrophic-cardiomyopathy
Об этом документе:
Опубликовано: июнь 2015
Отзыв: май 2022
, чтобы сообщить Chf о комментарии, пожалуйста, свяжитесь с нами info@chf. .uk или тел.: 0300 561 0065.
А. Педиатрическая перспектива на ACC/AHA Hypertrophic Cardomyopathy
01 апр. 2021 г.
| Сима Митал, MBBS, FACC
Отправить по:
- Размер шрифта
- А
- А
- А
Краткие сведения
- Генетическое тестирование с консультированием должно быть предложено всем пациентам с ГКМП и ближайшим родственникам пациентов с положительным генотипом для выявления тех, кто генетически подвержен риску развития ГКМП.

- Все дети, подростки и подростки с ГКМП должны пройти стратификацию риска внезапной сердечной смерти путем оценки возрастных факторов риска, чтобы помочь в обсуждении вопросов первичной профилактики ИКД для лиц из группы риска.
- Здоровые рекреационные упражнения следует поощрять для пропаганды здорового образа жизни, поскольку данные подтверждают, что упражнения умеренной (или даже высокой интенсивности) безопасны; пациентов следует поощрять к участию в совместном принятии решений относительно физических упражнений и ИКД на основе их предпочтений, образа жизни и устойчивости к риску.
Недавно были достигнуты впечатляющие успехи в нашем понимании гипертрофической кардиомиопатии (ГКМП). Руководство Американской кардиологической ассоциации / Американского колледжа кардиологов 2020 года по диагностике и лечению пациентов с ГКМП содержит важные фактические данные и рекомендации, основанные на консенсусе, для информирования о передовой клинической практике, направленной на оптимизацию результатов лечения пациентов. 1 Впервые рекомендации для педиатрической популяции включены в основные рекомендации, а не рассматриваются отдельно. Это отражает признание того, что ГКМП является семейным заболеванием, которое может проявиться в любом возрасте у любого члена семьи, включая детей. Фактически дети подвержены высокому риску развития серьезных неблагоприятных сердечных событий (включая серьезные аритмические события) или нуждаются в серьезных кардиохирургических вмешательствах в течение 2-3 лет после постановки диагноза. 2 В рекомендациях 2020 г. отражены последние данные о естественном течении ГКМП у детей, полученные в результате нескольких многоцентровых международных когортных исследований 3-5 и обеспечить, чтобы эти новые данные учитывались при принятии решений пациентами и врачами с целью оказания помощи, ориентированной на пациента и его семью. Обобщены ключевые сообщения, имеющие отношение к педиатрической популяции.
1 Впервые рекомендации для педиатрической популяции включены в основные рекомендации, а не рассматриваются отдельно. Это отражает признание того, что ГКМП является семейным заболеванием, которое может проявиться в любом возрасте у любого члена семьи, включая детей. Фактически дети подвержены высокому риску развития серьезных неблагоприятных сердечных событий (включая серьезные аритмические события) или нуждаются в серьезных кардиохирургических вмешательствах в течение 2-3 лет после постановки диагноза. 2 В рекомендациях 2020 г. отражены последние данные о естественном течении ГКМП у детей, полученные в результате нескольких многоцентровых международных когортных исследований 3-5 и обеспечить, чтобы эти новые данные учитывались при принятии решений пациентами и врачами с целью оказания помощи, ориентированной на пациента и его семью. Обобщены ключевые сообщения, имеющие отношение к педиатрической популяции.
- Семейный скрининг : Для любого пробанда с диагнозом ГКМП следует начинать эхокардиографический скрининг ближайших родственников независимо от их возраста.
 Наблюдение за клиническим эхокардиографическим скринингом следует продолжать каждые 1-3 года, поскольку ГКМП может проявиться в любом возрасте в семье. 2
Наблюдение за клиническим эхокардиографическим скринингом следует продолжать каждые 1-3 года, поскольку ГКМП может проявиться в любом возрасте в семье. 2 - Генетический скрининг : Генетическое тестирование с консультированием следует предлагать всем пациентам с ГКМП. 6 Для пациентов с ГКМП, у которых при генетическом тестировании обнаружены патогенные варианты, каскадное генетическое тестирование должно быть предложено всем родственникам первой степени родства с постоянным клиническим наблюдением, показанным только тем родственникам, которые являются носителями патогенного варианта. Для пациентов с ГКМП, у которых нет патогенных вариантов при генетическом тестировании, каскадное генетическое тестирование семьи бесполезно. Важно переоценивать патогенность вариантов каждые 2-3 года, поскольку классификация вариантов может меняться со временем и изменять рекомендации по текущему семейному скринингу. 7 На рис. 1 показан подход к генетическому скринингу.

Рисунок 1: Рекомендуемая оценка и тестирование для HCM
Рисунок 1: Рекомендуемая оценка и тестирование для HCM . Цвета соответствуют классу рекомендаций в таблице 1. *Интервал может быть увеличен, особенно у взрослых пациентов, состояние которых остается стабильным после нескольких обследований. CMR указывает на кардиоваскулярный магнитный резонанс; CPET, кардиопульмональный нагрузочный тест; ЭКГ, электрокардиография/электрокардиограмма; ГКМП, гипертрофическая кардиомиопатия; СН, сердечная недостаточность; ИКД, имплантируемый кардиовертер-дефибриллятор; LVOTO, обструкция выводного тракта левого желудочка; P/LP, патогенный или вероятно патогенный вариант; ВСС, внезапная сердечная смерть; и VUS, вариант неизвестного значения. Оммен С.Р., Митал С., Берк М.А. и соавт. Руководство AHA/ACC 2020 года по диагностике и лечению пациентов с гипертрофической кардиомиопатией. J Am Coll Cardiol 2020;76:3022-55. Рисунок 1: Рекомендуемая оценка и тестирование для HCM . Цвета соответствуют классу рекомендаций в таблице 1. *Интервал может быть увеличен, особенно у взрослых пациентов, состояние которых остается стабильным после нескольких обследований. CMR указывает на кардиоваскулярный магнитный резонанс; CPET, кардиопульмональный нагрузочный тест; ЭКГ, электрокардиография/электрокардиограмма; ГКМП, гипертрофическая кардиомиопатия; СН, сердечная недостаточность; ИКД, имплантируемый кардиовертер-дефибриллятор; LVOTO, обструкция выводного тракта левого желудочка; P/LP, патогенный или вероятно патогенный вариант; ВСС, внезапная сердечная смерть; и VUS, вариант неизвестного значения. Оммен С.Р., Митал С., Берк М.А. и соавт. Руководство AHA/ACC 2020 года по диагностике и лечению пациентов с гипертрофической кардиомиопатией. J Am Coll Cardiol 2020;76:3022-55.
Цвета соответствуют классу рекомендаций в таблице 1. *Интервал может быть увеличен, особенно у взрослых пациентов, состояние которых остается стабильным после нескольких обследований. CMR указывает на кардиоваскулярный магнитный резонанс; CPET, кардиопульмональный нагрузочный тест; ЭКГ, электрокардиография/электрокардиограмма; ГКМП, гипертрофическая кардиомиопатия; СН, сердечная недостаточность; ИКД, имплантируемый кардиовертер-дефибриллятор; LVOTO, обструкция выводного тракта левого желудочка; P/LP, патогенный или вероятно патогенный вариант; ВСС, внезапная сердечная смерть; и VUS, вариант неизвестного значения. Оммен С.Р., Митал С., Берк М.А. и соавт. Руководство AHA/ACC 2020 года по диагностике и лечению пациентов с гипертрофической кардиомиопатией. J Am Coll Cardiol 2020;76:3022-55.
- Визуализация сердца : В то время как эхокардиография остается краеугольным камнем в диагностике ГКМП, сердечно-сосудистая магнитно-резонансная томография (CMR) может быть полезна у пациентов с диагностической неопределенностью, например, при подозрении на нарушение обмена веществ, плохие окна эхокардиографической визуализации или дополнение к оценке риска внезапной сердечной смерти (ВСС) посредством измерения позднего усиления гадолиния.
 8
8 - Оценка риска ВСС : Стратификация риска ВСС у детей должна включать специфические для детей факторы риска, поскольку многие факторы риска у детей имеют разные веса, чем у взрослых. 3,4,9 Например, в отличие от взрослых, у детей существует нелинейная ассоциация гипертрофии левого желудочка (ЛЖ) с риском ВСС; поэтому не существует абсолютного порогового показателя диаметра перегородки z, который можно было бы использовать в качестве порога для рекомендации имплантируемого кардиовертера-дефибриллятора (ИКД) для первичной профилактики. 3,4 Градиент оттока ЛЖ и ВСС в семейном анамнезе не связаны с более высоким риском ВСС у детей так же, как у взрослых, хотя последний может отражать отставание между диагнозом и появлением событий ВСС у молодых взрослых членов семьи. На рис. 2 показан подход к оценке риска ВСС у детей и взрослых.
Рисунок 2: Выбор пациента с ИКД
Рисунок 2: Выбор пациента с ИКД . Цвета соответствуют классу рекомендаций в таблице 1. *Решения ИКД у педиатрических пациентов с ГКМП основаны на ≥1 из этих основных факторов риска: семейный анамнез ГКМП ВСС, НУЖТ на амбулаторном мониторе, массивная ГЛЖ и необъяснимые обмороки. †Для пациентов старше 16 лет можно использовать 5-летние оценки риска, чтобы полностью информировать пациентов во время совместного обсуждения решений. ‡ Представляется наиболее целесообразным придавать большее значение частым, более длительным и более быстрым запускам NSVT. CMR указывает на кардиоваскулярный магнитный резонанс; ФВ, фракция выброса; FH, семейный анамнез; ГКМП, гипертрофическая кардиомиопатия; ИКД, имплантируемый кардиовертер-дефибриллятор; LGE, позднее усиление гадолинием; ГЛЖ, гипертрофия левого желудочка; НЖТ, неустойчивая желудочковая тахикардия; ВСС, внезапная сердечная смерть; ФЖ, фибрилляция желудочков; и ЖТ, желудочковая тахикардия. Оммен С.Р., Митал С., Берк М.А. и соавт. Руководство AHA/ACC 2020 года по диагностике и лечению пациентов с гипертрофической кардиомиопатией.
Цвета соответствуют классу рекомендаций в таблице 1. *Решения ИКД у педиатрических пациентов с ГКМП основаны на ≥1 из этих основных факторов риска: семейный анамнез ГКМП ВСС, НУЖТ на амбулаторном мониторе, массивная ГЛЖ и необъяснимые обмороки. †Для пациентов старше 16 лет можно использовать 5-летние оценки риска, чтобы полностью информировать пациентов во время совместного обсуждения решений. ‡ Представляется наиболее целесообразным придавать большее значение частым, более длительным и более быстрым запускам NSVT. CMR указывает на кардиоваскулярный магнитный резонанс; ФВ, фракция выброса; FH, семейный анамнез; ГКМП, гипертрофическая кардиомиопатия; ИКД, имплантируемый кардиовертер-дефибриллятор; LGE, позднее усиление гадолинием; ГЛЖ, гипертрофия левого желудочка; НЖТ, неустойчивая желудочковая тахикардия; ВСС, внезапная сердечная смерть; ФЖ, фибрилляция желудочков; и ЖТ, желудочковая тахикардия. Оммен С.Р., Митал С., Берк М.А. и соавт. Руководство AHA/ACC 2020 года по диагностике и лечению пациентов с гипертрофической кардиомиопатией. J Am Coll Cardiol 2020;76:3022-55. Рисунок 2: Выбор пациента с ИКД . Цвета соответствуют классу рекомендаций в таблице 1. *Решения ИКД у педиатрических пациентов с ГКМП основаны на ≥1 из этих основных факторов риска: семейный анамнез ГКМП ВСС, НУЖТ на амбулаторном мониторе, массивная ГЛЖ и необъяснимые обмороки. †Для пациентов старше 16 лет можно использовать 5-летние оценки риска, чтобы полностью информировать пациентов во время совместного обсуждения решений. ‡ Представляется наиболее целесообразным придавать большее значение частым, более длительным и более быстрым запускам NSVT. CMR указывает на кардиоваскулярный магнитный резонанс; ФВ, фракция выброса; FH, семейный анамнез; ГКМП, гипертрофическая кардиомиопатия; ИКД, имплантируемый кардиовертер-дефибриллятор; LGE, позднее усиление гадолинием; ГЛЖ, гипертрофия левого желудочка; НЖТ, неустойчивая желудочковая тахикардия; ВСС, внезапная сердечная смерть; ФЖ, фибрилляция желудочков; и ЖТ, желудочковая тахикардия.
J Am Coll Cardiol 2020;76:3022-55. Рисунок 2: Выбор пациента с ИКД . Цвета соответствуют классу рекомендаций в таблице 1. *Решения ИКД у педиатрических пациентов с ГКМП основаны на ≥1 из этих основных факторов риска: семейный анамнез ГКМП ВСС, НУЖТ на амбулаторном мониторе, массивная ГЛЖ и необъяснимые обмороки. †Для пациентов старше 16 лет можно использовать 5-летние оценки риска, чтобы полностью информировать пациентов во время совместного обсуждения решений. ‡ Представляется наиболее целесообразным придавать большее значение частым, более длительным и более быстрым запускам NSVT. CMR указывает на кардиоваскулярный магнитный резонанс; ФВ, фракция выброса; FH, семейный анамнез; ГКМП, гипертрофическая кардиомиопатия; ИКД, имплантируемый кардиовертер-дефибриллятор; LGE, позднее усиление гадолинием; ГЛЖ, гипертрофия левого желудочка; НЖТ, неустойчивая желудочковая тахикардия; ВСС, внезапная сердечная смерть; ФЖ, фибрилляция желудочков; и ЖТ, желудочковая тахикардия. Оммен С.Р., Митал С., Берк М.А. и соавт. Руководство AHA/ACC 2020 года по диагностике и лечению пациентов с гипертрофической кардиомиопатией. J Am Coll Cardiol 2020;76:3022-55.
Оммен С.Р., Митал С., Берк М.А. и соавт. Руководство AHA/ACC 2020 года по диагностике и лечению пациентов с гипертрофической кардиомиопатией. J Am Coll Cardiol 2020;76:3022-55.
- Показания к применению ИКД : ИКД рекомендуется для вторичной профилактики у любого ребенка с ГКМП с подтвержденной остановкой сердца или устойчивой желудочковой тахикардией в анамнезе. Установка ИКД для первичной профилактики целесообразна для детей с ГКМП, у которых есть обычные факторы риска, включая необъяснимые обмороки, массивную гипертрофию ЛЖ, неустойчивую желудочковую тахикардию или семейный анамнез ранней связанной с ГКМП ВСС (, рис. 2, ). Однако имплантация ИКД для первичной профилактики у детей раннего возраста часто требует более высокого порога, чем у взрослых (например, наличие более одного фактора риска), учитывая сложность установки ИКД, а также более высокий риск осложнений, связанных с устройством, у детей раннего возраста. 10 У пациентов с неясной стратификацией риска обширное позднее усиление гадолинием на МРТ-изображениях может дополнять стратификацию риска.

- Лечение обструкции выносящего тракта ЛЖ : Редукционная терапия показана симптоматическим, резистентным к лекарствам пациентам с постоянным состоянием покоя или провокационным градиентом выносящего тракта ЛЖ > 50 мм рт. Операция должна проводиться в центрах HCM опытными бригадами. 11
Рисунок 3: Лечение симптомов у пациентов с ГКМП
Рисунок 3: Лечение симптомов у пациентов с ГКМП . Цвета соответствуют классу рекомендаций в таблице 1. GL указывает на рекомендации; ГКМП, гипертрофическая кардиомиопатия; HFpEF, сердечная недостаточность с сохраненной фракцией выброса; HFrEF, сердечная недостаточность со сниженной фракцией выброса; и СРТ, септальная редукционная терапия. Оммен С.Р., Митал С., Берк М.А. и соавт. Руководство AHA/ACC 2020 года по диагностике и лечению пациентов с гипертрофической кардиомиопатией. J Am Coll Cardiol 2020;76:3022-55. Рисунок 3: Лечение симптомов у пациентов с ГКМП . Цвета соответствуют классу рекомендаций в таблице 1. GL указывает на рекомендации; ГКМП, гипертрофическая кардиомиопатия; HFpEF, сердечная недостаточность с сохраненной фракцией выброса; HFrEF, сердечная недостаточность со сниженной фракцией выброса; и СРТ, септальная редукционная терапия. Оммен С.Р., Митал С., Берк М.А. и соавт. Руководство AHA/ACC 2020 года по диагностике и лечению пациентов с гипертрофической кардиомиопатией. J Am Coll Cardiol 2020;76:3022-55.
Цвета соответствуют классу рекомендаций в таблице 1. GL указывает на рекомендации; ГКМП, гипертрофическая кардиомиопатия; HFpEF, сердечная недостаточность с сохраненной фракцией выброса; HFrEF, сердечная недостаточность со сниженной фракцией выброса; и СРТ, септальная редукционная терапия. Оммен С.Р., Митал С., Берк М.А. и соавт. Руководство AHA/ACC 2020 года по диагностике и лечению пациентов с гипертрофической кардиомиопатией. J Am Coll Cardiol 2020;76:3022-55.
- Совместное принятие решений : Важно понимать предпочтения пациента и его семьи в отношении ИКД, упражнений, генетического тестирования, семейного скрининга, а также типа и времени вмешательств. Врач должен вовлекать пациента и его семью в общий процесс принятия решений, учитывающий выбор образа жизни и предпочтения пациента при принятии сложных решений, которые могут изменить его жизнь. 12
- Упражнение : Всем пациентам следует пропагандировать здоровый образ жизни для сердца, в том числе избегать ненужных ограничений физической активности.
 Появляется все больше доказательств того, что здоровые рекреационные упражнения (умеренной интенсивности) не связаны с повышенным риском желудочковых аритмий. 13-15 Для пациентов с положительным генотипом и отрицательным по фенотипу разумно участвовать в более интенсивных спортивных соревнованиях, 16 и участие в соревновательном уровне может быть приемлемым для отдельных пациентов с положительным фенотипом после полного раскрытия информации и обсуждения рисков и преимуществ . Размещение ICD с единственной целью участия в соревнованиях по легкой атлетике не должно выполняться.
Появляется все больше доказательств того, что здоровые рекреационные упражнения (умеренной интенсивности) не связаны с повышенным риском желудочковых аритмий. 13-15 Для пациентов с положительным генотипом и отрицательным по фенотипу разумно участвовать в более интенсивных спортивных соревнованиях, 16 и участие в соревновательном уровне может быть приемлемым для отдельных пациентов с положительным фенотипом после полного раскрытия информации и обсуждения рисков и преимуществ . Размещение ICD с единственной целью участия в соревнованиях по легкой атлетике не должно выполняться. - Модель мультидисциплинарной помощи : Лечение ГКМП должно развиваться по мере развития пенетрантности, тяжести и проявлений заболевания с возрастом. 17 Для этого необходимо, чтобы пациент и его семья имели доступ к многопрофильной команде, в которую входят кардиологи, специализирующиеся на кардиомиопатии, электрофизиологи, специалисты в области эхокардиографии и МРТ, кардиоторакальные хирурги, интервенционные кардиологи, генетики и консультанты по генетическим вопросам.
 Направление в многопрофильные центры ГКМП с разным уровнем знаний рекомендуется для принятия сложных решений и передовых методов лечения пациентов с ГКМП.
Направление в многопрофильные центры ГКМП с разным уровнем знаний рекомендуется для принятия сложных решений и передовых методов лечения пациентов с ГКМП.
В рекомендациях 2020 г. также указывается необходимость будущих исследований в областях с неудовлетворенными потребностями, чтобы постоянно обновлять рекомендации на основе фактических данных. Эти области включают подходы точной медицины, носимые устройства для физиологического мониторинга аритмий, совместную поддержку принятия решений для врачей и пациентов, усилия по расширению генетических диагнозов и генетической осведомленности, интеграцию информации о генотипе в модели прогнозирования риска, а также клинические испытания генотипов. управляемая и таргетная терапия.
Таблица 1
Таблица 1: Американский колледж кардиологов/Американская кардиологическая ассоциация Применение класса рекомендаций и уровня доказательности к клиническим стратегиям, вмешательствам, лечению или диагностическому тестированию при оказании помощи пациентам (обновлено в мае 2019 г. ). Оммен С.Р., Митал С., Берк М.А. и соавт. Руководство AHA/ACC 2020 года по диагностике и лечению пациентов с гипертрофической кардиомиопатией. J Am Coll Cardiol 2020;76:3022-55. Таблица 1: Американский колледж кардиологов/Американская ассоциация кардиологов, применяющий класс рекомендаций и уровень доказательности для клинических стратегий, вмешательств, лечения или диагностических тестов при уходе за пациентами (обновлено в мае 2019 г.)). Оммен С.Р., Митал С., Берк М.А. и соавт. Руководство AHA/ACC 2020 года по диагностике и лечению пациентов с гипертрофической кардиомиопатией. J Am Coll Cardiol 2020;76:3022-55.
). Оммен С.Р., Митал С., Берк М.А. и соавт. Руководство AHA/ACC 2020 года по диагностике и лечению пациентов с гипертрофической кардиомиопатией. J Am Coll Cardiol 2020;76:3022-55. Таблица 1: Американский колледж кардиологов/Американская ассоциация кардиологов, применяющий класс рекомендаций и уровень доказательности для клинических стратегий, вмешательств, лечения или диагностических тестов при уходе за пациентами (обновлено в мае 2019 г.)). Оммен С.Р., Митал С., Берк М.А. и соавт. Руководство AHA/ACC 2020 года по диагностике и лечению пациентов с гипертрофической кардиомиопатией. J Am Coll Cardiol 2020;76:3022-55.
Ссылки
- Ommen SR, Mital S, Burke MA, et al. Руководство AHA/ACC 2020 года по диагностике и лечению пациентов с гипертрофической кардиомиопатией: отчет Объединенного комитета Американского колледжа кардиологов/Американской кардиологической ассоциации по клиническим рекомендациям. J Am Coll Cardiol 2020;76:3022-55.

- Лафреньер-Рула М., Болкиер Ю., Захавич Л. и др. Семейный скрининг на гипертрофическую кардиомиопатию: пора ли менять практические рекомендации? Евро Сердце J 2019;40:3672-81.
- Баладжи С., ДиЛоренцо М.П., Фиш Ф.А. и др. Факторы риска летальных аритмических событий у детей и подростков с гипертрофической кардиомиопатией и имплантируемым дефибриллятором: международное многоцентровое исследование. Ритм Сердца 2019;16:1462-67.
- Мирон А., Лафреньер-Рула М., Стив Фан С.П. и др. Утвержденная модель прогнозирования риска внезапной сердечной смерти при детской гипертрофической кардиомиопатии. Тираж 2020;142:217-29.
- Норриш Г., Дин Т., Филд Э. и др. Разработка новой модели прогнозирования риска внезапной сердечной смерти при детской гипертрофической кардиомиопатии (HCM Risk-Kids). JAMA Cardiol 2019;4:918-27.
- Ахмад Ф., МакНалли Э.М., Акерман М.Дж. и др. Создание специализированных программ клинической сердечно-сосудистой генетики: признание необходимости и соблюдение стандартов: научное заявление Американской кардиологической ассоциации.
 Circ Geonom Precis Med 2019;12:e000054.
Circ Geonom Precis Med 2019;12:e000054. - Дейнан Д.Л., Чанг В.К., Кирни Х.М., Монаган К.Г., Редер К.В., Чао Э.К. Моменты, которые следует учитывать при переоценке и повторном анализе результатов геномных тестов: заявление Американского колледжа медицинской генетики и геномики (ACMG). Genet Med 2019;21:1267-70.
- Венг З., Яо Дж., Чан Р.Х. и др. Прогностическое значение LGE-CMR при ГКМП: метаанализ. JACC Cardiovasc Imaging 2016;9:1392-1402.
- Норриш Г., Кантарутти Н., Писсариду Э. и др. Факторы риска внезапной сердечной смерти при детской гипертрофической кардиомиопатии: систематический обзор и метаанализ. Eur J Prev Cardiol 2017;24:1220-30.
- Krause U, Müller MJ, Wilberg Y, et al. Трансвенозные и нетрансвенозные имплантируемые кардиовертер-дефибрилляторы у детей, подростков и взрослых с врожденными пороками сердца: кто подвержен риску адекватных и неадекватных разрядов? Европас 2019;21:106-13.

- Аргами А., Диарани Дж. А., Саид С. М., О’Лири П. В., Шафф Х. В. Гипертрофическая кардиомиопатия у детей. Ann Cardiothorac Surg 2017;6:376-85.
- Легаре Ф., Адекпеджу Р., Стейси Д. и др. Вмешательства для увеличения использования совместного принятия решений медицинскими работниками. Cochrane Database Syst Rev 2018;7:Cd006732.
- Lampert R, Olshansky B, Heidbuchel H, et al. Безопасность спорта для спортсменов с имплантируемыми кардиовертерами-дефибрилляторами: долгосрочные результаты проспективного многонационального регистра. Тираж 2017;135:2310-12.
- Пелличча А., Лемме Э., Маэстрини В. и др. Ухудшает ли занятие спортом клиническое течение гипертрофической кардиомиопатии? Клинические исходы гипертрофической кардиомиопатии у спортсменов. Тираж 2018;137:531-33.
- Сабери С., Уилер М., Брэгг-Грешам Дж. и др. Влияние тренировок средней интенсивности на пиковое потребление кислорода у пациентов с гипертрофической кардиомиопатией: рандомизированное клиническое исследование.
 JAMA 2017;317:1349-57.
JAMA 2017;317:1349-57. - Маурици Н., Мишельс М., Роуин Э.Дж. и др. Клиническое течение и значение гипертрофической кардиомиопатии без гипертрофии левого желудочка. Тираж 2019;139:830-33.
- Ho CY, Day SM, Ashley EA, et al. Генотип и пожизненное бремя болезни при гипертрофической кардиомиопатии: информация из Реестра саркомерной кардиомиопатии человека (SHaRe). Тираж 2018;138:1387-98.
Отправить по:
Клинические темы: Аритмии и клиническая внезапная энцефалопатия, врожденные пороки сердца и детская кардиология, сердечная недостаточность и кардиомиопатии, неинвазивная визуализация, профилактика, спортивная кардиология и упражнения, имплантируемые устройства, ВСС/желудочковые аритмии, фибрилляция предсердий/наджелудочковые аритмии, врожденное сердце Болезни, ИБС и педиатрия и аритмии, ИБС и педиатрия и визуализация, ИБС и педиатрия и профилактика, ИБС и педиатрия и улучшение качества, острая сердечная недостаточность, эхокардиография/ультразвук, спорт и упражнения и врожденные пороки сердца и детская кардиология, спорт и упражнения и Визуализация
Keywords: Heart Failure, Pediatrics, Heart Defects, Congenital, Gadolinium, Contrast Media, Defibrillators, Implantable, Secondary Prevention, American Heart Association, Patient Отбор, Принятие решений, Кардиомиопатия, гипертрофическая, Аритмии, сердечные, Эхокардиография, Первичная профилактика, Genetic Testing, Risk Assessment, Tachycardia, Ventricular, Risk Factors, Syncope, Sports, Monitoring, Physiologic, Hypertrophy, Genotype, Magnetic Resonance Spectroscopy, Уход, ориентированный на пациента, Фармацевтические препараты
< Вернуться к списку
Гипертрофическая кардиомиопатия у новорожденных от матерей с диабетом: гетерогенное состояние, важность анамнеза, физикального обследования и последующего наблюдения | Итальянский журнал педиатрии
- История болезни
- Открытый доступ
- Опубликовано:
- Alessia Claudia Codazzi 1 ,
- Rosario Ippolito 2 ,
- Cecilia Novara 2 ,
- Enrico Tondina 2 ,
- Rosa Maria Cerbo 3 &
- …
- Chryssoula Tzialla 3
Итальянский педиатрический журнал
том 47 , Номер статьи: 197 (2021)
Процитировать эту статью
3387 доступов
2 Цитаты
2 Альтметрический
Сведения о показателях
Abstract
История вопроса
Гипертрофическая кардиомиопатия (ГКМП) у новорожденных является редким и гетерогенным заболеванием. На ГКМП приходится от 25 до 40% всех случаев детской кардиомиопатии, и самая высокая заболеваемость в педиатрической популяции зарегистрирована у детей младше 1 года.
На ГКМП приходится от 25 до 40% всех случаев детской кардиомиопатии, и самая высокая заболеваемость в педиатрической популяции зарегистрирована у детей младше 1 года.
Представление случая
мы сообщаем о двух клинических случаях новорожденных, рожденных от матерей соответственно с инсулинозависимым сахарным диабетом 2 типа до беременности и подозрением на диабет, с неадекватным пренатальным гликемическим контролем для первого и заниженным гликемическим контролем для второго случае с другой эволюцией.
В первом случае наблюдались медленные признаки улучшения ГКМП, что убедило нас в диагнозе ГКМП, связанного с диабетом; Во втором случае прогрессирующее ухудшение ГКМП во время наблюдения в связи с дальнейшими исследованиями привело к диагнозу болезни Помпе.
Выводы
Гипертрофическая кардиомиопатия у новорожденных может быть клиническим выражением различных фоновых заболеваний. Мы стремимся показать важность как переоценки материнского и семейного анамнеза, так и критической оценки физикального обследования для постановки правильного дифференциального диагноза. Кроме того, важно продолжать регулярное кардиологическое наблюдение за этой патологией с неонатальным началом, чтобы предотвратить неблагоприятный прогноз.
Кроме того, важно продолжать регулярное кардиологическое наблюдение за этой патологией с неонатальным началом, чтобы предотвратить неблагоприятный прогноз.
Введение
Гипертрофическая кардиомиопатия (ГКМП) у новорожденных представляет собой редкое и гетерогенное заболевание, характеризующееся гистологическими и функциональными нарушениями структуры/состава миокарда. На ГКМП приходится от 25 до 40% всех случаев детской кардиомиопатии, и самая высокая заболеваемость в педиатрической популяции зарегистрирована у детей младше 1 года. Существует небольшое преобладание мужчин, и распространенность выше у афроамериканских детей, чем у белых или латиноамериканских детей [1].
В педиатрической популяции этиология ГКМП в основном генетическая/семейная: около 50% всех педиатрических случаев связаны с мутациями белка саркомера; около 30% классифицируются следующим образом: врожденные нарушения метаболизма (болезни накопления гликогена, такие как болезнь Помпе и болезнь Данона, нарушения метаболизма жирных кислот, лизосомальные нарушения накопления, такие как мукополисахаридозы) и митохондриальные кардиомиопатии (комплексная недостаточность дыхательной цепи, митохондриальные синдромы), синдромы пороков развития, связанные с ГКМП (синдром Костелло, кожно-кардиальный синдром и синдром Нунана) и нервно-мышечные расстройства, каждый из которых составляет около 10% всех случаев [2]. Согласно последним данным, точный генетический диагноз может быть установлен почти у 80% пациентов с ГКМП с дебютом в детском возрасте [3].
Согласно последним данным, точный генетический диагноз может быть установлен почти у 80% пациентов с ГКМП с дебютом в детском возрасте [3].
Среди детей грудного возраста этиологическая диагностика ГКМП представляет особую трудность для клиницистов: в целом наблюдается самая высокая частота врожденных нарушений обмена веществ и нервно-мышечных расстройств, и, несмотря на достижения в генетической и метаболической диагностике, около 50% случаев ГКМП в возрасте до 1 года возраст остается идиопатическим. Кроме того, выживаемость у младенцев намного ниже, чем у детей более старшего возраста [1].
Особой этиологией, характерной для неонатального возраста, является развитие ГКМП у младенцев от матерей-диабетиков (IDMs), с частотой от 13 до 44% [4]. Это состояние обычно объясняется гипергликемией матери Педерсона и гиперинсулинемией плода: анаболический эффект гиперинсулинизма плода, связанный с гипергликемией матери, который транзиторно сохраняется в неонатальном периоде, приводит к увеличению синтеза и отложения жира и гликогена в клетках миокарда плода. Паттерн ГКМП, связанный с гиперинсулинемическими состояниями, часто описывается как гипертрофия перегородки или обструкция выводного тракта левого желудочка [4, 5]. В этом состоянии ГКМП обычно обратима, так как исчезает стимул для выработки инсулина, и в большинстве случаев она уже не выявляется на УЗИ через 6 месяцев после рождения [5, 6].
Паттерн ГКМП, связанный с гиперинсулинемическими состояниями, часто описывается как гипертрофия перегородки или обструкция выводного тракта левого желудочка [4, 5]. В этом состоянии ГКМП обычно обратима, так как исчезает стимул для выработки инсулина, и в большинстве случаев она уже не выявляется на УЗИ через 6 месяцев после рождения [5, 6].
Мы описываем два случая ГКМП у новорожденных женского пола, от матерей с анамнезом диабета с различной эволюцией во время эхокардиографического наблюдения. Мы стремимся показать важность подробного анамнеза, физикального обследования и строгого наблюдения за этой патологией с неонатальным началом, которая требует постоянного регулярного кардиологического мониторинга для предотвращения неблагоприятного прогноза в первый год жизни.
Описание случая
Случай 1
Е.А. девочка, рожденная в срок (37 недель и 4 дня гестационного возраста), дочь некровных родителей, африканского происхождения, без семейного анамнеза сердечно-сосудистых заболеваний, ее мать страдала до беременности плохо контролируемый инсулинозависимый сахарный диабет 2 типа. Уровень гликозилированного гемоглобина у матери на момент постановки диагноза составлял 17%, и из-за плохого контроля пероральной терапии она быстро начала инсулинотерапию. В третьем триместре ее гликозилированный гемоглобин составлял 7% при инсулинотерапии. Эхокардиография плода на 35-й неделе гестационного возраста показала тяжелую ГКМП, которая прогрессивно ухудшалась в течение следующих двух недель, присутствовало систолическое движение митрального клапана вперед (SAM) с обструкцией выходного тракта левого желудочка (LV); водянки плода не выявлено.
Уровень гликозилированного гемоглобина у матери на момент постановки диагноза составлял 17%, и из-за плохого контроля пероральной терапии она быстро начала инсулинотерапию. В третьем триместре ее гликозилированный гемоглобин составлял 7% при инсулинотерапии. Эхокардиография плода на 35-й неделе гестационного возраста показала тяжелую ГКМП, которая прогрессивно ухудшалась в течение следующих двух недель, присутствовало систолическое движение митрального клапана вперед (SAM) с обструкцией выходного тракта левого желудочка (LV); водянки плода не выявлено.
Затем по кардиологическим показаниям было выполнено кесарево сечение для подтверждения быстрого развития гипертрофии миокарда плода. Масса тела при рождении составила 3840 г (LGA), оценка по шкале Апгар 1/6/7/8 на 1, 5, 10 и 20 мин соответственно. После реанимации новорожденных ее перевели в отделение интенсивной терапии новорожденных (ОИТН). В первые сутки жизни выявляли гипогликемию и лечили внутривенным (в/в) введением глюкозы. Эхокардиограмма, выполненная после рождения, показала тяжелую гипертрофию левого желудочка (ЛЖ) и гипертрофию межжелудочковой перегородки (IVSd 15,9).мм, z-показатель 6,81) со значительным уменьшением полости желудочка, конечного диастолического объема (КДО 2,4 мл) и обструкцией выходного тракта ЛЖ с максимальным градиентом внутрижелудочкового давления 48,7 мм рт.ст. и средним 12 мм рт.ст. (рис. 1). Результаты ЭКГ (высокий вольтаж QRS в прекардиальных отведениях) подтверждали ГКМП. Немедленно начата терапия бета-адреноблокаторами: в/в эсмолол (начальная доза 50 γ/кг/мин увеличена до 100 γ/кг/мин). После улучшения эхокардиографических показателей терапия была переведена на пероральный прием пропранолола (3–4 мг/кг/сут), который хорошо переносился во время наблюдения. Принимая во внимание тяжесть ГКМП, были проведены дальнейшие исследования для исключения метаболических и генетических заболеваний: биопсия мышц и кожи для выявления митохондриальных заболеваний, ферментные анализы крови для выявления метаболических заболеваний, секвенирование нового поколения (NGS) для выявления мутаций генов саркомерных белков.
Эхокардиограмма, выполненная после рождения, показала тяжелую гипертрофию левого желудочка (ЛЖ) и гипертрофию межжелудочковой перегородки (IVSd 15,9).мм, z-показатель 6,81) со значительным уменьшением полости желудочка, конечного диастолического объема (КДО 2,4 мл) и обструкцией выходного тракта ЛЖ с максимальным градиентом внутрижелудочкового давления 48,7 мм рт.ст. и средним 12 мм рт.ст. (рис. 1). Результаты ЭКГ (высокий вольтаж QRS в прекардиальных отведениях) подтверждали ГКМП. Немедленно начата терапия бета-адреноблокаторами: в/в эсмолол (начальная доза 50 γ/кг/мин увеличена до 100 γ/кг/мин). После улучшения эхокардиографических показателей терапия была переведена на пероральный прием пропранолола (3–4 мг/кг/сут), который хорошо переносился во время наблюдения. Принимая во внимание тяжесть ГКМП, были проведены дальнейшие исследования для исключения метаболических и генетических заболеваний: биопсия мышц и кожи для выявления митохондриальных заболеваний, ферментные анализы крови для выявления метаболических заболеваний, секвенирование нового поколения (NGS) для выявления мутаций генов саркомерных белков. негативы. Во время кардиологического наблюдения (проводилось еженедельно в течение первого месяца, затем каждые две недели до третьего месяца и затем ежемесячно) наблюдались медленные признаки улучшения ГКМП. Последняя выполненная эхокардиограмма (возраст 6 месяцев) показала значительное уменьшение гипертрофии межжелудочковой перегородки (IVSd 8 мм; z-score 3,01), нормализацию полости левого желудочка (EDV 11,4 мл) с уменьшением экокардиографических признаков оттока LV. обструкция тракта (максимальный градиент внутрижелудочкового давления 14 мм рт.ст., средний 6 мм рт.ст.) (рис. 2).
негативы. Во время кардиологического наблюдения (проводилось еженедельно в течение первого месяца, затем каждые две недели до третьего месяца и затем ежемесячно) наблюдались медленные признаки улучшения ГКМП. Последняя выполненная эхокардиограмма (возраст 6 месяцев) показала значительное уменьшение гипертрофии межжелудочковой перегородки (IVSd 8 мм; z-score 3,01), нормализацию полости левого желудочка (EDV 11,4 мл) с уменьшением экокардиографических признаков оттока LV. обструкция тракта (максимальный градиент внутрижелудочкового давления 14 мм рт.ст., средний 6 мм рт.ст.) (рис. 2).
Рис. 1
Эхокардиограмма, выполненная после рождения, показала тяжелую гипертрофию левого желудочка (ЛЖ) и гипертрофию межжелудочковой перегородки (IVSd 15,9 мм, z-показатель 6,81) со значительным уменьшением полости желудочка
Полноразмерное изображение
Рис. 2
Проведенная эхокардиограмма (возраст 6 месяцев) показала значительное уменьшение гипертрофии межжелудочковой перегородки (IVSd 8 мм; z-показатель 3,01)
Изображение в натуральную величину , без признаков аритмических событий.
Ребенок всегда был бессимптомным, с регулярным ростом при грудном вскармливании матери.
Пероральная терапия пропранололом все еще продолжается в дозе 1 мг/кг/день, и каждые три месяца она проходит кардиологическое наблюдение.
Случай 2
К. А. — девочка, рожденная в срок (37 недель и 3 дня гестационного возраста) от дихориальной диамниотической двойни в результате кесарева сечения, выполненного по поводу непрекращающихся родов. Оценка по шкале Апгар составила 9 и 10 баллов на 1 и 5 мин соответственно, а масса тела при рождении составила 2275 г (малый для гестационного возраста, SGA). Пациентка была третьим ребенком от кровнородственных родителей без семейного анамнеза сердечно-сосудистых заболеваний, и мать на момент родов не предъявила документов, касающихся текущей беременности, хотя в анамнезе она сообщила о предшествующем плохо контролируемом инсулинозависимом сахарном диабете. тип 2, обнаруженный при предыдущей беременности. К сожалению, поспешные роды и отсутствие документального подтверждения текущего гликемического баланса позволили диагностировать подозрение на гестационный диабет. Шумы в сердце были обнаружены в первые часы жизни, поэтому были выполнены ЭКГ (высокий вольтаж комплекса QRS в прекардиальных отведениях) (рис. 3) и эхокардиограмма, показывающая умеренную гипертрофию бивентрикулярных сосудов с гипертрофией межжелудочковой перегородки (SIVd 6,6 мм; Z-оценка 5.1, LVPWd 4,6 мм, Z-показатель 4,75), умеренный градиент давления в выходном тракте ПЖ (8,5 мм рт.ст.), полость ЛЖ с КДО 5,3 мл, без обструкции выходного тракта ЛЖ. Систолическая функция ЛЖ была сохранена (FE 74%, FS 40%), тогда как у нее была легкая диастолическая дисфункция LV (E/A 1,13, E/E’ 14). Мышечный тонус, осанка и активность оставались в пределах нормы для гестационного возраста.
Шумы в сердце были обнаружены в первые часы жизни, поэтому были выполнены ЭКГ (высокий вольтаж комплекса QRS в прекардиальных отведениях) (рис. 3) и эхокардиограмма, показывающая умеренную гипертрофию бивентрикулярных сосудов с гипертрофией межжелудочковой перегородки (SIVd 6,6 мм; Z-оценка 5.1, LVPWd 4,6 мм, Z-показатель 4,75), умеренный градиент давления в выходном тракте ПЖ (8,5 мм рт.ст.), полость ЛЖ с КДО 5,3 мл, без обструкции выходного тракта ЛЖ. Систолическая функция ЛЖ была сохранена (FE 74%, FS 40%), тогда как у нее была легкая диастолическая дисфункция LV (E/A 1,13, E/E’ 14). Мышечный тонус, осанка и активность оставались в пределах нормы для гестационного возраста.
Рис. 3
ЭКГ: высоковольтажные комплексы QRS в прекардиальных отведениях и короткий интервал PR
Увеличенное изображение
После выписки еженедельно проводилось кардиологическое наблюдение: наблюдалось быстрое прогрессирующее ухудшение ГКМП и терапия был начат пероральный прием пропранолола. Тем не менее, ультразвуковая картина не улучшалась, а общее состояние пациентки прогрессивно ухудшалось (сосательная слабость, мягкая гипотония, замедление роста), в связи с чем она была повторно госпитализирована в ОРИТН. На ЭКГ выявлено появление укороченного интервала PR как паттерна предвозбуждения. По этим причинам исследования для оценки сопутствующих состояний, особенно врожденных нарушений метаболизма, включали: мышечную биопсию, предполагающую гликогеноз, и тест сухой капли крови (DBS) на активность альфа-1,4-глюкозидазы, демонстрирующий низкую активность, предполагающую наличие болезни Помпе. заболевание (гликогеноз II типа). Затем диагноз был подтвержден генетическим анализом мутаций в гене GAA.
Тем не менее, ультразвуковая картина не улучшалась, а общее состояние пациентки прогрессивно ухудшалось (сосательная слабость, мягкая гипотония, замедление роста), в связи с чем она была повторно госпитализирована в ОРИТН. На ЭКГ выявлено появление укороченного интервала PR как паттерна предвозбуждения. По этим причинам исследования для оценки сопутствующих состояний, особенно врожденных нарушений метаболизма, включали: мышечную биопсию, предполагающую гликогеноз, и тест сухой капли крови (DBS) на активность альфа-1,4-глюкозидазы, демонстрирующий низкую активность, предполагающую наличие болезни Помпе. заболевание (гликогеноз II типа). Затем диагноз был подтвержден генетическим анализом мутаций в гене GAA.
Последняя выполненная эхокардиограмма (в возрасте 3 месяцев) показала гипертрофию межжелудочковой перегородки (SIVd 11,2 мм; z-показатель 5,1) и значительное уменьшение полости левого желудочка (EDV 5 мл) с экокардиографическими признаками обструкции выходного тракта ЛЖ (максимальная градиент внутрижелудочкового давления 7,9 мм рт. ст.) (рис. 4). Во время госпитализации К.А. кормили обогащенной питательными веществами молочной смесью с лучшим набором веса и улучшением общего состояния. Наконец, ее перевели в референс-центр для пациентов Помпе, чтобы начать заместительную ферментную терапию (ФЗТ), которая в настоящее время продолжается.
ст.) (рис. 4). Во время госпитализации К.А. кормили обогащенной питательными веществами молочной смесью с лучшим набором веса и улучшением общего состояния. Наконец, ее перевели в референс-центр для пациентов Помпе, чтобы начать заместительную ферментную терапию (ФЗТ), которая в настоящее время продолжается.
Рис. 4
Выполненная эхокардиограмма (возраст 3 мес.) показала гипертрофию межжелудочковой перегородки (SIVd 11,2 мм; z-показатель 5,1) и значительное уменьшение полости левого желудочка (EDV 5 мл) с экокардиографическими признаками выходного тракта ЛЖ обструкции (максимальный градиент внутрижелудочкового давления 7,9 мм рт. ст.)
Увеличенное изображение
Обсуждение
Мы сообщаем о двух клинических случаях новорожденных, рожденных от матерей соответственно с до беременности инсулинозависимым сахарным диабетом 2 типа и подозрением на диабет с неадекватным пренатальный гликемический контроль для первого и заниженный гликемический контроль для второго случая. Клинические и эхокардиографические данные для каждого случая выявили тяжелую гипертрофическую кардиомиопатию и были одинаковыми при представлении. Низкий вес второго случая был связан как с беременностью двойней, так и с возможной плацентарной диабетической микроангиопатией.
Клинические и эхокардиографические данные для каждого случая выявили тяжелую гипертрофическую кардиомиопатию и были одинаковыми при представлении. Низкий вес второго случая был связан как с беременностью двойней, так и с возможной плацентарной диабетической микроангиопатией.
Хорошо известно, что прегестационный диабет является значительным фактором риска врожденных аномалий сердца, таких как дефекты желудочковой и межпредсердной перегородки (ДМЖП, ДМПП), открытый артериальный проток (ОАП), транспозиция магистральных сосудов (ТГА), коарктация аорты ( КоА) [7]. ГКМП часто наблюдается у младенцев от матерей с диабетом (ИДМ), частота которых колеблется от 10 до 71% [8]. Исход для плода при ИСД обычно связан с периодом возникновения у матери и длительностью непереносимости глюкозы у матери во время беременности, помимо тяжести диабета у матери [4]. Плоды матерей с диабетом 1 типа имеют самый высокий риск развития ГКМП, за ними следует диабет 2 типа и лишь низкий процент гестационного диабета [4, 5].
Гипертрофическая кардиомиопатия, наблюдаемая у плодов, подвергшихся гипергликемии и гиперинсулинемии во время диабетической беременности, в первую очередь поражает межжелудочковую перегородку из-за большого количества рецепторов инсулина в перегородке сердца, но в более тяжелых случаях может распространяться на миокард [8]. ]. Гипертрофия перегородки обнаруживается с помощью эхокардиографии в 30% всех ИДМ и может быть воспроизводимо обнаружена уже на 18-й неделе беременности, тогда как прогрессирующее утолщение может быть документировано по крайней мере до 33-й недели беременности [9].]. Хотя гипертрофия перегородки менее распространена у хорошо контролируемых беременных женщин с диабетом, остается неясным, приведет ли более жесткий контроль уровня глюкозы после диагностики гипертрофии межжелудочковой перегородки плода к регрессу гипертрофии и уменьшению тяжести этого состояния.
Однако важно помнить, что ГКМП новорожденных является гетерогенным состоянием, которое может сопровождаться несколькими нарушениями, потенциально трудно различимыми даже на основании первого ультразвукового исследования сердца.
У детей ГКМП может прогрессировать, а серийные ЭКГ и эхокардиографические измерения размеров ЛЖ, толщины стенки и степени обструкции позволяют проводить диагностическую программу.
Наши случаи представляют собой два примера ГКМП у новорожденных от матери с диабетом, в которых последующее наблюдение имело решающее значение для установления основного диагноза: в первом случае во время кардиологического наблюдения наблюдались медленные признаки улучшения ГКМП. , убеждая нас в диагнозе ГКМП, связанного с диабетом; во втором случае прогрессирующее ухудшение ГКМП во время наблюдения в сочетании с очень типичными изменениями ЭКГ побудило нас провести дальнейшие исследования, в результате которых был поставлен диагноз метаболического нарушения накопления гликогена: болезнь Помпе. Прогноз ГКМП зависит от основного диагноза: ГКМП, связанная с диабетом матери, обычно проходит без осложнений в течение 6 месяцев после рождения, в конечном итоге при соответствующей терапии (например, пропранолол или другие бета-блокаторы). У пациентов с болезнью Помпе обычно наблюдается прогрессирующая кардиальная ГКМП, и они редко доживают до возраста одного года, при этом основной причиной смерти является сердечная недостаточность. При раннем развитии болезни Помпе младенцы часто вялые при рождении. С момента введения ФЗТ выживаемость значительно увеличилась за счет уменьшения сердечной гипертрофии и улучшения сердечной функции; однако мало что известно о долгосрочном влиянии ФЗТ на сердце [10].
У пациентов с болезнью Помпе обычно наблюдается прогрессирующая кардиальная ГКМП, и они редко доживают до возраста одного года, при этом основной причиной смерти является сердечная недостаточность. При раннем развитии болезни Помпе младенцы часто вялые при рождении. С момента введения ФЗТ выживаемость значительно увеличилась за счет уменьшения сердечной гипертрофии и улучшения сердечной функции; однако мало что известно о долгосрочном влиянии ФЗТ на сердце [10].
Выводы
Гипертрофическая кардиомиопатия у новорожденных может быть клиническим выражением различных фоновых заболеваний. У младенцев от матерей с диабетом обычно обнаруживается ГКМП, особенно при плохо контролируемой пренатальной гликемии. Все IDM с гипертрофией перегородки должны получить консультацию и последующее наблюдение детского кардиолога, работающего в сотрудничестве с гинекологом: требуется мониторинг плода, планирование родов и родовспоможение.
После рождения важно переоценить материнский и семейный анамнез и критически оценить физикальное обследование для постановки правильного дифференциального диагноза. Кроме того, важно продолжать регулярное кардиологическое наблюдение с ЭКГ, эхокардиографией и холтеровским мониторированием ЭКГ по показаниям, чтобы оценить прогрессирование ГКМП: как правило, ГКМП при IDM имеет хороший прогноз, и эта кардиомиопатия обычно обратима. Когда ГКМП не улучшается или ухудшается, срочно необходимы дальнейшие исследования для исключения метаболических нарушений, так как они характеризуются неблагоприятным прогнозом на первом году жизни.
Кроме того, важно продолжать регулярное кардиологическое наблюдение с ЭКГ, эхокардиографией и холтеровским мониторированием ЭКГ по показаниям, чтобы оценить прогрессирование ГКМП: как правило, ГКМП при IDM имеет хороший прогноз, и эта кардиомиопатия обычно обратима. Когда ГКМП не улучшается или ухудшается, срочно необходимы дальнейшие исследования для исключения метаболических нарушений, так как они характеризуются неблагоприятным прогнозом на первом году жизни.
Наличие данных и материалов
Наборы данных, использованные и проанализированные в ходе текущего исследования, доступны по адресу.
корреспонденту автора по обоснованному запросу.
Сокращения
- HCM:
Гипертрофическая кардиомиопатия
- IDM:
Младенцы от матери с диабетом
- СЭМ:
Систолическое переднее движение
- СИВд:
Диаметр гипертрофии межжелудочковой перегородки
- ЭДВ:
Конечный диастолический объем
- ASD:
Дефекты межпредсердной перегородки
- КПК:
Патологический артериальный проток
- ТГА:
Транспозиция больших сосудов
- Сертификат подлинности:
Коарктация аорты
- ДБС:
Засохшее пятно крови
- ERT:
Ферментозаместительная терапия
- LV:
Левый желудочек
Каталожные номера
- «>
Моак Дж.П., Каски Дж.П. Гипертрофическая кардиомиопатия у детей. Сердце. 2012;98(14):1044–54. https://heart.bmj.com/content/98/14/1044. https://doi.org/10.1136/heartjnl-2011-300531.
Артикул
пабмедGoogle ученый
Рупп С., Фелимбан М., Шэнцер А., Шранц Д., Маршалл С., Ценкер М. и др. Генетические основы гипертрофической кардиомиопатии у детей. Клин Рез Кардиол. 2019;108(3):282–9. https://doi.org/10.1007/s00392-018-1354-8.
КАС
Статья
пабмедGoogle ученый
Paauw ND, Stegeman R, de Vroede MAMJ, Termote JUM, Freund MW, Breur JMPJ. Неонатальная сердечная гипертрофия: роль гиперинсулинизма — обзор литературы.
 Eur J Педиатр. 2020;179(1):39–50. https://doi.org/10.1007/s00431-019-03521-6.
Eur J Педиатр. 2020;179(1):39–50. https://doi.org/10.1007/s00431-019-03521-6.КАС
Статья
пабмедGoogle ученый
Шарма Д., Пандита А., Шастри С., Шарма П. Асимметричная гипертрофия перегородки и гипертрофическая кардиомиопатия у младенцев от матери-диабетика: обратимая кардиомиопатия. Med J Dr DY Patil Univ. 2016;9(2): 257. https://doi.org/10.4103/0975-2870.177679.
Артикул
Google ученый
Ульмо С., Виал Ю., Ди Бернардо С. и др. Патологическая гипертрофия желудочков у потомства матерей с диабетом: ретроспективное исследование. Европейское сердце J. 2007; 28 (11): 1319–25. https://doi.org/10.1093/eurheartj/ehl416.
КАС
Статья
пабмедGoogle ученый
Каллем В.Р., Пандита А., Пиллаи А. Младенец матери с диабетом: что нужно знать? J Matern Fetal Neonatal Med.
 2020;33(3):482–92. https://doi.org/10.1080/14767058.2018.1494710 Epub 2018 Sep 9. PMID: 29947269.
2020;33(3):482–92. https://doi.org/10.1080/14767058.2018.1494710 Epub 2018 Sep 9. PMID: 29947269.Статья
пабмедGoogle ученый
Palmieri CR, Simões MA, Silva JC, Santos AD, Silva MR, Ferreira B. Распространенность гипертрофической кардиомиопатии у плодов матерей с гестационным диабетом до начала лечения. Rev Bras Ginecol Obstet 2017;39(1):9–13. Английский. doi: https://doi.org/10.1055/s-0037-1598602. Epub 2017, 28 февраля. PMID: 28245507.
Леви П.Т., Тиссо С., Хорсберг Эриксен Б. и др. Применение неонатологом выполненной эхокардиографии в оценке и лечении неонатальной сердечной недостаточности, не связанной с врожденным пороком сердца. Педиатр рез. 2018). https://doi.org/10.1038/s41390-018-0075-z;84(S1):78–88.
Артикул
Google ученый
Van Capelle CI, Poelman E, Frohn-Mulder IM, et al.
 Сердечный исход при классической детской болезни Помпе после 13 лет лечения рекомбинантной кислой альфа-глюкозидазой человека. Int J Кардиол. 2018;269: 104–10. https://doi.org/10.1016/j.ijcard.2018.07.091.
Сердечный исход при классической детской болезни Помпе после 13 лет лечения рекомбинантной кислой альфа-глюкозидазой человека. Int J Кардиол. 2018;269: 104–10. https://doi.org/10.1016/j.ijcard.2018.07.091.Артикул
пабмедGoogle ученый
Колан SD. Гипертрофическая кардиомиопатия в детском возрасте. Клиника сердечной недостаточности. 2010;6(4):433–44, vii-iii. doi: https://doi.org/10.1016/j.hfc.2010.05.004. PMID: 20869644; PMCID: PMC2946944.
Ссылки на скачивание
Благодарности
Неприменимо.
Финансирование
Финансирование данного исследования не предоставлялось.
Информация об авторе
Авторы и организации
Детская клиника, Fondazione IRCCS Policlinico San Matteo, Павия, Италия
Alessia Claudia Codazzi
Pediatric Clinic, Fondazione IRCCS Polliclinico S. Matteo, Университет Павии, Павия, Италия
Rosario Ippolito, Cecilia Novara & Enrico Tondina
9002
777777777777777777777 гол. San Matteo, Pavia, Italy
Rosa Maria Cerbo & Chryssoula Tzialla
Авторы
- Alessia Claudia Codazzi
Посмотреть публикации авторов
Вы также можете искать этого автора в
PubMed Google Scholar - Rosario Ippolito
Посмотреть публикации автора
Вы также можете искать этого автора в
PubMed Google Scholar - Cecilia Novara
Просмотр публикаций автора
Вы также можете искать этого автора в
PubMed Google Scholar - Enrico Tondina
Посмотреть публикации автора
Вы также можете искать этого автора в
PubMed Google Scholar - Rosa Maria Cerbo
Посмотреть публикации автора
Вы также можете искать этого автора в
PubMed Google Scholar - Chryssoula Tzialla
Посмотреть публикации автора
Вы также можете искать этого автора в
PubMed Google Scholar
Вклады
RI, CN и ET собрали и проанализировали клинические данные и составили рукопись. RMC и CT внесли свой вклад в клиническое ведение пациента, а также в проведение инструментальных исследований и дали окончательное одобрение версии, которая будет представлена. ACC участвовал в клиническом ведении пациента, провел кардиологическую оценку, отредактировал рукопись и дал окончательное одобрение версии, которая будет представлена. Все авторы прочитали и одобрили окончательный вариант рукописи.
RMC и CT внесли свой вклад в клиническое ведение пациента, а также в проведение инструментальных исследований и дали окончательное одобрение версии, которая будет представлена. ACC участвовал в клиническом ведении пациента, провел кардиологическую оценку, отредактировал рукопись и дал окончательное одобрение версии, которая будет представлена. Все авторы прочитали и одобрили окончательный вариант рукописи.
Автор, ответственный за переписку
Переписка с
Росарио Ипполито.
Декларация этики
Одобрение этики и согласие на участие
Письменное информированное согласие было получено от обоих родителей при поступлении.
их новорожденных.
Все процедуры, выполненные в этом отчете, соответствовали этическим стандартам.
Согласие на публикацию
Неприменимо.
Конкурирующие интересы
Авторы заявляют, что у них нет конкурирующих интересов.
Дополнительная информация
Примечание издателя
Springer Nature остается нейтральной в отношении юрисдикционных претензий в опубликованных картах и институциональной принадлежности.
Права и разрешения
Открытый доступ Эта статья находится под лицензией Creative Commons Attribution 4.0 International License, которая разрешает использование, совместное использование, адаптацию, распространение и воспроизведение на любом носителе или в любом формате при условии, что вы укажете соответствующую ссылку на оригинальный автор(ы) и источник, предоставьте ссылку на лицензию Creative Commons и укажите, были ли внесены изменения. Изображения или другие сторонние материалы в этой статье включены в лицензию Creative Commons на статью, если иное не указано в кредитной строке материала. Если материал не включен в лицензию Creative Commons статьи, а ваше предполагаемое использование не разрешено законом или выходит за рамки разрешенного использования, вам необходимо получить разрешение непосредственно от правообладателя. Чтобы просмотреть копию этой лицензии, посетите http://creativecommons.org/licenses/by/4.0/. Отказ Creative Commons от права на общественное достояние (http://creativecommons. org/publicdomain/zero/1.0/) применяется к данным, представленным в этой статье, если иное не указано в кредитной линии данных.
org/publicdomain/zero/1.0/) применяется к данным, представленным в этой статье, если иное не указано в кредитной линии данных.
Перепечатки и разрешения
Об этой статье
Кардиомиопатия у детей | Бостонская детская больница
Как диагностируется кардиомиопатия?
Поскольку симптомы кардиомиопатии могут быть разнообразными, ее часто неправильно диагностируют как астму, инфекцию или желудочно-кишечные заболевания.
У детей, у которых нет симптомов, кардиомиопатия иногда диагностируется, когда ребенку делают рентгенографию грудной клетки, которая показывает увеличенное сердце, или эхокардиограмму по другой причине.
Если врач вашего ребенка подозревает кардиомиопатию, он или она может назначить один или несколько из следующих тестов:
- анализы крови
- рентген грудной клетки
- электрокардиограмма
(ЭКГ или ЭКГ)
- эхокардиограмма (УЗИ сердца)
- магнитно-резонансная томография сердца (МРТ)
- стресс-эхокардиография, которая использует ультразвук и мониторинг сердечного ритма для оценки функции сердца вашего ребенка непосредственно перед и сразу после тренировки
- катетеризация сердца
- коронарография
9Стресс-тест 0021 или нагрузочный тест
Какие существуют варианты лечения кардиомиопатии?
Варианты лечения вашего ребенка будут определяться типом кардиомиопатии, а также конкретными симптомами. Ребенку без симптомов может не понадобиться лекарство или другое лечение сразу. Вместо этого кардиолог будет наблюдать за вашим ребенком, чтобы оценить прогрессирование заболевания.
Ребенку без симптомов может не понадобиться лекарство или другое лечение сразу. Вместо этого кардиолог будет наблюдать за вашим ребенком, чтобы оценить прогрессирование заболевания.
Ребенку с более серьезными симптомами могут потребоваться дополнительные анализы, чтобы предоставить лечащей бригаде более подробную информацию о влиянии кардиомиопатии на сердце и остальные части тела. .
Многие дети с кардиомиопатией чувствуют себя хорошо, принимая только лекарства. Другим требуется хирургическое вмешательство для улучшения функции клапанов, а в самых тяжелых случаях некоторым детям требуется пересадка сердца.
Лекарство от кардиомиопатии
Существует несколько различных типов лекарств от кардиомиопатии, в зависимости от того, какой тип у вашего ребенка и симптомы.
- Ангиотестин Ингибиторы конвертирующего фермента (АПФ) — это препараты, которые расширяют кровеносные сосуды в организме, борясь с эффектом сужения, вызванным сердечной недостаточностью.

- Антиаритмические препараты борются с ненормальным сердечным ритмом, вызванным нерегулярной электрической активностью в сердце.
- Бета-блокаторы блокируют связывание некоторых химических веществ с нервными рецепторами в сердце, замедляя частоту сердечных сокращений и снижая кровяное давление.
- Разбавители крови или антикоагулянты помогают предотвратить образование тромбов, особенно у детей с дилатационной формой кардиомиопатии.
- Диуретики предотвращают скопление жидкости в организме и могут помочь дыханию, уменьшая количество жидкости в легких. Эти препараты также могут быть полезны при лечении рубцовой ткани на сердце.
Хирургическое лечение кардиомиопатии
Существует несколько вариантов лечения кардиомиопатии с помощью хирургии или малоинвазивных процедур.
Дефибрилляторы
Для некоторых детей с кардиомиопатией, особенно с ГКМП, имплантируемый кардиовертер-дефибриллятор (ИКД) может спасти жизнь. Этот крошечный прибор размером с колоду карт помещают в грудь, чтобы следить за сердцебиением ребенка. Если у ребенка аритмия, дефибриллятор подаст точный электрический импульс для восстановления нормального сердечного ритма.
Этот крошечный прибор размером с колоду карт помещают в грудь, чтобы следить за сердцебиением ребенка. Если у ребенка аритмия, дефибриллятор подаст точный электрический импульс для восстановления нормального сердечного ритма.
Кардиостимуляторы
Имплантация кардиостимулятора является минимально инвазивным вариантом для некоторых детей с кардиомиопатией. Кардиостимулятор — небольшое электронное устройство — вводится прямо под кожу, откуда он посылает электрические сигналы сердцу ребенка, контролируя и контролируя частоту сердечных сокращений. Процедуру можно провести под местной анестезией в течение нескольких часов.
Радиочастотная абляция
Радиочастотная абляция — еще один тип минимально инвазивного лечения, который может быть очень эффективным для некоторых детей с кардиомиопатией вследствие аритмии. Небольшой игольчатый зонд вводится в рубцовую ткань сердечной мышцы, посылая радиочастотные волны, которые сжигают рубцовую ткань и аритмию.
Хирургическое удаление части сердечной мышцы
В серьезных случаях гипертрофической кардиомиопатии лечащая бригада может выполнить операцию, называемую септальной миэктомией или септальной миомэктомией. Эта процедура включает удаление части утолщенной мышцы сердца, расширение канала в желудочке сердца, который ведет к аортальному клапану. Процедура имеет очень хорошие показатели успеха, и у большинства детей улучшается кровоток по всему сердцу и всему телу.
Эта процедура включает удаление части утолщенной мышцы сердца, расширение канала в желудочке сердца, который ведет к аортальному клапану. Процедура имеет очень хорошие показатели успеха, и у большинства детей улучшается кровоток по всему сердцу и всему телу.
Вентрикулярное вспомогательное устройство
При определенных типах кардиомиопатии желудочковое вспомогательное устройство (VAD) может использоваться для восстановления работы сердца и нормализации его функции. После того, как функция сердца вернется к норме, VAD будет удален, и ребенок будет находиться под наблюдением на предмет любых дальнейших проблем с сердцем. Такой подход с использованием VAD называется «мостом к выздоровлению».
Пересадка сердца
Детям с наиболее тяжелыми случаями кардиомиопатии может потребоваться пересадка сердца, если другие методы не помогают справиться с симптомами. Пока ваш ребенок ждет доступного сердца, VAD может использоваться для поддержки сердца. Во многих случаях дети могут вернуться в школу и заниматься другими делами в ожидании трансплантации.
Хирургическое лечение гипертрофической кардиомиопатии приносит пользу педиатрическим пациентам
31 марта 2022 г.
Гипертрофическая кардиомиопатия (ГКМП) является наиболее распространенной наследственной кардиомиопатией, поражающей 1 из 500 человек. Это также наиболее частая причина внезапной смерти молодых людей, особенно молодых спортсменов.
ГКМП проявляется гипертрофией левого желудочка при отсутствии другой этиологии. Приблизительно от 60% до 70% людей имеют идентифицируемый генетический патогенный вариант.
Семейный анамнез имеет решающее значение при обследовании таких пациентов. Все родственники первой линии любого взрослого пациента или ребенка с HCM нуждаются в скрининге с помощью эхокардиографии, и у больных взрослых есть 50% вероятность передачи патогенного варианта своим детям.
Эхокардиограммы, проводимые в связи с положительным семейным анамнезом, могут потребоваться повторять с интервалами в течение всей жизни, часто каждые несколько лет в детстве, каждые 1–2 года в подростковом возрасте и каждые 3–5 лет во взрослом возрасте.
Эхокардиография используется для выявления гипертрофии левого желудочка и обструкции выходного тракта, которые присутствуют у 70% пациентов. Магнитно-резонансная томография с усилением гадолинием также рекомендуется в дополнение к эхокардиографии и для определения наличия мышечного фиброза.
Медикаментозное лечение является терапией первой линии для пациентов с симптомами ГКМП . Это лечение чаще всего включает лекарства от артериального давления, такие как бета-блокаторы или блокаторы кальциевых каналов, или антиаритмические препараты.
Симптомы могут включать:
- Одышку, особенно во время физической нагрузки
- Боль или давление в груди, особенно во время физической нагрузки
- Обморок, особенно во время или сразу после физической нагрузки или напряжения
- Шумы в сердце
- Учащенное сердцебиение
Расширенная миэктомия перегородки левого желудочка — операция на открытом сердце, включающая резекцию утолщенной перегородки миокарда, которая способствует обструкции выходного тракта левого желудочка — является процедурой выбора, если медикаментозное лечение неэффективно или возникают невыносимые побочные эффекты медикаментозной терапии.
«Врачи клиники Майо обследуют и лечат более 2100 детей и взрослых на HCM каждый год, — говорит Джозеф А. Дирани, доктор медицинских наук, директор отделения хирургии врожденных пороков сердца у детей и взрослых в клинике Майо в Рочестере, Миннесота. «Около двух третей пациентов будут кандидатами на септальную миэктомию, включая наших педиатрических пациентов».
Общий опыт миэктомии в клинике Майо насчитывает около 4500 пациентов. Опыт педиатрической миэктомии в настоящее время превышает 200 процедур.
Септальная миэктомия показана пациентам с ГКМП , у которых есть симптомы, рефрактерные к медикаментозной терапии, и тяжелая обструкция выходного тракта левого желудочка, определяемая как градиент в покое или спровоцированный более 30 мм рт.ст. Дополнительные показания теперь включают симптоматических пациентов с низким градиентом оттока в покое и скрытой обструкцией, наличием легочной гипертензии или предсердных тахиаритмий или тяжелой сопутствующей митральной регургитацией. Наконец, опыт клиники Майо показывает, что подгруппа пациентов с благоприятной анатомией перегородки отвечает исключительно хорошо и может быть рассмотрена для хирургического вмешательства до неэффективной медикаментозной терапии.
Наконец, опыт клиники Майо показывает, что подгруппа пациентов с благоприятной анатомией перегородки отвечает исключительно хорошо и может быть рассмотрена для хирургического вмешательства до неэффективной медикаментозной терапии.
Рассмотрение хирургического вмешательства у детей
Медикаментозное лечение и показания к хирургическому вмешательству, как правило, одинаковы для детей и взрослых. Но дети младшего возраста часто не имеют симптомов. Часто гипертрофия начинает развиваться в подростковом возрасте или во время скачков роста. Отсутствие симптомов затрудняет решение об операции.
Педиатрическая миэктомия технически более сложна из-за небольших структур, что приводит к увеличению вероятности неполной миэктомии или таких осложнений, как повреждение аорты или митрального клапана. Хотя после миэктомии у детей можно ожидать улучшения симптомов, прогноз у детей с HCM хуже, чем у взрослых. Несмотря на это, опыт клиники Мэйо показывает, что септальная миэктомия может быть безопасной и эффективной у детей с симптомами, обеспечивая большую отдаленную выживаемость и лучшее качество жизни, чем ожидаемая выживаемость пациентов с обструкцией, получающих только медикаментозную терапию.
