Гемофільна інфекція у дітей: Неприпустима назва — Вікіпедія
У чому небезпека гемофільної інфекції і як захиститися
Гемофільна інфекція характеризується переважним ураженням органів дихання, центральної нервової системи та розвитком гнійних вогнищ у різних органах. Заразитися можна лише від хворої людини.
Гемофільна інфекція передається повітряно-крапельним шляхом, проте у маленьких дітей шлях передачі може бути контактним.
Збудник інфекції локалізується на слизовій оболонці верхніх дихальних шляхів. Найчастіше хворіють діти віком від 6 міс. до 4 років. Рідше хворіють новонароджені, діти більш старшого віку і дорослі.
В Україні за 2018 рік зареєстровано 75 випадків. За 7 місяців 2019 року захворіло 14 людей (показник на 100 тисяч складає 0,03), що в 5 раз менше аналогічного періоду минулого року, коли захворіли 63 людини (показник 0,15).
Найчастішими клінічними формами гемофільної інфекції є менінгіт, середній отит і пневмонія. Реєструються також і інші ускладнення: перикардит, синусит, отит, гнійні артрити, захворювання дихальних шляхів та ін.
Гемофільна пневмонія є другою за частотою серед усіх бактеріальних пневмоній у дітей. Може проявлятися як у вигляді осередкової пневмонії, так і у вигляді крупозної, дуже часто (до 70 %) супроводжується гнійним плевритом у дітей, може ускладнюватися гнійним перикардитом, середнім отитом. Може приймати затяжний перебіг. У дорослих, особливо літніх осіб, гемофільна інфекція може нашаровуватися на інші види інфекцій.
Єдиним профілактичним захистом є вакцинація, яка передбачена Календарем профілактичних щеплень.
Вакцинація дітей може проводитись моновакцинами та комбінованими вакцинами, що містять Hib-компонент. Щеплення необхідно проводити за схемою 2-4-12 місяців.
Вакцинація проводиться дітям до 5 років. Безоплатно вакцинуватися за Календарем чи надолужити пропущені щеплення можуть усі діти до 18 років. Дорослі можуть вакцинуватись проти Hib-інфекції за власні кошти.
Переглядів: 187
Дата публікації: 10:19 22. 09.2020
09.2020
Прививка от гемофильной инфекции. График вакцинации
Гемофильная инфекция – тяжелая инфекция детей раннего возраста, в основном до 1 года жизни, проявляется гнойным менингитом, отитом, заболеваниями дыхательных путей (пневмония, бронхит, эпиглоттит), а также поражением со стороны сердца, суставов и др.
Вакцинация согласно календарю прививок России должна проводиться в возрасте 3; 4,5 и 6 месяцев с ревакцинацией в 18 месяцев.
Вакцинация против гемофильной инфекции
В России зарегистрированы три вакцины против гемофильной инфекции Акт-ХИБ, Хиберикс и комбинированная вакцина Пентаксим, в состав которой входит дифтерийная, столбнячная, коклюшная, полиомиелитная и гемофильная вакцины. Все вакцины вводятся внутримышечно в бедро или верхнюю часть плеча.
Вакцины Акт-ХИБ или Хиберикс могут вводиться одновременно с вакцинами АКДС, гепатита В и полиомиелитной вакциной в разные части тела.
Вакцинация детей согласно календарю прививок:
Возраст | |
Первая вакцина | 3 месяца |
Вторая вакцинация | 4,5 месяца |
Третья вакцинация Ревакцинация | 6 месяцев 18 месяцев |
Побочные эффекты
У большинства детей никаких побочных явлений после вакцинации нет. Могут быть небольшое повышение температуры тела, покраснение и болезненность в месте введения.
Когда вакцинация откладывается
Противопоказаний к вакцинации нет. Временное противопоказание – острое заболевание, после которого вакцина может быть введена.
Вакцинація проти гемофільної інфекції в Тернополі
Вакцинація проти цієї інфекції включена до календаря профілактичних щеплень України. Гемофільна інфекція являється причиною близько половини випадків гнійних менінгітів у дітей до п’яти років. Захиститися від гемофільної інфекції дозволяє тільки вакцинація.
Симптоми гемофільної інфекції
Гемофільна інфекція (ХІБ-інфекція) — поширена інфекційна хвороба гострого характеру, збудником якої є гемофільна паличка, що викликає:
- респіраторні захворювання;
- бронхіт;
- ангіну;
- синусит;
- отит;
- пневмонії.
Дані захворювання часто переходять в хронічну форму і загострюються протягом всього життя. Також є й більш важкі прояви.
Гнійний бактеріальний менінгіт (запальний процес мозкових оболонок) — найбільш важка форма ХІБ-інфекції. Клінічно менінгіт і пневмонія, викликані H.influenzae, не відрізняються від хвороб, викликаних іншими мікроорганізмами. Діагноз встановлюється тільки за допомогою лабораторних тестів.
Діагноз встановлюється тільки за допомогою лабораторних тестів.
Епіглотит — запалення надгортанника — дуже небезпечна форма ХІБ-інфекції з важкою інтоксикацією і крупом, який прогресує дуже швидко. Він може викликати задуху з летальним результатом.
Гемофільний сепсис (зараження крові) характерний для дітей 6-12 місяців і протікає нерідко блискавично — з септичним шоком і швидкою загибеллю дитини.
Всі ці хвороби зустрічаються у дітей з 0 до 5 років. У старших дітей захворювання, викликані гемофільною інфекцією, бувають вкрай рідко.
Проведення вакцинації проти ХІБ-інфекції
Вакцинація проти ХІБ-інфекції дітей першого року життя захищає від найнебезпечніших її форм – менігіту та пневмонії, адже пік захворюваності даними формами припадає на 6-12 місяців. Дітям старше року вакцинація \проводиться з метою зменшення захворюваністю на ГРЗ, пневмонію, отит, бронхіт та інші недуги органів дихання.
Найбільш поширена і безпечна вакцина проти гемофільної інфекції, що застосовується в нашій країні не вміщує живих мікробів, а тому неможливо захворіти в результаті щеплення, і поява побічних реакцій зведена до мінімуму. Вакцина добре переноситься, але іноді в місці уколу можливе почервоніння, ущільнення, невелике підвищення температури.
Вакцина добре переноситься, але іноді в місці уколу можливе почервоніння, ущільнення, невелике підвищення температури.
МЦ «Оксфорд Медікал Тернопіль» пропонує пройти вакцинацію від гемофільної інфекції вашим малюкам, особливо якщо вони входять в зону ризику захворюваності:
- діти на штучному вигодовуванні;
- діти з малою масою тіла;
- діти з імунодефіцитними станами;
- діти, які часто хворіють;
- діти, які планують ходити чи відвідують дошкільні установи.
У дитячому колективі відбувається тривалий і тісний контакт між собою і, як наслідок, передача один одному цієї повітряно-крапельної інфекції. Тому при підготовці дитини до садка, для зниження частоти ГРЗ та їх ускладнень, рекомендуємо не нехтувати щепленням від гемофільної інфекції.
Схеми вакцинації проти гемофільної інфекції
В Україні вакцинація проти даної інфекції проводиться двічі на першому році: в 2 і 6 місяців (одночасно з щепленням проти кашлюку, правця, дифтерії і поліомієліту). Ревакцинація — у 12 місяців.
Ревакцинація — у 12 місяців.
При вакцинації у віці 12-14 місяців друга (бустерна) доза вводиться через 2 місяці після першої. При вакцинації після 15 місяців досить 1 дози. Після 5 років вакцинація від ХІБ не проводиться.
Вакцинація проти гемофільної інфекції є доступною, безпечною і надійним захистом, що дозволяє знизити захворюваність гемофільною інфекцією до одиночних випадків в цілому по країні.
Для бронування телефонуйте (068) 752 52 52.
Прививка от гемофильной инфекции в Днепре
Гемофильная инфекция или так называемая (ХИБ-инфекция) — это большая группа тяжелых инфекционных заболеваний, причиной которых становится гемофильная палочка. Зачастую эти заболевания поражают детей младшего возраста (до 1 года) вызывая многие другие тяжело переносимые заболевания дыхательных путей, например, отит и даже гнойный менингит, которые также снижают работоспособность сердечнососудистой системы и суставов.
Для предупреждения таких серьезных заболеваний, детям на первом году жизни показана вакцинация
против гемофильной инфекции. Эта процедура позволяет выработать необходимые антитела, защищающие ребенка на 95-100% на протяжении не менее 4 лет.
Эта процедура позволяет выработать необходимые антитела, защищающие ребенка на 95-100% на протяжении не менее 4 лет.
Что такое прививка против гемофильной инфекции
Прививка от гемофильной инфекции — это, пожалуй, единственный проверенный и надежный метод защиты от ХИБ-инфекции, защищающий младенцев и детей младшего возраста от заболеваний, вызываемых этим возбудителем. Этот вид вакцинации является обязательным в Украине, как и во многих развитых странах мира.
В свете возрастающей резистентности возбудителей к антибиотикам и недостаточного развития иммунной системы у детей младшего возраста, а именно до 5 лет, становится практически невозможно сформировать иммунитет способный противостоять гемофильной инфекции.
Эта инфекция попадает в организм больного воздушно-капельным путем, нередко переносчиками возбудителя могут быть не только люди, но и игрушки, одежда, обычные предметы общего пользования. Согласно статистическим данным, каждый год в стране регистрируется порядка 2 тысяч случаев заболевания бактериальным менингитом, а также 140 смертей от бактериальной пневмонии, 250 детей могут иметь септицемию, а 5 из них с летальным исходом. Такой простой метод заражения и показательные статистические данные, делает вакцинацию крайне актуальной.
Такой простой метод заражения и показательные статистические данные, делает вакцинацию крайне актуальной.
Схема вакцинации прививок против гемофильной инфекции
В зависимости от того, сколько ребенку лет, выбирается доза для первичной иммунизации.
| Возраст | Доза | Схема |
| От 6 недель до 6 месяцев | 3 инъекции + ревакцинация | Интервалы между инъекциями 30-60 дней Ревакцинация через год после окончания курса |
| От 6 месяцев до 1 года | 2 инъекции + ревакцинация | Интервалы между инъекциями не более 30 дней Ревакцинация не позже, чем через 12 месяцев после окончания курса |
| От 1 года до 5 лет | 1 инъекции | Однократно |
Успешно завершенным курс вакцинации считается после ревакцинации, если все прививки были проведены согласно схеме.
Імунітет до Haemophilus influenzae типу b та кашлюка у дітей з ВІЛ-інфекцією
SOVREMENNAYA PEDIATRIYA.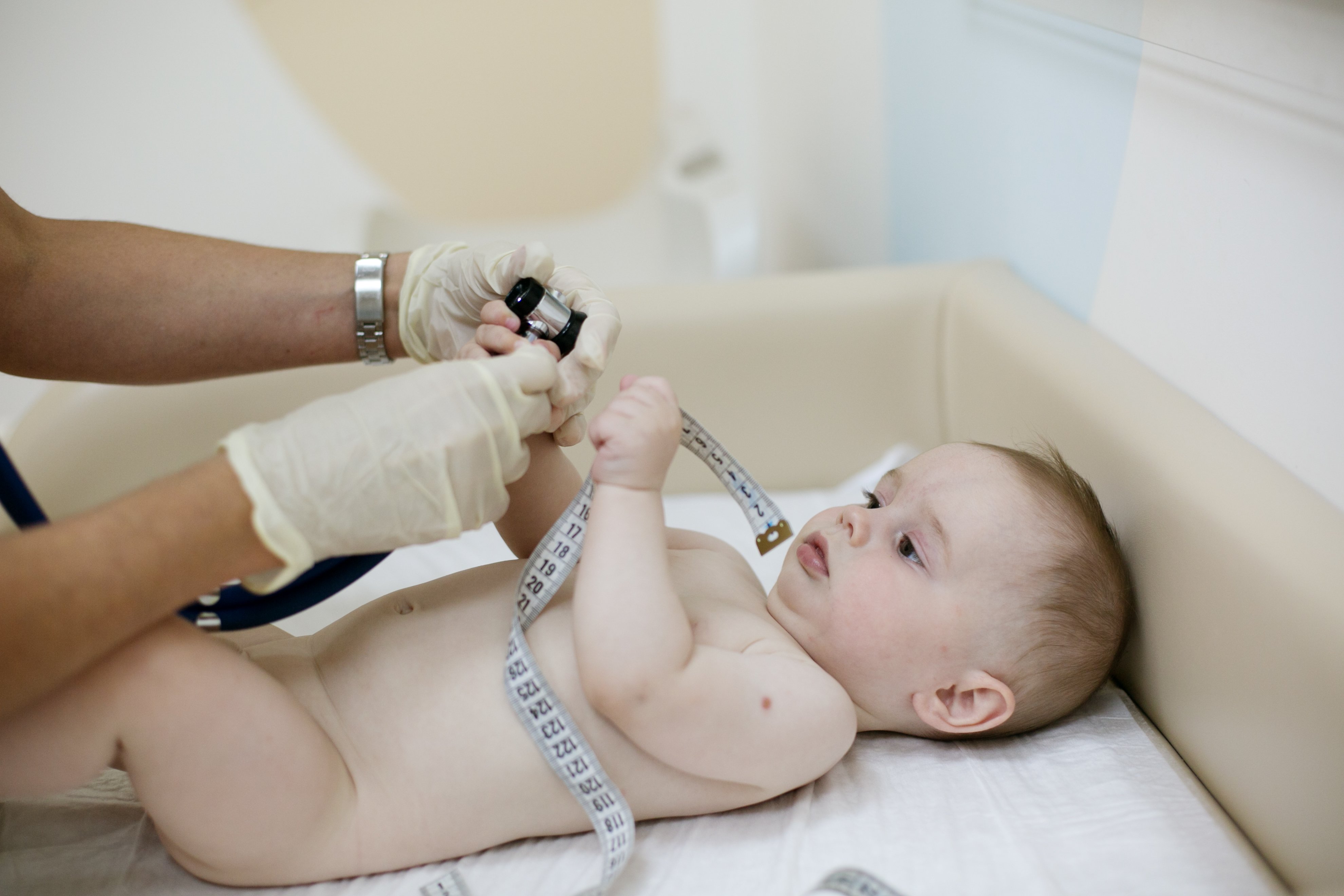 2019.3(99):18-24; doi 10.15574/SP.2019.99.18
2019.3(99):18-24; doi 10.15574/SP.2019.99.18
Раус І. В.
Київська міська клінічна лікарня №5, Україна
Київський міський центр профілактики та боротьби з ВІЛ/СНІДом, Україна
Діти, які живуть з ВІЛ, мають підвищений ризик захворюваності на вакцинокеровані бактеріальні інфекції, такі як гемофільна інфекція і кашлюк. Дані про захищеність ВІЛ-інфікованих дітей від цих інфекцій обмежені.
Мета: оцінка імунітету до Haemophilus influenzae тип b (Hib) і кашлюка у підлітків з перинатальною ВІЛ-інфекцією.
Матеріали і методи. Проведений аналіз вакцинального статусу та специфічного імунітету проти Hib і кашлюка у дітей з перинатальною ВІЛ-інфекцією, що спостерігаються в Київському міському центрі профілактики та боротьби з ВІЛ/СНІДом. У ВІЛ-інфікованих дітей підліткового віку (n=51) визначений рівень антитіл класу IgG до полірибозилрибітолфосфату капсули Hib та кашлюкового токсину. До групи порівняння увійшли 22 здорові дитини, не інфіковані ВІЛ, аналогічного віку.
Результати. Охоплення імунізацією ВІЛ-інфікованих дітей проти кашлюка становило 63,6%, проти Hib-інфекції — 16,8%. Більшість ВІЛ-інфікованих підлітків (43/51, 84,3%) мали рівень антитіл до капсулярного полісахариду Hib≥1 мкг/мл, який вважається захисним проти інвазивних форм гемофільної інфекції. Високий рівень антитіл до кашлюкового токсину (>100 МО/мл) визначено у 32/51 (62,7%) дітей з ВІЛ-інфекцією.
Висновки. Актуальним є проведення вакцинації проти Hib-інфекції дітям з ВІЛ$інфекцією старше п’яти років, які не отримали щеплення раніше або були щеплені не повністю. Наявність високого рівня антитіл до кашлюкового токсину у більшості підлітків з ВІЛ-інфекцією свідчить про високу захворюваність їх на кашлюк. З метою захисту ВІЛ-інфікованих дітей від кашлюка необхідно рекомендувати введення бустерної дози ацелюлярної кашлюкової вакцини зі зниженим вмістом антигенів дітям шкільного віку.
Ключові слова: ВІЛ-інфекція, діти, гемофільна інфекція, кашлюк, імунітет.
ЛІТЕРАТУРА
1. Волоха АП, Чернишова ЛІ, Раус ІВ. (2013). Проблеми імунізації ВІЛ-інфікованих дітей (огляд літератури). Современная педиатрия. 2(50): 10—17.
2. Волоха АП, Чернишова ЛІ, Раус ІВ. (2015). Вакцинація дітей з ВІЛ-інфекцією. Методичні рекомендації: 28.
3. Волоха АП, Чернишова ЛІ, Раус ІВ. (2018). Поствакцинальний імунітет дітей з ВІЛ-інфекцією. Современная педиатрия. 6(94): 41—46. https://doi.org/10.15574/SP.2018.94.41
4. Про порядок проведення профілактичних щеплень в Україні та контроль якості й обігу медичних імунобіологічних препаратів. Наказ МОЗ України від 16.09.2011 №595 (2011). http://www.moz.gov.ua.
5. Чернишова ЛІ, Лапій ФІ, Волоха А.П (редактори) (2018). Імунопрофілактика інфекційних хвороб. Київ: ВСВ Медицина.
6. Abzug MJ, Song Lin-Ye, Fenton T et al. (2007). Pertussis boster vaccination in HIV-infected children receiving highly active antiretroviral therapy. Pediatrics. 120 (5): 1190—1202. https://doi.org/10.1542/peds.2007-0729; PMid:17938165
https://doi.org/10.1542/peds.2007-0729; PMid:17938165
7. Anukam KC, Osazuwa EE, Mbata TI, Ahonkhai IN. (2004). Increased incidence of pertussis and parapertussis in HIV-1 positive adolescents vaccinated previously wіth whole-cell vaccine. World Journal of Microbiology and Biotechnology. 20: 231—234. https://doi.org/10.1023/B:WIBI.0000023825.36332.f1
8. Arvas A, Gur E, Hrisi Bahar H et al. (2008). Haemophilus influenzae type b antibodies in vaccinated and non-vaccinated children. Pediatrics International. 50: 469—473. https://doi.org/10.1111/j.1442-200X.2008.02591.x; PMid:19143969
9. Arya BK, Bhattacharya SD, Sutcliffe CG et al. (2016). Immunogenicity and safety of two doses of catch-up immunization with Haemophilus influenza type b conjugate vaccine in Indian children living with HIV. Vaccine. https://doi.org/10.1016/j.vaccine.2016.03.012; PMid:26988256
10. Bamford A, Emma C, Manno EC et al. (2016). Immunisation practices in centres caring for children with perinatally acquired HIV: A call for harmonization. Vaccine. 34: 5587—5594. https://doi.org/10.1016/j.vaccine.2016.09.035; PMid:27727030
Vaccine. 34: 5587—5594. https://doi.org/10.1016/j.vaccine.2016.09.035; PMid:27727030
11. Briere EC, Rubin L, Moro PL. (2014). Prevention and Control of Haemophilus influenzaetype b disease. Recommendations of the Advisory Committee on Immunization Practices (ACIP). MMWR. 63
12. Cagigi A, Cotugno N, Giaquinto C et al. (2012). Immune reconstitution and vaccination outcome in HIV-infected children. Human Vaccine and Immunotherapeutics. 8: 12: 1784—1794. https://doi.org/10.4161/hv.21827; PMid:22906931 PMCid:PMC3656066
13. Cordero E, Pachon J, Rivero A. et al. (2000). Haemophilus influenzae-рneumonia in Human Immunodeficiency Virus-Infected рatients. Clinical Infectious Diseases. 30: 461—5. https://doi.org/10.1086/313690; PMid:10722428
14. Kerneis S, Launay O, Turbelin C et al. (2014). Long-term immune responses to vaccination in HIV-Infected patients: a systematic review and meta-analysis. Clinical Infectious Diseases. 58(8): 1130—9. https://doi.org/10. 1093/cid/cit937; PMid:24415637 PMCid:PMC4761378
1093/cid/cit937; PMid:24415637 PMCid:PMC4761378
15. Madhi SA, Kuwanda L, Saarinen L et al. (2005, Dec). Immunogenicity and effectiveness of Haemophilus influenza type b conjugate vaccine in HIV infected and uninfected African children. Vaccine. 23(48—49): 5517—5525. https://doi.org/10.1016/j.vaccine.2005.07.038; PMid:16107294
16. Mangtani P, Mulholland K, Madhi SA et al. (2010). Heamophilus influenza type B disease in HIV-infected children: a review of the disease epidemiology and effectiveness of Hib conjugate vaccine. Vaccine. 28: 1677—1683. https://doi.org/10.1016/j.vaccine.2009.12.011; PMid:20034606
17. Manno EC, Bamford A, Rojo P, Volokha A et al. (2015, 19—22 July). Immunization practice and vaccine safety perception in centres caring for children with perinatally acquired HIV: results from the Pediatric European Network for Treatment of AIDS survey. Abstract book of 8th IAS Conference on HIV Pathogenesis, Treatment and Prevention: 272.
18. Melvin AJ. (2003). Response to immunization with measles, tetanus, and Haemophilus influenza type b vaccines in children who have Human Immunodeficiency virus type 1 infection and are treated with highly active antiretroviral therapy. Pediatrics. 111: 641—644. https://doi.org/10.1542/peds.111.6.e641; PMid:12777579
(2003). Response to immunization with measles, tetanus, and Haemophilus influenza type b vaccines in children who have Human Immunodeficiency virus type 1 infection and are treated with highly active antiretroviral therapy. Pediatrics. 111: 641—644. https://doi.org/10.1542/peds.111.6.e641; PMid:12777579
19. Menson EN, Mellado MJ, Bamford A et al. (2012). Guidance on vaccination of HIV-Infected children in Europe. HIV Medicine. 13(6): 333—336. https://doi.org/10.1111/j.1468-1293.2011.00982.x; PMid:22296225
20. Moss WJ, Sutcliff CG. (2010). Do children infected with HIV receiving HAART need to be revaccinated? Lancet Infect Dis. 10: 630—4. https://doi.org/10.1016/S1473-3099(10)70116-X
21. Nix EВ, Hawdon N, Gravelle S et al. (2012). Risk of invasive Haemophilus influenzae Type b (Hib) disease in adults with secondary immunodeficiency in the post-Hib vaccine era. Clinical and Vaccine Immunology. 19(5): 766—771. https://doi.org/10.1128/CVI.05675-11; PMid:22398246 PMCid:PMC3346318
22. Obaro SK, Pugatch D, Luzuriaga K. (2004). Immunogenicity and efficacy of childhood vaccines in HIV-1-infected children. Lancet Infect Dis. 4: 510—518. https://doi.org/10.1016/S1473-3099(04)01106-5
Obaro SK, Pugatch D, Luzuriaga K. (2004). Immunogenicity and efficacy of childhood vaccines in HIV-1-infected children. Lancet Infect Dis. 4: 510—518. https://doi.org/10.1016/S1473-3099(04)01106-5
23. Perrett КР, John ТМ, Jin С et al. (2014). Long-term persistence of immunity and B-cell memory following Haemophilus influenzaetype b conjugate vaccination in early childhood and response to booster. Clinical Infectious Diseases. 58(7): 949—59. https://doi.org/10.1093/cid/ciu001; PMid:24403544
24. Read JS et al. (1998). The immunogenicity of Haemophilus influenzae Type b conjugate vaccines in children born with Human Immunodeficiency virus-infected women. Pediatr Infect Dis J. 17: 391—97. https://doi.org/10.1097/00006454-199805000-00009; PMid:9613652
25. Rubin LG., Levin M.J., Per Ljungman et al. (2014). 2013 IDSA Clinical Practice Guideline for Vaccination of the Immunocompromised Host. Clinical Infectious Diseases. 58(3): 44—100. https://doi.org/10.1093/cid/cit684; PMid:24311479
26. Sticchi L, Bruzzone B, Caligiuri P et al. (2015). Seroprevalence and vaccination coverage of vaccinepreventable diseases in perinatally HIV-1-infected patients. Human Vaccines & Immunotherapeutics. 11: 1: 263—269. https://doi.org/10.4161/hv.36162; PMid:25483544 PMCid:PMC4514310
Sticchi L, Bruzzone B, Caligiuri P et al. (2015). Seroprevalence and vaccination coverage of vaccinepreventable diseases in perinatally HIV-1-infected patients. Human Vaccines & Immunotherapeutics. 11: 1: 263—269. https://doi.org/10.4161/hv.36162; PMid:25483544 PMCid:PMC4514310
27. Succi R, Margot R, Krauss MR, Harris R et al. (2018). Immunity after childhood vaccinations in perinatally HIV-exposed children with and without HIV infection in Latin America. The Pediatric Infectious Disease Journal. 37 (4). https://doi.org/10.1097/INF.0000000000001831; PMid:29140938 PMCid:PMC5849487
28. Tejiokem MC, Njampero E, Gouandjika J et al. (2009, Apr). Whole-cell pertussis vaccine induces low antibody levels in Human Immunodeficiency virus-infected children living in Sub-Saharan Africa. Clinical and Vaccine Immunology. 16(4): 479—483. https://doi.org/10.1128/CVI.00312-08; PMid:19193831 PMCid:PMC2668289
29. Troy SB et al. (2016). Seroprevalence of pertussis infection in HIV-infected adults in United States. J Acquir Immune Defic Syndr. 73(3): 282—286. https://doi.org/10.1097/QAI.0000000000001037; PMid:27105050 PMCid:PMC5065371
J Acquir Immune Defic Syndr. 73(3): 282—286. https://doi.org/10.1097/QAI.0000000000001037; PMid:27105050 PMCid:PMC5065371
30. Ulanova M, Hawdon N, Nix E et al. (2011). Immune response of adults with secondary immunodeficiency to pediatric Haemophilus influenzae type b (Hib) vaccine. Allergy, Asthma & Clinical Immunology. 7(2): A23. https://doi.org/10.1186/1710-1492-7-S2-A23; PMCid:PMC3242185
Стаття надійшла до редакції 09.01.2019 р., прийнята до друку 27.03.2019 р.
Інфекційні хвороби у дітей
У національному підручнику викладено основні симптоми та синдроми інфекційних хвороб у дітей. Наведено класичні й нові дані щодо етіології, діагностики, лікування та профілактики інфекцій, які можуть траплятися у практичній діяльності лікаря-педіатра. Висвітлено епідеміологічну ситуацію щодо окремих інфекцій у світі і в Україні.
Зміст[showhide]
І. Загальна частина. — С. 12
Чернишова, Л. І. Розділ 1. Інфекція. Основні поняття / Л. І. Чернишова, І. В. Богадєльніков. — С. 12
Інфекція. Основні поняття / Л. І. Чернишова, І. В. Богадєльніков. — С. 12
Класифікації інфекційних хвороб. — С. 23
Волоха, А. П. Розділ 2. Протиінфекційний імунітет у дітей / А. П. Волоха. — С. 25
Основи протиінфекційного імунітету. — С. 25
Компоненти патогенів, що модулюють активність імунної системи. — С. 27
Імунітет проти бактерій, що розмножуються позаклітинно. — С. 28
Імунітет проти внутрішньоклітинних бактерій. — С. 30
Противірусний імунітет. — С. 31
Імунітет проти паразитарних інфекцій. — С. 34
Імунітет проти грибкових інфекцій. — С. 35
Розділ 3. Основні клінічні симптоми і синдроми інфекційних хвороб. — С. 37
Крючко, Т. О. Гарячка / Т. О. Крючко. — С. 37
Класифікація гарячки. — С. 39
Зміни в органах і системах. — С. 41
Екзогенна гіпертермія. — С. 42
Ендогенна гіпертермія. — С. 42
Антипіретична терапія. — С. 43
Гарячка невідомого походження. — С. 46
Волоха, А. П. Синдром системної запальної відповіді. Сепсис / А. П. Волоха. — С. 49
П. Волоха. — С. 49
Волоха, А. П. Синдром токсичного шоку / А. П. Волоха. — С. 60
Волоха, А. П. Гнійні менінгіти / А. П. Волоха. — С. 62
Етіологія гнійних менінгітів. — С. 63
Патогенез бактеріального менінгіту. — С. 67
Патоморфологія гнійного менінгіту. — С. 68
Клінічна картина гнійних менінгітів. — С. 69
Гострі ускладнення гнійних менінгітів. — С. 72
Діагностика бактеріальних менінгітів. — С. 74
Частково лікований гнійний менінгіт. — С. 77
Лікування гнійних менінгітів. — С. 78
Прогноз і віддалені наслідки гнійних менінгітів. — С. 82
Профілактика бактеріальних менінгітів. — С. 82
Волоха, А. П. Серозні менінгіти / А. П. Волоха. — С. 85
Вірусні менінгіти. — С. 86
Туберкульозний менінгіт. — С. 89
Волоха, А. П. Енцефаліти / А. П. Волоха. — С. 91
Енцефаліти в імунокомпетентних осіб. — С. 92
Енцефаліти в імуноскомпрометованих осіб. — С. 93
Кліщовий енцефаліт. — С. 99
Хронічні енцефаліти. — С. 100
Степановський, Ю. С. Спленомегалія. Причини, диференціальна діагностика / Ю. С. Степановський. — С. 101
С. Спленомегалія. Причини, диференціальна діагностика / Ю. С. Степановський. — С. 101
Анатомія та функції селезінки. — С. 101
Причини спленомегалії. — С. 103
Диференціальна діагностика. — С. 103
Зразок обстеження пацієнта зі спленомегалією. — С. 105
Спленектомія. — С. 107
Бондаренко, А. В. Висипка / А. В. Бондаренко. — С. 108
Елементи висипки. — С. 108
Плямисто-папульозна екзантема. — С. 109
Утворення везикул і бул. — С. 123
Геморагічна висипка. — С. 129
Піодермії (пустульозна висипка). — С. 131
Незгода, І. І. Блювання та діарея. Причини, диференціальна діагностика / І. І. Незгода. — С. 133
Блювання. — С. 133
Діарея. — С. 137
Бондаренко, А. В. Інфекції, що передаються людині від домашніх тварин / А. В. Бондаренко. — С. 139
Захворювання, що можуть передаватися людині від собак. — С. 140
Захворювання, що можуть передаватися людині від кішок. — С. 145
Захворювання, що можуть передаватися людині від птахів. — С. 149
Захворювання, що можуть передаватися людині від кролів.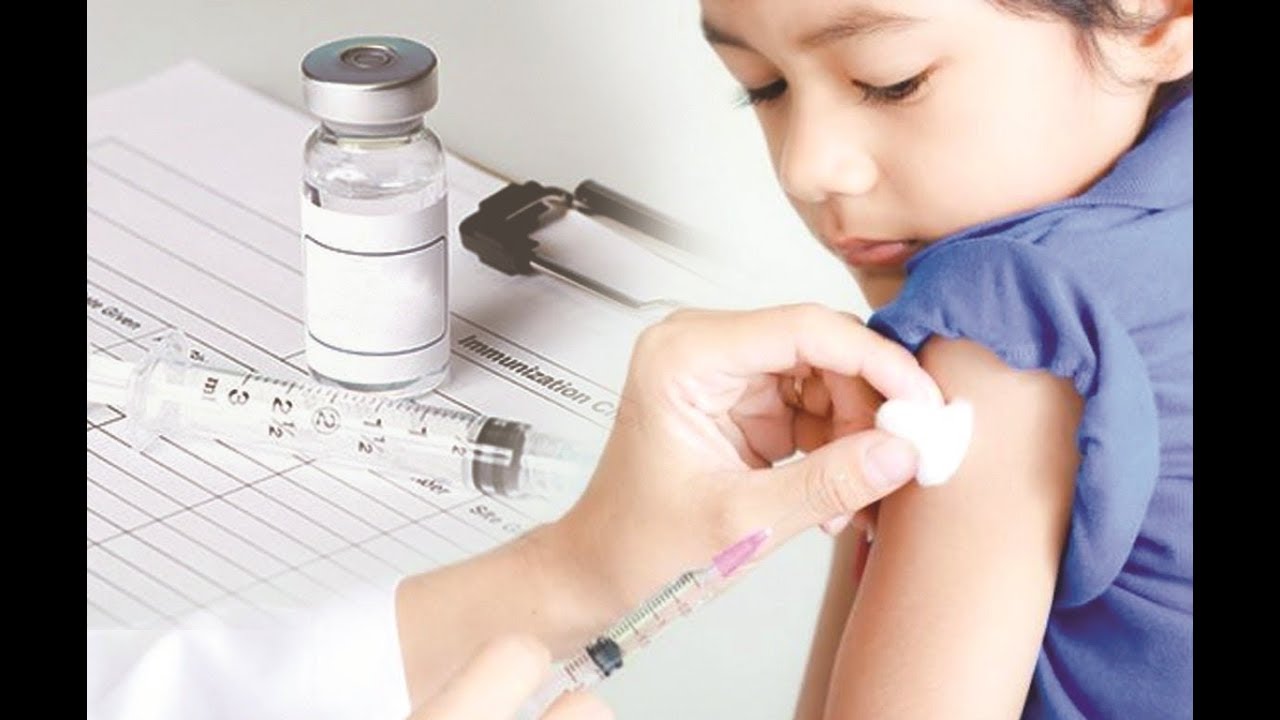 — С. 150
— С. 150
Захворювання, що можуть передаватися людині від домашніх гризунів (щури, миші, морські свинки, хом’яки). — С. 150
Захворювання, що можуть передаватися людині від акваріумних рибок. — С. 151
Захворювання, що можуть передаватися людині від рептилій. — С. 152
Захворювання, що можуть передаватися людині від тхорів. — С. 152
Волоха, А. П. Інфекції у пацієнтів із первинними імунодефіцитами / А. П. Волоха. — С. 153
Схильність до інфекцій, спричинюваних піогенними бактеріями. — С. 154
Схильність до інфекцій, спричинюваних мікобактеріями. — С. 156
Схильність до грибкових інфекцій. — С. 158
Схильність до вірусних інфекцій. — С. 159
Схильність до паразитарних інфекцій. — С. 160
Бондаренко, А. В. Інфекції при укусах комах / А. В. Бондаренко. — С. 161
Укуси кліщів та інфекційні захворювання, які вони переносять. — С. 162
Укуси комарів та інфекційні захворювання, які вони переносять. — С. 168
Укуси вошей та інфекційні захворювання, які вони можуть передавати людині. — С. 172
— С. 172
Укуси бліх та інфекційні захворювання, які вони можуть передавати людині. — С. 176
Розділ 4. Профілактика інфекційних хвороб і принципи терапії. — С. 178
Лапій, Ф. І. Активна імунопрофілактика / Ф. І. Лапій. — С. 178
Класифікація вакцин. — С. 178
Складові компоненти вакцин. — С. 180
Транспортування і зберігання вакцин. — С. 181
Способи введення препарату для активної імунопрофілактики. — С. 183
Моніторинг можливих ускладнень вакцинації. — С. 183
Національний календар щеплень. Документи, що регламентують проведення щеплень в Україні. — С. 186
Лапій, Ф. І. Пасивна імунопрофілактика / Ф. І. Лапій. — С. 194
Препарати нормального людського імуноглобуліну. — С. 195
Специфічні (гіперімунні) імуноглобуліни. — С. 196
Гіперімунні сироватки тваринного походження. — С. 200
Вертегел, А. О. Антибактеріальні препарати / А. О. Вертегел, Л. С. Овчаренко. — С. 200
Методи запобігання антибіотикорезистентності. — С. 201
Принципи раціонального вибору антибіотика. — С. 203
— С. 203
Класифікація протимікробних засобів. — С. 204
Маврутєнков, В. В. Противірусні препарати / В. В. Маврутєнков. — С. 227
Історична довідка. — С. 227
Класифікація противірусних препаратів. — С. 229
Принципи застосування. — С. 237
Чернишова, Л. І. Препарати інтерферонів / Л. І. Чернишова. — С. 243
Класифікація інтерферонів. — С. 244
Біологічна активність інтерферонів. — С. 245
Принципи застосування інтерферонів. — С. 245
Вертегел, А. О. Протигрибкові препарати. Класифікація. Принципи застосування / А. О. Вертегел, Л. С. Овчаренко. — С. 251
Воронов, О. О. Порушення водно-електролітного балансу при інфекційних хворобах. Регідратаційна та інфузійна терапія / О. О. Воронов. — С. 255
Фізіологічні основи розподілу води в організмі. — С. 255
Порушення водно-електролітного балансу. — С. 258
Лікування дегідратації. — С. 265
Розділ 5. Діагностика інфекційних хвороб. — С. 271
Глушкевич, Т. Г. Лабораторна діагностика бактеріальних інфекцій / Т. Г. Глушкевич. — С. 271
Г. Глушкевич. — С. 271
Демчишина, І. В. Лабораторна діагностика вірусних інфекцій / І. В. Демчишина. — С. 278
II. Спеціальна частина. — С. 282
Розділ 6. Інфекції, зумовлені вірусами. — С. 282
Чернишова, Л. І. Класифікація вірусів / Л. І. Чернишова. — С. 282
Герпесвірусні інфекції. — С. 284
Чернишова, Л. І. Класифікація герпесвірусних інфекцій / Л. І. Чернишова. — С. 284
Чернишова, Л. І. Інфекція, спричинювана вірусом простого герпесу / Л. І. Чернишова. — С. 285
Волоха, А. П. Вітряна віспа та оперізувальний герпес / А. П. Волоха. — С. 296
Волоха, А. П. Епштейна-Барр вірусна інфекція / А. П. Волоха. — С. 300
Чернишова, Л. І. Цитомегаловірусна інфекція / Л. І. Чернишова. — С. 316
Бондаренко, А. В. Інфекції, спричинювані герпесвірусами людини 6-го та 7-го типів / А. В. Бондаренко. — С. 325
Чернишова, Л. І. Інфекція, спричинювана герпесвірусом людини 8-го типу / Л. І. Чернишова. — С. 330
Шостакович-Корецька, Л. Р. Вірусні гепатити / Л. Р. Шостакович-Корецька. — С. 332
— С. 332
Вірусний гепатит В. — С. 333
Вірусний гепатит С. — С. 351
Вірусні гепатити D, Е та інші. — С. 364
Вірусний гепатит А. — С. 370
Гострі респіраторні вірусні інфекції. — С. 375
Чернишова, Л. І. Загальна харатеристика / Л. І. Чернишова. — С. 375
Чернишова, Л. І. Грип / Л. І. Чернишова. — С. 376
Чернишова, Л. І. Парагрип / Л. І. Чернишова. — С. 386
Лапій, Ф. І. Аденовірусна інфекція / Ф. І. Лапій. — С. 390
Чернишова, Л. І. Коронавірусна інфекція / Л. І. Чернишова. — С. 395
Лапій, Ф. І. Риновірусна інфекція / Ф. І. Лапій. — С. 398
Лапій, Ф. І. Респіраторно-синцитіальна вірусна інфекція / Ф. І. Лапій. — С. 402
Чернишова, Л. І. Метапневмовірусна інфекція / Л. І. Чернишова. — С. 407
Чернишова, Л. І. Бокавірусна інфекція / Л. І. Чернишова. — С. 408
Інші вірусні інфекції. — С. 409
Лапій, Ф. І. Інфекція, спричинювана вірусом папіломи людини / Ф. І. Лапій. — С. 409
Чернишова, Л. І. Поліомавірусна інфекція / Л. І. Чернишова. — С. 420
— С. 420
Бондаренко, А. В. Парвовірусна інфекція / А. В. Бондаренко. — С. 422
Лапій, Ф. І. Епідемічний паротит / Ф. І. Лапій. — С. 428
Бондаренко, А. В. Кір / А. В. Бондаренко. — С. 435
Бондаренко, А. В. Краснуха / А. В. Бондаренко. — С. 442
Степановський, Ю. С. Ентеровірусна інфекція / Ю. С. Степановський. — С. 449
Степановський, Ю. С. Сказ / Ю. С. Степановський. — С. 457
Чернишова, Л. І. Вірусні геморагічні гарячки / Л. І. Чернишова. — С. 461
Лапій, Ф. І. Поліомієліт / Ф. І. Лапій. — С. 483
Волоха, А. П. ВІЛ-інфекція / А. П. Волоха. — С. 489
Розділ 7. Гострі кишкові інфекції. — С. 508
Чернишова, Л. І. Загальна характеристика / Л. І. Чернишова. — С. 508
Незгода, І. І. Вірусні діареї / І. І. Незгода. — С. 512
Ротавірусна інфекція. — С. 513
Діареї, спричинювані іншими вірусами. — С. 520
Лікування вірусних діарей. — С. 523
Ходак, Л. А. Сальмонельоз / Л. А. Ходак, Л. І. Чернишова. — С. 527
Ходак, Л. А. Шигельоз / Л. А. Ходак. — С. 532
— С. 532
Чернишова, Л. І. Ешерихіози / Л. І. Чернишова. — С. 537
Кузнєцов, С. В. Кампілобактеріоз / С. В. Кузнєцов, О. М. Ольховськая. — С. 540
Харченко, Ю. П. Холера / Ю. П. Харченко [та ін.]. — С. 544
Другие авторы: Ходак Л. А., Єлоєва З. В., Степановський Ю. С.
Розділ 8. Інфекції, зумовлені бактеріями. — С. 555
Чернишова, Л. І. Класифікація бактерій / Л. І. Чернишова. — С. 555
Волоха, А. П. Менінгококова інфекція / А. П. Волоха. — С. 558
Лапій, Ф. І. Дифтерія / Ф. І. Лапій. — С. 569
Степановський, Ю. С. Стафілококова інфекція / Ю. С. Степановський. — С. 582
Клінічні форми стафілококової інфекції. — С. 585
Діагностика стафілококової інфекції. — С. 587
Лікування стафілококової інфекції. — С. 587
Лапій, Ф. І. Стрептококова інфекція / Ф. І. Лапій. — С. 590
Класифікація стрептококів. — С. 590
Клінічні форми стрептококової інфекції. — С. 591
Діагностика та лікування стрептококової інфекції . — С. 594
Чернишова, Л. І. Скарлатина / Л. І. Чернишова, А. В. Бондаренко. — С. 595
І. Чернишова, А. В. Бондаренко. — С. 595
Крючко, Т. О. Лістеріоз / Т. О. Крючко. — С. 598
Чернишова, Л. І. Інфекції, спричинювані Acinetobacter / Л. І. Чернишова. — С. 606
Чернишова, Л. І. Ентеробактеріальні інфекції / Л. І. Чернишова. — С. 608
Чернишова, Л. І. Ентерококова інфекція / Л. І. Чернишова. — С. 613
Чернишова, Л. І. Інфекція, спричинювана Pseudomonas aeruginosa / Л. І. Чернишова. — С. 616
Чернишова, Л. І. Інфекції, спричинювані Moraxella catarrhalis / Л. І. Чернишова. — С. 618
Ходак, Л. А. Єрсиніози / Л. А. Ходак, З. В. Єлоєва. — С. 621
Кишковий єрсиніоз. — С. 621
Псевдотуберкульоз. — С. 626
Ходак, Л. А. Черевний тиф / Л. А. Ходак. — С. 636
Харченко, Ю. П. Чума / Ю. П. Харченко. — С. 641
Лапій, Ф. І. Кашлюк / Ф. І. Лапій. — С. 654
Бондаренко, А. В. Туляремія / А. В. Бондаренко. — С. 664
Чернишова, Л. І. Гемофільна інфекція типу b / Л. І. Чернишова. — С. 672
Чернишова, Л. І. Пневмококова інфекція / Л. І. Чернишова. — С. 679
679
Клінічні форми пневмококової інфекції. — С. 683
Діагностика пневмококової інфекції. — С. 688
Лікування пневмококової інфекції. — С. 688
Профілактика пневмококової інфекції. — С. 690
Чернишова, Л. І. Легіонельоз / Л. І. Чернишова. — С. 693
Кузнецов, С. В. Хелікобактерна інфекція / С. В. Кузнецов, О. М. Ольховськая. — С. 694
Бондаенко, А. В. Бруцельоз / А. В. Бондаенко. — С. 697
Волоха, А. П. Хвороба Лайма (кліщовий бореліоз) / А. П. Волоха. — С. 703
Волоха, А. П. Хвороба котячої подряпини / А. П. Волоха. — С. 712
Гільфанова, А. М. Лептоспіроз / А. М. Гільфанова. — С. 718
Степановський, Ю. С. Хвороба від укусу щура / Ю. С. Степановський. — С. 722
Пипа, Л. В. Розділ 9. Рикетсіози / Л. В. Пипа. — С. 725
Загальна характеристика. — С. 725
Епідемічний висипний тиф і спорадичний висипний тиф (хвороба Брілла—Цінссера). — С. 727
Ендемічний блошиний тиф. — С. 737
Плямисті гарячки. — С. 739
Гарячка цуцугамуші. — С. 746
Ку-гарячка. — С. 750
— С. 750
Ерліхіози (лейкоцитарні рикетсіози). — С. 753
Розділ 10. Паразитарні інфекції. — С. 763
Чернишова, Л. І. Класифікація гельмінтозів / Л. І. Чернишова. — С. 763
Лапій, Ф. І. Нематодози / Ф. І. Лапій. — С. 763
Окремі види нематодозів. — С. 767
Лапій, Ф. І. Трематодози / Ф. І. Лапій. — С. 774
Окремі види трематодозів. — С. 777
Лапій, Ф. І. Цестодози / Ф. І. Лапій. — С. 779
Окремі види цестодозів. — С. 784
Розділ 11. Мікози. — С. 798
Надрага, О. Б. Загальна характеристика / О. Б. Надрага. — С. 798
Надрага, О. Б. Поверхнева грибкова інфекція / О. Б. Надрага. — С. 800
Дерматофітоз. — С. 800
Кандидоз. — С. 803
Надрага, О. Б. Аспергільоз / О. Б. Надрага. — С. 809
Надрага, О. Б. Гістоплазмоз / О. Б. Надрага. — С. 813
Надрага, О. Б. Криптококоз / 814
Чернишова, Л. І. Нокардіоз / Л. І. Чернишова. — С. 816
Волоха, А. П. Пневмоцистоз. Пневмоцистна пневмонія / А. П. Волоха. — С. 819
Лапій, Ф. І. Розділ 12. Мікоплазмова інфекція / Ф. І. Лапій. — С. 826
І. Лапій. — С. 826
Степановський, Ю. С. Розділ 13. Хламідійні інфекції / Ю. С. Степановський. — С. 833
Інфекція, спричинювана Chlamidia trachomatis. — С. 834
Інфекція, спричинювана Chlamidia pneumoniae. — С. 836
Інфекція, спричинювана Chlamidia psittaci. — С. 837
Розділ 14. Клостридіальні інфекції. — С. 839
Чернишова, Л. І. Загальна характеристика / Л. І. Чернишова. — С. 839
Степановський, Ю. С. Ботулізм / Ю. С. Степановський. — С. 839
Степановський, Ю. С. Правець / Ю. С. Степановський. — С. 847
Гільфанова, А. М. Clostridium difficile-інфекція / А. М. Гільфанова. — С. 854
Чернишова, Л. І. Clostridium perfringens-інфекція / Л. І. Чернишова. — С. 864
Клостридіальний міонекроз. — С. 864
Харчове отруєння, спричинене Clostridium perfringens. — С. 867
Розділ 15. Протозойні інфекції. — С. 868
Чернишова, Л. І. Класифікація найпростіших / Л. І. Чернишова. — С. 868
Крамарьов, С. О. Амебіаз / С. О. Крамарьов. — С. 868
Степановський, Ю.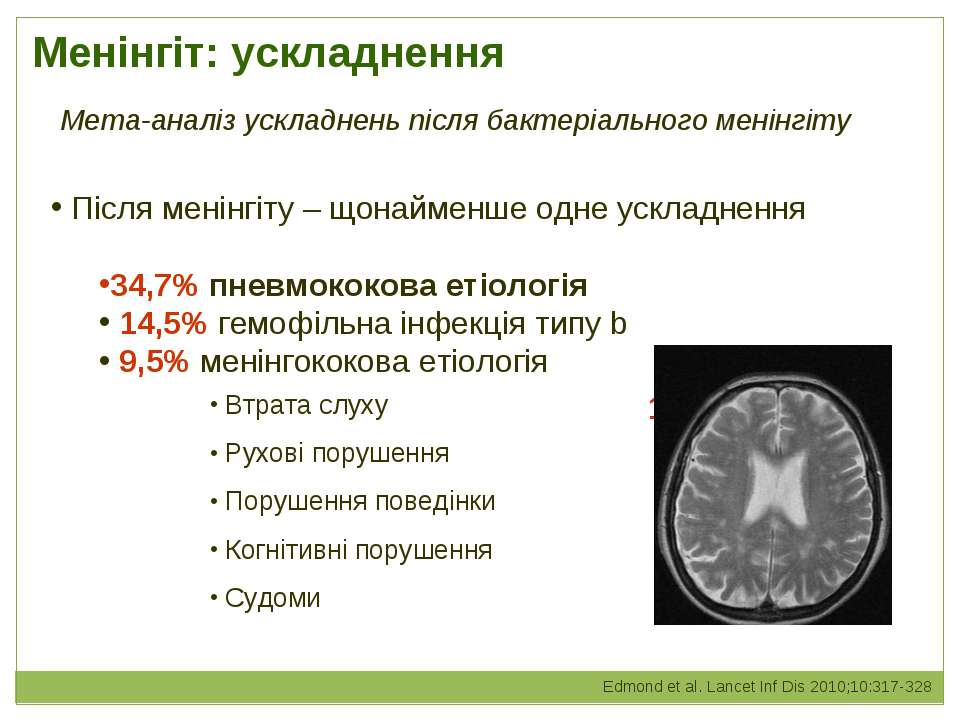 С. Лямбліоз / Ю. С. Степановський. — С. 873
С. Лямбліоз / Ю. С. Степановський. — С. 873
Гільфанова, А. М. Лейшманіоз / А. М. Гільфанова. — С. 876
Крамарьов, С. О. Малярія / С. О. Крамарьов, В. І. Трихліб. — С. 879
Волоха, А. П. Токсоплазмоз / А. П. Волоха. — С. 903
Чернишова, Л. І. Бабезіоз / Л. І. Чернишова. — С. 914
Розділ 16. Невідкладні стани в клініці інфекційних хвороб. — С. 917
Воронов, О. О. ДВЗ-синдром / О. О. Воронов. — С. 917
Біляєв, А. В. Гостра дихальна недостатність / А. В. Біляєв. — С. 924
Класифікація і патогенез. — С. 924
Клініко-фізіологічні особливості дітей молодшого віку. — С. 925
Клінічна картина. — С. 927
Спеціальний моніторинг при дихальній недостатності. — С. 930
Загальні принципи терапії. — С. 932
Гострий респіраторний дистрес-синдром. — С. 935
Біляєв, А. В. Гостра недостатність надниркових залоз / А. В. Біляєв. — С. 938
Клінічна фізіологія. — С. 938
Варіанти і причини недостатності надниркових залоз при критичних станах. — С. 941
Клінічні прояви та діагностика недостатності надниркових залоз. — С. 942
— С. 942
Лікування недостатності надниркових залоз. — С. 945
Біляєв, А. В. Гостра серцево-судинна недостатність / А. В. Біляєв. — С. 950
Клінічна фізіологія. — С. 950
Клініко-фізіологічні особливості серцево-судинної системи у новонароджених і дітей молодшого віку. — С. 951
Клінічна картина. — С. 952
Діагностика серцево-судинної недостатності. — С. 954
Принципи лікування. — С. 956
Біляєв, А. В. Шок / А. В. Біляєв. — С. 963
Кардіогенний шок, гостра серцева недостатність. — С. 970
Чернишова, Л. І. Гостра печінкова недостатність / Л. І. Чернишова, М. Ю. Тесленко. — С. 971
Степановський, Ю. С. Гемолітико-уремічний синдром / Ю. С. Степановський. — С. 981
[/showhide]
Імунітет до Haemophilus influenzae типу b та кашлюка у дітей з ВІЛ-інфекцією
Діти, які живуть з ВІЛ, мають підвищений ризик захворюваності на вакцинокеровані бактеріальні інфекції, такі як гемофільна інфекція і кашлюк. Дані про захищеність ВІЛ-інфікованих дітей від цих інфекцій обмежені.
Мета: оцінка імунітету до Haemophilus influenzae тип b (Hib) і кашлюка у підлітків з перинатальною ВІЛ-інфекцією.
Матеріали і методи. Проведений аналіз вакцинального статусу та специфічного імунітету проти Hib і кашлюка у дітей з перинатальною ВІЛ-інфекцією, що спостерігаються в Київському міському центрі профілактики та боротьби з ВІЛ/СНІДом. У ВІЛ-інфікованих дітей підліткового віку (n=51) визначений рівень антитіл класу IgG до полірибозилрибітолфосфату капсули Hib та кашлюкового токсину. До групи порівняння увійшли 22 здорові дитини, не інфіковані ВІЛ, аналогічного віку.
Результати. Охоплення імунізацією ВІЛ-інфікованих дітей проти кашлюка становило 63,6%, проти Hib-інфекції — 16,8%. Більшість ВІЛ-інфікованих підлітків (43/51, 84,3%) мали рівень антитіл до капсулярного полісахариду Hib ≥1 мкг/мл, який вважається захисним проти інвазивних форм гемофільної інфекції. Високий рівень антитіл до кашлюкового токсину (>100 МО/мл) визначено у 32/51 (62,7%) дітей з ВІЛ-інфекцією.
Висновки. Актуальним є проведення вакцинації проти Hib-інфекції дітям з ВІЛ-інфекцією старше п’яти років, які не отримали щеплення раніше або були щеплені не повністю. Наявність високого рівня антитіл до кашлюкового токсину у більшості підлітків з ВІЛ-інфекцією свідчить про високу захворюваність їх на кашлюк. З метою захисту ВІЛ-інфікованих дітей від кашлюка необхідно рекомендувати введення бустерної дози ацелюлярної кашлюкової вакцини зі зниженим вмістом антигенів дітям шкільного віку.
Вступ
Діти, які живуть з ВІЛ-інфекцією, мають вищий ризик захворюваності на вакцинокеровані бактеріальні інфекції, такі як гемофільна інфекція та кашлюк [1,7,9].
Haemophilus influenzae типу b (Hib) — грамнегативна капсульна кокобацила, провідна причина менінгітів та бактеріальних пневмоній у дітей віком до п’яти років, які не отримали щеплення кон’югованою Hib-вакциною. Іншими клінічними проявами інвазивної Hib-інфекції є септицемія, остеомієліт, епіглотит. Інвазивні Hib-захворювання виникають внаслідок інвазії в кров, паренхіму легень або менінгеальні оболонки бактерії, яка зазвичай існує як коменсал у верхніх дихальних шляхах у 3–11% нещеплених дітей. Haemophilus influ enzae типу b характеризується наявністю полірибозилрібитолфосфат (PRP) капсули, яка є важливим фактором вірулентності. Імунну відповідь проти бактерії зумовлюють циркулюючі анти-PRP антитіла. Ці антитіла активують систему комплементу та здійснюють опсонізацію збудника, необхідну для ефективного фагоцитозу [8,12]. За даними ВООЗ, у світі щорічно виникає понад 8 млн. випадків важкої Hib-інфекції у дитячому віці, 371 000 дітей помирає, з них 8100 дітей з ВІЛ-інфекцією [5].
Інвазивні Hib-захворювання виникають внаслідок інвазії в кров, паренхіму легень або менінгеальні оболонки бактерії, яка зазвичай існує як коменсал у верхніх дихальних шляхах у 3–11% нещеплених дітей. Haemophilus influ enzae типу b характеризується наявністю полірибозилрібитолфосфат (PRP) капсули, яка є важливим фактором вірулентності. Імунну відповідь проти бактерії зумовлюють циркулюючі анти-PRP антитіла. Ці антитіла активують систему комплементу та здійснюють опсонізацію збудника, необхідну для ефективного фагоцитозу [8,12]. За даними ВООЗ, у світі щорічно виникає понад 8 млн. випадків важкої Hib-інфекції у дитячому віці, 371 000 дітей помирає, з них 8100 дітей з ВІЛ-інфекцією [5].
На сьогодні у світі проживає понад 2 млн. ВІЛ-інфікованих дітей віком до 15 років, і додатково щорічно інфікується ВІЛ близько 180 000 дітей, переважно в країнах, що розвиваються [15]. Діти з ВІЛ-інфекцією характеризуються високим ризиком розвитку інвазивних захворювань, викликаних Hib, який у шість разів перевищує ризик інвазивної Hib-інфекції у дітей без ВІЛ [16].
Високоефективна кон’югована вакцина проти Hib-інфекції включена в програму імунізації немовлят з 1990 року, що дозволило суттєво знизити захворюваність на інвазивні Hib-захворювання у багатьох країнах світу. Вакцинація проти Hib-інфекції знижує рівень носійства збудника і таким чином захищає від захворювання навіть нещеплених осіб. В Україні календарна імунізація проти Hib-інфекції введена з 2006 року. Дітям з ВІЛ-інфекцією вакцинація проти Hib-інфекції згідно з Календарем щеплень рекомендована на першому році життя. Дітям, що не отримали щеплення за Календарем, проводять вакцинацію однією дозою вакцини до п’яти років [3]. Дані про захищеність від Hib-інфекції ВІЛ-інфікованих дітей обмежені.
Кашлюк — висококонтагіозна респіраторна інфекція, викликана B. pertussis, яка може спричинити важкі і затяжні форми захворювання у ВІЛ-інфікованих осіб.
За даними ВООЗ, B. pertussis спричиняє щорічно у світі понад 60 000 смертей (1%) у дітей віком до п’яти років [3]. Більшість випадків кашлюка залишаються не розпізнаними внаслідок обмежених можливостей діагностики захворювання, атипового перебігу інфекції у дітей старшого віку та дорослих осіб. Кашлюк легко поширюється від підлітків та дорослих, але найбільшу загрозу становить для немовлят, у яких можуть виникати смертельні ускладнення [29].
Більшість випадків кашлюка залишаються не розпізнаними внаслідок обмежених можливостей діагностики захворювання, атипового перебігу інфекції у дітей старшого віку та дорослих осіб. Кашлюк легко поширюється від підлітків та дорослих, але найбільшу загрозу становить для немовлят, у яких можуть виникати смертельні ускладнення [29].
Імунізація проти кашлюка із застосуванням цільноклітинної та ацелюлярної вакцин дозволяє ефективно попередити важкі форми захворювання у немовлят і суттєво знижує циркуляцію B. pertussis. Однак без бустерної дози проти кашлюка імунітет знижується у підлітків та дорослих осіб, які можуть слугувати резервуаром для трансмісії збудника [9,29]. В Україні вакцинація проти кашлюка закінчується в шість років [4]. Частота кашлюка значно зросла в Україні за останні роки, як у дітей, так і у дорослих, у зв’язку з погіршенням охоплення імунізацією АКДП. Захищеність підлітків, особливо з ВІЛ-інфекцією, проти кашлюка невідома [19,20].
Матеріал і методи дослідження
У даному одноцентровому когортному дослідженні нами проведено аналіз вакцинального статусу дітей з перинатальною ВІЛ-інфекцією, які знаходяться під спостереженням у Київському міському центрі профілактики та боротьби з ВІЛ/СНІДом, що є клінічною базою кафедри дитячих інфекційних хвороб та дитячої імунології НМАПО імені П. Л. Шупика. У 142 дітей з ВІЛ-інфекцією віком від 1,5 до 15 років оцінювали вакцинальний анамнез. Діти отримали щеплення згідно з Національним календарем профілактичних щеплень (накази МОЗ України №48 від 03.02.2006 р. та №595 від 16.09.2011 р.). Була проаналізована медична документація для визначення дати вакцинації дітей, кількості отриманих доз вакцини.
Л. Шупика. У 142 дітей з ВІЛ-інфекцією віком від 1,5 до 15 років оцінювали вакцинальний анамнез. Діти отримали щеплення згідно з Національним календарем профілактичних щеплень (накази МОЗ України №48 від 03.02.2006 р. та №595 від 16.09.2011 р.). Була проаналізована медична документація для визначення дати вакцинації дітей, кількості отриманих доз вакцини.
Специфічний імунітет проти Hib та кашлюка був досліджений у 51 підлітка з ВІЛ-інфекцією. Показники серопозитивності та рівень напруженості імунітету проти цих збудників порівнювали з даними 22 імунокомпетентних дітей групи контролю, не інфікованих ВІЛ.
Методика визначення специфічних антитіл. Рівень специфічних антитіл визначений у досліджуваних дітей імуноферментним методом: антитіла до полірибозилрибітолфосфату Hib визначали у сироватці за допомогою тест-систем Haemophilus influenzae type b ant-PRP IgG ELISA, антитіла проти кашлюкового токсину (РТ) — за допомогою тест-систем Bordetella pertussis PT IgG ELISA (IBL International GBMH, Німеччина). Згідно з протоколом виробника, відповідний антиген (полірибозилрібітолфосфат Haemophilus influenzae типу b або кашлюковий токсин) фіксований на поверхні стрипів мікропланшета. Розведені сироватки пацієнта та готові до використання стандарти прокапуються в лунки мікропланшета. Відбувається зв’язування між специфічними IgG-антитілами сироватки та фіксованим антигеном. Після інкубації протягом години при кімнатній температурі планшет промивають розведеним промивним розчином, щоб видалити незв’язаний матеріал. Тоді готові до застосування кон’юговані з пероксидазою антитіла до IgG людини додають та інкубують протягом 30 хвилин. Після наступної стадії промивання прокапують розчин тетраметилбензидин субстрату та інкубують протягом 20 хвилин, що спричиняє розвиток синього забарвлення у лунках. Формування кольору закінчується додаванням стоп-розчину, який змінює синій колір на жовтий. Отриманий результат забарвлення вимірюється спектрофотометрично на довжині хвилі 450 нм. Концентрація IgG-антитіл прямо пропорційна інтенсивності кольору, визначена за стандартним калібратором та оцінена в мкг/мл.
Згідно з протоколом виробника, відповідний антиген (полірибозилрібітолфосфат Haemophilus influenzae типу b або кашлюковий токсин) фіксований на поверхні стрипів мікропланшета. Розведені сироватки пацієнта та готові до використання стандарти прокапуються в лунки мікропланшета. Відбувається зв’язування між специфічними IgG-антитілами сироватки та фіксованим антигеном. Після інкубації протягом години при кімнатній температурі планшет промивають розведеним промивним розчином, щоб видалити незв’язаний матеріал. Тоді готові до застосування кон’юговані з пероксидазою антитіла до IgG людини додають та інкубують протягом 30 хвилин. Після наступної стадії промивання прокапують розчин тетраметилбензидин субстрату та інкубують протягом 20 хвилин, що спричиняє розвиток синього забарвлення у лунках. Формування кольору закінчується додаванням стоп-розчину, який змінює синій колір на жовтий. Отриманий результат забарвлення вимірюється спектрофотометрично на довжині хвилі 450 нм. Концентрація IgG-антитіл прямо пропорційна інтенсивності кольору, визначена за стандартним калібратором та оцінена в мкг/мл.
За даними попередніх досліджень, рівень анти-PRP IgG-антитіл у сироватці крові ≥1,0 мкг/мл розцінюється як довготривалий захист проти Hib, рівень антитіл від 0,15 мкг/мл до 1,0 мкг/мл — як короткотривалий захист, показник ≤0,15 мкг/мл вказує на відсутність захисту проти збудника [7,14]. Вважають, що рівень анти-PRP IgG-антитіл ≥1,0 мкг/мл захищає від інвазивних форм Hib-інфекції, >5,0 мкг/мл — від носійства Hіb [15,23].
Запропонований виробником показник рівня антитіл IgG до кашлюкового токсину ≥100 МО/мл за відсутності бустерної дози вакцини за попередні п’ять років свідчить про нещодавно перенесену інфекцію, викликану B. pertussis. Як позитивний результат щодо наявності анти-PT IgG-антитіл у сироватці крові розцінюють при рівні антитіл 25 МО/мл [17]. Наявні зразки сироватки крові дітей основної та контрольної груп класифікували відповідно до титру анти-PT IgG (<25 МО/мл, 25 — <50 МО/мл, 50 — <100 МО/мл та >100 МО/мл) [29].
Клінічна стадія ВІЛ-інфекції встановлена на підставі даних ретроспективної оцінки клінічних проявів захворювання (класифікація ВООЗ, 2006). У дітей з ВІЛ-інфекцією проводилось визначення відносних і кількісних показників CD4+ Т-лімфоцитів у периферичній крові. Кількісний вміст субпопуляцій лімфоцитів визначали за допомогою методу проточної цитометрії з використанням моноклональних антитіл. Імунологічна стадія ВІЛ-інфекції у дітей визначена з урахуванням відсоткових показників CD4+ Т-лімфоцитів у дітей молодше 5 років та кількості CD4+ Т-лімфоцитів у дітей старше 5 років відповідно до класифікації імуносупресії у ВІЛ-інфікованих дітей (ВООЗ, 2006). Проведена оцінка імунного статусу у ВІЛ-інфікованих дітей перед початком АРТ та на момент дослідження рівня специфічного імунітету проти вакцинокерованих інфекцій. Вірусологічна діагностика ВІЛ-інфекції застосовувалась для оцінки ефективності АРТ (кількісна ПЛР для визначення рівня вірусної РНК у плазмі крові).
У дітей з ВІЛ-інфекцією проводилось визначення відносних і кількісних показників CD4+ Т-лімфоцитів у периферичній крові. Кількісний вміст субпопуляцій лімфоцитів визначали за допомогою методу проточної цитометрії з використанням моноклональних антитіл. Імунологічна стадія ВІЛ-інфекції у дітей визначена з урахуванням відсоткових показників CD4+ Т-лімфоцитів у дітей молодше 5 років та кількості CD4+ Т-лімфоцитів у дітей старше 5 років відповідно до класифікації імуносупресії у ВІЛ-інфікованих дітей (ВООЗ, 2006). Проведена оцінка імунного статусу у ВІЛ-інфікованих дітей перед початком АРТ та на момент дослідження рівня специфічного імунітету проти вакцинокерованих інфекцій. Вірусологічна діагностика ВІЛ-інфекції застосовувалась для оцінки ефективності АРТ (кількісна ПЛР для визначення рівня вірусної РНК у плазмі крові).
Математична обробка даних дослідження виконувалась з використанням стандартних статистичних пакетiв STATISTICA 6.0.
Дослідження виконані відповідно до принципів Гельсінської Декларації. Протокол дослідження ухвалений Локальним етичним комітетом (ЛЕК) всіх зазначених у роботі установ. На проведення досліджень було отримано поінформовану згоду батьків дітей (або їхніх опікунів).
Протокол дослідження ухвалений Локальним етичним комітетом (ЛЕК) всіх зазначених у роботі установ. На проведення досліджень було отримано поінформовану згоду батьків дітей (або їхніх опікунів).
Результати дослідження та їх обговорення
Вакцинальний статус дітей з ВІЛ-інфекциєю. Рівень охоплення імунізацією когорти ВІЛ-інфікованих дітей проти вакцинокерованих бактеріальних інфекцій був нижчим, ніж у загальній популяції. Охоплення щепленням дітей, що живуть з ВІЛ, проти кашлюка становило 63,6%, проти Hib-інфекції — 16,8%. Дані досліджень в інших країнах також свідчать про недостатній рівень вакцинації проти цих збудників дітей з ВІЛ-інфекцією. Так, вчені з Італії вказують на низький рівень вакцинації дітей проти Hib-інфекції — 18% і проти кашлюка — 43,6% [24]. У дослідженні з Латинської Америки наведено дані про охоплення імунізацією проти Hib-інфекції 52,7% дітей з перинатальною ВІЛ-інфекцією, проти кашлюка — 60,5% [25]. Недостатнє охоплення вакцинацією дітей, що живуть з ВІЛ, пояснюється кількома чинниками: пропущені можливості для завершення запланованих щеплень, оскільки діти мали симптоматичну ВІЛ-інфекцію або були госпіталізовані, а також неправильне уявлення та міфи про імунізацію ВІЛ-інфікованих дітей серед батьків і навіть побоювання лікарів щодо ускладнень, пов’язаних з вакцинацією [26].
Характеристика групи дослідження специфічного імунітету проти Haemophilus influenzae типу b та кашлюка
Середній вік ВІЛ-інфікованих дітей (основна група) не відрізнявся від віку дітей, не неінфікованих ВІЛ: 12,5±0,29 і 12,1±0,85 року відповідно.
Клінічна стадія ВІЛ-інфекції у дітей оцінювалася відповідно до класифікації ВООЗ 2006 року: І стадія ВІЛ-інфекції встановлена у 1 (1,9%) дитини, ІІ стадія — у 33 (64,7%) дітей, ІІІ стадія — у 13 (25,4%) дітей і IV стадія — у 4 (7,8%) дітей. Виявлено, що більшість дітей (66,6%) мали легкі клінічні прояви ВІЛ-інфекції (І та ІІ клінічні стадії захворювання).
Усі діти з ВІЛ-інфекцією отримували антиретровірусну терапію (АРТ) на момент дослідження, переважна більшість з них (45/51, 88,2%) мала невизначальне вірусне навантаження ВІЛ. Лише 13 дітей розпочали АРТ у віці до 2 років, з них 5 дітей у віці менше року, середній вік початку АРТ становив 4,5 року.
На початок АРТ 13 (25,4%) дітей мали важку імуносупресію (CD4+ Т-лімфоцити <15%), 31 (60,7%) дитина — імуносупресію середнього ступеня важкості (CD4+ Т-лімфоцити 15-25%), у 7 (41,5%) дітей імуносупресія була відсутня. Середній рівень CD4+ Т-лімфоцитів у цих дітей на момент початку АРТ становив 675±64 клітин/мкл, 18,2±0,9%. На час проведення дослідження імунітету проти Hib та кашлюка імунодефіцит зберігався у 7 (13,7%) дітей із 51 з ВІЛ-інфекцією. Середня кількість CD4+ Т-лімфоцитів у дітей з ВІЛ-інфекцією на час проведення дослідження специфічного імунітету проти вакцинокерованих інфекцій становила 904±68 клітин/мкл, середня кількість CD4+ Т-лімфоцитів — 33,4±1,3%.
Стан захищеності проти Haemophilus influenzae типу b
Переважна більшість дітей з ВІЛ-інфекцією (41/51, 80,3%) не мали щеплення проти Hib-інфекції. Серед 10 (19,6%) дітей, вакцинованих проти Hib, двоє отримали первинну вакцинацію на першому році життя трьома дозами вакцини до початку лікування ВІЛ-інфекції, 8 (15,6%) були імунізовані однією дозою Hib-вакцини у віці 2–5 років після початку АРТ. Серед 22 дітей групи контролю тільки 3 (14,2%) дітей були повністю вакциновані проти Hib згідно з Календарем щеплень, 5 дітей отримали одну дозу вакцини у віці 1–2 років, 13 дітей не мали щеплення проти Hib-інфекції.
За результатами обстеження не виявлено різниці в концентрації анти-PRP IgG-антитіл у сироватці ВІЛ-інфікованих дітей (4,5±0,37 мкг/мл) та дітей без ВІЛ-інфекції (4,9±0,58 мкг/мл). Як видно з таблиці, переважна більшість дітей основної та контрольної груп мали захисний рівень антитіл проти капсулярного полісахариду Hib≥1,0 мкг/мл (84,3% та 80,9% відповідно). У 96% дітей з ВІЛ-інфекцією та 95,6% здорових дітей концентрація циркулюючих анти-PRP IgG-антитіл була вищою за рівень, який забезпечує короткотривалий захист проти інвазивних Hib-захворювань, тобто >0,15 мкг/мл. Ці дані свідчать про наявність імунного захисту проти інвазивних Hib-захворювань у переважної більшості дітей підліткового віку, як у дітей з ВІЛ-інфекцією, так і здорових дітей, не інфікованих ВІЛ.
При порівнянні стану захищеності проти Hib дітей основної групи залежно від вакцинального статусу було встановлено, що рівень анти-PRP IgG≥1,0 мкг/мл, який корелює з довготривалим захистом проти інвазивної Hib-інфекції, мали 7/10 (70%) дітей з ВІЛ-інфекцією, щеплених проти Hib, і 35/41 (85,4%) дітей, не щеплених проти Hib. Хоча середня концентрація анти-PRP IgG-антитіл у дітей основної групи, що отримали щеплення (3,5±0,6 мкг/мл), не відрізнялась суттєво від концентрації антитіл дітей, які не були щеплені проти Hib (4,5±0,5 мкг/мл), однак спостерігалась тенденція до наявності вищого рівня антитіл у дітей, не вакцинованих проти Hib-інфекції (табл.).
Taблиця. Рівень анти-PRP IgG-антитіл у дітей з ВІЛ-інфекцією та дітей групи контролю
Наявність високого рівня анти-PRP IgG-антитіл у дітей підліткового віку, які не отримали щеплення, свідчить про природний імунітет, імовірно, зумовлений продукцією анти-PRP IgG-антитіл після безсимптомної Hib-інфекції або контакту з іншими антигенами, які індукують перехресний імунітет. Відомо, що продукція анти-PRP антитіл може стимулюватись при колонізації Escherichia coli K-100 та іншими кишковими бактеріями [8]. Однак захисний ефект природного імунітету внаслідок безсимптомної інфекції або перехресно-реагуючих антигенів проти інвазивних Hib-інфекцій вивчений недостатньо. Є дані, що анти-PRP IgG-антитіла, що утворюються при природному імунітеті, менш ефективні в захисті проти Hib-інфекції порівняно з антитілами, що продукуються після вакцинації. Антитіла, що індукуються у не щеплених проти Hib осіб перехресно-реагуючими антигенами, мають нижчу функціональну активність. Це підтверджено результатами досліджень, які не виявили кореляції між рівнем природних анти-PRP IgG-антитіл та бактерицидною активністю сироватки крові [15,29]. Цікавими є дані спостереження, яке вказує на необхідність вищої концентрації анти-PRP антитіл у ВІЛ-інфікованих осіб для досягнення таких самих рівнів бактерицидної активності сироватки крові порівняно з дітьми, не інфікованими ВІЛ [20]. Це свідчить про те, що концентрація анти-PRP IgG-антитіл 1,0 мкг/мл, яка корелює із захистом проти інвазивних Hib-захворювань, серед осіб, не інфікованих ВІЛ, може бути недостатньою для захисту ВІЛ-інфікованих осіб.
Більшість повідомлень щодо імуногенності кон’югованих Hib-вакцин у ВІЛ-інфікованих дітей свідчать про нижчу середню концентрацію анти-PRP IgG після вакцинації їх проти Hib-інфекції порівняно з дітьми, не інфікованими ВІЛ [21]. У дослідженні JS. Read (2009) виявлена незначна кореляція між відповіддю анти-PRP IgG-антитіл, клінічною або імунологічною стадією, та/або вірусним навантаженням ВІЛ у ВІЛ-інфікованих дітей [24]. За даними досліджень, відсоток дітей з ВІЛ-інфекцією, що досягають титрів анти-PRP IgG антитіл ≥1,0 мкг/мл, який корелює з довгостроковим захистом проти Hib-інфекції, коливається в межах 46–88% [13]. У ВІЛ-інфікованих дітей захисний рівень антитіл ≥1,0 мкг/мл рідше утримується більше року після вакцинації, ніж у дітей, не інфікованих ВІЛ (57% проти 89% відповідно) [14]. Дослідження з Південної Африки виявило нижчу ефективність кон’югованої Hib-вакцини (43,9%) у ВІЛ-інфікованих дітей віком менше року порівняно з дітьми, не інфікованими ВІЛ (96,5%) [15].
Зважаючи на недостатню ефективність природного захисту ВІЛ-інфікованих дітей проти інвазивних Hib-захворювань, більшість експертів Європи та США на сьогодні рекомендують щеплення проти Hib-інфекції дітям з ВІЛ-інфекцією віком старше п’яти років, які не отримали вакцинацію проти цього збудника [10,18,23]. Актуальним є введення рекомендації щодо вакцинації проти Hib-інфекції ВІЛ-інфікованих дітей віком старше п’яти років у Національний Календар щеплень.
Стан захищеності проти кашлюка
Аналіз даних вакцинального анамнезу показав, що всі ВІЛ-інфіковані діти з групи дослідження отримали щеплення проти кашлюка, від трьох до п’яти доз вакцини. Повністю імунізованими проти кашлюка п’ятьма дозами вакцини АКДП/АаКДП були 27% (14/51) дітей з ВІЛ-інфекцією, 45,0% (23/51) отримали чотири дози вакцини, 19,6% (10/51) були вакциновані трьома дозами вакцини. Усі діти отримали останню дозу вакцини проти кашлюка понад п’ять років тому. Більшість дітей групи контролю були щеплені за календарем і отримали 4–5 доз вакцини АКДП/АаКДП, п’ятеро дітей отримали чотири дози вакцини, 15 дітей — п’ять доз вакцини, двоє дітей були щеплені трьома дозами вакцини.
Серед ВІЛ-інфікованих дітей, які отримали 3, 4 або 5 доз кашлюкової вакцини, не було виявлено достовірної різниці в рівнях анти-PT антитіл, 127,6±12,3 МО/мл, 114,9±14,7 МО/мл та 115,8±9,1 МО/мл відповідно.
ВІЛ-інфіковані діти з раннім початком АРТ (<2 років) (13/51) мали нижчий рівень антитіл до кашлюкового токсину, ніж діти, які почали АРТ пізніше, після двох років життя (38/51), — 104,5+9,2 та 148,4+8,9 відповідно (p<0,05). Слід зазначити, що більшість дітей з раннім початком лікування ВІЛ-інфекції розпочали вакцинацію проти кашлюка пізніше, вони отримали першу дозу АКДП/АаКДП у середньому у віці 12 місяців на тлі АРТ. Проведення вакцинації при відновленні імунної системи на АРТ дозволяє сформувати оптимальну і довготривалу імунну відповідь на вакцинальні антигени. Дані попередніх спостережень вказують на краще формування імунологічної пам’яті і довготривалий імунний захист проти вакцинокерованих інфекцій у ВІЛ-інфікованих дітей, що отримують вакцинацію на тлі раннього початку АРТ [1,2].
ВІЛ-інфіковані діти з пізнім початком АРТ отримали первинну серію вакцинації відповідно до Календаря щеплень на першому році життя, до початку АРТ. У таких дітей пізній початок лікування ВІЛ-інфекції асоціюється з прогресуванням імунодефіциту і втратою імунної відповіді, порушенням формування імунологічної пам’яті на вакцинальні антигени. Як показують дослідження, імунний захист проти вакцинокерованих інфекцій швидко втрачається у дітей з ВІЛ-інфекцією при прогресуванні імуносупресії [14,18,20].
На рисунку узагальнено рівень антитіл проти кашлюкового токсину у ВІЛ-інфікованих дітей та дітей групи контролю. У більшості дітей з ВІЛ-інфекцією (62%) спостерігався високий рівень анти-PT IgG >100 МО/мл, тоді як у дітей, не інфікованих ВІЛ, найчастіше визначались анти-PT антитіл у межах 50–100 МО/мл. Середня концентрація антитіл до кашлюкового токсину була вищою у ВІЛ-інфікованих дітей, ніж у групі контролю (115,5±7,6 МО/мл проти 84,7±10,6 МО/мл, р<0,05). Висока поширеність анти-PT IgG >100 МО/мл серед ВІЛ-інфікованих дітей може бути зумовлена нещодавнім захворюванням на кашлюк. Оскільки діти не були щеплені проти кашлюка в останні п’ять років, високий рівень анти-PT IgG не може бути пов’язаний з вакцинацією.
Рис. Сироватковий рівень антитіл проти кашлюкового токсину (МО/мл)
у ВІЛ-інфікованих дітей та дітей групи контролю
Дані дослідження частоти кашлюка у ВІЛ-інфікованих підлітків, проведеного в країнах Африки, демонструють високий рівень носійства B. pertussis та інфекції, викликаної цим збудником, у дітей з ВІЛ-інфекцією (37,5%) порівняно з дітьми, не інфікованими ВІЛ [7]. Як свідчать дані дослідження частоти серопозитивних до кашлюку ВІЛ-інфікованих осіб, проведеного в США, у 4,3% не щеплених в останні шість місяців дорослих з ВІЛ були виявлені серологічні дані про нещодавно перенесений кашлюк, а щорічна частота інфікування кашлюком серед осіб, які не були вакциновані протягом останніх п’ятьох років, становила 10,5–17,5%. Цей показник в 1000 разів перевищує частоту повідомлених випадків кашлюку в популяції, що узгоджується з результатами інших досліджень, які вказують на занижену кількість випадків кашлюка, який є поширеною інфекцією серед ВІЛ-інфікованих осіб [28].
Дослідження імуногенності ацелюлярної вакцини проти кашлюка у ВІЛ-інфікованих дітей, середній вік 45 місяців, повідомляли про продукцію специфічних антитіл у 50% пацієнтів, але титри антитіл були нижчими, ніж у дітей, не інфікованих ВІЛ [14]. Підвищення титру специфічних антитіл корелювало з числом CD4+ T-лімфоцитів, і значне зростання титру антитіл виявлено через чотири місяці після третьої дози імунізації.
Отже, дані проведеного нами дослідження демонструють високу частоту нещодавно перенесеного кашлюка у підлітків з ВІЛ-інфекцією, незважаючи на попередню вакцинацію в дошкільному віці. Введення додаткової дози ацелюлярної кашлюкової вакцини ВІЛ-інфіковним дітям шкільного віку є актуальним у захисті цієї вразливої групи проти кашлюка.
Висновки
Дані дослідження вказують на низький рівень щеплення проти Hib та кашлюка дітей з перинатальною ВІЛ-інфекцією. Неможливість забезпечити захист цих дітей від вакцинокерованих захворювань не тільки створює загрозу захворюваності, але й підвищує ризик передачі інфекцій іншим особам з їхнього оточення.
Переважна більшість ВІЛ-інфікованих дітей підліткового віку мають імунітет до Hib, отриманий, імовірно, після перенесеної інфекції або експозиції перехресними антигенами. Тому актуальним є проведення вакцинації проти Hib дітям з ВІЛ-інфекцією старше п’яти років, які не отримали щеплення раніше або були щеплені неповністю. Наявність високого рівня антитіл до кашлюкового токсину у більшості підлітків з ВІЛ-інфекцією свідчить про високу захворюваність їх на кашлюк.
З метою захисту ВІЛ-інфікованих дітей проти кашлюка необхідно рекомендувати введення бустерної дози ацелюлярної кашлюкової вакцини зі зниженим вмістом антигенів дітям шкільного віку.
Автор заявляє про відсутність конфлікту інтересів.
Література
1. Волоха А.П., Чернишова Л.І.., Раус ІВ. (2013). Проблеми імунізації ВІЛ-інфікованих дітей (огляд літератури). Современная педиатрия. 2(50): 10—17.
2. Волоха А.П., Чернишова Л.І., Раус І.В. (2015). Вакцинація дітей з ВІЛ-інфекцією. Методичні рекомендації: 28.
3. Волоха А.П., Чернишова Л.І., Раус І.В. (2018). Поствакцинальний імунітет дітей з ВІЛ-інфекцією. Современная педиатрия. 6(94):41—46. Doi 10.15574/SP.2018.94.41
4. Про порядок проведення профілактичних щеплень в Україні та контроль якості й обігу медичних імунобіологічних препаратів. Наказ МОЗ України від 16.09.2011 №595 (2011). http://www.moz.gov.ua.
5. Чернишова Л.І., Лапій Ф.І., Волоха А.П. (редактори) (2018). Імунопрофілактика інфекційних хвороб. Київ: ВСВ Медицина.
6. Abzug M.J., Song Lin-Ye, Fenton T. et al. (2007). Pertussis boster vaccination in HIV-infected children receiving highly active antiretroviral therapy. Pediatrics. 120 (5): 1190—1202.
7. Anukam K.C., Osazuwa E.E., Mbata T.I., Ahonkhai I.N. (2004). Increased incidence of pertussis and parapertussis in HIV-1 positive adolescents vaccinated previously wіth whole-cell vaccine. World Journal of Microbiology and Biotechnology. 20: 231—234.
8. Arvas A., Gur E., Hrisi Bahar H. et al. (2008). Haemophilus influenzae type b antibodies in vaccinated and non-vaccinated children. Pediatrics International. 50: 469—473.
9. Arya B.K., Bhattacharya S.D., Sutcliffe C.G. et al. (2016). Immunogenicity and safety of two doses of catch-up immunization with Haemophilus influenza type b conjugate vaccine in Indian children living with HIV. Vaccine. http://dx.doi.org/10.1016/j.vaccine.2016.03.12
10. Bamford A., Emma C., Manno E.C. et al. (2016). Immunisation practices in centres caring for children with perinatally acquired HIV: A call for harmonization. Vaccine. 34: 5587—5594.
11. Briere E.C., Rubin L., Moro P.L. (2014). Prevention and Control of Haemophilus influenzaetype b disease. Recommendations of the Advisory Committee on Immunization Practices (ACIP). MMWR. 63
12. Cagigi A., Cotugno N., Giaquinto C. et al. (2012). Immune reconstitution and vaccination outcome in HIV-infected children. Human Vaccine and Immunotherapeutics. 8: 12: 1784—1794.
13. Cordero E., Pachon J., Rivero A. et al. (2000). Haemophilus influenzaeрneumonia in Human Immunodeficiency Virus-Infected рatients. Clinical Infectious Diseases. 30: 461—5.
14. Kerneis S., Launay O., Turbelin C.. et al. (2014). Long-term immune responses to vaccination in HIV-Infected patients: a systematic review and meta-analysis. Clinical Infectious Diseases. 58(8): 1130—9.
15. Madhi S.A., Kuwanda L., Saarinen L. et al. (2005, Dec). Immunogenicity and effectiveness of Haemophilus influenza type b conjugate vaccine in HIV infected and uninfected African children. Vaccine. 23(48—49): 5517—5525.
16. Mangtani P., Mulholland K., Madhi S.A. et al. (2010). Heamophilus influenza type B disease in HIV-infected children: a review of the disease epidemiology and effectiveness of Hib conjugate vaccine. Vaccine. 28: 1677—1683.
17. Manno E.C., Bamford A., Rojo P., Volokha A. et al. (2015, 19—22 July). Immunization practice and vaccine safety perception in centres caring for children with perinatally acquired HIV: results from the Pediatric European Network for Treatment of AIDS survey. Abstract book of 8th IAS Conference on HIV Pathogenesis, Treatment and Prevention: 272.
18. Melvin A.J. (2003). Response to immunization with measles, tetanus, and Haemophilus influenza type b vaccines in children who have Human Immunodeficiency virus type 1 infection and are treated with highly active antiretroviral therapy. Pediatrics. 111: 641—644.
19. Menson E.N., Mellado M.J., Bamford A. et al. (2012). Guidance on vaccination of HIV-Infected children in Europe. HIV Medicine. 13(6): 333—336.
20. Moss W.J., Sutcliff C.G. (2010). Do children infected with HIV receiving HAART need to be revaccinated? Lancet Infect Dis. 10: 630—4.
21. Nix E.В., Hawdon N., Gravelle S. et al. (2012). Risk of invasive Haemophilus influenzae Type b (Hib) disease in adults with secondary immunodeficiency in the post-Hib vaccine era. Clinical and Vaccine Immunology. 19(5): 766—771.
22. Obaro S.K., Pugatch D., Luzuriaga K. (2004). Immunogenicity and efficacy of childhood vaccines in HIV-1-infected children. Lancet Infect Dis. 4: 510—518.
23. Perrett К.Р., John Т.М., Jin С. et al. (2014). Long-term persistence of immunity and B-cell memory following Haemophilus influenzaetype b conjugate vaccination in early childhood and response to booster. Clinical Infectious Diseases. 58(7): 949—59.
24. Read J.S. et al. (1998). The immunogenicity of Haemophilus influenzae Type b conjugate vaccines in children born with Human Immunodeficiency virus-infected women. Pediatr Infect Dis J. 17: 391—97.
25. Rubin L.G., Levin M.J., Per Ljungman et al. (2014). 2013 IDSA Clinical Practice Guideline for Vaccination of the Immunocompromised Host. Clinical Infectious Diseases. 58(3): 44—100.
26. Sticchi L., Bruzzone B., Caligiuri P. et al. (2015). Seroprevalence and vaccination coverage of vaccinepreventable diseases in perinatally HIV-1-infected patients. Human Vaccines & Immunotherapeutics. 11: 1: 263—269.
27. Succi R., Margot R., Krauss M.R., Harris R. et al. (2018). Immunity after childhood vaccinations in perinatally HIV-exposed children with and without HIV infection in Latin America. The Pediatric Infectious Disease Journal. 37 (4).
28. Tejiokem M.C., Njampero E., Gouandjika J. et al. (2009, Apr). Whole-cell pertussis vaccine induces low antibody levels in Human Immunodeficiency virus-infected children living in Sub-Saharan Africa. Clinical and Vaccine Immunology. 16(4): 479—483. doi 10.1128/CVI.00312—08
29. Troy S.B. et al. (2016). Seroprevalence of pertussis infection in HIV-infected adults in United States. J. Acquir Immune Defic Syndr. 73(3): 282—286.
30. Ulanova M., Hawdon N., Nix E. et al. (2011). Immune response of adults with secondary immunodeficiency to pediatric Haemophilus influenzae type b (Hib) vaccine. Allergy, Asthma & Clinical Immunology. 7(2): A23.
Гемофилия у детей | Johns Hopkins Medicine
Что такое гемофилия?
Гемофилия — это наследственное нарушение свертываемости крови. Дети с гемофилией не могут остановить кровотечение, потому что в их крови недостаточно фактора свертывания. Факторы свертывания необходимы для свертывания крови. Сгустки крови для предотвращения чрезмерного кровотечения.
Есть много факторов свертывания крови, участвующих в образовании сгустков, останавливающих кровотечение. Двумя общими факторами, влияющими на свертываемость крови, являются фактор VIII и фактор IX.
Насколько серьезна гемофилия у вашего ребенка, зависит от уровня факторов свертывания крови в его или ее крови.
К 3 основным формам гемофилии относятся:
Гемофилия A . Это вызвано недостатком фактора свертывания крови VIII. Примерно 9 из 10 больных гемофилией имеют болезнь типа А. Это также называется классической гемофилией или дефицитом фактора VIII.
Гемофилия B . Это вызвано дефицитом фактора IX.Это также называется рождественской болезнью или дефицитом фактора IX.
Гемофилия C . Некоторые врачи используют этот термин для обозначения недостатка фактора XI свертывания крови.
#TomorrowsDiscoveries: Использование стволовых клеток для лечения заболеваний крови — доктор Элиас Замбидис
Доктор Элиас Замбидис заботится о детях, страдающих лейкемией и другими заболеваниями крови.Его лаборатория изучает плюрипотентные стволовые клетки человека, которые однажды могут быть использованы для лечения не только заболеваний крови, но также болезней сердца, сосудов, рака и аутоиммунных заболеваний.
Что вызывает гемофилию у детей?
Гемофилия типов A и B является наследственным заболеванием. Они передаются от родителей к детям через ген на Х-хромосоме. У женщин две Х-хромосомы, а у мужчин — одна Х-хромосома и одна Y-хромосома.
Женщина-носитель имеет ген гемофилии на одной из Х-хромосом.Когда женщина-носитель гемофилии беременна, вероятность того, что ген гемофилии передается ребенку, составляет 50/50.
Если ген передается сыну, он заболеет.
Если ген передается дочери, она будет носителем.
Если отец болен гемофилией, но мать не несет гена гемофилии, то ни один из сыновей не будет болеть гемофилией, но все дочери будут носителями.
Примерно у одной трети детей с гемофилией семейный анамнез этого заболевания отсутствует. В этих случаях считается, что заболевание может быть связано с новым дефектом гена.
Носители гена гемофилии часто имеют нормальный уровень факторов свертывания крови, но могут:
Гемофилия С обычно не вызывает проблем, но у людей может увеличиться кровотечение после операции.
Каковы симптомы гемофилии?
Самый частый симптом этого заболевания — обильное неконтролируемое кровотечение.
Тяжесть гемофилии зависит от количества факторов свертывания крови в крови. Те, кто страдают гемофилией, уровень которой превышает 5% (100% — средний показатель для здоровых детей), чаще всего имеют кровотечение только после серьезных операций или удаления зубов. Этим детям может быть даже не поставлен диагноз до тех пор, пока в результате операции не возникнут кровотечения.
Тяжелая гемофилия — это когда фактор VIII или IX ниже 1%. У этих детей может возникнуть кровотечение даже при минимальной активности в повседневной жизни.Кровотечение также может возникнуть из-за неизвестной травмы. Кровотечение чаще всего возникает в суставах и в голове.
Симптомы вашего ребенка также могут включать:
Ушиб. Синяки могут возникнуть даже в результате небольших несчастных случаев. Это может привести к сильному скоплению крови под кожей, вызывающему отек (гематому). По этой причине большинству детей ставится диагноз в возрасте от 12 до 18 месяцев. Это когда ребенок более активен.
Легко кровоточит. Склонность к кровотечению из носа, рта и десен при незначительной травме. Кровотечение при чистке зубов или при стоматологической работе часто указывает на гемофилию.
Кровотечение в сустав. Гемартроз (кровотечение в сустав), если его не лечить, может вызвать боль, неподвижность и деформацию. Это наиболее частая причина осложнений, связанных с кровотечением при гемофилии. Эти совместные кровотечения могут приводить к хроническим болезненным заболеваниям, артритам, деформации и хроническим повреждениям.
Кровотечение в мышцах. Кровотечение в мышцы может вызвать отек, боль и покраснение. Отек из-за чрезмерного количества крови в этих областях может увеличить давление на ткани и нервы в этой области. Это может привести к необратимым повреждениям и деформации.
Кровотечение в мозг в результате травмы или спонтанно. Кровотечение в результате травмы или спонтанное кровотечение в головном мозге является наиболее частой причиной смерти детей с гемофилией и наиболее серьезным кровотечением.Кровотечение в головном мозге или вокруг него может возникнуть даже из-за небольшой шишки на голове или падения. Небольшие кровотечения в головном мозге могут привести к слепоте, умственной отсталости, различным неврологическим расстройствам. Это может привести к летальному исходу, если его не обнаружить и сразу же не лечить.
Другие источники кровотечения. Кровь, обнаруженная в моче или кале, также может сигнализировать о гемофилии.
Симптомы гемофилии могут быть похожи на другие проблемы. Всегда уточняйте диагноз у лечащего врача.
Как диагностируется гемофилия у детей?
он диагноз гемофилии основывается на вашей семейной истории, истории болезни вашего ребенка и медицинском осмотре. Анализы крови включают:
Общий анализ крови. В общем анализе крови проверяются красные и белые кровяные тельца, тромбоциты (тромбоциты) и иногда молодые эритроциты (ретикулоциты). Он включает гемоглобин и гематокрит, а также более подробную информацию о красных кровяных тельцах.
Факторы свертывания. Для проверки уровней каждого фактора свертывания.
Время кровотечения. Для проверки скорости свертывания крови.
Генетическое или ДНК-тестирование . Чтобы проверить наличие аномальных генов.
Как лечится гемофилия?
Лечащий врач вашего ребенка направит вас к гематологу, специалисту по заболеваниям крови.Лечащий врач вашего ребенка подберет лучшее лечение на основе:
Сколько лет вашему ребенку
Его или ее общее состояние здоровья и история болезни
Насколько он болен
Насколько хорошо ваш ребенок может переносить определенные лекарства, процедуры или методы лечения
Ожидаемый срок действия состояния
Ваше мнение или предпочтение
Лечение зависит от типа и тяжести гемофилии.Лечение гемофилии направлено на предотвращение кровотечений (в основном, головных и суставных). Лечение может включать:
Кровотечение в суставе может потребовать хирургического вмешательства или иммобилизации. Вашему ребенку может потребоваться реабилитация пораженного сустава. Это может включать физиотерапию и упражнения для укрепления мышц вокруг этой области.
Переливание крови может потребоваться, если произошла большая кровопотеря. Это когда вашему ребенку сдают донорскую кровь.
Самостоятельное введение фактора VIII или IX может позволить ребенку с гемофилией вести почти нормальный образ жизни.
Каковы осложнения гемофилии?
Осложнения гемофилии включают:
Кровотечение в суставах или мышцах
Воспаление слизистой оболочки сустава
Долговременные проблемы с суставами
Очень серьезные опухолевидные увеличения мышц и костей
Выработка антител к факторам свертывания
Инфекции при переливании (ВИЧ и гепатиты B и C больше не передаются через донорскую кровь)
Как лечить гемофилию?
При тщательном лечении многие дети с гемофилией могут жить относительно здоровой жизнью с нормальной продолжительностью жизни.
Лечение гемофилии вашего ребенка может включать:
Принимать участие в деятельности и упражнениях, но избегать тех, которые могут причинить травму. К ним относятся футбол, регби, борьба, мотокросс и катание на лыжах.
Получение специального ухода перед операцией, включая стоматологическую помощь. Врач вашего ребенка может порекомендовать инфузии, замещающие фактор. Они повышают уровень свертывания крови у ребенка перед процедурами. Ваш ребенок также может получать инфузии заместителя определенного фактора во время и после процедуры.Они поддерживают уровень фактора свертывания крови и улучшают заживление и предотвращают кровотечение после процедуры.
Предотвращение проблем с зубами и деснами с помощью надлежащей гигиены полости рта.
Иммунизация проводится под кожу, а не в мышцу, чтобы предотвратить кровотечение в мышцах.
Избегайте аспирина и других нестероидных противовоспалительных препаратов (НПВП).
Ношение медицинского удостоверения личности в экстренных случаях.
Когда мне следует позвонить поставщику медицинских услуг для моего ребенка?
Когда вам следует позвонить, будет зависеть от того, насколько тяжелое состояние вашего ребенка и какое лечение он получает. Поскольку гемофилия — это хроническое заболевание, поговорите с лечащим врачом вашего ребенка о том, когда вам следует позвонить или получить медицинскую помощь для вашего ребенка.
Позвоните лечащему врачу вашего ребенка, если ваш ребенок:
Основные сведения о гемофилии у детей
Гемофилия — это наследственное нарушение свертываемости крови.Это вызывает у пораженного ребенка низкий уровень факторов свертывания крови.
Самый частый симптом гемофилии — усиленное неконтролируемое кровотечение.
Введение фактора VIII или IX может позволить ребенку с гемофилией вести почти нормальный образ жизни.
Следующие шаги
Советы, которые помогут вам получить максимальную пользу от посещения лечащего врача вашего ребенка:
Перед визитом запишите вопросы, на которые хотите получить ответы.
Во время посещения запишите названия новых лекарств, методов лечения или тестов, а также все новые инструкции, которые ваш поставщик дает вам для вашего ребенка.
Если вашему ребенку назначен повторный прием, запишите дату, время и цель этого визита.
Узнайте, как можно связаться с лечащим врачом вашего ребенка в нерабочее время. Это важно, если ваш ребенок заболел и у вас есть вопросы или вам нужен совет.
Гемофилия — симптомы и причины
Обзор
Гемофилия — это редкое заболевание, при котором ваша кровь не свертывается нормально из-за недостатка белков свертывания крови (факторов свертывания крови). Если у вас гемофилия, у вас может продолжаться кровотечение в течение более длительного времени после травмы, чем при нормальном свертывании крови.
Небольшие порезы обычно не проблема. Если у вас серьезный дефицит белка фактора свертывания крови, большую проблему для здоровья вызывает глубокое кровотечение внутри вашего тела, особенно в коленях, лодыжках и локтях.Это внутреннее кровотечение может повредить ваши органы и ткани и может быть опасным для жизни.
Гемофилия — это генетическое заболевание. Лечение включает регулярную замену определенного сниженного фактора свертывания крови.
Продукты и услуги
Показать больше товаров от Mayo Clinic
Симптомы
Признаки и симптомы гемофилии различаются в зависимости от уровня факторов свертывания крови. Если у вас незначительно снижен уровень фактора свертывания крови, кровотечение может начаться только после операции или травмы.Если у вас серьезный дефицит, у вас может возникнуть спонтанное кровотечение.
Признаки и симптомы самопроизвольного кровотечения включают:
- Необъяснимое и чрезмерное кровотечение в результате порезов или травм, хирургического вмешательства или стоматологической работы
- Много больших или глубоких синяков
- Необычное кровотечение после прививок
- Боль, припухлость или стеснение в суставах
- Кровь в моче или стуле
- Носовое кровотечение без известной причины
- У младенцев необъяснимая раздражительность
Кровотечение в мозг
Простая шишка на голове может вызвать кровотечение в мозг у некоторых людей с тяжелой гемофилией.Это случается редко, но это одно из самых серьезных осложнений, которые могут возникнуть. Признаки и симптомы включают:
- Болезненная продолжительная головная боль
- Повторяющаяся рвота
- Сонливость или вялость
- Двойное зрение
- Внезапная слабость или неуклюжесть
- Судороги или припадки
Когда обращаться к врачу
Обратитесь за неотложной помощью, если вы или ваш ребенок испытали:
- Признаки или симптомы кровотечения в мозг
- Травма, при которой кровотечение не прекращается
- Опухшие суставы, горячие на ощупь и болезненные при сгибании
Если у вас есть семейная история гемофилии, вы можете пройти генетическое тестирование, чтобы узнать, являетесь ли вы носителем болезни, прежде чем создавать семью.
Причины
Когда вы истекаете кровью, ваше тело обычно объединяет кровяные клетки, образуя сгусток, останавливающий кровотечение. Некоторые частицы крови способствуют свертыванию крови. Гемофилия возникает при дефиците одного из этих факторов свертывания крови.
Существует несколько типов гемофилии, большинство из которых передаются по наследству. Однако около 30% людей с гемофилией не имеют семейного анамнеза заболевания.У этих людей неожиданное изменение происходит в одном из генов, связанных с гемофилией.
Приобретенная гемофилия — это редкая разновидность состояния, которое возникает, когда иммунная система человека атакует факторы свертывания крови. Может быть ассоциирован с:
- Беременность
- Аутоиммунные заболевания
- Рак
- Рассеянный склероз
Наследование гемофилии
При наиболее распространенных типах гемофилии дефектный ген расположен на Х-хромосоме.У каждого есть две половые хромосомы, по одной от каждого родителя. Женщина наследует Х-хромосому от матери и Х-хромосому от отца. Мужчина наследует Х-хромосому от матери и Y-хромосому от отца.
Это означает, что гемофилия почти всегда встречается у мальчиков и передается от матери к сыну через один из генов матери. Большинство женщин с дефектным геном являются просто носителями и не испытывают никаких признаков или симптомов гемофилии. Но некоторые носители могут испытывать симптомы кровотечения, если их факторы свертывания крови умеренно снижены.
Факторы риска
Самым большим фактором риска гемофилии является наличие членов семьи, которые также страдают этим заболеванием.
Осложнения
Осложнения гемофилии могут включать:
- Глубокое внутреннее кровотечение. Кровотечение в глубоких мышцах может вызвать отек конечностей. Отек может давить на нервы и вызывать онемение или боль.
- Повреждение суставов. Внутреннее кровотечение также может оказывать давление на суставы, вызывая сильную боль. При отсутствии лечения частое внутреннее кровотечение может вызвать артрит или разрушение сустава.
- Заражение. Люди, больные гемофилией, более склонны к переливанию крови, что увеличивает их риск получения зараженных продуктов крови. Продукты крови стали более безопасными после середины 1980-х годов благодаря скринингу донорской крови на гепатит и ВИЧ.
- Побочная реакция на лечение фактором свертывания крови. У некоторых людей с тяжелой формой гемофилии иммунная система отрицательно реагирует на факторы свертывания крови, используемые для лечения кровотечения. Когда это происходит, иммунная система вырабатывает белки (известные как ингибиторы), которые инактивируют факторы свертывания крови, делая лечение менее эффективным.
07 августа 2020 г.
Инфекции, вызванные Haemophilus Influenzae у детей
Не то, что вы ищете?
Что такое Haemophilus influenzae у детей?
Haemophilus influenzae (H.influenzae) — это группа бактерий, которые могут вызывать различные типы инфекций у младенцев и детей. H. influenzae чаще всего вызывает инфекции уха, глаз или носовых пазух. Они также вызывают пневмонию.
Штамм бактерий, вызывающих более серьезное заболевание, называется H. influenzae типа b. Штамм типа b сейчас редко встречается в США из-за вакцины против Hib. До повсеместной вакцинации серьезные заболевания встречались у 130 из 100 000 детей. Сейчас этот показатель составляет менее 1 на 100 000 детей.Штамм типа b вызвал много случаев инфицирования оболочек, окружающих мозг (менингит). Это также вызвало опасную для жизни инфекцию под названием эпиглоттит. Это инфекция части горла, которая покрывает и защищает голосовой ящик и дыхательное горло (трахею) во время глотания. В редких случаях ребенок все же может заразиться инфекцией H. influenzae типа B. Это более вероятно у ребенка, который не закончил серию вакцинации. Или это может произойти у более старшего ребенка, который не получил вакцину в младенчестве.Дети, путешествующие в другие страны, также могут подвергаться риску. Это связано с тем, что не все дети во всем мире получают вакцину от Hib. Большинство случаев H. influenzae, которые происходят сегодня, вызваны штаммами бактерий, не относящимися к типу B.
Что вызывает H. грипп у ребенка?
Бактерии H. influenzae обитают в носу, носовых пазухах и горле.
Часто они передаются при тесном контакте с инфицированным человеком. Капли в воздухе от
можно вдохнуть чихание или кашель.Они также могут вызвать инфекцию.
Каковы симптомы H. influenzae у ребенка?
Симптомы могут быть немного разными
для каждого ребенка. Ниже приведены наиболее частые симптомы.
Инфекция среднего уха (средний отит)
Это может произойти после того, как ребенок
простуда, вызванная вирусом. Симптомы могут включать:
- Ненормальное ворчание
- Проблемы со сном или сонливость
- Дергать или тянуть за одно или оба уха
- Лихорадка
- Утечка жидкости из уха или ушей
- Утрата баланса
- Проблемы со слухом
- Боль в ухе
- Потеря аппетита
Конъюнктивит
Это воспаление конъюнктивы глаза.Конъюнктива — это мембрана, которая покрывает внутреннюю часть века, а также тонкую мембрану, покрывающую глазное яблоко. Симптомы могут включать:
- Покраснение глаз
- Вздутие
- Жидкость из одного или обоих глаз
- Чувство жжения в глазах
- Глаза, светобоязнь (светобоязнь)
Гайморит
Это инфекция носовых пазух.Симптомы у детей младшего возраста могут включать:
- Насморк, который продолжается более 10–14 дней. Носовая жидкость может стать густой, зеленой, желтой или с оттенком крови.
- Ночной кашель
- Иногда дневной кашель
- Отеки вокруг глаз
Симптомы синусита у детей старшего возраста могут включать:
- Симптомы насморка или простуды длятся более 10-14 дней
- Носовая жидкость, стекающая по задней стенке глотки (постназальный капель)
- Головная боль
- Боль в скулах или над ними
глаза, что хуже при наклоне (боль в носовых пазухах) - Неприятный запах изо рта
- Кашель
- Лихорадка
- Боль в горле
- Отек вокруг глаза, усиливающийся по утрам
Эпиглоттит
Это зараза детали
глотки, которая покрывает и защищает голосовой аппарат и дыхательное горло при глотании.Эпиглоттит требует неотложной медицинской помощи. Это может быть смертельным, если не лечить быстро. Из-за
Вакцина против Hib, эпиглоттит очень редко встречается у детей и младенцев.
Симптомы могут включать:
- Вдруг сильно заболел
горло - Лихорадка
- Приглушенный голос
- Нет кашля
- Одышка
По мере обострения инфекции симптомы могут включать:
- Слюни
- Неспособность говорить
- Наклонение вперед, сидя
- Дыхание с открытым ртом
- Проблемы с дыханием
Менингит
Это инфекция
мембраны, которые окружают головной и спинной мозг.Из-за вакцины менингит
вызванный H. influenzae, очень редко встречается у детей и младенцев. Симптомы у детей
старше 1 года могут включать:
- Боль в шее или спине, особенно при
движение подбородка к груди - Головная боль
- Расстройство желудка и рвота
- Жесткость шеи
- Глаза, чувствительные к свету
У младенцев симптомы больше
общие и могут включать:
- Ворчун
- Все время спит
- Проблемы с кормлением, например отказ
бутылка - Плачет, когда берут на руки или когда
состоялось - Плач, который не прекращается
- Вздутие мягкого пятна (родничок)
- Изменения поведения
- Лихорадка
- Не сгибать шею при движении или
играть с игрушкой
Симптомы H.influenzae может показаться другим заболеванием. Пусть ваш ребенок увидит его или ее
поставщик медицинских услуг для диагностики.
Как диагностируется H. influenzae у ребенка?
Медицинский работник спросит о симптомах и истории здоровья вашего ребенка. Он или она проведет медицинский осмотр вашего ребенка. Ваш ребенок также может сдать анализы, например:
- Тестирование небольшой пробы жидкости
из глаза, уха, крови или спинномозгового канала, чтобы проверить наличие бактерий - Анализы крови на наличие признаков
бактерии - Рентген грудной клетки или шеи
Каким образом H.influenzae лечили у ребенка?
Антибиотики используются для лечения инфекций, вызванных H. influenzae. Продолжительность лечения зависит от того, где находится инфекция и насколько она серьезна. Другое лечение проводится для облегчения симптомов. Обсудите с лечащим врачом вашего ребенка риски, преимущества и возможные побочные эффекты всех лекарств.
Как я могу предотвратить инфекцию H. influenzae у моего ребенка?
Вакцины против H.тип influenzae
b обычно даются сериями из 3 или 4 частей. Вакцину часто называют Hib.
вакцина. Первые дозы вводятся в возрасте 2 и 4 месяцев или в возрасте 2 месяцев, 4 месяцев,
и 6 месяцев. Затем в возрасте от 12 до 15 месяцев назначают ревакцинацию. Если у ребенка нет
получил вакцину и старше 5 лет, он или она может не быть
вакцинированы. Детям старшего возраста также следует сделать прививку, если они:
- Страдают серповидно-клеточной анемией
- Нет селезенки
- Имеют слабую иммунную систему
- Есть ВИЧ
Когда мне следует позвонить поставщику медицинских услуг для моего ребенка?
Позвоните поставщику медицинских услуг, если у вашего ребенка:
- Симптомы, которые не проходят или ухудшаются
- Новые симптомы
Ключевые моменты о H.грипп у детей
- Haemophilus influenzae (H. influenzae) — это группа бактерий, которые могут вызывать различные типы инфекций у младенцев и детей.
- H. influenzae чаще всего вызывает инфекции уха, глаз или носовых пазух. Они также вызывают пневмонию.
- Более серьезный штамм бактерий.
называемый H. influenzae типа b, больше не активен в США из-за Hib
вакцина. - H.гриппозные бактерии часто
распространяется при тесном контакте с инфицированным человеком. Капли в воздухе от чихания или
кашель может быть вдохом и также может вызвать инфекцию. - Антибиотики используются для лечения инфекций, вызванных H. influenza.
- Вакцины против H. influenzae типа b обычно вводятся детям.
Следующие шаги
Советы, которые помогут вам получить максимальную пользу от посещения лечащего врача вашего ребенка:
- Знайте причину визита и то, что вы хотите.
- Перед визитом запишите вопросы, на которые хотите получить ответы.
- Во время посещения запишите название нового диагноза и любые новые лекарства, методы лечения или тесты. Также запишите все новые инструкции, которые ваш поставщик дает вам для вашего ребенка.
- Узнайте, почему прописано новое лекарство или лечение и как они помогут вашему ребенку. Также знайте, каковы побочные эффекты.
- Спросите, можно ли вылечить состояние вашего ребенка другими способами.
- Знайте, почему рекомендуется тест или процедура и что могут означать результаты.
- Знайте, чего ожидать, если ваш ребенок не принимает лекарство, не проходит обследование или процедуру.
- Если вашему ребенку назначен повторный прием, запишите дату, время и цель этого визита.
- Знайте, как вы можете связаться с лечащим врачом вашего ребенка в нерабочее время. Это важно, если ваш ребенок заболел и у вас есть вопросы или вам нужен совет.
Не то, что вы ищете?
Гемофилия A: основы практики, предыстория, патофизиология
Автор
Дуглас А. Дрелих, доктор медицины Директор Фонда Кардезы, Центр гемостаза и тромбоза, заместитель директора специальной лаборатории коагуляции Кардеза, Университетская больница Томаса Джефферсона; Доцент медицины, Медицинский колледж Сидни Киммела Университета Томаса Джефферсона
Дуглас А. Дрелих, доктор медицины, является членом следующих медицинских обществ: Американской медицинской ассоциации, Американского общества клинической онкологии, Американского общества гематологии
сумма, равная или превышающая 250 долларов США, от: Bayer, Octapharma, BPL, CSL Behring (член совета консультантов).
Главный редактор
Srikanth Nagalla, MD, MS, FACP Заведующий отделением доброкачественной гематологии, Институт рака Майами, Baptist Health South Florida
Srikanth Nagalla, MD, MS, FACP является членом следующих медицинских обществ: Американского общества гематологии, Ассоциации Профессора по специальности
Раскрытие информации: Служить (г) в качестве директора, должностного лица, партнера, сотрудника, советника, консультанта или попечителя для: Alexion; Алнилам; Кедрион; Санофи.
Дополнительные участники
Эммануэль Беса, доктор медицины Почетный профессор кафедры медицины, отделение гематологических злокачественных новообразований и трансплантации гемопоэтических стволовых клеток, Онкологический центр Киммела, Медицинский колледж Джефферсона Университета Томаса Джефферсона
Эммануэль Беса, доктор медицины, является членом следующих медицинских организаций: общества: Американская ассоциация по образованию в области рака, Американское общество клинической онкологии, Американский колледж клинической фармакологии, Американская федерация медицинских исследований, Американское общество гематологии, Нью-Йоркская академия наук
Раскрытие: нечего раскрывать.
Мэри А. Ферлонг, доктор медицины Адъюнкт-профессор и директор программы / резидентуры, Департамент патологии, Медицинский факультет Джорджтаунского университета
Мэри А. Ферлонг, доктор медицины, является членом следующих медицинских обществ: Академия патологии США и Канады
Раскрытие информации: нечего раскрывать.
Гэри Д. Крауч, доктор медицины Адъюнкт-профессор, программный директор стипендии педиатрической гематологии и онкологии, Департамент педиатрии, Служба униформы Университета медицинских наук
Гэри Д. Крауч, доктор медицины, является членом следующих медицинских обществ: Педиатрия, Американское общество гематологии
Раскрытие информации: нечего раскрывать.
Роберт Зайден, доктор медицины Доцент, Отделение гематологии / онкологии, Медицинский факультет, Университет Флориды, Медицинский колледж Джексонвилля
Роберт Зайден, доктор медицины, является членом следующих медицинских обществ: Американский колледж врачей, Американское общество клинической онкологии
Раскрытие: Ничего не разглашать.
Благодарности
Димитриос Агалиотис, доктор медицинских наук, FACP Консультант, Департамент медицины, Баптистская система здравоохранения
Димитриос Агалиотис, доктор медицинских наук, FACP является членом следующих медицинских обществ: Американского колледжа врачей, Американской медицинской ассоциации, Американского общества гематологов и Флоридской медицинской ассоциации
Раскрытие: Ничего не нужно раскрывать.
Джеффри Л. Арнольд, доктор медицины, FACEP Председатель, Отделение неотложной медицины, Медицинский центр Санта-Клара-Вэлли
Джеффри Л. Арнольд, доктор медицины, FACEP является членом следующих медицинских обществ: Американской академии экстренной медицины и Американского колледжа врачей
Раскрытие: Ничего не нужно раскрывать.
Эммануэль Беса, доктор медицины Профессор кафедры медицины, отделение гематологических злокачественных новообразований и трансплантации гемопоэтических стволовых клеток, Онкологический центр Киммеля, Медицинский колледж Джефферсона Университета Томаса Джефферсона
Эммануэль Беса, доктор медицины, является членом следующих медицинских обществ: Американской ассоциации онкологического образования, Американского колледжа клинической фармакологии, Американской федерации медицинских исследований, Американского общества клинической онкологии, Американского общества гематологии и Нью-Йоркской академии наук.
Раскрытие: Ничего не нужно раскрывать.
Макс Дж. Коппс, доктор медицины, доктор философии, MBA Президент, BC Cancer Agency, Ванкувер
Макс Дж. Коппс, доктор медицинских наук, магистр делового администрирования, является членом следующих медицинских обществ: Медицинская ассоциация Альберты, Американский колледж руководителей здравоохранения, Американское общество детской гематологии / онкологии и Общество педиатрических исследований
Раскрытие информации: Astellas Pharma US Inc. Honoraria, председатель комитета по проверке конечных точек
Брендан Р. Ферлонг, доктор медицины Главный врач, отделение неотложной медицины, больница Джорджтаунского университета
Брендан Р. Ферлонг, доктор медицины, является членом следующих медицинских обществ: Американского колледжа врачей неотложной помощи и Общества академической неотложной медицины
Раскрытие: Ничего не нужно раскрывать.
Пере Гаскон, доктор медицинских наук Профессор и директор отделения медицинской онкологии, Институт гематологии и медицинской онкологии, IDIBAPS, Медицинский факультет Университета Барселоны, Испания
Пере Гаскон, доктор медицинских наук, является членом следующих медицинских обществ: Alpha Omega Alpha, Американский колледж врачей, Нью-Йоркская медицинская академия, Нью-Йоркская академия наук и Sigma Xi
.
Раскрытие: Ничего не нужно раскрывать.
Уильям Дж. Госсман, MD Адъюнкт-профессор клинической медицины неотложной помощи, Медицинский факультет Университета Крейтон; Консультанты, Отделение неотложной медицины, Медицинский центр Университета Крейтон
Уильям Дж. Госсман, доктор медицины, является членом следующих медицинских обществ: Американская академия неотложной медицины
Раскрытие: Ничего не нужно раскрывать.
Лоуренс Ф. Джардин, доктор медицины, FRCPC Доцент кафедры педиатрии, Школа медицины и стоматологии им. Шулиха, Университет Западного Онтарио; Заведующий отделением детской гематологии и онкологии Детской больницы Западного Онтарио; Младший научный сотрудник Научно-исследовательского института здоровья детей
Лоуренс Ф. Джардин, доктор медицины, FRCPC является членом следующих медицинских обществ: Американского общества гематологов, Американского общества детской гематологии / онкологии, Канадской медицинской ассоциации защиты, Группы детской онкологии, Колледжа врачей и хирургов Онтарио, гемофилии и тромбоза. Исследовательское общество, Медицинская ассоциация Онтарио и Королевский колледж врачей и хирургов Канады
Раскрытие информации: Baxter Honoraria Consulting; Bayer Honoraria Consulting; Novartis Honoraria Выступление и обучение
Elzbieta Klujszo, MD Заведующий отделением дерматологии, Wojewodzki Szpital Zespolony, Kielce
Раскрытие: Ничего не нужно раскрывать.
Адонис Лоренцана, MD Консультант, Отделение детской онкологии, Больница Св. Иоанна и Медицинский центр
Адонис Лоренцана, доктор медицины, является членом следующих медицинских обществ: Американской академии педиатрии и Американского общества детской гематологии / онкологии
Раскрытие: Ничего не нужно раскрывать.
Rajalaxmi McKenna, MD, FACP Southwest Medical Consultants, SC, Департамент медицины, Госпиталь Доброго Самаритянина, Advocate Health Systems
Rajalaxmi McKenna, MD, FACP является членом следующих медицинских обществ: Американского общества клинической онкологии, Американского общества гематологов и Международного общества тромбозов и гемостаза
Раскрытие: Ничего не нужно раскрывать.
Садуман Озтюрк, PA-C Ассистент врача, Центр трансплантации костного мозга, Институт рака больницы Флориды
Раскрытие: Ничего не нужно раскрывать.
Рональд Захер, MB, BCh, MD, FRCPC Профессор, внутренняя медицина и патология, директор Хоксвортского центра крови, Академический центр здоровья Университета Цинциннати
Ronald A Sacher, MB, BCh, MD, FRCPC является членом следующих медицинских обществ: Американской ассоциации развития науки, Американской ассоциации банков крови, Американской клинической и климатологической ассоциации, Американского общества клинической патологии, Американского общества Гематология, Колледж американских патологов, Международное общество переливания крови, Международное общество тромбоза и гемостаза и Королевский колледж врачей и хирургов Канады
Раскрытие информации: Глаксо Смит Клайн Гонорария Выступление и обучение
Хади Саваф, доктор медицины Директор отделения детской гематологии и онкологии, Онкологический центр Ван Элслендера; Клинический доцент, Медицинский факультет Государственного университета Уэйна
Хади Саваф, доктор медицинских наук, является членом следующих медицинских обществ: Американской академии педиатрии, Американского общества клинической онкологии и Американского общества гематологов
.
Раскрытие: Ничего не нужно раскрывать.
Ребекка Дж. Шмидт, DO, FACP, FASN Профессор медицины, заведующий отделением, отделение медицины, отделение нефрологии, Медицинский факультет Университета Западной Вирджинии
Ребекка Дж. Шмидт, DO, FACP, FASN является членом следующих медицинских обществ: Американского колледжа врачей, Американской медицинской ассоциации, Американского общества нефрологов, Международного общества нефрологов, Национального фонда почек, Ассоциации врачей почек и штата Западная Вирджиния. Медицинское объединение
Раскрытие информации: Доля участия Renal Ventures Прочее
Роберт А. Шварц, доктор медицины, магистр здравоохранения Профессор и руководитель дерматологии, профессор патологии, педиатрии, медицины, профилактической медицины и общественного здравоохранения, Медицинская школа Рутгерса, Нью-Джерси,
Роберт А. Шварц, доктор медицины, магистр здравоохранения является членом следующих медицинских обществ: Alpha Omega Alpha, Американская академия дерматологии, Американский колледж врачей, Нью-Йоркская медицинская академия и Sigma Xi
.
Раскрытие: Ничего не нужно раскрывать.
Карен Зайтер, доктор медицины Профессор, кафедра внутренней медицины, отделение онкологии / гематологии, Медицинский колледж Нью-Йорка
Карен Зайтер, доктор медицины, является членом следующих медицинских обществ: Американской ассоциации исследований рака, Американского колледжа врачей и Американского общества гематологов
Раскрытие информации: Novartis Honoraria Выступление и обучение; Гонорар Novartis Consulting Устная речь и обучение; Ариад Гонорария Выступление и преподавание; Celgene Honoraria Устная речь и преподавание
Франсиско Талавера, фармацевт, доктор философии Адъюнкт-профессор, Фармацевтический колледж Медицинского центра Университета Небраски; Главный редактор Medscape Drug Reference
Раскрытие информации: Medscape Salary Employment
Благодарности
Авторы с благодарностью подтверждают предоставление нескольких фотографий, использованных в этой статье, преданной коллегой из Чикаго, Маргарет Телфер, Мэриленд.Авторы также выражают признательность профессору К. Субраманиану (Департамент молекулярной генетики, Медицинский центр Университета Иллинойса) за общие обсуждения некоторых аспектов структуры гена и мутации гена FVIII.
Гемофилия: болезни и состояния | Вызов педиатра
Обучение пациентов
Что такое гемофилия?
Гемофилия — это наследственное заболевание, при котором не удается сформировать эффективный сгусток и, следовательно, вызывает длительное кровотечение у пациента.Встречается исключительно у мужчин. Больной гемофилией кровоточит не быстрее, а только дольше.
Насколько распространена гемофилия?
Гемофилия поражает примерно 1 из 5000 живорожденных мальчиков.
Как передается гемофилия?
Существует два типа гемофилии — гемофилия A и гемофилия B. Гемофилия A возникает в результате недостаточности или отклонения от нормы фактора свертывания крови, называемого «фактором VIII».
Гемофилия B возникает в результате недостаточности или отклонения от нормы другого фактора свертывания крови, называемого «фактором IX».Самки обычно являются носителями (т.е. у них есть аномальный ген, вызывающий гемофилию, но не имеющий клинических проявлений). Заболевание обычно проявляется у детей мужского пола. Иногда гемофилия возникает из-за свежей мутации в последовательности гена у ребенка.
Следующие комбинации-перестановки могут возникать при наследовании гемофилии: —
Нормальная мать + отец с гемофилией.
Во время каждой беременности женское потомство имеет 100% шанс быть носителем, а потомство мужского пола всегда нормальное.Значит, сыновья отцов-гемофиликов и нормальных матерей нормальные.
Мать-носитель + нормальный отец
Во время каждой беременности существует 25% вероятность рождения здоровой женщины, 25% вероятность рождения женщины-носителя, 25% вероятность нормального мужчины и 25% вероятность заражения мужчиной.
Мать-носитель + отец, больной гемофилией
Каждая беременность имеет 25% шанс быть носителем женского пола, 25% шанс женщины с гемофилией, 25% шанс нормального мужчины и 25% шанс зараженного мужчины.
Мать с гемофилией + Отец с гемофилией
Во время каждой беременности существует 50% вероятность заражения женщины и 50% вероятность заражения мужчины (реальное явление встречается редко).
Мать с гемофилией + нормальный отец
Во время каждой беременности существует 50% вероятность заражения женщиной-носителем и 50% вероятность заражения мужчиной, хотя на самом деле это случается редко.
Какие проблемы у ребенка с гемофилией?
Гемофилия подразделяется на тяжелые, среднетяжелые и легкие заболевания в зависимости от уровня функционального фактора VIII или фактора IX.(нормальный уровень составляет от 50% до 150%). Пациенты с легкой формой гемофилии (уровни фактора> 5% и
Совместное и мышечное кровотечение может вызывать боль, покалывание, жар, отек, ограниченный диапазон движений и т. Д. Это обычно происходит в лодыжках, локтях и коленях, но также может влиять на любой сустав. в организме.
Как диагностируется гемофилия?
Анализы крови помогают диагностировать болезнь. Диагноз может быть подтвержден путем определения уровня фактора в крови.
Как лечится гемофилия?
Замещение дефицитного фактора в крови — основа терапии.Доступны различные концентраты факторов. Эти факторы могут быть назначены в соответствии с различными режимами лечения:
- Терапия по требованию: инфузия фактора во время кровотечения.
- Профилактическая терапия: вместо того, чтобы получать фактор по требованию, пациент получает инфузии через регулярные промежутки времени для постоянного поддержания функционального уровня фактора в крови.
- Непрерывная инфузия: обычно вводится до или после плановой операции или после серьезной травмы.
Какие еще общие меры необходимо соблюдать при гемофилии?
Новорожденные с гемофилией редко кровоточат. Доставка методом вакуумной экстракции противопоказана. Если плод большой или если роды затруднены, следует рассмотреть возможность кесарева сечения. Новорожденным, больным гемофилией, нельзя делать обрезание. Могут быть назначены обычные внутримышечные инъекции. Также рекомендуется иммунизация против гепатита A и B.
Для детей, больных гемофилией, домашняя среда должна быть защищена.На полу должно быть ковровое покрытие. Брюки и рубашки с длинными рукавами должны иметь подкладку на уровне колен и локтей для защиты от падений и ударов.
Детям следует избегать контактных видов спорта. Следует посоветовать хороший стоматологический уход. Рекомендуются физические упражнения, так как сильные мышцы поддерживают суставы и могут предотвратить обильное кровотечение.
Как защищаются суставы у больных гемофилией?
У больных гемофилией часто наблюдаются совместные кровотечения и повторные кровотечения.При повторных кровотечениях может возникнуть хроническое повреждение суставов, вызывающее повторное кровотечение. Таким образом, создается порочный круг. Суставной хрящ постепенно разрушается, а кость реабсорбируется, вызывая дегенеративный артрит. Совместное кровотечение в период взросления может вызвать разную длину двух конечностей. Следовательно, для поддержания полной подвижности сустава рекомендуется предотвращение совместных кровотечений и раннее лечение суставных кровотечений.
Какие другие методы лечения гемофилии доступны?
Генная терапия гемофилии A и B проходит испытания на животных.
Как можно обнаружить гемофилию у будущего ребенка в утробе матери?
Инвазивные тесты были сделаны на 8 неделе или 12-14 недель могут использоваться для пренатальной диагностики с помощью анализа ДНК, если известно состояние носительства матери. Эти тесты удаляют часть околоплодных вод (небольшое количество воды из водяного мешочка, в котором ребенок растет в утробе матери) или другие клетки из плаценты. Если анализ ДНК недоступен, кровь плода (кровь из вены будущего ребенка) может быть аспирирована на 18-20 неделе беременности для определения уровней фактора у плода.
Каков прогноз у ребенка, больного гемофилией?
Дети с легкой формой гемофилии могут вести нормальный образ жизни. С появлением факторной терапии дети с гемофилией средней и тяжелой степени при раннем лечении могут вести почти нормальный образ жизни.
Имплантируемые устройства венозного доступа у детей с тяжелой гемофилией: опыт педиатрического учреждения третичного уровня
Предпосылки
Замена фактора свертывания крови составляет основу лечения детей с гемофилией.Большинство детей можно лечить с помощью периферической венопункции, но очень маленьким детям и детям с плохим венозным доступом может потребоваться центральный венозный катетер. Краткосрочные и долгосрочные осложнения установки имплантируемого устройства венозного доступа (также известного как установка порта) могут привести к серьезным осложнениям и смертности у детей с гемофилией.
Цель
Цель этого исследования — описать наш опыт размещения порта у детей и подростков с тяжелой гемофилией (<1% факторов VIII или IX).
Материалы и методы
Мы провели ретроспективный обзор за 10-летний период, чтобы определить размещение порта у педиатрических пациентов с тяжелой гемофилией. Мы рассмотрели демографическую и процедурную информацию, частоту доступа, механические осложнения и инфекции кровотока, связанные с центральной линией (CLABSI). В исследование были включены 18 мужчин, средний возраст которых составлял 3,9 года (0,7–22,7 года). Пятнадцать из 18 пациентов имели гемофилию типа A, а 3/18 — типа B. Тринадцать имели высокие титры нейтрализующих ингибиторов.
Результаты
Технический успех в установке порта был достигнут у 26/27 (96,3%) пациентов, при этом отказ 1 порта был вызван венозной окклюзией из-за предшествующей установки катетера. Размер портового катетера варьировался от 5 французских (Fr) до 7,5 Fr. Все были однопросветными и размещались через правую (76,9%) или левую (23,1%) внутреннюю яремную вену; 59,3% были размещены во время общей анестезии, и всем была проведена профилактика замещения фактора. Периферически введенный центральный катетер (PICC) был установлен одновременно в 69.2% случаев; согласно политике больницы, доступ к порту осуществлялся только через 15 дней после помещения, чтобы снизить риск возникновения гематомы. Два пациента были потеряны для последующего наблюдения. Общее количество катетерных дней составило 15893. Порты были удалены в 14/24 случаях, чаще всего из-за CLABSI (7/24; 29,2%) и перехода на периферическую инфузию (3/24; 12,5%). Кровотечение было наиболее частым осложнением в первые 30 дней после установки. Было девять событий CLABSI (0,57 на 1000 катетер-дней), все у пациентов с высокими титрами нейтрализующих ингибиторов.Более высокая частота доступа к порту (более или равная ежедневному по сравнению с менее чем ежедневным) коррелировала с более высокими показателями заражения ( P = 0,02). Среднее время от введения порта до первого заражения составило 348 дней (диапазон 167–1 055 дней). Было четыре окклюзии катетера, связанного с фибриновой оболочкой (0,25 на 1000 катетер-дней): три катетера были спасены с помощью внутрикатетерной инстилляции тканевого активатора плазминогена (tPA), что привело к сохранению дополнительных 1214 катетер-дней, и один катетер был удален после Ошибка tPA (0.06 на 1000 катетер-дней).
Заключение
Поддержание порта у мальчиков с тяжелой гемофилией является сложной задачей, учитывая необходимость длительного частого доступа к устройству, связанного с инфекциями, связанными с катетером. Скорость кровотечения или инфицирования не различалась у пациентов независимо от того, был ли доступ к устройству немедленно или через 15 дней после установки. При надлежащей замене факторов до и после процедуры тяжелые осложнения в ближайшем или раннем сроке не являются обычным явлением.
Состояние крови — особые потребности
Свинец — это тяжелый металл, который чрезвычайно токсичен.Когда ребенок соприкасается с предметами, содержащими свинец, металл со временем накапливается в его организме. Симптомы отравления свинцом могут включать раздражительность, агрессивное поведение, снижение аппетита и энергии, проблемы со сном, головные боли, потерю прежних навыков развития у маленьких детей, анемию и запор. Боль в животе и спазмы обычно являются первым признаком высокой токсической дозы свинцового яда. Очень высокие уровни могут вызвать рвоту, пошатнувшуюся походку, мышечную слабость, судороги или кому.
Причины:
Свинец можно найти в краске, припое, используемом в сантехнике, старых игрушках или мебели, керамике, фарфоре, свинцовом стекле и материалах для хобби. Младенцы и дети могут контактировать с отслаивающейся краской на кроватках или стенах, пылью, содержащей свинец, загрязненной голой почвой, воздухом, загрязненной питьевой водой через свинцовые трубы, керамикой, окрашенной свинцовой краской, и домашними средствами, содержащими свинец.
Возможные осложнения;
Отравление свинцом может вызвать необратимое повреждение мозга, почек и нервной системы.Очень высокий уровень также может стать причиной смерти.
Обработка:
В более легких случаях простое удаление ребенка из окружающей среды, загрязненной свинцом, может помочь со временем снизить уровни свинца в их организме. Количество свинца в организме ребенка также можно снизить, если в его рацион входит большое количество продуктов, богатых железом, кальцием и цинком. Примеры продуктов, богатых железом, включают яйца, изюм, зелень, фасоль, горох и другие бобовые. Молочные продукты, такие как молоко, сыр и йогурт, рекомендуются из-за высокого содержания кальция.Постное красное мясо и устрицы — примеры продуктов, содержащих цинк. В более тяжелых случаях доступны лекарства, которые помогают снизить очень высокий уровень свинца у детей.
Прогноз:
При раннем выявлении и лечении дети, подвергшиеся воздействию свинца, обычно не имеют долгосрочных последствий. Однако, если воздействие свинца будет продолжительным или серьезным и без лечения, может произойти необратимое повреждение.
Ресурсов:
.
