Escherichia coli у грудничка в кале: Дисбактериоз у грудничка. Симптомы и лечение дисбактериоза кишечника у детей и взрослых
причины появления, симптомы заболевания, диагностика и способы лечения
Подтверждаю
Подробнее
- ИНВИТРО
- Библиотека
- Справочник заболеваний
- Эшерихиоз
Диарея
Рвота
Лихорадка
Дисбактериоз
Колит
Энтероколит
Гастрит
Еscherichia coli
25754
04 Июля
ВАЖНО!
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Для корректной оценки результатов ваших анализов в динамике предпочтительно делать исследования в одной и той же лаборатории, так как в разных лабораториях для выполнения одноименных анализов могут применяться разные методы исследования и единицы измерения.
Эшерихиоз: причины появления, симптомы, диагностика и способы лечения.
Определение
Эшерихиозы (коли-инфекции) — группа бактериальных антропонозных инфекционных болезней (возбудители заболевания способны паразитировать в естественных условиях только в организме человека), вызываемых патогенными штаммами кишечной палочки. Возбудитель был открыт в 1886 году немецким педиатром T. Escherich, который предположил связь диареи и кишечной палочки, которую он выделил из кишечника детей. Возбудитель был назван его именем – Еscherichia coli.
Возбудитель был назван его именем – Еscherichia coli.
Эшерихии — постоянные обитатели кишечника человека и теплокровных животных.
В результате снижения иммунитета и резистентности организма непатогенная эшерихия становится патогенной и вызывает эшерихиозы, поражая желудочно-кишечный тракт и симптомы общей интоксикации.
Причины появления эшерихиоза
Основной источник инфекции – больные люди в острой фазе заболевания или со стертыми формами эшерихиоза, или носители. Заражение энетропатогенной инфекцией происходит чаще пищевым путем, но возможен водный и контактный пути инфицирования. Пищевое заражение происходит в основном при употреблении молочных продуктов, мясных блюд, напитков (кваса, компотов) и салатов.
В детских коллективах и среди лиц, пренебрегающих правилами гигиены, возможно распространение кишечной палочки контактно-бытовым путем через грязные руки и предметы.
Водный путь заражения достаточно редок и регистрируется при купании в водоемах, куда был произведен сброс сточных вод без предварительного обезвреживания.
Естественная восприимчивость к эшерихиозам высокая, после перенесенного заболевания формируется нестойкий иммунитет (то есть повторные заражения возможны).
Классификация заболевания
Эшерихиозы классифицируются по этиологическому признаку в зависимости от группы возбудителя:
- энтеропатогенные (ЭПЭ),
- энтеротоксигенные (ЭТЭ),
- энтерогеморрагические (ЭГЭ),
- энтероинвазивные (ЭИЭ).
По форме заболевания:
- гастроэнтеритическая,
- энтероколитическая,
- гастроэнтероколитическая,
- генерализованная (коли-сепсис, менингит, пиелонефрит, холецистит).
По тяжести течения:
- легкое;
- средней тяжести;
- тяжелое.
Симптомы эшерихиоза
Энтеропатогенный эшерихиоз (ЭПЭ)
Этот вид заболеваний чаще поражает младенцев и детей в возрасте до 24 месяцев, редко регистрируется у детей старшего возраста и взрослых. При заражении ЭПЭ инкубационный период составляет 5-8 суток. При массивном инфицировании ослабленных, а также новорожденных детей инкубационный период может сокращаться до 1–2 суток.
При заражении ЭПЭ инкубационный период составляет 5-8 суток. При массивном инфицировании ослабленных, а также новорожденных детей инкубационный период может сокращаться до 1–2 суток.
Существует два варианта манифестации болезни: острое начало или постепенное. Первыми появляются признаки энтерита: стул чаще всего водянистый, желтого или оранжевого цвета. Каловые массы могут быть кашицеобразной консистенции, пенистыми, с незначительными зелеными включениями. Постоянным симптомом является рвота 1–2 раза в сутки.
У детей первых месяцев жизни с первых суток заболевания могут наблюдаться упорные срыгивания.
Максимальная симптоматика развивается к 5–7-му дню: состояние ребенка ухудшается, усиливается адинамия, значительно снижается аппетит, частота срыгиваний или рвоты увеличивается. Температура может быть фебрильной (38-39оС) или субфебрильной (37,1- 38оС) и держаться до 2 недель. Частота стула достигает 10–15 раз в сути и даже больше.
При осмотре у ребенка выявляется вздутый живот (метеоризм), урчание по ходу тонкого кишечника, бледность кожных покровов. Инфицированные дети иногда теряют до 15% массы тела, что приводит к серьезным электролитным нарушениям, тяжелой дегидратации, интоксикации, а также к поражению центральной нервной системы (гипертонусу мышц, судорогам и коме).
Особую опасность заболевание представляет для ослабленных новорожденных детей – у них велик риск генерализации патологического процесса, то есть его распространения на другие органы.
Энтеротоксигенный эшерихиоз (ЭТЭ)
Встречается у детей любого возраста и у взрослых. Клинические проявления напоминают симптомы при сальмонеллезе, пищевой токсикоинфекции или могут напоминать легкую форму холеры. Инкубационный период составляет от нескольких часов до 1–2 дней. Начинается заболевание при субфебрильной или нормальной температуре, отмечаются многократная рвота, неприятные ощущения в животе, обильная и водянистая диарея (диарейный синдром появляется одновременно с рвотой или несколько часов спустя). Интоксикация, судороги, тенезмы (ложный болезненный позыв к дефекации) отсутствуют. Каловые массы лишены специфического энтеритного запаха, а также примесей крови или слизи. В тяжелых случаях частота стула достигает 15–20 раз в сутки и более, постепенно нарастает дегидратация, отмечается снижение количества выделяемой мочи. Продолжительность заболевания обычно не превышает 5–10 дней. Исключение составляют дети первых лет жизни с тяжелым обезвоживанием – у них возможен летальный исход.
Интоксикация, судороги, тенезмы (ложный болезненный позыв к дефекации) отсутствуют. Каловые массы лишены специфического энтеритного запаха, а также примесей крови или слизи. В тяжелых случаях частота стула достигает 15–20 раз в сутки и более, постепенно нарастает дегидратация, отмечается снижение количества выделяемой мочи. Продолжительность заболевания обычно не превышает 5–10 дней. Исключение составляют дети первых лет жизни с тяжелым обезвоживанием – у них возможен летальный исход.
Энтерогеморрагический эшерихиоз (ЭГЭ)
Клиническая картина заболевания разнообразна — от бессимптомной инфекции и легкой диареи до тяжелого патологического процесса, протекающего с явлениями геморрагического колита (воспаления толстой кишки). Манифестное (явное) заболевание начинаются, как правило, с нарушения функции кишечника по типу энтерита или энтероколита: кашицеобразного или водянистого стула без каких-либо примесей с частотой 3–5 раз в сутки. Симптомы интоксикации выражены слабо или умеренно (вялость, снижение аппетита, субфебрильная температура и др.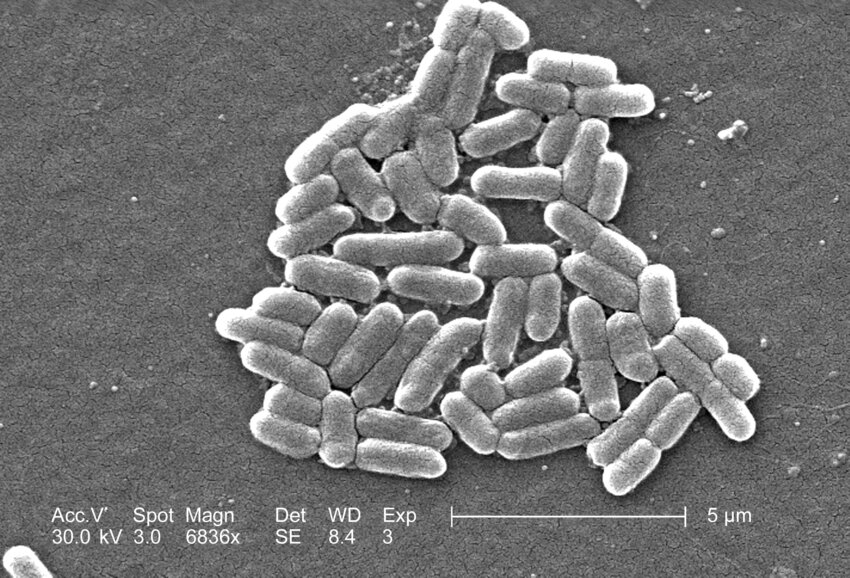 ). Рвота чаще всего отсутствует. К 3–5-му дню нарастает слабость и присоединяется рвота, кожный покров бледный, в стуле появляется кровь, снижается диурез. При прогрессировании заболевания появляются клинические и лабораторные признаки анемии, тромбоцитопении и острая почечная недостаточности.
). Рвота чаще всего отсутствует. К 3–5-му дню нарастает слабость и присоединяется рвота, кожный покров бледный, в стуле появляется кровь, снижается диурез. При прогрессировании заболевания появляются клинические и лабораторные признаки анемии, тромбоцитопении и острая почечная недостаточности.
Без адекватной терапии заболевание может закончиться летально.
Энтероинвазивный эшерихиоз (ЭИЭ)
Инкубационный период продолжается до 3 дней. Заболевание начинается остро, с подъема температуры, головной боли, тошноты, рвоты, умеренных абдоминальных болей (боли в животе). Примерно в это же время или чуть позже появляется жидкий стул (у ряда пациентов в стуле присутствуют патологические примеси в виде крови или слизи). Симптомы интоксикации могут давать о себе знать лишь в самом начале болезни. Выздоровление наступает достаточно быстро – примерно к пятому дню.
Диагностика эшерихиоза
Биоматериалом для постановки диагноза служит кал, реже – слизь из ротоглотки, рвотные массы, промывные воды из желудка, спинномозговая жидкость, при генерализованных формах заболевания — кровь.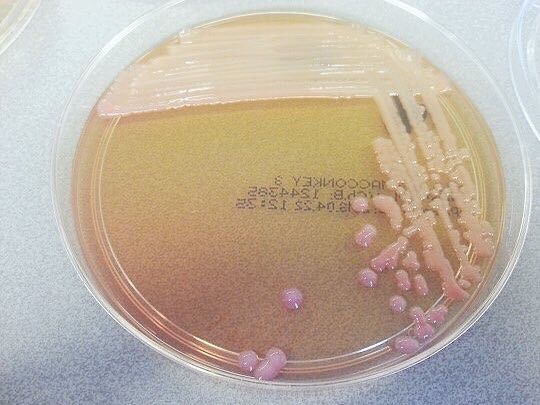
Золотой стандарт диагностики – бактериологический анализ, применять который рекомендуется на начальных этапах заболевания и до начала антибактериальной терапии. Результаты бактериологического исследования получают на 3–5-е сутки.
Посев на энтеропатогенную кишечную палочку О157:Н7 (E.coli О157:Н7) и определение чувствительности к антимикробным препаратам
Диагностика этиологии геморрагического колита и гемолитического уремического синдрома.
Escherichia coli (или просто E.coli) — грамотрицательные палочковидные бактерии. …
До 5 рабочих дней
Доступно с выездом на дом
1 260 руб
В корзину
Посев на энтеропатогенную кишечную палочку О157:Н7 (E.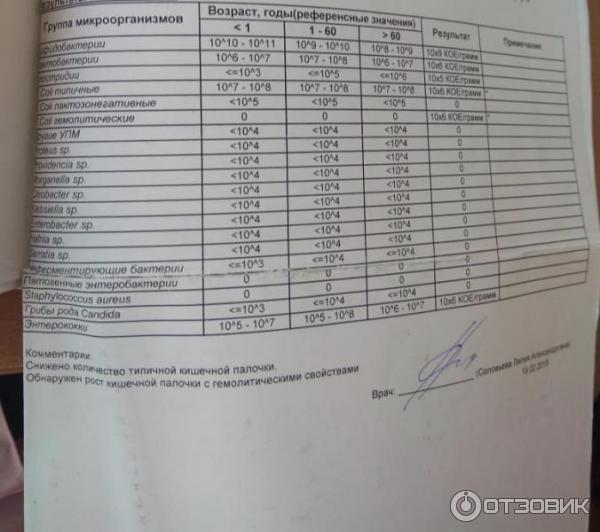 coli О157:Н7), определение чувствительности к антимикробным препаратам и бактериофагам
coli О157:Н7), определение чувствительности к антимикробным препаратам и бактериофагам
Диагностика этиологии геморрагического колита и гемолитического уремического синдрома.
Escherichia coli (или просто E.coli) — грамотрицательные палочковидные бактерии. …
До 5 рабочих дней
Доступно с выездом на дом
1 375 руб
В корзину
ПЦР-диагностика служит вспомогательным экспресс-методом.
Оценка состояния микробиоты толстого кишечника методом ПЦР. КОЛОНОФЛОР-16 (метаболизм)
Оценка состояния микробиоценоза толстого кишечника, 19 показателей (нормофлора, микроорганизмы — маркёры заболеваний) методом ПЦР
Синонимы: Анализ кал. ..
..
До 7 рабочих дней
Доступно с выездом на дом
4 715 руб
В корзину
Серологические исследования иммуноглобулинов IgM и IgG в ИФА являются дополнительными и применяются при отрицательных результатах бактериологического теста.
При копрологическом исследовании (макро- и микроскопия кала) определяется наличие лейкоцитов в поле зрения (свыше 10), эритроцитов, которые в норме отсутствуют, и слизи (в норме — незначительное количество).
Копрограмма (Koprogramma, Stool)
Синонимы: Общий анализ кала. Stool analysis, Fecal analysis.
Краткая характеристика исследования «Копрограмма»
Кал – конечный продукт, образующийся в результате сло…
До 4 рабочих дней
Доступно с выездом на дом
725 руб
В корзину
При энтерогеморрагическом эшерихиозе в анализе крови могут быть признаки гемолитической анемии.
Глюкозо-6-фосфатдегидрогеназа эритроцитов, активность (Г6ФД, Glucose-6-phosphate dehydrogenase, G6PD, activity)
Синонимы: Анализ крови на активность глюкозо-6-фосфатдегидрогеназа эритроцитов; Активность фермента глюкозо-6-фосфатдегидрогеназы в эритроцитах; Анализ активно…
До 7 рабочих дней
Доступно с выездом на дом
3 445 руб
В корзину
В анализе мочи обычно обнаруживают протеинурию, лейкоцитурию и гематурию.
Анализ мочи общий (Анализ мочи с микроскопией осадка)
Метод определения
Определение физико-химических параметров выполняется на автоматическом анализаторе методом «сухой химии».
Аппаратная микроскоп. ..
..
До 1 рабочего дня
Доступно с выездом на дом
410 руб
В корзину
К каким врачам обращаться
Диагностикой и лечением эшерихиозов занимается врач-инфекционист или
гастроэнтеролог.
Если болен ребенок, то следует обратиться к
врачу-педиатру.
Лечение эшерихиоза
Лечение легкой формы эшерихиоза обычно проводят в амбулаторных условиях. Госпитализируют в инфекционные стационары детей со среднетяжелой, тяжелой и осложненными формами заболевания.
Больным эшерихиозом рекомендована диета: на период острых клинический проявлений (диареи) – стол №4, после их прекращения – стол № 2, в период выздоровления — № 13.
Умеренное обезвоживание устраняют приемом жидкости и регидратационных смесей перорально (через рот), при нарастании и выраженной степени обезвоживания проводят внутривенное введение растворов. Показаны препараты, содержащие ферменты, и энтеросорбенты. Легкие и стертые формы эшерихиозов не требуют назначения антибиотиков.
Показаны препараты, содержащие ферменты, и энтеросорбенты. Легкие и стертые формы эшерихиозов не требуют назначения антибиотиков.
Если антибактериальные препараты назначены, то необходим прием эубиотиков и для коррекции дисбактериозов на протяжении не менее 7–10 дней.
Симптоматическое лечение включает жаропонижающие средства и болеутоляющие препараты.
Осложнения
При инфекции, спровоцированной энтерогеморрагичекской формой эшерихиоза, может возникнуть анемия, осложнения со стороны мочевыделительной системы, церебральные расстройства (группа заболеваний головного мозга, обусловленных патологическими изменениями церебральных сосудов с нарушением мозгового кровообращения).
Профилактика эшерихиоза
Основная профилактика — гигиена рук для предотвращения передачи заболевания от человека к человеку.
Особое внимание необходимо уделять гигиене в детских коллективах.
Источники:
- Р.Н. Манкевич, Л.И. Матуш, Г.М. Лагир. Шигеллезы и эшерихиозы у детей / Учебно-методическое пособие. Минск. БГМУ. – 2019. – 40 с.
- Пронько Н.В., Цыркунов В.М., Якусевич Т.В. К вопросу об особенностях течения энтерогеморрагического и других эшерихиозов // Атуальная инфектология. – 2016. – №3(12). DOI: 10.22141/2312-413×3.12.2016.81722
ВАЖНО!
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Для корректной оценки результатов ваших анализов в динамике предпочтительно делать исследования в одной и той же лаборатории, так как в разных лабораториях для выполнения одноименных анализов могут применяться разные методы исследования и единицы измерения.
Рекомендации
Показать еще
Угри (акне)
Тиреотоксикоз
Гастрит
Менопауза
Энцефалит
Гиперхолистеринемия
Гепатит
Дерматиты
Дерматиты: причины появления, симптомы, диагностика и способы лечения.
Подробнее
Дефицит железа
Helicobacter pylori
Рефлюкс
Рвота
Отрыжка
Изжога
Гастрит
Гастрит – это наиболее распространенное воспалительное заболевание слизистой оболочки желудка. Гастрит возникает из-за нарушения равновесия между процессами, обеспечивающими защиту или вызывающими повреждение слизистой оболочки желудка.
Гастрит возникает из-за нарушения равновесия между процессами, обеспечивающими защиту или вызывающими повреждение слизистой оболочки желудка.
Подробнее
Простуда
Грибок
Интоксикация
Лихорадка
Кашель
Одышка
Пневмония
Пневмония или воспаление легких – одна из распространенных инфекционно-воспалительных болезней. В связи с тем, что при пневмонии поражается жизненно важный орган – легкие, она представляет угрозу жизни, особенно для ослабленных пациентов, страдающих хроническими заболеваниями.
Подробнее
Простуда
Кашель
Насморк
Интоксикация
Лихорадка
Грипп
Аденовирус
Коронавирус
Риновирус
ОРВИ
ОРВИ, или острые респираторные вирусные инфекции, представляют собой группу инфекционных заболеваний, вызванных вирусами. Их основные симптомы – насморк, боль в горле и кашель – это следствие воспалительных процессов в верхних и нижних дыхательных путях.
Их основные симптомы – насморк, боль в горле и кашель – это следствие воспалительных процессов в верхних и нижних дыхательных путях.
Подробнее
Диарея
Рвота
Аллергия
Глисты
Токсоплазмоз
Токсоплазмоз: причины появления, симптомы, диагностика и способы лечения.
Подробнее
Подпишитесь на наши рассылки
Введите e-mail
Даю согласие на
обработку персональных данных
Подписаться
Обоснование введения индикаторых показателей «Обобщённые колиформные бактерии» и « Escherichia coli » в систему санитарно-эпидемиологического контроля безопасности питьевой воды | Загайнова
© КОЛЛЕКТИВ АВТОРОВ, 2020
Загайнова А. В.1, Трухина Г.М.2, Рахманин Ю.А.1, Артемова Т.З.1, Сухина М.А.1,3
В.1, Трухина Г.М.2, Рахманин Ю.А.1, Артемова Т.З.1, Сухина М.А.1,3
Обоснование введения индикаторых показателей «обобщённые колиформные бактерии» и «Escherichia coli» в систему санитарно-эпидемиологического контроля безопасности питьевой воды
1НИИ экологии человека и гигиены окружающей среды им. А.Н. Сысина ФГБУ «Центр стратегического планирования и управления медико-биологическими рисками здоровью» ФМБА России, 119121, Москва;
2ФБУН Институт комплексных проблем гигиены «Федеральный научный центр гигиены им. Ф.Ф. Эрисмана» Роспотребнадзора, 141014, г. Мытищи;
3ФГБУ «Национальный медицинский исследовательский центр колопроктологии им. А.Н. Рыжих» Минздрава России, 123423, Москва
Введение. Возрастающее бактериальное загрязнение водных объектов требует повышения надёжности контроля качества воды в целях обеспечения эпидемической безопасности в отношении инфекций, передающихся водным путём, поэтому исследователи как в России, так и в Европе пришли к мнению о необходимости поиска индикаторных микроорганизмов, которые могут более точно указывать на присутствие патогенных микроорганизмов в воде, чем традиционные индикаторы.
Целью исследования явилось обоснование введения индикаторных показателей фекального загрязнения «обобщённые колиформные бактерии» и Escherichia coli для оценки безопасности питьевой воды.
Материал и методы. В статье приведён анализ отечественных и международных нормативных документов и литературных материалов, регламентирующих качество питьевой воды по санитарно-микробиологическим показателям и критериям оценки. Представлены результаты многолетних экспериментальных и натурных исследований, проведённых научно-исследовательскими организациями и практическими организациями Роспотребнадзора.
Результаты. На территории России безопасность питьевой воды определяется одним из индикаторных показателей общие колиформные бактерии, определяемые по ферментации лактозы, при этом в воде не учитываются патогенные бактерии (Salmonella, Shigella) и ряд лактозоотрицательных условно патогенных бактерий – возбудителей кишечных инфекций. Изучение микроорганизмов, выделенных из фекалий больных, подтверждает, что частота встречаемости лактозоотрицательных микроорганизмов составляет от 20 до 100% штаммов. При ежегодной тенденции снижения процента нестандартных проб питьевой воды по микробиологическим показателям возрастает число острых кишечных инфекций (ОКИ) неустановленной этиологии, то есть возрастает риск возникновения ОКИ. При несоответствии качества питьевой воды по термотолерантным колиформным бактериям в 95% проб обнаруживали E. coli. Поэтому определение E. coli более надёжно указывает на поступление свежего фекального загрязнения и обеспечивает оперативность в принятии мер по устранению неблагоприятной ситуации, чем термотолерантные колиформные бактерии (ТКБ).
Изучение микроорганизмов, выделенных из фекалий больных, подтверждает, что частота встречаемости лактозоотрицательных микроорганизмов составляет от 20 до 100% штаммов. При ежегодной тенденции снижения процента нестандартных проб питьевой воды по микробиологическим показателям возрастает число острых кишечных инфекций (ОКИ) неустановленной этиологии, то есть возрастает риск возникновения ОКИ. При несоответствии качества питьевой воды по термотолерантным колиформным бактериям в 95% проб обнаруживали E. coli. Поэтому определение E. coli более надёжно указывает на поступление свежего фекального загрязнения и обеспечивает оперативность в принятии мер по устранению неблагоприятной ситуации, чем термотолерантные колиформные бактерии (ТКБ).
Заключение. Приведены основания для введения более надёжных микробиологических показателей контроля безопасности воды, таких как «обобщённые колиформные бактерии» (ОКБ), объединяющие как лактозоположительные, так и лактозоотрицательные бактерии, определяемые по признаку ферментации глюкозы, отрицательному оксидазному тесту и отрицательной окраске по Граму, и E. coli в качестве показателя недавнего поступления фекального загрязнения, что позволит проводить оценку качества воды по широкому спектру бактерий порядка Enterobacterialеs, соответствующих современной таксономии энтеробактерий NCBI, обеспечит гармонизацию с международными требованиями и безопасность питьевой воды для населения.
coli в качестве показателя недавнего поступления фекального загрязнения, что позволит проводить оценку качества воды по широкому спектру бактерий порядка Enterobacterialеs, соответствующих современной таксономии энтеробактерий NCBI, обеспечит гармонизацию с международными требованиями и безопасность питьевой воды для населения.
Ключевые слова: питьевое водоснабжение; фекальное загрязнение; санитарно-бактериологические показатели; колиформные бактерии; обобщённые колиформные бактерии; термотолерантные колиформные бактерии; Escherichia coli
Для цитирования: Загайнова А.В., Трухина Г.М., Рахманин Ю.А., Артемова Т.З., Сухина М.А. Обоснование введения индикаторых показателей «обобщённые колиформные бактерии» и «Escherichia coli» в систему санитарно-эпидемиологического контроля безопасности питьевой воды. Гигиена и санитария. 2020; 99 (12): 1353-1359. https://doi.org/10.47470/0016-9900-2020-99-12-1353-1359
Для корреспонденции: Загайнова Анжелика Владимировна, канд.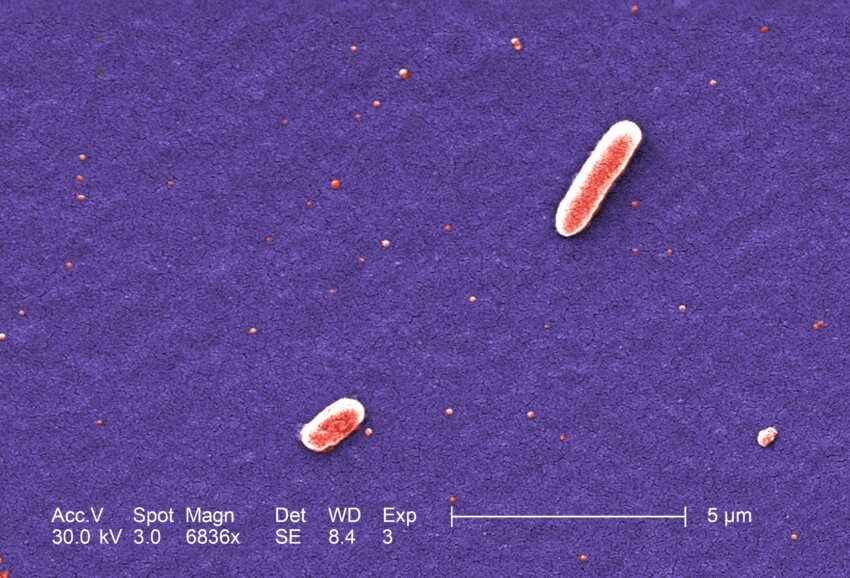 биол. наук, зав. лаб. микробиологии и паразитологии НИИ ЭЧ и ГОС им. А.Н. Сысина ФГБУ «ЦСП» ФМБА России, 119121, Москва. E-mail: [email protected]
биол. наук, зав. лаб. микробиологии и паразитологии НИИ ЭЧ и ГОС им. А.Н. Сысина ФГБУ «ЦСП» ФМБА России, 119121, Москва. E-mail: [email protected]
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Финансирование. Исследование проводилось при поддержке Государственного задания Peг. № АААА-А18-118020590087-5, тема «Научное обоснование методологии оценки биологической эффективности и безопасности питьевых вод, полученных на основе новых физических технологий, для применения их в целях профилактики метаболических нарушений и в качестве вспомогательного средства в комплексной терапии экологически обусловленных заболеваний».
Участие авторов: Загайнова А.В. – концепция и дизайн исследования, сбор и обработка материала, выполнение экспериментальной работы, статистическая обработка, написание текста; Рахманин Ю.А. – концепция и дизайн исследования, редактирование; Трухина Г.В. – редактирование, утверждение окончательного варианта статьи; Артемова Т.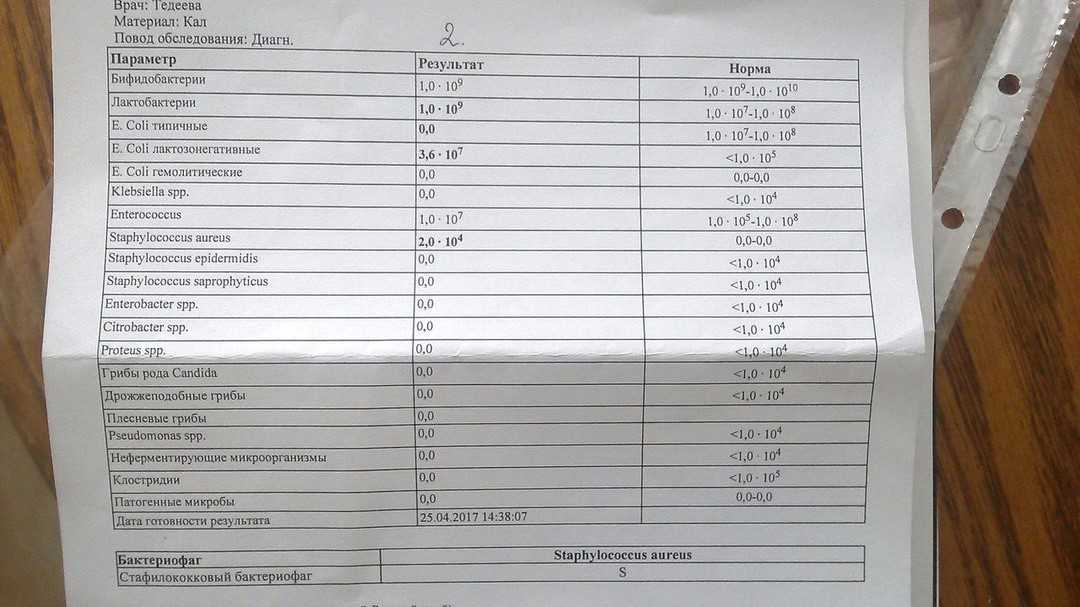 З. – редактирование, написание текста; Сухина М.А. – выполнение экспериментальной работы, сбор и обработка материала.
З. – редактирование, написание текста; Сухина М.А. – выполнение экспериментальной работы, сбор и обработка материала.
Поступила 05.11.2020
Принята к печати 15.12.2020
Опубликована 25.01.2021
Angelika V. Zagainova1, Galina M. Trukhina2, Yury A. Rakhmanin1, Tamara Z. Artemova1, Marina A. Sukhina1,3
The rationale for introducing the indices «generalized coliform bacteria» and «Escherichia coli» into the scheme of sanitary and microbiological control of water quality as indices of fecal contamination
1Centre for Strategic Planning and Management of Biomedical Health Risks of the Federal Medical Biological Agency, Moscow, 119121, Russian Federation;
2Institute for Complex Problems of Hygiene of the F.F. Erisman Federal Scientific Center for Hygiene, Mytishchi, 141014, Russian Federation;
3A.N. Ryzhikh National Medical Research Center of Coloproctology, Moscow, 123423, Russian Federation
Introduction.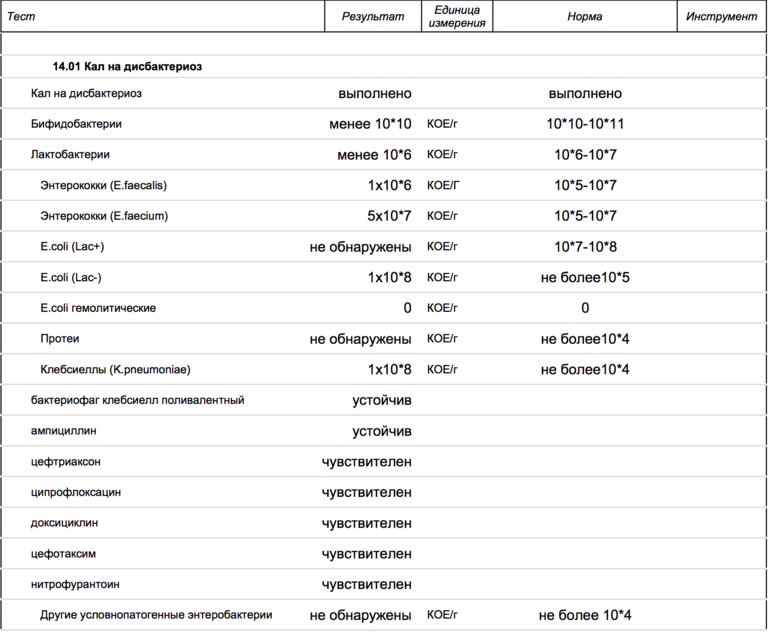 The increasing bacterial contamination of water bodies requires an increase in water quality control’s reliability to ensure epidemic safety against waterborne infections. Therefore, researchers in both Russia and Europe came to the conclusion that it is necessary to search for indicator microorganisms that can more accurately suggest the presence of pathogens. microorganisms in water than traditional indicators.
The increasing bacterial contamination of water bodies requires an increase in water quality control’s reliability to ensure epidemic safety against waterborne infections. Therefore, researchers in both Russia and Europe came to the conclusion that it is necessary to search for indicator microorganisms that can more accurately suggest the presence of pathogens. microorganisms in water than traditional indicators.
The aim of the study was to justify the introduction of indicator indices of fecal contamination “generalized coliform bacteria” and Escherichia coli to assess the safety of drinking water
Material and methods. The article provides an analysis of domestic and international regulatory documents and literary materials regulating the quality of drinking water in terms of sanitary and microbiological indicators and assessment criteria. The results of many years of experimental and field research carried out by research organizations and practical organizations of the Federal Service for Supervision of Consumer Rights Protection and Human Welfare are presented.
Results. On the territory of Russia, “general coliform bacteria,” is one of the indicator indices chosen according to the fermentation of lactose, determine the safety of drinking water. The water does not take into account pathogenic bacteria (Salmonella, Shigella) and a number of lactose-negative opportunistic bacteria, causative agents of intestinal infections. The study of microorganisms isolated from the feces of patients confirms the frequency of occurrence of lactose-negative microorganisms to varying from 20 to 100% of strains. With an annual trend towards a decrease in the percentage of non-standard drinking water samples in terms of microbiological indices, general intestinal infections (GII) of unknown etiology increase, i.e. risk of GII. If the quality of drinking water does not correspond to thermotolerant coliform bacteria (TCB), 95% of samples contain E. coli. Therefore, the determination of E. coli more reliably indicates the intake of fresh fecal contamination and provides efficiency in taking measures to eliminate an unfavorable situation than TCB.
Conclusion. Reasons are given for the introduction of more reliable microbiological indicators of water safety control, such as — “generalized coliform bacteria” with the preservation of the abbreviation GCB, combining both lactose-positive and lactose-negative bacteria, determined by the sign of glucose fermentation, negative oxidase test and negative stain according to Gram and E. coli as an indicator of recent faecal contamination, which will allow the assessment of water quality for a wide range of bacteria of the order Enterobacterials, corresponding to the modern taxonomy of Enterobacteriaceae NCBI, will ensure harmonization with international requirements and the safety of drinking water for the population.
Keywords: drinking water supply; fecal contamination; sanitary and bacteriological indicators; coliform bacteria; generalized coliform bacteria; thermotolerant coliform bacteria; Escherichia coli
For citation: Zagainova A. V., Trukhina G.M., Rakhmanin Yu.A., Artemova T.Z., Sukhina M.A. The rationale for introducing the indices «generalized coliform bacteria» and «Escherichia coli» into the scheme of sanitary and microbiological control of water quality as indices of fecal contamination. Gigiena i Sanitariya (Hygiene and Sanitation, Russian journal). 2020; 99 (12): 1353-1359. https://doi.org/10.47470/0016-9900-2020-99-12-1353-1359 (In Russ.)
V., Trukhina G.M., Rakhmanin Yu.A., Artemova T.Z., Sukhina M.A. The rationale for introducing the indices «generalized coliform bacteria» and «Escherichia coli» into the scheme of sanitary and microbiological control of water quality as indices of fecal contamination. Gigiena i Sanitariya (Hygiene and Sanitation, Russian journal). 2020; 99 (12): 1353-1359. https://doi.org/10.47470/0016-9900-2020-99-12-1353-1359 (In Russ.)
For correspondence: Angelika V. Zagainova, MD, Ph.D., Head of Microbiology and parasitology laboratory in the Centre for Strategic Planning and Management of Biomedical Health Risks of the Federal Medical Biological Agency, Moscow, 119121, Russian Federation. E-mail: [email protected]
Information about the authors:
Zagainova A.V. https://orcid.org/0000-0003-4772-9686
Trukhina C.M. https://orcid.org/0000-0001-9955-7447
Sukhina M.A. https://orcid.org/0000-0003-4795-0751
Rakhmanin Yu. A. https://orcid.org/0000-0003-4795-0751
A. https://orcid.org/0000-0003-4795-0751
Artemova T.Z. https://orcid.org/0000-0002-0986-250X
Conflict of interest. The authors declare no conflict of interest.
Acknowledgment. The research was carried out with the support of the State Task of Reg. No. АААА-А18-118020590087-5, topic “Scientific substantiation of the methodology for assessing the biological effectiveness and safety of drinking water obtained on the basis of new physical technologies for their use in the prevention of metabolic disorders and as an aid in the complex therapy of environmentally related diseases.”
Contribution: Zagainova A.V. – concept and design of research, collection and processing of material, experimental work, statistical processing, text writing; Rakhmanin Yu.A. – research concept and design, editing; Trukhina G.V. – editing, approval of the final version of the article; Artemova T.Z. – editing, writing text; Sukhina M.A. – performance of experimental work, collection and processing of material.
Received: November 5, 2020
Accepted: December 15, 2020
Published: January 25, 2021
Введение
По определению Федерального закона от 03.03.1999 г. № 52-ФЗ «О санитарно-эпидемиологическом благополучии населения» питьевая вода должна быть безопасной в эпидемиологическом и радиационном отношении, безвредной по химическому составу и должна иметь благоприятные органолептические свойства. При разработке международных и отечественных нормативов для оценки качества воды заложен основной принцип – осуществление контроля качества воды по индикаторным показателям, гарантирующим отсутствие в воде патогенных микроорганизмов. Нормативы должны учитывать региональные условия формирования, состав источника водоснабжения, применяемые методы водоподготовки и транспортировки.
Первоначальное использование бактерий в качестве индикаторных показателей фекального загрязнения воды датируется 1880 г., когда фон Фрич описал Klebsiella pneumoniae и Klebsiella rhinoscleromatis как микроорганизмы, характерные для фекалий человека [1]. Началом развития санитарной микробиологии можно считать 1888 г., когда французский врач Е. Mace предложил считать кишечную палочку показателем фекального загрязнения воды [2]. В 1891 г. Франклендс для оценки потенциальной опасности сточной воды предложил идентификацию микроорганизмов, циркулирующих в сточных водах [1].
Началом развития санитарной микробиологии можно считать 1888 г., когда французский врач Е. Mace предложил считать кишечную палочку показателем фекального загрязнения воды [2]. В 1891 г. Франклендс для оценки потенциальной опасности сточной воды предложил идентификацию микроорганизмов, циркулирующих в сточных водах [1].
Эти основные гигиенические подходы к регламентации питьевого водоснабжения подтверждены 3-м и 4-м изданиями ВОЗ «Руководство по контролю качества питьевой воды» (2004, 2011) [3, 4], приняты международной водной ассоциацией (IWA), Директивой Совета Европейского союза, национальными законодательными и нормативными актами других развитых стран (Австралии, Канады, Финляндии, Швеции, Бразилии, Франции, Японии, Китая, США) [5–12].
Впервые систематизация структурных и функциональных особенностей бактерий с целью их классификации создана в 1923 г. Дэвидом Берджи, однако она носила больше эмпирический характер [13]. С 1980 г. справочник Берджи значительно увеличен и стал четырёхтомным [14, 15], содержащим информацию обо всех микроорганизмах, имеющих «медицинское и промышленное значение» [15].
Первая таксономия Национального центра биотехнологической информации (NCBI) включена в первую версию Entrez в 1991 г., в которой отражены связывающие нуклеотиды и белки из многочисленных разрозненных источников с различными системами таксономической классификации, а в 1996 г. на ежегодном совещании INSDC принято решение использовать таксономию NCBI в качестве единственного источника таксономической классификации для поддержания согласованности между международными базами данных [16].
Современная таксономия NCBI включает названия таксонов микроорганизмов и классификацию каждой из нуклеотидных и белковых последовательностей по международной схеме типирования (INSDC), включающие GenBank, европейскую лабораторию молекулярной биологии (EMBL) и Банк данных ДНК Японии (DDBJ). База данных таксономии NCBI содержит список названий, которые определены как правильные или действительные номенклатурно, классифицированные в приблизительно филогенетической иерархии (в зависимости от уровня знаний о филогенетических отношениях данной группы), и ориентирована на номенклатуру и систематику.
Внутренние национальные стандарты и руководства ряда евразийских, южно- и североамериканских государств, Директивы европейских стран в качестве основных показателей при определении качества вод различного назначения определяют фекальное загрязнение, то есть наличие в воде всех «колиформных бактерий» (Total coliforms) и в том числе фекальных колиформ (Faecal coliforms), включая бактерии Klebsiella и E. coli, как показателя недавнего фекального загрязнения (см. рисунок) [11]. В России и в Республике Беларусь в соответствии с ГОСТ 18963-731 (ГОСТ 18963-73 «Вода питьевая. Методы санитарно-бактериологического анализа», Издательство стандартов, 1973; Стандартинформ, 2008, с. 2.) в воде контролируется более широкий показатель – бактерии группы кишечных палочек (БГКП), который, согласно современной таксономии, включает в себя все бактерии фекального происхождения семейства Enterobacteriaceae. Методически при определении БГКП учитывают как бактерии, ферментирующие глюкозу с образованием молочной кислоты и газа, а следовательно, в эту группу попадают энтеробактерии, которые не входят в настоящее время в семейство Enterobacteriaceae, но входят в порядок Enterobacteriales, поэтому аббревиатура БГКП не удовлетворяет современной таксономии, поскольку обозначает более узкую группу бактерий группы кишечных палочек семейства Enterobacteriaceae (см. рисунок, табл. 1).
рисунок, табл. 1).
Понимание микробиологических показателей для оценки питьевой воды: интерпретация результатов испытаний и значимость для общественного здравоохранения [12].
В соответствии с действующим ГОСТ 18963-73 в пробах питьевой воды контролируются бактерии семейства Enterobacteriaceae БГКП как показателя фекального загрязнения. Количественный учёт бактерий БГКП в воде позволяет судить об уровне её фекального загрязнения.
Введение в действие СанПиН 2.1.4.559-96 (СанПиН 2.1.4.559-96 «Питьевая вода. Гигиенические требования к качеству воды централизованных систем питьевого водоснабжения. Контроль качества», Госсанэпиднадзор России. М., 1996., с. 111.) явилось прогрессивным шагом к гармонизации с международными требованиями. В нём показатель БГКП был заменён на более узкий, терминологически неудачный показатель – общие колиформные бактерии (ОКБ), определяемый как «грам-отрицательные, не образующие спор палочки, сбраживающие лактозу с образованием кислоты и газа при температуре 37 ± 0,5 °С в течение 24–48 ч», из которого исчез признак ферментации глюкозы.
За 5 лет практического применения СанПиН 2.1.4.559-96 и 19-летнего применения частично переработанного его варианта СанПиН 2.1.4.1074-01 (СанПиН 2.1.4.1074-01 «Питьевая вода. Гигиенические требования к качеству воды централизованных систем питьевого водоснабжения. Контроль качества. Гигиенические требования к обеспечению безопасности систем горячего водоснабжения». Госсанэпиднадзор России. М., 2001., с. 95.) выявлены аспекты, свидетельствующие о недостаточной надёжности качества питьевой воды в эпидемическом отношении, контролируемой по показателю ОКБ. Подтверждением служат материалы Государственных докладов «О состоянии санитарно-эпидемиологического благополучия населения в Российской Федерации главного государственного санитарного врача Российской Федерации» (2001–2019 гг.). Количество нестандартных проб по бактериологическим показателям с 2001 по 2010 г. снизилось с 9,4 до 5,1%, но за это же время доля нестандартных проб с обнаружением возбудителей инфекционных заболеваний возросла в 2 раза, что, согласно Г. Г. Онищенко, «в значительной мере является следствием того, что выбор индикаторных микроорганизмов недостаточно адекватно отражает степень потенциальной эпидемической опасности питьевой воды» [19–21]. В течение 2012–2019 гг. наблюдалось снижение в 1,35 раза доли проб воды источников централизованного водоснабжения, не соответствующих санитарно-эпидемиологическим требованиям по санитарно-микробиологическим показателям, в то время как процент неудовлетворительных проб воды поверхностных источников снизился всего с 15,9 до 15,4%, а подземных – с 4 до 2,7% [22]. В 2019 г. регистрировались заболевания острыми кишечными инфекциями (ОКИ) установленной этиологии на уровне 37,1%, большинство из которых имели вирусную природу, тогда как заболеваемость ОКИ неустановленной этиологии сохранилась на уровне предыдущих лет и составила 334,1 на 100 тыс. населения [22]. По данным ФБУН «Центральный НИИ эпидемиологии» Роспотребнадзора, такой постоянно высокий уровень ОКИ с неустановленным возбудителем связан с «недостаточным уровнем внедрения современных методов лабораторных исследований, сопровождающийся высокой долей диагнозов ОКИ (> 20%), ассоциированных с условно патогенной микрофлорой» [22].
Г. Онищенко, «в значительной мере является следствием того, что выбор индикаторных микроорганизмов недостаточно адекватно отражает степень потенциальной эпидемической опасности питьевой воды» [19–21]. В течение 2012–2019 гг. наблюдалось снижение в 1,35 раза доли проб воды источников централизованного водоснабжения, не соответствующих санитарно-эпидемиологическим требованиям по санитарно-микробиологическим показателям, в то время как процент неудовлетворительных проб воды поверхностных источников снизился всего с 15,9 до 15,4%, а подземных – с 4 до 2,7% [22]. В 2019 г. регистрировались заболевания острыми кишечными инфекциями (ОКИ) установленной этиологии на уровне 37,1%, большинство из которых имели вирусную природу, тогда как заболеваемость ОКИ неустановленной этиологии сохранилась на уровне предыдущих лет и составила 334,1 на 100 тыс. населения [22]. По данным ФБУН «Центральный НИИ эпидемиологии» Роспотребнадзора, такой постоянно высокий уровень ОКИ с неустановленным возбудителем связан с «недостаточным уровнем внедрения современных методов лабораторных исследований, сопровождающийся высокой долей диагнозов ОКИ (> 20%), ассоциированных с условно патогенной микрофлорой» [22].
Показатель ОКБ в санитарную практику в нашей стране введён с целью гармонизации с международными стандартами, которые не изменялись с 1886 г., после введения Теодором Эшерихием метода подсчёта бактерий Bacterium coli cоmmunae путём прямого перенесения посевов на лакмусовую бумажку и посева проб воды на лактозный агар, основанного на использовании концепции выделения молочной кислоты (а после 1893 г. и образования газа) при сбраживании лактозы как диагностического признака [1].
Концепцию «колиформных» бактерий стали использовать в Великобритании с 1901 г. Санитарно-микробиологический анализ воды в СССР не производили до 1934 г., и, следовательно, санитарное значение обнаружения различных колиформных бактерий признано бактериологами только после 3-й декады ХХ века. В 1905 г. Мак-Конки создал знаменитый бульон MacConkey’s, который помогал выявлять толерантность желчных солей к бактериям, ферментирующим лактозу с применением бродильного метода. Тем не менее coli-формы всё ещё считались гетерогенной группой микроорганизмов. Появились различные схемы классификации колиформ. Самые ранние из них были разработаны в 1908 г. Bergey и Dikhan [1]. К началу 1920-х годов дифференциация колиформных бактерий была одним из наиболее важных тестов для определения фекального загрязнения и предполагала образование индола, разжижение желатина, ферментацию сахарозы и Voges-реакцию Проскауэра [1].
Появились различные схемы классификации колиформ. Самые ранние из них были разработаны в 1908 г. Bergey и Dikhan [1]. К началу 1920-х годов дифференциация колиформных бактерий была одним из наиболее важных тестов для определения фекального загрязнения и предполагала образование индола, разжижение желатина, ферментацию сахарозы и Voges-реакцию Проскауэра [1].
В настоящее время исследователи как в России, так и в Европе пришли к мнению о необходимости поиска индикаторных микроорганизмов, которые могут более точно указывать на присутствие патогенных микроорганизмов, чем традиционные индикаторы «Total coliforms», определяемые по ферментации лактозы [23, 24].
В питьевой воде в России показатель ОКБ определяется в соответствии с МУК 4.2.1018-01 (МУК 4.2.1018-01 «Санитарно-микробиологический анализ питьевой воды»: Методические указания. М.: Федеральный центр гигиены и эпидемиологии Роспотребнадзора, 2011. 16 с.) как грамотрицательные палочки, способные расти на дифференциальных лактозных средах, при этом традиционно в качестве среды для исследования используется лактозная среда Эндо (так называемый лактозный тест, основанный на бета-галактозидазе). Вместе с тем признак ферментации лактозы показал себя неустойчивым и вариабельным (табл. 2). В качестве примера можно привести микрообъёмную биохимическую идентификацию фекальных энтеробактерий [19] семейства Enterobacteriaceae, которые в большинстве случаев ферментируют лактозу, но так же часто встречаются лактозонегативные штаммы, особенно в фекалиях человека и коммунальных сточных водах, обладающие патогенными и вирулентными свойствами [25]. При этом вне учёта в воде остаются как патогенные бактерии (Salmonella, Shigella), так и условно патогенные бактерии, которые до недавнего времени входили в состав бактерий семейства Enterobacteriaceae (см. табл. 1) [26].
Вместе с тем признак ферментации лактозы показал себя неустойчивым и вариабельным (табл. 2). В качестве примера можно привести микрообъёмную биохимическую идентификацию фекальных энтеробактерий [19] семейства Enterobacteriaceae, которые в большинстве случаев ферментируют лактозу, но так же часто встречаются лактозонегативные штаммы, особенно в фекалиях человека и коммунальных сточных водах, обладающие патогенными и вирулентными свойствами [25]. При этом вне учёта в воде остаются как патогенные бактерии (Salmonella, Shigella), так и условно патогенные бактерии, которые до недавнего времени входили в состав бактерий семейства Enterobacteriaceae (см. табл. 1) [26].
Контроль качества воды на территории России проводили по показателю ОКБ (аббревиатура принята после 2001 г.) в соответствии с МУК 4.2.1018-01 и МУК 1884-04 (Cанитарно-микробиологический и санитарно-паразитологический анализ воды поверхностных водных объектов: Методические указания. М.: Федеральный центр гигиены и эпидемиологии Роспотребнадзора, 2005. 75 с.), в которых заложены такие же методы идентификации, как в европейских странах, для определения показателя «Total coliforms» [27], при определении которых в соответствии с современной таксономией учитывают только лактозопозитивные энтеробактерии фекального происхождения, входящие в семейство Enterobacteriaceae порядка Enterobacteriales: Aeromonas (только лактоза+), Budvicia, Buttiauxella (только лактоза+), Cedecea (только лактоза+), Citrobacter (только лактоза+), Cronobacter, Enterobacillus, Enterobacter (только лактоза+), Escherichia (только лактоза+), Franconibacter, Gibbsiella, Izhakiella, Klebsiella (только лактоза+), Kluyvera, Kosakonia, Leclercia (только лактоза+), Lelliottia, Mangrovibacter, Pluralibacter, Pseudocitrobacter, Raoultella, Rosenbergiella, Shimwellia, Siccibacter, Trabulsiella, Yokenella [17].
75 с.), в которых заложены такие же методы идентификации, как в европейских странах, для определения показателя «Total coliforms» [27], при определении которых в соответствии с современной таксономией учитывают только лактозопозитивные энтеробактерии фекального происхождения, входящие в семейство Enterobacteriaceae порядка Enterobacteriales: Aeromonas (только лактоза+), Budvicia, Buttiauxella (только лактоза+), Cedecea (только лактоза+), Citrobacter (только лактоза+), Cronobacter, Enterobacillus, Enterobacter (только лактоза+), Escherichia (только лактоза+), Franconibacter, Gibbsiella, Izhakiella, Klebsiella (только лактоза+), Kluyvera, Kosakonia, Leclercia (только лактоза+), Lelliottia, Mangrovibacter, Pluralibacter, Pseudocitrobacter, Raoultella, Rosenbergiella, Shimwellia, Siccibacter, Trabulsiella, Yokenella [17].
В соответствии с действующим ГОСТ 18963-73 на территории России качество воды контролировалось ещё и по показателю БГКП (аббревиатура принята с 1973 г. и действует по настоящее время), так же как в Республике Беларусь, при этом фекальное загрязнение определяется с учётом энтеробактерий семейства Enterobacteriaceae порядка Enterobacteriales (см. табл. 1, рисунок), включая как лактозопозитивные, так и лактозонегативные бактерии, так как в соответствии с ГОСТ 18963-73 БГКП определяют в воде как «грамотрицательные, не образующие спор палочки, сбраживающие лактозу с образованием кислоты и газа при температуре 37 ± 0,5 °С в течение 24–48 ч. или сбраживающие глюкозу с образованием кислоты и газа при температуре 37 ± 0,5 °С в течение 24 ч. и не обладающие оксидазной активностью», включая как условно патогенные бактерии: Aeromonas, Biostraticola, Buttiauxella, Cedecea, Citrobacter (Л+Л–), Cronobacter, Enterobacillus, Enterobacter, Escherichia (Л+Л–), Franconibacter, Gibbsiella, Izhakiella, Klebsiella (Л+Л–), Kluyvera, Kosakonia, Leclercia, Lelliottia (Л+Л–), Mangrovibacter, Pluralibacter, Pseudocitrobacter, Raoultella, Rosenbergiella, Shimwellia, Siccibacter, Trabulsiella, Yokenella, так и патогенные и энтеропатогенные бактерии Salmonella (сальмонеллы), Shigella (шигеллы) и E.
и действует по настоящее время), так же как в Республике Беларусь, при этом фекальное загрязнение определяется с учётом энтеробактерий семейства Enterobacteriaceae порядка Enterobacteriales (см. табл. 1, рисунок), включая как лактозопозитивные, так и лактозонегативные бактерии, так как в соответствии с ГОСТ 18963-73 БГКП определяют в воде как «грамотрицательные, не образующие спор палочки, сбраживающие лактозу с образованием кислоты и газа при температуре 37 ± 0,5 °С в течение 24–48 ч. или сбраживающие глюкозу с образованием кислоты и газа при температуре 37 ± 0,5 °С в течение 24 ч. и не обладающие оксидазной активностью», включая как условно патогенные бактерии: Aeromonas, Biostraticola, Buttiauxella, Cedecea, Citrobacter (Л+Л–), Cronobacter, Enterobacillus, Enterobacter, Escherichia (Л+Л–), Franconibacter, Gibbsiella, Izhakiella, Klebsiella (Л+Л–), Kluyvera, Kosakonia, Leclercia, Lelliottia (Л+Л–), Mangrovibacter, Pluralibacter, Pseudocitrobacter, Raoultella, Rosenbergiella, Shimwellia, Siccibacter, Trabulsiella, Yokenella, так и патогенные и энтеропатогенные бактерии Salmonella (сальмонеллы), Shigella (шигеллы) и E. coli O 157:H7, а также бактерии порядка Enterobacterialis, которые до 2001 г. входили в семейство бактерий Enterobacteriaceae: Proteus, Serratia, Morganella, Hafnia, Yersinia [18–20].
coli O 157:H7, а также бактерии порядка Enterobacterialis, которые до 2001 г. входили в семейство бактерий Enterobacteriaceae: Proteus, Serratia, Morganella, Hafnia, Yersinia [18–20].
Колиформные бактерии БГКП, входящие в семейство Enterobacteriaceae, давно используются в качестве индикаторного показателя при оценке качества воды на основании того, что эти бактерии присутствуют в кишечнике теплокровных животных, в почве, воде, на фруктах, овощах, зерне, способны длительно выживать в воде, устойчивы к обеззараживающим агентам, их наличие в воде свидетельствует о недавнем фекальном загрязнении. Входящие в эту подгруппу микроорганизмы весьма разнообразны по особенностям экологической среды, кругу хозяев, а также патогенности для человека, животных, насекомых и растений. Одни виды БГКП могут вызвать желудочно-кишечные заболевания, другие могут служить оппортунистическими инфекциями (бактериемии, менингит, инфекции мочевыводящих путей, дыхательных путей и раневых поверхностей), 50% бактерий семейства Enterobacteriaceae являются возбудителями внутрибольничных инфекций, среди которых в качестве этиологического агента наиболее часто выступают E. coli, Klebsiella, Enterobacter, Salmonella, а также лактозонегативные бактерии, выделенные в настоящее время из семейства Enterobacteriaceae в отдельные роды порядка Enterobacteriales и имеющие большое клиническое значение: Proteus, Serratia, Morganella, Hafnia, Yersinia.
coli, Klebsiella, Enterobacter, Salmonella, а также лактозонегативные бактерии, выделенные в настоящее время из семейства Enterobacteriaceae в отдельные роды порядка Enterobacteriales и имеющие большое клиническое значение: Proteus, Serratia, Morganella, Hafnia, Yersinia.
Все эти грамотрицательные бактерии были объединены в семейство Enterobacteriaceae порядка Enterobacteriales потому, что они обладают объединяющими их признаками – палочки, способны ферментировать (согласно «Краткому определителю Берджи») D-глюкозу [19], являются оксидазоотрицательными, каталазоположительными, индолоотрицательными, грамотрицательными, что свидетельствует о том, что под слоем пептидогликана у них имеется особая структура, которой нет у грамположительных бактерий, – периплазматическое пространство, заполненное гидролитическими ферментами – β-лактамазой, рибонуклеазой-один и фосфатазой. Проведённые в течение 2019 г. исследования в рамках государственного задания ФГБУ «ЦСП» ФМБА России (Peг. № АААА-А18-118020590091-2, тема «Разработка технологий криоконсервации и архивирования биобразцов микроэкологических ресурсов человека» под руководством д.м.н., профессора С.М. Юдина) по анализу 1280 проб фекалий человека показали (см. табл. 2), что наибольшая частота встречаемости выявлена у лактозонегативных бактерий (далее лактоза -): Escherichia coli (из 1158 выделенных из кала штаммов 30% лактоза -), Escherichia coli hem+ (из 155 штаммов – 100% лактоза -), Klebsiella pneumoniae (из 310 штаммов – 45% штаммов лактоза -), Klebsiella variicola (из 40 штаммов –50% штаммов лактоза -), Klebsiella aerogenes (из 11 штаммов – 20% штаммов лактоза -), Salmonella spp. (из 11 штаммов – 100% лактоза -), Hafnia alvei (из 77 штаммов – 100% лактоза -), Citrobacter freundii (из 139 штаммов – 30% лактоза -), Citrobacter braaki (из 76 штаммов – 80% лактоза -), Serratia spp. (из 7 штаммов – 100% лактоза -), Proteus vulgaris (из 35 штаммов – 100% лактоза -), Proteus mirabilis (из 168 штаммов – 100% лактоза -), Morganella morganii (из 65 штаммов – 100% лактоза -), Providencia alcalifaciens (из 15 штаммов – 100% лактоза -), Yersinia intermedia (1 штамм – лактоза -).
№ АААА-А18-118020590091-2, тема «Разработка технологий криоконсервации и архивирования биобразцов микроэкологических ресурсов человека» под руководством д.м.н., профессора С.М. Юдина) по анализу 1280 проб фекалий человека показали (см. табл. 2), что наибольшая частота встречаемости выявлена у лактозонегативных бактерий (далее лактоза -): Escherichia coli (из 1158 выделенных из кала штаммов 30% лактоза -), Escherichia coli hem+ (из 155 штаммов – 100% лактоза -), Klebsiella pneumoniae (из 310 штаммов – 45% штаммов лактоза -), Klebsiella variicola (из 40 штаммов –50% штаммов лактоза -), Klebsiella aerogenes (из 11 штаммов – 20% штаммов лактоза -), Salmonella spp. (из 11 штаммов – 100% лактоза -), Hafnia alvei (из 77 штаммов – 100% лактоза -), Citrobacter freundii (из 139 штаммов – 30% лактоза -), Citrobacter braaki (из 76 штаммов – 80% лактоза -), Serratia spp. (из 7 штаммов – 100% лактоза -), Proteus vulgaris (из 35 штаммов – 100% лактоза -), Proteus mirabilis (из 168 штаммов – 100% лактоза -), Morganella morganii (из 65 штаммов – 100% лактоза -), Providencia alcalifaciens (из 15 штаммов – 100% лактоза -), Yersinia intermedia (1 штамм – лактоза -).
Таким образом, определение качества воды целесообразно проводить по показателю «обобщённые колиформные бактерии», оставив общепринятую аббревиатуру – ОКБ, но методически определять выросшие на чашке грамотрицательных, оксидазоотрицательных колоний, способные ферментировать глюкозу до кислоты и газа и принадлежность к этой группе всех фекальных колиформ, включая патогенные бактерии. Применение данного показателя в практике санитарно-микробиологического контроля даёт возможность своевременно выявить фекальное загрязнение воды, представляющее эпидемическую опасность. Показатель «обобщённые колиформные бактерии» является экономически выгодным в плане финансовой стоимости проведения исследований и более надёжным в предупреждении возникновения инфекций, связанных с водным путём распространения.
Обоснование введения в схему санитарно-микробиологического контроля качества воды показателя
Escherichia сoli
В европейских странах определяют ещё один показатель – фекальные колиформы (Faecal coliforms), к которым относятся E. сoli, являющаяся частным случаем колиформ, чаще всего фекального происхождения, наличие которых в питьевой воде свидетельствует о её недавнем загрязнении фекальными стоками и требует немедленно принятия мер по их устранению. E. coli является также показателем загрязнения воды фекалиями теплокровных животных. В 1885 г. Т. Escherich описал бактерии Bacillus coli, выделенные из фекалий грудных детей, а в 1958 г. в честь него возбудитель был официально назван Escherichia coli [28, 29]. Определяются эти микроорганизмы так же, как и остальные колиформы, способные производить бета-глюкуронидазу (хотя около 10% Escherichia coli из окружающей среды не имеют такой способности) [27]. Оценка микробиологического качества воды, основанная на детекции индикаторных микроорганизмов фекального загрязнения, где индикатором является E. coli или их термотолерантные колиформы, уверенно свидетельствует о недавнем фекальном загрязнении. При этом считается, что E. coli являются индикатором свежего фекального загрязнения воды, а общие колиформы – индикатором герметичности и чистоты водоразводящей системы.
сoli, являющаяся частным случаем колиформ, чаще всего фекального происхождения, наличие которых в питьевой воде свидетельствует о её недавнем загрязнении фекальными стоками и требует немедленно принятия мер по их устранению. E. coli является также показателем загрязнения воды фекалиями теплокровных животных. В 1885 г. Т. Escherich описал бактерии Bacillus coli, выделенные из фекалий грудных детей, а в 1958 г. в честь него возбудитель был официально назван Escherichia coli [28, 29]. Определяются эти микроорганизмы так же, как и остальные колиформы, способные производить бета-глюкуронидазу (хотя около 10% Escherichia coli из окружающей среды не имеют такой способности) [27]. Оценка микробиологического качества воды, основанная на детекции индикаторных микроорганизмов фекального загрязнения, где индикатором является E. coli или их термотолерантные колиформы, уверенно свидетельствует о недавнем фекальном загрязнении. При этом считается, что E. coli являются индикатором свежего фекального загрязнения воды, а общие колиформы – индикатором герметичности и чистоты водоразводящей системы.
E. coli – факультативный анаэроб, колонизирующий желудочно-кишечный тракт младенца в течение 40 ч после рождения, и пока эти бактерии не приобретают генетически обусловленные свойства, кодирующие факторы их вирулентности, они являются доброкачественными комменсалами [28, 29]. E. coli обеспечивают наилучшие признаки определения свежего фекального загрязнения в питьевой воде, что не могут обеспечить термотолерантные колиформные бактерии, поскольку кишечные палочки способны расти как при 37 °С, так и при 44 °С (что не является их основным признаком) и превалируют в фекалиях человека и животных по сравнению с другими представителями термотолерантных колиформ, а также они способны образовывать в водопроводной системе биоплёнки [30]. Для идентификации E. coli доступны быстрые, чувствительные, простые и специфические методы. При анализе проб питьевой воды, не соответствующих требованиям по термотолерантным колиформным бактериям, в 95% и более проб обнаруживали E. coli, то есть показатель E. coli более надёжно определял поступление свежего фекального загрязнения воды и обеспечивал оперативность в принятии мер по устранению неблагоприятной ситуации.
coli, то есть показатель E. coli более надёжно определял поступление свежего фекального загрязнения воды и обеспечивал оперативность в принятии мер по устранению неблагоприятной ситуации.
В ходе всемирного исследования выделено более 1000 штаммов кишечных палочек из различных типов воды, 61% из которых имели фекальное происхождение [31]. Некоторые страны тестируют общее количество кишечных палочек для того, чтобы отслеживать изменения качества воды, при этом повышение уровня содержания кишечной палочки может указывать на неисправность или нарушение режима работы технологической системы очистки воды, на попадание сточных вод в распределительную систему. Отсутствие кишечных палочек в воде является показателем эпидемической безопасности системы водоподготовки, эффективности процессов очистки воды [31].
В России одним из показателей фекального загрязнения являются термотолерантные колиформные бактерии (ТКБ), входящие в число общих колиформных бактерий, из которых 95% термотолерантных колиформ приходится на Escherichia coli, а остальные относят к родам Klebsiella, Enterobacter и Citrobacter [32]. Термотолерантные бактерии обладают всеми признаками колиформных бактерий, основным из которых является дифференциальный признак (в соответствии с МУК 4.2.1018-01) – «ферментация лактозы до кислоты, альдегида и газа при температуре 44 ± 0,5 °С в течение 24 ч». Однако признак термотолерантности подвержен значительному влиянию факторов окружающей среды, в том числе климатических, поэтому нестабильность в процессе выполнения анализа может быть не связана с патогенными свойствами этих бактерий [31–35], что является неприемлемым для индикаторного микроорганизма. Часто ТКБ обнаруживали в окружающей среде, где не было фекального загрязнения [31, 35, 36]. ТКБ также не обладают основными признаками, по которым эта группа могла бы быть отнесена к значимым индикаторам в отношении патогенных бактерий. Как в экспериментальных, так и в натурных исследованиях получены данные о том, что ТКБ в ряде случаев менее устойчивы к факторам окружающей среды, чем сальмонеллы. Выявлена меньшая устойчивость ТКБ к физическим и биологическим факторам окружающей среды, в том числе к средствам обеззараживания [34, 35].
Термотолерантные бактерии обладают всеми признаками колиформных бактерий, основным из которых является дифференциальный признак (в соответствии с МУК 4.2.1018-01) – «ферментация лактозы до кислоты, альдегида и газа при температуре 44 ± 0,5 °С в течение 24 ч». Однако признак термотолерантности подвержен значительному влиянию факторов окружающей среды, в том числе климатических, поэтому нестабильность в процессе выполнения анализа может быть не связана с патогенными свойствами этих бактерий [31–35], что является неприемлемым для индикаторного микроорганизма. Часто ТКБ обнаруживали в окружающей среде, где не было фекального загрязнения [31, 35, 36]. ТКБ также не обладают основными признаками, по которым эта группа могла бы быть отнесена к значимым индикаторам в отношении патогенных бактерий. Как в экспериментальных, так и в натурных исследованиях получены данные о том, что ТКБ в ряде случаев менее устойчивы к факторам окружающей среды, чем сальмонеллы. Выявлена меньшая устойчивость ТКБ к физическим и биологическим факторам окружающей среды, в том числе к средствам обеззараживания [34, 35]. При их учёте в практике контроля качества питьевой воды они создают определённую проблему, поскольку показатель основан на виртуальном признаке термотолерантности, который не используется ни в одной международной классификации энтеробактерий. Точность и воспроизводимость метода снижаются из-за субъективной выборочной проверки колоний, а также из-за восстановления признака термотолерантности бактериями на первом этапе проведения исследований. В настоящее время показатель ТКБ исключён из международных документов ЕС и стандартов ИСО [35, 36]. Представляется целесообразным исключение «термотелерантных колиформных бактерий» из индикаторных показателей санитарно-микробиологического контроля качества воды.
При их учёте в практике контроля качества питьевой воды они создают определённую проблему, поскольку показатель основан на виртуальном признаке термотолерантности, который не используется ни в одной международной классификации энтеробактерий. Точность и воспроизводимость метода снижаются из-за субъективной выборочной проверки колоний, а также из-за восстановления признака термотолерантности бактериями на первом этапе проведения исследований. В настоящее время показатель ТКБ исключён из международных документов ЕС и стандартов ИСО [35, 36]. Представляется целесообразным исключение «термотелерантных колиформных бактерий» из индикаторных показателей санитарно-микробиологического контроля качества воды.
Заключение
Вышеизложенное является обоснованием для введения более надёжного санитарно-микробиологического показателя качества питьевой воды, которым, на наш взгляд, является индикаторный показатель фекального загрязнения «Обобщённые колиформные бактерии» (с сохранением аббревиатуры ОКБ), объединяющий широкий спектр микроорганизмов, включая бактерии порядка Enterobacteriales, как лактозоположительных, так и лактозоотрицательных. Индикаторный бактериальный показатель ОКБ является надёжным показателем фекального загрязнения воды, так как включает в себя грамотрицательные, оксидазоотрицательные, не образующие спор палочки, способные расти на дифференциальных средах и ферментировать глюкозу до кислоты и газа при температуре 36 ± 1 °С в течение 24 ч, что надёжно гарантирует отсутствие в исследуемом объёме воды патогенных (Salmonella, Shigella) и условно патогенных бактерий (Proteus, Serratia, Morganella, Hafnia, Yersinia и др.). Одновременное наличие E. coli в воде свидетельствует о её потенциальной эпидемической опасности, является достоверным доказательством недавнего поступления фекального загрязнения и определяет необходимость срочного принятия противоэпидемических мер. Показатель содержания термотолерантных колиформных бактерий, основанный на виртуальном признаке термотолерантности, то есть способности расти при повышенных температурах, не связанных с патогенными свойствами этих бактерий, и не входящий в настоящее время в международную классификацию энтеробактерий, должен быть исключён из системы санитарно-бактериологического контроля качества воды как эпидемиологически и экономически нецелесообразный.
Индикаторный бактериальный показатель ОКБ является надёжным показателем фекального загрязнения воды, так как включает в себя грамотрицательные, оксидазоотрицательные, не образующие спор палочки, способные расти на дифференциальных средах и ферментировать глюкозу до кислоты и газа при температуре 36 ± 1 °С в течение 24 ч, что надёжно гарантирует отсутствие в исследуемом объёме воды патогенных (Salmonella, Shigella) и условно патогенных бактерий (Proteus, Serratia, Morganella, Hafnia, Yersinia и др.). Одновременное наличие E. coli в воде свидетельствует о её потенциальной эпидемической опасности, является достоверным доказательством недавнего поступления фекального загрязнения и определяет необходимость срочного принятия противоэпидемических мер. Показатель содержания термотолерантных колиформных бактерий, основанный на виртуальном признаке термотолерантности, то есть способности расти при повышенных температурах, не связанных с патогенными свойствами этих бактерий, и не входящий в настоящее время в международную классификацию энтеробактерий, должен быть исключён из системы санитарно-бактериологического контроля качества воды как эпидемиологически и экономически нецелесообразный.
Расшифровка анализа кала на дисбактериоз
Таблица 1. Качественный и количественный состав основной микрофлоры толстого кишечника у здоровых людей (Кое/г Фекалий)
(Отраслевой стандарт 91500.11.0004-2003 «Протокол ведения больных. Дисбактериоз кишечника» — УТВЕРЖДЕНО приказом Минздрава России от 09.06.2003 г. N 231)
| Виды микроорганизмов | Возраст, годы | ||
| < 1 | 1-60 | > 60 | |
| Бифидобактерии | 1010 — 1011 | 109 — 1010 | 108 – 109 |
| Лактобактерии | 106 — 107 | 107 – 108 | 106 — 107 |
| Бактероиды | 107 – 108 | 109 — 1010 | 1010 — 1011 |
| Энтерококки | 105 — 107 | 105 – 108 | 106 – 107 |
| Фузобактерии | < 106 | 108 – 109 | 108 – 109 |
| Эубактерии | 106 — 107 | 109 — 1010 | 109 — 1010 |
| Пептострептококки | < 105 | 109 — 1010 | 1010 |
| Клостридии | <= 103 | <= 105 | <= 106 |
Эшерихии (E. coli): coli): | |||
| E.coli типичные | 107 – 108 | 107 – 108 | 107 – 108 |
| E.coli лактозонегативные | < 105 | < 105 | < 105 |
| E.coli гемолитические | 0 | 0 | 0 |
| Другие условнопатогенные энтеробактерии <*> | < 104 | < 104 | < 104 |
| Стафилококк золотистый | 0 | 0 | 0 |
| Стафилококки (сапрофитный, эпидермальный) | <= 104 | <= 104 | <= 104 |
| Дрожжеподобные грибы рода Candida | <= 103 | <= 104 | <= 104 |
| Неферментирующие бактерии <**> | <= 103 | <= 104 | <= 104 |
<*> — представителиродов Klebsiella, Enterobacter, Hafnia, Serratia, Proteus, Morganella, Providecia,
Citrobacter идр.
<**> — Pseudomonas, Acinetobacter идр.
Микроорганизмы, перечисленные в бланке анализа на дисбактериоз, можно разделить на три группы:
- молочнокислые бактерии нормальной микрофлоры — преимущественно бифидобактерии и лактобактерии,
- патогенные энтеробактерии,
- условно-патогенная флора (УПФ).
Молочнокислые бактерии
Основу нормальной микрофлоры кишечника составляют молочнокислые бактерии — бифидобактерии, лактобактерии и пропионовокислые бактерии с преобладанием бифидобактерий, которые выполняют ключевую роль в поддержании оптимального состава биоценоза и его функций. Падение количества бифидобактерий и лактобактерий ниже нормы говорит о наличии проблем в организме. Как минимум, это воспаление на слизистых оболочках и снижение иммунной защиты.
Патогенные энтеробактерии
Патогенные энтеробактерии — это бактерии, способные вызывать острые кишечные инфекции (возбудители брюшного тифа — сальмонеллы, возбудители дизентерии — шигеллы, возбудители йерсиниоза — йерсинии и др. ) Их присутствие в кале — это уже не просто дисбактериоз, а показатель опасного инфекционного заболевания кишечника.
) Их присутствие в кале — это уже не просто дисбактериоз, а показатель опасного инфекционного заболевания кишечника.
Условно-патогенная флора (УПФ)
К условно-патогенной флоре относятся лактозонегативные энтеробактерии, клостридии, различные кокки и др. Суть этих микробов отражена в названии группы: «условно-патогенные». В норме они не вызывают нарушений. Многие из них даже могут быть в определенной степени полезны организму. Но при превышении нормы и/или неэффективности иммунной защиты они могут стать причиной серьезных заболеваний. Конкурируя с полезными бактериями, условно-патогенная флора может войти в состав микробной пленки кишечника и стать причиной функциональных нарушений, воспалительных и аллергических заболеваний.
Возможно попадание условно-патогенной флоры через кишечную стенку в кровь и распространение ее по организму (транслокация), что особенно опасно для детей раннего возраста и лиц с выраженными иммунодефицитами, у которых эти микроорганизмы могут вызвать различные заболевания, в том числе, опасные для жизни.
Пояснения к таблице
Обычно количество обнаруженных бактерий в бланке анализа обозначается числом 10 в какой-либо степени: 103, 105, 106 и т. д. и аббревиатурой КОЕ/г, что означает количество живых, способных к росту бактерий в 1 г фекалий.
Аббревиатура «abs» напротив названия бактерии означает, что данный микроорганизм не был обнаружен в пределах нормы и выше ее, а значения ниже нормы (субнормальные), как несущественные, не смотрели.
Бифидобактерии
Бифидобактерии – это основа нормальной микрофлоры толстого кишечника. В норме их содержание в кишечнике должно быть у детей до года — 1010 — 1011, у взрослых — 109-1010 КОЕ/г. Заметное снижение количества бифидобактерий — главный признак наличия дисбактериоза и иммунных нарушений.
Дефицит бифидобактерий приводит к росту интоксикации, нарушению процессов углеводного обмена, всасывания и усвоения в кишечнике витаминов, кальция, железа и других микро- и макроэлементов. Без биопленки из бифидобактерий меняется структура и нарушаются функции слизистой оболочки кишечника, уменьшается количество иммунных клеток и их активность, повышается проницаемость кишечника для чужеродных агентов (токсинов, вредоносных микробов и др.). В результате значительно увеличивается токсическая нагрузка на печень и почки, повышается риск развития инфекций и воспалений, авитаминозов и различных микроэлементозов.
Без биопленки из бифидобактерий меняется структура и нарушаются функции слизистой оболочки кишечника, уменьшается количество иммунных клеток и их активность, повышается проницаемость кишечника для чужеродных агентов (токсинов, вредоносных микробов и др.). В результате значительно увеличивается токсическая нагрузка на печень и почки, повышается риск развития инфекций и воспалений, авитаминозов и различных микроэлементозов.
Лактобактерии
Лактобактерии, так же как и бифидобактерии, являются одной из главных составляющих нормальной микрофлоры человека. Норма содержания в кишечнике у детей до года — 106 — 107, у взрослых — 107-108 КОЕ/г. Значительное снижение количества лактобактерий говорит не только о дисбиотических нарушениях, но и о том, что организм находится в состоянии хронического стресса, а также о снижении противовирусной и противоаллергической защиты, нарушениях липидного обмена, обмена гистамина и т. д. Дефицит лактобактерий сильно повышает риск развития аллергических реакций, заболевания атеросклерозом, неврологических нарушений, сердечно-сосудистых заболеваний, может также стать причиной запоров, развития лактазной недостаточности.
Бактероиды
Бактероиды — условно-патогенные бактерии. Вторая по численности (после бифидобактерий) группа кишечных микроорганизмов, особенно у взрослых (норма — до 1010 КОЕ/г), у детей до года — 107-108. При содержании в пределах нормы они выполняют много полезных для организма функций. Но при нарушении баланса в кишечном микроценозе или при превышении нормы бактероиды могут приводить к многообразным инфекционно-септическим осложнениям. При избыточном росте бактероиды могут подавлять рост кишечной палочки, конкурируя с ней за кислород. Бесконтрольный рост бактероидов и проявление ими агрессивных свойств ограничивают основные компоненты защитной флоры — бифидобактерии, лактобациллы и пропионовокислые бактерии.
Энтерококки
Энтерококки — наиболее часто встречающиеся в кишечнике здоровых людей условно-патогенные микроорганизмы. Норма содержания для детей до года — 105-107, для взрослых – 105-108 (до 25% от общего количества кокковых форм). Некоторые специалисты считают их безобидными. На деле же многие энтерококки способны вызывать воспалительные заболевания кишечника, почек, мочевого пузыря, репродуктивных органов не только при превышении ими допустимого количества (при содержании более 107), но и в количестве, соответствующем верхней границе нормы (106-107), особенно у людей со сниженным иммунитетом.
Некоторые специалисты считают их безобидными. На деле же многие энтерококки способны вызывать воспалительные заболевания кишечника, почек, мочевого пузыря, репродуктивных органов не только при превышении ими допустимого количества (при содержании более 107), но и в количестве, соответствующем верхней границе нормы (106-107), особенно у людей со сниженным иммунитетом.
Фузобактерии
Фузобактерии — условно-патогенные бактерии, основные места обитания которых в человеческом организме — толстая кишка и респираторный тракт. В полости рта у взрослого человека содержится 102-104 КОЕ/г фузобактерий. Допустимое количество в кишечнике у детей до года < 106, у взрослых — 108 – 109.
Некоторые виды фузобактерий при иммунодефицитах могут вызывать вторичные гангренозные и гнойно-гангренозные процессы. При ангине, герпетическом стоматите, гипотрофии у детей, при иммунодефицитных состояниях возможно развитие фузоспирохетоза — некротического воспалительного процесса на миндалинах, слизистой оболочки полости рта.
Эубактерии (лат. Eubacterium)
Относятся к основной резидентной микрофлоре как тонкой, так и толстой кишки человека и составляют значительную часть от всех населяющих желудочно-кишечный тракт микроорганизмов. Допустимое количество эубактерий в кале здоровых людей: у детей первого года — 106-107 КОЕ/г; у детей старше года и взрослых, включая пожилых — 109-1010 КОЕ/г.
Примерно половина видов эубактерий, обитающих в организме человека, могут участвовать в развитии воспаления ротовой полости, формировании гнойных процессов в плевре и легких, инфекционного эндокардита, артрита, инфекций мочеполовой системы, бактериального вагиноза, сепсиса, абсцессов мозга и прямой кишки, послеоперационных осложнений.
Повышенное содержание эубактерий обнаруживается в фекалиях больных полипозом толстой кишки. Эубактерии редко встречаются у детей, находящихся на грудном вскармливании, но у детей, находящихся на искусственном вскармливании могут выявляться в количестве, соответствующем норме взрослого человека.
Пептострептококки
Пептострептококкиотносятся к нормальной микрофлоре человека. Норма содержания в кале у детей до года < 105, у детей старше года и взрослых — 109 – 1010. В организме здорового человека пептострептококки обитают в кишечнике (в основном, в толстой кишке), ротовой полости, влагалище, дыхательных путях. Обычно пептострептококки являются возбудителями смешанных инфекций, проявляясь в ассоциациях с другими микроорганизмами.
Клостридии
Условно-патогенные бактерии, представители гнилостной и газообразующей флоры, количество которых зависит от состояния местного иммунитета кишечника. Основное место обитания в человеческом организме — толстая кишка. Допустимое количество клостридий у детей до года не более 103, а у взрослых — до 105 КОЕ/мг.
В комплексе с другой условно-патогенной флорой клостридии могут вызывать разжижение стула, понос, повышенное газообразование, которое наряду с тухлым запахом кала (симптомы гнилостной диспепсии) является косвенным признаком повышенной численности и активности этих бактерий. В определенных условиях они могут быть причиной некротического энтерита, вызывать пищевую токсикоинфекцию, сопровождающуюся водянистой диареей, тошнотой, коликами в животе, иногда лихорадкой.
В определенных условиях они могут быть причиной некротического энтерита, вызывать пищевую токсикоинфекцию, сопровождающуюся водянистой диареей, тошнотой, коликами в животе, иногда лихорадкой.
При приеме некоторых антибиотиков клостридии могут вызывать антибиотикоассоциированную диарею или псевдомембранозный колит. Кроме проблем с кишечником, клостридии могут вызывать заболевания мочеполовых органов человека, в частности, острый простатит. Симптомы воспаления, спровоцированного клостридиями во влагалище, имеют сходство с симптомами кандидозного вагинита («молочницы»).
E.coli типичные (эшехирии, кишечная палочка типичные), т. е. с нормальной ферментативной активностью
Условно-патогенные микроорганизмы, которые вместе с бифидо- и лактобактериями относятся к группе защитной микрофлоры кишечника. Эта палочка препятствует заселению кишечной стенки чужеродными микроорганизмами, создает комфортные условия для других важных бактерий кишечника, например, поглощает кислород, являющийся ядом для бифидобактерий. Это главная «фабрика витаминов» в организме.
Это главная «фабрика витаминов» в организме.
В норме общее содержание кишечной палочки — 107-108 КОЕ/ мг (что соответствует 300-400 млн/г). Повышенный уровень E. coli в кишечнике может стать причиной воспаления, сопровождающегося нарушениями стула и болями в животе. А ее проникновение из кишечника в другие экониши организма (мочевыводящие пути, носоглотку и т. д.) – причиной цистита, заболеваний почек и др.
Снижение этого показателя является сигналом о высоком уровне интоксикации в организме. Сильное снижение количества кишечной палочки типичной (до 105 КОЕ/ мг и ниже) – косвенный признак присутствия паразитов (например, глистов или паразитических простейших — лямблий, бластоцист, амеб и др.). Кроме паразитов, среди самых вероятных причин снижения уровня кишечной палочки существование в организме очагов хронической инфекции, повышенная аллергизация, дисфункции или заболевания различных органов, в первую очередь печени, почек, поджелудочной и щитовидной желез. Чтобы избежать ошибочного диагноза и, соответственно, неправильного лечения, рекомендуется сначала исключить паразитарное заражение.
Чтобы избежать ошибочного диагноза и, соответственно, неправильного лечения, рекомендуется сначала исключить паразитарное заражение.
Кишечная палочка со сниженной ферментативной активностью (E.coli лактозонегативные).
Норма содержания – не более 105 КОЕ/г. Это неполноценная разновидность кишечной палочки, которая прямой опасности обычно не представляет. Но эта палочка — «тунеядец». Она занимает место полноценной E.coli, не выполняя при этом присущих полноценной E.coli полезных функций. В результате организм недополучает необходимые ему витамины, ферменты и другие полезные вещества, синтезируемые полноценными эшерихиями, что в итоге может привести к серьезным обменным нарушениям и даже воспалительным заболеваниям. Присутствие этой палочки в количестве выше допустимой нормы — всегда признак начинающегося дисбактериоза и, наряду со снижением общего количества кишечной палочки, может быть косвенным показателем присутствия в кишечнике паразитических простейших или глистов.
E.coli гемолитическая (гемолитическая кишечная палочка)
Патогенный вариант кишечной палочки. В норме должна отсутствовать. Ее присутствие требует иммунокоррекции. Может вызывать аллергические реакции и различные кишечные проблемы, особенно у маленьких детей и лиц с ослабленным иммунитетом. Часто образует патогенные ассоциации с золотистым стафилококком, но в отличие от него практически не встречается в составе грудного молока.
Другие условно-патогенные энтеробактерии
(протеи, серрации, энеробактеры, клебсиеллы, хафнии, цитробактеры, морганеллы и др.) Большая группа лактозонегативных энтеробактерий большей или меньшей степени патогенности. Допустимое количество этих микроорганизмов менее 104 КОЕ/г. Большее количество этих бактерий является признаком дисбактериоза. Значительное превышение нормы (более 106) может приводить к воспалительным заболеваниям кишечника (проявляются нарушениями стула, болями), урогенитальной сферы и даже ЛОР-органов, особенно у детей раннего возраста и лиц с пониженным иммунитетом.
Наиболее неприятные бактерии данной группы:
- Протеи — чаще всего с ними связаны запоры, но они также могут вызывать острые кишечные инфекции, заболевания мочевыводящих путей и почек человека, в частности, острый и хронический простатит, цистит, пиелонефрит.
- Клебсиеллы — прямые антагонисты (конкуренты) лактобактерий, приводят к развитию аллергий, запоров, проявлениям лактазной недостаточности. Косвенный признак избыточного присутствия клебсиеллы — зеленый стул со слизью, кислый запах кала (симптомы бродильной диспепсии).
Стафилококк золотистый (S. aureus)
Один из наиболее неприятных представителей условно-патогенной флоры. В норме должен отсутствовать, особенно у детей. Для взрослых допустимо содержание 103 КОЕ/г.
Даже небольшие количества золотистого стафилококка могут вызвать выраженные клинические проявления (аллергические реакции, гнойничковые кожные высыпания, дисфункции кишечника), особенно у детей первых месяцев жизни. Кроме кишечника и кожных покровов, стафилококки в немалых количествах живут на слизистых оболочках носа и могут вызывать воспалительные заболевания носоглотки, отиты.
Кроме кишечника и кожных покровов, стафилококки в немалых количествах живут на слизистых оболочках носа и могут вызывать воспалительные заболевания носоглотки, отиты.
Главные условия, от которых зависит степень патогенности стафилококков и восприимчивость к ним организма, — это активность иммунной защиты организма, а также количество и активность конкурирующих со стафилококком бифидо- и лактобактерий, которые способны нейтрализовать его вредоносность. Чем больше в организме сильных, активных бифидобактерий и лактобактерий, тем меньше вреда от стафилококка (клинических проявлений может не быть, даже если его количество достигло 105 КОЕ/г). Чем больше дефицит бифидо- и лактобактерий и чем слабее иммунная защита организма, тем активнее стафилококк.
В группе риска сладкоежки и люди, имеющие слабый иммунитет. В первую очередь это дети — недоношенные, рожденные в результате проблемной беременности, кесарева сечения, лишенные естественного грудного скармливания, перенесшие антибиотическую терапию. В организм ребенка стафилококки могут попасть через материнское молоко, со слизистых и кожи мамы (тесный контакт).
В организм ребенка стафилококки могут попасть через материнское молоко, со слизистых и кожи мамы (тесный контакт).
Стафилококки сапрофитный, эпидермальный (S. epidermidis, S. saprophyticus)
Относится к условно-патогенной микрофлоре. При превышении нормальных значений (104 КОЕ/г или 25% от общего количества кокков) эти стафилококки способны вызывать определенные нарушения. Как правило, они выступают в роли вторичной инфекции. Кроме кишечника живут в верхних слоях кожи, на слизистых оболочках рта, носа и наружного уха. Патогенность микроорганизма усиливается при значительном снижении защитных сил организма, при длительных хронических заболеваниях, стрессах, переохлаждении, иммунодефицитных состояниях.
Дрожжеподобные грибы рода Candida
Максимально допустимое количество — до 104. Превышение этого уровня говорит о снижении иммунной защиты организма и очень низком рН в зоне обитания кандиды, а также может быть следствием применения антибиотиков и большого количества углеводов в рационе. При повышенном количестве этих грибов на фоне снижения количества нормальной флоры на слизистых оболочках ротовой полости и половых органов могут появится симптомы кандидоза, чаще называемого молочницей. Инфицирование грибами кишечника на фоне дефицита основных групп кишечных бактерий говорит о системном кандидозе, неработающем иммунитете и повышении риска развития диабета.
При повышенном количестве этих грибов на фоне снижения количества нормальной флоры на слизистых оболочках ротовой полости и половых органов могут появится симптомы кандидоза, чаще называемого молочницей. Инфицирование грибами кишечника на фоне дефицита основных групп кишечных бактерий говорит о системном кандидозе, неработающем иммунитете и повышении риска развития диабета.
Неферментирующие бактерии (в некоторых бланках обозначены как «Прочие микроорганизмы»)
Pseudomonas, Acinetobacter и др. редко встречающиеся в кишечнике человека виды бактерий, самым опасным из которых является синегнойная палочка (Pseudomonas aerugenosa). Максимально допустимое количество у взрослых — не более 104. Как правило, их обнаружение в количестве выше нормы требует антибактериальной терапии и иммуннокоррекции.
Наши пробиотики:
Бифидум Баг | Трилакт | Экофлор |
Посмотреть все
Фекальная колонизация кишечной палочкой с множественной лекарственной устойчивостью среди здоровых младенцев в сельской местности Бангладеш
Введение
Быстрый рост бактериальных инфекций с множественной лекарственной устойчивостью (МЛУ) представляет собой серьезную проблему общественного здравоохранения и растущую угрозу глобальной безопасности здравоохранения. Нерегулируемое использование антибиотиков широкого спектра действия и обширные резервуары этих патогенов являются основными причинами этой проблемы (Hilty et al., 2012). Антибиотики широкого спектра действия, в частности цефалоспорины третьего поколения (3GC), относятся к числу наиболее часто назначаемых препаратов для лечения инфекций, вызванных Enterobacteriaceae (Pereira et al., 2004; Всемирная организация здравоохранения [ВОЗ], 2017). Все чаще сообщалось о неэффективности лечения этими антибиотиками из-за появления в течение последних двух десятилетий бета-лактамаз расширенного спектра действия (БЛРС) (Pitout and Laupland, 2008). Несколько исследований показали, что дети с большей вероятностью подвергаются воздействию антибиотиков как напрямую (Alexander et al., 2011; Saari et al., 2015), так и косвенно, через воздействие антибиотиков, принимаемых их матерями (Verani et al., 2010; Macones et al., 2012; Ledger and Blaser, 2013; de Tejada, 2014). Таким образом, такое прямое и/или косвенное потребление антибиотиков может повлиять на кишечную микрофлору младенцев, включая Escherichia coli , которая является одним из первых видов бактерий, колонизирующих кишечник младенцев (Hewitt and Rigby, 1976).
Нерегулируемое использование антибиотиков широкого спектра действия и обширные резервуары этих патогенов являются основными причинами этой проблемы (Hilty et al., 2012). Антибиотики широкого спектра действия, в частности цефалоспорины третьего поколения (3GC), относятся к числу наиболее часто назначаемых препаратов для лечения инфекций, вызванных Enterobacteriaceae (Pereira et al., 2004; Всемирная организация здравоохранения [ВОЗ], 2017). Все чаще сообщалось о неэффективности лечения этими антибиотиками из-за появления в течение последних двух десятилетий бета-лактамаз расширенного спектра действия (БЛРС) (Pitout and Laupland, 2008). Несколько исследований показали, что дети с большей вероятностью подвергаются воздействию антибиотиков как напрямую (Alexander et al., 2011; Saari et al., 2015), так и косвенно, через воздействие антибиотиков, принимаемых их матерями (Verani et al., 2010; Macones et al., 2012; Ledger and Blaser, 2013; de Tejada, 2014). Таким образом, такое прямое и/или косвенное потребление антибиотиков может повлиять на кишечную микрофлору младенцев, включая Escherichia coli , которая является одним из первых видов бактерий, колонизирующих кишечник младенцев (Hewitt and Rigby, 1976).
Устойчивость комменсальных бактерий к противомикробным препаратам вызывает беспокойство из-за их способности распространяться на патогены (Munk et al., 2018). Недавние исследования показали, что дети школьного возраста и дети до 2 лет были колонизированы E. coli , устойчивыми к антибиотикам широкого спектра действия и ципрофлоксацину соответственно (Gurnee et al., 2015; Ferjani et al., 2017). Однако информация о частоте носительства и распространенности этого антибиотикорезистентного 9 отсутствует.0005 E. coli по отношению к общему количеству E. coli , присутствующих в кишечнике. Кроме того, отсутствуют данные о частоте носительства MDR E. coli , в том числе ESBL-продуцирующей E. coli , среди детей в возрасте до 1 года. Поэтому в этом исследовании оценивалась распространенность и скорость колонизации этого организма в раннем возрасте младенцев. Мы определили распространенность, обилие и уровень носительства 3GC-резистентных (3GCr) E. coli , включая патогенные E. coli путем анализа культивируемых штаммов E. coli в образцах стула младенцев.
coli путем анализа культивируемых штаммов E. coli в образцах стула младенцев.
Материалы и методы
Заявление об этике
Исследовательский комитет и комитет по этике icddr,b одобрили и отслеживали ход исследования. Информированное письменное согласие было получено от матерей всех младенцев либо под роспись, либо, для неграмотных, отпечатком большого пальца после устного общения. Образцы были идентифицированы кодами для сохранения анонимности. Свидетель также подписал каждую форму информированного согласия. Все авторы ручаются за полноту и точность представленных данных и анализов.
План исследования, место проведения и набор участников
Мы провели перекрестное исследование детей в возрасте до 1 года, проживающих в пяти сельских деревнях Матлаб и Хаджигандж, подокруга округа Чандпур в Бангладеш, в период с марта по октябрь. 2017. Хаджигондж имеет общую площадь 189 км 2 с 327 367 людьми, проживающими в 64 257 домохозяйствах в 11 союзах, тогда как Матлаб Уттар имеет общую площадь 279 км 2 с 382 195 людьми в 62 418 домохозяйствах в 15 союзах (DGHS Health Bulletin). , 2014). По данным Всемирного банка (2016 г.), общий коэффициент рождаемости в Бангладеш составляет 18,9.5 на 1000 человек по состоянию на 2016 год, поэтому приблизительное количество младенцев в Хаджигондже и Матлаб-Уттаре составляет 6200 и 7250 соответственно, или менее 13 500 младенцев (2016). Для исследовательских участков мы включили по одному профсоюзу из каждого подрайона. Всего в исследование было включено 100 домохозяйств (по 50 от каждого союза), содержащих одного младенца (возраст ≤1 года) в каждом домохозяйстве после получения письменного информированного согласия от матерей включенных младенцев. Для сбора информации о возрасте, поле, способе родоразрешения, потреблении антибиотиков матерью и ребенком, заболеваемости и методах кормления использовалась предварительно протестированная анкета.
, 2014). По данным Всемирного банка (2016 г.), общий коэффициент рождаемости в Бангладеш составляет 18,9.5 на 1000 человек по состоянию на 2016 год, поэтому приблизительное количество младенцев в Хаджигондже и Матлаб-Уттаре составляет 6200 и 7250 соответственно, или менее 13 500 младенцев (2016). Для исследовательских участков мы включили по одному профсоюзу из каждого подрайона. Всего в исследование было включено 100 домохозяйств (по 50 от каждого союза), содержащих одного младенца (возраст ≤1 года) в каждом домохозяйстве после получения письменного информированного согласия от матерей включенных младенцев. Для сбора информации о возрасте, поле, способе родоразрешения, потреблении антибиотиков матерью и ребенком, заболеваемости и методах кормления использовалась предварительно протестированная анкета.
Сбор образцов
Всего было взято 100 образцов стула у 100 младенцев, проживающих в выбранных домохозяйствах, с использованием стерильных контейнеров для стула, ранее предоставленных всем матерям в день проведения опроса. Предполагая, что младенческое население в Хаджигонге и Матлаб Уттар составляет 13 500 человек, размер выборки из 100 образцов стула будет означать погрешность примерно 10% с 95% доверительным интервалом для показателей распространенности 3GCr E. coli (Dhand and Khatkar, 2014). ). На следующий день полевые сотрудники собрали образцы и доставили их в лабораторию icddr,b (Дакка, Бангладеш) на льду для микробиологического анализа в течение 4 часов.
Предполагая, что младенческое население в Хаджигонге и Матлаб Уттар составляет 13 500 человек, размер выборки из 100 образцов стула будет означать погрешность примерно 10% с 95% доверительным интервалом для показателей распространенности 3GCr E. coli (Dhand and Khatkar, 2014). ). На следующий день полевые сотрудники собрали образцы и доставили их в лабораторию icddr,b (Дакка, Бангладеш) на льду для микробиологического анализа в течение 4 часов.
Подсчет и выделение
E. coli
Как общее количество, так и 3GCr E. coli подсчитывали с использованием метода капельных чашек, как описано ранее (Herigstad et al., 2001). Вкратце, для подсчета 3GCr E. coli и общего количества E. coli использовали чашки с агаром MacConkey (Becton Dickson, MD) с фиксированными концентрациями цефотаксима и без них (1,0 мкг/мл). Всего четыре 10-кратных серийных разведения (от 10 -1 до 10 -4 ) каждого образца стула, и 50 мкл из каждого разведения инокулировали на чашки с агаром MacConkey с добавлением и без добавления антибиотика в культуральную среду. Все планшеты инкубировали при 37°C в течение 18 часов, и количество колониеобразующих единиц (КОЕ) на грамм сырой массы образца стула подсчитывали из диапазона разведения. Долю чувствительных к 3GC (3GC) E. coli КОЕ на грамм фекалий (КОЕ/г) рассчитывали путем вычитания количества 3GCr КОЕ/г из соответствующего общего количества E. coli КОЕ/г. Кроме того, измеряли долю количества 3GCr E. coli по отношению к общему количеству E. coli , полученному на чашке с агаром MacConkey. По крайней мере, три колонии из каждого образца были подтверждены как E. coli с помощью API-20E (bioMerieux, Франция) и хранились при -80°C для дальнейшей характеристики.
Все планшеты инкубировали при 37°C в течение 18 часов, и количество колониеобразующих единиц (КОЕ) на грамм сырой массы образца стула подсчитывали из диапазона разведения. Долю чувствительных к 3GC (3GC) E. coli КОЕ на грамм фекалий (КОЕ/г) рассчитывали путем вычитания количества 3GCr КОЕ/г из соответствующего общего количества E. coli КОЕ/г. Кроме того, измеряли долю количества 3GCr E. coli по отношению к общему количеству E. coli , полученному на чашке с агаром MacConkey. По крайней мере, три колонии из каждого образца были подтверждены как E. coli с помощью API-20E (bioMerieux, Франция) и хранились при -80°C для дальнейшей характеристики.
Тест на чувствительность к антибиотикам
Чувствительность к антибиотикам штамма E. coli (один изолят на образец) определяли стандартным методом диско-диффузии в соответствии с рекомендациями Института клинических и лабораторных стандартов (CLSI) (Patel, 2017). Антибиотики, использованные в этом исследовании, включали ампициллин (10 мкг), гентамицин (10 мкг), тетрациклин (30 мкг), меропенем (10 мкг), имипенем (10 мкг), цефтриаксон (30 мкг), цефотаксим (30 мкг), цефтазидим. (30 мкг), цефепим (30 мкг), колистин (10 мкг), ципрофлоксацин (5 мкг), налидиксовая кислота (30 мкг), азитромицин (15 мкг), триметоприм/сульфаметоксазол (25 мкг), нитрофурантоин (30 мкг), и хлорамфеникол (30 мкг) (Oxoid, Великобритания). Была измерена зона ингибирования, и изоляты были классифицированы как устойчивые, промежуточные или чувствительные в соответствии с руководством по интерпретации, предоставленным CLSI (Patel, 2017). Изолят считался МЛУ, если он был устойчив к трем или более классам антибиотиков.
(30 мкг), цефепим (30 мкг), колистин (10 мкг), ципрофлоксацин (5 мкг), налидиксовая кислота (30 мкг), азитромицин (15 мкг), триметоприм/сульфаметоксазол (25 мкг), нитрофурантоин (30 мкг), и хлорамфеникол (30 мкг) (Oxoid, Великобритания). Была измерена зона ингибирования, и изоляты были классифицированы как устойчивые, промежуточные или чувствительные в соответствии с руководством по интерпретации, предоставленным CLSI (Patel, 2017). Изолят считался МЛУ, если он был устойчив к трем или более классам антибиотиков.
Тест на бета-лактамазы расширенного спектра (ESBL)
Бета-лактамазы расширенного спектра тестировали с помощью комбинированного дискового теста (CDT), как описано CLSI (Patel, 2017). Наносили диски, содержащие 3GC, включая цефотаксим, CTX (30 мкг) или цефтазидим, CAZ (30 мкг) отдельно и в сочетании с клавулановой кислотой (CLA, 10 мкг) (Oxoid, Великобритания). Зону ингибирования вокруг дисков CTX или CAZ в сочетании с CLA сравнивали с зоной ингибирования только вокруг дисков CTX или CAZ. Тест считался положительным на продукцию ESBL, если диаметр зоны ингибирования был на ≥5 мм больше с CLA, чем без (Patel, 2017).
Тест считался положительным на продукцию ESBL, если диаметр зоны ингибирования был на ≥5 мм больше с CLA, чем без (Patel, 2017).
ПЦР для генов ESBL и
E. coli Патотипы
Все 3GCr E. coli были протестированы на наличие генов ESBL, которые считаются приоритетными из-за их клинической значимости, а именно: bla CTX–M–group–1 , бла ШВ , бла ТЭМ , и бла ОХА–1 . Эти гены были протестированы с помощью ПЦР с использованием последовательностей праймеров и условий ПЦР, как описано ранее (Islam et al., 2017). Патотипы штаммов E. coli (EPEC, ETEC, EAEC, EIEC и STEC) идентифицировали с помощью мультиплексной ПЦР различных патогенных генов по методике, описанной ранее (Talukdar et al., 2013).
Статистический анализ данных
Данные были введены в SPSS 20.0 (IBM Inc., Чикаго, Иллинойс, США). Очистка данных, статистический анализ и графическое представление были выполнены в Stata 13. 0 (College Station, TX, United States) и R-3.4.2 (R Core Team, 2014). Концентрации E. coli были log 10 , преобразованные для оценки связи между демографическими переменными с носительством 3GCr E. coli с использованием критерия хи-квадрат и непараметрического критерия Манна-Уитни U . Подсчет популяции восприимчивых и резистентных изолятов от одного и того же младенца сравнивали с использованием критерия суммы рангов Уилкоксона на парных данных. Статистическую значимость определяли с использованием альфа = 0,05 для всех тестов, кроме критерия суммы рангов Уилкоксона, который стратифицирует анализы по возрасту (1–3, 4–6, 7–9 лет).и 10-12 месяцев). Для этого была применена консервативная поправка Бонферрони, чтобы скорректировать альфа до 0,0125 (0,5/4), чтобы скорректировать множественные сравнения.
0 (College Station, TX, United States) и R-3.4.2 (R Core Team, 2014). Концентрации E. coli были log 10 , преобразованные для оценки связи между демографическими переменными с носительством 3GCr E. coli с использованием критерия хи-квадрат и непараметрического критерия Манна-Уитни U . Подсчет популяции восприимчивых и резистентных изолятов от одного и того же младенца сравнивали с использованием критерия суммы рангов Уилкоксона на парных данных. Статистическую значимость определяли с использованием альфа = 0,05 для всех тестов, кроме критерия суммы рангов Уилкоксона, который стратифицирует анализы по возрасту (1–3, 4–6, 7–9 лет).и 10-12 месяцев). Для этого была применена консервативная поправка Бонферрони, чтобы скорректировать альфа до 0,0125 (0,5/4), чтобы скорректировать множественные сравнения.
Результаты
Носительство 3GCr
E. coli в образце кала младенцев
Из 100 образцов стула младенцев 82% были положительными на 3GCr E. coli . Среднее количество ± стандартное отклонение для общего количества E. coli составило 6,86 ± 1,56 log 10 E. coli КОЕ/г стула, в то время как среднее количество 3GCr E. coli составлял 6,21 ± 1,32 log 10 КОЕ/г. В среднем 3GCr E. coli составляет примерно одну треть (33%) от общего количества E. coli , присутствующих на грамм сырой массы стула.
coli . Среднее количество ± стандартное отклонение для общего количества E. coli составило 6,86 ± 1,56 log 10 E. coli КОЕ/г стула, в то время как среднее количество 3GCr E. coli составлял 6,21 ± 1,32 log 10 КОЕ/г. В среднем 3GCr E. coli составляет примерно одну треть (33%) от общего количества E. coli , присутствующих на грамм сырой массы стула.
Чувствительность к антибиотикам 3GCr
E. coli
Все изоляты 3GCr ( n = 82) E. coli были протестированы на чувствительность к группе из 13 антибиотиков. Резистентность ко многим антибиотикам, кроме 3GCr, была очень распространена: 77% ( n = 63) изолятов, классифицированных как МЛУ. Ни один из изолятов не был устойчив к колистину или карбапенему (рис. 1).
Рисунок 1. Распространенность 3GCr E. coli , устойчивой к различным классам антибиотиков, у детей в возрасте от 1 до 12 месяцев ( n = 82). АМП, ампициллин; АЗМ, азитромицин; ФЭП, цефепим; NA, налидиксовая кислота; CIP, ципрофлоксацин; SXT, сульфаметоксазол; ТЕ, тетрациклин; CN, гентамицин; F, нитрофурантоин; С, хлорамфеникол; МЕМ, меропенем; КТ, колистин; ИМФ, имипенем; 3GCr, устойчивый к цефалоспоринам третьего поколения.
АМП, ампициллин; АЗМ, азитромицин; ФЭП, цефепим; NA, налидиксовая кислота; CIP, ципрофлоксацин; SXT, сульфаметоксазол; ТЕ, тетрациклин; CN, гентамицин; F, нитрофурантоин; С, хлорамфеникол; МЕМ, меропенем; КТ, колистин; ИМФ, имипенем; 3GCr, устойчивый к цефалоспоринам третьего поколения.
Преобладание БЛРС среди изолятов 3GCr
E. coli
CDT всех изолятов 3GCr E. coli ( n = 82) показало, что более 90% ( n 704006) продуцируют BL. Среди изолятов, продуцирующих БЛРС, 96% ( n = 71) были положительными на bla CTX-M-group-1 , 41% ( n = 30) на bla TEM, 2 % ( n = 8) для bla OXA–1 . Из 8 CDT-отрицательных изолятов 4 оказались положительными в отношении bla CTX-M-group-1 указывает на то, что эти изоляты могли одновременно продуцировать ферменты ESBL и AmpC. Учитывая высокий уровень положительных результатов при обнаружении bla CTX-M-group-1 , дальнейшая молекулярная характеристика генов устойчивости не проводилась; носительство множественных механизмов резистентности возможно, но не изучалось.
Распространенность
E. coli Патотипы среди 3GCr E. coli Изоляты
Анализ генов вирулентности среди изолятов 3GCr показал, что 23% ( n = 19) изолятов были положительными по генам, специфичным для ЕРЕС ( аат А, ааи С) и 3,6% ( n = 3) изолятов были положительными по генам, специфичным для ЕРЕС ( п.н. , еае ). Других генов вирулентности обнаружено не было ( lt , st , ipa H и ial ).
Детерминанты 3GCr
E. coli Носительство у детей раннего возраста
Статистический анализ результатов не выявил значимой связи между наличием 3GCr E. coli в стуле младенца и характеристики младенца, включая пол, религию, возраст, способ родоразрешения, практику кормления ребенка, диарею в анамнезе и потребление антибиотиков матерью и ребенком (таблица 1). Кроме того, связь между скоростью колонизации 3GCr E. coli в кишечнике ребенка и демографическими характеристиками младенца (возраст, p = 0,5; способ родоразрешения, p = 0,8; потребление антибиотиков младенцем и матерью, p). = 0,2, р = 0,4; и детская диарея, p = 0,2) не были статистически значимыми в непараметрическом критерии Манна-Уитни U (табл. 2). Следовательно, присутствие или обилие 3GCr E. coli в стуле младенцев в этом исследовании нельзя объяснить некоторыми из наиболее распространенных факторов риска, включая предшествующее воздействие антибиотиков.
= 0,2, р = 0,4; и детская диарея, p = 0,2) не были статистически значимыми в непараметрическом критерии Манна-Уитни U (табл. 2). Следовательно, присутствие или обилие 3GCr E. coli в стуле младенцев в этом исследовании нельзя объяснить некоторыми из наиболее распространенных факторов риска, включая предшествующее воздействие антибиотиков.
Таблица 1. Демографические характеристики детей раннего возраста с фекальным носительством и без фекального носительства резистентных к цефалоспоринам третьего поколения (3GCr) Кишечная палочка .
Таблица 2. Связь между демографическими переменными и колонизацией E. coli в кишечнике младенцев, устойчивых к цефалоспоринам третьего поколения (3GCr).
Возрастное распределение фекального носительства 3GCr
E. coli по отношению к 3GCs E. coli
Мы рассчитали среднее количество 3GCr E. coli среди младенцев тех же возрастных групп и построили график распределения с интервалом в 1 месяц, чтобы определить, изменяется ли количество КОЕ резистентной микрофлоры с возрастом ребенка. Анализ среднего количества 3GCr до 12 месяцев показал, что log 10 КОЕ среднее количество 3GCr даже в возрасте 3 месяцев было высоким (6,43 log 10 ) и постоянным в последующие месяцы (рис. 2), что указывает на раннее появление 3GCr E. coli у младенцев. Однако процент младенцев, инфицированных резистентной популяцией E. coli (3GCr и MDR), постепенно увеличивался по мере увеличения возраста младенцев по месяцам (рис. 3).
Анализ среднего количества 3GCr до 12 месяцев показал, что log 10 КОЕ среднее количество 3GCr даже в возрасте 3 месяцев было высоким (6,43 log 10 ) и постоянным в последующие месяцы (рис. 2), что указывает на раннее появление 3GCr E. coli у младенцев. Однако процент младенцев, инфицированных резистентной популяцией E. coli (3GCr и MDR), постепенно увеличивался по мере увеличения возраста младенцев по месяцам (рис. 3).
Рисунок 2. Вариации частоты носительства 3GCr E. coli у детей раннего возраста в разном возрасте от 3 до 12 месяцев. Журнал 10 Среднее количество 3GCr КОЕ у младенцев в возрасте 1 и 2 месяцев было исключено, поскольку в эти периоды времени регистрировался только один младенец каждого месяца. Планки погрешностей представляют собой стандартные ошибки результатов для каждой возрастной группы. 3GCr, устойчивый к цефалоспоринам третьего поколения.
Рисунок 3. Возрастное распределение распространенности 3GCr, MDR и ESBL-P E. coli в образцах стула младенцев. 3GCr, устойчивый к цефалоспоринам третьего поколения; БЛРС-П, БЛРС-продуцирующие; МЛУ, множественная лекарственная устойчивость.
coli в образцах стула младенцев. 3GCr, устойчивый к цефалоспоринам третьего поколения; БЛРС-П, БЛРС-продуцирующие; МЛУ, множественная лекарственная устойчивость.
Мы сравнили различия между подсчетами 3GCr и 3GCs E. coli среди младенцев тех же возрастных групп в возрасте 1–3, 4–6, 7–9 и 10–12 месяцев, чтобы выяснить, может ли 3GCr E. coli благополучно сосуществуют с 3GC без селективного давления антибиотиков. В популяции 3GCr и 3GCs E. coli с использованием критерия суммы рангов Вилкоксона не было обнаружено значительных различий в любой возрастной группе, кроме самой старшей, 10–12 месяцев ( p = 0,011) (рис. 4), что свидетельствует о что 3GCr E. coli может стабильно сохраняться, как 3GCs E. coli , с первых месяцев жизни. Примечательно, что статистическая значимость различий в 3GCr и 3GCs E. coli среди младенцев в возрасте 10–12 месяцев является гранично значимой по сравнению с скорректированным Бонферрони уровнем значимости альфа = 0,0125 для стратифицированного по возрасту критерия суммы рангов Уилкоксона.
Рисунок 4. Сравнительный анализ показателей носительства (в КОЕ/г сырой массы стула) 3GCr и 3GCs E. coli в аналогичной возрастной группе младенцев. (A) в возрасте 1–3 месяцев, (B) в возрасте 4–6 месяцев, (C) в возрасте 7–9 месяцев и (D) в возрасте 10–12 месяцев. 3GCr, устойчивый к цефалоспоринам третьего поколения; 3GCs, чувствительные к цефалоспоринам третьего поколения; КОЕ, колониеобразующая единица.
Обсуждение
Мы обнаружили чрезвычайно высокую распространенность как 3GCr E. coli (82%), так и ESBL-продуцирующей E. coli (74%) в образцах стула здоровых младенцев, проживающих в сельских районах Бангладеш. Несмотря на относительно небольшой размер выборки ( n = 100), выбранных на основе логистических ограничений, высокие показатели распространенности, вероятно, репрезентативны для бангладешских младенцев в возрасте до 1 года в районе исследования с погрешностью 10% (с доверительным интервалом 95%). Даже с учетом связанной с этим неопределенности это самая высокая распространенность ESBL-продуцирующих штаммов E. coli в кишечнике здорового человека, наблюдаемая на сегодняшний день. Например, в исследовании, проведенном в Тунисе, распространенность MDR E. coli среди детей в возрасте от 6 до 12 лет составила 6,6% (Ferjani et al., 2017). Ставки 3GCr E. coli у здоровых детей разного возраста составляла 2,9% в Швеции, 2,7% в Португалии и 10% в Сенегале (Guimaraes et al., 2009; Kaarme et al., 2013). Частота фекального носительства Enterobacteriaceae, продуцирующих БЛРС, у здоровых детей (0–59 месяцев) была намного выше (59%) в Центральной Африке (Farra et al., 2016). Ни в одном из этих исследований не сообщались данные о культивируемом 3GCr E. coli в виде доли от общего количества культивируемого E. coli в образцах стула. В нашем исследовании мы обнаружили, что около одной трети от общего числа колоний E. coli , полученных в культуре, были 3GCr, что вызывает тревогу.
Даже с учетом связанной с этим неопределенности это самая высокая распространенность ESBL-продуцирующих штаммов E. coli в кишечнике здорового человека, наблюдаемая на сегодняшний день. Например, в исследовании, проведенном в Тунисе, распространенность MDR E. coli среди детей в возрасте от 6 до 12 лет составила 6,6% (Ferjani et al., 2017). Ставки 3GCr E. coli у здоровых детей разного возраста составляла 2,9% в Швеции, 2,7% в Португалии и 10% в Сенегале (Guimaraes et al., 2009; Kaarme et al., 2013). Частота фекального носительства Enterobacteriaceae, продуцирующих БЛРС, у здоровых детей (0–59 месяцев) была намного выше (59%) в Центральной Африке (Farra et al., 2016). Ни в одном из этих исследований не сообщались данные о культивируемом 3GCr E. coli в виде доли от общего количества культивируемого E. coli в образцах стула. В нашем исследовании мы обнаружили, что около одной трети от общего числа колоний E. coli , полученных в культуре, были 3GCr, что вызывает тревогу.
Разница между 3GCr и 3GCs E. coli дает представление о затратах на поддержание резистентности кишечного микробного сообщества. Доля 3GCr среди общего количества E. coli (сумма 3GCr и 3GCs E. coli ) была незначительной у младенцев в разных возрастных группах, что указывает на то, что конкурентоспособность резистентных бактерий с нормальной резидентной флорой в кишечнике невелика. под влиянием возраста. Могут быть низкие затраты на фитнес, связанные с сохранением и распространением резистентности. Действительно, Коттелл и соавт. (2012) предполагают низкую стоимость пригодности, связанную с плазмидой (pCT), несущей ген устойчивости 9.0005 bla CTX-M-14 для E. coli , поскольку E. coli были способны сохраняться и легко распространяться даже в отсутствие селективного давления со стороны антибиотиков (Cottell et al., 2012). Наши результаты также согласуются с предыдущими отчетами, демонстрирующими, что устойчивые к тетрациклину и ампициллину изоляты постоянно сохраняются без какого-либо избирательного давления антибиотиков в кишечнике детей разных возрастных групп (Karami et al. , 2006, 2008).
, 2006, 2008).
Последствия такой высокой нагрузки 3GCr E. coli существенны в контексте безопасности здоровья детей. Устойчивая к антибиотикам E. coli и другие распространенные комменсалы кишечника, включая Klebsiella spp. и Acinetobacter spp. являются одной из основных причин внебольничной тяжелой инфекции в Юго-Восточной Азии. В поперечном исследовании пяти участков в Юго-Восточной Азии Saha et al. (2018) обнаружили, что только 17% возможных серьезных бактериальных инфекций (pSBI), выявленных у детей раннего возраста, были устойчивы к антибиотикам первого ряда. Резистентные инфекции, по сравнению с восприимчивыми инфекциями, связаны с худшими исходами. Например, в Танзании у детей с септицемией, вызванной бактериями, продуцирующими бета-лактамазы расширенного спектра, вероятность смерти почти в два раза выше, чем при инфекциях, не связанных с БЛРС (коэффициент смертности 71% против 39%).%) (Бломберг и др., 2007). В настоящем исследовании наблюдаемая высокая частота носительства и высокая относительная доля культивируемой 3GCr E. coli могут предвещать более высокие показатели 3GCr E. coli как долю инфекций pSBI. Необходимы дальнейшие исследования, связывающие фекальное носительство резистентных бактерий с риском резистентных инфекций.
coli могут предвещать более высокие показатели 3GCr E. coli как долю инфекций pSBI. Необходимы дальнейшие исследования, связывающие фекальное носительство резистентных бактерий с риском резистентных инфекций.
Помимо повышения риска резистентных инфекций, высокое носительство 3GCr Enterobacteriaceae в кишечнике приводит к выделению с детским стулом и, таким образом, способствует повышенному риску контакта с находящимися поблизости людьми и животными. Среди неграмотных или малограмотных матерей в сообществе распространено мнение, что стул младенцев не представляет опасности для здоровья или вреда, особенно по сравнению со стулом взрослых (Yeager et al., 19).99; Гил и др., 2004). Согласно общенациональному исследованию, проведенному в период с 2012 по 2013 год в Бангладеш, фекалии около 61% детей в возрасте 0–2 лет утилизировались небезопасно, причем этот процент был намного выше в сельской местности (67%) по сравнению с городскими районами (40%). ) (Бюро статистики Бангладеш [BBS] и Детский фонд Организации Объединенных Наций [ЮНИСЕФ], 2014 г. ). Таким образом, члены домохозяйства, включая матерей или опекунов, подвергаются воздействию фекальных бактерий МЛУ в результате небезопасного удаления детских фекалий. Точно так же неправильная утилизация детского стула во дворах или в близлежащих канавах может способствовать передаче этих устойчивых бактерий домашним и диким птицам и/или другим животным (Hasan et al., 2012).
). Таким образом, члены домохозяйства, включая матерей или опекунов, подвергаются воздействию фекальных бактерий МЛУ в результате небезопасного удаления детских фекалий. Точно так же неправильная утилизация детского стула во дворах или в близлежащих канавах может способствовать передаче этих устойчивых бактерий домашним и диким птицам и/или другим животным (Hasan et al., 2012).
Изоляты 3GCr E. coli в этом исследовании были преимущественно устойчивы к азитромицину и ципрофлоксацину, а также к другим антибиотикам (рис. 1). Азитромицин является препаратом первой линии выбора для лечения шигеллеза у детей (Центры по контролю и профилактике заболеваний [CDC], 2006 г.) и второй линии выбора для лечения шигеллеза у взрослых (Всемирная организация здравоохранения [ВОЗ], 2005 г.). Хотя в течение периода исследования не было зарегистрировано ни одного случая заболевания шигеллезом младенцев, было установлено, что шигеллез является основным фактором диареи средней и тяжелой степени в соседнем Мирзапуре (Kotloff et al. , 2013). Лечение этой инфекции может быть затруднено из-за высокой распространенности резистентности к азитромицину в исследуемом сообществе. Среди других антибиотиков устойчивость к ципрофлоксацину была обнаружена среди 37% изолятов 3GCr, что даже выше, чем в предыдущем отчете, который показал устойчивость у 19% от штаммов E. coli , полученных от здоровых детей (Gurnee et al., 2015). Интересно, что только 29% из изолятов E. coli в этом исследовании были устойчивы к тетрациклину, антибиотику первого поколения, который реже используется для лечения инфекций E. coli в обществе (Calva et al., 1996; Домингес и др., 2002). Детям тетрациклин не назначают из-за его влияния на рост костей и зубов (Sánchez et al., 2004). Это предполагает, что за счет сокращения использования антибиотиков у людей и животных можно уменьшить бремя устойчивых микроорганизмов, и это может в конечном итоге восстановить эффективность существующих антибиотиков даже в таких условиях, как Бангладеш, где чрезмерное использование антибиотиков и бремя УПП, оба слишком высокие.
, 2013). Лечение этой инфекции может быть затруднено из-за высокой распространенности резистентности к азитромицину в исследуемом сообществе. Среди других антибиотиков устойчивость к ципрофлоксацину была обнаружена среди 37% изолятов 3GCr, что даже выше, чем в предыдущем отчете, который показал устойчивость у 19% от штаммов E. coli , полученных от здоровых детей (Gurnee et al., 2015). Интересно, что только 29% из изолятов E. coli в этом исследовании были устойчивы к тетрациклину, антибиотику первого поколения, который реже используется для лечения инфекций E. coli в обществе (Calva et al., 1996; Домингес и др., 2002). Детям тетрациклин не назначают из-за его влияния на рост костей и зубов (Sánchez et al., 2004). Это предполагает, что за счет сокращения использования антибиотиков у людей и животных можно уменьшить бремя устойчивых микроорганизмов, и это может в конечном итоге восстановить эффективность существующих антибиотиков даже в таких условиях, как Бангладеш, где чрезмерное использование антибиотиков и бремя УПП, оба слишком высокие.
Наше исследование показало, что кишечник младенцев служит резервуаром для E. coli , устойчивых к множеству антибиотиков, включая 3GCr и фторхинолоны, которые имеют решающее значение для лечения многих инфекционных заболеваний у людей (Всемирная организация здравоохранения [ВОЗ], 2017). Высокий уровень БЛРС-продуцентов среди изолятов 3GCr в настоящем исследовании вызывает тревогу, поскольку пациенты с внебольничными инфекциями, а также члены их домохозяйств, являющиеся носителями БЛРС-продуцирующих Enterobacteriaceae, могут распространять устойчивость среди других людей в своем сообществе (Valverde et al., 2008). Это можно объяснить общей высокой распространенностью БЛРС 9.0005 инфекции E. coli среди населения. Недавнее исследование в Бангладеш показало, что 34% всех клинических изолятов E. coli от пациентов с внекишечными инфекциями продуцируют БЛРС (Khan et al., 2018).
Вероятная причина колонизации ESBL-продуцирующими энтеробактериями среди детей дошкольного возраста в Лаосе была связана с неправильным использованием антибиотиков (Stoesser et al. , 2015). В нашем исследовании мы этого не наблюдали: не было значимой связи между колонизацией и сообщениями о предшествующем лечении антибиотиками у младенцев. Предыдущие исследования показали, что приобретение устойчивых к противомикробным препаратам бактерий или генов устойчивости к противомикробным препаратам в кишечнике младенцев может происходить во время и/или после родов (Zhang et al., 2011). В частности, флора матери во время нормальных вагинальных родов или флора окружающей среды во время кесарева сечения (кесарева сечения) колонизируют кишечник младенца (Zhang et al., 2011). Таким образом, бактерии УПП от матери или больничной среды могут способствовать вынашиванию младенцев. Например, исследование, проведенное в Тунисе, показало, что 20% пациентов приобрели 3GCr9.0005 E. coli в кишечнике из-за внутрибольничной инфекции (Maamar et al., 2016). В нашем исследовании мы не обнаружили каких-либо существенных различий в уровне колонизации 3GCr E. coli между детьми с нормальными вагинальными родами и детьми, рожденными с помощью кесарева сечения (таблицы 1, 2).
, 2015). В нашем исследовании мы этого не наблюдали: не было значимой связи между колонизацией и сообщениями о предшествующем лечении антибиотиками у младенцев. Предыдущие исследования показали, что приобретение устойчивых к противомикробным препаратам бактерий или генов устойчивости к противомикробным препаратам в кишечнике младенцев может происходить во время и/или после родов (Zhang et al., 2011). В частности, флора матери во время нормальных вагинальных родов или флора окружающей среды во время кесарева сечения (кесарева сечения) колонизируют кишечник младенца (Zhang et al., 2011). Таким образом, бактерии УПП от матери или больничной среды могут способствовать вынашиванию младенцев. Например, исследование, проведенное в Тунисе, показало, что 20% пациентов приобрели 3GCr9.0005 E. coli в кишечнике из-за внутрибольничной инфекции (Maamar et al., 2016). В нашем исследовании мы не обнаружили каких-либо существенных различий в уровне колонизации 3GCr E. coli между детьми с нормальными вагинальными родами и детьми, рожденными с помощью кесарева сечения (таблицы 1, 2). Недавнее исследование в Бангладеш показало, что роды с помощью кесарева сечения увеличились с 3,5 до 23% в период с 2004 по 2014 год (Khan et al., 2017), и это обычная практика профилактического применения антибиотиков до и после операции. Во время послеоперационного ухода матери начинают кормить грудью новорожденного, продолжая лечение антибиотиками. Это приводит к передаче антибиотиков в их активной форме младенцам, и, таким образом, микробиота их кишечника может измениться, чтобы выжить в селективной к антибиотикам среде (Mathew, 2004). Кроме того, в Дакке, Бангладеш, значительная часть новорожденных (98%) получают антибиотики (сульфаниламиды, фторхинолоны, метронидазол, пенициллины и др.) до 6-месячного возраста (Rogawski et al., 2017), что создает селективную среду для устойчивых к антибиотикам бактерий. Даже при очень низкой концентрации антибиотиков затраты на приспособление микроорганизмов к устойчивости ниже, чем к устойчивости к антибиотикам (Sandegren, 2014). Удивительно, но в нашем исследовании ни использование антибиотиков в анамнезе, ни предыдущая история госпитализации не были связаны с колонизацией 3GCr, равно как и пол, религия и практика питания.
Недавнее исследование в Бангладеш показало, что роды с помощью кесарева сечения увеличились с 3,5 до 23% в период с 2004 по 2014 год (Khan et al., 2017), и это обычная практика профилактического применения антибиотиков до и после операции. Во время послеоперационного ухода матери начинают кормить грудью новорожденного, продолжая лечение антибиотиками. Это приводит к передаче антибиотиков в их активной форме младенцам, и, таким образом, микробиота их кишечника может измениться, чтобы выжить в селективной к антибиотикам среде (Mathew, 2004). Кроме того, в Дакке, Бангладеш, значительная часть новорожденных (98%) получают антибиотики (сульфаниламиды, фторхинолоны, метронидазол, пенициллины и др.) до 6-месячного возраста (Rogawski et al., 2017), что создает селективную среду для устойчивых к антибиотикам бактерий. Даже при очень низкой концентрации антибиотиков затраты на приспособление микроорганизмов к устойчивости ниже, чем к устойчивости к антибиотикам (Sandegren, 2014). Удивительно, но в нашем исследовании ни использование антибиотиков в анамнезе, ни предыдущая история госпитализации не были связаны с колонизацией 3GCr, равно как и пол, религия и практика питания. Отсутствие связи может быть связано с высокой скоростью колонизации в сочетании с относительно небольшим размером выборки (9).0005 н = 100). Низкая доля младенцев без 3GCr ограничивает статистический анализ. Таким образом, необходимы дальнейшие исследования, особенно сфокусированные на больших размерах выборки, для выявления причин высокой частоты носительства антибиотикорезистентности среди детей в возрасте до 1 года в этих условиях.
Отсутствие связи может быть связано с высокой скоростью колонизации в сочетании с относительно небольшим размером выборки (9).0005 н = 100). Низкая доля младенцев без 3GCr ограничивает статистический анализ. Таким образом, необходимы дальнейшие исследования, особенно сфокусированные на больших размерах выборки, для выявления причин высокой частоты носительства антибиотикорезистентности среди детей в возрасте до 1 года в этих условиях.
Заключение
Высокий уровень кишечного носительства МЛУ-микроорганизмов среди младенцев в сельских районах Бангладеш является серьезной проблемой, которая может поставить под угрозу лечение инфекционных заболеваний. Кроме того, выделение большого количества МЛУ-микроорганизмов с фекалиями младенцев увеличивает риск широко распространенной передачи этих микроорганизмов в обществе и окружающей среде. Это исследование поднимает важные вопросы о том, как происходит приобретение резистентных микроорганизмов в кишечнике младенцев в течение первых 3 месяцев жизни, каковы основные факторы приобретения и каковы последствия для здоровья и благополучия младенцев. Будущие исследования должны изучить источник приобретения резистентности у младенцев, чтобы понять, приобретается ли такая резистентность в первую очередь из окружающей среды, вертикально от матери ребенка или в результате селективного давления при использовании педиатрических антибиотиков.
Будущие исследования должны изучить источник приобретения резистентности у младенцев, чтобы понять, приобретается ли такая резистентность в первую очередь из окружающей среды, вертикально от матери ребенка или в результате селективного давления при использовании педиатрических антибиотиков.
Авторские вклады
MAI и TJ задумали разработку. MAI, TJ, MK, KL, TN-D и MM разработали исследование и разработали протокол. MA, SR и MBA внесли свой вклад в эксперименты, сбор и сбор данных. МРТ, MBA и TJ внесли свой вклад в ввод данных и статистический анализ. MAI и MBA выполнили первый проект рукописи. TJ, MK, KL, TN-D, MM, MA и MAI отредактировали рукопись и подготовили окончательный вариант рукописи.
Финансирование
Это исследование было поддержано каталитическим грантом REACH, Соединенное Королевство (грант icddr,b № GR-01507). icddr,b с благодарностью отмечает финансовую поддержку программы REACH, Великобритания. icddr,b также выражает благодарность следующим донорам: правительствам Бангладеш, Канады, Швеции и Соединенного Королевства за предоставление основной/неограниченной поддержки. KL был поддержан грантом Национального института аллергии и инфекционных заболеваний K01AI103544. Содержание является исключительной ответственностью авторов и не обязательно отражает официальную точку зрения Национальных институтов здравоохранения.
KL был поддержан грантом Национального института аллергии и инфекционных заболеваний K01AI103544. Содержание является исключительной ответственностью авторов и не обязательно отражает официальную точку зрения Национальных институтов здравоохранения.
Заявление о конфликте интересов
Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могли бы быть истолкованы как потенциальный конфликт интересов.
Ссылки
Александр, В. Н., Нортруп, В., и Биззарро, М. Дж. (2011). Воздействие антибиотиков в отделении интенсивной терапии новорожденных и риск развития некротизирующего энтероколита. J. Педиатр. 159, 392–397. doi: 10.1016/j.jpeds.2011.02.035
Полнотекстовая перекрестная ссылка | Google Scholar
Статистическое бюро Бангладеш [BBS] и Детский фонд Организации Объединенных Наций [ЮНИСЕФ] (2014). Кластерное обследование по многим показателям в Бангладеш, 2012–2013 гг. , ProgotirPathey: итоговый отчет. Дакка: Статистическое бюро Бангладеш.
, ProgotirPathey: итоговый отчет. Дакка: Статистическое бюро Бангладеш.
Google Scholar
Бломберг Б., Манджи К. П., Урасса В. К., Тамим Б. С., Мвакагиле Д. С., Джурин Р. и др. (2007). Устойчивость к противомикробным препаратам предсказывает смерть танзанийских детей с инфекциями кровотока: проспективное когортное исследование. BMC Заражение. Дис. 7:43. doi: 10.1186/1471-2334-7-43
CrossRef Полный текст | Google Scholar
Кальва, Дж. Дж., Сифуэнтес-Осорнио, Дж., и Серон, К. (1996). Устойчивость к противомикробным препаратам в фекальной флоре: лонгитюдное наблюдение за детьми из городских районов Мексики на базе местных сообществ. Антимикроб. Агенты Чемотер. 40, 1699–1702. doi: 10.1128/AAC.40.7.1699
CrossRef Полный текст | Google Scholar
Центры по контролю и профилактике заболеваний [CDC] (2006). Вспышки множественной лекарственной устойчивости Shigella sonnei гастроэнтерит, связанный с детскими садами – Канзас, Кентукки и Миссури, 2005 г. MMWR Morb. Смертный. Wkly Rep. 55, 1068–1071.
MMWR Morb. Смертный. Wkly Rep. 55, 1068–1071.
Google Scholar
Коттелл Дж. Л., Уэббер М. А. и Пиддок Л. Дж. (2012). Сохранение переносимой резистентности к бета-лактамазам расширенного спектра в отсутствие давления антибиотиков. Антимикроб. Агенты Чемотер. 56, 4703–4706. doi: 10.1128/AAC.00848-12
CrossRef Полный текст | Академия Google
де Техада, Б.М. (2014). Использование и неправильное использование антибиотиков во время беременности и родов: преимущества и риски. Междунар. Дж. Окружающая среда. Рез. Общественное здравоохранение 11, 7993–8009. doi: 10.3390/ijerph210807993
CrossRef Full Text | Google Scholar
Бюллетень здравоохранения DGHS (2014 г.). Матлаб (Уттар) Оздоровительный комплекс Упазила. Дакка: Министерство здравоохранения и благосостояния семьи.
Google Scholar
Дханд, Н.К., и Хаткар, М.С. (2014). Statulator: Статистический онлайн-калькулятор. Калькулятор размера выборки для оценки одной доли. Доступно по адресу: http://statulator.com/SampleSize/ss1P.html (по состоянию на 28 января 2019 г.).
Доступно по адресу: http://statulator.com/SampleSize/ss1P.html (по состоянию на 28 января 2019 г.).
Google Scholar
Домингес Э., Сарасага М., Саенс Ю., Бриньяс Л. и Торрес К. (2002). Механизмы устойчивости к антибиотикам в изолятах Escherichia coli , полученных от здоровых детей в Испании. Микроб. Сопротивление наркотикам. 8, 321–327. doi: 10.1089/107662
469589
CrossRef Full Text | Google Scholar
Фарра А., Франк Т., Тондер Л., Бата П., Годи Дж., Онамбеле М. и др. (2016). Высокая частота фекального носительства β-лактамаз, продуцирующих расширенный спектр Enterobacteriaceae у здоровых детей в Банги, Центральноафриканская Республика. клин. микробиол. Заразить. 22, 891.e1–891.e4. doi: 10.1016/j.cmi.2016.07.001
CrossRef Полный текст | Google Scholar
Ferjani, S., Saidani, M., Hamzaoui, Z., Alonso, C.A., Torres, C., Maamar, E., et al. (2017). Внебольничное фекальное носительство резистентной к цефалоспоринам широкого спектра действия Escherichia coli у тунисских детей. Диагн. микробиол. Заразить. Дис. 87, 188–192. doi: 10.1016/j.diagmicrobio.2016.03.008
Диагн. микробиол. Заразить. Дис. 87, 188–192. doi: 10.1016/j.diagmicrobio.2016.03.008
CrossRef Полный текст | Google Scholar
Гил А., Ланата К., Кляйнау Э. и Пенни М. (2004). Практика удаления детских фекалий в развивающихся странах и мероприятия по профилактике диарейных заболеваний. МакМюррей, Пенсильвания: Проект гигиены окружающей среды.
Google Scholar
Гимарайнш Б., Баррето А., Радуани Х., Фигейредо Н., Гаспар Э., Родригес Дж. и др. (2009). Генетическое обнаружение β-лактамаз расширенного спектра, содержащих Изоляты Escherichia coli и устойчивые к ванкомицину энтерококки в образцах фекалий здоровых детей. Микроб. Сопротивление наркотикам. 15, 211–216. doi: 10.1089/mdr.2009.0910
CrossRef Полный текст | Google Scholar
Герни Э. А., Ндао И. М., Джонсон Дж. Р., Джонстон Б. Д., Гонсалес М. Д., Бернем К.-А. Д. и др. (2015). Колонизация кишечника здоровых детей и их матерей патогенной резистентной к ципрофлоксацину Escherichia coli . Дж. Заразить. Дис. 212, 1862–1868 гг. doi: 10.1093/infdis/jiv278
Дж. Заразить. Дис. 212, 1862–1868 гг. doi: 10.1093/infdis/jiv278
Полный текст CrossRef | Google Scholar
Хасан Б., Сандегрен Л., Мельхус А., Дробни М., Эрнандес Дж., Вальденстрем Дж. и др. (2012). Устойчивая к противомикробным препаратам Escherichia coli у диких птиц и домашней птицы на свободном выгуле, Бангладеш. Аварийный. Заразить. Дис. 18, 2055–2058 гг. doi: 10.3201/eid1812.120513
CrossRef Полный текст | Google Scholar
Херигстад Б., Гамильтон М. и Херсинк Дж. (2001). Как оптимизировать метод капельной пластины для подсчета бактерий. J. Microbiol. Методы 44, 121–129. doi: 10.1016/S0167-7012(00)00241-4
CrossRef Полный текст | Google Scholar
Хьюитт Дж. и Ригби Дж. (1976). Влияние различных видов молочного питания на количество Escherichia coli и бифидобактерий в стуле новорожденных. Эпидемиол. Заразить. 77, 129–139. doi: 10.1017/S0022172400055601
CrossRef Полный текст | Google Scholar
Hilty, M. , Betsch, B.Y., Bögli-Stuber, K., Heiniger, N., Stadler, M., Küffer, M., et al. (2012). Динамика передачи β-лактамаз, продуцирующих расширенный спектр Enterobacteriaceae в больницах третичного уровня и в домашних условиях. клин. Заразить. Дис. 55, 967–975. doi: 10.1093/cid/cis581
, Betsch, B.Y., Bögli-Stuber, K., Heiniger, N., Stadler, M., Küffer, M., et al. (2012). Динамика передачи β-лактамаз, продуцирующих расширенный спектр Enterobacteriaceae в больницах третичного уровня и в домашних условиях. клин. Заразить. Дис. 55, 967–975. doi: 10.1093/cid/cis581
Полный текст CrossRef | Google Scholar
Ислам М. А., Ислам М., Хасан Р., Хоссейн М. И., Наби А., Рахман М. и др. (2017). Распространение в окружающей среде полирезистентных бактерий, продуцирующих металло-β-лактамазу-1 Нью-Дели, в Дакке, Бангладеш. Заяв. Окружающая среда. микробиол. 83, е793-17. doi: 10.1128/AEM.00793-17
Полнотекстовая перекрестная ссылка | Google Scholar
Каарме Дж., Молин Ю., Олсен Б. и Мельхус О. (2013). Распространенность Enterobacteriaceae , продуцирующих бета-лактамазы расширенного спектра, у здоровых шведских детей дошкольного возраста. Acta Педиатр. 102, 655–660. doi: 10.1111/apa.12206
Полный текст CrossRef | Google Scholar
Карами Н. , Ханнун К., Адлерберт И. и Уолд А. Э. (2008). Динамика колонизации ампициллинрезистентной Escherichia coli в инфантильной микробиоте толстой кишки. J. Антимикроб. Чемотер. 62, 703–708. doi: 10.1093/jac/dkn263
, Ханнун К., Адлерберт И. и Уолд А. Э. (2008). Динамика колонизации ампициллинрезистентной Escherichia coli в инфантильной микробиоте толстой кишки. J. Антимикроб. Чемотер. 62, 703–708. doi: 10.1093/jac/dkn263
Полный текст CrossRef | Google Scholar
Карами Н., Новрузян Ф., Адлерберт И. и Уолд А. Э. (2006). Резистентность к тетрациклину у Escherichia coli и персистенция в микробиоте толстой кишки младенцев. Антимикроб. Агенты Чемотер. 50, 156–161. doi: 10.1128/AAC.50.1.156-161.2006
CrossRef Полный текст | Академия Google
Хан, Э. Р., Аунг, М. С., Пол, С. К., Ахмед, С., Хак, Н., Ахамед, Ф., и др. (2018). Распространенность и молекулярная эпидемиология клинических изолятов Escherichia coli и Klebsiella pneumoniae , несущих гены бета-лактамаз и карбапенемаз расширенного спектра в Бангладеш. Микроб. Сопротивление наркотикам. doi: 10.1089/mdr.2018.0063 [Epub перед печатью].
Полнотекстовая перекрестная ссылка | Google Scholar
Хан М. Н., Ислам М. М., Шариф А. А., Алам М. М. и Рахман М. М. (2017). Социально-демографические предикторы и среднегодовые показатели кесарева сечения в Бангладеш в период с 2004 по 2014 год9.0005 PLoS One 12:e0177579. doi: 10.1371/journal.pone.0177579
Н., Ислам М. М., Шариф А. А., Алам М. М. и Рахман М. М. (2017). Социально-демографические предикторы и среднегодовые показатели кесарева сечения в Бангладеш в период с 2004 по 2014 год9.0005 PLoS One 12:e0177579. doi: 10.1371/journal.pone.0177579
CrossRef Full Text | Google Scholar
Котлофф К.Л., Натаро Дж.П., Блэквелдер В.К., Насрин Д., Фараг Т.Х., Панчалингам С. и др. (2013). Бремя и этиология диарейных заболеваний у младенцев и детей раннего возраста в развивающихся странах (глобальное многоцентровое исследование кишечных инфекций, GEMS): проспективное исследование случай-контроль. Ланцет 382, 209–222. doi: 10.1016/S0140-6736(13)60844-2
PubMed Abstract | Полный текст перекрестной ссылки | Академия Google
Леджер, В. Дж., и Блазер, М. Дж. (2013). Не используем ли мы слишком много антибиотиков во время беременности? БЙОГ 120, 1450–1452. doi: 10.1111/1471-0528.12371
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Maamar, E. , Ferjani, S., Jendoubi, A., Hammami, S., Hamzaoui, Z., Mayonnove-Coulange, L., et al. (2016). Высокая распространенность колонизации кишечной микробиоты устойчивыми к цефалоспоринам широкого спектра действия энтеробактериями в тунисском отделении интенсивной терапии. Фронт. микробиол. 7:1859. doi: 10.3389/fmicb.2016.01859
, Ferjani, S., Jendoubi, A., Hammami, S., Hamzaoui, Z., Mayonnove-Coulange, L., et al. (2016). Высокая распространенность колонизации кишечной микробиоты устойчивыми к цефалоспоринам широкого спектра действия энтеробактериями в тунисском отделении интенсивной терапии. Фронт. микробиол. 7:1859. doi: 10.3389/fmicb.2016.01859
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Macones, G.A., Cleary, K.L., Parry, S., Stamilio, D.M., Cahill, A.G., Odibo, A.O., et al. (2012). Сроки назначения антибиотиков при кесаревом сечении: рандомизированное контролируемое исследование. утра. Дж. Перинатол. 29, 273–276. doi: 10.1055/s-0031-1295657
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Мэтью, Дж. (2004). Влияние материнских антибиотиков на младенцев, находящихся на грудном вскармливании. Постград. Мед. Дж. 80, 196–200. doi: 10.1136/pgmj.2003.011973
Полный текст CrossRef | Google Scholar
Мунк П. , Кнудсен Б. Е., Лукьянченко О., Дуарте А. С. Р., Ван Гомпель Л., Люйкен Р. Э. К. и др. (2018). Обилие и разнообразие фекального резистома убойных свиней и бройлеров в девяти европейских странах. Нац. микробиол. 3, 898–908. doi: 10.1038/s41564-018-0192-9
, Кнудсен Б. Е., Лукьянченко О., Дуарте А. С. Р., Ван Гомпель Л., Люйкен Р. Э. К. и др. (2018). Обилие и разнообразие фекального резистома убойных свиней и бройлеров в девяти европейских странах. Нац. микробиол. 3, 898–908. doi: 10.1038/s41564-018-0192-9
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Патель, Дж. Б. (2017). Стандарты эффективности для тестирования чувствительности к противомикробным препаратам. Уэйн, Пенсильвания: Институт клинических и лабораторных стандартов.
Google Scholar
Перейра Л. М. П., Филлипс М., Рамлал Х., Тимул К. и Прабхакар П. (2004). Использование цефалоспоринов третьего поколения в больнице третичного уровня в Порт-оф-Спейн, Тринидад: необходимость политики антибиотикотерапии. BMC Заражение. Дис. 4:59. doi: 10.1186/1471-2334-4-59
PubMed Abstract | Полный текст перекрестной ссылки | Академия Google
Pitout, JD, and Laupland, KB (2008). Enterobacteriaceae , продуцирующие бета-лактамазы расширенного спектра: новая проблема общественного здравоохранения. Ланцет Заражение. Дис. 8, 159–166. doi: 10.1016/S1473-3099(08)70041-0
Ланцет Заражение. Дис. 8, 159–166. doi: 10.1016/S1473-3099(08)70041-0
Полный текст CrossRef | Google Scholar
Основная группа R (2014 г.). R: Язык и среда для статистических вычислений. Вена: Фонд статистических вычислений R.
Google Scholar
Rogawski, E.T., Platts-Mills, J.A., Seidman, J.C., John, S., Mahfuz, M., Ulak, M., et al. (2017). Применение антибиотиков у детей младше двух лет в восьми странах: проспективное когортное исследование. Бык. Всемирный орган здравоохранения. 95:49. doi: 10.2471/BLT.16.176123
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Саари А., Вирта Л. Дж., Санкилампи У., Дункель Л. и Саксен Х. (2015). Воздействие антибиотиков в младенчестве и риск избыточного веса в первые 24 месяца жизни. Педиатрия 135, 617–626. doi: 10.1542/peds.2014-3407
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Саха, С. К., Шраг, С. Дж., Эль Арифин, С. , Маллани, Л. К., Ислам, М. С., Шанг, Н., и др. (2018). Причины и заболеваемость внебольничными серьезными инфекциями среди детей раннего возраста в Южной Азии (ANISA): обсервационное когортное исследование. Ланцет 392, 145–159. doi: 10.1016/S0140-6736(18)31127-9
, Маллани, Л. К., Ислам, М. С., Шанг, Н., и др. (2018). Причины и заболеваемость внебольничными серьезными инфекциями среди детей раннего возраста в Южной Азии (ANISA): обсервационное когортное исследование. Ланцет 392, 145–159. doi: 10.1016/S0140-6736(18)31127-9
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Санчес А.Р., Роджерс Р.С. и Шеридан П.Дж. (2004). Окрашивание зубов и полости рта тетрациклином и другими производными тетрациклина. Междунар. Дж. Дерматол. 43, 709–715. doi: 10.1111/j.1365-4632.2004.02108.x
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Сандегрен, Л. (2014). Селекция антибиотикорезистентности при очень низких концентрациях антибиотиков. Упсала J. Med. науч. 119, 103–107. doi: 10.3109/03009734.2014.7
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Стоессер Н., Шаяхеуанг С., Вонгсуват М., Фоммасон К., Эллиотт И., Дель Охо Элиас К. и др. (2015). Колонизация Enterobacteriaceae , продуцирующими БЛРС, у детей, посещающих дошкольные детские учреждения в Лаосской Народно-Демократической Республике. J. Антимикроб. Чемотер. 70, 1893–1897 гг. doi: 10.1093/jac/dkv021
и др. (2015). Колонизация Enterobacteriaceae , продуцирующими БЛРС, у детей, посещающих дошкольные детские учреждения в Лаосской Народно-Демократической Республике. J. Антимикроб. Чемотер. 70, 1893–1897 гг. doi: 10.1093/jac/dkv021
Реферат PubMed | Полный текст перекрестной ссылки | Google Scholar
Талукдар П.К., Рахман М., Рахман М., Наби А., Ислам З., Хок М.М. и др. (2013). Устойчивость к противомикробным препаратам, факторы вирулентности и генетическое разнообразие изолятов Escherichia coli из бытового водоснабжения в Дакке, Бангладеш. PLoS One 8:e61090. doi: 10.1371/journal.pone.0061090
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Всемирный банк (2016). Коэффициент рождаемости, грубо (на 1000 человек) | Данные. Доступно по адресу: https://data.worldbank.org/indicator/SP.DYN.CBRT.IN?locations=BD (по состоянию на 28 января 2019 г.).
Вальверде А., Гриль Ф., Коке Т. М., Пинтадо В. , Бакеро Ф., Кантон Р. и др. (2008). Высокая частота кишечной колонизации микроорганизмами, продуцирующими бета-лактамазы расширенного спектра, при бытовых контактах с инфицированными внебольничными пациентами. Дж. Клин. микробиол. 46, 2796–2799. doi: 10.1128/JCM.01008-08
, Бакеро Ф., Кантон Р. и др. (2008). Высокая частота кишечной колонизации микроорганизмами, продуцирующими бета-лактамазы расширенного спектра, при бытовых контактах с инфицированными внебольничными пациентами. Дж. Клин. микробиол. 46, 2796–2799. doi: 10.1128/JCM.01008-08
PubMed Abstract | Полный текст перекрестной ссылки | Академия Google
Верани, Дж. Р., Макги, Л., Шраг, С. Дж., и Отделение бактериальных заболеваний, Национальный центр иммунизации и респираторных заболеваний (2010 г.). Профилактика перинатального стрептококкового заболевания группы В: пересмотренные рекомендации CDC, 2010 г. MMWR Recomm. Респ. 59, 1–36.
Реферат PubMed | Google Scholar
Всемирная организация здравоохранения [ВОЗ] (2005 г.). Руководство по борьбе с шигеллезом, включая эпидемии, вызванные Shigella dysenteriae типа 1. Женева: Всемирная организация здравоохранения.
Google Scholar
Всемирная организация здравоохранения [ВОЗ] (2017). Критически важные противомикробные препараты для медицины человека: рейтинг противомикробных препаратов для управления рисками устойчивости к противомикробным препаратам в связи с использованием не человеком. Женева: Всемирная организация здравоохранения.
Критически важные противомикробные препараты для медицины человека: рейтинг противомикробных препаратов для управления рисками устойчивости к противомикробным препаратам в связи с использованием не человеком. Женева: Всемирная организация здравоохранения.
Google Scholar
Йегер Б.А., Хаттли С.Р., Бартолини Р., Рохас М. и Ланата С.Ф. (1999). Практика дефекации маленьких детей в перуанских трущобах. Соц. науч. Мед. 49, 531–541. doi: 10.1016/S0277-9536(99)00119-7
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Чжан Л., Кинкелаар Д., Хуанг Ю., Ли Ю., Ли Х. и Ван Х. Х. (2011). Приобретенная устойчивость к антибиотикам: рождаемся ли мы с ней? Заяв. Окружающая среда. микробиол. 77, 7134–7141. doi: 10.1128/AEM.05087-11
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Фекальное носительство кишечной палочки с множественной лекарственной устойчивостью среди детей общины на юге Тайваня | БМК Гастроэнтерология
- Исследовательская статья
- Открытый доступ
- Опубликовано:
- I-FEI HUANG 1,2,3 NA1 ,
- Wei-Yang Lee 4 NA1 ,
- JIUN-ling Wang 5,6 . 7 ,
- Хун-Сян Ху 1 ,
- WAN-YU HUND 7 ,
- Yun-Ju Hung 1 ,
- Wen-chi Chen 2,8 ,
- Ying-Tso Shen 1 &
- Ying-Tso Shen 1 &
- ying-tso shen 1 &
- …
- …
- . 1,2,9
BMC Гастроэнтерология
том 18 , номер статьи: 86 (2018)
Процитировать эту статью
2032 доступа
20 цитирований
1 Альтметрический
Детали показателей
Реферат
История вопроса
Возникновение множественной лекарственной устойчивости (МЛУ) Escherichia coli ( E. coli ), особенно E. coli последовательности типа ST131, становится всеобщей проблемой. Комменсальные бактерии, важный резервуар генов устойчивости к антибиотикам, способствуют распространению таких генов среди патогенных бактериальных штаммов. Целью исследования является изучение фекального носительства MDR E. coli и ST131 E. coli у детей из общин на юге Тайваня.
coli ), особенно E. coli последовательности типа ST131, становится всеобщей проблемой. Комменсальные бактерии, важный резервуар генов устойчивости к антибиотикам, способствуют распространению таких генов среди патогенных бактериальных штаммов. Целью исследования является изучение фекального носительства MDR E. coli и ST131 E. coli у детей из общин на юге Тайваня.
Методы
В этом проспективном исследовании образцы стула у детей в возрасте 0–18 лет были получены в течение 3 дней после госпитализации с октября 2013 года по сентябрь 2014 года. Дети с сопутствующими заболеваниями в анамнезе, лечение антибиотиками или госпитализация в течение 3 мес до сбора образцов были исключены. колоний E. coli были отобраны и протестированы на чувствительность к противомикробным препаратам, и были обнаружены O25b-ST131, многолокусное типирование последовательности и группы генов blaCTX-M.
Результаты
Среди 157 изолятов E. coli частота нечувствительности к ампициллину, амоксициллину + клавуланату, триметоприму-сульфаметоксазолу и цефазолину составила 70, 65,6, 47,1 и 32,5% соответственно. Двадцать девять (18,5%) изолятов оказались нечувствительными к ципрофлоксацину. MDR E. coli составлял 58 (37%) всех изолятов. Тринадцать (8,3%) изолятов продуцировали бета-лактамазы расширенного спектра действия (БЛРС). Кроме того, 26 (16,6%) и 13 (8,3%) изолятов были O25b и ST131 положительными соответственно. Пять (38,5%) из 13 БЛРС-продуцирующих E. coli принадлежали к группе blaCTX-M 9, среди которых были CTXM-14 и 4 (80%) были положительными по O25b-ST131. По сравнению с группами, не чувствительными к ESBL и ципрофлоксацину, группы ESBL и группы, не чувствительные к ципрофлоксацину, показали значительно более высокие показатели положительности O25b-ST131.
coli частота нечувствительности к ампициллину, амоксициллину + клавуланату, триметоприму-сульфаметоксазолу и цефазолину составила 70, 65,6, 47,1 и 32,5% соответственно. Двадцать девять (18,5%) изолятов оказались нечувствительными к ципрофлоксацину. MDR E. coli составлял 58 (37%) всех изолятов. Тринадцать (8,3%) изолятов продуцировали бета-лактамазы расширенного спектра действия (БЛРС). Кроме того, 26 (16,6%) и 13 (8,3%) изолятов были O25b и ST131 положительными соответственно. Пять (38,5%) из 13 БЛРС-продуцирующих E. coli принадлежали к группе blaCTX-M 9, среди которых были CTXM-14 и 4 (80%) были положительными по O25b-ST131. По сравнению с группами, не чувствительными к ESBL и ципрофлоксацину, группы ESBL и группы, не чувствительные к ципрофлоксацину, показали значительно более высокие показатели положительности O25b-ST131.
Выводы
Распространенность фекального носительства нечувствительной E. coli у детей была высокой; среди этих E. coli 37% были МЛУ, 18,5% были нечувствительны к ципрофлоксацину и 8,3% продуцировали БЛРС. O25b-ST131 был наиболее распространенным ESBL-продуцирующим 9Клональная группа 0005 E. coli , присутствующая в фекалиях детей, и группы, не чувствительные к БЛРС и ципрофлоксацину, показали значительно более высокие показатели положительности O25b-ST131.
coli 37% были МЛУ, 18,5% были нечувствительны к ципрофлоксацину и 8,3% продуцировали БЛРС. O25b-ST131 был наиболее распространенным ESBL-продуцирующим 9Клональная группа 0005 E. coli , присутствующая в фекалиях детей, и группы, не чувствительные к БЛРС и ципрофлоксацину, показали значительно более высокие показатели положительности O25b-ST131.
Отчеты экспертной оценки
История вопроса
Виды рода Escherichia гетерогенны, и этот род включает как комменсальные, так и патогенные бактерии. Хотя только некоторые E. coli являются патологическими видами, они вызывают инфекции в различных органах, таких как мочевыводящие пути, билиарная система и центральная нервная система, начиная от спонтанно разрешающегося цистита и заканчивая опасным для жизни синдромом сепсиса у людей всех возрастов. 1]. Повышение устойчивости к антибиотикам приводит к увеличению смертности и заболеваемости, усиливает передачу резистентных бактерий и увеличивает расходы на здравоохранение [2]. Появление MDR E. coli становится все более серьезной проблемой, особенно с последовательностью E. coli типа ST131, о которой все чаще сообщают при инфекциях мочевыводящих путей (ИМП). В 2008 г. штаммов E. coli ST131 были идентифицированы как основной клон, связанный с распространением устойчивости к БЛРС CTX-M-15 [3,4,5]. После этого E. coli ST131 также были тесно связаны с устойчивостью к фторхинолонам и корезистентностью к аминогликозидам и триметоприм-сульфаметоксазолу (ТМП-СМЗ) [6,7,8]. Современные стратегии мониторинга устойчивости бактерий к антибиотикам в основном основаны на изучении устойчивости патогенных организмов [9].]. Однако комменсальные бактерии, являющиеся важным резервуаром генов устойчивости к антибиотикам, способствуют распространению таких генов среди патогенных бактериальных штаммов [10, 11]. Люди, животные-компаньоны и животные, не являющиеся домашними животными, а также продукты питания являются установленными резервуарами клона ST131 E.
Появление MDR E. coli становится все более серьезной проблемой, особенно с последовательностью E. coli типа ST131, о которой все чаще сообщают при инфекциях мочевыводящих путей (ИМП). В 2008 г. штаммов E. coli ST131 были идентифицированы как основной клон, связанный с распространением устойчивости к БЛРС CTX-M-15 [3,4,5]. После этого E. coli ST131 также были тесно связаны с устойчивостью к фторхинолонам и корезистентностью к аминогликозидам и триметоприм-сульфаметоксазолу (ТМП-СМЗ) [6,7,8]. Современные стратегии мониторинга устойчивости бактерий к антибиотикам в основном основаны на изучении устойчивости патогенных организмов [9].]. Однако комменсальные бактерии, являющиеся важным резервуаром генов устойчивости к антибиотикам, способствуют распространению таких генов среди патогенных бактериальных штаммов [10, 11]. Люди, животные-компаньоны и животные, не являющиеся домашними животными, а также продукты питания являются установленными резервуарами клона ST131 E. coli [12]. В нескольких исследованиях изучалось фекальное носительство MDR E. coli детьми из общины. Поэтому целью исследования было изучение фекального носительства MDR E. coli и ST131 9.0005 E. coli детей общины на юге Тайваня.
coli [12]. В нескольких исследованиях изучалось фекальное носительство MDR E. coli детьми из общины. Поэтому целью исследования было изучение фекального носительства MDR E. coli и ST131 9.0005 E. coli детей общины на юге Тайваня.
Методы
Исследуемая популяция
В этом проспективном исследовании принимали участие дети в возрасте 0–18 лет, которые были госпитализированы в педиатрическое отделение Гаосюнской больницы общего профиля для ветеранов с октября 2013 г. по сентябрь 2014 г. по поводу легких лихорадочных заболеваний, а именно острых респираторных заболеваний, гастроэнтерита, или инфекции кожи и мягких тканей и проходили регулярные обследования. Критериями исключения были любое лечение антибиотиками или госпитализация в анамнезе за 3 месяца до забора образцов и наличие основных заболеваний в анамнезе. Исследование было одобрено Комитетом по этике Гаосюнского госпиталя для ветеранов (номер ссылки VGHKS16-CT2–04). Все участники (их родители или законные опекуны в случае детей младше 16 лет) дали информированное согласие. Образцы стула были получены, как только они были доступны после госпитализации. Все они были получены в течение 3 дней после поступления [13].
Образцы стула были получены, как только они были доступны после госпитализации. Все они были получены в течение 3 дней после поступления [13].
Микробиологические лабораторные процедуры
Скрининг штаммов
E. coli в образцах стула
Каждый образец стула распределяли на чашке CHROMagar™ ECC (CHROMagar, Париж, Франция), которая эффективна для одновременного подсчета E. coli [14] и инкубировали при 37°С в течение 24 ч; штаммов E. coli появились в виде синих колоний. Была собрана синяя колония [14] и добавлена к 1 мл стерилизованной среды Луриа-Бертани для серийного разведения. Затем суспензию объемом 100 мкл снова наносили на чашку CHROMagar™ ECC для идентификации E. coli колоний синего цвета; Для дальнейшего анализа была отобрана 1 колония.
Тест на чувствительность к противомикробным препаратам
Отобранную колонию E. coli подвергали тесту на чувствительность к противомикробным препаратам с использованием автоматизированной системы Vitek 2 (Vitek AMS; bioMerieux Vitek Systems Inc. , Хейзелвуд, Миссури, США) с ID-GN и AST- Карты N277 (Дарем, Северная Каролина, США). Карту ASTN277 использовали для исследования продукции ESBL и чувствительности к противомикробным препаратам. Пограничные значения противомикробных препаратов определяли в соответствии со стандартами Института клинических и лабораторных стандартов [15]. Каждая панель имела шесть лунок, содержащих цефепим (1,0 мкг/мл), цефотаксим (0,5 мкг/мл) и цефтазидим (0,5 мкг/мл) отдельно и в сочетании с клавулановой кислотой (10, 4 и 4 мкг/мл соответственно). . Пропорциональное снижение роста в лунках, содержащих цефалоспорин + клавулановую кислоту, по сравнению с таковым в лунках, содержащих только цефалоспорин, считалось показателем продукции БЛРС. В этом исследовании возможных продуцентов БЛРС проводили скрининг с использованием M100-S19.(2009 г.) контрольные точки за весь период исследования (дополнительный файл 1).
, Хейзелвуд, Миссури, США) с ID-GN и AST- Карты N277 (Дарем, Северная Каролина, США). Карту ASTN277 использовали для исследования продукции ESBL и чувствительности к противомикробным препаратам. Пограничные значения противомикробных препаратов определяли в соответствии со стандартами Института клинических и лабораторных стандартов [15]. Каждая панель имела шесть лунок, содержащих цефепим (1,0 мкг/мл), цефотаксим (0,5 мкг/мл) и цефтазидим (0,5 мкг/мл) отдельно и в сочетании с клавулановой кислотой (10, 4 и 4 мкг/мл соответственно). . Пропорциональное снижение роста в лунках, содержащих цефалоспорин + клавулановую кислоту, по сравнению с таковым в лунках, содержащих только цефалоспорин, считалось показателем продукции БЛРС. В этом исследовании возможных продуцентов БЛРС проводили скрининг с использованием M100-S19.(2009 г.) контрольные точки за весь период исследования (дополнительный файл 1).
МЛУ определяли как приобретенную нечувствительность по крайней мере к 1 агенту из 3 или более противомикробных категорий, а именно к ингибиторам β-лактамов или β-лактамаз (ампициллин и амоксициллин-клавунат), цефалоспоринам (флормоксеф, цефазолин, цефуроксим, цефокситин, цефотаксим, цефатазидим) и цефпиром), карбапенемы (эртапенем и имипенем), аминогликозиды (гентамицин и амикацин), фторхинолоны (ципрофлоксацин и моксифлоксацин), тигециклин, колистин и ТМП-СМЗ [16].
Обнаружение O25b–ST131, мультилокусное типирование последовательности и группы генов blaCTX-M 3′) и rfbO25b.r (5′-TGCTATTCATTATGCGCAGC-3′) [18, 19]. Тип последовательности определяли методом мультилокусного типирования последовательности (MLST) по схеме Ахтмана (http://mlst.warwick.ac.uk/mlst/dbs/Ecoli) [20]. Группы blaCTX-M 1, 2 и 9 были обнаружены с помощью мультиплексных полимеразных цепных реакций с использованием специфических праймеров, как описано ранее [21]. Кроме того, были проведены специфические полимеразные цепные реакции для обнаружения общей группы 9.вариант (СТХ-М-14) и вариант группы 1 (СТХ-М-15) [19, 20].
Статистический анализ
Все статистические анализы были выполнены с использованием пакета статистического программного обеспечения Stata Version 12.1 (StataCorp., Колледж-Стейшн, Техас, США). Категориальные данные были проанализированы с использованием критерия хи-квадрат и точного критерия Фишера.
Результаты
Тест на чувствительность к противомикробным препаратам
Образцы стула были взяты у 255 детей; E. coli был выделен от 169 детей. Двенадцать детей были исключены, поскольку они получали лечение антибиотиками или были госпитализированы за 3 месяца до сбора образцов. Среди 157 изолятов E. coli , 25,5% (40/157) были чувствительны ко всем протестированным антибиотикам. Кроме того, 70,1% (110/157), 65,6% (103/157), 47,1% (74/157) и 32,5% (51/157) изолятов были нечувствительны к ампициллину, амоксициллин-клавунату, ТМП-СМЗ, и цефазолин соответственно. На MDR E. coli приходилось 36,9 % всех изолятов (58/157; таблица 1), среди которых 17,2 % (27/157), 14,0 % (22/157) и 5,7 % (9/157) были нечувствительными не менее чем к 1 агенту из 3, 4 и 5 противомикробных категорий соответственно.
coli был выделен от 169 детей. Двенадцать детей были исключены, поскольку они получали лечение антибиотиками или были госпитализированы за 3 месяца до сбора образцов. Среди 157 изолятов E. coli , 25,5% (40/157) были чувствительны ко всем протестированным антибиотикам. Кроме того, 70,1% (110/157), 65,6% (103/157), 47,1% (74/157) и 32,5% (51/157) изолятов были нечувствительны к ампициллину, амоксициллин-клавунату, ТМП-СМЗ, и цефазолин соответственно. На MDR E. coli приходилось 36,9 % всех изолятов (58/157; таблица 1), среди которых 17,2 % (27/157), 14,0 % (22/157) и 5,7 % (9/157) были нечувствительными не менее чем к 1 агенту из 3, 4 и 5 противомикробных категорий соответственно.
Таблица 1 Показатели нечувствительности к противомикробным препаратам E. coli в стуле детей из общин на юге Тайваня
Полноразмерная таблица
Тринадцать изолятов E. coli , полученных БЛРС; 11 были MDR E. coli . Двадцать девять изолятов E. coli были нечувствительны к ципрофлоксацину; 25 были MDR E. coli (таблица 2).
coli были нечувствительны к ципрофлоксацину; 25 были MDR E. coli (таблица 2).
Таблица 2 Количество изолятов E. coli с/без ESBL, чувствительных/нечувствительных к ципрофлоксацину, O25b и ST131 в детском стуле
Полный размер таблицы
MLST
изолятов E. coli
Двадцать шесть изолятов E. coli были положительными на O25b, среди которых 9 были MDR E. coli и 9 были продуцентами ESBL. Среди 58 изолятов MDR E. coli 7 были положительными по O25b-ST131 и продуцировали БЛРС. Только 1 изолят был положительным на O25b-ST131, но не имел МЛУ и не продуцировал БЛРС. Семь изолятов с положительной реакцией O25b-ST131 относились к MDR E. coli , среди которых только 1 был чувствителен к ципрофлоксацину. Кроме того, 1 изолят с положительной реакцией O25b-ST131 не имел МЛУ и был чувствителен к ципрофлоксацину. По сравнению с группами без БЛРС и с чувствительностью к ципрофлоксацину, в группах с БЛРС и с нечувствительностью к ципрофлоксацину частота положительных результатов O25b-ST131 была значительно выше (4,2% против 53,9%). и 4,70% против 24,1% соответственно; Таблица 3).
и 4,70% против 24,1% соответственно; Таблица 3).
Таблица 3 Частота положительных результатов на E. coli ST131 в группах БЛРС, не-БЛРС, нечувствительных к ципрофлоксацину, чувствительных к ципрофлоксацину, с МЛУ и без МЛУ
Полноразмерная таблица
blaCTX-M2
Пять из 13 (38,5%) ESBL-продуцирующих E. coli принадлежали к группе 9 blaCTX-M, среди которых все были CTXM-14, а 4 (80%) были подтверждены как ST131. Три E. coli , продуцирующие O25b ESBL, содержали гены CTX-M группы 1, которые, как было подтверждено, являются CTX-M-(3, 15), и все они были ST131 (таблица 4).
Таблица 4 Количество генов CTX-M, обнаруженных в O25b и не-O25b ESBL-продуцирующих E. coli и ESBL-непродуцирующих E. coli
Полноразмерная таблица
Обсуждение
Устойчивость к противомикробным препаратам у флоры серьезная угроза, потому что очень густонаселенная экосистема, такая как кишечник, может стать источником дополнительных кишечных инфекций на более позднем этапе. Эти инфекции могут впоследствии распространяться на других хозяев или передавать элементы генетической устойчивости другим членам микробиоты, включая патогены [22]. Серьезной проблемой общественного здравоохранения является то, что с увеличением числа людей, являющихся носителями этих устойчивых штаммов в составе своей нормальной флоры, возрастает вероятность заражения клиническими инфекциями как в обществе, так и в больнице. В нескольких исследованиях изучалась распространенность резистентных E. coli , выделенная из фекалий детей [23,24,25,26,27,28,29,30,31,32,33,34,35,36,37,38] (табл. 5). Показатели резистентности к противомикробным препаратам первой линии, а именно к ампициллину, ТМП-СМЗ и цефалоспоринам первого поколения, составляли 16–100%, 8–100% и 6–10% соответственно. Кроме того, уровень устойчивости к ципрофлоксацину составлял 0–53%, а 2,6–20,3% E. coli были продуцентами БЛРС. Вышеупомянутые исследования имели разные методологии, периоды исследований, размеры выборки и демографические данные, и поэтому их следует сравнивать с осторожностью.
Эти инфекции могут впоследствии распространяться на других хозяев или передавать элементы генетической устойчивости другим членам микробиоты, включая патогены [22]. Серьезной проблемой общественного здравоохранения является то, что с увеличением числа людей, являющихся носителями этих устойчивых штаммов в составе своей нормальной флоры, возрастает вероятность заражения клиническими инфекциями как в обществе, так и в больнице. В нескольких исследованиях изучалась распространенность резистентных E. coli , выделенная из фекалий детей [23,24,25,26,27,28,29,30,31,32,33,34,35,36,37,38] (табл. 5). Показатели резистентности к противомикробным препаратам первой линии, а именно к ампициллину, ТМП-СМЗ и цефалоспоринам первого поколения, составляли 16–100%, 8–100% и 6–10% соответственно. Кроме того, уровень устойчивости к ципрофлоксацину составлял 0–53%, а 2,6–20,3% E. coli были продуцентами БЛРС. Вышеупомянутые исследования имели разные методологии, периоды исследований, размеры выборки и демографические данные, и поэтому их следует сравнивать с осторожностью. Тем не менее, необходимо учитывать важность эпиднадзора за резистентными штаммами для достижения целостной стратегии борьбы с резистентностью.
Тем не менее, необходимо учитывать важность эпиднадзора за резистентными штаммами для достижения целостной стратегии борьбы с резистентностью.
Таблица 5 Резюме 20 исследований фекального носительства E. coli у детей из разных стран
Полная таблица
Настоящее исследование является первым исследованием фекального носительства MDR E. coli общинные дети на Тайване. В этом исследовании были получены высокие показатели нечувствительности к широко используемым противомикробным препаратам, таким как ампициллин, амоксициллин + клавуланат, ТМП-СМЗ и цефазолин (70, 65,6, 47,1 и 32,5% соответственно). Частота нечувствительности к ципрофлоксацину составила примерно 18,3%. Напротив, уровень нечувствительности к относительно редко используемым антибиотикам, которые могли быть назначены только врачами-инфекционистами в медицинских центрах Тайваня, таким как имипенем, амикацин, тигециклин и колистин, составлял 0%. Это явление можно объяснить избирательным давлением, вызванным интенсивным использованием антибиотиков, обычно применяемых как у людей, так и у животных. Следовательно, под давлением чрезмерного использования антибиотиков гены, такие как blaCTX-M, распространяются среди различных видов и штаммов бактерий путем горизонтального переноса генов и, таким образом, способствуют быстрому распространению устойчивости к антибиотикам в сообществе [39].]. В нашем исследовании MDR E. coli составлял 36,9% всех изолятов. Хотя этот процент ниже, чем в Гвинее-Бисау [33], частота нечувствительности к амоксициллину + клавуланату и ципрофлоксацину, а также к ESBL-продуцирующей E. coli все еще выше, чем в развитых странах [28, 36]. .
Следовательно, под давлением чрезмерного использования антибиотиков гены, такие как blaCTX-M, распространяются среди различных видов и штаммов бактерий путем горизонтального переноса генов и, таким образом, способствуют быстрому распространению устойчивости к антибиотикам в сообществе [39].]. В нашем исследовании MDR E. coli составлял 36,9% всех изолятов. Хотя этот процент ниже, чем в Гвинее-Бисау [33], частота нечувствительности к амоксициллину + клавуланату и ципрофлоксацину, а также к ESBL-продуцирующей E. coli все еще выше, чем в развитых странах [28, 36]. .
В нашем предыдущем исследовании 111 младенцев, госпитализированных по поводу ИМП, вызванной ESBL-продуцирующим штаммом E. coli, O25b-ST131 был идентифицирован в 65% изолятов [40]. Среди 111 пациентов 92 изолята принадлежали к группе 9 blaCTX-M, и большинство из них были CTXM-14. Кроме того, большинство пациентов с бактериемией или ИМП ранее были здоровы и не имели явных факторов риска, включая предыдущее применение противомикробных препаратов, госпитализацию, неонатальную инфекцию и основное заболевание. Только 30% детей с ИМП, вызванными этим клоном, имели идентифицируемые факторы риска. Наши результаты подтверждают, что большинство лекарственно-устойчивых инфекций E. coli являются внебольничными, а не внутрибольничными [17, 40, 41]. Кроме того, мы ранее оценили E. coli , выделенная из нескольких рек на юге Тайваня, показала, что наиболее часто выделяемыми клональными комплексами E. coli , продуцирующими БЛРС, были ST10 и ST58, а не основной клон E. coli ST131, продуцирующий БЛРС, который вызывает внебольничных инфекций как во всем мире, так и на Тайване [42]. Напротив, в настоящем исследовании ST131 (7/13) был наиболее частым ESBL-продуцирующим клоном E. coli в стуле детей.
Только 30% детей с ИМП, вызванными этим клоном, имели идентифицируемые факторы риска. Наши результаты подтверждают, что большинство лекарственно-устойчивых инфекций E. coli являются внебольничными, а не внутрибольничными [17, 40, 41]. Кроме того, мы ранее оценили E. coli , выделенная из нескольких рек на юге Тайваня, показала, что наиболее часто выделяемыми клональными комплексами E. coli , продуцирующими БЛРС, были ST10 и ST58, а не основной клон E. coli ST131, продуцирующий БЛРС, который вызывает внебольничных инфекций как во всем мире, так и на Тайване [42]. Напротив, в настоящем исследовании ST131 (7/13) был наиболее частым ESBL-продуцирующим клоном E. coli в стуле детей.
В настоящем исследовании 13 изолятов E. coli продуцировали ESBL, из которых 11 были MDR E. coli , а 69% (9/13) были нечувствительны к ципрофлоксацину. Эти результаты подтверждают вывод о том, что плазмид-опосредованный перенос БЛРС повышает устойчивость к не-β-лактамам, таким как хинолоны, поскольку плазмиды могут содержать гены, придающие устойчивость к нескольким группам антибиотиков [43, 44]. Кроме того, по сравнению с группами, не чувствительными к ESBL и ципрофлоксацину, группы ESBL и группы, не чувствительные к ципрофлоксацину, показали значительно более высокие показатели положительности ST131. Показатели положительности ST131, как правило, были выше в группе с МЛУ, чем в группе без МЛУ (13,8% против 5,1%, p = 0,073). Эти результаты также показали, что клон E. coli ST131 может быть связан с устойчивостью к противомикробным препаратам.
Кроме того, по сравнению с группами, не чувствительными к ESBL и ципрофлоксацину, группы ESBL и группы, не чувствительные к ципрофлоксацину, показали значительно более высокие показатели положительности ST131. Показатели положительности ST131, как правило, были выше в группе с МЛУ, чем в группе без МЛУ (13,8% против 5,1%, p = 0,073). Эти результаты также показали, что клон E. coli ST131 может быть связан с устойчивостью к противомикробным препаратам.
Наше исследование имеет некоторые ограничения. Во-первых, мы использовали дизайн больницы; следовательно, наши результаты нельзя обобщить на здоровых детей в сообществе из-за потенциальной систематической ошибки отбора при включении пациентов. Кроме того, образцы кала в этом исследовании были собраны в течение 3 дней после госпитализации. Передача, приводящая к бессимптомному носительству, может произойти менее чем через 3 дня после госпитализации. Во-вторых, чтобы предотвратить влияние факторов риска на фекальное носительство устойчивых штаммов 9. 0005 E. coli , пациенты, которые получали лечение антибиотиками или были госпитализированы в течение 3 месяцев до сбора образцов, а также пациенты с сопутствующими заболеваниями, были исключены, что привело к возможной недооценке устойчивости к противомикробным препаратам. В-третьих, поскольку болезни зарегистрированных пациентов не были дополнительно классифицированы, мы не могли определить, влияют ли различные заболевания на фекальное носительство и уровень резистентности к противомикробным препаратам E. coli . Например, включение детей с гастроэнтеритом может привести к систематической ошибке, поскольку инфекция может привести к временному изменению кишечной флоры с преобладанием патогенных бактерий. Кроме того, выявление E. coli , основанный на синем цвете CHROMagar™ ECC, может привести к неправильной идентификации, поскольку другие виды, такие как Enterobacter , Klebisella и Citrobacter , также имели синий цвет, что может завышать распространенность Кишечная палочка .
0005 E. coli , пациенты, которые получали лечение антибиотиками или были госпитализированы в течение 3 месяцев до сбора образцов, а также пациенты с сопутствующими заболеваниями, были исключены, что привело к возможной недооценке устойчивости к противомикробным препаратам. В-третьих, поскольку болезни зарегистрированных пациентов не были дополнительно классифицированы, мы не могли определить, влияют ли различные заболевания на фекальное носительство и уровень резистентности к противомикробным препаратам E. coli . Например, включение детей с гастроэнтеритом может привести к систематической ошибке, поскольку инфекция может привести к временному изменению кишечной флоры с преобладанием патогенных бактерий. Кроме того, выявление E. coli , основанный на синем цвете CHROMagar™ ECC, может привести к неправильной идентификации, поскольку другие виды, такие как Enterobacter , Klebisella и Citrobacter , также имели синий цвет, что может завышать распространенность Кишечная палочка . Однако выбор одного изолята на образец для тестирования мог привести к недооценке распространенности E. coli в этом исследовании.
Однако выбор одного изолята на образец для тестирования мог привести к недооценке распространенности E. coli в этом исследовании.
Заключение
Это первое исследование, в котором сообщается о высокой частоте (37%) МЛУ E. coli в стуле общинных детей на юге Тайваня. Двадцать девять изолятов E. coli (18,5%) не были чувствительны к ципрофлоксацину, и примерно 8,3% из E. coli продуцировали БЛРС. O25b-ST131 (7/13) был наиболее распространенной ESBL-продуцирующей клональной группой E. coli в стуле детей. Эти результаты подчеркивают важность разработки программ рационального использования антибиотиков и инфекционного контроля для сокращения ненадлежащего использования антибиотиков и ограничения передачи МЛУ-9.0005 Кишечная палочка .
Сокращения
-
Кишечная палочка
: Кишечная палочка
- БЛРС:
Бета-лактамаза расширенного спектра действия
- МДР:
С множественной лекарственной устойчивостью
- МЛСТ:
Тип многолокусной последовательности
- ТМП-СМЗ:
Триметоприм-сульфаметоксазол
- ИМП:
Инфекции мочевыводящих путей
Ссылки
- «>
Cosgrove SE, Carmeli Y. Влияние устойчивости к противомикробным препаратам на здоровье и экономические результаты. Клин Инфекция Дис. 2003;36(11):1433–7.
Артикул
пабмедGoogle ученый
Николя-Чанойн М.Х., Бланко Дж., Лефлон-Гибу В., Демарти Р., Алонсо М.П., Каника М.М. и др. Межконтинентальное появление Escherichia coli клона O25:h5-ST131, продуцирующего CTX-M-15. J Антимикробная химиотерапия. 2008;61(2):273–81.
Артикул
пабмед
КАСGoogle ученый
Coque TM, Novais Â, Carattoli A, Poire L, Pitout J, Peixe L, et al. Распространение клонально родственных штаммов Escherichia coli , экспрессирующих бета-лактамазу расширенного спектра CTX-M-15.
 Эмердж Инфекция Дис. 2008;14(2):195–200.
Эмердж Инфекция Дис. 2008;14(2):195–200.Артикул
пабмед
ПабМед Центральный
КАСGoogle ученый
Лау С.Х., Редди С., Чизбро Дж., Болтон Ф.Дж., Уиллшоу Г., Чести Т. и др. Основной уропатогенный штамм Escherichia coli , выделенный на северо-западе Англии, идентифицирован мультилокусным типированием последовательности. Дж. Клин Микробиол. 2008;46(3):1076–80.
Артикул
пабмед
ПабМед Центральный
КАСGoogle ученый
Роджерс Б.А., Сиджабат Х.Е., Патерсон Д.Л. Escherichia coli O25b-ST131: пандемический полирезистентный внебольничный штамм. J Антимикробная химиотерапия. 2011;66(1):1–14.
Артикул
пабмед
КАСGoogle ученый
Johnson JR, Johnston B, Clabots C, Kuskowski MA, Pendyala S, Debroy C, et al.
 Escherichia coli типа последовательности ST131 как возникающий устойчивый к фторхинолонам уропатоген среди реципиентов почечного трансплантата. Противомикробные агенты Chemother. 2010;54(1):546–50.
Escherichia coli типа последовательности ST131 как возникающий устойчивый к фторхинолонам уропатоген среди реципиентов почечного трансплантата. Противомикробные агенты Chemother. 2010;54(1):546–50.Артикул
пабмед
КАСGoogle ученый
Учида Ю., Мочимару Т., Морокума Ю., Киёсуке М., Фудзисе М., Это Ф. и др. Клональное распространение в Восточной Азии устойчивых к ципрофлоксацину штаммов Escherichia coli серогруппы O25 и связанных с ними факторов вирулентности. Противомикробные агенты Int J. 2010;35(5):444–50.
Артикул
пабмед
КАСGoogle ученый
Caprioli A, Busani L, Martel JL, Helmuth R. Мониторинг устойчивости бактерий животного происхождения к антибиотикам: эпидемиологические и микробиологические методологии. Противомикробные агенты Int J. 2000;14(4):295–301.
Артикул
пабмед
КАСGoogle ученый
«>Блейк Д.П., Хиллман К., Фенлон Д.Р., Лоу Дж.К. Передача устойчивости к антибиотикам между комменсальными и патогенными представителями Enterobacteriaceae в идеальных условиях. J Appl Microbiol. 2003;95(3):428–36.
Артикул
пабмед
КАСGoogle ученый
Отео Дж., Перес-Васкес М., Кампос Дж. [бета]-лактамазы расширенного спектра, продуцирующие Escherichia coli : изменение эпидемиологии и клиническое воздействие. Curr Opin Infect Dis. 2010;23(4):320–6.
Артикул
пабмед
КАСGoogle ученый
«>Алонсо Дж.Л., Сориано А., Карбахо О., Аморос И., Гарелик Х. Сравнение и восстановление Escherichia coli и термотолерантных колиформных бактерий в воде с хромогенной средой, инкубированной при 41 и 44,5°C. Appl Environ Microbiol. 1999;65(8):3746–9.
ПабМед
ПабМед Центральный
КАСGoogle ученый
Институт клинических лабораторных стандартов. Стандарты эффективности для тестирования чувствительности к противомикробным препаратам, 19Информационное приложение М100-С19.
 Уэйн, Пенсильвания: Институт клинических лабораторных стандартов; 2009.
Уэйн, Пенсильвания: Институт клинических лабораторных стандартов; 2009.Google ученый
Маджиоракос А.П., Шринивасан А., Кэри Р.Б., Кармели И., Фалагас М.Э., Гиске К.Г., Харбарт С., Хиндлер Дж.Ф., Калметер Г., Олссон-Лильеквист Б., Патерсон Д.Л., Райс Л.Б., Стеллинг Дж., Струэленс М.Дж., Ватопулос А. , Вебер Дж.Т., Монне Д.Л. Бактерии с множественной лекарственной устойчивостью, широкой лекарственной устойчивостью и панлекарственной устойчивостью: предложение международного эксперта по временным стандартным определениям приобретенной устойчивости. Клин Микробиол Инфект. 2012;18(3):268–81.
Артикул
пабмед
КАСGoogle ученый
Chung HC, Lai CH, Lin JN, Huang CK, Liang SH, Chen WF, et al. Бактериемия, вызванная клонами Escherichia coli , продуцирующими бета-лактамазы расширенного спектра, типа ST131 и не-ST131: сравнение демографических данных, клинических особенностей и смертности.
 Противомикробные агенты Chemother. 2012;56(2):618–22.
Противомикробные агенты Chemother. 2012;56(2):618–22.Артикул
пабмед
ПабМед Центральный
КАСGoogle ученый
Клермон О., Лаволле М., Вимон С., Дешам С., Форестье С., Бранже С. и др. Диффундирующий клон Escherichia coli , продуцирующий CTX-M-15, принадлежит к высоковирулентной филогенетической подгруппе B2. J Антимикробная химиотерапия. 2008;61(5):1024–8.
Артикул
пабмед
КАСGoogle ученый
Сиджабат Х.Э., Патерсон Д.Л., Адамс-Хадуч Дж.М., Эван Л., Паскулле А.В., Муто К.А. и др. Молекулярная эпидемиология CTX-M-продуцирующих Изоляты Escherichia coli в третичном медицинском центре в западной Пенсильвании. Противомикробные агенты Chemother. 2009;53(11):4733–9.
Артикул
пабмед
ПабМед Центральный
КАСGoogle ученый
«>Dallenne C, Da Costa A, Decre D, Favier C, Arlet G. Разработка набора мультиплексных ПЦР-анализов для обнаружения генов, кодирующих важные бета-лактамазы в Enterobacteriaceae . J Антимикробная химиотерапия. 2010;65(3):490–5.
Артикул
пабмед
КАСGoogle ученый
Макферсон А.Дж., Харрис Н.Л. Взаимодействие между комменсальными кишечными бактериями и иммунной системой. Нат Рев Иммунол. 2004;4(6):478–85.
Артикул
пабмед
КАСGoogle ученый
«>Бартолони А., Каттс Ф., Леони С., Остин К.С., Мантелла А., Гульельметти П. и др. Модели использования противомикробных препаратов и устойчивость к противомикробным препаратам среди здоровых детей в Боливии. Тропикал Мед Инт Здоровье. 1998;3(2):116–23.
Артикул
КАСGoogle ученый
Zhang XL, Wang F, Zhu DM, Wu S, Wu PC, Chen YD и др. Носительство Escherichia coli , устойчивой к антибиотикам, у здорового населения в Шанхае. Биомед Окружающая среда Sci. 1998;11(4):314–20.
ПабМед
КАСGoogle ученый
«>Бартолони А., Паллекки Л., Бенедетти М., Фернандес С., Вальехос Ю., Гусман Э. и др. Комменсал Escherichia coli с множественной лекарственной устойчивостью у детей, Перу и Боливия. Эмердж Инфекция Дис. 2006;12(6):907–13.
Артикул
пабмед
ПабМед ЦентральныйGoogle ученый
Lietzau S, Raum E, von Baum H, Marre R, Brenner H. Бытовые контакты были ключевым фактором колонизации детей резистентной Escherichia coli в общественных условиях. Дж. Клин Эпидемиол. 2007;60(11):1149–55.
Артикул
пабмедGoogle ученый
«>Ruppe E, Woerther PL, Diop A, Sene AM, Da Costa A, Arlet G, et al. Носительство СТХ-М-15-продуцирующих изолятов кишечной палочки среди детей, проживающих в отдаленной деревне в Сенегале. Противомикробные агенты Chemother. 2009;53(7):3135–7.
Артикул
пабмед
ПабМед Центральный
КАСGoogle ученый
Гимарайнш Б., Баррето А., Радуани Х., Фигейредо Н., Гаспар Э., Родригес Дж. и др. Генетическое выявление изолятов Escherichia coli , содержащих бета-лактамазы расширенного спектра действия, и энтерококков, устойчивых к ванкомицину, в образцах фекалий здоровых детей.
 Устойчивость к микробным препаратам. 2009;15(3):211–6.
Устойчивость к микробным препаратам. 2009;15(3):211–6.Артикул
КАСGoogle ученый
Dyar OJ, Hoa NQ, Trung NV, Phuc HD, Larsson M, Chuc NT, et al. Высокая распространенность устойчивости к антибиотикам у комменсалов Escherichia coli среди детей в сельской местности Вьетнама. BMC Infect Dis. 2012;12:92–9.
Артикул
пабмед
ПабМед Центральный
КАСGoogle ученый
Isendahl J, Turlej-Rogacka A, Manjuba C, Rodrigues A, Giske CG, Naucler P. Фекальное носительство ESBL-продуцирующих E. coli и K. pneumoniae у детей в Гвинее-Бисау: больница на основе перекрестного исследования. ПЛОС Один. 2012;7(12):e51981.
Артикул
пабмед
ПабМед Центральный
КАСGoogle ученый
Каарме Дж., Молин Ю., Олсен Б.
 , Мельхус А. Распространенность Enterobacteriaceae , продуцирующих бета-лактамазы расширенного спектра, у здоровых шведских детей дошкольного возраста. Акта Педиатр. 2013;102(6):655–60.
, Мельхус А. Распространенность Enterobacteriaceae , продуцирующих бета-лактамазы расширенного спектра, у здоровых шведских детей дошкольного возраста. Акта Педиатр. 2013;102(6):655–60.Артикул
пабмедGoogle ученый
Ахмед С.Ф., Али МММ, Мохамед З.К., Мусса Т.А., Клена Д.Д. Фекальное носительство β-лактамаз расширенного спектра и AmpC-продуцирующих Escherichia coli в ливийской общине. Энн Клин Микроб Антимикроб. 2014;13:22–9.
Артикул
КАСGoogle ученый
Блан В., Лефлон-Гибу В., Бланко Дж., Хенни М., Мадек Дж. Ю., Рафиньон Г. и др. Распространенность детей из детских садов (Франция) с фекалиями, продуцирующими CTX-M Escherichia coli , включающими штаммы O25b:h5 и O16:H5 ST131. J Антимикробная химиотерапия. 2014;69(5):1231–1237.
Артикул
пабмед
КАСGoogle ученый
«>Стёссер Н., Шаяхеуанг С., Вонгсуват М., Фоммасон К., Эллиотт И., Дель Охо Элиас С. и др. Колонизация с Enterobacteriaceae , продуцирующие БЛРС у детей, посещающих детские дошкольные учреждения в Лаосской Народно-Демократической Республике. J Антимикробная химиотерапия. 2015; 70 (6): 1893–1897.
ПабМед
ПабМед Центральный
КАСGoogle ученый
Хоки PM, Джонс AM. Меняющаяся эпидемиология резистентности. J Антимикробная химиотерапия. 2009; 64 (Приложение 1): i3–10.

Артикул
пабмед
КАСGoogle ученый
Cheng MF, Chen WL, Hung WY, Huang IF, Chiou YH, Chen YS, et al. Появление Escherichia coli O25b-ST131, продуцирующих бета-лактамазы расширенного спектра: основного внебольничного уропатогена у младенцев. Pediatr Infect Dis J. 2015;34(5):469–75.
Артикул
пабмедGoogle ученый
Ву Ю. Х., Ченг М. Ф., Лай Ч., Линь Х. Х., Хун Ч., Ван Д. Л. Роль типа последовательности (ST) 131 во внебольничных заболеваниях у взрослых, не продуцирующих БЛРС Бактериемия Escherichia coli . BMC Infect Dis. 2014;14:579.
Артикул
пабмед
ПабМед Центральный
КАСGoogle ученый
Chen PA, Hung CH, Huang PC, Chen JR, Huang IF, Chen WL, et al. Характеристики штаммов Escherichia coli , продуцирующих бета-лактамазы расширенного спектра действия CTX-M, выделенных из нескольких рек на юге Тайваня.
 Appl Environ Microbiol. 2016;82(6):1889–97.
Appl Environ Microbiol. 2016;82(6):1889–97.Артикул
пабмед
ПабМед Центральный
КАСGoogle ученый
Леви С.Б., Маршалл Б. Устойчивость к антибиотикам во всем мире: причины, проблемы и ответы. Нат Мед. 2004; 10 (12 Дополнение): S122–9.
Артикул
пабмед
КАСGoogle ученый
Маммери Х., Ван Де Лоо М., Пуарель Л., Мартинес-Мартинес Л., Нордманн П. Возникновение плазмид-опосредованной устойчивости к хинолонам у Escherichia coli в Европе. Противомикробные агенты Chemother. 2005;49(1):71–6.
Артикул
пабмед
ПабМед Центральный
КАСGoogle ученый
Mandell GL, Bennett JE, Mandell DR. Принципы и практика инфекционных заболеваний Дугласа и Беннета. 7-е изд. Филадельфия, Пенсильвания: Черчилль Ливингстон/Эльзевир; 2010.
Google ученый
Карами Н., Мартнер А., Энне В.И., Сверкерссон С., Адлерберт И., Уолд А.Е. Перенос гена устойчивости к ампициллину между двумя штаммами Escherichia coli в микробиоте кишечника младенца, получавшего антибиотики. J Антимикробная химиотерапия. 2007;60(5):1142–5.
Артикул
пабмед
КАС
Google ученый
Rivard-Yazigi L, Zahar JR, Le Guillou S, Chalouhi C, Lecuyer H, Bureau C, Nassif X, Gendrel D, Abadie V. Факторы риска, связанные с носительством энтеробактерий, продуцирующих бета-лактамазы расширенного спектра, при поступлении в когорте младенцев в третичной клинической больнице во Франции. Am J Infect Control. 2013;41(9):844–5.
Артикул
пабмед
Google ученый
Chia JH, Chu C, Su LH, Chiu CH, Kuo AJ, Sun CF, et al. Разработка мультиплексной ПЦР и системы обнаружения мутаций кривой плавления SHV для обнаружения некоторых бета-лактамаз SHV и CTX-M Escherichia coli , Klebsiella pneumoniae и Enterobacter cloacae на Тайване. Дж. Клин Микробиол. 2005;43(9):4486–91.
Артикул
пабмед
ПабМед Центральный
КАС
Google ученый
Ревз Р.Р., Мюррей Б.Е., Пикеринг Л.К., Прадо Д., Мэддок М., Бартлетт А.В. 3-й. Дети с фекалиями, устойчивыми к триметоприму и ампициллину Escherichia coli в детских садах. J заразить Dis. 1987;156(5):758–62.
Артикул
пабмед
КАС
Google ученый
Заиди М.Б., Замора Э., Диаз П., Толлефсон Л., Федорка-Крей П.Дж., Хедрик М.Л. Факторы риска фекальной резистентности к хинолонам Escherichia coli у мексиканских детей. Противомикробные агенты Chemother. 2003;47(6):1999–2001.
Артикул
пабмед
ПабМед Центральный
КАС
Google ученый
Сейдман Дж. К., Анита К. П., Канунго Р., Буржуа А. Л., Коулз К. Л. Факторы риска антибиотикорезистентной E. coli у детей в сельской местности. Эпидемиол инфекции. 2009 г.;137(6):879–88.
Артикул
пабмед
КАС
Google ученый
Fernandez-Reyes M, Vicente D, Gomariz M, Esnal O, Landa J, Onate E, et al. Высокий уровень фекального носительства Escherichia coli , продуцирующего расширенный спектр бета-лактамаз, у здоровых детей в Гипускоа, северная Испания. Противомикробные агенты Chemother. 2014;58(3):1822–4.
Артикул
пабмед
ПабМед Центральный
КАС
Google ученый
Ссылки на скачивание
Финансирование
Это исследование было поддержано грантами Гаосюнской больницы общего профиля для ветеранов, Тайвань (VGHNSU104–004 для И-Фей Хуан) и Министерства науки и технологий Тайваня (MOST 104–2314-B). -075B-003 -MY3 — Мин-Фан Ченгу). Спонсоры не играли никакой роли в разработке исследования, сборе и интерпретации данных или решении опубликовать исследование.
-075B-003 -MY3 — Мин-Фан Ченгу). Спонсоры не играли никакой роли в разработке исследования, сборе и интерпретации данных или решении опубликовать исследование.
Наличие данных и материалов
Наборы данных, созданные и/или проанализированные в ходе текущего исследования, будут предоставлены соответствующим автором по обоснованному запросу.
Информация об авторе
Примечания автора
И-Фей Хуан и Вей-Ян Ли внесли равный вклад в эту работу.
Авторы и организации
Отделение педиатрии, Гаосюнская больница общего профиля для ветеранов, № 386, Ta-Chung 1st Road, Гаосюн, 81362, Тайвань
И-Фэй-Джу-Хуан, Ху, Хун-Сян Hung, Ying-Tso Shen & Ming-Fang Cheng
Медицинский факультет, Национальный университет Ян-Мин, Тайбэй, Тайвань
И-Фей Хуан, Вен-Чи Чен и Мин-Фан Ченг
Университет медицинских технологий Чунг Хва, Тайнань, Тайвань
И-Фей Хуан
Объединенная педиатрическая больница, Гаосюн , Тайвань
Wei-Yang Lee
Кафедра внутренних болезней, Медицинский колледж, Госпиталь Национального университета Ченг Кунг, Национальный университет Ченг Кунг, Тайнань, Тайвань
Jiun-Ling Wang
Медицинский факультет, Медицинский колледж, Национальный университет Ченг Кунг, Тайнань, Тайвань
Jiun-Ling Wang
Факультет химического машиностроения и Институт биотехнологии и химического машиностроения, Университет И-Шоу, Гаосюн, Тайвань
Chih-Hsin Hung & Wan-Yu Hung
Отделение гастроэнтерологии, отделение медицины, Гаосюнский госпиталь для ветеранов, Гаосюн, Тайвань
Wen-Chi Chen
Fooyin University, Kaohsiung, Taiwan
Ming-Fang Cheng
Авторы
- I-Fei Huang
Посмотреть публикации автора
Вы также можете искать этого автора в
PubMed Google Scholar - Wei-Yang Lee
Просмотр публикаций автора
Вы также можете искать этого автора в
PubMed Google Scholar - Jiun-Ling Wang
Посмотреть публикации автора
Вы также можете искать этого автора в
PubMed Google Scholar - Chih-Hsin Hung
Посмотреть публикации автора
Вы также можете искать этого автора в
PubMed Google Scholar - Hong-Hsiang Hu
Просмотр публикаций автора
Вы также можете искать этого автора в
PubMed Google Scholar - Wan-Yu Hung
Просмотр публикаций автора
Вы также можете искать этого автора в
PubMed Google Академия - Yun-Ju Hung
Посмотреть публикации автора
Вы также можете искать этого автора в
PubMed Google Scholar - Wen-Chi Chen
Просмотр публикаций автора
Вы также можете искать этого автора в
PubMed Google Scholar - Ying-Tso Shen
Просмотр публикаций автора
Вы также можете искать этого автора в
PubMed Google Scholar - Ming-Fang Cheng
Посмотреть публикации автора
Вы также можете искать этого автора в
PubMed Google Scholar
Contributions
IFH и WYL внесли равный вклад в это исследование. IFH внесла большой вклад в составление рукописи. WYL выполнил поиск статьи. MFC и JLW выполнили анализ и интерпретацию данных. HHH, WCC и YTS собрали образцы стула. CHH и WYH выполнили микробиологические лабораторные процедуры. YJH провел статистический анализ. Все авторы прочитали и одобрили рукопись и порядок авторов.
IFH внесла большой вклад в составление рукописи. WYL выполнил поиск статьи. MFC и JLW выполнили анализ и интерпретацию данных. HHH, WCC и YTS собрали образцы стула. CHH и WYH выполнили микробиологические лабораторные процедуры. YJH провел статистический анализ. Все авторы прочитали и одобрили рукопись и порядок авторов.
Автор, ответственный за переписку
Переписка с
Мин-Фан Ченг.
Декларации этики
Утверждение этических норм и согласие на участие
Это исследование было одобрено Институциональным наблюдательным советом Гаосюнского госпиталя для ветеранов (VGHKS14-CT3–09). Все участники (их родители или законные опекуны в случае детей в возрасте до 16 лет) предоставили письменное информированное согласие.
Конкурирующие интересы
Авторы заявляют об отсутствии конкурирующих интересов.
Примечание издателя
Springer Nature остается нейтральной в отношении юрисдикционных претензий в опубликованных картах и институциональной принадлежности.
Дополнительный файл
Дополнительный файл 1:
Таблица S1. Пороговые значения минимальной ингибирующей концентрации для Enterobacteriaceae. (DOCX 16 КБ)
Права и разрешения
Открытый доступ Эта статья распространяется в соответствии с условиями международной лицензии Creative Commons Attribution 4.0 (http://creativecommons.org/licenses/by/4.0/), которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии, что вы укажете первоначальных авторов и источник, предоставите ссылку на лицензию Creative Commons и укажете, были ли внесены изменения. Отказ от права Creative Commons на общественное достояние (http://creativecommons.org/publicdomain/zero/1.0/) применяется к данным, представленным в этой статье, если не указано иное.
Перепечатки и разрешения
Об этой статье
Escherichia coli Диарея | SpringerLink
- «>
Джайлз, К., Сангстер, Г. и Смит, Дж., Эпидемический гастроэнтерит младенцев в Абердине в течение 19 лет.47, Арх. Дис. Ребенок.
24 : 45–53 (1949).ПабМед
КАСGoogle ученый
Тейлор Дж., Пауэлл Б.В. и Райт Дж. Детская диарея и рвота: клиническое и бактериологическое исследование, Br. Мед. Дж.
2 : 117–125 (1949).ПабМед
КАСGoogle ученый
Ewing, WH, (ed.), The genus Escherichia in: Edward’s and Ewing’s Identification of Enterobacteriaceae , 4-е изд.
 , стр. 93–134, Elsevier, New York, 1986.
, стр. 93–134, Elsevier, New York, 1986.Google ученый
Кауфман, Ф., Серология группы катушки , J. Immunol.
57 : 71–100 (1947).Google ученый
Kaufmann, F., и DuPont, A.J., штаммы Escherichia от детского эпидемического гастроэнтерита, Acta Pathol. микробиол. Сканд.
27 : 552–564 (1950).Google ученый
Taylor, J., Wilkins, M.P., and Payne, J.M., Отношения реакции кишечника кролика на энтеропатогенные Escherichia coli , Br. Дж. Эксп. Патол.
42 :43–52 (1961).ПабМед
КАСGoogle ученый
Роу Б., Тейлор Дж. и Беттельхейм К. А., Исследование диареи путешественников, Lancet
1 : 1–5 (1970).
ПабМед
КАСGoogle ученый
Smith, H.W., and Gyles, C.L., Связь между двумя явно различными энтеротоксинами, продуцируемыми энтеропатогенными штаммами Escherichia coli свиного происхождения, J. Med. микробиол.
3 : 387–401 (1970).ПабМед
КАСGoogle ученый
DuPont, H.L., Formal, S.B., Hornick, R.B., Snyder, MJ, Libonati, J.P., Sheahan, D.G., LaBrec, E.H., and Kalas, J.P., Pathogenesis Escherichia coli диарея, N. Engl. Дж. Мед.
285 : 1–9 (1971).ПабМед
КАСGoogle ученый
Горбач С.Л., Банвелл Дж.Г., Чаттерджи Б.Д., Джейкобс Б. и Сак Р.Б., Острая недифференцированная диарея человека в тропиках. I. Изменения кишечной микрофлоры .J. клин.
 Инвестировать . 50 : 881–889 (1971).
Инвестировать . 50 : 881–889 (1971).ПабМед
КАСGoogle ученый
Сак, Р. Б., Горбач, С. Л., Банвелл, Дж. Г., Джейкобс, Б., Чаттерджи, Б. Д., и Митра, Р., Энтеротоксигенные Escherichia coli , выделенная от больных тяжелым холероподобным заболеванием, J. Infect. Дис.
123 : 378–385 (1971).ПабМед
КАСGoogle ученый
Evans, D.J., Jr., Evans, D.G., и DuPont, H.L., Факторы вирулентности энтеротоксигенных Escherichia coli , J. Infect. Дис.
136 : 5118–5123 (1977).Google ученый
Ogawa, H., Nakamura, A. и Sakazaki, R., Патогенные свойства «энтеропатогенных» Escherichia coli от диареи у детей и взрослых, Jpn. Дж. Мед. науч. биол.

21 : 333–349 (1968).ПабМед
КАСGoogle ученый
Trabulsi, L.R., and de Toledo, M.R.F., Escherichia coli серогруппы 0115, выделенная от пациентов с энтеритом: биохимические характеристики и экспериментальная патогенность, Ред. Инст. Мед.
Троп. Сан-Пало
11 : 358–362 (1969).КАС
Google ученый
Gordillo, M.E., Reeve, G.R., Pappas, J., Mathewson, J.J., DuPont, H.L., и Murray, B.E., Молекулярная характеристика штаммов энтероинвазивных Escherichia coli , J. Clin. микробиол.
30 : 889–893 (1992).ПабМед
КАСGoogle ученый
Мариер, Р., Уэллс, Дж. Г., Суонсон, Р. К., Каллахан, В., и Мелман, И.
 Дж., Вспышка энтеропатогенного Escherichia coli пищевого отравления, связанного с импортным французским сыром, Lancet
Дж., Вспышка энтеропатогенного Escherichia coli пищевого отравления, связанного с импортным французским сыром, Lancet
2 : 1376–1378 (1973).Google ученый
Tulloch, E.F., Jr., Ryan, K.J., Formal, S.B., and Franklin, F.A., Инвазивные энтеропатогенные Escherichia cols дизентерия: Вспышка у 28 взрослых, Ann. Стажер Мед.
79 : 13–17 (1973).ПабМед
Google ученый
Райли, Л. В., Ремис, Р. С., Хелгерсон, С. Д., МакГи, Х. Б., Уэллс, Дж. Г., Дэвис, Б. Р., Герберт, Р. Дж., Олкотт, Э. С., Джонсон, Л. М., Харгретт, Н. Т., Блейк, П. А., и Коэн , ML, Геморрагический колит, связанный с редким серотипом Escherichia coli , N. Engl. Дж. Мед.
308 : 681–685 (1983).ПабМед
КАСGoogle ученый
«>Борис М., Томасон Б. М., Хайнс В. Д., Монтегю Т. С. и Селлерс Т. Ф., Общественная эпидемия энтеропатогенных Escherichia Coil O126:B16:NM гастроэнтерит, связанный с бессимптомной респираторной инфекцией, Педиатрия
33 : 18–29 (1964).ПабМед
КАСGoogle ученый
Кесснер, Д. М., Шонесси, Х. Дж., Гугинс, Дж., Расмуссен, К. М., Роуз, М. Дж., Маршалл, А. Л., младший, Андельман, С. Л., Холл, Дж. Б., и Розенблом, П. Дж., Массовая вспышка диарея вследствие энтеропатогенной Escherichia tali O111:B4.
 I. Эпидемиологические исследования, Am. Дж. Хиг.
I. Эпидемиологические исследования, Am. Дж. Хиг.
76 : 27–43 (1962).ПабМед
КАСGoogle ученый
Drucker, M.M., Poliack, A., Yevien, R. и Sacks, T.G., Иммунофлуоресцентная демонстрация энтеропатогенных Escherichia
coli в тканях младенцев, умирающих от энтерита, Педиатрия
46 : 855–864 (1970).ПабМед
КАСGoogle ученый
Белл, Б. П., Голдофт, М., Гриффин, П. М., Дэвис, М. А., Гордон, Д. К., Тарр, П. И., Бартлесон, К. А., Льюис, Дж. Х., Барретт, Т. Дж., Уэллс, Дж. Г., Барон, Р., и Кобаяши, Дж., Вспышка Escherichia coli O157:H7, связанная с кровавой диареей и гемолитико-уремическим синдромом, связанная с гамбургерами, в нескольких штатах. Опыт Вашингтона, J. Am. Мед. доц.
274 : 1349–1353 (1994).
Google ученый
Натаро, Дж. П., Бальдини, М. М., Капер, Дж. Б., Блэк, Р. Э., Браво, Н. и Левин, М. М., Определение фактора прилипания энтеропатогенных штаммов Escherichia coli с помощью ДНК-зонда, Дж. , Заразить. Дис.
152 : 560–565 (1985).ПабМед
КАСGoogle ученый
Gustafsson, B., and Mollby, R., GM1 ганглиозидный иммуноферментный анализ для обнаружения термолабильного энтеротоксина, продуцируемого человеческими и свиными штаммами Escherichia coli , J. Clin. микробный.
15 : 298–301 (1982).КАС
Google ученый
Томпсон М.Р., Брандвейн Х., Лабин-Ракке М. и Джаннела Р.А. Простой и надежный иммуноферментный анализ с моноклональными антителами для обнаружения Escherichia coli термостабильные энтеротоксины, J.
 Clin. микробиол.
Clin. микробиол.
20 : 59–64 (1984).ПабМед
КАСGoogle ученый
Мозли С. Л., Эчеверрия П., Сериватана Дж., Тирапат К., Чайкумпа В. и Фалькоу С. Идентификация энтеротоксигенных Escherichia coli путем гибридизации колоний с использованием трех генных зондов, Дж. Заразить. Дис.
145 : 863–869 (1982).Google ученый
Серени, Б., Экспериментальный шигеллезный кератоконъюнктивит: предварительный отчет, ActaMicrobiol. акад. науч. Повесили.
2 : 293–296 (1955).КАС
Google ученый
Boileau, C.R., d’Hauteville, H.M., and Sansonetti, P.J., Метод гибридизации ДНК для обнаружения Shigella видов и энтероинвазивных Escherichia coli ,J.
 клин. микробиол. 20 : 959–961 (1984).
клин. микробиол. 20 : 959–961 (1984).ПабМед
КАСGoogle ученый
Farmer, J.J., Jr., and Davis, B.R., Среда для ферментации антисыворотки и сорбита H7: метод скрининга в одной пробирке для выявления Escherichia coli O157:H7, связанных с геморрагическим колитом, J. Clin. микробиол.
22 :620–625 (1985).ПабМед
Google ученый
O’Brien, A.D., Lively, T.A., и Chen, M.S., Штаммы Escherichia coli O157:H7, связанные с геморрагическим колитом в США, продуцируют Shigella dysenteriae 1 (Shiga)-подобный цитотоксин , Ланцет
1 :702 (1983).ПабМед
Google ученый
Winsor, D.K., Jr., Mathewson, J.J., и DuPont, H.L., Вестерн-блот-анализ кишечного секреторного IgA-ответа на Антигены Campylobacter tejuni у пациентов с естественно приобретенным энтеритом Campylobacter , Гастроэнтерология
90 : 1217–1222 (1986).
ПабМед
Google ученый
Ferguson, W. W., and June, R. C., Эксперименты по кормлению взрослых добровольцев Escherichia coli 111, B4, кишечной палочкой, вызывающей диарею у младенцев, Am. Дж. Хиг.
55 : 155–169 (1952).ПабМед
КАСGoogle ученый
Джун, Р. К., Фергюсон, В. В., и Ворфель, М. Т., Эксперименты по кормлению взрослых добровольцев Escherichia coli 55, B5, колиформный организм, вызывающий диарею у младенцев, Am. Дж. Хиг.
57 : 222–236 (1953).ПабМед
КАСGoogle ученый
Donta, S.T., Sack, D.A., Wallacer, B., DuPont, H-.L., и Sack, R.B., Тканевой культуральный анализ антител к термолабильным энтеротоксинам Escherichia coli , N.
 Engl. Дж. Мед.
Engl. Дж. Мед.
291 : 117–121 (1974).ПабМед
КАСGoogle ученый
Evans, D.J., Jr., Ruiz-Palacios, G., Evans, D.C., DuPont, H.L., Pickering, L.K., и Olarte, J., Гуморальный иммунный ответ на термолабильный энтеротоксин Escherichia coli при естественной диарее и определении антитоксина методом пассивного иммунного гемолиза, Infect. Иммун.
16 : 781–788 (1977).ПабМед
Google ученый
Сак, Р. Б., Джейкобс, Б. и Митра, Р., Реакция антитоксинов на инфекции энтеротоксигенными Escherichia coli , J. Infect. Дис.
129 :330–335 (1974).ПабМед
КАСGoogle ученый
Ruiz-Palacios, G.M., Evans, D.G., Evans, D.J., Jr., и DuPont, H.
 L. Иммуноферментный анализ (ИФА) для обнаружения антител к термолабильным энтеротоксинам Escherichia coli , Абсте Анну. Встретиться. Являюсь. соц. микробиол. р. 60 (1978).
L. Иммуноферментный анализ (ИФА) для обнаружения антител к термолабильным энтеротоксинам Escherichia coli , Абсте Анну. Встретиться. Являюсь. соц. микробиол. р. 60 (1978).Google ученый
Дитц, Т.Р., Эванс, Д.Дж., младший, Эванс, Д.Г., и Дюпон, Х.Л., Серологические реакции на соматические антигены O и антигены фактора колонизации энтеротоксигенных Escherichia coli у путешественников, J. Infect. Дис.
140 : 114–118 (1979).ПабМед
КАСGoogle ученый
DuPont, H.L., Hornick, R.B., Dawkins, A.T., Snyder, MJ, and Formal, S.B. Реакция человека на вирулентный Shigella fiexneri 2a, J. Infect. Дис.
119 : 296–299 (1969).Google ученый
Greatorex, J.
 S., and Thorne, G. M., Гуморальные иммунные реакции на шига-подобные токсины и липополисахарид Escherichia coli O157:H7 у пациентов с гемолитико-уремическим синдромом и здоровых субъектов, J. Clin. микробиол.
S., and Thorne, G. M., Гуморальные иммунные реакции на шига-подобные токсины и липополисахарид Escherichia coli O157:H7 у пациентов с гемолитико-уремическим синдромом и здоровых субъектов, J. Clin. микробиол.
32 : 1172–1178 (1994).ПабМед
КАСGoogle ученый
Neter, E., and Shumway, C.N., E. coli серотип D433: Появление в кишечнике и дыхательных путях, культуральные особенности, чувствительность к антибиотикам, Проц. соц. Эксп. биол. Мед.
75 : 504–507 (1950).ПабМед
КАСGoogle ученый
Levine, M.M., Bergquist, E.J., Nalin, D.R., Waterman, D.H., Homick, R.B., Young, C.R., Scotman, S., and Rowe, R., штаммы Escherichia coli , вызывающие диарею, но не продуцируют термолабильные или термостабильные энтеротоксины и являются неинвазивными, Lancet
1 : 1119–1122 (1978).
ПабМед
КАСGoogle ученый
Эдельман Р. и Левин М. М., Резюме семинара по энтеропатогенным Escherichia coli , J. Infect. Дис.
147 : 1108–1118 (1983).ПабМед
КАСGoogle ученый
Ротбаум Р., МакАдамс А. Дж., Джанелла Р. и Партин Дж. К., Клинико-патологическое исследование энтероцитарно-адгезивных Escherichia cols: Причина затяжной диареи у младенцев, Гастроэнтерология
83 : 441–454 (1982).ПабМед
КАСGoogle ученый
Cravioto, A., Gross, R.J., Scotland, S.M., and Rowe, B., Адгезивный фактор, обнаруженный в штаммах Escherichia coli , принадлежащих к традиционным энтеропатогенным серотипам, Curr. микробиол.
3 : 95–99 (1979).
Google ученый
Scaletsky, I.C.A., Silva, M.L.M., и Trabulsi, L.R., Отличительные особенности прикрепления энтеропатогенных Escherichia tali к клеткам HeLa, Infect. Иммун.
45 : 534–536 (1984).ПабМед
КАСGoogle ученый
Baldini, M.M., Kaper, J.B., Levine, M.M., Candy, D.C.A., и Moon, H.W., Плазмид-опосредованная адгезия при энтеропатогенных Escherichia coli , J. Pediatr. Гастроэнтерол. Нутр.
2 : 534–538 (1983).ПабМед
КАСGoogle ученый
Мэтьюсон, Дж. Дж., Джонсон, П. С., Дюпон, Х. Л., Морган, Д. Р., Торнтон, С. А., Вуд, Л. В., и Эрикссон, С. Д., Недавно признанная причина диареи путешественников: Enteroadherent Escherichia coli , J , Заразить.
 Дис.
Дис.
151 : 471–475 (1985).ПабМед
КАСGoogle ученый
Mathewson, J.J., Johnson, P.C., DuPont, H.L., Satterwhite, T.K., and Winsor, D.K., Патогенность энтероадгезивных Escherichia coli , изученных у взрослых добровольцев, J. Infect. Дис.
154 : 524–527 (1986).ПабМед
КАСGoogle ученый
Mathewson, J.J., Oberhelman, R.A., DuPont, H.L., de la Cabada, FJ, and Garibay, E.V., Enteroadherent Escherichia coli как причина диареи у детей в Мексике, J. Clin. микробиол.
25 : 1917–1919 (1987).ПабМед
КАСGoogle ученый
Левин, М. М., Капер, Дж. Б., Блэк, Р. Э., и Клементс, М. Л., Новые знания о патогенезе бактериальных кишечных инфекций применительно к разработке вакцин, Микробиолог.
 Ред.
Ред.
47 : 510–550 (1983).ПабМед
КАСGoogle ученый
Karch, H., Heeseman, J., Laufs, R., O’Brien, A.D., Tacket, C.O., и Levine, M.M. Плазмида энтерогеморрагической Escherichia coli O157:H7 необходима для экспрессии новый фимбриальный антиген и адгезия к эпителиальным клеткам, Infect. Иммун.
55 :455–461 (1987).ПабМед
КАСGoogle ученый
Белнап, В. Д., и О’Доннелл, Дж. Дж., Эпидемический гастроэнтерит, вызванный Escherichia coli 0–111: обзор литературы с эпидемиологическими, бактериологическими и клиническими данными о крупной вспышке, J. Pediatr .
47 : 178–193 (1955).ПабМед
КАСGoogle ученый
Gurwith, M.
 , Hinde, D., Gross, R. и Rowe, B., Проспективное исследование энтеропатогенных Escherichia coli при эндемическом диарейном заболевании, J. Infect. Дис.
, Hinde, D., Gross, R. и Rowe, B., Проспективное исследование энтеропатогенных Escherichia coli при эндемическом диарейном заболевании, J. Infect. Дис.
137 : 292–297 (1978).ПабМед
КАСGoogle ученый
Пал, С., Рао, С. К., Кереселидзе, Т., Кришнасвами, А. К., Мурти, Д. К., Пандит, К. Г., и Шривастав, Дж. Б., Обширная вспышка энтеропатогенной инфекции в сообществе Escherichia coli O86:B7 гастроэнтерит, Bull. ВОЗ
41 : 851–858 (1969).ПабМед
КАСGoogle ученый
Echeverria, P., Blacklow, N.R., и Smith, D.H., Роль термолабильных токсигенных Escherichia coli и реовирусоподобных агентов при диарее у бостонских детей, Lancet
2 : 1113–1116 (1975).ПабМед
КАСGoogle ученый
«>Гурвит, М. Дж., и Уильямс, Т. В., Гастроэнтерит у детей: двухлетний обзор в Манитобе. I. Этиология, J. Infect. Дис.
136 : 239–247 (1977).ПабМед
КАСGoogle ученый
Капикян А.З., Ким Х.В. и Вятт Р.Г. Реовирусоподобный агент человека как основной патоген, связанный с «зимним» гастроэнтеритом у госпитализированных младенцев и детей младшего возраста, N. Engl. Дж. Мед.
294 : 965–972 (1976).ПабМед
КАСGoogle ученый
«>Макдональд, К. Л., Эйдсон, М., Стромейер, К., Леви, М. Э., Уэллс, Дж. Г., Пур, Н. Д., Ваксмут, К., Харгретт, Н. Т., и Коэн, М. Л., Вспышка желудочно-кишечного заболевания в нескольких штатах вызванные энтеротоксигенными Escherichia coli в импортном полумягком сыре, J. Infect. Дис.
151 : 716–720 (1985).ПабМед
КАСGoogle ученый
Розенберг, М. И., Коплан, Дж. П., Ваксмут, И. К., Уэллс, Дж. Г., Гангароса, И. Дж., Геррант, Р. Л. и Сак, Д. А., Эпидемическая диарея в Кратер-Лейк от энтеротоксигенного Escherichia coli: Крупный переносимый водой вспышка, Ann.
 Стажер Мед.
Стажер Мед.
86 : 714–718 (1977).ПабМед
КАСGoogle ученый
Вуд, Л. В., Вулф, У. Х., Руис-Паласиос, Г., Фоши, У. С., Корман, Л. И., Макклески, Э., Райт, Дж. А., и Дюпон, Х. Л., Вспышка гастроэнтерита, вызванная термолабильным энтеротоксином, продуцирующим штамм Escherichia coli , Infect. Иммун.
41 : 931–934 (1983).ПабМед
КАСGoogle ученый
Guerrant, R.L., Dickens, MD, Wenzel, R.P., и Kapikian, A.Z., Токсогенная бактериальная диарея: Вспышка с участием нескольких штаммов, J. Pediatr.
89 : 885–891 (1976).ПабМед
КАСGoogle ученый
Ryder, R.W., Wachsmuth, I.K., Buxton, A.E., Evans, D.G., DuPont, H.L., Mason, E.
 , и Barret, F.F., Детская диарея, вызванная термостабильным энтеротоксигенным Escherichia coli , N. Engl. Дж. Мед.
, и Barret, F.F., Детская диарея, вызванная термостабильным энтеротоксигенным Escherichia coli , N. Engl. Дж. Мед.
295 : 849–853 (1976).ПабМед
КАСGoogle ученый
Лопес-Видаль, Ю., Кальва, Дж. Дж., Трухильо, А., Понсе де Леон, А., Рамос, А., Свеннерхольм, А.-М., и Руис-Паласиос, Г. М., Энтеротоксины и спайки энтеротоксигенных Escherichia coli: Являются ли они факторами риска острой диареи в обществе? Дж. Заразить. Дис.
162 : 442–447 (1990).ПабМед
КАСGoogle ученый
DuPont, H.L., Olarte, J., Evans, D.G., Pickering, L.K., и Evans, D.J., Jr., Сравнительная восприимчивость студентов из Латинской Америки и США к кишечным патогенам, N. Engl. Дж. Мед.
295 : 1520–1521 (1976).ПабМед
КАСGoogle ученый
«>Мацусита С., Ямада С., Кай А. и Кудо Ю. Инвазивные штаммы Escherichia coli , относящаяся к серотипу O121:NM, J. Clin. микробный.
31 : 3034–3035 (1993).КАС
Google ученый
Gorbach, S.L., и Khurana, C.M., Toxigenic Escherichia coli: Причина детской диареи в Чикаго, N. Engl. Дж. Мед.
287 : 933–936 (1972).Google ученый
«>Геррант Р. Л., Мур Р. А., Кирченфилд П. М. и Санде М. А., Роль токсигенных и инвазивных бактерий при острой диарее у детей, стр. Н. англ. Дж. Мед.
293 : 567–573 (1975).ПабМед
КАСGoogle ученый
Сак Д. А., Каминский Д. С., Сак Р. Б., Вамола И. А., Орсков Ф., Орсков И. . путешественников: проспективное исследование добровольцев Американского корпуса мира, Johns Hopkins Med. Дж.
141 : 64–70 (1977).Google ученый
«>Йоу, М. Д., Мельник, Дж. Л., Блаттнер, Р. Дж., Стефенсон, В. Б., Робисон, Н. В., и Буркхардт, М. А., Связь вирусов и бактерий с детской диареей, стр. 900:05 утра. Дж. Эпидемиол.
92 : 33–39 (1970).ПабМед
КАСGoogle ученый
Томсон С., Уоткинс А. Г. и Грей О. П., Escherichia coli гастроэнтерит, Arch. Дис. Ребенок.
31 : 340–345 (1956).ПабМед
Google ученый
Блэк, Р. Э., Мерсон, Х. Х.
 , Хук, И., Алим, А. Р. М. А., и Юнус, М., Заболеваемость и тяжесть ротавируса и Escherichia coli диарея в сельских районах Бангладеш, Lancet
, Хук, И., Алим, А. Р. М. А., и Юнус, М., Заболеваемость и тяжесть ротавируса и Escherichia coli диарея в сельских районах Бангладеш, Lancet
1 : 141–143 (1981).ПабМед
КАСGoogle ученый
Айронсайд, А. Г., Таксфорд, А. Э., и Хейворт, Б., Обзор детского гастроэнтерита, Br. Мед. Дж.
3 : 20–24 (1970).ПабМед
КАСGoogle ученый
Мата, Л. Дж., и Уррутия, Дж. Дж., Колонизация кишечника детей, находящихся на грудном вскармливании, в сельской местности с низким социально-экономическим уровнем, Ann. Академик Нью-Йорка науч.
176 : 93–109 (1971).Google ученый
Cooper, M.L., Keller, H.M., Walters, E.W., Partin, J.C., и Boye, D.
 E., Выделение энтеропатогенных Escherichia coli от матерей и новорожденных, Am. Дж. Дис. Ребенок.
E., Выделение энтеропатогенных Escherichia coli от матерей и новорожденных, Am. Дж. Дис. Ребенок.
97 : 255–266 (1959).КАС
Google ученый
Ocklitz, H.W., и Schmidt, E.F., Энтеропатогенные серотипы Escherichia coli : Заражение новорожденного через мать, Br. Мед. Дж.
2 : 1036–1038 (1957).ПабМед
КАСGoogle ученый
Smith, M.H.D., Newell, K.W., and Sulianti, J., Эпидемиология энтеропатогенных Инфекция Escherichia coli у негоспитализированных детей, Antimicrob. Агенты Чемотер.
5 : 77–83 (1965).ПабМед
КАСGoogle ученый
Сак Р. Б., Сак Д. А., Мельман И. Дж., Орсков Ф. и Орсков И. Энтеротоксигенные Escherichia coli , выделенные из пищевых продуктов, J.
 Infect. Дис.
Infect. Дис.
235 : 313–317 (1977).Google ученый
Тьоа, В., Дюпон, Х.Л., Салливан, П., Пикеринг, Л.К., Ольгин, А.Х., Оларте, Дж., Эванс, Д.Г., и Эванс, Д.Дж., младший, Место потребления продуктов питания и путешествия диарея, Am. Дж. Эпидемиол.
106 : 61–66 (1977).ПабМед
КАСGoogle ученый
Кин, У. Э., Макэнулти, Дж. М., Хосли, Ф. К., Уильямс, Л. Э., младший, Хедберг, К., Оксман, Г. Л., Барретт, Т. Дж., Пфаллер, М. А., и Флеминг, Д. В., Плавание- ассоциированная вспышка геморрагического колита вызвала Escherichia coli O157:H7 и Shigella sonnei , N. Engl. Дж. Мед.
331 : 579–584 (1994).ПабМед
КАСGoogle ученый
Дев, В.
 Дж., Мейн, М., и Гулд, И., Вспышка инфекции Escherichia coli, передаваемая через воду 0157, Ланцет
Дж., Мейн, М., и Гулд, И., Вспышка инфекции Escherichia coli, передаваемая через воду 0157, Ланцет
2 :1412 (1991).Google ученый
Moon, HW, Whip, S.L., Argenzio, R.A., Levine, M.M., и Gianella, R.A., Прикрепление и устранение действия энтеропатогенных бактерий Escherichia coli у кроликов и человека в кишечнике свиней и кроликов, Infect. Иммун.
41 : 1341–1351 (1983).Google ученый
Арбакл, Дж. Б. Р., Расположение Escherichia coli в кишечнике свиньи, J. Med. микробиол.
3 : 333–340 (1970).ПабМед
КАСGoogle ученый
Jones, G.W., and Rutter, J.M., Роль антигена K88 в патогенезе неонатальной диареи, вызванной Escherichia coli у поросят, Infect.
 Иммун.
Иммун.
6 : 918–927 (1972).ПабМед
КАСGoogle ученый
Smith, H.W., and Linggood, M.A., Наблюдение за патогенными свойствами плазмид K88 Hly и Ent Escherichia coli с особой ссылкой на диарею свиней, J. Med. микробный.
4 : 467–485 (1971).КАС
Google ученый
Раттер Дж. М., Берроуз М. Р., Селлвуд Р. и Гиббонс Р. А. Генетическая основа устойчивости к кишечным заболеваниям, вызываемым Кишечная палочка , Природа
257 : 135–136 (1975).ПабМед
КАСGoogle ученый
Isaacson, R.E., Fusco, P.C., Brinton, C.C., and Moon, H.W., In vitro Адгезия Escherichia coli к эпителиальным клеткам тонкого кишечника свиньи: Пили как факторы адгезии, Infect.
 Иммун.
Иммун.
21 : 392–397 (1978).ПабМед
КАСGoogle ученый
Пикеринг Л. К., Дюпон Х. Л., Эванс Д. Г., Эванс Д. Дж. Младший и Оларте Дж. Выделение кишечных патогенов у бессимптомных студентов из США и Латинской Америки, J. Infect. Дис.
135 : 1003–1005 (1977).ПабМед
КАСGoogle ученый
Формал, С. Б., Хейл, Т. Л., Капфер, К., Коган, Дж. П., Сной, П. Дж., Кунг, Р., Вингфилд, М. Э., Элисберг, Б. Л., и Барон, Л. С., Пероральная вакцинация обезьян инвазивным Escherichia coli Гибридная экспрессия K-12 Shigella
ф
flexneri 2a соматический антиген, Infect. Иммун.
46 : 465–469 (1984).ПабМед
КАСGoogle ученый
«>Бейкер С. Дж., Баррет Ф. Ф. и Кларк Д. Дж., Модели чувствительности к антибиотикам энтеропатогенных изолятов Escherichia coli , South. Мед. Дж.
67 : 412–414 (1974).ПабМед
КАСGoogle ученый
Каслоу, Р. А., Тейлор, А., младший, Двек, Х. С., Бобо, Р. А., Стил, К. Д., и Кэссиди, Г., младший, Энтеропатогенная инфекция Escherichia coli в отделении для новорожденных, 900:05 утра. Дж. Дис.
Ребенок.
128 : 797–801 (1974).ПабМед
КАСGoogle ученый
Нетер, Э., Энтерит, вызванный энтеропатогенными Escherichia coli , J.
 Pediate
Pediate
55 : 223–239 (1959).КАС
Google ученый
Роджерс, К.Б., Бенсон, П.Р., Фостер, В.П., Джонс, Л.Ф., Батлер, Э.Б., и Уильямс, Т.С., Фталилсульфацетамид и неомицин в лечении детского гастроэнтерита, Ланцет
2 : 599–604 (1956).Google ученый
Wheeler, W.E., Распространение и контроль диарейной болезни Escherichia coli , Ann. Академик Нью-Йорка науч.
66 : 112–117 (1969).Google ученый
Лапорта, М. З., Сильва, М. Л. М., Скалецкий, С. А., и Трабулси, Л. Р., Плазмиды, кодирующие лекарственную устойчивость и локализованное прилипание к клеткам HeLa при энтеропатогенных Escherichia coli 055:H — и O55:H6, Infect.

Иммун.
51 : 715–717 (1986).ПабМед
КАСGoogle ученый
DuPont, H.L., Ericsson, C.D., Johnson, P.C., Bitsura, J.M., DuPont, M.W., and de la Cabada, E J., Профилактика диареи путешественников с помощью таблетированной формы субсалицилата висмута, J. Am . Мед. доц.
257 : 1347–1350 (1987).Google ученый
Bray, J., Выделение антигенно гомогенных штаммов Bact.
coli neapolitanum от летней диареи младенцев, J. Pathol. бактериол.
57 : 239–247 (1945).
КАС
Google ученый
Ремис, Р. С., Макдональд, К. Л., Райли, Л. В., Пур, Б. С., Уэллс, Дж. Г., Дэвис, Б. Р., Блейк, П. А., и Коэн, М. Л., Спорадические случаи геморрагического колита, связанные с Escherichia coli O15006 H7, Анн. Стажер Мед.
101 : 624–626 (1984).
ПабМед
КАС
Google ученый
Горбач, С. Л., Кин, Б. Х., Эванс, Д. Г., Эванс, Д. Дж., Младший, и Бессудо, Д., Диарея путешественников и токсигенный Escherichia coli , N. Engl. Дж. Мед.
292 : 933–936 (1975).
ПабМед
КАС
Google ученый
Пикеринг Л.К., Эванс Д.Дж. мл., Муньос О., Дюпон Х.Л., Коэлла-Рамирез П., Воллет Дж.Дж., Конклин Р.Х., Оларте Дж. и Коль С., Проспективное исследование энтеропатогенов у детей с диареей в Хьюстоне и Мексике, J. Pediatr.
93 : 383–388 (1978).
ПабМед
КАС
Google ученый
Мерсон, М. Х., Уэллс, Дж. Г., Фили, Дж. К., Сак, Р. Б., Чич, В. Б., Капикан, А. З., Гангароса, Э. Дж., Моррис, Г. К., и Сак, Д. А., Диарея путешественников в Мексике: проспективное исследование врачей и членов семьи, посещающих конгресс, N. Engl. Дж. Мед.
294 : 1299–1305 (1976).
ПабМед
КАС
Google ученый
Сак, Р. Б., Хиршхорн, Н., Браунли, И., Кэш, Р. А., Вудворд, В. Е., и Сак, Д. А., Энтеротоксигенные Escherichia coli ассоциированные диарейные заболевания у детей апачей, N. Engl. Дж. Мед.
292 : 1041–1045 (1975).
ПабМед
КАС
Google ученый
Кудо Ю., Зен-йодзи Х., Мацусита С., Сакаи С. и Маруяма Т. Вспышки острого энтерита, вызванные термостабильными энтеротоксин-продуцирующими штаммами Escherichia coli , микробный. Иммун.
21 : 175–178 (1977).
КАС
Google ученый
Ramsay, A.M., Острая инфекционная диарея, Br. Мед. Дж.
2 : 347–350 (1968).
ПабМед
КАС
Google ученый
Рекомендуемая литература
DuPont, H.L., Formal, S.B., Homick, R.B., Snyder, M.J., Libonati, J.P., Sheahan, D.B., LaBrec, E.H., and Escherich, J.P. , Н. Англ. Дж. Мед.
285 : 1–9 (1971).Google ученый
DuPont, H.L., и Pickering, L.K., Инфекции желудочно-кишечного тракта: микробиология , Патофизиология , и клинические признаки , Plenum Medical, New York, 1980.

