Энтероколит у новорожденных: Некротизирующий энтероколит новорожденных | Морозовская ДГКБ ДЗМ
Редкое осложнение некротического энтероколита у новорожденного
Редкое осложнение некротического энтероколита у новорожденного
Соловьёв А.Е.
Запорожский государственный медицинский университет, Украина
Аникин И.А.
Запорожский государственный медицинский университет, Украина
Кокоркин А.Д.
Запорожский государственный медицинский университет, Украина
Пахольчук А.П.
Запорожский государственный медицинский университет, Украина
Мариев Г.С.
Запорожский государственный медицинский университет, Украина
Редкое осложнение некротического энтероколита у новорожденного
Журнал:
Хирургия. Журнал им. Н.И. Пирогова. 2016;(1): 78‑79
DOI
10.17116/hirurgia2016178-79
Как цитировать
Соловьёв А.Е., Аникин И.А., Кокоркин А.Д., Пахольчук А. П., Мариев Г.С.
П., Мариев Г.С.
Редкое осложнение некротического энтероколита у новорожденного. Хирургия. Журнал им. Н.И. Пирогова.
2016;(1):78‑79.
Solov’ev AE, Anikin IA, Kokorkin AD, Pakhol’chuk AP, Mariev GS. A rare complication of necrotizing enterocolitis in newborn. Pirogov Russian Journal of Surgery = Khirurgiya. Zurnal im. N.I. Pirogova. 2016;(1):78‑79. (In Russ.).
https://doi.org/10.17116/hirurgia2016178-79
Авторы:
Соловьёв А.Е.
Запорожский государственный медицинский университет, Украина
Все авторы (5)
Читать метаданные
Ключевые слова:
некротический энтероколит
флегмона
паранефрит
новорожденный
Авторы:
Соловьёв А.Е.
Запорожский государственный медицинский университет, Украина
Аникин И.А.
Запорожский государственный медицинский университет, Украина
Кокоркин А. Д.
Д.
Запорожский государственный медицинский университет, Украина
Пахольчук А.П.
Запорожский государственный медицинский университет, Украина
Мариев Г.С.
Запорожский государственный медицинский университет, Украина
Закрыть метаданные
Некротический энтероколит (НЭК) является распространенным заболеванием новорожденных, которое требует неотложной помощи [1, 2, 4, 6]. За последнее десятилетие отмечается тенденция к снижению летальности от НЭК (17% в развитых странах и 42% в странах с низким и средним уровнем экономики соответственно) [2, 3, 5, 6]. Успех лечения при НЭК зависит от многих факторов, особенно от своевременной диагностики перехода заболевания из терапевтической стадии в хирургическую. Абсолютными показаниями к оперативному вмешательству являются перитонит, перфорация толстой кишки, ухудшение общего состояния [1-3, 5]. В клинике детской хирургии Запорожья мы наблюдали редкое осложнение НЭК. Приводим наше наблюдение.
Больной С. , 6 мес, поступил в клинику детской хирургии с тонкокишечным и толстокишечным свищами.
, 6 мес, поступил в клинику детской хирургии с тонкокишечным и толстокишечным свищами.
Из анамнеза известно, что 15.08.14 ребенок родился недоношенным массой тела 2700 г, оценка по шкале Апгар 7 баллов.
К груди новорожденного приложили через 2 ч. На 2-е сутки ребенок стал беспокойным, отказывался от груди. Появился жидкий стул, температура 37,7 °С. В левой поясничной области был обнаружен участок гиперемии и инфильтрации размером 4×3 см. Ребенок направлен в клинику детской хирургии с диагнозом: «флегмона новорожденного».
При поступлении состояние тяжелое, температура 38,6 °С. Патологических изменений органов грудной клетки не выявили. Живот вздут, мягкий, безболезненный. Печень и селезенка не увеличены. Стул 4 раза, мочится свободно. В левой поясничной области виден инфильтрат размером 6×4,5 см, кожа над ним гиперемирована. 17.08 ребенок оперирован с диагнозом: «обширная флегмона новорожденного левой поясничной области». Флегмону вскрыли 16 разрезами, получили гной, раны дренировали турундами с гипертоническим раствором. Назначили антибиотики, перевязки 2 раза в сутки.
Назначили антибиотики, перевязки 2 раза в сутки.
Состояние ребенка ухудшилось вечером 20.08, когда живот стал резко вздутым, появились напряжение передней брюшной стенки, рвота кишечным содержимым. После предоперационной подготовки ребенка оперировали 21.08 с диагнозом «распространенный перитонит». После срединной лапаротомии в брюшной полости обнаружили большое количество гноя. В нисходящем отделе ободочной кишки выявили множество перфоративных язв. Этот отдел толстой кишки на протяжении 11 см оказался некротизированным. Кроме того, диагностировали забрюшинную флегмону и гнойный паранефрит слева. Брюшную полость промыли фурацилином и резецировали нисходящую ободочную кишку на протяжении 15 см. Дистальный отдел нисходящей ободочной кишки ушили наглухо, проксимальный вывели через дополнительный разрез в левом подреберье в виде одноствольной колостомы. Забрюшинное и паранефральное пространства дренировали через разрез в левой поясничной области двумя трубками. Пересекли подвздошную кишку на расстоянии 20 см от баугиниевой заслонки. Дистальный конец тонкой кишки ушили наглухо, проксимальный вывели через отдельный разрез в правой подвздошной области в виде терминальной илеостомы. Тонкую кишку интубировали. Срединную рану ушили наглухо. Послеоперационное течение тяжелое. После 2-недельного пребывания в реанимационном отделении и в отделении патологии новорожденных (также в течение 2 нед) ребенка выписали в удовлетворительном состоянии.
Дистальный конец тонкой кишки ушили наглухо, проксимальный вывели через отдельный разрез в правой подвздошной области в виде терминальной илеостомы. Тонкую кишку интубировали. Срединную рану ушили наглухо. Послеоперационное течение тяжелое. После 2-недельного пребывания в реанимационном отделении и в отделении патологии новорожденных (также в течение 2 нед) ребенка выписали в удовлетворительном состоянии.
За 5 мес ребенок прибавил в массе 3 кг. Его общее состояние удовлетворительное. В правой подвздошной области имеется терминальная илеостома, в левом — одноствольная колостома. Живот мягкий, безболезненный.
02.03.15 ребенку выполнили реконструктивно-восстановительную операцию — ликвидировали илеостому и колостому.
В ходе вмешательства между поперечной ободочной кишкой и дистальным отделом нисходящей ободочной кишки, а также между приводящей петлей тонкой кишки и дистальным участком подвздошной кишки сформировали два анастомоза по типу конец в конец.
Послеоперационное течение без осложнений, швы сняты на 10-е сутки, больного выписали на 16-е сутки в удовлетворительном состоянии.
Наблюдение приводим в связи с удачным лечением при редком осложнении некротического энтероколита. У ребенка возник некротический энтероколит нисходящей ободочной кишки, осложненный забрюшинной флегмоной и паранефритом слева, инфильтратом в левой поясничной области, который был принят за флегмону новорожденного. Окончательный диагноз сформулировали только в ходе диагностического этапа лапаротомии.
Журнал: «Медицина целевые проекты» статья: Консервативная терапия некротического энтероколита у новорожденных
Настороженность в отношении развития НЭК у детей группы риска, отработанный алгоритм лечения по стадиям процесса, ранняя диагностика осложнений НЭК, соблюдение правил введения энтеральной нагрузки, парентерального питания с постепенным переходом на энтеральное питание позволили уменьшить и остановить процесс на более ранних стадиях развития, уменьшить летальность в этой группе пациентов на 85%
Главный врач ГБУЗ Самарской области «Тольяттинская городская клиническая больница № 5», к. м.н., врач высшей квалификационной категории, заслуженный врач РФ Николай Ренц
м.н., врач высшей квалификационной категории, заслуженный врач РФ Николай Ренц
Заместитель главного врача по акушерству и гинекологии ГБУЗ СО «Тольяттинская городская клиническая больница № 5», к.м.н, врач высшей квалификационной категории Наталья Хуторская
Заведующий отделением реанимации и интенсивной терапии новорожденных межрайонного перинатального центра, врач высшей квалификационной категории Евгений Алексеевнин
Летальностьпри язвенно-некротическом энтероколите (НЭК) и перфорации желудочно-кишечного тракта составляет 40–80%, достигая 100% у пациентов с наиболее тяжелыми формами заболевания и сопутствующей патологией. Клиническое течение НЭК и перфораций желудочно-кишечного тракта (ЖКТ) у новорожденных сопровождается перитонитом, высоким внутрибрюшным давлением с развитием синдрома полиорганной недостаточности
Факторы риска
Патологическое течение беременности, применение женщиной во время беременности наркотических препаратов, асфиксия в родах, синдром дыхательных расстройств, значительное охлаждение ребенка, синдром малого сердечного выброса при врожденных пороках развития сердца, полицитемия, медикаменты, нарушающие мезентериальный кровоток (индометацин, витамин Е).
Клиническая картина
По течению заболевания выделяют следующие формы:
· Молниеносная форма.От первых нечетких симптомов дискомфорта в состоянии ребенка до возникновения перфорации проходит не более 1,5–2 суток.
· Острая форма.Заболевание начинается с ярко выраженных симптомов со стороны брюшной полости, отказа от еды, срыгивания и рвоты, вздутия живота, нарушения пассажа по кишечнику, что соответствует Iстадии. Вскоре присоединяются общесоматические симптомы, свидетельствующие об интоксикации и дисфункции жизненно важных органов и систем (IIcтадия). При неадекватности или неэффективности консервативной терапии заболевание может быстро перейти в IIIстадию развития процесса, что требует незамедлительного хирургического лечения.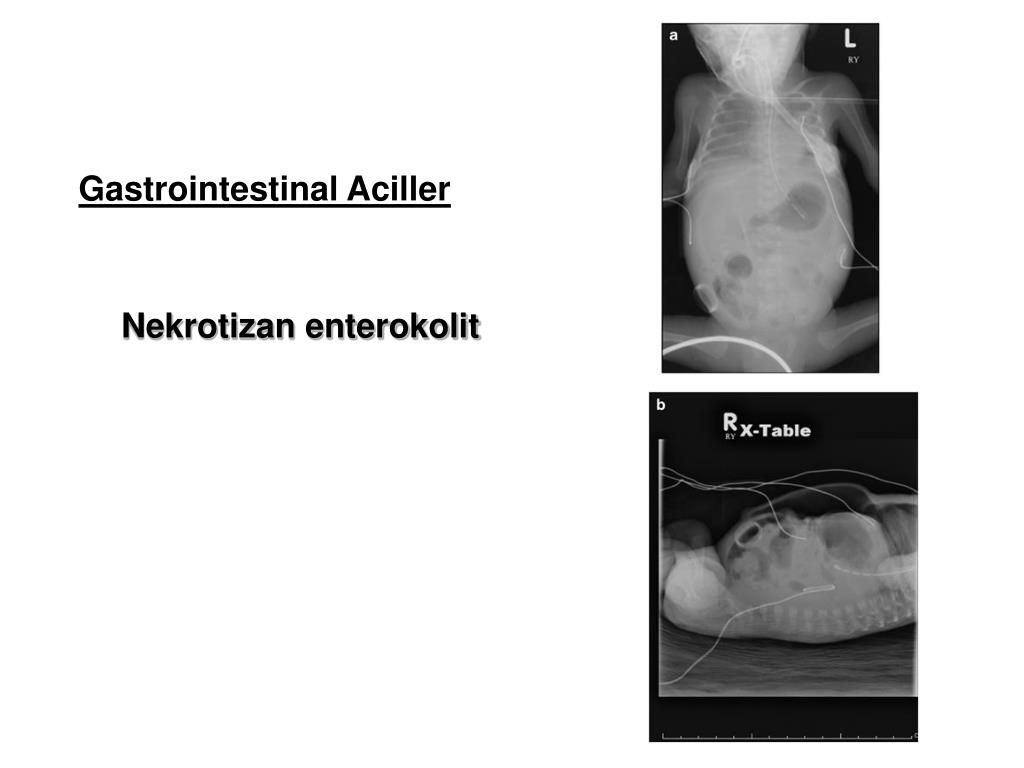
· Подострая форма.Симптомы со стороны ЖКТ появляются постепенно и имеют перемежающийся характер, т.е. периоды клинического благополучия сменяются дисфункцией органов ЖКТ.
В зависимости от распространенности процесса выделяют:
· локальную форму – поражение ограничено небольшим участком кишки;
· мультисегментарную форму – поражено несколько участков кишки;
· тотальное поражение кишечника,или паннекроз.
Молниеносная форма НЭК характерна для доношенных («крупных») детей, перенесших в родах асфиксию, а также для новорожденных с гемолитической болезнью (после повторных заменных переливаний крови) и для пациентов с пороками развития ЖКТ. Первые симптомы заболевания при молниеносной форме НЭК появляются несколько раньше (на 3–5-й день жизни), чем при других вариантах течения болезни. Своевременная диагностика этой формы заболевания нередко затруднена из-за преморбидного фона и очень тяжелого общего состояния ребенка. Появление вздутия живота, беспокойство ребенка, резкое ухудшение лабораторных данных, свидетельствующих о воспалительном процессе, должны навести на мысль о возможном развитии НЭК. Такие дети требуют срочного осмотра хирурга и рентгенологического обследования.
Первые симптомы заболевания при молниеносной форме НЭК появляются несколько раньше (на 3–5-й день жизни), чем при других вариантах течения болезни. Своевременная диагностика этой формы заболевания нередко затруднена из-за преморбидного фона и очень тяжелого общего состояния ребенка. Появление вздутия живота, беспокойство ребенка, резкое ухудшение лабораторных данных, свидетельствующих о воспалительном процессе, должны навести на мысль о возможном развитии НЭК. Такие дети требуют срочного осмотра хирурга и рентгенологического обследования.
Острая формаНЭК характерна для недоношенных детей с массой более 1000 г. При этой форме чаще встречается локальное поражение тонкой кишки, причем от первых симптомов до возникновения перфорации кишки, обычно проходит 2–3 суток. Заболевание начинается остро на 10–28-й день жизни с появления признаков поражения ЖКТ. Быстро присоединяются или нарастают общесоматические симптомы, состояние прогрессивно ухудшается.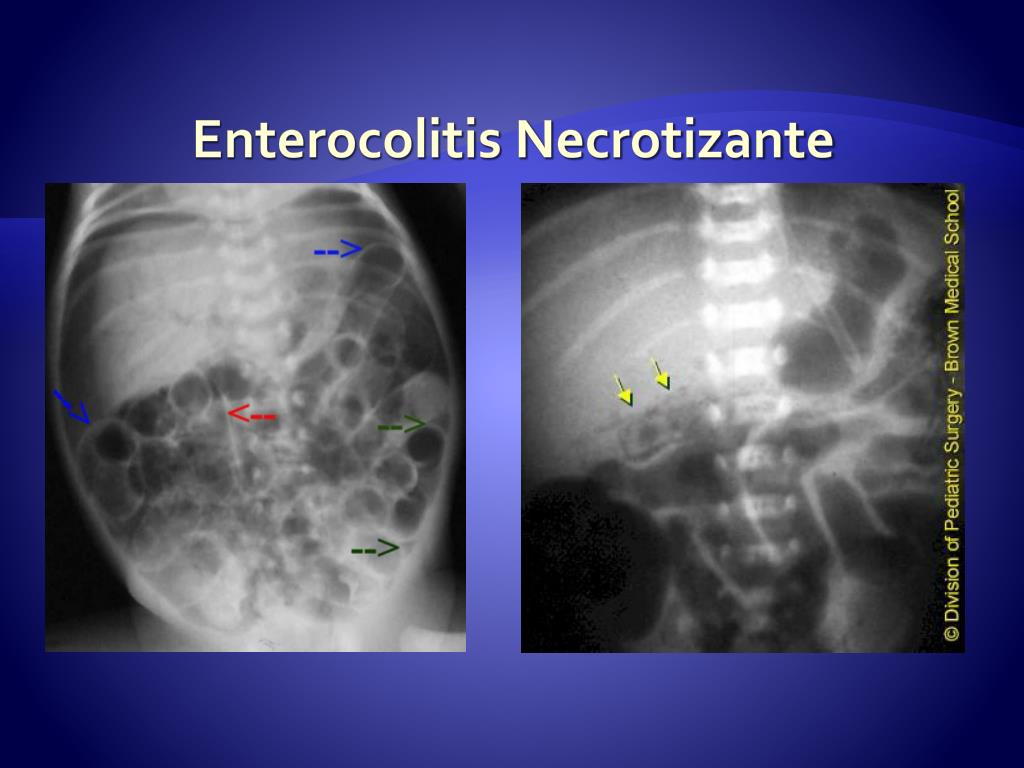 У больных выявляют локальное поражение тонкой кишки или некроз стенки желудка.
У больных выявляют локальное поражение тонкой кишки или некроз стенки желудка.
Подострая формахарактерна для глубоко недоношенных детей и детей с критически низкой массой тела. Первые симптомы появляются на 12–45-е сутки жизни. Ребенок перестает усваивать питание, начинает срыгивать, возникает вздутие живота, меняется характер стула: он может учащаться, в нем появляется примесь зелени и крови, а иногда, наоборот, становится более редким и прекращается вообще. При подострой форме НЭК нередко в последующем развивается частичная, а затем и полная кишечная непроходимость.
Диагностика
Консультация хирурга на всех этапах НЭК.
Рентгенологическое обследование:
Расширение кишечных петель – наиболее частый симптом. Значительное расширение кишечных петель и появление горизонтальных уровней свидетельствует о тяжести заболевания и его прогрессирующем течении.
Значительное расширение кишечных петель и появление горизонтальных уровней свидетельствует о тяжести заболевания и его прогрессирующем течении.
Пневматоз кишечной стенкиявляется одним из наиболее важных радиологических признаков НЭК. Этот симптом чаще возникает чаще у детей, уже получавших энтеральное питание, чем у пациентов, которые не кормились.
На рентгенограмме могут одновременно определяться два вида пневматоза – кистовидный и линейный.
Газ в воротной вене – очень грозный признак, часто свидетельствующий о далеко зашедшем процессе. Наличие газа в системе воротной вены встречается у детей с тотальным некрозом кишки и предопределяет неблагоприятный прогноз, поэтому наличие данного симптома является абсолютным показанием к хирургическому лечению. Наличие неподвижной (статичной) петли кишки, не изменяющей свое положение на повторных снимках, свидетельствует о кишечной ишемии. Сопоставление рентгенограмм, сделанных с некоторым интервалом во времени (6–8 часов), помогает дифференцировать обычное расширение кишечных петель от фиксированных и неподвижных участков. Этот симптом считается патогномоничным для некроза кишки, а соответственно, позволяющим ставить показания к операции.
Сопоставление рентгенограмм, сделанных с некоторым интервалом во времени (6–8 часов), помогает дифференцировать обычное расширение кишечных петель от фиксированных и неподвижных участков. Этот симптом считается патогномоничным для некроза кишки, а соответственно, позволяющим ставить показания к операции.
Снижение пневматизации и неравномерное газонаполнение кишечных петель позволяют продолжить консервативную терапию с тщательным контролем за состоянием ребенка и изменением рентгенологической картины. Внезапное появление на рентгенограммах признаков асцита является неблагоприятным фактором, говорящим о реакции брюшины на бактериальный перитонит, о возможной прикрытой перфорации кишки. Сочетание асцита и появления газа в воротной вене сопровождается высокой смертностью пациентов.
Пневмоперитонеум – скопление свободного газа в брюшной полости, чаще под куполами диафрагмы, у детей с НЭК неопровержимо свидетельствует о перфорации полого органа. Отсутствие на рентгенограмме газа в свободной брюшной полости при наличии перфорации объясняется тем, что перфорация может быть прикрытой или «открываться» в карман или полость сальниковой сумки, изолированные от свободной брюшной полости.
Отсутствие на рентгенограмме газа в свободной брюшной полости при наличии перфорации объясняется тем, что перфорация может быть прикрытой или «открываться» в карман или полость сальниковой сумки, изолированные от свободной брюшной полости.
УЗИ органов брюшнойполости и забрюшинного пространства – для выявления выпота в брюшной полости, инфильтратов, абсцессов.
Лапароцентез.Получение из брюшной полости при аспирация более чем 1,0 мл желто-коричневого или зеленого мутного содержимого свидетельствует о некрозе кишки.
Лабораторная диагностика – специфических тестов не существует.
Таким образом, основной целью обследования детей с НЭК является выявление всего комплекса клинических проявлений, позволяющих как можно раньше диагностировать заболевание и оперировать больных до развития перфорации кишки или желудка.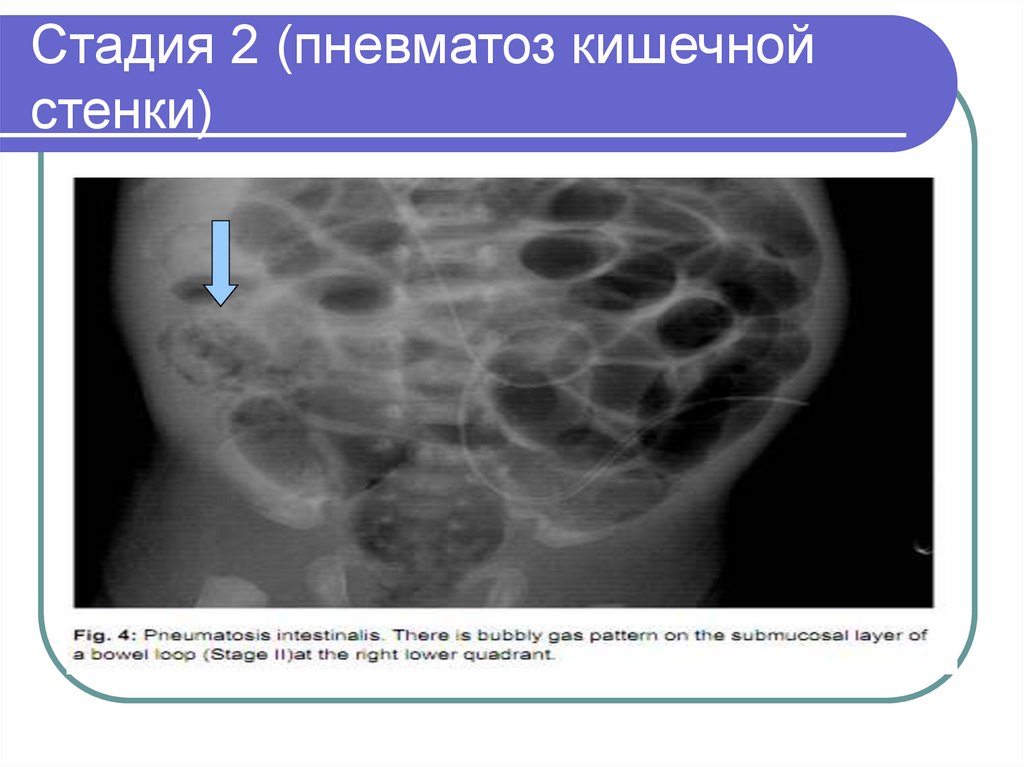
Абсолютные показания к хирургическому лечению
Появление в брюшной полости пальпируемого опухолевидного образования, свидетельствующего о наличии внутрибрюшного абсцесса или конгломерата спаянных между собой некротизированных кишечных петель.
Лечение некротического энтероколита зависит от стадии заболевания и степени выраженности симптомов и складывается из консервативного и хирургического этапов.
Консервативное лечение некротического энтероколита
1. Энтеральное питание – режим трофического кормления (1ml/kg – микроструйное введение) при НЭК 1 ст.
При малейшем подозрении на НЭК IIа ст. – отмена энтерального питания.
– отмена энтерального питания.
Постановка в желудок для декомпрессии постоянного назогастрального или орогастрального зонда (держать открытым).
2. Респираторная поддержка (ИВЛ, неинвазивная вентиляция легких).
3. Антибактериальная терапия (карбапенемы +гликопептиды иликомбинированные цефалоспорины).
Схемы введения антибактериальной терапии:
Карбапенемы: меропенем (меронем) – 20 мг/кг.
Менее 32 недель гестации – менее 14 дней – каждые 12 часов.
Старше 14 дней – каждые 8 часов.
Старше 32 недель гестации – 1–7 дней – каждые 12 часов.
Старше 7 дней – каждые 8 часов.
Тиенам (имипенем-циластатин) – 20–25 мг/кг каждые 12 часов.
Гликопептиды: ванкомицин (эдицин) – 15 мг/кг.
Менее 29 недель гестации – менее 14 дней – через18 часов.
Старше 14 дней – через 12 часов.
30–40 недель гестации – 0–14 дней – через 12 часов.
Старше 14 дней – через 8 часов .
При выделении вероятного инфекционного агента-возбудителя – смена антибактериальной терапии с учетом спектра его чувствительности.
4. Препарат глутамина для парентерального питания («Дипептивен» – 2 мл/кг).
5. Седация и аналгезия (наркотические аналгетики <фентанил – 1–3 мкг/кг/ч>),
Бензодиазепины (седуксен – 0,02–0,3 мг/кг), согласно шкале СRIES.
Натрия оксибутират (100–200 мг/кг/мин).
6. Добутамин – 2–5 мкгр/кг/ч. – с появления первых симптомов НЭК.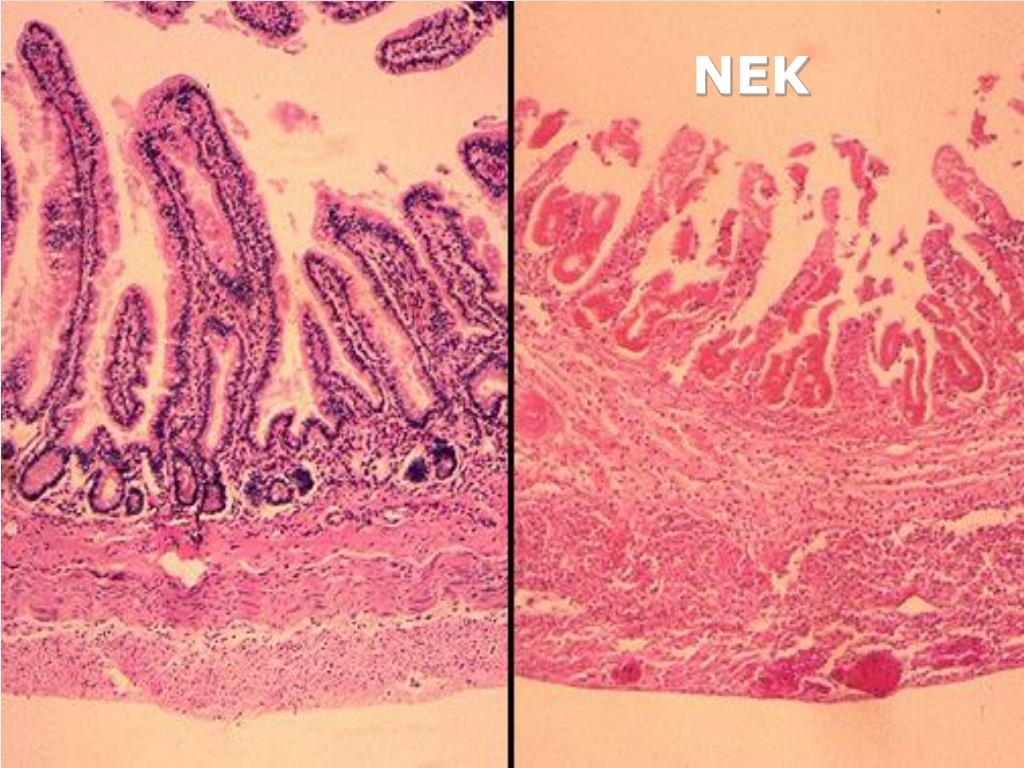
7. Полигаммаглобулины («Пентоглобин» – 5 мл/кг).
8. Гемо- и плазмотрансфузия по показаниям.
9. Целенаправленная терапия патологического состояния, которое было первичным у ребенка и потенцировало развитие НЭК.
10. Полное парэнтеральное питание (TPN).
Критерии для проведения TPN:
1. TPN проводится при развитии НЭК II–IIIстадии и продолжается в ранние сроки после хирургического лечения (3–5-е сутки).
2. Для назначения TPN необходимо добиться полной стабилизации состояния больного (коррекция метаболических нарушений и КОС, стабилизация гемодинамики, отмена планового наркотического обезболивания).
TPN начинают детям, рожденным с массой <1500 г, или новорожденным, которые не могут получить энтеральное питание, обеспечивающее им 80–90 ккал/кг/сут. к концу 1-й недели жизни.
к концу 1-й недели жизни.
Период энтерального голода недлительный (7–8 дней). Энтеральное кормление возобновляется с того момента, как у ребенка восстанавливается пассаж по кишечнику, исчезает вздутие живота, появляется стойкая тенденция к улучшению или нормализации лабораторных показателей и рентгенологических данных.
Наилучшим видом питания для новорожденного ребенка, конечно, является грудное молоко. Однако после тяжелых воспалительных заболеваний ЖКТ, длительной антибактериальной терапии развивается тяжелый дисбактериоз, в связи чем в качестве первой смеси для энтерального питания можно использовать смесь типа «Альфаре».
По мере повышения толерантности организма к вводимой смеси, стабилизации весовых прибавок ребенка постепенно переводят на вскармливание грудным молоком.
Профилактика некротического энтероколита
· Профилактика НЭК должна начинаться еще до рождения ребенка.
· Заместительная терапия внутривенным человеческим иммуноглобулином.
· «Пентаглобин».
· Оптимальный выбор антибактериальной терапии с лабораторным контролем ее эффективности.
· Соблюдение правил введения энтеральной нагрузки.
Выводы
1. К группе риска по развитию НЭК относятся недоношенные дети, перенесшие гипоксию, и дети, угрожаемые по развитию интранатальной и внутриутробной инфекции.
2. Новорожденные должны быть проконсультированы детским хирургом при появлении первых симптомов НЭК, до развития хирургических осложнений.
3. Улучшение результатов лечения НЭК возможно лишь при тесном взаимодействии врачей различных специальностей, занимающихся выхаживанием недоношенных детей.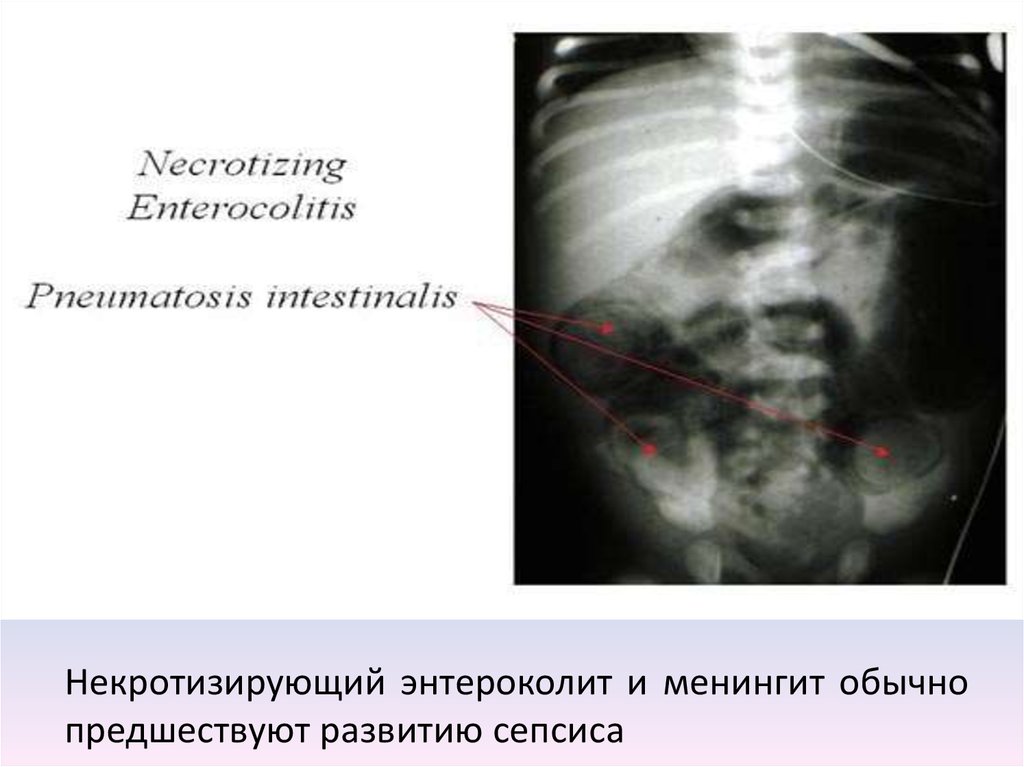
445846, г. Тольятти, бульвар Здоровья, д. 25
Тел.: (8482) 79-00-00
Сайт: http://www.medvaz.tlt.ru
Язвенно-некротический энтероколит — причины, симптомы, диагностика и лечение
Язвенно-некротический энтероколит – это воспалительное заболевание кишечника у новорожденных, для которого характерен некроз стенки кишки и развитие сопутствующей симптоматики. Проявляется признаками кишечной непроходимости и перитонита, интоксикацией вплоть до септического состояния, а также развитием ДВС-синдрома. Течение циклическое, возможно повторное появление симптомов. Диагностика клиническая и рентгенологическая, также проводится комплекс лабораторных исследований. Лечение патогенетическое и симптоматическое, направлено на устранение кишечной непроходимости, коррекцию электролитных нарушений, ДВС-синдрома и других проявлений.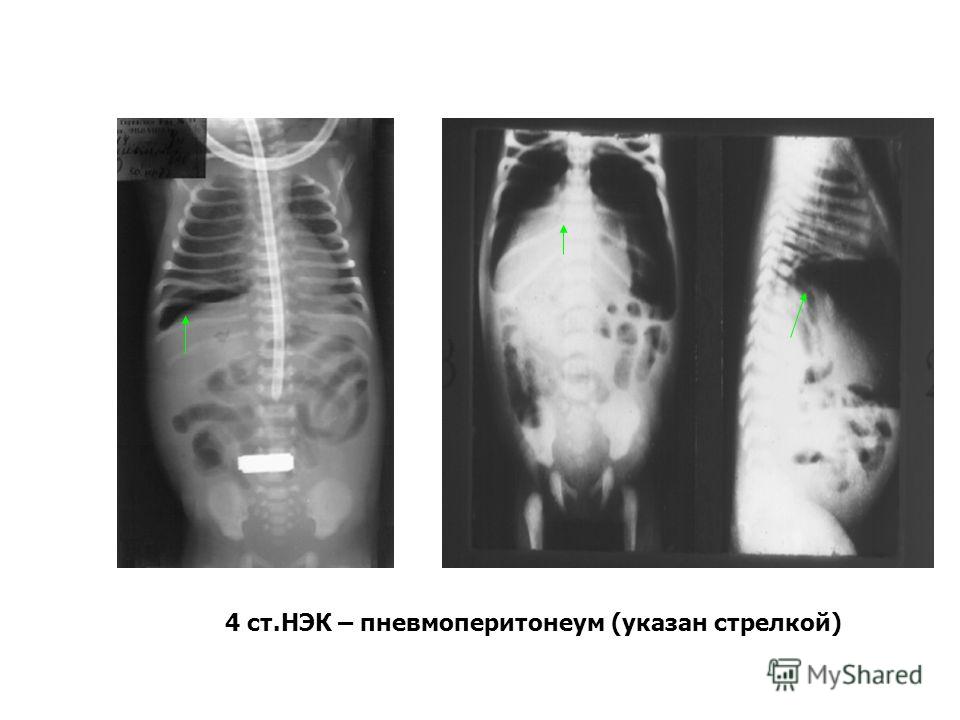 При необходимости осуществляются хирургические вмешательства.
При необходимости осуществляются хирургические вмешательства.
Общие сведения
Язвенно-некротический энтероколит является одним из самых опасных заболеваний периода новорожденности. Другое его название – некротизирующий энтероколит (НЭК). Общая распространенность составляет 2,4 случая на 1000 новорожденных. Развивается у детей на первой неделе жизни, с одинаковой частотой поражает девочек и мальчиков.
Язвенно-некротический энтероколит вносит весомый вклад в структуру общей неонатальной смертности. Несмотря на современные методы диагностики и лечения, летальность составляет 10-40%, при этом она коррелирует со сроком гестации, достигая максимальных значений в группе глубоко недоношенных детей. Кроме того, существует риск послеоперационных осложнений даже в случае успешной терапии. В частности, язвенно-некротический энтероколит является одной из основных причин развития синдрома короткой кишки.
Язвенно-некротический энтероколит
Причины
Этиология заболевания в настоящее время продолжает изучаться специалистами в сфере педиатрии. Определенную роль играет генетический аспект, то есть частота язвенно-некротического энтероколита среди родственников достоверно выше. Повышает риск развития заболевания искусственное вскармливание смесями с высокой осмолярностью. Доказана связь патологии с патогенными микроорганизмами, однако данные о конкретном возбудителе отсутствуют. Часто при заболевании обнаруживаются кишечная палочка, клебсиелла, стафилококк и клостридии. Условно-патогенная микрофлора также может способствовать развитию симптоматики язвенно-некротического энтероколита. Микроорганизмы не только напрямую повреждают ворсинки кишечного эпителия, но и повышают его проницаемость.
Определенную роль играет генетический аспект, то есть частота язвенно-некротического энтероколита среди родственников достоверно выше. Повышает риск развития заболевания искусственное вскармливание смесями с высокой осмолярностью. Доказана связь патологии с патогенными микроорганизмами, однако данные о конкретном возбудителе отсутствуют. Часто при заболевании обнаруживаются кишечная палочка, клебсиелла, стафилококк и клостридии. Условно-патогенная микрофлора также может способствовать развитию симптоматики язвенно-некротического энтероколита. Микроорганизмы не только напрямую повреждают ворсинки кишечного эпителия, но и повышают его проницаемость.
Патогенез
В патогенезе заболевания большое значение придается снижению барьерной функции кишечника. Отчасти это связано с высокой концентрацией патогенной микрофлоры, также играет роль срок беременности на момент рождения малыша. Язвенно-некротический энтероколит в большинстве случаев развивается у недоношенных детей. Кроме того, любое гипоксическое повреждение вызывает перераспределение крови в организме ребенка с преимущественным кровенаполнением жизненно важных органов. Ишемия кишечника приводит к некрозу его стенки, что также является одним из основных звеньев патогенеза. Что касается гипоксии, то ее причинами могут быть внутриутробная инфекция, патологии плаценты и пуповины, пороки развития сердечно-сосудистой системы и т. д.
Кроме того, любое гипоксическое повреждение вызывает перераспределение крови в организме ребенка с преимущественным кровенаполнением жизненно важных органов. Ишемия кишечника приводит к некрозу его стенки, что также является одним из основных звеньев патогенеза. Что касается гипоксии, то ее причинами могут быть внутриутробная инфекция, патологии плаценты и пуповины, пороки развития сердечно-сосудистой системы и т. д.
Симптомы
Язвенно-некротический энтероколит развивается стадийно. Сначала появляются симптомы непереваривания пищи в виде срыгивания и визуального увеличения живота из-за перерастяжения желудка и кишечника. Возможна рвота с примесью желчи, дыхательные расстройства, в том числе приступы апноэ. Ребенок становится вялым, температура может незначительно повышаться. Далее присоединяются симптомы кишечной непроходимости. Рвота учащается, в кале появляется примесь алой крови. Живот значительно вздут, температура повышена. Приступы апноэ также учащаются, сатурация (насыщение крови кислородом) существенно снижается.
При отсутствии лечения или стремительном течении язвенно-некротический энтероколит проявляется симптомами перитонита, поскольку происходит перфорация кишечника, которая обычно обнаруживается в терминальном отделе подвздошной кишки. Выявляется пневмоперитонеум и признаки сепсиса в виде интоксикации, критического падения артериального давления и др. Воспалительная реакция при язвенно-некротическом энтероколите носит системный характер, поэтому наблюдаются признаки полиорганной недостаточности. Для заболевания характерно циклическое течение, то есть после нормализации состояния возможны повторные приступы.
Диагностика
Первые признаки заболевания неспецифичны и характерны для многих нозологий, в частности, болезни Гиршпрунга и других аномалий развития кишечника. Кроме того, сама по себе недоношенность часто проявляется трудностями с энтеральным питанием вследствие недоразвития секреторной и моторной функции отделов ЖКТ. Заподозрить язвенно-некротический энтероколит на начальных стадиях педиатр может в случае, если ребенок родился недоношенным, либо на этапе внутриутробного развития или в родах имела место гипоксия.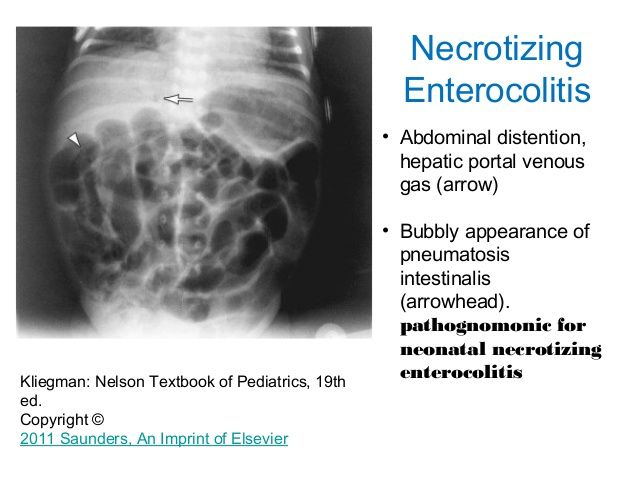
Также проводится анализ кала на скрытую кровь, поскольку визуально прожилки алой крови еще не обнаруживаются, но клеточные элементы уже присутствуют из-за микроповреждений стенки кишечника. После развития признаков кишечной непроходимости диагноз становится более очевидным:
- На рентгенограмме органов брюшной полости заметны расширенные петли кишечника и пневматоз кишечной стенки. Рентгенография подтверждает развитие перитонита, заподозрить который можно по сильному вздутию живота при отсутствии газонаполнения кишечных петель.
- В кале обнаруживается кровь, хотя стул может отсутствовать вследствие пареза кишечника и непроходимости.
- При УЗИ органов брюшной полости можно выявить газ или жидкость в брюшной полости, обнаружить эхогенные точки (участки некроза кишечной стенки). Этот признак является одним из первых, позволяющих диагностировать язвенно-некротический энтероколит на ранних стадиях.
- Общий анализ крови выявляет признаки воспаления в виде лейкоцитоза со сдвигом влево.
 Значительно повышается уровень C-реактивного белка, именно этот показатель обычно отслеживается в динамике с целью контроля эффективности лечения. Для язвенно-некротического энтероколита характерны тяжелые электролитные нарушения в виде гипонатриемии и метаболического ацидоза, а также нарушения процессов свертываемости крови вплоть до ДВС-синдрома. Часто выявляется конкретный инфекционный агент, который далеко не всегда играет ключевую роль в развитии клиники заболевания, но служит важным моментом для выбора терапевтической тактики.
Значительно повышается уровень C-реактивного белка, именно этот показатель обычно отслеживается в динамике с целью контроля эффективности лечения. Для язвенно-некротического энтероколита характерны тяжелые электролитные нарушения в виде гипонатриемии и метаболического ацидоза, а также нарушения процессов свертываемости крови вплоть до ДВС-синдрома. Часто выявляется конкретный инфекционный агент, который далеко не всегда играет ключевую роль в развитии клиники заболевания, но служит важным моментом для выбора терапевтической тактики.
Лечение язвенно-некротического энтероколита
Консервативная терапия
Терапия заболевания должна начинаться на этапе первых подозрений на язвенно-некротический энтероколит. Сразу отменяется энтеральное питание, проводится декомпрессия желудка и кишечника. Возможно превентивное назначение антибиотиков широкого спектра действия. Ребенку необходима респираторная поддержка. Требуется кувезный режим в отделении интенсивной терапии, ИВЛ проводится по показаниям.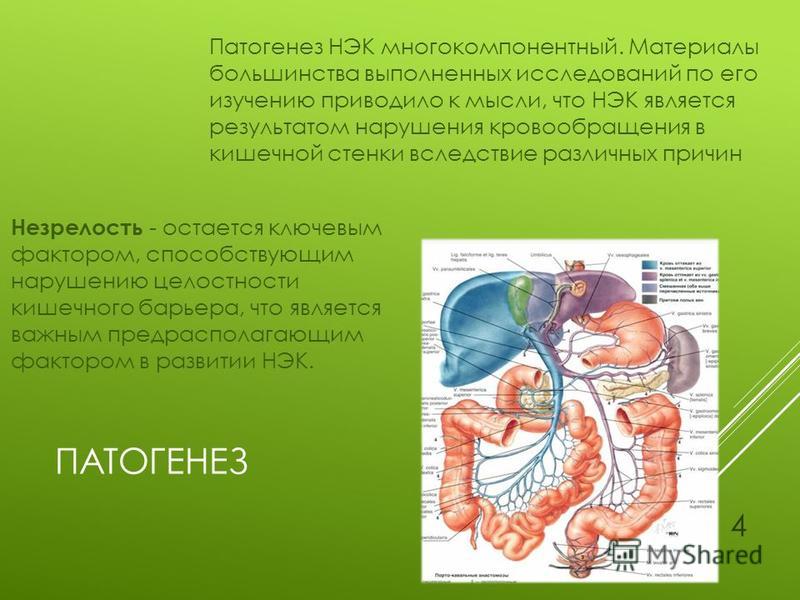 Посиндромное лечение язвенно-некротического энтероколита заключается в коррекции электролитных нарушений и эксикоза, который неизбежен при кишечной непроходимости. Необходима профилактика ДВС-синдрома. В большинстве случаев своевременно начатая терапия позволяет ограничиться консервативными методами.
Посиндромное лечение язвенно-некротического энтероколита заключается в коррекции электролитных нарушений и эксикоза, который неизбежен при кишечной непроходимости. Необходима профилактика ДВС-синдрома. В большинстве случаев своевременно начатая терапия позволяет ограничиться консервативными методами.
Хирургическое лечение
Оперативное лечение язвенно-некротического энтероколита показано в случае обнаружения клинических и рентгенологических признаков перитонита в результате перфорации кишечной стенки. Некротизированный участок кишечника необходимо удалить. Также операция показана при неэффективности проводимых терапевтических мероприятий, то есть при сохранении клинических симптомов, появлении признаков шока, отсутствии положительной динамики в анализах крови. Вопрос о времени возвращения к энтеральному питанию решается индивидуально.
Прогноз и профилактика
Прогноз заболевания сомнительный. Как правило, состояние пациента нормализуется после своевременной диагностики и лечения. Однако возможно стремительное течение язвенно-некротического энтероколита, особенно при наличии предрасполагающих факторов или глубокой недоношенности ребенка. Смертность, по разным данным, составляет от 10 до 40%. Кроме того, если проводилась операция, и резецированный участок был достаточно обширным, развивается синдром «короткой кишки». Статистика показывает, что именно язвенно-некротический энтероколит в большинстве случаев является причиной возникновения данного послеоперационного осложнения, которое значительно снижает качество жизни ребенка, а часто – и ее продолжительность, поскольку усвоение пищи значительно и необратимо ухудшается.
Однако возможно стремительное течение язвенно-некротического энтероколита, особенно при наличии предрасполагающих факторов или глубокой недоношенности ребенка. Смертность, по разным данным, составляет от 10 до 40%. Кроме того, если проводилась операция, и резецированный участок был достаточно обширным, развивается синдром «короткой кишки». Статистика показывает, что именно язвенно-некротический энтероколит в большинстве случаев является причиной возникновения данного послеоперационного осложнения, которое значительно снижает качество жизни ребенка, а часто – и ее продолжительность, поскольку усвоение пищи значительно и необратимо ухудшается.
Медицинский вестник Северного Кавказа :: Научно-практический журнал
Поиск по сайту
Адрес редакции
355017, Ставрополь, улица Мира, 310.
Телефоны
(8652) 35-25-11, 35-32-29.
E-mail
[email protected]
Журнал включён в Перечень ведущих рецензируемых научных журналов и изданий, в которых должны быть опубликованы результаты диссертаций на соискание учёной степени кандидата и доктора наук (решение Президиума ВАК Минобрнауки РФ №6/6, февраль 2010).
Журнал включён в Реферативный журнал и Базы данных ВИНИТИ РАН и зарегистрирован в Научной электронной библиотеке в базе данных Российского индекса научного цитирования на основании сублицензионного договора № 07-04/09-14 от 25 марта 2009 года.
Журнал индексируется: БД SCOPUS, Ulrich’s International Periodicals Directory.
EBSCO
https://doi.org/10.14300/mnnc.2020.15115
[Педиатрия]
Вешкурцева Изабелла Михайловна; Аксельров Михаил Александрович; Минаев Сергей Викторович; Супрунец Светлана Николаевна; Емельянова Виктория Александровна; Гордийчук Светлана Николаевна; Сергиенко Татьяна Владимировна; Баринов Александр Леонидович; Колесников Евгений Геннадьевич;
Проведена клинико-микробиологическая оценка лечения 67 новорожденных, оперированных по поводу прогрессирующего некротизирующего энтероколита (НЭК). С учетом полученных результатов корригировалась стартовая антибактериальная терапия (АБТ), включающая меропенем и ванкомицин (70,7 %) – ванкомицин заменяли на линезолид, а меропенем – на цефтазидим/цефепим. При выявлении резистентной Гр- микрофлоры использовали ципрофлоксацин (9,8 %). При высеве неферментирующего микроорганизма S. maltophilia назначали ко-тримоксазол (6,4 %), при обнаружении грибов Candida non-albicans – микафунгин или амфотерицин (8,0 %). Среднее количество схем АБТ у детей с 3-й стадией НЭК составило 3,35±0,31. Таким образом, использование дифференцированного подхода к терапии НЭК с учетом данных микробиологического исследования позволило снизить летальность пациентов до 39,3±6,57 %.
При выявлении резистентной Гр- микрофлоры использовали ципрофлоксацин (9,8 %). При высеве неферментирующего микроорганизма S. maltophilia назначали ко-тримоксазол (6,4 %), при обнаружении грибов Candida non-albicans – микафунгин или амфотерицин (8,0 %). Среднее количество схем АБТ у детей с 3-й стадией НЭК составило 3,35±0,31. Таким образом, использование дифференцированного подхода к терапии НЭК с учетом данных микробиологического исследования позволило снизить летальность пациентов до 39,3±6,57 %.
Скачать
Список литературы:
1. Намазова-Баранова Л. С. Принципы этапного выхаживания недоношенных детей. М.: «ПедиатрЪ», 2013.
2. Obedin A. N., Kachanov A. V., Annenkov M. V., Tovkan E. A., Kiriyenko O. S. Necrotizing enterocolitis in newborns. Do we all do to save their patients? Meditsinskii Vestnik Severnogo Kavkaza. – Medical News of North Caucasus. 2015;10(2):140-143. https://doi.org/10.14300/mnnc.2015.10032
4. Аболина Т. Б., Цап Н. А., Чудаков В. Б. Хирургические результаты лечения некротизирующего энтероколита у недоношенных детей с экстремально низкой массой тела. Российский вестник детской хирургии, анестезиологии и реаниматологии. 2018;8:1.
Б. Хирургические результаты лечения некротизирующего энтероколита у недоношенных детей с экстремально низкой массой тела. Российский вестник детской хирургии, анестезиологии и реаниматологии. 2018;8:1.
5. Minaev S. V., Obedin A. N., Kachanov A. V., Annenkov M. V., Tovkan E. A. Fast track in the treatment of newborns with necrotizing enterocolites. Medical News of North Caucasus. 2016;11(2):152-154. https://doi.org/10.14300/mnnc.2016.11023
6. Gephart Sh., Newnam K., Wyles Ch., Bethel C., Porter C. [et al.]. Development of the NEC-Zero Toolkit: Supporting Reliable Implementation of Necrotizing Enterocolitis Pre vention and Recognition. Neonatal Network. 2020;39:6-15. https://doi.org/10.1891/0730-0832.39.1.6
7. Shahbaz S., Maurice A., Sim M.-Sh., Rubin Z., Garg M. Effect of Contact Precautions on Staphylococcus aureus and Clinical Outcomes of Colonized Patients in the Neonatal Intensive Care Unit. Pediatr. Infect. Dis. J. 2020;39(11):1045-1049. https://doi.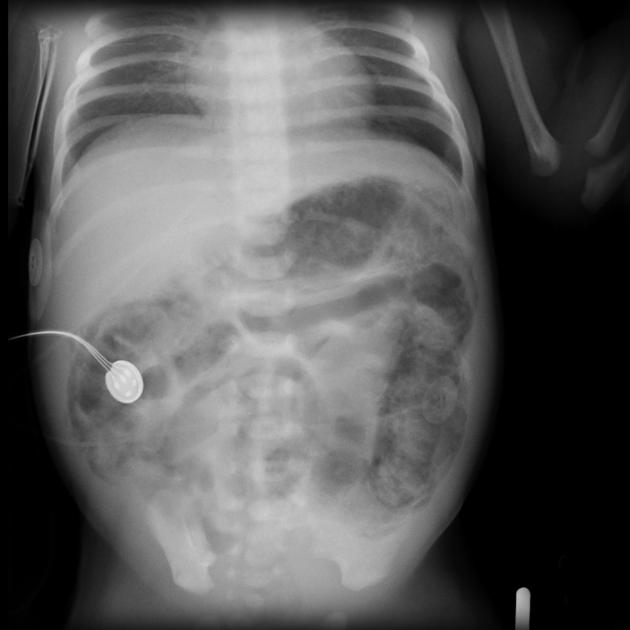 org/10.1097/INF.0000000000002795
org/10.1097/INF.0000000000002795
8. Dobler P. T., Procianov R. S., Mai V., Silveira R. C., Corso A. L. [et al.]. Low Microbial Diversity and Abnormal Microbial Succession Is Associated with Necrotizing Enterocolitis in Preterm Infants. Front. Microbiol. 2017;8:2243. https://doi.org/10.3389/fmicb.2017.02243
9. Terrin G., Scipione A., De Curtis M. Update in Pathogenesis and Prospective in Treatment of Necrotizing Enterocolitis. BioMed Research International. 2014;543765. https://doi.org/10.1155/2014/543765
10. Дорофеева Е. И., Подуровская Ю. Л., Буров А. А., Рюмина И. И., Нароган М. В. [и др.]. Диагностика и консервативное лечение новорожденных с некротизирующим энтероколитом. Клинические рекомендации. 2014.
11. Li X., Li X., Shang Q., Gao Z., Hao F. [et al.]. Fecal microbiota transplantation (FMT) could reverse the severity of experimental necrotizing enterocolitis (NEC) via oxidative stress modulation. Free Radical Biology & Medicine. 2017;108:32-43.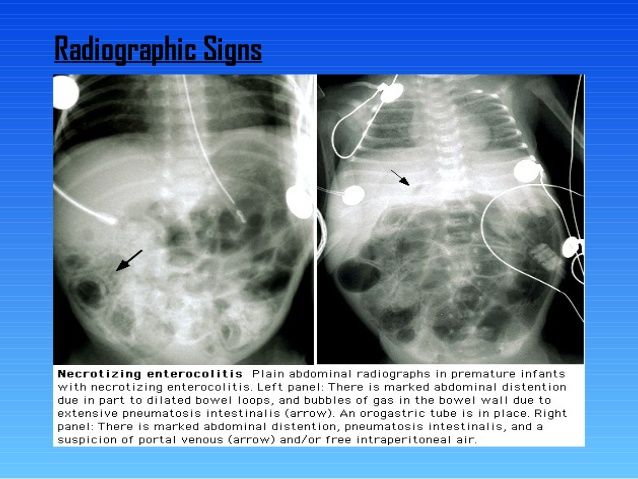 https://doi.org/10.1016/j.freeradbiomed.2017.03.011
https://doi.org/10.1016/j.freeradbiomed.2017.03.011
12. Zani A., Eaton S., Puri P., Rintala R. International survey on the management of necrotizing enterocolitis. Eur. J. Ped. Surg. 2015;25(1):27-33. https://doi.org/10.1055/s-0034-1387942
13. Kirgizov I. V., Minaev S. V., Shishkin I., Aprosimova S., Ukhina L. Surgical treatment of idiopathic megarectum in constipated children. J. Pediatric Surgery. 2019;54(7):1379-1383. https://doi.org/10.1016/j.jpedsurg.2018.10.103
14. Аксельров М. А., Иванов В. В., Аксельров А. М., Сергиенко Т. В., Супрунец С. Н. [и др.]. Этапное лечение осложненных форм прогрессирующего некротического энтероколита у новорожденных. Медицинская наука и образование Урала. 2010;4(64):101-104.
15. Minaev S. V., Isaeva A. V., Tovkan E. A., Gudiev Ch. G., Timofeev S. I. [et al.]. The prognostic value of bactericidal/permeability-increasing protein in infants with congenital pathology of the gastrointestinal tract. Medical News of North Caucasus.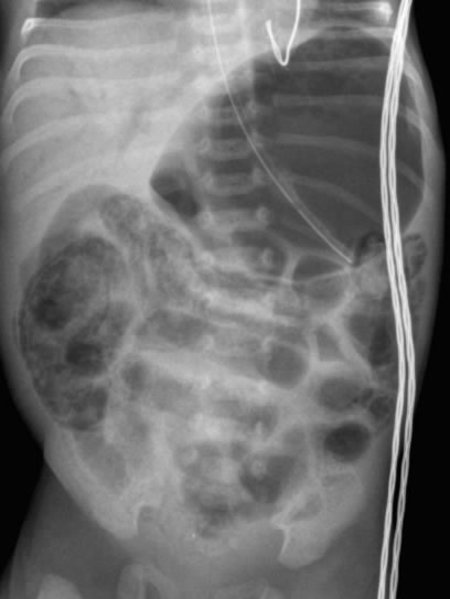 2014;9(2):116-119. https://doi.org/10.14300/mnnc.2014.09032
2014;9(2):116-119. https://doi.org/10.14300/mnnc.2014.09032
16. Gordon P., Swanson J., Clark R., Spitzer A. The complete blood cell count in a refined cohort of preterm NEC: the importance of gestational age and day of diagnosis when using the CBC to estimate mortality. Journal of Perinatology. 2016;36:121-125. https://doi.org/10.1038/jp.2015.162
17. Тараканов В. А., Минаев С. В., Колесников Е. Г., Коротков К. Г., Абушкевич В. Г. [и др.]. Топическая диагностика границ некротизированного сегмента тонкой кишки в высокочастотном электромагнитном поле. Медицинский вестник Северного Кавказа. 2019;14(2):308-311. https://doi.org/10.14300/mnnc.2019.14074
18. Pell L., Loutet M., Roth D., Sherman Ph. Arguments against routine administration of probiotics for NEC prevention. Curr. Opin. Pediatr. 2019;31:195-201. https://doi.org/10.1097/MOP.0000000000000730
19. Livermore D. M. Multiple mechanisms of antimicrobial resistance in Pseudomonas aeruginosa: our worst nightmare? Clin . Infect. Dis. 2002;34:634-640. https://doi.org/10.1086/338782
Infect. Dis. 2002;34:634-640. https://doi.org/10.1086/338782
20. Geng Q., Wang Y., Li L., Guo Ch. Early postoperative outcomes of surgery for intestinal perforation in NEC based on intestinal location of disease. Medicine. 2018;97:e12234. https://doi.org/10.1097/MD.0000000000012234
21. Brooke J. S. Stenotrophomonas maltophilia: an Emerging Global Opportunistic Pathogen. Clin. Microbiol. Rev. 2012;25(1):2-41. https://doi.org/10.1128/CMR.00019-11
22. Подкаменев В. В., Григорьев Е. Г. Язвенно-некротический энтероколит у новорожденных. М., 2010.
Ключевые слова: новорожденные, некротизирующий энтероколит, микробиологическое исследование, антибактериальная терапия
Усовершенствование диагностики и хирургического лечения некротического энтероколита у новорожденных
Paediatric Surgery.Ukraine.2017.2(55):76-84; doi 10.15574/PS.2017.55.76
Переяслов А. А., Борис О. Я.
Львовский национальный медицинский университет имени Данила Галицкого, Украина
Ивано-Франковский национальный медицинский университет, Украина
Цель: обобщить собственный опыт использования ультрасонографии (УСГ) с допплерографией для определения уровня и степени поражения кишечника и решения вопроса дальнейшей хирургической тактики при лечении новорожденных с некротическим энтероколитом (НЭК).
Пациенты и методы. Работа основывается на про- и ретроспективном обследовании 111 новорожденных с разной степенью тяжести НЭК. Диагноз устанавливали на основании результатов объективного обследования и инструментальных (рентгенологических, УСГ и допплерография) методов. У 41 (66,1%) новорожденного после резекции кишки накладывали стому, а у 21 (33,9%) операцию завершали накладыванием первичного анастомоза. Результаты. Общая летальность среди новорожденных после хирургического лечения составляла 17,7% (11 младенцев), в том числе после наложения стомы — 19,5% (8 новорожденных) и после наложения первичного анастомоза — 14,3% (3 ребенка). Различные послеоперационные осложнения развились у 17 (41,5%) детей, которым наложена стомы, и у 5 (23,8%) пациентов после наложения первичного анастомоза.
Выводы. Подтверждено, что для четкой верификации стадии заболевания необходимо комплексное обследование пациента, с учетом результатов УСГ с допплерографией, что позволяет установить наличие некроза кишки еще до момента возникновения перфорации. В сомнительных случаях, при отсутствии убедительных данных по результатам рентгенологического обследования и УСГ, показана диагностическая лапароскопия. Наложение первичного анастомоза при наличии четких показаний является безопасным и эффективным методом лечения у новорожденных с НЭК, что сопровождается меньшим количеством осложнений и более низкой летальностью.
В сомнительных случаях, при отсутствии убедительных данных по результатам рентгенологического обследования и УСГ, показана диагностическая лапароскопия. Наложение первичного анастомоза при наличии четких показаний является безопасным и эффективным методом лечения у новорожденных с НЭК, что сопровождается меньшим количеством осложнений и более низкой летальностью.
Ключевые слова: некротический энтероколит, новорожденные, ультрасонография, медиаторы воспаления, хирургическое лечение, первичный анастомоз.
Литература
1. Баиров В.Г. Об опыте хирургического лечения некротического энтероколита / В.Г. Баиров, С.А. Караваева // Сборник науч. трудов. – Саратов, 2002. – С. 16–20.
2. Карпова И.Ю. Роль инструментальных методов исследования в диагностике некротического энтероколита у новорожденных / И.Ю. Карпова, В.В. Паршиков, Л.Е. Егорская // Вестник експеримент. и клин. хирургии. – 2012. –№2. – С.412–415.
3. Клименко Т.М. Патогенетические подходы к ранней диагностике некротизирующего энтероколита недоношенных новорожденных / Т. М. Клименко, О.В. Воробьева // Неонатологія, хірургія та перинатальна медицина. – 2011. – №1. – С.24–40.
М. Клименко, О.В. Воробьева // Неонатологія, хірургія та перинатальна медицина. – 2011. – №1. – С.24–40.
4. Переяслов А.А. Роль цитокінів при некротичному ентероколіті у дітей / А.А. Переяслов // Хірургія дитячого віку. – 2007. – №4. – С.8–17.
5. Berseth C.L. Prolonging small feeding volumes early in life decreases the incidence of necrotizing enterocolitis in very low birth weight infants / C.L. Berseth, J.A. Bisquera, V.U. Paje // Pediatrics. – 2003. – Vol.111. – P.671–672. https://doi.org/10.1542/peds.111.3.529
6. Bhatia J. Strategies to prevent necrotising enterocolitis / J. Bhatia // Chin. Med. J. –2010. – Vol.123. – Р.2759–2765.
7. Gupta A. Etiology and medical management of NEC / A. Gupta, A. Paria // Early Hum. Dev. – 2016. – Vol.97. – P.17–23. https://doi.org/10.1016/j.earlhumdev.2016.03.008; PMid:27080373
8. Hunter C.J. Inflammatory signaling in NEC: Role of NF-κB, cytokines and other inflammatory mediators / C.J. Hunter, I.G. De Plaen // Pathophysiology. – 2014. –Vol.21. – P.55–65. https://doi.org/10.1016/j.pathophys.2013.11.010; PMid:24388163 PMCid:PMC4354685
– 2014. –Vol.21. – P.55–65. https://doi.org/10.1016/j.pathophys.2013.11.010; PMid:24388163 PMCid:PMC4354685
9. Kastenberg Z.J. The surgical management of necrotizing enterocolitis / Z.J. Kastenberg, K.G. Sylvester // Clin. Perinatol. – 2013. – Vol.40. – P.135–148. https://doi.org/10.1016/j.clp.2012.12.011; PMid:23415269
10. Kim J.H. Necrotizing enterocolitis: The road to zero / J.H. Kim // Semin. Fetal Neonatal Med. – 2014. – Vol.19. – P.39–44. https://doi.org/10.1016/j.siny.2013.10.001; PMid:24268863
11. Luig M. Epidemiology of necrotizing enterocolitis – part I: changing regional trends in extremely preterm infants over 14 years / M. Luig, K. Lui; NSW & ACT NICUS Group // J. Paediatr. Child Health. – 2005. – Vol.41. – P.169–173. https://doi.org/10.1111/j.1440-1754.2005.00582.x; PMid:15813869
12. Maheshwari A. Immunologic and hematological abnormalities in necrotizing enterocolitis / A. Maheshwari // Clin. Perinatol. – 2015. – Vol.42. – P.567–585. https://doi.org/10.1016/j.clp.2015.04.014; PMid:26250918 PMCid:PMC4530495
https://doi.org/10.1016/j.clp.2015.04.014; PMid:26250918 PMCid:PMC4530495
13. Muller M.J. Necrotizing enterocolitis in premature infants and newborns / M.J. Muller, T. Paul, S. Seeliger // J. Neonatal Perinatal Med. – 2016. – Vol.9. – P.233–242. https://doi.org/10.3233/NPM-16915130; PMid:27589549
Медсовет для врачей | Remedium.ru
19.09.2022
Что влияет на выявляемость ишемического инсульта при нейровизуализации?
З.А. Ахатова, Р.С. Мусин, П.Н. Власов, Ю.И. Макарова, С.А. Труханов; МГМСУ им. А.И. Евдокимова
Введение. Заболеваемость инсультом составляет 2,5–3 случая на 1 тыс. населения в год, смертность – 1 случай на 1 тыс. населения в год. По разным данным, до 20% компьютерных томографий (КТ), проведенных в …
Подробнее
15. 09.2022
09.2022
Клинические особенности и тактика терапии коморбидных дерматозов
Е.Е. Жильцова1,2, С.A. Политов1,2, О.В. Баковецкая1; 1 РязГМУ им. ак. И.П. Павлова, 2 РО «ОККВД»
В статье представлен случай возможной коморбидности в дерматологической практике. Известно, что инфекции кожи являются распространенными у пациентов с хронической экземой, причем они могут иметь бактериальную,…
Подробнее
13.09.2022
Альтернативные виды терапии рецидивирующего цистита у женщин в менопаузе
Е.В. Кульчавеня1,2,3, Л.С. Трейвиш3, Е.В. Телина3; 1 Новосибирский научно-исследовательский институт туберкулеза, 2 Новосибирский государственный медицинский университет, 3 Медицинский центр «Авиценна»
Инфекции мочевыводящих путей (ИМП). ..
..
Подробнее
09.09.2022
Сравнительная оценка результатов терапии акне легкой степени
И.М. Хисматулина, Е.В. Файзуллина, Е.С. Гусарова, Р.Р. Набиева; Казанский государственный медицинский университет
Введение. Акне легкой степени является самой недооцененной формой заболевания.
Цель исследования – сравнить результаты наружной комбинированной терапии…
Подробнее
08.09.2022
Иридоциклит и другие увеиты
Увеит, процесс внутриглазного воспаления, может быть вызван многими причинами. Направление к специалисту-офтальмологу показано для диагностики и лечения большинства пациентов с симптомами, указывающими на воспаление сосудистой оболочки глаза. Увеит характеризуется воспалением сосудистой оболочки глаза,…
Увеит характеризуется воспалением сосудистой оболочки глаза,…
Подробнее
07.09.2022
Аудиологический скрининг школьников: международный опыт и рекомендации
С.С. Чибисова1, И. Альшарджаби2, А.С. Зюзин1, Е.Р. Цыганкова1, В.И. Попадюк2, Г.А. Таварткиладзе1, И.М. Кириченко2; 1 Российская медицинская академия непрерывного профессионального образования, 2 Российский университет дружбы народов
Нарушение слуха в детском возрасте затрудняет…
Подробнее
06.09.2022
Что исследуют с помощью щелевой лампы?
Щелевая лампа представляет собой бинокулярный микроскоп, который обеспечивает исследователю стереоскопическое (т. е. трехмерное) изображение глаза. Он мало изменился с момента его разработки Гольдманом в 1937 году. Однако существуют альтернативные методы исследования глаза с использованием портативных…
е. трехмерное) изображение глаза. Он мало изменился с момента его разработки Гольдманом в 1937 году. Однако существуют альтернативные методы исследования глаза с использованием портативных…
Подробнее
05.09.2022
Вопросы терапии поствоспалительной гиперпигментации постакне
Л.С. Круглова, Н.В. Грязева; ЦГМА
Введение. Поствоспалительная гиперпигментация постакне наиболее часто формируется у пациентов со среднетяжелой и тяжелой степенью акне. Пигментация постакне может носить стойкий характер и сохраняться от месяцев до нескольких лет, что оказывает отрицательное влияние…
Подробнее
02.09.2022
Ангина у детей
Ангина – общепринятое название острого тонзиллита у детей. Это патологический процесс, который в первую очередь лечат педиатры и врачи первичной медико-санитарной помощи, остается одним из самых распространенных инфекционных заболеваний среди населения в целом, в основном среди детского. В обзоре обсуждается…
Это патологический процесс, который в первую очередь лечат педиатры и врачи первичной медико-санитарной помощи, остается одним из самых распространенных инфекционных заболеваний среди населения в целом, в основном среди детского. В обзоре обсуждается…
Подробнее
01.09.2022
Сопоставление результатов пункционных биопсий узлов щитовидной железы и ультразвуковой стратификации рисков рака щитовидной железы по системе TIRADS с результатами гистологического исследования
Aleksandr A. Shchegolev1,2, Aleksandr A. Larin1, Andrey S. Slobodyanik2*, Evgeniy V. Svetlov2, Rinat R. Shafigullin2; 1 Pirogov Russian National Research Medical University, 2 Inozemtsev City Clinical Hospital of the Department of Health of Moscow
. ..
..
Подробнее
Загрузить еще
Некротизирующий энтероколит у новорожденных: патогенез, профилактика и лечение
Обзор
. 2008;68(9):1227-38.
doi: 10.2165/00003495-200868090-00004.
Алисия М Томпсон
1
, Мэтью Дж. Биззарро
принадлежность
- 1 Кафедра педиатрии, Медицинский факультет Йельского университета, Нью-Хейвен, Коннектикут 06520-8064, США.
PMID:
18547133
DOI:
10.
 2165/00003495-200868090-00004
2165/00003495-200868090-00004
Обзор
Alecia M Thompson et al.
Наркотики.
2008.
. 2008;68(9):1227-38.
дои: 10.2165/00003495-200868090-00004.
Авторы
Алисия М Томпсон
1
, Мэтью Дж. Биззарро
принадлежность
- 1 Кафедра педиатрии, Медицинский факультет Йельского университета, Нью-Хейвен, Коннектикут 06520-8064, США.
PMID:
18547133
DOI:
10.
 2165/00003495-200868090-00004
2165/00003495-200868090-00004
Абстрактный
Некротизирующий энтероколит (НЭК) представляет собой преимущественно патологический процесс желудочно-кишечного тракта (ЖКТ) недоношенных новорожденных, который приводит к воспалению и бактериальной инвазии стенки кишечника. Несмотря на успехи в уходе за недоношенными детьми, НЭК остается одной из ведущих причин заболеваемости и смертности в этой популяции. Он встречается у 1-5% всех госпитализаций новорожденных в реанимацию и у 5-10% всех новорожденных с очень низкой массой тела при рождении (<1500 г). Хотя исследования представили интересный набор потенциальных способствующих факторов, точная этиология этого многофакторного болезненного процесса остается неясной. Исторически считалось, что НЭК возникает преимущественно из-за ишемического повреждения незрелого желудочно-кишечного тракта, однако альтернативные правдоподобные гипотезы указывают на то, что, вероятно, участвуют многие факторы. Они могут включать проблемы, связанные с введением и продвижением энтерального питания, изменениями в нормальной бактериальной колонизации желудочно-кишечного тракта, бактериальной транслокацией и активацией цитокинового каскада, снижением эпидермального фактора роста, увеличением фактора активации тромбоцитов и повреждением слизистой оболочки свободными радикалами. производство. Клинические проявления НЭК могут быть нечеткими, включая учащение эпизодов апноэ, десатурацию, брадикардию, вялость и нестабильность температуры. Также могут быть специфические желудочно-кишечные симптомы, такие как непереносимость пищи, рвота, кровавый стул, вздутие и болезненность живота, изменение цвета брюшной стенки. Лабораторные показатели могут свидетельствовать об инфекции, нарушениях коагуляции и задержке жидкости. Рентгенологические признаки могут включать кишечную непроходимость, расширенные или фиксированные петли кишечника, воздух в стенке кишечника или свободный воздух в брюшной полости. Медикаментозное лечение обычно состоит из отдыха кишечника и декомпрессии, антибактериальной терапии и лечения других нарушений гематологического или электролитного баланса.
Они могут включать проблемы, связанные с введением и продвижением энтерального питания, изменениями в нормальной бактериальной колонизации желудочно-кишечного тракта, бактериальной транслокацией и активацией цитокинового каскада, снижением эпидермального фактора роста, увеличением фактора активации тромбоцитов и повреждением слизистой оболочки свободными радикалами. производство. Клинические проявления НЭК могут быть нечеткими, включая учащение эпизодов апноэ, десатурацию, брадикардию, вялость и нестабильность температуры. Также могут быть специфические желудочно-кишечные симптомы, такие как непереносимость пищи, рвота, кровавый стул, вздутие и болезненность живота, изменение цвета брюшной стенки. Лабораторные показатели могут свидетельствовать об инфекции, нарушениях коагуляции и задержке жидкости. Рентгенологические признаки могут включать кишечную непроходимость, расширенные или фиксированные петли кишечника, воздух в стенке кишечника или свободный воздух в брюшной полости. Медикаментозное лечение обычно состоит из отдыха кишечника и декомпрессии, антибактериальной терапии и лечения других нарушений гематологического или электролитного баланса. Иногда требуется усиленная респираторная и сердечно-сосудистая поддержка. У новорожденных, которые не реагируют адекватно на медикаментозное лечение, или при наличии пневмоперитонеума может потребоваться хирургическое вмешательство с использованием перитонеального дренирования или лапаротомии. Достижения в дородовой и неонатальной помощи привели к увеличению выживаемости крайне недоношенных новорожденных. Поскольку эта группа риска продолжает расти, необходима эффективная стратегия профилактики НЭК. Одной из профилактических стратегий является использование антенатальных кортикостероидов для ускорения созревания плода, если вероятны преждевременные роды. Рекомендации по использованию грудного молока, раннее начало трофического питания и разумное продвижение кишечного питания являются текущими послеродовыми стратегиями. Другие исследованные профилактические стратегии включают использование пероральных антибактериальных препаратов, антиоксидантов, добавок аргинина и эпидермального фактора роста, ни одна из которых не изменила клиническую практику.
Иногда требуется усиленная респираторная и сердечно-сосудистая поддержка. У новорожденных, которые не реагируют адекватно на медикаментозное лечение, или при наличии пневмоперитонеума может потребоваться хирургическое вмешательство с использованием перитонеального дренирования или лапаротомии. Достижения в дородовой и неонатальной помощи привели к увеличению выживаемости крайне недоношенных новорожденных. Поскольку эта группа риска продолжает расти, необходима эффективная стратегия профилактики НЭК. Одной из профилактических стратегий является использование антенатальных кортикостероидов для ускорения созревания плода, если вероятны преждевременные роды. Рекомендации по использованию грудного молока, раннее начало трофического питания и разумное продвижение кишечного питания являются текущими послеродовыми стратегиями. Другие исследованные профилактические стратегии включают использование пероральных антибактериальных препаратов, антиоксидантов, добавок аргинина и эпидермального фактора роста, ни одна из которых не изменила клиническую практику. Недавние многообещающие данные показывают, что профилактическое использование пробиотиков может играть роль в предотвращении возникновения НЭК. Однако необходимы более масштабные, окончательные исследования.
Недавние многообещающие данные показывают, что профилактическое использование пробиотиков может играть роль в предотвращении возникновения НЭК. Однако необходимы более масштабные, окончательные исследования.
Похожие статьи
Некротизирующий энтероколит: профилактические стратегии.
Ребер К.М., Нанкервис, Калифорния.
Ребер К.М. и др.
Клин Перинатол. 2004 март; 31(1):157-67. doi: 10.1016/j.clp.2004.03.002.
Клин Перинатол. 2004.PMID: 15183664
Обзор.
Пробиотики и другие стратегии профилактики некротизирующего энтероколита.
Эмблтон Н.Д., Йейтс Р.
Эмблтон Н.Д. и соавт.
Semin Fetal Neonatal Med. 2008 фев; 13 (1): 35-43. doi: 10.1016/j.siny.2007.09.003. Epub 2007 31 октября.
Semin Fetal Neonatal Med. 2008.
2008.PMID: 17974513
Обзор.
Что дальше при некротическом энтероколите?
Юрдакёк М.
Юрдакок М.
Терк Дж. Педиатр. 2008 янв-февраль;50(1):1-11.
Терк Дж. Педиатр. 2008.PMID: 18365584
Обзор.
Некротизирующий энтероколит — классификация и два первых шага к профилактике.
Юл С.М.
Юл СМ.
Dan Med J. 2017 Jun; 64 (6): B5362.
Дэн Мед Дж. 2017.PMID: 28566122
Клиническое испытание.
Добавление пробиотиков матерям для профилактики заболеваемости и смертности у недоношенных детей.
Грев Дж., Берг М., Солл Р.
Грев Дж. и др.
Cochrane Database Syst Rev. 2018 Dec 12;12(12):CD012519. doi: 10.1002/14651858.CD012519.pub2.
2018 Dec 12;12(12):CD012519. doi: 10.1002/14651858.CD012519.pub2.
Кокрановская система баз данных, ред. 2018 г.PMID: 30548483
Бесплатная статья ЧВК.
Посмотреть все похожие статьи
Цитируется
Дистанционное ишемическое кондиционирование вызывает сдвиг Т-клеток CD4 в сторону уменьшения клеточно-опосредованного воспаления.
Алганаби М., Биус Г., Ганджи Н., Ямото М., Ли С., Ли Б., Пьеро А.
Алганаби М. и др.
Pediatr Surg Int. 2022 май; 38 (5): 657-664. doi: 10.1007/s00383-022-05093-3. Epub 2022 4 марта.
Pediatr Surg Int. 2022.PMID: 35244771
Инвазивные инфекции Bacillus cereus у недоношенных новорожденных: современный обзор литературы.
Лотте Р.
 , Шевалье А., Бойер Л., Руми Р.
, Шевалье А., Бойер Л., Руми Р.
Лотте Р. и др.
Clin Microbiol Rev. 2022 Apr 20;35(2):e0008821. doi: 10.1128/cmr.00088-21. Epub 2022 9 фев..
Clin Microbiol Rev. 2022.PMID: 35138121
Обзор.
Печеночный портальный венозный газ без определенных клинических проявлений некротизирующего энтероколита у 3-дневного доношенного новорожденного: история болезни.
Юань К., Чен QQ, Чжу Ю.Л., Луо Ф.
Юань К. и др.
Мировые дела J Clin. 2021 26 октября; 9 (30): 9269-9275. дои: 10.12998/wjcc.v9.i30.9269.
Мировые дела J Clin. 2021.PMID: 34786413
Бесплатная статья ЧВК.Взаимодействие иммунитета и микробиома и его последствия при нейродегенеративных расстройствах.
Униял А., Тивари В., Рани М., Тивари В.

Униял А. и др.
Метаб Мозг Дис. 2022 Январь; 37(1):17-37. doi: 10.1007/s11011-021-00807-3. Epub 2021 6 августа.
Метаб Мозг Дис. 2022.PMID: 34357554
Обзор.
Стресс эндоплазматического ретикулума при остром повреждении эпителия кишечника при некротическом энтероколите.
Лау Э., Ли С., Ли Б., Пьеро А.
Лау Э. и др.
Pediatr Surg Int. 2021 сен;37(9):1151-1160. doi: 10.1007/s00383-021-04929-8. Epub 2021 12 июня.
Pediatr Surg Int. 2021.PMID: 34117913
Обзор.
Просмотреть все статьи «Цитируется по»
использованная литература
J Pediatr Surg. 2000 г., февраль; 35(2):173-6; обсуждение 177
—
пабмед
J Педиатр.
 1997 авг; 131 (2): 226-32
1997 авг; 131 (2): 226-32—
пабмед
J Pediatr Gastroenterol Nutr. 2000 янв; 30 (1): 61-7
—
пабмед
Радиология. 2005 май; 235 (2): 587-94
—
пабмед
Дж. Гум Лакт. 2004 августа; 20 (3): 335-9
—
пабмед
Типы публикаций
термины MeSH
3
вещества
Некротический энтероколит: симптомы, причины, лечение
В этой статье
- Чем это вызвано?
- Кто подвержен риску
- Каковы симптомы?
- Как это диагностируется?
- Какое лечение?
- Каковы перспективы NEC?
Некротизирующий энтероколит, или НЭК, представляет собой серьезное заболевание, поражающее кишечник недоношенных детей. Обычно это происходит в течение первых 2 недель жизни у детей, которых кормят смесями вместо грудного молока.
Обычно это происходит в течение первых 2 недель жизни у детей, которых кормят смесями вместо грудного молока.
В этом состоянии бактерии внедряются в стенку кишечника. Начинается воспаление. Это может привести к образованию трещины или щели, позволяющей неприятным микробам просачиваться в брюшную полость. Если не лечить, это может привести к серьезной инфекции и смерти.
Чем это вызвано?
Врачи не уверены. Они знают, что у недоношенных детей легкие и кишечник слабее и менее развиты, чем у доношенных детей. Это означает, что их тела не перемещают кровь и кислород, как должны. У них также есть проблемы с расщеплением пищи и борьбой с инфекцией.
Кто в группе риска
К счастью, НЭК встречается редко. Он затрагивает только одного из 2000–4000 новорожденных. Это может произойти у любого новорожденного ребенка, но чаще всего это происходит у недоношенных детей, которые весят менее 3,25 фунтов. В группу риска могут входить:
- Дети из группы высокого риска или недоношенные дети, которых кормят смесью через рот или через зонд
- Те, у кого были тяжелые роды или у которых снижен уровень кислорода
- Младенцы, у которых слишком много эритроцитов в циркуляции
- Младенцы с существующими желудочно-кишечными инфекциями
- Тяжелобольные младенцы и те, кому сделали переливание крови
Каковы симптомы?
Они могут отличаться от ребенка к ребенку. Но у младенца с НЭК в первые две недели жизни обычно развивается следующее:
Но у младенца с НЭК в первые две недели жизни обычно развивается следующее:
- Опухший или вздутый живот
- Корм, который остается в желудке и не проходит через кишечник
- Зеленая жидкость в желудке
- Кровавый кал
- Затрудненное дыхание, учащенное сердцебиение или вялость пищеварения
- состояния или проблемы со здоровьем вызывают симптомы, сходные с НЭК. Если у вашего ребенка разовьется что-либо из перечисленного выше, позвоните своему врачу.
Как это диагностируется?
Врач вашего ребенка сделает рентген брюшной полости и проведет несколько анализов крови, обычно в отделении интенсивной терапии новорожденных. Если это НЭК, рентген покажет газ или пузырьки воздуха в стенке кишечника. Врач также может ввести иглу в живот вашего ребенка. Если жидкость вытекает, это признак того, что в их кишечнике есть дыра. Анализы крови младенцев с НЭК показывают низкий уровень лейкоцитов. Это означает, что способность вашего ребенка бороться с инфекцией ослаблена.

Что лечить?
Это будет зависеть от ряда факторов, в том числе от того, насколько недоношен ваш ребенок, его общего состояния здоровья и истории болезни, а также от того, насколько далеко распространилась инфекция.
Затем ваш врач может сделать следующее:
- Прекратить кормление
- Вставить трубку через нос в желудок, чтобы удалить жидкость и оставить желудок пустым.
- Начните внутривенно вводить жидкости для питания и увлажнения
- Дайте антибиотики для борьбы с инфекцией
- Регулярно делайте рентгеновские снимки для контроля состояния
- Обеспечьте дополнительный кислород или аппарат искусственного дыхания, если их живот слишком опух, чтобы они могли дышать самостоятельно
- Держите их подальше от других детей, чтобы остановить распространение NEC
После исчезновения инфекции (обычно через 5–7 дней) ваш ребенок может снова начать кормить через рот.
Если им не станет лучше после лечения или у них появится дырка в кишечнике, им потребуется операция.
 Это включает удаление мертвых тканей и частей кишечника, которые разорвались или вот-вот разорвутся. В наиболее серьезных случаях детям, перенесшим операцию, может потребоваться соединение кишечника или кишечника с отверстием в брюшной полости. Врачи называют это «стома».
Это включает удаление мертвых тканей и частей кишечника, которые разорвались или вот-вот разорвутся. В наиболее серьезных случаях детям, перенесшим операцию, может потребоваться соединение кишечника или кишечника с отверстием в брюшной полости. Врачи называют это «стома».Каковы перспективы NEC?
Большинство младенцев с этим заболеванием полностью выздоравливают. В некоторых случаях кишка рубцуется или сужается. Это может привести к блокировке в будущем. Младенцы, у которых во время операции был удален большой кусок кишечника, могут быть не в состоянии нормально усваивать питательные вещества. В самых тяжелых случаях им может потребоваться пересадка кишечника, чтобы выжить.
На данный момент нет способа предотвратить NEC. Но исследования показывают, что дети, которых кормили только грудным молоком (без смеси), реже болели этим заболеванием. Вот почему врачи рекомендуют кормить детей из группы риска грудным молоком, начиная с небольших количеств. Многие отделения интенсивной терапии в настоящее время используют донорское грудное молоко, когда его нет в наличии от матери, чтобы снизить заболеваемость НЭК
Исследователи работают над многообещающими новыми методами лечения НЭК.
 Среди них: пробиотики, которые представляют собой живые бактерии и дрожжи, которые полезны для вас, противодействуют бактериям, вызывающим инфекцию, и блокируют оксид азота. Это газ, который образуется в результате NEC. Он помогает разрушить стенку кишечника.
Среди них: пробиотики, которые представляют собой живые бактерии и дрожжи, которые полезны для вас, противодействуют бактериям, вызывающим инфекцию, и блокируют оксид азота. Это газ, который образуется в результате NEC. Он помогает разрушить стенку кишечника.Некротический энтероколит: симптомы, причины, лечение
В этой статье
- Что его вызывает?
- Кто в группе риска
- Каковы симптомы?
- Как это диагностируется?
- Какое лечение?
- Каковы перспективы NEC?
Некротизирующий энтероколит, или НЭК, представляет собой серьезное заболевание, поражающее кишечник недоношенных детей. Обычно это происходит в течение первых 2 недель жизни у детей, которых кормят смесями вместо грудного молока.
В этом состоянии бактерии внедряются в стенку кишечника. Начинается воспаление. Это может привести к образованию трещины или щели, позволяющей неприятным микробам просачиваться в брюшную полость. Если не лечить, это может привести к серьезной инфекции и смерти.

Чем это вызвано?
Врачи не уверены. Они знают, что у недоношенных детей легкие и кишечник слабее и менее развиты, чем у доношенных детей. Это означает, что их тела не перемещают кровь и кислород, как должны. У них также есть проблемы с расщеплением пищи и борьбой с инфекцией.
Кто в группе риска
К счастью, НЭК встречается редко. Он затрагивает только одного из 2000–4000 новорожденных. Это может произойти у любого новорожденного ребенка, но чаще всего это происходит у недоношенных детей, которые весят менее 3,25 фунтов. В группу риска могут входить:
- Дети из группы высокого риска или недоношенные дети, которых кормят смесью через рот или через зонд
- Те, у кого были тяжелые роды или у которых снижен уровень кислорода
- Младенцы, у которых слишком много эритроцитов в циркуляции
- Младенцы с существующими желудочно-кишечными инфекциями
- Тяжелобольные младенцы и те, кому сделали переливание крови
Каковы симптомы?
Они могут отличаться от ребенка к ребенку.
 Но у младенца с НЭК в первые две недели жизни обычно развивается следующее:
Но у младенца с НЭК в первые две недели жизни обычно развивается следующее:- Опухший или вздутый живот
- Корм, который остается в желудке и не проходит через кишечник
- Зеленая жидкость в желудке
- Кровавый кал
- Затрудненное дыхание, учащенное сердцебиение или вялость пищеварения
- Другое
- состояния или проблемы со здоровьем вызывают симптомы, сходные с НЭК. Если у вашего ребенка разовьется что-либо из перечисленного выше, позвоните своему врачу.
Как это диагностируется?
Врач вашего ребенка сделает рентген брюшной полости и проведет несколько анализов крови, обычно в отделении интенсивной терапии новорожденных. Если это НЭК, рентген покажет газ или пузырьки воздуха в стенке кишечника. Врач также может ввести иглу в живот вашего ребенка. Если жидкость вытекает, это признак того, что в их кишечнике есть дыра. Анализы крови младенцев с НЭК показывают низкий уровень лейкоцитов. Это означает, что способность вашего ребенка бороться с инфекцией ослаблена.

Что лечить?
Это будет зависеть от ряда факторов, в том числе от того, насколько недоношен ваш ребенок, его общего состояния здоровья и истории болезни, а также от того, насколько далеко распространилась инфекция.
Затем ваш врач может сделать следующее:
- Прекратить кормление
- Вставить трубку через нос в желудок, чтобы удалить жидкость и оставить желудок пустым.
- Начните внутривенно вводить жидкости для питания и увлажнения
- Дайте антибиотики для борьбы с инфекцией
- Регулярно делайте рентгеновские снимки для контроля состояния
- Обеспечьте дополнительный кислород или аппарат искусственного дыхания, если их живот слишком опух, чтобы они могли дышать самостоятельно
- Держите их подальше от других детей, чтобы остановить распространение NEC
После исчезновения инфекции (обычно через 5–7 дней) ваш ребенок может снова начать кормить через рот.
Если им не станет лучше после лечения или у них появится дырка в кишечнике, им потребуется операция.
 Это включает удаление мертвых тканей и частей кишечника, которые разорвались или вот-вот разорвутся. В наиболее серьезных случаях детям, перенесшим операцию, может потребоваться соединение кишечника или кишечника с отверстием в брюшной полости. Врачи называют это «стома».
Это включает удаление мертвых тканей и частей кишечника, которые разорвались или вот-вот разорвутся. В наиболее серьезных случаях детям, перенесшим операцию, может потребоваться соединение кишечника или кишечника с отверстием в брюшной полости. Врачи называют это «стома».Каковы перспективы NEC?
Большинство младенцев с этим заболеванием полностью выздоравливают. В некоторых случаях кишка рубцуется или сужается. Это может привести к блокировке в будущем. Младенцы, у которых во время операции был удален большой кусок кишечника, могут быть не в состоянии нормально усваивать питательные вещества. В самых тяжелых случаях им может потребоваться пересадка кишечника, чтобы выжить.
На данный момент нет способа предотвратить NEC. Но исследования показывают, что дети, которых кормили только грудным молоком (без смеси), реже болели этим заболеванием. Вот почему врачи рекомендуют кормить детей из группы риска грудным молоком, начиная с небольших количеств. Многие отделения интенсивной терапии в настоящее время используют донорское грудное молоко, когда его нет в наличии от матери, чтобы снизить заболеваемость НЭК
Исследователи работают над многообещающими новыми методами лечения НЭК.
 Среди них: пробиотики, которые представляют собой живые бактерии и дрожжи, которые полезны для вас, противодействуют бактериям, вызывающим инфекцию, и блокируют оксид азота. Это газ, который образуется в результате NEC. Он помогает разрушить стенку кишечника.
Среди них: пробиотики, которые представляют собой живые бактерии и дрожжи, которые полезны для вас, противодействуют бактериям, вызывающим инфекцию, и блокируют оксид азота. Это газ, который образуется в результате NEC. Он помогает разрушить стенку кишечника.Некротический энтероколит: симптомы, причины, лечение
В этой статье
- Что его вызывает?
- Кто в группе риска
- Каковы симптомы?
- Как это диагностируется?
- Какое лечение?
- Каковы перспективы NEC?
Некротизирующий энтероколит, или НЭК, представляет собой серьезное заболевание, поражающее кишечник недоношенных детей. Обычно это происходит в течение первых 2 недель жизни у детей, которых кормят смесями вместо грудного молока.
В этом состоянии бактерии внедряются в стенку кишечника. Начинается воспаление. Это может привести к образованию трещины или щели, позволяющей неприятным микробам просачиваться в брюшную полость. Если не лечить, это может привести к серьезной инфекции и смерти.

Чем это вызвано?
Врачи не уверены. Они знают, что у недоношенных детей легкие и кишечник слабее и менее развиты, чем у доношенных детей. Это означает, что их тела не перемещают кровь и кислород, как должны. У них также есть проблемы с расщеплением пищи и борьбой с инфекцией.
Кто в группе риска
К счастью, НЭК встречается редко. Он затрагивает только одного из 2000–4000 новорожденных. Это может произойти у любого новорожденного ребенка, но чаще всего это происходит у недоношенных детей, которые весят менее 3,25 фунтов. В группу риска могут входить:
- Дети из группы высокого риска или недоношенные дети, которых кормят смесью через рот или через зонд
- Те, у кого были тяжелые роды или у которых снижен уровень кислорода
- Младенцы, у которых слишком много эритроцитов в циркуляции
- Младенцы с существующими желудочно-кишечными инфекциями
- Тяжелобольные младенцы и те, кому сделали переливание крови
Каковы симптомы?
Они могут отличаться от ребенка к ребенку.
 Но у младенца с НЭК в первые две недели жизни обычно развивается следующее:
Но у младенца с НЭК в первые две недели жизни обычно развивается следующее:- Опухший или вздутый живот
- Корм, который остается в желудке и не проходит через кишечник
- Зеленая жидкость в желудке
- Кровавый кал
- Затрудненное дыхание, учащенное сердцебиение или вялость пищеварения
- Другое
- состояния или проблемы со здоровьем вызывают симптомы, сходные с НЭК. Если у вашего ребенка разовьется что-либо из перечисленного выше, позвоните своему врачу.
Как это диагностируется?
Врач вашего ребенка сделает рентген брюшной полости и проведет несколько анализов крови, обычно в отделении интенсивной терапии новорожденных. Если это НЭК, рентген покажет газ или пузырьки воздуха в стенке кишечника. Врач также может ввести иглу в живот вашего ребенка. Если жидкость вытекает, это признак того, что в их кишечнике есть дыра. Анализы крови младенцев с НЭК показывают низкий уровень лейкоцитов. Это означает, что способность вашего ребенка бороться с инфекцией ослаблена.

Что лечить?
Это будет зависеть от ряда факторов, в том числе от того, насколько недоношен ваш ребенок, его общего состояния здоровья и истории болезни, а также от того, насколько далеко распространилась инфекция.
Затем ваш врач может сделать следующее:
- Прекратить кормление
- Вставить трубку через нос в желудок, чтобы удалить жидкость и оставить желудок пустым.
- Начните внутривенно вводить жидкости для питания и увлажнения
- Дайте антибиотики для борьбы с инфекцией
- Регулярно делайте рентгеновские снимки для контроля состояния
- Обеспечьте дополнительный кислород или аппарат искусственного дыхания, если их живот слишком опух, чтобы они могли дышать самостоятельно
- Держите их подальше от других детей, чтобы остановить распространение NEC
После исчезновения инфекции (обычно через 5–7 дней) ваш ребенок может снова начать кормить через рот.
Если им не станет лучше после лечения или у них появится дырка в кишечнике, им потребуется операция.
 Это включает удаление мертвых тканей и частей кишечника, которые разорвались или вот-вот разорвутся. В наиболее серьезных случаях детям, перенесшим операцию, может потребоваться соединение кишечника или кишечника с отверстием в брюшной полости. Врачи называют это «стома».
Это включает удаление мертвых тканей и частей кишечника, которые разорвались или вот-вот разорвутся. В наиболее серьезных случаях детям, перенесшим операцию, может потребоваться соединение кишечника или кишечника с отверстием в брюшной полости. Врачи называют это «стома».Каковы перспективы NEC?
Большинство младенцев с этим заболеванием полностью выздоравливают. В некоторых случаях кишка рубцуется или сужается. Это может привести к блокировке в будущем. Младенцы, у которых во время операции был удален большой кусок кишечника, могут быть не в состоянии нормально усваивать питательные вещества. В самых тяжелых случаях им может потребоваться пересадка кишечника, чтобы выжить.
На данный момент нет способа предотвратить NEC. Но исследования показывают, что дети, которых кормили только грудным молоком (без смеси), реже болели этим заболеванием. Вот почему врачи рекомендуют кормить детей из группы риска грудным молоком, начиная с небольших количеств. Многие отделения интенсивной терапии в настоящее время используют донорское грудное молоко, когда его нет в наличии от матери, чтобы снизить заболеваемость НЭК
Исследователи работают над многообещающими новыми методами лечения НЭК.
 Среди них: пробиотики, которые представляют собой живые бактерии и дрожжи, которые полезны для вас, противодействуют бактериям, вызывающим инфекцию, и блокируют оксид азота. Это газ, который образуется в результате NEC. Он помогает разрушить стенку кишечника.
Среди них: пробиотики, которые представляют собой живые бактерии и дрожжи, которые полезны для вас, противодействуют бактериям, вызывающим инфекцию, и блокируют оксид азота. Это газ, который образуется в результате NEC. Он помогает разрушить стенку кишечника.Некротический энтероколит: симптомы, причины, лечение
В этой статье
- Что его вызывает?
- Кто в группе риска
- Каковы симптомы?
- Как это диагностируется?
- Какое лечение?
- Каковы перспективы NEC?
Некротизирующий энтероколит, или НЭК, представляет собой серьезное заболевание, поражающее кишечник недоношенных детей. Обычно это происходит в течение первых 2 недель жизни у детей, которых кормят смесями вместо грудного молока.
В этом состоянии бактерии внедряются в стенку кишечника. Начинается воспаление. Это может привести к образованию трещины или щели, позволяющей неприятным микробам просачиваться в брюшную полость. Если не лечить, это может привести к серьезной инфекции и смерти.

Чем это вызвано?
Врачи не уверены. Они знают, что у недоношенных детей легкие и кишечник слабее и менее развиты, чем у доношенных детей. Это означает, что их тела не перемещают кровь и кислород, как должны. У них также есть проблемы с расщеплением пищи и борьбой с инфекцией.
Кто в группе риска
К счастью, НЭК встречается редко. Он затрагивает только одного из 2000–4000 новорожденных. Это может произойти у любого новорожденного ребенка, но чаще всего это происходит у недоношенных детей, которые весят менее 3,25 фунтов. В группу риска могут входить:
- Дети из группы высокого риска или недоношенные дети, которых кормят смесью через рот или через зонд
- Те, у кого были тяжелые роды или у которых снижен уровень кислорода
- Младенцы, у которых слишком много эритроцитов в циркуляции
- Младенцы с существующими желудочно-кишечными инфекциями
- Тяжелобольные младенцы и те, кому сделали переливание крови
Каковы симптомы?
Они могут отличаться от ребенка к ребенку.
 Но у младенца с НЭК в первые две недели жизни обычно развивается следующее:
Но у младенца с НЭК в первые две недели жизни обычно развивается следующее:- Опухший или вздутый живот
- Корм, который остается в желудке и не проходит через кишечник
- Зеленая жидкость в желудке
- Кровавый кал
- Затрудненное дыхание, учащенное сердцебиение или вялость пищеварения
- Другое
- состояния или проблемы со здоровьем вызывают симптомы, сходные с НЭК. Если у вашего ребенка разовьется что-либо из перечисленного выше, позвоните своему врачу.
Как это диагностируется?
Врач вашего ребенка сделает рентген брюшной полости и проведет несколько анализов крови, обычно в отделении интенсивной терапии новорожденных. Если это НЭК, рентген покажет газ или пузырьки воздуха в стенке кишечника. Врач также может ввести иглу в живот вашего ребенка. Если жидкость вытекает, это признак того, что в их кишечнике есть дыра. Анализы крови младенцев с НЭК показывают низкий уровень лейкоцитов. Это означает, что способность вашего ребенка бороться с инфекцией ослаблена.

Что лечить?
Это будет зависеть от ряда факторов, в том числе от того, насколько недоношен ваш ребенок, его общего состояния здоровья и истории болезни, а также от того, насколько далеко распространилась инфекция.
Затем ваш врач может сделать следующее:
- Прекратить кормление
- Вставить трубку через нос в желудок, чтобы удалить жидкость и оставить желудок пустым.
- Начните внутривенно вводить жидкости для питания и увлажнения
- Дайте антибиотики для борьбы с инфекцией
- Регулярно делайте рентгеновские снимки для контроля состояния
- Обеспечьте дополнительный кислород или аппарат искусственного дыхания, если их живот слишком опух, чтобы они могли дышать самостоятельно
- Держите их подальше от других детей, чтобы остановить распространение NEC
После исчезновения инфекции (обычно через 5–7 дней) ваш ребенок может снова начать кормить через рот.
Если им не станет лучше после лечения или у них появится дырка в кишечнике, им потребуется операция.
 Это включает удаление мертвых тканей и частей кишечника, которые разорвались или вот-вот разорвутся. В наиболее серьезных случаях детям, перенесшим операцию, может потребоваться соединение кишечника или кишечника с отверстием в брюшной полости. Врачи называют это «стома».
Это включает удаление мертвых тканей и частей кишечника, которые разорвались или вот-вот разорвутся. В наиболее серьезных случаях детям, перенесшим операцию, может потребоваться соединение кишечника или кишечника с отверстием в брюшной полости. Врачи называют это «стома».Каковы перспективы NEC?
Большинство младенцев с этим заболеванием полностью выздоравливают. В некоторых случаях кишка рубцуется или сужается. Это может привести к блокировке в будущем. Младенцы, у которых во время операции был удален большой кусок кишечника, могут быть не в состоянии нормально усваивать питательные вещества. В самых тяжелых случаях им может потребоваться пересадка кишечника, чтобы выжить.
На данный момент нет способа предотвратить NEC. Но исследования показывают, что дети, которых кормили только грудным молоком (без смеси), реже болели этим заболеванием. Вот почему врачи рекомендуют кормить детей из группы риска грудным молоком, начиная с небольших количеств. Многие отделения интенсивной терапии в настоящее время используют донорское грудное молоко, когда его нет в наличии от матери, чтобы снизить заболеваемость НЭК
Исследователи работают над многообещающими новыми методами лечения НЭК.
 Среди них: пробиотики, которые представляют собой живые бактерии и дрожжи, которые полезны для вас, противодействуют бактериям, вызывающим инфекцию, и блокируют оксид азота. Это газ, который образуется в результате NEC. Он помогает разрушить стенку кишечника.
Среди них: пробиотики, которые представляют собой живые бактерии и дрожжи, которые полезны для вас, противодействуют бактериям, вызывающим инфекцию, и блокируют оксид азота. Это газ, который образуется в результате NEC. Он помогает разрушить стенку кишечника.Некротизирующий энтероколит у недоношенных: медикаментозное и диетическое ведение новорожденных в одноцентровом исследовании | Итальянский журнал педиатрии
- Исследования
- Открытый доступ
- Опубликовано:
- Джованни Саварино
ORCID: orcid.org/0000-0001-6163-0979 1 , - Maurizio Carta 1 ,
- Marcello Cimador 1 ,
- Antonio Corsello 2 ,
- Mario Giuffrè 1 ,
- Ингрид Энн Мэнди Ширц 1 ,
- Грегорио Серра 1 и
- …
- Джованни Корселло 1
21
2504 доступа
1 Альтметрика
Сведения о показателях
способствует развитию дефицита витаминов и питательных веществ
определяет атрофию слизистой оболочки кишечника
способствует размножению бактерий
пролонгированное парентеральное питание, увеличивающее его инфекционно-метаболические осложнения.
- CID:
Диссеминированное внутрисосудистое свертывание
- ELBW:
Крайне низкий возраст рождения
- ГЭ:
Срок беременности
- И-ФАБП:
Белок 9, связывающий кишечные жирные кислоты0003
- ИФАЛД:
Болезнь печени, связанная с кишечной недостаточностью
- НЭК:
Некротический энтероколит
- НИРС:
Спектроскопия в ближней инфракрасной области
- ПНЖК:
Полиненасыщенные жирные кислоты
- УДХК:
Урсодезоксихолевая кислота
- ОНМТ:
Очень низкий вес при рождении
- 2 этажа:
2-фукозиллактоза
Катленд С.Л., Лакриц Э.М., Маллетт-Мур Т., Бардаджи А., Чандрасекаран Р., Лахария С. и др. Низкий вес при рождении: определение случая и рекомендации по сбору данных, анализу и представлению данных о безопасности материнской иммунизации. вакцина. 2017; 35(48Часть А):6492–500.
Артикул
Google ученый
Белл М.Дж., Тернберг Дж.Л., Фейгин Р.Д., Китинг Дж.П., Маршалл Р., Бартон Л. и др. Некротизирующий энтероколит новорожденных. Терапевтические решения основаны на клинической стадии. Энн Сург. 1978;187(1):1–7. https://doi.org/10.1097/00000658-197801000-00001.
КАС
Статья
пабмед
ПабМед ЦентральныйGoogle ученый
«>Оу Дж., Кортни К.М., Стейнбергер А.Е., Текос М.Е., Уорнер Б.В. Питание при некротическом энтероколите и после резекции кишечника. Питательные вещества. 2020;18(2):12(2). https://doi.org/10.3390/nu12020520.
КАС
СтатьяGoogle ученый
Schnabl K-L, Van Aerde J-E, Thomson AB, Clandinin MT. Некротизирующий энтероколит: многофакторное заболевание, неизлечимое. Мир J Гастроэнтерол. 2008;14(14):2142–61. https://doi.org/10.3748/wjg.14.2142.
КАС
Статья
пабмед
ПабМед ЦентральныйGoogle ученый
«>Саварино Г., Корселло А., Корселло Г. Баланс макронутриентов и количество микроэлементов в процессе роста и развития. Ital J Pediatr. 2021;47(1):109. https://doi.org/10.1186/s13052-021-01061-0.
КАС
Статья
пабмед
ПабМед ЦентральныйGoogle ученый
Morgan J, Bombell S, McGuire W. Раннее трофическое питание в сравнении с энтеральным голоданием для очень недоношенных или очень маловесных детей при рождении. Cochrane Database Syst Rev. 2013;3:CD000504. https://doi.org/10.1002/14651858.CD000504.pub4.
Артикул
Google ученый
«>Майнцен-Дерр Дж., Пойндекстер Б., Рэйдж Л., Морроу А.Л., Столл Б., Донован Э.Ф. Роль грудного молока в риске некротизирующего энтероколита или смерти у младенцев с экстремально низкой массой тела при рождении. Дж. Перинатол. 2009 г.;29(1):57–62. https://doi.org/10.1038/jp.2008.117.
КАС
Статья
пабмедGoogle ученый
Лукас А., Коул Т.Дж. Грудное молоко и неонатальный некротизирующий энтероколит. Ланцет. 1990;336(8730):1519–23. https://doi.org/10.1016/0140-6736(90)93304-8.

КАС
Статья
пабмедGoogle ученый
Гуд М., Содхи С.П., Иган С.Э., Афрази А., Цзя Х., Ямагути Ю. и др. Грудное молоко защищает от развития некротизирующего энтероколита за счет ингибирования толл-подобного рецептора 4 в кишечном эпителии путем активации рецептора эпидермального фактора роста. Иммунол слизистых оболочек. 2015;8(5):1166–79.. https://doi.org/10.1038/mi.2015.30.
КАС
Статья
пабмед
ПабМед ЦентральныйGoogle ученый
Салливан С., Шанлер Р.Дж., Ким Дж.Х., Патель А.Л., Травогер Р., Кичль-Колендорфер У. и др. Диета, основанная исключительно на женском молоке, связана с более низким уровнем некротизирующего энтероколита, чем диета на основе человеческого молока и продуктов на основе коровьего молока. J Педиатр. 2010;156(4):562–567.e1.
КАС
СтатьяGoogle ученый
«>Cristofalo EA, Schanler RJ, Blanco CL, Sullivan S, Trawoeger R, Kiechl-Kohlendorfer U, et al. Рандомизированное исследование эксклюзивного грудного молока в сравнении с рационом искусственного питания для недоношенных детей у крайне недоношенных детей. J Педиатр. 2013;163(6):1592–1595.e1.
Артикул
Google ученый
Boyd CA, Quigley MA, Brocklehurst P. Донорское грудное молоко по сравнению с детской смесью для недоношенных детей: систематический обзор и метаанализ. Arch Dis Child Fetal Neonatal Ed.
 2007; 92(3):F169–75. https://doi.org/10.1136/adc.2005.089490.
2007; 92(3):F169–75. https://doi.org/10.1136/adc.2005.089490.Артикул
пабмедGoogle ученый
Valpacos M, Arni D, Keir A, Aspirot A, Wilde JCH, Beasley S, et al. Диагностика и лечение некротизирующего энтероколита: международный обзор неонатологов и детских хирургов. НЕО. 2018;113(2):170–6. https://doi.org/10.1159/000484197.
Артикул
Google ученый
Хок А.М., Чен Ю., Мияке Х., Койке Ю., Сео С., Пьеро А. Начало энтерального питания после некротизирующего энтероколита. Eur J Pediatr Surg. 2018;28(1):44–50. https://doi.org/10.1055/s-0037-1604436.
Артикул
пабмедGoogle ученый
Бонхорст Б., Мюллер С., Дёрдельманн М., Петер К.С., Петерсен К., Поэтс К.Ф. Раннее вскармливание после некротизирующего энтероколита у недоношенных детей.
 J Педиатр. 2003;143(4):484–7. https://doi.org/10.1067/S0022-3476(03)00443-8.
J Педиатр. 2003;143(4):484–7. https://doi.org/10.1067/S0022-3476(03)00443-8.Артикул
пабмедGoogle ученый
Куик С.Дж., Калтерен В.С., Мебиус М.Дж., Бос А.Ф., Хюльшер Дж.Б.Ф., Коой Э.М.В. Прогнозирование восстановления кишечника после некротизирующего энтероколита у недоношенных детей. Педиатр Рез. 2020;87(5):903–9. https://doi.org/10.1038/s41390-019-0634-y.
КАС
Статья
пабмедGoogle ученый
Хит М., Бакли Р., Гербер З., Дэвис П., Линнеман Л., Гонг К. и другие. Ассоциация кишечной щелочной фосфатазы с некротизирующим энтероколитом у недоношенных детей. JAMA Сеть открыта. 20191;2(11):e1914996. https://doi.org/10.1001/jamanetworkopen.2019.14996.
Neu J. Некротизирующий энтероколит новорожденных: обновление. Акта Педиатр. 2005; 94 (s449): 100–5. https://doi.org/10.1111/j.
 1651-2227.2005.tb02163.x.
1651-2227.2005.tb02163.x.Артикул
Google ученый
Ибрагим Х.М., Джеруди М.А., Байер Р.Дж., Дханиредди Р., Крускоп Р.В. Агрессивное раннее Полное родительское питание у детей с низкой массой тела при рождении. Дж. Перинатол. 2004;24(8):482–6. https://doi.org/10.1038/sj.jp.7211114.
Артикул
пабмедGoogle ученый
Can E, Bülbül A, Uslu S, Cömert S, Bolat F, Nuhoğlu A. Влияние агрессивного парентерального питания на рост и клинические исходы у недоношенных детей. Педиатр Междунар. 2012;54(6):869–74. https://doi.org/10.1111/j.1442-200X.2012.03713.x.
КАС
Статья
пабмедGoogle ученый
Сквайрс Р.Х., Дагган С., Тейтельбаум Д.Х., Уэльс П.В., Балинт Дж., Веник Р. и др. Естественная история детской кишечной недостаточности: первоначальный отчет Консорциума детской кишечной недостаточности.
 J Педиатр. 2012;161(4):723–728.e2.
J Педиатр. 2012;161(4):723–728.e2.Артикул
Google ученый
Котоньи П., Муцио Г., Тромбетта А., Раньери В.М., Кануто Р.А. Влияние соотношения полиненасыщенных жирных кислот ω-3 и ω-6 на высвобождение цитокинов в альвеолярных клетках человека. J Родитель Введите Nutr. 2011;35(1):114–21. https://doi.org/10.1177/0148607110372392.
КАС
СтатьяGoogle ученый
Ван Ю, Фэн Ю, Лу Л-Н, Ван В-П, Хэ З-Дж, Се Л-Дж и др. Влияние различных липидных эмульсий на липидный профиль, состав жирных кислот и антиоксидантную способность недоношенных детей: двойное слепое рандомизированное клиническое исследование. Клин Нутр. 2016;35(5):1023–31. https://doi.org/10.1016/j.clnu.2015.10.011.
КАС
Статья
пабмедGoogle ученый
Хуккинен М., Мутанен А.
 , Ниссинен М., Меррас-Салмио Л., Гиллинг Х., Пакаринен М.П. Парентеральные растительные стеролы накапливаются в печени, что отражает их повышенный уровень в сыворотке крови и портальное воспаление у детей с кишечной недостаточностью. J Родитель Введите Nutr. 2017;41(6):1014–22. https://doi.org/10.1177/0148607116637855.
, Ниссинен М., Меррас-Салмио Л., Гиллинг Х., Пакаринен М.П. Парентеральные растительные стеролы накапливаются в печени, что отражает их повышенный уровень в сыворотке крови и портальное воспаление у детей с кишечной недостаточностью. J Родитель Введите Nutr. 2017;41(6):1014–22. https://doi.org/10.1177/0148607116637855.КАС
СтатьяGoogle ученый
Курвинен А., Ниссинен М.Дж., Андерссон С., Корхонен П., Рууска Т., Таймисто М. и др. Парентеральные растительные стеролы и заболевания печени, связанные с кишечной недостаточностью, у новорожденных. J Pediatr Gastroenterol Nutr. 2012;54(6):803–11. https://doi.org/10.1097/MPG.0b013e3182474118.
КАС
Статья
пабмедGoogle ученый
Калиш Б.Т., Ле Х.Д., Фитцджеральд Дж.М., Ван С., Симон К., Гура К.М. и др. Внутривенное введение липидной эмульсии рыбьего жира способствует переходу на противовоспалительные прорезольвентные липидные медиаторы.
 Am J Physiol Gastrointest Liver Physiol. 2013;305(11):G818–28. https://doi.org/10.1152/ajpgi.00106.2013.
Am J Physiol Gastrointest Liver Physiol. 2013;305(11):G818–28. https://doi.org/10.1152/ajpgi.00106.2013.КАС
Статья
пабмед
ПабМед ЦентральныйGoogle ученый
Мухаммед Р., Бремнер Р., Протеро С., Джонсон Т., Холден С., Мерфи М.С. Разрешение желтухи, связанной с парентеральным питанием, при переходе с эмульсии соевого масла на сложную смешанно-липидную эмульсию. J Pediatr Gastroenterol Nutr. 2012;54(6):797–802. https://doi.org/10.1097/MPG.0b013e3182447daf.
КАС
Статья
пабмедGoogle ученый
Mundi MS, Martindale RG, Hurt RT. Появление смешанных жировых эмульсий для парентерального питания. J Родитель Введите Nutr. 2017;41(1С):3С–13С. https://doi.org/10.1177/0148607117742595.
Артикул
Google ученый
Goulet O, Ruemmele F.
 Причины и лечение кишечной недостаточности у детей. Гастроэнтерология. 2006;130(2):S16–28. https://doi.org/10.1053/j.gastro.2005.12.002.
Причины и лечение кишечной недостаточности у детей. Гастроэнтерология. 2006;130(2):S16–28. https://doi.org/10.1053/j.gastro.2005.12.002.КАС
Статья
пабмедGoogle ученый
Бухман А.Л., Сколапио Дж., Фрайер Дж. Технический обзор AGA по синдрому короткой кишки и трансплантации кишечника. Гастроэнтерология. 2003;124(4):1111–34. https://doi.org/10.1016/S0016-5085(03)70064-X.
Артикул
пабмедGoogle ученый
Ksiazyk J, Piena M, Kierkus J, Lyszkowska M. Диета с гидролизованным и негидролизованным белком при синдроме короткой кишки у детей. J Pediatr Gastroenterol Nutr. 2002;35(5):615–8. https://doi.org/10.1097/00005176-200211000-00005.
КАС
Статья
пабмедGoogle ученый
Грабингер Т., Глаус Гарзон Дж. Ф., Хаусманн М., Гейрнарт А.
 , Лакруа С., Хеннет Т. Облегчение воспаления кишечника путем перорального приема 2-фукозиллактозы у мышей. Front Microbiol [Интернет]. 2019;10 [цитировано 12 сентября 2020 г.] Доступно по ссылке: https://www.frontiersin.org/articles/10.3389/fmicb.2019.01385/full.
, Лакруа С., Хеннет Т. Облегчение воспаления кишечника путем перорального приема 2-фукозиллактозы у мышей. Front Microbiol [Интернет]. 2019;10 [цитировано 12 сентября 2020 г.] Доступно по ссылке: https://www.frontiersin.org/articles/10.3389/fmicb.2019.01385/full.Кирос-Техейра Р.Е., Амент М.Е., Рейен Л., Херцог Ф., Мерджанян М., Оливарес-Серрано Н. и др. Длительная парентеральная нутритивная поддержка и кишечная адаптация у детей с синдромом короткой кишки: 25-летний опыт. J Педиатр. 2004;145(2):157–63. https://doi.org/10.1016/j.jpeds.2004.02.030.
Артикул
пабмедGoogle ученый
Гуле О., Баглин-Гобет С., Талботек С., Фуркад Л., Коломб В., Соват Ф. и др. Исходы и отдаленные сроки роста после обширных резекций тонкой кишки в периоде новорожденности: обследование 87 детей. Eur J Pediatr Surg. 2005;15(02):95–101. https://doi.org/10.1055/s-2004-821214.
КАС
Статья
пабмедGoogle ученый
«>Андорски Д.Дж., Лунд Д.П., Лиллехей К.В., Якшич Т., Диканзио Дж., Ричардсон Д.С. и др. Нутритивное и другое послеоперационное ведение новорожденных с синдромом короткой кишки коррелирует с клиническими исходами. J Педиатр. 2001;139(1): 27–33. https://doi.org/10.1067/mpd.2001.114481.
КАС
Статья
пабмедGoogle ученый
Белза К., Фитцджеральд К., де Сильва Н., Авицур Ю., Стейнберг К., Кортни-Мартин Г. и др. Прогнозирование адаптации кишечника при кишечной недостаточности у детей: ретроспективное когортное исследование.
 Энн Сург. 2019;269(5):988–93. https://doi.org/10.1097/SLA.0000000000002602.
Энн Сург. 2019;269(5):988–93. https://doi.org/10.1097/SLA.0000000000002602.Артикул
пабмедGoogle ученый
Allin BSR, Long AM, Gupta A, Lakhoo K, Knight M. Годичные результаты после операции по поводу некротизирующего энтероколита: когортное исследование в Великобритании. Arch Dis Child Fetal Neonatal Ed. 2018;103(5):F461–6. https://doi.org/10.1136/archdischild-2017-313113.
Артикул
пабмедGoogle ученый
Аби Надер Э., Ламбе С., Талботек С., Донг Л., Пиньер Б., Гуле О. Новая концепция для достижения оптимального набора веса у недоедающих детей на полном парентеральном питании. JPEN J Parenter Enteral Nutr. 2018;42(1):78–86.
КАС
пабмедGoogle ученый
Alshaikh B, Dharel D, Yusuf K, Singhal N. Раннее полное энтеральное питание у стабильных недоношенных детей: систематический обзор и метаанализ.
 J Matern Fetal Neonatal Med. 2019;9(9):1–8. https://doi.org/10.1080/14767058.2019.1637848.
J Matern Fetal Neonatal Med. 2019;9(9):1–8. https://doi.org/10.1080/14767058.2019.1637848.Артикул
Google ученый
Дорлинг Дж., Эббот Дж., Беррингтон Дж., Босиак Б., Боулер Ю., Бойл Э. и др. Контролируемое исследование двух возрастающих скоростей кормления грудью у недоношенных детей. N Engl J Med [Интернет]. 2019; [цитировано 11 сентября 2020 г.]; Доступно по адресу: https://www.nejm.org/doi/10.1056/NEJMoa1816654.
Wang Y, Zhu W, Luo B. Непрерывное кормление в сравнении с прерывистым болюсным кормлением для недоношенных детей с низкой массой тела при рождении: метаанализ рандомизированных контролируемых исследований. Eur J Clin Nutr. 2020;74(5):775–83. https://doi.org/10.1038/s41430-019-0522-x.
Артикул
пабмедGoogle ученый
Кафедра укрепления здоровья, охраны материнства и детства, внутренних болезней и медицинских специальностей «Г. Д’Алессандро», Университетская клиника «П. Джакконе», Палермо, Италия
Джованни Саварино, Маурицио Карта, Марчелло Чимадор, Марио Джуффре, Ингрид Энн Мэнди Ширц, Грегорио Серра и Джованни Корселло
Миланский университет, Милан, Италия
Антонио Корселло
- Джованни Саварино
Просмотр публикаций автора
Вы также можете искать этого автора в
PubMed Google Scholar - Maurizio Carta
Просмотр публикаций автора
Вы также можете искать этого автора в
PubMed Google Scholar - Marcello Cimador
Посмотреть публикации автора
Вы также можете искать этого автора в
PubMed Google Scholar - Antonio Corsello
Просмотр публикаций автора
Вы также можете искать этого автора в
PubMed Google Scholar - Mario Giuffrè
Просмотр публикаций автора
Вы также можете искать этого автора в
PubMed Google Scholar - Ingrid Anne Mandy Schierz
Посмотреть публикации автора
Вы также можете искать этого автора в
PubMed Google Scholar - Gregorio Serra
Просмотр публикаций автора
Вы также можете искать этого автора в
PubMed Google Scholar - Giovanni Corsello
Просмотр публикаций автора
Вы также можете искать этого автора в
PubMed Google Scholar
- Другое
1
Итальянский журнал педиатрии
том 47 , Номер статьи: 226 (2021)
Процитировать эту статью
Abstract
Некротизирующий энтероколит (НЭК) — типичное заболевание недоношенных новорожденных с высокой смертностью и заболеваемостью. Терапевтическое и диетическое лечение болезни зависит от нескольких факторов. Его прогноз связан, помимо тяжести заболевания и необходимости оперативного вмешательства, с правильным энтеральным питанием у этих больных. Это исследование направлено на определение клинических характеристик 18 пациентов с НЭК, оценку различных предпринятых терапевтических путей, типа используемой формулы и выживаемости этой популяции. Среднее время энтерального питания до начала НЭК составило 11,3 ± 11,6 сут, при среднем периоде голодания с начала заболевания 24 ± 18,9 сут.дней. 77,8% пациентов были оперированы и возобновили энтеральное питание через 17,7 ±17,9 дней после вмешательства. Общая выживаемость нашей когорты составила 55,5%. Необходимы дополнительные проспективные исследования для оценки долгосрочных результатов выживших детей с НЭК.
Терапевтическое и диетическое лечение болезни зависит от нескольких факторов. Его прогноз связан, помимо тяжести заболевания и необходимости оперативного вмешательства, с правильным энтеральным питанием у этих больных. Это исследование направлено на определение клинических характеристик 18 пациентов с НЭК, оценку различных предпринятых терапевтических путей, типа используемой формулы и выживаемости этой популяции. Среднее время энтерального питания до начала НЭК составило 11,3 ± 11,6 сут, при среднем периоде голодания с начала заболевания 24 ± 18,9 сут.дней. 77,8% пациентов были оперированы и возобновили энтеральное питание через 17,7 ±17,9 дней после вмешательства. Общая выживаемость нашей когорты составила 55,5%. Необходимы дополнительные проспективные исследования для оценки долгосрочных результатов выживших детей с НЭК.
Введение
Некротизирующий энтероколит (НЭК) является критическим заболеванием, типичным для недоношенных детей. Хотя его частота варьирует в разных отделениях интенсивной терапии новорожденных, средняя распространенность среди новорожденных с очень низкой массой тела при рождении (ОНМТ), определяемая как дети с впервые зарегистрированным весом < 1500 г, составляет 7% [1, 2]. Незрелость кишечного барьера и дисбактериоз кишечной микробиоты, вероятно, могли способствовать воспалению кишечника и повреждениям, наблюдаемым у этих пациентов [1, 3].
Незрелость кишечного барьера и дисбактериоз кишечной микробиоты, вероятно, могли способствовать воспалению кишечника и повреждениям, наблюдаемым у этих пациентов [1, 3].
Стадия Белла, введенная в 1978 г. и позже модифицированная Клигеманом и Уолшем, позволяет стратифицировать тяжесть этой патологии и определить подход к лечению [4]. При I и II стадиях болезни Белла, соответствующих случаям подозрения на НЭК легкой и средней степени тяжести, терапия состоит из антибиотикотерапии широкого спектра действия и парентерального питания с одновременным прекращением энтерального питания в среднем на 7–14 дней. В случаях ухудшения симптомов или тяжелого заболевания (стадия III) частыми находками являются гемодинамическая нестабильность, низкий уровень тромбоцитов, CID, перитонит или пневмоперитонеум. В этих случаях без хирургического вмешательства обычно не обойтись [5]. Смертность среди случаев НЭК, нуждающихся в хирургическом вмешательстве, возрастает с 3 до 30% [6]. Кроме того, при выполнении массивной резекции кишечника может развиться синдром короткой кишки [5]. Действительно, на гистологическом уровне после массивных резекций наблюдались адаптации оставшейся структуры кишечника, такие как удлинение ворсинок, углубление крипт и усиление пролиферации энтероцитов. Эти изменения повышают всасывательную способность остаточной кишки [7].
Действительно, на гистологическом уровне после массивных резекций наблюдались адаптации оставшейся структуры кишечника, такие как удлинение ворсинок, углубление крипт и усиление пролиферации энтероцитов. Эти изменения повышают всасывательную способность остаточной кишки [7].
Целью данного исследования является оценка популяции пациентов, страдающих НЭК, сбор их клинических данных и анализ влияния заболевания на питание.
Материалы и методы
Обсервационное проспективное исследование было проведено путем сбора данных о случаях НЭК, поступивших в отделение неонатологии и интенсивной терапии новорожденных Поликлиники П. Джакконе, Палермо в период с января 2015 г. по январь 2019 г. Мы пересмотрели медицинские записи этих младенцев; данные были экстраполированы с помощью стандартизированной таблицы. Основным результатом этого исследования была оценка выживаемости, распределения и характеристик пациентов с НЭК в одной когорте, оценка различных используемых подходов и наблюдение за их возможными клиническими исходами.
Клинические данные, которые были собраны, включали клиническое состояние и возраст на момент постановки диагноза, прогрессирование заболевания, терапевтическое питание и хирургическое лечение. Для каждого пациента проводилась междисциплинарная оценка путем совместных посещений в присутствии педиатра, хирурга, родителей. Категориальные переменные были синтезированы с частотами, процентами и статистическим распределением.
Исследование проводилось в соответствии с рекомендациями Хельсинкской декларации и было одобрено этическим комитетом участвующего центра.
Результаты
Всего в исследование было включено 18 младенцев: 8 мальчиков и 10 девочек (таблица 1). Гестационный возраст (ГВ) при рождении составлял от 23 + 6 недель до 35 + 2 недель, в среднем 29 + 1. поздний недоношенный (ГЭ между 34 и 36 нед и 6 дней). Младший младенец весил 600 г, а старший — 2130 г. Средний вес при рождении составил 1078 ± 478,96 г. 4 ребенка имели низкий вес при рождении (НМТ) (< 2500 г), 4 — очень низкий вес при рождении (ОНМТ) (< 1500 г), 10 — экстремально низкий вес при рождении (ЭНМТ) (< 1000 г). Все дети в нашей популяции были недоношенными, у некоторых были специфические сопутствующие заболевания; у 2 обнаружена генетическая патология, у 5 обнаружен открытый артериальный проток. У 1 новорожденного диагностирована гипертрофическая болезнь сердца. От многоплодной беременности родилось 3 новорожденных, от одноплодной — 15. Что касается тяжести НЭК, то у 14 новорожденных была III стадия по Беллу, у 4 — II стадия и ни у кого не было I стадии. 8 новорожденных умерли во время госпитализации, из них 7 — на III стадии и 1 — на II стадии. Выживаемость нашей популяции составила 55,5%. На рисунках 1 и 2 показано распределение случаев по гестационному возрасту и массе тела при рождении.
Все дети в нашей популяции были недоношенными, у некоторых были специфические сопутствующие заболевания; у 2 обнаружена генетическая патология, у 5 обнаружен открытый артериальный проток. У 1 новорожденного диагностирована гипертрофическая болезнь сердца. От многоплодной беременности родилось 3 новорожденных, от одноплодной — 15. Что касается тяжести НЭК, то у 14 новорожденных была III стадия по Беллу, у 4 — II стадия и ни у кого не было I стадии. 8 новорожденных умерли во время госпитализации, из них 7 — на III стадии и 1 — на II стадии. Выживаемость нашей популяции составила 55,5%. На рисунках 1 и 2 показано распределение случаев по гестационному возрасту и массе тела при рождении.
Таблица 1 Исходные характеристики пациентов
Полноразмерная таблица
Рис. 1
Распределение пациентов по гестационному возрасту при рождении (недель)
Полноразмерное изображение
Рис. 2
2
Распределение массы тела при рождении (г) 3
Энтеральное питание
В нашей серии случаев энтеральное питание начинали в среднем после 6,7 ±9,6 дней жизни. Эта задержка в начале питания может быть связана с недоношенностью. С учетом вида молока, вводимого перед НЭК, было выделено 5 групп новорожденных: 2 новорожденных получали грудное молоко и гидролизованную смесь, 5 — грудное молоко и смесь для недоношенных, 2 — смесь для недоношенных и 8 — только грудное молоко; У 1 новорожденного НЭК развился до начала энтерального питания. У 17 новорожденных, у которых НЭК развился после начала энтерального питания, он был купирован по причине пищевой непереносимости через 15,5±13 дней жизни. Детям этой серии случаев энтеральное питание проводили за 11,3 ±11,6 дней до начала НЭК. Учитывая интервал между началом заболевания и повторным энтеральным введением, средний период натощак составляет 24 ± 18,9дней было выполнено. На рисунке 3 показано распределение дней для энтерального голодания после начала НЭК.
Рис. 3
Распределение дней энтерального голодания после начала НЭК
Изображение полного размера
Время достижения полного энтерального питания оценивали путем измерения интервала между днем повторного энтерального введения и днем прекращения парентерального питания. 8 детей были исключены (7 из-за раннего выхода и 1 из-за отсутствия клинических данных).
В таблице 2 приведены типы молока, вводимого на этапе повторного введения энтерального питания.
Таблица 2 Тип энтерального питания, повторно введенного в фазу заживления
Полноразмерная таблица
Парентеральное питание
В нашей серии из-за недоношенности многие дети начали парентеральное питание до начала НЭК. Следует отметить, что в случае смерти днем выхода из организма считали день парентерального выведения. В среднем младенцы в нашей популяции практиковали парентеральное питание в течение 50 ± 28 дней. Что касается состава вводимой парентеральной смеси, 12 новорожденных получали липидные эмульсии с оливковым маслом, 5 — соевые липидные эмульсии и 1 — парентерально без липидов.
Что касается состава вводимой парентеральной смеси, 12 новорожденных получали липидные эмульсии с оливковым маслом, 5 — соевые липидные эмульсии и 1 — парентерально без липидов.
Хирургическое вмешательство
4 пациента не оперировались (22,2%) и 14 оперировались (77,8%). Операцию выполняли в среднем через 32,5 ± 27,1 дня жизни. Среди оперированных новорожденных у 5 резекция кишки с наложением илеостомы (27,8%), у 4 — только наложение илеостомы (22,2%), у 1 — колостома, у 2 — ни резекции, ни илеостомы. У 2 больных лечили исключительно с помощью дренирования брюшной полости. В группе оперированных детей возобновление энтерального питания происходило в среднем через 17,7 ± 17,9 лет.дней после операции.
Использование пищевых добавок и лекарств
Добавки железа, витаминов D и K необходимы недоношенным новорожденным [8]. Наша популяция, в дополнение к присущему риску недоношенности, была более подвержена мальабсорбции витаминов и недостатку микроэлементов. Кроме того, у новорожденных, длительно практикующих парентеральное питание, может развиться дефицит карнитина [8]. Мы оценили витаминные добавки в нашей популяции: 2 новорожденных получали карнитин, 4 перорально железо, 1 инъекционное введение микроэлементов и 9 новорожденных.получали пероральные поливитамины.
Кроме того, у новорожденных, длительно практикующих парентеральное питание, может развиться дефицит карнитина [8]. Мы оценили витаминные добавки в нашей популяции: 2 новорожденных получали карнитин, 4 перорально железо, 1 инъекционное введение микроэлементов и 9 новорожденных.получали пероральные поливитамины.
Мы оценили назначение антацидов и урсодезоксихолевой кислоты (УДХК) в нашей популяции, пытаясь определить косвенный параметр, который дал бы нам представление об основных гастроэнтерологических последствиях НЭК (например, гиперсекреция желудка и заболевание печени). У многих новорожденных с НЭК, особенно у тех, у кого была еюностомия, наблюдалась повышенная желудочная секреция, что может потребовать назначения антацидов [5]. В нашей популяции антациды получали 6 детей раннего возраста. Кроме того, у детей раннего возраста с НЭК вследствие длительного парентерального питания повышен риск развития заболеваний печени и холестаза. Эти состояния требуют модификации питания и добавления УДХК. В нашей популяции 4 ребенка получали УДХК.
В нашей популяции 4 ребенка получали УДХК.
Признаки и симптомы НЭК
Многие клинические и рентгенологические признаки оценивались с начала НЭК. Основными признаками пищевой непереносимости, приведшими к прекращению энтерального питания, были вздутие живота (83,2%), застойные явления (33,3%) и кишечные кровотечения (27,7%) (табл. 3). Наиболее частыми системными признаками были повышение показателей воспаления (55,5%) и тромбоцитопения (27,8%) (табл. 4). Рентгенологически наблюдались пневмоперитонеум (38,9%), гидро-аэральные уровни (38,9%).%) и невозможность газификации прямой кишки (33,3%) (таблица 5). Реже рентгенологическими признаками были портальный пневматоз и аэробилия.
Таблица 3 Кишечные признаки НЭК
Полная таблица
Таблица 4 Системные признаки НЭК
Полная таблица
Таблица 5 Рентгенологический признак НЭК
Полная таблица
Основные проблемы профилактики1 9006 НЭК касаются введения энтерального питания и вида вводимой смеси.
 10 новорожденных начали энтеральное питание в первые 2 сутки жизни, но в среднем энтеральное питание было начато через 6,7 сутки после рождения. Эта изменчивость может быть связана с неоднородностью гестационного возраста. Недавние данные свидетельствуют о том, что раннее энтеральное питание, несмотря на то, что оно не является защитным фактором, не увеличивает заболеваемость НЭК, но способствует более быстрому росту и снижает риск развития сепсиса и пищевой непереносимости [9]., 10]. Что касается типа вводимой смеси, грудное молоко было показано как защитный фактор [11]. Частота НЭК у грудных детей действительно в 6-10 раз ниже, чем при вскармливании исключительно адаптированной смесью [12]. Несколько непитательных компонентов грудного молока способствуют иммунной функции желудочно-кишечного тракта и повышают целостность слизистой оболочки [9, 10]. Некоторыми из этих компонентов являются IgA, факторы роста и полиненасыщенные жирные кислоты. Благотворное влияние грудного молока также связано с наличием олигосахаридов, способных стимулировать рост здоровой бактериальной флоры [13,14,15,16,17].
10 новорожденных начали энтеральное питание в первые 2 сутки жизни, но в среднем энтеральное питание было начато через 6,7 сутки после рождения. Эта изменчивость может быть связана с неоднородностью гестационного возраста. Недавние данные свидетельствуют о том, что раннее энтеральное питание, несмотря на то, что оно не является защитным фактором, не увеличивает заболеваемость НЭК, но способствует более быстрому росту и снижает риск развития сепсиса и пищевой непереносимости [9]., 10]. Что касается типа вводимой смеси, грудное молоко было показано как защитный фактор [11]. Частота НЭК у грудных детей действительно в 6-10 раз ниже, чем при вскармливании исключительно адаптированной смесью [12]. Несколько непитательных компонентов грудного молока способствуют иммунной функции желудочно-кишечного тракта и повышают целостность слизистой оболочки [9, 10]. Некоторыми из этих компонентов являются IgA, факторы роста и полиненасыщенные жирные кислоты. Благотворное влияние грудного молока также связано с наличием олигосахаридов, способных стимулировать рост здоровой бактериальной флоры [13,14,15,16,17].
В нашей серии случаев отсутствие младенцев с НЭК I стадии может быть связано с неудачной ранней диагностикой из-за родов в других больницах. Разработка специфических биомаркеров может помочь в дифференциальной диагностике. Высокая распространенность НЭК на III стадии в наших исследованиях (78%), вероятно, связана с наличием отделения детской хирургии в том же ведомственном комплексе. Низкая масса тела при рождении и высокая распространенность хирургических НЭК могут объяснить общую высокую смертность в нашей выборке (44,5%), которая выше, чем смертность, описанная в других отчетах [5].
Медикаментозное лечение НЭК
Медикаментозное лечение НЭК состоит из введения антибиотиков широкого спектра действия, голодания и начала парентерального питания. Продолжительность голодания зависит от клинической, лабораторной и инструментальной оценки [18]. Согласно последним данным, раннее повторное введение энтерального питания связано с меньшим количеством осложнений, меньшей продолжительностью антибактериальной терапии, более быстрым прогрессом в достижении целей питания в зависимости от возраста и более коротким периодом госпитализации [19]. , 20]. Недавний обзор [5] предполагает, что у пациентов на 1 и 2 стадии голодание должно длиться от 7 до 14 дней. Наоборот, метаанализ сообщает об отсутствии существенных различий в отношении осложнений, если энтеральное введение проводят до пятого дня [19]. Длительное энтеральное голодание может иметь несколько негативных последствий:
, 20]. Недавний обзор [5] предполагает, что у пациентов на 1 и 2 стадии голодание должно длиться от 7 до 14 дней. Наоборот, метаанализ сообщает об отсутствии существенных различий в отношении осложнений, если энтеральное введение проводят до пятого дня [19]. Длительное энтеральное голодание может иметь несколько негативных последствий:
Клиницисты должны свести к минимуму голодание, возобновив энтеральное питание, как только наступит клиническое улучшение, подтвержденное стабильностью основных показателей жизнедеятельности, абдоминальным физикальным исследованием, нормализацией числа тромбоцитов и рентгенологических признаков Идентификация биомаркеров (NIRS, I-FABP , щелочная фосфатаза кишечника) [21, 22], способные отражать тяжесть НЭК и восстановление кишечника, могли бы помочь персонализировать момент возобновления энтерального питания, минимизируя последствия длительного голодания. В дополнение к правильному выбору времени для возобновления энтерального питания важным фактором является тип используемой смеси. Превосходство грудного молока кажется бесспорным, но когда его нет, неизвестно, предпочтительнее ли адаптированная смесь или гидролизат. В нашей серии 10 новорожденных возобновили энтеральное питание грудным молоком (исключительно 5, 3 в связи с гидролизованной смесью, 2 в связи с адаптированной смесью), 4 возобновили энтеральное питание гидролизованным молоком, остальные 4 не возобновили энтеральное питание, так как умерли раньше. После возобновления энтерального питания необходимо оказывать помощь новорожденному до достижения полного энтерального питания: этот интервал в нашей популяции длился в среднем через 17,2 ±8,2 сут.
В дополнение к правильному выбору времени для возобновления энтерального питания важным фактором является тип используемой смеси. Превосходство грудного молока кажется бесспорным, но когда его нет, неизвестно, предпочтительнее ли адаптированная смесь или гидролизат. В нашей серии 10 новорожденных возобновили энтеральное питание грудным молоком (исключительно 5, 3 в связи с гидролизованной смесью, 2 в связи с адаптированной смесью), 4 возобновили энтеральное питание гидролизованным молоком, остальные 4 не возобновили энтеральное питание, так как умерли раньше. После возобновления энтерального питания необходимо оказывать помощь новорожденному до достижения полного энтерального питания: этот интервал в нашей популяции длился в среднем через 17,2 ±8,2 сут.
Парентеральное питание
Новорожденным с НЭК следует начинать раннее парентеральное питание с адекватной дозой аминокислот (3,5–4 г/кг/день) для поддержания положительного баланса азота, улучшения прироста массы тела и обеспечения восстановления поврежденных тканей [1, 23,24,25]. Парентеральное питание может быть прекращено, когда энтерального питания достаточно для удовлетворения потребностей в питании. Длительное парентеральное питание связано с повышенным риском инфекций и нарушений обмена веществ, таких как дислипидемия и заболевания печени. Продолжительность парентерального питания в нашей серии особенно велика по сравнению с другими исследованиями в литературе, но эти данные могут быть связаны с недоношенностью и тяжестью НЭК у наших новорожденных. В нашей серии парентеральное питание начинали в среднем на второй день жизни и практиковали в течение интервала 50 ± 28 дней. В нашей серии случаев 12 новорожденных получали липидные эмульсии оливкового масла; 5 получали соевые липидные эмульсии; наконец, 1 новорожденный практиковал парентеральное питание без липидов.
Парентеральное питание может быть прекращено, когда энтерального питания достаточно для удовлетворения потребностей в питании. Длительное парентеральное питание связано с повышенным риском инфекций и нарушений обмена веществ, таких как дислипидемия и заболевания печени. Продолжительность парентерального питания в нашей серии особенно велика по сравнению с другими исследованиями в литературе, но эти данные могут быть связаны с недоношенностью и тяжестью НЭК у наших новорожденных. В нашей серии парентеральное питание начинали в среднем на второй день жизни и практиковали в течение интервала 50 ± 28 дней. В нашей серии случаев 12 новорожденных получали липидные эмульсии оливкового масла; 5 получали соевые липидные эмульсии; наконец, 1 новорожденный практиковал парентеральное питание без липидов.
Основными метаболическими осложнениями парентерального питания являются заболевания печени и кишечная недостаточность (IFALD) [26]. Частоту этих осложнений можно изменить, сократив продолжительность парентерального питания, отдав предпочтение циклическим инфузиям и используя подходящие липидные смеси. При выборе липидной эмульсии для парентерального введения необходимо учитывать несколько факторов: содержание незаменимых жирных кислот, соотношение омега-6 и омега-3, количество α-токоферола и фитостеролов. Соевые липидные эмульсии имеют соотношение омега-6:омега-3 7:1, тогда как идеальное соотношение должно быть 4:1 [27, 28]. Кроме того, в них высокое содержание фитостеролов, вызывающих воспаление печени и холестаз [29]., 30]. Липидные эмульсии рыбьего жира в основном состоят из омега-3 и содержат небольшое количество омега-6 [31]. Поэтому эмульсии рыбьего жира разрешены в качестве терапии IFALD, но не для обычного детского парентерального питания из-за риска дефицита незаменимых омега-6 жирных кислот.
При выборе липидной эмульсии для парентерального введения необходимо учитывать несколько факторов: содержание незаменимых жирных кислот, соотношение омега-6 и омега-3, количество α-токоферола и фитостеролов. Соевые липидные эмульсии имеют соотношение омега-6:омега-3 7:1, тогда как идеальное соотношение должно быть 4:1 [27, 28]. Кроме того, в них высокое содержание фитостеролов, вызывающих воспаление печени и холестаз [29]., 30]. Липидные эмульсии рыбьего жира в основном состоят из омега-3 и содержат небольшое количество омега-6 [31]. Поэтому эмульсии рыбьего жира разрешены в качестве терапии IFALD, но не для обычного детского парентерального питания из-за риска дефицита незаменимых омега-6 жирных кислот.
Недавно были разработаны новые липидные смеси под названием Smoflipid. Они состоят из соевого масла (30%), кокосового масла (30%), оливкового масла (25%) и рыбьего жира (15%).
У детей с холестатической желтухой отмечается улучшение функции печени после перехода с липидных эмульсий сои на Смофлипид [32]. Смофлипид оказывает положительное влияние на ферменты печени благодаря низкому содержанию фитостеролов и высокому содержанию витамина Е. Его применение определяет снижение перекисного окисления липидов и оптимизацию соотношения ПНЖК омега-3: омега-6, что создает незначительный провоспалительный инсульт [33].
Смофлипид оказывает положительное влияние на ферменты печени благодаря низкому содержанию фитостеролов и высокому содержанию витамина Е. Его применение определяет снижение перекисного окисления липидов и оптимизацию соотношения ПНЖК омега-3: омега-6, что создает незначительный провоспалительный инсульт [33].
Хирургическое лечение НЭК
В случаях НЭК, осложненных перфорацией кишечника, требуется хирургическое вмешательство. В нашей выборке оперировано 14 новорожденных. Из 14 прооперированных новорожденных у 5 была выполнена резекция кишечника с установкой энтеростомии, у 5 — только упаковка энтеростомы, у 2 — лапаротомия без резекции или энтеростомии и, наконец, у 2 — исключительно с установкой абдоминального дренажа. После обширных резекций кишечника может развиться кишечная недостаточность [34]. Это состояние можно преодолеть благодаря кишечной адаптации, позволяющей достичь энтеральной автономии [35]. Длина остаточной кишки и тип питания влияют на адаптацию кишечника. Стратегии послеоперационного питания, направленные на улучшение адаптации кишечника, являются краеугольным камнем лечения.
Стратегии послеоперационного питания, направленные на улучшение адаптации кишечника, являются краеугольным камнем лечения.
Энтеральное питание при хирургическом НЭК
В нашей серии пациентов, перенесших операцию, возобновили энтеральное питание через 17,7±17,9 дней после вмешательства. На рисунке 4 показано распределение различных интервалов энтерального питания у пациентов, перенесших операцию. 7 новорожденных получали грудное молоко (4 исключительно, 3 совместно с гидролизованной смесью), а 4 получали энтеральное питание исключительно гидролизованной смесью. Грудное молоко обладает многочисленными преимуществами в отношении адаптации кишечника благодаря высокому содержанию факторов роста [36]. Грудное молоко содержит олигосахариды, такие как 2-фукозиллактоза (2-FL), которые положительно регулируют микробиом кишечника, стимулируя пролиферацию энтероцитов [37].
Рис. 4
Распределение дней между операцией и энтеральным кормлением
Увеличенное изображение
Парентеральное питание при хирургическом НЭК
У пациентов нашей серии с НЭК III стадии ( n = 14), парентеральное практиковался в течение 53,4 ± 29 дней: 11/14 получали липидные эмульсии оливкового масла, 2/14 — липидные эмульсии соевых бобов, наконец, 1/14 получали эмульсии без липидов. Хирургический НЭК обычно требует длительного использования парентерального питания (> 21 дня) [5]. Пациентам с меньшим количеством остаточного кишечника требуется больше дней парентерального питания [38,39].,40,41,42]. Парентеральная поддержка через 28 дней после операции связана с увеличением смертности через 1 год [43]. В клинической практике кишечную недостаточность можно косвенно измерить по продолжительности парентерального питания, необходимой для нормального или восстановительного роста [44].
Хирургический НЭК обычно требует длительного использования парентерального питания (> 21 дня) [5]. Пациентам с меньшим количеством остаточного кишечника требуется больше дней парентерального питания [38,39].,40,41,42]. Парентеральная поддержка через 28 дней после операции связана с увеличением смертности через 1 год [43]. В клинической практике кишечную недостаточность можно косвенно измерить по продолжительности парентерального питания, необходимой для нормального или восстановительного роста [44].
Использование добавок
Стомы приводят к потере минеральных солей и питательных микроэлементов, особенно цинка. Резекции кишечника изменяют всасывание определенных питательных веществ в зависимости от резекции кишечного тракта. При еюностомии может нарушаться всасывание железа и цинка. При резекции подвздошной кишки и натощак нарушается всасывание витамина В12 и резорбция желчных солей. Кроме того, у младенцев, которые практикуют длительную исключительно парентеральную терапию, может развиться дефицит карнитина. Длительное парентеральное введение может вызвать холестаз, что снижает резорбцию жирорастворимых витаминов.
Длительное парентеральное введение может вызвать холестаз, что снижает резорбцию жирорастворимых витаминов.
Выводы
Наш отчет подтверждает, что НЭК может считаться гетерогенным и связанным с питанием заболеванием, которое создает ряд проблем, в основном связанных с разными пациентами с разными факторами риска, связанными с разным возрастом, с очень разными хирургическими доступами. По этой причине у каждого пациента есть определенные риски, связанные с питанием, и его должны оценивать диетологи или неонатологи, обладающие специальными знаниями, чтобы оценить правильное лечение, правильный период голодания и то, как управлять парентеральным питанием.
Грудное молоко представляет собой единственную реальную профилактику НЭК, а также полезно для новорожденных после операции. Он идеален для повторного питания как по усвояемости, так и по способности стимулировать трофику кишечника [19, 20, 45]. Никакие другие стратегии питания не были признаны полезными для профилактики НЭК; даже раннее энтеральное питание (< 96 ч) или прерывистое кормление, которые можно считать полезными и безопасными методами для новорожденных с низкой массой тела при рождении и недоношенных, не снижают заболеваемость НЭК [45,46,47].
Главной задачей при лечении этого заболевания является ранняя диагностика, которая может привести к снижению смертности и заболеваемости. Идентификация конкретного биомаркера может затем позволить раннюю диагностику или предоставить информацию о прогнозе и степени тяжести.
Что касается различных стратегий питания новорожденных с НЭК, следует избегать чрезмерно длительного голодания, поскольку это может увеличить продолжительность парентерального питания и способствовать атрофии кишечника. Энтеральное питание следует начинать в течение 7 дней при НЭК I и II стадии и в течение 14 дней при НЭК III стадии [5].
Новорожденные с НЭК имеют различные факторы риска нутритивной недостаточности: недоношенность, поражение кишечника, голодание, длительное парентеральное питание и возможное наличие энтеростомии [5]. Дефицит макронутриентов может вызвать недостаточность энергетического белка. Дефицит микронутриентов может мешать нормальному процессу роста, поэтому часто требуется экзогенная добавка [8].
В случаях возможного хирургического лечения следует учитывать, что оно может вызвать мальабсорбцию, что может закончиться синдромом короткой кишки. Принимая во внимание все эти последствия, чтобы контролировать и ограничить последствия заболевания, новорожденный с НЭК нуждается в периодическом и частом мультидисциплинарном обследовании, проводимом неонатологом, хирургом и диетологом.
Наше исследование можно считать ограниченным подходом с одним центром, хотя это снижает однородность в подходе к лечению заболевания. Еще одним ограничением этого исследования может быть вариабельность веса и гестационного возраста недоношенных.
Основная сила этого исследования, напротив, заключается в количестве пациентов с таким редким заболеванием, что помогло определить эпидемиологические характеристики пациентов с НЭК и различные возможные терапевтические методы лечения.
Необходимы дополнительные исследования, чтобы определить идеальную стратегию питания для этих младенцев и определить, как определить специфические маркеры патологии. Кроме того, проспективное обследование новорожденных с НЭК может быть полезным для оценки качества жизни этих пациентов в долгосрочной перспективе с учетом нутритивных, ауксологических и неврологических исходов.
Кроме того, проспективное обследование новорожденных с НЭК может быть полезным для оценки качества жизни этих пациентов в долгосрочной перспективе с учетом нутритивных, ауксологических и неврологических исходов.
Доступность данных и материалов
Наборы данных, использованные и проанализированные в ходе настоящего исследования, можно получить у соответствующего автора по обоснованному запросу.
Сокращения
Ссылки
- «>
Neu J, Walker WA. Некротический энтероколит. N Engl J Med. 2011;364(3):255–64. https://doi.org/10.1056/NEJMra1005408.
КАС
Статья
пабмед
ПабМед Центральный
Google ученый
Грегори К.Е., ДеФордж К.Е., Натале К.М., Филлипс М., Ван Мартер Л.Дж. Некротизирующий энтероколит у недоношенных детей. Adv Неонатальный уход. 2011;11(3):155–66. https://doi.org/10.1097/ANC.0b013e31821baaf4.
Артикул
пабмед
ПабМед Центральный
Google ученый
Уорнер БВ. Патогенез кишечной адаптации, связанной с резекцией. Селл Мол Гастроэнтерол Гепатол. 2016;2(4):429–38. https://doi.org/10.1016/j.jcmgh.2016.05.001.
Артикул
пабмед
ПабМед Центральный
Google ученый
Нангиа С., Вадивел В., Тукрал А., Саили А. Раннее полное энтеральное питание по сравнению с обычным энтеральным питанием у стабильных новорожденных с очень низкой массой тела при рождении: рандомизированное контролируемое исследование. Неонатология. 2019;115(3):256–62. https://doi.org/10.1159/000496015.
Артикул
пабмед
Google ученый
Шанлер Р.Дж., Лау С., Херст Н.М., Смит Э.О. Рандомизированное исследование донорского человеческого молока по сравнению со смесью для недоношенных в качестве заменителей собственного молока матерей при вскармливании крайне недоношенных детей. Педиатрия. 2005;116(2):400–6. https://doi.org/10.1542/peds.2004-1974.
Артикул
пабмед
Google ученый
Engelstad HJ, Barron L, Moen J, Wylie TN, Wylie K, Rubin DC, et al. Остаточная длина тонкой кишки при синдроме короткой кишки у детей и корреляция с дисбиозом кишечника и линейным ростом. J Am Coll Surg. 2018;227(4):439–49. https://doi.org/10.1016/j.jamcollsurg.2018.07.657.
Артикул
пабмед
ПабМед Центральный
Google ученый
Скачать ссылки
Благодарности
Неприменимо.
Финансирование
Финансирование данного исследования не предоставлялось.
Информация об авторе
Авторы и организации
Авторы
Вклады
GS собрал клинические данные, провел статистический анализ, написал и отредактировал рукопись. МЦ проводил клиническое и диетическое консультирование пациентов. МЦ проводил хирургическую диагностику и тактику лечения. AC критически рассмотрел рукопись и выбрал библиографические источники. М.Г. провел клиническое и генетическое консультирование. IAMS провел клиническую и кардиологическую оценку. GS пересмотрела литературу. GC задумал тему, руководил клинической оценкой и отредактировал окончательный вариант рукописи. Все авторы одобрили окончательный вариант рукописи в представленном виде и соглашаются нести ответственность за все аспекты работы.
МЦ проводил клиническое и диетическое консультирование пациентов. МЦ проводил хирургическую диагностику и тактику лечения. AC критически рассмотрел рукопись и выбрал библиографические источники. М.Г. провел клиническое и генетическое консультирование. IAMS провел клиническую и кардиологическую оценку. GS пересмотрела литературу. GC задумал тему, руководил клинической оценкой и отредактировал окончательный вариант рукописи. Все авторы одобрили окончательный вариант рукописи в представленном виде и соглашаются нести ответственность за все аспекты работы.
Автор, ответственный за переписку
Переписка с
Джованни Саварино.
Декларация этики
Утверждение этики и согласие на участие
Неприменимо.
Согласие на публикацию
Неприменимо.
Конкурирующие интересы
Авторы заявляют об отсутствии конкурирующих интересов.
Дополнительная информация
Примечание издателя
Springer Nature остается нейтральной в отношении юрисдикционных претензий в опубликованных картах и институциональной принадлежности.
Права и разрешения
Открытый доступ Эта статья находится под лицензией Creative Commons Attribution 4.0 International License, которая разрешает использование, совместное использование, адаптацию, распространение и воспроизведение на любом носителе или в любом формате, при условии, что вы укажете соответствующую ссылку на оригинальный автор(ы) и источник, предоставьте ссылку на лицензию Creative Commons и укажите, были ли внесены изменения. Изображения или другие сторонние материалы в этой статье включены в лицензию Creative Commons на статью, если иное не указано в кредитной строке материала. Если материал не включен в лицензию Creative Commons статьи, а ваше предполагаемое использование не разрешено законом или выходит за рамки разрешенного использования, вам необходимо получить разрешение непосредственно от правообладателя. Чтобы просмотреть копию этой лицензии, посетите http://creativecommons.org/licenses/by/4.0/. Отказ Creative Commons от права на общественное достояние (http://creativecommons.
