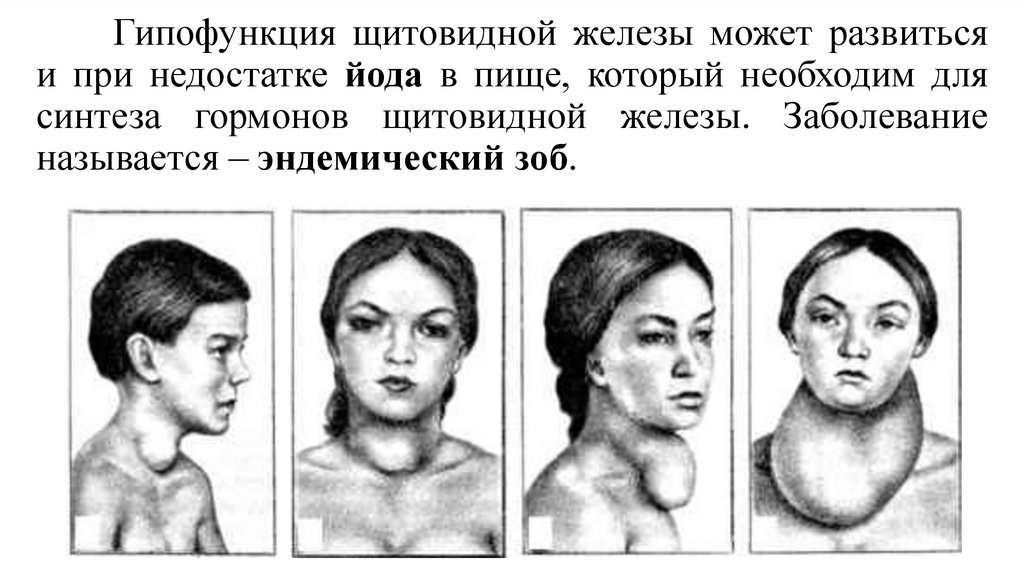
Диффузный зоб 1 степени у детей: Диффузный токсический зоб у детей
Лечение диффузного эутиреоидного зоба у детей | Таранушенко
До настоящего времени отсутствует единый подход к консервативной терапии диффузного эутиреоидного зоба у детей. Варианты лечебной тактики различны: монотерапия тироксином (Т4), монотерапия физиологическими дозами йода, комбинация левотироксина с йодом. Каждый из указанных методов лечения имеет как преимущества, так и недостатки.
Положительный эффект Т4 при зобе связывают с прекращением стимулирующего влияния тиреотропного гормона (ТТГ) на щитовидную железу, нормализацией интратиреоидального кровотока и восстановлением морфологической структуры (уменьшением размеров фолликулярных клеток). Однако после прекращения приема препарата за относительно короткий срок (несколько недель) может развиться ’’синдром отмены» с увеличением объема щитовидной железы из-за снижения уровня интратиреоидального йода на фоне лечения Т4. К недостаткам монотерапии Т4 относят также возможность индуцирования гипертиреоза и необходимость коррекции дозы вследствие различных обстоятельств (присоединение других заболеваний, прием лекарственных препаратов, влияющих на метаболизм тиреоидных гормонов и т. д.) [2, 3, 6, 7, 9, 13].
д.) [2, 3, 6, 7, 9, 13].
Применение препаратов йода с лечебной целью также оказывает положительное влияние на тиреоидную структуру (предупреждает гипертрофию и гиперплазию щитовидной железы, которые инициируются интратиреоидальным дефицитом йода и ростстимулирующими факторами), уменьшает размеры зоба и обеспечивает насыщение железы йодом. К недостаткам монотерапии йодом относят возможность манифестации аутоиммунных нарушений в щитовидной железе, развитие йодиндуцированного гипертиреоза и недостаточный эффект от лечения в тех случаях, когда йодному дефициту не принадлежит ведущая роль в развитии зоба (при участии в генезе зоба факторов дисгормоногенеза и(или) других струмоге- нов) [1—3, 7, И].
Таким образом, оба метода монотерапии имеют как преимущества, так и недостатки и нуждаются в дальнейшем изучении с оценкой результативности их применения при диффузном эутиреоидном зобе. Не исключается, что эффективность использования того или иного вида лечения зависит от экологических особенностей региона (йодный дефицит разной степени тяжести, микроэле- ментный дисбаланс, антропотехногенные нагрузки и т. д.) [2, 3, 7]. В связи с этим поставлена цель — сравнить терапевтический эффект Т4 и йодида калия (антиструмина) при диффузном эутиреоидном зобе у детей, проживающих в регионе со средней степенью тяжести йодного дефицита.
д.) [2, 3, 7]. В связи с этим поставлена цель — сравнить терапевтический эффект Т4 и йодида калия (антиструмина) при диффузном эутиреоидном зобе у детей, проживающих в регионе со средней степенью тяжести йодного дефицита.
Материалы и методы
Проведен анализ результатов лечения 110 детей с диффузным эутиреоидным зобом (31 мальчик и 79 девочек) в возрасте 9—14 лет. Диагноз верифицирован клиническими данными, ультразвуковым (УЗИ) и гормональным исследованиями. УЗИ проводили на аппарате «Aloka-500» (Япония), работающем в реальном масштабе времени с использованием линейного датчика с частотой 7,5 мГц. Для оценки объема щитовидной железы использовали нормативы F. Delange и соавт. [5].
Функциональное состояние щитовидной железы оценивали методом радиоиммунологического анализа с использованием стандартных тест-набо- ров: в сыворотке крови определяли содержание Т4, трийодтиронина (Т3), ТТГ.
Лечение Т4 и антиструмином начинали после проведения необходимого обследования. Т4 назначали в среднесуточной дозе 2—3 мкг/кг утром, до еды, антиструмин — в средней дозе 2 таблетки в неделю, что эквивалентно 200 мкг йода в сутки. Эффективность проводимой терапии оценивали по клиническим данным и результатам ультрасонографической волюмометрии.
Т4 назначали в среднесуточной дозе 2—3 мкг/кг утром, до еды, антиструмин — в средней дозе 2 таблетки в неделю, что эквивалентно 200 мкг йода в сутки. Эффективность проводимой терапии оценивали по клиническим данным и результатам ультрасонографической волюмометрии.
Статистическую обработку осуществляли по общепринятой методике с применением вариационного и корреляционного анализа. Данные представлены в виде среднего арифметического значения (Л/) и сигмального отклонения (ст). Достоверность различий определяли по Г-критерию Стью- дента. Математическую обработку проводили на IBM PC АТ в системе электронных таблиц Exell фирмы «Microsoft”. ч
Результаты и их обсуждение
Проведен анализ лечения диффузного эутиреоидного зоба у детей, получающих различные виды терапии.
В 1-ю группу вошли 63 ребенка (17 мальчиков и 46 девочек) с диффузным эутиреоидным зобом (средний возраст детей 11,06 ± 2,54 года). По данным волюмометрии средний объем щитовидной железы в группе до начала лечения составил 168,91 ± 70,80% от половозрастной нормы. Ультразвуковая структура щитовидной железы у всех детей данной группы была однородной; нормальная эхогенность тиреоидной ткани отмечена у 42 (66,6%) детей, повышение эхогенности — у 19 (30,2%), диффузное снижение эхогенности — у 2 (3,2%). Показатели гормонального исследования соответствовали эутиреозу (в среднем по группе: ТТГ = = 2,37 ± 1,23 МЕ/л; Т4 = 119,31 ± 27,95 нмоль/л; Т3 = 2,51 ± 0,54 нмоль/л). Всем детям данной группы назначали Т4 в дозе 2,22 ± 0,63 мкг/кг в сутки при средней продолжительности лечения 5,61 ± 2,36 мес.
Ультразвуковая структура щитовидной железы у всех детей данной группы была однородной; нормальная эхогенность тиреоидной ткани отмечена у 42 (66,6%) детей, повышение эхогенности — у 19 (30,2%), диффузное снижение эхогенности — у 2 (3,2%). Показатели гормонального исследования соответствовали эутиреозу (в среднем по группе: ТТГ = = 2,37 ± 1,23 МЕ/л; Т4 = 119,31 ± 27,95 нмоль/л; Т3 = 2,51 ± 0,54 нмоль/л). Всем детям данной группы назначали Т4 в дозе 2,22 ± 0,63 мкг/кг в сутки при средней продолжительности лечения 5,61 ± 2,36 мес.
Анализ результатов лечения в данной группе показал следующее: на фоне лечения Т4 в 71% случаев отмечены нормализация и уменьшение объема щитовидной железы, которые зарегистрированы соответственно у 27 и 44% обследованных (положительный эффект проводимой терапии). Уменьшение объема железы в среднем по группе составило 25,5 ± 18,3%. У 11% детей определялось увеличение объема щитовидной железы (отрицательный эффект терапии).
Во 2-ю группу включили 47 детей (14 мальчиков и 33 девочки), средний возраст которых составил 10,26 ± 2,54 года. По данным сонографии средний объем щитовидной железы составил 132,94 ± 39,64% от нормы, при этом у 38 (80,0%) детей структура щитовидной железы была неизмененной, повышение и снижение эхогенности регистрировались у 7 (14,9%) и 2 (4,3%) пациентов соответственно. Эутиреоидная функция щитовидной железы подтверждена данными гормонального исследования (в среднем по группе: ТТГ = = 2,09 ± 0,98 МЕ/л; Т4 = 121,49 ± 25,95 нмоль/л; Т3 = 2,19 ± 0,46 нмоль/л). Все дети 2-й группы после подтверждения диагноза диффузного эутиреоидного зоба получали антиструмин по 2 таблетки в неделю, средняя продолжительность лечения составила 11,02 ± 9,33 мес.
Оценка проведенного антиструмином лечения показала, что положительный эффект от проводимой терапии с нормализацией и уменьшением размеров щитовидной железы отмечен только у 59,6% детей, при этом объем щитовидной железы уменьшился в среднем на 14,47 ± 8,55%. В 34% случаев регистрировалось увеличение тиреоидного объема в среднем на 35,19 ± 40,94%. Отсутствие эффекта от проводимой терапии (сохранение прежнего объема щитовидной железы) отмечено у 6,4% пациентов данной группы.
В 34% случаев регистрировалось увеличение тиреоидного объема в среднем на 35,19 ± 40,94%. Отсутствие эффекта от проводимой терапии (сохранение прежнего объема щитовидной железы) отмечено у 6,4% пациентов данной группы.
Сравнение результатов лечения в анализируемых группах показало достоверно более высокую частоту случаев с отрицательным эффектом терапии (с увеличением объема щитовидной железы) при назначении антиструмина по сравнению с Т4 (р < 0,05). Кроме того, по данным УЗИ у 2 детей с увеличенным тиреоидным объемом на фоне приема антиструмина отмечено изменение эхогенности. Возможно, что появление неоднородности (гетерогенности) структуры тиреоидной ткани не связано с приемом антиструмина и является отражением прогрессирования морфологической трансформации зобно-измененной железы. Не исключается, что отрицательный эффект от приема антиструмина обусловлен и другими причинами, скрытыми от врача: самовольным изменением дозы препарата, отказом от лечения, нерегулярностью приема антиструмина и т. д. Однако нельзя не учитывать тот факт, что назначение антиструмина не является в полной мере физиологическим методом восполнения эндогенных запасов йода. Установлено, что избыточные дозы йода, которые не причиняют вред нормальной железе, могут вызывать изменения в йодистощен- ной железе в связи с развитием ’’эффекта йодного переполнения” [7].
д. Однако нельзя не учитывать тот факт, что назначение антиструмина не является в полной мере физиологическим методом восполнения эндогенных запасов йода. Установлено, что избыточные дозы йода, которые не причиняют вред нормальной железе, могут вызывать изменения в йодистощен- ной железе в связи с развитием ’’эффекта йодного переполнения” [7].
Учитывая значительные колебания сроков лечения как в 1-й, так и во 2-й группе, проанализировали эффективность терапии в зависимости от длительности приема лекарственного препарата. В соответствии с этим среди пациентов, получающих Т4, выделены 3 подгруппы: 1-я подгруппа — дети, которые принимали Т4 в течение 3 мес; 2-я подгруппа — лечение Т4 от 4 до 6 мес (4,82 ± 0,86 мес) и 3-я подгруппа — прием препарата более 6 мес (8,48 ± 1,53 мес). Среднесуточная доза Т4 в рассматриваемых подгруппах не имела достоверных различий. Положительный эффект от лечения с нормализацией и уменьшением объема щитовидной железы в анализируемых подгруппах отмечен соответственно в 42,9, 71,4 и 85,7% случаев. Частота встречаемости положительных результатов лечения имела достоверные различия в 1-й и 3-й подгруппах (/? < 0,001). По мере увеличения сроков терапии уменьшалось количество детей с неизмененным или нарастающим объемом щитовидной железы. Количество пациентов, у которых отсутствовала динамика объема щитовидной железы на фоне лечения, уменьшилось с 42,9% в 1-й подгруппе до 14,3% в 3-й подгруппе (р < 0,05). При сроке лечения Т4 более 6 мес (8,48 ± 1,53 мес) эффективность проводимой терапии оказалась самой высокой: нормализация размеров щитовидной железы отмечена у 28,6% обследованных, уменьшение объема (в среднем на 27,1 ± 16,9%) — у 57,1%, сохранение прежнего объема — у 14,3%; увеличения размеров щитовидной железы не наблюдалось.
Частота встречаемости положительных результатов лечения имела достоверные различия в 1-й и 3-й подгруппах (/? < 0,001). По мере увеличения сроков терапии уменьшалось количество детей с неизмененным или нарастающим объемом щитовидной железы. Количество пациентов, у которых отсутствовала динамика объема щитовидной железы на фоне лечения, уменьшилось с 42,9% в 1-й подгруппе до 14,3% в 3-й подгруппе (р < 0,05). При сроке лечения Т4 более 6 мес (8,48 ± 1,53 мес) эффективность проводимой терапии оказалась самой высокой: нормализация размеров щитовидной железы отмечена у 28,6% обследованных, уменьшение объема (в среднем на 27,1 ± 16,9%) — у 57,1%, сохранение прежнего объема — у 14,3%; увеличения размеров щитовидной железы не наблюдалось.
Аналогичная сравнительная оценка эффективности лечения проведена во 2-й группе детей, получающих антиструмин. Распределение с учетом длительности лечения было следующим: 1-я подгруппа — прием антиструмина менее 6 мес (4,22 ± 0,73 мес), 2-я — от 6 до 12 мес (9,71 ± ± 1,90 мес) и 3-я — лечение более 12 мес (20,21 ± 12,41 мес). Положительный результат лечения с нормализацией и уменьшением размеров щитовидной железы в рассматриваемых подгруппах составил соответственно 68,8, 47,1 и 64,3%. Степень снижения тиреоидного объема не имела достоверных различий в анализируемых подгруппах и составила в среднем 14,47 ± 8,55% от исходного значения. Увеличение сроков приема антиструмина не оказывало существенного влияния на частоту эпизодов с положительным эффектом от терапии. Однако отмечена тенденция к увеличению частоты случаев с нарастанием объема щитовидной железы при более продолжительном приеме препарата: во 2-й и 3-й подгруппах тиреоидный объем увеличился у 47,1 и 35,7% обследованных против 18,7% детей в 1-й подгруппе с самым коротким сроком лечения (до 6 мес). Средний прирост объема щитовидной железы в группе составил 35,19 ± 40,94% от исходного значения (до начала терапии).
Положительный результат лечения с нормализацией и уменьшением размеров щитовидной железы в рассматриваемых подгруппах составил соответственно 68,8, 47,1 и 64,3%. Степень снижения тиреоидного объема не имела достоверных различий в анализируемых подгруппах и составила в среднем 14,47 ± 8,55% от исходного значения. Увеличение сроков приема антиструмина не оказывало существенного влияния на частоту эпизодов с положительным эффектом от терапии. Однако отмечена тенденция к увеличению частоты случаев с нарастанием объема щитовидной железы при более продолжительном приеме препарата: во 2-й и 3-й подгруппах тиреоидный объем увеличился у 47,1 и 35,7% обследованных против 18,7% детей в 1-й подгруппе с самым коротким сроком лечения (до 6 мес). Средний прирост объема щитовидной железы в группе составил 35,19 ± 40,94% от исходного значения (до начала терапии).
Сравнение влияния Т4 и антиструмина на размеры щитовидной железы показало, что при одинаковых сроках лечения (до 6 мес) положительный результат терапии с уменьшением и нормализацией тиреоидного объема отмечен у 71,4 и 68,8% детей с диффузным эутиреоидным зобом соответственно. Увеличение размеров железы при данной длительности лечения регистрируется у 17,9 и 18,7% детей соответственно, однако при более длительной терапии антиструмином возрастает число отрицательных результатов. С учетом полученных данных и в соответствии с рекомендациями по лечению диффузного эутиреоидного зоба препаратами йода сроки до 6 мес, вероятно, следует рассматривать как оптимальные при использовании антиструмина.
Увеличение размеров железы при данной длительности лечения регистрируется у 17,9 и 18,7% детей соответственно, однако при более длительной терапии антиструмином возрастает число отрицательных результатов. С учетом полученных данных и в соответствии с рекомендациями по лечению диффузного эутиреоидного зоба препаратами йода сроки до 6 мес, вероятно, следует рассматривать как оптимальные при использовании антиструмина.
Отсутствие ожидаемого положительного эффекта при проведении монотерапии Т4 или препаратами йода (в данном случае антиструмином) может быть обусловлено различными причинами: степенью йодного дефицита, неадекватностью дозы, длительностью лечения, индивидуальной чувствительностью к препарату, невыполнением и несоблюдением пациентом врачебных рекомендаций и т. д. Однако даже с учетом перечисленных выше причин известно, что .по-настоящему эффективной может быть только такая терапия, которая направлена на этиопатогенетические механизмы заболевания.
Установлено, что диффузное увеличение щитовидной железы обусловлено двумя основными механизмами: накоплением коллоида в фолликулах (увеличением размеров фолликулов) с развитием коллоидного зоба при повышении уровня ТТГ в крови и пролиферацией фолликулярных клеток (гиперплазией фолликулов) с развитием паренхиматозного зоба при дефиците йода [7]. Часто имеет место сочетание обоих механизмов в развитии зоба. Очевидно, что при соответствии терапии морфологическому варианту зоба (назначение Т4 при коллоидном зобе и соответственно препаратов йода при паренхиматозном зобе) должна возрастать эффективность лечения.
Часто имеет место сочетание обоих механизмов в развитии зоба. Очевидно, что при соответствии терапии морфологическому варианту зоба (назначение Т4 при коллоидном зобе и соответственно препаратов йода при паренхиматозном зобе) должна возрастать эффективность лечения.
Учитывая, что пусковым механизмом в развитии диффузного эутиреоидного зоба в эндемичных регионах является йодная недостаточность с последующим повышением уровня ТТГ (после наступления «йодного истощения” в щитовидной железе), возможно, более оправданной «стартовой» терапией в йоддефицитных регионах следует считать назначение препаратов йода в дозах, соответствующих возрастным физиологическим потребностям (препарат выбора — «йодид») [1, 9, И, 12]. Однако при отсутствии положительной динамики по данным волюмометрии через 6 мес от начала лечения йодом оправдан пересмотр дальнейшей лечебной тактики с решением вопроса о назначении Т4 при обязательном регулярном контроле тиреоидного объема каждые 6 мес.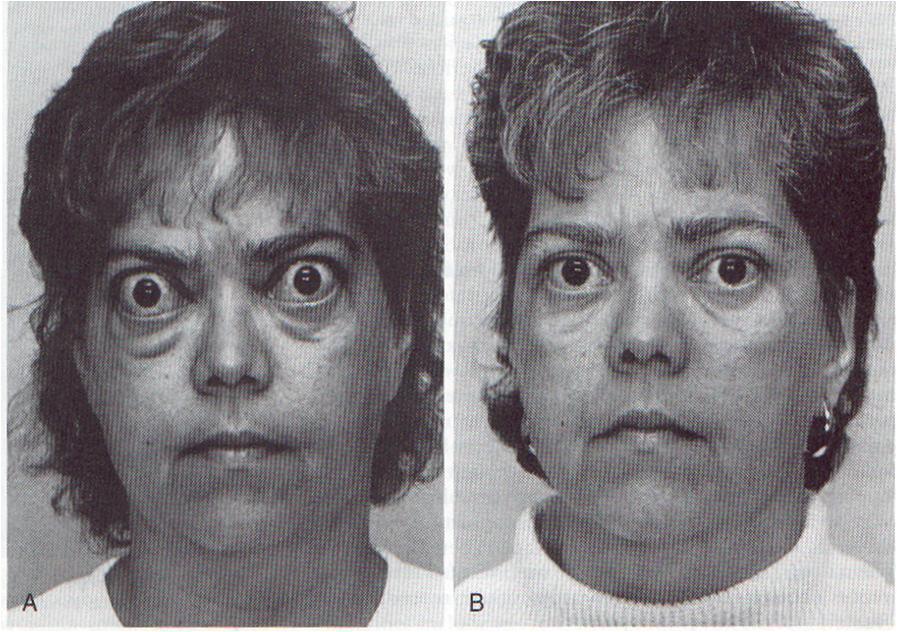 Отмена Т4 при нормализации объема щитовидной железы должна сопровождаться назначением физиологических доз йода [2, 6, 8, 13].
Отмена Т4 при нормализации объема щитовидной железы должна сопровождаться назначением физиологических доз йода [2, 6, 8, 13].
Выводы
- Изменения объема диффузного эутиреоидного зоба на фоне приема Т4 и антиструмина разнонаправленны. На фоне лечения размеры щитовидной железы могут уменьшаться, увеличиваться, достигать нормы или оставаться прежними.
- Терапевтическое воздействие Т4 и антиструмина на степень снижения тиреоидного объема и частоту положительных результатов при длительности лечения до 6 мес достоверно не различается.
- Т4 в дозе 2—2,5 мкг/кг в сутки (в среднем 2,2 мкг/кг в сутки) способствовал уменьшению и нормализации объема зобно-измененной щитовидной железы. Эффективность использования Т4 зависела от длительности лечения и достоверно возрастала при назначении препарата более чем на 6 мес.
- Антиструмин в средней дозе 2 таблетки в неделю приводил к уменьшению размеров зоба и нормализации объема железы.
 Наиболее благоприятные результаты получены при лечении антиструмином сроком до 6 мес. При более продолжительном приеме препарата отмечена тенденция к увеличению частоты нежелательных эффектов лечения (увеличение тиреоидного объема).
Наиболее благоприятные результаты получены при лечении антиструмином сроком до 6 мес. При более продолжительном приеме препарата отмечена тенденция к увеличению частоты нежелательных эффектов лечения (увеличение тиреоидного объема). - Длительное (более 6 мес) назначение препаратов йода в дозах, превышающих физиологические потребности, увеличивает частоту отрицательных результатов лечения при диффузном эутиреоидном зобе.
Диффузный токсический зоб у детей. Что такое Диффузный токсический зоб у детей?
ВАЖНО
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Диффузный токсический зоб у детей — это системная аутоиммунная патология, которая возникает при появлении антител, стимулирующих тиреоидную гормональную функцию. Заболевание имеет генетическую предрасположенность, провоцируется стрессом, инфекцией, изменениями гормонального фона. Клинически проявляется увеличением объема щитовидной железы, признаками тиреотоксикоза. Для диагностики определяют уровень тиреоидных гормонов и специфических иммунологических маркеров, инструментально визуализируют щитовидную железу. Лечение включает тиреостатические препараты, бета-адреноблокаторы, по показаниям требуется помощь хирургов.
Заболевание имеет генетическую предрасположенность, провоцируется стрессом, инфекцией, изменениями гормонального фона. Клинически проявляется увеличением объема щитовидной железы, признаками тиреотоксикоза. Для диагностики определяют уровень тиреоидных гормонов и специфических иммунологических маркеров, инструментально визуализируют щитовидную железу. Лечение включает тиреостатические препараты, бета-адреноблокаторы, по показаниям требуется помощь хирургов.
МКБ-10
Е05.0 Тиреотоксикоз с диффузным зобом
- Причины
- Патогенез
- Симптомы
- Осложнения
- Диагностика
- Лечение диффузного токсического зоба у детей
- Консервативная терапия
- Хирургическое лечение
- Прогноз и профилактика
- Цены на лечение
Общие сведения
Диффузный токсический зоб (ДТЗ) также называют болезнью Грейвса-Базедова. Пик заболеваемости в педиатрии приходится на пубертатный возраст, причем девочки болеют в 6 раз чаще мальчиков. В редких случаях патология выявляется у младенцев, рожденных от матерей, которые страдают диффузным токсическим зобом. Болезнь дает серьезные осложнения при отсутствии лечения, не всегда успешно поддается контролю, что обуславливает ее актуальность в современной детской эндокринологии.
В редких случаях патология выявляется у младенцев, рожденных от матерей, которые страдают диффузным токсическим зобом. Болезнь дает серьезные осложнения при отсутствии лечения, не всегда успешно поддается контролю, что обуславливает ее актуальность в современной детской эндокринологии.
Диффузный токсический зоб у детей
Причины
Этиология заболевания точно не изучена. По современным данным, диффузный токсический зоб признан системным аутоиммунным нарушением, которое связано с действием провоцирующих факторов у генетически предрасположенных людей. Предикторами развития патологии у детей считаются аллели HLA-B8 и BW-35, которые повышают риск не только диффузного токсического зоба, но и коллагенозов, аутоиммунного гастрита, иммунной тромбоцитопенической пурпуры.
К типичным пусковым факторам относят длительную психическую травму, отравление токсическими веществами, проживание в условиях неблагоприятной экологической ситуации. Важным фактором риска считаются эндогенные очаги инфекции: у детей они в основном представлены хроническим тонзиллитом, кариесом зубов. Частое появление диффузного токсического зоба в подростковом возрасте связывают с гормональными перестройками в периоде полового созревания.
Важным фактором риска считаются эндогенные очаги инфекции: у детей они в основном представлены хроническим тонзиллитом, кариесом зубов. Частое появление диффузного токсического зоба в подростковом возрасте связывают с гормональными перестройками в периоде полового созревания.
Патогенез
В основе диффузного поражения тиреиодной ткани лежит иммунная дисфункция, нарушения контроля над числом и активностью аутореактивных клеток. Щитовидная железа инфильтрируется лимфоцитами, плазматическими клетками, макрофагами, также в организме образуются аутоантитела против тиреоидной ткани. Главную роль в стимуляции гормонального синтеза играют антитела к ТТГ-рецептору, которые имитируют действие гипофизарного тиреотропина.
Особенность диффузного токсического зоба — так называемый «порочный круг»: избыток тиреоидных гормонов активизирует аутоиммунные процессы, а те, в свою очередь, обеспечивают поддержку диффузного разрастания тиреоидной ткани. Это объясняет сложности подбора терапии, высокий риск рецидива после отмены препаратов.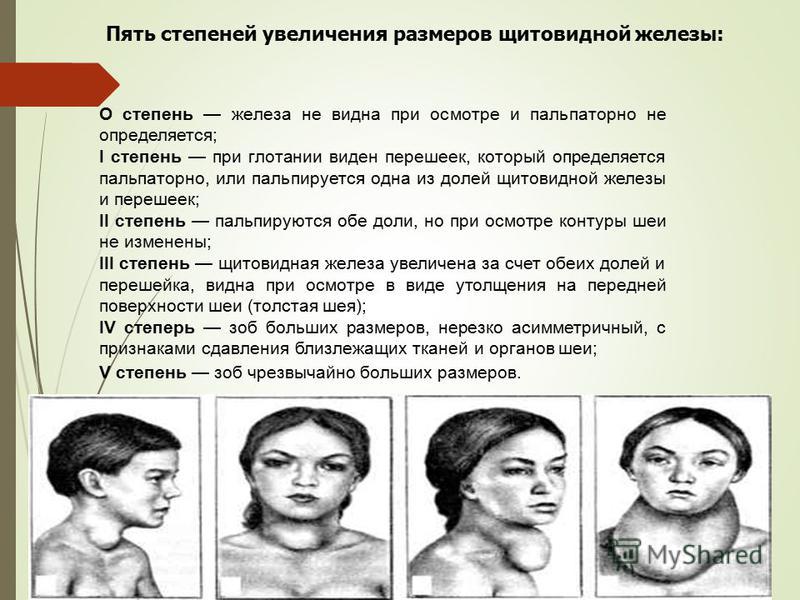 Характерное увеличение эндокринного органа связано как с пролиферацией тиреоцитов под воздействием аутоантител, так и с замедлением процессов апоптоза.
Характерное увеличение эндокринного органа связано как с пролиферацией тиреоцитов под воздействием аутоантител, так и с замедлением процессов апоптоза.
Клиническая симптоматика диффузного зоба обусловлена тиреотоксикозом — увеличением уровня гормонов тироксина (Т4), трийодтиронина (Т3). Вследствие их токсического эффекта активизируются метаболические процессы во всех тканях организма, повышается потребление кислорода и утилизация глюкозы. Под действием тиреоидных гормонов усиливается теплопродукция, происходит активный липолиз.
Симптомы
У детей, страдающих токсическим зобом, сначала появляется нервно-астенический синдром. Он характеризуется повышенной утомляемостью, резкими перепадами настроения, возбудимостью. Ребенку сложно сконцентрироваться на учебе, он становится неусидчивым и суетливым, плохо спит. Зачастую отмечаются дрожание пальцев рук, мышечная слабость («симптом телеграфного столба»), тремор высунутого изо рта языка.
Сердечно-сосудистые расстройства представлены клиникой нейроциркуляторной дистонии. Больного беспокоит постоянное чувство жара, длительный субфебрилитет. Выражен стойкий красный дермографизм. У ребенка даже во сне определяется учащенный пульс. Систолическое АД повышено, ощущаются перебои в работе сердца.
Больного беспокоит постоянное чувство жара, длительный субфебрилитет. Выражен стойкий красный дермографизм. У ребенка даже во сне определяется учащенный пульс. Систолическое АД повышено, ощущаются перебои в работе сердца.
Тиреотоксикоз при ДТЗ негативно влияет на состояние ЖКТ. Большинство детей испытывают усиленный аппетит в сочетании с хронической диареей и мальабсорбцией, что усиливает потери массы тела, вызванные патологически ускоренным метаболизмом. Реже встречается fat-Базедов-вариант, при котором вес увеличивается, несмотря на усиленную перистальтику и расстройства пищеварения. Возможны жировая дистрофия печени, желтушный синдром.
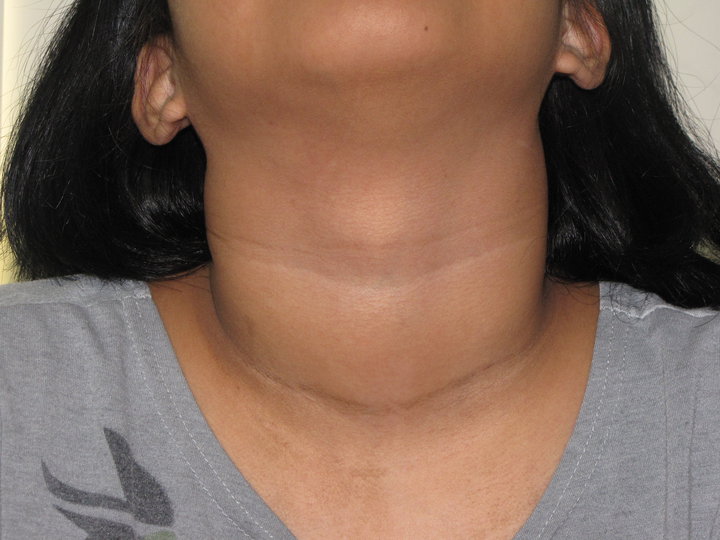
Характерным симптомом токсического зоба является гипертрофия щитовидной железы. Она равномерно увеличена, имеет плотноэластическую консистенцию, не спаяна с окружающими тканями. По классификации ВОЗ выделяют 3 степени процесса:
- 0 — отсутствие признаков гипертрофии органа;
- 1 — пальпируемое увеличение размеров органа, при этом каждая доля размером не более фаланги большого пальца ребенка;
- 3 — видимое на глаз увеличение железы.

Осложнения
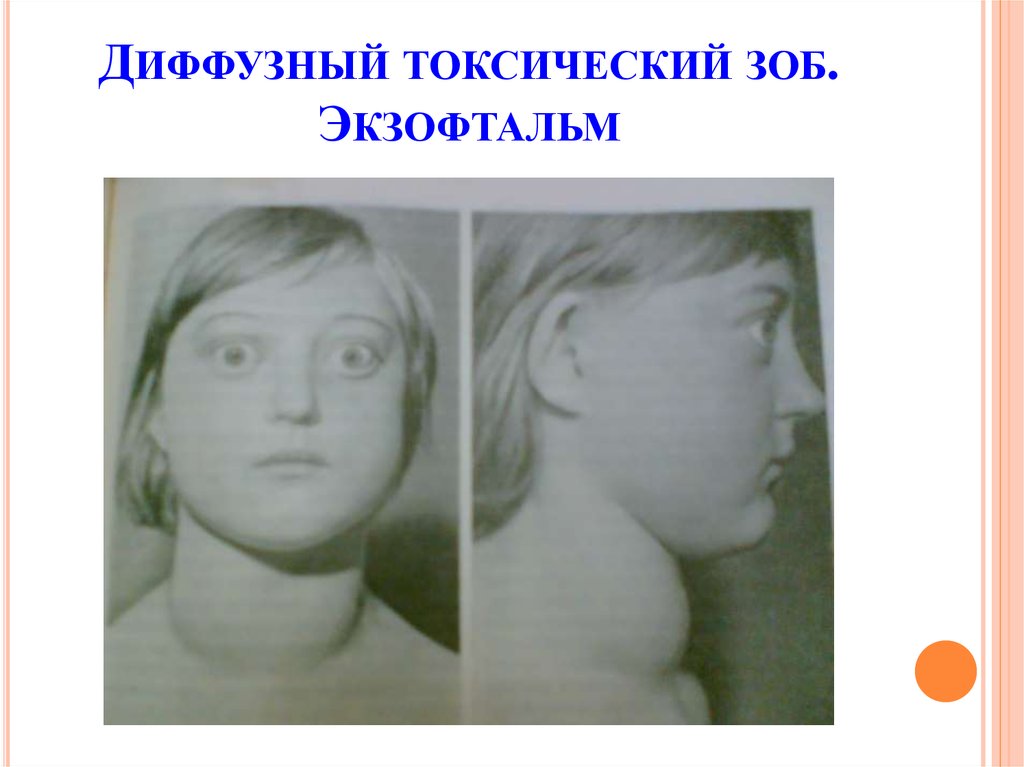
У 45% детей с диффузным зобом развивается эндокринная офтальмопатия (ЭОП), причем в 26,3% она появляется до клинического тиреотоксикоза, а в остальных случаях — одновременно с ним. ЭОП характеризуется глазными симптомами: экзофтальмом, отставанием верхнего века при взгляде вниз (симптом Кохера). Также наблюдается редкое мигание (симптом Штельвага), неполное зажмуривание глаз, нарушения конвергенции. В некоторых случаях болезнь провоцирует слепоту.
При тяжелых формах возможна надпочечниковая недостаточность, что проявляется гиперпигментацией кожи, снижением АД. При длительном существовании патологии нарушается половое развитие, у девочек возникает дисфункция яичников с отсутствием менархе или явлениями дисменореи. Сердечно-сосудистые осложнения включают миокардиодистрофию, мерцательную аритмию, недостаточность кровообращения.
Под влиянием неблагоприятных факторов диффузный токсический зоб осложняется тиреотоксическим кризом. Он связан с резким поступлением в кровоток большого количества тиреоидных гормонов, что сопровождается сердечно-сосудистыми, неврологическими, диспепсическими нарушениями. При несвоевременном оказании медицинской помощи состояние переходит в коматозное, может заканчиваться смертью ребенка.
Он связан с резким поступлением в кровоток большого количества тиреоидных гормонов, что сопровождается сердечно-сосудистыми, неврологическими, диспепсическими нарушениями. При несвоевременном оказании медицинской помощи состояние переходит в коматозное, может заканчиваться смертью ребенка.
Диагностика
При физикальном осмотре детский эндокринолог пальпирует щитовидную железу, чтобы определить степень ее увеличения, проводит аускультацию сердца, во время которой выявляются усиленные тоны с металлическим оттенком, акцент 2-го тона над легочной артерией, систолический шум. Детальное обследование ребенка с подозрением на диффузный токсический зоб включает следующие методы:
- Визуализация щитовидной железы. Объем, размеры и структуру органа оценивают на УЗИ. К специфическим признакам относят среднюю эхогенность паренхимы, усиление кровообращения. Для точной диагностики характера диффузного поражения железы, степени ее функциональной активности выполняется сцинтиграфия.
 Иногда размеры зоба уточняют по КТ, МРТ.
Иногда размеры зоба уточняют по КТ, МРТ. - Исследование сердца. При диффузном токсическом зобе наблюдаются ЭКГ-симптомы нарушения метаболизма в миокарде, отклонение электрической оси влево. При ЭхоКГ определяется гипертрофия левого желудочка, усиление сердечного выброса. Для визуализации серьезных структурных изменений сердца выполняют рентгенографию ОГК.
- Анализ тиреоидных гормонов. При классическом варианте заболевания повышается уровень свободных Т3 и Т4 при одновременном снижении ТТГ. Субклинический вариант характеризуется падением уровня ТТГ при нормальном количестве гормонов щитовидной железы.
- Иммунологические исследования. У 99% детей определяются антитела к рецепторам ТТГ, у 40-60% — к тиреопероксидазе, тиреоглобулину. Анализы повторяют в процессе лечения, на успех терапии указывает снижение уровня аутоантител или приобретение ими блокирующих свойств.
Лечение диффузного токсического зоба у детей
Консервативная терапия
При впервые выявленном ДТЗ у детей показано медикаментозное лечение. Требуется госпитализация на 3-4 недели в эндокринологический стационар с соблюдением постельного режима, после чего переходят на амбулаторную терапию. Помимо лекарств, рекомендуют высококалорийную диету с дополнительным введением белковых и витаминизированных продуктов, чтобы покрыть нутритивный дефицит.
Требуется госпитализация на 3-4 недели в эндокринологический стационар с соблюдением постельного режима, после чего переходят на амбулаторную терапию. Помимо лекарств, рекомендуют высококалорийную диету с дополнительным введением белковых и витаминизированных продуктов, чтобы покрыть нутритивный дефицит.
Патогенетическое лечение заболевания проводится тиреостатическими средствами — производными тиомочевины (мерказолил). Они угнетают образование тиреоидных гормонов, купируют тиреотоксикоз. Длительность приема медикаментов варьируется от полугода при легком течении диффузного токсического зоба до 5 лет при тяжелой форме патологии. В схему консервативного лечения входят и другие препараты:
- L-тироксин. Гормон назначают после достижения эутиреоза, чтобы предотвратить развитие ятрогенного гипотиреоза, блокировать струмогенное действие тиреостатиков. Медикамент вводят с постепенным увеличением дозы по принципу «блокируй и замещай».
- Бета-блокаторы.
 Показаны для коррекции токсического влияния на сердечно-сосудистую систему. Снижают чувствительность периферических бета-адренорецепторов к катехоламинам. Лекарства также блокируют превращение Т4 в более активный Т3 в периферических тканях.
Показаны для коррекции токсического влияния на сердечно-сосудистую систему. Снижают чувствительность периферических бета-адренорецепторов к катехоламинам. Лекарства также блокируют превращение Т4 в более активный Т3 в периферических тканях. - Кортикостероиды. Медикаменты используются при осложнении заболевания надпочечниковой недостаточностью. Они также применяются в случае тиреотоксических кризов, при побочных реакциях тиреостатической терапии.
Хирургическое лечение
Помощь детских хирургов требуется при загрудинном зобе, сильном разрастании тканей щитовидной железы, которые сдавливают окружающие органы. Оперативное лечение применяют при формировании узлов на фоне диффузного токсического зоба, рецидиве болезни или непереносимости тиреостатиков. В среднем хирургическую помощь назначают спустя 6 месяцев от начала терапии тиреостатическими препаратами, если она не дает эффекта.
При ДТЗ проводят субтотальную субфасциальную резекцию щитовидной железы. Операция требует подготовки в течение нескольких месяцев, чтобы максимально устранить клинику тиреотоксикоза. В предоперационном периоде обязательно используют глюкокортикостероиды для предупреждения недостаточности надпочечников. После удаления ЩЗ возникает гипотиреоз, который корректируют заместительной терапией L-тироксином.
Операция требует подготовки в течение нескольких месяцев, чтобы максимально устранить клинику тиреотоксикоза. В предоперационном периоде обязательно используют глюкокортикостероиды для предупреждения недостаточности надпочечников. После удаления ЩЗ возникает гипотиреоз, который корректируют заместительной терапией L-тироксином.
Прогноз и профилактика
Тиреотоксические проявления ДТЗ успешно купируются медикаментами, что способствует достижению ремиссии, однако в будущем у ребенка остается высокая вероятность рецидива. Прогноз ухудшается при наличии органических поражений сердца, нейропатии зрительного нерва, вызванных длительным течением токсического зоба. Нелеченая болезнь приводит к тяжелым осложнениям и может закончиться смертью пациента.
Учитывая аутоиммунный характер патологии, специфические меры профилактики не разработаны. Рекомендовано диспансерное наблюдением за детьми, чьи родственники страдали от этого заболевания. Чтобы снизить вероятность развития диффузного токсического зоба, нужно ограничить стрессовые факторы, своевременно санировать очаги хронической инфекции, проводить общеукрепляющую терапию.
Вы можете поделиться своей историей болезни, что Вам помогло при лечении диффузного токсического зоба у детей.
Источники
- Диффузный токсический зоб в терапевтической практике: учебное пособие / Л.М. Фархутдинова. — 2015.
- Тиреотоксикоз с диффузным зобом (диффузный токсический зоб, болезнь Грейвса-Базедова), узловым/многоузловым зобом. Клинические рекомендации Российской ассоциации эндокринологов. — 2014.
- Тиреотоксикоз у детей. Клинический протокол МЗ РК. — 2013.
- Диффузный токсический зоб в детском возрасте/ В.В. Смирнов, И.С. Мавричева// Лечащий врач. — 2007.
- Настоящая статья подготовлена по материалам сайта: https://www.krasotaimedicina.ru/
ВАЖНО
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Диффузный токсический зоб – StatPearls
Непрерывное обучение
Зоб – это анатомическое увеличение щитовидной железы. Это может быть связано с дисфункцией щитовидной железы или иметь нормальную функцию щитовидной железы. Это мероприятие посвящено оценке и лечению диффузного токсического зоба и объясняет роль межпрофессиональной команды в оценке и лечении пациентов с этим заболеванием.
Цели:
Определить этиологию диффузного токсического зоба и неотложных состояний.
Опишите соответствующую оценку диффузного токсического зоба.
Изучить варианты лечения диффузного токсического зоба.
Опишите стратегии межпрофессиональной бригады по улучшению координации помощи и коммуникации для улучшения лечения диффузного токсического зоба и улучшения результатов.
Доступ к бесплатным вопросам с несколькими вариантами ответов по этой теме.
Введение
Зоб просто означает увеличение щитовидной железы. Это может быть вызвано различными причинами, наиболее распространенной причиной во всем мире является дефицит йода в пище. Однако в Соединенных Штатах более распространены болезнь Грейвса и болезнь Хашимото. Зоб классифицируют по различным категориям, морфологии (узловой/диффузный), функциональному состоянию (гипер/гипо/эутиреоид), злокачественности и т. д. По определению, «диффузный, токсический» зоб относится к диффузно гиперпластической щитовидной железе, которая чрезмерно перепроизводство гормонов щитовидной железы.0005
Etiology
The following are common causes of goiter:
Iodine deficiency[1]
Autoimmune disorders[2]
Smoking
Heredity[3]
Medications ex . литий, йодиды, интерферон-альфа[4]
Лучевая терапия[5]
Воспаление напр. инфекции
Диффузный токсический зоб чаще всего вызывается аутоиммунными заболеваниями, такими как болезнь Грейвса в США.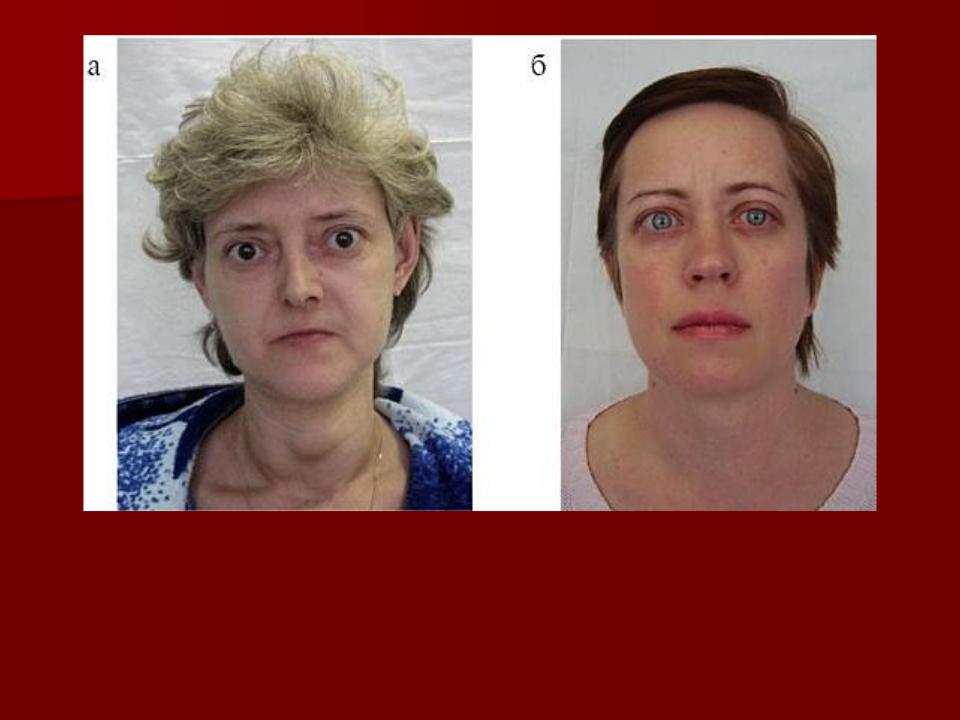
Эпидемиология
Наиболее частой причиной диффузного токсического зоба является болезнь Грейвса. Это наиболее распространенная причина гипертиреоза в Соединенных Штатах, от которой страдает 1 из 200 человек.
Обычно поражает людей в возрасте от 30 до 50 лет, но может возникнуть в любой возрастной группе. У женщин встречается в 7-10 раз чаще, чем у мужчин. Наблюдается также заметный рост семейной заболеваемости.
Патофизиология
Диффузный токсический зоб состоит из диффузно увеличенной сосудистой железы резиноподобной консистенции. Микроскопически фолликулярные клетки гипертрофированы и гиперпластичны, в них мало коллоида. Лимфоциты и плазматические клетки проникают в железу и в конечном итоге могут агрегировать в лимфоидные фолликулы.
Все случаи диффузного токсического зоба не являются болезнью Грейвса и могут иметь различные неаутоиммунные каузальные процессы. Но большинство случаев имеют аутоиммунный характер. При болезни Грейвса антитела направляются к рецептору тиреотропного гормона (ТТГ), присутствующему на фолликулярных клетках. Хроническая стимуляция этих рецепторов приводит к выработке избыточного количества Т3, Т4 и, в конечном итоге, к увеличению щитовидной железы, что приводит к зобу.[6]
Хроническая стимуляция этих рецепторов приводит к выработке избыточного количества Т3, Т4 и, в конечном итоге, к увеличению щитовидной железы, что приводит к зобу.[6]
Гистопатология
Это заболевание имеет следующие гистологические характеристики[7]:
Диффузное неузелковое увеличение железы с гладкой капсулой и повышенной васкуляризацией.
Гиперплазия как фолликулярных, так и папиллярных клеток с лимфоцитарной инфильтрацией стромы щитовидной железы
Фолликулярные клетки также могут быть увеличены и, в крайних случаях, имеют увеличенные ядра, имитирующие ядра папиллярной карциномы щитовидной железы. Однако при болезни Грейвса они, как правило, сохраняют свою округлую форму и имеют минимальное просветление.
В связи с последним пунктом выше, были разногласия относительно связи между болезнью Грейвса и папиллярной карциномой щитовидной железы, а также относительно того, влияет ли их сосуществование на прогноз. При систематическом обзоре различных исследований было замечено, что при обнаружении папиллярной карциномы после хирургического удаления железы прогноз благоприятный, тогда как при обнаружении опухоли у пациента с болезнью Грейвса местные характеристики опухоли (размер, степень, поля, функциональность и т. д.) определяют прогноз.
При систематическом обзоре различных исследований было замечено, что при обнаружении папиллярной карциномы после хирургического удаления железы прогноз благоприятный, тогда как при обнаружении опухоли у пациента с болезнью Грейвса местные характеристики опухоли (размер, степень, поля, функциональность и т. д.) определяют прогноз.
История и физика
История
[9]
Пациенты могут иметь в анамнезе одно или несколько последствий состояния гипертиреоза. К ним относятся потеря веса, непереносимость жары (с другими симптомами, связанными с жарой, такими как полидипсия, потливость), тремор, нервозность, беспокойство, утомляемость, сердцебиение, одышка, частая дефекация, диарея, тошнота, рвота и т. д.
Пациенты могут также жаловаться на явный отек шеи или ощущение комка в шее, комка, затруднение глотания, ортопноэ и т. д.
У пациентов с болезнью Грейвса могут быть дополнительные признаки, такие как:
Офтальмопатия/орбитопатия Грейвса (наблюдается у 25% пациентов): экзофтальм, диплопия, периорбитальный отек, чрезмерное слезотечение и т.
 д.
д.- 5
- 5
- 5 Тиреоидная дерматопатия (редко, наблюдается у 4% пациентов и обычно сочетается с орбитопатией): слегка утолщенная пигментированная кожа, особенно в претибиальной области.
Репродуктивная система – нерегулярные менструации
Физикальное обследование
Общие находки у больного с диффузным токсическим зобом при физикальном обследовании:
Конституциональная потеря веса отеки
Сердечно-сосудистая система: тахикардия, нерегулярное сердцебиение, систолическая гипертензия
Нервно-мышечная система: тремор конечностей, гиперрефлексия, гиперактивность, мышечная слабость
Дыхательная система – тахипноэ
Кожа и конечности – влажная, теплая кожа, претибиальная микседема
ТТГ в сыворотке крови является лучшим скрининговым тестом для оценки избытка или дефицита гормонов щитовидной железы.[10]
В случае диффузного токсического зоба вышеуказанные тесты обычно дают низкий или нормальный уровень ТТГ с повышенным уровнем щитовидной железы в сыворотке.

Основываясь на предпочтениях в соответствии с характеристиками населения, социально-экономическими причинами и культурным фоном, методами оценки причины тиреотоксикоза могут быть либо поглощение радиоактивного йода, либо комбинация УЗИ щитовидной железы с антителами к рецептору ТТГ.[9]
Высокое поглощение радиоактивного йода диффузно указывает на болезнь Грейвса, как и увеличение железы с положительными антителами к рецептору ТТГ (TRAb).
Лечение/управление
Методы лечения диффузного токсического зоба включают:
Антитиреоидные препараты (ATD)
Варианты антитиреоидных препаратов: пропилтиоурацил, тиамазол и карбимазол.
Американская ассоциация щитовидной железы (ATA) и Американская ассоциация клинической эндокринологии рекомендуют тиамазол в качестве предпочтительного препарата для лечения болезни Грейвса, за исключением пациентов с побочными реакциями на препарат или пациентов в первом триместре беременности.
 Он предпочтительнее пропилтиоурацила из-за лучшей эффективности, более длительного периода полувыведения и продолжительности действия, а также дозирования один раз в день.
Он предпочтительнее пропилтиоурацила из-за лучшей эффективности, более длительного периода полувыведения и продолжительности действия, а также дозирования один раз в день.Существует два режима введения АТД, и первый – титрование, при котором доза АТД снижается до минимально возможной дозы при достижении эутиреоидного состояния. Следующий режим — блокировка и замена, при котором высокая доза АТД вводится вместе с тироксином для поддержания эутиреоидного состояния.[11]
Недостатком терапии АТД является риск рецидива, особенно в первый год после прекращения терапии. Исследования подтверждают риск рецидива от 50% до 55% с неблагоприятными прогностическими факторами, такими как тяжелый гипертиреоз, большой зоб, высокое соотношение T3: T4, стойкое подавление ТТГ и высокие исходные концентрации TRAb.[12]
Редкие, но серьезные побочные эффекты терапии ATD включают агранулоцитоз, гепатотоксичность, васкулит и т. д.
Радиойодтерапия (I-31, RAI) [12]
RAI — это наиболее распространенный метод лечения болезни Грейвса в Соединенных Штатах, а также безопасная и эффективная форма лечения.

Абсолютными противопоказаниями к данной терапии являются беременность, кормление грудью и тяжелый неконтролируемый тиреотоксикоз.
Его можно вводить в форме жидкости или капсул, а терапия с фиксированной дозой так же эффективна, как и терапия с расчетной дозой на основе объема железы, поглощения йода и т. д.
Пациенты должны прекратить прием всех йодсодержащих препаратов. лекарства и соблюдать диету с ограничением йода, чтобы обеспечить эффективное поглощение RAI.
Терапия ATD должна быть прекращена перед использованием RAI и может быть возобновлена через неделю после введения RAI, если это необходимо.
Потенциальные побочные эффекты включают риск развития гипотиреоза и, в редких случаях, транзиторного радиационного гипертиреоза или обострения тиреоид-ассоциированной офтальмопатии (ТАО).
В то время как гипотиреоз активно выявляют в ходе последующего наблюдения, известно, что преднизолон предотвращает прогрессирование легкого ТАО.
Пациенты должны быть проинформированы о пожизненном наблюдении за рецидивом заболевания или развитием гипотиреоза и нуждаются в немедленном лечении, если у них диагностировано то же самое.
Хирургия
Тиреоидэктомия является наиболее успешной формой лечения диффузного токсического зоба, причем тотальная тиреоидэктомия более успешна, чем субтотальная, с аналогичными побочными эффектами.
В связи с побочными эффектами, связанными с применением общей анестезии, параличом возвратного гортанного нерва, гипотиреозом и т. д. обычно это последняя линия лечения.
Предпочтителен у пациентов, которые не переносят антитиреоидные препараты или RAI, или у пациентов с компрессионными симптомами.[13]
Дифференциальный диагноз
Хотя диагноз диффузного токсического зоба диагностируется с помощью различных форм, как указано выше, дифференциальный диагноз диффузного токсического зоба включает: тиреоидит
Многоузловой зоб
ТТГ-секретирующая аденома гипофиза
Ятрогенное введение йода
Прогноз
Ожидается, что у пациентов с диффузным токсическим зобом, особенно из-за болезни Грейвса, гипотиреоз разовьется во время естественного течения их заболевания независимо от лечения.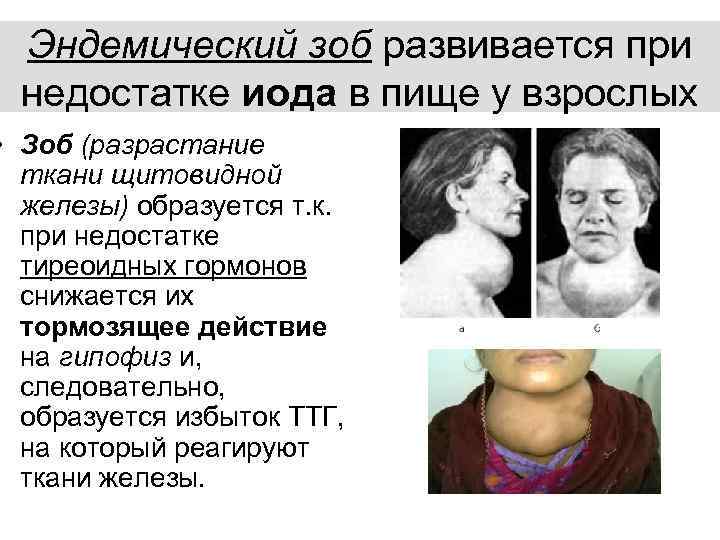 Длительный тиреотоксикоз может вызвать утолщение желудочков и, следовательно, повышенный риск сердечной смертности.
Длительный тиреотоксикоз может вызвать утолщение желудочков и, следовательно, повышенный риск сердечной смертности.
Лечение с помощью RAI проводится с целью постоянного гипотиреоза, что делает пациента зависимым от пожизненного приема гормонов щитовидной железы. ATD имеют средний уровень ремиссии 50%, но отличный прогноз через 4 года, без рецидивов.
осложнения
Гипертиреоз, или шторм щитовидной железы из -за длительного необработанного избытка гормона щитовидной железы
Дерматопатия, связанная с болезнью могилы
Graysempary. могут проявляться обычными гиперметаболическими (например, непереносимостью жары, потливостью, потерей веса и т. д.) и адренергическими симптомами (например, сердцебиением, тремором, эмоциональной лабильностью и т. д.) гипертиреоза, а также отеком зоба. Но у пожилых пациентов могут отсутствовать адренергические симптомы, а скорее апатия, мерцательная аритмия и т. д., которые также могут свидетельствовать о депрессии, злокачественных новообразованиях или сердечных аномалиях.
Повышение эффективности медицинских работников
Диагностика диффузного токсического зоба представляет собой сочетание клинических признаков и исследований. Оценка радиологических исследований и исследований крови важна для того, чтобы прийти к заключению об основной причине заболевания. После постановки диагноза врач несет ответственность за то, чтобы помочь пациенту выбрать наилучший вариант лечения на основе его профиля и с полным пониманием потенциальных побочных эффектов. Женщины должны быть особенно осторожны и хорошо информированы, поскольку беременность или кормление грудью требуют от них изменения формы терапии, если она противопоказана. Поскольку это состояние может также привести к косметическим проблемам (например, выпуклые глаза и т. д.), врачи должны быть чуткими и восприимчивыми к ним и консультировать пациентов о доступных вариантах лечения, а также иметь реалистичный подход к ответу на лечение.
Контрольные вопросы
Доступ к бесплатным вопросам с несколькими вариантами ответов по этой теме.
Комментарий к этой статье.
Рисунок
токсический узловой зоб. Изображение предоставлено S Bhimji MD
Рисунок
зоб у женщины. Изображение предоставлено S Bhimji MD
Ссылки
- 1.
Zimmermann MB, Boelaert K. Дефицит йода и заболевания щитовидной железы. Ланцет Диабет Эндокринол. 2015 апр; 3 (4): 286-95. [PubMed: 25591468]
- 2.
Суэйн М., Суэйн Т., Моханти Б.К. Аутоиммунные заболевания щитовидной железы — обновление. Индиан Дж. Клин Биохим. 2005 янв; 20(1):9-17. [PMC free article: PMC3454167] [PubMed: 23105486]
- 3.
Knobel M. Этиопатология, клиника и лечение диффузного и многоузлового нетоксического зоба. Дж Эндокринол Инвест. 2016 апр; 39(4):357-73. [PubMed: 26392367]
- 4.
Донг Б.Дж. Как лекарства влияют на функцию щитовидной железы. Уэст Дж. Мед. 2000 г., февраль; 172(2):102-6. [Бесплатная статья PMC: PMC1070767] [PubMed: 10693372]
- 5.

Jereczek-Fossa BA, Alterio D, Jassem J, Gibelli B, Tradati N, Orecchia R. Заболевания щитовидной железы, вызванные лучевой терапией. Cancer Treat Rev. 2004 Jun;30(4):369-84. [PubMed: 15145511]
- 6.
Prabhakar BS, Bahn RS, Smith TJ. Современный взгляд на патогенез болезни Грейвса и офтальмопатии. Endocr Rev. 2003 Dec;24(6):802-35. [PubMed: 14671007]
- 7.
LiVolsi VA, Baloch ZW. Патология гипертиреоза. Фронт Эндокринол (Лозанна). 2018;9:737. [Бесплатная статья PMC: PMC6286962] [PubMed: 30559722]
- 8.
Ортли Д., Хардер Ф., Оберхольцер М., Штауб Дж. Дж. [Гипертиреоз и карцинома щитовидной железы — совпадение или ассоциация?]. Schweiz Med Wochenschr. 1998 28 ноября; 128 (48): 1910-4. [PubMed: 9879620]
- 9.
Де Лео С., Ли С.Ю., Браверман Л.Е. Гипертиреоз. Ланцет. 2016 авг 27;388(10047):906-918. [Бесплатная статья PMC: PMC5014602] [PubMed: 27038492]
- 10.

Baskin HJ, Cobin RH, Duick DS, Gharib H, Guttler RB, Kaplan MM, Segal RL., Американская ассоциация клинических эндокринологов. Медицинские рекомендации Американской ассоциации клинических эндокринологов для клинической практики по оценке и лечению гипертиреоза и гипотиреоза. Эндокр Практ. 2002 г., ноябрь-декабрь; 8(6):457-69. [PubMed: 15260011]
- 11.
Allannic H, Fauchet R, Orgiazzi J, Madec AM, Genetet B, Lorcy Y, Le Guerrier AM, Delambre C, Derennes V. Антитиреоидные препараты и болезнь Грейвса: перспектива рандомизированная оценка эффективности продолжительности лечения. J Clin Endocrinol Metab. 1990 марта; 70 (3): 675-9. [PubMed: 1689737]
- 12.
Авраам П., Авенелл А., МакГеоч С.К., Кларк Л.Ф., Беван Дж.С. Схема приема антитиреоидных препаратов для лечения гипертиреоза Грейвса. Cochrane Database Syst Rev. 2010 20 января; 2010(1):CD003420. [Бесплатная статья PMC: PMC6599817] [PubMed: 20091544]
- 13.
Girgis CM, Champion BL, Wall JR.
 Современные представления о болезни Грейвса. The Adv Endocrinol Metab. 2011 июнь;2(3):135-44. [Бесплатная статья PMC: PMC3474632] [PubMed: 23148179]
Современные представления о болезни Грейвса. The Adv Endocrinol Metab. 2011 июнь;2(3):135-44. [Бесплатная статья PMC: PMC3474632] [PubMed: 23148179]- 14.
Вирсинга В.М. Болезнь Грейвса: можно ли вылечить? Эндокринол Метаб (Сеул). 2019 март;34(1):29-38. [PMC free article: PMC6435849] [PubMed: 30912336]
ЛЕЧЕНИЕ ТОКСИЧЕСКОГО ДИФФУЗНОГО ЗОБА (БОЛЕЗНЬ ГРЕЙВСА) В ДЕТСТВЕ: Отчет об успешном лечении пропилтиоурацилом | JAMA Pediatrics
ЛЕЧЕНИЕ ТОКСИЧЕСКОГО ДИФФУЗНОГО ЗОБА (БОЛЕЗНЬ ГРЕЙВСА) В ДЕТСТВЕ: отчет об успешном лечении пропилтиоурацилом | ДЖАМА Педиатрия | Сеть ДЖАМА
[Перейти к навигации]
Эта проблема
- Скачать PDF
- Полный текст
Поделиться
Твиттер
Фейсбук
Электронная почта
LinkedIn- Процитировать это
- Разрешения
Артикул
Апрель 1951 г.

ЭНН ТОППЕР, доктор медицины
Принадлежности автора
НЬЮ-ЙОРК
Из педиатрической службы доктора Горация Л. Ходса, больница Маунт-Синай.
AMA Am J Dis Child. 1951;81(4):556-562. doi:10.1001/archpedi.1951.02040030567011
Полный текст
Абстрактный
В предыдущих публикациях 1 указывалось, что, хотя хирургическое вмешательство может быть лучшим методом лечения диффузного токсического зоба у взрослых, консервативное лечение рекомендуется, когда заболевание возникает до полового созревания. Был представлен отчет о восьми детях, прошедших медикаментозное лечение, которые после периода наблюдения от 3,5 до 25 лет полностью выздоровели.
Можно кратко суммировать аргументы в пользу медикаментозного лечения диффузного токсического зоба. 1. Операционная смертность, хотя и относительно низкая с момента появления йода, всегда имеет место, в то время как в литературе нет сообщений о смерти среди детей, получающих медикаментозное лечение.