Атомы и молекулы упражнение: Упражнение «Молекулы»
Тренинг с подростками, направленный на профилактику употребления наркотиков и других психоактивных веществ
Тренинг с подростками, направленный на профилактику употребления наркотиков и других психоактивных веществ
1 2 3 4 5 6 7 8 9 … 22
1 2 3 4 5 6 7 8 9 … 22 База данных защищена авторским правом ©psihdocs.ru 2023 | Главная страница Автореферат Анализ Анкета Бағдарламасы Бизнес-план Биография Бюллетень Викторина Выпускная работа Глава Диплом |
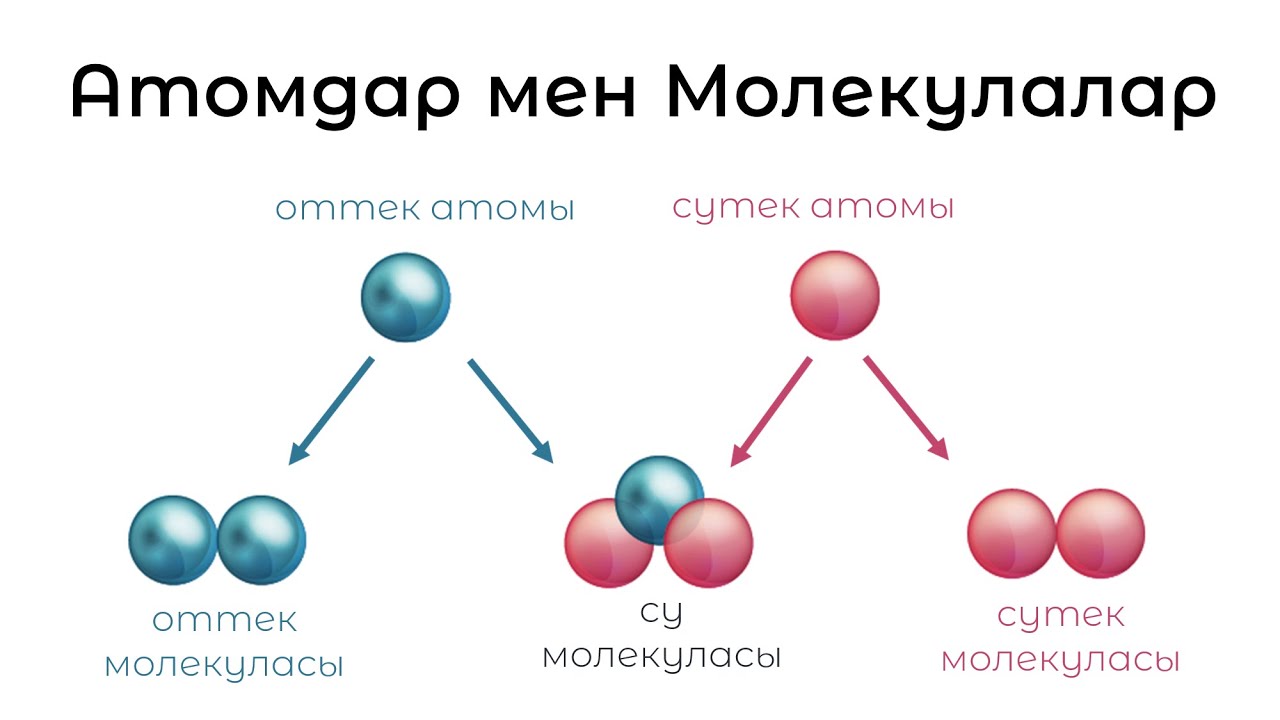
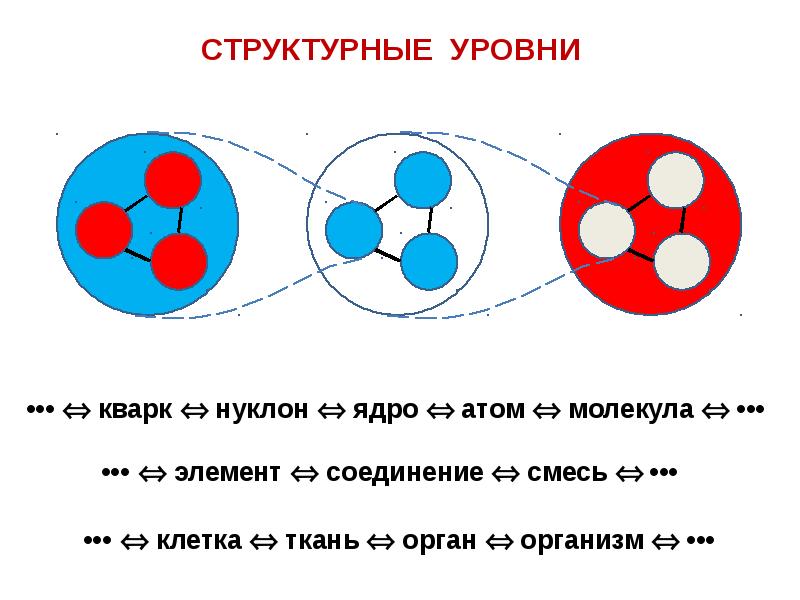
6. Упражнение «Молекулы и атомы».
Представим
себя атомами. Они выглядят так (тренер
показывает,
согнув руки в локтях и прижав кисти к
плечам). Атомы двигаются
по комнате, пока тренер не назовет
какое-либо число. Тогда
все объединяются в молекулу из названного
числа атомов. «Атомы»
«Атомы»
стоят в молекуле лицом друг к другу в
кругу, касаясь предплечьями.
Не называются числа, при которых один
участник группы
может остаться один вне молекулы. В
конце упражнения
тренер называет число, равное количеству
участников группы.
7.
Психотехническое упражнение «Комплимент».
Участники
садятся по кругу. Ведущий берет мяч и
бросает одному
из участников, говоря комплимент.
Получивший мяч выбирает
любого в круге и говорит свой комплимент
любому из круга.
Игра продолжается до тех пор, пока мяч
не побывает у каждого
участника. Комплимент должен быть
коротким, лучше — в одно
слово.
8.
Упражнение
«Самореклама».
За 25 —
30 минут написать работодателю письмо
с предложением
своих услуг и описанием своих
психологических особенностей,
способностей, склонностей, успехов.
Автор подписывает письмо
и сдает его ведущему. Ведущий собирает
все письма, а затем, не
называя автора, читает письма вслух.
Проводится обсуждение писем
в круге. Участники круга пытаются угадать
автора.
9.
Подведение
итогов.
10.
Домашнее задание.
Ответить
письменно на вопросы (см. 1 занятие)
Занятие 3. Мое видение будущей профессии
Цель занятия: сформировать
более подробное
представление о различных профессиях.
Приветствие
ведущего и вопрос об актуальном
состоянии
каждого
участника группы: физическом и
психологическом.Обсуждение домашнего задания.
Психотехническое упражнение «Стража».
Необходимо нечетное
количество участников. Все рассчитываются
на «первый—второй». Вторые номера сидят
на стульях, первые
стоят за спинками стульев. Оставшийся
без пары участник
группы стоит за спинкой свободного
стула. Его задача, используя
только неречевые средства общения,
переманить к себе на
стул кого-нибудь из участников. Задача
Задача
тех, кто стоит за спинками
— удержать своих «подопечных», успев
положить руку на
плечо того человека, который сидит на
их стуле, в тот момент, когда
они заметили его намерение пересесть.
Постоянно держать руку над плечом
«подопечного» не стоит.
4. Упражнение «Покажи, кто он?».
На доске
записывают 10—12 нравящихся участникам
группы профессий.
Ведущий называет каждую из выбранных
профессий и
говорит: «Покажи, кто он?». Все показывают
на того, кому больше
всего подходит данная профессия.
5. Упражнение «Выступление у микрофона».
Представитель
одного из профессиональных учебных
заведений (начальных, средних специальных,
высших) предлагает выпускникам средней
школы получить стоящую профессию.
Слушатели могут задавать
вопросы в конце выступления. Представителем
по очереди становятся все участники.
Обсуждение представленных профессий.
6. Психотехническое упражнение «Бип».
Группа
сидит по кругу. Один из участников с
Один из участников с
завязанными глазами
ходит внутри круга, периодически садясь
к сидящим на колени.
Его задача — угадать, к кому он сел.
Ощупывать руками не
разрешается, садиться надо спиной к
сидящему, так, как будто
садишься на стул. Сидящий должен сказать:
«Бип», желательно,
«не своим голосом», чтобы его не узнали.
Если водящий угадал, на чьих коленях он
сидит, то этот участник тренинга начинает
водить, а предыдущий садится на его
место.
7.
Психотехническое
упражнение «Сядем вместе, сядем рядом».
Все
участники обнимаются за плечи и
одновременно медленно
садятся лицом к центру круга. Затем
встают, также держась за
плечи друг друга.
Актуальное состояние участников.
Итоги дня. Вопросы участников.
Домашнее
задание.
Занятие
4. Профессии на «языке тела» или ни
слова о профессиях!
Цель занятия:
получить знания,
обходясь без слов. Обострить внимание
Обострить внимание
к своим ощущениям, чувствам групповой
сплоченности,
взаимного доверия.
Приветствие ведущего.
Упражнение «Мое внутреннее состояние».
Бросая друг другу мяч,
называют имя того, кому бросают. Тот,
кто
получает мяч, принимает позу, отражающую
его внутреннее состояние,
а все остальные, воспроизводя эту позу,
стараются почувствовать,
понять состояние этого человека.
Вопрос:
«Как вам кажется, какое состояние у
каждого из нас?»
После того, как относительно каждого
высказывается несколько
гипотез, следует обратиться к самому
человеку с тем, чтобы он сказал, какое
у него состояние.
Обсуждение домашнего
задания.Упражнение «Надпись на спине».
Ведущий
прикрепляет карточку с названием
профессии одному из участников.
Остальным участникам необходимо
изобразить эту профессию так,
чтобы участник с карточкой на спине
угадал, что написано на
листочке.
5.
Упражнение
«Скульптор».
Работа
в парах. «Скульптор» «лепит» из участника
группы представителя
той профессии, которая, с его точки
зрения, наиболее соответствует
данному человеку. Затем — обмен ролями.
Обсуждение: «Что помогало справиться
с задачей? Какие были затруднения?
6.
Упражнение
«Крокодил».
Группа
разделяется на две команды. Первая —
загадывает какую-либо
профессию, а вторая делегирует своего
участника (с его
согласия) или игроки первой группы могут
сами назвать того,
кому они сообщат загаданную профессию.
Последнему нужно изобразить ее только
с помощью жестов и мимики, а его команда
пытается понять, что было загадано.
Команды загадывают профессии
по очереди.
Обсуждение:
что помогло справиться с поставленной
задачей и
что затрудняло ее выполнение?
7.
Упражнение
«Барьер».
Каждый
из участников тренинга мысленно
представляет то, что
является препятствием — барьером на
пути достижения ближайшей
профессиональной цели. Этот барьер
Этот барьер
представляется в виде
членов группы, которые, сжав в кольцо
участника, мешают выбраться ему из
круга. Прорыв означает преодоление
препятствия.
Участник может выйти из круга, уговорив
одного из препятствующих.
Обсуждение.
8.
Упражнение
«Укачивание».
Участник
группы ложится на стулья (на пол). В этом
горизонтальном
положении его поднимают и раскачивают
вверх — вниз. Эту процедуру повторяют
по очереди с каждым. Перед упражнением
ведущий делает следующее замечание:
«Очень важно испытать
доверие, а также нашу зависимость от
других членов группы.
Следующее упражнение даст нам такую
возможность».
9.Актуальное состояние участников.
Итоги дня.
Домашнее задание.
NCERT Solutions Class 9 Science Chapter 3 Atoms And Molecules
NCERT Solutions for Class 9 Science Chapter 3 – CBSE Получите бесплатный PDF
NCERT Solutions for Class 9 Science Chapter 3 — Atoms and Molecules — это подробный учебный материал, подготовленный экспертами. Дает ответы на вопросы, заданные в учебнике. Решения NCERT очень полезны для лучшего понимания концепций и самоанализа.
Дает ответы на вопросы, заданные в учебнике. Решения NCERT очень полезны для лучшего понимания концепций и самоанализа.
Вопросы из всех тем включены в решения. Все представлено так, чтобы учащиеся могли легко понять. Это поможет им получить хорошие оценки на экзамене CBSE. Ответы на все виды длинных и коротких вопросов, MCQ, приемы и советы представлены в решениях NCERT для класса 9.Наука. Попробуйте решить вопросы после прохождения всей программы и устранения недостатков до прибытия экзаменов CBSE.
Глава «Атомы и молекулы» составляет основу следующих глав; поэтому с ним следует разобраться основательно. Вопросы и решения помогут учащимся прояснить все свои сомнения, связанные с темой.
Решения NCERT для класса 9 содержат все важные вопросы и ответы по всем предметам и главам. Студенты могут обратиться к этим решениям, чтобы преуспеть в экзаменах CBSE.
Скачать PDF
карусельExampleControls111
Предыдущий
Следующий
Доступ к ответам по науке NCERT, класс 9, глава 3 — Атомы и молекулы (решены все вопросы в тексте и упражнения)
Класс 9 Естествознание Глава 3 Упражнение 3.
 1 Вопросы с ответами
1 Вопросы с ответами
Упражнение-3.1 Страница: 32
1. В ходе реакции 5,3 г карбоната натрия вступили в реакцию с 6 г уксусной кислоты. Продуктов было 2,2 г углекислого газа, 0,9г воды и 8,2 г ацетата натрия. Покажите, что эти наблюдения согласуются с законом сохранения массы.
Карбонат натрия + уксусная кислота → ацетат натрия + диоксид углерода + вода
Решение:
Карбонат натрия + уксусная кислота → ацетат натрия + диоксид углерода + вода
5,3 г 6 г 8,2 г 2,2 г 0,9 г
По закону сохранения массы общая масса реагентов должна быть равна общей массе
товара.
В соответствии с приведенной выше реакцией L.H.S. = R.H.S. т. е. 5,3 г + 6 г = 2,2 г + 0,9 г + 8,2 г = 11,3 г
Следовательно, наблюдения согласуются с законом сохранения массы.
2. Водород и кислород соединяются в соотношении 1:8 по массе с образованием воды. Какая масса газообразного кислорода потребуется для полной реакции с 3 г газообразного водорода?
Какая масса газообразного кислорода потребуется для полной реакции с 3 г газообразного водорода?
Решение:
Нам известна смесь водорода и воды в соотношении 1:8.
На каждый 1 г водорода приходится 8 г кислорода.
Следовательно, для 3 г водорода количество кислорода = 3 x 8 = 24 г
Следовательно, для полной реакции с 3 г газообразного водорода потребуется 24 г кислорода.
3. Какой постулат теории атома Дальтона является следствием закона сохранения массы?
Решение:
Относительное число и типы атомов в данном составе постоянны, утверждает атомная теория Дальтона, основанная на законе сохранения массы.
«Атомы не могут быть ни созданы, ни уничтожены в химической реакции».
4. Какой постулат теории атома Дальтона может объяснить закон определенных пропорций?
Решение:
Постулат атомной теории Дальтона, который может объяснить закон определенных пропорций, состоит в том, что
относительное число и род атомов одинаковы в данных соединениях.
Упражнение-3.2 Страница: 35
1. Дайте определение единице атомной массы.
Решение:
Атомная единица массы – это единица массы, используемая для выражения веса атомов и молекул, где
атомная масса равна 1/12 массы одного атома углерода-12.
2. Почему нельзя увидеть атом невооруженным глазом?
Решение:
Во-первых, атомы по своей природе крохотны, измеряются в нанометрах. Во-вторых, кроме атомов благородного
газов, они не существуют самостоятельно. Следовательно, атом не может быть виден невооруженным глазом.
Упражнение-3.3-3.4 Страница: 39
1. Запишите формулы
(i) оксид натрия
(ii) хлорид алюминия
(iii) сульфид натрия
(iv) гидроксид магния
Решение:
Ниже приведены формулы:
(i) оксид натрия – Na 2 O
(ii) хлорид алюминия – AlCl 3
(iii) сульфид натрия – Na 2 С
(iv) гидроксид магния – Mg (OH) 2
2. Запишите названия соединений, представленных следующими формулами:
Запишите названия соединений, представленных следующими формулами:
(i) Ал 2 (SO 4 ) 3
(ii) CaCl 2
(iii) К 2 SO 4
(iv) КНО 3
(v) CaCO 3 .
Решение:
Ниже перечислены названия соединений для каждой из следующих формул:
(i) Al 2 (SO 4 ) 3 – Сульфат алюминия
(ii) CaCl 2 – Хлорид кальция
(iii) K 2 SO 4 – Сульфат калия
(iv) KNO 3 – Нитрат калия
(v) CaCO 3 – Карбонат кальция
3. Что означает термин «химическая формула»?
Решение:
Химические формулы используются для описания различных типов атомов и их количества в соединении или элементе. Атомы каждого элемента обозначаются одной или двумя буквами. Набор химических символов, который изображает элементы, из которых состоит соединение, и их количество.
Атомы каждого элемента обозначаются одной или двумя буквами. Набор химических символов, который изображает элементы, из которых состоит соединение, и их количество.
Например, химическая формула соляной кислоты — HCl.
4. Сколько атомов содержится в
(i) H 2 Молекула S и
(ii) PO 4 3- ион?
Решение:
Число присутствующих атомов следующее:
(i) H 2 Молекула S имеет 2 атома водорода и 1 атом серы, следовательно, всего 3 атома.
(ii) PO 4 3- ион имеет 1 атом фосфора и 4 атома кислорода, следовательно, всего 5 атомов.
Упражнение-3.5.1-3.5.2 Страница: 40
1. Рассчитайте молекулярные массы H 2 , O 2 , Cl 2 , CO 2 , CH 4 , C 2 H 6 , C 2 H 4 , NH 3 , CH 3 ОН.
Решение:
Ниже приведены молекулярные массы:
Молекулярная масса H 2 – 2 x атомов атомная масса H = 2 x 1u = 2u
Молекулярная масса O 2 – 2 x атомов атомная масса O = 2 x 16u = 32u
Молекулярная масса Cl 2 – 2 x атомов атомная масса Cl = 2 x 35,5u = 71u
Молекулярная масса CO 2 – атомная масса C + 2 x атомная масса O = 12 + ( 2×16)u = 44u
Молекулярная масса CH 4 – атомная масса C + 4 x атомная масса H = 12 + ( 4 x 1)u = 16u
Молекулярная масса C 2 H 6 – 2 x атомная масса C + 6 x атомная масса H = (2 x 12) +
(6 х 1)u=24+6=30u
Молекулярная масса C 2 H 4 – 2 x атомная масса C + 4 x атомная масса H = (2x 12) +
(4 x 1)u=24+4=28u
Молекулярная масса NH 3 – атомная масса N + 3 x атомная масса H = (14 +3 x 1)u= 17u
Молекулярная масса CH 3 OH – атомная масса C + 3x атомная масса H + атомная масса O + атомная масса H = (12 + 3×1+16+1)u=(12+3+17)u = 32u
2. Рассчитайте формулу удельных масс ZnO, Na 2 O, K 2 CO 3 , учитывая атомные массы Zn = 65u,
Рассчитайте формулу удельных масс ZnO, Na 2 O, K 2 CO 3 , учитывая атомные массы Zn = 65u,
Na = 23 ед., K=39 ед., C = 12 ед. и O=16 ед.
Решение:
Дано:
Атомная масса Zn = 65u
Атомная масса Na = 23u
Атомная масса K = 39u
Атомная масса C = 12u
Атомная масса O = 16u
Формула единицы массы ZnO= Атомная масса Zn + Атомная масса O = 65u + 16u = 81u
Формула единицы массы Na 2 O = 2 x атомная масса Na + атомная масса O = (2 x 23)u + 16u = 46u + 16u = 62u
Формула единицы массы K 2 CO 3 = 2 x атомная масса K + атомная масса C + 3 x атомная масса O = (2 x 39)u + 12u + (3 x 16)u = 78u + 12u + 48u = 138u
Упражнение-3.5.3 Страница: 42
1. Если один моль атомов углерода весит 12 граммов, какова масса (в граммах) 1 атома углерода?
Решение:
Дано: 1 моль углерода весит 12 г
1 моль атомов углерода = 6,022 x 10 23
Молекулярная масса атомов углерода = 12г = атом углерода массой
Следовательно, масса 1 атома углерода = 12 / 6,022 x 10 23 = 1,99 x 10 -23 г
2. Что имеет большее количество атомов, 100 граммов натрия или 100 граммов железа (учитывая атомную массу Na = 23 ед., Fe = 56 ед.)?
Что имеет большее количество атомов, 100 граммов натрия или 100 граммов железа (учитывая атомную массу Na = 23 ед., Fe = 56 ед.)?
Решение:
(а) В 100 граммах Na:
m = 100 г, Молярная масса атома Na = 23 г, N 0 = 6,022 х 10 23 , N = ?
N = (Данная масса x N 0 )/Молярная масса
Н = (100 х 6,022 х 10 23 )/ 23
N = 26,18 х 10 23 атомов
(b) В 100 граммах Fe:
m = 100 г, Молярная масса атома Fe = 56 г, N 0 = 6,022 x 10 23 , N = ?
N = (Данная масса x N 0 )/ Молярная масса
Н = (100 х 6,022 х 10 23 )/ 56
Н = 10,75 х 10 23 атомов
Следовательно, в 100 г Na больше атомов, чем в 100 г Fe.
Страница упражнений: 43
1. Анализ показал, что образец соединения кислорода и бора массой 0,24 г содержит 0,096 г бора и 0,144 г кислорода. Рассчитайте процентный состав соединения по массе.
Рассчитайте процентный состав соединения по массе.
Решение:
Дано: Масса пробы соединения = 0,24 г, масса бора = 0,096 г, масса кислорода = 0,144 г
Для расчета процентного состава соединения,
Процентное содержание бора = масса бора/масса соединения x 100
= 0,096 г / 0,24 г x 100 = 40%
Процентное содержание кислорода = 100 – процентное содержание бора
= 100 – 40 = 60%
2. При сгорании 3,0 г углерода в 8,00 г кислорода образуется 11,00 г двуокиси углерода. Какая масса углекислого газа образуется при сгорании 3,00 г углерода в 50,00 г кислорода? Какой закон химического соединения будет определять ваш ответ?
Решение:
При сгорании 3,0 г углерода в 8,00 г кислорода образуется 11,00 г двуокиси углерода.
Учитывая, что
3,0 г углерода соединяется с 8,0 г кислорода с образованием 11,0 г двуокиси углерода.
Узнать
Нам нужно найти массу углекислого газа, который образуется при сгорании 3,00 г углерода в 50,00 г кислорода.
Раствор
Сначала напишем протекающую здесь реакцию.
C + O2 → CO2
При данном условии при сгорании 3,0 г углерода в 8,00 г кислорода образуется 11,00 г углекислого газа.
3 г + 8 г → 11 г (из вышеуказанной реакции)
Общая масса реагентов = масса углерода + масса кислорода
=3г+8г
= 11 г
Суммарная масса реагентов = Суммарная масса продуктов
Таким образом, закон сохранения массы доказан.
Затем также показано, что двуокись углерода содержит углерод и кислород в фиксированном соотношении по массе, которое составляет 3:8.
Таким образом, это еще раз доказывает закон постоянных пропорций.
3 г углерода также должны соединяться только с 8 г кислорода.
Это означает, что (50−8)=42 г кислорода останется непрореагировавшим.
Оставшиеся 42 г кислорода останутся неактивными. В этом случае тоже образуется только 11 г углекислого газа
Приведенный выше ответ подчиняется закону постоянных пропорций.
3. Что такое многоатомные ионы? Приведи примеры.
Решение:
Многоатомные ионы — это ионы, которые содержат более одного атома, но ведут себя как единое целое.
Пример: CO 3 2-, H 2 PO 4 –
4. Напишите химическую формулу следующего вещества.
(а) Хлорид магния
(б) Оксид кальция
(в) Нитрат меди
(г) Хлорид алюминия
(e) Карбонат кальция
Решение:
Ниже приводится химическая формула вышеупомянутого списка:
(a) Хлорид магния – MgCl 2
(б) Оксид кальция – CaO
(c) Нитрат меди – Cu(NO 3 ) 2
(d) Хлорид алюминия – AlCl 3
(e) Карбонат кальция – CaCO 3
5. Назовите элементы, входящие в состав следующих соединений.
(а) Негашеная известь
(б) Бромистый водород
(с) Разрыхлитель
(г) Сульфат калия
Решение:
Ниже приведены названия элементов, присутствующих в следующих соединениях:
(a) Негашеная известь – кальций и кислород (CaO)
(b) Бромоводород – Водород и бром (HBr)
(c) Разрыхлитель – натрий, углерод, водород, кислород (NaHCO 3 )
(d) Сульфат калия – сера, кислород, калий (K 2 SO 4 )
6. Рассчитайте молярную массу следующих веществ.
(a) Этин, C 2 H 2
(b) Молекула серы, S 8
(c) Молекула фосфора, P 4 (Атомная масса фосфора =31)
(d) Соляная кислота, HCl
(e) Азотная кислота, HNO 3
Решение:
Ниже указаны молярные массы следующих веществ:
(a) Молярная масса этина C 2 H 2 = 2 x Масса C+2 x Масса H = (2×12)+(2×1)=24+2=26 г
(b) Молярная масса молекулы серы S 8 = 8 x Масса S = 8 x 32 = 256 г
(c) Молярная масса молекулы фосфора, P 4 = 4 x Масса P = 4 x 31 = 124 г
(d) Молярная масса соляной кислоты, HCl = масса H+ масса Cl = 1+35,5 = 36,5 г
(e) Молярная масса азотной кислоты, HNO 3 = масса H+ масса азота + 3 x масса O = 1 + 14+
3×16 = 63 г
7. Какова масса
Какова масса
(а) 1 моль атомов азота?
(b) 4 моля атомов алюминия (Атомная масса алюминия =27)?
(c) 10 молей сульфита натрия (Na 2 SO 3 )?
Решение:
Масса вышеуказанного списка следующая:
(а) Атомная масса атомов азота = 14u
Масса 1 моля атомов азота = Атомная масса атомов азота
Следовательно, масса 1 моля атома азота равна 14 г.
(b) Атомная масса алюминия =27u
Масса 1 моля атомов алюминия = 27 г
1 моль атомов алюминия = 27 г, 4 моля атомов алюминия = 4 x 27 = 108 г
(c) Масса 1 моля сульфита натрия Na 2 SO 3 = Молекулярная масса сульфита натрия = 2 x Масса Na + Масса S + 3 x Масса O = (2 x 23) + 32 + (3x 16) = 46+32+48 = 126 г
Следовательно, масса 10 молей Na 2 SO 3 = 10 x 126 = 1260 г
8. Превратить в крота.
(a) 12 г газообразного кислорода
(б) 20 г воды
(c) 22 г диоксида углерода
Решение:
Преобразование вышеупомянутых молекул в моли происходит следующим образом:
(a) Дано: Масса газообразного кислорода = 12 г
Молярная масса газообразного кислорода = 2 Масса кислорода = 2 x 16 = 32 г
Количество молей = данная масса / молярная масса газообразного кислорода = 12/32 = 0,375 моль
(б) Дано: масса воды = 20 г
Молярная масса воды = 2 x Масса водорода + Масса кислорода = 2 x 1 + 16 = 18 г
Количество молей = данная масса / молярная масса воды
= 20/18 = 1,11 моль
(c) Дано: Масса двуокиси углерода = 22 г
Молярная масса диоксида углерода = Масса C + 2 x Масса кислорода = 12 + 2x 16 = 12+32=44 г
Число молей = данная масса/молярная масса двуокиси углерода = 22/44 = 0,5 моля
9. Какова масса:
Какова масса:
(а) 0,2 моль атомов кислорода?
(b) 0,5 моль молекул воды?
Решение:
Масса следующая:
(а) Масса 1 моля атомов кислорода = 16u; следовательно, он весит 16 г.
Масса 0,2 моля атомов кислорода = 0,2 x 16 = 3,2 г
(б) Масса 1 моля молекул воды = 18u; следовательно, он весит 18 г.
Масса 0,5 моль молекул воды = 0,5 х 18 = 9г
10. Рассчитайте количество молекул серы (S 8 ), присутствующих в 16 г твердой серы.
Решение:
Для расчета молекулярной массы серы,
Молекулярная масса серы (S 8 ) = 8xмасса серы = 8×32 = 256 г
Приведенная масса = 16 г
Количество молей = данная масса/молярная масса серы
= 16/256 = 0,0625 моль
Чтобы рассчитать количество молекул серы в 16 г твердой серы,
Количество молекул = Количество молей x число Авогадро
= 0,0625 х 6,022 х 10²³ молекул
= 3,763 х 10 22 молекул
11. Рассчитайте количество ионов алюминия, присутствующих в 0,051 г оксида алюминия.
Рассчитайте количество ионов алюминия, присутствующих в 0,051 г оксида алюминия.
( Подсказка: Масса иона равна массе атома того же элемента. Атомная масса Al = 27u)
Решение:
Чтобы рассчитать количество ионов алюминия в 0,051 г оксида алюминия,
1 моль оксида алюминия = 6,022 x 10 23 молекул оксида алюминия
1 моль оксида алюминия (Al 2 O 3 ) = 2 x масса алюминия + 3 x масса кислорода
= (2 х 27) + (3 х 16) = 54 + 48 = 102 г
1 моль оксида алюминия = 102 г = 6,022 x 10 23 молекул оксида алюминия
Следовательно, 0,051 г оксида алюминия имеет = 6,022 x 10 23 / 102 x 0,051
= 3,011 x 10 20 молекулы оксида алюминия
Одна молекула оксида алюминия имеет 2 иона алюминия; следовательно, количество ионов алюминия, присутствующих в 0,051 г оксида алюминия, = 2 х 3,011 х 10 20 молекул оксида алюминия.
= 6,022 х 10 20
Решения NCERT для науки 9 класса Глава 3 — Атомы и молекулы
Глава имеет вес 23 балла на экзаменах. Вопросы не являются конкретными и могут быть заданы из любой темы. Поэтому учащимся рекомендуется тщательно изучить всю главу. Химические формулы и числовые должны хорошо практиковаться.
Важные темы, представленные в этой главе, включают
3.1 Законы химического соединения
3.2 Что такое атом?
3.3 Что такое молекула?
3.4 Написание химических формул
3.5 Молекулярная масса и концепция молей
Решения для упражнений 11 вопросов (8 числовых, 3 коротких)
Молекулярная масса и концепция молей – 8 числовых значений
Химическая формула – 2 вопроса
Что такое атом — 1 вопрос
Решения NCERT для науки класса 9, глава 3
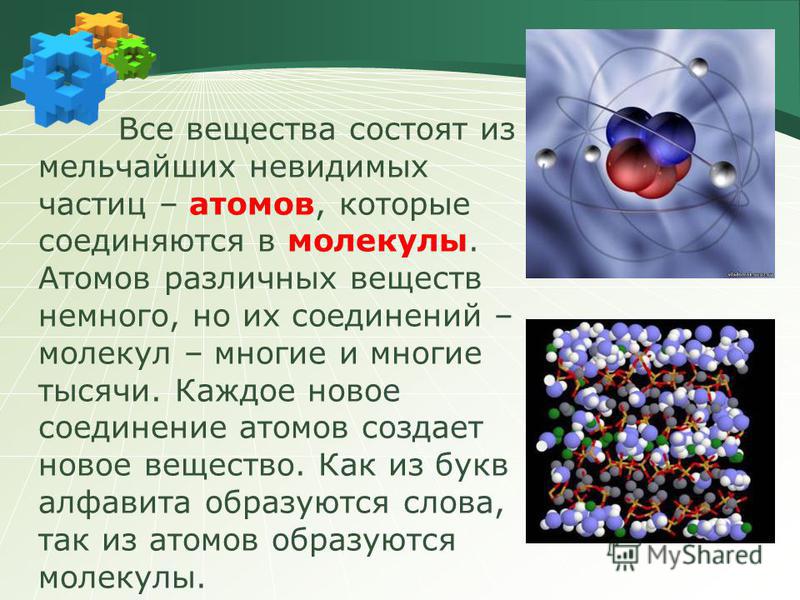
Наименьшая единица материи — атом. Он обладает свойствами элемента. Атом состоит из плотного ядра, называемого ядром, окруженного рядом внешних оболочек. В этих оболочках находятся электроны. Ядро содержит протоны и нейтроны. Протоны имеют положительный заряд, а нейтроны нейтральны.
В этих оболочках находятся электроны. Ядро содержит протоны и нейтроны. Протоны имеют положительный заряд, а нейтроны нейтральны.
Два или более атома, тесно связанные друг с другом, образуют молекулу. Молекулы, состоящие из двух атомов, называются двухатомными. Кислород, азот, водород и йод являются двухатомными молекулами. Атмосфера Земли состоит в основном из двухатомных молекул. Молекула – это наименьшая часть соединения.
Основные характеристики решений NCERT для научной главы 9 класса. Глава 3 — Атомы и молекулы
- Ответы предоставлены экспертами науки.
- Ответы не ошибочны.
- У Решений есть вопросы по всем важным темам.
- Это дает полное понимание концепций.
Отказ от ответственности:
Удаленные темы — Концепция крота.
Часто задаваемые вопросы о решениях NCERT для класса 9Science Chapter 3
Q1
Упомяните темы, включенные в главу 3 NCERT Solutions for Class 9 Science.

Темы, включенные в главу 3 Решения NCERT для класса 9 Науки:
3.1 Законы химического соединения
3.2 Что такое атом?
3.3 Что такое молекула?
3.4 Написание химических формул
3.5 Молекулярная масса и понятие молей
Q2
Как быстрее решить числовые числа, представленные в главе 3 NCERT Solutions for Class 9 Science?
Учащиеся 9-го класса должны решить числа, представленные в учебнике NCERT, чтобы получить представление о важных формулах, присутствующих в них. Если при решении упражнений возникают сомнения, учащиеся могут обратиться к Решениям NCERT для 9-го класса по науке от BYJU’S, где каждая задача решается точно. Решения содержат пояснения к каждому шагу, чтобы помочь учащимся без труда понять метод решения задач.
Q3
Каковы ключевые особенности решений NCERT для класса 9Наука Глава 3?
Ключевыми особенностями NCERT Solutions for Class 9 Science Chapter 3 являются
1. Ответы подготовлены высококвалифицированными научными экспертами.
Ответы подготовлены высококвалифицированными научными экспертами.
2. Решения точные, без ошибок, на основе последней программы CBSE.
3. Каждая важная тема объясняется простым языком, чтобы помочь учащимся получить высокие баллы на экзаменах CBSE.
4. Учащиеся получают полное представление о важных концепциях, используя решения NCERT от BYJU’S.
Решения
NCERT для класса 9Наука Глава 3 Атомы и молекулы
Абхишек
Вы найдете NCERT Solutions for Class 9 Science Chapter 3 Atoms and Molecules , которые являются точными и подробными, с помощью которых вы можете подготовить свои собственные ответы, воспользовавшись помощью. Эти решения NCERT являются полезными ресурсами, которые могут помочь вам не только охватить всю учебную программу, но и предоставить глубокий анализ тем. Глава 3 Класс 9 Наука Решения NCERT дадут хороший опыт и дадут возможность узнать что-то новое.
Вы можете выяснить последнюю схему выставления оценок и подготовить ответы в соответствии с требованиями. Глава 3 Атомы и молекулы NCERT Вопросы и ответы помогают в создании отличной основы концепций и облегчают учащимся понимание основ. Студенты могут перепроверить свои ответы, а также правильно ли они усвоили материал.
Решения NCERT для науки класса 9 Глава 3 Атомы и молекулы
Эти Решения NCERT для науки класса 9 поможет вам хорошо разбираться в различных темах и поможет учащимся исключительно хорошо сдать экзамены CBSE. Эти решения NCERT курируются экспертами в комплексе, который может помочь мгновенно развеять ваши сомнения. Это будет полезно для расширения кругозора учащихся, поскольку охватывает множество вопросов.
In Text Questions
Номер страницы: 32
1. В ходе реакции 5,3 г карбоната натрия вступили в реакцию с 6 г этановой кислоты. Продуктов было 2,2 г углекислого газа, 0,9г воды и 8,2 г этаноата натрия. Покажите, что эти наблюдения согласуются с законом сохранения массы.
Покажите, что эти наблюдения согласуются с законом сохранения массы.
Карбонат натрия + этановая кислота → этаноат натрия + диоксид углерода + вода
Ответ
В данной реакции карбонат натрия взаимодействует с этановой кислотой с образованием этаноата натрия, диоксида углерода и воды.
Карбонат натрия + Этановая кислота → этаноат натрия + диоксид углерода + вода
Масса карбоната натрия = 5,3 г (данные)
Масса этановой кислоты = 6 г (Данная)
Масса этаноата натрия = 8,2 г (Данная)
Масса диоксида углерода = 2,2 г (Данная)
Масса воды = 0,9 г (Данная)
Теперь общая масса до реакции = (5,3 + 6) г
= 11,3 г
А, общая масса после реакции = (8,2 + 2,2 + 0,9) г
= 11,3 г
∴ Общая масса до реакции = Общая масса после реакции
Следовательно, данные наблюдения согласуются с законом сохранения массы.
Страница №: 33
2. Водород и кислород соединяются в соотношении 1:8 по массе, образуя воду. Какая масса газообразного кислорода потребуется для полной реакции с 3 г газообразного водорода?
Какая масса газообразного кислорода потребуется для полной реакции с 3 г газообразного водорода?
Ответ
Дано, что массовая доля водорода и кислорода в воде составляет 1:8.
Тогда масса газообразного кислорода, необходимая для полной реакции с 1 г газообразного водорода, составляет 8 г.
Следовательно, масса газообразного кислорода, необходимая для полной реакции с 3 г газообразного водорода, составляет 8 × 3 г = 24 г.
3. Какой постулат теории атома Дальтона является следствием закона сохранения массы?
Ответ
Постулат Дальтона: «Атомы — неделимые частицы, которые не могут образоваться или разрушиться в результате химической реакции» является следствием закона сохранения массы.
4. Какой постулат теории атома Дальтона может объяснить закон определенных пропорций?
Ответ
Постулат Дальтона «Относительное число и виды атомов в данном соединении постоянны» может объяснить закон определенных пропорций.
Номер страницы: 35
1. Дайте определение единице атомной массы.
Ответ
Единица массы, равная ровно одной двенадцатой массы одного атома углерода-12, называется одной атомной единицей массы. Пишется как «у».
2. Почему невозможно увидеть атом невооруженным глазом?
Ответ
Размер атома настолько мал, что его невозможно увидеть невооруженным глазом. Кроме того, атом элемента не существует независимо.
Номер страницы: 39
1. Запишите формулы
(i) оксид натрия
► Na 2 O
(ii) хлорид алюминия
► AlCl 3
(iii) сульфид натрия
► Na 2 S
(iv) гидроксид магния
► Mg(OH) 2
2. Запишите названия соединений, представленных следующими формулами:
(i) Ал 2 (СО 4 ) 3
► Сульфат алюминия
(ii) CaCl 2
► Хлорид кальция
(iii) K 2 SO 4
► Сульфат калия
(iv) KNO 3
► Нитрат калия
(v) CaCO 3
► Карбонат кальция
3. Что означает термин «химическая формула»?
Что означает термин «химическая формула»?
Ответить
Химическая формула соединения является символическим представлением его состава.
4. Сколько атомов входит в состав молекулы
(i) H 2 S и иона
(ii) PO 4 3-?
Ответ
(i) В молекуле H 2 S присутствуют три атома; два из водорода и один из серы.
(ii) В ионе PO 4 3- присутствует пять атомов; один из фосфора и четыре из кислорода.
Номер страницы: 40
1. Рассчитайте молекулярные массы H 2 , O 2 , Cl 2 , CO 2 , CH 4 901 41, C 2 H 6 , C 2 H 4 , NH 3 , CH 3 OH.
Ответ
► Молекулярная масса H 2 = 2 × атомная масса H
= 2 × 1
= 2 u
► Молекулярная масса O 2 = 2 × Атомная масса O
= 2 × 16
= 32 u
► Молекулярная масса Cl 2 = 2 × атомная масса Cl
= 2 × 35,5
= 71 u
► Молекулярная масса CO 2 = атомная масса C + 2 × атомная масса O
= 12 + 2 × 16
= 44 ед.![]()
► Молекулярная масса CH 4 = атомная масса C + 4 × атомная масса H
= 12 + 4 × 1
= 16 ед.
► Молекулярная масса C 2 H 6 = 2× атомная масса C + 6× атомная масса H
= 2 × 12 + 6 × 1
= 30 u
► Молекулярная масса C 2 H 4 = 2 x атомная масса C + 4 × атомная масса H
= 2 × 12 + 4 × 1
= 28 u
► Молекулярная масса NH 3 = Атомная масса N + 3 × Атомная масса H
= 14 + 3×1
= 17 u
► Молекулярная масса CH 3 OH = Атомная масса C + 3 × Атомная масса H + Атомная масса O + Атомная масса H 90 019 = 12 + 3×1 + 8 + 1
= 24 u
2. Рассчитайте формулу удельных масс ZnO, Na 2 O, K 2 CO 3 , при атомных массах Zn = 65 ед., Na = 23 ед., K = 39 ед., C = 12 ед. и O = 16 ед.
Ответ
► Формула единицы массы ZnO = атомная масса Zn + атомная масса O
= 65 + 16
= 81 u
► Формула единицы массы Na 2 O = 2 × Атомная масса Na + Атомная масса O
= 2 × 23 + 16
= 62 u
► Масса формульной единицы K 2 CO 3 = 2 × Атомная масса K + Атомная масса C + 3 × Атомная масса O
= 2 × 39 + 12 + 3 × 16
= 78 + 12 + 48
= 122 u
Номер страницы: 42
1. Если один моль атомов углерода весит 12 граммов, какова масса (в граммах) 1 атома углерода?
Если один моль атомов углерода весит 12 граммов, какова масса (в граммах) 1 атома углерода?
Ответ
Один моль атомов углерода весит 12 г (Дано)
т.е. масса 1 моля атомов углерода = 12 г
Тогда масса 6,022 × 10 23 число атомов углерода = 12 г
Следовательно, масса 1 атома углерода = 12 ÷ (6,022 × 10 23 )
= 1,9926 x 10 -23 г
2. Что имеет большее число атомов, 100 г натрия или 100 г железа (данные, атомная масса Na = 23 ед., Fe = 56 ед.)?
Ответ
Атомная масса Na = 23 ед. (Дано)
Тогда грамм атомной массы Na = 23 г
Теперь 23 г Na содержит = 6,022 × 10 23 г Число атомов 9 0019 Таким образом, 100 г Na содержит = 6,022 × 10 23 / 23 × 100 число атомов
= 2,6182 × 10 24 число атомов
Снова атомная масса Fe = 56 ед. (Данная)
Тогда грамм атомной массы Fe = 56 г
Теперь 56 г Fe содержит = 6,022 × 10 23 г число атомов
Таким образом, 100 г Fe содержит = 6,022 × 10 23 / 56 × 100 число атомов
= 1,0753 × 10 24 число атомов
Следовательно, 100 граммов натрия содержат большее число атомов, чем 100 граммов железа. .
.
Номер страницы: 43
Упражнения
1. В пробе соединения кислорода и бора массой 0,24 г анализом установлено, что она содержит 0,096 г бора и 0,144 г кислорода. Рассчитайте процентный состав соединения по массе.
Ответ
Общая масса соединения = 0,24 г (данные)
Масса бора = 0,096 г (данные)
Масса кислорода = 0,144 г (данные)
Таким образом, процент бора по массе в соединении = 0,096 / 0,24 × 100 % = 40 %
И процент кислорода по весу в соединении = 0,144 / 0,24 × 100% = 60%
2. При сгорании 3,0 г углерода в 8,00 г кислорода образуется 11,00 г двуокиси углерода. Какая масса углекислого газа образуется при сгорании 3,00 г углерода в 50,00 г кислорода? Какой закон химических соединений будет определять ваш ответ?
Ответ
3,0 г углерода соединяется с 8,0 г кислорода с образованием 11,0 г двуокиси углерода.
Если 3 г углерода сжечь в 50 г кислорода, то 3 г углерода прореагируют с 8 г кислорода. Оставшиеся 42 г кислорода останутся нереакционноспособными.
Оставшиеся 42 г кислорода останутся нереакционноспособными.
В этом случае также образуется только 11 г углекислого газа.
Приведенный выше ответ подчиняется закону постоянных пропорций.
Номер страницы: 44
3. Что такое многоатомные ионы? Приведи примеры?
Ответ
Многоатомный ион представляет собой группу атомов, несущих заряд (положительный или отрицательный). Например, нитрат (NO 3 — ) , гидроксид-ион (OH — ).
4. Напишите химические формулы следующих веществ:
(а) Хлорид магния
► MgCl 2
(b) Оксид кальция
► CaO
(c) Нитрат меди
► Cu (NO 3 ) 2
(d) Хлорид алюминия
► AlCl 3
(e) Карбонат кальция
► CaCO 3
5. Назовите элементы, входящие в состав следующих соединений:
(a) Негашеная известь
► Кальций и кислород
(b) Бромид водорода
► Водород и бром
(c) Разрыхлитель
► Натрий, водород, углерод и кислород
(d) Сульфат калия
► Калий, сера и кислород
9000 4 6.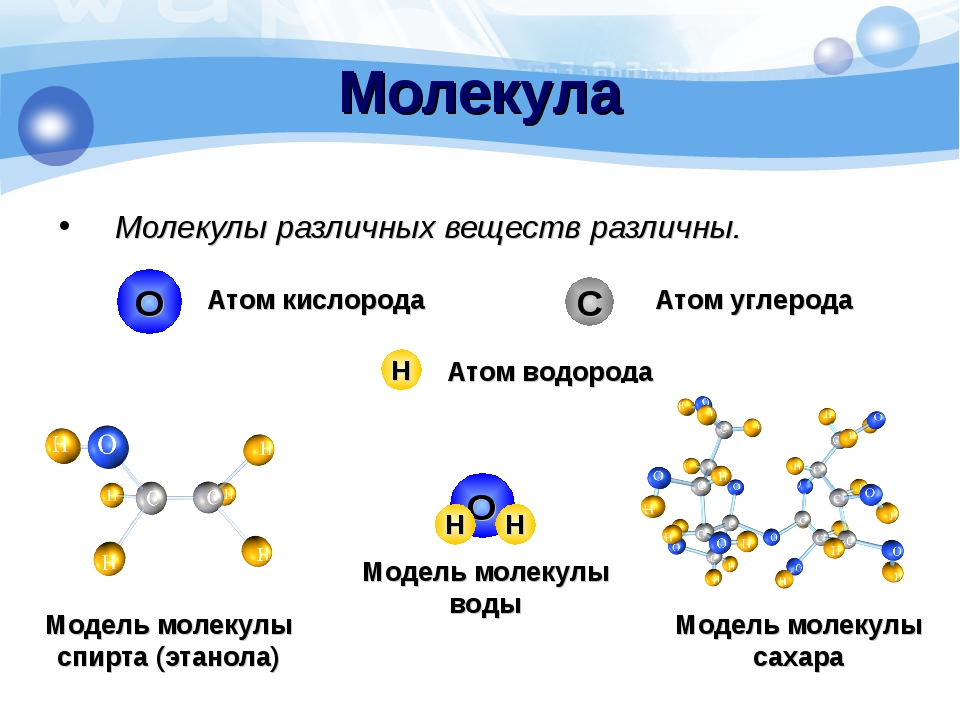 Рассчитайте молярную массу следующих веществ:
Рассчитайте молярную массу следующих веществ:
(a) Этин, C 2 H 2
► Молярная масса этина, C 2 H 2 901 41 = 2×12 + 2×1 = 26 г
(b) Молекула серы, S 8
►Молярная масса молекулы серы, S 8 = 8×32 = 256 г
(c) Молекула фосфора, P 4 (атомная масса фосфора = 31)
► Молярная масса молекулы фосфора, P 4 = 4 × 31 = 12 4 г
(d) Соляная кислота, HCl
► Молярная масса соляной кислоты, HCl = 1 + 35,5 = 36,5 г
(e) Азотная кислота, HNO 3
► Молярная масса азотной кислоты, HNO 3 = 1 + 14 + 3×16 = 63 г
7. Какова масса-
(a) 1 моль атомов азота?
(b) 4 моля атомов алюминия (Атомная масса алюминия = 27)?
(c) 10 моль сульфита натрия (Na 2 SO 3 )?
Ответ
(а) Масса 1 моля атомов азота равна 14 г.
(б) Масса 4 молей атомов алюминия равна (4 × 27) г = 108 г
(в) Масса 10 молей сульфита натрия (Na 2 SO 3 ) равна
10 × [2×23 + 32 + 3×16] г = 1 0×126 г = 1260 г
8. Перевести в моль.
Перевести в моль.
(a) 12 г газообразного кислорода
(b) 20 г воды
(c) 22 г углекислого газа
Ответ
(a) 32 г газообразного кислорода = 1 моль кислород = 12/32 моль = 0,375 моль
(b) 18 г воды = 1 моль
Тогда 20 г воды = 20/18 моль = 1,111 моль
(c) 44 г диоксида углерода = 1 моль
Тогда 22 г диоксида углерода = 22/4 4 моля = 0,5 моля
9. Какова масса:
(а) 0,2 моля атомов кислорода?
(б) 0,5 моль молекул воды?
Ответ
(a) Масса одного моля атомов кислорода = 16 г
Тогда масса 0,2 моля атомов кислорода = 0,2 × 16 г = 3,2 г
(b) Масса одного моля молекулы воды = 18 г
Тогда масса 0,5 моль молекул воды = 0,5 × 18 г = 9 г
10. Рассчитайте количество молекул серы (S 8 ), присутствующих в 16 г твердой серы.
Ответить
1 моль твердой серы (S 8 ) = 8 × 32 г = 256 г
т. е. в 256 г твердой серы содержится = 6,022 × 10 23 молекул
Тогда в 16 г твердой серы содержится = 6,022 × 10 23 / 2 56 = 16 молекул
= 3,76375 × 10 22 молекул
11. Рассчитайте количество ионов алюминия, присутствующих в 0,051 г оксида алюминия.
Рассчитайте количество ионов алюминия, присутствующих в 0,051 г оксида алюминия.
(Подсказка: масса иона равна массе атома того же элемента. Атомная масса Al = 27 ед.)
Ответ
Моль оксида алюминия (Al 2 O 3 ) = 2×27 + 3×16 = 102 г
, т. е. 102 г Al 2 O 3 = 6,022 × 10 9 0249 23 молекул Al 2 O 3
Тогда 0,051 г Al 2 O 3 содержит = 6,022 × 10 23 / 10 2 × 0,051 молекул
= 3,011 × 10 20 молекул Al 2 O 3
Количество ионов алюминия (Al 3+ ), присутствующих в одной молекуле оксида алюминия, равно 2
Следовательно, количество ионов алюминия (Al 3+ ), присутствующих в 3,011 × 10 20 молекул (0,051 г) оксида алюминия (Al 2 O 3 ) = 2 × 3,011 × 10 20
= 6,022 × 10 20
Вернуться к NCERT Solutions for Class 9 Science 9000 7
Глава 3 Атомы и молекулы Решения NCERT для класса 9 Наука
Глава 3 Атомы и молекулы Класс 9Решения Science NCERT резко улучшат ваши навыки осознания, и вы сможете легко запоминать больше вещей точно.

 В ходе некоторых упражнений ведущему приходится выполнять роль игрока, что дает ему преимущество общения «на равных» с подростками.
В ходе некоторых упражнений ведущему приходится выполнять роль игрока, что дает ему преимущество общения «на равных» с подростками.
 00. 13 психология развития, акмеология
00. 13 психология развития, акмеология