Амг после лапароскопии: Послеоперационное снижение АМГ не связано со снижением фертильности в течение двух лет после операции по поводу кист яичников
Послеоперационное снижение АМГ не связано со снижением фертильности в течение двух лет после операции по поводу кист яичников
HEALTH OF WOMAN. 2016.7(113):147–151
Послеоперационное снижение АМГ не связано со снижением фертильности в течение двух лет после операции по поводу кист яичников
Tekla Lind, Claudia Lampic, Jan I. Olofsson, Kenny A. Rodriguez-Wallberg
Department of Oncology-Pathology, KarolinskaInstitutet, Stockholm, Sweden
Department of Obstetrics and Gynecology, So ̈dersjukhuset, Stockholm, Sweden
Department of Neurobiology, Care Sciences and Society, KarolinskaInstitutet, Stockholm, Sweden
Division of Obstetrics/ Gynecology, Department of Clinical Science, Intervention and Technology, KarolinskaInstitutet, Stockholm, Sweden
Division of Reproductive Medicine, Department of Obstetrics and Gynecology, Karolinska University, Stockholm, Sweden
Gynecol Endocrinol, Early Online: 1–4. Перевод – С.А. Шурпяк
Перевод – С.А. Шурпяк
В проспективном исследовании мы исследовали влияние изменений концентрации антимюллерова гормона (АМГ) после операций по поводу кист яичников на вероятность наступления беременности и рождения живого ребенка. Женщины репродуктивного возраста (N=60) были включены в исследование до оперативного лечения доброкачественных кист яичников. Концентрации АМГ в сыворотке крови определяли до и после операции через 6 и 24 мес. Информацию о желании и попытках забеременеть получали с помощью опросника. В момент включения 45/60 женщин сообщили о желании забеременеть. На шестом месяце наблюдения уровни АМГ значительно снизились во всей группе, дальнейшее снижение наблюдалось на протяжении двух лет (от 2,7 мг/л до 2,0 мг/л и до 1,1 мг/л соответственно; р<0,008) при процентном уменьшении 42,9%. В период двухлетнего наблюдения 36 женщин сообщили, что пытались зачать, и 18 из них достигли беременности (50%) с рождением живого ребенка у 33%. Процентное изменение в концентрации АМГ за два года существенно не отличалось между женщинами, которые забеременели, и теми, кто не забеременел (р=0,117). Данные, представленные в настоящем исследовании, показывают, что снижение уровня АМГ после операций по поводу кист яичников сохраняется через два года после операции. Однако это послеоперационное снижение уровня АМГ не уменьшает шансов женщины беременеть.
Данные, представленные в настоящем исследовании, показывают, что снижение уровня АМГ после операций по поводу кист яичников сохраняется через два года после операции. Однако это послеоперационное снижение уровня АМГ не уменьшает шансов женщины беременеть.
Ключевые слова: АМГ, цистэктомия, частота рождения живых детей, овариальный резерв, хирургическое лечение кист яичников, исход беременности.
Литература:
1. Kwon SK, Kim SH, Yun SC, et al. Decline of serum antimullerian hormone levels after laparoscopic ovarian cystectomy in endome- trioma and other benign cysts: a prospective cohort study. FertilSteril 2014;101:435–41. http://dx.doi.org/10.1016/j.fertnstert.2013.10.043; PMid:24290000
2. Uncu G, Kasapoglu I, Ozerkan K, et al. Prospective assessment of the impact of endometriomas and their removal on ovarian reserve and determinants of the rate of decline in ovarian reserve. Hum Reprod 2013;28:2140–5. http://dx.doi.org/10.1093/humrep/det123; PMid:23624580
3. Somigliana E, Berlanda N, Benaglia L, et al. Surgical excision of endometriomas and ovarian reserve: a systematic review on serum antimu ?llerian hormone level modifications. FertilSteril 2012;98: 1531–8. http://dx.doi.org/10.1016/j.fertnstert.2012.08.009
Somigliana E, Berlanda N, Benaglia L, et al. Surgical excision of endometriomas and ovarian reserve: a systematic review on serum antimu ?llerian hormone level modifications. FertilSteril 2012;98: 1531–8. http://dx.doi.org/10.1016/j.fertnstert.2012.08.009
4. Raffi F, Metwally M, Amer S. The impact of excision of ovarian endometrioma on ovarian reserve: a systematic review and meta- analysis. J ClinEndocrinolMetab 2012;97:3146–54. http://dx.doi.org/10.1210/jc.2012-1558; PMid:22723324
5. Iwase A, Hirokawa W, Goto M, et al. The post-operative decline in serum anti-Mullerian hormone correlates with the bilaterality and severity of endometriosis. Hum Reprod 2011;26:904–10. http://dx.doi.org/10.1093/humrep/der006; PMid:21292639
6. Lind T, Hammarstrom M, Lampic C, Rodriguez-Wallberg K. AMH reduction after ovarian cyst surgery is dependent on the histological cyst type and pre-operative AMH levels. ActaObstetGynecolScand 2015;94:183–90. http://dx.doi.org/10.1111/aogs. 12526; PMid:25287421
12526; PMid:25287421
7. Kalampokas T, Kamath MS, Kalampokas E. AMH after laparo- scopic surgery of the ovaries: a review. GynecolEndocrinol 2013; 29:408–11. http://dx.doi.org/10.3109/09513590.2012.754877; PMid:23452339
8. Moscarini M, Milazzo GN, Assorgi C, et al. Ovarian stripping versus cystectomy: recurrence of endometriosis and pregnancy rate. Arch GynecolObstet 2014;290:163–7. http://dx.doi.org/10.1007/s00404-014-3158-z
9. Carmona F, Martinez-Zamora MA, Rabanal A, et al. Ovarian cystectomy versus laser vaporization in the treatment of ovarian endometriomas: a randomized clinical trial with a five-year follow- up. FertilSteril 2011;96:251–4. http://dx.doi.org/10.1016/j.fertnstert.2011.04.068
10. Lind T, Lampic C, Hammarstrom M, Rodriguez-Wallberg K. Young women’s perceptions of fertility-related information and fertility distress before surgery for ovarian cysts. ActaObstetGynecolScand 2013;92:1290–6. http://dx.doi.org/10.1111/aogs.12228
11. Armuand GM, Rodriguez-Wallberg KA, Wettergren L, et al. Sex differences in fertility-related information received by young adult cancer survivors. J ClinOncol 2012;30:2147–53. http://dx.doi.org/10.1200/JCO.2011.40.6470; PMid:22585695
Armuand GM, Rodriguez-Wallberg KA, Wettergren L, et al. Sex differences in fertility-related information received by young adult cancer survivors. J ClinOncol 2012;30:2147–53. http://dx.doi.org/10.1200/JCO.2011.40.6470; PMid:22585695
12. Asante A, Whiteman MK, Kulkarni A, et al. Elective oophorectomy in the United States: trends and in-hospital complications, 1998- 2006. ObstetGynecol 2010;116:1088–95. http://dx.doi.org/10.1097/aog.0b013e3181f5ec9d
13. Statistical database, Operationerislutenva ?rd. Operations in inpatient care. [Internet]. 2015. Available from: http://www.socialstyrelsen.se/ statistik/statistikdatabas/operationerislutenvard, [last accessed 30 Dec 2015].
14. Lee MM, Donahoe PK, Hasegawa T, et al. Mullerian inhibiting substance in humans: normal levels from infancy to adulthood. J ClinEndocrinolMetab 1996;81:571–6. http://dx.doi.org/10.1210/jcem.81.2.8636269; http://dx.doi.org/10.1210/jc.81.2.571
15. Bentzen JG, Forman JL, Johannsen TH, et al. Ovarian antral follicle subclasses and anti-mullerian hormone during normal reproductive aging. J ClinEndocrinolMetab 2013;98:1602–11. http://dx.doi.org/10.1210/jc.2012-1829; PMid:23463653
Ovarian antral follicle subclasses and anti-mullerian hormone during normal reproductive aging. J ClinEndocrinolMetab 2013;98:1602–11. http://dx.doi.org/10.1210/jc.2012-1829; PMid:23463653
16. La Marca A, Spada E, Grisendi V, et al. Normal serum anti- Mullerian hormone levels in the general female population and the relationship with reproductive history. Eur J ObstetGynecolReprodBiol 2012;163:180–4. http://dx.doi.org/10.1016/j.ejogrb.2012.04.013
17. Shao MJ, Hu M, He YQ, Xu XJ. AMH trend after laparoscopic cystectomy and ovarian suturing in patients with endometriomas. Arch GynecolObstet 2015. [Epub ahead of print]. DOI: 10.1007/ s00404-015-3926-4.
18. Lee HJ, Lee JE, Ku SY, et al. Natural conception rate following laparoscopic surgery in infertile women with endometriosis. ClinExpReprod Med 2013;40:29–32. http://dx.doi.org/10.5653/cerm.2013.40.1.29
19. Rizk B, Turki R, Lotfy H, et al. Surgery for endometriosis- associated infertility: do we exaggerate the magnitude of effect? Facts Views Vis Obgyn 2015;7:109–18. PMCid:PMC4498168
PMCid:PMC4498168
20. Vercellini P, Somigliana E, Vigano P, et al. Surgery for endomet- riosis-associated infertility: a pragmatic approach. Hum Reprod 2009;24:254–69. http://dx.doi.org/10.1093/humrep/den379; PMid:18948311
21. Pados G, Venetis CA, Almaloglou K, Tarlatzis BC. Prevention of intra-peritoneal adhesions in gynaecological surgery: theory and evidence. Reprod Biomed Online 2010;21:290–303. http://dx.doi.org/10.1016/j.rbmo.2010.04.021; PMid:20688570
22. Lower AM, Hawthorn RJ, Clark D, et al. Adhesion-related readmissions following gynaecological laparoscopy or laparotomy in Scotland: an epidemiological study of 24 046 patients. Hum Reprod 2004;19:1877–85. http://dx.doi.org/10.1093/humrep/deh421; PMid:15178659
Сохранение овариального резерва у больных эндометриозом
Потенциал функции яичников, отражающий количество и качество фолликулов в яичниках в данный момент, обозначается термином «овариальный резерв» [1]. Понятие «овариальный резерв» напрямую относится к женской фертильности, поэтому все технологии, способные нарушить, восстановить или сохранить способность пациентки к зачатию, рассматриваются с позиций влияния на овариальный резерв.
Овариальный резерв оценивается по нескольким маркерам, наиболее информативным из которых признается антимюллеров гормон (АМГ) [2, 3]. В постнатальной жизни АМГ продуцируется клетками гранулезы яичников, причем максимально интенсивно он производится преантральными и малыми антральными фолликулами и практически не синтезируется на финальных стадиях фолликулогенеза [4]. АМГ теснее связан с числом антральных фолликулов, которое подсчитывается при ультразвуковом исследовании, чем фолликулостимулирующий гормон или ингибин-В [5, 6]. Одним из преимуществ уровня АМГ плазмы крови является его низкая вариабельность от цикла к циклу, чем он отличается от других маркеров [7], несмотря на легкие изменения на протяжении каждого менструального цикла [8]. Благодаря этим особенностям определение уровня АМГ в плазме крови используется для оценки повреждений яичников при хирургических вмешательствах, а также прогноза исходов применения программ вспомогательных репродуктивных технологий (ВРТ) [5, 9-11]. На протяжении биологической репродуктивной жизни женщины уровень АМГ в плазме крови снижается очень медленно и доходит до неопределяемых значений за 5 лет до менопаузы [12], что позволяет использовать его как суррогатный маркер овариального резерва и предиктор преждевременной недостаточности яичников (ПНЯ) [13].
На протяжении биологической репродуктивной жизни женщины уровень АМГ в плазме крови снижается очень медленно и доходит до неопределяемых значений за 5 лет до менопаузы [12], что позволяет использовать его как суррогатный маркер овариального резерва и предиктор преждевременной недостаточности яичников (ПНЯ) [13].
Не только возраст, но и другие обстоятельства способны оказать влияние на функциональный потенциал яичников. Воспалительные заболевания органов малого таза, эндометриоз, субклинические токсические воздействия, лекарственные и хирургические вмешательства, наконец, генетическая предрасположенность — все это определяет растущую распространенность ПНЯ среди современных женщин.
Хирургические вмешательства на репродуктивных органах малого таза могут нарушить функцию яичников как из-за потери овариальной коры, так и в результате повреждающего воздействия на кровоток [14]. Парадокс состоит в том, что целью операций часто является восстановление фертильности при заболеваниях, ассоциированных с бесплодием. Наиболее ярким примером подобного нежелательного исхода является эндометриоз, особенно эндометриома яичников.
Наиболее ярким примером подобного нежелательного исхода является эндометриоз, особенно эндометриома яичников.
Актуальность проблемы снижения фертильности при эндометриозе дала импульс к проведению многочисленных исследований по оценке овариального резерва. Результаты этих исследований неоднозначны. Согласно некоторым из них, даже минимальный/умеренный эндометриоз I-II стадии по классификации ASRM связан с достоверным снижением уровня АМГ у бесплодных женщин по сравнению с женщинами, имеющими трубно-перитонеальную причину бесплодия [15]. У пациенток с эндометриомами уровень АМГ был существенно ниже, чем у сравнимых по возрасту и антропометрическим показателям женщин, оперированных по поводу тератомы [16]. Аналогичные показатели были получены при сравнении показателя у женщин с тяжелым эндометриозом (III-IV стадия по ASRM) и здоровых фертильных женщин того же возраста в исследовании случай-контроль [17]. По данным других авторов [18], отмечено снижение содержания АМГ у больных с эндометриомами по сравнению со здоровыми женщинами. Однако крупное поперечное исследование, включившее 313 женщин с диагностированным эндометриозом и 413 женщин без эндометриоза (контроль), выявило достоверные различия в уровне АМГ только в группе женщин, перенесших операцию по поводу эндометриоидных кист яичников [19].
Однако крупное поперечное исследование, включившее 313 женщин с диагностированным эндометриозом и 413 женщин без эндометриоза (контроль), выявило достоверные различия в уровне АМГ только в группе женщин, перенесших операцию по поводу эндометриоидных кист яичников [19].
По-видимому, эндометриомы представляют особую опасность для овариального резерва. Яичниковая кора, окружающая кисту и составляющая ее стенку, отличается от здоровой ткани низкой плотностью фолликулов и потерей кортикоспецифичной стромы [20, 21]. По качеству этой условной стенки кисты можно опосредованно судить об активности эндометриоидного процесса. Показано, что через 3 мес после операции уровень АМГ достоверно выше у тех женщин, стенка кисты которых содержала здоровую овариальную ткань, по сравнению с пациентками, у которых такой ткани не обнаруживалось [22].
Таким образом, на сегодня можно считать признанным, что эндометриоз способен негативно влиять на овариальный резерв, в большей степени это характеризует эндометриомы, но прогностические маркеры неблагоприятных исходов эндометриоза в отношении овариального резерва нам пока не известны.
В отличие от противоречивых результатов оценки влияния эндометриоза на овариальный резерв двух мнений относительно эффекта удаления эндометриом не существует. Установлено, что цистэктомия эндометриомы приводит к большему снижению уровня АМГ в плазме крови, чем удаление других доброкачественных опухолей [23, 24]. Среди многочисленных исследований [25, 26] только одно, в котором исходный уровень АМГ был ниже, чем в аналогичных испытаниях, не продемонстрировало снижения концентрации гормона после операции. Итоговые метаанализы исследований, посвященные результатам хирургического лечения эндометриом, показали, что цистэктомия, действительно, редуцирует овариальный резерв у больных эндометриозом [27, 28], что подтверждают данные недавнего поперечного контролируемого исследования [19].
Измерение содержания АМГ в сыворотке крови сделало возможным осуществить количественную оценку хирургического вмешательства на яичниках и сформировать несколько проблемных вопросов для обсуждения. Первый из них связан с частотой и факторами риска послеоперационного снижения овариального резерва. Вероятно, лапароскопическая цистэктомия двусторонних эндометриом вызывает более выраженное снижение уровня АМГ, чем односторонняя цистэктомия [23, 24]. Через месяц после операции относительное снижение показателя АМГ от исходного уровня было достоверно более значимым у пациенток, перенесших билатеральную цистэктомию, и коррелировало также со стадией эндометриоза по ASRM [29]. Авторы исследования, длившегося в течение года, связали немедленное послеоперационное снижение уровня АМГ с потерей объема коры после эксцизии, а долговременное уменьшение — с другими факторами, включая редукцию овариального кровотока [30]. Наконец, в исследовании, включившем 193 пациентки, перенесших лапароскопическую цистэктомию по поводу эндометриомы, было продемонстрировано снижение уровня АМГ после операции вне зависимости от возраста пациентки, размеров кист и наличия одностороннего или двустороннего поражения [31].
Первый из них связан с частотой и факторами риска послеоперационного снижения овариального резерва. Вероятно, лапароскопическая цистэктомия двусторонних эндометриом вызывает более выраженное снижение уровня АМГ, чем односторонняя цистэктомия [23, 24]. Через месяц после операции относительное снижение показателя АМГ от исходного уровня было достоверно более значимым у пациенток, перенесших билатеральную цистэктомию, и коррелировало также со стадией эндометриоза по ASRM [29]. Авторы исследования, длившегося в течение года, связали немедленное послеоперационное снижение уровня АМГ с потерей объема коры после эксцизии, а долговременное уменьшение — с другими факторами, включая редукцию овариального кровотока [30]. Наконец, в исследовании, включившем 193 пациентки, перенесших лапароскопическую цистэктомию по поводу эндометриомы, было продемонстрировано снижение уровня АМГ после операции вне зависимости от возраста пациентки, размеров кист и наличия одностороннего или двустороннего поражения [31].
Еще одним проблемным вопросом является определение роли примененной хирургической техники в нанесении ущерба яичникам. Каутеризация и вапоризация стенки кисты могут иметь преимущества в сбережении овариального резерва [14], так же как и включение в комплекс лечебных мероприятий гормональных препаратов. В одном из исследований наблюдались лучшие исходы по уровню АМГ при использовании трехэтапного ведения больных с применением ирригации во время первой лапароскопии, последующим назначением аналогов гонадолиберина (ГнРГ) и вапоризации кисты во время второй лапароскопии по сравнению с одномоментным удалением кисты с помощью стрипинга [32]. Биполярная электрокоагуляция может повредить кору яичников, но не все рандомизированные контролируемые исследования (РКИ) подтверждают эту гипотезу. Так, в сравнительном РКИ применение биполярной коагуляции с целью гемостаза сопровождалось примерно тем же снижением уровня АМГ через 3, 6 и 12 мес после лапароскопической цистэктомии двусторонних эндометриом, как и при наложении швов [33].![]() В другом РКИ, сравнивавшем эффекты биполярной коагуляции и гемостатической матрицы при односторонней цистэктомии [34], обнаружено, что через месяц после операции уровень АМГ существенно снижался в группе женщин, перенесших биполярную коагуляцию, но через 3 мес различия между группами исчезали. Напротив, при сравнении в РКИ исходов лапароскопической цистэктомии с биполярной коагуляцией и лапаротомической цистэктомии с ушиванием яичника уровень АМГ был достоверно ниже в группе «лапароскопия + биполярная коагуляция» через 6, 12 и 18 мес наблюдения при одинаковых исходных данных [35].
В другом РКИ, сравнивавшем эффекты биполярной коагуляции и гемостатической матрицы при односторонней цистэктомии [34], обнаружено, что через месяц после операции уровень АМГ существенно снижался в группе женщин, перенесших биполярную коагуляцию, но через 3 мес различия между группами исчезали. Напротив, при сравнении в РКИ исходов лапароскопической цистэктомии с биполярной коагуляцией и лапаротомической цистэктомии с ушиванием яичника уровень АМГ был достоверно ниже в группе «лапароскопия + биполярная коагуляция» через 6, 12 и 18 мес наблюдения при одинаковых исходных данных [35].
Рассматривая вопросы сохранения овариального резерва, надо понимать, что уровень АМГ отражает не число фолликулов в яичнике, т. е. не истинный их запас, а количество и качество когорты, вступившей в фолликулогенез. Если отбор когорты происходит из здоровых примордиальных фолликулов, то уровень АМГ, снизившийся после хирургического вмешательства, может восстановиться. В ряде РКИ рост содержания АМГ в сыворотке крови наблюдался через неделю, 1 и 3 мес после операции [23, 34, 36].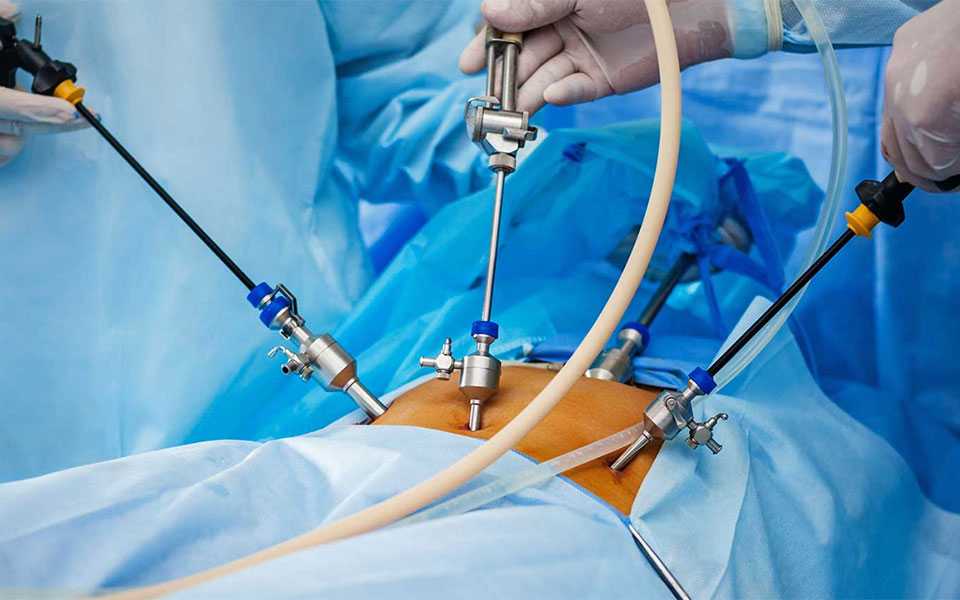 Но, в противоположность этим наблюдениям, другие авторы отмечают постепенное снижение или сохранение стабильно сниженного уровня АМГ после хирургического вмешательства [18, 33, 37, 38]. В одной из работ отмечено, что уровень АМГ в сыворотке крови после хирургического вмешательства постепенно снижается у пациенток с билатеральными эндометриомами в случаях исходного размера кист, равного или превышающего 5 см [37]. Можно прогнозировать снижение уровня АМГ в ближайшие сроки после операции по поводу эндометриом. В течение года содержание АМГ в сыворотке крови может восстановиться или не восстановиться [30], но однозначно предсказать динамику этого процесса сегодня не представляется возможным.
Но, в противоположность этим наблюдениям, другие авторы отмечают постепенное снижение или сохранение стабильно сниженного уровня АМГ после хирургического вмешательства [18, 33, 37, 38]. В одной из работ отмечено, что уровень АМГ в сыворотке крови после хирургического вмешательства постепенно снижается у пациенток с билатеральными эндометриомами в случаях исходного размера кист, равного или превышающего 5 см [37]. Можно прогнозировать снижение уровня АМГ в ближайшие сроки после операции по поводу эндометриом. В течение года содержание АМГ в сыворотке крови может восстановиться или не восстановиться [30], но однозначно предсказать динамику этого процесса сегодня не представляется возможным.
Измерение уровня АМГ в практике ведения больных эндометриозом имеет ту же цель, что в других областях гинекологии, — оценить овариальный резерв для прогнозирования фертильности, исходов ВРТ и возможных негативных последствий медицинских вмешательств в виде наступления преждевременной недостаточности яичников [39-41]. Но прогнозирование не может являться самоцелью, гораздо более важно найти способы сохранить овариальный резерв, подвергающийся агрессивным воздействиям болезни или лечения.
Но прогнозирование не может являться самоцелью, гораздо более важно найти способы сохранить овариальный резерв, подвергающийся агрессивным воздействиям болезни или лечения.
Поиск способов защиты овариального резерва начался в областях онкологии и терапии. Известно, что лечение злокачественных или тяжелых аутоиммунных заболеваний у большого числа пациенток приводит к ПНЯ, клинически выражающейся в необратимой аменорее и бесплодии. Риск ПНЯ зависит от кумулятивного действия химиопрепарата и возраста женщины к началу лечения и ассоциирован с гибелью фолликулярного аппарата яичников и истощением овариального резерва [42, 43]. Каждый месяц химиотерапии уменьшает продолжительность репродуктивного периода жизни женщины, в среднем, на 1,5 года [44], с вариациями, зависящими от возраста пациентки и вида химиотерапии. Химиотерапия рака молочной железы связана с длительной аменореей не менее чем у 40% больных. У женщин 35-40 лет частота преждевременной менопаузы достигает 50%, а ранняя менопауза после 40 лет наступает у 85% пациенток [45]. Преждевременная/ранняя менопауза приводит к возникновению вазомоторных, психовегетативных симптомов, сексуальной дисфункции, значительно ухудшая качество жизни пациенток и становясь причиной тяжелого психологического дистресса [46, 47]. Сохранение овариальной функции у данной категории больных является одной из актуальнейших проблем по причине как сохранения фертильности, так и уменьшения риска развития симптомов эстрогенного дефицита [48].
Преждевременная/ранняя менопауза приводит к возникновению вазомоторных, психовегетативных симптомов, сексуальной дисфункции, значительно ухудшая качество жизни пациенток и становясь причиной тяжелого психологического дистресса [46, 47]. Сохранение овариальной функции у данной категории больных является одной из актуальнейших проблем по причине как сохранения фертильности, так и уменьшения риска развития симптомов эстрогенного дефицита [48].
Одной из стратегий сохранения овариального резерва у больных, страдающих онкологическими или тяжелыми аутоиммунными заболеваниями, является применение аналогов ГнРГ. Эта группа препаратов уже более 10 лет используется с целью предохранения яичников у женщин, получающих химиотерапию [49-53]. В метаанализе, включившем 7 контролируемых исследований (320 пациенток), установлено, что использование аналогов ГнРГ во время химиотерапии достоверно связано с сохранением овариальной функции (относительный риск — ОР 1,7; 95% доверительный интервал — ДИ 1,4-2,2) [55]. Недавний метаанализ, включивший уже 11 РКИ (1062 пациентки), продемонстрировал существенно более высокую частоту восстановления спонтанных менструаций у женщин, применявших аналоги ГнРГ, по сравнению с пациентками, получавшими только химиотерапию (отношение шансов — ОШ 2,57; 95% ДИ 1,65-4,01) [56]. В контролируемых испытаниях, включавших группы женщин с аутоиммунными заболеваниями (например, системная красная волчанка) при использовании химиопрепарата в сравнении с химиопрепаратом + аналоги ГнРГ, агонисты показали достоверно лучшие результаты по сохранению овариальной функции (достоверно более высокий уровень АМГ). И хотя эта протекция не была полной — уровень АМГ снижался по сравнению с пациентками, не получавшими химиолечение [57], авторы исследований считают применение аналогов ГнРГ у молодых женщин, получающих химиотерапию, целесообразным и обоснованным.
Недавний метаанализ, включивший уже 11 РКИ (1062 пациентки), продемонстрировал существенно более высокую частоту восстановления спонтанных менструаций у женщин, применявших аналоги ГнРГ, по сравнению с пациентками, получавшими только химиотерапию (отношение шансов — ОШ 2,57; 95% ДИ 1,65-4,01) [56]. В контролируемых испытаниях, включавших группы женщин с аутоиммунными заболеваниями (например, системная красная волчанка) при использовании химиопрепарата в сравнении с химиопрепаратом + аналоги ГнРГ, агонисты показали достоверно лучшие результаты по сохранению овариальной функции (достоверно более высокий уровень АМГ). И хотя эта протекция не была полной — уровень АМГ снижался по сравнению с пациентками, не получавшими химиолечение [57], авторы исследований считают применение аналогов ГнРГ у молодых женщин, получающих химиотерапию, целесообразным и обоснованным.
Механизмы, благодаря которым аналоги ГнРГ способны сохранять овариальный резерв: прекращение секреции ФСГ, снижение маточно-яичниковой перфузии, активация рецепторов гонадолиберина, up-регуляция внутрияичниковых антиапоптических молекул, таких как сфингозин-l-фосфат, и протекция недифференцированных стволовых клеток [58]. Предполагается, что агонисты могут действовать на растущий пул фолликулов на гонадотропиннезависимых стадиях, о чем свидетельствуют не ассоциированные с уровнями гонадотропинов, ингибина В и эстрадиола колебания содержания АМГ после введения аналогов ГнРГ [59]. Именно эти колебания уровня АМГ стали поводом для опасений в отношении снижения овариального резерва при использовании аналогов ГнРГ при эндометриозе.
Предполагается, что агонисты могут действовать на растущий пул фолликулов на гонадотропиннезависимых стадиях, о чем свидетельствуют не ассоциированные с уровнями гонадотропинов, ингибина В и эстрадиола колебания содержания АМГ после введения аналогов ГнРГ [59]. Именно эти колебания уровня АМГ стали поводом для опасений в отношении снижения овариального резерва при использовании аналогов ГнРГ при эндометриозе.
Как бы не парадоксально звучало это опасение в свете имеющихся данных по профилактике повреждения овариального резерва с помощью аналогов ГнРГ, влияние этой группы препаратов на овариальный резерв требует обсуждения. К сожалению, нынешний уровень знаний не позволяет понять механизмы, посредством которых секреция АМГ связана с гонадолиберином и его агонистами, можно только предполагать, что они реализуются через факторы аутокринной и паракринной регуляции на уровне самого яичника. Известно, что аналоги ГнРГ, связываясь со специфическими рецепторами I и II типов, оказывают значительное тканевое действие на репродуктивные органы, в том числе яичники [60]. Применение этих препаратов снижает уровень белка мидкайна — фактора роста, участвующего в процессе овуляции и связанного с ангиогенезом, хемотаксисом, митотической активностью, воспалением, избыточная экспрессия которого в фолликулярной и перитонеальной жидкостях обнаружена у больных наружным генитальным эндометриозом [61, 62]. Эффективность аналогов ГнРГ связывают также с уменьшением чувствительности тканей к тромбину, участвующему в воспалительной, пролиферативной и гемостатической реакциях [63], снижением экспрессии сосудистого эндотелиального фактора роста [64] и др. Существенные изменения в экспрессии разнообразных ростовых факторов, бесспорно, должны отразиться на секреции АМГ, который и сам является представителем семейства трансформирующего фактора роста β. Взаимоотношения между ростовыми факторами, как и функции АМГ, плохо изучены, но принимая во внимание их существование, можно легко разрешить диссонанс в представлениях о действии аналогов ГнРГ на секрецию АМГ и овариальный резерв: временное снижение секреции АМГ при использовании аналогов ГнРГ отражает не гибель преантральных и малых антральных фолликулов (путь к ПНЯ), а уменьшение их гормональной активности (путь к сохранению овариального резерва).
Применение этих препаратов снижает уровень белка мидкайна — фактора роста, участвующего в процессе овуляции и связанного с ангиогенезом, хемотаксисом, митотической активностью, воспалением, избыточная экспрессия которого в фолликулярной и перитонеальной жидкостях обнаружена у больных наружным генитальным эндометриозом [61, 62]. Эффективность аналогов ГнРГ связывают также с уменьшением чувствительности тканей к тромбину, участвующему в воспалительной, пролиферативной и гемостатической реакциях [63], снижением экспрессии сосудистого эндотелиального фактора роста [64] и др. Существенные изменения в экспрессии разнообразных ростовых факторов, бесспорно, должны отразиться на секреции АМГ, который и сам является представителем семейства трансформирующего фактора роста β. Взаимоотношения между ростовыми факторами, как и функции АМГ, плохо изучены, но принимая во внимание их существование, можно легко разрешить диссонанс в представлениях о действии аналогов ГнРГ на секрецию АМГ и овариальный резерв: временное снижение секреции АМГ при использовании аналогов ГнРГ отражает не гибель преантральных и малых антральных фолликулов (путь к ПНЯ), а уменьшение их гормональной активности (путь к сохранению овариального резерва).
В контексте «оздоравливающего» действия аналогов ГнРГ на яичники и улучшения рецептивности эндометрия становится понятной концепция применения от 3 до 6 инъекций этих препаратов перед экстракорпоральным оплодотворением у пациенток с эндометриозом [65]. Но и вне связи с программами ВРТ применение аналогов ГнРГ у женщин, страдающих бесплодием, ассоциированным с эндометриозом, является вполне обоснованным. Это подтверждается исследованием, продемонстрировавшим лучшие исходы хирургического лечения с применением предоперационного введения аналогов ГнРГ [32], а также исследованием, в процессе которого оценивалась частота наступления беременности после удаления эндометриом у женщин, применявших и не применявших аналоги ГнРГ на втором этапе лечения [66]. Постоперационная терапия в виде 6 инъекций аналога ГнРГ продемонстрировала достоверно лучший результат по таким показателям, как сохранение дооперационного уровня ФСГ (95,3% женщин группы исследования по сравнению с 82,2% женщин группы контроля) и частота рецидивов эндометриоза (12,5 и 24,7% соответственно) при последующем наблюдении. Главным результатом исследования стал достоверно более высокий (57,1) процент наступления беременности у женщин, получивших после операции терапию аналогом ГнРГ, по сравнению с пациентками, лечение которых ограничилось только операцией (36,8%).
Главным результатом исследования стал достоверно более высокий (57,1) процент наступления беременности у женщин, получивших после операции терапию аналогом ГнРГ, по сравнению с пациентками, лечение которых ограничилось только операцией (36,8%).
Аналоги ГнРГ представлены большой группой препаратов, эквивалентных по своей эффективности [67]. В частности, бусерелин в дозе 3,75 мг (Бусерелин Депо) широко используется в программах ВРТ [68] и лечении эндометриоза [69]. Накопленные на сегодня данные свидетельствуют о положительном влиянии всех представителей группы аналогов ГнРГ на овариальный резерв, в том числе у пациенток с эндометриозом, подвергающихся риску ПНЯ после операций на яичниках. Разумное использование аналогов ГнРГ у больных эндометриозом, планирующих деторождение, позволит снизить риск бесплодия и неудач программ ВРТ.
Конфликт
интересов
отсутствует
.
Влияние хирургического лечения эндометриомы на уровень АМГ и частоту наступления беременности: обзор последних публикаций
1. Verkauf B.S. Заболеваемость, симптомы и признаки эндометриоза у фертильных и бесплодных женщин. J. Fla. Med. доц. 1987; 74: 671–675. [PubMed] [Google Scholar]
Verkauf B.S. Заболеваемость, симптомы и признаки эндометриоза у фертильных и бесплодных женщин. J. Fla. Med. доц. 1987; 74: 671–675. [PubMed] [Google Scholar]
2. Chapron C., Vercellini P., Barakat H., Vieira M., Dubuisson J.-B. Лечение эндометриом яичников. Гум. Воспр. Обновлять. 2002; 8: 591–597. doi: 10.1093/humupd/8.6.591. [PubMed] [CrossRef] [Академия Google]
3. Юнис Дж.С., Шапсо Н., Флеминг Р., Бен-Шломо И., Ижаки И. Влияние односторонней и двусторонней эндометриоидной цистэктомии яичников на овариальный резерв: систематический обзор и метаанализ. Гум. Воспр. Обновлять. 2018;25:375–391. doi: 10.1093/humupd/dmy049. [PubMed] [CrossRef] [Google Scholar]
4. Hughesdon P.E. Строение эндометриальной кисты яичника. БЙОГ Интерн. Дж. Обст. Гинеколь. 1957; 64: 481–487. doi: 10.1111/j.1471-0528.1957.tb06276.x. [PubMed] [CrossRef] [Академия Google]
5. Brosens J.J., Puttemans P.J., Deprest J. Эндоскопическая локализация эндометриальных имплантатов в шоколадной кисте яичника. Плодородный. Стерильно. 1994;61:1034–1038. doi: 10.1016/S0015-0282(16)56752-1. [PubMed] [CrossRef] [Google Scholar]
Плодородный. Стерильно. 1994;61:1034–1038. doi: 10.1016/S0015-0282(16)56752-1. [PubMed] [CrossRef] [Google Scholar]
6. Nezhat F., Nezhat C., Allan C.J., A Metzger D., Sears D.L. Клиническая и гистологическая классификация эндометриом. Последствия для механизма патогенеза. Дж. Репрод. Мед. 1992; 37: 771–776. [PubMed] [Google Scholar]
7. Donnez J., Nisolle M., Gillet N., Smets M., Bassil S., Casanas-Roux F. Большие эндометриомы яичников. Гум. Воспр. 1996;11:641–645. doi: 10.1093/HUMREP/11.3.641. [PubMed] [CrossRef] [Google Scholar]
8. Саридоган Э., Беккер С.М., Феки А., Гримбизис Г.Ф., Хуммельшой Л., Кекштейн Дж., Нисолль М., Танос В., Ульрих У.А., Вермеулен Н. , и другие. Рекомендации по хирургическому лечению эндометриоза. Часть 1: Эндометриома яичников. Гинекол. Surg. 2017;14:27. doi: 10.1186/s10397-017-1029-x. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
9. Крэнни Р., Кондоус Г., Рид С. Обновленная информация о диагностике, хирургическом лечении и результатах фертильности у женщин с эндометриомой. Acta Obstet. Гинекол. Сканд. 2017;96: 633–643. doi: 10.1111/aogs.13114. [PubMed] [CrossRef] [Google Scholar]
Acta Obstet. Гинекол. Сканд. 2017;96: 633–643. doi: 10.1111/aogs.13114. [PubMed] [CrossRef] [Google Scholar]
10. Muzii L., Bianchi A., Bellati F., Cristi E., Pernice M., Zullo M.A., Angioli R., Panici P.B. Гистологический анализ эндометриом: что нужно знать хирургу. Плодородный. Стерильно. 2007; 87: 362–366. doi: 10.1016/j.fertnstert.2006.06.055. [PubMed] [CrossRef] [Google Scholar]
11. Donnez J., Lousse J.-C., Jadoul P., Donnez O., Squifflet J. Лапароскопическое лечение эндометриом с использованием комбинированной техники эксцизионной (цистэктомии) и абляционная хирургия. Плодородный. Стерильно. 2010;94:28–32. doi: 10.1016/j.fertnstert.2009.02.065. [PubMed] [CrossRef] [Google Scholar]
12. Джаяпракасан К., Беккер К., Миттал М., от имени Королевского колледжа акушеров и гинекологов Влияние хирургии эндометриом на фертильность. Научный доклад № 55. BJOG-AN Int. Дж. Обст. Гинеколь. 2017;125:e19–e28. дои: 10.1111/1471-0528.14834. [PubMed] [CrossRef] [Google Scholar]
13. Dunselman G.A.J., Vermeulen N., Becker C., Calhaz-Jorge C., D’Hooghe T., De Bie B., Heikinheimo O., Horne A.W., Kiesel Л., Нап А. и др. Руководство ESHRE: Ведение женщин с эндометриозом. Гум. Воспр. 2014;29: 400–412. doi: 10.1093/humrep/det457. [PubMed] [CrossRef] [Google Scholar]
Dunselman G.A.J., Vermeulen N., Becker C., Calhaz-Jorge C., D’Hooghe T., De Bie B., Heikinheimo O., Horne A.W., Kiesel Л., Нап А. и др. Руководство ESHRE: Ведение женщин с эндометриозом. Гум. Воспр. 2014;29: 400–412. doi: 10.1093/humrep/det457. [PubMed] [CrossRef] [Google Scholar]
14. Hart R., Hickey M., Maouris P., Buckett W. Эксцизионная хирургия в сравнении с абляционной хирургией при эндометриоме яичников. Кокрановская система баз данных. Ред. 2008; 16:CD004992. doi: 10.1002/14651858.CD004992.pub3. [PubMed] [CrossRef] [Google Scholar]
15. Практический комитет Американского общества репродуктивной медицины Эндометриоз и бесплодие: мнение комитета. Плодородный. Стерильно. 2012; 98: 591–598. doi: 10.1016/j.fertnstert.2012.05.031. [PubMed] [CrossRef] [Академия Google]
16. Ла Марка А., Джулини С., Тирелли А., Бертуччи Э., Марселла Т., Кселла С., Вольпе А. Измерение антимюллерова гормона в любой день менструального цикла точно предсказывает реакцию яичников при вспомогательной терапии. репродуктивная технология. Гум. Воспр. 2007; 22: 766–771. doi: 10.1093/humrep/del421. [PubMed] [CrossRef] [Google Scholar]
репродуктивная технология. Гум. Воспр. 2007; 22: 766–771. doi: 10.1093/humrep/del421. [PubMed] [CrossRef] [Google Scholar]
17. Seifer D.B., Baker V.L., Leader B. Возрастные значения антимюллерова гормона в сыворотке для 17 120 женщин, обратившихся в центры лечения бесплодия в США. Плодородный. Стерильно. 2011;95: 747–750. doi: 10.1016/j.fertnstert.2010.10.011. [PubMed] [CrossRef] [Google Scholar]
18. Андерсон Р.А., Уоллес У.Х.Б. Антимюллеров гормон, оценка овариального резерва и репродуктивный исход молодой пациентки с онкологическим заболеванием. Плодородный. Стерильно. 2013;99:1469–1475. doi: 10.1016/j.fertnstert.2013.03.014. [PubMed] [CrossRef] [Google Scholar]
19. Somigliana E., Ragni G., Benedetti F., Borroni R., Vegetti W., Crosignani P. Влияет ли лапароскопическое удаление эндометриоидных кист яичников на овариальный резерв? Выводы из циклов ЭКО. Гум. Воспр. 2003;18:2450–2453. дои: 10.1093/humrep/deg432. [PubMed] [CrossRef] [Google Scholar]
20. Muzii L., Di Tucci C., Di Feliciantonio M., Galati G., Di Donato V., Musella A., Palaia I., Panici P.B. Снижение уровня антимюллерова гормона при эндометриомах яичников: систематический обзор и метаанализ. Плодородный. Стерильно. 2018;110:932–940. doi: 10.1016/j.fertnstert.2018.06.025. [PubMed] [CrossRef] [Google Scholar]
Muzii L., Di Tucci C., Di Feliciantonio M., Galati G., Di Donato V., Musella A., Palaia I., Panici P.B. Снижение уровня антимюллерова гормона при эндометриомах яичников: систематический обзор и метаанализ. Плодородный. Стерильно. 2018;110:932–940. doi: 10.1016/j.fertnstert.2018.06.025. [PubMed] [CrossRef] [Google Scholar]
21. Somigliana E., Berlanda N., Benaglia L., Viganò P., Vercellini P., Fedele L. Хирургическое удаление эндометриом и овариальный резерв: систематический обзор сыворотки изменение уровня антимюллерова гормона. Плодородный. Стерильно. 2012;98: 1531–1538. doi: 10.1016/j.fertnstert.2012.08.009. [PubMed] [CrossRef] [Google Scholar]
22. Раффи Ф., Метвалли М., Амер С. Влияние удаления эндометриомы яичников на резерв яичников: систематический обзор и метаанализ. Дж. Клин. Эндокринол. Метаб. 2012;97:3146–3154. doi: 10.1210/jc.2012-1558. [PubMed] [CrossRef] [Google Scholar]
23. Романски П.А., Брейди П.С., Фарланд Л.В., Томас А.М., Хорнштейн М.Д. Влияние эндометриоза на уровень антимюллерова гормона у бесплодной популяции. Дж. Ассист. Воспр. Жене. 2019;36:1179–1184. doi: 10.1007/s10815-019-01450-9. [PubMed] [CrossRef] [Google Scholar]
Дж. Ассист. Воспр. Жене. 2019;36:1179–1184. doi: 10.1007/s10815-019-01450-9. [PubMed] [CrossRef] [Google Scholar]
эндометриомы на овариальном резерве: серийные изменения уровня антимюллерова гормона в сыворотке. Плодородный. Стерильно. 2012;97:1472–1478. doi: 10.1016/j.fertnstert.2012.03.027. [PubMed] [CrossRef] [Google Scholar]
25. Alborzi S., Keramati P., Younesi M., Samsami A., Dadras N. Влияние лапароскопической цистэктомии на овариальный резерв у пациенток с односторонними и двусторонними эндометриомами. Плодородный. Стерильно. 2014; 101:427–434. doi: 10.1016/j.fertnstert.2013.10.019. [PubMed] [CrossRef] [Google Scholar]
26. Vignali M., Mabrouk M., Ciocca E., Alabiso G., Di Prun A.B., Gentilini D., Busacca M. Хирургическое иссечение эндометриом яичников: действительно ли это ухудшить овариальный резерв? Долговременные изменения антимюллерова гормона (АМГ) после операции. Дж. Обст. Гинеколь. Рез. 2015;41:1773–1778. doi: 10.1111/jog.12830. [PubMed] [CrossRef] [Google Scholar]
27. Сугита А., Ивасэ А., Гото М., Накахара Т., Накамура Т., Кондо М., Осука С., Мори М., Сайто А., Киккава Ф. Годичное наблюдение за уровнями антимюллерова гормона в сыворотке у пациентов с цистэктомией: связаны ли различные последовательные изменения с различными механизмами, вызывающими повреждение овариального резерва? Плодородный. Стерильно. 2013; 100: 516–522. doi: 10.1016/j.fertnstert.2013.03.032. [PubMed] [CrossRef] [Академия Google]
Сугита А., Ивасэ А., Гото М., Накахара Т., Накамура Т., Кондо М., Осука С., Мори М., Сайто А., Киккава Ф. Годичное наблюдение за уровнями антимюллерова гормона в сыворотке у пациентов с цистэктомией: связаны ли различные последовательные изменения с различными механизмами, вызывающими повреждение овариального резерва? Плодородный. Стерильно. 2013; 100: 516–522. doi: 10.1016/j.fertnstert.2013.03.032. [PubMed] [CrossRef] [Академия Google]
28. Ван Ю., Руан С., Лу Д., Шэн Дж., Муек А.О. Влияние лапароскопической цистэктомии эндометриомы на уровень антимюллерова гормона (АМГ). Гинекол. Эндокринол. 2019; 35: 494–497. doi: 10.1080/09513590.2018.1549220. [PubMed] [CrossRef] [Google Scholar]
29. Kostrzewa M., Wilczyński J.R., Głowacka E., Żyła M., Szyło K., Stachowiak G. Однолетнее наблюдение овариального резерва тремя методами у женщин после лапароскопической цистэктомии по поводу эндометриомы и доброкачественных кист яичников. Междунар. Дж. Гинекол. Обст. 2019;146:350–356. doi: 10. 1002/ijgo.12884. [PubMed] [CrossRef] [Google Scholar]
1002/ijgo.12884. [PubMed] [CrossRef] [Google Scholar]
30. Ковачевич В.М., Анджелич Л.М., Митрович-Йованович А. Изменения уровня антимюллерова гормона в сыворотке крови у пациенток через 6 и 12 мес после операции по удалению эндометриомы. Плодородный. Стерильно. 2018;110:1173–1180. doi: 10.1016/j.fertnstert.2018.07.019. [PubMed] [CrossRef] [Google Scholar]
31. Ким Ю.-Дж., Ча С.-В., Ким Х.-О. Уровень антимюллерова гормона в сыворотке снижается после операции по поводу эндометриоза. Дж. Обст. Гинеколь. 2017; 37: 342–346. дои: 10.1080/01443615.2016.1239071. [PubMed] [CrossRef] [Google Scholar]
32. Танигучи Ф., Сакамото Ю., Ябута Ю., Адзума Ю., Хиракава Э., Нагира К., Уегаки Т., Деура И., Хата К. ., Harada T. Анализ исхода беременности и снижения уровня антимюллерова гормона после лапароскопической цистэктомии при эндометриомах яичников. Дж. Обст. Гинеколь. Рез. 2016;42:1534–1540. doi: 10.1111/jog.13081. [PubMed] [CrossRef] [Google Scholar]
33. Карадаг С., Демиркан С. , Тургут А., Чалишкан Э. Влияние лапароскопической цистэктомии на овариальный резерв у пациенток с эндометриомой и дермоидной кистой. Дж. Терк. соц. Обст. Гинекол. 2020;17:15–20. doi: 10.4274/tjod.galenos.2020.37605. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
, Тургут А., Чалишкан Э. Влияние лапароскопической цистэктомии на овариальный резерв у пациенток с эндометриомой и дермоидной кистой. Дж. Терк. соц. Обст. Гинекол. 2020;17:15–20. doi: 10.4274/tjod.galenos.2020.37605. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
34. Одзаки Р., Кумакири Дж., Тинелли А., Гримбизис Г.Ф., Китаде М., Такеда С. Оценка факторов, предсказывающих снижение овариального резерва до и после лапароскопической цистэктомии при эндометриомах яичников: проспективное когортное исследование. Дж. Яичник Res. 2016;9:37. doi: 10.1186/s13048-016-0241-z. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
35. Марселлин Л., Сантулли П., Бурдон М., Конт К., Майньен К., Джаст П.А., Штрёли И., Боргезе Б., Чапрон C. Концентрация антимюллерова гормона в сыворотке увеличивается с увеличением размера эндометриомы яичника. Плодородный. Стерильно. 2019;111:944–952. doi: 10.1016/j.fertnstert.2019.01.013. [PubMed] [CrossRef] [Google Scholar]
36. Muzii L., Achilli C., Lecce F., Bianchi A., Franceschetti S., Marchetti C., Marchetti C., Panici P.B. Вторая операция по поводу рецидивирующей эндометриомы более вредна для здоровой ткани яичника и овариального резерва, чем первая операция. Плодородный. Стерильно. 2015; 103: 738–743. doi: 10.1016/j.fertnstert.2014.12.101. [PubMed] [CrossRef] [Google Scholar]
Muzii L., Achilli C., Lecce F., Bianchi A., Franceschetti S., Marchetti C., Marchetti C., Panici P.B. Вторая операция по поводу рецидивирующей эндометриомы более вредна для здоровой ткани яичника и овариального резерва, чем первая операция. Плодородный. Стерильно. 2015; 103: 738–743. doi: 10.1016/j.fertnstert.2014.12.101. [PubMed] [CrossRef] [Google Scholar]
37. Zhou Y., Chen C., Hu C., Wang Y., Zhang X., Wu R. Прогностическое значение антимюллерова уровня сыворотки для спонтанной беременности в женщин после хирургического лечения эндометриоза. Дж. Междунар. Мед. Рез. 2019;47:5643–5649. doi: 10.1177/0300060519861171. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
38. Zhang C.-H., Wu L., Li P.-Q. Клиническое исследование влияния на овариальный резерв различных методов гемостаза при лапароскопической цистэктомии по поводу эндометриомы яичника. Тайвань. Дж. Обст. Гинекол. 2016;55:507–511. doi: 10.1016/j.tjog.2015.08.026. [PubMed] [CrossRef] [Google Scholar]
39. Baracat C.M.F., Abdalla-Ribeiro H.S.A., Araujo R.S.D.C., Bernando W.M., Ribeiro P.A. Влияние на овариальный резерв различных методов гемостаза при лапароскопической цистэктомии: систематический обзор и метаанализ. Преподобный Брас. гинекол. Обст. РБГО Гинекол. Обст. 2019;41:400–408. doi: 10.1055/s-0039-1692697. [PubMed] [CrossRef] [Google Scholar]
Baracat C.M.F., Abdalla-Ribeiro H.S.A., Araujo R.S.D.C., Bernando W.M., Ribeiro P.A. Влияние на овариальный резерв различных методов гемостаза при лапароскопической цистэктомии: систематический обзор и метаанализ. Преподобный Брас. гинекол. Обст. РБГО Гинекол. Обст. 2019;41:400–408. doi: 10.1055/s-0039-1692697. [PubMed] [CrossRef] [Google Scholar]
40. Ding W., Li M., Teng Y. Влияние биполярной коагуляции на овариальный резерв гемостаза по сравнению с наложением швов после хирургического удаления эндометриомы яичника: метаанализ. Воспр. Биомед. В сети. 2015;30:635–642. doi: 10.1016/j.rbmo.2015.02.012. [PubMed] [CrossRef] [Google Scholar]
41. Araujo R.S.C., Maia S.S.B., Baracat C.M.F., Lima MD, Soares E.S.S., Ribeiro H.S.A.A., Ribeiro P.A.A.G. Функция яичников после использования различных гемостатических методов во время лечения эндометриомы: протокол рандомизированного клинического исследования. Испытания. 2019;20:1–8. doi: 10.1186/s13063-019-3524-z. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
42. Chung J., Law T., Chung C., Mak J.S., Sahota D.S., Li T.-C., Chung J.P.W., Law T.S.M., Чанг Ч.Х.С., Мак Дж.С.М. Влияние гемостатического герметика по сравнению с электрокоагуляцией на овариальный резерв после лапароскопической цистэктомии яичников при эндометриомах яичников: рандомизированное контролируемое исследование. БЙОГ Интерн. Дж. Обст. Гинеколь. 2019;126:1267–1275. дои: 10.1111/1471-0528.15807. [PubMed] [CrossRef] [Академия Google]
Chung J., Law T., Chung C., Mak J.S., Sahota D.S., Li T.-C., Chung J.P.W., Law T.S.M., Чанг Ч.Х.С., Мак Дж.С.М. Влияние гемостатического герметика по сравнению с электрокоагуляцией на овариальный резерв после лапароскопической цистэктомии яичников при эндометриомах яичников: рандомизированное контролируемое исследование. БЙОГ Интерн. Дж. Обст. Гинеколь. 2019;126:1267–1275. дои: 10.1111/1471-0528.15807. [PubMed] [CrossRef] [Академия Google]
43. Nappi L., Angioni S., Sorrentino F., Cinnella G., Lombardi M., Greco P. Оценка тренда антимюллерова гормона после лапароскопической хирургии монолатеральной эндометриомы с использованием новой двухволновой лазерной системы (DWLS) для гемостаз. Гинекол. Эндокринол. 2015;32:34–37. doi: 10.3109/09513590.2015.1068754. [PubMed] [CrossRef] [Google Scholar]
44. Roman H., Bubenheim M., Auber M., Marpeau L., Puscasiu L. Уровень антимюллерова гормона и абляция эндометриомы с использованием энергии плазмы. Дж. Соц. Лапароэндоск. Surg. 2014;18 дои: 10. 4293/JSLS.2014.00002. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
4293/JSLS.2014.00002. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
45. Сточино-Лой Э., Дарвиш Б., Мирча О., Тулеймат С., Миллохау Ж.-К., Або К., Ангиони С. ., Roman H. Влияет ли предоперационный уровень антимюллерова гормона на частоту послеоперационных беременностей у женщин, перенесших операцию по поводу тяжелого эндометриоза? Плодородный. Стерильно. 2017;107:707–713. doi: 10.1016/j.fertnstert.2016.12.013. [PubMed] [CrossRef] [Google Scholar]
46. Saito N., Yamashita Y., Okuda K., Kokunai K., Terai Y., Ohmichi M. Сравнение влияния лапароскопической эндометриоидной цистэктомии и вапоризации на послеоперационную сыворотку уровня антимюллерова гормона. Азиат Дж. Эндоск. Surg. 2018;11:23–29. doi: 10.1111/ases.12412. [PubMed] [CrossRef] [Google Scholar]
47. Кандиани М., Оттолина Дж., Посадска Э., Феррари С., Кастеллано Л.М., Тандои И., Пальярдини Л., Нокунь А., Ях Р. Оценка овариальный резерв после цистэктомии по сравнению с «одноэтапной» лазерной вапоризацией при лечении эндометриомы яичника: небольшое рандомизированное клиническое исследование. Гум. Воспр. 2018;33:2205–2211. doi: 10.1093/humrep/dey305. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Гум. Воспр. 2018;33:2205–2211. doi: 10.1093/humrep/dey305. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
48. Кандиани М., Оттолина Дж., Шимберни М., Тандой И., Бартиромо Л., Феррари С. Частота повторения после «One-Step» СО 2 Вапоризация с помощью волоконного лазера по сравнению с цистэктомией при эндометриоме яичников: 3-летнее последующее исследование. Дж. Миним. Инвазивный гинекол. 2020; 27: 901–908. doi: 10.1016/j.jmig.2019.07.027. [PubMed] [CrossRef] [Google Scholar]
49. Giampaolino P., Bifulco G., Sardo A.D.S., Mercorio A., Bruzzese D., Di Carlo C. Размер эндометриомы является важным фактором при выборе наиболее подходящего хирургического вмешательства. метод: проспективное рандомизированное предварительное исследование. Евро. Дж. Обст. Гинекол. Воспр. биол. 2015;195:88–93. doi: 10.1016/j.ejogrb.2015.09.046. [PubMed] [CrossRef] [Google Scholar]
50. Цолакидис Д., Падос Г., Вавилис Д., Атанатос Д., Цаликис Т., Яннакоу А., Тарлатзис Б. К. Влияние на овариальный резерв после лапароскопической цистэктомии яичников по сравнению с трехэтапным лечением у пациенток с эндометриомами: проспективное рандомизированное исследование. Плодородный. Стерильно. 2010;94:71–77. doi: 10.1016/j.fertnstert.2009.01.138. [PubMed] [CrossRef] [Google Scholar]
К. Влияние на овариальный резерв после лапароскопической цистэктомии яичников по сравнению с трехэтапным лечением у пациенток с эндометриомами: проспективное рандомизированное исследование. Плодородный. Стерильно. 2010;94:71–77. doi: 10.1016/j.fertnstert.2009.01.138. [PubMed] [CrossRef] [Google Scholar]
51. Lee HJ, Lee JE, Ku S.-Y., Kim S.H., Kim J.G., Moon S.Y., Choi Y.M. Частота естественного зачатия после лапароскопической операции у бесплодных женщин с эндометриозом. клин. Эксп. Воспр. Мед. 2013;40:29–32. doi: 10.5653/cerm.2013.40.1.29. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
52. Раффи Ф., Амер С.А. Долгосрочные репродуктивные функции после операции по поводу эндометриомы яичников. Евро. Дж. Обст. Гинекол. Воспр. биол. 2014; 172:80–84. doi: 10.1016/j.ejogrb.2013.09.042. [PubMed] [CrossRef] [Google Scholar]
53. Maggiore U.L.R., Scala C., Tafi E., Racca A., Biscaldi E., Vellone V.G., Venturini P.L., Ferrero S. Спонтанная фертильность после выжидательной или хирургической тактики лечения. ректовагинальный эндометриоз у женщин с эндометриомой яичников или без нее: ретроспективный анализ. Плодородный. Стерильно. 2017;107:969–976.e5. doi: 10.1016/j.fertnstert.2017.02.106. [PubMed] [CrossRef] [Google Scholar]
ректовагинальный эндометриоз у женщин с эндометриомой яичников или без нее: ретроспективный анализ. Плодородный. Стерильно. 2017;107:969–976.e5. doi: 10.1016/j.fertnstert.2017.02.106. [PubMed] [CrossRef] [Google Scholar]
54. Дубинская Е.Д., Гаспаров А.С., Радзинский В.Е., Барабанова О.Е., Дутов А.А., Дутов А.А. Хирургия эндометриом в контексте лечения бесплодия. Евро. Дж. Обст. Гинекол. Воспр. биол. 2019; 241:77–81. doi: 10.1016/j.ejogrb.2019.08.009. [PubMed] [CrossRef] [Google Scholar]
55. Alborzi S., Sorouri Z.Z., Askari E., Poordast T., Chamanara K. Успех различных методов лечения эндометриомы при бесплодии: систематический обзор и метаанализ проспективных исследования. Воспр. Мед. биол. 2019;18:312–322. doi: 10.1002/rmb2.12286. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
56. Vercellini P., Somigliana E., Viganò P., Abbiati A., Barbara G., Crosignani P.G. Хирургия бесплодия, связанного с эндометриозом: прагматичный подход. Гум. Воспр. 2009; 24: 254–269. doi: 10.1093/humrep/den379. [PubMed] [CrossRef] [Google Scholar]
doi: 10.1093/humrep/den379. [PubMed] [CrossRef] [Google Scholar]
57. Dong Z., An J., Xie X., Wang Z., Sun P. Предоперационный уровень антимюллерова гормона в сыворотке крови является потенциальным предиктором тяжести эндометриомы яичников и послеоперационного периода. плодородие. Евро. Дж. Обст. Гинекол. Воспр. биол. 2019;240:113–120. doi: 10.1016/j.ejogrb.2019.06.024. [PubMed] [CrossRef] [Google Scholar]
58. Ивасэ А., Накамура Т., Като Н., Гото М., Такикава С., Кондо М., Осука С., Мори М., Киккава Ф. Анти — Уровни мюллерова гормона после лапароскопической цистэктомии по поводу эндометриомы как возможный предиктор беременности при лечении бесплодия. Гинекол. Эндокринол. 2015; 32:1–5. doi: 10.3109/09513590.2015.1114078. [PubMed] [CrossRef] [Google Scholar]
59. Roman H., Auber M., Bourdel N., Martin C., Marpeau L., Puscasiu L. Послеоперационный рецидив и фертильность после абляции эндометриомы с использованием энергии плазмы: ретроспективная оценка из 3-летнего опыта. Дж. Миним. Инвазивный гинекол. 2013;20:573–582. doi: 10.1016/j.jmig.2013.02.016. [PubMed] [CrossRef] [Академия Google]
Дж. Миним. Инвазивный гинекол. 2013;20:573–582. doi: 10.1016/j.jmig.2013.02.016. [PubMed] [CrossRef] [Академия Google]
60. Motte I., Roman H., Clavier B., Jumeau F., Chanavaz-Lacheray I., Letailleur M., Darwish B., Rives N. Результаты экстракорпорального оплодотворения после абляции эндометриом с использованием энергии плазмы: A ретроспективное исследование случай-контроль. Гинеколь. Обст. Плодородный. 2016; 44: 541–547. doi: 10.1016/j.gyobfe.2016.08.008. [PubMed] [CrossRef] [Google Scholar]
61. Deckers P., Ribeiro S.C., Simões RDS, Miyahara CBDF, Baracat E.C. Систематический обзор и метаанализ влияния биполярной электрокоагуляции во время лапароскопического удаления эндометриомы яичников на овариальный резерв. Междунар. Дж. Гинекол. Обст. 2018; 140:11–17. doi: 10.1002/ijgo.12338. [PubMed] [CrossRef] [Академия Google]
62. Donnez J., Wyns C., Nisolle M. Влияет ли операция яичников на эндометриомы на реакцию яичников на гонадотропин? Плодородный. Стерильно. 2001; 76: 662–665. doi: 10.1016/S0015-0282(01)02011-8. [PubMed] [CrossRef] [Google Scholar]
doi: 10.1016/S0015-0282(01)02011-8. [PubMed] [CrossRef] [Google Scholar]
63. Brougham M.F.H., Crofton P.M., Johnson E.J., Evans N., Anderson R.A., Wallace W.H.B. Антимюллеровский гормон является маркером гонадотоксичности у девочек до и после полового созревания, получавших лечение от рака: проспективное исследование. Дж. Клин. Эндокринол. Метаб. 2012;97:2059–2067. doi: 10.1210/jc.2011-3180. [PubMed] [CrossRef] [Google Scholar]
64. La Marca A., Spada E., Grisendi V., Argento C., Papaleo E., Milani S., Volpe A. Нормальные уровни антимюллерова гормона в сыворотке крови общее женское население и связь с репродуктивной историей. Евро. Дж. Обст. Гинекол. Воспр. биол. 2012; 163:180–184. doi: 10.1016/j.ejogrb.2012.04.013. [PubMed] [CrossRef] [Google Scholar]
65. Роман Х., Тарта О., Пура И., Оприс И., Бурдель Н., Марпо Л., Сабурин Ж.-К. Прямо пропорциональная зависимость между размером эндометриомы и паренхимой яичника, случайно удаленной во время цистэктомии, и ее влияние на лечение увеличенных эндометриом. Гум. Воспр. 2010; 25:1428–1432. дои: 10.1093/humrep/deq069. [PubMed] [CrossRef] [Google Scholar]
Гум. Воспр. 2010; 25:1428–1432. дои: 10.1093/humrep/deq069. [PubMed] [CrossRef] [Google Scholar]
66. Muzii L., Di Tucci C., Di Feliciantonio M., Galati G., Pecorella I., Radicioni A., Anzuini A., Piccioni M.G., Patacchiola F. , Паничи П.Б. Уменьшение овариального резерва при хирургическом вмешательстве не коррелирует с количеством ткани яичника, непреднамеренно удаленной при лапароскопической операции по поводу эндометриомы. Воспр. науч. 2019;26:1493–1498. doi: 10.1177/1933719119828055. [PubMed] [CrossRef] [Google Scholar]
67. Даффи Дж. М. Н., Хирш М., Верко М., Эббот Дж., Баркер С., Коллура Б., Дрейк Р., Эверс Дж., Хикки М., Хорн А.В. и др. Основной результат, установленный для будущих исследований эндометриоза: международное согласованное исследование развития. БЙОГ Интерн. Дж. Обст. Гинеколь. 2020;127:967–974. дои: 10.1111/1471-0528.16157. [PubMed] [CrossRef] [Google Scholar]
Оценка овариального резерва после лапароскопической хирургии у пациенток с синдромом поликистозных яичников
Bioimpacts. 2012 г.; 2(3): 167–170.
2012 г.; 2(3): 167–170.
Опубликовано в Интернете 25 июня 2012 г. doi: 10.5681/bi.2012.018
,
1
,
2
, * ,
3
,
3
и
2
,
4
, *
Информация об авторе Примечания к статье Информация об авторских правах и лицензиях Отказ от ответственности
Введение
Овариальный резерв зависит от размера и качества ооцитов, хранящихся в яичнике. Старение и некоторые заболевания снижают овариальный резерв, что приводит к снижению репродуктивной функции. Лапароскопическая хирургия используется для лечения бесплодия у женщин с СПКЯ. Целью данного исследования было измерение овариального резерва у пациенток с СПКЯ до и после лапароскопической операции.
Методы
В этом исследовании были отобраны тридцать бесплодных пациенток с СПКЯ, которые не ответили на первоначальное лечение препаратом. Оценивали сывороточные уровни антимюллерова гормона, тестостерона, лютеинизирующего гормона (ЛГ), количество антральных фолликулов до лапароскопической операции и через 1 нед, 3 и 6 мес после операции.
Результаты
Средний уровень антимюллерова гормона в сыворотке крови составлял 8,4±4,7 до лапароскопической операции и 7,5±4,5, 7±4,5 и 7,7±4,4 нг/мл через неделю, 3 и 6 месяцев после операции соответственно. Уровень ЛГ в сыворотке составил 13,6±6,7 и 12,7±11,1 МЕ/мл (р=0,87) до операции и через 6 мес после лапароскопии соответственно. Средние уровни тестостерона в сыворотке были 0,9±0,8, 0,8±0,9 нг/мл (P=0,86) до и после операции. Годовой коэффициент воспроизводства в этой популяции составил 26,7 процента.
Заключение
Лапароскопическая пункция яичников не изменила сыворотку антимюллерова гормона, тестостерона и ЛГ у женщин с СПКЯ и, следовательно, не оказывает неблагоприятного воздействия на овариальный резерв.
Ключевые слова: Овариальный резерв, лапароскопия, антимюллеров гормон, синдром поликистозных яичников
Овариальный резерв связан с размером, количеством и качеством ооцитов в фолликулах. Овариальный резерв – это репродуктивная способность яичника, которая показывает количество в нем фолликулов. Старение снижает овариальный резерв и впоследствии репродуктивную способность женщин (Hansen et al 2008). Маркеры, связанные с овариальным резервом, включают возраст, сонографические переменные (такие как объем яичников), количество антральных фолликулов (АФК), стромальный кровоток яичников, гормональные параметры (например, фолликулостимулирующий гормон (ФСГ), эстрадиол (Е9).0097 2 ), лютеинизирующего гормона (ЛГ), антимюллерова гормона (АМГ)), уровней ингибина В и соотношения ФСГ/ЛГ (Sowers et al 2010). Для оценки резерва яичников Gleicher et al (2010) измерили уровень в сыворотке крови. ФСГ, Ингибина В и Е2 в фолликулярной фазе. Одним из лучших факторов, определяющих овариальный резерв, является количество антральных фолликулов, которое оценивается с помощью трансвагинального ультразвукового исследования во время фолликулярной фазы. В последние годы измерение АМГ в сыворотке стало одним из лучших и простых маркеров овариального резерва (Maheshwari et al 2009).). AMH или Mullerian Inhibiting Substance (MIS) входит в состав трансформирующего фактора роста ß (TGF-ß).
Старение снижает овариальный резерв и впоследствии репродуктивную способность женщин (Hansen et al 2008). Маркеры, связанные с овариальным резервом, включают возраст, сонографические переменные (такие как объем яичников), количество антральных фолликулов (АФК), стромальный кровоток яичников, гормональные параметры (например, фолликулостимулирующий гормон (ФСГ), эстрадиол (Е9).0097 2 ), лютеинизирующего гормона (ЛГ), антимюллерова гормона (АМГ)), уровней ингибина В и соотношения ФСГ/ЛГ (Sowers et al 2010). Для оценки резерва яичников Gleicher et al (2010) измерили уровень в сыворотке крови. ФСГ, Ингибина В и Е2 в фолликулярной фазе. Одним из лучших факторов, определяющих овариальный резерв, является количество антральных фолликулов, которое оценивается с помощью трансвагинального ультразвукового исследования во время фолликулярной фазы. В последние годы измерение АМГ в сыворотке стало одним из лучших и простых маркеров овариального резерва (Maheshwari et al 2009).). AMH или Mullerian Inhibiting Substance (MIS) входит в состав трансформирующего фактора роста ß (TGF-ß). Это димерный гликопротеин, продуцируемый гранулезными клетками от рождения до менопаузы, который контролирует образование первичных фолликулов, ингибируя рекрутирование фолликулов (Rey et al 2003). Исследования in vivo и in vitro показали, что АМГ ингибирует использование примордиальных фолликулов и уменьшает количество растущих фолликулов (Dumesic et al 2008). Следовательно, АМГ играет важную роль в фолликулогенезе яичников, а его сыворотка связана с рефлекторным числом антральных фолликулов. Его основная функция заключается в ингибировании организации роста примордиальных фолликулов, что важно при отборе доминантных фолликулов (Barad et al 2009).).
Это димерный гликопротеин, продуцируемый гранулезными клетками от рождения до менопаузы, который контролирует образование первичных фолликулов, ингибируя рекрутирование фолликулов (Rey et al 2003). Исследования in vivo и in vitro показали, что АМГ ингибирует использование примордиальных фолликулов и уменьшает количество растущих фолликулов (Dumesic et al 2008). Следовательно, АМГ играет важную роль в фолликулогенезе яичников, а его сыворотка связана с рефлекторным числом антральных фолликулов. Его основная функция заключается в ингибировании организации роста примордиальных фолликулов, что важно при отборе доминантных фолликулов (Barad et al 2009).).
Синдром поликистозных яичников (СПКЯ) — это эндокринное заболевание, которое встречается у 6-8 процентов женщин репродуктивного возраста. Это основная причина бесплодия, связанного с овуляцией. Это заболевание характеризуется нарушениями овуляции, такими как олигоменорея и аменорея; на самом деле существуют незрелые фолликулы, которые не могут овулировать (Dumesic et al 2008).
Оценка АМГ в сыворотке является практическим маркером бесплодия, поскольку она позволяет оценить овариальный резерв и распознать низкую фертильность женщин (Daniel et al 2009).).
Исследования показывают, что старение приводит к снижению женской репродуктивной функции из-за уменьшения количества фолликулов в яичниках и качества ооцитов (Ficiciog et al 2006). Также циркулирующий АМГ в сыворотке снижается на третий день менструального цикла у здоровых женщин и после овариэктомии. АМГ также является маркером овариального резерва у пациенток, перенесших вспомогательные репродуктивные технологии (ВРТ) (Chie et al, 2008).
В последние годы АМГ использовался в качестве вероятного предиктора ответа яичников на стимуляцию во время экстракорпорального оплодотворения (ЭКО) и может применяться как метод определения снабжения яичников (Mashiach et al 2010).
Лапароскопическая диатермия яичников (LOD) широко используется для индукции овуляции у пациенток с СПКЯ. Однако тридцать процентов пациентов не реагируют на лапароскопическое лечение по неизвестной причине.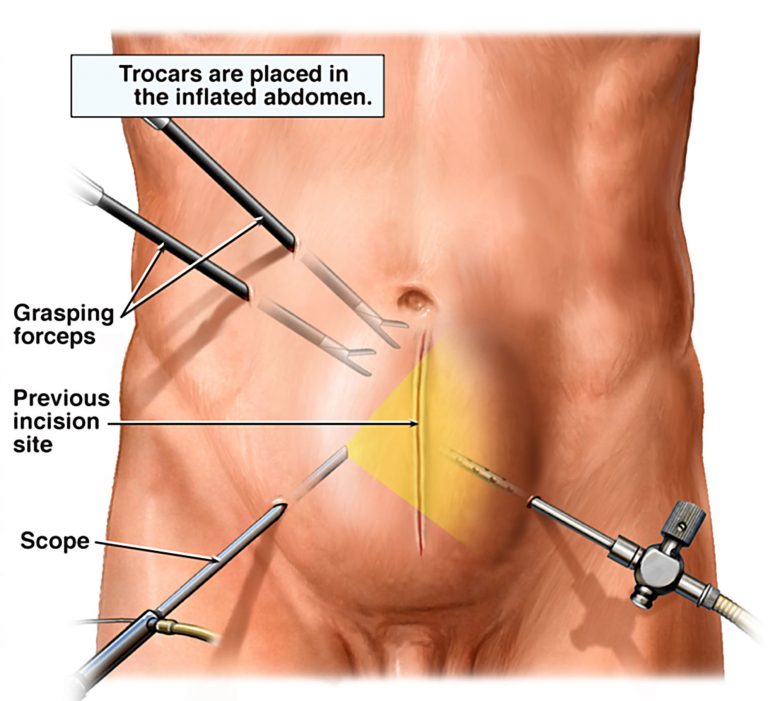 LOD разрушает части яичников, и эта операция обычно не используется, однако ее можно использовать в качестве альтернативного варианта для бесплодных женщин, у которых все еще нет овуляции из-за отсутствия реакции на препарат (Fernandez et al 2011).
LOD разрушает части яичников, и эта операция обычно не используется, однако ее можно использовать в качестве альтернативного варианта для бесплодных женщин, у которых все еще нет овуляции из-за отсутствия реакции на препарат (Fernandez et al 2011).
Лапароскопия может привести к повреждению ткани яичника и вызвать снижение овариального резерва. Степень повреждения, влияющего на овариальный резерв, коррелирует с содержанием ткани яичника, удаленной во время операции, и повреждением сосудистой системы яичника во время лапароскопии (Fernandez et al, 2011). Оценка уровня АМГ в сыворотке может быть использована в качестве предиктора лапароскопического возможного повреждения овариального резерва. С другой стороны, уровни АМГ в сыворотке исчезают при циклическом кровотечении, и весь цикл имеет минимальные внутрицикловые изменения (Iwase et al 2010).
Поскольку предыдущие исследования показали, что изменения концентрации АМГ в сыворотке, вызванные лапароскопией, могут быть использованы в качестве эффективного и подходящего фактора в пределах яичника при оценке уровней повреждения ткани яичника (Iwase et al 2010), целью этого исследования было определить изменения овариального резерва путем сравнения уровня АМГ в сыворотке до и после лапароскопической операции, а также проверить, может ли лапароскопическая операция уменьшить овариальный резерв.
Пациенты
В этом поперечном исследовании мы отобрали тридцать пациенток в возрасте от 19 до 35 лет с проблемами бесплодия, СПКЯ и резистентными к лечению препаратом цитрат кломифена. Количество пациентов и лечение было основано на предыдущих исследованиях (Iwase et al 2010). Эти пациенты были отобраны на основе таблицы случайных чисел.
Настройка
Исследование проводилось в образовательно-медицинском центре Альзахра в Тебризе, Иран. Исследование началось в апреле 2010 года и продолжалось 15 месяцев.
Критерии включения
Диагноз у пациенток устанавливали по Роттердамским критериям как нарушение овуляции, гиперандрогению и наличие более 12 фолликулов размером от 2 до 9 мм в каждом яичнике при ультразвуковом исследовании женщинами-врачами.
Процедуры
Перед операцией у каждого пациента брали около 5 кубических сантиметров крови и хранили в пробирках, содержащих тканевый активатор (отделение сыворотки, Deltalab Rubi, ИСПАНИЯ). Образцы центрифугировали при 3000 об/мин, сыворотку собирали в микропробирки на 2 мл и хранили при –20 º C морозильник до последующего анализа.
Образцы центрифугировали при 3000 об/мин, сыворотку собирали в микропробирки на 2 мл и хранили при –20 º C морозильник до последующего анализа.
Во время лапароскопии пациенткам прокалывали от 6 до 7 точек в яичнике монополярным коагуляционным крючком. У всех пациентов измеряли уровни сывороточного тестостерона, ЛГ, антимюллерова гормона и антральных фолликулов. АМГ измеряли с использованием имеющегося в продаже набора для иммуноферментного анализа (ELAab & USCNLIFE, Wuhan ELAab Science Co.Ltd). Нижний предел обнаружения этого анализа составляет 0,053 нг/мл. В соответствии с инструкциями, содержащимися в наборе для анализа, уровни тестостерона, а также ЛГ у всех пациентов измеряли методом иммуноферментного анализа (ИФА, Cayman Chemical, 582701). После ЛОД измеряли уровень сывороточного антимюллерова гормона через одну неделю, три и шесть месяцев после этого. Уровень тестостерона и ЛГ в сыворотке измеряли через шесть месяцев после операции. Кроме того, мы изучили ежегодную частоту наступления беременности среди этих лиц.
Статистический анализ
Анализ проводили с использованием SPSS версии 13. Данные выражали как среднее ± стандартное отклонение или количество и проценты. Различия между группами оценивали с помощью Т-критерия независимых выборок. Для оценки корреляции между количественными переменными определяли коэффициент корреляции Пирсона (r). Во всех случаях значение P≤0,05 считалось значимым.
указывает информацию о возрасте, ИМТ, продолжительности использования цитрата кломифена и количестве основных фолликулов у субъектов. Как показано на рисунке, концентрации АМГ существенно не различались до и после операции. После лечения годовой коэффициент фертильности составил 26,7% (8 случаев) среди пациенток. Выявлена достоверная положительная корреляция между уровнем антимюллерова гормона в сыворотке крови и количеством антральных фолликулов (r=0,685, P≤0,05).
Table 1
Information related to age, BMI, treatment duration with clomiphene citrate and number of basic follicles in patients
| Variable | Mean±SD |
| Age (N=30) | 28. 4±2.3 4±2.3 |
| BMI | 29.1±1.5 |
| Treatment duration with clomiphene citrate (period) | 03.9±2.3 |
| number of basic follicles | 10.9±2.1 |
Open in a separate window
Table 2
Serum AMH, LH, testosterone levels pre- and post-surgery
| Variable (ng/ml) | До Операция | После 1 неделя | после 3 месяца | После 6 месяцев | P | 07.7±04.5 | 07. 7±04.5 7±04.5 | 0.70 |
| LH | 13.1±6.7 | — | — | 12.7±11.1 | 0.87 | |||
| Testosterone | 00.9±0.8 | — | — | 00,8±00,9 | 0,86 |
Открыть в отдельном окне
Исследования показали, что уровни АМГ в сыворотке у женщин с возрастом снижаются, а также подтвердили, что АМГ является одним из лучших маркеров овариального резерва (Maheswari et al 2009).). Лечение ЭКО в соответствии с соотношением между количеством фолликулов в яичнике и уровнем АМГ в сыворотке показало, что АМГ является хорошим предиктором для оценки овариального резерва. Следовательно, на уровни АМГ в сыворотке влияет уменьшение количества антральных фолликулов или повреждений ткани яичника (Fernandez et al 2011).
Следовательно, на уровни АМГ в сыворотке влияет уменьшение количества антральных фолликулов или повреждений ткани яичника (Fernandez et al 2011).
Вопрос в том, повлияла ли лапароскопия на ткани яичников и уменьшила ли овариальный резерв. Weerakiet et al (2007) исследовали изменения уровня антимюллерова гормона в сыворотке до и после LOD. Они обнаружили, что средний уровень антимюллерова гормона в сыворотке крови у 21 пациента с СПКЯ составил 4,6 нг/мл через три дня после LOD, что не было статистически значимым.
В нашем исследовании средние уровни антимюллерова гормона до лапароскопии, через 1 неделю, 3 месяца и 6 месяцев после лапароскопии существенно не изменились. Хотя через неделю после лапароскопии уровни в сыворотке снизились, это изменение не было статистически значимым.
С другой стороны, предыдущие исследования показали, что у женщин с СПКЯ уровень концентрации АМГ в сыворотке повышен в 2-3 раза, что было связано с увеличением числа мелких фолликулов (Dumesic et al 2008). Согласно исследованиям Эльмашада, достоверное снижение уровня АМГ и АФК в сыворотке крови было выявлено на 1-м, 3-м и 6-м циклах после лапароскопии (Elmashad et al 2011). Это можно объяснить возможным повреждением сосудов яичника и паренхимы яичника после биполярной электрокоагуляции во время лапароскопии. Количество ткани яичника, удаляемой во время лапароскопии, влияет на АМГ, продуцируемый антральным фолликулом (Chang et al 2010). В этом исследовании у женщин, перенесших лапароскопию яичников, уровни АМГ в сыворотке были снижены в первую неделю после операции, а уровни АМГ восстановились через 1 и 3 месяца после операции примерно до 65% от дооперационного уровня. Исследования показывают, что лапароскопическая пункция яичников не изменяет стойкого уровня антимюллерова гормона в сыворотке у женщин с поликистозом яичников и, следовательно, не оказывает неблагоприятного воздействия на овариальный резерв (Amer et al 2009).).
Согласно исследованиям Эльмашада, достоверное снижение уровня АМГ и АФК в сыворотке крови было выявлено на 1-м, 3-м и 6-м циклах после лапароскопии (Elmashad et al 2011). Это можно объяснить возможным повреждением сосудов яичника и паренхимы яичника после биполярной электрокоагуляции во время лапароскопии. Количество ткани яичника, удаляемой во время лапароскопии, влияет на АМГ, продуцируемый антральным фолликулом (Chang et al 2010). В этом исследовании у женщин, перенесших лапароскопию яичников, уровни АМГ в сыворотке были снижены в первую неделю после операции, а уровни АМГ восстановились через 1 и 3 месяца после операции примерно до 65% от дооперационного уровня. Исследования показывают, что лапароскопическая пункция яичников не изменяет стойкого уровня антимюллерова гормона в сыворотке у женщин с поликистозом яичников и, следовательно, не оказывает неблагоприятного воздействия на овариальный резерв (Amer et al 2009).).
Фактически, высокие уровни АМГ в сыворотке у пациентов с СПКЯ снижают чувствительность фолликулов к циркулирующему ФСГ (La Marca et al 2005). Таким образом, у этих пациентов предотвращается выделение фолликулов и впоследствии останавливаются фолликулы в малой антральной фазе. АМГ также снижает активность ароматазы, что приводит к уменьшению продукции эстрадиола фолликулами (La Marca et al 2005). У пациенток, получавших вспомогательные репродуктивные технологии (ВРТ), уровни АМГ постепенно снижались при приеме ФСГ в рамках контролируемой гиперстимуляции яичников (КГЯ) (Iwase et al, 2010).
Таким образом, у этих пациентов предотвращается выделение фолликулов и впоследствии останавливаются фолликулы в малой антральной фазе. АМГ также снижает активность ароматазы, что приводит к уменьшению продукции эстрадиола фолликулами (La Marca et al 2005). У пациенток, получавших вспомогательные репродуктивные технологии (ВРТ), уровни АМГ постепенно снижались при приеме ФСГ в рамках контролируемой гиперстимуляции яичников (КГЯ) (Iwase et al, 2010).
В нашем исследовании небольшое снижение уровня АМГ при приеме ФСГ может быть связано с негативным влиянием ФСГ на секрецию АМГ. Как правило, уровни АМГ в сыворотке крови при КГЯ имеют положительную корреляцию с количеством мелких фолликулов; хотя уровни АМГ в сыворотке во время созревания нескольких небольших фолликулов снижались (Amer et al 2004). Следовательно, на основании предыдущих исследований можно сделать вывод, что LOD немного снизил уровень АМГ в сыворотке, что является важным фактором в отборе фолликулов, их созревании и длительности работы LOD, однако уровни АМГ заметно не изменятся; следовательно, LOD не оказывает негативного влияния на снабжение яичников. Эти данные полностью сопоставимы с результатами нашего исследования. В нашем исследовании была выявлена достоверная положительная корреляция между основанием сывороточного антимюллерова гормона и количеством антрального. Ла Марка и др. (2005) сообщили о результатах, аналогичных нашим.
Эти данные полностью сопоставимы с результатами нашего исследования. В нашем исследовании была выявлена достоверная положительная корреляция между основанием сывороточного антимюллерова гормона и количеством антрального. Ла Марка и др. (2005) сообщили о результатах, аналогичных нашим.
Amer и соавт. обследовали 29 пациенток с СПКЯ после лапароскопической диатермии яичников и показали, что уровень АМГ в сыворотке крови составил 6,1 нг/мл, который через неделю снизился до 4,7 мг/мл и остался на прежнем уровне. Снижение уровня АМГ может быть связано с использованием метода двусторонней диатермии (Amer et al 2004). Api (2009) показал, что овариальный резерв пациенток с СПКЯ существенно не изменяется после LOD; следовательно, можно констатировать, что возможность травматического АМГ свидетельствует только о том, что состояние пациента нормальное. Слушайте, читайте фонетически. Канди и Салим изучили уровни овариального резерва после лечения кломифеном, односторонний и двусторонний LOD и показали, что только после двустороннего LOD овариальный резерв значительно снижается.
Следовательно, вероятность травматического повреждения при такой форме вмешательства равна нулю (Kandi et al 2005). В целом кажется, что, хотя LOD приводит к снижению уровня АМГ у пациенток с СПКЯ, эти изменения не являются статистически значимыми и указывают только на нормальное состояние пациентки и не оказывают отрицательного влияния на снабжение яичников.
В связи с ограниченным количеством исследований, проведенных в этой области, в будущем необходимо провести дополнительные исследования. Таким образом, мы предлагаем более контролируемые исследования с большим размером выборки (акцент на роли одностороннего и двустороннего LOD отдельно).
Перед включением пациентов в исследование все пациенты подписывали письменную форму информированного согласия. Это исследование было одобрено Этическим комитетом Тебризского университета медицинских наук, Тебриз, Иран.
Авторы заявляют об отсутствии конфликта интересов.
Амер С., Ли Т.К. и Леджер В.Л. 2004 Индукция овуляции с помощью лапароскопического сверления яичников у женщин с синдромом поликистозных яичников: предикторы успеха. Хум Репрод, 19(1), 719-24
2004 Индукция овуляции с помощью лапароскопического сверления яичников у женщин с синдромом поликистозных яичников: предикторы успеха. Хум Репрод, 19(1), 719-24
[PubMed] [Google Scholar]
Амер С., Ли Т.С. и Леджер В.Л. 2009 г.Значение измерения антимюллерова гормона у женщин с овуляторным синдромом поликистозных яичников, перенесших лапароскопическую диатермию яичников. Хум Репрод, 24, 2760-6
[PubMed] [Google Scholar]
Api M . 2009 Уменьшается ли овариальный резерв после лапароскопического сверления яичников? . Гинекол Эндокринол, 25(3), 159-65
[PubMed] [Google Scholar]
Барад Д . 2009 Сравнение антимюллерова гормона (АМГ) и фолликулостимулирующего гормона (ФСГ) как предикторов функции яичников. Фертиль Стерил, 91, 1553-5
[PubMed] [Google Scholar]
Chang H, Hoon Han S, Hoon HanRyeol Lee J, Hoon HanRyeol LeeChul Jee B, Ick Lee и Hyun Kim . 2010 Влияние лапароскопической цистэктомии на овариальный резерв: серийные изменения уровней антимюллерова гормона в сыворотке. Фертил Стерил, 94(1), 343-9
Фертил Стерил, 94(1), 343-9
[PubMed] [Google Scholar]
Чие Т., Ацуй Ф., Масахиро К., Рие С., Хироэ И. и Кейчи И. 2008 Антимюллерова гормональная субстанция из фолликулярной жидкости положительно связана с успехом оплодотворения ооцитов во время экстракорпорального оплодотворения. Фертил Стерил, 89 лет(3), 586-91
[PubMed] [Google Scholar]
Daniel A, Dumes IC и Timoth Y . 2009 Уровни внутрифолликулярного антимюллерова гормона предсказывают реакцию фолликулов на фолликулостимулирующий гормон (ФСГ) у нормоандрогенных женщин с овуляцией, подвергающихся терапии аналогом гонадотропин-высвобождающего гормона/рекомбинантным человеческим ФСГ для экстракорпорального оплодотворения и переноса эмбрионов. Фертил Стерил, 92(1), 217-21
[Бесплатная статья PMC] [PubMed] [Google Scholar]
Dumesic D, PadmanabhanV и Abbott D. Синдром поликистозных яичников и компетентность развития ооцитов, 2008 г. Акушер Гинекол Сурв, 63(1), 39-48
[Бесплатная статья PMC] [PubMed] [Google Scholar]
Эльмашад А . 2011 Влияние лапароскопического сверления яичников на уровни антимюллерова гормона и стромальный кровоток яичников с использованием трехмерной энергетической допплерографии у женщин с ановуляторным синдромом поликистозных яичников. Фертил Стерил, 95(7), 2342-6
2011 Влияние лапароскопического сверления яичников на уровни антимюллерова гормона и стромальный кровоток яичников с использованием трехмерной энергетической допплерографии у женщин с ановуляторным синдромом поликистозных яичников. Фертил Стерил, 95(7), 2342-6
[PubMed] [Google Scholar]
Фернандес Х., Морин-Суррука М., Торре А., Фавр Э., Деффье Х. и Жервез А. . 2011 Бурение яичников для хирургического лечения синдрома поликистозных яичников: всесторонний обзор. Репродуктивная биомедицина, 22(6), 556-8.
[PubMed] [Академия Google]
Fiçiciog C, Kutlu T, Baglam E и Bakacak Z . 2006 Ранний фолликулярный антимюллеровый гормон как показатель овариального резерва. Фертил Стерил, 85(3), 592-6
[PubMed] [Google Scholar]
Глейхер Н., Вегхофер А. и Барад Д. . 2010 Антимюллеровский гормон (АМГ) определяет, независимо от возраста, низкие или хорошие шансы на живорождение у женщин с сильно сниженным овариальным резервом. Фертил Стерил, 94(7), 2824-7
[PubMed] [Google Scholar]
Hansen KR, Knowlton NS, Thyer AC, Charleston JS, Soules MR и Klein NA . 2008 Новая модель репродуктивного старения: снижение количества нерастущих фолликулов в яичниках от рождения до менопаузы. Хум Репрод, 23, 699-708
2008 Новая модель репродуктивного старения: снижение количества нерастущих фолликулов в яичниках от рождения до менопаузы. Хум Репрод, 23, 699-708
[PubMed] [Google Scholar]
Ивасэ А., Хирокава В., Гото М., Такикава С., Нагатомо Ю., Накахара Т. и др. 2010 Уровень антимюллерова гормона в сыворотке является полезным маркером для оценки влияния лапароскопической цистэктомии на овариальный резерв. Фертил Стерил, 94(7), 2846-9
[PubMed] [Google Scholar]
Кандиль М. и Селим М. . 2005 Гормональная и сонографическая оценка овариального резерва до и после лапароскопического сверления яичников при синдроме поликистозных яичников. Акушерство и гинекология, 112(10), 1427-30.
[PubMed] [Академия Google]
Хун ХанРёль ЛиЧул ДжиЛа Марка А, Хун ХанРёль ЛиЧул ДжиЛа МаркаДе Лео В., Джулини С., Орвието Р., Мальмузи С. и Джаннелла Л. . 2005 Антимюллеровский гормон у женщин в пременопаузе и после спонтанной или вызванной хирургическим вмешательством менопаузы. Соц Гинеколь Инвест, 12, 545-8
[PubMed] [Google Scholar]
Махешвари А. , Гибрил А., Бхаттачарья С. и Джонсон Н. . 2009 г. Динамические тесты овариального резерва: систематический обзор диагностической точности. Репродуктивная биомедицина в Интернете, 18 (5), 717-34.
, Гибрил А., Бхаттачарья С. и Джонсон Н. . 2009 г. Динамические тесты овариального резерва: систематический обзор диагностической точности. Репродуктивная биомедицина в Интернете, 18 (5), 717-34.
[PubMed] [Академия Google]
Машиах Р., Амит А., Хассон Дж., Амзалзг С., Бен-Йосеф Б., Лессин Дж. и др. 2010 Уровни антимюллерова гормона в фолликулярной жидкости как предиктор созревания ооцитов, скорости оплодотворения и эмбрионального развития у пациентов с синдромом поликистозных яичников. Фертил Стерил, 93(7), 2299-302
[PubMed] [Google Scholar]
Рей Р., Лукас-Круазье С., Ласала С. и Бедекаррас П. . 2003 AMH/MIS: что мы уже знаем о гене, белке и его регуляции. Молекулярная и клеточная эндокринология, 211, 21-31
[PubMed] [Академия Google]
Сауэрс М., МакКоннелл Д., Чжэн Х., Нан Б., Маккар Дж. и Рэндольф Дж. . 2010 Вариабельность антимюллерова гормона и ингибина В во время нормальных менструальных циклов. Фертил Стерил, 94 (4), 1482–1486 гг.
[Бесплатная статья PMC] [PubMed] [Google Scholar]
Weerakiet S, Lertvikool S, Tingthanatikul Y, Wansumrith S, Leelaphiwat S и Jultanmas R .