Афатиниб новейшее противоопухолевое средство: Афатиниб — описание вещества, фармакология, применение, противопоказания, формула
Профессор В.А. ГОРБУНОВА о новых перспективных противоопухолевых препаратах uMEDp
О наиболее перспективных терапевтических подходах к лечению злокачественных новообразований, современных исследованиях в этой области и механизмах действия некоторых высокоэффективных препаратов рассказывает заведующая отделением химиотерапии Российского онкологического научного центра им. Н.Н. Блохина РАМН, доктор медицинских наук, профессор Вера Андреевна ГОРБУНОВА.
– Вера Андреевна, какое из современных направлений онкологии Вы считаете наиболее перспективным?
– Современная клиническая онкология – одна из наиболее динамично развивающихся областей медицины. Например, в клинической практике США в настоящее время используется 125 противоопухолевых препаратов, которые упомянуты в справочнике под редакцией Де Вита, изданном в 2014 г. В справочнике Н.И. Переводчиковой описаны 145 противоопухолевых препаратов, в том числе противорвотных, то есть препаратов сопровождения.
Среди множества различных направлений в первую очередь хотелось бы отметить наиболее актуальное – таргетную терапию, нацеленную на определенные мишени опухолевой клетки, инициирующие злокачественный рост. Образно говоря, точное попадание в цель обеспечивает максимальный эффект. В качестве примера приведу препарат иматиниб (Гливек), который продемонстрировал высокую эффективность у больных с хроническим миелолейкозом и стромальными гастроинтестинальными опухолями, или так называемыми стромальными саркомами. В мировой клинической практике используется до 50 новых таргетных препаратов; насчитывается 139 препаратов, которые либо разрешены к использованию, либо находятся в фазах II и III клинических исследований. В России разрешены к применению 30 таргетных противоопухолевых лекарственных средств. Это свидетельствует о бурном развитии такого направления онкологии, как лекарственная терапия злокачественных опухолей.
Наличие большого количества противоопухолевых препаратов не препятствует созданию новых молекул, которые генерируются с поразительной скоростью. Сначала новые молекулы исследуются в условиях экспериментальной медицины, затем испытания продолжаются в клинике. Не будет преувеличением сказать, что сегодня в портфеле фармацевтических компаний насчитывается 100 и более новых молекул, находящихся на разных стадиях предклинических и ранних клинических испытаний.
Сначала новые молекулы исследуются в условиях экспериментальной медицины, затем испытания продолжаются в клинике. Не будет преувеличением сказать, что сегодня в портфеле фармацевтических компаний насчитывается 100 и более новых молекул, находящихся на разных стадиях предклинических и ранних клинических испытаний.
– Все ли таргетные препараты обладают таким же высокоточным действием, как иматиниб?
– Отнюдь. Другие препараты менее точны и соответственно характеризуются меньшим противоопухолевым эффектом, меньшей активностью, вызывают меньший процент объективных ремиссий. Но для таргетной терапии характерно такое воздействие на опухоль, как ее стабилизация. Зачастую мы не видим объективного эффекта, проявляющегося в уменьшении размеров опухоли, но наблюдаем стабилизацию процесса, иногда достаточно длительную. Именно благодаря введению в клиническую практику большого количества таргетных препаратов мы научились контролировать опухолевый процесс, то есть удерживать его в стадии ремиссии или стабилизации. Опухоль в принципе характеризуется отсутствием клинической симптоматики. Именно поэтому так трудна ее диагностика. Опухоль увеличивается в размерах, а симптомы болезни при этом отсутствуют. Человек чувствует себя абсолютно здоровым, его ничто не беспокоит до тех пор, пока не начнется механическое препятствие или сдавливание опухолью жизненно важных структур либо поражение нервных стволов, что вызывает боль. Контроль опухолевого процесса или его стабилизация – это тоже хороший выход при диссеминированном онкологическом заболевании. Современные препараты сделали это возможным. На наш взгляд, перспективы очень хорошие, поскольку новые обнадеживающие научные достижения обсуждаются на каждом научном симпозиуме. Не стал исключением и последний XVIII Российский онкологический конгресс, состоявшийся в ноябре 2014 г.
Опухоль в принципе характеризуется отсутствием клинической симптоматики. Именно поэтому так трудна ее диагностика. Опухоль увеличивается в размерах, а симптомы болезни при этом отсутствуют. Человек чувствует себя абсолютно здоровым, его ничто не беспокоит до тех пор, пока не начнется механическое препятствие или сдавливание опухолью жизненно важных структур либо поражение нервных стволов, что вызывает боль. Контроль опухолевого процесса или его стабилизация – это тоже хороший выход при диссеминированном онкологическом заболевании. Современные препараты сделали это возможным. На наш взгляд, перспективы очень хорошие, поскольку новые обнадеживающие научные достижения обсуждаются на каждом научном симпозиуме. Не стал исключением и последний XVIII Российский онкологический конгресс, состоявшийся в ноябре 2014 г.
– Насколько широко врачебное сообщество, различные клиники вовлечены в данные исследования?
– В научных клинических исследованиях принимает участие все больше медицинских учреждений РФ. Онкологические научные сообщества поддерживают проведение подобных исследований. Ведь знания, которые врачи получают в результате участия в клинических испытаниях, из научного формата переходят в практику. Важно, чтобы врачи не только были широко информированы о новейших достижениях, но и имели собственный практический опыт. Поэтому я выступаю за то, чтобы как можно больше клиник вовлекалось в этот процесс.
Онкологические научные сообщества поддерживают проведение подобных исследований. Ведь знания, которые врачи получают в результате участия в клинических испытаниях, из научного формата переходят в практику. Важно, чтобы врачи не только были широко информированы о новейших достижениях, но и имели собственный практический опыт. Поэтому я выступаю за то, чтобы как можно больше клиник вовлекалось в этот процесс.
РОНЦ им. Н.Н. Блохина принимает участие в исследованиях с 1994 г. Именно тогда впервые для изучения в России были предложены различные режимы паклитаксела (трех- и 24-часовые инфузии Таксола). В результате был выбран трехчасовой режим как наиболее перспективный. Но самые интересные исследования проводятся в настоящее время. Они включают новые направления, в том числе иммунотерапию.
– Как относятся больные к участию в клинических исследованиях?
– Для больных это возможность воспользоваться наиболее эффективными на данный момент методами лечения. Пациенты не только получают современные препараты, но и проходят лечение до тех пор, пока сохраняется позитивный эффект или продолжается стабилизация.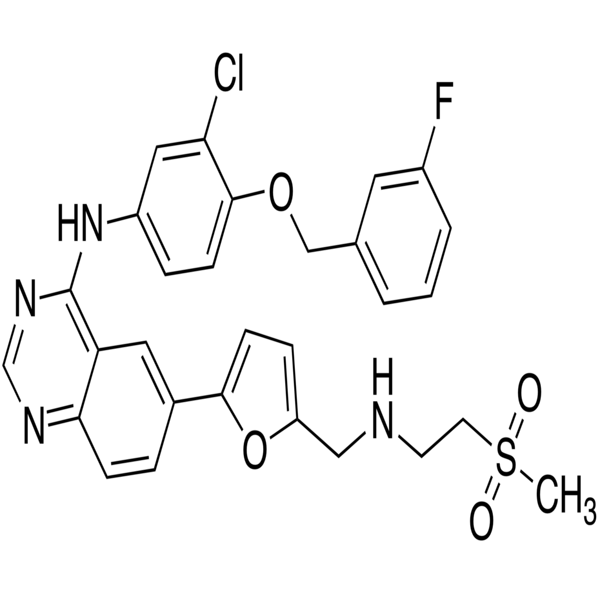 Для медицинских учреждений, вовлеченных в исследования, это еще и доступ к новейшим препаратам и возможность обеспечить ими своих пациентов в реальной клинической практике.
Для медицинских учреждений, вовлеченных в исследования, это еще и доступ к новейшим препаратам и возможность обеспечить ими своих пациентов в реальной клинической практике.
– Какие препараты, используемые в противоопухолевой терапии, наиболее совершенные?
– Препаратов, которые шагнули из научных исследований в практику, много. Все перечислять долго, но одни из последних – препараты с антиангиогенным механизмом действия. Например, новый препарат афлиберцепт (Залтрап) уже вошел в клиническую практику. Его действие обусловлено способностью связывать VEGF, блокируя сразу три рецептора сосудистого эндотелиального фактора роста. Блокада ростовых факторов препятствует формированию новых опухолевых сосудов. Препарат останавливает ангиогенез опухоли, становясь ловушкой для VEGF.
Мы изучали эффективность афлиберцепта при немелкоклеточном раке легкого и раке толстой кишки. При раке легкого препарат не был оценен как эффективный, поскольку не дал результатов по главному критерию – общей выживаемости. Тем не менее он продемонстрировал объективный эффект: у 52% больных отмечалось уменьшение размеров опухоли. Несмотря на то что афлиберцепт не вошел в клиническую практику при немелкоклеточном раке легкого, он оказался высокоэффективным в лечении рака толстой кишки. В этом случае эффективность препарата полностью подтверждена результатами общей выживаемости и выживаемости без прогрессирования. И по этому показанию препарат утвержден Минздравом России для лечения больных метастатическим раком толстой кишки.
Тем не менее он продемонстрировал объективный эффект: у 52% больных отмечалось уменьшение размеров опухоли. Несмотря на то что афлиберцепт не вошел в клиническую практику при немелкоклеточном раке легкого, он оказался высокоэффективным в лечении рака толстой кишки. В этом случае эффективность препарата полностью подтверждена результатами общей выживаемости и выживаемости без прогрессирования. И по этому показанию препарат утвержден Минздравом России для лечения больных метастатическим раком толстой кишки.
– Это исследование проводилось тоже на базе вашего центра?
– Да, мы участвовали в исследовании, в ходе которого химиотерапию в режиме FOLFIRI и афлиберцепт получали 17 наших больных. У 35,7% из них был получен позитивный эффект, у 50% наступила стабилизация. Таким образом, у большинства наших пациентов был достигнут контроль роста опухоли. Кроме того, достигнута общая цель исследования – улучшение общей выживаемости. В результате афлиберцепт применяется сегодня в России, как и во всех странах мира, для лечения больных колоректальным раком.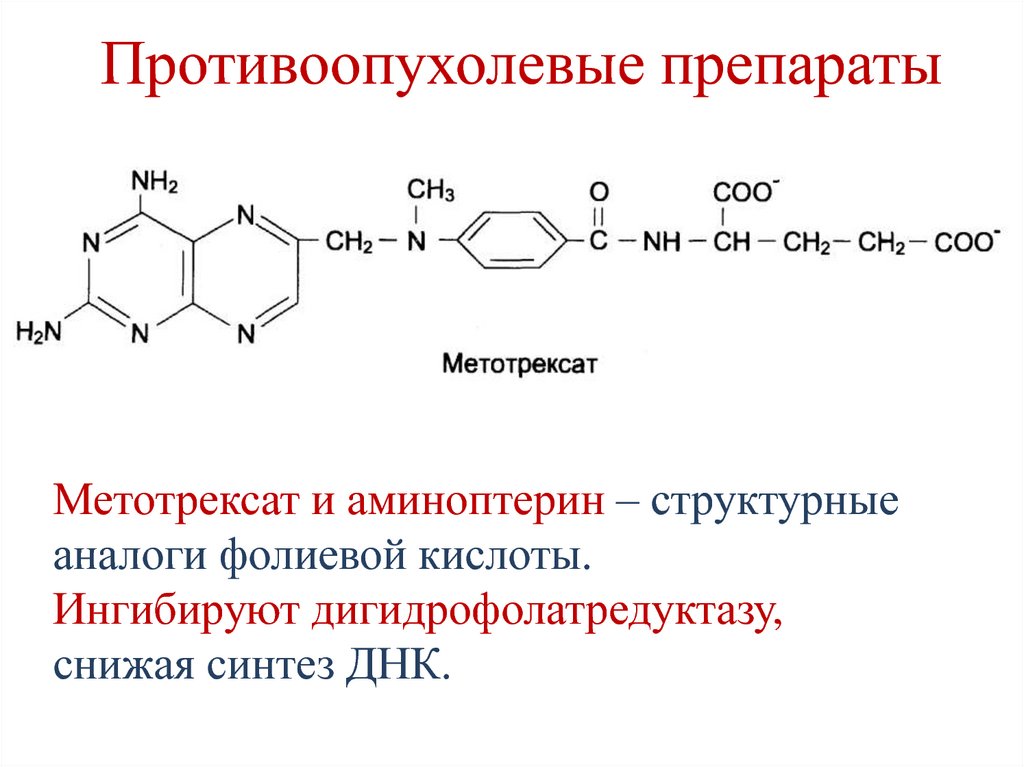
– Вы говорили о группе препаратов с антиангиогенным механизмом действия. У каждого препарата своя мишень?
– Да, мишени могут быть разные. Например, препарат из антиангиогенной группы рамуцирумаб. Этот таргетный препарат, блокирующий неоваскуляризацию за счет влияния на один из основных тирозинкиназных рецепторов –VEGFR-2, оказался эффективным при раке желудка и раке легкого. Мы участвовали в исследовании этого препарата. В ходе исследования REVEL в группе из 20 наших пациентов с немелкоклеточным раком легкого сравнивали эффективность совместного приема рамуцирумаба и доцетаксела с эффективностью плацебо в сочетании с доцетакселом. Был получен положительный результат. Общая выживаемость пациентов, принимавших рамуцирумаб, составила 11,8 месяца по сравнению с семью месяцами в контрольной группе. В настоящее время препарат проходит процедуру официального разрешения к применению за рубежом для лечения немелкоклеточного рака легкого. В США он уже утвержден для лечения рака желудка, в России планируется его утверждение в начале 2016 г.
– Такой прорыв в лекарственной терапии злокачественных новообразований связан с появлением именно антиангиогенной группы препаратов?
– Не только. Есть и другие, не менее перспективные направления. Это многие мультитаргетные лекарственные средства, воздействующие на несколько мишеней одновременно. Например, один из них – регорафениб уже разрешен для лечения 3-й линии больных метастатическим раком толстой кишки.
Еще один интересный препарат – ипилимумаб. Это новый препарат с иммунологическим механизмом действия, представляющий новое направление лекарственной терапии. Речь идет об иммунной терапии злокачественных опухолей, которая рассматривается сегодня как одна из наиболее перспективных. В самое ближайшее время мы ждем от этого направления выдающихся результатов. Несколько препаратов данного направления уже используются в клинической практике, большая часть находится на этапе клинических и предклинических исследований.
Действие иммуноблокатора CTLA-4 направлено на активацию Т-клеточного иммунитета, являющегося противоопухолевой защитой собственного иммунитета организма. Любой организм имеет иммунологическую защиту, но в определенный момент она блокируется и не может противостоять образованию и росту опухоли. Ипилимумаб ингибирует механизм блокирования собственного Т-клеточного иммунитета, который вновь начинает работать, обеспечивая противоопухолевую защиту. Препарат осуществляет лекарственную активацию иммунной системы, вооружая ее против новообразований. Ипилимумаб уже утвержден для лечения диссеминированной меланомы, сейчас изучается его эффективность при немелкоклеточном и мелкоклеточном раке легкого. В нашем отделении мы использовали данный препарат в комбинации с химиотерапией для лечения 32 больных мелкоклеточным раком легкого, которым провели 174 курса терапии. У 25 (75,7%) пациентов получен частичный объективный эффект. Стабилизация зафиксирована у четверых. Прогрессирование заболевания наблюдалось у одного больного, двое не были оценены. Эта эффективность сравнима с результатами одной химиотерапии при данной болезни. Однако интересен тот факт, что у ряда пациентов возможно нарастание эффекта после отмены химиотерапии.
Любой организм имеет иммунологическую защиту, но в определенный момент она блокируется и не может противостоять образованию и росту опухоли. Ипилимумаб ингибирует механизм блокирования собственного Т-клеточного иммунитета, который вновь начинает работать, обеспечивая противоопухолевую защиту. Препарат осуществляет лекарственную активацию иммунной системы, вооружая ее против новообразований. Ипилимумаб уже утвержден для лечения диссеминированной меланомы, сейчас изучается его эффективность при немелкоклеточном и мелкоклеточном раке легкого. В нашем отделении мы использовали данный препарат в комбинации с химиотерапией для лечения 32 больных мелкоклеточным раком легкого, которым провели 174 курса терапии. У 25 (75,7%) пациентов получен частичный объективный эффект. Стабилизация зафиксирована у четверых. Прогрессирование заболевания наблюдалось у одного больного, двое не были оценены. Эта эффективность сравнима с результатами одной химиотерапии при данной болезни. Однако интересен тот факт, что у ряда пациентов возможно нарастание эффекта после отмены химиотерапии. По сути это свидетельствует о включении иммунологического механизма действия.
По сути это свидетельствует о включении иммунологического механизма действия.
Существует еще одна группа интересных препаратов и в то же время новый подход к лечению – комбинированная таргетная терапия, используемая при раке молочной железы. Один из них – гуманизированное моноклональное антитело против экстрацеллюлярного домена HER2 – пертузумаб (Перьета), демонстрирующий защиту против HER2-позитивного метастатического рака молочной железы. Совместное применение пертузумаба и трастузумаба приводит к комплексной блокаде HER2. Связываясь с различными доменами HER2, препараты оказывают синергическое действие, что позволяет осуществлять двойное воздействие на опухоль – двойную таргетную терапию. Пертузумаб также используется в новом, уже одобренном методе лечения, заключающемся в комбинировании пертузумаба, трастузумаба и доцетаксела. Этот метод показывает хорошие результаты с максимальными результатами по общей выживаемости.
Возможности комбинации по типу «два в одном стакане» демонстрирует новый препарат T-DM1 (трастузумаб эмтанзин), сочетающий цитотоксическое вещество эмтанзин с анти-HER2-таргетным препаратом трастузумабом, достаточно давно применяемым в лекарственной терапии. Двойное действие T-DM1, одобренного для практического использования под названием Кадсила, значительно повышает эффективность лечения.
Двойное действие T-DM1, одобренного для практического использования под названием Кадсила, значительно повышает эффективность лечения.
Препарат эверолимус (Афинитор) – ингибитор mTOR – утвержден для лечения нейроэндокринных опухолей и рака молочной железы. При гормонозависимых формах рака молочной железы он применяется как препарат, восстанавливающий гормональную чувствительность. Например, когда гормонотерапия уже не действует, к ней добавляют эверолимус. Наблюдается противоопухолевый эффект, который может продолжаться долгое время.
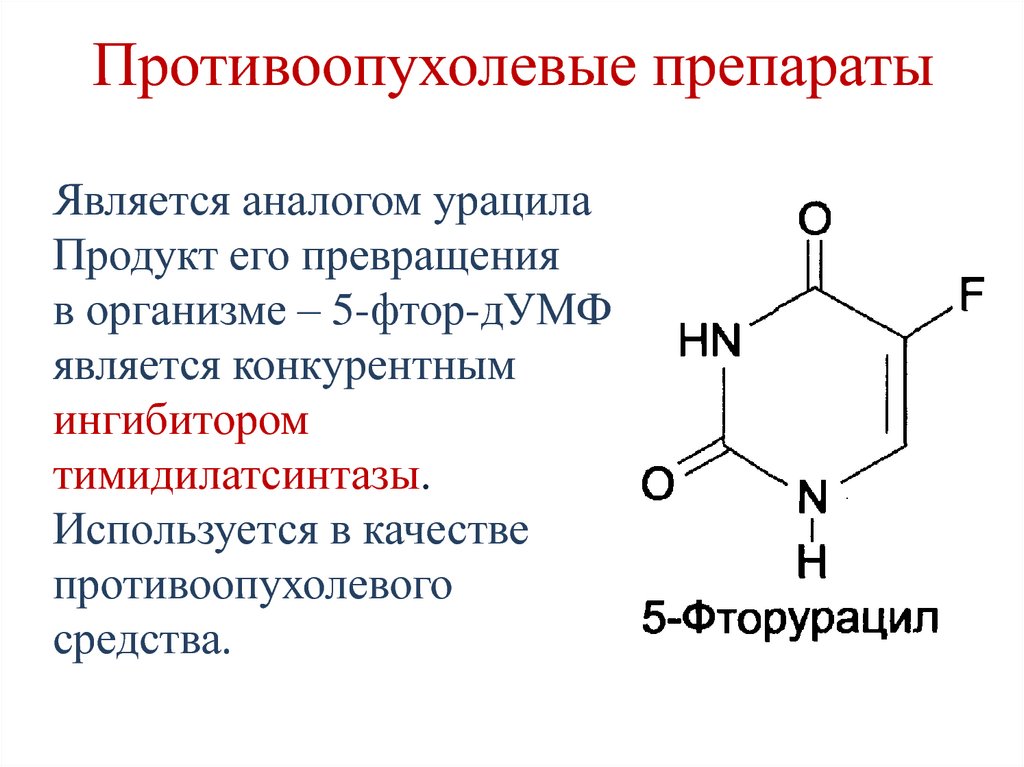
Одним из последних достижений в лечении больных немелкоклеточным раком легкого с мутацией эпидермального фактора роста EGFR стал препарат афатиниб (Гиотриф). Его эффективность изучали в отделении химиотерапии и продолжают изучать в отделении для лечения больных раком легкого РОНЦ им. Н.Н. Блохина. Препарат представляет собой селективный пероральный необратимый блокатор семейства ErbB EGFR-ErbBl, HER2 (ErbB2) и ErbB4. В двух исследованиях продемонстрировано улучшение общей выживаемости при использовании этого препарата. При ретроспективной оценке показано, что в группе больных с мутацией в экзоне 19 (Del19) наблюдается максимальный эффект. Медиана общей выживаемости достигла предельно высокого значения. Именно при использовании афатиниба медиана составила 33,3 месяца. Это очень хороший показатель при диссеминированном процессе.
При ретроспективной оценке показано, что в группе больных с мутацией в экзоне 19 (Del19) наблюдается максимальный эффект. Медиана общей выживаемости достигла предельно высокого значения. Именно при использовании афатиниба медиана составила 33,3 месяца. Это очень хороший показатель при диссеминированном процессе.
Из отечественных лекарственных средств хотелось бы выделить препарат Араноза, относящийся к цитотоксическим препаратам, производным нитрозомочевин. И хотя эта группа препаратов постепенно выходит из широкого клинического использования, более узкие показания остаются. Араноза является аналогом стрептозотоцина, утвержденного и применяемого у больных с нейроэндокринными опухолями. Однако в нашу страну стрептозотоцин не поставляют.
Под руководством профессора М.Н. Преображенской в лаборатории химического синтеза РОНЦ им. Н.Н. Блохина был создан препарат Араноза, неполный аналог стрептозотоцина, весьма эффективный при экспериментальном изучении. Согласно результатам более ранних клинических исследований препарат был утвержден для лечения больных диссеминированной меланомой. В настоящее время изучается эффективность препарата при нейроэндокринных опухолях. Первые результаты весьма обнадеживающие.
В настоящее время изучается эффективность препарата при нейроэндокринных опухолях. Первые результаты весьма обнадеживающие.
Появилось два новых лекарственных средства и для лечения больных саркомами мягких тканей. Препарат пазопаниб (Вотриент) – мультитирозинкиназный ингибитор – мы изучали при саркомах мягких тканей. Были оценены эффекты у 40 из 42 больных, контроль роста опухоли составил 77,5%.
Изучен также препарат трабектедин (Йонделис), который относится к новым цитотоксическим препаратам и является алкалоидом природного происхождения, получаемым из морского оболочечника. Он эффективен при саркомах мягких тканей, особенно при липосаркомах и лейомиосаркомах. При его применении у 50 больных были получены частичный эффект у пяти и стабилизация у 23 пациентов. Таким образом, контроль роста опухоли составил 56%. Препарат также показан для лечения больных раком яичников. Наибольший эффект препарат продемонстрировал у той категории больных, которая имела ремиссию после первоначального лечения длительностью от шести до 12 месяцев.
Как видим, для каждого лекарственного средства можно выделить особые показания, что подтверждает и поддерживает существующую тенденцию к индивидуализации или персонализации лекарственной терапии.
– Вера Андреевна, судя по тому, что Вы рассказали, в РОНЦ им. Н.Н. Блохина идет активная работа и по клиническим исследованиям, и по созданию новых препаратов. Хватает ли кадров, достаточен ли уровень их квалификации?
– Поскольку сейчас у нас проводится много мероприятий, общая подготовленность врачей, участвующих в них, достаточно высока. Однако не могу утверждать, что все специалисты обладают знаниями, позволяющими квалифицированно и правильно осуществлять тактику лечения онкологических больных. В связи с этим трудно переоценить роль школ, семинаров и конференций. Специалисты нашего центра – высокообразованные квалифицированные врачи.
Что касается профессиональной подготовки молодежи, здесь существует ряд проблем. На мой взгляд, в образовательную программу медицинских вузов следует ввести ряд дисциплин.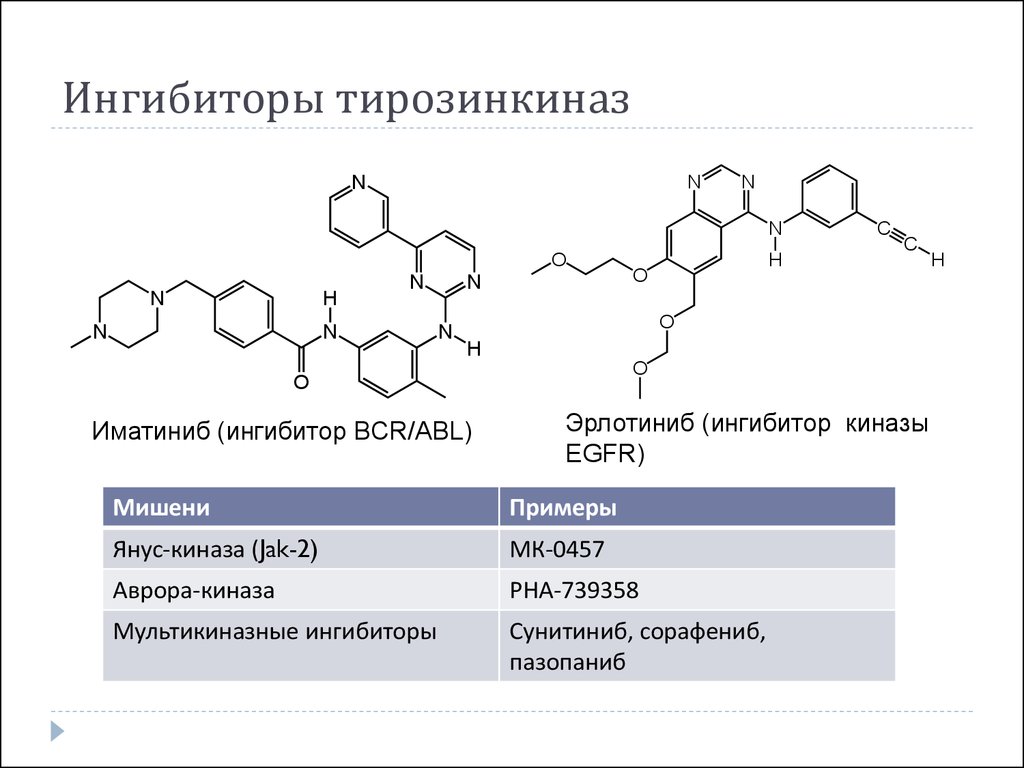 Например, для онкологов чрезвычайно важно изучение генетики и иммунологии. Это две дисциплины, которые должны быть включены в программу обучения онкологов. В свое время нам преподавали генетику, но в недостаточном объеме. Была и иммунология, но сегодня другие подходы в онкологии благодаря развитию этих направлений. Мы вынуждены изучать их самостоятельно. Основные современные направления онкологии связаны с генетикой, многие – с иммунологией. Молодой специалист сможет хорошо ориентироваться в современной онкологии, если будет знать и понимать все процессы и зависимости, происходящие в опухолевой клетке. Крайне важно также, чтобы молодые люди обладали уверенными знаниями о фармакокинетике, фармакодинамике, взаимодействии различных групп препаратов. Этот запас знаний необходим для того, чтобы в конечном итоге мы смогли осуществлять персонализированную медицину.
Например, для онкологов чрезвычайно важно изучение генетики и иммунологии. Это две дисциплины, которые должны быть включены в программу обучения онкологов. В свое время нам преподавали генетику, но в недостаточном объеме. Была и иммунология, но сегодня другие подходы в онкологии благодаря развитию этих направлений. Мы вынуждены изучать их самостоятельно. Основные современные направления онкологии связаны с генетикой, многие – с иммунологией. Молодой специалист сможет хорошо ориентироваться в современной онкологии, если будет знать и понимать все процессы и зависимости, происходящие в опухолевой клетке. Крайне важно также, чтобы молодые люди обладали уверенными знаниями о фармакокинетике, фармакодинамике, взаимодействии различных групп препаратов. Этот запас знаний необходим для того, чтобы в конечном итоге мы смогли осуществлять персонализированную медицину.
– Спасибо за интересное интервью.
МНН | лекарственная форма | производитель |
Препараты для лечения заболеваний печени и желчевыводящих путей | ||
Янтарная кислота+Меглумин+Инозин+Метионин+Никотинамид | р/р для инфузий | НТФФ «Полисан» |
Противодиарейные, кишечные противовоспалительные и противомикробные препараты | ||
Месалазин | суппозитарии, суспензия, таблетки | несколько |
Средства для лечения сахарного диабета | ||
Ликсисенатид | р/р для подкожного введения | Sanofi |
Эмпаглифлозин | таблетки | Boehringer Ingelheim |
Другие препараты для лечения заболеваний желудочно-кишечного тракта и нарушений обмена веществ | ||
Элиглустат | капсулы | Sanofi |
Гемостатики | ||
Элтромбопаг | таблетки | Скопинфарм |
Препараты, влияющие на систему ренин-ангиотензин | ||
Валсартан+Сакубитрил | таблетки | Novartis |
Гиполипидемические препараты | ||
Алирокумаб | р/р для подкожного введения | Sanofi |
Эволокумаб | р/р для подкожного введения | Amgen |
Гормоны гипофиза и гипоталамуса и их аналоги | ||
Ланреотид | гель для подкож. | Ipsen |
Антибактериальные препараты для системного использования | ||
Телаванцин | лиофилизат для приготовления р/ра для инфузий | Р-Фарм |
Даптомицин | лиофилизат для приготовления р/ра для инфузий | MSD |
Тедизолид | таблетки, лиофилизат для пригот. концентрата для пригот. р/ра для инфузий | Bayer |
Противовирусные препараты для системного применения | ||
Дасабувир; Омбитасвир+Паритапревир+Ритонавир | таблеток набор | Р-Фарм |
Нарлапревир | таблетки | Р-Фарм |
Даклатасвир | таблетки | Р-Фарм |
Долутегравир | таблетки | ViiV Healthcare |
Противоопухолевые препараты | ||
Кабазитаксел | концентрат для приготовления р/ра для инфузий | Sanofi |
Брентуксимаб ведотин | лиофилизат д/пригот концентрата д/пригот р/ра для инфузий | Takeda |
Ниволумаб | концентрат для приготовления р/ра для инфузий | Bristol-Myers Squibb |
Обинутузумаб | концентрат для приготовления р/ра для инфузий | Roche |
Панитумумаб | концентрат для приготовления р/ра для инфузий | Amgen |
Пембролизумаб | концентрат для приготовления р/ра для инфузий | Р-Фарм |
Пертузумаб | концентрат для приготовления р/ра для инфузий | Roche |
Трастузумаб эмтанзин | лиофилизат для приготовления концентрата для приготовления р/ра для инфузий | Roche |
Афатиниб | таблетки | Boehringer Ingelheim |
Дабрафениб | капсулы | Скопинфарм |
Кризотиниб | капсулы | Pfizer |
Нинтеданиб | капсулы мягкие | Boehringer Ingelheim |
Пазопаниб | таблетки | Российское общество клинической онкологии |
Регорафениб | таблетки | Bayer |
Руксолитиниб | таблетки | Скопинфарм |
Траметиниб | таблетки | Скопинфарм |
Афлиберцепт | концентрат для приготовления р/ра для инфузий | Sanofi |
Висмодегиб | капсулы | Roche |
Карфилзомиб | лиофилизат для приготовления р/ра для инфузий | Amgen |
Фактор некроза опухоли альфа-1 [тимозин рекомбинантный]* | лиофилизат для приготовления р/ра для подкожного введения | Рефнот-Фарм |
Противоопухолевые гормональные препараты | ||
Энзалутамид | капсулы | Astellas Pharma |
Дегареликс | лиофилизат для приготовления р/ра для подкожного введения | Ferring Pharmaceuticals |
Иммуномодуляторы | ||
Пэгинтерферон бета-1a | р/р для подкожного введения | Johnson & Johnson |
Иммунодепрессанты | ||
Алемтузумаб | концентрат для приготовления р/ра для инфузий | Sanofi |
Апремиласт | таблетки | Фармстандарт-Лекарства |
Ведолизумаб | лиофилизат для приготовления концентрата для приготовл р/ра для инфузий | Takeda |
Тофацитиниб | таблетки | Pfizer |
Канакинумаб | лиофилизат для приготовления р/ра для подкожного введения | Novartis |
Секукинумаб | лиофилизат для приготовления раствора д/подкожн введения; | Novartis |
Пирфенидон | капсулы | Roche |
Противовоспалительные и противоревматические препараты | ||
Декскетопрофен | р/ для внутривенного и внутримышечного введения | Berlin Chemie |
Анестетики | ||
Левобупивакаин | раствор для инъекций | Abbvie |
Противоэпилептические препараты | ||
Перампанел | таблетки | Eisai |
Препараты для лечения заболеваний нервной системы другие | ||
Диметилфумарат | капсулы кишечнорастворимые | Johnson & Johnson |
Тетрабеназин | таблетки | Farma Mondo |
Препараты для лечения обструктивных заболеваний дыхательных путей | ||
Вилантерол+Флутиказона фуроат | порошок для ингаляций дозированный | GSK |
Гликопиррония бромид+Индакатерол | капсулы с порошком для ингаляций | Novartis |
Олодатерол+Тиотропия бромид | раствор для ингаляций дозированный | Boehringer Ingelheim |
Другие препараты для лечения заболеваний дыхательной системы | ||
Берактант | суспензия для эндотрахеального введения | Фармстандарт-Лекарства |
Препараты для лечения заболеваний глаз | ||
Тафлупрост | капли глазные | Santen |
Афлиберцепт | раствор для внутриглазного введения | Bayer |
Другие лечебные средства | ||
Комплекс b-железа (III) оксигидроксида, сахарозы и крахмала | таблетки жевательные | Fresenius Kabi |
Йомепрол | раствор для инъекций | Имэкс |
Новый многоцелевой ингибитор семейства ErbB афатиниб блокирует индуцированную EGF передачу сигналов и индуцирует апоптоз при нейробластоме
1. Brodeur GM. Нейробластома: биологический взгляд на клиническую загадку. Природа отзывается о Раке. 2003; 3: 203–216. [PubMed] [Google Scholar]
2. Ирвин М.С., Парк Дж.Р. Нейробластома: парадигма прецизионной медицины. Педиатр Клин Норт Ам. 2015;62:225–256. [PubMed] [Google Scholar]
3. Louis CU, Shohet JM. Нейробластома: молекулярный патогенез и терапия. Анну Рев Мед. 2015;66:49–63. [Бесплатная статья PMC] [PubMed] [Google Scholar]
4. Николай С., Пьераччоли М., Пескьяроли А., Мелино Г., Расчелла Г. Нейробластома: онкогенные механизмы и терапевтическое использование некроптоза. Клеточная смерть Дис. 2015;6:e2010. [Бесплатная статья PMC] [PubMed] [Google Scholar]
5. Смит М.А., Сейбел Н.Л., Альтекрусе С.Ф., Рис Л.А., Мелберт Д.Л., О’Лири М., Смит Ф.О., Риман Г.Х. Исходы для детей и подростков, больных раком: вызовы двадцать первого века. Дж. Клин Онкол. 2010;28:2625–2634. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Дж. Клин Онкол. 2010;28:2625–2634. [Бесплатная статья PMC] [PubMed] [Google Scholar]
6. Марис Дж.М., Хогарти М.Д., Багателл Р., Кон С.Л. Нейробластома. Ланцет. 2007; 369:2106–2120. [PubMed] [Google Scholar]
7. Hynes NE, Lane HA. Рецепторы ERBB и рак: сложность целевых ингибиторов. Нат Рев Рак. 2005; 5: 341–354. [PubMed] [Google Scholar]
8. Sequist LV, Soria JC, Goldman JW, Wakelee HA, Gadgeel SM, Varga A, Papadimitrakopoulou V, Solomon BJ, Oxnard GR, Dziadziuszko R, Aisner DL, Doebele RC, Galasso C, и другие. Роцилетиниб при немелкоклеточном раке легкого с мутацией EGFR. N Engl J Med. 2015; 372:1700–1709. [PubMed] [Google Scholar]
9. Brands RC, Muller-Richter UD, De Donno F, Seher A, Mutzbauer G, Linz C, Kubler AC, Hartmann S. Совместное лечение рака головы и шеи с EGFR дикого типа клеточные линии с афатинибом и цисплатином. Mol Med Rep. 2016;13:2338–2344. [PubMed] [Google Scholar]
10. Bellizzi A, Greco MR, Rubino R, Paradiso A, Forciniti S, Zeeberg K, Cardone RA, Reshkin SJ. Каркасный белок NHERF1 повышает чувствительность EGFR-зависимого роста, подвижности и функции инвадоподий к лечению гефитинибом в клетках рака молочной железы. Int J Oncol. 2015;46:1214–1224. [PubMed] [Академия Google]
Каркасный белок NHERF1 повышает чувствительность EGFR-зависимого роста, подвижности и функции инвадоподий к лечению гефитинибом в клетках рака молочной железы. Int J Oncol. 2015;46:1214–1224. [PubMed] [Академия Google]
11. Левандовска М.А., Чубак К., Клоновска К., Йозвицки В., Ковалевски Дж., Козловски П. Использование стратегии двухуровневого тестирования для одновременного обнаружения небольших мутаций EGFR и амплификации EGFR при раке легкого. ПЛОС Один. 2015;10:e0117983. [Бесплатная статья PMC] [PubMed] [Google Scholar]
12. Lynch TJ, Bell DW, Sordella R, Gurubhagavatula S, Okimoto RA, Brannigan BW, Harris PL, Haserlat SM, Supko JG, Haluska FG, Louis DN, Christiani округ Колумбия, Сетлман Дж. и др. Активирующие мутации в рецепторе эпидермального фактора роста, лежащие в основе реакции немелкоклеточного рака легкого на гефитиниб. N Engl J Med. 2004;350:2129–2139. [PubMed] [Google Scholar]
13. Walker F, Abramowitz L, Benabderrahmane D, Duval X, Descatoire V, Henin D, Lehy T, Aparicio T. Экспрессия рецептора фактора роста в анальных плоскоклеточных поражениях: модификации, связанные с онкогенным вирусом папилломы человека и вирус иммунодефицита человека. Хум Патол. 2009;40:1517–1527. [PubMed] [Google Scholar]
Экспрессия рецептора фактора роста в анальных плоскоклеточных поражениях: модификации, связанные с онкогенным вирусом папилломы человека и вирус иммунодефицита человека. Хум Патол. 2009;40:1517–1527. [PubMed] [Google Scholar]
14. Kuan CT, Wikstrand CJ, Bigner DD. Мутантный рецептор EGF vIII как молекулярная мишень в терапии рака. Endocr Relat Рак. 2001; 8: 83–9.6. [PubMed] [Google Scholar]
15. Harris RC, Chung E, Coffey RJ. Лиганды рецептора ЭФР. Разрешение ячейки опыта. 2003; 284:2–13. [PubMed] [Google Scholar]
16. Ojeda SR, Ma YJ, Rage F. Семейство генов трансформирующего фактора роста альфа участвует в нейроэндокринном контроле полового созревания млекопитающих. Мол Психиатрия. 1997; 2: 355–358. [PubMed] [Google Scholar]
17. Сешачарьюлу П., Поннусами М.П., Харидас Д., Джайн М., Ганти А.К., Батра С.К. Ориентация на сигнальный путь EGFR в терапии рака. Экспертное мнение о терапевтических мишенях. 2012; 16:15–31. [Бесплатная статья PMC] [PubMed] [Google Scholar]
18. Colomiere M, Ward AC, Riley C, Trenerry MK, Cameron-Smith D, Findlay J, Ackland L, Ahmed N. Взаимная связь сигналов между EGFR и IL-6R через JAK2/STAT3 опосредует эпителиально-мезенхимальный переход в карциномы яичников. Британский журнал рака. 2009; 100:134–144. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Colomiere M, Ward AC, Riley C, Trenerry MK, Cameron-Smith D, Findlay J, Ackland L, Ahmed N. Взаимная связь сигналов между EGFR и IL-6R через JAK2/STAT3 опосредует эпителиально-мезенхимальный переход в карциномы яичников. Британский журнал рака. 2009; 100:134–144. [Бесплатная статья PMC] [PubMed] [Google Scholar]
19. Ho R, Minturn JE, Hishiki T, Zhao H, Wang Q, Cnaan A, Maris J, Evans AE, Brodeur GM. Пролиферация нейробластом человека опосредована рецептором эпидермального фактора роста. Рак Рез. 2005;65:9868–9875. [PubMed] [Google Scholar]
20. Richards KN, Zweidler-McKay PA, Van Roy N, Speleman F, Trevino J, Zage PE, Hughes DP. Передача сигналов тирозинкиназ рецептора ERBB способствует росту нейробластомы in vitro и in vivo . Рак. 2010;116:3233–3243. [Бесплатная статья PMC] [PubMed] [Google Scholar]
21. Tamura S, Hosoi H, Kuwahara Y, Kikuchi K, Otabe O, Izumi M, Tsuchiya K, Iehara T, Gotoh T, Sugimoto T. Индукция апоптоза с помощью ингибитор EGFR в клетках нейробластомы. Biochem Biophys Res Commun. 2007; 358: 226–232. [PubMed] [Академия Google]
Biochem Biophys Res Commun. 2007; 358: 226–232. [PubMed] [Академия Google]
22. Дунго Р.Т., Китинг Г.М. Афатиниб: первое глобальное одобрение. Наркотики. 2013;73:1503–1515. [PubMed] [Google Scholar]
23. Ли Д., Амброджо Л., Шимамура Т., Кубо С., Такахаши М., Кириак Л.Р., Падера Р.Ф., Шапиро Г.И., Баум А., Химмельсбах Ф., Реттиг В.Дж., Мейерсон М., Солка Ф., и другие. BIBW2992, необратимый ингибитор EGFR/HER2, высокоэффективный в доклинических моделях рака легких. Онкоген. 2008; 27:4702–4711. [Бесплатная статья PMC] [PubMed] [Google Scholar]
24. Solca F, Dahl G, Zoephel A, Bader G, Sanderson M, Klein C, Kraemer O, Himmelsbach F, Haaksma E, Adolf GR. Свойства связывания с мишенью и клеточная активность афатиниба (BIBW 2992), необратимый блокатор семейства ErbB. J Pharmacol Exp Ther. 2012; 343:342–350. [PubMed] [Google Scholar]
25. Modjtahedi H, Cho BC, Michel MC, Solca F. Всесторонний обзор доклинического профиля эффективности блокатора семейства ErbB афатиниба при раке. Naunyn Schmiedebergs Arch Pharmacol. 2014; 387: 505–521. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Naunyn Schmiedebergs Arch Pharmacol. 2014; 387: 505–521. [Бесплатная статья PMC] [PubMed] [Google Scholar]
26. Harbeck N, Solca F, Gauler TC. Доклиническая и клиническая разработка афатиниба: в центре внимания рак молочной железы и плоскоклеточный рак головы и шеи. Онкол будущего. 2014;10:21–40. [PubMed] [Академия Google]
27. De Pauw I, Wouters A, Van den Bossche J, Peeters M, Pauwels P, Deschoolmeester V, Vermorken JB, Lardon F. Доклинические и клинические исследования афатиниба в монотерапии и в комбинированных режимах: потенциальное влияние на колоректальный рак. Фармакол Тер. 2016; 166:71–83. [PubMed] [Google Scholar]
28. Cappuzzo F, Finocchiaro G, Grossi F, Bidoli P, Favaretto A, Marchetti A, Valente ML, Cseh A, Clementi L, Massey D, Santoro A. Исследование фазы II афатиниба, необратимый блокатор семейства ErbB при EGFR FISH-положительном немелкоклеточном раке легкого. Дж. Торак Онкол. 2015;10:665–672. [PubMed] [Академия Google]
29. Чжан В.Дж., Чжу Дж. Ф., Ван Л.М. Ингибирование пролиферации и индукция апоптоза в клетках ретинобластомы RB116 при лечении афатинибом. Опухоль биол. 2016; 37:9249–9254. [PubMed] [Google Scholar]
Ф., Ван Л.М. Ингибирование пролиферации и индукция апоптоза в клетках ретинобластомы RB116 при лечении афатинибом. Опухоль биол. 2016; 37:9249–9254. [PubMed] [Google Scholar]
30. Tang Y, Zhang X, Qi F, Chen M, Li Y, Liu L, He W, Li Z, Zu X. Афатиниб ингибирует пролиферацию и инвазию и способствует апоптозу мочевого пузыря T24. линию раковых клеток. Эксперт Тер Мед. 2015; 9: 1851–1856. [Бесплатная статья PMC] [PubMed] [Google Scholar]
31. Чао Т.Т., Ван Ц.Ю., Чен Ю.Л., Лай Ц.К., Чанг Ф.Ю., Цай Ю.Т., Чао Ч., Шиау Ч.В., Хуан Ю.С., Юй СиДжей, Чен К.Ф. Афатиниб индуцирует апоптоз при НМРЛ без мутации EGFR посредством Elk-1-опосредованной супрессии CIP2A. Онкотаргет. 2015; 6: 2164–2179. doi: 10.18632/oncotarget.2941. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
32. Данешманеш А.Х., Ходжат-Фарсанги М., Мошфег А., Хан А.С., Микаэльссон Э., Остерборг А., Меллстедт Х. Путь PI3K/AKT/mTOR участвует в прямом апоптозе клеток CLL, индуцированном моноклональными антителами ROR1. Бр Дж Гематол. 2015; 169: 455–458. [PubMed] [Google Scholar]
Бр Дж Гематол. 2015; 169: 455–458. [PubMed] [Google Scholar]
33. Meyers MB, Shen WP, Spengler BA, Ciccarone V, O’Brien JP, Donner DB, Furth ME, Biedler JL. Увеличение рецептора эпидермального фактора роста в клетках нейробластомы человека с множественной лекарственной устойчивостью. Джей Селл Биохим. 1988;38:87–97. [PubMed] [Google Scholar]
34. Mendelsohn J, Baselga J. Нацеливание на рецептор эпидермального фактора роста при раке. Семин Онкол. 2006; 33: 369–385. [PubMed] [Google Scholar]
35. Izycka-Swieszewska E, Brzeskwiniewicz M, Wozniak A, Drozynska E, Grajkowska W, Perek D, Balcerska A, Klepacka T, Limon J. Статус генов EGFR, PIK3CA и PTEN и их белок экспрессия продукта в нейробластных опухолях. Фолиа Нейропатол. 2010; 48: 238–245. [PubMed] [Google Scholar]
36. Пью Т.Дж., Морозова О., Аттие Э.Ф., Асгарзаде С., Вей Дж.С., Оклер Д., Картер С.Л., Цибульскис К., Ханна М., Киезун А., Ким Дж., Лоуренс М.С., Лихенштейн Л., и другие. Генетический ландшафт нейробластомы высокого риска. Нат Жене. 2013;45:279–284. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Нат Жене. 2013;45:279–284. [Бесплатная статья PMC] [PubMed] [Google Scholar]
37. Eleveld TF, Oldridge DA, Bernard V, Koster J, Daage LC, Diskin SJ, Schild L, Bentahar NB, Bellini A, Chicard M, Lapouble E, Combaret V, Legoix-Ne P и др. Рецидивирующие нейробластомы демонстрируют частые мутации пути RAS-MAPK. Нат Жене. 2015; 47: 864–871. [Бесплатная статья PMC] [PubMed] [Google Scholar]
38. Келлер Дж., Нимнуал А.С., Варгезе М.С., ВанХейст К.А., Хейман М.Дж., Чан Э.Л. Новый мутант внеклеточного домена EGFR, EGFRdelta768, обладает особыми биологическими и биохимическими свойствами при нейробластоме. Мол Рак Рез. 2016; 14:740–752. [Бесплатная статья PMC] [PubMed] [Google Scholar]
39. Evangelopoulos ME, Weis J, Kruttgen A. Сигнальные пути, ведущие к дифференцировке нейробластомы после отмены сыворотки: HDL блокирует дифференцировку нейробластомы путем ингибирования EGFR. Онкоген. 2005; 24:3309–3318. [PubMed] [Google Scholar]
40. Evangelopoulos ME, Weis J, Kruttgen A. Мевастатин-индуцированный рост нейритов клеток нейробластомы посредством активации EGFR. J Neurosci Res. 2009; 87: 2138–2144. [PubMed] [Google Scholar]
Мевастатин-индуцированный рост нейритов клеток нейробластомы посредством активации EGFR. J Neurosci Res. 2009; 87: 2138–2144. [PubMed] [Google Scholar]
41. Ватануки З., Косай Х., Осанай Н., Огама Н., Мочизуки М., Тамаи К., Ямагучи К., Сато К., Фукухара Т., Маемондо М., Ичиносе М., Нукива Т., Танака Н. Синергетическая цитотоксичность афатиниба и цетуксимаба в отношении EGFR T790M включает рециклинг Rab11-зависимого EGFR. Biochem Biophys Res Commun. 2014; 455: 269–276. [PubMed] [Google Scholar]
42. Ioannou N, Seddon AM, Dalgleish A, Mackintosh D, Modjtahedi H. Лечение комбинацией блокатора семейства ErbB (HER) афатиниба и ингибитора IGF-IR, NVP-AEW541 вызывает синергетическое ингибирование роста клеток рака поджелудочной железы человека. БМК Рак. 2013;13:41. [Статья бесплатно PMC] [PubMed] [Google Scholar]
43. Chen G, Noor A, Kronenberger P, Teugels E, Umelo IA, De Greve J. Синергетический эффект афатиниба с su11274 в клетках немелкоклеточного рака легкого, устойчивых к гефитинибу или эрлотинибу. ПЛОС Один. 2013;8:e59708. [Бесплатная статья PMC] [PubMed] [Google Scholar]
ПЛОС Один. 2013;8:e59708. [Бесплатная статья PMC] [PubMed] [Google Scholar]
44. Arora A, Scholar EM. Роль ингибиторов тирозинкиназы в терапии рака. J Pharmacol Exp Ther. 2005; 315:971–979. [PubMed] [Google Scholar]
45. Shawver LK, Slamon D, Ullrich A. Умные лекарства: ингибиторы тирозинкиназы в терапии рака. Раковая клетка. 2002; 1: 117–123. [PubMed] [Google Scholar]
46. Мадхусудан С., Ганесан Т.С. Ингибиторы тирозинкиназы в терапии рака. Клин Биохим. 2004; 37: 618–635. [PubMed] [Академия Google]
47. Роскоски Р., мл. Протеин-тирозинкиназы ErbB/HER: структуры и низкомолекулярные ингибиторы. Фармакол рез. 2014;87:42–59. [PubMed] [Google Scholar]
48. Cheng W, Hu Y, Sheng R. Разработка низкомолекулярных ингибиторов семейства EGFR для противоопухолевого вмешательства: обзор одобренных препаратов и клинических кандидатов. Курр Мед Хим. 2014;21:4374–4404. [PubMed] [Google Scholar]
49. Kuang Y, Rogers A, Yeap BY, Wang L, Makrigiorgos M, Vetrand K, Thiede S, Distel RJ, Janne PA. Неинвазивное обнаружение EGFR T790M при немелкоклеточном раке легкого, устойчивом к гефитинибу или эрлотинибу. Клин Рак Рез. 2009;15:2630–2636. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Неинвазивное обнаружение EGFR T790M при немелкоклеточном раке легкого, устойчивом к гефитинибу или эрлотинибу. Клин Рак Рез. 2009;15:2630–2636. [Бесплатная статья PMC] [PubMed] [Google Scholar]
50. Нгуен К.С., Кобаяши С., Коста Д.Б. Приобретенная устойчивость к ингибиторам тирозинкиназы рецептора эпидермального фактора роста при немелкоклеточном раке легкого зависит от пути рецептора эпидермального фактора роста. Клин Рак легких. 2009; 10: 281–289. [Бесплатная статья PMC] [PubMed] [Google Scholar]
51. Yun C-H, Mengwasser KE, Toms AV, Woo MS, Greulich H, Wong K-K, Meyerson M, Eck MJ. Т79Мутация 0M киназы EGFR вызывает лекарственную устойчивость за счет увеличения сродства к АТФ. Труды Национальной академии наук. 2008;105:2070–2075. [Бесплатная статья PMC] [PubMed] [Google Scholar]
52. Oxnard GR, Arcila ME, Chmielecki J, Ladanyi M, Miller VA, Pao W. Новые стратегии преодоления приобретенной устойчивости к ингибиторам тирозинкиназы рецептора эпидермального фактора роста в легких рак. Клинические исследования рака. 2011;17:5530–5537. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Клинические исследования рака. 2011;17:5530–5537. [Бесплатная статья PMC] [PubMed] [Google Scholar]
53. Доллофф Н.Г., Майес П.А., Харт Л.С., Диккер Д.Т., Хамфрис Р., Эль-Дейри В.С. Нецелевая активность лапатиниба сенсибилизирует раковые клетки толстой кишки за счет активации рецептора смерти TRAIL. Sci Transl Med. 2011;3:86ra50. [Бесплатная статья PMC] [PubMed] [Google Scholar]
54. Дэнси Дж. Э., Фрейдлин Б. Ориентация на рецептор эпидермального фактора роста — не попали ли мы в цель? Ланцет. 2003; 362: 62–64. [PubMed] [Google Scholar]
55. Борди П., Тисео М., Бортези Б., Налди Н., Бути С., Ардиццони А. Преодоление T79Приобретенная резистентность к ингибиторам тирозинкиназы EGFR при приеме афатиниба, вызванная 0M: отчет о клиническом случае. Тумори. 2014;100:e20–23. [PubMed] [Google Scholar]
56. Zhang H, Dou J, Yu Y, Zhao Y, Fan Y, Cheng J, Xu X, Liu W, Guan S, Chen Z, shi Y, Patel R, Vasudevan SA, и другие. Ингибитор mTOR, конкурирующий с АТФ, INK128 ингибирует рост нейробластомы путем блокирования передачи сигналов mTORC. Апоптоз. 2015;20:50–62. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Апоптоз. 2015;20:50–62. [Бесплатная статья PMC] [PubMed] [Google Scholar]
57. Li H, Chen Z, Hu T, Wang L, Yu Y, Zhao Y, Sun W, Guan S, Pang JC, Woodfield SE, Liu Q, Yang J. Новый ингибитор протеасом иксазомиб повышает чувствительность клеток нейробластомы к лечению доксорубицином. Научные отчеты. 2016;6:34397. [Бесплатная статья PMC] [PubMed] [Google Scholar]
58. Wang Y, Wang L, Guan S, Cao W, Wang H, Chen Z, Zhao Y, Yu Y, Zhang H, Pang JC, Huang SL , Акияма Й, Ян Й и др. Новый ингибитор ALK AZD3463 ингибирует рост нейробластомы, преодолевая устойчивость к кризотинибу и индуцируя апоптоз. Научный доклад 2016; 6: 19423. [Бесплатная статья PMC] [PubMed] [Google Scholar]
59. Li H, Wang Y, Chen Z, Lu J, Pan J, Yu Y, Zhao Y, Zhang H, Hu T, Liu Q, Yang J. Роман множественный ингибитор тирозинкиназы понатиниб ингибирует bFGF-активированную передачу сигналов в клетках нейробластомы и подавляет рост нейробластомы in vivo . Онкотаргет. 2016; 8: 5874–5884. doi: 10. 18632/oncotarget.11580. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
18632/oncotarget.11580. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
60. Fan Y, Mao R, Yu Y, Liu S, Shi Z, Cheng J, Zhang H, An L, Zhao Y, Xu X, Chen З., Когисо М., Чжан Д. и др. USP21 негативно регулирует противовирусный ответ, действуя как деубиквитиназа RIG-I. J Эксперт Мед. 2014; 211:313–328. [Бесплатная статья PMC] [PubMed] [Google Scholar]
61. Liu ZG, Tang J, Chen Z, Zhang H, Wang H, Yang J, Zhang H. Новый двойной ингибитор mTORC1/2 INK128 повышает радиочувствительность рака молочной железы клеточная линия MCF-7. Int J Oncol. 2016;49: 1039–1045. [PubMed] [Google Scholar]
62. Chen Z, Wang Z, Pang JC, Yu Y, Bierkehazhi S, Lu J, Hu T, Zhao Y, Xu X, Zhang H, Yi JS, Liu S, Yang J. Множественный ингибитор CDK динациклиб подавляет рост нейробластомы за счет ингибирования активности CDK2 и CDK9. Научный доклад 2016; 6: 29090. [Бесплатная статья PMC] [PubMed] [Google Scholar]
63. Shi Y, Ma IT, Patel RH, Shang X, Chen Z, Zhao Y, Cheng J, Fan Y, Rojas Y, Barbieri E, Chen Z, Yu Ю, Джин Дж и др. NSC-87877 ингибирует функцию DUSP26 при нейробластоме, что приводит к p53-опосредованному апоптозу. Клеточная смерть Дис. 2015;6:e1841. [Бесплатная статья PMC] [PubMed] [Google Scholar]
NSC-87877 ингибирует функцию DUSP26 при нейробластоме, что приводит к p53-опосредованному апоптозу. Клеточная смерть Дис. 2015;6:e1841. [Бесплатная статья PMC] [PubMed] [Google Scholar]
64. Паттерсон Д.М., Шохет Дж.М., Ким Э.С. Доклинические модели солидных опухолей (нейробластомы) у детей и их использование для разработки лекарств. Курр Проток Фармакол. 2011 Chapter 14:Unit 14 17. [PubMed] [Google Scholar]
Нацеливание на редкие мутации EGFR при НМРЛ: афатиниб и мобоцертиниб
Нацеливание на НМРЛ с необычными мутациями EGFR — Эпизод 3
Sandip Patel, MD, подчеркивает использование афатиниба и мобоцертиниба, соответственно, для лечения НМРЛ с редкими вариантами мутации EGFR.
ЭП. 1: Оптимальные стратегии молекулярного тестирования при немелкоклеточном раке легкого
EP. 2: Обзор немелкоклеточного рака легкого с мутацией EGFR
Сейчас просматривается
EP. 3: Ориентация на редкие мутации EGFR при НМРЛ: афатиниб и мобоцертиниб
3: Ориентация на редкие мутации EGFR при НМРЛ: афатиниб и мобоцертиниб
EP. 4: Терапия, направленная на EGFR, при НМРЛ: Оптимизация последовательности и комбинаций
EP. 5: Улучшение таргетной терапии при лечении НМРЛ
EP. 6: Обзор действенных мутаций и молекулярного профилирования при НМРЛ
ЭП. 7: Оптимизация использования молекулярного тестирования при немелкоклеточном раке легкого
EP. 8: Понимание влияния мутаций EGFR на лечение НМРЛ
EP. 9: Новые агенты, нацеленные на мутации EGFR при немелкоклеточном раке легкого
EP. 10: Оптимизация секвенирования новых агентов, нацеленных на EGFR, при НМРЛ
Стенограмма:
Sandip P. Patel, MD: Другая категория мутаций в EGFR — это атипичные мутации EGFR. Они находятся в экзоне 18 и экзоне 20. Лучший набор данных, который у нас есть для этих мутаций, связан с препаратом под названием афатиниб, который представляет собой низкомолекулярный ингибитор, блокирующий EGFR и HER2 [рецептор 2 эпидермального фактора роста человека]. Были получены замечательные результаты в некоторых из этих очень редких подмножеств EGFR , представляющих от 5% до 10% пациентов. В дополнение к тестированию на EGFR следует помнить, что ваш тест является частью более широкой панели. Панель секвенирования нового поколения с биопсией ткани или жидкости дает вам полный набор генов EGFR . Для подходящих пациентов рассмотрите возможность применения афатиниба, одобренного FDA для лечения этих редких мутаций.
Были получены замечательные результаты в некоторых из этих очень редких подмножеств EGFR , представляющих от 5% до 10% пациентов. В дополнение к тестированию на EGFR следует помнить, что ваш тест является частью более широкой панели. Панель секвенирования нового поколения с биопсией ткани или жидкости дает вам полный набор генов EGFR . Для подходящих пациентов рассмотрите возможность применения афатиниба, одобренного FDA для лечения этих редких мутаций.
Было проведено множество клинических испытаний афатиниба, низкомолекулярного ингибитора EGFR и HER2, по сравнению с другими терапевтическими средствами и традиционной химиотерапией, включая исследование рефрактерных состояний и даже плоскоклеточную гистологию. Есть несколько настроек. Есть также некоторые данные для атипичных мутаций EGFR , которые очень надежны. Все эти исследования являются рандомизированными контролируемыми испытаниями, так что это самый высокий уровень доказательности. Было продемонстрировано преимущество использования афатиниба по сравнению с другими видами лечения, доступными в то время, для пациентов с длительной выживаемостью без прогрессирования и данными общей выживаемости. Возможно, самые убедительные данные, которые у нас есть по некоторым атипичным мутациям, относятся к экзону 18 и экзону 20.
Было продемонстрировано преимущество использования афатиниба по сравнению с другими видами лечения, доступными в то время, для пациентов с длительной выживаемостью без прогрессирования и данными общей выживаемости. Возможно, самые убедительные данные, которые у нас есть по некоторым атипичным мутациям, относятся к экзону 18 и экзону 20.
Поскольку афатиниб является необратимым низкомолекулярным ингибитором EGFR/HER2, он имеет побочные эффекты, которые мы связываем с блокадой EGFR дикого типа. Как правило, это кожные и желудочно-кишечные [желудочно-кишечные] отравления — наиболее распространены стоматит, сыпь и диарея. Это очень хорошо поддается лечению. Я обычно прописываю профилактический топический стероид, а также лоперамид, когда даю рецепт на препарат этого класса, чтобы опередить токсичность. При стоматите [я назначу] жидкость для полоскания рта дексаметазоном, который используется с ингибиторами mTOR при раке молочной железы. Он также может быть очень эффективным. Подавляющее большинство токсичности можно контролировать с помощью поддерживающих препаратов. Если этих препаратов недостаточно, целесообразно снижение дозы афатиниба до 30 мг. Имеются данные о том, что у пациентов, получающих афатиниб в дозе 30 мг, показатели противоракового контроля такие же, как и у пациентов, получающих полную дозу афатиниба 40 мг.
Если этих препаратов недостаточно, целесообразно снижение дозы афатиниба до 30 мг. Имеются данные о том, что у пациентов, получающих афатиниб в дозе 30 мг, показатели противоракового контроля такие же, как и у пациентов, получающих полную дозу афатиниба 40 мг.
Мобоцертиниб представляет собой низкомолекулярный ингибитор EGFR с одобрением для вставки экзона 20 EGFR. Эта мутация встречается у 5-7% пациентов и может быть обнаружена с помощью жидкостной биопсии или биопсии ткани с помощью более широкой панели. Он продемонстрировал эффективность, и исторически очень сложно лечить подгруппу со вставкой экзона 20. Основная токсичность связана с блокадой EGFR дикого типа. Это дерматологическая токсичность, с которой часто можно справиться с помощью местных стероидов; и желудочно-кишечная токсичность, особенно диарея, которую можно лечить лоперамидом или ломотилом [дифеноксилатом], если это необходимо.
Раннее вмешательство и выявление этих видов токсичности имеет ключевое значение, поскольку гарантирует, что пациенты смогут продолжать получать значимую дозу.

 введения пролонг. действия
введения пролонг. действия ru
ru