Аденома гипофиза и беременность: Гиперпролактинемия и беременность (обзор литературы)
Гиперпролактинемия и беременность (обзор литературы)
Беременность сопровождается значительными гормональными преобразованиями. Гипофиз является одним из наиболее вовлеченных в процесс гормональной перестройки органов, что проявляется в течение беременности его структурными и функциональными изменениями. В связи с этим затруднена оценка гормонального профиля, который в значительной степени отличается от показателей, предшествующих беременности. Аденомы гипофиза могут приводить к нарушениям гормональной секреции, отрицательно влияющим на мать и плод.
В течение различных периодов онтогенеза наблюдаются изменения размеров гипофиза. В течение первых двух декад жизни отмечается его усиленный рост, и к репродуктивному возрасту гипофиз достигает 10 мм в длину, 5—10 мм в высоту и 10—15 мм в ширину. У женщин в детородном периоде отмечается тенденция к увеличению размеров гипофиза, у беременных увеличение размеров гипофиза выявляется всегда. Это происходит в результате процессов гиперплазии и гипертрофии лактотрофов вследствие стимулирующего воздействия на них эстрогенов и прогестерона [10].
Однако при беременности физиологическое увеличение размеров гипофиза в некоторых случаях необходимо дифференцировать от патологических состояний. Дифференциальный диагноз у беременных женщин представляет определенные сложности, поскольку магнитно-резонансная томография (МРТ) гипофиза не является достаточно специфичным методом исследования и имеет строгие показания к назначению в течении беременности. При ее выполнении следует обратить внимание на такие изменения, как асимметричное увеличение размеров гипофиза и отклонение ножки гипофиза, не встречающиеся при физиологическом увеличении и указывающие на наличие аденомы. Высота гипофиза, превышающая в течение беременности показатели 9—10 мм, а в первые дни после родов — 12 мм, также может свидетельствовать о патологии [2, 10].
Гипофиз и его тропные гормоны при беременности являются ключевым звеном в системе регуляции лактации. Основная роль в этом процессе отводится влиянию пролактина. Воздействие пролактина на молочные железы заключается в обеспечении их развития (маммогенез), синтеза молока (лактогенез) и поддержании секреции молока (галактопоэз). Стимуляция соответствующей стадии развития секреторного аппарата молочных желез достигается совместно с воздействием эстрогенов, прогестерона, плацентарного лактогена, инсулина, кортизола, тиреоидных гормонов, гормона роста и ряда других ростовых факторов. Особо важную роль пролактин играет в послеродовом периоде, существенно влияя на секрецию молока в первые несколько недель после родов [1].
Стимуляция соответствующей стадии развития секреторного аппарата молочных желез достигается совместно с воздействием эстрогенов, прогестерона, плацентарного лактогена, инсулина, кортизола, тиреоидных гормонов, гормона роста и ряда других ростовых факторов. Особо важную роль пролактин играет в послеродовом периоде, существенно влияя на секрецию молока в первые несколько недель после родов [1].
У женщин репродуктивного возраста (не беременных и не кормящих) среднее содержание пролактина не намного превышает его уровень у мужчин. При беременности у женщины происходит прогрессирующее увеличение уровня пролактина параллельно с повышением уровня эстрогенов. В I триместре его концентрация обычно не превышает 30 нг/мл. Максимальный уровень пролактина (200 нг/мл и более) отмечается непосредственно перед родами [10].
Высокие концентрации прогестерона, эстрогенов и плацентарного лактогена в течение беременности подавляют лактацию. Резкое снижение уровня эстрогенов после родов способствует «разблокированию» рецепторов к пролактину в молочных железах: сохраняющаяся при этом гиперпролактинемия инициирует лактацию. Далее в течение 1-й недели после родов содержание пролактина у кормящих матерей быстро уменьшается. В последующие 2—3 нед после родов его концентрация снижается до исходного уровня, предшествовавшего беременности. Акт сосания является триггером, инициирующим повышение содержания пролактина в 3—5 раз при каждом эпизоде прикладывания ребенка к груди [1].
Далее в течение 1-й недели после родов содержание пролактина у кормящих матерей быстро уменьшается. В последующие 2—3 нед после родов его концентрация снижается до исходного уровня, предшествовавшего беременности. Акт сосания является триггером, инициирующим повышение содержания пролактина в 3—5 раз при каждом эпизоде прикладывания ребенка к груди [1].
Синтез и секреция пролактина в гипофизе плода начинаются с 5-й недели онтогенеза. С 10-й недели содержание гормона в крови плода возрастает, достигая максимума к концу беременности. В последние недели гестации его уровень в пупочной вене плода выше, чем у матери. К концу 1-й недели постнатального периода концентрация пролактина в крови новорожденного резко снижается. Предполагается, что физиологическая значимость пролактина для плода заключается в процессах осморегуляции и созревания легочной ткани [1].
В течение гестационного периода интенсивный синтез пролактина осуществляется не только лактотрофами аденогипофиза, но и децидуальной тканью. Пролактин, содержащийся в околоплодных водах, не связан с его поступлением из крови женщины и не подвержен ингибирующему действию дофамина и его агонистов. Концентрация гормона в амниотической жидкости в 5—10 раз превышает его содержание в сыворотке крови беременной. Роль экстрагипофизарного пролактина до конца не изучена, однако предполагается, что он принимает участие в осморегуляции амниотической жидкости и совместно с децидуальным релаксином влияет на сократительную способность матки в родах [3, 10].
Пролактин, содержащийся в околоплодных водах, не связан с его поступлением из крови женщины и не подвержен ингибирующему действию дофамина и его агонистов. Концентрация гормона в амниотической жидкости в 5—10 раз превышает его содержание в сыворотке крови беременной. Роль экстрагипофизарного пролактина до конца не изучена, однако предполагается, что он принимает участие в осморегуляции амниотической жидкости и совместно с децидуальным релаксином влияет на сократительную способность матки в родах [3, 10].
Помимо физиологического увеличения уровня пролактина выделяют и патологическую гиперпролактинемию. Пролактиномы (микро- и макроаденомы) являются одной из наиболее частых причин стойкой гиперпролактинемии и выявляются в 50% всех случаев определения гормонально-активных опухолей гипофиза [10].
Реже причинами патологической гиперпролактинемии являются неактивные опухоли гипофиза, синдром «пустого» турецкого седла, лучевые и другие травмирующие воздействия, системные заболевания, симптоматическая гиперпролактинемия (медикаментозная, алкогольная, психогенная, вследствие поражения периферических эндокринных желез) , а также идиопатическая гиперпролактинемия [1].
Наличие избыточной продукции пролактина у пациентов ведет к развитию гиперпролактинемического гипогонадизма.
Клиническая картина при гиперпролактинемическом гипогонадизме отличается от таковой у женщин в постменопаузе тем, что в первом случае не отмечается развития атрофии морфологических структур молочных желез и увеличения уровня гонадотропинов [10].
Под влиянием избыточной продукции пролактина снижается продукция гонадотропин-рилизинг-гормонов (ГнРГ) в гипоталамусе, в связи с чем происходит подавление синтеза и секреции гонадотропинов — ЛГ и ФСГ, уменьшается пульсовая активность ЛГ, характерная для нормального функционирования репродуктивной системы. Гиперпролактинемия также блокирует эффекты гонадотропинов на уровне органов-мишеней (гонад), что приводит к гипоэстрогенемии, уменьшает синтез прогестерона, стимулирует секрецию надпочечниками андрогенов [20].
Хроническая гиперпродукция пролактина приводит, таким образом, к нарушениям менструального цикла, ановуляции и бесплодию, галакторее и увеличению массы тела. Для гиперпролактинемического гипогонадизма характерна нормогонадотропная ановуляция, при этом вызванное им бесплодие излечимо [3].
Для гиперпролактинемического гипогонадизма характерна нормогонадотропная ановуляция, при этом вызванное им бесплодие излечимо [3].
По данным некоторых зарубежных исследователей [15], гиперпролактинемия довольно часто является причиной нарушений менструального цикла и встречается у 9% женщин с аменореей, у 25% — с галактореей и у 70%, имеющих оба эти симптома.
В настоящее время в лечении нарушений менструального цикла и бесплодия успешно применяются препараты агонистов дофамина. Восстановление овуляторного менструального цикла наблюдается у 70—80% пациенток, получающих лечение бромокриптином и хинаголидом, и более чем у 90% — при терапии каберголином. При первом назначении терапии агонистами дофамина женщины должны быть предупреждены, что восстановление овуляции и фертильности может произойти немедленно (даже до их первой физиологической менструации) [2].
Так, при длительном (в течение 24 мес) наблюдении за 207 пациентками с гиперпролактинемией вследствие микро- и макроденом, а также гиперпролактинемии неопухолевого генеза на фоне лечения каберголином отмечались более выраженные улучшения при нормализации уровня пролактина и уменьшении объемов опухоли как при макропролактиномах (82,1% против 46,4%), так и при микропролактиномах (90% против 56,8%), чем на фоне приема бромокриптина [18].
В рандомизированном двойном слепом исследовании, выполненном J. Webster и соавт. [21], проводилось наблюдение за 459 женщинами с гиперпролактинемической аменореей по причине микропролактином и идиопатической гиперпролактинемии в течение 24 нед приема агонистов дофамина. На фоне приема каберголина также наблюдалась более выраженная тенденция к нормализации уровня пролактина (83% против 59%) и степень восстановления овуляторных циклов и наступления беременности (72% против 52%), чем на фоне приема бромокриптина. При увеличении же продолжительности приема каберголина до 40 нед восстановление овуляции и/или наступление беременности отмечалось у 90% пациенток. Также переносимость бромокриптина хуже по сравнению с таковой каберголина.
Желательно применять контрацептивные меры при лечении препаратами агонистов дофамина даже у женщин, желающих забеременеть. В этом случае применение механической контрацепции рекомендуется в первые 2—3 менструальных цикла после начала терапии, что позволяет определить межменструальный интервал, вовремя заподозрить беременность, провести ее биохимическое подтверждение для дальнейшего точного расчета возраста плода [2].
В международных клинических практических рекомендациях по диагностике и лечению гиперпролактинемии рекомендована отмена агонистов дофамина у женщин с пролактиномами при установлении факта беременности. У некоторых пациенток с макроаденомами, забеременевших на фоне приема агонистов дофамина и не подвергавшихся ранее хирургическому лечению или радиотерапии по поводу аденомы гипофиза, возможно продолжение приема препаратов агонистов дофамина в течение беременности, особенно если опухоль имеет тенденцию к инвазивному росту или воздействует на хиазму зрительных нервов. Поскольку агонисты дофамина проникают через плаценту, препарат в большинстве случаев необходимо отменять в первые 4 нед после зачатия. Препараты агонистов дофамина не обладают эмбриотоксичностью, и отмена их обусловлена тем, что во время беременности повышенный уровень пролактина является физиологичным [3, 12].
Безопасность применения бромокриптина у женщин с идиопатической или вызванной аденомами гипофиза гиперпролактинемией в течение I триместра беременности доказана и широко подтверждена множеством зарубежных исследований [3, 12, 19, 21].
При динамическом наблюдении более чем за 6000 беременностей у пациенток, принимавших бромокриптин по поводу гиперпролактинемии, не отмечалось увеличения частоты возникновения внутриутробных пороков развития или преждевременного прекращения беременности [13].
По данным других зарубежных исследований [5, 6, 11], также не выявлено тератогенного воздействия препарата на плод. Прием бромокриптина на ранних сроках беременности не был ассоциирован с увеличением частоты возникновения спонтанных абортов, внематочной и многоплодной беременности, преждевременных родов.
Также, по данным J. Raymond и соавт. [17], при длительном (с рождения и до 9 лет) наблюдении за детьми, матери которых принимали бромокриптин в течение беременности, не установлено отрицательного влияния препарата на их умственное и физическое развитие.
В настоящее время в клинической практике для лечения гиперпролактинемии активно используется селективный агонист дофамина пролонгированного действия — каберголин.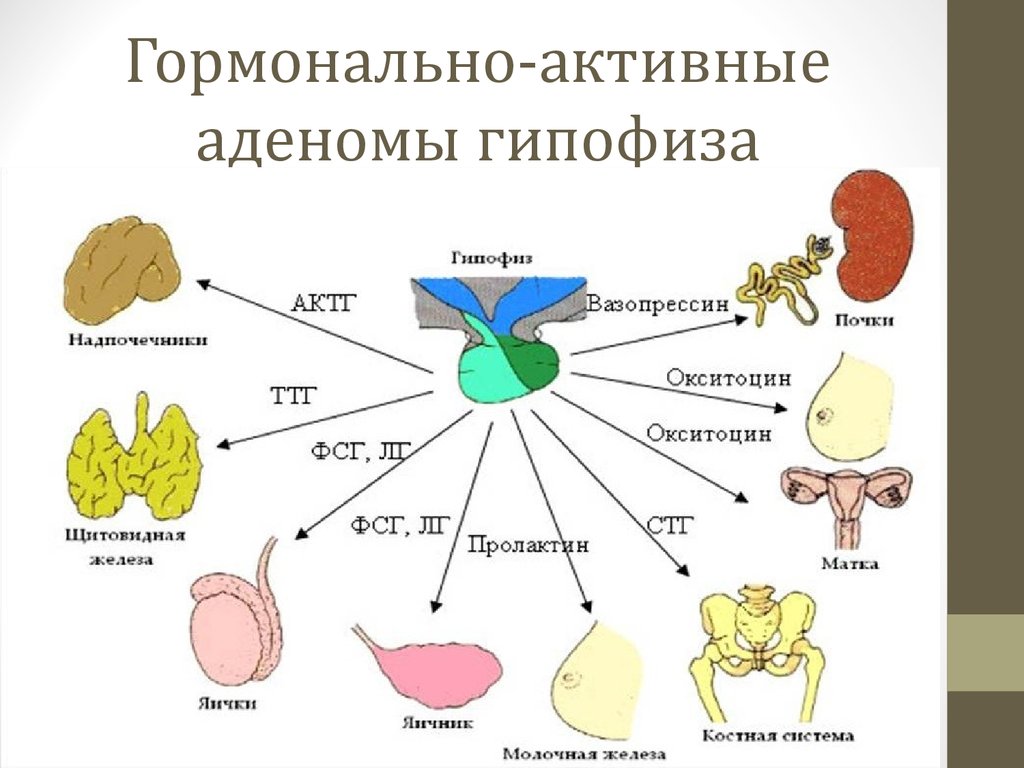 На фоне приема каберголина отмечается меньшее количество побочных эффектов и, как следствие этого, — лучшая переносимость препарата по сравнению с бромокриптином, что связано с большей селективностью по отношению к D-2 дофаминовым рецепторам более длинным периодом полувыведения препарата и незначительными колебаниями концентрации препарата в плазме крови пациенток [21].
На фоне приема каберголина отмечается меньшее количество побочных эффектов и, как следствие этого, — лучшая переносимость препарата по сравнению с бромокриптином, что связано с большей селективностью по отношению к D-2 дофаминовым рецепторам более длинным периодом полувыведения препарата и незначительными колебаниями концентрации препарата в плазме крови пациенток [21].
Каберголин также подтвердил свою безопасность при лечении нарушений фертильности у женщин с гиперпролактинемией и применении его при беременности [12].
По данным M. Ono и соавт. [16], в проспективном исследовании с участием 85 женщин (из них 29 — с макропролактиномами и 56 — с микропролактиномами), получавших высокие дозы каберголина в связи с гиперпролактинемическим гипогонадизмом, нормализация уровня пролактина и восстановление овуляторных циклов наблюдались у всех пациенток. У 80 (94%) из них на фоне приема каберголина развилась беременность. Препарат был отменен в течение первых 4 нед гестации, все дети родились здоровыми, у матерей при этом не отмечалось симптомов роста размеров опухоли, а именно: ухудшения зрения или возникновения головной боли.
G. Stalldecker и соавт. [19] провели наблюдение за течением и исходами 103 беременностей у 90 женщин с гиперпролактинемией. Зачатие во всех случаях возникало на фоне приема каберголина. Прием препарата осуществлялся по показаниям в течение периода от 3 до 25 нед гестации. 96,9% женщин получали каберголин в течение I триместра беременности, остальные — до конца II триместра. При этом не отмечалось значимых осложнений беременности на фоне приема препарата. У 7 женщин наблюдалось развитие спонтанного аборта на ранних сроках беременности, что не отличалось от показателей предыдущих исследований и не превышало частоты развития данного осложнения в общей популяции. Преждевременные роды зарегистрированы у 8 (8,8%) женщин, что также соответствует показателям общей популяции. Неонатальные пороки развития отмечались в 3,6% случаев: 1 существенный — синдром Дауна и 2 незначительных порока — пупочная и паховая грыжи. Однако частота возникновения данных пороков развития на фоне приема каберголина не превышала таковую для общей популяции.
В работе G. Stalldecker и соавт. [19] приведен анализ зарубежных исследований безопасности применения каберголина во время беременности, при этом не выявлено увеличения частоты самопроизвольных абортов по сравнению с данными показателями в общей популяции. При оценке частоты возникновения преждевременных родов приводятся противоречивые данные — от 1 до 18% случаев, однако сами исследователи зарегистрировали 8,8% случаев преждевременных родов, что соответствует показателям в общей популяции. В исследованиях не отмечается увеличения риска рождения детей с низкой массой тела и риска развития врожденных аномалий на фоне приема каберголина, а также увеличения риска нарушений умственного и физического развития детей в постнатальном периоде.
Частота таких осложнений беременности, как преждевременное излитие околоплодных вод, слабость родовой деятельности, гипоксия плода, практически не отличается от частоты этих осложнений в аналогичной возрастной группе здоровых женщин [2].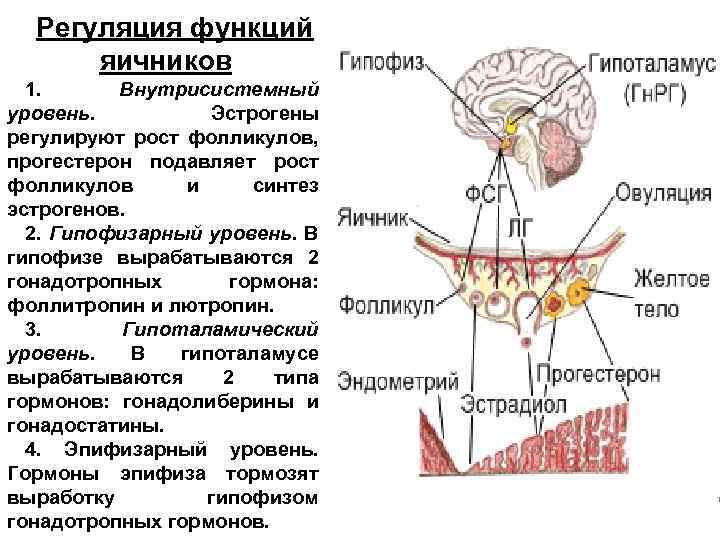
Применение хинаголида во время беременности не показано в связи с наблюдавшимися в ряде исследований [4] увеличением случаев осложнений беременности и возникновением внутриутробных пороков развития на фоне приема препарата.
Как уже было описано, в норме во время беременности отмечается 10-кратное повышение уровня пролактина, происходит увеличение размеров гипофиза под влиянием эстрогенов. При прекращении приема агонистов дофамина на фоне беременности у пациенток с гиперпролактинемией происходит увеличение уровня пролактина в сыворотке крови. При этом последующее повышение уровня пролактина достоверно не отражает изменений в росте и активности опухоли. Более того, уровень пролактина увеличивается в течение беременности не у всех пациенток с пролактиномами. На фоне беременности может отмечаться улучшение течения гиперпролактинемии, поскольку уровень пролактина в послеродовом периоде часто ниже, чем показатели до зачатия. У некоторых пациенток гиперпролактинемия может нивелироваться после беременности.
В международных практических клинических рекомендациях проведение МРТ у пациенток с микроаденомами и интраселлярными аденомами гипофиза в течение беременности не рекомендовано, за исключением случаев, когда имеются явные клинические признаки роста опухоли, такие как изменение полей зрения [12].
Под влиянием высокого уровня эстрогенов в течение беременности стимулирование гиперплазии лактотрофов и их увеличение может вызывать выход опухоли за пределы турецкого седла. Также гиперэстрогенемия может стимулировать увеличение лактотрофов самой пролактиномы [8].
В большинстве случаев микропролактиномы и макропролактиномы, локализованные в пределах турецкого седла, не имеют тенденции к росту в течение беременности. В обзоре зарубежных исследований рост опухоли у 457 беременных женщин с микропролактиномами наблюдался в 2,6% случаев. При применении технических средств визуализации опухоли риск роста опухоли составлял 4,5—5%. Учитывая низкую вероятность прогрессирующего роста микропролактином, у данной группы пациенток рекомендовано рутинное проведение клинического обследования в каждом триместре без применения технических средств визуализации опухоли [7].
Подобные результаты наблюдаются и у пациенток с макропролактиномами, ранее подвергавшимися хирургическому лечению или воздействию радиотерапии, — клинически значимое увеличение роста опухоли в данной группе отмечается в 2,8% случаев, в связи с чем проведение МРТ в течение беременности таким пациенткам также не показано [12].
Однако у пациенток с макропролактиномами без предшествующего хирургического или радиолечения риск увеличения опухоли возрастает до 31%. Появление или ухудшение течения уже существующей головной боли, а также снижение остроты зрения и сужение полей зрения служит показанием к исследованию полей зрения и последующему проведению МРТ без применения контрастных веществ. При непереносимости бромокриптина или развитии резистентности к препарату возможно применение каберголина. При отсутствии улучшения клинической симптоматики и уменьшения размеров опухоли проводится хирургическое удаление пролактиномы. На больших сроках беременности целесообразно инициировать искусственные роды до проведения нейрохирургического вмешательства [12].
Пациенткам с макропролактиномами целесообразно планировать беременность после нормализации уровня пролактина сыворотки крови и значительного уменьшения размеров опухоли с тем, чтобы избежать или уменьшить риск роста опухоли во время беременности. По современным рекомендациям, продолжительность лечения у пациенток с макропролактиномами должна составлять более 2 лет [2].
Если у пациенток с макропролактиномами лечение агонистами дофамина не привело к уменьшению размеров опухоли, рекомендовано решение вопроса о целесообразности проведения нейрохирургического лечения до зачатия [12].
По данным M. Molitch [2, 14], в период лактации под влиянием естественного вскармливания не выявлено прогрессирования роста аденом гипофиза. Женщинам, желающим кормить грудью своих младенцев, не следует назначать лечение агонистами дофамина, поскольку подавление уровня пролактина сыворотки будет угнетать лактацию. Комплексное клинико-рентгенологическое обследование пациенток с гиперпролактинемией непосредственно после родов и после окончания кормления ребенка грудью не выявило отрицательной динамики заболевания.
Таким образом, при наличии у пациенток макропролактиномы всегда имеется настороженность в отношении возможной вероятности роста опухоли в течение беременности. Для микропролактином во время беременности увеличение размеров опухоли не характерно. Однако при отмене агонистов дофамина на фоне беременности возможно возвращение размеров опухоли к первоначальным, отмечавшимся до начала терапии препаратами [9]. Исследование уровня пролактина в течение беременности у пациенток с пролактиномами не рекомендуется, поскольку это не отражает истинной картины течения заболевания и может привести к диагностическим ошибкам [10, 12].
Как уже указывалось, максимальная стимуляция лактотрофов гипофиза происходит во время беременности, поэтому, если за это время клинически значимого роста аденомы гипофиза не зафиксировано, то его выявление в послеродовом периоде также маловероятно. Как правило, нет необходимости контроля уровня пролактина и МРТ-картины аденомы гипофиза до окончания грудного вскармливания. Но некоторыми авторами [2] рекомендуется не превышать социально приемлемую продолжительность грудного вскармливания, т.е. 6—12 мес.
Но некоторыми авторами [2] рекомендуется не превышать социально приемлемую продолжительность грудного вскармливания, т.е. 6—12 мес.
Аденома гипофиза:Патогенез аденомы гипофиза,Симптомы аденомы гипофиза,Диагностика аденомы гипофиза
Патогенез аденомы гипофиза
Симптомы аденомы гипофиза
Аденома гипофиза и беременность
Диагностика аденомы гипофиза
Лечение аденомы гипофиза
Патогенез аденомы гипофиза
Механизмы возникновения и течения аденомы гипофиза головного мозга изучены не в полной мере. Распространена концепция первичного поражения гипоталамуса, при котором вторично в процесс вовлекаются ткани аденогипофиза, проходит стадия гиперплазии, аденоматоза и после – аденома. Также есть концепция первичного поражения гипофиза, которое прямо влияет на развитие аденомы.
Большая часть аденом – опухоли, не имеющие морфологических признаков злокачественных. Тем не менее, они предрасположены к прорастанию и дальнейшему сдавливанию близко расположенных к гипофизу структур головного мозга. Это может проявляться в виде эндокринных, неврологических, зрительных нарушений. Также аденома гипофиза может сопровождаться рядом осложнений – кровоизиляниями в опухоль (апоплексией), кистозным перерождением. Также есть неподтвержденная теория об излишне долгом приема оральных контрацептивов.
Это может проявляться в виде эндокринных, неврологических, зрительных нарушений. Также аденома гипофиза может сопровождаться рядом осложнений – кровоизиляниями в опухоль (апоплексией), кистозным перерождением. Также есть неподтвержденная теория об излишне долгом приема оральных контрацептивов.
Аденома гипофиза может быть гормонально неактивной (клетки, из которой она состоит, гормонов не продуцируют) или же гормонально активной. По размерам аденомы гипофиза разделяют на микроаденомы (1мм-2см в диаметре) и макроаденомы (больше 2см).
Виды аденом:
- аденома соматотропинпродуцирующая, продуцирующая гормон роста: аденома соматотропная; соматотропинома;
- аденома пролактинсекретирующая: пролактиновая аденома; пролактинома;
- аденома аденокортикопинпродуцирующая: кортикотропная аденома; кортикотропинома;
- аденома тиротропинпродуцирующая: тиреотропная аденома; тиротропинома;
- аденома фоллтропинпродуцирующая (лютропинпродуцирующая, гонадотропная).
 Продуцирует гонадотропные гормоны.
Продуцирует гонадотропные гормоны.
Симптомы аденомы гипофиза
В целом аденома гипофиза симптомы имеет неоднозначные. Клинические проявления аденом гормонально-активного типа — это эндокринно-обменный синдром, рентгенологические и офтальмоневрологические симптомы. Выраженный эндокринно-обменный синдром свидетельствует об избыточном уровне гормона гипофиза и степени поражения ткани, которая окружает опухоль.
Офтальмоневрологические симптомы: первичная атрофия зрительного нерва, изменение поля зрения и другие проявления. Интенсивность этих симптомов напрямую зависит от роста опухоли. Если процесс усиливается, к симптомам добавляются головные боли, сосредоточенные в лобной, глазничной, височной областях. Боли тупые, не сопровождаются тошнотой, не меняются при смене положения тела. Анальгетики чаще всего не снижают боль. Если рост опухоли продолжается в сторону верхней области, повреждаются гипоталамические структуры. Рост книзу провоцирует ощущения заложенного носа, постоянное течение из носа цереброспинальной жидкости.
Усиление головной боли вместе с офтальмоневрологическими симптомами происходит резко. Это связано в большинстве случаев с ускорением увеличения опухоли (к примеру, при беременности) или с кровоизлиянием в опухоль. Это тяжелое, но не смертельное осложнение. Кровоизлияния характерны для аденомы гипофиза и в некоторых случаях приводят к спонтанному излечению аденомы гипофиза гормонально-активного типа.
При рентгенологическом исследовании к основным симптомам аденомы гипофиза относят изменение размера и формы турецкого седла, истончение и деструкцию образующих его костных структур. В случае проведения компьютерной томографии можно визуализировать и непосредственно опухоль.
В отдельных случаях аденома пролактинома головного мозга гормоналньо-активной формы имеет специфическую симптоматику. У женщин опухоль может проявляться как синдром галактореи аменореи. Треть женщин с опухолями имеет умеренное ожирение, себорею волосистой части головы, снижение либидо, аноргазмию. Основное эндокринное проявление опухоли у мужчин – импотенция или снижение либидо.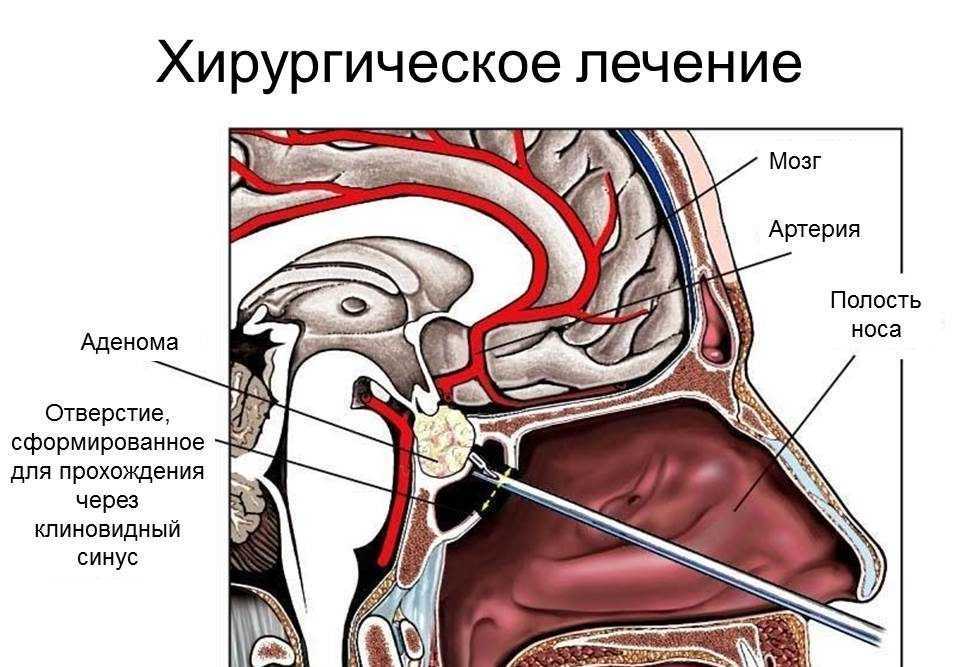
Соматотропинома проявляется клинически как синдром акромелагии либо гигантизма у детей. Кроме характерных для этого заболевания изменений скелета и мягких тканей возможно развитие ожирения и появление симптомов сахарного диабета, часто увеличивается щитовидная железа (ее функции при этом не нарушаются). Часто отмечается появление папиллом, бородавок, увеличение сальности кожи, сильное потоотделение, снижение работоспособности.
Кортикотропиномы – редко встречающиеся аденомы гипофиза. Современные данные свидетельствуют, что при болезни Иценко Кушинга почти всегда обнаруживаются кортикотропиномы. Кортикотропиномы чаще всего склонны к метастазированию (по сравнению с аденомами гипофиза других типов). Офтальмоневрологические симптомы при кортикотропиномах чаще всего не проявляется, так как диагностика этих опухолей почти всегда происходит на ранних этапах. Один из показателей наличия опухоли – эндокринное психическое расстройство.
Тиреотропиномы и гонадотропиномы – редко встречающиеся аденомы гипофиза. Их проявления зависят от того, проявляются они как первичные опухоли или развились из-за длительного поражения железы-мишени.
Их проявления зависят от того, проявляются они как первичные опухоли или развились из-за длительного поражения железы-мишени.
Аденома гипофиза и беременность
Беременность и аденома – несовместимые понятия (при пролактиносекретирующих аденомах гипофиза, при которых не было проведено адекватное лечение). Опухоль секретирует большим количеством пролактина, из-за чего забеременеть женщина не сможет. Однако есть случаи, когда аденома гипофиза начинает развиваться в процессе беременности. Что касается других типов аденом гипофиза у женщин – если концентрация пролакетина в крови находится в пределах нормы, никаких помех для зачатия ребенка нет. Если заболевание выявлено, на протяжении всей беременности женщине рекомендуется наблюдаться не только у
Диагностика аденомы гипофиза
Главный метод диагностики аденомы гипофиза – клинико-биохимическое исследование, а также краниография (рентгенологическое исследование). Кроме того, используют компьютерную томографию, радиоиммунологический метод, ЯМР-томографию. В первую очередь проводится именно краниография в 2 проекциях, а также томография области турецкого седла, позволяющая выявить признаки внутриселлярного объемного процесса, который провоцирует изменения в костных структурах (остеопороз, деструкцию спинки турецкого седла). Характерная особенность – двухконтурность дна в турецком седле. Наличие опухоли, ее структуру, размеры и направление разрастания позволяет определить компьютерная томография (с контрастным усилением). Радиоиммунологическое обследование позволяет определить концентрацию гипофизарных гормонов в сыворотке крови. Это специфичный и высокочувствительный метод определения аденомы гипофиза.
В первую очередь проводится именно краниография в 2 проекциях, а также томография области турецкого седла, позволяющая выявить признаки внутриселлярного объемного процесса, который провоцирует изменения в костных структурах (остеопороз, деструкцию спинки турецкого седла). Характерная особенность – двухконтурность дна в турецком седле. Наличие опухоли, ее структуру, размеры и направление разрастания позволяет определить компьютерная томография (с контрастным усилением). Радиоиммунологическое обследование позволяет определить концентрацию гипофизарных гормонов в сыворотке крови. Это специфичный и высокочувствительный метод определения аденомы гипофиза.
В любом случае диагностику аденомы гипофиза нужно проводить комплексно. Подозрения на наличие заболевание должны вызвать офтальмоневрологические нарушения и эндокринно-обменный синдром. Больные аденомой гипофиза характеризируются выраженной эмоциональностью, поэтому доктор должен знакомить их с результатами обследования тактично, уведомив о трудностях диагностического поиска, вероятности гипердиагностики, доброкачественном течении большинства аденом и медленном их росте.
Первоначально доктор должен убедиться, что эндокринно-обменный синдром – это не итог приема антидепрессантов, нейролептиков и других лекарственных средств, а также нервно-рефлекторных воздействий (наличия контрацептива внутри матки, частой самопальпации груди и т.п.). Также нужно определить степень концентрации в крови тропных гормонов гипофиза.
Если концентрация сильно увеличена, а рентгенологическое обследование указывает на признаки аденомы гипофиза, диагноз можно подтверждать. При невысокой концентрации гормонов гипофиза, но при этом наличии признаков объемного образования на рентгенограмме в области турецкого седла можно использовать дополнительные методики обследования: компьютерную томографию, церебральную ангиографию, ЯМР-томографию и другие.
Чтобы выявить аномальную реакцию аденоматозной ткани на фармакологическое воздействие обычно применяют специальные фармакологические нагрузочные пробы. При наличии подозрения на аденому гипофиза пациента нужно направить на обследование к офтальмологу. Обследование полей зрения и остроты, исследование глазного дна позволяет обнаружить зрительные нарушения, в некоторых случаях – поражение глазодвигательного нерва.
Обследование полей зрения и остроты, исследование глазного дна позволяет обнаружить зрительные нарушения, в некоторых случаях – поражение глазодвигательного нерва.
Дифференциальный диагноз характерен для гормонально-неактивных опухолей, расположенных в области турецкого седла, опухолей негипофизарной локализации, продуцирующих пептидные гормоны, гипоталамо-гипофизарной недостаточности неопухолевого генеза. Дифференцируют аденому гипофиза с синдромом пустого турецкого седла, для которого присуще также развитие офтальмоневрологического синдрома.
Лечение аденомы гипофиза
Если у пациента подтверждена аденома гипофиза, лечение может быть медикаментозным, радиохирургическим и нейрохирургическим. Медикаментозное лечение проводят с помощью препарата парлодела (бромокриптина). Также применяют методы лучевого лечения: дистанционную лучевую терапию, гамма-терапию, протонную терапию, радиохирургию. Радиохирургическая методика заключается в введении в аденому радиоактивных веществ. Особенно эффективны лучевые методы лечения аденомы гипофиза при небольших опухолях.
Особенно эффективны лучевые методы лечения аденомы гипофиза при небольших опухолях.
Нейрохирургическое лечение проводят при нарушении зрения, а также при осложненных аденомах (при кровоизлиянии в аденому, при образовании кисты в области аденомы). Также сейчас выполняют операции с применением транссфеноидального хирургического подхода. При небольших аденомах такое лечение дает преимущественно хорошие результаты.
Общий прогноз на выздоровление – 85% положительных случаев. Естественно, все зависит от размеров опухоли, а также того, насколько рано она была диагностирована. Чтобы последствия аденомы гипофиза не были тяжелыми, нужно вовремя диагностировать заболевание и провести удаление аденомы гипофиза. Для этого важно обратиться к опытному врачу-эндокринологу или нейрохирургу, который проведет комплексное обследование пациента и выберет оптимальный способ лечения.
Опухоли гипофиза и беременность — PubMed
Сохранить цитату в файл
Формат:
Резюме (текст)PubMedPMIDAbstract (текст)CSV
Добавить в коллекции
- Создать новую коллекцию
- Добавить в существующую коллекцию
Назовите свою коллекцию:
Имя должно содержать менее 100 символов
Выберите коллекцию:
Не удалось загрузить вашу коллекцию из-за ошибки
Повторите попытку
Добавить в мою библиографию
- Моя библиография
Не удалось загрузить делегатов из-за ошибки
Повторите попытку
Ваш сохраненный поиск
Название сохраненного поиска:
Условия поиска:
Тестовые условия поиска
Электронная почта:
(изменить)
Который день?
Первое воскресеньеПервый понедельникПервый вторникПервая средаПервый четвергПервая пятницаПервая субботаПервый деньПервый рабочий день
Который день?
ВоскресеньеПонедельникВторникСредаЧетвергПятницаСуббота
Формат отчета:
РезюмеРезюме (текст)АбстрактАбстракт (текст)PubMed
Отправить максимум:
1 шт. 5 шт. 10 шт. 20 шт. 50 шт. 100 шт. 200 шт.
5 шт. 10 шт. 20 шт. 50 шт. 100 шт. 200 шт.
Отправить, даже если нет новых результатов
Необязательный текст в электронном письме:
Создайте файл для внешнего программного обеспечения для управления цитированием
Полнотекстовые ссылки
Эльзевир Наука
Полнотекстовые ссылки
Обзор
. 2003 г., 13 августа, Приложение A:S38-44.
doi: 10.1016/s1096-6374(03)00054-6.
Марк Е Молитч
1
принадлежность
- 1 Центр эндокринологии, метаболизма и молекулярной медицины, Медицинская школа им.
 Файнберга, Северо-Западный университет, Чикаго, Иллинойс, США. [email protected]
Файнберга, Северо-Западный университет, Чикаго, Иллинойс, США. [email protected]
PMID:
12914726
DOI:
10.1016/s1096-6374(03)00054-6
Обзор
Марк Э Молич.
Гормон роста IGF Res.
2003 авг.
. 2003 г., 13 августа, Приложение A:S38-44.
дои: 10.1016/s1096-6374(03)00054-6.
Автор
Марк Э Молитч
1
принадлежность
- 1 Центр эндокринологии, метаболизма и молекулярной медицины, Медицинская школа им.
 Файнберга, Северо-Западный университет, Чикаго, Иллинойс, США. [email protected]
Файнберга, Северо-Западный университет, Чикаго, Иллинойс, США. [email protected]
PMID:
12914726
DOI:
10.1016/s1096-6374(03)00054-6
Абстрактный
Опухоли различаются по тому, как они влияют на беременность, в зависимости от секретируемого гормона. Некоторые синдромы гиперсекреции гормонов необходимо контролировать, чтобы беременность протекала без чрезмерных осложнений для матери и плода (болезнь Кушинга и гипертиреоз), в то время как лечение других опухолей во время беременности не требуется. Наблюдение за ростом опухоли во время беременности необходимо в первую очередь для пролактином. Был проведен поиск литературы для выявления влияния беременности на ранее существовавшие опухоли гипофиза и влияние на исход беременности из-за гиперсекреции гормонов опухолями гипофиза.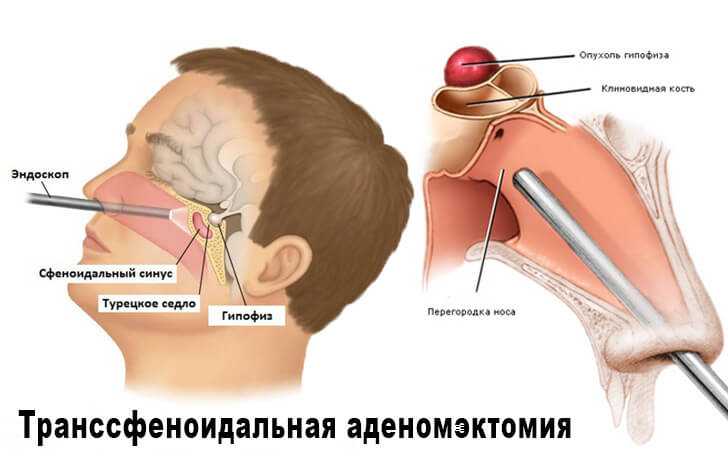 Результаты показывают, что гиперпролактинемия и болезнь Кушинга могут влиять на фертильность и обычно требуют контроля, чтобы обеспечить зачатие. Синдром Кушинга, акромегалия и гипертиреоз, вторичные по отношению к гиперсекреции тиреотропного гормона (ТТГ), могут увеличить заболеваемость матери (гестационный диабет, артериальная гипертензия), а также заболеваемость и смертность плода. Вмешательство оправдано для удаления опухоли, которая секретирует адренокортикотропный гормон (АКТГ) во время беременности, чтобы снизить риск потери плода и контролировать гипертиреоз. Напротив, хирургическое вмешательство или медикаментозная терапия аденом, секретирующих гормон роста (GH), и клинически нефункционирующих аденом во время беременности не показаны. Беременность может вызвать увеличение размера опухолей, секретирующих пролактин (ПРЛ), особенно макроаденом, поэтому показано тщательное наблюдение, и может потребоваться повторное назначение терапии бромокриптином для лечения такого увеличения размера опухоли.
Результаты показывают, что гиперпролактинемия и болезнь Кушинга могут влиять на фертильность и обычно требуют контроля, чтобы обеспечить зачатие. Синдром Кушинга, акромегалия и гипертиреоз, вторичные по отношению к гиперсекреции тиреотропного гормона (ТТГ), могут увеличить заболеваемость матери (гестационный диабет, артериальная гипертензия), а также заболеваемость и смертность плода. Вмешательство оправдано для удаления опухоли, которая секретирует адренокортикотропный гормон (АКТГ) во время беременности, чтобы снизить риск потери плода и контролировать гипертиреоз. Напротив, хирургическое вмешательство или медикаментозная терапия аденом, секретирующих гормон роста (GH), и клинически нефункционирующих аденом во время беременности не показаны. Беременность может вызвать увеличение размера опухолей, секретирующих пролактин (ПРЛ), особенно макроаденом, поэтому показано тщательное наблюдение, и может потребоваться повторное назначение терапии бромокриптином для лечения такого увеличения размера опухоли. Увеличение размеров других видов опухолей при беременности встречается очень редко.
Увеличение размеров других видов опухолей при беременности встречается очень редко.
Похожие статьи
Как беременность влияет на пациентов с аденомами гипофиза: исследование 113 беременностей в Турции.
Караджа З., Ярман С., Озбас И., Кадиоглу П., Актюрк М., Киличли Ф., Докметас Х.С., Чолак Р., Атмаджа Х., Кантюрк З., Алтунташ Й., Озбей Н., Хатипоглу Н., Танриверди Ф., Унлухизарчи К., Келестимур Ф.
Караджа З. и др.
Дж Эндокринол Инвест. 2018 янв;41(1):129-141. doi: 10.1007/s40618-017-0709-8. Epub 2017 20 июня.
Дж Эндокринол Инвест. 2018.PMID: 28634705
Макропролактиномы и нефункционирующие аденомы гипофиза и исходы беременности.
Ламберт К., Рис К., Сид П.Т., Дханджал М.К.
 , Найт М., Макканс Д.Р., Уильямсон К.
, Найт М., Макканс Д.Р., Уильямсон К.Ламберт К. и др.
Акушерство Гинекол. 2017 Январь; 129(1):185-194. doi: 10.1097/AOG.0000000000001747.
Акушерство Гинекол. 2017.PMID: 27926659
Медикаментозное лечение аденом гипофиза: частный случай ведения беременной.
Бронштейн, доктор медицины, Сальгадо Л.Р., де Кастро Мусолино Н.Р.
Бронштейн М.Д. и соавт.
гипофиз. 2002;5(2):99-107. дои: 10.1023/а:1022364514971.
гипофиз. 2002.PMID: 12675507
Обзор.
Диагностика и лечение аденом гипофиза.
Шансон П., Саленаве С.
Чансон П. и др.
Минерва Эндокринол. 2004 декабрь; 29 (4): 241-75.
Минерва Эндокринол. 2004.PMID: 15765032
Обзор.
Лечение аденом гипофиза.
Мезоси Э., Немес О.
Мезози Э. и др.
Орв Хетил. 2009 г.27 сентября; 150 (39): 1803-10. doi: 10.1556/OH.2009.28584.
Орв Хетил. 2009.PMID: 19758960
Обзор.
Венгерский язык.
Посмотреть все похожие статьи
Цитируется
Заболевания гипофиза при беременности: особенности диагностики и лечения?
Петерсенн С., Крист-Крейн М., Дросте М., Финке Р., Флитч Дж., Крайчманн-Андермар И., Люгер А., Шополь Дж., Сталла Г.
Петерсенн С. и соавт.
Geburtshilfe Frauenheilkd. 2019Апр; 79(4):365-374. doi: 10.1055/a-0794-7587. Epub 2019 6 марта.
Geburtshilfe Frauenheilkd. 2019.PMID: 31000881
Бесплатная статья ЧВК.
Беременность способствует развитию опухолей гипофиза за счет увеличения скорости клеточного цикла.
Инь Ц, Ци Х.
Инь С. и др.
Онкол Летт. 2017 Октябрь; 14 (4): 4873-4877. doi: 10.3892/ol.2017.6756. Epub 2017 16 августа.
Онкол Летт. 2017.PMID: 29085495
Бесплатная статья ЧВК.Как беременность влияет на пациентов с аденомами гипофиза: исследование 113 беременностей в Турции.
Караджа З., Ярман С., Озбас И., Кадиоглу П., Актюрк М., Киличли Ф., Докметас Х.С., Чолак Р., Атмаджа Х., Кантюрк З., Алтунташ Й., Озбей Н., Хатипоглу Н., Танриверди Ф., Унлухизарчи К., Келестимур Ф.
Караджа З. и др.
Дж Эндокринол Инвест. 2018 янв;41(1):129-141. doi: 10.1007/s40618-017-0709-8. Epub 2017 20 июня.
Epub 2017 20 июня.
Дж Эндокринол Инвест. 2018.PMID: 28634705
Стратегии лечения неопластических и сосудистых поражений головного мозга, возникающих во время беременности: серия из 29 пациентов.
Перейра К.Э., Линч Дж.К.
Перейра К.Э. и соавт.
Сург Нейрол Инт. 2017 20 фев; 8:27. doi: 10.4103/2152-7806.200575. Электронная коллекция 2017.
Сург Нейрол Инт. 2017.PMID: 28303207
Бесплатная статья ЧВК.Обзор представлений, диагностики и лечения опухолей гипофиза во время беременности.
Ламберт К., Уильямсон К.
Ламберт К. и др.
Акушерство Мед. 2013 март;6(1):13-19. doi: 10.1258/OM.2012.120022. Epub 2013 1 марта.
Акушерство Мед. 2013.PMID: 27757146
Бесплатная статья ЧВК.
Обзор.
Просмотреть все статьи «Цитируется по»
Типы публикаций
термины MeSH
Полнотекстовые ссылки
Эльзевир Наука
Укажите
Формат:
ААД
АПА
МДА
НЛМ
Отправить по телефону
Беременность способствует развитию опухолей гипофиза за счет увеличения скорости клеточного цикла
1. Эззат С., Аса С.Л., Коулвелл В.Т., Барр К.Е., Додж В.Е., Вэнс М.Л., Маккатчеон И.Е. «Распространенность аденом гипофиза»: систематический обзор. Рак. 2004; 101: 613–619. doi: 10.1002/cncr.20412. [PubMed][CrossRef][Google Scholar]
2. Каравитаки Н. Распространенность и заболеваемость аденомами гипофиза. Энн Эндокринол (Париж) 2012; 73:79–80. doi: 10.1016/j.ando.2012.03.039. [PubMed] [CrossRef] [Google Scholar]
Каравитаки Н. Распространенность и заболеваемость аденомами гипофиза. Энн Эндокринол (Париж) 2012; 73:79–80. doi: 10.1016/j.ando.2012.03.039. [PubMed] [CrossRef] [Google Scholar]
3. Heaney AP. Клинический обзор: Карцинома гипофиза: трудная диагностика и лечение. J Clin Endocrinol Metab. 2011;96:3649–3660. doi: 10.1210/jc.2011-2031. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
4. Scheithauer BW, Kovacs KT, Laws ER, Jr, Randall RV. Патология инвазивных опухолей гипофиза с особой ссылкой на функциональную классификацию. Дж Нейрохирург. 1986; 65: 733–744. doi: 10.3171/jns.1986.65.6.0733. [PubMed] [CrossRef] [Google Scholar]
5. Леви М.Дж., Матару М.С., Миран К., Пауэлл М., Гоудсби П.Дж. Клиническая характеристика головной боли у больных с опухолями гипофиза. Мозг. 2005;128:1921–1930. doi: 10.1093/brain/awh525. [PubMed] [CrossRef] [Google Scholar]
6. Milos P, Havelius U, Hindfelt B. Кластерная головная боль у пациента с аденомой гипофиза. С обзором литературы. Головная боль. 1996; 36: 184–188. doi: 10.1046/j.1526-4610.1996.3603184.x. [PubMed] [CrossRef] [Google Scholar]
Головная боль. 1996; 36: 184–188. doi: 10.1046/j.1526-4610.1996.3603184.x. [PubMed] [CrossRef] [Google Scholar]
7. Кирк Л.Ф., младший, Хэш Р.Б., Катнер Х.П., Джонс Т. Болезнь Кушинга: клинические проявления и диагностическая оценка. Ам семейный врач. 2000;62(1119–1127):1133–1134. [PubMed] [Академия Google]
8. Кумар В., Аббас А., Фаусто Н., Астер Дж., редакторы. Роббинс и Котран, патологические основы болезни. 9-й. Эльзевир Науки о здоровье; ISBN 9780323296397 (электронная книга) [Google Scholar]
9. Lee NM, Saha S. Тошнота и рвота при беременности. Гастроэнтерол Клин Норт Ам. 2011;40:309–334. doi: 10.1016/j.gtc.2011.03.009. vii. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
10. Шарма Дж. Б., Рой К. К., Моханрадж П., Кумар С., Кармакар Д., Баруа Дж. Исход беременности при опухолях гипофиза. Arch Gynecol Obstet. 2009 г.;280:401–404. doi: 10.1007/s00404-008-0917-8. [PubMed] [CrossRef] [Google Scholar]
11. Молич М.Е. Опухоли гипофиза и беременность. Гормон роста IGF Res. 2003; 13: С38–С44. doi: 10.1016/S1096-6374(03)00054-6. Suppl A. [PubMed] [CrossRef] [Google Scholar]
Гормон роста IGF Res. 2003; 13: С38–С44. doi: 10.1016/S1096-6374(03)00054-6. Suppl A. [PubMed] [CrossRef] [Google Scholar]
12. Кумар П., Магон Н. Гормоны при беременности. Niger Med J. 2012;53:179–183. doi: 10.4103/0300-1652.107549. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
13. Karaca Z, Tanriverdi F, Unluhizarci K, Kelestimur F. Беременность и нарушения гипофиза. Евр Дж Эндокринол. 2010; 162:453–475. дои: 10.1530/EJE-09-0923е. [PubMed] [CrossRef] [Google Scholar]
14. Молич М.Е. Гипофизарные нарушения во время беременности. Эндокринол Метаб Клин Норт Ам. 2006; 35: 99–116. doi: 10.1016/j.ecl.2005.09.011. ви. [PubMed] [CrossRef] [Google Scholar]
15. Mirshokraei P, Hassanpour H, Rahnama A, Foster WG. Экспрессия генов BDNF и его рецепторов, TrkB и p75 в матке и яйцеводе беременных и небеременных овец. рез. вет. 2013;95:164–168. doi: 10.1016/j.rvsc.2013.03.009. [PubMed] [CrossRef] [Академия Google]
16. Okamura K, Harada T, Wang S, Ijichi K, Furuyama K, Koga T, Okamoto T, Takayama K, Yano T, Nakanishi Y. Экспрессия TrkB и BDNF связана с плохим прогнозом в немелкоклеточном легком рак. Рак легких. 2012;78:100–106. doi: 10.1016/j.lungcan.2012.07.011. [PubMed] [CrossRef] [Google Scholar]
Экспрессия TrkB и BDNF связана с плохим прогнозом в немелкоклеточном легком рак. Рак легких. 2012;78:100–106. doi: 10.1016/j.lungcan.2012.07.011. [PubMed] [CrossRef] [Google Scholar]
17. Национальные институты здравоохранения США: благополучие лабораторных животных: политика службы общественного здравоохранения в отношении гуманного ухода и использования лабораторных животных учреждениями, получившими награды; уведомление. Реестр ФРС. 1985;50:19584–19585. [PubMed] [Google Scholar]
18. Ma H, Guo J, Xia J, Niu C, Shen X, Sun H, Zheng Y. Получение и применение поликлональных антител кролика против мышиного Setd8. Си Бао Ю Фен Цзы Мянь И Сюэ За Чжи. 2017; 33: 246–251. (На китайском языке) [PubMed] [Google Scholar]
19. Tomura M, Sakaue-Sawano A, Mori Y, Takase-Utsugi M, Hata A, Ohtawa K, Kanagawa O, Miyawaki A. Сравнение покоящейся фазы G0 с митотической клеткой циклы в иммунной системе мыши. ПЛОС Один. 2013;8:e73801. doi: 10.1371/journal.pone.0073801. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
20. Прагер Д., Браунштейн Г.Д. Гипофизарные нарушения во время беременности. Эндокринол Метаб Клин Норт Ам. 1995; 24:1–14. [PubMed] [Google Scholar]
Прагер Д., Браунштейн Г.Д. Гипофизарные нарушения во время беременности. Эндокринол Метаб Клин Норт Ам. 1995; 24:1–14. [PubMed] [Google Scholar]
21. Надер С. Нарушения гипофиза и беременность. Семин Перинатол. 1990; 14:24–33. [PubMed] [Google Scholar]
22. Фунг Дж., Гелай Б., Чжун К.Ю., Рондон М.Б., Санчес С.Е., Барриос Ю.В., Хевнер К., Цю С., Уильямс М.А. Связь сниженных концентраций нейротрофического фактора головного мозга (BDNF) в сыворотке крови на ранних сроках беременности с дородовой депрессией. БМС Психиатрия. 2015;15:43. doi: 10.1186/s12888-015-0428-7. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
23. Эван Г.И., Вусден К.Х. Пролиферация, клеточный цикл и апоптоз при раке. Природа. 2001; 411:342–348. doi: 10.1038/35077213. [PubMed] [CrossRef] [Google Scholar]
24. Beck B, Blanpain C. Раскрытие потенциала раковых стволовых клеток. Нат Рев Рак. 2013; 13:727–738. doi: 10.1038/nrc3597. [PubMed] [CrossRef] [Google Scholar]
25. Нгуен Л.В., Ваннер Р., Диркс П., Ивз С.Дж. Раковые стволовые клетки: развивающаяся концепция. Нат Рев Рак. 2012;12:133–143. [PubMed] [Академия Google]
Нгуен Л.В., Ваннер Р., Диркс П., Ивз С.Дж. Раковые стволовые клетки: развивающаяся концепция. Нат Рев Рак. 2012;12:133–143. [PubMed] [Академия Google]
26. Дин М. Раковые стволовые клетки: влияние на этиологию рака и резистентность к терапии. Дисков Мед. 2005; 5: 278–282. [PubMed] [Google Scholar]
27. Yang Y, Xu H, Huang W, Ding M, Xiao J, Yang D, Li H, Liu XY, Chu L. Нацеливание на стволовые клетки рака легких с помощью онколитика, вооруженного геном TRAIL. аденовирус. J Cell Mol Med. 2015;19:915–923. doi: 10.1111/jcmm.12397. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
28. Мартин В., Санчес-Санчес А.М., Эррера Ф., Гомес-Мансано С., Фуэйо Дж., Альварес-Вега М.А., Антолин И., Родригес С. Мелатонин Индуцированное метилирование промотора ABCG2/BCRP как новый механизм преодоления множественной лекарственной устойчивости в стволовых клетках опухоли головного мозга. Бр Дж Рак. 2013;108:2005–2012. doi: 10.1038/bjc.2013.188. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
29. Li N, Yang Y, Ding M, Huang W, Li H, Ye J, Xiao J, Zha X, Xu H. Стабильная трансфекция GFP облегчила характеристику стволовых клеток рака легких. Мол Биотехнолог. 2014;56:1079–1088. doi: 10.1007/s12033-014-9788-3. [PubMed] [CrossRef] [Google Scholar]
Li N, Yang Y, Ding M, Huang W, Li H, Ye J, Xiao J, Zha X, Xu H. Стабильная трансфекция GFP облегчила характеристику стволовых клеток рака легких. Мол Биотехнолог. 2014;56:1079–1088. doi: 10.1007/s12033-014-9788-3. [PubMed] [CrossRef] [Google Scholar]
30. Chen K, Huang YH, Chen JL. Понимание и нацеливание на раковые стволовые клетки: терапевтические последствия и проблемы. Акта Фармакол Син. 2013; 34: 732–740. doi: 10.1038/aps.2013.27. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
31. Andoniadou CL, Matsushima D, Gharavy Mousavi SN, Signore M, Mackintosh AI, Schaeffer M, Gaston-Massuet C, Mollard P, Jacques TS, Le Tissier P, et al. Sox2(+) стволовые клетки/клетки-предшественники в гипофизе взрослых мышей поддерживают гомеостаз органов и обладают потенциалом индукции опухолей. Клеточная стволовая клетка. 2013; 13: 433–445. doi: 10.1016/j.stem.2013.07.004. [PubMed] [CrossRef] [Google Scholar]
32. Tunici P, Yu JS. Стволовые клетки аденомы гипофиза.
