Транзиторная иммунная недостаточность у детей что это такое: Иммунодефицит у ребенка — виды, симптомы и лечение у детей
Иммунодефицитные состояния: симптомы, диагностика, лечение иммунодефицитных состояний
Роль защитника в нашем организме от проникновения чужеродных вирусов, бактерий, грибков и прочих паразитов выполняет иммунная система. Состояние, при котором иммунная система в силу разных причин дает сбой, и эти нарушения иммунной защиты имеют долгосрочный патологический характер, называется иммунодефицитом (иммунодефицитным состоянием, ИДС). Помимо этого, при иммунодефиците притормаживается или вовсе прекращается процесс обновления организма.
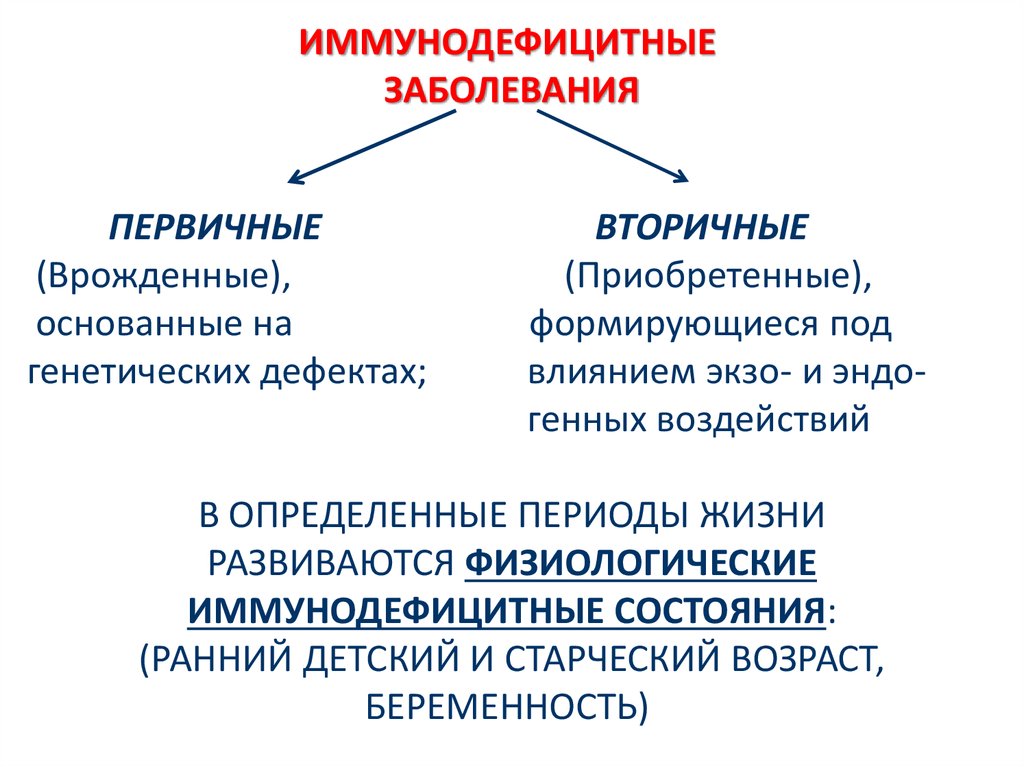
Иммунодефициты подразделяют на:
- первичные (наследственные, на генетическом уровне)
- вторичные (приобретенные в течение жизни).
Вторичные ИДС встречаются намного чаще, чем первичные. Хронические инфекционные болезни являются основным признаком иммунодефицитного состояния обоих типов.
Симптомы иммунодефицита
Симптомы первичного и вторичного иммунодефицита имеют схожие проявления и признаки:
- частые обострения хронических заболеваний (верхних дыхательных путей, артрозы, артриты, болезни желудочно-кишечного тракта и др.
 )
) - повышенная восприимчивость к различным инфекциям
- хроническая слабость, подавленное настроение, усталость, потливость
- систематически повышенная температура тела до 37,7
- совмещение патологий разного происхождения при одном заболевании (Бактериальных, вирусных и грибковых инфекций)
- болезненность и увеличение лимфатических узлов
- частые аллергические реакции
Чем опасно заболевание.
В результате иммунодефицита организм больного становится очень восприимчив к различным опасным заболеваниям. Это онкологические заболевания, вирус папилломы человека, менингит, ВИЧ, СПИД, тяжелые инфекции (абсцесс, пневмония, сепсис). Не исключена возможность летального исхода. Поэтому необходимо вовремя и правильно назначенное лечение.
Диагностика иммунодефицита
Проявление признаков первичного иммунодефицита происходит сразу после рождения ребенка или спустя небольшой промежуток времени.
Вторичный иммунодефицит могут развиться на любом этапе жизни.
Диагностика иммунной недостаточности включает в себя:
- первичный осмотр больного и сбор полного анамнеза
- общий анализ крови
- биохимический анализ крови
- генетические и иммунологические тесты (для первичного иммунодефицита)
- ПЦР-диагностика
- вирусологическое исследование
Специалисты, к которым стоит обратиться при подозрении на иммунодефицит:
- иммунолог
- вирусолог
- аллерголог
Лечение
Проявление признаков иммунодефицита у детей и у подростков говорит о врожденной форме заболевания, а у взрослого – о приобретенной.
Лечение первичного иммунодефицита гораздо сложней и представляет собой комплексный подход:
- Постановка точного диагноза с определением звена иммунной системы, которое было нарушено.

- Заместительная коррекция недостающего звена иммунной системы (например, трансплантация костного мозга).
- Введение иммуноглобулинов – внутривенно или подкожно (противопоказано больным с сердечной недостаточностью).
- Лечение антибиотиками, противогрибковыми или противовирусными препаратами при возникновении инфекционных осложнений.
Лечение второго типа необходимо начинать с установления и устранения причины его появления. Затем врач-иммунолог назначает: прием антибиотиков, иммунотерапию и витаминотерапию.
Профилактика
Профилактика иммунодефицитного состояния заключается в соблюдении здорового образа жизни и профилактике инфекций.
Запись на прием
Записаться на прием к иммунологу, а также к другим специалистам и пройти необходимое обследование в Москве Вы можете в клинике НКЦ №2 (ЦКБ РАН).
Взаимосвязь функции местного иммунитета и микробиоценоза кишечника, возможности иммунокоррекции дисбактериоза | #09/09
Желудочно-кишечный тракт (ЖКТ) выполняет не только пищеварительную, но и иммунную функцию, в частности, участвует в реализации защитных реакций организма против патогенных, условно-патогенных микроорганизмов и многих неорганических веществ.
Местный иммунитет кишечника
Около 80% всех иммунокомпетентных клеток организма локализовано именно в слизистой оболочке кишечника; около 25% слизистой оболочки кишечника состоит из иммунологически активной ткани и клеток; каждый метр кишечника содержит около 1010 лимфоцитов [1].
Иммунокомпетентная (лимфоидная) ткань ЖКТ представлена организованными структурами (пейеровы бляшки, аппендикс, миндалины, лимфатические узлы) и отдельными клеточными элементами (интраэпителиальные лимфоциты, плазматические клетки, макрофаги, тучные клетки, гранулоциты). Популяция клеток лимфоидной ткани разнородна и состоит из множества групп, подгрупп и клонов клеток с различными функциональными свойствами и специфичностью рецепторов к антигенам [2, 3].
Эпителий ЖКТ отграничивает ткани макроорганизма от огромного количества живых и неживых антигенов — субстанций, несущих признаки чужеродной генетической информации. Пероральное воздействие антигена (в том числе микробов и их токсинов) обычно создает, с одной стороны, местную «слизистую» IgA-защиту (секреторный иммунитет) и клеточно-опосредованную реакцию, но, с другой стороны, и системную толерантность или гипореактивность — подавление последующей выработки антигеноспецифических антител классов G и М и развития клеточно-опосредованного иммунитета. По отношению к патогенным и условно-патогенным микроорганизмам система местного иммунитета кишечника должна проявить адекватные защитные свойства, а по отношению к нормофлоре — как минимум, толерантность, а в лучшем случае — активно участвовать в процессах адгезии, выживания и размножения представителей нормофлоры.
Пероральное воздействие антигена (в том числе микробов и их токсинов) обычно создает, с одной стороны, местную «слизистую» IgA-защиту (секреторный иммунитет) и клеточно-опосредованную реакцию, но, с другой стороны, и системную толерантность или гипореактивность — подавление последующей выработки антигеноспецифических антител классов G и М и развития клеточно-опосредованного иммунитета. По отношению к патогенным и условно-патогенным микроорганизмам система местного иммунитета кишечника должна проявить адекватные защитные свойства, а по отношению к нормофлоре — как минимум, толерантность, а в лучшем случае — активно участвовать в процессах адгезии, выживания и размножения представителей нормофлоры.
Специфические иммунные механизмы вырабатываются кишечником для защиты от потенциально опасных микроорганизмов в течение всей жизни. Недифференцированные лимфоциты, продуцирующие в большинстве своем секреторные IgA- или IgM-антитела, присутствуют в собственном слизистом слое или пейеровых бляшках. Стимуляция В- и Т-лимфоцитов в присутствии чужеродного антигена происходит вслед за их выходом из брыжеечных узлов в грудной проток, кровеносное русло и возвращением в кишечник, где они скапливаются также в собственном слое слизистой оболочки. Активированные клетки продуцируют специфические антитела классов IgА и IgМ, которые секретируются на поверхности слизистой оболочки через 4–8 дней после стимуляции. Иммуноглобулины образуют комплексы с антигенами, нейтрализуют токсины, препятствуют контакту микроорганизмов с клетками-«мишенями» макроорганизма, способствуют быстрому выведению микроорганизмов из ЖКТ благодаря агглютинации.
Стимуляция В- и Т-лимфоцитов в присутствии чужеродного антигена происходит вслед за их выходом из брыжеечных узлов в грудной проток, кровеносное русло и возвращением в кишечник, где они скапливаются также в собственном слое слизистой оболочки. Активированные клетки продуцируют специфические антитела классов IgА и IgМ, которые секретируются на поверхности слизистой оболочки через 4–8 дней после стимуляции. Иммуноглобулины образуют комплексы с антигенами, нейтрализуют токсины, препятствуют контакту микроорганизмов с клетками-«мишенями» макроорганизма, способствуют быстрому выведению микроорганизмов из ЖКТ благодаря агглютинации.
Главная функция кишечных антител — иммунное отторжение у поверхности слизистой оболочки. Известно, что IgA преобладает среди иммуноглобулинов во всех секретах и в собственной пластинке кишечника. Секреторный IgA, выполняющий роль главного «чистильщика» и иммуномодулятора слизистой оболочки ЖКТ, удерживается около эпителиальных клеток в результате взаимодействия с гликокаликсом, во многом благодаря присутствию нормофлоры. IgA занимает благоприятную позицию, препятствующую поглощению антигенов. Двумерная молекула IgA может функционировать как агглютинин, уменьшая прилипание бактерий к энтероцитам [4].
IgA занимает благоприятную позицию, препятствующую поглощению антигенов. Двумерная молекула IgA может функционировать как агглютинин, уменьшая прилипание бактерий к энтероцитам [4].
В слизистой оболочке кишечника есть также клетки, вырабатывающие иммуноглобулины других классов, но их значительно меньше. Так, соотношение плазматических клеток, продуцирующих IgA, IgM, IgG, равно соответственно 20:3:1 [2].
Важнейшее свойство системы местного иммунитета кишечника — феномен рециркуляции лимфоцитов. Сенсибилизированные антигенами (как пищевыми, так и инфекционными) лимфоциты пейеровых бляшек мигрируют в брыжеечные лимфатические узлы, а оттуда по лимфатическим сосудам через грудной проток и систему кровообращения направляются к собственному слою слизистой оболочки кишечника, главным образом в качестве клеток, секретирующих IgA. Этот механизм обеспечивает формирование клонов лимфоцитов и образование специфических антител в участках слизистой оболочки, отдаленных от очага первичной сенсибилизации. В процессе сенсибилизации плазматических клеток с последующим клонированием лимфоцитов, вырабатывающих антитела с определенными свойствами (аналогичными тем, которые выступили матрицей), участвуют не только нативные молекулы иммуноглобулинов, но и активные Fc- и F(ab’)2-фрагменты.
В процессе сенсибилизации плазматических клеток с последующим клонированием лимфоцитов, вырабатывающих антитела с определенными свойствами (аналогичными тем, которые выступили матрицей), участвуют не только нативные молекулы иммуноглобулинов, но и активные Fc- и F(ab’)2-фрагменты.
Клеточный иммунитет кишечника в отличие от системы секретируемых им антител изучен недостаточно. Известно, что после перорального воздействия антигенов системные клеточные иммунные реакции выявляются редко. Очевидно, когда здоровые люди получают безвредные антигены (например, антигены нормофлоры), в слизистой оболочке кишечника не развиваются реакции клеточного иммунитета [2].
Система местного иммунитета кишечника работает следующим образом. Попавшие в просвет кишечника или на слизистые оболочки микроорганизмы распознаются иммуноглобулинами памяти (IgG), после чего информация передается в иммунокомпетентные клетки слизистой оболочки, где из сенсибилизированных лимфоцитов клонируются плазматические клетки, ответственные за синтез IgА и IgМ. В результате защитной деятельности этих иммуноглобулинов включаются механизмы иммунореактивности или иммунотолерантности. Иммунная система «запоминает» антигены нормофлоры, чему способствуют генетические факторы, а также антитела класса G, передающиеся от матери плоду во время беременности, и иммуноглобулины, поступающие в ЖКТ ребенка с грудным молоком. В результате рециркуляции лимфоцитов и клонирования иммунный ответ охватывает все слизистые ЖКТ.
В результате защитной деятельности этих иммуноглобулинов включаются механизмы иммунореактивности или иммунотолерантности. Иммунная система «запоминает» антигены нормофлоры, чему способствуют генетические факторы, а также антитела класса G, передающиеся от матери плоду во время беременности, и иммуноглобулины, поступающие в ЖКТ ребенка с грудным молоком. В результате рециркуляции лимфоцитов и клонирования иммунный ответ охватывает все слизистые ЖКТ.
Регуляция иммунных реакций слизистой оболочки кишечника представляет собой сложный процесс, который может изменяться в различных ситуациях, таких как: наличие или отсутствие повреждения слизистой оболочки, сохранение целостности и функциональности биопленки, наличие острых или хронических инфекций, зрелость иммунной системы, состояние питания и генетический потенциал индивидуума. В результате повреждения слизистой оболочки могут возникнуть изменения иммунологической реактивности, хотя в этой ситуации трудно различить первичные и вторичные эффекты.
Роль кишечной микрофлоры в иммунных реакциях
Микрофлора кишечника защищает человека от колонизации экзогенными патогенными микроорганизмами и подавляет рост уже имеющихся в кишечнике патогенных микроорганизмов за счет конкуренции за питательные вещества и участки связывания, а также выработки определенных ингибирующих рост патогенов субстанций. Кроме того, бактерии участвуют в реализации иммунологических защитных механизмов [5].
Известно, что одна из функций нормофлоры — иммунотропная, заключающаяся в стимуляции синтеза иммуноглобулинов, потенцировании механизмов неспецифической резистентности, системного и местного иммунитета, пропердина, комплемента, лизоцима, а также в стимуляции созревания системы фагоцитирующих мононуклеаров и лимфоидного аппарата кишечника [6, 7]. Нормофлора активирует не только местный иммунитет кишечника, но и иммунную систему всего организма, что подтверждается в опытах на безмикробных животных [8]. Основные направления деятельности индигенной (нормальной) микрофлоры в обеспечении нормального иммунного ответа: изменение иммуногенности чужеродных белков путем протеолиза; снижение секреции медиаторов воспаления в кишечнике; снижение интестинальной проницаемости; направление антигена к пейеровым бляшкам. Эти же эффекты реализуются в пробиотических препаратах [5].
Основные направления деятельности индигенной (нормальной) микрофлоры в обеспечении нормального иммунного ответа: изменение иммуногенности чужеродных белков путем протеолиза; снижение секреции медиаторов воспаления в кишечнике; снижение интестинальной проницаемости; направление антигена к пейеровым бляшкам. Эти же эффекты реализуются в пробиотических препаратах [5].
В кишечнике бактерии являются важнейшей составной частью биопленки: гликокаликс — слизь — IgA — нормофлора. Биопленка покрывает слизистую кишечника изнутри, занимает все выпуклости, образуемые энтероцитами, и защищает слизистую оболочку от дегидратации, физической и химической агрессии, а также от атак микроорганизмов, бактериальных токсинов, паразитов [9].
На фоне снижения бифидо- и лактобактерий повышается проницаемость эпителиального барьера кишечника для макромолекул пищи и дефицит секреторного IgA [10]. В свою очередь, дефицит секреторного IgA может приводить к развитию заболеваний кишечника и к частым синубронхиальным инфекциям, а в конечном итоге — к предрасположенности к атопии и аутоиммунным заболеваниям [11].
Проведенные на животных исследования показали, что при нарушениях биоценоза в ЖКТ развивается аутоиммунизация к комплексному антигену кишечной стенки, а применение иммунобиологических препаратов предотвращает этот процесс [12].
Дисбактериоз как иммунная дисфункция
Иммунная система регулирует баланс биоценоза кишечника, т. е. механизмы саморегуляции нормофлоры контролируются местным иммунитетом кишечника. Поскольку любой микроорганизм является антигеном, должны существовать механизмы отторжения чужеродных микроорганизмов, а также толерантности и создания благоприятных условий для нормофлоры.
Известно, что через плаценту от матери плоду передаются IgG, то есть иммуноглобулины, обеспечивающие иммунологическую память. Антитела классов М и А через плаценту не проходят, что объясняет недостаточную защищенность новорожденного против грамотрицательных микроорганизмов (энтеробактерии, сальмонеллы) [13]. Кроме того, доказано, что первые микроорганизмы, попадающие в кишечник, появляются там в процессе и после рождения ребенка и прикрепляются к определенным рецепторам [14]. Процесс специфической адгезии условно-патогенных и болезнетворных микроорганизмов к слизистой оболочке ЖКТ может блокироваться среди прочих факторов присутствием IgA и лизоцимом, которые, в свою очередь, способствуют адгезии к рецепторам представителей бифидо- и лактофлоры [15].
Кроме того, доказано, что первые микроорганизмы, попадающие в кишечник, появляются там в процессе и после рождения ребенка и прикрепляются к определенным рецепторам [14]. Процесс специфической адгезии условно-патогенных и болезнетворных микроорганизмов к слизистой оболочке ЖКТ может блокироваться среди прочих факторов присутствием IgA и лизоцимом, которые, в свою очередь, способствуют адгезии к рецепторам представителей бифидо- и лактофлоры [15].
Подтверждением роли IgA в предотвращении колонизации слизистых оболочек посторонними микроорганизмами является тот факт, что 99% бактерий представителей нормофлоры не покрыты секреторными иммуноглобулинами. Напротив, энтеробактерии, стафилококки, другие условно-патогенные и сапрофитные микроорганизмы полностью покрыты IgA [8]. В основе этого явления лежит феномен иммунологической толерантности к нормофлоре.
У новорожденных и детей раннего возраста транзиторная иммунная недостаточность — биологическая закономерность, в основном относящаяся к гуморальному иммунитету [13]. У детей этой возрастной группы значительно чаще, чем у детей старше года, возникают стойкие нарушения биоценоза кишечника, что отчасти связано с недостаточностью иммунной системы.
У детей этой возрастной группы значительно чаще, чем у детей старше года, возникают стойкие нарушения биоценоза кишечника, что отчасти связано с недостаточностью иммунной системы.
Физиологическая недостаточность системы местного иммунитета кишечника в первые три мес жизни ребенка компенсируется поступлением IgA и других защитных факторов с женским молоком. При грудном вскармливании ежесуточно ребенок получает до 1,5 г IgА. У детей, находящихся на искусственном или раннем смешанном вскармливании, т. е. лишенных защитных факторов женского молока, значительно чаще наблюдаются пищевые аллергии и дисбактериозы кишечника, что отмечается большинством исследователей в этой области.
Проникновение инфекционных агентов на слизистые оболочки ЖКТ и других органов вызывает ответную реакцию системы местного иммунитета в виде нарастания концентрации IgA, который вырабатывается при участии нормофлоры. Соответственно, может возникнуть ситуация, когда микробиологический дисбаланс одного типа будет способствовать усугублению микроэкологических нарушений. Так, снижение количества нормофлоры влечет за собой дефицит IgA, в результате чего повышается колонизация слизистых оболочек условно-патогенной флорой (УПФ).
Так, снижение количества нормофлоры влечет за собой дефицит IgA, в результате чего повышается колонизация слизистых оболочек условно-патогенной флорой (УПФ).
Врожденные и транзиторные аномалии системы местного иммунитета кишечника снижают резистентность организма не столько к агрессивным вирулентным микроорганизмам, сколько к УПФ. С ними связана устойчивость кишечного дисбактериоза [16].
Практически у 100% людей с приобретенными иммунодефицитами (в результате радиационного воздействия и других иммуносупрессорных факторах) имеются нарушения состава кишечной микрофлоры, при этом у них отмечается не только повышенный рост УПФ, но и резкое снижение нормофлоры [8], то есть нарушаются и защитная функция местного иммунитета, и иммунологическая толерантность, что может косвенно свидетельствовать о том, что система местного иммунитета способствует не только элиминации чужеродных микроорганизмов, но и создает оптимальные условия (а не только иммунологическую толерантность) для нормофлоры.
Учитывая значительное взаимодействие между биоценозом кишечника и системой местного иммунитета кишечника, целесообразно считать дисбактериоз не только микробиологической, но и иммунологической проблемой, что должно отражаться в лечебной тактике.
Иммунокоррекция при дисбактериозе кишечника
Развитие дисбактериоза свидетельствует о недостаточности работы системы местного иммунитета кишечника. Полностью поддерживая тезис о вторичности нарушений биоценоза (дисбактериоз всегда вторичен и причинно обусловлен), можно считать, что одной из причин развития любого дисбактериоза является иммунологическая дисфункция и, прежде всего, недостаточность гуморального иммунитета.
У детей первых месяцев жизни транзиторная иммунная недостаточность — это биологическая закономерность, в основном относящаяся к гуморальному иммунитету. Именно поэтому у детей этой возрастной группы значительно чаще, чем у детей старше года, возникают стойкие и транзиторные нарушения биоценоза кишечника без каких-либо других видимых причин. Затем причинами иммунной дисфункции могут быть хронические вялотекущие паразитарные или микробные инфекции, острые кишечные инфекции, острые респираторные заболевания, детские инфекции, вакцинации; неблагоприятные экологические факторы; стрессы; применение антибиотиков и др. Очень часто проявления дисбактериоза отмечаются через некоторое время после перечисленных воздействий.
Затем причинами иммунной дисфункции могут быть хронические вялотекущие паразитарные или микробные инфекции, острые кишечные инфекции, острые респираторные заболевания, детские инфекции, вакцинации; неблагоприятные экологические факторы; стрессы; применение антибиотиков и др. Очень часто проявления дисбактериоза отмечаются через некоторое время после перечисленных воздействий.
Основное средство для иммунокоррекции дисбактериоза — комплексный иммуноглобулиновый препарат (КИП), разработанный сотрудниками МНИИЭМ им. Г. Н. Габричевского [17]. Материалом для получения КИП служит донорская плазма от нескольких тысяч доноров, поэтому можно говорить о коллективном иммунитете. КИП, в отличие от нормального иммуноглобулина человека, содержит иммуноглобулины трех классов: 50% IgG, 25% IgM, 25% IgA. КИП характеризуется повышенным содержанием антител к энтеробактериям (шигеллы, сальмонеллы, эшерихии, протей, клебсиелла и др.), Pseudomonas aeruginosa, стафилококкам, а также к ротавирусам. Таким образом, в состав КИП входят иммуноглобулины 3 классов к основным видам патогенной и условно-патогенной флоры. Специфические антитела, содержащиеся в КИП, нейтрализуют действие энтеропатогенных микроорганизмов, что достигается наличием в препарате антител одинаковой специфичности, но разных классов, способствующих агглютинации, нейтрализации и преципитации инфекционных агентов.
Таким образом, в состав КИП входят иммуноглобулины 3 классов к основным видам патогенной и условно-патогенной флоры. Специфические антитела, содержащиеся в КИП, нейтрализуют действие энтеропатогенных микроорганизмов, что достигается наличием в препарате антител одинаковой специфичности, но разных классов, способствующих агглютинации, нейтрализации и преципитации инфекционных агентов.
Препарат представляет собой лиофилизированную смесь во флаконах. 1 стандартная доза содержит 300 мг белка и следовые количества консервантов. Введенный через рот, КИП частично расщепляется в желудке и двенадцатиперстной кишке на активные составляющие: Fc- и F(ab’)2-фрагменты, которые сохраняют серологическую и антигенсвязывающую активность иммуноглобулинов [18]. Эти фрагменты имеют слишком большую молекулярную массу, чтобы проникнуть в системный кровоток через слизистую оболочку кишечника, поэтому КИП оказывает в основном местное действие в просвете, на слизистых оболочках и в собственном слое слизистой оболочки, проникая в кровоток в микроколичествах путем пиноцитоза и т. п. Действие КИП происходит на протяжении всего ЖКТ, но особенно в толстом кишечнике, где сосредоточено большое количество лимфоидной ткани (пейеровы бляшки).
п. Действие КИП происходит на протяжении всего ЖКТ, но особенно в толстом кишечнике, где сосредоточено большое количество лимфоидной ткани (пейеровы бляшки).
Чтобы понять механизм действия КИП, следует вспомнить основные положения классической иммунологии [13, 16]. Известно, что наиболее представленные в сыворотке крови любого человека IgG (75%) имеют самую простую среди антител структуру и являются основными носителями иммунологической памяти. Специфические моноклональные иммуноглобулины образуются в лимфоидной ткани, их синтезируют лимфоциты, прошедшие дифференцировку за счет сенсибилизированных антигеном антител. Несмотря на короткий срок жизни иммуноглобулинов класса G (21–28 дней), за счет дифференцировки лимфоцитов иммунологическая память сохраняется достаточно долго (часто пожизненно). Молекулы иммуноглобулинов у всех людей имеют сходную структуру (например, IgG к клебсиеллам одинаков у всех), поэтому не воспринимаются иммунной системой как чужеродные белки. Введенные в организм «чужие» антитела, достигнув лимфоидной ткани кишечника, включаются в формирование иммунологической памяти наряду с собственными, которые вырабатываются в результате контакта с антигеном. Феномен рециркуляции лимфоцитов способствует образованию специфических антител в участках слизистой оболочки, отдаленных от очага первичной сенсибилизации. Поэтому иммуноглобулины, введенные энтерально, не только выполняют функцию иммунного ответа в кишечнике, но и выступают в роли матрицы, с которой клонируются плазматические клетки с заданными свойствами. Система местного иммунитета кишечника приобретает способность противостоять тем микроорганизмам, антитела к которым содержатся в КИП. Пассивная иммунизация ребенка, получающего материнское молоко, осуществляется аналогично через иммуноглобулины, содержащиеся в нем. Таким образом, иммунокоррекция комплексным иммуноглобулиновым препаратом физиологична. КИП стимулирует механизмы развития собственного местного гуморального иммунитета, что особенно важно для детей, лишенных материнского молока.
Введенные в организм «чужие» антитела, достигнув лимфоидной ткани кишечника, включаются в формирование иммунологической памяти наряду с собственными, которые вырабатываются в результате контакта с антигеном. Феномен рециркуляции лимфоцитов способствует образованию специфических антител в участках слизистой оболочки, отдаленных от очага первичной сенсибилизации. Поэтому иммуноглобулины, введенные энтерально, не только выполняют функцию иммунного ответа в кишечнике, но и выступают в роли матрицы, с которой клонируются плазматические клетки с заданными свойствами. Система местного иммунитета кишечника приобретает способность противостоять тем микроорганизмам, антитела к которым содержатся в КИП. Пассивная иммунизация ребенка, получающего материнское молоко, осуществляется аналогично через иммуноглобулины, содержащиеся в нем. Таким образом, иммунокоррекция комплексным иммуноглобулиновым препаратом физиологична. КИП стимулирует механизмы развития собственного местного гуморального иммунитета, что особенно важно для детей, лишенных материнского молока.
Кроме действия на иммунитет кишечника, КИП обладает прямым антимикробным действием за счет содержания в нем антител классов М и А. Эти иммуноглобулины, связываясь с комплементом, вызывают лизис бактерий. Поэтому КИП может использоваться без добавления других антибактериальных препаратов [19].
Для коррекции микробиологических нарушений КИП назначают курсом 5–10 дней по 1 дозе 1 раз в сутки (утром за 30 мин до еды). Пятидневный курс рекомендован при следующих типах дисбактериоза:
-
дисбактериоз с отсутствием в исследовании УПФ компенсированный; -
дисбактериоз с количеством УПФ ≤ 50%;
Пролонгированные курсы КИП (десятидневный или два пятидневных курса с интервалом между ними 5 дней — схема 5+5) показаны:
-
при любом декомпенсированном дисбактериозе; -
при дисбактериозе с количеством УПФ > 50%).
Пролонгированные курсы при описанных ситуациях оказались эффективнее традиционного пятидневного курса, что подтвердило специальное исследование [20].
Кроме КИП во флаконах существуют свечные формы, а также комбинации КИП с интерфероном (Кипферон). Кипферон в свечах обладает местным действием в дистальных отделах прямой кишки и общим иммуностимулирующим действием за счет всасывания в геморроидальном сплетении прямой кишки (система нижней полой вены).
КИП в свечах используется у детей со следующими показаниями: запоры, сопровождающиеся развитием трещин прямой кишки; симптомы колита; профилактика и лечение респираторных инфекций у детей старше 1 года; а также совместно с КИП во флаконах, применяемым per os, для усиления иммуностимулирующего действия у детей с выраженным ослаблением иммунитета.
Курс лечения КИП в свечах составляет 5–10 дней, по 1/2–1 свече однократно на ночь, после опорожнения кишечника. Улучшение самочувствия ребенка наступает в процессе лечения или по окончании курса. Эффект применения КИП в свечах подтверждается лабораторными исследованиями.
Улучшение самочувствия ребенка наступает в процессе лечения или по окончании курса. Эффект применения КИП в свечах подтверждается лабораторными исследованиями.
Кроме коррекции дисбактериоза КИП используют в сочетании с традиционной этиотропной и патогенетической терапией для лечения острых кишечных инфекций установленной или неясной этиологии, особенно у детей раннего возраста [21, 22]. У больных на 2–3 день уменьшается интоксикация, снижается кратность стула, улучшается его консистенция, исчезают патологические примеси, а на 5–6 день наступает нормализация стула. Исследование микрофлоры кишечника показывает санацию организма от возбудителя, при этом, в отличие от использования антибиотиков, уменьшения количества нормофлоры не наблюдается. Свечи с КИП показаны для лечения острых кишечных инфекций у выборочного контингента детей (при рвоте, непереносимости орального введения и т. д.).
Безопасность использования КИП
КИП с осторожностью следует применять у детей с аллергией на белок, реакцией на введение иммуноглобулинов в анамнезе, а также при других ситуациях, чреватых развитием побочных реакций при использовании, и противопоказаниях к применению иммуноглобулинов.
Технология получения КИП, включающая спиртовое фракционирование сыворотки с последующим осаждением фракции иммуноглобулинов полиэтиленгликолем, исключает возможность передачи с препаратом вирусов гепатита В, ВИЧ и других патогенных микроорганизмов. Кроме того, донорская или плацентарная кровь, из которых получают плазму для приготовления КИП, а также серии готового препарата тщательно проверяют. Поэтому опасения инфицирования посредством приема КИП не обоснованы [23].
Клинически выраженные аллергические реакции при приеме КИП наблюдались крайне редко. В некоторых случаях (особенно при совместном использовании с бактериофагами) отмечалось кратковременное ухудшение самочувствия, усиление имевшихся до начала лечения симптомов, что, по-видимому, связано с лизисом УПФ. У некоторых детей на фоне приема КИП снижался аппетит, но восстанавливался всегда быстро и самостоятельно.
Использование КИП пролонгированными курсами не увеличило частоту побочных эффектов по сравнению с традиционными схемами. Для подстраховки в отдельных случаях одновременно с приемом КИП можно назначать антигистаминные препараты.
Для подстраховки в отдельных случаях одновременно с приемом КИП можно назначать антигистаминные препараты.
По вопросам литературы обращайтесь в редакцию.
Ю. А. Копанев, кандидат медицинских наук НИИ эпидемиологии и микробиологии им. Г. Н. Габричевского, Москва
Транзиторная гипогаммаглобулинемия грудного возраста | Больница на Грейт-Ормонд-стрит
Транзиторная гиогаммаглобулинемия младенчества (THI) — это название состояния, при котором иммунная система созревает медленнее, чем обычно, но в конечном итоге функционирует совершенно нормально. В этом информационном бюллетене больницы Грейт-Ормонд-стрит (GOSH) объясняются причины, симптомы и лечение преходящей гипогаммаглобулинемии у младенцев (THI), а также информация о том, где можно получить помощь. «Гипогаммаглобулинемия» означает низкий уровень иммуноглобулинов (также известных как антитела) в тела, которые важны в борьбе с инфекциями. Существуют три основные группы иммуноглобулинов — IgG, IgA и IgM.
Существуют три основные группы иммуноглобулинов — IgG, IgA и IgM.
Как обычно развивается иммунная система?
Когда дети рождаются, их иммунная система очень незрелая. Они получат некоторое количество IgG от своих матерей путем передачи через плаценту в течение последних нескольких месяцев беременности, и они будут производить только небольшое количество собственных IgA и IgM.
В течение первых шести месяцев жизни IgG, полученные от матери, постепенно утрачиваются. В то же время ребенок начинает вырабатывать свой собственный IgG и больше IgA и M. Однако, поскольку ребенок не вырабатывает IgG так быстро, как теряет тот, что был получен от матери, общее количество IgG в кровь стабильно падает. Обычно он достигает своего самого низкого уровня примерно в шестимесячном возрасте. Это нормально и называется «физиологической гипогаммаглобулинемией».
После этого уровни иммуноглобулинов постепенно повышаются на протяжении всего детства, пока не достигают уровня взрослых, когда детям исполняется около 14 лет.
Если ребенок рождается очень рано, у него не будет времени для нормальной передачи IgG от матери. Поэтому у недоношенных детей может быть более ранняя и более выраженная физиологическая гипогаммаглобулинемия, чем в норме.
Что происходит с иммунной системой при THI?
Младенцы иногда медленно начинают вырабатывать иммуноглобулины. Все типы иммуноглобулинов могут быть низкими, или один или два могут быть нормальными. Эта проблема обычно не длится очень долго, и уровни у большинства детей «догоняют» к тому времени, когда им исполняется три-четыре года. У некоторых детей полного наверстывания может не быть, пока им не исполнится около десяти лет.
Какие проблемы вызывает THI?
Дети с THI могут иметь более частые и длительные инфекции, чем другие дети того же возраста. Часто это инфекции горла и уха или неспецифические вирусы. Типичная история состоит в том, что ребенку приходится часто ходить к врачу, и ему назначают много курсов антибиотиков, особенно зимой. Некоторые родители сообщают, что их ребенок снова плохо себя чувствует, как только антибиотики прекращаются. Однако важно помнить, что частые инфекции у нормальных детей особенно распространены в то время, когда они начинают общаться с другими детьми, например, в детском саду или школе. Многие маленькие дети страдают от частых незначительных инфекций, и у большинства из них полностью нормальная иммунная система.
Некоторые родители сообщают, что их ребенок снова плохо себя чувствует, как только антибиотики прекращаются. Однако важно помнить, что частые инфекции у нормальных детей особенно распространены в то время, когда они начинают общаться с другими детьми, например, в детском саду или школе. Многие маленькие дети страдают от частых незначительных инфекций, и у большинства из них полностью нормальная иммунная система.
Дети с THI иногда подвергаются риску серьезных инфекций, таких как пневмония или менингит, но это относительно редко.
Что может произойти в долгосрочной перспективе?
У подавляющего большинства детей к школьному возрасту проблема решается. Тем не менее, состояние небольшого числа тех, у кого предположительно есть ТГИ, не улучшается со временем, и их уровни иммуноглобулина остаются низкими или даже падают дальше. У этого очень небольшого числа детей развивается долговременный иммунодефицит, известный как общий вариабельный иммунодефицит (ОВИН). Важно подчеркнуть, что у большинства детей с рецидивирующими инфекциями и низким уровнем иммуноглобулина в младенчестве не возникнут пожизненные проблемы, но они будут иметь нормальную иммунную систему и вести нормальный здоровый образ жизни.
Важно подчеркнуть, что у большинства детей с рецидивирующими инфекциями и низким уровнем иммуноглобулина в младенчестве не возникнут пожизненные проблемы, но они будут иметь нормальную иммунную систему и вести нормальный здоровый образ жизни.
Что вызывает THI?
Это неизвестно. Скорость развития иммунной системы сильно различается у разных людей, и THI, вероятно, просто представляет собой один конец спектра.
Насколько распространен THI?
Истинная частота THI неизвестна. Возможно, что у многих детей, страдающих от частых инфекций в первые несколько лет жизни, на самом деле может быть ТГИ, но они просто никогда не исследуются.
Есть ли риск, что у других детей в семье может быть ТГИ?
Существует несколько повышенный риск для других детей в той же семье по сравнению с населением в целом, но общий риск все еще очень низок.
Как будет проходить обследование моего ребенка?
Если есть опасения, что ребенок страдает более частыми, более длительными или более тяжелыми инфекциями, чем обычно, его или ее могут направить к педиатру и, возможно, к иммунологу. Потребуется анализ крови, чтобы измерить уровень его или ее иммуноглобулина и, возможно, проверить наличие специфических антител, которые должны были быть выработаны после вакцинации против определенных инфекций, таких как столбняк и Hib. Маловероятно, что потребуются более сложные тесты. Если у ребенка обнаруживается низкий уровень антител к вакцине, возможно, потребуется сделать несколько «бустерных» прививок с последующим повторным анализом крови, чтобы убедиться, что он или она должным образом защищены от определенных инфекций, и в качестве дополнительного теста на его или ее иммунная система.
Потребуется анализ крови, чтобы измерить уровень его или ее иммуноглобулина и, возможно, проверить наличие специфических антител, которые должны были быть выработаны после вакцинации против определенных инфекций, таких как столбняк и Hib. Маловероятно, что потребуются более сложные тесты. Если у ребенка обнаруживается низкий уровень антител к вакцине, возможно, потребуется сделать несколько «бустерных» прививок с последующим повторным анализом крови, чтобы убедиться, что он или она должным образом защищены от определенных инфекций, и в качестве дополнительного теста на его или ее иммунная система.
Чем лечить?
Стандартного лечения THI не существует. Управление направлено на поддержание хорошего повседневного здоровья и нормальной жизни, включая регулярное посещение школы или детского сада. Некоторых детей можно лечить, просто быстро леча инфекции по мере их возникновения. Однако, если ребенок заболевает очень часто — возможно, каждые четыре недели — ему или ей может потребоваться регулярная низкая доза антибиотиков. Это может быть очень успешным, а иногда может превратить ребенка из постоянно нездорового, несчастного и медленно растущего в нормального, живого и счастливого. При необходимости регулярный прием антибиотиков можно продолжать в течение нескольких лет, хотя на практике это необычно. Некоторым детям регулярный прием антибиотиков необходим только в зимние месяцы.
Это может быть очень успешным, а иногда может превратить ребенка из постоянно нездорового, несчастного и медленно растущего в нормального, живого и счастливого. При необходимости регулярный прием антибиотиков можно продолжать в течение нескольких лет, хотя на практике это необычно. Некоторым детям регулярный прием антибиотиков необходим только в зимние месяцы.
Иногда дети с THI могут иметь или продолжают иметь более серьезные инфекции. В этой очень небольшой группе можно рассмотреть заместительный иммуноглобулин. Это может продолжаться в течение нескольких лет, но обычно в этом нет необходимости после десятилетнего возраста. Если инфекции и степень гипогаммаглобулинемии достаточно серьезны, чтобы потребовать замены иммуноглобулина, существует более высокая вероятность того, что проблема сохранится и перерастет в ОВИН.
Существуют ли какие-либо долгосрочные эффекты THI?
Практически у всех детей с ТГИ долговременные проблемы отсутствуют. Они будут хорошо расти и развиваться и вести нормальный здоровый образ жизни. Однако, если у них были серьезные инфекции до того, как проблема была распознана, возможно, что может быть какое-то повреждение, особенно ушей и легких. Слух может ухудшиться, и потребуется последующее наблюдение специалистов по уху, горлу и носу, а также аудиологов. Повреждение легких встречается гораздо реже и возникает только в том случае, если были повторные эпизоды пневмонии.
Однако, если у них были серьезные инфекции до того, как проблема была распознана, возможно, что может быть какое-то повреждение, особенно ушей и легких. Слух может ухудшиться, и потребуется последующее наблюдение специалистов по уху, горлу и носу, а также аудиологов. Повреждение легких встречается гораздо реже и возникает только в том случае, если были повторные эпизоды пневмонии.
Как будет контролироваться мой ребенок?
Ребенок будет проходить регулярные осмотры у иммунолога или педиатра, обычно каждые четыре-шесть месяцев. Его или ее уровни иммуноглобулина будут проверяться анализом крови каждые шесть-двенадцать месяцев. Если вы беспокоитесь в любое время между регулярными проверками, вы можете назначить дополнительные встречи.
Нужно ли мне принимать какие-либо особые меры предосторожности для защиты моего ребенка?
В идеале дети с THI должны вести совершенно нормальную жизнь. Они могут принимать участие во всех мероприятиях. Единственная разница будет заключаться в том, что родители должны заранее спросить своего врача общей практики, если их ребенок нездоров, поскольку могут потребоваться антибиотики.
Единственная разница будет заключаться в том, что родители должны заранее спросить своего врача общей практики, если их ребенок нездоров, поскольку могут потребоваться антибиотики.
А прививки?
Большинству детей будут сделаны первые прививки, в том числе живая вакцина против полиомиелита, до того, как им будет поставлен диагноз THI. Многие еще не получили MMR. Часть начального исследования THI включает оценку реакции антител на вакцины, как упоминалось выше. Если можно продемонстрировать хороший ответ на первый набор вакцин, то нет причин не продолжать вакцинацию MMR. Однако, если ответы плохие или отсутствуют, введение MMR следует отложить до тех пор, пока не будет доказано, что иммунная система созревает — с доказательствами хороших ответов на предыдущие вакцины. Нет никаких доказательств того, что у младенцев с THI следует избегать живых вакцин.
Составитель:
Отделение иммунологии в сотрудничестве с Информационной группой о детях и семьях
Дата последней проверки:
Декабрь 2015 г.
Ref:
2015F0553 IMM-INF-01
Транзиторная гипогаммаглобулинемия младенческого возраста — StatPearls
Непрерывное обучение
Транзиторная гипогаммаглобулинемия младенчества (THI) представляет собой тип дефицита антител, который поражает младенцев и детей, как правило, в возрасте до 6 лет. Для него характерны рецидивирующие бактериальные инфекции, и его можно лечить антибиотиками или заместительной иммуноглобулиновой терапией. В этом упражнении рассматривается клиническая оценка, диагностика и лечение THI.
Цели:
Проанализируйте клиническую картину новорожденных с иммунодефицитом THI.
Опишите эпидемиологию и предлагаемую патофизиологию THI.
Опишите варианты лечения и ведения, доступные для THI.
Кратко опишите межпрофессиональные групповые стратегии по улучшению координации помощи и коммуникации для улучшения результатов.

Получите доступ к бесплатным вопросам с несколькими вариантами ответов по этой теме.
Введение
Транзиторная гипогаммаглобулинемия младенцев (THI) представляет собой первичный иммунодефицит, вызванный преходящим снижением уровня иммуноглобулина G (IgG) у младенцев в возрасте от 5 до 24 месяцев. Уровни обычно возвращаются к референсному диапазону в возрасте от 2 до 6 лет. IgG продуцируется плодом в небольших количествах, и это единственный иммуноглобулин, проникающий через плаценту. При рождении уровень IgG у младенца такой же, как у его матери. Вскоре после рождения у младенцев начинают вырабатываться собственные IgG, и их уровни постепенно увеличиваются до ожидаемого значения примерно в возрасте 6 месяцев. Этот процесс совпадает со снижением уровня IgG у матери.
Ожидается физиологическая гипогаммаглобулинемия, которая возникает в возрасте от 3 до 6 месяцев, когда материнские уровни низки, а продуктивность младенцев низкая. Этот физиологический ответ обычно не имеет клинического значения. В случае THI уровни IgG остаются значительно ниже (два стандартных отклонения) у младенцев после 6-месячного возраста. Клинически THI может характеризоваться рецидивирующими инфекциями, хотя некоторые пациенты остаются бессимптомными. Также может наблюдаться наличие адекватных или слегка пониженных уровней IgA и IgM в сыворотке крови. Эта комбинация исключает диагноз Х-сцепленной агаммаглобулинемии. Однако другие иммунодефициты, такие как общий вариабельный иммунодефицит, нельзя полностью исключить до тех пор, пока не закончится транзиторный период и уровни IgG не вернутся к норме. Диагноз обычно подтверждается ретроспективно. Мужчины страдают больше, чем женщины, в соотношении 2 к 1. Причина и частота THI неизвестны. Лечение антибиотиками и заместительной иммуноглобулиновой терапией имеет первостепенное значение в лечении симптоматических младенцев.[1][2]
В случае THI уровни IgG остаются значительно ниже (два стандартных отклонения) у младенцев после 6-месячного возраста. Клинически THI может характеризоваться рецидивирующими инфекциями, хотя некоторые пациенты остаются бессимптомными. Также может наблюдаться наличие адекватных или слегка пониженных уровней IgA и IgM в сыворотке крови. Эта комбинация исключает диагноз Х-сцепленной агаммаглобулинемии. Однако другие иммунодефициты, такие как общий вариабельный иммунодефицит, нельзя полностью исключить до тех пор, пока не закончится транзиторный период и уровни IgG не вернутся к норме. Диагноз обычно подтверждается ретроспективно. Мужчины страдают больше, чем женщины, в соотношении 2 к 1. Причина и частота THI неизвестны. Лечение антибиотиками и заместительной иммуноглобулиновой терапией имеет первостепенное значение в лечении симптоматических младенцев.[1][2]
Этиология
Точная причина транзиторной гипогаммаглобулинемии в младенчестве неизвестна. Предлагаемые механизмы включают 1) неисправность Т-клеток, которые не могут стимулировать соответствующий синтез антител В-клетками, 2) подавление продукции IgG материнскими IgG, 3) низкую продукцию критических цитокинов и 4) генетические вариации в семьях, склонных к иммунодефициту. [3][4][5]
[3][4][5]
Эпидемиология
Расчетная частота транзиторной гипогаммаглобулинемии различается в разных исследованиях. В некоторых исследованиях это наиболее распространенный дефицит IgG в детском возрасте.[6] Исследования описали его во всем мире, и считается, что он крайне недооценивается из-за различий в критериях диагностики. Сообщается, что THI чаще встречается у мужчин. Более чем у половины больных диагноз ставится в возрасте до года, а у остальных — после пяти лет. Исходно низкие уровни IgM и IgA были связаны с медленным выздоровлением. Пациенты с более длительным периодом грудного вскармливания выздоравливают раньше.[7]
Патофизиология
Транзиторная гипогаммаглобинемия в младенчестве может представлять собой преувеличенный физиологический минимум, когда материнский IgG начинает снижаться и до того, как ребенок начинает синтезировать свой собственный иммуноглобулин. Хотя механизм полностью не выяснен, одним из предположений является присутствие материнских иммуносупрессивных антител (IgG), проникающих через плаценту и разрушающих гуморальную иммунную систему новорожденного. Это ингибирование может вызвать снижение уровня не только IgG, но также IgM и IgA, что наблюдается в некоторых случаях.
Это ингибирование может вызвать снижение уровня не только IgG, но также IgM и IgA, что наблюдается в некоторых случаях.
Некоторые исследования показывают, что у пациентов с THI имеется нормальное количество B-лимфоцитов, но преходящее нарушение функции T-лимфоцитов, связанное с синтезом иммуноглобулина. В нем подчеркивается важность сотрудничества В- и Т-клеток для обеспечения надлежащего иммунного ответа.[1]
Анамнез и физикальное исследование
При транзиторной гипогаммаглобулинемии в младенчестве у большинства пациентов возникают инфекции верхних и нижних дыхательных путей и аллергические расстройства, включая пищевую аллергию. Более тяжелые проявления включают инфекции мочевыводящих путей, гастроэнтерит и инвазивные инфекции. Результаты физического осмотра соответствуют конкретному типу инфекции.
Типичные симптоматические проявления включают [2][3][4]:
Синусные инфекции легких
Бактериемия
Менингит
9 0092
Средний отит
Артрит
Септицемия
Bronchiectasis
Рецидивый тонзиллит
Pyodermitis
Гуленый конъюнктивит
Задержка развития
Афтозный стоматит
Диарея
Потеря веса
Рецидивирующий абсцесс
Потеря веса
Аутоиммунитет
Атопия
Инфекции легких
Вирусные инфекции
Нейтропения
Постоянная рвота
Грибковая инфекция (кандидоз)
Некоторые младенцы остаются бессимптомными с диагнозом после иммунологического обследования по другим причинам или в семейном анамнезе.
Оценка
Лабораторное исследование пациента с транзиторной гипогаммаглобулинемией в младенчестве включает оценку уровней обоих иммуноглобулинов, количественную оценку В-клеток, тестирование на антитела, иммунофенотипирование и функцию Т-клеток, а также другие исследования, как указано ниже[5][ 6][7][8]:
Количественный анализ сывороточных иммуноглобулинов
IgG
IgM
IgA
IgG1
IgG2
IgG3
IgG4
В THI IgG ниже минимум на два стандартных отклонения ожидаемый контроль.[9] IgA и IgM могут быть снижены, а могут и не быть.
Активность антител
Обнаружение изогемагглютининов (IgM)
Кровь против группы А
Кровь против группы В
Антитела IgG (после контакта)
Краснуха
Корь
Ветряная оспа
Антитела IgG (после иммунизации)
Большинство детей грудного возраста с THI вырабатывают нормальные антитела к вакцинам, включая вакцины против дифтерии, столбняка, гепатита A и B, конъюгированные Haemophilus influenzae типа B, вакцины против кори, эпидемического паротита и краснухи. В США большинство детей получают конъюгированную пневмококковую вакцину, и они хорошо реагируют на нее. Если пациент не отвечает на иммунизацию, такую как столбняк, необходимо провести тщательное иммунологическое исследование для диагностики раннего иммунодефицитного расстройства.
В США большинство детей получают конъюгированную пневмококковую вакцину, и они хорошо реагируют на нее. Если пациент не отвечает на иммунизацию, такую как столбняк, необходимо провести тщательное иммунологическое исследование для диагностики раннего иммунодефицитного расстройства.
Другие анализы
Субпопуляции Т-лимфоцитов крови
Общее количество лимфоцитов
Т-лимфоциты (CD3, CD4 и CD8)
Соотношение CD4/CD8
Количественная оценка В-клеток
Уровни CD19
Уровни CD20
Уровни CD21
Уровни CD81 9 0003
Уровни CD 225
Функция Т- и В-клеток считается нормальной в большинство исследований.
Микробиологические исследования
Спинномозговая жидкость (посев, биохимия и гистопатология)
Посев крови
Посев кала гм осмотр
Другие расследования
анализ ДНК 092
КТ
Другие тесты могут быть необходимы по клиническим показаниям для исключения других причин.
Лечение/управление
Медицинское обслуживание
Транзиторная гипогаммаглобулинемия грудного возраста Лечение консервативное.
Лечение антибиотиками с профилактической целью целесообразно, если у детей начинают возникать инфекции.
У пациентов, у которых развиваются тяжелые угрожающие жизни инфекции или рецидивирующие инфекции дыхательных путей, несмотря на антибактериальную терапию, показана пробная заместительная терапия антителами в виде внутривенного иммуноглобулина (ВВИГ).
Если возникает аллергический ринит, лечите местными назальными кортикостероидами и антигистаминными препаратами.
Следует проводить плановые прививки, включая конъюгированную семивалентную пневмококковую вакцину для плановой иммунизации детей, начиная с 2-месячного возраста. [10][11][12][13][10]
Хирургическая помощь
Из-за частоты ушных инфекций следует рассмотреть вопрос о размещении тимпаностомических трубок. Функциональная эндоскопическая хирургия околоносовых пазух (FESS) при хроническом синусите также может быть рассмотрена.
Функциональная эндоскопическая хирургия околоносовых пазух (FESS) при хроническом синусите также может быть рассмотрена.
Дифференциальный диагноз
Дифференциальный диагноз транзиторной гипогаммаглобулинемии у младенцев включает:
Х-сцепленную (Брутона) агаммаглобулинемию: рецидивирующие бактериальные инфекции поражают мальчиков, и генетические исследования могут выявить наличие мутаций тирозинкиназы Брутона (BTK). [14]
Общий вариабельный иммунодефицит: рецидивирующие бактериальные инфекции, обычно в более позднем возрасте (второе-четвертое десятилетие жизни). Диагноз подтверждается после исключения всех причин иммунодефицита.[15]
Прогноз
Прогноз транзиторной гипогаммаглобулинемии у младенцев зависит от тяжести иммунодефицита. Прогноз для тех, у кого есть симптомы или заболевание протекает в легкой форме, благоприятный, без значительной заболеваемости. Пациенты с тяжелым заболеванием могут быть поражены оппортунистическими инфекциями, атопией или аутоиммунитетом и иметь более сложное течение, но, по определению, THI должен полностью разрешиться. У некоторых пациентов может наблюдаться состояние, сходное с Х-сцепленной агаммаглобулинемией, и они должны получать противомикробные препараты и ВВИГ пожизненно.
У некоторых пациентов может наблюдаться состояние, сходное с Х-сцепленной агаммаглобулинемией, и они должны получать противомикробные препараты и ВВИГ пожизненно.
Осложнения
Осложнения транзиторной гипогаммаглобулинемии у младенцев включают[16]:
Консультации
В случаях тяжелой транзиторной гипогаммаглобулинемии у младенцев необходимы педиатр и клинический иммунолог. Консультации с другими специалистами, такими как инфекционист и аллерголог, также могут иметь значение.
Сдерживание и просвещение пациентов
Родители детей с транзиторной гипогаммаглобулинемией в младенчестве должны получать информацию о риске инфекций. Соблюдение режима лечения, включая антибиотики, иммуноглобулины и антигистаминные препараты, необходимо для уменьшения осложнений от транзиторной гипогаммаглобулинемии в младенчестве.
Pearls and Other Issues
Транзиторная гипогаммаглобулинемия младенчества (THI) — транзиторный иммунодефицит детского возраста, характеризующийся низким (не менее двух стандартных отклонений) уровнем IgG.

THI обычно проявляется в течение первого года жизни рецидивирующими инфекциями верхних и нижних дыхательных путей.
Атопия является частым проявлением.
Первичный дифференциальный диагноз включает Х-сцепленную агаммаглобулинемию и общий вариабельный иммунодефицит.
Диагноз THI подтверждается ретроспективно, когда уровень IgG возвращается к ожидаемому уровню.
Антибиотикопрофилактика и заместительная терапия иммуноглобулином могут быть необходимы для пациентов с тяжелыми и рецидивирующими инфекциями.
Улучшение результатов медицинского персонала
Транзиторная гипогаммаглобулинемия в младенчестве может проявляться рецидивирующими инфекциями, атопией, аутоиммунитетом и желудочно-кишечными расстройствами. Лечение может быть сложным, учитывая спектр проявлений заболевания с вовлечением нескольких систем органов. Им должна управлять межпрофессиональная команда, в которую входят иммунолог, специалист по инфекционным заболеваниям, медсестры, педиатр, фармацевт, аллерголог и лечащий врач, которые сотрудничают между собой в разных дисциплинах для достижения оптимальных результатов для пациентов. [Уровень V] Ключевым моментом является выявление дефицита иммуноглобулина и начало оперативного лечения.
[Уровень V] Ключевым моментом является выявление дефицита иммуноглобулина и начало оперативного лечения.
Контрольные вопросы
Доступ к бесплатным вопросам с несколькими вариантами ответов по этой теме.
Комментарий к этой статье.
Референции
- 1.
Семинская И., Рутковска-Запала М., Буковска-Стракова К., Груца А., Шафлярска А., Кобыларж К., Сидлар М., Бар J. Положительный уровень супрессорных клеток миелоидного происхождения коррелирует с регуляторными Т-клетками в крови детей с транзиторной гипогаммаглобулинемией младенческого возраста. Cent Eur J Immunol. 2018;43(4):413-420. [Бесплатная статья PMC: PMC6384417] [PubMed: 30799989]
- 2.
Келес С., Артак Х., Кара Р., Гоктурк Б., Озен А., Рейсли И. Транзиторная гипогаммаглобулинемия и неклассифицированная гипогаммаглобулинемия: «сходства и различия». Детская Аллергия Иммунол. 2010 авг; 21 (5): 843-51. [PubMed: 20609138]
- 3.

Уилан М.А., Хван В.Х., Босолей Дж., Хаук В.В., Макгиди С.Дж. Младенцы с рецидивирующими инфекциями и низким уровнем иммуноглобулинов: характеристика и анализ нормализации. Дж. Клин Иммунол. 2006 янв; 26(1):7-11. [В паблике: 16418798]
- 4.
Ван Л.Дж., Ян Ю.Х., Линь Ю.Т., Чан Б.Л. Иммунологические и клинические особенности педиатрических больных с первичной гипогаммаглобулинемией на Тайване. Азиатская Пак J Аллергия Иммунол. 2004 март; 22(1):25-31. [PubMed: 15366655]
- 5.
Wang HC, Whelan MA, McGeady SJ, Yousef E. 5-месячный мальчик с рецидивирующими респираторными инфекциями, отставанием в развитии и пограничным повышенным уровнем хлоридов пота. Аллергия Астма Proc. 2006 г., май-июнь; 27(3):285-8. [В паблике: 16913275]. Подгруппы В-лимфоцитов и исходы у пациентов с первоначальным диагнозом транзиторной гипогаммаглобулинемии младенчества. Сканд Дж. Иммунол. 2018 Октябрь;88(4):e12709. [PubMed: 30152873]
- 7.
Rutkowska M, Trzyna E, Lenart M, Szaflarska A, Pituch-Noworolska A, Kobylarz K, Siedlar M. Повышенное количество циркулирующих регуляторных Т-клеток у пациентов с транзиторной гипогаммагло булинемия младенчестве не связано с какими-либо аномалиями в генах, кодирующих рецепторы TGF-β. Клин Иммунол. 2013 окт;149(1):83-5. [PubMed: 23899993]
- 8.
Karaca NE, Aksu G, Gulez N, Yildiz B, Azarsiz E, Kutukculer N. Новые лабораторные данные у турецких пациентов с преходящей гипогаммаглобулинемией младенчества. Иран J Аллергия Астма Иммунол. 2010 декабрь;9(4):237-43. [PubMed: 21131704]
- 9.
Далал И., Рид Б., Нисбет-Браун Э., Ройфман К.М. Исходы больных гипогаммаглобулинемией в младенчестве и раннем детстве. J Педиатр. 1998 г., июль; 133 (1): 144-6. [В паблике: 9672529]
- 10.
Амератунга Р., Ан И., Стил Р., Вун С.Т. Транзиторная гипогаммаглобулинемия младенческого возраста: многие пациенты выздоравливают в подростковом и зрелом возрасте.
 Клин Эксп Иммунол. 2019 ноябрь; 198(2):224-232. [Бесплатная статья PMC: PMC6797871] [PubMed: 31260083]
Клин Эксп Иммунол. 2019 ноябрь; 198(2):224-232. [Бесплатная статья PMC: PMC6797871] [PubMed: 31260083]- 11.
Беллутти Эндерс Ф., Конти Ф., Кандотти Ф., Анджелини Ф. [Транзиторная гипогаммаглобулинемия младенчества]. Преподобный Мед Свисс. 2017 05 апреля; 13 (557): 739-742. [PubMed: 28722362]
- 12.
Бреслин М.Е., Лин Дж.Х., Робертс Р., Лим К.Дж., Стим Э.Р. Транзиторная гипогаммаглобулинемия и тяжелый атопический дерматит: открытое лечение иммуноглобулином в серии случаев. Аллергия Ринол (Провиденс). 2016 Январь;7(2):69-73. [Бесплатная статья PMC: PMC5010435] [PubMed: 27470901]
- 13.
Меммедова Л., Азарсиз Э., Эдер Караджа Н., Аксу Г., Кутуккулер Н. Продлевает ли внутривенная иммуноглобулиновая терапия иммунодефицит при транзиторной гипогамии маглобулинемия младенческого возраста? Педиатр Респ. 2013;5(3):e14. [Бесплатная статья PMC: PMC3812531] [PubMed: 24198926]
- 14.
Сури Д.


 )
)