Si это что: Si | это… Что такое Si?
Si | это… Что такое Si?
| Кремний/Silicium (Si) | |
|---|---|
| Атомный номер | 14 |
| Внешний вид простого вещества | В аморфной форме — коричневый порошок, в кристаллической — тёмно-серый, слегка блестящий |
| Свойства атома | |
| Атомная масса (молярная масса) | 28,0855 а. е. м. (г/моль) |
| Радиус атома | 132 пм |
| Энергия ионизации (первый электрон) | 786,0(8,15) кДж/моль (эВ) |
| Электронная конфигурация | [Ne] 3s2 3p2 |
| Химические свойства | |
| Ковалентный радиус | 111 пм |
| Радиус иона | 42 (+4e) 271 (-4e) пм |
| Электроотрицательность (по Полингу) | 1,90 |
| Электродный потенциал | 0 |
| Степени окисления | +4, −4, +2 |
| Термодинамические свойства простого вещества | |
| Плотность | 2,33 г/см³ |
| Удельная теплоёмкость | 19,8 Дж/(K·моль) |
| Теплопроводность | 149 Вт/(м·K) |
| Температура плавления | 1688 K |
| Теплота плавления | 50,6 кДж/моль |
| Температура кипения | 2623 K |
| Теплота испарения | 383 кДж/моль |
| Молярный объём | 12,1 см³/моль |
| Кристаллическая решётка простого вещества | |
| Структура решётки | алмаз |
| Период решётки | 5,430 Å |
| Отношение c/a | n/a |
| Температура Дебая | 625,00 K |
| Si | 14 |
| 28,0855 | |
| 3s²3p² | |
| Кремний | |
Содержание
|
История
Схема атома кремния
В чистом виде кре́мний был выделен в 1811 году французскими учеными Жозефом Луи Гей-Люссаком и Луи Жаком Тенаром.
Происхождение названия
В 1825 году шведский химик Йёнс Якоб Берцелиус действием металлического калия на фтористый кремний SiF4 получил чистый элементарный кремний. Новому элементу было дано название «силиций» (от лат. silex — кремень). Русское название «кремний» введено в 1834 году российский химиком Германом Ивановичем Гессом. В переводе c греческого kremnos — «утес, гора».
Нахождение в природе
По распространённости в земной коре кремний среди всех элементов занимает второе место (после кислорода). Масса земной коры на 27,6—29,5 % состоит из кремния. Кремний входит в состав нескольких сотен различных природных силикатов и алюмосиликатов. Больше всего распространен кремнезём — многочисленные формы диоксида кремния (IV) SiO2 (речной песок, кварц, кремень и др.), составляющий около 12 % земной коры (по массе). В свободном виде кремний в природе не встречается, хотя одна четвертая земли состоит из кремния.
Кремний входит в состав нескольких сотен различных природных силикатов и алюмосиликатов. Больше всего распространен кремнезём — многочисленные формы диоксида кремния (IV) SiO2 (речной песок, кварц, кремень и др.), составляющий около 12 % земной коры (по массе). В свободном виде кремний в природе не встречается, хотя одна четвертая земли состоит из кремния.
Получение
В промышленности кремний получают, восстанавливая расплав SiO2коксом при температуре около 1800 °C в дуговых печах. Чистота полученного таким образом кремния составляет около 99,9 %. Так как для практического использования нужен кремний более высокой чистоты, полученный кремний хлорируют. Образуются соединения состава SiCl4 и SiCl3H. Эти хлориды далее очищают различными способами от примесей и на заключительном этапе восстанавливают чистым водородом. Возможна также очистка кремния за счет предварительного получения силицида магния Mg2Si. Далее из силицида магния с помощью соляной или уксусной кислот получают летучий моносилан SiH4. Моносилан очищают далее ректификацией, сорбционными и др. методами, а затем разлагают на кремний и водород при температуре около 1000 °C. Содержание примесей в получаемом этими методами кремнии снижается до 10-8-10-6% по массе.
Моносилан очищают далее ректификацией, сорбционными и др. методами, а затем разлагают на кремний и водород при температуре около 1000 °C. Содержание примесей в получаемом этими методами кремнии снижается до 10-8-10-6% по массе.
Способ получения кремния в чистом виде разработан Николаем Николаевичем Бекетовым. Крупнейшим производителем кремния в России является ОК Русал[1] — кремний производится на заводах в г. Каменск-Уральский (Свердловская область) и г. Шелехов (Иркутская область).
Физические свойства
Кристаллическая структура кремния.
Кристаллическая решетка кремния кубическая гранецентрированная типа алмаза, параметр а = 0,54307 нм (при высоких давлениях получены и другие полиморфные модификации кремния), но из-за большей длины связи между атомами Si—Si по сравнению с длиной связи С—С твердость кремния значительно меньше, чем алмаза. Кремний хрупок, только при нагревании выше 800 °C он становится пластичным веществом. Интересно, что кремний прозрачен к инфракрасному излучению, начиная с длины волны 1. 1 микрометр.
1 микрометр.
Схематическое изображение зонной структуры кремния [1]
Электрофизические свойства
Элементарный кремний — типичный непрямозонный полупроводник. Ширина запрещенной зоны при комнатной температуре 1,12 эВ, а при Т = 0 К составляет 1,21 эВ [2]. Концентрация носителей заряда в кремнии с собственной проводимостью при комнатной температуре 1,5·1016м-3. На электрофизические свойства кристаллического кремния большое влияние оказывают содержащиеся в нем микропримеси. Для получения монокристаллов кремния с дырочной проводимостью в кремний вводят добавки элементов III-й группы — бора, алюминия, галлия и индия, с электронной проводимостью — добавки элементов V-й группы — фосфора, мышьяка или сурьмы. Электрические свойства кремния можно варьировать, изменяя условия обработки монокристаллов, в частности, обрабатывая поверхность кремния различными химическими агентами.
Подвижность электронов 1400 см²/(в*c).
Химические свойства
В соединениях кремний склонен проявлять степень окисления +4 или −4, так как для атома кремния более характерно состояние sp³-гибридизации орбиталей. Поэтому во всех соединениях, кроме оксида кремния (II) SiO, кремний четырёхвалентен.
Поэтому во всех соединениях, кроме оксида кремния (II) SiO, кремний четырёхвалентен.
Химически кремний малоактивен. При комнатной температуре реагирует только с газообразным фтором, при этом образуется летучий тетрафторид кремния SiF4. При нагревании до температуры 400—500°C кремний реагирует с кислородом с образованием диоксида SiO2, с хлором, бромом и иодом — с образованием соответствующих легко летучих тетрагалогенидов SiHal4.
С водородом кремний непосредственно не реагирует, соединения кремния с водородом — силаны с общей формулой SinH2n+2 — получают косвенным путем. Моносилан SiH4 (его часто называют просто силаном) выделяется при взаимодействии силицидов металлов с растворами кислот, например:
Ca2Si + 4HCl → 2CaCl2 + SiH4↑.
Образующийся в этой реакции силан SiH4 содержит примесь и других силанов, в частности, дисилана Si2H6 и трисилана Si3H8, в которых имеется цепочка из атомов кремния, связанных между собой одинарными связями (—Si—Si—Si—).
С азотом кремний при температуре около 1000 °C образует нитрид Si3N4, с бором — термически и химически стойкие бориды SiB3, SiB6 и SiB12. Соединение кремния и его ближайшего аналога по таблице Менделеева — углерода — карбид кремния SiC (карборунд) характеризуется высокой твердостью и низкой химической активностью. Карборунд широко используется как абразивный материал.
При нагревании кремния с металлами возникают силициды. Силициды можно подразделить на две группы: ионно-ковалентные (силициды щелочных, щелочноземельных металлов и магния типа Ca2Si, Mg2Si и др.) и металлоподобные (силициды переходных металлов). Силициды активных металлов разлагаются под действием кислот, силициды переходных металлов химически стойки и под действием кислот не разлагаются. Металлоподобные силициды имеют высокие температуры плавления (до 2000 °C). Наиболее часто образуются металлоподобные силициды составов MeSi, Me3Si2, Me2Si3, Me5Si3 и MeSi2. Металлоподобные силициды химически инертны, устойчивы к действию кислорода даже при высоких температурах.
Металлоподобные силициды химически инертны, устойчивы к действию кислорода даже при высоких температурах.
При восстановлении SiO2 кремнием при высоких температурах образуется оксид кремния (II) SiO.
Для кремния характерно образование кремнийорганических соединений, в которых атомы кремния соединены в длинные цепочки за счет мостиковых атомов кислорода —О—, а к каждому атому кремния, кроме двух атомов О, присоединены еще два органических радикала R1 и R2 = CH3, C2H5, C6H5, CH2CH2CF3 и др.
Применение
Микроконтроллер 1993 года с УФ стиранием памяти 62E40 европейской фирмы
В настоящее время кремний — основной материал для электроники и солнечной энергетики.
Монокристаллический кремний — материал для зеркал газовых лазеров.
Иногда кремний (технической чистоты) и его сплав с железом (ферросилиций) используется для производства водорода в полевых условиях.
Соединения металлов с кремнием — силициды, являются широкоупотребляемыми в промышленности (например электронной и атомной) материалами с широким спектром полезных химических, электрических и ядерных свойств (устойчивость к окислению, нейтронам и др.), а также силициды ряда элементов являются важными термоэлектрическими материалами.
Кремний применяется в металлургии при выплавке чугуна, сталей, бронз, силумина и др. (как раскислитель и модификатор, а также как легирующий компонент).
Соединения кремния служат основой для производства стекла и цемента. Производством стекла и цемента занимается силикатная промышленность. Она также выпускает силикатную керамику — кирпич, фарфор, фаянс и изделия из них.
Широко известен силикатный клей, преимущественно применяемый для склеивания бумаги.
Последнее время очень широко применяются полимеры на основе кремния — силиконы.
Биологическая роль
Для некоторых организмов кремний является важным биогеным элементом. Он входит в состав опорных образований у растений и скелетных — у животных. В больших количествах кремний концентрируют морские организмы — диатомовые водоросли, радиолярии, губки. Большие количества кремния концентрируют хвощи и злаки, в первую очередь — подсемейства Бамбуков и Рисовидных, в том числе — рис посевной. Мышечная ткань человека содержит (1-2)·10-2% кремния, костная ткань — 17·10-4%, кровь — 3,9 мг/л. С пищей в организм человека ежедневно поступает до 1 г кремния.
Он входит в состав опорных образований у растений и скелетных — у животных. В больших количествах кремний концентрируют морские организмы — диатомовые водоросли, радиолярии, губки. Большие количества кремния концентрируют хвощи и злаки, в первую очередь — подсемейства Бамбуков и Рисовидных, в том числе — рис посевной. Мышечная ткань человека содержит (1-2)·10-2% кремния, костная ткань — 17·10-4%, кровь — 3,9 мг/л. С пищей в организм человека ежедневно поступает до 1 г кремния.
Соединения кремния относительно нетоксичны. Но очень опасно вдыхание высокодисперсных частиц как силикатов, так и диоксида кремния, образующихся, например, при взрывных работах, при долблении пород в шахтах, при работе пескоструйных аппаратов и т. д. Микрочастицы SiO2, попавшие в лёгкие, кристаллизуются в них, а возникающие кристаллики разрушают лёгочную ткань и вызывают тяжёлую болезнь — силикоз. Чтобы не допустить попадания в лёгкие опасной пыли, следует использовать для защиты органов дыхания респиратор.
См. также
- Категория: Соединения кремния
- Пористый кремний
- Кристаллический кремний
- Германий
- Кремнийорганические соединения
Ссылки
- Кремний на Webelements
- Кремний в Популярной библиотеке химических элементов
Литература
- Самсонов. Г. В. Силициды и их использование в технике. Киев, Изд-во АН УССР, 1959. 204 стр. с илл.
- Алёшин Е. П., Алёшин Н. Е. Рис. Москва, 1993. 504 стр. 100 рис.
Примечания
- ↑ Р Смит., Полупроводники: Пер. с англ. — М.: Мир, 1982. — 560 с, ил.
- ↑ Зи С., Физика полупроводниковых приборов: В 2-х книгах. Кн. 1. Пер. с англ. — М.: Мир, 1984. — 456 с, ил.
Периодическая система химических элементов Д. И. Менделеева
| H | He | ||||||||||||||||||||||
| Li | Be | B | C | N | O | F | Ne | ||||||||||||||||
| Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||||||||
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | ||||||
| Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | ||||||
| Cs | Ba | * | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | ||||||
| Fr | Ra | ** | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Uub | Uut | Uuq | Uup | Uuh | Uus | Uuo | ||||||
| Uue | Ubn | ||||||||||||||||||||||
| * | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | ||||||||
| ** | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | ||||||||
Wikimedia Foundation.
2010.
Si | это… Что такое Si?
| Кремний/Silicium (Si) | |
|---|---|
| Атомный номер | 14 |
| Внешний вид простого вещества | В аморфной форме — коричневый порошок, в кристаллической — тёмно-серый, слегка блестящий |
| Свойства атома | |
| Атомная масса (молярная масса) | 28,0855 а. е. м. (г/моль) |
| Радиус атома | 132 пм |
| Энергия ионизации (первый электрон) | 786,0(8,15) кДж/моль (эВ) |
| Электронная конфигурация | [Ne] 3s2 3p2 |
| Химические свойства | |
| Ковалентный радиус | 111 пм |
| Радиус иона | 42 (+4e) 271 (-4e) пм |
| Электроотрицательность (по Полингу) | 1,90 |
| Электродный потенциал | 0 |
| Степени окисления | +4, −4, +2 |
| Термодинамические свойства простого вещества | |
| Плотность | 2,33 г/см³ |
| Удельная теплоёмкость | 19,8 Дж/(K·моль) |
| Теплопроводность | 149 Вт/(м·K) |
| Температура плавления | 1688 K |
| Теплота плавления | 50,6 кДж/моль |
| Температура кипения | 2623 K |
| Теплота испарения | 383 кДж/моль |
| Молярный объём | 12,1 см³/моль |
| Кристаллическая решётка простого вещества | |
| Структура решётки | алмаз |
| Период решётки | 5,430 Å |
| Отношение c/a | n/a |
| Температура Дебая | 625,00 K |
| Si | 14 |
| 28,0855 | |
| 3s²3p² | |
| Кремний | |
Содержание
|
История
Схема атома кремния
В чистом виде кре́мний был выделен в 1811 году французскими учеными Жозефом Луи Гей-Люссаком и Луи Жаком Тенаром.
Происхождение названия
В 1825 году шведский химик Йёнс Якоб Берцелиус действием металлического калия на фтористый кремний SiF4 получил чистый элементарный кремний. Новому элементу было дано название «силиций» (от лат. silex — кремень). Русское название «кремний» введено в 1834 году российский химиком Германом Ивановичем Гессом. В переводе c греческого kremnos — «утес, гора».
Нахождение в природе
По распространённости в земной коре кремний среди всех элементов занимает второе место (после кислорода). Масса земной коры на 27,6—29,5 % состоит из кремния. Кремний входит в состав нескольких сотен различных природных силикатов и алюмосиликатов. Больше всего распространен кремнезём — многочисленные формы диоксида кремния (IV) SiO2 (речной песок, кварц, кремень и др.), составляющий около 12 % земной коры (по массе). В свободном виде кремний в природе не встречается, хотя одна четвертая земли состоит из кремния.
Кремний входит в состав нескольких сотен различных природных силикатов и алюмосиликатов. Больше всего распространен кремнезём — многочисленные формы диоксида кремния (IV) SiO2 (речной песок, кварц, кремень и др.), составляющий около 12 % земной коры (по массе). В свободном виде кремний в природе не встречается, хотя одна четвертая земли состоит из кремния.
Получение
В промышленности кремний получают, восстанавливая расплав SiO2коксом при температуре около 1800 °C в дуговых печах. Чистота полученного таким образом кремния составляет около 99,9 %. Так как для практического использования нужен кремний более высокой чистоты, полученный кремний хлорируют. Образуются соединения состава SiCl4 и SiCl3H. Эти хлориды далее очищают различными способами от примесей и на заключительном этапе восстанавливают чистым водородом. Возможна также очистка кремния за счет предварительного получения силицида магния Mg2Si. Далее из силицида магния с помощью соляной или уксусной кислот получают летучий моносилан SiH4. Моносилан очищают далее ректификацией, сорбционными и др. методами, а затем разлагают на кремний и водород при температуре около 1000 °C. Содержание примесей в получаемом этими методами кремнии снижается до 10-8-10-6% по массе.
Моносилан очищают далее ректификацией, сорбционными и др. методами, а затем разлагают на кремний и водород при температуре около 1000 °C. Содержание примесей в получаемом этими методами кремнии снижается до 10-8-10-6% по массе.
Способ получения кремния в чистом виде разработан Николаем Николаевичем Бекетовым. Крупнейшим производителем кремния в России является ОК Русал[1] — кремний производится на заводах в г. Каменск-Уральский (Свердловская область) и г. Шелехов (Иркутская область).
Физические свойства
Кристаллическая структура кремния.
Кристаллическая решетка кремния кубическая гранецентрированная типа алмаза, параметр а = 0,54307 нм (при высоких давлениях получены и другие полиморфные модификации кремния), но из-за большей длины связи между атомами Si—Si по сравнению с длиной связи С—С твердость кремния значительно меньше, чем алмаза. Кремний хрупок, только при нагревании выше 800 °C он становится пластичным веществом. Интересно, что кремний прозрачен к инфракрасному излучению, начиная с длины волны 1. 1 микрометр.
1 микрометр.
Схематическое изображение зонной структуры кремния [1]
Электрофизические свойства
Элементарный кремний — типичный непрямозонный полупроводник. Ширина запрещенной зоны при комнатной температуре 1,12 эВ, а при Т = 0 К составляет 1,21 эВ [2]. Концентрация носителей заряда в кремнии с собственной проводимостью при комнатной температуре 1,5·1016м-3. На электрофизические свойства кристаллического кремния большое влияние оказывают содержащиеся в нем микропримеси. Для получения монокристаллов кремния с дырочной проводимостью в кремний вводят добавки элементов III-й группы — бора, алюминия, галлия и индия, с электронной проводимостью — добавки элементов V-й группы — фосфора, мышьяка или сурьмы. Электрические свойства кремния можно варьировать, изменяя условия обработки монокристаллов, в частности, обрабатывая поверхность кремния различными химическими агентами.
Подвижность электронов 1400 см²/(в*c).
Химические свойства
В соединениях кремний склонен проявлять степень окисления +4 или −4, так как для атома кремния более характерно состояние sp³-гибридизации орбиталей. Поэтому во всех соединениях, кроме оксида кремния (II) SiO, кремний четырёхвалентен.
Поэтому во всех соединениях, кроме оксида кремния (II) SiO, кремний четырёхвалентен.
Химически кремний малоактивен. При комнатной температуре реагирует только с газообразным фтором, при этом образуется летучий тетрафторид кремния SiF4. При нагревании до температуры 400—500°C кремний реагирует с кислородом с образованием диоксида SiO2, с хлором, бромом и иодом — с образованием соответствующих легко летучих тетрагалогенидов SiHal4.
С водородом кремний непосредственно не реагирует, соединения кремния с водородом — силаны с общей формулой SinH2n+2 — получают косвенным путем. Моносилан SiH4 (его часто называют просто силаном) выделяется при взаимодействии силицидов металлов с растворами кислот, например:
Ca2Si + 4HCl → 2CaCl2 + SiH4↑.
Образующийся в этой реакции силан SiH4 содержит примесь и других силанов, в частности, дисилана Si2H6 и трисилана Si3H8, в которых имеется цепочка из атомов кремния, связанных между собой одинарными связями (—Si—Si—Si—).
С азотом кремний при температуре около 1000 °C образует нитрид Si3N4, с бором — термически и химически стойкие бориды SiB3, SiB6 и SiB12. Соединение кремния и его ближайшего аналога по таблице Менделеева — углерода — карбид кремния SiC (карборунд) характеризуется высокой твердостью и низкой химической активностью. Карборунд широко используется как абразивный материал.
При нагревании кремния с металлами возникают силициды. Силициды можно подразделить на две группы: ионно-ковалентные (силициды щелочных, щелочноземельных металлов и магния типа Ca2Si, Mg2Si и др.) и металлоподобные (силициды переходных металлов). Силициды активных металлов разлагаются под действием кислот, силициды переходных металлов химически стойки и под действием кислот не разлагаются. Металлоподобные силициды имеют высокие температуры плавления (до 2000 °C). Наиболее часто образуются металлоподобные силициды составов MeSi, Me3Si2, Me2Si3, Me5Si3 и MeSi2. Металлоподобные силициды химически инертны, устойчивы к действию кислорода даже при высоких температурах.
Металлоподобные силициды химически инертны, устойчивы к действию кислорода даже при высоких температурах.
При восстановлении SiO2 кремнием при высоких температурах образуется оксид кремния (II) SiO.
Для кремния характерно образование кремнийорганических соединений, в которых атомы кремния соединены в длинные цепочки за счет мостиковых атомов кислорода —О—, а к каждому атому кремния, кроме двух атомов О, присоединены еще два органических радикала R1 и R2 = CH3, C2H5, C6H5, CH2CH2CF3 и др.
Применение
Микроконтроллер 1993 года с УФ стиранием памяти 62E40 европейской фирмы
В настоящее время кремний — основной материал для электроники и солнечной энергетики.
Монокристаллический кремний — материал для зеркал газовых лазеров.
Иногда кремний (технической чистоты) и его сплав с железом (ферросилиций) используется для производства водорода в полевых условиях.
Соединения металлов с кремнием — силициды, являются широкоупотребляемыми в промышленности (например электронной и атомной) материалами с широким спектром полезных химических, электрических и ядерных свойств (устойчивость к окислению, нейтронам и др.), а также силициды ряда элементов являются важными термоэлектрическими материалами.
Кремний применяется в металлургии при выплавке чугуна, сталей, бронз, силумина и др. (как раскислитель и модификатор, а также как легирующий компонент).
Соединения кремния служат основой для производства стекла и цемента. Производством стекла и цемента занимается силикатная промышленность. Она также выпускает силикатную керамику — кирпич, фарфор, фаянс и изделия из них.
Широко известен силикатный клей, преимущественно применяемый для склеивания бумаги.
Последнее время очень широко применяются полимеры на основе кремния — силиконы.
Биологическая роль
Для некоторых организмов кремний является важным биогеным элементом. Он входит в состав опорных образований у растений и скелетных — у животных. В больших количествах кремний концентрируют морские организмы — диатомовые водоросли, радиолярии, губки. Большие количества кремния концентрируют хвощи и злаки, в первую очередь — подсемейства Бамбуков и Рисовидных, в том числе — рис посевной. Мышечная ткань человека содержит (1-2)·10-2% кремния, костная ткань — 17·10-4%, кровь — 3,9 мг/л. С пищей в организм человека ежедневно поступает до 1 г кремния.
Он входит в состав опорных образований у растений и скелетных — у животных. В больших количествах кремний концентрируют морские организмы — диатомовые водоросли, радиолярии, губки. Большие количества кремния концентрируют хвощи и злаки, в первую очередь — подсемейства Бамбуков и Рисовидных, в том числе — рис посевной. Мышечная ткань человека содержит (1-2)·10-2% кремния, костная ткань — 17·10-4%, кровь — 3,9 мг/л. С пищей в организм человека ежедневно поступает до 1 г кремния.
Соединения кремния относительно нетоксичны. Но очень опасно вдыхание высокодисперсных частиц как силикатов, так и диоксида кремния, образующихся, например, при взрывных работах, при долблении пород в шахтах, при работе пескоструйных аппаратов и т. д. Микрочастицы SiO2, попавшие в лёгкие, кристаллизуются в них, а возникающие кристаллики разрушают лёгочную ткань и вызывают тяжёлую болезнь — силикоз. Чтобы не допустить попадания в лёгкие опасной пыли, следует использовать для защиты органов дыхания респиратор.
См. также
- Категория: Соединения кремния
- Пористый кремний
- Кристаллический кремний
- Германий
- Кремнийорганические соединения
Ссылки
- Кремний на Webelements
- Кремний в Популярной библиотеке химических элементов
Литература
- Самсонов. Г. В. Силициды и их использование в технике. Киев, Изд-во АН УССР, 1959. 204 стр. с илл.
- Алёшин Е. П., Алёшин Н. Е. Рис. Москва, 1993. 504 стр. 100 рис.
Примечания
- ↑ Р Смит., Полупроводники: Пер. с англ. — М.: Мир, 1982. — 560 с, ил.
- ↑ Зи С., Физика полупроводниковых приборов: В 2-х книгах. Кн. 1. Пер. с англ. — М.: Мир, 1984. — 456 с, ил.
Периодическая система химических элементов Д. И. Менделеева
| H | He | ||||||||||||||||||||||
| Li | Be | B | C | N | O | F | Ne | ||||||||||||||||
| Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||||||||
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | ||||||
| Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | ||||||
| Cs | Ba | * | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | ||||||
| Fr | Ra | ** | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Uub | Uut | Uuq | Uup | Uuh | Uus | Uuo | ||||||
| Uue | Ubn | ||||||||||||||||||||||
| * | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | ||||||||
| ** | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | ||||||||
Wikimedia Foundation.
2010.
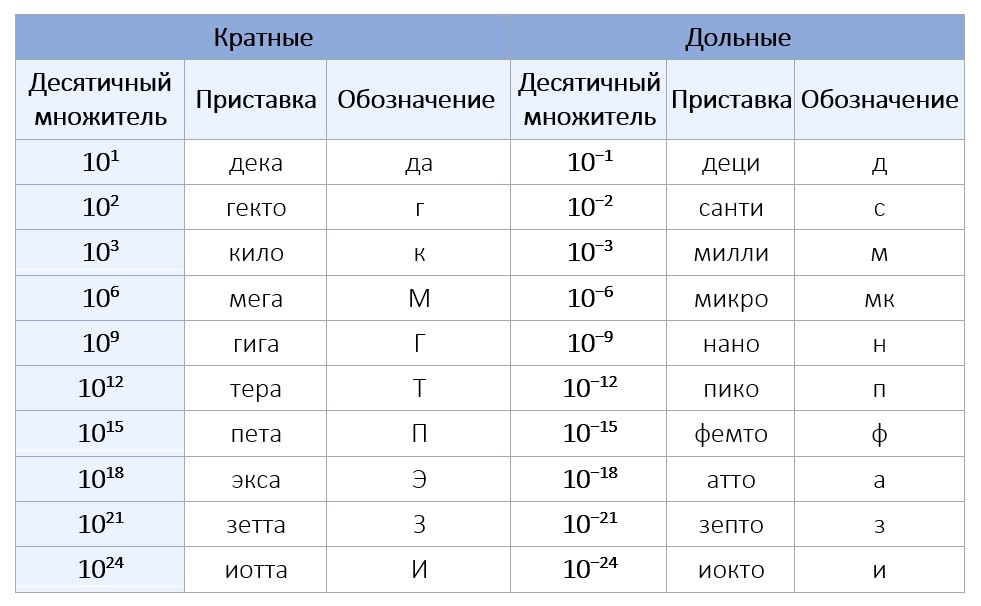
единиц СИ | НИСТ
SI основывается на семи (7) определяющих константах: частота сверхтонкого расщепления цезия, скорость света в вакууме, постоянная Планка, элементарный заряд (то есть заряд протона), постоянная Больцмана, Авогадро постоянная и световая отдача указанного монохроматического источника. Определения всех семи (7) базовых единиц СИ выражаются с использованием явно-константной формулировки и экспериментально реализуются с использованием конкретной mises en pratique (практическая техника).
Семь основных единиц СИ, которые состоят из:
- Длина в метрах (м)
- Время — секунды (с)
- Количество вещества — моль (моль)
- Электрический ток — ампер (А)
- Температура – Кельвин (К)
- Сила света — кандела (кд)
- Масса — килограмм (кг)
Международная система единиц (СИ), широко известная как метрическая система, является международным стандартом измерения. Международный договор по метрологии был подписан в Париже 20 мая 1875 года семнадцатью странами, включая США, и в настоящее время отмечается во всем мире как Всемирный день метрологии. NIST обеспечивает официальное представительство США в различных международных органах, учрежденных Метрической конвенцией: CGPM — Генеральная конференция по мерам и весам; CIPM – Международный комитет мер и весов; и BIPM – Международное бюро мер и весов.
Международный договор по метрологии был подписан в Париже 20 мая 1875 года семнадцатью странами, включая США, и в настоящее время отмечается во всем мире как Всемирный день метрологии. NIST обеспечивает официальное представительство США в различных международных органах, учрежденных Метрической конвенцией: CGPM — Генеральная конференция по мерам и весам; CIPM – Международный комитет мер и весов; и BIPM – Международное бюро мер и весов.
Система СИ состоит из 7 основных единиц, которые определяют 22 производные единицы со специальными именами и символами, которые проиллюстрированы в NIST SP 1247, Плакате о взаимосвязи базовых единиц СИ. SI играет важную роль в международной торговле и широко используется в научных и технологических исследованиях и разработках. Узнайте больше об СИ в NIST SP 330 и SP 811.
Таблица основных единиц СИ.
Кредит:
НИСТ
Полезные определения
Ресурсы для студентов и преподавателей
- Новое определение SI.
 В ноябре 2018 года мировые эксперты по измерениям проголосовали и единогласно одобрили пересмотр SI, который устанавливает систему измерения, полностью основанную на физических константах природы. Изменения вступили в силу во Всемирный день метрологии, 20 мая 2019 г. (NIST)
В ноябре 2018 года мировые эксперты по измерениям проголосовали и единогласно одобрили пересмотр SI, который устанавливает систему измерения, полностью основанную на физических константах природы. Изменения вступили в силу во Всемирный день метрологии, 20 мая 2019 г. (NIST) - Узнайте больше о Пути к пересмотренной СИ. Узнайте больше о переопределении СИ. (НИСТ)
- Документальный фильм «Последний артефакт» и сопутствующие образовательные ресурсы для 5-12 классов, которые документируют работу, которая велась за кулисами по модернизации Международной системы единиц (СИ). (Монтана PBS)
- NIST SP 1247 Плакат о взаимосвязях базовых единиц СИ — красочный плакат, иллюстрирующий взаимосвязь между производными единицами Международной системы единиц (СИ) со специальными названиями и символами и семью традиционными базовыми единицами. (НИСТ)
- Метрическая викторина. Что вы знаете о метрической системе (СИ)? Попробуйте онлайн-викторину NIST Metric Trivia Quiz или воспользуйтесь навыком Alexa, чтобы проверить свои знания и стать на путь к метрике мышления! (НИСТ)
- SI Education and Training — изучите образовательные ресурсы NIST по метрической системе, которые помогут вам познакомиться с системой измерения SI и свободно владеть ею.
 (НИСТ)
(НИСТ) - Детские образовательные ресурсы. (НИСТ)
- Разрушение мифов о метрической системе. (Блог о принятии мер NIST)
Ресурсы
- Знакомство с SI
- Ежедневная оценка
- Часто задаваемые вопросы по метрике
- Префиксы
- SI Образование и обучение
- Публикации SI
- Понимание метрики
- Запись с использованием метрических единиц
- Национальная метрическая неделя
NEST-R (реестр STEM)
Образовательные ресурсы NIST
Метрология, метрика и меры весов и мер
Создано 12 апреля 2010 г., обновлено 7 марта 2023 г.
единиц СИ – длина | НИСТ
Метр (м) определяется путем принятия фиксированного числового значения скорости света в вакууме с равным 299 792 458 при выражении в единицах м с -1 , где секунда определяется через ∆ν Cs .
Счетчик когда-то определялся физическим артефактом — двумя отметками, нанесенными на платиново-иридиевый стержень, вроде этих из музея NIST.
Из метра получают несколько других единиц измерения, таких как:
- Единицей скорости является метр в секунду (м/с). Скорость света в вакууме 299 792 458 метров в секунду.
- единицей ускорения является метр в секунду за секунду (м/с 2 ).
- единица площади – квадратный метр (м 2 ).
- единицей объема является кубический метр (м 3 ). Литр (1 кубический дециметр), хотя и не является единицей СИ, но принят к использованию вместе с СИ и обычно используется при измерении объема жидкости, но также используется при измерении газов и твердых веществ.
Часто задаваемые вопросы: когда произошло переопределение дюйма в метрической системе?
В 1958 году конференция англоязычных стран согласилась унифицировать свои стандарты длины и массы и определить их с точки зрения метрических мер. В результате американский двор был укорочен, а имперский двор удлинён. Новые коэффициенты пересчета были объявлены в 1959 в уведомлении Федерального реестра 59-5442 (30 июня 1959 г.), в котором приводится определение стандартного дюйма: значение дюйма, полученное из значения ярда, действующего на 1 июля 1959 г., составляет , что точно эквивалентно 25,4 мм. .
В результате американский двор был укорочен, а имперский двор удлинён. Новые коэффициенты пересчета были объявлены в 1959 в уведомлении Федерального реестра 59-5442 (30 июня 1959 г.), в котором приводится определение стандартного дюйма: значение дюйма, полученное из значения ярда, действующего на 1 июля 1959 г., составляет , что точно эквивалентно 25,4 мм. .
Можно определить коэффициент преобразования:
| Единицы длины | ||
| 10 миллиметров (мм) | = | 1 сантиметр (см) |
| 10 сантиметров | = | 1 дециметр (дм) |
| 10 см | = | 100 мм |
| 10 дециметров | = | 1 метр (м) |
| 10 дециметров | = | 1000 миллиметров |
| 10 метров | = | 1 декаметр (дамба) |
| 10 декаметров | = | 1 гектометр (гм) |
| 10 декаметров | = | 100 метров |
| 10 гектометров | = | 1 километр (км) |
| 10 гектометров | = | 1000 метров |
Часто задаваемые вопросы: Как получить метрическую линейку?
Метрические линейки можно приобрести у многих розничных продавцов, которые можно идентифицировать с помощью поисковых запросов, таких как «метрическая линейка», «метрическая линейка» или «метрическая линейка». Пригодные для печати линейки, такие как сантиметровые линейки Color-Square, могут быть напечатаны в цвете на прозрачных листах для накладных работ, чтобы сделать недорогие метрические линейки.
Пригодные для печати линейки, такие как сантиметровые линейки Color-Square, могут быть напечатаны в цвете на прозрачных листах для накладных работ, чтобы сделать недорогие метрические линейки.
Ресурсы для студентов и преподавателей
- Счетчик — будь то бесконечное расстояние до бабушкиного дома, отрезок ткани, расстояние до финиша легкоатлетического забега или расстояние между непостижимо маленькими транзисторами в компьютере. чип, длина — одна из самых привычных единиц измерения. (НИСТ)
- Национальный прототип счетчика № 27. (NIST)
- Использование метрической линейки. (Примечания к сварке, видео)
- Использование микрометра. (Университет Торонто)
- Использование штангенциркуля и микрометра. (Университет Кейптауна, факультет физики)
- Таблица шкалы вещей. (Министерство энергетики США)
- Изучите размер и масштаб ячеек с помощью интерактивной графики. (Университет Юты)
- Попрактикуйтесь в измерении длины в сантиметрах в упражнении «Квадраты и прямоугольники».
 (ПБС)
(ПБС) - Вычислите фокусное расстояние в этом практическом упражнении и изучите эту важную концепцию, которая используется в инструментах STEAM, таких как микроскопы, телескопы и камеры. (Оптическое общество)
- Развивайте понимание того, насколько на самом деле мал нанометр, с помощью задания «Что такое нанометр»? Во время урока учащиеся будут измерять обычные предметы в классе и переводить результаты в нанометры. (IEEE)
- Ознакомьтесь с эквивалентными метрическими измерениями длины в игре «Длина столбца». Нарисуйте линию, чтобы соединить одинаковые измерения. Смотрите внимательно, потому что у некоторых предметов нет совпадений! (Типичный учебный архив)
- Как это измеряется: калибровка рулеток. Внутри 60-метрового подземного туннеля ученые-измерители проверяют точность рулеток. (НИСТ, видео).
- Как убедиться, что рулетка точна. Узнайте, как лазерный интерферометр используется для точного измерения расстояний вдоль измерительной ленты. (НИСТ)
- На дистанции в Национальный день рулетки.
 Узнайте о значении рулеток, отмечаемых в Национальный день рулетки 14 июля года года. (НИСТ)
Узнайте о значении рулеток, отмечаемых в Национальный день рулетки 14 июля года года. (НИСТ) - Как измерить глубину океана. Ученые и исследователи могут использовать гидролокатор, радар и спутниковые методы для измерения глубины океана. Средняя глубина океана составляет 3,7 км, но самая глубокая из когда-либо зарегистрированных частей находится в Марианской впадине на глубине около 11 км. (НИСТ)
- Спроектируйте, спланируйте и начертите планировку сада в масштабе с помощью метрической линейки. (Калифорнийский университет в Беркли, Ноттингемский университет)
- Зона СИ. Исследуйте ресурсы, чтобы ознакомиться с единицами измерения площади, включая гектар.
- Объем СИ. Изучите ресурсы, чтобы ознакомиться с единицами измерения объема, включая литр.
- Расчет длины окружности, площади и объема. Ознакомьтесь с методами, используемыми для вычисления длины окружности, площади и объема обычных предметов. (НИСТ)
Кредит:
Дж.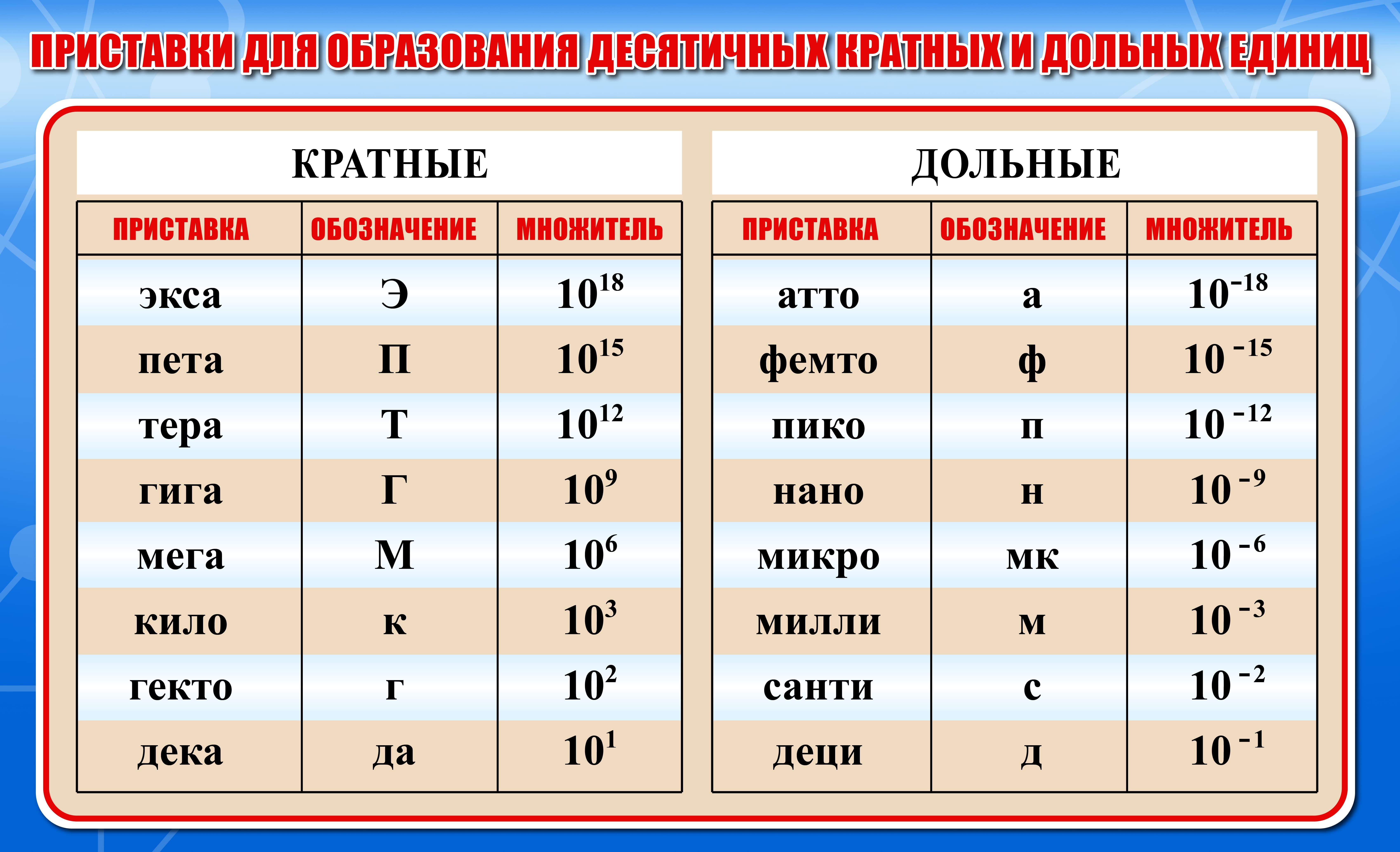

 1 Электрофизические свойства
1 Электрофизические свойства 1 Электрофизические свойства
1 Электрофизические свойства