Респираторный микоплазмоз у детей: Микоплазменная инфекция у детей
Респираторные инфекции, вызванные микоплазмой пневмонии
Микоплазма пневмонии является «атипичной» бактерией, которая вызывает респираторные инфекции верхних и нижних дыхательных путей. Наиболее распространённой формой заболевания, особенно у детей, является трахеобронхит, который часто наблюдается вместе с другими симптомами поражения верхних дыхательных путей. Реже встречаются фарингиты, ринофарингиты, ларингофарингиты, бронхиты. Данный возбудитель также может приводить к развитию более серьезного заболевания – воспалению легких (пневмонии).
Распространение инфекции происходит воздушно – капельным путем: при кашле и чихании бактерии попадают в окружающую среду в виде инфекционного аэрозоля. Для передачи инфекции нужен длительный тесный контакт. Непродолжительное нахождение с больным человеком, как правило, не приводит к заражению. Чаще данное заболевание распространяется между членами одной семьи, которые живут вместе. Микоплазменной инфекцией можно заболеть в любое время года.
По сравнению с другими респираторными инфекциями для инфекций, вызванных микоплазмой пневмонии, характерен более длительный инкубационный период, первые симптомы заболевания появляются через 2 – 3 недели после инфицирования.
Среди наиболее частых симптомов пневмонии наблюдаются: боли в горле, усталость, лихорадка, головные боли, приступообразный кашель, который может длиться неделями или месяцами. При развитии пневмонии к данным симптомам присоединяются затрудненное дыхание и, в некоторых случаях, боли в области грудной клетки при дыхании или кашле.
В любом возрасте существует риск заражения микоплазменной инфекцией, но чаще болеют школьники и лица молодого возраста (до 25 лет). Люди с ослабленным иммунитетом, недавно перенесшие другие респираторные инфекции, имеющие хронические бронхиты и астму также имеют более высокий риск развития данного заболевания.
В ответ на микоплазменную инфекцию в нашем организме вырабатываются антитела двух классов IgM и IgG.
Первыми в крови обнаруживаются IgM, их уровень повышается в течение короткого периода времени и определяется, как правило, в течение нескольких месяцев. Вслед за образованием IgM начинают вырабатываться IgG, со временем их уровень повышается и достигает определенного предела. После перенесенного заболевания в течение длительного времени в крови обнаруживаются IgG. Определение иммуноглобулинов М и G помогает врачу – инфекционисту в диагностике респираторной инфекции, вызванной микоплазмой пневмонии. В дополнение к данным исследованиям может быть проведено ПЦР- исследование, позволяющее выявить ДНК возбудителя в отделяемом из носоглотки.
Вслед за образованием IgM начинают вырабатываться IgG, со временем их уровень повышается и достигает определенного предела. После перенесенного заболевания в течение длительного времени в крови обнаруживаются IgG. Определение иммуноглобулинов М и G помогает врачу – инфекционисту в диагностике респираторной инфекции, вызванной микоплазмой пневмонии. В дополнение к данным исследованиям может быть проведено ПЦР- исследование, позволяющее выявить ДНК возбудителя в отделяемом из носоглотки.
В большинстве случаев микоплазменная инфекция имеет умеренное течение, необходимость назначения антибактериальных препаратов определяется только лечащим врачом. При правильном лечении заболевания наступает полное выздоровление.
В медицинском центре «Биомедика» Вы можете записаться на прием к врачу-инфекционисту и выполнить необходимые лабораторные исследования.
Особенности микоплазменной инфекции при вспышечной и спорадической заболеваемости у детей
В последние годы в детских коллективах отмечается стойкая тенденция к росту вспышек и спорадической заболеваемости респираторным микоплазмозом.
Цель. Изучить особенности течения микоплазменных пневмоний при вспышках и спорадических заболеваниях.
Материалы и методы. Обследовано 55 детей с микоплазменной пневмонией из очага инфекции и 90 детей с различными формами респираторного микоплазмоза при спорадической заболеваемости, госпитализированных в стационар за последние три года. Этиология заболевания подтверждалась выявлением ДНК микоплазмы в мазках из зева и носа и IgM к M.Pneumonia в сыворотке крови.
Результаты и обсуждение. Микоплазменная пневмония у детей протекает с лихорадкой, значительными аускультативными изменениями со стороны легких при умеренно выраженной интоксикации.
Особенностью респираторного микоплазмоза при вспышке является преобладание среднетяжелых форм пневмонии с наличием катарального синдрома у каждого второго ребенка, поражение ЖКТ в 34,4% наблюдений, развитие артралгий -у 20% обследованных. При спорадической заболеваемости чаще госпитализировались дети с обструктивным синдром, дыхательной недостаточностью. Внелегочные проявления регистрировались в 4 раза реже, чем при вспышке респираторного микоплазмоза в детском коллективе.
При спорадической заболеваемости чаще госпитализировались дети с обструктивным синдром, дыхательной недостаточностью. Внелегочные проявления регистрировались в 4 раза реже, чем при вспышке респираторного микоплазмоза в детском коллективе.
Заключение. Респираторный микоплазмоз сохраняет выраженную осенне-зимнюю сезонность и типичные клинические симптомы. Чаще болеют дети школьного возраста. Анализ вспышки респираторного микоплазмоза выявил редкое развитие обструктивного синдрома при пневмонии, преобладание среднетяжелых форм заболевания с внелегочными проявлениями болезни и катаральным синдромом.
При спорадической заболеваемости микоплазменной пневмонией госпитализируются паценты с более тяжелым течением болезни и явлениями дыхательной недостаточности за счет обструктивного синдрома.
Острые респираторные инфекции являются лидером в структуре детской инфекционной заболеваемости. В Российской Федерации острые респираторные заболевания (ОРЗ)
составляют 90% детской патологии, при этом наиболее подвержены развитию ОРЗ дети, посещающие организованные коллективы [1, 2]. По данным Воронежской областной детской клинической больницы, за последние 5 лет сохраняется устойчивая тенденция к росту числа детей, госпитализированных в стационар с острыми респираторными инфекциями. За этот период рост составил около 30% [3]. В этиологической структуре острых респираторных заболеваний на долю микоплазмозов приходится от 7 до 30% [4]. Как правило, микоплазменную инфекцию связывают с развитием бронхитов и атипичных пневмоний, но в настоящее время доказана роль M. Pneumonia в развитии ринитов, назофарингитов, трахеитов, синуситов, отитов, ларингитов. Возбудитель может длительно персистировать в клетках эпителия, повышая, тем самым, сенсибилизацию организма, вызывая длительные, рецидивирующие формы болезни. Течение микоплазменной инфекции не имеет патогномоничных клинических проявлений и подтверждение этиологии возможно лишь при лабораторной диагностике, что вызывает трудности в выборе этиотропной
По данным Воронежской областной детской клинической больницы, за последние 5 лет сохраняется устойчивая тенденция к росту числа детей, госпитализированных в стационар с острыми респираторными инфекциями. За этот период рост составил около 30% [3]. В этиологической структуре острых респираторных заболеваний на долю микоплазмозов приходится от 7 до 30% [4]. Как правило, микоплазменную инфекцию связывают с развитием бронхитов и атипичных пневмоний, но в настоящее время доказана роль M. Pneumonia в развитии ринитов, назофарингитов, трахеитов, синуситов, отитов, ларингитов. Возбудитель может длительно персистировать в клетках эпителия, повышая, тем самым, сенсибилизацию организма, вызывая длительные, рецидивирующие формы болезни. Течение микоплазменной инфекции не имеет патогномоничных клинических проявлений и подтверждение этиологии возможно лишь при лабораторной диагностике, что вызывает трудности в выборе этиотропной
терапии, учитывая узкий спектр чувствительности возбудителя.
Микоплазменная инфекция имеет выраженную эпидемическую сезонность, которая приходится на осенне-зимнее время, а также носит циклический характер с подъемами заболеваемости каждые 3-5 лет [5, 6]. В периоды роста циркуляции возбудителя отмечается значимый подъем заболеваемости микоплазменной пневмонией у детей школьного возраста (до 60% пневмоний у детей имеют микоплазменную этиологию), возможны вспышки микоплазменной инфекции в закрытых детских коллективах. По данным Всемирной организации здравоохранения, в мире регистрируется около 155 миллионов случаев пневмоний у детей, при этом из них 1,4 миллиона детей умирает. В Российской Федерации приходится от 10 до 30 случаев пневмонии на 1000 детского населения [7]. Пневмонии, наряду с патологией ЛОР-органов, являются наиболее частыми осложнениями заболеваний верхних дыхательных путей, но если речь идет об атипичных возбудителях, поражение легких может быть первичным очагом инфекции [8].
В настоящее время имеет место выраженный рост и распространенность заболеваемости микоплазменной инфекцией, в 2012-2013 годах в Москве и Московской области зарегистрирован ряд вспышек микоплазменной инфекции, выявлено 99 заболевших детей [9, 10]. По данным нашего стационара, доля респираторного микоплазмоза в структуре острых респираторных заболеваний возросла за 4 года с 10,9% до 27,4%. В 2013 году были зафиксированы вспышки респираторного микоплазмоза в трех районах Воронежской области.
По данным нашего стационара, доля респираторного микоплазмоза в структуре острых респираторных заболеваний возросла за 4 года с 10,9% до 27,4%. В 2013 году были зафиксированы вспышки респираторного микоплазмоза в трех районах Воронежской области.
Цель исследования
Изучить особенности течения микоплазменных пневмоний при вспышках и спорадических заболеваниях.
Материалы и методы
Под нашим наблюдением находилось 55 детей с микоплазменной пневмонией из очага инфекции и 90 детей с различными формами респираторного микоплазмоза при спорадической заболеваемости, поступившие в стационар за последние три года.
Всем детям проводилось общеклиническое исследование, биохимическое исследование крови, рентгенография органов грудной клетки. Этиология заболевания подтверждалась методом ПЦР – выявление ДНК микоплазмы в мазках из зева и носа, цитоскопией мазков из зева и носа, серологическими методами: определением IgM и IgG к хламидиям и микоплазме (savyon diagnostics версия М1262-01Е09-07/09). Исследование проводилось при госпитализации на 8,6±1,7 день заболевания, при этом у 65,5% при первичном обследовании специфические антитела не обнаруживались, при повторном исследовании крови на 12,0±2,4 день у всех пациентов определялись IgM к M. Pneumonia. Статистический анализ проводился с помощью лицензионных программных средств Microsoft Word, Microsoft Excel.
Исследование проводилось при госпитализации на 8,6±1,7 день заболевания, при этом у 65,5% при первичном обследовании специфические антитела не обнаруживались, при повторном исследовании крови на 12,0±2,4 день у всех пациентов определялись IgM к M. Pneumonia. Статистический анализ проводился с помощью лицензионных программных средств Microsoft Word, Microsoft Excel.
Результаты и обсуждение
В октябре 2013 года в одной из школ Воронежской области зафиксирована вспышка микоплазменной инфекции. На прилегающей к школе территории имел место резкий скачок заболеваемости детей острыми респираторными инфекциями, о чем свидетельствует рост вызовов участкового педиатра на дом. На отдельных участках их количество увеличилось на 73,5%. В стационар направлялись дети с локальными аускультативными изменениями со стороны легких, не отвечающие на проводимую терапию полусинтетическими пенициллинами и цефалоспоринами и с очаговыми инфильтративными изменениями на рентгенограмме органов грудной клетки. Поступление детей в стационар имело групповой характер, за сутки госпитализировалось до 10 человек, в течение 8 дней поступило 81,2% всех пациентов с лабораторно подтвержденной микоплазменной пневмонией. Среди них количество мальчиков и девочек было одинаковым. Пневмонии встречались во всех возрастных группах, но наиболее часто – среди детей среднего школьного звена, 58,1% (32). В начале заболевания у 30,9% (17) детей отмечалось повышение температуры до фебрильных цифр. У трети больных температура в начале болезни и на всем ее протяжение также не превышала субфебрильных значений. У остальных детей имело место постепенное нарастание температуры в течение 4±0,9 дней, от субфебрилитета до гипертермических цифр. В среднем лихорадка сохранялась 7,04±2,8 дней. У одного ребенка пневмония протекала на фоне нормальной температуры в течение всего периода болезни. Явлений токсикоза не отмечалось, интоксикация была умеренно выражена, а у трети детей, даже на фоне гипертермии, самочувствие не страдало.
Поступление детей в стационар имело групповой характер, за сутки госпитализировалось до 10 человек, в течение 8 дней поступило 81,2% всех пациентов с лабораторно подтвержденной микоплазменной пневмонией. Среди них количество мальчиков и девочек было одинаковым. Пневмонии встречались во всех возрастных группах, но наиболее часто – среди детей среднего школьного звена, 58,1% (32). В начале заболевания у 30,9% (17) детей отмечалось повышение температуры до фебрильных цифр. У трети больных температура в начале болезни и на всем ее протяжение также не превышала субфебрильных значений. У остальных детей имело место постепенное нарастание температуры в течение 4±0,9 дней, от субфебрилитета до гипертермических цифр. В среднем лихорадка сохранялась 7,04±2,8 дней. У одного ребенка пневмония протекала на фоне нормальной температуры в течение всего периода болезни. Явлений токсикоза не отмечалось, интоксикация была умеренно выражена, а у трети детей, даже на фоне гипертермии, самочувствие не страдало. Однако большинство детей с начала заболевания жаловались на быструю утомляемость, нарушение аппетита. У всех пациентов с первого-второго дня болезни регистрировался сухой кашель. У большинства детей (69%) имело место постепенное усиление кашля в виде нарастания частоты и интенсивности, преимущественно кашель возникал в ночные часы, к моменту разгара он носил «коклюшеподобный» характер. У 30,9% пациентов с первых дней кашель был сильным, мучительным, непродуктивным.
Однако большинство детей с начала заболевания жаловались на быструю утомляемость, нарушение аппетита. У всех пациентов с первого-второго дня болезни регистрировался сухой кашель. У большинства детей (69%) имело место постепенное усиление кашля в виде нарастания частоты и интенсивности, преимущественно кашель возникал в ночные часы, к моменту разгара он носил «коклюшеподобный» характер. У 30,9% пациентов с первых дней кашель был сильным, мучительным, непродуктивным.
Половину заболевших детей (54,5%) беспокоили головные боли, которые преимущественно (72,7%) возникали в первые два дня болезни. У каждого третьего ребенка с головной болью регистрировалась повторная рвота, что не исключает поражения центральной нервной системы при микоплазмозе, но из-за отсутствия менингеального симптомо-комплекса и кратковременности клинических проявлений (1-2 дня), люмбальная пункция не проводилась.
Катарально-респираторный синдром проявлялся в виде катарального фарингита у 20% (11) детей, ринита –25,4% (14),ларингита –30,9%, отита или евстахиита –27,3% пациентов (15).
К 4-6 дню заболевания у детей выявлялись аускультативные изменения в легких, у 54,5% было ослабление дыхания, у 78,2% выслушивалась крепитация или влажные мелкопузырчатые хрипы.
Явлений дыхательной недостаточности у наблюдаемых детей не было, бронхообструктивный синдромитакже не диагностировался. При анализе рентгено-графических данных у одного ребенка выявлен очаговый процесс, поражение одного сегмента легкого было у 33,7%, наиболее часто встречались полисегментарные пневмонии –52,1%, инфильтративные изменения доли легкого выявлялись у 10,6% детей, у одного ребенка развился плеврит на фоне полисегментарной пневмонии.
Из внелегочных проявлений респираторного микоплазмоза отмечались миалгии –11,0% (6), артралгии –20% (11), у 34,4% (19) отмечены нарушения со стороны желудочно-кишечного тракта в первые дни болезни: гастрит –9% (5), энтерит–20 % (11), явления гастроэнтерита –5,4% (3). Результат комплексного обследования на энтеропатогенные бактериальные и вирусные агенты был отрицательным.
Со стороны периферической крови умеренный лейкоцитоз (до 13,1×109/л) регистрировался только у 7,2% (4) детей, у остальных количество лейкоцитов соответствовало возрастной норме, но у всех больных отмечен резкий сдвиг лейкоцитарной формулы влево, значительное ускорение СОЭ –максимально до 44 мм/ч. Основные биохимические показатели крови не были изменены, у 65,4% (36) детей имело место 2–-х кратное повышение уровня С-реактивного белка относительно нормы
Клиническое и рентгенологическое выздоровление наступало на 12,7±2,5 день пребывания в стационаре. У 9% (5) детей разрешение пневмонии затягивалось до 19,2±1,7 дней.
Проведен анализ спорадических случаев респираторного микоплазмоза у 90 госпитализированных детей. Заболевание протекало в форме пневмонии у 27,8% (25) детей. Среди них мальчиков и девочек было 60 и 40% соответственно. Наиболее часто микоплазменную пневмонию переносили дети школьного возраста, младший школьный возраст – 32%, дети среднего звена – 28%. Дети первого года жизни и в возрасте от года до трех лет составили по 8%, от 3 до 7 лет – 20%. Наиболее выраженная сезонность отмечалась в 2012/13 годах – 55% детей с респираторным микоплазмозом госпитализированы в октябре-сентябре, в то время как на другие месяцы пришлось не более 7,5% детей. В 2014 году отмечалось расширение сезона, респираторный микоплазмоз с одинаковой частотой встречался в осеннее и зимнее время – по 35%.
Дети первого года жизни и в возрасте от года до трех лет составили по 8%, от 3 до 7 лет – 20%. Наиболее выраженная сезонность отмечалась в 2012/13 годах – 55% детей с респираторным микоплазмозом госпитализированы в октябре-сентябре, в то время как на другие месяцы пришлось не более 7,5% детей. В 2014 году отмечалось расширение сезона, респираторный микоплазмоз с одинаковой частотой встречался в осеннее и зимнее время – по 35%.
Дети с микоплазменной пневмонией госпитализировались на 6,24±2,3день болезни. У всех детей имело место повышение температуры тела: у 56% – до гипертермических цифр, у 32% – в пределах фебрильных цифр, субфебрилитет был у 8% детей, у одного ребенка заболевание протекало на фоне нормальной температуры. Продолжительность лихорадки составила 7,95±3,1 сутки. Катаральный синдром встречался у 28% и проявлялся в виде ринита. У половины пациентов (52%) в дебюте заболевания начинался сухой кашель, который к 5,8±2,1 дню становился влажным, продуктивным. У 44% с первого дня болезни формировался влажный, продуктивный кашель, который сохранялся в течение 8,3±3,2 дней.
У большинства детей при поступлении отмечались клинические проявления дыхательной недостаточности: у 68% (17) – первой степени, у 8% (2) – второй степени. У 24% (6) детей диагностированы явления бронхообструкции.
При поступлении только у одного ребенка не было аускультативных изменений со стороны легких, у остальных детей регистрировались сухие или влажные мелкопузырчатые хрипы, крепитация. Изменения сохранялись в течение 6,76±4,3 дней. При проведении рентгенографии органов грудной клетки у 32% детей было сегментарное поражение легких, у 36% – полисегментарная пневмония, у 28% – долевая пневмония, у одного ребенка была поли-сегментарная плевропневмония.
При сравнении течения микоплазменной пневмонии у детей дошкольного и школьного возраста, была получена достоверная разница только по частоте развития явлений дыхательной недостаточности: 89% – у детей дошкольного возраста и 68,75% – у школьников (р<0,05).
Только у одного ребенка было поражение тонкого кишечника, у двух детей отмечалась пятнисто-папулезная экзантема, при этом аллергологический анамнез у данных детей отягощен не был. Анализ лабораторных данных показал, что в общем анализе крови у 40% детей выявлен лейкоцитоз, у 76% (19) – отмечался сдвиг лейкоцитарной формулы влево, у всех детей имела место резко повышенная скорость оседания эритроцитов, максимально до 53 мм/ч. В общем анализе мочи у трети детей выявлена транзиторная лейкоцитурия. Выздоровление детей наступало на 13,96±4,1 день пребывания в стационаре.
Анализ лабораторных данных показал, что в общем анализе крови у 40% детей выявлен лейкоцитоз, у 76% (19) – отмечался сдвиг лейкоцитарной формулы влево, у всех детей имела место резко повышенная скорость оседания эритроцитов, максимально до 53 мм/ч. В общем анализе мочи у трети детей выявлена транзиторная лейкоцитурия. Выздоровление детей наступало на 13,96±4,1 день пребывания в стационаре.
Заключение
Таким образом, можно отметить, что респираторный микоплазмоз имеет выраженную осенне-зимнюю сезонность. Наиболее часто заболевание развивается у детей школьного возраста, преимущественно среднего звена (11–15 лет). При респираторном микоплазмозе серологическое обследование методом ИФА целесообразно проводить не ранее 11-12 дня болезни, так как у 65,5% обследованных детей на первой неделе заболевания специфические антитела класса М выявить не удается.
Для микоплазменной пневмонии не характерен выраженный токсикоз, хотя заболевание преимущественно протекает с фебрильной температурой. Особенностью клинических проявлений микоплазменной пневмонии в описанной нами вспышке является отсутствие бронхообструктивного синдрома и дыхательной недостаточности, частое развитие внелегочных проявлений микоплазмоза. Поступление детей в этот же эпидемический сезон при спорадической заболеваемости показало более тяжелое течение респираторного микоплазмоза с частым развитием при пневмонии обструкции бронхов, дыхательной недостаточности, особенно у дошкольников. При этом внелегочные проявления инфекции встречались в 4 раза реже, чем при вспышке в детском коллективе. Проведенный анализ свидетельствует о том, что при вспышечной заболеваемости возможно более детальное изучение всех проявлений болезни. В то же время при обследовании госпитализированных детей при спорадической заболеваемости чаще выявляются наиболее тяжелые клинические синдромы.
Особенностью клинических проявлений микоплазменной пневмонии в описанной нами вспышке является отсутствие бронхообструктивного синдрома и дыхательной недостаточности, частое развитие внелегочных проявлений микоплазмоза. Поступление детей в этот же эпидемический сезон при спорадической заболеваемости показало более тяжелое течение респираторного микоплазмоза с частым развитием при пневмонии обструкции бронхов, дыхательной недостаточности, особенно у дошкольников. При этом внелегочные проявления инфекции встречались в 4 раза реже, чем при вспышке в детском коллективе. Проведенный анализ свидетельствует о том, что при вспышечной заболеваемости возможно более детальное изучение всех проявлений болезни. В то же время при обследовании госпитализированных детей при спорадической заболеваемости чаще выявляются наиболее тяжелые клинические синдромы.
Литература
- Кокорева С.П., Сахарова Л.А., Куприна Н.П. Этиологическая
характеристика и осложнения острых респираторных
инфекций у детей. Вопросы современной педиатрии. 2008.
Вопросы современной педиатрии. 2008.
Т. 7. № 1. С. 47-50.
- Bartlett J. G. Management of respiratory tract infection – 3rd. –
Philadelphia, 2001. – P. 178–182.
- Кокорева С.П., Трушкина А.В., Разуваев О.А. Оптимизация
этиотропной терапии острых респираторных вирусных
инфекций у детей. Детские инфекции. 2013. Т. 12. № 4.С. 42-46.
- Fraaij P. L. A., Visser E. G., Hoogenboezem T., Hop W. C. J., van
Adricgem L. N. A., Weber F., Moll H. A., Broekman B., Berger M.
Y., van Rijsoort-Vos T., van Belkum A., Schutten M., van Rossum
- M. C. Published: Carriage of Mycoplasma pneumoniae in
the Upper respiratory Tract of Symptomatic and Asymptomatic
Children: An Observational Study: May 14, 2013. DOI: 10.1371/
journal.pmed.1001444
- Hauksdottir G.
 S., Jonsson T., Sigurdardottir V., Love A.
S., Jonsson T., Sigurdardottir V., Love A.
Seroepidemiology of Mycoplasma pneumonia infections in
Iceland // Scan. J. Epidemiol. 1998, 30(2): 177-80.
- Ito I., Ishida T., Osawa M., Arita M., et al. Culturally verified
Mycoplasma pneumonia in Japan: a long-term observation from
1979-1999. Epidemiol. Infekt. Dis. 1998, 30 (2): 177-80.
- Козлов Р.С. Пневмококки: уроки прошлого – взгляд в будущее.
– Смоленск: МАКМАХ, 2010 – 128 с.
- Нагаева Т.А., Фурманова Е.А., Пономарева Д.А. Роль
матриксной металлопротеиназы-9 при патологии
миндалин и аденоидов у часто болеющих детей. Лечение и
профилактика 2015, №1(13), с. 48-51.
- Целипанова Е.Е., Россошанская Н. В. Вспышки пневмонии
микоплазменной этиологии у детей Московской области.
Лечение и профилактика. 2014, №4(12), с. 64-66.
- Гадлия Д.Д., Бакрадзе М.Д., Таточенко В.К., Петровская
М. ., Хохлова Т.А., Зубкова И. В. Вспышка микоплазменной
инфекции Фарматека № 11 (304), 2015 с. 63-67.
Рубрики: Статьи для докторов
Частота и клиническая картина кожно-слизистых заболеваний, вызванных инфекцией Mycoplasma pneumoniae, у детей с внебольничной пневмонией | Инфекционные болезни | JAMA Dermatology
Первоначальное исследование
18 декабря 2019 г.
Патрик М. Мейер Сотер, доктор медицинских наук 1 ; Мартин Тайлер, MD 2,3 ; Майкл Бютчер, MD 4 ; и другие
Мишель Зайлер, MD 5 ; Лиза Вайбель, врач 2,3 ; Кристоф Бергер, MD 1
Принадлежность автора Информация о статье
1 Отделение инфекционных болезней и госпитальной эпидемиологии, Детская университетская больница Цюриха, Цюрих, Швейцария
2 Отделение детской дерматологии, Детская университетская клиника Цюриха, Цюрих, Швейцария
3 Отделение дерматологии, Университетская клиника Цюриха, Цюрих, Швейцария
4 Отделение инфекционных заболеваний, Детская больница Люцерна, Люцерн, Швейцария
5 Отделение неотложной помощи, Детская университетская клиника Цюриха, Цюрих, Швейцария
ДЖАМА Дерматол. 2020;156(2):144-150. дои: 10.1001 / джамадерматол.2019.3602
2020;156(2):144-150. дои: 10.1001 / джамадерматол.2019.3602
Ключевые моменты
Вопрос
Какова частота и клинические характеристики Mycoplasma pneumoniae – кожно-слизистое заболевание у детей с внебольничной пневмонией (ВП)?
Выводы
В этом когортном исследовании 152 детей с ВП кожно-слизистые высыпания развились у 10 из 44 пациентов (22,7%) с ВП, вызванной M. pneumoniae , и у 3 из 108 пациентов (2,8%) с ВП других причин, существенная разница. Среди пациентов с инфекцией M pneumoniae кожно-слизистые заболевания были в значительной степени связаны с более длительной лихорадкой, более высоким уровнем С-реактивного белка и большей вероятностью госпитализации, использования кислорода и осложнений.
Значение
Полученные данные свидетельствуют о том, что кожно-слизистое заболевание является частым проявлением инфекции M pneumoniae у детей и связано с повышенным системным воспалением, заболеваемостью и более высоким риском отдаленных последствий.
Абстрактный
Важность
Диагностика инфекции Mycoplasma pneumoniae как причины кожно-слизистого заболевания является сложной задачей, поскольку современные диагностические тесты не позволяют дифференцировать Заражение M pneumoniae от носительства.
Объектив
Изучить частоту и клиническую картину M pneumoniae -индуцированного кожно-слизистого заболевания у детей с внебольничной пневмонией (ВП) с использованием усовершенствованной диагностики.
Дизайн, настройка и участники
Это проспективное продольное когортное исследование включало 152 ребенка в возрасте от 3 до 18 лет с ВП, включенных в исследование ВП с 1 мая 2016 г. по 30 апреля 2017 г. в Детской университетской больнице Цюриха. Дети находились на стационарном или амбулаторном лечении с клинически определенной ВП в соответствии с рекомендациями Британского торакального общества. Анализ данных проводился с 10 июля 2017 г. по 29 июня., 2018.
Анализ данных проводился с 10 июля 2017 г. по 29 июня., 2018.
Основные результаты и показатели
Частота и клиническая картина M pneumoniae -индуцированного кожно-слизистого заболевания при ВП у детей. Инфекция Mycoplasma pneumoniae была диагностирована с помощью полимеразной цепной реакции (ПЦР) образцов из ротоглотки и подтверждена измерением специфических IgM-секретирующих антител периферической крови клеток с помощью иммуноферментного анализа для дифференциации M pneumoniae – инфицированных пациентов от носителей ВП вызванные другими возбудителями. Слизисто-кожное заболевание определяли как любое эруптивное поражение кожи и/или слизистых оболочек, возникающее во время эпизода ВП.
Результаты
Среди 152 зарегистрированных детей с ВП (средний [межквартильный диапазон] возраст 5,7 [4,3–8,9] года; 84 [55,3%] мальчика) 44 (28,9%) дали положительный результат на M pneumoniae с помощью ПЦР; из них у 10 детей (22,7%) развились кожно-слизистые поражения. Все 10 пациентов с кожно-слизистыми высыпаниями дали положительный результат на клетки, секретирующие специфические IgM-антитела. Кожные проявления были обнаружены в 3 случаях (2,8%) из M pneumoniae ПЦР-негативных ВП ( P < .001). Спектр M pneumoniae – индуцированное кожно-слизистое заболевание включало M pneumoniae – индуцированную сыпь и мукозит (3 случая [6,8%]), крапивницу (2 случая [4,5%]) и пятнисто-папулезные высыпания на коже (5 случаев [11,4%]). У двух пациентов было поражение глаз как единственное проявление слизистой оболочки (двусторонний передний увеит и негнойный конъюнктивит). У пациентов с M pneumoniae , индуцированным слизисто-кожным заболеванием, продолжительность продромальной лихорадки была больше (медиана [межквартильный диапазон], 10,5 [8,3-11,8] против 7,0 [5,5-9.5 дней; P = ,02) и более высокие уровни С-реактивного белка (медиана [межквартильный диапазон], 31 [22–59] против 16 [7–23] мг/л; P = ,04), чем у пациентов с ВП вследствие до М.
Все 10 пациентов с кожно-слизистыми высыпаниями дали положительный результат на клетки, секретирующие специфические IgM-антитела. Кожные проявления были обнаружены в 3 случаях (2,8%) из M pneumoniae ПЦР-негативных ВП ( P < .001). Спектр M pneumoniae – индуцированное кожно-слизистое заболевание включало M pneumoniae – индуцированную сыпь и мукозит (3 случая [6,8%]), крапивницу (2 случая [4,5%]) и пятнисто-папулезные высыпания на коже (5 случаев [11,4%]). У двух пациентов было поражение глаз как единственное проявление слизистой оболочки (двусторонний передний увеит и негнойный конъюнктивит). У пациентов с M pneumoniae , индуцированным слизисто-кожным заболеванием, продолжительность продромальной лихорадки была больше (медиана [межквартильный диапазон], 10,5 [8,3-11,8] против 7,0 [5,5-9.5 дней; P = ,02) и более высокие уровни С-реактивного белка (медиана [межквартильный диапазон], 31 [22–59] против 16 [7–23] мг/л; P = ,04), чем у пациентов с ВП вследствие до М. pneumoniae без кожно-слизистых проявлений. Они также чаще нуждались в кислороде (5 [50%] против 1 [5%]; P = ,007), нуждались в госпитализации (7 [70%] против 4 [19%]; P = . 01) и развитие долгосрочных последствий (3 [30%] против 0; P = ,03).
pneumoniae без кожно-слизистых проявлений. Они также чаще нуждались в кислороде (5 [50%] против 1 [5%]; P = ,007), нуждались в госпитализации (7 [70%] против 4 [19%]; P = . 01) и развитие долгосрочных последствий (3 [30%] против 0; P = ,03).
Выводы и актуальность
Поражение кожи и слизистых значительно чаще встречалось у детей с ВП, вызванной M. pneumoniae , чем у детей с ВП другого генеза. Mycoplasma pneumoniae – индуцированное слизисто-кожное заболевание было связано с повышенным системным воспалением, заболеваемостью и более высоким риском отдаленных последствий.
Введение
Mycoplasma pneumoniae является частой причиной внебольничной пневмонии у детей (ВП). 1 Кроме того, M. pneumoniae может вызывать внелегочное заболевание, включая кожно-слизистые проявления. 2 Эти проявления включают пятнисто-папулезные кожные высыпания, крапивницу и кожно-слизистые высыпания по спектру многоформной эритемы, синдром Стивенса-Джонсона и токсический эпидермальный некролиз. 2 Слизисто-кожные высыпания, вызванные M. pneumoniae , часто сопровождающиеся выраженным мукозитом и минимальным поражением кожи или даже его отсутствием, обозначаемые как M pneumoniae – индуцированная сыпь и мукозит (MIRM). 3 Диагноз инфекции M pneumoniae в таких случаях в основном основывается на серологических исследованиях и редко на полимеразной цепной реакции (ПЦР) образцов из верхних дыхательных путей. 2 -4 Однако ПЦР и серологическое тестирование на M pneumoniae не позволяют надежно дифференцировать инфицированных пациентов от носителей ВП, вызванной другими возбудителями. 5 ,6 9Носительство 0061 M pneumoniae в верхних дыхательных путях зарегистрировано у 56% здоровых детей. 5 -7 Таким образом, обнаружение M pneumoniae с помощью этих доступных в настоящее время диагностических тестов может привести к завышенной оценке бремени M pneumoniae , индуцированного слизисто-кожными заболеваниями.
2 Слизисто-кожные высыпания, вызванные M. pneumoniae , часто сопровождающиеся выраженным мукозитом и минимальным поражением кожи или даже его отсутствием, обозначаемые как M pneumoniae – индуцированная сыпь и мукозит (MIRM). 3 Диагноз инфекции M pneumoniae в таких случаях в основном основывается на серологических исследованиях и редко на полимеразной цепной реакции (ПЦР) образцов из верхних дыхательных путей. 2 -4 Однако ПЦР и серологическое тестирование на M pneumoniae не позволяют надежно дифференцировать инфицированных пациентов от носителей ВП, вызванной другими возбудителями. 5 ,6 9Носительство 0061 M pneumoniae в верхних дыхательных путях зарегистрировано у 56% здоровых детей. 5 -7 Таким образом, обнаружение M pneumoniae с помощью этих доступных в настоящее время диагностических тестов может привести к завышенной оценке бремени M pneumoniae , индуцированного слизисто-кожными заболеваниями.
Недавнее проспективное продольное исследование ВП 6 среди детей показало, что измерение специфических клеток, секретирующих IgM антитела (ASC) в периферической крови, с помощью иммуноферментного анализа (ELISpot) улучшило диагностику Инфекция M pneumoniae . 6 Используя этот набор данных, мы стремились оценить частоту и клиническую картину M pneumoniae -индуцированного кожно-слизистого заболевания при ВП у детей.
Методы
Пациенты
В это когортное исследование были включены пациенты, зарегистрированные в период с 1 мая 2016 г. по 30 апреля 2017 г. в Детской университетской больнице Цюриха. Первичным критерием включения была ВП, определенная в соответствии с рекомендациями Британского торакального общества 9.0007 8 у ранее здоровых детей в возрасте от 3 до 18 лет. 6 Кожно-слизистое заболевание определяли как любое эруптивное поражение кожи и/или слизистых оболочек, возникающее во время эпизода ВП; MIRM определяли как поражение 2 или более участков слизистой оболочки с отсутствием или ограниченным поражением кожи. 3 Анализ данных проводился с 10 июля 2017 г. по 29 июня 2018 г. Комитет по этике Цюриха, Швейцария, одобрил протокол исследования. Письменное информированное согласие было получено от всех родителей и от детей 14 лет и старше. Все данные обезличены.
3 Анализ данных проводился с 10 июля 2017 г. по 29 июня 2018 г. Комитет по этике Цюриха, Швейцария, одобрил протокол исследования. Письменное информированное согласие было получено от всех родителей и от детей 14 лет и старше. Все данные обезличены.
Процедуры исследования
Подходящие пациенты с ВП были протестированы на наличие ДНК M pneumoniae в образцах мазка из ротоглотки с помощью M pneumoniae -специфической ПЦР. 9 Пациенты с кожно-слизистыми заболеваниями, у которых были положительные результаты ПЦР, были протестированы с помощью анализа M pneumoniae –специфического IgM ASC ELISpot для подтверждения инфекции M pneumoniae , как описано ранее. 6 Всем детям было проведено тщательное клиническое обследование кожи и слизистых оболочек. Пациенты с подтвержденным M pneumoniae , индуцированное кожно-слизистым заболеванием, наблюдали в течение 6 месяцев.
Статистический анализ
Категориальные и непрерывные переменные сравнивались с точным критерием Фишера и критерием Манна-Уитни соответственно. Был проведен анализ случай-контроль между пациентами с ВП и кожно-слизистыми заболеваниями, которые дали положительный результат на M pneumoniae -специфический анализ IgM ASC ELISpot, и пациентами без кожно-слизистых проявлений. 2-хвостая P < .05 считается статистически значимым. Анализы проводились с помощью программного обеспечения R версии 3.6.0 (R Foundation for Statistical Computing).
Был проведен анализ случай-контроль между пациентами с ВП и кожно-слизистыми заболеваниями, которые дали положительный результат на M pneumoniae -специфический анализ IgM ASC ELISpot, и пациентами без кожно-слизистых проявлений. 2-хвостая P < .05 считается статистически значимым. Анализы проводились с помощью программного обеспечения R версии 3.6.0 (R Foundation for Statistical Computing).
Полученные результаты
Среди 152 зарегистрированных детей с ВП (средний [межквартильный диапазон] возраст 5,7 [4,3–8,9] года; 84 [55,3%] мальчика) 44 (28,9%) дали положительный результат на M pneumoniae с помощью ПЦР; из них у 10 детей (22,7%) (средний возраст 8,7 лет; диапазон 3,8-14,6 лет; 6 [60%] мальчиков) развились кожно-слизистые поражения (рис. 1 в Приложении). Диагноз 9Инфекция 0061 M pneumoniae была подтверждена у всех 10 пациентов с поражением кожи и слизистых путем обнаружения M pneumoniae -специфических IgM ASC. Из 108 пациентов с ВП, у которых ПЦР дал отрицательный результат на M pneumoniae , кожно-слизистые заболевания (макулопапулезные высыпания на коже и конъюнктивит) наблюдались у 3 (2,8%) ( P < .001 по сравнению с пациентами с ВП, которые дали положительный результат с помощью ПЦР). ПЦР).
Из 108 пациентов с ВП, у которых ПЦР дал отрицательный результат на M pneumoniae , кожно-слизистые заболевания (макулопапулезные высыпания на коже и конъюнктивит) наблюдались у 3 (2,8%) ( P < .001 по сравнению с пациентами с ВП, которые дали положительный результат с помощью ПЦР). ПЦР).
Из 44 пациентов с ВП, у которых был положительный результат на M pneumoniae Результаты ПЦР, у 34 были доступны мононуклеарные клетки периферической крови для анализа M pneumoniae –специфического IgM ASC ELISpot, и 31 дал положительный результат. Анализ случай-контроль этих 31 пациента с ВП с положительными результатами анализа M pneumoniae -специфического IgM ASC ELISpot показал, что у 10 пациентов с слизисто-кожным заболеванием была более длительная продромальная лихорадка (медиана 10,5 дней; межквартильный диапазон 8,3-11,8). дни; P = .02) и более высокие уровни С-реактивного белка (медиана 31 мг/л; межквартильный диапазон 22–59).мг/л [для перевода в наномоль на литр умножить на 9,524]; P = ,04) и с большей вероятностью нуждались в кислороде (отношение шансов, 17,6; 95% ДИ, 1,5-984,1; P = ,007) по сравнению с 21 пациентом без кожно-слизистых проявлений (таблица 1). Пациенты с поражением кожи и слизистых были более склонны к госпитализации (отношение шансов 9,0; 95% ДИ 1,4–81,4; P = ,01) и развитию отдаленных последствий (3 [30%] против 0; P = ,03), включая облитерирующий бронхиолит, одышку при физической нагрузке и поствоспалительные пигментные изменения.
Пациенты с поражением кожи и слизистых были более склонны к госпитализации (отношение шансов 9,0; 95% ДИ 1,4–81,4; P = ,01) и развитию отдаленных последствий (3 [30%] против 0; P = ,03), включая облитерирующий бронхиолит, одышку при физической нагрузке и поствоспалительные пигментные изменения.
Среди 10 пациентов с M pneumoniae , индуцированным слизисто-кожным заболеванием, у 3 (6,8%) была диагностирована MIRM, у 2 (4,5%) — крапивница и у 5 (11,4%) — пятнисто-папулезные высыпания на коже (рис. 4 в дополнении). Подробная клиническая характеристика пациентов с M pneumoniae -индуцированным заболеванием кожи и слизистых оболочек представлена в таблице 2. Все пациенты с MIRM были госпитализированы (медиана 7,0 дней; диапазон 5,0-13,0 дней) и получали антибиотики против M pneumoniae и короткий курс системных кортикостероидов (метилпреднизолон, 1-3 мг/кг, ежедневно в течение 3 дней). Кожно-слизистые поражения зажили без рубцевания, а поствоспалительные пигментные изменения наблюдались у 1 пациента (рис. 5 в Приложении). Рецидивов в течение 6 месяцев наблюдения не наблюдалось.
5 в Приложении). Рецидивов в течение 6 месяцев наблюдения не наблюдалось.
Обсуждение
Насколько нам известно, это первое проспективное лонгитудинальное когортное исследование для изучения M pneumoniae, индуцированного заболеванием кожи и слизистых оболочек у детей. Мы обнаружили, что M pneumoniae – индуцированное кожно-слизистое заболевание возникло у 1 из 4 детей с ВП, у которых ПЦР дал положительный результат на M pneumoniae , включая значительную долю (6,8%) с MIRM. Инфекция Mycoplasma pneumoniae была подтверждена у всех пациентов с кожно-слизистым поражением путем выявления специфических ASC IgM, что позволяет, в отличие от ПЦР и серологического тестирования IgM, дифференцировать инфекцию M pneumoniae от носительства. 6
Наблюдаемая в нашем исследовании частота кожно-слизистых заболеваний, индуцированных M pneumoniae (22,7%), согласуется с оценками, приведенными в литературе (25,0–33,0%), часто (6,8% против 1,0%-5,0%). 2 Хотя M. pneumoniae может нечасто вызывать обширное кожное заболевание с образованием пузырей, клинически неотличимое от синдрома Стивенса-Джонсона и токсического эпидермального некролиза, 2 наши данные подтверждают концепцию MIRM как специфической сущности. 3 Новая предложенная пересмотренная классификация тяжелых кожных реакций у детей предлагает термин реактивная инфекционная кожно-слизистая сыпь 10 для охвата других патогенов, которые также могут вызывать MIRM-подобные клинические проявления, такие как Chlamydophila pneumoniae . 11 Эти определения случаев имеют решающее значение для ведения пациентов, поскольку раннее распознавание кожно-слизистых заболеваний как вызванных инфекцией, а не лекарствами (синдром Стивенса-Джонсона и токсический эпидермальный некролиз) позволяет получить более конкретную информацию о лечении и прогнозе и, что наиболее важно, позволяет избежать ограничения возможного возбудители наркотиков.
2 Хотя M. pneumoniae может нечасто вызывать обширное кожное заболевание с образованием пузырей, клинически неотличимое от синдрома Стивенса-Джонсона и токсического эпидермального некролиза, 2 наши данные подтверждают концепцию MIRM как специфической сущности. 3 Новая предложенная пересмотренная классификация тяжелых кожных реакций у детей предлагает термин реактивная инфекционная кожно-слизистая сыпь 10 для охвата других патогенов, которые также могут вызывать MIRM-подобные клинические проявления, такие как Chlamydophila pneumoniae . 11 Эти определения случаев имеют решающее значение для ведения пациентов, поскольку раннее распознавание кожно-слизистых заболеваний как вызванных инфекцией, а не лекарствами (синдром Стивенса-Джонсона и токсический эпидермальный некролиз) позволяет получить более конкретную информацию о лечении и прогнозе и, что наиболее важно, позволяет избежать ограничения возможного возбудители наркотиков.
Наблюдение, что M pneumoniae – индуцированное кожно-слизистое заболевание связано с более выраженным воспалением, согласуется с недавним исследованием синдрома Стивенса-Джонсона 12 , ассоциированного с M pneumoniae , и предполагает отчетливую иммунную реакцию. Редкое обнаружение M pneumoniae из кожно-слизистых поражений 3 ,4,13 также предполагает иммуноопосредованный патогенез. Предлагаемые иммунные механизмы включают повреждение сосудов, опосредованное иммунными комплексами, повреждение эпителия, опосредованное цитотоксическими Т-клетками, или заболевание, опосредованное антителами. 2 -4,14
Не существует основанных на доказательствах руководств по лечению M pneumoniae – индуцированного слизисто-кожного заболевания. Остается неясным, имеют ли какие-либо показания антибиотики и противовоспалительное лечение, такое как системные кортикостероиды или внутривенные иммуноглобулины, при общем благоприятном течении заболевания.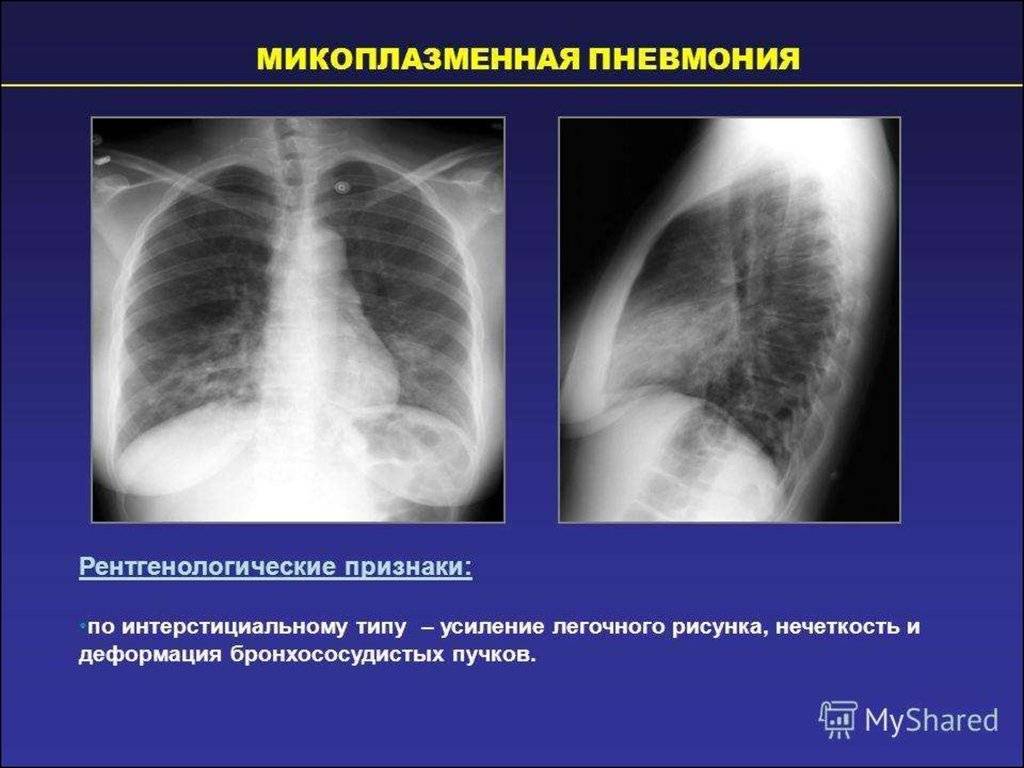 3 ,15 Тем не менее, пациенты нуждаются в тщательном наблюдении для выявления ранних признаков потенциальных осложнений, таких как облитерирующий бронхиолит или последствия для слизистых оболочек. 2 ,3,12
3 ,15 Тем не менее, пациенты нуждаются в тщательном наблюдении для выявления ранних признаков потенциальных осложнений, таких как облитерирующий бронхиолит или последствия для слизистых оболочек. 2 ,3,12
Ограничения
Это исследование может быть смещено в сторону более тяжелого заболевания, потому что легкие случаи, возможно, не направлялись в наш центр третичной медицинской помощи. Мы не анализировали штамм M pneumoniae на наличие генетических различий и не тестировали пациентов на наличие других патогенов. Дети младше 3 лет были исключены; следовательно, частота и клиническая картина M pneumoniae -индуцированного кожно-слизистого заболевания у детей этого возраста неизвестны. Значительная часть детей с макуло-папулезными кожными высыпаниями ранее лечилась амоксициллином (-клавуланат), что затрудняет дифференциальную диагностику инфекций и высыпаний, вызванных лекарствами. Однако точный микробиологический диагноз 9Инфекция 0061 M pneumoniae в сочетании с коротким периодом воздействия лекарственного средства и незудящей, слабо выраженной сыпью в большинстве этих случаев свидетельствует в пользу инфекционной причины.
Однако точный микробиологический диагноз 9Инфекция 0061 M pneumoniae в сочетании с коротким периодом воздействия лекарственного средства и незудящей, слабо выраженной сыпью в большинстве этих случаев свидетельствует в пользу инфекционной причины.
Выводы
В этом исследовании кожно-слизистые поражения значительно чаще встречались у детей с ВП, вызванной M. pneumoniae , чем у детей с ВП другого происхождения. Mycoplasma pneumoniae – индуцированное слизисто-кожное заболевание было связано с повышенным системным воспалением, заболеваемостью и более высоким риском отдаленных последствий. Общий прогноз M pneumoniae – индуцированное кожно-слизистое заболевание было хорошим. Необходимы дальнейшие исследования для выяснения микробных характеристик или характеристик хозяина, которые приводят к этому значимому и потенциально тяжелому внелегочному проявлению инфекции M pneumoniae .
Наверх
Информация о статье
Принято к публикации: 24 сентября 2019 г.
Автор, ответственный за переписку: Патрик М. Мейер Сотер, доктор медицинских наук, отделение инфекционных болезней и госпитальной эпидемиологии, Университетская детская больница Цюриха, Steinwiesstrasse 75, Zu богатый CH-8032 , Швейцария ([email protected]).
Опубликовано в Интернете: 18 декабря 2019 г. doi:10.1001/jamadermatol.2019.3602
Вклад авторов: Д-р Мейер Сотер имел полный доступ ко всем данным исследования и берет на себя ответственность за целостность данных и в точность анализа данных.
Концепция и дизайн: Meyer Sauteur, Theiler, Berger.
Сбор, анализ или интерпретация данных: Все авторы.
Составление рукописи: Мейер Сотер, Тайлер.
Критическая проверка рукописи на наличие важного интеллектуального содержания: Все авторы.
Статистический анализ: Мейер Сотер.
Получено финансирование: Мейер Сотер, Бергер.
Административная, техническая или материальная поддержка: Meyer Sauteur, Weibel, Berger.
Надзор: Мейер Сотер, Вайбель, Бергер.
Раскрытие информации о конфликте интересов: Д-р Мейер Сотер сообщил о получении грантов от Европейского общества детских инфекционных заболеваний, Фонда Промедика и Международного фонда Старра, помимо представленной работы. Других раскрытий не поступало.
Дополнительные взносы: Мы благодарим пациентов и их родителей за разрешение опубликовать эту информацию. Мы благодарим сотрудников отделения неотложной помощи и сотрудников поликлиники Детской университетской больницы Цюриха за набор участников и сотрудников лаборатории микробиологии Детской университетской больницы Цюриха за обработку образцов.
Рекомендации
1.
Джейн
С, Уильямс
диджей, Арнольд
СР,
и другие; Исследовательская группа CDC EPIC. Внебольничная пневмония, требующая госпитализации среди детей в США. N Engl J Med . 2015;372(9):835-845. doi:10.1056/NEJMoa1405870PubMedGoogle ScholarCrossref
Внебольничная пневмония, требующая госпитализации среди детей в США. N Engl J Med . 2015;372(9):835-845. doi:10.1056/NEJMoa1405870PubMedGoogle ScholarCrossref
2.
Шалок
ПК, Динулос
Дж. Г. Микоплазма пневмонии – индуцированное кожное заболевание. Int J Dermatol . 2009;48(7):673-680. doi:10.1111/j.1365-4632.2009.04154.xPubMedGoogle ScholarCrossref
3.
Канаван
Т.Н., Матес
Э.Ф., Фриден
Я, Синкай
K. Mycoplasma pneumoniae – индуцированная сыпь и мукозит как синдром, отличный от синдрома Стивенса-Джонсона и многоформной эритемы: систематический обзор. J Am Acad Dermatol . 2015;72(2):239-245. doi:10.1016/j.jaad.2014.06.026PubMedGoogle ScholarCrossref
4.
Мейер Сотер
Премьер-министр, Гетшель
П, Лаутеншлагер
S. Mycoplasma pneumoniae и мукозит — часть спектра синдрома Стивенса-Джонсона. J Dtsch Dermatol Ges . 2012;10(10):740-746. doi:10.1111/j.1610-0387.2012.07951.xPubMedGoogle Scholar
J Dtsch Dermatol Ges . 2012;10(10):740-746. doi:10.1111/j.1610-0387.2012.07951.xPubMedGoogle Scholar
5.
Spuesens
ЭБ, Фраай
PL, Виссер
НАПРИМЕР,
и другие. Носительство Mycoplasma pneumoniae в верхних дыхательных путях симптомных и бессимптомных детей: обсервационное исследование. PLoS Med . 2013;10(5):e1001444. doi:10.1371/journal.pmed.1001444PubMedGoogle Scholar
6.
Мейер Сотер
премьер-министр, Зайлер
М, Грузовик
Дж,
и другие. Диагностика Mycoplasma pneumoniae пневмонии с измерением специфических клеток, секретирующих антитела. Am J Respir Crit Care Med . 2019;200(8):1066-1069. doi:10.1164/rccm.201904-0860LEPubMedGoogle ScholarCrossref
7.
Уэйтс
КБ, Сяо
Л, Лю
Y, Балиш
МФ, Аткинсон
ТП. Mycoplasma pneumoniae из дыхательных путей и за их пределы. Clin Microbiol, ред. . 2017;30(3):747-809. doi:10.1128/CMR.00114-16PubMedGoogle ScholarCrossref
Clin Microbiol, ред. . 2017;30(3):747-809. doi:10.1128/CMR.00114-16PubMedGoogle ScholarCrossref
8.
Харрис
М, Кларк
Джей, Кут
Н,
и другие; Комитет по стандартам медицинской помощи Британского торакального общества. Рекомендации Британского торакального общества по лечению внебольничной пневмонии у детей: обновление 2011 г. Торакс . 2011;66(дополнение 2):ii1-ii23. doi: 10.1136/thoraxjnl-2011-200598PubMedGoogle ScholarCrossref
9.
Хардеггер
Д, Надаль
Д, Боссарт
В, Альтвегг
М, Дутли
F. Быстрое обнаружение Mycoplasma pneumoniae в клинических образцах с помощью ПЦР в реальном времени. J Микробиологические методы . 2000;41(1):45-51. doi:10.1016/S0167-7012(00)00135-4PubMedGoogle ScholarCrossref
10.
Альянс исследований детской дерматологии (PeDRA). Переопределение тяжелых кожных реакций у детей. https://pedraresearch.org/wp-content/uploads/2018/11/MRamien.pdf. По состоянию на 11 сентября 2019 г..
Переопределение тяжелых кожных реакций у детей. https://pedraresearch.org/wp-content/uploads/2018/11/MRamien.pdf. По состоянию на 11 сентября 2019 г..
11.
Майор-Ибаргурен
А, Фейто-Родригес
М, Гонсалес-Рамос
Дж,
и другие. Мукозит, вторичный по отношению к инфекции Chlamydia pneumoniae : расширение концепции сыпи и мукозита, вызванных Mycoplasma pneumoniae . Детский Дерматол . 2017;34(4):465-472. doi:10.1111/pde.13140PubMedGoogle ScholarCrossref
12.
Олсон
Д, Уоткинс
Л.К., Демирджян
А,
и другие. Вспышка Mycoplasma pneumoniae – ассоциированный синдром Стивенса-Джонсона. Педиатрия . 2015;136(2):e386-e394. doi:10.1542/peds.2015-0278PubMedGoogle ScholarCrossref
13.
Amode
R, Инген-Хауз-Оро
С, Ортонн
Н,
и другие. Клинические и гистологические особенности мультиформной эритемы, связанной с Mycoplasma pneumoniae : одноцентровая серия из 33 случаев по сравнению со 100 случаями, вызванными другими причинами. J Am Acad Dermatol . 2018;79(1):110-117. doi:10.1016/j.jaad.2018.03.013PubMedGoogle ScholarCrossref
J Am Acad Dermatol . 2018;79(1):110-117. doi:10.1016/j.jaad.2018.03.013PubMedGoogle ScholarCrossref
14.
Шалок
ПК, Динулос
Дж. Г. Mycoplasma pneumoniae – индуцированный синдром Стивенса-Джонсона без поражения кожи: правда или вымысел? J Am Acad Dermatol . 2005;52(2):312-315. doi:10.1016/j.jaad.2004.07.044PubMedGoogle ScholarCrossref
15.
Гардинер
СЖ, Гавранич
Джей Би, Чанг
АБ. Антибиотики при внебольничных инфекциях нижних дыхательных путей, вторичных по отношению к Mycoplasma pneumoniae у детей. Кокрановская система базы данных, ред. . 2015;1:CD004875. doi:10.1002/14651858.CD004875.pub5PubMedGoogle Scholar
Микоплазменные инфекции: симптомы, лечение и профилактика
Написано авторами WebMD Editorial Contributors
- Mycoplasma pneumoniae
- Mycoplasma genitalium
- Mycoplasma hominis
- Ureaplasma urealyticum и Ureaplasma parvum
Микоплазма — это бактерия (или микроб), которая может инфицировать различные части вашего тела. Какая часть тела поражена — ваши легкие, кожа или мочевыводящие пути, зависит от того, какой тип миклоплазменных бактерий вызывает вашу инфекцию.
Какая часть тела поражена — ваши легкие, кожа или мочевыводящие пути, зависит от того, какой тип миклоплазменных бактерий вызывает вашу инфекцию.
Все миклоплазменные инфекции имеют одну общую черту. В отличие от других бактерий, миклоплазмы не имеют клеточных стенок. Они также очень малы по сравнению с другими бактериями. Это важно, потому что многие антибиотики убивают бактерии, ослабляя их стенки. Поскольку у микоплазменных бактерий их нет, некоторые антибиотики, такие как пенициллин, против них не действуют.
Существует около 200 видов микоплазменных бактерий, но большинство из них безвредны. Вам, возможно, придется беспокоиться о:
- Mycoplasma pneumoniae
- Mycoplasma genitalium
- Mycoplasma hominis
- Ureaplasma urea lyticum
- Ureaplasma parvum
Этот тип вызывает инфекции легких. Около трети инфицированных людей заболевают легкой формой пневмонии, называемой «ходячей пневмонией». Ее называют атипичной пневмонией, потому что у большинства людей, особенно у детей, возникает «трахеобронхит» — причудливое название простуды грудной клетки.
Ее называют атипичной пневмонией, потому что у большинства людей, особенно у детей, возникает «трахеобронхит» — причудливое название простуды грудной клетки.
Вы можете заразиться одной из этих инфекций, когда больной кашляет или чихает и выбрасывает капли с бактериями в воздух.
Если вы инфицированы Mycoplasma pneumoniae , у вас могут появиться такие симптомы, как:
- Боль в горле
- Кашель
- Лихорадка
- Усталость
- Головная боль
Для лечения инфекции врач может предложить один из эти типы антибиотиков:
- Макролиды, такие как азитромицин (ZIthromax) или эритромицин (Erythrocin)
- Тетрациклины, такие как доксициклин
Вы получаете это, если занимаетесь сексом с инфицированным человеком. У некоторых людей нет никаких симптомов.
Если вы женщина, вы можете заметить, что у вас:
- Боль во время секса
- Кровотечение из влагалища после секса
- Выделения из влагалища
Если вы мужчина, инфекция может вызвать:
- Уретрит — отек уретры, трубки, через которую проходит моча при выходе из организма
- Покалывание или жжение при мочеиспускании
- Выделения из полового члена
Чтобы определить, инфицированы ли вы, врач может провести тест под названием МАНК (анализ амплификации нуклеиновых кислот) для поиска генов бактерий. Они попросят сдать образец первой утренней мочи (или спермы мужчин) или возьмут мазок из влагалища, шейки матки или уретры.
Они попросят сдать образец первой утренней мочи (или спермы мужчин) или возьмут мазок из влагалища, шейки матки или уретры.
Для лечения вам может потребоваться прием одного из следующих типов антибиотиков:
- Макролиды, такие как азитромицин (однократная доза ZIthromax)
- Тетрациклины, такие как доксициклин
Второй линией лечения могут быть фторхинолоны, такие как моксифлоксацин (Авелокс).
Вашему партнеру тоже может понадобиться лечение.
Когда вы принимаете эти лекарства, приходится немного проб и ошибок, потому что иногда бактерии не реагируют на них. Если первый препарат не работает, врач может назначить другой.
Вы можете помочь предотвратить Mycoplasma genitalium , если будете использовать презерватив во время секса.
Эти бактерии обитают в мочевыводящих путях и половых органах примерно половины всех женщин и меньше мужчин. Но если у вас в целом хорошее здоровье, вам не о чем беспокоиться. Они редко вызывают инфекцию. Женщины с ослабленной иммунной системой — защитой организма от микробов — подвергаются наибольшему риску.
Женщины с ослабленной иммунной системой — защитой организма от микробов — подвергаются наибольшему риску.
Иногда эту инфекцию можно подхватить во время секса. Бактерии также могут передаваться от матери ребенку во время родов.
Если вы женщина, эти бактерии могут быть связаны с воспалительным заболеванием органов малого таза, инфекцией ваших репродуктивных органов. Они также могут привести к проблемам, если вы беременны, например:
- Внематочная беременность (эмбрион растет вне матки)
- Ранние роды
- Выкидыш
Mycoplasma hominis также может вызывать лихорадку и инфекцию у новорожденного.
Чтобы выяснить, есть ли у вас инфекция, вызванная бактериями этого типа, врач возьмет образец жидкости из влагалища или уретры. Если вы это сделаете, вас будут лечить антибиотиками, такими как антибиотики из семейства тетрациклинов, такие как доксициклин.
Чтобы предотвратить эту инфекцию, всегда используйте презерватив во время секса.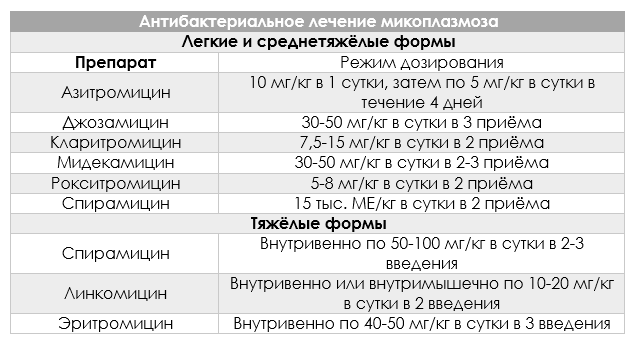 И ограничьте количество партнеров.
И ограничьте количество партнеров.
У большинства здоровых женщин эти бактерии есть в шейке матки или во влагалище, и у меньшего числа мужчин они также есть в уретре. Как правило, они не вызывают никаких проблем.
Уреаплазма может распространяться во время полового акта. Если вы беременны и инфицированы, вы можете передать бактерии своему ребенку в утробе матери или во время родов.
Некоторые симптомы, которые могут появиться у женщин:
- Боль при мочеиспускании
- Боль в животе
- Боль, запах или выделения из влагалища
- Отек у входа в уретру
- Выделения из уретры
Инфицированные мужчины может получить воспаление уретры , называемый уретритом.
Во время беременности бактерии могут вызывать инфекции как у матери, так и у ребенка. Проблемы у новорожденных могут включать:
- Низкий вес при рождении
- Пневмония
- Бактерии в крови, называемые септицемией
Для диагностики уреаплазменной инфекции врач может взять образец жидкости из: 023 Шейка матки
Ваш врач назначит антибиотик для лечения инфекции.