Пустой фолликул без яйцеклетки причины: Синдром «пустых» фолликулов — клиника Эмбрио
Синдром «пустых» фолликулов — клиника Эмбрио
Синдром «пустых» фолликулов — это патология, возникающая в 1-7% протоколов ЭКО1. Так именуют полное отсутствие ооцитов в фолликуле. О возможной этиологии синдрома пустых фолликулов, его диагностике и лечении рассказываем в этом материале.
Определение синдрома «пустых» фолликулов
Синдром «пустых» фолликулов — состояние, при котором в фолликулах яичников отсутствуют яйцеклетки1,2. Этот синдром обнаруживают как после стимуляции, так и в естественном цикле. Выделяют два вида синдрома «пустых» фолликулов2:
Истинный — невозможность извлечения ооцитов из зрелых яичниковых фолликулов после индукции овуляции, несмотря на оптимальный уровень хорионического гонадотропина человека (ХГЧ) в день аспирации. Встречается реже.
Ложный — невозможность извлекать ооциты при низких уровнях ХГЧ (<40 МЕ/л) из-за некорректного введения или низкой биодоступности ХГЧ. Встречается чаще.
Причины синдрома «пустых» фолликулов
Возможная причина — гормональный дисбаланс или нарушение работы яичников2. При сниженном уровне гормонов или неадекватном ответе рецепторов на препарат фолликул не созревает в принципе или оказывается пустым при пункции2.
При сниженном уровне гормонов или неадекватном ответе рецепторов на препарат фолликул не созревает в принципе или оказывается пустым при пункции2.
Ряд исследователей признает существование данного синдрома, другие стараются изучить этиопатогенетическую суть механизмов его развития, с целью поиска возможных методов диагностики и способов лечения этого синдрома2.
Кто в группе риска
Факторы риска синдрома «пустых» фолликулов исследуются давно. Существует как минимум три фактора, способных привести к синдрому «пустых» фолликулов.
Первый фактор риска — генетический. Одно исследование обнаружило мутацию гена, определяющего работу гормональных рецепторов яичников2. В результате нарушенного функционирования рецепторов яичники не реагируют на изменения гормонального фона, и яйцеклетка в фолликуле не созревает. Также синдром «пустых» фолликулов может возникнуть из-за хромосомных мутаций2.
Возраст старше 35 лет — второй неблагоприятный фактор3. Ряд исследований утверждает, что синдром «пустых» фолликулов — это показатель «старения» яичников, наряду с уменьшением запаса яйцеклеток.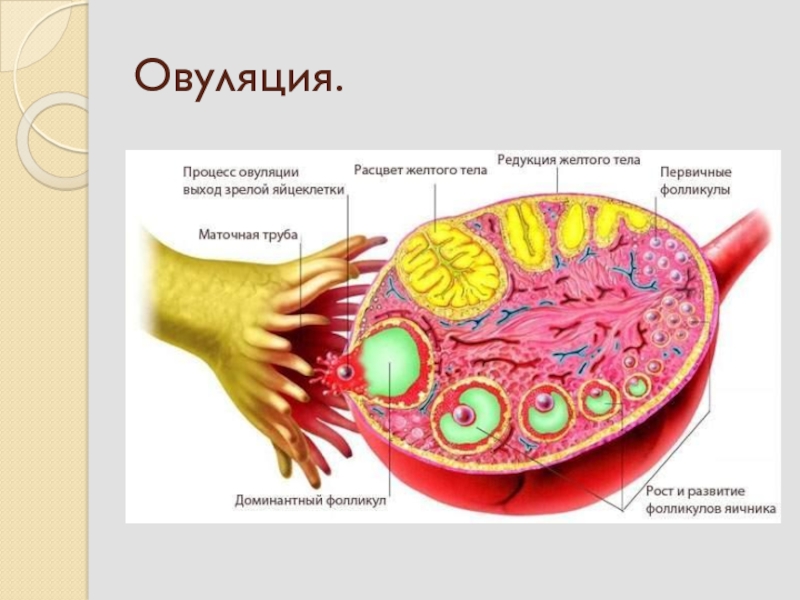
Третий фактор риска — сопутствующие заболевания. В одном наблюдении примерно у 37% женщин с синдромом пустых фолликулов обнаружен эндометриоз, а у 26% — синдром истощенных яичников3. Это патология, при которой у женщины до сорока лет преждевременно нарушается гормональный фон и функция яичников. Ее характерная черта — отсутствие овуляции в естественном цикле.
Как диагностируют синдром пустых фолликулов
Существует лабораторный метод, позволяющий заподозрить симптом «пустых» фолликулов. Через 36 часов после введения препарата для стимуляции у женщины измеряют уровень бета-субъединицы ХГЧ2. Норма — 110 мМЕ/мл. Если результат ниже 10 мМЕ/мл, то, скорее всего, стимуляция прошла неуспешно и пунктировать фолликулы бессмысленно.
Как лечат синдром пустых фолликулов
Синдром «пустых» фолликулов в текущем цикле вылечить нельзя, но можно предотвратить его при следующей стимуляции. Рациональная тактика — это смена препарата3, комбинирование двух препаратов4 или выбор средства для стимуляции из другой партии. Вторую инъекцию препарата для стимуляции делают через 36 часов после первой.
Вторую инъекцию препарата для стимуляции делают через 36 часов после первой.
Для женщин старше 35 лет создан метод профилактики — промывание фолликулов буферным раствором3. Обеспечивается доступ к яичникам, позволяющий ввести раствор с помощью пункционной иглы. Эта мера снижает вероятность возникновения синдрома пустых фолликулов3.
Куда обратиться за помощью
Синдром пустых фолликулов — патология, возникающая после стимуляции овуляции. Если при предыдущей пункции фолликулы оказались пустыми, нужно обратиться к другому врачу-репродуктологу, который подберет оптимальный протокол индукции суперовуляции в новой программе ВРТ. В клинике репродукции Эмбрио работают врачи с опытом работы не менее 10 лет, соблюдающие принципы доказательной медицины. Начните свой путь к счастливому родительству — запишитесь по телефону xxx или оставьте заявку на сайте.
Список использованной литературы:
1. Яковенко С.А., Рыбалка А.Н., Баскаков П.Н., Литвинов В.В., Сулима А.Н. Синдром «пустых» фолликулов. Журнал Таврический медико-биологический вестник, том 15, № 2, ч.2(58), с. 244-246.
Синдром «пустых» фолликулов. Журнал Таврический медико-биологический вестник, том 15, № 2, ч.2(58), с. 244-246.
2. Попова Ж.Ю., Овсянникова Т.В., Морозов В.В. Синдром «пустых» фолликулов — поиск путей профилактики и лечения // Современные проблемы науки и образования. – 2017. – № 2.
3. Болдонова Н. А. Факторы риска и пути к преодолению синдрома «пустых» фолликулов / Н. А. Болдонова // Международный научно-исследовательский журнал. — 2013. — № 7 (14) Часть 5. — С. 25—28.
4. Е. Б. Рудакова, Т. В. Стрижова, Е. А. Федорова, Л. Ю. Замаховская. Возможности улучшения результативности программ ЭКО у «трудных» пациенток. Лечащий врач № 12/2019. С. 14-19.
Яйцеклетка не созревает: почему и что делать
Зачатие происходит только в том случае, если яйцеклетка созрела и вышла из фолликула в брюшную полость. Этот процесс называется овуляцией, и обычно он приходится на середину цикла. Но в организме иногда бывают сбои, которые негативно отражаются на фертильности. Почему не созревает яйцеклетка, поможет установить высококвалифицированный гинеколог. Нарушения могут затрагивать различные звенья фолликулогенеза. И только грамотный подход к диагностике, проводимой на современном оборудовании, позволит разобраться в истинных причинах и механизмах ановуляции.
Почему не созревает яйцеклетка, поможет установить высококвалифицированный гинеколог. Нарушения могут затрагивать различные звенья фолликулогенеза. И только грамотный подход к диагностике, проводимой на современном оборудовании, позволит разобраться в истинных причинах и механизмах ановуляции.
Как созревает яйцеклетка
Овуляция – это эндокринно-опосредованный процесс разрыва фолликула, который происходит примерно через 35-40 часов после подъема уровня лютеинизирующего гормона (ЛГ). Яйцеклетка должна выйти в брюшную полость и затем попасть в маточную трубу.
Подъем уровня лютеинизирующего гормона инициирует окончательное созревание женской половой клетки, которая будет готова к встрече со сперматозоидом. Одновременно с этим под влиянием ЛГ активируется синтез простагландинов. Эти вещества способствуют отделению яйценосного бугорка от стенки фолликула, а также способствуют растворению мембраны фолликула и ее разрыву. Если этого не происходит, то развивается синдром пустого фолликула. В этом случае при проведении ЭКО после пункции фолликула не удается получить яйцеклетку.
В этом случае при проведении ЭКО после пункции фолликула не удается получить яйцеклетку.
В норме яичник в фазе овуляции должен сблизиться с фимбриями маточной трубы, чтобы ооцит с легкостью туда мог попасть. Этот процесс могут нарушить спайки и рубцы, кисты, эндометриоидные очаги вследствие механического давления или посредством нарушения моторики маточной трубы.
Таким образом, процесс созревания фолликулов очень сложный. И только его грамотное моделирование, учитывающее физиологические особенности, может привести к желаемым результатам в рамках лечения эндокринного бесплодия.
Персонифицированный подход к каждой женщине центра репродуктивного здоровья «СМ-Клиника» позволяет добиваться наилучших терапевтических результатов. Врачи разбираются в каждом случае до мельчайших подробностей, отвечают на вопрос, может ли яйцеклетка не созреть, и выявляют факторы, которые этому способствуют, чтобы провести коррекцию имеющихся нарушений.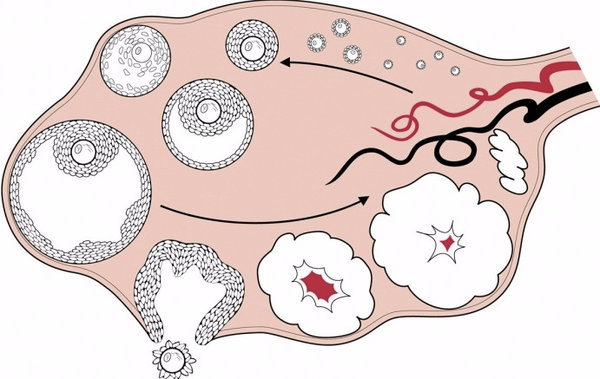
Как может повести себя фолликул
Созревание фолликула происходит в первой фазе менструального цикла. В норме этот процесс завершается овуляцией, при этом эндометрий становится достаточно толстым, чтобы в последующем быть в состоянии принять оплодотворенную яйцеклетку (после процесса секреторной трансформации).
Однако процесс фолликулогенеза может нарушиться. Основные варианты нарушения:
- Отсутствие овуляции – фолликул так и не разрывается, что выявляется на УЗИ в виде синдрома неовулировавшего фолликула. Если размеры этого образования превышают 21 мм в диаметре, то это расценивается как фолликулярная киста.
- Запоздалая овуляция – выход яйцеклетки происходит позже, чем в норме.
- Преждевременная овуляция – яйцеклетка выходит раньше, чем успевает подготовиться эндометрий.
Во всех случаях нарушается репродуктивная функция женщины, и может развиваться эндокринное бесплодие.
Причины, по которым не созревает яйцеклетка
Основными причинами нарушенной овуляции являются эндокринные факторы – недостаточная активность щитовидной железы или гипофиза, который вырабатывает тропные гормоны, стимулирующие яичник. Также яйцеклетка не созревает правильно при повышенном уровне мужских половых гормонов или пролактина. Зачастую подобные эндокринные расстройства можно заподозрить по нарушению менструального цикла. У женщин месячные приходят нерегулярно, могут быть скудными или обильными.
Процесс выхода яйцеклетки из фолликула могут нарушать некоторые лекарственные препараты, которые отодвигают наступление овуляции или вовсе блокируют ее.
Естественные физиологические причины
Как ни странно это звучит, но даже в норме допускается отсутствие овуляции. В течение года может быть 2-3 менструальных цикла, которые не сопровождаются созреванием яйцеклетки и ее выходом из фолликула.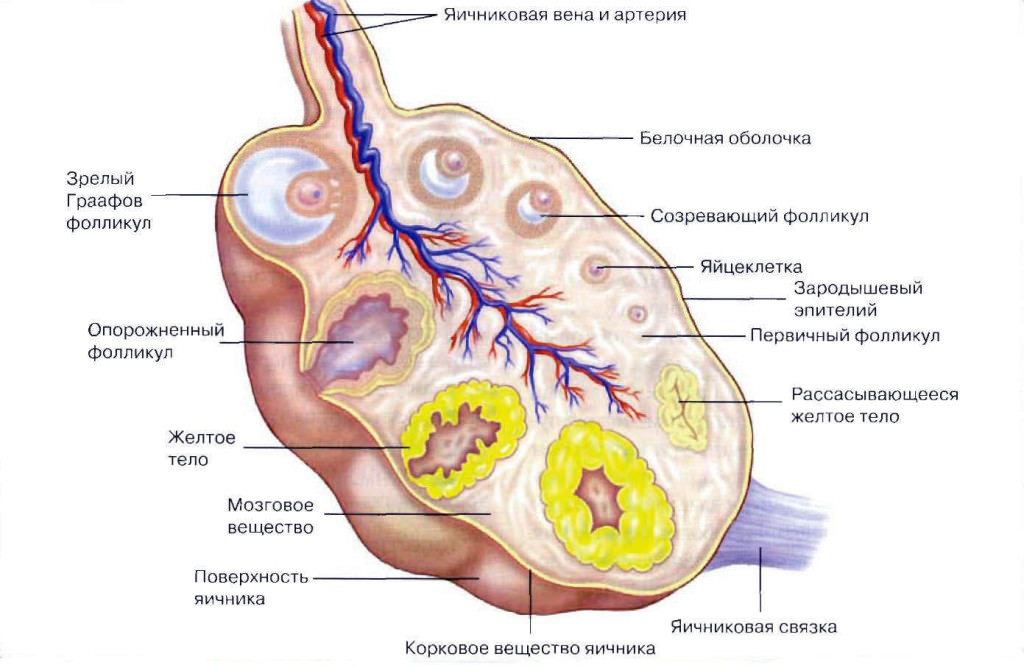 Стоит отметить, что такое состояние является вариантом нормы только в том случае, если ановуляторные циклы не следуют один за другим.
Стоит отметить, что такое состояние является вариантом нормы только в том случае, если ановуляторные циклы не следуют один за другим.
Достаточно часто несозревание фолликула могут спровоцировать следующие состояния:
- жаркий климат;
- авиаперелет;
- психо-эмоциональные переживания;
- снижение массы тела.
Патологии в органах малого таза
Основными патологиями в органах малого таза, при которых не созревает яйцеклетка, являются следующие:
- спаечная болезнь;
- поликистоз яичников;
- эндометриоз;
- преждевременная недостаточность яичников;
- яичниковые кисты;
- воспалительные процессы.
Симптомы и диагностика
По клиническим симптомам бывает трудно догадаться, что яйцеклетка не созревает. Обычно подобные расстройства устанавливаются с помощью ультразвуковой оценки состояния эндометрия и яичников. На 8-9-й день менструального цикла в норме должен определяться доминантный фолликул, который увеличивается каждый день на 2-3 мм. Накануне овуляции его размер должен достигать 18-22 мм. Гранулезные клетки такого фолликула вырабатывают половые гормоны, преобладающим из которых в первую фазу цикла является эстрадиол. Он вызывает пролиферацию эндометрия, в результате чего слизистая утолщается и имеет типичную трехслойную структуру. Ближе к овуляции начинается рост желез – секреторная трансформация эндометрия, которая хорошо определяется с помощью ультразвука.
На 8-9-й день менструального цикла в норме должен определяться доминантный фолликул, который увеличивается каждый день на 2-3 мм. Накануне овуляции его размер должен достигать 18-22 мм. Гранулезные клетки такого фолликула вырабатывают половые гормоны, преобладающим из которых в первую фазу цикла является эстрадиол. Он вызывает пролиферацию эндометрия, в результате чего слизистая утолщается и имеет типичную трехслойную структуру. Ближе к овуляции начинается рост желез – секреторная трансформация эндометрия, которая хорошо определяется с помощью ультразвука.
Заподозрить нарушенное созревание яйцеклетки помогают следующие симптомы:
недостаточная толщина эндометрия; отсутствие трехслойной структуры и предовуляторных изменений; отсутствие доминантного фолликула или его малые размеры накануне овуляции.
Дополнительно для оценки фолликулогенеза может определяться концентрация в крови эстрадиола и лютеинизирующего гормона.
Когда необходима стимуляция овуляции
Стимуляция овуляции – это медикаментозное моделирование фолликулогенеза и проведение соответствующей подготовки эндометрия. Такое лечение показано тогда, когда овуляция не происходит или запаздывает. Достаточно часто синдром неовулировавшего фолликула подразумевает индукцию с помощью инъекций ХГЧ. Могут применяться и другие препараты (рекомбинантный лютеинизирующий гормон, антагонисты гонадолиберинов и т.д.). Оптимальный препарат гинеколог подбирает индивидуально каждой женщине после детального обследования.
После индукции овуляции пара должна совершить половой акт через 24-36 часов. Если уровень ЛГ в сыворотке крови уже повышен, то интимная близость должна состояться в день введения индуцирующего препарата.
Поле стимуляции овуляции гинеколог подбирает прогестероновый препарат для поддержания второй фазы менструального цикла. Это позволит подготовить эндометрий (вызвать секреторную трансформацию) для возможной имплантации оплодотворенной яйцеклетки.
Преимущества лечения в Центре репродуктивного здоровья «СМ-Клиника»
В многопрофильном холдинге центр репродуктивного здоровья «СМ-Клиника» прием ведут не только гинекологи, но и врачи других специальностей, задача которых «настроить» организм женщины на правильное функционирование и успешную реализацию репродуктивной функции. Диагностика выполняется с использованием оборудования экспертного класса, которое позволяет выявить даже незначительные отклонения в функциональном состоянии органов. В собственной лаборатории проводится оценка различных показателей, которые отражают состояние и функционирование репродуктивной системы.
Центр репродуктивного здоровья «СМ-Клиника» — это центр, в котором квалифицированные специалисты помогут оценить вашу фертильность и в случае имеющихся нарушений подберут наиболее оптимальный способ коррекции.
Клиника ЭКО | О пустых фолликулах замолвите слово…
Пустые фолликулы — чаще всего досадный эпизод для «молодой» пациентки, а для «более старой» — почти что правило. Поэтому опытный врач всегда предупредит свою пациентку о такой неприятности. В свою очередь, врач Клиники МАМА попытается максимально подготовить организм женщины для сохранения резерва яичника, а также обеспечить благожелательную обстановку в лечебном цикле ЭКО. Почему порой под воздействием стимулирующих препаратов у женщины созревает мало яйцеклеток? Рассказывает главный врач московской Клиники репродукции МАМА Виктория Викторовна ЗАЛЕТОВА.
Поэтому опытный врач всегда предупредит свою пациентку о такой неприятности. В свою очередь, врач Клиники МАМА попытается максимально подготовить организм женщины для сохранения резерва яичника, а также обеспечить благожелательную обстановку в лечебном цикле ЭКО. Почему порой под воздействием стимулирующих препаратов у женщины созревает мало яйцеклеток? Рассказывает главный врач московской Клиники репродукции МАМА Виктория Викторовна ЗАЛЕТОВА.
О наличии «пустых» фолликулов можно достоверно говорить, только рассмотрев этих пустышек во время ЭКО под микроскопом. Да, полученная при пункции яичников жидкость, не содержит половые клетки, а также и других частей которые должны быть в нормальном фолликуле. То есть, проще говоря, все — кисты! К счастью, вероятность тотального кистообразования у женщины репродуктивного возраста низка, и возникает редко. Чаще встречаются смесь: полноценные фолликулы и фолликулы «из прошлой жизни» (атрезированные, в которых клеток нет).
В 50-60 гг. прошлого столетия некий ученый Рубин предлагает методы косвенного (!!!) определения овуляции — биопсию эндометрия и тесты функциональной диагностики (измерение базальной температуры тела, мазки на «гормональное зеркало»). Он впервые определил синдром пустого фолликула, а так же возможность иммунологической несовместимости мужчины и женщины.
Несмотря на то, что само по себе образование и рост кисты происходит даже у вполне здоровой женщины в молодом возрасте в среднем с частотой 1-2 раза в год, это открытие повергает женщин, проходящих цикл ЭКО, в шок. Помните, никто кроме врачей-«экошников» никогда не видит ни по базальной температуре, ни на УЗИ: есть ооцит в фолликуле или нет. Соответственно, никогда нельзя заранее исключить возможность аномалий ооцитов, пустых фолликулов, пока врач не получит фолликулярную жидкость и не рассмотрит ее в микроскоп.
Согласно медицинской статистике, у женщины после 33 лет циклы без овуляции («циклы без клеток») будут повторяться чаще чем у 20-летних, то есть 3-4 раза в год. Связано это с приходящими изменениями женского организма: снижением половых гормонов и способности вырастить полноценные клетки. Устроено так, что давать команду «начать рост яйцеклеток», организм получает из высших центров головы, но с учетом мнения низов: яичников и других гормональных очагов ( в том числе надпочечников и жировой ткани). Поэтому сопутствующие проблемы: ожирение, поликистоз, эндометриоз, спайки повышает вероятность образования кист.
Связано это с приходящими изменениями женского организма: снижением половых гормонов и способности вырастить полноценные клетки. Устроено так, что давать команду «начать рост яйцеклеток», организм получает из высших центров головы, но с учетом мнения низов: яичников и других гормональных очагов ( в том числе надпочечников и жировой ткани). Поэтому сопутствующие проблемы: ожирение, поликистоз, эндометриоз, спайки повышает вероятность образования кист.
Стресс так же опасен для молодой женщины, планирующей беременность. Большинство знают, что во время Великой Отечественной войны множество молодых женщин «впадало» в ановуляцию, вплоть до отсутствия менструации на фоне стресса, тяжелой работы и недоедания. Тогда просто не было время на деторождение, надо было ковать победу над врагом в тылу. В мирное же время, у здоровой женщины могут быть стрессы и другие, более сильные приоритеты над репродуктивными задачами в данном конкретном менструальном цикле. Это и ссоры с мужем, и забота о родителях, и переходный возраст старших детей, да и собственные карьерные перипетии. Тогда в данном менструальном цикле может произойти не рост, а блокада выработки половых клеток. И, конечно, чаще такое настигает пациентку в возрасте более 35 лет.
Тогда в данном менструальном цикле может произойти не рост, а блокада выработки половых клеток. И, конечно, чаще такое настигает пациентку в возрасте более 35 лет.
Надо сказать, что гормональный фон организма очень зависит от еды и воды, которые приходится потреблять ежедневно, а так же от наличия или отсутствия витаминов. Нормализация питания, обмена веществ важнейшая задача до ЭКО и во время лечения ЭКО. Об оздоровлении перед ЭКО читайте в архиве сайта. И не забывайте про мужнин образ жизни, конечно.
Пустые фолликулы — чаще всего досадный эпизод для «молодой» пациентки, а для «более старой» — почти что правило. Поэтому опытный врач всегда предупредит свою пациентку о такой неприятности. В свою очередь, врач Клиники МАМА попытается максимально подготовить организм женщины для сохранения резерва яичника, а также обеспечить благожелательную обстановку в лечебном цикле ЭКО. А в тяжелом случае, конечно, предложит донорскую программу.
Виктория ЗАЛЕТОВА
Сделайте первый шаг — запишитесь на прием!
Ознакомьтесь с текстом по ссылке
Y
N
возможно ли зачатие, причины и лечение синдрома
Наступление зачатия возможно только во время овуляции, наступающей после выхода яйцеклетки из фолликула. Однако иногда в процессе диагностики определяются пустые фолликулы. В них яйцеклетка отсутствует.
Однако иногда в процессе диагностики определяются пустые фолликулы. В них яйцеклетка отсутствует.
Редкий диагноз
Чаще всего такой диагноз слышат пары, которые длительное время не могут зачать ребенка. Ведь именно поэтому они начинают проходить тщательную диагностику для выявления бесплодия, которая включает в себя лабораторные исследования, УЗИ и анализ фолликулярной жидкости.
Последнее исследование проводится только на уровне ЭКО и является, по мнению медиков, единственной возможностью выявить такую патологию как фолликул без яйцеклетки. Однако и оно часто дает ложные результаты.
По какой причине появляются «пустышки» на яичниках женщины, можно ли устранить эту проблему? И, главное, почему многие медики не признают факт такой патологии?
Почему созревают фолликулы без яйцеклетки
Здоровая женская репродуктивная система работает как отлаженный механизм, ежемесячно «поставляя» зрелые яйцеклетки для оплодотворения. Однако организм – не машина, и ему иногда нужен отдых. Поэтому 1-2 раза в год у молодой здоровой женщины происходят ановуляторные циклы: доминантный фолликул не созревает. Иногда это пустой фолликул без яйцеклетки. И в этом явлении нет никакого отклонения: яичники «отдохнут» и вновь начнут свое естественное функционирование.
Поэтому 1-2 раза в год у молодой здоровой женщины происходят ановуляторные циклы: доминантный фолликул не созревает. Иногда это пустой фолликул без яйцеклетки. И в этом явлении нет никакого отклонения: яичники «отдохнут» и вновь начнут свое естественное функционирование.
К тому же, чем дальше женский возраст от тридцатилетнего рубежа, тем чаще будут случаться такие циклы. Ведь с возрастом организм вырабатывает все меньше половых гормонов, поэтому вырастить полноценную яйцеклетку ему сложнее.
Существует еще ряд причин, почему зреют пустые фолликулы.
Мы уже упоминали о том, что организм женщины функционирует как механизм, в котором все части тесно взаимосвязаны. Команду к началу роста яйцеклеток дает головной мозг. Однако он обязательно «учитывает мнение» органов, вырабатывающих гормоны: яичников, надпочечников, жировой ткани.
Следовательно, причины появления «пустышек» кроются в таких факторах:
- Поликистоз;
- Ожирение;
- Эндометриоз;
- Синдром преждевременного старения яичников;
- Проблемы генетического характера;
- Спайки.
Особенно хочется отметить влияние стрессовых ситуаций на работу репродуктивной системы. Женщины очень эмоциональны, поэтому любые ссоры, переживания и волнения обязательно скажутся на работе их яичников. В этом случае мозговой центр посылает сигнал блокировать рост половых клеток, вследствие чего созревшие полноценные фолликулы остаются пустыми.
Как правило, такая проблема после восстановления психологического комфорта и устранения сопутствующих заболеваний решаются благополучно. Однако ситуация обстоит сложнее, когда «пустышки» диагностируют после стимуляции яичников.
Синдром пустого фолликула
Термин «синдром пустых фолликулов» был введен в обиход и детально описан только в 1986 году. Каролина Колам с коллегами определила, что иногда длительное отсутствие зачатия связано с отсутствием яйцеклетки в фолликуле. Однако механизм этого процесса они объяснить не смогли. Более того, ответ на этот вопрос не нашла и современная медицина. Ведь подтвердить синдром пустого фолликула можно только после того, как будут исключены такие важные факторы:
- Синдром Тернера. Патология представляет собой полное отсутствие яйцеклеток на протяжении всего репродуктивного цикла женщины. Этот синдром диагностируется крайне редко, однако исключать его нельзя.
- Неправильно выбранное время для введения ХГЧ (хорионический гонадотропин человека). Это лекарство вводят для того, чтобы лопнул созревший фолликул. В данном случае речь идет о врачебной ошибке, когда препарат вводят не за 36 часов до овуляции, а значительно раньше. То есть у яйцеклетки не было времени, чтобы полностью созреть.
- Ошибки в дозировке ХГЧ. Определяют это нарушение, исходя из неравномерности «жизнедеятельности» яйцеклетки. Часть фолликулов признают пустыми, а часть содержащими яйцеклетку.
- Плохого качества препарат ХГЧ;
- Перезревание фолликулов. Если ХГЧ ввелось слишком поздно или в превышенной дозировке, даже созревшие яйцеклетки растворяются, так как фолликулы становятся кистами.
- Неправильно подобранный протокол стимуляции яичников;
- Нарушение правил забора и промывки полученного материала;
- Ранняя овуляция;
- Плохое усвоение ХГЧ;
- Раннее старение яичников;
- Проблемы в созревании и развитии фолликулов в естественном цикле;
- Дефектные изменения в развитии яйцеклетки;
- Гормональные нарушения, возникшие из-за больших доз лекарственных средств, прописанных в протоколе;
- Чрезмерные физические и психо-эмоциональные нагрузки, неправильное распределение часов отдыха и работы, неполноценное питание;
- Необъяснимые причины, когда все возможные провоцирующие факторы исключены, а фолликулы вырастают «пустышками».
Из-за влияния на процесс созревания яйцеклетки многочисленных сторонних факторов многие специалисты в репродуктивной области не признают синдром пустых фолликулов в качестве отдельной патологии. Ведь многочисленные попытки подтвердить наличие и клиническую картину его развития с помощью диагностики УЗИ не увенчались успехом. Только пункция с исследованием фолликулярной жидкости может с точностью диагностировать наличие пустого фолликула.
Результаты данного исследования специалисты разделяют на две группы: истинный синдром и ложный.
Истинным синдромом пустого фолликула считают невозможность получить яйцеклетку из зрелых фолликул при условии их правильного развития и оптимального уровня β-ХГЧ в день стимуляции.
Ложным считают синдром, при котором в фолликуле нет яйцеклетки из-за низкого уровня β-ХГЧ. Падение показателя может быть связано с ошибками при его введении или же низкой активности биологического характера.
– В данном случае общая рекомендация – обсудите проблему со своим лечащим врачом, – говорит акушер-гинеколог, врач вышей категории, кандидат медицинских наук, директор семейной клиники «Репромед» Елена Канаева. – Как правило, имеет место снижение фолликулярного резерва, в том числе и связанное с возрастными изменениями в гормональной регуляции цикла. Оценивается фолликулярный резерв яичников и базовые показатели гормонального профиля – ФСГ, ЛГ, АМГ в первые дни цикла. Вопросы донорских программ решаются с врачом индивидуально.
Это не приговор
Может ли фолликул без яйцеклетки быть приговором, который навсегда лишит женщину надежды на радость материнства?
К счастью, нет. Опытный специалист в области репродуктивной медицины, как правило, находит выход из ситуации. В первую очередь, речь пойдет об изменении тактики лечения и стимулирования яичников. Чаще всего меняют вид лекарственных препаратов в протоколе. Например, если применялись антагонисты, их меняют на агонисты ГнРГ.
Также корректируют дозировку и меняют используемую партию препарата. Интервал между пункцией и стимулированием овуляции удлиняют. Используют методику промывания яичников.
Повторное диагностирование синдрома пустых фолликулов встречается очень редко. Но даже в этом случае отчаиваться не стоит: современная репродуктивная медицина позволяет женщине стать матерью с помощью донорской яйцеклетки.
Фолликулы без яйцеклетки – редкое явление для юных девушек. Однако для дам в возрасте эти изменения в функции яичников становятся закономерностью.
Опытный врач, который готовит женщину к процедуре искусственного оплодотворения, должен рассказать пациентке о возможности возникновения такой «внештатной ситуации». Объяснить возможные причины этого явления и способы их преодоления. Женщине после озвученного неутешительного диагноза нужно сохранять душевное спокойствие, не паниковать, ведь измененная схема лечения и соблюдение всех рекомендаций доктора обязательно помогут ей стать матерью.
🥚🐣… — Академический Медицинский Центр «Мудрий Лікар»
🥚🐣 СИНДРОМ пустых фолликулов!
Как правило, невозможность получения яйцеклеток из фолликулов в протоколах ЭКО называют #синдромом #пустых_фолликулов. Именно отсутствие клеток означает невозможность далее работать!
👩⚕️Итак, нужно понимать, что часто число растущих фолликулов не совпадает с количеством полученных яйцеклеток. Почему? ⠀
🐣 Во- первых, фолликулы не всегда растут ровно и одинаково и есть множество мелких фолликулов, которые не дорастают к моменту пункции, или наоборот, один фолликул перерастает, так как мы ждём, чтоб вырастить основной пул.⠀
🐣Также у пациенток могут вместе с фолликулами расти кисты, которые выглядят на УЗИ как фолликулы, но не содержат яйцеклеток (такое встречается при СПКЯ)⠀
🐣 И, наконец, особенности пункции. При тяжелом спаянном процессе и эндометриозе не всегда из- за тяжелого доступа удаётся спунктировать все фолликулы. ⠀
Но во всех этих случаях мы получаем меньше, чем росло, но не ноль ❗️
Важно понимать, что определить пустой фолликул или нет, не может никто до момента пункции (по УЗИ все выглядит одинаково).⠀
👩⚕️Нужно различать истинный синдром пустого фолликула и ложный. ⠀
В большинстве случаев причина отсутствия яйцеклеток — это не корректно введённый триггер овуляции. Пациентки периодически путают дату 📆 и время ⏰ введения триггера (важно установить до пункции), могут рассыпать или разлить часть препарата 💉, неправильно его хранить.
👩⚕️Но у большинства женщин ооциты все же появляются, и хотя пустых фолликулов может быть достаточно много, в некоторых из них находят яйцеклетки! И этого достаточно для оплодотворения🤰
Но бывает и такое, что яйцеклеток в пустых фолликулах нет вообще! Тогда единственным выходом является донорский протокол.
Записаться на консультацию к доктору репродуктологу можно по ☎️ +38 (063)468 78 02 / ☎️+38 (096)793 72 06
🏠 Киев, ул.Терехина,4
#АМЦ #Мудрий_Лікар #репродуктолог #врач_вісшей_категорией #доктор_Гульмамедова #медичний_центр #IVF #Wisedoc #reproductologist #to_be_parents #Ukrain #Kiev #medical_center
ЭКО — Kinderwunsch Institut Feichtinger, Wien
При проведении ЭКО несколько 100. 000 сперматозоидов помещаются в среду вместе с яйцеклеткой. При этом лучший сперматозоид находит себе путь в яйцеклетку.
Показания
При непроходимости маточных труб, эндометриозе или синдроме поликистозных яичников экстракорпоральное оплодотворение является методом выбора (при условии нормального состояния семени мужчины).
Шансы на успех
Шансы забеременеть при помощи ЭКО составляют примерно 30-40 % в каждом цикле ЭКО. Успех зависит от возраста пациентов, гормонального статуса, а также сопутствующих заболеваний (напр. диабет, гипертония, снижение или повышение мыссы тела и т.д. ) и факторов образа жизни (стресс, курение, чрезмерное употребление спиртных напитков).
ГОРМОНАЛЬНАЯ СТИМУЛЯЦИЯ ЯИЧНИКОВ
ЭКО (экстракорпоральное оплодотворение) или ИКСИ (интрацитоплазматическая инъекция сперматозоида) проводится чаще всего после гормональной стимуляции яичников. Стимуляция необходима для одновременного созревания нескольких фолликул в обоих яичниках с тем, чтобы получить несколько способных к оплодотворению яйцеклеток.
Фаза подготовки к ЭКО («отрицательная модуляция») должна настроить организм на предстоящую стимуляцию. В этой фазе происходит подавление выработки собственных гормонов. С этой целью производятся ежедневные подкожные инъекции, либо применяются определенные медикаменты в таблетированной форме. Подготовительная фаза дает возможность внешнего управления фазой стимуляции.
Для последующей стимуляции яичников используются препараты, содержащие ФСГ (фолликулостимулирующий гормон) или ЛГ (лютеинизирующий гормон) в чистом виде или в комбинации. В процессе стимуляции делаются подкожные инъекции определенной дозы данных гормонов (в зависимости от возраста пациентки, веса и пр.) в одно и то же время суток. Применение этих медикаментов объясняется и демонстрируется перед началом лечения. Инъекции могут выполнятья пациенткой или партнером самостоятельно, что избавляет от необходимости ежедневных визитов к врачу.
При тщательном ультразвуковом обследовании определяется количество созревающих фолликулов, степень их зрелости, а также структура слизистой оболочки полости матки. Как только фолликулы достигнут определенной величины, производится индукция овуляции путем введения гормона ХГЧ (человеческого хорионального гонадотропина). При этом устанавливается оптимальное время для забора яйцеклетки.
ПУНКЦИЯ ЯЙЦЕКЛЕТОК
Спустя 36 часов после инъекции гормона, вызывающей овуляцию, производится забор яйцеклеток через влагалище. Под ультразвуковым контролем выполняется прокол фолликулов с помощью пункционной иглы, и фолликулярная жидкость забирается вместе с яйцеклетками.
Затем, под микроскопом из фолликулярной жидкости отбираются яйцеклетки, помещаются в специальную питательную среду и инкубируются в термостате при 37°C. Процедура пункции фолликулов продолжается по времени от 5 до 15 минут, в зависимости от количества фолликул. С целью устранения дискомфорта в процессе вмешательства мы вводим нашим пациенткам комбинацию из снотворных и болеутоляющих препаратов. Пункция фолликула происходит амбулаторно, с последующим обязательным медицинским наблюдением в течение 2 часов в наших комнатах отдыха.
ЗАБОР СЕМЕНИ
Забор семени производится путем мастурбации (после 2-3 дней воздержания) в день забора яйцеклеток. В случае возникновения каких-либо проблем, связанных с недостатком времени или стрессом, можно принести пробу с эякулятом из дома. При этом важно, чтобы между получением эякулята и моментом передачи пробы в институт прошло не более 2 часов.
ОПЛОДОТВОРЕНИЕ — МЕТОД ТРАДИЦИОННОГО ЭКО
Оплодотворение изъятых яйцеклеток происходит в тот же самый день. Для этого сперматозоиды, после специальной подготовительной обработки, помещают вместе с яйцеклетками в чаше. Процесс оплодотворения происходит естественным путем. На следующий день под микроскопом определяется, сколько яйцеклеток проявляют признаки состоявшегося оплодотворения (2 пронуклеуса и 2 полярных тельца).
ТРАНСФЕР ЭМБРИОНА
Через 2-5 дней после оплодотворения эмбрион(ы) вводятся при помощи тонкого гибкого пластикового катетера под ультразвуковым контролем в матку. В какой именно день состоится трансфер эмбриона — зависит от количества оплодотворенных яйцеклеток. Если оплодотворены 1-4 яйцеклетки, в большинстве случаев трансфер эмбриона назначается через 2-3 дня после пункции. До этого времени развитие эмбрионов ежедневно контролируется и оценивается по определенным критериям, при этом обращается внимание на процесс клеточного деления и его регулярность. Для трансфера выбираются самые хорошие по качеству эмбрионы. При наличии 5-ти или большего количества эмбрионов трансфер осуществляется через 5 дней после оплодотворения, так называемый трансфер бластоциста. Бластоциста — это максимальная стадия развития эмбриона, которая может быть достигнута вне тела. Если хороших по качеству эмбрионов оказалось больше, чем требовалось для трансфера, их могут законсервировать путем заморозки (заморозить в жидком азоте). Перенос эмбрионов занимает всего несколько минут и проходит безболезненно. После этой поцедуры мы рекомендуем нашим пациенткам расслабиться в течение 20-30 минут в наших комнатах отдыха.
ВСПОМОГАТЕЛЬНЫЙ ХЭТЧИНГ, «ПОМОЩЬ ПРИ ВЫСКАЛЬЗЫВАНИИ»
Яйцеклетка и, соответственно, эмбрион окружены прочной оболочкой, так называемой зоной пеллюцида (прозрачная оболочка, окружающая яйцеклетку). Когда эмбрион в течение своего развития достигает стадии бластоциста, он должен выскользнуть из этой оболочки, чтобы иметь возможность разместиться в матке. Тем не менее, иногда эта оболочка «затвердевает» или бывает слишком толстой, что затрудняет имплантацию или делает ее невозможной. В этих случаях зона пеллюцида надсекается с помощью лазера, что облегчения «выскальзывания» подрастающего эмбриона и повышает успех имплантции.
Фаза имплантации (фаза лютеинизации)
С момента забора яйцеклетки начинается вторая половина цикла, так называемая фаза созревания желтого тела в яичнике. На этой фазе собственное производство гормона желтого тела поддерживается медикаментозно, вследствие чего слизистая оболочка матки (эндометрий) подготавливается к оптимальной имплантации эмбриона. Медикаменты, используемые в фазе лютеинизации, могут приниматься в форме внутримышечных уколов, подкожных инъекций, в форме таблеток или вагинальных свечей. Спустя 2 недели после оплодотворения яйцеклеток доказательством беременности является наличие гормона беременности (ХГЧ) в крови или в моче. При подтверждении беременности поддержка функции желтого тела осуществляется вплоть до 12 недель беременности.
Ученые дают надежду женщинам с преждевременной менопаузой
Підпис до фото,
Доктор Казухиро Кавамура из Медицинской школы Университета им. Святой Марианны с малышом, родившимся благодаря технологии «пробуждения» яичников
Группа врачей из США и Японии помогли забеременеть женщине, у которой началась преждевременная менопауза, использовав технологию «пробуждения» яичников. Недавно эта женщина родила здорового малыша.
Технология, использованная врачами, заключается в том, что женщине удаляют яичники, активируют их в лабораторных условиях, а затем пересаживают пациентке фрагменты ткани яичников.
С помощью этого метода уже родился один ребенок, а вскоре на свет должен появиться еще один.
Ученые говорят, что выводы об эффективности их технологии делать рано, но потенциально их метод может стать революционным.
К своему эксперименту ученые привлекли 27 молодых женщин в возрасте около 30 лет, которые не могли забеременеть из-за так называемого синдрома истощения яичников. Сегодня этот синдром наблюдается у каждой 100-й женщины. Он проявляется в том, что у женщины преждевременно заканчиваются жизнеспособные яйцеклетки, в результате чего наступает ранняя менопауза.
От рождения у женщины есть определенное количество яйцеклеток. Но в случае синдрома истощения яичников, яйцеклетки либо быстро заканчиваются, либо их количество невелико с самого рождения.
Разбудить яичники
Яйцеклетки в яичнике находятся в полусформированном виде — в форме фолликулов. Каждый месяц у женщины созревает одна или несколько яйцеклеток.
Команда ученых из Стэнфордского университета (США) и Медицинской школы Университета им. Святой Марианны (Япония) попытались активизировать яйцеклетки, которые еще оставались в яичниках женщин, переживающих менопаузу.
Ученые удалили женщинам яичники, а потом попытались «разбудить» спящие яйцеклетки. Сначала ученые разделили яичники на несколько фрагментов, а потом обработали их специальным реагентом с активизирующим свойством. После этого фрагменты яичника подсаживали женщинам, которые с того времени должны были пройти курс гормонотерапии.
После завершения курса терапии ученые провели обследование и увидели, что восемь из испытуемых женщин демонстрируют признаки развития яичных фолликулов. Образующиеся таким образом яйцеклетки ученые в дальнейшем использовали для искусственного оплодотворения. На сегодня с помощью этого метода уже появился на свет один малыш, а рождения еще одного ждут счастливые родители.
Профессор Аарон Хсуе из Стэнфордского университета рассказал, что разработанный его командой метод требует совершенствования и по предварительным подсчетам, может помочь 25-30 % женщин.
«Думаем, этот метод может использоваться еще в двух случаях: для женщин, которые преодолели рак и прошли курс химио — или радиотерапии. Если у них остались фолликулы яйцеклеток, есть шанс, что этот метод может помочь. Вторая категория — женщины в возрасте 40-45 лет с нерегулярным менструальным циклом», — говорит Хсуе.
Большой интерес
Последствия применения этого метода для женщин с преждевременной менопаузой пока неизвестны, поскольку эта технология требует дальнейшего тестирования и совершенствования, прежде чем ее можно будет применять в больницах.
«Это очень умное изобретение, но сработает ли оно для всех? Этого мы не знаем. Потенциально, эта технология является чрезвычайно интересной, но нужно провести больше исследований, чтобы можно было с уверенностью сказать, что это не очередной повод для ложной надежды», — высказывает свое мнение профессор Чарльз Кингсланд из ливерпульской женской больницы и Королевского колледжа акушеров и гинекологов.
Профессор Ник Маклон из Саутгемптонского университета также с оптимизмом воспринимает новую технологию. «Найти новый способ производить яйцеклетки путем пробуждения спящих фолликулов — звучит очень обнадеживающе. Это может стать настоящим прорывом. Это очень важный и захватывающий научный эксперимент, но пока этот метод недостаточно исследован для использования в больницах», — говорит Маклон.
По мнению господина Маклона, применить этот метод за пределами лаборатории будет невозможно, но все же лучшее понимание механизмов развития яйцеклетки может помочь в поиске новых путей лечения бесплодия.
По материалам статьи Джеймса Галлахера, корреспондента по вопросам науки и здоровья, BBC News
Успешная беременность после двойного триггера
J Hum Reprod Sci. 2015 июль-сентябрь; 8 (3): 170–174.
K. Deepika
Отделение репродуктивной медицины, Милан — Центр репродуктивной медицины, Бангалор, Карнатака, Индия
Суварна Ратхор
Отделение репродуктивной медицины, Милан — Центр репродуктивной медицины, Бангалор, Карнатака, Индия
Нупур Гарг
Отделение репродуктивной медицины, Милан — Центр репродуктивной медицины, Бангалор, Карнатака, Индия
Камини Рао
Отделение репродуктивной медицины, Милан — Центр репродуктивной медицины, Бангалор, Карнатака, Индия
Отделение репродуктивной медицины, Милан — Фертильность Center, Бангалор, Карнатака, Индия
Адрес для корреспонденции: Dr.К. Дипика, Отделение репродуктивной медицины, Милан — Центр фертильности, № 6/7, Кумара Крупа Роуд, Хай Граундс, Бангалор — 560 001, Карнатака, Индия. E-mail: moc.liamg@akipidkrd
Поступила 25 мая 2015 г .; Пересмотрено 30 июня 2015 г .; Принято 10 июля 2015 г.
Авторские права: © Journal of Human Reproductive Sciences
Это статья в открытом доступе, распространяемая в соответствии с условиями лицензии Creative Commons Attribution-NonCommercial-ShareAlike 3.0, которая позволяет другим редактировать, настраивать и развивать работу некоммерчески, при условии, что автор указан и новые творения лицензируются на идентичных условиях.
Эта статья цитируется в других статьях в PMC.
Abstract
Синдром пустого фолликула (EFS) — это редкое, но неприятное осложнение вспомогательных репродуктивных технологий с невозможностью получить ооциты после адекватного ответа яичников на стимуляцию. Большинство зарегистрированных случаев EFS — это проблемы, связанные с наркотиками, которых можно избежать и которые не представляют собой какой-либо потенциальной патологии, и что риск подлинного EFS (GEFS) намного меньше, чем когда-то считалось. Наш случай является первым сообщением о беременности, полученным после лечения GEFS с двойным триггером цикла антагонистов гонадотропин-рилизинг-гормона (GnRH).В этом отчете мы представляем пациента, у которого было выполнено два извлечения ооцитов, у которых не было получено ни одного ооцита. В третьем цикле оплодотворения in vitro двойной триггер с комбинацией агониста GnRH и хорионического гонадотропина человека дал 11 ооцитов, что привело к переносу 2 бластоцист, что привело к рождению живого ребенка. Изменение протокола лечения с двойным триггером привело к успешному результату.
КЛЮЧЕВЫЕ СЛОВА: Двойной триггер, синдром пустого фолликула, синдром подлинного пустого фолликула, антагонист гонадотропин-рилизинг-гормона
ВВЕДЕНИЕ
Синдром пустого фолликула (EFS), широко обсуждаемый загадочный синдром, раздражает и вызывает серьезное беспокойство. как для врача, так и для пациента.[1] EFS определяется как состояние, при котором ооциты не извлекаются из зрелых фолликулов яичников после индукции овуляции в цикле оплодотворения in vitro (ЭКО) с очевидным нормальным фолликулогенезом и стероидогенезом, несмотря на тщательную аспирацию и промывание фолликулов. Его нельзя предсказать по типу реакции яичников на стимуляцию, ни сонографически, ни гормонально. Следовательно, диагноз EFS является ретроспективным. Ввиду неопределенности причин этого явления и растущего числа доказательств того, что в некоторых случаях ооциты можно успешно извлечь, термин EFS считается неуместным; но все еще используется в современной медицинской литературе.[2]
EFS подразделяется на два типа: «подлинный EFS» (GEFS) и «ложный» EFS (FEFS). Распространенность ГЭФС составляет 0–1,1% [3]. GEFS определяется как неспособность получить ооциты из явно нормальных растущих фолликулов яичников после стимуляции в циклах ЭКО нормальными уровнями эстрадиола и соответствующими уровнями бета-хорионического гонадотропина человека (β-ХГЧ) в сыворотке крови в день получения ооцитов (OR). Механизм, лежащий в основе GEFS, остается неясным, все еще подвергая сомнению сомнительное существование этого синдрома как отдельной клинической единицы.[4] Здесь мы сообщаем о случае GEFS, которым удалось успешно управлять с помощью двойного триггера.
ОТЧЕТ О ПРАКТИКЕ
Пара с шестилетним первичным бесплодием была направлена в наш центр репродуктивного здоровья по поводу бесплодия необъяснимой природы. Женщине было 32 года с нормальным менструальным циклом, известным случаем гипотиреоза, и она получала тироксин 50 мкг в день. Ее старшая сестра также страдала необъяснимым бесплодием, она перенесла три цикла ЭКО в другом месте с извлечением только 1-2 незрелых ооцитов во всех циклах, и ей посоветовали донорские ооциты.При физикальном обследовании не было замечено ни прыщей, ни гирсутизма, индекс массы тела 22 кг / м 2 . Сонография органов малого таза была нормальной, и все ее исходные исследования были в пределах нормы: фолликулостимулирующий гормон (ФСГ) -7,5 МЕ / л, антимюллеров гормон — 2,9 нг / мл и пролактин-17 нг / мл. Ее тиреотропный гормон (ТТГ) составлял 6,6 мкМЕ / мл, при этом ее тироксин был повышен до 75 мкг / день с повторным уровнем ТТГ через 6 недель до 1,9 мкМЕ / мл. Диагностическая гистеролапароскопия в норме.Мужу пациентки 38 лет, анализ спермы нормальный (общее количество — 69 млн / мл, общая подвижность — 68%, нормальные формы — 35%) и нормальный индекс фрагментации ДНК.
Поскольку пациентка не забеременела в четырех циклах внутриматочной инсеминации, ЭКО было запланировано с использованием длительного протокола лютеиновых агонистов. Двойное подавление было достигнуто с помощью пероральных противозачаточных таблеток, которые начинали с 5 дня предыдущего менструального цикла, и агониста гонадотропин-рилизинг-гормона (GnRHa) (Lupride, Sun Pharmaceutical Ltd.,) 0,25 мг подкожно (п / к) два раза в день, начиная с 21 дня, после того как трансвагинальная сонография подтвердила отсутствие кист. На 2 день цикла, после подтверждения подавления: (эстрадиол [E2] -41 пг / мл, лютеинизирующий гормон [LH] -1,1 МЕ / л, прогестерон [P4] -0,1 нг / мл) была начата стимуляция яичников рекомбинантным ФСГ. (R-FSH), (Recagon, Organon) 150 МЕ подкожно ежедневно и GnRHa 0,25 мг один раз в день продолжали до дня триггера. На 5 день стимуляции 8 фолликулами размером от 7 до 11 мм и E2-230 пг / мл, 75 МЕ менопаузального гонадотропина человека (HMG) (Reprogon, Ferring Pharmaceuticals Ltd.,) был добавлен к рекагону 150 МЕ. На 10 день стимуляции 4 доминантными фолликулами ≥17 мм, толщиной эндометрия 9,8 мм с E2-2011 пг / мл, LH-1,9 МЕ / л и P4-0,2 нг / мл. Рекомбинантный ХГЧ (R-hCG) (Ovitrelle, Serono) 250 мкг вводили в качестве триггера и назначили операцию на 35 часов. Перед началом сбора ооцитов трансвагинальное сканирование (TVS) показало наличие интактных фолликулов в обоих яичниках. После аспирации зрелых фолликулов из правого яичника, поскольку фолликулярная жидкость в первых трех пробирках не показала никаких признаков гранулезных клеток или ооцитов, мы решили промыть оставшиеся фолликулы.Несмотря на многократную промывку, ни ооциты, ни комплексы кумулус-корона не были восстановлены. Фолликулярная жидкость, проверенная на β-ХГЧ, оказалась положительной. Тщательный допрос пациента и медсестры, которая делала инъекцию ХГЧ, показал, что проблем, связанных с лекарствами или их введением, не было. Мы также решили проверить сывороточные уровни ХГЧ и Р4 и неожиданно обнаружили, что они составляют 165 мМЕ / мл и 14 нг / мл соответственно. Поскольку уровни сыворотки были удовлетворительными и находились в ожидаемом диапазоне, мы приступили к аспирации другого яичника.К сожалению, ооциты не были получены.
Второй цикл был запланирован через 4 месяца с протоколом антагонистов. На 2-й день спонтанного цикла уровни ФСГ, ЛГ, E2 и P4 составляли 6,5 МЕ / л, 4,6 МЕ / л, 37 пг / мл и 2,1 нг / мл, соответственно, с числом антральных фолликулов (AFC) 6– 8 в обоих яичниках. Стимуляцию начинали с комбинации 150 МЕ R-FSH (Recagon, Органон) и 75 МЕ HMG (Menogon, Ferring Pharmaceuticals Ltd). На 5-й день стимуляции свинцовыми фолликулами размером 13 мм и 14 мм и E2-456 пг / мл, антагонист GnRH, ганиреликс (Оргалутран, Органон) 0.25 мг п / к был добавлен, который продолжался ежедневно до дня срабатывания триггера. На 9-й день стимуляции 3 доминантными фолликулами ≥17 мм и пиковыми уровнями E2, LH и P4 1856 пг / мл, 2,4 МЕ / л и 1,01 нг / мл, соответственно, R-ХГЧ (Ovitrelle, Serono) 500 мкг был введен sc квалифицированной медсестрой и операционная была запланирована на 36 часов. TVS во время забора показал неповрежденные фолликулы в обоих яичниках, а также уровень ЛГ в день триггера был обнадеживающим. Даже при многократном промывании фолликулов обоих яичников ни кумулюсные комплексы, ни ооциты не были восстановлены.Мы были озадачены, обнаружив, что уровень ХГЧ в сыворотке составляет 154 мМЕ / мл, а P4 — 19 нг / мл, и повторяющаяся проблема заставила нас серьезно обеспокоиться, несмотря на принятие всех мер предосторожности во втором цикле.
После двух предыдущих неудачных попыток ЭКО пациент вернулся только через 2 года для третьего цикла. В этом цикле мы выбираем протокол антагониста с двойным триггером. На 2-й день уровни ФСГ, ЛГ, E2, P4 составляли 7,9 МЕ / л, 3,5 МЕ / л, 43 пг / мл, 1,9 нг / мл соответственно с AFC 5–6 в каждом яичнике. Стимуляцию яичников начинали с R-FSH, (Gonal F, Serono) 225 МЕ.На 6 день стимуляции свинцовым фолликулом размером 13 мм и остальными фолликулами размером от 9 до 11 мм с E2-301 пг / мл, рекомбинантным LH, Luveris (Serono) 75 МЕ вместе с Gonal F 150 IU и антагонистом GnRH, и Добавляли ганиреликс (Оргалутран, Органон) 0,25 мг подкожно, что продолжали ежедневно до дня триггера. На 10 день стимуляции 5 свинцовыми фолликулами 17 мм и E2, LH и P4: 2415 пг / мл, 2,45 МЕ / л и 0,78 нг / мл соответственно. R-hCG (Ovitrelle, Serono) 250 мкг и трипторелин (декапептил, Ferring) 0.2 мг вводили для окончательного созревания, а OR планировалось через 36 часов. Было извлечено одиннадцать ооцитов, 10 были зрелыми, 9 оплодотворенных с помощью интрацитоплазматической инъекции и 9 дополнительно отщепились. Всего на 3-й день было доступно семь 8-клеточных эмбрионов хорошего качества, при этом два 6-клеточных эмбриона были отброшены. Четыре 8-клеточных эмбриона хорошего качества культивировали до бластоцисты, а оставшиеся 3–8-клеточные эмбрионы хорошего качества замораживали на 3-й день. Две бластоцисты хорошего качества (311, 211) были перенесены на 5-й день. Лютеиновая фаза поддерживалась микронизированным прогестероном 400. мг вагинально два раза в день и три дозы ХГЧ по 2000 МЕ каждые 3 дня со дня переноса эмбриона.Уровень β-ХГЧ в сыворотке крови через 2 недели составил 426 мМЕ / л, а TVS через 6+ недель показал единственного живого внутриутробного плода.
Пациентка благополучно пережила первый триместр. Добавки для щитовидной железы были изменены в соответствии с потребностью в беременности и контролировались с помощью уровней ТТГ и свободного Т4. Во втором триместре у нее развился гестационный диабет, и ей начали принимать инсулин. Плановое кесарево сечение было выполнено на 38 неделе беременности, когда родилась девочка весом 3,1 кг без осложнений во внутри- и послеродовом периоде.
ОБСУЖДЕНИЕ
EFS впервые было сообщено Coulam et al . в 1986 г. [5] Частота EFS оценивается в 0,6–7%, [6,7] 2–7%, [4] и 0,5–2% [4,8,9] циклов ЭКО. Неудачная OR не связана с режимом стимуляции [4], поскольку это явление наблюдается как в естественных, так и в стимулированных циклах [10] и почти во всех циклах ЭКО, поскольку выход ооцитов редко достигает 100%. Однако эта терминология обычно используется для обозначения полной невозможности получить какие-либо ооциты.[11] Этиология EFS многогранна, и как предполагал Бустилло, этому способствуют как процедурные факторы, так и дисфункция яичников. [2]
FEFS определяется как состояние, при котором не извлекаются ооциты в присутствии низкого уровня β-ХГЧ из-за человеческих ошибок [12] или фармацевтических проблем [12] или из-за снижения биодоступности ХГЧ [11]. Действительно, EFS был описан как «синдром фармацевтической промышленности» [8] и составляет около 67% случаев. [11]
GEFS предположительно связан с внутренней дисфункцией яичников [10], и были предложены различные гипотезы, которые включают: (1) Дисфункциональный фолликулогенез или преждевременный апоптоз ооцитов, которые все еще продолжали рост фолликулов.[4,13] (2) Нарушение функции клеток гранулезы. [10] (3) Нарушение развития и созревания ооцитов. [14] В некоторых случаях причиной могут быть аномальные ооциты, такие как незрелые ооциты, свободные от зоны или у которых зона отсутствует в ооцитах [14]. (4) Сильное прикрепление комплексов кумулюсных клеток к фолликулярной стенке. (5) Дисфункциональная индукция овуляции. (6) В редких случаях фолликулам может потребоваться более длительное воздействие ХГЧ, чтобы подвергнуться расширению кумулюса и отделиться от стенки фолликула. [8,9] (7) Биологические нарушения в снабжении зрелыми ооцитами.[7] (8) Генетические факторы (а) Мутации рецептора ЛГ / ХГЧ. [15] (б) измененная экспрессия генов, регулирующих распространение кучевых облаков. (c) Измененная экспрессия генов, участвующих в клеточных процессах и апоптозе, приводящая к увеличению экспрессии апоптотических генов и снижению транскриптов с потерей ооцитов во время позднего фолликулогенеза из-за апоптоза. (d) Перицентрическая инверсия хромосомы 2. [15] (9) Ускоренное старение яичников [4] за счет изменения фолликулогенеза, которое рассматривается как фактор риска рецидива EFS.[10]
К различным причинам FEFS относятся: (1) Причины, связанные с лекарственными препаратами, из-за отклонения в вивобиологической активности некоторых серий коммерчески доступных препаратов ХГЧ в моче. [8] (2) Человеческие ошибки — неправильное время, прием и дозировка ХГЧ. [7,8,9] (3) Низкая биодоступность, вызванная изменением абсорбции или клиренса ХГЧ с некоторыми партиями ХГЧ с мочой. [8,12] (4) Фармакологические проблемы. [7] (5) Изменение порога фолликулярной реакции на ХГЧ.(6) Изменение времени, необходимого от воздействия ХГЧ до созревания комплексов ооцит-кумулюс. (7) Быстрое разложение продуктов, содержащих десиалилированный ХГЧ, печенью, что приводит к отсутствию воздействия биологически активного ХГЧ. [8] (8) Как и в случае с любым другим метаболическим процессом, люди различаются по скорости клиренса ХГЧ, а некоторые могут довольно быстро метаболизировать ХГЧ.
В вспомогательных репродуктивных технологиях (ВРТ) на протяжении десятилетий болюс ХГЧ обычно используется в качестве суррогата выброса ЛГ в середине цикла, поскольку его действие аналогично действию эндогенного ЛГ.Всплеск ЛГ инициирует каскад событий, приводящих к слизистым клеткам кумулюса, способствуя отслоению ооцит-кумулюсного комплекса от стенки фолликула, возобновлению мейоза с экструзией первого полярного тельца и последующей овуляцией. [16] Пороговая амплитуда для определения всплеска ЛГ все еще является предметом дискуссий, но обычно сообщается об уровнях более 10 МЕ / л, хотя удвоение базального уровня могло бы быть более подходящим определением, особенно для пациентов с высокими базальными уровнями ЛГ.[12] Концентрация ЛГ должна поддерживаться выше порогового значения в течение 14–27 часов, чтобы обеспечить максимальное созревание ооцитов с получением ооцитов в метафазе II в течение 28–38 часов после начала выброса ЛГ. [12] Таким образом, легко понять те случаи EFS, которые возникают из-за неправильных методов. В таких случаях повторный ХГЧ из другой партии или использование R-ХГЧ с OR, запланированным на 24 часа, [4], 36 часов [9] позже, приведет к получению зрелых ооцитов из интактного яичника. [4,10] Таким образом, он Для клинициста важно различать два типа EFS, и если FEFS был идентифицирован, следует использовать протокол спасения, чтобы спасти цикл.Пациенты GEFS вряд ли отреагируют на протокол спасения. FEFS не должен повторяться, при условии соблюдения осторожности, чтобы свести к минимуму его повторение в последующих циклах. [2]
Оптимальные сывороточные концентрации ХГЧ для прогнозирования EFS и успешный выход зрелых ооцитов до сих пор не определены однозначно. Различные авторы сообщают о различных уровнях сывороточного β-ХГЧ в качестве порогового значения в день OR; 106 мМЕ / мл, [17] 40 мМЕ / мл, [11] 100 мМЕ / мл, [8] и 98–161 МЕ / л. [18] Уровень ХГЧ в сыворотке <10 мМЕ / мл по данным Ndukwe et al .может предсказать EFS с чувствительностью и специфичностью 100%. [12] Дрисколл и др. . сообщили о средней концентрации ХГЧ в сыворотке 117,1 МЕ / л (диапазон: 48–249) после 250 мкг R-hCG и 83,6 МЕ / л (диапазон: 32–99) с 5000 МЕ ХГЧ в моче [19] благодаря иммуноанализам, используемым для измерить сывороточный ХГЧ. ХГЧ в моче может содержать диссоциированные и окисленные субъединицы, которые могут быть обнаружены с помощью иммуноанализа, но могут не иметь биологической активности. R-hCG из-за отсутствия примесных белков в моче и строгих стандартов, применяемых в процессе производства, может позволить более точно предсказать риск неудачного ИЛИ.[19]
Различные стратегии, предлагаемые для предотвращения возникновения EFS в последующем цикле АРТ: (1) Изменение партии ХГЧ. [7,9,12] (2) Использование R-hCG для запуска эндогенного выброса ЛГ. . R-hCG с его высокой чистотой (≥99%) и консистенцией между партиями может быть лучшим выбором, чем мочевой hCG, который содержит различные белки мочи и на биологическую активность которого могут влиять отсутствующие пептидные связи и изменения профиля гликозилирования. . [19] (3) переход от протокола агониста к протоколу антагониста.[11] (4) Использование рекомбинантного ЛГ в качестве триггера. (5) Использование GnRHa в качестве триггера в антагонистическом цикле. (6) Увеличение интервала между триггером овуляции и OPU. Droesch и др. . сообщили, что получение ооцитов через 35–36 часов превосходит получение ооцитов через <24 часов [20].
В нашем отчете о клиническом случае уровни ХГЧ и прогестерона в сыворотке подтверждали правильное время введения дозы R-ХГЧ в обоих циклах ЭКО. В день операции уровень β-ХГЧ в сыворотке крови в первом и втором циклах ЭКО составлял 165 мМЕ / мл и 154 мМЕ / мл соответственно.Поскольку пороговые значения β-ХГЧ в день OR были гарантированными и соответствовали уровням, указанным выше различными авторами, мы не сочли необходимым повторно вводить GnRHa в качестве триггера.
В обоих циклах ЭКО фолликулометрия показала хорошее фолликулярное развитие и нормальный стероидогенез. В день триггера уровни ЛГ и Р4 в первом и втором циклах составляли 1,9 МЕ / л, Р4-0,2 нг / мл и ЛГ = 2,4 МЕ / л, Р4 = 1,01 нг / мл соответственно. Кроме того, сонография в день забора ооцитов выявила интактные фолликулы в обоих циклах с обеспечением пиковых уровней ЛГ, исключающих преждевременный выброс ЛГ и овуляцию как причину EFS.
Нашей пациентке было 32 года с первичным бесплодием, которое, по-видимому, является типичным профилем в этих случаях, как описано Levran et al . [21] Ее тесты яичникового резерва были в пределах нормы, что опровергает гипотезу о старении яичников как о старении яичников. потенциальная причина состояния. У нее было необъяснимое бесплодие, и в первоначальном отчете Coulam et al . всем пациенткам был поставлен диагноз необъяснимого бесплодия, где авторы предположили, что EFS сама может быть причиной бесплодия.[5] Однако более поздние исследования показали, что EFS может возникать при различных категориях бесплодия. [10] Стивенсон и Лашен показали, что около 41% пар GEFS имели бесплодие по мужскому фактору, что указывает на то, что у большинства женщин, испытавших EFS, не было потенциальной основной патологии. [11]
У пациентов с EFS измененный стероидный профиль считается признаком дисфункциональной индукции овуляции. [13] Фолликулярная жидкость у этих пациентов показала высокий уровень эстрадиола (E2) и андростендиона с низким уровнем прогестерона.Напротив, Zreik et al . сообщили о низких уровнях концентрации эстрадиола из-за нарушения функции и / или метаболизма гранулезных клеток [11]. В нашем случае пиковые концентрации E2 и P4 в первом и втором циклах ЭКО составили: E2-2011 пг / мл; P4-0,2 нг / мл и E2-1856 пг / мл; и P4–1,01 нг / мл, соответственно, без каких-либо явных изменений, о которых сообщают несколько авторов.
Мы пришли к выводу, что это случай GEFS, и вероятная причина была в комплексе кумулюс-ооцит. Следовательно, можно предположить, что более физиологическая индукция окончательного созревания фолликулов с естественной активностью ЛГ и ФСГ непосредственно из гипофиза и с точки зрения продолжительности выброса гонадотропинов может оптимизировать механизмы передачи сигналов от окружающих кучевых облаков и ооцита, что приводит к адекватному OR и созревание.[22] Это может быть достигнуто за счет использования GnRHa в качестве триггера в циклах антагонистов GnRH, при этом одновременная индукция всплеска ФСГ является дополнительным преимуществом, напоминающим естественный цикл. Этот выброс ФСГ вызывает образование рецептора ЛГ в лютеинизирующих клетках гранулезы, способствует созреванию ядер ооцитов и расширению кумулюса, открывает щелевые соединения между ооцитами и кумулюсными клетками, которые важны в сигнальных путях, позволяя ооцит-кумулюсной клеточной массе отделяться от стенки фолликула. перед овуляцией.Это может объяснить, почему в некоторых исследованиях сообщается об извлечении более зрелых ооцитов после триггера ГнРГ по сравнению с триггером ХГЧ. Всплеск ФСГ и прямое действие агониста на рецептор гонадолиберина в яичниках могут объяснить благоприятные результаты у нашей пациентки.
Мы можем предположить, что один только триггер GnRHa в третьем цикле мог привести к адекватному созреванию ооцитов и, возможно, предотвратить EFS. Мы решили использовать двойной триггер, чтобы имитировать физиологический всплеск ФСГ и ЛГ, и в то же время добавление ХГЧ повысило активность ЛГ для лютеиновой поддержки, чтобы противодействовать лютеолитическому эффекту, наблюдаемому после триггера ГнРГ, «спасая» недостаточность лютеиновой фазы для успешный исход.[23]
У пациентов с пустым циклом EFS следует рассматривать как пограничную форму плохой реакции на стимуляцию яичников и может быть повторяющимся событием. Если EFS произошел один раз, риск рецидива составляет 20%. [10] С возрастом риск рецидива увеличивается и составляет около 24% для пациентов в возрасте от 35 до 39 лет, тогда как для пациентов старше 40 лет он составляет около 57%. [10] В этой подгруппе населения пустой цикл может быть хорошим предиктором того, что последующий стимулированный цикл будет неблагоприятным, и таких пациентов необходимо проконсультировать относительно риска рецидива и может помочь донорство ооцитов.
Относительно небольшой риск GEFS и еще меньший риск рецидива указывают на то, что это случайное явление, а не постоянное патофизиологическое состояние [4], как это очевидно в нашем случае.
Также нельзя исключить, что 2 года, прошедшие между предыдущими неудачами лечения и успешным лечением, могли повлиять на результат. Таким образом, EFS может быть самоограничивающим явлением, и в большинстве случаев оно происходит спорадически. [4] Если EFS встречался в предыдущих циклах, различные методы лечения ЭКО в последующих циклах, такие как использование двойного триггера с использованием GnRHa и hCG, могли бы модулировать ответ с успешным восстановлением ооцитов, беременностью и донорскими родами, как доказано в нашем случае.
Это также первый случай, когда комбинация GnRHa и R-hCG была использована в качестве триггера для лечения GEFS, тем самым добавив новый вариант лечения в арсенал этого необычного, но тревожного и сложного состояния.
Финансовая поддержка и спонсорство
Нет.
Конфликт интересов
Конфликта интересов нет.
ССЫЛКИ
1. Дрисколл Г.Л., Тайлер Дж. П., Найт, округ Колумбия, Кук С., Кайм Л., Кларк Л. и др. Неспособность собрать ооциты в вспомогательных репродуктивных технологиях: ретроспектива.Hum Reprod. 1998. 13: 84–7. [PubMed] [Google Scholar] 2. Бустилло М. Неудачное извлечение ооцитов: технический артефакт или настоящий «синдром пустого фолликула»? Репродукция Биомед онлайн. 2004. 8: 59–67. [PubMed] [Google Scholar] 3. Бек-Фрухтер Р., Вайс А., Лави М., Геслевич Ю., Шалев Е. Синдром пустого фолликула: успешное лечение в рецидивирующем случае и обзор литературы. Hum Reprod. 2012; 27: 1357–67. [PubMed] [Google Scholar] 4. Бен-Шломо И., Шифф Е., Левран Д., Бен-Рафаэль З., Машиах С., Дор Дж. Неудача при извлечении ооцитов во время оплодотворения in vitro : спорадическое событие, а не синдром.Fertil Steril. 1991; 55: 324–7. [PubMed] [Google Scholar] 5. Coulam CB, Bustillo M, Schulman JD. Синдром пустого фолликула. Fertil Steril. 1986; 46: 1153–5. [PubMed] [Google Scholar] 6. Халаф Y, Амин Y, Андерсон Х. Несоответствующее время введения ХГЧ: предотвратимая причина синдрома пустого фолликула при оплодотворении in vitro . Ближний Восток Fertil Soc J. 1999; 4: 254–6. [Google Scholar] 7. Awonuga A, Govindbhai J, Zierke S, Schnauffer K. Продолжение дискуссии о синдроме пустого фолликула: может ли он быть связан с нормальной биодоступностью бета-хорионического гонадотропина человека в день восстановления ооцитов? Hum Reprod.1998; 13: 1281–4. [PubMed] [Google Scholar] 8. Зегерс-Хохшильд Ф., Фернандес Э., Маккенна А., Фабрес С., Алтьери Э., Лопес Т. Синдром пустого фолликула: синдром фармацевтической промышленности. Hum Reprod. 1995; 10: 2262–5. [PubMed] [Google Scholar] 9. Квинтанс CJ, Дональдсон MJ, Бланко Л.А., Паскуалини RS. Синдром пустого фолликула из-за человеческой ошибки: его появление в программе оплодотворения in vitro . Hum Reprod. 1998. 13: 2703–5. [PubMed] [Google Scholar] 10. Зрейк Т.Г., Гарсиа-Веласко Дж.А., Вергара Т.М., Ариси А., Олив Д., Джонс Э.Синдром пустого фолликула: доказательства рецидива. Hum Reprod. 2000; 15: 999–1002. [PubMed] [Google Scholar] 11. Стивенсон Т.Л., Лашен Х. Синдром пустого фолликула: реальность противоречивого синдрома, систематический обзор. Fertil Steril. 2008; 90: 691–8. [PubMed] [Google Scholar] 12. Ндукве Г., Торнтон С., Фишел С., Доуэлл К., Алум М., Грин С. Лечение синдрома пустого фолликула. Hum Reprod. 1997; 12: 21–3. [PubMed] [Google Scholar] 13. Цуйки А., Роуз Б.И., Хунг Т.Т. Стероидные профили фолликулярной жидкости пациента с синдромом пустого фолликула.Fertil Steril. 1988. 49: 104–107. [PubMed] [Google Scholar] 14. Inan MS, Al-Hassan S, Ozand P, Coskun S. Транскрипционное профилирование гранулезных клеток пациента с синдромом рецидивирующего пустого фолликула. Репродукция Биомед онлайн. 2006; 13: 481–91. [PubMed] [Google Scholar] 15. Onalan G, Pabuçcu R, Onalan R, Ceylaner S, Selam B. Синдром пустого фолликула у двух сестер с тремя циклами: отчет о болезни. Hum Reprod. 2003; 18: 1864–7. [PubMed] [Google Scholar] 16. Сейбел М.М., Смит Д.М., Левеск Л., Бортен М., Таймор М.Л.Временная зависимость между выбросом лютеинизирующего гормона и созреванием ооцитов человека. Am J Obstet Gynecol. 1982; 142: 568–72. [PubMed] [Google Scholar] 17. Ндукве Г., Торнтон С., Фишел С., Доуэлл К., аль-Хассан С., Хантер А. Прогнозирование синдрома пустого фолликула. Fertil Steril. 1996; 66: 845–7. [PubMed] [Google Scholar] 18. Актас М., Бекерс Н.Г., Ван Инзен В.Г., Верхофф А., де Йонг Д. Ооциты в пустом фолликуле: противоречивый синдром. Fertil Steril. 2005; 84: 1643–8. [PubMed] [Google Scholar] 19. Дрисколл Г.Л., Тайлер Дж. П., Ханган Дж. Т., Фишер ПР, Бердсолл, Массачусетс, Найт, округ Колумбия.Проспективное, рандомизированное, контролируемое, двойное слепое, двойное фиктивное сравнение рекомбинантного и мочевого ХГЧ для индукции созревания ооцитов и лютеинизации фолликулов при стимуляции яичников. Hum Reprod. 2000; 15: 1305–10. [PubMed] [Google Scholar] 20. Дроеш К., Муашер С.Дж., Крайнер Д., Джонс Г.С., Акоста А.А., Розенвакс З. Сроки извлечения ооцитов в циклах со спонтанным выбросом лютеинизирующего гормона в большой программе оплодотворения in vitro . Fertil Steril. 1988. 50: 451–6. [PubMed] [Google Scholar] 21.Левран Д., Фархи Дж., Наум Х., Глезерман М., Вайсман А. Остановка созревания человеческих ооцитов как причина бесплодия: отчет о болезни. Hum Reprod. 2002; 17: 1604–9. [PubMed] [Google Scholar] 22. Кастильо Дж. К., Гарсия-Веласко Дж., Хумайдан П. Синдром пустого фолликула после запуска ГнРГ по сравнению с запуском ХГЧ в COS. J Assist Reprod Genet. 2012; 29: 249–53. [Бесплатная статья PMC] [PubMed] [Google Scholar] 23. Хумайдан П. Восстановление лютеиновой фазы у пациентов с высоким риском СГЯ за счет запуска гонадолиберина в сочетании с низкими дозами ХГЧ: пилотное исследование.Репродукция Биомед онлайн. 2009; 18: 630–4. [PubMed] [Google Scholar]
Успешная беременность после двойного триггера
J Hum Reprod Sci. 2015 июль-сентябрь; 8 (3): 170–174.
K. Deepika
Отделение репродуктивной медицины, Милан — Центр репродуктивной медицины, Бангалор, Карнатака, Индия
Суварна Ратхор
Отделение репродуктивной медицины, Милан — Центр репродуктивной медицины, Бангалор, Карнатака, Индия
Нупур Гарг
Отделение репродуктивной медицины, Милан — Центр репродуктивной медицины, Бангалор, Карнатака, Индия
Камини Рао
Отделение репродуктивной медицины, Милан — Центр репродуктивной медицины, Бангалор, Карнатака, Индия
Отделение репродуктивной медицины, Милан — Фертильность Center, Бангалор, Карнатака, Индия
Адрес для корреспонденции: Dr.К. Дипика, Отделение репродуктивной медицины, Милан — Центр фертильности, № 6/7, Кумара Крупа Роуд, Хай Граундс, Бангалор — 560 001, Карнатака, Индия. E-mail: moc.liamg@akipidkrd
Поступила 25 мая 2015 г .; Пересмотрено 30 июня 2015 г .; Принято 10 июля 2015 г.
Авторские права: © Journal of Human Reproductive Sciences
Это статья в открытом доступе, распространяемая в соответствии с условиями лицензии Creative Commons Attribution-NonCommercial-ShareAlike 3.0, которая позволяет другим редактировать, настраивать и развивать работу некоммерчески, при условии, что автор указан и новые творения лицензируются на идентичных условиях.
Эта статья цитируется в других статьях в PMC.
Abstract
Синдром пустого фолликула (EFS) — это редкое, но неприятное осложнение вспомогательных репродуктивных технологий с невозможностью получить ооциты после адекватного ответа яичников на стимуляцию. Большинство зарегистрированных случаев EFS — это проблемы, связанные с наркотиками, которых можно избежать и которые не представляют собой какой-либо потенциальной патологии, и что риск подлинного EFS (GEFS) намного меньше, чем когда-то считалось. Наш случай является первым сообщением о беременности, полученным после лечения GEFS с двойным триггером цикла антагонистов гонадотропин-рилизинг-гормона (GnRH).В этом отчете мы представляем пациента, у которого было выполнено два извлечения ооцитов, у которых не было получено ни одного ооцита. В третьем цикле оплодотворения in vitro двойной триггер с комбинацией агониста GnRH и хорионического гонадотропина человека дал 11 ооцитов, что привело к переносу 2 бластоцист, что привело к рождению живого ребенка. Изменение протокола лечения с двойным триггером привело к успешному результату.
КЛЮЧЕВЫЕ СЛОВА: Двойной триггер, синдром пустого фолликула, синдром подлинного пустого фолликула, антагонист гонадотропин-рилизинг-гормона
ВВЕДЕНИЕ
Синдром пустого фолликула (EFS), широко обсуждаемый загадочный синдром, раздражает и вызывает серьезное беспокойство. как для врача, так и для пациента.[1] EFS определяется как состояние, при котором ооциты не извлекаются из зрелых фолликулов яичников после индукции овуляции в цикле оплодотворения in vitro (ЭКО) с очевидным нормальным фолликулогенезом и стероидогенезом, несмотря на тщательную аспирацию и промывание фолликулов. Его нельзя предсказать по типу реакции яичников на стимуляцию, ни сонографически, ни гормонально. Следовательно, диагноз EFS является ретроспективным. Ввиду неопределенности причин этого явления и растущего числа доказательств того, что в некоторых случаях ооциты можно успешно извлечь, термин EFS считается неуместным; но все еще используется в современной медицинской литературе.[2]
EFS подразделяется на два типа: «подлинный EFS» (GEFS) и «ложный» EFS (FEFS). Распространенность ГЭФС составляет 0–1,1% [3]. GEFS определяется как неспособность получить ооциты из явно нормальных растущих фолликулов яичников после стимуляции в циклах ЭКО нормальными уровнями эстрадиола и соответствующими уровнями бета-хорионического гонадотропина человека (β-ХГЧ) в сыворотке крови в день получения ооцитов (OR). Механизм, лежащий в основе GEFS, остается неясным, все еще подвергая сомнению сомнительное существование этого синдрома как отдельной клинической единицы.[4] Здесь мы сообщаем о случае GEFS, которым удалось успешно управлять с помощью двойного триггера.
ОТЧЕТ О ПРАКТИКЕ
Пара с шестилетним первичным бесплодием была направлена в наш центр репродуктивного здоровья по поводу бесплодия необъяснимой природы. Женщине было 32 года с нормальным менструальным циклом, известным случаем гипотиреоза, и она получала тироксин 50 мкг в день. Ее старшая сестра также страдала необъяснимым бесплодием, она перенесла три цикла ЭКО в другом месте с извлечением только 1-2 незрелых ооцитов во всех циклах, и ей посоветовали донорские ооциты.При физикальном обследовании не было замечено ни прыщей, ни гирсутизма, индекс массы тела 22 кг / м 2 . Сонография органов малого таза была нормальной, и все ее исходные исследования были в пределах нормы: фолликулостимулирующий гормон (ФСГ) -7,5 МЕ / л, антимюллеров гормон — 2,9 нг / мл и пролактин-17 нг / мл. Ее тиреотропный гормон (ТТГ) составлял 6,6 мкМЕ / мл, при этом ее тироксин был повышен до 75 мкг / день с повторным уровнем ТТГ через 6 недель до 1,9 мкМЕ / мл. Диагностическая гистеролапароскопия в норме.Мужу пациентки 38 лет, анализ спермы нормальный (общее количество — 69 млн / мл, общая подвижность — 68%, нормальные формы — 35%) и нормальный индекс фрагментации ДНК.
Поскольку пациентка не забеременела в четырех циклах внутриматочной инсеминации, ЭКО было запланировано с использованием длительного протокола лютеиновых агонистов. Двойное подавление было достигнуто с помощью пероральных противозачаточных таблеток, которые начинали с 5 дня предыдущего менструального цикла, и агониста гонадотропин-рилизинг-гормона (GnRHa) (Lupride, Sun Pharmaceutical Ltd.,) 0,25 мг подкожно (п / к) два раза в день, начиная с 21 дня, после того как трансвагинальная сонография подтвердила отсутствие кист. На 2 день цикла, после подтверждения подавления: (эстрадиол [E2] -41 пг / мл, лютеинизирующий гормон [LH] -1,1 МЕ / л, прогестерон [P4] -0,1 нг / мл) была начата стимуляция яичников рекомбинантным ФСГ. (R-FSH), (Recagon, Organon) 150 МЕ подкожно ежедневно и GnRHa 0,25 мг один раз в день продолжали до дня триггера. На 5 день стимуляции 8 фолликулами размером от 7 до 11 мм и E2-230 пг / мл, 75 МЕ менопаузального гонадотропина человека (HMG) (Reprogon, Ferring Pharmaceuticals Ltd.,) был добавлен к рекагону 150 МЕ. На 10 день стимуляции 4 доминантными фолликулами ≥17 мм, толщиной эндометрия 9,8 мм с E2-2011 пг / мл, LH-1,9 МЕ / л и P4-0,2 нг / мл. Рекомбинантный ХГЧ (R-hCG) (Ovitrelle, Serono) 250 мкг вводили в качестве триггера и назначили операцию на 35 часов. Перед началом сбора ооцитов трансвагинальное сканирование (TVS) показало наличие интактных фолликулов в обоих яичниках. После аспирации зрелых фолликулов из правого яичника, поскольку фолликулярная жидкость в первых трех пробирках не показала никаких признаков гранулезных клеток или ооцитов, мы решили промыть оставшиеся фолликулы.Несмотря на многократную промывку, ни ооциты, ни комплексы кумулус-корона не были восстановлены. Фолликулярная жидкость, проверенная на β-ХГЧ, оказалась положительной. Тщательный допрос пациента и медсестры, которая делала инъекцию ХГЧ, показал, что проблем, связанных с лекарствами или их введением, не было. Мы также решили проверить сывороточные уровни ХГЧ и Р4 и неожиданно обнаружили, что они составляют 165 мМЕ / мл и 14 нг / мл соответственно. Поскольку уровни сыворотки были удовлетворительными и находились в ожидаемом диапазоне, мы приступили к аспирации другого яичника.К сожалению, ооциты не были получены.
Второй цикл был запланирован через 4 месяца с протоколом антагонистов. На 2-й день спонтанного цикла уровни ФСГ, ЛГ, E2 и P4 составляли 6,5 МЕ / л, 4,6 МЕ / л, 37 пг / мл и 2,1 нг / мл, соответственно, с числом антральных фолликулов (AFC) 6– 8 в обоих яичниках. Стимуляцию начинали с комбинации 150 МЕ R-FSH (Recagon, Органон) и 75 МЕ HMG (Menogon, Ferring Pharmaceuticals Ltd). На 5-й день стимуляции свинцовыми фолликулами размером 13 мм и 14 мм и E2-456 пг / мл, антагонист GnRH, ганиреликс (Оргалутран, Органон) 0.25 мг п / к был добавлен, который продолжался ежедневно до дня срабатывания триггера. На 9-й день стимуляции 3 доминантными фолликулами ≥17 мм и пиковыми уровнями E2, LH и P4 1856 пг / мл, 2,4 МЕ / л и 1,01 нг / мл, соответственно, R-ХГЧ (Ovitrelle, Serono) 500 мкг был введен sc квалифицированной медсестрой и операционная была запланирована на 36 часов. TVS во время забора показал неповрежденные фолликулы в обоих яичниках, а также уровень ЛГ в день триггера был обнадеживающим. Даже при многократном промывании фолликулов обоих яичников ни кумулюсные комплексы, ни ооциты не были восстановлены.Мы были озадачены, обнаружив, что уровень ХГЧ в сыворотке составляет 154 мМЕ / мл, а P4 — 19 нг / мл, и повторяющаяся проблема заставила нас серьезно обеспокоиться, несмотря на принятие всех мер предосторожности во втором цикле.
После двух предыдущих неудачных попыток ЭКО пациент вернулся только через 2 года для третьего цикла. В этом цикле мы выбираем протокол антагониста с двойным триггером. На 2-й день уровни ФСГ, ЛГ, E2, P4 составляли 7,9 МЕ / л, 3,5 МЕ / л, 43 пг / мл, 1,9 нг / мл соответственно с AFC 5–6 в каждом яичнике. Стимуляцию яичников начинали с R-FSH, (Gonal F, Serono) 225 МЕ.На 6 день стимуляции свинцовым фолликулом размером 13 мм и остальными фолликулами размером от 9 до 11 мм с E2-301 пг / мл, рекомбинантным LH, Luveris (Serono) 75 МЕ вместе с Gonal F 150 IU и антагонистом GnRH, и Добавляли ганиреликс (Оргалутран, Органон) 0,25 мг подкожно, что продолжали ежедневно до дня триггера. На 10 день стимуляции 5 свинцовыми фолликулами 17 мм и E2, LH и P4: 2415 пг / мл, 2,45 МЕ / л и 0,78 нг / мл соответственно. R-hCG (Ovitrelle, Serono) 250 мкг и трипторелин (декапептил, Ferring) 0.2 мг вводили для окончательного созревания, а OR планировалось через 36 часов. Было извлечено одиннадцать ооцитов, 10 были зрелыми, 9 оплодотворенных с помощью интрацитоплазматической инъекции и 9 дополнительно отщепились. Всего на 3-й день было доступно семь 8-клеточных эмбрионов хорошего качества, при этом два 6-клеточных эмбриона были отброшены. Четыре 8-клеточных эмбриона хорошего качества культивировали до бластоцисты, а оставшиеся 3–8-клеточные эмбрионы хорошего качества замораживали на 3-й день. Две бластоцисты хорошего качества (311, 211) были перенесены на 5-й день. Лютеиновая фаза поддерживалась микронизированным прогестероном 400. мг вагинально два раза в день и три дозы ХГЧ по 2000 МЕ каждые 3 дня со дня переноса эмбриона.Уровень β-ХГЧ в сыворотке крови через 2 недели составил 426 мМЕ / л, а TVS через 6+ недель показал единственного живого внутриутробного плода.
Пациентка благополучно пережила первый триместр. Добавки для щитовидной железы были изменены в соответствии с потребностью в беременности и контролировались с помощью уровней ТТГ и свободного Т4. Во втором триместре у нее развился гестационный диабет, и ей начали принимать инсулин. Плановое кесарево сечение было выполнено на 38 неделе беременности, когда родилась девочка весом 3,1 кг без осложнений во внутри- и послеродовом периоде.
ОБСУЖДЕНИЕ
EFS впервые было сообщено Coulam et al . в 1986 г. [5] Частота EFS оценивается в 0,6–7%, [6,7] 2–7%, [4] и 0,5–2% [4,8,9] циклов ЭКО. Неудачная OR не связана с режимом стимуляции [4], поскольку это явление наблюдается как в естественных, так и в стимулированных циклах [10] и почти во всех циклах ЭКО, поскольку выход ооцитов редко достигает 100%. Однако эта терминология обычно используется для обозначения полной невозможности получить какие-либо ооциты.[11] Этиология EFS многогранна, и как предполагал Бустилло, этому способствуют как процедурные факторы, так и дисфункция яичников. [2]
FEFS определяется как состояние, при котором не извлекаются ооциты в присутствии низкого уровня β-ХГЧ из-за человеческих ошибок [12] или фармацевтических проблем [12] или из-за снижения биодоступности ХГЧ [11]. Действительно, EFS был описан как «синдром фармацевтической промышленности» [8] и составляет около 67% случаев. [11]
GEFS предположительно связан с внутренней дисфункцией яичников [10], и были предложены различные гипотезы, которые включают: (1) Дисфункциональный фолликулогенез или преждевременный апоптоз ооцитов, которые все еще продолжали рост фолликулов.[4,13] (2) Нарушение функции клеток гранулезы. [10] (3) Нарушение развития и созревания ооцитов. [14] В некоторых случаях причиной могут быть аномальные ооциты, такие как незрелые ооциты, свободные от зоны или у которых зона отсутствует в ооцитах [14]. (4) Сильное прикрепление комплексов кумулюсных клеток к фолликулярной стенке. (5) Дисфункциональная индукция овуляции. (6) В редких случаях фолликулам может потребоваться более длительное воздействие ХГЧ, чтобы подвергнуться расширению кумулюса и отделиться от стенки фолликула. [8,9] (7) Биологические нарушения в снабжении зрелыми ооцитами.[7] (8) Генетические факторы (а) Мутации рецептора ЛГ / ХГЧ. [15] (б) измененная экспрессия генов, регулирующих распространение кучевых облаков. (c) Измененная экспрессия генов, участвующих в клеточных процессах и апоптозе, приводящая к увеличению экспрессии апоптотических генов и снижению транскриптов с потерей ооцитов во время позднего фолликулогенеза из-за апоптоза. (d) Перицентрическая инверсия хромосомы 2. [15] (9) Ускоренное старение яичников [4] за счет изменения фолликулогенеза, которое рассматривается как фактор риска рецидива EFS.[10]
К различным причинам FEFS относятся: (1) Причины, связанные с лекарственными препаратами, из-за отклонения в вивобиологической активности некоторых серий коммерчески доступных препаратов ХГЧ в моче. [8] (2) Человеческие ошибки — неправильное время, прием и дозировка ХГЧ. [7,8,9] (3) Низкая биодоступность, вызванная изменением абсорбции или клиренса ХГЧ с некоторыми партиями ХГЧ с мочой. [8,12] (4) Фармакологические проблемы. [7] (5) Изменение порога фолликулярной реакции на ХГЧ.(6) Изменение времени, необходимого от воздействия ХГЧ до созревания комплексов ооцит-кумулюс. (7) Быстрое разложение продуктов, содержащих десиалилированный ХГЧ, печенью, что приводит к отсутствию воздействия биологически активного ХГЧ. [8] (8) Как и в случае с любым другим метаболическим процессом, люди различаются по скорости клиренса ХГЧ, а некоторые могут довольно быстро метаболизировать ХГЧ.
В вспомогательных репродуктивных технологиях (ВРТ) на протяжении десятилетий болюс ХГЧ обычно используется в качестве суррогата выброса ЛГ в середине цикла, поскольку его действие аналогично действию эндогенного ЛГ.Всплеск ЛГ инициирует каскад событий, приводящих к слизистым клеткам кумулюса, способствуя отслоению ооцит-кумулюсного комплекса от стенки фолликула, возобновлению мейоза с экструзией первого полярного тельца и последующей овуляцией. [16] Пороговая амплитуда для определения всплеска ЛГ все еще является предметом дискуссий, но обычно сообщается об уровнях более 10 МЕ / л, хотя удвоение базального уровня могло бы быть более подходящим определением, особенно для пациентов с высокими базальными уровнями ЛГ.[12] Концентрация ЛГ должна поддерживаться выше порогового значения в течение 14–27 часов, чтобы обеспечить максимальное созревание ооцитов с получением ооцитов в метафазе II в течение 28–38 часов после начала выброса ЛГ. [12] Таким образом, легко понять те случаи EFS, которые возникают из-за неправильных методов. В таких случаях повторный ХГЧ из другой партии или использование R-ХГЧ с OR, запланированным на 24 часа, [4], 36 часов [9] позже, приведет к получению зрелых ооцитов из интактного яичника. [4,10] Таким образом, он Для клинициста важно различать два типа EFS, и если FEFS был идентифицирован, следует использовать протокол спасения, чтобы спасти цикл.Пациенты GEFS вряд ли отреагируют на протокол спасения. FEFS не должен повторяться, при условии соблюдения осторожности, чтобы свести к минимуму его повторение в последующих циклах. [2]
Оптимальные сывороточные концентрации ХГЧ для прогнозирования EFS и успешный выход зрелых ооцитов до сих пор не определены однозначно. Различные авторы сообщают о различных уровнях сывороточного β-ХГЧ в качестве порогового значения в день OR; 106 мМЕ / мл, [17] 40 мМЕ / мл, [11] 100 мМЕ / мл, [8] и 98–161 МЕ / л. [18] Уровень ХГЧ в сыворотке <10 мМЕ / мл по данным Ndukwe et al .может предсказать EFS с чувствительностью и специфичностью 100%. [12] Дрисколл и др. . сообщили о средней концентрации ХГЧ в сыворотке 117,1 МЕ / л (диапазон: 48–249) после 250 мкг R-hCG и 83,6 МЕ / л (диапазон: 32–99) с 5000 МЕ ХГЧ в моче [19] благодаря иммуноанализам, используемым для измерить сывороточный ХГЧ. ХГЧ в моче может содержать диссоциированные и окисленные субъединицы, которые могут быть обнаружены с помощью иммуноанализа, но могут не иметь биологической активности. R-hCG из-за отсутствия примесных белков в моче и строгих стандартов, применяемых в процессе производства, может позволить более точно предсказать риск неудачного ИЛИ.[19]
Различные стратегии, предлагаемые для предотвращения возникновения EFS в последующем цикле АРТ: (1) Изменение партии ХГЧ. [7,9,12] (2) Использование R-hCG для запуска эндогенного выброса ЛГ. . R-hCG с его высокой чистотой (≥99%) и консистенцией между партиями может быть лучшим выбором, чем мочевой hCG, который содержит различные белки мочи и на биологическую активность которого могут влиять отсутствующие пептидные связи и изменения профиля гликозилирования. . [19] (3) переход от протокола агониста к протоколу антагониста.[11] (4) Использование рекомбинантного ЛГ в качестве триггера. (5) Использование GnRHa в качестве триггера в антагонистическом цикле. (6) Увеличение интервала между триггером овуляции и OPU. Droesch и др. . сообщили, что получение ооцитов через 35–36 часов превосходит получение ооцитов через <24 часов [20].
В нашем отчете о клиническом случае уровни ХГЧ и прогестерона в сыворотке подтверждали правильное время введения дозы R-ХГЧ в обоих циклах ЭКО. В день операции уровень β-ХГЧ в сыворотке крови в первом и втором циклах ЭКО составлял 165 мМЕ / мл и 154 мМЕ / мл соответственно.Поскольку пороговые значения β-ХГЧ в день OR были гарантированными и соответствовали уровням, указанным выше различными авторами, мы не сочли необходимым повторно вводить GnRHa в качестве триггера.
В обоих циклах ЭКО фолликулометрия показала хорошее фолликулярное развитие и нормальный стероидогенез. В день триггера уровни ЛГ и Р4 в первом и втором циклах составляли 1,9 МЕ / л, Р4-0,2 нг / мл и ЛГ = 2,4 МЕ / л, Р4 = 1,01 нг / мл соответственно. Кроме того, сонография в день забора ооцитов выявила интактные фолликулы в обоих циклах с обеспечением пиковых уровней ЛГ, исключающих преждевременный выброс ЛГ и овуляцию как причину EFS.
Нашей пациентке было 32 года с первичным бесплодием, которое, по-видимому, является типичным профилем в этих случаях, как описано Levran et al . [21] Ее тесты яичникового резерва были в пределах нормы, что опровергает гипотезу о старении яичников как о старении яичников. потенциальная причина состояния. У нее было необъяснимое бесплодие, и в первоначальном отчете Coulam et al . всем пациенткам был поставлен диагноз необъяснимого бесплодия, где авторы предположили, что EFS сама может быть причиной бесплодия.[5] Однако более поздние исследования показали, что EFS может возникать при различных категориях бесплодия. [10] Стивенсон и Лашен показали, что около 41% пар GEFS имели бесплодие по мужскому фактору, что указывает на то, что у большинства женщин, испытавших EFS, не было потенциальной основной патологии. [11]
У пациентов с EFS измененный стероидный профиль считается признаком дисфункциональной индукции овуляции. [13] Фолликулярная жидкость у этих пациентов показала высокий уровень эстрадиола (E2) и андростендиона с низким уровнем прогестерона.Напротив, Zreik et al . сообщили о низких уровнях концентрации эстрадиола из-за нарушения функции и / или метаболизма гранулезных клеток [11]. В нашем случае пиковые концентрации E2 и P4 в первом и втором циклах ЭКО составили: E2-2011 пг / мл; P4-0,2 нг / мл и E2-1856 пг / мл; и P4–1,01 нг / мл, соответственно, без каких-либо явных изменений, о которых сообщают несколько авторов.
Мы пришли к выводу, что это случай GEFS, и вероятная причина была в комплексе кумулюс-ооцит. Следовательно, можно предположить, что более физиологическая индукция окончательного созревания фолликулов с естественной активностью ЛГ и ФСГ непосредственно из гипофиза и с точки зрения продолжительности выброса гонадотропинов может оптимизировать механизмы передачи сигналов от окружающих кучевых облаков и ооцита, что приводит к адекватному OR и созревание.[22] Это может быть достигнуто за счет использования GnRHa в качестве триггера в циклах антагонистов GnRH, при этом одновременная индукция всплеска ФСГ является дополнительным преимуществом, напоминающим естественный цикл. Этот выброс ФСГ вызывает образование рецептора ЛГ в лютеинизирующих клетках гранулезы, способствует созреванию ядер ооцитов и расширению кумулюса, открывает щелевые соединения между ооцитами и кумулюсными клетками, которые важны в сигнальных путях, позволяя ооцит-кумулюсной клеточной массе отделяться от стенки фолликула. перед овуляцией.Это может объяснить, почему в некоторых исследованиях сообщается об извлечении более зрелых ооцитов после триггера ГнРГ по сравнению с триггером ХГЧ. Всплеск ФСГ и прямое действие агониста на рецептор гонадолиберина в яичниках могут объяснить благоприятные результаты у нашей пациентки.
Мы можем предположить, что один только триггер GnRHa в третьем цикле мог привести к адекватному созреванию ооцитов и, возможно, предотвратить EFS. Мы решили использовать двойной триггер, чтобы имитировать физиологический всплеск ФСГ и ЛГ, и в то же время добавление ХГЧ повысило активность ЛГ для лютеиновой поддержки, чтобы противодействовать лютеолитическому эффекту, наблюдаемому после триггера ГнРГ, «спасая» недостаточность лютеиновой фазы для успешный исход.[23]
У пациентов с пустым циклом EFS следует рассматривать как пограничную форму плохой реакции на стимуляцию яичников и может быть повторяющимся событием. Если EFS произошел один раз, риск рецидива составляет 20%. [10] С возрастом риск рецидива увеличивается и составляет около 24% для пациентов в возрасте от 35 до 39 лет, тогда как для пациентов старше 40 лет он составляет около 57%. [10] В этой подгруппе населения пустой цикл может быть хорошим предиктором того, что последующий стимулированный цикл будет неблагоприятным, и таких пациентов необходимо проконсультировать относительно риска рецидива и может помочь донорство ооцитов.
Относительно небольшой риск GEFS и еще меньший риск рецидива указывают на то, что это случайное явление, а не постоянное патофизиологическое состояние [4], как это очевидно в нашем случае.
Также нельзя исключить, что 2 года, прошедшие между предыдущими неудачами лечения и успешным лечением, могли повлиять на результат. Таким образом, EFS может быть самоограничивающим явлением, и в большинстве случаев оно происходит спорадически. [4] Если EFS встречался в предыдущих циклах, различные методы лечения ЭКО в последующих циклах, такие как использование двойного триггера с использованием GnRHa и hCG, могли бы модулировать ответ с успешным восстановлением ооцитов, беременностью и донорскими родами, как доказано в нашем случае.
Это также первый случай, когда комбинация GnRHa и R-hCG была использована в качестве триггера для лечения GEFS, тем самым добавив новый вариант лечения в арсенал этого необычного, но тревожного и сложного состояния.
Финансовая поддержка и спонсорство
Нет.
Конфликт интересов
Конфликта интересов нет.
ССЫЛКИ
1. Дрисколл Г.Л., Тайлер Дж. П., Найт, округ Колумбия, Кук С., Кайм Л., Кларк Л. и др. Неспособность собрать ооциты в вспомогательных репродуктивных технологиях: ретроспектива.Hum Reprod. 1998. 13: 84–7. [PubMed] [Google Scholar] 2. Бустилло М. Неудачное извлечение ооцитов: технический артефакт или настоящий «синдром пустого фолликула»? Репродукция Биомед онлайн. 2004. 8: 59–67. [PubMed] [Google Scholar] 3. Бек-Фрухтер Р., Вайс А., Лави М., Геслевич Ю., Шалев Е. Синдром пустого фолликула: успешное лечение в рецидивирующем случае и обзор литературы. Hum Reprod. 2012; 27: 1357–67. [PubMed] [Google Scholar] 4. Бен-Шломо И., Шифф Е., Левран Д., Бен-Рафаэль З., Машиах С., Дор Дж. Неудача при извлечении ооцитов во время оплодотворения in vitro : спорадическое событие, а не синдром.Fertil Steril. 1991; 55: 324–7. [PubMed] [Google Scholar] 5. Coulam CB, Bustillo M, Schulman JD. Синдром пустого фолликула. Fertil Steril. 1986; 46: 1153–5. [PubMed] [Google Scholar] 6. Халаф Y, Амин Y, Андерсон Х. Несоответствующее время введения ХГЧ: предотвратимая причина синдрома пустого фолликула при оплодотворении in vitro . Ближний Восток Fertil Soc J. 1999; 4: 254–6. [Google Scholar] 7. Awonuga A, Govindbhai J, Zierke S, Schnauffer K. Продолжение дискуссии о синдроме пустого фолликула: может ли он быть связан с нормальной биодоступностью бета-хорионического гонадотропина человека в день восстановления ооцитов? Hum Reprod.1998; 13: 1281–4. [PubMed] [Google Scholar] 8. Зегерс-Хохшильд Ф., Фернандес Э., Маккенна А., Фабрес С., Алтьери Э., Лопес Т. Синдром пустого фолликула: синдром фармацевтической промышленности. Hum Reprod. 1995; 10: 2262–5. [PubMed] [Google Scholar] 9. Квинтанс CJ, Дональдсон MJ, Бланко Л.А., Паскуалини RS. Синдром пустого фолликула из-за человеческой ошибки: его появление в программе оплодотворения in vitro . Hum Reprod. 1998. 13: 2703–5. [PubMed] [Google Scholar] 10. Зрейк Т.Г., Гарсиа-Веласко Дж.А., Вергара Т.М., Ариси А., Олив Д., Джонс Э.Синдром пустого фолликула: доказательства рецидива. Hum Reprod. 2000; 15: 999–1002. [PubMed] [Google Scholar] 11. Стивенсон Т.Л., Лашен Х. Синдром пустого фолликула: реальность противоречивого синдрома, систематический обзор. Fertil Steril. 2008; 90: 691–8. [PubMed] [Google Scholar] 12. Ндукве Г., Торнтон С., Фишел С., Доуэлл К., Алум М., Грин С. Лечение синдрома пустого фолликула. Hum Reprod. 1997; 12: 21–3. [PubMed] [Google Scholar] 13. Цуйки А., Роуз Б.И., Хунг Т.Т. Стероидные профили фолликулярной жидкости пациента с синдромом пустого фолликула.Fertil Steril. 1988. 49: 104–107. [PubMed] [Google Scholar] 14. Inan MS, Al-Hassan S, Ozand P, Coskun S. Транскрипционное профилирование гранулезных клеток пациента с синдромом рецидивирующего пустого фолликула. Репродукция Биомед онлайн. 2006; 13: 481–91. [PubMed] [Google Scholar] 15. Onalan G, Pabuçcu R, Onalan R, Ceylaner S, Selam B. Синдром пустого фолликула у двух сестер с тремя циклами: отчет о болезни. Hum Reprod. 2003; 18: 1864–7. [PubMed] [Google Scholar] 16. Сейбел М.М., Смит Д.М., Левеск Л., Бортен М., Таймор М.Л.Временная зависимость между выбросом лютеинизирующего гормона и созреванием ооцитов человека. Am J Obstet Gynecol. 1982; 142: 568–72. [PubMed] [Google Scholar] 17. Ндукве Г., Торнтон С., Фишел С., Доуэлл К., аль-Хассан С., Хантер А. Прогнозирование синдрома пустого фолликула. Fertil Steril. 1996; 66: 845–7. [PubMed] [Google Scholar] 18. Актас М., Бекерс Н.Г., Ван Инзен В.Г., Верхофф А., де Йонг Д. Ооциты в пустом фолликуле: противоречивый синдром. Fertil Steril. 2005; 84: 1643–8. [PubMed] [Google Scholar] 19. Дрисколл Г.Л., Тайлер Дж. П., Ханган Дж. Т., Фишер ПР, Бердсолл, Массачусетс, Найт, округ Колумбия.Проспективное, рандомизированное, контролируемое, двойное слепое, двойное фиктивное сравнение рекомбинантного и мочевого ХГЧ для индукции созревания ооцитов и лютеинизации фолликулов при стимуляции яичников. Hum Reprod. 2000; 15: 1305–10. [PubMed] [Google Scholar] 20. Дроеш К., Муашер С.Дж., Крайнер Д., Джонс Г.С., Акоста А.А., Розенвакс З. Сроки извлечения ооцитов в циклах со спонтанным выбросом лютеинизирующего гормона в большой программе оплодотворения in vitro . Fertil Steril. 1988. 50: 451–6. [PubMed] [Google Scholar] 21.Левран Д., Фархи Дж., Наум Х., Глезерман М., Вайсман А. Остановка созревания человеческих ооцитов как причина бесплодия: отчет о болезни. Hum Reprod. 2002; 17: 1604–9. [PubMed] [Google Scholar] 22. Кастильо Дж. К., Гарсия-Веласко Дж., Хумайдан П. Синдром пустого фолликула после запуска ГнРГ по сравнению с запуском ХГЧ в COS. J Assist Reprod Genet. 2012; 29: 249–53. [Бесплатная статья PMC] [PubMed] [Google Scholar] 23. Хумайдан П. Восстановление лютеиновой фазы у пациентов с высоким риском СГЯ за счет запуска гонадолиберина в сочетании с низкими дозами ХГЧ: пилотное исследование.Репродукция Биомед онлайн. 2009; 18: 630–4. [PubMed] [Google Scholar]
Успешная беременность после двойного триггера
J Hum Reprod Sci. 2015 июль-сентябрь; 8 (3): 170–174.
K. Deepika
Отделение репродуктивной медицины, Милан — Центр репродуктивной медицины, Бангалор, Карнатака, Индия
Суварна Ратхор
Отделение репродуктивной медицины, Милан — Центр репродуктивной медицины, Бангалор, Карнатака, Индия
Нупур Гарг
Отделение репродуктивной медицины, Милан — Центр репродуктивной медицины, Бангалор, Карнатака, Индия
Камини Рао
Отделение репродуктивной медицины, Милан — Центр репродуктивной медицины, Бангалор, Карнатака, Индия
Отделение репродуктивной медицины, Милан — Фертильность Center, Бангалор, Карнатака, Индия
Адрес для корреспонденции: Dr.К. Дипика, Отделение репродуктивной медицины, Милан — Центр фертильности, № 6/7, Кумара Крупа Роуд, Хай Граундс, Бангалор — 560 001, Карнатака, Индия. E-mail: moc.liamg@akipidkrd
Поступила 25 мая 2015 г .; Пересмотрено 30 июня 2015 г .; Принято 10 июля 2015 г.
Авторские права: © Journal of Human Reproductive Sciences
Это статья в открытом доступе, распространяемая в соответствии с условиями лицензии Creative Commons Attribution-NonCommercial-ShareAlike 3.0, которая позволяет другим редактировать, настраивать и развивать работу некоммерчески, при условии, что автор указан и новые творения лицензируются на идентичных условиях.
Эта статья цитируется в других статьях в PMC.
Abstract
Синдром пустого фолликула (EFS) — это редкое, но неприятное осложнение вспомогательных репродуктивных технологий с невозможностью получить ооциты после адекватного ответа яичников на стимуляцию. Большинство зарегистрированных случаев EFS — это проблемы, связанные с наркотиками, которых можно избежать и которые не представляют собой какой-либо потенциальной патологии, и что риск подлинного EFS (GEFS) намного меньше, чем когда-то считалось. Наш случай является первым сообщением о беременности, полученным после лечения GEFS с двойным триггером цикла антагонистов гонадотропин-рилизинг-гормона (GnRH).В этом отчете мы представляем пациента, у которого было выполнено два извлечения ооцитов, у которых не было получено ни одного ооцита. В третьем цикле оплодотворения in vitro двойной триггер с комбинацией агониста GnRH и хорионического гонадотропина человека дал 11 ооцитов, что привело к переносу 2 бластоцист, что привело к рождению живого ребенка. Изменение протокола лечения с двойным триггером привело к успешному результату.
КЛЮЧЕВЫЕ СЛОВА: Двойной триггер, синдром пустого фолликула, синдром подлинного пустого фолликула, антагонист гонадотропин-рилизинг-гормона
ВВЕДЕНИЕ
Синдром пустого фолликула (EFS), широко обсуждаемый загадочный синдром, раздражает и вызывает серьезное беспокойство. как для врача, так и для пациента.[1] EFS определяется как состояние, при котором ооциты не извлекаются из зрелых фолликулов яичников после индукции овуляции в цикле оплодотворения in vitro (ЭКО) с очевидным нормальным фолликулогенезом и стероидогенезом, несмотря на тщательную аспирацию и промывание фолликулов. Его нельзя предсказать по типу реакции яичников на стимуляцию, ни сонографически, ни гормонально. Следовательно, диагноз EFS является ретроспективным. Ввиду неопределенности причин этого явления и растущего числа доказательств того, что в некоторых случаях ооциты можно успешно извлечь, термин EFS считается неуместным; но все еще используется в современной медицинской литературе.[2]
EFS подразделяется на два типа: «подлинный EFS» (GEFS) и «ложный» EFS (FEFS). Распространенность ГЭФС составляет 0–1,1% [3]. GEFS определяется как неспособность получить ооциты из явно нормальных растущих фолликулов яичников после стимуляции в циклах ЭКО нормальными уровнями эстрадиола и соответствующими уровнями бета-хорионического гонадотропина человека (β-ХГЧ) в сыворотке крови в день получения ооцитов (OR). Механизм, лежащий в основе GEFS, остается неясным, все еще подвергая сомнению сомнительное существование этого синдрома как отдельной клинической единицы.[4] Здесь мы сообщаем о случае GEFS, которым удалось успешно управлять с помощью двойного триггера.
ОТЧЕТ О ПРАКТИКЕ
Пара с шестилетним первичным бесплодием была направлена в наш центр репродуктивного здоровья по поводу бесплодия необъяснимой природы. Женщине было 32 года с нормальным менструальным циклом, известным случаем гипотиреоза, и она получала тироксин 50 мкг в день. Ее старшая сестра также страдала необъяснимым бесплодием, она перенесла три цикла ЭКО в другом месте с извлечением только 1-2 незрелых ооцитов во всех циклах, и ей посоветовали донорские ооциты.При физикальном обследовании не было замечено ни прыщей, ни гирсутизма, индекс массы тела 22 кг / м 2 . Сонография органов малого таза была нормальной, и все ее исходные исследования были в пределах нормы: фолликулостимулирующий гормон (ФСГ) -7,5 МЕ / л, антимюллеров гормон — 2,9 нг / мл и пролактин-17 нг / мл. Ее тиреотропный гормон (ТТГ) составлял 6,6 мкМЕ / мл, при этом ее тироксин был повышен до 75 мкг / день с повторным уровнем ТТГ через 6 недель до 1,9 мкМЕ / мл. Диагностическая гистеролапароскопия в норме.Мужу пациентки 38 лет, анализ спермы нормальный (общее количество — 69 млн / мл, общая подвижность — 68%, нормальные формы — 35%) и нормальный индекс фрагментации ДНК.
Поскольку пациентка не забеременела в четырех циклах внутриматочной инсеминации, ЭКО было запланировано с использованием длительного протокола лютеиновых агонистов. Двойное подавление было достигнуто с помощью пероральных противозачаточных таблеток, которые начинали с 5 дня предыдущего менструального цикла, и агониста гонадотропин-рилизинг-гормона (GnRHa) (Lupride, Sun Pharmaceutical Ltd.,) 0,25 мг подкожно (п / к) два раза в день, начиная с 21 дня, после того как трансвагинальная сонография подтвердила отсутствие кист. На 2 день цикла, после подтверждения подавления: (эстрадиол [E2] -41 пг / мл, лютеинизирующий гормон [LH] -1,1 МЕ / л, прогестерон [P4] -0,1 нг / мл) была начата стимуляция яичников рекомбинантным ФСГ. (R-FSH), (Recagon, Organon) 150 МЕ подкожно ежедневно и GnRHa 0,25 мг один раз в день продолжали до дня триггера. На 5 день стимуляции 8 фолликулами размером от 7 до 11 мм и E2-230 пг / мл, 75 МЕ менопаузального гонадотропина человека (HMG) (Reprogon, Ferring Pharmaceuticals Ltd.,) был добавлен к рекагону 150 МЕ. На 10 день стимуляции 4 доминантными фолликулами ≥17 мм, толщиной эндометрия 9,8 мм с E2-2011 пг / мл, LH-1,9 МЕ / л и P4-0,2 нг / мл. Рекомбинантный ХГЧ (R-hCG) (Ovitrelle, Serono) 250 мкг вводили в качестве триггера и назначили операцию на 35 часов. Перед началом сбора ооцитов трансвагинальное сканирование (TVS) показало наличие интактных фолликулов в обоих яичниках. После аспирации зрелых фолликулов из правого яичника, поскольку фолликулярная жидкость в первых трех пробирках не показала никаких признаков гранулезных клеток или ооцитов, мы решили промыть оставшиеся фолликулы.Несмотря на многократную промывку, ни ооциты, ни комплексы кумулус-корона не были восстановлены. Фолликулярная жидкость, проверенная на β-ХГЧ, оказалась положительной. Тщательный допрос пациента и медсестры, которая делала инъекцию ХГЧ, показал, что проблем, связанных с лекарствами или их введением, не было. Мы также решили проверить сывороточные уровни ХГЧ и Р4 и неожиданно обнаружили, что они составляют 165 мМЕ / мл и 14 нг / мл соответственно. Поскольку уровни сыворотки были удовлетворительными и находились в ожидаемом диапазоне, мы приступили к аспирации другого яичника.К сожалению, ооциты не были получены.
Второй цикл был запланирован через 4 месяца с протоколом антагонистов. На 2-й день спонтанного цикла уровни ФСГ, ЛГ, E2 и P4 составляли 6,5 МЕ / л, 4,6 МЕ / л, 37 пг / мл и 2,1 нг / мл, соответственно, с числом антральных фолликулов (AFC) 6– 8 в обоих яичниках. Стимуляцию начинали с комбинации 150 МЕ R-FSH (Recagon, Органон) и 75 МЕ HMG (Menogon, Ferring Pharmaceuticals Ltd). На 5-й день стимуляции свинцовыми фолликулами размером 13 мм и 14 мм и E2-456 пг / мл, антагонист GnRH, ганиреликс (Оргалутран, Органон) 0.25 мг п / к был добавлен, который продолжался ежедневно до дня срабатывания триггера. На 9-й день стимуляции 3 доминантными фолликулами ≥17 мм и пиковыми уровнями E2, LH и P4 1856 пг / мл, 2,4 МЕ / л и 1,01 нг / мл, соответственно, R-ХГЧ (Ovitrelle, Serono) 500 мкг был введен sc квалифицированной медсестрой и операционная была запланирована на 36 часов. TVS во время забора показал неповрежденные фолликулы в обоих яичниках, а также уровень ЛГ в день триггера был обнадеживающим. Даже при многократном промывании фолликулов обоих яичников ни кумулюсные комплексы, ни ооциты не были восстановлены.Мы были озадачены, обнаружив, что уровень ХГЧ в сыворотке составляет 154 мМЕ / мл, а P4 — 19 нг / мл, и повторяющаяся проблема заставила нас серьезно обеспокоиться, несмотря на принятие всех мер предосторожности во втором цикле.
После двух предыдущих неудачных попыток ЭКО пациент вернулся только через 2 года для третьего цикла. В этом цикле мы выбираем протокол антагониста с двойным триггером. На 2-й день уровни ФСГ, ЛГ, E2, P4 составляли 7,9 МЕ / л, 3,5 МЕ / л, 43 пг / мл, 1,9 нг / мл соответственно с AFC 5–6 в каждом яичнике. Стимуляцию яичников начинали с R-FSH, (Gonal F, Serono) 225 МЕ.На 6 день стимуляции свинцовым фолликулом размером 13 мм и остальными фолликулами размером от 9 до 11 мм с E2-301 пг / мл, рекомбинантным LH, Luveris (Serono) 75 МЕ вместе с Gonal F 150 IU и антагонистом GnRH, и Добавляли ганиреликс (Оргалутран, Органон) 0,25 мг подкожно, что продолжали ежедневно до дня триггера. На 10 день стимуляции 5 свинцовыми фолликулами 17 мм и E2, LH и P4: 2415 пг / мл, 2,45 МЕ / л и 0,78 нг / мл соответственно. R-hCG (Ovitrelle, Serono) 250 мкг и трипторелин (декапептил, Ferring) 0.2 мг вводили для окончательного созревания, а OR планировалось через 36 часов. Было извлечено одиннадцать ооцитов, 10 были зрелыми, 9 оплодотворенных с помощью интрацитоплазматической инъекции и 9 дополнительно отщепились. Всего на 3-й день было доступно семь 8-клеточных эмбрионов хорошего качества, при этом два 6-клеточных эмбриона были отброшены. Четыре 8-клеточных эмбриона хорошего качества культивировали до бластоцисты, а оставшиеся 3–8-клеточные эмбрионы хорошего качества замораживали на 3-й день. Две бластоцисты хорошего качества (311, 211) были перенесены на 5-й день. Лютеиновая фаза поддерживалась микронизированным прогестероном 400. мг вагинально два раза в день и три дозы ХГЧ по 2000 МЕ каждые 3 дня со дня переноса эмбриона.Уровень β-ХГЧ в сыворотке крови через 2 недели составил 426 мМЕ / л, а TVS через 6+ недель показал единственного живого внутриутробного плода.
Пациентка благополучно пережила первый триместр. Добавки для щитовидной железы были изменены в соответствии с потребностью в беременности и контролировались с помощью уровней ТТГ и свободного Т4. Во втором триместре у нее развился гестационный диабет, и ей начали принимать инсулин. Плановое кесарево сечение было выполнено на 38 неделе беременности, когда родилась девочка весом 3,1 кг без осложнений во внутри- и послеродовом периоде.
ОБСУЖДЕНИЕ
EFS впервые было сообщено Coulam et al . в 1986 г. [5] Частота EFS оценивается в 0,6–7%, [6,7] 2–7%, [4] и 0,5–2% [4,8,9] циклов ЭКО. Неудачная OR не связана с режимом стимуляции [4], поскольку это явление наблюдается как в естественных, так и в стимулированных циклах [10] и почти во всех циклах ЭКО, поскольку выход ооцитов редко достигает 100%. Однако эта терминология обычно используется для обозначения полной невозможности получить какие-либо ооциты.[11] Этиология EFS многогранна, и как предполагал Бустилло, этому способствуют как процедурные факторы, так и дисфункция яичников. [2]
FEFS определяется как состояние, при котором не извлекаются ооциты в присутствии низкого уровня β-ХГЧ из-за человеческих ошибок [12] или фармацевтических проблем [12] или из-за снижения биодоступности ХГЧ [11]. Действительно, EFS был описан как «синдром фармацевтической промышленности» [8] и составляет около 67% случаев. [11]
GEFS предположительно связан с внутренней дисфункцией яичников [10], и были предложены различные гипотезы, которые включают: (1) Дисфункциональный фолликулогенез или преждевременный апоптоз ооцитов, которые все еще продолжали рост фолликулов.[4,13] (2) Нарушение функции клеток гранулезы. [10] (3) Нарушение развития и созревания ооцитов. [14] В некоторых случаях причиной могут быть аномальные ооциты, такие как незрелые ооциты, свободные от зоны или у которых зона отсутствует в ооцитах [14]. (4) Сильное прикрепление комплексов кумулюсных клеток к фолликулярной стенке. (5) Дисфункциональная индукция овуляции. (6) В редких случаях фолликулам может потребоваться более длительное воздействие ХГЧ, чтобы подвергнуться расширению кумулюса и отделиться от стенки фолликула. [8,9] (7) Биологические нарушения в снабжении зрелыми ооцитами.[7] (8) Генетические факторы (а) Мутации рецептора ЛГ / ХГЧ. [15] (б) измененная экспрессия генов, регулирующих распространение кучевых облаков. (c) Измененная экспрессия генов, участвующих в клеточных процессах и апоптозе, приводящая к увеличению экспрессии апоптотических генов и снижению транскриптов с потерей ооцитов во время позднего фолликулогенеза из-за апоптоза. (d) Перицентрическая инверсия хромосомы 2. [15] (9) Ускоренное старение яичников [4] за счет изменения фолликулогенеза, которое рассматривается как фактор риска рецидива EFS.[10]
К различным причинам FEFS относятся: (1) Причины, связанные с лекарственными препаратами, из-за отклонения в вивобиологической активности некоторых серий коммерчески доступных препаратов ХГЧ в моче. [8] (2) Человеческие ошибки — неправильное время, прием и дозировка ХГЧ. [7,8,9] (3) Низкая биодоступность, вызванная изменением абсорбции или клиренса ХГЧ с некоторыми партиями ХГЧ с мочой. [8,12] (4) Фармакологические проблемы. [7] (5) Изменение порога фолликулярной реакции на ХГЧ.(6) Изменение времени, необходимого от воздействия ХГЧ до созревания комплексов ооцит-кумулюс. (7) Быстрое разложение продуктов, содержащих десиалилированный ХГЧ, печенью, что приводит к отсутствию воздействия биологически активного ХГЧ. [8] (8) Как и в случае с любым другим метаболическим процессом, люди различаются по скорости клиренса ХГЧ, а некоторые могут довольно быстро метаболизировать ХГЧ.
В вспомогательных репродуктивных технологиях (ВРТ) на протяжении десятилетий болюс ХГЧ обычно используется в качестве суррогата выброса ЛГ в середине цикла, поскольку его действие аналогично действию эндогенного ЛГ.Всплеск ЛГ инициирует каскад событий, приводящих к слизистым клеткам кумулюса, способствуя отслоению ооцит-кумулюсного комплекса от стенки фолликула, возобновлению мейоза с экструзией первого полярного тельца и последующей овуляцией. [16] Пороговая амплитуда для определения всплеска ЛГ все еще является предметом дискуссий, но обычно сообщается об уровнях более 10 МЕ / л, хотя удвоение базального уровня могло бы быть более подходящим определением, особенно для пациентов с высокими базальными уровнями ЛГ.[12] Концентрация ЛГ должна поддерживаться выше порогового значения в течение 14–27 часов, чтобы обеспечить максимальное созревание ооцитов с получением ооцитов в метафазе II в течение 28–38 часов после начала выброса ЛГ. [12] Таким образом, легко понять те случаи EFS, которые возникают из-за неправильных методов. В таких случаях повторный ХГЧ из другой партии или использование R-ХГЧ с OR, запланированным на 24 часа, [4], 36 часов [9] позже, приведет к получению зрелых ооцитов из интактного яичника. [4,10] Таким образом, он Для клинициста важно различать два типа EFS, и если FEFS был идентифицирован, следует использовать протокол спасения, чтобы спасти цикл.Пациенты GEFS вряд ли отреагируют на протокол спасения. FEFS не должен повторяться, при условии соблюдения осторожности, чтобы свести к минимуму его повторение в последующих циклах. [2]
Оптимальные сывороточные концентрации ХГЧ для прогнозирования EFS и успешный выход зрелых ооцитов до сих пор не определены однозначно. Различные авторы сообщают о различных уровнях сывороточного β-ХГЧ в качестве порогового значения в день OR; 106 мМЕ / мл, [17] 40 мМЕ / мл, [11] 100 мМЕ / мл, [8] и 98–161 МЕ / л. [18] Уровень ХГЧ в сыворотке <10 мМЕ / мл по данным Ndukwe et al .может предсказать EFS с чувствительностью и специфичностью 100%. [12] Дрисколл и др. . сообщили о средней концентрации ХГЧ в сыворотке 117,1 МЕ / л (диапазон: 48–249) после 250 мкг R-hCG и 83,6 МЕ / л (диапазон: 32–99) с 5000 МЕ ХГЧ в моче [19] благодаря иммуноанализам, используемым для измерить сывороточный ХГЧ. ХГЧ в моче может содержать диссоциированные и окисленные субъединицы, которые могут быть обнаружены с помощью иммуноанализа, но могут не иметь биологической активности. R-hCG из-за отсутствия примесных белков в моче и строгих стандартов, применяемых в процессе производства, может позволить более точно предсказать риск неудачного ИЛИ.[19]
Различные стратегии, предлагаемые для предотвращения возникновения EFS в последующем цикле АРТ: (1) Изменение партии ХГЧ. [7,9,12] (2) Использование R-hCG для запуска эндогенного выброса ЛГ. . R-hCG с его высокой чистотой (≥99%) и консистенцией между партиями может быть лучшим выбором, чем мочевой hCG, который содержит различные белки мочи и на биологическую активность которого могут влиять отсутствующие пептидные связи и изменения профиля гликозилирования. . [19] (3) переход от протокола агониста к протоколу антагониста.[11] (4) Использование рекомбинантного ЛГ в качестве триггера. (5) Использование GnRHa в качестве триггера в антагонистическом цикле. (6) Увеличение интервала между триггером овуляции и OPU. Droesch и др. . сообщили, что получение ооцитов через 35–36 часов превосходит получение ооцитов через <24 часов [20].
В нашем отчете о клиническом случае уровни ХГЧ и прогестерона в сыворотке подтверждали правильное время введения дозы R-ХГЧ в обоих циклах ЭКО. В день операции уровень β-ХГЧ в сыворотке крови в первом и втором циклах ЭКО составлял 165 мМЕ / мл и 154 мМЕ / мл соответственно.Поскольку пороговые значения β-ХГЧ в день OR были гарантированными и соответствовали уровням, указанным выше различными авторами, мы не сочли необходимым повторно вводить GnRHa в качестве триггера.
В обоих циклах ЭКО фолликулометрия показала хорошее фолликулярное развитие и нормальный стероидогенез. В день триггера уровни ЛГ и Р4 в первом и втором циклах составляли 1,9 МЕ / л, Р4-0,2 нг / мл и ЛГ = 2,4 МЕ / л, Р4 = 1,01 нг / мл соответственно. Кроме того, сонография в день забора ооцитов выявила интактные фолликулы в обоих циклах с обеспечением пиковых уровней ЛГ, исключающих преждевременный выброс ЛГ и овуляцию как причину EFS.
Нашей пациентке было 32 года с первичным бесплодием, которое, по-видимому, является типичным профилем в этих случаях, как описано Levran et al . [21] Ее тесты яичникового резерва были в пределах нормы, что опровергает гипотезу о старении яичников как о старении яичников. потенциальная причина состояния. У нее было необъяснимое бесплодие, и в первоначальном отчете Coulam et al . всем пациенткам был поставлен диагноз необъяснимого бесплодия, где авторы предположили, что EFS сама может быть причиной бесплодия.[5] Однако более поздние исследования показали, что EFS может возникать при различных категориях бесплодия. [10] Стивенсон и Лашен показали, что около 41% пар GEFS имели бесплодие по мужскому фактору, что указывает на то, что у большинства женщин, испытавших EFS, не было потенциальной основной патологии. [11]
У пациентов с EFS измененный стероидный профиль считается признаком дисфункциональной индукции овуляции. [13] Фолликулярная жидкость у этих пациентов показала высокий уровень эстрадиола (E2) и андростендиона с низким уровнем прогестерона.Напротив, Zreik et al . сообщили о низких уровнях концентрации эстрадиола из-за нарушения функции и / или метаболизма гранулезных клеток [11]. В нашем случае пиковые концентрации E2 и P4 в первом и втором циклах ЭКО составили: E2-2011 пг / мл; P4-0,2 нг / мл и E2-1856 пг / мл; и P4–1,01 нг / мл, соответственно, без каких-либо явных изменений, о которых сообщают несколько авторов.
Мы пришли к выводу, что это случай GEFS, и вероятная причина была в комплексе кумулюс-ооцит. Следовательно, можно предположить, что более физиологическая индукция окончательного созревания фолликулов с естественной активностью ЛГ и ФСГ непосредственно из гипофиза и с точки зрения продолжительности выброса гонадотропинов может оптимизировать механизмы передачи сигналов от окружающих кучевых облаков и ооцита, что приводит к адекватному OR и созревание.[22] Это может быть достигнуто за счет использования GnRHa в качестве триггера в циклах антагонистов GnRH, при этом одновременная индукция всплеска ФСГ является дополнительным преимуществом, напоминающим естественный цикл. Этот выброс ФСГ вызывает образование рецептора ЛГ в лютеинизирующих клетках гранулезы, способствует созреванию ядер ооцитов и расширению кумулюса, открывает щелевые соединения между ооцитами и кумулюсными клетками, которые важны в сигнальных путях, позволяя ооцит-кумулюсной клеточной массе отделяться от стенки фолликула. перед овуляцией.Это может объяснить, почему в некоторых исследованиях сообщается об извлечении более зрелых ооцитов после триггера ГнРГ по сравнению с триггером ХГЧ. Всплеск ФСГ и прямое действие агониста на рецептор гонадолиберина в яичниках могут объяснить благоприятные результаты у нашей пациентки.
Мы можем предположить, что один только триггер GnRHa в третьем цикле мог привести к адекватному созреванию ооцитов и, возможно, предотвратить EFS. Мы решили использовать двойной триггер, чтобы имитировать физиологический всплеск ФСГ и ЛГ, и в то же время добавление ХГЧ повысило активность ЛГ для лютеиновой поддержки, чтобы противодействовать лютеолитическому эффекту, наблюдаемому после триггера ГнРГ, «спасая» недостаточность лютеиновой фазы для успешный исход.[23]
У пациентов с пустым циклом EFS следует рассматривать как пограничную форму плохой реакции на стимуляцию яичников и может быть повторяющимся событием. Если EFS произошел один раз, риск рецидива составляет 20%. [10] С возрастом риск рецидива увеличивается и составляет около 24% для пациентов в возрасте от 35 до 39 лет, тогда как для пациентов старше 40 лет он составляет около 57%. [10] В этой подгруппе населения пустой цикл может быть хорошим предиктором того, что последующий стимулированный цикл будет неблагоприятным, и таких пациентов необходимо проконсультировать относительно риска рецидива и может помочь донорство ооцитов.
Относительно небольшой риск GEFS и еще меньший риск рецидива указывают на то, что это случайное явление, а не постоянное патофизиологическое состояние [4], как это очевидно в нашем случае.
Также нельзя исключить, что 2 года, прошедшие между предыдущими неудачами лечения и успешным лечением, могли повлиять на результат. Таким образом, EFS может быть самоограничивающим явлением, и в большинстве случаев оно происходит спорадически. [4] Если EFS встречался в предыдущих циклах, различные методы лечения ЭКО в последующих циклах, такие как использование двойного триггера с использованием GnRHa и hCG, могли бы модулировать ответ с успешным восстановлением ооцитов, беременностью и донорскими родами, как доказано в нашем случае.
Это также первый случай, когда комбинация GnRHa и R-hCG была использована в качестве триггера для лечения GEFS, тем самым добавив новый вариант лечения в арсенал этого необычного, но тревожного и сложного состояния.
Финансовая поддержка и спонсорство
Нет.
Конфликт интересов
Конфликта интересов нет.
ССЫЛКИ
1. Дрисколл Г.Л., Тайлер Дж. П., Найт, округ Колумбия, Кук С., Кайм Л., Кларк Л. и др. Неспособность собрать ооциты в вспомогательных репродуктивных технологиях: ретроспектива.Hum Reprod. 1998. 13: 84–7. [PubMed] [Google Scholar] 2. Бустилло М. Неудачное извлечение ооцитов: технический артефакт или настоящий «синдром пустого фолликула»? Репродукция Биомед онлайн. 2004. 8: 59–67. [PubMed] [Google Scholar] 3. Бек-Фрухтер Р., Вайс А., Лави М., Геслевич Ю., Шалев Е. Синдром пустого фолликула: успешное лечение в рецидивирующем случае и обзор литературы. Hum Reprod. 2012; 27: 1357–67. [PubMed] [Google Scholar] 4. Бен-Шломо И., Шифф Е., Левран Д., Бен-Рафаэль З., Машиах С., Дор Дж. Неудача при извлечении ооцитов во время оплодотворения in vitro : спорадическое событие, а не синдром.Fertil Steril. 1991; 55: 324–7. [PubMed] [Google Scholar] 5. Coulam CB, Bustillo M, Schulman JD. Синдром пустого фолликула. Fertil Steril. 1986; 46: 1153–5. [PubMed] [Google Scholar] 6. Халаф Y, Амин Y, Андерсон Х. Несоответствующее время введения ХГЧ: предотвратимая причина синдрома пустого фолликула при оплодотворении in vitro . Ближний Восток Fertil Soc J. 1999; 4: 254–6. [Google Scholar] 7. Awonuga A, Govindbhai J, Zierke S, Schnauffer K. Продолжение дискуссии о синдроме пустого фолликула: может ли он быть связан с нормальной биодоступностью бета-хорионического гонадотропина человека в день восстановления ооцитов? Hum Reprod.1998; 13: 1281–4. [PubMed] [Google Scholar] 8. Зегерс-Хохшильд Ф., Фернандес Э., Маккенна А., Фабрес С., Алтьери Э., Лопес Т. Синдром пустого фолликула: синдром фармацевтической промышленности. Hum Reprod. 1995; 10: 2262–5. [PubMed] [Google Scholar] 9. Квинтанс CJ, Дональдсон MJ, Бланко Л.А., Паскуалини RS. Синдром пустого фолликула из-за человеческой ошибки: его появление в программе оплодотворения in vitro . Hum Reprod. 1998. 13: 2703–5. [PubMed] [Google Scholar] 10. Зрейк Т.Г., Гарсиа-Веласко Дж.А., Вергара Т.М., Ариси А., Олив Д., Джонс Э.Синдром пустого фолликула: доказательства рецидива. Hum Reprod. 2000; 15: 999–1002. [PubMed] [Google Scholar] 11. Стивенсон Т.Л., Лашен Х. Синдром пустого фолликула: реальность противоречивого синдрома, систематический обзор. Fertil Steril. 2008; 90: 691–8. [PubMed] [Google Scholar] 12. Ндукве Г., Торнтон С., Фишел С., Доуэлл К., Алум М., Грин С. Лечение синдрома пустого фолликула. Hum Reprod. 1997; 12: 21–3. [PubMed] [Google Scholar] 13. Цуйки А., Роуз Б.И., Хунг Т.Т. Стероидные профили фолликулярной жидкости пациента с синдромом пустого фолликула.Fertil Steril. 1988. 49: 104–107. [PubMed] [Google Scholar] 14. Inan MS, Al-Hassan S, Ozand P, Coskun S. Транскрипционное профилирование гранулезных клеток пациента с синдромом рецидивирующего пустого фолликула. Репродукция Биомед онлайн. 2006; 13: 481–91. [PubMed] [Google Scholar] 15. Onalan G, Pabuçcu R, Onalan R, Ceylaner S, Selam B. Синдром пустого фолликула у двух сестер с тремя циклами: отчет о болезни. Hum Reprod. 2003; 18: 1864–7. [PubMed] [Google Scholar] 16. Сейбел М.М., Смит Д.М., Левеск Л., Бортен М., Таймор М.Л.Временная зависимость между выбросом лютеинизирующего гормона и созреванием ооцитов человека. Am J Obstet Gynecol. 1982; 142: 568–72. [PubMed] [Google Scholar] 17. Ндукве Г., Торнтон С., Фишел С., Доуэлл К., аль-Хассан С., Хантер А. Прогнозирование синдрома пустого фолликула. Fertil Steril. 1996; 66: 845–7. [PubMed] [Google Scholar] 18. Актас М., Бекерс Н.Г., Ван Инзен В.Г., Верхофф А., де Йонг Д. Ооциты в пустом фолликуле: противоречивый синдром. Fertil Steril. 2005; 84: 1643–8. [PubMed] [Google Scholar] 19. Дрисколл Г.Л., Тайлер Дж. П., Ханган Дж. Т., Фишер ПР, Бердсолл, Массачусетс, Найт, округ Колумбия.Проспективное, рандомизированное, контролируемое, двойное слепое, двойное фиктивное сравнение рекомбинантного и мочевого ХГЧ для индукции созревания ооцитов и лютеинизации фолликулов при стимуляции яичников. Hum Reprod. 2000; 15: 1305–10. [PubMed] [Google Scholar] 20. Дроеш К., Муашер С.Дж., Крайнер Д., Джонс Г.С., Акоста А.А., Розенвакс З. Сроки извлечения ооцитов в циклах со спонтанным выбросом лютеинизирующего гормона в большой программе оплодотворения in vitro . Fertil Steril. 1988. 50: 451–6. [PubMed] [Google Scholar] 21.Левран Д., Фархи Дж., Наум Х., Глезерман М., Вайсман А. Остановка созревания человеческих ооцитов как причина бесплодия: отчет о болезни. Hum Reprod. 2002; 17: 1604–9. [PubMed] [Google Scholar] 22. Кастильо Дж. К., Гарсия-Веласко Дж., Хумайдан П. Синдром пустого фолликула после запуска ГнРГ по сравнению с запуском ХГЧ в COS. J Assist Reprod Genet. 2012; 29: 249–53. [Бесплатная статья PMC] [PubMed] [Google Scholar] 23. Хумайдан П. Восстановление лютеиновой фазы у пациентов с высоким риском СГЯ за счет запуска гонадолиберина в сочетании с низкими дозами ХГЧ: пилотное исследование.Репродукция Биомед онлайн. 2009; 18: 630–4. [PubMed] [Google Scholar]
незрелых ооцитов в «синдроме очевидного пустого фолликула»: клинический случай
Синдром пустого фолликула (EFS) — это состояние, при котором не удается получить ооциты после явно успешной стимуляции яичников. Подлинный EFS (GEFS) отличается от ложного EFS по оптимальному уровню хорионического гонадотропина человека в день получения ооцитов. Некоторые считают, что GEFS не существует и что это только отражение погрешности, связанной с процедурой аспирации ооцитов.Другие считают, что GEFS вызывается дисфункциональным фолликулогенезом, что приводит к ранней атрезии ооцитов. В этом отчете мы представляем случай очевидного GEFS, в котором незрелые ооциты были идентифицированы после фильтрации фолликулярных аспиратов. Наши результаты предполагают, что задержка созревания кумулюсных комплексов ооцитов в ответ на ХГЧ может быть этиологическим механизмом в некоторых случаях GEFS. Это создает ситуацию, аналогичную аспирации незрелых фолликулов, где ооциты на стадии зародышевых пузырьков с плотными скудными кумулюсными клетками часто трудно идентифицировать под препарирующим микроскопом.
1. Введение
Синдром пустого фолликула (EFS) — это состояние, при котором не извлекаются ооциты после явно успешной стимуляции яичников [1, 2]. Заболеваемость оценивается примерно в 0,2–7% [1, 3–6]. Эта ситуация расстраивает и вызывает большой стресс как для пациентов, так и для команды ЭКО.
Синдром пустого фолликула (EFS) был впервые описан Coulam et al. [7] у 4 пациентов с необъяснимым бесплодием, перенесших 5 циклов экстракорпорального оплодотворения.Они предположили, что EFS может представлять собой до сих пор неизвестную причину бесплодия. В последующих исследованиях сообщалось о EFS в парах практически с любыми причинами бесплодия [1, 2]. Для простоты Стивенсон и Лашен [1] классифицировали EFS на подлинные и ложные EFS. Ложный EFS был определен как невозможность получить ооциты при низком уровне-ХГЧ. Возможные этиологии включают неправильное введение ХГЧ [5, 8], дефекты биологических препаратов ХГЧ [6] или индивидуальные вариации биодоступности и метаболизма ХГЧ [2].Подлинный EFS был определен как неудачное извлечение ооцитов после очевидного нормального развития фолликулов с оптимальными уровнями 𝛽-ХГЧ в день извлечения ооцитов [1]. Некоторые полагали, что подлинный EFS возник исключительно из-за технических трудностей во время аспирации ооцитов [9, 10]. Учитывая, что процент извлечения ооцитов составляет всего 80%, несмотря на использование промывки фолликулов, van Heusden et al. [9] подсчитали, что вероятность неспособности восстановить хотя бы один ооцит в их 14 случаях EFS составляет 0,064–4%. Это число по совпадению было близко к зарегистрированной распространенности EFS в целом и использовалось как один из аргументов против существования EFS как клинической сущности.Бен-Шломо и др. [4] проанализировали 26 пациентов с EFS и не обнаружили различий между успешными и неудачными циклами в отношении протоколов стимуляции, характера гормонального ответа или количества крупных фолликулов (≥15 мм), обнаруженных при сонографии. Десять из их пациенток были беременны в прошлом, а двадцать прошли по крайней мере еще один цикл ЭКО, в результате которого были получены ооциты. Таким образом, авторы пришли к выводу, что невозможность получения ооцитов следует рассматривать как «спорадическое событие», а не как синдром.Они также отметили, что у 4 из этих пациенток в анамнезе была плохая реакция на стимуляцию яичников, подразумевая, что, возможно, дисфункция яичников могла сыграть свою роль. Другие [6, 11] также предположили дисфункциональный фолликулогенез, клиническую дисфункцию, при которой аномальная функция клеток гранулезы приводит к измененному росту ооцитов и ранней атрезии, как вероятной причине GEFS. Zreik et al. [12] обнаружили, что пациенты с одним циклом GEFS имели 20% риск рецидива в более поздних циклах ЭКО. Риск рецидива увеличивается с возрастом.У лиц в возрасте от 35 до 39 лет риск рецидива составлял 24%, а у лиц старше 40 лет он повышается до 57%. Они предположили, что старение яичников, возможно, из-за изменения функции гранулезных клеток и апоптоза, может быть вовлечено в этиологию EFS и особенно в его рецидивы. Onalan et al. [13] описали рецидивирующий GEFS в 3 стимулированных циклах у 2 сестер с врожденной потерей слуха и постулировали наследственный генетический фактор в качестве его этиологии. Однако для подтверждения этого утверждения необходимы дальнейшие сообщения о случаях и более подробные молекулярные исследования.
В этом отчете мы представляем случай очевидной подлинности EFS. Интересным открытием было то, что фолликулярные аспираты, которые не содержали ооцитов при обычном наблюдении, при фильтрации через сетчатый фильтр для клеток содержали незрелые (зародышевые пузырьки) ооциты.
2. История болезни
32-летняя таиландская женщина была направлена к нам для лечения экстракорпорального оплодотворения (ЭКО) в июне 2008 года. Предыдущий анамнез показал, что она лечилась от бесплодия необъяснимого характера в провинциальной больнице в г. 2005 г.Она забеременела после определенного времени полового акта на третьем курсе кломифена цитрата. К сожалению, беременность закончилась полным самопроизвольным выкидышем на сроке гестации 5 недель 3 дня. После аборта она безуспешно пыталась забеременеть. Она вернулась к своему предыдущему врачу, который лечил ее 3 циклами кломифена с указанием времени полового акта, за которыми следовали 2 цикла суперовуляции и внутриматочной инсеминации (ВМИ). После неудачного лечения пациенту в 2006 году была проведена диагностическая лапароскопия.Обнаружен минимальный эндометриоз таза, видимые имплантаты прижжены. Инъекция красителя выявила проходимость обеих маточных труб. Она получала лейпрорелин ацетат 3,75 мг (Enantone; Takeda, Осака, Япония) ежемесячно в течение 6 месяцев с последующими еще 2 циклами суперовуляции и ВМИ, но безрезультатно.
При ЭКО использовался длинный лютеиновый протокол. 30 июня 2008 г. ей дали 1,88 мг лейпрорелина ацетата (энантон). 9 июля 2008 г. (3-й день цикла) была взята кровь для подтверждения снижения регуляции и рекомбинантного фолликулостимулирующего гормона (rFSH — Puregon; Organon, Oss, Нидерланды) 150 МЕ в день.После трех доз 150 МЕ рФСГ в день снова брали кровь и выявляли уровень эстрадиола 86,9 пг / мл. Дозу рФСГ увеличили до 200 МЕ в сутки в течение еще двух дней, и повторный анализ крови показал удовлетворительное повышение уровня эстрадиола. Через 8 дней было проведено трансвагинальное ультразвуковое исследование, в ходе которого было выявлено 12 следующих фолликулов: фолликулы 2 × 15 мм, 1 × 14 мм, 8 × 13 мм и 1 × 12 мм. Ультразвук был повторен через 2 дня, выявив фолликулы 2 × 19, 1 × 18, 4 × 17, 4 × 15 и 1 × 13 мм. Хорионический гонадотропин человека (ХГЧ; прегнил, Органон) вводили внутримышечно 10 000 МЕ, а через 36 часов проводили забор ооцитов.При извлечении ооцитов в тупике было минимальное количество жидкости. Все 12 фолликулов были аспирированы с использованием двухпросветной аспирационной иглы 16G (каталожный номер K-OPSD-1635-A-L; Cook Medical, Брисбен, Австралия). Промывание выполняли дважды после каждой аспирации фолликулов, используя гепаринизированный фосфатно-солевой буфер Дублекко (DPBS; Gibco, BRL, NY, USA). Фолликулярная жидкость и промывочная жидкость из последовательных фолликулов вместе аспирировали в теплые культуральные колбы на 50 мл (Nunc, Роскилле, Дания). В наших условиях два эмбриолога работали бок о бок, регулярно проверяя фолликулярные аспираты, ранее исследованные другим.Поскольку ооцит не был получен, мы исследовали аспираты в третий раз, прежде чем был поставлен предварительный диагноз «синдром пустого фолликула».
Пациентка подтвердила, что квалифицированная медсестра ввела ей ХГЧ в нужное время, примерно за 36 часов до забора ооцитов. Сразу взяли кровь на гормональное исследование. Уровень 𝛽-ХГЧ составил 851 МЕ / л, ФСГ 12 МЕ / л, ЛГ <0,1 МЕ / л, эстрадиол 2637 пг / мл и прогестерон 37,5 нг / мл. Из-за разочарования мы решили поближе взглянуть на аспираты, отфильтровав их через фильтр для клеток на 70 мкм (BD Falcon, Бедфорд, Массачусетс, США).К сожалению, половина фолликулярных аспиратов к этому времени уже была выброшена. К нашему большому удивлению, в оставшейся жидкости были идентифицированы 4 незрелых (на стадии зародышевых пузырьков) ооцита. В двух ооцитах было очень мало плотно упакованных кумулюсных клеток, а в двух других почти не было кумулюсов, что затрудняло или делало невозможным их идентификацию без помощи клеточного фильтра. Поскольку ооциты слишком долго стояли при комнатной температуре (> 3 часов), мы решили их выбросить.Пациент был проконсультирован относительно EFS. Ей сообщили, что вероятность рецидива в ее случае ничтожна, и мы сделаем все возможное в ее следующем цикле.
Пациент вернулся для второй попытки ЭКО через 4 месяца после инцидента. Менопаузальный гонадотропин человека (HMG; Menogon; Ferring GmbH, Киль, Германия) 225 МЕ в день вводили в день 3 цикла в течение 9 дней подряд. Ганиреликс 0,25 мг (Оргалутран; Органон) давали ежедневно в дни цикла 8-11. ХГЧ 10000 МЕ (прегнил, Органон) вводили на 12-й день цикла, а забор ооцитов проводили через 36 часов (на 14-й день цикла).Было получено двенадцать ооцитов и 9 эмбрионов были получены с помощью ЭКО. Два эмбриона были перенесены и 7 эмбрионов были заморожены методом сверхбыстрой заморозки. Через две недели после переноса эмбриона тест на беременность был положительным. Трансвагинальное ультразвуковое исследование было выполнено через семь недель после переноса эмбриона. Внутри полости матки был визуализирован единственный гестационный мешок с желточным мешком и сердечной деятельностью плода. На момент написания этого отчета беременность все еще продолжалась.
3.Обсуждение
Преждевременный всплеск ЛГ был маловероятным объяснением GEFS в нашем случае, поскольку однократная половина дозы депо лейпролида использовалась в протоколе длительного подавления, чтобы предотвратить его возникновение. В недавнем рандомизированном исследовании Isikoglu et al. [14] показали, что однократная полудоза депо лейпролида была так же эффективна, как и протокол с несколькими дозами для десенсибилизации гипофиза. В их исследовании [14] преждевременный выброс ЛГ не наблюдался ни в одном из 51 пациента, получавшего это лекарство. Наличие неповрежденных фолликулов во время извлечения ооцитов также предоставило дополнительные доказательства против преждевременного выброса ЛГ в нашем случае.
Обычная скорость извлечения ооцитов составляет 80% [9]. Математический шанс неспособности восстановить какой-либо ооцит в нашем случае с 12 фолликулами будет только 4 из 10 миллионов. Такая крайняя вероятность предполагала, что предел погрешности, присущий самой процедуре аспирации ооцитов, был бы маловероятным объяснением EFS в нашем описанном случае.
Первоначально пациентка плохо отреагировала на стимуляцию яичников, что привело к необходимости увеличения доз рФСГ.Возможно, аномальный фолликулогенез мог произойти в начале цикла, как и в других зарегистрированных случаях GEFS [4, 6]. Однако нормальные уровни эстрадиола и прогестерона в день извлечения ооцитов не подтверждают утверждение некоторых авторов [6, 11] о том, что GEFS, по крайней мере, в нашем случае, был вызван ранней атрезией ооцитов. Аномальный фолликулоген может изменить фолликулярный ответ на овуляторную дозу ХГЧ. Интересно, что Meniru и Craft [15] предположили, что может происходить отсроченное отделение ооцит-кумулюсного комплекса (ОКК) от стенки фолликула после инъекции ХГЧ.В их отчете первая доза ХГЧ повысила уровень прогестерона в плазме, но при аспирации одного яичника ооциты не извлекались. Они повторили инъекцию ХГЧ и смогли получить 20 ооцитов из другого яичника при повторном извлечении через 24 часа. Hassan et al. [16] также сообщили о схожих результатах, предполагая, что некоторым пациентам может потребоваться более длительное время воздействия ХГЧ, чтобы их ОКР отделились от стенки фолликула. Подобно нашему случаю, ХГЧ может вызывать нормальную выработку прогестерона, но окончательное созревание ОКК каким-то образом задерживается.Поскольку незрелые ооциты не плавают в фолликулярной жидкости во время извлечения ооцитов, результативность фолликулярной аспирации, даже при повторной промывке фолликулов, будет заметно снижена. Мы предположили, что наличие меньшего количества ОКР в фолликулярных аспиратах вместе с уникальными особенностями незрелых ОКР затрудняют их идентификацию для среднего эмбриолога. Учитывая нормальный уровень прогестерона, мы поставили под сомнение роль второй инъекции ХГЧ, как это предполагают некоторые авторы [15, 16].Возможно, созревание ооцитов в ответ на первую дозу ХГЧ просто потребовало больше времени, чем 36 часов, и зрелые ооциты можно было аспирировать позже, независимо от второй инъекции ХГЧ.
Недавно наш центр начал изучать возможность использования созревания in vitro (IVM) ооцитов из нестимулированных циклов у пациентов с синдромом поликистозных яичников (СПКЯ). Фолликулярный аспират из случаев внутривенного вливания был более сильно загрязнен кровью, но в определенной степени был похож на тот, что наблюдался у этого пациента.Хотя мы обнаружили только 4 ооцита GV, не исключено, что больше незрелых ооцитов могло быть пропущено в оставшемся аспирате, который был отброшен. Наш поиск в PubMed с 1986 по 2009 год с использованием ключевых слов «синдром пустого фолликула» или «неудачное извлечение ооцита» выявил один отчет [17], в котором также был обнаружен 1 ооцит на стадии зародышевых пузырьков без зоны в фолликулярном аспирате в 1 случае GEFS. .
В заключение, некоторые случаи подлинного EFS могут быть вызваны задержкой созревания ОКК в ответ на ХГЧ.Ситуация была аналогична извлечению ооцитов из незрелых фолликулов. Меньшее количество незрелых ооцитов в аспиратах и сложность их идентификации могут привести к ошибочному диагнозу GEFS.
Пограничная форма синдрома пустого фолликула, леченная новым двойным триггерным методом в сочетании с отсроченным извлечением ооцитов: отчет о болезни
Авторские права
© Автор (ы) 2020. Опубликовано Baishideng Publishing Group Inc. Все права защищены.
Пограничная форма синдрома пустого фолликула, леченная новым методом двойного триггера в сочетании с отсроченным извлечением ооцитов: отчет о клиническом случае
Сянь-Лин Цао, Чжэнь-Гао Сунь
Xian-Ling Cao, Колледж традиционной китайской медицины, Шаньдунский университет традиционной китайской медицины, Цзинань 250011, провинция Шаньдун, Китай
Xian-Ling Cao, Zhen-Gao Sun, Центр исследований репродуктивной медицины и наследственности в интегративной медицине , филиал больницы Шаньдунского университета традиционной китайской медицины, Цзинань 250011, провинция Шаньдун, Китай
Вклад авторов : Цао XL рецензировал литературу и участвовал в составлении рукописей; Sun ZG отвечал за редактирование рукописи на предмет важного интеллектуального содержания; все авторы дали окончательное одобрение представленной версии.
Заявление об информированном согласии : От пациента было получено информированное письменное согласие на публикацию этого отчета и любых сопутствующих изображений.
Заявление о конфликте интересов : Авторы заявляют, что у них нет конфликта интересов.
Контрольный список CARE (2016) заявление : Авторы прочитали Контрольный список CARE (2016), и рукопись была подготовлена и отредактирована в соответствии с Контрольным списком CARE (2016).
Открытый доступ : Эта статья представляет собой статью с открытым доступом, которая была выбрана штатным редактором и полностью прорецензирована внешними рецензентами.Он распространяется в соответствии с лицензией Creative Commons Attribution NonCommercial (CC BY-NC 4.0), которая разрешает другим распространять, ремикшировать, адаптировать, использовать эту работу в некоммерческих целях и лицензировать свои производные работы на других условиях, при условии, что оригинал работа правильно процитирована и используется в некоммерческих целях. См .: http://creativecommons.org/licenses/by-nc/4.0/
Автор, ответственный за переписку : Чжэнь-Гао Сунь, доктор философии, доктор, отделение репродуктивной медицины, Шаньдунский университет традиционной китайской медицины, No.42 Wen Hua Xi Road, Цзинань 250011, провинция Шаньдун, Китай. [email protected]
Поступило: 26 ноября 2019 г.
Началась экспертная оценка : 10 декабря 2019 г.
Первое решение : 7 января 2020 г.
Доработано: 10 января 2020 г.
Принято: 15 января 2020 г.
Статья в прессе : 15 января 2020 г.
Опубликована онлайн: 26 февраля 2020 г.
ВВЕДЕНИЕ
Синдром пустого фолликула (EFS) был впервые описан Coulam et al [1].Это состояние, при котором ооциты не извлекаются после тщательной аспирации фолликулов, несмотря на нормальное развитие фолликулов. Невозможность восстановить ооциты из доминантных фолликулов — редкое явление, частота которого оценивается от 0,045% до 3,5% [2]. Условие делится на два типа: «подлинная» EFS и «ложная» EFS. Подлинная форма — это ситуация, в которой при аспирации ооциты не образуются, несмотря на удовлетворительную реакцию яичников, тогда как ложная форма может быть описана как неспособность восстановить ооциты из-за низкого уровня бета-хорионического гонадотропина человека (β-ХГЧ).Низкий уровень β-ХГЧ в сыворотке крови может возникать в результате его ошибочного введения или снижения биодоступности [3].
Пограничная форма EFS была описана в случаях, когда только несколько зрелых или незрелых ооцитов извлекаются из нескольких зрелых фолликулов. Первоначально считалось, что это состояние вызвано плохим качеством β-ХГЧ или его неправильным введением [4-6]. До сих пор основные причины этого состояния остаются загадкой. Кроме того, по-прежнему обсуждается оптимальный пороговый уровень циркулирующего сывороточного β-ХГЧ (сообщения варьируются от 5–160 МЕ / л введения экзогенного ХГЧ примерно через 36 часов) [7].Основная причина этих противоречивых результатов может быть связана с ограниченными знаниями о патофизиологии EFS, что привело к отсутствию практических решений для лечения этих состояний. В настоящее время считается, что изменение триггерной стратегии может быть возможным подходом для улучшения получения яйцеклеток у пациентов с EFS [7].
ПРЕДСТАВЛЕНИЕ ДЕЛА
Главные жалобы
Супружеская пара с шестилетним вторичным бесплодием посетила репродуктивно-генетический центр в 2019 году.
История настоящего заболевания
У 38-летней пациентки были нерегулярные менструации после менархе (которое произошло в возрасте 14 лет) с максимальным периодом аменореи 90 дней. Индекс массы тела составил 22,04 кг / м 2 2 .
История перенесенных заболеваний
В 2006 году она перенесла искусственный аборт после 40 дней беременности (из-за незапланированной беременности), других беременностей в анамнезе не было. В 2015 году она получала медикаментозное лечение овуляции в течение трех месяцев (кломифен / летрозол / гонадотропины в моче).Впоследствии она смогла производить доминантные фолликулы ежемесячно и овулировать естественным путем; однако она не могла забеременеть. В декабре 2015 года ей было выполнено лапароскопическое удаление кисты двустороннего эндометриоза яичников с последующей гистероскопической резекцией полипа эндометрия, которая была проведена в больнице Цилу по строгим хирургическим показаниям. Кроме этого, у нее не было никаких хирургических операций или болезней.
Объективное обследование
В целом результаты медицинского обследования были нормальными.Ее муж был 40-летним государственным служащим, не курил и не пил. При его физическом осмотре не было обнаружено никаких явных отклонений от нормы.
Лабораторные исследования
Концентрации следующих гормонов в сыворотке крови были исследованы в лаборатории на третий день ее менструального цикла в мае 2019 года, и профиль гормонов ранней фолликулярной фазы был следующим: Фолликулостимулирующий гормон (ФСГ) 5,64 Ед / л ; лютеинизирующий гормон (ЛГ) 3,06 Ед / л; эстрадиол (E2) 42,13 пг / мл; пролактин (ПРЛ) 10.64 нг / мл; тестостерон (Т) 0,14 нг / мл. Из-за длительного бесплодия ее хромосомный статус был проанализирован с использованием периферической крови. По результатам хромосомного исследования кариотип 46, XX, 1qh +.
Результаты анализа спермы ее мужа выявили олигоастенозооспермию (12 моль / мл, подвижность 35%), которая была диагностирована в соответствии со стандартом параметров спермы 5 th Всемирной организации здравоохранения, и его хромосомный кариотип был 46, XY.
Визуальные исследования
Гистеросальпингография показала двустороннюю непроходимость маточных труб, но причину установить не удалось.Ультразвуковое исследование органов малого таза показало нормальное состояние тазовых органов с нормальным эндометрием 1,04 мм и фолликулом яичника 1,6 мм.
ОКОНЧАТЕЛЬНЫЙ ДИАГНОЗ
Предыдущее определение пограничной формы EFS, которое было описано в случаях, когда только несколько зрелых или незрелых ооцитов извлекаются из нескольких зрелых фолликулов. В сочетании с историей этого случая, в ее первых двух циклах оплодотворения (ЭКО) in vitro и ее целевое количество зрелых фолликулов было больше 10, но каждый раз получался только один ооцит.Таким образом, у нас есть основания полагать, что она соответствует определению пограничной формы EFS, и поэтому ей был поставлен диагноз пограничной формы EFS.
ПРОЦЕДУРА
В декабре 2016 года в больнице Цилу было проведено ЭКО с использованием протокола антагонистов гонадолиберина [8], чтобы помочь ей в зачатии. Было получено двенадцать фолликулов размером ≥ 14 мм и одно яйцо M1; однако образования зародыша не произошло. В марте 2017 г. в Шаньдунском университете было проведено еще одно ЭКО по короткому протоколу [8]. Было получено четырнадцать фолликулов размером ≥ 14 мм и одна яйцеклетка, произошло оплодотворение одной яйцеклетки, но формирование эмбриона не удалось.К сожалению, количественный уровень β-ХГЧ в то время не исследовался. Конкретный метод запуска и протокол приема лекарств описаны в таблице 1.
Таблица 1 Описание цикла вспомогательных репродуктивных технологий.
| Дата | Гонадотропин | Суточная доза | Всего | Аналоговый GnRH | Протокол овуляции | Ооцит № | ||
| Декабрь 2016 г. | HMG | 225U | 2475U | GnRH-ant (0.25 мг) | ХГЧ 1000U | Антагонист, фиксированный | 3101 | M1 × 1 |
| март 2017 г. | rFSH + HMG | 75U + 225U | 900U + 2700U 905 мг ) | HCG 2000U + rHCG 250U | Agonist, короткий | 4870 | M1 × 1 | |
| июнь 2019 г. GnRH-a (0,05 мг) | GnRH (0.2 мг) rHCG + HCG 10000U | Агонист, длинный | 3623 | M I × 2 M II × 3 |
7 июня 2019 г. в нашем репродуктивно-генетическом центре был проведен третий цикл ЭКО с использованием гибкого протокола стимуляции яичников в лютеиновой фазе [9]. Овуляция поддерживалась на высоком уровне прогестерона (Р) пероральным приемом дигидроксипрогестерона. 24 9 9 0 0 50 дней ее менструального цикла было выполнено В-УЗИ и серологический тест на гормоны.Гормональный профиль показал, что E2 составлял 64 пг / мл, LH составлял 1,79 МЕ / л, а P составлял 0,82 нг / л. Сонография органов малого таза показала нормальное состояние тазовых органов (эндометрий 12,1 мм и 6,5 мм, два фолликула яичника и десять фолликулов антрального отдела). Стратегия лечения была изменена в этом исследовании на основании двух предыдущих неудачных попыток ЭКО.
Впоследствии, с 24 950 до 29 дней ее менструального цикла, ей вводили суточную дозу 75 Ед гонадотропина мочи (HMG, Zhu hai Li zhu group Libao Biochemical Pharmaceutical Co., Ltd., Чжухай, Китай, спецификация: 75 ед / ПК), 200 ед. Рекомбинантного человеческого ФСГ (rFSH, Merck Serono SA, Aubonne Branch, спецификация: 75 ед. / ПК), 75 ед. Рекомбинантного ЛГ (rLH, Merck Serono SA, 75 ед. / Шт) и 40 мг дидрогестерона. Введение гонадотропина (Gn) продолжалось в течение трех дней (с 29 до 32 ) в зависимости от роста фолликулов. После девяти дней приема лекарств уровень E2 в сыворотке составил 2357 пг / мл, ЛГ — 1,42 МЕ / л, а P — 0,78 нг / л. В-ультразвук показал нормальный рост фолликулов.Чтобы получить больше яиц, доза HMG была увеличена вдвое до 300 ЕД в день в течение следующих трех дней при сохранении дозировки других лекарств. Лечение длилось 11 дней с общей дозировкой rFSH, HMG и rLH 2200U, 825U и 825U соответственно. На 12 9 9 50 дн введения Gn, что было 35 9 949 9 9 50 дн ее менструации, все препараты были прекращены. В это время уровень Е2 в сыворотке составлял 3623 пг / мл, ЛГ — 1,03 МЕ / л, а Р — 1,48 нг / л. Чтобы избежать рецидива пограничной формы EFS, ее триггерный протокол был тщательно оценен и было введено 10000 Ед ХГЧ, 250 мкг рекомбинантного ХГЧ (rHCG) (хориогонадотропин альфа, овитрелле 250 мкг, сероно) и 0.Окончательно было принято решение о 2 мг антагониста GnRH (Ipsen Pharma Biotech, диферелин, ацетат трипторелина, декапептил 0,1 мг × 2). К этому моменту размер десяти фолликулов превышал 1,4 мм. Забор ооцитов (OPU) был отложен на 3 часа из-за ее ситуации. В итоге было получено пять ооцитов (M I × 2, M II × 3), два из них были оплодотворены и позже сформировали два эмбриона (оценка эмбриона, 6C II × 1, 9C II × 1). Для предотвращения синдрома гиперстимуляции яичников в этом цикле выполнялась криоконсервация эмбрионов.В настоящее время она проходит подготовку к переносу замороженных эмбрионов. Подробная запись представлена в таблице 2.
Таблица 2 Введение в третье оплодотворение in vitro .
| Дата | 7 июня 2019 г. | 12 июня 2019 г. | 15 июня 2019 г. | 17 июня 2019 г. 20 июня 2019 г. E2 (пг / мл) | 64 | 1120 | 2357 | 4146 | 3623 | |
| LH (МЕ / л) | 1.79 | 2,19 | 1,42 | 1,49 | 1,03 | |||||
| P (нг / л) | 0,82 | 1,01 | 0,78 | 1,28 | 1,2, 1,1 × 3, 1,0, 0,9 × 3 | 1,35 × 2, 1,25 × 3, 1,2 × 4, 0,95 × 3 | 1,7, 1,65, 1,55, 1,3 × 3, 1,15 × 3 , 1,05 × 3, 0,9 | 1,9, 1,7 × 2, 1,6, 1,45, 1,4, 1,35, 1,3, 1,25 × 3, 1,15, 1.0 | Всего 10, ≥ 1,4 | |
| LF (см) | 0,6, 0,2 × 10 | 1,25, 1,15, 1,1, 0,8 × 2, 0,75 × 2, 0,6 | 1,65, 1,45, 1,25, 1,05, 0,95 × 2, 0,9, 0,85, 0,75, 0,6 | 1,7, 1,55, 1,5, 1,15 × 3, 0,95, 0,9, 0,7 × 2 | 1,75 × 2, 1,7, 1,4, 1,35, 1,2 × 3, 1,0 × 2 | |||||
| EM (см) | 1.21AB | 1.2B | 1.38B | 1.29B | 1.13B | |||||
| HMG | 75U × 5 | 75U × 3 | 75U × 3 | |||||||
| rFSH | 200U × 5 | 200U × 3 | 200U × 2 | 200U × 1 | ||||||
| rLH | 75U × 5 | 75U × 5 | 75U | 75U × 1 | ||||||
| Дидрогестерон | 20 мг Bid | 20 мг Bid | 20 мг Bid | 20 мг Bid | ||||||
| Триггер овуляции | rHCG 250U + GnRH-a 0.2 мг + ХГЧ 10000U | 39 ч извлечение ооцитов | ||||||||
РЕЗУЛЬТАТ И ПОСЛЕДУЮЩИЕ ДЕЙСТВИЯ
В конце концов, в этом исследовании были получены три зрелых ооцита, которые позже сформировали два эмбриона после интрацитоплазматической инъекции сперматозоидов. Пациент решил отдохнуть несколько месяцев перед переносом замороженных размороженных эмбрионов.
ОБСУЖДЕНИЕ
Несмотря на низкую заболеваемость пограничной формой EFS, это состояние ложится тяжелым бременем на пациентов и врачей, которые тратят на этих пациентов много времени и других ресурсов.Факторы, предрасполагающие к заболеванию, включают дисфункцию яичников и факторы, связанные с дозировкой, временем приема, биодоступностью и метаболизмом ХГЧ [10]. В настоящее время основное лечение для обеспечения окончательного созревания ооцитов включает введение 10000 МЕ ХГЧ (наиболее часто), 250 мкг rHCG [11] и двойного триггера GnRH-a (0,2 мг) + rHCG (250 мкг) + 2000 МЕ ХГЧ [ 12]. Кроме того, эффективно продление интервала между овуляциями [10].
Запуск и несоответствующий OPU может быть фактором, способствующим в некоторых случаях EFS, потому что он может повлиять на количество или качество ооцитов [13,14].Большинство исследований EFS ограничены по размеру выборки, и это ставит под сомнение надежность их результатов.
Действительно, существование EFS остается спорным [10]. Состояние все еще может возникать в тех случаях, когда было достигнуто правильное введение и высокая биодоступность ХГЧ. Кроме того, EFS может быть вызвано низкой доступностью ХГЧ в яичниках, и это состояние было описано как «синдром фармацевтической промышленности» [15]. В настоящем исследовании метод триггера, который включал двойной триггер сверхнормальной дозы ХГЧ в сочетании с отложенным извлечением ооцитов, предотвращал связанные с ХГЧ нарушения и обеспечивал адекватное время действия ХГЧ и относительное увеличение концентрации ХГЧ в яичниках.Однако это исследование имело некоторые ограничения: (1) использованная доза ХГЧ была выше, чем обычная доза, и это могло увеличить риск синдрома гиперстимуляции яичников; (2) Забор ооцитов проводили через 39 часов после инъекции ХГЧ, что могло привести к чрезмерному созреванию ооцитов или спонтанной овуляции; и (3) Это исследование не определило, повлияли ли повышенная доза ХГЧ и отсроченное извлечение ооцитов на фундаментальные аспекты качества ооцитов или эмбрионов.
В настоящем исследовании уровень β-ХГЧ в сыворотке был 389.47 Ед / л, за 3 часа до OPU, что было выше порога β-ХГЧ, ранее упомянутого при пограничных формах EFS [16]. Следовательно, для диагностики EFS по-прежнему необходимы стандартизованный пороговый уровень β-ХГЧ и время его обнаружения в сыворотке [17]. Результаты этого исследования показали, что пациенты, которым неоднократно был поставлен диагноз EFS, должны иметь более строгий подход к окончательному созреванию ооцитов в следующем цикле ЭКО, чтобы избежать повторения EFS.
ЗАКЛЮЧЕНИЕ
Пациентка в настоящем исследовании получила три цикла АРТ в трех разных репродуктивных центрах, и ооциты, собранные в первых двух циклах, были плохого качества, несмотря на адекватный ответ яичников.В третьем цикле высокий уровень P контролировал протокол гиперстимуляции яичников и применялся для получения большего количества ооцитов. Двойной пусковой механизм сверхнормальной дозы ХГЧ в сочетании с подходом отсроченного извлечения ооцитов был выбран после тщательной оценки истории болезни пациента. Двойной триггер предполагает использование одного болюса агониста ГнРГ в сочетании с уменьшенной или стандартной дозой ХГЧ, чтобы вызвать овуляцию [18]. В конце концов, в этом исследовании были получены три зрелых ооцита, которые позже сформировали два эмбриона после интрацитоплазматической инъекции сперматозоидов.
В этом тематическом исследовании описывается новый подход к запуску овуляции, который включает двойной запуск сверхнормальной дозы ХГЧ в сочетании с отсроченным извлечением ооцитов. Метод может быть применен при лечении пограничной формы EFS.
БЛАГОДАРНОСТИ
Авторы выражают благодарность пациенту за поддержку этого исследования и Zhen-Gao Sun за помощь в подготовке рукописи.
Источник рукописи: незапрашиваемая рукопись
Тип специальности: медицина, исследовательская и экспериментальная
Страна происхождения: Китай
Классификация экспертных оценок
Оценка A (отлично): 0
Оценка B (очень хорошо): 0
Оценка C (хорошо): C
Оценка D (удовлетворительная): 0
Оценка E (плохая): 0
P-рецензент: Exbrayat JM S-редактор: Zhang L L-редактор: Webster JR Электронный редактор: Ци LL
Синдром пустого фолликула: правильный медицинский ответ
Вагинальный сбор яйцеклеток — это очень рутинная часть процесса ЭКО.Процедура завершается примерно через 20 минут, и опытные врачи обычно получают по одной яйцеклетке из каждого зрелого фолликула.
Однако одним осложнением, которое может испортить сбор вагинальных яйцеклеток, является синдром пустого фолликула .
Сбор яйцеклеток состоит из ряда рутинных шагов: врач аспирирует фолликулы, чтобы они разрушились, прокалывает фолликулы, и фолликулярная жидкость, предположительно содержащая яйца, перетекает в пробирки. Фолликулярная жидкость передается эмбриологу для сканирования под микроскопом, где видны яйца.
Синдром пустого фолликула выявляется, когда яйцеклетки не видны под микроскопом. Это неожиданно и необычно; и многие врачи совершенно не понимают, что делать в таких случаях. На самом деле это неотложная медицинская помощь, но часто с ней плохо справляются.
Иногда врач просто слепо продолжает процедуру и высасывает фолликулярную жидкость из всех фолликулов. После завершения процедуры и выхода из операционной эмбриолог сообщает врачу, что яйцеклеток не обнаружено.Затем врач должен сказать пациенту — извините, яиц не поступило. Пациент обычно ошеломлен и / или не верит. Врач может предложить использовать донорские яйцеклетки в это время, и пациент может почувствовать, что его заставят согласиться, чтобы спасти плохую ситуацию.
Как врачу разрешить кризис синдрома пустого фолликула?
Важно понимать, что в 99% случаев синдром пустого фолликула возникает из-за того, что пациент неправильно сделал инъекцию ХГЧ.Это могло произойти по нескольким причинам. Пациент, возможно, забыл растворить порошок в растворителе при спусковом выстреле и принял только инертный растворитель; или она могла сделать инъекцию ГМГ вместо ХГЧ; или, возможно, неправильно рассчитали время; или, возможно, пролил лекарство и был слишком напуган, чтобы рассказать врачу о том, что случилось.
Правильное лечение синдрома пустого фолликула заключается в следующем. Во-первых, мы используем иглу с двойным просветом для сбора яйцеклеток и промываем каждый фолликул не менее 4 раз, ожидая найти по одной яйцеклетке в каждом фолликуле.Однако, если эмбриолог не обнаружит яйцеклеток после промывания трех зрелых фолликулов, мы прекращаем процедуру.
Мы проводим подробный анализ, чтобы убедиться, что пациент сделал триггерную инъекцию в нужное время. Чтобы поставить диагноз синдрома пустого фолликула, мы используем набор для быстрого домашнего теста на беременность, чтобы проверить мочу (полученную путем катетеризации) на наличие ХГЧ. (Вместо мочи также можно сделать анализ аспирированной фолликулярной жидкости.) Если пациентка правильно приняла ХГЧ, можно ожидать положительного результата теста на беременность. Это исключает диагноз синдрома пустого фолликула, и мы можем продолжить сбор яйцеклеток.
Однако, если тест на беременность отрицательный, диагноз синдрома пустого фолликула подтверждается. На этом этапе мы останавливаем процедуру, оставляя остальные фолликулы нетронутыми, и вывозим пациента из операционной. Мы делаем пациенту дополнительную инъекцию HMG для поддержки роста фолликулов.и сделайте анализ крови, чтобы измерить уровни эстрогена и ХГЧ. (Помните, что результаты анализов крови мы получим только через несколько часов.)
Затем мы делаем пациенту еще одну инъекцию ХГЧ и меняем график сбора яйцеклеток через 36 часов после этой второй инъекции ХГЧ. Если нас беспокоит качество инъекции ХГЧ, мы можем использовать рекомбинантный ХГЧ (например, Овитрелл), чтобы вызвать овуляцию, и мы также можем увеличить дозу ХГЧ до 20000 МЕ (вместо стандартных 10000 МЕ, которые мы обычно используем).
На следующий день смотрим результаты анализа крови. Мы ожидаем, что уровни эстрадиола будут высокими, а уровень ХГЧ будет менее 100 мМЕ / мл, что подтверждает диагноз EFS. Ультразвуковое сканирование в это время подтверждает, что фолликулы все еще не повреждены.
Во время второго извлечения яйцеклеток, которое запланировано через 36 часов после второй инъекции ХГЧ, мы ожидаем увидеть неповрежденные фолликулы и ожидаем извлечения яйцеклеток из каждого из этих фолликулов. Чтобы задокументировать диагноз, мы снова повторяем уровень ХГЧ в крови и ожидаем, что он будет более 100 мМЕ / мл.
Используя этот протокол, можно спасти ситуацию и дать пациентке очень хорошие шансы забеременеть!
Что такое фолликулы? Не яйца!
Мы часто говорим о фолликулах (ласково называемых «глупостями») во время процесса ЭКО. Но пациенты ЭКО часто не понимают разницы между фолликулами и яйцеклетками. В любом случае, если яйца не фолликулы, что такое ?
Фолликул — это анатомическая структура, в которой выделяется зрелая яйцеклетка или ооцит.Иногда врачи несут ответственность за путаницу между яйцеклетками и фолликулами, потому что мы обычно вольно называем фолликулы, которые мы видим на ультразвуковом сканировании, яйцами. Это особенно верно во время циклов ВМИ; или когда сонографист или техник делает сканирование. Когда она видит, что ваши яичники хорошо отреагировали на суперовуляцию, она часто говорит: «Хорошо, ваши яйца хорошо растут».
На самом деле яйца представляют собой микроскопические образования, которые нельзя увидеть на УЗИ.Их размер составляет всего 100 микрон (0,1 мм), и их может увидеть только эмбриолог в лаборатории ЭКО при сканировании фолликулярной жидкости, полученной от врача (собранной во время извлечения яйцеклеток) под стереомикроскопом.
Сканирование с отслеживанием фолликулов
Ультразвуковое сканирование позволяет нам отслеживать рост фолликулов в ваших яичниках. Фолликулы видны как крошечные черные пузырьки на сканированном изображении , потому что они содержат фолликулярную жидкость. Они бывают размером от 4 мм до 25 мм; и яйца растут внутри этих фолликулов.Однако не все фолликулы содержат яйца, поэтому корреляция между количеством фолликулов, видимых на ультразвуковом сканировании ЭКО, и количеством яйцеклеток, которые фактически извлекаются, не идеальна.
Когда все фолликулы растут с одинаковой скоростью (синхронная когорта), время срабатывания триггера ХГЧ намного проще. Однако часто рост бывает асинхронным; и некоторые фолликулы могут стать большими, а другие останутся маленькими . Врачу бывает очень сложно рассчитать ХГЧ у таких пациентов.
Почему количество фолликулов и яиц не всегда совпадает
Таким образом, вы можете быть разочарованы, когда врач получит меньше яиц по сравнению с количеством фолликулов, подсчитанным во время введения триггера ХГЧ. Это потому, что некоторые фолликулы маленькие и не содержат яиц ; в то время как другие большие и образовали кисты без яйцеклетки. По изображениям ультразвукового сканирования невозможно отличить кисту от большого фолликула. Только после того, как врач отправит фолликульную жидкость эмбриологу в лабораторию ЭКО, мы узнаем, есть ли в ней яйцеклетка или нет.
Возможные проблемы при извлечении яиц
Другая возможность получить меньше яиц, чем ожидалось, заключается в том, что у врача могут возникнуть технические проблемы во время извлечения яйцеклеток, и он не сможет достичь фолликула (например, когда пациент страдает ожирением и процедура выполняется без Общая анестезия). Некоторые врачи могут плохо справиться с аспирацией каждого фолликула и могут не собрать яйцеклетку, потому что они не промывают фолликул полностью, и яйцеклетка остается прилипшей к стенке фолликула; или потому что крови слишком много; или потому, что эмбриолог может не иметь опыта в идентификации яйца.
Это особенно верно, когда яиц всего несколько; или если врач неопытен; или если на этот день запланировано слишком много случаев и врач спешит завершить процедуру.
Синдром пустого фолликула — очень редкое осложнение
В очень редком случае синдрома пустого фолликула при попытке извлечения яйцеклеток в фолликулах отсутствуют яйцеклетки.
Скрытые фолликулы могут означать «лишние» яйца
Иногда мы также можем получить на яиц больше, чем количество фолликулов , подсчитанное при сканировании.Это связано с тем, что врачи могут не беспокоиться о тщательном подсчете всех фолликулов, обнаруженных на ультразвуковом сканировании; или что одни фолликулы прячутся за другими, поэтому их нельзя увидеть во время сканирования.
Даже если врачу удастся извлечь все яйца, помните, что не все яйца созреют; и что не все будет удобрять .
Уровни эстрадиола говорят нам больше о фолликулах
Поскольку нас интересует качество и количество яйцеклеток, мы также отслеживаем уровень эстрадиола в крови во время цикла ЭКО.Эстрадиол вырабатывается не яйцеклеткой, а клетками гранулезы, выстилающими фолликул. По мере созревания фолликула он увеличивается в размерах, а также увеличивается количество клеток гранулезы, в результате чего уровень эстрадиола прогрессивно повышается. Уровни эстрадиола помогают нам определить, когда фолликулы созреют. , поэтому мы можем правильно рассчитать триггер ХГЧ и максимально увеличить количество зрелых яйцеклеток, которые мы извлекаем.
Хотя корреляция между уровнем эстрадиола и количеством собранных зрелых яиц довольно хорошая, она не всегда идеальна.Вот почему врачи ЭКО нуждаются в большом опыте и знаниях при интерпретации этих снимков.
