Повышены лимфоциты при беременности: повышены лимфоциты при беременности — 25 рекомендаций на Babyblog.ru
норма, о чем это говорит, способы лечения отклонений
Материалы публикуются для ознакомления, и не являются предписанием к лечению! Рекомендуем обратиться к врачу-гематологу в вашем лечебном учреждении!
Соавторы: Марковец Наталья Викторовна, врач-гематолог
В период беременности женский организм подвергается изменениям, за течением которых необходимо следить. В частности, это касается количества лимфоцитов в крови. Их понижение или повышение может иметь разные причины и последствия.
Содержание:
- Что такое лимфоциты, их роль в организме
- Отклонения от нормы
- Пониженные значения
- Лимфоцитоз
Пониженные лимфоциты при беременности — это частое явление. Важно следить за граничным значением, чтобы не допустить ослабления организма и развития неприятных последствий. Также может встречаться увеличение количества этих кровяных телец. Рассмотрим ситуацию подробнее.
Необходимо регулярно следить за составом крови при беременности
Что такое лимфоциты, их роль в организме
Основными защитниками организма являются лимфоциты. При беременности некоторые их функции могут сыграть негативную роль, если будет нарушен баланс. Эти белые кровяные тельца выполняют такие задачи:
При беременности некоторые их функции могут сыграть негативную роль, если будет нарушен баланс. Эти белые кровяные тельца выполняют такие задачи:
- идентифицируют чужеродные или мутировавшие клетки;
- вырабатывают антитела для борьбы с чужеродными агентами;
- оказывают цитотоксическое действие;
- формируют иммунитет.
Основные функции лимфоцитов
Если лимфоциты ниже нормы при беременности, с одной стороны, это способствует защите плода от влияния агрессивных клеток, а с другой — делает организм будущей матери более уязвимым к болезням.
Отклонения от нормы
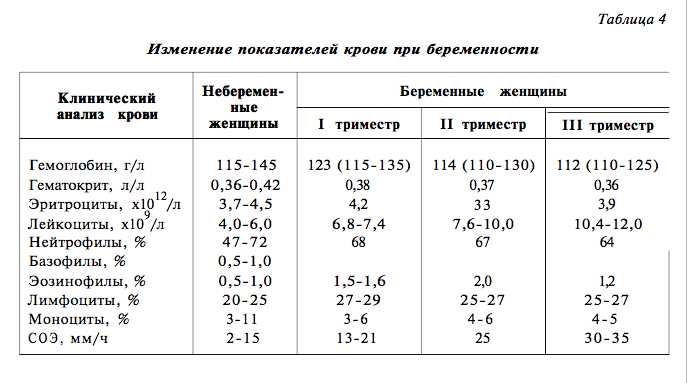
У женщин в положении состав крови подвергается изменениям, в том числе затрагиваются и лимфоциты. При беременности норма зачастую сдвигается влево, то есть в сторону уменьшения процентного значения. При этом изменяется и внутренняя структура лимфоцитарной формулы.
| Клинический анализ крови | Небеременные женщины | Беременные женщины | ||
| 1 триместр | II триместр | III триместр | ||
| Гемоглобин, г/л | 115-145 | 123(116-135) | 114(110-130) | 112(110-125) |
| Гематокрит, л/л | 0.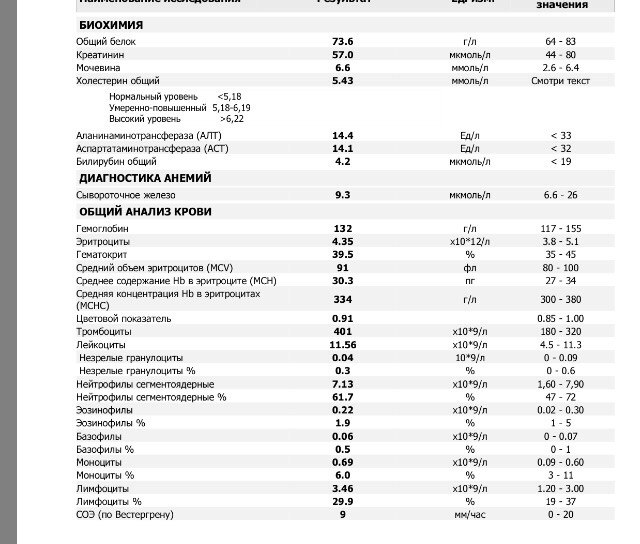 36-0.42 36-0.42 | 0.38 | 0.37 | 0.36 |
| Эритроциты, х 1012/л | 3.7-4.5 | 4.2 | 3.5 | 3.9 |
| Цветной показатель | 0.86-1.05 | 0.86-1.05 | ||
| Ретикулоциты, % | 0.5-1.2 | 2-12 | ||
| Лейкоциты, х 10°/л | 4.0-6.0 | 6.8-7,4 | 7.6-10.0 | 10.4-12.0 |
| Нейтрофилы, % | 47-72 | 68 | 67 | 64 |
| Базофилы, % | 0.5-1.0 | — | — | — |
| Эозинофилы, % | 0.5-1.0 | 1.5-1.6 | 2.0 | 1.2 |
| Лимфоциты, % | 20-25 | 27-29 | 25-27 | 25-27 |
| Моноциты, % | 3-11 | 3-6 | 4-6 | 4-5 |
| СОЭ, мм/ч | 2-15 | 13-21 | 25 | 30-35 |
| Тромбоциты, х 10э/л | 130-400 | 130-400 | ||
Таблица: Нормы содержания кровяных телец до и в период беременности
Прочитайте также статью Лейкоциты в крови при беременности на нашем портале.
Нормой считается значение в пределах 18–40%. Если оно опускается ниже 16%, говорят о лимфоцитопении, а при повышении свыше 45–50% возникает риск развития лимфоцитоза. О чем это говорит и в чем заключаются причины отклонений — рассмотрим подробнее.
Пониженные значения
Достаточно часто наблюдается ситуация, когда лимфоциты в крови понижены. При беременности такая реакция организма считается естественной, так как он намеренно снижает защитный барьер, чтобы дать возможность адаптироваться плоду и предотвратить его отторжение.
Видео доктора Комаровского о повышенном уровне лейкоцитов при беременности
Обычно снижаются не все показатели. Наибольшие изменения касаются Т-киллеров и В-клеток, так как именно они борются с чужеродными клетками и вырабатывают антитела. Супрессоры же становятся более многочисленными и активными, чтобы подавить агрессивную реакцию остальных лимфоцитов.
Супрессоры же становятся более многочисленными и активными, чтобы подавить агрессивную реакцию остальных лимфоцитов.
Так как понижены лимфоциты, при беременности женщина становится более слабой и восприимчивой к заболеваниям. Важно в этот период избегать источников заражения, полноценно питаться и принимать витамины.
Совет: рекомендуется укрепить иммунитет минимум за 3-4 месяца до планируемого зачатия.
Женщина становится более восприимчива к болезням
Если лимфоциты понижены у беременных менее чем до 16%, стоит провериться на наличие таких заболеваний:
- апластическая анемия;
- туберкулез;
- лимфогранулематоз;
- волчанка;
- аутоиммунные патологии;
- онкология.
Лечение заключается в устранении причин отклонений и приеме стимулирующих препаратов. В связи с беременностью терапия проводится под строгим наблюдением врача.
Лимфоцитоз
Гораздо более опасным явлением считается ситуация, когда лимфоциты при беременности повышены. Незначительное их увеличение может быть спровоцировано инфекцией или аллергической реакций, то есть иммунным ответом организма.
Незначительное их увеличение может быть спровоцировано инфекцией или аллергической реакций, то есть иммунным ответом организма.
Когда отклонения превышают 15% барьер, развивается лимфоцитоз. Он представляет прямую угрозу для ребенка, так как плод воспринимается лимфоцитами, как инородное тело, что связано с наличием генов отца. Клетки начинают атаковать «чужака», провоцируя его отторжение, то есть выкидыш.
Лимфоцитоз может спровоцировать выкидыш
Важно: для устранения подобных рисков нужно следить за анализами и при необходимости принимать лекарства, которые подавляют выработку агрессивных клеток.
Постоянный контроль над здоровьем будущей матери — это основа правильного развития ребенка в ее утробе.
Рекомендуем изучить похожие материалы:
- 1. Причины и опасности повышения уровня базофилов у детей
- 2. Причины повышения или понижения нейтрофилов в анализе крови у детей?
- 3. Функции и возможные причины патологий сегментоядерных нейтрофилов
- 4.
 Что значат повышенные эозинофилы в анализе крови у взрослых?
Что значат повышенные эозинофилы в анализе крови у взрослых? - 5. Правильное питание при повышенном уровне билирубина в крови
- 6. Что делать при повышенном уровне билирубина во время беременности?
- 7. Что делать при повышении уровня базофилов и что это может означать?
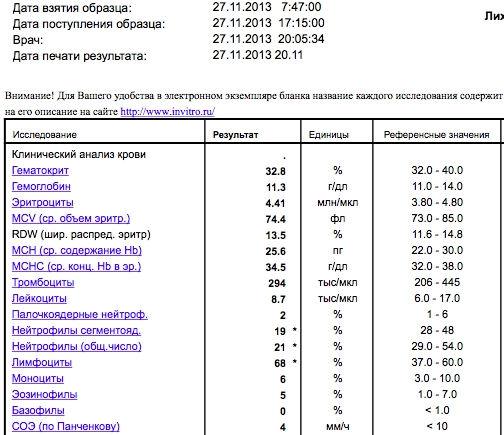
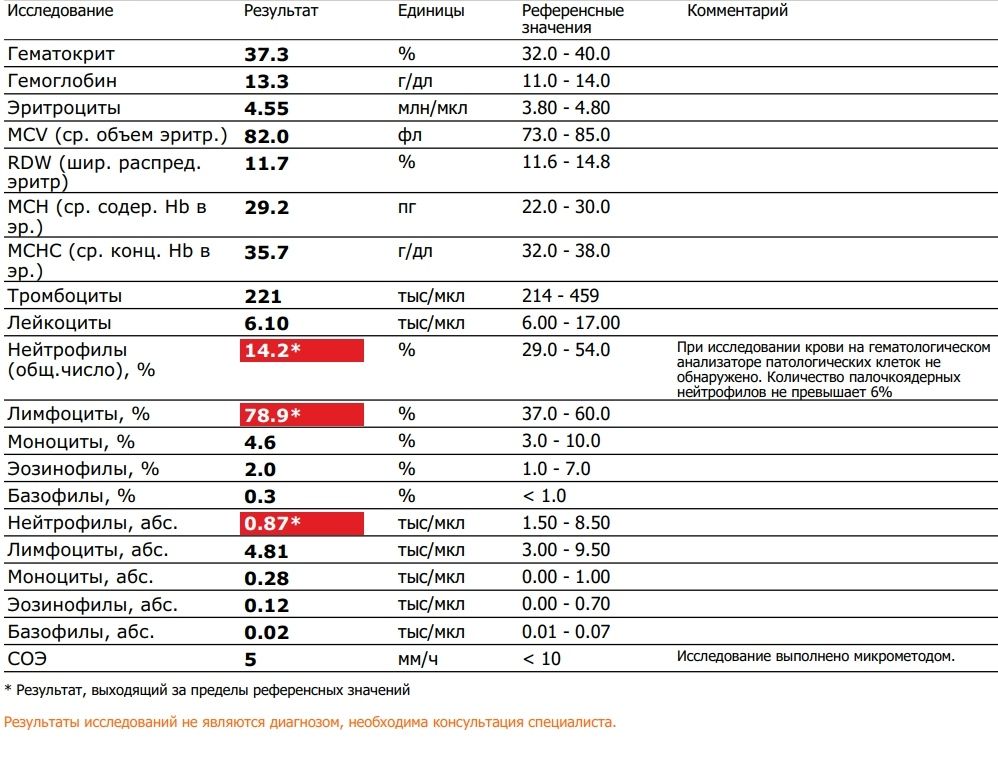
О чем говорит уровень лимфоцитов в крови при беременности. Норма лимфоцитов в крови во время беременности. Понижены или повышены лимфоциты при беременности — что делать
11 ноября 20180
В период беременности женщина в обязательном порядке сдает анализ крови, чтобы врач мог следить за состоянием ее здоровья. Среди многих показателей особое место занимают лимфоциты. Эти кровяные клетки являются стражами здоровья женского организма. Их резкое повышение или снижение свидетельствует о многих заболеваниях, поэтому регулярное определение их уровня является обязательным. Каким должен быть показатель лимфоцитов в крови при беременности, и каковы причины отклонения от нормы?
Содержание
- Лимфоциты при беременности: общие понятия
- Лимфоциты при беременности — норма
- Возможные причины отклонения лимфоцитов от нормы при беременности
- Почему при беременности повышены лимфоциты
- Причины пониженных лимфоцитов при беременности
- Как стабилизировать уровень лимфоцитов при беременности
Лимфоциты при беременности: общие понятия
Лимфоциты — тип лейкоцитов, которые называют белыми кровяными тельцами. У этих клеток очень важное предназначение: они защищают организм от всех вирусно-бактериальных инфекций. Являясь стражами иммунитета, лимфоциты отвечают за выработку антител, а также поддерживают клеточный иммунитет (обеспечивают взаимодействие антител с вредоносными клетками). Во взрослом организме лимфоциты составляют около 40% общего числа лейкоцитов, что равно около 1000 клеткам в 1 мкл.
У этих клеток очень важное предназначение: они защищают организм от всех вирусно-бактериальных инфекций. Являясь стражами иммунитета, лимфоциты отвечают за выработку антител, а также поддерживают клеточный иммунитет (обеспечивают взаимодействие антител с вредоносными клетками). Во взрослом организме лимфоциты составляют около 40% общего числа лейкоцитов, что равно около 1000 клеткам в 1 мкл.
Существует несколько разновидностей лимфоцитов, каждая из которых выполняет определенные функции. Образование клеток происходит в костном мозге, после чего лимфоциты высвобождаются и разносятся по организму.
В зависимости от функционального назначения лимфоциты бывают трех видов:
- В-клетки ― они распознают «чужеродных агентов», и начинают продуцировать антитела, которые уничтожают инфекцию.
- Т-киллеры ― регулируют иммунную систему, повышая ее активность в период болезни, и замедляя после выздоровления.
- NK-лимфоциты ― являются «контролерами качества» всех клеток организма.
 Именно они распознают генетически неправильные (раковые) клетки и уничтожают их.
Именно они распознают генетически неправильные (раковые) клетки и уничтожают их.
Контролировать работоспособность лимфоцитов позволяет обычный анализ крови. Благодаря микроскопическому исследованию определяют количество лимфоцитов, и делают вывод о состоянии здоровья человека. Повышение уровня лимфоцитов указывает на инфекционное заболевание, патологии крови и лимфатической системы. А снижение лимфоцитов может говорить о снижении иммунной функции, а также о приеме определенных лекарственных средств.
Лимфоциты при беременности — норма
В период беременности формула крови женщины немного видоизменяется: одни показатели превышают норму, другие, наоборот, опускаются к нижней границе. Без каких-либо патологических признаков болезни такие изменения считаются нормой. Много беспокойств вызывает показатель лимфоцитов у беременной женщины. Сразу отметим, что он может значительно отличаться от нормы для не беременных дам и не должен быть причиной паники.
У 80% женщин лимфоциты понижены при беременности.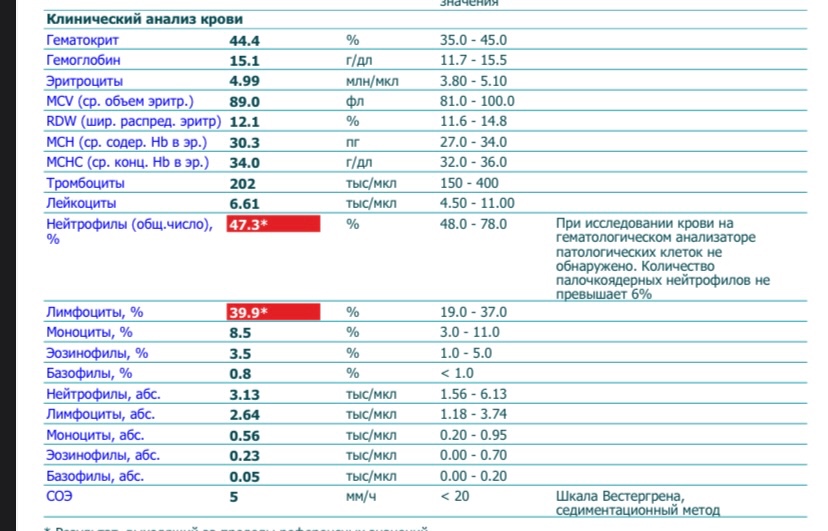 Это результат незначительного транзиторного снижения иммунитета с целью сохранности беременности. Тем не менее, снижение показателя носит лишь временный характер, и если ближе ко второй половине беременности он не приходит в норму, проводят дополнительные исследования.
Это результат незначительного транзиторного снижения иммунитета с целью сохранности беременности. Тем не менее, снижение показателя носит лишь временный характер, и если ближе ко второй половине беременности он не приходит в норму, проводят дополнительные исследования.
Если же при беременности организм не снижает синтез лимфоцитов и они превышают верхнюю границу референтного значения, у женщин может нарушиться течение беременности и даже случиться выкидыш.
Что же является нормой при беременности? Врачи придерживаются международной нормы показателей лимфоцитов во время беременности, которая составляет от 18 до 45% общего числа лейкоцитов.
Возможные причины отклонения лимфоцитов от нормы при беременности
Колебания уровня лимфоцитов при беременности могут происходить по разным причинам. Не всегда снижение и повышение этого показателя указывает на болезнь, но это не означает, что стоит упускать это из вида. Необходимо точно узнать причину такого явления и убедиться, что здоровью женщины ничего не угрожает.
Почему при беременности повышены лимфоциты
Повышение лимфоцитов при беременности часто происходит по вине самой беременности. Лимфоциты беспрерывно «проверяют» женский организм на наличие чужеродных клеток и как только в ней зарождается новая жизнь, лимфоциты активизируются и их количество возрастает. Дело в том, что эмбрион, помимо материнской ДНК, содержит белки отца будущего малыша, которые лимфоциты воспринимают как угрозу. Чтобы предотвратить «атаку» на плод организм снижает иммунную функцию, и уровень лимфоцитов вскоре понижается.
Однако есть ряд причин, которые вызывают не физиологический лимфоцитоз (повышение лимфоцитов), а патологический. Так, причиной повышения лимфоцитов может быть:
- Бактериально-вирусная инфекция.
- Гнойное воспаление (аппендицит, ангина, перитонит).
- Воспаление органов репродуктивной системы.
- Аллергия.
Важно! Устойчивый лимфоцитоз при беременности требует обязательного лечения, поскольку может стать причиной прерывания беременности.
Чтобы выяснить причину патологического состояния, женщину направляют на полный медицинский осмотр.
В редких случаях у женщины реактивные лимфоциты повышены при беременности. Это атипичный тип лимфоцитов, появление которого в анализе крови свидетельствует о неблагополучии. Такое случается в таких случаях:
- Инфекционный мононуклеоз.
- Уремия.
- Онкологический процесс.
- Токсоплазмоз.
- Гепатит.
- Эклампсия.
- Герпесная инфекция.
Лимфоцитоз также может быть вызван приемом некоторых препаратов:
- Офлокацин.
- Дексаметазон.
- Левадопа.
Важно! Если у женщины лимфоциты повышены при беременности длительное время, необходимо исключить онкологическое заболевание лимфатической системы, а именно лимфому.
Причины пониженных лимфоцитов при беременности
Низкие лимфоциты при беременности в первой половине беременности считаются физиологической нормой, если самочувствие женщины в порядке и нет никаких патологических симптомов.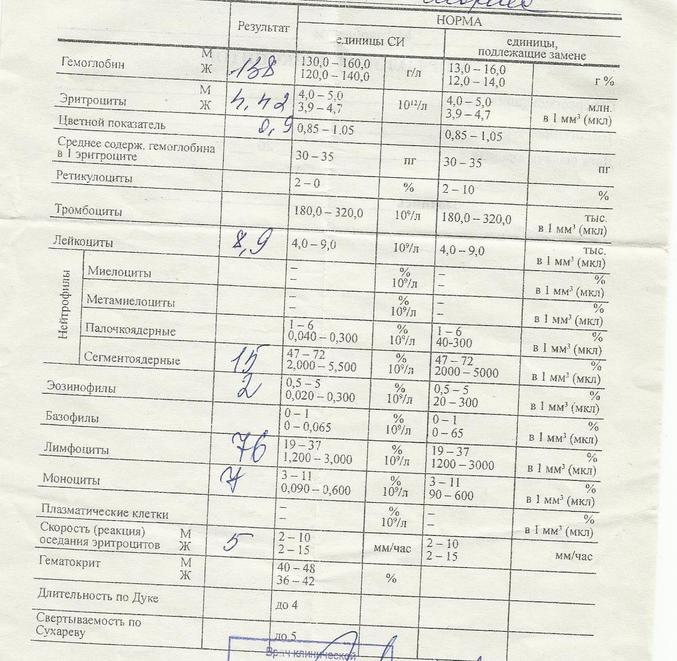
Однако под маской лимфопении (снижения концентрации лимфоцитов) могут скрываться некоторые заболевания, а именно:
- корь;
- краснуха;
- эндокринные заболевания;
- дисфункция почек;
- гепатит.
Кроме того, падение лимфоцитов при беременности может быть следствием:
- Интоксикации организма в результате воздействия химических соединений.
- Дефицита витаминов и минералов.
- Красной волчанки.
- Анемии по причине кровопотери.
- Иммунодефицита.
- Заболевания костного мозга (метастазы, гранулематоз).
В момент интерпретации результатов анализа важно выяснить, не принимала ли беременная женщина какие-либо препараты. Известно, что лимфоциты могут снижаться на фоне приема таких лекарств:
- Аспарагиназа.
- Фуросемид.
- Цефтриаксон.
- Фолиевая кислота.
- Препараты на основе ибупрофена.
- Глюкокортикоиды.
На заметку! Падение лимфоцитов на ранних сроках беременности встречается у каждой второй беременной женщины.
Если видимых признаков болезни нет, анализ повторяют через месяц. В большинстве случаев за это время показатели крови приходят в норму.
Как стабилизировать уровень лимфоцитов при беременности
Кратковременное отклонение лимфоцитов от нормы при беременности не нуждается в лечении. Тем не менее необходимо регулярно проводить анализ крови и следить за самочувствием беременной женщины.
Если уровень лимфоцитов не приходит в норму в течение длительного времени, врачу необходимо провести диагностику и выяснить причину. После лечения основного заболевания лимфоциты придут в норму.
Что же касается пониженного уровня лимфоцитов на фоне беременности, важно понимать, что в таких условиях женщина беззащитна перед вирусами и бактериями. Чтобы поддержать сниженный иммунитет желательно хорошо питаться и проходить курсы витаминотерапии по назначению доктора.
Чтобы беременность протекала хорошо, нужно проходить все назначенные исследования. Если же в анализе крови вы заметили изменения в худшую сторону, не стоит паниковать. Возможно, уровень лимфоцитов вскоре стабилизируется, и поводов для беспокойства нет.
Возможно, уровень лимфоцитов вскоре стабилизируется, и поводов для беспокойства нет.
Автор статьи:
Надежда Стойко
Ретикулоциты (определение уровня в крови)
Поиск по сайту
Артикул: 00310
Стоимость анализа
в интернет-магазине: скидка 7%!
Обычный
456руб
Экспресс
911руб
в лаборатории:
Обычный
490руб
Экспресс
980руб
стоимость указана без учета стоимости забора биологического материала
Добавить в корзину
Готовность результатов анализа
Обычные*: в тот же день (при условии сдачи до 12.00)
Дата сдачи анализа:
Дата готовности:
*не считая дня сдачи.
Экспресс
Где и когда можно сдать
- Бунинская аллея
- Войковская
- Дубровка
- Марьино
- Новокузнецкая
- Подольск
- Будни: с 7.45 до 12.00
- Выходные: с 8.45 до 12.00
Изменения в графике работы
Подготовка к анализу
Общие рекомендации по сдаче анализов
Натощак, не менее 8 часов после последнего приема пищи.
Забор биоматериала
- Забор крови для проведения лабораторных исследований
Методы выполнения и тесты
Микроскопия со специальной окраской. Количественный, ‰
Файлы
Скачать образец результата анализа
Для чего это нужно
Ретикулоциты — непосредственные предшественники зрелых эритроцитов; показатель отражает продукцию эритроцитов в красном костном мозге (оценка эритропоэза). Исследование количества ретикулоцитов проводится при состояниях, которые сопровождаются кровопотерей, анемиях, после лечения цитотоксическими препаратами, трансплантации костного мозга.
Исследование количества ретикулоцитов проводится при состояниях, которые сопровождаются кровопотерей, анемиях, после лечения цитотоксическими препаратами, трансплантации костного мозга.
Условия сдачи анализа
Натощак (не менее 8 часов после последнего приема пищи).
Также спрашивают:
- Общий анализ крови (ОАК, с лейкоцитарной формулой и СОЭ)
- Общий анализ мочи
- Панель онкомаркеров для женщин
- Расширенная гемостазиограмма
С этим анализом сдают:
- Железо (Fe) (определение уровня в крови)
- Ненасыщенная железосвязывающая способность сыворотки (НЖСС) (определение уровня в крови)
- Процент насыщения трансферрина (железо, трансферрин, НЖСС и процент насыщения трансферрина) (определение в крови)
- Трансферрин (определение уровня в крови)
- Ферритин (определение уровня в крови)
- Эритропоэтин (определение уровня в крови)
Теги:
ретикулоциты, анемия, кровопотеря, эритроциты, трансплантация, жда, железодефицитная анемия, красный костный мозг
Как сдать анализы в Лабораториях ЦИР?
Для экономии времени оформите заказ на анализ в Интернет-магазине! Оплачивая заказ онлайн, Вы получаете скидку 7% на весь оформленный заказ!
У Вас есть вопросы? Напишите нам или позвоните +7 (495) 514-00-11. По анализам Вы можете задать вопрос на нашем форуме и обратиться на консультацию к специалисту.
По анализам Вы можете задать вопрос на нашем форуме и обратиться на консультацию к специалисту.
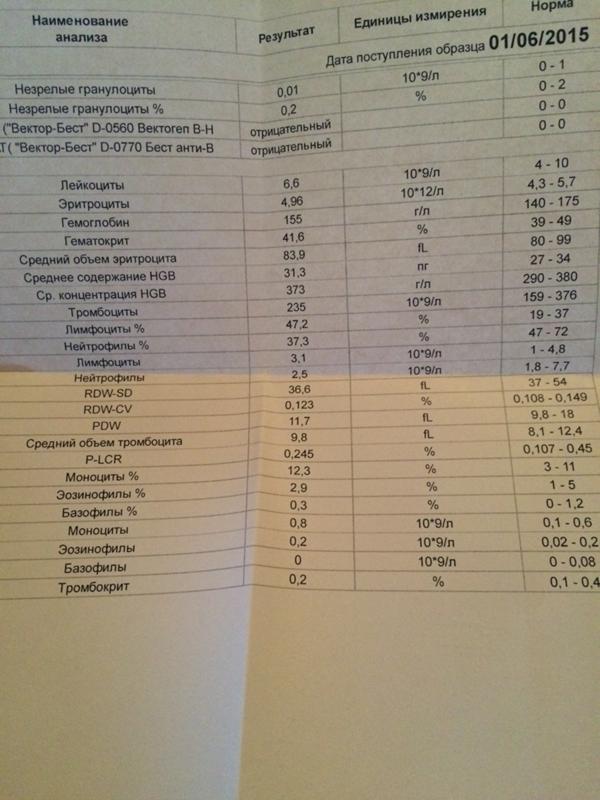
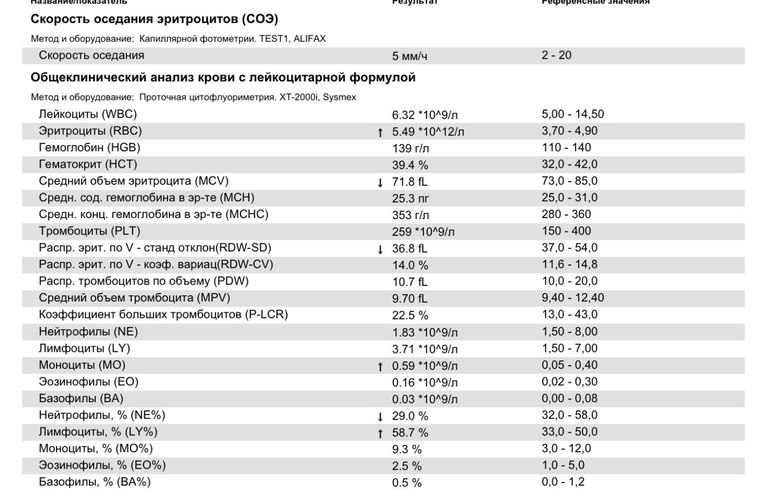
Норма общего анализа крови во время беременности. Гемоглобин, тромбоциты, гематокрит, эритроциты и лейкоциты при беременности. Клинический анализ крови во время беременности. Гематологические изменения при беременности.
Перевод материалов сайта UpTodate.com
Нормально протекающая беременность характеризуется значительными изменениями почти во всех органах и системах для приспособления к требованиям фетоплацентарного комплекса, в том числе, во время беременности меняются показатели анализов крови.Железодефицитная анемия. Какие анализы сдавать
Наиболее распространенной формой анемии является железодефицитная анемия (ЖДА), для диагностики которой проводится клиническое и лабораторное обследование.Фолиевая кислота в сыворотке крови, фолатный статус, витамин В12
Фолиевая кислота — водорастворимый витамин, необходимый для деления клеток.
 Недостаток фолиевой кислоты в организме может быть причиной анемии (фолиеводефицитная анемия) и гипергомоцистеинемии.
Недостаток фолиевой кислоты в организме может быть причиной анемии (фолиеводефицитная анемия) и гипергомоцистеинемии.Основные тесты в диагностике анемий
Скрининговое обследование диагностика железодефицитной анемии, выявление латентного дефицита железа и анемии
Общий анализ крови, клинический анализ крови
ЖСС, железосвязывающая способность сыворотки
Сывороточное железо
При подготовке…HLA-типирование
HLA-типирование супругов (гистосовместимость супругов)
HLA антигены (human leucocyte antigens) тканевой совместимости (cиноним: MHC — major histocompatibility complex — главный комплекс гистосовместимости)Анализы у детей
Врач-педиатр, к.м.н.Овсянников Д.Ю.
- Общий анализ крови у детей, частые показания
- Биохимический анализ крови у детей, частые показания
- Гемостазиограмма
Гемоглобин
Гемоглобин (от др.
 -греч. Гемо — кровь и лат. globus — шар) – это сложная белковая молекула внутри красных клеток крови – эритроцитов (у человека и позвоночных животных). Гемоглобин составляет примерно 98% массы всех белков эритроцита.
-греч. Гемо — кровь и лат. globus — шар) – это сложная белковая молекула внутри красных клеток крови – эритроцитов (у человека и позвоночных животных). Гемоглобин составляет примерно 98% массы всех белков эритроцита.
Стоимость анализа
в интернет-магазине: скидка 7%!
Обычный
456руб
Экспресс
911руб
в лаборатории:
Обычный
490руб
Экспресс
980руб
стоимость указана без учета стоимости забора биологического материала
Добавить в корзину
Готовность результатов анализа
Обычные*: в тот же день (при условии сдачи до 12.00)
Дата сдачи анализа:
Дата готовности:
*не считая дня сдачи.
Экспресс
Где и когда можно сдать
- Бунинская аллея
- Войковская
- Дубровка
- Марьино
- Новокузнецкая
- Подольск
- Будни: с 7.
 45 до 12.00
45 до 12.00 - Выходные: с 8.45 до 12.00
Изменения в графике работы
Подготовка к анализу
Общие рекомендации по сдаче анализов
Натощак, не менее 8 часов после последнего приема пищи.
Забор биоматериала
- Забор крови для проведения лабораторных исследований
Методы выполнения и тесты
Микроскопия со специальной окраской. Количественный, ‰
Файлы
Скачать образец результата анализа
Протромбиновое время, МНО, протромбин по Квику
Поиск по сайту
Артикул: 00207
Стоимость анализа
в интернет-магазине: скидка 7%!
Обычный
265руб
Экспресс
530руб
в лаборатории:
Обычный
285руб
Экспресс
570руб
стоимость указана без учета стоимости забора биологического материала
Добавить в корзину
Готовность результатов анализа
Обычные*: в тот же день (при условии сдачи до 12. 00)
00)
Дата сдачи анализа:
Дата готовности:
*не считая дня сдачи.
Экспресс
Где и когда можно сдать
- Бунинская аллея
- Войковская
- Дубровка
- Марьино
- Новокузнецкая
- Подольск
- Будни: с 7.45 до 12.00
- Выходные: с 8.45 до 12.00
Изменения в графике работы
Подготовка к анализу
Натощак, не менее 8 часов после последнего приема пищи, вне менструации.
Забор биоматериала
- Забор крови для проведения лабораторных исследований
Методы выполнения и тесты
Оптическая коагулометрия. Количественный, сек, %
Файлы
Скачать образец результата анализа
Этот анализ входит в блоки:
- Базовая гемостазиограмма (коагулограмма) + волчаночный антикоагулянт
- Базовая гемостазиограмма + волчаночный антикоагулянт + агрегация тромбоцитов с одним индуктором (АДФ)
- Базовая коагулограмма/гемостазиограмма
- БЛОК: Базовая коагулограмма/гемостазиограмма + Агрегация тромбоцитов с одним индуктором (АДФ)
- Расширенная гемостазиограмма
- Тромбофилические и аутоиммунные нарушения, БАЗОВОЕ обследование ЭКОНОМ
- Тромбофилические и аутоиммунные нарушения, ПОЛНОЕ РАСШИРЕННОЕ обследование
- Тромбофилические и аутоиммунные нарушения, СКРИНИНГОВОЕ обследование МИНИ
Значение анализов
Протромбиновое время — время, необходимое для свертывания плазмы при добавлении кальция и тканевого фактора. Метод воспроизводит внешний путь свертывания крови с оценкой так называемого протромбинового комплекса — факторов VII, X, протромбина. Во внешнем пути принимают участие витамин К-зависимые факторы свертывания, поэтому ПВ используется для оценки терапии непрямыми антикоагулянтами.
Метод воспроизводит внешний путь свертывания крови с оценкой так называемого протромбинового комплекса — факторов VII, X, протромбина. Во внешнем пути принимают участие витамин К-зависимые факторы свертывания, поэтому ПВ используется для оценки терапии непрямыми антикоагулянтами.
Читать дальше..
Также спрашивают:
- Блок анализов на ВИЧ, сифилис, гепатиты В и С
- Панель онкомаркеров для женщин
С этим анализом сдают:
- D-димер (определение уровня в крови)
- Активированный протеин С (определение уровня в плазме крови)
- Антитромбин III (определение уровня в плазме крови)
- Биохимический анализ крови, расширенный
- Блок аутоантител
- Гомоцистеин (определение уровня в крови)
Теги:
Протромбиновое время, протромбин по Квику, МНО
Как сдать анализы в Лабораториях ЦИР?
Для экономии времени оформите заказ на анализ в Интернет-магазине! Оплачивая заказ онлайн, Вы получаете скидку 7% на весь оформленный заказ!
У Вас есть вопросы? Напишите нам или позвоните +7 (495) 514-00-11. По анализам Вы можете задать вопрос на нашем форуме и обратиться на консультацию к специалисту.
По анализам Вы можете задать вопрос на нашем форуме и обратиться на консультацию к специалисту.
Что такое гемостазиограмма?
Система свертывания крови. Лабораторная диагностика нарушений гемостаза. Интерпретация результатов. Особенности гемостаза во время беременности. Молекулярно-генетические анализы. Функция тромбоцитов.
Стоимость анализа
в интернет-магазине: скидка 7%!
Обычный
265руб
Экспресс
530руб
в лаборатории:
Обычный
285руб
Экспресс
570руб
стоимость указана без учета стоимости забора биологического материала
Добавить в корзину
Готовность результатов анализа
Обычные*: в тот же день (при условии сдачи до 12. 00)
00)
Дата сдачи анализа:
Дата готовности:
*не считая дня сдачи.
Экспресс
Где и когда можно сдать
- Бунинская аллея
- Войковская
- Дубровка
- Марьино
- Новокузнецкая
- Подольск
- Будни: с 7.45 до 12.00
- Выходные: с 8.45 до 12.00
Изменения в графике работы
Подготовка к анализу
Натощак, не менее 8 часов после последнего приема пищи, вне менструации.
Забор биоматериала
- Забор крови для проведения лабораторных исследований
Методы выполнения и тесты
Оптическая коагулометрия. Количественный, сек, %
Файлы
Скачать образец результата анализа
| Витаминно-минеральные комплексы | |||||
| 00703 | [00703] Иммунная система (Fe, Cu, Zn, Cr, Mn, Se, Mg, Hg, Ni, Co, Li; Витамины: C, E, A, B9, B12, B5, B6, D) 19 986 руб | 21 490 руб | 19 986 руб | ||
| 00704 | [00704] Антиоксидантная система (Fe, Cu, Zn, S, Mn, Se, Mg, Co; Витамины: C, E, A, K, B2, B5, B6; омега-3, омега-6 жирные кислоты) 21 846 руб | 23 490 руб | 21 846 руб | ||
| 00705 | [00705] Детоксикационная система печени (Fe, Zn, S, Mо, Mg; Витамины: C, A, B1, B3, B5, B6, B9, B12) 15 336 руб | 16 490 руб | 15 336 руб | ||
| 00706 | [00706] Состояние кожи, ногтей, волос (K, Na, Ca, Fe, Cu, Zn, Mg, S, P; Витамины: C, E, A, B1, B2, B3, B5, B6, B9, B12) 18 591 руб | 19 990 руб | 18 591 руб | ||
| 00707 | [00707] Состояние костной системы (Fe, Cu, Zn, Ca, K, Si, Mg, S, P; Витамины: B9, B12, K, D) 9 254 руб | 9 950 руб | 9 254 руб | ||
| 00708 | [00708] Женская репродуктивная система (Fe, Cu, Zn, Cr, Mn, Se, Mg, Hg, Ni, Co, Pb, As, Cd; Витамины: A, C, Е; омега-3,омега-6 жирные кислоты) 15 801 руб | 16 990 руб | 15 801 руб | ||
| 00709 | [00709] Мужская репродуктивная система (Fe, Zn, Cr, Mn, Se, Ni, Co; Витамины: A, C, B9, B12) 7 673 руб | 8 250 руб | 7 673 руб | ||
| 00710 | [00710] Cистема кроветворения (Fe, Cu, Zn, Ca, Mg, Co, Mo; Витамины: B9, B12, B5, B6, D, E, K, омега-3, омега-6 жирные кислоты) 19 521 руб | 20 990 руб | 19 521 руб | ||
| 00711 | [00711] Сердечно-сосудистая система (K, Na, Ca, Fe, Cu, Zn, Mg, Mn, P; Витамины: B1, B5, E, B9, B12 ) 17 196 руб | 18 490 руб | 17 196 руб | ||
| 00712 | [00712] Поджелудочная железа — углеводный обмен (Cu, Zn, Cr, Mn, Mg, Ni, K; Витамины: A, B6) 5 571 руб | 5 990 руб | 5 571 руб | ||
| 00713 | [00713] Щитовидная железа (I, Se, Mg, Cu, Витамин B6) 4 362 руб | 4 690 руб | 4 362 руб | ||
| 00714 | [00714] Нервная система (Ca, Mg, Cu, P, Витамины E, B1, B5, B6, C) 18 591 руб | 19 990 руб | 18 591 руб | ||
| 00715 | [00715] Выделительная система (Ca, Mg, K, Na, Витамины: D, B6) 5 952 руб | 6 400 руб | 5 952 руб | ||
| 00716 | [00716] Желудочно-кишечный тракт (K, Mg, Fe, Zn, Витамины: K, D, B1, B5) 9 291 руб | 9 990 руб | 9 291 руб | ||
| 00884 | [00884] Коэнзим Q 10 4 613 руб | 4 960 руб | 4 613 руб | ||
| Витамины | |||||
| 00572 | [00572] Витамин В12 (цианкобаламин) (определение уровня в крови) 1 014 руб | 1 090 руб | 1 014 руб | ||
| 00573 | [00573] Фолиевая кислота (определение уровня в крови) 1 153 руб | 1 240 руб | 1 153 руб | ||
| 00600 | [00600] 25-ОН Витамин D (25-гидроксикальциферол, 25(OH)D) (определение уровня в крови) 1 376 руб | 1 480 руб | 1 376 руб | ||
| 00686 | [00686] Витамин А (ретинол) 2 269 руб | 2 440 руб | 2 269 руб | ||
| 00687 | [00687] Бета-каротин 2 362 руб | 2 540 руб | 2 362 руб | ||
| 00689 | [00689] Витамин K (филлохинон) 2 465 руб | 2 650 руб | 2 465 руб | ||
| 00690 | [00690] Витамин E (токоферол) 2 455 руб | 2 640 руб | 2 455 руб | ||
| 00691 | [00691] Витамин C (аскорбиновая кислота) 2 465 руб | 2 650 руб | 2 465 руб | ||
| 00692 | [00692] Витамин B1 (тиамин) 2 595 руб | 2 790 руб | 2 595 руб | ||
| 00693 | [00693] Витамин B2 (рибофлавин) 2 455 руб | 2 640 руб | 2 455 руб | ||
| 00694 | [00694] Витамин B3 (ниацин, никотиновая кислота) 2 595 руб | 2 790 руб | 2 595 руб | ||
| 00695 | [00695] Витамин B5 (пантотеновая кислота) 2 455 руб | 2 640 руб | 2 455 руб | ||
| 00696 | [00696] Витамин B6 (пиридоксин) 2 455 руб | 2 640 руб | 2 455 руб | ||
| 00697 | [00697] Витамины группы D (D2 и D3) 4 325 руб | 4 650 руб | 4 325 руб | ||
| 00698 | [00698] Водорастворимые витамины: B1, B5, B6, C 8 975 руб | 9 650 руб | 8 975 руб | ||
| 00699 | [00699] Жирорастворимые витамины: A, D, E, K 8 510 руб | 9 150 руб | 8 510 руб | ||
| 00700 | [00700] Витамины группы B: B1, B2, B3, B5, B6, B9, B12 11 616 руб | 12 490 руб | 11 616 руб | ||
| 00701 | [00701] Анализ крови на витамины (жирорастворимые, водорастворимые): A, D, E, K, C, B1, B5, B6 15 801 руб | 16 990 руб | 15 801 руб | ||
| 00702 | [00702] Расширенный анализ на витамины (жирорастворимые, водорастворимые): A, бета-каротин, D, E, K, C, B1, B2, B3, B5, B6, B9, B12 21 381 руб | 22 990 руб | 21 381 руб | ||
| Микроэлементы | |||||
| 00727 | [00727] Селен (Se) 828 руб | 890 руб | 828 руб | ||
| 00782 | [00782] Медь (Сu), цельная кровь, моча, волосы, ногти (метод ААС) 1 200 руб | 1 290 руб | 1 200 руб | ||
| 00784 | [00784] Йод (I), цельная кровь, моча, волосы, ногти (метод ААС) 1 200 руб | 1 290 руб | 1 200 руб | ||
| 00785 | [00785] Литий (Li), цельная кровь, моча, волосы, ногти (метод ААС) 1 200 руб | 1 290 руб | 1 200 руб | ||
| 00786 | [00786] Бор (B), цельная кровь, моча, волосы, ногти (метод ААС) 1 200 руб | 1 290 руб | 1 200 руб | ||
| 00787 | [00787] Алюминий (Al), цельная кровь, моча, волосы, ногти (метод ААС) 1 200 руб | 1 290 руб | 1 200 руб | ||
| 00788 | [00788] Кремний (Si), цельная кровь, моча, волосы, ногти (метод ААС) 1 200 руб | 1 290 руб | 1 200 руб | ||
| 00789 | [00789] Титан (Ti), цельная кровь, моча, волосы, ногти (метод ААС) 1 200 руб | 1 290 руб | 1 200 руб | ||
| 00790 | [00790] Марганец (Mn), цельная кровь, моча, волосы, ногти (метод ААС) 1 200 руб | 1 290 руб | 1 200 руб | ||
| 00791 | [00791] Хром (Cr), цельная кровь, моча, волосы, ногти (метод ААС) 1 200 руб | 1 290 руб | 1 200 руб | ||
| 00792 | [00792] Железо (Fe), цельная кровь, моча, волосы, ногти (метод ААС) 1 200 руб | 1 290 руб | 1 200 руб | ||
| 00793 | [00793] Кобальт (Co), цельная кровь, моча, волосы, ногти (метод ААС) 1 200 руб | 1 290 руб | 1 200 руб | ||
| 00794 | [00794] Никель (Ni), цельная кровь, моча, волосы, ногти (метод ААС) 1 200 руб | 1 290 руб | 1 200 руб | ||
| 00795 | [00795] Цинк (Zn), цельная кровь, моча, волосы, ногти (метод ААС) 1 200 руб | 1 290 руб | 1 200 руб | ||
| 00796 | [00796] Мышьяк (As), цельная кровь, моча, волосы, ногти (метод ААС) 1 200 руб | 1 290 руб | 1 200 руб | ||
| 00797 | [00797] Кадмий (Cd), цельная кровь, моча, волосы, ногти (метод ААС) 1 200 руб | 1 290 руб | 1 200 руб | ||
| 00798 | [00798] Сурьма (Sb), цельная кровь, моча, волосы, ногти (метод ААС) 1 200 руб | 1 290 руб | 1 200 руб | ||
| 00799 | [00799] Ртуть (Hg), цельная кровь, моча, волосы, ногти (метод ААС) 1 200 руб | 1 290 руб | 1 200 руб | ||
| 00800 | [00800] Свинец (Pb), цельная кровь, моча, волосы, ногти (метод ААС) 1 200 руб | 1 290 руб | 1 200 руб | ||
| 00801 | [00801] Натрий (Na), цельная кровь, моча, волосы, ногти (метод ААС) 1 200 руб | 1 290 руб | 1 200 руб | ||
| 00802 | [00802] Магний (Mg), цельная кровь, моча, волосы, ногти (метод ААС) 1 200 руб | 1 290 руб | 1 200 руб | ||
| 00803 | [00803] Калий (К), цельная кровь, моча, волосы, ногти (метод ААС) 1 200 руб | 1 290 руб | 1 200 руб | ||
| 00804 | [00804] Кальций (Са), цельная кровь, моча, волосы, ногти (метод ААС) 1 200 руб | 1 290 руб | 1 200 руб | ||
| 00805 | [00805] Молибден (Мо), цельная кровь, моча, волосы, ногти (метод ААС) 1 200 руб | 1 290 руб | 1 200 руб | ||
| 00808 | [00808] Микроэлементы: Кадмий, Ртуть, Свинец (Cd, Hg, Pb), цельная кровь, моча, волосы, ногти (метод ААС) 1 637 руб | 1 760 руб | 1 637 руб | ||
| 00809 | [00809] Микроэлементов и тяжелые металлы: Hg, Cd, As, Li, Pb, Al (6 показателей) (метод ИСП -МС), волосы, кровь, ногти, моча 2 390 руб | 2 570 руб | 2 390 руб | ||
| 00810 | [00810] Микроэлементы и тяжелые металлы: Se, Zn, Co, Mn, Mg, Cu, Fe, Ca, Hg, As, Pb, Cd, Al (13 показателей) (метод ИСП -МС), волосы, кровь, ногти, моча 3 023 руб | 3 250 руб | 3 023 руб | ||
| 00811 | [00811] Микроэлементы и тяжелые металлы: Li, B, Na, Mg, Al, Si, K, Ca, Ti, Cr, Mn, Fe, Co, Ni, Cu, Zn, As, Se, Mo,Cd, Sb, Hg, Pb (23 показателя) (метод ИСП -МС), волосы, кровь, ногти, моча 3 711 руб | 3 990 руб | 3 711 руб | ||
| 00812 | [00812] Микроэлементы и тяжелые металлы: Li, B, Na, Mg, Al, Si, K, Ca, Ti, Cr, Mn, Fe, Co, Ni, Cu, Zn, As, Se, Mo, Cd, Sb и другие (40 показателей) (метод ИСП -МС), волосы, кровь, ногти, моча 4 873 руб | 5 240 руб | 4 873 руб | ||
Что означает повышение лимфоцитов в крови
В статье дается подробный список причин повышения лимфоцитов в крови при инфекции, онкологии и неблагоприятных факторах. Врач-иммунолог рассказывает почему иммунная система человека реагирует на раздражители и зачем выявлять причину лимфоцитоза.
Врач-иммунолог рассказывает почему иммунная система человека реагирует на раздражители и зачем выявлять причину лимфоцитоза.
Лимфоциты — это главные клетки иммунной системы, которые отвечают за всю нашу внутреннюю защиту. Лимфоциты — это представители клеток белой крови, которые являются главными клетками иммунной системы. Их задача — стоять на нашей внутренней генетической чистоте.
В рамках консультации вы сможете озвучить свою проблему, врач уточнит ситуацию, расшифрует анализы, ответит на ваши вопросы и даст необходимые рекомендации.
Повышение лимфоцитов при инфекции
Повышение концентрации лимфоцитов называется лимфоцитоз. При этих заболеваниях мы будем видеть повышение количества лимфоцитов в крови:
- грипп. При гриппе всегда будет лимфоцитоз, независимо от того, какой он тяжести;
- в начальной стадии ВИЧ инфекции;
- инфекционный мононуклеоз – это заболевание, которое вызывается, как правило, вирусом герпеса четвёртого типа, и при нём тоже всегда будет лимфоцитоз;
- герпетическая инфекция, любого типа;
- при ветрянке, (герпес третьего типа) тоже всегда будет лимфоцитоз;
- любые вирусные гепатиты тоже будут изменять формулу крови, повышая уровень лимфоцитов;
- краснуха;
- коклюш;
- эпидемический паротит или в народе называется свинка;
- сифилис;
- туберкулёз;
Это основной перечень инфекционных заболеваний, при которых будет происходить повышение лимфоцитов в крови.
Мы сейчас с вами поговорили о лимфоцитозе, который возникает преимущественно при инфекционных заболеваниях. Но есть ряд заболеваний, которые могут вызвать лимфоцитоз и неинфекционной природы.
Лимфоцитоз при онкологии
Такое грозное заболевание, как лимфобластный лейкоз. Оно может быть острым, может быть хроническим. Естественно при этом грозном заболевании будет катастрофически в десятки, в сотни раз повышено количество лимфоцитов.
- Лимфогранулематоз – онкологическое заболевание с преимущественным поражением лимфоузлов всегда вызывает лимфоцитоз.
- Заболевание крови из серии онкологических, таких как лимфомы, всегда вызывают лимфоцитоз.
- Лимфосаркомы (опухоль из злокачественных клеток лимфоидных элементов)
- Миеломная болезнь (злокачественная опухоль)
Вот это те заболевания, при которых тоже мы можем видеть повышение количества лимфоцитов в периферической крови.
Прочие причины повышения лимфоцитов в анализе крови
Есть ещё и другие состояния, которые не связанны с онкологическими, инфекционными, паразитарными заболеваниями, но так же могут резко изменять работу иммунной системы и стимулировать её на повышение количества лимфоцитов.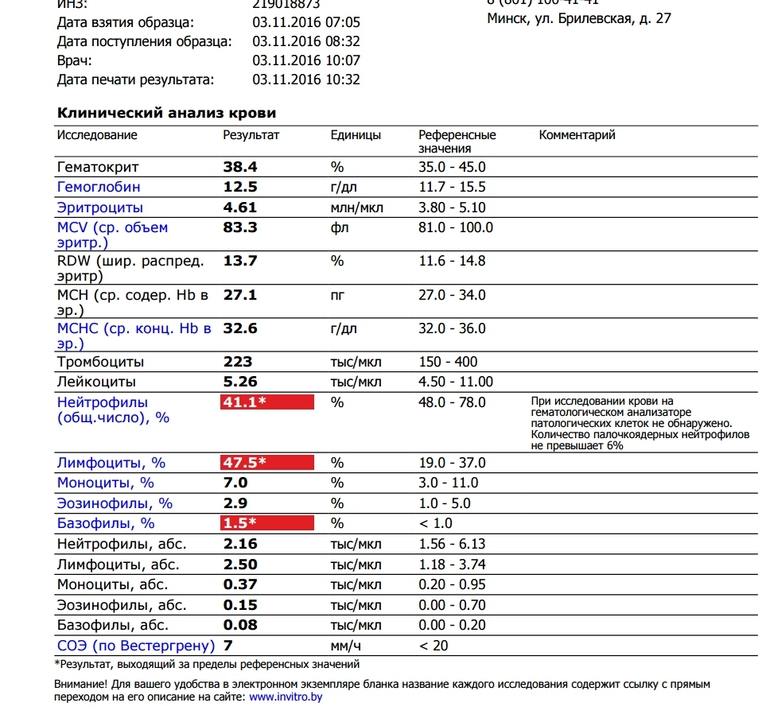
- Как правило, на фоне алкоголизма идёт хроническое истощение иммунной системы, но на первом этапе — бурный рост количества лимфоцитов.
- Частое курение тоже может вызвать излишнюю выработку лимфоцитов.
- Приём некротических веществ, лекарств. Некоторые анальгетики, антибиотики – могут вызывать повышение уровня лимфоцитов.
- В женском организме состояние перед менструацией может повышать количество лимфоцитов в крови.
- Длительное голодание, диеты.
- Употребление пищи богатой углеводами. Хотя тут несколько иной механизм, чаще это связано с не прямым воздействием углеводов на концентрацию лимфоцитов, а опосредованно, через разрастание бродильной и грибковой флоры в кишечнике, и уже микробиота кишечника будет стимулировать лимфоцитарное изменение.
- Поражение щитовидной железы, в частности гипотиреоз, тоже будет постоянно стимулировать повышенную концентрацию лимфоцитов.
- Некоторые аллергические состояния могут спровоцировать лимфоцитоз.
- Отравление токсическими веществами, такими как: свинец, мышьяк, дисульфид углерода, любое нарушение иммунитета, тоже может вызывать лимфоцитоз.
- Эндокринные нарушения, в первую очередь нарушение работы щитовидной железы, нарушение работы надпочечников, нарушение работы яичников, яичек, ранние стадии некоторых онкологических заболеваний, при которых идёт активация лимфоцитарного узла.
- Неврастения, стрессы.
- Недостаток витамина В12.
- Травмы, ранения, ожоги.
- Удаление селезёнки. Бывают ситуации, когда есть необходимость удалить селезёнку – это может стимулировать повышение концентрации лимфоцитов.
- Применение некоторых вакцин. При вакцинации мы всегда подразумеваем, что будет период повышения лимфоцитов. Это нормально, потому что мы вводиться вакцина, которая является либо частичкой, либо ослабленным возбудителем инфекционных заболеваний, и иммунная система будет вести себя как с обычным возбудителем.
- Интенсивное занятие спортом.
 Ибо чрезмерные физические нагрузки тоже могут привести к состоянию лимфоцитоза.
Ибо чрезмерные физические нагрузки тоже могут привести к состоянию лимфоцитоза. - Аутоиммунные заболевания, которые тоже могут привести к повышению уровня лимфоцитов в крови. В первую очередь это болезнь крона (тяжёлое хроническое иммуноопосредованное воспалительное заболевание желудочно-кишечного тракта).
- Ревматоидные артриты.
- Красная волчанка.
Заключение специалиста
Я не случайно остановилась так подробно на тех заболеваниях и состояниях, при которых мы будем видеть повышенную концентрацию лимфоцитов в крови. Сам по себе лимфоцитоз – не диагноз, это состояние, которое может отражать тот огромный перечень диагнозов о котором мы говорили. Поэтому если вы сдав общий анализ крови с подсчётом лейкоцитарной формулы, увидели, что концентрация лимфоцитов вышла за референсное значение, в зависимости от вашего возраста, то это должно быть для вас важным сигналом, для того, чтобы обратиться к врачу и разобраться, за из-за чего ваша иммунная система бурно работает, какое у вас заболевание есть, или какое состояние испытывает организм.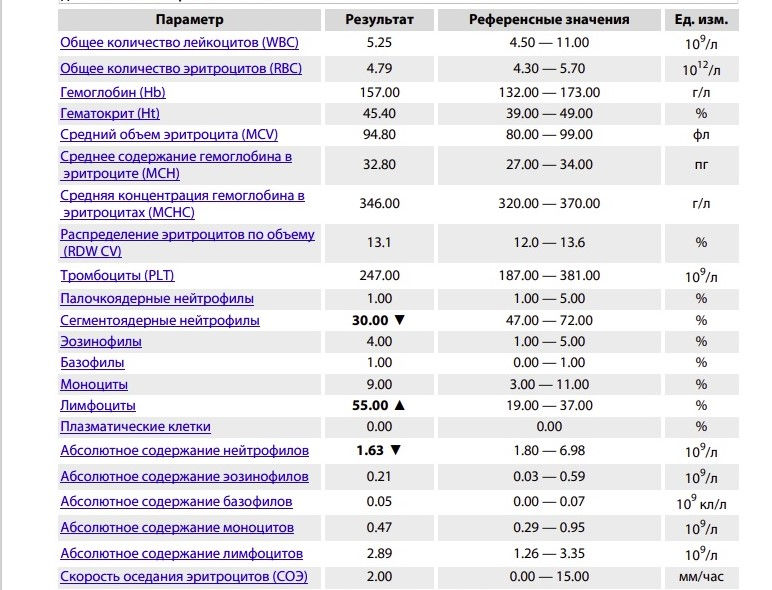
Всего вам хорошего и будьте здоровы. И пусть ваши клетки иммунной системы всегда стоят на страже и пребывают в коридоре нормы.
Диагностика заболеваний почек — довольно сложная задача, поскольку большая часть нефрологических болезней долгое время протекает бессимптомно. Специфические лабораторные тесты позволяют вовремя выявить нарушения работы почек и назначить эффективное лечение.
Какие анализы покажут заболевания почек? Как расшифровать результаты исследований? Читайте об этом в нашей статье!
Для чего нужно обследовать почки?
Почки — орган мочевыделительной системы, который выполняет много важных функций:
- выводит из организма избыток жидкости, органических и неорганических веществ, вредные и токсические соединения;
- секретирует фермент ренин, необходимый для поддержания нормального артериального давления;
- вырабатывает гормон эритропоэтин, контролирующий эритропоэз — процесс образования эритроцитов;
- поддерживает постоянство состава и pH крови;
- участвует в обмене веществ.
Однако при заболеваниях почек функциональность органа снижается, что приводит к изменению нормального состава крови, интоксикации организма и другим патологическим состояниям. Без своевременной диагностики многие нефрологические заболевания приводят к терминальной хронической почечной недостаточности — угрожающему жизни состоянию, при котором требуется заместительная терапия в виде гемодиализа или пересадки почки.
Для диагностики нарушения работы почек существуют специальные лабораторные тесты:
- на определенные показатели, которые отражают функциональное состояние почек;
- определение скорости клубочковой фильтрации (СКФ), проба Реберга;
- анализы мочи — общий анализ мочи, исследование на микроальбуминурию, проба Зимницкого, анализ мочи по Нечипоренко.
В каких ситуациях назначаются анализы?
Врач может назначить скрининг состояния почек при наличии у пациента симптомов, характерных для почечных патологий. Например, к таким признакам относятся отеки на лице и теле, высокое артериальное давление, тошнота, сниженный диурез. Также поводом для назначения скрининга могут стать сомнительные результаты общего анализа крови, общего анализа мочи и других базовых исследований.
Например, к таким признакам относятся отеки на лице и теле, высокое артериальное давление, тошнота, сниженный диурез. Также поводом для назначения скрининга могут стать сомнительные результаты общего анализа крови, общего анализа мочи и других базовых исследований.
Скрининг показан людям с высокой вероятностью развития заболеваний почек. К ним относятся пациенты с диабетом, системной красной волчанкой, гипертонической болезнью. Также скрининг может быть назначен после приема нефротоксичных препаратов.
Кроме этого, регулярный мониторинг необходим людям с хроническими заболеваниями почек для оценки течения болезни и эффективности лечения.
Почечные показатели биохимического исследования крови
Некоторых показатели биохимического исследования крови позволяют врачу сделать вывод о состоянии почек. Анализ проводится в утренние часы натощак. Подготовка к исследованию заключается в следующем:
- за сутки до забора биологического материала исключается прием алкоголя;
- между взятием крови и последним приемом пищи должно пройти не менее 12 часов;
- за час до сдачи анализа нужно отказаться от курения;
- перед исследованием можно употреблять только воду.
Рассмотрим основные показатели исследования, которые помогают обнаружить заболевания почек.
Креатинин
Вещество, которое образуется в мышечной ткани, далее поступает в кровь и выводится из организма почками. Первостепенной задачей креатинина является обеспечение организма энергией, необходимой для сокращения мышц. Уровень вещества в крови во многом зависит от мышечной массы. Именно поэтому его концентрация в крови у мужчин больше, чем у женщин и детей.
Креатинин относится к беспороговым веществам, которые не подвергаются процессу реабсорбции в почечных канальцах и полностью выводятся мочевыделительной системой при любой их концентрации в крови. При стабильной мышечной нагрузке и хорошей работе почек концентрация его в крови у человека достаточно постоянна. Поэтому уровень креатинина в крови напрямую отражает функциональное состояние почек.
Референсные значения показателя представлены в таблице ⇓⇓⇓
Уровень креатинина, мкмоль/л
Высокий уровень вещества в крови может указывать на следующие заболевания почек:
- острая почечная недостаточность — стремительно развивающееся нарушение функционирования почек;
- хроническая почечная недостаточность — постепенное угасание почечных функций;
- гломерулонефрит — поражение почечных клубочков, которое может быть следствием инфекции или аутоиммунного процесса;
- пиелонефрит — воспалительный процесс в почечных канальцах.
Также причиной высокого показателя может стать обструкция мочеточника, вызванная воспалительным процессом или механическим фактором. Например, обструкция может наблюдаться при мочекаменной болезни. Если камень попадает в мочеточник, то нарушается отток мочи, соответственно уровень креатинина в крови растет.
Высокий уровень показателя не всегда указывает на проблемы с почками. Концентрация вещества в крови повышается при лихорадке, травмах с разрушением тканей, обезвоживании, сильных физических нагрузках, преобладании мясных продуктов в рационе. Также повышенные значения креатинина могут наблюдаться при гипертиреозе, акромегалии, гигантизме.
Низкие значения наблюдаются на ранних сроках беременности, при длительном голодании или отсутствии в рационе мясных продуктов, избыточном содержании воды в организме.
Мочевина
Образование мочевины проходит в несколько этапов:
- При распаде белков образуется аммиак — токсичное для организма вещество.
- Аммиак нейтрализуется клетками печени, превращаясь в мочевину, которая выводится из организма почками.

Данное химическое соединение организм никак не использует, а только избавляется от него. Так как процесс образования мочевины непрерывный, небольшое количество вещества постоянно находится в крови. Референсные значения показателя представлены ниже ⇓⇓⇓
Как правило, повышение уровня мочевины в крови вызывают те же факторы, что и повышение уровня креатинина. А вот низкие показатели чаще всего указывают на патологии печени. Также показатель снижается при нефротическом синдроме, низкобелковой диете, гипергидратации, на ранних сроках беременности.
Мочевая кислота
Образуется в результате обмена пуринов — азотсодержащих веществ, входящих в состав нуклеиновых кислот. Кроме этого, мочевая кислота является результатом переваривания продуктов с высоким содержание пуринов. Большая часть вещества выводится из организма почками, меньшая — желудочно-кишечным трактом. Референсные значения содержания мочевой кислоты в крови представлены в таблице ⇓⇓⇓
Повышение показателя может быть признаком почечной недостаточности, а также:
- подагры — отложения в тканях кристаллов уратов;
- синдрома Леша-Нихена — наследственной патологии, при которой увеличен синтез мочевой кислоты;
- злокачественных заболеваний кроветворной системы;
- алкогольной интоксикации организма;
- приема мочегонных препаратов;
- преобладания в рационе продуктов, богатых пуринами — рыбы, телятины, субпродуктов, бобовых;
- избыточной физической нагрузки.
Низкий показатель наблюдается при дисфункции почечных канальцев. Например, уровень мочевой кислоты в крови снижается при синдроме Фанкони — наследственном заболевании, которое характеризуется общим нарушением проксимального канальцевого транспорта.
Другие причины низкого показателя — нарушения пуринового обмена, низкопуриновая диета.
Общий белок
Показатель отражает концентрацию всех белков в крови и служит маркером не только почечных патологий, но также заболеваний печени, щитовидной железы и других органов. Референсные значения показателя выглядят следующим образом ⇓⇓⇓
Высокое содержание общего белка в крови наблюдаются при:
- обезвоживании организма;
- острых и хронических инфекционных патологиях;
- аутоиммунных процессах;
- злокачественных образованиях.
Низкие значения показателя могут указывать на гломерулонефрит, нефротический синдром.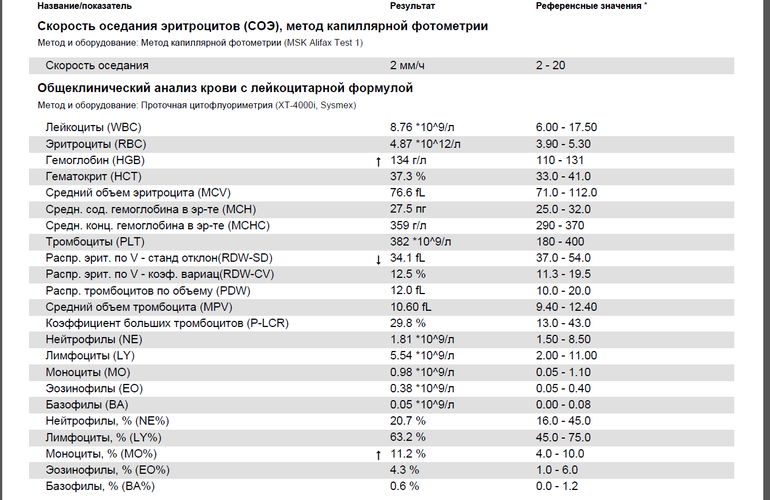 Кроме этого, концентрация белка в крови снижается при заболеваниях печени, кровотечениях, гиперфункции щитовидной железы, голодании, во время беременности, в период грудного вскармливания.
Кроме этого, концентрация белка в крови снижается при заболеваниях печени, кровотечениях, гиперфункции щитовидной железы, голодании, во время беременности, в период грудного вскармливания.
Скорость клубочковой фильтрации (СКФ), проба Реберга
Нефроны (структурные единицы почки) состоят из почечных клубочков и канальцев. В почечных клубочках происходит первый этап мочеобразования — фильтрация практически всех составляющих плазмы, кроме высокомолекулярных белков и форменных элементов крови. В почечных канальцах происходит обратная реабсорбция некоторых веществ, т.е. канальцевая реабсорбция отражает состояние концентрационной функции почек.
При некоторых патологиях почек этот процесс нарушается.
Для оценки функционального состояния различных отделов нефрона пользуются несколькими методиками: определение СКФ и проведение пробы Реберга. СКФ рассчитывается по специальной формуле, в которой отражаются возраст, пол, масса тела, рост, раса пациента и уровень креатинина в крови конкретного человека.
Проба Реберга — тест отражает несколько показателей: СКФ, канальцевую реабсорбцию и минутный диурез. Существуют несколько вариантов проведения пробы:
- Собирается суточное количество мочи. Первая утренняя порция урины пропускается в унитаз, время мочеиспускания фиксируется. Вся суточная моча, включая утреннюю порцию следующего дня, собирается в стерилизованный контейнер емкостью 2-3 литра. Последнее мочеиспускание должно совпадать со временем, отмеченным накануне. Во время сбора биологического материала контейнер с мочой должен храниться в холодильнике, но без замораживания. После сбора последней порции урины измеряется общий объем мочи. Биологический материал перемешивается, и от него в небольшой контейнер отбирают примерно 30-50 мл, контейнер маркируют, указывая суточный объем мочи. Например: «Диурез 1100 мл». Биологический материал как можно быстрее доставляется в лабораторию, где также выполняется забор крови из вены.
- В настоящее время чаще других используется вариант, не требующий сбора суточного количества мочи.
 Собирают двухчасовую порцию мочи и в этот промежуток времени забирают кровь из вены пациента. В лаборатории определяется уровень креатинина в моче и крови и по специальным формулам рассчитываются показатели минутного диуреза, СКФ, канальцевой реабсорбции.
Собирают двухчасовую порцию мочи и в этот промежуток времени забирают кровь из вены пациента. В лаборатории определяется уровень креатинина в моче и крови и по специальным формулам рассчитываются показатели минутного диуреза, СКФ, канальцевой реабсорбции.
Референсные значения клиренса креатинина представлены в таблице, единицы измерения — мл/мин/1,7 м².
Точность результатов исследования во многом зависит от правильной подготовки. В связи с этим за несколько дней до начала сбора урины нужно исключить:
- сильные физические нагрузки;
- употребление алкогольных напитков, кофеина;
- прием диуретиков, препаратов с содержанием аскорбиновой кислоты.
Также стоит ограничить употребление мясных продуктов.
Какие заболевания позволяет выявить исследование?
- Исследование клубочковой фильтрации имеет важное практическое значение, так как при ряде почечных патологий (хронический гломерулонефрит, волчаночный нефрит, диабетический гломерулосклероз) снижение СКФ является наиболее ранним признаком начинающейся хронической почечной недостаточности.
- Высокие значения СКФ — признак нефротического синдрома, начала развития сахарного диабета, артериальной гипертензии.
- Также показатель может отклоняться от референтных значений по физиологическим причинам. Например, повышение СКФ наблюдается при избытке белков в рационе, приеме диуретиков, обильном употреблении жидкости; снижение — при обезвоживании, при бессолевой диете.
- Снижение канальцевой реабсорбции рано наступает у больных поликистозом почек, при гидронефрозе, пиелонефрите. При заболеваниях почек, сопровождающимися преимущественным поражением клубочков (гломерулонефрит и др.), канальцевая реабсорбция снижается значительно позже, чем клубочковая фильтрация.
Другие лабораторные методы обследования почек
Также для диагностики заболеваний почек применяют такие методы исследования, как анализ мочи на микроальбуминурию, проба Зимницкого, анализ мочи по Нечипоренко.
Анализ на микроальбуминурию проводится для определения наличия в моче альбуминов — простых растворимых в воде белков. При отсутствии заболеваний почек альбумин может попасть в мочу только в следовых количествах.
При отсутствии заболеваний почек альбумин может попасть в мочу только в следовых количествах.
Повышенная концентрация вещества в моче наблюдается при диабетической, токсической, лекарственной нефропатии, гломерулонефрите, воспалительных процессах в почках. Также альбумин в моче повышается при непереносимости фруктозы, высоком артериальном давлении, некоторых аутоиммунных заболеваниях, сердечной недостаточности, тяжелой физической работе.
Микроальбуминурия может определяться как в утренней, так и в суточной моче. Референсные значения представлены ниже ⇓⇓⇓
Анализ мочи по Нечипоренко чаще всего назначается, если в общем анализе мочи обнаружены отклонения от референтных значений. Во время исследования определяется количество форменных элементов в 1 мл осадка мочи.
Проба Зимницкого позволяет оценить работу почек в динамике. Биоматериал собирается каждые три часа на протяжении суток.
Более подробную информацию об анализе мочи по Нечипоренко и пробе Зимницкого вы найдете в нашей статье.
Во время и после химиотерапии онкологи назначают пациентам различные анализы крови. На какие показатели необходимо обращать внимание в первую очередь?
Лейкоциты
Уровень лейкоцитов может снижаться и повышаться по разным причинам – в том числе, самым безобидным. На уровень лейкоцитов в крови влияет время суток, прием пищи, эмоциональное и физическое напряжение.
Когда речь идет о противоопухолевом лечении, количество лейкоцитов в крови снижается. Пациент становится более уязвимым для бактериальной, вирусной и грибковой инфекции. Это обстоятельство может прервать проводимую терапию.
Впрочем, даже если уровень лейкоцитов в норме, это не значит, что ситуация под контролем. Здесь важно понимать, какую часть от общего показателя составляют тот и или иной подвид лейкоцитов. Для планирования системного лечения это очень важно. Именно поэтому онкологи всегда требуют, чтобы в анализах крови было указано абсолютное число всех подвидов лейкоцитов – вся лейкоцитарная формула.
| Нейтрофилы палочкоядерные | 1 — 6 | 0,04 — 0,3 |
| Нейтрофилы сегментоядерные | 47 — 72 | 2,0 — 5,5 |
| Эозинофилы | 0,5 — 5 | 0,02 — 0,3 |
| Базофилы | 0 — 1 | 0 — 0,065 |
| Лимфоциты | 19 — 37 | 1,2 — 3,0 |
| Моноциты | 3 — 11 | 0,09 — 0,6 |
Нейтрофилы
Нейтрофилы играют огромную роль в защите организма от инфекций. При проведении химиотерапии уровень нейтрофилов – критично важный показатель. Если их количество падает ниже 0,5 на литр, то даже нормальная микрофлора, которая присутствует во рту или кишечнике, может вызывать инфекции.
Время, за которое повысится уровень лейкоцитов и нейтрофилов в крови, для каждого пациента разное. Это индивидуальный процесс. Различные иммуномодуляторы в данном случае также не будут иметь эффекта./15.jpg)
Поэтому важно придерживаться нескольких простых правил:
- Следовать рекомендациям врача.
- Придерживаться полноценного рациона, исключить сырые продукты.
- Соблюдать режим работы и отдыха.
- Соблюдать личную гигиену.
- Избегать места большого скопления людей и носить маску.
Химиотерапия сопряжена с развитием целого ряда осложнений, среди которых наиболее клинически значима миелосупрессия (уменьшение количества образующихся в костном мозге клеток крови) – это нейтропения , тромбоцитопения и анемия .
Фебрильная нейтропения – угрожающее жизни состояние, внезапно и остро развивающееся у больных на фоне снижения числа циркулирующих в крови нейтрофилов, сопровождающееся повышением температуры тела.
При отсутствии своевременного лечения в течение 48 часов после развития фебрильной нейтропении летальный исход наступает в 50 % случаев.
Проблема в том, что врачам трудно контролировать это осложнение и оперативно на него реагировать.
У большинства пациентов фебрильная нейтропения развивается в тот момент, когда они уже выписаны из стационара и находятся дома.
Поэтому, если за сутки происходит двукратное повышение температуры тела >38.0 °C или однократное повышение температуры >38.3 °C, необходимо как можно быстрее сделать анализ крови. Если количество нейтрофилов в периферической крови
Гемоглобин
Гемоглобин – белок, содержащийся в эритроцитах и осуществляющий обмен кислорода между легкими и тканями организма. Имеет в своем составе железо.
| 12 -15 лет | 120-160 | 115 — 150 | г/л |
| 15-18 лет | 117-166 | 117-153 | г/л |
| 18-45 лет | 132-173 | 117-155 | г/л |
| 45-65 лет | 131-172 | 117-160 | г/л |
| После 65 лет | 126-174 | 117-161 | г/л |
Анемия – патологическое состояние, которое характеризуется низким содержанием гемоглобина, эритроцитов и железа в крови.
Анемия при злокачественных новообразованиях определяется снижением концентрации гемоглобина ниже нормального значения – обычно
Симптомы анемии не специфичны, поэтому распознать ее на ранних стадиях развития сложно. Распространенные симптомы – сонливость, слабость, раздражительность, частые головные боли.
Степени анемии
1. Легкая степень — 100 – 119 г/л
2. Средняя степень — 80 – 99 г/л
3. Тяжелая степень — ниже 80 г/л
Почему так важно знать уровень гемоглобина и чем опасна анемия?
Анемия не только ухудшает качество жизни онкологических больных, но и отрицательно влияет на продолжительность жизни при большинстве типов опухоли, снижает эффективность лечения.
Лабораторные показатели
1. Общий (клинический) анализ крови.
2. Оценка показателей обмена железа.
3. Пробы на скрытую кровь в кале, эндоскопическое исследование.
4. Исследование костного мозга — по показаниям.
Тромбоциты
При проведении химиотерапии нередко возникает тромбоцитопения – патологическое состояние, при котором определяется недостаточное количество тромбоцитов (клеток крови, отвечающих за работу свертывающей системы крови). В результате повышается риск развития массивных кровотечений и кровоизлияний в жизненно важные органы.
В результате повышается риск развития массивных кровотечений и кровоизлияний в жизненно важные органы.
Тромбоцитопения может протекать бессимптомно, многие пациенты даже не догадываются о том, что у них падает уровень тромбоцитов. Поэтому после химиотерапии назначают контрольные анализы крови. Таким образом, врачи могут отследить появление и развитие тромбоцитопении. Выраженные симптомы начинают появляться, когда уровень тромбоцитов становится запредельно низким.
Угрожающие симптомы тромбоцитопении:
- сильная головная боль;
- дезориентация;
- кровотечение из носа, рта, десен, влагалища, уретры, прямой кишки;
- изменение цвета мочи и кала;
- мелкоточечная сыпь на коже.
Эффективных методов лечения и профилактики тромбоцитопении на сегодняшний день нет. Единственным способом повышения уровня тромбоцитов остается переливание крови. В большинстве случаев после окончания химиотерапии клетки крови, в том числе тромбоциты, через некоторое время восстанавливаются самостоятельно.
Важно! Избегать контактных видов спорта, которые могут привести к травмам, порезам и ушибам. Использовать с осторожностью любые режущие и колющие предметы – ножи, ножницы, иглы, бритвы. Ограничить употребление алкоголя.
Креатинин
Показатель работы почек. Превышение может быть признаком почечной недостаточности.
Норма креатинина
| > 15 лет | мужской | 62 — 106 мкмоль/л |
| > 15 лет | женский | 44 — 80 мкмоль/л |
Аланинаминотрансфераза (АЛТ) и Аспартатаминотрансфераза (АСТ)
Это ферменты, которые находится во всех клетках организма, главным образом в сердце и печени и в меньшей степени в почках и мышцах. У здоровых пациентов активность АЛТ и АСТ в крови очень низкая. При химиотерапии повышается риск печеночных осложнений, поэтому так важно следить за уровнем АСТ и АЛТ – одними из главных показателей нарушений работы печени.
Билирубин
Продукт распада гемоглобина, является основным компонентом желчи в организме. Показатель работы печени.
Норма билирубина
| Общий билирубин | 3,4 — 20,4 мкмоль/л |
| Непрямой билирубин | До 16,5 мкмоль/л |
| Прямой билирубин | От 0 до 5,1 мкмоль/л |
Кальций
Злокачественные новообразования с поражением костной системы могут привести к развитию гипокальциемии или гиперкальциемии. В норме содержание кальция в крови – 2,15-2.5 мкмоль/л .
Перечисленные показатели крови – самые важные, когда речь идет химиотерапии. Но нужно понимать, что все индивидуально и врач может назначить дополнительные анализы в зависимости от состояния конкретного пациента.
Полная версия вебинара
Авторская публикация:
Масуд Резванович Салихов
ординатор НМИЦ онкологии им.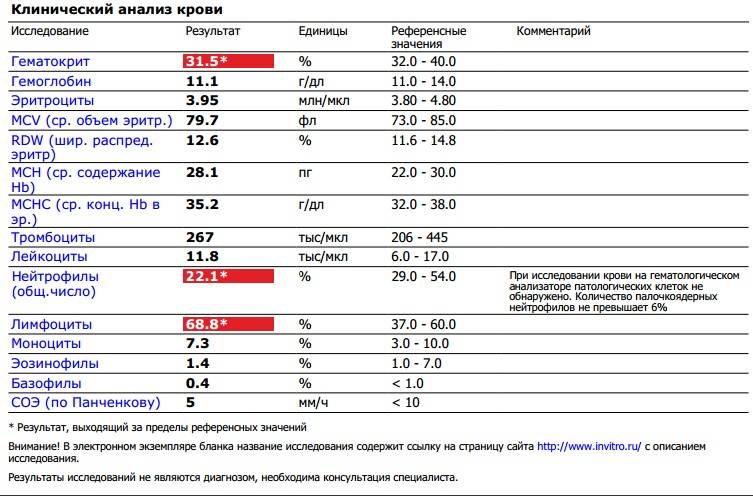 Н.Н. Петрова
Н.Н. Петрова
Авторская публикация:
ТКАЧЕНКО ЕЛЕНА ВИКТОРОВНА
онколог-химиотерапевт, гериатр
Заведующий отделением краткосрочной химиотерапии, врач-онколог высшей категории
НМИЦ онкологии им Н.Н. Петрова
Побочные действия свойственны всем видам противоопухолевого лечения, даже если оно проводится по современным стандартам. Большая часть осложнений, в том числе и связанных с подавлением кроветворения, таких как лейко- и нейтропения, развивается отсрочено, когда пациент уже не находится в условиях стационара, а выписан под амбулаторное наблюдение.
Лейкопенией называется такое состояние, которое характеризуется снижением уровня лейкоцитов в крови.
Лейкоциты – это белые кровяные тельца. Одна из разновидностей форменных элементов крови наряду с эритроцитами и тромбоцитами.
Главная функция лейкоцитов — это защита организма от инфекций, чужеродных белков и инородных тел, способных нанести ему вред и нарушить баланс биохимических реакций.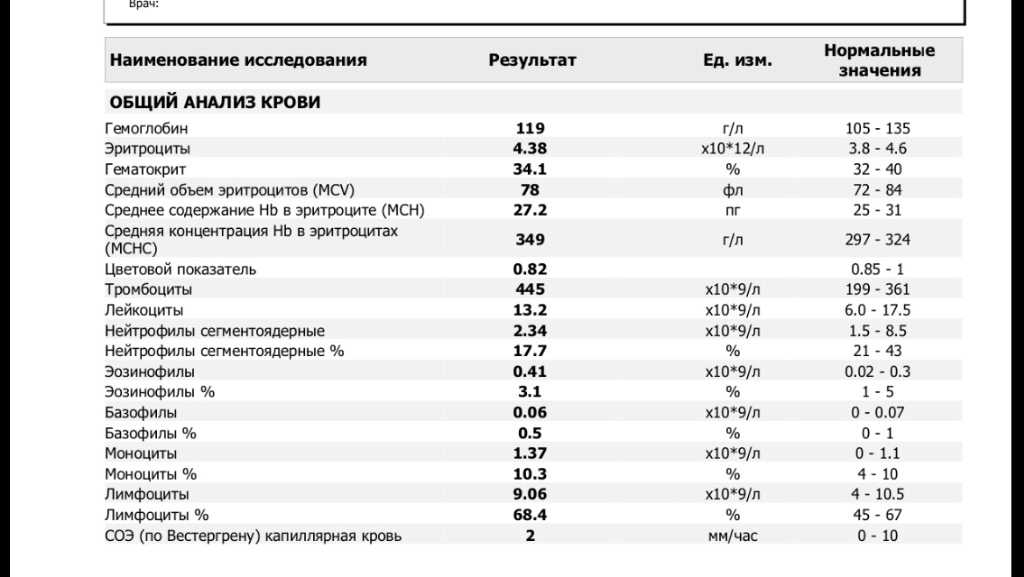
Содержание лейкоцитов в крови не является постоянным, оно динамически изменяется в течение дня в зависимости от времени суток и функционального состояния организма. Например, уровень лейкоцитов повышается не только во время наличия какого-либо воспаления в организме, но и обычно несколько повышается к вечеру, после приёма пищи, а также после физического и эмоционального напряжения.
Но мы говорим о тех случаях, когда количество лейкоцитов снижается.
Этому всегда имеется какая-то причина, в том числе это закономерное осложнение противоопухолевого лечения.
Почему это состояние имеет для нас значение?
Лейкоциты отвечают за иммунитет и сопротивление различным неблагоприятным факторам, поэтому при снижении их уровня в крови в первую очередь страдает «оборона» организма.
В этом случае человек становится более уязвим для любой инфекции: бактериальной, вирусной или грибковой.
В большинстве случаев при развитии инфекционных осложнений специализированное противоопухолевое лечение должно быть отложено.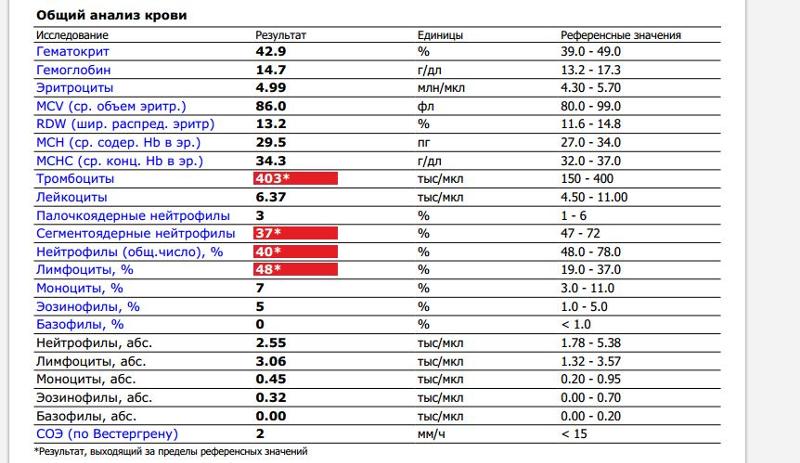 Следовательно, помимо главной опасности для человека, которая заключается именно в инфекционном процессе, мы еще сталкиваемся и с тем, что приходится откладывать лечение онкологического заболевания на неопределенный срок до тех пор, пока мы не разберемся с инфекцией.
Следовательно, помимо главной опасности для человека, которая заключается именно в инфекционном процессе, мы еще сталкиваемся и с тем, что приходится откладывать лечение онкологического заболевания на неопределенный срок до тех пор, пока мы не разберемся с инфекцией.
Почему важно знать о лейкоцитарной формуле?
Существует так называемая лейкоцитарная формула, которая формируется из подвидов лейкоцитов: моноцитов, эозинофилов, базофилов, лимфоцитов и нейтрофилов.
Каждый из видов выполняет собственную специфическую для него функцию, хотя в основе лежат именно иммунные процессы.
Когда мы получаем результаты клинического анализа крови, уровень лейкоцитов в нем может быть нормальным, но какую часть от этого общего показателя составляет тот или иной подвид, сказать навскидку невозможно. При этом для планирования системного лечения это очень важно. Именно поэтому онкологи требуют, чтобы в анализах крови было указано абсолютное число всех подвидов лейкоцитов. Обращать на это внимание должен и пациент, когда получает результаты анализов.
Наибольший интерес для химиотерапевтов представляют нейтрофилы. Этот подвид лейкоцитов играет очень важную роль в защите организма от бактериальных и грибковых инфекций и сравнительно меньшую — в защите от вирусных инфекций. В противоопухолевой или антигельминтной защите нейтрофилы практически не играют роли, в этих процессах участвуют другие клетки.
Если же провести химиотерапию, несмотря на низкий уровень лейкоцитов в целом и нейтрофилов в частности, то это приведет к полному угнетению работы костного мозга, в котором у нас образуются и созревают клетки крови. Это гарантирует развитие всевозможных осложнений, с которыми придется долго и упорно бороться с вероятностью успеха 50/50. Поэтому лучше лечение отложить на неделю, чтобы дать организму самостоятельно восстановиться, чем провести цикл и потом вернуться к терапии в лучшем случае через месяц.
При лечении рака молочной железы, желудочно-кишечного тракта, онкогинекологических заболеваний, раке легкого и других опухолей применяются различные комбинации препаратов, которые обладают разной степенью токсичности.
Поэтому в каждом отдельном случае лечащий врач принимает решение о безопасности проведения очередного цикла химиотерапии индивидуально исходя из текущей ситуации.
Не стоит требовать и уговаривать лечащего врача провести лечение, несмотря на плохие результаты анализа крови. Врач в таком случае не хочет сделать вам хуже, а он реально оценивает риски и старается вас от них оградить.
Можно ли поднять уровень лейкоцитов и нейтрофилов?
Химиопрепараты – это токсичные вещества. К их применению существуют показания и противопоказания, потому что они могут как помочь пациенту, так и очень сильно навредить, если использовать их бездумно. Единственным подходящим и разумным методом повышения уровня лейкоцитов и нейтрофилов является ожидание.
Да, это действительно так.
Во-первых, потому что каждый организм имеет свои особенности и не всегда способен восстановиться к тому времени, которое предусмотрено рекомендациями.
Интервалы между циклами являются оптимальными, но при этом отклонение от сроков на 1-2 недели (иногда и больше, если потребуется) является допустимым, если имеются противопоказания к проведению химиотерапии.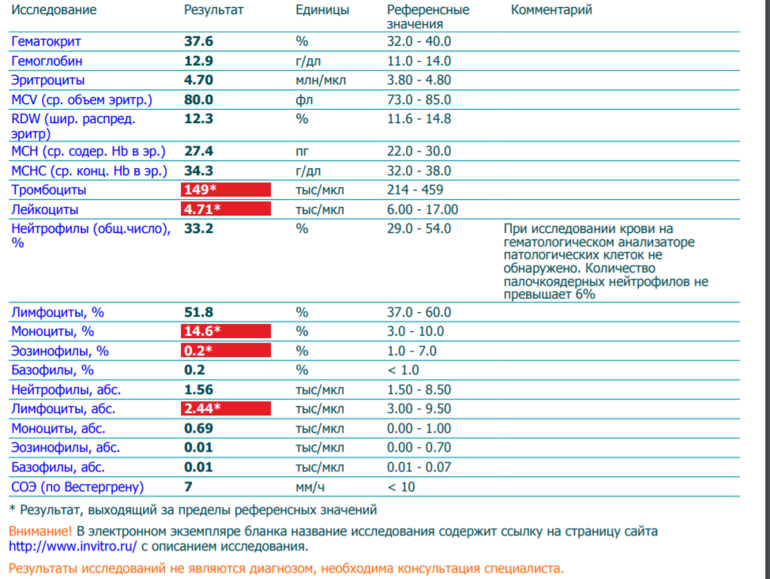
Во-вторых, любые препараты, которые стимулируют повышение уровня лейкоцитов и нейтрофилов опасны тем, что после нескольких таких стимуляций резерв костного мозга может быть истощен, и после этого восстановление будет проходить намного дольше и будет сопряжено с возможными осложнениями.
Если лейко- и нейтропения постоянная, и организм не восстанавливается должным образом даже при увеличении интервалов между циклами, то назначаются специализированные препараты, которые должны применяться только под наблюдением врача в строго показанных ситуациях.
Любые так называемые иммуномодуляторы, стимуляторы иммунитета никакой пользы не принесут, эффекта от них не будет, потому что лейкоциты все равно будут снижаться на фоне химиотерапии, так и должно быть, но при этом такие препараты могут спровоцировать развитие нежелательных реакций.
Фебрильная нейтропения
Сочетание повышения температуры тела со снижением количества нейтрофилов носит термин фебрильной нейтропении. Это угрожающее жизни пациента состояние, внезапно и остро развивающееся у больных на фоне снижения числа циркулирующих в крови нейтрофилов ниже 0,5х10*9/л.
Это угрожающее жизни пациента состояние, внезапно и остро развивающееся у больных на фоне снижения числа циркулирующих в крови нейтрофилов ниже 0,5х10*9/л.
- количество нейтрофилов в периферической крови
- двукратное за сутки повышение температуры тела >38.0 0 С или однократное повышение температуры >38.3 0 С при измерении температуры во рту. Это значит, что при измерении температуры в подмышечной впадине вас и вашего врача должна начать беспокоить температура выше 37.5 0 С.
Основная проблема состоит в том, что врачам-онкологам очень трудно контролировать это осложнение и своевременно принимать необходимые меры, поскольку у большинства пациентов фебрильная нейтропения развивается в период, когда они уже не находятся в условиях стационара.
Поэтому пациент также должен быть внимателен к своему состоянию и своевременно принимать меры: связаться с врачом, как можно скорее сдать кровь и неукоснительно следовать тому, что рекомендует лечащий врач.
При повышении температуры тела выше 38. 0 0 С необходимо как можно скорее сдать клинический анализ крови. Это важно! Без его результата невозможно сказать наверняка есть ли фебрильная нейтропения у пациента, нужны ли какие-либо срочные мероприятия.
0 0 С необходимо как можно скорее сдать клинический анализ крови. Это важно! Без его результата невозможно сказать наверняка есть ли фебрильная нейтропения у пациента, нужны ли какие-либо срочные мероприятия.
Помните, что это осложнение может обернуться большой бедой, если его не распознать и не начать вовремя лечить.
В отсутствие своевременного лечения в течение 48 часов после развития фебрильной нейтропении летальный исход имеет место в 50% случаев! Даже при проведении антибактериальной терапии риск смертельного исхода сохраняется в 10% случаев.
Это говорит о том, что это очень опасное осложнение, нельзя относиться к нему легкомысленно.
Около 80 % фебрильных эпизодов на фоне сниженного уровня нейтрофилов в крови связаны с развитием инфекции, которая протекает с отсутствием классических симптомов (боль, гиперемия, отёк, жар), а основным критерием инфекционного процесса является высокая температура тела.
До последнего времени лихорадка, возникающая у больного с нейтропенией, являлась основанием для обязательной госпитализации и проведения лечения в стационаре. Однако в результате проведения клинических исследований была создана система оценки осложнений у больных с фебрильной нейтропенией. Врач согласно этой шкале считает баллы и может оценить существуют ли риски при проведении лечения амбулаторно.
Однако в результате проведения клинических исследований была создана система оценки осложнений у больных с фебрильной нейтропенией. Врач согласно этой шкале считает баллы и может оценить существуют ли риски при проведении лечения амбулаторно.
Что рекомендуется делать пациентам, у которых развилось данное осложнение
1) При повышении температуры тела срочно сдать анализ крови. Сообщить лечащему врачу о результатах анализа.
При наличии критично низкого уровня лейкоцитов и нейтрофилов очередное введение химиопрепаратов будет отложено до момента полного восстановления.
2) Старайтесь придерживаться полноценного рациона, исключите сырые продукты (то есть мясо, рыбу, яйца, фрукты и овощи) – все продукты без исключения должны быть термически обработаны.
3) Соблюдайте режим работы и отдыха, не нагружайте себя, дайте возможность организму восполнить силы и энергию для скорейшего восстановления.
4) Тщательно соблюдайте личную гигиену, потому как любая инфекция может стать причиной ухудшения состояния.
5) Не посещайте места большого скопления людей без необходимости. Соблюдайте самоизоляцию. Это актуально не только во время нынешней пандемии, ведь риски присоединения инфекций во время фебрильной нейтропении колоссальные – даже ваши домочадцы могут представлять опасность, что уж говорить о большом количестве незнакомцев, например, в магазинах.
6) Если вы вынуждены посетить место с большим количеством людей, например, чтобы сдать анализ крови, то обязательно носите защитную маску. Старайтесь соблюдать дистанцию с окружающими.
К основным препаратам, которые используют при лечении фебрильной нетропении, относятся антибиотики, также используются специализированные препараты для стимуляции повышения уровня лейкоцитов и нейтрофилов – это колониестимулирующие факторы (Г-КСФ).
Эти препараты применяются для ускорения образования, созревания и выброса нейтрофилов из костного мозга в периферическую кровь, где они начинают выполнять свои функции и защищать организм.
Что следует знать пациентам о применении колониестимулирующих факторов
1) Применение Г-КСФ сразу после ХТ (в первые сутки) или на фоне ХТ строго запрещено, это может привести к развитию тяжелой лейко- и нейтропении. К сожалению, иногда такое происходит, поэтому пациенты тоже должны быть осведомлены, что так делать нельзя.
К сожалению, иногда такое происходит, поэтому пациенты тоже должны быть осведомлены, что так делать нельзя.
2) Применение этих препаратов должно быть прекращено как минимум за 48 часов до начала цикла химиотерапии.
3) Г-КСФ не применяются для лечения афебрильной нейтропении (то есть если уровень нейтрофилов низкий, но повышения температуры тела нет).
4) Не применяют их также при осложнениях и инфекциях, которые не связаны с нейтропенией (например, если развилась пневмония, но при этом уровень лейкоцитов и нейтрофилов в норме или повышен).
5) В некоторых случаях разрешается введение колониестимулирующих факторов с целью профилактики развития фебрильной нейтропении, если у пациента имеются факторы высокого риска развития этого осложнения. Наличие этих факторов должен перед каждым циклом химиотерапии оценивать лечащий врач.
Участие самого пациента в процессе лечения – это неоценимая помощь врачу в борьбе с онкологическим заболеванием. Когда пациент внимателен к себе, интересуется происходящим и стремится к командной работе с врачом, выполняя его рекомендации, то лечение проходит легче. И с осложнениями, которые, к сожалению, нередки, справляться тоже становится проще.
И с осложнениями, которые, к сожалению, нередки, справляться тоже становится проще.
Полный анализ крови (ОАК) — это анализ крови, используемый для оценки вашего общего состояния здоровья и выявления широкого спектра заболеваний, включая анемию, инфекции и лейкемию.
Абсолютно здоровым людям рекомендуется сдавать анализ крови хотя бы раз в год или во время плановой диспансеризации. Тем, кто имеет различные патологии, частоту обследований назначает врач. Кроме того, ОАК назначают при поступлении в больницу или обращении в поликлинику по любым поводам, включая травмы, прививки, получение справок, консультации или диагностика с лечением различных болезней.
Зачем нужен общий анализ?
Полный (развернутый) анализ крови измеряет несколько компонентов и характеристик вашей крови, в том числе:
- Красные кровяные тельца (эритроциты), переносящие кислород.
- Лейкоциты, борющиеся с инфекцией (в том числе с лейкоцитарной формулой – количеством каждого типа клеток).
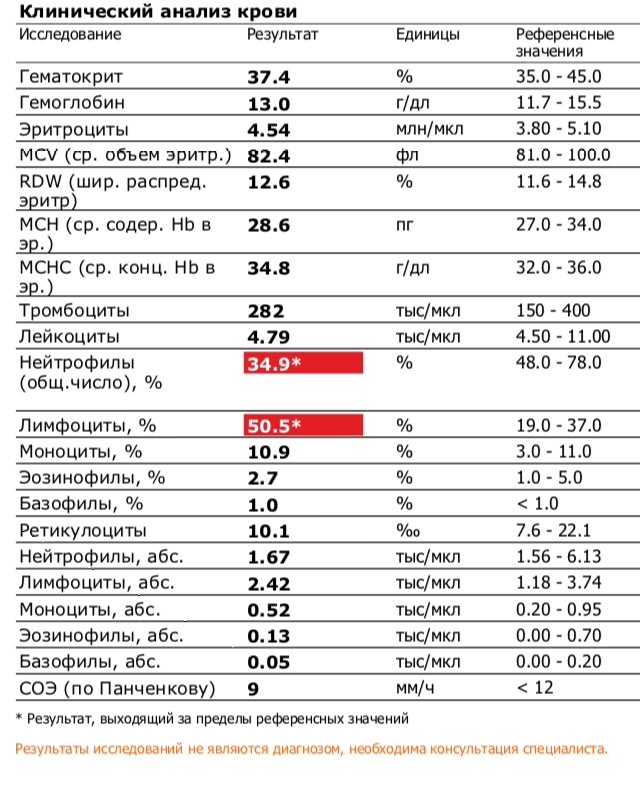
- Гемоглобин, белок, переносящий кислород в красных кровяных тельцах.
- Гематокрит, соотношение красных кровяных телец к жидкому компоненту или плазме в крови.
- Тромбоциты, способствующие свертыванию крови.
Аномальное увеличение или уменьшение количества клеток, выявленное в общем анализе крови, может указывать на то, что у вас есть какое-либо заболевание, которое требует дальнейшего обследования.
Когда назначают анализ крови
Общий анализ крови – это распространенный анализ, который проводится по разным причинам:
- Чтобы проверить общее состояние здоровья. Ваш врач может порекомендовать сделать общий анализ крови в рамках обычного медицинского обследования для наблюдения за вашим общим состоянием здоровья и выявления различных заболеваний, таких как анемия или лейкемия.
- Чтобы диагностировать заболевание. Лечащий врач может предложить общий анализ крови, если вы испытываете слабость, усталость, жар, воспаление, на теле появились синяки или возникло кровотечение.
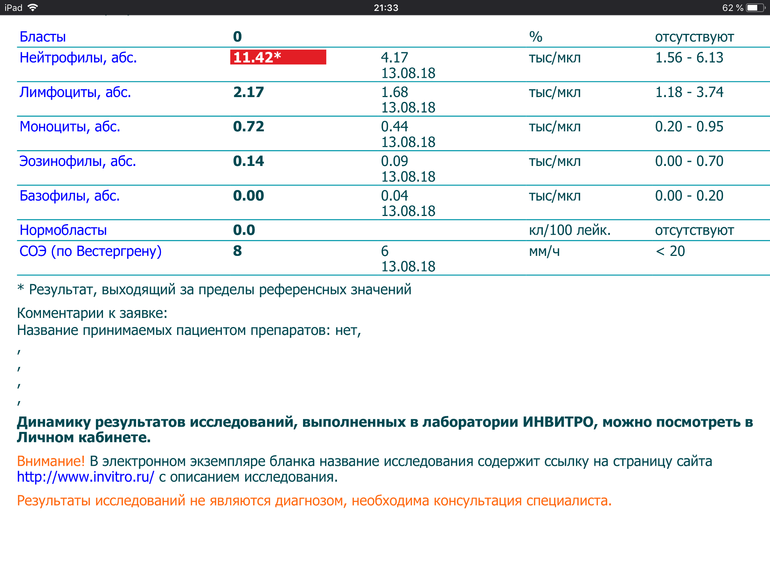 Общий анализ крови может помочь диагностировать причину этих признаков и симптомов. Если врач подозревает, что у пациента инфекция, тест также может помочь подтвердить этот диагноз.
Общий анализ крови может помочь диагностировать причину этих признаков и симптомов. Если врач подозревает, что у пациента инфекция, тест также может помочь подтвердить этот диагноз. - Для наблюдения за состоянием здоровья. Если ранее было диагностировано заболевание крови, которое влияет на количество клеток, врач может использовать полный анализ крови для контроля вашего состояния.
- Для наблюдения за лечением. Если вы принимаете лекарства, которые могут повлиять на количество клеток крови, общий анализ крови может использоваться для контроля вашего здоровья.
Как подготовиться к сдаче крови
Если образец крови исследуется только для общего анализа крови, вы можете нормально есть и пить перед анализом. Если образец крови будет использован для дополнительных анализов (биохимия, посев крови на стерильность, исследование на гормоны, электролиты), может потребоваться голодать определенное время перед обследованием. Перед сдачей крови врач даст вам конкретные инструкции.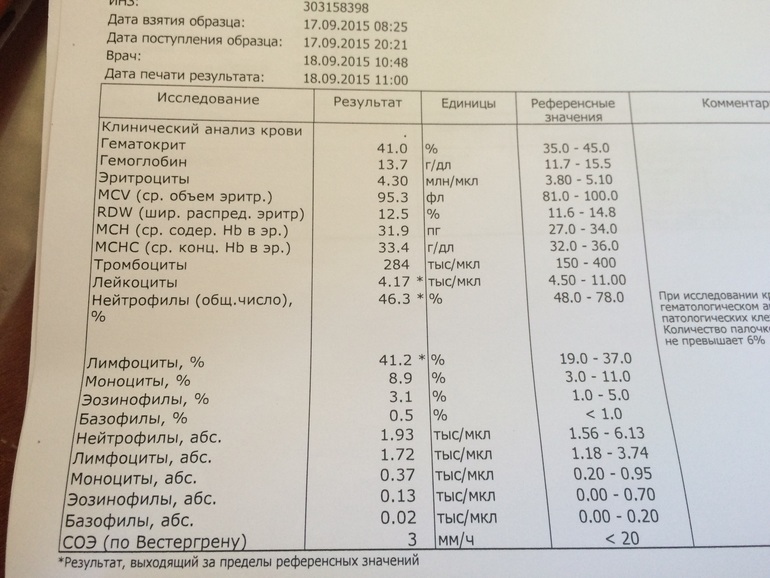
Чего можно ожидать
Для полного анализа крови медсестра процедурного кабинета берет образец крови, вводя иглу в вену на руке, обычно в месте сгиба локтя. Образец крови отправляется в лабораторию для анализа. Вы можете немедленно вернуться к своим обычным занятиям.
Ниже приведены нормальные результаты общего анализа крови для взрослых:
- Количество эритроцитов у мужчин: 4,35-5,65 трлн клеток / л
- Женщины: 3,92-5,13 трлн клеток / л
- Гемоглобин мужчины: 132-166 грамм / л
- Женщины: 116-150 г / л
- Гематокрит мужчины: 38,3–48,6%
- Женщины: 35,5–44,9 %
- Количество лейкоцитов 3,4-9,6 млрд клеток / л
- Количество тромбоцитов мужчины: 135-317 млрд / л
- Женщины: 157-371 млрд / л
Общий анализ крови обычно не является окончательным диагностическим тестом. В зависимости от причины, по которой врач рекомендовал этот тест, результаты за пределами нормального диапазона могут потребовать или не потребовать последующего наблюдения. Лечащему врачу может потребоваться изучить результаты общего анализа крови вместе с результатами других анализов крови или могут потребоваться дополнительные тесты.
Лечащему врачу может потребоваться изучить результаты общего анализа крови вместе с результатами других анализов крови или могут потребоваться дополнительные тесты.
Например, если в остальном вы здоровы и у вас нет признаков или симптомов заболевания, результаты общего анализа крови, слегка выходящие за пределы нормы, могут не вызывать беспокойства, и последующее наблюдение может не потребоваться. Если вы проходите курс лечения от рака, результаты общего анализа крови за пределами нормы могут указывать на необходимость изменения плана лечения.
В некоторых случаях, если ваши результаты значительно выше или ниже нормальных диапазонов, врач может направить вас к врачу, который специализируется на заболеваниях крови (гематологу).
На что могут указывать результаты
Результаты в количестве красных или белых клеток, тромбоцитов или гемоглобина, которые выше или ниже нормальных значений общего анализа крови могут указывать на проблему.
Количество эритроцитов, гемоглобин и гематокрит.
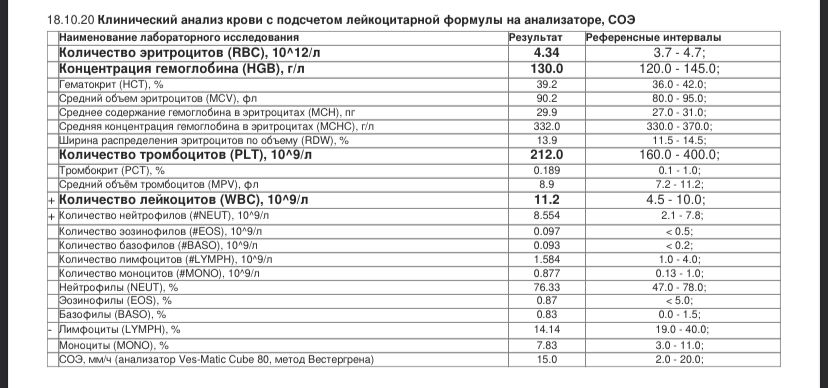
Результаты подсчета эритроцитов, гемоглобина и гематокрита связаны, потому что каждый из них измеряет определенные параметры эритроцитов. Если показатели в этих трех областях ниже нормы, у вас анемия. Анемия вызывает утомляемость и слабость, она имеет множество причин, включая низкий уровень определенных витаминов или железа, потерю крови или серьезное заболевание.
Количество эритроцитов выше нормы (эритроцитоз) или высокий уровень гемоглобина или гематокрита, может указывать на основное заболевание, такое как истинная полицитемия или болезнь сердца.
Количество лейкоцитов
Низкое количество лейкоцитов (лейкопения) может быть вызвано каким-либо заболеванием, например аутоиммунным заболеванием, которое разрушает лейкоциты, проблемами с костным мозгом. Некоторые лекарства также могут вызывать снижение количества лейкоцитов.
Если количество лейкоцитов выше нормы, возможно, у вас инфекция или воспаление. Или это может указывать на то, что у вас нарушение иммунной системы или заболевание костного мозга. Повышенное количество лейкоцитов также может быть реакцией на лекарства.
Повышенное количество лейкоцитов также может быть реакцией на лекарства.
Количество тромбоцитов
Количество тромбоцитов ниже нормы (тромбоцитопения) или выше нормы (тромбоцитоз) часто является признаком основного заболевания или может быть побочным эффектом от приема лекарств. Если количество тромбоцитов выходит за пределы нормы, вам, вероятно, потребуются дополнительные тесты для диагностики причины. Чтобы точно узнать, что означают результаты общего анализа крови, когда они выходят за пределы нормы, нужно задать вопросы врачу.
Изменения субпопуляций лимфоцитов при нормальной беременности
. 1998 г., февраль; 76 (2): 147–51.
doi: 10.1016/s0301-2115(97)00180-2.
М Кюнерт
1
, R Strohmeier, M Stegmüller, E Halberstadt
принадлежность
- 1 Отделение гинекологии и акушерства, Университетская клиника Франкфурт-на-Майне, Германия.
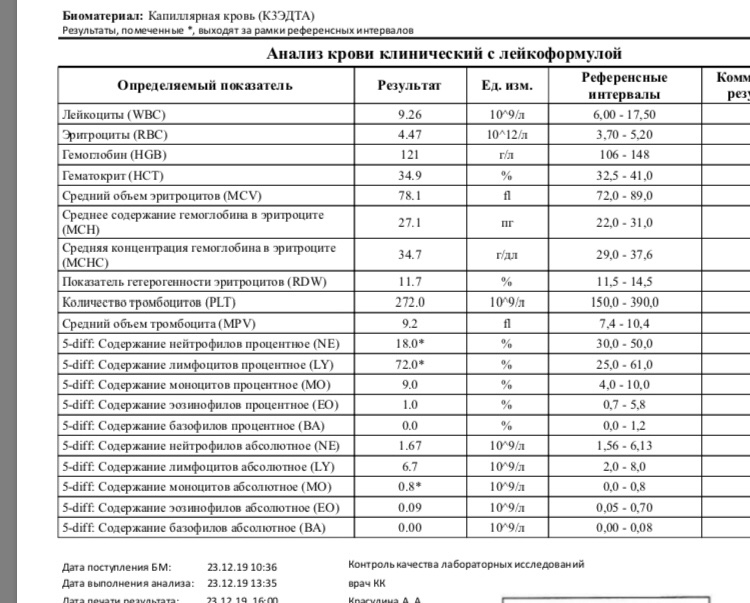
PMID:
64
DOI:
10.1016/с0301-2115(97)00180-2
М. Кюнерт и соавт.
Eur J Obstet Gynecol Reprod Biol.
1998 фев.
. 1998 г., февраль; 76 (2): 147–51.
doi: 10.1016/s0301-2115(97)00180-2.
Авторы
М Кюнерт
1
, Р. Штромайер, М. Штегмюллер, Э. Хальберштадт
принадлежность
- 1 Отделение гинекологии и акушерства, Университетская клиника Франкфурт-на-Майне, Германия.

PMID:
64
DOI:
10.1016/с0301-2115(97)00180-2
Абстрактный
Лимфоциты периферической крови здоровых женщин изучали во время беременности и после родов и сравнивали с лимфоцитами небеременной контрольной группы того же возраста. По сравнению с небеременными женщинами общее количество лейкоцитов было значительно увеличено во время всех беременностей, а также после родов. При беременности абсолютное количество и процентное содержание Т-лимфоцитов были несколько повышены, в то время как В-клетки практически не изменились. Достоверных изменений процентного содержания супрессорных/цитотоксических (CD8+), хелперных/индукторных (CD4+) Т-лимфоцитов, а также соотношения CD4+/CD8+ на всех сроках беременности и послеродового периода не выявлено.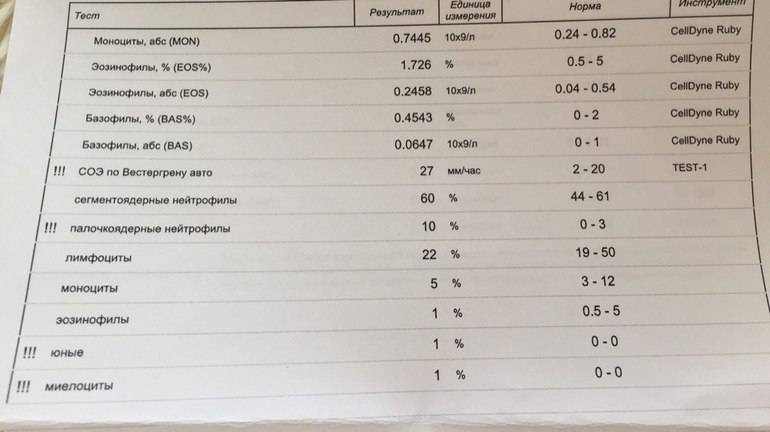 Наиболее заметные изменения иммунной системы произошли в группе HLA-DR+ и CD56+ активированных Т-клеток. Количество клеток значительно увеличилось в первом триместре (<14 недель) и несколько уменьшилось от этапа к этапу. Более низкие значения в NK-клетках (естественных киллерах) и более высокие уровни положительных по рецептору IL-2 Т-лимфоцитов не достигли значительных уровней изменения.
Наиболее заметные изменения иммунной системы произошли в группе HLA-DR+ и CD56+ активированных Т-клеток. Количество клеток значительно увеличилось в первом триместре (<14 недель) и несколько уменьшилось от этапа к этапу. Более низкие значения в NK-клетках (естественных киллерах) и более высокие уровни положительных по рецептору IL-2 Т-лимфоцитов не достигли значительных уровней изменения.
Похожие статьи
Популяции и субпопуляции лимфоцитов периферической крови беременных с преэклампсией.
Димитракова-Джамбазова Е, Мильчев Н, Павлов П, Димитраков Д.
Димитракова-Джамбазова Е, и соавт.
Акуш Гинекол (София). 2005;44(1):40-4.
Акуш Гинекол (София). 2005.PMID: 15853011
Болгарский.
Изменения субпопуляций лимфоцитов во время беременности и в послеродовом периоде при начинающейся эклампсии.

Кюнерт М., Шмидт С.
Кюнерт М. и соавт.
J Перинат Мед. 2000;28(5):389-98. doi: 10.1515/JPM.2000.050.
J Перинат Мед. 2000.PMID: 11125930
Связанные с беременностью изменения субпопуляций лимфоцитов периферической крови у нормальных кувейтских женщин.
Махмуд Ф., Абул Х., Ому А., Аль-Райес С., Хейнс Д., Уэйли К.
Махмуд Ф. и др.
Гинеколь Обстет Инвест. 2001;52(4):232-6. дои: 10.1159/000052981.
Гинеколь Обстет Инвест. 2001.PMID: 11729335
Фенотипические аномалии Т- и NK-клеток при системном склерозе: когортное исследование и всесторонний обзор литературы.
Алмейда И., Силва С.В., Фонсека А.Р., Силва И., Васконселос С., Лима М.
Алмейда I и др.
Клин Рев Аллергия Иммунол. 2015 Декабрь;49(3):347-69. doi: 10.1007/s12016-015-8505-8.
2015 Декабрь;49(3):347-69. doi: 10.1007/s12016-015-8505-8.
Клин Рев Аллергия Иммунол. 2015.PMID: 26445774
Обзор.
Распределение субпопуляций лимфоцитов и естественных клеток-киллеров в организме человека.
Вестерманн Дж., Пабст Р.
Вестерманн Дж. и соавт.
Клин Инвест. 1992 июль; 70 (7): 539-44. дои: 10.1007/BF00184787.
Клин Инвест. 1992.PMID: 13
Обзор.
Посмотреть все похожие статьи
Цитируется
Базовый уровень физиологической температуры тела и гематологических параметров у содержащихся в неволе Rousettus aegyptiacus и Eidolon helvum Летучие мыши.
Рисманн М., Фридрихс В., Клей Н., Штраубе М., Садеги Б.
 , Балкема-Бушманн А.
, Балкема-Бушманн А.
Рисманн М. и соавт.
Фронт Физиол. 2022 авг 29;13:7. doi: 10.3389/fphys.2022.
7. Электронная коллекция 2022.
Фронт Физиол. 2022.PMID: 36105294
Бесплатная статья ЧВК.Лабораторный анализ симптоматических и бессимптомных беременных с инфекцией SARS-CoV-2.
Фишер С.А., Гольдштейн Дж.А., Митхал Л.Б., Исайя А.Л., Шейнс Э.Д., Отеро С., Миллер Э.С.
Фишер С.А. и др.
Am J Obstet Gynecol MFM. 2021 ноябрь;3(6):100458. doi: 10.1016/j.ajogmf.2021.100458. Epub 2021 14 августа.
Am J Obstet Gynecol MFM. 2021.PMID: 34403821
Бесплатная статья ЧВК.Экзосомы, полученные из плаценты, как модулятор материнской иммунной толерантности во время беременности.
Бай К., Ли С., Чжун Дж.
 , Нг ЭХИ, Юнг В.С.Б., Ли К.Л., Чиу П.С.Н.
, Нг ЭХИ, Юнг В.С.Б., Ли К.Л., Чиу П.С.Н.
Бай К. и др.
Фронт Иммунол. 2021 11 мая; 12:671093. doi: 10.3389/fimmu.2021.671093. Электронная коллекция 2021.
Фронт Иммунол. 2021.PMID: 34046039
Бесплатная статья ЧВК.Обзор.
Иммунологическая адаптация матери во время нормальной беременности.
Абу-Рая Б., Михальски С., Садарангани М., Лавуа П.М.
Абу-Рая Б. и др.
Фронт Иммунол. 2020 7 окт;11:575197. doi: 10.3389/fimmu.2020.575197. Электронная коллекция 2020.
Фронт Иммунол. 2020.PMID: 33133091
Бесплатная статья ЧВК.Обзор.
Иммунная функция во время беременности различается у экологически разных популяций.
Hové C, Trumble BC, Anderson AS, Stieglitz J, Kaplan H, Gurven MD, Blackwell AD.

Хове С. и др.
Эвол Мед Общественное Здравоохранение. 2020 3 июля; 2020(1):114-128. doi: 10.1093/emph/eoaa022. Электронная коллекция 2020.
Эвол Мед Общественное Здравоохранение. 2020.PMID: 32983537
Бесплатная статья ЧВК.
Просмотреть все статьи «Цитируется по»
термины MeSH
вещества
Физиологические изменения гематологических показателей во время беременности
Indian J Hematol Blood Transfus. 2012 сен; 28(3): 144–146.
Опубликовано онлайн 2012 г. 15 июля. DOI: 10.1007/S12288-012-0175-6
, 1 , 1 , 1 , 1 и 2
Авторская информация. и Информация о лицензии Отказ от ответственности
Беременность — это состояние, характеризующееся многими физиологическими гематологическими изменениями, которые могут казаться патологическими в небеременном состоянии. В обзоре освещается большинство этих изменений, а также их научная основа, согласно современным знаниям, с особым упором на эритроциты и лейкоциты, тромбоциты и гемостатический профиль.
В обзоре освещается большинство этих изменений, а также их научная основа, согласно современным знаниям, с особым упором на эритроциты и лейкоциты, тромбоциты и гемостатический профиль.
Ключевые слова: Беременность, физиологические, гематологические изменения
Физиологические изменения во время беременности и послеродового периода в основном зависят от изменений гормонального фона. Многие гематологические изменения, происходящие в эти периоды, также являются физиологическими и не представляют серьезного интереса для гематолога.
Во время беременности общий объем крови увеличивается примерно на 1,5 литра, в основном для удовлетворения потребностей нового сосудистого русла и компенсации кровопотери, возникающей при родах [1]. Из них около одного литра крови содержится в матке и материнских кровяных пространствах плаценты. Таким образом, увеличение объема крови более заметно при многоплодной беременности и железодефицитных состояниях. Увеличение объема плазмы происходит на 10–15 % на 6–12 неделе беременности [2, 3]. Во время беременности активность ренина плазмы имеет тенденцию к увеличению, а уровни предсердного натрийуретического пептида имеют тенденцию к снижению, хотя и незначительно. Это говорит о том, что в состоянии беременности увеличение объема плазмы является ответом на недостаточное наполнение сосудистой системы в результате системной вазодилатации и увеличения сосудистой емкости, а не на фактическое увеличение объема крови, которое вместо этого привело бы к противоположному гормональному профилю (т. плазменный ренин и повышенный уровень предсердного натрийуретического пептида) [4, 5].
Во время беременности активность ренина плазмы имеет тенденцию к увеличению, а уровни предсердного натрийуретического пептида имеют тенденцию к снижению, хотя и незначительно. Это говорит о том, что в состоянии беременности увеличение объема плазмы является ответом на недостаточное наполнение сосудистой системы в результате системной вазодилатации и увеличения сосудистой емкости, а не на фактическое увеличение объема крови, которое вместо этого привело бы к противоположному гормональному профилю (т. плазменный ренин и повышенный уровень предсердного натрийуретического пептида) [4, 5].
Масса эритроцитов (обусловленная увеличением выработки материнского эритропоэтина) также увеличивается, но относительно меньше, по сравнению с увеличением объема плазмы, в результате чего снижается концентрация гемоглобина. Таким образом, возникает дилюционная анемия. Падение гемоглобина обычно составляет 1–2 г/дл к концу второго триместра и стабилизируется после этого в третьем триместре, когда происходит снижение объема материнской плазмы (из-за повышения уровня предсердного натрийуретического пептида). У женщин, принимающих добавки железа, изменения гемоглобина менее выражены, поскольку они увеличивают массу эритроцитов более пропорциональным образом, чем те, кто не принимает добавки с гематином.
У женщин, принимающих добавки железа, изменения гемоглобина менее выражены, поскольку они увеличивают массу эритроцитов более пропорциональным образом, чем те, кто не принимает добавки с гематином.
Показатели эритроцитов мало изменяются при беременности. Однако наблюдается небольшое увеличение среднего эритроцитарного объема (MCV), в среднем на 4 fl у женщин с высоким содержанием железа, которое достигает максимума на 30–35 неделях беременности и не свидетельствует о каком-либо дефиците витаминов B12 и фолиевой кислоты. Повышенное производство эритроцитов для удовлетворения потребностей во время беременности разумно объясняет, почему существует повышенный MCV (из-за более высокой доли молодых эритроцитов, которые больше по размеру). Однако MCV существенно не меняется во время беременности, а концентрация гемоглобина <90,5 г/дл в сочетании со средним корпускулярным объемом <84 фл, вероятно, указывает на сопутствующий дефицит железа или какую-либо другую патологию [6].
После беременности объем плазмы уменьшается в результате диуреза, и объем крови возвращается к небеременным значениям. Соответственно повышается гемоглобин и гематокрит. Объем плазмы снова увеличивается через два-пять дней, возможно, из-за увеличения секреции альдостерона. Позже она снова снижается. Было задокументировано значительное повышение уровня гемоглобина между измерениями гемоглобина, проведенными через 6–8 недель после родов, и измерениями, проведенными через 4–6 месяцев после родов, что указывает на то, что для восстановления физиологического падения гемоглобина до ненормального требуется не менее 4–6 месяцев после беременности. значения беременных [7].
Соответственно повышается гемоглобин и гематокрит. Объем плазмы снова увеличивается через два-пять дней, возможно, из-за увеличения секреции альдостерона. Позже она снова снижается. Было задокументировано значительное повышение уровня гемоглобина между измерениями гемоглобина, проведенными через 6–8 недель после родов, и измерениями, проведенными через 4–6 месяцев после родов, что указывает на то, что для восстановления физиологического падения гемоглобина до ненормального требуется не менее 4–6 месяцев после беременности. значения беременных [7].
Количество лейкоцитов увеличивается во время беременности, при этом нижняя граница референтного диапазона обычно составляет 6000/мкл. Лейкоцитоз, возникающий во время беременности, обусловлен физиологическим стрессом, вызванным состоянием беременности [8]. Нейтрофилы являются основным типом лейкоцитов при дифференциальном подсчете [9, 10]. Вероятно, это связано с нарушением нейтрофильного апоптоза при беременности [9]. В цитоплазме нейтрофилов обнаруживаются токсические грануляции. Хемотаксис нейтрофилов и фагоцитарная активность угнетаются, особенно за счет ингибирующих факторов, присутствующих в сыворотке беременной женщины [11]. Имеются также данные об усилении окислительного метаболизма в нейтрофилах во время беременности. Незрелые формы в виде миелоцитов и метамиелоцитов могут обнаруживаться в мазке периферической крови здоровых женщин во время беременности и не имеют патологического значения [12]. Они просто указывают на адекватную реакцию костного мозга на усиление эритропоэза во время беременности.
Хемотаксис нейтрофилов и фагоцитарная активность угнетаются, особенно за счет ингибирующих факторов, присутствующих в сыворотке беременной женщины [11]. Имеются также данные об усилении окислительного метаболизма в нейтрофилах во время беременности. Незрелые формы в виде миелоцитов и метамиелоцитов могут обнаруживаться в мазке периферической крови здоровых женщин во время беременности и не имеют патологического значения [12]. Они просто указывают на адекватную реакцию костного мозга на усиление эритропоэза во время беременности.
Количество лимфоцитов снижается во время беременности в течение первого и второго триместров и увеличивается в течение третьего триместра. Во время беременности наблюдается абсолютный моноцитоз, особенно в первом триместре, но он снижается по мере увеличения срока беременности. Моноциты помогают предотвратить отторжение плодного аллотрансплантата за счет инфильтрации децидуальной ткани (7-20-я неделя гестации), возможно, посредством иммуносупрессии, опосредованной PGE2 [13]. Отношение моноцитов к лимфоцитам заметно увеличивается во время беременности. Однако количество эозинофилов и базофилов существенно не меняется во время беременности [14].
Отношение моноцитов к лимфоцитам заметно увеличивается во время беременности. Однако количество эозинофилов и базофилов существенно не меняется во время беременности [14].
Стресс родов сам по себе может привести к резкому лейкоцитозу. Документально подтверждено, что через несколько часов после родов у здоровых женщин количество лейкоцитов колеблется от 9000 до 25000/м3. К 4 неделям после родов типичные диапазоны лейкоцитов аналогичны таковым у здоровых небеременных женщин.
Крупные перекрестные исследования, проведенные во время беременности с участием здоровых женщин (в частности, за исключением женщин с артериальной гипертензией), показали, что количество тромбоцитов действительно снижается во время беременности, особенно в третьем триместре. Это называется «гестационная тромбоцитопения». Частично это связано с гемодилюцией и частично с повышенной активацией тромбоцитов и ускоренным клиренсом [15]. Гестационная тромбоцитопения не имеет осложнений, связанных с тромбоцитопенией, и у детей не бывает тяжелой тромбоцитопении (количество тромбоцитов ≤20 000/мкл). Поэтому было рекомендовано, чтобы нижний предел количества тромбоцитов на поздних сроках беременности считался равным 1,15 лейк/мл [1]. Ширина распределения тромбоцитов по объему значительно и постоянно увеличивается по мере продвижения беременности по причинам, указанным ранее. Таким образом, с увеличением срока беременности средний объем тромбоцитов становится нечувствительным показателем размера тромбоцитов.
Поэтому было рекомендовано, чтобы нижний предел количества тромбоцитов на поздних сроках беременности считался равным 1,15 лейк/мл [1]. Ширина распределения тромбоцитов по объему значительно и постоянно увеличивается по мере продвижения беременности по причинам, указанным ранее. Таким образом, с увеличением срока беременности средний объем тромбоцитов становится нечувствительным показателем размера тромбоцитов.
Количество тромбоцитов после родов увеличивается в ответ на повышенное потребление тромбоцитов в процессе родов и в качестве компенсации.
Беременность связана со значительными изменениями гемостатического профиля. Активность фибриногена и факторов свертывания крови VII, VIII, X, XII, фактора Виллебранда и ристоцетина заметно возрастает по мере развития беременности. Повышение уровня факторов свертывания связано с усилением синтеза белка, опосредованного повышением уровня эстрогена. В экспериментах in vitro было показано, что беременная плазма способна увеличивать образование тромбина [16]. Таким образом, беременность является протромботическим состоянием. Во время беременности аЧТВ обычно укорачивается до 4 с в третьем триместре, в основном из-за увеличения уровня фактора VIII под влиянием гормонов. Однако заметных изменений PT или TT не происходит [1].
Таким образом, беременность является протромботическим состоянием. Во время беременности аЧТВ обычно укорачивается до 4 с в третьем триместре, в основном из-за увеличения уровня фактора VIII под влиянием гормонов. Однако заметных изменений PT или TT не происходит [1].
Также наблюдаются изменения уровней и активности природных антикоагулянтов. Уровни и активность протеина С не меняются и остаются в том же диапазоне, что и у небеременных женщин того же возраста. Уровни общего и свободного (т. е. биологически доступного) белка S постепенно снижаются по мере увеличения срока беременности. Уровни и активность антитромбина обычно стабильны на протяжении всей беременности, снижаются во время родов и снова повышаются вскоре после родов. Было обнаружено, что приобретенная резистентность к активированному протеину С (APC) возникает во время беременности, даже когда фактор V Лейдена и антифосфолипидные антитела отсутствуют. [18]. Это объясняется высокой активностью фактора VIII и фактора V и низким уровнем свободного белка S. Следовательно, коэффициент чувствительности APC не служит скрининговым тестом на фактор V Лейдена во время беременности.
Следовательно, коэффициент чувствительности APC не служит скрининговым тестом на фактор V Лейдена во время беременности.
Факторы свертывания крови остаются повышенными до 8–12 недель после родов, и анализы на них могут быть ложноотрицательными в течение этого периода.
Маркерами гемостатической активности, имеющими клиническое значение, являются тромбин-антитромбиновые комплексы (ТАТ) и фрагменты протромбина (F 1 + 2), которые отражают образование тромбина in vivo, а также тесты, демонстрирующие расщепление плазмином полимера фибрина с образованием фрагментов, а именно анализ продуктов деградации D-димера и фибрина (FDP). Уровни ТАТ увеличиваются во время беременности; на ранних сроках беременности верхний предел нормы аналогичен диапазону взрослых 2,63 г/л, тогда как в срок верхний предел нормы составляет 18,03 г/л. Уровни D-димера заметно повышаются во время беременности, при этом типичный референтный диапазон в десять раз выше на поздних сроках беременности, чем на ранних сроках беременности или в небеременном состоянии [1]. Увеличение D-димеров отражает общее увеличение общего количества фибрина во время беременности в результате повышенного образования тромбина, повышенного фибринолиза или их комбинации [17]. Это также объясняет, почему анализ D-димера не является надежным для прогнозирования возможности венозной тромбоэмболии у беременных [13].
Увеличение D-димеров отражает общее увеличение общего количества фибрина во время беременности в результате повышенного образования тромбина, повышенного фибринолиза или их комбинации [17]. Это также объясняет, почему анализ D-димера не является надежным для прогнозирования возможности венозной тромбоэмболии у беременных [13].
1. Рамзи Маргарет. Нормальные гематологические изменения во время беременности и послеродового периода. В: Паворд С., Хант Б., редакторы. Руководство по акушерской гематологии. Кембридж: Издательство Кембриджского университета; 2010. С. 1–11. [Google Scholar]
2. Бернштейн И.М., Зиглер В., Бэджер Г.Дж. Увеличение объема плазмы на ранних сроках беременности. J Obstet Gynecol. 2001;97:669. doi: 10.1016/S0029-7844(00)01222-9. [PubMed] [CrossRef] [Google Scholar]
3. Бьоркстен Б., Содерстром Т., Дамбер М.-Г., Шульц Б., Стигбранд Т. Функция полиморфноядерных лейкоцитов во время беременности. Сканд Дж. Иммунол. 1978;8(3):257–262. doi: 10.1111/j. 1365-3083.1978.tb00518.x. [PubMed] [CrossRef] [Google Scholar]
1365-3083.1978.tb00518.x. [PubMed] [CrossRef] [Google Scholar]
4. Ajzenberg N, Dreyfus M, Kaplan C, Yvart J, Weill B, Tchernia G. Повторное посещение тромбоцитопении, связанной с беременностью: оценка и последующее наблюдение за 50 случаями. Кровь. 1998;92(12):4573–4580. [PubMed] [Google Scholar]
5. Баррига С., Родригес А.Б., Орега Э. Повышение фагоцитарной активности полиморфноядерных лейкоцитов во время беременности. Eur J Obstet Gynecol Reprod Biol. 1994;57(1):43–46. дои: 10.1016/0028-2243(94)
6. Crocker IP, Baker PN, Fletcher J. Функция нейтрофилов при беременности и ревматоидном артрите. Энн Реумат Дис. 2000; 59: 555–564. doi: 10.1136/ard.59.7.555. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
7. Taylor DJ, Lind T. Масса эритроцитов во время и после нормальной беременности. Br J Obstet Gynecol. 1979; 86: 364–370. doi: 10.1111/j.1471-0528.1979.tb10611.x. [PubMed] [CrossRef] [Google Scholar]
8. Флеминг А.Ф. Гематологические изменения при беременности. Клин Обстет Гинекол. 1975;2:269. [Google Scholar]
Флеминг А.Ф. Гематологические изменения при беременности. Клин Обстет Гинекол. 1975;2:269. [Google Scholar]
9. Gatti L, Tinconi PM, Guarneri D, Bertuijessi C, Ossola MW, Bosco P, Gianotti G. Параметры гемостаза и активация тромбоцитов с помощью проточной цитометрии при нормальной беременности: продольное исследование. Интернат J Clin Lab Res. 1994;24(4):217–219. doi: 10.1007/BF025. [PubMed] [CrossRef] [Google Scholar]
10. Konijnenberg A, Stokkers E, Post J. Обширная активация тромбоцитов при преэклампсии по сравнению с нормальной беременностью: повышенная экспрессия молекул клеточной адгезии. Am J Obstet Gynecol. 1997;176(2):461–469. doi: 10.1016/S0002-9378(97)70516-7. [PubMed] [CrossRef] [Google Scholar]
11. Джессика М., Бэджер Ф., Хсейх К.С., Троизи Р., Лагиу П., Полишман Н. Увеличение объема плазмы при беременности: последствия для биомаркеров в популяционных исследованиях. Эпидемиологические биомаркеры рака. 2007;16:1720. doi: 10.1158/1055-9965.EPI-07-0311. [PubMed] [CrossRef] [Google Scholar]
[PubMed] [CrossRef] [Google Scholar]
12. Каралис Л., Надан С., Йемен Э.А. Активация тромбоцитов при артериальной гипертензии, вызванной беременностью. Рез. Тромб. 2005;116(5):377–383. doi: 10.1016/j.thromres.2005.01.009. [PubMed] [CrossRef] [Google Scholar]
13. Клайн А.Дж., Уильямс Г.В., Эрнандес-Нино Дж. Концентрация D-димера при нормальной беременности: необходимы новые диагностические пороги. Клин Хим. 2005;51(5):825–829. doi: 10.1373/clinchem.2004.044883. [PubMed] [CrossRef] [Google Scholar]
14. Edlestam G, Lowbeer C, Kral G, et al. Новые референтные значения для рутинных образцов крови и нейтрофильного липокалина человека во время беременности в третьем триместре. Scand J Clin Lab Inv. 2001; 61: 583–592. дои: 10.1080/003655101753267937. [PubMed] [CrossRef] [Google Scholar]
15. Shehlata N, Burrows RF, Kelton JG. Гестационная тромбоцитопения. Клин Обстет Гинекол. 1999;42:327–334. doi: 10.1097/00003081-199
0-00017. [PubMed] [CrossRef] [Google Scholar]
16. Boer K, Cate JW, Sturk A, Borm JJ, Treffers PE. Повышенное образование тромбина при нормальной и гипертонической беременности. Am J Obstet Gynecol. 1989;160(1):95–100. [PubMed] [Google Scholar]
Boer K, Cate JW, Sturk A, Borm JJ, Treffers PE. Повышенное образование тромбина при нормальной и гипертонической беременности. Am J Obstet Gynecol. 1989;160(1):95–100. [PubMed] [Google Scholar]
17. Эйхингер С. Тестирование D-димера при беременности. Патофизиол Гемост Тромб. 2004; 33: 327–329.. doi: 10.1159/000083822. [PubMed] [CrossRef] [Google Scholar]
18. Clark P, Brennard J, Conkie JA, et al. Чувствительность к активированному протеину С, протеин С, протеин S и коагуляция при нормальной беременности. Тромб Хемост. 1998; 79: 1166–1170. [PubMed] [Google Scholar]
Иммунологическая адаптация матери во время нормальной беременности
Введение
Во время беременности в иммунной системе матери происходят основные адаптации, чтобы защитить мать и ее будущего ребенка от патогенов, избегая вредных иммунных реакций против аллогенного плода . Несмотря на то, что имеется мало данных, подтверждающих глобальное подавление материнской иммунной системы во время беременности, повышенный риск некоторых типов инфекций указывает на важные качественные иммунологические изменения (1). Из-за сложности и уникальных обстоятельств, связанных с нормальной беременностью, выяснение того, как конкретные эндокринологические, физиологические и иммунологические факторы повышают риск инфекции, требует тщательного рассмотрения. Например, инфекции мочевыводящих путей могут быть более распространенными или пневмония может быть более тяжелой во время беременности, в основном из-за изменений кровообращения и снижения функциональной остаточной емкости легких из-за повышенного внутрибрюшного давления (2, 3). Другие типы инфекций могут быть просто более частыми из-за их тяжелых клинических последствий для плода (таблица 1). Лучшее понимание иммунологических изменений во время беременности также может быть важным при рассмотрении оптимальных стратегий использования вакцин, таких как грипп и коклюш, для защиты как беременной женщины, так и младенца (73). Тем не менее, эти примеры показывают сложность понимания того, как физиологическая, гормональная и иммунологическая адаптация во время нормальной беременности напрямую влияет на риск инфекции.
Из-за сложности и уникальных обстоятельств, связанных с нормальной беременностью, выяснение того, как конкретные эндокринологические, физиологические и иммунологические факторы повышают риск инфекции, требует тщательного рассмотрения. Например, инфекции мочевыводящих путей могут быть более распространенными или пневмония может быть более тяжелой во время беременности, в основном из-за изменений кровообращения и снижения функциональной остаточной емкости легких из-за повышенного внутрибрюшного давления (2, 3). Другие типы инфекций могут быть просто более частыми из-за их тяжелых клинических последствий для плода (таблица 1). Лучшее понимание иммунологических изменений во время беременности также может быть важным при рассмотрении оптимальных стратегий использования вакцин, таких как грипп и коклюш, для защиты как беременной женщины, так и младенца (73). Тем не менее, эти примеры показывают сложность понимания того, как физиологическая, гормональная и иммунологическая адаптация во время нормальной беременности напрямую влияет на риск инфекции. В недавних обзорах обсуждались основные адаптации взаимодействия матери и плода (74, 75). Была рассмотрена локальная иммунологическая адаптация в плаценте (76). В этой обзорной статье мы описываем динамические изменения, происходящие в периферической иммунной системе матери во время нормальной беременности.
В недавних обзорах обсуждались основные адаптации взаимодействия матери и плода (74, 75). Была рассмотрена локальная иммунологическая адаптация в плаценте (76). В этой обзорной статье мы описываем динамические изменения, происходящие в периферической иммунной системе матери во время нормальной беременности.
Таблица 1 Инфекции, связанные с повышенной материнской восприимчивостью или тяжестью течения беременности, или тяжелые неблагоприятные исходы для плода.
Врожденный иммунитет
Система комплемента
Исследования показывают повышение активности комплемента во время беременности (таблица 2). Уровни в плазме C3a, C4a, C5a, C4d, C3a, C3, C9 и мембранно-атакующего комплекса сывороточного комплемента SC5b9 повышены во время беременности (77, 78, 106). В целом, это увеличение количества расщепленных белков комплемента свидетельствует о повышении активности комплемента у беременных женщин, в то время как баланс поддерживается за счет высоких уровней регуляторных белков, таких как фактор Н, который блокирует альтернативную конвертазу С3 (79). ). В соответствии с этим ингибитор фактора ускорения распада (DAF), также известный как CD55, увеличивается в мононуклеарных клетках периферической крови во время беременности (80). Блокируя образование C3-конвертазы, DAF эффективно ингибирует последующие эффекты активации комплемента. Точно так же во время второго и третьего триместров увеличивается уровень ингибитора С3, ассоциированного с беременностью белка А плазмы (РАРРА) (81, 82). Гемолитическая активность комплемента (CH50) отражает активность классического пути комплемента. Уровень CH50 в сыворотке увеличивается по мере развития беременности (83, 84). Повышенная активность комплемента была связана с преэклампсией и преждевременными родами (107), что позволяет предположить, что сбалансированная активация комплемента необходима для здоровой беременности [рассмотрено в (108)].
). В соответствии с этим ингибитор фактора ускорения распада (DAF), также известный как CD55, увеличивается в мононуклеарных клетках периферической крови во время беременности (80). Блокируя образование C3-конвертазы, DAF эффективно ингибирует последующие эффекты активации комплемента. Точно так же во время второго и третьего триместров увеличивается уровень ингибитора С3, ассоциированного с беременностью белка А плазмы (РАРРА) (81, 82). Гемолитическая активность комплемента (CH50) отражает активность классического пути комплемента. Уровень CH50 в сыворотке увеличивается по мере развития беременности (83, 84). Повышенная активность комплемента была связана с преэклампсией и преждевременными родами (107), что позволяет предположить, что сбалансированная активация комплемента необходима для здоровой беременности [рассмотрено в (108)].
Таблица 2 Изменения комплемента, гранулоцитов и моноцитов при нормальной беременности.
Беременность — это состояние гиперкоагуляции с четырехкратно повышенным риском тромбоза глубоких вен по сравнению с небеременными женщинами (109). Существует взаимодействие между белками острой фазы, системами свертывания крови и системы комплемента. С-реактивный белок (СРБ) активирует С1, С4, С2 и С3 (110–112), а уровни СРБ в сыворотке повышаются во время беременности (85). Фибриноген и фактор VII являются частью каскада коагуляции, который независимо активирует систему комплемента, например, было показано, что тромбин расщепляет С3 и С5 [рассмотрено в (113)]. Уровень фибриногена и фактора VII также увеличивается во время беременности (86), что еще раз подтверждает мнение о том, что система комплемента активируется во время беременности. Высокий уровень прокоагулянтных факторов уравновешивается повышенным уровнем специфических для беременности гликопротеинов (ПСГ) в плазме крови. Эти плацентарные молекулы предотвращают активацию тромбоцитов интегрин-зависимым образом (114).
Существует взаимодействие между белками острой фазы, системами свертывания крови и системы комплемента. С-реактивный белок (СРБ) активирует С1, С4, С2 и С3 (110–112), а уровни СРБ в сыворотке повышаются во время беременности (85). Фибриноген и фактор VII являются частью каскада коагуляции, который независимо активирует систему комплемента, например, было показано, что тромбин расщепляет С3 и С5 [рассмотрено в (113)]. Уровень фибриногена и фактора VII также увеличивается во время беременности (86), что еще раз подтверждает мнение о том, что система комплемента активируется во время беременности. Высокий уровень прокоагулянтных факторов уравновешивается повышенным уровнем специфических для беременности гликопротеинов (ПСГ) в плазме крови. Эти плацентарные молекулы предотвращают активацию тромбоцитов интегрин-зависимым образом (114).
Гранулоциты
Беременность не влияет на количество эозинофилов и базофилов (таблица 2) (85, 86). Однако секреция нейротоксина эозинофилами с мочой повышена во втором и третьем триместре, что свидетельствует об усилении дегрануляции эозинофилов. Напротив, концентрация N-метилгистамина в моче ниже в третьем триместре, что свидетельствует о снижении дегрануляции тучных клеток (87).
Напротив, концентрация N-метилгистамина в моче ниже в третьем триместре, что свидетельствует о снижении дегрануляции тучных клеток (87).
Нейтрофилы убивают микроорганизмы за счет фагоцитоза, нейтрофильных внеклеточных ловушек (NET), образования токсичных гранул и активных форм кислорода (АФК) (115). Начиная с первого триместра беременности наблюдается постепенное заметное увеличение нейтрофилов (85, 88). В соответствии с этим уровни Г-КСФ и ГМ-КСФ, двух цитокинов, опосредующих выработку нейтрофилов костного мозга, также повышены во время беременности (85, 116). Функция нейтрофилов также может изменяться во время беременности. Нейтрофилы — это клетки с высокой потребностью в энергии, которые зависят от гликолиза для производства АТФ и резервируют кислород для производства АФК и азотных соединений митохондриями. Чтобы удовлетворить их метаболические потребности, глюкоза метаболизируется через гексозомонофосфатный шунт, который производит НАДФН для окислительного взрыва. Активация нейтрофилов приводит к транслокации метаболических ферментов к клеточной мембране, где они образуют ферментные комплексы, повышая эффективность этих анаболических процессов. Нейтрофилы беременных женщин обнаруживают ретроградный транспорт этих метаболических ферментов к центросомам, что предполагает активное предотвращение активации метаболизма (89)., 90): Глюкозо-6-фосфатдегидрогеназа и 6-фосфоглюконатдегидрогеназа остаются функциональными в нейтрофилах во время беременности, но поскольку их активность ограничена цитоплазмой, метаболический выход снижается (89, 90). Это может объяснить, почему активированных in vitro нейтрофилов беременных женщин демонстрируют сниженную активность респираторного взрыва и невосприимчивы к примированию IFN-γ (89–91). Напротив, нестимулированные нейтрофилы беременных женщин имеют повышенный окислительный взрыв и продуцируют уровни АФК, которые сопоставимы со стимулированными нейтрофилами небеременных женщин (9).0, 92). В дополнение к продукции АФК нейтрофилы также усиливают НЕТоз во время беременности с постоянным увеличением на протяжении всей беременности (117). В целом, эти исследования in vitro показывают, что базальная функция нейтрофилов увеличивается в покое, но снижается после активации во время беременности.
Нейтрофилы беременных женщин обнаруживают ретроградный транспорт этих метаболических ферментов к центросомам, что предполагает активное предотвращение активации метаболизма (89)., 90): Глюкозо-6-фосфатдегидрогеназа и 6-фосфоглюконатдегидрогеназа остаются функциональными в нейтрофилах во время беременности, но поскольку их активность ограничена цитоплазмой, метаболический выход снижается (89, 90). Это может объяснить, почему активированных in vitro нейтрофилов беременных женщин демонстрируют сниженную активность респираторного взрыва и невосприимчивы к примированию IFN-γ (89–91). Напротив, нестимулированные нейтрофилы беременных женщин имеют повышенный окислительный взрыв и продуцируют уровни АФК, которые сопоставимы со стимулированными нейтрофилами небеременных женщин (9).0, 92). В дополнение к продукции АФК нейтрофилы также усиливают НЕТоз во время беременности с постоянным увеличением на протяжении всей беременности (117). В целом, эти исследования in vitro показывают, что базальная функция нейтрофилов увеличивается в покое, но снижается после активации во время беременности. Различие между покоящимися и активированными нейтрофилами может объяснить кажущиеся противоречивыми сообщения об активности нейтрофилов во время беременности. Повышенная исходная активность нейтрофилов при беременности может быть связана с более эффективной локализацией цитоплазматического фермента миелопероксидазы на поверхности клеток плазматической мембраны при стимуляции (118). Конститутивная экспрессия клеточной поверхности во время беременности может привести к непрерывной продукции АФК без необходимости повторной стимуляции.
Различие между покоящимися и активированными нейтрофилами может объяснить кажущиеся противоречивыми сообщения об активности нейтрофилов во время беременности. Повышенная исходная активность нейтрофилов при беременности может быть связана с более эффективной локализацией цитоплазматического фермента миелопероксидазы на поверхности клеток плазматической мембраны при стимуляции (118). Конститутивная экспрессия клеточной поверхности во время беременности может привести к непрерывной продукции АФК без необходимости повторной стимуляции.
Данные подтверждают измененный фагоцитоз нейтрофилов во время беременности (93). Эластаза и лактоферрин секретируются из гранул первичных и вторичных нейтрофилов, соответственно, и их уровень повышен в первом триместре (85). Хотя повышенные уровни могут указывать на повышенную активацию нейтрофилов, количество белка эластазы или лактоферрина на гранулоцит остается неизменным или даже снижается по мере развития беременности (85, 91). Таким образом, повышенные уровни в плазме могут просто отражать увеличение числа гранулоцитов во время беременности. Экспрессия маркера активации человеческого нейтрофильного антигена-2a (HNA-2a), также известного как NB1 или CD177, увеличивается во время беременности и остается повышенной в течение как минимум 4–8 недель после родов по сравнению с небеременными женщинами (9).4). С другой стороны, поверхностная экспрессия маркеров активации нейтрофилов CD11b, CD15, CD18 и CD62L не отличается у беременных и небеременных женщин (91, 92). Нейтрофилы могут представлять антигены Т-лимфоцитам через молекулу MHC II HLA-DR (119). Экспрессия маркера зрелости нейтрофилов CD16 и HLA-DR была снижена на гранулоцитах беременных женщин в одном исследовании (92). В другом исследовании сообщалось о повышенной экспрессии CD11b на гранулоцитах на поздних сроках беременности, но несколько женщин были в родах во время сбора крови, что могло исказить результаты (9).5). Одно исследование показало, что экспрессия мРНК TLR2 и TLR4 была сопоставима у беременных и небеременных женщин (120). Напротив, экспрессия корецептора TLR4 CD14 и рецептора Fc CD64 была повышена на гранулоцитах во втором и третьем триместрах беременности, что подтверждает повышенную активацию нейтрофилов во время беременности (92).
Экспрессия маркера активации человеческого нейтрофильного антигена-2a (HNA-2a), также известного как NB1 или CD177, увеличивается во время беременности и остается повышенной в течение как минимум 4–8 недель после родов по сравнению с небеременными женщинами (9).4). С другой стороны, поверхностная экспрессия маркеров активации нейтрофилов CD11b, CD15, CD18 и CD62L не отличается у беременных и небеременных женщин (91, 92). Нейтрофилы могут представлять антигены Т-лимфоцитам через молекулу MHC II HLA-DR (119). Экспрессия маркера зрелости нейтрофилов CD16 и HLA-DR была снижена на гранулоцитах беременных женщин в одном исследовании (92). В другом исследовании сообщалось о повышенной экспрессии CD11b на гранулоцитах на поздних сроках беременности, но несколько женщин были в родах во время сбора крови, что могло исказить результаты (9).5). Одно исследование показало, что экспрессия мРНК TLR2 и TLR4 была сопоставима у беременных и небеременных женщин (120). Напротив, экспрессия корецептора TLR4 CD14 и рецептора Fc CD64 была повышена на гранулоцитах во втором и третьем триместрах беременности, что подтверждает повышенную активацию нейтрофилов во время беременности (92). В целом данные свидетельствуют об усилении активации нейтрофилов во время беременности, но их способность выполнять эффекторные функции (например, презентация антигена) может быть ограничена.
В целом данные свидетельствуют об усилении активации нейтрофилов во время беременности, но их способность выполнять эффекторные функции (например, презентация антигена) может быть ограничена.
Во время беременности сообщалось о снижении экспрессии нейтрофилами CD10 и повышении экспрессии CD15 (96). Этот фенотип (CD10 низкий , CD15 высокий ) был наиболее выражен в третьем триместре и характерен для незрелых нейтрофилов (96). Во многих исследованиях для выделения нейтрофилов используется центрифугирование в плотности, что приводит к потере незрелых нейтрофилов низкой плотности. Та же фракция низкой плотности также содержит миелоидные супрессорные клетки (MDSC), гетерогенную группу зрелых и незрелых моноцитарных или гранулоцитарных клеток, обладающих иммунодепрессивной функцией. MDSC обычно не обнаруживаются в периферической крови здоровых взрослых, но часто встречаются у онкологических больных или новорожденных [рассмотрено в (121)]. Количество циркулирующих гранулоцитарных, но не моноцитарных MDSC выше у беременных женщин (97). Низкий уровень MDSC во время беременности был связан с выкидышем (122), таким образом, MDSC могут играть важную роль в поддержании адекватной иммуносупрессии на границе между матерью и плодом.
Низкий уровень MDSC во время беременности был связан с выкидышем (122), таким образом, MDSC могут играть важную роль в поддержании адекватной иммуносупрессии на границе между матерью и плодом.
Моноциты
У человека были охарактеризованы три основных подмножества моноцитов. Классические моноциты (CD14 high CD16 — ) составляют основную часть периферической крови здоровых взрослых (~80% всех моноцитов) и выполняют фагоцитарные функции. Неклассические моноциты (CD14 низкий CD16 высокий ) являются воспалительными, и высокие уровни в периферической крови наблюдались у взрослых, страдающих хроническими или острыми воспалительными заболеваниями (123). Промежуточные моноциты (CD14 высокие CD16 промежуточные ) могут представлять собой переходное состояние, проявляя как воспалительную, так и фагоцитарную способность (123). Моноциты также представляют антигены Т-клеткам, тем самым модулируя адаптивные иммунные ответы.
Влияние беременности на функцию материнских моноцитов рассматривалось в другом месте (124, 125), и здесь мы лишь кратко суммируем ключевые моменты. Моноциты увеличиваются во время беременности, начиная с первого триместра (табл. 2) (9).8, 99). Это увеличение в основном связано с более высокими уровнями «промежуточных» моноцитов, в то время как классические моноциты снижаются без изменения доли неклассических моноцитов (100, 101). Увеличением промежуточных моноцитов можно объяснить наблюдаемую повышенную продукцию IL-12 и TNFα, индуцированную стимуляцией, моноцитами беременных женщин на протяжении всей беременности (102, 103) и снижение фагоцитоза во время беременности (93). Повышенная провоспалительная активность моноцитов дополнительно подтверждается повышенным уровнем маркеров активации CD11a, CD11b, CD14 и CD64, а также более высокой продукцией АФК моноцитами беременных женщин (88, 9).2). Повышенное количество неклассических моноцитов и повышенная активация моноцитов могут быть частично вызваны секретируемыми плацентой молекулами и клеточными частицами [рассмотрено в (125)]. Например, было показано, что внеклеточные везикулы плацентарного происхождения индуцируют созревание и активацию моноцитов ex vivo (126). Кроме того, гормональные изменения во время беременности могут влиять на активность моноцитов (127).
Например, было показано, что внеклеточные везикулы плацентарного происхождения индуцируют созревание и активацию моноцитов ex vivo (126). Кроме того, гормональные изменения во время беременности могут влиять на активность моноцитов (127).
В отличие от результатов, приведенных выше, моноциты у беременных женщин обладают противовоспалительным действием и демонстрируют фенотипические признаки толерантности к эндотоксинам, наблюдаемые на поздних стадиях сепсиса (9).9, 104). В периферической крови беременных женщин в третьем триместре LPS-индуцированная продукция IL-12 и TNFα моноцитами была снижена по сравнению с контрольной группой без беременных (99, 127). Кроме того, несколько генов, кодирующих HLA, экспрессируются на более низких уровнях в моноцитах у беременных женщин в первом триместре по сравнению с небеременными женщинами (98), а поверхностная экспрессия MHC II снижена (101). Вместе это напоминает противовоспалительное состояние, наблюдаемое при сепсисе, когда за начальной сильной провоспалительной реакцией следует иммунный паралич (128). Как и при сепсисе, время забора крови во время беременности может влиять на сообщаемые иммунологические изменения. В нескольких исследованиях сообщалось об увеличении продукции TNFα и IL-12 моноцитами у беременных женщин, использующих IFN-γ в коктейле для стимуляции (102, 103). Давно известно, что IFN-γ устраняет паралич септических моноцитов (129).), следовательно, вполне вероятно, что во время беременности материнские моноциты находятся в хроническом слабовыраженном воспалительном, но невосприимчивом состоянии, которое можно преодолеть с помощью адекватной стимуляции (130).
Как и при сепсисе, время забора крови во время беременности может влиять на сообщаемые иммунологические изменения. В нескольких исследованиях сообщалось об увеличении продукции TNFα и IL-12 моноцитами у беременных женщин, использующих IFN-γ в коктейле для стимуляции (102, 103). Давно известно, что IFN-γ устраняет паралич септических моноцитов (129).), следовательно, вполне вероятно, что во время беременности материнские моноциты находятся в хроническом слабовыраженном воспалительном, но невосприимчивом состоянии, которое можно преодолеть с помощью адекватной стимуляции (130).
Это провоспалительное состояние уравновешивается активацией регуляторных функций. Гены, кодирующие IL-10 и IDO, а также негативный иммунный регулятор CD200, активируются, в то время как транскрипты IL8 и CXCL10 подавляются на моноцитах после первого триместра беременности (98). В соответствии с этим сообщалось о снижении количества неклассических моноцитов и увеличении количества классических моноцитов в третьем триместре беременности по сравнению со здоровым контролем (105).
Хотя описанные результаты кажутся противоречивыми, они могут указывать на то, что беременность вызывает специфические иммунологические изменения, которые не поддаются упрощенному сравнению с болезненными состояниями. Например, подобно гранулоцитам, моноциты сталкиваются с повышенной потребностью в фагоцитозе во время беременности из-за присутствия в кровотоке фетальных и плацентарных клеток и частиц. Это может быть достигнуто за счет увеличения количества классических моноцитов. Однако повышенное поглощение антигена должно быть тщательно сбалансировано с подавлением антигенпрезентирующих функций лимфоцитов, чтобы предотвратить аллогенное отторжение плода, примером которого является снижение экспрессии MHC II на моноцитах беременных женщин (101). Более того, противоречивые данные могут быть вызваны различиями в дизайне исследования (например, гестационном возрасте на момент взятия проб) и методе выделения клеток. Например, было показано, что изоляция РВМС влияет на соотношение обнаруживаемых неклассических и классических моноцитов (123).
Врожденные лимфоидные клетки
Врожденные лимфоидные клетки (ILC) лишены CD3 и антиген-специфических рецепторов (131). NK-клетки являются наиболее охарактеризованными ILC (132). В крови большинство NK-клеток экспрессируют низкий уровень молекулы адгезии CD56 и Ig-рецептора CD16. Эти клетки CD56 dim считаются цитотоксическими эффекторными клетками. И наоборот, CD56 яркая NK-клетки гораздо реже встречаются в периферической крови, а также менее цитотоксичны из-за низкой экспрессии CD16, что позволяет предположить, что они обладают иммуномодулирующим действием (132). NKT-клетки экспрессируют как Т-клеточный рецептор (TCR), так и маркеры, связанные с NK-клетками. NKT-клетки типа I (классические или NKT [iNKT]-клетки) имеют ограниченное разнообразие TCR и распознают липидные антигены α-галактозилцерамида (αGalCer) зависимым от CD1d образом. Тип II, или неклассические, NKT-клетки также ограничены по CD1d, но реагируют на липиды, отличные от αGalCer, и имеют большее разнообразие в своем репертуаре TCR (133). NKT-клетки могут защищать от инфекций и аутоиммунных заболеваний и, подобно NK-клеткам, могут продуцировать цитокины по типу, отражающему субпопуляции Th (133).
NKT-клетки могут защищать от инфекций и аутоиммунных заболеваний и, подобно NK-клеткам, могут продуцировать цитокины по типу, отражающему субпопуляции Th (133).
Специализированные NK-клетки обнаруживаются в децидуальной оболочке плаценты и необходимы для успешного развития спиральных артерий и имплантации плода в первом триместре беременности [рассмотрено в (134)]. Напротив, меньше известно о влиянии беременности на циркулирующие NK-клетки (таблица 3). Большинство исследований сообщают об отсутствии изменений в подмножествах NK (CD56 тусклый , CD56 яркий ), инвариантных NK T-клетках (iNKT) и неклассических NK T-клетках II типа в периферической крови между беременными и небеременными женщинами (135–137). ), несмотря на снижение количества NK-клеток (138, 139). Подмножества NK-клеток иногда дополнительно подразделяют на иммунитет типа 1 и типа 2 в зависимости от цитокинов, которые они продуцируют. При изучении поверхностной экспрессии IL18R1 (иммунитет 1-го типа из-за стимуляции продукции IFN-γ) и IL1RL1 (его активация IL-33 способствует врожденному иммунитету) было обнаружено, что соотношение NK-клеток 1-го и 2-го типа снижается на третьем триместре по сравнению со здоровым контролем (140). По сравнению с контрольной группой, не состоящей в беременности, процент клеток, экспрессирующих IL18R1, значительно ниже в третьем триместре беременности. Кроме того, снижается количество поверхностных молекул IL18R1 на клетку (140). Также было показано, что экспрессия рецептора самонаведения увеличивается на CD56 9 типа 2.0007 ярких NK-клеток во втором триместре по сравнению с первым и третьим триместром. Для NK-клеток CD56 dim типа 2 экспрессия рецептора самонаведения наиболее высока в третьем триместре (135). Соответствует ли это повышенной миграции NK-клеток в плаценту на разных стадиях беременности, еще предстоит выяснить.
По сравнению с контрольной группой, не состоящей в беременности, процент клеток, экспрессирующих IL18R1, значительно ниже в третьем триместре беременности. Кроме того, снижается количество поверхностных молекул IL18R1 на клетку (140). Также было показано, что экспрессия рецептора самонаведения увеличивается на CD56 9 типа 2.0007 ярких NK-клеток во втором триместре по сравнению с первым и третьим триместром. Для NK-клеток CD56 dim типа 2 экспрессия рецептора самонаведения наиболее высока в третьем триместре (135). Соответствует ли это повышенной миграции NK-клеток в плаценту на разных стадиях беременности, еще предстоит выяснить.
Таблица 3 Изменения системных врожденных лимфоидных клеток при нормальной беременности.
Материнские NK-клетки и моноциты имеют повышенную экспрессию белка иммунных контрольных точек TIM-3 во время беременности (137, 141), что может быть вызвано высоким уровнем IL-4 и низким уровнем IFN-γ (143). TIM-3 важен для опосредованной NK-клетками продукции IFN-γ и может способствовать усилению фагоцитоза во время беременности (143). Высокие поверхностные уровни TIM-3, характерные для истощения лимфоцитов (144), потенциально указывают на то, что NK-клетки беременных являются анергическими. Плазменные уровни галектина-9(лиганд TIM-3) повышены на протяжении всей беременности (137). Высокий уровень этого лектина может быть связан с высокой выработкой плаценты (137), однако его влияние во время беременности и его вклад в активацию TIM-3 неясны. Повышенная способность воспалительных NK-клеток во время беременности дополнительно подтверждается исследованиями, показывающими повышенную экспрессию маркера активации CD69 на CD4 neg iNKT-клетках по мере развития беременности (136). Точно так же экспрессия маркера дегрануляции LAMP-1 (CD107a) на CD56 dim клеток после стимуляции РМА-иономицином и исходные уровни цитотоксических маркеров NKp46 (CD335) и CD38 повышаются в третьем триместре по сравнению с небеременными женщинами (101, 137, 145). Кроме того, NK-клеток in vitro реагируют на инфицированные гриппом или раковые клетки выше во время беременности (145).
Высокие поверхностные уровни TIM-3, характерные для истощения лимфоцитов (144), потенциально указывают на то, что NK-клетки беременных являются анергическими. Плазменные уровни галектина-9(лиганд TIM-3) повышены на протяжении всей беременности (137). Высокий уровень этого лектина может быть связан с высокой выработкой плаценты (137), однако его влияние во время беременности и его вклад в активацию TIM-3 неясны. Повышенная способность воспалительных NK-клеток во время беременности дополнительно подтверждается исследованиями, показывающими повышенную экспрессию маркера активации CD69 на CD4 neg iNKT-клетках по мере развития беременности (136). Точно так же экспрессия маркера дегрануляции LAMP-1 (CD107a) на CD56 dim клеток после стимуляции РМА-иономицином и исходные уровни цитотоксических маркеров NKp46 (CD335) и CD38 повышаются в третьем триместре по сравнению с небеременными женщинами (101, 137, 145). Кроме того, NK-клеток in vitro реагируют на инфицированные гриппом или раковые клетки выше во время беременности (145). В совокупности это указывает на повышенную исходную активность и повышенный потенциал усиления провоспалительных реакций, что подчеркивает усиление врожденного иммунитета во время беременности. Напротив, продукция IFN-γ снижается, а продукция IL-10 после ex vivo стимуляция РМА-иономицином увеличивает количество NK-клеток с первого триместра по сравнению с небеременными женщинами (142). Эта противовоспалительная способность может способствовать ослаблению адаптивной иммунной системы.
В совокупности это указывает на повышенную исходную активность и повышенный потенциал усиления провоспалительных реакций, что подчеркивает усиление врожденного иммунитета во время беременности. Напротив, продукция IFN-γ снижается, а продукция IL-10 после ex vivo стимуляция РМА-иономицином увеличивает количество NK-клеток с первого триместра по сравнению с небеременными женщинами (142). Эта противовоспалительная способность может способствовать ослаблению адаптивной иммунной системы.
Нецитотоксические ILC сгруппированы в три подтипа: ILC1, ILC2 и ILC3. Эти типы клеток имеют сходные функции и фенотипы с Th2, Th3 и Th27 соответственно (131). ILC обнаружены в плаценте человека (146), но, насколько нам известно, ни одно исследование не оценивало ILC в других тканях или крови матери во время беременности.
Адаптивный иммунитет
Т-клетки
Абсолютное количество лимфоцитов и процент от общего количества Т-клеток существенно не различается в течение первого, второго и третьего триместров беременности (147, 148), в то время как количество Т-клеток во время беременности ниже, чем до беременности (таблица 4) (149).
Таблица 4 Изменения Т-клеток, В-клеток и иммуноглобулинов при нормальной беременности.
Беременность также была связана с изменениями в подмножествах Т-клеток, хотя данные противоречивы, а значимость неясна (147–150). Процент CD4 + и CD8 + Т-клеток женщин на разных сроках гестации существенно не различаются (147, 148). В другом исследовании не было обнаружено существенных изменений в процентном соотношении CD4 + клеток, CD8 + клеток, а также в соотношении CD4 + / CD8 + на любой стадии беременности (150). Однако по сравнению с периодом до беременности количество Т-хелперов и цитотоксических Т-клеток было ниже в третьем и первом триместрах беременности, соответственно, тогда как количество супрессорных Т-клеток было выше в первом триместре беременности (149).). В конце первого триместра наблюдается всплеск эстрогена и прогестерона, что приводит к обратимой инволюции тимуса, что может частично объяснить наблюдаемое снижение как клеток CD4 + , так и клеток CD8 + (196, 197).
В исследованиях изучалось соотношение клеток Th3 и Th2, измеренное по уровням в кровотоке секретируемых цитокинов Th2 или Th3 сыворотки, или по уровням клеток CD4 + , продуцирующих цитокины Th2 или Th3, или по экспрессии хемокиновых рецепторов CXCR3 (связанных с клетками Th2 ) и CCR4 (связанный с клетками Th3) на CD4 + Т-клетки. Представление о беременности как о состоянии Th3 поддерживается многочисленными исследованиями (151–155), но также отвергается другими (198). Рассмотрение беременности как состояния Th3 подтверждается повышением уровня противовоспалительных цитокинов и исследованиями, показывающими, что аутоиммунные расстройства Th2- и Th27-типа улучшаются (199–201), тогда как аутоиммунные расстройства Th3-типа ухудшаются во время беременности (202). Прогрессивный переход от клеточно-опосредованного, провоспалительного, Th2-клеточного ответа к гуморальному, противовоспалительному, Th3-клеточному ответу начинается на ранних сроках беременности (1, 156). Этот связанный с беременностью фенотип Th3 разрешается через 4 недели после родов (203). Процент IFN-γ-продуцирующих CD4 + клеток ниже в третьем триместре, в то время как в одном исследовании не наблюдалось никаких изменений в IL-4-продуцирующих CD4 + Т-клетках (158). Другие исследования не обнаружили изменений в клетках Th2/Th3 во время беременности (158, 159) и стабильной пропорции CD3 + CD8 — IFN-γ + клеток на протяжении всей беременности (159). Однако недавнее исследование показало, что уровни IL-2 в плазме (указывающие на клетки Th2) были ниже в послеродовом периоде по сравнению со всеми триместрами (157).
Этот связанный с беременностью фенотип Th3 разрешается через 4 недели после родов (203). Процент IFN-γ-продуцирующих CD4 + клеток ниже в третьем триместре, в то время как в одном исследовании не наблюдалось никаких изменений в IL-4-продуцирующих CD4 + Т-клетках (158). Другие исследования не обнаружили изменений в клетках Th2/Th3 во время беременности (158, 159) и стабильной пропорции CD3 + CD8 — IFN-γ + клеток на протяжении всей беременности (159). Однако недавнее исследование показало, что уровни IL-2 в плазме (указывающие на клетки Th2) были ниже в послеродовом периоде по сравнению со всеми триместрами (157).
В то время как провоспалительные цитокины (ИЛ-1β, ИЛ-6, ИЛ-8 и ФНО-α) увеличиваются в амниотической жидкости во время беременности и родов (204, 205), плазматические провоспалительные цитокины (например, ИЛ-2 и IFN-γ) (206) снижается, а противовоспалительные цитокины увеличиваются (например, IL-4 и IL-10) при беременности (175, 203). Однако количество клеток, секретирующих IFN-γ и IL-4, постепенно увеличивается по мере развития беременности по сравнению с послеродовым периодом (160). Напротив, недавнее исследование показало, что процент покоящихся CD4 9Клетки 0007 + , экспрессирующие CXCR3 и CCR4, существенно не менялись на разных стадиях беременности (159).
Однако количество клеток, секретирующих IFN-γ и IL-4, постепенно увеличивается по мере развития беременности по сравнению с послеродовым периодом (160). Напротив, недавнее исследование показало, что процент покоящихся CD4 9Клетки 0007 + , экспрессирующие CXCR3 и CCR4, существенно не менялись на разных стадиях беременности (159).
Гормоны могут влиять на дифференцировку Th-клеток. Уровни эстрадиола в сыворотке увеличиваются до 500 раз во время беременности (175). Низкий уровень эстрадиола способствует ответу Th2, тогда как высокий уровень эстрадиола способствует ответу Th3 (1). Повышенный уровень прогестерона подавляет Th2-ответы во время беременности (207) и может индуцировать цитокины Th3-типа (например, IL-4 и IL-5) (208), дополнительно усиливая поляризацию к Th3. Кроме того, прогестерон может оказывать противовоспалительное действие, что подтверждается более высокими уровнями ИЛ-10 у женщин, получавших прогестерон, по сравнению с плацебо (209).).
Клетки Th27 играют важную роль в борьбе с внеклеточными бактериями или грибковыми патогенами (210). Соотношение клеток Th27 и CD4 + Т-клеток такое же, как и у здоровых небеременных женщин на всех стадиях беременности (161, 211). Однако одно исследование выявило 60-процентное падение процентного содержания клеток CD3 + CD8 − IL17 + между первым и вторым триместрами беременности (159).
Соотношение клеток Th27 и CD4 + Т-клеток такое же, как и у здоровых небеременных женщин на всех стадиях беременности (161, 211). Однако одно исследование выявило 60-процентное падение процентного содержания клеток CD3 + CD8 − IL17 + между первым и вторым триместрами беременности (159).
Данные о функции Т-клеток во время беременности немногочисленны и противоречивы (таблица 4). Методы, используемые для измерения пролиферации, имеют значение для интерпретации функции Т-клеток. Например, пролиферация, измеренная с использованием 3 Включение H-тимидина в реплицирующуюся ДНК может занижать истинный пролиферативный ответ, поскольку он выявляет только клетки в раннем цикле деления, таким образом потенциально пропуская клетки, которые уже находились за пределами S-фазы клеточного цикла до 3 H -тимидиновый пульс (212).
В-клетки
Материнские антитела являются основным компонентом материнского иммунитета, защищающим новорожденного сразу после рождения (213). Исследования показали, что нецитотоксические антитела, продуцируемые материнскими В-клетками, направленные против отцовских антигенов, обнаруживаются у большинства женщин, перенесших нормальную беременность в течение первого триместра, тогда как они отсутствуют у подавляющего большинства женщин, перенесших самопроизвольный аборт. Это также указывает на то, что эти антитела могут иметь решающее значение для успешной беременности (214). Количество В-клеток периферической крови различается во время нормальной беременности и в послеродовой период, а также по сравнению со здоровыми небеременными женщинами (таблица 4) (149)., 150, 165–174). Снижение циркулирующих В-клеток особенно заметно в третьем триместре, что свидетельствует о «физиологической» В-клеточной лимфопении (175) из-за влияния повышенного уровня эстрогенов на лимфопоэз (215, 216). Эту В-клеточную лимфопению также связывают с миграцией клеток в ткани, включая децидуальную оболочку плаценты, и предполагается, что В-клетки играют особенно важную роль в поддержании толерантности на границе между матерью и плодом (217).
Исследования показали, что нецитотоксические антитела, продуцируемые материнскими В-клетками, направленные против отцовских антигенов, обнаруживаются у большинства женщин, перенесших нормальную беременность в течение первого триместра, тогда как они отсутствуют у подавляющего большинства женщин, перенесших самопроизвольный аборт. Это также указывает на то, что эти антитела могут иметь решающее значение для успешной беременности (214). Количество В-клеток периферической крови различается во время нормальной беременности и в послеродовой период, а также по сравнению со здоровыми небеременными женщинами (таблица 4) (149)., 150, 165–174). Снижение циркулирующих В-клеток особенно заметно в третьем триместре, что свидетельствует о «физиологической» В-клеточной лимфопении (175) из-за влияния повышенного уровня эстрогенов на лимфопоэз (215, 216). Эту В-клеточную лимфопению также связывают с миграцией клеток в ткани, включая децидуальную оболочку плаценты, и предполагается, что В-клетки играют особенно важную роль в поддержании толерантности на границе между матерью и плодом (217). В мышиной модели лечение мышей эстрогеном повышало экспрессию генов рецептора CD22 и внутриклеточной тирозинфосфатазы SHP-1 в В-клетках. Сверхэкспрессия этих генов приводит к уменьшению кальциевого ответа в В-клетках после активации BCR, что подтверждает роль этих молекул в снижении передачи сигналов рецепторов В-клеток (218).
В мышиной модели лечение мышей эстрогеном повышало экспрессию генов рецептора CD22 и внутриклеточной тирозинфосфатазы SHP-1 в В-клетках. Сверхэкспрессия этих генов приводит к уменьшению кальциевого ответа в В-клетках после активации BCR, что подтверждает роль этих молекул в снижении передачи сигналов рецепторов В-клеток (218).
Беременность также связана с изменениями в подмножествах В-клеток, особенно с более низкими врожденными В-1-клетками во время беременности до родов и в раннем послеродовом периоде (149, 165, 169, 173). В-1-клетки являются основным источником «врожденных» IgM-антител, играющих защитную роль на ранней стадии после заражения (219).
Функция В-клеток также снижается по мере развития беременности. Сообщалось о потере чувствительности к митогенам и инфекционным агентам, что может увеличить риск инфекции (таблица 4) (180). Анализ сывороточных маркеров функции и активации В-клеток, таких как растворимый CD23 (sCD23) и фактор активации В-клеток (BAFF), обеспечивает дальнейшее понимание изменений в биологии В-клеток во время беременности. CD23 экспрессируется на самых ранних В-клетках, выходящих из костного мозга, в то время как В-клетки постгерминального центра являются CD23-отрицательными. После активации В-клеток CD23 расщепляется, и, таким образом, уровни sCD23, стабильные в течение 12–24 часов, являются маркером перехода от наивных к В-клеткам памяти (MBC) (220). У небеременных людей высокий уровень sCD23 был связан с воспалительными и лимфопролиферативными заболеваниями (221, 222) и рецидивом ревматоидного артрита (223). Плазменные уровни sCD23 снижаются в течение третьего триместра беременности (179), что свидетельствует о более низком переходе от наивных к MBC и может отражать противовоспалительное состояние во время беременности. Экспрессия BAFF в трофобластах и децидуальной оболочке ассоциирована с ранним рецидивирующим спонтанным абортом (224). Уровни BAFF в плазме увеличиваются в течение третьего триместра (179), что свидетельствует о том, что BAFF может играть важную роль в имплантации эмбриона. Кроме того, уровни периферических В-клеток обратно коррелируют с уровнями BAFF в сыворотке у пациентов с ревматоидным артритом, получающих терапию, направленную на истощение В-клеток, или у пациентов с первичным дефицитом антител (223, 225).
CD23 экспрессируется на самых ранних В-клетках, выходящих из костного мозга, в то время как В-клетки постгерминального центра являются CD23-отрицательными. После активации В-клеток CD23 расщепляется, и, таким образом, уровни sCD23, стабильные в течение 12–24 часов, являются маркером перехода от наивных к В-клеткам памяти (MBC) (220). У небеременных людей высокий уровень sCD23 был связан с воспалительными и лимфопролиферативными заболеваниями (221, 222) и рецидивом ревматоидного артрита (223). Плазменные уровни sCD23 снижаются в течение третьего триместра беременности (179), что свидетельствует о более низком переходе от наивных к MBC и может отражать противовоспалительное состояние во время беременности. Экспрессия BAFF в трофобластах и децидуальной оболочке ассоциирована с ранним рецидивирующим спонтанным абортом (224). Уровни BAFF в плазме увеличиваются в течение третьего триместра (179), что свидетельствует о том, что BAFF может играть важную роль в имплантации эмбриона. Кроме того, уровни периферических В-клеток обратно коррелируют с уровнями BAFF в сыворотке у пациентов с ревматоидным артритом, получающих терапию, направленную на истощение В-клеток, или у пациентов с первичным дефицитом антител (223, 225). Таким образом, это повышение уровня BAFF в третьем триместре беременности подтверждает факт снижения общего пула В-клеток на поздних сроках беременности.
Таким образом, это повышение уровня BAFF в третьем триместре беременности подтверждает факт снижения общего пула В-клеток на поздних сроках беременности.
Иммуноглобулины
Исследования 1960–1970-х годов показали противоречивые результаты относительно уровней иммуноглобулинов (Ig) во время беременности (таблица 4). Некоторые исследования предполагают, что уровни общего IgG остаются стабильными во время беременности (181–183), в то время как другие исследования показывают снижение на поздних сроках беременности (179, 184–189). Уровни IgG1 были выше во время беременности по сравнению с небеременными женщинами, в то время как уровни IgG3 были выше у беременных во втором триместре беременности по сравнению с небеременными женщинами (178). IgG1 представляет собой подкласс, который наиболее эффективно трансплацентарно передается новорожденному и является более сильным индуктором Fc-опосредованных эффекторных механизмов (например, антителозависимой клеточной цитотоксичности, комплементзависимой цитотоксичности и антителозависимого клеточного фагоцитоза (226), таким образом, потенциально обеспечение критической защиты как для матери, так и для ребенка в раннем возрасте Уровни IgG2 и IgG4 остаются стабильными во время беременности и сопоставимы с таковыми у небеременных женщин (178). IgG1 и IgG3, сопоставимые с IgG2 и IgG4), подчеркивают проблемы интерпретации и сравнения результатов, полученных в разных когортах с использованием разных иммунологических анализов. Еще одним важным предостережением в отношении этих исследований является то, что измерение концентраций антител, безусловно, не полностью объясняет функциональные изменения антител, если только другие характеристики не учитываются. исследуются, включая авидность и, в последнее время, структурные изменения такие как гликозилирование, которые усиливают функции антител (227, 228).
IgG1 и IgG3, сопоставимые с IgG2 и IgG4), подчеркивают проблемы интерпретации и сравнения результатов, полученных в разных когортах с использованием разных иммунологических анализов. Еще одним важным предостережением в отношении этих исследований является то, что измерение концентраций антител, безусловно, не полностью объясняет функциональные изменения антител, если только другие характеристики не учитываются. исследуются, включая авидность и, в последнее время, структурные изменения такие как гликозилирование, которые усиливают функции антител (227, 228).
IgG представляют собой гликопротеины и содержат N-гликаны как в Fc-, так и в Fab-части IgG. Эти N-гликаны состоят из постоянного гептасахаридного ядра, фукозы, N-ацетилглюкозамина (GlcNAc), галактозы и сиаловой кислоты (190, 229). Было показано, что беременность связана с изменениями в гликозилировании Fc-домена IgG, с увеличением галактозилирования и сиалирования Fc-фрагмента IgG (190–192), тогда как фукозилирование Fc, как было показано, остается на высоком и очень похожем уровне во время беременности. 190, 192). Гликозилирование домена Fc IgG может иметь иммунорегуляторные функции и модулировать эффекторные функции IgG, поскольку гликаны, связанные с Fc, изменяют трехмерную структуру белка, таким образом влияя на связывание с Fc-рецепторами (230, 231). Гликан-гликановые взаимодействия происходят между IgG и Fc-рецептором IIIa (232), при этом коровая фукоза снижает аффинность этого взаимодействия (233). Таким образом, высокое фукозилирование части Fc IgG, которое, как сообщается, происходит во время беременности, может ингибировать связывание с Fc-рецептором IIIa, экспрессируемым на NK-клетках, и, таким образом, снижать активность ADCC, предполагая, что эта посттрансляционная модификация может связаны с повышенным риском инфекций во время беременности.
190, 192). Гликозилирование домена Fc IgG может иметь иммунорегуляторные функции и модулировать эффекторные функции IgG, поскольку гликаны, связанные с Fc, изменяют трехмерную структуру белка, таким образом влияя на связывание с Fc-рецепторами (230, 231). Гликан-гликановые взаимодействия происходят между IgG и Fc-рецептором IIIa (232), при этом коровая фукоза снижает аффинность этого взаимодействия (233). Таким образом, высокое фукозилирование части Fc IgG, которое, как сообщается, происходит во время беременности, может ингибировать связывание с Fc-рецептором IIIa, экспрессируемым на NK-клетках, и, таким образом, снижать активность ADCC, предполагая, что эта посттрансляционная модификация может связаны с повышенным риском инфекций во время беременности.
Асимметричные IgG характеризуются наличием олигосахаридной группы с высоким содержанием маннозы только в одном из двух Fab-фрагментов и присутствуют в сыворотке млекопитающих примерно в 15% от общего количества IgG. Считается, что эти антитела действуют локально на плацентарном уровне, блокируя плацентарные антигены, тем самым предотвращая иммунологическую атаку со стороны материнских естественных киллеров (NK) и цитотоксических лимфоцитов (193). Интересно, что беременность связана с увеличением количества асимметричных антител IgG (193, 19).4).
Интересно, что беременность связана с увеличением количества асимметричных антител IgG (193, 19).4).
В то время как некоторые данные, в основном относящиеся к 1960–1970-м годам, подтверждают отсутствие значительных изменений уровня IgA во время беременности (166, 182, 183, 186, 189), другие данные указывают на то, что во время беременности происходят более динамичные изменения (178, 179). , 187). Данные об уровне IgM во время беременности противоречивы (166, 178, 179, 181, 182, 184–187, 195). Немногочисленные данные показывают, что уровни IgE остаются стабильными во время беременности (таблица 4) (178).
Различные факторы могут объяснить снижение общего уровня Ig во время беременности, включая угнетение клеточно-опосредованного иммунитета, потерю белка с мочой, гемодилюцию, перенос IgG от матери к плоду через плаценту или гормоны, связанные с беременностью, особенно стероидные гормоны. , которые влияют на синтез белка (234, 235). Гемодилюция из-за увеличения внутрисосудистого объема во время беременности может объяснить низкий уровень Ig. Тем не менее, одно небольшое исследование показало, что хотя общие уровни IgG, IgM и IgA снижались от первого триместра ко второму триместру, а в третьем триместре также для IgG по сравнению с первым триместром, это снижение также сопровождалось уменьшением отношения общего IgG к сывороточному белку во втором и третьем триместре, что подтверждает истинное снижение уровня сывороточного Ig, не связанное только со снижением сывороточного белка (187).
Тем не менее, одно небольшое исследование показало, что хотя общие уровни IgG, IgM и IgA снижались от первого триместра ко второму триместру, а в третьем триместре также для IgG по сравнению с первым триместром, это снижение также сопровождалось уменьшением отношения общего IgG к сывороточному белку во втором и третьем триместре, что подтверждает истинное снижение уровня сывороточного Ig, не связанное только со снижением сывороточного белка (187).
T-регуляторные клетки
T-регуляторные клетки (Treg) индуцируют периферическую толерантность путем подавления пролиферации и продукции цитокинов CD4 и CD8 T-клетками, продукции Ig B-клетками, цитотоксической активности NK-клеток и созревания дендритных клеток (236, 237). Tregs экспрессируют низкий уровень IL7R и высокий уровень альфа-цепи рецептора IL-2 (CD25) (238) и фактора транскрипции Forkhead box p3 (Foxp3) (239). Были описаны другие субпопуляции супрессивных Т-клеток (240), в том числе CD4 + CD25 + Регуляторные Т-клетки Foxp3-типа 1 (Tr1) и CD4 + CD25 low Th4-клетки (241, 242), которые индуцируются и проявляют свою супрессивную активность через IL-10 (243 ) и TGF-β (244).
Tregs играют важную роль в регуляции отторжения плода материнскими иммунными клетками (245) и в подавлении воспаления в матке в период имплантации (238, 246–249). Динамика Tregs во время беременности противоречива, что может быть отчасти связано с различиями в том, как определяются Tregs в разных исследованиях (таблица 5). Экспрессия Foxp3, усиленная эстрогеном in vitro и in vivo , а лечение эстрогеном повышало CD4 + CD25 + «Tregs» в модели на животных, потенциально способствуя толерантности матери к плоду (254). Сообщалось о снижении CD25 брайт CD4 + Т-клеток в периферической крови у беременных женщин со спонтанным абортом по сравнению с неосложненной беременностью (249) и по сравнению с женщинами с плановым абортом (249, 255). Однако, поскольку активированные Т-клетки также экспрессируют CD25, этот выбор маркеров мог привести к чрезмерной классификации Treg. В то время как CD25 и Foxp3 часто используются в качестве маркеров Treg, активированные обычные Т-клетки могут также экспрессировать Foxp3 в дополнение к низким уровням CD25 (256, 257). В одном исследовании более высокий процент CD4 + CD25 тусклых Т-клеток наблюдали в срок по сравнению с 17–24 неделями беременности, однако существенных изменений в CD4 + CD25 ярких Т-клеток не наблюдалось (251). В другом исследовании количество Т-клеток CD4 + CD25 + FoxP3 + снижалось в течение первого триместра, затем увеличивалось на 24–30 неделе беременности, а затем снова снижалось через 31 неделю до срока (252). Некоторые исследования показали, что доля Tregs в циркуляции увеличивается на ранних сроках беременности (238, 249).) и пики во втором триместре (238, 250), при этом одно исследование показало, что эти клетки экспрессируют Foxp3 (238), что еще раз подтверждает, что они являются Treg (таблица 5). Однако в последних исследованиях (238, 250) не было сделано никакого различия между CD4 + CD25 тусклого и CD4 + CD25 яркого Т-клеток, что ограничивает определенный вывод об истинной динамике Treg в организме человека.
В одном исследовании более высокий процент CD4 + CD25 тусклых Т-клеток наблюдали в срок по сравнению с 17–24 неделями беременности, однако существенных изменений в CD4 + CD25 ярких Т-клеток не наблюдалось (251). В другом исследовании количество Т-клеток CD4 + CD25 + FoxP3 + снижалось в течение первого триместра, затем увеличивалось на 24–30 неделе беременности, а затем снова снижалось через 31 неделю до срока (252). Некоторые исследования показали, что доля Tregs в циркуляции увеличивается на ранних сроках беременности (238, 249).) и пики во втором триместре (238, 250), при этом одно исследование показало, что эти клетки экспрессируют Foxp3 (238), что еще раз подтверждает, что они являются Treg (таблица 5). Однако в последних исследованиях (238, 250) не было сделано никакого различия между CD4 + CD25 тусклого и CD4 + CD25 яркого Т-клеток, что ограничивает определенный вывод об истинной динамике Treg в организме человека. беременность. Сравнивая различные методы характеристики Treg, оба CD4 + CD25 яркие и CD4 + CD127 низкие CD25 + Субпопуляции Т-клеток были значительно повышены во время родов по сравнению с небеременными женщинами (258). CD4 + Foxp3 + Доли Т-клеток также были выше, но не статистически значимы. Необходима дальнейшая работа, чтобы по-настоящему понять динамику регуляторных Т-клеток крови при беременности человека.
беременность. Сравнивая различные методы характеристики Treg, оба CD4 + CD25 яркие и CD4 + CD127 низкие CD25 + Субпопуляции Т-клеток были значительно повышены во время родов по сравнению с небеременными женщинами (258). CD4 + Foxp3 + Доли Т-клеток также были выше, но не статистически значимы. Необходима дальнейшая работа, чтобы по-настоящему понять динамику регуляторных Т-клеток крови при беременности человека.
Таблица 5 Изменения системных Т- и В-регуляторных клеток при нормальной беременности.
Регуляторные клетки В
Регуляторные клетки В (Breg) экспрессируют высокие уровни CD24, CD27 и/или CD38 и обладают способностью частично подавлять ответы Т-клеток за счет продукции противовоспалительного цитокина IL-10 (259 –261). Breg-специфические факторы транскрипции не были идентифицированы, и существует фенотипическая гетерогенность Breg, указывающая на то, что Breg не могут представлять отдельную линию (262). CD19 + CD24 hi CD27 + Повышение уровня Breg в первом триместре беременности (253) (табл. 5). Хорионический гонадотропин человека (ХГЧ) усиливает функцию Breg, поскольку ХГЧ индуцирует продукцию ИЛ-10 в В-клетках и ~95% CD19 + CD24 hi CD27 + клетки экспрессировали рецептор ХГЧ (253). Абсолютное количество продуцирующих ИЛ-10 Breg и CD24 hi CD38 hi Breg ниже в третьем триместре и при родах, чем у женщин в послеродовом периоде (174). Основная роль Breg во время беременности может заключаться в подавлении материнских Th2-ответов, тем самым предотвращая аллогенные реакции на плод (253). Однако полный механизм активации и распространения Breg во время беременности остается неясным.
CD19 + CD24 hi CD27 + Повышение уровня Breg в первом триместре беременности (253) (табл. 5). Хорионический гонадотропин человека (ХГЧ) усиливает функцию Breg, поскольку ХГЧ индуцирует продукцию ИЛ-10 в В-клетках и ~95% CD19 + CD24 hi CD27 + клетки экспрессировали рецептор ХГЧ (253). Абсолютное количество продуцирующих ИЛ-10 Breg и CD24 hi CD38 hi Breg ниже в третьем триместре и при родах, чем у женщин в послеродовом периоде (174). Основная роль Breg во время беременности может заключаться в подавлении материнских Th2-ответов, тем самым предотвращая аллогенные реакции на плод (253). Однако полный механизм активации и распространения Breg во время беременности остается неясным.
Иммунная патология матери, приводящая к неблагоприятным исходам беременности
В этом обзоре мы описали, как иммунная система матери претерпевает основную адаптацию во время здоровой беременности. Неспособность вызвать эти системные изменения предрасполагает женщин к неблагоприятным исходам беременности, и это может быть более вероятным у женщин с сопутствующими аутоиммунными заболеваниями. Женщины с системной красной волчанкой (СКВ) подвергаются непропорционально высокому риску осложнений беременности. Преждевременные роды происходят в три раза чаще, а послеродовые инфекции более чем в четыре раза чаще встречаются у беременных с СКВ, чем у здоровых женщин (263). Используя транскриптомику цельной крови, Hong et al. обнаружили, что в то время как признаки, характерные для СКВ (например, повышенный ответ интерферона), сохраняются, изменения, наблюдаемые при беременности здоровых женщин, на удивление хорошо воспроизводятся у пациенток с СКВ при неосложненной беременности (264). Однако у пациенток с СКВ с осложнениями беременности некоторые транскриптомные модули (например, сигнатуры плазматических клеток) не были подавлены в такой степени, как при здоровой или неосложненной беременности с СКВ.
Неспособность вызвать эти системные изменения предрасполагает женщин к неблагоприятным исходам беременности, и это может быть более вероятным у женщин с сопутствующими аутоиммунными заболеваниями. Женщины с системной красной волчанкой (СКВ) подвергаются непропорционально высокому риску осложнений беременности. Преждевременные роды происходят в три раза чаще, а послеродовые инфекции более чем в четыре раза чаще встречаются у беременных с СКВ, чем у здоровых женщин (263). Используя транскриптомику цельной крови, Hong et al. обнаружили, что в то время как признаки, характерные для СКВ (например, повышенный ответ интерферона), сохраняются, изменения, наблюдаемые при беременности здоровых женщин, на удивление хорошо воспроизводятся у пациенток с СКВ при неосложненной беременности (264). Однако у пациенток с СКВ с осложнениями беременности некоторые транскриптомные модули (например, сигнатуры плазматических клеток) не были подавлены в такой степени, как при здоровой или неосложненной беременности с СКВ.
В то время как на акушерские исходы плода и матери часто отрицательно влияют аутоиммунные заболевания, тяжесть заболевания или риск рецидива часто снижаются во время беременности. Это особенно верно для Th2-опосредованных аутоиммунных заболеваний, таких как ревматоидный артрит (РА) и рассеянный склероз (РС), тогда как Th3-опосредованные заболевания, такие как расстройства спектра оптиконейромиелита, ухудшаются во время беременности [рассмотрено в (265)]. Эта дихотомия связана со сдвигом в сторону иммунитета на основе Th3 во время беременности. Одновременно с возвращением уровня гормонов до беременности и иммунного статуса в послеродовой период у многих женщин, страдающих РА или РС, наблюдается рецидив и ухудшение симптомов (266, 267). Лучшее понимание того, как специфические изменения в иммунной системе матери во время беременности приводят к улучшению симптомов, может помочь в разработке новых терапевтических средств для лечения аутоиммунных заболеваний.
Выводы и будущие направления
В заключение, большое количество научной литературы, накопленной за многие годы, демонстрирует значительную системную иммунологическую адаптацию во время беременности (рис. 1). Изменения указывают на высокодинамичные кооперативные взаимодействия между иммунной системой матери и плода, а не на широкое подавление материнского иммунитета. Знание этих изменений полезно для интерпретации результатов клинического иммунологического тестирования. Однако, несмотря на все эти данные, у нас все еще нет четкого понимания того, как эти иммунологические изменения способствуют модуляции риска инфекции и течения иммунологического заболевания во время беременности. Кроме того, беременность остается одним из наиболее уязвимых периодов с точки зрения заболеваемости и смертности, безусловно, для плода, но также и для матери. Действительно, только на сепсис приходится около 12,5% всех случаев смерти женщин во время или в течение 42 дней после окончания беременности в США (268). Основные сопутствующие физиологические (например, изменения кровообращения, повышение внутрибрюшного давления) и эндокринологические изменения явно модулируют эти риски. Тем не менее, выявление конкретного вклада иммунологических изменений в исходы беременности потребует более взвешенных подходов.
1). Изменения указывают на высокодинамичные кооперативные взаимодействия между иммунной системой матери и плода, а не на широкое подавление материнского иммунитета. Знание этих изменений полезно для интерпретации результатов клинического иммунологического тестирования. Однако, несмотря на все эти данные, у нас все еще нет четкого понимания того, как эти иммунологические изменения способствуют модуляции риска инфекции и течения иммунологического заболевания во время беременности. Кроме того, беременность остается одним из наиболее уязвимых периодов с точки зрения заболеваемости и смертности, безусловно, для плода, но также и для матери. Действительно, только на сепсис приходится около 12,5% всех случаев смерти женщин во время или в течение 42 дней после окончания беременности в США (268). Основные сопутствующие физиологические (например, изменения кровообращения, повышение внутрибрюшного давления) и эндокринологические изменения явно модулируют эти риски. Тем не менее, выявление конкретного вклада иммунологических изменений в исходы беременности потребует более взвешенных подходов. Системная иммунология может беспристрастно интегрировать большой объем информации. В сочетании с подробными клиническими результатами эти исследования оказались чрезвычайно ценными в исследованиях здоровья человека, где классические экспериментальные подходы неприменимы по очевидным этическим причинам (269).). Совсем недавно многопараметрический анализ, включающий анализы крови, проточную цитометрию и протеомику, выявил иммунологические изменения, тесно связанные со стадиями развития плода (270). Эти подходы могут также помочь понять, могут ли и каким образом ухудшаться специфические Th3-опосредованные аутоиммунные состояния, в то время как некоторые иммуноопосредованные заболевания клинически улучшаются во время беременности, как описано выше. Системная иммунология также может дать представление о происхождении аллергической сенсибилизации в раннем возрасте (271) и об оптимизации графиков вакцинации матери для наилучшей защиты как матери, так и ее ребенка. В конце концов, потенциал этих беспристрастных подходов к иммунологии человека для обоснования терапевтических вмешательств во время беременности огромен, но для этого потребуются согласованные усилия клиницистов, специалистов по биостатистике, эпидемиологов и молекулярных иммунологов.
Системная иммунология может беспристрастно интегрировать большой объем информации. В сочетании с подробными клиническими результатами эти исследования оказались чрезвычайно ценными в исследованиях здоровья человека, где классические экспериментальные подходы неприменимы по очевидным этическим причинам (269).). Совсем недавно многопараметрический анализ, включающий анализы крови, проточную цитометрию и протеомику, выявил иммунологические изменения, тесно связанные со стадиями развития плода (270). Эти подходы могут также помочь понять, могут ли и каким образом ухудшаться специфические Th3-опосредованные аутоиммунные состояния, в то время как некоторые иммуноопосредованные заболевания клинически улучшаются во время беременности, как описано выше. Системная иммунология также может дать представление о происхождении аллергической сенсибилизации в раннем возрасте (271) и об оптимизации графиков вакцинации матери для наилучшей защиты как матери, так и ее ребенка. В конце концов, потенциал этих беспристрастных подходов к иммунологии человека для обоснования терапевтических вмешательств во время беременности огромен, но для этого потребуются согласованные усилия клиницистов, специалистов по биостатистике, эпидемиологов и молекулярных иммунологов.
Рисунок 1 Изменения компонентов иммунной системы матери во время беременности на основе современной литературы. Специфические для триместра изменения, не описанные в литературе, не показаны и представлены в виде пробелов и остановок в строках (т. е. активация комплемента и регуляторные белки, регуляторные клетки СН50 и В). Пунктирные линии указывают на то, что снижение количества В-клеток может происходить в течение первого или второго триместра. В литературе существуют разногласия относительно динамики общего и подклассов IgG, объединенных для построения определенной закономерности (поэтому она не описана на рисунке, подробности см. в полном тексте). Фукозилирование части Fc IgG похоже на отсутствие беременности, но на очень высоких уровнях. * Белки активации комплемента: C3a, C4a, C5a, сывороточный комплемент мембранный атакующий комплекс SC5b9; Регуляторные белки комплемента: фактор, ускоряющий распад (CD55), ингибитор С3, связанный с беременностью белок плазмы A.
Вклад авторов
BA разработал проект раздела адаптивной иммунной системы, а CM разработал раздел врожденной иммунной системы. Все авторы внесли свой вклад в статью и одобрили представленную версию.
Конфликт интересов
Программа бакалавриата поддерживается стипендией Канадского института здравоохранения и исследований Vanier Canada Graduate. CM был поддержан аспирантом Научно-исследовательского института детской больницы Британской Колумбии. МС поддерживается через выплаты заработной платы от Фонда детской больницы Британской Колумбии, Канадской программы ученых-клиницистов в области детского здоровья и Фонда исследований в области здравоохранения Майкла Смита. MS был исследователем в проектах, финансируемых GlaxoSmithKline, Merck, Pfizer, Sanofi-Pasteur, Seqirus, Symvivo и VBI Vaccines. Все средства были выплачены его институту, и никаких личных выплат он не получал. PL поддерживается Программой грантов для исследователей детской больницы Британской Колумбии.
Каталожные номера
1. Кортис А.П., Рид Дж.С., Джеймисон Д.Дж. Беременность и инфекции. N Engl J Med (2014) 370:2211–8. doi: 10.1056/NEJMra1213566
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
2. Schnarr J, Smaill F. Бессимптомная бактериурия и симптоматические инфекции мочевыводящих путей при беременности. Eur J Clin Invest (2008) 38 (Приложение 2): 50–7. doi: 10.1111/j.1365-2362.2008.02009.x
PubMed Abstract | Полный текст перекрестной ссылки | Академия Google
3. Шеффилд Дж.С., Каннингем Ф.Г. Внебольничная пневмония у беременных. Obstet Gynecol (2009) 114:915–22. doi: 10.1097/AOG.0b013e3181b8e76d
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
4. Джексон К.А., Ивамото М., Свердлоу Д. Листериоз, связанный с беременностью. Epidemiol Infect (2010) 138:1503–9. doi: 10.1017/S0
8810000294
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
5. Геллин Б.Г., Брум К.В., Бибб В.Ф., Уивер Р.Е., Гавента С., Маскола Л. Эпидемиология листериоза в США – 1986. Группа по изучению листериоза. Am J Epidemiol (1991) 133:392–401. doi: 10.1093/oxfordjournals.aje.a115893
Геллин Б.Г., Брум К.В., Бибб В.Ф., Уивер Р.Е., Гавента С., Маскола Л. Эпидемиология листериоза в США – 1986. Группа по изучению листериоза. Am J Epidemiol (1991) 133:392–401. doi: 10.1093/oxfordjournals.aje.a115893
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
6. Шухат А., Дивер К.А., Венгер Д.Д., Пликайтис Б.Д., Маскола Л., Пиннер Р.В. и другие. Роль пищевых продуктов при спорадическом листериозе. I. Исследование диетических факторов риска случай-контроль. Группа по изучению листерии. JAMA (1992) 267:2041–5. doi: 10.1001/jama.267.15.2041
PubMed Abstract | Полный текст перекрестной ссылки | Академия Google
7. MacDonald PD, Whitwam RE, Boggs JD, MacCormack JN, Anderson KL, Reardon JW, et al. Вспышка листериоза среди мексиканских иммигрантов в результате употребления незаконно произведенного сыра в мексиканском стиле. Clin Infect Dis (2005) 40:677–82. doi: 10.1086/427803
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
8. Silk BJ, Date KA, Jackson KA, Pouillot R, Holt KG, Graves LM, et al. Инвазивный листериоз в Сети активного эпиднадзора за болезнями пищевого происхождения (FoodNet), 2004–2009 гг.: необходима дальнейшая целенаправленная профилактика для групп повышенного риска. Clin Infect Dis (2012) 54 (Приложение 5): S396–404. doi: 10.1093/cid/cis268
Silk BJ, Date KA, Jackson KA, Pouillot R, Holt KG, Graves LM, et al. Инвазивный листериоз в Сети активного эпиднадзора за болезнями пищевого происхождения (FoodNet), 2004–2009 гг.: необходима дальнейшая целенаправленная профилактика для групп повышенного риска. Clin Infect Dis (2012) 54 (Приложение 5): S396–404. doi: 10.1093/cid/cis268
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
9. Милонакис Э., Палиу М., Хохманн Э.Л., Калдервуд С.Б., Винг Э.Дж. Листериоз во время беременности: серия случаев и обзор 222 случаев. Med (Балтимор) (2002) 81:260–9. doi: 10.1097/00005792-200207000-00002
Полный текст CrossRef | Google Scholar
10. Goulet V, Hebert M, Hedberg C, Laurent E, Vaillant V, De Valk H, et al. Заболеваемость листериозом и связанная с ним смертность среди групп риска заражения листериозом. Clin Infect Dis (2012) 54:652–60. doi: 10.1093/cid/cir902
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
11. Cheng VC, Woo PC, Lau SK, Cheung CH, Yung RW, Yam LY, et al. Перинатальный туберкулез как форма иммунореститутивной болезни. Eur J Clin Microbiol Infect Dis (2003) 22:313–7. doi: 10.1007/s10096-003-0927-1
Cheng VC, Woo PC, Lau SK, Cheung CH, Yung RW, Yam LY, et al. Перинатальный туберкулез как форма иммунореститутивной болезни. Eur J Clin Microbiol Infect Dis (2003) 22:313–7. doi: 10.1007/s10096-003-0927-1
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
12. Зеннер Д., Круйшаар М.Е., Эндрюс Н., Абубакар И. Риск туберкулеза во время беременности: национальное когортное исследование, основанное на первичной медико-санитарной помощи, и самоконтролируемое исследование серии случаев. Am J Respir Crit Care Med (2012) 185:779–84. doi: 10.1164/rccm.201106-1083OC
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
13. Ококо Б.Дж., Энвере Г., Ота М.О. Эпидемиология и последствия материнской малярии: обзор иммунологических основ. Acta Trop (2003) 87:193–205. doi: 10.1016/s0001-706x(03)00097-4
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
14. Rijken MJ, McGready R, Boel ME, Poespoprodjo R, Singh N, Syafruddin D, et al. Малярия беременных в Азиатско-Тихоокеанском регионе. Lancet Infect Dis (2012) 12:75–88. doi: 10.1016/S1473-3099(11)70315-2
Малярия беременных в Азиатско-Тихоокеанском регионе. Lancet Infect Dis (2012) 12:75–88. doi: 10.1016/S1473-3099(11)70315-2
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
15. МакГрегор И.А. Эпидемиология, малярия и беременность. Am J Trop Med Hyg (1984) 33:517–25. doi: 10.4269/ajtmh.1984.33.517
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
16. Taylor SM, van Eijk AM, Hand CC, Mwandagalirwa K, Messina JP, Tshefu AK, et al. Количественная оценка бремени и последствий малярии, связанной с беременностью, в Демократической Республике Конго. J Infect Dis (2011) 204:1762–71. doi: 10.1093/infdis/jir625
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
17. Siston AM, Rasmussen SA, Honein MA, Fry AM, Seib K, Callaghan WM, et al. Пандемия вируса гриппа A(h2N1) 2009 года среди беременных женщин в Соединенных Штатах. JAMA (2010) 303:1517–25. doi: 10.1001/jama. 2010.479
2010.479
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
18. Расмуссен С.А., Джеймисон Д.Дж., Бреси Дж.С. Пандемия гриппа и беременные женщины. Emerg Infect Dis (2008) 14:95–100. doi: 10.3201/eid1401.070667
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
19. Мосби Л.Г., Расмуссен С.А., Джеймисон Д.Дж. Пандемический грипп A (h2N1) 2009 г. у беременных: систематический обзор литературы. Am J Obstet Gynecol (2011) 205:10–8. doi: 10.1016/j.ajog.2010.12.033
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
20. Dodds L, McNeil SA, Fell DB, Allen VM, Coombs A, Scott J, et al. Влияние воздействия гриппа на частоту госпитализаций и посещений врачей по поводу респираторных заболеваний среди беременных женщин. CMAJ (2007) 176:463–8. doi: 10.1503/cmaj.061435
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
21. Нейзил К.М., Рид Г. В., Митчел Э.Ф., Симонсен Л., Гриффин М.Р. Влияние гриппа на острые сердечно-легочные госпитализации у беременных. Am J Epidemiol (1998) 148:1094–102. doi: 10.1093/oxfordjournals.aje.a009587
В., Митчел Э.Ф., Симонсен Л., Гриффин М.Р. Влияние гриппа на острые сердечно-легочные госпитализации у беременных. Am J Epidemiol (1998) 148:1094–102. doi: 10.1093/oxfordjournals.aje.a009587
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
22. Freeman DW, Barno A. Смертность от азиатского гриппа, связанная с беременностью. Am J Obstet Gynecol (1959) 78:1172–5. doi: 10.1016/0002-9378(59)
-8
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
23. Triebwasser JH, Harris RE, Bryant RE, Rhoades ER. Ветряная оспа у взрослых. Отчет о семи случаях и обзор литературы. Med (Балтимор) (1967) 46:409–23. doi: 10.1097/00005792-196709000-00003
CrossRef Full Text | Google Scholar
24. Lamont RF, Sobel JD, Carrington D, Mazaki-Tovi S, Kusanovic JP, Vaisbuch E, et al. Заражение вирусом ветряной оспы (ветрянки) во время беременности. BJOG (2011) 118:1155–62. doi: 10.1111/j.1471-0528. 2011.02983.x
2011.02983.x
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
25. Парьяни С.Г., Арвин А.М. Внутриутробное заражение вирусом ветряной оспы после материнской ветряной оспы. N Engl J Med (1986) 314:1542–6. doi: 10.1056/NEJM198606123142403
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
26. Хааке Д.А., Заковски П.С., Хааке Д.Л., Брайсон Ю.Дж. Раннее лечение ацикловиром пневмонии, вызванной ветряной оспой, у здоровых взрослых: ретроспективное контролируемое исследование и обзор. Rev Infect Dis (1990) 12:788–98. doi: 10.1093/clinids/12.5.788
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
27. Esmonde TF, Herdman G, Anderson G. Пневмония ветряной оспы: связь с беременностью. Грудная клетка (1989) 44:812–5. doi: 10.1136/thx.44.10.812
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
28. Патра С., Кумар А., Триведи С.С., Пури М. , Сарин С.К. Исходы для матери и плода у беременных с острой инфекцией, вызванной вирусом гепатита Е. Ann Intern Med (2007) 147:28–33. doi: 10.7326/0003-4819-147-1-200707030-00005
, Сарин С.К. Исходы для матери и плода у беременных с острой инфекцией, вызванной вирусом гепатита Е. Ann Intern Med (2007) 147:28–33. doi: 10.7326/0003-4819-147-1-200707030-00005
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
29. Кумар А., Бенивал М., Кар П., Шарма Дж. Б., Мурти Н. С. Гепатит Е при беременности. Int J Gynaecol Obstet (2004) 85:240–4. doi: 10.1016/j.ijgo.2003.11.018
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
30. Khuroo MS, Kamili S. Этиология и прогностические факторы острой печеночной недостаточности в Индии. J Viral Hepat (2003) 10:224–31. doi: 10.1046/j.1365-2893.2003.00415.x
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
31. Аггарвал Р., Кравчински К. Гепатит Е: обзор и последние достижения в клинических и лабораторных исследованиях. J Gastroenterol Hepatol (2000) 15:9–20. doi: 10.1046/j.1440-1746.2000.02006.x
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
32. Аня СЭ. Сезонные колебания риска и причин материнской смертности в Гамбии: малярия, по-видимому, является важным фактором. Am J Trop Med Hyg (2004) 70:510–3. doi: 10.4269/ajtmh.2004.70.510
Аня СЭ. Сезонные колебания риска и причин материнской смертности в Гамбии: малярия, по-видимому, является важным фактором. Am J Trop Med Hyg (2004) 70:510–3. doi: 10.4269/ajtmh.2004.70.510
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
33. Desai M, ter Kuile FO, Nosten F, McGready R, Asamoa K, Brabin B, et al. Эпидемиология и бремя малярии во время беременности. Lancet Infect Dis (2007) 7:93–104. doi: 10.1016/S1473-3099(07)70021-X
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
34. Роджерсон С.Дж. Малярия беременных и новорожденных. Adv Exp Med Biol (2010) 659:139–52. doi: 10.1007/978-1-4419-0981-7_12
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
35. Менендес С. Малярия во время беременности. Curr Mol Med (2006) 6:269–73. doi: 10.2174/156652406776055186
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
36. Collins S, Ramsay M, Slack MP, Campbell H, Flynn S, Litt D, et al. Риск инвазивной инфекции Haemophilus influenzae во время беременности и связь с неблагоприятными исходами для плода. JAMA (2014) 311:1125–32. doi: 10.1001/jama.2014.1878
Collins S, Ramsay M, Slack MP, Campbell H, Flynn S, Litt D, et al. Риск инвазивной инфекции Haemophilus influenzae во время беременности и связь с неблагоприятными исходами для плода. JAMA (2014) 311:1125–32. doi: 10.1001/jama.2014.1878
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
37. Берндсен М.Р., Эрлендсдоттир Х., Готтфредссон М. Эволюция эпидемиологии инвазивных гемофильных инфекций в поствакцинальную эпоху: результаты долгосрочного популяционного исследования. Clin Microbiol Infect (2012) 18:918–23. doi: 10.1111/j.1469-0691.2011.03700.x
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
38. Perdue DG, Bulkow LR, Gellin BG, Davidson M, Petersen KM, Singleton RJ, et al. Инвазивная гемофильная инфекция у жителей Аляски в возрасте 10 лет и старше до и после программ вакцинации младенцев. JAMA (2000) 283:3089–94. doi: 10.1001/jama.283.23.3089
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
39. Deutscher M, Lewis M, Zell ER, Taylor TH, Van Beneden C, Schrag S, et al. Заболеваемость и тяжесть инвазивных Streptococcus pneumoniae, Streptococcus группы A и Streptococcus группы B среди беременных и родильниц. Clin Infect Dis (2011) 53:114–23. doi: 10.1093/cid/cir325
Deutscher M, Lewis M, Zell ER, Taylor TH, Van Beneden C, Schrag S, et al. Заболеваемость и тяжесть инвазивных Streptococcus pneumoniae, Streptococcus группы A и Streptococcus группы B среди беременных и родильниц. Clin Infect Dis (2011) 53:114–23. doi: 10.1093/cid/cir325
PubMed Abstract | Полный текст перекрестной ссылки | Академия Google
40. Machado CR, Machado ES, Rohloff RD, Azevedo M, Campos DP, de Oliveira RB, et al. Связана ли беременность с тяжелым течением денге? Обзор данных информационной системы наблюдения Рио-де-Жанейро. PLoS Negl Trop Dis (2013) 7:e2217. doi: 10.1371/journal.pntd.0002217
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
41. Уайт С.Р., Хенретиг Ф.М., Дюкс Р.Г. Медицинское ведение уязвимых групп населения и сопутствующие заболевания жертв биотерроризма. Emerg Med Clin North Am (2002) 20:365–92, xi. doi: 10.1016/S0733-8627(01)00006-2
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
42. Price ME, Fisher-Hoch SP, Craven RB, McCormick JB. Проспективное исследование исходов для матери и плода при острой лихорадке Ласса во время беременности. BMJ (1988) 297:584–7. doi: 10.1136/bmj.297.6648.584
Price ME, Fisher-Hoch SP, Craven RB, McCormick JB. Проспективное исследование исходов для матери и плода при острой лихорадке Ласса во время беременности. BMJ (1988) 297:584–7. doi: 10.1136/bmj.297.6648.584
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
43. Кан А.Х., Грейвс Ч.Р. Гепатит простого герпеса у беременных: клинический случай и обзор литературы. Obstet Gynecol Surv (1999) 54:463–8. doi: 10.1097/00006254-1990-00026
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
44. Чейз Р.А., Pottage JC, Haber MH, Kistler G, Jensen D, Levin S. Вирусный гепатит простого герпеса у взрослых: два описания клинических случаев и обзор литературы. Rev Infect Dis (1987) 9:329–33. doi: 10.1093/clinids/9.2.329
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
45. Yaziji H, Hill T, Pitman TC, Cook CR, Schrodt GR. Гестационный гепатит, вызванный вирусом простого герпеса. South Med J (1997) 90:347–51. doi: 10.1097/00007611-199703000-00019
South Med J (1997) 90:347–51. doi: 10.1097/00007611-199703000-00019
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
46. Smale LE, Waechter KG. Распространение кокцидиоидомикоза при беременности. Am J Obstet Gynecol (1970) 107:356–61. doi: 10.1016/0002-9378(70)
-0
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
47. Vaughan JE, Ramirez H. Кокцидиоидомикоз как осложнение беременности. Калифорния Мед (1951) 74: 121–5.
Реферат PubMed | Google Scholar
48. Беркович Р.С., Катандзаро А., Шварц Б.С., Паппагианис Д., Уоттс Д.Х., Ампель Н.М. Кокцидиоидомикоз во время беременности: обзор и рекомендации по лечению. Clin Infect Dis (2011) 53:363–8. doi: 10.1093/cid/cir410
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
49. Wack EE, Ampel NM, Galgiani JN, Bronnimann DA. Кокцидиоидомикоз при беременности. Анализ десяти случаев среди 47 120 беременностей. Сундук (1988) 94: 376–9. doi: 10.1378/chest.94.2.376
Сундук (1988) 94: 376–9. doi: 10.1378/chest.94.2.376
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
50. Колдуэлл Дж.В., Арсура Э.Л., Килгор В.Б., Гарсия А.Л., Редди В., Джонсон Р.Х. Кокцидиоидомикоз беременных во время эпидемии в Калифорнии. Obstet Gynecol (2000) 95:236–9. doi: 10.1097/00006250-200002000-00013
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
51. Eberhart-Phillips JE, Frederick PD, Baron RC, Mascola L. Корь во время беременности: описательное исследование 58 случаев. Obstet Gynecol (1993) 82:797–801.
Реферат PubMed | Google Scholar
52. Али М.Э., Албар Х.М. Корь у беременных: материнская заболеваемость и перинатальные исходы. Int J Gynaecol Obstet (1997) 59:109–13. doi: 10.1016/s0020-7292(97)00196-3
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
53. Север Дж. Л., Элленберг Дж. Х., Лей А. С., Мэдден Д. Л., Фуччилло Д. А., Цан Н. Р. и другие. Токсоплазмоз: материнские и педиатрические данные при 23 000 беременностей. Педиатрия (1988) 82:181–92.
А., Цан Н. Р. и другие. Токсоплазмоз: материнские и педиатрические данные при 23 000 беременностей. Педиатрия (1988) 82:181–92.
Реферат PubMed | Google Scholar
54. Desmonts G, Couvreur J. Врожденный токсоплазмоз. Проспективное исследование 378 беременностей. N Engl J Med (1974) 290:1110–6. doi: 10.1056/NEJM197405162
3
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
55. Расмуссен С.А., Джеймисон Д.Дж., Уеки Т.М. Последствия гриппа для беременных женщин и младенцев. Am J Obstet Gynecol (2012) 207:S3–8. doi: 10.1016/j.ajog.2012.06.068
Резюме PubMed | Полный текст перекрестной ссылки | Google Scholar
56. Луи Дж. К., Акоста М., Джеймисон Д. Д., Хонейн М. А., Группа CPHNW. Тяжелый грипп h2N1 2009 г. среди беременных и родильниц в Калифорнии. N Engl J Med (2010) 362:27–35. doi: 10.1056/NEJMoa0
4
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
57. Джеймисон Д.Дж., Тейлер Р.Н., Расмуссен С.А. Новые инфекции и беременность. Emerg Infect Dis (2006) 12:1638–43. doi: 10.3201/eid1211.060152
Джеймисон Д.Дж., Тейлер Р.Н., Расмуссен С.А. Новые инфекции и беременность. Emerg Infect Dis (2006) 12:1638–43. doi: 10.3201/eid1211.060152
Резюме PubMed | Полный текст перекрестной ссылки | Google Scholar
58. Lindsay L, Jackson LA, Savitz DA, Weber DJ, Koch GG, Kong L, et al. Активность гриппа среди населения и риск эпизодов острых гриппоподобных заболеваний среди здоровых невакцинированных беременных и родильниц. Am J Epidemiol (2006) 163:838–48. doi: 10.1093/aje/kwj095
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
59. Pastuszak AL, Levy M, Schick B, Zuber C, Feldkamp M, Gladstone J, et al. Исход после инфицирования матери ветряной оспой в первые 20 недель беременности. N Engl J Med (1994) 330:901–5. doi: 10.1056/NEJM1913301305
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
60. (CDC). Борьба с краснухой и синдромом врожденной краснухи и их ликвидация – глобальный прогресс, 2000–2012 гг. MMWR Morb Mortal Wkly Rep (2013) 62:983–6.
MMWR Morb Mortal Wkly Rep (2013) 62:983–6.
Реферат PubMed | Google Scholar
61. Зигель М., Фюрст Х.Т. Низкая масса тела при рождении и вирусные заболевания матери. Проспективное исследование краснухи, кори, эпидемического паротита, ветряной оспы и гепатита. JAMA (1966) 197:680–4. doi: 10.1001/jama.197.9.680
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
62. (CDC). Три случая синдрома врожденной краснухи в эпоху после элиминации – Мэриленд, Алабама и Иллинойс, 2012 г. MMWR Morb Mortal Wkly Rep (2013) 62:226–9.
Реферат PubMed | Google Scholar
63. Dijkmans AC, de Jong EP, Dijkmans BA, Lopriore E, Vossen A, Walther FJ, et al. Парвовирус В19 при беременности: пренатальная диагностика и лечение осложнений у плода. Curr Opin Obstet Gynecol (2012) 24:95–101. doi: 10.1097/GCO.0b013e3283505a9d
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
64. Lamont RF, Sobel J, Mazaki-Tovi S, Kusanovic JP, Vaisbuch E, Kim SK, et al. Листериоз у беременных: систематический обзор. J Perinatal Med (2011) 39:227–36. doi: 10.1515/jpm.2011.035
Листериоз у беременных: систематический обзор. J Perinatal Med (2011) 39:227–36. doi: 10.1515/jpm.2011.035
CrossRef Full Text | Google Scholar
65. Smith B, Kemp M, Ethelberg S, Schiellerup P, Bruun BG, Gerner-Smidt P, et al. Listeria monocytogenes: инфекции матери и плода в Дании 1994-2005. Scand J Infect Dis (2009) 41:21–5. doi: 10.1080/00365540802468094
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
66. Peng W, Yang J, Liu E. Анализ 170 случаев врожденного ТБ, описанных в литературе в период с 1946 по 2009 год. Pediatr Pulmonol (2011) 46:1215–24. doi: 10.1002/ppul.21490
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
67. Яна Н., Васишта К., Саха С.К., Гош К. Акушерские исходы у женщин с внелегочным туберкулезом. N Engl J Med (1999) 341:645–9. doi: 10.1056/NEJM1993410903
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
68. Meaney-Delman D, Hills SL, Williams C, Galang RR, Iyengar P, Hennfent AK, et al. Заражение вирусом Зика среди беременных путешественников в США — август 2015 г. — февраль 2016 г. MMWR Morb Mortal Wkly Rep (2016) 65:211–4. doi: 10.15585/mmwr.mm6508e1
Meaney-Delman D, Hills SL, Williams C, Galang RR, Iyengar P, Hennfent AK, et al. Заражение вирусом Зика среди беременных путешественников в США — август 2015 г. — февраль 2016 г. MMWR Morb Mortal Wkly Rep (2016) 65:211–4. doi: 10.15585/mmwr.mm6508e1
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
69. Расмуссен С.А., Джеймисон Д.Дж., Хонейн М.А., Петерсен Л.Р. Вирус Зика и врожденные дефекты – обзор доказательств причинно-следственной связи. N Engl J Med (2016) 374:1981–7. doi: 10.1056/NEJMsr1604338
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
70. Зигель М., Фюрст Х.Т., Пересс Н.С. Сравнительная смертность плода при вирусных заболеваниях матери. Проспективное исследование краснухи, кори, эпидемического паротита, ветряной оспы и гепатита. N Engl J Med (1966) 274:768–71. doi: 10.1056/NEJM196604072741404
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
71. Атмар Р.Л., Инглунд Дж.А., Хэммилл Х. Осложнения кори во время беременности. Clin Infect Dis (1992) 14:217–26. doi: 10.1093/clinids/14.1.217
Атмар Р.Л., Инглунд Дж.А., Хэммилл Х. Осложнения кори во время беременности. Clin Infect Dis (1992) 14:217–26. doi: 10.1093/clinids/14.1.217
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
72. Доллард С.К., Гросс С.Д., Росс Д.С. Новые оценки распространенности неврологических и сенсорных последствий и смертности, связанной с врожденной цитомегаловирусной инфекцией. Rev Med Virol (2007) 17:355–63. doi: 10.1002/rmv.544
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
73. Абу Рая Б., Эдвардс К.М., Шайфеле Д.В., Гальперин С.А. Иммунизация против коклюша и гриппа во время беременности: общий обзор. Lancet Infect Dis (2017) 17:e209–e22. doi: 10.1016/S1473-3099(17)30190-1
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
74. Андер С.Е., Даймонд М.С., Койн С.Б. Иммунные реакции на границе матери и плода. Sci Immunol (2019) 4(31):eaat6114. doi: 10.1126/sciimmunol. aat6114
aat6114
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
75. PrabhuDas M, Bonney E, Caron K, Dey S, Erlebacher A, Fazleabas A, et al. Иммунные механизмы взаимодействия матери и плода: перспективы и проблемы. Nat Immunol (2015) 16:328–34. doi: 10.1038/ni.3131
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
76. Мор Г., Альдо П., Альверо А.Б. Уникальные иммунологические и микробные аспекты беременности. Nat Rev Immunol (2017) 17:469–82. doi: 10.1038/nri.2017.64
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
77. Richani K, Soto E, Romero R, Espinoza J, Chaiworapongsa T, Nien JK, et al. Нормальная беременность характеризуется системной активацией системы комплемента. J Matern Fetal Neonatal Med (2005) 17:239–45. doi: 10.1080/14767050500072722
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
78. Derzsy Z, Prohászka Z, Rigó J, Füst G, Molvarec A. Активация системы комплемента при нормальной беременности и преэклампсии. Мол Иммунол (2010) 47:1500–6. doi: 10.1016/j.molimm.2010.01.021
Активация системы комплемента при нормальной беременности и преэклампсии. Мол Иммунол (2010) 47:1500–6. doi: 10.1016/j.molimm.2010.01.021
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
79. Сарма СП, Уорд, Пенсильвания. Система комплемента. Cell Tissue Res (2011) 343:227–35. doi: 10.1007/s00441-010-1034-0
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
80. Nowicki S, Izban MG, Pawelczyk E, Agboto VK, Pratap S, Olson G, et al. Преждевременные роды: CD55 в лейкоцитах крови матери. Am J Reprod Immunol (2009) 61:360–7. doi: 10.1111/j.1600-0897.2009.00702.x
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
81. Бишоф П., Гейноз А., Херрманн В.Л., Сизоненко П.С. Ассоциированный с беременностью белок плазмы А (РАРР-А) специфически ингибирует третий компонент комплемента человека (С3). Плацента (1984) 5:1–7. doi: 10.1016/S0143-4004(84)80044-2
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
82. Lin TM, Halbert SP, Spellacy WN. Измерение связанных с беременностью белков плазмы во время беременности человека. J Clin Invest (1974) 54:576–82. doi: 10.1172/JCI107794
Lin TM, Halbert SP, Spellacy WN. Измерение связанных с беременностью белков плазмы во время беременности человека. J Clin Invest (1974) 54:576–82. doi: 10.1172/JCI107794
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
83. Jagadeesan V. Уровни комплемента в сыворотке крови при нормальной беременности и гипертонии, вызванной беременностью. Int J Gynaecol Obstet (1988) 26:389–91. doi: 10.1016/0020-7292(88)
-7
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
84. Бейнс М.Г., Миллар К.Г., Миллс П. Исследования уровней комплемента при нормальной беременности человека. Obstet Gynecol (1974) 43:806–10.
Реферат PubMed | Google Scholar
85. Бело Л., Сантос-Сильва А., Роча С., Каслейк М., Куни Дж., Перейра-Лейт Л. и др. Колебания концентрации С-реактивного белка и активации нейтрофилов при нормальной беременности человека. Eur J Obstet Gynecol Reprod Biol (2005) 123:46–51. doi: 10.1016/j.ejogrb.2005.02.022
doi: 10.1016/j.ejogrb.2005.02.022
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
86. Аббасси-Ганавати М., Грир Л.Г., Каннингем Ф.Г. Беременность и лабораторные исследования: справочная таблица для клиницистов. Obstet Gynecol (2009) 114:1326–31. doi: 10.1097/AOG.0b013e3181c2bde8
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
87. Мацумото К., Огасавара Т., Като А., Хомма Т., Иида М., Акасава А. и др. Дегрануляция эозинофилов во время беременности и после родов путем кесарева сечения. Int Arch Allergy Immunol (2003) 131 (Приложение 1): 34–9. doi: 10.1159/000070479
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
88. Luppi P, Haluszczak C, Betters D, Richard CA, Trucco M, DeLoia JA. Моноциты прогрессивно активируются в кровообращении беременных женщин. J Leukoc Biol (2002) 72:874–84. doi: 10.1034/j.1600-0897.2002.1o041.x
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
89. Киндзельский А.Л., Хуанг Дж.Б., Чайворапонгса Т., Фахми Р.М., Ким Ю.М., Ромеро Р. и др. Беременность изменяет перенос глюкозо-6-фосфатдегидрогеназы, клеточный метаболизм и высвобождение оксидантов нейтрофилами матери. J Clin Invest (2002) 110:1801–11. doi: 10.1172/JCI200215973
Киндзельский А.Л., Хуанг Дж.Б., Чайворапонгса Т., Фахми Р.М., Ким Ю.М., Ромеро Р. и др. Беременность изменяет перенос глюкозо-6-фосфатдегидрогеназы, клеточный метаболизм и высвобождение оксидантов нейтрофилами матери. J Clin Invest (2002) 110:1801–11. doi: 10.1172/JCI200215973
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
90. Киндзельский А.Л., Уэки Т., Мичибата Х., Чайворапонгса Т., Ромеро Р., Петти Х.Р. 6-фосфоглюконатдегидрогеназа и глюкозо-6-фосфатдегидрогеназа образуют надмолекулярный комплекс в нейтрофилах человека, который подвергается ретроградному переносу во время беременности. J Immunol (2004) 172:6373–81. doi: 10.4049/jimmunol.172.10.6373
PubMed Abstract | Полный текст перекрестной ссылки | Академия Google
91. Crocker IP, Baker PN, Fletcher J. Функция нейтрофилов при беременности и ревматоидном артрите. Энн Реум Дис (2000) 59: 555–64. doi: 10.1136/ard.59.7.555
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
92. Naccasha N, Gervasi MT, Chaiworapongsa T, Berman S, Yoon BH, Maymon E, et al. Фенотипические и метаболические характеристики моноцитов и гранулоцитов при нормальной беременности и инфицировании матери. Am J Obstet Gynecol (2001) 185:1118–23. doi: 10.1067/моб.2001.117682
Naccasha N, Gervasi MT, Chaiworapongsa T, Berman S, Yoon BH, Maymon E, et al. Фенотипические и метаболические характеристики моноцитов и гранулоцитов при нормальной беременности и инфицировании матери. Am J Obstet Gynecol (2001) 185:1118–23. doi: 10.1067/моб.2001.117682
Резюме PubMed | Полный текст перекрестной ссылки | Google Scholar
93. Lampé R, Kövér Á, Szucs S, Pál L, Árnyas E, Ádány R, et al. Фагоцитарные индексы нейтрофильных гранулоцитов и моноцитов при здоровой и преэклампсии при беременности. J Reprod Immunol (2015) 107:26–30. doi: 10.1016/j.jri.2014.11.001
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
94. Танигучи К., Нагата Х., Кацуки Т., Накашима С., Онодера Р., Хираока А. и др. Значение экспрессии человеческого нейтрофильного антигена-2a (NB1) и количества нейтрофилов при беременности. Переливание (2004) 44:581–5. doi: 10.1111/j.1537-2995.2004.03298.x
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
95. Luppi P, Haluszczak C, Trucco M, Deloia JA. Нормальная беременность связана с активацией периферических лейкоцитов. Am J Reprod Immunol (2002) 47:72–81. doi: 10.1034/j.1600-0897.2002.1o041.x
Luppi P, Haluszczak C, Trucco M, Deloia JA. Нормальная беременность связана с активацией периферических лейкоцитов. Am J Reprod Immunol (2002) 47:72–81. doi: 10.1034/j.1600-0897.2002.1o041.x
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
96. Blazkova J, Gupta S, Liu Y, Gaudilliere B, Ganio EA, Bolen CR, et al. Многоцентровый системный анализ крови человека выявляет незрелые нейтрофилы у мужчин и во время беременности. J Immunol (2017) 198:2479–88. doi: 10.4049/jimmunol.1601855
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
97. Köstlin N, Kugel H, Spring B, Leiber A, Marmé A, Henes M, et al. Гранулоцитарные супрессорные клетки миелоидного происхождения размножаются во время беременности человека и модулируют ответы Т-клеток. Eur J Immunol (2014) 44:2582–91. doi: 10.1002/eji.201344200
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
98. Koldehoff M, Cierna B, Steckel NK, Beelen DW, Elmaagacli AH. Молекулярные особенности матери и профилирование генов моноцитов в первом триместре беременности. J Reprod Immunol (2013) 99:62–8. doi: 10.1016/j.jri.2013.07.001
Молекулярные особенности матери и профилирование генов моноцитов в первом триместре беременности. J Reprod Immunol (2013) 99:62–8. doi: 10.1016/j.jri.2013.07.001
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
99. Veenstra van Nieuwenhoven AL, Bouman A, Moes H, Heineman MJ, de Leij LF, Santema J, et al. Эндотоксин-индуцированная продукция цитокинов моноцитами беременных в третьем триместре по сравнению с женщинами в фолликулярной фазе менструального цикла. Am J Obstet Gynecol (2003) 188:1073–7. doi: 10.1067/моб.2003.263
PubMed Abstract | Полный текст перекрестной ссылки | Академия Google
100. Melgert BN, Spaans F, Borghuis T, Klok PA, Groen B, Bolt A, et al. Беременность и преэклампсия влияют на субпопуляции моноцитов у людей и крыс. PLoS One (2012) 7:e45229. doi: 10.1371/journal.pone.0045229
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
101. Groen B, van der Wijk AE, van den Berg PP, Lefrandt JD, van den Berg G, Sollie KM, et al. Иммунологическая адаптация к беременности у женщин с диабетом 1 типа. Научный представитель (2015) 5:13618. дои: 10.1038/srep13618
Иммунологическая адаптация к беременности у женщин с диабетом 1 типа. Научный представитель (2015) 5:13618. дои: 10.1038/srep13618
Резюме PubMed | Полный текст перекрестной ссылки | Google Scholar
102. Sacks GP, Redman CW, Sargent IL. Моноциты праймированы для производства цитокина IL-12 типа Th2 при нормальной беременности человека: внутриклеточный проточный цитометрический анализ мононуклеарных клеток периферической крови. Clin Exp Immunol (2003) 131:490–7. doi: 10.1046/j.1365-2249.2003.02082.x
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
103. Germain SJ, Sacks GP, Sooranna SR, Soorana SR, Sargent IL, Redman CW. Системное воспалительное праймирование при нормальной беременности и преэклампсии: роль циркулирующих микрочастиц синцитиотрофобласта. J Immunol (2007) 178:5949–56. doi: 10.4049/jimmunol.178.9.5949
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
104. Сакс Г. П., Студена К., Сарджент К., Редман К.В. Как нормальная беременность, так и преэклампсия вызывают воспалительные изменения лейкоцитов периферической крови, сходные с таковыми при сепсисе. Am J Obstet Gynecol (1998) 179:80–6. doi: 10.1016/s0002-9378(98)70254-6
П., Студена К., Сарджент К., Редман К.В. Как нормальная беременность, так и преэклампсия вызывают воспалительные изменения лейкоцитов периферической крови, сходные с таковыми при сепсисе. Am J Obstet Gynecol (1998) 179:80–6. doi: 10.1016/s0002-9378(98)70254-6
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
105. Аль-Офи Э., Коффелт С.Б., Анумба Д.О. Субпопуляции моноцитов у пациенток с преэклампсией аномально асимметричны и проявляют преувеличенный ответ на лиганды Toll-подобных рецепторов. PLoS One (2012) 7:e42217. doi: 10.1371/journal.pone.0042217
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
106. He YD, Xu BN, Song D, Wang YQ, Yu F, Chen Q и другие. Нормальный набор компонентов комплемента во время беременности: проспективное исследование. Am J Reprod Immunol (2020) 83:e13202. doi: 10.1111/aji.13202
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
107. Salmon JE, Heuser C, Triebwasser M, Liszewski MK, Kavanagh D, Roumenina L, et al. Мутации в регуляторных белках комплемента предрасполагают к преэклампсии: генетический анализ группы PROMISSE. PLoS Med (2011) 8:e1001013. doi: 10.1371/journal.pmed.1001013
Salmon JE, Heuser C, Triebwasser M, Liszewski MK, Kavanagh D, Roumenina L, et al. Мутации в регуляторных белках комплемента предрасполагают к преэклампсии: генетический анализ группы PROMISSE. PLoS Med (2011) 8:e1001013. doi: 10.1371/journal.pmed.1001013
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
108. Денни К.Дж., Вудрафф Т.М., Тейлор С.М., Каллауэй Л.К. Дополнение во время беременности: тонкий баланс. Am J Reprod Immunol (2013) 69:3–11. doi: 10.1111/aji.12000
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
109. Heit JA, Kobbervig CE, James AH, Petterson TM, Bailey KR, Melton LJ. Тенденции заболеваемости венозной тромбоэмболией во время беременности или после родов: 30-летнее популяционное исследование. Ann Intern Med (2005) 143:697–706. doi: 10.7326/0003-4819-143-10-200511150-00006
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
110. Молд С. , Гевурц Х., Дю Кло Т.В. Регуляция активации комплемента С-реактивным белком. Иммунофармакология (1999) 42:23–30. doi: 10.1016/S0162-3109(99)00007-7
, Гевурц Х., Дю Кло Т.В. Регуляция активации комплемента С-реактивным белком. Иммунофармакология (1999) 42:23–30. doi: 10.1016/S0162-3109(99)00007-7
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
111. Berman S, Gewurz H, Mold C. Связывание С-реактивного белка с ядросодержащими клетками приводит к активации комплемента без цитолиза. J Immunol (1986) 136:1354–9.
Реферат PubMed | Google Scholar
112. Биро А., Рово З., Папп Д., Червенак Л., Варга Л., Фюст Г. и др. Исследования взаимодействия между С-реактивным белком и белками комплемента. Иммунология (2007) 121:40–50. doi: 10.1111/j.1365-2567.2007.02535.x
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
113. Amara U, Rittirsch D, Flierl M, Bruckner U, Klos A, Gebhard F, et al. Взаимодействие системы свертывания крови и системы комплемента. Adv Exp Med Biol (2008) 632:71–9. doi: 10.1007/978-0-387-78952-1_6
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
114. Shanley DK, Kiely PA, Golla K, Allen S, Martin K, O’Riordan RT, et al. Гликопротеины, специфичные для беременных, связывают интегрин αIIbβ3 и ингибируют взаимодействие тромбоцитов с фибриногеном. PLoS One (2013) 8:e57491. doi: 10.1371/journal.pone.0057491
Shanley DK, Kiely PA, Golla K, Allen S, Martin K, O’Riordan RT, et al. Гликопротеины, специфичные для беременных, связывают интегрин αIIbβ3 и ингибируют взаимодействие тромбоцитов с фибриногеном. PLoS One (2013) 8:e57491. doi: 10.1371/journal.pone.0057491
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
115. Колачковска Е., Кубес П. Рекрутирование и функция нейтрофилов в норме и воспалении. Nat Rev Immunol (2013) 13:159–75. doi: 10.1038/nri3399
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
116. Макинода С., Микуни М., Фурута И., Окуяма К., Сагава Т., Фудзимото С. Концентрация эндогенного Г-КСФ в сыворотке крови у женщин во время менструального цикла и беременности. Eur J Clin Invest (1995) 25:877–9. doi: 10.1111/j.1365-2362.1995.tb01699.x
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
117. Giaglis S, Stoikou M, Sur Chowdhury C, Schaefer G, Grimolizzi F, Rossi SW, et al. Мультимодальная регуляция образования NET при беременности: прогестерон противодействует про-NETotic эффекту эстрогена и G-CSF. Фронт Иммунол (2016) 7:565. doi: 10.3389/fimmu.2016.00565
Мультимодальная регуляция образования NET при беременности: прогестерон противодействует про-NETotic эффекту эстрогена и G-CSF. Фронт Иммунол (2016) 7:565. doi: 10.3389/fimmu.2016.00565
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
118. Киндзельский А.Л., Кларк А.Дж., Эспиноза Дж., Маэда Н., Аратани Ю., Ромеро Р. и др. Миелопероксидаза накапливается на поверхности нейтрофилов и усиливает клеточный метаболизм и высвобождение оксидантов во время беременности. Eur J Immunol (2006) 36:1619–28. doi: 10.1002/eji.200535391
PubMed Abstract | Полный текст перекрестной ссылки | Академия Google
119. Vono M, Lin A, Norrby-Teglund A, Koup RA, Liang F, Loré K. Нейтрофилы приобретают способность к презентации антигена памяти CD4. Кровь (2017) 129:1991–2001. doi: 10.1182/blood-2016-10-744441
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
120. Ницше Дж.Ф., Цзян С.В., Брост Б.К. Экспрессия толл-подобного рецептора-2 и толл-подобного рецептора-4 на материнских нейтрофилах во время беременности. Am J Reprod Immunol (2010) 64:427–34. дои: 10.1111/j.1600-0897.2010.00891.x
Am J Reprod Immunol (2010) 64:427–34. дои: 10.1111/j.1600-0897.2010.00891.x
Реферат PubMed | Полный текст перекрестной ссылки | Google Scholar
121. Велья Ф., Перего М., Габрилович Д. Супрессорные клетки миелоидного происхождения, достигшие совершеннолетия. Nat Immunol (2018) 19:108–19. doi: 10.1038/s41590-017-0022-x
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
122. Наир Р.Р., Синха П., Кханна А., Сингх К. Уменьшение количества супрессорных клеток миелоидного происхождения в крови и эндометрии связано с ранним выкидышем. Am J Reprod Immunol (2015) 73:479–86. doi: 10.1111/aji.12351
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
123. Мукерджи Р., Канти Барман П., Кумар Татои П., Трипати Р., Кумар Дас Б., Равиндран Б. Неклассические моноциты проявляют признаки воспаления: проверка при сепсисе и системной красной волчанке. Научный представитель (2015) 5:13886. doi: 10.1038/srep13886
doi: 10.1038/srep13886
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
124. Тан М.Х., Ху XH, Лю ZZ, Квак-Ким Дж., Ляо А.Х. Какова роль макрофагов и моноцитов при беременности человека? J Reprod Immunol (2015) 112:73–80. doi: 10.1016/j.jri.2015.08.001
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
125. Faas MM, de Vos P. Материнские моноциты при беременности и преэклампсии у людей и крыс. J Reprod Immunol (2017) 119:91–7. doi: 10.1016/j.jri.2016.06.009
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
126. Göhner C, Plösch T, Faas MM. Иммуномодулирующие эффекты внеклеточных везикул синцитиотрофобласта при беременности и преэклампсии. Плацента (2017) 60 (Приложение 1): S41–51. doi: 10.1016/j.placenta.2017.06.004
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
127. Ziegler SM, Feldmann CN, Hagen SH, Richert L, Barkhausen T, Goletzke J, et al. Врожденные иммунные ответы на стимуляцию толл-подобных рецепторов изменяются в течение беременности. J Reprod Immunol (2018) 128:30–7. doi: 10.1016/j.jri.2018.05.009
Врожденные иммунные ответы на стимуляцию толл-подобных рецепторов изменяются в течение беременности. J Reprod Immunol (2018) 128:30–7. doi: 10.1016/j.jri.2018.05.009
PubMed Abstract | Полный текст перекрестной ссылки | Академия Google
128. Hotchkiss RS, Monneret G, Payen D. Иммуносупрессия при сепсисе: новое понимание расстройства и новый терапевтический подход. Lancet Infect Dis (2013) 13:260–8. doi: 10.1016/S1473-3099(13)70001-X
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
129. Döcke WD, Randow F, Syrbe U, Krausch D, Asadullah K, Reinke P, et al. Деактивация моноцитов у пациентов с сепсисом: восстановление лечением IFN-gamma. Nat Med (1997) 3:678–81. дои: 10.1038/nm0697-678
Реферат PubMed | Полный текст перекрестной ссылки | Google Scholar
130. Faas MM, Spaans F, De Vos P. Моноциты и макрофаги при беременности и преэклампсии. Фронт Иммунол (2014) 5:298. doi: 10.3389/fimmu. 2014.00298
2014.00298
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
131. Artis D, Spits H. Биология врожденных лимфоидных клеток. Природа (2015) 517:293–301. doi: 10.1038/nature14189
PubMed Abstract | Полный текст перекрестной ссылки | Академия Google
132. Фрейд А.Г., Мунди-Боссе Б.Л., Ю.Дж., Калиджиури М.А. Широкий спектр человеческого разнообразия естественных клеток-киллеров. Иммунитет (2017) 47:820–33. doi: 10.1016/j.immuni.2017.10.008
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
133. Бреннан П.Дж., Бригл М., Бреннер М.Б. Инвариантные естественные Т-киллеры: врожденная схема активации, связанная с разнообразными эффекторными функциями. Nat Rev Immunol (2013) 13:101–17. doi: 10.1038/nri3369
PubMed Abstract | Полный текст перекрестной ссылки | Академия Google
134. Moffett A, Colucci F. Маточные NK-клетки: активные регуляторы на границе между матерью и плодом. J Clin Invest (2014) 124:1872–9. doi: 10.1172/JCI68107
J Clin Invest (2014) 124:1872–9. doi: 10.1172/JCI68107
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
135. Burke SD, Seaward AV, Ramshaw H, Smith GN, Virani S, Croy BA, et al. Экспрессия рецептора самонаведения на CD56+ лимфоцитах крови отклоняется во время беременности у женщин с диабетом 1 типа. PLoS One (2015) 10:e0119526. doi: 10.1371/journal.pone.0119526
Реферат PubMed | Полный текст перекрестной ссылки | Google Scholar
136. Southcombe J, Redman C, Sargent I. Инвариантные Т-клетки естественных киллеров периферической крови во время беременности и у женщин с преэклампсией. J Reprod Immunol (2010) 87:52–9. doi: 10.1016/j.jri.2010.07.003
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
137. Мегьес М., Мико Э., Полгар Б., Богар Б., Фаркас Б., Иллес З. и др. TIM-3-положительные NK- и CD8+ Т-клетки периферической крови на протяжении всей беременности: TIM-3/галектин-9взаимодействие и его возможная роль во время беременности. PLoS One (2014) 9:e
PLoS One (2014) 9:e
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
138. Чжан Дж., Шинлова О., Сабра С., Банг А., Бриолле Л., Лай С.Дж. Иммунофенотипирование и статус активации лейкоцитов периферической крови матери при беременности и родах, как доношенных, так и недоношенных. J Cell Mol Med (2017) 21:2386–402. doi: 10.1111/jcmm.13160
PubMed Abstract | Полный текст перекрестной ссылки | Академия Google
139. Veenstra van Nieuwenhoven AL, Bouman A, Moes H, Heineman MJ, de Leij LF, Santema J, et al. Продукция цитокинов натуральными киллерами и лимфоцитами у беременных по сравнению с женщинами в фолликулярной фазе овариального цикла. Fertil Steril (2002) 77:1032–7. doi: 10.1016/S0015-0282(02)02976-X
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
140. Borzychowski AM, Croy BA, Chan WL, Redman CWG, Sargent IL. Изменения системного иммунитета 1-го и 2-го типов при нормальной беременности и преэклампсии могут быть опосредованы естественными клетками-киллерами. Eur J Immunol (2005) 35:3054–63. doi: 10.1002/eji.200425929
Eur J Immunol (2005) 35:3054–63. doi: 10.1002/eji.200425929
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
141. Sun J, Yang M, Ban Y, Gao W, Song B, Wang Y и др. Tim-3 активируется в NK-клетках на ранних сроках беременности и ингибирует цитотоксичность NK по отношению к трофобласту в галектин-9-зависимом пути. PLoS One (2016) 11:e0147186. doi: 10.1371/journal.pone.0147186
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
142. Higuma-Myojo S, Sasaki Y, Miyazaki S, Sakai M, Siozaki A, Miwa N, et al. Цитокиновый профиль естественных клеток-киллеров на ранних сроках беременности человека. Am J Reprod Immunol (2005) 54:21–9. doi: 10.1111/j.1600-0897.2005.00279.x
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
143. Zhao J, Lei Z, Liu Y, Li B, Zhang L, Fang H, et al. Беременность человека активирует Tim-3 в клетках врожденного иммунитета для системного иммунитета. J Immunol (2009) 182:6618–24. doi: 10.4049/jimmunol.0803876
J Immunol (2009) 182:6618–24. doi: 10.4049/jimmunol.0803876
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
144. Das M, Zhu C, Kuchroo VK. Tim-3 и его роль в регуляции противоопухолевого иммунитета. Immunol Rev (2017) 276:97–111. doi: 10.1111/imr.12520
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
145. Le Gars M, Seiler C, Kay AW, Bayless NL, Starosvetsky E, Moore L, et al. Вызванные беременностью изменения фенотипа и функции NK-клеток. Фронт Иммунол (2019) 10:2469. doi: 10.3389/fimmu.2019.02469
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
146. Vacca P, Montaldo E, Croxatto D, Loiacono F, Canegallo F, Venturini PL, et al. Идентификация разнообразных врожденных лимфоидных клеток в децидуальной оболочке человека. Mucosal Immunol (2015) 8:254–64. doi: 10.1038/mi.2014.63
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
147. Глассман А.Б., Беннетт К.Э., Кристофер Дж.Б., Селф С. Иммунитет во время беременности: субпопуляции лимфоцитов и чувствительность к митогенам. Ann Clin Lab Sci (1985) 15:357–62.
Глассман А.Б., Беннетт К.Э., Кристофер Дж.Б., Селф С. Иммунитет во время беременности: субпопуляции лимфоцитов и чувствительность к митогенам. Ann Clin Lab Sci (1985) 15:357–62.
Реферат PubMed | Google Scholar
148. Coulam CB, Silverfield JC, Kazmar RE, Fathman CG. Субпопуляции Т-лимфоцитов при беременности и менструальном цикле. Am J Reprod Immunol (1983) 4:88–90. doi: 10.1111/j.1600-0897.1983.tb00259.x
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
149. Ватанабэ М., Иватани Ю., Канеда Т., Хидака Ю., Мицуда Н., Моримото Ю. и др. Изменения субпопуляций Т-, В- и NK-лимфоцитов во время и после нормальной беременности. Am J Reprod Immunol (1997) 37:368–77. doi: 10.1111/j.1600-0897.1997.tb00246.x
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
150. Kühnert M, Strohmeier R, Stegmüller M, Halberstadt E. Изменения в субпопуляциях лимфоцитов при нормальной беременности. Eur J Obstet Gynecol Reprod Biol (1998) 76:147–51. doi: 10.1016/S0301-2115(97)00180-2
doi: 10.1016/S0301-2115(97)00180-2
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
151. Wegmann TG, Lin H, Guilbert L, Mosmann TR. Двунаправленные взаимодействия цитокинов в отношениях матери и плода: является ли успешная беременность феноменом Th3? Immunol Today (1993) 14:353–6. doi: 10.1016/0167-5699(93)
-D
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
152. Вегманн Т.Г. Защита плода от аборта: иммуносупрессия или иммуностимуляция? Ann Immunol (Париж) (1984) 135D:309–12. doi: 10.1016/S0769-2625(84)81196-4
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
153. Секерес-Барто Дж., Вегманн Т.Г. Прогестеронзависимый иммуномодулирующий белок изменяет баланс Th2/Th3. J Reprod Immunol (1996) 31:81–95. doi: 10.1016/0165-0378(96)00964-3
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
154. Piccinni MP, Beloni L, Livi C, Maggi E, Scarselli G, Romagnani S. Дефектная продукция фактора ингибирования лейкемии и Т-хелперных цитокинов типа 2 децидуальными Т-клетками при необъяснимых рецидивирующих абортах. Nat Med (1998) 4:1020–4. doi: 10.1038/2006
Дефектная продукция фактора ингибирования лейкемии и Т-хелперных цитокинов типа 2 децидуальными Т-клетками при необъяснимых рецидивирующих абортах. Nat Med (1998) 4:1020–4. doi: 10.1038/2006
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
155. Сайто С. Цитокиновая сеть на фето-материнском интерфейсе. J Reprod Immunol (2000) 47:87–103. doi: 10.1016/S0165-0378(00)00060-7
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
156. Raghupathy R, Makhseed M, Azizieh F, Omu A, Gupta M, Farhat R. Производство цитокинов материнскими лимфоцитами во время нормальной беременности человека и при необъяснимом рецидивирующем самопроизвольном аборте. Hum Reprod (2000) 15:713–8. doi: 10.1093/humrep/15.3.713
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
157. Aghaeepour N, Ganio EA, Mcilwain D, Tsai AS, Tingle M, Van Gassen S, et al. Иммунные часы беременности человека. Sci Immunol (2017) 2. doi: 10.1126/sciimmunol.aan2946
Sci Immunol (2017) 2. doi: 10.1126/sciimmunol.aan2946
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
158. Saito S, Sakai M, Sasaki Y, Tanebe K, Tsuda H, Michimata T. Количественный анализ периферической крови Th0, Th2, Th3 и соотношения клеток Th2:Th3 при нормальной беременности человека и преэклампсии. Clin Exp Immunol (1999) 117:550–5. doi: 10.1046/j.1365-2249.1999.00997.x
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
159. Лиссауэр Д., Гудиер О., Ханум Р., Мосс П.А., Килби М.Д. Профиль эффекторной функции материнских Т-клеток CD4 при нормальной беременности и у женщин с привычным невынашиванием беременности в анамнезе. Clin Sci (Лондон) (2014) 126:347–54. doi: 10.1042/CS20130247
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
160. Маттисен Л., Экерфельт С., Берг Г., Эрнеруд Дж. Увеличение количества циркулирующих интерферон-гамма- и интерлейкин-4-секретирующих клеток во время нормальной беременности. Am J Reprod Immunol (1998) 39:362–7. doi: 10.1111/j.1600-0897.1998.tb00370.x
Am J Reprod Immunol (1998) 39:362–7. doi: 10.1111/j.1600-0897.1998.tb00370.x
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
161. Накашима А., Ито М., Йонеда С., Шиодзаки А., Хидака Т., Сайто С. Уровни циркулирующих и децидуальных клеток Th27 при здоровой беременности. Am J Reprod Immunol (2010) 63:104–9. doi: 10.1111/j.1600-0897.2009.00771.x
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
162. Fujisaki S, Mori N, Sasaki T, Maeyama M. Клеточный иммунитет при беременности человека: изменения реактивности лимфоцитов во время беременности и после родов. Microbiol Immunol (1979) 23:899–907. doi: 10.1111/j.1348-0421.1979.tb02823.x
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
163. Marzi M, Vigano A, Trabattoni D, Villa ML, Salvaggio A, Clerici E, et al. Характеристика профиля продукции цитокинов 1-го и 2-го типов при физиологической и патологической беременности человека. Clin Exp Immunol (1996) 106:127–33. doi: 10.1046/j.1365-2249.1996.d01-809.x
Clin Exp Immunol (1996) 106:127–33. doi: 10.1046/j.1365-2249.1996.d01-809.x
PubMed Abstract | Полный текст перекрестной ссылки | Академия Google
164. Bailey K, Herrod HG, Younger R, Shaver D. Функциональные аспекты субпопуляций Т-лимфоцитов при беременности. Obstet Gynecol (1985) 66:211–5.
Реферат PubMed | Google Scholar
165. Бхат Н.М., Митал А., Бибер М.М., Герценберг Л.А., Тенг Н.Н. Человеческие CD5+ B-лимфоциты (клетки B-1) уменьшаются в периферической крови во время беременности. J Reprod Immunol (1995) 28:53–60. doi: 10.1016/0165-0378(94)00907-O
PubMed Abstract | Полный текст перекрестной ссылки | Академия Google
166. Кристиансен Дж.С., Андерсен А.Р., Остер К., Пайтерсен Б., Бах-Мортенсен Н., Лебех П.Е. Взаимосвязь между беременностью, ГКС и В-лимфоцитами. Acta Pathol Microbiol Scand C (1976) 84:313–8. doi: 10.1111/j.1699-0463.1976.tb00035.x
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
167. Мур М.П., Картер Н.П., Редман К.В. Субпопуляции лимфоцитов, определяемые моноклональными антителами при беременности человека. Am J Reprod Immunol (1983) 3:161–4. дои: 10.1111/j.1600-0897.1983.tb00239.x
Мур М.П., Картер Н.П., Редман К.В. Субпопуляции лимфоцитов, определяемые моноклональными антителами при беременности человека. Am J Reprod Immunol (1983) 3:161–4. дои: 10.1111/j.1600-0897.1983.tb00239.x
Реферат PubMed | Полный текст перекрестной ссылки | Google Scholar
168. Valdimarsson H, Mulholland C, Fridriksdottir V, Coleman DV. Продольное исследование лейкоцитарной формулы крови и реакции лимфоцитов при беременности: заметное раннее увеличение отношения моноцитов к лимфоцитам. Clin Exp Immunol (1983) 53:437–43.
Реферат PubMed | Google Scholar
169. Дельгадо И., Нойберт Р., Дуденхаузен Дж.В. Изменения лейкоцитов в родах у матерей и новорожденных. Gynecol Obstet Invest (1994) 38:227–35. doi: 10.1159/0002
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
170. Иватани Ю., Амино Н., Тачи Дж., Кимура М., Ура И., Мори М. и др. Изменения субпопуляций лимфоцитов у нормальных беременных и родильниц: послеродовое увеличение NK/K (Leu 7) клеток. Am J Reprod Immunol Microbiol (1988) 18:52–5. doi: 10.1111/j.1600-0897.1988.tb00235.x
Am J Reprod Immunol Microbiol (1988) 18:52–5. doi: 10.1111/j.1600-0897.1988.tb00235.x
PubMed Abstract | Полный текст перекрестной ссылки | Академия Google
171. Kraus TA, Engel SM, Sperling RS, Kellerman L, Lo Y, Wallenstein S, et al. Характеристика иммунного фенотипа беременности: результаты исследования вирусного иммунитета и беременности (ВИП). J Clin Immunol (2012) 32:300–11. doi: 10.1007/s10875-011-9627-2
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
172. Mahmoud F, Abul H, Omu A, Al-Rayes S, Haines D, Whaley K. Связанные с беременностью изменения субпопуляций лимфоцитов периферической крови у нормальных кувейтских женщин. Gynecol Obstet Invest (2001) 52:232–6. doi: 10.1159/000052981
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
173. Маттисен Л., Берг Г., Эрнеруд Дж., Хоканссон Л. Субпопуляции лимфоцитов и митогенная стимуляция лимфоцитов крови при нормальной беременности. Am J Reprod Immunol (1996) 35:70–9. doi: 10.1111/j.1600-0897.1996.tb00010.x
Am J Reprod Immunol (1996) 35:70–9. doi: 10.1111/j.1600-0897.1996.tb00010.x
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
174. Lima J, Martins C, Leandro MJ, Nunes G, Sousa MJ, Branco JC, et al. Характеристика В-клеток у здоровых беременных женщин от поздних сроков беременности до послеродового периода: проспективное обсервационное исследование. BMC Беременность Роды (2016) 16:139. doi: 10.1186/s12884-016-0927-7
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
175. Пазос М., Сперлинг Р.С., Моран Т.М., Краус Т.А. Влияние беременности на системный иммунитет. Immunol Res (2012) 54:254–61. doi: 10.1007/s12026-012-8303-9
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
176. Додсон М.Г., Керман Р.Х., Ланге С.Ф., Стефани С.С., О’Лири Дж.А. Т- и В-клетки при беременности. Obstet Gynecol (1977) 49:299–302.
Реферат PubMed | Google Scholar
177. Биркеланд С.А., Кристофферсен К. Т- и В-лимфоциты при нормальной беременности человека: продольное исследование. Scand J Immunol (1979) 10:415–9. doi: 10.1111/j.1365-3083.1979.tb01370.x
Биркеланд С.А., Кристофферсен К. Т- и В-лимфоциты при нормальной беременности человека: продольное исследование. Scand J Immunol (1979) 10:415–9. doi: 10.1111/j.1365-3083.1979.tb01370.x
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
178. Ziegler KB, Muzzio DO, Matzner F, Bommer I, Ventimiglia MS, Malinowsky K, et al. Беременность у человека сопровождается изменениями в развитии В-клеток и профиле иммуноглобулинов. J Reprod Immunol (2018) 129:40–7. doi: 10.1016/j.jri.2018.07.003
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
179. Лима Дж., Кембридж Г., Вилас-Боас А., Мартинс С., Боррего Л.М., Леандро М. Сывороточные маркеры активации В-клеток при беременности на поздних сроках беременности, в родах и в послеродовом периоде. Am J Reprod Immunol (2019) 81:e13090. doi: 10.1111/aji.13090
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
180. Биркеланд С. А., Кристофферсен К. Трансформация лимфоцитов с помощью митогенов и антигенов во время нормальной беременности человека: продольное исследование. Scand J Immunol (1980) 11:321–5. doi: 10.1111/j.1365-3083.1980.tb00240.x
А., Кристофферсен К. Трансформация лимфоцитов с помощью митогенов и антигенов во время нормальной беременности человека: продольное исследование. Scand J Immunol (1980) 11:321–5. doi: 10.1111/j.1365-3083.1980.tb00240.x
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
181. Best JM, Banatvala JE, Watson D. Сывороточные IgM и IgG ответы при постнатальной краснухе. Ланцет (1969) 2:65–8. doi: 10.1016/S0140-6736(69)-1
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
182. Гусдон Дж. П. Уровни иммуноглобулинов плода и матери во время беременности. Am J Акушерство Gynecol (1969) 103:895–900. doi: 10.1016/S0002-9378(16)34434-9
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
183. Менденхолл Х.В. Концентрация белка в сыворотке крови при беременности. I. Концентрации в материнской сыворотке. Am J Obstet Gynecol (1970) 106:388–99. doi: 10.1016/0002-9378(70)
-9
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
184. Стадд Дж.В. Иммуноглобулины при нормально протекающей беременности, преэклампсии и беременности, осложненной нефротическим синдромом. J Obstet Gynaecol Br Commonw (1971) 78:786–90. doi: 10.1111/j.1471-0528.1971.tb00339.x
Стадд Дж.В. Иммуноглобулины при нормально протекающей беременности, преэклампсии и беременности, осложненной нефротическим синдромом. J Obstet Gynaecol Br Commonw (1971) 78:786–90. doi: 10.1111/j.1471-0528.1971.tb00339.x
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
185. Бенстер Б., Вуд Э.Дж. Уровень иммуноглобулинов при нормально протекающей беременности и беременности, осложненной артериальной гипертензией. J Obstet Gynaecol Br Commonw (1970) 77:518–22. doi: 10.1111/j.1471-0528.1970.tb03559.x
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
186. Сонг К.С., Меркатц И.Р., Рифкинд А.Б., Джиллетт П.Н., Каппас А. Влияние беременности и оральных контрацептивов на концентрацию белков плазмы. Исследования количественным иммунодиффузионным методом. Am J Obstet Gynecol (1970) 108:227–31. doi: 10.1016/0002-9378(70)
-7
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
187. Amino N, Tanizawa O, Miyai K, Tanaka F, Hayashi C, Kawashima M, et al. Изменения сывороточных иммуноглобулинов IgG, IgA, IgM и IgE при беременности. Obstet Gynecol (1978) 52:415–20.
Amino N, Tanizawa O, Miyai K, Tanaka F, Hayashi C, Kawashima M, et al. Изменения сывороточных иммуноглобулинов IgG, IgA, IgM и IgE при беременности. Obstet Gynecol (1978) 52:415–20.
Реферат PubMed | Google Scholar
188. Маролис Г.Б., Бакли Р.Х., Янгер Дж.Б. Концентрация иммуногбулина в сыворотке при нормальной беременности. Am J Obstet Gynecol (1971) 109:971–6. doi: 10.1016/0002-9378(71)
-4
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
189. Ларссон А., Палм М., Ханссон Л.О., Басу С., Аксельссон О. Референтные значения альфа-1-кислого гликопротеина, альфа-1-антитрипсина, альбумина, гаптоглобина, С-реактивного белка, IgA, IgG и IgM во время беременности. Acta Obstet Gynecol Scand (2008) 87:1084–8. doi: 10.1080/00016340802428146
PubMed Abstract | Полный текст перекрестной ссылки | Академия Google
190. Bondt A, Rombouts Y, Selman MH, Hensbergen PJ, Reiding KR, Hazes JM, et al. Анализ гликозилирования иммуноглобулина G (IgG) Fab с использованием нового масс-спектрометрического высокопроизводительного метода профилирования выявляет изменения, связанные с беременностью. Mol Cell Proteomics (2014) 13:3029–39. doi: 10.1074/mcp.M114.039537
Mol Cell Proteomics (2014) 13:3029–39. doi: 10.1074/mcp.M114.039537
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
191. Bondt A, Selman MH, Deelder AM, Hazes JM, Willemsen SP, Wuhrer M, et al. Связь между галактозилированием иммуноглобулина G и улучшением течения ревматоидного артрита во время беременности не зависит от сиалирования. J Proteome Res (2013) 12:4522–31. doi: 10.1021/pr400589m
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
192. Selman MH, Derks RJ, Bondt A, Palmblad M, Schoenmaker B, Koeleman CA, et al. Fc-специфическое профилирование гликозилирования IgG с помощью надежной нано-ВЭЖХ-МС с обращенной фазой с использованием интерфейса распылителя ESI с проточным потоком. J Proteomics (2012) 75:1318–29. doi: 10.1016/j.jprot.2011.11.003
PubMed Abstract | Полный текст перекрестной ссылки | Академия Google
193. Zenclussen AC, Gentile T, Kortebani G, Mazzolli A, Margni R. Асимметричные антитела и беременность. Am J Reprod Immunol (2001) 45:289–94. doi: 10.1111/j.8755-8920.2001.450504.x
Асимметричные антитела и беременность. Am J Reprod Immunol (2001) 45:289–94. doi: 10.1111/j.8755-8920.2001.450504.x
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
194. Гутьеррес Г., Джентиле Т., Миранда С., Маргни Р.А. Асимметричные антитела: защитная рука во время беременности. Chem Immunol Allergy (2005) 89:158–68. doi: 10.1159/000087964
PubMed Abstract | Полный текст перекрестной ссылки | Академия Google
195. Panpatana P, Wasi C, Ruangpairoj T, Chunarmchai S, Theeravuthichai J, Thongcharoen P. Иммуноглобулины сыворотки при беременности и после родов. J Med Assoc Thai (1974) 57:109–11.
Реферат PubMed | Google Scholar
196. Золлер А.Л., Шнелл Ф.Дж., Керш Г.Дж. Мышиная беременность приводит к снижению пролиферации материнских тимоцитов и снижению эмиграции тимуса. Иммунология (2007) 121:207–15. doi: 10.1111/j.1365-2567.2006.02559.x
PubMed Abstract | Полный текст перекрестной ссылки | Академия Google
197. Clarke AG, Kendall MD. Вилочковая железа при беременности: взаимодействие нервных, эндокринных и иммунных влияний. Immunol Today (1994) 15:545–51. doi: 10.1016/0167-5699(94)
Clarke AG, Kendall MD. Вилочковая железа при беременности: взаимодействие нервных, эндокринных и иммунных влияний. Immunol Today (1994) 15:545–51. doi: 10.1016/0167-5699(94)
-7
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
198. Мор Г., Карденас И. Иммунная система во время беременности: уникальная сложность. Am J Reprod Immunol (2010) 63:425–33. doi: 10.1111/j.1600-0897.2010.00836.x
PubMed Abstract | Полный текст перекрестной ссылки | Академия Google
199. де Ман Ю.А., Долхайн Р.Дж., Хейз Дж.М. Активность заболевания или ремиссия ревматоидного артрита до, во время и после беременности. Curr Opin Rheumatol (2014) 26:329–33. doi: 10.1097/BOR.0000000000000045
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
200. Pozzilli C, Pugliatti M, Group P. Обзор проблем, связанных с беременностью, у пациентов с рассеянным склерозом. Eur J Neurol (2015) 22 (Приложение 2): 34–9. doi: 10.1111/en.12797
doi: 10.1111/en.12797
Реферат PubMed | Полный текст перекрестной ссылки | Google Scholar
201. Айрас Л. Гормональные и связанные с полом иммунные изменения при рассеянном склерозе. Acta Neurol Scand (2015) 132:62–70. doi: 10.1111/ane.12433
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
202. Хара Л.Дж., Медина Г., Крус-Домингес П., Наварро С., Вера-Ластра О., Сааведра М.А. Факторы риска системной красной волчанки во время беременности. Иммунол Рез (2014) 60:184–92. doi: 10.1007/s12026-014-8577-1
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
203. Sykes L, MacIntyre DA, Yap XJ, Teoh TG, Bennett PR. Дихотомия Th2:th3 беременности и преждевременных родов. Медиаторы Inflamm (2012) 2012:967629. doi: 10.1155/2012/967629
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
204. Килан Дж. А., Блуменштейн М., Хеллиуэлл Р. Дж., Сато Т. А., Марвин К. В., Митчелл М. Д. Цитокины, простагландины и роды – обзор. Placenta (2003) 24 (Приложение A): S33–46. doi: 10.1053/plac.2002.0948
В., Митчелл М. Д. Цитокины, простагландины и роды – обзор. Placenta (2003) 24 (Приложение A): S33–46. doi: 10.1053/plac.2002.0948
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
205. Cierny JT, Unal ER, Flood P, Rhee KY, Praktish A, Olson TH, et al. Маркеры воспаления у матери и продуктивность родов в срок. Am J Obstet Gynecol (2014) 210:447.e1–6. doi: 10.1016/j.ajog.2013.11.038
CrossRef Полный текст | Google Scholar
206. Denney JM, Nelson EL, Wadhwa PD, Waters TP, Mathew L, Chung EK, et al. Продольная модуляция цитокинового профиля иммунной системы во время беременности. Цитокин (2011) 53:170–7. doi: 10.1016/j.cyto.2010.11.005
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
207. Piccinni MP, Giudizi MG, Biagiotti R, Beloni L, Giannarini L, Sampognaro S, et al. Прогестерон способствует развитию человеческих Т-хелперных клеток, продуцирующих цитокины Th3-типа, и способствует как продукции IL-4, так и экспрессии мембранного CD30 в установленных клонах клеток Th2. J Immunol (1995) 155:128–33.
J Immunol (1995) 155:128–33.
Реферат PubMed | Академия Google
208. Piccinni MP, Scaletti C, Maggi E, Romagnani S. Роль гормонозависимых цитокинов Th2- и Th3-типа в успешной беременности. J Neuroimmunol (2000) 109:30–3. doi: 10.1016/S0165-5728(00)00299-X
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
209. Norman JE, Yuan M, Anderson L, Howie F, Harold G, Young A, et al. Влияние длительного введения прогестерона in vivo во время беременности на экспрессию генов миометрия, активацию лейкоцитов периферической крови и уровни циркулирующих стероидных гормонов. Reprod Sci (2011) 18:435–46. doi: 10.1177/1
95404
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
210. Zenclussen AC. Адаптивные иммунные реакции во время беременности. Am J Reprod Immunol (2013) 69:291–303. doi: 10.1111/aji.12097
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
211. Крой Б.А., Чантакру С., Эсадег С., Ашкар А.А., Вей К. Децидуальные естественные клетки-киллеры: ключевые регуляторы развития плаценты (обзор). J Reprod Immunol (2002) 57:151–68. doi: 10.1016/S0165-0378(02)00005-0
Крой Б.А., Чантакру С., Эсадег С., Ашкар А.А., Вей К. Децидуальные естественные клетки-киллеры: ключевые регуляторы развития плаценты (обзор). J Reprod Immunol (2002) 57:151–68. doi: 10.1016/S0165-0378(02)00005-0
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
212. Piguet PF, Vassalli P. Изучение тимусной или независимой природы клеток селезенки мыши, индуцированных к пролиферации в культуре различными митогенами и антигенами. Eur J Immunol (1973) 3:477–83. doi: 10.1002/eji.1830030805
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
213. Muzzio D, Zenclussen AC, Jensen F. Роль В-клеток во время беременности: хорошая и плохая. Am J Reprod Immunol (2013) 69:408–12. doi: 10.1111/aji.12079
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
214. Power DA, Catto GR, Mason RJ, MacLeod AM, Stewart GM, Stewart KN, et al. Плод как аллотрансплантат: доказательства наличия защитных антител к HLA-связанным отцовским антигенам. Ланцет (1983) 2:701–4. doi: 10.1016/S0140-6736(83)
Ланцет (1983) 2:701–4. doi: 10.1016/S0140-6736(83)
-8
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
215. Медина К.Л., Смитсон Г., Кинкейд П.В. Подавление В-лимфопоэза при нормальной беременности. J Exp Med (1993) 178:1507–15. doi: 10.1084/jem.178.5.1507
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
216. Muzzio DO, Soldati R, Ehrhardt J, Utpatel K, Evert M, Zenclussen AC, et al. Развитие В-клеток претерпевает глубокие модификации и адаптации во время беременности у мышей. Biol Reprod (2014) 91:115. doi: 10.1095/biolreprod.114.122366
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
217. Хусейн М.Р., Абд-Эльвахед А.Р., Абодеиф Э.С., Абдулвахед С.Р. Инфильтрат децидуальных иммунных клеток в пузырном заносе. Cancer Invest (2009) 27:60–6. doi: 10.1080/07357
2161054
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
218. Grimaldi CM, Cleary J, Dagtas AS, Moussai D, Diamond B. Эстроген изменяет пороги апоптоза и активации В-клеток. J Clin Invest (2002) 109:1625–33. doi: 10.1172/JCI0214873
Grimaldi CM, Cleary J, Dagtas AS, Moussai D, Diamond B. Эстроген изменяет пороги апоптоза и активации В-клеток. J Clin Invest (2002) 109:1625–33. doi: 10.1172/JCI0214873
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
219. Prieto JMB, Felippe MJB. Развитие, фенотип и функция нетрадиционных В-клеток. Comp Immunol Microbiol Infect Dis (2017) 54:38–44. doi: 10.1016/j.cimid.2017.08.002
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
220. Bansal AS, Haeney MR, Cochrane S, Pumphrey RS, Green LM, Bhavnani M, et al. Сывороточный растворимый CD23 у пациентов с гипогаммаглобулинемией. Clin Exp Immunol (1994) 97:239–41. doi: 10.1111/j.1365-2249.1994.tb06074.x
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
221. Yoshikawa T, Nanba T, Kato H, Hori K, Inamoto T, Kumagai S, et al. Растворимый Fc-эпсилон RII/CD23 у пациентов с аутоиммунными заболеваниями и нарушениями, связанными с вирусом Эпштейна-Барр: анализ растворимого Fc-эпсилон RII/CD23 методом ИФА. Immunmethods (1994) 4:65–71. doi: 10.1006/immu.1994.1008
Immunmethods (1994) 4:65–71. doi: 10.1006/immu.1994.1008
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
222. Goller ME, Kneitz C, Mehringer C, Müller K, Jelley-Gibbs DM, Gosselin EJ, et al. Регуляция изоформ CD23 при В-хроническом лимфоцитарном лейкозе. Leuk Res (2002) 26:795–802. doi: 10.1016/s0145-2126(02)00007-3
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
223. Cambridge G, Perry HC, Nogueira L, Serre G, Parsons HM, De La Torre I, et al. Влияние терапии истощения В-клеток на серологические признаки активации В-клеток и плазмобластов у пациентов с ревматоидным артритом в течение нескольких циклов лечения ритуксимабом. J Autoimmun (2014) 50:67–76. doi: 10.1016/j.jaut.2013.12.002
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
224. Guo WJ, Qu X, Yang MX, Zhang WD, Liang L, Shao QQ и др. Экспрессия BAFF в трофобласте и децидуальной оболочке нормальных беременных женщин на ранних сроках и пациенток с привычным самопроизвольным невынашиванием беременности. Chin Med J (англ.) (2008) 121:309–15.
Chin Med J (англ.) (2008) 121:309–15.
Реферат PubMed | Google Scholar
225. Kreuzaler M, Rauch M, Salzer U, Birmelin J, Rizzi M, Grimbacher B, et al. Уровни растворимого BAFF обратно пропорциональны количеству периферических В-клеток и экспрессии рецепторов BAFF. J Immunol (2012) 188:497–503. doi: 10.4049/jimmunol.1102321
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
226. de Taeye SW, Rispens T, Vidarsson G. Лиганды человеческого IgG и их эффекторные функции. Antibodies (Basel) (2019) 8. doi: 10.3390/antib8020030
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
227. Jennewein MF, Goldfarb I, Dolatshahi S, Cosgrove C, Noelette FJ, Krykbaeva M, et al. Fc-гликан-опосредованная регуляция переноса плацентарных антител. Cell (2019) 178:202–15.e14. doi: 10.1016/j.cell.2019.05.044
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
228. Абу-Рая Б., Джайлз М.Л., Коллманн Т.Р., Садарангани М. Влияние сроков введения вакцины против столбняка, дифтерии и бесклеточного коклюша во время беременности на авидность коклюшных антител. Фронт Иммунол (2019) 10:2423. doi: 10.3389/fimmu.2019.02423
Абу-Рая Б., Джайлз М.Л., Коллманн Т.Р., Садарангани М. Влияние сроков введения вакцины против столбняка, дифтерии и бесклеточного коклюша во время беременности на авидность коклюшных антител. Фронт Иммунол (2019) 10:2423. doi: 10.3389/fimmu.2019.02423
PubMed Abstract | Полный текст перекрестной ссылки | Академия Google
229. Арнольд Дж. Н., Вормалд М. Р., Сим Р. Б., Радд П. М., Двек Р. А. Влияние гликозилирования на биологическую функцию и структуру иммуноглобулинов человека. Annu Rev Immunol (2007) 25:21–50. doi: 10.1146/annurev.immunol.25.022106.141702
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
230. Nesspor TC, Raju TS, Chin CN, Vafa O, Brezski RJ. Авидность придает связывание FcγR и иммунную эффекторную функцию агликозилированному иммуноглобулину G1. J Mol Recognit (2012) 25:147–54. doi: 10.1002/jmr.2155
Резюме PubMed | Полный текст перекрестной ссылки | Google Scholar
231. Jung ST, Reddy ST, Kang TH, Borrok MJ, Sandlie I, Tucker PW, et al. Агликозилированные варианты IgG, экспрессированные в бактериях, которые селективно связывают FcgammaRI, потенцируют уничтожение опухолевых клеток моноцитарно-дендритными клетками. Proc Natl Acad Sci U S A (2010) 107:604–9. doi: 10.1073/pnas.09085
Агликозилированные варианты IgG, экспрессированные в бактериях, которые селективно связывают FcgammaRI, потенцируют уничтожение опухолевых клеток моноцитарно-дендритными клетками. Proc Natl Acad Sci U S A (2010) 107:604–9. doi: 10.1073/pnas.09085
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
232. Ferrara C, Grau S, Jäger C, Sondermann P, Brünker P, Waldhauer I, et al. Для высокоаффинного связывания между FcgammaRIII и антителами, лишенными сердцевинной фукозы, необходимы уникальные углевод-углеводные взаимодействия. Proc Natl Acad Sci U S A (2011) 108:12669–74. doi: 10.2210/pdb3sgj/pdb
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
233. Shields RL, Lai J, Keck R, O’Connell LY, Hong K, Meng YG, et al. Отсутствие фукозы в N-связанном олигосахариде IgG1 человека улучшает связывание с человеческим Fcgamma RIII и антителозависимую клеточную токсичность. J Biol Chem (2002) 277:26733–40. doi: 10.1074/jbc.M202069200
doi: 10.1074/jbc.M202069200
PubMed Abstract | Полный текст перекрестной ссылки | Академия Google
234. Tandon R, Bhatia BD, Narang P. Неонатальные инфекции: I – уровни IgG в сыворотке матери и пуповины в зависимости от беременности и внутриутробного роста. Indian J Pediatr (1984) 51:521–7. doi: 10.1007/BF02776614
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
235. Pitcher-Wilmott RW, Hindocha P, Wood CB. Плацентарный перенос подклассов IgG при беременности человека. Clin Exp Immunol (1980) 41:303–8.
Реферат PubMed | Академия Google
236. Sakaguchi S. Естественно возникающие Foxp3-экспрессирующие CD25+CD4+ регуляторные Т-клетки в иммунологической толерантности к своим и чужим. Nat Immunol (2005) 6:345–52. doi: 10.1038/ni1178
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
237. Акбар А.Н., Вукманович-Стейич М., Таамс Л.С., Макаллан Д.К. Динамическая коэволюция памяти и регуляторных CD4+ Т-клеток на периферии. Nat Rev Immunol (2007) 7:231–7. doi: 10.1038/nri2037
Nat Rev Immunol (2007) 7:231–7. doi: 10.1038/nri2037
Реферат PubMed | Полный текст перекрестной ссылки | Google Scholar
238. Somerset DA, Zheng Y, Kilby MD, Sansom DM, Drayson MT. Нормальная беременность у человека связана с повышением иммуносупрессивной субпопуляции CD25+ CD4+ регуляторных Т-клеток. Иммунология (2004) 112:38–43. doi: 10.1111/j.1365-2567.2004.01869.x
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
239. Фонтенот Д.Д., Гэвин М.А., Руденски А.Ю. Основная статья: Foxp3 программирует развитие и функцию CD4+CD25+ регуляторных Т-клеток. Nat Immunol (2003) 4:330–6. Дж Иммунол 2017; 198:986-92.
Реферат PubMed | Google Scholar
240. Chaouat G, Lédée-Bataille N, Zourbas S, Ostojic S, Dubanchet S, Martal J, et al. Цитокины, имплантация и ранний аборт: пересмотр парадигмы Th2/Th3 приводит к вопросу о единственном пути, концепции единственной терапии. Am J Reprod Immunol (2003) 50:177–86. doi: 10.1034/j.1600-0897.2003.00080.x
doi: 10.1034/j.1600-0897.2003.00080.x
PubMed Abstract | Полный текст перекрестной ссылки | Академия Google
241. Джадиди-Ниараг Ф., Юсефи М., Мемариан А., Ходжат-Фарсанги М., Хошнуди Дж., Разави С.М. и др. Повышенная частота регуляторных Т-клеток CD8+ и CD4+ при хроническом лимфоцитарном лейкозе: связь с прогрессированием заболевания. Cancer Invest (2013) 31:121–31. doi: 10.3109/07357907.2012.756110
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
242. Сакагути С., Сакагути Н., Асано М., Ито М., Тода М. Иммунологическая самопереносимость, поддерживаемая активированными Т-клетками, экспрессирующими альфа-цепи рецептора ИЛ-2 (CD25). Нарушение единого механизма самопереносимости вызывает различные аутоиммунные заболевания. J Immunol (1995) 155:1151–64.
Реферат PubMed | Google Scholar
243. Alijotas-Reig J, Llurba E, Gris JM. Потенцирование материнской иммунной толерантности во время беременности: новая сложная роль регуляторных Т-клеток. Плацента (2014) 35:241–8. doi: 10.1016/j.placenta.2014.02.004
Плацента (2014) 35:241–8. doi: 10.1016/j.placenta.2014.02.004
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
244. Кларк Д.А., Чауат Г. Регуляторные Т-клетки и размножение: как они это делают? J Reprod Immunol (2012) 96:1–7. doi: 10.1016/j.jri.2012.07.007
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
245. Tilburgs T, Scherjon SA, van der Mast BJ, Haasnoot GW, Versteeg —D, Voort-Maarschalk M, et al. Несоответствие HLA-C плода и матери связано с активацией децидуальных Т-клеток и индукцией функциональных Т-регуляторных клеток. J Reprod Immunol (2009) 82:148–57. doi: 10.1016/j.jri.2009.05.003
PubMed Abstract | Полный текст перекрестной ссылки | Академия Google
246. Zenclussen AC, Gerlof K, Zenclussen ML, Sollwedel A, Bertoja AZ, Ritter T, et al. Аномальная реактивность Т-клеток против отцовских антигенов при самопроизвольном аборте: адоптивный перенос индуцированных беременностью CD4+CD25+ Т-регуляторных клеток предотвращает отторжение плода в модели аборта у мышей. Am J Pathol (2005) 166:811–22. doi: 10.1016/S0002-9440(10)62302-4
Am J Pathol (2005) 166:811–22. doi: 10.1016/S0002-9440(10)62302-4
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
247. Zhao JX, Zeng YY, Liu Y. Фетальный аллоантиген отвечает за расширение пула регуляторных Т-клеток CD4(+)CD25(+) во время беременности. J Reprod Immunol (2007) 75:71–81. doi: 10.1016/j.jri.2007.06.052
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
248. Tilburgs T, Roelen DL, Van Der Mast BJ, De Groot-Swings GM, Kleijburg C, Scherjon SA, et al. Доказательства избирательной миграции специфических для плода CD4+CD25bright регуляторных Т-клеток из периферической крови в децидуальную оболочку при беременности человека. J Immunol (2008) 180:5737–45. doi: 10.4049/jimmunol.180.8.5737
PubMed Abstract | Полный текст перекрестной ссылки | Академия Google
249. Sasaki Y, Sakai M, Miyazaki S, Higuma S, Shiozaki A, Saito S. CD4+CD25+ регуляторные Т-клетки децидуальной и периферической крови у субъектов на ранних сроках беременности и случаи самопроизвольного аборта. Mol Hum Reprod (2004) 10:347–53. doi: 10.1093/molehr/gah044
Mol Hum Reprod (2004) 10:347–53. doi: 10.1093/molehr/gah044
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
250. Хейккинен Дж., Моттонен М., Аланен А., Лассила О. Фенотипическая характеристика регуляторных Т-клеток в децидуальной оболочке человека. Клин Эксперт Иммунол (2004) 136:373–8. doi: 10.1111/j.1365-2249.2004.02441.x
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
251. Tilburgs T, Roelen DL, van der Mast BJ, van Schip JJ, Kleijburg C, de Groot-Swings GM, et al. Дифференциальное распределение CD4(+)CD25(bright) и CD8(+)CD28(-) Т-клеток в децидуальной оболочке и материнской крови при беременности человека. Placenta (2006) 27 (Приложение A): S47–53. doi: 10.1016/j.placenta.2005.11.008
PubMed Abstract | Полный текст перекрестной ссылки | Академия Google
252. Steinborn A, Haensch GM, Mahnke K, Schmitt E, Toermer A, Meuer S, et al. Различные подмножества регуляторных Т-клеток во время беременности: участвует ли дисбаланс этих подмножеств в патогенезе преэклампсии? Clin Immunol (2008) 129:401–12. doi: 10.1016/j.clim.2008.07.032
doi: 10.1016/j.clim.2008.07.032
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
253. Rolle L, Memarzadeh Tehran M, Morell-Garcia A, Raeva Y, Schumacher A, Hartig R, et al. Передний край: ИЛ-10-продуцирующие регуляторные В-клетки на ранних сроках беременности у человека. Am J Reprod Immunol (2013) 70:448–53. doi: 10.1111/aji.12157
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
254. Polanczyk MJ, Carson BD, Subramanian S, Afentoulis M, Vandenbark AA, Ziegler SF, et al. Передовой опыт: эстроген стимулирует расширение регуляторного Т-клеточного компартмента CD4+CD25+. J Immunol (2004) 173:2227–30. doi: 10.4049/jimmunol.173.4.2227
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
255. Jin LP, Chen QY, Zhang T, Guo PF, Li DJ. Яркие регуляторные Т-клетки CD4+CD25 и экспрессия CTLA-4 в периферических и децидуальных лимфоцитах подавляются при невынашивании беременности у человека. Clin Immunol (2009) 133:402–10. doi: 10.1016/j.clim.2009.08.009
Clin Immunol (2009) 133:402–10. doi: 10.1016/j.clim.2009.08.009
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
256. О’Гарра А., Виейра П. Регуляторные Т-клетки и механизмы контроля иммунной системы. Nat Med (2004) 10:801–5. doi: 10.1038/nm0804-801
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
257. Сакагути С., Сакагути Н., Симидзу Дж., Ямадзаки С., Сакихама Т., Ито М. и др. Иммунологическая толерантность, поддерживаемая CD25+ CD4+ регуляторными Т-клетками: их общая роль в контроле аутоиммунитета, противоопухолевого иммунитета и толерантности к трансплантации. Immunol Rev (2001) 182:18–32. doi: 10.1034/j.1600-065X.2001.1820102.x
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
258. Santner-Nanan B, Peek MJ, Khanam R, Richarts L, Zhu E, Fazekas de St Groth B, et al. Системное увеличение соотношения между Foxp3+ и IL-17-продуцирующими CD4+ T-клетками при здоровой беременности, но не при преэклампсии. J Immunol (2009) 183:7023–30. doi: 10.4049/jimmunol.0
J Immunol (2009) 183:7023–30. doi: 10.4049/jimmunol.0
PubMed Abstract | Полный текст перекрестной ссылки | Академия Google
259. Sanz I. Обоснование нацеливания на В-клетки при СКВ. Semin Immunopathol (2014) 36:365–75. doi: 10.1007/s00281-014-0430-z
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
260. Blair PA, Noreña LY, Flores-Borja F, Rawlings DJ, Isenberg DA, Ehrenstein MR, et al. CD19(+)CD24(hi)CD38(hi) B-клетки проявляют регуляторную способность у здоровых людей, но функционально нарушены у пациентов с системной красной волчанкой. Иммунитет (2010) 32:129–40. doi: 10.1016/j.immuni.2009.11.009
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
261. Iwata Y, Matsushita T, Horikawa M, Dillo DJ, Yanaba K, Venturi GM, et al. Характеристика редкой IL-10-компетентной субпопуляции B-клеток у людей, которая аналогична регуляторным клеткам B10 мыши. Кровь (2011) 117:530–41. doi: 10.1182/blood-2010-07-2
doi: 10.1182/blood-2010-07-2
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
262. Rosser EC, Mauri C. Регуляторные В-клетки: происхождение, фенотип и функция. Иммунитет (2015) 42:607–12. doi: 10.1016/j.immuni.2015.04.005
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
263. Bundhun PK, Soogund MZ, Huang F. Влияние системной красной волчанки на исходы матери и плода после беременности: метаанализ исследований, опубликованных в период с 2001 по 2016 годы. J Autoimmun (2017) 79:17–27. doi: 10.1016/j.jaut.2017.02.009
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
264. Hong S, Banchereau R, Maslow BL, Guerra MM, Cardenas J, Baisch J, et al. Продольное профилирование транскриптома крови человека при здоровой и волчаночной беременности. J Exp Med (2019) 216:1154–69. doi: 10.1084/jem.201
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
265. Qiu K, He Q, Chen X, Liu H, Deng S, Lu W. Иммунные изменения, связанные с беременностью, и демиелинизирующие заболевания центральной нервной системы. Фронт Нейрол (2019) 10:1070. doi: 10.3389/fneur.2019.01070
Qiu K, He Q, Chen X, Liu H, Deng S, Lu W. Иммунные изменения, связанные с беременностью, и демиелинизирующие заболевания центральной нервной системы. Фронт Нейрол (2019) 10:1070. doi: 10.3389/fneur.2019.01070
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
266. Jethwa H, Lam S, Smith C, Giles I. Ревматоидный артрит действительно улучшается во время беременности? Систематический обзор и метаанализ. J Rheumatol (2019) 46:245–50. doi: 10.3899/jrheum.180226
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
267. Hughes SE, Spelman T, Gray OM, Boz C, Trojano M, Lugaresi A, et al. Предикторы и динамика послеродовых рецидивов у женщин с рассеянным склерозом. Мульт Склер (2014) 20:739–46. doi: 10.1177/1352458513507816
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
268. Центры по контролю и профилактике заболеваний. Система наблюдения за смертностью беременных . Доступно по адресу: https://www.cdc.gov/reproductivehealth/maternal-mortality/pregnancy-mortality-surveillance-system.htm (по состоянию на 12 мая 2020 г.).
Доступно по адресу: https://www.cdc.gov/reproductivehealth/maternal-mortality/pregnancy-mortality-surveillance-system.htm (по состоянию на 12 мая 2020 г.).
Google Scholar
269. Christophersen A, Lund EG, Snir O, Sola E, Kanduri C, Dahal-Koirala S, et al. Отчетливый фенотип CD4(+) Т-клеток, вызывающих целиакию, идентифицированный при множественных аутоиммунных состояниях. Nat Med (2019) 25:734–7. doi: 10.1038/s41591-019-0403-9
Реферат PubMed | Полный текст перекрестной ссылки | Google Scholar
270. Apps R, Kotliarov Y, Cheung F, Han KL, Chen J, Biancotto A, et al. Мультимодальное иммунное фенотипирование периферической крови матери при нормальной беременности человека. JCI Insight (2020) 5. doi: 10.1172/jci.insight.134838
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
271. Sbihi H, Jones MJ, MacIsaac JL, Brauer M, Allen RW, Sears MR, et al. Пренатальное воздействие загрязнения воздуха, связанного с дорожным движением, гестационные эпигенетические часы и риск аллергической сенсибилизации в раннем возрасте. J Allergy Clin Immunol (2019) 144:1729–31.e5. doi: 10.1016/j.jaci.2019.07.047
J Allergy Clin Immunol (2019) 144:1729–31.e5. doi: 10.1016/j.jaci.2019.07.047
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Низкие лимфоциты во время беременности — стоит ли беспокоиться?
Цель FirstCry Parenting — предоставить вам самую актуальную, точную и актуальную информацию.
Каждая статья, которую мы публикуем, соответствует строгим правилам и включает в себя несколько уровней рецензирования, как нашей редакционной группы, так и экспертов. Мы приветствуем ваши предложения по тому, как сделать эту платформу более полезной для всех наших пользователей. Пишите нам по адресу [email protected]
- Что такое лимфоциты?
- Каков нормальный диапазон лимфоцитов в крови?
- Каковы возможные причины снижения уровня лимфоцитов во время беременности?
- Существуют ли какие-либо осложнения, вызванные снижением лимфоцитов у беременных?
- Можно ли предотвратить последствия?
- Советы по повышению иммунитета во время беременности
Последнее обновление
Когда вы хотите забеременеть или узнаете, что забеременели, обязательно сдайте анализы и пройдите обследование, чтобы выяснить состояние вашего здоровья. Одним из таких тестов является анализ лимфоцитов. Не существует «нормального» диапазона лимфоцитов, который должен быть у женщины во время беременности, потому что, как правило, количество лимфоцитов у нормального взрослого человека отличается от количества лимфоцитов у беременной женщины. Далее она меняется по мере развития беременности. Таким образом, беременной женщине важно узнать и понять уровни лимфоцитов, какой диапазон считается низким и как при необходимости предпринять корректирующие действия.
Что такое лимфоциты?
Лимфоциты — это тип лейкоцитов (лейкоцитов), которые являются частью иммунной системы нашего организма. Эти клетки работают в тандеме с другими лейкоцитами, чтобы защитить организм от определенных атак. Антитела, вырабатываемые лимфоцитами, помогают организму бороться с различными типами вирусов, а также с клетками, которые могут оказаться опухолевыми.
Лимфоциты образуются в костном мозге организма. У ребенка в утробе матери они вырабатываются в виде недифференцированных клеток печени ниже сердца матери. Обширное развитие иммунной системы и распознавание признаков внешних атак зависят в первую очередь от лимфоцитов. Внутри них лимфоциты В-типа помогают распознать, какие клетки являются вредными и нуждаются в антителах. Лимфоциты Т-типа контролируют иммунный ответ организма, запуская его, когда это необходимо, и снижая его, когда это не требуется.
Какой нормальный уровень лимфоцитов в крови?
Диапазон лимфоцитов является важным средством определения того, работает ли ваш организм должным образом или подвергается ли он атаке вредоносных микробов. Нормальный диапазон варьируется в зависимости от наличия и отсутствия беременности, а также различных ее стадий.
- Нормальный диапазон лимфоцитов у взрослых составляет от 0,7 до 4,6 x 10 9 на литр.
- В первом триместре беременности нижний конец выталкивается вверх на уровне 1,1 – 3,6 x 10 9 .
 0007 9 за литр.
0007 9 за литр. - Во втором триместре беременности нормальный диапазон составляет 0,9 – 3,9 x 10 9 на литр.
- В третьем и последнем триместре сохраняется аналогичный диапазон от 1,0 до 3,6 x 10 9 на литр.
Каковы возможные причины снижения уровня лимфоцитов во время беременности?
Снижение уровня лимфоцитов у беременной женщины является естественным следствием зачатия и совершенно нормальным процессом в организме. Когда происходит зачатие, и эмбрион ожидает имплантации в матку, организм настраивается внутри себя, чтобы это произошло без каких-либо препятствий. Для человеческого организма вновь созданный внутри себя эмбрион является чужеродным существом, поэтому для иммунной системы естественно воспринимать его как нечто вредоносное и отвергать. Поэтому организм в конечном итоге подавляет реакцию иммунной системы, сокращая количество лимфоцитов. Это позволяет эмбриону успешно имплантироваться и превратиться в плод.
Тем не менее, даже когда количество лимфоцитов снижается на этом этапе, организм по-прежнему надежно защищает мать. Активируются другие сущности, такие как нейтрофилы, которые временно берут на себя обязанности по защите организма от внешних атак.
Уровни лимфоцитов в организме, как правило, остаются в диапазоне, как описано ранее. Однако, если уровни выходят за пределы нормы на данном конкретном этапе беременности, это может быть вызвано потенциально опасными факторами, такими как:
- Резус-конфликт, который при возникновении между ребенком и матерью может привести к нарушению соотношения лимфоцитов.
- Несовместимость тканей ребенка и матери или сочетанные аллергические реакции по разным причинам.
- Наличие инфекции, которая может быть такой же опасной, как ВИЧ.
- Хроническое состояние, связанное с такими проблемами, как гастрит или воспаление мочевого пузыря.
- Дефицит различных минералов и витаминов, оставляющий организм на низком уровне питания.

- Склонность к ожирению, а также постоянное употребление наркотиков или алкоголя.
Существуют ли какие-либо осложнения, вызванные снижением лимфоцитов у беременных?
Организм человека способен балансировать, приспосабливаться к внешним или внутренним изменениям, чтобы процессы могли нормально функционировать. В то время как подавление лимфоцитов сопровождается образованием нейтрофилов и других объектов для защиты организма, предлагаемая ими защита не всегда успешна. Ниже приведены последствия снижения лимфоцитов у беременной женщины:
- Само снижение лимфоцитов в организме может ослабить организм матери, который уже борется с рядом внутренних изменений.
- Эта слабость может сделать тело очень чувствительным и уязвимым к внешним изменениям, таким как колебания температуры, атмосферные изменения, загрязнение воздуха и так далее.
- Кроме того, поскольку (иммунитет) охрана не работает, любое присутствие простейших микробов, с которыми могла бы легко бороться полноценная иммунная система, может проникнуть в организм и привести к болезни или инфекции.

Можете ли вы предотвратить последствия?
Снижение лимфоцитов при беременности изменить нельзя, так как это естественный процесс, который крайне необходим малышу, чтобы найти себе место в утробе матери. Однако перед попыткой забеременеть настоятельно рекомендуется обоим партнерам пройти полное обследование на предмет наличия каких-либо заболеваний, требующих немедленного лечения, так как такое наличие может создать дополнительную нагрузку на плод и ослабленный организм, который должен бороться с этими инфекциями, а также обеспечивать безопасность тела.
Коррекция диеты, лекарства или пищевые добавки могут быть рекомендованы для поддержания здоровья матери, поскольку ребенок будет использовать все имеющиеся у нее запасы энергии. Определенные изменения в образе жизни, такие как отказ от посещения мест с высокой вероятностью заражения, могут обеспечить вашу безопасность в любое время. Проконсультируйтесь с врачом, прежде чем принимать добавки или лекарства или менять диету.
Советы по укреплению иммунитета во время беременности
Чтобы повысить иммунитет во время беременности, следуйте нескольким советам:
- Сбалансированная диета, состоящая из злаков, овощей, фруктов и нежирного мяса, может обеспечить здоровье и безопасность как матери, так и ребенка.
- Наряду с этим могут быть рекомендованы дополнительные препараты для поддержки иммунной системы, такие как Алфавит, Прегнавит, Элевит и другие. Тем не менее, рекомендуется проконсультироваться с врачом, прежде чем принимать какие-либо из них.
Важно не беспокоиться о низком уровне лимфоцитов при наступлении беременности, так как это естественный процесс. Тем не менее, проверка на то же самое должно быть сделано. Беременность принесет много изменений в ваше тело, но ничего, с чем вы не могли бы справиться. Хотя потребность организма в снижении своего иммунитета, чтобы помочь вашему ребенку найти дом в вашей утробе, неизбежна, вы можете столкнуться с этим изменением, не подвергая свое тело внешнему вреду. Надлежащие меры, такие как здоровое питание и изменение некоторых привычек образа жизни, могут помочь вам и вашему ребенку в безопасности.
Надлежащие меры, такие как здоровое питание и изменение некоторых привычек образа жизни, могут помочь вам и вашему ребенку в безопасности.
Читайте также: Общий анализ крови во время беременности
Реклама
Популярные посты
Реклама
Последние
Материнская иммунная система во время беременности и его влияние на плод
Lara S Morelli, 1 Mili Maldal, 2 Lara S Morelli, 1 мили. Банафшех Н. Кашани, 1 Николас М. Понцио 3,4
1 Кафедра акушерства, гинекологии и женского здоровья, Медицинская школа Нью-Джерси, Университет Рутгерса, Ньюарк, 2 Кафедра фармакологии и токсикологии, Фармацевтическая школа им. Эрнеста Марио, Университет Ратгерса, Пискатауэй, 3 Кафедра патологии и лабораторной медицины, Медицинская школа Нью-Джерси, Университет Рутгерса, Ньюарк, 4 Высшая школа биомедицинских наук, Университет Рутгерса, Ньюарк, Нью-Джерси, США
Резюме: Иммунная система матери играет решающую роль в установлении, поддержании и завершении здоровой беременности. Однако конкретные механизмы, используемые для достижения этих целей, недостаточно изучены. Различные клетки и молекулы иммунной системы играют ключевую роль в развитии и функционировании плаценты и плода. Эффекторные клетки иммунной системы стимулируют и в то же время ограничивают развитие плаценты. Иммунный сдвиг Т-хелпер 1 (Th2)/Т-хелпер 2 (Th3) во время беременности хорошо известен. Требуется тонкий баланс между провоспалительным и противовоспалительным влияниями. В данном обзоре мы рассматриваем данные о материнской толерантности к фетальным тканям и лежащих в их основе клеточно-опосредованных иммунных и гуморальных (гормоны и цитокины) механизмах. Мы также отмечаем множество оставшихся без ответа вопросов в нашем понимании этих механизмов. Кроме того, мы суммируем клинические проявления измененной иммунной системы матери во время беременности, связанные с восприимчивостью к распространенным вирусным, бактериальным и паразитарным инфекциям, а также к аутоиммунным заболеваниям.
Однако конкретные механизмы, используемые для достижения этих целей, недостаточно изучены. Различные клетки и молекулы иммунной системы играют ключевую роль в развитии и функционировании плаценты и плода. Эффекторные клетки иммунной системы стимулируют и в то же время ограничивают развитие плаценты. Иммунный сдвиг Т-хелпер 1 (Th2)/Т-хелпер 2 (Th3) во время беременности хорошо известен. Требуется тонкий баланс между провоспалительным и противовоспалительным влияниями. В данном обзоре мы рассматриваем данные о материнской толерантности к фетальным тканям и лежащих в их основе клеточно-опосредованных иммунных и гуморальных (гормоны и цитокины) механизмах. Мы также отмечаем множество оставшихся без ответа вопросов в нашем понимании этих механизмов. Кроме того, мы суммируем клинические проявления измененной иммунной системы матери во время беременности, связанные с восприимчивостью к распространенным вирусным, бактериальным и паразитарным инфекциям, а также к аутоиммунным заболеваниям.
Ключевые слова: интерфейс мать-плод, иммунная система, толерантность плода, субпопуляции лимфоцитов, децидуальная оболочка, беременность
Введение
Взаимоотношения между матерью и плодом десятилетиями интересовали иммунологов. Выживание полуаллогенного плода использовалось Billingham et al. 1 в 1953 г. в качестве примера иммунной толерантности к плоду со стороны материнской иммунной системы. Многочисленные гипотезы, связанные с плацентарной защитой плода, включая экспрессию (или отсутствие экспрессии) антигенов гистосовместимости в тканях плода, иммунную толерантность матери к антигенам плода и ингибирование и/или регуляцию материнского антифетального иммунного ответа, были выдвинуты для объяснения выживаемость «иммуногенного» плода. Тем не менее, механизмы еще предстоит полностью прояснить.
Выживание полуаллогенного плода использовалось Billingham et al. 1 в 1953 г. в качестве примера иммунной толерантности к плоду со стороны материнской иммунной системы. Многочисленные гипотезы, связанные с плацентарной защитой плода, включая экспрессию (или отсутствие экспрессии) антигенов гистосовместимости в тканях плода, иммунную толерантность матери к антигенам плода и ингибирование и/или регуляцию материнского антифетального иммунного ответа, были выдвинуты для объяснения выживаемость «иммуногенного» плода. Тем не менее, механизмы еще предстоит полностью прояснить.
Частично трудности в изучении этих механизмов связаны с различиями между видами, у которых проводятся такие исследования. Мыши используются для многих из этих исследований из-за их короткого гестационного периода, относительно низкой стоимости, четко определенной генетики (включая мутантные, трансгенные и нокаутные штаммы) и доступности широкого спектра антител и реагентов для проведения иммунологических и молекулярных исследований. . Однако различия в репродуктивной системе в целом и плодно-материнско-плацентарной единице в частности, а также различия в развитии и функционировании иммунных элементов часто препятствуют прямому переносу результатов, наблюдаемых у мышей, на человека. Напротив, исследования, направленные на изучение таких вопросов на людях, неэтичны, а исследования, включающие в эти исследования нечеловеческих приматов, поднимают аналогичные моральные проблемы и также являются непомерно дорогими.
. Однако различия в репродуктивной системе в целом и плодно-материнско-плацентарной единице в частности, а также различия в развитии и функционировании иммунных элементов часто препятствуют прямому переносу результатов, наблюдаемых у мышей, на человека. Напротив, исследования, направленные на изучение таких вопросов на людях, неэтичны, а исследования, включающие в эти исследования нечеловеческих приматов, поднимают аналогичные моральные проблемы и также являются непомерно дорогими.
Таким образом, наш обзор не предназначен для рассмотрения всех оставшихся без ответа вопросов, связанных со значением иммунной системы матери во время беременности и ее влиянием на развитие плода. Скорее, наши цели состоят в том, чтобы выявить пробелы в знаниях и понимании темы из опубликованной литературы о различных видах и признать контексты, в которых различия исключают прямое сравнение с людьми. Однако, несмотря на эти различия, исследования, проведенные на других видах, таких как грызуны, действительно служат для определения возможных стратегий решения некоторых из этих оставшихся без ответа вопросов.
Кроме того, мы используем междисциплинарный подход как соавторы, которые привносят клинические и фундаментальные научные взгляды и опыт в репродуктивных и иммунологических дисциплинах. Таким образом, мы обращаемся к темам, связанным с определением взаимодействия мать-плод, а также значением иммунных реакций матери в регуляции ключевых ранних событий как во время беременности (например, имплантации, ангиогенеза и ремоделирования сосудов), так и в развитии иммунной системы плода. система. Затем мы рассмотрим современные представления о материнской переносимости тканей плода и основных клеточных и гуморальных иммунных механизмах. Наконец, мы рассматриваем клинические проявления измененной иммунной системы матери во время беременности, связанные с восприимчивостью к некоторым вирусным, бактериальным и паразитарным инфекциям, а также к аутоиммунным заболеваниям.
Описание и определение интерфейса мать-плод
Материнство: децидуальная оболочка
У женщин обширная инвазия трофобласта, охватывающая эндометрий, а также внутреннюю треть миометрия. 2 Чтобы приспособиться к этому, должен произойти выраженный процесс ремоделирования, вовлекающий несколько клеточных компартментов матки в подготовку к имплантации, установлению и поддержанию беременности. Этот процесс, децидуализация, происходит у человека циклически, начиная со средней лютеиновой фазы менструального цикла, независимо от беременности. Напротив, у грызунов и большинства других видов децидуализация требует присутствия бластоцисты. Таким образом, термин «материнская децидуальная оболочка» относится к слою слизистой оболочки матки (эндометрию) после того, как он подвергся децидуализации, необходимому и сложному процессу дифференцировки, включающему множество клеточных компартментов эндометрия при подготовке к имплантации эмбриона.
2 Чтобы приспособиться к этому, должен произойти выраженный процесс ремоделирования, вовлекающий несколько клеточных компартментов матки в подготовку к имплантации, установлению и поддержанию беременности. Этот процесс, децидуализация, происходит у человека циклически, начиная со средней лютеиновой фазы менструального цикла, независимо от беременности. Напротив, у грызунов и большинства других видов децидуализация требует присутствия бластоцисты. Таким образом, термин «материнская децидуальная оболочка» относится к слою слизистой оболочки матки (эндометрию) после того, как он подвергся децидуализации, необходимому и сложному процессу дифференцировки, включающему множество клеточных компартментов эндометрия при подготовке к имплантации эмбриона.
Паренхиматозные клеточные компартменты материнской децидуальной оболочки включают железистый эпителиальный компартмент, люминальный эпителиальный компартмент, эндотелий спиральных артерий и децидуализированные стромальные клетки, все из которых претерпевают значительные изменения при подготовке к беременности. Железистый эпителий приобретает повышенную секреторную активность под влиянием материнского прогестерона. 3 Значительное ремоделирование спиральных артерий происходит во время децидуализации, что более подробно обсуждается далее в этом обзоре. Стромальные фибробласты эндометрия, которые подвергаются значительной морфологической и биохимической дифференциации при подготовке к имплантации и поддержке беременности, становятся известными как децидуальные клетки или децидуализированные стромальные клетки. Децидуализированные стромальные клетки больше не имеют характерной формы веретена эндометриального стромального фибробласта и вместо этого приобретают эпителиоидный фенотип, характеризующийся прогрессирующим увеличением клеток, округлением ядра и расширением шероховатого эндоплазматического ретикулума и комплекса Гольджи, что соответствует превращение в секреторную клетку. 3 Основные секреторные продукты децидуализированных стромальных клеток включают пролактин и белок-1, связывающий инсулиноподобный фактор роста, характерные белки, широко используемые в качестве фенотипических маркеров децидуализации.
Железистый эпителий приобретает повышенную секреторную активность под влиянием материнского прогестерона. 3 Значительное ремоделирование спиральных артерий происходит во время децидуализации, что более подробно обсуждается далее в этом обзоре. Стромальные фибробласты эндометрия, которые подвергаются значительной морфологической и биохимической дифференциации при подготовке к имплантации и поддержке беременности, становятся известными как децидуальные клетки или децидуализированные стромальные клетки. Децидуализированные стромальные клетки больше не имеют характерной формы веретена эндометриального стромального фибробласта и вместо этого приобретают эпителиоидный фенотип, характеризующийся прогрессирующим увеличением клеток, округлением ядра и расширением шероховатого эндоплазматического ретикулума и комплекса Гольджи, что соответствует превращение в секреторную клетку. 3 Основные секреторные продукты децидуализированных стромальных клеток включают пролактин и белок-1, связывающий инсулиноподобный фактор роста, характерные белки, широко используемые в качестве фенотипических маркеров децидуализации. 4 Эти клетки также секретируют ряд цитокинов и факторов роста (например, интерлейкин [IL]-11, эпидермальный фактор роста [EGF], гепарин-связывающий EGF-подобный фактор роста), которые дополнительно регулируют процесс децидуализации в аутокринный и/или паракринный характер. 5
4 Эти клетки также секретируют ряд цитокинов и факторов роста (например, интерлейкин [IL]-11, эпидермальный фактор роста [EGF], гепарин-связывающий EGF-подобный фактор роста), которые дополнительно регулируют процесс децидуализации в аутокринный и/или паракринный характер. 5
В дополнение к паренхиматозным клеточным компартментам, составляющим децидуальную оболочку матери, различные популяции иммунных клеток существуют в эндометрии человека на протяжении всего менструального цикла. На ранних сроках беременности лейкоциты многочисленны и составляют 30-40% всех клеток децидуальной стромы человека. 6 Базальный слой эндометрия человека содержит лимфоидные агрегаты, состоящие из Т-клеток и небольшого количества В-клеток. В функциональном слое пролиферативной фазы небольшое количество маточных естественных киллеров (uNK), Т-клеток и макрофагов рассеяно по всему стромальному компартменту. 7 Хотя количество Т-клеток и макрофагов остается практически неизменным на протяжении лютеиновой фазы и в процессе децидуализации, 7 наблюдается резкое увеличение количества uNK-клеток после овуляции, играющих критическую роль в подготовке эндометрия при беременности. Что касается популяций децидуальных иммунных клеток на ранних сроках беременности, исследования с использованием проточной цитометрии и иммуноокрашивания тканей человека показывают, что большинство децидуальных лейкоцитов человека в первом триместре представляют собой uNK-клетки (~ 70%), за которыми следуют макрофаги (~ 20%). 8 Т-клетки составляют примерно 10-20% децидуальных лейкоцитов, а дендритные клетки (ДК) и В-клетки встречаются редко. 8 Как и у людей, uNK-клетки являются преобладающей популяцией лейкоцитов в децидуальной оболочке макаки-резус и мыши, но исследования по определению относительного количества других популяций лейкоцитов в децидуальной оболочке мышей отсутствуют. Функции каждого типа иммунных клеток на границе между матерью и плодом более подробно обсуждаются в этом обзоре с особым акцентом на uNK-клетках.
Что касается популяций децидуальных иммунных клеток на ранних сроках беременности, исследования с использованием проточной цитометрии и иммуноокрашивания тканей человека показывают, что большинство децидуальных лейкоцитов человека в первом триместре представляют собой uNK-клетки (~ 70%), за которыми следуют макрофаги (~ 20%). 8 Т-клетки составляют примерно 10-20% децидуальных лейкоцитов, а дендритные клетки (ДК) и В-клетки встречаются редко. 8 Как и у людей, uNK-клетки являются преобладающей популяцией лейкоцитов в децидуальной оболочке макаки-резус и мыши, но исследования по определению относительного количества других популяций лейкоцитов в децидуальной оболочке мышей отсутствуют. Функции каждого типа иммунных клеток на границе между матерью и плодом более подробно обсуждаются в этом обзоре с особым акцентом на uNK-клетках.
Плод: плацента, плодные оболочки (амнион и хорион)
Структурно границу между слизистой оболочкой матки и экстраэмбриональными тканями обычно называют границей между матерью и плодом. Это представлено на рисунке 1, на котором изображены материнские иммунные клетки и трофобласт плода. 9
Это представлено на рисунке 1, на котором изображены материнские иммунные клетки и трофобласт плода. 9
Рис. 1 Схематическое изображение взаимодействия матери и плода у человека, включая материнские иммунные клетки, такие как маточные естественные киллеры (uNK), макрофаги (преобладающие типы иммунных клеток) и Т-хелперы (Th) клетки, Т-цитотоксические (Тс) клетки, дендритные клетки, а также инвазивные клетки трофобласта. |
Внезародышевые клетки, непосредственно контактирующие с материнскими клетками, представляют собой клетки трофобласта, происходящие из слоя трофэктодермы, окружающего бластоцисту. У женщин инвазия трофобласта в спиральные артерии матери существенно увеличивает маточный кровоток, приводит материнскую кровь в непосредственный контакт с клетками трофобласта плода и обеспечивает достаточную доставку материнских питательных веществ и кислорода к плаценте. 10 Однако кровообращение матери и плода не смешивается. После прикрепления бластоцисты к эпителию просвета эндометрия клетки трофобласта проникают в децидуальную оболочку, как показано на рисунке 1. Трофобласт, состоящий из внутреннего слоя клеток (цитотрофобласт) и внешнего слоя клеток (синцитиотрофобласт), не дает самого плода. , а скорее к плаценте и оболочкам плода (амнион и хорион). По мере проникновения бластоцисты и окружающего трофобласта в децидуальную оболочку один полюс бластоцисты остается ориентированным в сторону просвета эндометрия, а другой остается погруженным в децидуальную оболочку, которая развивается в закрепляющиеся цитотрофобласты и трофобласты ворсинок, способствуя формированию плаценты, хориона. , и амнион. Следует отметить видовые различия в степени инвазии клетками трофобласта, которые были подробно задокументированы в другом месте. 11 В отличие от процесса у женщин инвазия трофобласта у грызунов минимальна. 11,12
10 Однако кровообращение матери и плода не смешивается. После прикрепления бластоцисты к эпителию просвета эндометрия клетки трофобласта проникают в децидуальную оболочку, как показано на рисунке 1. Трофобласт, состоящий из внутреннего слоя клеток (цитотрофобласт) и внешнего слоя клеток (синцитиотрофобласт), не дает самого плода. , а скорее к плаценте и оболочкам плода (амнион и хорион). По мере проникновения бластоцисты и окружающего трофобласта в децидуальную оболочку один полюс бластоцисты остается ориентированным в сторону просвета эндометрия, а другой остается погруженным в децидуальную оболочку, которая развивается в закрепляющиеся цитотрофобласты и трофобласты ворсинок, способствуя формированию плаценты, хориона. , и амнион. Следует отметить видовые различия в степени инвазии клетками трофобласта, которые были подробно задокументированы в другом месте. 11 В отличие от процесса у женщин инвазия трофобласта у грызунов минимальна. 11,12
Значение иммунных реакций матери во время беременности
Подтипы иммунных клеток и их функциональное значение функции в имплантации, развитии плаценты и иммунитете против инфекционных заболеваний. Из всех популяций децидуальных лейкоцитов наиболее распространены фенотипически уникальные uNK-клетки. Количество этих клеток резко увеличивается в эндометрии человека через 3–5 дней после овуляции, составляя 25–40% лейкоцитов эндометрия до имплантации и примерно 70% децидуальных лейкоцитов в первом триместре. 7,8 Важно отметить, что uNK-клетки как фенотипически, так и функционально отличаются от периферических NK-клеток. Фенотипически они идентифицируются по экспрессии маркера NK-клеток CD56, экспрессируемого в высоких концентрациях (CD56 яркая ), но у них отсутствует экспрессия CD16, обнаруженная на большинстве периферических NK-клеток (CD56 dim CD16 + ). 7 С точки зрения функции, периферические CD56 dim CD16 + NK-клетки обладают высокой цитотоксичностью, опосредуя как естественную, так и антителозависимую гибель, тогда как uNK-клетки обладают лишь слабой цитотоксичностью и обычно не убивают клетки трофобласта.
Из всех популяций децидуальных лейкоцитов наиболее распространены фенотипически уникальные uNK-клетки. Количество этих клеток резко увеличивается в эндометрии человека через 3–5 дней после овуляции, составляя 25–40% лейкоцитов эндометрия до имплантации и примерно 70% децидуальных лейкоцитов в первом триместре. 7,8 Важно отметить, что uNK-клетки как фенотипически, так и функционально отличаются от периферических NK-клеток. Фенотипически они идентифицируются по экспрессии маркера NK-клеток CD56, экспрессируемого в высоких концентрациях (CD56 яркая ), но у них отсутствует экспрессия CD16, обнаруженная на большинстве периферических NK-клеток (CD56 dim CD16 + ). 7 С точки зрения функции, периферические CD56 dim CD16 + NK-клетки обладают высокой цитотоксичностью, опосредуя как естественную, так и антителозависимую гибель, тогда как uNK-клетки обладают лишь слабой цитотоксичностью и обычно не убивают клетки трофобласта. 13 Кроме того, uNK-клетки являются мощным источником иммунорегуляторных цитокинов, 14 матриксных металлопротеиназ (ММП), 15 и ангиогенных факторов. 16 Эти различные факторы опосредуют ремоделирование внеклеточного матрикса, инвазию трофобласта и ангиогенез, которые являются ключевыми процессами в плацентации и установлении ранней беременности на границе между матерью и плодом. 17
13 Кроме того, uNK-клетки являются мощным источником иммунорегуляторных цитокинов, 14 матриксных металлопротеиназ (ММП), 15 и ангиогенных факторов. 16 Эти различные факторы опосредуют ремоделирование внеклеточного матрикса, инвазию трофобласта и ангиогенез, которые являются ключевыми процессами в плацентации и установлении ранней беременности на границе между матерью и плодом. 17
Помимо uNK-клеток относительно многочисленны децидуальные макрофаги, составляющие ~20% популяции децидуальных лейкоцитов человека в первом триместре. 8 При нормальной беременности большинство макрофагов на границе между матерью и плодом имеют фенотип М2 (иммуномодулирующий). 18 Присутствуют в децидуальной оболочке до появления вневорсинчатого трофобласта. 19 Макрофаги играют роль в раннем ремоделировании спиральных артерий, продуцируя факторы, связанные с ремоделированием ткани (ММР-9) и ангиогенезом (фактор роста эндотелия сосудов [VEGF]). 18 Апоптоз является важным событием во время ремоделирования спиральных артерий и инвазии трофобласта, и децидуальные макрофаги фагоцитируют апоптотические клетки в ремоделированной сосудистой стенке и апоптозных клетках трофобласта, тем самым предотвращая высвобождение провоспалительных веществ из апоптотических клеток в децидуальную оболочку. 20 Децидуальные макрофаги первого триместра также могут быть ответственны за ингибирование опосредованного клетками uNK человека лизиса инвазивного цитотрофобласта, опосредованного децидуальной секрецией трансформирующего фактора роста бета-1 (TGF-²1), как показано в исследованиях на людях in vitro . 21 В отличие от человеческих uNK-клеток, количество которых достигает максимума на 20-й неделе беременности и почти отсутствует в децидуальной оболочке к концу беременности, 12 децидуальные макрофаги присутствуют на протяжении всей беременности, но точная роль децидуальных макрофагов в конце беременность остается неизвестной.
18 Апоптоз является важным событием во время ремоделирования спиральных артерий и инвазии трофобласта, и децидуальные макрофаги фагоцитируют апоптотические клетки в ремоделированной сосудистой стенке и апоптозных клетках трофобласта, тем самым предотвращая высвобождение провоспалительных веществ из апоптотических клеток в децидуальную оболочку. 20 Децидуальные макрофаги первого триместра также могут быть ответственны за ингибирование опосредованного клетками uNK человека лизиса инвазивного цитотрофобласта, опосредованного децидуальной секрецией трансформирующего фактора роста бета-1 (TGF-²1), как показано в исследованиях на людях in vitro . 21 В отличие от человеческих uNK-клеток, количество которых достигает максимума на 20-й неделе беременности и почти отсутствует в децидуальной оболочке к концу беременности, 12 децидуальные макрофаги присутствуют на протяжении всей беременности, но точная роль децидуальных макрофагов в конце беременность остается неизвестной. 18
18
Т-клетки также довольно многочисленны в децидуальной оболочке человека, составляя ~10–20% популяции децидуальных лейкоцитов человека, 22,23 из которых 30–45% составляют CD4 + Т-клетки и 45–75% составляют CD8 + Т-клетки. 23 Основной функцией Т-клеток в децидуальной оболочке, особенно CD4 + Т-регуляторных (Treg) клеток, как правило, считается повышение толерантности к плоду 24 (подробно обсуждается далее в этом документе). обзор). Однако, поскольку присутствует множество различных подмножеств Т-клеток, сложные взаимодействия Т-клеток в децидуальной оболочке не были полностью определены. 25 Исследования in vitro CD8 + Т-клеток, выделенных из децидуальной оболочки первого триместра беременности, демонстрируют, что эти клетки проявляют цитотоксическую активность, а также вырабатывают цитокины (преимущественно интерферон-гамма [IFN-γ] и IL-8). 26 Поскольку децидуальные супернатанты CD8 + Т-клеток повышают in vitro инвазивную способность вневорсинчатых клеток трофобласта, секретируемые продукты CD8 + Т-клеток могут играть роль в регуляции инвазии трофобласта, но точные медиаторы еще не установлены. были идентифицированы. 26
были идентифицированы. 26
ДК, представляющие собой антигенпрезентирующие клетки, играющие важную роль в регуляции адаптивного иммунного ответа, составляют очень небольшую часть децидуальных лейкоцитов человека. Однако не существует единого специфического маркера для ДК, поэтому их фенотипическое определение является спорным, что ограничивает существующие исследования децидуальных ДК. 27 Использование статуса отрицательных по линии и положительных по человеческому лейкоцитарному антигену DR (HLA-DR + ) в качестве комбинированного маркера для ДК, Gardner and Moffett 28 продемонстрировали, что децидуальные дендритные клетки составляют ~1% децидуальных лейкоцитов человека в первом триместре. Из-за редкости этой клеточной популяции функциональные исследования децидуальных ДК человека немногочисленны. Исследования на людях in vitro продемонстрировали, что децидуальные ДК, выделенные из децидуальной оболочки на ранних сроках беременности, с большей вероятностью, чем периферические ДК, примируют наивные CD4+ Т-клетки к фенотипу Th3, что указывает на потенциальную роль децидуальных ДК в предотвращении Th2-опосредованного отторжения плод. 29 Децидуальные ДК также регулируют функцию uNK-клеток, поскольку совместное культивирование децидуальных ДК с uNK-клетками стимулирует пролиферацию и активацию uNK-клеток. 30 Функциональные исследования децидуальных ДК in vivo проводятся только на мышах и являются более точными. У децидуальных DC-истощенных мышей наблюдается серьезное нарушение имплантации, нарушение децидуальной пролиферации и дифференцировки, нарушение ангиогенеза, нарушение дифференцировки uNK-клеток и резорбция эмбрионов. 31,32 Таким образом, по крайней мере у мышей децидуальные ДК играют важную роль в децидуализации, установлении и поддержании ранней беременности.
29 Децидуальные ДК также регулируют функцию uNK-клеток, поскольку совместное культивирование децидуальных ДК с uNK-клетками стимулирует пролиферацию и активацию uNK-клеток. 30 Функциональные исследования децидуальных ДК in vivo проводятся только на мышах и являются более точными. У децидуальных DC-истощенных мышей наблюдается серьезное нарушение имплантации, нарушение децидуальной пролиферации и дифференцировки, нарушение ангиогенеза, нарушение дифференцировки uNK-клеток и резорбция эмбрионов. 31,32 Таким образом, по крайней мере у мышей децидуальные ДК играют важную роль в децидуализации, установлении и поддержании ранней беременности.
Механизмы, с помощью которых иммунные клетки (фокус: uNK-клетки) регулируют ключевые ранние события установления беременности: имплантацию, ангиогенез и ремоделирование сосудов
uNK-клетки регулируют инвазию трофобласта
Исследования, проведенные Hanna et al. 33 , предоставили убедительные доказательства того, что uNK-клетки человека играют роль в регуляции инвазии трофобласта. Эти исследователи продемонстрировали, что uNK-клетки, выделенные из децидуальной оболочки человека в первом триместре беременности, экспрессируют хемокины IL-8 и IFN-индуцируемый белок (IP)-10, а очищенные инвазивные трофобласты человека экспрессируют хемокиновые рецепторы для этих лигандов: CXCR1 (рецептор IL-8). ) и CXCR3 (рецептор IP-10). Способность uNK-клеток, но не NK-клеток периферической крови, индуцировать миграцию трофобласта в анализе миграции трофобласта in vitro была значительно снижена в присутствии нейтрализующих антител к IL-8 и IP-10. Эти исследователи впоследствии провели исследования in vivo, в которых субпопуляции NK-клеток, встроенные в Matrigel, вводили в подкожные ткани голых мышей, а клетки трофобласта человека вводили вокруг матригеля. Эти эксперименты in vivo дополнительно продемонстрировали, что маточные, но не периферические, NK-клетки способствуют инвазии трофобласта, и что миграция клеток трофобласта в матригельную пробку была значительно снижена в присутствии IL-8- и IP-10-нейтрализующих антител.
Эти исследователи продемонстрировали, что uNK-клетки, выделенные из децидуальной оболочки человека в первом триместре беременности, экспрессируют хемокины IL-8 и IFN-индуцируемый белок (IP)-10, а очищенные инвазивные трофобласты человека экспрессируют хемокиновые рецепторы для этих лигандов: CXCR1 (рецептор IL-8). ) и CXCR3 (рецептор IP-10). Способность uNK-клеток, но не NK-клеток периферической крови, индуцировать миграцию трофобласта в анализе миграции трофобласта in vitro была значительно снижена в присутствии нейтрализующих антител к IL-8 и IP-10. Эти исследователи впоследствии провели исследования in vivo, в которых субпопуляции NK-клеток, встроенные в Matrigel, вводили в подкожные ткани голых мышей, а клетки трофобласта человека вводили вокруг матригеля. Эти эксперименты in vivo дополнительно продемонстрировали, что маточные, но не периферические, NK-клетки способствуют инвазии трофобласта, и что миграция клеток трофобласта в матригельную пробку была значительно снижена в присутствии IL-8- и IP-10-нейтрализующих антител. В целом, эти исследования продемонстрировали способность uNK-клеток положительно регулировать инвазию трофобласта, опосредованную производными uNK цитокинами IL-8 и IP-10. 33 Однако проникновение трофобласта в децидуальную оболочку матери должно строго регулироваться. Баланс факторов, участвующих в регуляции инвазии, еще точно не установлен. Чрезмерная инвазия предрасполагает к приращению плаценты, потенциально опасному для жизни акушерскому состоянию, при котором плацента аномально прикрепляется к миометрию матки. 34 Интересно, что человеческие uNK-клетки также обладают способностью ингибировать инвазию трофобласта, как показано Lash et al. 35 с использованием анализов инвазии матригеля in vitro. Эти исследователи продемонстрировали, что человеческие uNK-клетки, выделенные из децидуальной оболочки человека на ранних сроках беременности, являются источником IFN-γ, который ингибирует инвазию трофобласта за счет усиления апоптоза экстраворсинчатых клеток трофобласта и снижения секреции трофобластом MMP-2.
В целом, эти исследования продемонстрировали способность uNK-клеток положительно регулировать инвазию трофобласта, опосредованную производными uNK цитокинами IL-8 и IP-10. 33 Однако проникновение трофобласта в децидуальную оболочку матери должно строго регулироваться. Баланс факторов, участвующих в регуляции инвазии, еще точно не установлен. Чрезмерная инвазия предрасполагает к приращению плаценты, потенциально опасному для жизни акушерскому состоянию, при котором плацента аномально прикрепляется к миометрию матки. 34 Интересно, что человеческие uNK-клетки также обладают способностью ингибировать инвазию трофобласта, как показано Lash et al. 35 с использованием анализов инвазии матригеля in vitro. Эти исследователи продемонстрировали, что человеческие uNK-клетки, выделенные из децидуальной оболочки человека на ранних сроках беременности, являются источником IFN-γ, который ингибирует инвазию трофобласта за счет усиления апоптоза экстраворсинчатых клеток трофобласта и снижения секреции трофобластом MMP-2. 35 Таким образом, тонкий баланс, необходимый для предотвращения как недостаточной, так и чрезмерной инвазии трофобласта на ранних сроках беременности человека, регулируется, по крайней мере частично, различными цитокинами, полученными из человеческих uNK-клеток, присутствующих в децидуальной оболочке.
35 Таким образом, тонкий баланс, необходимый для предотвращения как недостаточной, так и чрезмерной инвазии трофобласта на ранних сроках беременности человека, регулируется, по крайней мере частично, различными цитокинами, полученными из человеческих uNK-клеток, присутствующих в децидуальной оболочке.
Роль uNK-клеток в ангиогенезе и ремоделировании сосудов на ранних сроках беременности
У людей должно происходить обширное ремоделирование сосудов, чтобы обеспечить плацентацию и зарождение ранней беременности, а также удовлетворить потребности растущего плода. Децидуальные спиральные артерии должны быть преобразованы в сосуды большего диаметра с низким сопротивлением и высокой скоростью потока, способные транспортировать питательные вещества и кислород к плоду. 22 Кроме того, эндотелий этих сосудов замещается вневорсинчатыми клетками трофобласта, мигрировавшими из плаценты, что позволяет отводить кровоток в пространство, окружающее плацентарное ворсинчатое дерево, и тем самым обеспечивает обмен питательными веществами и газами между матерью и плодом. 36 Мало того, что адекватное ремоделирование сосудов имеет решающее значение для установления нормальной беременности, аномалии в этих ранних событиях связаны с более поздними осложнениями беременности, такими как преэклампсия и задержка внутриутробного развития, которые могут иметь серьезное влияние на здоровье плода и новорожденного. . 34
36 Мало того, что адекватное ремоделирование сосудов имеет решающее значение для установления нормальной беременности, аномалии в этих ранних событиях связаны с более поздними осложнениями беременности, такими как преэклампсия и задержка внутриутробного развития, которые могут иметь серьезное влияние на здоровье плода и новорожденного. . 34
Критическая роль uNK-клеток в ремоделировании сосудов была продемонстрирована как в исследованиях in vivo на мышах, так и в исследованиях in vitro на людях. Однако важно отметить значительные различия между видами с точки зрения стратегий увеличения притока крови к месту материнско-плацентарного обмена. У людей происходит обширная инвазия и разрушение ранее существовавших артерий трофобластом. У нечеловеческих приматов, таких как макаки-резусы, происходит инвазия трофобласта и модификация маточных артерий, но, в отличие от человека, инвазия трофобластом децидуальной стромы у макаки-резус происходит лишь в минимальной степени. 12 У мышей степень проникновения трофобласта как в децидуальную строму, так и в маточные артерии еще более ограничена. 12 Таким образом, модели грызунов имеют ограниченное значение для углубления нашего понимания механизмов ремоделирования сосудов, способствующих беременности человека. Тем не менее, существуют исследования in vivo, проводимые на мышах, которые нельзя проводить на людях, и доступность приматов, отличных от человека, для таких исследований in vivo на ранних сроках беременности ограничена. Следовательно, большая часть существующих данных о функциях uNK-клеток при ремоделировании сосудов получена из исследований на мышах.
12 У мышей степень проникновения трофобласта как в децидуальную строму, так и в маточные артерии еще более ограничена. 12 Таким образом, модели грызунов имеют ограниченное значение для углубления нашего понимания механизмов ремоделирования сосудов, способствующих беременности человека. Тем не менее, существуют исследования in vivo, проводимые на мышах, которые нельзя проводить на людях, и доступность приматов, отличных от человека, для таких исследований in vivo на ранних сроках беременности ограничена. Следовательно, большая часть существующих данных о функциях uNK-клеток при ремоделировании сосудов получена из исследований на мышах.
Многочисленные исследования in vivo на мышах демонстрируют, что uNK-клетки играют решающую роль в ремоделировании спиральных артерий эндометрия как до, так и во время беременности. Самые ранние исследования, демонстрирующие критическую роль uNK-клеток в ремоделировании сосудов во время беременности, были проведены Guimond et al. , 37 , которые продемонстрировали несколько репродуктивных аномалий у линии мышей Tgµ26, у которых дефицит NK-клеток. Множественные сосудистые аномалии, связанные с местами имплантации, включая утолщение медии и адвентиции, повреждение эндотелия, уменьшение размера плаценты и начало потери плода на 10-й день беременности, были продемонстрированы у мышей с дефицитом NK-клеток. Последующие исследования в той же лаборатории 38 продемонстрировано, что трансплантация костного мозга от мышей с тяжелым комбинированным иммунодефицитом (у которых отсутствуют Т- и В-лимфоциты, но не NK-клетки) мышам с дефицитом NK-клеток приводила к восстановлению популяции uNK-клеток у реципиентов, уменьшению аномалий в децидуальной крови сосуды, увеличение размеров плаценты и восстановление жизнеспособности плода. В целом, эти исследования подтверждают критическую роль мышиных uNK-клеток в децидуализации, плацентации и соответствующей васкуляризации мест имплантации.
, 37 , которые продемонстрировали несколько репродуктивных аномалий у линии мышей Tgµ26, у которых дефицит NK-клеток. Множественные сосудистые аномалии, связанные с местами имплантации, включая утолщение медии и адвентиции, повреждение эндотелия, уменьшение размера плаценты и начало потери плода на 10-й день беременности, были продемонстрированы у мышей с дефицитом NK-клеток. Последующие исследования в той же лаборатории 38 продемонстрировано, что трансплантация костного мозга от мышей с тяжелым комбинированным иммунодефицитом (у которых отсутствуют Т- и В-лимфоциты, но не NK-клетки) мышам с дефицитом NK-клеток приводила к восстановлению популяции uNK-клеток у реципиентов, уменьшению аномалий в децидуальной крови сосуды, увеличение размеров плаценты и восстановление жизнеспособности плода. В целом, эти исследования подтверждают критическую роль мышиных uNK-клеток в децидуализации, плацентации и соответствующей васкуляризации мест имплантации.
Роль мышиных uNK-клеток в ремоделировании и децидуализации сосудов, по-видимому, опосредуется через IFN-γ, поскольку трансгенные мыши, у которых отсутствует IFN-γ или его рецептор, не могут инициировать модификацию децидуальных артерий и обнаруживают некроз децидуальных клеток, а также лечение NK-дефицитные мыши с рекомбинантным IFN-γ восстанавливают децидуальную морфологию и инициируют модификацию децидуальных сосудов. 39,40 Однако еще предстоит окончательно определить, регулируют ли человеческие uNK-клетки ремоделирование децидуальных сосудов с помощью IFN-γ. Данные об экспрессии IFN-γ uNK-клетками человека противоречивы, вероятно, из-за различий в методологии между исследованиями и статуса цитокиновой стимуляции изучаемых uNK-клеток. Доказательства продукции IFN-γ в нестимулированных человеческих uNK-клетках ограничены, но после воздействия стимулирующих цитокинов, таких как IL-2, IL-12 или IL-15, человеческие uNK-клетки, выделенные из децидуальной оболочки первого триместра, демонстрируют значительно повышенный уровень IFN-γ. секреция γ. 41,42 Кроме того, поскольку IFN-γ быстро секретируется после образования, а экспрессия мРНК и белка IFN-γ человеческими uNK-клетками быстро снижается через 24–48 часов в культуре, 35 противоречивые данные относительно IFN-γ Экспрессия uNK-клетками человека может быть связана с продолжительностью времени в культуре перед измерением.
39,40 Однако еще предстоит окончательно определить, регулируют ли человеческие uNK-клетки ремоделирование децидуальных сосудов с помощью IFN-γ. Данные об экспрессии IFN-γ uNK-клетками человека противоречивы, вероятно, из-за различий в методологии между исследованиями и статуса цитокиновой стимуляции изучаемых uNK-клеток. Доказательства продукции IFN-γ в нестимулированных человеческих uNK-клетках ограничены, но после воздействия стимулирующих цитокинов, таких как IL-2, IL-12 или IL-15, человеческие uNK-клетки, выделенные из децидуальной оболочки первого триместра, демонстрируют значительно повышенный уровень IFN-γ. секреция γ. 41,42 Кроме того, поскольку IFN-γ быстро секретируется после образования, а экспрессия мРНК и белка IFN-γ человеческими uNK-клетками быстро снижается через 24–48 часов в культуре, 35 противоречивые данные относительно IFN-γ Экспрессия uNK-клетками человека может быть связана с продолжительностью времени в культуре перед измерением. В модели ранней беременности у нечеловекообразных приматов основная популяция CD56 ярких uNK-клеток, выделенных из децидуальной оболочки макаки-резус на ранней стадии беременности, не является источником IFN-γ. 43 Таким образом, хотя существуют убедительные доказательства, подтверждающие роль IFN-γ в ремоделировании децидуальных сосудов у грызунов, остается неясным, играет ли IFN-γ, полученный из uNK-клеток, одинаково важную роль в ремоделировании сосудов у людей и приматов.
В модели ранней беременности у нечеловекообразных приматов основная популяция CD56 ярких uNK-клеток, выделенных из децидуальной оболочки макаки-резус на ранней стадии беременности, не является источником IFN-γ. 43 Таким образом, хотя существуют убедительные доказательства, подтверждающие роль IFN-γ в ремоделировании децидуальных сосудов у грызунов, остается неясным, играет ли IFN-γ, полученный из uNK-клеток, одинаково важную роль в ремоделировании сосудов у людей и приматов.
Скорее, тот факт, что человеческие uNK-клетки, выделенные из децидуальной оболочки первого триместра, являются мощным источником ангиогенных факторов ангиопоэтина (Ang)1, Ang2, VEGF и PLGF 16,33 , подтверждает важную роль этих клеток в ремоделирование сосудов, необходимое для успешной беременности у человека. Функциональные исследования Hanna et al 33 продемонстрировали, что uNK-клетки человека, выделенные из децидуальной оболочки первого триместра, являются мощными секреторами ангиогенных факторов, таких как VEGF и плацентарный фактор роста (PLGF). Супернатанты, полученные из маточных (но не периферических) NK-клеток человека, стимулировали ангиогенез in vitro, о чем свидетельствует повышенная способность эндотелиальных клеток пупочных сосудов человека образовывать сетчатые структуры, процесс, ингибируемый в присутствии VEGF- и PLGF-нейтрализующих белков. . Кроме того, эти исследователи 33 продемонстрировал in vivo способность человеческих uNK-клеток стимулировать ангиогенез и рост опухолевых клеток трофобластной хориокарциномы человека (JEG-3) при подкожной инъекции бестимусным мышам. In vivo ангиогенные свойства uNK-клеток ингибировались в присутствии VEGF- и PLGF-нейтрализующих белков. Эти исследования предоставляют убедительные доказательства того, что ангиогенные свойства человеческих uNK-клеток опосредованы, по крайней мере частично, их секрецией VEGF и PLGF.
Супернатанты, полученные из маточных (но не периферических) NK-клеток человека, стимулировали ангиогенез in vitro, о чем свидетельствует повышенная способность эндотелиальных клеток пупочных сосудов человека образовывать сетчатые структуры, процесс, ингибируемый в присутствии VEGF- и PLGF-нейтрализующих белков. . Кроме того, эти исследователи 33 продемонстрировал in vivo способность человеческих uNK-клеток стимулировать ангиогенез и рост опухолевых клеток трофобластной хориокарциномы человека (JEG-3) при подкожной инъекции бестимусным мышам. In vivo ангиогенные свойства uNK-клеток ингибировались в присутствии VEGF- и PLGF-нейтрализующих белков. Эти исследования предоставляют убедительные доказательства того, что ангиогенные свойства человеческих uNK-клеток опосредованы, по крайней мере частично, их секрецией VEGF и PLGF.
Влияние иммунного ответа матери на развитие иммунной системы плода
Убедительные клинические данные показывают, что у детей матерей, подвергшихся воздействию определенных инфекционных организмов во время беременности, значительно выше частота неврологических расстройств, 44–53 , включая шизофрению и расстройства аутистического спектра. В таких сценариях этиология этих нарушений была связана с активацией материнских воспалительных/иммунных реакций (рассмотрено Jonakait 54 и Patterson 55 ). Исследования на грызунах, в которых материнская иммунная система активируется во время беременности, повторяют эти клинические данные и предоставляют проверенные мышиные модели этих нарушений. 46,47,51,56–66 Таким образом, стимуляция материнского иммунитета во время беременности действует как фактор риска окружающей среды, влияющий на развитие мозга и иммунной системы у потомства.
В таких сценариях этиология этих нарушений была связана с активацией материнских воспалительных/иммунных реакций (рассмотрено Jonakait 54 и Patterson 55 ). Исследования на грызунах, в которых материнская иммунная система активируется во время беременности, повторяют эти клинические данные и предоставляют проверенные мышиные модели этих нарушений. 46,47,51,56–66 Таким образом, стимуляция материнского иммунитета во время беременности действует как фактор риска окружающей среды, влияющий на развитие мозга и иммунной системы у потомства.
Механизмы, лежащие в основе этих явлений, были изучены в основном на пренатальных моделях грызунов, в которых беременным самкам вводили либо инфекционные патогены, либо синтетические агенты, имитирующие вирусные или бактериальные инфекции (а именно, липополисахариды и полиинозиновую: полицитидиловую кислоту [поли(I: С)]). Потомство таких иммуностимулированных беременных самок демонстрирует иммунную дисрегуляцию и поведенческие аномалии, а также химические и структурные аномалии головного мозга, которые аналогичны тем, которые наблюдаются у людей с шизофренией и расстройствами аутистического спектра. 63,67–72
63,67–72
Транзиторное повышение цитокинов (ИЛ-1, ИЛ-6, ИЛ-12, фактора некроза опухоли-альфа [ФНО-α], гранулоцитарно-макрофагального колониестимулирующего фактора) в крови и амниотическая жидкость иммуностимулированных беременных самок, 73,74 , которая, по-видимому, влияет на развитие иммунной системы плода, концепция, известная как «фетальное программирование». 75–79 Mandal et al 73,74,80 также показали, что потомство беременных самок, подвергшихся иммуностимуляции, демонстрирует ускоренное развитие и повышенную реактивность субпопуляций Th2, Th27 и цитотоксических эффекторных Т-клеток, что указывает на провоспалительный фенотип у этих потомков .
Мы предположили, что внутриутробное воздействие на плод цитокинов, вызванное стимуляцией материнского иммунитета, действует как «первый удар», влияющий на программирование иммунной системы плода, которое сохраняется после рождения и во взрослом возрасте. Такие изменения нормального фетального программирования приводят к развитию «провоспалительного» фенотипа, и при последующем постнатальном воздействии иммунного стимула (т. е. второго удара) потомство беременных самок, подвергшихся иммуностимулированию, проявляет более выраженные реакции по сравнению с потомством животных, получавших фосфатный буфер. плотины с закачкой солевого раствора (PBS). Такой сценарий также согласуется с концепцией «множественных поражений» психических расстройств. 81,82 В контексте нарушений развития нервной системы это означает, что аномалии поведения и нарушения иммунной регуляции, наблюдаемые у некоторых больных детей, могут отражать такое измененное программирование плода, которое проявляется постнатально при повторном попадании (например, инфекции) в их организм. иммунная система. Мы проверили эту гипотезу на взрослых потомках беременных самок, подвергшихся иммуностимуляции, с использованием хорошо задокументированных экспериментальных моделей in vivo, которые включают активацию врожденной и/или адаптивной иммунной системы. В каждой из этих моделей у взрослых потомков иммуностимулированных самок развилась более сильная воспалительная реакция, чем у взрослых потомков контрольных самок, которым вводили PBS.
е. второго удара) потомство беременных самок, подвергшихся иммуностимулированию, проявляет более выраженные реакции по сравнению с потомством животных, получавших фосфатный буфер. плотины с закачкой солевого раствора (PBS). Такой сценарий также согласуется с концепцией «множественных поражений» психических расстройств. 81,82 В контексте нарушений развития нервной системы это означает, что аномалии поведения и нарушения иммунной регуляции, наблюдаемые у некоторых больных детей, могут отражать такое измененное программирование плода, которое проявляется постнатально при повторном попадании (например, инфекции) в их организм. иммунная система. Мы проверили эту гипотезу на взрослых потомках беременных самок, подвергшихся иммуностимуляции, с использованием хорошо задокументированных экспериментальных моделей in vivo, которые включают активацию врожденной и/или адаптивной иммунной системы. В каждой из этих моделей у взрослых потомков иммуностимулированных самок развилась более сильная воспалительная реакция, чем у взрослых потомков контрольных самок, которым вводили PBS. 73,83 Таким образом, у потомства иммуностимулированных самок обнаруживаются поведенческие аномалии, напоминающие те, которые наблюдаются у особей с некоторыми нарушениями развития нервной системы, такими как шизофрения и аутизм. В дополнение к их поведенческим аномалиям наши исследования показывают, что в результате внутриутробного воздействия продуктов материнской иммунной стимуляции эти взрослые потомки также демонстрируют «провоспалительный» фенотип, который придает уязвимость к развитию иммуноопосредованной патологии после рождения и во взрослом возрасте. . 73,74,80
73,83 Таким образом, у потомства иммуностимулированных самок обнаруживаются поведенческие аномалии, напоминающие те, которые наблюдаются у особей с некоторыми нарушениями развития нервной системы, такими как шизофрения и аутизм. В дополнение к их поведенческим аномалиям наши исследования показывают, что в результате внутриутробного воздействия продуктов материнской иммунной стимуляции эти взрослые потомки также демонстрируют «провоспалительный» фенотип, который придает уязвимость к развитию иммуноопосредованной патологии после рождения и во взрослом возрасте. . 73,74,80
В этом отношении результаты, полученные в ходе наших исследований на моделях мышей, дали научное обоснование продолжающемуся трансляционному исследовательскому проекту, чтобы определить, задействованы ли сходные молекулярные патогенные механизмы в когорте аутичных детей, которые также обнаруживают диагностические признаки иммунной дисрегуляции. 84 Используя ДНК, полученную из базы данных Autism Genetic Resource Exchange, мы инициировали исследование, чтобы определить, встречаются ли полиморфизмы в выбранных материнских генах цитокинов чаще у матерей этих аутичных детей. Наши результаты показывают, что матери детей с аутизмом в этой когорте имеют значительно более высокие частоты полиморфизма генов провоспалительных цитокинов, тем самым придавая генетическую способность более энергично реагировать на иммунную стимуляцию, производя типы и количества цитокинов, которые способствуют воспалительным реакциям. Более того, анализ предварительных данных потомства свидетельствует о том, что аутичные дети этих матерей наследуют материнский генотип. Таким образом, результаты, полученные в результате нашего исследования экспериментальной пренатальной мышиной модели стимуляции материнского иммунитета во время беременности 73 имеют биологическое значение для человека.
Наши результаты показывают, что матери детей с аутизмом в этой когорте имеют значительно более высокие частоты полиморфизма генов провоспалительных цитокинов, тем самым придавая генетическую способность более энергично реагировать на иммунную стимуляцию, производя типы и количества цитокинов, которые способствуют воспалительным реакциям. Более того, анализ предварительных данных потомства свидетельствует о том, что аутичные дети этих матерей наследуют материнский генотип. Таким образом, результаты, полученные в результате нашего исследования экспериментальной пренатальной мышиной модели стимуляции материнского иммунитета во время беременности 73 имеют биологическое значение для человека.
Материнско-плодовая толерантность
Billingham et al 1 в 1953 г. первыми предложили концепцию иммунологической толерантности во время беременности. Они предположили, что полуаллогенный плод способен выжить благодаря регуляции иммунологических взаимодействий между матерью и плодом. Такая регуляция может быть вызвана отсутствием экспрессии фетального антигена и/или функциональным подавлением материнского иммунного ответа. 1
Такая регуляция может быть вызвана отсутствием экспрессии фетального антигена и/или функциональным подавлением материнского иммунного ответа. 1
HLA, которые экспрессируются в оболочках плода, являются толерогенными, а не иммуногенными, 85 , а экспрессия белков главного комплекса гистосовместимости (MHC) на границе между матерью и плодом строго регулируется во время беременности. 86 Гены MHC класса I подразделяются на классы Ia и Ib. MHC класса Ia далее подразделяется на HLA-A, B и C, а класс Ib подразделяется на HLA-E, F и G. Гены HLA класса II (HLA-D) не транслируются в клетках трофобласта человека. 87 Клетки трофобласта человека экспрессируют одну молекулу MHC класса Ia (HLA-C) и все молекулы MHC класса Ib. В плаценте человека клетки трофобласта плода не экспрессируют молекулы MHC класса Ia (HLA-A и B), ответственные за отторжение аллотрансплантатов у людей. 88,89 Взаимодействия между HLA-C и децидуальными NK-клетками также могут вызывать инфильтрацию трофобласта в ткани матери. Беременности с несовместимым HLA-C плода демонстрируют большее количество активированных Т-клеток и функциональных Treg в децидуальной ткани по сравнению с беременностями с совпадением HLA-C. 90 Это говорит о том, что при неосложненной беременности децидуальные Т-клетки распознают HLA-C плода на границе между матерью и плодом, но не вызывают деструктивного иммунного ответа. 91
Беременности с несовместимым HLA-C плода демонстрируют большее количество активированных Т-клеток и функциональных Treg в децидуальной ткани по сравнению с беременностями с совпадением HLA-C. 90 Это говорит о том, что при неосложненной беременности децидуальные Т-клетки распознают HLA-C плода на границе между матерью и плодом, но не вызывают деструктивного иммунного ответа. 91
Что касается беременности, то одним из наиболее важных вопросов является то, как плодно-плацентарная единица избегает отторжения матерью. Хотя на протяжении всей беременности между плодом и материнскими клетками происходит постоянное взаимодействие, плод действует как привилегированное место, защищенное от иммунного отторжения. 91 Экспрессия молекул MHC на клетках трофобласта подавлена у большинства видов в качестве стратегии предотвращения распознавания и разрушения материнскими иммунными клетками. 92 Лимфоциты периферической крови жеребых кобыл демонстрируют сниженную способность развиваться в эффекторные цитотоксические Т-лимфоциты. 93 Это снижение опосредованной Т-клетками аллореактивности возвращается к норме после прерывания беременности и не наблюдается у небеременных кобыл. Кроме того, было показано, что экстракты 80-дневных плацент кобыл ингибируют пролиферацию материнских лимфоцитов, а совместное культивирование клеток трофобласта с материнскими лимфоцитами вызывает снижение пролиферации и продукции цитокинов. 94
93 Это снижение опосредованной Т-клетками аллореактивности возвращается к норме после прерывания беременности и не наблюдается у небеременных кобыл. Кроме того, было показано, что экстракты 80-дневных плацент кобыл ингибируют пролиферацию материнских лимфоцитов, а совместное культивирование клеток трофобласта с материнскими лимфоцитами вызывает снижение пролиферации и продукции цитокинов. 94
Клеточный иммунитет: механизмы, способствующие толерантности мать-плод
Сдвиг Th2-Th3 во время беременности иммуносупрессии. С другой стороны, мать должна поддерживать достаточную иммунную функцию для борьбы с инфекцией. Одним из механизмов, который играет роль в поддержании успешной беременности, является переключение с профиля цитокинов Th2 на профиль Th3. Этот переключатель более заметен на границе между матерью и плодом. Клетки Th3 накапливаются в децидуальной оболочке, а ДК матки могут превращать наивные Т-клетки в клетки Th3. 95,96 Таким образом, переключение на фенотип Th3 обусловлено как миграцией Th3-клеток, так и индукцией Th3-клеток на границе между матерью и плодом, но изменения в системной иммунной системе незначительны. 96 Гипотеза о преобладании Th3 и подавлении ответа Th2 во время беременности была предложена Wegmann et al, 97 , что подтверждается исследованиями как на мышах, так и на людях. У мышей провоспалительные цитокины IFN-γ и TNF-α или стимуляция toll-подобных рецепторов вызывают выкидыш, который можно обратить ингибиторами цитокинов Th2 или введением противовоспалительного IL-10 (цитокина Th3). 98 Однако IFN-γ также играет важную роль в ремоделировании сосудов на ранних сроках беременности мышей. Следовательно, иммунитет Th2-типа, по-видимому, контролируется, чтобы избежать чрезмерной стимуляции во время беременности. Прогестерон, эстрадиол, простагландин D2 (PGD2) и ингибирующий лейкемический фактор, образующиеся во время беременности, способствуют профилю Th3 и частично ответственны за смещение Th3, связанное с нормальной беременностью. 96 Однако трансгенные мыши с однократным нокаутом цитокинов Th3, такие как IL-4 -/- , IL-10 -/-99 и мыши с одинарными, двойными, тройными и четверными делециями генов IL-4, IL-5, IL-9 и IL-13 имеют нормальную беременность, что предполагает что преобладающий иммунитет Th3-типа может не иметь существенного значения для успешной беременности.
96 Гипотеза о преобладании Th3 и подавлении ответа Th2 во время беременности была предложена Wegmann et al, 97 , что подтверждается исследованиями как на мышах, так и на людях. У мышей провоспалительные цитокины IFN-γ и TNF-α или стимуляция toll-подобных рецепторов вызывают выкидыш, который можно обратить ингибиторами цитокинов Th2 или введением противовоспалительного IL-10 (цитокина Th3). 98 Однако IFN-γ также играет важную роль в ремоделировании сосудов на ранних сроках беременности мышей. Следовательно, иммунитет Th2-типа, по-видимому, контролируется, чтобы избежать чрезмерной стимуляции во время беременности. Прогестерон, эстрадиол, простагландин D2 (PGD2) и ингибирующий лейкемический фактор, образующиеся во время беременности, способствуют профилю Th3 и частично ответственны за смещение Th3, связанное с нормальной беременностью. 96 Однако трансгенные мыши с однократным нокаутом цитокинов Th3, такие как IL-4 -/- , IL-10 -/-99 и мыши с одинарными, двойными, тройными и четверными делециями генов IL-4, IL-5, IL-9 и IL-13 имеют нормальную беременность, что предполагает что преобладающий иммунитет Th3-типа может не иметь существенного значения для успешной беременности. 100
100
Повышение уровня цитокинов Th3 IL-4, IL-10 и моноцитарного колониестимулирующего фактора в периферической крови и на границе раздела мать-плод связано с успешным течением беременности. Трофобласт, децидуальная оболочка и амнион вносят свой вклад в среду, предвзятую к цитокинам Th3, путем продукции IL-13, IL-10, IL-4 и IL-6. 101–103 Было показано, что цитотрофобласты плаценты человека продуцируют иммунодепрессивный цитокин IL-10. 101 Кроме того, макрофаги и Treg, присутствующие в децидуальной оболочке во время беременности, также продуцируют IL-10 и участвуют в поддержании иммунной толерантности к аллогенным фетальным антигенам. 91 Плацента также продуцирует PGD2, который может действовать как хемоаттрактант для клеток Th3 на границе между матерью и плодом через рецептор Th3 CRTh3 (молекула, гомологичная рецептору хемоаттрактанта, экспрессируемая на клетках Th3). У женщин, страдающих привычным невынашиванием беременности, экспрессия клеток CRTh3+ снижена по сравнению с женщинами, перенесшими плановое прерывание беременности. 104 Противовоспалительные цитокины IL-4 и IL-10 ингибируют клетки Th2 и макрофаги, что, в свою очередь, предотвращает отторжение плодного аллотрансплантата. Кроме того, эти цитокины также ингибируют ФНО-α, циклооксигеназу-2 (ЦОГ-2) и простагландин Е2 в клетках, полученных из амниона, что предотвращает начало родов. 24,105–107
104 Противовоспалительные цитокины IL-4 и IL-10 ингибируют клетки Th2 и макрофаги, что, в свою очередь, предотвращает отторжение плодного аллотрансплантата. Кроме того, эти цитокины также ингибируют ФНО-α, циклооксигеназу-2 (ЦОГ-2) и простагландин Е2 в клетках, полученных из амниона, что предотвращает начало родов. 24,105–107
Роды часто связаны с провоспалительным состоянием с возвратом к Th2, а не Th3. Исследования указывают на увеличение провоспалительных цитокинов Th2 и снижение цитокинов Th3 у женщин, находящихся в активной родах. Оболочки плода, миометрий, амнион, амниотическая жидкость и децидуальная оболочка продуцируют провоспалительные цитокины IL-1² и TNF-α в срок и могут индуцировать ядерный фактор каппа B. Этот транскрипционный фактор регулирует экспрессию связанных с родами генов, таких как COX-2, IL -8 и ММП-9и запускает каскад событий, вызывающих роды. Несмотря на провоспалительную природу цитокинов Th2, они необходимы для успешной беременности, способствуя своевременному родоразрешению. 108–110
108–110
Роль Tregs при беременности
CD4+CD25+ Tregs представляют собой субпопуляцию Т-клеток, ответственных за поддержание иммунологической самотолерантности путем подавления аутореактивных лимфоцитов в зависимости от клеточного контакта путем продукции ТГФ-² и ИЛ-10. 111,112 Treg экспрессируют транскрипционный фактор forkhead box транскрипционный фактор (FoxP3), который действует как основной регулятор их развития и функционирования. 113 Существует два основных подмножества Treg: природные или тимические Treg (tTreg) и индуцированные или экстратимические/периферические Treg (pTreg). tTreg представляют собой CD4+CD25+Foxp3+ и экспрессируют антиген 4, ассоциированный с цитотоксическими Т-лимфоцитами. pTreg развиваются из наивных Т-клеток после воздействия антигенов на периферии и воздействия IL-10 или TGF-² и могут быть Foxp3- или Foxp3+. . 114,115 Благодаря своей иммунодепрессивной функции Treg также играют ключевую роль во время беременности, поддерживая толерантность матери и плода.
Несколько исследований подтвердили увеличение Treg во время беременности в крови, лимфатических узлах и тимусе с последующим снижением в середине беременности и далее, пока они не достигнут уровней небеременных в срок или вскоре после этого. Они играют решающую роль в имплантации эмбриона и в поддержании иммунной толерантности матери к полуаллогенным фетальным антигенам. 116,117 Данные свидетельствуют о том, что Treg во время беременности специфичны к отцовским аллоантигенам, которые защищают плод от отторжения иммунной системой матери. 118 Распространение Tregs в децидуальной оболочке у нормальных беременных женщин подавляет активность материнских Th2/Th27 на полуаллогенном плоде. 119
Эксперименты на мышах показали повышенный уровень Treg как при сингенном, так и при аллогенном спаривании, что свидетельствует о независимой от аллоантигена экспансии Treg. 120 Экспансия Treg, по-видимому, регулируется эстрадиолом. Это подтверждается исследованиями in vitro, которые показывают, что физиологические уровни эстрадиола не только увеличивают количество Treg, но и стимулируют превращение CD4+CD25-T-клеток в CD4+CD25+ T-клетки. 121 С другой стороны, Zhao et al. 122 не наблюдали увеличения Treg у мышей после овариэктомии. Более того, они обнаружили большее количество Treg у беременных мышей в результате аллогенных спариваний по сравнению с сингенными, что свидетельствует об участии отцовских антигенов в экспансии Treg. 122 Недавно Robertson et al 123 показали, что семенная жидкость может стимулировать распространение Treg. Следовательно, в экспансии Treg, вероятно, участвуют как антигензависимые, так и антигеннезависимые механизмы.
121 С другой стороны, Zhao et al. 122 не наблюдали увеличения Treg у мышей после овариэктомии. Более того, они обнаружили большее количество Treg у беременных мышей в результате аллогенных спариваний по сравнению с сингенными, что свидетельствует об участии отцовских антигенов в экспансии Treg. 122 Недавно Robertson et al 123 показали, что семенная жидкость может стимулировать распространение Treg. Следовательно, в экспансии Treg, вероятно, участвуют как антигензависимые, так и антигеннезависимые механизмы.
Tregs экспрессируют различные хемокиновые рецепторы, лиганды которых экспрессируются на границе между матерью и плодом, что может способствовать опосредованной хемокинами миграции Tregs в децидуальную оболочку. 120 Кроме того, другие иммунные клетки продуцируют большое количество CCL17, CCL4 и CCL1, 124–126 , которые могут привлекать Tregs, специфически экспрессирующие CCR4 и CCR8. 127,128 Помимо опосредованной хемокинами миграции Treg, интегрины, подобные CD62L, по-видимому, играют важную роль в миграции Treg, поскольку нейтрализующие CD62L-специфические антитела блокируют распространение Treg в дренирующих лимфатических узлах и приводят к отторжению аллотрансплантата. Шумахер и др. 129 показали важность хорионического гонадотропина человека как одного из основных аттрактантов Treg для взаимодействия матери и плода.
Шумахер и др. 129 показали важность хорионического гонадотропина человека как одного из основных аттрактантов Treg для взаимодействия матери и плода.
Aluvihare et al 117 впервые отметили, что количество Treg увеличилось во всех лимфоидных органах при аллогенных скрещиваниях самок мышей C57BL/6 с самцами CBA. Они также адоптивно перенесли лимфоциты от самок BALB/c, аллобеременных от самцов C57BL/6 или синбеременных от самцов BALB/c, в самок BALB/c с дефицитом Т-клеток, которых затем скрещивали с самцами C57BL/6. Беременность протекала нормально при переносе целых популяций лимфоцитов. Напротив, лимфоциты, обедненные Treg, приводили к резорбции плода и массивной инфильтрации Т-клеток в места имплантации. 117 Zenclussen 130 и Zenclussen et al 131 продемонстрировали полную профилактику абортов в модели естественных спонтанных абортов CBA × DBA/2J путем переноса Treg от аллоиммунизированных мышей, и они также сообщили, что абортов не произошло в Контрольные пары CBA × BALB/c и CBA × CBA. Наконец, Chen et al. 116 продемонстрировали, что стимуляция Treg либо непосредственно низкой дозой IL-2, либо косвенно лигандом тирозинкиназы 3, родственной Fms, приводила к нормальным показателям беременности у мышей CBA × DBA/2J, склонных к абортам. Все результаты этих экспериментов демонстрируют, что при аллогенных спариваниях Treg необходимы для предотвращения материнского иммунного ответа против плода.
Наконец, Chen et al. 116 продемонстрировали, что стимуляция Treg либо непосредственно низкой дозой IL-2, либо косвенно лигандом тирозинкиназы 3, родственной Fms, приводила к нормальным показателям беременности у мышей CBA × DBA/2J, склонных к абортам. Все результаты этих экспериментов демонстрируют, что при аллогенных спариваниях Treg необходимы для предотвращения материнского иммунного ответа против плода.
Клинические проявления измененной иммунной системы при беременности
Представление о беременности как измененном состоянии подавления иммунитета хорошо задокументировано. 132–136 Беременность — это период времени, который представляет риск повышенной восприимчивости к инфекционным заболеваниям, и иммунная система матери несет исключительную ответственность за защиту от инфекционных микроорганизмов и защиту плода, поскольку реакции как плода, так и плаценты ограничены. 132,136 Иммунные сдвиги Th2/Th3 во время беременности хорошо известны и предоставили платформу для дальнейшего изучения иммунной системы. 136 Это привело к уточнению нашего понимания иммунной системы и развитию новой парадигмы в отношении беременности и иммунной функции. Эта более новая теория предполагает, что иммунная система во время беременности является функциональной и активной системой, в которой существует не только материнский иммунный ответ, но и плодно-плацентарный иммунный ответ, который в сочетании эффективно защищает как мать, так и плод. 133,136 При таком представлении иммунная система не подавлена, а находится в модулированном состоянии, и, следовательно, это объясняет, почему беременные женщины по-разному реагируют на различные патогены. 133 Во время этой измененной реакции в плаценте генерируются сигналы, которые модулируют иммунную систему матери, чтобы она реагировала уникальным образом на различные микроорганизмы. 133 Хотя эти старые и новые парадигмы, касающиеся иммунологии беременности, различаются, ясно, что цель иммунной системы во время беременности состоит в том, чтобы обеспечить успешное течение беременности, при этом обеспечивая защиту как матери, так и плода от внешних патогенов.
136 Это привело к уточнению нашего понимания иммунной системы и развитию новой парадигмы в отношении беременности и иммунной функции. Эта более новая теория предполагает, что иммунная система во время беременности является функциональной и активной системой, в которой существует не только материнский иммунный ответ, но и плодно-плацентарный иммунный ответ, который в сочетании эффективно защищает как мать, так и плод. 133,136 При таком представлении иммунная система не подавлена, а находится в модулированном состоянии, и, следовательно, это объясняет, почему беременные женщины по-разному реагируют на различные патогены. 133 Во время этой измененной реакции в плаценте генерируются сигналы, которые модулируют иммунную систему матери, чтобы она реагировала уникальным образом на различные микроорганизмы. 133 Хотя эти старые и новые парадигмы, касающиеся иммунологии беременности, различаются, ясно, что цель иммунной системы во время беременности состоит в том, чтобы обеспечить успешное течение беременности, при этом обеспечивая защиту как матери, так и плода от внешних патогенов.
Эндокринная регуляция иммунных клеток
Концентрация гормонов меняется в зависимости от начала беременности, и в каждом триместре беременности наблюдаются определенные колебания уровня гормонов. В целом считается, что гормоны беременности подавляют материнские аллореакции, одновременно стимулируя пути толерантности. 137 Считается, что гормональные сдвиги уменьшают количество ДК и моноцитов, снижают активность макрофагов, одновременно блокируя NK-клетки, Т-клетки и В-клетки. 137 Считается, что каждый из основных гормонов, связанных с беременностью, прямо или косвенно влияет на функцию основных иммунных клеток и, таким образом, влияет на иммунную среду во время беременности. Эти изменения обсуждаются в таблице 1.
Таблица 1 Эндокринная регуляция иммунных клеток и иммунная функция |
Признаки изменения иммунной функции при беременности: влияние инфекционных организмов на течение беременности
Изменения в иммунной системе во время беременности хорошо известны, и впоследствии эти изменения приводят к повышенной восприимчивости к некоторым вирусным, бактериальным и паразитарным инфекциям. 132 Считается, что эта повышенная восприимчивость является результатом подавления клеточно-опосредованного иммунитета, поскольку беременность способствует переходу от Th2 к Th3 иммунной среде. 132,134 Кроме того, было задокументировано, что инфекция некоторыми патогенами приводит к тяжелым симптомам у беременных из-за этих иммунных изменений. 133,138 Однако важно отметить, что при некоторых инфекционных заболеваниях беременных заболеваемость и смертность различаются между развитыми и неразвитыми странами. Например, беременные женщины с ветряной оспой в США или Канаде чувствуют себя лучше, чем женщины с диагнозом в слаборазвитых странах, где ресурсы ограничены. 139 Таким образом, при оценке тяжести болезненных состояний у беременных в зависимости от географического распределения может иметь место некоторая погрешность.
139 Таким образом, при оценке тяжести болезненных состояний у беременных в зависимости от географического распределения может иметь место некоторая погрешность.
В таблице 2 обобщены наиболее известные и изученные патогены, связанные с беременностью. Как видно из таблицы 2, инфекционные заболевания во время беременности связаны не только с риском для матери, но и с риском для плода. Эти эффекты на плод возникают в результате инфекций, которые проникают через плаценту и могут вызвать выкидыш, врожденные аномалии или даже гибель плода. 133 В связи с этим Американский конгресс акушеров-гинекологов и Центры США по контролю и профилактике заболеваний рекомендуют всем женщинам вакцинироваться от гриппа и столбняка, дифтерии и коклюша (Tdap) во время беременности. 140–142 Обе эти вакцины кажутся безопасными при введении во время беременности с небольшим количеством нежелательных явлений со стороны матери и плода. 142,143 Напротив, живые вакцины, такие как корь-паротит-краснуха (MMR) и ветряная оспа, не рекомендуются во время беременности из-за теоретического риска для плода. 141 142
141 142
Таблица 2 Общие инфекционные микроорганизмы при беременности |
Риск заражения во время беременности представляет собой серьезную проблему не только с точки зрения благополучия матери, но и с точки зрения потенциальных рисков для плода, которые могут иметь долгосрочные последствия. Исследования на животных показали, что плацента может вызывать синдром воспалительной реакции плода (FIRS), который с точки зрения микробиологии является диагнозом плацентарной инфекции без роста организма. 133,136 FIRS является серьезным заболеванием и приводит к повышению уровня циркулирующих цитокинов, таких как IL-1, IL-6, IL-8 и TNF-α. 133 Было показано, что эти воспалительные сдвиги увеличивают риск аномалий плода, таких как вентрикуломегалия или кровоизлияния. Кроме того, исследования на людях продемонстрировали связь между FIRS и развитием аутизма, шизофрении, нейросенсорных расстройств и психоза. 133,136 Эти наблюдения еще раз подтверждают экспериментальные мышиные модели, описанные ранее, в которых иммуностимуляция индуцирует высокие уровни провоспалительных цитокинов в крови и амниотической жидкости беременных самок, которые, вероятно, участвуют в этиологии нарушений развития нервной системы, проявляющихся у их потомства. 63,72–74 Напротив, бактериальные инфекции, достигающие децидуальной оболочки, вызывают провоспалительную реакцию, которая приводит к развитию внутриутробных инфекций. 144 Это происходит за счет активации рецепторов распознавания образов (PRR) и увеличения секреции цитокинов, таких как IL-1 и TNF-α.
133,136 FIRS является серьезным заболеванием и приводит к повышению уровня циркулирующих цитокинов, таких как IL-1, IL-6, IL-8 и TNF-α. 133 Было показано, что эти воспалительные сдвиги увеличивают риск аномалий плода, таких как вентрикуломегалия или кровоизлияния. Кроме того, исследования на людях продемонстрировали связь между FIRS и развитием аутизма, шизофрении, нейросенсорных расстройств и психоза. 133,136 Эти наблюдения еще раз подтверждают экспериментальные мышиные модели, описанные ранее, в которых иммуностимуляция индуцирует высокие уровни провоспалительных цитокинов в крови и амниотической жидкости беременных самок, которые, вероятно, участвуют в этиологии нарушений развития нервной системы, проявляющихся у их потомства. 63,72–74 Напротив, бактериальные инфекции, достигающие децидуальной оболочки, вызывают провоспалительную реакцию, которая приводит к развитию внутриутробных инфекций. 144 Это происходит за счет активации рецепторов распознавания образов (PRR) и увеличения секреции цитокинов, таких как IL-1 и TNF-α. 145 В совокупности они способствуют неблагоприятным исходам беременности, нарушению развития плода или преждевременным родам, в результате чего дети рождаются с низкой массой тела. 146,147 Таким образом, важно признать, что беременность может вызывать повышенную восприимчивость к заболеваниям, что не только влияет на материнскую заболеваемость, но и способствует неблагоприятным отдаленным исходам для плода и новорожденного.
145 В совокупности они способствуют неблагоприятным исходам беременности, нарушению развития плода или преждевременным родам, в результате чего дети рождаются с низкой массой тела. 146,147 Таким образом, важно признать, что беременность может вызывать повышенную восприимчивость к заболеваниям, что не только влияет на материнскую заболеваемость, но и способствует неблагоприятным отдаленным исходам для плода и новорожденного.
Доказательства изменения иммунной функции во время беременности: влияние беременности на аутоиммунные заболевания
Как уже говорилось, беременность вызывает переход от Th2- к Th3-опосредованному иммунитету, и этот сдвиг влияет на статус заболевания у женщин с известными аутоиммунными заболеваниями. В целом гормональная среда, вызванная беременностью, смещает цитокиновый профиль в сторону от клеточно-опосредованного иммунитета (иммунитет Th2-типа) и, следовательно, улучшает течение аутоиммунных заболеваний воспалительного типа. 132 Напротив, аутоиммунные заболевания, опосредованные гуморально (или антителами), обостряются, так как беременность способствует увеличению активности, связанной с Th3, а также профиля цитокинов Th3. 132,148 Подробнее см. Таблицу 3.
132 Напротив, аутоиммунные заболевания, опосредованные гуморально (или антителами), обостряются, так как беременность способствует увеличению активности, связанной с Th3, а также профиля цитокинов Th3. 132,148 Подробнее см. Таблицу 3.
Таблица 3 Аутоиммунные заболевания при беременности |
Заключение и перспективы на будущее
Беременность у женщин представляет собой динамическое состояние, при котором в разные триместры используются различные механизмы, обеспечивающие успешное установление, сохранение и своевременное прерывание беременности. Механизмы, действующие на ранних сроках беременности для установления беременности, могут отличаться от тех, которые необходимы для сохранения беременности и от тех, которые необходимы для обеспечения успешных и своевременных родов и родоразрешения. Последние данные бросают вызов представлению о том, что беременность — это просто состояние иммуносупрессии, защищающее аллогенный плод от атаки материнской иммунной системы. Данные свидетельствуют о том, что, скорее, беременность может быть состоянием усиленного врожденного иммунного ответа и сниженного клеточно-опосредованного ответа. Уникальные популяции децидуальных лимфоидных клеток активно способствуют развитию плаценты и толерантности плода. Несмотря на достигнутый значительный прогресс в понимании функции иммунных клеток во время беременности, особенно на ранних сроках беременности, все еще остается много нерешенных вопросов, касающихся регуляции их пролиферации и функции эндокринными и другими факторами. Опубликованные результаты исследований на людях и животных моделях ясно показывают, что правильный баланс между провоспалительным и противовоспалительным действием имеет решающее значение для успешной беременности. Таким образом, будущая задача трансляционных исследований в области репродуктивной иммунологии будет заключаться в более полном определении тех факторов, которые благоприятствуют оптимальной иммунологической среде, способствующей здоровью и развитию плода на определенных стадиях беременности, чтобы затем можно было разработать научно обоснованные регулирующие терапевтические стратегии.
Последние данные бросают вызов представлению о том, что беременность — это просто состояние иммуносупрессии, защищающее аллогенный плод от атаки материнской иммунной системы. Данные свидетельствуют о том, что, скорее, беременность может быть состоянием усиленного врожденного иммунного ответа и сниженного клеточно-опосредованного ответа. Уникальные популяции децидуальных лимфоидных клеток активно способствуют развитию плаценты и толерантности плода. Несмотря на достигнутый значительный прогресс в понимании функции иммунных клеток во время беременности, особенно на ранних сроках беременности, все еще остается много нерешенных вопросов, касающихся регуляции их пролиферации и функции эндокринными и другими факторами. Опубликованные результаты исследований на людях и животных моделях ясно показывают, что правильный баланс между провоспалительным и противовоспалительным действием имеет решающее значение для успешной беременности. Таким образом, будущая задача трансляционных исследований в области репродуктивной иммунологии будет заключаться в более полном определении тех факторов, которые благоприятствуют оптимальной иммунологической среде, способствующей здоровью и развитию плода на определенных стадиях беременности, чтобы затем можно было разработать научно обоснованные регулирующие терапевтические стратегии.
Благодарности
Авторы благодарят Yingting Zhang за помощь в подготовке рукописи. Мили Мандал в настоящее время сотрудничает с Oncology, R&D, GlaxoSmithKline, Колледжвилль, Пенсильвания, США.
Раскрытие информации
Авторы сообщают об отсутствии конфликта интересов в этой работе.
Ссылки
1. | Billingham RE, Brent L, Medawar PB. Активно приобретенная толерантность к чужеродным клеткам. Природа . 1953;172(4379):603–606. |
2. | Бросенс Дж.Дж., Пейненборг Р., Бросенс И.А. Зона соединения спиральных артерий миометрия при нормальной и аномальной беременности: обзор литературы. Am J Obstet Gynecol . 2002;187(5):1416–1423. |
3. | Геллерсен Б., Бросенс И.А., Бросенс Дж.Дж. Децидуализация эндометрия человека: механизмы, функции и клинические перспективы. |
4. | Геллерсен Б., Бросенс Дж. Взаимодействие циклического АМФ и рецептора прогестерона в эндометрии человека: децидуализирующее дело. J Эндокринол . 2003;178(3):357–372. |
5. | Димитриадис Э., Уайт К.А., Джонс Р.Л., Саламонсен Л.А. Цитокины, хемокины и факторы роста в эндометрии, связанные с имплантацией. Hum Reprod Обновление . 2005;11(6):613–630. |
6. | Lash GE, Robson SC, Bulmer JN. Обзор: функциональная роль маточных естественных киллеров (uNK) в децидуальной оболочке человека на ранних сроках беременности. Плацента . 2010; 31 (Прил.): S87–S92. |
7. | Кинг А. Лейкоциты матки и децидуализация. Обновление воспроизведения шума . 2000;6(1):28–36. |
8. | Bulmer JN, Morrison L, Longfellow M, Ritson A, Pace D. Гранулированные лимфоциты в эндометрии человека: гистохимические и иммуногистохимические исследования. Репродукция гула . 1991;6(6):791–798. |
9. | Вайс Г., Голдсмит Л.Т., Тейлор Р.Н., Беллет Д., Тейлор Х.С. Воспаление при репродуктивных расстройствах. Reprod Sci . 2009;16(2):216–229. |
10. | Moffett A, Colucci F. Маточные NK-клетки: активные регуляторы на границе между матерью и плодом. Дж Клин Инвест . 2014; 124(5):1872–1879. |
11. | Моффет А., Локе С. Иммунология плацентации у плацентарных млекопитающих. Нат Рев Иммунол . 2006;6(8):584–594. |
12. | Моффет-Кинг А. Естественные клетки-киллеры и беременность. Нат Рев Иммунол . 2002;2(9):656–663. |
13. | Кинг А., Биркби С., Локи Ю.В. Ранние децидуальные клетки человека проявляют активность NK против клеточной линии K562, но не против трофобласта первого триместра. Селл Иммунол . 1989;118(2):337–344. |
14. | Купман Л.А., Копцов Х.Д., Рыбалов Б. и др. Децидуальные естественные клетки-киллеры человека представляют собой уникальную подгруппу NK-клеток с иммуномодулирующим потенциалом. J Exp Med . 2003;198(8):1201–1212. |
15. | Нарус К., Лэш Г.Э., Иннес Б.А., и др. Локализация матриксной металлопротеиназы (ММП)-2, ММП-9 и тканевых ингибиторов ММП (ТИМП) в естественных клетках-киллерах матки на ранних сроках беременности человека. Репродукция гула . 2009;24(3):553–561. |
16. | Lash GE, Schiessl B, Kirkley M, et al. Экспрессия ангиогенных факторов роста маточными естественными клетками-киллерами на ранних сроках беременности. |
17. | Ягель С. Роль естественных киллеров в развитии на границе плода и матери. Am J Obstet Gynecol . 2009;201(4):344–350. |
18. | Faas MM, Spaans F, De Vos P. Моноциты и макрофаги при беременности и преэклампсии. Фронт Иммунол . 2014;5:298. |
19. | Smith SD, Dunk CE, Aplin JD, Harris LK, Jones RL. Доказательства участия иммунных клеток в ремоделировании децидуальной спиральной артериолы на ранних сроках беременности у человека. Ам Дж. Патол . 2009; 174(5):1959–1971. |
20. | Абрахамс В.М., Ким Ю.М., Страшевский С.Л., Ромеро Р., Мор Г. Макрофаги и клиренс апоптотических клеток во время беременности. Am J Reprod Immunol . 2004;51(4):275–282. |
21. | Co EC, Gormley M, Kapidzic M, et al. Материнские децидуальные макрофаги ингибируют уничтожение NK-клетками инвазивных цитотрофобластов во время беременности человека. Биол Репрод . 2013;88(6):155. |
22. | Уоллес А.Е., Фрейзер Р., Картрайт Дж.Е. Вневорсинчатый трофобласт и децидуальные естественные клетки-киллеры: партнерство по ремоделированию. Обновление воспроизведения шума . 2012;18(4):458–471. |
23. | Нэнси П., Эрлебахер А. Поведение Т-клеток на границе материнского плода. Int J Dev Biol . 2014;58(2–4):189–198. |
24. | Piccinni MP. Толерантность Т-клеток к плодному аллотрансплантату. J Reprod Immunol . 2010;85(1):71–75. |
25. | Балмер Дж. Н., Уильямс П. Дж., Лэш Дж. Э. Иммунные клетки в плацентарном ложе. |
26. | Scaife PJ, Bulmer JN, Robson SC, Innes BA, Searle RF. Эффекторная активность децидуальных CD8+ Т-лимфоцитов на ранних сроках беременности человека. Биол Репрод . 2006;75(4):562–567. |
27. | Хсу П, Нанан Р.К. Врожденные и адаптивные иммунные взаимодействия на границе плода и матери при здоровой беременности человека и преэклампсии. Фронт Иммунол . 2014;5:125. |
28. | Гарднер Л., Моффет А. Дендритные клетки децидуальной оболочки человека. Биол Репрод . 2003;69(4):1438–1446. |
29. | Миядзаки С., Цуда Х., Сакаи М. и др. Преобладание Th3-промотирующих дендритных клеток в децидуальной оболочке человека на ранних сроках беременности. J Лейкок Биол . 2003;74(4):514–522. |
30. | Ласкарин Г., Редзович А., Рубеса З. и др. Настройка децидуальных естественных клеток-киллеров с помощью аутологичных дендритных клеток. Am J Reprod Immunol . 2008;59(5):433–445. |
31. | Плакс В., Бирнберг Т., Беркутцки Т. и др. Маточные ДК имеют решающее значение для образования децидуальной оболочки во время имплантации эмбрионов у мышей. Дж Клин Инвест . 2008;118(12):3954–3965. |
32. | Krey G, Frank P, Shaikly V, et al. Истощение дендритных клеток in vivo снижает эффективность размножения, влияя на имплантацию и раннее развитие плаценты у мышей. J Mol Med (Берл) . 2008;86(9):999–1011. |
33. | Hanna J, Goldman-Wohl D, Hamani Y, et al. Децидуальные NK-клетки регулируют ключевые процессы развития на границе плода и матери человека. |
34. | Norwitz ER. Дефектная имплантация и плацентация: подготовка к осложнениям беременности. Reprod Biomed Online . 2007; 14 Спец. № 1:101–109. |
35. | Lash GE, Otun HA, Innes BA, et al. Интерферон-гамма ингибирует вневорсинчатую инвазию клеток трофобласта по механизму, который включает как изменения апоптоза, так и уровни протеазы. FASEB J . 2006;20(14):2512–2518. |
36. | Эрлебахер А. Иммунология интерфейса мать-плод. Annu Rev Immunol . 2013; 31:387–411. |
37. | Guimond MJ, Luross JA, Wang B, Terhorst C, Danial S, Croy BA. Отсутствие естественных клеток-киллеров во время мышиной беременности связано с нарушением репродуктивной функции у мышей TgE26. Биол Репрод . 1997;56(1):169–179. |
38. | Гимонд М.Дж., Ван Б., Крой Б.А. Приживление костного мозга от мышей с тяжелым комбинированным иммунодефицитом (SCID) устраняет репродуктивный дефицит у мышей tg epsilon 26 с дефицитом естественных клеток-киллеров. J Exp Med . 1998;187(2):217–223. |
39. | Ашкар А.А., Ди Санто Дж.П., Крой Б.А. Гамма-интерферон способствует инициации модификации сосудов матки, целостности децидуальной оболочки и созреванию естественных клеток-киллеров в матке во время нормальной мышиной беременности. J Exp Med . 2000;192(2):259–270. |
40. | Монк Дж.М., Леонард С., МакБей Б.А., Крой Б.А. Индукция модификации мышиной спиральной артерии рекомбинантным интерфероном-гамма человека. Плацента . 2005;26(10):835–838. |
41. | Манастер И., Газит Р. |
42. | Вигано П., Гаффури Б., Сомильяна Э., Инфантино М., Виньяли М., Ди Блазио А.М. Интерлейкин-10 продуцируется естественными клетками-киллерами матки человека, но не влияет на выработку ими интерферона-гамма. Моль Гум Репрод . 2001;7(10):971–977. |
43. | Дамбаева С.В., Дёрнинг М., Рознер А.Е., Голос Т.Г. Иммунофенотип и цитокиновый профиль децидуальных естественных клеток-киллеров макак-резус CD56bright и CD56dim. Биол Репрод . 2012;86(1):1–10. |
44. | Croonenberghs J, Bosmans E, Deboutte D, Kenis G, Maes M. Активация системы воспалительного ответа при аутизме. Нейропсихобиология . 2002; 45:1–6. |
45. | Дейкин Э., МакМахон Б. Воздействие вирусов и аутизм. Am J Эпидемиол . 1979; 109: 628–638. |
46. | Hagberg H, Mallard C. Влияние воспаления на развитие и уязвимость центральной нервной системы: обзор. Карр Опин Нейрол . 2005; 18: 117–123. |
47. | Хорниг М., Вайсенбок Х., Хорскрофт Н., Липкин В.И. Инфекционная модель повреждения нервной системы. Proc Natl Acad Sci . 1999; 96: 12101–12107. |
48. | Липкин В., Хорниг М. Микробиология и иммунология расстройств аутистического спектра. Компания Novartis обнаружила симптом . 2003; 251:129–143. |
49. | Малек-Ахмади П. Цитокины и этиопатогенез первазивных нарушений развития. Медицинские гипотезы . 2001;56(3):321–324. |
50. | Пардо К., Эберхарт К. Нейробиология аутизма. Мозговой Патол . 2007; 17: 434–447. |
51. | Паттерсон П. Инфекция матери: окно нейроиммунных взаимодействий в развитии мозга плода и психических заболеваниях. Curr Opin Neurobiol . 2002; 12:115–118. |
52. | Коричневый КАК. Пренатальная инфекция как фактор риска шизофрении. Шизофр Бык . 2006;32(2):200–202. |
53. | Браун А.С., Деркитс Э.Дж. Пренатальная инфекция и шизофрения: обзор эпидемиологических и трансляционных исследований. Am J Психиатрия . 2010;167(3):261–280. |
54. | Джонакайт Г. Влияние материнского воспаления на развитие нейронов: возможные механизмы. Int J Dev Neurosci . 2007; 25: 415–425. |
55. | Паттерсон PH. Инфицирование матери и участие иммунной системы в развитии аутизма. Тренды Мол Мед . 2011; 17: 389–394. |
56. | Белл М., Халленбек Дж. Влияние внутриутробного воспаления на развивающийся мозг крысы. J Neurosci Res . 2002; 70: 570–579. |
57. | Карви П., Чанг К., Липтон Дж., Линг З. Пренатальное воздействие липополисахарида бактериотоксина приводит к долгосрочной потере дофаминовых нейронов у потомства: потенциальная новая модель болезни Паркинсона . Передний Biosci . 2003;8:с826–с837. |
58. | Fatemi SH, Earle J, Kanodia R, et al. Пренатальная вирусная инфекция приводит к атрофии пирамидных клеток и макроцефалии во взрослом возрасте: значение для генеза аутизма и шизофрении. Клин Мол Нейробиол . 2002; 22: 25–33. |
59. | Hornig M, Solbrig M, Horscroft N, Weissenbock H, Lipkin W. Вирусная инфекция болезни Борна взрослых и новорожденных крыс: модели нервно-психических заболеваний. Curr Top Microbiol Immunol . 2001; 253:157–177. |
60. | Плетников М.В., Джонс М.Л., Рубин С.А., Моран Т.Х., Карбоне К.М. Крысиная модель расстройств аутистического спектра. Влияние генетического фона на индуцированное вирусом болезни Борна развитие поражения головного мозга. Ann NY Acad Sci . 2001; 939: 318–319. |
61. | Плетников М., Рубин С., Шварц Г., Моран Т., Карбон К. Персистирующая неонатальная инфекция вируса болезни Борна (BDV) головного мозга вызывает хронические эмоциональные аномалии у взрослых крыс. Физиол Поведение . 1999; 66: 823–831. |
62. | Ши Л., Фатеми С.Х., Сидуэлл Р.В., Паттерсон Ф.Х. Заражение матери гриппом вызывает заметные поведенческие и фармакологические изменения у потомства. |
63. | Smith SE, Li J, Garbett K, Mirnics K, Patterson PH. Активация материнского иммунитета изменяет развитие мозга плода посредством интерлейкина-6. Дж Нейроски . 2007;27(40):10695–10702. |
64. | Weissenbock H, Hornig M, Hickey W, Lipkin W. Активация микроглии и апоптоз нейронов у новорожденных крыс Льюиса, инфицированных борнавирусом. Мозговой патол . 2000; 10: 260–272. |
65. | Ланкастер К., Дитц Д., Моран Т., Плетников М. Аномальное социальное поведение у молодых и взрослых крыс, неонатально инфицированных вирусом болезни Борна. Поведение мозга Res . 2007; 176: 141–148. |
66. | Rousset CI, Chalon S, Cantagrel S, et al. Воздействие ЛПС на мать вызывает гипомиелинизацию внутренней капсулы и запрограммированную гибель клеток глубокого серого вещества у новорожденных крыс. |
67. | Дамманн О., Левитон А. Материнская внутриутробная инфекция, цитокины и повреждение головного мозга у недоношенных новорожденных. Педиатр Рез. . 1997; 42:1–8. |
68. | Conroy SM, Nguyen V, Quina LA, et al. Интерлейкин-6 вызывает потерю нейронов в развивающихся культурах гранулярных нейронов мозжечка. J Нейроиммунол . 2004; 155:43–54. |
69. | Гилмор Дж., Фредрик Дж., Вадламуди С., Лаудер Дж. Пренатальная инфекция и риск шизофрении: ИЛ-1бета, ИЛ-6 и ФНО-альфа ингибируют развитие дендритов кортикальных нейронов. Нейропсихофармакология . 2004; 29: 1221–1229. |
70. | Nawa H, Takei N. Недавний прогресс в моделировании иммунных воспалительных процессов при шизофрении на животных: влияние специфических цитокинов. |
71. | Samuelsson A, Jennische E, Hansson H, Holmang A. Пренатальное воздействие интерлейкина-6 приводит к воспалительной нейродегенерации в гиппокампе с NMDA/GABA(A) дисрегуляцией и нарушением пространственного обучения. Amer J Physiol Regul Integr Comp Phyusiol . 2006; 290: R1345–R1356. |
72. | Понцио Н.М., Серватиус Р., Бек К., Марзук А., Крайдер Т. Уровни цитокинов во время беременности влияют на иммунологические профили и нейроповеденческие модели потомства. Ann NY Acad Sci . 2007; 1107: 118–128. |
73. | Mandal M, Donnelly R, Elkabes S, et al. Иммунная стимуляция матери во время беременности формирует иммунологический фенотип потомства. Иммунитет к поведению мозга . 2013; 33:33–45. |
74. | Мандал М. |
75. | Баркер Д.Дж. Внутриутробное программирование болезней взрослых. Мол Мед Сегодня . 1995;1(9):418–423. |
76. | Бильбо С.Д., Шварц Дж.М. Раннее программирование мозга и поведения в более позднем возрасте: решающая роль иммунной системы. Front Behav Neurosci . 2009; 3:1–14. |
77. | Барретт Э.Г. Материнское влияние на передачу предрасположенности к астме. Пульм Фармакол Тер . 2008;21(3):474–484. |
78. | Bellinger DL, Lubahn C, Lorton D. Влияние стресса на иммунную функцию у матери и в раннем возрасте: актуальность для иммунотоксикологии. |
79. | Conrad ML, Ferstl R, Teich R, et al. Материнская передача сигналов TLR необходима для пренатальной защиты от астмы непатогенным микробом Acinetobacter lwoffii F78. J Exp Med . 2009;206(13):2869–2877. |
80. | Мандал М., Марзук А.С., Доннелли Р., Понцио Н.М. Преимущественное развитие клеток Th27 у потомства беременных мышей, подвергшихся иммуностимулированию. J Reprod Immunol . 2010;87(1–2):97–100. |
81. | Кешаван МС. Развитие, заболевание и дегенерация при шизофрении: единая патофизиологическая модель. J Психиатр Res . 1999;33(6):513–521. |
82. | Кешаван М.С., Хогарти Г.Э. Процессы созревания мозга и отсроченное начало при шизофрении. Дев Психопат . 1999;11(3):525–543. |
83. | Ponzio NM, Mandal M, Elkabes S, et al. Провоспалительный фенотип, вызванный стимуляцией материнского иммунитета во время беременности. В: Фицджеральд М., изд. Последние достижения в лечении расстройств аутистического спектра . Том 1. Риека: Технологии; 2013: 113–141. |
84. | Раманатан М., Понцио Н., Лимсон Ф., Шах С., Фернандес Х. Регуляция материнских цитокинов в патогенезе аутизма. В: Программа и тезисы 9-й ежегодной международной встречи по исследованию аутизма; 20–22 мая 2010 г.; Филадельфия, Пенсильвания. Аннотация 136.101. |
85. | Блашиц А., Хаттер Х., Дор GHLA. Экспрессия белков класса I в плаценте человека. Ранняя беременность . 2001;5(1):67–69. |
86. | Брауд В.М., Аллан Д.С., МакМайкл А.Дж. Функции неклассических MHC и молекул класса I, не кодируемых MHC. |
87. | Хант Дж.С., Эндрюс Г.К., Вуд Г.В. Нормальные трофобласты сопротивляются индукции HLA класса I. Дж Иммунол . 1987;138(8):2481–2487. |
88. | Хант Дж.С., Орр ХТ. HLA и распознавание матери и плода. FASEB J . 1992;6(6):2344–2348. |
89. | Claas FH, Gijbels Y, van der Velden-de Munck J, van Rood JJ. Индукция невосприимчивости В-клеток к ненаследственным материнским антигенам HLA в течение внутриутробной жизни. Наука . 1988; 241 (4874): 1815–1817. |
90. | Тилбургс Т., Шерджон С.А., ван дер Маст Б.Дж. и др. Несоответствие HLA-C плода и матери связано с активацией децидуальных Т-клеток и индукцией функциональных Т-регуляторных клеток. J Reprod Immunol . 2009;82(2):148–157. |
91. | Chen SJ, Liu YL, Sytwu HK. Иммунологическая регуляция беременности: от механизма к терапевтической стратегии иммуномодуляции. Клин Дев Иммунол . 2012;2012:258391. |
92. | Норонья Л.Е., Антчак Д.Ф. Материнские иммунные реакции на трофобласт: вклад лошади в иммунологию беременности. Am J Reprod Immunol . 2010;64(4):231–244. |
93. | Бейкер Дж.М., Бамфорд А.И., Антчак Д.Ф. Модуляция аллоспецифических ответов ЦТЛ во время беременности у непарнокопытных: иммунологический барьер для межвидовых спариваний? Дж Иммунол . 1999;162(8):4496–4501. |
94. | Фламинио М.Дж., Антчак Д.Ф. Ингибирование пролиферации и активации лимфоцитов: механизм, используемый инвазивным трофобластом лошадей, чтобы избежать материнского иммунного ответа. |
95. | Thellin O, Coumans B, Zorzi W, Igout A, Heinen E. Терпимость к фетоплацентарному «трансплантату»: десять способов поддержки ребенка в течение девяти месяцев. Карр Опин Иммунол . 2000;12(6):731–737. |
96. | Sykes L, MacIntyre DA, Yap XJ, Teoh TG, Bennett PR. Дихотомия Th2:th3 беременности и преждевременных родов. Медиаторы воспаления . 2012;2012:967629. |
97. | Wegmann TG, Lin H, Guilbert L, Mosmann TR. Двунаправленные взаимодействия цитокинов в отношениях матери и плода: является ли успешная беременность феноменом Th3? Иммунол Сегодня . 1993;14(7):353–356. |
98. | Шауат Г., Ассал Мелиани А., Мартал Дж. и др. IL-10 предотвращает естественную гибель плода в комбинации спаривания CBA × DBA/2, а локальный дефект продукции IL-10 в этой предрасположенной к аборту комбинации корректируется инъекцией IFN-tau in vivo. |
99. | Svensson L, Arvola M, Sallstrom MA, Holmdahl R, Mattsson R. Цитокины Th3 IL-4 и IL-10 не имеют решающего значения для завершения аллогенной беременности у мышей. J Reprod Immunol . 2001 г.; 51(1):3–7. |
100. | Fallon PG, Jolin HE, Smith P, et al. ИЛ-4 индуцирует характерные Th3-ответы даже при комбинированном отсутствии ИЛ-5, ИЛ-9и Ил-13. Иммунитет . 2002;17(1):7–17. |
101. | Рот И., Корри Д.Б., Локсли Р.М., Абрамс Дж.С., Литтон М.Дж., Фишер С.Дж. Цитотрофобласты плаценты человека продуцируют иммунодепрессивный цитокин интерлейкин 10. J Exp Med . 1996;184(2):539–548. |
102. | Jones CA, Finlay-Jones JJ, Hart PH. Цитокины типа 1 и типа 2 в децидуальной ткани человека на поздних сроках беременности. |
103. | Bennett WA, Lagoo-Deenadayalan S, Brackin MN, Hale E, Cowan BD. Экспрессия цитокинов на моделях трофобласта человека, оцененная методом полуколичественной полимеразной цепной реакции с обратной транскрипцией. Am J Reprod Immunol . 1996;36(5):285–294. |
104. | Мичимата Т., Сакаи М., Миядзаки С. и др. Снижение количества Т-хелперов 2 и Т-цитотоксических 2 клеток в местах имплантации происходит при необъяснимом рецидивирующем самопроизвольном аборте с нормальным хромосомным составом. Репродукция гула . 2003;18(7):1523–1528. |
105. | Гилмор Дж.С., Хансен В.Р., Миллер Х.К., Килан Дж.А., Сато Т.А., Митчелл М.Д. Влияние интерлейкина-4 на экспрессию и активность простагландин-эндопероксид H-синтазы-2 в клетках WISH, полученных из амниона. Дж Мол Эндокринол . |
106. | Килан Дж.А., Сато Т.А., Митчелл М.Д. Сравнительные исследования влияния интерлейкина-4 и интерлейкина-13 на продукцию цитокинов и простагландинов E2 клетками WISH, происходящими из амниона. Am J Reprod Immunol . 1998;40(5):332–338. |
107. | Гудвин В.Дж., Сато Т.А., Митчелл М.Д., Килан Дж.А. Противовоспалительное действие интерлейкина-4, интерлейкина-10 и трансформирующего фактора роста-бета на клетки плаценты человека in vitro. Am J Reprod Immunol . 1998;40(5):319–325. |
108. | Килан Дж.А., Марвин К.В., Сато Т.А., Коулман М., МакКован Л.М., Митчелл М.Д. Обилие цитокинов в тканях плаценты: свидетельство активации воспаления в гестационных оболочках при доношенных и преждевременных родах. Am J Obstet Gynecol . 1999;181(6):1530–1536. |
109. | Lindstrom TM, Bennett PR. Роль ядерного фактора каппа В в трудовой деятельности человека. Репродукция . 2005;130(5):569–581. |
110. | Эллиотт С.Л., Лаудон Дж.А., Браун Н., Слейтер Д.М., Беннетт П.Р., Салливан М.Х. IL-1beta и IL-8 в оболочках плода человека: изменения в зависимости от гестационного возраста, родов и условий культивирования. Am J Reprod Immunol . 2001;46(4):260–267. |
111. | Sakaguchi S, Sakaguchi N, Asano M, Itoh M, Toda M. Иммунологическая самотолерантность поддерживается активированными Т-клетками, экспрессирующими альфа-цепи рецептора IL-2 (CD25). Нарушение единого механизма самопереносимости вызывает различные аутоиммунные заболевания. Дж Иммунол . 1995 год; 155 (3): 1151–1164. |
112. | Кингсли К.И., Карим М., Бушелл А.Р., Вуд К.Дж. CD25+CD4+ регуляторные Т-клетки предотвращают отторжение трансплантата: CTLA-4- и IL-10-зависимая иммунорегуляция аллореакций. |
113. | Hori S, Nomura T, Sakaguchi S. Контроль развития регуляторных Т-клеток с помощью фактора транскрипции Foxp3. Наука . 2003;299(5609):1057–1061. |
114. | Sakaguchi S. Естественно возникающие CD4+ регуляторные Т-клетки для иммунологической самопереносимости и негативного контроля иммунных реакций. Анну Рев Иммунол . 2004; 22: 531–562. |
115. | Апостолу И., Сарухан А., Кляйн Л., фон Бемер Х. Происхождение регуляторных Т-клеток с известной специфичностью к антигену. Нат Иммунол . 2002;3(8):756–763. |
116. | Chen T, Darrasse-Jèze G, Bergot AS, et al. Самоспецифические Т-клетки, регулирующие память, защищают эмбрионы при имплантации мышам. Дж Иммунол . 2013;191(5):2273–2281. |
117. | Алувихаре В.Р., Калликурдис М., Бетц АГ. Регуляторные Т-клетки опосредуют материнскую толерантность к плоду. Нат Иммунол . 2004;5(3):266–271. |
118. | Moldenhauer LM, Diener KR, Thring DM, Brown MP, Hayball JD, Robertson SA. Перекрестная презентация антигенов мужской семенной жидкости вызывает активацию Т-клеток, чтобы инициировать женский иммунный ответ на беременность. Дж Иммунол . 2009;182(12):8080–8093. |
119. | Сайто С., Накашима А., Шима Т., Ито М. Th2/Th3/Th27 и парадигма регуляторных Т-клеток при беременности. Am J Reprod Immunol . 2010;63(6):601–610. |
120. | Лебер А., Телес А., Зенклуссен А.С. Регуляторные Т-клетки и их роль во время беременности. Am J Reprod Immunol . 2010;63(6):445–459. |
121. | Тай П., Ван Дж., Джин Х. и др. Индукция регуляторных Т-клеток физиологическим уровнем эстрогена. J Cell Physiol . 2008;214(2):456–464. |
122. | Zhao JX, Zeng YY, Liu Y. Фетальный аллоантиген отвечает за расширение пула регуляторных Т-клеток CD4(+)CD25(+) во время беременности. J Reprod Immunol . 2007;75(2):71–81. |
123. | Robertson SA, Guerin LR, Bromfield JJ, Branson KM, Ahlstrom AC, Care AS. Семенная жидкость стимулирует расширение пула регуляторных CD4+CD25+ Т-клеток и индуцирует толерантность к отцовским аллоантигенам у мышей. Биол Репрод . 2009;80(5):1036–1045. |
124. | Быстрый Р.С., Алувихаре В., Велч К.А., Калликурдис М., Бетц А.Г. В-клетки и профессиональные АПК рекрутируют регуляторные Т-клетки через CCL4. Нат Иммунол . 2001;2(12):1126–1132. |
125. | Schaniel C, Pardali E, Sallusto F, et al. Активированные мышиные В-лимфоциты и дендритные клетки продуцируют новый CC-хемокин, который избирательно действует на активированные Т-клетки. J Exp Med . 1998;188(3):451–463. |
126. | Тан Х.Л., Цистер Дж.Г. Повышающая регуляция хемокинов и активация привлечения Т-клеток созревающими дендритными клетками. Наука . 1999; 284(5415):819–822. |
127. | Иеллем А., Мариани М., Ланг Р. и др. Уникальный профиль хемотаксического ответа и специфическая экспрессия хемокиновых рецепторов CCR4 и CCR8 регуляторными Т-клетками CD4(+)CD25(+). J Exp Med . 2001;194(6):847–853. |
128. | Colantonio L, Iellem A, Sinigaglia F, D’Ambrosio D. Воздействующие на кожу CLA+ T-клетки и регуляторные CD25+ T-клетки представляют собой основные подмножества Т-клеток памяти периферической крови человека, мигрирующих в ответ к CCL1/I-309. |
129. | Шумахер А., Брахвиц Н., Зор С. и др. Хорионический гонадотропин человека привлекает регуляторные Т-клетки в плодно-материнскую среду на ранних сроках беременности человека. J Иммунол . 2009;182(9):5488–5497. |
130. | Зенклуссен АС. CD4(+)CD25+ Т-регуляторные клетки при беременности мышей. J Reprod Immunol . 2005;65(2):101–110. |
131. | Zenclussen AC, Gerlof K, Zenclussen ML, et al. Аномальная реактивность Т-клеток против отцовских антигенов при самопроизвольном аборте: адоптивный перенос индуцированных беременностью CD4+CD25+ Т-регуляторных клеток предотвращает отторжение плода в модели аборта у мышей. утра Дж. Патол . 2005;166(3):811–822. |
132. | Jamieson DJ, Theiler RN, Rasmussen SA. |
133. | Мор Г, Карденас И. Иммунная система во время беременности: уникальная сложность. Am J Reprod Immunol . 2010;63(6):425–433. |
134. | Муццио Д., Зигмунт М., Дженсен Ф. Роль гормонов, связанных с беременностью, в развитии и функционировании регуляторных В-клеток. Передний эндокринол (Лозанна) . 2014;5:39. |
135. | Polese B, Gridelet V, Araklioti E, Martens H, Perrier d’Hauterive S, Geenen V. Эндокринная среда и поляризация CD4 T-лимфоцитов во время беременности. Передний эндокринол (Лозанна) . 2014;5:106. |
136. | Racicot K, Kwon JY, Aldo P, Silasi M, Mor G. Понимание сложности иммунной системы во время беременности. Am J Reprod Immunol . |
137. | Шумахер А., Коста С.Д., Зенклуссен А.С. Эндокринные факторы, модулирующие иммунный ответ при беременности. Фронт Иммунол . 2014;5:196. |
138. | Шминки Д.Л., Гроер М. Имитация реакции на стресс: новая гипотеза о роли врожденной иммунной системы при беременности. Мед Гипотезы . 2014;82(6):721–729. |
139. | Zhang HJ, Patenaude V, Abenhaim HA. Материнские исходы при беременности, пораженной инфекциями, вызванными вирусом ветряной оспы: популяционное исследование 7,7 миллионов госпитализаций беременных. J Obstet Gynaecol Res . 2014;41(1):62–68. |
140. | Американский колледж акушеров и гинекологов. Обновленная информация об иммунизации и беременности: вакцинация против столбняка, дифтерии и коклюша. Мнение Комитета ACOG № 566. |
141. | Рабочая группа экспертов по иммунизации Американского колледжа акушеров и гинекологов (ACOG). Иммунизация и плановая акушерско-гинекологическая помощь . Вашингтон, округ Колумбия: ACOG; 2013. |
142. | Центры по контролю и профилактике заболеваний (CDC). Руководство по вакцинации беременных женщин. 2013. Консультативный комитет по практике иммунизации (ACIP) рекомендовал график иммунизации для лиц в возрасте от 0 до 18 лет 9 лет.0264 . Атланта, Джорджия: CDC; 2013. |
143. | Munoz FM, Weisman LE, Read JS, et al. Оценка безопасности у новорожденных от матерей, участвующих в клинических испытаниях вакцин, вводимых во время беременности. Клин Заражение Дис . 2014; 59 (Приложение 7): S415–S427. |
144. | Kraus TA, Engel SM, Sperling RS, et al. Характеристика иммунного фенотипа беременности: результаты исследования вирусного иммунитета и беременности (ВИП). J Клин Иммунол . 2012;32(2):300–311. |
145. | Радж Р.С., Бонни Э.А., Филипп М. Грипп, иммунная система и беременность. Reprod Sci . 2014;21(12):1434–1451. |
146. | Брабин Б.Дж., Ромагоса С., Абдельгалил С. и др. Больная плацента — роль малярии. Плацента . 2004;25(5):359–378. |
147. | Rogerson SJ, Hviid L, Duffy PE, Leke RFG, Taylor DW. Малярия при беременности: патогенез и иммунитет. Ланцет Infect Dis . 2007;7(2):105–117. |
148. | Ngo ST, Steyn FJ, McCobe PA. Половые различия в аутоиммунных заболеваниях. Передний нейроэндокринол . 2014;35(3):347–369. |
149. | . Биол Репрод . 2010;82(4):698–705. |
150. | Lee JH, Ulrich B, Cho J, Park J, Kim CH. Прогестерон способствует дифференцировке Т-клеток плода пуповинной крови человека в Т-регуляторные клетки, но подавляет их дифференцировку в клетки Th27. Дж Иммунол . 2011;187(4):1778–1787. |
151. | Хендерсон Т.А., Сондерс П.Т., Моффет-Кинг А., Грум Н.П., Кричли Х.О. Экспрессия стероидных рецепторов в естественных клетках-киллерах матки. J Clin Endocrinol Metab . 2003;88(1):440–449. |
152. | Косака К., Фудзивара Х., Тацуми К. и др. Хорионический гонадотропин человека (ХГЧ) активирует моноциты для выработки интерлейкина-8 по пути, отличному от системы лютеинизирующего гормона/рецептора ХГЧ. J Clin Endocrinol Metab . 2002;87(11):5199–5208. |
153. | Севьера Дж., Эль Коста Х., Табиаско Дж. и др. Цитомегаловирусная инфекция человека вызывает новые эффекторные функции децидуальных естественных клеток-киллеров. ПЛОС Патог . 2013;9(4):e1003257. |
154. | Габриэль Г., Арк ПК. Секс, иммунитет и грипп. J Заразить Dis . 2014; 209 (Приложение 3): S93–S99. |
155. | Parboosing R, Bao Y, Shen L, Schaefer CA, Brown AS. Гестационный грипп и биполярное расстройство у взрослого потомства. JAMA Психиатрия . 2013;70(7):677–685. |
156. | Браун А.С., Бегг М.Д., Гравенштейн С. и др. Серологические признаки пренатального гриппа в этиологии шизофрении. JAMA Психиатрия . 2004;61(8):774–780. |
157. | Lamont RF, Sobel JD, Carrington D, et al. |
158. | Мандельброт Л. Ветряная оспа плода – диагностика, лечение и исход. Пренат Диагн . 2012;32(6):511–518. |
159. | Baud D, Greub G. Внутриклеточные бактерии и неблагоприятные исходы беременности. Clin Microbiol Infect . 2011;17(9):1312–1322. |
160. | Уильямс Д., Данн С., Ричардсон А., Фрэнк Дж. Ф., Смит М.А. Динамика инвазии Listeria monocytogenes в ткань плода после оральной инокуляции беременным морским свинкам. J Пищевая защита . 2011;74(2):248–253. |
161. | Поульсен К.П., Чупрински С.Дж. Патогенез листериоза при беременности. Anim Health Res Rev . 2013;14(1):30–39. |
162. | Lamont RF, Sobel J, Mazaki-Tovi S, et al. Листериоз у беременных: систематический обзор. Дж Перинат Мед . 2011;39(3):227–236. |
163. | Роу Дж. Х., Эртельт Дж. М., Синь Л., Уэй С. С. Цитоплазматическое проникновение Listeria monocytogenes вызывает потерю плода путем нарушения толерантности плода, поддерживаемой материнскими регуляторными Т-клетками Foxp3+. ПЛОС Патог . 2012;8(8):e1002873. |
164. | Nguyen HT, Pandolfini C, Chiodini P, Bonati M. Туберкулезная помощь беременным женщинам: систематический обзор. BMC Infect Dis . 2014;14(617):1–10. |
165. | Sugarman J, Colvin C, Moran AC, Oxlade O. Туберкулез у беременных: оценка глобального бремени болезни. Ланцет Глоб Здоровье . 2014;2(12):e710–e716. |
166. | Бейтс М. |
167. | Деван П., Гомбер С., Дас С. Врожденный туберкулез: редкое проявление распространенного заболевания. Педиатр, детское здравоохранение . 2014;34(1):60–62. |
168. | Молина Р.Л., Диуф К., Нур Н.М. Туберкулез и акушер-гинеколог: глобальная перспектива. Rev Obstet Gynecol . 2013;6(3–4):174–181. |
169. | Beeson JG, Duffy PE. Иммунология и патогенез малярии при беременности. Curr Top Microbiol Immunol . 2005; 297: 187–227. |
170. | Адамс Уолдорф К.М., МакАдамс Р.М. Влияние инфекции во время беременности на развитие плода. Репродукция . 2013;146(5):R151–R162. |
171. | Li XL, Wei HX, Zhang H, Peng HJ, Lindsay DS. Метаанализ рисков неблагоприятных исходов беременности при инфекции Toxoplasma gondii . PLoS One . 2014;9(5):e97775. |
172. | Хань М., Цзян И., Лао К. и др. sHLA-G участвует в апоптозе децидуальных естественных клеток-киллеров после инфекции Toxoplasma gondii . Воспаление . 2014;37(5):1718–1727. |
173. | Miller DH, Fazekas F, Montalban X, Reingold SC, Trojano M. Беременность, пол и гормональные факторы при рассеянном склерозе. Мульт Склер . 2014;20(5):527–536. |
174. | Мурасе Дж. Э., Чан К. К., Гарите Т. Дж., Купер Д. М., Вайнштейн Г. Д. Гормональное влияние на псориаз во время беременности и после родов. Арка Дерматол . 2005;141(5):601–606. |
175. | Амин С. |
176. | Фридман Д.М., Дункансон Л.Дж., Гликштейн Дж., Буйон Дж.П. Обзор врожденной блокады сердца. Изображения Педиатр Кардиол . 2003;5(3):36–48. |
177. | Frize CJ, Williamson C. Эндокринные заболевания при беременности. Clin Med JR Coll Phys Lond . 2013;13(2):176–181. |
Повышение фагоцитарной активности полиморфноядерных лейкоцитов при беременности
ScienceDirect
Registersign в
View PDF
- Доступ через Ваше учреждение
Том 57, выпуск 1, октябрь 1994, страница 43-46
HTTTP. -2243(94)
Многие иммунологические параметры угнетаются во время беременности. По этой причине была проведена оценка фагоцитарной активности, представляющей неспецифический иммунитет, полиморфноядерных лейкоцитов беременных. Клетки выделяли из гепаринизированной венозной крови беременных женщин со сроком гестации 10 и более недель и небеременных женщин (контроль) в возрасте 20–30 лет. Полученные результаты свидетельствуют о том, что фагоцитоз инертных частиц (латексных шариков) существенно не меняется при беременности. Однако присоединение, проглатывание и переваривание Candida albicans значительно увеличивалась во время беременности, при этом наибольшее отличие от контроля наблюдалось во втором триместре. Эти данные свидетельствуют о том, что фагоцитарная активность у беременных повышена и что этот повышенный неспецифический иммунитет может частично компенсировать ослабленный специфический иммунитет матери-хозяина.
По этой причине была проведена оценка фагоцитарной активности, представляющей неспецифический иммунитет, полиморфноядерных лейкоцитов беременных. Клетки выделяли из гепаринизированной венозной крови беременных женщин со сроком гестации 10 и более недель и небеременных женщин (контроль) в возрасте 20–30 лет. Полученные результаты свидетельствуют о том, что фагоцитоз инертных частиц (латексных шариков) существенно не меняется при беременности. Однако присоединение, проглатывание и переваривание Candida albicans значительно увеличивалась во время беременности, при этом наибольшее отличие от контроля наблюдалось во втором триместре. Эти данные свидетельствуют о том, что фагоцитарная активность у беременных повышена и что этот повышенный неспецифический иммунитет может частично компенсировать ослабленный специфический иммунитет матери-хозяина.
Ссылки (28)
- E Ортега и др.
Влияние стресса физической активности на фагоцитарный процесс перитонеальных макрофагов старых морских свинок
Mech Aging Dev
(1992)
- T Mori и др.

Ингибирующее действие прогестерона и 20α-гидроксипрегн-4-ен-3-она на индуцированную фитогемагглютинином трансформацию лимфоцитов человека
Влияние трофобласта на иммунный статус женщин
Am J Obstet Gyecol
(1973)
- M De la Fuente
Изменения функции макрофагов при старении
Comp Biochem Physiol
(1985)
- J Castilla et al.
Снижение уровня циркулирующих CD4
+ Т-лимфоцитов при нормальной беременности человека
J Reprod Immunol
(1989)
- R Finn et al.
Иммунологические реакции при беременности и выживаемость гомотрансплантата плода
Br Med J
(1972)
- В Шридама и др.
Снижение уровня Т-хелперов: возможная причина иммунодефицита при беременности
Угнетение реакции трансформации лимфоцитов на микробные антигены и фитогемагглютинин при беременности
J Clin Invest
(1983)
- JI Gallin
Воспаление
- B Бьоркестен и др.

Функция полиморфноядерных лейкоцитов во время беременности
Scand J Immunol
(1978)
Микрометодика изучения хемилюминесцентного ответа фагоцитов при беременности
J Reticuloendothel Soc
(1992)
Исследование неспецифического иммунитета у беременных: усиление хемилюминесцентного ответа фагоцитов периферической крови
Am J Reprod Immunol Microbiol
(1987)
Корреляция между антимикробной активностью и содержанием пероксидазы в лейкоцитах
Nature
(1973)
Фагоцитарная функция нейтрофилов крови у малоподвижных молодых людей после физической нагрузки
Int J Sports Med
(1991)
Стресс-физиология хозяина и гемопаразитарная инфекция Trypanosoma влияют на врожденный иммунитет у белянки (Bettongia penicillata)
2016, Сравнительная иммунология, микробиология и инфекционные заболевания
Понимание функции иммунной системы имеет решающее значение для сохранения дикой природы в связи с угрозами инфекционных заболеваний, особенно при угрозе виды, уязвимые к стрессу, ослаблению иммунитета и инфекциям.
 Однако лишь немногие исследования изучают стресс, иммунную функцию и инфекции у диких животных. Мы использовали протокол проточной цитометрии, разработанный для младенцев человека, для оценки фагоцитоза, ключевого компонента врожденного иммунитета, у сумчатого животного, находящегося под угрозой исчезновения (9).0101 Bettongia penicillata ). Было исследовано влияние физиологического стресса и инфекции Trypanosoma на фагоцитоз. Образцы крови и фекалий были собраны у войли в вольере в течение трех месяцев. Статус трипаносомы определяли с помощью ПЦР. Метаболиты фекального кортизола (FCM) определяли количественно с помощью иммуноферментного анализа. Средний измеренный фагоцитоз был >90%. Взаимодействие между полом и ФКМ влияло на процент фагоцитирующих лейкоцитов, возможно, отражая влияние половых гормонов и глюкокортикоидов. Взаимодействие между Статус Trypanosoma и FCM влияли на индекс фагоцитоза, предполагая, что физиология стресса и инфекционный статус влияют на врожденный иммунитет.
Однако лишь немногие исследования изучают стресс, иммунную функцию и инфекции у диких животных. Мы использовали протокол проточной цитометрии, разработанный для младенцев человека, для оценки фагоцитоза, ключевого компонента врожденного иммунитета, у сумчатого животного, находящегося под угрозой исчезновения (9).0101 Bettongia penicillata ). Было исследовано влияние физиологического стресса и инфекции Trypanosoma на фагоцитоз. Образцы крови и фекалий были собраны у войли в вольере в течение трех месяцев. Статус трипаносомы определяли с помощью ПЦР. Метаболиты фекального кортизола (FCM) определяли количественно с помощью иммуноферментного анализа. Средний измеренный фагоцитоз был >90%. Взаимодействие между полом и ФКМ влияло на процент фагоцитирующих лейкоцитов, возможно, отражая влияние половых гормонов и глюкокортикоидов. Взаимодействие между Статус Trypanosoma и FCM влияли на индекс фагоцитоза, предполагая, что физиология стресса и инфекционный статус влияют на врожденный иммунитет.
Воспаление и преэклампсия
2006, Семинары по фетальной и неонатальной медицине
Преэклампсия является распространенным и потенциально опасным нарушением беременности у человека. Материнский синдром гипертонии, протеинурии и отека является частью тяжелой системной воспалительной реакции, которая включает активацию лейкоцитов и эндотелиальных клеток. Хотя происхождение преэклампсии остается неясным, основной причиной является неспособность обеспечить адекватное кровоснабжение плаценты, что приводит к плацентарному окислительному стрессу. Это приводит к избыточному высвобождению плацентарных факторов, таких как остатки синцитиотрофобласта или растворимая fms-подобная тирозинкиназа-1 (sFlt-1), растворимый рецептор сосудистого эндотелиального фактора роста (VEGF), в кровоток матери, где они запускают воспалительная реакция и эндотелиальная дисфункция. В качестве альтернативы преэклампсия может развиться при наличии нормальной плаценты у женщин, предрасположенных к системному воспалению, например, с хроническими сердечно-сосудистыми заболеваниями или диабетом.
 Хотя клиническое лечение преэклампсии в настоящее время не включает противовоспалительные средства, текущие исследования сосредоточены на способах уменьшения воспаления и окислительного стресса.
Хотя клиническое лечение преэклампсии в настоящее время не включает противовоспалительные средства, текущие исследования сосредоточены на способах уменьшения воспаления и окислительного стресса.Митогенный эффект встречающегося в природе повышенного уровня пролактина в плазме на кольцевидные лимфоциты
1997, Развивающая и сравнительная иммунология
3 Включение H-тимидина в изолированные кольцевидные лимфоциты in vitro использовали в качестве меры пролиферации лимфоцитов. Лимфоциты, взятые у голубей с повышенной концентрацией пролактина в плазме, продемонстрировали значительно повышенное включение 3 Н-тимидина. Инкубация in vitro с митогенами значительно увеличивала включение 3 Н-тимидин в лимфоциты неразмножающихся голубей. Однако аналогичная обработка лимфоцитов, взятых у голубей, у которых был повышенный уровень пролактина в плазме, не вызывала дальнейшего увеличения индекса стимуляции.
Антиген вызывал значительное увеличение включения 3 H-тимидина у неразмножающихся голубей.
 Введение антигена также приводило к продукции специфических антител. Титр специфических агглютининов против эритроцитов человека (HRBC) был самым высоким у тех птиц, которые также имели повышенный уровень пролактина в плазме, достигая значительного значения в группе инкубирующих голубей с естественными повышенными концентрациями пролактина в плазме. Представленные здесь результаты могут иметь отношение к нашему пониманию роли гормонов, таких как пролактин, в активации лимфоцитов.
Введение антигена также приводило к продукции специфических антител. Титр специфических агглютининов против эритроцитов человека (HRBC) был самым высоким у тех птиц, которые также имели повышенный уровень пролактина в плазме, достигая значительного значения в группе инкубирующих голубей с естественными повышенными концентрациями пролактина в плазме. Представленные здесь результаты могут иметь отношение к нашему пониманию роли гормонов, таких как пролактин, в активации лимфоцитов.Беременность адаптирует эндотоксин-индуцированный ответ моноцитов и нейтрофилов в материнском кровотоке
2022, Inflammation Research
Специфические врожденные иммунные клетки поглощают фетальный антиген и проявляют гомеостатические фенотипы в материнском кровотоке
Последние достижения в иммунологии верблюдов
2021, Frontiers in Immunology
Посмотреть все статьи со ссылками на Scopus
Исследовательская статья
Влияние состояния организма до отела и уровня кормления перед отелом на экспрессию генов в циркулирующих нейтрофилах
Journal of Dairy Science, Volume 100, Issue 3, 2017, pp.
 иммунологические изменения связаны с отелом и началом лактации. В результате коровы, находящиеся в переходном периоде между стельностью и лактацией, подвергаются большему риску метаболических и инфекционных заболеваний. Способность нейтрофилов формировать эффективный иммунный ответ на инфекцию имеет решающее значение для ее разрешения, и все больше данных указывает на то, что питание до отела влияет на послеродовую функцию нейтрофилов. Цели настоящего исследования заключались в изучении влияния 2 показателей состояния тела до отела (BCS; 4 против 5 по 10-балльной шкале) и 2 уровней кормления (75 против 125% расчетных потребностей в поддержании) на экспрессию генов. в циркулирующих нейтрофилах. Мы выделили РНК из нейтрофилов коров (n = 45) в 5 временных точках в течение переходного периода: до отела (-1 неделя), в день отела (d = 0) и после отела на 1, 2 и 4 неделе. ПЦР на транскриптазу с специально разработанными парами праймеров и химическим составом библиотеки Roche Universal Probe Library (Roche, Базель, Швейцария) в сочетании с микрофлюидными чипами с интегрированной жидкостной схемой (96,96 динамического массива) использовали для количественной оценки экспрессии 78 генов, участвующих в функции нейтрофилов, и 18 эндогенных контрольных генов.
иммунологические изменения связаны с отелом и началом лактации. В результате коровы, находящиеся в переходном периоде между стельностью и лактацией, подвергаются большему риску метаболических и инфекционных заболеваний. Способность нейтрофилов формировать эффективный иммунный ответ на инфекцию имеет решающее значение для ее разрешения, и все больше данных указывает на то, что питание до отела влияет на послеродовую функцию нейтрофилов. Цели настоящего исследования заключались в изучении влияния 2 показателей состояния тела до отела (BCS; 4 против 5 по 10-балльной шкале) и 2 уровней кормления (75 против 125% расчетных потребностей в поддержании) на экспрессию генов. в циркулирующих нейтрофилах. Мы выделили РНК из нейтрофилов коров (n = 45) в 5 временных точках в течение переходного периода: до отела (-1 неделя), в день отела (d = 0) и после отела на 1, 2 и 4 неделе. ПЦР на транскриптазу с специально разработанными парами праймеров и химическим составом библиотеки Roche Universal Probe Library (Roche, Базель, Швейцария) в сочетании с микрофлюидными чипами с интегрированной жидкостной схемой (96,96 динамического массива) использовали для количественной оценки экспрессии 78 генов, участвующих в функции нейтрофилов, и 18 эндогенных контрольных генов. Статистическую значимость между временными точками определяли с использованием повторных измерений ANOVA с коррекцией множественного тестирования Тьюки-Крамера для определения эффектов лечения в течение нескольких недель. BCS перед отелом изменяет воспалительное состояние нейтрофилов со значительным увеличением общей экспрессии генов противомикробных пептидов ( BNBD4 и DEFB10 ) и противовоспалительного цитокина 9.0101 IL10 , и значительно сниженная экспрессия провоспалительного цитокина IL23A у более худых коров (BCS 4) по сравнению с коровами, отевшими с BCS 5. Уровень кормления зависел от времени на экспрессию генов; например, повышенная экспрессия генов, участвующих в синтезе лейкотриенов ( PLA2G4A и ALOX5AP ), наблюдалась только через 1 неделю после отела у коров, перекормленных (125% потребности) перед отелом, по сравнению с теми, у которых было 75% поддерживающей потребности. Результаты показывают, что состояние организма перед отелом и изменения в предродовой энергии приводят к изменению экспрессии генов циркулирующих нейтрофилов, что подчеркивает важность питания коров в переходный период для здоровья в послеродовой период.
Статистическую значимость между временными точками определяли с использованием повторных измерений ANOVA с коррекцией множественного тестирования Тьюки-Крамера для определения эффектов лечения в течение нескольких недель. BCS перед отелом изменяет воспалительное состояние нейтрофилов со значительным увеличением общей экспрессии генов противомикробных пептидов ( BNBD4 и DEFB10 ) и противовоспалительного цитокина 9.0101 IL10 , и значительно сниженная экспрессия провоспалительного цитокина IL23A у более худых коров (BCS 4) по сравнению с коровами, отевшими с BCS 5. Уровень кормления зависел от времени на экспрессию генов; например, повышенная экспрессия генов, участвующих в синтезе лейкотриенов ( PLA2G4A и ALOX5AP ), наблюдалась только через 1 неделю после отела у коров, перекормленных (125% потребности) перед отелом, по сравнению с теми, у которых было 75% поддерживающей потребности. Результаты показывают, что состояние организма перед отелом и изменения в предродовой энергии приводят к изменению экспрессии генов циркулирующих нейтрофилов, что подчеркивает важность питания коров в переходный период для здоровья в послеродовой период.
Исследовательская статья
Прекондиционирование Toll-подобным рецептором 3 повышает терапевтическую эффективность мезенхимальных стромальных клеток пуповины в модели колита, индуцированного декстрансульфатом натрия
Cytotherapy, Volume 18, Issue 5, 2016, pp. 630 -641
Иммуномодулирующие свойства мезенхимальных стромальных клеток, полученных из пуповины человека (UCMSCs), можно дифференцированно модулировать агонистами толл-подобных рецепторов (TLR). Здесь терапевтическая эффективность короткого предварительного кондиционирования TLR3 и TLR4 UCMSC оценивалась при колите, вызванном декстрансульфатом натрия (DSS), у мышей. Новизна этого исследования заключается в том, что, хотя модуляция активности МСК человека с помощью TLR не является новой концепцией, это первый случай, когда короткое предварительное кондиционирование TLR было проведено на мышиной воспалительной модели острого колита.
Мышей C57BL/6 подвергали воздействию 2,5% декстрансульфата натрия (DSS) в питьевой воде ad libitum в течение 7 дней.
 В дни 1 и 3 мышам внутрибрюшинно вводили 1 × 10 6 необработанных UCMSC или предварительно кондиционированных TLR3 и TLR4 UCMSC. UCMSC предварительно кондиционировали поли(I:C) для TLR3 и LPS для TLR4 в течение 1 часа при 37°C и 5% CO 2 . Мы ежедневно оценивали клинические признаки заболевания и массу тела. В конце эксперимента оценивали длину толстой кишки и гистологические изменения.
В дни 1 и 3 мышам внутрибрюшинно вводили 1 × 10 6 необработанных UCMSC или предварительно кондиционированных TLR3 и TLR4 UCMSC. UCMSC предварительно кондиционировали поли(I:C) для TLR3 и LPS для TLR4 в течение 1 часа при 37°C и 5% CO 2 . Мы ежедневно оценивали клинические признаки заболевания и массу тела. В конце эксперимента оценивали длину толстой кишки и гистологические изменения.UCMSC, предварительно кондиционированные поли(I:C), значительно улучшали клиническую и гистопатологическую тяжесть колита, индуцированного DSS, по сравнению с UCMSC или предварительно кондиционированными LPS. Напротив, инфузия предварительно кондиционированных LPS UCMSC значительно увеличивала клинические признаки заболевания, укорочение толстой кишки и гистологический индекс заболевания при колите, вызванном DSS.
Эти результаты показывают, что короткое предварительное кондиционирование TLR3 in vitro поли(I:C) повышает терапевтическую эффективность UCMSC, что является крупным прорывом в разработке улучшенных методов лечения пациентов с воспалительными заболеваниями кишечника.

Исследовательская статья
ORGMA: Надежная оппортунистическая маршрутизация с градиентной переадресацией для сетей MANET
Компьютерные сети, том 131, 2018 г., стр. 52–64 специальные сети. Однако эти протоколы маршрутизации по-прежнему обеспечивают ограниченную производительность в динамических средах мобильных одноранговых сетей (MANET). В этой статье мы рассмотрим репрезентативные протоколы маршрутизации и оценим их производительность с помощью моделирования NS-3, чтобы выявить их основные недостатки. Основываясь на наших наблюдениях, мы разрабатываем надежный и практичный протокол оппортунистической маршрутизации для сетей MANET, названный 9.0101 ОРГМА . Мы применяем подход градиентной переадресации, при котором отправитель просто передает пакет, а получатели принимают решение о маршрутизации. Наш вклад включает использование мгновенного отношения сигнал-шум (SNR) для стоимости маршрутизации и разработку облегченного управления затратами на основе лавинной рассылки.
 Они позволяют ORGMA достигать высокого коэффициента доставки пакетов в динамичных средах MANET. С помощью моделирования NS-3 мы оцениваем ORGMA по сравнению с другими схемами маршрутизации, и результаты показывают, что ORGMA не только значительно превосходит современные схемы маршрутизации, но и достигает производительности, близкой к идеальной схеме маршрутизации с глобальной информацией.
Они позволяют ORGMA достигать высокого коэффициента доставки пакетов в динамичных средах MANET. С помощью моделирования NS-3 мы оцениваем ORGMA по сравнению с другими схемами маршрутизации, и результаты показывают, что ORGMA не только значительно превосходит современные схемы маршрутизации, но и достигает производительности, близкой к идеальной схеме маршрутизации с глобальной информацией.Исследовательская статья
Синдром сепсиса, инфекции кровотока и инфекции, связанные с устройствами
Медицинские клиники Северной Америки, том 96, выпуск 6, 2012 г., стр. 1203-1223
Научная статья
Транзиторная гипотироксинемия недоношенных и проблемное поведение в молодом возрасте был связан с последующими нарушениями развития нервной системы.
 О поведенческих исходах во взрослом возрасте после THoP никогда не сообщалось.
О поведенческих исходах во взрослом возрасте после THoP никогда не сообщалось.Чтобы выяснить, существует ли связь между THoP и проблемным поведением в молодом взрослом возрасте.
Это исследование было частью последующего наблюдения за 19-летними субъектами, родившимися очень недоношенными (т. е. <32 недель) и/или с очень низкой массой тела при рождении (т. е. <1500 г) в рамках Проекта по недоношенности и Когорта младенцев с малым весом для гестационного возраста (POPS). Мы включили 468 субъектов когорты POPS; из которых 123 имели THoP. Концентрации тироксина (Т4) были получены в рамках национальной программы неонатального скрининга на врожденный гипотиреоз. THoP определяли как концентрацию T4 <-3 SD (приблизительно 60 нмоль/л).
В возрасте 19 лет поведение оценивалось с использованием Самоотчета молодых взрослых и Контрольного списка поведения молодых взрослых для родителей.
THoP был связан с увеличением в 1,8 (95% доверительный интервал (ДИ): 1,01–3,4) −кратного увеличения вероятности интернализирующего поведения, о котором сообщают сами, а также с увеличением в 1,9 (95% ДИ: 1,1–3,1) −кратного увеличения вероятность общего проблемного поведения, о котором сообщают родители.

- Исследовательская статья 900 внутрибрюшного давления на уровне сенсорного блока при однократной спинномозговой анестезии при кесаревом сечении: обсервационное исследование
Международный журнал акушерской анестезии, том 24, выпуск 1, 2015 г., стр. 35-40
Считается, что повышение внутрибрюшного давления во время беременности влияет на интратекальное распространение препарата. Однако это предположение остается в значительной степени непроверенным. Цель этого проспективного исследования состояла в том, чтобы оценить связь между внутрибрюшным давлением и максимальным уровнем сенсорного блока у рожениц, находящихся под спинальной анестезией при кесаревом сечении.
Однако это предположение остается в значительной степени непроверенным. Цель этого проспективного исследования состояла в том, чтобы оценить связь между внутрибрюшным давлением и максимальным уровнем сенсорного блока у рожениц, находящихся под спинальной анестезией при кесаревом сечении.
Были включены роженицы, перенесшие плановое кесарево сечение с однократной спинальной анестезией с использованием гипербарического бупивакаина 12,5 мг. Внутрибрюшное давление измеряли с помощью мочевого катетера после установления сенсорного блока Т4 и в конце операции в положении лежа на спине с наклоном влево на 10°. Мы записывали демографические данные, описательные характеристики беременности, самооценку прибавки в весе и веса новорожденного. В качестве вторичных результатов мы оценивали начало сенсорного блока, максимальный сенсорный блок, двигательный блок, количество гипотензивных эпизодов, потребность в жидкости и эфедрине, время до первой потребности в анальгетиках, время до однократного восстановления моторного блока и побочные эффекты.
Среднее значение максимального уровня сенсорной блокады составило T2 у 117 рожениц. Медиана [межквартильный диапазон] предоперационного и послеоперационного внутрибрюшного давления составляла 13 [11–16] и 9 [6–10] мм рт. ст. соответственно. Никакой связи между максимальным уровнем сенсорного блока и внутрибрюшным давлением перед разрезом не наблюдалось ( P = 0,83). Вес был связан с внутрибрюшным давлением до разреза с предполагаемым отношением шансов 1,04 на кг (99,4% ДИ: 1,00–1,08). Выявлена умеренная корреляция между предоперационным и послеоперационным внутрибрюшным давлением с коэффициентом корреляции Спирмена 0,67 (9).9,5% ДИ: 0,5–0,79). Не было выявлено связи между внутрибрюшным давлением до разреза и вторичными исходами.
У рожениц внутрибрюшное давление не было связано с распространением спинальной блокады, временем начала блокады, выздоровлением или побочными эффектами.
