Перивентрикулярная область эхогенность повышена: Перивентрикулярная зона повышенной эхогености — Вопрос педиатру
перивентрикулярная область — 23 рекомендаций на Babyblog.ru
Причина ДЦП и других повреждений ЦНС в индукции и стимуляции родов.
Индукция и стимуляция родов – угроза повреждения ЦНС рождающегося ребёнка.
Никольский А.В.,
кандидат медицинских наук,
невролог
«Плод как пациент»
(Девиз Всемирного конгресса перинатологов, Амстердам, 1998г.)
В 21 век акушеры нашей страны вошли без общепризнанной, научно доказанной теории родового процесса (1*, с.3). Можно ли принимать роды, не зная, почему и за счёт каких процессов в организме беременной и плода они происходят?
В 20 веке до 50-х годов за границей и до начала 60-х годов в нашей стране акушеры использовали практический опыт, накопленный веками при приёме родов. Например: акушеры считали неразумным разрыв околоплодной оболочки (амниотомия) до того, как головка плода войдёт в полость малого таза (в нижний сегмент матки), и во время родов старались сохранить плодный пузырь как можно дольше с тем, чтобы уменьшить риск внутриматочной инфекции. В наше время эти и другие положения были полностью изменены. Появился так называемый принцип «активного ведения родов» или «программированные и индуцированные (искусственно вызванные) роды», когда врач-акушер каждой роженице составляет программу ведения родов, включающую «точную» диагностику сроков и признаков начала родов, раннюю амниотомию (вскрытие плодного пузыря), назначение простагландинов и (или) ламинарий для «созревания» шейки матки и индукции родов, антипрогестагенов и, при необходимости, окситоцина, и «постоянное» медицинское наблюдение за состоянием роженицы и плода. (2*, с. 39-40)
В наше время эти и другие положения были полностью изменены. Появился так называемый принцип «активного ведения родов» или «программированные и индуцированные (искусственно вызванные) роды», когда врач-акушер каждой роженице составляет программу ведения родов, включающую «точную» диагностику сроков и признаков начала родов, раннюю амниотомию (вскрытие плодного пузыря), назначение простагландинов и (или) ламинарий для «созревания» шейки матки и индукции родов, антипрогестагенов и, при необходимости, окситоцина, и «постоянное» медицинское наблюдение за состоянием роженицы и плода. (2*, с. 39-40)
Человечество активно росло в численности, прежде всего за счёт многодетных семей. Вряд ли бы это произошло, если бы роды в прошедшие века несли выраженную опасность роженицам и их детям. Да, детская смертность до 1 года жизни была высокой из-за гибели детей после рождения от заболеваний дыхательных путей и желудочно-кишечных инфекций (гигиена была низкой, и не было антибиотиков). С конца 20 века основной показатель уровня развития медицины в стране оценивается по смертности детей в ранний неонатальный период (до 3-х недель жизни новорожденного), а не до года жизни. Этот показатель у нас в несколько раз хуже, чем в развитых странах.
Этот показатель у нас в несколько раз хуже, чем в развитых странах.
Второй показатель, связанный прежде всего, как и предыдущий, с качеством акушерской помощи в родах – это показатель здоровья ребёнка к году жизни (ПЗ). У 712 на каждую 1000 детей до 1 года неврологами в детских поликлиниках С.-Петербурга в 2000г. выявлены нарушения развития ЦНС (3*, с.3). Из 1 415 799 детей, родившихся живыми в России в 2005г., среди доношенных ПЗ составил 59,3% (839 856 детей). 40,7% – 575 943 ребёнка к году жизни оказались больны, из них около 80 % (более 46 тысяч) – это дети с нарушениями развития ЦНС. 5% от всех родившихся составили недоношенные (76 662 ребёнка), из них здоровыми к году жизни были лишь 3,3% (1 556 детей). Т.е. больны к году жизни, прежде всего по нарушениям ЦНС, оказались -97,7% или 75 106 детей, родившихся недоношенными (4*).
Как видно из статистических данных, смена приоритетов акушерами нашей страны в середине 60-х годов 20 века – внедрение активного ведения родов и программирование и индуцирование родов, привела к тому, что основные показатели качества акушерской помощи в нашей стране совершенно не отвечают вызову времени, когда с резким падением рождаемости (и многодетности) будущее нашей страны (уровень науки, спортивных достижений, обороноспособности и проч. ) напрямую зависит от здоровья немногочисленного рождающегося молодого поколения. Несмотря на важность проблемы, на съездах, конгрессах, форумах, в периодической печати акушеров редко обсуждаются вопросы связанные с родами: подготовки шейки матки к родам, методы регуляции родов, причины нарушений сократительной деятельности матки (5*, с.7) и совсем отсутствует обсуждение биомеханизма родов (1*, с.60 и с.97). Абсолютное большинство акушеров работают с убеждением, что «управлять» родовым процессом можно и нужно и не зная тонкостей биомеханики родов (механизма раскрытия шейки матки и продвижения плода по родовому каналу) (1*, с.4).
) напрямую зависит от здоровья немногочисленного рождающегося молодого поколения. Несмотря на важность проблемы, на съездах, конгрессах, форумах, в периодической печати акушеров редко обсуждаются вопросы связанные с родами: подготовки шейки матки к родам, методы регуляции родов, причины нарушений сократительной деятельности матки (5*, с.7) и совсем отсутствует обсуждение биомеханизма родов (1*, с.60 и с.97). Абсолютное большинство акушеров работают с убеждением, что «управлять» родовым процессом можно и нужно и не зная тонкостей биомеханики родов (механизма раскрытия шейки матки и продвижения плода по родовому каналу) (1*, с.4).
У наших акушеров появились мощные по действию на матку и её шейку препараты: с середины 60-х годов 20 века синтетический окситоцин, с 70-х г.г. синтетические простагландины, с 80-х антипрогестагены, ламинарии и др. Причём сразу отметим, что естественные простагландины групп Е и F, естественный окситоцин – метаболит (продукт превращений в организме) гормона гипофиза вазопрессина, взаимодействуют и регулируются множеством других биологически активных веществ и гормонов в организме беременной и плода. То есть синтетические простагландины, антигестагены и окситоцин не могут вызывать роды и схватки, соответствующие физиологическим (нормальным) родам и схваткам, так как эти синтетические препараты не являются копиями натуральных простагландинов и окситоцина. Эти препараты вызывают искусственный, патологический родовой процесс, при котором меняются нормальные (физиологические) показатели (параметры) кровообращения (гемодинамики) матки в родах со всеми вытекающими от этого последствиями, в первую очередь, для плода (гипоксия, нарушение кровообращения, повреждение ЦНС) (1*, с.189). При применении этих препаратов часто происходит преждевременное излитие околоплодных вод без готовой к родам шейки матки, развивается первичная и вторичная слабость родовой деятельности. Но в большинстве случаев индуцирование родов с искусственной (простагландинами, антипрогестагенами, ламинариями и др.) подготовкой шейки матки приводит к стремительным и быстрым родам с силовым преодолением родовых путей, со «штурмовыми» характеристиками прохождения предлежащей части плода по родовому каналу, глубокими разрывами шейки матки.
То есть синтетические простагландины, антигестагены и окситоцин не могут вызывать роды и схватки, соответствующие физиологическим (нормальным) родам и схваткам, так как эти синтетические препараты не являются копиями натуральных простагландинов и окситоцина. Эти препараты вызывают искусственный, патологический родовой процесс, при котором меняются нормальные (физиологические) показатели (параметры) кровообращения (гемодинамики) матки в родах со всеми вытекающими от этого последствиями, в первую очередь, для плода (гипоксия, нарушение кровообращения, повреждение ЦНС) (1*, с.189). При применении этих препаратов часто происходит преждевременное излитие околоплодных вод без готовой к родам шейки матки, развивается первичная и вторичная слабость родовой деятельности. Но в большинстве случаев индуцирование родов с искусственной (простагландинами, антипрогестагенами, ламинариями и др.) подготовкой шейки матки приводит к стремительным и быстрым родам с силовым преодолением родовых путей, со «штурмовыми» характеристиками прохождения предлежащей части плода по родовому каналу, глубокими разрывами шейки матки. Плод при этом нередко травмируется (6*, с.56). Голова плода при искусственно вызванных или ускоренных схватках не успевает подготовиться для прохождения костей малого таза. Кости черепа и швы между ними у плода хрящевые и могут менять свою конфигурацию при прохождении родового канала. При стимуляции родов голова плода сдавливается так быстро, что резко повышается внутричерепное давление, нарушается венозный отток и артериальный приток крови в головном мозге, возникают участки отёка головного мозга, ишемии и кровоизлияния.
Плод при этом нередко травмируется (6*, с.56). Голова плода при искусственно вызванных или ускоренных схватках не успевает подготовиться для прохождения костей малого таза. Кости черепа и швы между ними у плода хрящевые и могут менять свою конфигурацию при прохождении родового канала. При стимуляции родов голова плода сдавливается так быстро, что резко повышается внутричерепное давление, нарушается венозный отток и артериальный приток крови в головном мозге, возникают участки отёка головного мозга, ишемии и кровоизлияния.
Крицкая И.А. с соавт., проводя НСГ (нейросонографию) новорожденным на 3 день после родов, выявила в огромном количестве сочетание перивентрикулярной лейкомаляции (ишемия и отёк головного мозга вокруг желудочков мозга) с пери- (там же где отёк) и(или) интравентрикулярными (внутри желудочков мозга) кровоизлияниями, кефалогематомы теменной области и дилатацию (расширение, гидроцефалию) основной цистерны только у детей (доношенных), матери которых получали родоусиление (стимуляцию родов)(6*, с. 56). В группе сравнения у детей от физиологических (без вмешательств акушеров) родов подобных нарушений не выявлено. Хотелось бы, чтобы неврологи сравнили развитие ЦНС у детей, к году жизни и далее, обследованных Крицкой И.А., но такие работы в нашей медицинской литературе ОТСУТСТВУЮТ.
56). В группе сравнения у детей от физиологических (без вмешательств акушеров) родов подобных нарушений не выявлено. Хотелось бы, чтобы неврологи сравнили развитие ЦНС у детей, к году жизни и далее, обследованных Крицкой И.А., но такие работы в нашей медицинской литературе ОТСУТСТВУЮТ.
Жизненный опыт показывает, что у 90% из опрошенных матерей, имеющих детей с ДЦП, искусственно вызывали и ускоряли роды или делали экстренное кесарево, когда на фоне стимуляции развивалась угроза жизни для плода (ок.10% женщин по давности и из-за нервной и тяжёлой жизни, не смогли вспомнить подробности родов).
Так почему акушеры противопоставили искусственную индукцию и стимуляцию родов естественному процессу родов? Прежде всего, акушеры уверены в постоянно ухудшающемся здоровье женщин, и в том, что без акушерской помощи и лечения ни выносить ребёнка во время гестации (беременности), ни родить большинство женщин не могут.
Приказом МЗ СССР №430 от 1981г. утверждена для работы акушеров шкала «Оценка пренатальных (предродовых) факторов риска » для оценки возможных перинатальных (в родах) осложнений. В настоящее время по этой шкале к группе высокого пренатального (и перинатального) риска можно отнести более 80% обследованных в женских консультациях беременных. Такая ситуация ведёт к необоснованной акушерской агрессии: дородовая госпитализация с медикаментозной подготовкой к родам, расширением показаний к индукции родов и кесареву сечению (6*, с.99). Многочисленные УЗИ и другие обследования, «курсы лечения»(?) во время беременности не укрепляют женщин и акушеров в благополучном исходе родов, а создают неуверенность и нервозность. А ещё проф. И.И. Яковлев в 1957 г. писал: «…у большего числа рожениц в этиопатогенезе (в причине) нарушений сократительной деятельности матки (слабости родовой деятельности) лежит не утомления гладкой мускулатуры миометрия, а расстройство функции нервной системы» (1*, с.214 и 11*, с.9). Поэтому до 60-х годов 20 века акушеры использовали психофизиопрофилактические методы подготовки к родам, то есть не медикаментозные.
В настоящее время по этой шкале к группе высокого пренатального (и перинатального) риска можно отнести более 80% обследованных в женских консультациях беременных. Такая ситуация ведёт к необоснованной акушерской агрессии: дородовая госпитализация с медикаментозной подготовкой к родам, расширением показаний к индукции родов и кесареву сечению (6*, с.99). Многочисленные УЗИ и другие обследования, «курсы лечения»(?) во время беременности не укрепляют женщин и акушеров в благополучном исходе родов, а создают неуверенность и нервозность. А ещё проф. И.И. Яковлев в 1957 г. писал: «…у большего числа рожениц в этиопатогенезе (в причине) нарушений сократительной деятельности матки (слабости родовой деятельности) лежит не утомления гладкой мускулатуры миометрия, а расстройство функции нервной системы» (1*, с.214 и 11*, с.9). Поэтому до 60-х годов 20 века акушеры использовали психофизиопрофилактические методы подготовки к родам, то есть не медикаментозные.
В современной медицине бытует миф, что прежде всего из-за плохого здоровья беременных родятся больные, с поражением ЦНС дети. Но женщины военных и послевоенных 40-х и 50-х годов, бараков, теплушек-вагончиков и коммуналок, тяжело трудящиеся на производстве и в деревнях, при разгуле половых инфекций (гонореи, сифилиса и др.) и абортов, отсутствии антибиотиков (для лечений любых воспалительных заболеваний) и отсутствии ультразвуковой диагностики, разве могли иметь показатель здоровья лучше современных женщин, если бы к ним применили минздравовскую акушерскую шкалу пренатальных факторов риска из приказа №430? Но зато не было средств для медикаментозной стимуляции родов, акушеры использовали в работе опыт, накопленный предшествующими поколениями, и женщины 40-х -50-х годов нарожали поколения россиян, проложивших дорогу к атому и в космос, на спортивные олимпийские пьедесталы. При этом цифры детской инвалидности по поражению ЦНС (данные проф. К.А.Семёновой) к 1964 году по ДЦП составляли 0, 64 на 1000 детского населения (дети до 15 лет), а в 2002 г. – 196,3 на 1000 детского населения, и рост продолжается, по синдрому детского аутизма рост с 1966 по 2001год составил 1800% и достигает 6,4 на 1000 детей (7*).
Но женщины военных и послевоенных 40-х и 50-х годов, бараков, теплушек-вагончиков и коммуналок, тяжело трудящиеся на производстве и в деревнях, при разгуле половых инфекций (гонореи, сифилиса и др.) и абортов, отсутствии антибиотиков (для лечений любых воспалительных заболеваний) и отсутствии ультразвуковой диагностики, разве могли иметь показатель здоровья лучше современных женщин, если бы к ним применили минздравовскую акушерскую шкалу пренатальных факторов риска из приказа №430? Но зато не было средств для медикаментозной стимуляции родов, акушеры использовали в работе опыт, накопленный предшествующими поколениями, и женщины 40-х -50-х годов нарожали поколения россиян, проложивших дорогу к атому и в космос, на спортивные олимпийские пьедесталы. При этом цифры детской инвалидности по поражению ЦНС (данные проф. К.А.Семёновой) к 1964 году по ДЦП составляли 0, 64 на 1000 детского населения (дети до 15 лет), а в 2002 г. – 196,3 на 1000 детского населения, и рост продолжается, по синдрому детского аутизма рост с 1966 по 2001год составил 1800% и достигает 6,4 на 1000 детей (7*). Такая же картина роста неврологических нарушений по синдрому СДВГ, хождению на носочках (цыпочках), ВСД, различным задержкам речевого развития (логопед – в наше время очень востребованная профессия) и др.
Такая же картина роста неврологических нарушений по синдрому СДВГ, хождению на носочках (цыпочках), ВСД, различным задержкам речевого развития (логопед – в наше время очень востребованная профессия) и др.
Бытует также мнение, что количество ДЦП и других нарушений ЦНС растёт за счёт увеличения выхаживаемых недоношенных детей. Но недоношенных, что в 60-е годы 20 века, что в начале 21 века, рождается из года в год 5-7% от всех родов, а по показателю здоровья к году жизни без нарушения развития ЦНС из года в год 3-4% от всех, родившихся недоношенными. Так что резкого роста поражений ЦНС у детей только за счёт недоношенных не получается. Достижения реанимации способствовали снижению смертности новорожденных в нашей стране, но эти успехи в большинстве случаев не могут исправить повреждения ЦНС недоношенного плода в родах, которые связаны с активным, программированным ведением родов(8*г).
Так, в работе сотрудников кафедры Радзинского в 2006 г (8*а) установлено, что тяжёлому состоянию доношенных детей при рождении, потребовавшему ИВЛ, способствуют не столько нарушения фетоплацентарной (плодово-плацентарной) системы, выявленные во время беременности, сколько элементы акушерской агрессии в родах.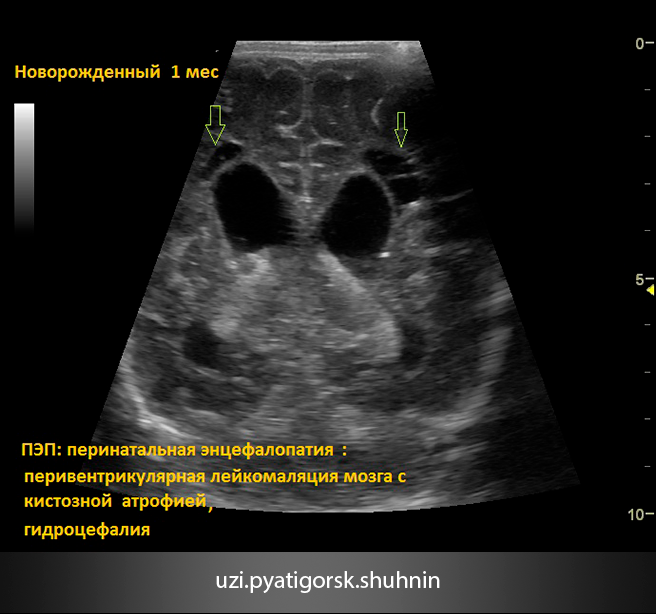 По анализу историй родов частота амниотомий составила 31,3%, среди аномалий родовой деятельности: 26,7% случаев – слабость родовой деятельности, в остальных – прежде всего гипертоническая дисфункция матки, которая напрямую (1*, с.257) связана со стимуляцией родов акушерами. Экстренное кесарево сечение составило 33,6% родов, после которых доношенные дети попали на ИВЛ (сразу после операции). В большинстве случаев кесарево сечение было запоздалым и производилось при выраженном страдании (гипоксии) плода. То есть такое экстренное кесарево сечение не спасало детей от повреждений ЦНС.
По анализу историй родов частота амниотомий составила 31,3%, среди аномалий родовой деятельности: 26,7% случаев – слабость родовой деятельности, в остальных – прежде всего гипертоническая дисфункция матки, которая напрямую (1*, с.257) связана со стимуляцией родов акушерами. Экстренное кесарево сечение составило 33,6% родов, после которых доношенные дети попали на ИВЛ (сразу после операции). В большинстве случаев кесарево сечение было запоздалым и производилось при выраженном страдании (гипоксии) плода. То есть такое экстренное кесарево сечение не спасало детей от повреждений ЦНС.
В анализируемых случаях рождения доношенных детей, попавших в реанимацию на ИВЛ, большинство их матерей во время беременности имели низкую степень перинатального риска. Хроническая плацентарная недостаточность на фоне хронической гипоксии плода во время беременности, приведшие к задержке развития плода(12*, с.37-38), встретились только у 9,7% пациенток анализируемой группы. При этом диагноз хронической плацентарной недостаточности в женских консультациях выставлялся во время беременности в 56,8% случаях, но подтверждён этот диагноз на основании осмотра последа (плаценты) только у половины женщин, имевших этот диагноз во время беременности. Таким образом, по материалам этой работы акушерской кафедры Радзинского, можно утверждать, что детская инвалидность и заболеваемость ЦНС возросла у нас из-за того, что реанимируются прежде всего доношенные дети, которые при правильной тактике ведения родов должны были родиться здоровыми.
Таким образом, по материалам этой работы акушерской кафедры Радзинского, можно утверждать, что детская инвалидность и заболеваемость ЦНС возросла у нас из-за того, что реанимируются прежде всего доношенные дети, которые при правильной тактике ведения родов должны были родиться здоровыми.
Повреждения головного мозга плода в родах может произойти даже при однократном внутривенном или внутримышечном введении окситоцина. Это проиллюстрировано в работе Савицкого Г.А. (1*, с. 257): по данным внутренней гистерограммы у роженицы с преждевременным излитием околоплодных вод, после однократного введения окситоцина (с целью родостимуляции) вначале резко повысился тонус миометрия, который только через 30 минут нормализовался (когда закончилось действие окситоцина) и «способствовал развитию полноценной схватки». То есть на протяжении более 30 минут наблюдался ятрогенный (связанный с действием окситоцина, введённого акушером) вариант окситоциновой гипертонической дисфункции матки. Значит, более 30 минут плод находился в условиях гипоксии, что вполне достаточно для необратимых повреждений ЦНС. Таким образом, к моменту рождения прямого действия окситоцина уже нет, акушер оценивает состояние новорожденного в 7, 8 а то и в 9 баллов по шкале Апгар. Но необратимые нарушения ЦНС уже произошли, и выявить их может невролог при полном неврологическом осмотре.
Таким образом, к моменту рождения прямого действия окситоцина уже нет, акушер оценивает состояние новорожденного в 7, 8 а то и в 9 баллов по шкале Апгар. Но необратимые нарушения ЦНС уже произошли, и выявить их может невролог при полном неврологическом осмотре.
Такое же пагубное воздействие на тонус матки, кровообращение и ЦНС плода происходит при применении простагландинов, антипрогестагенов, ламинарий (10*, с.91). Аналогично «работает» и прокол плодного пузыря (9*, с.532)), применяемый акушерами для искусственного ускорения родов, как процедура, якобы безопасная для плода.
Г.А. Савицкий пишет, что физиологический процесс раскрытия шейки матки в родах тесно связан с процессом продвижения предлежащей части плода. Процесс раскрытия шейки матки может осуществляться и при отсутствии продвижения плода, что происходит при стимуляции созревания шейки матки с применением простагландинов и ламинарий. Но это будет уже патологический процесс, при котором меняются физиологические параметры кровообращения в матке, с развитием кислородной недостаточности (гипоксии) у плода (1*, с. 189). При искусственном расширении шейки матки (простагландинами, ламинариями) роды ускоряются (по Савицкому Г.А.,(1*, с. 268-270) – это ложно «гиперэргические» схватки, как варианты ятрогенной гипертонической дисфункции матки), что может привести к «штурмовому» прохождению плода через родовые пути и закончиться родовой травмой и гипоксическими повреждениями ЦНС ребёнка.
189). При искусственном расширении шейки матки (простагландинами, ламинариями) роды ускоряются (по Савицкому Г.А.,(1*, с. 268-270) – это ложно «гиперэргические» схватки, как варианты ятрогенной гипертонической дисфункции матки), что может привести к «штурмовому» прохождению плода через родовые пути и закончиться родовой травмой и гипоксическими повреждениями ЦНС ребёнка.
Показательны и цифры роста родовой травмы в Омской области: 23 ребёнка на 1000 живорожденных в 1996г. с ежегодным приростом до 31 на 1000 – в 2005г. (6*, с.66 8*б) Кравченко Е.Н. делает вывод, что «наряду с ухудшением репродуктивного здоровья населения, влекущим за собой рост осложнений гестации (беременности) и затруднённых родов, возможно (автор допускает такую мысль) и неадекватное качество акушерской помощи». Правда, адекватность акушерской помощи автор видит в дальнейшей активизации вмешательств акушеров в роды, называя применение простагландинов, антигестагенов и ламинарий безопасными и эффективными методами индукции и стимуляции родов, не влияющих на показатель здоровья новорожденных после рождения и к году жизни.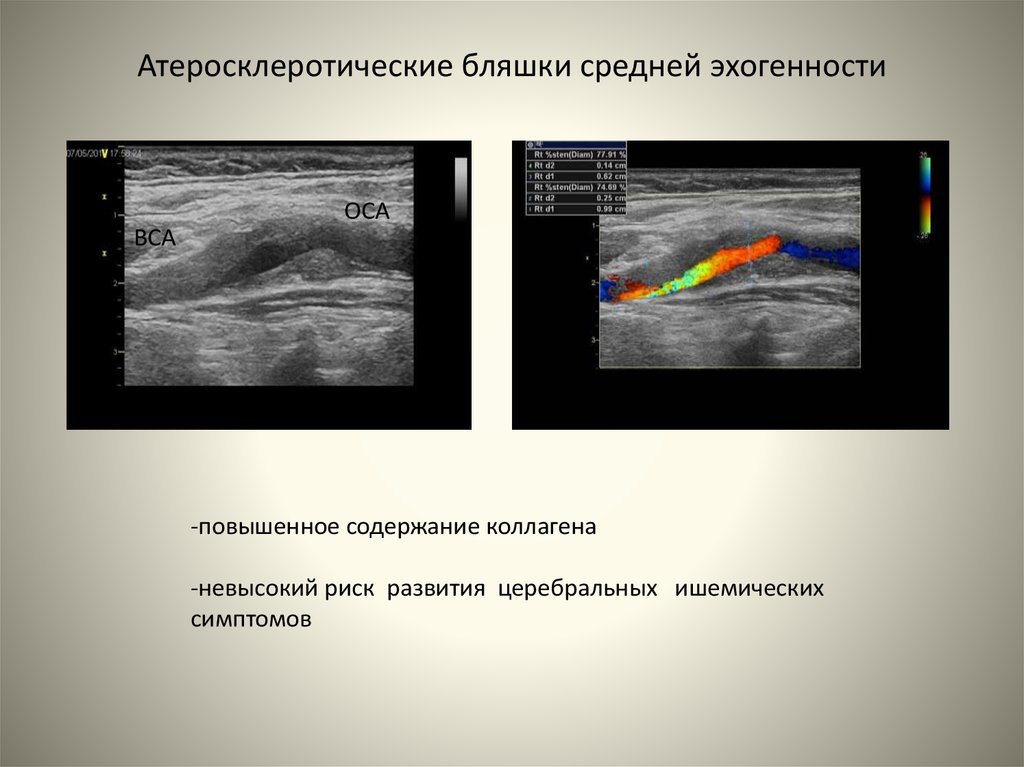 При этом никаких материалов и работ по оценке здоровья новорожденных, рождённых в родах со стимуляцией и индукцией автор не приводит (6*, с.174-175). Результаты же работы Крицкой И.А. (см. выше) по поражениям ЦНС новорожденных после акушерского родоусиления (6*, с.56 и 12*), не заставляют задуматься Кравченко Е.Н. и её коллег, что не всё, что в родах удобно современному акушеру, безопасно для здоровья ребёнка(8*в, 8*д).
При этом никаких материалов и работ по оценке здоровья новорожденных, рождённых в родах со стимуляцией и индукцией автор не приводит (6*, с.174-175). Результаты же работы Крицкой И.А. (см. выше) по поражениям ЦНС новорожденных после акушерского родоусиления (6*, с.56 и 12*), не заставляют задуматься Кравченко Е.Н. и её коллег, что не всё, что в родах удобно современному акушеру, безопасно для здоровья ребёнка(8*в, 8*д).
Необходимо особо отметить, что оценка состояния новорожденного по шкале Апгар не даёт правильного представления о состоянии ЦНС. В классических работах K. Nelson с соавт. было изучено 49000 детей, которые были оценены по Апгар через 1 и 5 минут после рождения и по состоянию ЦНС в дальнейшем по жизни. 99 детей имели оценку 3 балла на 5-10-15 -20 минутах, получили интенсивную терапию и выжили. У 12 из этих детей развился ДЦП, у 8 -отмечались менее значительные неврологические нарушения. Остальные 79(!), после проведённой интенсивной терапии, были здоровы по ЦНС. С другой стороны, из детей у которых в дальнейшем развился ДЦП, 55% имели на 1-ой минуте жизни оценку по шкале Апгар 7-10 баллов, на 5-й минуте – 73% детей с ДЦП имели по Апгар 7-10 баллов. Wayenberg с соавт. считает, что шкала Апгар не является информативной в отношении прогноза гипоксических поражений головного мозга. По их мнению, наиболее важна оценка нарушений неврологического статуса новорожденного в динамике. (3*, стр. 144-145). Не смотря на столь показательные данные работ иностранных специалистов, нашими неонатолагами и детскими неврологами в 2007г. принята классификация Церебральной ишемии (гипоксически-ишемической энцефалопатии), в которой рассматривать наличие энцефалопатии рекомендуется только у детей, у которых зафиксирована асфиксия при рождении (13*, стр. 11-12). То есть, гипоксия и асфиксия, повреждающая ЦНС, но возникающая в период вмешательства в роды индукцией и стимуляцией, остаётся с момента рождения не выявленной. Новорожденный при высоких баллах по шкале Апгар 7-10, не осматривается с описанием полного неврологического статуса, ведь асфиксии у него при рождении нет. В итоге, неврологические нарушения находят и фиксируют детские неврологи, когда с 1 месяца и далее, к ним приносят на приём таких детей.
Wayenberg с соавт. считает, что шкала Апгар не является информативной в отношении прогноза гипоксических поражений головного мозга. По их мнению, наиболее важна оценка нарушений неврологического статуса новорожденного в динамике. (3*, стр. 144-145). Не смотря на столь показательные данные работ иностранных специалистов, нашими неонатолагами и детскими неврологами в 2007г. принята классификация Церебральной ишемии (гипоксически-ишемической энцефалопатии), в которой рассматривать наличие энцефалопатии рекомендуется только у детей, у которых зафиксирована асфиксия при рождении (13*, стр. 11-12). То есть, гипоксия и асфиксия, повреждающая ЦНС, но возникающая в период вмешательства в роды индукцией и стимуляцией, остаётся с момента рождения не выявленной. Новорожденный при высоких баллах по шкале Апгар 7-10, не осматривается с описанием полного неврологического статуса, ведь асфиксии у него при рождении нет. В итоге, неврологические нарушения находят и фиксируют детские неврологи, когда с 1 месяца и далее, к ним приносят на приём таких детей.
Для снижения заболеваемости ДЦП и другими нарушениями развития ЦНС у детей нашей страны, акушеры обязаны прекратить использование для индукции (созревания шейки матки) и стимуляции родов и схваток искусственно созданные средства: окситоцин, простагландины, антипрогестагены и др., осмотические дилятаторы (ламинарии), так как при действии этих препаратов происходит развитие патологических (неестественных, ненатуральных) родов. Начавшийся же естественным образом процесс родов, под воздействием этих препаратов переходит в патологический процесс. Такое искусственно вызванное патологическое течение родового процесса опасно, прежде всего, нарушениями кровообращения и родовой травмой плода, что ведёт к повреждению ЦНС плода. В лёгких случаях, в течение первого года жизни ребёнка, невролог выявит синдром нервно-рефлекторной возбудимости, нарушения сна, мышечную дистонию, вегетативную дисфункцию (беспричинное срыгивание и др.), нормотензивную гидроцефалию, косолапость и др. После года – задержку речевого развития, гиперактивность и дефицит внимания, хождение на носочках и др.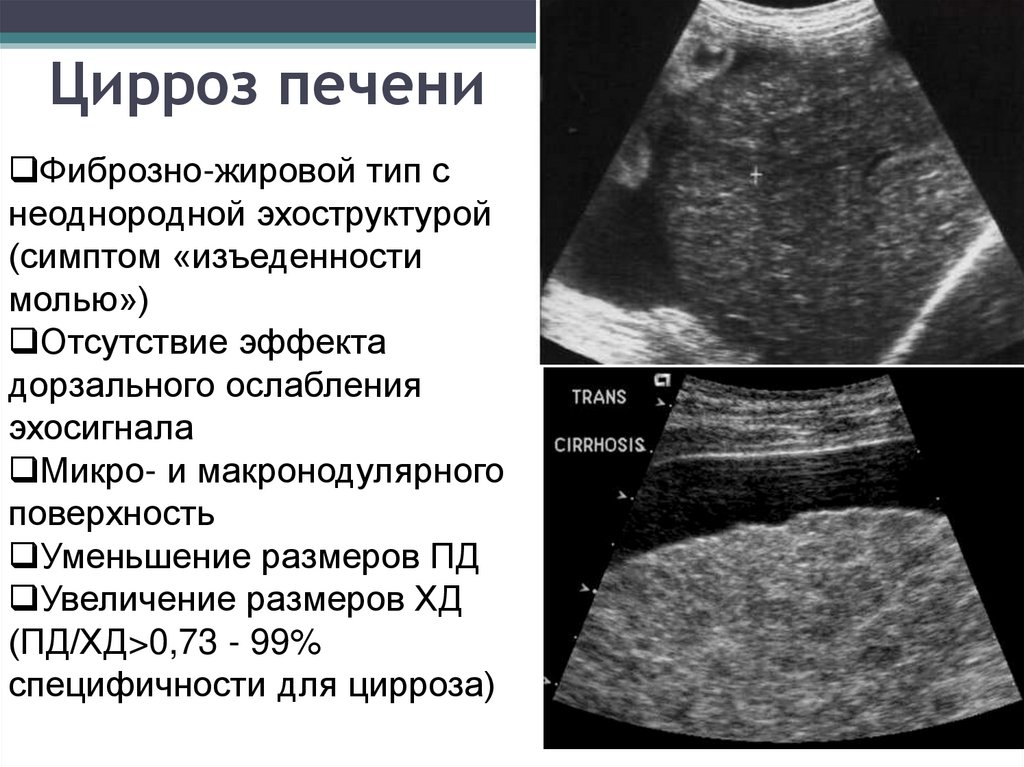 В тяжёлых случаях – эпилептический синдром, гиперкинезы, ДЦП, синдром аутизма, задержку психического развития и др.
В тяжёлых случаях – эпилептический синдром, гиперкинезы, ДЦП, синдром аутизма, задержку психического развития и др.
Индукция и стимуляция родов – основная причина повреждений ЦНС рождающегося ребенка.
Литература:
1. Г.А.Савицкий, А.Г.Савицкий «Биомеханика физиологической и патологической родовой схватки», » ЭЛСБИ-СПб», С.-Петербург,2003.
2. В.В.Абрамченко, Р.А.Абрамян, Л.Р.Абрамян «Индукция родов и их регуляция простагландинами», ЭЛБИ-СПб, С.-Петербург, 2005.
3. А.Е.Пальчик, Н.И.Шабалов «Гипоксически-ишемическая энцефалопатия новорожденных», «Питер» С.-Петербург, 2001.
4. «Национальное руководство по акушерству», «ГЭОТАР-Медиа» Москва, 2007.
И5.И.С.Сидорова «Физиология и патология родовой деятельности», «МИА», Москва, 2006.
6. Е.Н.Кравченко «Родовая травма. Акушерские и перинатальные аспекты», «ГЭОТАР-Медиа», 2009.
7. «Жизнь с ДЦП. Проблемы и решения» журнал №1,
8. «Акушерство и гинекология» журнал:
а).2007г.,№ 3, с.42-47, В.Е.Радзинский и др. «Доношенные дети, подвергшиеся реанимации. Анализ акушерской тактики».
«Доношенные дети, подвергшиеся реанимации. Анализ акушерской тактики».
б).2007г., №3, с.10-13, Е.Н.Кравченко «Факторы риска родовой травмы»
в).2008г.,№2, с.35-38, Е.Н.Кравченко «Осложнения гестационного периода и родовая травма новорожденного в условиях крупного региона Западной Сибири».
г).2008г.,№6, с.39-43, В.Е.Радзинский и др. «Недоношенные дети, подвергшиеся реанимации. Анализ акушерской тактики».
д).2006г.,№5, с.47- 49, Л.В.Гутиков, В.А.Лискович «Применение ламинарий для подготовки шейки матки к родам при гестозе лёгкой степени».
9. Справочник Калифорнийского университета «Акушерство», 1996г., Бостон, Нью-Йорк, Лондон, под.ред. Н.Нисвандера, А.Эванса, перевод с англ., «Практика», Москва, 1999.
10. В.В.Абрамченко «Простагландины и антигестагены в акушерстве и гинекологии», «Интеллект», Петрозаводск, 2003.
11. Т.И.Кузьминых «Подготовка беременных к родам», (Методическое пособие), «Издательство Н-Л», С.-Петербург, 2007.
12. А.В.Михайлов и Р.Тунелл «Клиническое руководство по асфиксии плода и новорожденного», «Петрополис», С. -Петербург,2001. 13. Классификация перинатальных поражений нервной системы и их последствий у детей первого года жизни» Российская ассоциация специалистов перинатальной медицины. Методические рекомендации. Москва, 2007г. (В разработке классификации приняли участие ак. РАМН д.м.н. Г.М. Савельева, ак. РАМН д.м.н. В.А.Таболин, д.м.н. Н.П. Шабалов, д.м.н. М.В. Фёдорова, д.м.н. Л.Г. Сичинава, д.м.н. Г.М. Дементьева, д.м.н. М.С. Ефимов, д.м.н. А.С. Петрухин, д.м.н. А.В. Горбунов, д.м.н. Е.П. Бомбардирова, д.м.н. Ю.И. Барашнев, д.м.н. М.И. Медведев и другие д.м.н. и к.м.н.)
-Петербург,2001. 13. Классификация перинатальных поражений нервной системы и их последствий у детей первого года жизни» Российская ассоциация специалистов перинатальной медицины. Методические рекомендации. Москва, 2007г. (В разработке классификации приняли участие ак. РАМН д.м.н. Г.М. Савельева, ак. РАМН д.м.н. В.А.Таболин, д.м.н. Н.П. Шабалов, д.м.н. М.В. Фёдорова, д.м.н. Л.Г. Сичинава, д.м.н. Г.М. Дементьева, д.м.н. М.С. Ефимов, д.м.н. А.С. Петрухин, д.м.н. А.В. Горбунов, д.м.н. Е.П. Бомбардирова, д.м.н. Ю.И. Барашнев, д.м.н. М.И. Медведев и другие д.м.н. и к.м.н.)
P.s.: 1 марта 1997 г. в Чан Мэе (Таиланд) на конференции «Роды без границ», проводившейся под эгидой ЮНИСЕФ, председатель нью-йоркского Фонда здоровья матери и ребенка д-р Дорис Хейр представила результаты исследования, начав свою речь со следующего заявления: «Мне очень больно признать, что нигде в мире нет столь искаженных представлений о нормальных родах, как в США. Вызывает все более растущее беспокойство, что так называемое акушерское лечение в значительной степени является причиной высокого показателей количества детей с проблемами в обучении. Американские школьники отстают по сравнению со школьниками из других стран в математике и других предметах, требующих логического мышления и понимания. Сотни миллионов долларов ежегодно тратятся на ведение беременностей и высокотехнологичную помощь в родах, в то время как школы заполнены детьми, для обучения которых требуются специальные методики и педагоги-дефектологи. Образовательные услуги для „особых“ детей стали бурно развивающейся отраслью экономики в США. И хотя мы пытаемся объяснить это увеличением числа недоношенных детей, факты говорят о том, что 75% детей-инвалидов в нашей стране родились в срок, с нормальным весом и не имеют отягощенного семейного анамнеза. Прежде чем ваши акушерские службы попытаются перенять западные методики в работе родильных отделений, объясните коллегам, что медицинские вмешательства, которые являются неотъемлемой частью западного подхода, могут навредить матери, ее ребенку и как результат – обществу в целом»
Американские школьники отстают по сравнению со школьниками из других стран в математике и других предметах, требующих логического мышления и понимания. Сотни миллионов долларов ежегодно тратятся на ведение беременностей и высокотехнологичную помощь в родах, в то время как школы заполнены детьми, для обучения которых требуются специальные методики и педагоги-дефектологи. Образовательные услуги для „особых“ детей стали бурно развивающейся отраслью экономики в США. И хотя мы пытаемся объяснить это увеличением числа недоношенных детей, факты говорят о том, что 75% детей-инвалидов в нашей стране родились в срок, с нормальным весом и не имеют отягощенного семейного анамнеза. Прежде чем ваши акушерские службы попытаются перенять западные методики в работе родильных отделений, объясните коллегам, что медицинские вмешательства, которые являются неотъемлемой частью западного подхода, могут навредить матери, ее ребенку и как результат – обществу в целом»
Ранняя неонатальная диагностика церебральных нарушений
Диагностика перинатальных церебральных нарушений у детей раннего возраста включает комплексное изучение показателей венозного кровотока, УЗИ структур головного мозга в определении особенностей гемодинамических расстройств в сопоставлении с гемодинамическими проявлениями.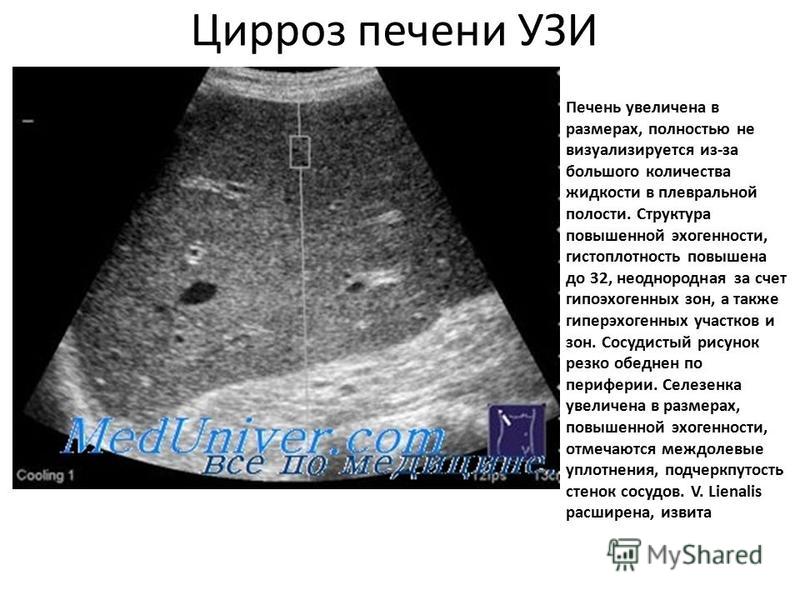 У детей, особенно родившихся ранее 34-й недели гестации, необходимо регулярно оценивать морфометрические и функциональные показатели сердца для раннего выявления отклонений, которые могут усугубить церебральную патологию.
У детей, особенно родившихся ранее 34-й недели гестации, необходимо регулярно оценивать морфометрические и функциональные показатели сердца для раннего выявления отклонений, которые могут усугубить церебральную патологию.
Проблема не только недоношенности
У доношенных и недоношенных новорожденных, перенесших тяжелую асфиксию или имеющих тяжелый синдром дыхательных расстройств, отмечена прямая связь между мозговым кровотоком и изменениями артериального давления, что явилось феноменом нарушения ауторегуляции. Из-за отсутствия регуляции мозговой кровоток пассивно следует за изменениями артериального давления, увеличивается риск развития ишемических поражений при гипотензии и кровоизлияний при эпизодах повышения артериального давления. Для более достоверной оценки состояния ребенка использовались не абсолютные значения скоростей артериального кровотока (ввиду их значительной вариабельности и зависимости от большого количества внешних факторов), а индексы резистентности, учитывая поправку на гестационный возраст.
У глубоконедоношенных детей возникают неврологические нарушения. Кроме того, на их дальнейшее развитие, биологическую и социальную адаптацию влияет ряд специфических факторов, включающих соматические хронические заболевания, функциональные расстройства, поведенческие особенности и нарушение социализации в семье и обществе. Проблемы связаны не только с самой недоношенностью, но и с перенесенной интенсивной терапией.
Качество жизни глубоконедоношенных детей может ухудшаться из-за специфических для них хирургических и соматических проблем, хронических заболеваний, регоспитализаций, что приводит к ежедневной активности, нарушению социального и поведенческого статуса. Ухудшение качества жизни происходит обратно пропорционально массе тела при рождении. Инфекции верхних дыхательных путей, бронхиальная астма, лор-патология усугубляют состояние, отягощенное неврологическим дефицитом.
Уровень физического развития ребенка является основным показателем здоровья. У недоношенных детей на первом году жизни отмечаются задержки весоростовых показателей, а также гетерохронии роста.
У недоношенных детей на первом году жизни отмечаются задержки весоростовых показателей, а также гетерохронии роста.
Диагностика микроцефалии (уменьшения окружности головы более чем на 2 стандартных отклонения в соответствии с возрастом и полом) продемонстрировала: патология связана с низким показателем психомоторного развития, высокой частотой развития детского церебрального паралича (ДЦП), задержкой двигательного и психического развития. Дети с замедленными темпами роста окружности головы имели значительно более низкий индекс ментального развития, чем здоровые.
Изучение биоэлектрической активности (БЭА) головного мозга проводится методом электроэнцефалографии (ЭЭГ). БЭА головного мозга формируется внутриутробно и к рождению имеет характер медленноволновой активности с фрагментами быстрых колебаний.
Важно учесть: при регистрации определенного патологического паттерна с помощью традиционной ЭЭГ нередко происходит наслоение ЭКГ, и помехи от работы электрических приборов могут маскировать грубое подавление активности в межвспышечных интервалах.
Фоновые характеристики БЭА (степень прерывистости, наличие циклической вариабельности БЭА, амплитуда, соответствие степени зрелости общего паттерна БЭА возрасту ребенка от зачатия) обладают высокой диагностической ценностью при оценке степени тяжести перинатальных поражений ЦНС у новорожденных разного гестационного возраста.
Сохранение патологического паттерна «вспышка — подавление» является маркером тяжести повреждения мозга для доношенных детей, патофизиологическая основа которого включает функциональное и/или структурное разобщение нейрональных связей между корой и глубокими структурами головного мозга, например, таламусом. В работах нейрофизиолога Карла Асо можно увидеть, что снижение амплитуды ЭЭГ-активности прямо пропорционально распространенности энцефаломаляции преимущественно коры головного мозга, мозолистого тела, таламуса, среднего мозга и моста при патологоанатомическом исследовании новорожденных. Патоморфологическое исследование показало прямую взаимосвязь между количеством поврежденных нейронов и фоновой активностью аЭЭГ как у доношенных, так и у недоношенных детей.
Преимущества аЭЭГ
Многоканальная неонатальная ЭЭГ подразумевает регистрацию БЭА от скальповых электродов, расположенных над основными областями коры головного мозга. Методика позволяет оценить общие и локальные характеристики фоновой БЭА с предположительной топической диагностикой одного или нескольких источников патологической активности, диагностировать задержку или процесс нарушения созревания функционального состояния ЦНС и объективно дифференцировать эпилептические феномены от пароксизмальных состояний несудорожного генеза.
При регистрации аЭЭГ (амплитудно-интегрированной электроэнцефалографии) на скальповые электроды подается очень слабый переменный ток частотой 400 Гц. Это необходимо для мониторного измерения межэлектродного импеданса и контроля исправности передачи сигнала от электродов через буферный усилитель к последующим каскадам усиления. После усиления сигнал проходит фильтр с полосой пропускания от 2 до 15 Гц, который минимизирует артефакты от движений, потоотделения, миограммы, ЭКГ и возможных помех от аппаратуры в условиях ОРИТ (искусственная вентиляция легких, инфузоматы и т. д.).
д.).
Метод аЭЭГ точно предсказывает исход у 80 % детей через 3 часа после рождения и у 90 % детей через 6 часов жизни. Сочетание клинической оценки неврологического статуса с аЭЭГ в первые 12 часов жизни повышает точность прогноза с 75 % до 85 %. При анализе взаимосвязи минимальной амплитуды аЭЭГ, оценки по шкале Sarnat и наличия структурных изменений при МРТ у доношенных младенцев наибольшую прогностическую информативность показала минимальная амплитуда. Ее значение менее 4 мкВ в первые 72 часа после рождения позволяло прогнозировать выявление последующих структурных отклонений при выполнении МРТ.
Вентрикуломегалия, диагностированная к 40-й неделе постменструального возраста, является предиктором развития ДЦП.
У глубоконедоношенных детей раннее прогнозирование исхода с использованием аЭЭГ/ЭЭГ значительно сложнее, чем у доношенных, перенесших асфиксию. Перинатальный исход зависит от степени недоношенности и спектра патологии перинатального периода и не всегда определяется наличием первичного церебрального повреждения.
Необходимо четко определять вспышки на аЭЭГ в первые 48 часов жизни, что будет ассоциировано с прогнозированием исхода пери- и интравентрикулярного кровоизлияния (ПИВК) до 3–4-й степени (около 130 вспышек за 60 минут увеличивают шансы на выживание, а также на благоприятный неврологический прогноз на 70–80 %). У детей с низкой плотностью вспышек БЭА статистически чаще отмечаются летальные или тяжелые инвалидизирующие исходы.
Судорожная активность, которая регистрируется на аЭЭГ у недоношенных детей с экстремально низкой массой тела, очень низкой массой тела с ПИВК 3–4-й степени, не имеет значимой взаимосвязи с неврологическими исходами.
Важным аспектом оценки функционального состояния мозга новорожденных является онтогенетический подход к анализу неонатальной ЭЭГ. Динамические изменения БЭА головного мозга у новорожденных с разным гестационным возрастом в полной мере отражают морфологическое и функциональное развитие ЦНС у детей в раннем онтогенезе.
Особенности диагностики
Для определения предрасположенности новорожденного к развитию ДЦП необходим комплексный подход оценки БЭА.
У малышей, рожденных в сроке гестации до 28-й недели, вплоть до 30–32-й недели постменструального возраста, БЭА представлена нерегулярной, прерывистой активностью на ЭЭГ. Окончательный переход от прерывистой к регулярной, непрерывной активности ЭЭГ заканчивается примерно к 44–46-й неделе постменструального возраста.
У новорожденных с малым и экстремально малым сроком гестации (до 30–32 недель) практически невозможно выделить физиологические стадии цикла сон/бодрствование или имеется их функциональная рудиментарность. Последовательное формирование физиологических и электрографических паттернов стадий цикла сон/бодрствование начинается примерно с 30-й недели, окончательная дифференцировка возможна после 36–37-й недели постменструального возраста.
В процессе функционального созревания ЦНС отмечается возрастание степени межполушарной синхронизации ритмов БЭА, которая достигает практически 100 % к 40–42-й неделе постментруального возраста.
Первые вспышки осцилляций активности на ЭЭГ могут быть зарегистрированы уже у плода на 22–23-й неделе гестации. Доминантной чертой ЭЭГ глубоконедоношенных новорожденных является прерывистый характер фоновой активности. Отмечаются при записи ЭЭГ интервалы электроцеребрального молчания, или межвспышечные инактивные интервалы, которые с некоторой периодичностью прерываются билатеральными разрядами высокоамплитудных медленных волн с включением в состав вспышки заостренных элементов и небольшого количества быстрых ритмов. Вспышки активности у новорожденных с экстремально малым сроком гестации (до 26 недель) в среднем составляют от 1 до 5 с, но могут достигать и 80 с, в то время как длительность межвспышечных интервалов электроцеребрального молчания у этих детей не превышает минуты.
Для недоношенного новорожденного в норме характерно наличие trace discontinue — прерывистой кривой. Необходимо помнить, что рудиментарные электрографические паттерны активного сна (REM) могут быть различимы у детей с 25–26 неделями постменструального возраста. С увеличением гестационного возраста новорожденных прогрессивно возрастает степень межполушарной синхронизации билатеральных вспышек в составе trace discontinuе.
С увеличением гестационного возраста новорожденных прогрессивно возрастает степень межполушарной синхронизации билатеральных вспышек в составе trace discontinuе.
Первой у недоношенных, начиная примерно с 25–26-й недели постменструального возраста, формируется филогенетически более древняя стадия активного сна (active sleep), или REM-стадия сна. На ЭЭГ в этот период регистрируется регулярная, непрерывная активность. Появление этих физиологических и функциональных феноменов отражает начало формирования стадии активного сна.
По принципу Prechtl
В основу оценки неврологического статуса лег принцип оптимальности Prechtl, при этом оптимальные показатели неврологического статуса новорожденного расценены как 0, субоптимальные — как отличные от 0. Оценивается неврологический статус новорожденного через взаимодействие процессов возбуждения и торможения. Избыток возбуждения или недостаток торможения определяется как положительное значение, а избыток торможения или недостаток возбуждения — как отрицательное. Методика включает 7 шкал: общей активности с 5 биполярными и 2 униполярными позитивными субшкалами особых феноменов (судорог-тремора), мышечного тонуса, глубоких рефлексов, рефлексов новорожденных, вегетативной, дополнительной биохимической, дополнительной нейрофизиологической. Затем определяется профиль новорожденного — суммируя баллы субшкал и вычисляя среднее арифметическое для данной шкалы. Также оценивается суммарный показатель по всем субшкалам и вычисляется суммарная оценка по шкалам.
Методика включает 7 шкал: общей активности с 5 биполярными и 2 униполярными позитивными субшкалами особых феноменов (судорог-тремора), мышечного тонуса, глубоких рефлексов, рефлексов новорожденных, вегетативной, дополнительной биохимической, дополнительной нейрофизиологической. Затем определяется профиль новорожденного — суммируя баллы субшкал и вычисляя среднее арифметическое для данной шкалы. Также оценивается суммарный показатель по всем субшкалам и вычисляется суммарная оценка по шкалам.
Важно при УЗИ
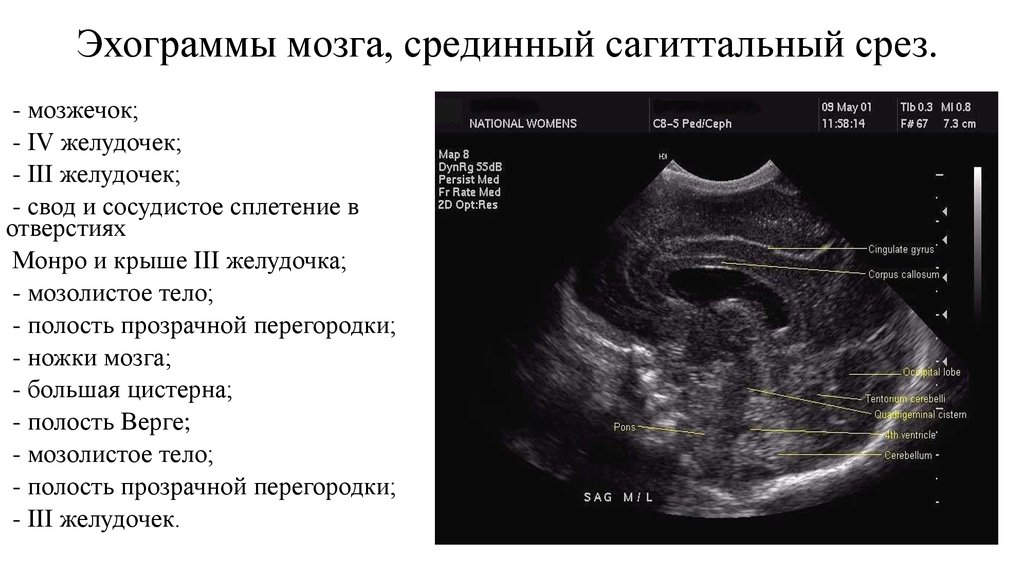
При ультразвуковой визуализации необходимо учитывать повышение эхоплотности перивентрикулярной зоны над плотностью сосудистого сплетения. Отмечается выявление очагов инфаркта и некроза перивентрикулярного белого вещества мозга на уровне треугольника боковых желудочков и белого вещества лобных долей; визуализация кист на 2–4-й неделе жизни вдоль латеральной или верхней границы бокового желудочка, расположение кист в теменных и затылочных отделах головного мозга. В некоторых случаях может визуализироваться полное, частичное или изолированное отсутствие мозолистого тела, признаки голопрозэнцефалии и гидроцефалии, кальцификация коры, базальных ядер или перивентрикулярной области.
В некоторых случаях может визуализироваться полное, частичное или изолированное отсутствие мозолистого тела, признаки голопрозэнцефалии и гидроцефалии, кальцификация коры, базальных ядер или перивентрикулярной области.
Клинический случай
Новорожденная девочка весом 1 600 г, ростом 43 см. Окружность головы — 31 см, груди — 28 см. Оценка по шкале Апгар 5/6 баллов (2-1(ИВЛ)-1-0-1 /2-1(ИВЛ)-1-1-1). От 3-й беременности, протекающей на фоне нарушения жирового обмена 1–2-й степени, артериальной гипертензии II риск 2, кисты правой почки, миопии средней степени обоих глаз в сроке 225 дней.
Поступление в ОАиР для новорожденных
Состояние крайне тяжелое. Находилась на аппарате ИВЛ. Мышечный тонус и двигательная активность снижены, рефлексы адаптации угнетены. Большой родничок — 2,0×2,0 см, спокоен. Кожа розовая, отечный синдром 2-й степени. Оценка гестационной зрелости по Petrussа 32 недели.
Дыхание аппаратное, симметрично проводится с обеих сторон, выслушиваются рассеянные хрипы в умеренном количестве. Тоны сердца ритмичные, несколько приглушены, шум не выслушивается. ЧСС 144–146 уд/ мин, АД 52/31→59/37 мм рт. ст. на фоне титрования дофамина 7,5 мкг/кг/мин и норадреналина 0,05 мкг/кг/мин. Вводился гидрокортизон по схеме.
Тоны сердца ритмичные, несколько приглушены, шум не выслушивается. ЧСС 144–146 уд/ мин, АД 52/31→59/37 мм рт. ст. на фоне титрования дофамина 7,5 мкг/кг/мин и норадреналина 0,05 мкг/кг/мин. Вводился гидрокортизон по схеме.
Живот мягкий, доступен пальпации, перистальтика выслушивается, снижена. Печень +1 см, селезенка не пальпируется. Стул после очистительной клизмы, мекониальный. Мочилась, моча светлая.
Гемодинамика в течение 7 суток стабилизировалась титрованием дофамина 7,5→3 мкг/кг/мин и 4 суток — норадреналина 0,05 мкг/кг/мин. АД 59/37 — 69/44 мм рт. ст., ЧСС 146–160 уд/мин.
Ребенок на ИВЛ, дыхание симметрично проводится с обеих сторон, с постепенным исчезновением хрипов к 2-м суткам, SaO2 97 %. Учитывая данные коагулограммы и УЗИ головного мозга, для повышения коагуляционного потенциала крови в 1-е, 4-е сутки жизни переливалась СЗП О (I) Rh +.
Отечный синдром в динамике с уменьшением, с 8-го дня жизни отеков нет. Желтухи не было. Кормление с первых суток жизни физиологическим раствором с переходом на смесь Pre-NAN 0, остатков не отмечалось. С 6-го дня жизни переведена на смесь Pre-NAN, усваивает.
Кормление с первых суток жизни физиологическим раствором с переходом на смесь Pre-NAN 0, остатков не отмечалось. С 6-го дня жизни переведена на смесь Pre-NAN, усваивает.
Обследование
ЭЭГ № 1–4: низкоамплитудная ЭЭГ с признаками дисциркуляторных расстройств в сосудистых бассейнах головного мозга.
УЗИ головного мозга № 1: боковые желудочки симметричны, передние рога справа 3 мм, слева 4 мм. Полости боковых желудочков не расширены. Затылочный рог справа 13 мм, слева 15 мм. III желудочек 3 мм. Перивентрикулярная область: эхогенность не повышена. Отмечается повышенное количество жидкости между извилинами. Межполушарная щель срединна, не расширена, 3 мм. Субарахноидальное пространство не расширено. Рисунок извилин и борозд слабо дифференцируется.
Сосудистые сплетения: справа контуры ровные, структура однородная, слева контуры неровные, структура однородная. Полость прозрачной перегородки 8 мм. Полость Верге 4 мм, большая цистерна 6 мм. Зрительные бугры и базальные ядра: эхоструктура однородная, эхогенность несколько повышена. В области переднего рога левого бокового желудочка визуализируется неоднородное гиперэхогенное образование 6×5 мм.
Полость Верге 4 мм, большая цистерна 6 мм. Зрительные бугры и базальные ядра: эхоструктура однородная, эхогенность несколько повышена. В области переднего рога левого бокового желудочка визуализируется неоднородное гиперэхогенное образование 6×5 мм.
Допплерометрия: PMA PS-13.2, PD -6,4, RI 0,52.
Заключение: субэпендимальное кровоизлияние слева, несколько снижен мозговой кровоток.
УЗИ головного мозга № 2–3: межполушарная борозда срединна. Подоболочечное пространство 4 мм. Извилины и борозды слабо дифференцируются. Передние рога боковых желудочков справа 4 мм, слева 4 мм. III желудочек 3 мм. Большая цистерна 8 мм. В области проекции боковых желудочков гиперэхогенные образования слева 7×4 мм, справа 6×4 мм.
Допплерометрия ПМА: PS-32,4, PD -11,3, RI 0,65 (N).
Заключение: внутрижелудочковые кровоизлияния (ВЖК) 1–2-й степени с двух сторон.
УЗИ головного мозга № 4
Допплерометрия ПМА: RI 0,72.
Заключение: незрелость структур головного мозга. ВЖК 1–2-й степени с двух сторон.
УЗИ головного мозга № 5: боковые желудочки симметричны, передние рога справа 4 мм, слева 4 мм. Полости боковых желудочков не расширены. Затылочный рог справа 25 мм, слева 24 мм. III желудочек 5 мм. Перивентрикулярная область: эхогенность повышена. Межполушарная щель срединна, не расширена. Субарахноидальное пространство не расширено. Субкортикальные зоны: эхогенность повышена. Рисунок извилин и борозд слабо выражен.
Сосудистые сплетения: справа контуры ровные, структура однородная, слева контуры неровные, структура неоднородная. Полость прозрачной перегородки 8 мм. Полость Верге 3 мм, большая цистерна 10 мм. Зрительные бугры и базальные ядра: эхоструктура однородная, эхогенность несколько повышена. В области боковых желудочков имеются гиперэхогенные образования справа 6×4 мм, слева 8×4 мм.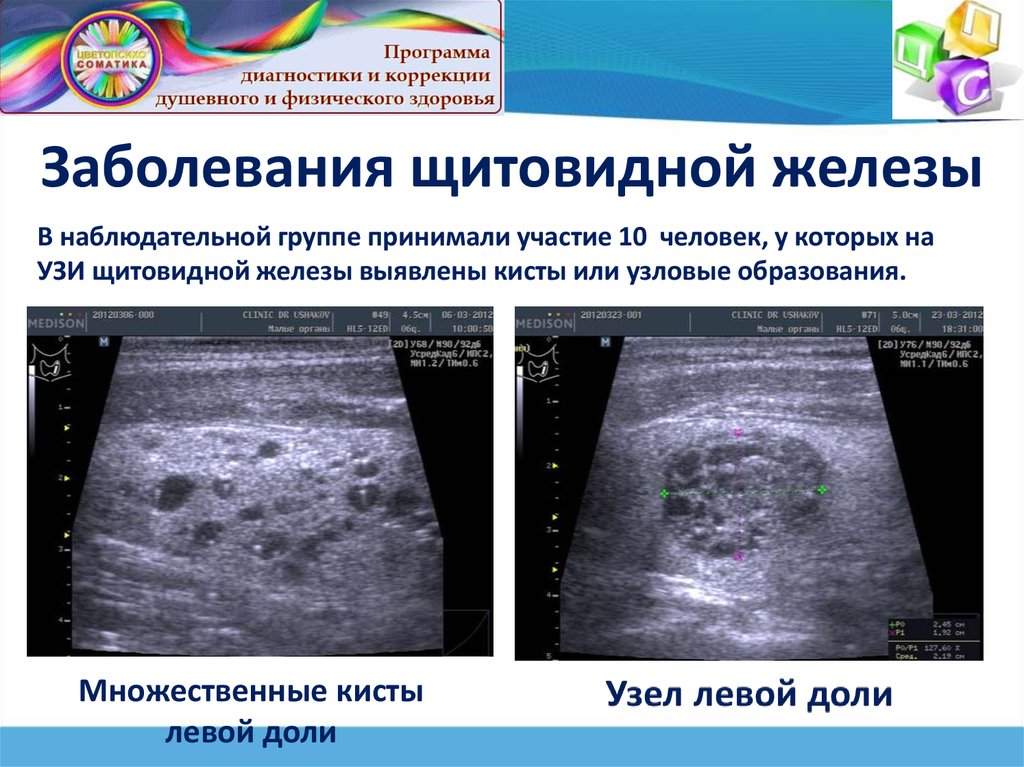
Заключение: ВЖК 1–2-й степени с двух сторон. Выраженная незрелость структур головного мозга.
УЗИ головного мозга № 6
Допплерометрия: RI 0,65.
Заключение: вентрикуломегалия, ВЖК 1–2-й степени с двух сторон.
УЗИ головного мозга № 7: в области проекции боковых желудочков гиперэхогенные образования слева 7×4 мм, справа 8×5 мм.
Заключение: без динамики.
УЗИ органов брюшной полости № 1–2: без патологии.
Rtg органов грудной клетки и брюшной полости № 1
ОГК: легкие расправлены, определяется усиление легочного рисунка в прикорневых отделах с двух сторон. Средостение срединно. Cor — N.
ОБП: следы газа в желудке.
Rtg органов грудной клетки и брюшной полости № 2
ОГК: по всем легочным полям затенения среднеинтенсивные с нечеткими контурами.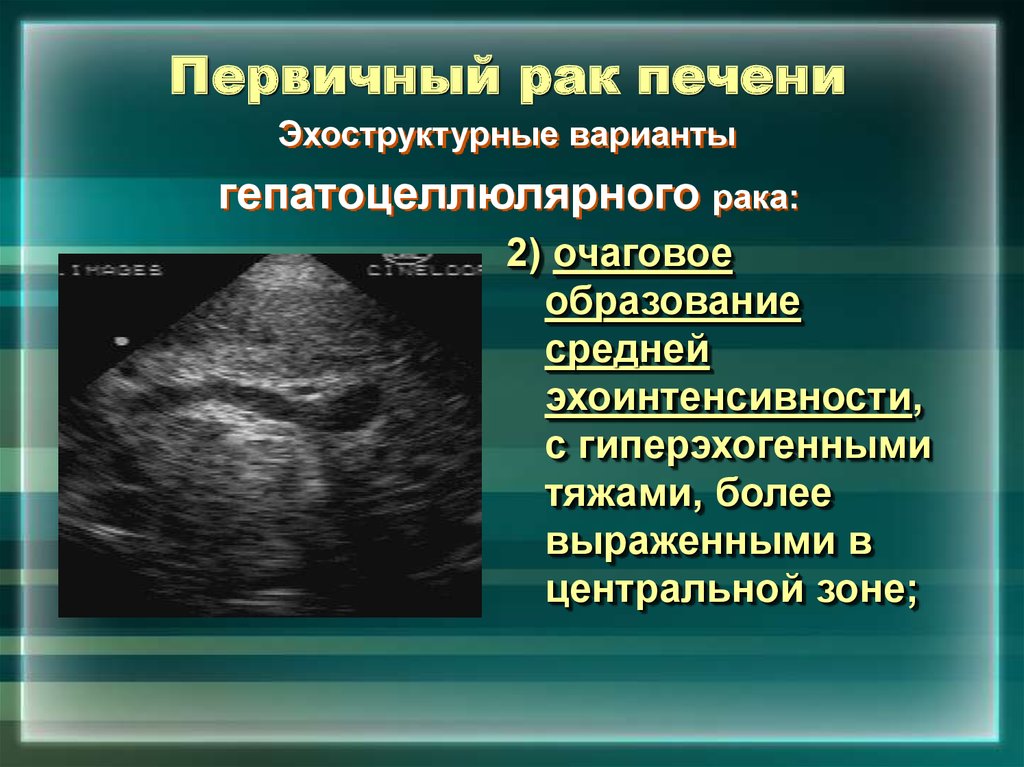 Корни прослеживаются. Средостение срединно. Cor — N.
Корни прослеживаются. Средостение срединно. Cor — N.
Окулист № 1: OU: спокойны, роговицы отечные, рефлекс с глазного дна тусклый, глазное дно из-за отека не офтальмоскопируется. Рекомендовано: осмотр детским офтальмологом.
Окулист № 2: OU: спокойны, роговицы чистые, прозрачные, рефлекс с глазного дна розовый, глазное дно соответствует сроку гестации. Рекомендовано: осмотр детским офтальмологом.
ЭКГ: снижен вольтаж, ритм синусовый, ЧСС 166–170 уд/мин, отклонение ЭОС вправо, нарушение процессов реполяризации в миокарде.
Эхо-КС: открытое овальное окно. Регургитация на МК 1-й степени, на ТК 1-й степени.
Диагноз
Спастическая диплегия. Детский церебральный паралич: ранняя стадия (?). Синдром дыхательного расстройства у новорожденного в стадии разрешения и формирования бронхолегочной дисплазии. Церебральная депрессия у новорожденного. ВЖК 1–2-й степени с двух сторон. Недоношенность 32 недели. Внутриутробная гипоксия плода, впервые отмеченная до родов. Умеренная асфиксия при рождении.
ВЖК 1–2-й степени с двух сторон. Недоношенность 32 недели. Внутриутробная гипоксия плода, впервые отмеченная до родов. Умеренная асфиксия при рождении.
К 6-му месяцу жизни выставлен окончательный диагноз: детский церебральный паралич, спастическая диплегия; канюленоситель.
Ультразвуковая диагностика | РЕАЛМЕД
Ультразвуковая диагностика – распознавание патологических изменений органов и тканей организма с помощью ультразвука. Основана на принципе эхолокации — приёме сигналов посланных, а затем отражённых от поверхностей раздела тканевых сред, обладающих различными акустическими свойствами.
Метод ультразвуковой диагностики широко распространён во всём мире, благодаря его безопасности, безвредности и высокой информативности.В настоящее время ультразвуковая диагностика стала всеобъемлющей, часто первичной, скрининговой и, в некоторых случаях, окончательной методикой диагностики, а порой, даже, единственной в постановке диагноза.
Ультразвуковое исследование (эхография, сонография) относится к неионизирующим методам исследования. Благодаря простоте выполнения, безвредности, высокой информативности оно получило широкое распространение в клинической практике. В ряде случаев ультразвукового исследования бывает достаточно для установления диагноза, в других — ультразвук используется наряду с прочими (рентгенологическими, радионуклидными) методами.
Благодаря простоте выполнения, безвредности, высокой информативности оно получило широкое распространение в клинической практике. В ряде случаев ультразвукового исследования бывает достаточно для установления диагноза, в других — ультразвук используется наряду с прочими (рентгенологическими, радионуклидными) методами.
Ультразвуковые волны легко распространяются в упругих средах и отражаются на границе различных слоев в зависимости от изменения акустического сопротивления среды. Чем больше акустическое сопротивление исследуемой ткани, тем интенсивнее она отражает ультразвуковые сигналы, тем светлее исследуемый участок выглядит на сканограмме. Отражение участком ткани ультразвуковых сигналов сильнее, чем в норме, определяют терминами «повышенная эхогенность», или «усиленная эхоструктура». Наибольшей эхогенностью обладают конкременты желчных путей, поджелудочной железы, почек и др. Их акустическое сопротивление может быть настолько велико, что они совершенно не пропускают ультразвуковые сигналы, полностью отражая их. На сканограммах такие образования имеют белый цвет, а позади них располагается черного цвета «акустическая дорожка», или тень конкремента, — зона, в которую сигналы не поступают. Жидкость (например, заполняющая кисты), обладающая низким акустическим сопротивлением, отражает эхосигналы в небольшой степени. Такие зоны с пониженной эхогенностью выглядят на сканограммах темными. Поскольку ткани человеческого организма (за исключением костной и легочной) содержат большое количество воды, они легко проводят ультразвуковые волны и являются хорошим объектом для исследования с помощью ультразвука. Газовая среда не проводит ультразвуковые волны. Этим объясняется малая эффективность использования ультразвука при исследовании лёгких. Главным элементом ультразвукового прибора является преобразователь (датчик), который с помощью пьезоэлектрического кристалла преобразует электрический сигнал в звук высокой частоты (0,5—15 МГц). Этот же кристалл используется для приема отраженных луковых волн и их преобразования в электрические сигналы.
На сканограммах такие образования имеют белый цвет, а позади них располагается черного цвета «акустическая дорожка», или тень конкремента, — зона, в которую сигналы не поступают. Жидкость (например, заполняющая кисты), обладающая низким акустическим сопротивлением, отражает эхосигналы в небольшой степени. Такие зоны с пониженной эхогенностью выглядят на сканограммах темными. Поскольку ткани человеческого организма (за исключением костной и легочной) содержат большое количество воды, они легко проводят ультразвуковые волны и являются хорошим объектом для исследования с помощью ультразвука. Газовая среда не проводит ультразвуковые волны. Этим объясняется малая эффективность использования ультразвука при исследовании лёгких. Главным элементом ультразвукового прибора является преобразователь (датчик), который с помощью пьезоэлектрического кристалла преобразует электрический сигнал в звук высокой частоты (0,5—15 МГц). Этот же кристалл используется для приема отраженных луковых волн и их преобразования в электрические сигналы.
Сканирование может быть линейным и секторным. Использование датчика с высокой скоростью сканирования (16—30 кадров в секунду) позволяет регистрировать движения органов в естественном временном режиме (реальном масштабе времени) В современных диагностических ультразвуковых приборах используются полутоновые дисплеи, на которых яркость световой точки пропорциональна интенсивности отраженного сигнала. Применяют также аппараты, снабженные ЭВМ, которые позволяют производить сканирование объекта с разных направлений (ультразвуковая компьютерная томография). Использование эффекта Допплера, заключающегося в изменении частоты отраженной ультразвуковой волны пропорционально скорости движения исследуемого объекта, позволило разработать приборы для исследования направления и скорости кровотока (допплерография).
Минимальная разрешающая способность современных ультразвуковых приборов, при которых исследуемые объекты различаются на экране как отдельные структуры, определяется расстоянием 1 мм. Глубина проникновения ультразвука в ткани организма обратно пропорциональна его частоте. С учетом этого созданы специализированные приборы, применяемые в офтальмологии, гинекологии и др.Ультразвуковые исследования обычно не требуют специальной подготовки. Исследование органов брюшной полости рекомендуется производить натощак, исследование женских половых органов, предстательной железы, мочевого пузыря осуществляют при наполненном мочевом пузыре.
Глубина проникновения ультразвука в ткани организма обратно пропорциональна его частоте. С учетом этого созданы специализированные приборы, применяемые в офтальмологии, гинекологии и др.Ультразвуковые исследования обычно не требуют специальной подготовки. Исследование органов брюшной полости рекомендуется производить натощак, исследование женских половых органов, предстательной железы, мочевого пузыря осуществляют при наполненном мочевом пузыре.
С помощью ультразвукового исследования с достаточно высокой точностью выявляются различные объемные образования как внутренних органов, так и поверхностно расположенных тканей. Кисты обычно имеют вид округлых низкой акустической плотности или эхонегативных образований с четким наружным контуром, равномерно тонкой гладкой стенкой. Удаленный от датчика контур более четкий, непосредственно за ним паренхима органа выглядит более светлой по сравнению с другими её участками (так называемый эффект усиления).
Гематомы отличаются преимущественно нечетким контуром, неправильной формой, отсутствием стенки. Внутренняя структура имеет низкую, вплоть до эхонегативности, акустическую плотность. Наблюдается эффект усиления наиболее удаленной границы гематомы. При организации гематомы внутри нее могут определяться участки более высокой эхогенности, обусловленные сгустками крови и образованиями утолщенной стенки.
Внутренняя структура имеет низкую, вплоть до эхонегативности, акустическую плотность. Наблюдается эффект усиления наиболее удаленной границы гематомы. При организации гематомы внутри нее могут определяться участки более высокой эхогенности, обусловленные сгустками крови и образованиями утолщенной стенки.
Абсцессы чаще бывают округлой или неправильной формы, контур их недостаточно четкий из-за реактивных изменений в окружающих тканях. Стенки абсцессов, как правило, неравномерно утолщены, внутренняя структура сниженной эхогенности, может иметь мелко- и крупнодисперсные включения, утолщенные перегородки, уровни расслоения жидких составных частей содержимого абсцесса. Стенками подпеченочных абсцессов являются петли кишечника и печень. Поддиафрагмальные абсцессы имеют вид полумесяца или овальную форму, часто сопровождаются реактивным выпотом в соответствующей плевральной полости, определяющимся как эхонегативное включение треугольной формы в области костно-диафрагмального синуса.
Опухоли имеют различную акустическую плотность и форму. У злокачественных опухолей часто наблюдаются неровность контура, неоднородность внутренней структуры, эхонегативные участки, обусловленные некрозом или кровоизлияниями. Низкоэхогенные опухоли, как правило, не имеют эффекта усиления наиболее удаленной стенки.
У злокачественных опухолей часто наблюдаются неровность контура, неоднородность внутренней структуры, эхонегативные участки, обусловленные некрозом или кровоизлияниями. Низкоэхогенные опухоли, как правило, не имеют эффекта усиления наиболее удаленной стенки.
Более эффективной, чем рентгеновская, является ультразвуковая диагностика инородных тел мягких тканей, позволяющая выявить и так называемые рентгенонегативные инородные тела. Поскольку инородные тела обычно имеют высокую акустическую плотность, они имеют вид образований повышенной эхогенности, часто с акустической тенью.
Ультразвуковая диагностика позволяет дифференцировать различную сосудистую патологию. В норме артериальные сосуды имеют в поперечнике вид четко очерченных округлых пульсирующих эхонегативных образований, венозные — форму вытянутого эллипса, при этом пульсация отмечается лишь у полых вен. На продольных сканограммах сосуды изображаются в виде двух параллельных полос повышенной эхогенности.При тромбозе или тромбоэмболии артериального сосуда в его просвете обнаруживается образование низкой эхогенности, дистальнее которого отсутствует или резко снижена пульсация сосуда.
При тромбозе венозного сосуда в результате нарушения оттека вена до места тромбоза приобретает в поперечнике округлую форму, увеличивается ее диаметр, при тромбозе полой вены исчезает пульсация. За тромбом вена может быть в спавшемся состоянии.
Аневризмы артерий при ультразвуковом следовании определяются как пульсирующие эхонегативные или с пониженной эхогенностью образования, имеющие связь с артериальным сосудом. Внутри аневризмы часто обнаруживаются пристеночные тромбы в виде участков более высокой эхогенности, а при применении аппаратуры с высокоразрешающей способностью в ряде случаев можно зарегистрировать турбулентные токи крови — участки с более высокой эхогенностью.Эхография, сонография и допплерография широко используются в диагностике заболеваний сердца. С помощью ультразвука можно определить систолический объем сердца, толщину миокарда, гемодинамические показатели, установить порок сердца, наличие перикардита и др. (см. Эхокардиография).
В пульмонологии ультразвук используют для выявления жидкости в плевральных полостях. Она имеет вид эхонегативных зон над диафрагмой или между грудной стенкой и легкими. При длительном существовании гидроторакса отмечаются утолщение листков плевры, тонкие спайки, перегородки. При эмпиеме плевры участок пониженной эхогенности имеет ограниченный характер. Он окружен толстой капсулой с нечеткими неровными контурами, отмечается резкое утолщение листков плевры, в плевральной полости видны утолщенные малоподвижные перегородки.
Она имеет вид эхонегативных зон над диафрагмой или между грудной стенкой и легкими. При длительном существовании гидроторакса отмечаются утолщение листков плевры, тонкие спайки, перегородки. При эмпиеме плевры участок пониженной эхогенности имеет ограниченный характер. Он окружен толстой капсулой с нечеткими неровными контурами, отмечается резкое утолщение листков плевры, в плевральной полости видны утолщенные малоподвижные перегородки.
Использование методов УЗД позволяет получить важную информацию о состоянии органов брюшной полости и забрюшинного пространства, щитовидной железы и др.
Щитовидная железа в норме на сонограммах имеет мелкозернистое строение. При диффузном увеличении щитовидной железы различной этиологии можно заподозрить аутоиммунную природу заболевания на основании неоднородности эхоструктуры железы. Кисты и опухоли железы имеют типичное для этих образований изображение. Дифференцировать злокачественную опухоль и аденому щитовидной железы на основании эхограммы затруднительно.
Печень в норме представлена однородной слабоинтенсивной эхоструктурой, в паренхиме определяются сосуды и желчные протоки — образования более высокой акустической плотности. При циррозе печени эхогенность паренхимы становится неоднородной из-за появления очагов более высокой акустической плотности, контуры печени — неровными; может определяться свободная жидкость в брюшной полости (асцит) в виде зон с пониженной эхогенностью, увеличиваются диаметр воротной вены, селезенка. При стеатозе отмечается усиление эхоструктуры, обусловленное увеличением печеночных долек в результате отложения в них жира. Характерным для эхинококковых кист являются наличие перегородок, характеризующихся усилением эхоструктуры, а также очаги обызвествления как в стенке, так и внутри кисты.
Желчный пузырь в норме имеет удлиненную форму, размеры в пределах 10×4 см, толщину стенок, не превышающую 0,3 см. Содержимое желчного пузыря у здорового человека имеет эхонегативную структуру. Ультразвуковое исследование желчного пузыря позволяет диагностировать врожденные аномалии (двойной желчный пузырь, дивертикул, наличие перегородки и др.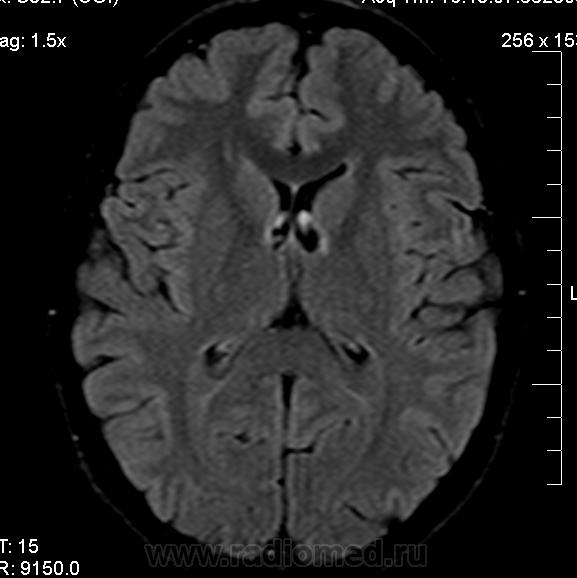 ), опухоли и холестериновые полипы в виде эхопозитивных образований средней или высокой плотности, исходящих из стенки органа, конкременты, воспалительные изменения, проявляются утолщением стенки (свыше 0,3 см), а при длительном процессе уплотнением, сопровождающимся усилением ее эхоструктуры.
), опухоли и холестериновые полипы в виде эхопозитивных образований средней или высокой плотности, исходящих из стенки органа, конкременты, воспалительные изменения, проявляются утолщением стенки (свыше 0,3 см), а при длительном процессе уплотнением, сопровождающимся усилением ее эхоструктуры.
Сонография является наиболее достоверным методом диагностики подпеченочной желтухи. Для выявления локализации и характера препятствия исследование рекомендуется проводить на приборах, работающих в реальном масштабе времени. Уровень блока (как вне-, так и внутрипеченочного) можно определить по расширению желчных путей (симптомы «двустволки» и «трехстволки»). Признаком механической желтухи может служить также расширенный желчный пузырь — так называемый ультразвуковой симптом Курвуазье. Сонографические признаки подпеченочной желтухи можно использовать при дифференциальной диагностике ее с печеночной, при которой расширения желчных путей не наблюдается.
Поджелудочная железа по акустическим свойствам ткани близка к печени. При остром панкреатите отмечаются увеличение органа, ослабление эхоструктуры, плохая визуализация селезеночной (проходя вдоль задневерхней поверхности железы) и воротной вен. Признаками хронического панкреатита служат увеличение органа, неровность, иногда размытость контуров, неоднородное усиление эхоструктуры, расширение панкреатического протока, образование псевдокист в виде зон с пониженной эхогенностью.Селезёнка на сканограмме в норме имеет полулунную форму, гомогенную эхоструктуру, в отличие от печени содержит меньше эхопозитивных включений. Исследование применяют при спленомегалии с целью обнаружения причины увеличения органа — опухоли, кисты, гематомы и др.
При остром панкреатите отмечаются увеличение органа, ослабление эхоструктуры, плохая визуализация селезеночной (проходя вдоль задневерхней поверхности железы) и воротной вен. Признаками хронического панкреатита служат увеличение органа, неровность, иногда размытость контуров, неоднородное усиление эхоструктуры, расширение панкреатического протока, образование псевдокист в виде зон с пониженной эхогенностью.Селезёнка на сканограмме в норме имеет полулунную форму, гомогенную эхоструктуру, в отличие от печени содержит меньше эхопозитивных включений. Исследование применяют при спленомегалии с целью обнаружения причины увеличения органа — опухоли, кисты, гематомы и др.
Ультразвуковое исследование почек проводят при подозрении на аномалии развития, закрытое повреждение, патологические процессы; показаниями к У. д., кроме того, служат стойкая артериальная гипертензия, макро- и микрогематурия.
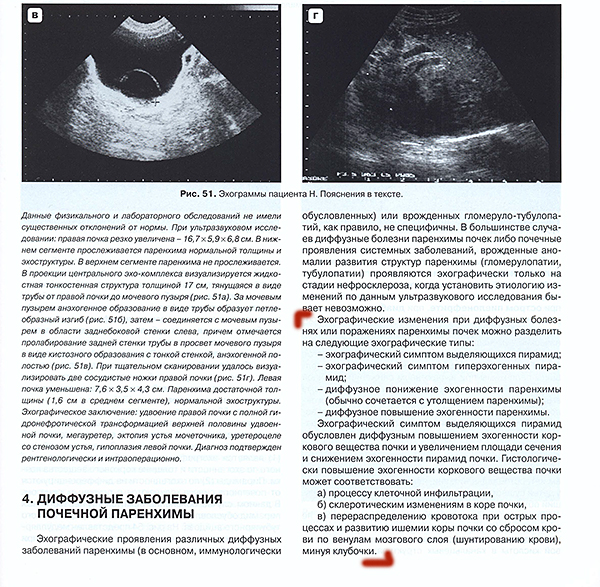
К ультразвуковым признакам аплазии почки относятся отсутствие акустических структур органа с одной стороны при обычно компенсаторном его увеличении с противоположной. Удвоение почки характеризуется наличием двойного акустического сигнала чашечно-лоханочного комплекса с одной стороны. Большое значение при удвоенной почке имеет оценка степени расширения верхней и нижней лоханок. С наибольшими трудностями сталкиваются при ультразвуковом исследовании дистопированных почек. При этом для получения лучшего изображения почечных структур со стороны передней брюшной стенки необходимы подготовка кишечника и достаточное наполнение мочевого пузыря. Большую роль сонография играет в диагностике поликистоза почек, который устанавливается практически в 100% случаев (множественные эхонегативные зоны в паренхиме органа). При этом определяют размеры и расположение кист, состояние паренхимы и чашечно-лоханочной системы.Травма почки с нарушением целостности почечной паренхимы и наличием интра- или паранефральной гематомы всегда сопровождается нарушениями строения и плотности тканей, что находит отражение в изменении эхоструктуры органа.
Удвоение почки характеризуется наличием двойного акустического сигнала чашечно-лоханочного комплекса с одной стороны. Большое значение при удвоенной почке имеет оценка степени расширения верхней и нижней лоханок. С наибольшими трудностями сталкиваются при ультразвуковом исследовании дистопированных почек. При этом для получения лучшего изображения почечных структур со стороны передней брюшной стенки необходимы подготовка кишечника и достаточное наполнение мочевого пузыря. Большую роль сонография играет в диагностике поликистоза почек, который устанавливается практически в 100% случаев (множественные эхонегативные зоны в паренхиме органа). При этом определяют размеры и расположение кист, состояние паренхимы и чашечно-лоханочной системы.Травма почки с нарушением целостности почечной паренхимы и наличием интра- или паранефральной гематомы всегда сопровождается нарушениями строения и плотности тканей, что находит отражение в изменении эхоструктуры органа.
Важное значение сонография имеет в диагностике острого и хронического нарушения пассажа мочи по верхним мочевым путям, признаками которого являются расширения чашечно-лоханочного комплекса и верхнего отдела мочеточника. Результаты исследования не зависят от функционального состояния органа и позволяют получать информацию при всех формах обструкции верхних мочевых путей. Признаками почечных камней размером более 0,4–0,5 см независимо от их химического состава являются характерные для конкрементов участки повышенной эхогенности и «акустические дорожки».
Результаты исследования не зависят от функционального состояния органа и позволяют получать информацию при всех формах обструкции верхних мочевых путей. Признаками почечных камней размером более 0,4–0,5 см независимо от их химического состава являются характерные для конкрементов участки повышенной эхогенности и «акустические дорожки».
При выявлении воспалительных заболеваний большую роль играет определение размеров почек, толщины паренхимы, состояния чашечно-лоханочной системы. При туберкулезе почки исследование позволяет уточнить стадию и форму заболевания, диагностировать туберкулезный пиелонефроз. Крупные участки с неоднородной эхоструктурой, менее эхогенные по сравнению с окружающей паренхимой в сочетании с деформацией наружных контуров почки в этой области характерны для карбункула почки. Образование округлой формы с однородным содержимым пониженной эхогенности — признак абсцесса. Пункция под ультразвуковым контролем позволяет провести дифференциальный диагноз абсцесса с кистой почки. О нарушении почечной гемодинамики можно судить по результатам допплеросонографии.
О нарушении почечной гемодинамики можно судить по результатам допплеросонографии.
Одним из наиболее частых показаний к ультразвуковому исследованию почек является дифференциальная диагностика объемных образований (опухолей, кист). К необходимым параметрам, определяемым посредством сонографии при опухоли почки, относятся размеры и объем опухоли, ее расположение, прорастание в соседние органы; обязательным также является исследование нижней полой и почечной вен с целью обнаружения опухолевого тромба. Опухоль верхнего сегмента почки, особенно при прорастании ее капсулы, иногда бывает трудно дифференцировать с опухолью надпочечника. В этом случае биопсия под ультразвуковым контролем и ангиографическое исследование позволяют уточнить диагноз.
У. д. используют также при динамическом наблюдении за трансплантированной почкой (ее размерами, толщиной коркового и мозгового слоев, состоянием паренхимы, почечных сосудов и окружающих тканей) с целью выявления реакции отторжения, а также осложнений посттрансплантационного периода таких как гематома, абсцесс, лимфоцеле, мочевой затек и др. Ее, кроме того, применяют для наблюдения за эффективностью лечения, например при консервативной терапии мочекаменной болезни.В урологической практике широко применяется также ультразвуковое исследование мочевого пузыря, предстательной железы, яичек и их придатков, мочеиспускательного канала. Мочевой пузырь исследуется в наполненном состоянии, интенсивность изображения на сканограмме соответствует интенсивности изображения других структур, содержащих жидкость, — лоханок, почечных кист.
Ее, кроме того, применяют для наблюдения за эффективностью лечения, например при консервативной терапии мочекаменной болезни.В урологической практике широко применяется также ультразвуковое исследование мочевого пузыря, предстательной железы, яичек и их придатков, мочеиспускательного канала. Мочевой пузырь исследуется в наполненном состоянии, интенсивность изображения на сканограмме соответствует интенсивности изображения других структур, содержащих жидкость, — лоханок, почечных кист.
Показаниями к ультразвуковому исследованию мочевого пузыря являются макро- и микрогематурия, подозрение на новообразование, конкременты, дивертикулы, повреждения мочевого пузыря, кистозные образования и опухоли мочевого протока. При подозрении на опухоль оцениваются объем мочевого пузыря, форма, конфигурация, симметричность, целостность послойного строения его стенок. С помощью ультразвука устанавливают локализацию опухоли, форму, размеры, степень инвазии, а также наличие обструкции верхних мочевых путей и метастазов в печени. При неинвазивных опухолях мочевой пузырь симметричен. При инвазии опухоли в мышечный слой нарушается симметричность мочевого пузыря и появляются дефекты в его стенке, вплоть до прерывистости в основании опухоли в случае распространения опухоли а паравезикальные ткани. Камни мочевого пузыря размерами более 0,4 см имеют ту же ультразвуковую картину, что и конкременты любой другой локализации; кроме того, важным дифференциально-диагностическим признаком является смещаемость камня при изменении положения тела больного. Дивертикулы мочевого пузыря имеют характерную картину дополнительной полости, наполненной жидкостью, рядом с мочевым пузырем. Важными показателями, оцениваемыми при ряде заболеваний мочевого пузыря и предстательной железы, сопровождающихся инфравезикальной обструкцией, являются наличие остаточной мочи и ее количество. При травматических повреждениях мочевого пузыря в некоторых случаях удается выявить наличие мочевого затека в паравезикальном пространстве (напоминает дивертикул либо визуализируется, как зона пониженной эхогенности на фоне окружающей клетчатки).
При неинвазивных опухолях мочевой пузырь симметричен. При инвазии опухоли в мышечный слой нарушается симметричность мочевого пузыря и появляются дефекты в его стенке, вплоть до прерывистости в основании опухоли в случае распространения опухоли а паравезикальные ткани. Камни мочевого пузыря размерами более 0,4 см имеют ту же ультразвуковую картину, что и конкременты любой другой локализации; кроме того, важным дифференциально-диагностическим признаком является смещаемость камня при изменении положения тела больного. Дивертикулы мочевого пузыря имеют характерную картину дополнительной полости, наполненной жидкостью, рядом с мочевым пузырем. Важными показателями, оцениваемыми при ряде заболеваний мочевого пузыря и предстательной железы, сопровождающихся инфравезикальной обструкцией, являются наличие остаточной мочи и ее количество. При травматических повреждениях мочевого пузыря в некоторых случаях удается выявить наличие мочевого затека в паравезикальном пространстве (напоминает дивертикул либо визуализируется, как зона пониженной эхогенности на фоне окружающей клетчатки). Преимуществом ультразвукового исследования перед восходящей цистографией а этом случае является отсутствие необходимости катетеризации и введения жидкости в мочевой пузырь.
Преимуществом ультразвукового исследования перед восходящей цистографией а этом случае является отсутствие необходимости катетеризации и введения жидкости в мочевой пузырь.
При оценке предстательной железы учитывают ее размеры, симметричность, форму, выраженность капсулы, эхоструктуру паренхимы, а также состояние перипростатического венозного сплетения. При использовании датчиков линейного сканирования измеряют каждую долю в переднезаднем и верхненижнем направлениях, с помощью датчиков секторного сканирования получают максимальные поперечный и верхненижний размеры. Более информативным параметром является объем предстательной железы, в т.ч. каждой ее доли. О симметричности железы лучше судить по данным, полученным с помощью датчика секторного сканирования: ориентиром для оценки симметрии служит уретра; изображение нормальной предстательной железы имеет вид треугольника, разделенного уретрой на равные части. Асимметрия характерна для рака предстательной железы, реже для аденомы. Оценка состояния капсулы важна для диагностики стадии рака предстательной железы (инвазия капсулы либо ее полное прорастание). Изменения эхоструктуры оцениваются лишь в совокупности с другими признаками патологии органа. Однородная эхоструктура, характерная для нормальной предстательной железы, может встречаться и при ее воспалительных заболеваниях. Воспаление может сопровождаться диффузными изменениями в виде зон повышенной эхогенности без четких границ, не превышающих эхогенность капсулы. Очаговые изменения в виде зон повышенной эхогенности, равной (либо превышающей) эхогенности капсулы предстательной железы, могут наблюдаться как при воспалительных процессах, так и при наличии конкрементов в органе (в последнем случае ниже зоны повышенной эхогенности определяется характерная «акустическая дорожка»). Зоны пониженной эхогенности (иногда имеют четкие границы) могут соответствовать местам скопления жидкости, что наблюдается, например, при остром простатите в фазе формирования абсцесса. Гипоэхогенные зоны, особенно если они расположены по периферии органа, подкапсульно, часто могут быть обусловлены раком предстательной железы.
Изменения эхоструктуры оцениваются лишь в совокупности с другими признаками патологии органа. Однородная эхоструктура, характерная для нормальной предстательной железы, может встречаться и при ее воспалительных заболеваниях. Воспаление может сопровождаться диффузными изменениями в виде зон повышенной эхогенности без четких границ, не превышающих эхогенность капсулы. Очаговые изменения в виде зон повышенной эхогенности, равной (либо превышающей) эхогенности капсулы предстательной железы, могут наблюдаться как при воспалительных процессах, так и при наличии конкрементов в органе (в последнем случае ниже зоны повышенной эхогенности определяется характерная «акустическая дорожка»). Зоны пониженной эхогенности (иногда имеют четкие границы) могут соответствовать местам скопления жидкости, что наблюдается, например, при остром простатите в фазе формирования абсцесса. Гипоэхогенные зоны, особенно если они расположены по периферии органа, подкапсульно, часто могут быть обусловлены раком предстательной железы. В этих случаях необходимо особенно тщательно оценить симметричность предстательной железы, состояние капсулы над зоной разрежения, а также ровность контуров.Перипростатическое венозное сплетение при использовании датчика секторного сканирования визуализируется в виде округлых с признаками наличия жидкости образований по бокам от верхушечной части предстательной железы. Датчик линейного сканирования позволяет визуализировать сплетение в виде образований линейной формы по бокам от обеих долей органа. В случае резкого расширения вен перипростатического сплетения (при использовании датчика линейного сканирования) они могут выглядеть как круглые, овальные или неправильной формы образования (плоскость сечения проходит через гроздьевидно расширенные вены).Семенные пузырьки визуализируются тотчас над предстательной железой. При использовании датчика секторного сканирования их изображение напоминает усы, проксимальные отделы пузырьков имеют вид содержащих жидкость образований с ровными контурами, округлых книзу.
В этих случаях необходимо особенно тщательно оценить симметричность предстательной железы, состояние капсулы над зоной разрежения, а также ровность контуров.Перипростатическое венозное сплетение при использовании датчика секторного сканирования визуализируется в виде округлых с признаками наличия жидкости образований по бокам от верхушечной части предстательной железы. Датчик линейного сканирования позволяет визуализировать сплетение в виде образований линейной формы по бокам от обеих долей органа. В случае резкого расширения вен перипростатического сплетения (при использовании датчика линейного сканирования) они могут выглядеть как круглые, овальные или неправильной формы образования (плоскость сечения проходит через гроздьевидно расширенные вены).Семенные пузырьки визуализируются тотчас над предстательной железой. При использовании датчика секторного сканирования их изображение напоминает усы, проксимальные отделы пузырьков имеют вид содержащих жидкость образований с ровными контурами, округлых книзу.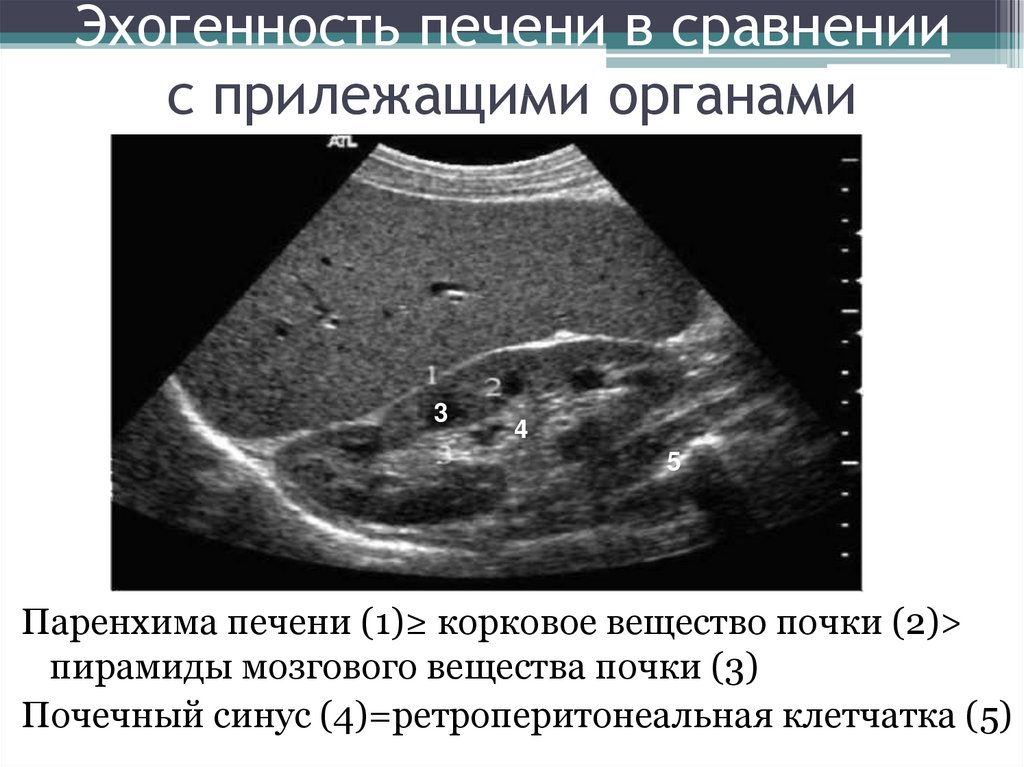 При линейном сканировании визуализируются проксимальные отделы семенных пузырьков в виде структур овальной формы. Расширение пузырьков чаще обусловлено снижением сексуальной активности, редко — их воспалением.Эхоструктура нормальных яичек однородна, средней плотности. При исследовании яичка в положении наружной ротации в ткани его определяется продольная полоса усиленных эхосигналов, исходящих от срединных структур. По задней его поверхности определяются сигналы средней плотности, соответствующие придатку яичка. Ультразвуковыми признаками повреждения яичек служат неровность их контуров, прерывистость белочной оболочки (более эхогенна, чем окружающая ткань), неоднородность эхоструктуры с появлением участков пониженной эхогенности, а также признаки скопления жидкости в месте повреждения. В случае острого эпидидимита наблюдаются увеличение придатка яичка, в большинстве случаев за счет головки, как усиление, так и уменьшение эхогенности. При эпидидимите туберкулезной этиологии увеличение придатка яичка происходит в основном за счет хвоста, где определяются очаги повышенной эхоплотности с четкими границами либо очаги разрежения.
При линейном сканировании визуализируются проксимальные отделы семенных пузырьков в виде структур овальной формы. Расширение пузырьков чаще обусловлено снижением сексуальной активности, редко — их воспалением.Эхоструктура нормальных яичек однородна, средней плотности. При исследовании яичка в положении наружной ротации в ткани его определяется продольная полоса усиленных эхосигналов, исходящих от срединных структур. По задней его поверхности определяются сигналы средней плотности, соответствующие придатку яичка. Ультразвуковыми признаками повреждения яичек служат неровность их контуров, прерывистость белочной оболочки (более эхогенна, чем окружающая ткань), неоднородность эхоструктуры с появлением участков пониженной эхогенности, а также признаки скопления жидкости в месте повреждения. В случае острого эпидидимита наблюдаются увеличение придатка яичка, в большинстве случаев за счет головки, как усиление, так и уменьшение эхогенности. При эпидидимите туберкулезной этиологии увеличение придатка яичка происходит в основном за счет хвоста, где определяются очаги повышенной эхоплотности с четкими границами либо очаги разрежения.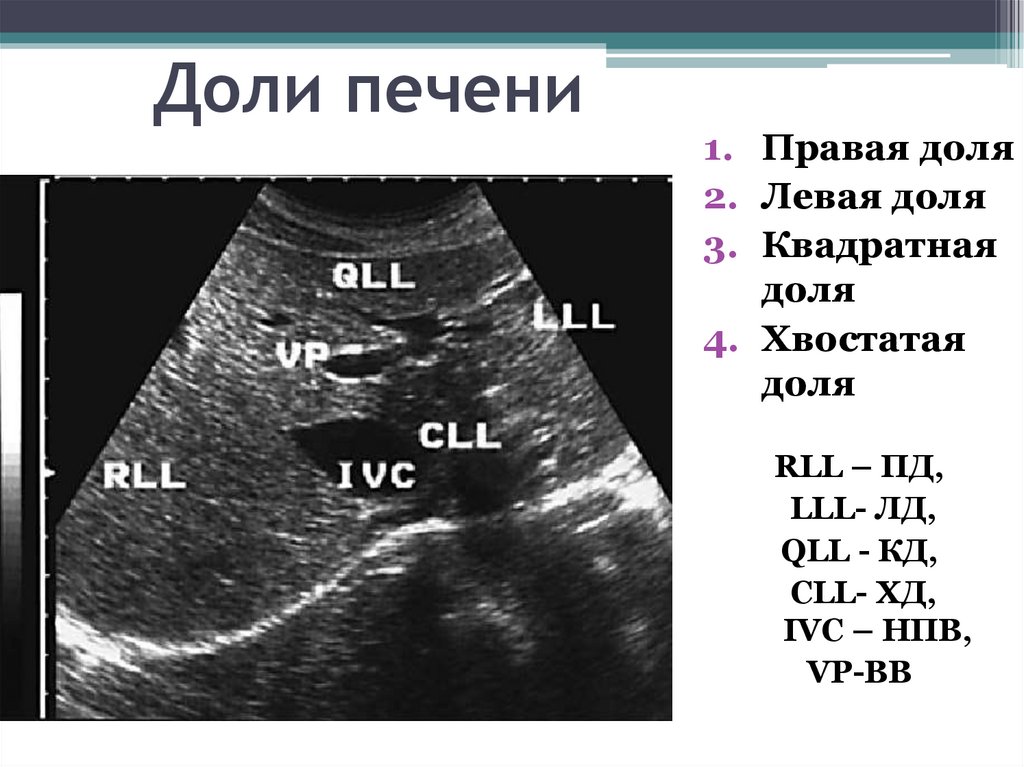 При вовлечении в воспалительный процесс яичка оно увеличивается, эхогенность тканей уменьшается. Абсцесс придатка яичка при ультразвуковом исследовании представляет собой объемное образование пониженной эхогенности с неровными контурами. Абсцесс яичка сопровождается обычно его увеличением, нечеткостью изображения вследствие воспалительной инфильтрации, появлением очагов разрежения с неровными контурами. Кисты придатка располагаются чаще в области головки и при ультразвуковом исследовании выглядят как округлые, содержащие жидкость образования с четкими контурами, однородной эхоструктуры. окруженные зоной усиления эхосигнала. При многокамерных кистах можно видеть перегородки в полости кисты в виде выраженных эхогенных линий. В случае водянки оболочек яичка последнее, как правило, смещено кпереди и книзу, жидкость, с трех сторон окружающая яичко и придаток, имеет меньшую эхогенность. Особую ценность ультразвуковое исследование приобретает для выявления опухолей яичка (исследование необходимо проводить при наличии в анамнезе больного крипторхизма или сведениях на позднее опущение яичек; в мошонку).
При вовлечении в воспалительный процесс яичка оно увеличивается, эхогенность тканей уменьшается. Абсцесс придатка яичка при ультразвуковом исследовании представляет собой объемное образование пониженной эхогенности с неровными контурами. Абсцесс яичка сопровождается обычно его увеличением, нечеткостью изображения вследствие воспалительной инфильтрации, появлением очагов разрежения с неровными контурами. Кисты придатка располагаются чаще в области головки и при ультразвуковом исследовании выглядят как округлые, содержащие жидкость образования с четкими контурами, однородной эхоструктуры. окруженные зоной усиления эхосигнала. При многокамерных кистах можно видеть перегородки в полости кисты в виде выраженных эхогенных линий. В случае водянки оболочек яичка последнее, как правило, смещено кпереди и книзу, жидкость, с трех сторон окружающая яичко и придаток, имеет меньшую эхогенность. Особую ценность ультразвуковое исследование приобретает для выявления опухолей яичка (исследование необходимо проводить при наличии в анамнезе больного крипторхизма или сведениях на позднее опущение яичек; в мошонку). В зависимости от вида опухоли могут выглядеть как объемные образования пониженной или повышенной эхоплотности располагающиеся как в ткани яичка, так и выходящие за его границы. В некоторых случаях для верификации опухоли показано проведение пункционной биопсии под контролем ультразвука. Одновременно необходимо исследовать парааортальные и паракавальные лимфатические узлы а также печень для исключения метастазов.Метод У. д. является необходимым дополнением к имеющимся способам диагностики стриктур уретры, т.к. позволяет уточнить степень выраженности склеротических изменений, что используется при установлении показаний к тому или иному виду операции. Применение ультразвука возможно и с целью диагностики заболеваний полового члена, и в первую очередь фибропластической индурации.
В зависимости от вида опухоли могут выглядеть как объемные образования пониженной или повышенной эхоплотности располагающиеся как в ткани яичка, так и выходящие за его границы. В некоторых случаях для верификации опухоли показано проведение пункционной биопсии под контролем ультразвука. Одновременно необходимо исследовать парааортальные и паракавальные лимфатические узлы а также печень для исключения метастазов.Метод У. д. является необходимым дополнением к имеющимся способам диагностики стриктур уретры, т.к. позволяет уточнить степень выраженности склеротических изменений, что используется при установлении показаний к тому или иному виду операции. Применение ультразвука возможно и с целью диагностики заболеваний полового члена, и в первую очередь фибропластической индурации.
В акушерстве и гинекологии исследование проводят как трансабдоминальным, так и трансвагинальным способом. Использование последнего значительно расширяет возможности УЗД. и позволяет более четко визуализировать органы малого таза, особенно у женщин с ожирением и спаечным процессом. Кроме того, применение этого способа не требует наполнения мочевого пузыря, что весьма тягостно для больных. Сонография позволяет получить информацию о наличии, характере и сроке беременности, распознать беременность в ранние (21/2—3 нед.) сроки. Использование ультразвука дает возможность установить неразвивающуюся беременность (фрагментация или нечеткость контуров, уменьшение размеров плодного яйца, отсутствие сердечной деятельности и двигательной активности плода), пузырный занос (множественные эхопозитивные структуры в полости матки, напоминающие губку), внематочную беременность (признаки плодного яйца за пределами матки, гематомы в позадиматочном пространстве). С помощью сонографии можно определить пол, пороки развития и заболевания плода (анэнцефалию, гидроцефалию, спинно- и черепно-мозговые грыжи, пороки сердца, диафрагмы, асцит, гидроторакс, гепато- и спленомегалию при гемолитической болезни плода, гидронефроз, поликистоз почек, водянку яичка и др.), а также его гипотрофию.
Кроме того, применение этого способа не требует наполнения мочевого пузыря, что весьма тягостно для больных. Сонография позволяет получить информацию о наличии, характере и сроке беременности, распознать беременность в ранние (21/2—3 нед.) сроки. Использование ультразвука дает возможность установить неразвивающуюся беременность (фрагментация или нечеткость контуров, уменьшение размеров плодного яйца, отсутствие сердечной деятельности и двигательной активности плода), пузырный занос (множественные эхопозитивные структуры в полости матки, напоминающие губку), внематочную беременность (признаки плодного яйца за пределами матки, гематомы в позадиматочном пространстве). С помощью сонографии можно определить пол, пороки развития и заболевания плода (анэнцефалию, гидроцефалию, спинно- и черепно-мозговые грыжи, пороки сердца, диафрагмы, асцит, гидроторакс, гепато- и спленомегалию при гемолитической болезни плода, гидронефроз, поликистоз почек, водянку яичка и др.), а также его гипотрофию.
Ультразвуковое исследование, особенно трансвагинальное, успешно используется при лечении бесплодия. Метод применяется для динамического наблюдения за ростом доминантного фолликула, эффективностью стимуляции овуляции. Под контролем ультразвукового сканирования производят пункцию фолликула при заборе яйцеклеток для внекорпорального оплодотворения.
Метод применяется для динамического наблюдения за ростом доминантного фолликула, эффективностью стимуляции овуляции. Под контролем ультразвукового сканирования производят пункцию фолликула при заборе яйцеклеток для внекорпорального оплодотворения.
Важная информация может быть получена при заболеваниях матки и яичников. В норме матка при продольном сканировании имеет грушевидную, при поперечном — овоидную форму. Внутри матки определяется небольшое количество эхопозитивных структур. При миоме отмечаются увеличение и неровность контуров органа, в миометрии — округлые образования с пониженной эхогенностью. В первой фазе менструального цикла полость матки не выявляется, во второй фазе на эхограммах в центре матки регистрируется повышение акустической плотности в виде срединного эхосигнала, ширина которого в норме не превышает 0,6 см; деформация эхосигнала свидетельствует о субмукозной миоме, расширение — о гиперплазии эндометрия или злокачественной опухоли (для последней особенно характерно одновременное расширение и деформация срединного эхосигнала). Выявление признаков полостей в миометрии указывает на возможность внутреннего эндометриоза.Яичники при ультразвуковом исследовании визуализируются в норме в виде образований овоидной формы обычно у женщин детородного возраста, значительно реже в период менопаузы. Фолликулярные кисты и кисты желтого тела выявляются как мелкие образования с ровными, четкими контурами, содержащие жидкость; склонны к регрессии при динамическом наблюдении. Паровариальные кисты, характеризующиеся теми же признаками, могут достигать 20 см и более в диаметре. Эндометриоидные кисты определяются как образования небольших размеров, могут иметь перегородки, увеличиваются в период менструации. Поликистозные яичники на сканограммах характеризуются увеличением размеров, утолщением капсулы, наличием множественных кистозных образований диаметром около 10 см (см. рис. к ст. Поликистозные яичники). Новообразования яичников имеют обычную для опухолей ультразвуковую картину. Дифференциальный диагноз доброкачественных и злокачественных опухолей на основе УЗД труден.
Выявление признаков полостей в миометрии указывает на возможность внутреннего эндометриоза.Яичники при ультразвуковом исследовании визуализируются в норме в виде образований овоидной формы обычно у женщин детородного возраста, значительно реже в период менопаузы. Фолликулярные кисты и кисты желтого тела выявляются как мелкие образования с ровными, четкими контурами, содержащие жидкость; склонны к регрессии при динамическом наблюдении. Паровариальные кисты, характеризующиеся теми же признаками, могут достигать 20 см и более в диаметре. Эндометриоидные кисты определяются как образования небольших размеров, могут иметь перегородки, увеличиваются в период менструации. Поликистозные яичники на сканограммах характеризуются увеличением размеров, утолщением капсулы, наличием множественных кистозных образований диаметром около 10 см (см. рис. к ст. Поликистозные яичники). Новообразования яичников имеют обычную для опухолей ультразвуковую картину. Дифференциальный диагноз доброкачественных и злокачественных опухолей на основе УЗД труден.
Ультразвуковое сканирование применяют с целью дифференциальной диагностики объемных процессов в области шеи, оценки их взаимоотношений с магистральными сосудами и др.В офтальмологии основными показаниями для ультразвукового исследования являются подозрение на наличие грубой патологии внутри глаза (при невозможности проведения офтальмоскопии) и экзофтальм, особенно односторонний. Ультразвуковые методы дают возможность визуализации содержимого глазного яблока (в том числе в случае отсутствия прозрачности оптических сред) и глазницы в виде зубцов различной амплитуды или сканограмм. Исследование позволяет обнаруживать помутнения и шварты в стекловидном теле, обычно являющиеся следствием гемофтальма, отслойку сетчатки и сосудистой оболочки, внутриглазные опухоли и новообразования глазницы, уточнять локализацию инородных тел, в том числе рентгенонегативных (камень, стекло, дерево). А-метод используется также для измерения глубины передней камеры глаза, толщины хрусталика, длины оптической оси (эхобиометрия) при расчете индивидуальной оптической силы искусственного хрусталика, контроле за степенью растяжения глазного яблока при близорукости и др.
Методы УЗД используются также при диагностических и лечебных чрескожных прицельных пункциях, что позволяет избегать повреждения жизненно важных органов. Одной из актуальных проблем современной неонатологии является диагностика поражений головного мозга у новорожденных детей, которые составляют 60-70% в структуре всей неврологической патологии детского возраста.
Современный этап развития медицины характеризуется широким внедрением в практику ультразвуковых методов исследования. Ценность метода определяется неинвазивностью, относительной простотой выполнения, информативностью, безопасностью и возможностью многократных исследований. Современные приборы, работающие в режиме «реального» времени, имеют небольшие размеры и могут быть использованы у постели больного, что особенно важно для обследования новорожденных детей. Выделяют линейное и секторальное сканирование. Система линейного сканирования позволяет визуализировать центральные структуры мозга и определить размеры боковых желудочков. Однако вследствие неполного контакта датчика с поверхностью головы ребенка поле наблюдения ограничено. При секторальном сканировании исследуемый объект может быть визуализирован из небольшого акустического окна (роднички, швы черепа), что устраняет необходимость прохождения ультразвуковых волн через сильно поглощающие ультразвук среды. Конвексное сканирование сочетает в себе преимущества обеих методов. В практическую медицину метод секторального сканирования головного мозга через большой родничок у новорожденного ребенка вошел под названием «чрезродничковой секторальной эхоэнцефалографии» или «нейросонографии» (НСГ). Для диагностики поражений головного мозга НСГ впервые применена в 1979 году и в настоящее время стала основным методом исследования головного мозга у новорожденных и детей раннего возраста.
Однако вследствие неполного контакта датчика с поверхностью головы ребенка поле наблюдения ограничено. При секторальном сканировании исследуемый объект может быть визуализирован из небольшого акустического окна (роднички, швы черепа), что устраняет необходимость прохождения ультразвуковых волн через сильно поглощающие ультразвук среды. Конвексное сканирование сочетает в себе преимущества обеих методов. В практическую медицину метод секторального сканирования головного мозга через большой родничок у новорожденного ребенка вошел под названием «чрезродничковой секторальной эхоэнцефалографии» или «нейросонографии» (НСГ). Для диагностики поражений головного мозга НСГ впервые применена в 1979 году и в настоящее время стала основным методом исследования головного мозга у новорожденных и детей раннего возраста.
Библиогр.: Богер М.М. и Мордвов С.А. Ультразвуковая диагностика в гастроэнтерологии, Новосибирск, 1988, библиогр.; Дворяковский В.И., Чурсин В.И. и Сафронов В.В. Ультразвуковая диагностика в педиатрии. Л., 1987, библиогр.; Демидов В.Н., Зыкин Б.И. Ультразвуковая диагностика в гинекологии, М., 1990; Демидов В.Н., Пытель Ю.А. и Амосов А.В. Ультразвуковая диагностика в уронефрологии, М., 1989, библиогр; Зубовский Г.А. Лучевая и ультразвуковая диагностика заболеваний печени и желчных путей, М., 1988;библиогр.; Клиническая ультразвуковая диагностика, под ред. Н.М. Мухарлямова, т. 1—2, М., 1987, библиогр.; Персианинов Л.С. и Демидов В.Н. Ультразвуковая диагностика в акушерстве, М., 1982, библиогр.; Соколов Л.К. и др. Клинико-инструментальная диагностика болезней органов гепатопанкреатодуоденальвой зоны, с. 20, М., 1987; Фридман Ф.Е., Гундорова Р.А., Кодзон М.Б. Ультразвук в офтальмологии, М., 1989; Шатихин А.И., Маколкин В.И. Ультразвуковая диагностика заболеваний поджелудочной железы, печени, желчевыводящих путей, легких и почек, М., 1983, библиогр.
Л., 1987, библиогр.; Демидов В.Н., Зыкин Б.И. Ультразвуковая диагностика в гинекологии, М., 1990; Демидов В.Н., Пытель Ю.А. и Амосов А.В. Ультразвуковая диагностика в уронефрологии, М., 1989, библиогр; Зубовский Г.А. Лучевая и ультразвуковая диагностика заболеваний печени и желчных путей, М., 1988;библиогр.; Клиническая ультразвуковая диагностика, под ред. Н.М. Мухарлямова, т. 1—2, М., 1987, библиогр.; Персианинов Л.С. и Демидов В.Н. Ультразвуковая диагностика в акушерстве, М., 1982, библиогр.; Соколов Л.К. и др. Клинико-инструментальная диагностика болезней органов гепатопанкреатодуоденальвой зоны, с. 20, М., 1987; Фридман Ф.Е., Гундорова Р.А., Кодзон М.Б. Ультразвук в офтальмологии, М., 1989; Шатихин А.И., Маколкин В.И. Ультразвуковая диагностика заболеваний поджелудочной железы, печени, желчевыводящих путей, легких и почек, М., 1983, библиогр.
Преждевременное повреждение белого вещества: ультразвуковая диагностика и классификация
1. Volpe JJ. Повреждение белого вещества головного мозга у недоношенных детей встречается чаще, чем вы думаете. Педиатрия. 2003; 112: 176–180. doi: 10.1542/peds.112.1.176. [PubMed] [CrossRef] [Google Scholar]
Педиатрия. 2003; 112: 176–180. doi: 10.1542/peds.112.1.176. [PubMed] [CrossRef] [Google Scholar]
2. Dyet LE, et al. Естественная история поражений головного мозга у крайне недоношенных детей изучалась с помощью серийной магнитно-резонансной томографии с рождения и оценки развития нервной системы. Педиатрия. 2006; 118: 536–548. doi: 10.1542/пед.2005-1866. [PubMed] [CrossRef] [Академия Google]
3. Индер Т.Е., и соавт. Определение характера церебральных аномалий у недоношенного ребенка: качественное магнитно-резонансное исследование. Дж. Педиатрия. 2003; 143:171–179. doi: 10.1067/S0022-3476(03)00357-3. [PubMed] [CrossRef] [Google Scholar]
4. Horsch S, et al. Аномалии головного мозга у младенцев с крайне низким гестационным возрастом: шведское популяционное исследование. Акта Педиатр. 2007; 96: 979–984. doi: 10.1111/j.1651-2227.2007.00294.x. [PubMed] [CrossRef] [Академия Google]
5. Hamrick SEG, et al. Тенденции тяжелой травмы головного мозга и исходы развития нервной системы у недоношенных новорожденных: роль кистозной перивентрикулярной лейкомаляции.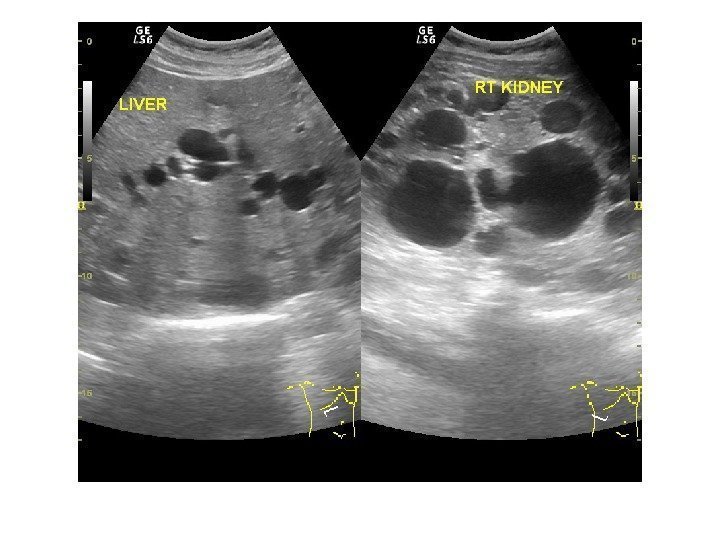 Дж. Педиатр. 2004; 145: 593–599. doi: 10.1016/j.jpeds.2004.05.042. [PubMed] [CrossRef] [Google Scholar]
Дж. Педиатр. 2004; 145: 593–599. doi: 10.1016/j.jpeds.2004.05.042. [PubMed] [CrossRef] [Google Scholar]
6. Back SA, Miller SP. Черепно-мозговая травма у недоношенных новорожденных: первичное нарушение мозгового созревания? Анна. Нейрол. 2014;75:469–486. doi: 10.1002/ana.24132. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
7. Woodward LJ, et al. МРТ новорожденных для прогнозирования исходов развития нервной системы у недоношенных детей. Н. англ. Дж. Мед. 2006; 355: 685–694. doi: 10.1056/NEJMoa053792. [PubMed] [CrossRef] [Google Scholar]
8. Maalouf EF, et al. Сравнение результатов ультразвукового исследования черепа и магнитно-резонансной томографии у недоношенных детей. Педиатрия. 2001; 107: 719–727. doi: 10.1542/peds.107.4.719. [PubMed] [CrossRef] [Google Scholar]
9. Mirmiran M, et al. Магнитно-резонансная томография головного мозга новорожденных перед выпиской лучше, чем серийное ультразвуковое исследование черепа, для прогнозирования церебрального паралича у недоношенных детей с очень низкой массой тела при рождении. Педиатрия. 2004;114:992–998. doi: 10.1542/peds.2003-0772-L. [PubMed] [CrossRef] [Google Scholar]
Педиатрия. 2004;114:992–998. doi: 10.1542/peds.2003-0772-L. [PubMed] [CrossRef] [Google Scholar]
10. Martinez-Biarge M, et al. Классификация преждевременных повреждений белого вещества на основе МРТ: важность последовательной визуализации в определении тяжести травмы. ПЛОС ОДИН. 2016;11:e0156245. doi: 10.1371/journal.pone.0156245. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
11. Leijser LM, et al. Надежно ли последовательное УЗИ головного мозга для выявления повреждения белого вещества у глубоко недоношенных детей? Нейрорадиология. 2010;52:397–406. doi: 10.1007/s00234-010-0668-7. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
12. Sarkar S, et al. Скрининг изображений черепа в несколько моментов времени улучшает обнаружение кистозной перивентрикулярной лейкомаляции. Являюсь. Дж. Перинатол. 2015; 32: 973–979. doi: 10.1055/s-0035-1545666. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
13. Skiöld, B. et al. Новая система подсчета очков для ультразвукового исследования черепа в доношенном возрасте у крайне недоношенных детей. УЗИ мед. биол. 45 , 786–794 (2019). [PubMed]
УЗИ мед. биол. 45 , 786–794 (2019). [PubMed]
14. Miller SP, et al. Сравнение диагностики повреждения белого вещества у недоношенных новорожденных с результатами серийной МРТ и трансфонтанальной ультрасонографии. Являюсь. Дж. Нейрорадиол. 2003; 24:1661–1669. [Бесплатная статья PMC] [PubMed] [Google Scholar]
15. Kidokoro H, Neil JJ, Inder TE. Новый инструмент оценки МРТ для определения аномалий головного мозга у глубоко недоношенных новорожденных в срок. Являюсь. Дж. Нейрорадиол. 2013;34:2208–2214. doi: 10.3174/ajnr.A3521. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
16. де Врис Л.С., Экен П., Дубовиц Л.М. Спектр лейкомаляции при УЗИ черепа. Поведение Мозг Res. 1992; 49:1–6. doi: 10.1016/S0166-4328(05)80189-5. [PubMed] [CrossRef] [Google Scholar]
17. Romero-Guzman GJ, Lopez-Munoz F. Распространенность и факторы риска перивентрикулярной лейкомаляции у недоношенных детей. Систематический обзор. Преподобный Нейрол. 2017;65:57–62. [PubMed] [Google Scholar]
2017;65:57–62. [PubMed] [Google Scholar]
18. Khwaja O, Volpe JJ. Патогенез повреждения белого вещества головного мозга у недоношенных. Арка Дис. Ребенок. Фетальный неонатальный Эд. 2008;93: F153–F161. doi: 10.1136/adc.2006.108837. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
19. Back SA. Повреждение белого вещества у недоношенных детей: патология и механизмы. Акта Нейропатол. (Берл.) 2017; 134: 331–349. doi: 10.1007/s00401-017-1718-6. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
20. Deng W, Pleasure J, Pleasure D. Прогресс при перивентрикулярной лейкомаляции. Арка Нейрол. 2008;65:1291–1295. doi: 10.1001/archneur.65.10.1291. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
21. Ву Ю.В., Колфорд Дж.М. Хориоамнионит как фактор риска церебрального паралича: метаанализ. ДЖАМА. 2000; 284:1417–1424. doi: 10.1001/jama.284.11.1417. [PubMed] [CrossRef] [Google Scholar]
22. Yoon BH, et al. Воздействие на плод внутриамниотического воспаления и развитие церебрального паралича в возрасте трех лет. Являюсь. Дж. Обст. Гинекол. 2000; 182: 675–681. doi: 10.1067/моб.2000.104207. [PubMed] [CrossRef] [Google Scholar]
Являюсь. Дж. Обст. Гинекол. 2000; 182: 675–681. doi: 10.1067/моб.2000.104207. [PubMed] [CrossRef] [Google Scholar]
23. Shah DK, et al. Неблагоприятное развитие нервной системы у недоношенных детей с постнатальным сепсисом или некротизирующим энтероколитом опосредовано аномалиями белого вещества на магнитно-резонансной томографии в срок. Дж. Педиатр. 2008; 153:170–175. doi: 10.1016/j.jpeds.2008.02.033. [PubMed] [CrossRef] [Академия Google]
24. Buser JR, et al. Задержка созревания преолигодендроцитов способствует нарушению миелинизации у недоношенных детей. Анна. Нейрол. 2012;71:93–109. doi: 10.1002/ana.22627. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
25. Volpe JJ, et al. Развивающиеся олигодендроциты: ключевая клеточная мишень при повреждении головного мозга у недоношенных детей. Междунар. Дж. Дев. Неврологи. 2011; 29: 423–440. doi: 10.1016/j.ijdevneu.2011.02.012. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
26. Haynes RL, et al. Развитие аксонов в белом веществе головного мозга плода и младенца человека. Дж. Комп. Нейрол. 2005; 484: 156–167. doi: 10.1002/cne.20453. [PubMed] [CrossRef] [Google Scholar]
Развитие аксонов в белом веществе головного мозга плода и младенца человека. Дж. Комп. Нейрол. 2005; 484: 156–167. doi: 10.1002/cne.20453. [PubMed] [CrossRef] [Google Scholar]
27. Alix JJP, et al. Центральные аксоны, готовящиеся к миелинизации, очень чувствительны [скорректированы] к ишемическому повреждению. Анна. Нейрол. 2012; 72: 936–951. doi: 10.1002/ana.23690. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
28. Volpe JJ. Черепно-мозговая травма у недоношенных детей: сложная смесь деструктивных нарушений и нарушений развития. Ланцет Нейрол. 2009 г.;8:110–124. doi: 10.1016/S1474-4422(08)70294-1. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
29. Volpe JJ. Энцефалопатия недоношенных включает аномалии нейронов. Педиатрия. 2005; 116: 221–225. doi: 10.1542/пед.2005-0191. [PubMed] [CrossRef] [Google Scholar]
30. Ball G, et al. Влияние преждевременных родов на развитие таламуса и коры головного мозга. Церебр. Cortex (Нью-Йорк, штат Нью-Йорк) 2012; 22:1016–1024. [Бесплатная статья PMC] [PubMed] [Google Scholar]
[Бесплатная статья PMC] [PubMed] [Google Scholar]
31. Ajayi-Obe M, et al. Снижение развития коры головного мозга у крайне недоношенных детей. Lancet (Лондон, Англия) 2000; 356:1162–1163. doi: 10.1016/S0140-6736(00)02761-6. [PubMed] [CrossRef] [Академия Google]
32. Peterson BS, et al. Региональные объемы головного мозга и их более поздние корреляты развития нервной системы у доношенных и недоношенных детей. Педиатрия. 2003; 111:939–948. doi: 10.1542/peds.111.5.939. [PubMed] [CrossRef] [Google Scholar]
33. Inder TE, et al. Аномальная структура головного мозга присутствует в срок у недоношенных детей. Педиатрия. 2005; 115: 286–294. doi: 10.1542/peds.2004-0326. [PubMed] [CrossRef] [Google Scholar]
34. Шринивасан Л. и соавт. Количественная оценка глубокого серого вещества у недоношенных детей в возрасте, эквивалентном доношенному, с использованием ручной волюметрии магнитно-резонансных изображений 3 тесла. Педиатрия. 2007;119: 759–765. doi: 10.1542/пед.2006-2508.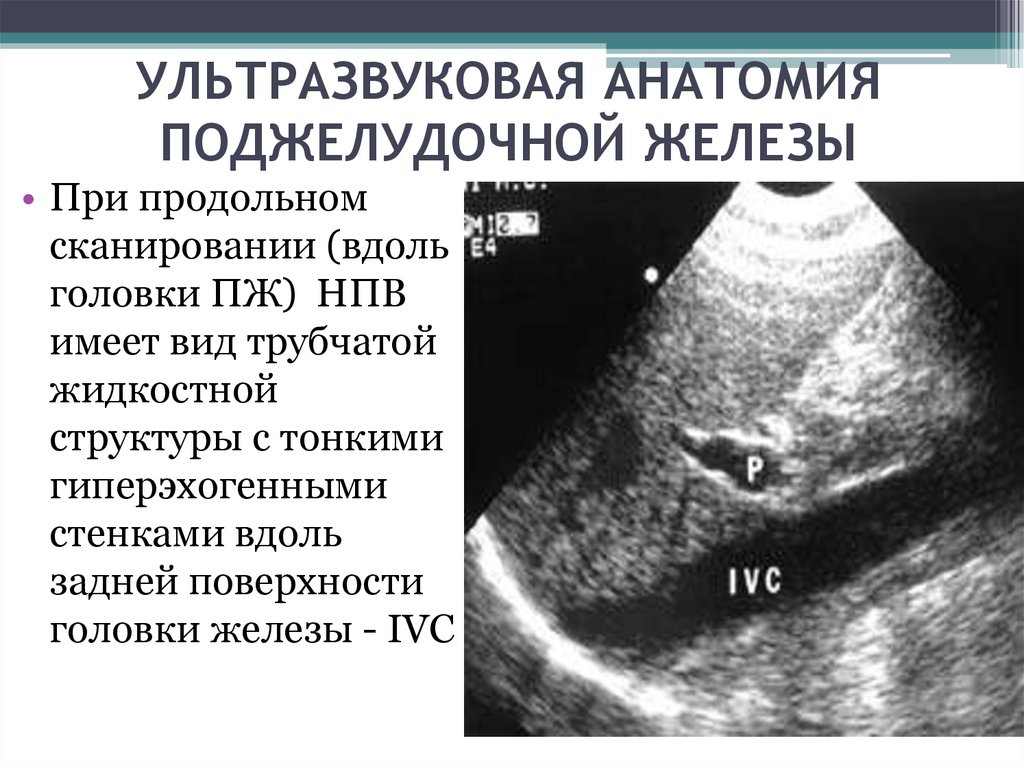 [PubMed] [CrossRef] [Google Scholar]
[PubMed] [CrossRef] [Google Scholar]
35. Hill A, et al. Геморрагическая перивентрикулярная лейкомаляция: диагностика с помощью УЗИ в реальном времени и корреляция с результатами вскрытия. Педиатрия. 1982; 69: 282–284. [PubMed] [Google Scholar]
36. Pierrat V, et al. Ультразвуковая диагностика и исход развития нервной системы при локализованной и обширной кистозной перивентрикулярной лейкомаляции. Арка Дис. Ребенок. Фетальный неонатальный Эд. 2001; 84: F151–F156. doi: 10.1136/fn.84.3.F151. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
37. De Vries LS, et al. Ультразвуковые аномалии, предшествующие детскому церебральному параличу, у недоношенных детей с высоким риском. Дж. Педиатр. 2004; 144: 815–820. doi: 10.1016/j.jpeds.2004.03.034. [PubMed] [CrossRef] [Google Scholar]
38. Leijser LM, et al. Сравнение белого вещества головного мозга при последовательном УЗИ черепа и МРТ у глубоко недоношенных детей. Нейрорадиология. 2008; 50: 799–811. doi: 10. 1007/s00234-008-0408-4. [PubMed] [CrossRef] [Google Scholar]
1007/s00234-008-0408-4. [PubMed] [CrossRef] [Google Scholar]
39. Pinto J, et al. Вариабельность между наблюдателями в неонатальной краниальной ультрасонографии. Педиатр. Перинат. Эпидемиол. 1988;2:43–58. doi: 10.1111/j.1365-3016.1988.tb00179.x. [PubMed] [CrossRef] [Google Scholar]
40. Hintz SR, et al. Межнаблюдательная надежность и точность интерпретации ультразвукового сканирования черепа у недоношенных детей. Дж. Педиатр. 2007; 150: 592–596. doi: 10.1016/j.jpeds.2007.02.012. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
41. Govaert, P. & de Vries, L. Атлас неонатальной сонографии мозга. Clinics in Developmental Medicine № 182–183 , 2-е изд. (Mac Keith Press, Лондон, 2010 г.).
42. Boxma A, et al. Сонографическое обнаружение оптического излучения. Акта Педиатр. (Осло, Норвегия: 1992) 2005; 94: 1455–1461. doi: 10.1080/08035250510031331. [PubMed] [CrossRef] [Google Scholar]
43. Leijser LM, et al. Часто встречающиеся краниальные эхографические признаки белого вещества недоношенных детей: корреляция с МРТ. Евро. Дж. Педиатр. Нейрол. 2009; 13: 317–326. doi: 10.1016/j.ejpn.2008.06.005. [PubMed] [CrossRef] [Google Scholar]
Евро. Дж. Педиатр. Нейрол. 2009; 13: 317–326. doi: 10.1016/j.ejpn.2008.06.005. [PubMed] [CrossRef] [Google Scholar]
44. Дамманн О., Левитон А. Продолжительность транзиторных гиперэхогенных изображений белого вещества у младенцев с очень низкой массой тела при рождении: предлагаемая классификация. Дев. Мед .Детский Нейрол. 1997;39:2–5. doi: 10.1111/j.1469-8749.1997.tb12287.x. [PubMed] [CrossRef] [Google Scholar]
45. Jongmans M, et al. Продолжительность перивентрикулярной плотности у недоношенных детей и неврологический исход в возрасте 6 лет. Арка Дис. Ребенок. 1993; 69: 9–13. doi: 10.1136/adc.69.1_Spec_No.9. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
46. Ancel P-Y, et al. Детский церебральный паралич среди глубоконедоношенных детей в зависимости от гестационного возраста и неонатальных ультразвуковых аномалий: когортное исследование EPIPAGE. Педиатрия. 2006; 117: 828–835. doi: 10.1542/пед.2005-0091. [PubMed] [CrossRef] [Google Scholar]
47. Pellicer A, et al. Естественная история дилатации желудочков у недоношенных детей: прогностическое значение. Педиатр. Нейрол. 1993; 9: 108–114. doi: 10.1016/0887-8994(93)
Pellicer A, et al. Естественная история дилатации желудочков у недоношенных детей: прогностическое значение. Педиатр. Нейрол. 1993; 9: 108–114. doi: 10.1016/0887-8994(93)
-D. [PubMed] [CrossRef] [Google Scholar]
48. Bennett FC, et al. Перивентрикулярная эхоплотность, обнаруженная с помощью краниальной ультрасонографии: полезность в прогнозировании исхода развития нервной системы у недоношенных детей с низкой массой тела при рождении. Педиатрия. 1990; 85: 400–404. [PubMed] [Академия Google]
49. Horsch S, et al. Ультразвуковая диагностика атрофии головного мозга связана с исходом развития нервной системы у недоношенных детей. Акта Педиатр. 2005; 94: 1815–1821. doi: 10.1111/j.1651-2227.2005.tb01858.x. [PubMed] [CrossRef] [Google Scholar]
50. Sie LT, et al. Ранние МР-признаки гипоксически-ишемического поражения головного мозга у новорожденных с перивентрикулярной плотностью на сонограммах. Являюсь. Дж. Нейрорадиол. 2000; 21:852–861. [Бесплатная статья PMC] [PubMed] [Google Scholar]
51. Fawer CL, Diebold P, Calame A. Перивентрикулярная лейкомаляция и исходы развития нервной системы у недоношенных детей. Арка Дис. Ребенок. 1987;62:30–36. doi: 10.1136/adc.62.1.30. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Fawer CL, Diebold P, Calame A. Перивентрикулярная лейкомаляция и исходы развития нервной системы у недоношенных детей. Арка Дис. Ребенок. 1987;62:30–36. doi: 10.1136/adc.62.1.30. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
52. van Haastert IC, et al. Снижение заболеваемости и тяжести детского церебрального паралича у недоношенных детей. Дж. Педиатр. 2011; 159:86–91. doi: 10.1016/j.jpeds.2010.12.053. [PubMed] [CrossRef] [Google Scholar]
53. Rodriguez J, et al. Перивентрикулярная лейкомаляция: ультразвуковые и нейропатологические корреляции. Дев. Мед. Детский Нейрол. 1990; 32: 347–352. doi: 10.1111/j.1469-8749.1990.tb16947.х. [PubMed] [CrossRef] [Google Scholar]
54. Sarkar, S. et al. Исход недоношенных детей с транзиторной кистозной перивентрикулярной лейкомаляцией при серийной визуализации черепа до доношенного возраста. Ж. Педиатр. 2 , pii: S0022-3476(17)31632-3 (2018). [Бесплатная статья PMC] [PubMed]
55.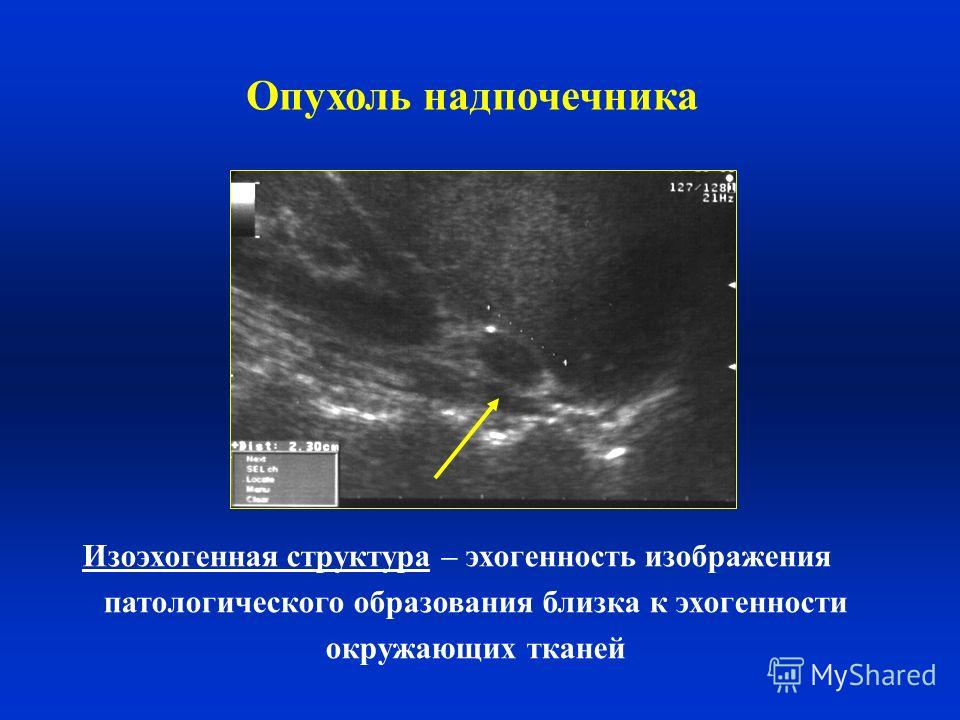 Maalouf EF, et al. Магнитно-резонансная томография головного мозга в когорте крайне недоношенных детей. Дж. Педиатр. 1999; 135:351–357. doi: 10.1016/S0022-3476(99)70133-2. [PubMed] [CrossRef] [Академия Google]
Maalouf EF, et al. Магнитно-резонансная томография головного мозга в когорте крайне недоношенных детей. Дж. Педиатр. 1999; 135:351–357. doi: 10.1016/S0022-3476(99)70133-2. [PubMed] [CrossRef] [Академия Google]
56. Maunu J, et al. Мозг и желудочки у доношенных детей с очень низкой массой тела при рождении: сравнение окружности головы, УЗИ и магнитно-резонансной томографии. Педиатрия. 2009; 123: 617–626. doi: 10.1542/пед.2007-3264. [PubMed] [CrossRef] [Google Scholar]
57. Fox LM, et al. Взаимосвязь между размером желудочка в 1 месяц и исходом в 2 года у младенцев со сроком гестации менее 30 недель. Арка Дис. Ребенок. Фетальный неонатальный Эд. 2014;99:F209–F214. doi: 10.1136/archdischild-2013-304374. [PubMed] [CrossRef] [Академия Google]
58. O’Shea TM, et al. Исследование ELGAN головного мозга и связанных с ним нарушений у новорожденных с крайне низким гестационным возрастом. Ранний гул. Дев. 2009; 85: 719–725. doi: 10.1016/j.earlhumdev.2009.08.060. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
59. Ment LR, et al. Этиология и исход церебральной вентрикуломегалии у недоношенных детей с очень низкой массой тела при рождении. Педиатрия. 1999; 104: 243–248. doi: 10.1542/peds.104.2.243. [PubMed] [CrossRef] [Google Scholar]
Ment LR, et al. Этиология и исход церебральной вентрикуломегалии у недоношенных детей с очень низкой массой тела при рождении. Педиатрия. 1999; 104: 243–248. doi: 10.1542/peds.104.2.243. [PubMed] [CrossRef] [Google Scholar]
60. Pappas A, et al. Исходы развития нервной системы и поведения у крайне недоношенных новорожденных с вентрикуломегалией при отсутствии перивентрикулярно-внутрижелудочкового кровоизлияния. JAMA Педиатр. 2018; 172:32–42. doi: 10.1001/jamapediatrics.2017.3545. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
61. Edwards AD, et al. Влияние МРТ на недоношенных детей и их семьи: рандомизированное исследование с вложенной диагностической и экономической оценкой. Арка Дис. Ребенок. Фетальный неонатальный Эд. 2018;103:F15–F21. doi: 10.1136/archdischild-2017-313102. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
62. Hintz SR, et al. Нейровизуализация и результаты развития нервной системы у крайне недоношенных детей. Педиатрия. 2015;135:e32–e42. doi: 10.1542/peds.2014-0898. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
2015;135:e32–e42. doi: 10.1542/peds.2014-0898. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
63. Rademaker KJ, et al. Большой размер мозолистого тела с лучшей двигательной активностью у недоношенных детей. Семин. перинатол. 2004; 28: 279–287. doi: 10.1053/j.semperi.2004.08.005. [PubMed] [CrossRef] [Google Scholar]
64. Counsell SJ, et al. Специфические отношения между способностями развития нервной системы и микроструктурой белого вещества у недоношенных детей. Мозг Дж. Нейрол. 2008; 131:3201–3208. doi: 10.1093/brain/awn268. [PubMed] [CrossRef] [Google Scholar]
65. Stippel G, Philips W, Govaert P. Тканеспецифический адаптивный текстурный фильтр для медицинских ультразвуковых изображений. УЗИ Мед. биол. 2005; 31: 1211–1223. doi: 10.1016/j.ultrasmedbio.2005.05.008. [PubMed] [CrossRef] [Академия Google]
66. Vansteenkiste E, et al. Классификация перивентрикулярной лейкомаляции на основе текстуры на ультразвуковых изображениях недоношенных. Курс. Мед. Imaging Rev. 2008; 4: 113–124. doi: 10.2174/157340508784356761. [CrossRef] [Google Scholar]
Мед. Imaging Rev. 2008; 4: 113–124. doi: 10.2174/157340508784356761. [CrossRef] [Google Scholar]
67. Tenorio V, et al. Корреляция количественного анализа текстуры черепа с последующим нейроповедением у недоношенных детей. УЗИ Мед. биол. 2014;40:2285–2294. doi: 10.1016/j.ultrasmedbio.2014.04.009. [PubMed] [CrossRef] [Академия Google]
68. Корнетт Л.Г. и соавт. Магнитно-резонансная томография головного мозга младенцев: анатомические характеристики и клиническое значение точечных поражений. Арка Дис. Ребенок. Фетальный неонатальный Эд. 2002; 86: F171–F177. doi: 10.1136/fn.86.3.F171. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
69. De Vries LS, et al. Асимметричная миелинизация задней ножки внутренней капсулы у младенцев с перивентрикулярным геморрагическим инфарктом: ранний предиктор гемиплегии. нейропедиатрия. 1999;30:314–319. doi: 10.1055/s-2007-973511. [PubMed] [CrossRef] [Google Scholar]
70. Kersbergen KJ, et al. Различные паттерны точечных поражений белого вещества у недоношенных новорожденных при серийном сканировании.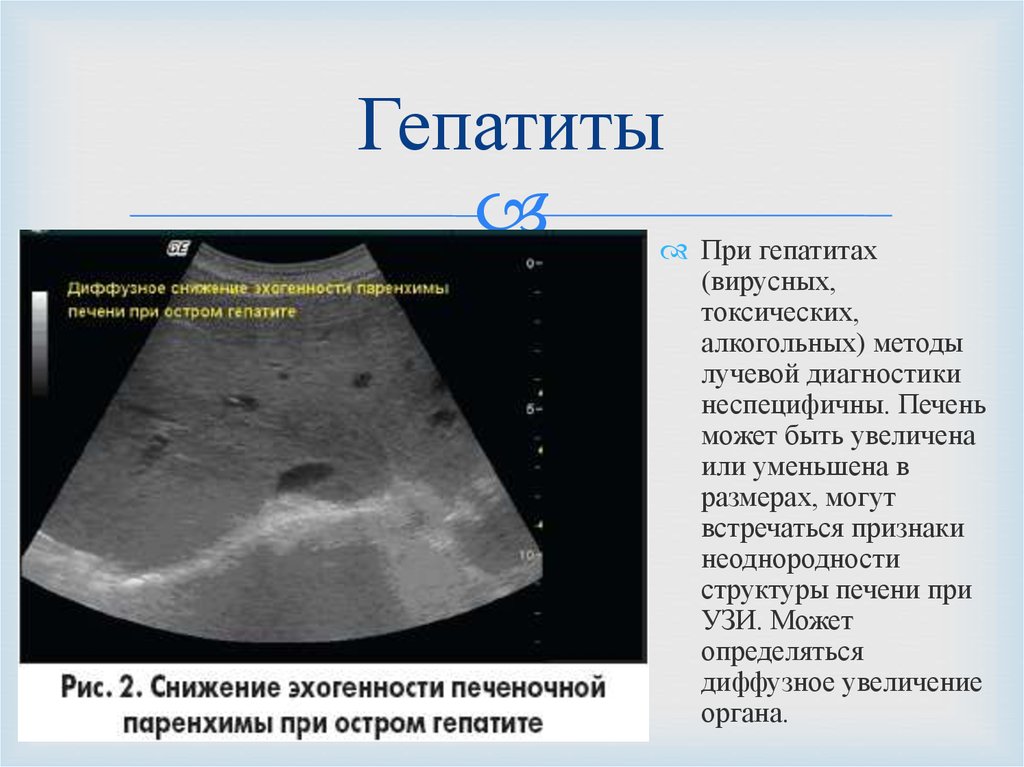 ПЛОС ОДИН. 2014;9:e108904. doi: 10.1371/journal.pone.0108904. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
ПЛОС ОДИН. 2014;9:e108904. doi: 10.1371/journal.pone.0108904. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
71. Smyser CD, Kidokoro H, Inder TE. Магнитно-резонансная томография головного мозга в доношенном возрасте у глубоконедоношенных новорожденных: сканировать или не сканировать? Дж. Педиатр. Здоровье ребенка. 2012;48:794–800. doi: 10.1111/j.1440-1754.2012.02535.x. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
72. Horsch S, et al. УЗИ и МРТ черепа в доношенном возрасте у глубоконедоношенных детей. Арка Дис. Ребенок. Фетальный неонатальный Эд. 2010; 95:F310–F314. doi: 10.1136/adc.2009.161547. [PubMed] [CrossRef] [Google Scholar]
73. van Wezel-Meijler G, et al. Ультразвуковое обнаружение повреждения белого вещества у глубоко недоношенных новорожденных: практические последствия. Дев. Мед. Детский Нейрол. 2011;53(Приложение 4):29–34. doi: 10.1111/j.1469-8749.2011.04060.x. [PubMed] [CrossRef] [Google Scholar]
74. Pearce R, Baardsnes J.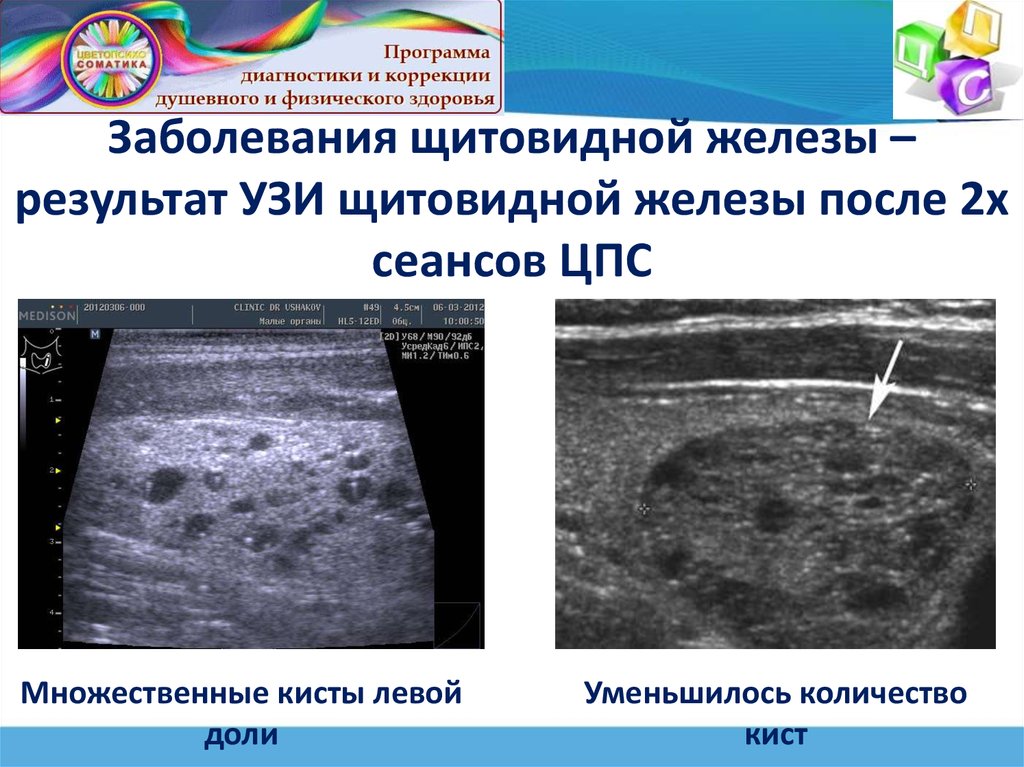 Доношенная МРТ для маловесных недоношенных детей: действительно ли родители хотят знать и почему их никто не спрашивал? Акта Педиатр. 2012;101:1013–1015. doi: 10.1111/j.1651-2227.2012.02767.x. [PubMed] [CrossRef] [Google Scholar]
Доношенная МРТ для маловесных недоношенных детей: действительно ли родители хотят знать и почему их никто не спрашивал? Акта Педиатр. 2012;101:1013–1015. doi: 10.1111/j.1651-2227.2012.02767.x. [PubMed] [CrossRef] [Google Scholar]
75. Pidcock FS, et al. Нейросонографические особенности перивентрикулярной эхоплотности, связанные с церебральным параличом у недоношенных детей. Дж. Педиатр. 1990;116:417–422. doi: 10.1016/S0022-3476(05)82836-7. [PubMed] [CrossRef] [Академия Google]
76. Пинто-Мартин Дж.А. и соавт. Ультразвуковое исследование черепа прогнозирует инвалидизирующий и неинвалидизирующий церебральный паралич в возрасте двух лет в популяции с низким весом при рождении. Педиатрия. 1995; 95: 249–254. [PubMed] [Google Scholar]
77. Холлинг Э.Э., Левитон А. Характеристики эхолюцентности белого вещества головного мозга при ультразвуковом исследовании, которые предсказывают инвалидность: обзор. Дев. Мед. Детский Нейрол. 1999; 41: 136–139. doi: 10.1017/S001216229
62. [PubMed] [CrossRef] [Google Scholar]
[PubMed] [CrossRef] [Google Scholar]
78. Resch B, et al. Факторы риска и детерминанты исхода развития нервной системы при кистозной перивентрикулярной лейкомаляции. Евро. Дж. Педиатр. 2000;159: 663–670. doi: 10.1007/PL00008403. [PubMed] [CrossRef] [Google Scholar]
79. Fazzi E, et al. Исход развития нервной системы в возрасте 5–7 лет у недоношенных детей с перивентрикулярной лейкомаляцией. нейропедиатрия. 1994; 25: 134–139. doi: 10.1055/s-2008-1071600. [PubMed] [CrossRef] [Google Scholar]
80. Rogers B, et al. Кистозная перивентрикулярная лейкомаляция и тип детского церебрального паралича у недоношенных детей. Дж. Педиатр. 1994; 125:S1–S8. doi: 10.1016/S0022-3476(94)70169-5. [PubMed] [CrossRef] [Академия Google]
81. Lanzi G, et al. Церебральные нарушения зрения при перивентрикулярной лейкомаляции. нейропедиатрия. 1998; 29: 145–150. doi: 10.1055/s-2007-973551. [PubMed] [CrossRef] [Google Scholar]
82. Cioni G, et al. Корреляция между зрительной функцией, исходом развития нервной системы и результатами магнитно-резонансной томографии у младенцев с перивентрикулярной лейкомаляцией. Арка Дис. Ребенок. Фетальный неонатальный Эд. 2000; 82: F134–F140. doi: 10.1136/fn.82.2.F134. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Арка Дис. Ребенок. Фетальный неонатальный Эд. 2000; 82: F134–F140. doi: 10.1136/fn.82.2.F134. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
83. Павлова М.А., Крагелох-Манн И. Ограничения развития головного мозга недоношенных: влияние перивентрикулярных поражений белого вещества на связность мозга и когнитивные функции. Мозг Дж. Нейрол. 2013; 136:998–1011. doi: 10.1093/мозг/aws334. [PubMed] [CrossRef] [Google Scholar]
84. Aarnoudse-Moens CSH, et al. Метаанализ нейроповеденческих исходов у очень недоношенных детей и/или детей с очень низкой массой тела при рождении. Педиатрия. 2009; 124:717–728. doi: 10.1542/пед.2008-2816. [PubMed] [CrossRef] [Академия Google]
85. Geldof CJA, et al. Зрительное восприятие и зрительно-моторная интеграция у очень недоношенных детей и/или детей с очень низкой массой тела при рождении: метаанализ. Рез. Дев. Инвалид. 2012; 33: 726–736. doi: 10.1016/j.ridd.2011.08.025. [PubMed] [CrossRef] [Google Scholar]
86. Reijneveld SA, et al. Поведенческие и эмоциональные проблемы у очень недоношенных детей и детей с очень низкой массой тела при рождении в возрасте 5 лет. Арка Дис. Ребенок. Фетальный неонатальный Эд. 2006; 91: F423–F428. doi: 10.1136/adc.2006.093674. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Поведенческие и эмоциональные проблемы у очень недоношенных детей и детей с очень низкой массой тела при рождении в возрасте 5 лет. Арка Дис. Ребенок. Фетальный неонатальный Эд. 2006; 91: F423–F428. doi: 10.1136/adc.2006.093674. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
87. Делобель-Аюб М. и соавт. Поведенческие проблемы и когнитивные способности в возрасте 5 лет после очень преждевременных родов: исследование EPIPAGE. Педиатрия. 2009; 123:1485–1492. doi: 10.1542/пед.2008-1216. [PubMed] [CrossRef] [Google Scholar]
88. Spittle AJ, et al. Раннее появление поведенческих и социально-эмоциональных проблем у глубоко недоношенных детей. Варенье. акад. Ребенок-подросток. Психиатрия. 2009; 48: 909–918. doi: 10.1097/CHI.0b013e3181af8235. [PubMed] [CrossRef] [Академия Google]
89. Leijser LM, et al. Структурные линейные измерения головного мозга новорожденного: точность краниального УЗИ по сравнению с МРТ. Педиатр. Радиол. 2007; 37: 640–648. doi: 10.1007/s00247-007-0485-2.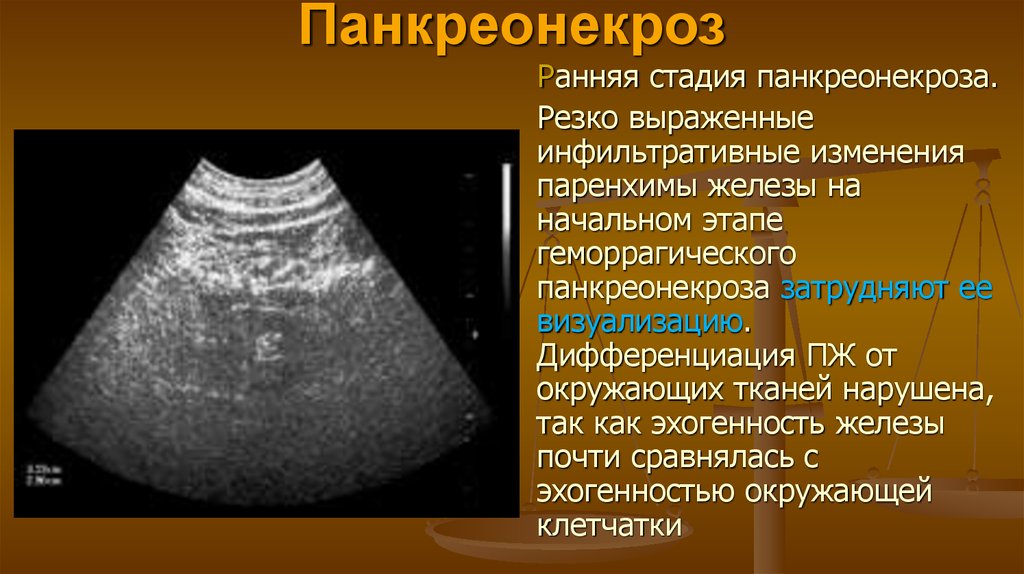 [PubMed] [CrossRef] [Google Scholar]
[PubMed] [CrossRef] [Google Scholar]
90. Hagmann CF, et al. Церебральные измерения, сделанные с помощью УЗИ черепа у доношенных новорожденных из Уганды. Ранний гул. Дев. 2011; 87: 341–347. doi: 10.1016/j.earlhumdev.2011.01.044. [PubMed] [CrossRef] [Google Scholar]
91. Brouwer MJ, et al. Новые референтные значения для желудочков головного мозга новорожденных. Радиология. 2012; 262: 224–233. doi: 10.1148/radiol.11110334. [PubMed] [CrossRef] [Академия Google]
92. Вольпе Дж.Дж. Путаница в номенклатуре: «перивентрикулярная лейкомаляция» и «поражение белого вещества» — идентичные, разные или перекрывающиеся? Педиатр. Нейрол. 2017;73:3–6. doi: 10.1016/j.pediatrneurol.2017.05.013. [PubMed] [CrossRef] [Google Scholar]
МРТ головного мозга новорожденных
Линда С де Врис, Флорис Грюнендал и Линда С Майнерс
8
- Введение
- Перивентрикулярная лейкомаляция (ПВЛ)
- Инфаркт
- Истории болезни
- Резюме
- Ссылки
Только у небольшого числа недоношенных детей развиваются тяжелые ишемические поражения в неонатальном периоде по сравнению с большей группой детей, у которых развиваются тяжелые внутрижелудочковые кровоизлияния с поражением паренхимы или без него. Несмотря на то, что обширное поражение белого вещества встречается нечасто, оно почти всегда приводит к церебральному параличу в более позднем возрасте. Важное значение имеет раннее распознавание, позволяющее нам начать надлежащее руководство как ребенком, так и семьей. В то время как обширные кисты в перивентрикулярном белом веществе могут быть легко распознаны с помощью УЗИ черепа, более мелкие кисты или просто повышенная перивентрикулярная эхогенность могут быть более трудными для выявления. В настоящее время проводится несколько исследований для оценки дополнительной ценности МРТ раннего новорожденного в этих условиях.
Несмотря на то, что обширное поражение белого вещества встречается нечасто, оно почти всегда приводит к церебральному параличу в более позднем возрасте. Важное значение имеет раннее распознавание, позволяющее нам начать надлежащее руководство как ребенком, так и семьей. В то время как обширные кисты в перивентрикулярном белом веществе могут быть легко распознаны с помощью УЗИ черепа, более мелкие кисты или просто повышенная перивентрикулярная эхогенность могут быть более трудными для выявления. В настоящее время проводится несколько исследований для оценки дополнительной ценности МРТ раннего новорожденного в этих условиях.
Очаговый инфаркт, обычно в области средней мозговой артерии, встречается еще реже и редко сообщается в литературе. Оба типа ишемического поражения обсуждаются и иллюстрируются изображениями, полученными с помощью УЗИ и МРТ.
< предыдущая | топ | содержание | далее >
Повреждение белого вещества вследствие гипоксии-ишемии было отмечено патологоанатомами еще в 1867 году, когда Вирхов впервые описал желтоватые белые участки в перивентрикулярном белом веществе 36 . Термин перивентрикулярная лейкомаляция (ПВЛ) был впервые введен в 1962 г. Banker и Larroche, поскольку в перивентрикулярном белом веществе наблюдались белые (лейкозные) пятна и размягчение (маляция) 3 . Эти ранние исследования патологии были в основном ограничены младенцами с гестационным возрастом 34 недели и более. Медицинские и технические разработки последних десятилетий позволили выжить младенцам с гестационным возрастом 23 недели и выше. Посмертные исследования этих более незрелых младенцев показывают более диффузный характер повреждения белого вещества, отличающийся от классической PVL, описанной Banker и Larroche 3 . Для младшей группы некоторые авторы предпочитают термин «повреждение белого вещества», а не PVL. Результаты вскрытия очень сильно зависят от времени, прошедшего между инсультом и временем смерти 25 . Через несколько дней в зоне поражения часто отмечают большое количество астроцитов и макрофагов. Разжижение центра некротического участка может произойти через 10–20 дней.
Термин перивентрикулярная лейкомаляция (ПВЛ) был впервые введен в 1962 г. Banker и Larroche, поскольку в перивентрикулярном белом веществе наблюдались белые (лейкозные) пятна и размягчение (маляция) 3 . Эти ранние исследования патологии были в основном ограничены младенцами с гестационным возрастом 34 недели и более. Медицинские и технические разработки последних десятилетий позволили выжить младенцам с гестационным возрастом 23 недели и выше. Посмертные исследования этих более незрелых младенцев показывают более диффузный характер повреждения белого вещества, отличающийся от классической PVL, описанной Banker и Larroche 3 . Для младшей группы некоторые авторы предпочитают термин «повреждение белого вещества», а не PVL. Результаты вскрытия очень сильно зависят от времени, прошедшего между инсультом и временем смерти 25 . Через несколько дней в зоне поражения часто отмечают большое количество астроцитов и макрофагов. Разжижение центра некротического участка может произойти через 10–20 дней. Разжижение может привести к образованию небольших полостей, обычно не сообщающихся с боковым желудочком. Однако в большинстве случаев в пораженной области развиваются только глиоз и кальцификация без образования полостей. В конце концов кистозные поражения исчезают и ex-vacuo затем может развиться дилатация соседнего желудочка.
Разжижение может привести к образованию небольших полостей, обычно не сообщающихся с боковым желудочком. Однако в большинстве случаев в пораженной области развиваются только глиоз и кальцификация без образования полостей. В конце концов кистозные поражения исчезают и ex-vacuo затем может развиться дилатация соседнего желудочка.
Хотя ПВЛ традиционно считается ишемическим поражением, и хотя у многих младенцев ПВЛ развивается после хорошо задокументированного клинического события, у многих других поражения выявляются случайно при ультразвуковом исследовании черепа. В последней группе может оказаться невозможным выявить какие-либо эпизоды тяжелой гипоксии-ишемии, хотя у некоторых младенцев может быть сепсис в анамнезе или клинические признаки инфекции (рис. 8.7). Ясно, что помимо ишемии важную роль в повреждении белого вещества играют и другие факторы. Повышенная уязвимость незрелых олигодендроцитов к глутамату была показана с использованием культивируемых олигодендроглий 9. 0225 1 . Провоспалительные цитокины связаны с развитием повреждения белого вещества и могут даже играть определенную роль перед родами. Связь повышенного уровня IL-1b, IL-6 и TNF-a, изученная в амниотической жидкости, а также в пуповинной крови, и болезни белого вещества в настоящее время хорошо установлена, причем данные получены как в экспериментах на животных, так и в клинических исследованиях. учеба 38 . Однако цитотоксические цитокины также могут высвобождаться во время ишемии 28 . PVL также может быть связана с постнатальными событиями. Всем новорожденным с клиническим ухудшением, например, вследствие сепсиса, следует проводить регулярные ультразвуковые исследования в течение следующих недель. Осложнения, возникающие после родов, также могут быть связаны с искусственной вентиляцией легких. Вазоконстрикция из-за гипокарбии является распространенным фактором риска, и следует избегать этого, особенно при использовании высокочастотной вентиляции.
0225 1 . Провоспалительные цитокины связаны с развитием повреждения белого вещества и могут даже играть определенную роль перед родами. Связь повышенного уровня IL-1b, IL-6 и TNF-a, изученная в амниотической жидкости, а также в пуповинной крови, и болезни белого вещества в настоящее время хорошо установлена, причем данные получены как в экспериментах на животных, так и в клинических исследованиях. учеба 38 . Однако цитотоксические цитокины также могут высвобождаться во время ишемии 28 . PVL также может быть связана с постнатальными событиями. Всем новорожденным с клиническим ухудшением, например, вследствие сепсиса, следует проводить регулярные ультразвуковые исследования в течение следующих недель. Осложнения, возникающие после родов, также могут быть связаны с искусственной вентиляцией легких. Вазоконстрикция из-за гипокарбии является распространенным фактором риска, и следует избегать этого, особенно при использовании высокочастотной вентиляции.
УЛЬТРАЗВУК ЧЕРЕПА
С 1983 года многие группы показали, что кистозная ПВЛ может быть диагностирована с помощью УЗИ черепа 32 . Корреляция с результатами вскрытия различается в различных исследованиях, опубликованных за последнее десятилетие. Чувствительность была очень высокой у младенцев, которые умерли после того, как развились кистозные поражения. Некоторыми было обнаружено большое количество ложноотрицательных результатов у младенцев с некавитирующей ПВЛ, поскольку небольшие участки ПВЛ и диффузный глиоз часто оставались незамеченными при УЗИ черепа 15 . Однако другие группы смогли показать хорошую корреляцию в этих некистозных случаях 32 . Серийные ультразвуковые исследования в течение достаточно длительного периода времени (несколько недель) необходимы при попытке диагностировать ПВЛ. Область эхоплотности появляется между 24 и 48 часами после известного повреждения, но кисты не развиваются в течение следующих 2-4 недель. Хотя единой общепринятой системы классификации PVL не существует, можно использовать следующую8:
- Степень I: области повышенной эхогенности, обычно проявляющиеся в течение 24–48 часов после инсульта и сохраняющиеся после 7-го дня, но не превращающиеся в кисты.

- II степень: локализованные мелкие кисты, чаще локализующиеся в лобно-теменном перивентрикулярном белом веществе.
- Степень III: обширные кистозные поражения, часто особенно заметные в теменно-затылочном перивентрикулярном белом веществе. Кисты обычно не сообщаются с боковым желудочком. Они разрушаются через несколько недель и перестают быть видны на УЗИ черепа, когда ребенку исполняется 2–3 месяца. На этой стадии можно отметить неравномерное ex-vacuo расширение желудочков из-за атрофии перивентрикулярного белого вещества 8 .
- Степень IV: обширные кистозные поражения, проникающие в глубокие (подкорковые) отделы белого вещества.
Рис. 8.1 (a), (b) Ультразвуковое исследование черепа, парасагиттальные проекции, показывающие обширные кистозные поражения в возрасте 3 недель. Кисты отделены от бокового желудочка. (c) МРТ, выполненная на 40 неделе ПМА. На уровне центрального полуовального окна (CSO) кисты можно увидеть в виде четко очерченных гипоинтенсивных областей, простирающихся по всему теменному белому веществу на этом инверсионно-восстановительном изображении (тип A).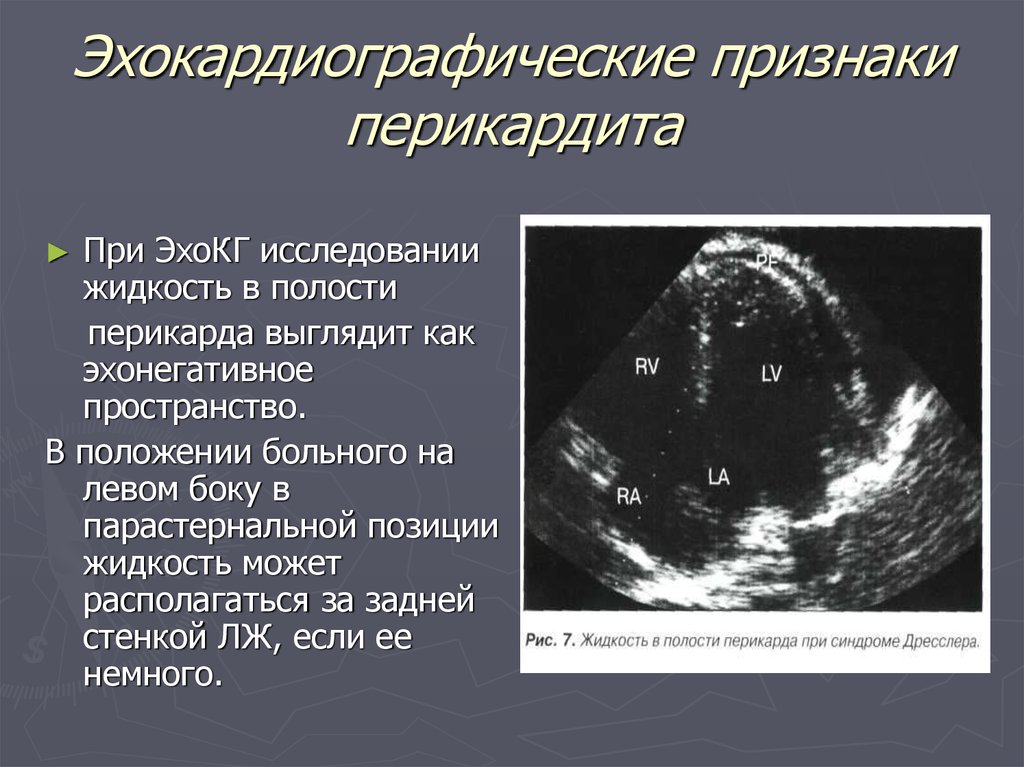
Рис. 8.2 УЗИ, проведенное в возрасте 3 и 6 недель у младенца, родившегося в возрасте 29 недель. Коронарные проекции под углом назад, показывающие неоднородные области повышенной эхогенности в теменно-затылочном белом веществе (а). Видны некоторые кисты, больше справа, чем слева. Повторное УЗИ в 40 недель ПМА показывает обширные кисты по всему перивентрикулярному белому веществу, больше справа, чем слева (б).
Рисунок 8.3 области со слабым сигналом, свидетельствующие о кавитации (тип B). (b) Повторная МРТ, ИК, выполненная в 40 недель ПМА, показывает обширные области кавитации (тип А). Септы видны не так четко, как на УЗИ.
КОМПЬЮТЕРНАЯ ТОМОГРАФИЯ
Компьютерная томография (КТ) имеет ограниченное значение в диагностике PVL. В острой стадии негеморрагическая ПВЛ не может быть распознана, так как высокое содержание воды в незрелом мозге приводит к недостаточному контрасту между нормальной мозговой тканью и областями, пораженными гипоксией-ишемией. На более поздней стадии на КТ 4 можно оценить специфическую форму боковых желудочков, уменьшение белого вещества и выраженные глубокие борозды.
На более поздней стадии на КТ 4 можно оценить специфическую форму боковых желудочков, уменьшение белого вещества и выраженные глубокие борозды.
МРТ
Первые МРТ-исследования, описывающие младенцев с ультразвуковым диагнозом ПВЛ, относятся к середине 1980-х гг. В то время МРТ-исследования обычно проводились в течение первого или второго года жизни, когда у ребенка развились признаки детского церебрального паралича 2, 12, 13 Впоследствии были опубликованы исследования результатов МРТ у младенцев со спастической диплегией, без знания данные предыдущего УЗИ 20 . Бейкер и др. 2 были первыми, кто описал классическую триаду результатов МРТ, начиная с младенчества, состоящую из (i) вентрикуломегалии с неправильными очертаниями тела и треугольником бокового желудочка; (ii) уменьшенное количество белого вещества, особенно на уровне треугольника, часто также распространяющееся на весь полуовальный центр и (iii) глубокие выступающие борозды, примыкающие к желудочку. Эти результаты можно идентифицировать как на Т1-, так и на Т2-взвешенных изображениях. Преимущество МРТ заключается в том, что повышенная интенсивность сигнала на Т2-взвешенных изображениях выделяет области предполагаемого глиоза. После того, как миелинизация произошла, последовательность восстановления инверсии с ослаблением жидкости (FLAIR) особенно полезна для демонстрации перивентрикулярного и коркового глиоза. Ослабленный (низкий) сигнал ЦСЖ с высоким сигналом большинства паренхиматозных патологий улучшает обнаружение поражений, прилегающих к пространствам ЦСЖ.
Эти результаты можно идентифицировать как на Т1-, так и на Т2-взвешенных изображениях. Преимущество МРТ заключается в том, что повышенная интенсивность сигнала на Т2-взвешенных изображениях выделяет области предполагаемого глиоза. После того, как миелинизация произошла, последовательность восстановления инверсии с ослаблением жидкости (FLAIR) особенно полезна для демонстрации перивентрикулярного и коркового глиоза. Ослабленный (низкий) сигнал ЦСЖ с высоким сигналом большинства паренхиматозных патологий улучшает обнаружение поражений, прилегающих к пространствам ЦСЖ.
Бейкер и др. 2 подчеркнули возможное наличие области обычно повышенной интенсивности сигнала на Т2-взвешенных изображениях, дорсально и выше треугольника боковых желудочков, которые не следует путать с областями глиоза. Эти области называются «терминальными зонами», представляющими собой ассоциативные тракты, которые содержат менее миелинизированные аксоны в течение первого десятилетия. Эта более низкая плотность миелинизации приводит к более высокому сигналу на Т2-взвешенных изображениях. Эти области отделены от бокового желудочка тонким ободком нормального миелина. Эта особенность отличает их от аномального сигнала, наблюдаемого в случаях с ПВЛ, примыкающей к стенке желудочка. Кроме того, в терминальных зонах не наблюдается потери белого вещества, а желудочки должны быть нормального размера и формы. Дифференциация лучше всего проводится на коронарных срезах.
Эти области отделены от бокового желудочка тонким ободком нормального миелина. Эта особенность отличает их от аномального сигнала, наблюдаемого в случаях с ПВЛ, примыкающей к стенке желудочка. Кроме того, в терминальных зонах не наблюдается потери белого вещества, а желудочки должны быть нормального размера и формы. Дифференциация лучше всего проводится на коронарных срезах.
В одном из первых неонатальных МРТ-исследований не сравнивали результаты УЗИ и МРТ, но изучали, влияет ли на прогрессирование миелинизации в 44-недельном постменструальном возрасте возникновение внутрижелудочкового кровоизлияния или кистозной ПВЛ (к-ПВЛ) 34 . Младенцы с к-ПВЛ имели значительно замедленную миелинизацию по Т1-взвешенным аксиальным изображениям по сравнению как с детьми без ультразвуковых отклонений, так и с детьми с внутрижелудочковыми кровоизлияниями различной степени. Впоследствии они сообщили, что существует значительная корреляция между задержкой миелинизации и исходом развития нервной системы через 1 год 9 лет.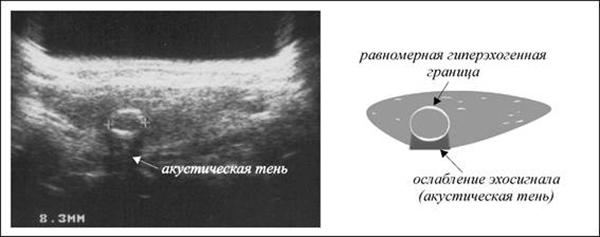 0225 14 .
0225 14 .
Совсем недавно в нескольких центрах были проведены МРТ-исследования новорожденных с PVL, как очень рано, на некистозной стадии, так и позже, когда кисты развились 30, 35 . Недавнее исследование Maalouf et al. 22 показали, что большое количество детей со сроком гестации (ГВ) менее 30 недель (22/29) имеют диффузную и чрезмерно высокую интенсивность сигнала в белом веществе (DEHSI) на Т2-взвешенных изображениях в доношенном возрасте. Это обычно ассоциировалось с визуализирующими признаками, указывающими на церебральную атрофию, дилатацию желудочков и расширение экстрацеребрального пространства, и поэтому они предположили, что это признак заболевания белого вещества. Эти проявления белого вещества могут быть неспецифическими, но очень похожи на интенсивность сигнала белого вещества в некистозных областях у младенцев с PVL (см. рис. 3.24) и могут представлять собой легкую форму диффузного повреждения белого вещества.
В дополнение к обычным последовательностям для оценки головного мозга недоношенных новорожденных использовались такие последовательности, как диффузионно-взвешенная визуализация (DWI) и количественная трехмерная объемная визуализация 17, 18 .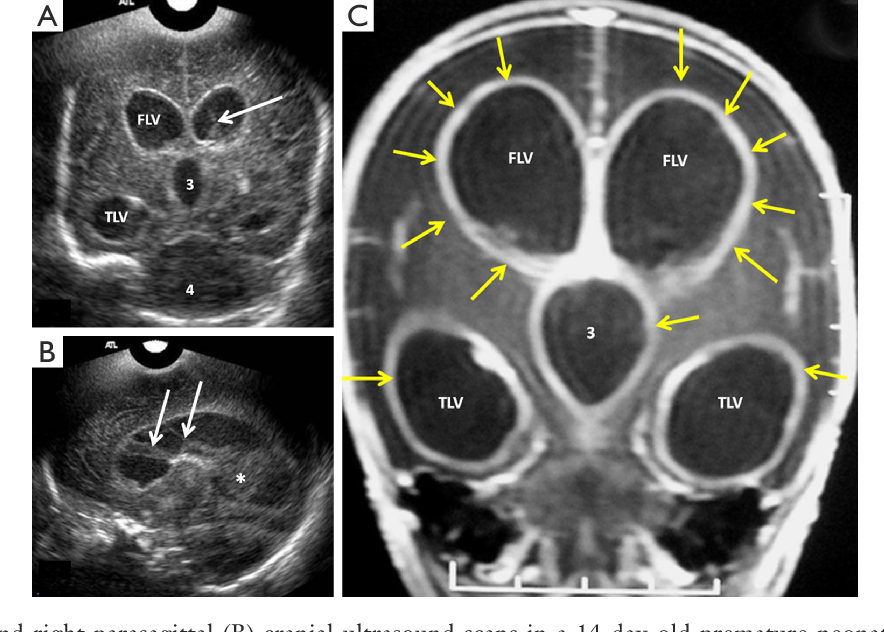 Индер и др. сообщил о случае, когда развился обширный c-PVL 17 . ДВИ, выполненная на 5-й день при отсутствии ультразвуковых аномалий, показала диффузные аномалии по всему белому веществу на ДВИ. Повторное МРТ подтвердило развитие кистозного поражения. Связь между PVL и развитием явно неповрежденных областей мозга была показана в более позднем исследовании той же группы. Они смогли показать уменьшение объема серого вещества с помощью трехмерной объемной визуализации в доношенном возрасте у детей с PVL по сравнению с нормальным контролем и недоношенными детьми без PVL 9.0225 18 .
Индер и др. сообщил о случае, когда развился обширный c-PVL 17 . ДВИ, выполненная на 5-й день при отсутствии ультразвуковых аномалий, показала диффузные аномалии по всему белому веществу на ДВИ. Повторное МРТ подтвердило развитие кистозного поражения. Связь между PVL и развитием явно неповрежденных областей мозга была показана в более позднем исследовании той же группы. Они смогли показать уменьшение объема серого вещества с помощью трехмерной объемной визуализации в доношенном возрасте у детей с PVL по сравнению с нормальным контролем и недоношенными детьми без PVL 9.0225 18 .
Рис. 8.4 Ультразвуковое исследование черепа, коронарные проекции, выполненное через 2 дня и 21 день после эпизода тяжелой гипокарбии, показывая области слабой эхогенности в наружном углу бокового желудочка (а), перерастающие в локализованные кисты (б).
Рис. 8.5 Тот же младенец, что и на рис. 8.4, поперечная МРТ, сильно взвешенное Т2-изображение спин-эхо в 40 недель PMA, показывающая одну небольшую область высокой интенсивности сигнала справа на уровне CSO, совместимую с небольшая киста (стрелка). В белом веществе можно увидеть множество небольших областей с низкой интенсивностью сигнала, что свидетельствует о гиперцеллюлярных поражениях (стрелки) (тип D). (С разрешения Roelants et al. 2001 Neuropediatrics27.)
В белом веществе можно увидеть множество небольших областей с низкой интенсивностью сигнала, что свидетельствует о гиперцеллюлярных поражениях (стрелки) (тип D). (С разрешения Roelants et al. 2001 Neuropediatrics27.)
Рис. 8.6 Недоношенный младенец, родившийся в возрасте 28 недель, у которого развилась ПВЛ I степени по данным краниального УЗИ, что видно в коронарной (а) и парасагиттальной (б) проекциях. МРТ, сильно Т2-взвешенное спин-эхо изображение (с) на 32 неделе PMA, показывает повышенную интенсивность сигнала перивентрикулярного белого вещества, окаймленную ободком низкой интенсивности сигнала.
Рис. 8.7 Недоношенный ребенок, родившийся в возрасте 29 недель, у которого развились резистентные к терапии судороги на 36 неделе ПМА. Энтеровирус был выделен из носа и горла. Ультразвук, коронарные проекции, показали области повышенной эхогенности через 48 часов после начала приступов. Также обратите внимание на повышенную эхогенность в правом таламусе (а). Эволюция в кисты, распространяющиеся вглубь белого вещества, наблюдается через 10 дней (б). На этом этапе (38 недель ПМА) была выполнена МРТ (с). Coronal FLAIR показывает обширные области с низкой интенсивностью сигнала, совместимые с ЦСЖ. Перегородку кистозной зоны нельзя распознать на МРТ, как и на УЗИ. Однако дополнительные кисты в обеих височных долях были отмечены на МРТ и не были видны на УЗИ. (c: с разрешения Roelants и др. 2001 Нейропиатрия 27 . )
Эволюция в кисты, распространяющиеся вглубь белого вещества, наблюдается через 10 дней (б). На этом этапе (38 недель ПМА) была выполнена МРТ (с). Coronal FLAIR показывает обширные области с низкой интенсивностью сигнала, совместимые с ЦСЖ. Перегородку кистозной зоны нельзя распознать на МРТ, как и на УЗИ. Однако дополнительные кисты в обеих височных долях были отмечены на МРТ и не были видны на УЗИ. (c: с разрешения Roelants и др. 2001 Нейропиатрия 27 . )
Рис. 8.8 Гидропический недоношенный ребенок, родившийся в 32 недели. После периода тяжелой и продолжительной гипотензии была отмечена заметная эхогенность и впоследствии развились обширные кисты. Корональная (а) и парасагиттальная (б) проекции в возрасте 2 недель с использованием датчика 10 МГц. Слева видна большая субэндимальная псевдокиста, а также двустороннее начало развития диффузной кистозной дегенерации в перивентрикулярном и глубоком белом веществе. (c) МРТ того же младенца, инверсионно-восстановительная последовательность, выполненная в тот же день, показывает петехиальные кровоизлияния в белом веществе, а также обширные области низкой интенсивности сигнала в перивентрикулярном и глубоком белом веществе. (С разрешения Roelants et al. 2001 Neuropediatrics27.)
(С разрешения Roelants et al. 2001 Neuropediatrics27.)
Рис. 8.9 Корональная (а) и парасагиттальная (б) проекции в возрасте 6 недель с использованием датчика 10 МГц. После еженедельных УЗИ образовались обширные кисты, которым не предшествовала выраженная эхогенность. Также обратите внимание на субэпендимальные псевдокисты. МРТ, выполненная в тот же день, показывает области с высокой интенсивностью сигнала на сильно взвешенном Т2-эхо-изображении (с) и области с высокой интенсивностью сигнала, прилегающие к этим кистозным областям на DWI (d).
СРАВНИТЕЛЬНЫЕ ИССЛЕДОВАНИЯ
МРТ и вскрытие
В корреляционном исследовании Schouman-Claeys et al. 29 , данные МРТ сравнивали с результатами вскрытия восьми недоношенных детей с ГВ ≤33 недель, которые умерли в возрасте от 3 до 7 недель. Смерть наступила через 3–11 дней после МРТ. Четыре типа аномалий с различной интенсивностью сигнала были распознаны на МРТ с использованием коронарных Т1-взвешенных изображений. При типе А зоны имели интенсивность сигнала, аналогичную таковой ЦСЖ. Во всех случаях они коррелировали с полостями на вскрытии (рис. 8.1). При типе Б зоны умеренно слабого сигнала с менее четко очерченными границами, чем при типе А. Эти участки соответствовали полупрозрачным редкоклеточным пятнам или небольшим кавернам. В типе С зоны имели очень высокую интенсивность сигнала и иногда были неоднородными. Эти участки коррелировали с геморрагическими полостями (рис. 8.2 и рис. 8.3). При типе D зоны имели умеренно высокий сигнал в виде полос или точечных областей. Эти области коррелировали с гиперклеточными поражениями с сидерофагами или без них (рис. 8.4 и рис. 8.5). Степень перивентрикулярных поражений была недооценена на МРТ, а небольшие таламические поражения были пропущены в трех случаях. В целом, точная оценка ПВЛ была возможна с использованием Т1-взвешенных МРТ-изображений.
При типе А зоны имели интенсивность сигнала, аналогичную таковой ЦСЖ. Во всех случаях они коррелировали с полостями на вскрытии (рис. 8.1). При типе Б зоны умеренно слабого сигнала с менее четко очерченными границами, чем при типе А. Эти участки соответствовали полупрозрачным редкоклеточным пятнам или небольшим кавернам. В типе С зоны имели очень высокую интенсивность сигнала и иногда были неоднородными. Эти участки коррелировали с геморрагическими полостями (рис. 8.2 и рис. 8.3). При типе D зоны имели умеренно высокий сигнал в виде полос или точечных областей. Эти области коррелировали с гиперклеточными поражениями с сидерофагами или без них (рис. 8.4 и рис. 8.5). Степень перивентрикулярных поражений была недооценена на МРТ, а небольшие таламические поражения были пропущены в трех случаях. В целом, точная оценка ПВЛ была возможна с использованием Т1-взвешенных МРТ-изображений.
МРТ И УЛЬТРАЗВУК
Неонатальный период
Сообщалось о нескольких сравнительных исследованиях, выполненных в неонатальном периоде, а также в более позднем младенчестве 19, 24, 25, 30, 35 . Кини и др. 19 включили 100 новорожденных из группы высокого риска, поступивших в отделение интенсивной терапии новорожденных, для проспективного МРТ-исследования. Двенадцать случаев были идентифицированы как имеющие PVL, и 10 из этих 12 случаев уже были обнаружены с помощью ультразвука. Четыре из 12 случаев были также обследованы с помощью КТ, и только в одном из них была выявлена ПВЛ. Во всех 12 случаях МРТ выявила геморрагические очаги при сканировании до конца 4-й недели жизни. Когда МРТ была сделана в возрасте от 4 до 8 недель, были видны кисты. К 8-недельному возрасту отмечалось рассасывание кист с появлением или без появления дилатации желудочков.
Кини и др. 19 включили 100 новорожденных из группы высокого риска, поступивших в отделение интенсивной терапии новорожденных, для проспективного МРТ-исследования. Двенадцать случаев были идентифицированы как имеющие PVL, и 10 из этих 12 случаев уже были обнаружены с помощью ультразвука. Четыре из 12 случаев были также обследованы с помощью КТ, и только в одном из них была выявлена ПВЛ. Во всех 12 случаях МРТ выявила геморрагические очаги при сканировании до конца 4-й недели жизни. Когда МРТ была сделана в возрасте от 4 до 8 недель, были видны кисты. К 8-недельному возрасту отмечалось рассасывание кист с появлением или без появления дилатации желудочков.
Van Wezel-Meijler и др. 35 исследовали 25 младенцев с «вспышками» (определяемыми как области повышенной эхогенности, присутствующие в течение 1–6 дней, ( n = 15) или PVL степени 1 ( n = 10) на УЗИ. Эхогенность определялась как эхогенное или менее эхогенное, чем сосудистое сплетение, но не неоднородное.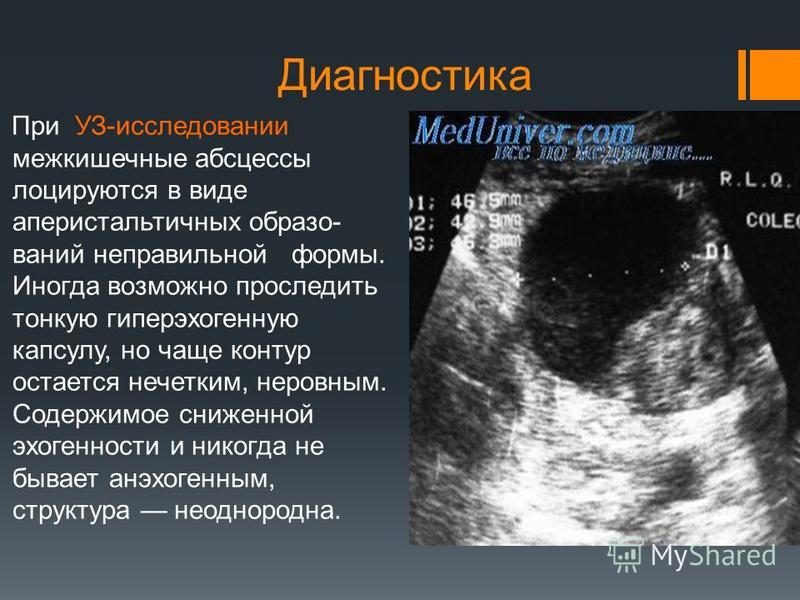 Более широкие зоны изменения интенсивности сигнала в белом веществе на МРТ соответствовали перивентрикулярной эхоплотности, наблюдаемой на УЗИ.Sie и др. также изучали младенцев с неоднородными («пятнистыми») вспышками с кистозной эволюцией или без нее 30 . Они смогли показать, что геморрагическая ПВЛ была более распространена (60%), чем сообщалось ранее в патологоанатомических исследованиях (25%), и что кисты были отмечены более многочисленными и иногда обнаруживались раньше на МРТ, чем на УЗИ.
Более широкие зоны изменения интенсивности сигнала в белом веществе на МРТ соответствовали перивентрикулярной эхоплотности, наблюдаемой на УЗИ.Sie и др. также изучали младенцев с неоднородными («пятнистыми») вспышками с кистозной эволюцией или без нее 30 . Они смогли показать, что геморрагическая ПВЛ была более распространена (60%), чем сообщалось ранее в патологоанатомических исследованиях (25%), и что кисты были отмечены более многочисленными и иногда обнаруживались раньше на МРТ, чем на УЗИ.
В нашей собственной популяции мы смогли изучить 35 случаев с различными степенями PVL. Новорожденных обследовали в неонатальном периоде с помощью системы визуализации Philips, работающей при 1,5 тесла (табл. 8.1). В этот же сеанс была проведена протонная МР-спектроскопия. Большинство детей, изученных до сих пор, имели кистозную ПВЛ (3 степени I, 10 степени II и 22 степени III). Сканирование выполнено в течение первых 4 недель жизни у 15 детей (3 степени I, 3 степени II, 9III степень), в возрасте 6 недель у 1 с III степенью и в 40-недельном постменструальном возрасте у 19 новорожденных (7 II степени и 12 III степени).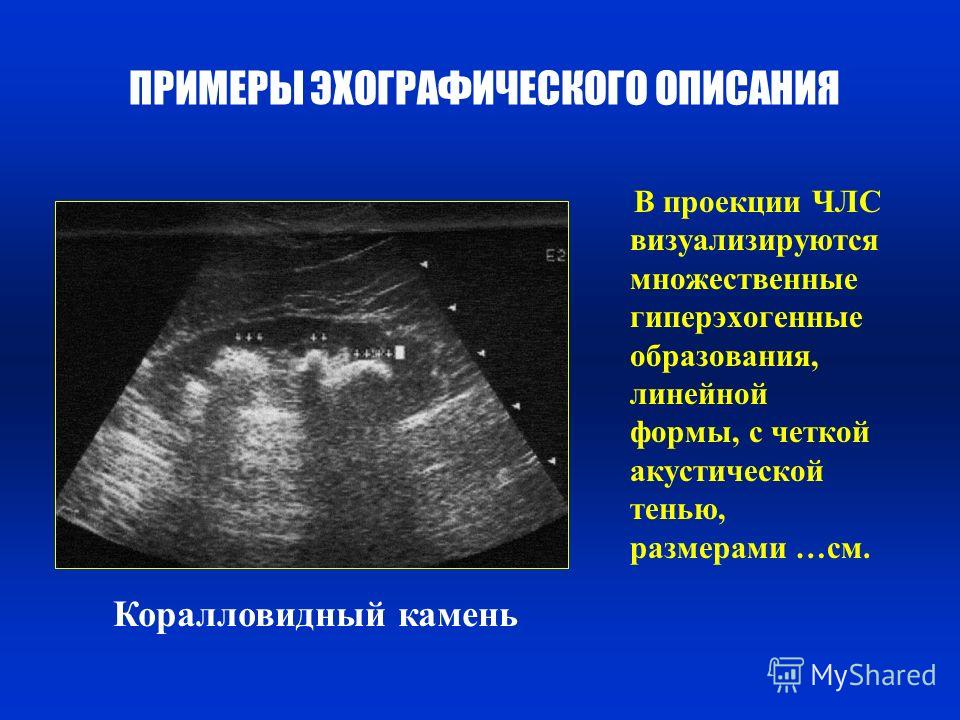 Двум детям в неонатальном периоде дважды проводилась МРТ. Точечные высокие изменения сигнала при обратном восстановлении (IR) наблюдались во всех наших случаях I степени (рис. 8.6), в 1 случае степени II и в 5 случаях степени III, и все они были обследованы в течение первых 4 недель. Такой находки не было ни у одного из младенцев, у которых первое сканирование было проведено в 40 недель постменструального возраста (ПМА). Однако у двух младенцев были обнаружены линейные полосы низкого сигнала на взвешенной последовательности Т2 на уровне полуовального центра (CSO) (рис. 8.5). В пяти из наших случаев с локализованными кистами на УЗИ (степень II) кисты больше не могли быть визуализированы во время МРТ-исследования (40 недель) ни одним из методов. У этих пациентов отмечалась только легкая дилатация желудочков, иногда связанная с ободком короткого Т1, очерчивающим боковой желудочек, что свидетельствует о реакции глиальных клеток. У трех детей на МРТ были обнаружены аномалии, которые не были видны при УЗИ.
Двум детям в неонатальном периоде дважды проводилась МРТ. Точечные высокие изменения сигнала при обратном восстановлении (IR) наблюдались во всех наших случаях I степени (рис. 8.6), в 1 случае степени II и в 5 случаях степени III, и все они были обследованы в течение первых 4 недель. Такой находки не было ни у одного из младенцев, у которых первое сканирование было проведено в 40 недель постменструального возраста (ПМА). Однако у двух младенцев были обнаружены линейные полосы низкого сигнала на взвешенной последовательности Т2 на уровне полуовального центра (CSO) (рис. 8.5). В пяти из наших случаев с локализованными кистами на УЗИ (степень II) кисты больше не могли быть визуализированы во время МРТ-исследования (40 недель) ни одним из методов. У этих пациентов отмечалась только легкая дилатация желудочков, иногда связанная с ободком короткого Т1, очерчивающим боковой желудочек, что свидетельствует о реакции глиальных клеток. У трех детей на МРТ были обнаружены аномалии, которые не были видны при УЗИ. У одного младенца в стриатуме была обнаружена неожиданная область инфаркта. В другом случае (рис. 8.7) небольшие кисты также были обнаружены в височных долях, а в третьем случае также было обнаружено поражение мозжечка. В целом, было хорошее согласование между УЗИ и МРТ при проведении ПМА около 40 недель. Однако при МРТ кисты выявлялись раньше, выглядели более обширными (рис. 8.8) и, по-видимому, были связаны с точечными кровоизлияниями при обследовании детей раннего возраста (через 2–4 нед после инсульта). В нашем последнем случае DWI была выполнена в возрасте 6 недель, когда кисты уже присутствовали как на УЗИ, так и на обычных взвешенных последовательностях T1 и T2. Обширные области с высокой интенсивностью сигнала были видны на ДВИ рядом с кистозными поражениями, что, возможно, предшествовало дальнейшей кистозной дегенерации (рис. 8.9).).
У одного младенца в стриатуме была обнаружена неожиданная область инфаркта. В другом случае (рис. 8.7) небольшие кисты также были обнаружены в височных долях, а в третьем случае также было обнаружено поражение мозжечка. В целом, было хорошее согласование между УЗИ и МРТ при проведении ПМА около 40 недель. Однако при МРТ кисты выявлялись раньше, выглядели более обширными (рис. 8.8) и, по-видимому, были связаны с точечными кровоизлияниями при обследовании детей раннего возраста (через 2–4 нед после инсульта). В нашем последнем случае DWI была выполнена в возрасте 6 недель, когда кисты уже присутствовали как на УЗИ, так и на обычных взвешенных последовательностях T1 и T2. Обширные области с высокой интенсивностью сигнала были видны на ДВИ рядом с кистозными поражениями, что, возможно, предшествовало дальнейшей кистозной дегенерации (рис. 8.9).).
| Pulse sequence | TR (ms) | T1 (ms) | TE (ms) |
|---|---|---|---|
| T1 weighted CSE | 514 | – | 15 |
| T2 weighted TSE | 4211 | — | 150 |
| IR | 3347 | 600 | 30 |
< предыдущая | топ | содержание | далее >
Антенатальное начало
Ультразвуковое исследование черепа выявило кистозные поражения, присутствующие в 1-й день, только в трех случаях. В двух из них их монозиготный брат-близнец умер за 2–3 недели до этого (рис. 8.10), а в третьем случае мать подверглась физическому насилию за 4 недели до родов. В четвертом случае были области повышенной перивентрикулярной эхогенности, связанные с внутрижелудочковым кровоизлиянием, присутствующие на первом УЗИ после острой потери движений плода за 2 дня до экстренного кесарева сечения.
Рис. 8.10 Недоношенный младенец, родившийся в возрасте 32 недель после смерти монозиготного близнеца. (а) Парасагиттальное Т1-взвешенное изображение показывает большой пристеночный кистозный дефект. Также обратите внимание на небольшой ободок с низкой интенсивностью сигнала вдоль стенки бокового желудочка (стрелки). Эти аномалии присутствовали в обоих полушариях. (b) Повторное парасагиттальное Т1-взвешенное изображение в скорректированном возрасте 15 месяцев показывает уменьшение размера кистозного дефекта, хотя ангуляция отличается. (c) Коронарный FLAIR показывает большие двусторонние париетальные кисты, а также обширный глиоз вокруг боковых желудочков.
(b) Повторное парасагиттальное Т1-взвешенное изображение в скорректированном возрасте 15 месяцев показывает уменьшение размера кистозного дефекта, хотя ангуляция отличается. (c) Коронарный FLAIR показывает большие двусторонние париетальные кисты, а также обширный глиоз вокруг боковых желудочков.
На данный момент только 16 из 29 выживших младенцев, прошедших неонатальную МРТ, прошли повторное сканирование в течение второго года жизни. Была обнаружена хорошая корреляция между областями глиоза в младенчестве и кистозными поражениями, наблюдаемыми в неонатальном периоде.
Младенчество
МРТ в сравнении с УЗИ новорожденных
Сравнение МРТ, проведенного в младенчестве, с предыдущими данными УЗИ впервые было проведено в конце 1980-х годов. Де Врис и др. 7 выполнили последовательные МРТ-исследования между 36 неделями ПМА и 36 месяцами в 13 случаях с обширной c-PVL или подкорковой лейкомаляцией. Как данные визуализации, так и результаты развития нервной системы различались между пациентами с кистами, ограниченными перивентрикулярным белым веществом, и теми, у которых кисты распространялись в глубокое белое вещество.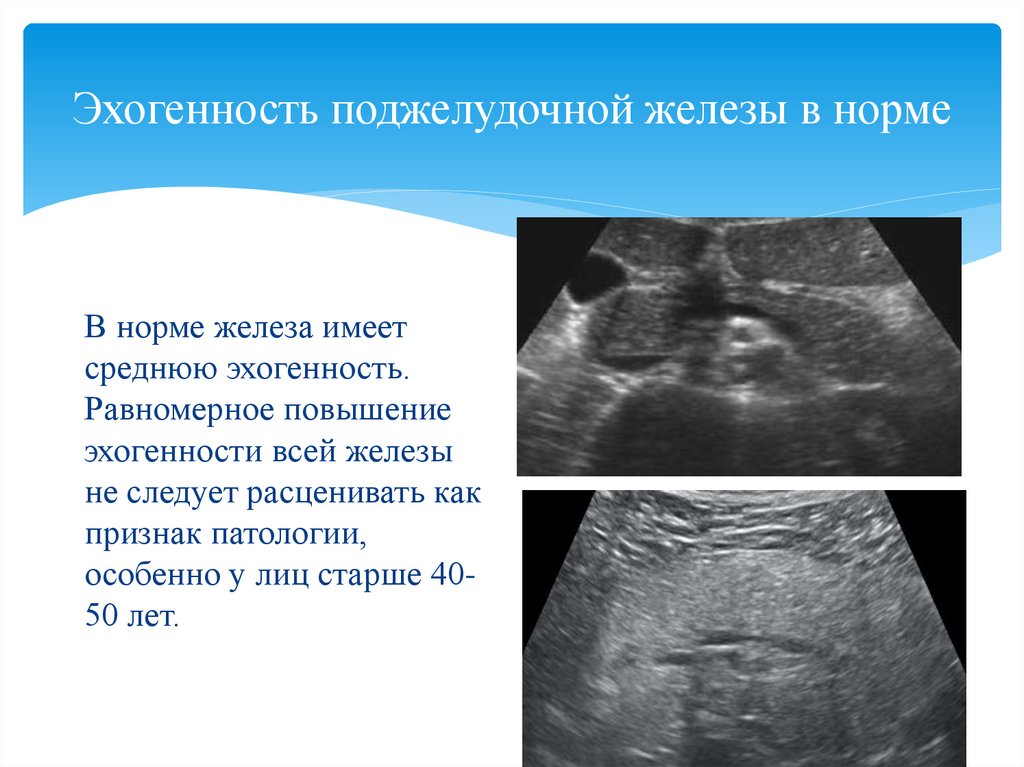 В последней группе кисты обычно сохранялись на поздних МРТ, и миелинизация была незначительной или отсутствовала. С клинической точки зрения в этой группе также наблюдались более тяжелые двигательные и психические нарушения, а также церебральные нарушения зрения. Впоследствии они изучили 15 младенцев, у которых развился церебральный паралич из-за стойкой эхо-плотности (степень I, 9 баллов).0027 n = 5), локализованная к-ПВЛ (II степень, n = 4) или обширная к-ПВЛ (III степень, n = 6)9. Выявлена хорошая корреляция между степенью ПВЛ, диагностированной с помощью УЗИ, и выраженностью МРТ-изменений, отмеченных в младенчестве. Перивентрикулярная высокая интенсивность сигнала (PVHI) на Т2-взвешенных изображениях присутствовала во всех случаях, но была наиболее обширной в случаях III степени. В случаях II степени, с несколькими небольшими кистами на УЗИ, PVHI на Т2-взвешенных изображениях и связанной с ними дилатацией желудочков были более обширными, чем ожидалось.
В последней группе кисты обычно сохранялись на поздних МРТ, и миелинизация была незначительной или отсутствовала. С клинической точки зрения в этой группе также наблюдались более тяжелые двигательные и психические нарушения, а также церебральные нарушения зрения. Впоследствии они изучили 15 младенцев, у которых развился церебральный паралич из-за стойкой эхо-плотности (степень I, 9 баллов).0027 n = 5), локализованная к-ПВЛ (II степень, n = 4) или обширная к-ПВЛ (III степень, n = 6)9. Выявлена хорошая корреляция между степенью ПВЛ, диагностированной с помощью УЗИ, и выраженностью МРТ-изменений, отмеченных в младенчестве. Перивентрикулярная высокая интенсивность сигнала (PVHI) на Т2-взвешенных изображениях присутствовала во всех случаях, но была наиболее обширной в случаях III степени. В случаях II степени, с несколькими небольшими кистами на УЗИ, PVHI на Т2-взвешенных изображениях и связанной с ними дилатацией желудочков были более обширными, чем ожидалось. Неравномерное увеличение желудочков наблюдалось только у пациентов с c-PVL.
Неравномерное увеличение желудочков наблюдалось только у пациентов с c-PVL.
МРТ и исходы развития нервной системы
Чтобы сопоставить отклонения на МРТ с исходами развития нервной системы, многие группы выполняли МРТ в младенчестве у детей со спастической диплегией или квадриплегией. При оценке МРТ обращали внимание на следующие характеристики33: истончение мозолистого тела, неправильную форму желудочков, увеличение желудочков, уменьшение перитригонального белого вещества, задержку миелинизации, ГВГИ на Т2-взвешенных изображениях и наличие коркового повреждения. В целом, существует хорошее соответствие между тяжестью нарушений МРТ и тяжестью двигательных и когнитивных последствий 6, 31, 33, 37 Во всех исследованиях показано, что выраженность PVHI, степень редукции белого вещества и увеличения желудочков коррелируют со степенью двигательных нарушений. Некоторые авторы обнаружили корреляцию между степенью этих отклонений и когнитивным развитием 6 . Это, однако, не было подтверждено другими (рис. 8.11)3 7 .
Это, однако, не было подтверждено другими (рис. 8.11)3 7 .
Iai и др. 16 далее подчеркивалось, что отношение толщины валика к длине мозолистого тела коррелирует с тяжестью двигательных нарушений (рис. 8.11).
| Pulse sequence | TR (ms) | T1 (ms) | TE (ms) |
|---|---|---|---|
| T1 weighted CSE | 544 | – | 16 |
| T2 weighted TSE | 3072 | – | 50/150 |
| IR | 2818 | 600 | 20 |
| FLAIR | 7565 | 2000 | 120 |
| TE, время эха; TR, время повторения; TI, время до инверсии; ИК, обратное восстановление; FLAIR, обратное восстановление с ослаблением жидкости; CSE, обычное спиновое эхо; TSE, турбо-спин-эхо. | |||
< предыдущая | топ | содержание | далее >
Рис. 8.11 (а) МРТ, выполненная в возрасте 2,5 лет у младенца с ПВЛ I степени по УЗИ. T2 TSE (3000/50), аксиальный срез на уровне середины желудочка. Видны небольшие участки ПВГИ и незначительное уменьшение перитригонального белого вещества, более обширное слева. (б) МРТ, выполненная в возрасте 22 месяцев, у ребенка с ПВЛ II степени по неонатальному УЗИ. Последовательность FLAIR, коронарный срез. С обеих сторон отмечается обширная ПВГИ с вовлечением зрительной лучистости. Левый желудочек умеренно расширен, имеет неправильную форму. (c) МРТ, выполненная в возрасте 24 месяцев у младенца с PVL III степени по неонатальному УЗИ (тот же младенец, что и на рис. 8.1). T2 TSE (3000/50), аксиальный срез на уровне середины желудочка, показывает обширные области PVHI и неравномерно расширенные желудочки. (d) МРТ, выполненная в возрасте 15 месяцев у младенца с PVL III при неонатальном УЗИ. Среднесагиттальное Т1-взвешенное изображение, показывающее заметное истончение, особенно дорсальной части мозолистого тела.
8.11 (а) МРТ, выполненная в возрасте 2,5 лет у младенца с ПВЛ I степени по УЗИ. T2 TSE (3000/50), аксиальный срез на уровне середины желудочка. Видны небольшие участки ПВГИ и незначительное уменьшение перитригонального белого вещества, более обширное слева. (б) МРТ, выполненная в возрасте 22 месяцев, у ребенка с ПВЛ II степени по неонатальному УЗИ. Последовательность FLAIR, коронарный срез. С обеих сторон отмечается обширная ПВГИ с вовлечением зрительной лучистости. Левый желудочек умеренно расширен, имеет неправильную форму. (c) МРТ, выполненная в возрасте 24 месяцев у младенца с PVL III степени по неонатальному УЗИ (тот же младенец, что и на рис. 8.1). T2 TSE (3000/50), аксиальный срез на уровне середины желудочка, показывает обширные области PVHI и неравномерно расширенные желудочки. (d) МРТ, выполненная в возрасте 15 месяцев у младенца с PVL III при неонатальном УЗИ. Среднесагиттальное Т1-взвешенное изображение, показывающее заметное истончение, особенно дорсальной части мозолистого тела.
Рис. 8.12 Поперечная МРТ, ИК, выполненная в 16 месяцев у младенца, родившегося в 37 недель. Тяжелая энцефалопатия присутствовала после трансфузионного синдрома от близнеца к близнецу. Наблюдается легкая эксвакуумная дилатация, тяжелая задержка миелинизации и обширное повреждение белого вещества затылка и коры.
МРТ и церебральные нарушения зрения
В ряде исследований показана корреляция между церебральными нарушениями зрения (ХВН) и наличием МР-аномалий задних зрительных путей у младенцев с PVL5 5, 11, 21 , ХВН расценивается как нарушение зрения из-за нарушения задних проводящих путей, то есть оптической радиации и/или первичной зрительной коры. Cioni и др. 5 обследовано 30 детей с I и II степенью ( n = 18) или III степенью ( n = 12) ПВЛ. Они обнаружили, что в половине случаев с PVL III степени наблюдалась серьезная потеря остроты зрения, сужение поля зрения и аномальная подвижность глаз, но ни один из них не был полностью слепым. На МРТ аномалии оптической радиации обнаружены в 50%. В 17% также была поражена зрительная кора. Они предположили, что поражения на уровне оптической радиации, а не поражения самой зрительной коры, являются анатомическими субстратами ХВН в 9 случаях.0027 недоношенных новорожденных.
На МРТ аномалии оптической радиации обнаружены в 50%. В 17% также была поражена зрительная кора. Они предположили, что поражения на уровне оптической радиации, а не поражения самой зрительной коры, являются анатомическими субстратами ХВН в 9 случаях.0027 недоношенных новорожденных.
Экен и др. 11 провели проспективное исследование когорты из 65 недоношенных и доношенных новорожденных из группы высокого риска, поступивших в наше отделение интенсивной терапии новорожденных. У девяти развилась тяжелая ХВН, и они функционировали как слепые дети. У всех был GA ≥35 недель, и у всех на УЗИ были обнаружены обширные кисты, распространяющиеся на подкорковое белое вещество. На МРТ у них были обнаружены серьезные аномалии, затрагивающие как оптическое излучение, так и зрительную кору (рис. 8.12).
< предыдущая | топ | содержание | далее >
Очаговый инфаркт часто называют «неонатальным инсультом». Сообщалось, в основном, у доношенных детей, у которых в первые несколько дней жизни наблюдаются гемиконвульсии (см. главу 7). Данных о недоношенных новорожденных мало. Панет и др. 26 сообщили, что в 17 % посмертных случаев, относящихся к когорте недоношенных детей, родившихся в округах Нью-Джерси между 1984 и 1987 гг., были поражения таламуса или базальных ганглиев.
главу 7). Данных о недоношенных новорожденных мало. Панет и др. 26 сообщили, что в 17 % посмертных случаев, относящихся к когорте недоношенных детей, родившихся в округах Нью-Джерси между 1984 и 1987 гг., были поражения таламуса или базальных ганглиев.
Мы исследовали 23 новорожденных с ГВ <37 недель с очаговым инфарктом. Семнадцать из них были описаны ранее 10 . В 19 из этих 23 случаев МРТ была выполнена либо в неонатальном периоде ( n = 17), либо позже в младенчестве ( n = 2). Аномалии на УЗИ почти никогда не выявлялись в течение первых нескольких дней жизни. Постепенное повышение эхогенности впервые было отмечено к концу первой недели. В двух из 23 случаев инфаркт был впервые обнаружен в кистозной фазе, но был пропущен во время эхогенной фазы из-за очень передней или очень периферической локализации поражения. Очаги иногда оставались эхогенными до доношенного возраста, но обычно на УЗИ становились кистозными. У двух детей была ассоциированная ВЖК с постгеморрагической дилатацией желудочков, а в трех других случаях также была выявлена хПВЛ.
МРТ новорожденных была проведена примерно в 40 недель ПМА, как только кистозная эволюция имела место на УЗИ. У всех, кроме одного ребенка, поражение было выявлено на УЗИ, что послужило поводом для проведения МРТ. У троих детей было поражение основной ветви средней мозговой артерии, у одного — инфаркт в области отведения задней мозговой артерии и у одного — передней мозговой артерии. Девять показали вовлечение одной или нескольких лентикулостриарных ветвей, два имели вовлечение кортикальных ветвей и один показал инфаркт водораздела между областями, снабжаемыми средней и передней мозговыми артериями.
МРТ
Инфаркт визуализировался как область низкой интенсивности сигнала на ИК и повышенной интенсивности сигнала на Т2-взвешенных спин-эхо-последовательностях. Дополнительная находка предшествующего кровоизлияния в области инфаркта присутствовала только в двух случаях (рис. 8.13). Также может быть вовлечена задняя ножка внутренней капсулы пораженного полушария (рис. 8.14). Это проявляется как уменьшение сигнала на ИК-изображениях и увеличение сигнала на изображениях, взвешенных по Т2.
8.14). Это проявляется как уменьшение сигнала на ИК-изображениях и увеличение сигнала на изображениях, взвешенных по Т2.
Рис. 8.13 (а) Поперечная МРТ, ИК, выполненная в ПМА в 40 недель у младенца, родившегося в ГС 36 недель, с геморрагическим инфарктом затылочной паренхимы, ассоциированным с коагулопатией. У него не развилась асимметрия тонуса, но была глобальная задержка с DQ 71 в возрасте 24 месяцев. (b) Поперечная МРТ, последовательность FLAIR, выполненная в возрасте 56 лет, показывающая остаточные повреждения после инфаркта. В затылочном белом веществе справа визуализируется умеренный глиоз.
Рис. 8.14 МРТ недоношенного ребенка с ГВ 32 недели. Рутинное УЗИ, проведенное в возрасте 2 недель, показывает кистозные изменения в распределении правой средней мозговой артерии. МРТ, ИК, аксиальный срез, выполненный в 40 недель ПМА, показывает область кавитации и эксвакуумной дилатации правого желудочка. Также обратите внимание на отсутствие миелинизации задней ножки правой внутренней капсулы. У него развилась умеренная гемиплегия, и в возрасте 24 месяцев он имеет DQ 91.
У него развилась умеренная гемиплегия, и в возрасте 24 месяцев он имеет DQ 91.
АНТЕНАТАЛЬНОЕ НАЧАЛО
В пяти из 23 случаев инфаркт был расценен как антенатальный. Трое были частью синдрома трансфузии от близнеца к близнецу, один был одним из тройни, а у последнего пациента перед родами развилась тяжелая аритмия (рис. 8.15). У одного из близнецов была поражена главная ветвь, а у трех других — лентикулостриарные ветви.
Рис. 8.15 (a, b) УЗИ в возрасте 2 недель у недоношенного ребенка, родившегося в возрасте 33 недель GA, после антенатальной суправентрикулярной тахикардии, показывающее эхоплотность в левом чечевицеобразном ядре. (c) МРТ, ИК-последовательность, выполненная в 38 недель ПМА, показывает небольшую кисту в левой скорлупе. (С разрешения Govaert и de Vries, Clin Dev Med 1998 и нейропедиатрия, 1997.)
РЕЗУЛЬТАТЫ НЕРВНОГО РАЗВИТИЯ
У трех детей с поражением основной ветви средней мозговой артерии развилась гемиплегия, в отличие от двух случаев с задним или передним инфарктом.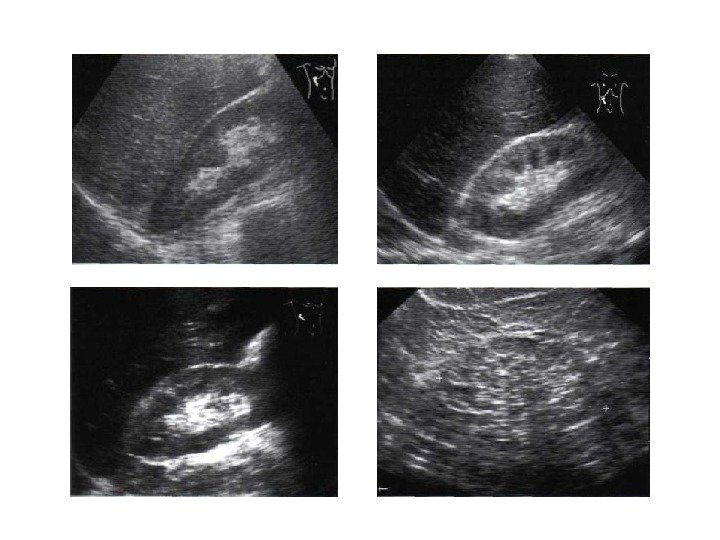 Среди пациентов с меньшими инфарктами у восьми из 18 к настоящему времени развились неблагоприятные неврологические последствия, из-за ассоциированной c-PVL в двух и из-за лакунарных инфарктов в других шести случаях.
Среди пациентов с меньшими инфарктами у восьми из 18 к настоящему времени развились неблагоприятные неврологические последствия, из-за ассоциированной c-PVL в двух и из-за лакунарных инфарктов в других шести случаях.
< предыдущая | топ | содержание | следующий >
Младенец женского пола, родившийся после экстренного кесарева сечения на сроке беременности 31 неделя из-за замедления на КТГ.
Ее первое ультразвуковое исследование черепа, проведенное в 1-й день, показало области повышенной эхогенности. Перивентрикулярные кисты начали развиваться с 13-го дня. На 9-е сутки также отмечалась зона повышенной эхогенности в правом хвостатом ядре.
Первая МРТ выполнена в 40-недельном постменструальном возрасте. На инверсионно-восстановительных изображениях видны области с низкой интенсивностью сигнала, сходные с таковыми в спинномозговой жидкости, в основном в переднем белом веществе на низком желудочковом уровне (рис. 8.16). На уровне ЦСО отмечают еще несколько участков со слабым сигналом, свидетельствующих о кавитации (тип А) ( стрелка ) (рис. 8.17). Сзади отмечена полосистая линия с высоким сигналом, что указывает на реакцию глиальных клеток или минерализацию (тип D) ( стрелки ).
8.17). Сзади отмечена полосистая линия с высоким сигналом, что указывает на реакцию глиальных клеток или минерализацию (тип D) ( стрелки ).
Рис. 8.16
Рис. 8.17
Рис. 8.18
Рис. 8.19
Вторая МРТ была сделана в возрасте 24 месяцев. Коронарное FLAIR по-прежнему показывает небольшую полость на уровне правого хвостатого ядра и области высокой интенсивности сигнала на уровне корково-спинномозговых путей (рис. 8.18). Последовательность SE с аксиальной протонной плотностью показывает высокую интенсивность сигнала по всему CSO, распространяющемуся на теменное белое вещество (рис. 8.19).). Также обратите внимание на линейную область низкого SI в том же месте, что и неонатальный IR, что свидетельствует о минерализации ( стрелки ).
Этой девочке сейчас 2 года. У нее развилась спастическая диплегия, а также наблюдаются некоторые дистонические движения рук. Она еще не может говорить, и ее коэффициент развития (DQ) составляет 70 без коррекции и 80 с поправкой на ее недоношенность (исключая моторную субшкалу).
Она еще не может говорить, и ее коэффициент развития (DQ) составляет 70 без коррекции и 80 с поправкой на ее недоношенность (исключая моторную субшкалу).
Младенец женского пола, рожденный после экстренного кесарева сечения в 33 недели из-за признаков дистресса плода на КТГ и обратного потока при допплеровском исследовании пуповины. Мать перенесла «гриппоподобный эпизод» за 5 недель до родов.
Она начала хорошо (7 баллов по шкале Апгар на 1 минуте и 9 на 5 минуте). Она весила 1,5 кг (p 10–50), имела длину 42 см (p 3–10) и окружность головы 30 см (p 10–50). Обычные лабораторные результаты показали низкий уровень тромбоцитов 35 x 109/л. У нее диагностировали врожденную цитомегаловирусную (ЦМВ) инфекцию.
Ее первое ультразвуковое исследование после направления на 9-й день не выявило каких-либо областей перивентрикулярной кальцификации или лентикулостриарной васкулопатии. Однако у нее были участки повышенной эхогенности по всему левому полушарию.
(Рис. 8.20a) Через 4 недели ей снова сделали сканирование, и к тому времени у нее развились кисты в этих ранее эхогенных областях.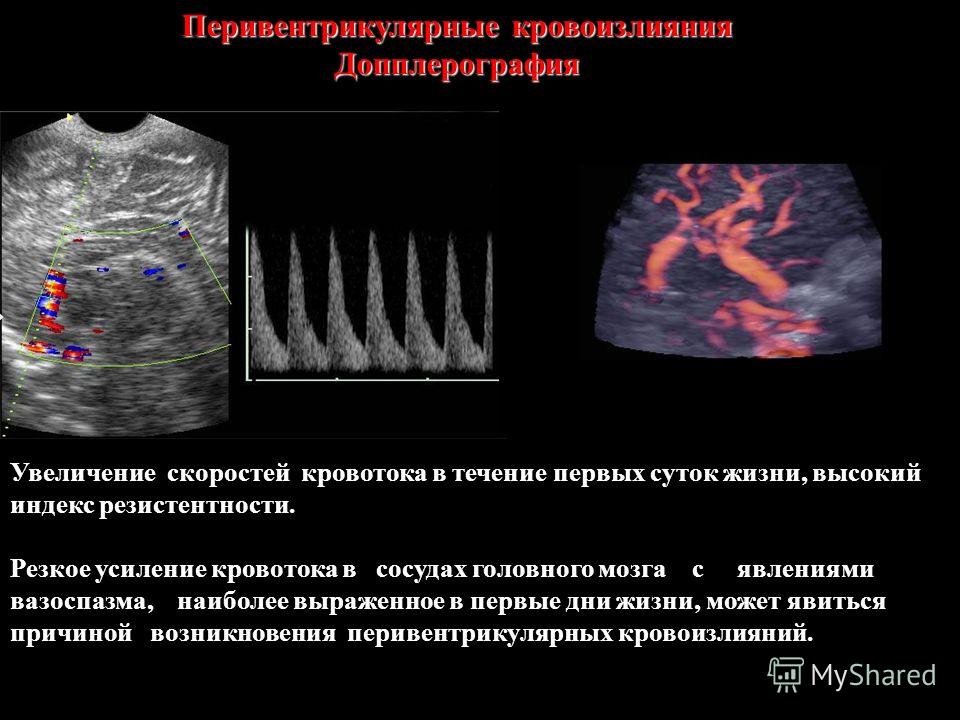
(рис. 8.20б)
В постменструальный возраст 40 недель проведена МРТ, подтверждена зона очагового инфаркта в области средней мозговой артерии (рис. 8.21). Обратите внимание на линию высокого сигнала, окружающую область инфаркта, что указывает на кровоизлияние или реакцию глиальных клеток. Также обратите внимание на отсутствие задней ножки внутренней капсулы на стороне поражения.
Несмотря на то, что затылочные кисты могут быть обнаружены в случаях врожденной ЦМВ-инфекции, маловероятно, что в этом случае кистозное поражение у этого ребенка связано с поздним началом ЦМВ-инфекции. Принимая во внимание время ЦМВ-инфекции и время кистозной эволюции на УЗИ, инфаркты с большей вероятностью были результатом длительного дистресса плода до и во время родов.
Сейчас ей 30 месяцев. У нее легкая нейросенсорная тугоухость. Она демонстрирует легкую асимметрию тона и имеет DQ 87 без коррекции и 92 с поправкой на недоношенность. Окружность ее головы ниже 3-го центиля (43 см), а вес и длина тела находятся на уровне 50-го центиля.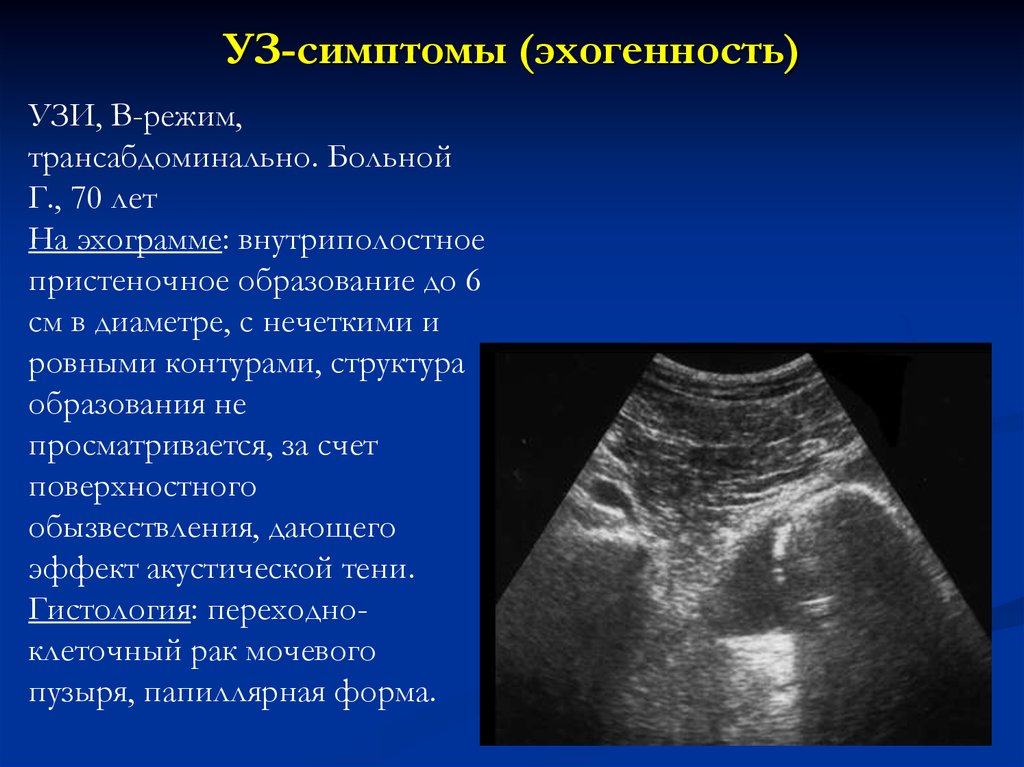
Рис. 8.20
Рис. 8.21
< предыдущая | топ | содержание | далее >
- Церебральные ишемические поражения у недоношенных детей можно диагностировать с помощью МРТ в неонатальном периоде.
- МРТ-изменения белого вещества после гипоксии-ишемии изучены как в раннем неонатальном периоде, так и в первое десятилетие жизни.
- До сих пор неясно, дает ли МРТ дополнительную информацию по сравнению с повторным ультразвуковым исследованием новорожденных в неонатальном периоде, хотя появляется все больше данных, подтверждающих это. Особенно при использовании нетрадиционных последовательностей, таких как DWI, на эхогенной стадии PVL можно предсказать последующую эволюцию в кистозные поражения.
- Возможно, количественная трехмерная объемная МРТ для измерения таких структур, как кора, может помочь в прогнозировании будущих когнитивных дефектов.
- также является очень полезным методом для выявления очаговых ишемических поражений в головном мозге недоношенных.
 Были идентифицированы различные модели «неонатального инсульта».
Были идентифицированы различные модели «неонатального инсульта». - Будущие исследования церебральных ишемических поражений у недоношенных детей могут помочь в определении физиологических механизмов, лежащих в основе этих поражений. Эти исследования могут в конечном итоге привести к вмешательствам, чтобы уменьшить повреждение головного мозга.
МРТ
< предыдущая | топ | содержание | следующий >
- Бэк С.А., Ган Х, Ли И и др. (1998) Зависимая от созревания уязвимость олигодендроцитов к смерти, вызванной окислительным стрессом, вызванной истощением глутатиона. J Neurosc 18 , 6241–6253.
- Бейкер Л.Л., Стивенсон Д.К. и Энцманн Д.Р. (1988) Конечная стадия перивентрикулярной лейкомаляции: оценка МРТ. Радиология 168 , 809–815.
- Банкир Б.К. и Ларрош Дж.Л. (1962) Перивентрикулярная лейкомаляция в детском возрасте: форма неонатальной аноксической энцефалопатии. Arch Neurol 7 , 386–410.
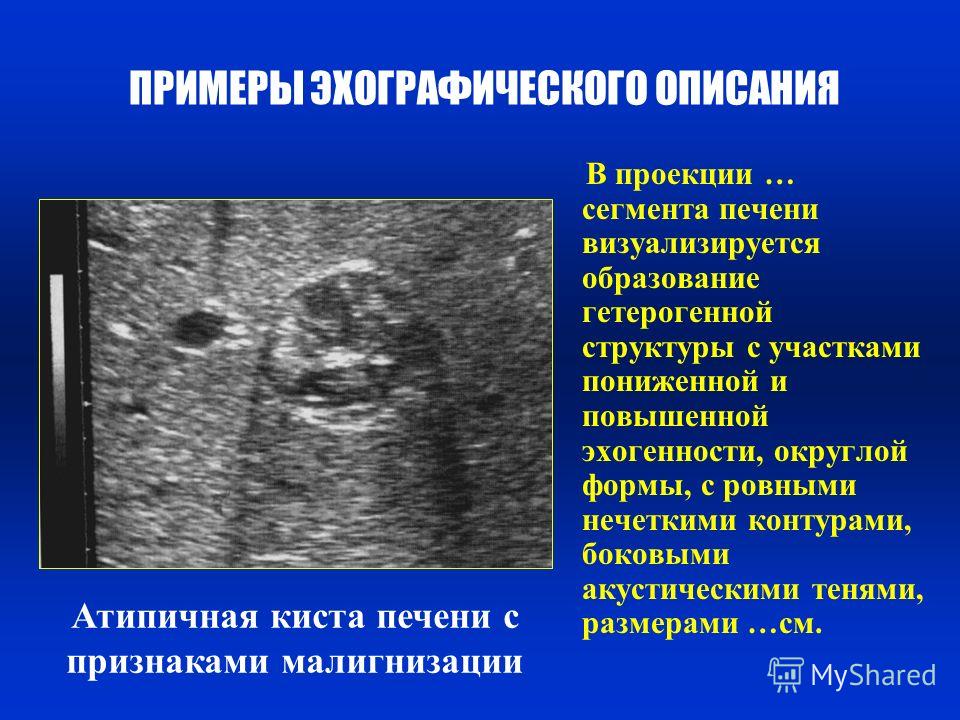
- Чоу П.П., Хорган Дж.Г. и Тейлор К.Дж.В. (1985)Неонатальная перивентрикулярная лейкомаляция: сонографическая диагностика в реальном времени с корреляцией КТ. Am J Нейрорадиол 6 , 383–388.
- Cioni G, Fazzi B, Ipata AE и др. (1996) Корреляция между церебральными нарушениями зрения и магнитно-резонансной томографией у детей с неонатальной энцефалопатией. Dev Med Child Neurol 38 , 120–132.
- Cioni G, Di Paco MC, Bertuccelli B и др. (1997) Результаты МРТ и сенсомоторное развитие у младенцев с двусторонним спастическим церебральным параличом. Brain Dev 19 , 245–253.
- De Vries LS, Connell JA, Dubowitz LMS и др. (1987) Электрофизиологические, неврологические и МРТ-аномалии у младенцев с обширной кистозной лейкомаляцией. Нейропиатрия 18 , 61–66.
- De Vries LS, Eken P и Dubowitz LMS (1992) Спектр лейкомаляции с использованием ультразвукового исследования черепа.
 Beh Brain Res 49 , 1–6.
Beh Brain Res 49 , 1–6. - De Vries LS, Eken P, Groenendaal F, и др. (1993) Корреляция между степенью перивентрикулярной лейкомаляции, диагностированной с помощью УЗИ черепа и МРТ в более позднем младенчестве у детей с церебральным параличом. Нейропиатрия 24 , 263–268.
- De Vries LS, Groenendaal F, Eken P и др. (1997)Инфаркты в сосудистом распределении средней мозговой артерии у недоношенных и доношенных детей. Нейропиатрия 28 , 88–96.
- Eken P, de Vries LS, van Nieuwenhuizen O et al. (1996) Ранние предикторы церебрального нарушения зрения у младенцев с кистозной лейкомаляцией. Нейропиатрия 27 , 16–25.
- Feldman HM, Scher MS и Kemp SS (1990) Исход развития нервной системы у детей с признаками перивентрикулярной лейкомаляции на поздней МРТ. Pediatr Neurol 6 , 296–302.
- Флодмарк О.
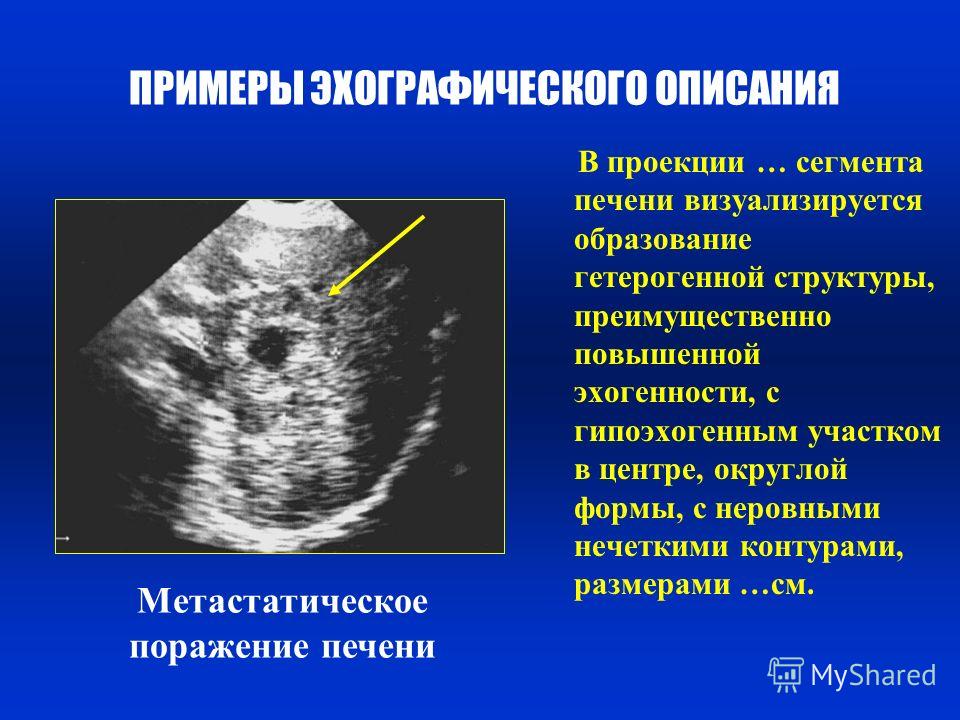 , Луптон Б., Ли Д. и др. (1989) МРТ перивентрикулярной лейкомаляции у детей. Am J Нейрорадиол 10 , 111–118.
, Луптон Б., Ли Д. и др. (1989) МРТ перивентрикулярной лейкомаляции у детей. Am J Нейрорадиол 10 , 111–118. - Guit GL, van de Bor M, den Ouden L и др. (1990) Прогноз исхода развития нервной системы у недоношенных детей: миелинизация на стадии МРТ по сравнению с УЗИ. Радиология 175 , 107–109.
- Хоуп PL, Гулд SJ, Ховард S и др. (1988) Ультразвуковая диагностика патологически верифицированных поражений головного мозга глубоко недоношенных детей. Dev Med Child Neurol 30 , 457–471.
- Иай М., Танабе Ю., Гото М. и др. (1994) Сравнительное магнитно-резонансное исследование мозолистого тела у неврологически нормальных детей и детей со спастической диплегией. Acta Paediatr 83 , 1086–1090.
- Inder T, Huppi P, Zientara GP и др. (1999)Раннее выявление перивентрикулярной лейкомаляции методами диффузионно-взвешенной магнитно-резонансной томографии.
 J Pediatr 134 , 631–634.
J Pediatr 134 , 631–634. - Inder TE, Hüppi PS, Warfield S и др. (1999) Перивентрикулярное повреждение белого вещества у недоношенных детей сопровождается уменьшением объема серого вещества коры головного мозга в срок. Энн Нейрол 46 , 755–760.
- Keeney SE, Adcock EW и McArdle CB (1991) Проспективные наблюдения 100 новорожденных с высоким риском с помощью высокопольной (1,5 Тесла) магнитно-резонансной томографии центральной нервной системы; II: Гипоксически-ишемическая энцефалопатия. Педиатрия 87 , 431–438.
- Коэда Т., Суганама И., Кохно Ю. и др. (1990) МРТ спастической диплегии. Сравнительное исследование недоношенных и доношенных детей. Нейрорадиология 32 , 187–190.
- Lanzi G, Fazzi E, Uggetti C и др. (1998) Церебральное нарушение зрения при перивентрикулярной лейкомаляции. Нейропиатрия 29 , 145–150.

- Маалуф Э.Ф., Дагган П.Дж., Резерфорд, Массачусетс, и др. (1999) Магнитно-резонансная томография головного мозга в когорте крайне недоношенных детей. J Pediatr 135 , 351–357.
- Maalouf EF, Duggan PJ, Counsell SJ и др. Сравнение результатов ультразвукового исследования черепа и магнитно-резонансной томографии у недоношенных детей. Педиатрия 2001; 107: 719–727.
- Millet V, Bartoli JM, Lacroze V и др. (1998) Прогностическое значение магнитно-резонансной томографии в 4 месяца скорректированного возраста после перинатального инсульта. Биол новорожденных 73 , 207–219.
- Панет Н., Руделли Р., Монте В. и др. (1990)Некроз белого вещества у младенцев с очень низкой массой тела при рождении: невропатологические и ультразвуковые данные у младенцев, выживших шесть дней или дольше. J Pediatr 116 , 975–984.
- Панет Н., Руделли Р.
 , Казам Э. и др. (1994) Сопутствующие патологические поражения: кровоизлияние в мозжечок, мостосубикулярный некроз, некроз базальных ганглиев. In: Повреждение головного мозга у недоношенного ребенка . Clin Dev Med 131 , Лондон, MacKeith Press, стр. 163–170.
, Казам Э. и др. (1994) Сопутствующие патологические поражения: кровоизлияние в мозжечок, мостосубикулярный некроз, некроз базальных ганглиев. In: Повреждение головного мозга у недоношенного ребенка . Clin Dev Med 131 , Лондон, MacKeith Press, стр. 163–170. - Roelants-van Rijn AM, Groenendaal F, Beek FJ и др. . Нейропиатрия: в печати. Паренхиматозное повреждение головного мозга у недоношенных детей: сравнение результатов ультразвукового исследования черепа, МРТ и результатов развития нервной системы.
- Савман К., Бленноу М., Густафсон К. и др. (1998) Цитокиновый ответ в спинномозговой жидкости после родовой асфиксии. Pediatr Res 43 , 746–751.
- Schouman-Claeys E, Henry-Feugeas MC, Roset F и др. (1993)Перивентрикулярная лейкомаляция: корреляция между МРТ и результатами вскрытия в течение первых 2 месяцев жизни. Радиология 189 , 59–64.

- Sie LTL, van der Knaap MS, van Wezel-Meijler G и др. (2000) Ранние МР-признаки гипоксически-ишемического повреждения головного мозга у новорожденных с перивентрикулярной плотностью на сонограммах. Am J Нейрорадиол 21 , 852–861.
- Сугита К., Такеучи А., Иай М. и др. (1989) Неврологические последствия и МРТ у пациентов с низким весом при рождении. Педиатр Нейрол 5 , 365–369.
- Trounce JQ, Fagan D и Levene MI (1986) Внутрижелудочковое кровоизлияние и перивентрикулярная лейкомаляция: корреляция ультразвука и вскрытия. Arch Dis Child 61 , 1203–1207.
- Truwit CL, Barkovich AJ, Koch TK et al. (1992)Детский церебральный паралич: результаты МРТ у 40 пациентов. Am J Нейрорадиол 13 , 67–78.
- ван де Бор М., Гуит Г.Л., Шредер А.М. и др. (1989)Раннее выявление задержки миелинизации у недоношенных детей.
 Педиатрия 84 , 407–411.
Педиатрия 84 , 407–411. - van Wezel-Meijler G, van der Knaap MS, Sie LTL и др. (1998) Магнитно-резонансная томография головного мозга у недоношенных детей в неонатальном периоде. Нормальные явления и отражение легких ультразвуковых отклонений. Нейропиатрия 29 , 89–96.
- Вирхов Р. (1867) Zur pathologischen Anatomie des Gehirns I: врожденный энцефалит и миелит. Арка Патол Анат 38 , 129–142.
- Йокочи К., Айба К., Хори М. и др. (1991) Магнитно-резонансная томография у детей со спастической диплегией: корреляция с тяжестью их двигательных и психических нарушений. Dev Med Child Neurol 33 , 18–25.
- Юн Б.Х., Джун Дж.К., Ромеро Р. и др. (1997) Воспалительные цитокины амниотической жидкости (интерлейкин-6, интерлейкин-1бета и фактор некроза опухоли-альфа), поражения белого вещества головного мозга новорожденных и церебральный паралич.
 Am J Акушер-гинеколог 177 , 19–26.
Am J Акушер-гинеколог 177 , 19–26.
Посетите сайт автора по адресу
www.maryrutherfordimaging.co.uk
< предыдущая | топ | содержание | следующий >
Перивентрикулярная лейкомаляция | Бостонская детская больница
Перивентрикулярная лейкомаляция (ПВЛ) — тип повреждения головного мозга, наиболее часто встречающийся у глубоко недоношенных детей.
- PVL — это повреждение белого вещества вокруг заполненных жидкостью желудочков головного мозга. Белое вещество передает информацию между нервными клетками, спинным мозгом и от одной части мозга к другой
- PVL часто встречается у очень недоношенных детей с низкой массой тела при рождении. Это второе по распространенности осложнение со стороны центральной нервной системы у недоношенных детей.
- PVL может вызывать повреждение нервных путей, контролирующих двигательные движения, что приводит к напряжению, спастичности или резистентности мышц в дополнение к их слабости.

- Младенцы с PVL имеют более высокий риск церебрального паралича и могут иметь трудности в обучении и другие проблемы развития.
- Лечения ПВЛ не существует. Прогноз зависит от тяжести поражения головного мозга.
Перивентрикулярная лейкомаляция | Симптомы и причины
Каковы симптомы PVL?
Каждый ребенок с PVL уникален и будет иметь свой собственный набор симптомов, которые часто проявляются со временем по мере развития ребенка, а не все сразу.
Наиболее распространенными симптомами PVL являются:
- проблемы со зрением и движениями глаз
- проблемы с движением и напряженные мышцы
- задержка развития, которая со временем становится все более очевидной
Что вызывает ПВЛ?
Хотя точная причина ПВЛ неизвестна, считается, что это состояние возникает, когда области мозга вокруг желудочков (заполненные жидкостью пространства мозга) не получают достаточного количества крови. Эта область мозга очень подвержена травмам, особенно у недоношенных детей, мозговая ткань которых хрупка. Чем более недоношенный ребенок, тем выше риск ПВЛ.
Эта область мозга очень подвержена травмам, особенно у недоношенных детей, мозговая ткань которых хрупка. Чем более недоношенный ребенок, тем выше риск ПВЛ.
Другие факторы, которые могут быть связаны с ПВЛ, включают:
- внутримозговое кровотечение (внутрижелудочковое кровоизлияние)
- преждевременный разрыв плодных оболочек (амниотического мешка)
- инфекция внутри матки
Перивентрикулярная лейкомаляция | Диагностика и лечение
Как диагностируется перивентрикулярная лейкомаляция?
Новорожденные могут не проявлять симптомов PVL в первые несколько дней жизни. Однако, поскольку недоношенные дети имеют повышенный риск развития этого состояния, врачи могут проводить следующие диагностические тесты:
- УЗИ черепа: безболезненный тест, при котором звуковые волны позволяют увидеть мозг ребенка через мягкое место на макушке (родничок)
- магнитно-резонансная томография (МРТ): эта процедура визуализации использует магнитное поле и радио для получения подробного изображения головного мозга без воздействия рентгеновских лучей на младенца.
 ПВЛ — это термин, описывающий то, как мозг пораженного младенца выглядит на МРТ.
ПВЛ — это термин, описывающий то, как мозг пораженного младенца выглядит на МРТ.
Клиницисты программы фетально-неонатальной неврологии Бостонской детской больницы обеспечивают всестороннюю раннюю и точную диагностику перивентрикулярной лейкомаляции и других повреждений головного мозга, приобретенных у новорожденных и детей раннего возраста. Поскольку мозг новорожденных находится в критическом периоде быстрого развития, мы выявляем проблемы как можно раньше и действуем быстро, чтобы предотвратить как можно больший ущерб.
Как лечить ПВЛ?
Несмотря на отсутствие лечения PVL, мы можем порекомендовать другие виды ухода за вашим ребенком, такие как:
- физиотерапия
- трудотерапия
- речевая терапия
- терапия зрения
Большинство этих видов лечения предоставляется в рамках программ раннего вмешательства в вашем районе. Здесь, в Boston Children’s, мы работаем, чтобы привлечь семьи к раннему вмешательству и поддержать их другими способами, такими как переход на другую программу в нашей больнице, которая специализируется на уходе за детьми старшего возраста.
Каковы долгосрочные перспективы моего ребенка?
Долгосрочные перспективы для детей с PVL зависят от тяжести первоначального повреждения головного мозга. Типы симптомов сильно различаются и могут варьироваться от ребенка с минимальными проблемами до ребенка с серьезными задержками и проблемами с движением.
Как Boston Children’s подходит к PVL
Клиницисты в нашей программе фетально-неонатальной неврологии обеспечивают раннюю и точную диагностику PVL и других повреждений головного мозга, полученных у новорожденных и детей раннего возраста. Мы следим за новорожденными, которых наблюдали в отделении интенсивной терапии новорожденных (NICU) в Boston Children’s, а также в других больницах. После того, как вашего ребенка выпишут из отделения интенсивной терапии, мы продолжаем следить за его неврологическим прогрессом, чтобы обеспечить лечение, которое поможет его развитию в долгосрочной перспективе.
Перивентрикулярная лейкомаляция | Исследования и клинические испытания
Все неврологи, участвующие в программе фетально-неонатальной неврологии , активно участвуют в исследованиях, которые помогают нам быстро и точно диагностировать ПВЛ и другие неврологические состояния, глубоко понимать их и разрабатывать более эффективные методы лечения.
Понимание и лечение перивентрикулярной лейкомаляции
Бостон Детский невролог Джозеф Вольпе, доктор медицинских наук, посвятил всю свою жизнь изучению ПВЛ, которая является причиной многих когнитивных, поведенческих и моторных нарушений у детей, рожденных недоношенными. Работа Вольпе помогла врачам понять, какие младенцы подвержены риску такого рода черепно-мозговых травм и как его можно предотвратить или вылечить. Многие считают Вольпе основателем области неонатальной неврологии. Его учебник, Неврология новорожденных является стандартом в этой области.
Дети, у которых развивается ПВЛ, часто имеют проблемы со зрением, связанные с черепно-мозговой травмой, а не с проблемами глаз. Это «церебральное нарушение зрения» может быть трудно диагностировать и лечить. Важно выявить эту проблему, потому что эти типы нарушений зрения могут повлиять на способность ребенка учиться в школе. Джанет Соул, MDCM, проводит исследование церебральных нарушений зрения у детей, родившихся недоношенными.