Норма прогестерона на 22 день цикла норма: Гормональные анализы при планировании ЭКО (20-23 день цикла)
Бесплатные консультации врачей онлайн
Вопрос создается. Пожалуйста, подождите…
Только зарегистрированные пользователи могу задавать вопрос.
Зарегистрируйтесь на портале, задавайте вопросы и получайте ответы от квалифицированных специалистов!
Напоминаем, что стоимость публикации вопроса — 10 бонусов.
Зарегистрироваться
Как получить бонусы
К сожалению, у вас недостаточно бонусов для оплаты вопроса.
Напоминаем, что стоимость публикации вопроса — 10 бонусов.
Как получить бонусы
Раздел медицины*:
— Не указано —КоронавирусАкушерствоАллергология, иммунологияАнестезиологияВенерологияВертебрологияВетеринарияГастроэнтерологияГематологияГепатологияГериатрияГинекологияГирудотерапияГомеопатияДерматологияДиетологияИглотерапия и РефлексотерапияИнфекционные и паразитарные болезниКардиологияКардиохирургияКосметологияЛабораторная и функциональная диагностикаЛечение травмЛогопедияМаммологияМануальная терапияМРТ, КТ диагностикаНаркологияНеврологияНейрохирургияНетрадиционные методы леченияНефрологияОбщая хирургияОнкологияОстеопатияОториноларингологияОфтальмологияПедиатрияПлазмаферезПластическая хирургияПодологияПроктологияПсихиатрияПсихологияПсихотерапияПульмонология, фтизиатрияРадиология и лучевая терапияРеабилитологияРеаниматология и интенсивная терапияРевматологияРепродукция и генетикаСексологияСомнологияСпортивная медицинаСтоматологияСурдологияТерапияТравматология и ортопедияТрансфузиологияТрихологияУЗИУльтразвуковая диагностикаУрология и андрологияФармакологияФизиотерапияФлебологияЧелюстно-лицевая хирургияЭндокринологияЗатрудняюсь выбрать (будет выбрана терапия)
Кому адресован вопросВопрос адресован:
ВсемКонсультантам
Консультант, которому задается вопрос:
Всем. ..Агабекян Нонна Вачагановна (Акушер, Гинеколог)Айзикович Борис Леонидович (Педиатр)Акмалов Эдуард Альбертович (Аллерголог, Врач спортивной медицины)Александров Павел Андреевич (Венеролог, Гепатолог, Инфекционист, Паразитолог, Эпидемиолог)Александрова Анна Михайловна (Педагог, Психолог, Психотерапевт)Аристова Анастасия Михайловна (Андролог, Уролог, Хирург)Армашов Вадим Петрович (Хирург)Афанасьева Дарья Львовна (Кардиолог, Терапевт)Беляева Елена Александровна (Гинеколог, Невролог, Рефлексотерапевт)Бушаева Ольга Владимировна (Пульмонолог, Терапевт)Врублевская Елена (Педиатр)Гензе Ольга Владимировна (Генетик, Педиатр)Горохова Юлия Игоревна (Венеролог, Врач общей практики, Дерматолог)Григорьева Алла Сергеевна (Врач общей практики, Терапевт)Демидова Елена Леонидовна (Психолог, Психотерапевт)Денищук Иван Сергеевич (Андролог, Уролог)Димина Тамара Олеговна (Акушер, Аллерголог, Ангиохирург)Довгаль Анастасия Юрьевна (Маммолог, Онколог, Радиолог)Долгова Юлия Владимировна (Педиатр)Дьяконова Мария Алексеевна (Гериатр, Терапевт)Загумённая Анна Юрьевна (Врач спортивной медицины, Гирудотерапевт, Диетолог, Косметолог, Терапевт)Зверев Валентин Сергеевич (Ортопед, Травматолог)Згоба Марьяна Игоревна (Окулист (Офтальмолог))Зинченко Вадим Васильевич (Рентгенолог, Хирург)Зорий Евген Владимирович (Невролог, Психолог, Терапевт, Хирург)Извозчикова Нина Владиславовна (Гастроэнтеролог, Дерматолог, Иммунолог, Инфекционист, Пульмонолог)Илона Игоревна (Врач общей практики, Гастроэнтеролог, Терапевт, Эндокринолог)Калявина Светлана Николаевна (Акушер, Гинеколог)Калягина Екатерина (Другая специальность)Карпенко Алик Викторович (Ортопед, Травматолог)Касимов Анар Физули оглы (Онколог, Хирург)Киреев Сергей Александрович (Психиатр, Психолог, Психотерапевт)Кирнос Марина Станиславовна (Стоматолог, Стоматолог детский, Стоматолог-терапевт)Копежанова Гульсум (Акушер, Гинеколог)Кравцов Александр Васильевич (Нарколог, Психиатр)Красильников Андрей Викторович (Врач ультразвуковой диагностики, Медицинский директор, Флеболог, Хирург)Кряжевских Инна Петровна (Терапевт, Гастроэнтеролог)Кудряшова Светлана Петровна (Эндокринолог)Куртанидзе Ираклий Малхазович (Окулист (Офтальмолог))Кущ Елена Владимировна (Диетолог, Терапевт)Лазарева Татьяна Сергеевна (ЛОР (Оториноларинголог))Лаптева Лариса Ивановна (Невролог)Лебединская Татьяна Александровна (Психолог, Психотерапевт)Ледник Максим Леонидович (Венеролог, Дерматолог)Леонова Наталья Николаевна (Детский хирург)Литвиненко Станислав Григорьевич (Ортопед, Травматолог)Лямина Ирина Алексеевна (Акушер)Максименко Татьяна Константиновна (Инфекционист)МАЛЬКОВ РОМАН ЕВГЕНЬЕВИЧ (Диетолог, Остеопат, Реабилитолог)Мамедов Рамис (ЛОР (Оториноларинголог))Мартиросян Яков Ашотович (Детский хирург, Проктолог, Травматолог, Уролог, Хирург)Маряшина Юлия Александровна (Акушер, Венеролог, Врач ультразвуковой диагностики, Гинеколог, Педиатр)Матвеева Ярослава Дмитриевна (Педиатр)Мершед Хасан Имадович (Вертебролог, Нейрохирург)Миллер Ирина Васильевна (Невролог)Мильдзихова АЛЬБИНА Бексолтановна (Врач общей практики, Гинеколог, ЛОР (Оториноларинголог), Педиатр, Терапевт)Муратова Наталья Сергеевна (Врач общей практики, Диетолог)Мухорин Виктор Павлович (Нефролог)Наумов Алексей Алексеевич (Мануальный терапевт)Никитина Анна Алексеевна (Окулист (Офтальмолог))Ольга Викторовна (Невролог, Неонатолог, Педиатр, Реабилитолог, Терапевт)Павлова Мария Игоревна (Стоматолог, Стоматолог-хирург, Челюстно-лицевой хирург)Панигрибко Сергей Леонидович (Венеролог, Дерматолог, Косметолог, Массажист, Миколог)Пантелеева Кристина Алексеевна (Невролог)Пастель Владимир Борисович (Ортопед, Ревматолог, Травматолог, Хирург)Паунок Анатолий Анатольевич (Андролог, Уролог)Першина Наталия Сергеевна (Невролог)Прокофьева Анастасия Михайловна (ЛОР (Оториноларинголог))Прохоров Иван Алексеевич (Нейрохирург, Хирург)Пушкарев Александр Вольдемарович (Гинеколог, Психотерапевт, Реабилитолог, Репродуктолог (ЭКО), Эндокринолог)Пьянцева Екатерина Вячеславна (Педиатр)Радевич Игорь Тадеушевич (Андролог, Венеролог, Сексолог, Уролог)Сапрыкина Ольга Александровна (Невролог)Свечникова Анастасия Евгеньевна (Стоматолог, Стоматолог детский, Стоматолог-ортопед, Стоматолог-терапевт, Стоматолог-хирург)Семений Александр Тимофеевич (Врач общей практики, Реабилитолог, Терапевт)Сергейчик Никита Сергеевич (Анестезиолог, Гомеопат)Силуянова Валерия Викторовна (Акушер, Врач ультразвуковой диагностики, Гинеколог)Соболь Андрей Аркадьевич (Кардиолог, Нарколог, Невролог, Психиатр, Психотерапевт)Сошникова Наталия Владимировна (Эндокринолог)Степанова Татьяна Владимировна (ЛОР (Оториноларинголог))Степашкина Анастасия Сергеевна (Гематолог, Пульмонолог, Терапевт)Сурова Лидия (Гирудотерапевт, Невролог, Терапевт)Суханова Оксана Александровна (Клинический фармаколог, Психолог)Сухих Данил Витальевич (Психиатр)Тумарец Кирилл Михайлович (Врач лечебной физкультуры, Врач спортивной медицины, Кинезитерапевт, Реабилитолог, Физиотерапевт)Турлыбекова Венера Равильевна (Врач общей практики, Педиатр)Устимова Вера Николаевна (Гематолог, Терапевт, Трансфузиолог)Фатеева Анастасия Александровна (Гастроэнтеролог, Диетолог, Психотерапевт, Эндокринолог)Федотова Татьяна Владимировна (Врач ультразвуковой диагностики, Гематолог, Терапевт)Фоминов Олег Эдуардович (Сексолог)Фоминов Олег Эдуардович (Сексолог)Фурманова Елена Александровна (Аллерголог, Иммунолог, Инфекционист, Педиатр)Хасанов Эльзар Халитович (Андролог, Врач ультразвуковой диагностики, Онколог, Уролог, Хирург)Хасанова Гульнара Сунагатулловна (Акушер, Врач ультразвуковой диагностики)Чупанова Аида (Акушер, Гинеколог)Чупанова Аида Идаятовна (Акушер, Гинеколог, Репродуктолог (ЭКО))Швайликова Инна Евненьевна (Окулист (Офтальмолог))Шибанова Мария Александровна (Нефролог, Терапевт)Штемберг Любовь Валерьевна (Невролог)Щепетова Ольга Александровна (Терапевт)Ягудин Денар Лукманович (ЛОР (Оториноларинголог))Ярвела Марианна Юрьевна (Психолог)
..Агабекян Нонна Вачагановна (Акушер, Гинеколог)Айзикович Борис Леонидович (Педиатр)Акмалов Эдуард Альбертович (Аллерголог, Врач спортивной медицины)Александров Павел Андреевич (Венеролог, Гепатолог, Инфекционист, Паразитолог, Эпидемиолог)Александрова Анна Михайловна (Педагог, Психолог, Психотерапевт)Аристова Анастасия Михайловна (Андролог, Уролог, Хирург)Армашов Вадим Петрович (Хирург)Афанасьева Дарья Львовна (Кардиолог, Терапевт)Беляева Елена Александровна (Гинеколог, Невролог, Рефлексотерапевт)Бушаева Ольга Владимировна (Пульмонолог, Терапевт)Врублевская Елена (Педиатр)Гензе Ольга Владимировна (Генетик, Педиатр)Горохова Юлия Игоревна (Венеролог, Врач общей практики, Дерматолог)Григорьева Алла Сергеевна (Врач общей практики, Терапевт)Демидова Елена Леонидовна (Психолог, Психотерапевт)Денищук Иван Сергеевич (Андролог, Уролог)Димина Тамара Олеговна (Акушер, Аллерголог, Ангиохирург)Довгаль Анастасия Юрьевна (Маммолог, Онколог, Радиолог)Долгова Юлия Владимировна (Педиатр)Дьяконова Мария Алексеевна (Гериатр, Терапевт)Загумённая Анна Юрьевна (Врач спортивной медицины, Гирудотерапевт, Диетолог, Косметолог, Терапевт)Зверев Валентин Сергеевич (Ортопед, Травматолог)Згоба Марьяна Игоревна (Окулист (Офтальмолог))Зинченко Вадим Васильевич (Рентгенолог, Хирург)Зорий Евген Владимирович (Невролог, Психолог, Терапевт, Хирург)Извозчикова Нина Владиславовна (Гастроэнтеролог, Дерматолог, Иммунолог, Инфекционист, Пульмонолог)Илона Игоревна (Врач общей практики, Гастроэнтеролог, Терапевт, Эндокринолог)Калявина Светлана Николаевна (Акушер, Гинеколог)Калягина Екатерина (Другая специальность)Карпенко Алик Викторович (Ортопед, Травматолог)Касимов Анар Физули оглы (Онколог, Хирург)Киреев Сергей Александрович (Психиатр, Психолог, Психотерапевт)Кирнос Марина Станиславовна (Стоматолог, Стоматолог детский, Стоматолог-терапевт)Копежанова Гульсум (Акушер, Гинеколог)Кравцов Александр Васильевич (Нарколог, Психиатр)Красильников Андрей Викторович (Врач ультразвуковой диагностики, Медицинский директор, Флеболог, Хирург)Кряжевских Инна Петровна (Терапевт, Гастроэнтеролог)Кудряшова Светлана Петровна (Эндокринолог)Куртанидзе Ираклий Малхазович (Окулист (Офтальмолог))Кущ Елена Владимировна (Диетолог, Терапевт)Лазарева Татьяна Сергеевна (ЛОР (Оториноларинголог))Лаптева Лариса Ивановна (Невролог)Лебединская Татьяна Александровна (Психолог, Психотерапевт)Ледник Максим Леонидович (Венеролог, Дерматолог)Леонова Наталья Николаевна (Детский хирург)Литвиненко Станислав Григорьевич (Ортопед, Травматолог)Лямина Ирина Алексеевна (Акушер)Максименко Татьяна Константиновна (Инфекционист)МАЛЬКОВ РОМАН ЕВГЕНЬЕВИЧ (Диетолог, Остеопат, Реабилитолог)Мамедов Рамис (ЛОР (Оториноларинголог))Мартиросян Яков Ашотович (Детский хирург, Проктолог, Травматолог, Уролог, Хирург)Маряшина Юлия Александровна (Акушер, Венеролог, Врач ультразвуковой диагностики, Гинеколог, Педиатр)Матвеева Ярослава Дмитриевна (Педиатр)Мершед Хасан Имадович (Вертебролог, Нейрохирург)Миллер Ирина Васильевна (Невролог)Мильдзихова АЛЬБИНА Бексолтановна (Врач общей практики, Гинеколог, ЛОР (Оториноларинголог), Педиатр, Терапевт)Муратова Наталья Сергеевна (Врач общей практики, Диетолог)Мухорин Виктор Павлович (Нефролог)Наумов Алексей Алексеевич (Мануальный терапевт)Никитина Анна Алексеевна (Окулист (Офтальмолог))Ольга Викторовна (Невролог, Неонатолог, Педиатр, Реабилитолог, Терапевт)Павлова Мария Игоревна (Стоматолог, Стоматолог-хирург, Челюстно-лицевой хирург)Панигрибко Сергей Леонидович (Венеролог, Дерматолог, Косметолог, Массажист, Миколог)Пантелеева Кристина Алексеевна (Невролог)Пастель Владимир Борисович (Ортопед, Ревматолог, Травматолог, Хирург)Паунок Анатолий Анатольевич (Андролог, Уролог)Першина Наталия Сергеевна (Невролог)Прокофьева Анастасия Михайловна (ЛОР (Оториноларинголог))Прохоров Иван Алексеевич (Нейрохирург, Хирург)Пушкарев Александр Вольдемарович (Гинеколог, Психотерапевт, Реабилитолог, Репродуктолог (ЭКО), Эндокринолог)Пьянцева Екатерина Вячеславна (Педиатр)Радевич Игорь Тадеушевич (Андролог, Венеролог, Сексолог, Уролог)Сапрыкина Ольга Александровна (Невролог)Свечникова Анастасия Евгеньевна (Стоматолог, Стоматолог детский, Стоматолог-ортопед, Стоматолог-терапевт, Стоматолог-хирург)Семений Александр Тимофеевич (Врач общей практики, Реабилитолог, Терапевт)Сергейчик Никита Сергеевич (Анестезиолог, Гомеопат)Силуянова Валерия Викторовна (Акушер, Врач ультразвуковой диагностики, Гинеколог)Соболь Андрей Аркадьевич (Кардиолог, Нарколог, Невролог, Психиатр, Психотерапевт)Сошникова Наталия Владимировна (Эндокринолог)Степанова Татьяна Владимировна (ЛОР (Оториноларинголог))Степашкина Анастасия Сергеевна (Гематолог, Пульмонолог, Терапевт)Сурова Лидия (Гирудотерапевт, Невролог, Терапевт)Суханова Оксана Александровна (Клинический фармаколог, Психолог)Сухих Данил Витальевич (Психиатр)Тумарец Кирилл Михайлович (Врач лечебной физкультуры, Врач спортивной медицины, Кинезитерапевт, Реабилитолог, Физиотерапевт)Турлыбекова Венера Равильевна (Врач общей практики, Педиатр)Устимова Вера Николаевна (Гематолог, Терапевт, Трансфузиолог)Фатеева Анастасия Александровна (Гастроэнтеролог, Диетолог, Психотерапевт, Эндокринолог)Федотова Татьяна Владимировна (Врач ультразвуковой диагностики, Гематолог, Терапевт)Фоминов Олег Эдуардович (Сексолог)Фоминов Олег Эдуардович (Сексолог)Фурманова Елена Александровна (Аллерголог, Иммунолог, Инфекционист, Педиатр)Хасанов Эльзар Халитович (Андролог, Врач ультразвуковой диагностики, Онколог, Уролог, Хирург)Хасанова Гульнара Сунагатулловна (Акушер, Врач ультразвуковой диагностики)Чупанова Аида (Акушер, Гинеколог)Чупанова Аида Идаятовна (Акушер, Гинеколог, Репродуктолог (ЭКО))Швайликова Инна Евненьевна (Окулист (Офтальмолог))Шибанова Мария Александровна (Нефролог, Терапевт)Штемберг Любовь Валерьевна (Невролог)Щепетова Ольга Александровна (Терапевт)Ягудин Денар Лукманович (ЛОР (Оториноларинголог))Ярвела Марианна Юрьевна (Психолог)
Описание проблемы:
Анализы крови на гормоны.
 Как разжечь и сохранить огонь желания. 100 верных советов для женщин
Как разжечь и сохранить огонь желания. 100 верных советов для женщин
Анализы крови на гормоны
При заболеваниях женской половой сферы сдают кровь на: лютеинизирующий гормон (ЛГ), фолликуло-стимулирующий гормон (ФСГ), эстрадиол, прогестерон, 17-oh-прогестерон, пролактин.
При заболеваниях мужской половой сферы и женщинам для углубленного анализа гормонального фона: дегидроэпиандростерон сульфат (ДГЭА), тестостерон.
Гормоны коры надпочечников: кортизол, адренокортикотропный гормон (АКТГ).
При заболеваниях щитовидной железы: тироксин (Т4), трийодтиронин (Т3), тиреотропный гормон (ТТГ), антитела к тиреоглобулину (АТ-ТГ), антитела к тиреоидной пероксидазе (АТ-ТПО) и др.
Как сдать анализ на гормоны правильно: поскольку гормональная система человека связана со всеми органами и системами организма, то сдавать этот анализ необходимо утром натощак. Перед сдачей крови на исследование гормонов откажитесь от курения, алкоголя и сильных физических нагрузок. Женщинам анализ многих гормонов необходимо сдавать в определенные дни менструального цикла.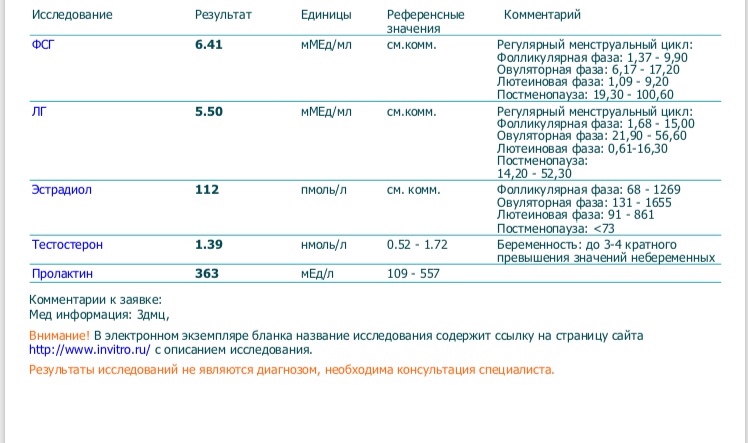 Обычно об этом говорит врач, назначая тот или иной анализ.
Обычно об этом говорит врач, назначая тот или иной анализ.
Гормоны женской половой сферы
Половые гормоны влияют на очень многие органы и системы женского организма, от них зависит, кроме того, и состояние кожи и волос, да и общее самочувствие. Недаром же, когда человек нервничает или даже ведет себя неадекватно, окружающие говорят: «Гормоны бушуют».
Правила сдачи крови примерно одинаковы для всех гормонов. Во-первых, анализ сдается натощак. Во-вторых, за день до сдачи анализа необходимо исключить алкоголь, курение, половые контакты, а также ограничить физические нагрузки. К искажению результатов также может привести эмоциональный стресс (поэтому анализ желательно сдавать в спокойном расположении духа) и прием некоторых лекарственных препаратов (прежде всего гормонсодержащих). Если вы принимаете какие-либо гормональные препараты, обязательно сообщите об этом врачу.
Разные гормоны сдаются женщинами в разные дни менструального цикла (считая от первого дня менструации).
ФСГ, ЛГ, пролактин – на 3–5 день цикла (ЛГ иногда сдается несколько раз в течение цикла для определения овуляции).
Тестостерон, ДГЭА-с – на 8—10 день цикла (в некоторых случаях допускается на 3–5 день цикла).
Прогестерон и эстрадиол обычно сдают на 21–22 день цикла (в идеале через 7 дней после предполагаемой овуляции. При измерении ректальной температуры – через 5–7 дней после начала подъема температуры. При нерегулярном цикле может сдаваться несколько раз).
Лютеинизирующий гормон (ЛГ)
Он вырабатывается гипофизом и регулирует деятельность половых желез: стимулирует выработку прогестерона у женщин и тестостерона у мужчин. У женщин стимулирует образование эстрогенов, обеспечивает овуляцию и образование желтого тела. У мужчин под влиянием лютеинизирующего гормона увеличивается уровень тестостерона, благодаря чему происходит созревание сперматозоидов.
Выделение гормона носит пульсирующий характер и зависит у женщин от фазы овуляционного цикла. В периоде полового созревания уровень ЛГ повышается, приближаясь к значениям, характерным для взрослых.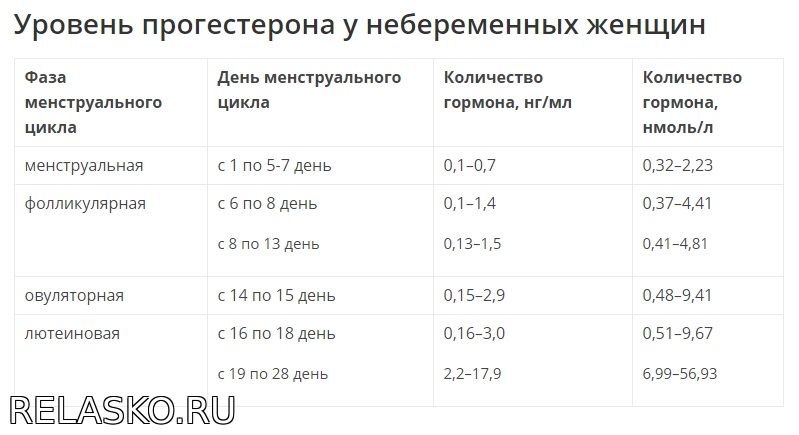 В менструальном цикле пик концентрации ЛГ приходится на овуляцию, после которой уровень гормона снижается. Во время беременности концентрация снижается. После прекращения менструаций (в постменопаузу) происходит повышение концентрации ЛГ.
В менструальном цикле пик концентрации ЛГ приходится на овуляцию, после которой уровень гормона снижается. Во время беременности концентрация снижается. После прекращения менструаций (в постменопаузу) происходит повышение концентрации ЛГ.
Важно соотношение лютеинизирующего гормона и фолликулостимулирующего гормона (ЛГ/ФСГ). В норме до наступления менструаций оно равно 1, после года их прохождения – от 1 до 1,5, в периоде от двух лет после наступления менструаций и до менопаузы – от 1,5 до 2.
За 3 дня до взятия крови необходимо исключить спортивные тренировки. Минимум час до взятия крови не курить. Кровь надо сдавать в спокойном состоянии, натощак.
Анализ делается на 4–7 день менструального цикла, если другие сроки не указаны лечащим врачом. В случае нерегулярных циклов кровь для измерения уровня ЛГ берут каждый день в период между 8—18 днями перед предполагаемой менструацией.
Нормы лютеинизирующего гормона:
– дети до 11 лет 0,03—3,9 мМЕмл,
– мужчины 0,8–8,4 мМЕмл,
– женщины: фолликуллярная фаза цикла 1,1–8,7 мМЕмл, овуляция 13,2—72 мМЕмл, лютеиновая фаза цикла 0,9—14,4 мМЕмл, постменопауза 18,6– 72 мМЕмл.
Фолликулостимулирующий гормон (ФСГ)
Он вырабатывается гипофизом. У мужчин вызывает развитие семенных канальцев, стимулирует сперматогенез, у женщин от него зависит развитие фолликулов в яичнике. ФСГ стимулирует образование фолликулов у женщин, при достижении критического уровня ФСГ происходит овуляция.
ФСГ в кровь выбрасывается импульсами с интервалом в 1–4 часа. Концентрация гормона во время выброса в 1,5–2,5 раза превышает средний уровень, выброс длится около 15 минут. Наблюдаются сезонные колебания концентрации гормона в крови: летом уровень ФСГ у мужчин выше, чем в другие времена года.
Анализ делается на 4–7 день менструального цикла, если другие сроки не указаны лечащим врачом. За 3 дня до взятия крови необходимо исключить спортивные тренировки. Минимум 1 час до взятия крови не курить. Нужно быть в спокойном состоянии и натощак.
Нормы ФСГ:
– дети до 11 лет 0,3–6,7 мМЕмл,
– мужчины 1,0—11,8 мМЕмл,
– женщины: фолликуллярная фаза цикла 1,8– 11,3 мМЕмл, овуляция 4,9—20,4 мМЕмл, лютеиновая фаза цикла 1,1–9,5 мМЕмл, постменопауза 31– 130 мМЕмл.
Эстрадиол
Вырабатывается в яичниках у женщин, яичками у мужчин, в небольшом количестве эстрадиол вырабатывается также корой надпочечников у мужчин и женщин.
Эстрадиол у женщин обеспечивает формирование половой системы по женскому типу, развитие женских вторичных половых признаков, становление и регуляцию менструальной функции, развитие яйцеклетки, рост и развитие матки при беременности; отвечает за психофизиологические особенности полового поведения. Обеспечивает формирование подкожной жировой клетчатки по женскому типу.
Также он обладает анаболическим действием, усиливает обмен в костной ткани и ускоряет созревание костей скелета. Способствует задержке натрия и воды в организме. Снижает уровень холестерина и повышает свертывающую активность крови.
У женщин детородного возраста уровень эстрадиола в сыворотке крови и плазме зависит от фазы менструального цикла. С начала менструального цикла содержание эстрадиола в крови постепенно нарастает, достигая пика к концу фолликуллярной фазы (он стимулирует выброс ЛГ перед овуляцией), затем в лютеиновую фазу уровень эстрадиола немного снижается. Содержание эстрадиола во время беременности в сыворотке и плазме нарастает к моменту родов, а после родов она возвращается к норме на 4-й день. С возрастом у женщин наблюдается снижение концентрации эстрадиола. В постменопаузу концентрация эстрадиола снижается до уровня, наблюдаемого у мужчин.
Содержание эстрадиола во время беременности в сыворотке и плазме нарастает к моменту родов, а после родов она возвращается к норме на 4-й день. С возрастом у женщин наблюдается снижение концентрации эстрадиола. В постменопаузу концентрация эстрадиола снижается до уровня, наблюдаемого у мужчин.
Накануне исследования обязательно надо исключить физические нагрузки (спортивные тренировки) и курение. У женщин репродуктивного возраста (примерно с 12–13 лет и до наступления климактерического периода) анализ производится на 4–7 день менструального цикла, если другие сроки не указаны лечащим врачом.
Нормальные показатели эстрадиола:
– дети до 11 лет < 15 пгмл,
– мужчины 10–36 пгмл,
– женщины: репродуктивного возраста 13—191 пг мл, в период менопаузы 11–95 пгмл.
Прогестерон
Он является стероидным гормоном, который производит у женщин желтое тело яичников, а в период беременности его производит плацента. В небольшом количестве и у мужчин, и у женщин он производится в корковом слое надпочечников под воздействием лютеинизирующего гормона (ЛГ). У женщин концентрация его в крови намного выше, чем у мужчин. Прогестерон называют «гормоном беременности», поскольку он играет определяющую роль в ее нормальном прохождении.
У женщин концентрация его в крови намного выше, чем у мужчин. Прогестерон называют «гормоном беременности», поскольку он играет определяющую роль в ее нормальном прохождении.
Если наступает оплодотворение яйцеклетки, то прогестерон угнетает синтез гонадотропных гормонов гипофиза и тормозит овуляцию, желтое тело не рассасывается, а продолжает синтезировать гормон вплоть до 16 недели, после чего синтез его продолжается в плаценте. Если оплодотворения не происходит, то желтое тело рассасывается через 12–14 дней, концентрация гормона уменьшается и наступает менструация.
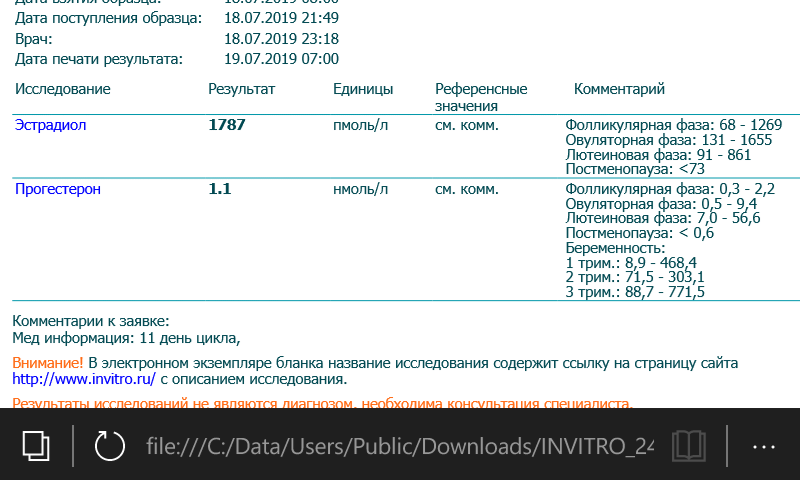
Исследование обычно проводят на 22–23 день менструального цикла, утром натощак. Разрешается пить воду. Если забор крови производится в течение дня, то период голодания должен быть не менее 6 часов, с исключением жиров в предыдущий день. При измерении ректальной температуры концентрацию прогестерона определяют на 5–7 день ее максимального подъема. При нерегулярном менструальном цикле чаще всего исследование проводят несколько раз.
Нормы прогестерона:
– дети 1—10 лет 0,2–1,7 нмоль/л,
– мужчины старше 10 лет 0,32—2,23 нмоль/л,
– женщины старше 10 лет: фолликулярная фаза 0,32—2,23 нмоль/л, овуляция 0,48—9,41 нмоль/л, лютеиновая фаза 6,99–56,63 нмоль/л, постменопауза < 0,64 нмоль/л,
– беременные: I триместр 8,90—468,40 нмоль/л, II триместр 71,50—303,10 нмоль/л, III триместр 88,70– 771,50 нмоль/л.
17-OH-прогестерон (17-Oh-П, 17-гидроксипрогестерон)
Это стероидный гормон, продуцирующийся в надпочечниках, половых органах и плаценте. В надпочечниках 17-ОН-прогестерон превращается в кортизол. Кроме того, в яичниках, как и в надпочечниках, этот гормон может превращаться в андростендион – предшественник гормонов тестостерона и эстрадиола.
Повышение его уровня в крови во время менструального цикла совпадает с увеличением концентрации лютеинизирующего гормона (ЛГ), эстрадиола и прогестерона. Также содержание 17-ОН увеличивается в период беременности.
В течение первой недели после рождения младенца уровень 17-ОН-прогестерона падает, он остается постоянно низким в детстве, в период половой зрелости прогрессивно повышается до уровня концентрации у взрослых.
Анализ сдается утром натощак, женщинам рекомендуется сдавать на 5 день менструального цикла.
Нормы 17-ОН-прогестерона:
– мужчины 1,52—6,36 нмоль/л,
– женщины от 14 лет: фолликулярная фаза 1,24– 8,24 нмоль/л, овуляция 0,91—4,24 нмоль/л, лютеиновая фаза 0,99–11,51 нмоль/л, постменопауза 0,39– 1,55 нмоль/л,
– беременные: I триместр 3,55–17,03 нмоль/л, II триместр 3,55–20,00 нмоль/л, III триместр 3,75–33,33 нмоль/л.
Пролактин
Гормон, способствующий формированию полового поведения. Вырабатывается в передней доле гипофиза, незначительное количество синтезируется периферическими тканями. При беременности пролактин вырабатывается в эндометрии (слизистой оболочке матки), поддерживает существование желтого тела и выработку прогестерона, стимулирует рост и развитие молочных желез и образование молока.
Пролактин регулирует водно-солевой обмен, задерживая выделение воды и натрия почками, стимулирует всасывание кальция. Среди других эффектов можно отметить стимуляцию роста волос.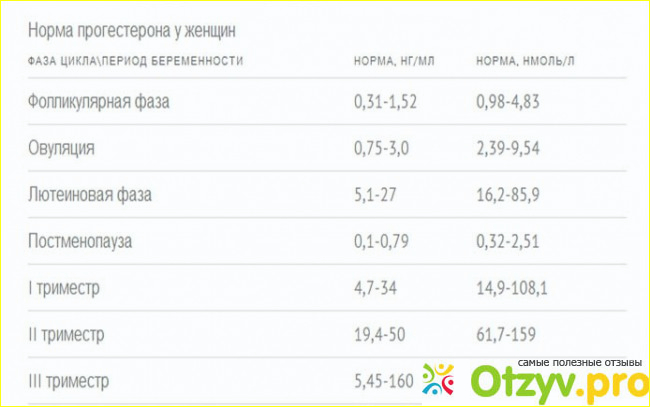 Пролактин также регулирует иммунитет.
Пролактин также регулирует иммунитет.
В лютеиновую фазу уровень пролактина выше, чем в фолликулярную. При беременности (с 8-й недели) уровень пролактина повышается, достигая пика к 20–25 неделе, затем снижается непосредственно перед родами и вновь увеличивается в период кормления грудью.
За один день до исследования следует исключить половые сношения и тепловые воздействия (сауну), за 1 час – курение. Поскольку на уровень пролактина большое влияние оказывают стрессовые ситуации, желательно исключить факторы, влияющие на результаты исследований: физическое напряжение (бег, подъем по лестнице), эмоциональное возбуждение. Перед процедурой следует отдохнуть 10–15 минут, успокоиться.
Нормы пролактина:
– дети до 10 лет 91—526 мМЕл,
– мужчины 105–540 мМЕл,
– женщины 67—726 мМЕл.
Гормоны мужской половой сферы
Эти гормоны хоть и считаются мужскими, но вырабатываются и женским организмом. Просто их количество у женщин меньше.
Дегидроэпиандростендион-сульфат (ДГЭА-С)
Это гормон, образующийся в надпочечниках (95 %) и яичках (5 %), обладает андрогенными свойствами. Как правило, низкий уровень ДГЭА в подростковом возрасте свидетельствует о задержке полового развития. В то же время повышенные показатели ДГЭА свидетельствует о преждевременном половом созревании. Показатели этого гормона важны для диагностики некоторых эндокринологических заболеваний. С возрастом абсолютная концентрация этого гормона в крови снижается. Для исследования берут кровь из вены натощак.
Как правило, низкий уровень ДГЭА в подростковом возрасте свидетельствует о задержке полового развития. В то же время повышенные показатели ДГЭА свидетельствует о преждевременном половом созревании. Показатели этого гормона важны для диагностики некоторых эндокринологических заболеваний. С возрастом абсолютная концентрация этого гормона в крови снижается. Для исследования берут кровь из вены натощак.
Нормы ДГЭА-С:
– мальчики 0—14 дней 37—376 мкг/дл,
– мальчики 1–3 года 6—21 мкг/дл,
– мальчики 3–6 лет 5—186 мкг/дл,
– мальчики 6–8 лет 10–94 мкг/дл,
– мальчики 8—10 лет 16–75 мкг/дл,
– мальчики 10–14 лет 18—344 мкг/дл,
– мужчины 80—560 мкг/дл,
– девочки 0—14 дней 44—367 мкг/дл,
– девочки 1–3 года 6—79 мкг/дл,
– девочки 3–6 лет 6—38 мкг/дл,
– девочки 6–8 лет 13–68 мкг/дл,
– девочки 10–12 лет 12—177 мкг/дл,
– девочки 12–14 лет 23—301 мкг/дл,
– женщины 35—430 мкг/дл,
– беременные: I триместр 66 – 460 мкг/дл, II триместр 37 – 260 мкг/дл, III триместр 19 – 130 мкг/дл.
Тестостерон
Это основной, наиболее активный мужской половой гормон, у мужчин вырабатывается клетками Лейдига семенников, а у женщин – корой надпочечников (примерно 25 %), яичниками (примерно 25 %) и в периферических тканях (50 %).
Тестостерон на стадии внутриутробного развития необходим для формирования мужских половых органов, а в период полового созревания отвечает за развитие вторичных половых признаков. Также необходим он и для поддержания нормальной половой функции.
У женщин исследование рекомендуется проводить на 6–7 день менструального цикла. Специальной подготовки не требуется. Кровь желательно сдавать утром, натощак.
Нормы тестостерона:
– мальчики 0—14 дней 75—400 нг/дл,
– мальчики 1—10 лет 2—30 нг/дл,
– мальчики 10–12 лет 15—280 нг/дл,
– мальчики 12–14 лет 105–545 нг/дл,
– мужчины 14–20 лет 200–810 нг/дл,
– мужчины 20–49 лет 286—1511 нг/дл,
– мужчины старше 50 лет 212–742 нг/дл,
– девочки 0—14 дней 20–64 нг/дл,
– девочки 1—10 лет 1—20 нг/дл,
– девочки 10–14 лет 5—40 нг/дл,
– женщины: фолликулярная фаза 14—118 нг/дл, овуляция 21—104 нг/дл, лютеиновая фаза 14—119 нг/ дл, менопауза 10—100 нг/дл,
– беременные: I триместр 30—230 нг/дл, II триместр 30—200 нг/дл, III триместр 30—190 нг/дл.
Данный текст является ознакомительным фрагментом.
Продолжение на ЛитРес
Эндокринное бесплодие
Главная » Лечение бесплодия » Эндокринное бесплодие
Эндокринное (или ановуляторное) бесплодие обусловлено нарушением процессов созревания и высвобождения яйцеклетки из фолликула (овуляции).
Наиболее частыми причинами являются эндокринные заболевания, связанные с такими структурами, как головной мозг, щитовидная железа, надпочечники. Очень часто в этом случае говорят о наличии гормонального бесплодия.
К числу подобных расстройств я отношу:
- Синдром поликистозных яичников – состояние, при котором яичники синтезируют большое количество мужских половых гормонов (андрогенов). В этом случае нарушаются процессы роста фолликула, что очень часто приводит к возникновению функциональных кист яичников (фолликулярная киста яичника).
- Гиперандрогения – состояние, при котором наблюдается высокий уровень мужских половых гормонов, так же, как при поликистозных яичниках, нарушаются процессы фолликулогенеза. Источником синтеза мужских половых гормонов могут быть надпочечники и избыточная жировая клетчатка при ожирении.
- Заболевания щитовидной железы – как гипофункция, так и гиперфункция щитовидной железы приводит к нарушению процессов фолликулогенеза. При заболеваниях щитовидной железы важно своевременное обращение к врачу и нормализация гормонального фона.
- Ранняя менопауза – преждевременное истощение яичниковой ткани. При этом даже выполнение стимуляции функции яичников высокоэффективными препаратами не приносит должного эффекта – роста яйцеклетки.
- Синдром резистентных яичников – это заболевание относят к иммунологическим. При нем у пациенток репродуктивного возраста невозможен естественный или индуцированный фолликулогенез. Многие научные статьи говорят о повреждении в первую очередь рецепторного аппарата к фолликулостимулирующему гормону.

- Гипоталамо-гипофизарные расстройства. Такие структуры центральной нервной системы, как гипоталамус и гипофиз, ответственны за регуляцию овуляторной и менструальной функции женщины. Нарушение работы в этих отделах центральной нервной системы приводят к изменению гормонального фона, в этом случае снижается уровень фолликулостимулирующего гормона и повышается уровень пролактина.
Диагностика эндокринного бесплодия
Тесты функциональной диагностики используются в гинекологии для определения гормональной активности яичников. С их помощью выявляют наличие овуляции. Для определения овуляторного цикла репродуктологи назначают расчёт графика базальной температуры, УЗИ-мониторинг (фолликулометрию) и мочевой тест на овуляцию.
Чтобы определить, имеются ли у женщины проблемы с овуляцией, составляют график базальной температуры. Сегодня это самый простой и дешёвый способ, отражающий выработку яичниками прогестерона, который должен подготовить слизистую оболочку матки для дальнейшей имплантации оплодотворенной яйцеклетки.
Чтобы составить точный линейный график базальной температуры, женщина, сразу после пробуждения, не вставая с постели, измеряет температуру в прямой кишке в одно и то же время. Полученные данные записываются ежедневно в график базальной температуры.
Если график составлен правильно, анализируя его информацию, можно определить начало овуляции (первая фаза менструального цикла с падением температуры на 0,2-0,4 градусов Цельсия). Температура во второй фазе цикла должна иметь разницу с первой на 0,5-0,6 °C. Длительность второй фазы графика составляет не менее 12-14 дней.
Если овуляция отсутствует, то график получится однофазным (монотонным). Однако и двухфазный график базальной температуры не даёт 100 % гарантию того, что овуляция была. Впрочем, то же самое можно сказать и об отрицательном результате однофазного графика. На базальную температуру большое влияние оказывают сторонние факторы: усталость, простуда и психоэмоциональное состояние женщины. График покажет, была ли овуляция или нет. Но эти результаты будут уже прошедшими.
Но эти результаты будут уже прошедшими.
Подтвердить овуляцию может уровень прогестерона в крови, который определяется в 28-дневном менструальном цикле с 20-го по 22-й день. При нормальной овуляции максимальный уровень прогестерона придётся на седьмой день после овуляции. Обычно врачом назначается несколько анализов крови на прогестерон в течение одного менструального цикла. Только повышение содержание прогестерона точно скажет, была ли овуляция или нет.
Также точно определить наличие овуляции можно по данным ультразвукового исследования. Спрогнозировать ее возможно вплоть до 12-24 часов, что является хорошим подспорьем в планировании беременности.
К инвазивным и более затратным методам оценки овуляции и соответствия слизистой полости матки дню менструального цикла является биопсия эндометрия. Процедура занимает около 10 минут, суть заключается в заборе небольшого фрагмента эндометрия из полости матки на 26-ой день нормального менструального цикла. Изменения эндометрия происходят в ответ на выработку эстрогенов и прогестерона.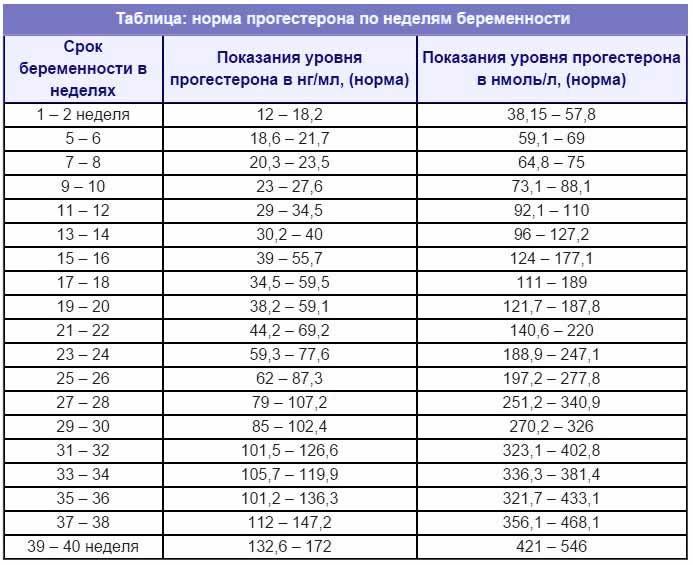 Поэтому наличие прогестерона говорит о начале овуляции. Ткань на анализ берётся из матки перед началом менструального цикла. Она обрабатывается специальным образом и исследуется под микроскопом. Биопсию эндометрия можно проводить на 26-ой день нормального менструального цикла или на 12-13 день, когда пик ЛГ достигает своего максимума. При гормональном бесплодии тесты выявляют различные степени пролиферации и секреции эндометрия (разрастание его структуры с изменением желёз).
Поэтому наличие прогестерона говорит о начале овуляции. Ткань на анализ берётся из матки перед началом менструального цикла. Она обрабатывается специальным образом и исследуется под микроскопом. Биопсию эндометрия можно проводить на 26-ой день нормального менструального цикла или на 12-13 день, когда пик ЛГ достигает своего максимума. При гормональном бесплодии тесты выявляют различные степени пролиферации и секреции эндометрия (разрастание его структуры с изменением желёз).
Иногда данное исследование не является достаточным в определении фактора эндокринного бесплодия, в этом случае я рекомендую выполнить дополнительное обследование:
- Измерение уровня гормонов на 2-5 день менструального цикла: ФСГ, ЛГ, пролактин, общий тестостерон, 17-ОН-прогестерон, ТТГ, Т3 свободный, Т4 свободный, антитела к ТПО, и на 20-22 день менструального цикла – прогестерон. Данные гормоны позволяют оценить функцию щитовидной железы, соотношение гормонов первой и второй фазы менструального цикла, оценить уровень мужских половых гормонов.

- Измерение уровня дегидроэпиандростерон-сульфата крови.
- В случае выявления уровня гиперандрогении с целью определения источника синтеза рекомендую сдавать стероидный профиль мочи.
Также с целью оценки овуляторной функции и для диагностики гормональных нарушений в репродуктивной системе репродуктологи назначают гормональные пробы. Их суть заключается в том, что пациентка принимает определённые гормональные препараты в определенные дни цикла, и по реакции собственных гормонов можно судить о состоянии репродуктивной системы. Для анализа берётся кровь и оценивается уровень выработки гормонов организмом, а также оценка менструальной функции.
Рисунок № 1. График базальной температуры. Овуляторный цикл.
Рисунок №2. График базальной температуры. Ановуляторный цикл.
Лечение эндокринного бесплодия
Лечение эндокринного (ановуляторного) бесплодия, на первом этапе, должно нормализовать работу эндокринной системы. Например, проводится корректировка функции надпочечников, щитовидной железы, лечение сахарного диабета и др.
Например, проводится корректировка функции надпочечников, щитовидной железы, лечение сахарного диабета и др.
Второй этап лечения направлен на стимулирование созревания фолликула и освобождение яйцеклетки. Терапия проводится лекарственными препаратами.
Овуляция стимулируется кломифен цитратом (лекарственные препараты кломид и клостилбегит). Клостилбегит подходит большинству пациенток. Плюс данного препарата только в невысокой стоимости, у многих пациенток он малоэффективен. Кломифен цитрат воздействует на гипофиз и вызывает увеличение количества гормона фолликулостимулирующего гормона. Только у 10 % пациенток после лечения этим препаратом наступает беременность.
Лечение кломифен цитратом не всегда приводит к овуляции. Когда не удаётся забеременеть в течение трех циклов стимуляции при подтвержденной овуляции, то назначается другая группа препаратов – гонадотропины. Они могут применяться самостоятельно или в сочетании с другими лекарствами.
Типы гонадотропина могут быть разные:
- человеческий менопаузный (Меногон и Менопур)
- синтетический фолликулостимулирующий гормон (Гонал-Ф и Пурегон)
- хорионический гонадотропин человека (Хорагон и Прегнил)
Лечение гонадотропином более дорогое, по сравнению с кломифен цитратом. К тому же имеется опасность возникновения побочных эффектов. Многоплодная беременность при использовании этого препарата более вероятна. При эндокринном (гормональном) бесплодии около 85 % всех пациенток, обратившихся к врачу и принимающих стимулирующие препараты, отмечают наступление овуляции. Из них более 60 % беременеет в первые 6 месяцев терапии.
Но всегда имеется некоторое количество женщин, которым стимулирующая терапия и хирургическое лечение не дали положительного результата. В таких случаях специалисты рекомендуют обратиться к вспомогательным репродуктивным технологиям – экстракорпоральному оплодотворению. Оно стимулирует суперовуляцию и приводит к созреванию большего числа фолликулов. Экстракорпоральное оплодотворение помогло многим женщинам, для которых эндокринное бесплодие стало препятствием обрести радость материнства.
Половые гормоны: ФСГ, ЛГ, пролактин, эстрогены, андрогены и другие. Соотношение ЛГ и ФСГ
Сбалансированный гормональный фон – важное условие нормального функционирования всех органов и систем. От концентрации гормонов зависит общее самочувствие, активность, сон, психическое состояние и многие другие процессы, особенно активность репродуктивной системы. Если уровень одного из гормонов изменяется, то это влечет за собой дисбаланс других элементов эндокринной системы, которые запускают реакцию патологических процессов, вызывающих расстройства половой системы. Поэтому анализ крови на гормоны ЛГ, ФСГ, тестостерон, эстрогены, прогестерон и другие – важные исследования, помогающие оценить состояние здоровья.
ФСГ, ЛГ и другие половые гормоны: роль в организме
ЛГ, ФСГ, эстрадиол и другие гормоны выделяются различными железами внутренней секреции. В определенной концентрации они действуют на органы мишени, но отклонения от нормы вызывают серьезные нарушения, отражающиеся на всем организме, в частности вероятности беременности и рождении ребенка. Женский организм более сложно устроен, так как подвержен серьезным циклическим изменениям уровня разных гормонов, запускающих различные реакции.
Женский гормональный фон напрямую зависит от концентрации ФСГ, ЛГ, пролактина, эстрадиола, тестостерона и других гормонов, уровень которых меняется в зависимости от дня цикла, возрасте и других факторов. Поэтому нормы ЛГ, ФСГ, эстрадиола и других компонентов в молодом возрасте являются признаками патологии у женщин после 45 лет. Регуляция активности половых гормонов осуществляется на трех уровнях: гипоталамус, гипофиз, яичники.
Гипофиз продуцирует ФСГ, ЛГ и пролактин, оказывающих сильное влияние на функциональность половых органов, их развитие, формирование гамет, появление половых признаков и общее состояние организма. К тому же ФСГ, ЛГ, пролактин, являясь гонадотропными гормонами, влияют на выработку гормонов в тканях яичников. ФСГ и ЛГ стимулируют синтез эстрадиола.
Выработка ФСГ, ЛГ и пролактина в гипофизе также регулируется: за счет механизма обратной связи (увеличение или уменьшение концентрации эстрогенов и тестостерона), а также за счет воздействия либеринов и статинов гипоталамуса. Гипоталамус получает сигналы из всех тканей организма и в зависимости от данных синтезирует либерины, которые стимулируют продукцию ФСГ, ЛГ и пролактина, или статины, которые тормозят образование гонадотропов.
Роль гормонов в мужском организме также не стоит недооценивать, хоть их уровень остается довольно стабильным в течение жизни. ФСГ и ЛГ стимулируют выработку тестостерона, воздействуют на процессы сперматогенеза, влияют на развитие половых органов и другие механизмы. ФСГ, ЛГ и тестостерон не зависят от дня месяца, но их уровень отличается в разные возрастные периоды.
Как сдавать ФСГ, эстрадиол и другие половые гормоны
Концентрация ФСГ, пролактина и других гормонов зависит не только от возраста и индивидуальных особенностей организма, она подвержена влиянию внешних факторов, поэтому к сдаче анализов следует подготовиться. Ответственность и серьезный подход поможет получить объективные данные, отражающие реальное состояние организма.
Гормоны ЛГ, ФСГ и другие элементы зависят от степени физической активности, поэтому за несколько дней следует ограничить спортивные нагрузки. Также необходимо избегать стрессовых ситуаций, полноценно питаться, нормализовать режим труда и отдыха. ФСГ, ЛГ и половые гормоны не стоит сдавать при наличии инфекционных заболеваний и обострения воспалительных процессов.
Основные правила для сдачи ФСГ, ЛГ, пролактина и других гормонов:
- Анализы на гормоны сдаются в утренние часы натощак;
- За день до сдачи на гормоны ЛГ, ФСГ и другие исключается алкоголь, курение, сексуальные контакты, физические нагрузки;
- Необходимо исключить прием лекарственных препаратов, желательно сдавать анализы не раньше недели после окончания курса терапии, если это невозможно, то условия следует обсудить с лечащим врачом.
Особенности при сдаче ФСГ, ЛГ, пролактина, эстрадиола, тестостерона и прогестерона:
- ФСГ, ЛГ, эстрадиол и другие вышеописанные гормоны чаще всего сдаются на 2-5 день цикла – при условии регулярного 28 дневного цикла;
- На 5-7 сутки при более длительном цикле;
- На 2-3 день при цикле менее 24 дня.
ФСГ и пролактин иногда назначают на 21-22 день цикла (во время лютеиновой фазы), а определение уровня ЛГ часто используют для выявления срока овуляции.
Особенности при проведении анализа ФСГ, ЛГ и других гормонов
- ФСГ (фолликулостимулирующий гормон) – это важный компонент репродуктивной системы, который запускает процесс созревания фолликула и развития яйцеклетки, а также вызывает синтез эстрогенов и рост эндометрия. У мужчин ФСГ отвечает за формирование семенных канальцев, развитие половых признаков, сперматогенез и секретирование тестостерона. Концентрация ФСГ и эстрадиола (тестостерона) регулируется по принципу отрицательной обратной связи, чем выше уровень одного, тем ниже уровень другого. Анализ на ФСГ сдается на 3-8 или 19-21 день цикла. Нормы находятся в широких пределах и зависят от фазы цикла, стоит отметить, что гормон в кровь выбрасывается в импульсном режиме, что влияет на поученные результаты;
- ЛГ (лютеинизирующий гормон) – это элемент репродуктивной системы, который влияет на овуляцию, синтез эстрогенов и поддерживает активность желтого тела. ЛГ и ФСГ работают совместно, достигнув своего максимума, они провоцируют выход яйцеклетки из созревшего фолликула – овуляцию. Норма ФСГ и ЛГ зависит от фазы цикла: в первой преобладает ФСГ, во второй ЛГ. Соотношение ФСГ и ЛГ – важный диагностический признак, нередко отклонение от нормы, но сохранение адекватного соотношения ЛГ и ФСГ является признаком индивидуальной нормы и наоборот, нормальный уровень ФСГ и ЛГ, но нарушение соотношения является признаком патологии. Анализ на ЛГ также сдается на 3-8 и 19-21 дни цикла;
- Пролактин – этот гормон оказывает влияние на желтое тело, водно-солевой обмен, стимулирует появление молока, а также подавляет формирование фолликула. Уровень пролактина воздействует на концентрацию ФСГ, уменьшая вероятность овуляции и наступления беременности. Количество гормона увеличивается во время сна и снижается после пробуждения, анализ на пролактин сдается в 1 и 2 фазу менструального цикла;
- Эстрогены – группа женских половых гормонов, которые обеспечивают функционирование репродуктивной системы, поведение и вторичные половые признаки. Наиболее активен эстрадиол, но во время беременности большее значение имеет эстриол. ФСГ и ЛГ влияют на концентрацию эстрогенов в крови. Уровень эстрадиола, ФСГ и ЛГ максимален во время овуляции. Анализ на эстрогены сдается на протяжении всего менструального цикла;
- Прогестерон – это гормон, вырабатывающийся желтым телом и создающий оптимальные условия для развития эмбриона. Анализ сдают на 19-21 день цикла, отклонения могут свидетельствовать о проблемах с вынашиванием и о бесплодии. Также гормон тормозит синтез ФСГ, ЛГ и созревание фолликулов;
- Андрогены – группа мужских половых гормонов, наибольшую активность проявляют тестостерон и ДЭГА-сульфат. Высокая концентрация тестостерона подавляет синтез ФСГ и ЛГ, вызывая выкидыши, бесплодие, ановуляцию. Анализ сдается на протяжении всего менструального цикла.
Гормоны ЛГ, ФСГ и другие компоненты эндокринной системы оказывают влияние на уровень друг друга: одни стимулируют синтез, другие подавляют формирование, поэтому отклонения одного гормона вызывают расстройства деятельности всей репродуктивной системы. Своевременное выявление нарушений позволяет предупредить развитие серьезных последствий, а также провести адекватную терапию, которая даст максимальный эффект.
По этой причине при выявлении каких-либо негативных симптомах, нарушении менструальной функции, изменении психоэмоционального состояния, веса и общего самочувствия необходимо сразу обратиться к врачу, который проведет тщательный осмотр и направит на полноценное обследование, включающее проведение анализов на гормоны. Пройти медицинский осмотр, сдать анализы на гормоны, выполнить дополнительные диагностические мероприятия и пройти полный курс терапии можно в «Центр ЭКО» Калининграда.
Нормы ФСГ, ЛГ и других половых гормонов зависят от фазы менструального цикла, поэтому квалифицированный специалист проводит динамическое наблюдение за состоянием пациентов. К тому же требуется неоднократное проведение анализов, которые помогают не только выявить какие-либо нарушения, но и осуществить контроль над терапевтическими мероприятиями. Методы определения гормонов в крови могут быть разными, поэтому нормы ФСГ, ЛГ и других элементов могут отличаться в разных лабораториях, поэтому рекомендуется выполнять анализы в одном учреждении.
Запишитесь на прием по телефону
+7 (4012) 92-06-76
или
воспользуйтесь формой записи:
Сдать анализ крови на Прогестерон в лаборатории KDL
Прогестерон 7.2.А5.201 Общие сведения.
Прогестерон – это стероидный гормон, продуцируемый желтым телом яичника. Его основная функция – подготовка организма женщины к беременности и сопровождение развития плода на раннем сроке. Под его воздействием прогестерона во второй фазе цикла матка становится готовой к имплантации оплодотворенной яйцеклетки. Если же происходит имплантация оплодотворённой яйцеклетки в матку, то желтое тело продолжает продуцировать прогестерон, а яйцеклетка образует трофобласт, который вырабатывает хорионический гонадотропин человека (ХГЧ). Через несколько недель плацента заменяет желтое тело в качестве основного источника гормона, при этом его уровень сохраняется довольно высоким на протяжении всего срока беременности.
Прогестерон вырабатывается в небольшом количестве в надпочечниках. У мужчин играет важную роль в процессе сперматогенеза.
В каких случаях обычно назначают исследование?
Анализ на прогестерон – обычный тест при обследовании женщин с бесплодием или с нарушениями менструального цикла. Его также используют при диагностике внематочной или замершей беременности, совместно с измерением ХГЧ.
Что означают результаты теста?
Интерпретация результатов анализа зависит от причины назначения и требует знания фазы менструального цикла или срока беременности пациентки.
Если уровень прогестерона не повышается и не падает ежемесячно, это говорит об отсутствии овуляции и других нарушениях менструального цикла. Это может быть причиной бесплодия.
Отсутствие повышения концентрации гормона на ранних сроках может указывать на внематочную или замершую беременность, а также быть признаком недостаточной функции желтого тела.
Повышенный уровень прогестерона может наблюдаться при следующих состояниях:
- Нормальная беременность
- Прием гормональных препаратов
- Опухоли яичников
- Врожденная гиперплазия надпочечников
Сроки выполнения теста.
Обычно результат анализа можно получить уже на следующий день.
Как подготовиться к анализу?
Исследование обычно проводится на 19-23 день менструального цикла, если лечащий врач не назначил иначе.
Стоимость анализа на прогестерон. Прогестерон при беременности в CMD
Референсные значения (вариант нормы):
|
Возраст, годы |
Мужчины |
Женщины |
Единицы измерения |
|---|---|---|---|
|
0 –1 |
<2.10 |
<4.20 |
нмоль/л |
|
1–10 |
<1.10 |
<1.10 | |
|
10-15 |
0.40 – 2.70 |
0.40 – 2.70 | |
|
15–19 |
0.50 – 1.80 Интерпретация результатов пациентов младше 18 лет зависит от стадии полового созревания. |
0.64 – 32.62 Интерпретация результатов пациентов младше 18 лет зависит от стадии полового созревания. Для взрослых небеременных женщин:
| |
|
19-100 |
0.32–0.65 |
| |
|
Интерпретация результата зависит от срока беременности:
|
|
Повышение значений |
Снижение значений |
|---|---|
|
|
Обращаем Ваше внимание на то, что интерпретация результатов исследований, установление диагноза, а также назначение лечения, в соответствии с Федеральным законом № 323-ФЗ «Об основах охраны здоровья граждан в Российской Федерации» от 21 ноября 2011 года, должны производиться врачом соответствующей специализации.
Недостаточность лютеиновой фазы
Лютеиновая фаза менструального цикла — это время от начала овуляции до первого дня менструации. При нормальном цикле его продолжительность составляет от 12 до 14 дней. В этой фазе эндометрий матки под воздействием гормона прогестерона готовится к имплантации оплодотворенной яйцеклетки. При недостаточности лютеиновой фазы это время сокращается из-за низких концентраций прогестерона, слизистая матки не подготовлена должным образом к беременности, что может помешать имплантации эмбриона и привести к раннему выкидышу. Таким образом, нарушения лютеиновой фазы могут стать причиной бесплодия у женщин и часто требуют надлежащей терапии ,чтобы достичь желательной беременности и избежать потери беременности в малом сроке гестации.
Продолжительность менструального цикла 28дней в среднем. Он начинается в первый день менструации, и это так называемая менструальная фаза, продолжительностью 1-5 дней, когда эндометрий отслаивается и происходит кровотечение. Затем начинается фолликулярная фаза, продолжительностью примерно от 6 до 13 дней цикла. В этой фазе под влиянием ФСГ происходит рост нескольких фолликулов яичников, ближе к 9 дню цикла происходит селекция доминантного фолликула. Под воздействием возрастания количества эстрогенов происходит восстановление слизистой оболочки матки, увеличивается количество и структура желез и увеличивается васкуляризация слизистой. Примерно на 14-й день под воздействием пика концентрации ЛГ происходит овуляция. После овуляции на месте фолликула образуется желтое тело, которое стимулируется гормонами гипофиза ЛГ, в меньшей мере ФСГ. Желтое тело в большом количестве производит прогестерон. Это лютеиновая фаза цикла, которая длится примерно от 15 до 28-го дня цикла. Пик секреции прогестерона приходится примерно на 22 – 23 день, в слизистой происходят секреторные изменения, все эти изменения направлены на подготовку к имплантации эмбриона. Если оплодотворение не происходит, то концентрация прогестерона снижается, и это приводит к дегенеративным изменениям в слизистой оболочке матки , к ее отслаиванию и наступлению менструации.
Диагностика и лечение недостаточности лютеиновой фазы.
При подозрении на недостаточность лютеиновой фазы основное значение имеет определение ее продолжительности. Чаще всего для этого используется измерение базальной температуры тела. При овуляции температура тела женщины повышается примерно на 0,5 градуса , это продолжается на протяжении лютеиновой фазы до наступления менструации, в норме 13-14 дней .Также при недостаточности лютеиновой фазы характерно снижения уровня прогестерона, ориентировочно через 7 дней после предполагаемой овуляции. УЗИ в динамике на протяжении менструального цикла также несет определенную информацию для диагностики недостаточности лютеиновой фазы. Гистологическое исследование эндометрия в позднюю лютеиновую фазу , иммуногистохимическое исследование позволяют оценить функциональное состояние эндометрия и желтого тела, а также оценить возможный ответ эндометрия на последующее лечение. Недостаточность лютеиновой фазы и низкий уровень прогестерона, означают то ,что слизистая оболочка матки недостаточно подготовлена для имплантации эмбриона. Терапия недостаточности лютеиновой фазы заключается в назначении препаратов прогестерона во вторую фазу цикла, коррекции состояний приведших к данной патологии. В каждом отдельном случае необходим персонализированный подход к данной проблеме и в этом вам поможет совет гинеколога.
Врач акушер-гинеколог Клиники доктора Медведева Галич Светлана Александровна.
Узнать все наши новости и море полезной информации на Telegram Public Accaunt: https://t.me/klinika_medvedev
Тестирование на 21 день: тесты на фертильность для женщин
На 21 день цикла ваш специалист по фертильности может проверить уровень определенных гормонов, таких как прогестерон и эстрадиол (E2), в вашей системе и измерить толщину эндометрия (слизистой оболочки матки).
Вот небольшой урок гормонов: при овуляции фолликул в яичнике выпускает яйцеклетку в фаллопиевы трубы, откуда она попадает в матку. После высвобождения фолликул, оставшийся в яичнике, выделяет большое количество прогестерона.
Таким образом, при тестировании на 21 день, примерно через 7 дней после овуляции, врач должен увидеть скачок прогестерона. Высокий уровень прогестерона на 21 день указывает на овуляцию и выделение яйцеклетки. Низкий уровень прогестерона на 21 день предполагает, что цикл был ановуляторным (яйцеклетки не производились). Если яйцеклетка не вырабатывается, беременность не может быть достигнута.
Кроме того, в тест на 21 день включен эстрадиол (E2). Это форма эстрогена, которая выделяется по мере роста яйцевых фолликулов в яичнике.Пик наступает при овуляции.
Уровни серийного эстрадиола (E2) часто измеряются для мониторинга суперовуляции в циклах лечения внутриматочной инсеминации (ВМИ) и экстракорпорального оплодотворения (ЭКО), поскольку это указывает на рост фолликулов. Суперовуляция — это контролируемая стимуляция яичников, поскольку с медицинской точки зрения ими манипулируют, чтобы производить более одной яйцеклетки в месяц (нормальная овуляция дает только одну яйцеклетку в месяц).
Ультразвуковое исследование также используется для измерения слизистой оболочки матки, чтобы определить, достаточно ли она толстая для имплантации оплодотворенной яйцеклетки.
Время овуляции связано с пиком прогестерона, и этот всплеск связан с последующим менструальным периодом, а не с предыдущим. В среднем цикле из 28 дней время между овуляцией и следующей менструацией составляет около двух недель, поэтому прогестерон измеряется примерно за семь дней до ожидаемой менструации или на 21 день.
Однако, если цикл женщины длиннее или короче 28 дней, день тестирования будет соответствующим образом скорректирован. Например, женщина с 35-дневным циклом будет проверена на прогестерон за семь дней до следующего менструального цикла, на 28-й день
.
При расчете своего Дня 21 убедитесь, что вы начинаете с настоящего Дня 1, который является первым днем потока, без учета каких-либо пятен.
Если результаты тестирования на 21 день показывают, что у вас нет овуляции, можно предпринять шаги, которые помогут высвободить яйцеклетки, включая лекарства. Ваш репродуктивный эндокринолог обсудит с вами эти варианты.
Что мне нужно знать о тесте на прогестерон на 21 день
9 месяцев назад
Когда вы пытаетесь забеременеть, один из тестов, которые может предложить ваш врач, — это тест на прогестерон на 21 день, который проводится примерно на 21 день вашего цикла (в зависимости от вашей обычной продолжительности цикла).
Но для чего нужен этот тест и почему он важен? Читай дальше что бы узнать.
Что такое тест на прогестерон на 21 день?
Тест на 21 день проводится для проверки уровней прогестерона и эстрадиола (E2) в вашей системе, а также толщины эндометрия (слизистой оболочки матки).
Ваш врач может предложить тест на прогестерон, чтобы проверить, идет ли у вас овуляция, и чтобы убедиться, что ваше тело вырабатывает достаточно прогестерона.
ПОДРОБНЕЕ: 6 фактов о фертильности, которые нужно знать будущим папам
Почему это называется тестом на прогестерон на 21 день?
Это называется тестом на 21-й день, потому что обычно его проводят на 21-й день менструального цикла (первый день — это первый день кровотечения, не считая мажущих кровянистых выделений), если у вас средний цикл 28 дней.
Если у вас цикл длиннее или короче 28 дней, день тестирования будет соответствующим образом скорректирован, так как тест всегда следует проводить в середине вашей лютеиновой фазы (стадия между овуляцией и следующим разом, когда у вас должна начаться менструация). , который длится около двух недель.)
Какова цель теста на прогестерон на 21 день?
Тест на прогестерон на 21 день предназначен для проведения, когда ваш прогестерон должен быть на пике вашего цикла. Проверка нормального уровня прогестерона на этом этапе помогает показать, что у вас овуляция и что ваш уровень прогестерона находится на нормальном уровне.
Низкий уровень прогестерона на 21 день показывает, что у вас не было яйцеклеток (ановуляторная), а это значит, что вы не можете забеременеть в этом месяце.
ПОДРОБНЕЕ: Ваш калькулятор овуляции
Почему прогестерон важен?
Прогестерон — чрезвычайно важный гормон для поддержания беременности. Он должен поддерживать слизистую оболочку матки, чтобы ваша матка была благоприятной средой для имплантации эмбриона.
А также показывает, была у вас овуляция или нет; Если у вас недостаточно прогестерона, слизистая оболочка матки может начать отслаиваться еще до того, как произойдет имплантация, что затруднит вам беременность.
ПОДРОБНЕЕ: Как справиться с бесплодием
Каким должен быть мой уровень прогестерона?
Важно помнить, что каждая женщина индивидуальна. Поэтому уровни прогестерона являются только средними — они могут меняться в зависимости от многих факторов, таких как ваш возраст, ваш цикл, лаборатория, проверившая вашу кровь, ели ли вы перед тестом, и было ли это утром или днем.
Уровень прогестерона измеряется в нанограммах на децилитр (нг / дл).
Ниже приведены данные о том, каким должен быть ваш уровень прогестерона:
- Женщины в постменопаузе и женщины в начале менструального цикла: 1 нг / мл или менее
- Женщины в середине менструального цикла: от 5 до 20 нг / мл
- Беременные в первом триместре: от 11,2 до 90 нг / мл
- Беременные женщины во втором триместре: от 25,6 до 89,4 нг / мл
- Беременных в третьем триместре: 48.От 4 до 42,5 нг / мл
Точный тест на прогестерон в домашних условиях
Тест на овуляцию на прогестерон контролирует овуляцию на 21 день вашего цикла. Анализируя содержание прогестерона в крови, тест может определить, нормально ли у вас происходит овуляция. Получите точные результаты в течение недели с Let’sGetChecked — их высокоаккредитованные лабораторные тесты будут доставлены прямо к вам, с онлайн-результатами в течение 2-5 дней, а специальная команда медсестер доступна 24/7, которые будут звонить, чтобы объяснить ваши результаты и предоставьте необходимую информацию.Используйте код EVERYMUM20, чтобы получить скидку 20%.
Что делать, если мои результаты выходят за пределы нормального диапазона?
Ваши результаты считаются ненормальными, если они выходят за пределы нормального диапазона, однако помните, что каждая женщина индивидуальна. Может быть много разных причин, по которым ваш уровень колеблется.
Если у вас нет овуляции, ваш врач может прописать вам лекарство, которое поможет вам овулировать.
Если уровень прогестерона колеблется, лучше всего обсудить это с врачом, поскольку может быть другая основная проблема, которая вызывает повышение или понижение уровня прогестерона в организме.
Обратите внимание: Эта статья содержит партнерские ссылки. Если вы покупаете что-то по нашим ссылкам, мы можем получать партнерскую комиссию бесплатно для вас. Мы рекомендуем только те продукты, которые нам действительно нравятся и которым мы доверяем.
Поделитесь этой статьей, чтобы связаться с каждым на Facebook, Instagram, Twitter и Pinterest
Уровни прогестерона в сыворотке выше 20 нг / дл в день переноса эмбрионов связаны с более низким уровнем живорождений и более высокой частотой выкидышей.
J Assist Reprod Genet.2015 сен; 32 (9): 1395–1399.
, , , и
Джейсон Д. Кофинас
Центр репродуктивной медицины Нью-Йоркского университета, Медицинская школа Лангоне Нью-Йоркского университета, 660 Первая авеню, 5-й этаж, Нью-Йорк, Нью-Йорк 10016 США
Дженнифер Блейкмор
Центр фертильности Нью-Йоркского университета, Медицинская школа Лангоне Нью-Йоркского университета, 660 Первая авеню, 5-й этаж, Нью-Йорк, Нью-Йорк 10016 США
Дэвид Х. Маккалох
Центр фертильности Нью-Йоркского университета, Медицинская школа Лангоне Нью-Йоркского университета, 660 Первая авеню, 5-й этаж, Нью-Йорк York, NY 10016 USA
Jamie Grifo
NYU Fertility Center, NYU Langone School of Medicine, 660 First Avenue, 5th floor, New York, NY 10016 USA
NYU Fertility Center, NYU Langone School of Medicine, 660 First Avenue, 5-й этаж, Нью-Йорк, NY 10016 USA
Автор для переписки.
Поступило 7 апреля 2015 г .; Принято 20 июля 2015 г.
Авторские права © Springer Science + Business Media, Нью-Йорк, 2015 г. Эта статья цитируется в других статьях в PMC.
Abstract
Предпосылки
Прогестерон (P4) необходим для поддержки эндометрия и имплантации эмбриона в нормальный менструальный цикл. В запрограммированных циклах переноса замороженных эмбрионов использование экзогенного P4 необходимо, поскольку эндогенное производство P4 требует функционирующего желтого тела, которого нет в запрограммированных циклах.На сегодняшний день продолжаются дискуссии об идеальных значениях эстрадиола и P4 в сыворотке в циклах переноса замороженных эмбрионов.
Методы
Пациенты прошли циклы переноса замороженных одиночных эуплоидных эмбрионов с 2010 по 2013 год в одном крупном академическом центре. Пациенты, использующие донорские ооциты, и пациенты с изменениями дозы прогестерона во время рассматриваемых циклов были исключены. Все циклы были запрограммированы, и использовался исключительно внутримышечный P4. Были включены только пациенты, которым вводили одинаковую суточную дозу P4 на протяжении всего цикла ( N = 213 пациентов).Основными исходами были показатели продолжающейся беременности / живорождений (OPR / LBR), частота клинических беременностей (CPR) и самопроизвольные аборты / биохимические беременности. СЛР определяли по наличию мешка на УЗИ 1-го триместра. Невозможные аборты рассчитывались на беременность с мешком. Кривые характеристик оператора приемника (кривые ROC) и критерии хи-квадрат были выполнены для статистического анализа.
Результаты
Сравнивали две группы на основе уровней P4 на 19 день (группа A, P4 <20 нг / мл; группа B, P4> 20 нг / мл).OPR / LBR составляли 65 против 49%, группа A против B, p, значение = 0,02, RR = 1,33 (1,1–1,7). Показатели несостоявшейся беременности и биохимических показателей были выше в группе B по сравнению с группой A, 27% против 12%, p = 0,01, ОР = 0,45 (0,24–0,86). Когда P4 был разделен на пять групп на основе нанограмм на миллилитр прогестерона на 19-й день (10-15, 15-20, 20-30, 30-40 и> 40), наблюдалась тенденция к снижению OPR / LBR (70 , 62, 52, 50 и 33% соответственно). Также увеличилось количество замерших беременностей / биохимических показателей (7, 15, 27, 32 и 20% соответственно).Множественная логистическая регрессия показала увеличение OPR / LBR с учетом возраста, уровня ФСГ на 2-й день, веса, количества биопсированных эмбрионов и количества эуплоидных эмбрионов.
Заключение
Уровни P4> 20 нг / мл в день переноса (во время циклов переноса замороженных одиночных эуплоидных эмбрионов) были связаны со снижением OPR / LBR.
Ключевые слова: Лютеиновая поддержка, экстракорпоральное оплодотворение, прегестационный скрининг, прогестерон, перенос замороженных эмбрионов
Введение
Прогестерон (P4) необходим для успешной имплантации эмбриона в эндометрий и поддержания беременности в естественных циклах, в свежем виде. циклы экстракорпорального оплодотворения и циклы переноса замороженных эмбрионов (FET) [1].Женщины, проходящие циклы замороженного переноса, в частности, не могут обеспечить адекватный эндогенный P4 и нуждаются в добавках прогестерона для инициирования и поддержания секреторного эндометрия и беременности. Ранее было проведено исследование поддержки лютеиновой фазы в замороженных циклах, которое продемонстрировало, что добавление прогестерона действительно влияет на исход при FET [2]. Несколько исследований показали, что при использовании лютеиновой поддержки P4 наблюдается увеличение числа живорождений, но существуют неоднозначные данные о том, снижает ли поддержка P4 выкидыш или уровень биохимической беременности [3, 4].
Несмотря на это свидетельство роли P4, имеется на удивление мало данных об оптимальных значениях сывороточного P4 во время лютеиновой фазы и особенно в день переноса эмбриона в замороженных циклах. После многих лет распространенного убеждения, что более высокие значения P4 лучше [5], теперь кажется, что может существовать оптимальное окно для значений P4 во время лютеиновой фазы при ЭКО крупного рогатого скота [10]. Хотя уровни прогестерона в день переноса еще не были широко изучены на людях, определение времени переноса замороженного эмбриона на основе серийных значений P4, а не только номера дня цикла, приводит к более высокому уровню беременностей [11].
Это первое исследование, в котором специально изучается перенос аутологичных эуплоидных одиночных эмбрионов и связанные с ними уровни P4 во время FET. Целью этого исследования было определить, предсказывают ли уровни P4 в день переноса замороженных эмбрионов клинический результат.
Материалы и методы
Ретроспективный обзор переноса замороженных эмбрионов проводился в нашем Центре репродуктивной медицины с 2010 по 2013 год. Критериями включения были пациенты, перенесшие стимуляцию яичников и извлечение яйцеклеток с последующей биопсией бластоцисты трофэктодермы (TE) и криоконсервацией всех эмбрионов. .Были проанализированы только те полевые транзисторы с одним переносом эмбриона эуплоидного эмбриона. Всем пациентам был предложен преимплантационный генетический скрининг (ПГС). В частности, пациенты старше 40 лет и пациенты с повторным невынашиванием беременности и задокументированными цитогенными аномалиями продуктов зачатия были проинформированы о преимуществах прегестационного скрининга. Около ~ 50% пациенток, включенных в это исследование, были пациентками ЭКО впервые, и ~ 50% не смогли пройти ЭКО в других учреждениях и / или имели повторную потерю беременности.Большинство пациентов в нашем центре и в этом исследовании прошли стандартную технику осеменения в отличие от ИКСИ. Критерии исключения включали пациентов, использующих ооциты, полученные от доноров, а также эмбрионы, полученные в результате предыдущих циклов замораживания и оттаивания яиц. Пациенты также были исключены, если внутримышечная доза P4 была изменена по какой-либо причине во время их цикла переноса замороженных эмбрионов. Пациенты, получавшие лютеиновые методы поддержки, отличные от внутримышечных инъекций P4, также были исключены из анализа.Наконец, из анализа были исключены две внематочные беременности. Таким образом, в исследование было включено 213 пациентов.
Протоколы стимуляции были выбраны на основе характеристик пациенток и исходных лабораторных значений резерва яичников. Максимальный уровень ФСГ на 2-й день составлял 10,3 мМЕ / мл. Большинство циклов стимуляции яичников включали антагонисты гонадотропинов / гонадолиберина, за исключением 11 циклов, которые представляли собой микродозовые циклы лейпролида ацетата и 11 длинных протокольных циклов лепролида ацетата. В циклах антагонистов гонадотропина / ГнРГ, когда фолликул свинца достигал 13 мм или если эстрадиол> 1000 пг / мл, вводился антагонист ГнРГ.Когда по крайней мере два свинцовых фолликула достигли ≥17–18 мм, триггер овуляции вводился с использованием 10 000 МЕ ХГЧ или 40 единиц ацетата лейпролида или 40 единиц ацетата лейпролида и 1000 МЕ ХГЧ, в зависимости от уровня эстрогена на момент запуска и количество фолликулов на триггере. Приблизительно через 35 часов ооциты собирали с помощью трансвагинальной аспирации под контролем ультразвука.
Условия инкубатора были установлены при 37 ° C, 6% CO 2 , 5% O 2 и 89% N 2 .Ооциты помещали в капли по 25 мкл одноступенчатой среды (LifeGlobal), покрытые 1,2 мл минерального масла (LifeGlobal; Онтарио, Канада). Осеменение проводили во второй половине дня после извлечения ооцитов. Если сперма была серьезно повреждена, вместо стандартного оплодотворения выполняли ИКСИ. В 1-й день оплодотворение оценивали визуализацией двух ядер. Эмбрионы снова проверяли на прогресс на 3-й день культивирования. Эмбрионы удаляли из культуры на короткое время на 3-й день и делали отверстие в блестящей оболочке с помощью лазера Cronus (Research Instruments; Фалмут, Соединенное Королевство) перед возвращением в инкубатор.
Эмбрионы оценивали на 5/6 дни в соответствии со стандартными морфологическими критериями, как описано Gardner и Lane [12]. Когда эмбрионы достигли стадии расширяющейся бластоцисты, они подверглись биопсии ТЕ (5, 6 или 7 дни). Сразу после биопсии эмбрионы витрифицировали в криозамках (Biotech, Inc.) с использованием замораживающих растворов для витрификации для криопектантов эмбрионов (Irvine Scientific, Санта-Ана, Калифорния). Биопсийный материал анализировали с использованием aCGH согласно нашему стандартному протоколу [13, 14]. Наш протокол культивирования и замораживания был описан ранее [15].
Перенос одного эмбриона выполнялся в последующих циклах переноса замороженных эмбрионов в соответствии со стандартным протоколом нашего центра. Пациентам давали перорально эстрадиол поэтапно до максимальной дозы 6 мг к 14-му дню менструального цикла. На 14-й день проверяли уровни эстрадиола и прогестерона, чтобы гарантировать адекватный уровень эстрадиола и гарантировать отсутствие овуляции у пациентки. Толщину эндометрия также оценивали с помощью трансвагинальной сонографии на 14 день. Когда толщина эндометрия достигала 7 мм или больше и выглядела триламинарная, пациенты получали внутримышечный (IM) P4 в течение 6 дней с постоянной дозой 50 или 75 мг в день.P4 вводили в качестве добавки, потому что нормальная выработка стероидов яичниками и переход яичников от фолликулярного фолликула к лютеиновому подавлялись с помощью эстрадиола. Учитывая отсутствие овуляции, образования желтого тела и выработки эндогенного P4, введение экзогенного P4 продолжали до 9-недельной беременности. Значения P4 проверяли через 2 дня после начала, чтобы гарантировать адекватные уровни. В нашем центре пациенты рекомендуют вводить прогестерон вечером с 18 до 21 часа. и вернуться через два календарных дня между 7 и 9 часами утра.м. для обеспечения адекватной реакции на значения P4. Перенос эмбрионов произошел на 6-й день внутримышечного введения P4. На 19-й день проверяли значения эстрадиола и P4. В частности, кровь брали у каждого пациента от ~ 30 мин до 1 ч до переноса эмбриона. Важно отметить, что значение P4 еще не было известно до передачи и не влияло на решения о продолжении передачи. Имеется опубликованная литература, подтверждающая мнение о том, что устойчивое состояние P4 в тканях эндометрия достигается в течение 24–48 часов, а пиковое значение P4 достигает 7.Через 3 часа после P4 в масляных инъекциях. Эти данные о стационарном состоянии подтверждают мнение о том, что время закачки менее важно, если значения проанализированы> 48 ч после инициирования P4 в нефти [16].
Витрифицированные эуплоидные бластоцисты нагревали в день переноса эмбриона (определенный как День 19) с использованием среды для размораживания, уравновешивания и промывки и протокола из вкладыша в упаковке (Irvine Scientific, Санта-Ана, Калифорния). Нагретые бластоцисты поддерживали в культуральной среде в инкубаторе до момента переноса эмбриона (между 30 и 300 мин после нагревания).Одиночные эмбрионы загружали в катетер для переноса (Sureview, Wallace, Smith’s Medical, XXX UK) и переносили в матку пациента. Во время процедуры переноса катетер в матке был подтвержден ультразвуковым исследованием брюшной полости.
Пациенты были разделены на две группы (группа А, значения P4 на 19 день <20 нг / дл и группа B, значения P4 на 19 день ≥20 нг / дл). Двадцать нанограмм на децилитр было выбрано на основании опубликованной литературы и общепринятой практики.Тесты на беременность были завершены на 28 день менструального цикла. Первое УЗИ обычно проводилось на 40–42 день цикла. Если в матке не наблюдалось гестационного мешка, положительные тесты на беременность (уровень ХГЧ> 5,3 мМЕ / мл) считались биохимическими беременностями. Если в матке был замечен гестационный мешок и наблюдалась сердечная деятельность плода, беременность считалась клинической. Если в матке был замечен гестационный мешок, а сердечная деятельность плода никогда не наблюдалась или не продолжалась после наблюдения, беременность считалась самопроизвольным абортом.
Статистический анализ проводился с использованием бесплатного эпидемиологического онлайн-калькулятора (http://www.openepi.com/v37/Menu/OE_Menu.htm). T Тесты средних значений были завершены, если соответствовали исходным характеристикам пациента. При необходимости также были построены кривые характеристик оператора приемника (ROC). Для оценки исхода беременности между двумя группами, стратифицированными по уровню P4, использовались тесты хи-квадрат. Множественная регрессия использовалась для подтверждения результатов для OPR, LBR и замершей беременности / биохимических беременностей.
Результаты
Для каждого цикла FET собирали информацию из исходного цикла стимуляции гонадотропинами / извлечения яйцеклеток. Все перенесенные эмбрионы были эуплоидными. Характеристики цикла между группой A (P4 <20 нг / мл) и группой B (P4 ≥ 20 нг / мл) не оказались значимыми для возраста, значений эстрадиола и ФСГ на второй день, общего количества используемых гонадотропинов, эстрадиола на момент запуска, количества извлеченных яиц, количества оплодотворенных эмбрионов (2PN) и количества биопсированных эмбрионов (см. таблицу). Уровни прогестерона значительно различались между двумя группами.
Таблица 1
Характеристики исходного цикла
| P4 <20 нг / мл день 19 | P4> 20 нг / мл день 19 | p значение | |||
|---|---|---|---|---|---|
| Возраст | 37 ± 4,2 | 37 ± 4,3 | NS | ||
| Всего гонадотропинов (МЕ) | 3400 ± 1375 | 35242 | 5,99 ± 2.74 | 5,87 ± 2,94 | NS |
| День 2 Эстрадиол (пг / мл) | 38,3 ± 14,2 | 46,1 ± 34 | NS | ||
| Эстрадиол на триггере (пг / мл) 2904 ± 2 | 9024 1173 | 2656 ± 1131 | NS | ||
| # Яйца | 17,3 ± 8,1 | 16,2 ± 8,9 | NS | ||
| # 2PN эмбрионы | 10,9 ± 5,4 | 10,9 ± 5,4 | 10,9 ± 5,4 | ||
| # Биопсия эмбрионов | 5.9 ± 4,2 | 5,5 ± 4,6 | NS | ||
| P4 на 19 сутки (нг / мл) | 15,9 ± 2,5 | 30,5 ± 11 | <0,001 |
После переноса зародышей, эуплоидных OPR / LBR были 65 против 49%, группа A против B, p Значение = 0,02, RR = 1,33 (1,1–1,7). Частота самопроизвольных абортов и биохимических показателей была выше в группе B по сравнению с группой A, 27% против 12%, p = 0,01, ОР = 0,45 (0,24–0,86). Когда P4 был разделен на группы на основе нанограмм на миллилитр P4 на 19-й день (10-15, 15-20, 20-30, 30-40 и> 40), наблюдалась тенденция к снижению OPR / LBR (70, 62, 52, 50 и 33% соответственно).Также увеличилось количество самопроизвольных абортов / биохимических показателей (7, 15, 27, 32 и 20% соответственно) (рис.).
Частота самопроизвольных абортов / биохимических беременностей
Наблюдалось значительное снижение OPR / LBR, когда прогестерон пересекал отметку 40 нг / мл на 19-й день цикла (33% для этих циклов). Наибольшая частота самопроизвольных абортов / биохимических беременностей была обнаружена в диапазоне 30–40 нг / мл P4 и в среднем составила 32% (рис.).
Построены
кривых ROC, площадь под кривыми представлена в таблице.Площадь под кривой, исследующей уровень P4 на 19-й день как предиктор продолжающейся беременности или живорождения, оказалась равной 0,60. Затем соотношение E2 / P4 на 19-й день было оценено на предмет его способности прогнозировать текущую беременность или живорождение, и было обнаружено, что AUC составляет 0,53. Низкое значение AUC кривой ROC для отношения E2 / P4 на 19-й день указывает на то, что это соотношение не является хорошим предиктором продолжающейся беременности или живорождения, поэтому мы не проводили дальнейшего анализа этого отношения.
Таблица 2
Площадь под кривой для соотношения прогестерон и эстрадиол / прогестерон на 19-й день
| OPR / LBR | Клиническая беременность | Замкнутый аборт | |
|---|---|---|---|
| AUC 0,56 | AUC 0,60 | ||
| Соотношение E2 / P4 день 19 | AUC 0,53 | нет данных | нет данных |
Также была выполнена множественная логистическая регрессия. В анализе исследовали возраст пациентов, уровень ФСГ на 2-й день, вес, количество взятых на биопсию эмбрионов и количество эуплоидных эмбрионов. OPR / LBR был достоверно связан со значением P4 в день перевода и ни с одной из других переменных. Самопроизвольный аборт / биохимическая беременность не были связаны со значением P4 в день перевода, однако были связаны с возрастом.
Обсуждение
Число женщин, перенесших перенос замороженных эмбрионов, увеличилось по многим причинам, включая плановое и медицинское сохранение яйцеклеток и эмбрионов. В настоящее время существует три различных пути введения экзогенного P4; вагинально, внутримышечно и перорально [5, 6]. По сравнению с хорионическим гонадотропином человека (ХГЧ) использование лютеиновой поддержки P4 предпочтительнее, чем использование ХГЧ, потому что он лучше работает в циклах FET [7] и имеет меньшую вероятность синдрома гиперстимуляции яичников [5].Следовательно, важно понимать влияние поддержки P4 и оптимальных значений P4 во время FET.
Это исследование является первым, которое связывает значения P4 на 19-й день во время циклов переноса замороженных эмбрионов с результатами после переноса одного размороженного эуплоидного эмбриона (STEET). Уровень ошибок 1,9% в статусе плоидности эмбрионов установлен и принят в литературе [14]. Таким образом, мы полагаем, что перенесенные нами эмбрионы действительно были эуплоидными в 98,1% циклов переноса на основании ранее опубликованной литературы о частоте ошибок с использованием той же методики, которая использовалась в этом исследовании — сравнительной геномной гибридизации массива [14].Наше использование эуплоидных эмбрионов, в свою очередь, позволяет более прямо оценить роль уровней P4 при имплантации, не опасаясь, что генетически аномальные эмбрионы будут мешать общему анализу.
Несколько исследований показали, что значения P4 в узком диапазоне в день триггера ХГЧ коррелируют с более высокой частотой наступления беременности [8, 9]. Во многих исследованиях сообщается, что преждевременное повышение уровня прогестерона неблагоприятно для исхода живорождений [17–22] после переноса эмбрионов в новых циклах ЭКО.Этот феномен (преждевременная лютеинизация) уникален для свежих циклов, когда яичники управляются экзогенно введенными гонадотропинами. В нашем исследовании изучаются уровни P4 в циклах, контролируемых экзогенно, но с использованием только эстрогенов и прогестеронов без неконтролируемых реакций яичников, вызываемых экзогенными гонадотропинами.
Недавно было обнаружено, что значения P4 ниже 20 нг / мл в день переноса эмбриона связаны с более низкими показателями живорождений и клинических беременностей в циклах донор-реципиент [23].Их исследование заметно отличается, потому что эмбрионы не подвергались генетическому скринингу (хотя они были получены из донорских ооцитов, для которых мы ожидаем высокий уровень эуплоидии), и они не подвергались криоконсервации. Их вывод зависит от предположения, что у эмбрионов высокий уровень эуплоидии. Напротив, наша рукопись гарантирует исключение смешанных эффектов анеуплоидных эмбрионов, ограничивая используемые эмбрионы известными эуплоидными эмбрионами. Мы считаем, что использование только явно эуплоидных эмбрионов важно для устранения эффектов эмбриона при попытке определить влияние P4 на результаты.
Весьма вероятно, что повышенные значения P4 на 19-й день указывают на то, что более высокие значения P4 достигаются раньше, а также поддерживаются на более высоких уровнях. Это может привести к прямому воздействию на «окно имплантации», сдвинув его раньше во времени. Ускоренное развитие эндометрия может рассинхронизировать развитие матки и эмбриона. Когда матка становится восприимчивой к имплантации раньше, чем эмбрион достигает состояния, пригодного для имплантации, это может привести к снижению имплантации или имплантации «плохого качества».Представленные здесь данные подтверждают это мнение. Основываясь на этом представлении, наши данные показывают, что значения P4 должны поддерживаться между 10 и 20 нг / мл на 19-й день. Возможно, нам следует попытаться поддерживать уровни между 10 и 20 нг / мл в течение всего лютеинового периода до имплантации, при по крайней мере во время циклов переноса замороженных эмбрионов. Мы признаем, что OPR / LBR не претерпел радикальных изменений, если P4 находился между 20 и 30 нг / мл. С другой стороны, значения P4> 30 нг / мл явно отрицательно сказываются на результатах цикла, и их следует избегать.Не было зарегистрировано значений P4 ниже 10 нг / мл. Согласно нашему протоколу, уровень IM P4 в сыворотке крови составляет менее 10 нг / мл через 48 часов после первоначального введения. Поскольку этим пациентам с уровнями менее 10 нг / мл потребовалось повышение уровня прогестерона, они были исключены из этого анализа, и мы не знаем о влиянии более низких уровней P4.
В заключение, в литературе по-прежнему существуют разногласия относительно оптимальных значений P4, и это, вероятно, связано с различиями в характеристиках пациентов, включая динамику матки, абсорбцию прогестерона и утилизацию / метаболизм.Мы предполагаем, что поддержание уровней от 10 до 20 нг / мл до имплантации максимизирует частоту имплантации и продолжающихся беременностей для FET с использованием одиночных эуплоидных эмбрионов (ESTEET). Однако это небольшое исследование на одном предприятии. Потребуются дальнейшие исследования, чтобы изучить универсальность этого предложенного диапазона для оптимизации результатов после эуплоидного полевого транзистора.
Сноски
Capsule Наши результаты показывают, что чрезмерное количество прогестерона во время циклов FET может привести к худшим результатам, предположительно вторичным по отношению к диссинхронному эндометрию и стадии эмбрионального развития.
Список литературы
1. Дайя С. Лютеиновая поддержка: прогестагены для защиты от беременности. Maturitas. 2009; 65 (s1): S29–34. DOI: 10.1016 / j.maturitas.2009.09.012. [PubMed] [CrossRef] [Google Scholar] 2. Велева З., Орава М., Нуоджуа-Хуттунен С., Тапанайнен Дж. С., Мартикайнен Х. Факторы, влияющие на результат переноса замороженных-размороженных эмбрионов. Hum Reprod. 2013. 28 (9): 2425–31. DOI: 10,1093 / humrep / det251. [PubMed] [CrossRef] [Google Scholar] 3. Бьюрестен К., Ландгрен Б., Ховатта О., Ставреус-Эверс А. Прогестерон в лютеиновой фазе увеличивает частоту живорождений после переноса замороженных эмбрионов.Fertil Steril. 2011; 95 (2): 534–7. DOI: 10.1016 / j.fertnstert.2010.05.019. [PubMed] [CrossRef] [Google Scholar] 4. Ким С, Ли Й, Ли К., Квон С., Ким С., Ча Х и др. Влияние добавок прогестерона в лютеиновой фазе на естественные циклы переноса замороженных-размороженных эмбрионов. Obstet Gynecol Sci. 2014. 57 (4): 291–6. DOI: 10.5468 / ogs.2014.57.4.291. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 5. Penzias AS. Поддержка лютеиновой фазы. Fertil Steril. 2002. 77 (2): 318–23. DOI: 10.1016 / S0015-0282 (01) 02961-2. [PubMed] [CrossRef] [Google Scholar] 6.Шапиро Д.Б., Паппадакис Дж. А., Эллсуорт Н. М., Хайт Г. И., Надь З. П.. Замена прогестерона вагинальным гелем по сравнению с внутримышечной инъекцией: цикл и исходы беременности у пациенток ЭКО, получавших витрифицированные бластоцисты. Hum Reprod. 2014. 29 (8): 1706–11. DOI: 10,1093 / humrep / deu121. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 7. Ван дер Линден М., Бэкингем К., Фаркуар С., Кремер Дж. А., Метвалли М. Поддержка лютеиновой фазы для циклов вспомогательной репродукции. Кокрановская база данных Syst Rev 2011; (10): CD009154. DOI: 10.1002 / 14651858.CD009154.pub2. [PubMed] 8. Сильверберг К.М., Бернс В.Н., Олив Д.Л., Риль Р.М., Шенкен Р.С. Уровни прогестерона в сыворотке позволяют прогнозировать успех экстракорпорального оплодотворения / переноса эмбриона у пациентов, получавших стимуляцию лейпролида ацетатом и менопаузальными гонадотропинами человека. J Clin Endocrinol Metabol. 1991. 73 (4): 797–803. DOI: 10.1210 / jcem-73-4-797. [PubMed] [CrossRef] [Google Scholar] 9. Сюй Б, Ли З, Чжан Х, Цзинь Л, Ли И, Ай Дж и др. Влияние уровня прогестерона в сыворотке на исход экстракорпорального оплодотворения у пациентов с различным ответом яичников: анализ более 10 000 циклов.Fertil Steril. 2012. 97 (6): 1321–7. DOI: 10.1016 / j.fertnstert.2012.03.014. [PubMed] [CrossRef] [Google Scholar] 10. Ниманн Х., Захер Б., Эльзэссер Ф. Частота наступления беременности относительно уровней прогестерона в плазме реципиента в день нехирургического переноса замороженных / размороженных эмбрионов крупного рогатого скота. Териогнология. 1985. 23 (4): 631–9. DOI: 10.1016 / 0093-691X (85) -9. [PubMed] [CrossRef] [Google Scholar] 11. Zhe D, Sun L, Zhang H, Chen Z, Jian Y. Время переноса замороженных-размороженных эмбрионов определяется уровнем прогестерона в сыворотке: последующее ретроспективное исследование.Eur J Obstet Gynecol Reprod Biol. 2014; 181: 210–3. DOI: 10.1016 / j.ejogrb.2014.07.012. [PubMed] [CrossRef] [Google Scholar] 12. Гарднер Д.К., Лейн М. Культура и отбор жизнеспособных бластоцист: выполнимое предложение для ЭКО человека? Обновление Hum Reprod. 1997; 3: 367–82. DOI: 10.1093 / humupd / 3.4.367. [PubMed] [CrossRef] [Google Scholar] 13. Гутьеррес-Матео С., Коллс П., Санчес-Гарсия Дж., Эскудеро Т., Пратес Р., Кеттерсон К. и др. Валидация сравнительной геномной гибридизации микрочипов для комплексного хромосомного анализа эмбрионов.Fertil Steril. 2011; 95: 953–8. DOI: 10.1016 / j.fertnstert.2010.09.010. [PubMed] [CrossRef] [Google Scholar] 14. Коллс П., Эскудеро Т., Фишер Дж., Чекленяк Н.А., Бен-Озер С., Мейер Б. и др. Валидация сравнительной гибридизации массивов геномов для диагностики транслокаций в доимплантационных эмбрионах человека. Воспроизвести BioMed Online. 2012; 24 (6): 621–9. DOI: 10.1016 / j.rbmo.2012.02.006. [PubMed] [CrossRef] [Google Scholar] 15. Крамер Ю.Г., Кофинас Д.Д., Мельцер К., Нойес Н., Маккаффри С., Бульдо-Личкарди Дж. И др. Оценка морфокинетических параметров с помощью интервальной микроскопии (TLM) для прогнозирования эуплоидии: универсальны ли модели классификации риска анеуплоидии? J Assist Reprod Genet.2014; 31 (9): 1231–42. DOI: 10.1007 / s10815-014-0285-1. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 16. Полсон Р.Дж., Коллинз М.Г., Янков В.И. Фармакокинетика и фармакодинамика прогестерона с 3 дозами и 2 схемами шипучей микронизированной вагинальной вставки с прогестероном. J Clin Endocrinol Metab. 2014; 99 (11): 4241–9. DOI: 10.1210 / jc.2013-3937. [PubMed] [CrossRef] [Google Scholar] 17. Сантос-Рибейро С., Полизос Н.П., Хентдженс П., Смитц Дж., Камю М., Турне Н. и др. Уровень живорождения после ЭКО снижается как из-за низкого, так и из-за высокого уровня прогестерона в день введения хорионического гонадотропина человека.Hum Reprod. 2014. 29 (8): 1698–705. DOI: 10,1093 / humrep / deu151. [PubMed] [CrossRef] [Google Scholar] 18. Venetis CA, Kolibianakis EM, Bosdou JK, Tarlatzis BC. Повышение уровня прогестерона и вероятность беременности после ЭКО: систематический обзор и метаанализ более 60 000 циклов. Репродукция Биомед онлайн. 2012; 97: 1321–7. [PubMed] [Google Scholar] 19. Huang R, Fang C, Xu S, Yi Y, Liang X. Преждевременное повышение прогестерона отрицательно коррелировало с частотой живорождений в циклах ЭКО с агонистом GnRH: анализ 2566 циклов.Fertil Steril. 2012; 98: 644–70. DOI: 10.1016 / j.fertnstert.2012.05.024. [PubMed] [CrossRef] [Google Scholar] 20. Burns WN, Witz CA, Klein NA, Silverberg KM, Schenken RS. Концентрация прогестерона в сыворотке крови на следующий день после введения хорионического гонадотропина человека и соотношение прогестерон / ооцит позволяют прогнозировать исход оплодотворения / переноса эмбриона in vitro. J Assist Reprod Genet. 1994; 11: 17–23. DOI: 10.1007 / BF02213692. [PubMed] [CrossRef] [Google Scholar] 21. Хуанг С.К., Лиен Ю.Р., Чен Х.Ф., Чен М.Дж., Шие С.Дж. и др.Продолжительность преовуляторного повышения уровня прогестерона в сыворотке до введения ХГЧ влияет на исход циклов ЭКО / ИКСИ. Hum Reprod. 2012; 27: 2036–45. DOI: 10,1093 / humrep / des141. [PubMed] [CrossRef] [Google Scholar] 22. Проверьте JH, AMui J, Choe JK, Brasile D. Взаимосвязь уровня прогестерона в сыворотке на следующий день после инъекции хорионического гонадотропина человека с исходом после переноса эмбриона с оплодотворением in vitro. Clin Exp Obstet Gynecol. 2009; 36: 214–5. [PubMed] [Google Scholar] 23. Brady PC, Kaser DJ, Ginsburg ES, Ashby RK, Missmer SA, Correia KF.Раковский. Концентрация прогестерона в сыворотке крови в день переноса эмбриона в циклах донорских ооцитов. J Assist Reprod Genet. 2014; 31 (5): 569–75. DOI: 10.1007 / s10815-014-0199-у. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] Тест на прогестерон сыворотки
: цель, процедура, результаты
Что такое тест на прогестерон?
Тест на прогестерон — это анализ крови, который определяет уровень гормона прогестерона.
Прогестерон важен при беременности. Он подготавливает ваше тело к оплодотворению яйцеклетки.Если вы беременны, прогестерон также заставляет грудь вырабатывать молоко.
Прогестерон также помогает контролировать менструальный цикл. Как правило, уровень прогестерона повышается каждый месяц, когда у вас овуляция и ваше тело готово к беременности. Если вы не забеременеете, прогестерон снова снизится, и у вас начнется менструальный цикл. Если вы забеременеете, уровень прогестерона будет расти. Во время беременности прогестерон примерно в 10 раз превышает его нормальный уровень.
Самого по себе теста на прогестерон недостаточно для диагностики какой-либо конкретной проблемы.Но это могло помочь вместе с другими тестами. Вы также можете использовать домашний анализ мочи на прогестерон, чтобы узнать, когда вы овулируете и, скорее всего, забеременеете.
Тест на прогестерон использует
Ваш врач может использовать тест на прогестерон, чтобы:
- Выяснить, почему вы не забеременеть, когда пытаетесь
- Проверить, если и когда у вас овуляция
- Проверьте, в высокий риск выкидыша во время беременности
- Наблюдать за беременностью высокого риска
- Диагностировать внематочную беременность, когда оплодотворенная яйцеклетка имплантируется вне вашей матки
Процедура теста на прогестерон
Тест показывает, какой у вас уровень прогестерона в это время .Для подготовки не нужно ничего делать. Но это поможет, если вы заметите, когда началась ваша последняя менструация.
Сам тест простой. Ваш врач, фельдшер или другой медицинский работник вставит иглу в вену на одной из ваших рук и возьмет немного крови для анализа в лаборатории.
Результаты теста на прогестерон
Ваши результаты могут быть одним из следующих:
Уровень прогестерона не колеблется регулярно. Это будет определено с помощью нескольких тестов.Если тесты показывают, что ваш уровень прогестерона не повышается и не падает ежемесячно, как должен, возможно, у вас не происходит овуляция или регулярные периоды. Это может затруднить беременность.
Низкий уровень прогестерона. Это может зависеть от того, когда в какой момент вашего цикла был проведен тест. Если тест показывает уровень прогестерона ниже нормы, это может быть потому, что:
- Ваши яичники не работают должным образом или у вас не происходит овуляция
- Возможная необычная беременность
Продолжение
Высокий уровни прогестерона. Если ваш тест показывает уровень прогестерона выше нормы, это может быть связано с:
Прогестерон в пределах нормы. Уровень прогестерона в определенном диапазоне может сигнализировать об овуляции. Тест следует проводить либо через 18–24 дня после первого дня менструации, либо за 7 дней до следующей ожидаемой менструации.
Тесты на прогестерон
Если ваш врач назначит тест на прогестерон, вы также можете получить:
- Другие анализы крови, чтобы проверить вашу способность забеременеть
- Домашние анализы мочи, которые рассматривают побочные продукты прогестерона как индикатор овуляции
- Ультразвук для измерения толщины слизистой оболочки матки
- Специальный анализ крови, если вы беременны, чтобы выяснить, есть ли проблемы с беременностью
Frontiers | Роль ХГЧ, запускающего уровни прогестерона: реальное ретроспективное когортное исследование, включающее более 8000 циклов ЭКО / ИКСИ
Введение
Связь между уровнями прогестерона (Р) в сыворотке, измеренными в день триггера овуляции, и результатом циклов оплодотворения in vitro, циклов оплодотворения (ЭКО), была одним из основных противоречий в области эндокринологии стимуляции яичников (1, 2).С 1991 г. во многих исследованиях подчеркивалось, что преждевременное и чрезмерное повышение P непосредственно перед индукцией овуляции может негативно повлиять на исход цикла ЭКО (3–6). Однако в большом количестве публикаций также приводятся противоположные выводы (7–10). До сих пор причина увеличения P точно не известна. Высокие дозы экзогенного фолликулярного стимулирующего гормона (ФСГ), используемые в циклах стимуляции яичников, могут вызвать повышение уровня фосфора к концу фолликулярной фазы.ФСГ напрямую индуцирует ферментативную активность 3-бета-гидроксистероиддегидрогеназы и, таким образом, увеличивает превращение прегненолона в Р. Более того, низкие уровни лютеинизирующего гормона (ЛГ) могут снижать превращение прегненолона и фосфора в андрогены тека-клетками (11). Некоторые авторы сообщают, что преждевременное повышение P во время стимуляции яичников может быть вызвано потерей активности ЛГ и хорионических гонадотропинов человека (ХГЧ) (12, 13).
Связь между чрезмерным повышением P и отрицательным исходом цикла ЭКО была предметом все еще продолжающихся дебатов.Большой метаанализ, насчитывающий более 55000 циклов, предоставил убедительные данные, подтверждающие гипотезу о том, что повышение уровня P в сыворотке крови связано с более низкой частотой наступления беременности (14). Однако обширный обзор литературы вместо того, чтобы дать окончательный ответ о роли P в вероятности беременности, породил новые важные клинические вопросы. Существует ли порог P, который может предсказать исход цикла ЭКО? Может ли перенос эмбрионов на стадии бластоцисты обратить вспять негативное влияние, которое может иметь высокий уровень фосфора? Может ли протокол агонистов или антагонистов гонадотропин-рилизинг-гормона (ГнРГ) изменить уровни прогестерона? Одинаковы ли эффекты высоких уровней фосфора для всех пациентов, независимо от их характеристик и реакции на стимуляцию яичников?
Целью данного исследования является обзор набора данных единого университетского центра для оценки влияния преждевременных высоких уровней P в сыворотке на исход циклов переноса свежих эмбрионов с точки зрения частоты клинических беременностей (CPR) и частоты живорождений ( LBR).На протяжении многих лет в литературе рассматривались разные пороговые уровни прогестерона, которые были проанализированы в настоящих реальных данных (15), чтобы оценить их применимость и осуществимость в нашей популяции для выявления их возможного различного воздействия на разные категории пациентов или на разные категории пациентов. стадии созревания эмбриона. Фактически, кроме того, настоящее исследование ретроспективно исследует, может ли перенос бластоцист на 5-й день после оплодотворения (D5-ET) улучшить СЛР и LBR у пациентов с повышением P.
Материалы и методы
Одноцентровое ретроспективное когортное исследование было проведено в академическом центре репродуктивной медицины третичного уровня (Центр репродуктивной медицины Humanitas, Роццано, Милан, Италия).
Были включены все переносы свежих эмбрионов как на стадии дробления (день 2 и день 3), так и на стадии бластоцисты (день 5), выполненные с января 2012 года по декабрь 2016 года.
Были проанализированы следующие клинические переменные: возраст, привычка к курению, индекс массы тела (ИМТ), причины бесплодия, время, в течение которого они пытались зачать ребенка, и протоколы стимуляции яичников.Другие измеренные параметры включали базальные уровни ФСГ и антимюллерова гормона (АМГ), уровни эстрадиола (E2) и P в день индукции овуляции, количество извлеченных ооцитов, стадию эмбриона в день переноса и количество перенесенных эмбрионов.
Протокол контролируемой стимуляции яичников (COS) предусматривал использование рекомбинантного ФСГ (рФСГ), чМГ или рФСГ + рекомбинантный ЛГ (рФСГ + рЛГ). Начальную дозу гонадотропина определяли в соответствии с параметрами резерва яичников, такими как АМГ, количество антральных фолликулов (AFC) и ИМТ.COS выполняли с использованием четырех различных протоколов: длинный протокол агонистов GnRH; Короткий протокол агонистов ГнРГ; Протокол антагонистов ГнРГ; протокол обострения агонистов ГнРГ. Большая часть антагонистов COS началась с использования предварительной обработки комбинированными оральными контрацептивами.
Протокол COS был выбран на основании характеристик пациентов и заключения гинекологов, в основном в соответствии с критериями Посейдона (16–18).
Протокол длинных агонистов ГнРГ был основан на ежедневном введении лейпрорелина (Enantone die; Takeda, Италия) или лейпролина ацетата 0.1 мг / день (Фертипептил; Abbott Pharmaceutical Products, США) на 21 день предыдущей лютеиновой фазы цикла стимуляции. Когда была достигнута десенсибилизация гипофиза (14 дней после начала приема агониста ГнРГ), о чем свидетельствует отсутствие фолликулов яичников> 5 мм и толщина эндометрия <5,4 мм при трансвагинальном ультразвуковом исследовании, была начата стимуляция гонадотропинами. В кратком протоколе агонистов ГнРГ агонист (лейпролин 0,1 мг / день) вводился с 21 дня предыдущего цикла и индукция с 1 или 2 дня цикла (день 1 является началом менструального кровотечения), снижая дозу агониста до 0.05 мг / день и продолжая стимуляцию до дня введения ХГЧ. В протоколе антагонистов ГнРГ в первый день спонтанного менструального цикла у женщин или кровотечения отмены после приема низких доз оральных контрацептивов начиналась стимуляция гонадотропинами и когда ведущий фолликул достигал 13–14 мм в среднем диаметре и / или в плазме. E2 превышал 400 пг / мл, инъекция 0,25 мг антагониста GnRH (Cetrotide, Merck Serono SpA, Рим, Италия; Оргалутран, Органон, MSD-Италия) вводилась подкожно (п / к) ежедневно до дня триггера овуляции. .
Наконец, в протоколе обострения ГнРГ, ежедневный агонист вводился в 1-й день цикла с трипторелином (0,1 мг / день), а затем гонадотропины были начаты в соответствии с параметром резерва яичников на 2-й день цикла. Начальная переменная доза гонадотропина [чМГ (Meropur; Ferring, Милан, Италия) или rFSH (Puregon, MSD-Италия; Gonal-F, Merck Serono SpA, Рим, Италия)] с добавлением или без добавления r-LH для первые 4 дня, а затем вводили индивидуальную дозу в соответствии с параметрами, полученными на основании трансвагинального ультразвукового исследования и уровней эстрадиола и прогестерона, до дня триггера овуляции.Протокол индукции и доза вводимых гонадотропинов подбирались индивидуально в зависимости от возраста пациента, гормонального фона в сыворотке и AFC. Трансвагинальное ультразвуковое исследование, определение эстрадиола и прогестерона выполняли во время COS. Когда наблюдались не менее трех фолликулов со средним диаметром> 17 мм, подкожно вводили 250 мкг рекомбинантного ХГЧ (Ovitrelle; Merck Serono S.p.A.). Забор ооцитов проводили трансвагинально через 36 ч после инъекции ХГЧ.Перенос эмбрионов проводили с 3-го по 5-й день после сбора ооцитов. Лютеиновая фаза поддерживалась у всех пациенток с вагинальным прогестероном (Crinone 8% дважды в день, Merck Serono S.p.A .; или Prometrium, Rottapharm 600 мг в день), начиная с вечернего забора ооцитов и продолжалась у беременных до девятой недели гестации.
У пациентов с высоким ответом (HR) (более 18 фолликулов диаметром ≥12 мм на момент индукции овуляции) триггер был получен с помощью трипторелина 0,2 мг подкожно.В этой когорте, если было извлечено <18 ооцитов, пациенты считались подверженными промежуточному риску синдрома гиперстимуляции яичников (СГЯ), и выполнялся свежий перенос. Была начата адекватная поддержка лютеиновой фазы: ХГЧ 1500 МЕ / пк в день извлечения + эстрадиол 4 мг + вагинальный прогестерон 400 мг в день (протокол спасения).
Уровень ХГЧ в сыворотке оценивался через 2 недели после переноса эмбриона, а затем каждые 48 часов до тех пор, пока не было обнаружено значение более 1000 мМЕ, и через 4 недели после переноса эмбриона было назначено вагинальное УЗИ.
Анализ эстрадиола ARCHITECT (Abbott, Ирландия, отдел диагностики, Лонгфорд, Ирландия) — это иммуноферментный анализ хемилюминесцентных микрочастиц (CMIA) для количественного определения эстрадиола в сыворотке и плазме человека. Аналитическая чувствительность теста ARCHITECT Estradiol составляет ≤ 10 пг / мл. Функциональная чувствительность теста ARCHITECT Estradiol ≤ 25 пг / мл. Тест ARCHITECT на прогестерон (Abbott, Ирландия, отдел диагностики, Лонгфорд, Ирландия) — это CMIA для количественного определения прогестерона в сыворотке и плазме человека.Анализатор прогестерона ARCHITECT имеет аналитическую чувствительность ≤ 0,1 нг / мл. Этот анализ разработан для обеспечения точности ≤ 10% общего межисследовательского и внутрианалитического CV (коэффициента вариации) для концентраций в диапазоне ARCHITECT Progesterone Low Control.
На 3-й день после оплодотворения количество перенесенных эмбрионов варьировалось в зависимости от возраста, прогноза, результатов предыдущих циклов ЭКО, гинекологического и акушерского анамнеза.
У пациентов с хорошими прогностическими характеристиками (т.е., возраст <39 лет, более 4 зигот на 1-й день после оплодотворения, образец эякулированной спермы хорошего качества), был проведен перенос одного эмбриона на стадии бластоцисты. У пациентов с P > 3 нг / мл была выбрана стратегия замораживания всего (19).
Результаты по прогестерону были разделены на четыре группы: <1, 1–1,5, 1,5–1,75 и ≥1,75.
В отношении повышения P более 1,5 нг / мл была принята общая политика замораживания, даже если предел отсечения был должным образом введен в наши протоколы только с января 2018 года, когда наши предварительные данные показали явную тенденцию к снижению частоты беременностей, даже если сокращение уже присутствовало на 1.0 нг / мл.
Мы также сравнили CPR и LBR с циклами размораживания того же периода, за исключением циклов, происходящих от PGTA (20).
Для целей данного исследования наша популяция была далее разделена на четыре группы в зависимости от возраста и количества извлеченных ооцитов:
Возраст ≤ 38, ооцит ≥8.
Возраст ≤ 38, яйцеклетка <8.
Возраст> 38, яйцеклетка ≥8.
Возраст> 38, яйцеклетка <8.
Протокол цикла замороженных эмбрионов (FET): в естественных циклах пациенты проходили серийный трансвагинальный ультразвуковой мониторинг (TU), начиная с 8-го и 12-го дня цикла, для выявления доминантного фолликула и оценки развития эндометрия.Пациентам было рекомендовано начать мониторинг уровня ЛГ в моче при выявлении фолликула со средним диаметром> 11 мм. Тестирование ЛГ проводилось рано утром перед ТЕ. Когда толщина эндометрия достигала 7 мм, а диаметр доминантного фолликула — 16–20 мм, пациенты считались готовыми к планированию переноса эмбриона. Пациентам с отсутствием положительного результата теста на ЛГ в моче, несмотря на наличие фолликула размером 16–20 мм и полоски эндометрия 7 мм и более, вводили 5000 ЕД ХГЧ в моче (Gonasi HP, Ibsa, Италия).Повторное нагревание и перенос эмбрионов планировалось через 7 дней после спонтанного пика ЛГ или введения ХГЧ.
Гормональные заместительные циклы (AR-FET) состояли из перорального эстрадиола валерата (E2V, 6 мг) (Progynova; Bayer, Schweiz, AG, 2 мг) со второго дня менструального цикла до тех пор, пока толщина эндометрия не достигнет минимум 7 мм. Перенос эмбриона был запланирован через 3-5 дней после начала приема прогестерона при той же дозе эстрадиола. Если через 12 дней E2V толщина эндометрия была менее 7 мм, дозу увеличивали до 8 мг / день.Подготовка эндометрия к переносу состояла из продолжающегося приема эстрадиола (6-8 мг E2V в день) в сочетании с 600 мг вагинальных микронизированных таблеток прогестерона (Prometrium, Rottapharm SpA или Progeffik, Effik Italia SpA, 200 мг каждые 8 часов) или 180 мг микронизированных таблеток вагинальный гель с прогестероном (Crinone 8%, Merck, Serono, 90 мг два раза в день). Добавки экзогенного прогестерона также начали в день переноса эмбриона в группе NC-FET и через 2 дня после введения ХГЧ в группе mNC-FET с использованием вагинальных микронизированных таблеток прогестерона 200 мг (Prometrium, Rottapharm S.p.a., или Progeffik, Effik Italia S.p.a., 200 мг каждый день) или 90 мг микронизированного вагинального геля прогестерона (Crinone 8%, Merck, Serono, 90 мг один раз в день).
Тесты на беременность (сывороточный бета-ХГЧ) были получены через 12 после ЭТ, и в случае положительного результата уровни бета-ХГЧ контролировались каждые 48 часов, пока они не достигли уровня не менее 1000 МЕ / мл. Через 2 недели было проведено трансвагинальное УЗИ для определения количества гестационных мешков и жизнеспособности плода.
Пациенты продолжали прием прогестерона и эстрадиола в AR-FET до 12 недели гестации.
Статистический анализ и описание переменных
Клиническая беременность была определена в соответствии с консенсусом ВОЗ-ICMART и регистром ESHRE: беременность, диагностированная с помощью ультразвуковой визуализации одного или нескольких гестационных мешков или окончательных клинических признаков беременности (21).
Статистический анализ и соображения относительно хранения данных
Все данные были сначала записаны в оцифрованные медицинские карты, которые обычно используются в Центре фертильности Humanitas; все базы данных защищены паролем.После этого данные, представляющие наибольший интерес, были перемещены в другую базу данных для лучшего управления и упрощения обработки.
Исследователи гарантируют, что это исследование соответствовало Хельсинкской декларации (22) и национальному законодательству Италии в отношении защиты данных пациентов (23). Все пациенты подписали форму информированного согласия перед тем, как получить доступ к программе вспомогательной репродуктивной технологии (ВРТ) нашего центра; этот документ специально разрешает обработку персональных данных для ретроспективных исследований.
Настоящее исследование получило окончательное одобрение Институционального наблюдательного совета Humanitas (IRB) в январе 2020 года и было зарегистрировано в соответствии с Международным комитетом редакторов медицинских журналов в регистре ClinicalTrials.gov (ID NCT04253470).
Беременности определены согласно международному глоссарию (21) и более подробно в нашем центре; клиническая беременность была определена как положительный результат теста на бета-ХГЧ ≥1000 мМЕ / мл, в то время как живорождения включали все роды живого плода, произошедшие после 24-й недели беременности.
Все данные были выражены в виде числа и процента или как среднее значение и стандартное отклонение. Влияние уровня P на CPR и LBR было исследовано с использованием многомерной логистической регрессии. Возможные смешивающие переменные были выбраны на основе повседневной клинической практики и литературы, а не на основе ранее проведенного одномерного анализа и значений p . Значение p ниже 0,05 считалось значимым. Все анализы проводились с использованием Stata 15.0 (StataCorp. 2017. Статистическое программное обеспечение Stata: выпуск 15.Колледж-Стейшн, Техас: StataCorp LP).
Результаты
В течение периода исследования было выполнено 8 034 переноса эмбрионов: 7 597 переносов на стадии дробления (D3) и 437 переносов бластоцист (D5). Мы также включили 3112 циклов оттаивания, из которых 2003 (64,36%) были вызваны избыточными циклами эмбрионов, 107 (3,44%) — увеличением P, 796 (25,58%) — OHSS и 206 (6,62%) другими причинами (т. Е. Неадекватными). эндометрий, медицинские осложнения и т. д.).
Исходные характеристики и сравнение популяций на стадии дробления и бластоцисты показали статистически значимые различия в возрасте женщин (37.1 ± 4,0 против 35,7 ± 4,0, p <0,001), ИМТ (22,25 ± 3,30 против 21,61 ± 2,95, p <0,001), ФСГ (7,66 ± 3,03 против 6,76 ± 2,03, p <0,001 ), АМГ (2,18 ± 3,60 против 3,07 ± 2,70, p <0,001), диагноз снижения резерва яичников [1417 (18,65%) против 20 (4,58%), p <0,001], прогестерон в триггерный день ( 0,88 ± 0,45 против 1,09 ± 0,54, p <0,001), количество извлеченных ооцитов (8,31 ± 4,48 против 12,91 ± 4,38, p <0.001), зрелые ооциты (7,33 ± 4,21 против 11,54 ± 4,15, p <0,001), оплодотворенные ооциты (4,03 ± 2,22 против 6,68 ± 1,79, p <0,001) как по количеству перенесенных эмбрионов, замороженные эмбрионы , и замороженные ооциты (таблица 1).
Таблица 1 . Исходные характеристики.
Использование рекомбинантного ЛГ или ФСГ, ГМГ, тип протокола (агонист против антагониста), выбор циклов спасения с запуском агониста или прием пероральных противозачаточных таблеток перед лечением в качестве других переменных были рассмотрены в предварительном одномерном анализе. анализа, но результаты не были подтверждены в последующем многомерном анализе, в котором не было обнаружено различий между различными группами.
Анализ повышения прогестерона по сравнению с различными протоколами индукции не входил в число основных и вторичных результатов в первоначально утвержденном и представленном протоколе, и размер выборки не учитывался для этих переменных [Мол, Босуйт, Сункара, Гарсия Веласко, Венетис, Саккас, Лундин , Simón, Taylor, Wan, Longobardi, (24, 25)], и по этим причинам дальнейший анализ не проводился.
После поправки на возраст матери и количество извлеченных ооцитов и перенесенных эмбрионов, уровни P в сыворотке были обратно пропорциональны CPR и LBR, которые уменьшались, когда уровни P в сыворотке были> 1 нг / мл [0.72 (0,63–0,81), p <0,001 и 0,73 (0,64–0,84), p <0,001]. Для уровня прогестерона от 1 до 1,5 нг / мл OR для CPR составил 0,85 (0,76–0,96), p = 0,008 и для LBR было 0,85 (0,75–0,97), p = 0,016. Дальнейшее снижение наблюдалось при уровнях P> 1,75 нг / мл, что приводило к CPO OR 0,55 (0,43–0,71), p <0,001 и LBR OR 0,55 (0,42–0,73), p <0,001 (Таблица 2 ).
Таблица 2 .Влияние уровня прогестерона на частоту клинической беременности (CPR) и частоту живорождений (LBR).
Коэффициенты были проанализированы также с учетом дня переноса эмбрионов. В группе D3 уровень P в сыворотке ≥1 нг / мл значительно снизил CPR и LBR, что привело к OR 0,71 (0,62–0,80), p <0,001 и 0,73 (0,63–0,84), p <0,001, соответственно. Для уровней прогестерона от 1 до 1,5 нг / мл OR составил 0,87 (0,77–0,99), p = 0,030 для СЛР и 0.87 (0,76–1,00), p = 0,048 для LBR. При уровне P ≥ 1,75 нг / мл, CPR и LBR снизились еще больше, почти до половины своего значения с OR 0,53 (0,41–0,70), p ≤ 0,001 и 0,55 (0,40–0,74), p <0,001 .
Соотношение между уровнем P в сыворотке крови и CPR и LBR в группе D5, напротив, существенно не различается [OR 0,37 (0,49–1,09), p = 0,123 и 0,71 (0,46–1,10), p = 0,126]. Для значений прогестерона от 1 до 1.5 нг / мл, OR составил 0,60 (0,37–0,96), p = 0,034 для СЛР и 0,61 (0,36–1,02), p = 0,061 для LBR. В группе значений прогестерона от 1,5 до 1,75 нг / мл OR составил 0,95 (0,49–1,85), p = 0,877 для СЛР и 1,24 (0,63–2,47), p = 0,533 для LBR. Когда значения были ≥1,75 нг / мл, OR составлял 0,52 (0,26–1,03), p = 0,062 для СЛР и 0,45 (0,21–0,99), p = 0,047 для LBR. Эти результаты также представлены в таблице 2.
Для оценки возможных различий в СЛР в зависимости от различных пороговых значений P анализ впоследствии был проведен отдельно в разных подгруппах.
В подгруппе 2,555 переноса эмбрионов D3 с хорошим прогнозом (т.е. женщины в возрасте ≤ 38 лет и количество извлеченных ооцитов ≥8) СЛР составила 38,6%, а LBR — 32,2% для P <1 нг / мл. Эффект увеличения P до значений от 1 до 1,5 нг / мл привел к 34,7% СЛР [OR 0,84 (0,70–1,01), p = 0,061] и 28,4% LBR [OR 0,83 (0,69–1,00), p = 0,055]. Для P > 1,5 нг / мл СЛР составила 28,5% [OR 0,63 (0,47–0,85), p = 0.003] и 25,2% [OR 0,71 (0,52–0,97), p = 0,031] для LBR. В группе ≥1,75 P СЛР составляла 29,4% [OR 0,66 (0,47–0,92), p = 0,015], а LBR составляла 25,0% [OR 0,69 (0,49–0,99), p = 0,046] (Таблица 3).
Таблица 3 . Подгруппа переноса эмбрионов D3: влияние уровней P на частоту клинической беременности (CPR) и частоту живорождений (LBR), стратифицированное по возрасту женщины и количеству извлеченных ооцитов и скорректированное на количество перенесенных эмбрионов.
В 1964 году возраст ≤ 38, группа ооцитов <8 пациентов, общее СЛР составило 26.6%, а LBR составлял 22,1% для P <1 нг / мл, а если P составлял от 1 до 1,5 нг / мл, CPR составлял 25,5% ( p = 0,541), а LBR составлял 20,3% ( p = 0,374). В группе 1,5–1,75 P СЛР составляла 24,1% ( p = 0,85), LBR составляла 19,0% ( p = 0,469), а в группе ≥1,75 — 19,6% ( p = 0,63) и 10,9%. ( p = 0,058) соответственно.
В 1266 возрасте> 38, группе ооцитов ≥8, СЛР составляла 29,9%, а LBR составляла 18,2% для P <1 нг / мл, и если P было между 1 и 1.5 нг / мл, CPR составляла 26,1% ( p = 0,147), а LBR составляла 14,9% ( p = 0,125). В группе 1,5–1,75 P СЛР составляла 20,6% ( p = 0,030), а LBR составляла 11,1% ( p = 0,054), а в группе ≥1,75 — 9,1% ( p ≤ 0,001) и 4,6%. ( p = 0,003) соответственно.
В 1812 году возраст> 38, группа ооцитов <8, CPR составляла 15,9%, а LBR составляла 9,5% для P <1 нг / мл, а если P составлял от 1 до 1,5 нг / мл, CPR составлял 14 .9% ( p = 0,305), а LBR составлял 10,4% ( p = 0,950). В группе 1,5–1,75 P СЛР составляла 7,8% ( p = 0,067), а LBR составляла 5,9% ( p = 0,354), а в группе ≥1,75 — 10,9% ( p ≤ 0,001) и 4,4. % ( p = 0,244) соответственно (таблица 3).
В подгруппе переноса эмбрионов D5 отрицательный эффект повышения P на LBR и CPR был зарегистрирован только в том случае, если P был> 1,75 нг / мл, независимо от возраста женщины или количества извлеченных ооцитов.Это могло зависеть от того факта, что размера каждой подгруппы было недостаточно, чтобы гарантировать достаточную статистическую мощность для оценки таких различий. По этой причине результаты, относящиеся к этой подгруппе, не были представлены ни в одной таблице.
В таблице 4 влияние уровней P на CPR и LBR, выраженное как OR, скорректированное по возрасту женщины, количеству извлеченных ооцитов и количеству перенесенных эмбрионов, показано у женщин, перенесших перенос свежих эмбрионов, как в группах D3, так и D5. , и те, кто прошел цикл замораживания-размораживания (независимо от эмбрионов D3 или D5).СЛР и LBR в циклах размораживания статистически значимо выше, чем в циклах свежего молока. Что касается группы D3, группа циклов размораживания привела к лучшему исходу беременности, как по CPR, так и LBR, даже по сравнению с пациентами с уровнем P <1 нг / мл. В группе D5 не наблюдалось значительных различий между циклами размораживания и свежего продукта, независимо от уровней Р.
Таблица 4 . Сравнение между женщинами, перенесшими перенос свежих эмбрионов в группах на 3-й (D3) и 5-й (D5) день, и женщинами, перенесшими циклы замораживания-размораживания (независимо от эмбрионов D3 или D5): влияние уровня P на частоту клинической беременности CPR) и коэффициент живорождения (LBR) (OR корректируется в зависимости от возраста женщины, количества извлеченных ооцитов и количества перенесенных эмбрионов).
Обсуждение
Результаты настоящего исследования показывают, что высокие уровни P, измеренные в день начала овуляции, снижают CPR, а также LBR при переносе свежих эмбрионов D3 и D5, как сообщается в литературе (14, 26, 27).
Точный механизм, объясняющий влияние, которое высокий уровень P, возникающий в день введения ХГЧ, может иметь на исход цикла ЭКО, все еще неясен. Качество ооцитов (27) и эндометрий играют существенную роль, но роль возвышения прогестерона в качестве ооцитов, зрелость и овуляция является спорной (28, 29), как показано в исследованиях по внутриматочной экспрессии генов (30, 31 ), а также в исследованиях, сравнивающих частоту живорождения свежих циклов с циклами донор / реципиент или циклами замороженного-размороженного эмбриона (14, 32).Ранее упомянутые исследования показывают, что повышение P в день введения ХГЧ связано с уменьшением вероятности достижения беременности в свежих циклах ЭКО, но нет статистически значимой разницы между циклами с высокими уровнями P и циклами без использования замороженного-размороженного или донорского циклы. Это предполагает, что повышение уровня P до ХГЧ может влиять на рецептивность эндометрия, а не на качество эмбриона. В 1997 году Убалди и др. (33) продемонстрировали, что повышение P может изменять частоту имплантации в зависимости от времени, в которое это происходит.Если это отложить более чем на 3 дня, асинхронность между восприимчивостью эндометрия и стадией эмбриона может снизить частоту имплантации. Этот вывод можно объяснить гипотезой о том, что повышение уровня P может способствовать созреванию эндометрия.
Негативное влияние повышения уровня P, которое, возможно, зависит от его воздействия на эндометрий, уже оценивалось в предыдущих исследованиях, которые не показали влияния P на качество ооцитов или эмбрионов (34, 35). К такому же выводу пришли и другие исследования циклов донорства ооцитов, в которых не было доказательств отрицательного влияния уровня P донора в конце цикла стимуляции (36).
Как сообщается в недавних исследованиях и метаанализе (14, 27), отрицательный эффект P наблюдался для уровней> 1 нг / мл, особенно при переносе эмбрионов с дроблением (D3). Следовательно, эти авторы рекомендовали поддерживать низкий уровень фосфора, чтобы избежать негативного воздействия на свежие циклы. В литературе описаны различные стратегии для этой цели, например, использование мягкой стимуляции яичников для поддержания низкого уровня эстрогена (37, 38) или индукция более ранней овуляции у пациентов с HR (39), а также у пациентов, у которых раннее повышение P в возможном предыдущем цикле.
В нашем наборе данных повышение уровня прогестерона (> 1 нг / мл) зарегистрировано более чем у одной трети нашей популяции (3092/8034 пациентов, которые прошли новые циклы в течение периода исследования). Интересно отметить, что у разных категорий пациентов наблюдалось разное влияние повышения уровня Р. В группе переноса эмбрионов D3, как правило, любой уровень P в сыворотке ≥1 нг / мл значительно снижал как CPR, так и LBR. Однако у пациентов с худшим прогнозом (количество извлеченных ооцитов <8) было обнаружено, что эффект увеличения P не отличался, даже с учетом возраста женщины.Следует учитывать, что у этой категории пациентов худший исход может зависеть от множества факторов, особенно от качества ооцитов и эмбрионов, в то время как восприимчивость эндометрия может играть второстепенную роль.
Взаимосвязь между высокими уровнями P в сыворотке и низким CPR и LBR в группе переноса эмбрионов D5 существенно не различалась даже для уровня P в сыворотке, превышающего пороговое значение 1,75 нг / мл.
Выводы
Из результатов нашего исследования следует, что перенос эмбриона на стадии бластоцисты позволяет установить порог P <1.75 нг / мл, чтобы избежать негативного влияния P на СЛР и LBR, но это не позволяет полностью преодолеть проблему.
В группе D3 для уровней P ниже 1,75 нг / мл по нашим результатам можно было бы рассмотреть возможность ожидания, если это клинически возможно, до D5 для переноса эмбриона, и если уровень P составляет ≥1,75 нг / мл, это следует учитывать. заморозить все эмбрионы и отложить перенос эмбрионов до тех пор, пока уровни P не нормализуются, анализируя результаты витрификации и нагревания в центре для подтверждения этого выбора.
CPR и LBR в циклах размораживания показали, что, по нашему опыту, статистически значимо выше, чем в циклах свежего молока.Что касается группы D3, группа с циклами размораживания показала лучший исход беременности, как по СЛР, так и по СЛР, даже по сравнению с пациентами с уровнем P <1 нг / мл. В группе D5 не наблюдалось значительных различий между циклами размораживания и свежего продукта, независимо от уровней Р. С другой стороны, необходимо учитывать возможное смещение, заключающееся в том, что измерения уровня P у женщин не проводились в день триггера овуляции с помощью введения ЛГ, ХГЧ или прогестерона до оттаивания эмбриона, что может быть исследовано в будущих исследованиях, поскольку считается, что прогестерон рассматривается. физиологический триггер овуляции (28).
Согласно нашему анализу, криоконсервация эмбрионов является оптимальной стратегией для минимизации побочных эффектов повышения P, особенно если они витрифицированы на стадии бластоцисты, и недавно была подчеркнута важность эффективной программы замораживания для кумулятивной скорости доставки (40). Все центры нуждаются в строгом анализе своих KPI, таких как частота бластоцист, выживаемость при потеплении, а также свежая и послеродовая имплантация, а также частота развивающейся беременности при принятии решения о стратегии полного замораживания при пограничном повышении прогестерона (41, 42).Однако важно учитывать, что эта процедура не может быть проведена у всех пациентов, потому что их перенос эмбрионов не всегда может быть разрешен, потому что эмбрионы могут не достичь стадии бластоцисты для витрификации или могут не выжить во время процедуры оттаивания. Даже в самых лучших условиях выживаемость не составляет 100%, и также возможно, что длительное культивирование эмбрионов может быть стрессом для эмбрионов у одной небольшой подгруппы пациентов, чем у других.
Не было обнаружено различий, связанных с типом протокола индукции, и были обнаружены незначительные, но значимые различия в подгруппах пациентов с хорошим прогнозом и пациентами.прогноз хуже. Однако размер нашей выборки был недостаточным для анализа других подгрупп пациентов, и для получения дополнительных доказательств в этой области необходимы другие данные.
В заключение, эффект повышения прогестерона очевиден в наших результатах, начиная со значений> 1 нг / мл, и значительно оказывает прогрессивное влияние на CPR и LBR при переносе стадии расщепления, но эти эффекты становятся очевидными при переносе стадии бластоцисты только для значений> 1,75 нг / мл.
Заявление о доступности данных
Необработанные данные, подтверждающие выводы этой статьи, будут предоставлены авторами без излишних оговорок.
Заявление об этике
Исследования с участием людей были рассмотрены и одобрены Советом по этике Humanitas. Пациенты / участники предоставили письменное информированное согласие на участие в этом исследовании.
Авторские взносы
PL-S и RD написали исследовательский проект. EM проанализировал данные. FC, VC, CR, PP, AB и MS внесли свой вклад в извлечение данных, ссылки и последующий анализ. FC и CR внесли свой вклад в подготовку рукописи. PL-S подготовила окончательный вариант.Все авторы внесли свой вклад в статью и одобрили представленную версию.
Конфликт интересов
Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могут быть истолкованы как потенциальный конфликт интересов.
Благодарности
Авторы благодарят весь медперсонал, эмбриологов и гинекологов, работающих в Центре фертильности Humanitas, Роццано, Милан, Италия.
Список литературы
1.Venetis CA, Kolibianakis EM, Bosdou JK, Lainas GT, Sfontouris IA, Tarlatzis BC, et al. Базальный сывороточный прогестерон и повышение прогестерона в анамнезе в день введения ХГЧ являются важными предикторами позднего повышения фолликулярного прогестерона в циклах ЭКО антагонистов ГнРГ. Репродукция Человека . (2016) 31: 1859–65. DOI: 10.1093 / humrep / dew141
PubMed Аннотация | CrossRef Полный текст | Google Scholar
2. Венетис К.А., Колибианакис Е.М., Папаниколау Е., Бонтис Дж., Деврой П., Тарлатзис BC.Связано ли повышение прогестерона в день введения хорионического гонадотропина человека с вероятностью беременности при оплодотворении in vitro ? Систематический обзор и метаанализ. Обновление Hum Reprod . (2007) 13: 343–55. DOI: 10.1093 / humupd / dmm007
PubMed Аннотация | CrossRef Полный текст | Google Scholar
3. Bosch E, Valencia I, Escudero E, Crespo J, Simón C, Remohí J и др. Преждевременная лютеинизация во время циклов антагонистов гонадотропин-рилизинг-гормона и ее связь с исходом оплодотворения in vitro . Fertil Steril . (2003) 80: 1444–9. DOI: 10.1016 / j.fertnstert.2003.07.002
PubMed Аннотация | CrossRef Полный текст | Google Scholar
4. Fanchin R, de Ziegler D, Taieb J, Hazout A, Frydman R. Преждевременное повышение уровня прогестерона в плазме изменяет частоту наступления беременности , оплодотворение in vitro и перенос эмбриона. Fertil Steril. (1993) 59: 1090–4. DOI: 10.1016 / S0015-0282 (16) 55933-0
PubMed Аннотация | CrossRef Полный текст | Google Scholar
5.Fanchin R, Righini C, Olivennes F, Ferreira AL, de Ziegler D, Frydman R. Последствия преждевременного повышения уровня прогестерона на исходе оплодотворения in vitro : понимание противоречий. Fertil Steril . (1997) 68: 799–805. DOI: 10.1016 / S0015-0282 (97) 00337-3
PubMed Аннотация | CrossRef Полный текст | Google Scholar
6. Колибианакис Е.М., Венетис Калифорния, Бонтис Дж., Тарлацис, Британская Колумбия. Значительно более низкие показатели наступления беременности на фоне повышения прогестерона у пациентов, получавших антагонисты ГнРГ и гонадотропины: систематический обзор и метаанализ. Карр Фарм Биотехнология . (2012) 13: 464–70. DOI: 10.2174 / 138920112799361927
PubMed Аннотация | CrossRef Полный текст | Google Scholar
7. Долди Н., Марсильо Э., Дестефани А., Гесси А., Мерати Г., Феррари А. Повышенный уровень прогестерона в сыворотке в день введения ХГЧ при ЭКО связан с более высокой частотой наступления беременности при синдроме поликистозных яичников. Репродукция Человека . (1999) 14: 601–5. DOI: 10.1093 / humrep / 14.3.601
PubMed Аннотация | CrossRef Полный текст | Google Scholar
8.Эдельштейн М.С., Селтман Х.Дж., Кокс Б.Дж., Робинсон С.М., Шоу Р.А., Муашер С.Дж. Уровни прогестерона в день введения хорионического гонадотропина человека в циклах с подавлением агонистов гонадотропин-рилизинг-гормона не позволяют прогнозировать исход беременности. Fertil Steril . (1990) 54: 853–7. DOI: 10.1016 / S0015-0282 (16) 53945-4
PubMed Аннотация | CrossRef Полный текст | Google Scholar
9. Харада Т., Йошида С., Катагири К., Такао Н., Икенари Т., Тода Т. и др. Снижение скорости имплантации, связанное с незначительным повышением концентрации прогестерона в сыворотке во время фолликулярной фазы циклов, стимулированных комбинацией агониста гонадотропин-рилизинг-гормона и гонадотропина. Hum Reprod. (1995) 10: 1060–4. DOI: 10.1093 / oxfordjournals.humrep.a136094
PubMed Аннотация | CrossRef Полный текст | Google Scholar
10. Мартинес Ф., Королеу Б., Клуа Е., Тур Р., Буксадерас Р., Парера Н. и др. Концентрация прогестерона в сыворотке крови в день введения ХГЧ не может предсказать беременность в циклах вспомогательной репродукции. Репродукция Биомед Интернет . (2004) 8: 183–90. DOI: 10.1016 / S1472-6483 (10) 60514-7
PubMed Аннотация | CrossRef Полный текст | Google Scholar
11.Лоуренс Б., Фатеми Х.М. Влияние повышения прогестерона в фолликулярной фазе циклов ЭКО на восприимчивость эндометрия. Репродукция Биомед Интернет . (2017) 34: 422–8. DOI: 10.1016 / j.rbmo.2017.01.011
PubMed Аннотация | CrossRef Полный текст | Google Scholar
12. Вернер, доктор медицины, Форман Э.Дж., Хонг К.Х., Франасиак Д.М., Молинаро Т.А., Скотт Р.Т. Определение «зоны наилучшего восприятия» для вводимых соотношений гонадотропина лютеинизирующего гормона и фолликулостимулирующего гормона во время стимуляции яичников для защиты от клинически значимого позднего фолликулярного увеличения прогестерона: анализ 10 280 первых 90 489 циклов оплодотворения in vitro Fertil Steril . (2014) 102: 1312–7. DOI: 10.1016 / j.fertnstert.2014.07.766
PubMed Аннотация | CrossRef Полный текст | Google Scholar
13. Андерсен А.Н., Деврой П., Арсе Дж. Клинический результат после стимуляции высокоочищенным чМГ или рекомбинантным ФСГ у пациентов, подвергающихся ЭКО: рандомизированное слепое контролируемое испытание оценщиком. Hum Reprod. (2006) 21: 3217–27. DOI: 10.1093 / humrep / del284
CrossRef Полный текст | Google Scholar
14.Venetis CA, Kolibianakis EM, Bosdou JK, Tarlatzis BC. Повышение уровня прогестерона и вероятность беременности после ЭКО: систематический обзор и метаанализ более 60 000 циклов. Обновление Hum Reprod . (2013) 19: 433–57. DOI: 10.1093 / humupd / dmt014
PubMed Аннотация | CrossRef Полный текст | Google Scholar
15. Мол Б.В., Боссайт П.М., Сункара С.К., Гарсия Веласко Дж. А., Венетис С., Саккас Д. и др. Персонализированная стимуляция яичников для вспомогательных репродуктивных технологий: рекомендации по дизайну исследования для перехода от ажиотажа к добавленной стоимости для пациентов. Fertil Steril . (2018) 109: 968–79. DOI: 10.1016 / j.fertnstert.2018.04.037
PubMed Аннотация | CrossRef Полный текст | Google Scholar
16. Эстевес С. К., Алвигги С., Хумайдан П., Фишер Р., Андерсен С. Ю., Конфорти А. и др. Критерии POSEIDON и их мера успеха глазами клиницистов и эмбриологов. Передний эндокринол . (2019) 10: 814. DOI: 10.3389 / fendo.2019.00814
PubMed Аннотация | CrossRef Полный текст | Google Scholar
17.Humaidan P, La Marca A, Alviggi C, Esteves SC, Haahr T. Будущие перспективы стратификации POSEIDON для клинической практики и исследований. Передний эндокринол . (2019) 10: 439. DOI: 10.3389 / fendo.2019.00439
PubMed Аннотация | CrossRef Полный текст | Google Scholar
18. Леви-Сетти П.Е., Зербетто И., Баггиани А., Заннони Е., Сакки Л., Смеральди А. и др. Наблюдательное ретроспективное когортное исследование 4828 циклов ЭКО с оценкой различных пациентов с низким прогнозом в соответствии с критериями POSEIDON. Front Endocrinol. (2019) 10: 282. DOI: 10.3389 / fendo.2019.00282
PubMed Аннотация | CrossRef Полный текст | Google Scholar
19. Махешвари А., Бхаттачарья С., Боулер Ю., Брисон Д., Чайлд Т., Коул С. и др. Протокол исследования: E-freeze — замораживание эмбрионов при вспомогательном зачатии: рандомизированное контролируемое испытание, оценивающее клиническую и экономическую эффективность политики замораживания эмбрионов с последующим переносом размороженных замороженных эмбрионов по сравнению с политикой переноса свежих эмбрионов у женщин, перенесших лет. vitro оплодотворение. Здоровье . (2019) 16:81. DOI: 10.1186 / s12978-019-0737-2
PubMed Аннотация | CrossRef Полный текст | Google Scholar
20. Сакки Л., Албани Э., Чезана А., Смеральди А., Парини В., Фабиани М. и др. Преимплантационное генетическое тестирование на анеуплоидию улучшает клинические, гестационные и неонатальные исходы у пациенток пожилого материнского возраста без снижения совокупной рождаемости. J Assist Reprod Genet . (2019) 36: 2493–504. DOI: 10.1007 / s10815-019-01609-4
PubMed Аннотация | CrossRef Полный текст | Google Scholar
21.Зегерс-Хохшильд Ф., Адамсон Г.Д., Дайер С., Раковски С., де Музон Дж., Сокол Р. и др. Международный глоссарий по лечению бесплодия и бесплодия, 2017 г. Fertil Steril . (2017) 108: 393–406. DOI: 10.1016 / j.fertnstert.2017.06.005
PubMed Аннотация | CrossRef Полный текст | Google Scholar
22. Герхард Н. Хельсинкская декларация. В: Словарь по фармацевтической медицине. Вена: Springer (2009). п. 48. DOI: 10.1007 / 978-3-211-89836-9_367
CrossRef Полный текст | Google Scholar
25.Wang R, Chen ZJ, Vuong LN, Legro RS, Mol BW, Wilkinson J. Крупные рандомизированные контролируемые испытания бесплодия. Fertil Steril . (2020) 113: 1093–9. DOI: 10.1016 / j.fertnstert.2020.04.037
PubMed Аннотация | CrossRef Полный текст | Google Scholar
26. Бош Э., Лабарта Э, Креспо Дж., Симон К., Ремохи Дж., Дженкинс Дж. И др. Уровни циркулирующего прогестерона и частота продолжающихся беременностей в контролируемых циклах стимуляции яичников для оплодотворения in vitro : анализ более 4000 циклов. Репродукция Человека . (2010) 25: 2092–100. DOI: 10.1093 / humrep / deq125
PubMed Аннотация | CrossRef Полный текст | Google Scholar
27. Хуан И, Ван ЭЙ, Ду Цюй, Сюн ИДж, Гуо Сю, Юй Ю.П. и др. Повышение уровня прогестерона в день введения хорионического гонадотропина человека отрицательно влияет на исход ЭКО с перенесенными эмбрионами на разных стадиях развития. Репрод Биол Эндокринол . (2015) 13:82. DOI: 10.1186 / s12958-015-0075-3
PubMed Аннотация | CrossRef Полный текст | Google Scholar
28.Дозорцев Д., Пеллисер А, Даймонд М.П. Прогестерон является физиологическим триггером овуляторных гонадотропинов. Fertil Steril. (2020) 113: 923–4. DOI: 10.1016 / j.fertnstert.2019.12.024
PubMed Аннотация | CrossRef Полный текст | Google Scholar
29. Дозорцев Д.И., Пеллисер А, Бриллиант М.П. Срок созревания ооцитов и срочная стимуляция яичников: влияние на компетентность ооцитов. Fertil Steril. (2020) 114: 221–2. DOI: 10.1016 / j.fertnstert.2020.04.013
PubMed Аннотация | CrossRef Полный текст | Google Scholar
30.Labarta E, Martínez-Conejero JA, Alamá P, Horcajadas JA, Pellicer A, Simón C, et al. Восприимчивость эндометрия нарушается у женщин с высоким уровнем циркулирующего прогестерона в конце фолликулярной фазы: анализ функциональной геномики. Репродукция Человека . (2011) 26: 1813–25. DOI: 10.1093 / humrep / der126
PubMed Аннотация | CrossRef Полный текст | Google Scholar
31. Ван Вэренберг И., Ван Ломмель Л., Гислен В., Ин’т Велд П., Скуит Ф., Фатеми Х.М. и др. В циклах, стимулированных антагонистами GnRH / rec-FSH, ускоренное созревание эндометрия в день извлечения ооцитов коррелирует с измененной экспрессией гена. Hum Reprod. (2009) 24: 1085–91. DOI: 10.1093 / humrep / den501
PubMed Аннотация | CrossRef Полный текст | Google Scholar
32. Лахуд Р., Квик М., Райан Дж., Аль-Джефут М., Фоули Дж., Иллингворт П. Повышенный уровень прогестерона в агонисте гонадолиберина, подавленный в циклах оплодотворения in vitro, (IVFICSI) снижает частоту живорождений, но не снижает качество эмбрионов. Arch Gynecol Obstet . (2012) 285: 535–40. DOI: 10.1007 / s00404-011-2045-0
PubMed Аннотация | CrossRef Полный текст | Google Scholar
33.Ubaldi F, Bourgain C, Tournaye H, Smitz J, Van Steirteghem A, Devroey P. Оценка эндометрия с помощью аспирационной биопсии в день извлечения ооцитов в циклах переноса эмбрионов у пациентов с повышением уровня прогестерона в сыворотке во время фолликулярной фазы. Fertil Steril . (1997) 67: 521–6. DOI: 10.1016 / S0015-0282 (97) 80080-5
PubMed Аннотация | CrossRef Полный текст | Google Scholar
34. Hofmann GE, Bentzien F, Bergh PA, Garrisi GJ, Williams MC, Guzman I, et al. Преждевременная лютеинизация при контролируемой гиперстимуляции яичников не оказывает отрицательного воздействия на качество ооцитов и эмбрионов. Fertil Steril . (1993) 60: 675–9. DOI: 10.1016 / S0015-0282 (16) 56221-9
PubMed Аннотация | CrossRef Полный текст | Google Scholar
35. Fanchin R, Hourvitz A, Olivennes F, Taieb J, Hazout A, Frydman R. Преждевременное повышение уровня прогестерона избавляет от бластуляции, но не снижает частоту наступления беременности при оплодотворении in vitro и совместным культивированием. Fertil Steril . (1997) 68: 648–52. DOI: 10.1016 / S0015-0282 (97) 80464-5
PubMed Аннотация | CrossRef Полный текст | Google Scholar
36.Melo MA, Meseguer M, Garrido N, Bosch E, Pellicer A, Remohí J. Значение преждевременной лютеинизации в программе донорства ооцитов. Репродукция Человека . (2006) 21: 1503–7. DOI: 10.1093 / humrep / dei474
PubMed Аннотация | CrossRef Полный текст | Google Scholar
37. Kolibianakis EM, Albano C, Camus M, Tournaye H, Van Steirteghem AC, Devroey P. Продление фолликулярной фазы при оплодотворении in vitro приводит к снижению продолжающейся беременности в циклах, стимулированных рекомбинантным фолликулостимулирующим гормоном и антагонисты гонадотропин-рилизинг-гормона. Fertil Steril . (2004) 82: 102–7. DOI: 10.1016 / j.fertnstert.2004.01.027
PubMed Аннотация | CrossRef Полный текст | Google Scholar
38. Лоуренс Б., Белиготти Ф., Энгельманн Н., Гейтс Д., Фатеми Х.М. Влияние типа гонадотропина на повышение прогестерона во время стимуляции яичников в циклах антагонистов ГнРГ. Репродукция Человека . (2016) 31: 2554–60. DOI: 10.1093 / humrep / dew213
PubMed Аннотация | CrossRef Полный текст | Google Scholar
39. Аль-Аземи М., Киру Д., Колибианакис Э.М., Хумайдан П., Ван Вэренберг И., Деврой П. и др.Повышенный прогестерон во время стимуляции яичников при ЭКО. Репродукция Биомед Интернет . (2012) 24: 381–8. DOI: 10.1016 / j.rbmo.2012.01.010
PubMed Аннотация | CrossRef Полный текст | Google Scholar
40. Скаравелли Дж., Леви-Сетти П. Е., Ливи К., Ла Сала Дж., Убальди Ф. М., Греко Е. и др. Вклад криоконсервации в совокупный коэффициент живорождения: большой многоцентровый анализ данных на основе цикла из Национального реестра Италии. J Assist Reprod Genet . (2019) 36: 2287–95.DOI: 10.1007 / s10815-019-01566-y
CrossRef Полный текст | Google Scholar
41. Фабоцци Дж., Чимадомо Д., Маггиулли Р., Вайарелли А., Убальди Ф. М., Риенци Л. Какие ключевые показатели эффективности наиболее эффективны при оценке и управлении лабораторией по оплодотворению in vitro ? Fertil Steril. (2020) 114: 9–15. DOI: 10.1016 / j.fertnstert.2020.04.054
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Уровни прогестерона в сыворотке выше 32.5 нг / мл в день переноса эмбриона связаны с более низким уровнем живорождений после искусственной обработки эндометрия: проспективное исследование | Репродуктивная биология и эндокринология
Мы провели это исследование, чтобы выяснить, могут ли уровни P 4 и E 2 , измеренные в день переноса эмбриона, коррелировать с исходами беременности после циклов FET с той же подготовкой эндометрия и поддержкой лютеиновой фазы. Мы идентифицируем значительную связь между уровнями P 4 в сыворотке, CPR и LBR.Однако эти отношения не были значимыми в случае уровней эстрадиола. В нашем исследовании пациенты с уровнем прогестерона в наивысшем квартиле (Q4) имели значительно более низкую вероятность СЛР и LBR по сравнению с пациентами во втором квартиле (Q2). Настоящее исследование, кроме того, показало, что женщины с концентрацией прогестерона ≥ 32,5 нг / мл имеют значительно более низкие показатели клинической беременности и рождаемости. Стоит отметить, что в нашем исследовании уровень прогестерона в самом нижнем квартиле составлял 19 нг / мл, а средний уровень прогестерона в сыворотке был выше, чем в предыдущих исследованиях, так как только 14 пациентов (5.4%) имели минимальный уровень прогестерона (<10,3 нг / мл). Это могло быть связано с тем, что использовался комбинированный подход вагинального и в / м введения прогестерона для подготовки эндометрия к ЗГТ.
Текущая литература относительно оптимального диапазона уровня P 4 в день ЭТ в циклах FET с использованием режима ЗГТ для подготовки эндометрия ограничена и, действительно, противоречива. Первое исследование, проведенное Kofinas et al. в ретроспективном исследовании 213 пациентов были оценены и прошли циклы замороженного переноса одиночных эуплоидных эмбрионов с запрограммированной подготовкой эндометрия с использованием 50 мг внутримышечно прогестерона, и они пришли к выводу, что уровни P 4 > 20 нг / мл в день переноса были связаны со снижением показатели продолжающейся беременности и живорождения [5].Точно так же Йович и др. [3] исследовали 529 циклов FET с переносом одного эмбриона бластоцисты и уникальную схему ЗГТ с вагинальными пессариями, содержащими 10-20 мг микронизированного 17-бета-эостерадиола и 400 мг микронизированного прогестерона для всех участников. Их анализ показал, что уровни прогестерона в средне-лютеиновой сыворотке ниже 50 нмоль / л (или 15,7 нг / мл) и выше 99 нмоль / л (или 31,1 нг / мл) были связаны со снижением частоты имплантации. В их исследовании максимальный уровень прогестерона (> 31.1 нг / мл) с определяющим влиянием на скорость имплантации [3], был аналогичен результатам, полученным в этом исследовании. Эти наблюдения предполагают, что очень низкий или очень высокий уровень концентрации прогестерона может нарушить созревание эндометрия в окне имплантации. Одна из интерпретаций состоит в том, что низкий уровень прогестерона может задерживать или препятствовать, в то время как избыточный уровень прогестерона может ускорять развитие эндометрия и, следовательно, либо задерживать, либо продвигать окно имплантации. В самом деле, подразумевая, что обе среды могут препятствовать синхронизации эмбриона и асинхронного эндометрия [3].В согласии с Йовичем и др. [3], при планировании приема прогестерона во время вспомогательных репродуктивных процедур следует уделять больше внимания, и клиницистам может потребоваться скорректировать свой режим и синхронизировать день перевода, чтобы регулировать концентрацию прогестерона в сыворотке.
Кроме того, Labarta et al. в проспективном исследовании оценивали 244 реципиента доноров-ооцитов, которые прошли циклы FET после искусственной подготовки эндометрия с эстрадиола валератом и вагинальным микронизированным прогестероном (400 мг / 12 ч).Они обнаружили, что уровень P 4 в сыворотке <9,2 нг / мл в день ЭТ был связан со снижением частоты продолжающихся беременностей [2]. Аналогичным образом Cedrin-Durerin et al. оценили 277 циклов FET с использованием микронизированного эстерадиола (2 мг в день) и вагинального микронизированного прогестерона (600 мг в день) для подготовки эндометрия и пришли к выводу, что уровень P 4 в сыворотке менее 10 нг / мл в день ET был значительно связан с снижение показателей беременности и рождаемости [10]. В соответствии с этим, Gaggiotti-Marre и его коллеги исследовали 244 цикла FET с точно таким же режимом HRT и продемонстрировали низкое значение P 4 в сыворотке за день до ET ≤ 10.64 нг / мл были связаны с уменьшением частоты беременностей и живорождений после переноса замороженных-оттаявших эуплоидных эмбрионов. Более того, они обнаружили, что женщины из нижнего квартиля P 4 имели значительно более высокий уровень выкидышей по сравнению с женщинами из более высокого квартиля [7]. Недавно Бойнукалин и др. В проспективном исследовании оценили 168 пациентов, которые прошли один цикл эуплоидного ФЭТ с препаратом эндометрия ЗГТ с использованием эстрадиола валерата и 100 мг прогестерона внутримышечно. Анализ их данных показал, что пациенты с уровнем P 4 в сыворотке <13.6 нг / мл до ЭТ значительно снижали вероятность продолжения беременности [6].
Как упоминалось выше, в предыдущих исследованиях сообщалось, что низкий уровень P до FET связан с плохим исходом беременности. В большинстве предыдущих исследований прогестерон применялся вагинально для подготовки эндометрия [2, 3, 7, 10], за исключением Kofinas et al. [5] и Бойнукалин и др. [6] исследования, в которых использовался прогестерон в / м. Кроме того, в настоящем исследовании подготовка эндометрия проводилась путем сочетания вагинального и внутримышечного прогестерона.Таким образом, различия в методологии предыдущих исследований затруднили сравнение результатов. Верхний предел прогестерона в группе четвертого квартиля в этом исследовании был аналогичен двум предыдущим исследованиям, в которых прогестерон внутримышечно использовался для подготовки эндометрия. Хорошо известно, что концентрация прогестерона в ткани эндометрия после использования вагинальных добавок прогестерона значительно выше, чем при внутримышечном введении прогестерона, тогда как; сывороточные уровни прогестерона примерно в четыре раза выше при внутримышечном введении прогестерона по сравнению с вагинальным введением [15, 16].Следовательно, пороговые значения сывороточного прогестерона будут различаться в зависимости от пути введения прогестерона [9]. Как сообщают Шапиро и его коллеги, мониторинг уровней P 4 в сыворотке невыгоден [17]. В случае трансвагинального введения лекарств, несмотря на низкие уровни P 4 в сыворотке, концентрация P 4 в эндометрии была выше, чем при внутримышечных инъекциях, из-за эффекта первого прохождения через матку [18,19, 20].
Данные о естественных циклах у фертильных женщин показали, что низкие уровни прогестерона необходимы для достижения восприимчивости эндометрия к имплантации эмбриона [21].Hull et al. в классическом исследовании показал, что нижний порог в 9,4 нг / мл был оптимальным для фертильности в естественных циклах [22]. Что касается циклов полевого транзистора, Рамезанали и др. [23] обнаружили, что не было значимой разницы в уровнях P 4 в день ЭТ между беременными и небеременными женщинами (8,7 ± 0,5 против 8,2 ± 0,5 нг / мл) в продольном исследовании 101 модифицированного цикла естественного FET. . В искусственных циклах текущие данные свидетельствуют о том, что уровни P 4 > 5 нг / мл обеспечивают приемлемо примированный эндометрий, что приводит к лютеинизации и рецептивности эндометрия, которые не отличаются от тех, которые достигаются при очень высоких уровнях [24, 25].Однако вопрос о том, достаточно ли этого функционально для имплантации и поддержания беременности в искусственных циклах, остается без ответа [2].
В отличие от некоторых предыдущих исследований, это исследование не обнаружило связи между группами квартилей прогестерона и частотой выкидышей. В предыдущих исследованиях у пациентов с самым низким квартилем прогестерона была значительно более высокая частота выкидышей. В связи с тем, что только небольшое количество пациентов в нашем исследовании имели минимальный зарегистрированный порог концентрации прогестерона (<10 нг / мл), при этом большинство участников имели благоприятные уровни в сыворотке крови, результаты этого исследования не могут полностью позволить прояснить эффекты. уровня прогестерона на минимальном пороге.
В соответствии с предыдущими результатами, в этом исследовании наблюдался широкий диапазон уровней прогестерона в сыворотке среди участников, несмотря на введение одинаковой дозы прогестерона для всех пациентов. Точная причина этого неясна, однако вариабельность абсорбции лекарств у пациентов с различным ИМТ и метаболическими вариациями может помочь объяснить это [3, 6]. Как отмечает Бойнукалин и др. заявлено, что уровни P 4 в сыворотке на ЕТ были связаны с ИМТ, и женщины с более высоким ИМТ, вероятно, выиграют от более высоких доз прогестерона после начала ЗГТ.Поэтому для определения оптимальной дозировки необходимы дальнейшие фармакокинетические исследования [6]. Тем не менее, широкий диапазон значений прогестерона в сыворотке подчеркивает, что поглощение, распределение и метаболизм прогестероновых препаратов могут сильно различаться между пациентами, что делает невозможным прогнозирование концентрации лютеинового прогестерона без надлежащего мониторинга [9].
Интересно, что отрицательное влияние высоких уровней E 2 в сыворотке также наблюдалось в настоящем исследовании, при этом пациенты из самого высокого квартиля (Q 4 ) имели самый низкий LBR.Однако после многомерного логистического регрессионного анализа уровни E 2 в день ET не имели значимого прогностического значения для LBR. Обзор литературы показал, что результаты в этой области противоречивы. В ретроспективном исследовании Bocca et al. Оценили взаимосвязь между уровнями E 2 (поздняя фолликулярная фаза) и исходами беременности в циклах ЗГТ. Результаты показали, что уровни E 2 в сыворотке поздней фолликулярной фазы не предсказывали исходы беременности в циклах ЗГТ [26].В соответствии с этим, Niu et al. Пришли к выводу, что мониторинг эстрадиола в цикле FET с использованием ЗГТ без предварительной обработки агонистом гонадотропного гормона (GnRH) не нужен [27]. В недавнем ретроспективном когортном исследовании He и его коллеги обнаружили, что концентрация сыворотки E 2 в день переноса эмбриона не может служить индикатором для прогнозирования результатов циклов искусственного FET [28]. Напротив, Fritz et al. Сообщили, что повышенные уровни E 2 в циклах искусственной аутологичной FET связаны с более низкой продолжающейся беременностью и частотой живорождений, и предполагают, что уровни эстрадиола следует контролировать во время циклов искусственной FET [29].Поскольку время измерений и способ введения E 2 в предыдущих исследованиях различались, необходимы дальнейшие проспективные исследования с более крупными размерами выборки для достижения консенсуса в этой области.
Основным ограничением настоящего исследования является то, что перенесенные эмбрионы не были определены как эуплоидные. Тем не менее, мы включили пациентов с эмбрионами бластоцисты высшего качества для переноса.
Кроме того, для подготовки эндометрия мы использовали как внутримышечный, так и вагинальный прогестерон, что не позволяет сравнивать эти результаты с предыдущими исследованиями.Клинические последствия этих результатов могут предполагать, что максимальное значение прогестерона, по-видимому, связано с более низкой частотой живорождений в этих условиях лечения, и это может быть предупреждением о том, что увеличение дозы прогестерона следует проводить с осторожностью и тщательным мониторингом.
В заключение, это исследование демонстрирует, что высокий уровень прогестерона в сыворотке (≥ 32,5 нг / мл) в день ET в циклах HRT – FET значительно снижает вероятность живорождения после переноса бластоцисты. Поскольку время и тип режима ЗГТ в предыдущих исследованиях различались, нижний и верхний пороги концентраций прогестерона до ЭТ не могут быть окончательно определены.Измерение уровней P 4 и его мониторинг во время циклов FET необходимы для прогнозирования исхода беременности и позволяют определять индивидуальную поддержку лютеиновой фазы для каждой пациентки. Тем не менее, результаты все еще противоречивы в отношении необходимости скрининга сывороточных уровней E 2 перед ET, и необходимы дальнейшие проспективные исследования.
Определение оптимальной продолжительности приема прогестерона перед переносом криоконсервированных эмбрионов и его влияние на частоту имплантации и наступления беременности: пилотное исследование
Цель. Для определения оптимальной продолжительности приема прогестерона до переноса криоконсервированных эмбрионов и его влияния на имплантацию и частоту наступления беременности. Дизайн исследования . Проспективное рандомизированное исследование. Материалы и методы . В отделение ЭКО третичного центра были включены шестьдесят шесть пациентов, перенесших циклы переноса криоконсервированных эмбрионов. Для подготовки эндометрия применяли валерат эстрадиола. Как только он достиг минимума 7 мм, пациентов случайным образом распределили на группу I () и группу II ().Затем начали вводить 100 мг прогестерона в день в течение 3 и 4 дней соответственно. За этим следовали перенос по крайней мере одного размороженного эмбриона на стадии 2-го дня дробления хорошего качества. Группы I и II сравнивали с точки зрения клинической беременности и частоты имплантации. Результатов . В группе I (3-дневный прогестерон) и группе II (4-дневный прогестерон) частота наступления беременности составила 41,02% (16/39) и 18,51% (5/27), соответственно. С другой стороны, частота имплантации составила 16,82% (18/107) и 7.69% (6/78) соответственно. Разница была статистически значимой (значения 0,0172 и 0,0386 соответственно). Заключение . Добавка прогестерона в течение трех дней до переноса стадии дробления (день 2) криоконсервированных эмбрионов имеет значительно более высокие показатели беременности и имплантации по сравнению с четырехдневной добавкой.
1. Введение
Имеются убедительные доказательства того, что у человека существует временное окно максимальной восприимчивости эндометрия, соответствующее 5-7 дням после овуляции.Восприимчивость эндометрия заключается в приобретении адгезионных лигандов с потерей ингибирующих компонентов, которые действуют как барьер для прикрепляющегося эмбриона. Это окно восприимчивости определяется большим количеством молекулярных медиаторов, которые активируются уровнями прогестерона. Теоретически можно предположить, что количество дней воздействия прогестерона будет влиять на восприимчивость эндометрия и, следовательно, на имплантацию, хотя воздействие эстрогена на эндометрий во время фолликулярной фазы не менее важно для того, чтобы прогестерон проявил свой максимальный эффект позже.Неадекватная восприимчивость матки является причиной примерно двух третей неудач имплантации в циклах ЭКО, тогда как сам эмбрион ответственен только за одну треть этих неудач [1, 2].
Имеется множество данных о дозировке и способах введения прогестерона после переноса эмбриона в качестве поддержки лютеиновой фазы, а также мало работы было выполнено по дозировке и режимам приема добавок прогестерона до переноса эмбриона, но данных мало. об оптимальной продолжительности приема прогестерона до переноса эмбриона и его влиянии на имплантацию и частоту наступления беременности [3–8].
Оптимальную продолжительность приема прогестерона и развитие максимальной восприимчивости эндометрия, то есть окна имплантации, можно изучить, взяв биопсию эндометрия и оценив наличие пиноподов (при сканирующей электронной микроскопии) и других биомаркеров имплантации (например, экспрессия генов @ Vb3, PP14 и HOXA 10) или путем переноса эмбрионов и наблюдения за частотой наступления беременности и имплантации. Первый метод невозможен в циклах передачи, и, более того, в большинстве центров могут быть недоступны услуги.
Это исследование проводится с целью определить, повлияет ли количество дней воздействия прогестерона до переноса криоконсервированных эмбрионов на частоту имплантации и наступления беременности, и если да, то какова оптимальная продолжительность приема прогестерона до переноса. перенос эмбриона?
Циклы переноса криоконсервированных эмбрионов выбраны для изучения, поскольку это, по-видимому, лучшая модель для человека для определения оптимальной продолжительности приема прогестерона, когда количество дней воздействия прогестерона может быть изменено, поддерживая постоянную стадию переноса эмбриона. .Циклы переноса криоконсервированных эмбрионов будут включать (а) избыточные эмбрионы для использования в последующем цикле, (б) эмбрионы из циклов донор-реципиент.
2. Цели и задачи
Целями являются определение оптимальной продолжительности приема прогестерона до переноса криоконсервированных эмбрионов и его влияние на имплантацию и частоту наступления беременности.
3. Материал и метод
3.1. Дизайн исследования
Это проспективное рандомизированное исследование.
Исследование проводилось в отделении ЭКО и репродукции человека центра третичной медицинской помощи в Индии в течение 9 месяцев.
3.2. Популяция исследования
Шестьдесят шесть индийских женщин, перенесших циклы переноса криоконсервированных эмбрионов, были включены в исследование после рассмотрения критериев включения и исключения (рис. 1). Соответствующее согласие было получено от пациентов, а одобрение было получено от наблюдательного совета учреждения.
Критерии включения следующие: (a) Все эмбрионы, криоконсервированные от женщин моложе 37 лет. (B) Криоконсервированные эмбрионы на стадии дробления. (C) Толщина эндометрия в день начала приема прогестерона> 7 мм.(d) Перенос по крайней мере 1 полностью интактного эмбриона после оттаивания.
Критерии исключения следующие: (a) Возраст пациента (и донора ооцитов)> 37 лет. (B) Естественные циклы без добавления эстрогенов. (C) Толщина эндометрия в день начала приема прогестерона <7 мм. (D ) Аденомиоз или интрамуральная миома> 4 см. (E) Очевидный гидросальпинкс. (F) История 3 предыдущих неудачных циклов ЭКО. Трансвагинальное сканирование было выполнено на третий день менструального цикла вместе с базальным уровнем ФСГ, ЛГ и эстрадиола.Подтвердив исходный уровень эндометрия менее 4 мм и уровень эстрадиола менее 50 пг / мл, было начато искусственное приготовление эндометрия с эстрадиола валерата 2 мг трижды в день в течение 12 дней, после чего было повторено трансвагинальное сканирование, чтобы увидеть толщину эндометрия и шаблон. Если толщина эндометрия достигала минимум 7 мм, пациентов случайным образом распределяли на группу I и группу II. Если было обнаружено, что ЕТ меньше 7 мм, эстрадиола валерат продолжали в течение еще 2-3 дней и повторно оценивали.Первоначально планировалось, что, если толщина эндометрия останется субоптимальной, пациенты будут исключены из исследования, но, к счастью, у всех пациентов она достигла минимум 7 мм. После того, как эндометрий достиг минимума 7 мм, пациенты были случайным образом распределены в группу I и группу II медсестрой, которая распределила участников по группам (рис. 1). Рандомизация проводилась на основе таблицы рандомизации, созданной компьютером. Команда, выполнявшая перенос эмбрионов, не понимала группового назначения.Испытание не контролировалось плацебо, так как результаты были объективными. Затем пациенты получали инъекционный прогестерон 100 мг в день в течение 3 и 4 дней соответственно.
Группа I . В этой группе инъекционный прогестерон вводили в течение 3 дней, а ЭТ — на 4-й день.
Группа II . В этой группе инъекционный прогестерон вводили в течение 4 дней, а ЭТ — на 5-й день.
Криоконсервированные эмбрионы размораживали в день переноса эмбрионов.После размораживания эмбрионы исследовали, и цикл включали в исследование, если было обнаружено, что хотя бы один эмбрион хорошего качества [24] был полностью неповрежденным.
За этим последовал перенос эмбриона, по крайней мере, одного после оттаивания полностью интактного эмбриона на стадии дробления (день 2) хорошего качества. Лютеиновая поддержка вводилась в форме микронизированного прогестерона 800 мг интравагинально в два приема, вместе с эстрадиола валератом 2 мг трижды в день. Все пациентки были протестированы на беременность через 14 дней после переноса эмбрионов путем проверки уровня сывороточного ХГЧ.При подтверждении беременности лютеиновая поддержка продолжалась до 14 недель. Через 4 недели после переноса эмбриона было проведено трансвагинальное сканирование, чтобы увидеть гестационный мешок и подтвердить клиническую беременность. Проведен сравнительный анализ показателей клинической беременности и имплантации в I и II группах.
Показатели результата (i) Первичный результат выглядит следующим образом: (a) Частота клинической беременности. (B) Частота имплантации. Частота клинической беременности (CPR) рассчитывалась отдельно для каждой группы как число пациенток, которые забеременели (подтверждено). по наличию гестационного мешка при транвагинальном сканировании через 4 недели после переноса эмбрионов), деленное на количество пациенток, перенесших перенос эмбрионов.Частота имплантации (IR) также рассчитывалась для каждой группы как количество гестационных мешков, деленное на количество перенесенных эмбрионов.
3.3. Статистический анализ
Результаты циклов лечения с точки зрения беременности и частоты имплантации сравнивали с использованием критерия Стьюдента. Значение <0,05 считалось статистически значимым.
4. Результаты
Всего в исследование было включено 66 пациентов, 39 — в группу I и 27 — во II группу.
Существенной разницы по возрасту в обеих группах не было.Пациенты в обеих группах были сопоставимы с точки зрения количества дней воздействия эстрогена, толщины эндометрия во время переноса эмбриона и количества перенесенных эмбрионов (Таблица 1).
| |||||||||||||||||||||||||||||||||||||
В группе I (3 дня воздействия прогестерона) и группе II (4 дня воздействия прогестерона) частота наступления беременности составила 41,02% (16/39) и 18.51% (5/27) соответственно. С другой стороны, частота имплантации составила 16,82% (18/107) и 7,69% (6/78), соответственно, тогда как частота многоплодной беременности составила 12,5% (2/16) и 20% (1/5) для группы I. и II. Разница была статистически значимой как для беременности (значение 0,0172), так и для частоты имплантации (значение 0,0386) (рисунки 2 и 3).
Была такая значительная разница в частоте беременностей и имплантации в обеих группах, что исследование пришлось преждевременно прервать, прежде чем было достигнуто заранее заданное целевое значение в 100 пациенток.
5. Обсуждение
Для успешной имплантации жизнеспособный эмбрион должен встретиться с эндометрием в правильной фазе восприимчивости, известной как окно имплантации. Об обнаружении остроконечных ножек как маркера восприимчивости матки сообщалось в прошлом [25–27]. Экспрессия определенных генов, которые сигнализируют о путях клеточной адгезии, необходима эндометрием для имплантации. Воздействие прогестерона вызывает изменения в эндометрии, примированном эстрогеном, что делает его восприимчивым к имплантации эмбриона.Окно имплантации у людей начинается через 5–7 дней после овуляции и остается открытым еще 4–5 дней. Это означает, что максимальная восприимчивость эндометрия в естественном 28-дневном менструальном цикле составляет с 19-го по 24-й день.
В большинстве клиник ЭКО во всем мире практика заключается в добавлении прогестерона в течение 3 дней перед переносом криоконсервированного эмбриона на 3-й день и в течение 5 дней до переноса. перенос криоконсервированной бластоцисты 5-го дня. Таким образом, количество дней воздействия прогестерона до переноса эмбриона зависит от стадии переносимых замороженных эмбрионов.Логика состоит в том, чтобы довести эндометрий до того же уровня зрелости, который был бы при естественной имплантации. Но, насколько нам известно, нет рандомизированных контролируемых испытаний, подтверждающих эту логическую практику. Более того, небольшая проблема здесь заключается в том, что в естественном цикле синтез некоторого количества прогестерона начинается после всплеска ЛГ, даже до овуляции. Точно так же в новом цикле ЭКО прогестерон начинает расти после триггера ХГЧ. Следовательно, кажется, что в цикле переноса замороженного размороженного эмбриона эндометрий отстает с точки зрения зрелости и воздействия прогестерона, если прогестерон вводится в течение того же количества дней, что и стадия переносимого эмбриона.Об этом также упоминали Навот и др. в 1986 году было показано, что во время нормальной имплантации эмбрион на стадии 4-8 клеток совпадает с развитием эндометрия через 3-4 дня после выброса ЛГ in vivo [28].
В подтверждение этого несколько, а точнее несколько исследований показали, что частота наступления беременности была выше, когда прогестерон принимался в течение 4 или 5 дней перед переносом эмбрионов на стадии дробления (стадия 4-8 клеток) [28]. Prapas et al. в 1998 г. также сообщалось о более высокой частоте беременностей (40%) и имплантации (14.1%) при добавлении прогестерона в течение 4 дней по сравнению с 3 днями до 2-го дня стадии переноса эмбрионов [5]. Они изучили окно имплантации в циклах донорства ооцитов в зависимости от продолжительности терапии прогестероном [5] и обнаружили, что частота имплантации и наступления беременности была значительно выше после введения прогестерона в течение 4 и 5 дней (40% и 48,3% соответственно), поскольку по сравнению с 0%, 12% и 20,4% после приема прогестерона в течение 2, 3 и 6 дней соответственно. Все пересадки были выполнены в течение 48 часов после осеменения (эмбриональная стадия 2-го дня).Они обнаружили, что воздействие прогестерона должно продолжаться не менее 48 часов, чтобы произошла имплантация.
Напротив, есть еще пара исследований, которые показывают, что показатели беременности и имплантации лучше, если дни воздействия прогестерона совпадают со стадией перенесенного эмбриона. Ding et al. в 2007 году изучали 49 циклов переноса замороженных оттаявших бластоцист и обнаружили, что частота клинических беременностей, продолжающейся беременности и имплантации была выше, когда прогестерон вводился за 5 дней до переноса по сравнению с 6 днями (60.9% против 53,8%, 56,5% против 50,0% и 40,7% против 30,0% соответственно), но различия не достигли статистической значимости (s> 0,05). Однако это исследование включало циклы переноса размороженных бластоцист, когда существует критический запас перед закрытием окна имплантации и один дополнительный день приема прогестерона может отрицательно повлиять на результаты [7].
Тем не менее, еще несколько авторов не отметили различий в частоте наступления беременности или имплантации с 3, 4 или 5 днями приема прогестерона до переноса эмбриона.В проспективном исследовании Navot et al. (1991) 60 реципиентов программы донорства ооцитов были изучены, и перенос эмбрионов (день 2 или 3) после и 6 дней введения прогестерона не оказал значительного влияния на частоту наступления беременности и абортов [3]. Это было показано Michalas et al. в 1996 г. выяснилось, что изменение введения прогестерона за 2–4 дня до переноса эмбриона (день 2) не повлияло на исход беременности [4].
Недавно на китайском языке был опубликован ретроспективный анализ 1103 циклов переноса замороженных оттаявших эмбрионов, в котором изучалась частота наступления беременности в течение 3 и 4 дней введения прогестерона с последующим переносом эмбрионов 3 дня [8].Они также изучили результаты циклов замороженного оттаивания, когда бластоцисты 5-го дня переносились через 5 и 6 дней введения прогестерона. Они обнаружили, что частота имплантации, частота беременностей, частота внематочных беременностей, частота многоплодных беременностей и частота ранних абортов существенно не различались, когда эмбрионы 3-го дня были перенесены через 3 или 4 дня прогестерона, а также когда бластоцисты 5-го дня были перенесены через 5 или 5 дней. 6 дней прогестерона. Интересно, что 3 или 4 дня приема прогестерона для переноса бластоцисты на 5 день или 5 или 6 дней прогестерона до переноса эмбриона на 3 день не изучались, вероятно, потому, что наша многолетняя логическая практика и удовлетворительные результаты сами по себе сняли некоторые сомнения.
В таблице 2 показаны некоторые исследования, посвященные добавлению эстрогена / прогестерона для подготовки эндометрия перед переносом замороженных размороженных эмбрионов. Здесь следует подчеркнуть, что даже до переноса эмбриона на второй день большинство центров предпочитают вводить прогестерон в течение не менее 3 дней, а не 2. Однако для переноса на 3 и 5 день количество дней введения прогестерона была такой же, как и на стадии перенесенных эмбрионов. Это соответствует исследованию Prapas et al.[5], где они пришли к выводу, что для открытия окна имплантации необходимо не менее 48 часов воздействия прогестерона.
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Источник: Nawroth and Ludwig [6]. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Однако, насколько нам известно, до настоящего времени не существует проспективного рандомизированного контролируемого исследования для решения вопроса об оптимальной продолжительности введения прогестерона до переноса криоконсервированных эмбрионов и его влиянии на имплантацию и частоту наступления беременности.
В нашем исследовании мы обнаружили, что продолжительность приема прогестерона имеет решающее значение для имплантации. В этом исследовании добавка прогестерона в течение трех дней до переноса криоконсервированных эмбрионов на стадии дробления (день 2; стадия 4–6 клеток) имела значительно более высокие показатели беременности и имплантации по сравнению с 4 днями введения прогестерона. Более того, до начала этого исследования наша практика заключалась в переносе размороженных эмбрионов на второй день после 2-3 дней воздействия прогестерона в цикле переноса криоконсервированных эмбрионов, результаты были удовлетворительными и сопоставимыми.Таким образом, мы пришли к выводу, что частота наступления беременности и имплантации будет лучше, если количество дней прогестерона будет таким же или на один день больше, чем стадия переноса замороженного эмбриона. Но разница в два дня может испортить результат. Прежде чем будет определена точная продолжительность приема прогестерона, необходимы большие многоцентровые рандомизированные контролируемые исследования.
Проспективное рандомизированное исследование проводится в Центре репродуктивной медицины больницы Брюссельского университета под официальным названием «Оптимальная продолжительность приема прогестерона перед переносом криоконсервированных (замороженных) -отмороженных эмбрионов 3-го дня в искусственном цикле с экзогенными клетками». Эстроген и прогестерон (ПРОФЕТА-3) »(ClinicalTrials.gov ID NCT01940653), где они сравнивают свою практику начала приема прогестерона за 5 дней до переноса эмбриона третьего дня с более распространенной практикой в большинстве центров, когда его начинают за 3 дня до переноса третьего дня [29].
Аналогичным образом, в том же центре проводится еще одно испытание (PROFETA-5) ( ClinicalTrials.gov, идентификатор NCT02032797), где они снова сравнивают свою практику начала приема прогестерона за 7 дней до переноса бластоцисты 5-го дня. , с более распространенной практикой в большинстве центров начинать его за 5 дней до этого [30].Мы надеемся получить результаты к концу 2016 года.
6. Заключение
Добавка прогестерона за три дня до переноса стадии дробления (день 2) криоконсервированных эмбрионов имеет значительно более высокие показатели беременности и имплантации по сравнению с четырехдневными. дневная добавка.
Дополнительные точки
Капсула . В проспективном исследовании было обнаружено, что прием прогестерона в течение трех дней до переноса криоконсервированных эмбрионов на стадии дробления имеет значительно более высокие показатели беременности и имплантации по сравнению с четырехдневным приемом.
Раскрытие информации
Настоящий адрес Сангиты Шармы — дом № 1, колония Вишну, Лакшми Нагар, Джайпур 302006, Раджастхан, Индия. Авторы заявляют, что описанная в нем работа является оригинальной, не была отправлена и не опубликована в каком-либо другом журнале и не находится на рассмотрении. Эта работа не была представлена ни на одной встрече.
Конкурирующие интересы
У авторов нет конфликта интересов, подлежащего раскрытию.
