Нарушение минерального обмена у детей: Минеральный обмен — ПроМедицина Уфа
Минеральный обмен — ПроМедицина Уфа
Понятие «минеральный обмен» объединяет процессы поступления в организм, распределения, использования и выведения веществ, находящихся преимущественно в виде неорганических соединений. Минеральные вещества в основном поступают в организм с продуктами питания и водой. Роль, которую играют данные элементы в организме, трудно переоценить. Участие в поддержании осмотического давления, кислотно-основного равновесия, свертывании крови, синтезе ферментов и гормонов, проведении нервных импульсов – вот только некоторые из их функций. Фактически, от них в значительной степени зависит жизнь и здоровье человека, вот почему нарушения минерального обмена сами являются причиной ряда патологических состояний и часто сопровождают тяжелые заболевания. При выраженном недостатке, избытке или дисбалансе в организме макро- и микроэлементов у человека развиваются патологические состояния, называемые микроэлементозами.
Почему необходимо знать показатели своего минерального обмена?
В настоящее время распространенность микроэлементозов огромна. По некоторым данным, лишь около 3% населения не имеют никаких нарушений минерального обмена. Дисбаланс содержания макро- и микроэлементов не только приводит к развитию патологических состояний сам по себе, но и сопровождает около 95% других заболеваний, зачастую утяжеляя их течение. В условиях современных мегаполисов, с их не всегда благополучной экологией и обилием всякого рода вредных производств, развитие техногенных микроэлементозов не редкость. Развитие микроэлементозов так или иначе может быть связано с медицинским вмешательством, избыточным лечением препаратами, содержащими микроэлементы или, напротив, выводящими необходимые организму вещества (например, мочегонными), а также проведение некоторых медицинских процедур (в частности, гемодиализа).
К сожалению, проявления микроэлементозов не всегда очевидны сразу, что приводит к поздней диагностике и, в ряде случаев, затрудняет последующее лечение.
— Магний (Mg): необходим для правильной работы сердца, нервной системы, почек, желчевыводящих путей. Из двадцати пяти грамм магния, имеющегося в организме, большая половина находится в костях, один процент во внеклеточной жидкости, а остальное в клетках тканей. Магний оказывает влияние на регуляцию липидного обмена. Его дефицит провоцирует бессонницу, перемены в настроении, мышечную слабость, тахикардию, судороги, повышает риск развития инсульта. Недостаток магния может служить причиной иммунодефицита. Потребность в магнии приблизительно 0,3-0,5 грамм.
— Кальций (Са): Организм человека содержит приблизительно килограмм кальция, и при этом 99% депонировано в скелете. Кальций необходим для обеспечения полноценного функционирование мышечной ткани, нервной ткани, миокарда, минерализации зубов, кожи, формирования костной ткани, принимает активное участие в процессах свертывания крови, клеточном метаболизме, поддерживает гомеостаз на требуемом уровне. Причинами его недостатка являются: усиленный расход в следствии стрессорных воздействий, переизбыток магния, калия, натрия, цинка, железа, свинца. Повышенное содержание связывают также и с развитием разнообразных заболеваний нервной системы, дисбалансом гормонов. Суточная потребность составляет приблизительно 0,8-1,2 грамма.
— Фосфор (Р): относится к жизненно необходимым веществам, он входит в состав всех тканей организма, особенно мышц и мозга, участвует во всех видах обмена веществ, необходим для нормального функционирования нервной системы, сердечной мышцы и т. д. Основной функцией фосфора в организме является формировании костей и зубов. При егонедостатке развиваются остеопороз и другие заболевания костей. У детей развивается рахит. Фосфор также необходим для сбалансированного использования организмом витаминов и минералов, в том числе витамин D, йод, магний и цинк.
Увеличивается содержание неорганического фосфора при молочной диете, а также при ряде заболеваний почек, при переломах в стадии заживления, сахарном диабете, акромегалии, аддисоновой болезни и др. ; уменьшается концентрация неорганического фосфора в сыворотке крови при повышении функции паращитовидных желез и ряде других заболеваний. При голодании организм расходует фосфор, содержащийся в тканях, поэтому концентрация его в крови не меняется, и лишь при потере 40% общего количества содержание его в крови уменьшается на 10%.
; уменьшается концентрация неорганического фосфора в сыворотке крови при повышении функции паращитовидных желез и ряде других заболеваний. При голодании организм расходует фосфор, содержащийся в тканях, поэтому концентрация его в крови не меняется, и лишь при потере 40% общего количества содержание его в крови уменьшается на 10%.
— Натрий (Na) – необходим для поддержания осмотического давления биологических жидкостей, участвует в поддержании водно-солевого обмена, в регуляции ферментативных процессов. Без него невозможны многие биоэлектрические процессы, в частности проведение импульсов по нервам.
— Калий (К) – без него невозможна нормальная сердечная деятельность, сокращение мышц, проведение нервных сигналов. Выраженные изменения его содержания могут привести к тяжелым последствиям вплоть до остановки сердца.
Особенности минерального обмена у детей с патологией опорно-двигательного аппарата Текст научной статьи по специальности «Клиническая медицина»
ОСОБЕННОСТИ МИНЕРАЛЬНОГО ОБМЕНА У ДЕТЕЙ С ПАТОЛОГИЕЙ ОПОРНО-ДВИГАТЕЛЬНОГО АППАРАТА
THE FEATURES OF MINERAL METABOLISM IN CHILDREN WITH LOCOMOTORIUM PATHOLOGY
Никонова Т.А. Nikonova T.A.
Довгаль Д.А. Dovgal D.A.
Хохлова О. И. Khokhlova O.I.
Устьянцева И.М. Ustyantseva I.M.
Федеральное государственное Federal State
лечебно-профилактическое учреждение Medical Prophylactic Institution
Научно-клинический центр охраны здоровья шахтеров», «Scientific Clinical Center of Miners’ Health Protection»,
г. Ленинск-Кузнецкий, Россия Leninsk-Kuznetsky, Russia
Ленинск-Кузнецкий, Россия Leninsk-Kuznetsky, Russia
Представлены результаты комплексной оценки минерального обмена у детей с врожденной и приобретенной патологией опорно-двигательного аппарата.
Обследовано 24 пациента с врожденной патологией развития опорно-двигательного аппарата, которые составили первую группу. Во вторую группу вошли 10 детей с приобретенной патологией опорно-двигательного аппарата (переломы длинных трубчатых костей различной локализации). Оценку состояния костного метаболизма осуществляли на основании однократного исследования концентрации щелочной фосфатазы, общего кальция, фосфора и магния, а также ионизированного кальция венозной крови. Выявлены достоверно более низкие значения концентраций общего и ионизированного кальция в группе детей с приобретенной травмой скелета, что свидетельствует о более низкой минерализации костей скелета у данной категории пациентов и может быть предрасполагающим фактором травмы. В обеих исследуемых группах установлено нарушение соотношения Са : Mg : Phos за счет повышенного содержания фосфора.
Использование биохимических показателей костного ремоделирования позволяет оценить состояние метаболизма костной ткани, выявить его нарушения, влекущие за собой развитие повреждений опорно-двигательного аппарата как врожденного, так и приобретенного характера. Ключевые слова: дети; минеральный обмен; травма; опорно-двигательный аппарат.
The results of the complex evaluation of mineral metabolism in children with congenital or acquired pathology of locomotorium are presented. 24 patients with congenital pathology of locomotorium, who presented the first group, were examined. The second group included 10 children with acquired pathology of locomotorium (fractures of long bones in different sites).
^he evaluation of bone metabolism was performed by means of single investigation of alkaline phosphatase concentration, total calcium, phosphorus, magnesium and ionized calcium of venous blood.
The lower values of concentrations of total and ionized calcium were identified in the group of the children with acquired locomotorium injury. It indicates to lower bone mineralization in this patient population and can be predisposing factor of trauma. In both investigated groups the ration distortion of Са : Mg : Phos at the expense of increased phosphorus concentration was found.
Using of biochemical values of bone remodeling allows assessing the state of osseous tissue metabolism and identifying its disorders which may cause both congenital and acquired locomotorium injuries.
Key words: children; mineral metabolism; trauma; locomotorium.
Минерализация — один из ключевых моментов в образовании костной ткани, определяющий ее прочность и возможность дальнейшей адаптации к изменяющимся условиям внешней среды. Ранняя диагностика и своевременная профилактика нарушений минерального обмена у детей и подростков крайне важна, поскольку уровень костной массы, достигнутый в этот период развития, определяет прочность кости на протяжении всей жизни. Определение в плазме крови маркеров резорбции крайне ограничено, так как практически нет данных о возрастной динамике этих показателей [1]. В последнее десятилетие, благодаря внедрению
новых лабораторных и инструментальных диагностических методов, клиницисты получили возможность идентифицировать различные варианты нарушений обмена костной ткани у детей как первичного, так и вторичного характера [2].
Цель исследования — выявить особенности минерального обмена у детей с патологией опорно-двигательного аппарата.
МАТЕРИАЛЫ И МЕТОДЫ
Обследовано 24 пациента с врожденной патологией развития опорно-двигательного аппарата (15 мальчиков и 9 девочек), которые составили первую группу. В эту группу
В эту группу
включали детей с дисплазиями и деформациями различных частей скелета, воронкообразной грудной клеткой и прочими врожденными дефектами опорно-двигательного аппарата. Средний возраст детей первой группы составил 10 ± 1 лет. Во вторую группу вошли 10 детей с приобретенной патологией опорно-двигательного аппарата (9 мальчиков и 1 девочка), средний возраст — 11 ± 1 лет. Эту группу составили пациенты с переломами различной локализации.
Оценку состояния костного метаболизма осуществляли на основании однократного исследования концентрации щелочной фосфа-тазы, общего кальция, фосфора и
ПОЛИТРАВМА
Исследования молодых ученых
52 — 54
магния, а также ионизированного кальция венозной крови. Первые 4 показателя определяли на биохимическом анализаторе «Hitachi». Содержание ионизированного кальция определяли на анализаторе кислотно-щелочного состояния «Omni S».
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ОБСУЖДЕНИЕ Проведенные исследования показали, что в группе детей с приобретенной патологией опорно-двигательного аппарата уровень общего кальция достоверно ниже (на 4 %, р = 0,03), чем в группе с врожденной патологией развития опорно-двигательного аппарата (табл.).
Также выявлено достоверное понижение концентрации ионизированного кальция (на 24 %, р = 0,0001) в группе детей с травмами опорно-двигательного аппарата, по сравнению с группой па-
циентов с врожденной патологией развития опорно-двигательного аппарата (табл.). Это значение также ниже нормальных показателей для здоровых детей [1].
Концентрация общего кальция в сыворотке венозной крови детей жестко детерминирована. Норма для детей 2,3-2,8 ммоль/л [1]. В результате исследования получена более низкая концентрация кальция в сыворотке детей с приобретенной патологией опорно-двигательного аппарата, чем указана в литературных данных для здоровых детей. Важнейшим биохимическим маркером является соотношение Са : Mg : Phos, которое должно быть 2 : 1 : 1 [3]. По нашим данным, это соотношение нарушено в группах детей с патологией развития опорно-двигательного аппарата. В исследуемых группах наблюдается более высокое содержание фосфора и низкая концентрация магния, по сравнению с нормальными значениями. Возможно, эти данные
Норма для детей 2,3-2,8 ммоль/л [1]. В результате исследования получена более низкая концентрация кальция в сыворотке детей с приобретенной патологией опорно-двигательного аппарата, чем указана в литературных данных для здоровых детей. Важнейшим биохимическим маркером является соотношение Са : Mg : Phos, которое должно быть 2 : 1 : 1 [3]. По нашим данным, это соотношение нарушено в группах детей с патологией развития опорно-двигательного аппарата. В исследуемых группах наблюдается более высокое содержание фосфора и низкая концентрация магния, по сравнению с нормальными значениями. Возможно, эти данные
объясняются различиями в гормональной регуляции минерального обмена при различном характере патологии опорно-двигательного аппарата.
Таким образом, получены следующие особенности минерального обмена у детей с патологией опорно-двигательного аппарата. Выявлены достоверно более низкие значения концентраций общего и ионизированного кальция в группе детей с приобретенной травмой скелета, что свидетельствует о более низкой минерализации костей скелета у данной категории пациентов и является предрасполагающим фактором переломов костей.
Использование биохимических показателей костного ремоделиро-вания позволяет оценить состояние метаболизма костной ткани, выявить его нарушения, влекущие за собой развитие повреждений опорно-двигательного аппарата, как врожденного, так и приобретенного характера.
Таблица
Показатели минерального обмена в исследуемых группах
Показатели Группа 1 n = 24 Группа 2 n = 10 Показатели для здоровых детей [3]
Общий кальций, ммоль/л 2,29 ± 0,024 2,2 ± 0,039* 2,3-2,8
Фосфор, ммоль/л 1,53 ± 0,043 1,6 ± 0,042 1,15-1,4
Магний, ммоль/л 0,93 ± 0,044 0,86 ± 0,025 1,15-1,4
Ионизированный кальций, ммоль/л 1,01 ± 0,025 0,77 ± 0,037* 1,120-1,320
Соотношение Са : Mg : Phos 1,49 : 0,6 : 1 1,37 : 0,53 : 1 2 : 1 : 1
Примечание: * достоверные различия между группами 1 и 2 при р < 0,05.
Литература:
1. Храмцова, С.Н. Оценка уровня кальция и фосфора в прогнозировании остеопении у детей и подростков /С.Н. Храмцова //Общественное здоровье и профилактика заболеваний. — 2007.
— № 2. — С. 47-50.
2. Состояние костного метаболизма у детей и подростков с сахарным диабетом типа 1 /Т.В. Коваленко, Я.А. Тыцкая, Н.Г. Пла-хотина, Е.В. Ибрагимова //Российский педиатрический журнал.
— 2004. — № 5. — С. 4-7.
3. Юдин, В.А. Минеральный обмен у детей при замедленной консолидации переломов длинных трубчатых костей /В.А Юдин, А.А. Булгаков //Детская хирургия. — 2000. — № 1. — С. 2832.
№ 2 [июнь] 2010
Сведения об авторах:
Никонова Т.А., врач клинической лабораторной диагностики, Федеральное государственное лечебно-профилактическое учреждение «Научно-клинический центр охраны здоровья шахтеров», г. Ленинск-Кузнецкий, Россия.
Довгаль Д.А., врач клинической лабораторной диагностики, Федеральное государственное лечебно-профилактическое учреждение «Научно-клинический центр охраны здоровья шахтеров», г. Ленинск-Кузнецкий, Россия.
Хохлова О.И., д.м.н., врач клинической лабораторной диагностики, Федеральное государственное лечебно-профилактическое учреждение «Научно-клинический центр охраны здоровья шахтеров», г. Ленинск-Кузнецкий, Россия.
Устьянцева И.М., д.б.н., профессор, заместитель директора по клинической лабораторной диагностике, Федеральное государственное лечебно-профилактическое учреждение «Научно-клинический центр охраны здоровья шахтеров», г. Ленинск-Кузнецкий, Россия.
Ленинск-Кузнецкий, Россия.
Адрес для переписки:
Устьянцева И.М., 7-й микрорайон, № 9, ФГЛПУ «НКЦОЗШ», Ленинск-Кузнецкий, Кемеровская область, Россия, 652509
Тел. 8 (38456) 2-38-88, 9-55-13
E-mail: [email protected]
Information about authors:
Nikonova T.A., MD, physician of clinical laboratory diagnostics, Federal state medical prophylactic institution «Scientific clinical center of miners’ health protection», Leninsk-Kuznetsky, Russia.
Dovgal D.A., MD, physician of clinical laboratory diagnostics, Federal state medical prophylactic institution «Scientific clinical center of miners’ health protection», Leninsk-Kuznetsky, Russia.
Khokhlova O.I., PhD, physician of clinical laboratory diagnostics, Federal state medical prophylactic institution «Scientific clinical center of miners’ health protection», Leninsk-Kuznetsky, Russia.
Ustyantseva I.M., PhD, professor, deputy director of clinical laboratory diagnostics, Federal state medical prophylactic institution «Scientific clinical center of miners’ health protection», Leninsk-Kuznetsky, Russia.
Adress for correspondence:
Ustyantseva I.M., 7th district, 9, Federal state medical prophylactic institution «Scientific clinical center of miners’ health protection», Len-insk-Kuznetsky, Kemerovo region, Russia, 652509
Tel. 8 (38456) 2-38-88, 9-55-13
E-mail: irmaust@gnkc. kuzbass.net
kuzbass.net
m
ПОЛИТРАВМА
Нарушения минерального обмена в почках (дисметаболические нефропатии)
Дисметаболические нефропатии (наршения минерального обмена почек — НМО) представляют собой группу заболеваний, характеризующихся поражением почек вследствие нарушения обмена веществ и приводящим к развитию мочекаменной болезни (МКБ), воспалению почек (пиелонефрит), которые могут осложниться хронической почечной недостаточностью (ХПН).
В зависимости от причины развития выделяют первичные и вторичные НМО.
Первичные нарушения представляют собой наследственно обусловленные формы заболеваний, характеризующихся прогрессирующим течением, ранним развитием мочекаменной болезни (МКБ) и хронической почечной недостаточности (ХПН). Первичные дисметаболические нефропатии встречаются редко и начало клинических проявлений развивается уже в детском возрасте.
Вторичные дисметаболические нефропатии могут быть связаны с повышенным поступлением определенных веществ в организм, нарушением их метаболизма в связи с поражением других органов и систем (например, желудочно-кишечного тракта), применением ряда лекарственных средств и др.
Подавляющее большинство (от 70 до 90%) дисметаболических нефропатий связаны с нарушением обмена кальция, при этом около 85–90% из них обусловлены избытком солей щавелевой кислоты в виде оксалата кальция — оксалатов, 3–10% — перегрузкой фосфатами (фосфаты кальция), существуют смешанный вариант нарушений – оксалатно/фосфатно-уратные.
Оскалатно-кальциевая нефропатия
Оксалатно-кальциевая нефропатия наиболее часто встречается в детском возрасте. Ее возникновение может быть связано с нарушением обмена кальция или оксалатов (солей щавелевой кислоты).
Причины образования оксалатов:
- повышенное поступление оксалатов с пищей
- заболевания кишечника – воспалительные заболевания кишечника (болезнь Крона, язвенный колит), кишечные анастомозы при проведении оперативных вмешательств на кишечнике
- повышенная выработка оксалатов самим организмом
Оксалатная нефропатия представляет собой многофакторный патологический процесс. Наследственная предрасположенность к развитию оксалатной нефропатии встречается в 70–75%. Помимо генетических, большую роль играют такие внешние факторы, как: питание, стресс, экологические проблемы и др.
Наследственная предрасположенность к развитию оксалатной нефропатии встречается в 70–75%. Помимо генетических, большую роль играют такие внешние факторы, как: питание, стресс, экологические проблемы и др.
Первые проявления болезни могут развиться в любом возрасте, даже в период новорожденности. Чаще всего они выявляются в 5–7 лет в виде обнаружения кристаллов оксалатов, небольшим содержанием белка, лейкоцитов и эритроцитов в общем анализе мочи. Характерно повышение удельной плотности мочи. Заболевание обостряется в период полового созревания в возрасте 10–14 лет, что, по-видимому, связано с гормональной перестройкой.
Прогрессирование оксалатной нефропатии может привести к формированию мочекаменной болезни, развитию воспаления почек — пиелонефриту при наслоении бактериальной инфекции.
Фосфатная нефропатия
Фосфатная нефропатия встречается при заболеваниях, сопровождающихся нарушением фосфорного и кальциевого обмена. Основная причина фосфатурии – хроническая инфекция мочевой системы. Часто фосфатно-кальциевая нефропатия сопровождает оксалатно-кальциевую, но при этом выражена в меньшей степени.
Уратная нефропатия (нарушения обмена мочевой кислоты)
Эта группа обменных нарушений наиболее часто встречается у взрослых. Первичные уратные нефропатииобусловлены наследственными нарушениями обмена мочевой кислоты. Вторичные возникают как осложнениядругих заболеваний (болезней крови и др.), являются следствием применения некоторых препаратов (тиазидовых диуретиков, цитостатиков, салицилатов, циклоспорина А и др.) или нарушения функции канальцев почек и физико-химических свойств мочи (при воспалении почек, например). Кристаллы уратов откладываются в ткани почек – это приводит к развитию воспаления и снижению почечных функций.
Первые признаки заболевания могут выявляться в раннем возрасте, хотя в большинстве случаев наблюдается длительное скрытое течение процесса.
Цистиновая нефропатия
Цистин является продуктом обмена аминокислоты метионина. Можно выделить две основные причины повышения концентрации цистина в моче:
Можно выделить две основные причины повышения концентрации цистина в моче:
- избыточное накопление цистина в клетках почки
- нарушение обратного всасывания цистина в почечных канальцах.
Накопление цистина в клетках происходит в результате генетического дефекта фермента цистинредуктазы. Это нарушение обмена носит системный характер и называется цистинозом. Внутриклеточное и внеклеточное накопление кристаллов цистина выявляется не только в канальцах и интерстиции почки, но и в печени, селезенке, лимфоузлах, костном мозге, клетках периферической крови, нервной и мышечной ткани, других органах. Нарушение обратного всасывания цистина в канальцах почек наблюдается вследствие генетически обусловленного дефекта транспорта через клеточную стенку для аминокислот – цистина, аргинина, лизина и орнитина.
По мере прогрессирования заболевания определяются признаки мочекаменной болезни, а при присоединении инфекции – воспаление почек.
Симптомы НМО
НМО почек, как правило, клинически течет бессимптомно до формирования мочекаменной болезни или пиелонефрита, но в ряде случаев могут проявляться следующими симптомами:
- дискомфорт при мочеиспускании
- учащенное мочеиспускание
- ноющая боль или дискомфорт, локализующиеся преимущественно в поясничной области или животе
- приступообразная («почечная колика») или постоянная боль, отдающая в. подвздошную или паховую область, на внутреннюю поверхность бедра, в половые органы
- боль над лоном может развиваться при отложении солей или наличии камней в мочевом пузыре
Диагностика НМО
Необходимое комплексное обследование включает лабораторные и инструментальные методы.
Лабораторная диагностика
- Общий анализ мочи, в котором выявляются кристаллы солей той или иной кислоты. Однако данное исследование не позволяет с полной уверенностью утверждать о присутствии дисметаболической нефропатии. Выявление кристаллов солей только в общих анализах мочи не является основанием для постановки диагноза дисметаболической нефропатии.
 Следует иметь в виду, что выделение кристаллов с мочой часто бывает преходящим и оказывается не связанным с нарушением обмена веществ. Поэтому для уточнения диагноза прибегают ко второму этапу исследования – проведению биохимического исследования мочи.
Следует иметь в виду, что выделение кристаллов с мочой часто бывает преходящим и оказывается не связанным с нарушением обмена веществ. Поэтому для уточнения диагноза прибегают ко второму этапу исследования – проведению биохимического исследования мочи. - Биохимический анализ мочи позволяет оценить концентрации тех или иных солей в порции мочи. Метод является более точным и чувствительным для определения количественного уровня оксалатов, фосфатов, уратов и других кристаллов солей.
- АКОСМ — определение антикристаллобразующей способности мочи. Метод достаточно сложный, проводится не в каждом лечебном заведении.
- Ряд тестов на перекиси в моче и кальцифилаксию. Данная методика позволяет выявить нарушения кальциевого обмена и оценить степень активности перекисного окисления мембран клеток почечной ткани, что является важным звеном в процессах развития дисметаболических нефропатий.
Инструментальная диагностика
УЗИ органов брюшной полости. Изменения, выявляемые при УЗИ почек, как правило, мало специфичны. Возможно выявление в почке микролитов или «песка» (включений). УЗИ почек, как правило, является неспецифичным методом диагностики, однако в ряде случаев позволяет отследить формирование мелких камней и, таким образом, зафиксировать время возникновения мочекаменной болезни.
Лечение
Рекомендации по питанию являются основой терапии как в детском, так и во взрослом состоянии.
| Вид нефропатии | Запрещенные продукты |
| Оксалатная нефропатия | Мясные блюда, щавель, шпинат, клюква, свекла, морковь, какао, шоколад |
| Уратная нефропатия | Печень, почки, мясные бульоны, горох, фасоль, орехи, какао, алкогольные напитки |
| Фосфатная нефропатия | Сыр, печень, икра, курица, бобовые, шоколад |
| Цистиновая нефропатия | Творог, рыба, яйца, мясо |
Лечение оксалатной нефропатии
Диета
- при лечении больных с оксалатной нефропатией назначается картофельно-капустная диета, при которой снижается поступление оксалатов с пищей и нагрузка на почки
- необходимо исключить холодец, крепкие мясные бульоны, щавель, шпинат, клюкву, свеклу, морковь, какао, шоколад
- рекомендуется ввести в рацион курагу, чернослив, груши
- из минеральных вод используются такие, как славяновская и смирновская, по 3–5 мл/кг/сут.
 в 3 приема курсом 1 месяц 2–3 раза в год
в 3 приема курсом 1 месяц 2–3 раза в год
Лекарственная терапия включает мембранотропные препараты и антиоксиданты. Лечение должно быть длительным. Применяются витамины группы В, А, Е. Назначаются специальные препараты при кристаллурии. Помимо этого, назначается окись магния, особенно при повышенном содержании оксалатов.
Лечение уратной нефропатии
Диета
- при лечении уратной нефропатии диета предусматривает исключение богатых пуриновыми основаниями продуктов (печени, почек, мясных бульонов, гороха, фасоли, орехов, какао и др.)
- преимущество должно отдаваться продуктам молочного и растительного происхождения
- важным условием успешной терапии является достаточное употребление жидкости – от 1 до 2 л в сутки. Предпочтение следует отдавать слабощелочным и слабоминерализованным водам, отварам трав (хвощ полевой, укроп, лист березы, брусничный лист, клевер, спорыш и др.), отвару овса
Для поддержания оптимальной кислотности мочи можно использовать цитратные смеси. При уратной нефропатии важно уменьшить концентрацию мочевой кислоты. Для этого используются средства, снижающие синтез мочевой кислоты.
Лечение фосфатной нефропатии
Назначается диета с ограничением продуктов, богатых фосфором (сыр, печень, икра, курица, бобовые, шоколад и др.).
Лечение при фосфатной нефропатии должно быть направлено на подкисление мочи (минеральные воды – нарзан, арзни, дзау-суар и др.; препараты – цистенал, аскорбиновая кислота, метионин).
При любой степени тяжести заболевания необходимо незамедлительно обратиться к врачу нефрологу или урологу за помощью, так как длительно текущие, в целом обратимые, нарушения обмена при отсутствии лечения могут привести к развитию мочекаменной болезни с последующим оперативным вмешательством и хронической почечной недостаточности. Самолечение не допустимо!
Все виды лекарственной терапии должен назначать и обязательно контролировать врач нефролог или уролог, так как:
- эти лекарства имеют серьезные побочные эффекты на другие органы и системы
- у части пациентов отмечается изначальная невосприимчивость или постепенно развивается устойчивость к препаратам
На первом этапе лечения составляется план лечения. Лечение любой дисметаболической нефропатии можно свести к четырем основным принципам:
Лечение любой дисметаболической нефропатии можно свести к четырем основным принципам:
- нормализация образа жизни
- правильный питьевой режим
- диета
- специфические методы терапии
Прием большого количества жидкости является универсальным способом лечения любой дисметаболической нефропатии, так как способствует уменьшению концентрации растворимых веществ в моче.
Одной из целей лечения является увеличение ночного объема мочеиспускания, что достигается приемом жидкости перед сном. Предпочтение следует отдавать простой или минеральной воде.
Диета позволяет в значительной степени снизить солевую нагрузку на почки.
Специфическая терапия должна быть направлена на предупреждение конкретного кристаллообразования, выведение солей, нормализацию обменных процессов.
На втором этапе терапии производится оценка эффективности диеты, проводятся контрольные УЗ-исследования и анализы.
Третий этап лечения осуществляется после достижения стойкой ремиссии. Он представляет собой схему постепенного снижения доз назначенных препаратов до поддерживающих или полной их отмены с сохранением диетических рекомендаций.
Даже после достижения долгожданной ремиссии пациенту рекомендуется быть внимательным к себе и регулярно наблюдаться у врача нефролога или уролога, так как высок риск рецидива заболеваний.
Практически всем пациентам необходимо принимать рекомендованные врачом средства противорецидивной терапии или придерживаться ранее разработанной диеты для предотвращения формирования или прогрессирования МКБ, воспаления почек.
Прогноз
Прогноз при дисметаболической нефропатии в целом благоприятен. В большинстве случаев при соответствующем режиме, диете и лекарственной терапии удается добиться стойкой нормализации соответствующих показателей в моче. В отсутствие лечения или при его неэффективности наиболее естественным исходом дисметаболической нефропатии является мочекаменная болезнь и воспаление почек.
Самым частым осложнением дисметаболической нефропатии является развитие инфекции мочевой системы, в первую очередь пиелонефрита.
Если вы обнаружили у себя какие-либо из перечисленных выше симптомов (нарушение мочеотделения, изменения свойств мочи, боли), необходимо в ближайшее время обратиться к врачу за помощью.
Помните, что очень важно начать лечение на ранних стадиях болезни, так как НМО в почках является преимущественно обратимым состоянием, а в случае отсутвтия лечения итогом является развитие мочекаменной болезни, пиелонефрита.
Рекомендации
Для профилактики развития заболевания, а так же рецидива, необходимо придерживаться правильного, сбалансированного и регулярного питания – избегать острой пищи, маринадов и пр. В период обострения пациентам рекомендуется щадящая диета, соответствующая требованиям биохимического вида нефропатии (оксалатная, уратная и пр.).
С целью профилактики рецидивов всем пациентам рекомендуется один раз в квартал консультация врача нефролога или уролога для необходимой коррекции медикаментозной терапии и пищевых рекомендаций.
Пациенты, длительно страдающие НМО в почках, относятся к группе повышенного риска по МКБ. Поэтому в период ремиссии им необходимо ежегодно проходить по назначению врача контрольные обследования (общий анализ мочи, биохимия мочи, УЗИ почек, мочеточников, мочевого пузыря) мочевыводящей системы.
Часто задаваемые вопросы
Излечимы ли НМО?
НМО часто обусловлено наследственными нарушениями обмена, что требует постоянного соблюдения как минимум диетических рекомендаций.
Из-за чего возникает заболевание?
НМО может быть связано с наследственной предрасположенностью, а также с заболеваниями внутренних органов (желудочно-кишечные проблемы, заболевания крови и пр.), применением определенных групп лекарственных препаратов (мочегонные средства, цитостатики и пр.).
Является ли заболевание противопоказанием к беременности?
Само НМО в почках требует наблюдения весь период беременности с соблюдением диетических рекомендаций.
При развитии МКБ, пиелонефрита и их осложнений в виде ХПН, возможность беременности и ее сохранения зависит от обострения процесса и стадии осложнений и решается в каждом конкретном случае.
Может ли заболевание почек проявляться снижением потенции?
Непосредственно НМО конечно не влияет на потенцию, но в случае развития осложнений МКБ, воспаления почек или развития ХПН снижение потенции может появиться как реакция на хроническое заболевание.
Увеличивается ли риск заболеть, если близкий родственник страдает данным заболеванием?
Да, существует группа первичных обменных нефропатий (НМО в почках), имеющая наследственную предрасположенность.
Особенности минерального и костного обмена у детей с пренатальной гипертрофией
На правах рукописи
КОРОЛЕВА Дарья Николаевна
ОСОБЕННОСТИ МИНЕРАЛЬНОГО И КОСТНОГО ОБМЕНА У ДЕТЕЙ С ПРЕНАТАЛЬНОЙ ГИПОТРОФИЕЙ
14.01.08 — педиатрия
АВТОРЕФЕРАТ диссертации на соискание ученой степени кандидата медицинских наук
3 0 СЕН 2010
Ижевск-2010
004609743
Работа выполнена в Государственном образовательном учреждении высшего профессионального образования «Ижевская государственная медицинская академия» Росздрава
Научный руководитель доктор медицинских наук, профессор
Ожегов Анатолий Михайлович
Официальные оппоненты: доктор медицинских наук, профессор
Мальцев Станислав Викторович доктор медицинских наук, профессор Софронов Валерий Викторович
Ведущая организация: Российский государственный медицинский университет им. Н.И. Пирогова (Москва)
Защита диссертации состоится « /Л октября 2010 г. в у/ часов на заседании диссертационного совета Д 208.029.01 при Государственном образовательном учреждении высшего профессионального образования «Ижевская государственная медицинская академия» Росздрава по адресу: 426034, г. Ижевск, ул. Коммунаров, 281.
С диссертацией можно ознакомиться в библиотеке ГОУ ВПО «ИГМА» Росздрава (г. Ижевск, ул. Коммунаров, 281).
Ижевск, ул. Коммунаров, 281).
Автореферат разослан « г » сентября 2010 г.
Учёный секретарь диссертационного совета, доктор медицинских наук, профессор л И.А.Казакова
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ Актуальность проблемы. Частота пренаталыюй гипотрофии (ПГ) у доношенных, детей, по данным различных авторов, составляет от 10,3 до 18-22% (Г.М. Дементьева, 2000; С.П. Хохлова, 2007). ПГ виосит существенный вклад в структуру перинатальной заболеваемости и смертности, приводит к нарушению адаптации в периоде новорождённое™, оказывает неблагоприятное влияние на дальнейшее развитие ребёнка и формирование хронической патологии у взрослых (Н.П. Шабалов, 2004; O.K. Нетребенко, 2004; О. Fricke et al., 2009).
ПГ является одним из факторов риска развития патологии костной системы, в частности остеопенического синдрома (Л.А. Щеплягина и соавт., 2002; J. Y. Chen et al., 1995). Условиями, способствующими снижению плотности костной ткани, у детей с ПГ являются дефицит минеральных веществ, депонированных антенатально, нарушенный метаболизм органического матрикса (преимущественно белкового) и незрелость ферментных систем (Г.М. Дементьева, 1994; F. Chunga Vega, 1996; Е. Domenech et al., 2001).
Высокие темпы костного ремоделирования в первые два года жизни, антенатальный дефицит минеральных веществ создают условия для развития остеопенического синдрома и рахита у детей с ПГ (Е.И. Капранова, 2003). Перенесенный в раннем возрасте рахит может оказать неблагоприятное воздействие на рост и развитие ребёнка в более старшем возрасте (Ф.П. Романюк и соавт., 2002). В последние годы широкое распространение получила гипотеза, согласно которой остеопенический синдром у детей и подростков является одной из причин роста заболеваемости остеопорозом у взрослых (Л.А. Щеплягина и соавт., 2005; C.B. Мальцев, 2008; А.А. Sayer et al., 2005). В связи с неуклонным ростом частоты развития остеопатий у детей, большое значение придаётся оценке состояния здоровья в критические периоды роста, одним из которых является первый год жизни (Л. А. Щеплягина и соавт., 2002).
А. Щеплягина и соавт., 2002).
Принимая во внимание вышеизложенное, изучение остеогенеза у детей первых лет жизни является важной задачей, поскольку профилактика остеопатий, предпринятая в этом возрасте, позволяет предупредить развитие органической патологии костной системы в последующем. В доступной литературе имеются
единичные данные, посвященные изучению минерального обмена и костного метаболизма у новорождённых детей с ПГ.
Цель исследования: совершенствование профилактических и лечебных мероприятий у грудных детей с пренатальной гипотрофией на основе изучения особенностей минерального и костного обмена.
Задачи исследования:
1. Дать комплексную оценку здоровья детей с пренатальной гипотрофией.
2. Изучить особенности костной системы у новорождённых и грудных детей
с ПГ.
3. Исследовать показатели фосфорно-кальциевого обмена и уровень каль-цийрегулирующих гормонов (паратгормон, кальцитонин, 25-гидроксивитамин £>3) у детей первого года жизни с ПГ.
4. Дать характеристику процессов костного ремоделирования на основании определения маркёров костеобразования (общая щелочная фосфатаза, остео-кальцин) и костной резорбции (С-концевые телопептиды коллагена I типа) у новорождённых и грудных детей с ПГ.
5. Определить факторы, способствующие развитию метаболических нарушений костной ткани у детей с ПГ, и предложить рекомендации по их профилактике.
Научная новизна работы
Впервые определен характер изменений минерального обмена и кальций-регулирующих гормонов (паратгормон, кальцитонин, 25-гидроксивитамин П3) у детей с ПГ на протяжении первого года жизни.
Показано, что в периоде новорождённое™ гипокапьциемия обусловлена дефицитом 25-гидроксивитамина В3 (25-ОН-й3), степень выраженности сдвигов которых зависит от тяжести гипотрофии.
Впервые показано снижение уровня кальцитонина (КТ) у новорождённых и развитие вторичного гиперпаратиреоза у грудных детей, имеющих ПГ Н-Ш степени, что является фактором риска снижения минеральной плотности костной ткани.
Впервые установлен тип метаболических нарушений костной ткани при врожденной гипотрофии в зависимости от её тяжести и возраста детей, характеризую-
щийся низким уровнем обмена с подавлением обеих фаз ремоделирования кости в периоде новорождёипости, угнетением резорбции к 6 месяцам и повышенной деструкцией кости на фоне сохранного остеобразования в возрасте одного года у детей с тяжёлой гипотрофией.
Установлены анте- и постнатальные факторы риска развития метаболических нарушений костной ткани у детей с нренаталыюй гипотрофией.
Практическая значимость
1. На основании определения анте- и постнатальных факторов, влияющих на минеральный и костный обмен, среди детей с ПГ выделена группа риска по развитию метаболических нарушений костной ткани.
2. Доказано, что отказ от курения, терапевтические мероприятия, направленные на оздоровление женщины до и во время беременности, рациональное грудное вскармливание, адекватная профилактика рахита, инфекционных заболеваний являются эффективными мерами по предупреждению метаболических остеопатий у грудных детей.
3. Доказана необходимость мониторинга показателей минерального и костного обмена у детей с ПГ на первом году жизни с целью своевременной коррекции выявленных нарушений.
Внедрение в практику
Результаты работы внедрены в практическую деятельность педиатрического отделения патологии новорожденных и недоношенных, педиатрического отделения для детей раннего возраста, консультативной поликлиники ГУЗ «Республиканская детская клиническая больница Министерства здравоохранения Удмуртской Республики», МУЗ «Детская городская поликлиника №1» г. Ижевска, в учебный процесс кафедры педиатрии и неонатологии ГОУ ВПО «Ижевская государственная медицинская академия» Росздрава.
Основные положения, выносимые на защиту
1. Особенностями фосфорно-кальциевого обмена у детей с ПГ в периоде новорождёипости является гипокальциемия, обусловленная дефицитом 25-0Н-03,
и низкий уровень KT. В грудном возрасте у детей с ПГ II-III степени наблюдается вторичный гиперпаратиреоз.
В грудном возрасте у детей с ПГ II-III степени наблюдается вторичный гиперпаратиреоз.
2. Метаболические нарушения костной ткани зависят от тяжести ПГ и характеризуются, в зависимости от возраста, преимущественно низким уровнем обмена с подавлением обеих фаз ремоделирования кости, а также относительным превалированием или угнетением костной резорбции на фоне сохранного остеобразования.
3. Антенатальными факторами риска развития метаболических нарушений костной ткани у детей с ПГ являются заболевания сердечно-сосудистой системы и генитальная патология у матерей, никотиновая интоксикация, фетоплацентарная недостаточность (ФПН), хроническая внутриутробная гипоксия плода. В постна-тальном периоде негативное влияние на минеральный и костный обмен оказывают нерациональное вскармливание, неадекватная специфическая профилактика рахита, острые инфекционные заболевания и дефицит массы тела.
Апробация работы
Материалы работы доложены на X Конгрессе педиатров России «Актуальные проблемы педиатрии» (Москва, 2006), VI Российском конгрессе «Современные технологии в педиатрии и детской хирургии» (Москва, 2007), IV межрегиональной межвузовской научной конференции молодых учёных и студентов «Актуальные вопросы биологии и медицины» (Ижевск, 2007), XI Конгрессе педиатров России «Актуальные проблемы педиатрии» (Москва, 2007), V межрегиональной межвузовской научной конференции молодых учёных и студентов «Современные аспекты медицины и биологии» (Ижевск, 2008), XII конгрессе педиатров России «Актуальные проблемы педиатрии» (Москва, 2008), VIII Российском конгрессе «Современные технологии в педиатрии и детской хирургии» (Москва, 2009), IX межвузовской научной конференции молодых учёных и студентов (Ижевск, 2009), XI итоговой открытой межрегиональной научно-практической конференции молодых учёных и студентов с международным участием «Молодёжь и медицинская наука в XXI веке» (Киров, 2009), XV Всероссийской научно-практической конференции «Молодые ученые в медицине» (Казань, 2010), Республиканской конференции для педиатров «Национальные программы Союза педиатров России в практику здра-
воохранения» (Ижевск, 2010), X межвузовской научной конференции молодых учёных и студентов «Современные аспекты медицины и биологии» (Ижевск, 2010).
По теме диссертации опубликовано 16 научных работ, из них 2 — в журналах, рецензируемых ВАК.
Объём и структура диссертации
Диссертация изложена на 134 страницах машинописного теста и состоит из введения, обзора литературы, описания материала и методов исследования, главы собственных исследований, заключения с обсуждением результатов, выводов, практических рекомендаций, списка литературы. Текст иллюстрирован 24 таблицами, 16 рисунками, 3 выписками из истории болезни. Указатель литературы включает 221 источник (135 отечественных и 86 иностранных).
Материалы и методы исследования
Работа выполнена в течение 2005-2010 годов на кафедре педиатрии и нео-натологии (заведующий — д.м.н., профессор A.M. Ожегов) ГОУ ВПО «Ижевская государственная медицинская академия» Росздрава (ректор — д.м.н., профессор U.C. Стрелков). Обследование детей с ПГ проведено на базе ГУЗ «Республиканская детская клиническая больница Министерства здравоохранения Удмуртской Республики» (главный врач — H.A. Краснова), МУЗ «Детская городская больница №1 » г. Ижевска (заведующая детской поликлиникой — J1.A. Яковлева).
До начала исследования у всех матерей получено информированное согласие. Проведение исследования одобрено комитетом по биомедицинской этике при ГОУ ВПО «Ижевская государственная медицинская академия» Росздрава.
Работа выполнена на основании динамического наблюдения 96 доношенных детей с ПГ с периода новорождённое™ до 1 года (основная группа — группа I). В зависимости от степени ПГ пациенты были разделены на 3 подгруппы: с I степенью 53 ребёнка, II — 32, III — 11 детей (табл. 1).
Диагноз ПГ выставлялся на основании комплекса клинических данных и оценки физического развития в периоде новорождённое™. Физическое развитие в неонатальном периоде определяли по оценочным (перцентильным) таблицам физического развития новорождённых с учетом гестационного возраста (Демен-
тьева Г.М., 1984). Показатели роста находились в пределах нормальных значений (/»>10) для данного гестационного возраста. Степень тяжести ПГ определялась путем расчёта массо-ростового коэффициента. Группу сравнения (II группа) составили 44 доношенных ребёнка, родившихся с массо-ростовыми показателями, соответствующими сроку гестации.
Степень тяжести ПГ определялась путем расчёта массо-ростового коэффициента. Группу сравнения (II группа) составили 44 доношенных ребёнка, родившихся с массо-ростовыми показателями, соответствующими сроку гестации.
У детей обеих групп изучено состояние костной системы в периоде новорож-дённости, в возрасте 6 и 12 месяцев. В эти же возрастные периоды исследовано состояние минерального и костного обмена. У новорождённых детей исследование показателей фосфорно-кальциевого обмена и костного ремоделирования проводилось в конце первой — начале второй недели жизни; содержание ионизированного Са в периоде новорождённое™ определено у Уз детей основной группы.
Дня оценки антенатальных факторов риска развития нарушений фосфорно-кальциевого и костного обмена проанализировано течение беременности, гинекологический анамнез, хроническая соматическая патология матери.
В периоде новорождённое™ у детей учитывали состояние при рождении, переносимые заболевания. При клиническом исследовании костной системы обращали внимание на размеры большого родничка, открытый малый родничок, сагиттальный и боковые швы, плотность костей, мышечный тонус.
Катамнестическое наблюдение за детьми проводилось в возрасте 6 и 12 месяцев и включало оценку физического (центильные таблицы для оценки физического развития детей г. Ижевска от 0 до 7 лет (2000 г.) и нервно-психического развития (НПР) (количественно-качественная оценка развития детей первых трёх лет жизни по К.Л. Печоре), резистентности; также обращали внимание на другие перенесённые заболевания, характер вскармливания, качество проведения специфической профилактики рахита. При исследовании состояния костной системы учитывали сроки начала прорезывания зубов, количество зубов в возрасте 6 месяцев и к 1 году, их состояние, размеры большого родничка и сроки его закрытия, наличие клинических симптомов рахита. Общеклинические, биохимические, электрокардиографические, ультразвуковые, рентгеновские (по показаниям) исследования проводились по общепринятым методам.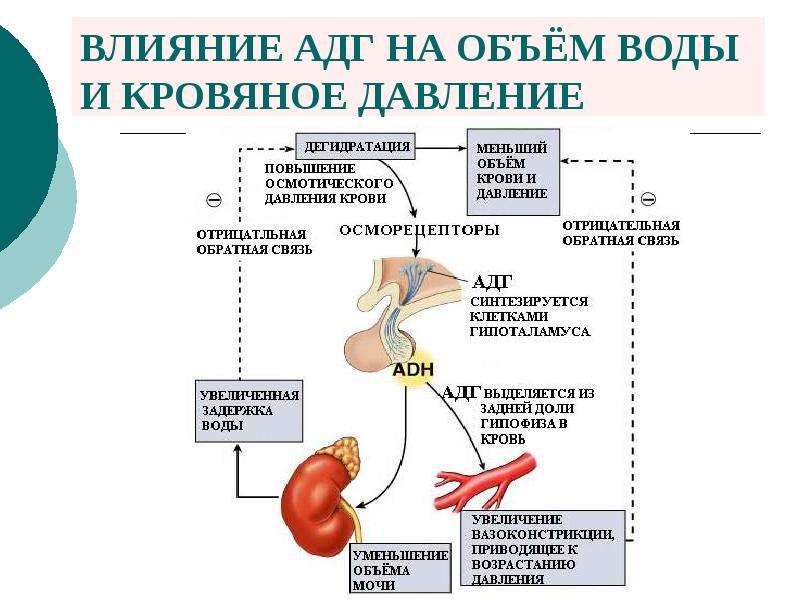 .
.
Таблица I
Объём проведённых клинических и лабораторных исследований
Основная группа Группа
Показатель Возраст В целом по Степень тяжести ПГ сравнения
группе I И III
Клиническое Период ново- 96 53 32 11 44
исследование, рождешгости
кальции, 6 мес. 67 37 22 8 33
фосфор,
щелочная 12 мес. 52 27 17 8 27
фосфатаза
Паратгормон, Период ново- 31 13 10 8 9
кальцитонин, рожденное™
25-гидроксивита- 6 мес. 28 11 9 8 9
мин £>з, остеока-
льцин,С-концевые 12 мес. 28 11 9 8 9
телопептиды
В качестве маркёров костеобразования у детей исследовано содержание ос-теокапьцина (OK), общей щелочной фосфатазы (ЩФ) в сыворотке крови. Уровень OK определяли иммуноферментным методом (тест-набор «Nordic Bioscience Diagnostics A/S N-MID™ Osteocalcin One Step ELISA» фирмы «Nordic Bioscience», Дания). Активность общей ЩФ в крови исследовали оптимизированным стандартным методом (тест-набор фирмы «Human», Германия). Верхняя граница нормы ЩФ составляет 644,0 МЕ/л. Для оценки состояния костной резорбции изучали содержание С-концевых телопептидов (С-КТП) в сыворотке крови иммуноферментным методом (тест-набор «Serum CrossLaps™ One Step ELIS» фирмы «Osteometr Bio Tech», Дания).
При оценке показателей кальцийрегулирующих гормонов, OK и С-КТП у детей с ПГ за норму принимались показатели группы сравнения (М±2о).
Статистическая обработка материала проводилась с помощью компьютерной программы Microsoft Office Excel. Производился расчёт средней величины (М), стандартного отклонения (J), ошибки средней (т). Для оценки достоверности различий показателей использовались параметрические (t — критерий Стыодснта) и непараметрические критерии (U — критерий Вилкоксона-Манна-Уитни). Достоверными считали различия при уровне значимости /><0,05. Взаимосвязь сравниваемых показателей была изучена с помощью коэффициента парной корреляции Пирсона
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ИХ ОБСУЖДЕНИЕ
Средняя масса тела детей с ПГ при рождении равнялась 2728,6±6,4 г, детей группы сравнения — 3583,6±20,9 г (р<0,001). У детей основной группы с увеличением степени гипотрофии масса тела была ниже: при I степени ПГ составила 2908,6±9,5 г (¿<0,001), при II — 2658,1±19,1 г (р<0,001), при III — 2303,3±46,0 г (¿><0,001). Длина тела у новорождённых обеих групп находилась в пределах нормальных значений (50,8±0,13 и 51,8±0,31 см,р>0,05).
У детей основной группы с увеличением степени гипотрофии масса тела была ниже: при I степени ПГ составила 2908,6±9,5 г (¿<0,001), при II — 2658,1±19,1 г (р<0,001), при III — 2303,3±46,0 г (¿><0,001). Длина тела у новорождённых обеих групп находилась в пределах нормальных значений (50,8±0,13 и 51,8±0,31 см,р>0,05).
Средняя оценка по шкале Апгар в основной группе была достоверно ниже в сравнении с детьми, родившимися с нормальной массой тела (7,4+0,17 баллов и 7,9+0,1 баллов на 1-й минуте соответственно, /><0,02). В состоянии асфиксии рождался каждый третий ребенок I группы (29,2% и 20,5% соответственно, />>0,05),
причём только у новорождённых этой группы была зарегистрирована асфиксия средней и тяжёлой степени (9,4%).
Течение неонаталыюго периода было осложнённым у большинства детей с ПГ (96,3% и 63,6% соответственно, р<0,001).
Таблица 2
Патологические состояния у новорождённых детей с ПГ
Патологи- Статис- Основная группа Группа
ческие тические В целом Степень тяжести ПГ сравнения
состояния показа- по группе I 11 III
тели «=96 «=53 «=32 п= 11 «=44
Церебраль- « 68 34 24 10 12
ная ишемия Р±т 70,8±4,6 64,2±6,б 75,0±7,7 90,9±8,7 27,3±6,7
Р <0,001 <0,001 <0,001 <0,001
Проявления п 46 22 17 7 12
внутриутроб- Р±т 47,9±5,1 41,5±6,8 53,1±8,8 63,6±14,5 27,3±6,7
ной инфекции Р <0,01 <0,02 <0,05
Неонаталь- п 41 24 13 4 11
ные желтухи Р±т 42,7±5,4 45,3±6,8 40,6±8,7 36,4±14,5 25,0±6,5
Р <0,02 <0,05
Патологичес- п 27 13 10 4 5
кая убыль Рш 28,1±4,6 24,5±5,9 31,3±8,2 36,4±14,5 11,4±4,8
массы тела Р <0,01 <0,05
Изменения со п 26 12 10 4 6
стороны сер- Р±т 27,1±4,5 22,6±5,7 31,3±8,2 36,4±14,5 13,6±5,2
дечно-сосудис- Р <0,02
тои системы
Полиците- п 33 19 10 4 8
мический Р±т 34,4±4,8 35,9±6,6 31,3±8,2 36,4±14,5 18,2±5,8
синдром Р <0,05 <0,05
Гипоглике- п 18 7 9 2 2
мия Р±т 18,8±4,0 13,2±3,5 28,1 ±7,9 18,2±11,6 4,6±3,1
Р <0,01 <0,01
Гипопро- п 6 3 2 1 -
теинемия Р±т Р 6,3±2,5 5,7±3,2 6,3±4,3 9,1±8,7
Примечание: р — достоверность различий с группой сравнения.
Выявлена высокая частота церебральной ишемии, локализованной внутриутробной инфекции, неонаталыюй желтухи, патологической убыли массы тела, функциональной кардиопатии, полицитемического синдрома, гипогликемии и ги-попротеинемии (табл. 2). С увеличением степени тяжести ПГ указанная патология,
как правило, регистрировалась чаще. При изучении состояния костной системы были выявлены следующие особенности: открытый малый родничок имели 5,6% детей с ПГ, расхождение швов черепа более 0,5 см — 12,5%.
Группа здоровья IIB выставлялась 83,3% новорождённых основной группы, в группе сравнения — 65,9% детей (/><0,05). Группа здоровья I, НА регистрировалась только у детей группы сравнения, III группа здоровья — у детей с ПГ. С увеличением степени тяжести ПГ III группа здоровья регистрировалась чаще.
Антропометрические показатели у детей с ПГ на 1-м году жизни не достигали среднего уровня детей группы сравнения. Из отклонений в физическом развитии у детей с ПГ в возрасте 1-го года преобладало низкое физическое развитие (15,4% и 3,7% соответственно, ¿>>0,05) и дефицит массы тела (25,0% и 3,7%, р<0,01). С увеличением степени тяжести ПГ указанные нарушения регистрировались чаще.
В возрасте 1 месяца у каждого третьего ребёнка I группы диагностировалась задержка НПР (34,9% и 8,1%, /?<0,001), зависящая от степени ПГ. Показатели НПР к возрасту 12 месяцев у детей с ПГ улучшились: задержка регистрировалась у 15,4% детей (в группе сравнения у 7,4% детей, р>0,05).
Таблица 3
Сроки начала прорезывания и количество зубов к 1 году у детей с ПГ
Показатель Статистические показатели Основная группа Группа сравнения «=27
В целом по группе «=52 Степень тяжести ПГ
I «=27 II «=17 III п= 8
Сроки начала прорезывания зубов, мес. М±т Р 6,9±0,21 <0,01 6,8±0,28 7,0±0,45 7,1±1,08 6,2±0,26
Количество зубов к 12 мес. М±т Р 6,4±0,21 <0,02 6,5±0,36 6,4±0,49 6,4±1,12 7,2±0,27
Примечание: р — достоверность различий с группой сравнения.
У детей I группы зубы начали прорезываться позже в отличие от детей группы сравнения (6,9±0,21 мес. и 6,2±0,26 мес.,р<0,01) (табл. 3). С прогрессированием степени ПГ отмечается тенденция к более позднему прорезыванию зубов. Среднее количество зубов к 12 месяцем было меньше у детей основной группы (6,4±0,21 зуба и 7,2±0,27 зуба, р<0,02). Выявлена обратная связь между количеством зубов в возрасте 12 месяцев и кратностью острых заболеваний, переносимых в течение го-
да (г=-0,5,/><0,01). Большой родничок закрылся к 1 году у каждого третьего ребенка (33,3% и 36,8%, />>0,05). Дети основной группы, у которых не закрылся большой родничок к 12 месяцам, имели большие его размеры в отличие от группы сравнения (р<0,001).
Дети с ПГ достоверно чаще имели сниженную и низкую резистентность (28,8% и 11,1%,/КО,05). На первом году жизни у детей основной группы выявлена высокая частота последствий перинатального поражения ЦНС (ПП ЦНС), жслезодефицитной анемии, атопического дерматита (рис. 1).
постдвш« ПП 1ш|ищ|и|»ц1шая пепрмехий рахит
LJC анвммя дермпиг
| И основная rpyma D группа сравнения |
Примечание: *-р<0,05, **-р<0,02, ***-р<0,01.
Рисунок 1. Характеристика заболеваний у детей с ПГ на первом году жизни
Диагноз рахита на первом году жизни достоверно чаще ставился детям с ПГ (32,9% и 12,9%, р<0,02). В основной группе преобладал среднетяжёлый рахит в виде преимущественно подострого течения. При I и II степени тяжести ПГ рахит диагностировался у каждого третьего ребёнка, при III степени — у каждого второго. Профилактика рахита проводилась подавляющему большинству детей обеих групп (89,0% и 93,6%,р>0,05).
В возрасте 12 месяцев большинство детей обеих групп имели II группу здоровья (76,9% и 77,8%, />>0,05). Каждый четвёртый ребёнок, родившийся с ПГ, был отнесён к III группе здоровья (23,1% и 11,1%,/>>0,05).
Таким образом, для детей, родившихся с ПГ, характерно осложненное течение неонатального периода; низкие показатели физического развития, высокая частота фоновых заболеваний, сниженная и низкая резистентность на первом году жизни.
При изучении минерального обмена установлено, что у новорождённых детей с ПГ содержание общего Ca в крови было существенно ниже, чем у младенцев группы сравнения (2,3б±0,04 ммоль/л и 2,49±0,05 ммоль/л, р<0,05). Минимальный уровень Ca зарегистрирован у новорожденных со II-III степенью гипотрофии. Гипокальциемия в раннем неонатальном периоде была диагностирована у 19,8% детей основной группы, в группе сравнения — у 6,8% детей (/КО,05).
При проведении корреляционного анализа выявлено, что хронические воспалительные заболевания половой сферы (г=-0,35, /><0,05), ФПН (/’=-0.33, /К0,05), хроническая внутриутробная гипоксия плода (г=-0,3, /КО,05), курение матери (/=-0,29, /КО,05) способствовали более низком у содержанию Ca в неонатальном периоде. Выявлена зависимость между содержанием Ca в периоде новорождённое™ и ростом на 1-м году жизни (г=+0,6, /КО,01), уровнем Ca в возрасте 6 мес. (г=+0,54,/К0,01), размерами большого родничка в 12 мес. (г—0,38,/КО,05).
Содержание фосфора в крови у новорожденных сравниваемых групп было одинаковым (табл. 4).
Концентрация 25-OH-D3 у новорождённых основной группы была в 2,5 раза меньше, чем у детей группы сравнения (39,4±5,1 нмоль/л и 106,3±13,58 нмоль/л, р<0,01). С увеличением степени тяжести ПГ выявлено более существенное снижение уровня данного показателя. Сниженное содержание 25-OH-D3 диагностировано более чем у половины новорождённых основной группы: при I степени ПГ у 30,8% , при II — у 60,0%, при III степени — у 62,5% детей.
Низкое содержание Ca и 25-OH-D, у детей с ПГ обусловлено недостаточным поступлением микронутриентов антенатально вследствие плацентарной недостаточности. При дефиците витамина D уменьшается синтез кальцийсвязывающего белка в кищечнике, что усугубляет снижение, кальция крови.
В ответ на гипокальциемию у новорожденных с ПГ II-III степени наблюдается гиперфункция паращитовидных желез, что проявляется повышенным уровнем ПТГ и нарушением минерализации костной ткани. Повышенное содержание ПТГ определялось у 12,9% детей основной группы, причём средняя его концентрация имела тенденцию к, росту с увеличением степени ПГ, так при II степени гипотрофии повышенный уровень ПТГ отмечался у каждого пятого ребёнка, при III степени — у каждого четвёртого. В то же время средняя концентрация KT у новорождённых с
Повышенное содержание ПТГ определялось у 12,9% детей основной группы, причём средняя его концентрация имела тенденцию к, росту с увеличением степени ПГ, так при II степени гипотрофии повышенный уровень ПТГ отмечался у каждого пятого ребёнка, при III степени — у каждого четвёртого. В то же время средняя концентрация KT у новорождённых с
ПГ была существенно ниже, чем в группе сравнения (6,9±1,08 пг/мл и 10,2±1,72 пг/мл соответственно, р<0,05), что оказывает негативное влияние на минеральный и костный обмен.
Высокий уровень ПТГ в организме, в свою очередь, оказывает ингибирующее действие на активность остеобластов, продуцирующих ОК. В периоде новорождённое™ концентрация ОК у детей с ПГ была в 1,8 раза ниже, чем у детей группы сравнения (55,9±7,96 нг/мл и 101,8±11,9 нг/мл, р<0,01). Минимальный уровень этого показателя зарегистрирован у детей с III степенью ПГ (р<0,05).
Перииаталь* ио-зиа чимые инфекции заболевания сердечно-сосудистой системь. порядковый помер родов хроническая внутр иутрой пая гипоксия плода аофаст женщины нарушение менструальной функции
г= -0,49* г= -0,5* г= -0,4Н* г—0,55* / = -0,4Н * *■= -0,51 *
рост у новораж да того кальци-топин оценкат Апгар 1-я мин. рост на 1-м году количество зубов в 1 год размеры большого родничка в 1 год кратность острых заболеваний в течение года остео-калъцин в ¡2 мес.
г =±0,5* /■=4 г = л-0,49* ,-=+0.7** г=+0г87* г—0,49*
Примечание: *-р<0,05, **-р<0,01.
Рисунок 2. Корреляции содержания остеокальцина у новорождённых детей с ПГ с антенатальным анамнезом и развитием на первом году жизни
Как показывают результаты корреляционного анализа (рис. 2), уровень ОК зависел от антенатальных факторов, определял состояние детей при рождении, линейный рост и костеобразование. Чем выше была концентрация КТ, тем более высокие значения ОК регистрировались у новорождённых детей (г=+0,8, /><0,01). По данным литературы, у детей низкий уровень ОК и КТ свидетельствует о «вялом ремоделировании» и сопровождается значимым уменьшением плотности костной ткани.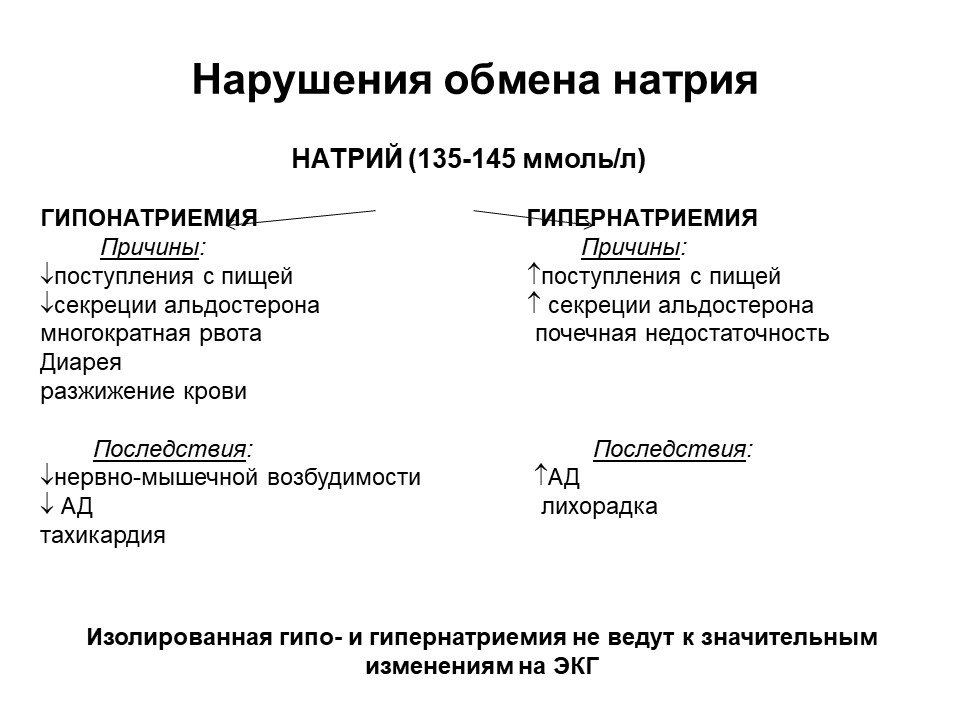
Содержание С-КТП, также как и OK, было существенно ниже у новорождённых основной группы. Наиболее низкие показатели этого маркёра диагностированы при III степени ПГ. Низкая костная резорбция обусловлена нарушением созревания, дифференцировки и активности остеокластов (чему способствует дефицит 25-OH-D}), а также недостаточной стимуляцией хемотаксиса предшественников остеокластов при низком синтезе ОК. Низкие уровни OK и С-КТП в целом свидетельствуют о снижении темпов костного ремоделирования.
Таким образом, у каждого пятого ребёнка с ПГ в раннем неонатальном периоде диагностирована гипокальциемия, обусловленная дефицитом 25-OH-D3. Содержание KT было сниженным, уровень ПТГ имел тенденцию к повышению. Метаболизм костной ткани характеризуется «вялыми темпами ремоделирования», что подтверждается более низким уровнем OK и С-КТП, особенно при тяжёлой ПГ.
К 6-ти месячному возрасту у подавляющего большинства детей основной группы отмечается нормализация уровня Ca и кальцийрегулирующих гормонов наряду с увеличением активности 1ДФ. В то же время у каждого десятого ребёнка, имевшего при рождении ПГ II-III степени, была зарегистрирована гипокальциемия и дефицит 25-OH-D;. В полугодовалом возрасте выявлена прямая связь между содержанием Ca и 25-OH-D3 (г=+0,56,/?<0,05). Повышенный уровень ПТГ установлен у 17,9% детей со II-III степенью ПГ, что свидетельствует о нарушении минерализации костной ткани.
В 6-ти месячном возрасте уровень OK был практически одинаковым в обеих группах детей. Максимальные показатели OK зарегистрированы у детей, имевших при рождении тяжёлую гипотрофию, что, наряду с достоверным повышением у них уровня KT (р<0,05), свидетельствует об оживлении процессов костеоб-разования. Концентрация OK в этом возрасте зависела от продолжительности грудного вскармливания (г=+0,59, р<0,05), получения витамина D в профилактической или лечебной дозе (г=+0,56, /?<0,05), уровня 25-OH-D3 в сыворотке крови (г=+0,58, /КО,05). Чем выше было содержание OK, тем меньшие размеры большого родничка имели дети (г=-0,6, р<0,05).
В то же время в этом возрасте у детей, родившихся с ПГ, уровень С-КТП был в 2 раза меньше, чем у детей в группе сравнения (р<0,001). Наиболее низкие значения этого маркёра выявлены у детей с тяжёлой гипотрофией. Низкая костная
резорбция, по-видимому, является защитной реакцией, направленной на предотвращение уменьшения минеральной плотности костной ткани.
Таким образом, костный обмен у детей полугодовалого возраста характеризуется, с одной стороны, адекватным остеообразованием, а с другой — снижением резорбции, что свидетельствует о дисбалансе процессов костного ремодели-рования.
В 12-ти месячном возрасте уровень Са был одинаковым у детей обеих групп, при этом у детей с тяжёлой ПГ — достоверно ниже (2,33±0,04 ммоль/л, р<0,05). Гипокальциемия диагностирована у 19,2% детей с ПГ (в группе сравнения у 3,7% детей, /><0,05), преимущественно при II и III степени. Содержание Са было ниже у детей, имевших рахит (г=-0,4, р<0,05), заболевания желудочно-кишечного тракта (/-=-0,38, /><0,05) и острые респираторные заболевания (/-=-0,5,/><0,01). Чем выше была концентрация Са, тем больше зубов имели дети к 1 году (/-=+0,68,/><0,01).
В годовалом возрасте у детей основной группы концентрация ПТГ была существенно выше, чем у детей группы сравнения (р<0,()5). Наиболее высокие показатели этого гормона зарегистрированы при Н-Ш степени ПГ, что свидетельствует о нарушении минерализации костной ткани. Установлена прямая связь средней силы между уровнем ПТГ и содержанием ЩФ (»-=+0,66, р<0,01). Уровень этого фермента был существенно повышен у детей с тяжелой степенью ПГ. Концентрация КТ и 25-ОН-Оз у детей основной группы не отличалась от показателей группы сравнения.
В возрасте 12 месяцев уровень ОК был практически одинаковым в обеих группах детей. Установлено, что в годовалом возрасте концентрация ОК зависела от продолжительности грудного вскармливания (/»=+0,64, /><0,01), своевременности введения прикормов (/-=+0,63,/><0,01) и уровня Са (г=+0,63,/><0,01). Выявлена прямая связь между уровнем ОК и количеством зубов у детей к 1 году (г=+0,73, /><0,01). Более низкие показатели ОК зарегистрированы у детей с заболеваниями желудочно-кишечного тракта (/=-0,78, /><0,01) и дефицитом массы тела (г=-0,63, р< 0,01).
Выявлена прямая связь между уровнем ОК и количеством зубов у детей к 1 году (г=+0,73, /><0,01). Более низкие показатели ОК зарегистрированы у детей с заболеваниями желудочно-кишечного тракта (/=-0,78, /><0,01) и дефицитом массы тела (г=-0,63, р< 0,01).
Таблица 4
Показатели, характеризующие метаболизм костной ткани у детей грудного возраста, родившихся с ПГ
Показатель Возраст Статистические Основная группа Группа
показатели В целом по Степень тяжести ПГ сравнения
группе I II III
1 2 3 4 5 6 7 8
Кальций, ммоль/л Новорожденные п М±т Р 96 2,36±0,04 <0,05 53 2,47±0,06 32 2,32±0,06 <0,05 11 2,28±0,16 <0,05 44 2,49±0,05
6 мес. п 67 37 22 8 33
М±т 2,41±0,03 2,45±0,06 2,38±0,1 2,38±0,1 2,48±0,1
Р >0,05
12 мес. п 52 27 17 8 27
М±т 2,41±0,03 2,43±0,05 2,44±0,1 2,33±0,04 2,42±0,04
Р ■ >0,05 <0,05
Фосфор, ммоль/л Новорожденные п М±т Р ‘ 96 1,69±0,05 >0,05 53 1,7±0,13 32 1,71±0,08 11 1,53±0,22 44 1,7±0,09
6 мес. п 67 37 22 8 33
М±т 1,74±0,03 1,77±0,06 1,66±0,06 1,78±0,07 1,65±0,11
Р >0,05
12 мес. п 52 27 17 8 27
М±т 1,61±0,03 1,56±0,04 1,6±0,1 1,6±0,17 1,63±0,07
Р >0,05
Паратгормон, пг/мл Новорожденные п М±т Р 31 26,4±3,6 >0,05 13 24,7±4,19 10 27,0±7,2 8 29,2±8,6 9 23,3±3,42
1 2 3 4 5 6 7 8
Паратгормон, пг/мл 6 мес. п М±т Р 28 22,9±2,46 >0,05 11 18,5±1,95 9 24,8±2,11 <0.02 8 23,7±2,7 <0,05 9 17,4±1,46
12 мес. п М±т Р 28 25,5±1,61 <0,05 11 22,7±1,4 9 25,8±2,12 <0,05 8 25,7±2,35 <0.05 9 18,3±2,96
Кальцитонин, пг/мл Новорожденные п М±т Р 31 6,9±1,08 <0,05 13 6,1±1,21 <0,05 10 6,6±1,17 8 7,9±3,19 9 10,2±1,72
6 мес. п М±т Р 28 10,0±0,7 >0,05 11 10,1±0,93 9 9,0±0,48 8 10,4±0,85 <0,05 9 8,7±0,88
12 мес. п М±т Р 28 6,5±1.13 — >0,05 11 6,2±2,0 9 6,3±0,66 8 7,0±2,11 9 9,3±0,7
п М±т Р 28 6,5±1.13 — >0,05 11 6,2±2,0 9 6,3±0,66 8 7,0±2,11 9 9,3±0,7
2 5 -гидроксивита-мин А, нмоль/л Новорожденные п М±т Р 31 39,4±5,1 <0,01 13 60,0± 15,04 <0,05 10 35,2±4,64 <0,02 8 27,1±6,85 <0,02 9 106,3±13,58
6 мес. п М±т Р 28 153,3±12,6 >0,05 11 161,6±16,2 9 130,9±15,6 8 157,4±19,4 9 153,6±15,6
12 мес. п М±т Р 28 164,9±15,5 >0.05 11 189,9±21,6 9 162,5±15,6 8 144,8±16,1 9 150,1±9,3
Щелочная фосфатаза, Ед/л Новорожденные п М±т Р 96 480,7± 18,48 >0,05 53 477,3±44,9 32 452,9±50,5 11 522,8±82,7 44 424,7±88,7
Продолжение табл. 4
1 2 3 4 5 6 7 8
6 мес. п 67 37 22 8 33
М±т 496,6±21,48 504,3±38,36 430,6±36,6 563,7±49,1 398.8±21.32
Щелочная Р <0,01 <0.02 <0.01
фосфатаза. Ед/л 12 мес. п 52 27 17 8 27
М±т 526,8±31,2 541,5±45,3 435,5±34,2 676.2±13.4 478,8±52,2
Р >0,05 <0,05
Остеокальцин, Новорожденные п 31 13 10 8 9
нг/мл М±т 55,9±7,96 56,2±8,23 69,7±12,1 37.9±3,6 101,8±11,9
Р <0,01 <0,05 <0,05
6 мес. п 28 11 9 8 9
М±т 100,8±5,64 96,1±12,9 88,6±9,3 117,8±9,37 101,9±3,51
Р >0,05
12 мес. п 28 11 9 8 9
М±т 100,4±7,52 91,7±8,37 103,6±7,58 103.8±8,8 88,1±8,63
Р >0,05
С-концевые Новорожденные п 31 13 10 8 9
телопептиды, М±т 1,06±0,08 1,07±0,09 1,38±0,06 0,82±0,11 1,76±0,28
нг/мл Р <0.05 <0.05 <0,05
6 мес. п 28 11 9 8 9
М±т 0,71±0,06 0,77±0,05 0,81±0,02 0,59±0,08 1,46±0,1
Р <0,001 <0,05 <0,05 <0,05
12 мес. п 28 11 9 8 9
М±т 0,82±0,08 0,69±0,09 0,68±0,16 1,07±0,12 0,81±0.001
Р >0,05 <0.05
Примечание: р — достоверность различий с группой сравнения.
Содержание С-КТП у детей сравниваемых групп статистически не различалось (/?>0,05), за исключением детей, имевших при рождении тяжёлую гипотрофию, у которых уровень этого соединения был существенно выше (1,07±0,12 нг/мл, /?<0,05). Выявлена прямая связь средней силы между содержанием С-КТП и уровнем ЩФ (г=+0,64, р<0,01). Повышенный уровень С-КТП при нормальном содержании ОК у детей, имевших при рождении тяжёлую гипотрофию, свидетельствует о дисбалансе процессов костного ремоделирования с преобладанием резорбции, обусловливающей снижение минеральной костной плотности.
Выявлена прямая связь средней силы между содержанием С-КТП и уровнем ЩФ (г=+0,64, р<0,01). Повышенный уровень С-КТП при нормальном содержании ОК у детей, имевших при рождении тяжёлую гипотрофию, свидетельствует о дисбалансе процессов костного ремоделирования с преобладанием резорбции, обусловливающей снижение минеральной костной плотности.
Таким образом, выявленныенарушения минерального обмена и костного ремоделирования у новорождённых и детей грудного возраста, родившихся с ПГ, являются основной причиной снижения минеральной костной плотности, что требует разработки методов адекватной терапевтической коррекции препаратами кальция и витамином £>.
ВЫВОДЫ
1. У новорождённых детей с ПГ наиболее существенными отклонениями в состоянии здоровья являются церебральная ишемия (70,8%), локализованная бактериальная внутриутробная инфекция (47,9%), клинические признаки нарушенного костеобразования (12,5%). Постнатальная адаптация характеризуется высокой частотой неонаталыюй желтухи (42,7%), значительной потерей первоначальной массы тела (28,1%), дезадаптацией сердечно-сосудистой системы (27,1%), полиците-мическим синдромом (34,4%), гипогликемией (18,8%) и гипопротеинемией (6,3%).
2. Дети, родившиеся с ПГ, на первом году жизни имеют низкие показатели физического развития (дефицит массы тела к 12-ти месяцам наблюдается у каждого четвёртого ребёнка), отставание в нервно-психическом развитии, сниженную и низкую резистентность, высокую частоту фоновых состояний (последствия перинатального поражения ЦНС — 86,3%, железодефицитная анемия — 56,2%, атопи-ческий дерматит — 35,6%, рахит — 32,9%).
3. Особенностями фосфорно-кальциевого обмена у детей, родившихся с ПГ, в периоде новорождённое™ является гипокальциемия, обусловленная дефицитом 25-0Н-03, степень выраженности сдвигов которых коррелирует с тяжестью гипотрофии. Уровень ПТГ соответствует нормальным значениям, а КТ снижен, что ока-
зывает существенное влияние на костеобразование. Метаболизм костной ткани характеризуется «вялыми темпами ремоделирования» с одновременным подавлением образования кости и её резорбции, особенно при тяжёлой гипотрофии.
Метаболизм костной ткани характеризуется «вялыми темпами ремоделирования» с одновременным подавлением образования кости и её резорбции, особенно при тяжёлой гипотрофии.
4. В 6-ти месячном возрасте у детей, родившихся с ПГ, отмечается нормализация уровня кальцийрегулирующих гормонов, содержания Са и ОК в крови. Костный обмен характеризуется, с одной стороны, адекватным остеобразованием, а с другой — снижением резорбции, что свидетельствует о дисбалансе процессов костного ремоделирования.
5. В возрасте одного года у детей наблюдается гиперфункция паращи-товидных желёз, что проявляется повышенным уровнем ПТГ. У пациентов, родившихся с тяжёлой ПГ, сохраняется гипокальциемия и асинхронность процессов костного ремоделирования с преобладанием резорбции, что является фактором риска снижения минеральной костной плотности.
6. Антенатальными факторами риска развития метаболических нарушений костной ткани у детей с ПГ являются патология сердечно-сосудистой системы (/-=-0,5, р<0,05), возраст женщины (г=-0,48, р<0,05), хронические воспалительные заболевания половой среды (г=-0,35, /><0,05), нарушения менструального цикла (/-=-0,51,/><0,05), никотиновая интоксикация (г=-0,29, р<0,05), фетоплацентарная недостаточность (г=-0,33, /КО,05), хроническая внутриутробная гипоксия плода (г=-0,55, /><0,05). В постнатальном периоде существенное влияние на минеральный и костный обмен оказывают продолжительность грудного вскармливания (/-=+0,64, р<0,01), своевременность и адекватность введения прикормов (г=+0,63,/><0,01), качество проведения специфической профилактики рахита (л=+0,56, /><0,05), частота инфекционных заболеваний (г=-0,5,/><0,01) и дефицит массы тела (/-=-0,63,/><0,01).
ПРАКТИЧЕСКИЕ РЕКОМЕНДАЦИИ
1. Группу повышенного риска по нарушению кальциевого и костного обмена в периоде поворождённости составляют дети с ПГ, у которых имеется отягощенный антенатальный анамнез: заболевания сердечно-сосудистой системы, хронические воспалительные заболевания половой сферы и нарушения менструального цикла у матерей, никотиновая интоксикация, фетоплацентарная недостаточность, хроническая внутриутробная гипоксия плода.
2. Антенатальная профилактика метаболических нарушений костной ткани у детей с ПГ должна включать приём препаратов, содержащих витамин D и соли кальция, отказ от курения, санацию очагов хронической инфекции и терапию, направленную на улучшение маточно-плацентарного кровообращения.
3. Детям с ПГ рекомендовано грудное вскармливание до 12-ти месячного возраста, своевременное и полноценное введение прикормов, проведение неспецифической и специфической профилактики рахита с индивидуальным подбором дозы и режима введения витамина Z)j, назначение препаратов кальция по показаниям, профилактика и лечение сопутствующих заболеваний и инфекционной патологии.
4. Дети, родившиеся с тяжёлой ПГ, нуждаются в проведении специфической профилактики рахита, начиная с 2-х недельного возраста.
5. Детям, родившимся с тяжёлой пренатальной гипотрофией, в возрасте одного года показано назначение препаратов кальция и витамина D с последующей оценкой минерального и костного обмена.
Список работ, опубликованных по теме диссертации
1. Пенкина, Д. Н. Состояние здоровья новорождённых детей с внутриутробной гипотрофией / Д. Н. Пенкина, И. Н. Петрова // Сборник материалов X конгресса педиатров России «Актуальные проблемы педиатрии». — Москва, 2006. — С. 450-451.
2. Особенности развития детей с внутриутробной гипотрофией на первом году жизни / Д. Н. Пенкина [и др.] // Труды Ижевской государственной медицинской академии. — Ижевск, 2006. — Т.44. — С. 101 -102.
3. Пенкина, Д. Н. Особенности костного метаболизма у новорождённых детей с пренатальной гипотрофией / Д. Н. Пенкина, А. М. Ожегов, И. Н. Петрова // Труды Ижевской государственной медицинской академии. — Ижевск, 2007. — Т. 45. -С. 114-115.
4. Пенкина, Д. Н. Кальций-фосфорный обмен у детей с пренатальной гипотрофией / Д. Н. Пенкина, А. М. Ожегов, И. Н. Петрова И Материалы VI Российского конгресса «Современные технологии в педиатрии и детской хирургии». — Москва, 2007.-С. 134.
— Москва, 2007.-С. 134.
5. Особенности метаболизма кальцийрегулиругощих гормонов у детей с внутриутробной гипотрофией / И. Н. Петрова [и др.] // Сборник материалов XI конгресса педиатров России «Актуальные проблемы педиатрии». — Москва, 2007. -С. 526.
6. Особенности метаболизма остеокальцина у детей с внутриутробной гипотрофией У И. Н. Петрова [и др.] /У Сборник материалов XI конгресса педиатров России «Актуальные проблемы педиатрии». — Москва, 2007. — С. 526-527.
7. Пенкина, Д. Н. Содержание кальцийрегулиругощих гормонов и остеокальцина у детей с внутриутробной гипотрофией / Д. Н. Пенкина // Материалы IV межрегиональной межвузовской научной конференции молодых учёных и студентов «Актуальные вопросы биологии и медицины». — Ижевск, 2007. — С. 93-94.
8. Пенкина, Д. Н. Динамика показателей костного метаболизма у детей с внутриутробной гипотрофией на первом году жизни У Д. Н. Пенкина // Материалы V межрегиональной межвузовской научной конференции молодых учёных и студентов «Современные аспекты медицины и биологии». — Ижевск, 2008. — С. 70-72.
9. Пенкина, Д. Н. Особенности течения неонатального периода у детей с пренатальной гипотрофией У Д. Н. Пенкина УУ Материалы IX межвузовской научной конференции молодых учёных и студентов. — Ижевск, 2009. — С. 174-176.
10. Пенкина, Д. Н. Состояние здоровья детей с пренатальной гипотрофией на первом году жизни / Д. Н. Пенкина // Вятский медицинский вестник. Материалы XI итоговой открытой межрегиональной научно-практической конференции молодых учёных и студентов с международным участием «Молодёжь и медицинская наука в XXI веке». — Киров, 2009. — №1. — С. 46-47.
11. Королева, Д. Н. Факторы риска рождения детей с пренатальной гипотрофией / Д. Н. Королева, А. М. Ожегов, И. Н. Петрова // VIII Российский конгресс «Современные технологии в педиатрии и детской хирургии». — Москва, 2009. — С. 160-161.
12. Ожегов, А. М. Особенности минерального обмена и костного метаболизма у новорождённых с пренатальной гипотрофией / А. М. Ожегов, Д. Н. Королева, И. Н. Петрова // Вопросы практической педиатрии. — 2009. — Т. 4, №3. — С. 23-26.
М. Ожегов, Д. Н. Королева, И. Н. Петрова // Вопросы практической педиатрии. — 2009. — Т. 4, №3. — С. 23-26.
13. Королева, Д. Н. Особенности течения антенатального периода у детей, родившихся с препатальной гипотрофией / Д. Н. Королева // XV Всероссийская научно-практическая конференция «Молодые учёные в медицине». — Казань, 2010. -С. 162-163.
14. Королева, Д. Н. Минеральный обмен у детей с препатальной гипотрофией на первом году жизни / Д. Н. Королева, А. М. Ожегов, И. Н. Петрова // Здоровье, демография, экология финно-угорских пародов. — Ижевск, 2010. — №3. — С. 40.
15. Королева, Д. Н. Физическое развитие детей, родившихся с препатальной гипотрофией, на первом году жизни / Д. Н. Королева// Материалы X межвузовской научной конференции молодых учёных и студентов «Современные аспекты медицины и биологии». — Ижевск, 2010. — С. 203-204.
16. Ожегов, А. М. Особенности минерального обмена и формирования костной ткани в грудном возрасте у детей, родившихся с пренаталыюй гипотрофией / А. М. Ожегов, Д. Н. Королева, И. Н. Петрова // Детская больница. — 2010.-№3 (41).-С. 23-29.
Список сокращений
25-0Н-03 — 25-гидроксивитамин КТ — кальцитонин
НПР — нервно-психическое развитие
ОК — остеокальцин
ПГ — пренатальная гипотрофия
ПП ЦНС — перинатальное поражение центральной нервной системы
ПТГ — паратиреоидный гормон
ФПН — фетоплацентарная недостаточность
ЩФ — щелочная фосфатаза
С-КТП — С-концевые телопептиды
Са — кальций
Отпечатано с оригинал-макета заказчика
Подписано в печать 06.09.10. Формат 60×84 1/|6. Тираж 100 экз. Заказ № 1431.
Типография ГОУВПО «Удмуртский государственный университет» 426034, Ижевск, ул. Университетская, 1, корп. 4.
V. 1. Нарушения минерального обмена.
Причиной
многих расстройств и даже угрожающих
жизни состояний нередко являются
нарушения минерального обмена. Это
Это
связано с тем, что электролиты влияют
на различные стороны жизнедеятельности
организма. Наряду с участием в поддержании
осмотического давления, кислотно-основного
состояния, в распределении воды между
клеточным и внеклеточным пространствами,
электролиты играют большую роль в
процессах нервно-мышечной возбудимости,
влияют на сократимость мышечных клеток.
Минеральный обмен тесно связан с другими
видами обмена – углеводным, энергетическим,
белковым и т.д. Поэтому понятно, что
сохранение различных гомеостатических
параметров организма в значительной
степени обусловлено состоянием
минерального обмена.
Расстройства
жизнедеятельности могут возникать
вследствие недостаточного или избыточного
поступления и усвоения электролитов,
но они могут быть следствием нарушения
функций эндокринной системы (гипофиза,
надпочечников, щитовидной и паращитовидных
желез) или недостаточного поступления
с пищей некоторых витаминов (например,
витаминов группы D).
Нарушение
обмена кальция. Кальций
обладает высокой биологической
активностью, являясь основным структурным
компонентом костей скелета и зубов,
важным фактором свертывания крови.
Кальций участвует в регуляции
проницаемости клеточных мембран,
электрогенезе нервной, мышечной и
железистой ткани, процессах синаптической
передачи, молекулярном механизме
мышечного сокращения, контролитует
ряд ферментативных процессов, оказывает
влияние на процессы синтеза макроэргов.
Кальций относится к трудно усвояемым
элементом. Поступающие с пищей соединения
кальция практически нерастворимы в
воде. Под влиянием кислого содержимого
желудка они частично переходят в
растворимые соединения. Всасывание
кальция происходит в основном в
двенадцатиперстной кишке (начальной
части тонкой кишки) в виде одноосновных
фосфорнокислых солей и в значительной
степени зависит от содержания жира,
жирных кислот, витамина D.
В крови содержится 2,1-2,55 ммоль/л кальция.
Обмен
кальция в организме находится под
нейрогормональным контролем. Паратиреоидин
Паратиреоидин
(паратгормон) повышает содержание
кальция в крови благодаря увеличению
его всасывания в кишечнике, задержке
выделения с мочой, рассасыванию костной
ткани за счет растворения ее минеральных
и органических компонентов. Антагонистом
паратгормона является кальцитонин
(тиреокальцитонин), который способен
предупреждать остеопороз, подавлять
распад коллагена, увеличивать экскрецию
кальция с мочой. На обмен кальция
оказывают также влияния соматотропный
гормон, глюкокортикоиды, минералокортикоиды,
тироксин, инсулин и другие гормоны.
Гиперкальциемия
может возникать при избыточном
поступлении солей кальция в организм
(в том числе в виде лекарственных
препаратов), уменьшении выведения
кальция через почки при гиперпродукции
паратгормона, гипервитаминозе D,
разрушении костной ткани, гипотиреозе,
а также иметь наследственное происхождение.
Начальными проявлениями гиперкальциемии
могут быть диспепсические расстройства
(снижение аппетита, тошнота, рвота и
т.д.), жажда и полиурия (наиболее постоянные
признаки гиперкальциемии), гипотония
мышц, гиперефлексия, боли в костях.
Выраженные длительно текущие формы
гиперкальциемии характеризуются
задержкой роста у детей, кальцинозом
сосудов, артериальной гипертензией,
кальцификицией роговицы, грубыми
нарушениями функций ЦНС.
Устранение
гиперкальциемии может быть достигнуто
прежде всего лечением заболевания,
вызвавшего нарушения кальциевого
обмена. Например, при гиперпаратиреозе
единственным рациональным путем
коррекции обмена кальция является
хирургическое удаление гормонально
активной опухоли или гиперплазированной
ткани околощитовидных желез. У детей
с гиперкальциемией при выявлении
признаков расстройства кальциевого
обмена необходимо ограничить поступление
в организм витамина D.
При выраженной гиперкальциемии,
патологическом окостенении скелета,
отложении кальция в почках, мышцах,
сосудах применяют внутривенное введение
динатриевой соли этилдиаминтетрауксусной
кислоты, способной образовывать
комплексные соединения с ионами кальция.
Гипокальциемия
может
возникнуть при снижении или полном
прекращении продукции паратгормона
(например, в результате удаления
околощитовидных желез), гиповитаминозе
D,
уменьшении всасывания кальция в
кишечнике вследствие его поражения
или недостаточного выделения желчи,
респираторном некомпенсированном
алкалозе.
Гипокальцемия
проявляется повышением нервно-мышечной
возбудимости и развитии тетанических
судорог, гипокоагуляцией крови,
ослаблением сердечной деятельности,
артериальной гипотензией. При длительной
гопокальциемии возникают рахит у детей,
различные трофические расстройства,
в том числе, кататракта, нарушение
обызвествления дентина зубов и др.
Пути
устранения гипокальциемии зависят от
причин ее развития и от формы возникающих
расстройств. В связи с тем, что в
большинстве случаев гипокальциемия
является следствием ослабления или
выпадения функции околощитовидных
желез заместительная гормонотерапия
имеет первоначальное степенное значение.
В настоящее время широко применяется
препарат паратиреоидного гормона –
паратиреоидин. Для купирования приступов
тетании у больных с выраженной
гипокальциемией применяют внутривенные
введения растворов хлористого кальция,
глюконата или лактата кальция, а также
используют препараты витамина D,
дигтдротахистирол. Для устранения
гипокальциемии, возникшей в результате
развития алкалоза, применяют средства,
направленные на коррекцию нарушения
кислотно-основного состояния.
Нарушения
обмена фосфора. Фосфор
и кальций являются основными компонентами
костной ткани. 98% от общего содержания
фосфора и кальция в организме приходится
на долю костной ткани и зубов. Нарушения
обмена фосфора проявляются в виде
гипофосфатемии и гиперфосфатемии. В
крови содержится 0,87-1,145 ммоль/л фосфора.
Гипофосфатемия
характеризуется понижением содержания
фосфора в сыворотке крови. Этот вид
Этот вид
нарушения обмена фосфора возникает
при гиперфункции паращитовидных желез
(торможение реабсорбции фосфора в
канальцах почек), гиповитаминозе D
(усилена экскреция фосфата с мочой),
первичной недостаточности канальцев
почек (проксимальных, дистальных –
нарушена реабсорбция фосфора).
Гипофосфатемия
ведет к торможению образования
макроэргических соединений
(аденозинтрифосфат, креатинфосфат),
нарушению образования РНК и ДНК, задержке
минерализации костей, развитию рахита,
остеомаляции, остеопороза.
Гиперфосфатемия
выражается в повышении содержания
фосфора в сыворотке крови. Может
возникнуть при гипофункции паращитовидных
желез (фосфор активно реабсорбируется
в канальцах почек, а секреция в канальцах
замедляется), поражении клубочков почек
(торможение фильтрации фосфора –
гиперфосфатемия и геперфосфатурия).
Нарушения
обмена магния. Магний
– один из основных наряду с калием
катионов клетки, его общее содержание
у взрослого человека составляет примерно
20-30 г. В сыворотке крови содержится
1,8-2,5 ммоль/л магния, в эритроцитах –
около 3,5 ммоль/л, а в клетках тканей –
16 ммоль/л. Основным депо магния, как и
кальция, является костная ткань. В
отличие от кальция, магний в больших
количествах содержится не только в
костной, но и в мышечной ткани. В крови
он находится преимущественно в
ионизированной форме. Магний активирует
многие ферменты (фосфатазы, фосфорилазы),
участвует в белковом и углеводном
обменах, влияет на нервно-мышечную
возбудимость.
Гипомагниемия
– снижение концентрации магния в плазме
крови ниже нормы, может возникать
вследствие уменьшения всасывания
магния из-за образования нерастворимых
магниевых солей с жирными кислотами
(например, при ахолии, вызванной
обтурацией желчевыводящих путей),
недостаточности внешнесекреторной
функции поджелудочной железы (например
при панкреатитах), при хроническом
алкоголизме, а также в результате
увеличенных потерь магния при неукротимой
многократной рвоте, хронической диарее,
продолжительных и обильных внутривенных
различных растворов, ведущих к выведению
магния с мочой. Ранними проявлениями
Ранними проявлениями
гипомагниемии являются повышение
нервно-вышечной возбудимости
(гиперрефлексия, тремор, вплоть до
тетании), тахикардия, повышение
артериального давления. Когда концентрация
мания в сыворотке крови снижается до
1 ммоль/л, возникает синдром, напоминающий
белую горячку. У больного наблюдается
полукоматозное состояние. Появляются
мышечная дрожь, спазмы мышц в области
запястья и стопы. Введение магния
вызывает быстрое улучшение состояния.
Всасывание
магния в кишечнике задерживается при
избыточном поступлении в ЖКТ жирных
кислот, солей фитиновой кислоты,
содержащейся в злаковых растениях,
фосфотов, при недостаточности витамина
D
и т.д. Существует врожденная недостаточность
всасывания магния из кишечника. При
хронической гипомагниемии отмечаются
расстройства, сходные в проявлениями
гиперкальциемии, но происходящие при
нормальном содержании кальция в крови.
Коррекция
расстройств, вызванных гипомагниемией,
может быть достигнута путем парентерального
введения солей магния. Однако в первую
очередь лечебные мероприятия должны
быть направлены на устранение патологии,
вызвавшей гипомагниемию.
Таблица 17.
Физиологическая
роль, суточная потребность организма
и источники поступления основных
минеральных ионов и микроээлементов.
Элементы
Физиологическая
роль и суточная потребностьИсточники
Натрий
Содержится
преимущественно во внеклеточной
жидкости и плазме крови. Играет роль
в процессах возбуждения, создании
величины осмотического давления
жидкостей внутренней среды,
распределении и выведении воды из
организма; участвует в функции
бикарбонатной буферной системы.
Суточная потребность – 130-155 ммоль.Поваренная
соль, растительная и животная пища,
жидкости, потребляемые при питье.Кальций
Выполняет
функцию структурного компонента в
тканях зубов и костей, где содержится
до 99% общего количества кальция в
организме. Вторичный посредник
регуляции функций и метаболизма
клеток. Необходим для осуществления
процессов возбуждения клеток,
синаптической передачи, свертывания
крови, сокращения мышц. Суточная
потребность 20-30 ммоль.Молоко
и молочные продукты, овощи, зеленые
пищевые приправы.Калий
Содержится
преимущественно внутри клеток, а
также в жидкостях внутренней среды.
Необходим для обеспечения возбудимости
клеток, проводимости в нервных
волокнах, сократимости мышц, основных
функциональных свойств миокарда.
Суточная потребность 55-80 ммоль.Овощи
(картофель), мясо, сухофрукты (изюм),
орехи.Хлор
Содержится
во внеклеточной и внутриклеточной
жидкостях внутренней среды. Играет
роль в процессах возбуждения и
торможения, в проведении нервных
импульсов, синаптической передаче,
образовании соляной кислоты и
желудочного сока. Суточная потребность
130-155 ммоль.Поверенная
соль, растительная и животная пищи,
жидкости, потребляемые при питье.Фосфор
В
виде фосфатного аниона содержание
в клетках в 40 раз выше, чем во
внеклеточной среде. До 80% содержится
До 80% содержится
в костях и зубах в виде минеральных
веществ. В составе фосфолипидов
входит в структуру клеточных мембран,
липопротеидов. Необходимый элемент
макроэргических соединений и их
производных, циклических нуклеотидов,
коферментов, играющих важную роль в
метаболизме и регуляции физиологических
функций. Суточная потребность 20-30
ммоль.Молоко,
рыба, мясо, яйца, орехи, злаки.Магний
Содержится
в костной ткани (необходим для ее
образования), скелетных мышцах и
нервной системе. Входит в состав
многих ферментов и коферментов.
Необходим для функции клеточных
мембран, сократимости миокарда и
гладких мышц. Суточная потребность
10-15 ммоль.Молоко, мясо,
злаки.
Гипермагниемия
– повышение концентрации магния в
плазме выше нормы – возможно при
избыточном поступлении его в организм
с пищевыми продуктами или в виде
лекарственных препаратов, нарушении
выделения магния почками (например,
при уремии), усиленном выходе его из
клеток (например, при диабетическом
ацидозе). Прогрессирующая гипермагниемия
проявляется угнетением ЦНС (вплоть до
развития комы), угасанием двигательных
рефлексов, нарушением функции дыхательного
центра, развитием брадикардии, снижением
артериального давления.
Повышенный
уровень магния в крови можно снизить
путем внутривенного введения растворов
бикарбоната или лактата натрия. При
гипермагниемии необходимо ограничить
прием продуктов, содержащих большое
количество магния. Иногда для устранения
гипермагниемии используют метод
искусственного очищения кров с помощью
различных видов диализа.
Нарушение обмена веществ
МЕТАБОЛИЗМ (или обмен веществ) — биохимические превращения питательных веществ, поступивших в организм, до момента их выведения. В результате этого процесса строятся структурные элементы клеток и тканей.
В результате этого процесса строятся структурные элементы клеток и тканей.
Выделяют следующие виды нарушений обменных процессов в организме:
- Нарушение обмена белков
Белки – это основной строительный материал для всех клеток организма. Все патологические процессы в той или иной степени являются либо причиной, либо следствием нарушения белкового обмена.
- Нарушение обмена воды
Вода – незаменимая жидкость, составляющая чуть больше половины массы тела взрослого человека. В норме в организм должно поступать в день примерно 2,5 литра и выделяться столько же. Нарушение водного обмена может протекать в виде обезвоживания и патологической задержки жидкости в организме. Оба состояния опасны и серьезно нарушают здоровье человека. При обезвоживании возникает сгущение крови, и, как следствие, все органы и ткани страдают от сниженного питания и гипоксии (особенно центральная нервная система и желудочно-кишечный тракт). При задержке воды возникают отеки, повышается давление.
- Нарушение обмена жиров
Жиры играют очень важную роль в работе органов и систем организма. Например, жировую основу имеют все гормоны. Присутствуют жиры и в нервной ткани, обеспечивая стабильность клеточных структур и нормальную передачу нервных импульсов.
- Нарушение минерального обмена веществ и кислотно-щелочного баланса
Минералы незаменимы при работе клеток, присутствуют в ферментах, витаминах, гормонах, пигментах. Это биокатализаторы большинства физиологических процессов и основа кислотно-щелочного состояния организма. Причин данного нарушения много: стрессы, неблагоприятная окружающая среда, увлечение диетами, несбалансированное питание, вредные привычки. Нарушение минерального обмена приводит к дисбалансу всех систем, гиповитаминозу и снижению качества работы ферментов, ослаблению иммунитета и пр.
- Нарушение обмена углеводов
Углеводы осуществляют важнейшую энергетическую функцию. Для организма одинаково неприемлемо как резкое увеличение уровня глюкозы (сахара) в крови, так и его падение. Более того, критические значения сахара крови могут обернуться летальным исходом.
Для организма одинаково неприемлемо как резкое увеличение уровня глюкозы (сахара) в крови, так и его падение. Более того, критические значения сахара крови могут обернуться летальным исходом.
Необходимо отметить, что выделение нескольких отдельных видов нарушений обмена является весьма условным, т.к. все виды обмена взаимосвязаны между собой и существенно влияют друг на друга.
Причины нарушения обмена веществ разнообразны. Наиболее частые из них – это наследственные факторы, приводящие к сбою работы органов и систем, непосредственно регулирующих обменные процессы.
В силу высокой актуальности вопроса остановимся подробнее на нарушении обмена жиров.
Важнейшим результатом метаболизма является ЭНЕРГИЯ, извлекающаяся из содержащихся в клетках веществ.
Жировая ткань является важнейшим энергетическим депо организма, а способность запасать энергию в виде жира является одной из основных жизненно важных функций жировой ткани.
При поступлении питательных веществ, превышающем потребности организма, происходит избыточное развитие жировой ткани, что приводит к ожирению.
Лечение ожирения в Пушкине.
ОСОБЕННОСТИ МЕТАБОЛИЗМА КОСТНОЙ ТКАНИ У ДЕТЕЙ С ПЕРЕЛОМАМИ КОНЕЧНОСТЕЙ | Галятина
1. The Bone and Joint Decade 2000–2010 for prevention and treatment of musculo-skeletal disorders // Acta Orthop. Scand. 1998. V. 69. Suppl. 281. P. 1–80.
2. Садовой М.А., Фаламеева О.В. Остеопороз в детском, подростковом и юношеском возрасте: патогенетические механизмы и основы профилактики. Новосибирск: АНО «Клиника НИИТО», 2009. 280 с.
3. Новиков П.В. Рахит и наследственные рахитоподобные заболевания у детей: диагностика, лечение, профилактика. М.: Триада-Х, 2006. 336 с.
4. Беневоленская Л.И., Лесняк О.М. Остеопороз: диагностика, профилактика и лечение. М.: ГЭОТАР-Медиа, 2005. 293 с.
Беневоленская Л.И., Лесняк О.М. Остеопороз: диагностика, профилактика и лечение. М.: ГЭОТАР-Медиа, 2005. 293 с.
5. Короткова Т.А. Характеристика костной ткани подростков по оценке показателей минерализации: автореф. дис. … канд. мед. наук. М., 2007. 23 c.
6. Soontrapa S., Bunyaratavei N. // J. Med. Assoc. Thai. 2005. Vol. 99. Suppl. 5. P. S29–S32.
7. Huesa C., Yadav M.C., Finnilä M.A.J., Goodyear S.R., Rob-ins S.P., Tanner K.E., Aspden R.M., Millán J.L., Farquharson C. Phospho1 is essential for mechanically competent mineralization and the avoidance of spontaneous fractures // Bone. 2011. V. 48, № 5. P. 1066–1074.
8. Петеркова В.А, Нагаева Е.В. Опыт применения гормона роста при различных вариантах низкорослости у детей // Вопросы современной педиатрии. 2009. Т. 8, № 2. С. 86–93.
9. Строев Ю.И., Чурилов Л.П. Эндокринология подростков / под ред. А.Ш. Зайчика. СПб.: ЭЛБИ-СПБ, 2004. 384 с.
10. Витебская А.В., Смирнова Г.Е., Ильин А.В. Витамин D и показатели кальций-фосфорного обмена у детей, проживающих в средней полосе России в период максимальной инсоляции // Остеопороз и остеопатии. 2010. № 2. С. 3–6.
11. Ермакова И.П., Бузулина В.П., Пронченко И.А., Дудов Н.С. Содержание маркера формирования кости ами-нотерминального пропептида коллагена первого типа в сыворотке крови здоровых мужчин // Клинич. лаб. диаг-ностика. 2007. № 5. С. 13–15.
12. Храмцова С. Н., Щеплягина Л.А., Моисеева Т.Ю. Маркеры костного ремоделирования у детей // Рос. педиатр. журн. 2006. № 4. С. 17–21.
Н., Щеплягина Л.А., Моисеева Т.Ю. Маркеры костного ремоделирования у детей // Рос. педиатр. журн. 2006. № 4. С. 17–21.
13. Никонова Т.А., Довгаль Д.А., Хохлова О.И., Устьянцева И.М. Особенности соматотропной регуляции кальциевого обмена у детей с патологией опорно-двигательного аппарата // Политравма. 2012. № 1. С. 52–53.
14. Никонова Т.А., Хохлова О.И., Устьянцева И.М., Довгаль Д.А. Маркеры костного ремоделирования у детей с врожденной и приобретенной патологией опорно-двигательного аппарата // Политравма. 2012. № 3. С. 68–71.
15. Щеплягина Л.А., Моисеева Т.Ю. Проблемы остеопороза в педиатрии: возможности профилактики // Рус. мед. журн. 2003. Т. 11, № 27. С. 1554–1556.
16. Свешников А.А.,. Каминский А.В., Ларионова Т.А. Изменение концентрации остеотропных гормонов, остеокальцина, гормонов стресс-группы при лечении чреc- и межвертельных переломов // Гений ортопедии. 2007. № 3. С. 48–51.
17. Хвостова С.А., Свешников К.А. Роль гормонов эндокринных желез в репаративном костеобразовании // Современные проблемы науки и образования. 2008. № 2. С. 52–56.
18. Ahmad A.M., Hopkins M.T., Thomas J., Durham B.H., Fraser W.D., Vora J.P. Parathyroid responsiveness to hypocalcemic and hypercalcemic stimuli in adult growth hormone deficiency after growth hormone replacement // Am. J. Physiol. Endocrinol. Metab. 2004. V. 286. P. 986–993.
19. Delmas P.D., Eastell R., Garnero P., Seibel M.J., Stepan J. The Use of Biochemical Markers of Bone Turnover in Osteoporosis // Osteoporos. Int. 2000. V. 6, Suppl. P. 2–17 (includes IOF recommendations).
Int. 2000. V. 6, Suppl. P. 2–17 (includes IOF recommendations).
Нарушения минерального обмена | UF Health, Университет здравоохранения Флориды,
Академический медицинский центр Университета Флориды — самый обширный академический медицинский центр на Юго-Востоке — предназначен для высококачественных программ образования, исследований, ухода за пациентами и государственных услуг.
Стоматологический колледж UF является единственной стоматологической школой во Флориде, финансируемой государством, и признан одной из лучших стоматологических школ США за качество образовательных программ, исследовательскую деятельность в области гигиены полости рта и приверженность уходу за пациентами и обслуживанию.
Медицинский колледж, крупнейший из шести колледжей Академического медицинского центра Университета Флориды, открылся в 1956 году с целью увеличения количества высококвалифицированных врачей во Флориде, предоставления передовых медицинских услуг жителям Флориды и содействия открытиям в области здравоохранения. исследовать.
Основанный в 1956 г. Колледж медсестер Университета Флориды является ведущим учебным заведением для медсестер в штате Флорида и входит в 10% лучших медицинских программ для выпускников по всей стране.Колледж медсестер UF постоянно привлекает и удерживает студентов и преподавателей медсестер самого высокого уровня, увлеченных наукой и заботой.
Фармацевтический колледж, основанный в 1923 году, является старейшим колледжем Академического медицинского центра UF. Колледж, входящий в число лучших фармацевтических школ страны, поддерживает исследовательские, сервисные и образовательные программы, дополненные онлайн-технологиями.
Колледж общественного здравоохранения и медицинских профессий (PHHP) предназначен для предоставления отличных образовательных программ, которые готовят выпускников к удовлетворению многогранных медицинских потребностей населения, сообществ и отдельных лиц.
UF College of Veterinary Medicine — единственный ветеринарный колледж Флориды, предлагающий множество уникальных образовательных программ для студентов и услуг, направленных на помощь домашним животным, дикой природе и исчезающим видам. Мы предлагаем четырехлетнюю программу доктора ветеринарной медицины, а также магистратуру M.S. и к.т.н. степени в области ветеринарной медицины.
Расположенный в одном месте с больницей Shands Jacksonville, Центр медицинских наук Джексонвилля выделяется в области образования, исследований и ухода за пациентами, что выражает наши неизменные ценности сострадания, совершенства, профессионализма и инноваций.Наш современный медицинский центр обслуживает 1 миллионное городское население от северной Флориды до южной Джорджии.
UFCOM-J предлагает аккредитованные программы ординатуры и стипендий для выпускников медицинского образования в дополнение к нестандартным программам стипендий. Клиническая ротация по всем основным дисциплинам предусмотрена для студентов-медиков UFCOM, а выборная ротация — для студентов из других аккредитованных школ.
UFHSC-J — это клинический учебный центр для медицинского колледжа в Гейнсвилле.Студенты сменяют друг друга в различных клинических учреждениях кампуса, а также в центрах первичной медицинской помощи и специализированных медицинских центрах, расположенных по всему Джексонвиллю.
Фармацевтический колледж UF в Джексонвилле предлагает четырехлетнюю программу доктора фармацевтики (Pharm.D.), Полностью завершенную в Джексонвилле. Также на территории кампуса предлагается программа резидентуры в аптеке Shands Jacksonville, аккредитованная Американским обществом фармацевтов системы здравоохранения.
University of Florida Health знает, насколько важно постоянное медицинское обучение для поставщиков медицинских услуг и общества. Вот почему мы предлагаем онлайн-курсы непрерывного медицинского образования (CME), которые вы можете пройти для получения кредитов CME. Эти курсы знакомят с последними медицинскими знаниями, обучают новым навыкам взаимоотношений с пациентами и помогают поставщикам медицинских услуг решать актуальные текущие проблемы.
Вот почему мы предлагаем онлайн-курсы непрерывного медицинского образования (CME), которые вы можете пройти для получения кредитов CME. Эти курсы знакомят с последними медицинскими знаниями, обучают новым навыкам взаимоотношений с пациентами и помогают поставщикам медицинских услуг решать актуальные текущие проблемы.
исследований наследственных заболеваний обмена веществ — Просмотр полного текста
Заболевания минерального обмена, такие как семейная множественная эндокринная неоплазия 1 типа (FMEN1), семейная гипокалиурическая гиперкальциемия (FHH), семейный гиперпаратиреоз (FH) и псевдогипопаратиреоз (PHP), известны как PHP наследственные аномалии.Это означает, что эти состояния передаются от родителей к детям через гены. Эти специфические условия приводят к аномальному уровню кальция в крови.
Это исследование было разработано, чтобы помочь исследователям больше узнать о генах, ответственных за эти нарушения. Узнав больше о генетическом процессе, участвующем в наследственных аномалиях, можно разработать новые тесты и методы лечения.
Объектами этого исследования будут члены семей, у родственников которых было диагностировано заболевание минерального обмена.Участников попросят сдать образцы крови для выделения ДНК. ДНК — это часть клеток, несущая генетическую информацию.
ДНК будет проанализирована, и результаты будут переданы испытуемым. Субъектам будет предоставлено генетическое консультирование, чтобы помочь в интерпретации их результатов.
Семейная множественная эндокринная неоплазия 1 типа (MEN1), семейная гипокальциурическая (или семейная доброкачественная) гиперкальциемия (FHH), гиперпаратиреоз — синдром опухоли челюсти (HPT-JT), другие причины семейного изолированного гиперпаратиреоза (FIH) и псевдогипопаратиреоидизма нарушения обмена веществ, которые обычно наследуются по аутосомно-доминантному типу.MEN1 характеризуется чрезмерным ростом и гиперфункцией паращитовидных желез, эндокринной ткани передней доли гипофиза и желудочно-кишечного тракта. MEN1, p15, p18, p21 и p27 являются идентифицированными генами для состояний, подобных MEN 1. СГГ характеризуется обычно доброкачественным синдромом, который иногда ошибочно принимают за типичный первичный гиперпаратиреоз, что может привести к ненужной и безуспешной операции на паращитовидных железах. Ген CASR для кальций-чувствительного рецептора паратироидной клетки мутирован у большинства родственников FHH; меньшая часть родственников с FHH имеет мутацию гена GA11 или AP2S.HPT-JT — это особый подтип семейного изолированного гиперпаратиреоза, который имеет комбинацию аденомы паращитовидной железы, рака паращитовидной железы, опухоли челюсти, опухоли матки, опухоли почек и кист почек. Это вызвано мутацией гена CDC73 / HRPT2. PHP характеризуется резистентностью к паратироидным гормонам, и одна из форм связана с мутациями в гене, кодирующем стимулирующий G-белок. Мы продолжаем собирать образцы крови и тканей у затронутых и здоровых членов родственников с известными или предполагаемыми заболеваниями MEN1, FHH, HPT-JT, FIH, PHP и родственными заболеваниями с целью генетического анализа и идентификации генов.В большинстве случаев образцы будут закуплены за пределами площадки. Образцы будут обработаны для извлечения ДНК и РНК.
MEN1, p15, p18, p21 и p27 являются идентифицированными генами для состояний, подобных MEN 1. СГГ характеризуется обычно доброкачественным синдромом, который иногда ошибочно принимают за типичный первичный гиперпаратиреоз, что может привести к ненужной и безуспешной операции на паращитовидных железах. Ген CASR для кальций-чувствительного рецептора паратироидной клетки мутирован у большинства родственников FHH; меньшая часть родственников с FHH имеет мутацию гена GA11 или AP2S.HPT-JT — это особый подтип семейного изолированного гиперпаратиреоза, который имеет комбинацию аденомы паращитовидной железы, рака паращитовидной железы, опухоли челюсти, опухоли матки, опухоли почек и кист почек. Это вызвано мутацией гена CDC73 / HRPT2. PHP характеризуется резистентностью к паратироидным гормонам, и одна из форм связана с мутациями в гене, кодирующем стимулирующий G-белок. Мы продолжаем собирать образцы крови и тканей у затронутых и здоровых членов родственников с известными или предполагаемыми заболеваниями MEN1, FHH, HPT-JT, FIH, PHP и родственными заболеваниями с целью генетического анализа и идентификации генов.В большинстве случаев образцы будут закуплены за пределами площадки. Образцы будут обработаны для извлечения ДНК и РНК.
Нарушения метаболизма костной ткани и минералов
Рекомбинантный терипаратид (Forteo ™; Forsteo ™) является анаболическим (костеформирующим) агентом. Исследования показали, что подкожное введение терипаратида 20 мкг / день эффективно у женщин с постменопаузальным остеопорозом, мужчин с идиопатическим или гипогонадальным остеопорозом, а также у пациентов с остеопорозом, вызванным глюкокортикоидами.Терипаратид улучшает минеральную плотность костной ткани (МПК) и изменяет уровни образования костной ткани и маркеры резорбции; гистоморфометрические исследования показали влияние терипаратида на структуру, прочность и качество костей.
Подкожное введение терипаратида 20 мкг / день в течение периода лечения 11–21 месяцев было эффективным для снижения риска переломов и улучшения МПК у мужчин с идиопатическим или гипогонадальным остеопорозом, женщин с постменопаузальным остеопорозом и пациентов с остеопорозом, вызванным глюкокортикоидами. Кроме того, положительное влияние терипаратида на профилактику переломов позвонков и МПК сохраняется после прекращения лечения. Терипаратид обычно хорошо переносится, и показатели соблюдения режима лечения благоприятные. Однако текущие ограничения продолжительности лечения и высокая стоимость приобретения означают, что терипаратид лучше всего использовать для лечения пациентов с остеопорозом с высоким риском переломов или для пациентов с остеопорозом, которые имеют неудовлетворительный ответ или непереносимость других методов лечения остеопороза.Фармакологические свойства
Кроме того, положительное влияние терипаратида на профилактику переломов позвонков и МПК сохраняется после прекращения лечения. Терипаратид обычно хорошо переносится, и показатели соблюдения режима лечения благоприятные. Однако текущие ограничения продолжительности лечения и высокая стоимость приобретения означают, что терипаратид лучше всего использовать для лечения пациентов с остеопорозом с высоким риском переломов или для пациентов с остеопорозом, которые имеют неудовлетворительный ответ или непереносимость других методов лечения остеопороза.Фармакологические свойства
Терипаратид представляет собой 1-34 N-концевой фрагмент паратироидного гормона человека (ПТГ) и, по-видимому, обладает всеми анаболическими свойствами полноразмерного ПТГ. И терипаратид, и эндогенный ПТГ опосредуют свои биологические эффекты через специфические высокоаффинные рецепторы мембранной поверхности клеток, экспрессируемые на остеобластах и клетках почечных канальцев. Обе молекулы связываются с рецепторами с одинаковым сродством и оказывают одинаковые физиологические эффекты на кости и почки. В отличие от антирезорбтивных средств (например,грамм. бисфосфонаты и ралоксифен), которые ингибируют резорбцию кости и сохраняют существующую структуру кости, терипаратид стимулирует остеобластическую активность и образование новой костной ткани. Повышение уровней маркеров костеобразования происходит раньше, чем повышение маркеров резорбции костной ткани, создавая «анаболическое окно». Ранние изменения биохимических маркеров образования кости могут коррелировать с улучшением структуры кости и МПК. Эффекты терипаратида на метаболизм кальция и фосфора согласуются с эффектами, наблюдаемыми при эндогенном ПТГ (временное повышение уровня кальция в сыворотке и снижение уровня фосфата в сыворотке).Подкожный терипаратид быстро и интенсивно всасывается, и его абсолютная биодоступность составляет 95%. Пиковая концентрация в сыворотке крови была достигнута ≈30 минут после подкожного введения 20 мкг терипаратида у здоровых добровольцев и у женщин в постменопаузе с остеопорозом, после чего концентрации снизились до не поддающихся количественному определению уровней в течение 3 часов. Накопление терипаратида в костях не ожидается. Период полувыведения терипаратида для подкожного введения составляет ≈1 час, что отражает время, необходимое для абсорбции из места инъекции.Он выводится через печеночный и внепеченочный клиренс. Исследования метаболизма или выведения терипаратида не проводились; однако считается, что периферический метаболизм эндогенного паратиреоидного гормона происходит в основном в печени с последующим выведением через почки. В ЕС терипаратид не рекомендуется применять пациентам с тяжелой почечной недостаточностью.
Накопление терипаратида в костях не ожидается. Период полувыведения терипаратида для подкожного введения составляет ≈1 час, что отражает время, необходимое для абсорбции из места инъекции.Он выводится через печеночный и внепеченочный клиренс. Исследования метаболизма или выведения терипаратида не проводились; однако считается, что периферический метаболизм эндогенного паратиреоидного гормона происходит в основном в печени с последующим выведением через почки. В ЕС терипаратид не рекомендуется применять пациентам с тяжелой почечной недостаточностью.
Терапевтическая эффективность
В крупных, хорошо спланированных клинических испытаниях терипаратид был эффективен в снижении риска переломов, увеличении значений МПК (особенно в поясничном отделе позвоночника) и повышении уровней маркеров метаболизма костной ткани при мужском идиопатическом или гипогонадальном остеопорозе, а также при постменопаузальном и индуцированном глюкокортикоидами остеопорозе.В крупном базовом плацебо-контролируемом двойном слепом клиническом исследовании с участием женщин с постменопаузальным остеопорозом подкожное введение терипаратида в дозе 20 мкг / день в среднем в течение 21 месяца эффективно снижало риск позвоночных и непозвоночных переломов (но не переломов бедра), и увеличение маркеров образования кости по сравнению с маркерами резорбции кости, что приводит к увеличению в поясничном отделе позвоночника, шейке бедра и общей МПК бедра. У значительно меньшего числа получателей терипаратида 20 мкг / день, чем у плацебо, был по крайней мере один новый перелом позвонка (5% против 14%; относительное снижение риска на 65%).Анализ данных этого исследования в подгруппах показал, что терипаратид был эффективен у женщин с различной степенью тяжести заболевания, и что эффективность не зависела от возраста, функции почек, значений МПК до лечения или количества или тяжести предыдущих переломов позвонков.
Терипаратид 20 мкг / день был более эффективным в повышении значений МПК поясничного отдела позвоночника после 6-24 месяцев лечения у женщин с постменопаузальным остеопорозом, чем антирезорбтивные препараты сравнения, алендронат или кальцитонин. И терипаратид, и алендронат оказали положительное влияние на МПК, но они были значительно сильнее в случае терипаратида, чем алендроната.Когда терипаратид комбинировали с ралоксифеном у женщин в постменопаузе, опосредованное терипаратидом действие на резорбцию кости, по-видимому, ослаблялось, с чистым эффектом увеличения костеобразования. После 6 месяцев лечения увеличение сшитого C-телопептида коллагена типа I, маркера резорбции кости, было значительно меньше при приеме ралоксифена плюс терипаратид, чем при монотерапии терипаратидом. Однако, когда терипаратид был добавлен к существующей схеме приема алендроната или ралоксифена, наблюдалось значительное увеличение по сравнению с исходным уровнем в поясничном отделе позвоночника и общей МПК бедра, но в целом совместное введение, по-видимому, не увеличивало активность любого агента в качестве монотерапии.Переход на терипаратид после антирезорбтивной терапии у женщин в постменопаузе приводит к дальнейшему увеличению МПК. Точно так же после прекращения приема терипаратида введение антирезорбтивного средства основано на повышении МПК, вызванном терипаратидом.
И терипаратид, и алендронат оказали положительное влияние на МПК, но они были значительно сильнее в случае терипаратида, чем алендроната.Когда терипаратид комбинировали с ралоксифеном у женщин в постменопаузе, опосредованное терипаратидом действие на резорбцию кости, по-видимому, ослаблялось, с чистым эффектом увеличения костеобразования. После 6 месяцев лечения увеличение сшитого C-телопептида коллагена типа I, маркера резорбции кости, было значительно меньше при приеме ралоксифена плюс терипаратид, чем при монотерапии терипаратидом. Однако, когда терипаратид был добавлен к существующей схеме приема алендроната или ралоксифена, наблюдалось значительное увеличение по сравнению с исходным уровнем в поясничном отделе позвоночника и общей МПК бедра, но в целом совместное введение, по-видимому, не увеличивало активность любого агента в качестве монотерапии.Переход на терипаратид после антирезорбтивной терапии у женщин в постменопаузе приводит к дальнейшему увеличению МПК. Точно так же после прекращения приема терипаратида введение антирезорбтивного средства основано на повышении МПК, вызванном терипаратидом.
Терипаратид 20 мкг / день был более эффективен, чем плацебо, в увеличении МПК поясничного отдела позвоночника (первичная конечная точка) и шейки бедренной кости, но не общей МПК бедра, после медианы лечения в течение 11 месяцев у мужчин с идиопатическим или гипогонадальным остеопорозом.
У пациентов с глюкокортикоид-индуцированным остеопорозом терипаратид в дозе 20 мкг / день в течение 18 месяцев был более эффективным в повышении МПК поясничного отдела позвоночника, чем алендронат.Уровни маркеров костеобразования также значительно повышались при приеме терипаратида, но значительно снижались при приеме алендроната. У реципиентов терипаратида произошло значительно меньше переломов позвонков, чем у реципиентов алендроната.
Фармакоэкономический анализ показывает, что терипаратид экономически эффективен только у женщин в постменопаузе с тяжелым остеопорозом и во всех остальных случаях преобладает алендронат.
Переносимость
Подкожный терипаратид 20 мкг / день обычно хорошо переносился во время клинических испытаний продолжительностью в среднем 21 месяц у пациентов с остеопорозом.Среди побочных эффектов, наиболее часто возникающих у реципиентов терипаратида, были боль в конечностях, тошнота, головная боль и головокружение. Серьезные побочные эффекты наблюдались редко, существенно не различались между группами, получавшими терипаратид и препараты сравнения, и в большинстве случаев считались не связанными с исследуемыми препаратами.
Не было сообщений об остеосаркоме во время клинических испытаний (период наблюдения <2 лет), а частота других злокачественных новообразований не различалась между реципиентами терипаратида и плацебо. Информация о назначениях в США содержит предупреждение о повышении частоты остеосаркомы, связанной с лечением терипаратидом.С момента коммерческого запуска терипаратида в 2002 г. сообщалось об одном случае остеосаркомы у пациента, получавшего терипаратид; однако причинно-следственную связь между терипаратидом и остеосаркомой установить не удалось. При терапии терипаратидом нечасто сообщалось о повышении уровня щелочной фосфатазы. Терипаратид противопоказан в ЕС и США пациентам с необъяснимым повышением щелочной фосфатазы, поскольку это может указывать на болезнь Педжета.
Маркеры костного метаболизма, на которые влияет функция почек и терапия гормоном роста у детей с хронической болезнью почек
Абстрактные
Цели
Степень и значение измененного метаболизма костей для естественного роста у детей с хроническим заболеванием почек является спорным.Мы проанализировали влияние почечной дисфункции и терапии рекомбинантным гормоном роста на панель сывороточных маркеров костного метаболизма в большой когорте детей с хроническим заболеванием почек.
Методы
Костная щелочная фосфатаза (BAP), тартрат-резистентная кислая фосфатаза 5b (TRAP5b), склеростин и C-концевой FGF-23 (cFGF23), нормализованные по возрасту и полу, были проанализированы у 556 детей в возрасте 6–18 лет с расчетной скоростью клубочковой фильтрации. (рСКФ) 10–60 мл / мин / 1,73 м 2 .41 ребенок, получавший терапию рекомбинантным гормоном роста, сравнивался с контрольной группой, не получавшей лечения.
(рСКФ) 10–60 мл / мин / 1,73 м 2 .41 ребенок, получавший терапию рекомбинантным гормоном роста, сравнивался с контрольной группой, не получавшей лечения.
Результаты
Стандартизированные уровни BAP, TRAP5b и cFGF-23 были увеличены, тогда как склеростин был снижен. BAP положительно коррелировал, а cFGF-23 — обратно с рСКФ. Паратгормон в интактной сыворотке был независимым положительным предиктором BAP и TRAP5b и отрицательно связан со склеростином. На BAP и TRAP5B отрицательно влияли повышенные уровни С-реактивного белка.У детей, получавших рекомбинантный гормон роста, BAP был выше, а TRAP5b ниже, чем в контрольной группе, не получавшей лечения. Уровни склеростина были в пределах нормы и были выше, чем в контрольной группе, не получавшей лечения. Склеростин сыворотки и cFGF-23 независимо предсказывали оценку стандартного отклонения роста, а BAP и TRAP5b — предполагаемое изменение оценки стандартного отклонения роста.
Заключение
Маркеры метаболизма костной ткани указывают на состояние высокого метаболизма костной ткани у детей с хронической болезнью почек.Гормон роста вызывает остеоанаболический паттерн и нормализует активность остеоцитов. Маркеры остеоцитов cFGF23 и склеростин связаны со стандартизованной высотой, а маркеры метаболизма кости предсказывают скорость роста.
Образец цитирования: Дойон А., Фишер Д.-К, Баязит А.К., Канполат Н., Дузова А., Сезери Б. и др. (2015) На маркеры костного метаболизма влияет функция почек и терапия гормоном роста у детей с хронической болезнью почек. PLoS ONE 10 (2):
e0113482.https://doi.org/10.1371/journal.pone.0113482
Академический редактор: Жоао Коста-Родригес, Faculdade de Medicina Dentária, Universidade do Porto, ПОРТУГАЛИЯ
Поступила: 4 марта 2014 г .; Одобрена: 28 октября 2014 г .; Опубликован: 6 февраля 2015 г.
Авторские права: © 2015 Doyon et al. Это статья в открытом доступе, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии указания автора и источника
Это статья в открытом доступе, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии указания автора и источника
Финансирование: Это исследование стало возможным грантами Фонда профилактической медицины KfH, Европейской почечной ассоциации — Европейской ассоциации диализа и трансплантологии (www.era-edta.org), Федерального министерства образования и исследований Германии (номер ссылки: 01EO0802) и Pfizer Deutschland GmbH. Финансирующие организации не играли никакой роли в дизайне исследования, сборе и анализе данных, принятии решения о публикации или подготовке рукописи.
Конкурирующие интересы: У нас есть следующие интересы. Это исследование частично финансировалось Pfizer Deutschland GmbH. Нет никаких патентов, продуктов в разработке или продаваемых продуктов, которые можно было бы декларировать. Это не влияет на нашу приверженность всем политикам PLOS ONE в отношении обмена данными и материалами, как подробно описано в руководстве для авторов.
Предпосылки
Минеральные и костные расстройства (МБК) — частое осложнение хронической болезни почек (ХБП) у детей. CKD-MBD включает сложные нарушения метаболизма и минерализации костей, минералов сыворотки и регуляторных гормонов [1–3], которые могут влиять на линейный рост и, способствуя кальцификации сосудов, считаются основной причиной ранней сердечно-сосудистой заболеваемости при CKD. Лечение рекомбинантным гормоном роста (рчГР) представляет собой одобренное и эффективное лечение задержки роста при ХЗП.Влияние rhGH на метаболизм костей представляет особый интерес, поскольку CKD-MBD и задержка роста часто связаны.
Однако мониторинг CKD-MBD является сложной задачей. Биопсия кости считается золотой стандартной процедурой, но из-за ее инвазивности в настоящее время рекомендуется только в исключительных клинических ситуациях [2]. В то время как обычным рентгеновским лучам не хватает чувствительности, измерения плотности костей более информативны, но все же включают многократное воздействие радиации. Следовательно, сывороточный паратгормон (ПТГ), кальций и фосфор составляют основу мониторинга ХБП-МБД в рутинной клинической практике.
В то время как обычным рентгеновским лучам не хватает чувствительности, измерения плотности костей более информативны, но все же включают многократное воздействие радиации. Следовательно, сывороточный паратгормон (ПТГ), кальций и фосфор составляют основу мониторинга ХБП-МБД в рутинной клинической практике.
В 2006 г. KDIGO впервые рекомендовал детальную оценку появляющихся новых биомаркеров, которые могут отражать активность костных клеток у пациентов с ХБП [1]. Для детей была подчеркнута особая необходимость исследования потенциальных связей с линейным ростом. Здесь мы исследовали в большой популяции детей с ХБП панель сывороточных белков, потенциально отражающую активность различных типов костных клеток. Костная щелочная фосфатаза ( BAP ), фермент остеобластов, является чувствительным и специфическим маркером формирования и ремоделирования кости.В рекомендациях KDIGO 2009 предлагается измерять либо интактный сывороточный паратгормон (iPTH), либо БАТ, поскольку заметно измененные уровни информативны для метаболизма костной ткани. У детей уровни БАТ достигают пика в младенчестве и в период полового созревания, отражая физиологическую активацию костеобразования в эти периоды быстрого продольного роста. Устойчивая к тартрату кислая фосфатаза 5b ( TRAP5b ) разрушает белки костного матрикса и считается специфическим маркером поздней дифференцировки остеокластов [4]. Пептид , склеростин — новый ключевой регулятор метаболизма костной ткани [5].Он высвобождается в основном остеоцитами в качестве паракринного сигнала отрицательной обратной связи, регулирующего формирование кости путем ингибирования дифференцировки остеохондральных клеток-предшественников в остеобласты [6]. Наконец, фактор роста фибробластов 23 ( FGF-23) является ключевым эндокринным игроком в регуляции метаболизма костных минералов. Синтезируемый и высвобождаемый остеоцитами и остеобластами [7] и направленный на почечные канальцы, FGF-23 играет важную роль в поддержании гомеостаза минералов и витамина D.
Принимая во внимание механизмы и пути метаболизма костной ткани и биологические функции биомаркеров белков хорошо известны, их точная ассоциация с CKD, связанных с нарушениями метаболизма костной ткани и их роль в высоте и рост детей с ХПН остается спорным.Возрастные и гендерные различия и, как правило, небольшие доступные размеры выборки еще больше усложняют интерпретацию циркулирующих костных маркеров в педиатрических исследованиях. Недавно были установлены детские референсные значения для BAP, TRAP5b, склеростина и c-концевого FGF-23 (cFGF-23), что позволяет независимо от возраста и пола оценивать метаболизм костной ткани у детей с хроническими заболеваниями [8].
Консорциум 4C Study отслеживает самую большую когорту детей с ХБП, собранную на сегодняшний день [9].Мы использовали когорту 4C, чтобы охарактеризовать паттерны этих новых сывороточных костных маркеров при ХБП у детей и описать их связь с конечными точками естественного роста, то есть шкалой стандартного отклонения роста (SDS) и ее изменением во времени у детей с и без сопутствующей рекомбинантной лечение гормоном роста (GH).
Методы
Заявление об этике
Это исследование было проведено в рамках исследования 4C. Исследование 4C было одобрено институциональными наблюдательными советами (IRB) и этическими комитетами (EC) всех участвующих исследовательских центров.Информированное письменное согласие на участие в исследовании 4C и анализе данных и биопроб было получено от родителей / опекунов от имени несовершеннолетних / детей, которые также дали свое согласие на участие в исследовании. Исследование проводилось в соответствии с этическими принципами Хельсинкской декларации 1964 года. Следующие комитеты по этике (EC) и институциональные контрольные комиссии (IRB) одобрили исследование 4C: Австрия: EC Венского университета; ЭК Университета Инсбрука. Чешская Республика: EC Пражского университета.Франция: Комитет защиты людей «Est IV», Страсбург. Германия: EC Charité — Universitätsmedizin Berlin; ЭК медицинского факультета Кельнского университета; Ethikkommission der sächsischen Länderkammer; EC Университета Фридриха-Александра в Эрлангене; EC Университета Дуйсбург-Эссен; EC Университета Альберта-Людвига во Фрайбурге; Ethikkommission der Ärztekammer Hamburg; EC и IRB Медицинской школы Ганновера; EC и IRB Гейдельбергского университета; ЭК медицинского факультета Йенского университета; ЭК медицинского факультета Лейпцигского университета; EC Университета Филиппа в Марбурге; Ethikkommission der Ärztekammer Westfalen-Lippe und der Medizinischen Fakultät der Westfälischen Wilhelms Universität Münster; ЭК медицинского факультета Университета Ростока.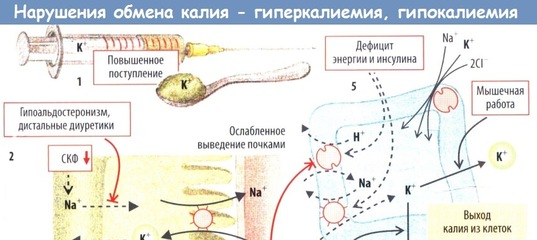 Италия: Комитато Этико Индипенденте дель Азиенда Больница Болоньи, Поликлиника Сан-Орсола-Мальпиги; Комитато этики делль’ИРКЦС Институт Джаннины Гаслини ди Генуя; Comitato Etico dell’IRCCS Ospedale Maggiore Policlinico, Mangiagalli e Regina Elena di Milano; Этический комитет клинической практики Главного госпиталя Университета Падуи; Comitato Etico per la Sperimentazione Clinica dell’IRCCS Ospedale Pediatrico Bambino Gesu ’di Roma. Литва: EC и IRB Вильнюсского университета.Польша: ЭК при Детском мемориальном институте здоровья, Варшава. Португалия: EC Университета Порту. Сербия: ЭК Белградского университета. Швейцария: ЕС кантона Берн; ЕС кантона Цюрих. Турция: ЭК Университета Чукурова, Адана; Совета по этике неинтервенционных клинических исследований Университета Хаджеттепе, Анкара; EC Университета Черрахпаша, Стамбул; EC и IRB Эгейского университета, Измир. Соединенное Королевство: Больница Грейт-Ормонд-Стрит и Исследовательский институт детского здоровья UCL.
Италия: Комитато Этико Индипенденте дель Азиенда Больница Болоньи, Поликлиника Сан-Орсола-Мальпиги; Комитато этики делль’ИРКЦС Институт Джаннины Гаслини ди Генуя; Comitato Etico dell’IRCCS Ospedale Maggiore Policlinico, Mangiagalli e Regina Elena di Milano; Этический комитет клинической практики Главного госпиталя Университета Падуи; Comitato Etico per la Sperimentazione Clinica dell’IRCCS Ospedale Pediatrico Bambino Gesu ’di Roma. Литва: EC и IRB Вильнюсского университета.Польша: ЭК при Детском мемориальном институте здоровья, Варшава. Португалия: EC Университета Порту. Сербия: ЭК Белградского университета. Швейцария: ЕС кантона Берн; ЕС кантона Цюрих. Турция: ЭК Университета Чукурова, Адана; Совета по этике неинтервенционных клинических исследований Университета Хаджеттепе, Анкара; EC Университета Черрахпаша, Стамбул; EC и IRB Эгейского университета, Измир. Соединенное Королевство: Больница Грейт-Ормонд-Стрит и Исследовательский институт детского здоровья UCL.
Исследуемая популяция
Все пациенты были участниками исследования 4C (исследование сочетанной сердечно-сосудистой патологии у детей с хроническим заболеванием почек, зарегистрированное на ClinicalTrials.gov 7 августа 2009 г., идентификатор NCT01046448). В исследовании участвуют дети с ХБП (рСКФ 10–60 мл / мин / 1,73 м 2 ) в возрасте 6–18 лет. Клинические и биохимические обследования проводятся каждые 6 месяцев. Набор начался в сентябре 2009 года. Все пациенты, зарегистрированные к декабрю 2011 года с доступными образцами крови для анализа костных маркеров, были включены в это субисследование анализа костных маркеров.Костные маркеры анализировали поперечно. Для анализа предикторов продольного роста было обязательным повторное клиническое посещение через 6 (или, альтернативно, через 12) месяцев после взятия пробы крови. Отдельные анализы были выполнены для 1) перекрестного анализа предикторов костных маркеров, связанных с ХЗП, 2) сравнения костных маркеров пациентов, получавших лечение рчГР, с подобранной контрольной группой без лечения рчГР, и 3) анализа влияния связанных с ХЗП факторы и лечение рчГР на рост и продольный рост. Отбор пациентов и критерии для каждого анализа см. На рис. 1.
Отбор пациентов и критерии для каждого анализа см. На рис. 1.
Панель костных маркеров измерялась в исходном образце крови при посещении одновременно с централизованным биохимическим анализом, включая сывороточный креатинин, цистатин C, мочевину, C-реактивный белок (CRP), бикарбонат, iPTH, кальций, фосфат и 25-гидроксивитамин D (25OHD). Расчетная СКФ (рСКФ, мл / мин / 1,73 м 2 ) была рассчитана на основе креатинина, цистатина с, мочевины и роста [10]. Стадия ХБП определялась согласно KDOQI [11].Гипокальциемия определялась как уровень кальция в сыворотке ниже 2,0 ммоль / л; гиперфосфатемия определялась как уровень сывороточного фосфора> 1,87 ммоль / л для пациентов в возрасте от 6 до 12 лет и> 1,45 ммоль / л для пациентов в возрасте от 12 лет и старше. Был записан подробный анамнез пациента и лекарств. Физическая активность была разделена на четыре уровня в зависимости от часов занятий спортом и других тяжелых физических нагрузок, выполняемых в неделю (0: нет, 1: 1-2 часа в неделю, 2: 3-4 часа в неделю, 3:> 4 часов / неделя). Пациенты были классифицированы как получавшие rhGH или не получавшие лечение, если методы лечения были постоянными в течение как минимум 3 месяцев до анализа костных маркеров.
Почечные диагнозы были классифицированы как CAKUT (врожденная аномалия почек и мочевыводящих путей), гломерулопатии (врожденный / инфантильный / синдромальный нефротический синдром, нефропатия с минимальными изменениями, фокальный сегментарный гломерулосклероз, мембранозная гломерулонефропатия, мезангиопролиферативная гломерулопролиферативная гломерулопролиферативная гломерулопролиферация постинфекционный гломерулонефрит), нефропатии, вызванные системными воспалительными заболеваниями (гранулематоз Вегенера, системная красная волчанка, нефрит Геноха-Шонлейна и нефропатия IgA), гемолитико-уремический синдром (ГУС), метаболические нарушения (цистиноз, оксалоз, другие нефропатии) нефропатия, реноваскулярное заболевание, постишемическая хроническая почечная недостаточность и др. ) или неизвестно.
) или неизвестно.
Лабораторные анализы
Наборы ELISA
использовали для количественного определения cFGF-23 (Immutopics, Сан-Клементе, Калифорния, США), склеростина (Tecomedical, Sissach, Швейцария), BAP (Quidel, San Diego, CA, USA) и TRAP5b (Quidel). Все анализы были выполнены в основном так, как описано производителями, и все образцы были проанализированы в двух экземплярах. Коэффициенты вариации между / внутри анализа для cFGF-23, склеростина, BAP и TRAP5b составляли 5,1% / 5,0%; 9,3% / 5,9%; 5,5% / 5,0%; и 4.2% / 2,8% соответственно. Если повторяющиеся результаты различались более чем на 5% (склеростин: 7%), измерения повторяли на второй аликвоте.
Биостатистические подходы
Костные маркеры были нормализованы, а оценки стандартного отклонения (SDS) были рассчитаны для возраста и пола, как было предложено Fischer et al., Чьи результаты по контрольным значениям были основаны на значениях, полученных от 424 здоровых детей в возрасте 0,1 и 21 года [8].
Влияние функции почек и стадии ХБП на характеристики субъектов было проверено с помощью дисперсионного анализа для стадии ХБП, корреляционного анализа для рСКФ и критериев Крускала-Уоллиса и критериев хи-квадрат для категориальных переменных.Связь пола, возраста, SDS ИМТ, физической активности, метаболического статуса (сывороточный кальций, бикарбонат, фосфор, 25OHD) и функции почек (рСКФ, альбуминурия) со стандартизованными концентрациями костных маркеров оценивалась пошаговым многомерным регрессионным анализом у пациентов без лечения рчГР. . Для оценки ассоциации костных маркеров с продольным ростом предполагаемое изменение SDS роста рассчитывалось за 12 месяцев, если это возможно, или в годовом выражении от 6-месячного изменения, если полное 12-месячное наблюдение не было доступно.Прогностическая ценность сывороточных маркеров костной ткани в отношении роста и роста была протестирована с помощью пошагового многомерного регрессионного анализа с поправкой на возраст, пол, метаболические параметры и функцию почек у пациентов с лечением rhGH и без него, используя лечение rhGH в качестве смешанной переменной.
Во всех многомерных анализах переменные со значением p <0,15 сохранялись в модели во время процедуры выбора. Переменные были проверены на нормальность и логарифмически преобразованы в случае нарушения предположения о нормальности.
Для сравнения уровней костных маркеров у пациентов с лечением rhGH и без него с максимально возможным исключением вмешивающихся факторов, группу пациентов с лечением rhGH сравнивали с необработанной контрольной группой, подобранной индивидуально по возрасту, полу, рСКФ, СРБ и iPTH. Из исходной когорты контрольная группа была выбрана из 186 пациентов, которые не получали лечение рчГР и проживали в тех же странах, что и дети, получавшие лечение рчГР. Сопоставление пациентов, получавших rhGH, и пациентов, не получавших лечения, проводили с использованием SAS 9.2. Были доступны результаты для 41 из 42 пациентов, получавших rhGH. Было проведено апостериорное тестирование значимых различий соответствующих переменных и дополнительных мешающих факторов между группами.
Парные t-тесты были применены для проверки различий уровней костных маркеров между подобранными группами. Статистический анализ проводился с использованием SAS 9.2 и R. Значение p ≤ 0,05 считалось статистически значимым.
Результаты
Характеристика предмета
Была изучена когорта из 556 детей и подростков (365 мужчин), участвовавших в исследовании 4C.Пациенты были включены в 55 центров в Турции (50%), Германии (15%), Франции (9%), Великобритании (6%), Италии (5%), Польше (4%), Австрии (2,5%). , Сербия (2,5%), Литва (2%), Швейцария (2%), Португалия (1%) и Чешская Республика (1%). Характеристики субъектов представлены в таблице 1. Основные заболевания включали CAKUT у 74%, гломерулопатии у 6%, метаболические заболевания у 3,5%, HUS у 2%, системный васкулит у 1%, другие заболевания у 9,5% и неизвестные у 4% пациентов. , соответственно. Распространенность и тяжесть альбуминурии (p <0.0003), гиперфосфатемия (p <0,0001), гиперпаратиреоз (p <0,0001) и метаболический ацидоз (p <0,0009) увеличивались с уменьшением рСКФ, тогда как сывороточный альбумин, 25OHD и CRP не были статистически значимо связаны с функцией почек. Дети с поздними стадиями ХБП были ниже ростом (p <0,0001), но темпы роста, выраженные предполагаемым изменением роста SDS, существенно не различались между стадиями ХБП (p = 0,32).
Эффекторы сывороточных концентраций маркеров костной ткани
По сравнению со здоровым контролем, стандартизованные BAP, TRAP5b и cFGF-23 были значительно увеличены, а склеростин снизился в популяции с ХЗП (рис.2 и таблица 2). В однофакторном анализе BAP SDS положительно коррелировал с SDS TRAP5b (r = 0,58, p <0,0001) и обратно с SDS cFGF-23 (r = -0,2, p <0,0001). Склеростин не показал корреляции с TRAP5b, BAP или cFGF-23 (данные не показаны).
Рис. 2. Распределение сывороточных концентраций костных маркеров у 510 педиатрических пациентов с ХБП. Данные выражаются в виде баллов стандартного отклонения (SDS).
Заштрихованная область показывает нормальный диапазон (от 5 -го до 95 -го процентилей концентраций биомаркеров у здоровых детей) [8].Звездочки указывают на значительное отклонение от распределения в контрольной популяции (*: p <0,05, **: p <0,0001 по сравнению со здоровым контролем).
https://doi.org/10.1371/journal.pone.0113482.g002
В пошаговом многофакторном анализе SDS BAP снизился, а SDS cFGF-23 увеличился с уменьшением рСКФ, в то время как SDS TRAP5b и склеростин не показали статистически значимой связи с функцией почек. (Таблица 3). Альбуминурия была связана с более высоким SDS TRAP и гломерулопатиями, поскольку почечная диагностика была связана с более низким SDS BAP.В то время как воспалительное заболевание почек не показало никакой связи с костными маркерами, BAP и TRAP5b, по-видимому, отражали влияние текущего воспалительного статуса на метаболизм кости, о чем свидетельствует их независимая связь с уровнями CRP. BAP и TRAP5b SDS были тесно связаны с iPTH (таблица 3). Склеростин SDS был предсказан обратно пропорционально iPTH и положительно на 25OHD. Пациенты с дефицитом 25OHD (25OHD <16 мкг / л) имели значительно более низкие уровни SDS склеростина и склеростина, чем пациенты с более высокими уровнями 25OHD (склеростин 0.30 против 0,36 мкг / л, p <0,0001 и -1,07 против -0,61 SDS, p <0,0001).
На концентрацию cFGF-23 в сыворотке сильно и независимо влияли eGFR, уровни сывороточного фосфора и бикарбоната. В отличие от других костных маркеров, не было никакой связи с iPTH или CRP.
Сывороточные маркеры костей и естественный рост
Стандартизированные уровни cFGF-23 и склеростина были независимо положительно связаны с SDS роста (таблица 4). Эти отношения независимо друг от друга добавили значимых положительных ассоциаций возраста, рСКФ и отрицательных эффектов метаболического ацидоза на SDS роста.
Рис. 3. Распределение сывороточных концентраций костных маркеров у детей, получавших и не получавших rhGH (n = 41 на группу).
Данные выражены в виде оценок стандартного отклонения (SDS). Заштрихованная область представляет собой нормальный диапазон (от 5 th до 95 th процентилей концентраций биомаркеров у здоровых детей) 8 . Звездочки указывают на значительное отклонение от распределения в контрольной популяции (*: p <0,05, **: p <0,01).
https: // doi.org / 10.1371 / journal.pone.0113482.g003
Обсуждение
Это первое комплексное исследование новых циркулирующих маркеров костной активности, проведенное в большой репрезентативной когорте детей с умеренной и тяжелой ХБП. В рамках педиатрического возраста скорость образования костной ткани и метаболизм костной ткани в основном зависят от состояния развития скелета. Связывание наших результатов с недавно установленными возрастными контрольными значениями [8] позволило нам учесть физиологическую изменчивость костных маркеров в детстве.Мы продемонстрировали аномальное распределение маркера остеобластов BAP, маркера остеокластов TRAP5b и маркеров остеоцитов cFGF-23 и склеростина, совместимые с серьезным изменением метаболизма костной ткани в этой популяции. Кроме того, мы наблюдали значительные изменения профиля костных маркеров у детей, получавших лечение rhGH.
BAP и TRAP
Уровни
БАТ отражают остеоанаболизм, а уровни TRAP5b — резорбцию кости [12,13]. Оба маркера коррелируют с сывороточным интактным ПТГ, но превосходят ПТГ в прогнозировании гистологии кости и предполагаемых изменений костной массы [13,14].Предыдущие исследования BAP и TRAP5B у детей с ХБП дали неоднородные результаты. В небольшом одноцентровом исследовании БАТ не отличался у детей с ХБП и здоровых детей из контрольной группы [15], возможно, из-за включения широкого возрастного диапазона, включающего физиологические пики концентрации в младенчестве и половом созревании. Повышенные уровни TRAP5b были обнаружены у детей с ХБП 5 стадии, но не у детей с 3 и 4 стадиями [16]. Нормализуя уровни BAP и TRAP5B в плазме для возраста и пола в этой большой педиатрической когорте с 3–5 стадиями ХБП, мы наблюдали явное увеличение BAP и небольшое, но значительное повышение уровней TRAP5B.Это открытие согласуется с предпочтительным высоким метаболизмом костной ткани в этой группе пациентов. Небольшая ассоциация BAP SDS с рСКФ выявлена при многомерном, но не однофакторном анализе, что указывает на более высокую скорость обновления костной ткани на более ранних стадиях ХБП. Однако связь была слабой, что свидетельствует о преобладающей роли других факторов, помимо функции почек. При контроле возраста, пола, рСКФ и основного заболевания почек основными предикторами повышения уровней BAP и TRAP5b были низкие уровни CRP и высокие уровни iPTH.Отрицательная связь BAP и TRAP5b с CRP может указывать на связь между воспалением и сниженным обменом костной ткани или адинамическим заболеванием костей независимо от основного заболевания почек, тогда как независимая положительная связь с iPTH подтверждает потенциальную роль этих костных маркеров для оценки высокого костный оборот.
Склеростин
У здоровых детей уровни склеростина выше у мальчиков, снижаются в период полового созревания и положительно коррелируют с индексом корковой пористости [17].В этой детской когорте с ХБП уровни склеростина в сыворотке также были выше у мальчиков, но не изменялись с возрастом.
У взрослых пациентов с ХБП уровни склеростина прогрессивно повышаются с прогрессирующей ХБП [18]. Однако у мышей с прогрессирующей ХБП было обнаружено повышение уровня склеростина на ранней стадии заболевания, но снижение на поздней стадии почечной недостаточности [19]. В соответствии с этим исследованием мы обнаружили общее снижение уровня склеростина в этой группе пациентов с умеренной и тяжелой ХБП. Имеются также экспериментальные и клинические доказательства подавления склеростина ПТГ [19–21].Соответственно, низкий уровень склеростина является предиктором высокого метаболизма костной ткани у взрослых с ХБП [22]. Наши результаты подтверждают обратную связь между склеростином и iPTH, добавляя к представлению о том, что остеоанаболические эффекты iPTH могут быть частично связаны с ингибированием высвобождения склеростина.
Кроме того, большая часть склеростина в здоровой кости высвобождается остеоцитами глубоко внутри костного матрикса, тогда как остеоциты вблизи зон ремоделирования кости производят мало склеростина [23]. В соответствии с наблюдаемыми высокими уровнями BAP и TRAP5b, предполагающими высокий уровень метаболизма костной ткани, низкие концентрации склеростина в плазме в этой когорте могут указывать на относительное преобладание зон ремоделирования кости над компартментами со зрелыми остеоцитами и постоянной выработкой склеростина.
На сегодняшний день мало что известно о взаимодействии склеростина с метаболизмом витамина D. Повышенная активность 1,25-дигидроксивитамина D-гидроксилазы недавно была продемонстрирована у мышей с нокаутом склеростина [24]. Наблюдаемая здесь независимая положительная ассоциация 25OHD и уровней склеростина может отражать влияние статуса витамина D на минерализованную костную массу. Поскольку у большинства детей в этой когорте было недостаточно или недостаточно витамина D, снижение уровня склеростина может частично объясняться нарушением действия витамина D.
FGF-23
FGF-23 действует как физиологический эндокринный регулятор уровней сывороточного фосфата и 1,25-дигидроксивитамина D [25]. Здесь мы подтверждаем для детей жесткую и независимую регуляцию циркулирующего FGF-23 с помощью рСКФ и уровней фосфата в сыворотке.
Уровни FGF-23 в плазме зависят от возраста и повышаются на ранних стадиях ХБП до появления каких-либо отклонений сывороточного фосфора, кальция или ПТГ [8,26]. Они хорошо коррелируют с синтезом FGF-23 в кости, как показано в исследовании 32 педиатрических пациентов и молодых взрослых пациентов с ХБП [27].FGF-23 в основном экспрессируется остеоцитами трабекулярной периферии. У детей, находящихся на диализе, было обнаружено, что уровни циркулирующего FGF-23 связаны с процессом созревания остеоидов и временем минерализации [28]. FGF-23 высоко экспрессируется в местах образования новой кости [29] и, по-видимому, регулирует минерализацию матрикса остеобластов в зависимости от возраста [30,31]. В исследовании детей до диализа FGF-23, но не ПТГ или сывороточный фосфор, независимо предсказал образование кости [32]. Все эти данные свидетельствуют о прямой роли FGF-23 в формировании и минерализации костей.Хотя наше исследование не может дать представление о морфологии костей у детей с ХБП, оно добавляет к текущему состоянию знаний важное наблюдение о том, что уровни FGF-23 связаны с относительным ростом у растущих детей. Мы также отметили, что пациенты с метаболическим ацидозом, как правило, имеют более низкий уровень FGF-23 при данном уровне рСКФ и сывороточного фосфора. Эта ассоциация может указывать на новую механистическую связь между метаболическим акдозом и нарушением минерально-костной ткани при ХБП.
rhGH способствует остеоанаболическому состоянию у CKD
Гормон роста (GH) и его медиатор IGF-1 стимулируют продольный рост как часть их общего анаболического действия на ткани.ХБП вызывает частичную устойчивость к эндогенному действию гормона роста, которую можно преодолеть путем введения рекомбинантного (р) гормона роста в фармакологических дозах. 40 детей, получавших терапию рчГР в нашей когорте, позволили оценить любые эффекты рчГР на метаболизм костей. По сравнению с подобранной контрольной группой детей, не получавших лечения, дети, получавшие rhGH, демонстрировали значительно более высокие уровни BAP и более низкие уровни TRAP, что согласуется с остеоанаболическим действием rhGH.
Эта интерпретация подтверждается рандомизированным исследованием на диализированных детях, изучающим влияние лечения rhGH на формирование костной ткани, где у детей, получавших rhGH, наблюдалась более высокая скорость образования кости, чем у нелеченных детей, независимо от гистологии кости на исходном уровне [33].Доказательства увеличения скорости образования костной ткани и костной массы в результате воздействия IGF1 также исходят от таких состояний, как акромегалия и лечение rhGH у детей, получающих длительную терапию кортикостероидами [34].
Склеростин — мощный ингибитор передачи сигналов Wnt, который играет важную роль во время формирования кости. Обнаружение того, что уровни склеростина в сыворотке были значительно выше с распределением, соответствующим таковому у здоровых детей, предполагает, что rhGH может играть роль в регуляции образования кости посредством этого пути.Нам не удалось подтвердить результаты небольшого исследования у детей с дефицитом GH, показывающего увеличение cFGF-23 во время терапии добавками rhGH [35]; небольшие изменения cFGF-23 могут быть омрачены общим увеличением cFGF-23 при ХЗП. Взятые вместе, наши результаты подтверждают главный остеоанаболический эффект лечения рчГР у детей с ХБП.
Костные маркеры предсказывают скорость роста
Мы подтвердили несколько установленных причинных факторов, которые независимо связаны с небольшим ростом при ХБП, таких как низкий рСКФ, метаболический ацидоз, воспаление и дефицит витамина D.Предполагаемый догоняющий рост был связан с лечением rhGH, высоким уровнем физической активности и повышенным уровнем фосфора в сыворотке, что, возможно, отражает хорошее потребление пищи. При корректировке на эти факторы SDS склеростина и cFGF-23 были независимо связаны с SDS роста, а SDS BAP и TRAP позволяли прогнозировать предполагаемое изменение роста. Подобно этому наблюдению, исследование пациентов с дефицитом GH показало увеличение BAP после лечения rhGH, что положительно коррелировало с улучшением SDS роста и увеличением плотности костей [36].Легко предположить, что склеростин и cFGF-23, представляющие активность клеток в минерализованном костном компартменте, связаны с относительным ростом, конечным результатом приобретения кости во время естественного роста, тогда как BAP и TRAP как маркеры ремоделирования кости скорее показывают связь с кратковременными изменениями скорости роста. Примечательно, что iPTH, традиционный биомаркер обновления костной ткани, не был связан ни с ростом, ни с темпами роста, что подтверждает предыдущие данные у детей, находящихся на диализе [37].
В заключение, в большой группе детей с преддиализной ХБП мы обнаружили важные ассоциации сывороточных биомаркеров костей с характеристиками пациентов, традиционными маркерами метаболизма костей и линейным ростом. Наше исследование извлекло пользу из большого размера выборки, контролируемого обсервационного дизайна исследования и применения возрастных эталонных значений. Однако ограничение возникает из-за отсутствия прямой оценки состояния кости с помощью биопсии или исследований скелета, таких как DEXA, pqCT или MRI.Также следует подчеркнуть, что наблюдаемые ассоциации в совокупности объясняли только 10–20% общей вариации концентраций костных маркеров и 10–24% вариации показателей роста. Следовательно, хотя наше исследование является информативным в отношении важных биологических регуляторов метаболизма и роста костей, другие основные источники вариаций, включая влияние генетической предрасположенности, еще предстоит изучить. Мы надеемся, что наши результаты побудят к дальнейшей оценке этих биомаркеров, включая методы визуализации костей и гистоморфометрию костей, чтобы дополнительно подтвердить их полезность при оценке и терапевтическом мониторинге метаболизма костей у детей с ХБП.
Благодарности
Авторы хотели бы поблагодарить всех детей и их семьи за участие в исследовании 4C.
Следующие основные исследователи участвуют в исследовании 4C: Австрия : Г. Кортина, Детская больница, Инсбрук; К. Арбайтер, Детская университетская больница, Вена. Чехия: Й. Дусек, Университетская клиника Мотол, Прага. Франция: J. Harambat, Hôpital des Enfants, Bordeaux; Б.Ранчин, Госпиталь женщин-матерей Enfant et Université de Lyon; М. Фишбах, Hôpital de Hautepierre, Страсбург. Германия: У. Керфельд, Р. Целлер, Детская больница Шарите, Берлин; Й. Дёч, Детская университетская больница, Кёльн; М. Галиано, Детская университетская больница, Эрланген; Р. Бюшер, Детская университетская больница, Эссен; К. Гимпель, Центр педиатрии и подростковой медицины, Фрайбург; М. Кемпер, Детская больница Университета UKE, Гамбург; А. Мельк, Д. Крахт, Ганноверская медицинская школа, Ганновер; Ф.Шефер, А. Дойон, Э. Вуэль, Центр педиатрии и подростковой медицины, Гейдельберг; M. Pohl, Центр педиатрии и подростковой медицины, Йена; С. Выгода, Городская больница Св. Георга, Лейпциг; Н. Джек, Детский центр почек KfH, Марбург; Б. Кранц, Детская университетская больница, Мюнстер; М. Виггер, Детская больница, Росток. Италия: Дж. Монтини, больница С. Орсола-Мальпиги, Болонья; А. Тривелли, Институт Джаннины Гаслини, Генуя; С. Теста, Fondazione Ospedale Maggiore Policlinico, Милан; Э.Видаль, отделение детской нефрологии, диализа и трансплантологии, Падуя; К. Маттеуччи, С. Пикка, больница Бамбино Джезу, Рим. Литва: А. Янкаускене, Детская университетская больница, Вильнюс. Польша: А. Зуровска, Детская и подростковая нефрология, Гданьск; Д. Дродз, Детская университетская больница, Краков; M. Tkaczyk, Исследовательский институт Мемориальной больницы польских матерей, Лодзь; T. Urasinski, Клиника педиатрии, Щецин; М. Литвин, Анна Немирска, Детский мемориальный институт здоровья, Варшава; М.Щепанска, Забже. Португалия: А. Тексейра, больница Сан-Жуан, Порту; Сербия: А. Пеко-Антик, Детская университетская больница, Белград. Швейцария: Г. Симонетти, Инзельшпиталь, Берн; Г. Лаубе, Детская университетская больница, Цюрих. Турция: А. Анарат, А.К. Баязит, Университет Чукурова, Адана; Ф. Ялчинкай, медицинский факультет Университета, Анкара; Э. Басин, медицинский факультет Баскентского университета, Анкара; Н. Чакар, детская больница Дискапи, Анкара; О.Сойлемезоглу, Университетская больница Гази, Анкара; А. Дузова, Ю. Билгинер, медицинский факультет Хаджеттепе, Анкара; Х. Эрдоган, детская больница Дорчелик, Бурса; О. Донмез, Университет Улудаг, Бурса; А. Балат, Газиантепский университет; А. Кияк, Детская больница Бакыркёй, Стамбул; С. Калискан, Н. Канполат, Медицинский факультет Джеррахпаша Стамбульского университета, Стамбул; К. Чандан, Образовательная и исследовательская больница Гёзтепе, Стамбул; М. Цивилибал, Образовательная и исследовательская больница Хасеки, Стамбул; С. Эмре, Стамбульский медицинский факультет, Стамбул, Х.Алпай, Медицинский факультет Университета Мармара, Стамбул; Г. Озчелик, Образовательная и исследовательская больница Шишли, Стамбул; С. Мир, Б. Созери, медицинский факультет Эгейского университета; Измир; О. Яваскан, Учебно-исследовательская больница Тепецик, Измир; Ю. Табель, Университет Инону, Малатья; П. Эртан, Университет Джелала Баяра, Маниса; Э. Йылмаз, Детская больница, Шанлыурфа. Соединенное Королевство: Р. Шрофф, Госпиталь на Грейт-Ормонд-стрит, Лондон.
Ведущие исследователи исследования 4C: F. Schaefer ([email protected]), У. Кверфельд ([email protected]), А.Мелк ([email protected]).
Вклад авторов
Задумал и спроектировал эксперименты: AD DF DH FS. Выполнял эксперименты: AD DF AKB NCan ADu BS JB ABa ABü CC NCak OD JD MH GK SM GÖ LS RS EV EW AM UQ. Проанализированы данные: AD MG. Предоставленные реагенты / материалы / инструменты анализа: DF MG. Написал бумагу: AD DF DH FS.
Ссылки
- 1.
Мо С., Дрюк Т., Каннингем Дж., Гудман В., Мартин К. и др.(2006) Определение, оценка и классификация почечной остеодистрофии: изложение позиции из книги «Болезнь почек: улучшение глобальных результатов» (KDIGO). Vol. 69. С. 1945–1953. - 2.
Заболевание почек: улучшение глобальных результатов (KDIGO) Рабочая группа CKD-MBD (2009) Руководство KDIGO по клинической практике по диагностике, оценке, профилактике и лечению хронической болезни почек — минерального и костного расстройства (CKD-MBD). Почки Int Suppl: S1 – S130. - 3.
Wesseling-Perry K, Salusky IB (2013) Хроническая болезнь почек: нарушение минеральных веществ и костей у детей.YSNEP 33: 169–179. Доступно: http://eutils.ncbi.nlm.nih.gov/entrez/eutils/elink.fcgi?dbfrom=pubmed&id=23465503&retmode=ref&cmd=prlinks. - 4.
Андерссон Г., Эк-Риландер Б., Холлберг К., Люсберг-Сьеландер Дж., Ланг П. и др. (2003) TRACP как остеопонтин фосфатаза. J Bone Miner Res 18: 1912–1915. pmid: 14584906 - 5.
Drüeke TB, Lafage-Proust MH (2011) Склеростин: еще один игрок в болезни почек? Clin J Am Soc Nephrol 6: 700–703. pmid: 21441122 - 6.Галли C, Пассери G, Macaluso GM (2010) Остеоциты и WNT: механический контроль образования кости. J Dent Res 89: 331–343. pmid: 20200416
- 7.
Лу И, Фэн Дж.К. (2011) FGF23 в моделировании и ремоделировании скелета. Curr Osteoporos Rep 9: 103–108. pmid: 21404002 - 8.
Фишер Д.К., Мишек А., Вольф С., Ран А., Салвески Б. и др. (2012) Педиатрические контрольные значения для C-концевого фрагмента фактора роста фибробластов-23, склеростина, костно-специфической щелочной фосфатазы и изоформы 5b устойчивой к тартрату кислой фосфатазы.Анналы клинической биохимии 49: 546–553. pmid: 22984195 - 9.
Querfeld U, Anarat A, Bayazit AK, Bakkaloglu AS, Bilginer Y, et al. (2010) Исследование коморбидности сердечно-сосудистой системы у детей с хроническим заболеванием почек (4C): цели, дизайн и методология. Clin J Am Soc Nephrol 5: 1642–1648. pmid: 20576824 - 10.
Schwartz GJ, Munoz A, Schneider MF, Mak RH, Kaskel F, et al. (2009) Новые уравнения для оценки СКФ у детей с ХБП. Журнал Американского общества нефрологов 20: 629–637.pmid: 19158356 - 11.
Хогг Р.Дж., Фурт С., Лемли К.В., Портман Р., Шварц Г.Дж. и др. (2003) Руководство по клинической практике Инициативы по качеству результатов заболеваний почек Национального фонда почек при хронической болезни почек у детей и подростков: оценка, классификация и стратификация. Педиатрия 111: 1416–1421. pmid: 12777562 - 12.
Ureña P, Hruby M, Ferreira A, Ang KS, de Vernejoul MC (1996) Общая плазма по сравнению с костной щелочной фосфатазой как маркеры метаболизма костной ткани у пациентов, находящихся на гемодиализе.J Am Soc Nephrol 7: 506–512. pmid: 8704118 - 13.
Шидара К., Инаба М., Окуно С., Ямада С., Кумеда И. и др. (2008) Сывороточные уровни TRAP5b, нового маркера резорбции кости, не подверженного почечной дисфункции, как полезного маркера потери кортикальной кости у пациентов, находящихся на гемодиализе. Calcif Tissue Int 82: 278–287. Доступно: http://www.cof.org.cn/pdf/2008/6/Serum%20Levels%20of%20TRAP5b.pdf. pmid: 18421493 - 14.
Ureña P, de Vernejoul MC (1999) Циркулирующие биохимические маркеры ремоделирования кости у пациентов с уремией.Почки Int 55: 2141–2156. pmid: 10354264 - 15.
Behnke B, Kemper M, Kruse HP, Müller-Wiefel DE (1998) Костная щелочная фосфатаза у детей с хронической почечной недостаточностью. Трансплантат Nephrol Dial 13: 662–667. pmid: 9550644 - 16.
Siomou E, Challa A, Printza N, Giapros V, Petropoulou F, et al. (2011) Сывороточный остеопротегерин, RANKL и фактор роста фибробластов-23 у детей с хронической болезнью почек. Педиатр Нефрол 26: 1105–1114. pmid: 21479768 - 17.Кирмани С., Амин С., Маккриди Л.К., Аткинсон Э.Дж., Мелтон Л.Дж. и др. (2011) Уровни склеростина во время роста у детей. Osteoporos Int 23: 1123–1130. pmid: 21617991
- 18.
Pelletier S, Dubourg L, Carlier MC, Hadj-Aissa A, Fouque D (2013) Связь между функцией почек и склеростином сыворотки у взрослых пациентов с ХБП. Clin J Am Soc Nephrol 8: 819–823. pmid: 23430206 - 19.
Саббаг И., Грасиолли Ф.Г., О’Брайен С., Тан В., Рейс дос Л. М. и др. (2012) Репрессия передачи сигналов Wnt / β-catenin остеоцитов является ранним событием в прогрессировании почечной остеодистрофии.J Bone Miner Res 27: 1757–1772. pmid: 22492547 - 20.
Kramer I, Keller H, Leupin O, Kneissel M (2010) Опосредует ли подавление SOST остеоцитов анаболизм костей ПТГ? Тенденции метаболизма эндокринола 21: 237–244. pmid: 20074973 - 21.
Drake MT, Srinivasan B, Mödder UI, Peterson JM, McCready LK и др. (2010) Влияние лечения паратироидным гормоном на уровни циркулирующего склеростина у женщин в постменопаузе. J Clin Endocrinol Metab 95: 5056–5062. pmid: 20631014 - 22.Cejka D, Herberth J, Branscum AJ, Fardo DW, Monier-Faugere M-C и др. (2011) Склеростин и Диккопф-1 при почечной остеодистрофии. Clin J Am Soc Nephrol 6: 877–882. pmid: 21164019
- 23.
Пул КЕС, ван Безойен Р.Л., Ловеридж Н., Хамерсма Х., Папапулос С.Е. и др. (2005) Склеростин — это продукт замедленной секреции остеоцитов, который ингибирует образование кости. FASEB J 19: 1842–1844. pmid: 16123173 - 24.
Райан З.С., Кета Х., МакНалти М.С., Макги-Лоуренс М., Крейг Т.А. и др.(2013) Склеростин изменяет сывороточные концентрации метаболита витамина D и фактора роста фибробластов 23, а также экскрецию кальция с мочой. Proc Natl Acad Sci USA 110: 6199–6204. pmid: 23530237 - 25.
Шимада Т., Какитани М., Ямадзаки Ю., Хасегава Х., Такеучи Ю. и др. (2004) Целенаправленное удаление Fgf23 демонстрирует важную физиологическую роль FGF23 в метаболизме фосфатов и витамина D. Дж. Клин Инвест 113: 561–568. pmid: 14966565 - 26.
Bacchetta J, Dubourg L, Harambat J, Ranchin B, Abou-Jaoude P и др.(2010) Влияние скорости клубочковой фильтрации и возраста на сывороточные уровни фактора роста фибробластов при хронической болезни почек у детей. J Clin Endocrinol Metab 95: 1741–1748. pmid: 20157196 - 27.
Pereira RCR, Juppner HH, Azucena-Serrano CEC, Yadin OO, Salusky IBI и др. (2009) Паттерны экспрессии FGF-23, DMP1 и MEPE у пациентов с хроническим заболеванием почек. Кость 45: 8–8. - 28.
Wesseling-Perry K, Pereira RC, Wang H, Elashoff RM, Sahney S и др.(2009) Взаимосвязь между концентрацией фактора роста фибробластов-23 в плазме и минерализацией костей у детей с почечной недостаточностью на перитонеальном диализе. Журнал клинической эндокринологии и метаболизма 94: 511–517. pmid: 25361544 - 29.
Риминуччи М., Коллинз М.Т., Федарко Н.С., Черман Н., Корси А. и др. (2003) FGF-23 при фиброзной дисплазии костей и его связь с почечным фосфатным истощением. Дж. Клин Инвест 112: 683–692. pmid: 12952917 - 30.
Йошико Ю., Ван Х., Минамидзаки Т., Иджуин С., Ямамото Р. и др.(2007) Минерализованные тканевые клетки являются основным источником FGF23. Кость 40: 1565–1573. pmid: 17350357 - 31.
Wesseling-Perry K (2010) FGF-23 в биологии костей. Педиатр Нефрол 25: 603–608. pmid: 20012997 - 32.
Wesseling-Perry K, Pereira RC, Tseng C-H, Elashoff R, Zaritsky JJ, et al. (2012) Ранние скелетные и биохимические изменения при хронической болезни почек у детей. Clin J Am Soc Nephrol 7: 146–152. pmid: 22052943 - 33.
Баккетта Дж., Весселинг-Перри К., Куизон Б., Перейра Р.С., Гейлс Б. и др.(2013) Последствия терапии гормоном роста у детей после диализа для скелета: рандомизированное исследование. Клинический журнал Американского общества нефрологов 8: 824–832. pmid: 23559676 - 34.
Bacchetta J, Harambat J, Cochat P, Salusky IB, Wesseling-Perry K (2012) Последствия хронической болезни почек на метаболизм и рост костей у детей. Нефрологическая диализная трансплантация 27: 3063–3071. pmid: 22851629 - 35.
Gardner J, Ashraf A, You Z, McCormick K (2011) Изменения в плазме FGF23 у детей с дефицитом гормона роста во время терапии rhGH.J Pediatr Endocrinol Metab 24: 645–650. pmid: 22145450 - 36.
Tobiume HH, Kanzaki SS, Hida SS, Ono TT, Moriwake TT и др. (1997) Уровни изофермента щелочной фосфатазы в сыворотке крови у здоровых детей и детей с дефицитом гормона роста (GH): потенциальный маркер образования кости и ответа на терапию GH. Журнал клинической эндокринологии и метаболизма 82: 2056–2061. pmid: 25361544 - 37.
Борзих Д., Рис Л., Су Ха Иль, Чуа А., Валлес П. Г. и др.(2010) Заболевание костей и минералов у детей, находящихся на хроническом перитонеальном диализе. Почки Int 78: 1295–1304. pmid: 20811335
Детская клиника нарушений костного и минерального обмена
Уход во время COVID-19
Наши преданные своему делу врачи, медсестры и персонал стремятся обеспечить наилучший уход за детьми. Мы предприняли беспрецедентные шаги, чтобы посещения офиса и процедуры были приятными и безопасными. Здоровье и безопасность вашего ребенка — наш главный приоритет.Узнать больше.
Обзор
В детской клинике нарушений костного и минерального метаболизма мы специализируемся на лечении низкой плотности костей, остеопороза, дефицита витамина D, рахита и остеомаляции, гипопаратиреоза, псевдогипопаратиреоза и других заболеваний, влияющих на здоровье костей и минеральный обмен у младенцев, детей и подростков. Взрослые.
Наши поставщики из детской эндокринологии и детской нефрологии совместно работают над созданием индивидуальных планов лечения для пациентов всех возрастов, от младенцев до детей и молодых людей.Медицинские работники из отделов генетики, детской неврологии и физиотерапии предоставляют консультации по мере необходимости. Мы также сотрудничаем со специалистами MGHfC и Массачусетской больницы общего профиля, включая педиатрическую гастроэнтерологию и диетологию, подростковую медицину и детскую ортопедию.
План ухода за каждым ребенком доводится до сведения поставщиков первичной медико-санитарной помощи, соответствующих специалистов и, что наиболее важно, ребенка и семьи, чтобы обеспечить высочайшее качество ухода. Мы считаем, что семьи знают своих детей лучше всего, поэтому мы привлекаем семью к каждому этапу плана ухода за ребенком.Наша клиника также способствует плавному переходу от педиатрической помощи к уходу за взрослыми для подростков старшего возраста, чтобы обеспечить постоянную заботу о здоровье их костей.
Условия, которые мы лечим
- Дефицит витамина D и другие нарушения обмена витамина D
- Рахит и остеомаляция
- Нарушения обмена кальция и фосфора
- Заболевания околощитовидной железы
- Нефрокальциноз и камни в почках
- Минеральные и костные нарушения, связанные с хронической болезнью почек (CKD-MBD)
- Несовершенный остеогенез («болезнь хрупкости костей») и другие генетические заболевания костей
- Низкая плотность костной ткани и остеопороз при следующих состояниях:
Услуги, которые мы предлагаем
- Измерение минералов в костях, метаболитов витамина D, гормонов, участвующих в минеральном обмене, и скрининговые тесты для выявления других медицинских проблем
- Двухэнергетическая рентгеновская абсорбциометрия (DXA) для измерения минеральной плотности костной ткани и минерального содержания костной ткани с использованием низкоэнергетических рентгеновских лучей, которые проверяются специалистами, имеющими опыт интерпретации результатов тестов на минеральную плотность костной ткани и плотность костной ткани у детей.
- Генетическое тестирование, включая полное секвенирование экзома для таких состояний, как несовершенный остеогенез (болезнь хрупкости костей) и других редких заболеваний, влияющих на метаболизм костей и минералов
- Опыт применения в педиатрии лекарств, нацеленных на кости, включая бисфосфонаты
- Лечебная физкультура
Наши исследования
Отделения детской эндокринологии и детской нефрологии MGHfC имеют богатые традиции фундаментальных и трансляционных научных исследований метаболизма костей и гомеостаза минеральных ионов.
Наши основополагающие открытия в MGHfC включают определение генетической основы многочисленных наследственных заболеваний и изучение их физиологии, а также выяснение влияния приобретенных нарушений, таких как нервная анорексия, аменорея, вызванная физическими упражнениями, и хроническое заболевание почек, на детство. наращивание костей и обмен веществ.
Эта традиция продолжается и сегодня. Текущие исследования, проводимые нашими учеными-медиками, включают:
- Определение естественного течения гипопаратиреоза и связанных с ним почечных осложнений
- Исследование наращивания костной ткани у молодежи с диабетом 1 типа
- Сравнение влияния различных методов замещения эстрогенов на здоровье костей в триаде спортсменок
- Изучение скелетных эффектов бариатрической хирургии у подростков и молодых людей
- Оценка состояния костей у мальчиков с расстройствами аутистического спектра и определение влияния окситоцина на их рост костей
- Определение молекулярных причин и клинических характеристик нескольких наследственных заболеваний, таких как гипо- и гиперпаратиреоз; псевдогипопаратиреоз; гипо- и гиперфосфатемические расстройства; первичное заболевание почек; и коллагеновые аномалии
Для получения дополнительной информации посетите наши исследовательские сайты www.aneresearch.com или rally.partners.org.
Клинические испытания
Разыскиваются дети и подростки с диабетом 1 типа для исследования плотности костей
Нас интересует влияние диабета 1 типа на плотность костей. Мы ищем здоровых в остальном детей и молодых людей в возрасте от 6 до 20 лет с диабетом 1 типа, чтобы узнать, как меняется их плотность костей с течением времени.
Участие включает:
- 3 посещения Массачусетской больницы общего профиля в течение 2 лет
- Анализы крови и сканирование плотности костей (рентген)
- Компенсация до 300 долларов
Если интересно, свяжитесь с Кейт Килро
Детское эндокринное отделение
Массачусетская больница общего профиля
617-724-3255
Healthybones @ partners.org
или посетите наш веб-сайт.
Здоровые дети и подростки разыскиваются для исследования плотности костной ткани
Нас интересует влияние диабета 1 типа на плотность костей. Мы ищем здоровых детей и молодых людей в возрасте от 6 до 20 лет без диабета, чтобы сравнить их с людьми с диабетом.
Участие включает:
- 3 посещения Массачусетской больницы общего профиля в течение 2 лет
- Анализы крови и сканирование плотности костей (рентген)
- Компенсация до 300 долларов
Если интересно, свяжитесь с Кейт Килро
Детское эндокринное отделение
Массачусетская больница общего профиля
617-724-3255
Healthybones @ partners.org
или посетите наш веб-сайт.
Исследование костей у подростков и молодых людей с избыточным весом
В поисках полных девочек и мальчиков 13-25 лет
Наша миссия: понять влияние операции по снижению веса по сравнению с отсутствием операции (обычное лечение) на плотность и силу костей и состав тела.
Всего 6 посещений в течение 26 месяцев (и дополнительное посещение), в том числе:
- ДРА, КТ и МРТ
- Оценка физического состояния
- Оценка гормонов
- Стипендия до 2100 долларов
Если интересно, позвоните Амите Бозе по телефону 617-643-0266 или напишите по электронной почте ANEresearch @ partners.org .
Врачи
- Паула К. Голденберг, MD
- Брайан Эдвард Гротткау, MD
- Harald W. Jueppner, MD
- Мадхусмита Мишра, MD, MPH
- Дебора М. Митчелл, MD
- Энн Ноймайер, Мэриленд
- Элахна Пол, MD, PhD
- Амита Шарма, MD
Гиперчувствительность зубов — причины, профилактика, лечение
Чувствительность зубов — распространенная стоматологическая проблема. Гиперестезия не только вызывает дискомфорт, но и часто предшествует другим, более серьезным стоматологическим заболеваниям.
Гиперчувствительность зубов характеризуется рядом симптомов:
- внезапные приступы боли при употреблении холодной или горячей пищи и напитков
- неприятных ощущений при резком вдохе холодного воздуха
- болезненных ощущений при чистке зубов
Все эти проявления сигнализируют о том, что зубы требуют квалифицированного лечения.
Почему зубы становятся чувствительными
Основная причина — истончение или нарушение целостности слоя эмали зуба.Эмаль защищает зуб от внешних температурных воздействий, а также от химических и механических воздействий. Под слоем эмали находится дентин — чувствительная ткань, через которую проходят микроскопические канальцы, соединяющиеся с нервными окончаниями.
В результате истончения эмали открывается доступ к дентинным канальцам, и зуб начинает реагировать на любые раздражители.
Причины разрушения эмали
Спровоцировать некариозное разрушение эмали могут несколько факторов:
- Сдвиг в эндокринной системе.Изменение гормонального фона может вызвать нарушение минерального обмена.
- Бруксизм. Скрежетание зубами во сне неизбежно приводит к стиранию эмали и обнажению дентина.
- Неправильная чистка зубов. Слишком жесткая щетка или чрезмерная интенсивность процесса очистки приводят к механическому повреждению эмали.
Кроме того, гиперестезия связана с рецессией десен при пародонтозе (когда обнажается чувствительный корень зуба).
Средства для лечения гиперчувствительности зубов
При решении этого вопроса все стоматологические процедуры направлены на укрепление зубной эмали или на лечение заболеваний десен.
Одна из самых частых процедур — фторирование, обогащающее эмаль и предотвращающее кариес.
Если причиной истирания эмали стал бруксизм, можно использовать специальную капу.
В запущенных случаях, когда пациент долгое время игнорировал проявления гиперестезии, может потребоваться лечение корневых каналов.
В любом случае, наши врачи в Tribeca Dental Studio найдут точное решение в соответствии с вашим случаем и назначат лечение индивидуально.
Лечение гиперчувствительности зубов
Профилактика чувствительности зубов
Необходимо соблюдать несколько правил:
- В первую очередь нужно соблюдать гигиену полости рта. Также необходимо убедиться, что зубная щетка не слишком жесткая, а чистящие движения выполняются вертикально. При горизонтальной чистке эмаль стирается быстрее.
- С отбеливанием зубов нужно быть осторожным и не злоупотреблять профессиональной чисткой.
- Следует избегать чрезмерного употребления кисло-сладких продуктов.
- Также очень важно придерживаться полноценной сбалансированной диеты.
А главное, вовремя вылечить заболевание десен и кариес. Регулярное посещение стоматолога — верный способ сохранить зубы здоровыми.
Костный и минеральный метаболизм | Детская больница Колорадо
Программа костного и минерального метаболизма в детской больнице Колорадо специализируется на оценке и лечении состояний, которые влияют на здоровье костей детей или вызывают аномальный уровень минералов в крови.Это может включать такие состояния, как гипокальциемия, гиперкальциемия, гипофосфатемия, гипопаратиреоз, расстройства, связанные с паратиреоидным гормоном, низкая плотность костной ткани, остеопороз, дефицит витамина D, а также пищевые и генетические формы рахита.
О программе метаболизма костей и минералов
Программа костного и минерального метаболизма обеспечивает комплексный междисциплинарный подход к лечению, в котором участвуют специалисты в области эндокринологии, нефрологии, питания и ортопедии. Прием начинается со сбора анамнеза и физического осмотра вашего ребенка, что помогает нам составить индивидуальный план оценки.Оценки могут включать:
- Анализ крови: помогает нам оценить уровень минералов, гормональную регуляцию этих минералов и определить причины низкой костной массы и остеопороза
- Анализ мочи: помогает нам оценить уровень минералов
- Рентген: метод визуализации, который позволяет нам исследовать кости вашего ребенка на предмет каких-либо аномалий
- Тест плотности костной ткани: метод визуализации, позволяющий количественно определить костную массу
В зависимости от диагноза вашего ребенка лечение может включать:
- Изменение минерального баланса в результате приема лекарств или диеты
- Бисфосфонатная терапия
- Консультации по питанию
- Лечебная физкультура
Почему выбирают нас для лечения костей и минерального обмена
Мы специально обучены лечению детей и подростков, а это значит, что мы понимаем, что есть возможность помочь молодежи достичь максимальной костной массы.Другими словами, к 20 годам у нас больше нет костей. Вот почему чрезвычайно важно помочь детям и подросткам нарастить как можно больше костей, пока их тела все еще растут.
Информация, которую мы получаем в результате обследования вашего ребенка, помогает нашим специалистам поставить точный диагноз. Это важный шаг, потому что он позволяет нам составить индивидуальный план ухода за вашим ребенком, чтобы его лечение было эффективным. Преимущество мультидисциплинарного подхода к лечению заключается в том, что мы можем смотреть на лечение с разных сторон.Если ваш ребенок страдает нарушением минерального обмена, лечение может включать изменение питания, добавок или лекарств. Или, если у вашего ребенка остеопороз, мы разработаем план, который поможет укрепить его кости, который может включать терапию бисфосфонатами, информацию о том, как составить разнообразный рацион, и соответствующие упражнения с весовой нагрузкой для увеличения его костной массы.
Мы создаем индивидуальный план ухода, подобный этому, для каждого ребенка на основе опыта многих педиатров, в том числе:
Кроме того, мы заинтересованы не только в лечении детей доступными в настоящее время методами.Мы работаем над созданием новых и лучших методов для достижения оптимального здоровья костей у детей посредством научных исследований и клинических испытаний, в которых некоторые из наших пациентов могут иметь возможность принять участие. Наши исследования включают:
- Понимание естественного течения ахондроплазии, включая изучение осложнений, связанных с этим заболеванием
- Фаза 2 клинических испытаний ахондроплазии, которая включает введение лекарств, способствующих более длительному росту костей
- Оценка долгосрочной безопасности и эффективности лечения буросумабом у пациентов с Х-сцепленной гипофосфатемией (XLH)
- Оценка нового состава цитрата калия и бикарбоната калия для лечения дистального почечного канальцевого ацидоза
Кого мы лечим по программе метаболизма костей и минералов
Программа метаболизма костей и минералов лечит детей всех возрастов с различными заболеваниями.
