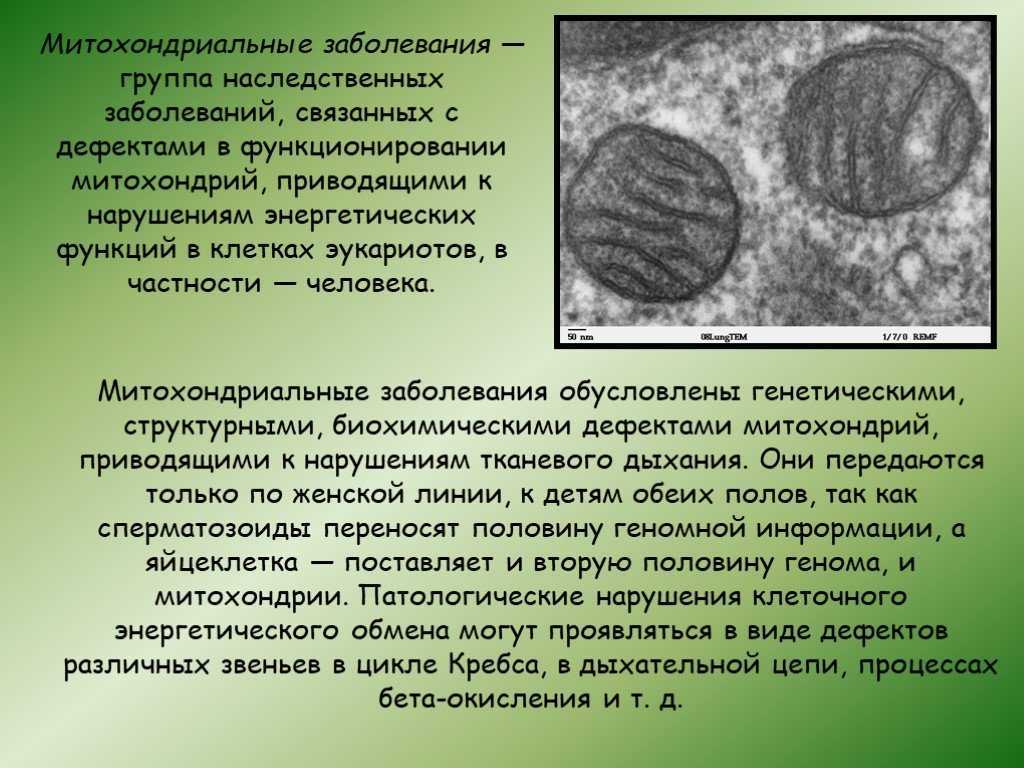
Митохондриальная дисфункция у детей: Проявления митохондриальной дисфункции у детей с дисплазией соединительной ткани и хроническим гастродуоденитом | Иванова
Проявления митохондриальной дисфункции у детей с дисплазией соединительной ткани и хроническим гастродуоденитом | Иванова
1. Брин И.Л., Неудахин Е.В., Дунайкин М.Л. Карнитин в педиатрии: исследования и клиническая практика. М.: Медпрактика-М, 2015; 112. [Brin I.L., Neudahin E.V., Dunajkin M.L. Carnitine in Pediatrics: research and clinical practice. Moscow: Medpraktika-M, 2015; 112 (in Russ.)]
2. Ивянский С.А., Балыкова Л.А., Щекина Н.В., Аритки- на А.А., Варлашина К.А., Широкова А.А. и др. Нарушения соединительной ткани у детей и подростков, занимающихся спортом. Consilium Medicum. Педиатрия 2016; 4: 94–101. [Ivyanskiy S.A., Balykova L.A., SHCHekina N.V., Aritkina A.A., Varlashina K.A., SHirokova A.A. et al. Disorders of connective tissue in children and adolescents involved in sports. Consilium Medicum. Pediatriya 2016; 4: 94–101 (in Russ.)]
3. Николаева Е.А. Митохондриальные болезни у детей: клинические проявления, возможности диагностики и лечения. Учебное пособие. М., 2017; 88. [Nikolaeva E.A. Mitochondrial diseases in children: clinical manifestations, diagnostics and treatment. Tutorial. Moscow, 2017; 88 (in Russ.)]
М., 2017; 88. [Nikolaeva E.A. Mitochondrial diseases in children: clinical manifestations, diagnostics and treatment. Tutorial. Moscow, 2017; 88 (in Russ.)]
4. Кадурина Т.И., Гнусаев С.Ф., Аббакумова Л.Н., Алимова И.Л., Антонова Н.С., Апенченко Ю.С. и др. Наследственные и многофакторные нарушения соединительной ткани у детей: алгоритмы диагностики, тактика ведения. Проект Российских рекомендаций. Педиатрия. Журнал им. Г.Н. Сперанского 2014; 93(5): Приложение: 1–40. [Kadurina T.I., Gnusaev S.F., Abbakumova L.N., Alimova I.L., Antonova N.S., Apenchenko Yu.S. et al. Inherited and multifactorial disorders of connective tissue in children: diagnostic algorithms and management. The project of the Russian recommendations. Pediatriya. Zhurnal im. G.N. Speranskogo ( Pediatria. Journal named after G.N. Speransky) 2014: 93(5): Suppl: 1–40 (in Russ.)]
5. Полиорганные нарушения при дисплазиях соединительной ткани у детей. Алгоритмы диагностики. Тактика ведения. Российские рекомендации. Часть 2.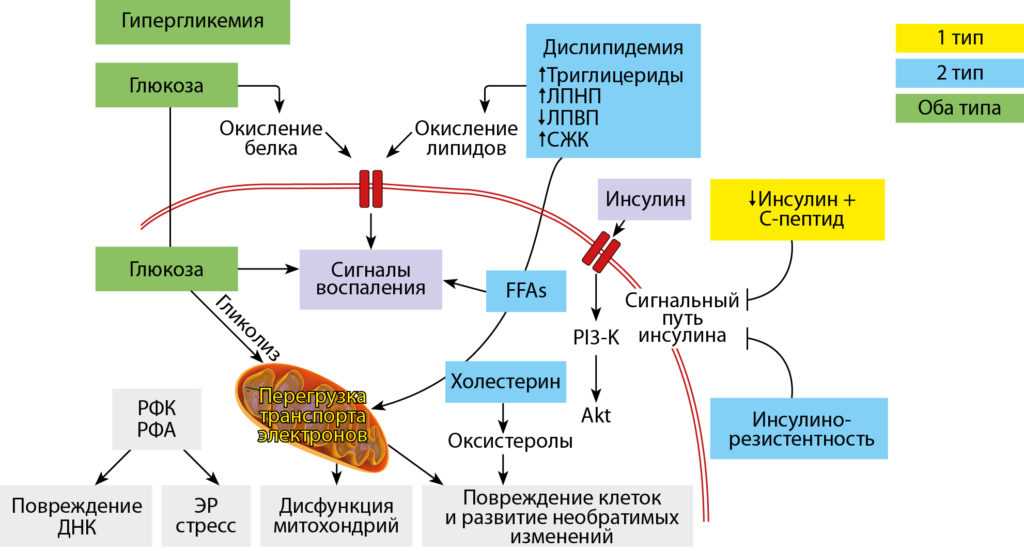 Вопросы детской диетологии 2017; 15(3): 47–70. [Multiorgan disorders in connective tissue dysplasia in children. Algorithms of diagnostics. Tactics of reference. Russian recommendations. Part 2. Voprosy detskoi dietologii 2017; 15 (3): 47–70 (in Russ.)]
Вопросы детской диетологии 2017; 15(3): 47–70. [Multiorgan disorders in connective tissue dysplasia in children. Algorithms of diagnostics. Tactics of reference. Russian recommendations. Part 2. Voprosy detskoi dietologii 2017; 15 (3): 47–70 (in Russ.)]
6. Кадурина Т.И., Горбунова В.Н. Дисплазия соединительной ткани: Руководство для врачей. СПб: Элби-СПб 2009; 704. [Kadurina T.I., Gorbunova V.N. Connective tissue dysplasia: a Guide for physicians. SPb.: EHlbi-SPb, 2009; 704 (in Russ.)]
7. Чемоданов В.В., Краснова Е.Е. Особенности течения заболеваний у детей с дисплазией соединительной ткани. Иваново: ГОУ ВПО ИвГМА Росздрава, 2009; 140. [Chemodanov V.V., Krasnova E.E. Peculiarities of disease in children with connective tissue dysplasia. Ivanovo: GOU VPO IvGMA Roszdrava, 2009; 140 (in Russ.)]
8. Арсентьев В.Г., Арзуманова Т.И., Асеев М.В., Баранов В.С., Калядин С.Б., Никифорова И.Д., Шабалов Н.П. Полиорганные нарушения при ДСТ у детей и подростков. Педиатрия 2009; 88(1): 135–138. [Arsent’ev V.G., Arzumanova T.I., Aseev M.V., Baranov V.S., Kalyadin S.B., Nikiforova I.D., Shabalov N.P. Multiple organ disorders in connective tissue dysplasia in children and adolescents. Pediatriya 2009; 88(1): 135–138 (in Russ.)]
[Arsent’ev V.G., Arzumanova T.I., Aseev M.V., Baranov V.S., Kalyadin S.B., Nikiforova I.D., Shabalov N.P. Multiple organ disorders in connective tissue dysplasia in children and adolescents. Pediatriya 2009; 88(1): 135–138 (in Russ.)]
9. Апенченко Ю.С., Басалаева Н.В., Капустина Л.В., Иванова И.И. Клинические и биохимические признаки дисплазии соединительной ткани у детей с гастроэзофагеальной рефлюксной болезнью. Вестник Ивановской медицинской академии 2014; 19(3): 17–19. [Apenchenko Yu.S., Basalaeva N.V., Kapustina L.V., Ivanova I.I. Clinical and biochemical signs of connective tissue dysplasia in children with gastroesophageal reflux disease. Vestnik Ivanovskoi meditsinskoi akademii 2014; 19(3): 17–19 (in Russ.)]
10. Иванова И.И., Гнусаев С.Ф., Апенченко Ю.С., Капустина Л.В., Герасимов Н.А., Солдатова И.А. Особенности проявлений заболеваний пищеварительного тракта у детей с дисплазией соединительной ткани. Вопросы современной педиатрии 2012; 11(5): 50–55. [Ivanova I.I., Gnusaev S. F., Apenchenko Yu.S., Kapustina L.V., Gerasimov N.A., Soldatova I.A. Features of diseases of the digestive tract in children with connective tissue dysplasia. Voprosy sovremennoi pediatrii 2012; 11(5): 50–55 (in Russ.)]
F., Apenchenko Yu.S., Kapustina L.V., Gerasimov N.A., Soldatova I.A. Features of diseases of the digestive tract in children with connective tissue dysplasia. Voprosy sovremennoi pediatrii 2012; 11(5): 50–55 (in Russ.)]
11. Смирнова Е.В., Лобанов Ю.Ф., Скударнов Е.В. Особенности течения эрозивного гастродуоденита у детей с дисплазией соединительной ткани. Вопросы современной педиатрии 2006; 5(4): 122–129. [Smirnova E.V., Lobanov Yu.F., Skudarnov E.V. Peculiarities of erosive gastroduodenitis in children with connective tissue dysplasia. Voprosy sovremennoi pediatrii 2006; 5(4): 122–129 (in Russ.)]
12. Демин В.Ф., Ключников С.О., Ключникова М.А. Значение соединительнотканных дисплазий в патологии детского возраста. Вопросы современной педиатрии 2005; 4(1): 50–56. [Demin V.F., Klyuchnikov S.O., Klyuchnikova M.A. The value of connective tissue dysplasia in childhood pathology. Voprosy sovremennoi pediatrii 2005; 4(1): 50–56 (in Russ.)]
13. Трутнева Л.А., Чемоданов В.В. Особенности гастродуоденальных заболеваний у детей с недифференцированной дисплазией соединительной ткани. Педиатрия. Журнал им. Г.Н. Сперанского 2010; 89(2): 12–17. [Trutneva L.A., Chemodanov V.V. Peculiarities of gastroduodenal diseases in children with undifferentiated dysplasia of connective tissue. Pediatriya. Zhurnal im. G.N. Speranskogo ( Pediatria. Journal named after G.N. Speransky) 2010; 89(2): 12–17 (in Russ.)]
Педиатрия. Журнал им. Г.Н. Сперанского 2010; 89(2): 12–17. [Trutneva L.A., Chemodanov V.V. Peculiarities of gastroduodenal diseases in children with undifferentiated dysplasia of connective tissue. Pediatriya. Zhurnal im. G.N. Speranskogo ( Pediatria. Journal named after G.N. Speransky) 2010; 89(2): 12–17 (in Russ.)]
14. Рахматуллина З.А., Выхристюк О.Ф., Русакова В.Д. Дис- плазии соединительной ткани и полиорганная патология у детей. Мед помощь 2008; 5: 29–31. [Rahmatullina Z.A., Vyhristyuk O.F., Rusakova V.D. Connective tissue dysplasia and multiple organ pathology in children. Med pomoshch’ 2008; 5: 29–31 (in Russ.)]
15. Сухоруков В.С. Очерки митохондриальной патологии. М.: Медпрактика-М, 2011; 288. [Suhorukov V.S. Study of mitochondrial pathology. Moscow: Medpraktika-M, 2011; 288 (in Russ.)]
16. Баедилова М.Т., Суменко В.В., Сухоруков В.С., Лебедькова С.Е., Трусова О.Ю. Эффективность энерготропной терапии при нарушении клеточного энергообмена у детей с пролапсом митрального клапана Российский вестник перинатологии и педиатрии 2017; 62(1): 74–80.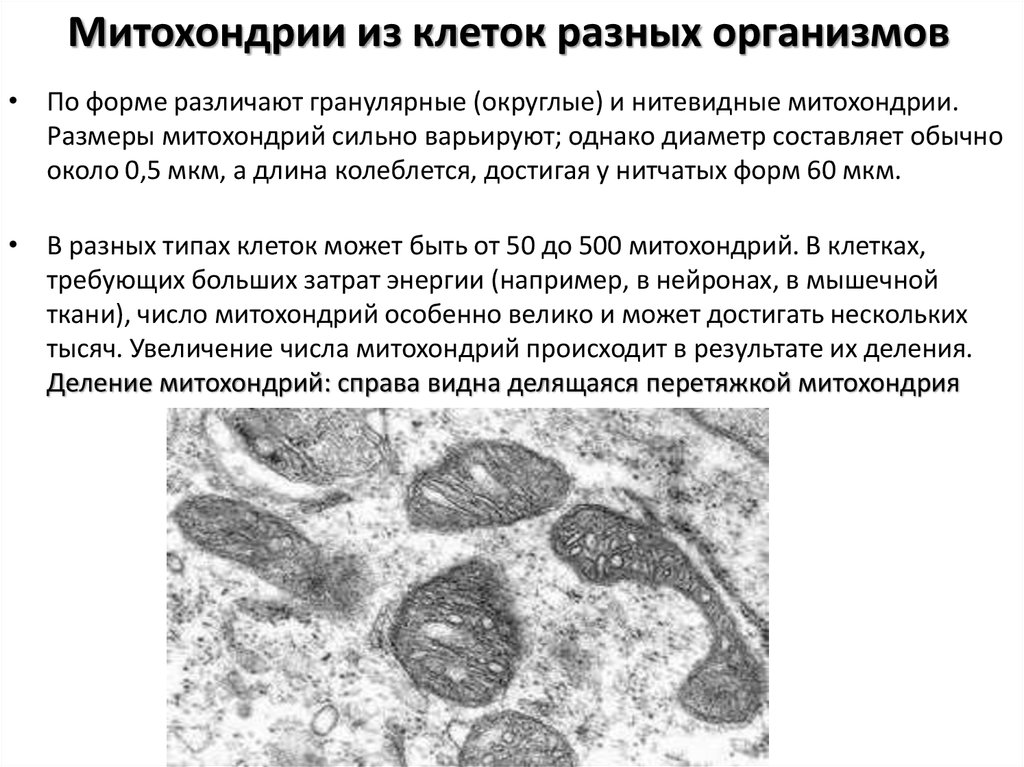 [Baedilova M.T., Sumenko V.V., Suhorukov V.S., Lebed’kova S.E., Trusova O.Yu. The effectiveness of energotropic therapy in violation of cellular energy exchange in children with mitral valve prolapse. Rossiyskiy Vestnik Perinatologii i Pediatrii ( Russian Bulletin of Perinatology and Pediatrics) 2017; 62(1): 74–80 (in Russ.)] DOI: 10.21508/1027-4065-2017-62-1-74-80
[Baedilova M.T., Sumenko V.V., Suhorukov V.S., Lebed’kova S.E., Trusova O.Yu. The effectiveness of energotropic therapy in violation of cellular energy exchange in children with mitral valve prolapse. Rossiyskiy Vestnik Perinatologii i Pediatrii ( Russian Bulletin of Perinatology and Pediatrics) 2017; 62(1): 74–80 (in Russ.)] DOI: 10.21508/1027-4065-2017-62-1-74-80
17. Думова С.В., Чугунова О.Л. Внутриклеточные энергетические нарушения у недоношенных детей с задержкой внутриутробного развития и их коррекция. Практика педиатра 2013; 1: 68–69. [Dumova S.V., Chugunova O.L. Intracellular energy disorders in premature infants with intrauterine growth retardation and their correction. Praktika pediatra (Current Pediatrics) 2013; 1: 68–69 (in Russ.)]
18. Неудахин Е.В. Целесообразность использования препаратов карнитина при лечении хронических расстройств питания у детей. Практика педиатра 2015; 2: 48–52. [Neudahin E.V. The feasibility of using preparations of carnitine in the treatment of chronic eating disorders in children. Praktika pediatra ( Current Pediatrics) 2015; 2: 48–52 (in Russ.)]
Praktika pediatra ( Current Pediatrics) 2015; 2: 48–52 (in Russ.)]
19. Иванова И.И., Гнусаев С.Ф., Коваль Н.Ю., Герасимов Н.А., Солдатова И.А. Метаболические аспекты недифференцированной дисплазии соединительной ткани у детей. Российский вестник перинатологии и педиатрии 2012; 57(4): 103–111. [Ivanova I.I., Gnusaev S.F., Koval’ N.Yu., Gerasimov N.A., Soldatova I.A. Metabolic aspects of undifferentiated connective tissue dysplasia in children. Rossiyskiy Vestnik Perinatologii i Pediatrii ( Russian Bulletin of Perinatology and Pediatrics) 2012; 57(4): 103–111 (in Russ.)]
20. Parich S., Goldstein A., Koenig M.K., Scaglia F., Enns G.M., Saneto R. et al. Diagnosis and management of mitochondrial disease: a consensus statement from the Mitochondrial Medicine Society. J Genet Med 2015; 17(9): 689–701. DOI: 10.1038/gim.2014.177
21. Иванова И.И., Гнусаев С.Ф., Ильина А.А. Клинические проявления нарушений клеточного энергообмена при соматических заболеваниях у детей. Российский вестник перинатологии и педиатрии 2018; 63(2): 27–33.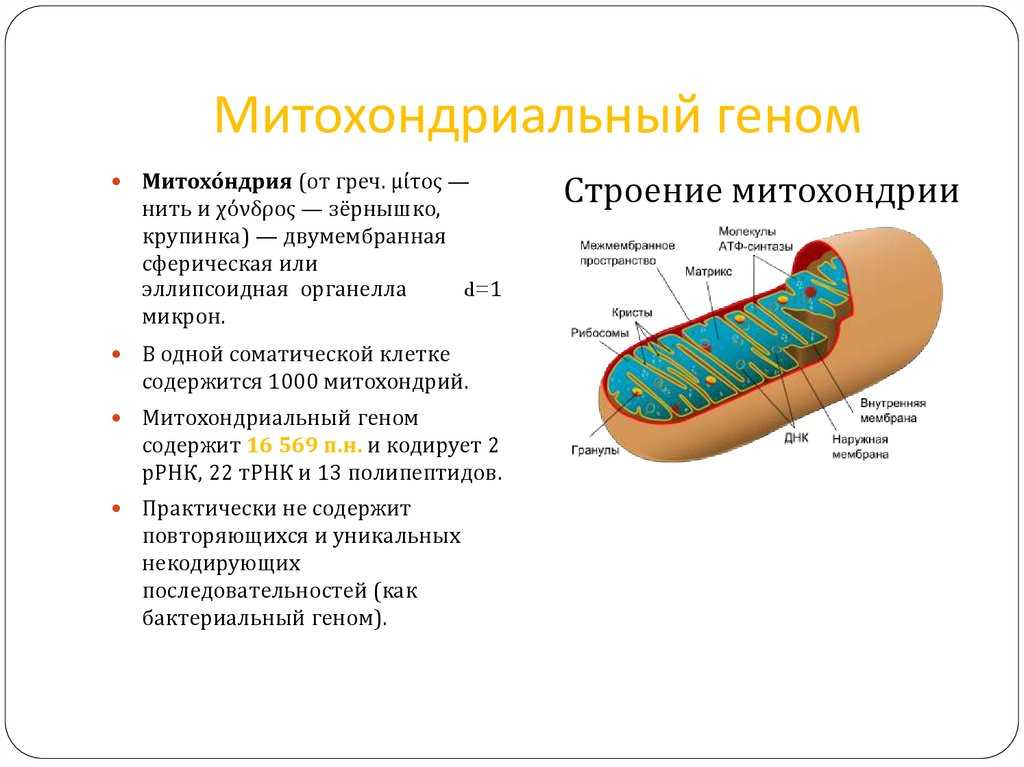 DOI: 10.21508/1027-4065-2018-63-2-27-33 [Ivanova I.I., Gnusaev S.F., Il’ina A.A. Clinical manifestations of cellular energy exchange disorders in somatic diseases in children. Rossiyskiy Vestnik Perinatologii i Pediatrii (Russian Bulletin of Perinatology and Pediatrics) 2018; 63(2): 27–33 (in Russ.)]
DOI: 10.21508/1027-4065-2018-63-2-27-33 [Ivanova I.I., Gnusaev S.F., Il’ina A.A. Clinical manifestations of cellular energy exchange disorders in somatic diseases in children. Rossiyskiy Vestnik Perinatologii i Pediatrii (Russian Bulletin of Perinatology and Pediatrics) 2018; 63(2): 27–33 (in Russ.)]
22. Каламбет Е.И., Османов И.М., Сухоруков В.С., Шабельникова Е.И., Хавкин А.И. Нарушения клеточного энергообмена и их коррекция при заболеваниях органов пищеварения у детей. Вопросы практической педиатрии 2012; 2: 69–72. [Kalambet E.I., Osmanov I.M., Suhorukov V.S., Shabel’nikova E.I., Khavkin А.I. Violation of cellular energy metabolism and their correction in diseases of the digestive system in children. Voprosy prakticheskoi pediatrii 2012; 2: 69–72 (in Russ.)]
23. Зиганшина А.А., Сухоруков В.С., Булатов В.П. Митохондриальная дисфункция у детей с рефлюкс-эзофагитом. Российский вестник перинатологии и педиатрии 2017; 62(2): 88–92. DOI: 10.21508/1027-4065-2017-62-2-88-93 [Ziganshina A. A., Suhorukov V.S., Bulatov V.P. Mitochondrial dysfunction in children with reflux esophagitis. Rossiyskiy Vestnik Perinatologii i Pediatrii (Russian Bulletin of Perinatology and Pediatrics) 2017; 62(2): 88–92 (in Russ.)]
A., Suhorukov V.S., Bulatov V.P. Mitochondrial dysfunction in children with reflux esophagitis. Rossiyskiy Vestnik Perinatologii i Pediatrii (Russian Bulletin of Perinatology and Pediatrics) 2017; 62(2): 88–92 (in Russ.)]
24. Ключников С.О., Ильяшенко Д.А., Ключникова М.С. Обоснование применения L-карнитина и коэнзима Q10 у подростков. Вопросы современной педиатрии 2008; 7(4): 102–104. [Klyuchnikov S.O., Il’yashenko D.А., Klyuchnikovа M.S. The rationale for the use of L-carnitine and coenzyme Q10 in adolescents. Voprosy Sovremennoi Pediatrii (Current Pediatrics) 2008; 7(4): 102–104 (in Russ.)]
25. Кадурина Т.И., Аббакумова Л.Н. Оценка степени тяжести недифференцированной дисплазии соединительной ткани у детей. Медицинский вестник Северного Кавказа 2008; 2: 15–21. [Kadurina T.I., Abbakumova L.N. Assessment of severity of undifferentiated connective tissue dysplasia in children. Meditsinskii vestnik Severnogo Kavkaza 2008; 2: 15–21 (in Russ.)]
26. Иванова И.И., Гнусаев С. Ф., Сухоруков В.С. Опыт применения препарата L-карнитина у детей с ХГД и ДСТ. Вопросы практической педиатрии 2018; 13(6): 72–78. DOI: 10.20953/1817-7646-2018-6-72-78 [Ivanova I.I., Gnusaev S.F., Suhorukov V.S. Experience with L-carnitine in children with chronic gastroduodenitis and connective tissue dysplasia. Voprosy prakticheskoi pediatrii 2018; 13(6): 72–78 (in Russ.)]
Ф., Сухоруков В.С. Опыт применения препарата L-карнитина у детей с ХГД и ДСТ. Вопросы практической педиатрии 2018; 13(6): 72–78. DOI: 10.20953/1817-7646-2018-6-72-78 [Ivanova I.I., Gnusaev S.F., Suhorukov V.S. Experience with L-carnitine in children with chronic gastroduodenitis and connective tissue dysplasia. Voprosy prakticheskoi pediatrii 2018; 13(6): 72–78 (in Russ.)]
Нарушение митохондриального обмена у детей с расстройствами аутистического спектра: обзор литературы и собственные данные
SOVREMENNAYA PEDIATRIYA.2017.8(88):111-119; doi 10.15574/SP.2017.88.111
Кирилова Л. Г., Мирошников А. А., Ткачук Л. И., Юзва А. А., Силаева Л. Ю., Михайлец Л. П., Ленчевская Л. К.
ГУ «Институт педиатрии, акушерства и гинекологии НАМН Украины», г. Киев
В современном обществе отмечается стремительный рост заболеваемости расстройствами аутистического спектра (РАС). Окончательно этиологические и патогенетические факторы этих заболеваний не установлены. В настоящем исследовании рассматриваются нарушения функционирования митохондрий как один из возможных патогенетических факторов формирования РАС.
Цель: определить особенности биохимических показателей митохондриальной дисфункции и ее распространенность среди детей с РАС.
Материалы и методы. Обследовано 25 детей с РАС и 15 здоровых детей группы контроля в возрасте 1,5–5,5 г. (средний возраст — 3,5 г.). Мальчиков было 18 (72%), девочек — 7 (18%). У детей проводили определение концентрации лактата и пирувата.
Результаты. Выявлено повышение концентрации лактата натощак у 18 детей (72,0%) с РАС. У детей данной группы в основном отмечался умеренно выраженный лактат4ацидоз, при котором концентрация лактата превышала референтные значения на 25–50%. Повышение концентрации лактата в пределах 25% отмечалось у 2 (8%) детей, а выше на 50% — у 7 (16,0%) детей. Также обнаружено снижение соотношения лактат/пируват у 19 (76,0%) детей с РАС.
Выводы. У детей с РАС виявлены высокие показатели распространенности и выраженности митохондриальной дисфункции, которую можно считать важным патогенетическим фактором регрессивных форм РАС. Раннее выявление митохондриальной дисфункции является критически важным и требует немедленного лечения. Предложено скрининговое определение уровня лактата, пирувата и их соотношения натощак у всех детей с РАС.
Раннее выявление митохондриальной дисфункции является критически важным и требует немедленного лечения. Предложено скрининговое определение уровня лактата, пирувата и их соотношения натощак у всех детей с РАС.
Ключевые слова: митохондриальная дисфункция, расстройства аутистического спектра, лактат, пируват, дыхательная цепь.
Литература
1. Батышева Т.Т., Трепилец В.М., Ахадова Л.Я., Голосная Г.С. (2015). Синдром Альперса-Хуттенлохера. Эпилепсия и пароксизмальные состояния. 7(1): 46—55.
2. A modern approach to the treatment of mitochondrial disease / Parikh S. [et al.] // Curr Treat Options Neurol. — 2009. — Vol.11(6). — P.414—30. https://doi.org/10.1007/s11940-009-0046-0; PMid:19891905 PMCid:PMC3561461
3. A proton spectroscopy study of white matter in children with autism / Hardan A.Y., Fung L.K., Frazier T. [et al.] // Prog Neuro Psychopharmacology Biol Psychiatry. — 2015. — Vol.66. — P.48—53. https://doi.org/10. 1016/j.pnpbp.2015.11.005; PMid:26593330 PMCid:PMC4728039
1016/j.pnpbp.2015.11.005; PMid:26593330 PMCid:PMC4728039
4. Alterations in mitochondrial DNA copy number and the activities of electron transport chain complexes and pyruvate dehydrogenase in the frontal cortex from subjects with autism / Gu F., Chauhan V., Kaur K. [et al.] // Transl Psychiatry. — 2013. — Vol.3. — P.299. https://doi.org/10.1038/tp.2013.68; PMid:24002085 PMCid:PMC3784762
5. An MRI and proton spectroscopy study of the thalamus in children with autism / Hardan A.Y., Minshew N.J., Melhem N.M. [et al.] // Psychiatry Res Neuroimaging. — 2008. — Vol.163. — P.97—105. https://doi.org/10.1016/j.pscychresns.2007.12.002; PMid:18508243 PMCid:PMC2467447
6. Brain region-specific deficit in mitochondrial electron transport chain complexes in children with autism / Chauhan A., Gu F., Essa M.M. [et al.] // J. Neurochem. — 2011. Vol.117. — P.209—220. https://doi.org/10.1111/j.1471-4159.2011.07189.x; PMid:21250997 PMCid:PMC4839269
7. Chan D.C. Mitochondria: Dynamic Organelles in Disease, Aging, and Development / D. C. Chan // Cell. — 2006. — Vol.125. — P.1241—1252. https://doi.org/10.1016/j.cell.2006.06.010; PMid:16814712
C. Chan // Cell. — 2006. — Vol.125. — P.1241—1252. https://doi.org/10.1016/j.cell.2006.06.010; PMid:16814712
8. Cohen R.D. Lactic acidosis: some physiological and clinical considerations / R.D. Cohen, R.A. Iles // Clin Sci Mol Med. Nov. — 1977. — Vol.53(5). — P.405—10.
9. Finsterer J. Mitochondrial toxicity of antiepileptic drugs and their tolerability in mitochondrial disorders / J. Finsterer, S.Z. Mahjoub // Expert Opinion on Drug Metabolism & Toxicology. — 2012. — Vol. 8(1). — P.71—9. https://doi.org/10.1517/17425255.2012.644535; PMid:22149023
10. Frye R.E. 15q11.2-13 duplication, mitochondrial dysfunction, and developmental disorders / R.E. Frye // J. Child Neurol. — 2009. — Vol.24(10). — P.1316—20. https://doi.org/10.1177/0883073809333531; PMid:19535813 PMCid:PMC2919279
11. Frye R.E. Metabolic and mitochondrial disorders associated with epilepsy in children with autism spectrum disorder / R.E. Frye // Epilepsy Behav. — 2015. — Vol.47. — P.147—57. https://doi.org/10.1016/j.yebeh.2014.08.134. Epub 2014 Nov 4.
https://doi.org/10.1016/j.yebeh.2014.08.134. Epub 2014 Nov 4.
12. Homo sapiens mitochondrion, complete genome. «Revised Cambridge Reference Sequence (rCRS): accession NC-012920», National Center for Biotechnology Information. Retrieved on 30 January 2016.
13. Lombard J. Autism: a mitochondrial disorder? / J. Lombard // Med Hypotheses. — 1998. Vol.50(6). — P.497—500. https://doi.org/10.1016/S0306-9877(98)90270-5
14. Manzi B. Autism and metabolic diseases / B. Manzi // J. Child Neurol. — 2008. — Vol.23(3). — P.307—14. https://doi.org/10.1177/0883073807308698; PMid:18079313
15. Mitochondrial abnormalities in temporal lobe of autistic brain / Tang G., Rios P.G., Kuo S.H. [et al.] // Neurobiol Dis. — 2009. — Vol.54. — P.349—361. https://doi.org/10.1016/j.nbd.2013.01.006; PMid:23333625 PMCid:PMC3959772
16. Mitochondrial disease criteria: diagnostic applications in children / Morava E., van den Heuvel L., Hol F. [et al.] // Neurology. — 2006. — Vol.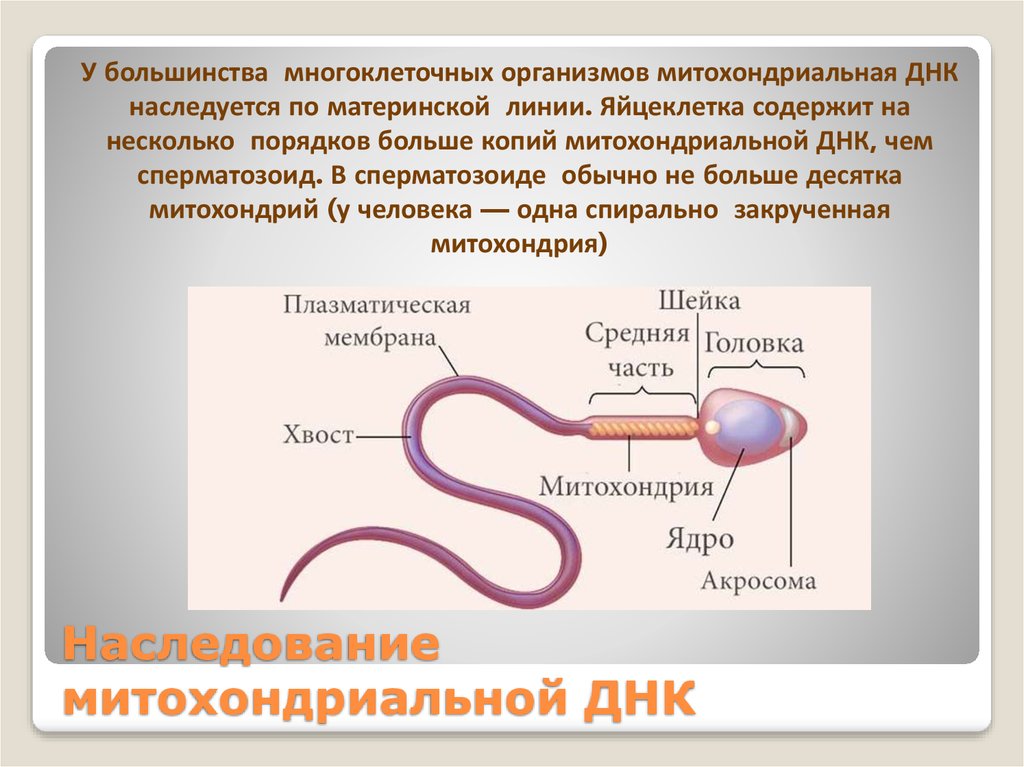 67(10). — P.1823—6. https://doi.org/10.1212/01.wnl.0000244435.27645.54; PMid:17130416
67(10). — P.1823—6. https://doi.org/10.1212/01.wnl.0000244435.27645.54; PMid:17130416
17. Mitochondrial disease in autism spectrum disorder patients: a cohort analysis / Weissman J.R., Kelley R.I., Bauman M.L. [et al.] // PLoS One. — 2008. — Vol. 3(11). — P.3815. https://doi.org/10.1371/journal.pone.0003815; PMid:19043581 PMCid:PMC2584230
18. Mitochondrial disease: a practical approach for primary care physicians / Haas R.H., Parikh S., Falk M.J. [et al.]// Pediatrics. Dec. — 2007. — Vol.120(6). — P.1326—33. https://doi.org/10.1016/j.mito.2007.04.005; https://doi.org/10.1016/j.mito.2007.03.008; PMid:17485245
19. Mitochondrial diseases associated with cerebral folate deficiency / Garcia-Cazorla A., Quadros E.V., Nascimento A. [et al.] // Neurology. — 2008. — Vol. 70(16). — P.1360—2. https://doi.org/10.1212/01.wnl.0000309223.98616.e4; PMid:18413591
20. Mitochondrial DNA haplogroup K is associated with a lower risk of Parkinson’s disease in Italians / Ghezzi D. [et al.] // European Journal of Human Genetics. — 2005. — Vol.13. — P. 748—752. https://doi.org/10.1038/sj.ejhg.5201425; PMid:15827561
[et al.] // European Journal of Human Genetics. — 2005. — Vol.13. — P. 748—752. https://doi.org/10.1038/sj.ejhg.5201425; PMid:15827561
21. Mitochondrial Dysfunction in Autism Spectrum Disorders /Siddiqui M. [et al.] // Autism Open Access. — 2016. — Vol.27. — P. 6(5).
22. Mitochondrial dysfunction in schizophrenia: evidence for compromised brain metabolism and oxidative stress / Prabakaran S., Swatton J.E., Ryan M.M. [et al.] // Mol Psychiatry. — 2004. — P.684—697., 643. [PubMed] https://doi.org/10.1038/sj.mp.4001532; https://doi.org/10.1038/sj.mp.4001511
23. Mitochondrial Medicine Society’s Committee on Diagnosis. Review The in-depth evaluation of suspected mitochondrial disease / Haas R.H., Parikh S., Falk M.J. [et al.] // Mol Genet Metab. — 2008 — Vol. 94(1). — P.16—37. https://doi.org/10.1016/j.ymgme.2007.11.018; PMid:18243024 PMCid:PMC2810849
24. Molecular evidence for mitochondrial dysfunction in bipolar disorder / Konradi C., Eaton M., MacDonald M. L. [et al.] // Arch Gen Psychiatry. — 2004. — Vol.61. — P.300—308. [PubMed] https://doi.org/10.1001/archpsyc.61.3.300; PMid:14993118
L. [et al.] // Arch Gen Psychiatry. — 2004. — Vol.61. — P.300—308. [PubMed] https://doi.org/10.1001/archpsyc.61.3.300; PMid:14993118
25. Multiple presentation of mitochondrial disorders / Nissenkorn A., Zeharia A., Lev D. [et al.] // Arch Dis Child. — 1999. — Vol.81(3). — P.209—14. https://doi.org/10.1136/adc.81.3.209; PMid:10451392 PMCid:PMC1718054
26. Naviaux R.K. Developing a systematic approach to the diagnosis and classification of mitochondrial disease / R.K. Naviaux // Mitochondrion. — 2004. — Vol.4. — P.351—361. https://doi.org/10.1016/j.mito.2004.07.002; PMid:16120397
27. Naviaux R.K. The Spectrum of Mitochondrial Disease, in Mitochondrial and Metabolic Disorders: A Primary Care Physician’s Guide / R.K. Naviaux. — 2nd ed., 2003.
28. Neurology of the Infant / Francesco Guzzetta (Ed.), John Libbey Eurotext. — Montrouge, 2009. — P.162.
29. Ohta S. Dysfunction of mitochondria and oxidative stress in the pathogenesis of Alzheimer’s disease: on defects in the cytochrome c oxidase complex and aldehyde detoxification / S. Ohta, I. Ohsawa // J. Alzheimers Dis. — 2006. — Vol.9. — P.155—166. https://doi.org/10.3233/JAD-2006-9208; PMid:16873963
Ohta, I. Ohsawa // J. Alzheimers Dis. — 2006. — Vol.9. — P.155—166. https://doi.org/10.3233/JAD-2006-9208; PMid:16873963
30. Palmieri L. Mitochondrial dysfunction in autism spectrum disorders: Cause or effect? / L. Palmieri, A.M. Persico // Biochim Biophys Acta. — 2010. — Vol.1797. — P.1130—1137. https://doi.org/10.1016/j.bbabio.2010.04.018; PMid:20441769
31. Pathogenic Mitochondrial DNA Mutations Are Common in the General Population / Elliot H., Samuels D. [et al.] // The American Journal of Human Genetics. — 2008. — Vol.83(2). —P. 254—260. https://doi.org/10.1016/j.ajhg.2008.07.004; PMid:18674747 PMCid:PMC2495064
32. Reanalysis and revision of the Cambridge reference sequence for human mitochondrial DNA / Andrews R. [et al.] // Nat Genet. — 1999. — Vol.23 (2). — P.147. https://doi.org/10.1038/13779; PMid:10508508
33. Richard I. Kelley, MD, PhD Evaluation and Treatment of Patients with Autism and Mitochondrial Disease [Electronic resource]. — URL: http://mitomedical. com.
com.
34. Rossignol D.A Mitochondrial dysfunction in autism spectrum disorders: a systematic review and meta_analysis / D.A. Rossignol // Mol Psychiatry. — 2012. — Vol.17(3). — P. 290—314. https://doi.org/10.1038/mp.2010.136; PMid:21263444 PMCid:PMC3285768
35. Smigrodzki R. M. Mitochondrial Microheteroplasmy and a Theory of Aging and Age_Related Disease / R. M. Smigrodzki, S. M. Khan // Rejuvenation Research. — 2005. — Vol.8 (3). — P.172—198. https://doi.org/10.1089/rej.2005.8.172; PMid:16144471
36. Trushina E. Oxidative stress and mitochondrial dysfunction in neurodegenerative diseases / E. Trushina, C.T. McMurray // Neuroscience. — 2007. — Vol.145. — P.1233—1248 [PubMed] https://doi.org/10.1016/j.neuroscience.2006.10.056; PMid:17303344
37. Valproic acid metabolism and its effects on mitochondrial fatty acid oxidation: a review / Silva M.F., Aires C.C., Luis P.B. [et al.] // J. Inherit Metab Dis. — 2008. — Vol.31. — P.205—216. https://doi.org/10.1007/s10545-008-0841-x; PMid:18392741
38. Zeviani M. Mitochondrial disorders / M. Zeviani, S. Di Donato // Brain. — 2004. — Vol.127 (10). — P.2153—2172. https://doi.org/10.1093/brain/awh359; PMid:15358637
Zeviani M. Mitochondrial disorders / M. Zeviani, S. Di Donato // Brain. — 2004. — Vol.127 (10). — P.2153—2172. https://doi.org/10.1093/brain/awh359; PMid:15358637
Митохондриальные заболевания
Использование моделей мышей Ndufs4 для понимания активации mTOR при синдроме Ли и других митохондриальных заболеваниях
Обзор технологии
Митохондриальные заболевания очень разнообразны, возникают в результате мутаций в сотнях генов и могут приводить к повреждению клеток в пораженных тканях. Одной из наиболее распространенных форм митохондриального заболевания является синдром Лея (LS), прогрессирующее нейродегенеративное заболевание, характеризующееся задержкой развития, двигательными нарушениями и, в конечном итоге, смертью. Прогрессирующие поражения ствола головного мозга и мозжечка являются отличительными чертами энцефалопатии. Большинство пациентов с LS проявляют симптомы в младенчестве и умирают в течение года после постановки диагноза, поскольку лечения нет.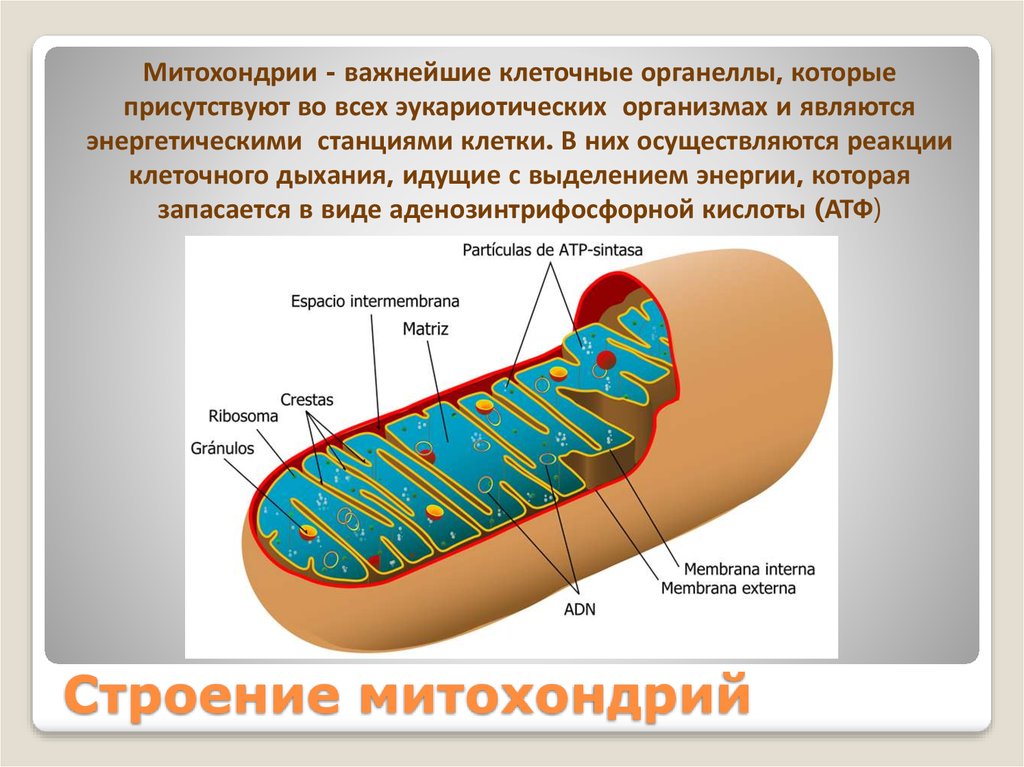 Плохой прогноз этого заболевания побуждает ученых искать основные пути, которые могут позволить ввести вмешательства.
Плохой прогноз этого заболевания побуждает ученых искать основные пути, которые могут позволить ввести вмешательства.
Д-р Маргарет СеденскиД-р. Филип Морган
Одно из направлений работы доктора. Sedensky and Morgan предполагает использование новой мышиной модели LS для понимания прогрессирования заболевания и потенциальных терапевтических целей. Эта мышиная модель LS, в которой субъединица комплекса I, NDUFS4, нокаутирована, повторяет симптомы, наблюдаемые у пациентов-людей, у которых диагностированы мутации Ndufs4 , а также другие мутации, связанные с LS. Важные результаты включают различные уровни аномалий головного мозга в разных регионах, что представляет собой беспрецедентную возможность понять механизмы, с помощью которых дисфункция комплекса I вызывает прогрессирующую нейродегенерацию в конкретной области.
Работа доктора. Sedensky и Morgan показали, что митохондриальная функция в случаях LS локализована в определенных областях ЦНС, оставляя незатронутыми многие области мозга. Электрофизиологические исследования показали усиление передачи синаптических возбуждающих сигналов в гиппокампе мыши Ndufs4(KO) . Кроме того, ограничение мутации специфичной экспрессией глутаматергических клеток повторяет паттерн общего KO, в то время как ГАМКергическая и холинергическая экспрессия этого не делают. Работа этой группы также показала, что лечение Ndufs4 с рапамицином облегчает повреждение ЦНС способом, соответствующим метаболическим эффектам, а не воспалительным путям. Известно, что мишень рапамицина (mTOR) устраняет токсичность глутамата.
Электрофизиологические исследования показали усиление передачи синаптических возбуждающих сигналов в гиппокампе мыши Ndufs4(KO) . Кроме того, ограничение мутации специфичной экспрессией глутаматергических клеток повторяет паттерн общего KO, в то время как ГАМКергическая и холинергическая экспрессия этого не делают. Работа этой группы также показала, что лечение Ndufs4 с рапамицином облегчает повреждение ЦНС способом, соответствующим метаболическим эффектам, а не воспалительным путям. Известно, что мишень рапамицина (mTOR) устраняет токсичность глутамата.
Несмотря на то, что рапамицин не рекомендуется для продолжительного применения и еще более рискован при использовании у детей, способность уменьшать повреждение ЦНС за счет подавления mTOR является ценным шагом в разработке вариантов долгосрочного лечения пациентов с СЛ. Двигаемся вперед, доктора. Седенски и Морган заинтересованы в понимании клеточных изменений, вызванных дисфункцией Ndufs4 и определение дополнительных целей, которые могут помочь восстановить функцию.
Стадия разработки
- Доклинические исследования in vivo
Партнерские возможности
- Возможность совместных исследований
- Соглашение о спонсируемых исследованиях
- Консультационное соглашение
Публикации
- Джонсон С.К., Кайзер Э.Б., Борнштейн Р., Стоукс Дж., Битто А., Парк К.Ю.… Седенский М.М., Морган П.Г. . Региональные метаболические сигнатуры в мозге мышей Ndufs4 (KO) указывают на дефектный метаболизм глутамата / α-кетоглутарата в митохондриальном заболевании. Мол Генет Метаб . 2020;130(2):118-132.
- Дэнси Б., Броквей Н., Рамадасан-Наир Р., Ян Ю., Седенски М., Морган П. . Глутатион-S-трансфераза опосредует реакцию старения на митохондриальную дисфункцию. Механизмы старения и развития . 2016;153:14-21.
- Морган П. , Хигдон Р., Колкер Н., Бауман А., Илькаева О., Ньюгард С., Колкер Э., Стил Л.
 , Седенски М. . Сравнение протеомного и метаболического профилей мутантов митохондриальной дыхательной цепи Caenorhabditis elegans. Митохондрия . 2015;20:95-102.
, Седенски М. . Сравнение протеомного и метаболического профилей мутантов митохондриальной дыхательной цепи Caenorhabditis elegans. Митохондрия . 2015;20:95-102. - Джонсон С., Янос М., Кайзер Э., Кинтана А., Сангесланд М., Кастанца А., Уде Л., Хуэй Дж., Уолл В., Гагнидзе А., О.К., Васко Б., Рамос Ф., Пальмитер Р., Рабинович П., Морган П., Sedensky M , Kaeberlein M. Ингибирование mTOR облегчает митохондриальное заболевание в мышиной модели синдрома Ли. Наука . 2013;342(6165):1524-1528.
- Quintana A, Morgan P , Kruse S, Palmiter R, Sedensky M. Измененная чувствительность к анестезии у мышей, лишенных Ndufs4, субъединицы митохондриального комплекса I. ПЛОС ОДИН . 2012;7(8):e42904.
Узнать больше
- Маргарет М. Седенски, MD
- Филип Г. Морган, MD
- Лаборатория Моргана
Дети с аутизмом имеют митохондриальную дисфункцию, результаты исследования — ScienceDaily .
 Исследование, опубликованное в Журнал Американской медицинской ассоциации (JAMA) обнаружил, что кумулятивное повреждение и окислительный стресс в митохондриях, производящих клеточную энергию, могут влиять как на возникновение, так и на тяжесть аутизма, что указывает на сильную связь между аутизмом и митохондриальными дефектами.
Исследование, опубликованное в Журнал Американской медицинской ассоциации (JAMA) обнаружил, что кумулятивное повреждение и окислительный стресс в митохондриях, производящих клеточную энергию, могут влиять как на возникновение, так и на тяжесть аутизма, что указывает на сильную связь между аутизмом и митохондриальными дефектами.
После сердца мозг является самым прожорливым потребителем энергии в организме. Авторы предполагают, что дефицит способности питать нейроны головного мозга может привести к некоторым когнитивным нарушениям, связанным с аутизмом. Митохондрии являются основным источником производства энергии в клетках и несут свой собственный набор генетических инструкций, митохондриальную ДНК (мтДНК), для осуществления аэробного дыхания. Дисфункция митохондрий уже связана с рядом других неврологических состояний, включая болезнь Паркинсона, болезнь Альцгеймера, шизофрению и биполярное расстройство.
«Дети с митохондриальными заболеваниями могут проявлять непереносимость физической нагрузки, судороги и снижение когнитивных функций, среди прочего. У некоторых проявляются симптомы заболевания, а у некоторых проявляются спорадические случаи», — сказала Сесилия Джуливи, ведущий автор исследования и профессор кафедры молекулярной медицины. Биологические науки в Школе ветеринарной медицины Калифорнийского университета в Дэвисе. «Многие из этих характеристик присущи детям с аутизмом».
У некоторых проявляются симптомы заболевания, а у некоторых проявляются спорадические случаи», — сказала Сесилия Джуливи, ведущий автор исследования и профессор кафедры молекулярной медицины. Биологические науки в Школе ветеринарной медицины Калифорнийского университета в Дэвисе. «Многие из этих характеристик присущи детям с аутизмом».
Исследователи подчеркивают, что эти новые результаты, которые могут помочь врачам в постановке раннего диагноза, не определяют причину или последствия аутизма, которым страдает до 1 из каждых 110 детей в Соединенных Штатах, по данным Центров США по изучению Контроль и профилактика заболеваний.
В то время как предыдущие исследования выявили намеки на связь между аутизмом и митохондриальной дисфункцией, эти сообщения были либо анекдотичными, либо касались тканей, которые могли не отражать нейронный метаболизм.
«Примечательно, что в крови этих маленьких детей с аутизмом были обнаружены признаки митохондриальной дисфункции и изменения в митохондриальной ДНК», — сказала Джеральдин Доусон, главный научный сотрудник организации Autism Speaks, которая предоставила финансирование для исследования. «Одна из проблем заключалась в том, что было трудно диагностировать митохондриальную дисфункцию, потому что для этого обычно требуется биопсия мышц. Если бы мы могли выявить эти метаболические проблемы с помощью анализа крови, это было бы большим шагом вперед».
«Одна из проблем заключалась в том, что было трудно диагностировать митохондриальную дисфункцию, потому что для этого обычно требуется биопсия мышц. Если бы мы могли выявить эти метаболические проблемы с помощью анализа крови, это было бы большим шагом вперед».
Для исследования Джуливи и ее коллеги набрали 10 детей с аутизмом в возрасте от 2 до 5 лет и 10 нормально развивающихся детей того же возраста из аналогичного окружения. Дети были случайным образом выбраны из субъектов Северной Калифорнии, которые ранее участвовали в исследовании риска детского аутизма из-за генетики и окружающей среды (CHARGE) с участием 1600 человек и которые также согласились вернуться для последующего исследования, известного как CHARGE-BACK, проведенного Калифорнийским университетом. Центр экологического здоровья детей и профилактики заболеваний Дэвиса.
реклама
Дети с аутизмом соответствовали строгим диагностическим критериям аутизма, определенным двумя наиболее широко используемыми и строгими инструментами оценки. Хотя общее число исследованных детей было небольшим, оно, как правило, репрезентативно для гораздо большей когорты CHARGE, и это повышает значимость результатов исследования, говорят авторы.
Хотя общее число исследованных детей было небольшим, оно, как правило, репрезентативно для гораздо большей когорты CHARGE, и это повышает значимость результатов исследования, говорят авторы.
Исследователи взяли образцы крови у каждого ребенка и проанализировали метаболические пути митохондрий в иммунных клетках, называемых лимфоцитами. В предыдущих исследованиях отбирали образцы митохондрий, полученных из мышц, но митохондриальная дисфункция иногда не проявлялась в мышцах. Мышечные клетки могут генерировать большую часть своей энергии за счет анаэробного гликолиза, в котором не участвуют митохондрии. Напротив, лимфоциты и в большей степени нейроны головного мозга в большей степени полагаются на аэробное дыхание, осуществляемое митохондриями.
Исследователи обнаружили, что митохондрии детей с аутизмом потребляют гораздо меньше кислорода, чем митохондрии детей из контрольной группы, что является признаком пониженной митохондриальной активности. Например, потребление кислорода одним важным комплексом митохондриальных ферментов, НАДН-оксидазой, у детей с аутизмом составляло лишь треть от того, что наблюдалось у детей из контрольной группы.
«Снижение на 66 процентов — это очень много», — сказал Джуливи. «Когда эти уровни ниже, у вас меньше возможностей производить АТФ (аденозинтрифосфат) для оплаты клеточной работы. Даже если это снижение считается умеренным, дефицит митохондриальной энергии не нужно сбрасывать со счетов, поскольку он может усугубиться или ухудшиться. проявляются в перинатальном периоде, но проявляются субклинически во взрослом возрасте».
Снижение функции митохондриальных ферментов оказалось широко распространенным среди детей, страдающих аутизмом. Восемьдесят процентов имели более низкую активность НАДН-оксидазы, чем контрольная группа, в то время как 60, 40 и 30 процентов имели низкую активность сукцинатоксидазы, АТФазы и цитохром-с-оксидазы соответственно. Исследователи продолжили изолировать происхождение этих дефектов, оценив активность каждого из пяти ферментных комплексов, участвующих в митохондриальном дыхании. Комплекс I был местом наиболее распространенного дефицита, обнаруживаемого у 60 процентов аутичных субъектов, и встречался в пяти из шести случаев в сочетании с комплексом V. У других детей были проблемы с комплексами III и IV.
У других детей были проблемы с комплексами III и IV.
Уровни пирувата, сырья, которое митохондрии трансформируют в клеточную энергию, также были повышены в плазме крови детей, страдающих аутизмом. Это говорит о том, что митохондрии детей с аутизмом неспособны перерабатывать пируват достаточно быстро, чтобы удовлетворить потребность в энергии, что указывает на новый дефицит на уровне фермента, называемого пируватдегидрогеназой.
Митохондрии также являются основным внутриклеточным источником свободных радикалов кислорода. Свободные радикалы — это очень реактивные виды, которые могут повредить клеточные структуры, включая ДНК. Клетки способны восстанавливать типичные уровни такого окислительного повреждения. Джуливи и ее коллеги обнаружили, что уровень перекиси водорода у детей, страдающих аутизмом, в два раза выше, чем у здоровых детей. В результате клетки детей с аутизмом подвергались более высокому окислительному стрессу.
Митохондрии часто реагируют на окислительный стресс, создавая дополнительные копии собственной ДНК.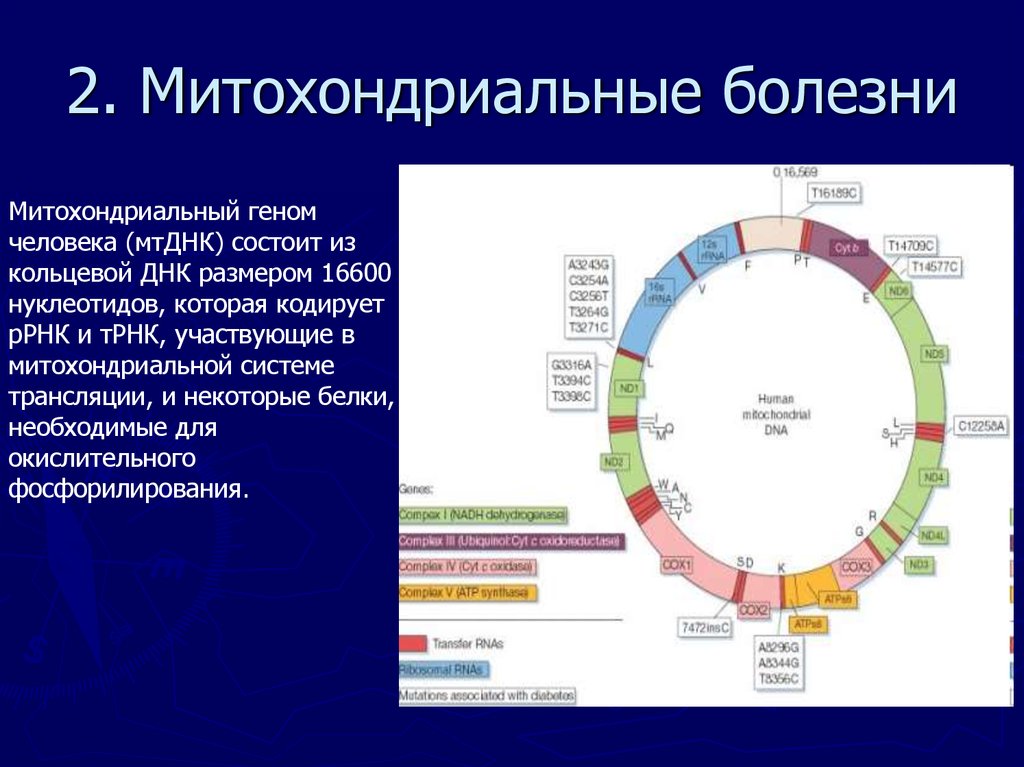 Стратегия помогает гарантировать, что некоторые нормальные гены присутствуют, даже если другие были повреждены окислением. Исследователи обнаружили более высокое число копий мтДНК в лимфоцитах половины детей с аутизмом. Эти дети несли такое же большое количество наборов мтДНК в своих гранулоцитах, другом типе иммунных клеток, демонстрируя, что эти эффекты не ограничивались конкретным типом клеток. Двое из пяти детей также имели делеции в генах мтДНК, тогда как ни у одного из детей контрольной группы делеций не было.
Стратегия помогает гарантировать, что некоторые нормальные гены присутствуют, даже если другие были повреждены окислением. Исследователи обнаружили более высокое число копий мтДНК в лимфоцитах половины детей с аутизмом. Эти дети несли такое же большое количество наборов мтДНК в своих гранулоцитах, другом типе иммунных клеток, демонстрируя, что эти эффекты не ограничивались конкретным типом клеток. Двое из пяти детей также имели делеции в генах мтДНК, тогда как ни у одного из детей контрольной группы делеций не было.
Взятые вместе, различные аномалии, дефекты и уровни нарушений, измеренные в митохондриях аутичных детей, указывают на то, что окислительный стресс в этих органеллах может влиять на возникновение аутизма.
«Различные дисфункции, которые мы измеряли, вероятно, еще более выражены в клетках мозга, которые полагаются исключительно на митохондрии для получения энергии», — сказал Исаак Песса, директор Центра детского экологического здоровья и профилактики заболеваний, исследователь и профессор Института MIND Калифорнийского университета в Дэвисе. молекулярной биологии в Школе ветеринарной медицины Калифорнийского университета в Дэвисе.
молекулярной биологии в Школе ветеринарной медицины Калифорнийского университета в Дэвисе.
Джуливи предупреждает, что эти результаты не равнозначны установлению причины аутизма.
«Мы сделали снимок митохондриальной дисфункции, когда детям было от 2 до 5 лет. Произошло ли это до их рождения или после, это исследование не может сказать нам», — сказала она. «Тем не менее, исследование способствует пониманию аутизма по нескольким направлениям и может, если его повторить, помочь врачам диагностировать проблему на более ранних стадиях».
«Педиатры должны знать об этой проблеме, чтобы они могли задавать правильные вопросы, чтобы определить, есть ли у детей с аутизмом проблемы со зрением или слухом или миопатии», — сказал Джуливи. Непереносимость физической нагрузки в виде мышечных судорог при интенсивных физических нагрузках является одной из характеристик митохондриальных миопатий.
Химические отпечатки митохондриальной дисфункции также могут иметь потенциал в качестве диагностического инструмента. Джуливи и его коллеги в настоящее время более тщательно изучают митохондриальную ДНК своих испытуемых, чтобы выявить более точные различия между аутичными и неаутичными детьми.
Джуливи и его коллеги в настоящее время более тщательно изучают митохондриальную ДНК своих испытуемых, чтобы выявить более точные различия между аутичными и неаутичными детьми.
«Если мы найдем какой-то маркер крови, который соответствует и уникален для детей с аутизмом, возможно, мы сможем изменить способ диагностики этого трудно поддающегося оценке состояния», — сказала она.
Исследование также помогает уточнить причины возникновения аутизма.
«Настоящая задача сейчас состоит в том, чтобы попытаться понять роль митохондриальной дисфункции у детей с аутизмом», — сказал Песса. «Например, многие факторы стресса окружающей среды могут вызвать повреждение митохондрий. В зависимости от того, когда ребенок подвергся воздействию, в материнском или неонатальном периоде, и насколько серьезным было это воздействие, это может объяснить диапазон симптомов аутизма».
«Это важное исследовательское исследование строго рассматривает возникающую гипотезу о потенциальной митохондриальной дисфункции и аутизме», — сказала Синди Лоулер, программный директор Национального института наук об окружающей среде (NIEHS), который предоставил финансирование для исследования.
