Лимфоциты при беременности повышены: Общий анализ крови на лимфоциты: показания, подготовка, норма
Общий анализ крови на лимфоциты: показания, подготовка, норма
Лимфоциты — что это, какие они бывают
Лимфоциты – это один из компонентов белых кровяных телец, для их обнаружения используют общий анализ крови на лимфоциты. Они играют важную роль в формировании иммунных реакций. Их функция состоит в распознавании возбудителей болезней и мутировавших собственных клеток. После идентификации чужеродного объекта лимфоциты уничтожают его тем или иным путем: фагоцитоз, выработка специальных антигенов. Для уничтожения собственных клеток, переродившихся в раковые либо подвергшиеся другим изменениям лимфоциты подают особый химический сигнал, который заставляет такую клетку запустить процесс самоуничтожения. Помимо общего анализа крови на лимфоциты, в медицинском центре МедАрт проводят биохимический анализ крови.
Существует три разновидности этих клеток:
- Т-лимфоциты. Они созревают в тимусе. Играют важную роль в борьбе с инородными телами, инфекциями.
 Часть Т-лимфоцитов выполняет регуляторные функции, отвечает за длительность и силу иммунной реакции. Именно эти клетки поражаются при заражении ВИЧ.
Часть Т-лимфоцитов выполняет регуляторные функции, отвечает за длительность и силу иммунной реакции. Именно эти клетки поражаются при заражении ВИЧ. - В-лимфоциты. Их основная задача – выработка антител против вирусов, других возбудителей инфекции. Кроме того, они способны сохранять информацию о перенесенных заболеваниях создавая тем самым постоянный иммунитет.
- NK – клетки. Их главная функция – обнаружение и устранение клеток организма переродившихся в злокачественные.
Образуются лимфоциты в красном костном мозге, их молодые, незрелые формы называются лимфобластами. Созревание идет в несколько стадий, происходит не только в костном мозге, но и в лимфоидных узлах, других органах лимфатической системы.
Появление повышенного количества лимфоцитов может служить маркером патологий костного мозга, развития опухолевых процессов в нем. Увеличение уровня лимфобластов также фиксируется при длительных инфекционных процессах. В этом случае это служит признаком истощения защитных сил организма.
Иммунная система не успевает подготовить достаточное количество лимфоцитов к борьбе с возбудителем, это и становится причиной появления в крови большого количества лимфобластов.
Показания для проведения анализа
Общий анализ крови на лимфоциты назначают если есть подозрение на повышение либо уменьшение их количества. Анализ может назначаться по другим причинам, он позволяет получить много ценных данных о состоянии крови и всего организма. К основным показаниям относятся:
- Выявление реакции иммунитета на присутствие патогенных микроорганизмов.
- Состояние иммунитета человека.
- Физический и химический состав крови.
- Профилактический анализ – для обнаружения скрытых изменений в формуле крови, которые не проявляют себя конкретными симптомами.
Подготовка к анализу
Анализ на лимфоциты входит в общий анализ крови, правила их проведения совпадают. То есть особой подготовки такое обследование не требует. Есть всего два условия которые нужно соблюдать:
Есть всего два условия которые нужно соблюдать:
- Кровь берется в утренние часы.
- За 8-12 часов до забора крови нужно воздержаться от пищи.
Также не следует курить за 2-3 часа до проведения процедуры. Компоненты табачного дыма могут вызывать серьезные временные изменения в уровне белых кровяных клеток. Стоит избегать употребления алкоголя за 2-3 дня до взятия анализа так как алкоголь также может повлиять на достоверность полученных результатов.
Если не соблюсти эти требования, возможно ухудшение точности исследования, что приведет к получению врачом недостоверной информации и возможным ошибкам в диагностике либо повторному назначению обследования.
Метод исследования
Забор материала для анализа на лимфоциты осуществляется из вены при помощи обычного шприца либо специальной вакуумной системы. Традиционная техника взятия анализа при помощи обычного шприца на данный момент устарела и может приводить к следующим сложностям:
- Свертывание крови в игле.
- Разрушение части клеток крови.
- Длительное время проведения манипуляции.
- Контакт крови с окружающей средой
- Сложность с соблюдением правильного соотношения крови и реагентов.Кроме того, традиционная техника не исключает контакта медперсонала с биоматериалом пациента, что может представлять опасность для здоровья. Поэтому во многих клиниках для забора крови применяют современные вакуумные контейнеры.
Кровь в него поступает за счет вакуума в пробирке, все параметры вакутейнера подбираются на этапе производства с целью сократить время для забора крови и обеспечить правильное соотношение количества реагента и крови.
Преимущества вакуумных систем:
- Стандартизированный процесс забора крови, занимающий минимальное время.
- Полностью исключен контакт медперсонала с кровью пациента.
- Простая маркировка и идентификация проб, что исключает путаницу с пробирками.
- Почти безболезненное проведение процедуры.
Взять кровь для общего анализа можно из пальца, но в настоящий момент эта процедура используется значительно реже.
Нормы
Нормальный уровень лимфоцитов в крови зависит от возраста пациента. У детей количество лимфоцитов выше, со временем этот показатель постепенно снижается. На количество этих клеток влияет пол пациента, у женщин показатель относительно выше. Это связано с большей активностью и адаптивной способностью лимфатической системы женского организма.
| Возраст человека | Абсолютный содержание | Соотношение в % |
|---|---|---|
| У ребёнка младше года | 2-12 | 45-71 |
| У годовалого ребенка | 4-10 | 38-61 |
| 2-4 года | 3-9 | 34-50 |
| 4-10 лет | 1,6-6,7 | 31-51 |
| 10-18 лет | 1,3-5,3 | 31-43 |
| Старже 18 лет, взрослые люди | 1-4,9 | 20-40 |
| Онкориск женский: | 265 | 368 |
Лимфоциты повышены
Причиной того, что лимфоциты повышены часто выступают разнообразные вирусные инфекции. Такое повышение называется лимфоцитозом, чаще всего его регистрируют при заболеваниях, вызванных вирусами:
Такое повышение называется лимфоцитозом, чаще всего его регистрируют при заболеваниях, вызванных вирусами:
- Эпштейн-Барр.
- Аденовирус.
- Герпес.
- Детские инфекции (краснуха, корь, паротит).
Количество лимфоцитов может расти при некоторых бактериальных инфекциях, например, сифилисе, коклюше или туберкулезе. К лимфоцитозу могут приводить заболевания, вызванные простейшими, например, малярия и токсоплазмоз. Нередко повышение лимфоцитов вызвано глистными инвазиями.
Лимфоциты могут быть повышаться по причинам, не связанным с инфекциями. К ним относятся:
- Реакции гиперчувствительности.
- Стрессовый лимфоцитоз.
- Аутоиммунные заболевания.
- Нарушения эндокринных органов, особенно щитовидной железы.
- Развитии опухолей и предопухолевых процессов.
К наиболее ярким признакам повышения числа лимфоцитов относятся:
- Увеличенные печени, селезенки и лимфатических узлов.
- Общее недомогание, проявления инфекций органов дыхания, покраснения и отек слизистых оболочек.

- Резкое повышение либо снижение температуры, сопровождающееся ознобом.
- Диспепсические явления – рвота, нарушения стула, тошнота.
- Расстройства нервной системы на фоне повышенной температуры.
Нужно учитывать, что лимфоцитоз не всегда проявляется через выраженные симптомы. Зачастую повышения уровня этих клеток обнаруживается случайно. Точно определить причину по которой произошло изменение формулы крови сможет только врач, для этого часто требуется проведение дополнительных тестов.
Чтобы устранить лимфоцитоз, нужно вылечить заболевание, которое привело к повышенной реакции иммунитета. Важно понимать, что кроветворная система отвечает на выздоровление с определенной задержкой. Даже после полного излечения лимфоцитоз может сохраняться до нескольких месяцев.
Лимфоциты понижены
Понижение лимфоцитов называется лимфопенией. Такое состояние характерно для следующих заболеваний:
- СПИД.
- Длительные, тяжело протекающие инфекции.
- Патологии костного мозга.
- Опухоли лимфатических тканей.
- Облучение радиацией.
- Прием некоторых групп препаратов, таких как цитостатики.
- Беременность.
В большинстве случаев снижение уровня лимфоцитов свидетельствует об истощении иммунной системы, когда организм по различным причинам не в состоянии поддерживать нужный уровень этих клеток в крови.
Лимфопения редко проявляется характерными симптомами. К наиболее частым признакам этого состояния относятся:
- Уменьшение либо полное отсутствие миндали и других периферических лимфоузлов.
- Заболевания кожи – экзема, пиодермия.
- Общие признаки болезней крови – язвы слизистой оболочки рта, петехии, бледность, желтуха.
- Увеличение печени и селезенки.
Как и в случае с лимфоцитозом, для нормализации уровня этих клеток нужно устранить причину, которая привела к патологическому состоянию. Нужно обратиться к врачу, который сможет установить точный диагноз и назначить правильную схему лечения.
Нужно обратиться к врачу, который сможет установить точный диагноз и назначить правильную схему лечения.
В случае лимфопении беременных, при умеренном снижении уровня лимфоцитов особых мер принимать нет необходимости. Достаточно усиленного контроля за состоянием здоровья и регулярного прохождения всех нужных обследований. Если произошло резкое падение лимфоцитов – стоит обратиться за медицинской помощью для дополнительной диагностики.
Лимфоцитоз у детей
Особенностью детского возраста являются достаточно значительные изменения в формуле крови. Выделяют два так называемых перекреста, когда происходят резкие изменения соотношения клеток крови. Первый происходит в возрасте около недели после рождения, когда количество лимфоцитов начинает превышать количество остальных клеток крови. Второй перекрест происходит в 5-6 лет, когда количество лейкоцитов начинает преобладать над лимфоцитами.
Эти явления носят физиологический характер и являются проявлениями нормального развития иммунной, кроветворной систем. Но встречаются и патологические лимфоцитозы, которые свидетельствуют о развитии разнообразных болезней (в основном инфекционной природы).
Но встречаются и патологические лимфоцитозы, которые свидетельствуют о развитии разнообразных болезней (в основном инфекционной природы).
Основной причиной повышения лимфоцитов в детском организме выше нормы являются инфекционные болезни, вызываемые различными вирусами. Чаще всего это заболевания, характерные для детского возраста – корь, краснуха, простудные инфекции. Может расти уровень лимфоцитов и по другим причинам:
- Аллергические реакции.
- Авитаминоз, систематическое недоедание.
- Бронхиальная астма.
- Отравления химическими веществами.
Несмотря на то, что повышение лимфоцитов в детском организме далеко не всегда сопровождается характерными симптомами, существует ряд признаков свидетельствующих об этом. К ним относятся:
- Повышение температуры тела.
- Сыпь.
- Увеличение миндалин и других региональных лимфоузлов.
- Нарушения пищеварения.
- Симптомы общего недомогания – слабость, быстрая утомляемость.
При проявлении таких симптомов нужно обратиться к педиатру и пройти рекомендуемые обследования.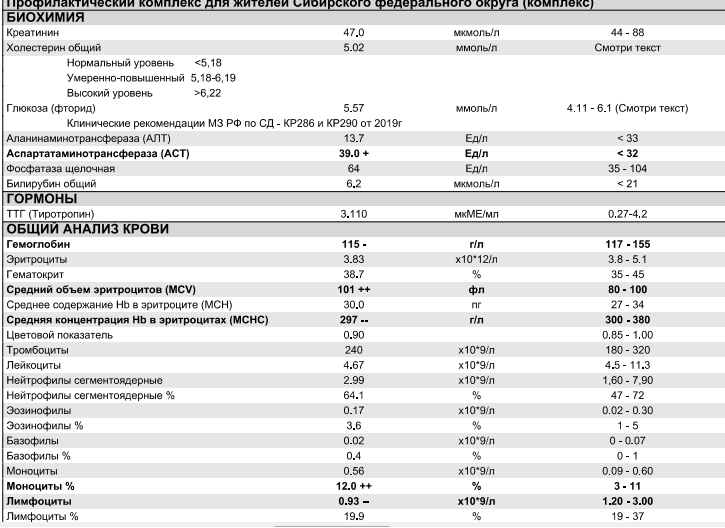 После постановки диагноза врач назначит соответствующее лечение, которое устранит причину активизации иммунной системы.
После постановки диагноза врач назначит соответствующее лечение, которое устранит причину активизации иммунной системы.
Нужно учитывать, что нормальный уровень лимфоцитов восстанавливается с запозданием. Даже после полного восстановления после инфекции либо других заболеваний пройдет от нескольких недель до 1-2 месяцев до нормализации уровня белых кровяных клеток. Это физиологический процесс, который не требует дополнительного лечения и не должен вызывать беспокойства.
норма, о чем это говорит, способы лечения отклонений
Материалы публикуются для ознакомления, и не являются предписанием к лечению! Рекомендуем обратиться к врачу-гематологу в вашем лечебном учреждении!
Соавторы: Марковец Наталья Викторовна, врач-гематолог
В период беременности женский организм подвергается изменениям, за течением которых необходимо следить. В частности, это касается количества лимфоцитов в крови. Их понижение или повышение может иметь разные причины и последствия.
Пониженные лимфоциты при беременности — это частое явление. Важно следить за граничным значением, чтобы не допустить ослабления организма и развития неприятных последствий. Также может встречаться увеличение количества этих кровяных телец. Рассмотрим ситуацию подробнее.
Необходимо регулярно следить за составом крови при беременности
Что такое лимфоциты, их роль в организме
Основными защитниками организма являются лимфоциты. При беременности некоторые их функции могут сыграть негативную роль, если будет нарушен баланс. Эти белые кровяные тельца выполняют такие задачи:
- идентифицируют чужеродные или мутировавшие клетки;
- вырабатывают антитела для борьбы с чужеродными агентами;
- оказывают цитотоксическое действие;
- формируют иммунитет.
Основные функции лимфоцитов
Если лимфоциты ниже нормы при беременности, с одной стороны, это способствует защите плода от влияния агрессивных клеток, а с другой — делает организм будущей матери более уязвимым к болезням.
Отклонения от нормы
У женщин в положении состав крови подвергается изменениям, в том числе затрагиваются и лимфоциты. При беременности норма зачастую сдвигается влево, то есть в сторону уменьшения процентного значения. При этом изменяется и внутренняя структура лимфоцитарной формулы.
| Клинический анализ крови | Небеременные женщины | Беременные женщины | ||
| 1 триместр | II триместр | III триместр | ||
| Гемоглобин, г/л | 115-145 | 123(116-135) | 114(110-130) | 112(110-125) |
| Гематокрит, л/л | 0.36-0.42 | 0.38 | 0.37 | 0.36 |
| Эритроциты, х 1012/л | 3.7-4.5 | 4.2 | 3.5 | 3.9 |
| Цветной показатель | 0.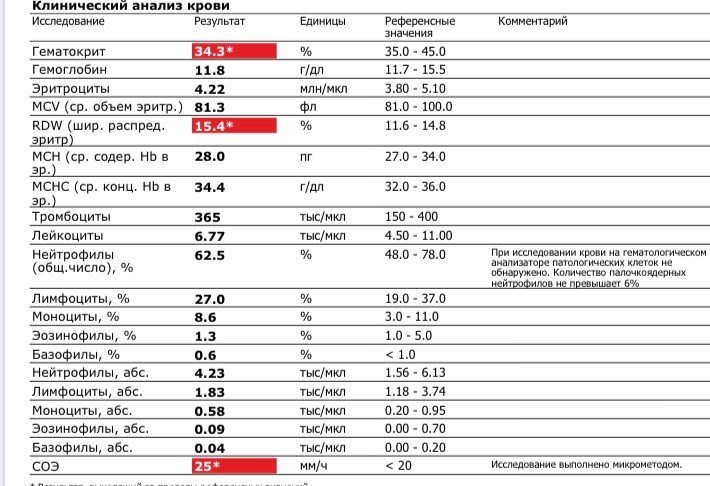 86-1.05 86-1.05 | 0.86-1.05 | ||
| Ретикулоциты, % | 0.5-1.2 | 2-12 | ||
| Лейкоциты, х 10°/л | 4.0-6.0 | 6.8-7,4 | 7.6-10.0 | 10.4-12.0 |
| Нейтрофилы, % | 47-72 | 68 | 67 | 64 |
| Базофилы, % | 0.5-1.0 | — | — | — |
| Эозинофилы, % | 0.5-1.0 | 1.5-1.6 | 2.0 | 1.2 |
| Лимфоциты, % | 20-25 | 27-29 | 25-27 | 25-27 |
| Моноциты, % | 3-11 | 3-6 | 4-6 | 4-5 |
| СОЭ, мм/ч | 2-15 | 13-21 | 25 | 30-35 |
| Тромбоциты, х 10э/л | 130-400 | 130-400 | ||
Таблица: Нормы содержания кровяных телец до и в период беременности
Прочитайте также статью Лейкоциты в крови при беременности на нашем портале.
Нормой считается значение в пределах 18–40%. Если оно опускается ниже 16%, говорят о лимфоцитопении, а при повышении свыше 45–50% возникает риск развития лимфоцитоза. О чем это говорит и в чем заключаются причины отклонений — рассмотрим подробнее.
Пониженные значения
Достаточно часто наблюдается ситуация, когда лимфоциты в крови понижены. При беременности такая реакция организма считается естественной, так как он намеренно снижает защитный барьер, чтобы дать возможность адаптироваться плоду и предотвратить его отторжение.
Видео доктора Комаровского о повышенном уровне лейкоцитов при беременности
Обычно снижаются не все показатели. Наибольшие изменения касаются Т-киллеров и В-клеток, так как именно они борются с чужеродными клетками и вырабатывают антитела.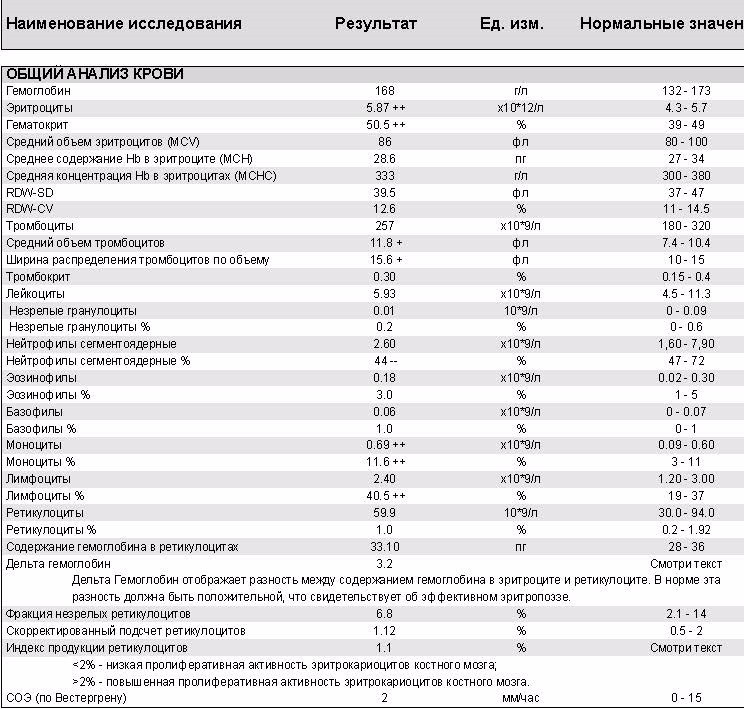 Супрессоры же становятся более многочисленными и активными, чтобы подавить агрессивную реакцию остальных лимфоцитов.
Супрессоры же становятся более многочисленными и активными, чтобы подавить агрессивную реакцию остальных лимфоцитов.
Так как понижены лимфоциты, при беременности женщина становится более слабой и восприимчивой к заболеваниям. Важно в этот период избегать источников заражения, полноценно питаться и принимать витамины.
Совет: рекомендуется укрепить иммунитет минимум за 3-4 месяца до планируемого зачатия.
Женщина становится более восприимчива к болезням
Если лимфоциты понижены у беременных менее чем до 16%, стоит провериться на наличие таких заболеваний:
- апластическая анемия;
- туберкулез;
- лимфогранулематоз;
- волчанка;
- аутоиммунные патологии;
- онкология.
Лечение заключается в устранении причин отклонений и приеме стимулирующих препаратов. В связи с беременностью терапия проводится под строгим наблюдением врача.
Лимфоцитоз
Гораздо более опасным явлением считается ситуация, когда лимфоциты при беременности повышены.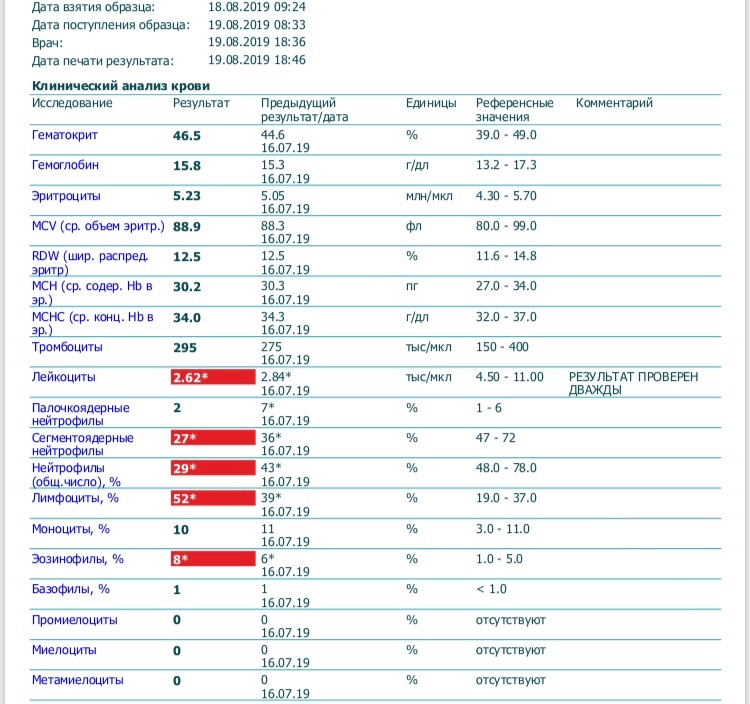 Незначительное их увеличение может быть спровоцировано инфекцией или аллергической реакций, то есть иммунным ответом организма.
Незначительное их увеличение может быть спровоцировано инфекцией или аллергической реакций, то есть иммунным ответом организма.
Когда отклонения превышают 15% барьер, развивается лимфоцитоз. Он представляет прямую угрозу для ребенка, так как плод воспринимается лимфоцитами, как инородное тело, что связано с наличием генов отца. Клетки начинают атаковать «чужака», провоцируя его отторжение, то есть выкидыш.
Лимфоцитоз может спровоцировать выкидыш
Важно: для устранения подобных рисков нужно следить за анализами и при необходимости принимать лекарства, которые подавляют выработку агрессивных клеток.
Постоянный контроль над здоровьем будущей матери — это основа правильного развития ребенка в ее утробе.
Рекомендуем изучить похожие материалы:
- 1. Причины и опасности повышения уровня базофилов у детей
- 2. Причины повышения или понижения нейтрофилов в анализе крови у детей?
- 3. Функции и возможные причины патологий сегментоядерных нейтрофилов
- 4.
 Что значат повышенные эозинофилы в анализе крови у взрослых?
Что значат повышенные эозинофилы в анализе крови у взрослых? - 5. Правильное питание при повышенном уровне билирубина в крови
- 6. Что делать при повышенном уровне билирубина во время беременности?
- 7. Что делать при повышении уровня базофилов и что это может означать?
Понижены лимфоциты при беременности — Гематология
анонимно (Женщина, 27 лет)
Боль в низу слева
Здравствуйте, беспокоит боль внизу живота слева, где сигмовидная, боль ноющая, сильнее ноет если сижу долго, аппетита нету, сухая кожа и иногда зуд, вздутие живота,газы плохо отходят, постоянное чувство распирания внутри.стул…
анонимно (Женщина, 27 лет)
Снижение нейтрофилов повышение лимфоцитов
Добрый день! Проконсультируйте, пожалуйста по такому вопросу- с июня месяца по результатам ОАК у меня понижены Нейтрофилы сегментоядерные 1.52- x10*9/л (норма 1,60 — 7,90), Нейтрофилы сегментоядерные % 33.4— % (норма…
анонимно (Женщина, 24 года)
ХГЧ 198 8 беременность исключена Что это может быть
Родила почти 5 месяцев назад. Беременность первая/Роды первые. Кормлю грудью. Неделю назад появилась тошнота, головная боль и головокружение.давление немного понижено. Предположила беременность. Сделала 5 разных тест-полосок все отрицательные. Сдала анализ…
Беременность первая/Роды первые. Кормлю грудью. Неделю назад появилась тошнота, головная боль и головокружение.давление немного понижено. Предположила беременность. Сделала 5 разных тест-полосок все отрицательные. Сдала анализ…
анонимно (Женщина, 24 года)
Аутоиммунные заболевания
Здравствуйте! Опишу, что замечаю за своим организмом: Периодически бывают чувство тревоги(я это называю паническими атаками), начали крайний месяц сильно выпадать волосы, приступы холодения рук и ног и бегаю по маленькому…
анонимно (Женщина, 22 года)
Цитомегаловирус
Здравствуйте. У ребёнка обнаружили цитомегаловирус. Нам сейчас 5,5 месяцев. Родились в срок 3.300 рост 50. 8-9 по Абгар. Желтухой не болели. Держится с рождения температура 37,4 (в последнее время 37,1)….
анонимно (Женщина, 34 года)
Давление в кости таза слева
Здравствуйте! Мне 34 года, беременность 27 недель. Месяца 3 назад начала ощущать странное чувство давления в левой части низа живота, даже скорее в паху. Врачу жаловалась — безрезультатно, это мол…
Врачу жаловалась — безрезультатно, это мол…
анонимно (Женщина, 27 лет)
Приступы астмы аллергии и беременность
Добрый вечер ольга вольдемаровна! Я беременна срок 5 недель узнала об этом неделю назад, и при этом до этого принммала монтелар, кларисенс и по необходимости сальбутомол. На данный момент все…
причины и последствия отклонения от нормы
Организм беременной женщины испытывает колоссальную нагрузку. Практически во всех его системах происходят значительные изменения, в том числе уменьшается численность лимфоцитов. Является ли это патологией и нужно ли корректировать количество этих клеток в крови?
Роль лимфоцитов в организме
Лимфоциты – это крупноядерные белые кровяные клетки, продуцируемые костным мозгом. Они являются главной защитой организма от болезней, поэтому при их нехватке значительно снижается сопротивляемость иммунитета внедрению вирусов и бактерий извне.
Существует 5 типов клеток:
| Разновидность белых кровяных клеток | Функция в организме |
| В-лимфоциты | Распознают попавший в кровь вирус, бактерию и т. д. Участвуют в продуцировании антител, которые необходимы для борьбы с недугами. д. Участвуют в продуцировании антител, которые необходимы для борьбы с недугами. |
| Т-лимфоциты | Формируют иммунный ответ на раздражитель. |
| Т-хелперы | Способствуют усилению ответа иммунитета на чужеродный агент. |
| Т-киллеры | Основной вид клеток, работа которых заключается в уничтожении собственных мутировавших клеток и чужеродных агентов, оказавшихся в кровеносной системе. |
| Т-супрессоры | Подавляют иммунный ответ. |
Лимфоциты оберегают организм матери от вторжения вирусов и бактерий. В кровотоке постоянно передвигается лишь 2% лимфоцитарных клеток, а остальные находятся в костных структурах и высвобождаются при активации иммунитета.
Нормальные показатели у беременных
Норма белых клеток крови для здорового человека составляет 20 -35% от числа всех лейкоцитов. Однако при беременности диапазон этого значения значительно увеличивается – норма лимфоцитов для женщин, ожидающих малыша, колеблется в рамках от 18 до 44%. Если показатель снижается до 16-17%, это свидетельствует о лимфоцитопении, а если увеличивается до 45%, врачи говорят о лимфоцитозе.
Однако при беременности диапазон этого значения значительно увеличивается – норма лимфоцитов для женщин, ожидающих малыша, колеблется в рамках от 18 до 44%. Если показатель снижается до 16-17%, это свидетельствует о лимфоцитопении, а если увеличивается до 45%, врачи говорят о лимфоцитозе.
У беременных отклонение количества лимфоцитарных клеток в меньшую сторону является нормой. Это естественное явление, предотвращающее отторжение плодного яйца, которое женский организм принимает за инородное тело.
Процентное количество белых клеток особенно важно контролировать в 1 и 2 триместрах – в этот период их численность часто меняется.
Причины понижения лимфоцитов в крови
Каждая женщина радуется беременности и старается сделать все для ее сохранения, но иммунная система организма настроена противоположным образом. Эмбрион образовывается не только из материнского генного материала – в нем есть и отцовские клетки. Это и является причиной того, что организм женщины воспринимает его как постороннее тело и стремится «уничтожить врага», активно борясь с ним, как с микробами или вирусами.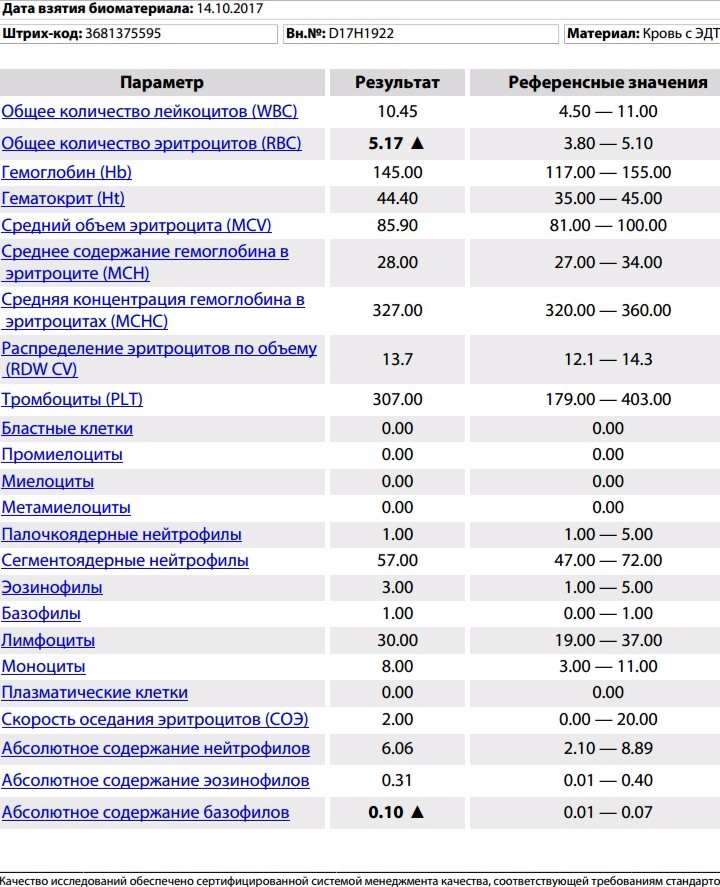 Лимфоциты раньше всех включаются в процесс борьбы, атакуя отцовские белки, из-за чего может нарушиться развитие эмбриона.
Лимфоциты раньше всех включаются в процесс борьбы, атакуя отцовские белки, из-за чего может нарушиться развитие эмбриона.
Однако природа позаботилась о защите плода, поэтому с момента зачатия численность лимфоцитов уменьшается. Параллельно происходит продуцирование веществ, подавляющих деятельность оставшихся активных клеток, чтобы они не могли оказывать отрицательное действие на эмбрион. Главным образом угнетается активность В-клеток и Т-киллеров, а Т-супрессоров в крови становится больше. Работоспособность последних повышается с 5-8 недели беременности, что позволяет организовать защиту ребенку и обеспечить сбалансированное функционирование иммунной системы матери.
Несмотря на то, что белых клеток становится меньше, организм женщины надежно защищен. Угнетение работы лимфоцитов компенсируется улучшением функционирования фагоцитов и нейтрофилов. Однако в некоторых случаях низкие показатели свидетельствуют о развитии патологии:
- воспалительный процесс в хронической форме (молочница, цистит, гастрит и т.
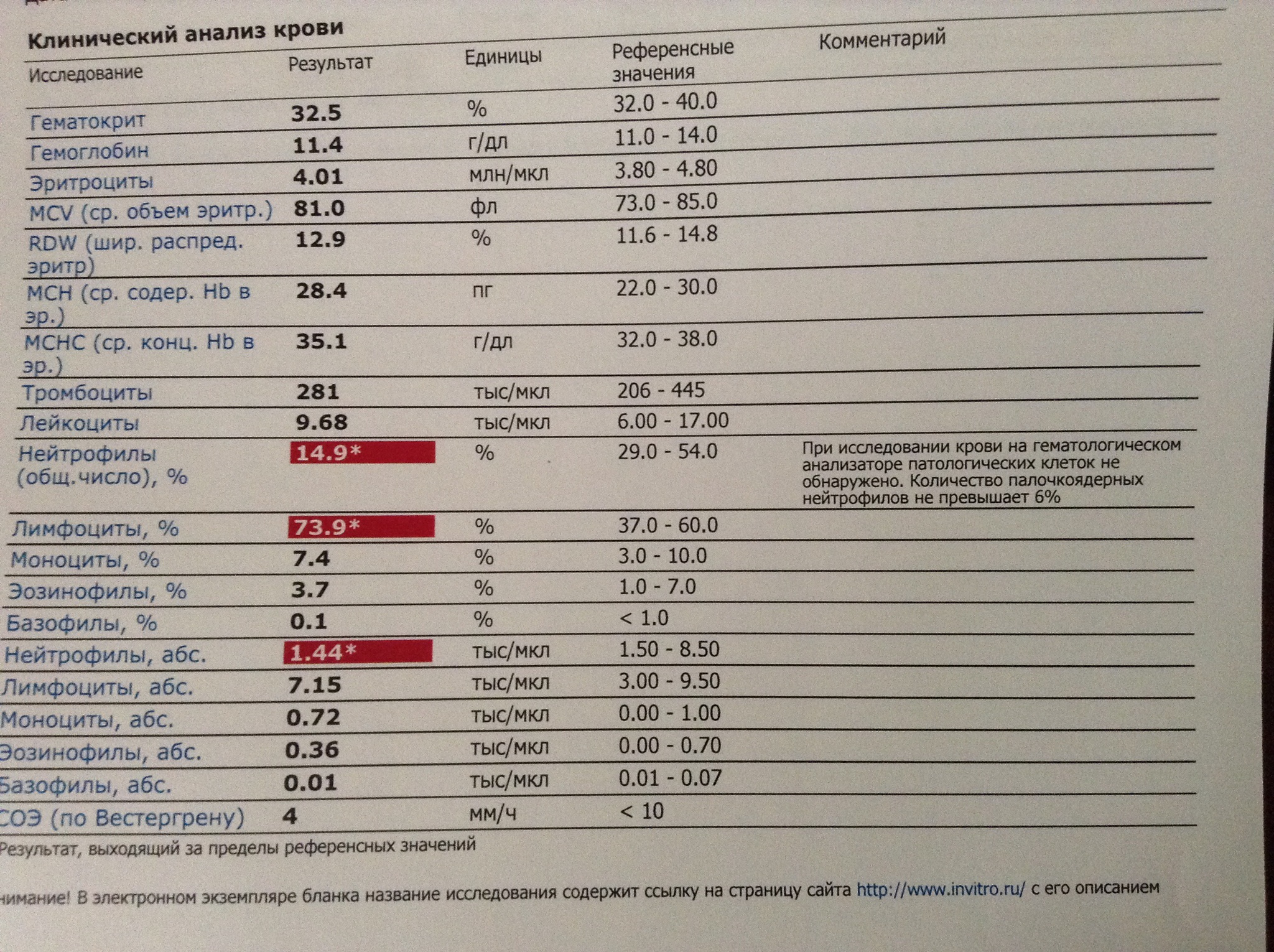 д.), при котором численность лимфоцитарных клеток может как повышаться, так и понижаться;
д.), при котором численность лимфоцитарных клеток может как повышаться, так и понижаться; - аллергия;
- ВИЧ-инфекция;
- резус-конфликт крови матери и плода;
- несовместимость тканей женщины и эмбриона (редкая патология).
Если лимфоциты понижены до 16%, требуется глубокое обследование. Слишком заниженное значение может свидетельствовать о развитии онкологии, аутоиммунной болезни, туберкулеза, апластической анемии и других серьезных недугов.
Возможные последствия для женщины и плода
Механизм защиты плода имеет слабые места. Вследствие снижения количества белых клеток в крови организм женщины становится уязвим к проникновению различных инфекционных агентов. Это приводит к развитию заболеваний, которые не только ухудшают самочувствие будущей матери, но и негативно влияют на развитие малыша. Например, обычная простуда может привести к гипоксии плода, а инфекционные заболевания иногда становятся причиной поражения нервной системы ребенка, преждевременных родов, выкидыша или мертворождения.
Снижение иммунитета особенно опасно в первом триместре – будущая мать легко может подхватить болезнь, а ведь именно в этот период происходит закладка основных органов ребенка. По этой причине большинство женщин стараются подготовить организм: проходят обследование, соблюдают режим дня, сбалансированно питаются. Врачи советуют планировать зачатие ребенка на осень, чтобы последние месяцы беременности пришлись на летний период. Доказано, что именно в теплое время года иммунитет работает в полную силу.
В большинстве случаев уменьшение лимфоцитов при беременности не считается аномалией. Хуже, когда их число повышено – это свидетельствует о развивающейся патологии, которая может привести к печальным последствиям.
Витаминотерапия для поддержания иммунитета
Хорошим способом укрепления иммунитета является прием витаминов. Фармацевтические компании предлагают огромный выбор препаратов, разработанных для женщин в положении. Однако стоит помнить, что самостоятельно их выбирать нельзя – медикамент должен назначить специалист с учетом потребностей беременной. Популярными препаратами являются:
Популярными препаратами являются:
- Алфавит. В нем минералы и витамины включены в разные таблетки, благодаря чему можно обеспечить поступление в организм только нужных веществ.
- Элевит Пренаталь. Витаминный комплекс, содержащий в большом количестве магний.
- Прегнавит. В препарат включен широкий спектр микроэлементов.
- Витрум Пренаталь. В средстве в большом объеме содержится фолиевая кислота и железо. Его часто назначают беременным с железодефицитной анемией.
- Компливит Мама. Витамины предназначены для пациенток, которые полноценно питаются. Комплекс необходим для профилактики дефицита полезных веществ.
Женщинам следует не только принимать витаминные препараты, но и правильно питаться. В рационе должны присутствовать фрукты, свежие овощи, мясо и рыба в ограниченных количествах, крупы, молочные продукты. Это поможет организму получать достаточно питательных веществ для поддержания его жизнедеятельности и нормального развития плода.
Врач акушер-гинеколог, репродуктолог, консультант по грудному вскармливанию, окончила ЧГУ им. Ульянова со специализацией гинекология, маммология Подробнее »
Поделитесь с друьями!
Причины и последствия низкого уровня лимфоцитов у беременных
Практически у каждой беременной женщины снижаются защитные функции организма, и прежде всего это отражается на клеточном иммунитете. Таким образом, женский организм защищается от отторжения чужеродного белка, то есть плода.
Таким образом, женский организм защищается от отторжения чужеродного белка, то есть плода.
И, конечно же, такое состояние сказывается на клиническом анализе крови, который обязательно покажет изменение уровня лимфоцитов.
Что такое лимфоциты, и какова их норма?
Кровяные клетки, вырабатываемые костным мозгом, а у ребенка под сердцем матери — в недифференцированных клетках печени, называются лимфоцитами. Данные форменные элементы крови несут ответственность за иммунный ответ и иммунологическую память.
В-лимфоциты отвечают за распознавание чужеродных клеток и микроорганизмов, а также за выработку антител.
Т-клетки — регулируют ответ иммунной системы организма. Т-лимфоциты делятся на:
- Т-хеллеры: усиливают реакцию организма на внедрение чужеродных макромолекул;
- Т-супрессоры: снижают повышенную реакцию В-лимфоцитов;
- Т-киллеры: отвечают за уничтожение чужеродных антигенов.
При отсутствии каких-либо нарушений нормой считается 20-35%. При беременности нормальный уровень лимфоцитов составляет 18-44%.
При беременности нормальный уровень лимфоцитов составляет 18-44%.
Любые отклонения от нормы могут сигнализировать о каких-либо нарушениях. Зачастую активизация лейкоцитов может привести к выкидышу либо преждевременной родовой активности.
Особенно важен контроль показателей крови в первом и втором триместре беременности. Именно в этот период плацента активизирует все силы, чтобы защитить плод от попадания лейкоцитов, поэтому сниженный уровень лимфоцитов является естественным явлением.
Понижены лимфоциты при беременности: в чем причина?
Дело в том, что женский организм воспринимает эмбрион как чужеродное тело. Это связано с тем, что плод состоит из материнского и отцовского генетического материала. Именно поэтому защитные функции беременной активизируются, чтобы устранить «врага», и лимфоциты принимают непосредственное участие в процессе уничтожения. Наибольшая опасность для ребенка исходит именно с их стороны. Клетки начинают уничтожать отцовские белки, вследствие чего может произойти нарушение нормального развития ребенка в утробе матери.
Но природа позаботилась о защите малыша. В организме женщины созданы специальные механизмы, предотвращающие отторжение эмбриона. Низкий уровень элементов иммунной системы и свидетельствует о защитной реакции. С первых дней беременности женский организм направляет все силы на подавление их активности.
Но даже в таком состоянии иммунная система беременной защищена. Подавленность лимфоцитов компенсируется активизацией нейтрофилов, которые усиливают фагоцитарную активность. В женском организме происходит угнетение клеток (Т-киллеров, В-клеток), отвечающих за выработку антител. В свою очередь, Т-супрессоры начинают активные действия, чтобы уменьшить атаку опасных лимфоцитов. Таким образом, в женском организме во время вынашивания ребенка иммунная система находится в сбалансированном состоянии. Если беременность протекает нормально, тогда при исследовании крови будет увеличено количество именно Т-супрессоров.
Клиническое исследование крови показывает только общее количество лимфоцитов. Для более детального анализа крови на все виды лимфоцитов необходима иммунограмма. Комплексный анализ проводится по определенным показаниям, к которым относятся:
Для более детального анализа крови на все виды лимфоцитов необходима иммунограмма. Комплексный анализ проводится по определенным показаниям, к которым относятся:
- Воспалительные процессы, имеющие хронический характер (кандидоз, воспаление мочевого пузыря, гастрит и т.п.).
- Аллергические проявления.
- ВИЧ-инфекция.
- Тканевая несовместимость матери и ребенка.
- Резус-конфликт.
Какие последствия могут возникнуть при пониженном уровне лимфоцитов и как можно их предотвратить?
Хотя матушка-природа и позаботилась о защите матери и ребенка, однако не все так идеально в этой защитной системе. Даже при нормальных показателях анализа крови женский организм ослабевает в результате понижения уровня лимфоцитов. Соответственно, у беременной снижаются защитные функции организма, поэтому будущие мамочки уязвимы к инфицированию патогенными микроорганизмами и воздействию внешних факторов. Чтобы предотвратить такое явление, нужно подготовить организм к грядущим переменам.
Врачи рекомендуют планировать пополнение семейства в осенний период, в таком случае последние месяцы пройдут в летнее время, когда иммунная система функционирует на полную силу.
Кроме того, перед беременностью важно пройти полное обследование обоих партнеров и при необходимости пролечить все инфекционные болезни. Если этого не сделать, то организм при беременности вынужден будет бороться еще и с сопутствующими заболеваниями, а это негативно отразится на состоянии матери и ребенка.
Во время беременности ребенку необходимы полезные вещества, которые он черпает из материнского организма, поэтому пополнить витаминный запас врачи рекомендуют до планируемой беременности.
Также женщине нужно понимать, что период ожидания малыша требует ответственного отношения. Поэтому не стоит подвергать свой организм лишним рискам. Беременным необходимо как можно больше бывать на свежем воздухе, а в период простудных эпидемий избегать общественных мест.
Также очень важно регулярно посещать врача и проходить все необходимые обследования, в том числе и анализ крови.
Как поддерживать иммунитет при беременности?
Витамины являются прекрасным способом укрепления иммунной системы. На сегодняшний день фармацевтические компании предлагают широкий выбор препаратов для женщин в положении. Однако самостоятельно принимать витаминные комплексы запрещено. Все назначения должны проводиться врачом с учетом течения беременности и индивидуальных особенностей пациентки.
Наиболее рекомендуемыми препаратами являются:
- «Элевит Пренаталь»;
- «Компливит Мама»;
- «Прегнавит»;
- «Алфавит».
Кроме фармацевтических средств женщинам при беременности необходимо сбалансированное питание. В ежедневном рационе должны обязательно присутствовать овощи и фрукты, крупы (особенно гречка), печень, мясо, рыбная продукция. Также не стоит забывать о фруктовых и овощных фрешах (свекольный, морковный, яблочный, гранатовый).
Специально для beremennost.net — Мария Дулина
Физиологические изменения показателей крови при беременности / «www.medportal.ru»
Получив на руки анализ крови, беременная женщина иногда ужасается, сравнив свои результаты и результаты «нормы». Однако ничего страшного в этом нет. Дело в том, что во время беременности действуют «свои нормы». Но поскольку, анализы крови изобилует страшными и непонятными названиями, беременные мамы все равно пугаются. На самом деле все не так страшно главное разобраться с терминами.
Изменение показателей коагулограммы и клинического анализа крови
Изменения в коагулограмме беременной это естественный физиологический процесс, связанный с появлением маточно-плацентарного круга кровообращения. Обусловлен он тем, что организм беременной готовиться к увеличению объема крови во время вынашивания ребенка и к возможной кровопотере во время родов.
При нормальном течении беременности повышается активность свертывающей системы крови. А это значит, что уже на 3-м месяце беременности повышается фибриноген, который достигает максимальных значений накануне родов. Поэтому гинекологи обоснованно рекомендуют контролировать данный показатель во время беременности (1 раз в триместр, при наличии отклонений данных показателей чаще, 1 раз в неделю).
Одновременно с повышением фибриногена повышается и активность внутреннего механизма свертывания крови, при этом в анализе отмечается укорочение активированное частичное тромбопластиновое время (АЧТВ). Изменяются во время беременности и другие звенья системы свертывания крови, такие как блокатор свертывания антитромбин III. Но по мере развития беременности происходит постепенное снижение активности этого показателя.
А вот волчаночный антикоагулянт не должен вырабатываться в норме у беременной.
Беременность влияет и на результаты общего анализа крови. Такие показатели как гемоглобин, гематокрит может снижаться во второй половине беременности, а лейкоциты, наоборот, повышаться.
Изменения биохимических показателей
При беременности снижение общей концентрации белка в плазме крови (альбумина) обусловлено частичным разведением крови из-за увеличения ее общего объема. Но может происходить в результате задержки жидкости в организме, нарушения гемодинамики, повышения проницаемости сосудов во время беременности.
Изменение концентрации белков крови обнаруживаются на протеинограмме. В первый и во второй триместр беременности уменьшается альбумин. В третьем триместре выявляется увеличение альфа-1-глобулиновой фракции, альфо-фетопротеина.
Альфа-2-глобулиновая фракция может повышаться за счет белков, связанных с беременностью (начинают повышаться с 8-12 недели беременности и достигают максимума в III триместре). Бетта и гаммаглобулины также увеличиваются. Незначительные изменения С-реактивного белка, наблюдаемые чаще в ранние сроки беременности, могут быть реакцией организма на процессы усиленного деления клеток при росте и развитии малыша.
Изменение объема циркулирующей крови (ОЦК) и кровоснабжения почек приводит к изменениям выделительной функции почек. Происходит задержка и накопление азотистых веществ, при этом количество мочевины снижается, особенно в поздние сроки беременности. Показатели креатинина снижаются максимально в I-II триместре (его концентрация может снижаться почти в 1,5 раза), что связано с ростом мышц массы матки и ребенка. Уровень мочевой кислоты чаще снижен за счет усиления кровоснабжения почек. Но даже небольшие нарушения в работе почек могут привести к повышению данного показателя, и это расценивается как возможный симптом интоксикации.
Существенно изменяется во время беременности жировой обмен. Так как усиливаются обменные процессы в организме, увеличиваются показатели холестерина (холестерола, липопротеинов высокой плотности ЛПВП).
Повышение уровня гормонов эстрогенов во время беременности приводит к отложению жира в молочных железах, на талии и ягодицах. Поэтому худеть и сидеть на диетах беременным бесполезно. Это гормональное и уйдет только после того, как ребенку исполнится год, причем практически независимо от того кормит мама грудью или нет.
Во время беременности увеличивается уровень инсулина. Показатель, отражающий уровень инсулина это С-пептид. При этом уровень глюкозы может меняться незначительно или совсем не меняться.
Однако в моче глюкоза имеет право обнаруживаться при нормальной беременности. Это происходит потому, что во время беременности повышается скорость фильтрации мочи через почки. Чаще глюкоза в моче появляется на сроке беременности 27-36 недели.
Особенностями минерального обмена у здоровых беременных по сравнению с небеременными женщинами является задержка в организме солей натрия, калия, хлора, фосфора. И именно изменения показателей фосфора в организме беременной связано с повышением щелочной фосфатазы. Это обусловлено изменениями во время беременности со стороны костной ткани и изменениями со стороны печени.
Как известно, во время беременности повышается потребность в солях кальция, которые необходимы для формирования скелета малыша. Поэтому у мамы может наблюдаться дефицит кальция, который иногда проявляется в судорогах мышц.
Повышение потребления железа организмом беременной может приводить к анемии. Характеризуется данное состояние снижением железа, ферритина, витаминов: В12, фолиевой кислоты.
Изменение в эндокринной системе
Гипофиз, особенно передняя доля, у беременных увеличивается, так как гормоны гипофиза АКТГ и пролактин играют большую роль в изменении обменных процессов организма беременной. Поэтому эти гормоны могут быть повышены.
Плацента, также обладает гормональной активностью. В ней вырабатывается прогестерон, свободный эстриол, хорионического гонадотропина (б-ХГЧ).
Претерпевает изменения и щитовидная железа. Она несколько увеличивается, и в первой половине беременности отмечается ее гиперфункция. Соответственно наблюдается повышение уровней некоторых гормонов щитовидной железы, например, свободного Т4 при нормальных показателях Т4. Также отмечается усиление функции паращитовидных желез относительным повышением паратгормона.
Выработка фолликулостимулирующего гормона (ФСГ) во время беременности снижается.
Так что будущим мамам не стоит переживать из-за несоответствия между своими результатами и показателями небеременных норм. К тому же нормы все равно у каждого свои. А индивидуальные колебания анализ никак не учитывает. Поэтому очень важно найти грамотного врача, который знает, как расшифровывать анализы беременных.
По материалам Независимой лаборатории ИНВИТРО.
Удар по лимфоцитам: COVID вызывает длительные сбои работы иммунитета | Статьи
Ученые из КНР предупреждают: многие переболевшие коронавирусом пациенты могут столкнуться с проблемами восстановления иммунитета. У части из них наблюдается снижение уровня лимфоцитов в крови, число которых не достигает нормы даже через 11 недель после выздоровления. Хроническое повреждение этих иммунных клеток чаще всего вызывает ВИЧ. Однако российские специалисты говорят, что, в отличие от вируса иммунодефицита человека, SARS-CoV-2 не способен размножаться в лимфоцитах. Поэтому описанные нарушения работы защитной системы организма могут носить длительный, но не перманентный характер.
Атака на защитников
Ученые из Института вирусологии Уханя опубликовали препринт научной статьи, в которой говорится о проведенном исследовании воздействия коронавируса на лимфоциты, — клетки крови, отвечающие за иммунитет.
Как сказано в аннотации к препринту, лимфопения (временное или стойкое снижение уровня лимфоцитов в крови. — «Известия») является типичным симптомом у пациентов с COVID-19. Ученые изучили состояние 55 выздоровевших от коронавирусной инфекции людей, чтобы узнать, как меняется со временем количество иммунных клеток в их крови.
Фото: REUTERS/Manuel Claure
«У пациентов с COVID-19 всё еще наблюдались значительные фенотипические изменения в лимфоцитах после клинического выздоровления через 4–11 недель. Это говорит о том, что инфекция SARS-CoV-2 глубоко влияет на лимфоциты и приводит к длительным потенциальным дисфункциям», — сказано в тексте.
Причем пациенты не показали даже тенденции к восстановлению числа лимфоцитов в течение всего периода наблюдения. Российские ученые подтверждают, что стойкое снижение уровня лимфоцитов в крови может быть следствием перенесенного вирусного заболевания. Однако механизмы, вызывающие потерю отдельных популяций иммунных клеток, пока еще хорошо не изучены, сообщил «Известиям» младший научный сотрудник лаборатории экспериментальной хирургии и онкологии Курского государственного медицинского университета Давид Наимзада.
— Известно, что их перманентная потеря может вызываться не только хроническими инфекциями, — пояснил ученый.
Бойцы невидимого фронта
Сама по себе лимфопения встречается при различных патологических состояниях: вследствие длительной вирусной инфекции, иммунодефицита, патологий костного мозга и т.д. Наиболее частым инфекционным заболеванием, вызывающим снижение лимфоцитов, является СПИД, при котором разрушаются пораженные ВИЧ CD4 Т-клетки (CD4 расшифровываются как cluster of differentiation, — это особая группа Т-клеток, а именно Т-хелперов, которые помогают другим клеткам уничтожать инфицирующие организмы). Однако в этом случае повреждения иммунной системы носят хронический характер.
Фото: ИЗВЕСТИЯ/Павел Бедняков
В случае же с коронавирусом речь идет о хоть и длительной, но обратимой дисфункции иммунитета. Когда человек заражается новым патогеном, в его организме происходит экспансия лимфоцитов. Это своего рода солдаты, которые должны бороться с вредоносным вирусом, пояснил «Известиям» руководитель лаборатории геномной инженерии МФТИ (вуз— участник проекта «5-100») Павел Волчков.
— А после инфекции в организме происходит «демобилизация», так как такое количество активированных Т-клеток и В-клеток уже не нужно, подчеркнул эксперт. — После активации иммунные клетки живут недолго, а затем исчезают либо становятся «клетками памяти». Это мы и называем иммунитетом. Система так устроена, что во время отправки солдат-лимфоцитов «в запас» могут обнаруживаться небольшие колебания в их количестве. Но потом провал будет восстановлен новыми клетками.
Иммунная дисфункция
О том, что коронавирус способен поражать клетки иммунитета, ранее сообщали китайские ученые из Фуданьского университета. В апреле этого года в ведущем мировом научном журнале Nature была опубликована их работа, в которой утверждалось, что в лабораторных условиях SARS-Cov-2 способен заражать Т-лимфоциты. Однако позже статья была отозвана самими авторами — выяснилось, что им следовало использовать первичные Т-клетки вместо лабораторных линий для достоверного результата.
— В данной статье было написано, что некоторые коронавирусы, например MERS (ближневосточный респираторный синдром), способны вызывать гибель клеток иммунной системы, запуская определённый каскад биохимических реакций, — рассказал «Известиям» заместитель директора по научной работе ИФХЭ РАН Олег Батищев. — Для SARS-Cov-2 четких подтверждений такой возможности пока не обнаружено. Ни один из коронавирусов в отличие от ВИЧ не может размножаться в иммунных клетках.
Фото: ИЗВЕСТИЯ/Сергей Коньков
Как подчеркнул эксперт, MERS приводил к более высокой смертности, чем COVID-19, отчасти из-за угнетения иммунного ответа.
— Лимфоциты поражают ВИЧ, вирусы герпеса и некоторые другие вирусы, — сообщил «Известиям» заведующий лабораторией биотехнологии и вирусологии Новосибирского государственного университета Сергей Нетесов. — Из-за этого иммунный ответ на инфекцию может замедляться или быть неполноценным.
Что касается коронавируса, то сейчас главное — это тщательное изучение инфекционного процесса в организме пациентов, что даст наиболее важные данные о выработке полноценного иммунного ответа или сложностях в этом процессе, считает эксперт.
Не путать с ВИЧ
Некоторые специалисты уже сравнивали коронавирус нового типа с ВИЧ и даже говорили об их сходстве. В частности, лауреат Нобелевской премии 2008 года, французский вирусолог Люк Монтанье заявлял о лабораторном происхождении COVID-19 и о том, что его геном содержит в себе элементы ВИЧ. Однако позже эти идеи подверглись жесткой критике со стороны научного сообщества.
— При ВИЧ-инфекции поражаются клетки иммунной системы. Причем их инфицирование является основным способом репликации вируса иммунодефицита человека, — сказала «Известиям» сотрудник научно-клинического отдела МГЦ СПИД и Международного центра вирусологии РУДН Елена Белова.
Для коронавируса такая возможность не доказана. Поэтому COVID-19 и ВИЧ — это принципиально разные патогены.
Фото: ИЗВЕСТИЯ/Сергей Коньков
— COVID-19 — это вирус, вызывающий острую, а значит, краткосрочную инфекцию, — пояснил Павел Волчков. — На сегодняшний день нет ни одного случая коронавируса, который бы перешел из острой фазы в хроническую, то есть стал жить в организме человека. Данный патоген поражает фактически все органы и ткани, в силу того что рецепторы на поверхности клеток, за которые он цепляется, находятся практически на всех типах тканей. По этой причине он теоретически может инфицировать и клетки иммунной системы, что действительно может вызывать их гибель.
ВИЧ — это вирус, вызывающий хроническую инфекцию именно иммунной системы, никаких других тканей он не поражает. Говоря точнее, вирус инфицирует и живет исключительно в CD4 T-клетках, рассказал эксперт.
Что касается препринта ученых из Уханя, то они в выводах к своей статье проводят параллель со СПИДом и гепатитом С. Также исследователи утверждают, что им еще предстоит выяснить, как долго будут длиться фенотипические изменения и потенциальные дисфункции лимфоцитов у выздоровевших пациентов.
T CD3 + CD8 + лимфоциты более восприимчивы к апоптозу в первом триместре нормальной беременности человека
Цели. Нормальная беременность человека — это сложный процесс, в котором задействованы многие иммунорегуляторные механизмы, которые защищают плод от активации материнской иммунной системы. Целью исследования было изучить апоптоз лимфоцитов периферической крови здоровых беременных пациенток и здоровых небеременных женщин. Методы. В исследование были включены 60 беременных и 17 небеременных женщин.Лимфоциты выделяли и метили моноклональными антителами против CD3, CD4 и CD8. Апоптоз выявляли окрашиванием CMXRos и анализировали методом проточной цитометрии.
Результаты. Мы обнаружили значительно более высокий апоптоз общих лимфоцитов в периферической крови беременных пациенток по сравнению со здоровыми небеременными женщинами. Процент апоптотических клеток T CD3 + CD8 + в первом триместре был значительно выше по сравнению с третьим триместром нормальной беременности.Соотношение T CD3 + CD4 + : T CD3 + CD8 + апоптотических лимфоцитов было значительно ниже в первом триместре по сравнению с другими триместрами беременности и с обеими фазами менструального цикла. Выводы. Более высокий апоптоз T CD3 + CD8 + лимфоцитов и более низкое соотношение T CD3 + CD4 + : T CD3 + CD8 + апоптозных клеток в первом триместре нормальной беременности может указывать на более высокая восприимчивость T CD3 + CD8 + клеток к апоптозу как защитному механизму на ранних сроках беременности.
1. Введение
Запрограммированная гибель клеток — важный иммунорегуляторный механизм, который происходит в самых разных физиологических и патологических ситуациях. Он играет важную роль в поддержании гомеостаза почти во всех тканях животных, включая иммунную систему [1–4]. Апоптоз состоит из отдельных биохимических и последовательных морфологических изменений. Это включает конденсацию и сегментацию как хроматина, так и цитоплазмы, а также обширную фрагментацию хромосомной ДНК на нуклеосомные единицы, образующие апоптотические тела, которые содержат плотные массы хроматина и интактных органелл, а также клеточную фрагментацию [1–4].У млекопитающих описаны два основных пути апоптоза: внешний сигнальный путь рецептора смерти и внутренний митохондриальный путь, приводящий к активации каспазного каскада [1–4]. Апоптоз — это эффективный механизм устранения активированных лимфоцитов с помощью Fas / FasL-опосредованного процесса запрограммированной гибели клеток в иммунной системе. Этот процесс называется активацией индуцированной гибели клеток (AICD) [5, 6]. Запрограммированная гибель клеток, опосредованная Fas / FasL, в основном является частью регуляции иммунного ответа и гомеостаза тканей организма.Многие исследования предполагают дополнительные функции этой системы, особенно важную роль в патогенезе многих заболеваний, характеризующихся сниженным или чрезмерным апоптозом [5, 6].
Считается, что запрограммированная гибель клеток значительна во время эмбриогенеза, канцерогенеза и защиты хозяина [1–4]. Некоторые находки позволяют предположить, что апоптоз играет важную роль в нормальном развитии, ремоделировании и старении плаценты [7–9]. Более того, было продемонстрировано, что апоптоз увеличивается по мере прогрессирования беременности, что позволяет предположить, что это нормальное физиологическое явление на протяжении всей беременности [7].
Есть исследования, которые показали, что апоптоз, присутствующий в периферической крови, участвует в процессе разрушения фрагментов ДНК плода. Kolialexi et al. показали, что повышенный перенос фетальных клеток в периферическую кровь матери стимулирует апоптоз, возможно, для предотвращения материнского отторжения плода [10]. С другой стороны, во время нормальной беременности апоптоз нейтрофилов задерживается, что может объяснить нейтрофилию во время беременности [11].
Целью нашего исследования было оценить популяции общих апоптотических лимфоцитов, а также T CD3 + , T CD4 + и T CD8 + апоптотических лимфоцитов в периферической крови беременных в первый, второй период. , а также в третьем триместре физиологической беременности и у здоровых небеременных женщин в обеих фазах менструального цикла.
2. Материалы и методы
Пациенты, принимавшие участие в исследовании, были госпитализированы в отделение акушерства и перинатологии Медицинского университета Люблина. В исследуемую популяцию вошли 60 беременных без осложнений в возрасте от 21 до 41 года. Они были разделены на три группы: 20 пациенток находились в первом триместре, 20 — во втором триместре и 20 — в третьем триместре нормальной беременности. Все беременности были одноплодными. У всех женщин был получен полный медицинский, хирургический и социальный анамнез.Контрольную группу составили 17 здоровых небеременных женщин, не принимавших противозачаточные таблетки. У них были регулярные двухфазные (овуляторные) циклы. Образцы крови у небеременных женщин собирали дважды, между 6 и 9 и 19 и 22 днями менструального цикла. Менструальные циклы женщин контролировались. Для оценки менструального цикла учитывались преовуляторный выброс ЛГ, повышение базальной температуры тела (БТТ) и изменения цервикальной слизи. Дизайн исследования был одобрен местным комитетом по этике.Получено информированное согласие пациентов на забор периферической крови.
Двадцать миллилитров периферической крови брали у каждого пациента венепункцией в стерильных условиях и собирали в гепаринизированные пробирки. Образцы крови разбавляли 1: 1 в 20 мл физиологического буферного раствора (PBS) (Serum and Vaccine Factory, Biomed, Люблин, Польша). Мононуклеарные клетки периферической крови (PBMC) разделяли на среде для разделения лимфоцитов: Gradisol L (Aqua Medica, Lodz, Poland). Их центрифугировали в течение 20 минут при 700 × g, собирали с поверхности раздела с помощью пипетки Пастера и дважды промывали в 2 мл PBS центрифугированием в течение 5 минут при 700 × g.Двадцать пять мкл л изолированных клеток смешивали с 475 мкл л раствора Турка (10% уксусная кислота), и общее количество клеток определяли с помощью микроскопа. Мы использовали 0,4% раствор трипанового синего (Sigma, Германия) для оценки безжизненных клеток с помощью микроскопа.
CMXRos (хлорметил-X-розамин), хранившийся при -20 ° C (в соответствии с инструкциями производителя), растворяли в 94 мкл л диметилсульфоксида (ДМСО) (Sigma, США) с получением исходного раствора. Затем мы разбавили основной раствор, смешав 10 мкл л исходного раствора с 190 мкл л ДМСО.Его можно хранить несколько месяцев при 4 ° C. Суспензию выделенных клеток (2,5 мкл л – 500000 клеток) помещали в 0,5 мл культуральной среды (10% FCS и RPMI). Клетки инкубировали с 5 мкл л CMXRos в среде для выращивания при 37 ° C и 5% CO 2 . Через 15 минут инкубации клетки метили прямым окрашиванием 2,5 мкл л моноклональных антител (BD Biosciences, Сан-Хосе, Калифорния, США) в следующих комбинациях: (1) анти-CD3 (FITC) и анти-CD3. -CD4 (PE), (2) анти-CD3 (FITC) и анти-CD8 (PE), (3) анти-гликофорин A (FITC).Клетки инкубировали с антителами и CMXRos в течение следующих 15 минут. Антитело против гликофорина А (Daco, Дания) использовали для удаления эритроцитов.
Стратегия проточного цитометрического анализа гейтирования и анализа апоптотических клеток. Клетки собирали с использованием проточного цитометра FACSCalibur, оборудованного аргоновым лазером 488 нм (Becton Dickinson), и анализировали с помощью программного обеспечения CellQuest. Лимфоциты классифицировали по прямому рассеянию (FSC) и боковому рассеянию (SSC). Клетки регистрировали с помощью дот-блотов FSC / SSC.В случае оценки общего апоптоза лимфоцитов, эритроциты (гликофорин A + событий) были исключены, и нарушение митохондриального потенциала рассчитывалось, как показано на гистограммах или точечных графиках. Результаты апоптоза представляют собой процент апоптотических событий в общем количестве лимфоцитов. Аналогичным образом рассчитывали апоптоз T CD3 + , T CD3 + CD4 + и T CD3 + CD8 + лимфоцитов. Во-первых, были обнаружены области T CD3 + , T CD3 + CD4 + и T CD3 + CD8 + лимфоцитов.Затем с помощью CMXRos оценивали процентное соотношение T CD3 + , T CD3 + CD4 + и T CD3 + CD8 + лимфоцитов. Результаты апоптоза представляют собой процент апоптотических событий в T CD3 + , T CD3 + CD4 + и T CD3 + CD8 + лимфоцитов. Стратегия стробирования и анализа общего количества апоптотических лимфоцитов и T CD3 + , T CD3 + CD4 + и T CD3 + CD8 + апоптотических лимфоцитов показана на рисунке 1.
Результаты представлены в виде медианы с интерквартильными размахами. Статистические различия между группами оценивали с помощью стандартного критерия Манна-Уитни U и критерия Вилкоксона. В случаях сравнения фолликулярной и лютеиновой фаз менструального цикла использовался стандартный тест Вилкоксона. Различия на уровне считались статистически значимыми. Для статистического анализа использовалась программа Statistica 7.1 PL.
3. Результаты
Процент общего количества апоптотических лимфоцитов был значительно выше у всех беременных женщин (в первом, втором и третьем триместрах) по сравнению с фолликулярной фазой небеременных женщин (1.57% против 1,35%; ). В первом триместре нормальной беременности процент апоптозных лимфоцитов был значительно выше по сравнению как с фолликулярной (1,78% против 1,35%;), так и с лютеиновой фазами менструального цикла (1,78% против 1,52%;). Процент общих апоптотических лимфоцитов был выше в первом триместре, чем во втором и третьем триместрах нормальной беременности, но различия не были статистически значимыми (I триместр по сравнению со II триместром: 1,78% против 1.39%, NS; I триместр по сравнению с III триместром: 1,78% против 1,43%, NS). Не было различий между процентами апоптозных лимфоцитов во втором и третьем триместрах беременности (II триместр по сравнению с III триместром: 1,39% против 1,43%, NS). Процент апоптозных лимфоцитов в лютеиновой фазе был выше, чем в фолликулярной фазе менструального цикла, но различия не были статистически значимыми (1,52% против 1,35%, NS).
Процент апоптозных лимфоцитов T CD3 + был значительно ниже в третьем триместре нормальной беременности по сравнению с фолликулярными (1.02% против 1,11%; ) и лютеиновые фазы менструального цикла (1,02% против 1,25%;). Процент апоптотических лимфоцитов T CD3 + был выше в первом триместре, чем во втором и третьем триместрах беременности и в фазах менструального цикла, но различия не были статистически значимыми (I триместр по сравнению со II триместром: 1,20% по сравнению с 1,04%, NS; I триместр по сравнению с III триместром: 1,20% против 1,02%, NS; I триместр по сравнению с фолликулярной фазой: 1,20% по сравнению с 1,11%, NS; I триместр по сравнению с лютеиновой фазой: 1.20% против 1,25%, NS). Не было различий между вторым и третьим триместрами беременности (1,04% против медианы: 1,02%, NS).
Процент апоптотических клеток T CD3 + CD4 + у небеременных женщин был значительно выше, чем у беременных (0,45% против 0,41%;). Кроме того, процент апоптотических клеток T CD3 + CD4 + в лютеиновой фазе менструального цикла был значительно выше, чем у беременных (0.50% против 0,41%; ). Процент апоптотических клеток T CD3 + CD4 + был значительно ниже в первом и третьем триместрах нормальной беременности по сравнению с лютеиновой фазой менструального цикла (I триместр по сравнению с лютеиновой фазой: 0,39% против 0,50%; , III триместр по сравнению с лютеиновой фазой: 0,42% против 0,50%;). Не было различий между первым, вторым и третьим триместрами нормальной беременности (I триместр по сравнению со II триместром: 0,39% против медианы: 0.44%, NS; I триместр по сравнению с III триместром: 0,39% против 0,42%, NS; II триместр по сравнению с III триместром: 0,44% против 0,42%, NS).
Процент апоптотических лимфоцитов T CD3 + CD8 + у здоровых беременных пациенток был значительно ниже по сравнению с небеременными (0,45% против 0,55%;). Процент T CD3 + CD8 + апоптотических лимфоцитов у здоровых беременных женщин был значительно ниже по сравнению с лютеиновой и фолликулярной фазами менструального цикла (нормальная беременность по сравнению с лютеиновой фазой: 0.45% против 0,64%,; нормальная беременность по сравнению с фолликулярной фазой: 0,45% против 0,51%,). Процент T CD3 + CD8 + апоптотических клеток в лютеиновой фазе был значительно выше, чем во втором (лютеиновая фаза по сравнению со II триместром: 0,64% против медианы: 0,44%;) и в третьем триместре нормальной беременности ( лютеиновая фаза по сравнению с III триместром: 0,64% против 0,42%;). Процент апоптотических T CD3 + CD8 + лимфоцитов в фолликулярной фазе менструального цикла был значительно выше по сравнению с третьим триместром нормальной беременности (0.51% против 0,42%; ). Апоптоз T CD3 + CD8 + лимфоцитов был значительно ниже в третьем триместре по сравнению с первым триместром нормальной беременности (0,42% против 0,54%;). Не было различий между вторым и третьим триместрами нормальной беременности (0,44% против 0,42%, NS). Процентные значения общего количества апоптотических лимфоцитов и T CD3 + , T CD3 + CD4 + и T CD3 + CD8 + апоптотических лимфоцитов представлены на рисунке 2.
Соотношение апоптотических T CD3 + CD4 + : T CD3 + CD8 + лимфоцитов в первом триместре было значительно ниже по сравнению со вторым (0,65 против 1,05;) и третьим триместрами беременности. нормальная беременность (0,65 против 1,04;). Более того, соотношение T CD3 + CD4 + : T CD3 + CD8 + апоптотических лимфоцитов в первом триместре нормальной беременности было значительно ниже по сравнению с лютеиновыми (0.65 против 0,83; ) и фолликулярные фазы менструального цикла (0,65 против 0,84;). Не было различий между вторым и третьим триместрами беременности (1,05 против 1,04, NS). Результаты соотношения T CD3 + CD4 + : T CD3 + CD8 + апоптотических лимфоцитов представлены на рисунке 3. Абсолютные числа апоптотических лимфоцитов и апоптотических T CD3 + , T CD3 + CD4 + и T CD3 + CD8 + клеток у здоровых беременных женщин и в фолликулярной и лютеиновой фазах менструального цикла небеременных женщин представлены в таблице 1.
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ; **; ***; ****. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
4. Обсуждение
Апоптоз происходит во время нормального развития и важен для правильного баланса между потерей старых, нефункциональных клеток и образованием новых клеток в различных органах и тканях. Недавние открытия предполагают, что антигены Fas и FasL или TRAIL-R-TRAIL важны для процесса гибели клеток и что любая дисфункция в этой системе может привести к нарушению периферической толерантности [5, 6].
Большинство исследований демонстрируют апоптоз плаценты. Документированных данных, описывающих этот процесс в периферической крови при физиологической беременности, очень мало [7–10, 12].
Хорошо известно, что антигены плода влияют на иммунную систему матери. Апоптотические тельца, присутствующие в периферической крови, вызывают повышенную регуляцию T CD4 + и T CD8 + клеток. Более того, в первом триместре беременности источником антигена, вероятно, являются апоптотические вневорсинчатые клетки трофобласта.Во втором триместре, при дальнейшей инвазии трофобласта, открытые апоптотические синцитиотрофобластные клетки попадают в кровоток матери. Они кратковременно опсонизируются и презентируются периферическими антигенпрезентирующими клетками (APC) [12, 13]. Таким образом, толерантность инициируется локально в децидуальной оболочке и поддерживается до срока за счет более «системной» презентации антигена. Кроме того, связывание CTLA-4 на Т-клетках с костимулирующим рецептором B7 будет доставить тормозной сигнал к Т-клеткам [14, 15]. Было обнаружено, что активированные Т-клетки, способные индуцировать апоптоз вневорсинчатого трофобласта, могут ингибироваться CTLA-4-зависимым механизмом.Кроме того, было сказано, что материнские иммунные клетки и их цитокины регулируют апоптоз трофобластов [16, 17].
Существует множество иммуномодулирующих путей, которые могут регулировать процесс активности лимфоцитов во время беременности. Было продемонстрировано, что экзосомы плаценты имеют решающее значение в модулировании активации Т-клеток и подавлении эффекторных Т-клеток за счет усиления апоптоза Т-лимфоцитов и потери CD3-дзета. В исследовании Sabapatha et al. Плацентарные экзосомы, выделенные из периферического кровообращения матери, подавляли экспрессию CD3-zeta и JAK3 Т-клетками, вызывая при этом SOCS-2.Уровень CD3-zeta на клетках T CD8 + подавлялся в 1,43 раза больше, чем на клетках T CD4 + [18]. Кроме того, недавно сообщалось, что неопределенный фактор, способный подавлять активность Т-клеток, продуцируется краткосрочными культурами фрагментов плаценты. Фактор продуцируется ворсинками хориона из доношенной плаценты. Этот низкомолекулярный термостабильный фактор был способен ингибировать IL-2-зависимую пролиферацию клеток CTLL-2 мыши. Иммуносупрессивное действие фактора, которым, вероятно, может быть простагландин PGE2, осуществлялось через рецептор EP4 [19].В другом исследовании анергия Т-лимфоцитов, вызванная низкомолекулярным материалом, присутствующим в супернатанте плаценты человека, была связана с дефектным фосфорилированием цепи CD3 TCR [20]. Кроме того, фактор регенерации и толерантности (RTF), экспрессируемый в плаценте человека, индуцирует продукцию IL-10 и может регулировать иммунный ответ во взаимоотношениях матери и плода [21]. Кроме того, было обнаружено, что RTF экспрессируется во время активации Т-лимфоцитов и играет роль в апоптозе Т-лимфоцитов [22, 23].
Другими факторами, которые могут влиять на апоптоз Т-лимфоцитов во время беременности, могут быть неклассические антигены HLA-G, экспрессируемые во вневорсинчатых цитотрофобластах, а также растворимые изоформы белков HLA-G. Как мембраносвязанный HLA-G, так и растворимые изоформы белков, происходящих из гена HLA-G класса Ib, продуцируются клетками трофобласта плаценты. Сообщалось, что неполиморфная растворимая изоформа HLA-G1 (sHLA-G1) секретируется клетками трофобласта на границе раздела матери и плода, что позволяет предположить, что она может действовать как иммуномодулятор во время беременности.Сообщалось, что аффинно очищенный бета2-микроглобулин-связанный sHLA-G1 усиливал экспрессию лиганда CD95 и апоптоз в активированных клетках T CD8 + [24, 25]. Исследования, проведенные на мышах, показали, что воздействие на материнские Т-клетки фетального антигена H-Y приводит к делеции 50% H-Y-специфических материнских Т-клеток. Оставшиеся H-Y-специфические Т-клетки были гипореактивны к H-Y, что было определено по снижению пролиферативной способности и активности CTL. Дальнейшие эксперименты показали, что экспрессия FasL плодом, но не матерью, необходима и достаточна для обоих компонентов материнской толерантности к антигенам плода.Авторы предполагают, что взаимодействие Fas с FasL плода является критическим как для делеции, так и для гипореактивности H-Y-реактивных T CD8 + клеток во время беременности [26].
Некоторые исследования показывают, что апоптоз на 16–19 неделях беременности был выше, чем у небеременных женщин. Повышенный перенос фетальных клеток в периферическую кровь матери может стимулировать апоптоз, возможно, для предотвращения материнского отторжения плода [10]. Более того, было обнаружено, что скорость апоптоза линейно замедлялась с увеличением срока гестации [10, 11].Апоптоз трофобластов в первом триместре может быть необходим для дальнейшего установления материнской толерантности к плоду путем индукции Т-клеток [27].
Известно, что цитотоксический эффект Т-лимфоцитов у беременных значительно снижен. Это может быть вызвано механизмами индукции анергии и / или повышенным апоптозом Т-цитотоксических лимфоцитов [27, 28].
Наши результаты показали, что апоптоз лимфоцитов периферической крови был выше у здоровых беременных женщин по сравнению со здоровыми небеременными женщинами.С другой стороны, мы заметили более низкий процент апоптотических лимфоцитов T CD3 + в третьем триместре физиологической беременности по сравнению с фазами менструального цикла. Наши данные также показали значительно более высокий процент апоптоза лимфоцитов T CD3 + CD8 + в периферической крови в первом триместре по сравнению с третьим триместром беременности. Кроме того, соотношение T CD3 + CD4 + : T CD3 + CD8 + апоптотических лимфоцитов было значительно ниже в первом триместре по сравнению с другими триместрами беременности и с обеими фазами менструального цикла. .Это может свидетельствовать о том, что T CD3 + CD8 + лимфоцитов легко подвергаются апоптозу в первом триместре физиологической беременности. Вероятно, это связано с тем, что плод в начале беременности должен быть более защищен. Более того, повышенный апоптоз лимфоцитов периферической крови в первом триместре беременности может быть связан с усилением апоптоза, связанного с имплантацией.
Повышенная экспрессия антигена APO-1 / Fas на Т-лимфоцитах и NK-клетках в лютеиновой фазе менструального цикла может отражать аспекты феномена подготовки к имплантации бластоцисты [29].Более низкая скорость апоптоза Т-клеток может коррелировать с подавлением антигена APO-1 / Fas. Более того, сниженная экспрессия антигена APO-1 / Fas (CD95) на лимфоидных клетках периферической крови может привести к нарушению функции апоптоза у беременных. Рейнхард и др. наблюдали, что экспрессия антигена APO-1 / Fas на Т-клетках была значительно повышена во время беременности и в фазе после родов, тогда как Fas-опосредованный апоптоз Т-лимфоцитов периферической крови беременных пациенток был значительно снижен по сравнению с небеременными женщинами [30].Точно так же мы наблюдали более низкий процент апоптотических лимфоцитов T CD3 + в периферической крови у нормальных беременных пациенток в третьем триместре по сравнению с небеременными женщинами.
Существует множество факторов, которые могут влиять на апоптоз Т-лимфоцитов во время беременности. Учитывались стероидные гормоны [30–33]. Ширшев и др. изучили влияние хорионического гонадотропина (ХГ), эстрадиола, прогестерона и их физиологических комбинаций на апоптоз Т-лимфоцитов периферической крови человека [31].Репродуктивные гормоны эффективно регулируют апоптоз Т-лимфоцитов периферической крови. Было показано, что гормональные комбинации по-разному влияют на различные субпопуляции Т-клеток. Гормональные комбинации, специфичные для первого триместра беременности, стимулировали апоптоз T CD8 + лимфоцитов и ингибировали апоптоз T CD4 + клеток [23]. Результаты нашего исследования согласуются с их наблюдениями. Мы наблюдали более низкое соотношение T CD3 + CD4 + : T CD3 + CD8 + апоптотических лимфоцитов в первом триместре по сравнению со вторым и третьим триместрами нормальной беременности.Это говорит о том, что скорость апоптоза T CD3 + CD8 + лимфоцитов выше, чем T CD3 + CD4 + лимфоцитов в первом триместре нормальной беременности по сравнению с другими триместрами.
Наши результаты показали, что процент апоптоза T CD3 + CD4 + у беременных женщин был значительно ниже, чем у небеременных. Кажется, что гормоны, которые выделяются во время беременности, могут ингибировать апоптоз, особенно апоптоз T CD3 + CD4 + лимфоцитов [30].Некоторые исследования показали, что менструальные стероидные гормоны оказывают множественное влияние на функцию иммунных клеток [30–33]. Стероидные гормоны, вероятно, являются наиболее важными факторами, регулирующими механизм апоптоза [30–33]. Hofmann-Lehmann et al. изучили скорость апоптоза лимфоцитов периферической крови у кошек и кошек. Они наблюдали более низкий уровень апоптоза в лимфоцитах периферической крови у кошек, чем у кошек-самцов. Они заметили корреляцию скорости апоптоза с концентрацией 17 бета-эстрадиола, но не с уровнем прогестерона в крови.Авторы пришли к выводу, что 17-бета-эстрадиол в физиологических концентрациях может защищать периферические лимфоциты от апоптоза [32].
Повышенная частота апоптоза лимфоцитов T CD3 + CD8 + в первом триместре нормальной беременности может свидетельствовать об удалении аллореактивных T CD3 + CD8 + лимфоцитов. Кажется, это один из механизмов защиты плода от материнского отторжения.
Более высокий процент T CD3 + CD8 + апоптотических лимфоцитов и более низкий коэффициент T CD3 + CD4 + : T CD3 + CD8 + апоптотических клеток в первом триместре нормальной беременности может указывать на более высокую восприимчивость T CD3 + CD8 + клеток к апоптозу как защитному механизму на ранней стадии беременности.Более того, повышенный апоптоз лимфоцитов периферической крови в первом триместре беременности может быть связан с усилением апоптоза, связанного с имплантацией.
Конфликт интересов
Авторы заявляют об отсутствии конфликта интересов в отношении публикации данной статьи.
Благодарность
Эта работа была поддержана грантом Nr N 407 125238 Национального центра наук.
(PDF) Изменение общего количества лимфоцитов крови во время и после беременности
3Örgül G.Сояк Б. Портакал О. Бексач М. Бексач MS.
приведены в литературе. Некоторые исследования были проведены для изучения распределения субпопуляций лимфоцитов во время беременности.
Т- и В-лимфоциты, NK-клетки и соотношение подгруппы Т-клеток —
Не меняется — это основной консенсус этих исследований (6,
9). Мы не анализировали изменения в субпопуляциях лимфоцитов в
нашем исследовании.
Беременность по-разному влияет на массу и активность тимуса.
ity.Хорошо известно, что вилочковая железа становится меньше во время беременности, и общее количество тимоцитов также уменьшается в ткани.
Все эти физиологические изменения приводят к значительному снижению общего числа Т-клеток (10,11). Зависимая от лимфоцитов цитотоксичность
активируется экспрессией a2V-АТФазы на поверхности клетки
. Этот фермент играет важную роль в дифференцировке и созревании Т-клеток и NK-клеток
. Беременность оказывает положительное влияние на a2V-АТФазу, особенно в тимусе, что
, по-видимому, является причиной изменения общего количества лимфоцитов в крови
(12).
Изменения уровня лимфоцитов в послеродовом периоде были изучены в ограниченном количестве исследований. Исследователи
заявили, что уровни нейтрофилов и лейкоцитов начинают повышаться,
даже в первый день после родов (13). Кроме того, Кюнер и др.
продемонстрировал повышенный уровень лимфоцитов на первой неделе
после родов (9). Мы показали, что количество лимфоцитов уменьшается на
после родов; однако наши данные ограничены 1-м послеродовым днем
.По всей видимости, это результат острой кровопотери после рождения, как ожидается,
.
В заключение отметим, что во время беременности наблюдается значительное снижение общего уровня лимфоцитов
. Беременность и родственные гормоны отрицательно влияют на общее количество лимфоцитов
крови. Необходимы хорошо спланированные будущие исследования, чтобы понять влияние беременности на лимфоциты.
Ссылки
1. Робертсон С.А. Иммунорегуляция зачатия и имплантация em-
bryo — все о контроле качества? J Reprod
Immunol 2010; 85 (1): 51-7.
2. Декель Н., Гнаински Ю., Гранот И., Мор Г. Воспаление и имплантация
. Am J Reprod Immunol 2010; 63 (1): 17-21.
3. Валдимарссон Х., Малхолланд С., Фридриксдоттир В., Коулман
Д.В. Продольное исследование количества лейкоцитов в крови и ответа
лимфоцитов во время беременности: заметное увеличение соотношения моноцитов и лимфоцитов на ранних сроках
. Clin Exp Immunol
1983; 53 (2): 437-43.
4. Tilburgs T, Claas FH, Scherjon SA. Лекция присуждения премии за исследования Elsevier Trophoblast
: Уникальные свойства децидуальных клеток T
и их роль в иммунной регуляции во время беременности человека
.Плацента 2010; 31 Дополнение: S82-6.
5. Милман Н., Бергхольт Т., Биг К.Е., Эриксен Л., Хвас А.М.
Референсные интервалы для гематологических переменных во время
нормальной беременности и в послеродовом периоде у 434 здоровых датских женщин
. Eur J Haematol 2007; 79 (1): 39-46.
6. Иватани Ю., Амино Н., Тачи Дж., Кимура М., Ура И., Мори М.,
и др. Изменения субпопуляций лимфоцитов у здоровых беременных
и послеродовых женщин: послеродовое увеличение NK / K
(Leu 7) клеток.Am J Reprod Immunol Microbiol 1988;
18 (2): 52-5.
7. Акинбами А.А., Аджибола С.О., Рабиу К.А., Адевунми А.А.,
Досунму А.О., Адедиран А. и др. Гематологический профиль
здоровых беременных женщин в Лагосе, Нигерия. Международный
Журнал женского здоровья 2013; 5: 227-32.
8. Лурье С., Рахамим Э., Пайпер И., Голан А., Садан О. Всего и
процентили дифференциального подсчета лейкоцитов при нормальной беременности. Eur J Obstet Gynecol Reprod Biol 2008; 136
(1): 16-9.
9. Kühnert M, Strohmeier R, Stegmüller M, Halberstadt E.
Изменения в субпопуляциях лимфоцитов во время нормальной беременности.
Европейский журнал акушерства и гинекологии и
Репродуктивная биология 1998; 76 (2): 147-51.
10. Rijhsinghani AG, Bhatia SK, Tygrett LT, Waldschmidt TJ.
Влияние беременности на развитие Т-лимфоцитов тимуса. Am J
Reprod Immunol 1996; 35 (6): 523-8.
11. Кендалл, Мэриленд, Кларк АГ. Тимус мыши
изменяет свою активность во время беременности: исследование микроокружения микроокружения
.Journal of anatomy 2000; 197 (03): 393-
411.
12. Jaiswal M, Mallers T, Chaouat G, Gilman-Sachs A,
Beaman K. Беременность изменяет развитие Т-клеток у мышей
вилочковая железа (115.11). Журнал иммунологии
2012; 188 (1 приложение): 115.11-11.
13. Onwukeme KE. Послеродовые гематологические индексы в
Нигерии. Африканский медицинский и медицинский журнал
Sciences 1992; 21 (2): 51-5.
Активация лимфоцитов в развитии иммунной толерантности у женщин с повторной потерей беременности
Сухих, Г.Т., Ванко Л.В. (2003) Иммунология беременности , Издательство РАМН, Москва.
Сидельникова В. М., Сухих Г. Т. (2011) Потеря беременности: руководство для практикующих , Медицинский информ. Агентство, Москва.
Карп, Х. Дж. А. (2014 ) Рецидивирующая потеря беременности: причины, противоречия и лечение , CRC Press London.
Санчо, Д., Гомес, М.и Sanchez-Madrid, F. (2005) CD69 представляет собой иммунорегуляторную молекулу, индуцируемую после активации, Trends Immunol. , 26 , 136-140, DOI: 10.1016 / j.it.2004.12.006.
Артикул
PubMed
CAS
Google Scholar
Hu, Y. P., Li, X. J. и Liu, S. W. (2010) Влияние ConA на раннюю активацию и функцию CD4 + CD25 + Treg-клеток у мышей, Chinese J. Cell. Мол. Immunology , 26, , 118-120, [на китайском языке].
CAS
Google Scholar
Мартин П., Гомес М., Лавана А., Крус-Адалия А., Рамирес-Уэска М., Урса М. А., Яньес-Мо М. и Санчес-Мадрид, F. (2010) Ассоциация CD69 с белками Jak3 / Stat5 регулирует дифференцировку клеток Th27, Mol. Клетка. Биол. , 30 , 4877-4889, DOI: 10.1128 / MCB.00456-10.
Артикул
PubMed
PubMed Central
CAS
Google Scholar
Лю, Л.Ф. и Руденский А. (2009) Молекулярная оркестровка дифференцировки и функции регуляторных Т-клеток, Genes Dev. , 23 , 1270-1282, DOI: 10.1101 / gad.17.
Артикул
PubMed Central
CAS
Google Scholar
Мартин П. и Санчес-Мадрид Ф. (2011) CD69: неожиданный регулятор воспалительных реакций, управляемых клетками Th27, Sci. Сигнал. , 4 , 14, DOI: 10.1126 / scisignal.2001825.
Артикул
CAS
Google Scholar
Мики-Хосокава, Т., Хасегава, А., Ивамура, К., Синода, К., Тофукудзи, С., Ватанабэ, Ю., Хосокава, Х., Мотохаси, С., Хасимото, К. ., Shirai, M., Yamashita, M., and Nakayama, T. (2009) CD69 контролирует патогенез аллергического воспаления дыхательных путей, J. Immunol. , 183 , 8203-8215, DOI: 10.4049 / jimmunol.06.
Артикул
PubMed
CAS
Google Scholar
Фаркухарсон, Р.Г. и Стивенсон, М. Д. (2017) Ранняя беременность , Издательство Кембриджского университета, Кембридж.
Портер, Т. Ф., Лакурсьер, Ю. и Скотт, Дж. Р. (2006) Иммунотерапия при повторном невынашивании беременности, Cochrane Database Syst. Ред. , 2 , CD000112, DOI: 10.1002 / 14651858.CD000112.pub2.
Артикул
Google Scholar
Mor, G. (2008) Воспаление и беременность: роль толл-подобных рецепторов во взаимодействии трофобластов с иммунитетом, Ann.Акад. Sci. , 1127 , 121-128, DOI: 10.1196 / annals.1434.006.
Артикул
PubMed
CAS
Google Scholar
Марцио Р., Мауэль Дж. И Бец-Коррадин С. (1999) CD69 и регуляция иммунной функции, Иммунофармакология Иммунотоксикология , 21 , 565-582, DOI: 10,3109 / 0899026.
Артикул
PubMed
CAS
Google Scholar
Сибриан, Д., и Санчер-Мадрид, Ф. (2017) CD69: от маркера активации до метаболического привратника, евро. J. Immunol. , 47 , 946-953, DOI: 10.1002 / eji.201646837.
Артикул
PubMed
PubMed Central
CAS
Google Scholar
Labiano, S., Melendez-Rodriguez, F., Palazon, A., Teijeira, A., Garasa, S., Etxeberria, I., Aznar, MA, Sanchez-Paulete, A.R, Azpilikueta , А., Боланос, Э., Молина, К., де ла Фуэнте, Х., Maiso, P, Sanchez-Madrid, F., de Landazuri, MO, Aragones, J., and Melero, I. (2017) CD69 — это прямой ген-мишень HIF-1α при гипоксии как механизм, усиливающий экспрессию при инфильтрации опухоли Т-лимфоциты, Онкоиммунология , 6 , DOI: 10.1080 / 2162402X.2017.1283468.
Артикул
Google Scholar
Кречетова Л.В., Хачатрян Н.А., Тетруашвили Н.К., Вторушина В.В., Степанова Е.О., Голубева Е.Л., Николаева М.А., Сухих Г.Т. (2015) Динамика продукции антилейкоцитарных антител к отцовским антигенам при иммунизации аллогенными клетками женщин с привычным невынашиванием беременности, Акушерство Гинекология , 3 , 16-20, [в Русский].
Google Scholar
Кречетова Л.В., Тетруашвили Н.К., Вторушина В.В., Николаева М.А., Голубева Е.Л., Сарибекова В.А., Агаджанова А.А., Ванко Л.В. (2017) Динамика выработки антилейкоцитарных антител во время беременности у женщин с привычным невынашиванием беременности на фоне иммуноцитотерапии, Акушерство гинекология , 9 , 48-55, doi: 10.18565 / aig.2017.9 .48-55, [на русском языке].
Артикул
Google Scholar
Кречетова Л.В., Степанова Е.О., Николаева М.А., Вторушина В.В., Голубева Е.Л., Хачатрян Н.А., Тетруашвили Н.К., Сухих Г.Т. (2015) Динамика состава субпопуляций лимфоцитов периферической крови женщин с привычным невынашиванием беременности при прегестационной иммуноцитотерапии, Акушерство Гинекология , 4 , 37-43, [на русском языке ].
Google Scholar
Кречетова Л.В., Тетруашвили Н.К., Вторушина В.В., Степанова Е.О., Николаева М.А., Голубева Е.Л., Хачатрян Н.А. (2015) Динамика состава субпопуляций лимфоцитов периферической крови у женщин с привычным невынашиванием беременности в I триместре беременности на фоне иммуноцитотерапии, Акушерство гинекология , 6 , 59-66, [на русском языке ].
Google Scholar
Тетруашвили Н.К., Кречетова Л.В., Сарибекова В.А., Вторушина В.В., Голубева Е.Л., Хачатрян Н.А., Агаджанова А.А. (2017) Динамика состава субпопуляций лимфоцитов периферической крови у пациенток с привычным невынашиванием беременности аллоиммунного происхождения, Акушерство Гинекология: Романы Мнения Образование , 4 , 28-36, [на русском].
Google Scholar
Сивьера, Дж., Сивьера, Дж., Гуйи, Дж., Хосин, Х.Р., Картрон, Г., Леви, К., Аль-Даккак, Р., и Джабран-Ферра, Н. (2015 г. Варианты сплайсинга рецепторов естественной цитотоксичности управляют различными функциями подтипов естественных клеток-киллеров человека, Nat.Commun. , 6 , 12. DOI: 10.1038 / ncomms10183.
Артикул
CAS
Google Scholar
Накашима, А., Накашима, А., Шима, Т., Инада, К., Ито, М., и Сайто, С. (2012) Баланс иммунной системы между Т-клетками и NK-клетками выкидыш, Am. J. Reprod. Иммунол. , 67 , 304-310, DOI: 10.1111 / j.1600-0897.2012.01115.
Артикул
PubMed
CAS
Google Scholar
Кречетова, Л.В., Тетруашвили, Н.К., Вторушина, В.В., Николаева, М.А., Хачатрян, Н.А., Агаджанова, А.А., Ванко, Л.В., Иванец, Т.Ю., Сухих, Г.Т. (2017) Особенности фенотипа лимфоцитов периферической крови женщин с идиопатический привычный выкидыш в зависимости от исхода беременности на фоне иммуноцитотерапии, Акушерство Гинекология , 7 , 52-60, doi: 10.18565 / aig.2017.7.52-60, [на русском языке].
Артикул
Google Scholar
Vacca, P., Moretta, L., Moretta, A., and Mingari, M. C. (2011) Происхождение, фенотип и функция естественных киллеров человека во время беременности, Trends Immunol. , 32 , 517-523, DOI: 10.1016 / j.it.2011.06.013.
Артикул
PubMed
CAS
Google Scholar
Кречетова Л.В., Хачатрян Н.А., Тетруашвили Н.К., Вторушина В.В., Степанова Е.О., Николаева М.А., Сухих Г.Т. (2014) Особенности фенотипа лимфоцитов периферической крови женщин с привычным выкидышем , Акушерство Гинекология , 10 , 27-33.
Google Scholar
Накачима, А., Ито, М., Йонеда, С., Сиодзаки, А., Хидака, Т., и Сайто, С. (2010) Уровни циркулирующих и децидуальных клеток Th27 при здоровой беременности, Am . J. Reprod. Иммунол. , 63 , 104-109, DOI: 10.1111 / j.1600-0897.2009.00771.x.
Артикул
CAS
Google Scholar
Онмахт, К., Парк, Дж. Х., Кординг, С., Wing, JB, Atarashi, K., Obata, Y., Gaboriau-Routhia, V., Marques, R., Dulauroy, S., Fedoseeva, M., Busslinger, M., Cerf-Bensussan, N., Boneca , IG, Voehringer, D., Hase, K., Honda, K., Sakaguchi, S., and Eberl, G. (2015) Микробиота регулирует иммунитет 2 типа посредством RORγt + T-клеток, Science , 349 , 989-993, DOI: 10.1126 / science.aac4263.
Артикул
PubMed
CAS
Google Scholar
Меньшиков В.В., Делекторская Л. Н., Золотницкая Р. П. (1987) Лабораторные методы в клинике , Медицина, Москва.
Шапиро С. С. и Уилк М. Б. (1965) Тест дисперсионного анализа на нормальность (полные образцы), Биометрика , 52 , 591-611.
Артикул
Google Scholar
Кинтана, Ф. Дж., Бассо, А. С., Иглесиас, А. Х., Корн, Т., Фарез, М. Ф., Беттелли, Э., Caccamo, M., Oukka, M. и Weiner, HL (2008) Контроль дифференцировки клеток T reg и TH 17 с помощью арилуглеводородного рецептора, Nature , 453 , 65-71, DOI: 10.1038 / nature06880 .
Артикул
PubMed
CAS
Google Scholar
Изменения в популяциях периферического иммунитета во время беременности и модуляция пробиотиками и ω-3 жирными кислотами
Pawankar, R., Canonica, G.W., Holgate, S.T.И Локки, Р. Ф. Аллергические заболевания и астма: серьезная проблема глобального здравоохранения. Curr. Opin. Allergy Clin. Иммунол. 12 , 39–41. https://doi.org/10.1097/ACI.0b013e32834ec13b (2012).
Артикул
PubMed
Google Scholar
Юлия В., Масия Л. и Домбрович Д. Влияние диеты на астму и аллергические заболевания. Нац. Rev. Immunol. 15 , 308–322. https://doi.org/10.1038 / nri3830 (2015).
CAS
Статья
PubMed
Google Scholar
Вест, К. Э., Дженмальм, М. С. и Прескотт, С. Л. Микробиота кишечника и ее роль в развитии аллергических заболеваний: более широкая перспектива. Clin. Exp. Аллергия 45 , 43–53. https://doi.org/10.1111/cea.12332 (2015).
CAS
Статья
PubMed
Google Scholar
Голлвитцер, Э. С. и Марсланд, Б. Дж. Влияние воздействия в раннем возрасте на иммунное созревание и восприимчивость к болезням. Trends Immunol. https://doi.org/10.1016/j.it.2015.09.009 (2015).
Артикул
PubMed
Google Scholar
Jenmalm, M. C. Детское иммунное созревание и развитие аллергии: регулирование материнским иммунитетом и воздействием микробов. Am. J. Reprod. Иммунол. 66 (Дополнение 1), 75–80.https://doi.org/10.1111/j.1600-0897.2011.01036.x (2011).
Артикул
PubMed
Google Scholar
Ламбрехт, Б. Н. и Хаммад, Х. Иммунология эпидемии аллергии и гигиеническая гипотеза. Нац. Иммунол. 18 , 1076–1083. https://doi.org/10.1038/ni.3829 (2017).
CAS
Статья
PubMed
Google Scholar
Jenmalm, M.C. & Duchén, K. Выбор времени для профилактических и иммуномодулирующих диетических вмешательств — пренатальный, перинатальный или послеродовой стратегии оптимальны? Clin. Exp. Аллергия 43 , 273–278. https://doi.org/10.1111/cea.12003 (2013).
CAS
Статья
PubMed
Google Scholar
DeVries, A. & Vercelli, D. Неонатальный метилом как привратник на пути к детской астме. Эпигеномика 9 , 585–593.https://doi.org/10.2217/epi-2016-0149 (2017).
CAS
Статья
PubMed
PubMed Central
Google Scholar
Furuhjelm, C. et al. Добавки рыбьего жира во время беременности и кормления грудью могут снизить риск детской аллергии. Acta Paediatr. 98 , 1461–1467. https://doi.org/10.1111/j.1651-2227.2009.01355.x (2009 г.).
Артикул
PubMed
Google Scholar
Dunstan, J. A. et al. Добавка рыбьего жира во время беременности изменяет неонатальные аллерген-специфические иммунные реакции и клинические исходы у младенцев с высоким риском атопии: рандомизированное контролируемое исследование. J. Allergy Clin. Иммунол. 112 , 1178–1184. https://doi.org/10.1016/j.jaci.2003.09.009 (2003).
CAS
Статья
PubMed
Google Scholar
Bisgaard, H. et al. Жирные кислоты, полученные из рыбьего жира, при беременности и при одышке и астме у потомства. N. Engl. J. Med. 375 , 2530–2539. https://doi.org/10.1056/NEJMoa1503734 (2016).
CAS
Статья
PubMed
Google Scholar
Фулад, Н., Брезински, Э. А., Чейз, Э. П. и Армстронг, А. В. Влияние пищевых добавок на атопический дерматит у детей: систематический обзор пробиотиков, пребиотиков, смесей и жирных кислот. JAMA Dermatol. 149 , 350–355 (2013).
CAS
Статья
Google Scholar
Рутер, К., Прескотт, С. Л. и Палмер, Д. Дж. Подходы к питанию для первичной профилактики аллергических заболеваний: обновление. J. Paediatr. Здоровье детей 51 , 962–969. https://doi.org/10.1111/jpc.12951 (2015).
Артикул
PubMed
Google Scholar
Баркер Д. Дж. Истоки теории происхождения развития. J. Intern. Med. 261 , 412–417. https://doi.org/10.1111/j.1365-2796.2007.01809.x (2007).
CAS
Статья
PubMed
Google Scholar
Форсберг, А., Уэст, К. Э., Прескотт, С. Л. и Дженмальм, М. С. Пре- и пробиотики для профилактики аллергии: время пересмотреть рекомендации ?. Clin. Exp. Аллергия 46 , 1506–1521. https://doi.org/10.1111/cea.12838 (2016).
CAS
Статья
PubMed
Google Scholar
Ван Х. Т., Анвари С. и Анагностоу К. Роль пробиотиков в предотвращении аллергических заболеваний. Дети (Базель) https://doi.org/10.3390/children6020024 (2019).
Артикул
PubMed Central
Google Scholar
Майлз, Э. А. и Колдер, П. С. Может ли раннее воздействие омега-3 жирных кислот снизить риск аллергических заболеваний у детей ?. Питательные вещества https://doi.org/10.3390/nu
84 (2017).
Артикул
PubMed
PubMed Central
Google Scholar
PrabhuDas, M. et al. Иммунные механизмы на стыке матери и плода: перспективы и проблемы. Нац. Иммунол. 16 , 328–334. https://doi.org/10.1038/ni.3131 (2015).
CAS
Статья
PubMed
PubMed Central
Google Scholar
Мор, Г., Альдо, П. и Альверо, А. Б. Уникальные иммунологические и микробные аспекты беременности. Нац. Rev. Immunol 17 , 469–482.https://doi.org/10.1038/nri.2017.64 (2017).
CAS
Статья
PubMed
Google Scholar
Watson, H. et al. Рандомизированное исследование влияния добавок полиненасыщенных жирных кислот омега-3 на микробиоту кишечника человека. Кишечник 67 , 1974–1983. https://doi.org/10.1136/gutjnl-2017-314968 (2018).
CAS
Статья
PubMed
Google Scholar
Barthow, C. et al. Исследование пробиотиков при беременности (исследование PiP): Обоснование и дизайн двойного слепого рандомизированного контролируемого исследования для улучшения здоровья матери во время беременности и предотвращения детской экземы и аллергии. BMC Беременность и роды 16 , 133. https://doi.org/10.1186/s12884-016-0923-y (2016).
CAS
Статья
PubMed
PubMed Central
Google Scholar
Quin, C. et al. Добавки с пробиотиками и связанный с ними микробиом кишечника младенцев и здоровье: предостерегающее ретроспективное клиническое сравнение. Sci. Реп. 8 , 8283. https://doi.org/10.1038/s41598-018-26423-3 (2018).
ADS
CAS
Статья
PubMed
PubMed Central
Google Scholar
Венделл С.Г., Баффи С. и Ольгин Ф. Жирные кислоты, воспаление и астма. J. Allergy Clin.Иммунол. 133 , 1255–1264. https://doi.org/10.1016/j.jaci.2013.12.1087 (2014).
CAS
Статья
PubMed
PubMed Central
Google Scholar
Jenmalm, M. C. Диада мать-потомство: передача микробов, иммунные взаимодействия и развитие аллергии. J. Intern. Med. https://doi.org/10.1111/joim.12652 (2017).
Артикул
PubMed
Google Scholar
Mjösberg, J., Berg, G., Jenmalm, M.C. & Ernerudh, J. FOXP3 + регуляторных Т-клеток и Т-хелперов 1, Т-хелперов 2 и Т-хелперов 17 в децидуальной оболочке ранней беременности человека. Biol. Репродукция. 82 , 698–705. https://doi.org/10.1095/biolreprod.109.081208 (2010).
CAS
Статья
PubMed
Google Scholar
Svensson, J. et al. Макрофаги на границе раздела плод-мать экспрессируют маркеры альтернативной активации и индуцируются M-CSF и IL-10. J. Immunol. 187 , 3671–3682. https://doi.org/10.4049/jimmunol.1100130 (2011 г.).
CAS
Статья
PubMed
Google Scholar
Gustafsson, C. et al. Профили экспрессии генов децидуальных макрофагов человека: доказательства иммуносупрессивного фенотипа. PLoS ONE 3 , e2078. https://doi.org/10.1371/journal.pone.0002078 (2008).
ADS
CAS
Статья
PubMed
PubMed Central
Google Scholar
Сарджент, И. Л., Боржиховски, А. М. и Редман, К. В. НК-клетки и беременность человека — воспалительный взгляд. Trends Immunol. 27 , 399–404. https://doi.org/10.1016/j.it.2006.06.009 (2006).
CAS
Статья
PubMed
Google Scholar
Borzychowski, A. M., Croy, B. A., Chan, W. L., Redman, C. W. и Sargent, I. L. Изменения системного иммунитета типа 1 и типа 2 при нормальной беременности и преэклампсии могут быть опосредованы естественными клетками-киллерами. евро. J. Immunol. 35 , 3054–3063. https://doi.org/10.1002/eji.200425929 (2005).
CAS
Статья
PubMed
Google Scholar
Svensson-Arvelund, J. et al. 2014 Плацента в токсикологии. Часть II: Системные и местные иммунные адаптации во время беременности. Toxicol. Патол. 42 , 327–338. https://doi.org/10.1177/01313482205 (2014).
CAS
Статья
PubMed
Google Scholar
Ceovic, R. et al. Псориаз: изменения женской кожи на различных гормональных стадиях на протяжении всей жизни — половое созревание, беременность и менопауза. Биомед. Res. Int. https://doi.org/10.1155/2013/571912 (2013).
Артикул
PubMed
PubMed Central
Google Scholar
де Ман, Ю. А., Долхайн, Р. Дж., Ван де Гейн, Ф. Э., Виллемсен, С. П. и Хейз, Дж. М. Активность заболевания ревматоидным артритом во время беременности: результаты общенационального проспективного исследования. Arthritis Rheum 59 , 1241–1248. https://doi.org/10.1002/art.24003 (2008 г.).
Артикул
PubMed
Google Scholar
Confavreux, C., Hutchinson, M., Hours, M. M., Cortinovis-Tourniaire, P. & Moreau, T. Частота рецидивов рассеянного склероза, связанных с беременностью. Беременность в группе рассеянного склероза. N. Engl. J. Med. 339 , 285–291. https://doi.org/10.1056/NEJM1998073033 (1998).
CAS
Статья
PubMed
Google Scholar
Kraus, T. A. et al. Характеристика иммунного фенотипа беременности: результаты исследования вирусного иммунитета и беременности (VIP). J. Clin. Иммунол. 32 , 300–311. https://doi.org/10.1007/s10875-011-9627-2 (2012).
CAS
Статья
PubMed
Google Scholar
Пазос М., Сперлинг Р. С., Моран Т. М. и Краус Т. А. Влияние беременности на системный иммунитет. Immunol. Res. 54 , 254–261. https://doi.org/10.1007/s12026-012-8303-9 (2012).
CAS
Статья
PubMed
PubMed Central
Google Scholar
Aghaeepour, N. et al. Иммунные часы человеческой беременности. Sci. Иммунол. https://doi.org/10.1126/sciimmunol.aan2946 (2017).
Артикул
PubMed
PubMed Central
Google Scholar
Abrahamsson, T. R. et al. Пробиотики в профилактике IgE-ассоциированной экземы: двойное слепое рандомизированное плацебо-контролируемое исследование. J. Allergy Clin. Иммунол. 119 , 1174–1180. https://doi.org/10.1016/j.jaci.2007.01.007 (2007).
CAS
Статья
PubMed
Google Scholar
Форсберг, А., Абрахамссон, Т. Р., Бьоркстен, Б. и Дженмальм, М. С. Дородовой и послеродовой прием Добавка Lactobacillus reuteri снижает чувствительность к аллергенам в младенчестве. Clin. Exp. Аллергия 43 , 434–442. https://doi.org/10.1111/cea.12082 (2013).
CAS
Статья
PubMed
Google Scholar
Forsberg, A., Abrahamsson, T. R., Björkstén, B. & Jenmalm, M. C. Пред- и послеродовое введение Lactobacillus reuteri снижает ответ TLR2 у младенцев. Clin. Пер. Аллергия 4 , 21. https://doi.org/10.1186/2045-7022-4-21 (2014).
CAS
Статья
PubMed
PubMed Central
Google Scholar
Mjosberg, J. et al. Системное снижение функционально супрессивных CD4 dim CD25 high Foxp3 + Tregs у человека во втором триместре беременности индуцируется прогестероном и 17-бета-эстрадиолом. J. Immunol. 183 , 759–769. https://doi.org/10.4049/jimmunol.0803654 (2009 г.).
CAS
Статья
PubMed
Google Scholar
Miyara, M. et al. Функциональное разграничение и динамика дифференцировки CD4 + Т-клеток человека, экспрессирующих фактор транскрипции FoxP3. Иммунитет 30 , 899–911. https://doi.org/10.1016/j.immuni.2009.03.019 (2009 г.).
CAS
Статья
PubMed
Google Scholar
Леви Б. Д. и Серхан С. Н. Разрешение острого воспаления в легких. Annu. Rev. Physiol. 76 , 467–492. https://doi.org/10.1146/annurev-physiol-021113-170408 (2014).
CAS
Статья
PubMed
Google Scholar
Риччиотти, Э. и Фитцджеральд, Г.А. Простагландины и воспаление. Артериосклер. Тромб. Васк. Биол. 31 , 986–1000. https://doi.org/10.1161 / ATVBAHA.110.207449 (2011).
CAS
Статья
PubMed
PubMed Central
Google Scholar
Boij, R. et al. Субпопуляции регуляторных Т-клеток при тяжелой или ранней преэклампсии. Am. J. Reprod. Иммунол. 74 , 368–378. https://doi.org/10.1111/aji.12410 (2015).
CAS
Статья
PubMed
Google Scholar
Ма, Х., Тао, В. и Чжу, С. Т-лимфоциты в слизистой оболочке кишечника: защита и толерантность. Ячейка. Мол. Иммунол. 16 , 216–224. https://doi.org/10.1038/s41423-019-0208-2 (2019).
CAS
Статья
PubMed
PubMed Central
Google Scholar
Hu, Z. et al. CCR7 модулирует образование регуляторных Т-клеток тимуса, изменяя состав компартмента дендритных клеток тимуса. Cell Rep. 21 , 168–180. https://doi.org/10.1016/j.celrep.2017.09.016 (2017).
CAS
Статья
PubMed
PubMed Central
Google Scholar
Evans-Marin, H. L. et al. Неожиданная регуляторная роль CCR9 в развитии регуляторных Т-клеток. PLoS ONE 10 , e0134100. https://doi.org/10.1371/journal.pone.0134100 (2015).
CAS
Статья
PubMed
PubMed Central
Google Scholar
Sun, C. M. et al. Дендритные клетки собственной пластинки тонкой кишки способствуют de novo генерации клеток Foxp3 reg с помощью ретиноевой кислоты. J. Exp. Med. 204 , 1775–1785. https://doi.org/10.1084/jem.20070602 (2007).
CAS
Статья
PubMed
PubMed Central
Google Scholar
Zheng, S. G. et al. TGF-бета требует CTLA-4 сразу после активации Т-клеток, чтобы индуцировать FoxP3 и генерировать адаптивные регуляторные клетки CD4 + CD25 + . J. Immunol. 176 , 3321–3329. https://doi.org/10.4049/jimmunol.176.6.3321 (2006).
CAS
Статья
PubMed
Google Scholar
Coombes, J. L. & Powrie, F. Дендритные клетки в регуляции иммунной системы кишечника. Нац. Rev. Immunol. 8 , 435–446. https://doi.org/10.1038/nri2335 (2008 г.).
CAS
Статья
PubMed
PubMed Central
Google Scholar
Chieppa, M., Rescigno, M., Huang, A. Y. & Germain, R. N. Динамическая визуализация расширения дендритных клеток в просвет тонкой кишки в ответ на вовлечение TLR эпителиальных клеток. J. Exp. Med. 203 , 2841–2852. https://doi.org/10.1084/jem.20061884 (2006).
CAS
Статья
PubMed
PubMed Central
Google Scholar
Matthiesen, L., Berg, G., Ernerudh, J. & Hakansson, L. Субпопуляции лимфоцитов и митогеновая стимуляция лимфоцитов крови при нормальной беременности. Am. J. Reprod. Иммунол. 35 , 70–79 (1996).
CAS
Статья
Google Scholar
Mjösberg, J. et al. Системное снижение функционально подавляющих CD4dimCD25highFoxp3 + Treg у человека во втором триместре беременности индуцируется прогестероном и 17-бета-эстрадиолом. J. Immunol. 183 , 759–769. https://doi.org/10.4049/jimmunol.0803654 (2009 г.).
CAS
Статья
PubMed
Google Scholar
Baecher-Allan, C., Wolf, E. & Hafler, D. A. Экспрессия MHC класса II идентифицирует функционально различные регуляторные Т-клетки человека. J. Immunol. 176 , 4622–4631 (2006).
CAS
Статья
Google Scholar
Сайто С., Сасаки Ю. и Сакаи М. CD4 (+) CD25high регуляторные Т-клетки при беременности человека. J. Reprod. Иммунол. 65 , 111–120. https://doi.org/10.1016/j.jri.2005.01.004 (2005).
CAS
Статья
PubMed
Google Scholar
Baecher-Allan, C., Brown, J. A., Freeman, G. J. & Hafler, D. A. CD4 + CD25high регуляторные клетки в периферической крови человека. J. Immunol. 167 , 1245–1253 (2001).
CAS
Статья
Google Scholar
Collison, L. W. et al. IL-35-опосредованная индукция мощной регуляторной популяции Т-клеток. Нац. Иммунол. 11 , 1093–1101. https://doi.org/10.1038/ni.1952 (2010).
CAS
Статья
PubMed
PubMed Central
Google Scholar
Nakashima, A. et al. Уровни циркулирующих и децидуальных клеток Th27 при здоровой беременности. Am. J. Reprod. Иммунол. 63 , 104–109. https://doi.org/10.1111/j.1600-0897.2009.00771.x (2010).
CAS
Статья
PubMed
Google Scholar
Santner-Nanan, B. et al. Системное увеличение соотношения между Foxp3 + и IL-17-продуцирующими CD4 + Т-клетками при здоровой беременности, но не при преэклампсии. J. Immunol. 183 , 7023–7030. https://doi.org/10.4049/jimmunol.04 (2009).
CAS
Статья
PubMed
Google Scholar
Сайто С., Накашима А., Шима Т. и Ито М. Th2 / Th3 / Th27 и парадигма регуляторных Т-клеток во время беременности. Am. J. Reprod. Иммунол. 63 , 601–610. https://doi.org/10.1111/j.1600-0897.2010.00852.x (2010).
CAS
Статья
PubMed
Google Scholar
Сакс, Г., Сарджент, И. и Редман, К. Врожденный взгляд на беременность человека. Immunol. Сегодня 20 , 114–118 (1999).
CAS
Статья
Google Scholar
Passlick, B., Flieger, D. и Ziegler-Heitbrock, H. W. Идентификация и характеристика новой субпопуляции моноцитов в периферической крови человека. Кровь 74 , 2527–2534 (1989).
CAS
Статья
Google Scholar
Ziegler-Heitbrock, L. et al. Номенклатура моноцитов и дендритных клеток крови. Кровь 116 , e74-80. https://doi.org/10.1182 / blood-2010-02-258558 (2010).
CAS
Статья
PubMed
Google Scholar
Крой, Б. А., ван ден Хеувель, М. Дж., Борзиховски, А. М. и Тайаде, С. Естественные клетки-киллеры матки: специализированная дифференцировка, регулируемая гормонами яичников. Immunol. Ред. 214 , 161–185. https://doi.org/10.1111/j.1600-065X.2006.00447.x (2006).
CAS
Статья
PubMed
Google Scholar
Сарджент, И. Л., Боржиховски, А. М. и Редман, К. В. Иммунорегуляция при нормальной беременности и преэклампсии: обзор. Репродукция. Биомед. Интернет 13 , 680–686 (2006).
CAS
Статья
Google Scholar
Nagler, A., Lanier, L. L., Cwirla, S. & Phillips, J.H. Сравнительные исследования человеческих FcRIII-положительных и отрицательных естественных клеток-киллеров. J. Immunol. 143 , 3183–3191 (1989).
CAS
PubMed
Google Scholar
Спитс, Х., Бернинк, Дж. Х. и Ланье, Л. NK-клетки и врожденные лимфоидные клетки 1-го типа: партнеры в защите хозяина. Нац. Иммунол. 17 , 758–764. https://doi.org/10.1038/ni.3482 (2016).
CAS
Статья
PubMed
Google Scholar
Cooper, M. A. et al. Человеческие естественные киллерные клетки: уникальная врожденная иммунорегуляторная роль для подгруппы CD56 (светлый). Кровь 97 , 3146–3151 (2001).
CAS
Статья
Google Scholar
Медина, К. Л., Смитсон, Г. и Кинкейд, П. В. Подавление В-лимфопоэза при нормальной беременности. J. Exp. Med. 178 , 1507–1515. https://doi.org/10.1084/jem.178.5.1507 (1993).
CAS
Статья
PubMed
Google Scholar
Гримальди, К. М., Клири, Дж., Дагтас, А. С., Муссаи, Д. и Даймонд, Б. Эстроген изменяет пороговые значения для апоптоза и активации В-клеток. J. Clin. Вкладывать деньги. 109 , 1625–1633. https://doi.org/10.1172/JCI14873 (2002).
CAS
Статья
PubMed
PubMed Central
Google Scholar
Анализ малавийских матерей, инфицированных и неинфицированных вирусом иммунодефицита человека типа 1, в JSTOR
Abstract
Исследования проточной цитометрии были проведены в Малави на 229 женщинах в третьем триместре и 128 женщинах через 6 недель после родов; как у женщин, инфицированных вирусом иммунодефицита человека типа 1 (ВИЧ-1), так и у женщин, инфицированных вирусом иммунодефицита человека, наблюдалось увеличение абсолютного количества лимфоцитов CD4 и CD8 между поздними сроками беременности и ранним послеродовым периодом, в то время как процентное содержание клеток CD4 и CD8 практически не изменилось.Последующее измерение клеток CD4 и CD8 через 6 недель после родов у 89 женщин, прошедших тестирование в третьем триместре, показало увеличение абсолютных чисел как у ВИЧ-1-серопозитивных, так и у -серонегативных женщин, без параллельного увеличения процента CD4 или CD8. Независимо от статуса инфицирования ВИЧ-1, иммуносупрессия малавийских женщин в третьем триместре беременности, по данным Т-лимфоцитов, не больше, чем у небеременных. При мониторинге уровней CD4 и CD8 у беременных женщин следует использовать процент, а не абсолютное число, чтобы избежать влияния более высокого объема распределения на абсолютное количество Т-клеток.
Journal Information
Основанный в 1904 году, The Journal of Infectious Diseases является ведущим изданием в Западном полушарии для оригинальных исследований патогенеза, диагностики и лечения инфекционных заболеваний, микробов, которые их вызывают, и нарушений иммунных механизмов хозяина. Статьи в JID включают результаты исследований в области микробиологии, иммунологии, эпидемиологии и смежных дисциплин. Опубликовано для Общества инфекционных болезней Америки.
Информация об издателе
Oxford University Press — это отделение Оксфордского университета. Издание во всем мире способствует достижению цели университета в области исследований, стипендий и образования. OUP — крупнейшая в мире университетская пресса с самым широким глобальным присутствием. В настоящее время он издает более 6000 новых публикаций в год, имеет офисы примерно в пятидесяти странах и насчитывает более 5500 сотрудников по всему миру. Он стал известен миллионам людей благодаря разнообразной издательской программе, которая включает научные работы по всем академическим дисциплинам, библии, музыку, школьные и университетские учебники, книги по бизнесу, словари и справочники, а также академические журналы.
Клиническая ценность соотношения нейтрофилов и лимфоцитов при осложнениях, связанных с беременностью: мини-обзор — Hai
Введение
Отношение нейтрофилов к лимфоцитам (NLR), которое можно легко рассчитать на основе общего анализа крови и дифференциального подсчета лейкоцитов, является недорогим параметром, имеющим множество клинических применений. Например, накопленные данные показали, что NLR является прогностическим фактором сердечной недостаточности (1), субарахноидального кровоизлияния у взрослых (2) и рака желудка (3).Одним из возможных механизмов, лежащих в основе многократного применения NLR, является воспалительный ответ, который увеличивает количество циркулирующих нейтрофилов и уменьшает количество лимфоцитов (4,5).
Осложнения, связанные с беременностью (PRC), такие как преэклампсия (PE) и гестационный сахарный диабет (GDM), являются серьезными факторами смертности и заболеваемости у беременных женщин. Ранняя диагностика и прогнозирование PRC имеют решающее значение для улучшения результатов. Интересно, что воспалительный ответ участвует в патогенезе почти всех типов этих осложнений (6-8).Следовательно, индикаторы воспаления, такие как C-реактивный белок (CRP) и интерлейкин 6 (IL-6), связаны с возникновением PRC (9-11).
Поскольку NLR является простым и недорогим индикатором воспаления, накопленные исследования изучали клиническую применимость NLR во время беременности. Поэтому мы суммировали и прокомментировали имеющиеся в настоящее время данные о NLR и PRC. В этом обзоре мы разделили доступные исследования на перекрестные, случай-контроль и когортные исследования.Эта информация не была извлечена из оригинальных отчетов, но была обоснована автором. Под поперечным дизайном понимались любые исследования, в которых одновременно измеряются факторы воздействия и исходы. Дизайн «случай-контроль» был определен как любые исследования, в которых сначала получены результаты, а факторы воздействия до наступления результатов получены ретроспективно. Под когортным дизайном понимались любые исследования, в которых в первую очередь определяются факторы воздействия и за субъектами наблюдают до наступления результата.
ПЭ
PE является основной причиной смертности и заболеваемости как для матери, так и для плода во всем мире (12). Он характеризуется гипертонией и протеинурией после 20 недель беременности (12). Распространенность ПЭ составляет от 1% до 8% (13-15). Хотя патогенез ПЭ в значительной степени неизвестен, исследования на животных и клинические исследования показывают, что воспалительный ответ играет решающую роль в возникновении и развитии ПЭ (6,16,17).Поскольку NLR является простым индикатором воспалительной реакции, в некоторых исследованиях изучалась клиническая применимость NLR при ПЭ.
Два перекрестных исследования, опубликованные в 2014 г. (18,19), изучали взаимосвязь между NLR и PE, но результаты противоречивы. Одно исследование показало, что NLR у пациентов с ПЭ был выше, чем у здоровых беременных женщин, а увеличение NLR было независимо связано с ПЭ после поправки на сопутствующие факторы (19). В другом исследовании определяли уровень NLR до кесарева сечения, но не удалось обнаружить повышенного NLR при ПЭ (18).Впоследствии в нескольких перекрестных исследованиях изучалась взаимосвязь между ПЭ и NLR, и результаты были разными (20–28). Некоторые исследования показали, что NLR был выше при ПЭ, чем у здоровых беременных женщин (20-25,28), в то время как одно исследование не продемонстрировало значительной разницы (27). Кроме того, некоторые исследования показали, что NLR был связан с тяжестью (22-24), исходом (21) и протеинурией (24) ПЭ.
В настоящее время в четырех исследованиях случай-контроль изучалась взаимосвязь между NLR и PE (20,29-31).Два из этих четырех исследований показали, что повышение NLR в первом (30) и втором триместре (31) было фактором риска ПЭ. Но в одном исследовании с большим размером выборки (118 пациенток с ТЭЛА и 1495 нормальных беременных женщин) авторам не удалось обнаружить NLR до того, как двадцатая неделя беременности увеличилась у пациентов с ТЭЛА (20).
Взятые вместе, текущие доказательства относительно NLR и PE несовместимы, и большинство текущих доказательств представляют собой поперечные сечения или дизайн случай-контроль.Следовательно, необходимы проспективные когортные исследования и метаанализы для получения надежных доказательств клинической пользы NLR при ПЭ.
Гемолиз, повышенные ферменты печени, синдром низкого числа тромбоцитов (HELLP)
Синдром
HELPP характеризуется гемолизом, повреждением печени и снижением количества тромбоцитов в третьем триместре беременности (32,33). В настоящее время два исследования из одной группы изучали клиническую полезность NLR при синдроме HELLP (34,35).В исследовании «случай-контроль» автор включил 14 пациентов с синдромом HELLP и 14 нормальных беременных женщин соответствующего возраста и обнаружил, что NLR в третьем триместре значительно увеличился у пациентов с синдромом HELPP (35). Напротив, в поперечном исследовании авторам не удалось доказать, что NLR в третьем триместре увеличивался при ПЭ (34). Учитывая, что размеры выборки в этих двух исследованиях невелики, а сопутствующие факторы не были полностью учтены, необходимы дальнейшие исследования для изучения полезности NLR в управлении синдромом HELLP.
ГДМ
GDM определяется как нарушение метаболизма глюкозы, которое возникает впервые во время беременности, и считается, что воспаление участвует в патогенезе GDM (36). В 2014 году перекрестное исследование с 42 GDM и 68 без GDM показало, что NLR был увеличен у пациентов с GDM, а NLR был независимо связан с GDM в модели многомерной логистической регрессии (37). Однако последующее исследование с большим размером выборки не смогло выявить повышенного NLR при GMD (38).Возможные причины несоответствия в значительной степени неизвестны. В недавно опубликованной работе исследователь включил 114 GDM и 114 хорошо подобранных без GDM и обнаружил, что NLR был увеличен у пациентов с GDM (39). Кроме того, NLR был независимо связан с HbA1c в модели многомерной линейной регрессии (39). Взятые вместе, текущие данные относительно GDM и NLR противоречивы, и необходимы дальнейшие исследования, особенно проспективные когортные исследования, чтобы проиллюстрировать клиническую полезность NLR при GDM.
Внематочная беременность (ВП)
EP — это осложнение беременности, которое определяется как имплантация эмбриона вне полости матки (40). В настоящее время в клинической практике для лечения ВП обычно используются метотрексат (МТ) и хирургическое вмешательство. Метотрексат — это неинвазивный подход к лечению, поэтому акушеры предпочитают его. Однако при выборе метода лечения следует уравновесить пользу и опасность метотрексата. Как правило, метотрексат обычно используется у пациентов со стабильной гемодинамикой, меньшей массой тела беременных, хорионическим гонадотропином человека с более низкой бета-субъединицей (β-ХГЧ), в то время как в остальных случаях используется хирургическое вмешательство.Однако граница между метотрексатом и хирургией не всегда ясна в клинической практике. Для некоторых пациентов выбор тактики лечения действительно является проблемой для акушеров.
В исследовании, опубликованном в 2017 году, исследователи сравнили клинические и лабораторные характеристики пациентов с ВП, получавших метотрексат (n = 93) и хирургическое вмешательство (n = 60) (41). Они обнаружили, что NLR был значительно увеличен у пациентов, перенесших операцию, что указывает на то, что NLR был полезен при выборе лечения EP.Этот вывод был подтвержден в последующем исследовании (42). В исследовании, опубликованном недавно, исследователь обнаружил, что пациенты с ВП с разрывом маточных труб имели более высокий NLR, чем они без (43), также подтверждает, что NLR может помочь акушерам выбрать подход к лечению. Кроме того, в одном исследовании с 78 успешным лечением метотрексатом и 37 пациентами с неудачным лечением метотрексатом более высокий NLR наблюдался у пациентов, успешно прошедших лечение метотрексатом (44), что указывает на то, что NLR является предиктором эффективности лечения метотрексатом.
Hyperemesis gravidarum (HG)
HG — серьезное осложнение, характеризующееся тошнотой и рвотой в первом триместре беременности.Это может привести к обезвоживанию, кетонурии, дисбалансу жидкости и электролитов и потере веса (45). В некоторых исследованиях сравнивали уровень NLR у здоровых беременных женщин и пациентов с HG (46-51), и все они обнаружили, что NLR был увеличен у пациентов с HG. Одно исследование показало, что NLR увеличивается по мере увеличения степени тяжести HG (47), что указывает на то, что NLR является полезным индикатором при оценке тяжести HG. Однако этот результат не был подтвержден в двух других исследованиях (48,51). Примечательно, что все эти исследования носят перекрестный характер, и поэтому причинно-следственная связь не может быть установлена.Необходимы дальнейшие проспективные когортные исследования, чтобы проверить, является ли NLR фактором риска HG.
Преждевременные роды (ПД)
PD, определяемая как роды на сроке до 37 недель беременности, является основной причиной перинатальной заболеваемости и смертности во всем мире. У некоторых беременных женщин при поступлении может возникнуть угроза преждевременных родов, но после лечения токолитиками роды не происходят. Очень важно выявить женщин с TPL, у которых родятся преждевременные роды.В некоторых исследованиях изучалась ценность NLR в прогнозировании БП (52-57). В трех ретроспективных когортных исследованиях (52,55,56) сообщалось, что NLR является фактором риска БП. Однако в двух исследованиях случай-контроль (54,57) авторы сообщили, что NLR не является фактором риска БП. В другом исследовании авторы сообщили, что NLR был выше у пациентов с преждевременным разрывом плодных оболочек и был предиктором неонатального сепсиса (53).
Выводы
На сегодняшний день накоплено множество исследований по изучению клинической применимости NLR в КНР (, таблица 1, ).Однако результаты не всегда были последовательными. Это может быть связано с небольшими размерами выборки и низкой статистической мощностью некоторых исследований. Следовательно, может потребоваться мета-анализ для объединения результатов имеющихся результатов в будущем. Примечательно, что большинство доказательств — это метод случай-контроль или кросс-секционный дизайн, а многофакторный анализ не выполняется в значительной части доступных исследований. Следовательно, для тщательной оценки клинической применимости NLR в PRC необходимы проспективные когортные исследования с большим размером выборки и полностью скорректированным анализом.
Таблица 1 Текущие данные о соотношении нейтрофилов и лимфоцитов и об осложнениях, связанных с беременностью.
Полный стол
Благодарности
Нет.
Конфликт интересов: Авторы не заявляют о конфликте интересов.
Этическое заявление: Авторы несут ответственность за все аспекты работы, гарантируя, что вопросы, связанные с точностью или целостностью любой части работы, должным образом исследованы и решены.
Список литературы
- Бенитес-Сапата В.А., Эрнандес А.В., Нагараджан В. и др. Полезность соотношения нейтрофилов и лимфоцитов в стратификации риска пациентов с тяжелой сердечной недостаточностью. Am J Cardiol 2015; 115: 57-61. [Crossref] [PubMed]
- Хуан Ю.Л., Хань Ц.Дж., Ху Ц.Д. Ширина распределения эритроцитов и соотношение нейтрофилов к лимфоцитам связаны с исходами у взрослых пациентов с субарахноидальным кровотечением, поступивших в отделение интенсивной терапии.Энн Клин Биохим 2017; 54: 696-701. [PubMed]
- Hu ZD, Huang YL, Qin BD, et al. Прогностическое значение соотношения нейтрофилов и лимфоцитов при раке желудка. Энн Транс Мед 2015; 3:50. [PubMed]
- Бхат Т., Тели С., Риджал Дж. И др. Отношение нейтрофилов к лимфоцитам и сердечно-сосудистые заболевания: обзор. Эксперт Rev Cardiovasc Ther 2013; 11: 55-9. [Crossref] [PubMed]
- Galliazzo S, Nigro O, Bert L и др. Прогностическая роль соотношения нейтрофилов и лимфоцитов у пациентов с острой тромбоэмболией легочной артерии: систематический обзор и метаанализ литературы.Intern Emerg Med 2018; 13: 603-8. [Crossref] [PubMed]
- Harmon AC, Cornelius DC, Amaral LM, et al. Роль воспаления в патологии преэклампсии. Clin Sci 2016; 130: 409-19. [Crossref] [PubMed]
- Врахнис Н., Виторатос Н., Илиодромити З. и др. Внутриутробное воспаление и преждевременные роды. Энн Н. И. Акад. Наук 2010; 1205: 118-22. [Crossref] [PubMed]
- Perucci LO, Corrêa MD, Dusse LM, et al. Разрешение путей воспаления при преэклампсии — повествовательный обзор.Immunol Res 2017; 65: 774-89. [Crossref] [PubMed]
- Кара А.Е., Гуней Г., Токмак А. и др. Роль воспалительных маркеров hs-CRP, сиаловой кислоты и IL-6 в патогенезе преэклампсии и задержки внутриутробного развития. Eur Cytokine Netw 2019; 30: 29-33. [PubMed]
- Райо Л., Берсингер Н.А., Малек А. и др. Сверхчувствительный С-реактивный белок при нормальной беременности и при преэклампсии. Журнал Hypertens 2019; 37: 1012-7. [Crossref] [PubMed]
- Haedersdal S, Salvig JD, Aabye M, et al.Маркеры воспаления во втором триместре до клинического проявления преэклампсии, ограничения внутриутробного роста и спонтанных преждевременных родов. Воспаление 2013; 36: 907-13. [Crossref] [PubMed]
- Сибай Б., Деккер Г., Купферминц М. Преэклампсия. Ланцет 2005; 365: 785-99. [Crossref] [PubMed]
- Сяо Дж., Шен Ф., Сюэ Ц. и др. Является ли этническая принадлежность фактором риска развития преэклампсии? Анализ распространенности преэклампсии в Китае.J Hum Hypertens 2014; 28: 694-8. [Crossref] [PubMed]
- Резенде КБ, Борниа Р.Г., Эстевес А.П. и др. Преэклампсия: распространенность и перинатальные последствия в университетской больнице в Рио-де-Жанейро, Бразилия. Гипертоническая беременность 2016; 6: 253-5. [Crossref] [PubMed]
- Khader YS, Batieha A, Al-njadat RA, et al. Преэклампсия в Иордании: заболеваемость, факторы риска и связанные с ней исходы для матери и новорожденного. J Matern Fetal Neonatal Med 2018; 31: 770-6.[Crossref] [PubMed]
- Аггарвал Р., Джайн А. К., Миттал П. и др. Ассоциация про- и противовоспалительных цитокинов при преэклампсии. J Clin Lab Anal 2019; 33: e22834. [Crossref] [PubMed]
- Wu LZ, Сяо XM. Оценка эффектов экстракта алкалоида Uncaria rhynchophylla на симптомы преэклампсии и воспаление, вызванные LPS, на модели беременных крыс. Braz J Med Biol Res 2019; 52: e8273. [Crossref] [PubMed]
- Yavuzcan A, Cağlar M, Ustün Y, et al.Средний объем тромбоцитов, соотношение нейтрофилов и лимфоцитов и соотношение тромбоцитов и лимфоцитов при тяжелой преэклампсии. Гинеколь Пол 2014; 85: 197-203. [Crossref] [PubMed]
- Ойлумлу М., Озлер А., Йылдыз А. и др. Новые воспалительные маркеры при преэклампсии: эхокардиографическая толщина эпикардиального жира и соотношение нейтрофилов к лимфоцитам. Clin Exp Hypertens 2014; 36: 503-7. [Crossref] [PubMed]
- Mannaerts D, Heyvaert S, De Cordt C, et al. Являются ли соотношение нейтрофилы / лимфоциты (NLR), соотношение тромбоцитов / лимфоцитов (PLR) и / или средний объем тромбоцитов (MPV) клинически полезными в качестве прогностических параметров преэклампсии? J Matern Fetal Neonatal Med 2019; 32: 1412-9.[Crossref] [PubMed]
- Wang J, Zhu QW, Cheng XY и др. Оценка эффективности соотношения нейтрофилов-лимфоцитов и моноцитов-лимфоцитов при преэклампсии. Журнал Репрод Иммунол 2019; 132: 29-34. [Crossref] [PubMed]
- Sitotaw C, Asrie F, Melku M. Оценка параметров тромбоцитов и лейкоцитов среди беременных с преэклампсией в Гондэре, Северо-Западная Эфиопия: сравнительное поперечное исследование. Гипертоническая беременность 2018; 13: 242-7. [Crossref] [PubMed]
- Cakmak HA, Dincgez Cakmak B, Abide Yayla C, et al.Оценка взаимосвязи между новыми воспалительными маркерами и наличием и тяжестью преэклампсии: толщина эпикардиального жира, пентраксин-3 и соотношение нейтрофилов к лимфоцитам. Гипертоническая беременность 2017; 36: 233-9. [Crossref] [PubMed]
- Серин С., Авджи Ф, Эркан О. и др. Является ли соотношение нейтрофилы / лимфоциты полезным маркером для прогнозирования тяжести преэклампсии? Гипертоническая беременность 2016; 6: 22-5. [Crossref] [PubMed]
- Куртоглу Э., Кокчу А., Челик Х. и др.Может ли соотношение нейтрофилов и лимфоцитов быть полезным для прогнозирования риска развития преэклампсии? Пилотное исследование. J Matern Fetal Neonatal Med 2015; 28: 97-9. [Crossref] [PubMed]
- Гогои П., Синха П., Гупта Б. и др. Отношение нейтрофилов к лимфоцитам и индексы тромбоцитов при преэклампсии. Int J Gynaecol Obstet 2019; 144: 16-20. [Crossref] [PubMed]
- Yücel B, Ustun B. Отношение нейтрофилов к лимфоцитам, соотношение тромбоцитов к лимфоцитам, средний объем тромбоцитов, ширина распределения эритроцитов и тромбоцит при преэклампсии.Гипертоническая беременность 2017; 7: 29-32. [Crossref] [PubMed]
- Jeon Y, Lee WI, Kang SY, et al. Модифицированные показатели общего анализа крови как прогнозирующие маркеры преэклампсии от гестационной гипертензии: отношение нейтрофилов к лимфоцитам, соотношение тромбоцитов к лимфоцитам и. Clin Lab 2017; 63: 1897-902. [Crossref] [PubMed]
- Örgül G, Aydın Haklı D, Özten G, et al. Показатели полных клеток крови в первом триместре при преэклампсии с ранним и поздним началом. Turk J Obstet Gynecol 2019; 16: 112-7.[Crossref] [PubMed]
- Gezer C, Ekin A, Ertas IE, et al. Высокое соотношение нейтрофилов к лимфоцитам и тромбоцитов к лимфоцитам в первом триместре беременности является показателем ранней диагностики преэклампсии. Гинеколь Пол 2016; 87: 431-5. [Crossref] [PubMed]
- Панвар М., Кумари А., Н. П. А и др. Повышенное соотношение нейтрофильных лимфоцитов и уровень бета-ХГЧ в сыворотке в начале второго триместра беременности как предикторы развития и тяжести преэклампсии. Drug Discov Ther 2019; 13: 34-7.[Crossref] [PubMed]
- Dusse LM, Alpoim PN, Silva JT, et al. Возвращаясь к синдрому HELLP. Clin Chim Acta 2015; 451: 117-20. [Crossref] [PubMed]
- Алоизос С., Серетис С., Лиакос Н. и др. Синдром HELLP: понимание и лечение специфического для беременности заболевания. Журнал J Obstet Gynaecol 2013; 33: 331-7. [Crossref] [PubMed]
- Sisti G, Faraci A, Silva J, et al. Отношение нейтрофилов к лимфоцитам, соотношение тромбоцитов к лимфоцитам и рутинные компоненты полного анализа крови при синдроме HELLP: согласованное исследование случай-контроль.Медицина (Каунас) 2019; 55: 123. [Crossref] [PubMed]
- Sisti G, Faraci A, Silva J, et al. Отношение нейтрофилов к лимфоцитам, соотношение тромбоцитов к лимфоцитам и компоненты полного анализа крови в первом триместре не позволяют прогнозировать синдром HELLP. Медицина (Каунас) 2019; 55: 219. [Crossref] [PubMed]
- Леква Т., Норвиц Э.Р., Аукруст П. и др. Влияние системного воспаления на прогрессирование гестационного сахарного диабета. Curr Diab Rep 2016; 16:26.[Crossref] [PubMed]
- Yilmaz H, Celik HT, Namuslu M, et al. Преимущества соотношения нейтрофилов к лимфоцитам для прогнозирования гестационного сахарного диабета у беременных. Exp Clin Endocrinol Diabetes 2014; 122: 39-43. [Crossref] [PubMed]
- Саргин М.А., Ясса М., Таймур Б.Д. и др. Отношение нейтрофилов к лимфоцитам и тромбоцитов к лимфоцитам: полезны ли они для прогнозирования гестационного сахарного диабета во время беременности? Ther Clin Risk Manag 2016; 12: 657-65.[Crossref] [PubMed]
- Басу Дж., Датта С., Чоудхури С. и др. Гестационный сахарный диабет в больнице третичного уровня Калькутты, Индия: распространенность, патогенез и потенциальные биомаркеры заболевания. Exp Clin Endocrinol Diabetes 2018. [Epub перед печатью].
- Shaw JL, Diamandis EP, Horne AW, et al. Внематочная беременность. Clin Chem 2012; 58: 1278-85. [Crossref] [PubMed]
- Аккая Х., Уйсал Г. Могут ли гематологические параметры предсказать лечение внематочной беременности? Пак Ж. Медицина, 2017; 33: 937-42.[Crossref] [PubMed]
- Kanmaz AG, İnan AH, Beyan E, et al. Роль различных параметров общего анализа крови в прогнозировании успеха однократной дозы метотрексата при лечении внематочной беременности. Пак Ж. Медицина, 2018; 34: 1132-6. [Crossref] [PubMed]
- Кан О, Gemici A, Alkilic A и др. Влияние предоперационного соотношения нейтрофилов и лимфоцитов и соотношения тромбоцитов и лимфоцитов на прогнозирование риска разрыва при трубной внематочной беременности. Gynecol Obstet Invest 2019; 84: 378-82.[Crossref] [PubMed]
- Cekmez Y, Göçmen A, Sanlιkan F, et al. Роль среднего объема тромбоцитов и соотношения нейтрофилов / лимфоцитов в прогнозировании успеха лечения однократной дозой метотрексата при трубной внематочной беременности. Clin Exp Obstet Gynecol 2016; 43: 509-11. [PubMed]
- Остин К., Уилсон К., Саха С. Hyperemesis Gravidarum. Нутр Клин Практ 2019; 34: 226-41. [Crossref] [PubMed]
- Чаглаян Э.К., Энгин-Устун Ю., Гокмен А.Ю. и др.Есть ли какая-либо связь между уровнем сиртуина-1 в сыворотке и соотношением нейтрофилов и лимфоцитов при гиперемезисе беременных? Журнал Perinat Med 2016; 44: 315-20. [Crossref] [PubMed]
- Курт Р.К., Гюлер А., Зильфелер ДБ и др. Связь маркеров воспаления с наличием и тяжестью гиперемезиса беременных. Гинеколь Пол 2014; 85: 589-93. [Crossref] [PubMed]
- Тайфур С., Бурку, округ Колумбия, Гултен О. и др. Связь между соотношением тромбоцитов и лимфоцитов, тромбоцитом и наличием и тяжестью гиперемезиса беременных.Журнал J Obstet Gynaecol Res 2017; 43: 498-504. [Crossref] [PubMed]
- intesun E, Akar S, Gul A, et al. Маркеры субклинического воспаления при гиперемезисе беременных и кетонурии: исследование случай-контроль. Врачи J Lab 2019; 11: 149. [Crossref] [PubMed]
- Beyazit F, Öztürk FH, Pek E, et al. Оценка гематологической системы как маркера субклинического воспаления при гиперемезисе беременных: исследование случай-контроль. Гинеколь Пол 2017; 88: 315-9. [Crossref] [PubMed]
- Кан Э., Эмектар Э., Корбачоглу К. и др.Оценка взаимосвязи между маркерами воспаления и гиперемезисом беременных у пациентов, поступивших в отделение неотложной помощи. Am J Emerg Med 2019. [Epub перед печатью]. [Crossref] [PubMed]
- Ким М.А., Ли Б.С., Пак Ю.В. и др. Сывороточные маркеры для прогнозирования спонтанных преждевременных родов при преждевременных родах. Eur J Clin Invest 2011; 41: 773-80. [Crossref] [PubMed]
- Озель А, Алиджи Давутоглу Э, Юрткал А и др. Как изменяется соотношение тромбоцитов к лимфоцитам и нейтрофилов к лимфоцитам у женщин с преждевременным разрывом плодных оболочек и угрожает преждевременным родам? J Obstet Gynaecol 2019.1-5. [Epub перед печатью]. [Crossref] [PubMed]
- Даглар Х.К., Кирбас А., Кая Б. и др. Значение показателей общего анализа крови в прогнозировании преждевременных родов. Eur Rev Med Pharmacol Sci 2016; 20: 801-5. [PubMed]
- Bozoklu Akkar O, Sancakdar E, Karakus S, et al. Оценка материнской сыворотки 25-гидроксивитамина D, уровней параоксоназы 1 и отношения нейтрофилов к лимфоцитам при спонтанных преждевременных родах. Med Sci Monit 2016; 22: 1238-43. [Crossref] [PubMed]
- Гезер С., Экин А., Солмаз У и др.Выявление преждевременных родов у женщин с угрозой преждевременных родов на сроке от 34 до 37 недель беременности. Журнал J Obstet Gynaecol 2018; 38: 652-7. [Crossref] [PubMed]
- Isık H, Aynıoglu O, Sahbaz A, et al. Может ли тромбоцит, заниженный параметр тромбоцитов, быть связан с преждевременными родами? Журнал J Obstet Gynaecol 2015; 35: 676-80. [Crossref] [PubMed]
doi: 10.21037 / jlpm.2019.10.03
Цитируйте эту статью как: Hai L, Hu ZD. Клиническая ценность соотношения нейтрофилов и лимфоцитов при осложнениях, связанных с беременностью: мини-обзор.J Lab Precis Med 2020; 5: 1.
Границы | Т-клетки памяти при беременности
Введение
Иммунная толерантность к отцовско-плодному антигену имеет решающее значение для репродуктивного успеха, поскольку дисфункциональная толерантность вовлечена в патофизиологию таких осложнений беременности, как бесплодие, повторный выкидыш, задержка роста плода, спонтанные преждевременные роды и преэклампсия (1–4). Во время репродукции материнская иммунная система подвергается воздействию отцовско-плодных антигенов (рис. 1).Во-первых, мужской антиген попадает в иммунную систему матери через сперму еще до беременности (5). Во-вторых, отцовско-плодные антигены экспонируются на границе плод-мать во время беременности, поскольку материнские иммунные клетки в крови находятся в прямом контакте с клетками трофобласта плода в плаценте (6, 7). Кроме того, во время беременности происходит перенос фетальных клеток, экспрессирующих отцовско-плодные антигены, в ткани матери на низких уровнях, которые могут рециркулировать в материнской крови в течение многих лет после беременности (8, 9).Это явление называется микрохимеризмом (8, 9). Было показано, что воздействие на материнскую иммунную систему отцовско-плодных антигенов индуцирует популяцию Т-клеток памяти со специфичностью к отцовско-плодному антигену (10–12).
Рисунок 1 . Гипотеза о генерации популяции Т-клеток памяти при репродукции через экспозицию отцовско-фетального антигена. Во-первых, наивные Т-клетки подвергаются воздействию мужского антигена через антигены в семенной жидкости. Последующий контакт с антигенами происходит во время беременности в результате воздействия антигенов плода на клетки трофобласта и посредством микрохимеризма.В послеродовом периоде материнская иммунная система остается подверженной воздействию антигенов плода через микрохимеризм. Кроме того, в послеродовом периоде Т-клетки памяти, возможно, подвергаются воздействию отцовских антигенов через воздействие семенной жидкости. При последующей беременности Т-клетки материнской памяти, вероятно, повторно накапливаются и реагируют на родственные отцовско-плодные антигены.
Популяция лимфоцитов памяти состоит из Т-лимфоцитов памяти (Т-лимфоцитов) и В-лимфоцитов памяти (В-клетки) (13, 14). Т-клетки памяти являются наиболее изученными и, по-видимому, являются наиболее важной популяцией клеток памяти при воспроизводстве.Клетки памяти позволяют иммунной системе эффективно защищать организм от патогенов, генерируя более адекватный иммунный ответ на известный антиген, что делает ненужным вызывать новый ответ на антиген, который встречался ранее (15). Этот процесс составляет основу вакцинации, которая широко используется для предотвращения инфекционных заболеваний, а в последнее время — для борьбы с раком и аутоиммунными заболеваниями (16–18). В целом, более агрессивный иммунный ответ на патогены защищает здоровье, поскольку патоген выводится быстрее, однако такой же агрессивный ответ на отцовские или фетальные антигены будет иметь катастрофические последствия для здоровья плода и матери.Действительно, большинство исследований популяций Т-клеток памяти при репродукции показали, что субпопуляции Т-клеток памяти могут проявлять другую функцию, характер пролиферации и миграционные способности по отношению к отцовским антигенам при здоровой беременности по сравнению с их функцией, пролиферацией и миграционными способностями по отношению к другим антигенам (12, 19, 20). Фактически, было показано, что специфические популяции клеток памяти участвуют в создании иммунной толерантности, а не иммунного отторжения по отношению к отцовско-плодным антигенам (12, 21–23).
В последние годы было выявлено значение и значимость Т-клеток памяти при беременности и ее осложнениях. Основные концептуальные прорывы были замечены в области Т-клеток, показав роль Т-клеток памяти в репродуктивной способности в исследованиях на мышах (11, 12, 21). Поскольку публикуется все больше исследований Т-клеток памяти на людях, в этом обзоре представлен обзор современной литературы о различных подтипах Т-клеток памяти и их адаптации во время беременности, а также о влиянии Т-клеток памяти на различные осложнения беременности.В основном мы сосредоточимся на исследованиях на людях и при необходимости обратимся к исследованиям на мышах. Также будут обсуждаться текущие пробелы в исследованиях, противоречия и возможные терапевтические цели.
Т-клетки памяти
Популяция Т-клеток памяти формируется во время первичного антигенного ответа (24). При первичном ответе антигены представляются Т-клеткам через молекулы главного комплекса гистосовместимости (MHC) (25). В зависимости от типа молекулы MHC, либо тип I, либо тип II, CD8-положительные или CD4-положительные Т-клетки соответственно активируются через рецептор Т-клеток (TCR) на клеточной мембране (25).Дополнительные костимулирующие молекулы могут соединяться с костимулирующими рецепторами Т-клеток, такими как CD28 и CD70, для дополнительной индукции Т-клеточного ответа (25, 26). В зависимости от цитокиновой среды клетки CD4 + дифференцируются либо в разные подмножества Т-хелперов (Th) (Th2, Th3 и Th27), которые помогают в индукции / активации иммунных ответов посредством секреции цитокинов, либо в Т-регуляторные (Treg) клетки. которые после активации оказывают регулирующее действие на другие иммунные клетки (27).После первичного ответа большинство клеток CD4 + погибает, но некоторые клетки CD4 + дифференцируются в Т-клетки памяти CD4 + (24, 28). Клетки CD8 + также дифференцируются в разные субпопуляции; т.е. эффекторные клетки CD8 + , которые готовы высвобождать цитотоксические цитокины или индуцировать апоптоз посредством взаимодействия на клеточной поверхности, и небольшая популяция регуляторных клеток CD8 + , которые обладают функцией регуляции иммунитета (29). После уничтожения патогена большинство клеток CD8 + погибает, однако некоторые из них пролиферируют в клетки памяти CD8 + (29).
Известно несколько подмножеств Т-клеток памяти, которые можно различить по различным маркерам (Таблицы 1, 2). Основными маркерами являются экспрессия CD45RO и отсутствие экспрессии CD45RA (52, 53). Фенотип CD45RO + CD45RA — был связан с долгоживущими Т-клетками памяти (52, 53). Следует отметить, что экспрессия CD45RO и отсутствие экспрессии CD45RA не являются окончательными маркерами для Т-клеток памяти, поскольку их экспрессия не предсказывает долгую выживаемость и быструю эффекторную функцию при вторичном воздействии per se (54).Кроме того, было показано, что Т-клетки CD45RO + могут быть перепрограммированы и вернуться к наивному фенотипу CD45RO — (55, 56). Пока нет других надежных маркеров фенотипа Т-клеток памяти в клинических экспериментах, поэтому широко используется фенотипическая характеристика популяции клеток памяти по экспрессии CD45RO. Память Клетки CD4 + и CD8 + можно разделить на подмножества на основе их характера миграции, способности секреции цитокинов и профиля экспрессии белка.Подмножества ячеек основной памяти — это клетки центральной памяти (CM) и клетки эффекторной памяти (EM), хотя количество подмножеств быстро увеличивается (Таблицы 1, 2). Подмножество клеток CM дифференцируется в эффекторные клетки при вторичном воздействии антигена и характеризуется экспрессией CCR7, которая делает их домом для вторичных лимфоидных органов (53, 57). Подмножество ЕМ клеток характеризуется их присутствием в периферической ткани и непосредственной провоспалительной эффекторной функцией при встрече вторичного антигена с родственным антигеном (53).Ниже приводится обзор современных знаний о различных подмножествах Т-клеток памяти во время беременности (дополнительные материалы).
Таблица 1 . CD4 + Т-лимфоцитов памяти при беременности.
Таблица 2 . CD8 + Т-клетки памяти при беременности.
CD4
+ Ячейки памяти при беременности
Внутри популяции клеток памяти CD4 + подразделение было сделано на основе паттерна миграции и эффекторной функции; я.е., CD4 + клеток эффекторной памяти (CD4 + EM), CD4 + клеток центральной памяти (CD4 + CM), CD4 + клеток резидентной памяти ткани (CD4 + TRM), CD4 + T фолликулярных хелперных клеток памяти (CD4 + FHM), регуляторных клеток памяти CD4 + и стволовых клеток памяти CD4 + (58–65).
Уже много лет известно, что беременность и некоторые ее осложнения влияют на общую популяцию Т-клеток памяти CD4 + .В 1996 году было показано, что общие пропорции клеток памяти CD4 + (CD4 + CD45RO + ) в периферической крови были ниже со второго триместра и далее до 2-7 дней после родов по сравнению с пропорциями в небеременной контрольной группе ( 66). Эти результаты были подкреплены исследованиями преэклампсии (67–69), гестационного диабета (70) и преждевременных родов (71), в которых были обнаружены более высокие доли общих Т-клеток памяти в периферической крови по сравнению со здоровыми беременными контрольными.Ранние исследования также показали, что клетки памяти CD4 + , CD45RO + находятся в децидуальной оболочке, и показали, что экспрессия CD45RO на клетках CD4 + повышена в децидуальной оболочке по сравнению с клетками CD4 + в периферической крови (72, 73). Позже Гомес-Лопес и др. предположили роль клеток памяти CD4 + в доношенных родах у человека, продемонстрировав увеличение количества клеток памяти CD4 + (CD4 + CD45RO + ) с использованием иммуногистохимии на хориодецидуальной ткани у женщин, находящихся в спонтанных родах в срок, по сравнению с женщинами при сроке планового кесарева сечения (74).Ранние данные уже показали, что на Т-клетки памяти влияет беременность и ее осложнения. В последние годы исследования были сосредоточены на конкретных подмножествах клеток памяти CD4 + . Эти данные рассматриваются ниже для каждой подгруппы Т-клеток памяти.
CD4
+ эффекторных клеток памяти при беременности
Эффекторные клетки
Th2, Th3 и, возможно, Th27 могут дифференцироваться в клетки CD4 + EM (75–77). Характеристика клеток CD4 + EM основана на отсутствии экспрессии рецепторов хоминга лимфатических узлов CC-Chemokine рецептор-7 (CCR7) и CD62L (L-селектин), что позволяет им мигрировать в периферические ткани (59).ЭМ-клетки — это клетки памяти с самым быстрым иммунным ответом на вторичный контакт. В течение нескольких часов после повторной стимуляции запомненным антигеном клетки CD4 + EM продуцируют различные цитокины, такие как интерферон-гамма (IFN-гамма), фактор некроза опухоли (TNF), интерлейкин-4 (IL4) и IL5 ( 53, 77, 78). Специфический подтип клеток CD4 + EM может повторно экспрессировать CD45RA после стимуляции антигеном (TEMRA) (79). Эти клетки плохо изучены, и насколько нам известно, нет опубликованных исследований воспроизводства клеток CD4 + TEMRA.
Во втором и третьем триместрах беременности два исследования показали более высокие доли CD4 + ЕМ клеток (CD45RA — CCR7 — и CD45RO + CCR7 — ) в периферической крови по сравнению с пропорциями этих клеток. у небеременных женщин (23, 30), в то время как другое исследование показало снижение количества CD4 + ЕМ-клеток в периферической крови во время беременности (34). Различия между исследованиями могут быть связаны с тем, что гормональные колебания во время менструального цикла не были приняты во внимание в последнем исследовании.Мало того, что доля клеток CD4 + EM увеличивается во время беременности, эти клетки также демонстрируют повышенную экспрессию CD69 (30), а также снижение экспрессии запрограммированной смерти-1 (PD-1) (23). Это говорит о том, что происходит повышенная активация ЕМ-клеток CD4 + и что эти клетки менее восприимчивы к апоптозу. Увеличение количества ЕМ клеток CD4 + наблюдается не только во время беременности, но и спустя годы, когда пропорции ЕМ клеток CD4 + оставались увеличенными, т.е.е., на уровне гестации по сравнению с никогда не беременными женщинами (30). Эти клетки также показали повышенную экспрессию CD69 после беременности, что может указывать на стойкую активацию в результате воздействия антигена. Это может быть связано с микрохимеризмом, хотя еще предстоит исследовать, связано ли увеличение доли ЭМ-клеток с увеличением количества клеток, специфичных для отцовско-плодных антигенов.
В то время как в крови доля ЕМ клеток CD4 + от общей популяции клеток CD4 + составляла около 20–30% (19, 30, 31), локально в децидуальной оболочке доля CD4 + ЭМ-клеток (CD45RA — , CCR7 — ) было выше: 50–60% от общей популяции клеток CD4 + составляли ЭМ-клетки (19, 31).Это может указывать на накопление ЕМ клеток CD4 + в децидуальной оболочке, хотя это также может быть связано просто с тем фактом, что наивные Т-клетки не накапливаются в периферической ткани (80). Важным для функции Т-клеток памяти является экспрессия костимулирующих молекул, таких как CD28 (81). Такие молекулы важны для ответа Т-клеток памяти (82). Интересно, что в популяции ЕМ клеток CD4 + в децидуальной оболочке доля подмножества ЕМ, не экспрессирующих костимулирующие молекулы, сильно увеличена по сравнению с периферической кровью (19), что позволяет предположить, что клетки ЕМ CD4 + в децидуальной оболочке может быть не в состоянии вызвать вторичный ответ, сравнимый с CD4 + ЕМ-клетками в периферической крови.Несмотря на это, повышенная экспрессия IFN-гамма и IL4 была обнаружена в децидуальных клетках CD4 + EM по сравнению с клетками CD4 + EM в периферической крови in vitro после стимуляции митогеном (19). Это может быть связано с высокими локальными концентрациями прогестерона на границе раздела плода и матери (19). Децидуальные ЭМ-клетки были способны не только отвечать на стимуляцию митогеном, но также и на фетальные антигены (19). Тот факт, что децидуальные ЭМ клетки способны реагировать на фетальные антигены и другие стимулы, предполагает, что существуют внешние или внутренние механизмы на стыке плода и матери для подавления этих клеток.Одним из таких механизмов может быть присутствие Treg-клеток (83, 84). Другим механизмом может быть экспрессия рецепторов иммунных ингибиторов контрольных точек на децидуальных CD4 + ЕМ клетках (19). Активация этих рецепторов подавляет иммунные ответы, чтобы избежать аутоиммунитета и хронического воспаления (85). Повышенная экспрессия рецепторов иммунной ингибиторной контрольной точки PD-1, Т-клеточного иммуноглобулина и муцинового домена 3 (Tim-3), цитотоксического антигена Т-лимфоцитов 4 (CTLA-4) и гена активации лимфоцитов 3 (LAG-3) на CD4 Было обнаружено + ЭМ клеток в децидуальной оболочке по сравнению с периферической кровью (19).Эти результаты согласуются с данными Wang et al. которые показали, что большинство клеток CD4 + EM (CD44 + CD62L —) в децидуальной ткани первого триместра от здоровых прерванных беременностей человека экспрессировали Tim-3 и PD-1 (86). Роль таких рецепторов иммунных ингибиторов контрольной точки при беременности была показана в исследованиях на мышах (86). Блокирование пути Tim-3 и PD-1 (не конкретно на CD4 + EM-клетках) у здоровых беременных мышей показало, что более низкая экспрессия Tim-3 и PD-1 увеличивает скорость резорбции плода (86).Эти исследования предлагают регуляторную функцию для ЕМ клеток CD4 + локально, которая может быть благоприятной для иммунной толерантности плода и матери и предотвратить потерю беременности.
Текущие данные по ЕМ-клеткам CD4 + у женщин с неосложненным исходом беременности показывают, что во время беременности ЕМ-клетки CD4 + могут накапливаться в децидуальной оболочке и оставаться на более высоких уровнях и более активированных пропорциях в периферической крови после родов (30). Кроме того, популяция ЕМ клеток CD4 + в децидуальной оболочке имеет другой фенотип с повышенной экспрессией IFN-гамма, однако популяция ЕМ клеток CD4 + также имеет повышенную экспрессию иммунных ингибирующих белков по сравнению с периферической кровью (19).Чтобы понять значимость и функцию ЕМ клеток CD4 + в толерантности плода и матери и их роль в послеродовом периоде, дальнейшие исследования должны быть сосредоточены на их общей и, более конкретно, на их антигенспецифической функции, поскольку ни одно из исследований не показало наличие антигена. специфической индукции толерантности клетками CD4 + EM пока нет.
К сожалению, до сих пор ЕМ клетки CD4 + практически не изучались при осложнениях беременности. ЕМ клетки CD4 + изучали при преэклампсии Loewendorf et al.кто выполнил проточно-цитометрический анализ периферической крови и мазка из внутриматочной полости во время кесарева сечения (32). Они не обнаружили различий в уровнях CD4 + EM-клеток у здоровых и преэкламптических женщин в периферической крови или в лимфоцитах, выделенных из внутриматочного мазка (32). Однако, поскольку конкретная ткань происхождения клеток из мазка не может быть определена, следует проявлять осторожность при интерпретации этих результатов. У небеременных женщин, страдающих рецидивирующими самопроизвольными выкидышами, в периферической крови наблюдались более высокие доли ЭМ-клеток по сравнению с небеременными фертильными контрольными женщинами (33).Это исследование не уточняло далее статус или фенотип CD4 + или CD8 + . Учитывая предполагаемую значимость ЕМ-клеток CD4 + для толерантности плода и матери, было бы очень полезно получить знания о ЕМ-клетках CD4 + при осложнениях беременности.
CD4
+ клеток центральной памяти при беременности
CD4 + CM-клетки циркулируют в крови и являются домом для лимфатических узлов благодаря экспрессии рецепторов нахождения в лимфатических узлах CCR7 и CD62L (57-59).CD4 + CM-клетки секретируют IL2 и очень низкие уровни цитокинов эффекторных клеток (28, 53). При вторичном воздействии антигена или спонтанно, в присутствии или в отсутствие поляризующих цитокинов, клетки CD4 + CM дифференцируются в клетки Th2, Th3 и CD4 + EM и продуцируют эффекторные цитокины, такие как IFN-гамма и IL4 (53, 87–89). Кроме того, клетки CM могут быстро вызывать рост популяции антигенспецифических Т-клеток (89).
Во время беременности, что касается CD4 + EM-клеток, CD4 + CM-клетки изучаются в основном в циркулирующей крови и в меньшей степени на границе раздела плод-мать.Одно исследование изучало CM-клетки CD4 + (CD45RA — CCR7 + ) в децидуальной ткани в конце беременности и показало, что пропорции CM-клеток CD4 + были выше по сравнению с периферической кровью небеременных женщин. (31). Другое исследование оценивало децидуальную ткань первого триместра от прерывистой здоровой беременности и показало, что около 40% CM-клеток CD4 + (CD44 + CD62L + ) были Tim-3 + и PD-1 + ( 86).Это, по-видимому, подмножество ЕМ-клеток CD4 + , которые обладают сильной подавляющей способностью к пролиферации и предпочтительно продуцируют цитокины типа Th3 (86). Поскольку блокирование PD-1 и Tim-3 при беременности у мышей вызвало потерю плода (86), клетки Tim-3 + PD-1 + CD4 + EM могут быть важны для поддержания нормальной беременности.
В ряде исследований во время беременности было обнаружено, что доли клеток CD4 + CM (CD45RA — CCR7 + ) в периферической крови сопоставимы между женщинами во втором или третьем триместре беременности и у здоровых небеременных женщин. (23, 30, 34).Однако, похоже, что после беременности пропорции СМ-клеток CD4 + в периферической крови увеличиваются, поскольку СМ-клетки CD4 + были выше у женщин после беременности по сравнению с беременными женщинами и по сравнению с женщинами, которые никогда не были беременными (30). . Активируются ли CM-клетки CD4 + в кровотоке беременных женщин, еще предстоит установить, поскольку экспрессия маркера активации CD69 была выше во время беременности по сравнению с небеременными женщинами (30), тогда как экспрессия маркеров активации HLA -DR и CD38 не были затронуты в популяции CM-клеток CD4 + (CCR7 + CD45RO + ) в периферической крови беременных женщин в 3-м триместре по сравнению с небеременными женщинами (34).Эта более высокая доля CD69 + CM-клеток CD4 + во время беременности оставалась высокой у женщин после беременности по сравнению с женщинами, которые никогда не были беременными (30).
На сегодняшний день клетки CD4 + CM исследуются при двух осложнениях беременности: преэклампсии и выкидышах. При преэклампсии несколько, но значительно более высокие доли CD4 + CM-клеток (CD45RO + CCR7 + ) были обнаружены в периферической крови преэклампсических женщин по сравнению со здоровыми беременными (32).Доля клеток CD4 + CM, выделенных из мазка из внутриматочной полости во время кесарева сечения, не показала различий между преэклампсией и здоровыми беременными женщинами (32). В этом исследовании также анализировалась экспрессия костимулирующих молекул CD28, CD27 и рецептора выживания CD127 (альфа-цепь рецептора IL7) на клетках CD4 + CM (32). Было обнаружено только различие в экспрессии CD28: во внутриматочном мазке от женщин с преэклампсией CD4 + CM-клетки экспрессировали более низкие уровни CD28 по сравнению со здоровыми беременными женщинами (32).В периферической крови такой разницы не наблюдалось (32). У женщин, страдающих рецидивирующими самопроизвольными выкидышами, в периферической крови были обнаружены более высокие уровни CM-клеток (CD45RO + CD62L + ) по сравнению с фертильными женщинами (33). Не уточняется, принадлежали ли эти клетки CM к линии CD4 + или CD8 + . Частично это увеличение, вероятно, связано с CD4 + CM-клетками, поскольку в другом исследовании сообщалось о более высоких уровнях CD4 + CM-клеток (CD4 + CD45RA — CCR7 + ) в периферической крови у женщин, страдающих рецидивирующим заболеванием. выкидыши по сравнению с женщинами с доказанной фертильностью и женщинами без предыдущей беременности (35).
Как указано выше, экспрессия Tim-3 и PD-1 в клетках памяти может быть важна для здоровой беременности. Это предположение согласуется с обнаружением уменьшенных пропорций клеток Tim-3 + PD-1 + CD4 + в децидуальной оболочке у пациентов, перенесших выкидыш (86). К сожалению, эти клетки CD4 + не были окрашены на маркеры клеток памяти. Необходимы дальнейшие исследования клеток CD4 + CM при осложнениях беременности в крови и на границе плода и матери, чтобы показать, что эти клетки могут играть роль в физиологии беременности и патофизиологии осложнений.
CD4
+ Регуляторные клетки памяти при беременности
Treg-клетки обладают мощными иммунодепрессивными свойствами. Они продуцируют IL10 и трансформирующий фактор роста бета (TGFB) и обладают способностью подавлять CD4 + , CD8 + , пролиферацию B-клеток и секрецию цитокинов, а также ингибирующие эффекты на дендритные клетки и макрофаги (90–93) . Долгое время считалось, что Treg-клетки не переживают фазу сокращения иммунного ответа и претерпевают апоптотическую гибель клеток (64).Тем не менее, в настоящее время показано, что долгоживущий субнабор Treg-клеток памяти сохраняется после воздействия антигена (12, 64, 94, 95). Появляется все больше доказательств того, что Treg-клетки памяти регулируют иммунный ответ EM при вторичном контакте с запомненным антигеном (64). Функция памяти Treg участвует во многих различных патологических и физиологических контекстах, таких как аутоиммунные заболевания (96), респираторные расстройства (97), гепатит (98) и беременность (12). Клетки памяти Treg сложно изучать, поскольку не известны убедительные маркеры долгоживущей популяции Treg-клеток (64).Таким образом, идентификация пула ячеек памяти Treg выполняется путем объединения маркеров ячеек Treg, таких как [forkhead box p3 (Foxp3 + ), CD25 + и CD127 — (99)] с маркерами ячеек памяти [как CD45RO + и CD45RA — (52, 53)] (64).
На моделях грызунов было показано, что Treg-клетки со специфичностью фетального антигена и фенотипом памяти накапливаются во время беременности и влияют на репродуктивный успех при последующих беременностях (12, 39, 40). Rowe et al.разработали мышиную модель, которая продемонстрировала увеличение фетальных антиген-специфических клеток памяти Treg в середине беременности при первых беременностях, которые оставались на более низких уровнях после родов (12). Популяция клеток памяти Treg значительно увеличилась с ускоренной кинетикой при следующей беременности по сравнению с первой беременностью (12). Это увеличение привело к снижению скорости резорбции по сравнению с мышами, у которых была удалена Treg-клетка памяти (12). Фетальные антиген-специфические Treg-клетки памяти, как показано Rowe et al.кажутся важными в середине беременности, и предполагается, что они могут быть особенно ценными при последующих беременностях для установления границ вторичного ответа ЭМ-клеток на отцовско-плодные антигены (12). Chen et al. показали, что на ранних сроках беременности у мышей (во время имплантации) аутоантиген-специфические Treg-клетки памяти, а не фетальные антиген-специфические Treg-клетки памяти, рекрутируются в репродуктивный тракт и создают толерантную среду для имплантации бластоцисты (39).
Подобно исследованиям на мышах, на ранних сроках беременности материнская иммунная толерантность плода, вероятно, не управляется исключительно Treg-клетками памяти, поскольку более высокие наивные субпопуляции Treg-клеток были связаны с успешным лечением оплодотворения (ЭКО) / интрацитоплазматической инъекции сперматозоидов (ИКСИ) in vitro 37).Schlossberger et al. выделяли наивные Treg (CD45RA + CD25 + Foxp3 + ) и Treg памяти (CD45RA — — CD25 + Foxp3 + ) в образцах крови женщин, подвергшихся лечению ЭКО / ИКСИ, и наблюдали более высокую долю наивные Treg-клетки у женщин, которые забеременели, по сравнению с женщинами, не забеременевшими (37). Это открытие может указывать на то, что при (подготовке) к ранней беременности более высокие уровни наивных Treg-клеток важны для успешной беременности.Можно предположить, что эти более высокие уровни наивных Treg-клеток могут быть способны пролиферировать в антиген-опытные Treg-клетки памяти, которые, возможно, полезны на поздних сроках беременности. Эту гипотезу необходимо проверить в дальнейших исследованиях, но она будет соответствовать результатам исследований на мышах, в которых отцовские антиген-специфические клетки памяти Treg были важны в середине беременности (12).
Та же группа продолжила это исследование и показала, что у здоровых беременных женщин на ранних сроках беременности (1-й триместр) снижение количества наивных Treg-клеток, скорее всего, связано со снижением выработки Treg-клеток тимуса, так как уменьшение количества недавно эмигрантов из тимуса Treg-клетки были обнаружены на ранних сроках беременности (38).Они также показали, что увеличение количества Treg-клеток памяти на ранних сроках беременности, по-видимому, связано с дифференцировкой недавно эмигрировавших Treg-клеток тимуса, поскольку была обнаружена повышенная доля Treg-клеток памяти CD45RA — CD31 — (38), которые вернулись к нормальным уровням, не связанным с беременностью, в течение беременности (38). В соответствии с их предыдущей публикацией (37), эта группа снова показала, что подавляющая способность наивных Treg-клеток увеличивается во время беременности, а подавляющая способность популяции Treg-клеток памяти снижается во время беременности (38).В конце беременности доля клеток памяти CD4 + Treg (CD45RA — Foxp3 + ) в периферической крови присутствовала на сопоставимых уровнях, как у небеременных женщин (34, 38), что может свидетельствовать о том, что Treg-клетки памяти либо подвергаются апоптотической гибели, либо к концу беременности остаются в тканях. Таким образом, обнаружено, что Treg-клетки памяти CD4 + являются благоприятными для беременности у мышей, дифференцируются от недавно эмигрировавших из тимуса Treg-клеток на ранних сроках беременности человека и циркулируют в периферической крови.Исследования их присутствия и функции на стыке плода и матери во время беременности, а также послеродовые исследования и во время второй беременности отсутствуют.
Foxp3 + Treg-клетки участвуют в патофизиологии многих осложнений беременности, таких как преэклампсия (4, 100), повторный выкидыш (101) и бесплодие (4, 102), однако потенциальная роль подмножества клеток памяти Популяция Treg-клеток при различных осложнениях изучена недостаточно. При преэклампсии наблюдалось уменьшение наивных Treg-клеток и увеличение Treg-клеток памяти по сравнению со здоровой беременностью (32, 103).Хотя наивная популяция Treg при преэклампсии показывала пониженную супрессивную активность по сравнению со здоровой беременностью, это не относилось к популяции клеток памяти (103). Необходимы дальнейшие исследования для оценки роли популяции Treg памяти при преэклампсии.
У женщин с гестационным диабетом фенотипическая характеристика субпопуляций Treg-клеток памяти показала, что доля наивных Treg-клеток (CD45RA + HLA-DR — CD127 + Foxp3 + ) была ниже у женщин с гестационным диабетом по сравнению с здоровым беременным женщинам, независимо от того, лечили ли диабет диетой или инсулином (41).С другой стороны, доля Treg-клеток памяти увеличивается при гестационном диабете (41). В популяции Treg-клеток памяти выделяются HLA-DR + и HLA-DR — Treg-клетки памяти (104), в которых Treg-клетки памяти HLA-DR + имеют более дифференцированный фенотип, более супрессивны и секретируют меньшее количество провоспалительных цитокинов по сравнению с Treg-клетками памяти HLA-DR — (104). Принимая во внимание, что количество Treg-клеток памяти HLA-DR — увеличивалось при гестационном диабете с диетической корректировкой, HLA-DR + Treg-клеток памяти значительно увеличивалось при гестационном диабете, получавшем инсулинотерапию, по сравнению со здоровыми беременными женщинами (41).Неизвестно, является ли это эффектом лечения инсулином или отражением патофизиологии заболевания.
Таким образом, исследования Treg-клеток памяти при осложнениях беременности показывают, что Treg-клетки памяти могут быть полезны для репродуктивного успеха при последующих беременностях у мышей (12), однако исследования на людях пока неубедительны. Тот факт, что некоторые исследования обнаруживают более высокие уровни Treg-клеток памяти при осложнениях беременности, таких как преэклампсия и гестационный диабет (32, 41, 103), тогда как другие показывают, что более низкие уровни до переноса эмбриона при лечении ЭКО / ИКСИ связаны с успехом беременности (37 ), может указывать на конкретные роли в зависимости от фазы беременности.Идентификация более убедительных маркеров функции и продолжительности жизни Treg-клеток памяти является приоритетом для полного выяснения роли Treg-клеток памяти в репродукции. Кроме того, поскольку предыдущие исследования в основном проводились в периферической крови, исследования Treg-клеток памяти также должны быть сосредоточены на взаимодействии плода и матери, поскольку известно, что T-клетки памяти находятся не только в периферических тканях, но и в децидуальной оболочке (48, 74).
CD4
+ Фолликулярные вспомогательные клетки памяти при беременности
CD4 + фолликулярные вспомогательные клетки, которые расположены в основном в лимфоидных органах и, в частности, в зародышевых центрах лимфоидных органов, также имеют подмножество клеток памяти, называемое клетками CD4 + FHM (63, 105).Известно, что они помогают В-клеткам в процессе их дифференцировки и продуцируют IL10 и IL21 (106). Клетки CD4 + FHM распознаются CXCR5, CD62L, CCR7 и рецептором фолиевой кислоты 4 (FR4) (106). В отличие от субпопуляции эффекторных Т фолликулярных хелперов, клетки FHM CD4 + обнаруживают низкую экспрессию В-клеточной лимфомы 6 (Bcl-6) (63, 106, 107). Bcl-6 является супрессором транскрипции GATA3, TBET и RORGT и имеет большое значение для функционирования и поддержания Т-фолликулярного помощника (63). Внутри популяции клеток CD4 + FHM можно выделить различные субпопуляции клеток CD4 + FHM на основе экспрессии PD-1, CCR7 и индуцибельного костимулятора Т-клеток (ICOS) (63, 106, 107).
В исследовании на одной мыши и одном человеке сообщалось о клетках CD4 + FHM во время беременности (42, 43). В середине беременности у мышей после аллогенного спаривания было показано, что Т-фолликулярные хелперные клетки (CD4 + CXCR5 + PD-1 + / ICOS + ) накапливаются в матке и плаценте (42). Эти CD4 + T фолликулярные хелперные клетки могли быть CD4 + FHM-клетками, поскольку они демонстрировали фенотип с активированной памятью (CD44 + ). Эта предполагаемая популяция CD4 + FHM значительно увеличилась к позднему сроку беременности, но это исследование также показало, что блокировка лиганда запрограммированной смерти-1 (PDL-1) вызывала аборт и еще больше увеличивала предполагаемое накопление клеток CD4 + FHM (42).Исследование действительно предполагает, что клетки CD4 + FHM могут быть вовлечены в толерантность плода и матери и что чрезмерное изобилие может быть связано с потерей беременности (42).
В соответствии с предположением о том, что повышенное количество клеток CD4 + FHM может быть причастно к потере беременности, исследование на людях при повторном невынашивании беременности показало более высокий уровень децидуальных клеток CD4 + FHM (CXCR5 + PD-1 + CCR7 — и CXCR5 + PD-1 + ICOS + ) в децидуальной ткани самопроизвольного выкидыша по сравнению с тканью от выборочного прерывания беременности у здоровых женщин (43).В периферической крови доли клеток CD4 + FHM (CXCR5 + PD-1 + CCR7 — и CXCR5 + PD-1 + ICOS + ) не различались между группами. , подразумевая местный ответ (43). Таким образом, текущие данные о клетках CD4 + FHM при осложнениях беременности могут предполагать, что потеря беременности связана с обилием клеток CD4 + FHM. Необходимы тщательные исследования, чтобы расширить фундаментальные знания о функции клеток памяти TFH при нормальной и осложненной беременности.
CD4
+ Тканевые резидентные клетки памяти при беременности
В классификации Т-клеток памяти клетки CD4 + TRM отличаются от циркулирующих клеток (108, 109). Поскольку не известны окончательные определяющие маркеры для клеток TRM из компартмента CD4 + , их трудно исследовать (62, 108, 109). Иногда маркеры для клеток TRM CD8 + используются для изучения клеток TRM в компартменте CD4 + , хотя неясно, правильно ли это (таблица 2) (108, 109).Насколько нам известно, литературы о воспроизводимых клетках CD4 + TRM еще не опубликовано.
CD4
+ Стволовые клетки памяти при беременности
CD4 + стволовые клетки памяти представляют собой редкий вид Т-клеток памяти, которые нельзя классифицировать в соответствии с общей дифференциацией наивных клеток и клеток памяти с использованием изоформ CD45 (65). Долгоживущие клетки с наивным фенотипом (CD45RA + CCR7 + CD27 + ), но с антигенной специфичностью и эффекторной функцией, были показаны в крови человека через годы после заражения вирусом Эпштейна-Барра (110).Так называемые Т-стволовые клетки памяти проявляют почти все обычные свойства клеток памяти, такие как высокая экспрессия рецептора CXCR3, CD95 и бета-рецептора IL2 (65, 111), однако им не хватает экспрессии CD45RO и они демонстрируют те же паттерны рециркуляции, что и наивные Т-клетки (65). . Исследования показали, что стволовые клетки памяти CD4 + играют роль в развитии аутоиммунных заболеваний, вируса иммунодефицита человека (ВИЧ) и иммунной защиты от ряда инфекций (65). Насколько нам известно, стволовые клетки памяти CD4 + еще не исследованы в репродукции.
CD8
+ Ячейки памяти при беременности
Подобно клеткам памяти CD4 + , подмножества клеток памяти CD8 + различаются в соответствии с их паттерном миграции, способностью к секреции цитокинов и экспрессией белка (Таблица 2) (112–114). Клетки памяти CD8 + разделены на несколько субпопуляций: CD8 + эффекторных клеток памяти (CD8 + EM), CD8 + клеток центральной памяти (CD8 + CM), CD8 + тканевых резидентных клеток памяти. (CD8 + TRM), CD8 + фолликулярных вспомогательных клеток памяти (CD8 + FHM) и стволовых клеток памяти CD8 + (58–65, 115, 116).Описаны клетки памяти CD8 + с регуляторными свойствами, однако единого мнения о существовании подмножества памяти Treg CD8 + нет (45). Большинство клеток памяти CD8 + генерируются из эффекторных клеток, подвергшихся воздействию антигена, в ходе иммунного ответа (113, 117, 118), однако некоторые клетки памяти CD8 + могут возникать непосредственно из наивных Т-клеток (119, 120). Клетки памяти CD8 + образуют первую линию защиты в тканях слизистой оболочки и способны продуцировать эффекторные цитокины и гранзимы, IFN-гамма и перфорин при стимуляции без необходимости в костимулирующих сигналах (53, 121).
Уже много лет известно, что клетки памяти CD8 + присутствуют в децидуальной оболочке во время беременности (73). Более высокие доли CD45RO + клеток CD8 + были обнаружены в децидуальной оболочке первого триместра по сравнению с периферической кровью в то же время беременности (72, 73). Кроме того, доля клеток памяти CD8 + (CD8 + CD45RO + ) в периферической крови не различалась между беременными и небеременными женщинами (30, 73). В другом исследовании было обнаружено, что популяция Т-клеток памяти CD8 + находится под влиянием семенной жидкости (122).С помощью иммуногистохимии было показано, что клетки памяти CD8 + (CD3 + CD8 + CD45RO + ) увеличиваются в строме и эпителии биопсий шейки матки человека, взятых через 12 часов после незащищенного полового акта по сравнению с биопсиями после периода воздержание и биопсия после полового акта с использованием презерватива (122). Хотя это показывает, что клетки памяти CD8 + генерируются в ответ на семенную жидкость, неизвестно, являются ли эти клетки специфичными по отношению к отцовскому антигену.Кроме того, неизвестна их роль в подготовке к беременности и переносимости плода и матери. Более поздние исследования были сосредоточены на оценке различных подмножеств ячеек памяти CD8 + при воспроизведении. Это рассматривается для каждого подмножества ниже.
CD8
+ Эффекторные клетки памяти при беременности
CD8 + EM-клетки экспрессируют CD45RO, но не имеют экспрессии CCR7 и поэтому обязаны циркулировать в периферической крови и нелимфоидной ткани (28, 112). ЕМ-клетки CD8 + быстро продуцируют эффекторные цитокины, такие как IL4, IL5 и IFN-гамма, при вторичном контакте с родственным антигеном и, таким образом, генерируют немедленную защиту (24).Клетки ЕМ CD8 + экспрессируют костимулирующие молекулы CD27 и CD28, которые постепенно теряются при дифференцировке клеток ЕМ CD8 + (47). Используя эти молекулы, популяция ЕМ клеток CD8 + может быть подразделена на 4 подтипа ЕМ клеток; т.е. EM1 (CD27 + CD28 + ), EM2 (CD27 + CD28 –), EM3 (CD27 – CD28 –) и EM4 (CD27 – CD28 + ) (Таблица 2) (47), причем EM-1 является наиболее заметным в периферической крови (около 70%) (47, 123).Наряду с другим иммунным фенотипом эти подмножества могут выполнять разные функции (47).
Экспрессия
CD45RA на CD8 + Т-клетках, как широко известно, теряется при воздействии антигена, однако в одной высокодифференцированной субпопуляции ЕМ-клеток CD8 + CD45RA снова экспрессируется, несмотря на предыдущее воздействие антигена (47, 121). Эти клетки памяти CD8 + терминально дифференцированы и называются ревертантными эффекторными клетками памяти CD45RA (CD8 + TEMRA или иногда сокращенно EMRA) (47, 121).CD8 + TEMRA-клетки проявляют большую цитолитическую активность, но не обладают способностями к экспансии и экспрессии CCR7, что не позволяет им мигрировать во вторичную лимфоидную ткань (47, 121).
Все больше данных показывает, что ЕМ клетки CD8 + участвуют в установлении функциональной иммунной толерантности по отношению к плоду (20, 46, 124). В периферической крови общая популяция ЕМ-клеток CD8 + была сходной у здоровых небеременных женщин по сравнению со здоровыми беременными женщинами во 2-м и 3-м триместрах (30, 34).Несколько исследований показали изменение профиля маркеров активации на CD8 + ЕМ-клетках во время беременности. Повышенная экспрессия CD38 + на клетках CD8 + EM (CD45RO + CCR7 — ) и CD8 + TEMRA (CCR7 — CD45RA + ) была обнаружена в периферической крови беременных женщин в г. 3-й триместр по сравнению с небеременными женщинами (34, 44). Более того, более высокая экспрессия HLA-DR, но сопоставимая экспрессия CD69, была обнаружена на CD8 + EM-клетках (CD45RO + CCR7 —) в периферической крови у беременных женщин по сравнению с небеременными женщинами (30, 34).Интересно, что хотя во время беременности пропорции ЕМ клеток CD8 + в крови не отличались от доли у небеременных женщин, более высокие доли ЕМ клеток CD8 + (CD45RO + CCR7 — ) были обнаружены в периферическая кровь у женщин в послеродовом периоде по сравнению с женщинами, которые никогда не были беременными (30). Более высокая экспрессия некоторых маркеров активации на ЕМ-клетках CD8 + во время беременности позволяет предположить, что ЕМ-клетки CD8 + активируются в периферической крови во время беременности.Обнаружена аналогичная экспрессия ингибирующих молекул PD-1 и PDL-1 на клетках CD8 + EM, что позволяет предположить, что их эффекторная функция остается той же (23).
Примерно половина клеток CD8 + в децидуальной оболочке оказалась CD8 + ЕМ-клетками (CD45RA — CCR7 — ), что примерно в два раза превышает долю этих клеток в периферической крови. (19, 22, 31). Это может быть связано с преимущественным накоплением этих клеток в децидуальной оболочке, но, что касается наивных клеток CD4 + , это также может быть связано с тем, что наивные клетки CD8 + не накапливаются в периферических тканях (80).Мало того, что соотношение CD8 + EM-клеток в периферической крови и децидуальной оболочке различается, также наблюдаются существенные различия в фенотипе, экспрессии генов и функциях этих клеток в периферической крови и децидуальной оболочке (19, 22, 31, 46) . ЕМ клетки CD8 + (CD45RA — CCR7 — ) в децидуальной оболочке показали повышенную способность к секреции IFN-гамма и IL4 и снижение экспрессии перфорина и гранзима B по сравнению с клетками CD8 + EM в периферической крови (19, 22).Остается установить, вносят ли эти специфические функции децидуальных ЕМ клеток CD8 + вклад в иммунную толерантность плода и матери.
Больше доказательств измененной функциональности CD8 + EM-клеток в децидуальной оболочке по сравнению с периферической кровью было обнаружено в исследовании, показывающем повышенную экспрессию рецепторов тормозных контрольных точек PD-1, Tim-3, CTLA-4 и LAG-3 на децидуальные ЕМ-клетки CD8 + по сравнению с ЕМ-клетками CD8 + в периферической крови (19, 45, 46).Более высокая экспрессия Tim-3 и PD-1 на децидуальных Т-клетках CD8 + может быть результатом взаимодействия с трофобластами, поскольку совместное культивирование Т-клеток CD8 + с трофобластами индуцировало повышенную регуляцию Tim-3 и PD-1 ( 45), предполагая, что трофобласты могут вызывать изменение функции, то есть толерантность в CD8 + ЕМ-клетках децидуальной оболочки. В соответствии с повышенной экспрессией маркеров активации, рецепторов ингибиторных контрольных точек и выработкой цитокинов в децидуальных клетках CD8 + EM наблюдается повышенная экспрессия нескольких генов, обнаруженная в децидуальных клетках CD8 + EM по сравнению с CD8 + ЭМ клеток периферической крови (19, 46).Гены, участвующие в хемотаксисе, ингибиторных рецепторах, активации Т-клеток, дифференцировке Treg-клеток и генах, связанных с путем IFN-гамма, были обнаружены выше в децидуальных клетках CD8 + EM по сравнению с клетками периферической крови CD8 + EM (19, 46) . Различные характеристики децидуальных ЕМ-клеток CD8 + по сравнению с ЕМ-клетками CD8 + периферической крови могут быть полезными для иммунной толерантности на границе раздела плода и матери.
Возникает вопрос, связаны ли изменения в ЕМ-клетках CD8 + с появлением специфичных для плода ЕМ-клеток CD8 + .Тетрамеры H HY используются для обнаружения материнских Т-клеток со специфичностью в отношении HY-белка, кодируемого Y-хромосомой, экспрессируемого плодом мужского пола (125). Доля HY-специфических клеток CD8 + (не уточняется, какой подтип памяти) в периферической крови на ранних сроках беременности составляла 0,035% от популяции CD8 + , которая почти утроилась к концу беременности (10). Большая часть HY-специфической популяции клеток памяти CD8 + в периферической крови и децидуальной оболочке демонстрировала фенотип эффекторной памяти: либо CD8 + EM (CCR7 — CD45RA — ), либо CD8 + TEMRA (CD45RA + CCR7 — ) (10, 125).При стимуляции мужскими клетками HY-специфические Т-клетки были цитотоксичными и секретировали IFN-гамма (10). Специфичные для HY клетки CD8 + в децидуальной оболочке экспрессировали более высокие уровни PD-1 и CD69 по сравнению с периферической кровью (19).
При преэклампсии пропорции ЕМ клеток CD8 + и их экспрессия CD27 и CD28 были сопоставимы с долями ЕМ клеток CD8 + у здоровых женщин в периферической крови и в мазке из внутриматочной полости (32). В отличие от преэклампсии, у небеременных женщин после рецидивирующих самопроизвольных выкидышей в периферической крови наблюдались более высокие доли ЭМ-клеток (не указано, из компартмента клеток CD4 + или CD8 + ) по сравнению с фертильной небеременной контрольной группой ( 33).Lissauer et al. обнаружили, что субпопуляции ЕМ клеток CD8 + присутствуют в различных пропорциях во время беременности у женщин с латентной ЦМВ-инфекцией (44). Они обнаружили, что у женщин с положительной реакцией на ЦМВ доля клеток TEMRA CD8 + (CD45RA + CCR7 —) была выше, и что популяция ЕМ-клеток CD8 + была более дифференцированной с более высоким значением EM3 (CD28 — CD27). — ) и EM4 CD28 + CD27 — ) фенотипами и более низким EM1 (CD28 + CD27 + ) по сравнению с беременными женщинами, серонегативными по ЦМВ (44).Учитывая предполагаемую важную роль ЕМ-клеток CD8 + в успешной беременности, целесообразно исследовать ЕМ-клетки CD8 + и их функцию в периферической крови и децидуальной оболочке при осложнениях беременности для дальнейшей оценки их роли в репродукции.
CD8
+ Ячейки центральной памяти при беременности
CD8 + CM-клетки обладают слабой эффекторной функцией и должны быть преобразованы в другие типы клеток, прежде чем эффекторные функции могут быть индуцированы (53, 112).В отличие от ЕМ-клеток CD8 + , они обладают высокой пролиферацией при стимуляции и экспрессируют рецептор самонаведения в лимфатических узлах CCR7, что позволяет этим клеткам мигрировать во вторичную лимфоидную ткань (57). Клетки CD8 + CM обладают способностью генерировать разнообразное потомство с различными типами дочерних клеток, таких как клетки CD8 + EM и эффекторные клетки (126). Основным цитокином, продуцируемым клетками CD8 + CM, является IL2, но они также продуцируют низкие уровни IFN-гамма и TNF (112).
В репродукции клетки CD8 + CM менее изучены, чем клетки CD8 + EM, это можно объяснить их низкой распространенностью, поскольку доля клеток CD8 + с фенотипом CM в децидуальной оболочке и периферической крови низкие (около 5% клеток CD8 + ) (22, 30, 31). Три исследования показали, что пропорции СМ-клеток CD8 + в периферической крови не меняются во время беременности (23, 30, 34). Экспрессия CD38, CD28 и CD27 в популяции CM-клеток CD8 + также оказалась сходной в периферической крови у беременных и небеременных женщин (23), хотя была обнаружена экспрессия HLA-DR на CM-клетках CD8 + выше в периферической крови у женщин в третьем триместре по сравнению с небеременными женщинами (34).Исследование CM-клеток CD8 + , специфичных для плода мужского пола, в периферической крови с помощью окрашивания HY-декстрамером показало, что очень низкие доли HY-специфичных клеток CD8 + имеют фенотип CD8 + CM (10, 19). Это может свидетельствовать о том, что антигены плода не достигают вторичной лимфоидной ткани, меньше HY-специфичных CD8 + CM-клеток и меньше HY-специфичных CD8 + CM-клеток рециркулируют в периферическую кровь (10). Неизвестно, будет ли развиваться меньше HY-специфичных клеток CD8 + .
Остается установить, присутствуют ли CM-клетки CD8 + в различных пропорциях в децидуальной ткани по сравнению с периферической кровью, поскольку одно исследование не обнаружило различий, а другое исследование показало значительно более низкое содержание CD8 + CM-клеток (CD45RA — CCR7 + ) в децидуальной ткани по сравнению с периферической кровью (22, 31). Возможное объяснение несоответствия могло быть методологическим, поскольку только в одном из исследований использовалось окрашивание жизнеспособности.Гранзим B и перфорин очень слабо экспрессируются CM-клетками CD8 + , и при сравнении CD8 + CM-клеток децидуальной и периферической крови не было обнаружено различий в экспрессии гранзима B и перфорина (22).
При преэклампсии пропорции CM-клеток CD8 + и их экспрессия CD28 и CD27 были сопоставимы с пропорциями у здоровых женщин как в периферической крови, так и в мазке из внутриматочной полости (32). В периферической крови небеременных женщин, страдающих рецидивирующим самопроизвольным выкидышем, было обнаружено более высокое содержание клеток CD8 + CM (CD45RO + CD62L + ) по сравнению с небеременными женщинами фертильного возраста (33).Однако, поскольку фенотип клеток CD4 + или CD8 + не был идентифицирован, неясно, отражает ли это открытие различие в клетках CD8 + CM.
CD8
+ Резидентные Т-клетки памяти при беременности
Резидентные клетки памяти (TRM) представляют собой отдельную субпопуляцию клеток памяти CD8 + , которые находятся в периферических тканях, включая эндометрий и децидуальную оболочку (49, 51). После первичного иммунного ответа клетки CD8 + TRM находятся в периферических тканях, ожидая вторичного контакта, без рециркуляции в периферической крови или лимфатических узлах (127–129).При реактивации клетки CD8 + TRM продуцируют IFN-гамма, гранзим B и перфорины (127). Клетки TRM обычно идентифицируются по экспрессии различных поверхностных маркеров, таких как CD103, CD69 и CD49A (127, 130–133). Клетки CD8 + TRM обнаруживаются во всем репродуктивном тракте и, в отличие от клеток CD8 + TRM в почках, коже и слюнной железе, не требуют IL15 для поддержания популяции клеток (48, 49, 134).
Кроме того, клетки CD8 + TRM в репродуктивном тракте, по-видимому, способны рекрутировать циркулирующие Т-клетки памяти, независимо от их родственного антигена, в ткань слизистой оболочки репродуктивного тракта и преобразовывать их в клетки TRM (50).Эти данные свидетельствуют о хорошо функционирующей первой линии защиты Т-клеток памяти в репродуктивном тракте. Предположительно, клетки TRM, CD4 + или CD8 + , являются первыми Т-клетками памяти, с которыми встретятся мужские антигены сперматозоидов. Несмотря на их присутствие в репродуктивном тракте, мало информации об их функциях и присутствии во время беременности. Одно исследование рассматривало CD8 + TRM в ткани эндометрия и показало наличие высокой доли клеток памяти CD8 + в ткани эндометрия, что было одинаково у женщин с повторными выкидышами и у женщин контрольной группы (51).Часть этих CD8 + Т-клеток памяти экспрессировала CD103, что указывает на то, что эти клетки могут быть CD8 + TRM-клетками (51). Доля клеток памяти CD8 + , экспрессирующих CD103, была сходной у женщин с повторными выкидышами и у женщин контрольной группы (51). Однако процент клеток памяти CD8 + , экспрессирующих CD69, маркер TRM, был снижен у женщин с повторными выкидышами по сравнению с контрольными женщинами (51). Это может указывать на снижение количества клеток CD8 + TRM у женщин с повторным выкидышем.
CD8
+ Regulatory Memory, CD8 + Follicular Helper Memory и CD8 + Стволовые клетки памяти во время беременности
Регуляторная память, фолликулярная память-помощник и субнаборы стволовых клеток памяти относительно хорошо изучены в клеточном компартменте CD4 + , но лишь в ограниченной степени в клеточном компартменте CD8 + . Клетки CD8 + с иммунорегулирующими способностями описаны в литературе (135–137), однако существование подмножества клеток памяти в популяции Treg-клеток CD8 + все еще остается неопределенным (45).Клетки CD8 + с экспрессией маркера фолликулярных клеток-помощников CXCR5 и маркера клеток памяти CD45RO идентифицированы в зародышевых центрах миндалин человека и, как было установлено, поддерживают В-клетки (116, 138). Присутствие таких CD8 + фолликулярных хелперных клеток памяти подтверждено совсем недавно и еще не изучено при беременности (116). Стволовые клетки памяти CD8 + , как и их аналог CD4 + , являются антигенспецифическими клетками памяти с наивным фенотипом и в основном изучаются в онкологических условиях (115, 139–141).Интересны исследования стволовых клеток памяти CD8 + , CD8 + FHM и CD8 + во время беременности, но прежде чем изучать их роль в репродукции, необходимы дополнительные знания об их функционировании в целом.
Т-клетки памяти при беременности как возможные терапевтические цели
Литература показывает, что Т-клетки памяти, вероятно, участвуют в толерантности плода и матери до, во время и после беременности. Во-первых, было показано, что воздействие семенной жидкости до беременности индуцирует популяцию Т-клеток памяти в эктоцервиксе (122).Хотя пока нет доказательств того, что эти клетки памяти специфичны к отцовскому антигену, это может быть механизмом, который способствует толерантности к отцовско-плодным антигенам. Этот механизм подтверждается существующими эпидемиологическими данными, показывающими связь между более длительным периодом воздействия семенной жидкости будущего отца и более низким риском преэклампсии (142–144). Создание отцовских Т-клеток специфической памяти в качестве терапевтической мишени посредством иммунизации отцовскими клетками до зачатия кажется очевидным и действительно проводилось в нескольких исследованиях (145, 146).Исследования, тем не менее, небольшие, но метаанализ 7 небольших исследований показал улучшение клинической частоты наступления беременности после лечения ЭКО, когда семенная плазма используется в качестве дополнительного лечения (средняя частота наступления беременности увеличилась с 25% в контрольной группе до 29% в контрольной группе). группа, получавшая семенную плазму), без значительного увеличения числа живорождений или продолжающихся беременностей (146). Поскольку в этих исследованиях предполагалось определенное время полового акта или отложение необработанной спермы во влагалище до использования ЭКО, неизвестно, обусловлен ли положительный эффект спермы самой семенной плазмой или воздействием отцовско-плодного антигена.Это должно стать предметом будущих исследований. Чтобы потенциально достичь лучших результатов, могут быть протестированы дополнительные варианты грунтования. Дополнительным вариантом может быть метод первичного и вытягивающего действия, в котором сначала вызывается иммунный ответ для набора Т-клеток в репродуктивный тракт, а затем следует местная вакцинация — метод, который оказался эффективным в профилактике генитального герпеса (147).
Во-вторых, этот обзор показывает, что механизмы толерантности с участием Т-клеток памяти присутствуют во время беременности.Были показаны различные изменения функции и уровней Т-клеток памяти, которые вместе, вероятно, обеспечивают толерантность; например, клетки памяти CD4 + Treg могут играть важную роль, в то время как на интерфейсе между плодами и матерями также присутствуют малочувствительные клетки памяти PD-1 + Tim-3 + CD8 + , которые также могут быть важным. Эти различные механизмы толерантности и их взаимодействия требуют дальнейшего изучения, при этом также важно сосредоточить внимание на их изменениях при осложнениях беременности.Отсутствие знаний об этих механизмах при здоровой беременности и о том, как на них влияют осложнения беременности, делает терапевтические варианты с использованием иммуномодуляции Т-клеток памяти для лечения осложнений беременности еще неосуществимыми.
В-третьих, после беременности материнские иммунные клетки подвергаются воздействию фето-отцовских антигенов через микрохимеризм и, возможно, через воздействие спермы (8, 9). Поскольку известно, что Т-клетки памяти CD4 + требуют низких уровней воздействия антигена для долгосрочного поддержания (60, 148, 149), предполагается, что микрохимеризм и воздействие спермы являются способами обеспечения устойчивости специфических для плода и отца CD4. + популяция ячеек памяти (150–152).Тщательные исследования возможных положительных эффектов Т-клеток памяти на репродуктивный успех и микрохимеризма на популяции Т-клеток памяти должны указать, может ли это выдвинуть еще одну возможную терапевтическую цель. Снижение частоты осложнений беременности за счет праймирования и улучшения репертуара Т-клеток материнской памяти у рожавших женщин может рассматриваться в качестве будущих методов лечения. Они могут включать те же подходы, что и варианты лечения до беременности.
Выводы
В заключение, тонкий баланс Т-клеток памяти кажется необходимым для успешной беременности, и Т-клетки памяти могут не быть вредными для беременности, но на самом деле они могут вызывать толерантность.Т-клетки памяти демонстрируют разные фенотипы, динамику и функционирование при неосложненной беременности по сравнению с Т-клетками памяти вне репродуктивного контекста. Вместе эти механизмы могут вызывать толерантность к антигенам плода во время беременности. Необходимы дополнительные исследования Т-клеток памяти во время беременности, чтобы лучше понять функцию этих клеток во время беременности и разработать терапевтические стратегии лечения осложнений беременности на основе Т-клеток памяти.
Авторские взносы
TK организовал финансовую поддержку, разработал стратегию поиска, провел изучение литературы и написал первый черновик рукописи.AL организовал финансовую поддержку, разработал стратегию поиска, провел исследование литературы, а также просмотрел и отредактировал рукопись. SS, MF и JP просмотрели и отредактировали рукопись, организовали финансовую поддержку и руководили проектом.
Финансирование
Это исследование финансировалось Университетским медицинским центром Гронингена, Университетом Гронингена, грантами младшего научного магистратуры MD / PhD (присуждаются TK и AL) и Mandema Stipendium So: (присуждаются JP).
Заявление о конфликте интересов
Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могут быть истолкованы как потенциальный конфликт интересов.
Дополнительные материалы
Дополнительные материалы к этой статье можно найти в Интернете по адресу: https://www.frontiersin.org/articles/10.3389/fimmu.2019.00625/full#supplementary-material
Список литературы
4. Герен Л. Р., Принс Дж. Р., Робертсон С. А.. Регуляторные Т-клетки и иммунная толерантность во время беременности: новая цель лечения бесплодия? Обновление Hum Reprod. (2009) 15: 517–35. DOI: 10.1093 / humupd / dmp004
PubMed Аннотация | CrossRef Полный текст | Google Scholar
5.Робертсон С.А., Герин Л.Р., Бромфилд Дж. Дж., Брэнсон К.М., Альстрём А.С., Care AS. Семенная жидкость стимулирует увеличение пула CD4 + CD25 + Т-регуляторных клеток и индуцирует толерантность к отцовским аллоантигенам у мышей. Биол Репрод . (2009) 80: 1036–45. DOI: 10.1095 / биолрепрод.108.074658
PubMed Аннотация | CrossRef Полный текст | Google Scholar
6. Lo YM, Lo ES, Watson N, Noakes L, Sargent IL, Thilaganathan B, et al. Двусторонний обмен клетками между матерью и плодом: биологические и клинические последствия. Кровь. (1996) 88: 4390–5.
PubMed Аннотация | Google Scholar
7. Арк П.С., Хечер К. Перекрестные помехи иммунитета плода и его последствия для здоровья матери и потомства. Нат Мед . (2013) 99: 548–56. DOI: 10,1038 / нм 3160
CrossRef Полный текст | Google Scholar
8. Бьянки Д.В., Зиквольф Г.К., Вейл Г.Дж., Сильвестр С., ДеМария М.А. Клетки-предшественники плода мужского пола сохраняются в материнской крови в течение 27 лет после родов. Proc Natl Acad Sci USA .(1996) 93: 705–8. DOI: 10.1073 / pnas.93.2.705
PubMed Аннотация | CrossRef Полный текст | Google Scholar
10. Лиссауэр Д., Пайпер К., Гудиер О., Килби, доктор медицины, Moss PAH. Специфические для плода CD8 + цитотоксические Т-клеточные ответы развиваются во время нормальной беременности человека и демонстрируют широкие функциональные возможности. Дж Иммунол . (2012) 189: 1072–80. DOI: 10.4049 / jimmunol.1200544
PubMed Аннотация | CrossRef Полный текст | Google Scholar
11. Кан Д.А., Балтимор Д. Беременность вызывает у плода антиген-специфический ответ материнских Т-регуляторных клеток, который способствует толерантности. Proc Natl Acad Sci USA . (2010) 107: 9299–304. DOI: 10.1073 / pnas.10037
PubMed Аннотация | CrossRef Полный текст | Google Scholar
15. Ахмед Р., Грей Д. Иммунологическая память и защитный иммунитет: понимание их взаимосвязи. Наука. (1996) 272: 54–60.
PubMed Аннотация | Google Scholar
19. Пауэлл Р.М., Лиссауэр Д., Тэмблин Дж., Беггс А., Кокс П., Мосс П. и др. Децидуальные Т-клетки демонстрируют высокодифференцированный фенотип и демонстрируют потенциальную специфичность для плода и сильный транскрипционный ответ на IFN. Дж Иммунол . (2017) 199: 3406–17. DOI: 10.4049 / jimmunol.1700114
PubMed Аннотация | CrossRef Полный текст | Google Scholar
20. Tilburgs T, Strominger JL. CD8 + эффекторные Т-клетки на границе плода и матери, уравновешивающие толерантность плода и противовирусный иммунитет. Ам Дж Репрод Иммунол . (2013) 69: 395–407. DOI: 10.1111 / aji.12094
PubMed Аннотация | CrossRef Полный текст | Google Scholar
21. Бартон Б.М., Сюй Р., Уэрри Э.Дж., Порретт П.М. Беременность способствует развитию толерантности к будущему потомству за счет программирования селективной дисфункции долгоживущих материнских Т-клеток. J Leukoc Biol. (2017) 101: 975–87. DOI: 10.1189 / jlb.1A0316-135R
PubMed Аннотация | CrossRef Полный текст | Google Scholar
22. Tilburgs T, Schonkeren D, Eikmans M, Nagtzaam NM, Datema G, Swings GM, et al. Децидуальная ткань человека содержит дифференцированные CD8 + эффекторные Т-клетки памяти с уникальными свойствами. Дж Иммунол . (2010) 185: 4470–7. DOI: 10.4049 / jimmunol.0
7
PubMed Аннотация | CrossRef Полный текст | Google Scholar
23.Шах Н.М., Герасимчук А.А., Боассо А., Бенлахрек А., Фукс Д., Имами Н. и др. Изменения фенотипа Т-клеток и дендритных клеток в период с середины до конца беременности указывают на переход от иммунной толерантности к иммунной активации. Фронт Иммунол . (2017) 8: 1138. DOI: 10.3389 / fimmu.2017.01138
PubMed Аннотация | CrossRef Полный текст | Google Scholar
24. Ланзавеккья А., Салласто Ф., Ланзавеккья Федерика А.С., Ланзавеккья А., Саллусто Ф. Понимание генерации и функции подмножеств Т-клеток памяти. Curr Opin Immunol . (2005) 17: 326–32. DOI: 10.1016 / j.coi.2005.04.010
PubMed Аннотация | CrossRef Полный текст | Google Scholar
28. Мюллер С.Н., Гебхардт Т., Карбон Ф.Р., Хит В.Р. Подмножества Т-клеток памяти, паттерны миграции и проживание в тканях. Анну Рев Иммунол . (2013) 31: 137–61. DOI: 10.1146 / annurev -munol-032712-095954
PubMed Аннотация | CrossRef Полный текст | Google Scholar
31. Фейертс Д., Беннер М., ван Краненбрук Б., ван дер Хейден О.В.Х., Йостен И., ван дер Молен Р.Г.Лимфоциты матки человека приобретают более опытный и толерогенный фенотип во время беременности. Научный сотрудник . (2017) 7: 2884. DOI: 10.1038 / s41598-017-03191-0
PubMed Аннотация | CrossRef Полный текст | Google Scholar
33. Рамхорст Р., Гарсия В., Агриелло Е., Корильяно А., Эчепареборда Е., Иригойен М. и др. Внутриклеточная экспрессия CD69 в эндометриальных и периферических Т-клетках представляет собой полезный маркер у женщин с повторным невынашиванием беременности: Модуляция после иммунотерапии аллогенными лейкоцитами. Ам Дж Репрод Иммунол . (2003) 49: 149–58. DOI: 10.1034 / j.1600-0897.2003.00021.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
34. Левендорф А.И., Нгуен Т.А., Есаян М.Н., Кан Д.А. Нормальная беременность у человека приводит к активации материнского иммунитета на периферии и в маточно-плацентарной области. PLoS ONE. (2014) 9: e96723. DOI: 10.1371 / journal.pone.0096723
PubMed Аннотация | CrossRef Полный текст | Google Scholar
35.Карбоне Дж., Сармьенто Э., Гальего А., Ланио Н., Наварро Дж., Гарсия С. и др. Иммунофенотипические аномалии Т- и В-клеток периферической крови у выбранных женщин с невынашиванием беременности невынашивания без объяснения причин. Дж Репрод Иммунол . (2016) 113: 50–3. DOI: 10.1016 / j.jri.2015.11.003
PubMed Аннотация | CrossRef Полный текст | Google Scholar
36. Тилбург Т., Ролен Д., ван дер Маст Б., де Гроот-Свингс Г., Клейбург С., Шерджон С.А. и др. Доказательства избирательной миграции специфичных для плода регуляторных Т-лимфоцитов CD4 + CD25bright из периферической крови в децидуальную оболочку при беременности человека. Дж Иммунол . (2008) 180: 5737–45. DOI: 10.4049 / jimmunol.180.8.5737
PubMed Аннотация | CrossRef Полный текст | Google Scholar
37. Schlossberger V, Schober L, Rehnitz J, Schaier M, Zeier M, Meuer S, et al. Успех технологий вспомогательной репродукции в отношении состава общего пула регуляторных Т-клеток (Treg) и различных подмножеств Treg. Репродукция Человека . (2013) 28: 3062–73. DOI: 10.1093 / humrep / det316
PubMed Аннотация | CrossRef Полный текст | Google Scholar
38.Вагнер М.И., Май К., Шмитт Э., Манке К., Меуэр С., Экштейн В. и др. Роль недавней дифференцировки регуляторных Т-клеток тимуса (RTE-Treg) во время беременности. Immunol Cell Biol . (2015) 93: 858–67. DOI: 10.1038 / icb.2015.51
PubMed Аннотация | CrossRef Полный текст | Google Scholar
39. Чен Т., Даррасс-Джез Дж., Бергот А.С., Курау Т., Курло Дж., Вальдивия К. и др. Самоспецифические Т-клетки, регулирующие память, защищают эмбрионы при имплантации мышам. Дж Иммунол .(2013) 191: 2273–81. DOI: 10.1016 / j.micinf.2011.07.011.Innate
PubMed Аннотация | CrossRef Полный текст | Google Scholar
40. Калекар Л.А., Шмиэль С.Е., Нандивада С.Л., Лам В.Й., Барснесс Л.О., Чжан Н. и др. Анергия CD4 + Т-клеток предотвращает аутоиммунитет и генерирует регуляторных предшественников Т-клеток. Нат Иммунол . (2016) 17: 304–14. DOI: 10.1038 / ni.3331
PubMed Аннотация | CrossRef Полный текст | Google Scholar
41. Шобер Л., Раднаи Д., Спратте Дж., Киселевич А., Шмитт Е., Манке К. и др.Роль субпопуляций регуляторных Т-лимфоцитов (Treg) в гестационном сахарном диабете. Clin Exp Immunol . (2014) 177: 76–85. DOI: 10.1111 / cei.12300
PubMed Аннотация | CrossRef Полный текст | Google Scholar
42. Цзэн В., Лю З., Чжан С., Рен Дж., Ма Х, Цинь С. и др. Характеристика Т-фолликулярных хелперов при аллогенной нормальной беременности и аборте, вызванном блокадой PDL1. Научный сотрудник . (2016) 6: 36560. DOI: 10.1038 / srep36560
PubMed Аннотация | CrossRef Полный текст | Google Scholar
43.Луан X, Кан X, Ли В., Донг К. Исследование взаимосвязи между повторяющимся самопроизвольным абортом и Т-фолликулярными вспомогательными клетками памяти. Ам Дж Репрод Иммунол . (2017) 78: e12714. DOI: 10.1111 / aji.12714
PubMed Аннотация | CrossRef Полный текст | Google Scholar
44. Лиссауэр Д., Чоудхари М., Пачнио А., Гудиер О., Мосс ПАУ, Килби М.Д. Серопозитивность цитомегаловируса резко изменяет репертуар материнских Т-лимфоцитов CD8 и приводит к накоплению высокодифференцированных клеток памяти во время беременности человека. Репродукция Человека . (2011) 26: 3355–65. DOI: 10.1093 / humrep / der327
PubMed Аннотация | CrossRef Полный текст | Google Scholar
45. Ван С., Ли И, Пяо Х, Хун Х, Чжан Д., Сюй И и др. Пути PD-1 и Tim-3 связаны с регуляторной функцией CD8 + Т-клеток в децидуальной оболочке и поддержанием нормальной беременности. Смерть клетки . (2015) 6: e1738. DOI: 10.1038 / cddis.2015.112
PubMed Аннотация | CrossRef Полный текст | Google Scholar
46. van der Zwan A, Bi K, Norwitz ER, Crespo ÂC, Claas FHJ, Strominger JL, et al.Смешанный признак активации и дисфункции позволяет децидуальным CD8 + Т-клеткам человека обеспечивать как толерантность, так и иммунитет. Proc Natl Acad Sci USA . (2018) 115: 385–90. DOI: 10.1073 / pnas.1713957115
PubMed Аннотация | CrossRef Полный текст | Google Scholar
47. Ромеро П., Циппелиус А., Курт И., Питтет М.Дж., Туври С., Янку Е.М. и др. Четыре функционально различных популяции CD8 + Т-лимфоцитов эффекторной памяти человека. Дж Иммунол . (2007) 178: 4112–9. DOI: 10.4049 / JIMMUNOL.178.7.4112
PubMed Аннотация | CrossRef Полный текст | Google Scholar
49. Кейси К.А., Фрейзер К.А., Шенкель Дж.М., Моран А., Абт М.К., Беура Л.К. и др. Антиген-независимая дифференцировка и поддержание эффектороподобных резидентных Т-клеток памяти в тканях. Дж Иммунол . (2012) 188: 4866–75. DOI: 10.4049 / jimmunol.1200402
PubMed Аннотация | CrossRef Полный текст | Google Scholar
50. Беура Л.К., Митчелл Дж. С., Томпсон Э. А., Шенкель Дж. М., Мохаммед Дж., Виджеесинге С. и др.Прижизненная визуализация слизистой оболочки CD8 + резидентных Т-клеток памяти показывает тканево-автономные ответы на воспоминания, которые усиливают вторичный элемент памяти. Нат Иммунол . (2018) 19: 173–82. DOI: 10.1038 / s41590-017-0029-3
CrossRef Полный текст | Google Scholar
51. Сауткомб Дж. Х., Маунс Дж., Макги К., Эльгаджиджи А., Бросенс Дж., Квенби С. и др. Популяция резидентных Т-клеток памяти CD8 эндометрия при повторном невынашивании беременности. Научный сотрудник . (2017) 7: 41335. DOI: 10.1038 / srep41335
PubMed Аннотация | CrossRef Полный текст | Google Scholar
53. Саллусто Ф, Гегинат Дж, Ланзавеккья А. Центральная память и субпопуляции эффекторных Т-клеток: функция, генерация и поддержание. Анну Рев Иммунол . (2004) 22: 745–63. DOI: 10.1146 / annurev.immunol.22.012703.104702
PubMed Аннотация | CrossRef Полный текст | Google Scholar
54. Бут Нью-Джерси, Маккуэйд А.Дж., Собанд Т., Киссан С., Агиус Е., Джексон С.Е. и др. Различный пролиферативный потенциал и миграционные характеристики CD4 + регуляторных Т-клеток человека, экспрессирующих CD45RA или CD45RO. Дж Иммунол . (2010) 184: 4317–26. DOI: 10.4049 / jimmunol.0
1
CrossRef Полный текст | Google Scholar
56. Данн П.Дж., Беларамани Л., Флетчер Дж. М., Фернандес де Маттос С., Лоуренц М., Соареш МВД и др. Спокойствие и функциональное перепрограммирование CD8 + Т-клеток, специфичных к вирусу Эпштейна-Барра (EBV), во время персистирующей инфекции. Кровь. (2005) 106: 558–65. DOI: 10.1182 / кровь-2004-11-4469
PubMed Аннотация | CrossRef Полный текст | Google Scholar
57.Фёрстер Р., Шубель А., Брайтфельд Д., Креммер Э., Реннер-Мюллер И., Вольф Э. и др. CCR7 координирует первичный иммунный ответ, создавая функциональную микросреду во вторичных лимфоидных органах. Ячейка. (1999) 99: 23–33. DOI: 10.1016 / S0092-8674 (00) 80059-8
PubMed Аннотация | CrossRef Полный текст | Google Scholar
58. Cyster JG. Хемокины, сфингозин-1-фосфат и миграция клеток во вторичных лимфоидных органах. Анну Рев Иммунол . (2005) 23: 127–59.DOI: 10.1146 / annurev.immunol.23.021704.115628
PubMed Аннотация | CrossRef Полный текст | Google Scholar
61. Гебхардт Т., Уитни П.Г., Заид А., Маккей Л.К., Брукс А.Г., Хит В.Р. и др. Различные модели периферической миграции CD4 + и CD8 + Т-клеток памяти. Природа. (2011) 477: 216–9. DOI: 10.1038 / природа10339
PubMed Аннотация | CrossRef Полный текст | Google Scholar
62. Кларк Р.А., Ватанабе Р., Тиг Дж. Э., Шлапбах С., Тава М. С., Адамс Н. и др.Эффекторные Т-клетки памяти кожи не рециркулируют и не обеспечивают иммунную защиту у пациентов с CTCL, получавших алемтузумаб. Sci Transl Med. (2012) 4: 117ra7. DOI: 10.1126 / scitranslmed.3003008
CrossRef Полный текст | Google Scholar
65. Gattinoni L, Lugli E, Ji Y, Pos Z, Paulos CM, Quigley MF, et al. Подмножество Т-клеток памяти человека со свойствами стволовых клеток. Нат Мед . (2011) 17: 1290–7. DOI: 10,1038 / нм.2446
PubMed Аннотация | CrossRef Полный текст | Google Scholar
66.Маттисен Л., Берг Г., Эрнеруд Дж., Хоканссон Л. Субпопуляции лимфоцитов и митогеновая стимуляция лимфоцитов крови при нормальной беременности. Ам Дж Репрод Иммунол . (1996) 35: 70–9. DOI: 10.1111 / j.1600-0897.1996.tb00010.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
67. Чайворапонгса Т., Герваси М.Т., Рефуэрзо Дж., Эспиноза Дж., Йошимацу Дж., Берман С. и др. Субпопуляции материнских лимфоцитов (CD45RA + и CD45RO +) при преэклампсии. Am J Obstet Gynecol .(2002) 187: 889–93. DOI: 10.1067 / моб.2002.127309
PubMed Аннотация | CrossRef Полный текст | Google Scholar
68. Дармохвал-Коларц Д., Сайто С., Ролински Дж., Табаркевич Дж., Коларц Б., Лещинска-Горжелак Б. и др. Активированные Т-лимфоциты при преэклампсии. Ам Дж Репрод Иммунол . (2007) 58: 39–45. DOI: 10.1111 / j.1600-0897.2007.00489.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
69. Маттиесен Л., Берг Дж., Эрнеруд Дж., Ског Т. Субпопуляции лимфоцитов и аутоантитела при беременностях, осложненных плацентарными нарушениями. Ам Дж Репрод Иммунол . (1995) 33: 31–9. DOI: 10.1111 / j.1600-0897.1995.tb01135.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
70. Махмуд Ф. Ф., Хейнс Д. Д., Абул Х. Т., Ому А. Э., Абу-Дония МБ. Активность бутирилхолинэстеразы при гестационном диабете: корреляция с субпопуляциями лимфоцитов в периферической крови. Ам Дж Репрод Иммунол . (2006) 56: 185–92. DOI: 10.1111 / j.1600-0897.2006.00416.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
71.Олещук Дж., Дармохвал-Коларц Д., Лещинска-Горжелак Б., Ролински Дж. Изменения в иммунной системе пациентов с неизбежными преждевременными родами. Гинекол Обстет Инвест . (2000) 49: 110–3. DOI: 10.1159 / 000010226
PubMed Аннотация | CrossRef Полный текст | Google Scholar
72. Слуквин И.И., Меркулова А.А., Водяник М.А., Чернышов В.П. Дифференциальная экспрессия молекул CD45RA и CD45RO на лимфоцитах децидуальной и периферической крови человека на ранних сроках беременности. Ам Дж Репрод Иммунол .(1996) 35: 16–22.
PubMed Аннотация | Google Scholar
73. Сайто С., Нисикава К., Мори Т., Нарита Н., Эномото М., Ито А. и др. Исследование экспрессии антигенов CD45RO, CD45RA и CD29 на децидуальных Т-клетках человека на ранней стадии беременности. Иммунол Летт . (1994) 40: 193–7. DOI: 10.1016 / 0165-2478 (93) 00019-A
PubMed Аннотация | CrossRef Полный текст | Google Scholar
74. Gomez-Lopez N, Vega-Sanchez R, Castillo-Castrejon M, Romero R, Cubeiro-Arreola K, Vadillo-Ortega F.Доказательства роли адаптивного иммунного ответа в доношенных родах у человека. Ам Дж Репрод Иммунол . (2013) 69: 212–30. DOI: 10.1111 / aji.12074
PubMed Аннотация | CrossRef Полный текст | Google Scholar
75. Pepper M, Linehan JL, Pagán AJ, Zell T, Dileepan T, Cleary PP, et al. Различные пути бактериальной инфекции индуцируют долгоживущие клетки памяти Th2 и короткоживущие клетки Th27. Нат Иммунол . (2010) 11: 83–9. DOI: 10.1038 / ni.1826
PubMed Аннотация | CrossRef Полный текст | Google Scholar
79.Тиан Й., Бабор М., Лейн Дж., Шультен В., Патил В.С., Сьюмуа Дж. И др. Уникальные фенотипы и клональные экспансии эффекторных Т-клеток памяти CD4 человека, повторно экспрессирующих CD45RA. Нац Коммуна . (2017) 8: 1473. DOI: 10.1038 / s41467-017-01728-5
PubMed Аннотация | CrossRef Полный текст | Google Scholar
82. Лангенхорст Д., Хаак С., Гёб С., Ури А., Людер Ф., Ванхове Б. и др. CD28 Костимуляция Т-хелперных клеток 1 усиливает высвобождение цитокинов in vivo . Фронт Иммунол .(2018) 9: 1060. DOI: 10.3389 / fimmu.2018.01060
PubMed Аннотация | CrossRef Полный текст | Google Scholar
83. Сасаки Ю. Децидуальная и периферическая кровь CD4 + CD25 + регуляторные Т-клетки у субъектов ранней беременности и самопроизвольных абортов. Мол Хум Репрод . (2004) 10: 347–53. DOI: 10,1093 / мольхр / gah044
PubMed Аннотация | CrossRef Полный текст | Google Scholar
84. Тилбург Т., Ролен Д.Л., ван дер Маст Б.Дж., ван Шип Дж.Дж., Клейбург С., де Гроот-Свингс Г.М. и др.Дифференциальное распределение CD4 + CD25bright и CD8 + CD28- Т-клеток в децидуальной оболочке и в крови матери во время беременности человека. Плацента. (2006) 27: 47–53. DOI: 10.1016 / j.placenta.2005.11.008
CrossRef Полный текст | Google Scholar
86. Ван С., Чжу X, Сюй Y, Zhang D, Li Y, Tao Y, et al. Запрограммированная гибель клеток-1 (PD-1) и Т-клеточный иммуноглобулин муцин-3 (Tim-3) регулируют CD4 + Т-клетки, вызывая смещение хелперных Т-клеток (Th3) типа 2 на границе раздела матери и плода. Репродукция Человека .(2016) 31: 700–11. DOI: 10.1093 / humrep / dew019
PubMed Аннотация | CrossRef Полный текст | Google Scholar
87. Rivino L, Messi M, Jarrossay D, Lanzavecchia A, Sallusto F, Geginat J. Экспрессия хемокинового рецептора выявляет пре-Т-хелперы (Th) 1, Pre-Th3 и неполяризованные клетки среди CD4 + Т-клеток центральной памяти человека. J Exp Med . (2004) 200: 725–35. DOI: 10.1084 / jem.20040774
PubMed Аннотация | CrossRef Полный текст | Google Scholar
88. Заф К., Узонна Дж., Беверли С.М., Скотт П.Т-клетки центральной памяти обеспечивают долговременный иммунитет к Leishmania major в отсутствие устойчивых паразитов. Нат Мед . (2004) 10: 1104–10. DOI: 10,1038 / нм1108
PubMed Аннотация | CrossRef Полный текст | Google Scholar
89. Gray JI, Westerhof LM, MacLeod MKL. Роль резидентных, центральных и эффекторных CD4 Т-клеток памяти в защитном иммунитете после инфекции или вакцинации. Иммунология. (2018) 154: 574–81. DOI: 10.1111 / imm.12929
CrossRef Полный текст | Google Scholar
90.Piccirillo CA, Шевач EM. Передний край: контроль активации CD8 + Т-клеток с помощью иммунорегуляторных клеток CD4 + CD25 +. Дж Иммунол . (2001) 167: 1137–40. DOI: 10.4049 / jimmunol.167.3.1137
PubMed Аннотация | CrossRef Полный текст | Google Scholar
91. Лим Х.В., Хиллсамер П., Банхам А.Х., Ким Ч. Передний край: прямое подавление В-клеток регуляторными Т-клетками CD4 + CD25 +. Дж Иммунол . (2005) 175: 4180–3. DOI: 10.4049 / jimmunol.175.7.4180
PubMed Аннотация | CrossRef Полный текст | Google Scholar
92.Misra N, Bayry J, Lacroix-Desmazes S, Kazatchkine MD, Kaveri SV. Передний край: человеческие CD4 + CD25 + Т-клетки сдерживают созревание и антигенпредставляющую функцию дендритных клеток. Дж Иммунол . (2004) 172: 4676–80. DOI: 10.4049 / jimmunol.172.8.4676
PubMed Аннотация | CrossRef Полный текст | Google Scholar
93. Taams LS, van Amelsfort JMR, Tiemessen MM, Jacobs KMG, de Jong EC, Akbar AN, et al. Модуляция функции моноцитов / макрофагов регуляторными Т-клетками CD4 + CD25 + человека. Хум Иммунол . (2005) 66: 222–30. DOI: 10.1016 / j.humimm.2004.12.006
PubMed Аннотация | CrossRef Полный текст | Google Scholar
94. Бринкс Е.Л., Робертс А.Д., Кукенхэм Т., Селл С., Кольмайер Дж. Э., Блэкман М.А. и др. Антиген-специфические регуляторные Т-клетки памяти CD4 + Foxp3 + контролируют ответы памяти на инфекцию вирусом гриппа. Дж Иммунол . (2013) 190: 3438–46. DOI: 10.4049 / jimmunol.1203140
PubMed Аннотация | CrossRef Полный текст | Google Scholar
95.Розенблюм, доктор медицины, Грац И.К., По Дж. С., Ли К., Маршак-Ротштейн А., Аббас А. К.. Ответ на аутоантиген отпечатывает регуляторную память в тканях. Природа. (2011) 480: 538–42. DOI: 10.1038 / природа10664
PubMed Аннотация | CrossRef Полный текст | Google Scholar
97. Ким Б.С., Ким И.К., Пак И.Дж., Ким И.С., Ким И.С., Чанг В.С. и др. Превращение клеток памяти Th3 в регуляторные Т-клетки Foxp3 +, подавляющие Th3-опосредованную аллергическую астму. Proc Natl Acad Sci . (2010) 107: 8742–7.DOI: 10.1073 / PNAS.0
6107
PubMed Аннотация | CrossRef Полный текст | Google Scholar
98. Hu C-C, Jeng W-J, Chen Y-C, Fang J-H, Huang C-H, Teng W. и др. Т-клетки, регулирующие память, увеличиваются только в воспалительной фазе хронического гепатита В и связаны с взаимодействием галектин-9 / Tim-3. Научный сотрудник . (2017) 7: 15280. DOI: 10.1038 / s41598-017-15527-x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
100. Prins JR, Boelens HM, Heimweg J, Van der Heide S, Dubois AE, Van Oosterhout AJ, et al.Преэклампсия связана с более низким процентом регуляторных Т-клеток в материнской крови. Гипертоническая беременность. (2009) 28: 300–11. DOI: 10.1080 / 10641950802601237
PubMed Аннотация | CrossRef Полный текст | Google Scholar
101. Вингер Э. Э., Рид Дж. Л.. Низкие уровни циркулирующих CD4 + CD25 + Foxp3 + Т-регуляторных клеток предсказывают риск выкидыша у недавно беременных женщин с историей неудач. Ам Дж Репрод Иммунол . (2011) 66: 320–8. DOI: 10.1111 / j.1600-0897.2011.00992.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
102. Джаспер М.Дж., Тремеллен К.П., Робертсон С.А. Первичное бесплодие необъяснимого характера связано со сниженной экспрессией фактора транскрипции Т-регуляторных клеток Foxp3 в ткани эндометрия. Мол Хум Репрод . (2006) 12: 301–8. DOI: 10,1093 / моль · ч / гал032
PubMed Аннотация | CrossRef Полный текст | Google Scholar
103. Wagner MI, Jöst M, Spratte J, Schaier M, Mahnke K, Meuer S, et al.Дифференциация ICOS + и ICOS- регуляторных Т-клеток, недавно эмигрировавших из тимуса (RTE T regs) во время нормальной беременности, преэклампсии и HELLP-синдрома. Clin Exp Immunol . (2016) 183: 129–42. DOI: 10.1111 / cei.12693
PubMed Аннотация | CrossRef Полный текст | Google Scholar
104. Dong S, Maiella S, Xhaard A, Pang Y, Wenandy L, Larghero J, et al. Многопараметрическое одноклеточное профилирование популяций регуляторных Т-клеток человека CD4 + FOXP3 + в гомеостатических условиях и во время реакции «трансплантат против хозяина». Кровь. (2013) 122: 1802–12. DOI: 10.1182 / BLOOD-2013-02-482539
PubMed Аннотация | CrossRef Полный текст | Google Scholar
107. He J, Tsai LM, Leong YA, Hu X, Ma CS, Chevalier N, et al. Циркулирующий предшественник CCR7 (lo) PD-1 (hi) CXCR5 + CD4 + Т-клетки указывают на активность клеток Tfh и стимулируют ответы антител при повторном воздействии антигена. Иммунитет. (2013) 39: 770–81. DOI: 10.1016 / j.immuni.2013.09.007
PubMed Аннотация | CrossRef Полный текст | Google Scholar
110.Лонг Х.М., Чагури О.Л., Лиз А.М., Райан Г.Б., Джеймс Э., Мортон Л.Т. и др. Тетрамеры MHC II визуализируют ответы CD4 + Т-клеток человека на инфекцию вируса Эпштейна-Барра и демонстрируют атипичную кинетику ответа ядерного антигена EBNA1. J Exp Med . (2013) 210: 933–49. DOI: 10.1084 / jem.20121437
PubMed Аннотация | CrossRef Полный текст | Google Scholar
112. Саллусто Ф., Лениг Д., Ферстер Р., Липп М., Ланзавеккья А. Два подмножества Т-лимфоцитов памяти с различными самонаводящимися потенциалами и эффекторными функциями. Дж Иммунол . (2014) 192: 840–4. DOI: 10.1126 / science.1058867
PubMed Аннотация | CrossRef Полный текст | Google Scholar
115. Гаттинони Л., Чжун X-S, Палмер Д.К., Джи Й., Хинрихс С.С., Ю З. и др. Передача сигналов Wnt останавливает дифференцировку эффекторных Т-клеток и генерирует стволовые клетки памяти CD8 +. Нат Мед . (2009) 15: 808–13. DOI: 10,1038 / нм.1982
PubMed Аннотация | CrossRef Полный текст | Google Scholar
116. Шен Дж., Ло Х, Ву Ц., Хуанг Дж., Сяо Дж., Ван Л. и др.Подмножество CXCR5 + CD8 + Т-клеток в зародышевых центрах миндалин и лимфатических узлов человека помогает В-клеткам вырабатывать иммуноглобулины. Фронт Иммунол . (2018) 9: 2287. DOI: 10.3389 / fimmu.2018.02287
PubMed Аннотация | CrossRef Полный текст | Google Scholar
117. Янгблад Б., Хейл Дж. С., Киссик Х. Т., Ан Э, Сюй Х, Виланд А. и др. Эффекторные Т-клетки CD8 дедифференцируются в долгоживущие клетки памяти. Природа. (2017) 552: 404–9. DOI: 10.1038 / природа25144
PubMed Аннотация | CrossRef Полный текст | Google Scholar
118.Akondy RS, Fitch M, Edupuganti S, Yang S, Kissick HT, Li KW и др. Происхождение и дифференциация Т-клеток памяти CD8 человека после вакцинации. Природа. (2017) 552: 362–7. DOI: 10.1038 / природа24633
PubMed Аннотация | CrossRef Полный текст | Google Scholar
120. Белый JT, Cross EW, Kedl RM. Неопытные антигенами CD8 + Т-клетки памяти: откуда они берутся и зачем они нужны. Нат Рев Иммунол . (2017) 17: 391–400. DOI: 10.1038 / н.в.2017.34
PubMed Аннотация | CrossRef Полный текст | Google Scholar
121.Appay V, van Lier RAW, Sallusto F, Roederer M. Фенотип и функция субпопуляций человеческих Т-лимфоцитов: консенсус и проблемы. Cytom. Часть A. (2008) 73A: 975–83. DOI: 10.1002 / cyto.a.20643
CrossRef Полный текст | Google Scholar
122. Шарки Диджей, Тремеллен К.П., Джаспер М.Дж., Гемцелл-Даниэльссон К., Робертсон С.А. Семенная жидкость индуцирует набор лейкоцитов и экспрессию мРНК цитокинов и хемокинов в шейке матки человека после коитуса. Дж Иммунол . (2012) 188: 2445–54.DOI: 10.4049 / jimmunol.1102736
PubMed Аннотация | CrossRef Полный текст | Google Scholar
123. Kaech SM, Tan JT, Wherry EJ, Konieczny BT, Surh CD, Ahmed R. Селективная экспрессия рецептора интерлейкина 7 позволяет идентифицировать эффекторные Т-клетки CD8, которые дают начало долгоживущим клеткам памяти. Нат Иммунол . (2003) 4: 1191–8. DOI: 10.1038 / ni1009
PubMed Аннотация | CrossRef Полный текст | Google Scholar
124. ван Эгмонд А., ван дер Кеур С., Swings GMJS, Scherjon SA, Claas FHJ.Возможная роль вирус-специфических CD8 + Т-клеток памяти в децидуальной ткани. Дж Репрод Иммунол . (2016) 113: 1–8. DOI: 10.1016 / j.jri.2015.09.073
PubMed Аннотация | CrossRef Полный текст | Google Scholar
125. Пайпер К.П., МакЛарнон А., Аррази Дж., Хорлок С., Эйнсворт Дж., Килби М.Д. и др. Функциональные HY-специфические CD8 + Т-клетки обнаруживаются у значительной части женщин, беременных плодом мужского пола. Биол Репрод . (2007) 76: 96–101. DOI: 10.1095 / биолрепрод.106.055426
PubMed Аннотация | CrossRef Полный текст | Google Scholar
126. Graef P, Buchholz VR, Stemberger C, Flossdorf M, Henkel L, Schiemann M, et al. Последовательный перенос иммунокомпетентности, происходящей от одной клетки, выявляет стволовость CD8 + центральных Т-клеток памяти. Иммунитет. (2014) 41: 116–26. DOI: 10.1016 / j.immuni.2014.05.018
PubMed Аннотация | CrossRef Полный текст | Google Scholar
130. Карико Э., Атланте М., Джарнери Э, Раффа С., Буччи Б., Джованьоли М. Р. и др.Экспрессия E-кадгерина и альфа-катенина в нормальном, гиперпластическом и неопластическом эндометрии. Anticancer Res . (2010) 30: 4993–7.
PubMed Аннотация | Google Scholar
131. Blechschmidt K, Mylonas I, Mayr D, Schiessl B, Schulze S, Becker K-F, et al. Экспрессия E-кадгерина и его репрессора Snail в плацентарной ткани при нормальных, преэкламптических беременностях и беременностях HELLP. Арка Вирхова . (2007) 450: 195–202. DOI: 10.1007 / s00428-006-0343-x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
132.Hadley GA, Bartlett ST, Via CS, Rostapshova EA, Moainie S. Специфичный для эпителиальных клеток интегрин, CD103 (интегрин альфа-E), определяет новую подгруппу аллореактивных CD8 + CTL. Дж Иммунол . (1997) 159: 3748–56.
PubMed Аннотация | Google Scholar
133. Маккей Л.К., Браун А., Маклеод Б.Л., Коллинз Н., Тебарц С., Бедуи С. и др. Передний край: вмешательство CD69 в функцию рецептора сфингозин-1-фосфата регулирует задержку периферических Т-клеток. Дж Иммунол . (2015) 194: 2059–63.DOI: 10.4049 / JIMMUNOL.1402256
PubMed Аннотация | CrossRef Полный текст | Google Scholar
134. Маккей Л.К., Рахимпур А., Ма Дж.З., Коллинз Н., Сток А.Т., Хафон М.-Л. и др. Путь развития CD103 + CD8 + резидентных Т-клеток памяти кожи. Нат Иммунол . (2013) 14: 1294–301. DOI: 10.1038 / ni.2744
PubMed Аннотация | CrossRef Полный текст | Google Scholar
135. Машикот А., Белен С., Баз П., Бильордо Л.А., Файнбойм Л. Человеческие CD8 + HLA-DR + регуляторные Т-клетки, подобно классическим CD4 + Foxp3 + клеткам, подавляют иммунные ответы через ось PD-1 / PD-L1. Фронт Иммунол . (2018) 9: 2788. DOI: 10.3389 / fimmu.2018.02788
PubMed Аннотация | CrossRef Полный текст | Google Scholar
136. Rifa’i M, Kawamoto Y, Nakashima I., Suzuki H. Важнейшие роли CD8 + CD122 + регуляторных Т-клеток в поддержании гомеостаза Т-клеток. J Exp Med. (2004) 200: 1123–34. DOI: 10.1084 / jem.20040395
PubMed Аннотация | CrossRef Полный текст | Google Scholar
137. Аррувито Л., Пайяслин Ф., Баз П., Подхорзер А., Бильордо А., Пандольфи Дж. И др.Идентификация и клиническая значимость природных CD8 + HLA-DR + регуляторных Т-клеток человека. Дж Иммунол . (2014) 193: 4469–76. DOI: 10.4049 / jimmunol.1401490
PubMed Аннотация | CrossRef Полный текст | Google Scholar
138. Куигли М.Ф., Гонсалес В.Д., Гранат А., Андерссон Дж., Сандберг Дж. К.. CXCR5 + CCR7– CD8 Т-клетки являются ранними эффекторными клетками памяти, которые инфильтрируют фолликулы В-клеток миндалин. евро J Immunol . (2007) 37: 3352–62. DOI: 10.1002 / eji.200636746
PubMed Аннотация | CrossRef Полный текст | Google Scholar
139.Сабатино М., Ху Дж., Соммарива М., Гаутам С., Феллоуз В., Хокер Дж. Д. и др. Получение CD19-специфических CAR-модифицированных стволовых клеток памяти CD8 + клинического уровня для лечения злокачественных опухолей B-клеток человека. Кровь. (2016) 128: 519–28. DOI: 10.1182 / кровь-2015-11-683847
PubMed Аннотация | CrossRef Полный текст | Google Scholar
140. Guan L, Li X, Wei J, Liang Z, Yang J, Weng X и др. Антигенспецифические стволовые Т-клетки памяти CD8 +, полученные из периферической крови человека, эффективно уничтожают аллогенные мишени у мышей. Ресурс стволовых клеток . (2018) 9: 337. DOI: 10.1186 / s13287-018-1080-1
PubMed Аннотация | CrossRef Полный текст | Google Scholar
142. Робиллард П.Ю., Халси Т.С., Периан Дж., Янки Э., Мири Э. Х., Папиерник Э. Связь гипертонии, вызванной беременностью, с продолжительностью полового сожительства до зачатия. Ланцет. (1994) 344: 973–5.
PubMed Аннотация | Google Scholar
143. Сафтлас А.Ф., Рубинштейн Л., Пратер К., Харланд К.К., Филд Е., Трише Е.В.Совокупное воздействие семенной жидкости отца до зачатия и последующий риск преэклампсии. J Reprod Immunol. (2014) 101–102: 104–10. DOI: 10.1016 / j.jri.2013.07.006
PubMed Аннотация | CrossRef Полный текст | Google Scholar
144. Коелман CA, Coumans AB, Nijman HW, Doxiadis II, Dekker GA, Claas FH. Корреляция между оральным сексом и низкой частотой преэклампсии: роль растворимого HLA в семенной жидкости? Дж Репрод Иммунол . (2000) 46: 155–66.DOI: 10.1016 / S0165-0378 (99) 00062-5
PubMed Аннотация | CrossRef Полный текст | Google Scholar
145. Вонг Л.Ф., Портер Т.Ф., Скотт-младший. Иммунотерапия при повторном невынашивании беременности. Кокрановская база данных Syst Rev. (2014) 1: CD000112. DOI: 10.1002 / 14651858.CD000112.pub3
CrossRef Полный текст | Google Scholar
146. Кроуфорд Г., Рэй А., Гуди А., Шах А., Хомбург Р. Роль семенной плазмы для улучшения результатов во время лечения оплодотворением in vitro : обзор литературы и метаанализ. Обновление Hum Reprod. (2015) 21: 275–84. DOI: 10.1093 / humupd / dmu052
PubMed Аннотация | CrossRef Полный текст | Google Scholar
148. Хоманн Д., Тейтон Л., Олдстон, MBA. Дифференциальная регуляция противовирусного Т-клеточного иммунитета приводит к стабильному CD8 +, но снижению памяти CD4 + Т-клеток. Нат Мед . (2001) 7: 913–9. DOI: 10.1038 /
PubMed Аннотация | CrossRef Полный текст | Google Scholar
149. Нельсон Р. У., Маклахлан Дж. Б., Курц Дж. Р., Дженкинс М.К.Персистенция и функция CD4 + Т-клеток после инфицирования поддерживаются пептидом низкого уровня: презентация MHC класса II. Дж Иммунол . (2013) 190: 2828–34. DOI: 10.4049 / jimmunol.1202183
PubMed Аннотация | CrossRef Полный текст | Google Scholar
150. Киндер Дж. М., Цзян Т. Т., Кларк Д. Р., Чатурведи В., Синь Л., Эртельт Дж. М. и др. Вызванные беременностью материнские регуляторные Т-клетки, добросовестная память или поддержание с помощью антигенного напоминания из микохимеризма фетальных клеток? Химеризм.
