Гистологическое исследование что это такое: Гистологические исследования — показания, анализы, результаты
Гистологические исследования — показания, анализы, результаты
directions
Гистологическое исследование представляет собой анализ биоматериала на тканевом уровне. Этот метод исследования является инвазивным, и его проводят только в случаях уже развившегося заболевания. При диагностике врач может определить точный метод лечения и выбрать необходимую тактику. Профилактическое направление очень важно для выявления ранних форм патологии. Своевременное обнаружение болезни позволит избежать ещё более разрушающих последствий для организма, поэтому лучше всего проходить все обследования вовремя. Сдать необходимые анализы Вы сможете в нашем медицинском центре.
Врачи-специалисты
Старшая медицинская сестра
Медицинская сестра
Медицинская сестра эндоскопического кабинета
Врач-терапевт
Медицинская сестра процедурной
Анализ на коронавирус методом ПЦР. Результат в течение 3-х дней
Результат в течение 3-х дней
Наши клиники в Санкт-Петербурге
Медицентр Юго-Запад
Пр.Маршала Жукова 28к2
Кировский район
- Автово
- Проспект Ветеранов
- Ленинский проспект
Получить подробную информацию и записаться на прием Вы можете по телефону
+7 (812) 640-55-25
Методы гистологических исследований:
- Биопсия – это изучение тканей и органов, которые были удалены во время хирургического вмешательства. При нём исследуются маленькие кусочки тканей и органов. С помощью этого способа можно выявить предопухолевую патологию.
Ни в коем случае не стоит забывать, что безобидные родинки могут оказаться злокачественной опухолью, а бородавки – раком. Только результаты гистологического исследования смогут ответить, какое это новообразование.
Показания к проведению исследования:
- подтверждение либо установка диагноза;
- контроль над заболеванием;
- установление стадии опухоли.

С помощью гистологического исследования можно выявить возникновение полипа. Данное аномальное разрастание тканей образуется там, где есть слизистая оболочка – в носу, желудке, толстой и тонкой кишке, теле матки.
Полип желудка – редкое заболевание, которое невозможно определить без биопсии по симптомам. Существуют некоторые клинические симптомы, которые появляются не часто: кровотечения, рвота, боль в животе. В большинстве случаев образования находят во время обследования по поводу других заболеваний. Причиной появления полипов могут послужить нарушения в слизистой оболочке или воспалительные процессы.
Так же в бессимптомном виде протекает полип шейки матки. Очень редко рост полипов в этой области становится толчком к возникновению кровотечений, нерегулярных менструаций, сильной боли, обильных выделений белого цвета.
Биопсия эндометрия проводится для диагностики состояния слизистой оболочки. При помощи этой процедуры могут выявить утолщение и разрастание слизистой матки, а так же карциномы. Исследование эндометрия происходит как обычным методом, так и пайпелем – небольшой пластмассовой трубкой, диаметр которой составляет в среднем 3 мм. Некоторые врачи репродуктологи назначают пайпель-биопсию как специальное обследование, чтобы исключить невынашивание плода.
Гистологические исследования могут быть частью мониторинга беременности. Хорионы – это клетки, содержащие в себе тот же генетический материал, что и плод. Биопсия хорионов может выявить такие заболевания как: синдром Эдвардса, Патау, Дауна и многие другие генные болезни, сопровождающиеся умственной отсталостью или уродствами. Проводят её на сроке до 12 недель. Исследование клеток плаценты назначается во втором триместре. Амниоцентез проводят значительно позже при сроке 16-24 недели. Диагностические способности данного вида анализа намного выше, чем двух предыдущих, но вместе с этим, чем больше срок, тем опаснее будет прерывание беременности. Пункция пуповины плода направлена на выявление хромосомных и генных болезней. Она проводится при сроке 22-25 недель.
Пункция пуповины плода направлена на выявление хромосомных и генных болезней. Она проводится при сроке 22-25 недель.
Подготовка к проведению биопсии может носить особый характер в зависимости от вида гистологических исследований. Обязательно назначается общий анализ крови и на ВИЧ, СПИД, гепатит и др., а женщинам следует дополнительно пройти гинекологическое обследование и сдать мазок (при биопсии матки). Можно отметить следующие несколько общих правил, которые необходимо соблюдать:
- заблаговременно предупредите врача о приёме каких-либо лекарственных средств, а так же скажите, на какие препараты у Вас имеется аллергия;
- не принимайте спиртные напитки за несколько дней до проведения гистологического исследования.
1330,831,933,805,1307,1318
Выражаю благодарность офтальмологу Тотоевой Алене! Очень внимательный и сопереживающий доктор, назначила грамотное лечение,ничего лишнего.
Здравствуйте. Благодарю за слаженную работу персонал Медицентра. Обратилась с признаками ОРЗ. 1. На ресепнш достаточно подробно описали правила прикрепления и уловия приема при остутствии прикрепления по полису ОМС. 2. Прекрасная работа процедурного кабинета, а также м/брата, который осуществляет забор мазков на дому. 3. Мои терапевты: Половодова Е.А. и Артюх Л.Ю.Спасибо за все!
4. Отличная работа сall-центра и личный кабинет просто СУПЕР!
Очень хотелось бы, чтобы отзыв нашел всех, кто упомянут. Спасибо!
Добрый день !
Хочу всех поздравить с наступившим Новым годом, пожелать всем хочу здоровья и благополучия.Но особенно хочу поздравить доктора клиники в Мурино , на Охтинской аллее-это доктор Султанга Валерия Дмитриевна.
Уважаемая Валерия Дмитриевна!
Хочу выразить Вам свою огромную благодарность за колоссальную помощь, за отзывчивость, за качественное лечение, за врачебную этику и за профессионализм своего дела. В нелегкий для моей жизни момент мне очень повезло встретить мудрого и чуткого специалиста. Спасибо Вам огромное за поддержку и профессиональное лечение.
В нелегкий для моей жизни момент мне очень повезло встретить мудрого и чуткого специалиста. Спасибо Вам огромное за поддержку и профессиональное лечение.
Спасибо Вам за Вашу бесконечную доброту и теплое отношение. Желаю Вам всего самого наилучшего и только благодарных пациентов.От всей души хочу сказать Вам «большое спасибо». Вы — врач от Бога.Благодарю Вас за Ваше доброе сердце , за оказанную помощь, за возможность полноценной жизни и за добрую надежду моей души. Желаю Вам достатка и здоровья в Новом году , сил и безграничных возможностей, подаренных судьбой.
Очень хотелось бы , что бы руководство клиники замечала таких докторов и каким то образом премировала таких уникальных по своей доброте людей , ведь такие доктора как Валерия Дмитриевна-уникальны , несмотря на то что это молодой доктор- она к каждому пациенту относится как к родному, со своим подходом, и восхищает своей самоотдачей любимому делу!
Еще раз благодарю доктора и от всей души ей всех благ и сил и терпения.
С уважением Анна Н.
Сайбель Ольга Евгеньевна
27.07.2020
16:07
medi-center.ru
Я, Сайбель Ольга Евгеньевна, 05.04.1976 года рождения, убедительно прошу вознаградить всех врачей, младший медицинский персонал и администраторов клиники ООО «Медицентр ЮЗ», г.Мурино, Охтинская аллея, д.18, за огромный вклад в деле спасении моей жизни.
У меня диагностирован рак подъязычной области полости рта. Абсолютно весь медицинский персонал этой клиники оказывали мне не только квалифицированную медицинскую помощь на высочайшем уровне, но и выходили за рамки должностных обязанностей, проявляя ко мне человеческое сочувствие, корректное отношение и искреннюю заинтересованность в оказании мне максимального содействия на пути к моему выздоровлению.
Огромное Вам спасибо!
Большое человеческое спасибо!!!
Наблюдаюсь у многих врачей по разным направлениям в отделении А. Поликарпова, все очень нравится, но всем беременным и не только-хочу посоветовать прекрасного врача-гинеколог Гиндрюк Василий Васильевич. Настоящий профессионал, все четко и по делу, всегда выслушает, подскажет, укажет, успокоит(если что)! После родов планирую наблюдаться, как у гинеколога, только у него! Спасибо ему большое!
Добрый день. Хочу поблагодарить Старкова Сергея Викторовича. Он диагностировал редкое и очень серьезное аутоиммунное заболевание, которое впоследствии подтвердили ревматологи. Его правильный диагноз в прямом смысле спас мне жизнь. Спасибо.
Гистологические исследования | Клиника Рассвет
Гистологическое исследование — это микроскопическое исследование тканей для выявления морфологических признаков патологического процесса.
В клинической медицине гистологическое исследование представляет собой исследование биопсии патологом (син. — патоморфолог, патологоанатом).
Гистологическое исследование — «золотой стандарт» диагностики многих заболеваний, в первую очередь онкологических процессов.
Биопсия — процесс прижизненного забора фрагмента ткани пораженного органа. Все хирургически удаленные ткани должны подвергаться обязательному гистологическому исследованию.
В зависимости от способа получения операционного материала выделяют следующие типы биопсий:
- Инцизионная: для исследования берут фрагмент пораженного органа/новообразования с целью установления диагноза, последующего назначения лечения и определения объема дальнейшего хирургического вмешательства. К этому типу в большинстве случаев относятся бритвенные (shave) и панч-биопсии.
- Эксцизионная: патологический очаг удаляется целиком в пределах здоровых тканей.
Показания и тип биопсии определяются индивидуально лечащим врачом или консилиумом.
Удаленные фрагменты тканей помещаются в фиксирующий раствор (чаще всего 10%-ный раствор нейтрального формалина) и направляются в патологоанатомическое отделение/лабораторию. Врач-патоморфолог производит макроскопическое исследование (описывает видимые на данном этапе изменения тканей) и выбирает для последующего микроскопического исследования достаточное количество репрезентативных участков пораженной ткани. Далее материал подвергается многоэтапной обработке (гистологическая проводка), в результате чего фрагмент нарезается на тонкие (сопоставимые с размером ядра клетки) срезы, срез депарафинируют и окрашивают гистологическими красителями — гематоксилином и эозином.
В некоторых случаях требуется применение дополнительных методов:
- специальных окрасок — гистохимического, иммуногистохимического исследований, иммунофлуоресценции;
- молекулярно-генетического исследования;
- электронной микроскопии.
Интерпретация результатов и формулировка заключения — это сложный процесс интеграции клинической информации, гистологических изменений и результатов дополнительных методов исследования в соответствии с современными классификациями и требованиями.
Гистологическое исследование. Что это такое?
Часть 1. Отбор и фиксация проб
Автор: Ганкина Ю. В., ветеринарный врач-патолог. Ветеринарная клиника неврологии, травматологии и интенсивной терапии, г. Санкт-Петербург.
Думаю, многие примерно представляют, что гистология – это наука о тканях (все врачи проходили курс гистологии в вузах, но было это, чаще всего, достаточно давно). Соответственно, когда доктор отправляет какой-то материал на гистологическое исследование, он понимает, что исследовать будут ткани, которые он отправил. Казалось бы, все и так понятно, но тем не менее возникает множество вопросов как от направляющих материал врачей-клиницистов, так и от врачей-патологов.
Зачем писать направление? Что там писать (почему так много, неужели патологи сами не увидят в микроскопе, что я прислал)? Зачем столько формалина? Почему не подходит формалин с белым осадком, который у нас хранился с времен основания клиники? Почему не спирт? Почему так долго? Для чего нужны дополнительные окраски? Почему вы не делаете электронную микроскопию, хотя у вас есть компьютер? И многое, многое другое.
В серии своих статей я постараюсь ответить на некоторые вопросы врачей-клиницистов, объяснить, что же происходит с материалом после попадания в недра лаборатории и что патологи пытаются в нем рассмотреть.
Что оправляется на гистологическое исследование?
Первое, что приходит в голову, когда заходит речь о гистологии, – это опухоли (любые опухоли: кожные, внутренних органов, нервной системы, костей и пр.). Конечно, многие врачи предпочитают проведение цитологической диагностики перед хирургическим вмешательством, чтобы затем опираться на нее для определения типа неоплазии. Однако стоит помнить, что ряд неопластических процессов не может быть доподлинно определен при цитологическом исследовании. Зачастую такое исследование имеет погрешность (она может быть различной в зависимости от типа опухоли, ткани и учитываемых в исследовании критериев, согласно литературным источникам). Это касается и новообразований молочных желез, которые составляют большинство биоптатов. Причина в основном состоит в том, что для цитологического исследования предоставляется весьма небольшая часть материала.
Только при гистологическом исследовании могут быть определены архитектоника тканей (в ряде случаев это является важной прогностической информацией), границы неопластического процесса, инвазия лимфатических сосудов и окружающих тканей, хотя некоторые типы новообразований можно с легкостью определить цитологически или цитологическое исследование может дополнять гистологическое (например, в случае мастоцитомы, а иногда – лимфомы и некоторых других).
Первый вопрос, на который должен ответить клиницист: «Что именно из всего операционного материала необходимо оправить на исследование?». Ведь иногда опухоли бывают очень большими, например большой орган или обширный пласт кожи, или, наоборот, очень маленькими. Встречаются идеальные условия, когда патолог находится в соседнем с операционной кабинете, что позволяет ему самому решать, с чем дальше иметь дело. В таком случае материал отправляется целиком, иногда даже до фиксации (допускается его охлаждение (не заморозка!) в течение 24 часов). Однако чаще всего отбором, фиксацией, вырезкой, нарезкой и микроскопией занимаются совершенно разные люди (хорошо, если они имеют возможность связаться друг с другом), поэтому важно знать основные правила отбора материала.
Основные правила отбора материала
Толщина образцов должна быть не более 1 см (иногда 2 см)
- Если опухоль располагается в толще кожи, не содержит различимой капсулы, имеет умеренную плотность и диаметр до 1 см, такой образец можно отправить целиком.
- Если новообразование (даже небольшого размера – 1–2 см) очень плотной консистенции и имеет плотную капсулу, то фиксатор в него проникать будет тяжелее и дольше или только при определенной температуре. Это может привести к тому, что ткань в центре образца не профиксируется (что особенно важно в том случае, если он будет доставлен в лабораторию в срок, превышающий 1 сутки), поэтому такой образец следует надрезать, причем чем плотнее ткань, тем более тонкие фрагменты нужно получить. В случае, когда образец большой (орган целиком, например селезенка), его также стоит нарезать «книжечкой» на множественные фрагменты толщиной до 1 см (рис. 1).
- При опухолевых процессах часто имеются области некроза – обычно в центре неоплазии (но могут быть исключения). Данные фрагменты следует отбирать в последнюю очередь, а в первую очередь нужно брать участок без некроза, если таковой имеется. То же самое касается выраженного гнойного воспаления (если только оно не является основным изменением).

- При некоторых неопластических процессах стоит отправлять дренирующий лимфатический узел (молочные железы, некоторые новообразования конечностей). В таком случае этот узел необходимо отправить отдельно, так как постоперационно его может быть сложно обнаружить. Кроме того, не следует забывать, что, например, в одной молочной железе может быть несколько совершенно различных образований, поэтому (в зависимости от имеющейся возможности) либо железа отправляется целиком с указанием расположения образований, либо производится отбор нескольких образцов. В последнем случае каждый из образцов следует поместить в отдельные подписанные контейнеры, а в сопроводительном документе обязательно указать, сколько было отправлено образцов материала, какой это материал и количество контейнеров, поскольку неидентифицированный материал может быть расценен при вырезке как одно новообразование и часть проб в работу может не пойти.
Принципы оценки хирургических границ
Оценивать хирургические границы важно для определения прогнозов, возможности возникновения повторного роста новообразования. Многие клиницисты желают видеть эту информацию в заключении от патолога. Так ли все просто? Пожалуй, нет. Это сложная задача, в решении которой должны участвовать три составляющие гистологического процесса: врач, который отправляет материал, лаборант/врач/техник, который будет проводить вырезку материала, и патолог, который будет оценивать стекло.
Вырезка – процесс, осуществляемый с фиксированным материалом в лаборатории для его последующей гистологической проводки, нарезки и фиксации. С этой целью отбираются кусочки малого размера (толщиной около 2–3 мм), позволяющего поместить их на стандартное предметное стекло.
Главная проблема заключается в предоставлении возможности участникам данного процесса контактировать друг с другом для достижения взаимопонимания.
Основные методы оценки хирургических границ:
- Метод поперечных срезов.
 Наиболее распространенный метод оценки хирургических границ (метод половин и четвертей). Для этого образец сначала разрезается по короткой оси, делаются срезы полученной области. Затем каждую половину разрезают по длинной оси, таким образом можно получить срезы новообразования в другой плоскости (это может быть один срез четверти новообразования либо несколько тангенциальных (по касательной) срезов в случае крупного образования) (рис. 2). Данный метод наиболее часто используется в рутинной практике, но с его помощью невозможно полностью оценить хирургические границы. Распространение опухоли может быть неравномерным, и клетки могут не попадать в срезы, полученные данным способом.
Наиболее распространенный метод оценки хирургических границ (метод половин и четвертей). Для этого образец сначала разрезается по короткой оси, делаются срезы полученной области. Затем каждую половину разрезают по длинной оси, таким образом можно получить срезы новообразования в другой плоскости (это может быть один срез четверти новообразования либо несколько тангенциальных (по касательной) срезов в случае крупного образования) (рис. 2). Данный метод наиболее часто используется в рутинной практике, но с его помощью невозможно полностью оценить хирургические границы. Распространение опухоли может быть неравномерным, и клетки могут не попадать в срезы, полученные данным способом. - Метод параллельных срезов. Подобно тому как материал нарезается для фиксации, образец нарезается на множественные фрагменты. Разрезы делаются параллельно, через равные промежутки (рис. 1). Таким образом, качество оценки хирургических границ напрямую зависит от количества таких разрезов, а увеличение этого количества может отражаться на стоимости исследования.
- Метод тангенциальных срезов. Множественные тонкие (2–3 мм толщиной) фрагменты отрезаются от края образца по касательной. При обнаружении неопластических клеток в таких образцах новообразование считается удаленным не полностью. Данный метод хорош и может быть более чувствительным, чем метод поперечных срезов, но он не позволяет оценить степень удаления края опухоли от хирургических границ. Для наиболее полной оценки предпочтительным является совмещение методов поперечных и тангенциальных срезов.
При любом методе оценки хирургических границ важной информацией может служить знание о том, как располагалась опухоль относительно тела животного и в каком точно месте имеются неопластические клетки на границе. Для этого может быть удобным использование фотоматериала и красителей.
Для маркировки образцов можно применять красители, которыми удобно отмечать границы материала, поверхности, специальные участки. Они видны в гистологических препаратах и не влияют на качество окраски. Существуют специальные гистологические красители, но можно также использовать водостойкие чернила. Краски наносят специальными кисточками или ватными палочками, после чего им дают высохнуть в течение 5–10 мин. Далее материал необходимо поместить в фиксатор (от момента отбора материала до помещения его в формалин должно пройти не более 30 минут). Если образец крупный, после окраски и просушки его стоит разрезать. В направлении указывают, какими цветами отмечены те или иные границы/участки и пр. Применение красителей более предпочтительно, чем использование шовного материала разного цвета, с разным количеством стежков.
Они видны в гистологических препаратах и не влияют на качество окраски. Существуют специальные гистологические красители, но можно также использовать водостойкие чернила. Краски наносят специальными кисточками или ватными палочками, после чего им дают высохнуть в течение 5–10 мин. Далее материал необходимо поместить в фиксатор (от момента отбора материала до помещения его в формалин должно пройти не более 30 минут). Если образец крупный, после окраски и просушки его стоит разрезать. В направлении указывают, какими цветами отмечены те или иные границы/участки и пр. Применение красителей более предпочтительно, чем использование шовного материала разного цвета, с разным количеством стежков.
При отборе биоптатов из желудочно-кишечного тракта отбирают материал из места поражения. Не стоит брать биоптаты из других участков, т. к. они могут сильно отличаться от основного поражения, и в таком случае ответ на исследование может удивить клинициста. При эндоскопической биопсии осуществляют забор материала из слизистой оболочки стенки желудка или кишки с помощью специальных биопсийных щипцов. В идеале для получения адекватного образца ткани биопсийные щипцы надо, проведя через эндоскоп, ориентировать перпендикулярно слизистой органа. Как правило, эту процедуру достаточно легко выполнить в просвете желудка, но тяжело – в более узких участках, например в двенадцатиперстной кишке. В случае отсутствия специфических повреждений отбирают 6–8 образцов слизистой оболочки в области дна и тела желудка, несколько образцов антрального отдела. Если было обнаружено явное патологическое изменение, такому материалу отдают предпочтение в первую очередь.
При обнаружении язвенного поражения материал отбирают из периферии и центра (при этом нельзя допускать перфорации стенки). Несмотря на то что центральная часть язвы содержит некротическую ткань, диагностически значимые образцы могут быть получены и оттуда.
При выявлении поражений, лежащих глубже слизистой оболочки, можно применить технику, при которой осуществляют многократный забор материала из одного и того же места, углубляясь в стенку и достигая таким образом патологического очага (хотя в этом случае полнослойный забор более предпочтителен).
Биоптаты слизистой оболочки тонкой кишки должны быть достаточно глубокими, чтобы в образце содержались ворсинки на всю длину и область крипт. Следует помнить, что при отборе очень плотного материала образцы могут иметь слишком мелкий размер и быть сильно подвержены артефактам от травмирования браншами щипцов (артефакты сдавливания). По рекомендациям Международной ветеринарной ассоциации мелких домашних животных (the World Small Animal Veterinary Association; WSAVA), в гистологическом описании следует указывать качество образцов для того, чтобы клиницист понимал, насколько точен диагноз и насколько правильно он проводил отбор материала.
Гистологическое исследование аутопсийного материала – последнее, по упоминанию у врачей, но не по значимости. «Человек, не прошедший специальную подготовку по ветеринарной патологии, не должен осуществлять вскрытие с идеей о том, что диагноз будет поставлен во время вскрытия» («A person not specially trained in veterinary pathology should not approach a necropsy with the idea that a diagnosis will be made during the post-mortem examination»; Terrell and Stacy, 2007). Зачастую диагноз не может быть доподлинно установлен до тех пор, пока не будет проведено гистологическое исследование. Материал в таком случае отбирается врачом-патологом. Следует помнить о правилах фиксации (см. далее) и толщине образцов. Как правило, весь материал от одного животного помещается в один контейнер. Некоторые органы фиксируются целиком: головной и спинной мозг (исключение составляют крупные животные, головной мозг которых может быть разрезан на 2–3 крупные части). Мелкие органы: гипофиз, надпочечники, щитовидные железы и пр. – помещают в гистологические кассеты, чтобы избежать утери (рис. 3). При отборе полых органов стоит ввести фиксирующую жидкость в просвет или разрезать его, оставив при этом область интереса интактной. Плоские фрагменты (стенка мочевого пузыря, диафрагма, стенка желудка) могут скручиваться, поэтому их нужно поместить на адсорбирующую подложку. Это может быть поролоновая подложка для гистологических кассет, если образец небольшого размера, или картон при наличии образцов крупного размера (материал просто кладут на подложку, при этом не требуется дополнительной фиксации иглами, швами) (рис. 4). При отборе мышц важно зафиксировать мышечные волокна, так как в процессе химической фиксации мышцы будут сжиматься, что скажется на дальнейшем микроскопическом виде, поэтому мышцы обязательно фиксируют на картонной или деревянной подложке (ею может быть деревянный шпатель) с помощью игл или специальных мышечных зажимов.
Это может быть поролоновая подложка для гистологических кассет, если образец небольшого размера, или картон при наличии образцов крупного размера (материал просто кладут на подложку, при этом не требуется дополнительной фиксации иглами, швами) (рис. 4). При отборе мышц важно зафиксировать мышечные волокна, так как в процессе химической фиксации мышцы будут сжиматься, что скажется на дальнейшем микроскопическом виде, поэтому мышцы обязательно фиксируют на картонной или деревянной подложке (ею может быть деревянный шпатель) с помощью игл или специальных мышечных зажимов.
После того как ткань перестала «жить» (отдельно от организма, без специальных условий ткани существовать не могут), она начинает подвергаться разрушению под действием собственных ферментов и бактерий, поэтому, чтобы материал сохранился, его необходимо зафиксировать. Фиксация должна проводиться сразу после отбора (исключением может служить срочное гистологическое исследование замороженного материала, о чем речь пойдет позже, в таком случае проводится фиксация охлаждением). Наиболее частым методом фиксации является химическая фиксация с помощью различных веществ. Фиксация всегда приводит к большим или меньшим изменениям структуры и объема ткани, степень выраженности которых зависит от рН фиксатора, его концентрации, температуры, продолжительности воздействия и других факторов. Концентрация ионов водорода фиксатора должна соответствовать таковой в тканях, в связи с этим фиксатор должен иметь рН, близкий к нейтральному. Слишком продолжительная фиксация приводит к значительному уплотнению материала, что в дальнейшем затрудняет его обработку (к вопросу о бессрочном хранении зафиксированного материала).
Рассмотрим некоторые фиксаторы:
- Этиловый спирт – этот фиксатор иногда пытаются использовать при отсутствии других химических веществ. Быстро фиксирует ткани, осаждает белки, вымывает жиры, иногда применяется для выявления гликогена, железа, амилоида. Главным его недостатком является сильное пересушивание и уплотнение тканей, поэтому фиксация в спирте не должна превышать одних суток.
 Также стоит учитывать, что дальнейшая проводка после фиксации спиртом будет несколько отличаться от таковой при фиксации формалином, поэтому всегда нужно уточнять, является ли фиксация этиловым спиртом или другими фиксаторами на его основе приемлемой в вашей лаборатории.
Также стоит учитывать, что дальнейшая проводка после фиксации спиртом будет несколько отличаться от таковой при фиксации формалином, поэтому всегда нужно уточнять, является ли фиксация этиловым спиртом или другими фиксаторами на его основе приемлемой в вашей лаборатории. - Специальные фиксирующие жидкости:
- Фиксатор Буэна используется чаще в экспериментальной патологии. Содержит пикриновую кислоту, окрашивающую образец, что в дальнейшем не мешает работе с ним. Продолжительность фиксации составляет 1–24 часа, после чего материал отмывают и переносят в спирт.
- Фиксатор Дэвидсона. Содержит формалин, этанол и ледяную уксусную кислоту. Приводит к быстрому обесцвечиванию тканей, что затрудняет дальнейшую работу с ними. Фиксация не должна превышать 24 часов. Используется в экспериментальной патологии, хорошо подходит для фиксации глаз лабораторных грызунов.
- Формалин (водный раствор формальдегида, стабилизированный метанолом) – самый недорогой и наиболее широко применяемый фиксатор. Используется 10%-й нейтральный забуференный формалин (указывается только процентное соотношение формальдегида). Если в требованиях лаборатории не указан другой фиксатор, то всегда для гистологического исследования используют именно его. В водных незабуференных растворах формальдегид со временем превращается в муравьиную кислоту, метиловый спирт и ацетон, которые ухудшают качество фиксации, как и выпадение белого осадка параформальдегида. Кроме того, забуференный формалин лучше сохраняет антигенные свойства ткани. Не стоит забывать, что формалин имеет резкий специфический запах, раздражает слизистые оболочки, является канцерогеном, поэтому любые работы с зафиксированными тканями должны проводиться только в перчатках и исключительно в вытяжном шкафу. При одновременном отборе материала для гистологического и цитологического исследований не следует подвергать стекла с цитологией действию паров формалина, необходимо максимально разделить нахождение этих двух типов материала.
 Длительность фиксации составляет 24–48 часов при комнатной температуре.
Длительность фиксации составляет 24–48 часов при комнатной температуре.
Соотношение объема фиксатора и фиксируемой ткани должно быть не менее 1:10–1:20.
Чаще всего объем жидкости лимитирован размерами тары (рис. 5), поэтому при отборе материала убедитесь, что подобранная тара имеет подходящий объем, который обычно указан на упаковке (объем образца можно оценить визуально, сравнить с объемом шприцев и пр.). Проследите, чтобы крышка банки была плотно закрыта. Не используйте банки с узким горлышком, т. к. после фиксации материал становится плотным и не может быть извлечен из таких емкостей (банку в подобных случаях разбивают или разрезают). Стеклянная тара не всегда идеальна, поскольку может разбиться при транспортировке. Контейнер можно положить в полиэтиленовый пакет (пакеты для продуктов с зажимом или специальные пакеты для биопроб), чтобы предотвратить вытекание фиксатора и загрязнение окружающих предметов. Обязательно нужно проследить за тем, чтобы проба при транспортировке не замерзла (если велика вероятность замерзания, к формалину можно добавить изопропиловый спирт из расчета 1 часть спирта к 10 частям формалина). Замерзание образца приводит к нарушению структуры ткани и часто к невозможности оценить ее гистологически, поэтому размороженные образцы не подходят для гистологического исследования.
При фиксации нужно проследить, чтобы органы, размещенные на дне или у края контейнера, профиксировались целиком (поверхность, обращенная к дну, может прилипнуть и не зафиксироваться, чтобы избежать этого, материал стоит встряхнуть или «отклеить» от дна). При фиксации сильно кровенаполненных органов (например, селезенки) кровь будет разбавлять фиксатор, поэтому требуется больший объем фиксатора или предпочтительнее сделать отмывание органа. Для этого орган помещается в соответствующий объем фиксатора (1:10, как обычно), но через 12 часов фиксатор меняют на новый.
Выводы
Информация, которая указана в данной статье, достаточно проста, но, к сожалению, врачи очень часто пренебрегают важными правилами, приведенными ниже, что делает исследования менее информативными.
- Материал должен быть зафиксирован сразу после отбора пробы (в срок до 30 минут).
- Для фиксации следует использовать только 10%-й нейтральный забуференный формалин (если лабораторией не указано использование другого фиксатора).
- Толщина образца не должна превышать 1–2 см (используйте линейку для измерения толщины образцов).
- Соотношение «ткань-фиксатор» должно составлять 1:10–1:20.
- Не нужно замораживать образцы для гистологического исследования.
Продолжение следует
Литература:
- Washabau R. J., Day M. J., Willard M. D., Hall E. J., Jergens A. E., Mansell J., Minami T. and Bilzer T. W. Endoscopic, Biopsy, and Histopathologic Guidelines for the Evaluation of Gastrointestinal Inflammation in Companion Animals. The WSAVA International Gastrointestinal Standardization Group. ACVIM Consensus Statement, J Vet Intern Med. 2010; 24:10–26.
- Sontas B. H., Yüzbaşıoğlu Öztürk G., Toydemir T. F., Arun S. S., Ekici H. Fine-needle aspiration biopsy of canine mammary gland tumours: a comparison between cytology and histopathology. Reprod Domest Anim. 2012 Feb; 47(1): 125–30.
- Handbook of small animal gastroenterology, 2003.
- Day M. J., Bilzer T., Mansell J., Wilcock B., Hall E. J., Jergens A., Minami T., Willard M. and Washabau R. Histopathological Standards for the Diagnosis of Gastrointestinal Inflammation in Endoscopic Biopsy Samples from the Dog and Cat: A Report from the World Small Animal Veterinary Association Gastrointestinal Standardization Group. J Comp Path. 2008, Vol. 138, S1eS43.
- Jubb, Kennedy, and Palmer’s pathology of domestic animals / edited by M. Grant Maxie. 6th Edition, 2016.
- Kamstock D. A., et al. Recommended Guidelines for Submission, Trimming, Margin Evaluation, and Reporting of Tumor Biopsy Specimens in Veterinary Surgical Pathology. Veterinary Pathology. 48(1) 19–31.
- Todd R.
 Tams, Clarence A. Rawlings. Small Animal Endoscopy, 3rd Edition, 2011.
Tams, Clarence A. Rawlings. Small Animal Endoscopy, 3rd Edition, 2011. - Jоrg M. Steiner (ed.). Small Animal Gastroenterology, 2008.
- Kiupel M. (ed.). Surgical pathology of tumors of domestic animals. Volume 1: Epithelial tumors of the skin, 2018.
Гистологические исследование матки и эндометрия — биопсия с гистологическим исследованием
Гистологический анализ широко применяется для диагностики онкологических заболеваний. Он дает высокоточную информацию о типе клеток взятого материала. Такой метод обследования основывается на изучении тканей, полученных в результате различных процедур: биопсии, среза, пункции, мазка.
Что диагностируют с помощью гистологического анализа
Гистологический анализ призван помочь в диагностике:
-
злокачественных, доброкачественных опухолей – это основное его назначение; -
причин женского бесплодия; -
заболеваний ЖКТ воспалительного характера; -
оценки характера патологического процесса – воспалительного, дегенеративного, предракового; -
аутоиммунных, инфекционных заболеваний; - заболеваний спинного, головного мозга.
Кроме того, такой метод обследования актуален в рамках пренатальной диагностики. Он позволяет своевременно уточнить состояние здоровья плода и подтвердить/опровергнуть предположение о наличии внутриутробной патологии.
Значение анализа в гинекологии
Гистологическое исследование биопсийного материала имеет особое значение в гинекологии. Оно не только позволяет изучить ткани шейки и тела матки, но и дает возможность получить точную информацию о состоянии будущего малыша.
Этот диагностический метод в обязательном порядке применяется после выкидыша или прерывания замершей беременности. Это позволяет выявить причины патологии и принять меры для профилактики в будущем.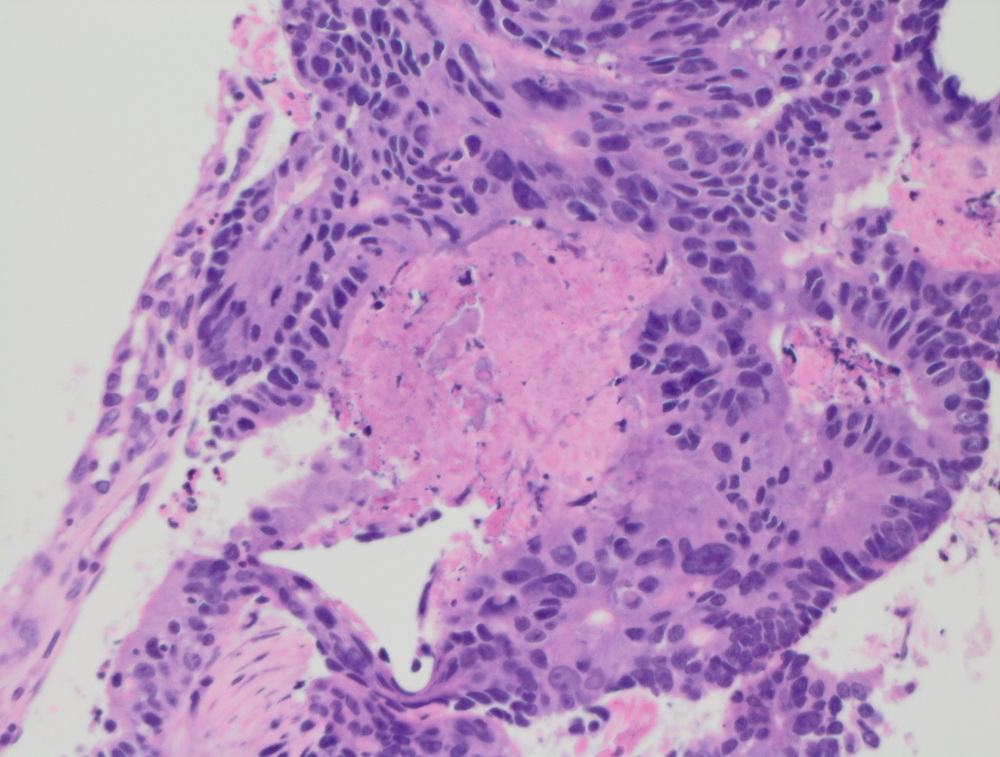
Кроме того, гистологию проводят женщинам, страдающим от увеличения периода менструации, обильных выделений, болях в пояснице и внизу живота. При подозрениях на заболевания воспалительного характера, опухоли, кондиломы, дисплазии и ряд других заболеваний такой анализ также является неотъемлемой частью диагностических мероприятий. Гистологию яичниковой ткани проводят для определения типа опухолей.
Как выполняется анализ
В связи с тем широким перечнем заболеваний, в диагностике которых может помочь гистологическое исследование, забор тканей проводится разными способами.
Биопсия с гистологическим исследованием – основной способ получения материала. Она может осуществляться в результате хирургического вмешательства и носит название инцизионной биопсии. Эксцизионная представляет собой изучение опухоли или части тканей, полностью удаленных хирургически.
Забор вне оперативного вмешательства выполняется с помощью щипчиков, иглы или небольшой трубочки, кюреты, инструментов для забора мазка – врач выбирает способ в зависимости от того, какие именно ткани подлежат изучению.
Далее материал направляется в лабораторию и исследуется с помощью электронного микроскопа. Предварительно его обрабатывают специальным веществом и проводят уплотнение парафином, нарезают тонкими срезами и окрашивают. Специалист получает возможность увидеть структуру причинного участка, определить характер патологических изменений. Срок готовности результатов составляет около 7-10 дней.
Если требуется получить данные быстрее, применяют ускоренную методику – материал быстро замораживают, нарезают и изучают под микроскопом. В этом случае результатов придется ждать не более часа.
Где сдать анализ на гистологию?
Сдать гистологический анализ в Москве вы можете в клинике «Семейный доктор». Забор материала выполняют квалифицированные специалисты с соблюдением всех условий и норм. У нас вы можете сдать анализ в комфортных условиях и получить результаты в регламентированные сроки.
У нас вы можете сдать анализ в комфортных условиях и получить результаты в регламентированные сроки.
Мы работаем в выходные и праздничные дни. Запись по телефону контакт-центра +7 (495) 775 75 66 и в регистратуре клиники.
Стоимость
врач акушер-гинеколог, врач ультразвуковой диагностики, ведущий специалист клиники
врач акушер-гинеколог, врач ультразвуковой диагностики
врач акушер-гинеколог, врач ультразвуковой диагностики
врач акушер-гинеколог, врач ультразвуковой диагностики
врач акушер-гинеколог, врач ультразвуковой диагностики, ведущий специалист клиники
врач акушер-гинеколог, врач ультразвуковой диагностики
врач акушер-гинеколог, врач ультразвуковой диагностики
врач акушер-гинеколог, врач ультразвуковой диагностики
врач акушер-гинеколог, врач ультразвуковой диагностики
врач акушер-гинеколог, врач ультразвуковой диагностики
врач акушер-гинеколог, врач ультразвуковой диагностики
врач акушер-гинеколог, врач ультразвуковой диагностики
Что такое гистологический анализ | Блог UNIM
Гистологическое исследование – это исследование ткани (или образца тканей) под оптическим микроскопом, позволяющее определить тип новообразования и его характеристики. Анализ на гистологию является непреложной основой дифференцирования онкологических заболеваний от неонкологических, без него невозможна постановка онкологического диагноза.
Процедура гистологического анализа
Анализ гистологии начинается с визуальной оценки биоптата путём вырезки отдельных участков для непосредственного проведения исследования. На следующем этапе осуществляется проводка материала — специальная подготовка и обработка биопсийного материала в результате которого получается гистологический (парафиновый) блок. Затем проводится нарезка этого блока на микротоме (микротомирование). В результате микротомирования полученный парафиновый блок нарезается на тончайшие пластины толщиной в несколько десятых миллиметра (около 1 микрона). Потом осуществляется окрашивание гистологических препаратов различными красителями в процессоре, называемом иммуногистостейнером. После этих этапов подготовки готовые препараты направляются под микроскоп для изучения врачом-патоморфологом. Именно такая технология позволяет практически со 100% уверенностью определить, является ли новообразование злокачественным. На данный момент гистологическое исследование — это едва ли не самый важный процесс в диагностировании злокачественных образований, а также в контроле над ходом лечения онкологических больных.
На следующем этапе осуществляется проводка материала — специальная подготовка и обработка биопсийного материала в результате которого получается гистологический (парафиновый) блок. Затем проводится нарезка этого блока на микротоме (микротомирование). В результате микротомирования полученный парафиновый блок нарезается на тончайшие пластины толщиной в несколько десятых миллиметра (около 1 микрона). Потом осуществляется окрашивание гистологических препаратов различными красителями в процессоре, называемом иммуногистостейнером. После этих этапов подготовки готовые препараты направляются под микроскоп для изучения врачом-патоморфологом. Именно такая технология позволяет практически со 100% уверенностью определить, является ли новообразование злокачественным. На данный момент гистологическое исследование — это едва ли не самый важный процесс в диагностировании злокачественных образований, а также в контроле над ходом лечения онкологических больных.
Сроки гистологического исследования
В среднем по России минимальные сроки гистологического исследования составляют от двух недель. Такие сроки исследования часто приводят к длительному ожиданию пациентом результатов, а значит, и упущенным веменем при необходимости своевременного адекватного лечения. При обращении в ЮНИМ сделать гистологию можно за 2 рабочих дня с момента доставки препаратов в лабораторию. Результаты пациент или лечащий врач смогут получить в день готовности заключения по электронной почте, а оригинал заключения, стекла и блоки будут доставлены позже экспресс-почтой.
Доставка материалов на гистологический анализ
Компания UNIM осуществляет доставку из регионов России в Москву гистологических препаратов (стекол, парафиновых блоков, биоптатов в формалине) бесплатно. При этом Вы можете не беспокоиться за судьбу своих препаратов — курьер компании забирает препараты по удобному для отправителя адресу и доставляет их прямиком в патоморфологические лаборатории наших партнеров, специализирующихся именно на данных типах опухолей. Доставка гистологических препаратов осуществляется в течение 1-3 дней из любого региона России.
Доставка гистологических препаратов осуществляется в течение 1-3 дней из любого региона России.
Гистологические исследования биопсийного и операционного материала
Гистологическое исследование подразумевает изучение образцов тканей и фрагментов органов, полученных из патологического очага в организме пациента. Оно проводится с использованием современного микроскопического оборудования и передовых технологий.
Показания
Гистологические исследования – важнейший инструмент оценки состояния здоровья того или иного органа, степени и формы его патологии. Гистологическое исследование биопсийного материала позволяет определить тактику лечения, методы консервативной и операционной терапии, прогноз развития патологии, а также дает возможность контролировать эффективность проводимого лечения. Гистологические исследования крайне важны для выявления ранних форм патологий, когда они еще никак не проявляют себя клиническими симптомами, а значит – для спасения здоровья и жизни пациента.
Врачи назначают гистологическое исследование в разных ситуациях, чаще всего – при обнаружении или подозрении на новообразование в органах или тканях организма. Данный анализ проводится планово или ургентно, во время выполнения хирургической операции, в ходе которой необходимо изучить ткани патологического очага. Особенно ценным гистологическое исследование является при оценке новообразований. Оно позволяет установить характер образования, скорость его роста, эффективность терапии, применяемой для лечения заболевания.
Противопоказания
Гистологическое исследование практически не имеет противопоказаний, однако ограниченно применяется при наличии аллергической реакции на обезболивающие препараты, при нарушениях свертываемости крови, а также если взятие материала сопряжено с риском потери плода, если его необходимо сделать беременной женщине. Противопоказанием могут быть некоторые патологии, например сердечная недостаточность.
Как проходит процедура гистологического исследования
Подготовка к исследованию осуществляется в соответствии со способом проведения анализа и локализацией патологического участка. В некоторых случаях необходимо воздержание от пищи, так как в ходе манипуляции выполняется седация или местный наркоз. Проведение исследований начинается с забора образцов тканей или фрагментов органов. Забор осуществляется различными методами, среди которых:
- щипковая биопсия;
- пункционная биопсия;
- аспирационная;
- эксцизионная;
- трепан-биопсия;
- кюретаж;
- мазок.
В АО «Медицина» (клиника академика Ройтберга) используется современное оборудование, благодаря которому процедура забора тканей проводится точно, быстро и безболезненно. Вы можете сдать анализ любой сложности. В зависимости от показаний и назначения врачей выбирается наиболее подходящий способ забора материала. Стоимость платной процедуры зависит от вида гистологического исследования, на формирование цены влияют также и другие факторы.
После взятия материала:
- изучение образцов тканей проводится в течение суток, после чего пациент получает патоморфологическое заключение;
- в экстренных случаях заключение может быть готово ранее чем через 4 часа;
- если показания CITO – заключение будет выдано через полчаса.
Преимущества лечения в клинике АО «Медицина»
Пройти исследование в нашей лаборатории – это означает получить точное гистологическое исследование биопсийного материала, с помощью которого врач сможет установить причину проблем со здоровьем, понять, в какой стадии находится заболевание и что нужно делать для его излечения. Наши специалисты проведут тщательное изучение полученного материала, установят причину болезни, степень и форму ее развития. Качественная диагностика позволяет эффективно решать проблемы со здоровьем. Нашим пациентам мы предлагаем:
- изучение образов тканей на самом лучшем, современном оборудовании японских и немецких марок;
- использование расходных материалов и химических реактивов высокого качества, импортного производства;
- практически полностью автоматизированный процесс изготовления гистологических препаратов;
- консультации по препаратам и заключениям, полученным в других лабораториях.

Контроль качества диагностики методами гистологии осуществляется ведущими специалистами патоморфологического отделения МНИОИ им. П. А. Герцена, которые проводят консультации в Москве. Записаться на консультацию можно в нашей клинике.
Врачи, выполняющие гистологические исследования
Каждый врач, работающий в гистологическом отделении, является специалистом своего дела, имеет высокую квалификацию и большой опыт работы.
Цены
Цена исследования зависит от его вида, срочности и других факторов.
Гистологические исследования. Особенности диагностики | Морозовская ДГКБ ДЗМ
В Морозовской больнице проводится весь спектр исследований биопсийного и операционного материала. Ежегодно исследуется материал почти 20 тысяч человек. В их числе пациенты Морозовской больницы, городских детских стационаров и поликлиник, акушерских стационаров.
По словам заведующего патологоанатомическим отделением Морозовской ДГКБ Алексея Николаевича Кислякова, в основе патоморфологических (гистологических) исследований лежит изучение изменений, происходящих в тканях, при помощи микроскопа. Врачами анализируется биопсийный материал, получаемый исключительно в диагностических целях.
Это могут быть фрагменты ткани пациента (кожи, слизистых оболочек, внутренних органов, костей, мягких тканей, головного и спинного мозга). Кроме того, обязательному исследованию подлежит операционный материал, т. е. все то, что удаляется во время операции (орган или его часть, опухоль).
В отделении проводится прижизненная диагностика широкого спектра детских болезней. Особое место занимают онкологические случаи.
«Мы анализируем фрагменты тканей, полученные с помощью биопсии или изъятые во время операции. Например, при проведении гастро- и колоноскопии, удалении аппендицита или патологическом родоразрешении исследования позволяют подтвердить диагноз на микроскопическом уровне. Если говорить об онкологии, которая является авангардом морфологической службы, то диагностика с учетом общей клинической картины, лабораторных и параклинических данных (КТ, МРТ) позволяет быстро и точно не только определить наличие патологии, но уточнить ее конкретный вид и индивидуальные характеристики. А от этого зависит, насколько точно будет поставлен диагноз и назначено эффективное лечение», — отметил Алексей Кисляков.
А от этого зависит, насколько точно будет поставлен диагноз и назначено эффективное лечение», — отметил Алексей Кисляков.
Для того чтобы специалист смог увидеть и проанализировать микроскопическую картину ткани, образец проходит специальную подготовку. Сначала врач-патологоанатом оценивает его макроскопически: измеряет, описывает внешний и внутренний вид (размер, цвет, плотность, структуру). После этого происходит вырезка, при которой врач отбирает определенные фрагменты пораженного органа или опухоли для гистологического исследования.
Лабораторный процесс преаналитического этапа гистологического исследования осуществляется в автоматизированном режиме на современном оборудовании. Процесс подготовки подразумевает поочередное выполнение следующих действий:
- Фиксация — помещение вырезанного образца в кассете в специальный химический раствор для сохранения структуры ткани;
- Процессинг (проводка) — процесс обезвоживания, обезжиривания и пропитки материала парафином;
- Заливка парафиновых блоков — материал после обработки заливается расплавленным парафином, затем охлаждается, в результате чего формируются парафиновые блоки, содержащие образцы тканей. Блоки могут храниться долгие годы и использоваться для проведения дополнительных гистологических исследований или пересмотров, а также в научных целях;
- Микротомия — изготовление срезов образцов и их перенесение на специальные предметные стекла. Толщина каждого среза, как правило, не превышает 4 мкм (0,004 мм).
- Окрашивание стекол со срезами гематоксилином и эозином. Изготовленные препараты позволяют увидеть микроскопическую картину образца.
Полученные после обработки материала гистологические препараты врач анализирует и описывает. Благодаря конференц-микроскопу существует возможность одновременного совместного просмотра образцов несколькими специалистами. Кроме того, наличие сканера гистологических препаратов позволяет проводить дистанционное консультирование биопсийного и операционного материала, в том числе, иностранными коллегами.
«При диагностике доброкачественных и злокачественных новообразований, когда постановка диагноза с помощью рутинных гистологических исследований невозможна или требуется уточнение важных иммунофенотипических параметров опухоли, в патологической анатомии применяется дополнительный метод исследования — иммуногистохимия. Она является составной частью гистологического исследования и проводится на том же материале. Иммуногистохимическое исследование позволяет определить гистогенез (происхождение) опухоли, установить ее конкретную нозологическую форму, оценить ее пролиферативный потенциал, то есть, степень возможного роста. В ряде случаев также определяют антигены-таргеты, которые являются «мишенями» для специфической терапии»,- отметил доктор медицинских наук, профессор, врач-патологоанатом Морозовской ДГКБ Александр Гаврилович Талалаев.
Некоторые злокачественные образования требуют также генетического подтверждения. В таком случае проводится флуоресцентная гибридизация in situ (FISH-тест). С ее помощью в анализируемом образце ткани можно выявить генетические аномалии, позволяющие отличить один вид опухоли от другой и выделить маркеры, отвечающие за лекарственную чувствительность опухоли.
Завершающим этапом является формирование заключения, то есть гистологического диагноза. Если речь идет об онкологии, заключение формулируется строго в соответствии с Международной классификацией онкологических заболеваний Всемирной организации здравоохранения (ВОЗ). Классификатор состоит из нескольких томов по каждому разделу онкологии. Он регулярно обновляется, дополняется и уточняется.
В патологоанатомическом отделении, которое существует со дня основания Морозовской больницы, работают высококвалифицированные специалисты: врачи-патологоанатомы, лаборанты. Все специалисты обладают экспертными компетенциями и накопленным опытом проведения исследований, от которых зависит точность поставленного диагноза и эффективность назначенного лечения.
Что такое отчет о гистопатологии или биопсии?
Национальный институт рака определяет гистопатологию как «исследование пораженных клеток и тканей с помощью микроскопа». Гистология — это исследование тканей, а патология — это изучение болезни. Взятые вместе, гистопатология буквально означает изучение тканей в связи с заболеванием.
Гистология — это исследование тканей, а патология — это изучение болезни. Взятые вместе, гистопатология буквально означает изучение тканей в связи с заболеванием.
В гистопатологическом отчете описывается ткань, отправленная на исследование, и особенности того, как рак выглядит под микроскопом.Отчет о гистопатологии иногда называют отчетом о биопсии или отчетом о патологии.
Изображения героев / Getty Images
Гистопатологические отчеты
Врач-специалист, проводящий обследование под микроскопом, называется патологоанатомом. Исследуемая ткань поступает в результате биопсии или хирургической процедуры, при которой отбирают образец подозрительной ткани и отправляют в лабораторию.
Затем его обрабатывают и разрезают на очень тонкие слои (называемые срезами), окрашивают и исследуют под микроскопом, чтобы охарактеризовать детали клеток в ткани.
При некоторых заболеваниях хирург может очень быстро интерпретировать образец ткани с помощью замороженных срезов. Однако замороженные срезы или срезы редко используются при лимфоме из-за проблем с интерпретацией и отбором образцов.
При лимфомах лимфатические узлы являются тканью, наиболее часто исследуемой при гистопатологии. При многих типах рака крови для постановки окончательного диагноза также может потребоваться биопсия костного мозга.
Компоненты отчета о гистопатологии
Гистопатологические отчеты о хирургических образцах рака становятся все более сложными.Они могут включать:
- Микроскопический вид пораженной ткани
- Специальные пятна
- Молекулярные методы
- Прочие испытания
Молекулярные методы относятся к способности анализировать клетки и ткани на молекулярном уровне, то есть на уровне белков, рецепторов и генов, кодирующих эти вещи.
Интерпретация отчета о гистопатологии
Многие результаты такого исследования тканей связаны с прогнозом.Прогностические индикаторы могут включать степень опухоли и степень распространения, а также то, был ли удален рак с небольшим количеством окружающих его здоровых клеток, или если есть доказательства, что рак распространился за пределы того, что было удалено.
Системы оценки различаются в зависимости от типа оцениваемого рака, но обычно клетки оцениваются в зависимости от того, насколько ненормальными они выглядят под микроскопом, причем опухоли 1-й степени выглядят более нормально, а опухоли 4-й степени отражают большее количество аномалий.Взаимодействие с другими людьми
Таким образом, опухоль высокой степени злокачественности — это, как правило, опухоль, в клетках которой больше аномалий. Оценивание — это не то же самое, что постановка. Стадия больше связана с тем, где находится рак в организме и насколько далеко он распространился.
Молекулярные описания
В дополнение к гистопатологии, для оценки наличия рака в тканях могут использоваться другие методы, включая цитологию тонкоигольной аспирации, и некоторые из этих методов могут более широко использоваться в медицинских учреждениях по всему миру.
Лейкемии и лимфомы диагностируют по сочетанию их внешнего вида:
- Цитохимия: ферментов, которые могут вызывать определенные химические реакции
- Иммунофенотип: маркеров или поверхностных белков, которые могут быть обнаружены с помощью тестов на антитела
- Кариотип: хромосомных изменений
- Морфология: Внешний вид клеток
Другие методы отбора проб
Часто при лимфомах и других видах рака метод, называемый иммуногистохимией, используется для оценки типа опухоли, прогноза и лечения.Взаимодействие с другими людьми
Иммуногистохимия включает использование антител для прикрепления к определенным меткам или маркерам на внешней стороне раковых клеток. Эти маркеры, к которым прикрепляются антитела, часто имеют в своем названии «CD», что означает кластер дифференцировки.
Например, CD23 и CD5 представляют собой микроскопические метки, которые, если они присутствуют в раковых клетках, могут поддерживать представление о том, что хронический лимфолейкоз (CLL) / малая лимфоцитарная лимфома (SLL) является возможным диагнозом.
Однако эти же маркеры присутствуют и в других злокачественных новообразованиях, поэтому врачи используют своего рода процесс устранения, основанный на доступной информации и том, что известно о различных злокачественных новообразованиях и их «типичных» маркерах CD.
Другой пример маркера CD — это CD20, который присутствует в некоторых лимфомах, но отсутствует в других. Диффузная крупноклеточная В-клеточная лимфома или DLBCL — очень распространенная лимфома, связанная с маркером CD20.
Для данного образца клеток лейкемии или лимфомы маркеры могут быть протестированы с использованием всей панели антител, которые прикрепляются к различным маркерам, со встроенными положительными и отрицательными контролями.
Могут быть проведены молекулярные и хромосомные исследования для изучения перестроек генов и специфических изменений хромосом.Иногда вставленные или удаленные гены связаны с информацией о прогнозе.
Например, при хроническом лимфолейкозе или ХЛЛ теряется определенный фрагмент хромосомы, и часто вместе с ним теряется ген, который помогает подавить рак.
В целом делеция 17p обнаруживается примерно у 5-10% людей с ХЛЛ. ХЛЛ с делецией 17p — это форма ХЛЛ, которую сложнее лечить с помощью традиционной химиотерапии.
Какова роль гистологического исследования в диагностике острого гастрита?
Автор
Сара Эль-Накип, доктор медицины Доцент, отделение гастроэнтрологии и гепатологии, отделение внутренней медицины, медицинский факультет, Университет Айн-Шамс, Египет
Раскрытие: Ничего не разглашать.
Специальная редакционная коллегия
Франсиско Талавера, фармацевт, доктор философии Адъюнкт-профессор, Фармацевтический колледж Медицинского центра Университета Небраски; Главный редактор Medscape Drug Reference
Раскрытие информации: Получил зарплату от Medscape за работу. для: Medscape.
для: Medscape.
Главный редактор
BS Ананд, доктор медицины Профессор кафедры внутренней медицины, отделение гастроэнтерологии, Медицинский колледж Бейлора
BS Ананд, доктор медицинских наук, является членом следующих медицинских обществ: Американской ассоциации по изучению заболеваний печени, Американского колледжа гастроэнтерологии , Американская гастроэнтерологическая ассоциация, Американское общество эндоскопии желудочно-кишечного тракта
Раскрытие: Ничего не говорится.
Дополнительные участники
Винсент В. Ян, доктор медицины, доктор медицины Р. Брюс Лог, профессор, директор отделения болезней органов пищеварения, медицинский факультет, профессор гематологии и онкологии, Институт рака Уиншип, Медицинский факультет Университета Эмори
Винсент В. Ян, доктор медицины, доктор философии является членом следующих медицинских обществ: Alpha Omega Alpha, Ассоциация американских врачей, Американская гастроэнтерологическая ассоциация, Американское общество клинических исследований
Раскрытие информации: не подлежит разглашению.
Вакар А. Куреши, доктор медицины, FRCP (Великобритания), FACP, FACG, FASGE Профессор медицины, заведующий эндоскопией, отделение внутренней медицины, отделение гастроэнтерологии, Медицинский колледж Бейлора
Вакар А. Куреши, доктор медицины, FRCP ( UK), FACP, FACG, FASGE является членом следующих медицинских обществ: Американского колледжа гастроэнтерологии, Американского колледжа врачей, Американской гастроэнтерологической ассоциации, Американского общества гастроэнтерологической эндоскопии
Раскрытие информации: не раскрывать.
Gwendolyn Sarver
Раскрытие информации: Ничего не раскрывать.
Mohammad Wehbi, MD Адъюнкт-профессор медицины, младший директор программы, отделение гастроэнтерологии, Медицинский факультет Университета Эмори; Заведующий отделением гастроэнтерологии, Медицинский центр по делам ветеранов Атланты
Мохаммад Вехби, доктор медицины, является членом следующих медицинских обществ: Американского колледжа врачей, Американской гастроэнтерологической ассоциации, Американской медицинской ассоциации
Раскрытие информации: не раскрывать.
Камил Обидин, MD Доцент медицины, Отделение болезней органов пищеварения, Медицинский факультет Университета Эмори; Консультант отдела эндоскопии желудочно-кишечного тракта, Медицинский центр по делам ветеранов Атланты
Камил Обидин, доктор медицинских наук, является членом следующих медицинских обществ: Американского колледжа гастроэнтерологии, Американской гастроэнтерологической ассоциации, Американского общества гастроэнтерологической эндоскопии
Раскрытие информации: раскрывать нечего.
Сунил Дача, MBBS, MD Персонал Дома, Отделение болезней пищеварения, Медицинская школа Университета Эмори
Сунил Дача, MBBS, MD является членом следующих медицинских обществ: Американский колледж гастроэнтерологии, Американский колледж врачей, Американский Гастроэнтерологическая ассоциация, Американское общество эндоскопии желудочно-кишечного тракта
Раскрытие: Ничего не разглашать.
Благодарности
Николь М. Григлионе, доктор медицины , научный сотрудник отделения гастроэнтерологии, медицинский факультет, медицинский факультет Университета Эмори,
Николь М. Григлионе, доктор медицины, является членом следующих медицинских обществ: Американской медицинской ассоциации и Медицинского общества штата Иллинойс
Раскрытие: Ничего не раскрывать.
Ричард Х. Снайдер, доктор медицины Заместитель председателя, программный директор, департамент медицины, больница общего профиля Норфолка; Доцент кафедры внутренней медицины Медицинской школы Восточной Вирджинии
Ричард Снайдер, доктор медицины, является членом следующих медицинских обществ: Американский колледж врачей
webmd.com»> Раскрытие: Ничего не раскрывать.
Гистологический анализ клеток мезотелиомы
Гистология мезотелиомы
Гистология — это исследование тканей и клеток под микроскопом.Гистологический анализ злокачественной ткани — бесценный инструмент в диагностике мезотелиомы пациента, а также в наблюдении за ходом различных видов лечения. Подразделом гистологии, который более точно определяет исследование раковых клеток, является гистопатология, которая определяется как исследование пораженной ткани под микроскопом.
Роль гистологии в диагностике рака
Хотя внешне видимые симптомы могут указывать на рак, гистологический отчет необходим для проверки каждого диагноза мезотелиомы.Гистологи используют образцы ткани, взятые у пациента, для выявления раковых клеток; сбор — это процесс, известный как биопсия. При некоторых типах рака биопсию ткани можно получить хирургическим путем, эндоскопией или взятием образцов кожи, но мезотелиома (и некоторые другие виды рака) почти всегда диагностируются с помощью игольной биопсии, при которой для сбора клеток из мезотелия используется шприц.
Наличие опухоли не обязательно указывает на рак. Фактически, большинство опухолей в организме не являются злокачественными.Доброкачественная мезотелиома встречается редко. Для определения клеточной основы этих опухолей и того, являются ли они злокачественными, необходимо выполнить гистологический отчет.
После получения биопсии образец ткани помещают в консервирующую жидкость, называемую формалином. Образец запечатывается, маркируется и затем передается в лабораторию патологии. В лаборатории образец исследуют без помощи микроскопа. Могут быть записаны основные характеристики образца, включая размер и цвет.Некоторые из этих внешне видимых особенностей могут указывать на конкретный тип рака и помогать гистологу сузить возможные типы рака.
После визуального осмотра биопсия обрабатывается и помещается в форму с горячим парафином. Когда этот воск остывает, образец фиксируется на месте и защищается от загрязнения. Затем тонкие пластинки этого воска вырезают и помещают под микроскоп для исследования. Для улучшения видимости клеточной ткани могут применяться различные типы красителей.
Когда этот воск остывает, образец фиксируется на месте и защищается от загрязнения. Затем тонкие пластинки этого воска вырезают и помещают под микроскоп для исследования. Для улучшения видимости клеточной ткани могут применяться различные типы красителей.
После завершения этого процесса подготовки гистолог рассматривает образец с помощью микроскопа.Гистолог будет искать уникальные характеристики раковых клеток, чтобы подтвердить диагноз рака. Различные типы рака обладают уникальными клеточными характеристиками, которые обычно позволяют диагностировать точный тип рака.
Пятна для специализированной гистологии
Специальная гистологическая окраска может дополнительно помочь гистологу в постановке диагноза. Гистохимические красители предназначены для привлечения и связывания определенных веществ, которые чрезмерно представлены в уникальных типах раковых клеток.Например, аденокарциномы выделяют слизь. Чтобы легче идентифицировать этот побочный продукт, используется пятно, которое привлекает слизь (пятно муцикармина).
Иммуно-гистохимические красители используют свойство связывания антитела / антигена только для изменения цвета тех клеток, в которых происходит связывание. Поскольку определенные антитела присутствуют только в раковых клетках, это помогает различать здоровые и нездоровые клетки. Иммуно-гистохимические красители используются для различения типов клеток саркоматоидной и эпитиальной мезотелиомы.Эта информация важна для онколога, планирующего схему лечения.
Гистологические характеристики раковых клеток
Патологоанатомы могут искать несколько широких признаков, указывающих на наличие раковых клеток. К ним относятся:
- Ненормальный размер: раковые клетки обычно больше или меньше здоровых клеток
- Аномальное ядро: ядра раковых клеток часто больше и темнее, чем у здоровых клеток (это связано с перепроизводством ДНК)
- Беспорядочное расположение: раковые клетки могут упорядочивать себя более беспорядочно, чем здоровые клетки
Гистопатология
Что такое гистопатология?
Гистопатология — это диагностика и изучение заболеваний тканей, включающая исследование тканей и / или клеток под микроскопом. Гистопатологи несут ответственность за диагностику тканей и помогают клиницистам управлять уходом за пациентом.
Гистопатологи несут ответственность за диагностику тканей и помогают клиницистам управлять уходом за пациентом.
Почему важна гистопатология?
Гистопатологи — это врачи, которые тесно сотрудничают с другими клиническими специалистами. Они могут поставить диагноз, исследуя небольшой кусочек ткани кожи, печени, почек или другого органа. Это называется биопсией.
Они внимательно изучают ткань под микроскопом в поисках изменений в клетках, которые могут объяснить причину болезни пациента.Ежегодно в Великобритании исследуется около 20 миллионов гистопатологических слайдов.
Диагноз рака
Гистопатологи предоставляют услуги диагностики рака; они обрабатывают клетки и ткани, удаленные из подозрительных « бугорков и шишек », идентифицируют природу аномалии и, в случае злокачественности, предоставляют врачу информацию о типе рака, его степени и, для некоторых видов рака, о его реакции на определенные методы лечения .
С помощью сложных методов визуализации теперь можно получить биопсию ткани из ранее недоступных участков, таких как поджелудочная железа или забрюшинное пространство (за
брюшина, оболочка, выстилающая брюшную полость).Затем ткань обрабатывают, обычно в течение ночи, прежде чем исследовать под микроскопом. В определенных ограниченных обстоятельствах с использованием специальных методов образец можно исследовать немедленно. В условиях быстро меняющихся тенденций развития молекулярной патологии патологи лидируют с новыми методами, такими как флуоресцентная гибридизация in-situ.
(FISH) и полимеразной цепной реакции (ПЦР) для картирования генетического материала в тканях или опухолях, которые необходимы для лечения многих видов рака.
Роль гистопатолога
Многие гистопатологи специализируются на определенных органах, таких как печень или кожа, рассекая («разрезая» или «обрезая») ткани для ежедневного наблюдения под микроскопом. Для больших образцов, таких как образцы кишечника или груди после операции, они препарируются, чтобы выбрать наиболее подходящие области для исследования под микроскопом. Гистопатологи пишут отчеты об образцах, обращаются к литературе (результаты прошлых и текущих исследований), а многие также занимаются преподаванием и исследованием.
Гистопатологи пишут отчеты об образцах, обращаются к литературе (результаты прошлых и текущих исследований), а многие также занимаются преподаванием и исследованием.
Они также будут посещать междисциплинарные встречи, чтобы их выводы можно было обсудить с другими клиницистами. Затем процедуры детально планируются и адаптируются к каждому пациенту.
Гистопатологи также работают напрямую с пациентами, например, они могут выполнять такие процедуры, как тонкая игла в клиниках головы и шеи или груди. На них все чаще ложатся ключевые обязанности по скринингу рака, в настоящее время на рак груди, кишечника и шейки матки, и в ближайшем будущем ожидается появление других программ.
Гистопатологи также исследуют клетки в мазках, аспиратах или биологических жидкостях (цитопатология), например, в мазках мочи или шейки матки. Другие узкие специальности включают судебную патологию, невропатологию и педиатрическую патологию.
За своим столом я делаю несколько дел под микроскопом, диктуя отчеты по ходу дела. Обычно я подстригаюсь утром. Моими интересами являются патология печени / поджелудочной железы и головы и шеи, поэтому я могу смотреть на печень, удаленную при трансплантации, частичную резекцию печени или резекцию поджелудочной железы по поводу опухоли.
Гистологическое исследование драгоценных кораллов с архипелага Рюкю
В этой статье мы изучили гистологию трех коммерчески ценных видов драгоценных кораллов ( Paracorallium japonicum , Corallium elatius, и C. konojoi ) с архипелага Рюкю. Чтобы наблюдать их внутреннюю структуру, образцы были разрезаны на тонкие срезы и исследованы с помощью цифрового светового микроскопа. Колонии C.konojoi имел более толстую цененхиму и более крупные автозооиды, чем у C. elatius и P. japonicum . Склериты трех видов имели тенденцию концентрироваться во внешних слоях цененхимы. У автозооидов всех трех видов полости желудка оказались относительно пустыми. Некоторые симбиотические полихаты наблюдались на оси P. japonicum . Кроме того, зоантид ( Corallizoanthus tsukaharai ) часто встречался, живущим на поверхности цененхимы P.japonicum . Надеемся, что наши наблюдения послужат хорошей основой для будущих исследований японских кораллов Coralliidae.
Некоторые симбиотические полихаты наблюдались на оси P. japonicum . Кроме того, зоантид ( Corallizoanthus tsukaharai ) часто встречался, живущим на поверхности цененхимы P.japonicum . Надеемся, что наши наблюдения послужат хорошей основой для будущих исследований японских кораллов Coralliidae.
1. Введение
Виды родов Corallium и Paracorallium (подкласс Octocorallia, отряд Alcyonacea, семейство Coralliidae) хорошо известны своими красными или розовыми скелетами, которые с древних времен использовались для украшения, медицины, талисманов и т. Д. и валюта. Поэтому они издавна известны как «драгоценные кораллы». Драгоценные кораллы добывали в Средиземном море на протяжении как минимум 5000 лет, а добывали даже 30 000 лет назад или более.Изделия, сделанные из Corallium rubrum (Linnaeus, 1758), обнаружены в памятнике каменного века, возрастом приблизительно 25 000 лет в Германии [1], а драгоценные кораллы и раковины были найдены в руинах возрастом приблизительно 30 000 лет в Лозанне, Швейцария [2]. Первое упоминание о сборе драгоценных кораллов в Японии относится к 1812 году, когда рыбак нашел запутавшийся в сети драгоценный коралл у Мурото, префектура Коти, и добыча продолжается по сей день в регионах Коти, Кагосима и Окинава.Общеизвестно, что биомасса драгоценных кораллов была уменьшена из-за чрезмерного вылова рыбы, но информации о биологии видов из японских водоемов мало.
Опубликованы некоторые таксономические исследования японских видов [например, [3–11]]. Что касается биологической информации, Григг [12], Косуге [1], Ивасаки и Судзуки [13] представили данные о росте. Ueno et al. [14], Ивасе [15], Нонака и др. [16] сообщили о выращивании драгоценных кораллов в аквариумах.Недавно Ивасаки [17] отредактировал обширную публикацию о научных, культурных и исторических перспективах кораллов Coralliidae.
Однако никаких исследований по гистологии и анатомии драгоценных японских кораллов не проводилось, за исключением работы, выполненной Кишиноу [7, 8]. Его «Санго но кэнкю (на японском языке)» и «Заметки о естественной истории кораллов (то же содержание предыдущей публикации, переведенной на английский язык)» были первой и последней публикациями, описывающими общую биологию японских драгоценных кораллов.В этой работе есть некоторые комментарии к анатомическим особенностям трех японских видов: P. japonicum (Kishinouye, 1903) , C. elatius (Ridley, 1882) и C. konojoi Kishinouye, 1903. Кишиноуе обнаружил, что автозооиды и сифонозооиды, сообщающиеся друг с другом через сосудистые каналы, сифонозооиды имели репродуктивные элементы и, следовательно, сообщили, что сифонозооиды были не незрелыми автозооидами, а другим органом, который принимает участие в воспроизводстве. Кишиноуе также включил рисунки секций колонии каждого из этих видов, собранные в Японии.За пределами Японии Lacaze-Duthiers [18] описал анатомию C. rubrum (Средиземноморье) и включил рисунки разделенной ветви и личинок полипа, вынашивающих потомство. Хиксон [19] включает схему поперечного сечения ответвления C. reginae Hickson, 1905 из моря Флорес, Индонезия. Grillo et al. [20] проанализировали образование оси и склерита у C. rubrum , включая некоторые микрофотографии гистологических срезов. Недавно Симпсон и Уотлинг [21] описали два новых вида Coralliidae с гистологическими срезами C.Bathyrubrum [21]. Они препарировали образцы и показали, что каналы функционируют в связи между полипами [21]. Также недавно Debreuil et al. [22] представили поперечные срезы осевых скелетов с окраской толуидиновым синим C. rubrum , а также сечения осей видов Corallium для сравнения, C. secundum Dana, 1846 (с Гавайев) и два японских вида: C. konojoi и C. elatius .
Его «Санго но кэнкю (на японском языке)» и «Заметки о естественной истории кораллов (то же содержание предыдущей публикации, переведенной на английский язык)» были первой и последней публикациями, описывающими общую биологию японских драгоценных кораллов.В этой работе есть некоторые комментарии к анатомическим особенностям трех японских видов: P. japonicum (Kishinouye, 1903) , C. elatius (Ridley, 1882) и C. konojoi Kishinouye, 1903. Кишиноуе обнаружил, что автозооиды и сифонозооиды, сообщающиеся друг с другом через сосудистые каналы, сифонозооиды имели репродуктивные элементы и, следовательно, сообщили, что сифонозооиды были не незрелыми автозооидами, а другим органом, который принимает участие в воспроизводстве. Кишиноуе также включил рисунки секций колонии каждого из этих видов, собранные в Японии.За пределами Японии Lacaze-Duthiers [18] описал анатомию C. rubrum (Средиземноморье) и включил рисунки разделенной ветви и личинок полипа, вынашивающих потомство. Хиксон [19] включает схему поперечного сечения ответвления C. reginae Hickson, 1905 из моря Флорес, Индонезия. Grillo et al. [20] проанализировали образование оси и склерита у C. rubrum , включая некоторые микрофотографии гистологических срезов. Недавно Симпсон и Уотлинг [21] описали два новых вида Coralliidae с гистологическими срезами C.Bathyrubrum [21]. Они препарировали образцы и показали, что каналы функционируют в связи между полипами [21]. Также недавно Debreuil et al. [22] представили поперечные срезы осевых скелетов с окраской толуидиновым синим C. rubrum , а также сечения осей видов Corallium для сравнения, C. secundum Dana, 1846 (с Гавайев) и два японских вида: C. konojoi и C. elatius .
Кораллы Octocorallia делятся на три систематических отряда: Helioporacea (синие кораллы), Alcyonacea (мягкие кораллы и морские вееры) и Pennatulacea (морские загоны) [23].Отряд Alcyonacea делится на пять подотрядов: Protoalcyonaria, Alcyoniina, Scleraxonia, Holaxonia и Calcaxonia.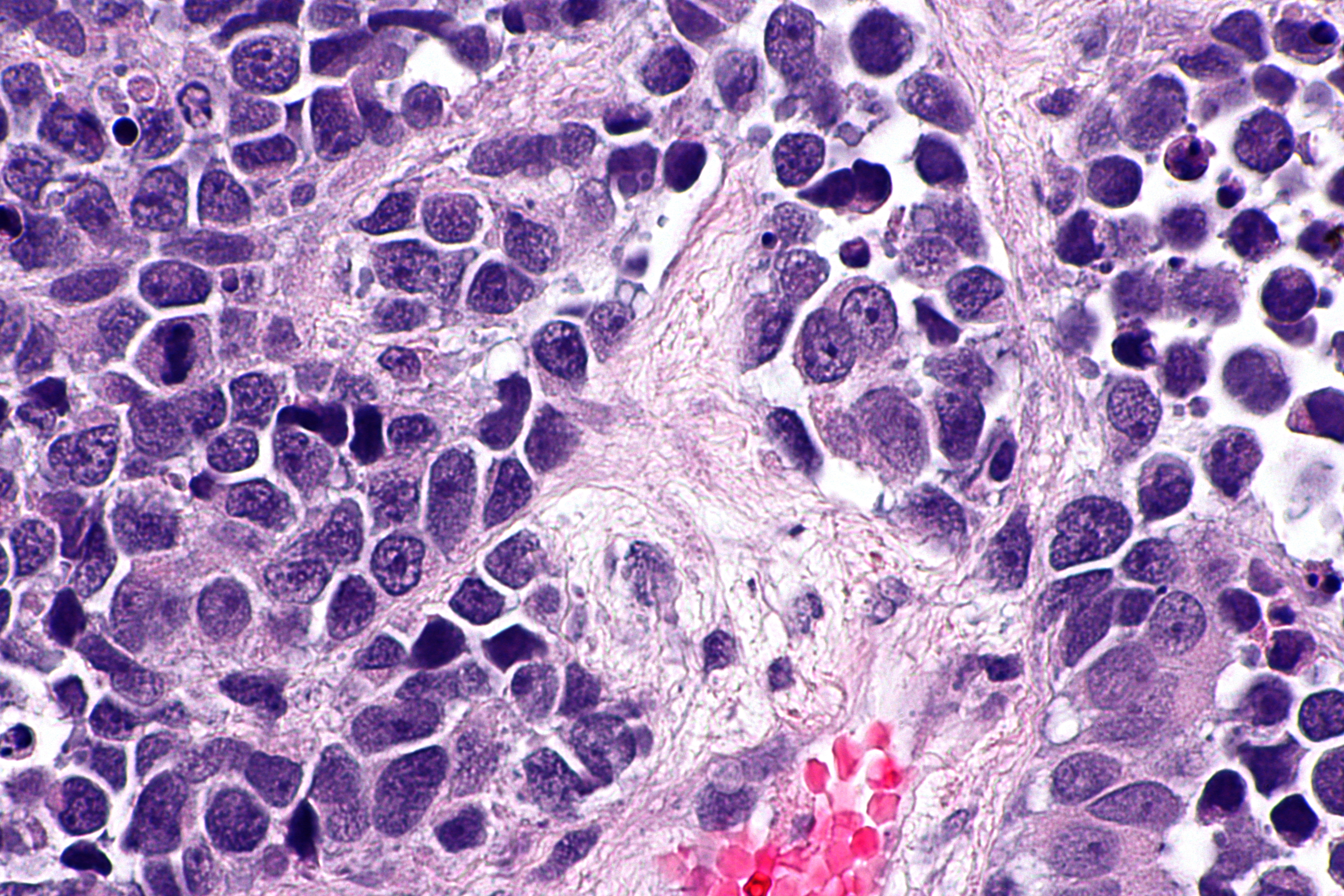 Эти подотряды разграничиваются содержанием их осевой структуры; подотряды Protoalcyonaria и Alcyoniina не имеют осевого скелета; подотряд Scleraxonia имеет оси со свободными осевыми склеритами; подотряд Holaxonia имеет сплошные сплошные оси без свободных осевых склеритов с полым межкамерным центральным ядром; подотряд Calcaxonia имеет сплошные оси без свободных осевых склеритов и без центрального ядра [23, 24].Есть некоторые исключения: Keroeididae с осевым склеритом, несмотря на принадлежность к подотряду Holaxonia [25], и Keratoisdinae (Isididae) с полым центральным ядром, несмотря на принадлежность к подотряду Calcaxonia [26]. Семейство Coralliidae относится к отряду Alcyonacea подотряда Scleraxonia [23]. Музик и Уэйнрайт [27] показали схематические срезы некоторых образцов Alcyonacea octocorals, включая два вида склерксонов: Subergorgia suberosa (Pallas, 1766) и Melithaea ochracea (Linnaeus, 1758).Анатомия и гистология карибского холаксонского вида Plexaura homomalla (Esper, 1794) были подробно изучены с 62 красивыми изящными рисунками [28]. Эти работы Музика и Уэйнрайта [27] и Байера [28] хороши для сравнения с настоящим исследованием. В нескольких публикациях описаны детали общей анатомии горгоний и включены подробные рисунки схематических разделов (например, [29, 30]).
Эти подотряды разграничиваются содержанием их осевой структуры; подотряды Protoalcyonaria и Alcyoniina не имеют осевого скелета; подотряд Scleraxonia имеет оси со свободными осевыми склеритами; подотряд Holaxonia имеет сплошные сплошные оси без свободных осевых склеритов с полым межкамерным центральным ядром; подотряд Calcaxonia имеет сплошные оси без свободных осевых склеритов и без центрального ядра [23, 24].Есть некоторые исключения: Keroeididae с осевым склеритом, несмотря на принадлежность к подотряду Holaxonia [25], и Keratoisdinae (Isididae) с полым центральным ядром, несмотря на принадлежность к подотряду Calcaxonia [26]. Семейство Coralliidae относится к отряду Alcyonacea подотряда Scleraxonia [23]. Музик и Уэйнрайт [27] показали схематические срезы некоторых образцов Alcyonacea octocorals, включая два вида склерксонов: Subergorgia suberosa (Pallas, 1766) и Melithaea ochracea (Linnaeus, 1758).Анатомия и гистология карибского холаксонского вида Plexaura homomalla (Esper, 1794) были подробно изучены с 62 красивыми изящными рисунками [28]. Эти работы Музика и Уэйнрайта [27] и Байера [28] хороши для сравнения с настоящим исследованием. В нескольких публикациях описаны детали общей анатомии горгоний и включены подробные рисунки схематических разделов (например, [29, 30]).
Таким образом, в настоящее время существует лишь старая и ограниченная информация о гистологии и анатомии видов японских Coralliidae.В этом исследовании мы стремимся прояснить гистологическую биологию Coralliidae из Японии и, в частности, трех промысловых видов архипелага Рюкю.
2. Материалы и методы
2.1. Отбор проб
Пробы были собраны на архипелаге Рюкю, самом южном регионе Японии (рис. 1). В северной части архипелага (к югу от островов Кагосима и включая острова Амами) образцы были собраны с пилотируемой подводной лодки на глубинах примерно от 100 до 300 метров.В южной части архипелага (включая острова Окинава, острова Мияко и Исигаки) образцы были собраны с помощью дистанционно управляемого транспортного средства (ROV). Поскольку коллекции собирались частной компанией, ищущей большие колонии для коммерческих целей, выборка не была случайной. Вместо этого выборочно собирали большие колонии, и данные об окружающей среде (глубина, температура воды, тип субстрата, приблизительные широты мест сбора) регистрировались для области, непосредственно отобранной для сбора.С 4 июня 2005 г. по 1 марта 2006 г. было собрано 83 экземпляра, а с 23 июня 2007 г. по 1 сентября 2009 г. было собрано 105 экземпляров. Данные об окружающей среде и размер всей колонии (высота, ширина и удерживающие диаметры) были представлены в предыдущей публикации [31]. Пробы были разделены на ценные части (основные части колоний) и неоцененные части (сломанные кончики ветвей; длиной до 15 см). Первые использовались в коммерческих целях, а вторые были сохранены и исследованы в данном исследовании. Все экземпляры (кончики веток) хранятся в коллекции Okinawa Churaumi Aquarium.
Поскольку коллекции собирались частной компанией, ищущей большие колонии для коммерческих целей, выборка не была случайной. Вместо этого выборочно собирали большие колонии, и данные об окружающей среде (глубина, температура воды, тип субстрата, приблизительные широты мест сбора) регистрировались для области, непосредственно отобранной для сбора.С 4 июня 2005 г. по 1 марта 2006 г. было собрано 83 экземпляра, а с 23 июня 2007 г. по 1 сентября 2009 г. было собрано 105 экземпляров. Данные об окружающей среде и размер всей колонии (высота, ширина и удерживающие диаметры) были представлены в предыдущей публикации [31]. Пробы были разделены на ценные части (основные части колоний) и неоцененные части (сломанные кончики ветвей; длиной до 15 см). Первые использовались в коммерческих целях, а вторые были сохранены и исследованы в данном исследовании. Все экземпляры (кончики веток) хранятся в коллекции Okinawa Churaumi Aquarium.
2.2. Идентификационные данные
Все образцы были идентифицированы по принятым морфологическим признакам, таким как цвет, структура ветвления, расположение и размер полипов, а также форма и размер склеритов. Цвет колоний и характер ветвления исследовали по фотографиям на месте или с борта с помощью шкалы. Расположение и детали полипа наблюдали и измеряли с помощью светового микроскопа. Размеры и форму склеритов документировали методами световой и сканирующей электронной микроскопии. Идентификация образцов проводилась по методикам Ridley [3], Kishinouye [5–8], Bayer [9], Bayer and Cairns [10], Nonaka and Muzik [11] и Nonaka et al.[32]. В Японии семь видов входят в семейство Coralliidae, шесть описаны Кишинуйе [4–8] и один вид — Ридли [3]. В этом исследовании мы изучали только виды, имеющие коммерческую ценность; а именно, P. japonicum , C. elatius и C. konojoi .
2.3. Наблюдение гистологических срезов, поверхности цененхимы и склеритов в цененхиме
Исходные образцы были сохранены в чистом этаноле, так как образцы хранились не только для гистологических исследований, но и для других исследований, включая молекулярные анализы. Небольшие образцы (длиной примерно 10–20 мм) для изготовления срезов отделяли от исходных образцов и декальцинировали в растворе Буэна. Образцы заливали парафином. Затем из тканей делали тонкие срезы (7 мкм, мкм), помещали на предметные стекла, окрашивали гематоксилином и эозином. Подготовленные образцы наблюдали и фотографировали с помощью цифрового микроскопа (Keyence VHX). Байер [28], Музик и Уэйнрайт [27] упоминались во время наших микроскопических наблюдений. Диаметр как автозооидов, так и сифонозооидов, толщина цененхимы и т. Д., были измерены с помощью дополнительного программного обеспечения цифрового микроскопа. В серийных срезах одного и того же автозооида или сифонозооида было выбрано наибольшее измерение, представляющее его фактический размер.
Небольшие образцы (длиной примерно 10–20 мм) для изготовления срезов отделяли от исходных образцов и декальцинировали в растворе Буэна. Образцы заливали парафином. Затем из тканей делали тонкие срезы (7 мкм, мкм), помещали на предметные стекла, окрашивали гематоксилином и эозином. Подготовленные образцы наблюдали и фотографировали с помощью цифрового микроскопа (Keyence VHX). Байер [28], Музик и Уэйнрайт [27] упоминались во время наших микроскопических наблюдений. Диаметр как автозооидов, так и сифонозооидов, толщина цененхимы и т. Д., были измерены с помощью дополнительного программного обеспечения цифрового микроскопа. В серийных срезах одного и того же автозооида или сифонозооида было выбрано наибольшее измерение, представляющее его фактический размер.
Для подтверждения данных мы также исследовали детали поверхности образцов (цененхимы, полипы, оси и склериты) с помощью сканирующего электронного микроскопа. Для этого склериты и оси были разделены и очищены 5% раствором гипохлорита натрия (бытовой отбеливатель). Обследование проводилось с помощью СЭМ низковольтного типа (Keyence VE-8800).
Диаграммы трех исследованных видов были составлены из изображений, полученных с помощью цифрового микроскопа и сканирующего электронного микроскопа.
2.4. Анализ данных
Тест Стьюдента t использовался для анализа различий в толщине цененхимы между передней и задней сторонами каждого вида. Статистический анализ проводился с использованием MS Excel.
3. Результаты
3.1. Идентификации
Мы идентифицировали 75 колоний как P.japonicum , 61 колония как C. elatius и 27 колоний как C. konojoi (рис. 2).
3.2. Наблюдение и измерение гистологических срезов
3.2.1. Paracorallium japocicum (японское название: Aka-Sango)
Образцы этого вида имели шероховатую поверхность цененхимы (рис. 3), в среднем толщиной 0,15 мм (± 0,04 SD, = 29), но цененхима была несколько толще на концах. веточек (рисунок 4). На поверхности цененхимы присутствовало много бородавок (рис.3, 4 и 5), в среднем 0.12 мм в высоту (± 0,024 SD, = 14). На гистологических срезах в цененхиме наблюдали множество мелких отверстий (рис. 5), в среднем 0,041 мм в диаметре. В цененхиме есть несколько мезоглоэальных отверстий [27, 28], но мезоглоя была мелкой и имела точечный рисунок при таком увеличении (Рис. 5). Склериты образцов были приблизительно 0,050 мм в длину при исследовании с помощью SEM (рис. 6). Таким образом, мы пришли к выводу, что отверстия представляют собой лакуны, оставшиеся после декальцификации склеритов.Склериты, заполняющие цененхиму, обычно располагались ближе к поверхностной стороне (рис. 5). В поперечных срезах более крупные отверстия (рис. 5) встречались чаще, чем в склеритах, а на продольных сечениях эти отверстия выглядели овальными, удлиненными или образовывали более длинные «каналы», в среднем 0,078 мм в ширину (± 0,022 SD, = 11), и они были параллельны оси (рис. 4; вверху). Они присоединились к организациям автозооидов и сифонозооидов, и они, как правило, были близки к осевой стороне (рис. 4 и 5).
веточек (рисунок 4). На поверхности цененхимы присутствовало много бородавок (рис.3, 4 и 5), в среднем 0.12 мм в высоту (± 0,024 SD, = 14). На гистологических срезах в цененхиме наблюдали множество мелких отверстий (рис. 5), в среднем 0,041 мм в диаметре. В цененхиме есть несколько мезоглоэальных отверстий [27, 28], но мезоглоя была мелкой и имела точечный рисунок при таком увеличении (Рис. 5). Склериты образцов были приблизительно 0,050 мм в длину при исследовании с помощью SEM (рис. 6). Таким образом, мы пришли к выводу, что отверстия представляют собой лакуны, оставшиеся после декальцификации склеритов.Склериты, заполняющие цененхиму, обычно располагались ближе к поверхностной стороне (рис. 5). В поперечных срезах более крупные отверстия (рис. 5) встречались чаще, чем в склеритах, а на продольных сечениях эти отверстия выглядели овальными, удлиненными или образовывали более длинные «каналы», в среднем 0,078 мм в ширину (± 0,022 SD, = 11), и они были параллельны оси (рис. 4; вверху). Они присоединились к организациям автозооидов и сифонозооидов, и они, как правило, были близки к осевой стороне (рис. 4 и 5).
Все автозооиды у исследованных экземпляров были контрактными. Контрактные автозооиды были покрыты тонкой цененхимой, состоящей из множества склеритов, которые на поверхности выглядели бугристыми (рис. 7). В последнее время при описании Coralliidae стали использовать термин «цененхимный холм» [32, 33]. Цененхимные бугры были почти однородными по форме и размеру (рис. 3 и 4). Диаметр в среднем составлял 1,0 мм (± 0,12 SD, = 45), а их высота составляла в среднем 0.47 мм (± 0,11 SD, = 35). У автозооидов были щупальца, полости желудка, мышечная ткань и брыжейки (рис. 7). Их желудочные полости были пусты. В части щупалец было много мелких отверстий, похожих на те, что видны в цененхиме. Эти отверстия могли быть следами склеритов (рис. 7).
Сифонозооиды имели неразвитые перегородки и структуры, подобные крышечкам, внутри своих отверстий. Отверстия на поверхности были мельчайшими (Рисунок 5), а их средний диаметр равнялся 0.046 мм (± 0,016 SD, 𝑛 = 43). Сифонозооиды были различной формы и размера, некоторые из которых образовывали «холмики» на поверхности (рис. 5), а некоторые — под автозооидами (рис. 7; вверху). Некоторые сифонозооиды нельзя было отличить от каналов на поперечных срезах. У некоторых особей сифонозооиды становятся больше, потому что у них есть дифференцированные гонады (рис. 5 и 7).
Отверстия на поверхности были мельчайшими (Рисунок 5), а их средний диаметр равнялся 0.046 мм (± 0,016 SD, 𝑛 = 43). Сифонозооиды были различной формы и размера, некоторые из которых образовывали «холмики» на поверхности (рис. 5), а некоторые — под автозооидами (рис. 7; вверху). Некоторые сифонозооиды нельзя было отличить от каналов на поперечных срезах. У некоторых особей сифонозооиды становятся больше, потому что у них есть дифференцированные гонады (рис. 5 и 7).
Осевой каркас был декальцинирован и, следовательно, выглядел как большой зазор в центре колоний на подготовленных предметных стеклах.Осевые скелеты были овальными или закругленными в поперечных сечениях (Рисунок 8), но неправильной формы на концах ветвей (Рисунок 4; внизу, Рисунок 9). При исследовании с помощью SEM поверхность осей была слегка продольно рифленой (рис. 8; вверху), с канавками на расстоянии в среднем 0,171 мм друг от друга (± 0,045 стандартное отклонение, = 26) и покрыта мелкими бугорками, украшенными шипами (рис. Рисунок 8; внизу). Эти осевые бороздки формируют каналы в цененхиме (рис. 4; внизу). Ямок под автозооидами у наших экземпляров почти не было.Некоторые образцы декальцинированы не полностью, поэтому осевую структуру можно было наблюдать. Некоторые кольца были обнаружены вокруг центра оси в поперечных сечениях (рис. 9).
В 21 образце наблюдались неизвестные комменсальные животные, встроенные в ось. Эти организмы напоминали полихет, поскольку у них были кольцевые структуры, а у одной особи были структуры в виде гонад в теле (рис. 10). Эти организмы населяли «гнездо», которое, казалось, было либо просверлено через ось хозяина, либо ось выделялась и росла вокруг комменсалов (рис. 11).На поверхности цененхимы мы могли найти гораздо более крупные, неоктокораллийные полипы, растущие на двух экземплярах, причем один из этих экземпляров потенциально имеет свои собственные гонады (рис. 12). Эти полипы оказались зоантидами вида Corallizoanthus tsukaharai Reimer, 2008 (рис.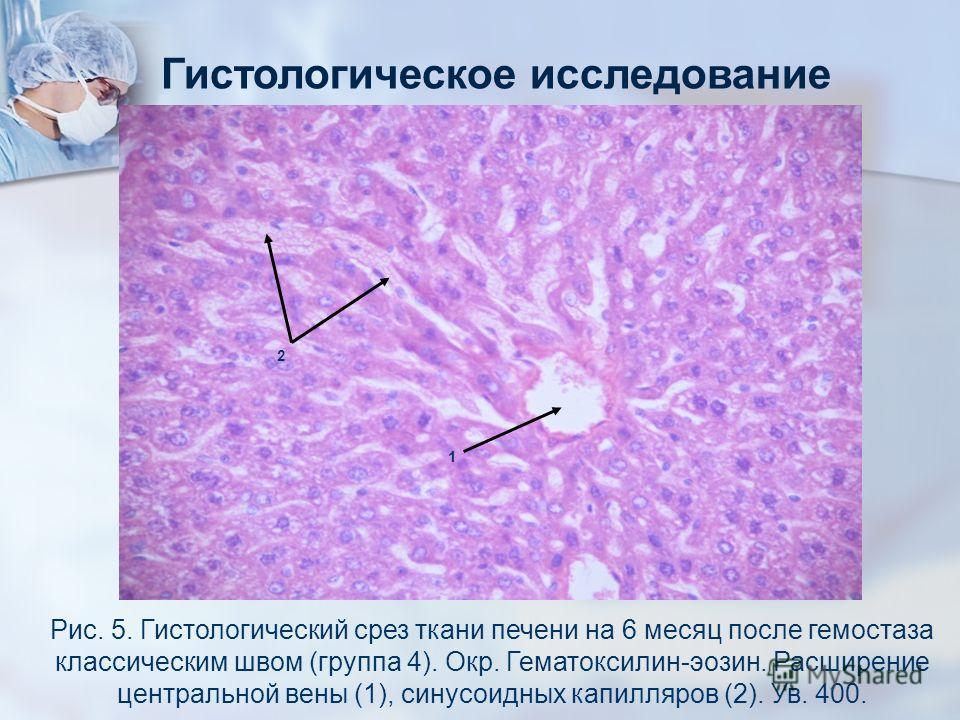 13) [34].
13) [34].
На рисунке 14 показана диаграмма P. japonicum , построенная на основе результатов этих наблюдений и измерений.
3.2.2. Corallium elatius (Японское название: Momoiro-Sango)
Этот вид имел довольно гладкую поверхность цененхимы (Рисунок 15), в среднем толщиной 0,51 мм (± 0,16 SD, = 65) (Рисунок 16). Цененхима была толще на стороне с автозооидами, в среднем 0,54 мм (± 0,16 SD, = 37), чем на задней (без автозооидов) стороне, в среднем 0,47 мм (± 0,15 SD, = 28). но достоверных отличий не было ( t -тест,> 0.05) между толщинами цененхимы двух сторон. В цененхиме на гистологических срезах наблюдали множество мелких отверстий диаметром примерно 0,06 мм (рис. 17). При исследовании SEM склериты образцов были приблизительно 0,05-0,06 мм в длину (рис. 18), поэтому мы пришли к выводу, что отверстия были декальцифицированными склеритами. Склериты, заполняющие цененхиму, имели тенденцию концентрироваться на поверхности (рис. 17). На поперечных срезах (рис. 16; внизу) были отверстия больше, чем следы склеритов, а на продольных срезах (рис. 16; вверху) отверстия были овальными, удлиненными или образовывали более длинные каналы.Каналы в среднем имели ширину 0,095 мм (± 0,018 SD, = 19) и примерно образовывали две линии вдоль оси и, были соединены в автозооидах и сифонозооидах (Рисунок 16; вверху).
Все автозооиды у исследованных экземпляров были контрактными. Контрактные автозооиды были покрыты тонкой цененхимой, состоящей из множества склеритов (рис. 19; вверху). Они имели форму полушария, и мы назвали их «цененхимальными холмиками» на поверхности цененхимы (рис. 15).Цененхимные холмы были почти однородными по форме и размеру (рис. 15), а их средний диаметр составлял 1,53 мм (± 0,19 SD, = 22), а высота составляла в среднем 0,54 мм (± 0,19 SD, = 22). У автозооидов были щупальца, полости желудка, мышечная ткань и перегородки. Их желудочные полости были пусты. В частях щупалец было много мелких отверстий, которые могли быть следами склеритов (рис. 19; вверху).
Сифонозооиды имели неразвитые перегородки, а внутри отверстий наблюдались структуры, подобные крышечке (рис. 17).Эти отверстия были мельчайшими на поверхности (рис. 17) с диаметром в среднем 0,039 мм (± 0,010 стандартное отклонение, = 23). Внутренности сифонозооидов были различной формы и размеров, в некоторых из них были гонады, и почти все сифонозооиды не выходили на поверхность (рис. 16 и 17). Системы сифонозооидов и каналов можно было различить по их форме и наличию неразвитых перегородок, однако и сифонозооиды, и системы каналов обычно представляли собой отверстия круглой формы в поперечных сечениях.Более того, попытки более детального наблюдения септ на других участках не увенчались успехом. Следовательно, сифонозооиды нельзя было строго отличить от каналов на поперечных срезах (рис. 16; внизу).
Осевые скелеты декальцинировали, и было обнаружено, что в центрах колоний на подготовленных предметных стеклах были большие отверстия. Осевые сечения скелета имели овальную или округлую форму (рис. 16; внизу). На концевых частях ветвей осевых скелетов не наблюдалось.При исследовании с помощью SEM поверхность оси была незаметной с продольными бороздками с интервалом примерно 0,27 мм и покрыта мелкими бугорками, украшенными шипами (рис. 20; внизу). У исследованных в данном исследовании особей не было ям под автозооидами.
На рисунке 21 показана диаграмма C. elatius , основанная на результатах этих наблюдений и измерений.
3.2.3. Corallium konojoi (японское название: Shiro-Sango)
Этот вид имел очень гладкую поверхность цененхимы (рис. 22), среднее значение 0.83 мм (± 0,32 SD, = 43) в толщину (Рисунок 23; вверху), а цененхима была значительно толще на стороне с автозооидами, в среднем 0,94 мм (± 0,34 SD, = 20), по сравнению с задняя (без автозооидов) сторона, которая в среднем составляла 0,74 мм (± 0,28 SD, = 23) ( t -тест, <0,05). Цененхима была гипертрофирована на концах веточек (рис. 23; внизу). В цененхиме на гистологических срезах наблюдалось много мелких отверстий, и их было приблизительно 0.06 мм в диаметре (рисунок 24). При исследованиях с помощью SEM склериты образцов были приблизительно 0,05–0,07 мм в длину (рис. 25), и поэтому мы пришли к выводу, что эти отверстия были декальцифицированными склеритами. Склериты, заполняющие цененхиму, были более плотно распределены на поверхностной стороне, чем на аксиальной стороне. В поперечных срезах (Рисунок 23; внизу) отверстия большего размера наблюдались чаще, чем в склеритах, а в продольном разрезе (Рисунок 23; вверху, Рисунок 24) отверстия выглядели овальными или удлиненными или образовывали более длинные каналы, в среднем 0.Шириной 13 мм (± 0,04 SD, 𝑛 = 20), параллельно оси. Они связаны с организациями автозооидов и сифонозооидов, а также с двумя или тремя слоями в толстой цененхиме (рис. 23; верх, рис. 24).
Все автозооиды у исследованных экземпляров были контрактными. Сокращенные автозооиды были покрыты цененхимными насыпями, которые были почти однородными по форме и размеру (Рисунки 22 и 23), и эти холмы образовывали низкие полушария, покрытые толстой цененхимой, состоящей из множества склеритов (Рисунок 23, Рисунок 26; внизу).Диаметр цененхимальных бугорков составлял в среднем 1,74 мм (± 0,30 стандартное отклонение, = 22), а средняя высота — 0,80 мм (± 0,32 стандартное отклонение, = 13). У автозооидов были щупальца, желудочные полости и брыжейки. Однако их желудочные полости оказались пустыми. В части щупалец было много мелких отверстий, похожих на те, что видны в цененхиме (рис. 26; внизу). Возможно, это были следы склеритов.
Сифонозооиды имели неразвитые перегородки и структуры, подобные крышечкам, внутри отверстий (рис. 24).Отверстия на поверхности были мельчайшими (рис. 24), в среднем 0,045 мм в диаметре (± 0,012 стандартное отклонение, = 16). Внутренности сифонозооидов были различной формы и размера, на некоторых из них были гонады (рис. 24). Сифонозооиды не образовывали полушарий, а некоторые сифонозооиды были распределены вблизи центральной части цененхимы. Некоторые сифонозооиды нельзя было четко отличить от каналов на поперечных срезах.
Осевые скелеты были декальцинированы, и было обнаружено, что в центрах колоний имеются большие отверстия (рис. 23).Поперечные сечения осей были овальными или закругленными (рис. 23; внизу). В конечных частях ветвей осевой каркас отсутствовал. При обследовании с помощью SEM поверхность оси была слегка рифленой в продольном направлении (рис. 27; вверху) с интервалом примерно 0,5 мм и покрыта мельчайшими бугорками, украшенными шипами (рис. 27; внизу). Некоторые образцы были не полностью декальцинированы, и были обнаружены полосы, похожие на годичные кольца, на поперечных срезах (рис. 28).
В одном экземпляре в цененхиме наблюдали животное-комменсал (Platyhelminthes?) (Рис. 29).Однако никаких других организмов в этих экземплярах не обнаружено.
На рисунке 30 показана диаграмма C. konojoi , основанная на результатах наблюдений и измерений.
4. Обсуждение
Единственный отчет гистологического исследования драгоценных японских кораллов был опубликован более 100 лет назад [7, 8]. Хотя наблюдения в этом исследовании проводились с помощью примитивного микроскопа, Кишиноуе дал очень подробный отчет об исследовании с рукописными цифрами.Кишиноуе объяснил, как гонады дифференцируются в сифонозооиды, и что тонкая цененхима P. japonicum имеет простые сосудистые каналы, тогда как толстая цененхима C. elatius имеет два слоя каналов, а толстая цененхима C. konojoi имеет сложную систему с тремя и более слоями каналов [7, 8]. Все эти результаты совпадают с нашими наблюдениями.
В этом исследовании толщину цененхимы и размеры полипов (автозооид и сифонозооид) измеряли с помощью гистологических срезов.Это более точный метод, чем предыдущие исследования, в которых измерялась внешняя морфология. Kishinouye [8] описал толщину цененхимы у трех видов: «тонкий» у P. japonicum и «толстый» у C. elatius и C. konojoi . В данном исследовании мы даем численное значение мощности цененхимы каждого вида. Цененхима P. japonicum была самой тонкой, со средней толщиной 0,15 мм, всего 29% от цененхимы C. elatius , и 18% от C.konojoi — цененхима. По результатам Kishinouye [7, 8] и настоящего исследования, более толстые цененхимы имеют тенденцию иметь более сложные системы сосудистых каналов, тогда как виды, имеющие более тонкие цененхимы, имеют тенденцию иметь шероховатую поверхность с мельчайшими бородавками. Эти результаты предполагают, что существует взаимосвязь между толщиной цененхимы и состоянием поверхности цененхимы. Другими словами, в толстой цененхиме достаточно места для структур, и такие виды имеют сложные органы в своих цененхимах, но, поскольку в тонкой цененхиме нет места, у этих видов структуры должны выступать за поверхность или под ось. .Например, поверхность цененхимы P. japonicum имеет отчетливые холмики цененхимы, покрывающие втянутые автозооиды (Рисунки 3 и 4), и выступы, содержащие сифонозооиды (Рисунки 3 и 5). Точно так же осевые бороздки были обнаружены только в каналах цененхимы P. japonicum (Рисунки 4 и 8). Однако колонии C. konojoi имеют более низкие возвышения цененхимных холмиков и не проецируются сифонозооидные отверстия на их более толстой цененхиме (рис. 22). Возможно, в г.japonicum градусы высоты выступов могут указывать на степень дифференцировки гонад у сифонозооидов.
Музик и Уэйнрайт [27] включают диаграммы некоторых видов октокоралов. На рисунках склераксоновых особей цененхимы полны склеритов. В поперечном сечении склериты располагались близко друг к другу во внешних слоях цененхимы у Subergorgia suberosa , и почти все склериты были распределены во внешних слоях у Melithaea ochracea [27].Grillo et al. [20] показывают микрофотографию среза C. rubrum (рис. 3 (а)) со склеритами, плотно распределенными в эпителиальной части цененхимы. У нас есть аналогичные результаты в этом исследовании; склериты трех видов имели тенденцию концентрироваться во внешних слоях цененхимы (рис. 5, 17 и 24). Это может быть защитная стратегия. Как правило, во внутренних слоях цененхимы у видов альционарий есть системы каналов с твердыми топорами (например, [27–30]), и мы также обнаружили сосудистые каналы в цененхиме исследованных особей.Кораллам может потребоваться свободное пространство для каналов во внутренних слоях цененхимы, а также может потребоваться более высокая плотность склеритов во внешних слоях их цененхимы.
Три вида, изученные в этом исследовании, успешно содержались в неволе более двух лет в Окинавском аквариуме Тюрауми, и было показано, что автозооиды ловят замороженных копепод в аквариуме [16]. Таким образом, мы рассчитывали найти добычу в желудочных полостях автозооидов. Однако в этом исследовании исследуемые нами полости желудка в основном были пустыми.В исследовании драгоценного средиземноморского коралла, C. rubrum , кишечник особей содержал в основном органическое вещество в виде детрита, а также фрагменты ракообразных, веслоногих ракообразных, яйца беспозвоночных и фитопланктон [35]. Кроме того, Аллеманд [36] сообщил, что C. rubrum может питаться двумя способами; он либо охотится на крошечный планктон с помощью своих щупалец, либо поглощает растворенное органическое вещество из морской воды. В полевых условиях японские виды, изученные в этом исследовании, могут в основном поглощать взвешенные органические вещества или белки, такие как морской снег, или их желудочный орган может относительно быстро переваривать предметы.
Неразвитые перегородки в сифонозооидах японских драгоценных кораллов наблюдались Кишиноу [7, 8], и мы также наблюдали перегородки в этом исследовании. Также имеются неразвитые перегородки у сифонозооидов атлантического вида C. Bathyrubrum [21]. Кроме того, в сифонозооидах наблюдались другие структуры. Эти структуры присутствовали на внутренних сторонах вокруг отверстий сифонозооидов (рис. 5, 17 и 24). Хотя мы не смогли идентифицировать функцию (и) этих структур, они могут быть внутренней крышкой, которая регулирует размер отверстия сифонозооидов.Как правило, автозооиды кораллов Coralliidae размножаются бесполым путем, отпочковываясь, и также возможно, что эти структуры являются ювенильными автозооидами. Строго говоря, сифонозооидов и ювенильных автозооидов отличить нельзя. Таким образом, чтобы подтвердить функцию этих структур, необходимо изучить процесс почкования автозооидов путем гистологического наблюдения в будущем.
Кишиноуе [7, 8] сообщил, что в базовой части колоний цененхима отсутствовала и была «атакована» сверлящими губками.Кроме того, он обнаружил несколько видов двустворчатых моллюсков, брюхоногих моллюсков, усоногих и мшанок на осевых скелетах кораллов. В настоящем исследовании некоторые комменсальные организмы (в основном полихеты) наблюдались только в колониях P. japonicum (Рисунок 10), за исключением одного возможного Platyhelminthes из единственной колонии C. konojoi (Рисунок 29). К сожалению, нам удалось увидеть только секционные изображения этих организмов, и мы не смогли подтвердить их таксон. Подготовленные образцы для микроскопического наблюдения представляли собой лишь небольшие кусочки целых колоний, но комменсалы были обнаружены в количестве 21 на 75 P.japonicum экз. (28% исследованных особей). Это говорит о том, что уровни комменсалов могут быть довольно высокими и что, возможно, большинство колоний P. japonicum содержат комменсалы. Байер [37] сообщил, что в колонии жили многощетинковые черви, а веслоногие рачки (семейство Lamippidae) были обнаружены в желудочных полостях автозооидов C. niobe (атлантический вид), и он включил рисунок «червячного туннеля». Точно так же комменсальная полихета, Gorgoniapolynoe ceceilae , содержалась в колониях C.niobe и C. bayeri (оба атлантических вида), что также предполагает существование видоспецифичных взаимоотношений комменсал-хозяин [21]. Следовательно, возможно, что комменсальная полихата, ассоциированная с P. japonicum , является неописанным видом. Calcinai et al. [38] описали новый вид буровой губки, Alectona sarai, , заросший в ось P. japonicum . Также известны четыре других вида губок, проникающих в оси C. elatius [38].Кроме того, некоторые виды брюхоногих моллюсков ( Primovula spp.) Были обнаружены на поверхности драгоценных коралловых цененхимов; Primovula jeanae ассоциирована с P. japonicum и C. elatius , а Primovula shikamai и Primovula luna связаны только с P. japonicum [39]. Ивасаки и Сузуки [13] предположили, что Primovula luna питается цененхимом P. japonicum . Наконец, Reimer et al.[34] описали новый род и вид зоантид, Corallizoanthus tsukaharai , связанные исключительно с P. japonicum , и в этом исследовании мы наблюдали два таких экземпляра зоантид (рис. 12 и 13). Одна особь зоантидов, собранная в январе 2006 г., имела дифференцированные гонады, но невозможно предположить сезонность нереста C. tsukaharai без дополнительных наблюдений.
В этом исследовании годичные кольца осевого скелета наблюдались у P.japonicum (Рисунок 9) и C. konojoi (Рисунок 28). Ивасаки и Судзуки [13] сообщили, что скорость роста у P. japonicum составляла 0,30–0,50 мм / год в ширину и 0,26–0,28 мм / год для C. elatius . Однако неясно, являются ли годичные кольца на самом деле годичными, но если это так, то кольца обоих видов уже, чем сообщалось ранее, и, следовательно, рост осей происходит медленнее, чем у Ивасаки и Судзуки [13]. .
На основании вышеупомянутых наблюдений мы составили цветные диаграммы гистологии трех видов (рис. 14, 21 и 30).Мы надеемся, что эти цифры послужат хорошей основой для дальнейшего изучения драгоценных кораллов.
Благодарности
Авторы хотели бы поблагодарить профессора Н. Ивасаки (Университет Риссио), предоставившего информацию о драгоценных кораллах, собранных на материковой части Японии. Д-р К. Музик (Музей епископа, Гавайи, США), г-н Я. Имахара и г-н Ф. Ивасе (биологическая лаборатория Куросио, Кочи, Япония) поделились с нами многими полезными знаниями о видах Coralliidae и других октокоралевых.Три анонимных рецензента помогли значительно улучшить рукопись. Особая благодарность д-ру С. Учиде (бывшему директору Окинавского аквариума Тюрауми) за руководство этим исследованием.
Диагностика рака: роль патологии
Полный и точный отчет о патологии имеет решающее значение для постановки точного диагноза и выбора наилучшего плана лечения для вас.
Пациенты Memorial Sloan Kettering пользуются опытом и знаниями наших десяти групп патологов, специализирующихся на конкретных заболеваниях — врачей, которые специализируются на интерпретации лабораторных тестов и оценке клеток, тканей и органов для диагностики заболеваний.Они используют самое современное оборудование и самые передовые методы для анализа тысяч образцов тканей каждый год.
Патолог определяет точный тип и степень тяжести (стадию) рака, а также может работать с другими членами вашей бригады, чтобы рекомендовать стратегию лечения, которая может включать наблюдение, хирургическое вмешательство, химиотерапию, лучевую терапию или комбинацию этих подходов.
Общение между моей группой и терапевтической командой, которая заботится о пациенте, абсолютно необходимо.
Мира Р. Хамид
Патологоанатом
Получение образца ткани
Врачи часто рекомендуют биопсию после физического обследования или диагностического теста, который выявил возможный рак. Во время биопсии врач удаляет небольшое количество ткани из рассматриваемой области тела, чтобы ее мог исследовать патолог.
Для большинства видов рака биопсия — единственный способ поставить окончательный диагноз рака. К наиболее распространенным типам биопсии относятся:
послеоперационная биопсия, при которой удаляется только образец ткани
эксцизионная биопсия, при которой удаляется вся опухоль или подозрительная область
игольчатая биопсия, при которой образец ткани или жидкости удаляется с помощью иглы
По мере того, как лечение рака становится более персонализированным, получение биопсийного образца, дающего достаточно материала не только для диагностики, но и для генетического анализа, становится критически важным.Интервенционная радиология — это метод, используемый в MSK для получения образца ткани из труднодоступных участков тела, таких как печень или легкое.
После того, как врачи получают биопсию, образец отправляется патологу, который анализирует внешний вид клеток под микроскопом и определяет, является ли удаленная ткань доброкачественной (доброкачественной) или злокачественной (злокачественной). Если ткань злокачественная, патологи проводят другие тесты, чтобы выявить дополнительные характеристики рака и определить вероятность его распространения на другие части тела.
Помощник лаборатории патологии Джеррел Хантер является частью большой команды, которая ежегодно помогает тысячам людей получать быстрые и точные диагнозы.
Отчет о патологии
В отчете о патологии описывается диагноз патологоанатома, основанный на его или ее исследовании образца ткани, взятого из вашей опухоли, или, в случае рака крови, образца, взятого из одного из ваших лимфатических узлов или костного мозга. Если диагностирован рак, в отчете будет представлена конкретная информация о характеристиках раковых клеток, которая поможет вашему врачу порекомендовать вам наилучшие варианты лечения.
В отчете подробно описывается тип рака, инвазивен ли он и может ли он распространяться на другие части тела, а также насколько далеко рак проник в окружающие здоровые ткани. Он также включает информацию о:
Гистологический класс , который сравнивает размер, форму и другие характеристики с вашими здоровыми клетками.Например, опухоль с клетками, которые больше похожи на здоровые, называется низкосортной или хорошо дифференцированной и часто связана с лучшим прогнозом или шансом на выздоровление.
Уровень митоза , который указывает, насколько часто раковые клетки делятся. Опухоли с меньшим количеством делящихся клеток обычно имеют низкую степень злокачественности и с большей вероятностью соответствуют лучшему прогнозу для пациента.
Статус лимфатических узлов , который показывает, распространился ли рак на близлежащие лимфатические узлы — маленькие бобовидные железы, которые помогают бороться с инфекцией — или другие органы.Если опухоль проникла в кровеносные сосуды или лимфатические сосуды, которые протекают в лимфатические узлы, существует большая вероятность того, что рак метастазировал (распространился) на другие части тела.
Стадия или степень рака в организме в зависимости от размера, расположения и распространения опухоли. Патологическая стадия, наряду с результатами других диагностических тестов, помогает определить варианты лечения.
Другие результаты тестов , указывающие на наличие рецепторов гормонов или других онкомаркеров.
Геномное секвенирование
Точность диагностики повысилась благодаря использованию новых технологий, которые могут дополнительно классифицировать рак и идентифицировать определенные гены, белки и генетические мутации или изменения, которые вызывают рост опухоли.
Например, специалисты MSK разработали тест секвенирования генома, который позволяет нашим врачам быстро определить, есть ли в опухоли пациента мутации, которые могут помочь в лечении, и сопоставить отдельных пациентов с доступными методами лечения или клиническими испытаниями, которые принесут им наибольшую пользу.
Тест, получивший название MSK-IMPACT ™ , позволяет провести всесторонний молекулярный анализ клеток любого типа солидной опухоли, независимо от того, в какой части тела предположительно возник рак. Исследователи MSK недавно работали с биотехнологической компанией над совместной разработкой аналогичного геномного теста для выявления генетических изменений при раке крови.
Результаты этих типов тестов могут быть указаны в вашем отчете о патологии или предоставлены вам в отдельном отчете.
Гистопатологическое исследование биопсии костного мозга (BMB) при первичных B-клеточных лимфомах селезенки маргинального происхождения (PSMZL).Надежный заменитель патологии селезенки ?. | Кровь
Реферат 1924
Доска объявлений I-947
Согласно классификации ВОЗ 2008 г., PSMZL в основном включают лимфому краевой зоны селезенки (SMZL) и диффузную B-клеточную лимфому / лейкоз селезенки, не поддающуюся классификации (SDLU). До недавнего времени гистологическое исследование образцов спленэктомии считалось предпосылкой для диагностики SMZL, хотя из-за недавнего прогресса в химио-иммунотерапевтической терапии спленэктомия больше не выполняется в большинстве случаев.Мы оценили диагностическую эффективность исследования BMB в документации по диагностике PSMZL и их дифференциальной диагностике от имитаторов, включая другие малые B-клеточные лимфомы, и проверили, может ли BMB служить заменой микроскопического исследования селезенки в дифференциальной диагностике SMZL. из СДЛУ. В исследуемую группу вошли 108 образцов BMB от пациентов с диагнозом PSMZL на основании исследования образцов спленэктомии (n = 46) или клинической картины, морфологии клеток и анализа проточной цитометрии (n = 62).Гистологические и иммуногистохимические результаты суммированы в таблице 1. Молекулярный анализ генов иммуноглобулинов показал, что 10 из 21 проанализированных случаев CD27 + несли гены IGHV с более чем 98% идентичностью зародышевой линии (немутантные), тогда как 5/8 проанализированных случаев CD27 несли мутировавшие гены IGHV. Кроме того, 7 из 14 проанализированных случаев SIgD + несли мутировавшие гены IGHV. Образцы спленэктомии были доступны в 46/108 случаях. Слепое гистопатологическое исследование селезенки выявило 35 SMZL и 11 SDLU. Парная оценка образцов BMB и селезенки не выявила какой-либо отличительной модели инфильтрации BMB и / или морфологии между SMZL и SDLU; в частности, иммунофенотипический профиль образцов BMB и селезенки был идентичным, когда использовались 14 различных маркеров (таблица 1).В заключение, наше исследование документирует значение гистопатологии BMB в диагностике PSMZL и их дифференциальной диагностике от других малых B-клеточных лимфом, в первую очередь или вторично вовлекающих селезенку. В настоящее время невозможно отличить SMZL от SDLU на основе единственной гистопатологии BMB. Наконец, наши результаты подтверждают и расширяют значительную гетерогенность PSMZL, которая может отражать различный статус активации и / или различный гистогенез клоногенных клеток.
Таблица 1.
Гистология и иммуногистохимия.
| Образец инфильтрации . | ||||
|---|---|---|---|---|
| Чистый интрасинусоидальный | 6/108 | |||
| Промежуточный | 19/108 | |||
| Узловой | 4/108 | 39/108 | ||
| Нодулярный в сочетании с другими типами | 32/108 | |||
| Морфология | ||||
| Малые лимфоциты | 105689 | |||
| 105689 | 13/105 | |||
| дифференцировка оноцитоидов (MC) | 20/105 | |||
| Чистая популяция MC | 3/108 | |||
| Иммуногистохимия | / 108 | |||
| CD43 + BCL6 + CD10 + CyclinD1 + | ||||
| CD5 + | 7/98 | |||
| CD23 + | 4 // 91 | |||
| CD5 + CD23 + | 0/91 | |||
| TRAP + | DBA44 + | 59/93 | ||
| CD27 + | 44/70 | |||
| SIgD + | 30/61 | |||
| SIgD + CD27 + | 18/24 |
