Гипоксия левого желудочка сердца: Диагностика и лечение гипоксии миокарда
Исследование маркеров ремоделирования миокарда при экспериментальной гипобарической гипоксии на фоне коррекции препаратом цитофлавин
Гипоксия рассматривается как ишемическая недостаточность, окислительная недостаточность, или «гипоксибиоз»1, т. е. состояние, когда потребность клеток в энергии не соответствует возможности генерации ее окислительным путем. Выявление морфологического субстрата повреждения миокарда в условиях различных форм хронической гипоксии продолжает привлекать внимание исследователей, так как именно гипоксическое повреждение сердца способствует летальному исходу [1].
В настоящее время значительный интерес для исследований представляет новый тип высотного воздействия: долгосрочная хроническая прерывистая гипобарическая гипоксия, которая классифицируется как отдельное патофизиологическое состояние, сопровождающееся повышением артериального давления преимущественно в легочной артерии и симптомами горной болезни [2]. Под прерывистой экспозицией гипоксического воздействия подразумевается долгосрочное пребывание (от 4 до 15 дней) на высоте более 3500 м, за которым следует такой же по длительности период покоя, но уже в условиях нормоксии [3]. Работники горной промышленности, военнослужащие и сотрудники пограничного контроля длительно и часто вынуждены находиться в вышеописанных условиях, а численность высотных и высокогорных профессий резко возрастает [4]. При этом многие аспекты, лежащие в основе молекулярных механизмов и клинических последствий воздействия высотной гипоксии, являются малоизученными.
Работники горной промышленности, военнослужащие и сотрудники пограничного контроля длительно и часто вынуждены находиться в вышеописанных условиях, а численность высотных и высокогорных профессий резко возрастает [4]. При этом многие аспекты, лежащие в основе молекулярных механизмов и клинических последствий воздействия высотной гипоксии, являются малоизученными.
Утрата части функционирующего миокарда вследствие гипоксического воздействия, повторяющихся ишемий либо воспалительного процесса, а также хроническая перегрузка сердца сопровождаются комплексом структурных изменений, называемых ремоделированием [5]. Они часто предшествуют клиническому проявлению сердечной недостаточности, могут самостоятельно усугублять систолическую и диастолическую дисфункцию желудочков и отрицательно влиять на качество жизни больных. Первоначально ремоделирование миокарда имеет компенсаторный характер, однако прогрессирующая гипертрофия и дилатация камер сердца определяют развитие негативных последствий, приводящих к декомпенсации. Сердце вступает в фазу нарастающего кардиосклероза и изнашивания внутриклеточных структур, которая влечет за собой гибель клеток. Прогрессирующая гипертрофия и дилатация сердца сопровождаются дальнейшим нарушением систолической и диастолической функций желудочков, увеличением потребности миокарда в кислороде, изменением субэндокардиального кровотока, а также нарушениями биоэнергетики миокарда [6].
Сердце вступает в фазу нарастающего кардиосклероза и изнашивания внутриклеточных структур, которая влечет за собой гибель клеток. Прогрессирующая гипертрофия и дилатация сердца сопровождаются дальнейшим нарушением систолической и диастолической функций желудочков, увеличением потребности миокарда в кислороде, изменением субэндокардиального кровотока, а также нарушениями биоэнергетики миокарда [6].
Современная кардиологическая наука не дает однозначной трактовки термину «ремоделирование». Ремоделирование представляет собой процесс комплексного нарушения структуры и функции сердца, являющийся следствием перегрузки или утраты части жизнеспособного миокарда. Одновременно в ответ на воздействие патологического агента в сердце активируется совокупность эволюционно закрепленных реакций, направленных на скорейшую адаптацию поврежденного органа к новым условиям жизнедеятельности [7]. Таким образом, ремоделирование рассматривается как процесс адаптации миокарда, направленный на поддержание его сократительной функции. Это обусловливает целесообразность поиска средств для фармакологической коррекции гипоксических и метаболических расстройств на ранних этапах ишемии миокарда. В последние годы в комплексную терапию ишемии миокарда стали включать комбинированный препарат цитофлавин, разработанный «НТФФ «ПОЛИСАН» (Санкт-Петербург, Россия), в состав которого входят рибоксин, рибофлавин, никотинамид, янтарная кислота [8—10].
Это обусловливает целесообразность поиска средств для фармакологической коррекции гипоксических и метаболических расстройств на ранних этапах ишемии миокарда. В последние годы в комплексную терапию ишемии миокарда стали включать комбинированный препарат цитофлавин, разработанный «НТФФ «ПОЛИСАН» (Санкт-Петербург, Россия), в состав которого входят рибоксин, рибофлавин, никотинамид, янтарная кислота [8—10].
Отсутствие возможностей для изучения морфологических изменений миокарда в клинике при применении цитофлавина обусловливает необходимость проведения подобных исследований в условиях эксперимента.
Цель исследования — выявить особенности изменений маркеров ремоделирования миокарда на фоне экспериментальной гипобарической гипоксии и при использовании цитофлавина.
Материал и методы
Исследование проводили на 26 половозрелых самцах крыс линии Wistar массой 220—310 г, разделенных на три группы. В 1-ю группу контроля вошли 6 интактных животных, во 2-ю группу — 10 крыс, у которых на протяжении 30 дней моделировали гипобарическую гипоксию без коррекции. В 3-ю группу вошли 10 крыс, которым за 15 мин до погружения в барокамеру 1 раз в сутки внутрибрюшинно вводили цитофлавин из расчета 0,5 мл на 100 г массы тела животного на протяжении 30 дней [10]. Крысам 2-й группы в качестве контроля внутрибрюшинно вводили 0,9% раствор NaCl в аналогичной дозировке.
В 3-ю группу вошли 10 крыс, которым за 15 мин до погружения в барокамеру 1 раз в сутки внутрибрюшинно вводили цитофлавин из расчета 0,5 мл на 100 г массы тела животного на протяжении 30 дней [10]. Крысам 2-й группы в качестве контроля внутрибрюшинно вводили 0,9% раствор NaCl в аналогичной дозировке.
На протяжении всего эксперимента животных 2-й и 3-й групп ежедневно на 1 ч погружали в прозрачную барокамеру, снабженную манометром, предохранительным клапаном, щелочным поглотителем для устранения избытка углекислого газа, где создавали давление ниже атмосферного, что соответствовало подъему на 6000 м над уровнем моря (354,2 мм рт.ст.), что эквивалентно умеренно интенсивному гипоксическому воздействию [3]. Животных содержали в стандартных условиях при свободном доступе к пище и воде. Длительную гипобарическую гипоксию моделировали после определения индивидуальной чувствительности по Л.Д. Лукьяновой (1991), в работе использовали низкоустойчивых крыс. Животных содержали в виварии, уход за ними осуществляли в соответствии с нормами и правилами обращения с лабораторными животными (И. П. Западнюк, 1983). Крыс выводили из эксперимента путем декапитации под наркозом (эфир с хлороформом) в соответствии с «Международными рекомендациями (этический кодекс) по проведению медико-биологических исследований с использованием животных» (1985) и правилами лабораторной практики в Российской Федерации (приказ Минздрава России № 267 от 19.06.03).
П. Западнюк, 1983). Крыс выводили из эксперимента путем декапитации под наркозом (эфир с хлороформом) в соответствии с «Международными рекомендациями (этический кодекс) по проведению медико-биологических исследований с использованием животных» (1985) и правилами лабораторной практики в Российской Федерации (приказ Минздрава России № 267 от 19.06.03).
После завершения эксперимента проводили торако- и перикардиотомию, сердца извлекали и мгновенно помещали в кардиоплегический раствор (0,9% КСl при температуре 0 °С), что приводило к остановке сердца в диастолу. Сердца фиксировали в 10% нейтральном формалине с последующей обработкой в спиртах возрастающей концентрации, заключением в парафин и приготовлением срезов толщиной 5—7 мкм, согласно общепринятым методикам [11]. Парафиновые срезы окрашивали гематоксилином и эозином (обзорные препараты), а также по Маллори и ГОФП-методом (гематоксилин — основной фуксин — пикриновая кислота). Выявляли нити фибрина методом MSB по Лендруму. В поляризованном свете на неокрашенных и окрашенных гематоксилином и эозином препаратах определяли контрактурные повреждения кардиомиоцитов по Ю. Г. Целлариусу и соавт. (1980).
Г. Целлариусу и соавт. (1980).
Для иммуногистохимического исследования материал фиксировали в 10% растворе забуференного формалина с последующим приготовлением парафиновых блоков. С каждого блока делали серийные срезы толщиной 5 км. Выявление одного из ключевых маркеров ремоделирования матриксной металлопротеиназы-9 (МПП 9, клон MS817PABX), а также сосудистых структур, образованных эндотелиальными (СD31+) клетками сердца (клон SP38), проводили с помощью двойного пероксидаза-антипероксидазного метода (G. Kumar, L. Rudbeck, DAKO, 2001) с использованием иммуногистостейнера Dako Autostainer («Dako Cytomation», Дания).
Микропрепараты поперечного среза сердца, окрашенные гематоксилином и эозином, изучали на микроскопе Olympus CX-3 (Япония). Морфометрические исследования структурных единиц сердца (не менее 30 измерений каждого параметра) проводили с учетом рекомендаций Г.Г. Автандилова, O.K. Хмельницкого и М.С. Третьяковой. Статистическую обработку данных осуществляли с помощью лицензионного программного обеспечения Microsoft Office Exсel-2007 и Statistica 10. 0. Данные представляли как M±m. Отличия между морфометрическими показателями разных групп оценивали по t-критерию Стьюдента, различия между величинами считали достоверными при p<0,05.
0. Данные представляли как M±m. Отличия между морфометрическими показателями разных групп оценивали по t-критерию Стьюдента, различия между величинами считали достоверными при p<0,05.
Все исследования проводили с использованием средств измерительной техники, прошедших метрологическую поверку, и вспомогательного оборудования, аттестованного на базе отдела морфологии с электронной микроскопией Центральной научно-исследовательской лаборатории Медицинской академии им. С.И. Георгиевского.
Результаты и обсуждение
Биологическая модель гипоксической формы гипоксии относится к категории хорошо управляемых состояний, позволяет получить динамическую характеристику нарастающего процесса. В таких условиях можно выявить регуляторную направленность в изменении метаболической адаптации в общем комплексе гипоксических сдвигов, интеграцию между кислородным режимом системы и ее метаболическим ответом.
В результате гипоксического повреждения миокарда у крыс 1-й группы количество «рабочих» кардиомиоцитов существенно снижалось. На гистологических препаратах миокарда отмечались признаки межмышечного отека. Структурные изменения миокарда характеризовались признаками повреждения в виде отека кардиомиоцитов, гомогенизации их саркоплазмы. При поляризационной микроскопии клетки имели нечеткие контуры, в них не прослеживалась поперечная исчерченность, отмечались глыбчатый распад миофибрилл, гиперрелаксация саркомеров и участки миоцитолиза. Сосудистая сеть отличалась неравномерностью: участки сужения чередовались с расширением просвета сосудов с плазменным пропитыванием их стенок, развитием паравазального отека и диапедеза эритроцитов в окружающую ткань. Отдельные группы кардиомиоцитов истончены, их саркоплазма имела неравномерную окраску. Здесь же отмечались признаки межмышечного отека (рис. 1, а). Рис. 1. Изменения миокарда левого желудочка при гипобарической гипоксии (а, в) и при коррекции цитофлавином (б, г). а — дистрофические изменения кардиомиоцитов, гомогенизация их саркоплазмы, признаки межмышечного отека, появление лимфоцитарных инфильтратов; б — интерстициальный отек и полнокровие капилляров; в — увеличение доли соединительной ткани в интерстиции, затрудняющее диффузию кислорода к рабочим кардиомиоцитам; г — умеренный фибриллогенез вокруг полнокровных сосудов.
На гистологических препаратах миокарда отмечались признаки межмышечного отека. Структурные изменения миокарда характеризовались признаками повреждения в виде отека кардиомиоцитов, гомогенизации их саркоплазмы. При поляризационной микроскопии клетки имели нечеткие контуры, в них не прослеживалась поперечная исчерченность, отмечались глыбчатый распад миофибрилл, гиперрелаксация саркомеров и участки миоцитолиза. Сосудистая сеть отличалась неравномерностью: участки сужения чередовались с расширением просвета сосудов с плазменным пропитыванием их стенок, развитием паравазального отека и диапедеза эритроцитов в окружающую ткань. Отдельные группы кардиомиоцитов истончены, их саркоплазма имела неравномерную окраску. Здесь же отмечались признаки межмышечного отека (рис. 1, а). Рис. 1. Изменения миокарда левого желудочка при гипобарической гипоксии (а, в) и при коррекции цитофлавином (б, г). а — дистрофические изменения кардиомиоцитов, гомогенизация их саркоплазмы, признаки межмышечного отека, появление лимфоцитарных инфильтратов; б — интерстициальный отек и полнокровие капилляров; в — увеличение доли соединительной ткани в интерстиции, затрудняющее диффузию кислорода к рабочим кардиомиоцитам; г — умеренный фибриллогенез вокруг полнокровных сосудов. Окраска гематоксилином и эозином (а, б) и по Маллори (в, г), ×400.
Окраска гематоксилином и эозином (а, б) и по Маллори (в, г), ×400.
В отдельных полях зрения отмечался лизис единичных кардиомиоцитов. На месте погибших кардиомиоцитов по ходу капилляров и вокруг крупных сосудов выявлялась пролиферация клеточных элементов соединительной ткани (см. рис. 1, в). Это связано с тем, что в ответ на ишемию происходит активация фибробластов, следствием чего является увеличение синтеза коллагена. Диспропорциональное повышение синтеза и ингибирование деградации белков экстрацеллюлярного матрикса могут стать причиной последующего фиброгенеза — диспропорциональной аккумуляции фибриллярного коллагена. На месте погибших кардиомиоцитов развивается репаративный (заместительный) фиброгенез. В свою очередь наблюдаемый реактивный фиброгенез, не связанный напрямую с некрозом кардиомиоцитов, представлен в виде интерстициального (накопление коллагена в межмышечном пространстве) и периваскулярного (накопление коллагена в пределах адвентиции коронарных артерий и артериол) фиброгенеза [5].
Известно, что развивающийся фиброгенез оказывает негативное воздействие на состояние миокарда, способствуя процессу ремоделирования. Накопление коллагена обусловливает повышение жесткости желудочковой стенки, что приводит к нарушению сократимости и расслабления [7]. Прогрессирующее накопление соединительной ткани приводит к снижению капиллярной плотности и повышает дистанцию, необходимую для диффузии кислорода, что определяет развитие последующей ишемии кардиомиоцитов. Фиброзирование может также нарушать электрическое взаимодействие кардиомиоцитов, содействуя развитию аритмий [1].
Введение цитофлавина несколько уменьшало дистрофические и некробиотические изменения кардиомиоцитов у крыс 3-й группы. При гистологическом исследовании препаратов миокарда на фоне предварительной прерывистой гипобарической гипоксии отмечались истончение отдельных групп мышечных волокон, гомогенизация саркоплазмы, уменьшение в них гликогена. Вакуолизация саркоплазмы кардиомиоцитов встречалась в единичных случаях.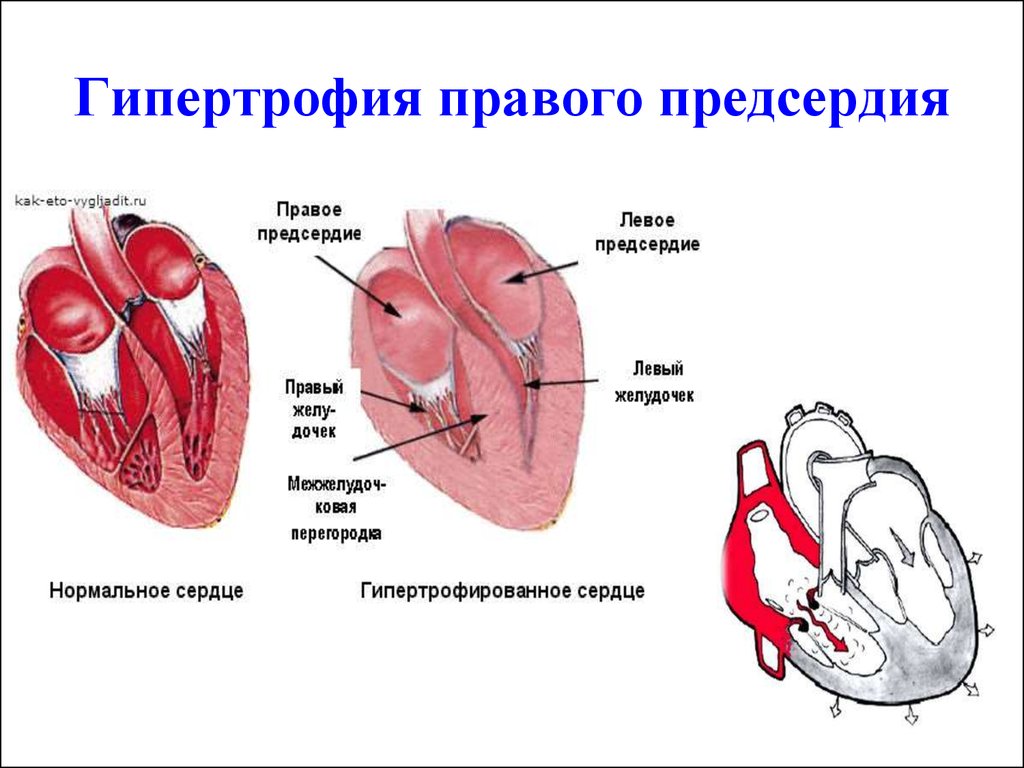 Большая часть кардиомиоцитов с четкими границами клеток, равномерно окрашенной саркоплазмой, крупными ядрами (см. рис. 1, б). При поляризационной микроскопии прослеживались миофибриллы, вставочные диски. В кардиомиоцитах с признаками деструкции выявлялись контрактуры I—II степени, реже отмечался глыбчатый распад миофибрилл. В интерстиции, вокруг артериол и венул обнаруживался слабо выраженный отек. На месте погибших кардиомиоцитов выявлялись очаги новообразованной соединительной ткани (см. рис. 1, г). Вблизи них располагались гипертрофированные кардиомиоциты с крупными ядрами. Необходимость поддержания ударного объема на фоне потери части сократительного миокарда определяет запуск внутренней, компенсаторной программы, направленной на адаптацию функционирующих кардиомиоцитов к повышенной нагрузке путем гипертрофии. Гипертрофия кардиомиоцитов обеспечивает адаптацию миокарда к новым рабочим условиям путем увеличения числа сократительных единиц и снижения напряжения утолщенной сердечной стенки в соответствии с законом Лапласа [6].
Большая часть кардиомиоцитов с четкими границами клеток, равномерно окрашенной саркоплазмой, крупными ядрами (см. рис. 1, б). При поляризационной микроскопии прослеживались миофибриллы, вставочные диски. В кардиомиоцитах с признаками деструкции выявлялись контрактуры I—II степени, реже отмечался глыбчатый распад миофибрилл. В интерстиции, вокруг артериол и венул обнаруживался слабо выраженный отек. На месте погибших кардиомиоцитов выявлялись очаги новообразованной соединительной ткани (см. рис. 1, г). Вблизи них располагались гипертрофированные кардиомиоциты с крупными ядрами. Необходимость поддержания ударного объема на фоне потери части сократительного миокарда определяет запуск внутренней, компенсаторной программы, направленной на адаптацию функционирующих кардиомиоцитов к повышенной нагрузке путем гипертрофии. Гипертрофия кардиомиоцитов обеспечивает адаптацию миокарда к новым рабочим условиям путем увеличения числа сократительных единиц и снижения напряжения утолщенной сердечной стенки в соответствии с законом Лапласа [6].
У крыс 2-й группы без проводимой коррекции сосудистая сеть представлена расширенными и суженными капиллярами. На фоне суженных капилляров встречались зоны, лишенные их (рис. 2, а). Рис. 2. Изменения микроциркуляторного русла и острые ишемические повреждения кардиомиоцитов при гипобарической гипоксии (а, в) и при коррекции цитофлавином (б, г). а — нечеткость контуров сосудов, обеднение элементов микроциркуляторного русла; б — посредством анастомозов капилляры оплетают кардиомиоциты со всех сторон, образуя сосудистые петли причудливой формы; в — фрагменты крупных очагов выраженной фуксинофилии саркоплазмы кардиомиоцитов в виде малинового окрашивания на желто-зеленом фоне. Часть кардиомиоцитов находится в пересокращенном состоянии. Окрашивание ГОФП-методом по Lie, ×400; г — небольшое количество диффузно расположенных мелких очагов умеренно выраженной фуксинофилии цитоплазмы кардиомиоцитов (преимущественно в области их ядер), окрашенных в малиновый цвет. Экспрессия CD31+ (а, б). Окраска ГОФП-методом по Lie (в, г), ×400. Средний диаметр капилляра достоверно отличался от контроля на 34,4% (см. таблицу). Показатели микрогемоциркуляторного русла на фоне гипобарической гипоксии (М±m) Примечание. * — достоверность различий показателей по отношению к контролю (р<0,05). Численная плотность капилляров в этот срок эксперимента составляла 27,51±0,34. Площадь поперечного сечения капилляра была ниже исходного уровня на 57,0%, а суммарная площадь их поперечных сечений — на 61,3%. Относительная поверхностная площадь сосудистого русла составила 21,5±0,18%, что меньше контроля на 32,0%.
Средний диаметр капилляра достоверно отличался от контроля на 34,4% (см. таблицу). Показатели микрогемоциркуляторного русла на фоне гипобарической гипоксии (М±m) Примечание. * — достоверность различий показателей по отношению к контролю (р<0,05). Численная плотность капилляров в этот срок эксперимента составляла 27,51±0,34. Площадь поперечного сечения капилляра была ниже исходного уровня на 57,0%, а суммарная площадь их поперечных сечений — на 61,3%. Относительная поверхностная площадь сосудистого русла составила 21,5±0,18%, что меньше контроля на 32,0%.
На фоне введения цитофлавина выявлено, что у крыс 3-й группы стенки некоторых сосудов утолщены, эндотелиальные клетки выступали в просвет в виде частокола. В отдельных полях наблюдалась «прерывистость» сосудистого рисунка (см. рис. 2, б). Диаметр капилляров превышал показатель 2-й группы (р<0,05), что свидетельствует об относительной сохранности микроциркуляторного русла, однако был достоверно ниже контрольного показателя (р<0,05). Соответственно по сравнению с серией без коррекции увеличена площадь поперечных сечений капилляров – 28,44±0,14 мкм2 против 24,53±0,20 мкм2 (р<0,05). Суммарная площадь поперечных сечений капилляров равна 0,77±0,10·103 мкм2. Относительная поверхностная площадь сосудистого русла была ниже контроля на 21,8% (р<0,05) (см. таблицу).
Соответственно по сравнению с серией без коррекции увеличена площадь поперечных сечений капилляров – 28,44±0,14 мкм2 против 24,53±0,20 мкм2 (р<0,05). Суммарная площадь поперечных сечений капилляров равна 0,77±0,10·103 мкм2. Относительная поверхностная площадь сосудистого русла была ниже контроля на 21,8% (р<0,05) (см. таблицу).
Оценка наличия очагов острого ишемического и метаболического повреждения миокарда с помощью ГОФП-окрашивания у крыс 2-й группы выявила обилие густо расположенных крупных очагов выраженной фуксинофилии саркоплазмы кардиомиоцитов, окрашенных в ярко-малиновый цвет на бледно-зеленом фоне, что свидетельствовало о наличии необратимых ишемических и контрактурных изменений (см. рис. 2, в).
На фоне введения корректора выявлялись небольшие диффузные очаги фуксинофилии саркоплазмы ряда кардиомиоцитов вблизи ядер, отражающие начальную стадию ишемических повреждений, с преобладанием желто-коричневого фона интактных кардиомиоцитов, что, возможно, обусловлено антиишемическими свойствами препарата (см. рис. 2, г).
рис. 2, г).
При отсутствии коррекции гипоксических повреждений обращало на себя внимание увеличение отложений фибрина в интерстиции и периваскулярном пространстве, что подтверждает выраженный отек и экссудацию плазмы в ткань (рис. 3, а). Рис. 3. Выявление основных триггерных белков ремоделирования миокарда в условиях гипобарической гипоксии (а, в) и при коррекции цитофлавином (б, г). а — наличие синих фибриновых нитей в расширенном периваскулярном и интерстициальном пространствах; б — умеренное количество фибрина в местах небольших лейкоцитарных инфильтратов; в — высокая цитоплазматическая экспрессия МПП-9 клетками интерстиция, ×400; г — слабоположительная экспрессия МПП-9-клетками интерстиция. Окраска по Лендруму (а, б). Экспрессия МПП-9 (в, г), ×400. Интересен факт возрастания фибрилловых отложений при отсутствии выраженного интерстициального отека при введении цитофлавина. Возможно, его роль заключается в стимуляции миграции клеток и активации компенсаторно-заместительных процессов фибриллогенеза за счет выработки коллагена фибробластами (см.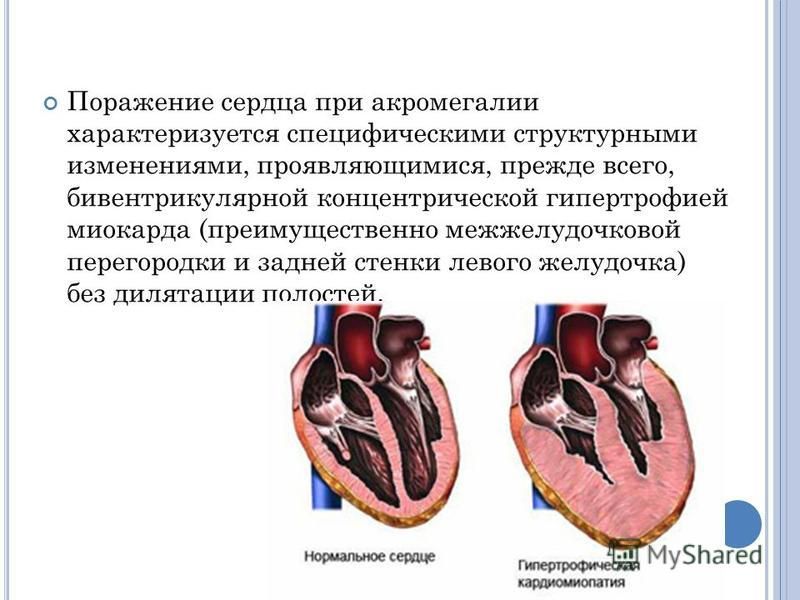 рис. 3, б).
рис. 3, б).
Фибробласты миокарда продуцируют белки экстрацеллюлярного матрикса и матриксные металлопротеиназы, осуществляя таким образом центральную роль в поддержании структуры интерстиция. Коллаген разрушается ферментами, относящимися к группе матриксных металлопротеиназ, способных расщеплять большое количество белков экстрацеллюлярного матрикса [5]. Баланс между синтезом матриксных белков и их деградацией играет существенную роль в поддержании целостности миокарда. Повышение содержания матриксных металлопротеиназ является свидетельством деградации коллагена и формирования ремоделирования сердца (см. рис. 3, в). Известно, что прогрессивная активация матриксных металлопротеиназ на фоне ишемии содействует развитию дилатации и ухудшению функции левого желудочка, что приводит к развитию сердечной недостаточности [12]. При длительном гипобарическом воздействии периваскулярно и в интерстиции появлялись клеточные элементы (нейтрофилы, макрофаги и фибробласты), экспрессирующие матриксную металлопротеиназу-9 (МПП 9), при этом интенсивность их окрашивания была высокой.
У крыс 3-й группы сравнения единичные ММР 9-позитивные клетки в препаратах выявлены на отдельных участках в миокарде, выраженность экспрессии маркера слабоположительная, что говорит о низкой интенсивности процессов ремоделирования миокарда (см. рис. 3, г). Известно, что сохраняющиеся устойчиво высокие концентрации ММП-9 свидетельствуют о перманентности деструктивных процессов во внеклеточном матриксе миокарда и являются предикторами неблагоприятного прогностического исхода заболевания.
Заключение
При микроскопическом исследовании установлено, что начальные этапы ремоделирования миокарда при прерывистой гипобарической гипоксии характеризуются структурной ресистематизацией компонентов миокарда левого желудочка, которая проявляется гипертрофией и ишемией кардиомиоцитов, циркуляторными нарушениями, пролиферацией фибробластов, резким усилением внеклеточной экспрессии белкового матрикса, что может привести к формированию фиброзной ткани и необратимой дисфункции миокарда. Идентификация молекулярных механизмов ремоделирования миокарда имеет важное практическое значение. Это дает возможность рассматривать маркеры ремоделирования в качестве потенциальной терапевтической «мишени» при лечении гипоксических повреждений миокарда. Цито- и ангиопротективный эффекты у крыс на фоне применения цитофлавина в комплексной терапии связаны, на наш взгляд, с составом препарата, активные компоненты которого (янтарная кислота, рибоксин, рибофлавин, никотинамид) дают взаимопотенцирующий эффект, являются индукторами основных метаболических путей в клетках, а также активаторами ключевых энергообразующих процессов. Эти изменения, вероятно, связаны с положительным влиянием цитофлавина на энергетические процессы в клетке и предотвращением избыточной продукции активных форм кислорода, что улучшает состояние эндотелия и, следовательно, состояние гемодинамики миокарда. Очевидно, что компоненты препарата в качестве составной части той или иной физиологической системы способны воздействовать на молекулярные мишени ремоделирования миокарда, по-видимому, за счет активации эндогенных ингибирующих факторов, которые могут подавить процессы избыточного фиброгенеза.
Идентификация молекулярных механизмов ремоделирования миокарда имеет важное практическое значение. Это дает возможность рассматривать маркеры ремоделирования в качестве потенциальной терапевтической «мишени» при лечении гипоксических повреждений миокарда. Цито- и ангиопротективный эффекты у крыс на фоне применения цитофлавина в комплексной терапии связаны, на наш взгляд, с составом препарата, активные компоненты которого (янтарная кислота, рибоксин, рибофлавин, никотинамид) дают взаимопотенцирующий эффект, являются индукторами основных метаболических путей в клетках, а также активаторами ключевых энергообразующих процессов. Эти изменения, вероятно, связаны с положительным влиянием цитофлавина на энергетические процессы в клетке и предотвращением избыточной продукции активных форм кислорода, что улучшает состояние эндотелия и, следовательно, состояние гемодинамики миокарда. Очевидно, что компоненты препарата в качестве составной части той или иной физиологической системы способны воздействовать на молекулярные мишени ремоделирования миокарда, по-видимому, за счет активации эндогенных ингибирующих факторов, которые могут подавить процессы избыточного фиброгенеза.
Исследование проведено по инициативе авторов. ООО «НТФФ «ПОЛИСАН» не оказывало влияния на определение структуры исследования, анализ полученного материала, интерпретацию результатов и написание статьи. Исследование проведено без стороннего финансового участия.
Участие авторов:
Концепция и дизайн — С.Т.П.
Сбор и обработка материала — С.Т.П.
Статистическая обработка данных — С.Т.П.
Написание текста статьи — С.Т.П.
Редактирование статьи — С.Т.П., З.И.В.
Авторы заявляют об отсутствии конфликта интересов.
Сведения об авторах
Сатаева Татьяна Павловна — канд. мед. наук, доцент каф. биологии; e-mail: [email protected] ; https://orcid.org/0000-0001-6451-7285
Заднипряный Игорь Владимирович — д-р мед. наук, проф., зав. каф. топографической анатомии человека; e-mail: [email protected]; https://orcid.org/0000-0002-8181-9709
1Термин «гипоксибиоз» как синоним окислительной недостаточности используется в некоторых русскоязычных исследованиях (см.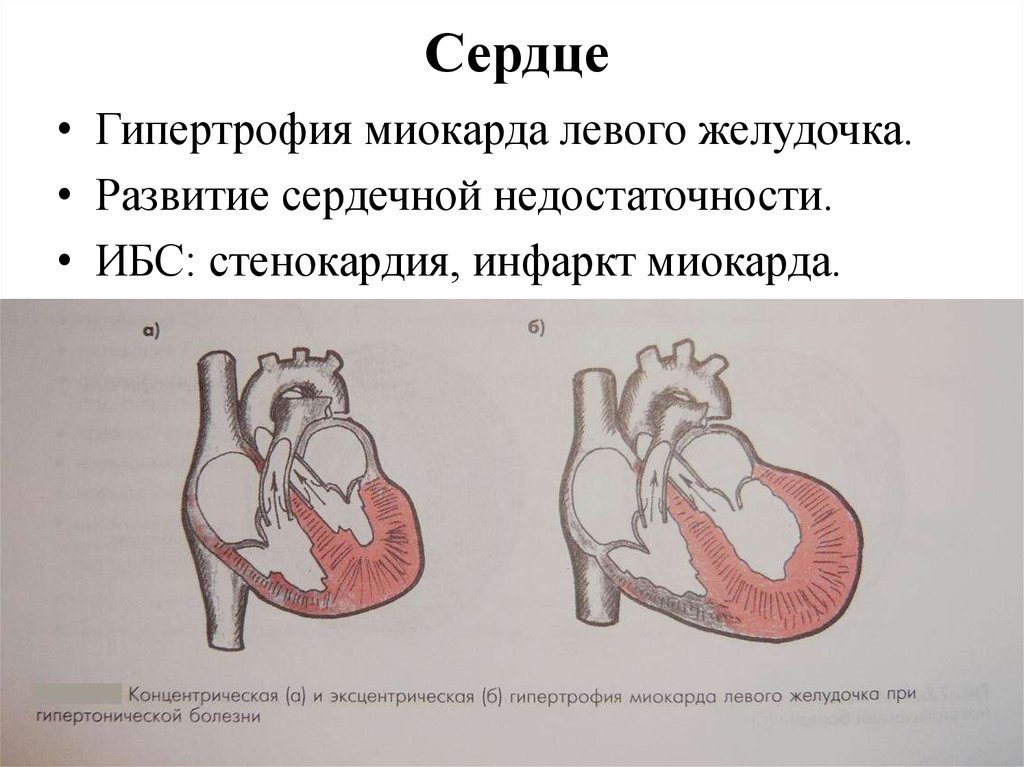 : Т.Н. Крестьянинова, О.Н. Малах. Витебск, 2010).
: Т.Н. Крестьянинова, О.Н. Малах. Витебск, 2010).
Гипоксия сердца медицинский термин
– это состояние, при котором сердечная мышца, а миокард – это и есть мышца сердца, не получает нужного количества кислорода. Такое состояние может развиться при наличии ишемической болезни сердца, при инфаркте миокарда, при стенокардии и при других заболеваниях сердца. При этом от нехватки кислорода сильно страдают клетки миокарда, на клеточном уровне сильно нарушается их дыхание, что приводит к гибели. А гибель клеток миокарда в свою очередь приводит к некрозу сердечной мышцы. А некроз – это состояние, при котором начинается отмирание тканей.
Классификация гипоксии сердца
По степени тяжести гипоксия миокарда подразделяется на лёгкую, умеренную, тяжёлую и смертельную или критическую. У каждой степени гипоксии есть и свои признаки гипоксии миокарда.
Симптомы гипоксии сердца
Сначала наблюдается частое сердцебиение, что носит название тахикардии. То есть сердце за счёт усиленной работы пытается компенсировать недостаток кислорода. Затем начинается ослабление сократительной способности самого миокарда. И только потом появляются сбои в работе самого сердца, которые проявляются аритмиями. При этом такие аритмии могут заканчиваться даже фибрилляцией желудочков.
То есть сердце за счёт усиленной работы пытается компенсировать недостаток кислорода. Затем начинается ослабление сократительной способности самого миокарда. И только потом появляются сбои в работе самого сердца, которые проявляются аритмиями. При этом такие аритмии могут заканчиваться даже фибрилляцией желудочков.
Давление в самом начале гипоксии миокарда может повышаться, но потом оно резко и очень быстро падает. Причём нередко возникает такое состояние, как коллапс. Но не только сердце начинает страдать при гипоксии миокарда. Начинает страдать и дыхание. Дыхательные движения становятся редкие, а затем и совсем прекращаются.
При молниеносной форме гипоксии миокарда выше перечисленных симптомов может и не быть. Происходит мгновенная остановка сердца и прекращение дыхания.
Диагноз гипоксии сердца
Признаки гипоксии миокарда практически всегда налицо. Не заметить их очень и очень сложно. Самым явным последствием гипоксии миокарда будет инфаркт.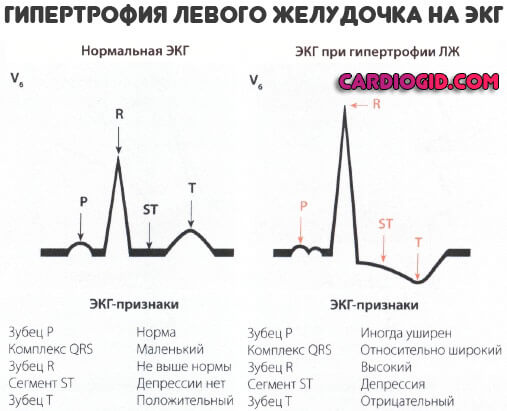 Именно поэтому каждый человек, который страдает болезнями сердца, должен с большим вниманием относиться к своему здоровью и делать всё для того, чтобы такое состояние не развилось.
Именно поэтому каждый человек, который страдает болезнями сердца, должен с большим вниманием относиться к своему здоровью и делать всё для того, чтобы такое состояние не развилось.
Нередко гипоксия миокарда возникает при очень сильных физических нагрузках. Если такое происходит, то рекомендуется прекратить нагружать организм физически и сделать передышку. А ещё гипоксия миокарда может появиться при курении. Именно поэтому рекомендуется бросить курить.
Лечение и профилактика гипоксии сердца
Сегодня применяют разнообразные способы и средства для профилактики, а также лечения этого опасного заболевания. Важную роль в предупреждении или ослаблении действия гипоксии миокарда на человека играют антигипоксанты – лекарственные средства, которые восстанавливают энергетические процессы в тканях. Они помогают возобновить функциональность нарушенных клеток. Так, например, антигипоксанты прямого действия воздействуют на энергетический обмен в миокарде и обладают антиангинальным, антиаритмическим и кардиопротекторным эффектами.
Широко распространенными и известными препаратами этой группы являются: актовегин, амтизол, инозин, лития оксибутират, триметазидин (предуктал, фосфокреатин). Однако важно, прежде всего, выяснить причину, вызвавшую такое серьёзное заболевание, как гипоксия миокарда. Лечение её можно совместить с прогулками на свежем воздухе, особыми диетами, посещением санатория. Также замечательными антигипоксантными свойствами обладают настои из мокрицы, берёзы, брусники и боярышника.
Потребление кислорода и функция левого желудочка при гипоксемии у находящихся в сознании ягнят
. 1983 г., май; 244(5):H664-71.
doi: 10.1152/ajpheart.1983.244.5.H664.
Ди Джей Фишер
PMID:
6846554
DOI:
10.
 1152/ajpheart.1983.244.5.H664
1152/ajpheart.1983.244.5.H664
Ди Джей Фишер.
Am J Physiol.
1983 май.
. 1983 г., май; 244(5):H664-71.
doi: 10.1152/ajpheart.1983.244.5.H664.
Автор
Ди Джей Фишер
PMID:
6846554
DOI:
10.1152/ajpheart.1983.244.5.H664
Абстрактный
Влияние гипоксемии на кровоток миокарда левого желудочка, потребление миокардом кислорода и сократительную функцию изучали на 12 находящихся в сознании новорожденных ягнятах через 4-24 дня после рождения. Через левую торакотомию мы установили наполненные жидкостью катетеры в восходящую аорту, коронарный синус и левое предсердие. Электромагнитный датчик потока помещали вокруг восходящей аорты, а твердотельный датчик давления вводили в левый желудочек. Через три-четыре дня измеряли содержание кислорода в крови аорты и коронарного синуса, кровоток миокарда левого желудочка, частоту сердечных сокращений, артериальное давление в аорте и левом желудочке, скорость кровотока в восходящей аорте и первую производную давления в левом желудочке (dP/dt). скорость кровотока в восходящей аорте (dV/dt) в течение контрольного периода и при снижении содержания кислорода в восходящей аорте на 50 и 75%. Рассчитывали потребление кислорода миокардом. Во время исследования не было отмечено значительных изменений рН крови в аорте или коронарном синусе или напряжения СО2. Содержание кислорода в крови коронарного синуса и артериовенозная разница кислорода в левом желудочке уменьшались как линейная функция содержания кислорода в аортальной крови.
Через левую торакотомию мы установили наполненные жидкостью катетеры в восходящую аорту, коронарный синус и левое предсердие. Электромагнитный датчик потока помещали вокруг восходящей аорты, а твердотельный датчик давления вводили в левый желудочек. Через три-четыре дня измеряли содержание кислорода в крови аорты и коронарного синуса, кровоток миокарда левого желудочка, частоту сердечных сокращений, артериальное давление в аорте и левом желудочке, скорость кровотока в восходящей аорте и первую производную давления в левом желудочке (dP/dt). скорость кровотока в восходящей аорте (dV/dt) в течение контрольного периода и при снижении содержания кислорода в восходящей аорте на 50 и 75%. Рассчитывали потребление кислорода миокардом. Во время исследования не было отмечено значительных изменений рН крови в аорте или коронарном синусе или напряжения СО2. Содержание кислорода в крови коронарного синуса и артериовенозная разница кислорода в левом желудочке уменьшались как линейная функция содержания кислорода в аортальной крови. Миокардиальный кровоток увеличивался пропорционально снижению содержания кислорода в аортальной крови. Потребление кислорода миокардом увеличивалось во время гипоксемии, но не как функция содержания кислорода в аортальной крови. Значимых изменений конечно-диастолического давления в левом желудочке или среднего артериального давления в аорте не наблюдалось. dP/dt и dV/dt удваивались во время гипоксемии, но это увеличение не зависело от содержания кислорода в аортальной крови. У находящихся в сознании, неанестезированных новорожденных ягнят снижение содержания кислорода в аортальной крови на 50 и 75% было связано со значительным увеличением кровотока миокарда левого желудочка, потребления кислорода и сократительной функции.
Миокардиальный кровоток увеличивался пропорционально снижению содержания кислорода в аортальной крови. Потребление кислорода миокардом увеличивалось во время гипоксемии, но не как функция содержания кислорода в аортальной крови. Значимых изменений конечно-диастолического давления в левом желудочке или среднего артериального давления в аорте не наблюдалось. dP/dt и dV/dt удваивались во время гипоксемии, но это увеличение не зависело от содержания кислорода в аортальной крови. У находящихся в сознании, неанестезированных новорожденных ягнят снижение содержания кислорода в аортальной крови на 50 и 75% было связано со значительным увеличением кровотока миокарда левого желудочка, потребления кислорода и сократительной функции.
Похожие статьи
Влияние бета-адренорецепторов на повышенное потребление кислорода миокардом при гипоксемии у бодрствующих новорожденных ягнят.

Фишер Диджей.
Фишер диджей.
Педиатр рез. 1989 июнь; 25 (6): 585-90. doi: 10.1203/00006450-198906000-00007.
Педиатр рез. 1989.PMID: 2740149
Ацидемия снижает сердечный выброс и сократительную способность левого желудочка у находящихся в сознании ягнят.
Фишер Диджей.
Фишер диджей.
Дж Дев Физиол. 1986 г., февраль; 8 (1): 23–31.
Дж Дев Физиол. 1986 год.PMID: 3958441
Повышение регионарного миокардиального кровотока и доставки кислорода при гипоксемии у ягнят.
Фишер Диджей.
Фишер диджей.
Педиатр рез. 1984 июль; 18 (7): 602-6. doi: 10.1203/00006450-198407000-00007.
Педиатр рез. 1984.PMID: 6472931
Потребление кислорода миокардом плода и потребление углеводов при остро индуцированной гипоксемии.

Фишер Д.Дж., Хейманн М.А., Рудольф А.М.
Фишер Д.Дж. и др.
Am J Physiol. 1982 г., апрель; 242(4):H657-61. doi: 10.1152/ajpheart.1982.242.4.H657.
Am J Physiol. 1982.PMID: 7065278
Влияние тахикардии, вызванной предсердной стимуляцией, на сократительную функцию левого желудочка у новорожденных и взрослых овец в сознании.
Фишер Д.Дж., Гросс Д.М.
Фишер Д.Дж. и др.
Педиатр рез. 1983 авг; 17 (8): 651-6. doi: 10.1203/00006450-198308000-00009.
Педиатр рез. 1983.PMID: 6889008
Посмотреть все похожие статьи
Цитируется
Режимы вентиляции с регулируемым объемом и давлением при острой дыхательной недостаточности у детей.

Кихтыр Х.С., Акчай Н., Шевкетоглу Э.
Кихтыр Х.С. и др.
Терк Дж Анаэстезиол Реаним. 2022 фев; 50 (1): 18-23. doi: 10.5152/TJAR.2021.1412.
Терк Дж Анаэстезиол Реаним. 2022.PMID: 35256341
Бесплатная статья ЧВК.Сердечно-сосудистые изменения и полиорганная дисфункция после родовой асфиксии.
Polglase GR, Ong T, Hillman NH.
Полглас Г.Р. и соавт.
Клин Перинатол. 2016 сен;43(3):469-83. doi: 10.1016/j.clp.2016.04.006. Epub 2016 22 июня.
Клин Перинатол. 2016.PMID: 27524448
Бесплатная статья ЧВК.Обзор.
Регуляция утилизации углеводов и жирных кислот L-карнитином при развитии сердца и гипоксии.
Абдель-Алим С., Сент-Луис Дж., Хендриксон С.
 К., Эль-Шеви Х.М., Эль-Дави К., Тейлор Д.А., Лоу Дж.Е.
К., Эль-Шеви Х.М., Эль-Дави К., Тейлор Д.А., Лоу Дж.Е.Абдель-алим С. и др.
Мол Селл Биохим. 1998 марта; 180 (1-2): 95-103.
Мол Селл Биохим. 1998.PMID: 9546635
Типы публикаций
термины MeSH
вещества
Гипоксия, усугубляющаяся механической вентиляцией легких: когда открывается люк при тяжелой правожелудочковой недостаточности
Текст статьи
Меню статей
- Артикул
Текст - Артикул
информация - Цитата
Инструменты - Поделиться
- Быстрое реагирование
- Артикул
метрика - Оповещения
Изображения в кардиологии
Гипоксия, усугубляемая искусственной вентиляцией легких: когда открывается люк при тяжелой правожелудочковой недостаточности
- Андрей Д.
 Маргулеску1,2,
Маргулеску1,2, - Ричард Уиллер1,
- Фонг Т. Леонг1
- 1 Отделение кардиологии, университетская больница Уэльса, Кардифф, Великобритания
- 2 Университет медицины и фармации им. Кэрол Давила, Бухарест, Румыния
- д-р Фонг Т. Леонг, отделение кардиологии, Университетская больница Уэльса, Хит-Парк, Кардифф CF14 4XW, Великобритания; ftleong{at}gmx.com
http://dx.doi.org/10.1136/heartjnl-2013-303905
Статистика с сайта Altmetric.com
Запросить разрешения
направит вас к службе RightsLink Центра защиты авторских прав. Вы сможете получить быструю цену и мгновенное разрешение на повторное использование контента различными способами.
- СЕРДЕЧНАЯ НЕДОСТАТОЧНОСТЬ
49-летний мужчина с неишемической кардиомиопатией поступил с острой гипоксией. Несколькими неделями ранее было обнаружено, что его правый желудочек серьезно нарушен в функции с признаками, указывающими на обширный миокардиальный фиброз (рис.