Гипертрофия плода при беременности: Вопрос задает – Юлечка, — вопрос-ответ от специалистов клиники «Мать и дитя»
Задержка роста и гипотрофия плода при многоплодной беременности
Несмотря на многочисленные исследования, направленные на совершенствование диагностики, тактики ведения беременности и родов, пациентки с многоплодной беременностью продолжают представлять группу высокого риска развития перинатальных осложнений, что вызывает постоянный научный и практический интерес [1]. Поскольку эволюционно организм женщины приспособлен для вынашивания одного плода, многоплодная беременность — это классическая модель фетоплацентарной недостаточности [2].
Цель исследования — выявление частоты случаев задержки роста и гипотрофии плода при многоплодной беременности с целью своевременной профилактики перинатальных потерь.
Материал и методы
В исследование были включены 202 беременные женщины, из которых были сформированы две клинические группы: 1-ю (основную) группу составила 51 беременная с многоплодием, наступившим после экстракорпорального оплодотворения (ЭКО) и переноса эмбриона; 2-ю группу (сравнения) — 151 женщина со спонтанно наступившей беременностью двойней.
Морфогистологическое исследование плаценты включало органо-, макро- и гистометрию. Первым этапом исследования плаценты явилось определение органометрических показателей.
При органометрии плаценты производили определение ее массы путем взвешивания без оболочек, с культей пуповины не более 1 см. Объем измеряли по вытесненной воде в мерном цилиндре. Площадь ее определяли по контуру отпечатка материнской поверхности с помощью миллиметровой бумаги. Высчитывали плацентарно-плодовый коэффициент (ППК) — отношение массы плаценты к массе плода.
При макрометрии плаценты визуально оценивали ткань свежей плаценты, определяли процентное соотношение видимых нерабочих зон, т. е. инфарктов, кровоизлияний или кист, известковых отложений по отношению к нормальной ткани плаценты.
С целью гистометрии взятие кусочков плаценты производили по следующей схеме: в случайном порядке через всю ее толщину брали по два образца ткани размером 1,5×0,8 см из центральной, парацентральной и краевой зон таким образом, чтобы в одном из них обязательно были хориальная пластинка, слой ворсинчатого хориона и материнская поверхность. Фиксацию проводили в 10% водном растворе формалина. Потом образцы проводили по общепринятым методикам с последующей заливкой в парафин. Гистологические срезы окрашивали гематоксилином и эозином.
Фиксацию проводили в 10% водном растворе формалина. Потом образцы проводили по общепринятым методикам с последующей заливкой в парафин. Гистологические срезы окрашивали гематоксилином и эозином.
Статистическую обработку данных осуществляли с помощью программы Statistiсa 6.0 с применением основных методов описательной статистики. Статистические гипотезы проверяли путем выявления различий между сравниваемыми группами с применением критерия Стьюдента, точного критерия Фишера, критерия χ2. При всех статистических расчетах критический уровень ошибки (p) принимали равным 0,05.
Результаты и обсуждение
В группе женщин с индуцированным многоплодием в 32—34 нед беременности при ультразвуковом исследовании (УЗИ) выявлена задержка роста плодов (ЗРП) в 29,4% (15) случаев, а гипотрофия новорожденных отмечена в 19,6% (22) наблюдений, из них I степени — в 72,7% (16) и II степени — в 13,6% (3), III степени — в 13,6% (3) случаев. При трихориальной триамниотической тройне среди 30 новорожденных ЗРП выявлена в 26,7% (8) случаев, среди 64 детей при дихориальной двойне — в 17,2% (11), а среди 18 новорожденных при монохориальной двойне — в 16,7% (3) случаев. У этих женщин течение беременности осложнялось угрозой прерывания беременности в 27,5% (15), анемией — в 13,7% (7), преэклампсией — в 17,6% (9) случаев.
У этих женщин течение беременности осложнялось угрозой прерывания беременности в 27,5% (15), анемией — в 13,7% (7), преэклампсией — в 17,6% (9) случаев.
При УЗИ была диагностирована ЗРП плодов у беременных группы сравнения (спонтанное многоплодие) в 28,5% (43) случаев. Гипотрофия новорожденных в этой группе наблюдалась в 25,2% (76) случаев, причем I степени — в 68,4% (52), II степени — в 22,4% (17) и III — в 9,2% (7) случаев. При анализе показателей у новорожденных с гипотрофией получены статистически значимые различия между основной группой и группой сравнения (р<0,01).
При дихориальном типе плацентации среди 162 новорожденных группы сравнения ЗРП различной степени тяжести выявлена в 25,9% (42) случаев. При монохориальном типе из 140 новорожденных данное осложнение имелось в 24,3% (34) случаев (р>0,05).
В обеих группах с многоплодием гипотрофия плода, как правило, носила асимметричный характер и была диагностирована по данным УЗИ. Лишь в нескольких случаях была диагностирована симметричная (гипопластическая) ЗРП. У этих пациенток беременность также протекала на фоне угрозы прерывания в 23,2% (35), преэклампсии — в 13,9% (21), анемии — в 12,6% (19), в 10,6% (16) случаев во время беременности было диагностировано диссоциированное развитие плодов.
У этих пациенток беременность также протекала на фоне угрозы прерывания в 23,2% (35), преэклампсии — в 13,9% (21), анемии — в 12,6% (19), в 10,6% (16) случаев во время беременности было диагностировано диссоциированное развитие плодов.
В основной группе при индуцированном многоплодии в 32—33 нед беременности было выявлено диссоциированное развитие плодов в 29,4% (15) случаев и встречалось при трихориальной триамниотической тройне у 4 обследуемых из 10, при монохориальном типе плацентации у 3 из 9, при дихориальном типе плацентации из 32 случаев в 8 (25%). Разница в массе тела новорожденных составляла при монохориальной двойне от 580 до 1200 г, а при трихориальной триамниотической тройне — от 550 до 1300 г. При осложненном течении беременности с ростом гестационного срока степень диссоциации плодов увеличивалась.
В группе сравнения диссоциированное развитие плодов выявлено также в 32—33 нед в 18,5% (28) случаев, из них при дихориальном типе плацентации в 15 (18,5%) из 81 наблюдения, при монохориальном из 70 наблюдений — у 13 (18,6%) обследуемых.
Оценить степень и характер плацентарных нарушений невозможно без анализа гистоморфологических данных. Исследованы плаценты, полученные в результате преждевременных родов в сроки 33,7±2,6 нед в основной группе при индуцированном многоплодии и в группе сравнения при преждевременных родах в сроки 35,1±1,1 нед.
Органометрические показатели плацент (масса плаценты, ее объем и площадь, плацентарно-плодовый коэффициент) у пациенток обследуемых групп находились в пределах нормы. Масса плаценты при дихориальном типе плацентации в основной группе составила 417,6±192,1 г, в группе сравнения — 356,6±99,2 г, площадь материнской поверхности — 472,0±93,5 и 390,3±21,9 см2 соответственно. При монохориальном типе плацентации масса плаценты была одинаковой в обеих группах — 703,1±145,6 г.
Масса, площадь материнской поверхности плацент в основной группе и группе сравнения не имели статистически достоверных различий. Плаценты с такими параметрами способны полностью обеспечить внутриутробное развитие плода.
Главной особенностью гистологического строения плацент было наличие неравномерного созревания отдельных котиледонов. Наряду с нормальными, хорошо васкуляризированными ворсинами, встречались хаотичные зоны склерозированных ворсин с малым количеством капилляров. Относительная незрелость ворсинчатого дерева выражалась в двух формах: преждевременном созревании ворсин и диссоциированном их развитии.
Нарушение созревания ворсин отмечено в 13,7% (7) случаев в основной и 5,96% (9) в группе сравнения. Нарушение созревания ворсин диагностировано у пациенток с экстрагенитальной патологией, с осложненным течением беременности (угроза прерывания беременности, преэклампсия, анемия).
Преждевременное созревание ворсин диагностировали при невынашивании беременности, когда в плаценте в гестационные сроки 32—33 нед доминировали терминальные ворсины с узкими капиллярами, не формирующими синцитиокапиллярные мембраны. Диссоциированное развитие ворсин имелось только при многоплодной беременности: в основной группе — у 5 (13,9%) пациенток, в группе сравнения — у 9 (9,4%) и проявлялось в распространенном сочетании котиледонов с персистенцией тех или иных типов незрелых ворсин с участками зрелого строения.
Анализ течения беременности у этих пациенток выявил наличие большого числа осложнений во всех триместрах: угроза прерывания, преэклампсия, анемии, соматические заболевания. Возраст этих женщин колебался от 31 года до 38 лет. У каждой был отягощен акушерско-гинекологический анамнез наличием медицинских и самопроизвольных абортов, хронических воспалительных заболеваний органов малого таза, миомы матки.
В исследуемых плацентах в 27,8% (10) наблюдений в основной группе и в 14,6% (14) наблюдений в группе сравнения отмечались признаки воспаления (децидуит, виллузит, хориоамнионит). У этих пациенток в анамнезе и во время беременности диагностировались инфекции, передаваемые половым путем, сифилис, заболевания мочеполовой системы: гестационные и хронические пиелонефриты, мочекаменная болезнь. В родах отмечались дородовое излитие околоплодных вод, слабость родовой деятельности, фетоплацентарная недостаточность, внутриутробное инфицирование плодов.
Таким образом, результаты проведенного исследования показывают, что при многоплодной беременности как индуцированной, так и спонтанно наступившей, определяется высокая частота задержки роста диссоциированного развития плодов, гипотрофии новорожденных, что обусловлено в большой степени неравномерным созреванием и диссоциированным развитием ворсин. Все перечисленное свидетельствует о необходимости проведения мероприятий по профилактике перинатальных потерь при многоплодной беременности. Проведение прегравидарной подготовки, предупреждение многоплодной беременности в программе ЭКО, ранняя диагностика многоплодной беременности и предупреждение ее осложнений, выбор рационального метода родоразрешения с учетом гестационного срока являются важным резервом в снижении перинатальной и материнской заболеваемости и смертности.
Все перечисленное свидетельствует о необходимости проведения мероприятий по профилактике перинатальных потерь при многоплодной беременности. Проведение прегравидарной подготовки, предупреждение многоплодной беременности в программе ЭКО, ранняя диагностика многоплодной беременности и предупреждение ее осложнений, выбор рационального метода родоразрешения с учетом гестационного срока являются важным резервом в снижении перинатальной и материнской заболеваемости и смертности.
Выводы
1. В результате проведенного исследования установлено, что при многоплодной беременности как индуцированной, так и спонтанно наступившей определяется высокая частота задержки роста плодов, диссоциированного развития плодов и гипотрофии новорожденных.
2. Особенностью гистологического строения плаценты (плацент) при многоплодной беременности является неравномерное созревание отдельных котиледонов, обусловленное как преждевременным созреванием ворсин, так и диссоциированным их развитием, что лежит в основе фетоплацентарной недостаточности.
3. Мероприятиями по профилактике перинатальных потерь при многоплодной беременности могут служить следующие: проведение прегравидарной подготовки, предупреждение многоплодия при использовании программ экстракорпорального оплодотворения, ранняя диагностика многоплодной беременности и предупреждение ее осложнений, выбор рационального метода родоразрешения с учетом срока беременности.
Внутриутробная гипотрофия плода при беременности: причины, признаки
Пожаловаться
Обновлено
Содержание:
Степени тяжести
Симметричная форма
Асимметричная форма
Диагностика
Последствия
Лечение
Профилактика
Видео
Вес и рост новорожденного играют важную роль в его будущем развитии. Родители гордятся хорошими показателями и с удовольствием рассказывают о них близким. Но не всем есть чем похвастаться. Гипотрофия плода – задержка развития еще не рожденного малыша. Диагноз ставится в ходе обследований беременной и требует лечения.
Диагноз ставится в ходе обследований беременной и требует лечения.
Гипотрофия плода – это вид дистрофии, при которой нарушение питания и трофики тканей имеет хронический характер, вследствие чего снижается масса плода по отношению к его длине. Гипотрофия плода опасна тем, что при это патологии нарушается развитие некоторых органов и систем плода.
Гипотрофия выявляется при осмотре у гинеколога и подтверждается результатами УЗИ.
Степени тяжести
Патология выражается по-разному. В связи с этим выделяют три степени:
- Первая. Отставание меньше двух недель. Обычно данный диагноз не представляет опасности и не подтверждается после родов. Признаки патологии связывают с неточностями при определении сроков беременности и генетическими особенностями матери и отца.
- Вторая. Задержка от двух до четырех недель. Требует наблюдения и обязательного лечения.
- Третья. Опасное состояние, при котором плод полностью истощен.

Любая степень требует внимания со стороны матери и врачей. Вовремя начатая терапия гарантирует положительный результат.
Симметричная форма
Патология выявляется на первых месяцах при помощи УЗИ. Плод развивается пропорционально, все органы уменьшены пропорционально. Причины возникновения данной формы гипотрофии:
- вредные привычки и плохое питание матери, отсутствие достаточного количества витаминов в рационе;
- внутриутробная инфекция плода;
- пороки в развитии;
- хромосомные аномалии;
- фетоплацентарная недостаточность.
Прежде чем поставить диагноз, назначаются повторные обследования, берутся анализы, выясняются возможные предпосылки.
Асимметричная форма
В данном случае патология развивается после шестого месяца. Явным признаком считается несоответствие размеров некоторых органов по отношению к телу. Мозг и внешние размеры тела соответствуют сроку, а некоторые внутренние органы значительно меньше. Причины отклонения:
Причины отклонения:
- возраст матери больше 30 или меньше 17 лет;
- профессиональная вредность;
- курение, алкоголь, прем наркотических средств;
- преэклампсия;
- наличие у матери хронических инфекций и общих заболеваний;
- гормональные нарушения;
- выкидыши, невынашивание в прошлом;
- патологии матки;
- анемия у матери;
- угроза прерывания или многоплодная беременность;
- обострение хронических заболеваний.
В результате воздействия этих факторов ухудшаются обменные процессы, матка перестает снабжаться питательными веществами и кислородом в достаточном объеме. Плод голодает, и темпы роста замедляются. При длительном отсутствии терапии развивается дистрофия.
Диагностика
Патологию можно обнаружить на очередном акушерском осмотре. Гинеколог измеряет высоту стояния дна матки, объем живота и другие показатели. В норме они должны увеличиваться из раза в раз.
В норме они должны увеличиваться из раза в раз.
Если при осмотре обнаружено, что масса тела в соотношении к его длине снижается, то это говорит о гипотрофии.
Гипотрофия плода возникает из-за хронического нарушения клеточного питания, это ведёт к неправильному развитию многих органов плода, нарушает функции отдельных систем.
Для уточнения диагноза проводится внеплановое УЗИ, измеряются все параметры плода, оценивается состояние плаценты. Исследование проводится в динамике, чтобы отслеживать состояние ребенка и вовремя оказать необходимую помощь. Повторное УЗИ женщина проходит через три недели.
Гипотрофия при беременности влияет не только на физические показатели, но и на самочувствие плода.
При голодании функциональное состояние значительно ухудшается. Для обследования используется метод допплерометрии. С его помощью определяется кровоток в крупных артериях. По результатам исследования дается заключение о достаточности снабжения кровью плода и матки.
С 30-й недели возможно проводить ультразвуковую кардиотокографию. Этот метод помогает оценить сердечно-сосудистую систему и эффективность ее работы.
Последствия
1-я степень гипотрофии не несет серьезной опасности для ребенка. Своевременная адекватная терапия без труда исправит ситуацию. Младенец появляется на свет здоровым, но с небольшим весом. К двум годам разница между ним и сверстниками исчезает. В некоторых случаях у детей отмечается слабый иммунитет, отсутствие аппетита, проблемы с концентрацией внимания и усидчивостью. При грамотном подходе все эти недостатки быстро купируются. При осмотре новорожденного отмечается:
- бледная кожа;
- низкий тургор тканей;
- тонкий подкожно-жировой слой на животе.
2-я и 3-я степень несут в себе более серьезную угрозу: пороки внутренних органов, задержка умственного и психического развития.
2-я степень проявляется у младенцев в следующем:
- аппетит снижен;
- ребенок очень активен временами либо вялый;
- медленное моторное развитие;
- кожа бледная, сухая;
- низкий тургор и потеря эластичности тканей;
- подкожный слой жира на всем теле практически отсутствует, за исключением лица;
- одышка, тахикардия.

Дети склонны к простудным заболеваниям, пиелонефриту, отиту, пневмонии.
Самая серьезная, 3-я степень характеризуются следующими факторами:
- подкожно жировой слой отсутствует во всем теле и лице;
- нервно-психическое развитие отстает от нормы;
- маленький рост;
- младенец не реагирует на звук, свет и боль;
- мышцы атрофируются;
- нарушена терморегуляция.
Внутриутробное истощение меняет черты лица. Родничок и глазные яблоки западают, образуются трещинки в уголках рта. Новорожденные плохо едят, часто срыгивают. Понос и рвота беспокоят их постоянно. Среди многочисленных заболеваний чаще всего диагностируют стоматит, конъюнктивит, рахит, пневмонию, анемию, глоссит, брадикардию, гипогликемию, гипотермию.
Лечение
Прежде всего врач стремится установить причину заболевания. После этого можно приступать к ее устранению. Существуют следующие методы лечения гипотрофии:
- Проводится коррекция рациона питания беременной.
 Увеличивается количества калорий, белков и витаминов.
Увеличивается количества калорий, белков и витаминов. - Прописываются препараты для улучшения кровообращения в плаценте.
- Чтобы расслабить матку, назначаются токолитики.
- Если плод страдает от гипоксии, необходимо принимать средства, которые способствуют притоку кислорода.
Женщина проходит лечение дома или в больнице. Обязательно проводится регулярная оценка функционального состояния ребенка.
Профилактика
Гипотрофия плода негативно сказывается на его состоянии и влияет на развитие в будущем. Таких ситуаций лучше не допускать. Для этого запомните простые правила профилактики.
- На этапе планирования беременности пройдите полное обследование. Пролечите все возможные инфекции. Сходите к стоматологу.
- Откажитесь от вредных привычек. Больше гуляйте на свежем воздухе. Делайте зарядку ежедневно.
- Спите минимум восемь часов в сутки. Ложитесь отдыхать днем.

- Позаботьтесь о сбалансированном питании. Если необходимо, покупайте специальные витамины для женщин в положении.
- Пройдите профилактическое лечение хронических заболеваний. Вам надо постараться избежать обострений при беременности.
- Проконсультируйтесь с врачом, если присутствуют отклонения в работе сердечно-сосудистой системы, печени, почек, легких. Вы должны быть оповещены о всех возможных осложнениях. Примите меры, чтобы их избежать.
- Становитесь на учет на раннем сроке. Врач сможет оценить ваше состояние, сделать прогноз.
- Неукоснительно выполняйте все рекомендации. Вовремя сдавайте анализы и делайте УЗИ.
Беременная женщина обязана беречь свое здоровье. От ее действий зависит жизнь будущего человека. Ради этого стоит изменить привычки, отказаться от курения и алкоголя. Диагноз «гипотрофия» в женских консультациях ставят часто. Обнаруженная на начальных сроках патология хорошо поддается лечению. Она требует совместной планомерной работы будущей матери и гинеколога.
Она требует совместной планомерной работы будущей матери и гинеколога.
Проходите вовремя все обследования и всегда будете точно знать, как обстоят дела у ребенка. Врач на каждом приеме дает рекомендации о том, как питаться, какие лекарственные препараты и витамины пить. Соблюдайте его рекомендации. Не отчаивайтесь, если обнаружилась данная патология 2-й или 3-й степени. Врач может порекомендовать госпитализацию, не отказывайтесь. Под ежеминутным наблюдением будет легче скорректировать все опасные моменты.
Находясь дома, больше отдыхайте, ешьте свежие фрукты. Займитесь йогой для беременных. Спокойные упражнения помогут расслабиться, снять стресс и обрести гармонию. Постарайтесь меньше нервничать, думайте только о хорошем.
Видео
Читайте также: симптомы внутриутробной гипотрофии у новорожденных
Фото: © Depositphotos
* Представленная информация не может быть использована для самостоятельной постановки диагноза, определения лечения и не заменяет обращение к врачу!
РубрикаЗдоровье
Причины схваткообразных болей внизу живота
Симптомы и лечение гиперплазии эндометрия
Искусство материнства – научить детей искусству жизни
Комментарии
Узнавай и участвуй
Клубы на Бэби. ру — это кладезь полезной информации
ру — это кладезь полезной информации
Как не провести осень на больничном?Покупать ли лекарства на маркетплейсах?Как выбрать продукты для ребенка?Первая аптечка для малышаГалерея пятен вашего малыша
Как выявить задержку роста и внутриутробного развития плода
Получить результаты анализов
- Главная
- Как распознать болезнь
- Беременность и роды
- Задержка внутриутробного развития плода
Подробнее о враче
Задержка внутриутробного развития (ЗВУР, гипотрофия) – отставание плода в физическом развитии. Это ситуация, когда фетометрические показатели не соответствуют конкретному сроку гестации. Чаще всего отклонения возникают в третьем триместре беременности и могут привести к гипоксии плода, порокам внутренних органов и даже его гибели.
Причины и патогенез
Основная причина – нарушение поступления питательных веществ и кислорода в организм малыша. Вызвать ухудшение трофики и оксигенации могут различные патологии.
- Соматические и инфекционные болезни матери. Это могут быть патологии крови, заболевания, сопровождающиеся спазмом сосудов, гинекологические проблемы, острые инфекции и эндокринопатии.
- Врожденные аномалии плода. Некоторые генетически обусловленные пороки не позволяют ребенку в полном объеме усваивать питательные вещества.
- Внутриутробная инфекция. Вирусы (краснухи, герпеса, ВИЧ и др.) и внутриклеточные паразиты (токсоплазма, микоплазма) становятся причиной врожденных аномалий и задержки внутриутробного развития.
- Патологии плаценты и оболочек. Инфаркт плаценты, ее преждевременная отслойка и инволюция приводят к фетоплацентарной недостаточности и становятся причиной кислородного голодания плода.
 Кроме того, задержку внутриутробного развития могут спровоцировать патологии пуповины, маловодие, амниотические перетяжки и др.
Кроме того, задержку внутриутробного развития могут спровоцировать патологии пуповины, маловодие, амниотические перетяжки и др. - Резус-конфликт и другие проблемы в системе «мать-ребенок». Несовместимость крови матери и плода по резус-фактору или по группе приводит к гемолизу эритроцитов, в результате чего образуется токсичный непрямой билирубин. Чаще всего при этом страдают транспортная функция крови и способность тканей усваивать питательные вещества.
- Погрешности питания беременной. Недостаток витаминов, минералов, а также дисбаланс в соотношении белков, жиров и углеводов плохо сказываются на состоянии плода.
- Негативное внешнее воздействие. Сюда можно отнести профвредности, неблагоприятную экологическую обстановку, вредные привычки, прием некоторых лекарственных препаратов, стрессы.
- Отягощенный акушерско-гинекологический анамнез. Нарушение менструального цикла, выкидыши, преждевременные роды и даже бесплодие в прошлом могут стать причиной гипотрофии плода.
 Кроме того, проблемы с внутриутробным развитием могут возникнуть при многоплодной беременности, когда появляется фетоплацентарная недостаточность.
Кроме того, проблемы с внутриутробным развитием могут возникнуть при многоплодной беременности, когда появляется фетоплацентарная недостаточность.
По данным статистики задержку внутриутробного развития регистрируют при каждой десятой беременности.
Симптомы задержки роста и развития плода
Выявить гипотрофию можно при прохождении планового УЗИ. Ярких клинических симптомов у патологии нет. Заподозрить задержку внутриутробного развития можно по медленной прибавке в весе будущей мамы и незначительному увеличению окружности живота.
В случае развития фитоплацентарной недостаточности и выраженной гипоксии снижается двигательная активность плода, что также является неблагоприятным признаком.
Диагностика задержки роста плода
Первые подозрения появляются уже на этапе акушерского осмотра, включающего измерение окружность живота и высоту стояния дна матки. При отставании показателей на 2 см можно говорить о гипотрофии. Далее беременной необходимо пройти:
Далее беременной необходимо пройти:
- УЗИ плаценты. Исследование помогает определить ее степень зрелости, размеры, структуру, местоположение и выявить повреждения. Специалисты рекомендуют дополнительно при этом сделать допплерографию маточно-плацентарного кровотока для обнаружения очагов инфаркта и патологий сосудистого русла.
- Фетометрия плода. Измерение размеров плода (окружности головы, груди, живота, длины конечностей и пр.) во время сонографии. Полученные данные сравнивают с нормой и делают соответствующее заключение.
- Кардиотокография и фонокардиография. Исследование сердцебиения плода. При ЗВУР на кардиотокограмме будут видны нарушения ритма и учащенное сердцебиение, что свидетельствует о фетоплацентарной недостаточности.
Достоверными лабораторными показателями, подтверждающими задержку внутриутробного развития, являются:
- накопление ингибиторов клеточного роста в плаценте — соединений, которые угнетают факторы роста, отвечающие за формирование плаценты;
- снижение концентрации инсулиноподобного фактора роста (ИФР) – вещества, участвующего в гормональной регуляции процессов роста и развития плода;
- повышение уровня сосудисто-эндотелиального фактора роста (СЭФР) – компенсаторного механизма, благодаря которому при развивающейся гипоксии плода активизируется процесс образования новых кровеносных сосудов в плаценте.

Все эти данные можно получить только при кордоцентезе – заборе крови из сосудов пуповины во время беременности. Но поскольку эта процедура является инвазивной и может привести к серьезным осложнениям, ее практически не проводят в ходе скрининга. Выполняют данный анализ только после рождения ребенка, извлекая все факторы непосредственно из плаценты.
Лечение
Выбор врачебной тактики зависит от степени гипотрофии плода и выраженности фетоплацентарной недостаточности. Лечение проходит под контролем УЗИ. При этом обязательно делают фетометрию плода, допплерографию плацентарного кровотока и кардиотокографию. Беременной назначают:
- Средства, улучшающие кровоснабжение плода. Сюда входят ангиопротекторы, препараты, влияющие на реологические свойства крови и токолитики, снимающие тонус матки.
- Противогипоксические и мембраностабилизирующие лекарства. Эта группа состоит из препаратов, улучшающих трофику, кровообращение и метаболизм, а также антиоксидантов и общеукрепляющих средств.

Если благодаря лечению удается стабилизировать состояние плода, беременность пролонгируют до 37 недель. В случае неэффективности проводимой терапии или при ухудшении общего состояния ребенка проводят досрочное родоразрешение путем кесарева сечения.
Гипертрофия плода при беременности: причины и последствия
Плюсы и минусы > Медицина и здоровье > Гипертрофия плода при беременности: причины и последствия
Каждая женщина, ожидающая рождения младенца, старается соблюдать все рекомендации врачей. Если размер плода меньше, чем срок беременности, женщина начинает волноваться: малыш отстает в развитии, возможно беременность прервется. Однако и ускоренное развитие, называемое в медицине гипертрофией, заслуживает серьезного внимания со стороны специалистов.
О гипертрофии говорят в том случае, когда по результатам скринингового исследования предполагаемый вес ребенка на момент родов превышает 4 кг, а его рост больше 54 см.
Что такое гипертрофия развития
Гипертрофией развития в медицине признается совокупность биометрических параметров плода, значение которых превышает средние показатели нормы. Как правило, о гипертрофии врачи-гинекологи и УЗИсты говорят не раньше 30 недели беременности.
Под влиянием различных групп факторов, ребенок в период внутриутробного развития может опережать нормы акушерских сроков беременности. При этом гинекологи подразделяют гипертрофию на истинную и ложную.
Истинная гипертрофия развивается из-за повышенной скорости работы органов и систем. Ложная гипертрофия обусловлена наличием у малыша избыточного количества жировой ткани.
В обществе существует стереотип, что чем крупнее родится малыш, тем лучше. Именно поэтому, будучи в положении, женщина стремится разнообразить свой рацион, не допускать возникновение чувства голода, чтобы ребенок получал все необходимые микроэлементы для полноценного развития.
Однако, с медицинской точки зрения, крупные размеры ребенка являются отклонением от нормального протекания беременности. В медицинской карте беременной участковый гинеколог при обнаружении ускоренного развития плода делает пометку о гипертрофии, так как это причинам и последствиям такого феномена во время беременности врачи уделяют пристальное внимание.
В медицинской карте беременной участковый гинеколог при обнаружении ускоренного развития плода делает пометку о гипертрофии, так как это причинам и последствиям такого феномена во время беременности врачи уделяют пристальное внимание.
Причины развития гипертрофии
Статистика родильных домов свидетельствует, что в последнее время количество новорожденных с повышенными биометрическими данными значительно увеличилось. По мнению специалистов, причинами гипертрофии являются:
- Неправильное определение акушерского срока беременности при постановке женщины на учет в женскую консультацию (в этом случае диагноз гипертрофии будет стоять только во время наблюдения за протеканием беременности, на свет появится ребенок, биометрические параметры которого соответствуют средним показателям нормы)
- Генетическая предрасположенность и наследственный фактор (если родители будущего ребенка высокие или имеют избыточную массу тела, то не стоит ожидать, что у них родится миниатюрный малыш)
- Нарушение нормальной выработки гормонов в женском организме (гормональный дисбаланс женщины приводит к неправильной работе жизненно важных органов у плода)
- Сахарный диабет в анамнезе будущей матери.

- Отечность у младенца, возникающая из-за врожденной патологии мочеполовой системы (при проведении УЗИ-диагностики в данном случае плод будет выглядеть крупным)
- Повышение качества жизни населения (большинство семейных пар не испытывают финансовых трудностей, поэтому будущие мамы имеют возможность соблюдать режим питания)
- Разнообразное меню женщины во время беременности (в период беременности вкусовые пристрастия женщины изменяются, в магазинах сегодня можно приобрести любые фрукты и овощи, всевозможные деликатесы)
- Употребление будущей матерью слишком калорийной пищи, продуктов, в которых содержится большое количество углеводов (если беременная женщина стремительно набирает вес при беременности, значит и ребенок стремительно растет)
- Ускоренное созревание плаценты влечет за собой закономерное ускоренное созревание плода (через пуповину питательные вещества из плаценты передаются малышу в ускоренном темпе)
- Перенашивание, затянувшаяся беременность (о ней говорят, когда женщина рожает позже 40 недели беременности, признаками перенашивания являются зеленоватые околоплодные воды, сухая кожа новорожденного, сморщенность кожных покровов, крупный плод).
Принято считать, что размеры тела и вес новорожденного зависят от количества родов, которые были у женщины. С каждой следующей беременностью вероятность гипертрофии повышается, так как вынашивание младенца становится для организма привычной функцией, не вызывающей стресса.
Последствия гипертрофии
Прохождение крупного ребенка по родовым путям осуществляется значительно труднее, чем рождение ребенка со средними показателями роста и веса. При гипертрофии возможны следующие последствия:
- При перенашивании возможно инфицирование плода патогенной микрофлорой околоплодных вод.
- Преждевременные роды (женщина может родить на 34-37 недели беременности)
- Затяжные роды.
- Невозможность естественных родов (если у женщины узкий таз, то крупный ребенок не сможет самостоятельно появиться на свет, поэтому врачи будут применять оперативные методы родовспоможения)
- Разрывы внешних и внутренних половых органов женщины в процессе родов (это чревато сложностями и ограничениями в послеродовом периоде)
- Риск травмирования ребенка во время родов (грозит серьезными нарушениями в умственном и психическом развитии малыша).

Рекомендации для предотвращения развития гипертрофии
Гипертрофия может стать причиной серьезных проблем со здоровьем как у ребенка, так и у матери в послеродовой период. Чтобы избежать этого, врачи рекомендуют женщинам планировать беременность и проходить углубленное обследование, ежедневно заниматься гимнастикой, больше двигаться и гулять.
Беременной женщине следует помнить, что переедание негативно сказывается не только на ее самочувствии, вызывая ощущение тяжести в животе, но и на созревании органов и систем плода. Поэтому в период беременности врачи советуют принимать пищу небольшими порциями 5-6 раз в день. Совокупный объем пищи, употребляемый за 1 раз не должен превышать 200 гр.
Если во время беременности наблюдается опережение акушерских сроков, следует обратиться за консультацией к эндокринологу.
Гипотрофия плода: симптомы и формы заболевания, а также методы его лечения
Вес новорожденного имеет фундаментальное значение для его развития в будущем. Поэтому часто информация о родившемся ребенке выглядит как: «Пол, вес». Но иногда ребенок рождается не таким крупным по сравнению с другими младенцами и на протяжении всей беременности отстает в физическом развитии и весе.
Поэтому часто информация о родившемся ребенке выглядит как: «Пол, вес». Но иногда ребенок рождается не таким крупным по сравнению с другими младенцами и на протяжении всей беременности отстает в физическом развитии и весе.
Что нужно знать о гипотрофии плода? Гипотрофия плода – это замедление темпов роста ребенка во время беременности, в наше время именуется «синдромом задержки внутриутробного развития».
Симптомы
Самостоятельно поставить себе диагноз «гипотрофия плода» невозможно. Однако высота дна матки и показатели окружности живота могут говорить нам о возможных нарушениях. Именно поэтому врач-гинеколог обязан записывать эти измерения при каждом осмотре.
К слову, настойчиво рекомендуется, чтобы женщину на протяжении всей беременности осматривал один и тот же врач. Кстати говоря, к сожалению, подкожный жир, индивидуальное телосложение будущей матери часто мешают однозначной диагностике.
Признаки
Поводом для обращения к врачу может стать «не увеличенный живот» на 2?3 неделе беременности. Иногда длина матки женщины может стать меньше, но, само собой, это не значит, что ребенок уменьшился в своих размерах, просто он изменил положение своего тела в матке.
Иногда длина матки женщины может стать меньше, но, само собой, это не значит, что ребенок уменьшился в своих размерах, просто он изменил положение своего тела в матке.
Небольшую длину матки и большой объем живота (измеряется по пупку) может иметь женщина, у которой плод находится в поперечном положении (лежит поперек матки).
Причины
Очень часто причиной отставания плода в развитии является его отравление различными «вредностями», которые могут поступать в организм матери. Причем, по ее собственной инициативе.
Это, известные всем, никотин и смолы из сигарет, (в принципе, весь их состав преимущественно опасен для ребенка), алкоголь (дети пьющих матерей часто имеют гипотрофию мозга ? он просто весит меньше нормы!), опиаты (например, такой наркотик, как героин, оставим без комментариев).
Нужно помнить, что для беременной женщины существует такая схема: «Твой образ жизни = здоровье твоего ребенка».
Еще частой причиной гипотрофии плода может быть возраст матери: рискованный возраст – это моложе восемнадцати и старше тридцати лет.
Как принимать Элевит при беременности ? Расскажет наша статья.
О симптомах пиелонефрита при беременности можно узнать в этой статье.
Патологии организма женщины (не связанные с беременностью):
патология почек; патология сердечно-сосудистой системы; патология эндокринной системы (например, заболевания поджелудочной железы).
Негативные изменения в состоянии плаценты:
воспалительные заболевания плаценты, например, плацентит; травма или отслойка плаценты; предлежание (неправильное расположение) плаценты; инфаркт или преждевременное старение плаценты.
Существуют причины со стороны плода:
пороки развития плода; многоплодная беременность. Формы заболевания
Симметричная форма гипотрофии плода
Симметричная форма гипотрофии развивается обычно в первом триместре. Проявляется в равномерной задержке развития всех органов плода.
Причинами такой формы гипотрофии плода являются выше описанные пороки развития плода, неправильное питание женщины, хромосомные патологии.
Асимметричная форма гипотрофии плода
Асимметричная форма гипотрофии плода начинает развиваться после 28-й недели беременности. Она характеризуется неравномерным развитием различных органов плода.
К примеру, конечности и скелет, головной мозг соответствуют норме в данном сроке беременности, а почки и печень (паренхиматозные органы) имеют задержку в развитии.
Чем опасен (и опасен ли?) синдром гипотрофии плода?
Первая степень практически никогда не несет никакой опасности. Следует выполнять предписания врача, обычно назначается диета и можно обойтись без медикаментозного лечения.
Для чего назначается настойка пустырника при беременности ? Спросим у доктора!
О первых признаках беременности читайте в нашем разделе.
О лечении неразвивающейся беременности http://avidium.ru/beremennost-na-rannih-srokah/problemy-na-rannih-srokah-beremennosti/nerazvivayushaya-beremennost.html – в этой статье.
Последствия гипотрофии
Классическим примером будет слабость плода; он может быть слаб настолько, что не будет способен пробраться на свет по родовым путям самостоятельно. В таком случае будет назначено кесарево сечение.
Само по себе оно не представляет никакой опасности. Но у «кесарят» могут проявиться свои психологические особенности в будущем.
Все зависит от причины возникновения заболевания. Приобретенное слабоумие – как следствие алкогольной интоксикации (сложно представить что-то страшнее пьющей беременной женщины), также к нему могут привести тяжело переносимые токсикоз, различные инфекции.
Если не лечить банальный простудный грипп, последствия для будущего ребенка могут быть не менее катастрофическими, чем при воздействии выше перечисленных вредных факторов.
Кроме того, у такого ребенка однозначно будет снижен иммунитет и уровень сопротивляемости болезням, например, простудным инфекциям; он будет требовать к себе повышенного ухода, внимания и осторожности.
Но, чаще всего, такой ребенок рождается банально слабым и недостаточно физически развитым по сравнению с другими новорожденными.
А это исправляется наблюдением у врача, хорошим питанием и специальными физическими нагрузками для ребенка в будущем.
Часто при качественном и регулярном кормлении и редкой заболеваемости вес восстанавливается самостоятельно.
Диагностика гипотрофии плода
Врач будет проводить диагностику следующим образом:
на каждом приеме должно будет произведено измерение окружности живота беременной и высоты дна матки;
наблюдение аппаратом ультразвукового исследования (УЗИ) тоже должно быть постоянным, т.е. наблюдение в динамике, желательно, в течении двух-трех недель. Лечение гипотрофии плода
Лечение в каждом случае назначается индивидуально.
Лечение хронических заболеваний у беременной.
Коррекция питательного рациона будущей матери (преимущество у белков и углеводов).
Назначаются расслабляющие матку препараты.
Сосудорасширяющие средства, улучшающие маточно-плацентарный кровоток.
Витамины, а также препараты, нормализующие реологию крови.
Антигипоксические препараты ? позволяют дополучить ребенку необходимое количество кислорода для развития.
Средства, улучшающие обмен веществ (ферменты).
Вы спрашивали: почему болит живот на ранних сроках беременности ? Ваш вопрос – наш ответ.
О применении валерианы при беременности читайте в этой статье.
Профилактика гипотрофии плода Регулярное наблюдение у врача.
Разнообразное питание (всегда согласуется с врачом). Подразумеваются индивидуальные порции белков, углеводов и жиров (первые два важнее для хорошего «строительства» организма плода).
Отсутствие вредных воздействий: следует исключить принятие алкоголя, наркотических веществ (в том числе и сигарет).
Малое количество стрессовых факторов для матери (которые неизбежно могут сказаться на ребенке).
Безопасное место проживания беременной женщины: максимально чистая среда, воздух. Низкий уровень радиации.
Низкий уровень радиации.
Задержка внутриутробного развития и ее влияние на состояние здоровья. Современные подходы к вскармливанию детей | #09/18
Нарушения в периоде внутриутробного развития плода обусловливают большую долю мертворождений, а также оказывают влияние на уровень неонатальной и детской смертности, ведут к долгосрочным негативным последствиям для последующего роста, развития и здоровья детей. По данным экспертов ВОЗ, среди отдаленных последствий неадекватного питания на ранних этапах развития плода/ребенка отмечается повышение риска заболеваний и смерти от них в любом периоде жизни в 4–10 раз [1]. В этой связи категория маловесных к гестационному возрасту детей заслуживает особого внимания со стороны врачей неонатологов, педиатров, нутрициологов.
При этом следует помнить, что маленький вес при рождении является лишь симптомом, а не диагнозом. Кроме того, из всех плодов, имеющих массу и/или длину тела на уровне или ниже 10-го процентиля, 40% являются конституционно маленькими. Таким образом, низкие параметры физического развития внутриутробного плода необязательно являются результатом воздействия патологического процесса во время беременности. Для такой категории пациентов в иностранной научной медицинской литературе используется термин «small for gestational age» (SGA). Эти дети, как правило, здоровы и не требуют назначения коррекции и/или лечения, а нуждаются только в контроле темпов роста [2]. Наряду с этим под задержкой внутриутробного развития в Российской Федерации (патология известна в акушерстве под аббревиатурой СЗРП (синдром задержки развития плода), а в педиатрии — ЗВУР (задержки внутриутробного развития)) понимают хроническое расстройство питания плода/ребенка, приводящее к замедлению его роста и развития, проявляющееся снижением антропометрических показателей (массы тела, длины тела и др. параметров) по сравнению с долженствующими для данного гестационного возраста плода/ребенка. В зарубежных источниках аналогом термина ЗВУР являются «intrauterine growth retardation» (IUGR), «intrauterine growth restriction», «growth delay syndrome», «brain-sparing».
Таким образом, низкие параметры физического развития внутриутробного плода необязательно являются результатом воздействия патологического процесса во время беременности. Для такой категории пациентов в иностранной научной медицинской литературе используется термин «small for gestational age» (SGA). Эти дети, как правило, здоровы и не требуют назначения коррекции и/или лечения, а нуждаются только в контроле темпов роста [2]. Наряду с этим под задержкой внутриутробного развития в Российской Федерации (патология известна в акушерстве под аббревиатурой СЗРП (синдром задержки развития плода), а в педиатрии — ЗВУР (задержки внутриутробного развития)) понимают хроническое расстройство питания плода/ребенка, приводящее к замедлению его роста и развития, проявляющееся снижением антропометрических показателей (массы тела, длины тела и др. параметров) по сравнению с долженствующими для данного гестационного возраста плода/ребенка. В зарубежных источниках аналогом термина ЗВУР являются «intrauterine growth retardation» (IUGR), «intrauterine growth restriction», «growth delay syndrome», «brain-sparing».
Известно, что у детей, родившихся с ЗВУР, потребности в питательных субстратах для достижения оптимального роста высокие, однако возможности обеспечить ребенка после его рождения необходимыми нутриентами путем увеличения объема питания порой весьма ограничены. Следует также отметить, что в настоящее время оптимальная скорость постнатального роста детей, родившихся с ЗВУР, неизвестна и общепринятых рекомендаций по их персонифицированному вскармливанию не существует. Подавляющее большинство исследователей сходится во мнении, что, как и в ситуациях с недоношенными детьми, необходим догоняющий рост, скорость которого, однако, не должна быть излишней, т. е. ребенок должен расти «не слишком быстро». Особенно важно предотвратить избыточные прибавки в массе тела после того, как ее дефицит будет восстановлен и антропометрические показатели сравняются со средневозрастными стандартами [3].
Эпидемиология ЗВУР и оценка антропометрических показателей
Частота ЗВУР в популяции весьма вариабельна и зависит от ряда причин. Так, у практически здоровых беременных СЗРП плода регистрируют в 3–5% случаев, при отягощенном акушерско-гинекологическом диагнозе и осложненной беременности — в 10–25% [4]. По данным ВОЗ число новорожденных с задержкой развития колеблется от 31,1% в Центральной Азии до 6,5% в развитых странах Европы [5]. На основании результатов исследований, проведенных в г. Новосибирске (работа выполнялась совместно с врачами генетиками), установлено, что частота регистрации ЗВУР у детей при врожденных пороках развития достигает 14,2%, а при наличии множественных пороков развития — 27,5%, при наследственной патологии ЗВУР регистрируется у 20% детей, в т. ч. у 50,4% вследствие хромосомных и у 49,6% — генных «поломок». У детей с малыми аномалиями развития ЗВУР встречается в 32,4% случаев [6]. Частота ЗВУР увеличивается с уменьшением гестационного возраста при рождении и может достигать 60% среди родившихся недоношенными [7].
Так, у практически здоровых беременных СЗРП плода регистрируют в 3–5% случаев, при отягощенном акушерско-гинекологическом диагнозе и осложненной беременности — в 10–25% [4]. По данным ВОЗ число новорожденных с задержкой развития колеблется от 31,1% в Центральной Азии до 6,5% в развитых странах Европы [5]. На основании результатов исследований, проведенных в г. Новосибирске (работа выполнялась совместно с врачами генетиками), установлено, что частота регистрации ЗВУР у детей при врожденных пороках развития достигает 14,2%, а при наличии множественных пороков развития — 27,5%, при наследственной патологии ЗВУР регистрируется у 20% детей, в т. ч. у 50,4% вследствие хромосомных и у 49,6% — генных «поломок». У детей с малыми аномалиями развития ЗВУР встречается в 32,4% случаев [6]. Частота ЗВУР увеличивается с уменьшением гестационного возраста при рождении и может достигать 60% среди родившихся недоношенными [7].
С 2006 г. доступны к применению для оценки физического развития детей таблицы ВОЗ, которые рекомендованы и МЗ РФ [8]./90.jpg) ВОЗ разработала эти нормы физического развития (массы тела, индекса массы тела, длины тела/роста), основываясь на выборке детей из 6 стран: Бразилии, Ганы, Индии, Норвегии, Омана и Соединенных Штатов Америки. Одной из ключевых особенностей данных номограмм является то, что в них грудное вскармливание определяется как биологическая «норма», а ребенок, вскармливаемый грудью, является эталоном для измерения здорового роста [9]. Но, к сожалению, для оценки детей с ЗВУР они оказались неудобны, так как в таблицах измерения представлены 5-м и 15-м перцентилем, но отсутствует 10-й перцентиль, который является диагностическим критерием для ЗВУР. Также по данным таблицам невозможно оценить дальнейшее развитие детей с ЗВУР и нет данных для оценки недоношенных новорожденных. В 2003 г. Tanis R. Fenton разработал таблицы соответствия антропометрических показателей недоношенных новорожденных, начиная с 22-й недели гестации. В 2013 г. был проведен пересмотр этих данных и их обновление согласно новым антропометрическим нормативам, принятым ВОЗ, проведено разделение массо-ростовых показателей в зависимости от половой принадлежности.
ВОЗ разработала эти нормы физического развития (массы тела, индекса массы тела, длины тела/роста), основываясь на выборке детей из 6 стран: Бразилии, Ганы, Индии, Норвегии, Омана и Соединенных Штатов Америки. Одной из ключевых особенностей данных номограмм является то, что в них грудное вскармливание определяется как биологическая «норма», а ребенок, вскармливаемый грудью, является эталоном для измерения здорового роста [9]. Но, к сожалению, для оценки детей с ЗВУР они оказались неудобны, так как в таблицах измерения представлены 5-м и 15-м перцентилем, но отсутствует 10-й перцентиль, который является диагностическим критерием для ЗВУР. Также по данным таблицам невозможно оценить дальнейшее развитие детей с ЗВУР и нет данных для оценки недоношенных новорожденных. В 2003 г. Tanis R. Fenton разработал таблицы соответствия антропометрических показателей недоношенных новорожденных, начиная с 22-й недели гестации. В 2013 г. был проведен пересмотр этих данных и их обновление согласно новым антропометрическим нормативам, принятым ВОЗ, проведено разделение массо-ростовых показателей в зависимости от половой принадлежности. Шкалы представляют собой графики перцентилей массы тела, длины тела и окружности головы и позволяют сравнить длину тела недоношенного с ростом плода, а не недоношенного ребенка, могут быть использованы только до 50 недель посткоцепционного возраста [10]. С 2008 г. запущен проект «Международный консорциум развития плода и новорожденных в XXI веке» (INTERGROWTH-21st) с целью разрушить представление о том, что младенцы разных стран изначально развиваются по-разному. К настоящему времени проведено большое международное, многонациональное, мультиэтническое проспективное исследование роста и развития плода и новорожденного, участие в котором приняли более 300 исследователей из 27 учреждений. Проект INTERGROWTH-21st включает в себя три крупных исследования: продольное исследование роста плода (ПИРП), перекрестное исследование новорожденного (ПИН) и послеродовое когортное исследование недоношенных (ПКИН) [1]. Основной вывод проекта INTERGROWTH-21st состоит в том, что показатели продольного роста скелета плода и роста новорожденного при рождении поразительно схожи во всем мире при условии, что здоровье матери, социальные условия и питание являются оптимальными и женщины имеют доступ к научно обоснованной медицинской помощи в ходе беременности и при родах.
Шкалы представляют собой графики перцентилей массы тела, длины тела и окружности головы и позволяют сравнить длину тела недоношенного с ростом плода, а не недоношенного ребенка, могут быть использованы только до 50 недель посткоцепционного возраста [10]. С 2008 г. запущен проект «Международный консорциум развития плода и новорожденных в XXI веке» (INTERGROWTH-21st) с целью разрушить представление о том, что младенцы разных стран изначально развиваются по-разному. К настоящему времени проведено большое международное, многонациональное, мультиэтническое проспективное исследование роста и развития плода и новорожденного, участие в котором приняли более 300 исследователей из 27 учреждений. Проект INTERGROWTH-21st включает в себя три крупных исследования: продольное исследование роста плода (ПИРП), перекрестное исследование новорожденного (ПИН) и послеродовое когортное исследование недоношенных (ПКИН) [1]. Основной вывод проекта INTERGROWTH-21st состоит в том, что показатели продольного роста скелета плода и роста новорожденного при рождении поразительно схожи во всем мире при условии, что здоровье матери, социальные условия и питание являются оптимальными и женщины имеют доступ к научно обоснованной медицинской помощи в ходе беременности и при родах. Полученные результаты предоставляют врачам неонатологам и педиатрам следующие возможности:
Полученные результаты предоставляют врачам неонатологам и педиатрам следующие возможности:
- новые инструменты на основе фактических данных для выявления детей с проблемами роста и питания в период внутриутробного развития, т. е. родившихся с ЗВУР;
- общий метод для количественной и сравнительной оценки распространенности дефицита питательных веществ в популяции новорожденных;
- первый метод на основе фактических данных для мониторинга постнатального развития недоношенных младенцев [11].
На сегодняшний момент данная шкала является наиболее оптимальной для оценки отклонений в физическом развитии родившегося ребенка и должна использоваться в том числе для детей, родившихся с ЗВУР. В отличие от стандартов ВОЗ, она учитывает не только пол ребенка, но и его гестационный возраст (24–42 недели). Если масса и/или длина тела ниже 10-го перцентиля, у ребенка диагностируется ЗВУР. Показатели менее 3-го перцентиля свидетельствуют об умеренной или тяжелой ЗВУР. В дальнейшем для установления степени недостаточности питания у детей необходимо рассчитывать сигмальные отклонения — Z-scores (WHO Child Growth Standards, программа WHO Anthro, 2006) [9]. Шкалы INTERGROWTH-21st позволяют своевременно выявлять проблему задержки развития, но в проект были отобраны беременные с низким риском фетальных проблем роста, что основано на их социальных, репродуктивных характеристиках и истории болезни, среди них задержка развития плодов выявлена только в 3,8% [12], соответственно, категория пациентов с ЗВУР осталась наименее изученной. В этой связи врачи по-прежнему не имеют четкого инструмента для дальнейшей оценки физического развития детей, родившихся с ЗВУР.
В дальнейшем для установления степени недостаточности питания у детей необходимо рассчитывать сигмальные отклонения — Z-scores (WHO Child Growth Standards, программа WHO Anthro, 2006) [9]. Шкалы INTERGROWTH-21st позволяют своевременно выявлять проблему задержки развития, но в проект были отобраны беременные с низким риском фетальных проблем роста, что основано на их социальных, репродуктивных характеристиках и истории болезни, среди них задержка развития плодов выявлена только в 3,8% [12], соответственно, категория пациентов с ЗВУР осталась наименее изученной. В этой связи врачи по-прежнему не имеют четкого инструмента для дальнейшей оценки физического развития детей, родившихся с ЗВУР.
В стадии разработки экспертами ВОЗ также находятся таблицы, отражающие массо-ростовые показатели плода в зависимости от роста родителей, что очень важно для выявления конституционально маленьких плодов. В июне 2018 г. стартовало еще одно очень важное клиническое исследование «Оптимальный рост недоношенных новорожденных с недостаточным ростом» (NCT02999945). В данном исследовании будут изучены антропометрические данные, определены параметры метаболизма, микробиоты стула и развития нервной системы, планируется проследить катамнез детей до 2-летнего возраста.
В данном исследовании будут изучены антропометрические данные, определены параметры метаболизма, микробиоты стула и развития нервной системы, планируется проследить катамнез детей до 2-летнего возраста.
Факторы риска формирования задержки внутриутробного развития и перинатальные осложнения
В структуре причин СЗРП плода, ЗВУР ребенка выделяют материнские, плацентарно-пуповинные и генетические факторы. Около одной трети плодов имеют задержку развития в связи с воздействием генетических факторов, например, таких, как делеция короткого плеча хромосомы 4, длинного плеча хромосомы 13, трисомия 13/18/21, врожденных нарушений обмена веществ (галактоземии, фенилкетонурии и др.), а также в результате текущей внутриутробной инфекции, например цитомегаловирусной, герпетической, краснухи и др. Эти причины порой трудно контролировать, и, соответственно, прогноз для плода и ребенка тесно связан с основным заболеванием.
К материнским причинам относят такие заболевания, как артериальная гипертензия (включая ассоциированную с беременностью), хроническую патологию сердечно-сосудистой системы, сахарный диабет 1 типа, гемоглобинопатии, аутоиммунные заболевания, тромбофилии, недостаточное питание, курение, употребление алкоголя или наркотических средств, аномалии развития матки. К плацентарным и пуповинным относят фето-фетальный трансфузионный синдром, плацентарные аномалии, предлежание плаценты, частичную отслойку плаценты, аномалии формирования и прикрепления пуповины, многоплодную беременность [2].
К плацентарным и пуповинным относят фето-фетальный трансфузионный синдром, плацентарные аномалии, предлежание плаценты, частичную отслойку плаценты, аномалии формирования и прикрепления пуповины, многоплодную беременность [2].
В понятие «недостаточное питание плода» включают не только отклонение параметров физического развития, но и дефицит белка, калорий, отдельных микронутриентов, а также гипоксию и анемию у плода в процессе вынашивании беременности [13]. Задержка развития происходит в результате недостаточного для адекватного роста плода поступления кислорода и нутриентов, в т. ч. и по причине изменений сосудов, ведущих к плаценте.
СЗРП и ЗВУР может привести к целому спектру перинатальных осложнений, включая внутриутробную гибель плода, асфиксию, аспирацию околоплодных вод, содержащих меконий, повышение частоты операций кесарева сечения. Хотя долгое время считалось, что стресс, который переживают плоды с СЗРП, приводит к раннему созреванию, что снижает перинатальную заболеваемость у недоношенных с ЗВУР по сравнению с новорожденными с нормальным физическим развитием при рождении. I. M. Bernstein и др. исследовали этот вопрос, идентифицировав почти 20 000 новорожденных белых или афроамериканцев из 196 центров, которые родились без серьезных аномалий, и выявили повышение рисков у недоношенных с ЗВУР. По данным указанных авторов, относительный риск (ОР) смерти составил 2,77; 95% доверительный интервал (ДИ) 2,31–3,33; ОР респираторного дистресс-синдрома — 1,19; 95% ДИ 1,03–1,29; ОР внутрижелудочкового кровоизлияния 1,13; 95% ДИ 0,99–1,29; ОР тяжелого кровотечения 1,27; 95% ДИ 0,98–1,59; ОР некротизирующего энтероколита 1,27; 95% ДИ 1,05–1,53 [14]. Дальнейшие исследования, в том числе и отечественные, подтвердили ранее представленные данные [15, 16].
I. M. Bernstein и др. исследовали этот вопрос, идентифицировав почти 20 000 новорожденных белых или афроамериканцев из 196 центров, которые родились без серьезных аномалий, и выявили повышение рисков у недоношенных с ЗВУР. По данным указанных авторов, относительный риск (ОР) смерти составил 2,77; 95% доверительный интервал (ДИ) 2,31–3,33; ОР респираторного дистресс-синдрома — 1,19; 95% ДИ 1,03–1,29; ОР внутрижелудочкового кровоизлияния 1,13; 95% ДИ 0,99–1,29; ОР тяжелого кровотечения 1,27; 95% ДИ 0,98–1,59; ОР некротизирующего энтероколита 1,27; 95% ДИ 1,05–1,53 [14]. Дальнейшие исследования, в том числе и отечественные, подтвердили ранее представленные данные [15, 16].
Особенности гомеостаза плода/ребенка при задержке внутриутробного развития
Состав тела и его изменения в разные периоды жизни отражают пластичность развития человека в условиях изменяющейся окружающей среды. Распределение энергии для роста различных тканей отражает адаптивное изменение жировой ткани, мышечной массы и других составляющих в течение роста и развития организма человека. Центильные таблицы, используемые для оценки параметров физического развития, не позволяют оценить долю жира и тощей массы в организме человека. Применение неинвазивной воздухозамещающей плетизмографии показало отличие состава тела у детей, родившихся с ЗВУР. Оценка взаимосвязи антропометрических индексов и состава тела проводилась с использованием той же популяции, что и шкалы INTERGROWTH-21st. Доношенные новорожденные, малые к сроку гестации, были в среднем на 680 г легче детей, соответствующих сроку гестации, из этих 680 г 27% за счет жировой массы и 73% за счет тощей массы [17]. Отдельную группу детей составляют недоношенные новорожденные с ЗВУР. Известно, что у них отмечается изначально меньшая доля жира в организме и быстрая прибавка объема жировой массы в неонатальном периоде, что может являться неблагоприятным признаком дальнейшего развития и состояния здоровья. Оценка изменения состава тела позволяет своевременно корректировать питание новорожденному [18].
Центильные таблицы, используемые для оценки параметров физического развития, не позволяют оценить долю жира и тощей массы в организме человека. Применение неинвазивной воздухозамещающей плетизмографии показало отличие состава тела у детей, родившихся с ЗВУР. Оценка взаимосвязи антропометрических индексов и состава тела проводилась с использованием той же популяции, что и шкалы INTERGROWTH-21st. Доношенные новорожденные, малые к сроку гестации, были в среднем на 680 г легче детей, соответствующих сроку гестации, из этих 680 г 27% за счет жировой массы и 73% за счет тощей массы [17]. Отдельную группу детей составляют недоношенные новорожденные с ЗВУР. Известно, что у них отмечается изначально меньшая доля жира в организме и быстрая прибавка объема жировой массы в неонатальном периоде, что может являться неблагоприятным признаком дальнейшего развития и состояния здоровья. Оценка изменения состава тела позволяет своевременно корректировать питание новорожденному [18].
Дети, родившиеся с ЗВУР, находятся в группе повышенного риска развития таких неонатальных осложнений, как гипотермия, гипогликемия, гипокальциемия, высокая вязкость крови (полицитемия), желтуха, некротический энтероколит (НЭК), тромбоцитопения и почечная недостаточность [2]. У маловесных недоношенных повышен риск формирования тяжелых форм бронхолегочной дисплазии [19].
У маловесных недоношенных повышен риск формирования тяжелых форм бронхолегочной дисплазии [19].
Ряд исследователей в своих результатах демонстрируют большую частоту неонатальных инфекционных заболеваний, включая сепсис, среди детей, родившихся с ЗВУР [20, 21]. Около 75% детей с ЗВУР имеют признаки энтеральной недостаточности. Так, панкреатическая недостаточность выявляется у 50% детей, родившихся с ЗВУР, билиарная недостаточность и колидистальный синдром — у 25% [22]. Вследствие нарушения брыжеечного кровотока в кишечной стенке и незрелости барьерной функции кишечника создаются предпосылки для развития НЭК, манифестация которого подразумевает под собой необходимость проведения энтеральной паузы, длительную антибактериальную терапию, замедление темпов наращивания объема энтерального кормления [23, 24]. К нарушению формирования нормальной микробиоты у детей с ЗВУР приводят такие причины, как высокая частота оперативных родов (кесарева сечения), отсроченное прикладывание к груди, нахождение ребенка в палате интенсивной терапии или отделении реанимации, низкий процент использования грудного молока при энтеральном вскармливании. Формируется порочный круг — нутритивная недостаточность влияет на развитие дисбиоза, который, в свою очередь, способствует нарушениям усвоения компонентов питания [25]. Кроме того, изменение индекса катаболизма белка, рассчитываемого как отношение содержания в крови α1-антитрипсина к концентрации трансферрина, выявляемое у детей с ЗВУР, свидетельствует о катаболической направленности белкового обмена на фоне снижения интенсивности его синтеза [26]. У каждого пятого ребенка имеет место гипокальцемия, которая сочетается с повышением содержания паратгормона и снижением концентрации кальцитонина, что коррелирует с тяжестью дефицита питания, нарушением метаболизма костной ткани и проявляется низкими темпами ремоделирования кости [27]. У недоношенных с ЗВУР значительно чаще диагностируется метаболическая болезнь костей в связи с нарушением транспорта фосфора при плацентарной недостаточности и длительным парентеральным питанием, как следствие, имеет место высокий риск переломов костей.
Формируется порочный круг — нутритивная недостаточность влияет на развитие дисбиоза, который, в свою очередь, способствует нарушениям усвоения компонентов питания [25]. Кроме того, изменение индекса катаболизма белка, рассчитываемого как отношение содержания в крови α1-антитрипсина к концентрации трансферрина, выявляемое у детей с ЗВУР, свидетельствует о катаболической направленности белкового обмена на фоне снижения интенсивности его синтеза [26]. У каждого пятого ребенка имеет место гипокальцемия, которая сочетается с повышением содержания паратгормона и снижением концентрации кальцитонина, что коррелирует с тяжестью дефицита питания, нарушением метаболизма костной ткани и проявляется низкими темпами ремоделирования кости [27]. У недоношенных с ЗВУР значительно чаще диагностируется метаболическая болезнь костей в связи с нарушением транспорта фосфора при плацентарной недостаточности и длительным парентеральным питанием, как следствие, имеет место высокий риск переломов костей. У детей, родившихся с ЗВУР, выявляется дисбаланс и других микро- и макроэлементов. В частности, повышено содержание так называемых токсичных (Cu, Zn, Ni, Mn, Cr, Со, Cr) и малотоксичных (Al, Ca, Mg, Zn, Na) элементов, снижен запас железа [28]. Наряду с этим отмечено уменьшение размеров печени и истощение запасов гликогена [22]. Определяются более низкие значения кортизола и отсутствие кортизолового всплеска в момент рождения, снижен уровень сывороточного альбумина, тироксин-связывающего преальбумина, трансферрина и ретинол-связывающего белка (особенно при гипотрофическом варианте ЗВУР) [28]. Нарушен также обмен фолиевой кислоты, которая участвует в качестве кофактора в большом количестве клеточных реакций, в их дифференцировке, жизнеобеспечении [29].
У детей, родившихся с ЗВУР, выявляется дисбаланс и других микро- и макроэлементов. В частности, повышено содержание так называемых токсичных (Cu, Zn, Ni, Mn, Cr, Со, Cr) и малотоксичных (Al, Ca, Mg, Zn, Na) элементов, снижен запас железа [28]. Наряду с этим отмечено уменьшение размеров печени и истощение запасов гликогена [22]. Определяются более низкие значения кортизола и отсутствие кортизолового всплеска в момент рождения, снижен уровень сывороточного альбумина, тироксин-связывающего преальбумина, трансферрина и ретинол-связывающего белка (особенно при гипотрофическом варианте ЗВУР) [28]. Нарушен также обмен фолиевой кислоты, которая участвует в качестве кофактора в большом количестве клеточных реакций, в их дифференцировке, жизнеобеспечении [29].
Таким образом, «полиорганность поражения» у ребенка, родившегося с ЗВУР, как доношенного, так и недоношенного, обусловлена особенностями реакций внутриутробного плода с СЗРП. В частности, при ограниченном резерве питания плод перераспределяет кровоток для поддержания функции и развития жизненно важных органов: головного мозга (феномен «щажения» головного мозга), сердца, надпочечников с «обкрадыванием» костного мозга, мышц, легких, органов желудочно-кишечного тракта (ЖКТ), почек [2]. В связи с этим у детей, родившихся с ЗВУР, меньше число и объем нефронов, что является фактором риска развития почечной недостаточности и гломерулярной гипертензии. Гипоксия плода и повышенная сопротивляемость в сосудистом русле плаценты вызывают специфические нарушения в сердечно-сосудистой системе, способствуя снижению пролиферации клеток миокарда, что приводит к уменьшению толщины сердечной мышцы, эндотелиальной дисфункции, которая выявляется практически у всех детей с ЗВУР [30]. Все указанные нарушения оказывают существенное влияние на дальнейшее развитие ребенка и состояние здоровья в другие периоды жизни человека.
В связи с этим у детей, родившихся с ЗВУР, меньше число и объем нефронов, что является фактором риска развития почечной недостаточности и гломерулярной гипертензии. Гипоксия плода и повышенная сопротивляемость в сосудистом русле плаценты вызывают специфические нарушения в сердечно-сосудистой системе, способствуя снижению пролиферации клеток миокарда, что приводит к уменьшению толщины сердечной мышцы, эндотелиальной дисфункции, которая выявляется практически у всех детей с ЗВУР [30]. Все указанные нарушения оказывают существенное влияние на дальнейшее развитие ребенка и состояние здоровья в другие периоды жизни человека.
Отдаленные последствия недостаточности питания в периоде внутриутробного развития
В настоящее время активно изучается связь между ростом, его отставанием и сохранением здоровья в течение последующей жизни человека, а у животных — между ростом и старением. Это новая область биологии, позволяющая иначе взглянуть на онтогенез, на формирование основ для последующего здоровья на ранних стадиях развития организма, а также на первичную профилактику заболеваний [3]._3.jpg/906px-%D0%91%D0%B5%D1%80%D0%B5%D0%BC%D0%B5%D0%BD%D0%BD%D0%BE%D1%81%D1%82%D1%8C_(%D0%9C%D0%A1%D0%AD)_3.jpg) Так, у детей, родившихся с ЗВУР, уже в раннем возрасте отмечена высокая частота кишечных инфекций, у каждого пятого ребенка медленно регрессируют последствия перинатальных поражений центральной нервной системы на первом году жизни. Такие дети в 2,4 раза чаще имеют признаки минимальных мозговых дисфункций, детский церебральный паралич, двигательные нарушения и когнитивные расстройства, 32% детей с тяжелой формой ЗВУР имеют проблемы при обучении и не могут окончить полный курс общеобразовательной школы [31]. Доля детей с хроническими заболеваниями легких составляет 74% при наличии ЗВУР и 49% — при ее отсутствии [19].
Так, у детей, родившихся с ЗВУР, уже в раннем возрасте отмечена высокая частота кишечных инфекций, у каждого пятого ребенка медленно регрессируют последствия перинатальных поражений центральной нервной системы на первом году жизни. Такие дети в 2,4 раза чаще имеют признаки минимальных мозговых дисфункций, детский церебральный паралич, двигательные нарушения и когнитивные расстройства, 32% детей с тяжелой формой ЗВУР имеют проблемы при обучении и не могут окончить полный курс общеобразовательной школы [31]. Доля детей с хроническими заболеваниями легких составляет 74% при наличии ЗВУР и 49% — при ее отсутствии [19].
В настоящее время доказано, что недостаточное питание в период внутриутробного развития и рождение ребенка с низкой массой тела служат факторами риска развития многих болезней в трудоспособном и пожилом возрасте (атеросклероз, ишемическая болезнь сердца, артериальная гипертензия, инсулинорезистентный диабет, ожирение и др.) [32]. Также для данной категории людей типично длительное сохранение недостаточности питания, отставание в росте, нарушение памяти, поведения, развитие хронических заболеваний ЖКТ, почек, сердечно-сосудистой системы [33].
Дети, родившиеся с ЗВУР, попадают в категорию «Failure to thrive» (буквальный перевод данного понятия «отказ процветать») — англоязычный термин, означающий ряд ситуаций, при которых ребенок имеет очень скудные прибавки массы тела, а иногда и роста, и формирования нервно-психических навыков [34]. В русскоязычной медицинской литературе нет полного эквивалента этому термину, обычно это состояние относят к гипотрофии. Кроме того, изменения метаболизма и композиции тела у плода (в периоде внутриутробного развития) в последующем негативным образом влияют на репродуктивную функцию, деторождение и повышают риск рождения маловесного потомства [33].
Механизмы формирования последствий задержки внутриутробного развития плода
Центральной идеей связи задержки внутриутробного развития с отдаленными последствиями является «программирование питанием» — широкая концепция, согласно которой стимул или повреждение в критический период раннего развития могут вызвать длительные или пожизненные эффекты [13]. Схематично влияние нарушений питания через эпигенетический путь регуляции развития организма человека на метаболизм может быть представлено следующим образом: нарушение внутриутробного питания запускает эпигенетический путь регуляции через экспрессию генов, метаболизм клеток и клеточную пролиферацию, что приводит к нарушению работы рецепторов, транспортных белков, ферментов, факторов роста, связывающих белки. Одновременно формируется измененная направленность сигналов адипоцитов в ответ на поступление нутриентов, изменяется активность ферментов, синтез белка, чувствительность рецепторов к гормонам (инсулину, лептину, гормону роста и др.) [27, 32]. По мнению P. D. GIukman и соавт., у ребенка, родившегося от неблагоприятно протекавшей беременности, неблагоприятная ситуация после рождения прогнозируется еще в периоде внутриутробного развития [35]. При этом организм выстраивает стратегию подготовки к выживанию, формирует «экономный фенотип» (по теории Р. Баркера): после рождения у этих детей маленький рост, ранний пубертатный период, изменение гормонального статуса, поведения, повышение резистентности к инсулину, склонность к накоплению жировой ткани [36].
Схематично влияние нарушений питания через эпигенетический путь регуляции развития организма человека на метаболизм может быть представлено следующим образом: нарушение внутриутробного питания запускает эпигенетический путь регуляции через экспрессию генов, метаболизм клеток и клеточную пролиферацию, что приводит к нарушению работы рецепторов, транспортных белков, ферментов, факторов роста, связывающих белки. Одновременно формируется измененная направленность сигналов адипоцитов в ответ на поступление нутриентов, изменяется активность ферментов, синтез белка, чувствительность рецепторов к гормонам (инсулину, лептину, гормону роста и др.) [27, 32]. По мнению P. D. GIukman и соавт., у ребенка, родившегося от неблагоприятно протекавшей беременности, неблагоприятная ситуация после рождения прогнозируется еще в периоде внутриутробного развития [35]. При этом организм выстраивает стратегию подготовки к выживанию, формирует «экономный фенотип» (по теории Р. Баркера): после рождения у этих детей маленький рост, ранний пубертатный период, изменение гормонального статуса, поведения, повышение резистентности к инсулину, склонность к накоплению жировой ткани [36].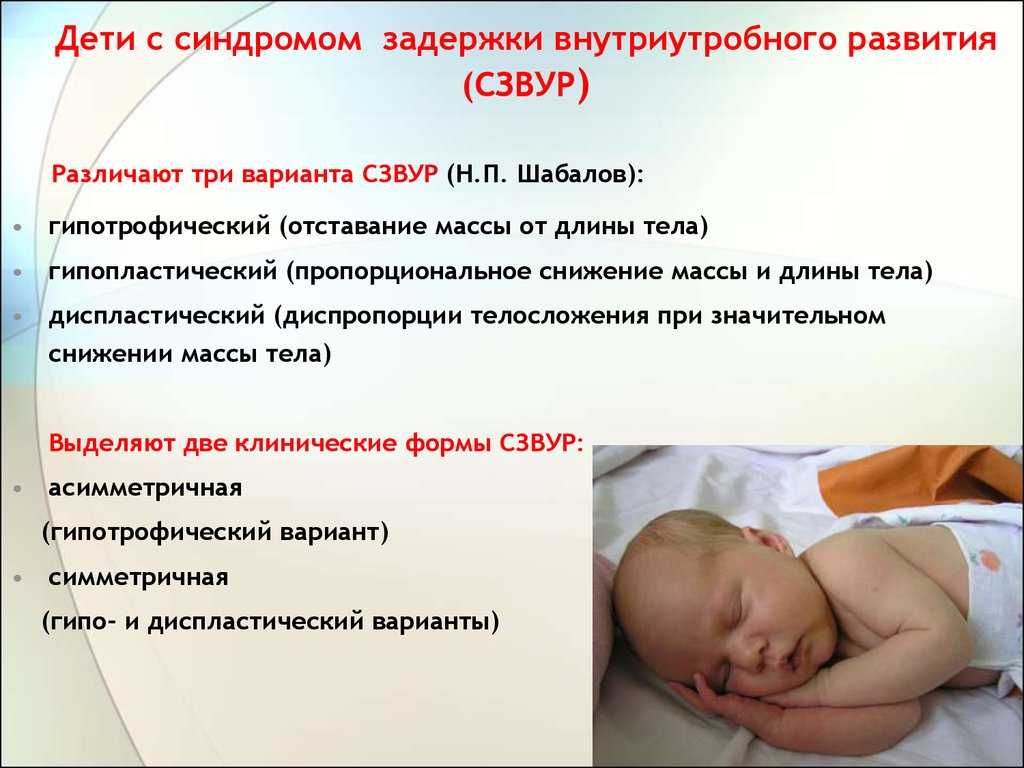
В настоящее время результаты многочисленных исследований на животных показывают, что посредством изменения питания на ранней стадии развития или путем воздействия на программы роста (индивидуальные, начиная с внутриутробного развития) можно влиять на состояние организма в более позднем возрасте. При этом имеются в виду такие последствия, как ожирение, а также изменение артериального давления, метаболизма холестерина, резистентности к инсулину, развитие атеросклероза, состояние костной ткани, иммунной системы, способность к обучению, поведенческие особенности и продолжительность жизни в целом [3]. Наряду с этим продемонстрировано пока только на животных, что высокая белковая нагрузка в питании не приводит к нарушению функции почек (у поросят с ЗВУР) [37].
Изучением влияния факторов питания на регуляцию и экспрессию генов, как известно, занимается «нутригеномика». На сегодняшний день, согласно разрабатываемой концепции, изменения в режиме питания, образе жизни, физической активности и факторах окружающей среды создают хронический стресс для клетки и ткани, значительно перегружая таким образом механизмы их восстановления с риском постоянных повреждений. Эта концепция, возможно, полностью изменит представление о том, как предотвратить ишемическую болезнь сердца или возникновение метаболического синдрома, поскольку отправная точка восприимчивости к болезни находится за годы, если не десятилетия, до возникновения первых симптомов. С пониманием молекулярных и эпигенетических механизмов эта концепция становится все более правдоподобной [38].
Эта концепция, возможно, полностью изменит представление о том, как предотвратить ишемическую болезнь сердца или возникновение метаболического синдрома, поскольку отправная точка восприимчивости к болезни находится за годы, если не десятилетия, до возникновения первых симптомов. С пониманием молекулярных и эпигенетических механизмов эта концепция становится все более правдоподобной [38].
Подходы к питанию детей с задержкой внутриутробного развития, с учетом дискуссионных аспектов
В связи с особенностями функционирования ЖКТ, мочевыделительной системы, белкового, жирового и минерального обмена, у детей с ЗВУР формируется низкая толерантность к адекватному питанию, что требует от врача определенного профессионального искусства в разработке и организации программы персонифицированного питания, особенно в один из критических периодов развития человека, в частности, на первом году жизни.
Согласно Национальной программе «Оптимизация вскармливания детей первого года жизни в Российской Федерации» [39] рекомендуется при выборе диетотерапии у ребенка с гипотрофией, в т. ч. пренатальной, т. е. с ЗВУР, учитывать гестационный возраст на момент рождения, остроту, степень тяжести и характер основного заболевания, удовлетворить возрастные потребности ребенка в энергии, макро- и микронутриентах путем постепенного увеличения пищевой нагрузки, принимая во внимание толерантность ребенка к пище, а при гипотрофии (недостаточности питания) II–III степени постепенно переходить на высококалорийную/высокобелковую диету; регулярно фиксировать фактическое питание с расчетом «химического» состава суточного рациона по основным пищевым нутриентам и энергии; увеличивать частоту кормлений с преимущественным использованием грудного молока или специализированных легкоусвояемых продуктов, а в наиболее тяжелых случаях применять постоянное зондовое питание в сочетании с частичным парентеральным питанием.
ч. пренатальной, т. е. с ЗВУР, учитывать гестационный возраст на момент рождения, остроту, степень тяжести и характер основного заболевания, удовлетворить возрастные потребности ребенка в энергии, макро- и микронутриентах путем постепенного увеличения пищевой нагрузки, принимая во внимание толерантность ребенка к пище, а при гипотрофии (недостаточности питания) II–III степени постепенно переходить на высококалорийную/высокобелковую диету; регулярно фиксировать фактическое питание с расчетом «химического» состава суточного рациона по основным пищевым нутриентам и энергии; увеличивать частоту кормлений с преимущественным использованием грудного молока или специализированных легкоусвояемых продуктов, а в наиболее тяжелых случаях применять постоянное зондовое питание в сочетании с частичным парентеральным питанием.
Вместе с тем в центре внимания специалистов разного профиля, особенно нутрициологов, находится вопрос о том, каким образом эффективно использовать «окно возможностей», т.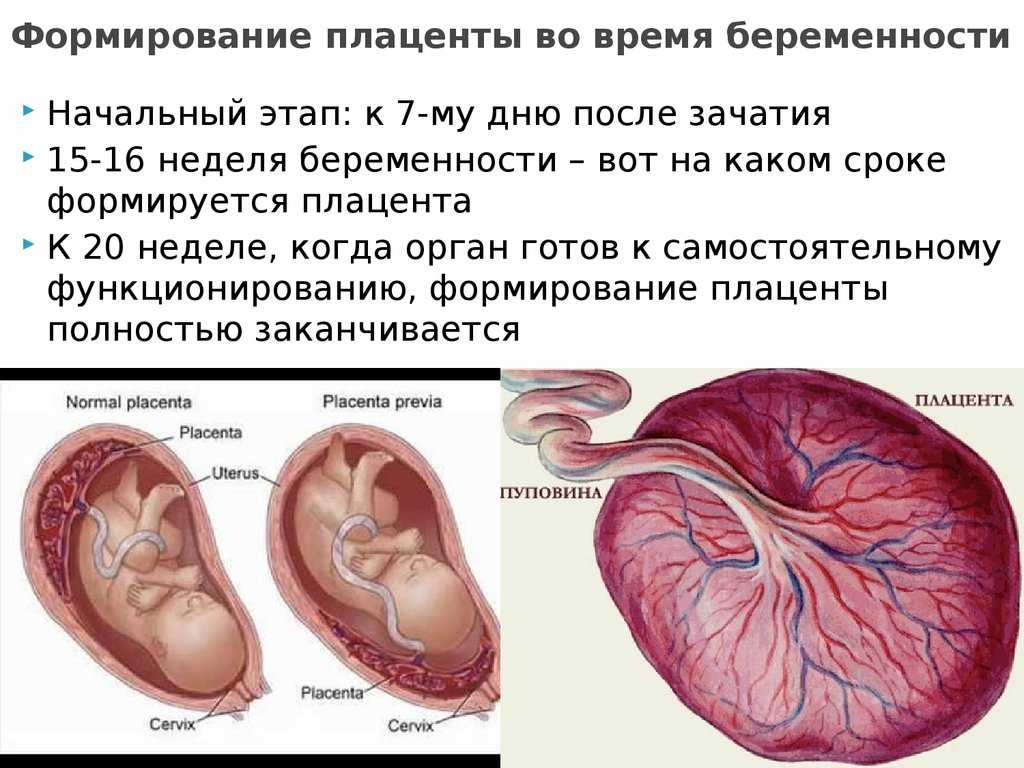 е. состояние метаболизма, когда организм испытывает острую нужду в питательных веществах, с целью влияния на состояние здоровья ребенка непосредственно после рождения и в долгосрочной перспективе. Нет никаких сомнений, что «золотым стандартом» вскармливания ребенка первых двух лет (особенно первого года жизни), в т. ч. родившихся с ЗВУР, является грудное молоко. Оно обеспечивает оптимальное физическое и нервно-психическое развитие младенца, а также оказывает долгосрочное протективное воздействие в отношении ряда заболеваний. Исследования последних лет показали, что продолжительное грудное вскармливание способно снизить риск развития сердечно-сосудистых заболеваний, влияя на уровень артериального давления и холестерина так же, как и все профилактические меры, предпринимаемые в последующие годы [3]. Давно известно, что дети, вскармливаемые грудным молоком, реже болеют инфекционными и аллергическими заболеваниями. Грудное молоко препятствует развитию ожирения в последующем, так, в 2005 г.
е. состояние метаболизма, когда организм испытывает острую нужду в питательных веществах, с целью влияния на состояние здоровья ребенка непосредственно после рождения и в долгосрочной перспективе. Нет никаких сомнений, что «золотым стандартом» вскармливания ребенка первых двух лет (особенно первого года жизни), в т. ч. родившихся с ЗВУР, является грудное молоко. Оно обеспечивает оптимальное физическое и нервно-психическое развитие младенца, а также оказывает долгосрочное протективное воздействие в отношении ряда заболеваний. Исследования последних лет показали, что продолжительное грудное вскармливание способно снизить риск развития сердечно-сосудистых заболеваний, влияя на уровень артериального давления и холестерина так же, как и все профилактические меры, предпринимаемые в последующие годы [3]. Давно известно, что дети, вскармливаемые грудным молоком, реже болеют инфекционными и аллергическими заболеваниями. Грудное молоко препятствует развитию ожирения в последующем, так, в 2005 г. Т. Harder и соавт. продемонстрировали «дозозависимый» эффект грудного молока на характер весовой кривой ребенка [40]. На каждый месяц увеличения продолжительности естественного вскармливания риск формирования у ребенка избыточной массы тела снижался на 4% [33]. При невозможности использования грудного молока рекомендуется использование адаптированных заменителей грудного молока, в том числе предназначенных для маловесных (недоношенных) детей. В качестве стартового продукта при тяжелом дефиците питания оправданным является применение смесей на основе высокогидролизованного сывороточного белка, не содержащих лактозу, обогащенных среднецепочечными триглицеридами. Они обеспечивают максимальное усвоение питательных веществ в условиях значительного угнетения переваривающей и всасывающей способности ЖКТ [41].
Т. Harder и соавт. продемонстрировали «дозозависимый» эффект грудного молока на характер весовой кривой ребенка [40]. На каждый месяц увеличения продолжительности естественного вскармливания риск формирования у ребенка избыточной массы тела снижался на 4% [33]. При невозможности использования грудного молока рекомендуется использование адаптированных заменителей грудного молока, в том числе предназначенных для маловесных (недоношенных) детей. В качестве стартового продукта при тяжелом дефиците питания оправданным является применение смесей на основе высокогидролизованного сывороточного белка, не содержащих лактозу, обогащенных среднецепочечными триглицеридами. Они обеспечивают максимальное усвоение питательных веществ в условиях значительного угнетения переваривающей и всасывающей способности ЖКТ [41].
В дальнейшем, при комбинации с продуктами для доношенных детей лучше выбирать смеси, обогащенные про- и пребиотиками, благоприятно влияющими на процессы пищеварения, преимущественно за счет нормализации состава микрофлоры кишечника, нуклеотидами, которые улучшают всасывание пищевых веществ и стимулируют иммунную систему ребенка [42], полиненасыщенными жирными кислотами, которые обладают противовоспалительным эффектом, препятствуют агрегации тромбоцитов, улучшают перфузию кишечника, повышают противоинфекционную активность иммунной системы [43]. При недостаточном обеспечении макронутриентами в связи с ограничением объема питания, обусловленным основным заболеванием, в рацион питания ребенка постепенно вводят высококалорийные продукты (формулы для недоношенных после выписки из стационара — post-discharge formulas), а также специализированные формулы смесей для энтерального питания детей, разрешенные в возрасте до одного года жизни. Результаты клинико-биохимических исследований свидетельствуют об удовлетворительной переносимости и выраженной клинической эффективности этих смесей у детей с различными патологическими состояниями (сердечно-сосудистой и дыхательной недостаточностью, перинатальными и органическими поражениями центральной нервной системы и др.), сопровождающимися недостаточностью питания. Назначение смеси позволяет существенно повысить энергетическую ценность и содержание нутриентов в рационе питания, оказывает положительное воздействие на антропометрические показатели у детей со сниженным нутритивным статусом и приводит к улучшению биохимических показателей, характеризующих метаболизм [44].
При недостаточном обеспечении макронутриентами в связи с ограничением объема питания, обусловленным основным заболеванием, в рацион питания ребенка постепенно вводят высококалорийные продукты (формулы для недоношенных после выписки из стационара — post-discharge formulas), а также специализированные формулы смесей для энтерального питания детей, разрешенные в возрасте до одного года жизни. Результаты клинико-биохимических исследований свидетельствуют об удовлетворительной переносимости и выраженной клинической эффективности этих смесей у детей с различными патологическими состояниями (сердечно-сосудистой и дыхательной недостаточностью, перинатальными и органическими поражениями центральной нервной системы и др.), сопровождающимися недостаточностью питания. Назначение смеси позволяет существенно повысить энергетическую ценность и содержание нутриентов в рационе питания, оказывает положительное воздействие на антропометрические показатели у детей со сниженным нутритивным статусом и приводит к улучшению биохимических показателей, характеризующих метаболизм [44]. Обсуждается также вопрос о возможности введения адаптированных кисломолочных смесей в объеме до 1/2 от суточного.
Обсуждается также вопрос о возможности введения адаптированных кисломолочных смесей в объеме до 1/2 от суточного.
Оптимальное наращивание объема энтерального кормления нередко затруднительно у детей с ЗВУР, особенно родившихся недоношенными, с очень и экстремально низкой массой тела, в связи с повышенной частотой дисфункций ЖКТ и риском развития некротического энтероколита новорожденных (НЭК). Использование продолжительного парентерального питания также может привести к осложнениям, связанным с длительным стоянием центрального венозного катетера, а также вредным эффектам голодания на ЖКТ — позднее введение кормления приводит к атрофии ворсинок и отсутствию образования гормонов и ферментов и может, напротив, повышать заболеваемость НЭК и удлинять сроки госпитализации [45]. Таким образом, организация питания детей, родившихся недоношенными и имеющими ЗВУР, представляет еще большие сложности. Современные подходы к энтеральному питанию недоношенных детей в России изложены в утвержденных федеральных клинических рекомендациях «Энтеральное вскармливание недоношенных» [46]. Рекомендуется стартовать с минимального трофического питания — для повышения моторики кишечника и развития соответствующей микрофлоры, сохранения целостности кишечного барьера и снижения риска развития инфекции. Клинические преимущества такого подхода к вскармливанию включают улучшение толерантности к молоку, больший постнатальный рост, снижение сепсиса и укорочение сроков госпитализации. В то же время темпы наращивания питания недоношенным детям до сих пор находятся в стадии обсуждения. Так, в Кохрейновском обзоре, опубликованном 30.08.2017 г., авторы делают вывод, что более медленные темпы наращивания энтерального питания (15–20 мл/кг), по сравнению с быстрыми (30–40 мл/кг), не профилактируют развитие НЭК и увеличивают риск инвазивной инфекции [47]. Тем не менее рекомендуется проявлять особую осторожность в расширении питания у детей, родившихся при сроке гестации менее 29 недель и с признаками ЗВУР [48]. Вскармливание недоношенных детей с ЗВУР, в отличие от вскармливания недоношенных без ЗВУР, рекомендуется проводить с использованием максимально высоких допустимых доз белка и энергии, рассчитанных на фактическую массу тела, с учетом осложнений, свойственных этим детям, — высокой частоты нарушений углеводного обмена и дисфункций ЖКТ [15].
Рекомендуется стартовать с минимального трофического питания — для повышения моторики кишечника и развития соответствующей микрофлоры, сохранения целостности кишечного барьера и снижения риска развития инфекции. Клинические преимущества такого подхода к вскармливанию включают улучшение толерантности к молоку, больший постнатальный рост, снижение сепсиса и укорочение сроков госпитализации. В то же время темпы наращивания питания недоношенным детям до сих пор находятся в стадии обсуждения. Так, в Кохрейновском обзоре, опубликованном 30.08.2017 г., авторы делают вывод, что более медленные темпы наращивания энтерального питания (15–20 мл/кг), по сравнению с быстрыми (30–40 мл/кг), не профилактируют развитие НЭК и увеличивают риск инвазивной инфекции [47]. Тем не менее рекомендуется проявлять особую осторожность в расширении питания у детей, родившихся при сроке гестации менее 29 недель и с признаками ЗВУР [48]. Вскармливание недоношенных детей с ЗВУР, в отличие от вскармливания недоношенных без ЗВУР, рекомендуется проводить с использованием максимально высоких допустимых доз белка и энергии, рассчитанных на фактическую массу тела, с учетом осложнений, свойственных этим детям, — высокой частоты нарушений углеводного обмена и дисфункций ЖКТ [15]. На втором этапе выхаживания недоношенные дети с ЗВУР и потерей массы тела свыше 15% от массы тела при рождении нуждаются в увеличении калорийности питания в неонатальном периоде до 130 ккал/кг/сут с целью обеспечения опережающих темпов роста, а также в контроле за калорийностью питания на амбулаторном этапе [49].
На втором этапе выхаживания недоношенные дети с ЗВУР и потерей массы тела свыше 15% от массы тела при рождении нуждаются в увеличении калорийности питания в неонатальном периоде до 130 ккал/кг/сут с целью обеспечения опережающих темпов роста, а также в контроле за калорийностью питания на амбулаторном этапе [49].
Вместе с тем, по мнению Д. В. Печкурова и соавт., изучавших особенности метаболизма детей, родившихся с ЗВУР, в настоящее время преобладают не экзо-, а эндогенные формы недостаточности питания. При этом патогенетической основой гипотрофии является не белково-энергетическое голодание, а нарушения метаболизма белка и энергетического баланса [26]. В этой связи питание, предусматривающее повышенную дотацию белка без учета особенностей обмена веществ, может оказаться небезопасным. Таким образом, при экстраполяции предложенной методики расчета питания на детей с ЗВУР и дефицитом массы тела II–III степени возникает ряд аспектов, которые нуждаются в обсуждении, в частности:
- Для недоношенных детей с ЗВУР темпы достижения полного объема энтерального питания еще ниже по сравнению с недоношенными того же гестационного возраста без ЗВУР — достаточным ли для этой категории младенцев будет использование исключительно грудного молока с его усилением фортификатором или требуются дополнительно специализированные продукты питания?
- Необходимо ли «усиление» грудного молока у поздних недоношенных и доношенных детей при отсутствии или недостаточных прибавках массы тела?
- Нужен ли перерасчет на фактический и долженствующий вес различных нутриентов? Это возможно только при проведении парентерального питания.

- Какие применять целевые значения белка, жира, углеводов, калорий на кг/массы тела при расчете энтерального питания у доношенных детей с ЗВУР?
- Должна ли отличаться дотация электролитов и витаминов у детей с ЗВУР от принятых норм для детей того же гестационного возраста с нормальными массо-ростовыми показателями?
Несмотря на постоянные усовершенствования протоколов вскармливания, технологию «агрессивной» тактики парентерального питания и раннее начало энтерального кормления, обогащение грудного молока и использование специализированных адаптированных смесей для недоношенных детей, не удается исключить основной проблемы физического развития недоношенных детей и тем более родившихся с ЗВУР, в виде высокой частоты постнатальной гипотрофии [50]. По данным исследования, проведенного в НЦАГиП, у всех детей с массой тела при рождении менее 1500 г, родившихся с ЗВУР, к 36-й неделе постменструального возраста (или моменту выписки из стационара, если она происходила раньше) масса тела не достигала 10-го перцентиля по графику Фентона 2013 г. Однако до сих пор остается неясным, как интенсивно должны расти недоношенные дети с ЗВУР. Нормативные параметры постнатального увеличения массы тела, роста и окружности головы для них не установлены, а тактика вскармливания недоношенных детей с ЗВУР остается предметом дискуссий [51].
Однако до сих пор остается неясным, как интенсивно должны расти недоношенные дети с ЗВУР. Нормативные параметры постнатального увеличения массы тела, роста и окружности головы для них не установлены, а тактика вскармливания недоношенных детей с ЗВУР остается предметом дискуссий [51].
Таким образом, проблема сохраняющихся низких показателей физического развития у детей с ЗВУР по отношению к сверстникам не может быть решена только увеличением дотации питательных веществ, так как ни один из доступных на сегодня питательных субстратов не может нормализовать состояние эндокринной системы и компенсировать нарушенное внутриутробное программирование. Это является одной из причин очень осторожных высказываний в отношении усиленного вскармливания и рациональности обеспечения быстрого «догоняющего роста» у детей с ЗВУР [52].
В настоящее время имеются данные, подтверждающие, что риск развития последствий ЗВУР для детей с низкой массой тела при рождении не так велик до того момента, когда начинается неблагоприятное программирование, т. е. проблему программирует не сам малый вес, а последующий быстрый скачок роста [3]. Более высокие массо-ростовые показатели в возрасте 6–18 месяцев у детей, родившихся с низкой массой тела, коррелируют с более высоким уровнем артериального давления в возрасте 30 лет и с более высоким показателем уровня проинсулина в плазме крови в возрасте 13–16 лет, т. е. являются фактором риска развития инсулинорезистентности и диабета 2 типа [32]. В этой связи тезис о том, что особенно важно предотвратить избыточные прибавки в массе тела после того, как ее дефицит будет восстановлен и данные физического развития сравняются со средневозрастными, приобретает особую значимость.
е. проблему программирует не сам малый вес, а последующий быстрый скачок роста [3]. Более высокие массо-ростовые показатели в возрасте 6–18 месяцев у детей, родившихся с низкой массой тела, коррелируют с более высоким уровнем артериального давления в возрасте 30 лет и с более высоким показателем уровня проинсулина в плазме крови в возрасте 13–16 лет, т. е. являются фактором риска развития инсулинорезистентности и диабета 2 типа [32]. В этой связи тезис о том, что особенно важно предотвратить избыточные прибавки в массе тела после того, как ее дефицит будет восстановлен и данные физического развития сравняются со средневозрастными, приобретает особую значимость.
Ряд исследователей придерживается мнения о вреде избыточного питания в первые недели жизни у детей с малой массой тела при рождении. С учетом особенностей функционирования ферментных систем, работы ЖКТ, мочевыделительной системы и риска развития в будущем метаболического синдрома, фазу «усиленного питания», вероятно, необходимо исключить из программы питания детей, родившихся с ЗВУР. Определяя потребность в энергии и макронутриентах, при расчете питания следует использовать нормативы, разработанные для данного срока гестации, а не для данной массы тела. Так, доношенный ребенок с ЗВУР должен получать белок и калории в таком же количестве, как и здоровый ребенок: 110–150 ккал/кг/сут, белок — 1,8–2,0 г/кг/сут [53]. Есть также и мнение о том, что допустимым считается набор веса, соответствующий 3-му перцентилю [54].
Определяя потребность в энергии и макронутриентах, при расчете питания следует использовать нормативы, разработанные для данного срока гестации, а не для данной массы тела. Так, доношенный ребенок с ЗВУР должен получать белок и калории в таком же количестве, как и здоровый ребенок: 110–150 ккал/кг/сут, белок — 1,8–2,0 г/кг/сут [53]. Есть также и мнение о том, что допустимым считается набор веса, соответствующий 3-му перцентилю [54].
Таким образом, необходимость коррекции нутритивного статуса ребенка, родившегося с ЗВУР, несомненна. Однако до настоящего времени окончательно не определена в целом степень «пищевой» нагрузки у детей с различной степенью и вариантом ЗВУР, особенно у недоношенных детей. Вероятно, ответы на поставленные вопросы и дискуссионные аспекты будут представлены в обновленной Национальной программе оптимизации вскармливания детей первого года (в 2019 г.), находящейся в настоящее время в разработке у ведущих специалистов по вопросам питания в Российской Федерации.
Об опыте организации питания детей, родившихся с ЗВУР и нутритивным дефицитом
При условии переносимости молочного белка у детей с неотягощенным аллергическим анамнезом среди адаптированных заменителей грудного молока в случаях его отсутствия, хорошо зарекомендовала себя смесь для питания на основе козьего молока Кабрита Голд 1 [55, 56]. Еще в 1900 г. Парижская академия медицинских наук признала козье молоко высокодиетическим продуктом и рекомендовала его для питания ослабленных детей и взрослых [55]. Из установленных преимуществ смеси на основе козьего молока в сравнении с формулами на основе коровьего молока можно отметить лучшую усвояемость жира, исчезновение кишечных колик, оптимальную динамику массы тела [55]. Указанная смесь является наиболее сбалансированным заменителем грудного молока, полученным на основе козьего молока, что определяется особенностями ее состава: это прежде всего сывороточная формула, а в казеиновой ее фракции доминирует β-казеин (известно, что α-s1-казеин определяет уровень коагуляции белка), и поэтому белок козьего молока образует мягкий, легко перевариваемый сгусток в желудке, подобный сгустку белка грудного молока [41]. Она содержит сывороточный α-лактальбумин, имеет малый размер жировых глобул и содержание белка 1,5 г/100 мл. В состав жирового компонента смеси (1-я, 2-я, 3-я формулы) включен липидный комплекс DigestX с высоким содержанием в молекуле глицерола пальмитиновой кислоты в sn-2-позиции (42%), аналогично грудному молоку. Этот комплекс способствует улучшению усвоения жира путем уменьшения экскреции жирных кислот с калом, а также улучшению усвоения кальция в результате снижения экскреции кальция с калом. В смесях содержатся пребиотики (галакто- и фруктоолигосахариды) и пробиотики (бифидобактерии ВВ12), нуклеотиды, длинноцепочечные полиненасыщенные жирные кислоты, витамины, макро- и микронутриенты.
Она содержит сывороточный α-лактальбумин, имеет малый размер жировых глобул и содержание белка 1,5 г/100 мл. В состав жирового компонента смеси (1-я, 2-я, 3-я формулы) включен липидный комплекс DigestX с высоким содержанием в молекуле глицерола пальмитиновой кислоты в sn-2-позиции (42%), аналогично грудному молоку. Этот комплекс способствует улучшению усвоения жира путем уменьшения экскреции жирных кислот с калом, а также улучшению усвоения кальция в результате снижения экскреции кальция с калом. В смесях содержатся пребиотики (галакто- и фруктоолигосахариды) и пробиотики (бифидобактерии ВВ12), нуклеотиды, длинноцепочечные полиненасыщенные жирные кислоты, витамины, макро- и микронутриенты.
В связи с вышеизложенным представляем собственный опыт применения данной смеси. По нашему мнению, особенности состава этой смеси позволяют рассматривать ее в качестве возможного предпочтительного продукта для доношенных детей, родившихся с ЗВУР, и детей раннего возраста с умеренным дефицитом питания.
На базе Государственной Новосибирской областной клинической больницы было проведено исследование, в рамках которого была осуществлена клинико-лабораторная оценка переносимости указанной смеси у детей периода новорожденности и раннего возраста (первых 3 месяцев жизни), в том числе родившихся с ЗВУР. Анализировали динамику массы тела, переносимость смеси (наличие/отсутствие диспепсических проявлений, функциональных нарушений ЖКТ, аллергических реакций, динамику биохимических показателей — уровня общего белка, альбумина, мочевины, а также показатели гемограммы и общего анализа мочи). При рандомизации группы исследования критериями исключения считали недоношенность, критическое и тяжелое состояние детей, наличие механической и динамической кишечной непроходимости, лактазной недостаточности, некротический энтероколит, врожденные пороки развития ЖКТ, наследственные болезни обмена веществ, непереносимость белков коровьего молока. Исследование было проспективным обсервационным, с обязательным оформлением информированного согласия матерей.
На момент формирования группы все дети находились в отделении патологии новорожденных на стадии реконвалесценции различных соматических заболеваний, на совместном посту с матерью, на искусственном вскармливании в связи с отсутствием грудного молока у их матерей. Дети имели стабильную прибавку в массе тела, усваивали полный объем энтерального питания и не нуждались в назначении лечебных смесей. Исследование продолжалось 3 месяца, длительность приема смеси для каждого ребенка составила от 10 дней до 3 недель (в среднем 16 дней). Оценку переносимости и эффективности продукта осуществляли по динамике состояния больного и критериям, занесенным в протокол наблюдения. Проводилась оценка динамики массы тела (среднесуточные прибавки), функции ЖКТ (наличие и степень выраженности срыгиваний, метеоризма, расстройств стула и характеристики копрограммы), биохимических показателей крови (не менее 1 раза в неделю). Все показатели сравнивали с исходными значениями. В исследование были включены 45 детей, родившихся при сроке гестации 38–41 неделя. При рождении 10 (22%) детей имели признаки ЗВУР I–II степени (преимущественно гипотрофический вариант), у 11 (24%) детей имелись признаки постнатальной гипотрофии I степени. Исходно (до начала исследования) пациенты получали базовые смеси на основе сывороточных белков коровьего молока.
При рождении 10 (22%) детей имели признаки ЗВУР I–II степени (преимущественно гипотрофический вариант), у 11 (24%) детей имелись признаки постнатальной гипотрофии I степени. Исходно (до начала исследования) пациенты получали базовые смеси на основе сывороточных белков коровьего молока.
Все дети в исследуемой группе имели удовлетворительную переносимость «изучаемой» смеси, отрицательной динамики по состоянию нутритивного статуса, функций ЖКТ, а также развитию аллергических реакций не зарегистрировано.
Дисфункция ЖКТ в виде выраженного метеоризма была зарегистрирована у 7 (15,5%) детей в момент перехода на смесь Кабрита Голд 1. В динамике к концу первой недели эта симптоматика сохранялась у 5 детей. При этом отмечено уменьшение степени выраженности данного симптома и его купирование на второй неделе приема смеси, когда объем потребляемого продукта увеличился в среднем в 1,3 раза. Следует отметить, что до перехода на смесь на основе козьего молока дети нуждались в назначении прокинетиков и препаратов, содержащих симетикон, но уже к концу первой недели ее приема указанные средства были отменены. Значимых нарушений консистенции и регулярности стула у детей не отмечено. Исходно, до начала приема изучаемой смеси, у 12 детей имелись срыгивания на 1–2 балла по шкале оценки интенсивности срыгиваний [57], которые купировались на второй неделе приема смеси. При оценке результатов биохимического анализа крови не установлено отклонений изучаемых показателей от нормативных значений (исходный уровень значений показателей также находился в пределах нормы). Содержание мочевины не превысило верхней границы нормы ни в одном случае, также не отмечалось снижения данного показателя ниже контрольных значений. Отклонений в общем анализе мочи, свидетельствующих о почечной дисфункции, не определялось.
Значимых нарушений консистенции и регулярности стула у детей не отмечено. Исходно, до начала приема изучаемой смеси, у 12 детей имелись срыгивания на 1–2 балла по шкале оценки интенсивности срыгиваний [57], которые купировались на второй неделе приема смеси. При оценке результатов биохимического анализа крови не установлено отклонений изучаемых показателей от нормативных значений (исходный уровень значений показателей также находился в пределах нормы). Содержание мочевины не превысило верхней границы нормы ни в одном случае, также не отмечалось снижения данного показателя ниже контрольных значений. Отклонений в общем анализе мочи, свидетельствующих о почечной дисфункции, не определялось.
Следует отдельно остановиться на характеристике детей с состоянием гипотрофии в постнатальном периоде и исходно имевших дефицит питания, то есть родившихся с признаками ЗВУР I–II степени. Таких детей из всей группы исследования в общей сложности было 21 (46,6%). Именно наличие указанных состояний послужило основанием смены питания для данной категории пациентов, поскольку прибавки в массе тела не были удовлетворительными при использовании базовых смесей на основе сывороточных белков коровьего молока. В частности, до момента назначения смеси на основе козьего молока среднесуточная прибавка массы тела у детей несколько отличалась от средних значений по группе и на предшествующей исследованию неделе составила (также по средним значениям) не более 15 г. Уже к концу первой недели приема изучаемой смеси среднесуточная прибавка массы тела у детей этой подгруппы увеличилась до 25 г, а к концу 2-й недели — до 35 г. Необходимо отметить, что описанные выше признаки гастроинтестинальной дисфункции до начала исследования имели место именно среди детей с гипотрофией и ЗВУР.
В частности, до момента назначения смеси на основе козьего молока среднесуточная прибавка массы тела у детей несколько отличалась от средних значений по группе и на предшествующей исследованию неделе составила (также по средним значениям) не более 15 г. Уже к концу первой недели приема изучаемой смеси среднесуточная прибавка массы тела у детей этой подгруппы увеличилась до 25 г, а к концу 2-й недели — до 35 г. Необходимо отметить, что описанные выше признаки гастроинтестинальной дисфункции до начала исследования имели место именно среди детей с гипотрофией и ЗВУР.
При опросе матерей относительно толерантности детей к питанию и комфортности в поведении детей были получены положительные отзывы.
Таким образом, результаты исследования свидетельствуют о том, что молочная смесь на основе козьего молока Кабрита Голд 1 характеризуется хорошей переносимостью при использовании в качестве основного продукта питания у детей, начиная с периода новорожденности. Смесь формирует адекватный «нутритивный статус», обеспечивая стабильную прибавку в массе тела, положительные изменения значений показателей белкового обмена. Кроме того, она оказывает определенный «лечебный» эффект при наличии у детей с дефицитом питания I степени функциональных расстройств питания в виде метеоризма, срыгиваний. У детей с умеренным дефицитом питания и постнатальной гипотрофией I степени отмечена отчетливая положительная динамика в нутритивном статусе в сравнении с показателями при использовании формул на основе сывороточных белков коровьего молока.
Кроме того, она оказывает определенный «лечебный» эффект при наличии у детей с дефицитом питания I степени функциональных расстройств питания в виде метеоризма, срыгиваний. У детей с умеренным дефицитом питания и постнатальной гипотрофией I степени отмечена отчетливая положительная динамика в нутритивном статусе в сравнении с показателями при использовании формул на основе сывороточных белков коровьего молока.
Заключение
Задача клинициста при работе с детьми, родившимися с низкой массой тела и/или имеющими в анамнезе ЗВУР, состоит в своевременном выявлении дефицита питания еще в период внутриутробного развития и далее после рождения, включая детей, родившихся преждевременно. Следует помнить, что здоровье детей с ЗВУР находится под угрозой и нуждается в надлежащей поддержке. Эта задача включает в себя также идентификацию небольшой, но здоровой группы детей, имеющих конституциональные особенности роста, для того, чтобы избежать причинения «ятрогенного вреда» неоправданными медицинскими вмешательствами [2]. С другой стороны, детям с ЗВУР необходимо комплексное медицинское сопровождение, включая в тяжелых случаях пребывание в отделении реанимации, они нуждаются в поддержке терморегуляции, гомеостаза, решении проблем обеспечения нутриентами. Идеальным продуктом питания для них является грудное молоко, но для обеспечения высоких потребностей в питательных веществах может потребоваться его фортификация (исключительно по медицинским показаниям) и использование специализированных продуктов питания [58]. Часто развивающееся у данной категории пациентов состояние, обозначаемое как «Failure to thrive» («отказ процветать»), ассоциируется с нарушением иммунной функции, ростом заболеваемости, тяжестью инфекционных болезней (особенно диареи и пневмонии), повышенной смертностью в возрасте до 5 лет [34]. В связи с этим достижение нормальной траектории роста имеет решающее значение в целях содействия «краткосрочному» здоровью и выживанию младенцев. Необходим компромисс между долго- и краткосрочными последствиями быстрого начала роста и понимание того, что подход к планированию питания должен быть индивидуальным, персонифицированным.
С другой стороны, детям с ЗВУР необходимо комплексное медицинское сопровождение, включая в тяжелых случаях пребывание в отделении реанимации, они нуждаются в поддержке терморегуляции, гомеостаза, решении проблем обеспечения нутриентами. Идеальным продуктом питания для них является грудное молоко, но для обеспечения высоких потребностей в питательных веществах может потребоваться его фортификация (исключительно по медицинским показаниям) и использование специализированных продуктов питания [58]. Часто развивающееся у данной категории пациентов состояние, обозначаемое как «Failure to thrive» («отказ процветать»), ассоциируется с нарушением иммунной функции, ростом заболеваемости, тяжестью инфекционных болезней (особенно диареи и пневмонии), повышенной смертностью в возрасте до 5 лет [34]. В связи с этим достижение нормальной траектории роста имеет решающее значение в целях содействия «краткосрочному» здоровью и выживанию младенцев. Необходим компромисс между долго- и краткосрочными последствиями быстрого начала роста и понимание того, что подход к планированию питания должен быть индивидуальным, персонифицированным. По мнению A. Lukas с соавт., требуются дальнейшие исследования и разработка критериев достаточности питания для детей с ЗВУР [3]. Пока не достигнута единая позиция, в частности, по вопросу о том, какие показатели считать долженствующими для детей, рожденных с ЗВУР. По имеющимся таблицам оценки физического развития нельзя определить «желаемый» показатель с учетом последствий для здоровья. Такие таблицы не содержат ранжирования траекторий индивидуального роста в зависимости от риска сердечно-сосудистых заболеваний или замедления темпов прироста окружности головы в зависимости от последующего когнитивного потенциала. Также пока мало известно о том, какие именно аспекты роста и связанного с ним состава тела наилучшим образом позволяют предсказать уровень здоровья в дальнейшем [3].
По мнению A. Lukas с соавт., требуются дальнейшие исследования и разработка критериев достаточности питания для детей с ЗВУР [3]. Пока не достигнута единая позиция, в частности, по вопросу о том, какие показатели считать долженствующими для детей, рожденных с ЗВУР. По имеющимся таблицам оценки физического развития нельзя определить «желаемый» показатель с учетом последствий для здоровья. Такие таблицы не содержат ранжирования траекторий индивидуального роста в зависимости от риска сердечно-сосудистых заболеваний или замедления темпов прироста окружности головы в зависимости от последующего когнитивного потенциала. Также пока мало известно о том, какие именно аспекты роста и связанного с ним состава тела наилучшим образом позволяют предсказать уровень здоровья в дальнейшем [3].
Статья написана при финансовой поддержке компании «Хипрока Нутришион Ист Лимитед».
Литература
- Hirst J., Villar J., Kennedy S., Bhutta Z. Being born stunted and/or wasted need not be inevitable/International Pediatric Association Newsletter Year 2015.
 Vol. 10; Issue 1: 9–14.
Vol. 10; Issue 1: 9–14. - Ross M. G., Smith C. V. Fetal Growth Restriction. Update 2018. http://emedicine.medscape.com/article/261226-overview. [Accessed 22 July, 2018].
- Lukas A., Makrides M., Ziegler E. Importance of growth for health and development. Nestle Nutr. Inst. Workshop Series Pediatr. Program. 2010; 65: 251 p.
- Levine T. A., Grunau R. E., McAuliffe F. M. et al. Early childhood neurodevelopment after intrauterine growth restriction: a systematic review // Pediatrics. 2015. Vol. 135, № 1. P. 126–141. DOI: 10.1542/peds.2014–1143.
- Савельева Г. М., Шалина Р. И., Панина О. Б., Курцер М. А. Акушерство. М.: ГЭОТАР-Медиа, 2010. 479 с.
- Василькова Н. Ю. Особенности нарушений роста у детей с наследственной патологией. Автореф. дис. … к.м.н. Новосибирск, 2004. 18 с.
- Горбань Т. С., Дегтярева М. В., Бабак О. А. и др. Особенности течения неонатального периода у недоношенных новорожденных детей с задержкой внутриутробного развития // Вопр.
 практ. педиатрии. 2011. Т. 6, № 6. С. 8–13.
практ. педиатрии. 2011. Т. 6, № 6. С. 8–13. - Письмо Министерства здравоохранения Российской Федерации от 21.11.2017 № 15–2/10/2–8090 «О направлении методических рекомендаций «Оценка физического развития детей и подростков».
- Стандартные показатели ВОЗ в области развития ребенка: методы и разработки [Электронный ресурс]. Группа ВОЗ по многофокусному исследованию эталонов роста // ActaPaediatrica. 2006. Vol. 95, Suppl. 450. P. 76–85. Режим доступа: http://www.who.int/childgrowth/standards/acta_paediatrica2006_suppl450 pp76_85_rus.pdf.
- Tanis R. Fenton. A new fetal-infant growth chart for preterm infants developed through a meta-analysis of published reference studies // BMC Pediatrics. 2003, р. 5–10.
- Villar J., Giuliani F., Bhutta Z. A., Bertino E., Ohuma E. O., Ismail L. C. et al. Postnatal growth standards for preterm infants: the Preterm Postnatal Follow-up Study of the INTERGROWTH-21 st Project // Lancet Glob Health.
 2015, 3 (11): e681-e691. DOI: 10.1016/S2214–109 X (15)00163–1.
2015, 3 (11): e681-e691. DOI: 10.1016/S2214–109 X (15)00163–1. - Victora C. G., Villar J., Barros F. C., Bertino E., Noble J. A., Purwar M. et al. Anthropometric characterization of impaired fetal growth: risk factors for and prognosis of newborns with stunting or wasting // JAMA Pediatr. 2015, 169 (7): e151431. DOI: 10.1001/jamapediatrics.2015.1431.
- Нетребенко О. К. Метаболическое программирование в антенатальном периоде // Вопросы гинекологии, акушерства и перинатологии. 2012; 11 (6): 58–64.
- Bernstein I. M., Horbar J. D., Badger G. J. et al. Morbidity and mortality among very-low-birth-weight neonates with intrauterine growth restriction. The Vermont Oxford Network // Am J Obstet Gynecol. 2000, Jan. 182 (1 Pt 1): 198–206. DOI: 10.1016/S0002–9378 (00)70513–8.
- Кириллова Е. А. Особенности раннего физического и стато-моторного развития недоношенных детей с задержкой внутриутробного развития.
 Дисс. … к. м.н., 2017. 146 c.
Дисс. … к. м.н., 2017. 146 c. - Близнецова Е. А., Антонова Л. К., Кулакова Н. И. Особенности течения неонатального периода у недоношенных детей с задержкой внутриутробного развития // Неонатология: новости, мнения, обучение. 2017. № 3. С. 83–88.
- Villar J., Puglia F., Fenton T., Cheikh Ismail L., Staines-Urias E., Giuliani F. et al. Body composition at birth and its relationship with neonatal anthropometric ratios: the Newborn Body Composition Study of the INTERGROWTH-21 st Project Pediatr Res 2017.
- Okada T., Takahashi S., Nagano N., Yoshikawa K., Usukura Y. Early postnatal alteration of body composition in preterm and small for-gestational-age infants: implications of catch-up fat // HosonoPediatr Res. 2015, Jan; 77 (1–2): 136–142. DOI:10.1038/pr.2014.164.
- Eriksson L., Haglund B., Odlind V., Altman M., Ewald U., Kieler H. Perinatal conditions related to growth restriction and inflammation are associated with an increased risk of bronchopulmonary dysplasia // Acta Paediatr.
 2015; 104 (3): 259–263. DOI: 10.1111/apa.12888.
2015; 104 (3): 259–263. DOI: 10.1111/apa.12888. - Weisz B., Hogen L., Yinon Y., Gindes L., Shrim A., Simchen M. et al. Perinatal outcome of monochorionic twins with selective IUGR compared with uncomplicated monochorionic twins. Twin Res Hum Genet Off // J Int Soc Twin Stud. 2011; 14: 457–462. DOI: 10.1375/twin.14.5.457.
- Damodaram M., Story L., Kulinskaya E., Rutherford M., Kumar S. Early adverse perinatal complications in preterm growth — restricted fetuses // J Obstet Gynaecol. 2011; 51: 204–209. DOI: 10.1111/j.1479–828 X.2011.01299.x.
- Ни А. Н., Фадеева Т. Ю., Быкова О. Г. Нутритивный статус детей, родившихся с синдромом задержки внутриутробного развития // Вопросы детской диетологии. 2011; 4: 9–13.
- Bozzetti V., Tagliabue P. E. Enteral feeding of intrauterine growth restriction preterm infants: theoretical risks and practical implications // Pediatr Med Chir. 2017, Jun 28; 39 (2): 160. DOI: 10.
 4081/pmc.2017.160.
4081/pmc.2017.160. - Isabelle M. C. Ree, Vivianne E. H. J.. Smits-Wintjens, Esther G. J., Rijntjes-Jacobs, Iris C. M., Pelsma, Sylke J., Steggerda Frans J., Walther Enrico Lopriore. Necrotizing Enterocolitis in Small — for — Gestational — Age Neonates: A Matched Case-Control Study // Neonatology. 2014; 105: 74–78. DOI: 0.1159/000356033.
- Tidjani Alou M., Lagier J. C., Raoult D. Diet influence on the gut microbiota and dysbiosis related to nutritional disorders // Human Microbiome Journal. 2016; 1: 3–11. DOI: 10.1016/j.humic.2016.09.001.
- Печкуров Д. В., Володина Н. А., Липатова Е. С. Содержание α1-антитрипсина и трансферина в сыворотке крови детей раннего возраста с гипотрофией // Педиатрия. 2011; 90: 43–47.
- Щеплягина Л. В., Нетребенко О. К. Питание беременной женщины и программирование заболеваний ребенка на разных этапах онтогенеза (теоретические и практические вопросы) // Лечение и профилактика.
 2012; 1 (2): 7–15.
2012; 1 (2): 7–15. - Фадеева Т. Ю. Клинико-функциональные особенности развития плода и новорожденного с задержкой внутриутробного развития. Автореф. дис. … к.м.н. Владивосток, 2012. 23 с.
- Ни А. Н., Фадеева Т. Ю., Васильева Т. Г., Зернова Е. С., Шишацкая С. Н. Патогенетические аспекты нарушения обмена фолиевой кислоты при задержке внутриутробного развития плода // Современные проблемы науки и образования. 2016. № 2. URL: http://science-education.ru/ru/article/view? id=24187 (дата обращения: 15.08.2018).
- Giussani D. A., Niu Y., Herrera E. A., Richter H. G., Camm E. J., Thakor A. S., Kane A. D., Hansell J. A., Brain K. L., Skeffington K. L., Itani N., Wooding F. B., Cross C. M., Allison B. J. Heart disease link to fetal hypoxia and oxidative stress // Adv. Exp. Med. Biol. 2014; 814: 77–87. DOI: 10.1007/978–1-4939–1031–1_7.
- Платовская Д. В. Дети с задержкой внутриутробного развития: ранняя гормональная адаптация и клинико-психологические особенности.
 Автореф. дис. … к.м.н. Воронеж, 2011. 24 с
Автореф. дис. … к.м.н. Воронеж, 2011. 24 с - Нетребенко О. К. Младенческие истоки хронических неинфекционных заболеваний: cахарный диабет, ожирение, сердечно-сосудистые заболевания // Педиатрия. 2014. Т. 93, № 5. С. 109–117.
- Захарова И. Н., Дмитриева Ю. А., Суркова Е. Н. Отдаленные последствия неправильного вскармливания детей. Уч. пос. для врачей. М., 2011. С. 13–14.
- Sirotnak A. P, Pataki C. Failure to Thrive Updated: Apr 21, 2017 https://emedicine.medscape.com/article/915575 [Accessed 25 July, 2018].
- Gluckman P. D., Hanson M. A., Low F. M. The role of developmental plasticity and epigenetics in human health // Birth Defects Res. С Embrio Today. 2011; 93: 12–18. DOI: 10.1002/bdrc.20198.
- Barker D. J. The developmental origins of chronic adult disease // Acta Paediatr. 2004; 93 (Suppl.): 26–33. DOI: 10.1111/j.1651–2227.2004.tb00236.x.
- Boubred F., Jamin A.
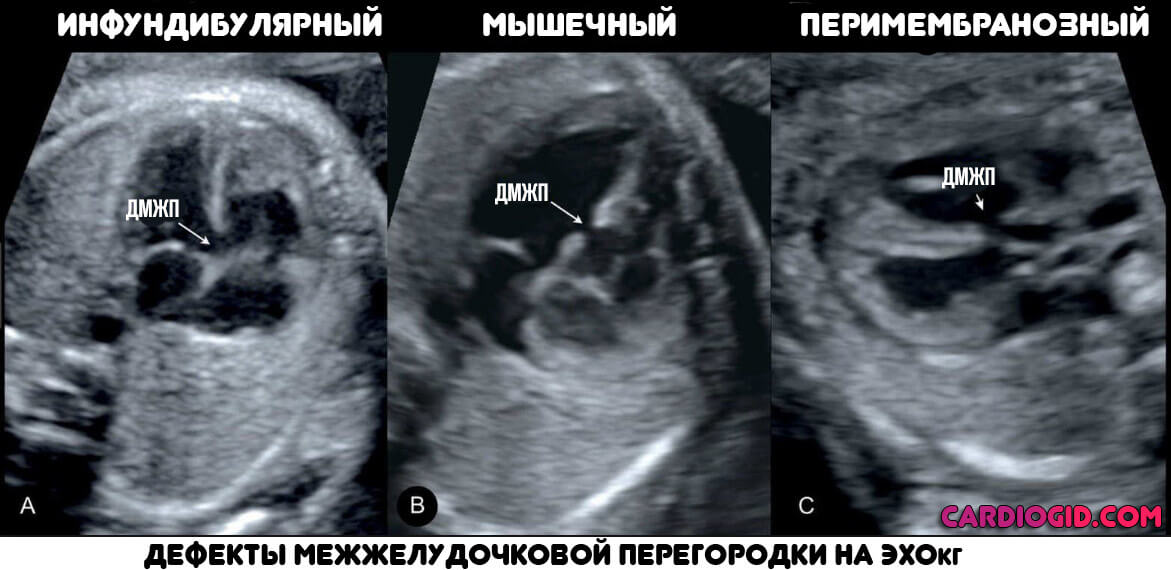 , Buffat C., Daniel L., Borel P., Boudry G., Le Huëron-Luron I., Simeoni U. Neonatal high protein intake enhances neonatal growth without significant adverse renal effects in spontaneous IUGR piglets // Physiol Rep. 2017, May; 5 (10). pii: e13296. DOI: 10.14814/phy2.13296.
, Buffat C., Daniel L., Borel P., Boudry G., Le Huëron-Luron I., Simeoni U. Neonatal high protein intake enhances neonatal growth without significant adverse renal effects in spontaneous IUGR piglets // Physiol Rep. 2017, May; 5 (10). pii: e13296. DOI: 10.14814/phy2.13296. - Frank M. Ruemmele F. M., Garnier-Lengliné H. Why Are Genetics Important for Nutrition? Lessons from Epigenetic Research // Ann. Nutr. Metab. 2012; 60 (Suppl. 3): 38–43.
- Национальная программа оптимизации вскармливания детей первого года жизни в Российской Федерации / Под ред. А. А. Баранова, В. А. Тутельяна. М., 2010. 68 с.
- Harder T., Bergmann R., Kallischnigg G., Plagemann A. Duration of breastfeeding and risk of overweight: a meta-analysis // Am. J. Epidemiol. 2005; 162: 397–403. DOI: 10.1093/aje/kwi222.
- Скворцова В. А., Нетребенко О. К., Боровик Т. Э. Нарушения питания у детей раннего возраста // Лечащий Врач. 2011; 1: 36–41.

- Клиническая диетология детского возраста. Руководство для врачей / Под ред. проф. Т. Э. Боровик, проф. К. С. Ладодо. 2-е изд., перераб. и доп. М.: ООО «Издательство «Медицинское информационное агентство», 2015. 720 с.: ил.
- Calder Р. С. S-3 fatty acid, inflammation and immunity-relevance to postsurgical and critically ill patients // Lipids. 2004; 39: 1147–1161.
- Скворцова В. А., Боровик Т. Э., Баканов М. И. и др. Нарушения питания у детей раннего возраста и возможности их коррекции // Вопросы современной педиатрии. 2011; 10 (4): 119–125.
- Schutzman D. L., Porat R., Salvador A., Janeczko M. Neonatal nutrition: a brief review // World J Pediatr. 2008; 4: 248–253. DOI: 10.1007/s12519–008–0046–2.
- Энтеральное вскармливание недоношенных. Клинические рекомендации. М., 2015. 28 с.
- Oddie S. J., Young L., McGuire W. Slow advancement of enteral feed volumes to prevent necrotising enterocolitis in very low birth weight infants // Cochrane Database of Systematic Reviews.
 2017, Issue 8. Art. № CD001241. DOI: 10.1002/14651858.CD001241.pub7.
2017, Issue 8. Art. № CD001241. DOI: 10.1002/14651858.CD001241.pub7. - Kempley S., Gupta N., Linsell L. et al. Feeding infants below 29 weeks’ gestation with abnormal antenatal Doppler: analysis from a randomised trial // Arch Dis Child Fetal Neonatal Ed. 2014; 99: 6–11.
- Халецкая О. В., Суслова М. А., Яцышина Е. Е., Федорина Н. А. Подходы по оптимизации питания и физического развития у недоношенных новорожденных на втором этапе выхаживания // Медицинский альманах. 2018, № 3 (54), с. 42–44.
- Рюмина И. И., Нароган М. В., Грошева Е. В., Дегтярева А. В. Трудные вопросы энтерального вскармливания недоношенных детей // Доктор.Ру. 2014. № 3 (91). С. 12–17.
- Descamps Olivier S., Eric T., Pierre-Francois G. Does FTO have a paradoxical effect in fetal life? // BMC Genetics. 2014; 15: 145. DOI: 10.1186/s12863–014–0145–0.
- Henriksson P., Eriksson B., Forsum E., Löf M. Gestational weight gain according to Institute of Medicine recommendations in relation to infant size and body composition // Pediatr Obes.
 2015, Oct; 10 (5): 388–394. DOI: 10.1111/ijpo.276.
2015, Oct; 10 (5): 388–394. DOI: 10.1111/ijpo.276. - Неонатология. Том 1. Детские болезни. Учебник / Под ред. Н. Н. Володина, Ю. Г. Мухиной, А. И. Чубаровой. М.: Династия, 2011. С. 79.
- Рооз Р., Генцель-Боровичени О., Прокитте Г. Неонатология. Практические рекомендации. М.: Медицинская литература, 2011. С. 153.
- Боровик Т. Э., Семенова Н. Н., Лукоянова О. Л. и др. К вопросу о возможности использования козьего молока и адаптированных смесей на его основе в детском питании // Вопросы современной педиатрии. 2013; 12 (1): 8–10.
- Juarez M., Ramos M. Physico-chemical characteristics of goat milk as distinct from those of cow’s milk // Int. Dairy Fed. Buffi. 1986; 202: 54–67.
- Vandenplas Y. The diagnosis and treatment of gastro-oesophageal reflux disease in infants and children // Ann. Med. 1993; 25 (4): 323–328. Review. PubMed. PMID: 8217096.
- Carducci B., Bhutta Z.
 Care of the growth-restricted newborn // Best Pract Res Clin Obstet Gynaecol. 2018, May; 49: 103–116. DOI: 10.1016/j.bpobgyn.2018.02.003.
Care of the growth-restricted newborn // Best Pract Res Clin Obstet Gynaecol. 2018, May; 49: 103–116. DOI: 10.1016/j.bpobgyn.2018.02.003.
Т. В. Белоусова1, доктор медицинских наук, профессор
И. В. Андрюшина, кандидат медицинских наук
ФГБОУ ВО НГМУ МЗ РФ, Новосибирск
1 Контактная информация: [email protected]
Задержка внутриутробного развития и ее влияние на состояние здоровья. Современные подходы к вскармливанию детей/ Т. В. Белоусова, И. В. Андрюшина
Для цитирования: Лечащий врач № 9/2018; Номера страниц в выпуске: 50-59
Теги: маловесные новорожденные, рост, питание, нутриенты
Новые рубежи гипертрофии сердца во время беременности
1. Cantor EJ, Babick AP, Vasanji Z, Dhalla NS, Netticadan T. Сравнительный серийный эхокардиографический анализ структуры и функции сердца у крыс, подвергшихся перегрузке давлением или объемом. Дж Мол Селл Кардиол. 2005; 38: 777–786. [PubMed] [Google Scholar]
Дж Мол Селл Кардиол. 2005; 38: 777–786. [PubMed] [Google Scholar]
2. Дорн Г.В., Манн Д.Л. Сигнальные пути, участвующие в ремоделировании левого желудочка: суммирование. Ошибка карты J. 2002;8:S387–S388. [PubMed] [Google Scholar]
3. Карабелло Б.А. Эволюция изучения функции левого желудочка: все старое снова новое. Тираж. 2002;105:2701–2703. [PubMed] [Академия Google]
4. Pluim BM, Swenne CA, Zwinderman AH, Maan AC, van der LA, Doornbos J, Van der Wall EE. Корреляция вариабельности сердечного ритма с сердечными функциональными и метаболическими переменными у велосипедистов с гипертрофией левого желудочка, вызванной тренировками. Сердце. 1999; 81: 612–617. [Бесплатная статья PMC] [PubMed] [Google Scholar]
5. Schannwell CM, Zimmermann T, Schneppenheim M, Plehn G, Marx R, Strauer BE. Гипертрофия левого желудочка и диастолическая дисфункция у здоровых беременных женщин. Кардиология. 2002;97:73–78. [PubMed] [Google Scholar]
6. Chung E, Yeung F, Leinwand LA. Передача сигналов Akt и MAPK опосредует индуцированную беременностью адаптацию сердца. J Appl Physiol. 2012; 112:1564–1575. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Передача сигналов Akt и MAPK опосредует индуцированную беременностью адаптацию сердца. J Appl Physiol. 2012; 112:1564–1575. [Бесплатная статья PMC] [PubMed] [Google Scholar]
7. Weir RJ. Вазопрессорные вещества при нормальной и патологической беременности. Eur J Obstet Gynecol Reprod Biol. 1975; 5: 75–85. [PubMed] [Google Scholar]
8. Robertson JI, Weir RJ, Dusterdieck GO, Fraser R, Tree M. Ренин, ангиотензин и альдостерон при беременности и менструальном цикле человека. Скотт Мед Дж. 1971;16:183–196. [PubMed] [Google Scholar]
9. Zheng J, Bird IM, Chen DB, Magness RR. Регуляция ангиотензином II функций эндотелия фетоплацентарных артерий овец: взаимодействие с оксидом азота. Дж. Физиол. 2005; 565: 59–69. [Бесплатная статья PMC] [PubMed] [Google Scholar]
10. Bowers SL, Banerjee I, Baudino TA. Внеклеточный матрикс: в центре всего этого. Дж Мол Селл Кардиол. 2010; 48: 474–482. [PMC бесплатная статья] [PubMed] [Google Scholar]
11. Swynghedauw B. Молекулярные механизмы ремоделирования миокарда. Физиол Ред. 1999;79:215–262. [PubMed] [Google Scholar]
Физиол Ред. 1999;79:215–262. [PubMed] [Google Scholar]
12. Berk BC, Fujiwara K, Lehoux S. Ремоделирование ECM при гипертонической болезни сердца. Джей Клин Инвест. 2007; 117: 568–575. [Бесплатная статья PMC] [PubMed] [Google Scholar]
13. Janicki JS, Brower GL. Роль миокардиального фибриллярного коллагена в ремоделировании и функции желудочков. Ошибка карты J. 2002;8:S319–S325. [PubMed] [Google Scholar]
14. Benito B, Gay-Jordi G, Serrano-Mollar A, Guasch E, Shi Y, Tardif JC, Brugada J, Nattel S, Mont L. Аритмогенное ремоделирование сердца на крысиной модели длительные интенсивные тренировки. Тираж. 2011; 123:13–22. [PubMed] [Академия Google]
15. Aljabri MB, Songstad NT, Lund T, Serrano MC, Andreasen TV, Al-Saad S, Lindal S, Sitras V, Acharya G, Ytrehus K. Беременность защищает от антиангиогенного и фиброгенного действия ангиотензина II в сердцах крыс. Acta Physiol (Oxf) 2011; 201:445–456. [PubMed] [Google Scholar]
16. Lemmens K, Doggen K, De Keulenaer GW. Активация системы нейрегулин/ErbB во время физиологического ремоделирования желудочков во время беременности. Am J Physiol Heart Circ Physiol. 2011; 300:H931–H942. [PubMed] [Академия Google]
Активация системы нейрегулин/ErbB во время физиологического ремоделирования желудочков во время беременности. Am J Physiol Heart Circ Physiol. 2011; 300:H931–H942. [PubMed] [Академия Google]
17. Shai SY, Harpf AE, Babbitt CJ, Jordan MC, Fishbein MC, Chen J, Omura M, Leil TA, Becker KD, Jiang M, Smith DJ, Cherry SR, Loftus JC, Ross RS. Специфическое для кардиомиоцитов удаление гена интегрина бета1 приводит к миокардиальному фиброзу и сердечной недостаточности. Цирк рез. 2002; 90: 458–464. [PubMed] [Google Scholar]
18. Suryakumar G, Kasiganesan H, Balasubramanian S, Kuppuswamy D. Отсутствие передачи сигналов интегрина бета3 способствует кальпаин-опосредованной потере клеток миокарда в перегруженном давлением миокарде. J Cardiovasc Pharmacol. 2010; 55: 567–573. [Бесплатная статья PMC] [PubMed] [Google Scholar]
19. Harston RK, Kuppuswamy D. Интегрины являются необходимыми звеньями гипертрофического роста кардиомиоцитов. J Сигнальный преобразователь. 2011;2011:521742. [Бесплатная статья PMC] [PubMed] [Google Scholar]
[Бесплатная статья PMC] [PubMed] [Google Scholar]
20. Hessel M, Steendijk P, den AB, Schutte C, van der LA. Правожелудочковая недостаточность, вызванная перегрузкой давлением, связана с повторной экспрессией миокардиального тенасцина-С и повышенными уровнями тенасцина-С в плазме. Cell Physiol Biochem. 2009; 24:201–210. [PubMed] [Google Scholar]
21. Hutchinson KR, Stewart JA Jr, Lucchesi PA. Ремоделирование внеклеточного матрикса при прогрессировании сердечной недостаточности, вызванной объемной перегрузкой. Дж Мол Селл Кардиол. 2010; 48: 564–569.. [Бесплатная статья PMC] [PubMed] [Google Scholar]
22. Умар С., Хессель М., Стендейк П., Бакс В., Шутте С., Шалий М., ван дер В.Е., Атсма Д., ван дер Л.А. Активация сигнальных молекул и матриксных металлопротеиназ в миокарде правого желудочка крыс с легочной гипертензией. Патол Res Pract. 2007; 203: 863–872. [PubMed] [Google Scholar]
23. Wang X, Chow FL, Oka T, Hao L, Lopez-Campistrous A, Kelly S, Cooper S, Odenbach J, Finegan BA, Schulz R, Kassiri Z, Lopaschuk GD, Fernandez -Patron C. Матричные металлопротеиназы-7 и ADAM-12 (дезинтегрин и металлопротеиназа-12) определяют сигнальную ось при агонист-индуцированной гипертензии и сердечной гипертрофии. Тираж. 2009 г.;119:2480–2489. [PubMed] [Google Scholar]
Матричные металлопротеиназы-7 и ADAM-12 (дезинтегрин и металлопротеиназа-12) определяют сигнальную ось при агонист-индуцированной гипертензии и сердечной гипертрофии. Тираж. 2009 г.;119:2480–2489. [PubMed] [Google Scholar]
24. Gooz M. ADAM-17: фермент, который делает все. Crit Rev Biochem Mol Biol. 2010;45:146–169. [Бесплатная статья PMC] [PubMed] [Google Scholar]
25. Fedak PW, Moravec CS, McCarthy PM, Altamentova SM, Wong AP, Skrtic M, Verma S, Weisel RD, Li RK. Измененная экспрессия дезинтегрин-металлопротеиназ и их ингибитора при дилатационной кардиомиопатии человека. Тираж. 2006; 113: 238–245. [PubMed] [Google Scholar]
26. Mahmoodzadeh S, Dworatzek E, Fritschka S, Pham TH, Regitz-Zagrosek V. 17бета-эстрадиол ингибирует транскрипцию матриксной металлопротеиназы-2 через MAP-киназу в фибробластах. Кардиовасц Рез. 2010;85:719–728. [Бесплатная статья PMC] [PubMed] [Google Scholar]
27. Dorn GW, Force T. Протеинкиназные каскады в регуляции сердечной гипертрофии. Джей Клин Инвест. 2005; 115: 527–537. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Джей Клин Инвест. 2005; 115: 527–537. [Бесплатная статья PMC] [PubMed] [Google Scholar]
28. Heineke J, Molkentin JD. Регуляция сердечной гипертрофии внутриклеточными сигнальными путями. Nat Rev Mol Cell Biol. 2006; 7: 589–600. [PubMed] [Google Scholar]
29. Эгбали М., Дева Р., Алиуа А., Миносян Т.Ю., Руан Х., Ван Ю., Торо Л., Стефани Э. Молекулярные и функциональные признаки гипертрофии сердца во время беременности. Цирк рез. 2005;96: 1208–1216. [PubMed] [Google Scholar]
30. Eghbali M, Wang Y, Toro L, Stefani E. Гипертрофия сердца во время беременности: лучшее функционирование сердца? Тенденции сердечно-сосудистой медицины. 2006; 16: 285–291. [PubMed] [Google Scholar]
31. Gonzalez AMD, Osorio JC, Manlhiot C, Gruber D, Homma S, Mital S. Передача сигналов гипертрофии во время перипартального ремоделирования сердца. Am J Physiol Heart Circ Physiol. 2007;293:h4008–h4013. [PubMed] [Google Scholar]
32. Matsui T, Rosenzweig A. Конвергентные пути передачи сигнала, контролирующие выживание и функцию кардиомиоцитов: роль PI 3-киназы и Akt. Дж Мол Селл Кардиол. 2005; 38: 63–71. [PubMed] [Академия Google]
Дж Мол Селл Кардиол. 2005; 38: 63–71. [PubMed] [Академия Google]
33. ДеБош Б., Тресков И., Лупу Т.С., Вайнхаймер С., Ковач А., Куртуа М., Муслин А.Дж. Akt1 необходим для физиологического роста сердца. Тираж. 2006;113:2097–2104. [PubMed] [Google Scholar]
34. ДеБош Б., Самбандам Н., Вайнхаймер С., Куртуа М., Муслин А.Дж. Akt2 регулирует сердечный метаболизм и выживаемость кардиомиоцитов. Дж. Биол. Хим. 2006; 281:32841–32851. [Бесплатная статья PMC] [PubMed] [Google Scholar]
35. Previlon M, Pezet M, Dachez C, Mercadier JJ, Rouet-Benzineb P. Последовательные изменения в передаче сигналов Akt, GSK3beta и кальциневрина в левом желудочке мыши после грудной сужение аорты. Может J Physiol Pharmacol. 2010;88:1093–1101. [PubMed] [Google Scholar]
36. Иванова М., Жанега П., Матежикова Дж., Симончикова П., Панча Д., Равингерова Т., Баранчик М. Активация киназы Akt сопровождает повышение резистентности сердца к ишемии/реперфузии у крыс после кратковременного кормление жирной диетой на основе сала и повышенным потреблением сахарозы. Нутр Рез. 2011; 31: 631–643. [PubMed] [Google Scholar]
Нутр Рез. 2011; 31: 631–643. [PubMed] [Google Scholar]
37. Hardt SE, Sadoshima J. Киназа-3бета гликогенсинтазы: новый регулятор гипертрофии и развития сердца. Цирк рез. 2002;90:1055–1063. [PubMed] [Google Scholar]
38. Sugden PH, Fuller SJ, Weiss SC, Clerk A. Киназа 3 гликогенсинтазы (GSK3) в сердце: точка интеграции в гипертрофической передаче сигналов и терапевтическая цель? Критический анализ. Бр Дж. Фармакол. 2008; 153 (Приложение 1): S137–S153. [Бесплатная статья PMC] [PubMed] [Google Scholar]
39. Markou T, Cullingford TE, Giraldo A, Weiss SC, Alsafi A, Fuller SJ, Clerk A, Sugden PH. Киназы гликогенсинтазы 3альфа и 3бета в кардиомиоцитах: регуляция и последствия их ингибирования. Сотовый сигнал. 2008; 20: 206–218. [PubMed] [Академия Google]
40. Антос С.Л., МакКинзи Т.А., Фрей Н., Кучке В., МакЭналли Дж., Шелтон Дж.М., Ричардсон Дж.А., Хилл Дж.А., Олсон Э.Н. Активированная гликогенсинтаза-3 бета подавляет гипертрофию сердца in vivo. Proc Natl Acad Sci USA. 2002; 99: 907–912. [Бесплатная статья PMC] [PubMed] [Google Scholar]
2002; 99: 907–912. [Бесплатная статья PMC] [PubMed] [Google Scholar]
41. Haq S, Choukroun G, Kang ZB, Ranu H, Matsui T, Rosenzweig A, Molkentin JD, Alessandrini A, Woodgett J, Hajjar R, Michael A, Force Т. Киназа-3бета гликогенсинтазы является негативным регулятором гипертрофии кардиомиоцитов. Джей Селл Биол. 2000; 151:117–130. [Бесплатная статья PMC] [PubMed] [Google Scholar]
42. Meng R, Pei Z, Zhang A, Zhou Y, Cai X, Chen B, Liu G, Mai W, Wei J, Dong Y. Активация AMPK усиливает активность PPAR-альфа для ингибирования сердечной гипертрофии через сигнальный путь ERK1/2 MAPK. . Арх Биохим Биофиз. 2011; 511:1–7. [PubMed] [Google Scholar]
43. Роуз Б.А., Force T, Wang Y. Митоген-активированная протеинкиназа, передающая сигналы в сердце: ангелы против демонов в душераздирающей сказке. Physiol Rev. 2010; 90: 1507–1546. [Бесплатная статья PMC] [PubMed] [Google Scholar]
44. Bogoyevitch MA, Sugden PH. Роль протеинкиназ в адаптационном росте сердца. Int J Biochem Cell Biol. 1996;28:1–12. [PubMed] [Google Scholar]
1996;28:1–12. [PubMed] [Google Scholar]
45. Kyriakis JM, Avruch J. Пути передачи сигнала митоген-активируемой протеинкиназы млекопитающих, активируемые стрессом и воспалением. Physiol Rev. 2001; 81: 807–869. [PubMed] [Google Scholar]
46. Zhang S, Weinheimer C, Courtois M, Kovacs A, Zhang CE, Cheng AM, Wang Y, Muslin AJ. Роль сигнального пути MAPK Grb2-p38 в сердечной гипертрофии и фиброзе. Джей Клин Инвест. 2003; 111: 833–841. [Бесплатная статья PMC] [PubMed] [Google Scholar]
47. Нисида К., Ямагути О., Хиротани С., Хикосо С., Хигучи Ю., Ватанабэ Т., Такеда Т., Осука С., Морита Т., Кондох Г., Уно Ю., Кашивасэ К., Таниике М., Накаи А., Мацумура Ю., Миядзаки J, Sudo T, Hongo K, Kusakari Y, Kurihara S, Chien KR, Takeda J, Hori M, Otsu K. Митоген-активируемая протеинкиназа p38alpha играет решающую роль в выживании кардиомиоцитов, но не в гипертрофическом росте сердца в ответ на перегрузку давлением . Мол Селл Биол. 2004; 24:10611–10620. [Бесплатная статья PMC] [PubMed] [Google Scholar]
48. Хилфикер-Кляйнер Д., Камински К., Подевски Э., Бонда Т., Шефер А., Слива К., Форстер О., Квинт А., Ландмессер У., Доэррис С., Лухтефельд М., Поли В., Шнайдер М.Д., Баллиганд Дж.Л., Дежарден Ф. , Ansari A, Struman I, Nguyen NQ, Zschemisch NH, Klein G, Heusch G, Schulz R, Hilfiker A, Drexler H. Катепсин D-расщепленная форма пролактина 16 кДа опосредует послеродовую кардиомиопатию. Клетка. 2007; 128: 589–600. [PubMed] [Google Scholar]
Хилфикер-Кляйнер Д., Камински К., Подевски Э., Бонда Т., Шефер А., Слива К., Форстер О., Квинт А., Ландмессер У., Доэррис С., Лухтефельд М., Поли В., Шнайдер М.Д., Баллиганд Дж.Л., Дежарден Ф. , Ansari A, Struman I, Nguyen NQ, Zschemisch NH, Klein G, Heusch G, Schulz R, Hilfiker A, Drexler H. Катепсин D-расщепленная форма пролактина 16 кДа опосредует послеродовую кардиомиопатию. Клетка. 2007; 128: 589–600. [PubMed] [Google Scholar]
49. Курди М., Буз Г.В. JAK redux: второй взгляд на регуляцию и роль JAK в сердце. Am J Physiol Heart Circ Physiol. 2009 г.;297:h2545–h2556. [Бесплатная статья PMC] [PubMed] [Google Scholar]
50. Kunisada K, Negoro S, Tone E, Funamoto M, Osugi T, Yamada S, Okabe M, Kishimoto T, Yamauchi-Takihara K. Преобразователь сигналов и активатор транскрипция 3 в сердце передает не только гипертрофический сигнал, но и защитный сигнал против доксорубицин-индуцированной кардиомиопатии. Proc Natl Acad Sci USA. 2000;97:315–319. [Бесплатная статья PMC] [PubMed] [Google Scholar]
51. Увы С., Бонавида Б. Ритуксимаб инактивирует преобразователь сигнала и активирует активность транскрипции 3 (STAT3) при B-неходжкинской лимфоме посредством ингибирования аутокринного интерлейкина 10/ паракринной петли и приводит к подавлению Bcl-2 и сенсибилизации к цитотоксическим препаратам. Рак рез. 2001;61:5137–5144. [PubMed] [Академия Google]
Увы С., Бонавида Б. Ритуксимаб инактивирует преобразователь сигнала и активирует активность транскрипции 3 (STAT3) при B-неходжкинской лимфоме посредством ингибирования аутокринного интерлейкина 10/ паракринной петли и приводит к подавлению Bcl-2 и сенсибилизации к цитотоксическим препаратам. Рак рез. 2001;61:5137–5144. [PubMed] [Академия Google]
52. Alas S, Bonavida B. Ингибирование конститутивной активности STAT3 повышает чувствительность резистентной неходжкинской лимфомы и множественной миеломы к апоптозу, опосредованному химиотерапевтическими препаратами. Клин Рак Рез. 2003; 9: 316–326. [PubMed] [Google Scholar]
53. Катлетт-Фальконе Р., Ландовски Т.Х., Оширо М.М., Терксон Дж., Левицки А., Савино Р., Чилиберто Г., Москински Л., Фернандес-Луна Дж.Л., Нуньес Г., Далтон В.С., Джоув Р. Конститутивная активация передачи сигналов Stat3 придает устойчивость к апоптозу в клетках миеломы U266 человека. Иммунитет. 1999;10:105–115. [PubMed] [Google Scholar]
54. Хилфикер-Кляйнер Д. , Хилфикер А., Фукс М., Камински К., Шефер А., Шиффер Б., Хиллмер А., Шмидль А., Дин З., Подевски Э., Подевски Э., Поли В., Шнайдер MD, Schulz R, Park JK, Wollert KC, Drexler H. Преобразователь сигнала и активатор транскрипции 3 необходимы для роста капилляров миокарда, контроля отложения интерстициального матрикса и защиты сердца от ишемического повреждения. Цирк рез. 2004; 95: 187–195. [PubMed] [Google Scholar]
, Хилфикер А., Фукс М., Камински К., Шефер А., Шиффер Б., Хиллмер А., Шмидль А., Дин З., Подевски Э., Подевски Э., Поли В., Шнайдер MD, Schulz R, Park JK, Wollert KC, Drexler H. Преобразователь сигнала и активатор транскрипции 3 необходимы для роста капилляров миокарда, контроля отложения интерстициального матрикса и защиты сердца от ишемического повреждения. Цирк рез. 2004; 95: 187–195. [PubMed] [Google Scholar]
55. Кодама Х., Фукуда К., Пан Дж., Макино С., Сано М., Такахаши Т., Хори С., Огава С. Двухфазная активация пути JAK/STAT ангиотензином II в кардиомиоцитах крыс. Цирк рез. 1998;82:244–250. [PubMed] [Google Scholar]
56. Джейкоби Дж. Дж., Калиновский А., Лю М. Г., Чжан С. С., Гао К., Чай Г. X., Цзи Л., Ивамото И., Ли Э., Шнайдер М., Рассел К. С., Фу XY. Ограниченный кардиомиоцитами нокаут STAT3 приводит к более высокой чувствительности к воспалению, сердечному фиброзу и сердечной недостаточности с пожилым возрастом. Proc Natl Acad Sci USA. 2003; 100:12929–12934. [Бесплатная статья PMC] [PubMed] [Google Scholar]
57. Molkentin JD, Lu JR, Antos CL, Markham B, Richardson J, Robbins J, Grant SR, Olson EN. Зависимый от кальциневрина путь транскрипции сердечной гипертрофии. Клетка. 1998;93:215–228. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Molkentin JD, Lu JR, Antos CL, Markham B, Richardson J, Robbins J, Grant SR, Olson EN. Зависимый от кальциневрина путь транскрипции сердечной гипертрофии. Клетка. 1998;93:215–228. [Бесплатная статья PMC] [PubMed] [Google Scholar]
58. Молкентин Д.Д. Кальциневрин и не только: сердечная гипертрофическая сигнализация. Цирк рез. 2000; 87: 731–738. [PubMed] [Google Scholar]
59. Sussman MA, Lim HW, Gude N, Taigen T, Olson EN, Robbins J, Colbert MC, Gualberto A, Wieczorek DF, Molkentin JD. Предотвращение сердечной гипертрофии у мышей путем ингибирования кальциневрина. Наука. 1998; 281:1690–1693. [PubMed] [Google Scholar]
60. Wilkins BJ, De Windt LJ, Bueno OF, Braz JC, Glascock BJ, Kimball TF, Molkentin JD. Направленное разрушение NFATc3, но не NFATc4, выявляет внутренний дефект опосредованного кальциневрином кардиального гипертрофического роста. Мол Селл Биол. 2002; 22:7603–7613. [Бесплатная статья PMC] [PubMed] [Google Scholar]
61. Фишер Т.А., Людвиг С., Флори Э. , Гамбарян С., Сингх К., Финн П., Пфеффер М.А., Келли Р.А., Пфеффер Дж.М. Активация кардиальных c-Jun NH(2)-терминальных киназ и p38-митоген-активируемых протеинкиназ при резких изменениях гемодинамической нагрузки. Гипертония. 2001; 37: 1222–1228. [PubMed] [Google Scholar]
, Гамбарян С., Сингх К., Финн П., Пфеффер М.А., Келли Р.А., Пфеффер Дж.М. Активация кардиальных c-Jun NH(2)-терминальных киназ и p38-митоген-активируемых протеинкиназ при резких изменениях гемодинамической нагрузки. Гипертония. 2001; 37: 1222–1228. [PubMed] [Google Scholar]
62. Sopontammarak S, Aliharoob A, Ocampo C, Arcilla RA, Gupta MP, Gupta M. Митогенактивируемые протеинкиназы (p38 и c-Jun Nh3-концевая киназа) по-разному регулируются во время сердечного объема и гипертрофия перегрузки давлением. Клеточная биохимия Биофиз. 2005;43:61–76. [PubMed] [Академия Google]
63. Ван И, Су Б, Сах В.П., Браун Дж.Х., Хан Дж., Чиен К.Р. Гипертрофия сердца, вызванная митоген-активируемой протеинкиназой 7, специфическим активатором c-Jun Nh3-терминальной киназы в клетках желудочковой мышцы. Дж. Биол. Хим. 1998; 273:5423–5426. [PubMed] [Google Scholar]
64. Петрич Б.Г., Ван Ю. Активируемые стрессом MAP-киназы при ремоделировании сердца и сердечной недостаточности; новые идеи из трансгенных исследований. Тенденции Cardiovasc Med. 2004; 14:50–55. [PubMed] [Google Scholar]
Тенденции Cardiovasc Med. 2004; 14:50–55. [PubMed] [Google Scholar]
65. Петрич Б.Г., Ляо П., Ван Ю. Использование трансгенного подхода с переключением генов для анализа различных ролей киназ MAP при сердечной недостаточности. Cold Spring Harb Symp Quant Biol. 2002;67:429–437. [PubMed] [Google Scholar]
66. Bartel DP, Chen CZ. Микроменеджеры экспрессии генов: потенциально широко распространенное влияние микроРНК многоклеточных животных. Нат Рев Жене. 2004; 5: 396–400. [PubMed] [Google Scholar]
67. Бартел Д.П. МикроРНК: распознавание мишеней и регуляторные функции. Клетка. 2009; 136: 215–233. [Бесплатная статья PMC] [PubMed] [Google Scholar]
68. Амброс В. Иерархия регуляторных генов контролирует переход от личинки к взрослой особи у C. elegans. Клетка. 1989;57:49–57. [PubMed] [Google Scholar]
69. Lee RC, Feinbaum RL, Ambros V. Гетерохронный ген lin-4 C. elegans кодирует малые РНК с антисмысловой комплементарностью lin-14. Клетка. 1993; 75: 843–854. [PubMed] [Google Scholar]
[PubMed] [Google Scholar]
70. Olsen PH, Ambros V. Регуляторная РНК lin-4 контролирует время развития Caenor-habditis elegans, блокируя синтез белка LIN-14 после инициации трансляции. Дев биол. 1999; 216: 671–680. [PubMed] [Google Scholar]
71. Reinhart BJ, Slack FJ, Basson M, Pasquinelli AE, Bettinger JC, Rougvie AE, Horvitz HR, Ruvkun G. РНК let-7 из 21 нуклеотида регулирует сроки развития у Caenorhabditis elegans. Природа. 2000;403:901–906. [PubMed] [Google Scholar]
72. Xu P, Vernooy SY, Guo M, Hay BA. МикроРНК Mir-14 дрозофилы подавляет гибель клеток и необходима для нормального метаболизма жиров. Карр Биол. 2003; 13: 790–795. [PubMed] [Google Scholar]
73. Hatfield SD, Shcherbata HR, Fischer KA, Nakahara K, Carthew RW, Ruohola-Baker H. Деление стволовых клеток регулируется путем микроРНК. Природа. 2005; 435:974–978. [PubMed] [Google Scholar]
74. Нгуен Х.Т., Фраш М. МикроРНК в дифференцировке мышц: уроки дрозофилы и не только. Curr Opin Genet Dev. 2006; 16: 533–539.. [PubMed] [Google Scholar]
2006; 16: 533–539.. [PubMed] [Google Scholar]
75. Lynn FC. Метарегуляция: регуляция микроРНК метаболизма глюкозы и липидов. Тенденции Эндокринол Метаб. 2009; 20: 452–459. [PubMed] [Google Scholar]
76. Magill ST, Cambronne XA, Luikart BW, Lioy DT, Leighton BH, Westbrook GL, Mandel G, Goodman RH. микроРНК-132 регулирует рост дендритов и разветвление новорождённых нейронов во взрослом гиппокампе. Proc Natl Acad Sci USA. 2010;107:20382–20387. [Бесплатная статья PMC] [PubMed] [Google Scholar]
77. Каллис Т.Е., Пандья К., Сеок Х.И., Тан Р.Х., Тацугучи М., Хуан З.П., Чен Дж.Ф., Дэн З., Ганн Б., Шумате Дж., Уиллис М.С., Зельцман Ч., Ван Д.З. МикроРНК-208a является регулятором сердечной гипертрофии и проводимости у мышей. Джей Клин Инвест. 2009; 119: 2772–2786. [Бесплатная статья PMC] [PubMed] [Google Scholar]
78. van RE, Sutherland LB, Liu N, Williams AH, McAnally J, Gerard RD, Richardson JA, Olson EN. Сигнатурный паттерн чувствительных к стрессу микроРНК, который может вызывать сердечную гипертрофию и сердечную недостаточность. Proc Natl Acad Sci USA. 2006; 103:18255–18260. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Proc Natl Acad Sci USA. 2006; 103:18255–18260. [Бесплатная статья PMC] [PubMed] [Google Scholar]
79. Манн Д.Л., Бристоу М.Р. Механизмы и модели сердечной недостаточности: биомеханическая модель и не только. Тираж. 2005; 111: 2837–2849. [PubMed] [Google Scholar]
80. Sayed D, Hong C, Chen IY, Lypowy J, Abdellatif M. МикроРНК играют важную роль в развитии сердечной гипертрофии. Цирк рез. 2007; 100:416–424. [PubMed] [Google Scholar]
81. Care A, Catalucci D, Felicetti F, Bonci D, Addario A, Gallo P, Bang ML, Segnalini P, Gu Y, Dalton ND, Elia L, Latronico MV, Hoydal M, Autore C, Russo MA, Dorn GW, Ellingsen O, Ruiz-Lozano P, Peterson KL, Croce CM, Peschle C, Condorelli G. МикроРНК-133 контролирует гипертрофию сердца. Нат Мед. 2007; 13: 613–618. [PubMed] [Академия Google]
82. Ван Р.Э., Сазерленд Л.Б., Ци Х., Ричардсон Дж.А., Хилл Дж., Олсон Э.Н. Контроль стресс-зависимого сердечного роста и экспрессии генов с помощью микроРНК. Наука. 2007; 316: 575–579. [PubMed] [Google Scholar]
83. Ниси Х., Оно К., Хориэ Т., Нагао К., Киношита М., Кувабара Й., Ватанабэ С., Такая Т., Тамаки Й., Таканабе-Мори Р., Вада Х., Хасегава К., Иванага Y, Kawamura T, Kita T, Kimura T. МикроРНК-27a регулирует экспрессию гена тяжелой цепи бета-сердечного миозина путем нацеливания на рецептор гормона щитовидной железы бета1 в желудочковых миоцитах новорожденных крыс. Мол Селл Биол. 2011; 31: 744–755. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Ниси Х., Оно К., Хориэ Т., Нагао К., Киношита М., Кувабара Й., Ватанабэ С., Такая Т., Тамаки Й., Таканабе-Мори Р., Вада Х., Хасегава К., Иванага Y, Kawamura T, Kita T, Kimura T. МикроРНК-27a регулирует экспрессию гена тяжелой цепи бета-сердечного миозина путем нацеливания на рецептор гормона щитовидной железы бета1 в желудочковых миоцитах новорожденных крыс. Мол Селл Биол. 2011; 31: 744–755. [Бесплатная статья PMC] [PubMed] [Google Scholar]
84. Soci UP, Fernandes T, Hashimoto NY, Mota GF, Amadeu MA, Rosa KT, Irigoyen MC, Phillips MI, Oliveira EM. МикроРНК 29 участвуют в улучшении растяжимости желудочков, чему способствуют аэробные упражнения у крыс. Физиол Геномика. 2011;43:665–673. [Бесплатная статья PMC] [PubMed] [Google Scholar]
85. Lin RC, Weeks KL, Gao XM, Williams RB, Bernardo BC, Kiriazis H, Matthews VB, Woodcock EA, Bouwman RD, Mollica JP, Speirs HJ, Dawes IW, Daly RJ, Shioi T, Izumo S, Febbraio MA, Du XJ, McMullen JR. PI3K (p110 альфа) защищает от сердечной недостаточности, вызванной инфарктом миокарда: идентификация миРНК и мРНК, регулируемых PI3K. Артериосклеры Тромб Васк Биол. 2010;30:724–732. [PubMed] [Академия Google]
Артериосклеры Тромб Васк Биол. 2010;30:724–732. [PubMed] [Академия Google]
86. Предмор Дж.М., Ван П., Дэвис Ф., Бартолоне С., Вестфолл М.В., Дайк Д.Б., Пагани Ф., Пауэлл С.Р., Дэй С.М. Дисфункция протеасом убиквитина при гипертрофических и дилатационных кардиомиопатиях человека. Тираж. 2010; 121:997–1004. [Бесплатная статья PMC] [PubMed] [Google Scholar]
87. Glickman MH, Ciechanover A. Убиквитинпротеасомный протеолитический путь: разрушение ради строительства. Physiol Rev. 2002; 82: 373–428. [PubMed] [Google Scholar]
88. Glickman MH, Raveh D. Пластичность протеасом. ФЭБС лат. 2005;579: 3214–3223. [PubMed] [Google Scholar]
89. Хохштрассер М. Убиквитин-зависимая деградация белков. Анну Рев Жене. 1996; 30: 405–439. [PubMed] [Google Scholar]
90. Депре С., Ван К., Ян Л., Хедхли Н., Питер П., Чен Л., Хонг С., Хиттингер Л., Галех Б., Садошима Дж., Ватнер Д.Е., Ватнер С.Ф., Мадура К. Активация сердечной протеасомы во время перегрузки давлением способствует гипертрофии желудочков. Тираж. 2006; 114:1821–1828. [PubMed] [Google Scholar]
Тираж. 2006; 114:1821–1828. [PubMed] [Google Scholar]
91. Hedhli N, Lizano P, Hong C, Fritzky LF, Dhar SK, Liu H, Tian Y, Gao S, Madura K, Vatner SF, Depre C. Ингибирование протеасом снижает ремоделирование сердца после начало перегрузки по давлению. Am J Physiol Heart Circ Physiol. 2008;295:h2385–h2393. [Бесплатная статья PMC] [PubMed] [Google Scholar]
92. Цукамото О., Минамино Т., Окада К., Синтани Ю., Такашима С., Като Х., Ляо Ю., Окадзаки Х., Асаи М., Хирата А., Фудзита М., Асано Y, Yamazaki S, Asanuma H, Hori M, Kitakaze M. Депрессия активности протеасом во время прогрессирования сердечной дисфункции в перегруженном давлением сердце мышей. Biochem Biophys Res Commun. 2006; 340:1125–1133. [PubMed] [Google Scholar]
93. Drews O, Tsukamoto O, Liem D, Streicher J, Wang Y, Ping P. Дифференциальная регуляция функции протеасом при гипертрофии сердца, вызванной изопротеренолом. Цирк рез. 2010;107:1094–1101. [Бесплатная статья PMC] [PubMed] [Google Scholar]
94. Otsuka K, Terasaki F, Shimomura H, Tsukada B, Horii T, Isomura T, Suma H, Shibayama Y, Kitaura Y. Улучшенная экспрессия убиквитин-протеасомы системы в миокарде пациентов с дилатационной кардиомиопатией, направленных на левожелудочковую пластику: иммуногистохимическое исследование со специальной ссылкой на окислительный стресс. Сердечные сосуды. 2010;25:474–484. [PubMed] [Google Scholar]
Otsuka K, Terasaki F, Shimomura H, Tsukada B, Horii T, Isomura T, Suma H, Shibayama Y, Kitaura Y. Улучшенная экспрессия убиквитин-протеасомы системы в миокарде пациентов с дилатационной кардиомиопатией, направленных на левожелудочковую пластику: иммуногистохимическое исследование со специальной ссылкой на окислительный стресс. Сердечные сосуды. 2010;25:474–484. [PubMed] [Google Scholar]
95. Кааб С., Барт А.С., Марджери Д., Дугас М., Гебауэр М., Цверманн Л., Мерк С., Пфойфер А., Штайнмейер К., Блейх М., Кройцер Э., Стейнбек Г., Набауэр М. Глобальная экспрессия генов в человеческом миокарде-олигонуклеотидном микрочипе, анализ регионального разнообразия и регуляции транскрипции при сердечной недостаточности. J Mol Med (Берл) 2004; 82: 308–316. [PubMed] [Академия Google]
96. Zolk O, Schenke C, Sarikas A. Убиквитин-протеасомная система: фокус на сердце. Кардиовасц Рез. 2006; 70: 410–421. [PubMed] [Google Scholar]
97. Гарднер Дж. Д., Брауэр Г. Л., Яники Дж. С. Гендерные различия в ремоделировании сердца вследствие хронической перегрузки объемом. Ошибка карты J. 2002; 8: 101–107. [PubMed] [Google Scholar]
Ошибка карты J. 2002; 8: 101–107. [PubMed] [Google Scholar]
98. Брауэр Г.Л., Гарднер Д.Д., Яники Д.С. Гендерно-опосредованная защита сердца от неблагоприятного ремоделирования желудочков устраняется овариэктомией. Мол Селл Биохим. 2003;251:89–95. [PubMed] [Google Scholar]
99. Гарднер Дж.Д., Брауэр Г.Л., Волошенюк Т.Г., Яницкий Дж.С. Кардиопротекция у самок крыс, подвергшихся хронической объемной перегрузке: синергетическое взаимодействие эстрогенов и фитоэстрогенов. Am J Physiol Heart Circ Physiol. 2008;294:h298–h304. [PubMed] [Google Scholar]
100. Гарднер Дж. Д., Мюррей Д. Б., Волошенюк Т. Г., Брауэр Г. Л., Брэдли Дж. М., Яники Дж. С. Эстроген ослабляет вызванное хронической объемной перегрузкой структурное и функциональное ремоделирование сердца самцов крыс. Am J Physiol Heart Circ Physiol. 2010;298:h597–H504. [Бесплатная статья PMC] [PubMed] [Google Scholar]
101. Педрам А., Разанди М., Эйткенхед М., Левин Э.Р. Эстроген ингибирует гипертрофию кардиомиоцитов in vitro. Антагонизм гипертрофии, связанной с кальциневрином, посредством индукции MCIP1. Дж. Биол. Хим. 2005; 280:26339–26348. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Антагонизм гипертрофии, связанной с кальциневрином, посредством индукции MCIP1. Дж. Биол. Хим. 2005; 280:26339–26348. [Бесплатная статья PMC] [PubMed] [Google Scholar]
102. Babiker FA, De Windt LJ, van EM, Thijssen V, Bronsaer RJ, Grohe C, van BM, Doevendans PA. 17бета-эстрадиол противодействует гипертрофии кардиомиоцитов за счет аутокринной/паракринной стимуляции рецептора гуанилатциклазы А-циклического гуанозинмонофосфатзависимого пути протеинкиназы. Тираж. 2004;109: 269–276. [PubMed] [Google Scholar]
103. Педрам А., Разанди М., О’Махони Ф., Любан Д., Левин Э.Р. Рецептор эстрогена-бета предотвращает сердечный фиброз. Мол Эндокринол. 2010;24:2152–2165. [бесплатная статья PMC] [PubMed] [Google Scholar]
104. Волошенюк Т.Г., Гарднер Ю.Д. Эстроген улучшает баланс ТИМП-ММП и распределение коллагена в перегруженных объемом сердцах женщин после овариэктомии. Am J Physiol Regul Integr Comp Physiol. 2010;299:R683–R693. [PubMed] [Google Scholar]
105. Бамманн Б. Л., Кулам С.Б., Цзян Н.С. Общий и свободный тестостерон при беременности. Am J Obstet Gynecol. 1980;137:293–298. [PubMed] [Google Scholar]
Л., Кулам С.Б., Цзян Н.С. Общий и свободный тестостерон при беременности. Am J Obstet Gynecol. 1980;137:293–298. [PubMed] [Google Scholar]
106. Harrison RF, Mansfield MD. Андрогены материнской плазмы на ранних сроках беременности. Br J Obstet Gynaecol. 1980; 87: 695–704. [PubMed] [Google Scholar]
107. Cavasin MA, Sankey SS, Yu AL, Menon S, Yang XP. Эстроген и тестостерон оказывают противоположное влияние на хроническое ремоделирование и функцию сердца у мышей с инфарктом миокарда. Am J Physiol Heart Circ Physiol. 2003; 284:h2560–h2569. [PubMed] [Google Scholar]
108. Frantz S, Hu K, Widder J, Weckler B, Scheuermann H, Bauersachs J, Ertl G, Callies F, Allolio B. Пагубное влияние тестостерона на ремоделирование постинфарктного миокарда у женщин крысы. J Physiol Pharmacol. 2007; 58: 717–727. [PubMed] [Академия Google]
109. Cunningham FG GNLKGLHJWK. Уильямс Акушерство. 21-е издание. Нью-Йорк, штат Нью-Йорк: McGraw-Hill; 2001. стр. 567–618. [Google Scholar]
110. Уокер Дж.Дж. Преэклампсия. Ланцет. 2000;356:1260–1265. [PubMed] [Google Scholar]
Уокер Дж.Дж. Преэклампсия. Ланцет. 2000;356:1260–1265. [PubMed] [Google Scholar]
111. Сибай Б.М., Юэлл М., Левин Р.Дж., Клебанофф М.А., Эстерлиц Дж., Каталано П.М., Гольденберг Р.Л., Джоффе Г. Факторы риска, связанные с преэклампсией у здоровых нерожавших женщин. Исследовательская группа «Кальций для профилактики преэклампсии» (CPEP). Am J Obstet Gynecol. 1997;177:1003–1010. [PubMed] [Google Scholar]
112. Фуруя М., Исида Дж., Аоки И., Фукамидзу А. Патофизиология аномалий плацентации при гипертензии, вызванной беременностью. Управление рисками для здоровья Vasc. 2008;4:1301–1313. [Бесплатная статья PMC] [PubMed] [Google Scholar]
113. Паттен И.С., Рана С., Шахул С., Роу Г.К., Ян С., Лю Л., Хакер М.Р., Ри Дж.С., Митчелл Дж., Махмуд Ф., Хесс П., Фаррелл C, Koulisis N, Khankin EV, Burke SD, Tudorache I, Bauersachs J, del MF, Hilfiker-Kleiner D, Karumanchi SA, Arany Z. Сердечный ангиогенный дисбаланс приводит к перипартальной кардиомиопатии. Природа. 2012; 485:333–338. [Бесплатная статья PMC] [PubMed] [Google Scholar]
[Бесплатная статья PMC] [PubMed] [Google Scholar]
114. Ханссенс М., Кейрс М.Дж., Шпиц Б., Ван Аш Ф.А. Измерение индивидуальных ангиотензинов плазмы при нормальной беременности и артериальной гипертензии, вызванной беременностью. J Clin Endocrinol Metab. 1991; 73: 489–494. [PubMed] [Google Scholar]
115. Takimoto E, Ishida J, Sugiyama F, Horiguchi H, Murakami K, Fukamizu A. Гипертензия, вызванная у беременных мышей плацентарным ренином и материнским ангиотензиногеном. Наука. 1996; 274: 995–998. [PubMed] [Google Scholar]
116. Zhou CC, Irani RA, Dai Y, Blackwell SC, Hicks MJ, Ramin SM, Kellems RE, Xia Y. Опосредованное аутоантителами повышение уровня IL-6-зависимого эндотелина-1 лежит в основе патогенеза мышиная модель преэклампсии. Дж Иммунол. 2011; 186:6024–6034. [Бесплатная статья PMC] [PubMed] [Google Scholar]
117. Рамарадж Р., Соррелл В.Л. Перипартальная кардиомиопатия: причины, диагностика и лечение. Клив Клин J Med. 2009; 76: 289–296. [PubMed] [Google Scholar]
118. Bultmann BD, Klingel K, Nabauer M, Wallwiener D, Kandolf R. Высокая распространенность вирусных геномов и воспаление при перипартальной кардиомиопатии. Am J Obstet Gynecol. 2005; 193:363–365. [PubMed] [Google Scholar]
Bultmann BD, Klingel K, Nabauer M, Wallwiener D, Kandolf R. Высокая распространенность вирусных геномов и воспаление при перипартальной кардиомиопатии. Am J Obstet Gynecol. 2005; 193:363–365. [PubMed] [Google Scholar]
119. Yamac H, Bultmann I, Sliwa K, Hilfiker-Kleiner D. Пролактин: новая терапевтическая цель при перипартальной кардиомиопатии. Сердце. 2010;96: 1352–1357. [PubMed] [Google Scholar]
120. Sliwa K, Forster O, Libhaber E, Fett JD, Sundstrom JB, Hilfiker-Kleiner D, Ansari AA. Перипартальная кардиомиопатия: воспалительные маркеры как предикторы исхода у 100 проспективно изученных пациентов. Европейское сердце Дж. 2006; 27: 441–446. [PubMed] [Google Scholar]
121. Хаякава Ю., Чандра М., Мяо В., Ширани Дж., Браун Дж.Х., Дорн Г.В., Армстронг Р.К., Китсис Р.Н. Ингибирование апоптоза сердечных миоцитов улучшает сердечную функцию и устраняет смертность при перинатальной кардиомиопатии трансгенных мышей G-альфа(q). Тираж. 2003; 108:3036–3041. [PubMed] [Академия Google]
122. Регитц-Загросек В., Бломстром Л.С., Борги С., Цифкова Р., Феррейра Р., Фойдарт Дж.М., Гиббс Дж.С., Гольке-Бэрвольф С., Горенек Б., Юнг Б., Кирби М., Маас А.Х., Мораис Дж., Нихояннопулос П., Пипер П.Г., Пресбитеро П., Роос-Хесселинк Дж.В., Шауфельбергер М., Силенд Ю., Торракка Л., Бакс Дж., Ауриккио А., Баумгартнер Х., Чекони С., Дин В., Дитон С., Фагард Р., Фанк-Брентано С., Хасдай Д., Хоэс А., Кнуути Дж., Колх П., МакДонах Т., Мулен С., Полдерманс Д., Попеску Б.А., Райнер З., Сехтем У., Сирнес П.А., Торбицки А., Ваханян А., Виндекер С., Баумгартнер Х., Дитон С., Агуяр С., Аль-Аттар Н., Гарсия А.А., Антониу А., Коман И., Элькаям У., Гомес-Санчес М.А., Готчева Н., Хилфикер-Кляйнер Д., Кисс Р.Г., Китсиу А., Конингс К.Т., Лип Г.Ю., Манолис А., Мебааза А., Минтале И., Морис М.С. , Mulder BJ, Pasquet A, Price S, Priori SG, Salvador MJ, Shotan A, Silversides CK, Skouby SO, Stein JI, Tornos P, Vejlstrup N, Walker F, Warnes C. Рекомендации ESC по лечению сердечно-сосудистых заболеваний во время беременности : Целевая группа по управлению o f Сердечно-сосудистые заболевания во время беременности Европейского общества кардиологов (ESC) Eur Heart J.
Регитц-Загросек В., Бломстром Л.С., Борги С., Цифкова Р., Феррейра Р., Фойдарт Дж.М., Гиббс Дж.С., Гольке-Бэрвольф С., Горенек Б., Юнг Б., Кирби М., Маас А.Х., Мораис Дж., Нихояннопулос П., Пипер П.Г., Пресбитеро П., Роос-Хесселинк Дж.В., Шауфельбергер М., Силенд Ю., Торракка Л., Бакс Дж., Ауриккио А., Баумгартнер Х., Чекони С., Дин В., Дитон С., Фагард Р., Фанк-Брентано С., Хасдай Д., Хоэс А., Кнуути Дж., Колх П., МакДонах Т., Мулен С., Полдерманс Д., Попеску Б.А., Райнер З., Сехтем У., Сирнес П.А., Торбицки А., Ваханян А., Виндекер С., Баумгартнер Х., Дитон С., Агуяр С., Аль-Аттар Н., Гарсия А.А., Антониу А., Коман И., Элькаям У., Гомес-Санчес М.А., Готчева Н., Хилфикер-Кляйнер Д., Кисс Р.Г., Китсиу А., Конингс К.Т., Лип Г.Ю., Манолис А., Мебааза А., Минтале И., Морис М.С. , Mulder BJ, Pasquet A, Price S, Priori SG, Salvador MJ, Shotan A, Silversides CK, Skouby SO, Stein JI, Tornos P, Vejlstrup N, Walker F, Warnes C. Рекомендации ESC по лечению сердечно-сосудистых заболеваний во время беременности : Целевая группа по управлению o f Сердечно-сосудистые заболевания во время беременности Европейского общества кардиологов (ESC) Eur Heart J. 2011;32:3147–3197. [PubMed] [Google Scholar]
2011;32:3147–3197. [PubMed] [Google Scholar]
123. Кэндис К., Silversides JMC. Болезни сердца при беременности, глава 2. второе издание, 2007 г. [Google Scholar]
124. Martin VT, Behbehani M. Гормоны яичников и головная боль при мигрени: понимание механизмов и патогенеза — часть 2. Головная боль. 2006; 46: 365–386. [PubMed] [Google Scholar]
125. Lapolt PS, Matt DW, Judd HL, Lu JK. Связь уровней стероидов в яичниках у молодых самок крыс с последующей эстральной цикличностью и репродуктивной функцией во время старения. Биол Репрод. 1986;35:1131–1139. [PubMed] [Google Scholar]
126. Altmann J, Lynch JW, Nguyen N, Alberts SC, Gesquiere LR. История жизни коррелирует с концентрацией стероидов у диких околородовых павианов. Am J Приматол. 2004; 64: 95–106. [PubMed] [Google Scholar]
127. Klinga K, Bek E, Runnebaum B. Уровни периферического тестостерона у матери в первой половине беременности. Am J Obstet Gynecol. 1978; 131: 60–62. [PubMed] [Google Scholar]
128. Бамманн Б.Л., Кулам С.Б., Цзян Н.С. Общий и свободный тестостерон при беременности. Am J Obstet Gynecol. 1980;137:293–298. [PubMed] [Google Scholar]
Бамманн Б.Л., Кулам С.Б., Цзян Н.С. Общий и свободный тестостерон при беременности. Am J Obstet Gynecol. 1980;137:293–298. [PubMed] [Google Scholar]
129. Бриджес Р.С., Тодд Р.Б., Лог С.М. Концентрация тестостерона в сыворотке на протяжении всей беременности у крыс. J Эндокринол. 1982; 94: 21–27. [PubMed] [Google Scholar]
130. Biswas S, Rodeck CH. Уровень пролактина в плазме при беременности. Br J Obstet Gynaecol. 1976; 83: 683–687. [PubMed] [Google Scholar]
131. Риордан Дж. Грудное вскармливание и лактация человека. 3-е изд. Гостон и Лондон: Джонс и Бартлетт; 2005. С. 75–77. [Академия Google]
132. Уокер М. Ведение грудного вскармливания для клинициста: Использование доказательств. Бостон: Джонс и Бартлетт; 2006. С. 63–66. [Google Scholar]
133. Hanssens M, Keirse MJ, Spitz B, Van Assche FA. Уровни ангиотензина II при гипертонической и нормотензивной беременности. Br J Obstet Gynaecol. 1991; 98: 155–161. [PubMed] [Google Scholar]
134. Magness RR, Cox K, Rosenfeld CR, Gant NF. Скорость метаболизма ангиотензина II и прессорные реакции у небеременных и беременных женщин. Am J Obstet Gynecol. 1994;171:668–679. [PubMed] [Google Scholar]
Magness RR, Cox K, Rosenfeld CR, Gant NF. Скорость метаболизма ангиотензина II и прессорные реакции у небеременных и беременных женщин. Am J Obstet Gynecol. 1994;171:668–679. [PubMed] [Google Scholar]
135. Broughton PF, Oats JJ, Symonds EM. Последовательные изменения в ренин-ангиотензиновой системе человека после родов. Br J Obstet Gynaecol. 1978; 85: 821–827. [PubMed] [Google Scholar]
136. Lu H, Melendez GC, Levick SP, Janicki JS. Предотвращение неблагоприятного ремоделирования сердца до перегрузки объемом у самок крыс является результатом эстроген-измененного фенотипа тучных клеток. Am J Physiol Heart Circ Physiol. 2012;302:H811–H817. [Бесплатная статья PMC] [PubMed] [Google Scholar]
137. Брэдшоу А.Д., Байку С.Ф., Ренц Т.Дж., Ван Лаер А.О., Боггс Дж., Лейси Дж.М., Зиле М.Р. Вызванные перегрузкой давлением изменения содержания фибриллярного коллагена и диастолической функции миокарда: роль секретируемого белка, кислого и богатого цистеином (SPARC), в постсинтетическом процессинге проколлагена. Тираж. 2009; 119: 269–280. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Тираж. 2009; 119: 269–280. [Бесплатная статья PMC] [PubMed] [Google Scholar]
138. Weber KT, Janicki JS, Shroff SG, Pick R, Chen RM, Bashey RI. Коллагеновое ремоделирование перегруженного давлением, гипертрофированного миокарда нечеловекообразных приматов. Цирк рез. 1988;62:757–765. [PubMed] [Google Scholar]
139. Melendez GC, Li J, Law BA, Janicki JS, Supowit SC, Levick SP. Вещество P вызывает неблагоприятное ремоделирование миокарда посредством механизма, включающего тучные клетки сердца. Кардиовасц Рез. 2011;92:420–429. [Бесплатная статья PMC] [PubMed] [Google Scholar]
140. Гиввимани С., Кипшидзе Н., Тяги Н., Мишра П.К., Сен У., Тяги С.К. Синергизм между аритмией и гипергомоцистеинемией при структурных заболеваниях сердца. Int J Physiol Pathophysiol Pharmacol. 2011; 3:107–119. [Бесплатная статья PMC] [PubMed] [Google Scholar]
141. Уласова Э., Глэдден Дж. Д., Чен Ю., Чжэн Дж., Пэт Б., Брэдли В., Пауэлл П., Змиевски Дж. В., Зеликсон Б. Р., Баллинджер С. В., Рлей-Усмар В. , Дел’Италия ЖЖ. Потеря интерстициального коллагена вызывает структурные и функциональные изменения субсарколеммальных митохондрий кардиомиоцитов при острой перегрузке объемом. Дж Мол Селл Кардиол. 2011;50:147–156. [Бесплатная статья PMC] [PubMed] [Google Scholar]
В., Рлей-Усмар В. , Дел’Италия ЖЖ. Потеря интерстициального коллагена вызывает структурные и функциональные изменения субсарколеммальных митохондрий кардиомиоцитов при острой перегрузке объемом. Дж Мол Селл Кардиол. 2011;50:147–156. [Бесплатная статья PMC] [PubMed] [Google Scholar]
142. Nagatomo Y, Carabello BA, Coker ML, McDermott PJ, Nemoto S, Hamawaki M, Spinale FG. Дифференциальные эффекты перегрузки давлением или объемом на уровни ММП миокарда и ингибирующий контроль. Am J Physiol Heart Circ Physiol. 2000;278:h251–h261. [PubMed] [Академия Google]
143. Miyamoto T, Takeishi Y, Takahashi H, Shishido T, Arimoto T, Tomoike H, Kubota I. Активация различных путей передачи сигналов в гипертрофированных сердцах при перегрузке давлением и объемом. Базовый Рез Кардиол. 2004; 99: 328–337. [PubMed] [Google Scholar]
144. Iemitsu M, Maeda S, Jesmin S, Otsuki T, Kasuya Y, Miyauchi T. Схема активации передачи сигналов MAPK в сердцах тренированных и нетренированных крыс после одного приступа упражнений. J Appl Physiol. 2006; 101:151–163. [PubMed] [Академия Google]
J Appl Physiol. 2006; 101:151–163. [PubMed] [Академия Google]
145. Sopontammarak S, Aliharoob A, Ocampo C, Arcilla RA, Gupta MP, Gupta M. Митоген-активируемые протеинкиназы (p38 и c-Jun Nh3-концевая киназа) по-разному регулируются во время сердечного объема и гипертрофии перегрузки давлением. Клеточная биохимия Биофиз. 2005;43:61–76. [PubMed] [Google Scholar]
146. Эспозито Г., Прасад С.В., Рапаччуоло А., Мао Л., Кох В.Дж., Рокман Х.А. Сердечная сверхэкспрессия ингибитора G(q) блокирует индукцию киназы, регулируемой внеклеточным сигналом, и активность c-Jun NH(2)-концевой киназы при перегрузке давлением in vivo. Тираж. 2001; 103:1453–1458. [PubMed] [Академия Google]
147. Харрис И.С., Чжан С., Тресков И., Ковач А., Вайнхаймер С., Муслин А.Дж. Киназа Raf-1 необходима для гипертрофии сердца и выживания кардиомиоцитов в ответ на перегрузку давлением. Тираж. 2004; 110:718–723. [PubMed] [Google Scholar]
148. Takeishi Y, Huang Q, Abe J, Glassman M, Che W, Lee JD, Kawakatsu H, Lawrence EG, Hoit BD, Berk BC, Walsh RA. Активация Src и множественной MAP-киназы при сердечной гипертрофии и застойной сердечной недостаточности при хронической перегрузке давлением: сравнение с острым механическим растяжением. Дж Мол Селл Кардиол. 2001; 33: 1637–1648. [PubMed] [Академия Google]
Активация Src и множественной MAP-киназы при сердечной гипертрофии и застойной сердечной недостаточности при хронической перегрузке давлением: сравнение с острым механическим растяжением. Дж Мол Селл Кардиол. 2001; 33: 1637–1648. [PubMed] [Академия Google]
149. Элвин З.В., Лоуренс Г.Г., Коулман Б.Р., Чжао А., Хадж-Мусса М., Хаддад Г.Э. Регуляция калиевых каналов мгновенного внутреннего выпрямления и замедленного внешнего выпрямления каптоприлом и ангиотензином II через путь киназы фосфоинозитид-3 в гипертрофированных сердечных миоцитах, вызванных объемной перегрузкой. Медицинский научный монит. 2011;17:BR165–BR172. [Бесплатная статья PMC] [PubMed] [Google Scholar]
150. Wu CH, Liu JY, Wu JP, Hsieh YH, Liu CJ, Hwang JM, Lee SD, Chen LM, Chang MH, Kuo WW, Shyu JC, Tsai JH, Хуанг CY. 17β-Эстрадиол уменьшает гипертрофию сердца, опосредованную активацией PI3K/Akt и подавлением сигнальных путей кальциневрина/NF-AT3 у крыс. Науки о жизни. 2005; 78: 347–356. [PubMed] [Академия Google]
151. Eto Y, Yonekura K, Sonoda M, Arai N, Sata M, Sugiura S, Takenaka K, Gualberto A, Hixon ML, Wagner MW, Aoyagi T. Кальциневрин активируется в сердцах крыс с физиологической гипертрофией левого желудочка, вызванной добровольные занятия физическими упражнениями. Тираж. 2000;101:2134–2137. [PubMed] [Google Scholar]
Eto Y, Yonekura K, Sonoda M, Arai N, Sata M, Sugiura S, Takenaka K, Gualberto A, Hixon ML, Wagner MW, Aoyagi T. Кальциневрин активируется в сердцах крыс с физиологической гипертрофией левого желудочка, вызванной добровольные занятия физическими упражнениями. Тираж. 2000;101:2134–2137. [PubMed] [Google Scholar]
152. Бартелдс Б., Боргдорф М.А., Смит-ван О.А., Такенс Дж., Бурсма Б., Недерхофф М.Г., Эльзенга Н.Дж., ван Гилст В.Х., Де Виндт Л.Дж., Бергер Р.М. Дифференциальные реакции правого желудочка на аномальные условия нагрузки у мышей: давление в сравнении с объемной нагрузкой. Сердечная недостаточность Eur J. 2011;13:1275–1282. [PubMed] [Академия Google]
153. Bartelds B, Borgdorff MA, Smit-van OA, Takens J, Boersma B, Nederhoff MG, Elzenga NJ, van Gilst WH, De Windt LJ, Berger RM. Дифференциальные реакции правого желудочка на аномальные условия нагрузки у мышей: давление в сравнении с объемной нагрузкой. Сердечная недостаточность Eur J. 2011;13:1275–1282. [PubMed] [Google Scholar]
154. Уилкинс Б.Дж., Дай Ю.С., Буэно О.Ф., Парсонс С.А., Сюй Дж., Планк Д.М., Джонс Ф., Кимбалл Т.Р., Молкентин Д.Д. Связь кальцинейрин/NFAT участвует в патологической, но не физиологической гипертрофии сердца. Цирк рез. 2004;94:110–118. [PubMed] [Google Scholar]
Уилкинс Б.Дж., Дай Ю.С., Буэно О.Ф., Парсонс С.А., Сюй Дж., Планк Д.М., Джонс Ф., Кимбалл Т.Р., Молкентин Д.Д. Связь кальцинейрин/NFAT участвует в патологической, но не физиологической гипертрофии сердца. Цирк рез. 2004;94:110–118. [PubMed] [Google Scholar]
155. Lebeche D, Kaprielian R, del MF, Tomaselli G, Gwathmey JK, Schwartz A, Hajjar RJ. Перенос кардиального гена Kv4.3 in vivo устраняет гипертрофический ответ у крыс после аортального стеноза. Тираж. 2004; 110:3435–3443. [PubMed] [Google Scholar]
156. Бартелдс Б., Боргдорф М.А., Смит-ван О.А., Такенс Дж., Бурсма Б., Недерхофф М.Г., Эльзенга Н.Дж., ван Гилст В.Х., Де Виндт Л.Дж., Бергер Р.М. Дифференциальные реакции правого желудочка на аномальные условия нагрузки у мышей: давление в сравнении с объемной нагрузкой. Сердечная недостаточность Eur J. 2011;13:1275–1282. [PubMed] [Академия Google]
157. Лебече Д., Каприэлян Р., дель М.Ф., Томаселли Г., Гватмей Дж.К., Шварц А., Хаджар Р.Дж. Перенос кардиального гена Kv4. 3 in vivo устраняет гипертрофический ответ у крыс после аортального стеноза. Тираж. 2004; 110:3435–3443. [PubMed] [Google Scholar]
3 in vivo устраняет гипертрофический ответ у крыс после аортального стеноза. Тираж. 2004; 110:3435–3443. [PubMed] [Google Scholar]
158. Razeghi P, Baskin KK, Sharma S, Young ME, Stepkowski S, Essop MF, Taegtmeyer H. Атрофия, гипертрофия и гипоксемия индуцируют регуляторы транскрипции протеасомной системы убиквитина в сердце крысы. . Biochem Biophys Res Commun. 2006; 342: 361–364. [PubMed] [Академия Google]
159. Hedhli N, Lizano P, Hong C, Fritzky LF, Dhar SK, Liu H, Tian Y, Gao S, Madura K, Vatner SF, Depre C. Ингибирование протеасом снижает ремоделирование сердца после начала перегрузки давлением. Am J Physiol Heart Circ Physiol. 2008;295:h2385–h2393. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Диабет матери и сердце плода
1. Weber H S, Copel J A, Reece E A. et al Кардиальный рост плодов у матерей с диабетом при хорошем метаболическом контроле. J Педиатр 19
2. Ghandi J A, Zhang X Y, Maidman J E. Гипертрофия сердца плода и сердечная функция при диабетической беременности. Am J Obstetr Gynecol 19
Гипертрофия сердца плода и сердечная функция при диабетической беременности. Am J Obstetr Gynecol 19
1132–1136. [PubMed] [Google Scholar]
3. Breitweiser JA, Meyer RA, Sivakoff M. et al Гипертрофия сердечной перегородки у младенцев с гиперинсулинемией. Дж. Педиатр 1980
–539. [PubMed] [Google Scholar]
4. Бьюкенен Т.А., Китцмиллер Дж.Л. Метаболические взаимодействия диабета и беременности. Анну Рев Мед 19
45–260. [PubMed] [Google Scholar]
5. Greco P, Vimercati A, Scioscia M. et al Время ускорения роста у женщин с инсулинозависимым диабетом. Диагностика плода Ther 200318437–441. [PubMed] [Google Scholar]
6. Macklon N S, Hop WC, Wladimiroff J W. Сердечная функция плода и толщина перегородки при диабетической беременности: контролируемое наблюдательное исследование и исследование воспроизводимости. Br J Obstetr Gynaecol 1998105661–666. [PubMed] [Google Scholar]
7. Veille J C, Hanson R, Sivakoff M. et al Размер сердца плода при нормальной беременности, задержке внутриутробного развития и диабетической беременности. Ам Дж. Перинат 19
Ам Дж. Перинат 19
75–279. [PubMed] [Google Scholar]
8. Фонтес-Педра С. Р. Ф., Смоллхорн Дж., Райан Г. и др. Кардиомиопатии плода: этиология, гемодинамические данные и клинический исход. Тираж 2002106585–591. [PubMed] [Google Scholar]
9. Lisowski L A, Verheijen PM, De Smedt M M. et al Измененное кровообращение плода при диабетической беременности типа 1. УЗИ Акушер Гинекол 200322365–369. [PubMed] [Google Scholar]
10. Rizzo G, Arduini D, Capponi A. et al Сердечный и венозный кровоток у плодов матерей с инсулинозависимым диабетом: свидетельство аномальной гемодинамики на ранних сроках беременности. Am J Obstetr Gynecol 19
1175–1181. [PubMed] [Google Scholar]
11. Вонг С. Ф., Чан Ф. Ю., Чинкотта Р. Б. и др. . Сердечная функция плода при плохо контролируемой предгестационной диабетической беременности — экспериментальное исследование. Gynecol Obstet Invest 200356113–116. [PubMed] [Академия Google]
12. Rizzo G, Pietropolli A, Capponi A. и др. J Perinat Med 19
Rizzo G, Pietropolli A, Capponi A. и др. J Perinat Med 19
49–157. [PubMed] [Google Scholar]
13. Gardiner HM, Pasquini L, Wolfenden J. et al Повышение гликированного гемоглобина матери в периконцептуальном периоде у матерей с диабетом снижает сердечную функцию плода по длинной оси. Сердце 2006
14. Vogel M, Cheung M M H, Li J. et al Неинвазивная оценка соотношения силы и частоты левого желудочка с использованием тканевого доплеровского изоволюмического ускорения. Тираж 2003 107 1647–1652. [PubMed] [Академия Google]
15. Kenny J F, Plappert E, Doubilet et al Изменения скорости внутрисердечного кровотока и ударных объемов правого и левого желудочка в зависимости от гестационного возраста у нормального человеческого плода: проспективное допплеровское эхокардиографическое исследование. Тираж 1986741208–1216. [PubMed] [Google Scholar]
16. Maulik D, Lysikiewicz A, Sicuranza G. Допплерография пупочных артерий для наблюдения за плодом при беременности, осложненной прегестационным сахарным диабетом. J Matern-Fetal and Neonatal Med 200212417–422. [PubMed] [Академия Google]
Допплерография пупочных артерий для наблюдения за плодом при беременности, осложненной прегестационным сахарным диабетом. J Matern-Fetal and Neonatal Med 200212417–422. [PubMed] [Академия Google]
17. Evers I M, Nikkels P G, Sikkema J M. et al Плацентарная патология у женщин с сахарным диабетом 1 типа и в контрольной группе с нормальными и крупными для гестационного возраста новорожденными. Плацента 200324819–825. [PubMed] [Google Scholar]
18. Mayhew TM. Усиленный фетоплацентарный ангиогенез при прегестационном сахарном диабете: дополнительный рост носит исключительно продольный характер и не сопровождается ремоделированием микрососудов. Диабетология 2002451434–1439. [PubMed] [Академия Google]
19. Crandell S S, Fisher D J, Morriss F H. Jr Влияние материнской гипергликемии овец на регионарные кровотоки и метаболизм плода. Am J Physiol 1985249E454–E460. [PubMed] [Google Scholar]
20. Tincello D, White S, Walkinshaw S. Компьютеризированный анализ записей сердечного ритма плода при сахарном диабете I типа у матери. Br J Obstetr Gynecol 2001108853–857. [PubMed] [Google Scholar]
Br J Obstetr Gynecol 2001108853–857. [PubMed] [Google Scholar]
21. Becerra J E, Khoury M J, Cordero J F. et al Сахарный диабет во время беременности и риски определенных врожденных дефектов: популяционное исследование случай-контроль. Педиатрия 19
–9. [PubMed] [Google Scholar]
22. Ferenz C, Rubin JD, McCarter R J. et al Диабет у матери и пороки развития сердечно-сосудистой системы: преобладание правого желудочка с двойным выходом и артериального ствола. Тератология 1919–326. [PubMed] [Google Scholar]
23. Kitzmiller J L, Gavin L A, Gin G D. et al Лечение диабета до зачатия. Гликемический контроль предотвращает врожденные аномалии. ЯМА 19731–736. [PubMed] [Google Scholar]
24. Greene MF, Hare JW, Cloherty J P. и др. Гемоглобин A1 первого триместра и риск серьезных пороков развития и самопроизвольного аборта при диабетической беременности. Тератология 198
5–231. [PubMed] [Google Scholar]
25. Рис Э. А. Материнское топливо, диабетическая эмбриопатия: патомеханизмы и профилактика. Семинары по репродуктивной эндокринологии 1993–194. [PubMed] [Google Scholar]
Рис Э. А. Материнское топливо, диабетическая эмбриопатия: патомеханизмы и профилактика. Семинары по репродуктивной эндокринологии 1993–194. [PubMed] [Google Scholar]
26. Suzuki N, Svensson K, Eriksson U J. Высокая концентрация глюкозы ингибирует миграцию клеток нервного гребня крыс in vitro. Диабетология 19
01–411. [PubMed] [Google Scholar]
27. Styrud J, Thunberg L, Nybacka O. et al Корреляция между материнским метаболизмом и нарушением развития у потомства нормальных и диабетических крыс. Тератология 19
3–353. [PubMed] [Google Scholar]
28. Radaelli T, Varastehpur A, Catalano P. et al Гестационный диабет индуцирует плацентарные гены для хронического стресса и путей воспаления. Диабет 2003522951–2958. [PubMed] [Академия Google]
29. Пунариваттана К., Холладей С.Д. Иммуностимуляция полным адъювантом Фрейнда, гранулоцитарно-макрофагальным колониестимулирующим фактором или интерфероном-γ снижает тяжесть диабетической эмбриопатии у мышей ICR. Исследование врожденных дефектов A 20047020–27. [PubMed] [Google Scholar]
Исследование врожденных дефектов A 20047020–27. [PubMed] [Google Scholar]
30. Хорнбергер Л.К., Бенасерраф Б.Р. Скорость кровотока у плода гестационного возраста 10–20 недель: влияние материнского диабета. Тираж 199694I–236. [Google Scholar]
Ультразвуковая и генетическая диагностика гипертрофической кардиомиопатии плода во втором триместре беременности
Текст статьи
Меню статьи
- Статья
Текст - Артикул
инфо - Цитата
Инструменты - Поделиться
- Быстрое реагирование
- Артикул
Метрика - Оповещения
Изображения в…
Ультразвуковое и генетическое выявление гипертрофической кардиомиопатии плода во втором триместре беременности
Бесплатно
- Celia Soares1,
- Cátia Lourenço1,
- Rosete Novais Nogueira2,3 and
- Ana Carrico4
- 1 Obstetrics and Gynecology, Centro Hospitalar de Vila Nova de Gaia Espinho EPE, Vila Nova de Gaia , Порту, Португалия
- 2 Патология, CGC Genetics Centro de Genetica Clinica, Порту, Португалия
- 3 Патология, Университет Миньо, Институт исследований в Португалии, Португалия, Португалия,
- 4 Детская кардиология, Centro Hospitalar de Vila Nova de Gaia Espinho EPE, Vila Nova de Gaia, Порту, Португалия
- Переписка с доктором Селией Соареш; celia.
 cmsoares{at}gmail.com
cmsoares{at}gmail.com
http://dx.doi.org/10.1136/bcr-2020-239773
Статистика с Altmetric.com
Запрос разрешений
Если вы хотите повторно использовать какие-либо или все этой статьи, воспользуйтесь приведенной ниже ссылкой, которая приведет вас к службе RightsLink Центра защиты авторских прав. Вы сможете получить быструю цену и мгновенное разрешение на повторное использование контента различными способами.
- Беременность
- Сердечно-сосудистые заболевания
- Медицина матери и плода
- Здоровье новорожденных
Описание
Кардиомиопатии (КМ) — это заболевания миокарда, которые приводят к нарушению функции сердца различной степени тяжести. Эти заболевания очень редко встречаются у плодов человека. Многие ВМ являются идиопатическими, и только 33–43% имеют идентифицируемые генетические, семейные, инфекционные или метаболические причины.1, 2 Около 76% случаев гипертрофической ВМ (ГКМП) связаны с диабетом матери и трансфузионным синдромом от близнеца к близнецу. ВМ, связанный с этими состояниями, часто бывает обратимым.2
ВМ, связанный с этими состояниями, часто бывает обратимым.2
ГКМП, вызванная семейными генетическими вариантами, встречается редко, но приводит к низкой выживаемости плода2 или серьезным долгосрочным клиническим последствиям, включая повышенный риск внезапной сердечной смерти.3 4 Пренатальная диагностика ГКМП является редкой и сложной, сообщается о заболеваемости 6,2 на 100 000.2 Насколько нам известно, сообщалось только об отдельных случаях и небольших сериях случаев ГКМП, диагностированных во время внутриутробного развития. самопроизвольных выкидышей в триместре) без гестационного диабета была направлена в наше отделение пренатальной диагностики на 23 неделе беременности из-за семейного анамнеза ГКМП, диагностированного во время настоящей беременности. Генетическое исследование больного члена семьи (матери беременной с диагнозом ГКМП в возрасте 53 лет) выявило вариант с.559.A>G (p.Asn187Asp) в гетерозиготности по гену MYH7 (NM_0002547.4). Наличие семейного варианта у беременной женщины было неизвестно, и ее эхокардиограмма оказалась нормальной. Эхокардиограмма плода (в 23 недели) показала симметричное утолщение стенок бивентрикулярного сердца плода и межжелудочковой перегородки размером около 5 мм и 4,5 мм соответственно. Сохраненная сердечная функция, нормальная венозная и артериальная допплерография и отсутствие препятствий в тракте оттока желудочков (рис. 1). Остальная морфология плода была нормальной. Кариотип плода в норме. Семейный вариант в гетерозиготности по гену MYH7 обнаружен у плода путем секвенирования ДНК. Пациентка приняла решение о прерывании беременности в сроке 24 недели гестации.
Эхокардиограмма плода (в 23 недели) показала симметричное утолщение стенок бивентрикулярного сердца плода и межжелудочковой перегородки размером около 5 мм и 4,5 мм соответственно. Сохраненная сердечная функция, нормальная венозная и артериальная допплерография и отсутствие препятствий в тракте оттока желудочков (рис. 1). Остальная морфология плода была нормальной. Кариотип плода в норме. Семейный вариант в гетерозиготности по гену MYH7 обнаружен у плода путем секвенирования ДНК. Пациентка приняла решение о прерывании беременности в сроке 24 недели гестации.
Рисунок 1
Эхокардиограмма плода (23 недели) показала нормальный размер сердца, симметричное утолщение бивентрикулярных стенок и межжелудочковой перегородки размером около 5 мм и 4,5 мм соответственно.
Вскрытие подтвердило плод с 20-недельной биометрией, сердцем с нормальной массой, но с концентрической бивентрикулярной гипертрофией (рис. 2) и отсутствием других морфологических аномалий.
Рис. 2
(A) Проекция сердца in situ. (B) Серийный срез, показывающий бивентрикулярную гипертрофию и гипертрофию перегородки. Толщина правого желудочка (ПЖ) 5 мм; толщина левого желудочка (ЛЖ) 4 мм; толщина перегородки (S) 3–5 мм. Предоставлено CGC Genetics, Лаборатория эмбриональной патологии.
Детальная диагностика типа ВМ у плода очень сложна, и возможна только начальная оценка этих нарушений на основании сонографического изображения миокарда. Кроме того, пренатальная диагностика ГКМП затруднена, особенно на ранней стадии, из-за ее сильно изменчивой экспрессии и непредсказуемой эволюции.1–3
немногочисленные исследования этого состояния.2 Следует отметить, что некоторые авторы сообщали о нормальных результатах сканирования в 20 недель5 или только что выявили ГКМП в 30+ недель.3 Своевременная диагностика ГКМП и точное прогнозирование функциональных исходов имеют первостепенное значение для ведения беременности, особенно когда прекращение является вариантом, и должны соблюдаться установленные законом сроки (например, 24 недели в Португалии).
В представленном случае наблюдалось морфологическое изменение сердца, включающее утолщение желудочка с нормальной функцией, что соответствует одному из наиболее важных исследований ГКМП. генетический вариант, была проведена целенаправленная этиологическая оценка.
Ключевым открытием, представленным в этом отчете, является вариант MYH7 (NM_000257.4):c.559A>G (p.Asn187Asp), который описан впервые и, вероятно, является патогенным. Этот специфический вариант не был описан у здоровых людей в gnomAD v3.1, и прогностическое программное обеспечение предпочло классифицировать его как патогенный.6,7,
Генетическое тестирование варианта гена тяжелой цепи сердечного β-миозина (MYH7) использовалось при клинической оценке фетальных кавернозных мальформаций.2 8 Фактически, патогенные варианты MYH7 были обнаружены пренатально в неуплотненных кавернозных мальформациях6 и расширенных кавернозных мальформациях.2 Тем не менее, есть только один отчет о пренатальном диагнозе ГКМП, указывающий на вариант MYH7 в качестве причины5, но включающий другой вариант MYH7, чем описано здесь.
Сообщается, что прогноз фетального CM крайне неблагоприятный с высоким риском перинатальной гибели.2 Тяжесть ГКМП, по-видимому, тесно связана с фенотипическими и функциональными проявлениями, и более неблагоприятные перинатальные исходы наблюдаются в случаях с ранними эхокардиографическими данными.2
Пункты обучения
У плода возможна только начальная оценка кардиомиопатии (КМ), основанная на сонографическом изображении миокарда.
Пренатальная диагностика гипертрофического ВМ (ГКМП) проводится редко. Из-за его очень вариабельной экспрессии и непредсказуемой эволюции сложно своевременно диагностировать ВМ во время беременности.
Вариант MYH7 может быть причиной ГКМП, диагностированной пренатально.
Ссылки
- ↵
- Pedra SRFF,
- Smallhorn JF,
- Ryan G, et al
. Кардиомиопатии плода: патогенетические механизмы, гемодинамические данные и клинический исход.
 Тираж 2002 г.;
Тираж 2002 г.; - Кантор П.,
- Читаят Д. и др.
. Спектр и исход первичных кардиомиопатий, диагностированных во время внутриутробного развития. Сердечная недостаточность JACC 2014;2:403–11.doi:10.1016/j.jchf.2014.02.010pmid:http://www.ncbi.nlm.nih.gov/pubmed/25023818
8 Hill MG,
. Внутриутробное лечение плода с семейной гипертрофической кардиомиопатией, вторичной по отношению к мутации MYH7. Pediatr Cardiol 2015;36:1774–7.doi:10.1007/s00246-015-1250-1pmid:http://www.ncbi.nlm.nih.gov/pubmed/26337809
- Колан С.Д.,
- Липшульц С.Е.,
- Лоу А.М. и др.
. Эпидемиология и причинно-специфические исходы гипертрофической кардиомиопатии у детей: данные Реестра детской кардиомиопатии. Циркуляция 2007; 115: 773–81.doi: 10.1161/циркуляцияаха.106.621185PMID: http: //www.ncbi.nlm.nih.gov/pubmed/17261650
Циркуляция 2007; 115: 773–81.doi: 10.1161/циркуляцияаха.106.621185PMID: http: //www.ncbi.nlm.nih.gov/pubmed/17261650
.
. Пренатальная молекулярная диагностика гипертрофической кардиомиопатии: отчет о первом случае. Prenat Diagn 2004;24:701–3.doi:10.1002/pd.969pmid:http://www.ncbi.nlm.nih.gov/pubmed/15386449
. Спектр мутационных ограничений количественно определен по вариациям у 141 456 человек. Nature 2020;581:434–43.doi:10.1038/s41586-020-2308-7pmid:http://www.ncbi.nlm.nih.gov/pubmed/32461654
- Копанос С.,
- Циолкас В.,
- Коурис А. и др.
. VarSome: поисковая система геномных вариантов человека. Bioinformatics 2019;35:1978–80.doi:10.1093/bioinformatics/bty897
VarSome: поисковая система геномных вариантов человека. Bioinformatics 2019;35:1978–80.doi:10.1093/bioinformatics/bty897
- Hoedemaekers YM,
- Cohen-Overbeek TE,
- Frohn-Mulder IME, et al
. Пренатальная ультразвуковая диагностика некомпактной кардиомиопатии MYH7. Ultrasound Obstet Gynecol 2013;41:336–9.doi:10.1002/uog.12279pmid:http://www.ncbi.nlm.nih.gov/pubmed/22859017
написал рукопись и получил данные. RNN получил данные и предоставил критический пересмотр рукописи. CL и AC обеспечили критический пересмотр рукописи.
Финансирование Авторы не объявили о специальном гранте для этого исследования от какого-либо финансирующего агентства в государственном, коммерческом или некоммерческом секторах.
Конкурирующие интересы Не заявлено.
Согласие пациента на публикацию получено.
Происхождение и рецензирование Не введен в эксплуатацию; рецензируется внешними экспертами.
Читать полный текст или скачать PDF:
Подписаться
Войти под своим именем пользователя и паролем
Для личных счетов ИЛИ управляющих корпоративными счетами
Имя пользователя *
Пароль *
Забыли данные для входа? Зарегистрировать новую учетную запись?
Забыли имя пользователя или пароль?
Беременность как модель сердечного стресса | Сердечно-сосудистые исследования
Журнальная статья
Выбор редакции
Ынхи Чон,
Юнхи Чанг
Ищите другие работы этого автора на:
Оксфордский академический
пабмед
Google ученый
Лесли А. Лейнванд
Лесли А. Лейнванд
*
Ищите другие работы этого автора на:
Оксфордский академический
пабмед
Google ученый
Примечания автора
Сердечно-сосудистые исследования , том 101, выпуск 4, 15 марта 2014 г. , страницы 561–570, https://doi.org/10.1093/cvr/cvu013
, страницы 561–570, https://doi.org/10.1093/cvr/cvu013
Опубликовано:
20 января 2014 г.
История статьи
Получен:
08 октября 2013 г.
Полученная ревизия:
28 ноября 2013 г.
Принято:
08 декабря 2013 г.
Опубликовано:
20 января 2014
Фильтр поиска панели навигации
Сердечно-сосудистые исследованияЭтот выпускПубликации ESCСердечно-сосудистые заболеванияКнигиЖурналыOxford Academic
Термин поиска мобильного микросайта
Закрыть
Фильтр поиска панели навигации
Сердечно-сосудистые исследованияЭтот выпускПубликации ESCСердечно-сосудистые заболеванияКнигиЖурналыOxford Academic
Термин поиска на микросайте
Advanced Search
5″> Abstract
Гипертрофия сердца возникает во время беременности как следствие перегрузки объемом и гормональных изменений. Обычно считается, что гипертрофия сердца, вызванная беременностью и физической нагрузкой, сходна и физиологична. Несмотря на то, что существуют общие транскрипционные ответы при обеих формах кардиальной адаптации, беременность приводит к отчетливой сигнатуре экспрессии генов в сердце. Однако в некоторых случаях беременность может вызвать неблагоприятные сердечные события у ранее здоровых женщин без каких-либо известных сердечно-сосудистых заболеваний. Перипартальная кардиомиопатия является ведущей причиной неакушерской смертности во время беременности. Чтобы понять, как беременность может вызвать сердечные заболевания, в первую очередь важно понять адаптацию сердца во время нормальной беременности. В этом обзоре представлен обзор сердечных последствий беременности, включая гемодинамическую, функциональную, структурную и морфологическую адаптацию, а также молекулярные фенотипы. Кроме того, в этом обзоре описаны сигнальные пути, ответственные за индуцированную беременностью гипертрофию сердца и ангиогенез.
Обычно считается, что гипертрофия сердца, вызванная беременностью и физической нагрузкой, сходна и физиологична. Несмотря на то, что существуют общие транскрипционные ответы при обеих формах кардиальной адаптации, беременность приводит к отчетливой сигнатуре экспрессии генов в сердце. Однако в некоторых случаях беременность может вызвать неблагоприятные сердечные события у ранее здоровых женщин без каких-либо известных сердечно-сосудистых заболеваний. Перипартальная кардиомиопатия является ведущей причиной неакушерской смертности во время беременности. Чтобы понять, как беременность может вызвать сердечные заболевания, в первую очередь важно понять адаптацию сердца во время нормальной беременности. В этом обзоре представлен обзор сердечных последствий беременности, включая гемодинамическую, функциональную, структурную и морфологическую адаптацию, а также молекулярные фенотипы. Кроме того, в этом обзоре описаны сигнальные пути, ответственные за индуцированную беременностью гипертрофию сердца и ангиогенез. Мы также сравниваем и противопоставляем сердечную адаптацию в ответ на болезнь, физическую нагрузку и беременность. Сравнение этих параметров сердечной гипертрофии дает представление об адаптации сердца, связанной с беременностью.
Мы также сравниваем и противопоставляем сердечную адаптацию в ответ на болезнь, физическую нагрузку и беременность. Сравнение этих параметров сердечной гипертрофии дает представление об адаптации сердца, связанной с беременностью.
Беременность, Физиологическая гипертрофия сердца, Гормоны, Сигнальные пути, Молекулярные признаки Гипертрофия сердца, вызванная физическими нагрузками, иногда называемая спортивным сердцем. 1 Гипертрофия сердца определяется как увеличение массы сердечной мышцы с изменением геометрии сердца. Патологические стимулы, такие как перегрузка давлением в ответ на артериальную гипертензию или аортальный стеноз, первоначально активируют адаптивное увеличение массы для компенсации увеличения рабочей нагрузки. Перегрузка объемом, вызванная митральной или аортальной недостаточностью, приводит к увеличению размера желудочка. Как давление, так и объемная перегрузка изначально изменяют морфометрию камеры. Как показано на Рисунок 1 , изменение геометрии может быть либо концентрическим (т. е. относительно большее увеличение толщины стенки при небольших полостях), либо эксцентричным (т. е. увеличенными желудочковыми полостями с относительно тонкими стенками), но такие сердца часто прогрессируют в фазу дезадаптации, которая сопровождается снижением сердечной функции и сердечной недостаточностью. 1 Таким образом, эти состояния называются патологической гипертрофией сердца. В отличие от патологической гипертрофии сердца, гипертрофия сердца, вызванная физической нагрузкой, называется физиологической, и при этом функция сердца либо нормальная, либо усиленная. 1 Упражнения обычно приводят к пропорциональному увеличению размеров камеры и толщины стенок. 2
е. относительно большее увеличение толщины стенки при небольших полостях), либо эксцентричным (т. е. увеличенными желудочковыми полостями с относительно тонкими стенками), но такие сердца часто прогрессируют в фазу дезадаптации, которая сопровождается снижением сердечной функции и сердечной недостаточностью. 1 Таким образом, эти состояния называются патологической гипертрофией сердца. В отличие от патологической гипертрофии сердца, гипертрофия сердца, вызванная физической нагрузкой, называется физиологической, и при этом функция сердца либо нормальная, либо усиленная. 1 Упражнения обычно приводят к пропорциональному увеличению размеров камеры и толщины стенок. 2
Рисунок 1
Открыть в новой вкладкеСкачать слайд
Морфометрические изменения в ответ на различные раздражители. См. подробную информацию в Разделе 3.
В дополнение к различимым структурным и функциональным фенотипам между физиологической и патологической гипертрофией сердца их различают многочисленные критерии. К ним относятся различные стимулы, молекулярные и сигнальные каскады, метаболический аспект и плотность капилляров/ангиогенез (9).0323 Таблица 1 ). Например, гипертрофия сердца, вызванная беременностью 3–6 и физической нагрузкой 7 , является обратимой, активирует «благоприятные» структурные и молекулярные признаки, нормальный или повышенный ангиогенез и, как правило, «благоприятные» гипертрофические сигнальные пути. Напротив, патологическая гипертрофия сопровождается активацией генов, нормально экспрессирующихся во внутриутробном развитии, снижением ангиогенеза и активацией канонических неблагоприятных сигнальных каскадов. 8,9
К ним относятся различные стимулы, молекулярные и сигнальные каскады, метаболический аспект и плотность капилляров/ангиогенез (9).0323 Таблица 1 ). Например, гипертрофия сердца, вызванная беременностью 3–6 и физической нагрузкой 7 , является обратимой, активирует «благоприятные» структурные и молекулярные признаки, нормальный или повышенный ангиогенез и, как правило, «благоприятные» гипертрофические сигнальные пути. Напротив, патологическая гипертрофия сопровождается активацией генов, нормально экспрессирующихся во внутриутробном развитии, снижением ангиогенеза и активацией канонических неблагоприятных сигнальных каскадов. 8,9
Таблица 1
Ключевые критерии для дифференциации физиологической гипертрофии сердца от патологической
| . | Беременность . | Упражнение . | Патологические . |
|---|---|---|---|
| Сердечная функция | Нормальная или угнетенная на поздних сроках беременности | Нормальная или усиленная | Пониженная |
| Reversibility | Reversible | Reversible | Irreversible |
| Foetal gene induction | Relatively normal | Relatively normal | Usually up-regulated |
| Fibrosis | None | None | Increased |
| Капиллярная плотность/ангиогенез | Нормальная | Нормальная или повышенная | Пониженная |
| Signalling pathway | PI3K/Akt, ERK1/2, and calcineurin | PI3K/Akt | Gaq (MAPKs and calcineurin) |
. | Беременность . | Упражнение . | Патологические . |
|---|---|---|---|
| Сердечная функция | Нормальная или угнетенная на поздних сроках беременности | Нормальная или усиленная | Decreased |
| Reversibility | Reversible | Reversible | Irreversible |
| Foetal gene induction | Relatively normal | Relatively normal | Usually up-regulated |
| Fibrosis | None | None | Повышенная |
| Плотность капилляров/ангиогенез | Нормальная | Нормальная или повышенная | Decreased |
| Signalling pathway | PI3K/Akt, ERK1/2, and calcineurin | PI3K/Akt | Gaq (MAPKs and calcineurin) |
Открыть в новой вкладке
Таблица 1
Ключевые критерии для дифференциации физиологической гипертрофии сердца от патологической
. | Беременность . | Упражнение . | Патологические . |
|---|---|---|---|
| Cardiac function | Normal or depressed in late pregnancy | Normal or enhanced | Decreased |
| Reversibility | Reversible | Reversible | Irreversible |
| Foetal gene induction | Relatively normal | Относительно нормальное | Обычно повышенное регулирование |
| Fibrosis | None | None | Increased |
| Capillary density/angiogenesis | Normal | Normal or increased | Decreased |
| Signalling pathway | PI3K/Akt, ERK1/2, and кальциневрин | PI3K/Akt | Gaq (MAPK и кальцинейрин) |
. | Беременность . | Упражнения . | Патологические . |
|---|---|---|---|
| Cardiac function | Normal or depressed in late pregnancy | Normal or enhanced | Decreased |
| Reversibility | Reversible | Reversible | Irreversible |
| Foetal gene induction | Relatively normal | Относительно нормальное | Обычно повышенное регулирование |
| Fibrosis | None | None | Increased |
| Capillary density/angiogenesis | Normal | Normal or increased | Decreased |
| Signalling pathway | PI3K/Akt, ERK1/2, and кальциневрин | PI3K/Akt | Gaq (MAPK и кальцинейрин) |
Открыть в новой вкладке
Значительное количество исследований 3–6,10,11 и обзорные статьи 8,12 описывают увеличение сердца во время беременности как «физиологическое», а не патологическое. В этом обзоре представлен обзор адаптации сердца, вызванной беременностью, чтобы помочь описать уникальную природу адаптации сердца во время беременности, и, где это возможно, приводятся параллельные сравнения с гипертрофией сердца, вызванной физической нагрузкой.
В этом обзоре представлен обзор адаптации сердца, вызванной беременностью, чтобы помочь описать уникальную природу адаптации сердца во время беременности, и, где это возможно, приводятся параллельные сравнения с гипертрофией сердца, вызванной физической нагрузкой.
Был поднят вопрос о том, является ли важной детерминантой физиологической или патологической гипертрофии продолжительность каждого стимула. Однако Perrino et al. 16 демонстрируют, что периодическая перегрузка давлением на сердце мышей по-прежнему вызывает сердечную дисфункцию. 16 Кроме того, беременность связана с постоянной перегрузкой объемом, но не приводит к долговременной сердечной дисфункции, что указывает на то, что характер стимула, а не его продолжительность, отличает два типа сердечной гипертрофии.
Патологическая гипертрофия в ответ на перегрузку давлением или объемом изначально носит адаптивный характер, но может привести к дилатации сердца и систолической и диастолической дисфункции. 1,2 Хотя есть сообщения о регрессе патологической гипертрофии сердца, 17 в какой-то момент это необратимо и приводит к сердечной недостаточности. 1,2 Напротив, гипертрофия сердца, вызванная физической нагрузкой, является обратимой после адекватной детренировки как у людей, так и у лабораторных животных. 7,18 Предыдущие исследования показали, что гипертрофия сердца, вызванная физическими упражнениями, регрессирует уже через 7-14 дней до 4 недель после прекращения упражнений 7 у грызунов, но сроки зависят от интенсивности и продолжительности тренировок. Подобно тренировкам, беременность связана с гипертрофией сердца, которая легко обратима уже через 7–14 дней после родов у грызунов 5,19 и может длиться до года у людей, 20,21 , но время течение регресса во многом зависит от лактационного статуса и количества беременностей (т.е. медленнее при лактации 22 и последующие беременности 21 ).
7,18 Предыдущие исследования показали, что гипертрофия сердца, вызванная физическими упражнениями, регрессирует уже через 7-14 дней до 4 недель после прекращения упражнений 7 у грызунов, но сроки зависят от интенсивности и продолжительности тренировок. Подобно тренировкам, беременность связана с гипертрофией сердца, которая легко обратима уже через 7–14 дней после родов у грызунов 5,19 и может длиться до года у людей, 20,21 , но время течение регресса во многом зависит от лактационного статуса и количества беременностей (т.е. медленнее при лактации 22 и последующие беременности 21 ).
 28 Релаксин представляет собой полипептидный гормон, вырабатываемый желтым телом во время беременности. 25 Уровни циркулирующего релаксина постепенно повышаются и достигают пиковых концентраций в конце беременности (∼100 нг/мл) у крыс. 25 Тот факт, что гемодинамическая адаптация, наблюдаемая во время беременности, имитируется введением релаксина крысам, позволяет предположить, что релаксин является основным фактором связанного с беременностью снижения сосудистого сопротивления и увеличения сердечного выброса. 25
28 Релаксин представляет собой полипептидный гормон, вырабатываемый желтым телом во время беременности. 25 Уровни циркулирующего релаксина постепенно повышаются и достигают пиковых концентраций в конце беременности (∼100 нг/мл) у крыс. 25 Тот факт, что гемодинамическая адаптация, наблюдаемая во время беременности, имитируется введением релаксина крысам, позволяет предположить, что релаксин является основным фактором связанного с беременностью снижения сосудистого сопротивления и увеличения сердечного выброса. 25 Кроме того, беременность сопровождается значительными изменениями половых стероидных гормонов 29–31 , которые считаются важными медиаторами сердечной гипертрофии и антигипертрофии. У мышей рождение чаще всего происходит на 20-й день, при этом наличие копулятивной пробки считается 1-м днем беременности. У мышей уровни циркулирующего прогестерона повышаются уже на 2-й день беременности (14,7–18,4 нг/мл), 29,30 и постепенно повышаются на ранних сроках беременности (до 9-го дня). : 34–54 нг/мл). 29–31 Затем уровни прогестерона значительно снижаются (8–10 дней беременности: 18–27 нг/мл), 29–31 и снова повышаются, достигая максимума на 15–16 день (82–113 нг/мл). ). 6,29,31 Затем следует непрерывное постепенное снижение до низкого значения, аналогичного контрольным значениям у небеременных, в день родов (0,8–5,5 нг/мл). 29–31 Было показано, что прогестерон увеличивает синтез белка в сердечной мышце 32 и может вызывать гипертрофию кардиомиоцитов. 6 Кроме того, экзогенное введение прогестерона девственным самкам мышей с нормальным циклом индуцирует гипертрофию сердца. 33 Характер циркулирующего эстрадиола отличается от прогестерона, и, в отличие от прогестерона, эстрадиол обладает антигипертрофическим действием. 34 Сывороточный эстрадиол не обнаруживается у небеременных мышей с циклом диэструса (<10 пг/мл 6 ). Уровни высоки в 1-й день беременности (38,6 пг/мл), но падают до низкого уровня с 5-го по 16-й день беременности (18,9 пг/мл).
: 34–54 нг/мл). 29–31 Затем уровни прогестерона значительно снижаются (8–10 дней беременности: 18–27 нг/мл), 29–31 и снова повышаются, достигая максимума на 15–16 день (82–113 нг/мл). ). 6,29,31 Затем следует непрерывное постепенное снижение до низкого значения, аналогичного контрольным значениям у небеременных, в день родов (0,8–5,5 нг/мл). 29–31 Было показано, что прогестерон увеличивает синтез белка в сердечной мышце 32 и может вызывать гипертрофию кардиомиоцитов. 6 Кроме того, экзогенное введение прогестерона девственным самкам мышей с нормальным циклом индуцирует гипертрофию сердца. 33 Характер циркулирующего эстрадиола отличается от прогестерона, и, в отличие от прогестерона, эстрадиол обладает антигипертрофическим действием. 34 Сывороточный эстрадиол не обнаруживается у небеременных мышей с циклом диэструса (<10 пг/мл 6 ). Уровни высоки в 1-й день беременности (38,6 пг/мл), но падают до низкого уровня с 5-го по 16-й день беременности (18,9 пг/мл). пг/мл) и значительно увеличивается только на поздних сроках беременности (17–19 дней беременности: 60,8–68 пг/мл). 6,30 Сводные данные об уровнях прогестерона и эстрадиола в сыворотке крови, полученные в различных исследованиях, представлены на рис. 2 . Введение эстрадиола девственным самкам морских свинок имитирует некоторые гемодинамики беременности, такие как увеличение сердечного выброса за счет увеличения ударного объема и объема крови. 35 Кроме того, снижение сердечных транскриптов Kv4.3 во время беременности имитируется введением эстрогена мышам после овариэктомии. 10 Эти результаты показывают, что изменения половых гормонов во время беременности способствуют адаптации сердца к беременности.
пг/мл) и значительно увеличивается только на поздних сроках беременности (17–19 дней беременности: 60,8–68 пг/мл). 6,30 Сводные данные об уровнях прогестерона и эстрадиола в сыворотке крови, полученные в различных исследованиях, представлены на рис. 2 . Введение эстрадиола девственным самкам морских свинок имитирует некоторые гемодинамики беременности, такие как увеличение сердечного выброса за счет увеличения ударного объема и объема крови. 35 Кроме того, снижение сердечных транскриптов Kv4.3 во время беременности имитируется введением эстрогена мышам после овариэктомии. 10 Эти результаты показывают, что изменения половых гормонов во время беременности способствуют адаптации сердца к беременности.
Рисунок 2
Открыть в новой вкладкеСкачать слайд
Циркуляция половых гормонов во время беременности у мышей. ( A ) Уровни прогестерона в сыворотке у мышей во время беременности. Уровень прогестерона повышается на ранних сроках беременности и несколько снижается в середине беременности, достигая своего пикового значения на 15–16-й день беременности. 6,29–31 ( Б ) Уровни эстрадиола в сыворотке у мышей во время беременности. Значения из предыдущих исследований. 6,30 День беременности сгруппирован на основе предыдущих отчетов, чтобы показать характер изменений гормонов. Значения являются средними значениями ± SEM.
6,29–31 ( Б ) Уровни эстрадиола в сыворотке у мышей во время беременности. Значения из предыдущих исследований. 6,30 День беременности сгруппирован на основе предыдущих отчетов, чтобы показать характер изменений гормонов. Значения являются средними значениями ± SEM.
Цитокины и хемокины играют важную роль в ремоделировании и физиологии сердца, особенно при патологии. Предыдущие исследования показали, что патологическая гипертрофия сердца, вызванная длительной стимуляцией изопреналином 36,37 и перегрузка давлением 38 сопровождается активацией хемокинов, провоспалительных цитокинов и родственных молекул, таких как интерлейкин (IL)-1β, IL-6, фактор некроза опухоли-α (TNF-α), трансформирующий фактор роста-β 1 (TGF-β 1 ) и NF-kB. Увеличение провоспалительных цитокинов при патологических состояниях сильно коррелирует с усилением фиброза. 38 Напротив, сердце тренированных животных не имеет повышенных провоспалительных цитокинов, таких как IL-6, TNF-α, TGF-β 1 и NF-kB, 36,39 , тогда как другое исследование 36 показывает, что противовоспалительный цитокин, IL-10, значительно увеличивается. У мышей, лишенных функционального IL-6, гипертрофия сердца, вызванная физической нагрузкой, не блокируется. Кроме того, физические упражнения на модели β-адренергической гиперактивности ослабляют сердечную дисфункцию и фиброз путем ингибирования провоспалительных цитокинов. 36 Однако имеются противоречивые результаты адаптации скелетных мышц к физической нагрузке, демонстрирующие, что уровень ИЛ-6 значительно повышается в работающих скелетных мышцах. 40
У мышей, лишенных функционального IL-6, гипертрофия сердца, вызванная физической нагрузкой, не блокируется. Кроме того, физические упражнения на модели β-адренергической гиперактивности ослабляют сердечную дисфункцию и фиброз путем ингибирования провоспалительных цитокинов. 36 Однако имеются противоречивые результаты адаптации скелетных мышц к физической нагрузке, демонстрирующие, что уровень ИЛ-6 значительно повышается в работающих скелетных мышцах. 40
Было высказано предположение, что сохранение беременности опосредуется балансом между про- и противовоспалительными цитокинами. 41 Уровень IL-6 в сыворотке постепенно увеличивается во время беременности, 42,43 , тогда как уровни IL-10 выше на поздних сроках беременности и во время родов без изменения TNF-α. 43 Ингибирующий лейкемию фактор (LIF) является важным цитокином для установления беременности. 44 Было показано, что LIF ослабляет фиброз за счет уменьшения выработки коллагена, но он также может вызывать сократительную дисфункцию и индуцировать программу генов плода. 45 Роль цитокинов в гипертрофии сердца, возникающей во время беременности, не изучалась.
45 Роль цитокинов в гипертрофии сердца, возникающей во время беременности, не изучалась.
3″ data-legacy-id=»s4″> 4. Функция сердца во время беременности
Одним из наиболее важных признаков, отличающих физиологическую гипертрофию сердца от патологической гипертрофии сердца, является функция; нормальная или повышенная функция в первом случае и сниженная функция во втором. 12 Функция левого желудочка определяется несколькими параметрами, такими как условия нагрузки (преднагрузка и постнагрузка), сократительные свойства миокарда и частота сердечных сокращений. Существует консенсус в отношении того, что гипертрофия сердца, вызванная физической нагрузкой, связана с нормальной или усиленной сердечной функцией по всем этим параметрам. 46 Однако имеются противоречивые сообщения о функции левого желудочка во время беременности. Например, сердечный выброс увеличивается постепенно и достигает пика от середины триместра до срока. 21,47 Увеличение сердечного выброса на ранних сроках беременности в основном связано с постепенным и существенным увеличением ударного объема. Дальнейшее увеличение сердечного выброса в середине и конце беременности в первую очередь связано с увеличением частоты сердечных сокращений 23,47 и снижением постнагрузки за счет снижения общего сосудистого сопротивления. 21,47 Увеличение ударного объема в первую очередь связано с увеличением преднагрузки за счет связанного с беременностью увеличения объема крови. 23,31,32 Однако отчеты о систолической функции, определяемые фракцией выброса или фракционным укорочением, обычно получаемые при эхокардиографической оценке во время беременности, несколько противоречивы. В некоторых исследованиях функция описывалась как нормальная, 47 , но другие описывали снижение функции. 3,6,10,48,49 Легкие нарушения диастолической функции левого желудочка 49 также сообщалось на более поздних стадиях беременности человека.
21,47 Увеличение сердечного выброса на ранних сроках беременности в основном связано с постепенным и существенным увеличением ударного объема. Дальнейшее увеличение сердечного выброса в середине и конце беременности в первую очередь связано с увеличением частоты сердечных сокращений 23,47 и снижением постнагрузки за счет снижения общего сосудистого сопротивления. 21,47 Увеличение ударного объема в первую очередь связано с увеличением преднагрузки за счет связанного с беременностью увеличения объема крови. 23,31,32 Однако отчеты о систолической функции, определяемые фракцией выброса или фракционным укорочением, обычно получаемые при эхокардиографической оценке во время беременности, несколько противоречивы. В некоторых исследованиях функция описывалась как нормальная, 47 , но другие описывали снижение функции. 3,6,10,48,49 Легкие нарушения диастолической функции левого желудочка 49 также сообщалось на более поздних стадиях беременности человека. Эти расхождения, вероятно, связаны с разным гестационным возрастом на момент проведения измерений (ранняя фаза третьего триместра 47 по сравнению с поздней фазой третьего триместра 48 ). В соответствии с тем, что функции различаются на разных стадиях беременности, исследования на животных показывают, что на поздних сроках беременности (т. е. за 1–2 дня до родов) систолическая функция, определяемая фракцией выброса или фракционным укорочением, значительно снижена. 6,10 Тот факт, что функция временно снижена на поздних сроках беременности, отличает ее от адаптации сердца, вызванной физическими нагрузками. Однако следует отметить, что фракция выброса или фракционное укорочение имеют ограниченное значение, так как эти параметры сильно зависят от пред- и постнагрузки. Например, гемодинамические параметры, измеренные на изолированных сердцах мышей, перфузированных по Лангендорфу, сходны между сердцами небеременных контролей и поздних сроков беременности.
Эти расхождения, вероятно, связаны с разным гестационным возрастом на момент проведения измерений (ранняя фаза третьего триместра 47 по сравнению с поздней фазой третьего триместра 48 ). В соответствии с тем, что функции различаются на разных стадиях беременности, исследования на животных показывают, что на поздних сроках беременности (т. е. за 1–2 дня до родов) систолическая функция, определяемая фракцией выброса или фракционным укорочением, значительно снижена. 6,10 Тот факт, что функция временно снижена на поздних сроках беременности, отличает ее от адаптации сердца, вызванной физическими нагрузками. Однако следует отметить, что фракция выброса или фракционное укорочение имеют ограниченное значение, так как эти параметры сильно зависят от пред- и постнагрузки. Например, гемодинамические параметры, измеренные на изолированных сердцах мышей, перфузированных по Лангендорфу, сходны между сердцами небеременных контролей и поздних сроков беременности. 50 Исследования с использованием изолированного препарата для работы сердца, в котором можно строго контролировать преднагрузку и постнагрузку, демонстрируют повышенную скорость укорочения периферических волокон у беременных крыс по сравнению с небеременными контрольными животными. 51 Это предполагает адаптацию сократительной функции миокарда во время беременности. 51 Таким образом, важно отметить, что во многих обзорных статьях 1,8,12 и оригинальных статьях 4,6,10,48 гипертрофия сердца, вызванная беременностью, описывается как чисто физиологическая. Тем не менее, сократительная дисфункция сердца, особенно зависящая от нагрузки эхокардиографическая оценка на поздних сроках беременности, носит скорее транзиторный, чем стойкий характер, и является обратимой в послеродовом периоде без каких-либо существенных долгосрочных неблагоприятных эффектов на сердечную функцию. 11
50 Исследования с использованием изолированного препарата для работы сердца, в котором можно строго контролировать преднагрузку и постнагрузку, демонстрируют повышенную скорость укорочения периферических волокон у беременных крыс по сравнению с небеременными контрольными животными. 51 Это предполагает адаптацию сократительной функции миокарда во время беременности. 51 Таким образом, важно отметить, что во многих обзорных статьях 1,8,12 и оригинальных статьях 4,6,10,48 гипертрофия сердца, вызванная беременностью, описывается как чисто физиологическая. Тем не менее, сократительная дисфункция сердца, особенно зависящая от нагрузки эхокардиографическая оценка на поздних сроках беременности, носит скорее транзиторный, чем стойкий характер, и является обратимой в послеродовом периоде без каких-либо существенных долгосрочных неблагоприятных эффектов на сердечную функцию. 11
5″ data-legacy-id=»s5″> 5. Структурный фенотип сердца и его регуляция при беременности
Структурный фенотип сердца и его регуляция при беременности
Еще одним существенным отличием патологической и физиологической гипертрофии сердца являются их гистологические особенности. В здоровом сердце внеклеточный матрикс обеспечивает поддерживающий каркас и строго контролируемый баланс между синтезом и распадом составляющих его белков. 52 В ответ на патологические стимулы происходит непропорциональное отложение сердечного коллагена, что приводит к увеличению интерстициального фиброза. 53 Повышенный интерстициальный фиброз способствует механической жесткости сердца и приводит к диастолической дисфункции и прогрессирует к систолической дисфункции. 54 И матриксные металлопротеиназы (ММР), и тканевые ингибиторы металлопротеиназ (ТИМП) регулируют внеклеточный матрикс. ММП находятся в интерстициальном пространстве и разрушают коллаген и другие белки, тогда как ТИМП противодействуют активности ММП. Одним из механизмов сердечной недостаточности из-за неблагоприятного ремоделирования желудочков является нарушение регуляции MMPs и TIMPs. 55 В модели декомпенсированной сердечной недостаточности уровни MMP3, TIMP1 и TIMP2 повышаются со значительным увеличением отложения коллагена I, 56 увеличением соотношения коллагена I/III, 57 и снижением соотношение эластин/коллаген I. 58 В хронически перегруженном давлением человеческом сердце 59 это увеличение экспрессии TIMP1 и TIMP2, отношения TIMP1/MMP2 и отношения TIMP2/MMP2. В модели инфаркта миокарда экспрессия мРНК коллагена I и III значительно увеличена. 60 Эти увеличения тесно связаны со степенью интерстициального фиброза. 59
55 В модели декомпенсированной сердечной недостаточности уровни MMP3, TIMP1 и TIMP2 повышаются со значительным увеличением отложения коллагена I, 56 увеличением соотношения коллагена I/III, 57 и снижением соотношение эластин/коллаген I. 58 В хронически перегруженном давлением человеческом сердце 59 это увеличение экспрессии TIMP1 и TIMP2, отношения TIMP1/MMP2 и отношения TIMP2/MMP2. В модели инфаркта миокарда экспрессия мРНК коллагена I и III значительно увеличена. 60 Эти увеличения тесно связаны со степенью интерстициального фиброза. 59
Напротив, гипертрофия сердца, вызванная беременностью или физической нагрузкой, не связана с фиброзом. 6,11,61 Ранее мы продемонстрировали, что гены, связанные с внеклеточным матриксом, представляют собой группу генов с наиболее значительной активацией на поздних сроках беременности и сразу после родов, 11 , но гистологический анализ показывает, что фиброз не возникает в сердце беременных 6,61 и послеродовые мыши. 19 Мы показываем, что MMP3 значительно активируется на поздних сроках беременности и сразу после родов, в то время как TIMP1 значительно активируется сразу после родов. 19 Таким образом, соотношение ММП3/ТИМП1 хорошо поддерживается во время беременности, в отличие от патологической гипертрофии, проявляющейся значительным повышением соотношения ТИМП1/ММП2. 59 Это также относится к гипертрофии сердца, вызванной физической нагрузкой. 11 Недавнее исследование показало, что гормон беременности, релаксин, обладает антифибротическими свойствами, модулируя активность ММП и синтез коллагена. 62 В совокупности эти результаты свидетельствуют о том, что гены, связанные с расщеплением и ингибированием расщепления белков внеклеточного матрикса, участвуют в физиологической сердечной адаптации, но точная настройка ММП и ТИМП позволяет дифференцировать физиологическую гипертрофию сердца в патологическую.
19 Мы показываем, что MMP3 значительно активируется на поздних сроках беременности и сразу после родов, в то время как TIMP1 значительно активируется сразу после родов. 19 Таким образом, соотношение ММП3/ТИМП1 хорошо поддерживается во время беременности, в отличие от патологической гипертрофии, проявляющейся значительным повышением соотношения ТИМП1/ММП2. 59 Это также относится к гипертрофии сердца, вызванной физической нагрузкой. 11 Недавнее исследование показало, что гормон беременности, релаксин, обладает антифибротическими свойствами, модулируя активность ММП и синтез коллагена. 62 В совокупности эти результаты свидетельствуют о том, что гены, связанные с расщеплением и ингибированием расщепления белков внеклеточного матрикса, участвуют в физиологической сердечной адаптации, но точная настройка ММП и ТИМП позволяет дифференцировать физиологическую гипертрофию сердца в патологическую.
8″ data-legacy-id=»s6″> 6. Индукция генов плода во время беременности
Индукция генов плода во время беременности
Общепризнано, что патологическая гипертрофия, вызванная перегрузкой давлением, связана с активацией генов плода, включая артериальный натрийуретический пептид (ANP) и мозговой натрийуретический пептид (BNP), а также генов для фетальных изоформ сократительных белков, таких как α-скелетный актин и тяжелая цепь β-миозина (MyHC), с подавлением генов, обычно экспрессирующихся на высоких уровнях в сердце взрослых мышей, таких как α-MyHC и саркоплазматический ретикулум Ca 2+ -АТФаза (SERCA2A). 8,9,63 Однако индукция гена плода во время физиологической гипертрофии не следует уникальному паттерну экспрессии (см. Таблица 2 ). Например, экспрессия ANP повышается в некоторых случаях сердечной адаптации, вызванной физической нагрузкой, 9,63,64 , тогда как в других экспрессия ANP снижается 65 или не изменяется. 60 В одном исследовании показано значительное увеличение экспрессии α-MyHC без изменения β-MyHC, 60 , тогда как в других исследованиях показано значительное снижение β-MyHC 66 при гипертрофии сердца, вызванной физической нагрузкой. Уровни ANP значительно снижаются в середине беременности, но BNP, SERCA2, фосфоламбан, α-скелетный актин, α-MyHC и β-MyHC не меняются в середине и на поздних сроках беременности. 6,10 С другой стороны, в другом исследовании сообщалось об увеличении экспрессии β-MyHC и снижении BNP на поздних сроках беременности. 63 Было показано, что повышенный уровень α-скелетного актина коррелирует с повышенным 67 или пониженным 68 Сократительная функция миокарда. Более того, экспериментальная перемежающаяся перегрузка давлением, связанная с сердечной дисфункцией, не индуцирует фетальную генную программу. 16 Таким образом, биологические последствия активации генной программы плода остаются нерешенными.
Уровни ANP значительно снижаются в середине беременности, но BNP, SERCA2, фосфоламбан, α-скелетный актин, α-MyHC и β-MyHC не меняются в середине и на поздних сроках беременности. 6,10 С другой стороны, в другом исследовании сообщалось об увеличении экспрессии β-MyHC и снижении BNP на поздних сроках беременности. 63 Было показано, что повышенный уровень α-скелетного актина коррелирует с повышенным 67 или пониженным 68 Сократительная функция миокарда. Более того, экспериментальная перемежающаяся перегрузка давлением, связанная с сердечной дисфункцией, не индуцирует фетальную генную программу. 16 Таким образом, биологические последствия активации генной программы плода остаются нерешенными.
Таблица 2
Индукция генов плода во время гипертрофии сердца, вызванной беременностью, физической нагрузкой и перегрузкой давлением
. | Беременность . | Упражнение . | Перегрузка по давлению 9 . | |
|---|---|---|---|---|
| МП . | ЛП . | . | . | |
| α-MyHC | = 6 | = 6,10 | ↑ 60 = 46 | ↓ |
| β-MyHC | = 6 | = 6,10 ↑ 63 | ↓ 66 = 46,60 | ↑ |
| α-Skeletal actin | = 6 | = 6 | = 60 | ↑ |
| SERCA2A | = 6 | = 6,10 | ↓ | |
| ANF | ↓ 6 | = 6,10 | ↑ 9,63,64 = 60 ↓ 65 | ↑ |
| BNP | = 6 | = 6 ↓ 63 | ↑ | |
. | Беременность . | Упражнение . | Перегрузка по давлению 9 . | |
|---|---|---|---|---|
| МП . | ЛП . | . | . | |
| α-MyHC | = 6 | = 6,10 | ↑ 60 = 46 | ↓ |
| β-MyHC | = 6 | = 6,10 ↑ 63 | ↓ 66 = 46,60 | ↑ |
| α-Skeletal actin | = 6 | = 6 | = 60 | ↑ |
| SERCA2A | = 6 | = 6,10 | ↓ | |
| ANF | ↓ 6 | = 6,10 | ↑ 9,63,64 = 60 ↓ 65 | ↑ |
| BNP | = 6 | = 6 ↓ 63 | ↑ | |
MyHC, myosin heavy chain; SERCA2A, сердечный Ca 2+ -АТФаза саркоплазматического ретикулума ANP, предсердный натрийуретический пептид; BNP, мозговой натрийуретический пептид; LP, поздняя беременность; МП, средний срок беременности; = , без изменений; ↓, уменьшение; ↑, увелич.
Открыть в новой вкладке
Таблица 2
Индукция генов плода во время гипертрофии сердца, вызванной беременностью, физической нагрузкой и перегрузкой давлением
| . | Беременность . | Упражнение . | Перегрузка по давлению 9 . | |
|---|---|---|---|---|
| МП . | ЛП . | . | . | |
| α-MyHC | = 6 | = 6,10 | ↑ 60 = 46 | ↓ |
| β-MyHC | = 6 | = 6,10 ↑ 63 | ↓ 66 = 46,60 | ↑ |
| α-Skeletal actin | = 6 | = 6 | = 60 | ↑ |
| SERCA2A | = 6 | = 6,10 | ↓ | |
| ANF | ↓ 6 | = 6,10 | ↑ 9,63,64 = 60 ↓ 65 | ↑ |
| BNP | = 6 | = 6 ↓ 63 | ↑ | |
. | Беременность . | Упражнение . | Перегрузка по давлению 9 . | |
|---|---|---|---|---|
| МП . | ЛП . | . | . | |
| 0471 60 = 46 | ↓ | |||
| β-MyHC | = 6 | = 6,10 ↑ 63 | ↓ 66 = 46,60 | ↑ |
| α-Skeletal actin | = 6 | = 6 | = 60 | ↑ |
| SERCA2A | = 6 | = 6,10 | ↓ | |
| ANF | ↓ 6 | = 6,10 | ↑ 9,63,64 = 60 ↓ 65 | ↑ |
| BNP | = 6 | = 6 ↓ 63 | ↑ | |
3 Тяжелая цепь Myos, myosHC,
3 SERCA2A, сердечный Ca 2+ -АТФаза саркоплазматического ретикулума ANP, предсердный натрийуретический пептид; BNP, мозговой натрийуретический пептид; LP, поздняя беременность; МП, средний срок беременности; = , без изменений; ↓, уменьшение; ↑, увелич.
Открыть в новой вкладке
Хотя на поздних сроках беременности сообщалось о повышенном вкладе углеводного обмена, измеренном с помощью дыхательной калориметрии, 71 гены, регулирующие углеводные пути (например, PDK4 и GLUT4), не изменены. 63 Гамма-коактиватор рецептора, активируемого пролифератором пероксисом (PGC)-1α, основной регулятор митохондриального биогенеза, был повышен в середине беременности, 33 , тогда как в беременность. 63 Необходимы дальнейшие исследования для выяснения метаболических путей во время беременности, поскольку метаболические нарушения, такие как гестационный сахарный диабет, распространены во время беременности. 72 73,74 До сих пор сигнальные пути фосфатидилинозитол-3-киназы (PI3 K)/Akt были связаны с физической нагрузкой, а пути Gαq были связаны с патологической сердечной адаптацией. 75 Однако следует отметить, что между двумя путями существуют перекрестные помехи. 6 На рис. 3 показано упрощенное схематическое изображение сигнальных путей в сердце.Рисунок 3
Открыть в новой вкладкеСкачать слайд
Упрощенное схематическое изображение сигнальных путей в сердце. Красные стрелки представляют собой сигнальные молекулы, которые изменяются во время беременности. См. подробную информацию в Разделе 8.
75 Например, экспрессия конститутивно активного PI3K-α (p110α или caPI3K) в сердце приводит к значительной сердечной гипертрофии с нормальной сократимостью и не переходит в дезадаптивную гипертрофию. 76 Наоборот, кардиальная экспрессия мутантного доминантно-негативного p110α (dnp110α) и инактивация регуляторной субъединицы PI3K у мышей демонстрируют притупленную гипертрофию, вызванную физической нагрузкой, с нормальной сердечной функцией в ответ на тренировку по плаванию, но не на перегрузку давлением. 74 Основным нижестоящим каскадом передачи сигналов PI3K является протеинкиназа B (Akt) и киназа гликогенсинтазы 3β (GSK3β). Исследования на мышах дикого типа (WT) 74,77 и моделях трансгенных мышей предполагают, что передача сигналов Akt важна для гипертрофии сердца, вызванной физической нагрузкой 73 , а также для защиты сердца от патологических инсультов. 78 Мыши со специфичной для сердца конститутивной активацией Akt (caAkt) или миристоилированием (myr-Akt) имеют увеличенную массу миокарда при нормальной систолической функции. 78 У этих мышей заметно повышается сократимость сердца, 79 , и они защищены от апоптоза 80 и ишемически-реперфузионного (ИР) повреждения. 78 Напротив, у мышей с целенаправленным нарушением гена Akt1 не наблюдается гипертрофия сердца, вызванная физической нагрузкой, но наблюдается усиленная гипертрофия сердца, вызванная перегрузкой давлением, по сравнению с мышами дикого типа. 73 Однако оказывается, что длительная активация Akt также может приводить к патологической гипертрофии. 78 Мыши, экспрессирующие специфическую для сердца активную (антигипертрофическую) форму GSK3β (caGSK3β), нижестоящую мишень Akt, имеют меньшие по размеру сердца, чем мыши дикого типа, в исходном состоянии и блокируются при патологической гипертрофии. 81
78 У этих мышей заметно повышается сократимость сердца, 79 , и они защищены от апоптоза 80 и ишемически-реперфузионного (ИР) повреждения. 78 Напротив, у мышей с целенаправленным нарушением гена Akt1 не наблюдается гипертрофия сердца, вызванная физической нагрузкой, но наблюдается усиленная гипертрофия сердца, вызванная перегрузкой давлением, по сравнению с мышами дикого типа. 73 Однако оказывается, что длительная активация Akt также может приводить к патологической гипертрофии. 78 Мыши, экспрессирующие специфическую для сердца активную (антигипертрофическую) форму GSK3β (caGSK3β), нижестоящую мишень Akt, имеют меньшие по размеру сердца, чем мыши дикого типа, в исходном состоянии и блокируются при патологической гипертрофии. 81
Мы 6 и другие 4 демонстрируют, что индуцированная беременностью гипертрофия сердца также опосредована Akt и его нижестоящими молекулами. Активность Akt, оцениваемая по отношению фосфо-Akt к общему количеству Akt, значительно повышается во время беременности. 4,6,82 Нижние мишени Akt, включая GSK3β, рибосомную протеинкиназу S6 (p70S6 K) и мишень рапамицина млекопитающих (mTOR), увеличиваются только в середине беременности, но не на поздних сроках беременности. 6 В соответствии с идеей о том, что активация Akt/GSK3β является важным медиатором сердечной гипертрофии, вызванной беременностью; гипертрофические реакции сердца мышей myr-Akt или caGSK3β ослаблены. 6 В совокупности эти исследования показывают, что гипертрофия сердца, вызванная беременностью, опосредована Akt и его нижестоящими мишенями. 4,6,82
4,6,82 Нижние мишени Akt, включая GSK3β, рибосомную протеинкиназу S6 (p70S6 K) и мишень рапамицина млекопитающих (mTOR), увеличиваются только в середине беременности, но не на поздних сроках беременности. 6 В соответствии с идеей о том, что активация Akt/GSK3β является важным медиатором сердечной гипертрофии, вызванной беременностью; гипертрофические реакции сердца мышей myr-Akt или caGSK3β ослаблены. 6 В совокупности эти исследования показывают, что гипертрофия сердца, вызванная беременностью, опосредована Akt и его нижестоящими мишенями. 4,6,82
 88 В отличие от гипертрофии сердца, вызванной физической нагрузкой, фосфорилирование ERK1/2 значительно увеличивается в середине беременности, тогда как фосфорилирование p38 значительно снижается во время беременности. 3,64 Поскольку уровни прогестерона, но не эстрадиола, значительно повышаются в середине беременности, мы исследовали причинно-следственную связь между прогестероном и ERK1/2. 6 Лечение прогестероном вызывает гипертрофию миоцитов и фосфорилирование ERK1/2. Когда ERK1/2 блокируется PD
88 В отличие от гипертрофии сердца, вызванной физической нагрузкой, фосфорилирование ERK1/2 значительно увеличивается в середине беременности, тогда как фосфорилирование p38 значительно снижается во время беременности. 3,64 Поскольку уровни прогестерона, но не эстрадиола, значительно повышаются в середине беременности, мы исследовали причинно-следственную связь между прогестероном и ERK1/2. 6 Лечение прогестероном вызывает гипертрофию миоцитов и фосфорилирование ERK1/2. Когда ERK1/2 блокируется PD, специфическим ингибитором MEK1, блокируется индуцированная прогестероном клеточная гипертрофия.
Другим нижестоящим путем передачи сигналов Gq является кальций-зависимая протеинфосфатаза, кальциневрин. Кальциневрин играет важную роль в патологической гипертрофии и сердечных заболеваниях. 89 Кальций активирует кальцинейрин, который дефосфорилирует цитоплазматический ядерный фактор активированных Т-клеток (NFAT), вызывая транслокацию NFAT в ядро. Затем NFAT активирует прогипертрофические гены. 1 Многочисленные исследования показали, что активность кальциневрина повышена в сердце пациентов с сердечной гипертрофией и сердечной недостаточностью, 90 , а ингибирование этого пути циклоспорином А (CsA) может задержать прогрессирование патологической сердечной недостаточности на животных моделях. 91 Однако в других сообщениях показано, что ингибирование кальцинейрина усугубляет патологическое заболевание сердца. 92 Роль кальциневрина в гипертрофии сердца, вызванной физической нагрузкой, остается спорной. 89,93,94 Например, уровни белка кальциневрина снижаются после произвольного обучения бега на колесе у мышей, 94 , в то время как у мышей-репортеров сердечного NFAT активность кальциневрина не меняется после обучения плаванию. 89 Одно исследование показывает, что лечение CsA не блокирует гипертрофию сердца, вызванную физической нагрузкой, 9 , тогда как другое исследование демонстрирует, что лечение CsA полностью блокирует гипертрофию сердца, вызванную физической нагрузкой.
Затем NFAT активирует прогипертрофические гены. 1 Многочисленные исследования показали, что активность кальциневрина повышена в сердце пациентов с сердечной гипертрофией и сердечной недостаточностью, 90 , а ингибирование этого пути циклоспорином А (CsA) может задержать прогрессирование патологической сердечной недостаточности на животных моделях. 91 Однако в других сообщениях показано, что ингибирование кальцинейрина усугубляет патологическое заболевание сердца. 92 Роль кальциневрина в гипертрофии сердца, вызванной физической нагрузкой, остается спорной. 89,93,94 Например, уровни белка кальциневрина снижаются после произвольного обучения бега на колесе у мышей, 94 , в то время как у мышей-репортеров сердечного NFAT активность кальциневрина не меняется после обучения плаванию. 89 Одно исследование показывает, что лечение CsA не блокирует гипертрофию сердца, вызванную физической нагрузкой, 9 , тогда как другое исследование демонстрирует, что лечение CsA полностью блокирует гипертрофию сердца, вызванную физической нагрузкой. 93 Наше недавнее исследование показывает, что уровни и активность кальциневрина повышаются на ранних сроках беременности. 33 Что еще более важно, с помощью лечения CsA мы показываем, что активность кальциневрина необходима для гипертрофии сердца, вызванной беременностью. 33 Ингибирование кальциневрина также блокирует активацию ERK1/2 и Akt. Однако, в отличие от патологической сердечной гипертрофии, регуляция кальциневрина является двухфазной, демонстрируя значительное увеличение на ранних сроках беременности и значительное снижение на поздних сроках беременности. 33,63 В совокупности гипертрофия сердца, вызванная беременностью, модифицируется кальциневрином, ERK1/2, Akt и его нижестоящими мишенями, и эти сигнальные каскады регулируются временным образом. Кроме того, активация кальцинейрина на ранних сроках беременности временно инициирует пути, ответственные за развитие физиологической гипертрофии (9).0323 Рисунок 4 ).
93 Наше недавнее исследование показывает, что уровни и активность кальциневрина повышаются на ранних сроках беременности. 33 Что еще более важно, с помощью лечения CsA мы показываем, что активность кальциневрина необходима для гипертрофии сердца, вызванной беременностью. 33 Ингибирование кальциневрина также блокирует активацию ERK1/2 и Akt. Однако, в отличие от патологической сердечной гипертрофии, регуляция кальциневрина является двухфазной, демонстрируя значительное увеличение на ранних сроках беременности и значительное снижение на поздних сроках беременности. 33,63 В совокупности гипертрофия сердца, вызванная беременностью, модифицируется кальциневрином, ERK1/2, Akt и его нижестоящими мишенями, и эти сигнальные каскады регулируются временным образом. Кроме того, активация кальцинейрина на ранних сроках беременности временно инициирует пути, ответственные за развитие физиологической гипертрофии (9).0323 Рисунок 4 ).
Рисунок 4
Открыть в новой вкладкеСкачать слайд
Сигнальные пути при гипертрофии сердца, вызванной беременностью. Беременность связана с длительной перегрузкой сердца объемом и изменениями гормонального фона, что приводит к гипертрофии сердца. Повышенный уровень прогестерона на ранних сроках беременности активирует кальциневрин. Это увеличение активности кальциневрина временно инициирует пути, такие как Akt и его нижестоящие мишени, а также ERK1/2, которые ответственны за развитие физиологической гипертрофии. Ингибирование кальциневрина при лечении CsA на ранних сроках беременности блокирует активацию Akt и ERK1/2 и блокирует гипертрофию сердца, вызванную беременностью. Специфический ингибитор MEK 1 (PD
Беременность связана с длительной перегрузкой сердца объемом и изменениями гормонального фона, что приводит к гипертрофии сердца. Повышенный уровень прогестерона на ранних сроках беременности активирует кальциневрин. Это увеличение активности кальциневрина временно инициирует пути, такие как Akt и его нижестоящие мишени, а также ERK1/2, которые ответственны за развитие физиологической гипертрофии. Ингибирование кальциневрина при лечении CsA на ранних сроках беременности блокирует активацию Akt и ERK1/2 и блокирует гипертрофию сердца, вызванную беременностью. Специфический ингибитор MEK 1 (PD
), который находится непосредственно перед ERK1/2, блокирует опосредованную прогестероном изолированную гипертрофию неонатальных миоцитов.
95 Гипертрофия сердца, вызванная физической нагрузкой, сопровождается пропорциональным увеличением плотности сердечных капилляров, 96 , тогда как патологическая гипертрофия, вызванная перегрузкой давлением, коррелирует со снижением плотности капилляров. 53 Во время беременности ангиогенез миокарда, оцениваемый по увеличению как плотности капилляров на кардиомиоцит, так и фактора роста эндотелия сосудов А (Vegfa), значительно увеличивается. 19,82 Кроме того, уровни мРНК ангиогенных факторов, таких как PGC-1α (Pgc1a), Vegfa, ангиогпиетин-1 и факт роста фибробластов 2, значительно повышаются в период от раннего до среднего периода беременности, но возвращаются к не- контрольные уровни беременных на поздних сроках беременности. 33 Предполагается, что плацента секретирует ингибиторы VEGF, такие как растворимая fms-подобная тирозинкиназа 1, которые создают антиангиогенную среду на поздних сроках беременности, и это более выражено при преэклампсии и многоплодной беременности. 97 Предполагается, что путь Akt-mTOR опосредует как рост сердца, так и ангиогенез. 95 Однако пролонгированная передача сигналов Akt предотвращает ангиогенез за счет подавления mTOR-опосредованного ангиогенеза. 98 Ранее мы показали, что фосфорилирование нижестоящих мишеней Akt увеличивается в середине беременности, но возвращается к небеременным контрольным уровням на поздних сроках беременности, тогда как Akt активируется в середине и конце беременности. 6 Длительная активация Akt (с середины до поздних сроков беременности) на фоне повышенного уровня mTOR только в середине беременности может привести к возвращению ангиогенных факторов к контрольным уровням, характерным для небеременных. Причинно-следственная связь между активацией Akt и ангиогенезом во время беременности требует дальнейшего изучения. 11 Данные, полученные на животных и людях, позволяют предположить, что гипертрофия сердца, вызванная беременностью, имеет сходные характеристики с физическими упражнениями, включая обратимость, структурные и молекулярные фенотипы и некоторые общие сигнальные пути, но также имеет различные особенности ( Таблица 1 ). Изменения уровня женских половых гормонов играют решающую роль в адаптации сердца к беременности. 6,32,33 В частности, выбросы прогестерона на ранних сроках беременности, по-видимому, инициируют гипертрофический сигнальный каскад. Всплески эстрадиола на поздних сроках беременности (15–16 дней беременности у мышей) 30 , по-видимому, инициируют ремоделирование сердца в послеродовой период, 33 , но необходимо провести дополнительные исследования роли эстрадиола в регрессии гипертрофии сердца после беременности . Как показано на Рисунок 4 , гипертрофия сердца, вызванная беременностью, очень динамична, и сигнальные каскады изменяются с течением времени беременности.
97 Предполагается, что путь Akt-mTOR опосредует как рост сердца, так и ангиогенез. 95 Однако пролонгированная передача сигналов Akt предотвращает ангиогенез за счет подавления mTOR-опосредованного ангиогенеза. 98 Ранее мы показали, что фосфорилирование нижестоящих мишеней Akt увеличивается в середине беременности, но возвращается к небеременным контрольным уровням на поздних сроках беременности, тогда как Akt активируется в середине и конце беременности. 6 Длительная активация Akt (с середины до поздних сроков беременности) на фоне повышенного уровня mTOR только в середине беременности может привести к возвращению ангиогенных факторов к контрольным уровням, характерным для небеременных. Причинно-следственная связь между активацией Akt и ангиогенезом во время беременности требует дальнейшего изучения. 11 Данные, полученные на животных и людях, позволяют предположить, что гипертрофия сердца, вызванная беременностью, имеет сходные характеристики с физическими упражнениями, включая обратимость, структурные и молекулярные фенотипы и некоторые общие сигнальные пути, но также имеет различные особенности ( Таблица 1 ). Изменения уровня женских половых гормонов играют решающую роль в адаптации сердца к беременности. 6,32,33 В частности, выбросы прогестерона на ранних сроках беременности, по-видимому, инициируют гипертрофический сигнальный каскад. Всплески эстрадиола на поздних сроках беременности (15–16 дней беременности у мышей) 30 , по-видимому, инициируют ремоделирование сердца в послеродовой период, 33 , но необходимо провести дополнительные исследования роли эстрадиола в регрессии гипертрофии сердца после беременности . Как показано на Рисунок 4 , гипертрофия сердца, вызванная беременностью, очень динамична, и сигнальные каскады изменяются с течением времени беременности. Стимулы как физических упражнений, так и беременности могут привести к сердечной патологии. Например, внезапная смерть может наступить у спортсменов, 99 , а беременность может быть связана с неблагоприятными событиями, такими как перипартальная кардиомиопатия, часто смертельная 97,100 , и более уязвима к ИР на поздних сроках беременности. 50 Хотя сердца поздних сроков беременности, по-видимому, работают на грани дисфункции, 6,10,50 снижение сердечной функции после ИР-повреждения полностью восстанавливается до уровня небеременных контролей через 7 дней после родов. 50 Таким образом, мы можем заключить, что гипертрофия сердца, вызванная беременностью, характеризуется многими признаками физиологической гипертрофии.
Стимулы как физических упражнений, так и беременности могут привести к сердечной патологии. Например, внезапная смерть может наступить у спортсменов, 99 , а беременность может быть связана с неблагоприятными событиями, такими как перипартальная кардиомиопатия, часто смертельная 97,100 , и более уязвима к ИР на поздних сроках беременности. 50 Хотя сердца поздних сроков беременности, по-видимому, работают на грани дисфункции, 6,10,50 снижение сердечной функции после ИР-повреждения полностью восстанавливается до уровня небеременных контролей через 7 дней после родов. 50 Таким образом, мы можем заключить, что гипертрофия сердца, вызванная беременностью, характеризуется многими признаками физиологической гипертрофии.Конфликт интересов: не заявлен.
A. Leinwand (HL50560).Ссылки
1
Heineke
J
,
Молкентин
JD
.
Регуляция гипертрофии сердца с помощью внутриклеточных сигнальных путей
7
(стр.
589
—
600
)
2
McMullen
JR
,
Jennings
JR
,
Jenning0003
ГЛ
.
Различия между патологической и физиологической гипертрофией сердца: новые терапевтические стратегии лечения сердечной недостаточности
34
(pg.
255
—
262
)
3
Gonzalez
AMD
,
Osorio
JC
,
Manlhiot
C
,
Gruber
D
,
Homma
S
,
Mital
S
.
Передача сигналов гипертрофии во время перинатального ремоделирования сердца
293
(стр.
h4008
—
h4013
)
4
Lemmens
K
,
Doggen
K
,
De Keulenaer
GW
2
2.
Активация системы нейрегулин/ErbB во время физиологического ремоделирования желудочков при беременности
300
(стр.
H931
—
H942
)
5
Iorga
A
,
Dewey
S
,
Partow-Navid
R
,
Gomes
AV
,
Eghbali
M
.
Беременность связана со снижением активности сердечных протеасом и окислительным стрессом у мышей
7
стр.
e48601
6
Chung
E
,
Yeung
F
,
Leinwand
LA
.
Akt и MAPK сигнализируют опосредованную адаптацию сердца к беременности, вызванную беременностью
112
(стр.
1565
—
1575
)
7
Френцель
H
,
Schwartzkopff
B
,
Höltermann
W
,
Schnürch
HG
,
42442442442442442442442442442442442442442442442442442442442442442442424242н
Регресс сердечной гипертрофии: морфометрические и биохимические исследования сердца крыс после обучения плаванию
20
(стр.
737
—
751
)
.
Гипертрофия сердца во время беременности: лучше работает сердце?
,
Trends Cardiovasc Med
,
2006
, vol.
16
(стр.
285
—
291
)
9
Hainsey
T
,
CSISZAR
A
,
,
Edwards
JG
.
Циклоспорин А не блокирует гипертрофию сердца, вызванную физической нагрузкой
34
(стр.
1249
—
1254
)
10
Эхбали0003
M
,
,
Alioua
A
,
Minosyan
TY
,
,
, et al.
Молекулярные и функциональные признаки гипертрофии сердца во время беременности
96
(стр.
1208
—
1216
)
11
Чанг
E
,
Heimiller
J
,
Leinwand
LA
.
Различные профили сердечной транскрипции, определяющие беременность и физическую нагрузку
7
стр.
e42297
12
Дорн
GW
II
.
Нечеткая логика физиологической гипертрофии сердца
,
Гипертония
,
2007
, том.
49
(pg.
962
—
970
)
13
Bassien-Capsa
V
,
Fouron
J-C
,
Comte
B
,
Чорватова
А
.
Структурное, функциональное и метаболическое ремоделирование миоцитов левого желудочка крысы в норме и при беременности с добавлением натрия
,
Cardiovasc Res
,
2006
, том.
69
(pg.
423
—
431
)
14
Maillet
M
,
van Berlo
JH
,
Molkentin
JD
.
Молекулярная основа физиологического роста сердца: фундаментальные концепции и новые игроки
,
Nat Rev Mol Cell Biol
,
2013
, том.
14
(стр.
38
—
48
)
15
Hunter
JJ
,
KR
.
Механизмы заболевания: сигнальные пути сердечной гипертрофии и сердечной недостаточности
341
(стр.
1276
—
1283
)
16
Perrino
C
,
Prasad
SVN
,
,
,
,
Kim
H-S
, и другие.
Перемежающаяся перегрузка давлением вызывает независимую от гипертрофии сердечную дисфункцию и сосудистое разрежение
116
(pg.
1547
—
1560
)
17
Zafeiridis
A
,
Jeevanandam
V
,
Houser
SR
,
Маргулиес
КБ
.
Регресс клеточной гипертрофии после поддержки вспомогательного устройства для левого желудочка98
, том.
98
(стр.
656
—
662
)
18
Шапиро
LM
.
Физиологическая гипертрофия левого желудочка
52
(стр.
130
—
135
)
19
, 3 900
02 R
,
Iorga
A
,
Amjedi
M
,
Matori
H
,
Eghbala
M
,
.
Кардиальные структурные и гемодинамические изменения, связанные с физиологической гипертрофией сердца во время беременности, обращаются после родов
113
(стр.
1253
—
1259
)
20
Robson
SC
,
Hunter
S
,
Moore
M
,
Dunlop
W
.
Гемодинамические изменения в послеродовом периоде: эхокардиографическое исследование в допплеровском и М-режиме
94
(стр.
1028
—
1039
)
21
CLAPP
JF
,
E
.
Сердечно-сосудистая функция до, во время и после первой и последующих беременностей
80
(стр.
1469
—
1473
)
22
Облигация
CF
.
Изменения объема крови у лактирующих крыс
63
(стр.
285
—
289
)
23
Longo
LD
.
Объем крови матери и сердечный выброс во время беременности: гипотеза эндокринологического контроля
,
Am J Physiol Regul Integr Comp Physiol
,
1983
, том.
245
(pg.
R720
—
R729
)
24
Barron
WM
,
Mujais
SK
,
Zinaman
M
,
Bravo
EL
,
Lindheimer
MD
.
Реакции катехоламинов плазмы на физиологические стимулы при нормальной беременности у человека
154
(стр.
80
—
84
)
25
Conrad
KP
.
Расширение сосудов у матери во время беременности: возрастающая роль релаксина
,
Am J Physiol Regul Integr Comp Physiol
,
2011
, том.
301
(pg.
R267
—
R275
)
26
Natrajan
PG
,
McGarrigle
HH
,
Lawrence
DW
,
Лашелен
ГК
.
Уровни норадреналина и адреналина в плазме при нормальной беременности и гипертензии, вызванной беременностью
,
Br J Obstet Gynaecol
,
1982
, том.
89
(стр.
1041
—
1045
)
27
WHITTAKER
PG
,
J.
,
J.
,
,
.
Реакция катехоламинов на изменения позы во время беременности человека
,
Br J Obstet Gynaecol
,
1985
, том.
92
(стр.
586
—
592
)
28
.
Сердечно-сосудистые реакции на циркулирующие катехоламины при нормальной беременности и гипертензии, вызванной беременностью0003
, том.
5
(стр.
479
—
493
)
29
DIRGO
BB
,
GB
,
GG
,
G.
,
.
Уровни прогестерона в сыворотке беременных и послеродовых лабораторных мышей
95
(стр.
1486
—
1490
)
30
McCormack
JT
,
Гринвальд
GS
.
Концентрации прогестерона и эстрадиола-17b в периферической плазме во время беременности у мышей
62
(стр.
101
—
107
)
31
Мурр
30002 SM
,
Stabenfeldt
GH
,
Bradford
GE
,
Geschwind
II
.
Прогестерон плазмы во время беременности у мышей
94
(стр.
1209
—
1211
)
32
Гольдштейн
0002 J
,
Сайты
CK
,
Toth
MJ
.
Прогестерон стимулирует синтез белка сердечной мышцы через рецептор-зависимый путь
82
(стр.
430
—
436
)
33
Chung
E
,
0003
F
,
Лейнванд
LA
.
Активность кальциневрина необходима для ремоделирования сердца при беременности
100
(стр.
402
—
410
)
34
van Eickels
M
,
2
.0003
JPM
,
Janssen
BJ
,
Wellens
HJJ
,
DoEvendans
PA
.
17{бета}-эстрадиол ослабляет развитие гипертрофии перегрузки давлением
,
Кровообращение
104
(стр.
1419
—
1423
)
35
HART
MV
,
Hosenpud
JD
,
Hohimer
AR
,
Morton
MJ
.
Гемодинамика во время беременности и введение половых стероидов у морских свинок
249
(стр.
R179
—
R185
)
36
Serra
AJ
,
Santos
MHH
,
Bocalini
DS
,
Antônio
EL
,
Levy
RF
,
Сантос
AA
, и др.
Упражнения ингибируют воспалительные цитокины и более чем предотвращают дисфункцию миокарда у крыс с устойчивой бета-адренергической гиперактивностью
,
Дж Физиол
,
2010
, том.
588
(стр.
2431
—
2442
)
37
Murray
DR
,
.
Хроническая β-адренергическая стимуляция индуцирует экспрессию миокардиальных провоспалительных цитокинов
,
Тираж
,
2000
, том.
101
(pg.
2338
—
2341
)
38
,
,
,
Corbett
D
,
Mendoza
L
,
Frangogiannis
N
.
Характеристика воспалительной и фиброзной реакции в мышиной модели перегрузки сердечным давлением
,
Histochem Cell Biol
,
2009
, том.
131
(pg.
471
—
481
)
39
Iemitsu
M
,
Maeda
S
,
Miyauchi
T
,
Мацуда
M
,
Танака
H
.
Профилирование экспрессии генов гипертрофии сердца, вызванной физической нагрузкой, у крыс
,
Acta Physiol Scand
,
2005
, том.
185
(стр.
259
—
270
)
40
Wojtaswskis
9000.
29292.
9000.
9000. 9000.
9000. 9000.
9000. 9000.
9000. 9000.
9000. 9000.
9000. 9000.
9000. 9000.
9000. 9000.
9000. 9000.
9000. 9000.
9000. 9000.
9000.
9000.
9000. 9000.
9000. 9000.
9000. 9000.
9000. 9000.
9000. 9000.
9000. 9000.
9000. 9000.
9000. 9000.
9000. 9000.
9000.
9000.
9000. 9000.
9000. 9000.
9000. 9000.
9000. 9000.
9000. 9000.
9000. 9000.
9000. 9000.
9000.
9000.
9000. 9000.
9000. 9000.
9000. 9000.
9000. 9000.
9000. 9000.
9000.
9000.
9000. 9000.
9000. 9000.
9000. 9000.
9000.
9000.
9000. 9000.
9000.
.
Kiens
B
,
Рихтер
EA
.
Высвобождение интерлейкина-6 скелетными мышцами человека во время физической нагрузки: связь с активностью AMPK
95
(pg.
2273
—
2277
)
41
Velez
DR
,
Fortunato
SJ
,
Morgan
N
,
Эдвардс
TL
,
Lombardi
SJ
,
Williams
SM
, и др.
Профили цитокинов различаются в зависимости от исхода беременности и этнической принадлежности
23
(стр.
1902
—
1909
)
42
Pazos
P
,
,
P
,
,
P
,
,
P
,
,
.0003
Casanueva
FF
,
Диегес
C
,
Гарсия
MC
3 .
Дефицит интерлейкина 6 модулирует гипоталамическую экспрессию пептидов, регулирующих энергетический баланс, во время беременности у мышей
8
стр.
e72339
43
Вассилиадис
S
,
Ranella
A
,
Papadimitriou
L
,
Makrygiannakis
A
,
Athanassakis
I
.
Уровни про- и противовоспалительных цитокинов в сыворотке крови у небеременных женщин, во время беременности, родов и абортов
7
(стр.
69
—
72
)
44
Vogiagis
D
,
Salamonsen
La
24.
Роль ингибиторного фактора лейкемии в установлении беременности
160
(стр.
181
—
190
)
45
Fischer
P
,
Hilfiker-Kleiner
D
.
Пути выживания при гипертрофии и сердечной недостаточности: ось gp130-STAT3
102
(стр.
279
—
297
)
46
Diffee
GM
,
E
,
E
,
g
,
g
,
г
0003
.
Изменение скоростно-силовых и силовых свойств отдельных клеток в тренированном миокарде крысы
94
(pg.
1941
—
1948
)
47
,
Jurcuţ
R
,
Giuşcă
S
,
van Mieghem
Т
,
Гусси
I
,
Попеску
BA
, и др.
Морфофункциональная адаптация материнского сердца во время беременности
5
(стр.
289
—
297
)
48
Mone
SM
,
Sanders
.0003
SP
,
Колан
SD
.
Механизмы контроля физиологической гипертрофии беременных
,
Кровообращение
,
1996
, том.
94
(pg.
667
—
672
)
49
Schannwell
CM
,
Zimmermann
T
,
Schneppenheim
M
,
Plehn
G
,
,
Strauer
BE
.
Гипертония левого желудочка и диастолическая дисфункция у здоровых беременных
97
(стр.
73
—
78
)
50
,
,
Iorga
,
,
Iorga
003
A
,
Youn
J-Y
,
,
Regitz-Zagrosek
V
3 90etal.
Уязвимость сердца к ишемическому/реперфузионному повреждению резко возрастает на поздних сроках беременности
107
(стр.
1
—
11
)
51
Баттрик
PM
,
Schaible
TF
,
Malhotra
A
,
Mattioli
S
,
.
Влияние беременности на сердечную функцию и энзимологию миозина у крыс
252
(стр.
H846
—
H850
)
52
GRAHAM
HK
,
,
Trafford
AW
.
Профили внеклеточного матрикса при прогрессировании сердечной недостаточности
194
(стр.
3
—
21
)
53
Содерс
0002 CA
,
Borg
TK
,
Banerjee
I
,
Baudino
TA
.
Перегрузка давлением вызывает ранние морфологические изменения в сердце
,
Am J.
181
(стр.
1226
—
1235
)
54
3 9 Брауэр0002 GL
,
Gardner
JD
,
Forman
MF
,
Murray
DB
,
Voloshenyuk
T
,
Levick
SP
, и другие.
Взаимосвязь между ремоделированием внеклеточного матрикса миокарда и функцией желудочка0424 , том.
30
(стр.
604
—
610
)
55
Vanhoutte
D
,
Heymans
S
,
S
,
.
TIMPs и ремоделирование сердца: охват MMP-независимой стороны семейства
,
J Mol Cell Cardiol
,
2010
, vol.
48
(стр.
445
—
453
)
56
,
Gibson
G
,
McTiernan
CF.
Дифференциальная экспрессия ММП и ТИМП при сердечной недостаточности средней и тяжелой степени в трансгенной модели
12
(стр.
314
—
325
)
57
Марижановский
MM
,
Тилинг
P
,
,
Becker
AE
.
Дилатационная кардиомиопатия связана с увеличением соотношения коллагена типа I/типа III: количественная оценка
25
(стр.
1263
—
1272
)
58
Муджумдар
ВС
,
Тяги
SC
.
Временная регуляция компонентов внеклеточного матрикса при переходе от компенсаторной гипертрофии к декомпенсаторной сердечной недостаточности
17
(стр.
261
—
270
)
59
02 3 S 90 90 Хейманс
4,
Schroen
B
,
Vermeersch
P
,
Обливание
H
,
,
Kassner
A
,
Kassner
A
,
Kassner
924,
,
.
Повышенная сердечная экспрессия тканевого ингибитора металлопротеиназы-1 и тканевого ингибитора металлопротеиназы-2 связана с сердечным фиброзом и дисфункцией сердца человека с хронической перегрузкой давлением
,
Кровообращение
,
2005
, том.
112
(pg.
1136
—
1144
)
60
,
,
,
,
Ryan
AM
,
Ogasawara
AK
и др.
Влияние физических упражнений на сердечную функцию, экспрессию генов и апоптоз у крыс
,
Am J Physiol Heart Circ Physiol
,
2000
, том.
279
(pg.
h3994
—
h4002
)
61
Aljabri
MB
,
Songstad
NT
,
,
Serrano
MC
,
Andreasen
TV
,
Al-Saad
S
, et al.
Беременность защищает от антиангиогенного и фиброгенного действия ангиотензина II в сердце крысы
,
Acta Physiol
,
2011
, том.
201
(стр.
445
—
456
)
62
Zamani
P
,
B
.
Новые вазодилататоры при сердечной недостаточности
10
(стр.
1
—
11
)
63
Rimbaud
S
,
Sanchez
H
,
Garnier
A
,
Fortin
D
,
Бигард
Х
,
Векслер
В
, и др.
Стимул-специфические изменения энергетического обмена в гипертрофированном сердце
,
J Mol Cell Cardiol
,
2009
, vol.
46
(стр.
952
—
959
)
64
Edwards
JG
.
Тренировки по плаванию повышают экспрессию гена желудочково-предсердного натрийуретического фактора (ANF) в качестве ранней адаптации к хроническим нагрузкам
70
(pg.
2753
—
2768
)
65
Diffee
GM
,
Seversen
EA
,
Stein
TD
,
Johnson
JA
.
Анализ экспрессии на микрочипах эффектов тренировки с физической нагрузкой: увеличение предсердного MLC-1 в желудочках крыс
,
Am J Physiol Heart Circ Physiol
,
2003
, том.
284
(pg.
H830
—
H837
)
66
Scheinowitz
M
,
Kessler-Icekson
G
,
Freimann
S
,
Zimmermann
R
,
Schaper
W
,
Голомб
9004 etal. 9004 etal.
Краткосрочные и длительные тренировки по плаванию повышают экспрессию гена инсулиноподобного фактора роста I миокарда
13
(pg.
19
—
25
)
67
Stilli
D
,
Bocchi
L
,
Berni
R
,
Занибони
M
,
Cacciani
F
,
Chaponnier
C
, et al.
Корреляция экспрессии α-скелетного актина, фиброза желудочков и функции сердца со степенью гипертрофии сердца при перегрузке давлением у крыс
91
(стр.
571
—
580
)
68
Carneiro-Júnior
MA
,
Quintão-Júnior
JF
,
Drummond
LR
,
Lavorato
VN
,
Drummond
FR
,
da Cunha
DNQ
, и др.
Положительный эффект тренировки на выносливость в отношении функции кардиомиоцитов у крыс с гипертонией нивелируется в течение четырех недель после отказа от тренировки
,
J Mol Cell Cardiol
,
2013
, vol.
57
(стр.
119
—
128
)
69
Kolwicz
SC
,
.
Метаболизм глюкозы и гипертрофия сердца
90
(стр.
194
—
201
)
70
Garnier
A
,
Fortin
D
,
Deloménie
C
,
Momken
I
,
Veksler
V
,
Ventura-Clapier
R
.
Депрессия митохондриальных факторов транскрипции и окислительная способность у крыс с недостаточностью сердечной и скелетной мускулатуры
,
Дж Физиол
,
2003
, том.
551
(pg.
491
—
501
)
71
Butte
NF
,
Hopkinson
JM
,
Mehta
N
,
Мун
JK
,
Смит
EOB
.
Коррекция расхода энергии и использования субстрата на поздних сроках беременности и в период лактации
,
Am J Clin Nutr
,
1999
, том.
69
(стр.
299
—
307
)
72
BUTTE
NF
.
Углеводный и липидный обмен при беременности: нормальный по сравнению с гестационным сахарным диабетом
71
(стр.
1256s
—
1261s
)
73
DeBosch
B
,
Treskov
I
,
Lupu
TS
,
Weinheimer
C
,
Ковач
A
,
Куртуа
M
, и др.
Akt1 необходим для физиологического роста сердца
,
Циркуляция
,
2006
, том.
113
(pg.
2097
—
2104
)
74
McMullen
JR
,
Shioi
T
,
Zhang
L
,
Тарнавски
О
,
Шервуд
MC
,
Кан
PM
9042 и др.
Фосфоинозитид-3-киназа (p110{альфа}) играет решающую роль в индукции физиологической, но не патологической гипертрофии сердца
100
(pg.
12355
—
12360
)
75
Dorn
GW
II
,
Force
T
.
Каскады протеинкиназ в регуляции сердечной гипертрофии
,
J Clin Invest
,
2005
, том.
115
(стр.
527
—
537
)
76
T
.
Hampe
J
,
Yballe
CM
,
Lawitts
J
и др.
Консервативный путь фосфоинозитид-3-киназы определяет размер сердца у мышей
19
(pg.
2537
—
2548
)
77
Konhilas
JP
,
Maass
AH
,
Luckey
SW
,
Штауффер
BL
,
Olson
EN
,
Leinwand
LA
.
Пол изменяет физическую нагрузку и сердечную адаптацию у мышей
287
(стр.
H3768
—
H3776
)
78
Matsui
T
,
0424,
,
Cook
SA
,
Nagoshi
T
,
Picard
MH
, et al.
Фенотипический спектр, вызванный трансгенной гиперэкспрессией активированного Akt в сердце
277
(стр.
22896
—
22901
)
79
Condorelli
G
,
Drusco
A
,
Stassi
G
,
Bellacosa
A
,
Roncarati
R
,
Iaccarino
G
и др.
Akt индуцирует повышенную сократимость миокарда и размер клеток in vivo у трансгенных мышей
,
Proc Natl Acad Sci USA
,
2002
, том.
99
(pg.
12333
—
12338
)
80
Skurk
C
,
Izumiya
Y
,
Maatz
H
,
Разеги
P
,
Сиодзима
I
,
Сандри
M
, и др.
Фактор транскрипции FOXO3a регулирует размер кардиомиоцитов после передачи сигналов Akt
,
J Biol Chem
,
2005
, том.
280
(pg.
20814
—
20823
)
81
Antos
CL
,
McKinsey
TA
,
,
Kutschke
W
,
McAnally
J
,
Шелтон
JM
, и др.
Активированная гликогенсинтаза-3бета подавляет гипертрофию сердца in vivo
,
Proc Natl Acad Sci USA
,
2002
,
99
(pg.
907
—
912
)
82
Hilfiker-Kleiner
D
,
Kaminski
K
,
Podewski
E
,
Бонда
T
,
Schaefer
A
,
Слива
K
, и др.
Расщепленная катепсином D форма пролактина массой 16 кДа опосредует послеродовую кардиомиопатию
128
(стр.
589
—
600
)
83
Adams
JW
,
0002 Sakata
Y
,
Davis
мг
,
,
,
Liggett
SB
, et al.
Усиленная передача сигналов Galalpha q: общий путь опосредует сердечную гипертрофию и апоптозную сердечную недостаточность
95
(стр.
10140
—
10145
)
84
Akhter
SA
,
Luttrell
LM
,
Rockman
HA
,
Iaccarino
G
,
Lefkowitz
RJ
,
Кох
WJ
.
Нацеливание на интерфейс рецептор-Gq для ингибирования in vivo гипертрофии миокарда при перегрузке давлением
,
Наука
,
1998
, том.
280
(pg.
574
—
577
)
85
Iemitsu
M
,
Maeda
S
,
Jesmin
S
,
Оцуки
T
,
Касуя
Y
,
Мияучи
T
9042 .
Паттерн активации передачи сигналов МАРК в сердце тренированных и нетренированных крыс после однократного упражнения
,
J Appl Physiol
,
2006
, том.
101
(стр.
151
—
163
)
86
из
. ,
Витт
СА
,
Кимбалл
ТР
,
Клевицкого
R
и др.
Сигнальный путь MEK1-ERK1/2 способствует компенсированной гипертрофии сердца у трансгенных мышей
19
(pg.
6341
—
6350
)
87
Yamaguchi
O
,
Higuchi
Y
,
Hirotani
S
,
Кашивасэ
K
,
Накаяма
H
,
Хикосо
S 90et al.
Направленная делеция киназы 1, регулирующей сигнал апоптоза, ослабляет ремоделирование левого желудочка
100
(стр.
15883
—
15888
)
88
Taniike
M
,
Yamaguchi
O
,
Tsujimoto
I
,
Hikoso
S
,
Takeda
T
,
Nakai
A
и др.
Сигнальный путь киназы 1/p38, регулирующий сигнал апоптоза, негативно регулирует физиологическую гипертрофию
,
Циркуляция
,
2008
, том.
117
(pg.
545
—
552
)
89
Wilkins
BJ
,
Dai
Y-S
,
Bueno
OF
,
Парсонс
SA
,
,
Доска
DM
, и др.
Связь кальциневрина/NFAT участвует в патологической, но не физиологической гипертрофии сердца
,
Circ Res
,
2004
, vol.
94
(pg.
110
—
118
)
90
,
Choukroun
G
,
,
Tymitz
KM
,
del Монте
F
,
Гватми
J
, и др.
Дифференциальная активация путей передачи сигнала в сердце человека с гипертрофией по сравнению с прогрессирующей сердечной недостаточностью
,
Тираж
,
2001
, том.
103
(pg.
670
—
677
)
91
Sussman
MA
,
,
,
Taigen
T
,
Olson
EN
,
Robbins
J
, и др.
Профилактика сердечной гипертрофии у мышей путем ингибирования кальциневрина
,
Наука
,
1998
, том.
281
(pg.
1690
—
1693
)
92
Fatkin
D
,
McConnell
BK
,
Mudd
JO
,
Semsarian
C
,
Moskowitz
IGP
,
Schoen
FJ
и др.
Аномальный ответ Ca 2+ при семейной гипертрофической кардиомиопатии, опосредованной белком мутантного саркомера
106
(pg.
1351
—
1359
)
93
,
Yonekura
K
,
Sonoda
M
,
,
,
Сугиура
S
, и др.
Кальциневрин активируется в сердцах крыс с физиологической гипертрофией левого желудочка, вызванной произвольной физической нагрузкой
101
(стр.
2134
—
2137
)
94
Конхилас
JP
,
.0003
Widegren
U
,
Allen
DL
,
Paul
AC
,
Cleary
A
,
Leinwand
LA
.
Бег с колесом под нагрузкой и адаптация мышц у мыши
289
(стр.
h555
—
h565
)
95
Shiojima
I
,
,
Izumiya
Y
,
Schiekofer
S
,
,
, et al .
Нарушение скоординированной сердечной гипертрофии и ангиогенеза способствует переходу в сердечную недостаточность
115
(pg.
2108
—
2118
)
96
Hudlicka
O
,
Brown
M
,
Egginton
S
.
Ангиогенез в скелетных и сердечных мышцах
72
(стр.
369
—
417
)
97
Patten
IS
,
,
Shahul
S
,
Rowe
GC
,
,
, et al.
Сердечный ангиогенный дисбаланс приводит к перипартальной кардиомиопатии
485
(стр.
333
—
338
)
98
Сиодзима
I
,
Уолш
К
.
Регуляция роста сердца и коронарного ангиогенеза с помощью сигнального пути Akt/PKB
20
(стр.
3347
—
3365
)
99
Pelliccia
A
,
0003
Maron
BJ
,
De Luca
R
,
Di Paolo
FM
,
Spataro
A
,
Culasso
F
.
Ремоделирование гипертрофии левого желудочка у спортсменов высокой квалификации после длительной детренировки
105
(стр.
944
—
949
)
100
Hilfiker-Kleiner
D
,
Struman
I
,
,
Podewski
E
,
Sliwa
К
.
Пролактин 16 кДа и бромокриптин при послеродовой кардиомиопатии
9
(стр.
174
—
182
)
Примечания автора
Опубликовано от имени Европейского общества кардиологов. Все права защищены. © The Author 2014. Для получения разрешений обращайтесь по электронной почте: [email protected].
Все права защищены. © The Author 2014. Для получения разрешений обращайтесь по электронной почте: [email protected].
Опубликовано от имени Европейского общества кардиологов. Все права защищены. © The Author 2014. Для получения разрешений обращайтесь по электронной почте: [email protected].
Раздел выпуска:
ТЕМАТИЧЕСКИЕ ОБЗОРЫ: ОБЗОР В ФОКУСЕ СЕРДЕЧНЫХ И СОСУДИСТЫХ ЗАБОЛЕВАНИЙ, ОБУСЛОВЛЕННЫХ БЕРЕМЕННОСТЬЮ
Скачать все слайды
Реклама
Цитаты
Альтметрика
Дополнительная информация о метриках
Оповещения по электронной почте
Оповещение об активности статьи
Предварительные уведомления о статьях
Оповещение о новой проблеме
Получайте эксклюзивные предложения и обновления от Oxford Academic
См.
 также
также
Ссылки на статьи через
Последний
Самые читаемые
Самые цитируемые
BMPR1A способствует взаимодействию ID2-ZEB1 для подавления чрезмерного перехода эндотелия в мезенхиму
Расширение горизонтов эндоваскулярного лечения инсульта: большие сердечники и дополнительные тромболитики
Тимозин β4 и протимозин α способствуют регенерации сердца после ишемического повреждения у мышей
ARHGEF26: новый игрок в транспортировке рецептора 2 фактора роста эндотелия сосудов
Объявленные умершими живут дольше
Реклама
Основные закономерности ремоделирования сердца плода — Полный текст — Диагностика и терапия плода 2020, Vol.
 47, № 5
47, № 5
Сердце является центральным органом в адаптации плода к неблагоприятным условиям окружающей среды. Изменения сердца плода могут сохраняться в постнатальном периоде и повышать риск сердечно-сосудистых заболеваний во взрослом возрасте. Знания о структурном и функциональном ремоделировании сердца плода за последние несколько лет радикально улучшились. Как это происходит в постнатальной жизни, сердце плода перестраивается, изменяя свою структуру и форму, чтобы приспособиться к инсульту. Сообщалось о нескольких состояниях, связанных с ремоделированием сердца плода, включая задержку внутриутробного развития, диабет, воздействие антиретровирусных препаратов, зачатие с помощью вспомогательных репродуктивных технологий, стеноз легочной артерии и другие врожденные пороки сердца. Здесь мы суммировали основные наблюдаемые паттерны ремоделирования сердца, то есть шаровидную форму, гипертрофию без дилатации и гипертрофию с кардиомегалией. Мы обсуждаем потенциальную патофизиологию различных типов ремоделирования. Точное определение различных паттернов ремоделирования сердца плода имеет решающее значение для продвижения в понимании сердечно-сосудистого программирования плода и его последствий для здоровья взрослых, а также, возможно, для разработки превентивных стратегий, которые могут оказать влияние на долгосрочное сердечно-сосудистое здоровье.
Точное определение различных паттернов ремоделирования сердца плода имеет решающее значение для продвижения в понимании сердечно-сосудистого программирования плода и его последствий для здоровья взрослых, а также, возможно, для разработки превентивных стратегий, которые могут оказать влияние на долгосрочное сердечно-сосудистое здоровье.
«Experentia docet»
– Tacitus (Roman)
Введение
Сердце является первым функциональным органом, который развивается. Это подчеркивает его критическую роль в распределении крови, питательных веществ, кислорода и отходов к развивающемуся плоду и от него. Сердце является кинетическим органом, структура и форма которого изменяются в процессе развития и заболевания [1]. Пренатальная среда будет стимулировать развитие сердца, чтобы оно имело оптимальную структуру и функции с учетом существующих условий. Таким образом, сердце необходимо для адаптации плода к патологической среде. На начальных стадиях инсульта сердцу обычно удается адаптироваться, претерпевая изменения формы, структуры и размера (определяемые как ремоделирование сердца) для поддержания оптимальной и эффективной функции [2]. В постнатальной (особенно взрослой) жизни ремоделирование сердца может происходить по разным основным схемам, которые хорошо известны [3]. Доказательства ремоделирования сердца во время внутриутробной жизни все еще свежие, но имеющиеся данные свидетельствуют о том, что у плода развиваются различные паттерны ремоделирования при различных повреждениях. В этой статье мы рассмотрим основные паттерны ремоделирования сердца, которые до сих пор были описаны внутриутробно при нескольких физиологических и патологических состояниях, а также его связь с сердечной дисфункцией и недостаточностью.
В постнатальной (особенно взрослой) жизни ремоделирование сердца может происходить по разным основным схемам, которые хорошо известны [3]. Доказательства ремоделирования сердца во время внутриутробной жизни все еще свежие, но имеющиеся данные свидетельствуют о том, что у плода развиваются различные паттерны ремоделирования при различных повреждениях. В этой статье мы рассмотрим основные паттерны ремоделирования сердца, которые до сих пор были описаны внутриутробно при нескольких физиологических и патологических состояниях, а также его связь с сердечной дисфункцией и недостаточностью.
Main Text
Нормальная структура и функция сердца плода
Основной функцией сердца является циркуляция крови для обеспечения адекватной перфузии органов [4]. Сердце выполняет эту функцию, сначала наполняя желудочки (диастола), а затем сокращая свои мышечные стенки вокруг закрытой камеры, чтобы создать достаточное давление для выброса крови из желудочка в аорту/легочную артерию (систола) [4, 5]. Таким образом, рост сердца во время внутриутробного развития определяется условиями, которым оно должно удовлетворять: кровотоком и механическими силами, воздействующими на мышцу. По существу, форма и функция сердца в основном определяются внутренними свойствами ткани, такими как сократимость миоцитов, ориентация волокон, эластичность ткани, геометрия сердца, а также граничными условиями, такими как взаимодействие сегментов, условия нагрузки, электрическая активация и перфузия миокарда. Кроме того, важными факторами являются внутреннее созревание миокарда, а также периферическое кровообращение и потребность плода.
Таким образом, рост сердца во время внутриутробного развития определяется условиями, которым оно должно удовлетворять: кровотоком и механическими силами, воздействующими на мышцу. По существу, форма и функция сердца в основном определяются внутренними свойствами ткани, такими как сократимость миоцитов, ориентация волокон, эластичность ткани, геометрия сердца, а также граничными условиями, такими как взаимодействие сегментов, условия нагрузки, электрическая активация и перфузия миокарда. Кроме того, важными факторами являются внутреннее созревание миокарда, а также периферическое кровообращение и потребность плода.
Сердце как центральный орган в адаптивной реакции плода на оскорбления
Сердце является ключевым органом в адаптивной реакции плода на такие воздействия, как токсины, гипоксия, недоедание или перегрузка давлением/объемом. Сердце плода будет адаптироваться, изменяя свою структуру и форму, чтобы обеспечить оптимальное кровоснабжение органов, где миоциты работают в своих наиболее эффективных (механических) условиях; этот процесс определяется как ремоделирование сердца. Характер ремоделирования сердца зависит от типа инсульта, времени и продолжительности воздействия. Отличительными паттернами ремоделирования являются изменение формы (более шаровидные желудочки, оптимизация сил миоцитов в ответ на перегрузку давлением), гипертрофия миокарда (улучшение сократительной способности в ответ на перегрузку давлением) или расширение полости (увеличение потенциала выброса, обычно вторичное по отношению к перегрузке объемом) или гипоплазия. .
Характер ремоделирования сердца зависит от типа инсульта, времени и продолжительности воздействия. Отличительными паттернами ремоделирования являются изменение формы (более шаровидные желудочки, оптимизация сил миоцитов в ответ на перегрузку давлением), гипертрофия миокарда (улучшение сократительной способности в ответ на перегрузку давлением) или расширение полости (увеличение потенциала выброса, обычно вторичное по отношению к перегрузке объемом) или гипоплазия. .
Изменения структуры и формы сердца обычно сопровождаются субклиническими изменениями в работе сердца; этот процесс ремоделирования может привести к сердечной дисфункции. Сердечная дисфункция плода может повлиять на систолическую — способность перекачивать достаточное количество крови в кровоток — и/или диастолическую — способность расслаблять миокард для наполнения желудочков — функции. Изменения в архитектуре сердца могут также приводить к изменениям ротации и перекрута желудочков [6-8]. В большинстве клинических ситуаций дисфункция сердца плода носит субклинический характер. Однако, если инсульт достаточно тяжелый или сохраняется, нарушение сердечной насосной функции для поддержания системного и/или легочного кровообращения и нарушение релаксации миокарда с повышенным давлением наполнения желудочков приводят к клинической сердечной недостаточности, которая в основном проявляется внутриутробно как водянка плода.
Однако, если инсульт достаточно тяжелый или сохраняется, нарушение сердечной насосной функции для поддержания системного и/или легочного кровообращения и нарушение релаксации миокарда с повышенным давлением наполнения желудочков приводят к клинической сердечной недостаточности, которая в основном проявляется внутриутробно как водянка плода.
Основные детерминанты ремоделирования сердца плода
Адаптация сердца к ноксасам приводит к увеличению массы миокарда и/или дилатации. Ремоделирование сердца может затрагивать все сердце (например, кардиомегалия) или, предпочтительно, затрагивать правый/левый желудочки/предсердия. У плода изменения, как правило, более выражены в правой половине, что, скорее всего, отражает доминирование правой половины сердца в пренатальном периоде и более высокую восприимчивость правого желудочка к перегрузке давлением по сравнению с левым желудочком. Фактически, правый желудочек действует как «системный» желудочек в жизни плода, отвечая за перфузию органов плода, а также плаценты.
Аномальная среда может воздействовать на сердце плода посредством различных механизмов:
Прямое повреждение миокарда. На миокард могут воздействовать непосредственно токсины (например, антиретровирусные препараты) [9], гипоксия/ишемия (например, плацентарная недостаточность [10] или анемия) или генетические кардиомиопатии, вызывающие глобальный/региональный отек, воспаление, беспорядок волокон, фиброз, или потеря клеток. Сердечная токсичность часто компенсируется гипертрофией миокарда, компенсирующей потерю клеток или снижение внутренней сократительной способности.
Перегрузка по давлению. Легочный/аортальный стеноз [5, 11], синдром трансфузии близнецов [12-14], заболевание плаценты [15] и зачатие с помощью вспомогательных репродуктивных технологий [16] вызывают перегрузку давлением и запускают сердечный ответ плода, изменение на более шаровидную форму (чтобы лучше переносить нагрузку на стенку) и последующее дальнейшее увеличение сократительной силы (гипертрофия миокарда), а также уменьшение внутреннего диаметра камеры.
Перегрузка тома. Пренатальная перегрузка объемом возникает при анемии плода [17], васкуляризированных опухолях [17], тяжелой задержке внутриутробного развития [6, 15, 18, 19], аномальном венозном оттоке [20] или трансфузионном синдроме от близнеца к плоду [12, 14]. Естественная реакция заключается в увеличении размеров сердца (сердечная дилатация), что увеличивает ударный объем с каждым ударом, чтобы лучше справляться с увеличенным объемом крови.
Таким образом, сердце плода обычно адаптируется к ноксам путем изменения формы, увеличения массы миокарда и/или расширения. Хотя ремоделирование сердца, таким образом, индуцируется для компенсации неблагоприятных условий, существуют некоторые существенные различия между ремоделированием плода и взрослого человека. Учитывая, что ремоделирование плода происходит во время развития, внутренняя форма и (микро)структура все еще могут изменяться, в то время как во взрослой жизни эти изменения гораздо более ограничены. Кроме того, некоторые повреждения плода исчезают с рождением, так что сердце, оптимизированное для конкретных состояний плода, может быть не идеальным для постнатальной жизни.
Паттерны ремоделирования желудочков обычно определяются по размеру и форме желудочка, наличию гипертрофии миокарда и соотношению между массой миокарда и размерами полости. Концентрическое ремоделирование определяется увеличением отношения массы к полости и обычно наблюдается, когда давление приводит к гипертрофии или гиперплазии кардиомиоцитов. Напротив, соотношение массы и полости сохраняется при эксцентрической гипертрофии и обычно является вторичным по отношению к объемной нагрузке, вызывающей удлинение миоцитов. Ремоделирование предсердий встречается реже и обычно проявляется в виде дилатации.
Эхокардиографическая оценка формы и размера сердца плода
Во взрослом возрасте наличие и характер ремоделирования сердца оценивают с помощью визуализации для оценки объемов желудочков и предсердий, массы левого желудочка (для определения гипертрофии миокарда) и относительной толщины стенок или массы- отношение к полости. Эхокардиография является наиболее часто используемым методом, но магнитно-резонансная томография сердца или компьютерная томография могут обеспечить более точные измерения. В то время как радиация исключает использование компьютерной томографии для оценки плода, относительно ограниченное использование внутриутробно, относительно небольшой размер сердца плода, повышенная частота сердечных сокращений плода и отсутствие ЭКГ плода также препятствуют использованию магнитного резонанса сердца в пренатальной жизни. Таким образом, фетальная эхокардиография считается лучшим доступным методом оценки ремоделирования сердца плода путем измерения размеров сердца, желудочков и предсердий (диаметра и площади) и толщины стенки миокарда.
В то время как радиация исключает использование компьютерной томографии для оценки плода, относительно ограниченное использование внутриутробно, относительно небольшой размер сердца плода, повышенная частота сердечных сокращений плода и отсутствие ЭКГ плода также препятствуют использованию магнитного резонанса сердца в пренатальной жизни. Таким образом, фетальная эхокардиография считается лучшим доступным методом оценки ремоделирования сердца плода путем измерения размеров сердца, желудочков и предсердий (диаметра и площади) и толщины стенки миокарда.
Двухмерная эхокардиография плода показала свою высокую применимость и воспроизводимость для оценки структуры и формы сердца плода при соблюдении стандартизированной и строгой методологии (рис. 1) [21, 22]. Апикальная или базальная четырехкамерная проекция позволяет измерять размеры сердца, желудочков и предсердий (диаметры и площади) и форму (сферичность путем деления продольного на поперечный диаметр) с использованием определенных ориентиров. Для измерения толщины стенки миокарда рекомендуется боковой двухмерный или четырехкамерный М-режим. Большинство сердечных и желудочковых параметров стандартизировано для измерения в конце диастолы (при максимальном растяжении желудочков в кадре, когда атриовентрикулярные клапаны закрываются), в то время как размеры предсердий обычно рекомендуется оценивать в конце систолы (максимальное растяжение предсердий непосредственно перед открытием). атриовентрикулярных клапанов). Стандартные критерии и номограммы для большинства размеров сердца плода на протяжении всей беременности доступны с использованием стандартного 2D эхокардиографа [21, 22], а также нового применения спекл-трекинговой эхокардиографии [23]. Несмотря на отсутствие фактического консенсуса, паттерны ремоделирования сердца в жизни плода обычно описываются с указанием сердечных, желудочковых и предсердных областей, индексов сферичности желудочков, толщины стенки перегородки и относительной толщины стенки, скорректированных в зависимости от гестационного возраста или расчетной массы плода (таблица 1).
Для измерения толщины стенки миокарда рекомендуется боковой двухмерный или четырехкамерный М-режим. Большинство сердечных и желудочковых параметров стандартизировано для измерения в конце диастолы (при максимальном растяжении желудочков в кадре, когда атриовентрикулярные клапаны закрываются), в то время как размеры предсердий обычно рекомендуется оценивать в конце систолы (максимальное растяжение предсердий непосредственно перед открытием). атриовентрикулярных клапанов). Стандартные критерии и номограммы для большинства размеров сердца плода на протяжении всей беременности доступны с использованием стандартного 2D эхокардиографа [21, 22], а также нового применения спекл-трекинговой эхокардиографии [23]. Несмотря на отсутствие фактического консенсуса, паттерны ремоделирования сердца в жизни плода обычно описываются с указанием сердечных, желудочковых и предсердных областей, индексов сферичности желудочков, толщины стенки перегородки и относительной толщины стенки, скорректированных в зависимости от гестационного возраста или расчетной массы плода (таблица 1).
Таблица 1.
Эхокардиографические параметры плода, предлагаемые для оценки закономерностей ремоделирования сердца в пренатальной жизни
Рис. 1.
Схемы сердца плода, иллюстрирующие измерение диаметров и площади сердца ( a ), диаметров и площадей желудочков ( b ) и толщины стенок миокарда в конце диастолы ( c ), а также диаметров и площадей предсердий в конце систолы ( d ). ЛЖ, левый желудочек; ПВ, правый желудочек; ЛА, левое предсердие; РА, правое предсердие.
Паттерны ремоделирования сердца плода
Здесь мы суммируем основные черты наиболее часто описываемых паттернов ремоделирования сердца плода (рис. 2).
Рис. 2.
Схемы сердца плода, иллюстрирующие закономерности ремоделирования сердца плода. a Шаровидная форма при поздней легкой задержке роста плода. b Гипертрофия миокарда и дилатация предсердий у плодов, зачатых с помощью вспомогательных репродуктивных технологий. c Гипертрофия миокарда и кардиомегалия у плодов, подвергшихся воздействию материнской ВИЧ-инфекции и антиретровирусных препаратов. d Гипертрофия миокарда, дилатация желудочков и кардиомегалия при ранней тяжелой задержке роста плода. ЛЖ, левый желудочек; ПВ, правый желудочек; ЛА, левое предсердие; РА, правое предсердие.
c Гипертрофия миокарда и кардиомегалия у плодов, подвергшихся воздействию материнской ВИЧ-инфекции и антиретровирусных препаратов. d Гипертрофия миокарда, дилатация желудочков и кардиомегалия при ранней тяжелой задержке роста плода. ЛЖ, левый желудочек; ПВ, правый желудочек; ЛА, левое предсердие; РА, правое предсердие.
Шаровидная форма
Шаровидное сердце характеризуется негипертрофированными, более сферическими желудочками с нормальным размером сердца (рис. 2а), обычно связанным с умеренным уменьшением продольного движения и нарушением релаксации [6, 15]. Этот паттерн был описан в легких случаях задержки роста плода, диагностированной на поздних сроках беременности, когда предположительно легкая степень плацентарной недостаточности повышает давление и вызывает компенсаторное изменение формы сердца без необходимости гипертрофии миокарда. Предлагаемый механизм заключается в том, что сердце плода должно работать против более устойчивой плаценты (перегрузка давлением) и ремоделируется до более шаровидной формы, чтобы уменьшить радиус кривизны желудочка и лучше переносить повышенную нагрузку на стенку.
Гипертрофия миокарда с сохраненным размером сердца
Постоянная перегрузка давлением вызывает шаровидную форму, но также увеличивает толщину стенки миокарда и уменьшает полость желудочка (увеличение относительной толщины стенки) при сохранении нормального внешнего размера сердца. Этот паттерн был описан в случаях тяжелого легочного стеноза, характеризующегося более толстой перегородкой и стенками правого миокарда вместе с меньшим размером полости правого желудочка и признаками диастолической дисфункции [11]. Хроническая перегрузка правого желудочка вызывает гипертрофию правого желудочка, а также более сферическую конфигурацию с меньшим внутренним диаметром, чтобы генерировать более высокую силу и давление с меньшей нагрузкой на отдельные миоциты и меньшим потреблением энергии.
Плоды, зачатые с помощью вспомогательных репродуктивных технологий, также демонстрируют кардиальный фенотип концентрического ремоделирования желудочков вместе с дилатацией предсердий, снижением продольного движения и нарушением релаксации [16, 24]. Постулируется, что это реакция на перегрузку давлением преимущественно справа, и это согласуется с исследованиями, сообщающими о повышении легочного давления у детей, зачатых с помощью вспомогательных репродуктивных технологий. Было высказано предположение, что наблюдаемое расширение предсердий объясняется проблемой раннего наполнения желудочков, которую необходимо компенсировать большим вкладом предсердий; повышенное давление также приводит к расширению предсердий. Паттерн гипертрофии миокарда с уменьшением полостей желудочков описан также в раннем постнатальном периоде у недоношенных детей [23], что, скорее всего, связано с относительной перегрузкой давлением в первые дни жизни недоношенных новорожденных.
Постулируется, что это реакция на перегрузку давлением преимущественно справа, и это согласуется с исследованиями, сообщающими о повышении легочного давления у детей, зачатых с помощью вспомогательных репродуктивных технологий. Было высказано предположение, что наблюдаемое расширение предсердий объясняется проблемой раннего наполнения желудочков, которую необходимо компенсировать большим вкладом предсердий; повышенное давление также приводит к расширению предсердий. Паттерн гипертрофии миокарда с уменьшением полостей желудочков описан также в раннем постнатальном периоде у недоношенных детей [23], что, скорее всего, связано с относительной перегрузкой давлением в первые дни жизни недоношенных новорожденных.
Гипертрофия миокарда с кардиомегалией
Первые сообщения о гипертрофии миокарда плода с кардиомегалией были связаны с диабетом матери и предположительно опосредованы гиперинсулинемией плода [24]. Для него характерны увеличенные сердца, утолщение миокарда, повышенная фракция укорочения и продольное движение [25]. Гипертрофия миокарда особенно влияет на перегородку и может привести к обструкции оттока из левого желудочка [24].
Гипертрофия миокарда особенно влияет на перегородку и может привести к обструкции оттока из левого желудочка [24].
Использование антиретровирусных препаратов, особенно зидовудина, который вызывает сердечную митохондриальную токсичность и, таким образом, снижает внутреннюю сократимость, во время беременности, как сообщалось, связано с характерным паттерном концентрической гипертрофии с более крупными сердцами, увеличенной толщиной стенки миокарда и более сферическими желудочками. (рис. 2в). Кроме того, в 35% случаев выявляется умеренный перикардиальный выпот, и в большинстве из них наблюдаются признаки систолической и диастолической дисфункции (уменьшение продольного движения и нарушение релаксации) [8, 26]. Было высказано предположение, что это компенсаторная гипертрофическая реакция сердца плода на повреждение миокарда, связанное с токсичностью.
Случаи ранней задержки роста плода с тяжелой плацентарной недостаточностью характеризуются кардиомегалией, гипертрофией миокарда и шаровидным расширением желудочков [15] (рис. 2d). Эта эксцентрическая гипертрофия обычно связана с умеренным перикардиальным выпотом, снижением продольной функции, нарушением релаксации [14, 27] и аномальной региональной деформацией [28] с сохраненной фракцией выброса в большинстве случаев. Предполагается, что патофизиология ремоделирования и дисфункции сердца при плацентарной недостаточности обусловлена сложными взаимодействиями [15]. Во-первых, снижение снабжения кислородом и питательными веществами может увеличить объемную нагрузку, а также напрямую нарушить нормальный рост кардиомиоцитов и структуру волокон и, следовательно, снизить их сократительную способность. Во-вторых, резистентность плаценты приводит к хронической перегрузке давлением. Сердце плода будет реагировать на перегрузку давлением, принимая более сферическую форму и утолщая стенки миокарда (гипертрофия). Кроме того, объемная перегрузка может быть причиной кардиомегалии и легкого перикардиального выпота.
2d). Эта эксцентрическая гипертрофия обычно связана с умеренным перикардиальным выпотом, снижением продольной функции, нарушением релаксации [14, 27] и аномальной региональной деформацией [28] с сохраненной фракцией выброса в большинстве случаев. Предполагается, что патофизиология ремоделирования и дисфункции сердца при плацентарной недостаточности обусловлена сложными взаимодействиями [15]. Во-первых, снижение снабжения кислородом и питательными веществами может увеличить объемную нагрузку, а также напрямую нарушить нормальный рост кардиомиоцитов и структуру волокон и, следовательно, снизить их сократительную способность. Во-вторых, резистентность плаценты приводит к хронической перегрузке давлением. Сердце плода будет реагировать на перегрузку давлением, принимая более сферическую форму и утолщая стенки миокарда (гипертрофия). Кроме того, объемная перегрузка может быть причиной кардиомегалии и легкого перикардиального выпота.
Помимо упомянутого выше, сообщалось о других паттернах ремоделирования сердца плода, описывающих удлинение или гипоплазию желудочков, истончение стенок желудочков, асимметричное ремоделирование, эндокардиальный фиброэластоз и т. д. [25-32].
д. [25-32].
Заключение
В этом обзоре мы суммировали основные модели ремоделирования сердца, описанные в жизни плода. Представленное здесь описание паттернов может помочь в оценке ремоделирования сердца. Такая оценка теперь стала проще, поскольку недавно были опубликованы номограммы для большинства размеров сердца [21, 22, 33]. Точное описание морфологических изменений в сердце плода может помочь в сравнении результатов научных исследований и способствует пониманию патофизиологии сердечно-сосудистых изменений, возникающих при различных состояниях беременности (плацентарная недостаточность, воздействие токсических веществ, вспомогательные репродуктивные технологии, стеноз клапана). Точно так же выявление ремоделирования сердца плода может дать возможность улучшить постнатальное сердечно-сосудистое здоровье.
Ремоделирование сердца может произойти на любом этапе жизни. Однако в то время как постнатальное ремоделирование сердца возвращается после устранения причины, ремоделирование сердца, происходящее внутриутробно, может сохраняться в постнатальном периоде даже после исчезновения триггера. На самом деле постнатальная персистенция ремоделирования сердца плода была продемонстрирована при нескольких состояниях, таких как задержка роста плода, диабет матери, воздействие антиретровирусных препаратов, недоношенность или вспомогательные репродуктивные технологии [9, 10, 16, 34-38]. Это явление объясняется гипотезой фетального программирования, которая предполагает внутриутробное происхождение некоторых сердечно-сосудистых заболеваний у взрослых. Гипотеза фетального программирования постулирует, что внутриутробные повреждения происходят на критической стадии развития, а структурные и функциональные изменения в ключевых органах на этой стадии жизни будут сохраняться после рождения, что объясняет большую восприимчивость к заболеваниям во взрослом возрасте. Это мнение полностью подтверждается крупными эпидемиологическими и экспериментальными исследованиями на животных, демонстрирующими взаимосвязь между низкой массой тела при рождении с сердечно-сосудистыми заболеваниями и смертностью во взрослом возрасте [30].
На самом деле постнатальная персистенция ремоделирования сердца плода была продемонстрирована при нескольких состояниях, таких как задержка роста плода, диабет матери, воздействие антиретровирусных препаратов, недоношенность или вспомогательные репродуктивные технологии [9, 10, 16, 34-38]. Это явление объясняется гипотезой фетального программирования, которая предполагает внутриутробное происхождение некоторых сердечно-сосудистых заболеваний у взрослых. Гипотеза фетального программирования постулирует, что внутриутробные повреждения происходят на критической стадии развития, а структурные и функциональные изменения в ключевых органах на этой стадии жизни будут сохраняться после рождения, что объясняет большую восприимчивость к заболеваниям во взрослом возрасте. Это мнение полностью подтверждается крупными эпидемиологическими и экспериментальными исследованиями на животных, демонстрирующими взаимосвязь между низкой массой тела при рождении с сердечно-сосудистыми заболеваниями и смертностью во взрослом возрасте [30]. Быстрая пролиферация и дифференцировка клеток во время роста плода очень чувствительны к любым изменениям в окружающей среде и приводят к необратимым изменениям в структурной и функциональной конституции. Собственно, внутриутробная жизнь — это критический период развития, когда происходит программирование органов на приспособление к окружающей среде. Любое повреждение, происходящее в этот критический период, может привести к адаптации развития, которая вызывает постоянные структурные, физиологические и метаболические изменения, тем самым предрасполагая человека к болезни во взрослой жизни.
Быстрая пролиферация и дифференцировка клеток во время роста плода очень чувствительны к любым изменениям в окружающей среде и приводят к необратимым изменениям в структурной и функциональной конституции. Собственно, внутриутробная жизнь — это критический период развития, когда происходит программирование органов на приспособление к окружающей среде. Любое повреждение, происходящее в этот критический период, может привести к адаптации развития, которая вызывает постоянные структурные, физиологические и метаболические изменения, тем самым предрасполагая человека к болезни во взрослой жизни.
Понимание адаптации плода к внутриутробной среде путем оценки ремоделирования сердца плода может быть полезным для наблюдения за плодом, а также для выявления случаев с повышенным риском сердечно-сосудистых заболеваний в более позднем возрасте. Это открывает возможность для раннего отбора людей, которым могут помочь профилактические меры по улучшению сердечно-сосудистого здоровья. Например, было продемонстрировано, что грудное вскармливание или здоровое питание в младенчестве могут улучшить ремоделирование сердечно-сосудистой системы, связанное с задержкой роста плода [15] или недоношенностью [31]. Эмбриональная жизнь, по-видимому, представляет собой уникальное окно возможностей для ранней диагностики и профилактики сердечно-сосудистых заболеваний.
Эмбриональная жизнь, по-видимому, представляет собой уникальное окно возможностей для ранней диагностики и профилактики сердечно-сосудистых заболеваний.
Заявление об этике
У авторов нет этических конфликтов, о которых следует сообщать.
Заявление о раскрытии информации
У авторов нет конфликта интересов, о котором следует заявить.
Источники финансирования
Этот проект частично финансируется при поддержке программы Erasmus+ Европейского Союза (номер рамочного соглашения: 2013-0040). Данная публикация отражает точку зрения только авторов, и Комиссия не может нести ответственность за любое использование содержащейся в ней информации. Кроме того, исследование, приведшее к этим результатам, получило финансирование от Фонда «La Caixa» по соглашению о гранте LCF/PR/GN14/10270005, Института Салуда Карлоса III (PI15/00130, PI15/00263, PI17/00675, PI18/00073). ) Интеграция в Национальный план I+D+I и совместное финансирование ISCIII-Subdirección General de Evaluación y el Fondo Europeo de Desarrollo Regional (FEDER) «Una manera de hacer Europa», Centro de Investigacion Biomédica en Red de Enfermedades Raras (ERPR04G719/2016), Фонд Cerebra для детей с травмами головного мозга (Кармартен, Уэльс, Великобритания) и грант SGR AGAUR 2017 № 1531.
Вклад авторов
, утвердил окончательный вариант и согласился на точность и добросовестность работы. Альваро Сепульведа-Мартинес участвовал в разработке концепции и дизайна обзора, составил проект работы, утвердил окончательный вариант и согласовал точность и целостность работы. Франческа Кроветто участвовала в разработке обзора, подготовила работу, утвердила окончательный вариант и согласовала точность и целостность работы. Ольга Гомес участвовала в разработке обзора, критически отредактировала его на предмет важного интеллектуального содержания, утвердила окончательную версию и согласилась с точностью и целостностью работы. Барт Бийненс участвовал в разработке обзора, критически пересмотрел его на предмет важного интеллектуального содержания, утвердил окончательную версию и согласился с точностью и целостностью работы. Эдуард Гратакос участвовал в разработке обзора, критически пересмотрел его с точки зрения важного интеллектуального содержания, утвердил окончательную версию и согласился с точностью и целостностью работы.
Авторское право: Все права защищены. Никакая часть данной публикации не может быть переведена на другие языки, воспроизведена или использована в любой форме и любыми средствами, электронными или механическими, включая фотокопирование, запись, микрокопирование или любую систему хранения и поиска информации, без письменного разрешения издателя. .
Дозировка препарата: авторы и издатель приложили все усилия, чтобы гарантировать, что выбор препарата и дозировка, указанные в этом тексте, соответствуют текущим рекомендациям и практике на момент публикации. Тем не менее, в связи с продолжающимися исследованиями, изменениями в правительственных постановлениях и постоянным потоком информации, касающейся лекарственной терапии и реакций на лекарства, читателю настоятельно рекомендуется проверять вкладыш в упаковке для каждого лекарства на предмет любых изменений в показаниях и дозировке, а также для дополнительных предупреждений. и меры предосторожности. Это особенно важно, когда рекомендуемый агент является новым и/или редко используемым лекарственным средством.
Отказ от ответственности: заявления, мнения и данные, содержащиеся в этой публикации, принадлежат исключительно отдельным авторам и участникам, а не издателям и редакторам. Появление рекламы и/или ссылок на продукты в публикации не является гарантией, одобрением или одобрением рекламируемых продуктов или услуг или их эффективности, качества или безопасности. Издатель и редактор(ы) отказываются от ответственности за любой ущерб, нанесенный людям или имуществу в результате любых идей, методов, инструкций или продуктов, упомянутых в содержании или рекламе.
Роль эхокардиографии плода в морфофункциональной оценке сердца плода у матерей с сахарным диабетом | Египетский журнал радиологии и ядерной медицины
- Исследования
- Открытый доступ
- Опубликовано:
- Мариам Раафат
ORCID: orcid. org/0000-0001-6081-2105 1,2 ,
org/0000-0001-6081-2105 1,2 , - Самех Аборизк 1 ,
- Махмуд Сарайя 1 и
- …
- Хазем Хамед Солиман 1
Египетский журнал радиологии и ядерной медицины
том 51 , Номер статьи: 84 (2020)
Процитировать эту статью
2573 доступа
2 Цитаты
Сведения о показателях
Abstract
История вопроса
Сахарный диабет (СД) является наиболее распространенным заболеванием, с которым сталкиваются во время беременности, и включает в себя диабет типа I, типа II и гестационный диабет. Это может предрасполагать к различным осложнениям, включая пороки развития плода, макросомию, самопроизвольный аборт, мертворождение, неонатальную смерть и задержку внутриутробного развития. Гипертрофическая кардиомиопатия (ГКМП) является одной из частых аномалий, характерных для диабета. Анализ сердечной функции плода может предоставить важную информацию о гемодинамическом статусе и адаптации сердца к различным перинатальным осложнениям.
Это может предрасполагать к различным осложнениям, включая пороки развития плода, макросомию, самопроизвольный аборт, мертворождение, неонатальную смерть и задержку внутриутробного развития. Гипертрофическая кардиомиопатия (ГКМП) является одной из частых аномалий, характерных для диабета. Анализ сердечной функции плода может предоставить важную информацию о гемодинамическом статусе и адаптации сердца к различным перинатальным осложнениям.
Результаты
Средняя толщина перегородки в диабетической группе составила 0,7163 ± 0,1746 см и 0,4989 ± 0,08068 см в контрольной группе. Средняя толщина миокарда свободной стенки правого желудочка в диабетической группе составила 0,6532 ± 0,13792 см, в контрольной группе — 0,4874 ± 0,07482 см. Средняя толщина миокарда свободной стенки левого желудочка в диабетической группе составила 0,6437 ± 0,13421 см, в контрольной группе — 0,4737 ± 0,07573 см. Среднее значение индекса работоспособности миокарда (Tie Index) в диабетической группе составило 0,6232 ± 0,15606 и 0,4626 ± 0,04357 в контрольной группе.
Заключение
На основании проведенного исследования можно сделать вывод, что пренатальное полное эхокардиографическое исследование должно быть обязательным у плодов от матерей с сахарным диабетом в связи с высоким риском врожденных пороков сердца и возникновения гипертрофической кардиомиопатии с нарушением сердечной функции плода в третьем триместре.
Ранняя диагностика врожденных пороков сердца, а также признаки гипертрофической кардиомиопатии и нарушения сердечной функции плода, возникающие у плодов с диабетом у матери, безусловно, будут способствовать своевременной послеродовой терапии и уходу за такими новорожденными.
Исходная информация
Сахарный диабет является наиболее распространенным заболеванием, с которым сталкиваются во время беременности, и включает в себя диабет типа I, типа II и гестационный диабет. Это может предрасполагать к различным осложнениям, включая пороки развития плода, макросомию, самопроизвольный аборт, мертворождение, неонатальную смерть и задержку внутриутробного развития [1]. Риск врожденных аномалий повышен у детей матерей с диабетом и составляет от 2,5% до 12% с чрезмерным присутствием врожденных пороков сердца [2].
Риск врожденных аномалий повышен у детей матерей с диабетом и составляет от 2,5% до 12% с чрезмерным присутствием врожденных пороков сердца [2].
Гипертрофическая кардиомиопатия (ГКМП) является одной из частых врожденных аномалий, проявляющихся при сахарном диабете (СД), поэтому требует высокой степени настороженности, поскольку специфическое лечение может различаться; например, инотропные средства или дигоксин, которые могут использоваться при сердечной недостаточности, связанной со структурными пороками сердца, противопоказаны при наличии гипертрофической кардиомиопатии [3]. Преимущественно поражается межжелудочковая перегородка, но также могут быть вовлечены свободные стенки правого и левого желудочка, преимущественно левого. Проявления гипертрофии миокарда часто малозаметны; однако гипертрофию можно обнаружить с помощью стандартной эхокардиографии плода, обычно путем сравнения толщины перегородки с контрольными случаями [4].
Предполагается, что у новорожденных матерей с диабетом ГКМП возникает в результате воздействия избыточного уровня инсулина. Однако механизмы, с помощью которых инсулин вызывает гипертрофию желудочков, до сих пор не объяснены, но сердце является основной мишенью для инсулина, а экспрессия функциональных рецепторов инсулина кардиомиоцитами сравнима с экспрессией других инсулинчувствительных клеток [5]. Таким образом, предполагается, что повышение уровня фетального инсулина может вызывать гиперплазию и гипертрофию клеток миокарда. Эта гипертрофия в основном поражает межжелудочковую перегородку и может возникать, несмотря на жесткий гликемический контроль [6].
Однако механизмы, с помощью которых инсулин вызывает гипертрофию желудочков, до сих пор не объяснены, но сердце является основной мишенью для инсулина, а экспрессия функциональных рецепторов инсулина кардиомиоцитами сравнима с экспрессией других инсулинчувствительных клеток [5]. Таким образом, предполагается, что повышение уровня фетального инсулина может вызывать гиперплазию и гипертрофию клеток миокарда. Эта гипертрофия в основном поражает межжелудочковую перегородку и может возникать, несмотря на жесткий гликемический контроль [6].
Гестационный сахарный диабет (ГСД) определяется как непереносимость углеводов, выявленная впервые во время беременности и обычно исчезающая после родов. Исход гестационного диабета хороший, особенно при контролируемом уровне глюкозы в крови. Однако ГСД увеличивает риск ряда неблагоприятных исходов для плода. Плоды матерей с диабетом склонны к гипергликемии плода и гиперинсулинизму, вторичному по отношению к материнской гипергликемии [7].
Несмотря на признание гипертрофии миокарда плода, до сих пор существуют разногласия по поводу ее влияния на глобальную сердечную функцию [6]. Однако известны случаи тяжелой перинатальной сердечной дисфункции и гибели плода [8].
Однако известны случаи тяжелой перинатальной сердечной дисфункции и гибели плода [8].
Анализ сердечной функции плода может предоставить важную информацию о гемодинамическом статусе и адаптации сердечно-сосудистой системы к различным перинатальным неблагоприятным воздействиям [9].
Допплеровский индекс работы миокарда правого и левого желудочков, объединяющий систолические и диастолические временные интервалы, был описан в литературе Tei et al. 1995 г. [10]. Было описано, что индекс Tei (TI) представляет собой неинвазивный, полезный допплеровский индекс работоспособности миокарда, который действует как комбинированный индекс глобальной функции миокарда. Интегрируя только временные интервалы, индекс меньше зависит от точной визуализации или анатомии. Более того, TI не зависит ни от геометрии желудочков, ни от частоты сердечных сокращений. TI определяется как сумма времени изообъемного сокращения (ICT) и времени изообъемного расслабления (IRT), деленная на время выброса (ET) [11].
Методы
Целью данного исследования является оценка влияния прегестационного диабета у матери, будь то тип I или тип II, и гестационного диабета на морфологию и функцию сердца плода.
Это исследование одобрено нашим экспертным советом.
Пациенты
Проспективное исследование включало 40 беременных женщин с метаболически контролируемым диабетом и 60 нормальных беременных без диабета (контрольная группа) в сроке от 28 до 40 недель беременности, датированных LMP. Полный анамнез был собран у всех женщин, включая возраст, паритет и историю приема наркотиков или любых связанных со здоровьем заболеваний. Результаты анализа уровня сахара в крови натощак получают во всех случаях, чтобы различать диабетические и контрольные случаи. Во всех случаях выполнялась биометрия плода, включающая измерение бипариетального и затылочно-лобного диаметров, окружности головы, окружности живота и длины бедренной кости. Также выполняли допплерографию пупочной, средней мозговой артерий и венозного протока.
Критерии исключения
Случаи с любыми другими сопутствующими заболеваниями были исключены из исследования.
Случаи структурных аномалий, включая различные системы плода, кроме сердца плода, а также случаи задержки роста плода (ЗВУР) были исключены из нашего исследования.
Случаи тяжелого многоводия или многоплодной беременности были исключены из исследования.
Протокол визуализации
Полная стандартизированная эхокардиограмма плода была выполнена для всех беременных женщин с диабетом для полной структурной оценки. В контрольной группе проводилось только базовое и расширенное базовое кардиологическое обследование плода в соответствии с (руководством ISUOG, 2013 г.) [12].
Измерение конечного диастолического МЖП (толщина межжелудочковой перегородки) и свободных стенок миокарда в латеральной подреберной проекции в некоторых случаях и апикальной или базальной четырехкамерной проекции в других случаях (в зависимости от положения плода во время сканирования) чуть ниже атриовентрикулярные клапаны выполнялись во всех случаях.
Доплеровская кривая для левого Mod-MPI (модифицированный индекс работоспособности миокарда) по Hernandez et al. (2012) [9]. Образец импульсного доплера помещали на внутреннюю стенку межжелудочковой перегородки над митральным клапаном и ниже аортального клапана в четырехкамерной проекции с базальной или апикальной проекцией, позволяющей одновременно отображать приток и отток из левого желудочка. Затем были измерены периоды времени для левого Mod-MPI:
ICT измеряли от щелчка закрытия митрального клапана до щелчка открытия аортального клапана.
IRT измеряли от щелчка закрытия аортального клапана до щелчка открытия митрального клапана.
ET измеряли от открытия до закрытия щелчка аортального клапана.
Статистический анализ
Статистический анализ проводили с использованием программного пакета SPSS версии 17.0 (SPSS Inc., Чикаго, Иллинойс, США). Акушерские характеристики были представлены как среднее + стандартное отклонение. Индекс связи, толщина стенки ПЖ, толщина стенки ЛЖ и толщина МЖП, полученные от плодов, были нанесены на график в зависимости от гестационного возраста, а коэффициенты корреляции были определены с использованием корреляции Пирсона. Нормальные значения этих переменных были представлены как 5-е, 50-е и 9-е.5-й процентиль. Значение P <0,05 считалось статистически значимым. Были получены нормограммы и кривые подбора процентилей.
Нормальные значения этих переменных были представлены как 5-е, 50-е и 9-е.5-й процентиль. Значение P <0,05 считалось статистически значимым. Были получены нормограммы и кривые подбора процентилей.
Результаты
Из 40 случаев диабета, изученных в нашем исследовании, 38 были применимы к нашему исследованию в отношении функциональной оценки с использованием индекса связи и оценки гипертрофии перегородки и свободной стенки миокарда. У одного из наших пациентов был структурный порок сердца, известный как синдром висцеральной гетеротаксии (левая изомерия), а у другого была диагностирована тетрада Фалло.
Из наших статистических результатов мы обнаружили следующее:
Мы обнаружили, что средняя толщина межжелудочковой перегородки (IVST) в группе пациентов с диабетом составляла 0,7163 ± 0,1746 см и 0,4989 ± 0,08068 см в контрольной группе (рис. 1). Значительная статистическая разница была обнаружена в отношении толщины перегородки между диабетической группой и нормальной группой ( P <0,05).
Рис. 1
Кривая линейной регрессии, иллюстрирующая значимую корреляцию между IVST как у пациентов, так и у контрольной группы (коэффициент корреляции R 2 = 0,244)
Изображение в натуральную величину
Мы обнаружили, что средняя толщина миокарда свободной стенки правого желудочка (RVWT) в диабетической группе составила 0,6532 ± 0,13792 см и 0,4874 ± 0,07482 см в контрольной группе. (рис. 2). Значительная статистическая разница была обнаружена в отношении толщины миокарда свободной стенки правого желудочка между диабетической группой и контрольной группой ( P <0,05).
Рис. 2
Кривая линейной регрессии, иллюстрирующая значимую корреляцию между RVWT как у пациентов, так и у контрольной группы (коэффициент корреляции R 2 = 0,206)
Изображение в натуральную величину
Мы обнаружили, что средняя толщина миокарда свободной стенки левого желудочка (LVWT) в группе диабетиков составила 0,6437 ± 0,13421 см и 0,4737 ± 0,0757 см в контрольной группе3 (рис. 3). Значительная статистическая разница была обнаружена в отношении толщины миокарда свободной стенки левого желудочка между группой диабетиков и контрольной группой ( P <0,05).
3). Значительная статистическая разница была обнаружена в отношении толщины миокарда свободной стенки левого желудочка между группой диабетиков и контрольной группой ( P <0,05).
Рис. 3
Кривая линейной регрессии, иллюстрирующая значимую корреляцию между LVWT как для пациентов, так и для контрольной группы (коэффициент корреляции R 2 = 0,32)
Полный размер изображения
Мы обнаружили, что среднее значение индекса работоспособности миокарда (Tei Index) в группе диабетиков составило 0,6232 ± 0,15606 и 0,4626 ± 0,04357 в контрольной группе (рис. 4). . Значительная статистическая разница была обнаружена в отношении индекса работоспособности миокарда между диабетической группой и контрольной группой ( P <0,05).
Рис. 4
Кривая линейной регрессии, иллюстрирующая значительную корреляцию между индексом Tie для пациентов и контрольной группы (коэффициент корреляции R 2 = 0,039)
Полноразмерное изображение
Расчетная масса плода и фетоплацентарное допплеровское исследование существенно не отличались между диабетиками и контрольной группой.
Обсуждение
В нашем исследовании мы стремились оценить влияние материнского прегестационного и гестационного диабета на морфологию и функцию сердца плода, для чего в каждом случае выполнялась полная эхокардиограмма плода, чтобы исключить какие-либо структурные дефекты. Измерение свободных стенок миокарда желудочков и толщины межжелудочковой перегородки проводилось в качестве инструмента для оценки сердечной гипертрофической кардиомиопатии, которая возникает у плодов и новорожденных от матерей с диабетом. Доплеровский модифицированный индекс работы миокарда (Mod-MPI) использовали для оценки глобальной общей систолической и диастолической функции, чтобы показать, произошло ли нарушение сердечной функции плода или нет.
В исследование были включены 40 беременных женщин с диабетом и 60 контрольных случаев. Обе группы были в пределах сопоставимого гестационного возраста (между 28 и 40 неделями беременности).
Средняя толщина перегородки в группе диабетиков составила 0,7163 ± 0,17 см (рис. 6 и 7) и 0,4989 ± 0,08 см (рис. 5) в группе здоровых.
6 и 7) и 0,4989 ± 0,08 см (рис. 5) в группе здоровых.
Рис. 5
2D-измерение толщины стенки миокарда и перегородки в боковой 4-камерной проекции и измерение модифицированного функционального индекса миокарда левого сердца по доплеровской шкале у беременной женщины 22 лет без диабета у матери в анамнезе. И индекс связи, и толщина стенки миокарда и перегородки были в пределах нормы (RVWT = 0,41, LVWT = 0,34, IVST = 0,32, Tie = 0,4)
Полноразмерное изображение
Значительная разница была обнаружена в отношении толщины перегородки между диабетической группой и нормальной группой ( P < 0,05). Эти результаты согласуются с результатами предыдущих исследований.
Джоана и др. (2018) [13] продемонстрировали, что плоды матерей с диабетом имели значительно более толстую межжелудочковую перегородку по сравнению с контрольными субъектами (медиана 4,25 мм [межквартильный размах (IQR), 3,87–4,50 мм] против 3,67 мм [IQR, 3,40–3,93 мм) , P < 0,001)
Garcia-Flores et al. (2011) [6] сообщили, что толщина перегородки была увеличена у плодов матерей с диабетом по сравнению с контрольной группой со статистически значимой разницей ( P < 0,001), несмотря на сравнительное исследование между случаями контролируемого гестационного диабета (случаи повышенных значений HbA1c выше 6,5% исключались) и нормальные. Установлено, что 66,6% (16/24) диабетических беременностей были выше 95-го процентиля по толщине МЖП в контрольной группе, которая оценивалась в 3,51 мм; однако измерения толщины МЖП в обеих группах в этом исследовании были в пределах нормы.
(2011) [6] сообщили, что толщина перегородки была увеличена у плодов матерей с диабетом по сравнению с контрольной группой со статистически значимой разницей ( P < 0,001), несмотря на сравнительное исследование между случаями контролируемого гестационного диабета (случаи повышенных значений HbA1c выше 6,5% исключались) и нормальные. Установлено, что 66,6% (16/24) диабетических беременностей были выше 95-го процентиля по толщине МЖП в контрольной группе, которая оценивалась в 3,51 мм; однако измерения толщины МЖП в обеих группах в этом исследовании были в пределах нормы.
Префумо и др. (2005) [8] сообщают о случаях выраженной гипертрофии миокарда плода, связанной с признаками миокардиальной недостаточности у плодов матерей с диабетом.
Балли и др. (2014) [14] показали, что средняя толщина перегородки на 36 неделе беременности составила 0,452 ± 0,49 см в группе с диабетом матери по сравнению с 0,38 ± 1,77 см в контрольной группе со значимой статистической разницей ( P < 0,001). В этом исследовании, несмотря на статистические различия, не было обнаружено патологической гипертрофии МЖП. Однако признаки диастолической дисфункции в исследуемой группе были обнаружены путем применения различных параметров для оценки диастолической дисфункции.
В этом исследовании, несмотря на статистические различия, не было обнаружено патологической гипертрофии МЖП. Однако признаки диастолической дисфункции в исследуемой группе были обнаружены путем применения различных параметров для оценки диастолической дисфункции.
Это исследование показало, что материнский диабет был связан со значительным увеличением толщины всех сердечных стенок (рис. 6 и 7) по сравнению с нормальной беременностью (рис. 5), что частично подтверждает результаты предыдущих исследований, проведенных Jaeggi et al. . 2001 [15]. Пенни и др. (2003) [16] сосредоточились на случаях уже существовавшего диабета, но Zielinsky, 2009 [17] применил свое исследование к популяции с гестационным сахарным диабетом. Оба они сообщили о значительной разнице в стенках без миокарда и толщине межжелудочковой перегородки между исследуемой и контрольной группами.
Рис. 6
2D-измерение толщины стенки миокарда и перегородки в боковой 4-камерной проекции и допплерометрическое измерение модифицированного индекса работоспособности миокарда слева у беременной женщины 25 лет с сахарным диабетом I типа в анамнезе, получавшей регулярную инсулинотерапию. антенатальное УЗИ на 30 неделе беременности. Аномальное увеличение толщины стенки миокарда и перегородки с аномально высоким МПА выше референсных значений (RVWT = 0,81, LVWT = 0,86, IVST = 1, Tie = 0,67)
антенатальное УЗИ на 30 неделе беременности. Аномальное увеличение толщины стенки миокарда и перегородки с аномально высоким МПА выше референсных значений (RVWT = 0,81, LVWT = 0,86, IVST = 1, Tie = 0,67)
Изображение в натуральную величину
Рис. 7
2D-измерение толщины миокарда и стенки перегородки в боковой 4-камерной проекции и измерение допплеровского модифицированного индекса активности миокарда слева у беременной женщины 32 лет с диабетом II типа в анамнезе на регулярной основе пероральная сахароснижающая терапия проводилась для рутинного антенатального УЗИ на 29 неделе беременности. Аномальное увеличение толщины стенки миокарда и перегородки с аномально высоким МПА выше референтных значений (RVWT = 0,68, LVWT = 0,65, IVST = 0,75, Tie = 0,85)
Изображение в натуральную величину
В группе новорожденных и младенцев кардиомиопатия (КМ) была отмечена примерно у 2–7%, но, вероятно, во время внутриутробного развития распространенность выше, достигая 6–11%. Высокая внутриутробная потеря, встречающаяся почти у трети пораженных плодов, скорее всего, объясняет эти различия [18].
Высокая внутриутробная потеря, встречающаяся почти у трети пораженных плодов, скорее всего, объясняет эти различия [18].
Тем не менее, авторы могут найти некоторые случаи гипертрофии перегородки, которые не проявляются постнатально. Хотя большинство симптомов кардиомиопатии могут спонтанно регрессировать в течение нескольких недель, иногда развиваются выраженная застойная сердечная недостаточность, тахикардия, тахипноэ, ритм галопа и гепатомегалия [19].].
В нашем исследовании средняя толщина перегородки и свободной стенки миокарда была статистически значимой по сравнению с контрольной группой со средним значением индекса связи выше 95 процентиля, обозначающего признаки гипертрофической кардиомиопатии с нарушением функции левого желудочка.
В этом исследовании нельзя было ожидать, будут ли эти плоды симптоматическими или нет по ультразвуковым и допплеровским критериям. Рекомендуется послеродовое обследование специализированным неонатологом и кардиологом.
Некоторые исследования предполагают, что гестационный диабет может быть фактором риска врожденных пороков сердца, но до сих пор существуют разногласия по поводу степени такой связи [20].
В нашем исследовании частота врожденных пороков сердца среди исследуемых случаев составляет 5% от общего числа случаев диабета. Предыдущие исследования показали 8,5% случаев пороков развития сердца у плодов беременных с диабетом [21]. Наше исследование было ограничено ограниченным числом пациентов, участвовавших в нашем исследовании; однако, если бы можно было включить большое количество пациентов с диабетом, заболеваемость могла бы измениться.
В нашем исследовании мы также стремились оценить влияние материнского диабета на функцию миокарда плода с использованием модифицированного индекса работоспособности миокарда (MPI).
MPI — это глобальный показатель сердечной функции. Повышение ИМБ свидетельствует о глобальном нарушении функции желудочков при сахарном диабете матери в промежуточный и поздний периоды беременности [22]. Hernandez-Andrade et al. (2012) [9] определили скорректированные по возрасту референтные значения Mod-MPI левого желудочка у нормальных плодов в возрасте 19–39 лет.недель беременности и рассчитали 5-й, 50-й и 95-й процентили для Mod-MPI, а также его компонентов (ICT, ET и IRT). Было обнаружено, что у нормальных плодов Mod-MPI не превышала 0,43 при любой гестации (при частоте сердечных сокращений плода 140 ударов в минуту: медиана 0,45, диапазон 0,36–0,54). Другое более недавнее исследование показало, что нормальное значение MPI составляет около 0,51 ± 0,12 [23]. Эти значения хорошо согласуются с нашими результатами для контрольной группы, но намного ниже, чем в исследуемой группе, что свидетельствует о снижении податливости стенки левого желудочка у плодов матерей с диабетом с последующим ухудшением общей сердечной функции плода.
Hernandez-Andrade et al. (2012) [9] определили скорректированные по возрасту референтные значения Mod-MPI левого желудочка у нормальных плодов в возрасте 19–39 лет.недель беременности и рассчитали 5-й, 50-й и 95-й процентили для Mod-MPI, а также его компонентов (ICT, ET и IRT). Было обнаружено, что у нормальных плодов Mod-MPI не превышала 0,43 при любой гестации (при частоте сердечных сокращений плода 140 ударов в минуту: медиана 0,45, диапазон 0,36–0,54). Другое более недавнее исследование показало, что нормальное значение MPI составляет около 0,51 ± 0,12 [23]. Эти значения хорошо согласуются с нашими результатами для контрольной группы, но намного ниже, чем в исследуемой группе, что свидетельствует о снижении податливости стенки левого желудочка у плодов матерей с диабетом с последующим ухудшением общей сердечной функции плода.
Наше исследование показало статистически значимое ( P < 0,001) более высокое значение общего Mod-MPI в исследуемой группе в целом (медиана 0,61, диапазон 0,39–0,83) по сравнению с контрольной группой (медиана 0,47, диапазон 0,32–0,62) .
Заключение
На основании проведенного исследования можно сделать вывод, что пренатальное полное эхокардиографическое исследование должно быть обязательным в связи с высоким риском развития врожденных пороков сердца и возникновения гипертрофической кардиомиопатии с нарушением сердечной функции у плодов матерей с сахарным диабетом в третьем триместре.
Ранняя диагностика врожденных пороков сердца, нарушений сердечной функции плода, а также признаки гипертрофической кардиомиопатии, возникающей у плодов с диабетом у матери, безусловно, будут способствовать своевременной послеродовой терапии и уходу за такими новорожденными.
Наличие данных и материалов
Доступно у соответствующего автора по запросу.
Сокращения
- HCM:
Гипертрофическая кардиомиопатия
- GDM:
Гестационный сахарный диабет
- ТИ:
Индекс галстука
- ЮГР:
Ограничение внутриутробного развития
- ИКТ:
Время изоволюмического сокращения
- ИРТ:
Время изоволюмической релаксации
- ET:
Время выброса
- ИВС:
Межжелудочковая перегородка
- МОД-MPI:
Модифицированный миокардиальный индекс
- РВВТ:
Толщина стенки правого желудочка
- LVWT:
Толщина стенки левого желудочка
- IQR:
Межквартильный диапазон
Ссылки
- «>
Hornberger LK (2006) Диабет матери и сердце плода. Сердце 92:1019–1021
CAS
СтатьяGoogle ученый
Russell NE, Holloway P, Quinn S, Foley M, Kelehan P, McAuliffe FM (2007)Кардиомиопатия и кардиомегалия у мертворожденных детей от матерей с диабетом. Pediatr Dev Pathol 11(1):10–14
Статья
Google ученый
Zielinsky P, Piccoli AL (2012)Гипертрофия и дисфункция миокарда при диабете матери. Early Hum Dev 88(5):273–278
Статья
Google ученый
Huang T, Kelly A, Becker SA, Cohen MS, Stanley CA (2013)Гипертрофическая кардиомиопатия у новорожденных с врожденным гиперинсулинизмом.
 Arch Dis Child Fetal Neonatal Ed 98(4):F351–F354
Arch Dis Child Fetal Neonatal Ed 98(4):F351–F354Статья
Google ученый
Garcia-Flores J, Jañez M, Gonzalez MC, Martinez N, Espada M, Gonzalez A (2011)Морфологические и функциональные изменения миокарда плода, связанные с хорошо контролируемым гестационным диабетом. Eur J Obstet Gynecol Reprod Biol 154:24–26
Статья
Google ученый
Mehta A, Hussain K (2003) Преходящий гиперинсулинизм, связанный с макросомией, гипертрофической обструктивной кардиомиопатией, гепатомегалией и нефромегалией. Арч Ди Чайлд 88(9)):822–824
CAS
СтатьяGoogle ученый
Префумо Ф., Челентано К., Прести Ф., Де Биазио П., Вентурини П.Л. Острое проявление гипертрофической кардиомиопатии плода при беременности с сахарным диабетом 1 типа. Diabetes Care 2005; 28 (август (8)): 2084.

Артикул
Google ученый
Hernandez Andrade E, Benavides JA, Serralde Cruz R, Martinez Welsh A, Mancilla Ramirez J (2012)Оценка стандартных допплеровских параметров сердечной функции плода: отношения E/A, пути оттока и индекс работоспособности миокарда. Диагностика плода Тер 32: 22–29
Артикул
Google ученый
Tei C, Lieng H, David O, Kent R, Jae K, Richard J, Jamil A, James B (1995) Новый индекс комбинированной систолической и диастолической работы миокарда: простой и воспроизводимый показатель сердечной функции-A Исследование при нормальной и дилатационной кардиомиопатии. J Cardiology:26, 357–366
Freedom RM, Jaeggi ET, Lim JS, Anderson RH (2005)Сердца с изомерией придатков правого предсердия – одна из худших форм заболевания в 2005 г. Cardiol Young 15(06) ):554–567
Артикул
Google ученый
«>Miranda JO, Cerqueira RJ, Ramalho C, Areias JC, Henriques-Coelho T (2018) Обычное эхокардиографическое исследование с отслеживанием спеклов. Журнал Американского общества эхокардиографии 31(3):333–341
Артикул
Google ученый
Balli S, Pac FA, Ece İ, Oflaz MB, Kibar AE, KandemirÖ (2014)Оценка сердечных функций у плодов гестационных матерей с диабетом. Pediatr Cardiol 35(1):30–37
Статья
Google ученый
Jaeggi ET, Fouron JC, Proulx F (2001)Работа сердца плода при неосложненном и хорошо контролируемом материнском диабете I типа.
 УЗИ Obstet Gynecol 17(4):311–315
УЗИ Obstet Gynecol 17(4):311–315КАС
СтатьяGoogle ученый
Penney GC, Mair G, Pearson DW (2003) Исходы беременности у женщин с диабетом 1 типа в Шотландии: национальное популяционное исследование. BJOG 110(3):315–318
Статья
Google ученый
Зелински П., Пикколи-младший А., Маника Дж.Л., Николозо Л.Х. (2009): Заболевания миокарда, эндокарда и перикарда в период внутриутробного развития. В: Ягель С., Сильверман Н., Коэн С.М. (ред.). Кардиология плода: эмбриология, генетика, физиология, эхокардиографическая оценка, диагностика и перинатальное лечение сердечно-сосудистых заболеваний. 2-е изд. Нью-Йорк: Информа Здравоохранение; П: 366.
Глава
Google ученый
Mongiovì M, Fesslova V, Fazio G, Barbaro G, Pipitone S (2013)Диагностика и прогноз кардиомиопатий плода: обзор.
 Curr Pharm Des 16(26):2929–2934
Curr Pharm Des 16(26):2929–2934Статья
Google ученый
Стюарт А., Амер-Вохлин И., Перссон Дж., Келлен К. (2013) Долгосрочный риск сердечно-сосудистых заболеваний в зависимости от массы тела при рождении и воздействия сахарного диабета у матери. Int J Cardiol 168 (3): 2653–2657
Артикул
Google ученый
Ботто Л.Д., Голдмунц Э., Лин А.Е. (2008) В: Хью А., Дрисколл Д., Шедди Р. (ред.). Болезнь сердца Мосса и Адамса у младенцев, детей и подростков: включая плод и молодых взрослых. 7-е изд. Филадельфия: Липпинкотт Уильямс и Уилкинс.; P: 535.
Lisowski LA, Verheijen PM, Copel JA, Kleinman CS, Wassink S, Visser GH, Meijboom EJ (2010)Врожденный порок сердца при беременности, осложненной материнским сахарным диабетом. Международное клиническое сотрудничество, обзор литературы и метаанализ.
 Герц;35(1):19-26.
Герц;35(1):19-26.Апи О., Эмексиз М.Б., Апи М., Угурел В., Унал О. (2009) Модифицированный индекс работоспособности миокарда для оценки сердечной функции плода при преэклампсии. УЗИ Obstet Gynecol 33:51–57
CAS
СтатьяGoogle ученый
Luliu C, Mihailescu, Mitran M, Marinescu B (2014): Роль индекса работоспособности миокарда (индекс связи) в изучении сердечной функции плода, Gineco.eu J Obstetrics and Gynecology Vol. 10 № 36 (2/2014).
Temple R (2006) Диабет во время беременности. Медицина 34(3):111–112
Статья
Google ученый
Каравелхо Дж. С., Аллан Л. Д., Чауи Р., Копел Дж. А., Девор Г. Р., Хечер К., Ли В. (2013) Международное общество ультразвука в акушерстве и гинекологии. Практические рекомендации (обновленные): ультразвуковое скрининговое исследование сердца плода. УЗИ Акушерство Гинекол ; том 41, выпуск 3.
Ссылки на скачивание
Благодарности
БЕЗ БОЛЬШЕ , Египет
Мариам Раафат, Самех Аборизк, Махмуд Сарайя и Хазем Хамед Солиман
Отделение диагностической и интервенционной радиологии, Больницы Каирского университета, Каср Аль-Айни, Эль-Маниал, Каир, 11956, Египет
Мариам Раафат
Авторы
- Мариам Раафат
Посмотреть публикации автора
Вы также можете искать этого автора в
PubMed Google Scholar - Sameh Aborizk
Просмотр публикаций автора
Вы также можете искать этого автора в
PubMed Google Scholar - Mahmoud Saraya
Просмотр публикаций автора
Вы также можете искать этого автора в
PubMed Google Академия - Хазем Хамед Солиман
Просмотр публикаций автора
Вы также можете искать этого автора в
PubMed Google Scholar
Вклады
MR внес свой вклад в разработку концепции и дизайна исследования, собрал данные пациентов, написал и отредактировал рукопись. SA помогал в сборе и интерпретации данных. М.С. участвовал в направлении и последующем наблюдении за случаями. HS помогла в разработке исследования и статистическом анализе. Все авторы прочитали и одобрили окончательный вариант рукописи.
SA помогал в сборе и интерпретации данных. М.С. участвовал в направлении и последующем наблюдении за случаями. HS помогла в разработке исследования и статистическом анализе. Все авторы прочитали и одобрили окончательный вариант рукописи.
Автор, ответственный за переписку
Переписка с
Мариам Раафат.
Декларация этики
Одобрение этики и согласие на участие
Письменное информированное согласие было подписано всеми пациентами перед обследованием. Исследование было одобрено комитетом по этике медицинского факультета Каирского университета. Номер ссылки не применим.
Согласие на публикацию
Все пациенты, включенные в это исследование, старше 16 лет, и все они дали письменное информированное согласие на публикацию данных, содержащихся в этом исследовании.
Конкурирующие интересы
Авторы заявляют, что у них нет конкурирующих интересов.
Дополнительная информация
Примечание издателя
Springer Nature остается нейтральной в отношении юрисдикционных претензий в опубликованных картах и институциональной принадлежности.

