Гемолитическая желтуха новорожденных: Гемолитическая желтуха новорожденных: причины и симптомы
Гемолитическая болезнь новорожденных — «Наша Радость»
Гемолитическая болезнь новорождённого. Звучит страшно, пугающе — особенно в сочетании с трогательным словом «новорожденный». И это действительно тяжелая патология, которая требует срочного медицинского вмешательства. По прогнозам более 90 % детей, получивших своевременное лечение, впоследствии не имеют неврологических нарушений. Поэтому медлить нельзя, нужно вовремя диагностировать и принимать меры.
Поскольку, как правило, ГБН проявляется в первые дни жизни ребёнка, лечение назначают сразу, пожалуйста, доверяйте и не препятствуйте действиям врачей!
Итак, что же это за заболевание — ГБН? Это разрушение эритроцитов новорожденного ребенка антителами его матери. И причина его — несовместимость материнской и детской крови по антигенам красных кровяных клеток (эритроцитов), как правило, по резус-фактору и системе групп крови, и, иногда, по другим факторам крови.
В чем же причина?
Если у матери резус-отрицательная кровь, а у ребёнка резус-положительная, то возникает резус-несовместимость. Из-за этого иммунная система матери эритроциты плода может определить как потенциально опасные, инородные, и начнет вырабатывать антитела против резус-фактора, расположенного на них. Прикрепившись к эритроцитам ребёнка, антитела разрушают их. Причем начинается этот процесс еще в период внутриутробного развития плода и после рождения ребенка продолжается. Если же у плода кровь резус-отрицательная, а у мамы — резус-положительная, то это ситуации не возникает.
Из-за этого иммунная система матери эритроциты плода может определить как потенциально опасные, инородные, и начнет вырабатывать антитела против резус-фактора, расположенного на них. Прикрепившись к эритроцитам ребёнка, антитела разрушают их. Причем начинается этот процесс еще в период внутриутробного развития плода и после рождения ребенка продолжается. Если же у плода кровь резус-отрицательная, а у мамы — резус-положительная, то это ситуации не возникает.
Как не пропустить симптомы гемолитической болезни
Пока мама беременна, признаки несовместимости крови никак себя не проявляют ни у матери, ни у плода. А уже после рождения ГБН клинически проявляется по-разному, в зависимости от того, какую форму примет: анемическую, желтушную и отёчную. Бывают также случаи сочетания этих форм. Давайте рассмотрим их отдельно.
1. Анемическая форма. Считается наиболее лёгкой. Ее проявления — бледность кожных покровов, неврологические нарушения, например, слишком продолжительный сон, вялость, апатичность, плохой аппетит, вялый сосательный рефлекс. Кроме того, присутствуют признаки увеличения селезёнки и печени, наблюдающиеся в динамике.
Кроме того, присутствуют признаки увеличения селезёнки и печени, наблюдающиеся в динамике.
2. Желтушная форма. Наиболее часто встречающаяся форма. Она диагностируется почти в 90 % случаев. При этой форме желтуха самый главный симптом. Желтый оттенок буквально в первые часы жизни приобретает кожа, слизистые оболочки, возможны увеличения печени и селезёнки. От распространенности по телу и интенсивности желтухи определяют степень тяжести желтушной формы. Это определяется визуально по шкале Крамера. Всего степеней пять, при первой поражены лицо и шея, при пятой — уже все тело. Зависит интенсивность желтухи от уровня билирубина, который придает коже жёлтый. Критический уровень этого фермента способен поразить нейроны головного мозга, его структуры, и вызвать серьезного грозного осложнения, биллирубиновой энцефалопатии.
3. Отёчная форма («водянка плода»). Это наиболее тяжёлая форма, чаще всего диагностируемая ещё внутриутробно. Желтушная окраска плодных оболочек, околоплодных вод, пуповины не остался врачами незамеченными. У ребенка с момента рождения отеки по всему телу — подкожные, брюшной полости, грудной клетки. Состояние новорожденного тяжелое. Детям, у которых диагностируется именно эта форма заболевания, требуется интенсивное лечение, в том числе переливание крови.
У ребенка с момента рождения отеки по всему телу — подкожные, брюшной полости, грудной клетки. Состояние новорожденного тяжелое. Детям, у которых диагностируется именно эта форма заболевания, требуется интенсивное лечение, в том числе переливание крови.
Сразу после рождения детям, особенно из группы риска, важно определить группу крови. Дети, у которых не совпали группы крови или резус-принадлежности с мамой, первые сутки жизни должны быть осмотрены врачом несколько раз.
Мама может и сама заметить желтушность, также как и чрезмерную бледность слизистых и кожи. В этом случае необходимо незамедлительно сообщить врачу.
ГБН нельзя путать с другими заболеваниями новорождённых:
- наследственные гемолитические или постгеморрагические анемии;
- неиммунная водянка плода;
- различные инфекции и др.
Точную диагностику может провести только врач, не пытайтесь сами поставить диагноз или преуменьшить его важность.
Как лечат ГБН?
В лечении используются два подхода — консервативный и оперативный. К первому относят фототерапию и инфузионную терапию с внутривенными иммуноглобулинами, ко второму — заменное переливание крови. Формы лечения в зависимости от степени тяжести определяют врачи.
Конечно, фототерапия самый эффективный и безопасный метод лечения. В его основе — лечебное воздействие ультрафиолетовых лучей с определенной длиной волны, проникающих через кожу малыша и помогающих образовываться нетоксичной водорастворимой форме билирубина, которая в последствии легко выводится из организма. Как следствие, уровень билирубина в крови ребёнка падает, и организм не страдает от его токсического воздействия.
После постановки диагноза фототерапия проводится «нон-стоп». При этом ребенок теряет много жидкости, и восполняют ее как раз за счет внутривенного введения, частого прикладывания к груди и восполнения питьем.
В качестве побочных эффектов от лечения могут наблюдаться мелкоточечная сыпь и окрашивание мочи, кала и кожи в бронзовый цвет, все это не требует специального лечения, и проходят через некоторое время.
Операция заменного переливания крови проводится при тяжёлых формах гемолитической болезни новорождённых, и выполняется в условиях реанимационного отделения.
Поскольку средняя форма тяжести ГБН встречается довольно часто, мамам необходимо не только полагаться на врачей, но и самим быть внимательным к малышу, наблюдать за ним, особенно если ребенок относится к группе риска по группе крови и резусу. Нельзя списывать все проблемы на «желтушку новорожденных», как ее называют, и игнорировать эти серьезные симптомы.
ГЕМОЛИТИЧЕСКАЯ БОЛЕЗНЬ НОВОРОЖДЕННОГО — ГБУЗ ЯНАО
Почти каждый второй новорожденный ребенок имеет физиологическую желтушку — это не опасное явление. Однако желтеть кожные покровы малышей могут и по другой причине – вследствие так называемой гемолитической болезни новорожденных-последствия у которой зачастую оказываются значительно серьезнее .Если вашему малышу поставили этот диагноз — не отчаивайтесь!
При своевременном оказании медицинской помощи все процессы в его маленьком организме быстро придут в норму и риск поражения нервной системы будет устранен.
Чтобы понять каковы же будут последствия гемолитической болезни, для начала надо понять, что из себя представляет данное заболевание и почему его срочно нужно лечить .Остановимся на примере гемолитической болезни новорожденных при групповой несовместимости , т.к. она встречается чаще и протекает несколько легче, чем при резус-конфликте. В данном случае мама имеет первую группу крови 0 (I), а плод – другую, чаще вторую А(II) или третьюВ(III). В основе этой болезни лежит массивный распад эритроцитов плода вследствии несовместимости его крови и крови матери. «Гемолиз» в переводе с латинского языка — разрушение.
Будущая мать имея первую группу крови -не имеет антигенов. Обозначим на картинке организм матери знаком «минус». А будущий ребенок, т.е. плод имеет вторую группу крови, т.е. в его крови есть антиген. На картинке обозначим плод знаком «плюс».При наличии антигена у плода иммунная система матери начнет считать этот антиген как чужеродный агент-враг и начнет вырабатывать против этого антигена защитные антитела(JgG). Эти антитела могут начать вырабатываться рано — еще во время беременности, а могут появиться практически в процессе родов. Чем меньше срок беременности, при котором начали вырабатываться антитела, тем больше их накапливается и тем вероятнее более тяжелое заболевание малыша. Эти антитела устремляются в кровь к плоду через плаценту, оседают на эритроцитах ребенка и начинают их разрушать. Их разрушается очень много, из разрушенных эритроцитов высвобождается большое количество пигмента билирубина. Этот билирубин является «плохим», он называется непрямым билирубином и является очень токсичным. Он должен обезвреживаться в печени. Но так как при рождении у ребенка ферментная система печени незрелая (она дозревает постнатально), она не сможет утилизировать полностью весь билирубин, его очень будет много, а его особенностью является накапливаться в тех тканях организма, которые содержат жир, то идеальным местом накопления билирубина будет подкожная жировая клетчатка и клинически мы будем видеть желтуху кожи.
Эти антитела могут начать вырабатываться рано — еще во время беременности, а могут появиться практически в процессе родов. Чем меньше срок беременности, при котором начали вырабатываться антитела, тем больше их накапливается и тем вероятнее более тяжелое заболевание малыша. Эти антитела устремляются в кровь к плоду через плаценту, оседают на эритроцитах ребенка и начинают их разрушать. Их разрушается очень много, из разрушенных эритроцитов высвобождается большое количество пигмента билирубина. Этот билирубин является «плохим», он называется непрямым билирубином и является очень токсичным. Он должен обезвреживаться в печени. Но так как при рождении у ребенка ферментная система печени незрелая (она дозревает постнатально), она не сможет утилизировать полностью весь билирубин, его очень будет много, а его особенностью является накапливаться в тех тканях организма, которые содержат жир, то идеальным местом накопления билирубина будет подкожная жировая клетчатка и клинически мы будем видеть желтуху кожи. Кроме этого вы должны знать, что эритроциты еще выполняют функцию доставки кислорода ко всем органам. А раз они разрушаются, то функция кислородоснабжения нарушается, и в первую очередь будет страдать один из наиболее уязвимых и пока еще не слишком развитых органов новорожденных — мозг, ведь он в первую очередь нуждается в кислородной подпитке.
Кроме этого вы должны знать, что эритроциты еще выполняют функцию доставки кислорода ко всем органам. А раз они разрушаются, то функция кислородоснабжения нарушается, и в первую очередь будет страдать один из наиболее уязвимых и пока еще не слишком развитых органов новорожденных — мозг, ведь он в первую очередь нуждается в кислородной подпитке.
Почему непрямой билирубин является токсичным? Потому что он повреждает клетки сердца, печени и в большей степени клетки мозга, возникает билирубиновая интоксикация, характеризующаяся вялостью, срыгиваниями, рвотой, патологическим зеванием, снижением мышечного тонуса. А при высоких критических показателях выше 340 мкмольл у доношенных детей и при показателе 160 мкмоль/л у недоношенных возникает “ядерная желтуха”- это билирубиновая интоксикация мозга, когда ядра клеток мозга прокрашиваются билирубином: появляется мышечный гипертонус, ригидность затылочных мышц, резкий «мозговой» крик, ребенок реагирует на все раздражители, выбухает большой родничок, подергиваются мышцы, появляются судороги, косоглазие, нарушение дыхания.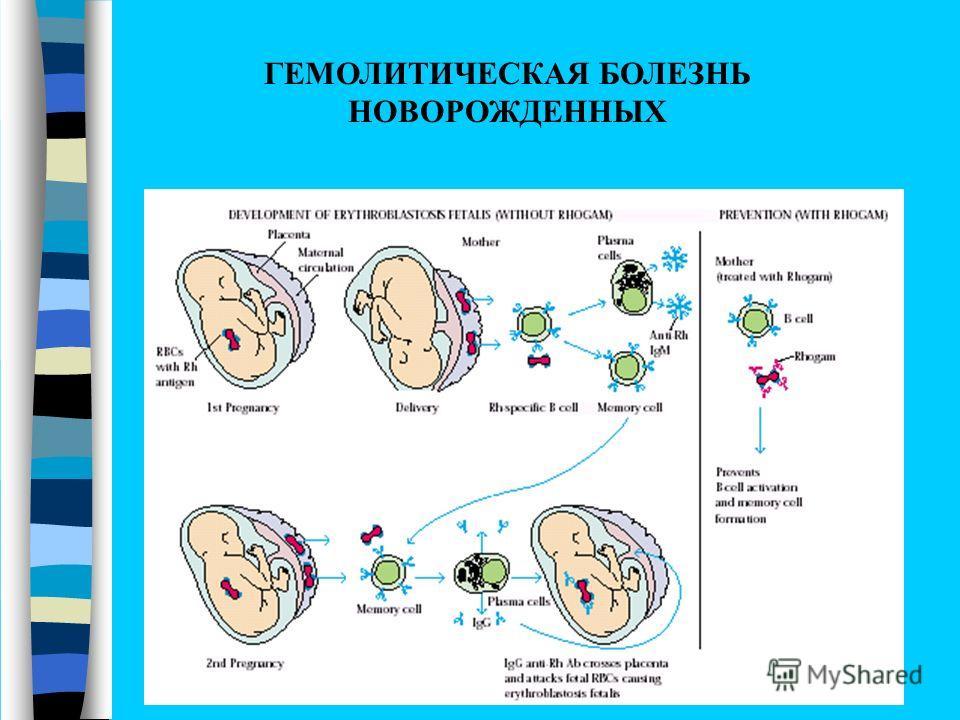
Яркость желтушного оттенка зависит от количества этого пигмента в организме новорожденного. Желтуха может возникать рано (возможно, даже в первые сутки жизни ребенка) и сохраняется в течение длительного времени. Характерно увеличение печени и селезенки, Цвет кожи ребенка — ярко-желтый, могут быть прокрашены склеры — белки глаз. Если есть анемия, а она обязательно есть, т.к. эритроциты погибают, то малыш будет бледным и желтуха может казаться не такой яркой.
Лечение при легких и средних формах тяжести данного конфликта часто проводится консервативно. Малышам проводится фототерапия, т.е.лечение светом, т.к. под действием света непрямой билирубин разрушается. Также назначаются адсорбенты, которые помогают кишечнику бороться с токсинами. При тяжелых состояниях проводится операция заменного переливания крови.
При поздно начатом лечении последствия гемолитической болезни могут быть опасными – от гибели малыша до тяжелых неврологических расстройств с признаками детского церебрального паралича, задержки психофизического развития, глухоты, нарушения речи.
Легкие и средние формы патологии редко( до10%) могут оставлять легкую задержку моторного развития при удовлетворительном состоянии умственных способностей; расстройство поведения; нарушение функций движения, косоглазие, нарушение слуха и речи. Дети с перенесенной ГБН плохо переносят прививки, склонны к развитию тяжелых аллергий и часто и длительно могут болеть инфекционными заболеваниями; зубы часто подвержены разрушению эмали и кариесу.
На период лечения малыш отстраняется от грудного вскармливания, т.к. через грудное молоко антитела (JgG) будут поступать к ребенку и желтуха будет усиливаться. Через 15-20 дней ,после исчезновения антител из молока, женщина может кормить грудью. Для мамы новорожденного очень важна диета. Правильное питание женщины обеспечит поступление витаминов и исключит воздействие вредных химических добавок. Обязательный рацион должен содержать овощи и фрукты, рыбу, печень. Главное, чтобы продукты были свежими и натуральными.
Дети , перенесшие ГБН, должны наблюдаться врачом- невропатологом в поликлинике и получать реабилитационное лечение.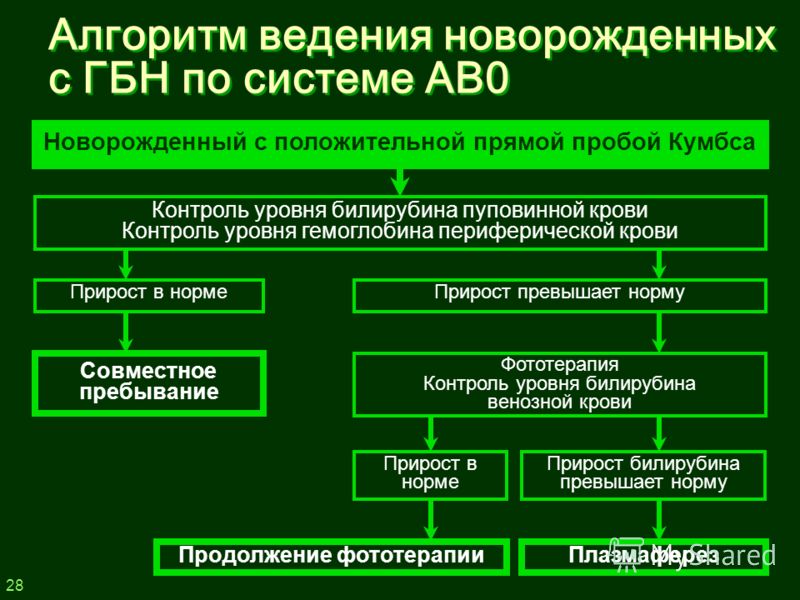
И в заключении хочу сказать, что даже поняв самую малость из выше описанного мною, любой разумный человек, в том числе тот, кто по роду деятельности далек от медицины, способен понять последствия гемолитической болезни.
Статью подготовила Кононова Наталья Федоровна заведующая отделением организации медицинской помощи детям в образовательных организациях ГБУЗ ЯНАО «Губкинская городская больница».
Гемолитические болезни новорожденных — StatPearls
Непрерывное обучение
Гемолитическая болезнь плода и новорожденного — это несоответствие эритроцитов между матерями и их плодом, которое может вызвать значительную заболеваемость и смертность. К счастью, фатальные последствия этого расстройства стали редкостью при соответствующем применении иммунопрофилактики. Однако, чтобы избежать фатальных последствий этого расстройства, жизненно важны своевременная диагностика и лечение. Это мероприятие рассматривает оценку, лечение и профилактику гемолитической болезни плода и новорожденного межпрофессиональной командой.
Цели:
Опишите этиологию и эпидемиологию гемолитической болезни плода и новорожденного.
Обзор патофизиологии гемолитической болезни плода и новорожденного.
Схема лечения гемолитической болезни плода и новорожденного.
Обобщение межпрофессиональных командных стратегий по улучшению координации оказания медицинской помощи и коммуникации для улучшения лечения гемолитической болезни плода и новорожденного и улучшения исходов.
Получите доступ к бесплатным вопросам с несколькими вариантами ответов по этой теме.
Введение
Гемолитическая болезнь плода и новорожденного (HDFN) представляет собой иммуноопосредованное заболевание эритроцитов (эритроцитов), при котором материнские антитела атакуют эритроциты плода или новорожденного.[1][2] HDFN может вызвать значительную заболеваемость и смертность, особенно в условиях ограниченных ресурсов здравоохранения. Эффекты HDFN варьируются от легкой анемии до водянки плода у плода и гипербилирубинемии и ядерной желтухи у новорожденных. Благодаря раннему выявлению, лечению и профилактике этого заболевания заболеваемость и распространенность ГБПН за последние 50 лет снизились в геометрической прогрессии.[1] 9[4] И наоборот, аллоиммунизация из-за фетоматеринского кровотечения (FMH) представляет собой приобретенный иммунно-опосредованный механизм, который обычно влияет на последующие беременности, а не на беременность, при которой происходит FMH.
Эффекты HDFN варьируются от легкой анемии до водянки плода у плода и гипербилирубинемии и ядерной желтухи у новорожденных. Благодаря раннему выявлению, лечению и профилактике этого заболевания заболеваемость и распространенность ГБПН за последние 50 лет снизились в геометрической прогрессии.[1] 9[4] И наоборот, аллоиммунизация из-за фетоматеринского кровотечения (FMH) представляет собой приобретенный иммунно-опосредованный механизм, который обычно влияет на последующие беременности, а не на беременность, при которой происходит FMH.
Эпидемиология
Гемолитическая болезнь плода и новорожденного впервые была описана доктором Луисом К. Даймондом в 1932, когда он написал об эритробластозе плода у новорожденных на основании мазков периферической крови.[6] Иммунопрофилактика резус-отрицательных (RhD) впервые была введена в 1968 году, благодаря чему заболеваемость ГБПН снизилась с 1% всех новорожденных во всем мире (с 50% смертностью) до 0,5% [1]. Заболеваемость HDFN снизилась еще больше до 0,1% при проведении дородовой иммунопрофилактики RhD [2]. Однако, несмотря на адекватную иммунопрофилактику RhD, по оценкам, от 1 до 3 из 1000 резус-отрицательных женщин все еще получают аллоиммунизацию. Таким образом, важно сохранять бдительность в отношении развития ГБПН.[1]
Однако, несмотря на адекватную иммунопрофилактику RhD, по оценкам, от 1 до 3 из 1000 резус-отрицательных женщин все еще получают аллоиммунизацию. Таким образом, важно сохранять бдительность в отношении развития ГБПН.[1]
Резус-несовместимость зависит от расы, этнической принадлежности и факторов риска. Резус-отрицательная группа крови наиболее преобладает у белых рас (15%) по сравнению с афроамериканцами (от 5% до 8%) или азиатами и коренными американцами (от 1% до 2%). Среди белых женщин резус-отрицательная женщина имеет 85% шанс спаривания с резус-положительным мужчиной.[1] Эта часто встречающаяся резус-несовместимость увеличивает риск ГБПН при любом событии СМГ.
Всего 0,1 мл крови плода, попадающей в кровоток матери, достаточно для аллоиммунизации.[7] Фактически, от 15 до 50 % беременных имеют достаточно фетально-материнских кровотечений, чтобы вызвать аллоиммунизацию, и только от 1 до 2 % всех резус-аллоиммунизаций вызваны дородовой FMH.[7] Таким образом, важно учитывать ГБПН на всех стадиях беременности, когда может возникнуть ЗМГ.
Патофизиология
Как уже упоминалось, существует два механизма, вызывающих гемолитическую болезнь плода и новорожденного. Во-первых, фето-материнская пара может иметь врожденную несовместимость по системе АВО, которая возникает в 15 – 25 % беременностей.[8] Только около 1% этих пар с высокими титрами IgG разовьют HDFN из-за несовместимости по системе ABO [8]. При несовместимости по системе ABO у матерей с группой крови O присутствуют естественные антигены против групп крови A или B. Если плод матери имеет группу крови А или В (или АВ), эти материнские антитела анти-А и/или анти-В соответственно будут атаковать чужеродную группу крови плода. Антитела анти-А и анти-В представляют собой IgG, которые могут проникать через плаценту и воздействовать на развивающийся плод.[9]] По сравнению с FMH, несовместимость по системе ABO обычно вызывает менее тяжелую форму HDFN. Постулированные теории для этого включают в себя фетальные эритроциты экспрессируют меньше антигенов группы крови ABO, чем взрослые, и что антигены группы крови ABO экспрессируются многими тканями, что снижает вероятность того, что антитела специфически нацелены на антигены на фетальных эритроцитах.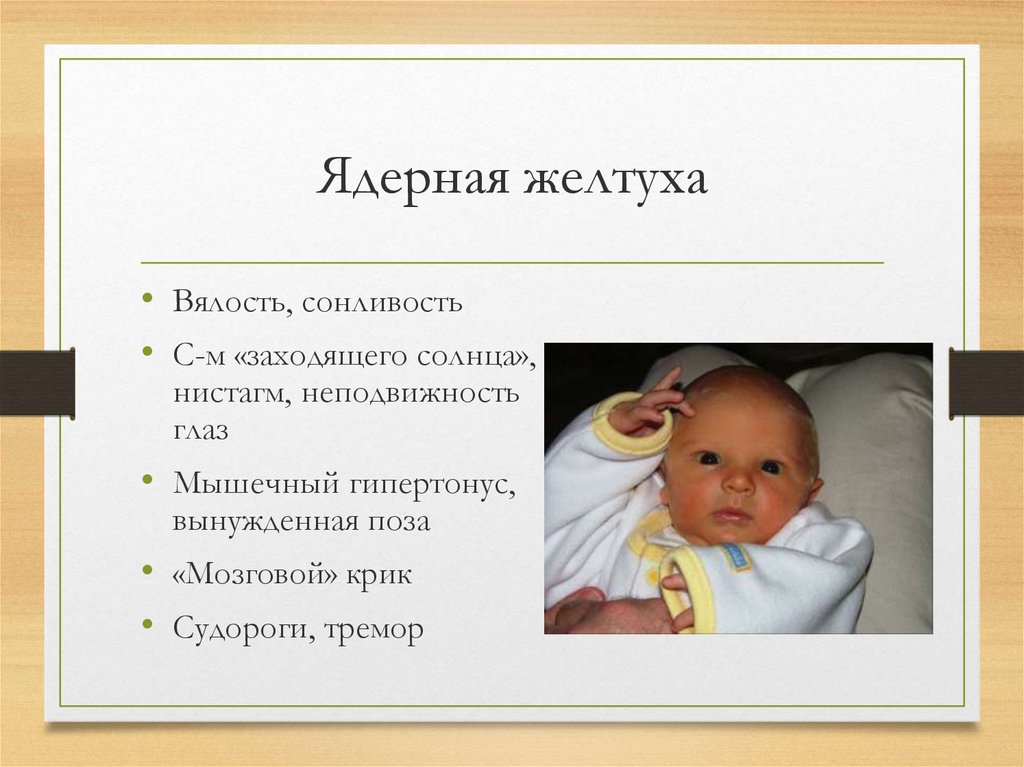
Вторым механизмом, наиболее часто вызывающим ГБПН, является фетоматеринское кровотечение (ФМК), при котором материнские антитела вырабатываются после контакта с кровью плода. Когда эритроциты плода попадают в кровоток матери, материнские антитела могут вырабатываться к антигену, представленному на поверхности эритроцитов плода. Наиболее распространенным антигеном, участвующим в этом механизме, является антиген резуса D.[10] По оценкам, у 1,5–2,5% акушерских пациенток вырабатываются антитела к другим «второстепенным» антигенам. Хотя в большинстве этих случаев аллоиммунизация не вызывает значимой гемолитической болезни новорожденных, некоторые могут вызывать тяжелую анемию при низком пороге титра. Антитела против антигенов группы крови Келла, например, связаны с повышенным риском тяжелой анемии и/или гибели плода. Эти пациенты должны находиться под очень пристальным наблюдением на протяжении всей беременности.[3][7]
Антигены крови плода, чужеродные материнской крови, наследуются от отцовских генов. Например, у резус-отрицательной женщины может быть резус-положительный плод из-за того, что ее партнер является резус-положительным. Антитела, которые развиваются из-за FMH, подвергают последующие беременности риску HDFN, поскольку первые антитела, которые вырабатываются, относятся к типу IgM, которые не могут проникать через плаценту. При последующих контактах с антигеном Rh-D материнские антитела быстро вырабатывают антитела IgG, которые проникают через плаценту.[11]
Например, у резус-отрицательной женщины может быть резус-положительный плод из-за того, что ее партнер является резус-положительным. Антитела, которые развиваются из-за FMH, подвергают последующие беременности риску HDFN, поскольку первые антитела, которые вырабатываются, относятся к типу IgM, которые не могут проникать через плаценту. При последующих контактах с антигеном Rh-D материнские антитела быстро вырабатывают антитела IgG, которые проникают через плаценту.[11]
Когда эритроциты младенцев подвергаются атаке и разрушаются, у младенцев развивается гемолитическая анемия. Расщепление гема приводит к образованию билирубина, который выводится плацентой внутриутробно. При рождении печень начинает обрабатывать билирубин. Непрямой билирубин или неконъюгированный билирубин конъюгируют с прямым билирубином с помощью фермента уридиндифосфоглюкуронозилтрансферазы (УДФ-глюкуронозилтрансферазы). Этот конъюгированный билирубин выводится с желчью, где в конечном итоге будет выводиться с фекалиями и мочой.
У младенцев, особенно недоношенных, процессинг печени менее эффективен, что часто приводит к естественной физиологической желтухе.[12] При избытке продуктов распада HDFN эти незрелые механизмы процессинга перегружаются, что может привести к выраженной гипербилирубинемии. Накопление несвязанного билирубина может привести к неврологической дисфункции, поскольку несвязанный билирубин пересекает гематоэнцефалический барьер и откладывается в головном мозге развивающегося новорожденного.[13] Своевременное распознавание и лечение гипербилирубинемии и ГБПН имеют первостепенное значение для предотвращения долгосрочной неврологической дисфункции у этих детей.
Анамнез и физикальное исследование
Подробный анамнез может иметь важное значение для подозрения на гемолитическую болезнь плода и новорожденного. Особое внимание следует уделить выявлению любых событий, которые могли привести к фетоматеринскому кровотечению. К ним относятся предыдущие беременности с ГБПН или водянкой плода, выкидыши, внематочная беременность, прерывание беременности на ранних сроках, переливание крови у матери, забор ворсин хориона, амниоцентез или документирование кровотечения во время беременности [7].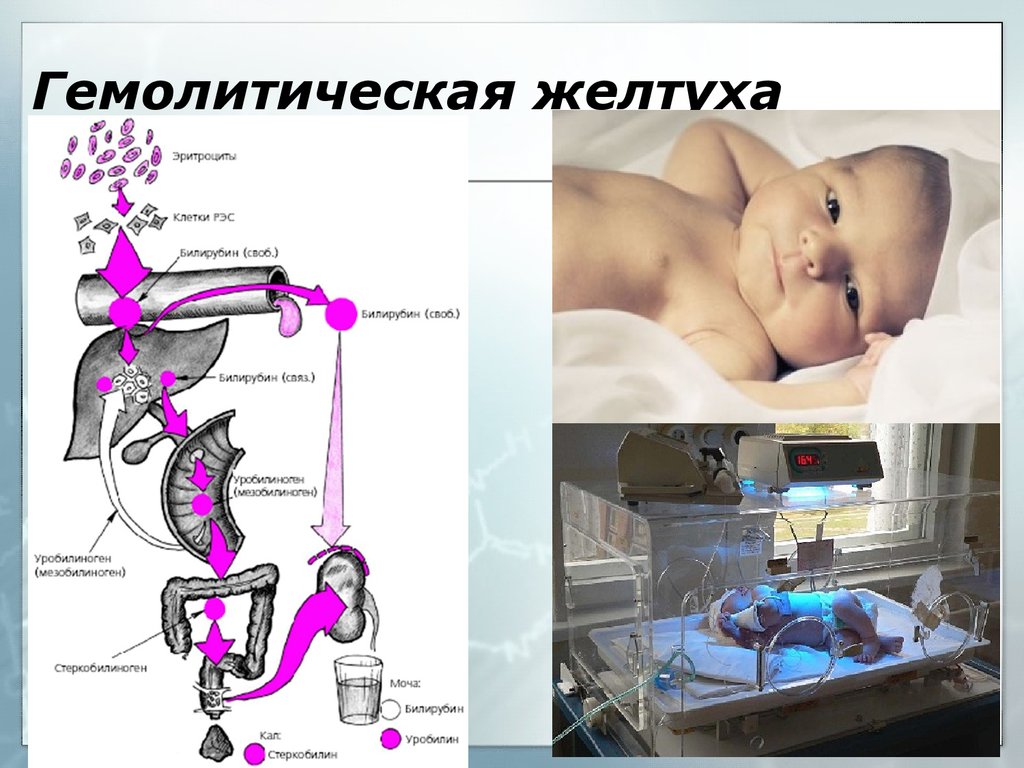
В начале первого триместра всем беременным женщинам следует провести анализ крови. Те, у кого группа крови O, естественным образом экспрессируют антитела к группам крови A и B, поэтому их следует контролировать на предмет развития HDFN, особенно во время родов и непосредственно после родов. Антитела, экспрессируемые у матерей с группой крови O, обычно представляют собой иммуноглобулин G (IgG) и могут проникать через плаценту. И наоборот, у матерей с группой крови А есть антитела против группы крови В, которые представляют собой преимущественно иммуноглобулины М (IgM) и не проникают через плаценту.[8] Общепринятой практикой является проверка групп крови младенцев, рожденных от матерей с группой крови О при рождении, в то время как группы крови младенцев, матери которых имеют группу крови А, В или АВ, могут не проверяться (если резус-фактор положительный). .
Основными признаками гемолитической болезни новорожденных (ГБН) являются анемия и гипербилирубинемия, которые могут проявляться вялостью, желтухой, иктеричностью конъюнктивы, бледностью, гепатоспленомегалией, тахикардией или брадикардией, повышенной потребностью в кислороде и/или апноэ. [9] [13]
[9] [13]
Оценка
Гемолитическая болезнь плода и новорожденного следует учитывать при дифференциальной диагностике новорожденных с желтухой/гипербилирубинемией и, безусловно, в случае неонатальной анемии. Диагноз HDFN может быть поставлен путем определения наличия материнских антител к эритроцитам (агглютинация в непрямом тесте на антитела) и/или положительного прямого теста на антитела (DAT) в сыворотке младенца.[4] Если у беременной женщины выявлена аллоиммунизация, первым шагом в дальнейшем обследовании является определение антигенного статуса эритроцитов отца. В случае положительного результата следующим шагом будет определение группы крови плода, что обычно делается с помощью амниоцентеза.[7]
По данным Американской академии педиатрии (AAP), «если у матери не было пренатальной группы крови или она резус-отрицательна, прямой тест на антитела (или тест Кумбса), группа крови и резус-фактор (D) на (пуповинной) крови младенца настоятельно рекомендуется». возможно при беременности. Пораженные беременности можно контролировать путем мониторинга титров антител и скорости движения средней мозговой артерии плода, внутриутробных трансфузий и, возможно, досрочных родов, поскольку дети с тяжелой анемией могут плохо переносить срочные роды.
Пораженные беременности можно контролировать путем мониторинга титров антител и скорости движения средней мозговой артерии плода, внутриутробных трансфузий и, возможно, досрочных родов, поскольку дети с тяжелой анемией могут плохо переносить срочные роды.
Гемолитическая болезнь новорожденных лечится путем лечения гипербилирубинемии фототерапией и при необходимости обменными трансфузиями. Рутинный универсальный скрининг чрескожного билирубина (TcB) часто проводится в первые 24 часа жизни, но скрининг следует проводить, как только подозревается гипербилирубинемия. Повышенный TcB всегда следует подтверждать с помощью общего билирубина сыворотки (ТБ). Затем почасовая номограмма Бутани используется для стратификации риска по количеству билирубина в крови младенца.[13] Эта номограмма обеспечивает рекомендуемый порог для начала фототерапии по сравнению с ранними трансфузиями в зависимости от уровня риска для младенца.
Фототерапия была внедрена в 1970-х годах и стала основой лечения гипербилирубинемии у новорожденных. Фотоизомеризация вызывает превращение билирубина в водорастворимый изомер, который затем может выводиться почками и калом без необходимости переработки в печени. Основными факторами, определяющими эффективность фототерапии, являются длина волны используемого света, интенсивность этого света, общая доза света (время воздействия и площадь поверхности воздействия) и порог, при котором начинается фототерапия. AAP рекомендует использовать интенсивную фототерапию при HDFN. Оптимальный свет, используемый для фототерапии, имеет длину волны 460-490 нм. Свет должен быть на близком расстоянии (около 20 см над младенцем), и двойная фототерапия оказалась более эффективной, чем одиночная. Имеются ограниченные данные об эффективности непрерывной фототерапии по сравнению с прерывистой для младенцев с массой тела > 2000 г [1]. Во время фототерапии матерей следует поощрять кормить своих детей грудью через определенные промежутки времени, несмотря на то, что для этого им необходимо отключать их от фототерапии.
Фотоизомеризация вызывает превращение билирубина в водорастворимый изомер, который затем может выводиться почками и калом без необходимости переработки в печени. Основными факторами, определяющими эффективность фототерапии, являются длина волны используемого света, интенсивность этого света, общая доза света (время воздействия и площадь поверхности воздействия) и порог, при котором начинается фототерапия. AAP рекомендует использовать интенсивную фототерапию при HDFN. Оптимальный свет, используемый для фототерапии, имеет длину волны 460-490 нм. Свет должен быть на близком расстоянии (около 20 см над младенцем), и двойная фототерапия оказалась более эффективной, чем одиночная. Имеются ограниченные данные об эффективности непрерывной фототерапии по сравнению с прерывистой для младенцев с массой тела > 2000 г [1]. Во время фототерапии матерей следует поощрять кормить своих детей грудью через определенные промежутки времени, несмотря на то, что для этого им необходимо отключать их от фототерапии.
Обменное переливание может потребоваться для новорожденных с тяжелой анемией, которое включает замену эритроцитов новорожденных на антиген-отрицательные эритроциты, тем самым предотвращая дальнейший гемолиз. Аликвоты по 5 мл/кг удаляют и заменяют в течение нескольких минут для общего обмена эритроцитов на 25-50 мл/кг. Обменные переливания рекомендуются ААР, если уровни общего билирубина остаются выше порога переливания, несмотря на интенсивную фототерапию, или если присутствуют признаки билирубиновой энцефалопатии. Если рассматривается обменное переливание крови, следует измерить уровень альбумина. Альбумин 3,0 г/дл или менее считается независимым фактором риска гипербилирубинемии и снижает порог фототерапии. Без достаточного количества альбумина для связывания билирубина количество свободного неконъюгированного билирубина увеличивается, что увеличивает риск ядерной желтухи.[1]
Младенцам с анемией может потребоваться переливание крови с эритроцитарной массой, соответствующей системе ABO. Если считается, что необходима немедленная трансфузия, при родах должна быть доступна резус-отрицательная кровь O-типа, лейкодеплеция и облучение [1].
Если считается, что необходима немедленная трансфузия, при родах должна быть доступна резус-отрицательная кровь O-типа, лейкодеплеция и облучение [1].
Были рассмотрены и другие методы лечения, но они все еще остаются спорными. Внутривенный иммуноглобулин (ВВИГ) у младенцев может блокировать рецепторы Fc на макрофагах, тем самым уменьшая разрушение эритроцитов, покрытых антителами. AAP рекомендует ВВИГ, если общий билирубин в сыворотке продолжает расти, несмотря на интенсивную фототерапию, или находится в пределах 2-3 мг/дл от уровня обменного переливания. Введение ВВИГ матерям до родов не показало своей эффективности и в настоящее время не рекомендуется. Другие агенты, такие как альбумин, фенобарбитал, металлопорфирины, цинк, клофибрат и пребиотики, изучались в качестве возможных вариантов лечения гипербилирубинемии, но в настоящее время ни один из них не рекомендован [14]. В недавнем рандомизированном контролируемом исследовании с участием 70 младенцев с Rh-аллоиммунизацией было показано, что отсроченное пережатие пуповины уменьшает анемию без увеличения частоты побочных эффектов. Однако отсроченное пережатие пуповины не оказало существенного влияния на потребность в обменном переливании крови или продолжительность фототерапии.[15]
Однако отсроченное пережатие пуповины не оказало существенного влияния на потребность в обменном переливании крови или продолжительность фототерапии.[15]
Дифференциальный диагноз
Гемолитическая болезнь плода и новорожденного должна быть включена в дифференциальный диагноз младенцев с ранней, тяжелой или длительной желтухой и анемией. Другие этиологии желтухи и гипербилирубинемии у новорожденных включают физиологическую желтуху, недоношенность, желтуху грудного молока и грудного вскармливания, дефицит G6PD, талассемию, сепсис, родовую травму, синдром Жильбера и гипотиреоз [3]. Сбор анамнеза и физическая, а также простая лабораторная оценка, как описано выше, могут помочь дифференцировать эти причины.
Планирование лечения
Американская ассоциация банков крови рекомендует повторный скрининг на антитела перед введением Rh-D иммунопрофилактики (Rh-D IgG) на 28 неделе беременности, в послеродовой период и при FMH[5]. В сетевом метаанализе, проведенном в Китае, наиболее эффективным протоколом для предотвращения материнской аллоиммунизации было введение Rh-D-иммунопрофилактики на 28 и 34 неделе беременности у резус-отрицательных женщин. [16]
[16]
Стандартная доза анти-RhD, вводимая во втором и третьем триместре и в послеродовом периоде, при необходимости, составляет 300 мкг. При необходимости в первом триместре рекомендуемая доза составляет 150 мкг. Одноразовая доза 300 мкг анти-RhD должна предотвратить изоиммунизацию, когда 15 мл или менее фетальных эритроцитов (или 30 мл цельной крови) попадает в кровоток матери. Тест на розетку — это качественный тест для оценки потенциальной FMH. В случае положительного результата за розеточным тестом следует провести тест Кляйхауэра-Бетке, чтобы количественно определить количество смешиваемой крови плода и матери, чтобы затем определить, нужны ли дополнительные дозы Rh-D-иммунопрофилактики.
Прогноз
Общий прогноз ГБПН благоприятный при своевременном выявлении и лечении. В то время как необратимая неврологическая дисфункция может быть результатом задержек в оказании помощи, в настоящее время это редкое явление благодаря достижениям в области мониторинга, а также профилактики ГБПН.
Осложнения
Острая билирубиновая энцефалопатия из-за накопления билирубина в мозгу младенца может проявляться гипотонией или плохим сосательным рефлексом, который затем прогрессирует до раздражительности и гипертонии с ретроколлисом и опистотонусом. Долгосрочные последствия хронической билирубиновой энцефалопатии могут привести к церебральному параличу, слуховой дисфункции, параличу взгляда вверх и стойкой интеллектуальной дисфункции.[13] Таким образом, раннее распознавание и лечение необходимы для предотвращения неблагоприятного прогрессирования ГБПН.
Сдерживание и просвещение пациентов
Обучение пациентов в отношении рутинных лабораторных анализов и Rh-иммунопрофилактики у резус-отрицательных женщин необходимо для того, чтобы обеспечить регистрацию возможных случаев FMH и надлежащее лечение беременных женщин. Кроме того, родители новорожденных могут быть проинформированы о признаках и симптомах гипербилирубинемии, чтобы помочь межпрофессиональной команде в раннем выявлении возможных случаев ГБПН.
Улучшение результатов работы команды здравоохранения
Улучшение результатов межпрофессиональной бригады для пациентов с гемолитической болезнью плода и новорожденного требует тесного сотрудничества между акушерами-гинекологами и педиатрами, медсестрами, фармацевтами и персоналом банка крови. При ГБПН всегда необходимо учитывать двух пациентов — мать и плод/новорожденный. Если ГБПН выявлена внутриутробно, родовспоможение должно быть хорошо осведомлено и заранее подготовлено для выявления признаков и симптомов ГБПН, поскольку этим детям может потребоваться своевременное переливание крови при рождении. Фармацевты и поставщики медицинских услуг должны определить, показана ли иммунопрофилактика резус-фактора D для предотвращения будущих случаев ГБПН на протяжении всей беременности. Благодаря развитию Rh-D-иммунопрофилактики и протоколов обследования новорожденных заболеваемость HDFN резко снизилась за последние 50 лет. Тем не менее, для обеспечения низкого уровня заболеваемости HDFN потребуется постоянное межпрофессиональное сотрудничество.
Контрольные вопросы
Доступ к бесплатным вопросам с несколькими вариантами ответов по этой теме.
Комментарий к этой статье.
Ссылки
- 1.
Ree IMC, Smits-Wintjens VEHJ, van der Bom JG, van Klink JMM, Oepkes D, Lopriore E. Ведение новорожденных и исходы при аллоиммунной гемолитической болезни. Эксперт преподобный Гематол. 2017 июль; 10 (7): 607-616. [PubMed: 28503958]
- 2.
Basu S, Kaur R, Kaur G. Гемолитическая болезнь плода и новорожденного: современные тенденции и перспективы. Азиатский J Transfus Sci. 2011 янв;5(1):3-7. [Бесплатная статья PMC: PMC3082712] [PubMed: 21572705]
- 3.
де Хаас М., Тюрик Ф.Ф., Колевейн Дж.М., ван дер Шут С.Э. Гемолитическая болезнь плода и новорожденного. Вокс Санг. 2015 авг; 109 (2): 99-113. [PubMed: 25899660]
- 4.
Меткалф Р.А., Хан Дж., Эндрюс Дж., Мэйок Д., Биллимория З., Пагано М.
 Б. Тяжелая гемолитическая болезнь АВО новорожденных, требующая обменного переливания крови. J Pediatr Hematol Oncol. 2019 ноябрь;41(8):632-634. [PubMed: 30044350]
Б. Тяжелая гемолитическая болезнь АВО новорожденных, требующая обменного переливания крови. J Pediatr Hematol Oncol. 2019 ноябрь;41(8):632-634. [PubMed: 30044350]- 5.
Noronha SA. Приобретенная и врожденная гемолитическая анемия. Pediatr Rev. 2016 Jun;37(6):235-46. [В паблике: 27252179]
- 6.
Найман Ю.Л. О статье доктора Луи К. Даймонда 1932 года и последующем вкладе в эритробластоз плода. J Pediatr Hematol Oncol. 2001 ноябрь; 23 (8): 550-3. [PubMed: 11878786]
- 7.
Практический бюллетень ACOG № 192: Управление аллоиммунизацией во время беременности. Акушерство Гинекол. 2018 март; 131(3):e82-e90. [PubMed: 29470342]
- 8.
Мюррей Н.А., Робертс И.А. Гемолитическая болезнь новорожденных. Arch Dis Child Fetal Neonatal Ed. 2007 март;92(2):F83-8. [Бесплатная статья PMC: PMC2675453] [PubMed: 17337672]
- 9.
Делани М., Мэтьюз, округ Колумбия. Гемолитическая болезнь плода и новорожденного: ведение матери, плода и новорожденного.
 Гематология Программа Am Soc Hematol Educ. 2015;2015:146-51. [PubMed: 26637714]
Гематология Программа Am Soc Hematol Educ. 2015;2015:146-51. [PubMed: 26637714]- 10.
Практический бюллетень № 181: Профилактика Rh D Аллоиммунизация. Акушерство Гинекол. 2017 авг;130(2):e57-e70. [PubMed: 28742673]
- 11.
Moinuddin I, Fletcher C, Millward P. Распространенность и специфичность клинически значимых аллоантител к эритроцитам у беременных женщин — исследование, проведенное в больнице третичного уровня в Юго-восточном Мичигане. Дж. Кровь Мед. 2019;10:283-289. [Бесплатная статья PMC: PMC6708388] [PubMed: 31692490]
- 12.
Митра С., Ренни Дж. Неонатальная желтуха: этиология, диагностика и лечение. Br J Hosp Med (Лондон). 2017 02 декабря; 78 (12): 699-704. [PubMed: 29240507]
- 13.
Подкомитет Американской академии педиатрии по гипербилирубинемии. Лечение гипербилирубинемии у новорожденных в возрасте 35 и более недель гестации. Педиатрия. 2004 г., июль; 114 (1): 297–316.
 [В паблике: 15231951]
[В паблике: 15231951]- 14.
Li S, He Z, Mo C, Ji Y, Luo Y, Fang Q, Gao Y. Гипорегенеративная анемия при анти-М-ассоциированной гемолитической болезни плода. Переливание. 2021 июнь;61(6):1908-1915. [PubMed: 33938570]
- 15.
Саху Т., Тукрал А., Санкар М.Дж., Гупта С.К., Агарвал Р., Деорари А.К., Пол В.К. Отсроченное пережатие пуповины у Rh-аллоиммунизированных младенцев: рандомизированное контролируемое исследование. Eur J Педиатр. 2020 июнь; 179 (6): 881-889. [PubMed: 31974670]
- 16.
Xie X, Fu Q, Bao Z, Zhang Y, Zhou D. Клиническая ценность различных анти-D-иммуноглобулиновых стратегий для предотвращения резус-гемолитической болезни плода и новорожденного: сетевой метаанализ. ПЛОС Один. 2020;15(3):e0230073. [Бесплатная статья PMC: PMC7067404] [PubMed: 32163467]
Гемолитические болезни новорожденных — StatPearls
Непрерывное обучение
Гемолитическая болезнь плода и новорожденного — это несоответствие эритроцитов между матерями и их плодом, которое может вызывают значительную заболеваемость и смертность. К счастью, фатальные последствия этого расстройства стали редкостью при соответствующем применении иммунопрофилактики. Однако, чтобы избежать фатальных последствий этого расстройства, жизненно важны своевременная диагностика и лечение. Это мероприятие рассматривает оценку, лечение и профилактику гемолитической болезни плода и новорожденного межпрофессиональной командой.
К счастью, фатальные последствия этого расстройства стали редкостью при соответствующем применении иммунопрофилактики. Однако, чтобы избежать фатальных последствий этого расстройства, жизненно важны своевременная диагностика и лечение. Это мероприятие рассматривает оценку, лечение и профилактику гемолитической болезни плода и новорожденного межпрофессиональной командой.
Цели:
Опишите этиологию и эпидемиологию гемолитической болезни плода и новорожденного.
Обзор патофизиологии гемолитической болезни плода и новорожденного.
Схема лечения гемолитической болезни плода и новорожденного.
Обобщение межпрофессиональных командных стратегий по улучшению координации оказания медицинской помощи и коммуникации для улучшения лечения гемолитической болезни плода и новорожденного и улучшения исходов.
Получите доступ к бесплатным вопросам с несколькими вариантами ответов по этой теме.
Введение
Гемолитическая болезнь плода и новорожденного (HDFN) представляет собой иммуноопосредованное заболевание эритроцитов (эритроцитов), при котором материнские антитела атакуют эритроциты плода или новорожденного.[1][2] HDFN может вызвать значительную заболеваемость и смертность, особенно в условиях ограниченных ресурсов здравоохранения. Эффекты HDFN варьируются от легкой анемии до водянки плода у плода и гипербилирубинемии и ядерной желтухи у новорожденных. Благодаря раннему выявлению, лечению и профилактике этого заболевания заболеваемость и распространенность ГБПН за последние 50 лет снизились в геометрической прогрессии.[1] 9[4] И наоборот, аллоиммунизация из-за фетоматеринского кровотечения (FMH) представляет собой приобретенный иммунно-опосредованный механизм, который обычно влияет на последующие беременности, а не на беременность, при которой происходит FMH.
Эпидемиология
Гемолитическая болезнь плода и новорожденного впервые была описана доктором Луисом К. Даймондом в 1932, когда он написал об эритробластозе плода у новорожденных на основании мазков периферической крови.[6] Иммунопрофилактика резус-отрицательных (RhD) впервые была введена в 1968 году, благодаря чему заболеваемость ГБПН снизилась с 1% всех новорожденных во всем мире (с 50% смертностью) до 0,5% [1]. Заболеваемость HDFN снизилась еще больше до 0,1% при проведении дородовой иммунопрофилактики RhD [2]. Однако, несмотря на адекватную иммунопрофилактику RhD, по оценкам, от 1 до 3 из 1000 резус-отрицательных женщин все еще получают аллоиммунизацию. Таким образом, важно сохранять бдительность в отношении развития ГБПН.[1]
Даймондом в 1932, когда он написал об эритробластозе плода у новорожденных на основании мазков периферической крови.[6] Иммунопрофилактика резус-отрицательных (RhD) впервые была введена в 1968 году, благодаря чему заболеваемость ГБПН снизилась с 1% всех новорожденных во всем мире (с 50% смертностью) до 0,5% [1]. Заболеваемость HDFN снизилась еще больше до 0,1% при проведении дородовой иммунопрофилактики RhD [2]. Однако, несмотря на адекватную иммунопрофилактику RhD, по оценкам, от 1 до 3 из 1000 резус-отрицательных женщин все еще получают аллоиммунизацию. Таким образом, важно сохранять бдительность в отношении развития ГБПН.[1]
Резус-несовместимость зависит от расы, этнической принадлежности и факторов риска. Резус-отрицательная группа крови наиболее преобладает у белых рас (15%) по сравнению с афроамериканцами (от 5% до 8%) или азиатами и коренными американцами (от 1% до 2%). Среди белых женщин резус-отрицательная женщина имеет 85% шанс спаривания с резус-положительным мужчиной. [1] Эта часто встречающаяся резус-несовместимость увеличивает риск ГБПН при любом событии СМГ.
[1] Эта часто встречающаяся резус-несовместимость увеличивает риск ГБПН при любом событии СМГ.
Всего 0,1 мл крови плода, попадающей в кровоток матери, достаточно для аллоиммунизации.[7] Фактически, от 15 до 50 % беременных имеют достаточно фетально-материнских кровотечений, чтобы вызвать аллоиммунизацию, и только от 1 до 2 % всех резус-аллоиммунизаций вызваны дородовой FMH.[7] Таким образом, важно учитывать ГБПН на всех стадиях беременности, когда может возникнуть ЗМГ.
Патофизиология
Как уже упоминалось, существует два механизма, вызывающих гемолитическую болезнь плода и новорожденного. Во-первых, фето-материнская пара может иметь врожденную несовместимость по системе АВО, которая возникает в 15 – 25 % беременностей.[8] Только около 1% этих пар с высокими титрами IgG разовьют HDFN из-за несовместимости по системе ABO [8]. При несовместимости по системе ABO у матерей с группой крови O присутствуют естественные антигены против групп крови A или B. Если плод матери имеет группу крови А или В (или АВ), эти материнские антитела анти-А и/или анти-В соответственно будут атаковать чужеродную группу крови плода. Антитела анти-А и анти-В представляют собой IgG, которые могут проникать через плаценту и воздействовать на развивающийся плод.[9]] По сравнению с FMH, несовместимость по системе ABO обычно вызывает менее тяжелую форму HDFN. Постулированные теории для этого включают в себя фетальные эритроциты экспрессируют меньше антигенов группы крови ABO, чем взрослые, и что антигены группы крови ABO экспрессируются многими тканями, что снижает вероятность того, что антитела специфически нацелены на антигены на фетальных эритроцитах.
Антитела анти-А и анти-В представляют собой IgG, которые могут проникать через плаценту и воздействовать на развивающийся плод.[9]] По сравнению с FMH, несовместимость по системе ABO обычно вызывает менее тяжелую форму HDFN. Постулированные теории для этого включают в себя фетальные эритроциты экспрессируют меньше антигенов группы крови ABO, чем взрослые, и что антигены группы крови ABO экспрессируются многими тканями, что снижает вероятность того, что антитела специфически нацелены на антигены на фетальных эритроцитах.
Вторым механизмом, наиболее часто вызывающим ГБПН, является фетоматеринское кровотечение (ФМК), при котором материнские антитела вырабатываются после контакта с кровью плода. Когда эритроциты плода попадают в кровоток матери, материнские антитела могут вырабатываться к антигену, представленному на поверхности эритроцитов плода. Наиболее распространенным антигеном, участвующим в этом механизме, является антиген резуса D.[10] По оценкам, у 1,5–2,5% акушерских пациенток вырабатываются антитела к другим «второстепенным» антигенам. Хотя в большинстве этих случаев аллоиммунизация не вызывает значимой гемолитической болезни новорожденных, некоторые могут вызывать тяжелую анемию при низком пороге титра. Антитела против антигенов группы крови Келла, например, связаны с повышенным риском тяжелой анемии и/или гибели плода. Эти пациенты должны находиться под очень пристальным наблюдением на протяжении всей беременности.[3][7]
Хотя в большинстве этих случаев аллоиммунизация не вызывает значимой гемолитической болезни новорожденных, некоторые могут вызывать тяжелую анемию при низком пороге титра. Антитела против антигенов группы крови Келла, например, связаны с повышенным риском тяжелой анемии и/или гибели плода. Эти пациенты должны находиться под очень пристальным наблюдением на протяжении всей беременности.[3][7]
Антигены крови плода, чужеродные материнской крови, наследуются от отцовских генов. Например, у резус-отрицательной женщины может быть резус-положительный плод из-за того, что ее партнер является резус-положительным. Антитела, которые развиваются из-за FMH, подвергают последующие беременности риску HDFN, поскольку первые антитела, которые вырабатываются, относятся к типу IgM, которые не могут проникать через плаценту. При последующих контактах с антигеном Rh-D материнские антитела быстро вырабатывают антитела IgG, которые проникают через плаценту.[11]
Когда эритроциты младенцев подвергаются атаке и разрушаются, у младенцев развивается гемолитическая анемия. Расщепление гема приводит к образованию билирубина, который выводится плацентой внутриутробно. При рождении печень начинает обрабатывать билирубин. Непрямой билирубин или неконъюгированный билирубин конъюгируют с прямым билирубином с помощью фермента уридиндифосфоглюкуронозилтрансферазы (УДФ-глюкуронозилтрансферазы). Этот конъюгированный билирубин выводится с желчью, где в конечном итоге будет выводиться с фекалиями и мочой.
Расщепление гема приводит к образованию билирубина, который выводится плацентой внутриутробно. При рождении печень начинает обрабатывать билирубин. Непрямой билирубин или неконъюгированный билирубин конъюгируют с прямым билирубином с помощью фермента уридиндифосфоглюкуронозилтрансферазы (УДФ-глюкуронозилтрансферазы). Этот конъюгированный билирубин выводится с желчью, где в конечном итоге будет выводиться с фекалиями и мочой.
У младенцев, особенно недоношенных, процессинг печени менее эффективен, что часто приводит к естественной физиологической желтухе.[12] При избытке продуктов распада HDFN эти незрелые механизмы процессинга перегружаются, что может привести к выраженной гипербилирубинемии. Накопление несвязанного билирубина может привести к неврологической дисфункции, поскольку несвязанный билирубин пересекает гематоэнцефалический барьер и откладывается в головном мозге развивающегося новорожденного.[13] Своевременное распознавание и лечение гипербилирубинемии и ГБПН имеют первостепенное значение для предотвращения долгосрочной неврологической дисфункции у этих детей.
Анамнез и физикальное исследование
Подробный анамнез может иметь важное значение для подозрения на гемолитическую болезнь плода и новорожденного. Особое внимание следует уделить выявлению любых событий, которые могли привести к фетоматеринскому кровотечению. К ним относятся предыдущие беременности с ГБПН или водянкой плода, выкидыши, внематочная беременность, прерывание беременности на ранних сроках, переливание крови у матери, забор ворсин хориона, амниоцентез или документирование кровотечения во время беременности [7].
В начале первого триместра всем беременным женщинам следует провести анализ крови. Те, у кого группа крови O, естественным образом экспрессируют антитела к группам крови A и B, поэтому их следует контролировать на предмет развития HDFN, особенно во время родов и непосредственно после родов. Антитела, экспрессируемые у матерей с группой крови O, обычно представляют собой иммуноглобулин G (IgG) и могут проникать через плаценту. И наоборот, у матерей с группой крови А есть антитела против группы крови В, которые представляют собой преимущественно иммуноглобулины М (IgM) и не проникают через плаценту. [8] Общепринятой практикой является проверка групп крови младенцев, рожденных от матерей с группой крови О при рождении, в то время как группы крови младенцев, матери которых имеют группу крови А, В или АВ, могут не проверяться (если резус-фактор положительный). .
[8] Общепринятой практикой является проверка групп крови младенцев, рожденных от матерей с группой крови О при рождении, в то время как группы крови младенцев, матери которых имеют группу крови А, В или АВ, могут не проверяться (если резус-фактор положительный). .
Основными признаками гемолитической болезни новорожденных (ГБН) являются анемия и гипербилирубинемия, которые могут проявляться вялостью, желтухой, иктеричностью конъюнктивы, бледностью, гепатоспленомегалией, тахикардией или брадикардией, повышенной потребностью в кислороде и/или апноэ.[9] [13]
Оценка
Гемолитическая болезнь плода и новорожденного следует учитывать при дифференциальной диагностике новорожденных с желтухой/гипербилирубинемией и, безусловно, в случае неонатальной анемии. Диагноз HDFN может быть поставлен путем определения наличия материнских антител к эритроцитам (агглютинация в непрямом тесте на антитела) и/или положительного прямого теста на антитела (DAT) в сыворотке младенца.[4] Если у беременной женщины выявлена аллоиммунизация, первым шагом в дальнейшем обследовании является определение антигенного статуса эритроцитов отца. В случае положительного результата следующим шагом будет определение группы крови плода, что обычно делается с помощью амниоцентеза.[7]
В случае положительного результата следующим шагом будет определение группы крови плода, что обычно делается с помощью амниоцентеза.[7]
По данным Американской академии педиатрии (AAP), «если у матери не было пренатальной группы крови или она резус-отрицательна, прямой тест на антитела (или тест Кумбса), группа крови и резус-фактор (D) на (пуповинной) крови младенца настоятельно рекомендуется». возможно при беременности. Пораженные беременности можно контролировать путем мониторинга титров антител и скорости движения средней мозговой артерии плода, внутриутробных трансфузий и, возможно, досрочных родов, поскольку дети с тяжелой анемией могут плохо переносить срочные роды.
Гемолитическая болезнь новорожденных лечится путем лечения гипербилирубинемии фототерапией и при необходимости обменными трансфузиями. Рутинный универсальный скрининг чрескожного билирубина (TcB) часто проводится в первые 24 часа жизни, но скрининг следует проводить, как только подозревается гипербилирубинемия. Повышенный TcB всегда следует подтверждать с помощью общего билирубина сыворотки (ТБ). Затем почасовая номограмма Бутани используется для стратификации риска по количеству билирубина в крови младенца.[13] Эта номограмма обеспечивает рекомендуемый порог для начала фототерапии по сравнению с ранними трансфузиями в зависимости от уровня риска для младенца.
Повышенный TcB всегда следует подтверждать с помощью общего билирубина сыворотки (ТБ). Затем почасовая номограмма Бутани используется для стратификации риска по количеству билирубина в крови младенца.[13] Эта номограмма обеспечивает рекомендуемый порог для начала фототерапии по сравнению с ранними трансфузиями в зависимости от уровня риска для младенца.
Фототерапия была внедрена в 1970-х годах и стала основой лечения гипербилирубинемии у новорожденных. Фотоизомеризация вызывает превращение билирубина в водорастворимый изомер, который затем может выводиться почками и калом без необходимости переработки в печени. Основными факторами, определяющими эффективность фототерапии, являются длина волны используемого света, интенсивность этого света, общая доза света (время воздействия и площадь поверхности воздействия) и порог, при котором начинается фототерапия. AAP рекомендует использовать интенсивную фототерапию при HDFN. Оптимальный свет, используемый для фототерапии, имеет длину волны 460-490 нм. Свет должен быть на близком расстоянии (около 20 см над младенцем), и двойная фототерапия оказалась более эффективной, чем одиночная. Имеются ограниченные данные об эффективности непрерывной фототерапии по сравнению с прерывистой для младенцев с массой тела > 2000 г [1]. Во время фототерапии матерей следует поощрять кормить своих детей грудью через определенные промежутки времени, несмотря на то, что для этого им необходимо отключать их от фототерапии.
Свет должен быть на близком расстоянии (около 20 см над младенцем), и двойная фототерапия оказалась более эффективной, чем одиночная. Имеются ограниченные данные об эффективности непрерывной фототерапии по сравнению с прерывистой для младенцев с массой тела > 2000 г [1]. Во время фототерапии матерей следует поощрять кормить своих детей грудью через определенные промежутки времени, несмотря на то, что для этого им необходимо отключать их от фототерапии.
Обменное переливание может потребоваться для новорожденных с тяжелой анемией, которое включает замену эритроцитов новорожденных на антиген-отрицательные эритроциты, тем самым предотвращая дальнейший гемолиз. Аликвоты по 5 мл/кг удаляют и заменяют в течение нескольких минут для общего обмена эритроцитов на 25-50 мл/кг. Обменные переливания рекомендуются ААР, если уровни общего билирубина остаются выше порога переливания, несмотря на интенсивную фототерапию, или если присутствуют признаки билирубиновой энцефалопатии. Если рассматривается обменное переливание крови, следует измерить уровень альбумина. Альбумин 3,0 г/дл или менее считается независимым фактором риска гипербилирубинемии и снижает порог фототерапии. Без достаточного количества альбумина для связывания билирубина количество свободного неконъюгированного билирубина увеличивается, что увеличивает риск ядерной желтухи.[1]
Альбумин 3,0 г/дл или менее считается независимым фактором риска гипербилирубинемии и снижает порог фототерапии. Без достаточного количества альбумина для связывания билирубина количество свободного неконъюгированного билирубина увеличивается, что увеличивает риск ядерной желтухи.[1]
Младенцам с анемией может потребоваться переливание крови с эритроцитарной массой, соответствующей системе ABO. Если считается, что необходима немедленная трансфузия, при родах должна быть доступна резус-отрицательная кровь O-типа, лейкодеплеция и облучение [1].
Были рассмотрены и другие методы лечения, но они все еще остаются спорными. Внутривенный иммуноглобулин (ВВИГ) у младенцев может блокировать рецепторы Fc на макрофагах, тем самым уменьшая разрушение эритроцитов, покрытых антителами. AAP рекомендует ВВИГ, если общий билирубин в сыворотке продолжает расти, несмотря на интенсивную фототерапию, или находится в пределах 2-3 мг/дл от уровня обменного переливания. Введение ВВИГ матерям до родов не показало своей эффективности и в настоящее время не рекомендуется. Другие агенты, такие как альбумин, фенобарбитал, металлопорфирины, цинк, клофибрат и пребиотики, изучались в качестве возможных вариантов лечения гипербилирубинемии, но в настоящее время ни один из них не рекомендован [14]. В недавнем рандомизированном контролируемом исследовании с участием 70 младенцев с Rh-аллоиммунизацией было показано, что отсроченное пережатие пуповины уменьшает анемию без увеличения частоты побочных эффектов. Однако отсроченное пережатие пуповины не оказало существенного влияния на потребность в обменном переливании крови или продолжительность фототерапии.[15]
Другие агенты, такие как альбумин, фенобарбитал, металлопорфирины, цинк, клофибрат и пребиотики, изучались в качестве возможных вариантов лечения гипербилирубинемии, но в настоящее время ни один из них не рекомендован [14]. В недавнем рандомизированном контролируемом исследовании с участием 70 младенцев с Rh-аллоиммунизацией было показано, что отсроченное пережатие пуповины уменьшает анемию без увеличения частоты побочных эффектов. Однако отсроченное пережатие пуповины не оказало существенного влияния на потребность в обменном переливании крови или продолжительность фототерапии.[15]
Дифференциальный диагноз
Гемолитическая болезнь плода и новорожденного должна быть включена в дифференциальный диагноз младенцев с ранней, тяжелой или длительной желтухой и анемией. Другие этиологии желтухи и гипербилирубинемии у новорожденных включают физиологическую желтуху, недоношенность, желтуху грудного молока и грудного вскармливания, дефицит G6PD, талассемию, сепсис, родовую травму, синдром Жильбера и гипотиреоз [3]. Сбор анамнеза и физическая, а также простая лабораторная оценка, как описано выше, могут помочь дифференцировать эти причины.
Сбор анамнеза и физическая, а также простая лабораторная оценка, как описано выше, могут помочь дифференцировать эти причины.
Планирование лечения
Американская ассоциация банков крови рекомендует повторный скрининг на антитела перед введением Rh-D иммунопрофилактики (Rh-D IgG) на 28 неделе беременности, в послеродовой период и при FMH[5]. В сетевом метаанализе, проведенном в Китае, наиболее эффективным протоколом для предотвращения материнской аллоиммунизации было введение Rh-D-иммунопрофилактики на 28 и 34 неделе беременности у резус-отрицательных женщин.[16]
Стандартная доза анти-RhD, вводимая во втором и третьем триместре и в послеродовом периоде, при необходимости, составляет 300 мкг. При необходимости в первом триместре рекомендуемая доза составляет 150 мкг. Одноразовая доза 300 мкг анти-RhD должна предотвратить изоиммунизацию, когда 15 мл или менее фетальных эритроцитов (или 30 мл цельной крови) попадает в кровоток матери. Тест на розетку — это качественный тест для оценки потенциальной FMH. В случае положительного результата за розеточным тестом следует провести тест Кляйхауэра-Бетке, чтобы количественно определить количество смешиваемой крови плода и матери, чтобы затем определить, нужны ли дополнительные дозы Rh-D-иммунопрофилактики.
В случае положительного результата за розеточным тестом следует провести тест Кляйхауэра-Бетке, чтобы количественно определить количество смешиваемой крови плода и матери, чтобы затем определить, нужны ли дополнительные дозы Rh-D-иммунопрофилактики.
Прогноз
Общий прогноз ГБПН благоприятный при своевременном выявлении и лечении. В то время как необратимая неврологическая дисфункция может быть результатом задержек в оказании помощи, в настоящее время это редкое явление благодаря достижениям в области мониторинга, а также профилактики ГБПН.
Осложнения
Острая билирубиновая энцефалопатия из-за накопления билирубина в мозгу младенца может проявляться гипотонией или плохим сосательным рефлексом, который затем прогрессирует до раздражительности и гипертонии с ретроколлисом и опистотонусом. Долгосрочные последствия хронической билирубиновой энцефалопатии могут привести к церебральному параличу, слуховой дисфункции, параличу взгляда вверх и стойкой интеллектуальной дисфункции. [13] Таким образом, раннее распознавание и лечение необходимы для предотвращения неблагоприятного прогрессирования ГБПН.
[13] Таким образом, раннее распознавание и лечение необходимы для предотвращения неблагоприятного прогрессирования ГБПН.
Сдерживание и просвещение пациентов
Обучение пациентов в отношении рутинных лабораторных анализов и Rh-иммунопрофилактики у резус-отрицательных женщин необходимо для того, чтобы обеспечить регистрацию возможных случаев FMH и надлежащее лечение беременных женщин. Кроме того, родители новорожденных могут быть проинформированы о признаках и симптомах гипербилирубинемии, чтобы помочь межпрофессиональной команде в раннем выявлении возможных случаев ГБПН.
Улучшение результатов работы команды здравоохранения
Улучшение результатов межпрофессиональной бригады для пациентов с гемолитической болезнью плода и новорожденного требует тесного сотрудничества между акушерами-гинекологами и педиатрами, медсестрами, фармацевтами и персоналом банка крови. При ГБПН всегда необходимо учитывать двух пациентов — мать и плод/новорожденный. Если ГБПН выявлена внутриутробно, родовспоможение должно быть хорошо осведомлено и заранее подготовлено для выявления признаков и симптомов ГБПН, поскольку этим детям может потребоваться своевременное переливание крови при рождении. Фармацевты и поставщики медицинских услуг должны определить, показана ли иммунопрофилактика резус-фактора D для предотвращения будущих случаев ГБПН на протяжении всей беременности. Благодаря развитию Rh-D-иммунопрофилактики и протоколов обследования новорожденных заболеваемость HDFN резко снизилась за последние 50 лет. Тем не менее, для обеспечения низкого уровня заболеваемости HDFN потребуется постоянное межпрофессиональное сотрудничество.
Фармацевты и поставщики медицинских услуг должны определить, показана ли иммунопрофилактика резус-фактора D для предотвращения будущих случаев ГБПН на протяжении всей беременности. Благодаря развитию Rh-D-иммунопрофилактики и протоколов обследования новорожденных заболеваемость HDFN резко снизилась за последние 50 лет. Тем не менее, для обеспечения низкого уровня заболеваемости HDFN потребуется постоянное межпрофессиональное сотрудничество.
Контрольные вопросы
Доступ к бесплатным вопросам с несколькими вариантами ответов по этой теме.
Комментарий к этой статье.
Ссылки
- 1.
Ree IMC, Smits-Wintjens VEHJ, van der Bom JG, van Klink JMM, Oepkes D, Lopriore E. Ведение новорожденных и исходы при аллоиммунной гемолитической болезни. Эксперт преподобный Гематол. 2017 июль; 10 (7): 607-616. [PubMed: 28503958]
- 2.
Basu S, Kaur R, Kaur G. Гемолитическая болезнь плода и новорожденного: современные тенденции и перспективы.
 Азиатский J Transfus Sci. 2011 янв;5(1):3-7. [Бесплатная статья PMC: PMC3082712] [PubMed: 21572705]
Азиатский J Transfus Sci. 2011 янв;5(1):3-7. [Бесплатная статья PMC: PMC3082712] [PubMed: 21572705]- 3.
де Хаас М., Тюрик Ф.Ф., Колевейн Дж.М., ван дер Шут С.Э. Гемолитическая болезнь плода и новорожденного. Вокс Санг. 2015 авг; 109 (2): 99-113. [PubMed: 25899660]
- 4.
Меткалф Р.А., Хан Дж., Эндрюс Дж., Мэйок Д., Биллимория З., Пагано М.Б. Тяжелая гемолитическая болезнь АВО новорожденных, требующая обменного переливания крови. J Pediatr Hematol Oncol. 2019 ноябрь;41(8):632-634. [PubMed: 30044350]
- 5.
Noronha SA. Приобретенная и врожденная гемолитическая анемия. Pediatr Rev. 2016 Jun;37(6):235-46. [В паблике: 27252179]
- 6.
Найман Ю.Л. О статье доктора Луи К. Даймонда 1932 года и последующем вкладе в эритробластоз плода. J Pediatr Hematol Oncol. 2001 ноябрь; 23 (8): 550-3. [PubMed: 11878786]
- 7.
Практический бюллетень ACOG № 192: Управление аллоиммунизацией во время беременности.
 Акушерство Гинекол. 2018 март; 131(3):e82-e90. [PubMed: 29470342]
Акушерство Гинекол. 2018 март; 131(3):e82-e90. [PubMed: 29470342]- 8.
Мюррей Н.А., Робертс И.А. Гемолитическая болезнь новорожденных. Arch Dis Child Fetal Neonatal Ed. 2007 март;92(2):F83-8. [Бесплатная статья PMC: PMC2675453] [PubMed: 17337672]
- 9.
Делани М., Мэтьюз, округ Колумбия. Гемолитическая болезнь плода и новорожденного: ведение матери, плода и новорожденного. Гематология Программа Am Soc Hematol Educ. 2015;2015:146-51. [PubMed: 26637714]
- 10.
Практический бюллетень № 181: Профилактика Rh D Аллоиммунизация. Акушерство Гинекол. 2017 авг;130(2):e57-e70. [PubMed: 28742673]
- 11.
Moinuddin I, Fletcher C, Millward P. Распространенность и специфичность клинически значимых аллоантител к эритроцитам у беременных женщин — исследование, проведенное в больнице третичного уровня в Юго-восточном Мичигане. Дж. Кровь Мед. 2019;10:283-289. [Бесплатная статья PMC: PMC6708388] [PubMed: 31692490]
- 12.

