Форум стеноз аортального клапана у детей: Врожденный стеноз аортального клапана
Врожденный стеноз аортального клапана
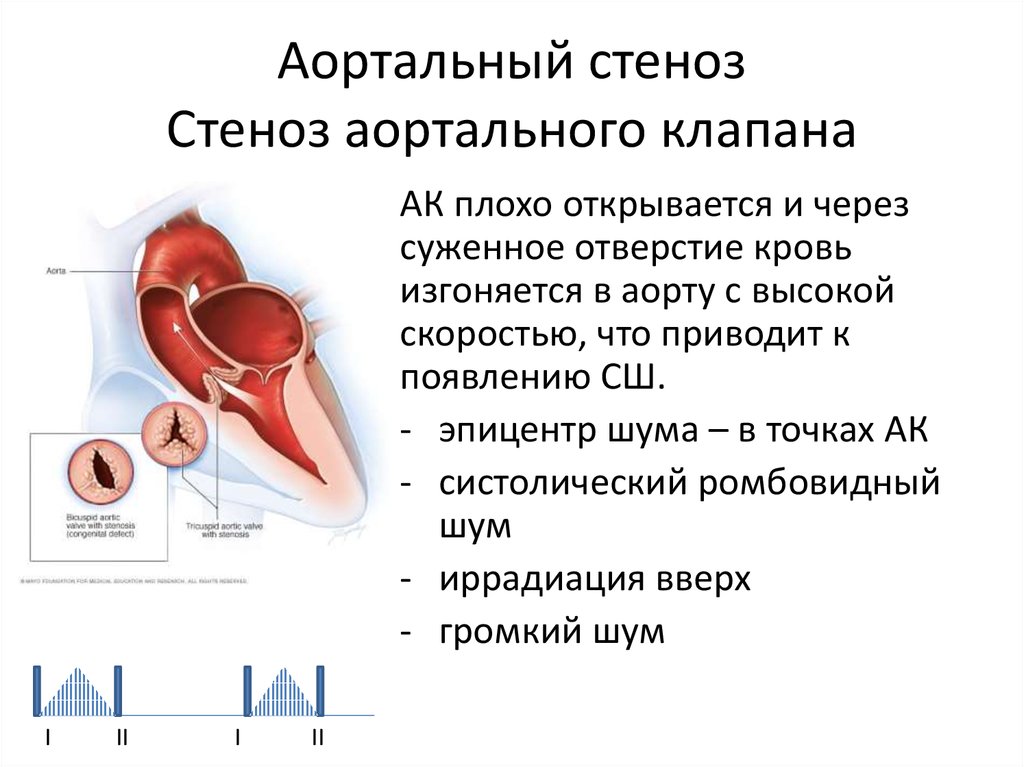
Суть нарушений при этом, довольно часто встречающемся пороке, состоит в следующем. Клапан аорты, регулирующий поток крови из левого желудочка в ее восходящий отдел, состоит из трех тонких полулунных створок, которые при каждом сокращении левого желудочка прижимаются к стенке аорты, открывая путь свободному потоку крови, а при каждом расслаблении – смыкаются, перегораживая этот путь.
В течение одного сердечного цикла они, таким образом, производят два действия: открывают и закрывают «шлюз». Можно только представить себе, каким идеальным должно быть состояние самих створок — их эластичность, подвижность, плотность – чтобы обеспечить такую многолетнюю, полноценную и непрерывную работу. Ведь достаточно их неполного соприкосновения, чтобы создать препятствие потоку или обратный ток крови в сторону желудочка.
Стеноз (применительно к клапанам или сосудам) означает сужение
При врожденном пороке сужение может быть за счет неправильного развития створок, их срастания между собой (точнее – их «неразделения» на три), отсутствия одной из створок (когда их две вместо трех, но они, все же, полностью закрывают клапанное отверстие) и, наконец, за счет узости самого кольца, к которому эти створки крепятся. Чаще наблюдается сочетание этих структурных изменений, выраженных в большей или меньшей степени.
Чаще наблюдается сочетание этих структурных изменений, выраженных в большей или меньшей степени.
Препятствие кровотоку создает разницу давления между левым желудочком и аортой, и степень этой разницы зависит от величины отверстия и состояния развития самих створок. В любом случае, на левый желудочек падает нагрузка большая, чем при нормальном кровообращении: при резком сужении желудочек может не справляться с ней вообще, а при небольшом – относительно легко все переносить, постепенно утолщая свою стенку и увеличиваясь в размере.
Приблизительно в 10% случаев этого порока створки клапана настолько обезображены, что вместо них имеется мембрана с отверстием в 1-2 мм с небольшими бороздками. Интересно, что у плода, находящегося в матке, такое грубейшее нарушение нормального развития сердца почти никак себя не проявляет. Это понятно, так как основная часть крови плода идет в обход аортального клапана через легочный ствол и открытый артериальный проток в аорту. Однако, диагностировать его с помощью эхокардиографии можно, начиная с 6-7 месяцев беременности, что очень важно, так как при таких стенозах ребенок сразу после рождения оказывается в критическом состоянии.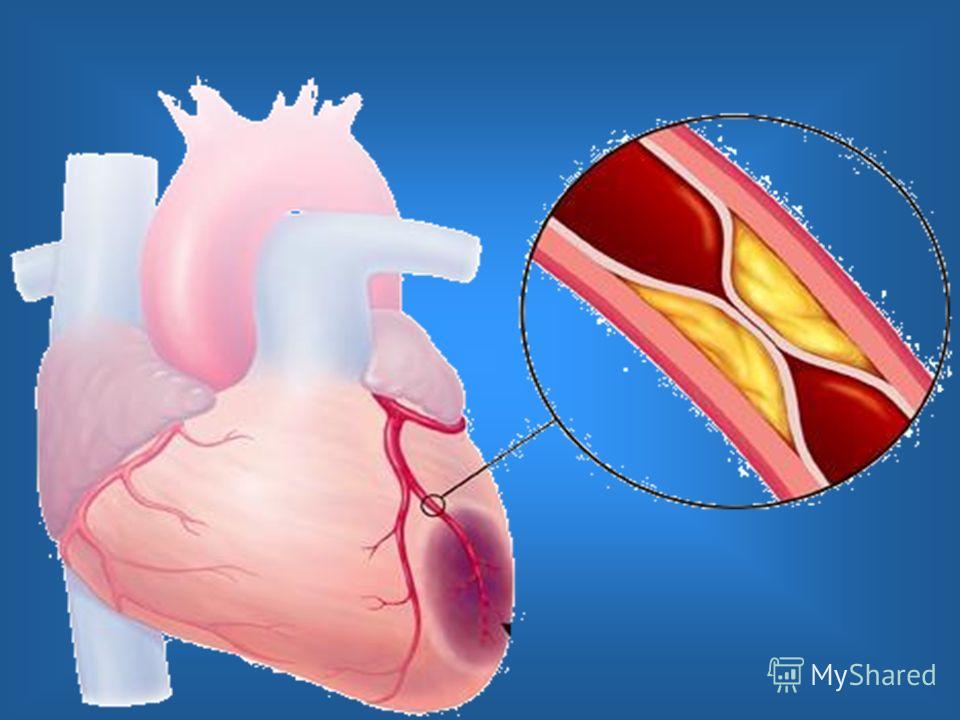 События будут развиваться драматически быстро, и, если экстренно ему не помочь, то он погибнет в течение первых недель. Это произойдет, прежде всего, из-за того, что левый желудочек постоянно будет работать с нагрузкой, превышающей его возможности, и он очень быстро может «сдаться». Более того, нарушается процесс кровоснабжения стенки самого левого желудочка, его питания. Необходима срочная операция.
События будут развиваться драматически быстро, и, если экстренно ему не помочь, то он погибнет в течение первых недель. Это произойдет, прежде всего, из-за того, что левый желудочек постоянно будет работать с нагрузкой, превышающей его возможности, и он очень быстро может «сдаться». Более того, нарушается процесс кровоснабжения стенки самого левого желудочка, его питания. Необходима срочная операция.
Казалось бы – чего проще? Взять, «раскрыть» клапан — и все. Быстро и легко, особенно при всех современных возможностях.
К сожалению, это не так. Вернее, не всегда так. В «идеальных» случаях, действительно несложно рассечь сращенные створки и расширить клапанное отверстие. Это делается в рентгенохирургическом кабинете. Процедура – короткая и достаточно безопасная. Но, если створки плохо развиты, а клапанное кольцо — узкое, то эффекта можно и не достичь, а кроме того, само вмешательство может оказаться слишком травматичным. Поэтому, даже сегодня лечение детей с критическим стенозом аорты связано с очень высокой степенью риска. Разрыв неразвитых створок никоим образом не восстанавливает их, а только устраняет сужение, спасая ребенка от скорой гибели. Даже при удачном непосредственном исходе на этом этапе, в дальнейшем ему предстоит операция на клапане аорты для полного восстановления его нормальной функции.
Разрыв неразвитых створок никоим образом не восстанавливает их, а только устраняет сужение, спасая ребенка от скорой гибели. Даже при удачном непосредственном исходе на этом этапе, в дальнейшем ему предстоит операция на клапане аорты для полного восстановления его нормальной функции.
Интересно, что в последние годы разрабатывается методика устранения стеноза аорты у плода, до его появления на свет, дающая возможность сердцу нормально работать последние месяцы внутриутробной жизни и быть лучше подготовленным к нагрузкам, которые его ожидают после первого самостоятельного вдоха. Пока это первые шаги, но вполне возможно, что близок день, когда критический стеноз аортального клапана станет вполне излечимым пороком сердца.
К счастью, в большинстве случаев клапанное кольцо сужено умеренно, две или только одна створка клапана сращена со своими соседками, но не полностью, и в целом, аппарат функционирует неплохо. Неплохо — но не идеально. Нагрузка на левый желудочек есть, и степень его зависит от величины препятствия.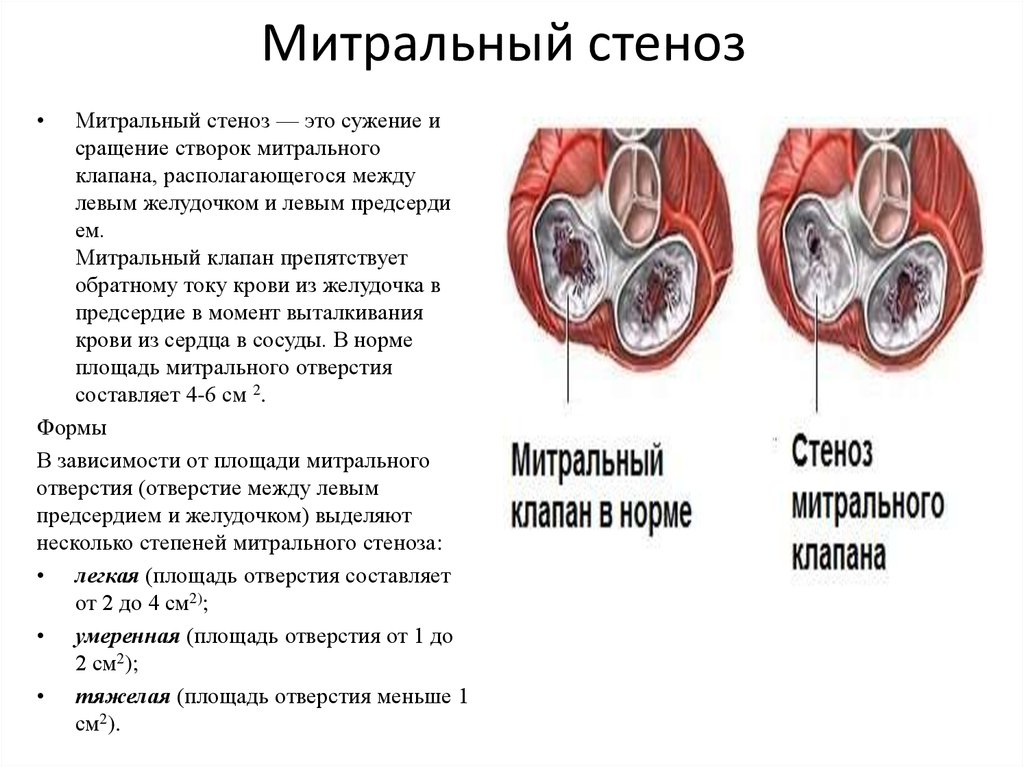 Что при этом происходит с желудочком? Стенка его утолщается, масса увеличивается, полость его камеры уменьшается и питание стенки артериальной кровью ухудшается из-за того, что утолщение намного опережает развитие сосудистой сети в толще мышцы сердца. Кроме того, при первой операции, если клапан был представлен плохо разделенной мембраной, результат был достигнут только расширением узкого отверстия. Сами створки остались обезображенными. Они не закрывают отверстие до конца, т.к. не смыкаются в фазу диастолы. В результате часть крови, выброшенной в аорту, идет обратно в левый желудочек, увеличивая и без того чрезмерную нагрузку. Это недостаточность клапана, которая в комбинации с его стенозом значительно ухудшает клиническую картину, и ускорит необходимость полной коррегирующей операции.
Что при этом происходит с желудочком? Стенка его утолщается, масса увеличивается, полость его камеры уменьшается и питание стенки артериальной кровью ухудшается из-за того, что утолщение намного опережает развитие сосудистой сети в толще мышцы сердца. Кроме того, при первой операции, если клапан был представлен плохо разделенной мембраной, результат был достигнут только расширением узкого отверстия. Сами створки остались обезображенными. Они не закрывают отверстие до конца, т.к. не смыкаются в фазу диастолы. В результате часть крови, выброшенной в аорту, идет обратно в левый желудочек, увеличивая и без того чрезмерную нагрузку. Это недостаточность клапана, которая в комбинации с его стенозом значительно ухудшает клиническую картину, и ускорит необходимость полной коррегирующей операции.
Стеноз аортального клапана у детей старшего возраста — совсем другая, и гораздо менее драматичная история. Признаков недостаточности сердца долгое время может не быть совсем, а диагноз ставят на основании типичного шума на клапане и по данным эхокардиографии. Не быстрое, но неуклонное увеличение сердца в размерах, нарушения ритма, и иногда — жалобы на боли за грудиной, могут быть признаком того, что вмешательство необходимо. Вместе с тем, течение заболевания позволяет следить за ним в динамике и выбрать время и метод коррекции порока.
Не быстрое, но неуклонное увеличение сердца в размерах, нарушения ритма, и иногда — жалобы на боли за грудиной, могут быть признаком того, что вмешательство необходимо. Вместе с тем, течение заболевания позволяет следить за ним в динамике и выбрать время и метод коррекции порока.
В наилучшем случае все дело в самих створках и простым их разделением все и ограничится. В других – они настолько изменены, что придется заменить весь клапан искусственным протезом. В третьих – самых тяжелых – само кольцо аортального клапана может быть настолько узким, что невозможно вшить в него протез, даже самого малого диаметр. Тогда применяют разнообразные методы расширения этого кольца. Это уже большие и травматичные вмешательства со значительным риском, и отличный результат уже не столь закономерен.
Мы не будем вдаваться в технические подробности. Особенности операции у вашего ребенка, как и степень риска, и последствия вам должны подробно объяснить. Скажем только, что длительная (имеется в виду 10-20 лет) жизнь со стенозом аортального клапана опасна, т. к. может привести к серьезным осложнениям вплоть до внезапной смерти у, казалось бы, в остальном вполне здорового подростка. В любом случае, дамоклов меч необходимой операции висит до тех пор, пока она не будет сделана, а этот факт — тоже неблагоприятен для нормального психологического состояния и ребенка, и вас самих.
к. может привести к серьезным осложнениям вплоть до внезапной смерти у, казалось бы, в остальном вполне здорового подростка. В любом случае, дамоклов меч необходимой операции висит до тех пор, пока она не будет сделана, а этот факт — тоже неблагоприятен для нормального психологического состояния и ребенка, и вас самих.
Результаты операций, в том числе и отдаленные, достаточно хорошие, если они делаются на благополучном (во всем остальном) фоне.
Интересно, что при совсем нередком варианте нормально работающего аортального клапана, когда вместо трех его створок имеются две (и обнаруживаются они случайно у «бессимптомного» человека), процессы «старения» створок, связанные с возрастом, идут гораздо быстрее, чем при трехстворчатом строении. Разрушение самих створок, отложение в них кальция можно наблюдать в 40-50 лет, когда появляются первые клинические симптомы: одышка, увеличение сердца, боли за грудиной, ощутимые нарушения ритма. Понятно, что это уже совсем другой сценарий, нежели описанный выше, но он вызван тем же стенозом клапана аорты. И, если двустворчатый клапан – это, несомненно, врожденное, то и его последствия можно отнести к врожденным порокам сердца, в каком бы возрасте они не были впервые выявлены.
И, если двустворчатый клапан – это, несомненно, врожденное, то и его последствия можно отнести к врожденным порокам сердца, в каком бы возрасте они не были впервые выявлены.
Показания к замене клапана при появлении симптомов абсолютны, потому что следующим симптомом может быть внезапная остановка сердца и смерть. Операция протезирования аортального клапана сегодня не должна сопровождаться практически никаким риском, а конструкции самих клапанов настолько совершенны и долговечны, что позволяют вести нормальный образ жизни многие годы.
Как попасть на лечение в Научный центр им. А.Н. Бакулева?
Онлайн-консультации
Аортальный стеноз лечение: протезирование аортального клапана, операция по замене аортального клапана сердца
При патологии аортального клапана частота осложнения в виде инфекционного эндокардита выше, чем при патологии митрального клапана. Двустворчатый аортальный клапан – самый частый врожденный порок сердца (распространенность — 2%). При обнаружении данной аномалии в детском возрасте пациенты должны в течение всей жизни находиться под наблюдением кардиолога, а при появлении клинической симптоматики аортального стеноза — так же и кардиохирурга.
Этиология:
- Воспалительные поражения: ревматизм, системная склеродермия, аортоартериит.
- Дегенеративные процессы: миксоматозная дегенерация.
- Атеросклероз.
- Инфекционные процессы: инфекционный эндокардит.
- Врожденная патология: двустворчатый аортальный клапан.
Отмечается тенденция к увеличению частоты инволюционных (дегенеративно-атеросклеротических) причин аортального стеноза, что привело к увеличению возрастных пациентов старше 60-65 лет, нуждающихся в хирургической коррекции аортального порока.
При врожденном или ревматическом поражении клапана отмечается длительный латентный период без клинических проявлений. Летальность и риск осложнений существенно увеличиваются с появлением симптомов заболевания. При стенокардии, обмороках и проявлениях сердечной недостаточности, обусловленной систолической дисфункцией левого желудочка средняя продолжительность жизни 5, 3 и 2года соответственно. При бессимптомном течении риск внезапной смерти невелик (даже при тяжелом аортальном стенозе), тогда как при наличии симптомов 15 – 20% больных умирают внезапно.
При бессимптомном течении риск внезапной смерти невелик (даже при тяжелом аортальном стенозе), тогда как при наличии симптомов 15 – 20% больных умирают внезапно.
Скорость прогрессирования поражения аортального клапана:
- легкий аортальный стеноз (площадь отверстия аортального клапана -1.2 – 2 см2) становится тяжелым, требующим протезирования аортального клапана, за 10 лет – у 10% больных, за 25 лет – у 38%;
- при умеренном бессимптомном аортальном стенозе (площадь отверстия аортального клапана – 0.75 – 1.2 см2) протезирование аортального клапана через 10 лет требуется в 25% случаев;
- бессимптомный тяжелый аортальный стеноз (площадь отверстия аортального клапана < 0,75 см2) обычно прогрессирует быстрее; у 30 – 40% больных в течение 2-х лет появляются симптомы и возникает потребность в протезировании аортального клапана.
Мерцательная аритмия, аортальная недостаточность (спонтанная или вызванная инфекционным эндокардитом), митральная недостаточность и острый инфаркт миокарда ускоряют декомпенсацию.
При неосложненном течении аортального стеноза характерная аускультативная картина: систолический шум в точке Боткина и на основании сердца справа, проводится на сосуды шеи, ослабление 2-го тона за счет аортального компонента. Интенсивность систолического шума может уменьшаться при развитии систолической дисфункции левого желудочка и не является критерием тяжести порока. Часто течение аортального стеноза осложняется патологией митрального клапана («митрализация»).
Диагностика аортального стеноза
- ЭКГ;
- Рентгенография грудной клетки;
- Коронароангиография — проводится при показаниях к хирургическому лечению или подозрении на коронарный атеросклероз;
- МСКТ восходящей аорты с контрастированием – показано при постстенотическом расширении корня аорты;
- ЭхоКГ. ЭХОКГ позволяет определить: структуру клапана (двустворчатый клапан, утолщение створок, фиброз, кальциноз, вегетации), характер его движения (подвижность створок, степень открытия) и площадь отверстия; изменения корня аорты (постстенотическая дилатация), объем левого желудочка, выраженность гипертрофии левого желудочка, нарушения локальной сократимости левого желудочка (указывающие на ИБС), ФВ, объем левого предсердия, состояние других клапанов.
 Доплеровское исследование позволяет с высокой точностью определить градиент давления между аортой и левым желудочком.
Доплеровское исследование позволяет с высокой точностью определить градиент давления между аортой и левым желудочком.
Эхокардиографические критерии тяжести аортального стеноза с учетом площади аортального клапана (в норме площадь составляет 3 – 4 см2):
- умеренный стеноз 1 – 1.4см2
- тяжелый стеноз < 1 см2
- критический стеноз < 0,75 см2
Средний систолический градиент между аортой и ЛЖ на уровне аортального клапана менее 50 мм рт. ст. – гемодинамически малозначимый аортальный стеноз, 50 – 80 мм рт.ст. – умеренный аортальный стеноз, более 80 мм рт.ст. – резкий аортальный стеноз.
Показания к хирургическому лечению (протезированию) аортального стеноза
(Американская Ассоциация сердца, Американская коллегия кардиологов)
Классификация рекомендаций и уровни достоверности в формате АКК/ААС:
- Класс I: Состояния, при которых есть доказательства и/или общее согласие, что процедура или метод лечения является благоприятным, полезным и эффективным.

- Класс II: Состояния, при которых есть противоречивые доказательства и/или расхождение во мнениях о полезности/эффективности процедуры или метода лечения.
- Класс IIА: Вес достоверность/мнение в пользу полезности/эффективности.
- Класс IIБ: Польза/эффективность менее хорошо установлены достоверностью/мнением.
- Класс III: Состояния, при которых есть доказательства и/или общее мнение, что процедура/метод лечения не полезны, не эффективны, а в некоторых случаях могут быть вредны.
Кроме того, уровни достоверности в поддержку рекомендаций изложены следующим образом:
- Уровень достоверности А: Данные получены из многочисленных рандомизированных клинических испытаний.
- Уровень достоверности В: Данные получены из единичных рандомизированных исследований или нерандомизированных испытаний.
- Уровень достоверности С: Только единодушное согласие экспертов, отдельные исследования случаев и стандарты лечения.

КЛАСС I
-
1. Протезирование аортального клапана показано симптомным пациентам с тяжелым аортальным стенозом (Уровень достоверности: B). -
2. Протезирование аортального клапана показано пациентам с тяжелым аортальным стенозом, при операции аорто-коронарного шунтирования (АКШ). (Уровень достоверности: С). -
3. Протезирование аортального клапана показано пациентам с тяжелым аортальным стенозом, при операции на аорте или других клапанах сердца. (Уровень достоверности: C). -
4. Протезирование аортального клапана показано пациентам с тяжелым аортальным стенозом и систолической дисфункцией ЛЖ (ФВ менее 50%). (Уровень достоверности: C).
КЛАСС IIА
Протезирование аортального клапана показано пациентам с умеренным аортальным стенозом, при операции АКШ, операции на аорте или других клапанах сердца. (Уровень достоверности: B).
(Уровень достоверности: B).
КЛАСС IIБ
-
1. Протезирование аортального клапана показано асимптомным пациентам с тяжелым аортальным стенозом и патологическим ответом на нагрузку (например, развитие симптомов гипотензии). (Уровень достоверности: C). -
2. Протезирование аортального клапана показано возрастным пациентам с тяжелым асимптомным аортальным стенозом, если существует высокая вероятность быстрого прогрессирования (возраст, кальциноз). (Уровень достоверности: C). -
3. Протезирование аортального клапана показано пациентам с легким аортальным стенозом, при операции АКШ, когда есть признаки умеренной — тяжелой кальцинации клапана, способной привести к быстрому прогрессированию. (Уровень достоверности: C). -
4. Протезирование аортального клапана показано асимптомным пациентам с крайне тяжелым аортальным стенозом (площадь аортального клапана менее 0. 6 cм2, средний градиент более 60 мм рт.ст. и скорость потока более 5.0 м/с), когда ожидаемая операционная летальность пациентов составляет менее 1.0%. (Уровень достоверности: C).
6 cм2, средний градиент более 60 мм рт.ст. и скорость потока более 5.0 м/с), когда ожидаемая операционная летальность пациентов составляет менее 1.0%. (Уровень достоверности: C).
КЛАСС III
-
1. Протезирование аортального клапана не показано для предупреждения внезапной смерти у асимптомных пациентов с аортальным стенозом у кого нет ни одного показателя из списка рекомендаций Классов IIА/IIБ. (Уровень достоверности: B). -
2. У возрастных пациентов с тяжелым, симптомным, кальцинированным аортальным стенозом протезирование аортального клапана является единственным эффективным методом лечения. -
3. Молодые пациенты с врожденным или ревматическим аортальным стенозом могут быть кандидатами на вальвулотомию. Хотя нет единого мнения относительно оптимального срока проведения операции у асимптомных пациентов, для большинства пациентов можно разработать рациональные рекомендации.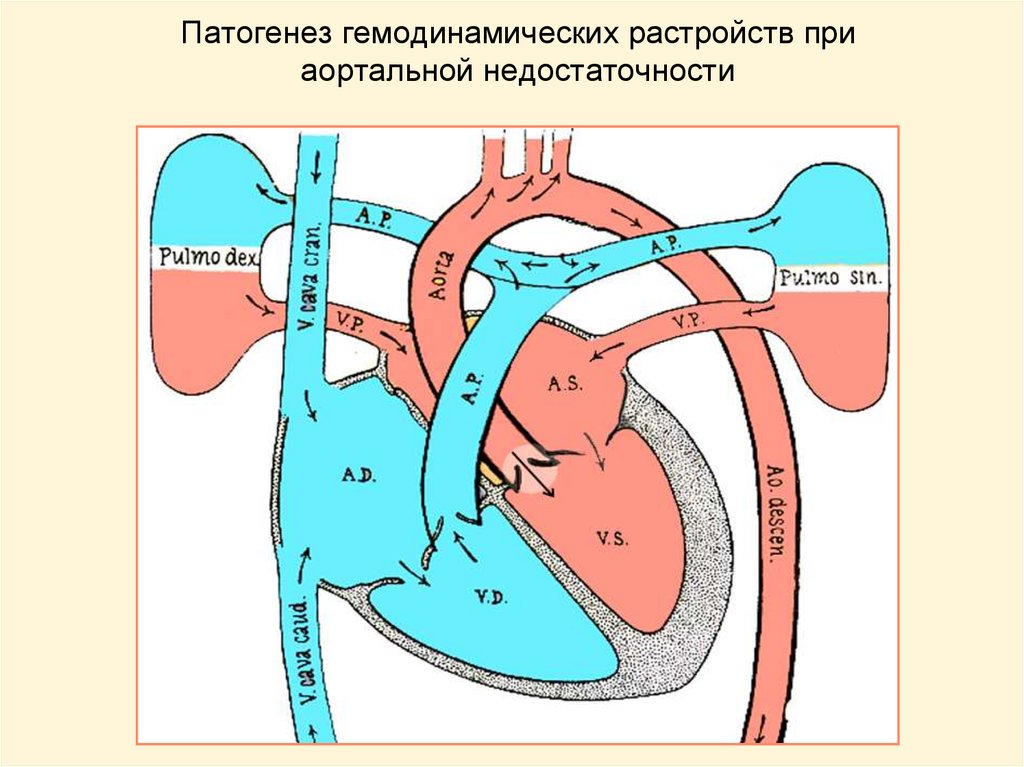
Протезирование аортального клапана
За последние годы в хирургическом лечении клапанов сердца наблюдался значительный прогресс. Усовершенствование техники (в т.ч. аппаратов искусственного кровообращения), разработка единых стандартов и протоколов как предоперационного обследования, так и хода операции позволили снизить риски периоперационных осложнений, сделав саму операцию на клапанном аппарате сердца более безопасной, чем отказ от операции и попытка жить с дисфункцией клапана.
Виды хирургического лечения: операции по замене клапана сердца
Принципиально существует два вида операции на клапанах сердца: протезирование искусственным или биологическим протезом и пластика собственного клапана. Вполне естественно, что собственный клапан человека после удачной реконструкции функционирует лучше, чем искусственный протез. Но в случае невозможности сохранения собственного клапана единственный выход – замена его на протез.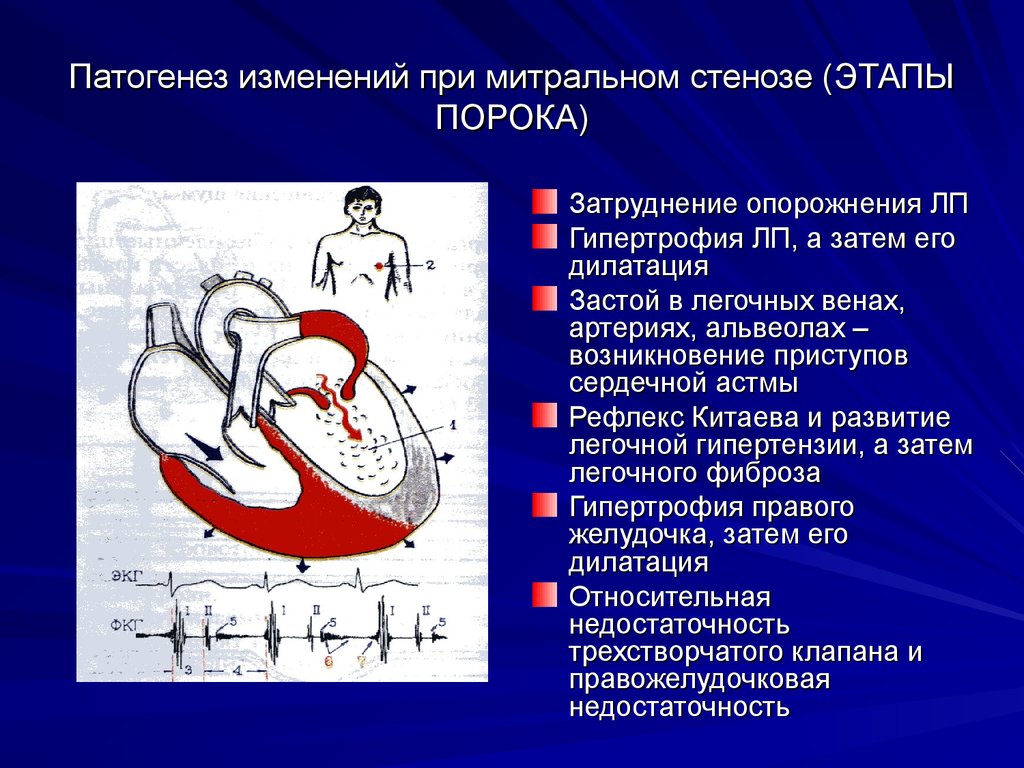
Виды клапанов, используемых при протезировании
- Биологические клапаны. Могут быть выполнены из тканей животного или человека (гетеротрансплантаты, гомотрансплантаты, аутотрансплантаты). Биологические клапаны могут содержать некоторые искусственные компоненты для обеспечения поддержки клапана и его размещения. Основное преимущество такого клапана в отсутствии необходимости в пожизненной антикоагулянтной терапии (постоянном строгом приеме препаратов, значительно разжижающих кровь и требующем постоянной сдачи анализов крови), а основной минус – ограниченный срок службы (15 – 20 лет).
- Механические клапаны. Состоят целиком из механических элементов (титана и пиролитического углерода) и разработаны таким образом, чтобы заменять пациенту функции его собственного клапана. Механический клапан очень надёжен и долговечен, предназначен для многолетней полноценной работы, что является основным преимуществом, однако требует от пациента постоянного приема антикоагулянтов.

При протезировании аортального клапана доступ к клапану осуществляется посредством рассечения аорты в восходящем отделе (поперечная аортотомия). После иссечения створок аортального клапана и тщательной декальцинации фиброзного кольца последнее прошивается П-образными швами. С целью предотвращения прорезывания фиброзного кольца швы укрепляют тефлоновыми прокладками. Для выбора размера имплантируемого протеза диаметр фиброзного кольца измеряют специальными калибраторами. Выбранный протез имплантируют в аортальную позицию путем прошивания его оплетки. После фиксации протеза оценивают подвижность запирательных элементов механического протеза или коаптацию створок биологического клапана. При отсутствии ограничений их подвижности рассеченную аорту герметизируют двумя рядами швов.
Врач поставил Вашему ребенку диагноз — врожденный порок сердца — За здоровый образ жизни! — Статьи — Центр Современной Кардиологии
Если вашему ребенку поставили диагноз врожденный порок сердца, не стоит опускать руки, нужно узнать все способы поддержания здоровья таких детей, а также причины развития данного заболевания, пройти необходимое обследование, чтобы врач назначил соответствующее лечение.
Сердце человека состоит из четырех камер: правое предсердие (ПП) и правый желудочек (ПЖ), левое предсердие (ЛП) и левый желудочек (ЛЖ). Правые и левые отделы сердца между собой никак не сообщаются. В этом нет необходимости, так как они обеспечивают движение крови каждый по своему кругу. Левые отделы сердца отвечают за движение крови по большому кругу кровообращения. Из левого предсердия через левый желудочек в аорту (Ао) поступает артериальная кровь, богатая кислородом. Из аорты по многочисленным артериям, а потом и по капиллярам она разносится по всему организму, доставляя клеткам кислород. В свою очередь, «отработанная» организмом венозная кровь собирается в мелкие вены, которые сливаются в более крупные венозные сосуды – верхнюю и нижнюю полые вены (ВПВ и НПВ). Конечная точка путешествия венозной крови – правое предсердие. Оттуда через правый желудочек кровь попадает в легочную артерию (ЛА). Малый круг кровообращения проходит через легкие, где венозная кровь обогащается кислородом и вновь становится артериальной. Отток обновленной крови осуществляется по легочным венам (ЛВ), впадающим, в свою очередь, в левое предсердие.
Отток обновленной крови осуществляется по легочным венам (ЛВ), впадающим, в свою очередь, в левое предсердие.
Особенности кровообращения у плода и новорожденного
Находясь в утробе матери, плод не дышит самостоятельно и его легкие не функционируют. Кровообращение осуществляется через плаценту. Насыщенная кислородом кровь матери поступает к плоду через пуповину: в венозный проток, откуда через систему сосудов в правое предсердие. У плода между правым и левым предсердием имеется отверстие – овальное окно. Через него кровь попадает в левое предсердие, затем в левый желудочек, аорту – и ко всем органам плода. Малый круг кровообращения отключен. В легкие плода кровь поступает через артериальный проток – соединение между аортой и легочной артерией. Венозный проток, овальное окно и артериальный проток имеются только у плода. Они называются «фетальными сообщениями». Когда ребенок рождается и пуповину перевязывают, схема кровообращения радикально изменяется. С первым вдохом ребенка его легкие расправляются, давление в сосудах легких снижается, кровь притекает в легкие. Малый круг кровообращения начинает функционировать. Фетальные сообщения больше не нужны ребенку и постепенно закрываются (венозный проток – в течение первого месяца, артериальный проток и овальное окно – через два-три месяца). В некоторых случаях своевременного закрытия не происходит, тогда у ребенка диагностируют врожденный порок сердца (ВПС). Иногда при развитии плода возникает аномалия и ребенок рождается с анатомически измененными структурами сердца, что также считается врожденным пороком сердца. Из 1000 детей с врожденными пороками рождается 8-10, и эта цифра увеличивается в последние годы (развитие и совершенствование диагностики позволяет врачам чаще и точнее распознавать пороки сердца, в том числе, когда ребенок еще в утробе матери).
Малый круг кровообращения начинает функционировать. Фетальные сообщения больше не нужны ребенку и постепенно закрываются (венозный проток – в течение первого месяца, артериальный проток и овальное окно – через два-три месяца). В некоторых случаях своевременного закрытия не происходит, тогда у ребенка диагностируют врожденный порок сердца (ВПС). Иногда при развитии плода возникает аномалия и ребенок рождается с анатомически измененными структурами сердца, что также считается врожденным пороком сердца. Из 1000 детей с врожденными пороками рождается 8-10, и эта цифра увеличивается в последние годы (развитие и совершенствование диагностики позволяет врачам чаще и точнее распознавать пороки сердца, в том числе, когда ребенок еще в утробе матери).
«Синие» и «бледные» пороки сердца
Аномалии могут быть очень разнообразными, наиболее часто встречающиеся имеют названия и объединяются в группы. Например, пороки разделяют на «синие» (при которых кожные покровы ребенка синюшные, «цианотичные») и «бледные» (кожные покровы бледные). Для жизни и развития ребенка более опасны «синие» пороки, при которых насыщение крови кислородом очень низкое. К «синим» порокам относятся Тетрада Фалло, транспозиция магистральных сосудов, атрезия легочной артерии. К «бледным» порокам относятся дефекты перегородок – межпредсердной, межжелудочковой. В некоторых случаях порок может частично компенсироваться за счет открытого артериального протока (в норме он закрывается, как только легкие ребенка расправляются с первым криком). Также у ребенка может недоразвиться клапан сердца – сформируется клапанный порок (наиболее часто, аортальный клапан или клапан легочной артерии).
Для жизни и развития ребенка более опасны «синие» пороки, при которых насыщение крови кислородом очень низкое. К «синим» порокам относятся Тетрада Фалло, транспозиция магистральных сосудов, атрезия легочной артерии. К «бледным» порокам относятся дефекты перегородок – межпредсердной, межжелудочковой. В некоторых случаях порок может частично компенсироваться за счет открытого артериального протока (в норме он закрывается, как только легкие ребенка расправляются с первым криком). Также у ребенка может недоразвиться клапан сердца – сформируется клапанный порок (наиболее часто, аортальный клапан или клапан легочной артерии).
Причины развития врожденного порока сердца
У плода формирование структур сердца происходит в первом триместре, на 2-8 неделе беременности. В этот период развиваются пороки, которые являются следствием наследственных генетических причин или воздействия неблагоприятных внешних факторов (например, инфекция или отравления). Иногда у ребенка имеется несколько пороков развития, в том числе и порок сердца. Риск рождения ребенка с врожденным пороком сердца очень высок, если:
Риск рождения ребенка с врожденным пороком сердца очень высок, если:
— ранее у женщины были выкидыши или мертворожденные
— возраст женщины более 35 лет
— женщина во время беременности принимает алкоголь, психоактивные вещества (наркотики), курит
— в семье женщины есть история рождения детей с пороками или мертворождения
— женщина живет в экологически неблагоприятной местности (радиация, отравляющие вещества)
или работает на экологически неблагоприятном производстве
— во время беременности (особенно первые 2 месяца) женщина перенесла инфекционные, вирусные заболевания
— женщина принимала во время беременности лекарственные препараты
с тератогенным эффектом (приводящие к развитию уродств у плода) или
эндокринные препараты для сохранения беременности (гормоны).
Можно ли поставить диагноз ВПС у плода?
Возможность выявить у плода врожденный порок сердца существует, хотя ее нельзя назвать абсолютно информативной. Это зависит от многих причин, основные их которых — наличие высококлассной аппаратуры и квалифицированного специалиста, имеющего опыт перинатальной диагностики. Диагностика возможна начиная с 14-й недели беременности. Если при обследовании у плода выявляется аномалия развития, родителям сообщают о тяжести патологических изменений, возможностях лечения и о том, насколько будет ребенок жизнеспособен. Женщина может принять решение о прерывании беременности. Если есть надежда на успешные роды и лечение, женщина наблюдается у специалиста, роды принимают в специализированном роддоме (чаще всего женщине предлагают кесарево сечение).
Это зависит от многих причин, основные их которых — наличие высококлассной аппаратуры и квалифицированного специалиста, имеющего опыт перинатальной диагностики. Диагностика возможна начиная с 14-й недели беременности. Если при обследовании у плода выявляется аномалия развития, родителям сообщают о тяжести патологических изменений, возможностях лечения и о том, насколько будет ребенок жизнеспособен. Женщина может принять решение о прерывании беременности. Если есть надежда на успешные роды и лечение, женщина наблюдается у специалиста, роды принимают в специализированном роддоме (чаще всего женщине предлагают кесарево сечение).
Врожденный порок сердца у новорожденных
При рождении ребенка или в первые дни его жизни врачи могут заподозрить врожденный порок сердца.
На чем они основывают свои предположения?
— Шум в сердце. В первые несколько дней жизни ребенка шум в сердце нельзя расценивать как достоверный симптом врожденного порока сердца. Такого ребенка наблюдают, при сохранении шумов более 4-5 суток – обследуют.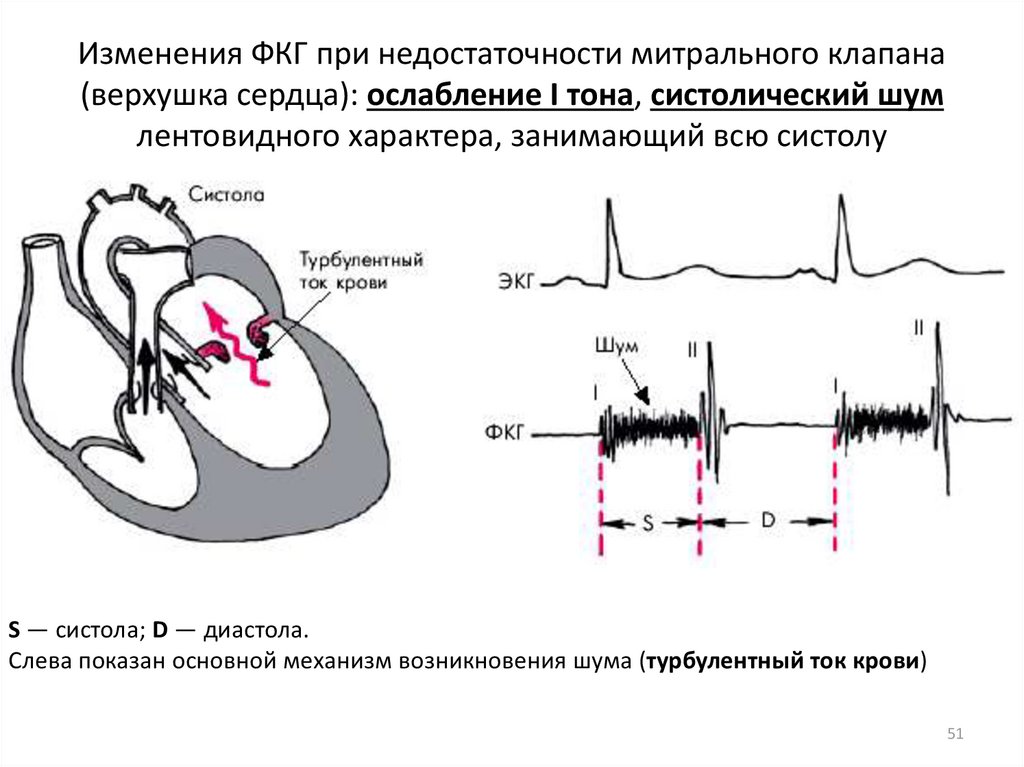 Само появление сердечного шума объясняется нарушением тока крови через сосуды и полости сердца (например, при наличии аномальных сужений, отверстий, резкой смены направления кровотока).
Само появление сердечного шума объясняется нарушением тока крови через сосуды и полости сердца (например, при наличии аномальных сужений, отверстий, резкой смены направления кровотока).
— синюшность кожных покровов (цианоз). В норме артериальная кровь богата кислородом и придает коже розовую окраску. Когда к артериальной крови примешивается бедная кислородом венозная кровь (в норме не происходит), кожа приобретает синюшный оттенок. В зависимости от типа порока цианоз может быть разной степени выраженности. Однако, врачам приходится уточнять причины цианоза, так как он может быть симптомом болезней органов дыхания и центральной нервной системы.
— проявления сердечной недостаточности. Сердце перекачивает кровь, работая как насос. Когда снижается насосная способность сердца, кровь начинает застаиваться в венозном русле, питание органов артериальной кровью снижается. Учащаются сердечные сокращения и дыхание, появляется увеличение печени и отечность, быстрая утомляемость и одышка. К сожалению, эти признаки очень трудно распознать у новорожденных. Высокая частота сердечных сокращений и дыхания наблюдается у маленьких детей в нормальном состоянии. Только при значительных отклонениях можно с достаточной уверенностью говорить о развитии у малыша сердечной недостаточности. Часто следствием развития сердечной недостаточности является спазм периферических сосудов, что проявляется похолоданием конечностей и кончика носа, их побледнением. Эти признаки помогают косвенно судить о недостаточности сердца.
К сожалению, эти признаки очень трудно распознать у новорожденных. Высокая частота сердечных сокращений и дыхания наблюдается у маленьких детей в нормальном состоянии. Только при значительных отклонениях можно с достаточной уверенностью говорить о развитии у малыша сердечной недостаточности. Часто следствием развития сердечной недостаточности является спазм периферических сосудов, что проявляется похолоданием конечностей и кончика носа, их побледнением. Эти признаки помогают косвенно судить о недостаточности сердца.
— нарушения электрической функции сердца (сердечного ритма и проводимости), проявляющиеся аритмиями и, иногда, потерей сознания. Врач может услышать неровное сердцебиение при аускультации (выслушивании фонендоскопом) или увидеть на записи электрокардиограммы.
Как сами родители могут заподозрить у ребенка врожденный порок сердца?
Если порок сердца приводит к серьезным нарушениям гемодинамики (кровотока), как правило, его диагностируют уже в роддоме. При отсутствии выраженных проявлений ребенка могут выписать домой.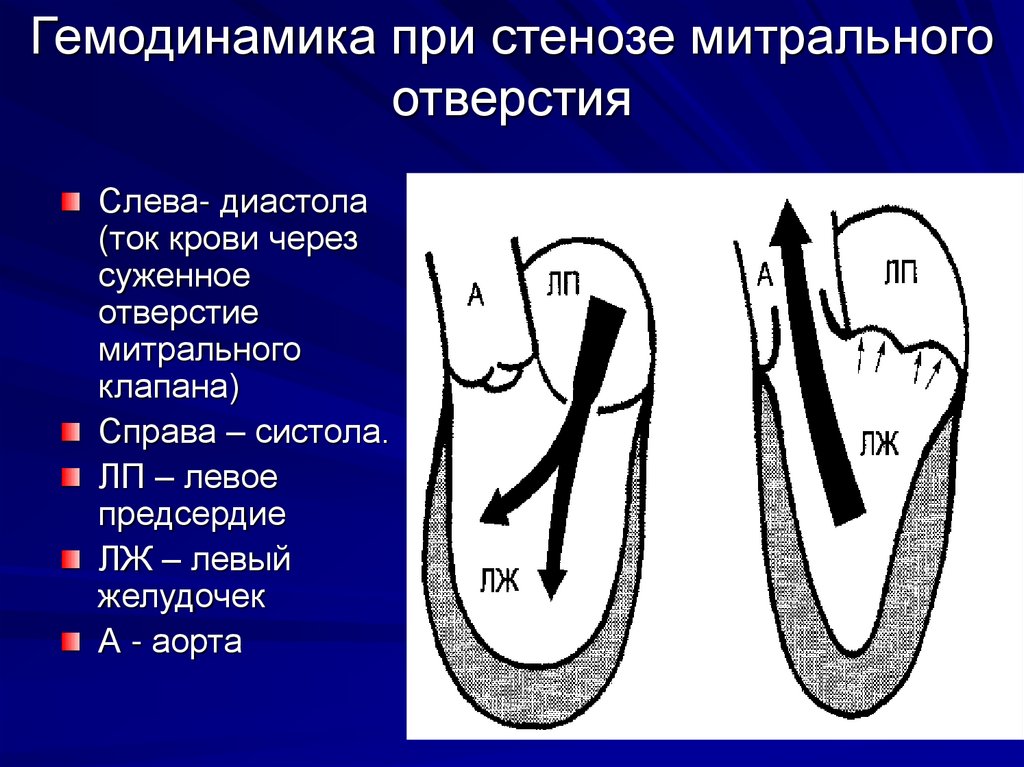 Родители могут заметить, что малыш вялый, плохо сосет и часто срыгивает, во время кормления и при крике — синеет. Может проявиться выраженная тахикардия (частота сердечных сокращений выше 150 ударов в минуту). В этом случае нужно обязательно сообщить о жалобах педиатру и пройти специальные обследования.
Родители могут заметить, что малыш вялый, плохо сосет и часто срыгивает, во время кормления и при крике — синеет. Может проявиться выраженная тахикардия (частота сердечных сокращений выше 150 ударов в минуту). В этом случае нужно обязательно сообщить о жалобах педиатру и пройти специальные обследования.
Подтверждение диагноза врожденного порока сердца
В настоящее время наиболее доступным, простым, безболезненным для ребенка и высокоинформативным методом диагностики пороков сердца является эхокардиография. Во время исследования с помощью ультразвукового датчика врач видит толщину стенок, размеры камер сердца, состояние клапанной системы и расположение крупных сосудов. Допплеровский датчик позволяет увидеть направления кровотока и измерить его скорость. Во время исследования можно выполнить снимки, подтверждающие заключение специалиста. Также ребенку обязательно запишут электрокардиограмму. При необходимости более точного исследования (как правило, для определения тактики хирургического лечения порока) врач порекомендует зондирование сердца. Это инвазивная методика, для выполнения которой ребенок госпитализируется в стационар. Зондирование проводится врачем-рентгенхирургом в рентгеноперационной, в присутствии врача-анестезиолога, под внутривенным наркозом. Через прокол в вене или артерии специальные катетеры вводятся в сердце и магистральные сосуды, позволяя точно измерить давление в полостях сердца, аорте, легочной артерии. Введение специального рентген-контрастного препарата позволяет получить точное изображение внутреннего строения сердца и крупных сосудов (см. рисунок).
Это инвазивная методика, для выполнения которой ребенок госпитализируется в стационар. Зондирование проводится врачем-рентгенхирургом в рентгеноперационной, в присутствии врача-анестезиолога, под внутривенным наркозом. Через прокол в вене или артерии специальные катетеры вводятся в сердце и магистральные сосуды, позволяя точно измерить давление в полостях сердца, аорте, легочной артерии. Введение специального рентген-контрастного препарата позволяет получить точное изображение внутреннего строения сердца и крупных сосудов (см. рисунок).
Диагноз – не приговор. Лечение ВПС (врожденного порока сердца)
Современная медицина позволяет не только своевременно диагностировать, но и лечить врожденные пороки сердца. Лечением ВПС занимаются кардиохирурги. При выявлении порока, сопровождающегося серьезным нарушением гемодинамики, влияющего на развитие ребенка и угрожающего жизни малыша, операция проводиться как можно раньше, иногда в первые дни жизни ребенка. При пороках, которые не влияют значительно на рост и развитие ребенка, операция может проводиться позже. Выбор сроков операции определяется хирургом. Если ребенку рекомендовали хирургическое вмешательство и его не удалось выполнить своевременно (часто из-за отказа родителей, непонимания серьезности проблемы), у ребенка может начаться патологическое изменение гемодинамики, приводящее к развитию и прогрессированию сердечной недостаточности. На определенном этапе изменения становятся необратимыми, операция уже не поможет. Отнеситесь внимательно к советам и рекомендациям врачей, не лишайте своего ребенка возможности расти и развиваться, не быть инвалидом на всю жизнь!
Выбор сроков операции определяется хирургом. Если ребенку рекомендовали хирургическое вмешательство и его не удалось выполнить своевременно (часто из-за отказа родителей, непонимания серьезности проблемы), у ребенка может начаться патологическое изменение гемодинамики, приводящее к развитию и прогрессированию сердечной недостаточности. На определенном этапе изменения становятся необратимыми, операция уже не поможет. Отнеситесь внимательно к советам и рекомендациям врачей, не лишайте своего ребенка возможности расти и развиваться, не быть инвалидом на всю жизнь!
Операция при врожденных пороках сердца
Многие годы операции при врожденных пороках сердца выполнялись только на открытом сердце, с использованием аппарата искусственного кровообращения (АИК), который берет на себя функции сердца во время его остановки. Сегодня при некоторых пороках такой операции существует альтернатива – устранение дефекта структур сердца с помощью системы AMPLATZER. Такие операции значительно безопаснее, не требуют раскрытия грудной клетки, не отличаясь по эффективности от «большой» хирургии.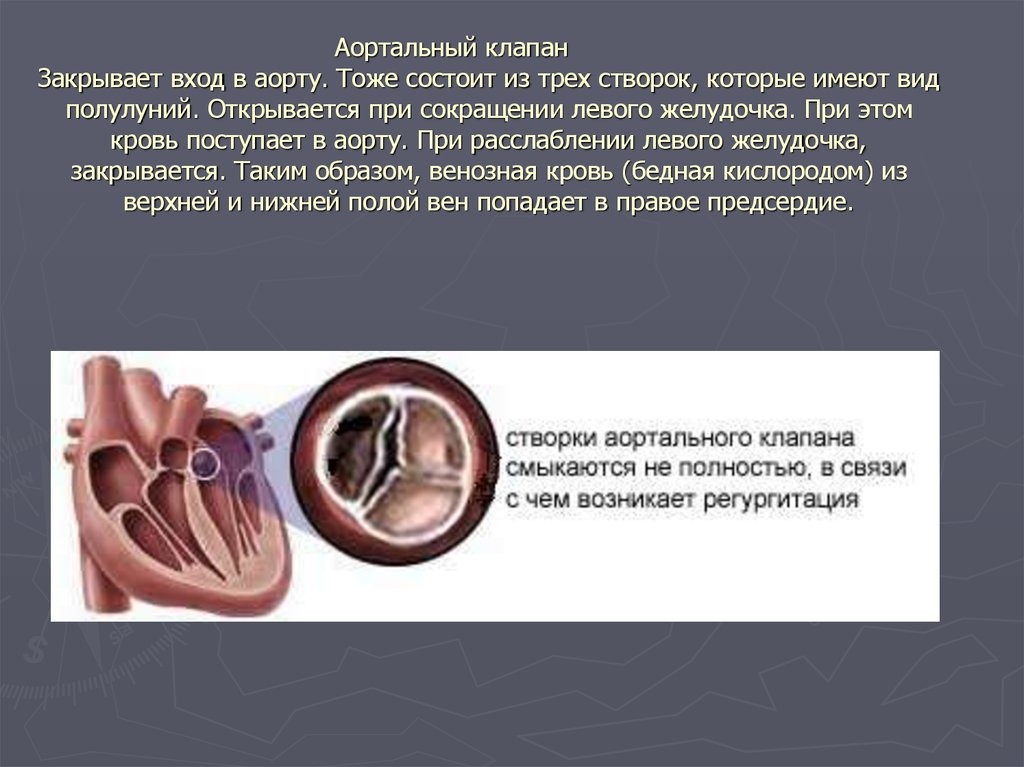 Если операция выполнена своевременно и успешно, ребенок полноценно развивается и растет, и часто – навсегда забывает о существовании порока. После операции обязательным является наблюдение педиатра, контрольные эхокардиографические исследования. Дети с врожденными пороками сердца часто болеют простудными заболеваниями из-за снижения иммунитета, поэтому в послеоперационном периоде проводится общеукрепляющее лечение и ограничиваются физические нагрузки. В дальнейшем у многих детей эти ограничения снимают и даже разрешают посещать спортивные секции.
Если операция выполнена своевременно и успешно, ребенок полноценно развивается и растет, и часто – навсегда забывает о существовании порока. После операции обязательным является наблюдение педиатра, контрольные эхокардиографические исследования. Дети с врожденными пороками сердца часто болеют простудными заболеваниями из-за снижения иммунитета, поэтому в послеоперационном периоде проводится общеукрепляющее лечение и ограничиваются физические нагрузки. В дальнейшем у многих детей эти ограничения снимают и даже разрешают посещать спортивные секции.
Если Вы считаете, что у Вашего ребенка есть проблемы с сердцем, то Вы можете пройти эхокардиографическое исследование и обратиться за консультацией к детскому кардиологу.
Стеноз аортального клапана лечение в Израиле — диагностика в Израильских клиниках, лечение стеноза аортального клапана по доступной цене
Стеноз аортального клапана лечение в Израиле — диагностика в Израильских клиниках, лечение стеноза аортального клапана по доступной цене | сайт Medlogist. com
com
консультация специалиста
Лечение стеноза аортального клапана в Израиле — теперь стало доступным для украинцев. Читать подробнее Стеноз аортального клапана и лечении в израильских клиниках.
АБВГДЕЖЗИЙКЛМНОПРСТУФХЦЧШЩЭЮЯ
Стеноз аортального клапана: лечение в клинике Израиля
Аортальный стеноз – это сужение отверстия аорты на уровне клапана, которое препятствует нормальному движению крови из левого желудочка во время сокращения сердечной мышцы, создает в левом желудочке высокое давление, расширяет его, провоцирует застой малого круга кровообращения, становится причиной ухудшения насосной функции сердца, угрожает жизни.
Стеноз происходит за счет сращивания соединительных пластинок клапана аорты, относится к порокам сердца. Клапан аорты регулирует ток крови из левого желудочка в ее восходящий отдел, имеет три тонких соединительных пластинки, которые во время сокращения левого желудочка открываются, предоставляя свободный путь крови, а в период расслабления – сжимаются, блокируя этот путь.
Симптомы стеноза:
- нехватка воздуха при физической нагрузке;
- приступообразные боли по типу стенокардии;
- утомляемость, слабость;
- ощущение сердцебиения;
- обморочные состояния при резкой смене положения тела.
Израильские кардиологи, имеющие огромный опыт в лечении стеноза, контролируют функциональное состояние сердечных клапанов и аорты, проводят тщательную диагностику на современной аппаратуре, работают в сотрудничестве с кардиохирургами, что обеспечивает комплексное обследование, выбор тактики терапии. Перед оперативным вмешательством назначается медикаментозное лечение. Хирургическая терапия осуществляется посредством протезирования или расширения участка патологического сужения пластинок клапана.
Обследование пациента со стенозом аортального клапана в клинике Израиля
Современное диагностическое обследование осуществляется в кратчайшие сроки с использованием лабораторных, инструментальных методов. Диагностика включает консультацию кардиолога, анализ клинической картины, рентгенографию грудной клетки, ЭХО, электрокардиографию, МРТ, КТ, ЭКГ, инвазивный метод диагностики, позволяющий произвести визуализацию коронарных артерий, аортографию и прочие методы. Лечение в Израиле проводят квалифицированные кардиологи с большим опытом лечения приобретенного, врожденного, критического стеноза аортального клапана, а цены на лечение данной патологии в Израиле намного ниже, чем в других развитых странах.
Лечение в Израиле проводят квалифицированные кардиологи с большим опытом лечения приобретенного, врожденного, критического стеноза аортального клапана, а цены на лечение данной патологии в Израиле намного ниже, чем в других развитых странах.
Качественное обследование, современные методы лечения пациентов со стенозом аортального клапана сердца в Израиле
Преимущества лечения в клинике Израиля:
- контролем состояния, лечением больных с сужением аортального клапана занимаются ведущие кардиологи Израиля, владеющие новейшими методиками терапии;
- благодаря современной диагностической аппаратуре удается выяснить все особенности патологии, максимально точно провести хирургическую операцию;
- после оперативных вмешательств осуществляется интенсивный уход за пациентом, назначается реабилитационная терапия, в клинике имеются комфортабельные палаты, оснащенные всем необходимым.
Обратившись в BK MEDICAL LOGISTIC (Украина, Киев), вы получите качественное обследование, соответствующее лечение стеноза аортального клапана от ведущих кардиологов Израиля.
Лечение стеноза аортального клапана получить полноценную информацию процедуры лечения болезни в клиниках Израиля. Написав к нам, составьте полную этапность лечения, израильских докторов, и стоимость процедур, по Вашему диагнозу. Бесплатная консультация докторов по направлению Лечение стеноза аортального клапана и подобным болезням только у Нас.
Стеноз аортального клапана , цена
| Название процедуры | Цены (USD)* |
| Консультация специалиста | Бесплатно |
| Онлайн консультация доктора | от 200 |
| Консультация доктора | от 500 |
| Стеноз аортального клапана лечение | от 2000 |
*Для того чтоб узнать полную цену лечения в Израиле, оставьте заявку и наши специалисты уточнят все детали.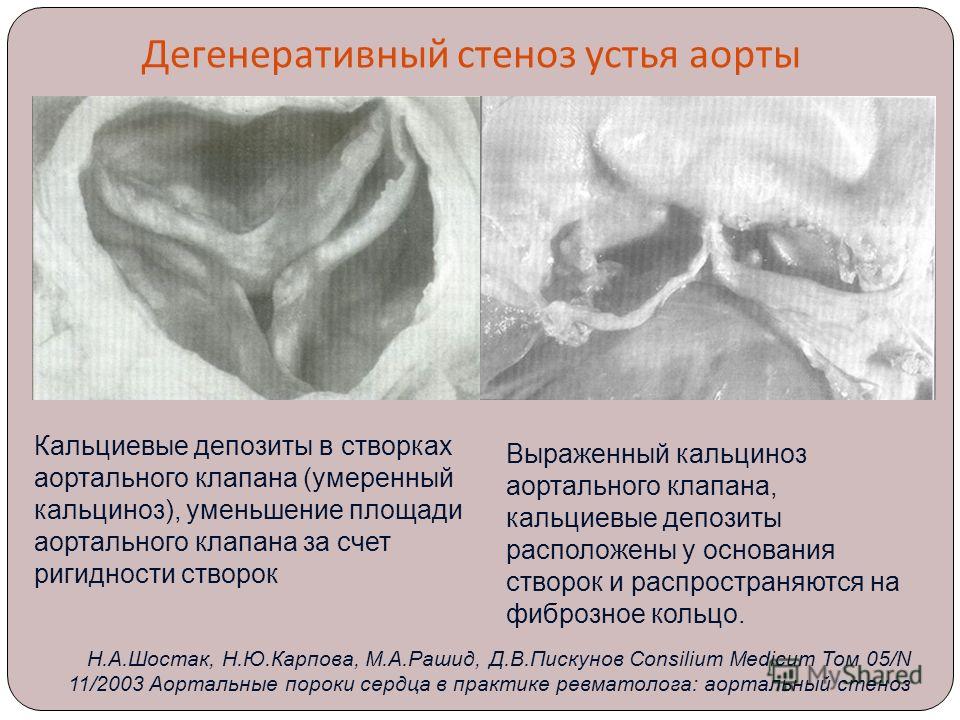
РАССЧИТАТЬ СТОИМОСТЬ ЛЕЧЕНИЯ
В этих клиниках можно
лечиться в Израиле
Медицинский центр «ЭМЕК»
Израиль, Афула
Подробнее
Клиника Герцлия медикал центр
Израиль, Герцлия
Подробнее
Клиника Хадасса
Израиль, Иерусалим
Подробнее
Клиника Шиба
Израиль, Рамат Ган
Подробнее
Клиника Рамбам
Израиль, Хайфа
Подробнее
Клиника Ассута
Израиль, Тель-Авив
Подробнее
Клиника Меланома Юнит
Израиль, Тель-Авив
Подробнее
Клиника Ихилов (Тель-Авивский медицинский центр Сураски)
Израиль, Тель-Авив
Подробнее
Лечение стеноза аортального клапана, лучшие врачи
Доктор Ирина Живелюк
Доктор Ирина Живелюк – врач специализирующийся на онкологии и химиотерапевт.
Подробнее
Профессор Хаим Гутман
Профессор Хаим Гутман занимает должность заведующего отделением онкологической хирургии клиники Onco Breast Unit, а также является врачом-консультантом в медицинском центре Герцлия. Основной его специализацией являются хирургические вмешательства при онкологических патологиях, в частности, при раке груди или меланоме.
Подробнее
Профессор Дан Эршко
Профессор Дан Эршко — заведующий отделением хирургии МЦ Эмек
Подробнее
Профессор Нимрод Розен
Директор отделения ортопедии и ортопедической реабилитации больницы Ха-Эмек, Афула
Подробнее
Профессор Корен Ариэль
Профессор Корен Ариэль — доктор с большим стажем в области гематологии и педиатрии
Подробнее
Доктор Ашер Прессман
Заведующий отделением детской хирургии Медицинского центра Эмек
Подробнее
Доктор Михаэль Райхель
Врач-нейрохирург, ортопед в отделении спинальной хирургии госпиталя Эмек. Старший сотрудник Всеизраильского спинального центра госпиталя Ассута, нейрохирург, ортопед
Старший сотрудник Всеизраильского спинального центра госпиталя Ассута, нейрохирург, ортопед
Подробнее
Доктор Елена Черток Шахам
Доктор Елена Черток Шахам — одна из самых выдающихся профессионалов по лечению диабета и похожих заболеваний.
Подробнее
Доктор Яков Хромов
Старший хирург, отделение общей хирургии «А»
Подробнее
Доктор Софья Римброт
Доктор София Римброт, заместитель заведующего терапевтическим отделением больницы «Эмек» (Афула)
Подробнее
Это полезные
публикации о
лечении в Израиле
Тесты на основе крови для помощи в лечении Альцгеймера
Уход за больными болезнью Альцгеймера сталкивается с нынешними и будущими проблемами как для пациентов, так и для медицинских работников.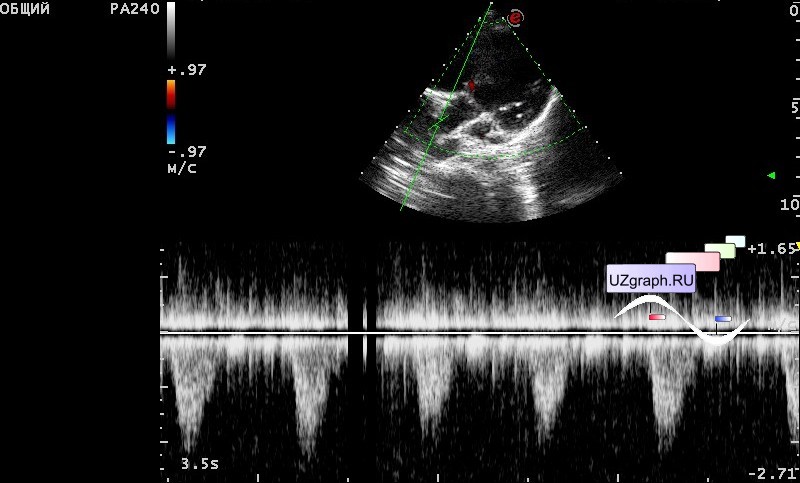
Подробнее
Анализы дыхания и мочи более точно выявляют рак груди, говорят исследователи
Используя легкодоступную технологию, израильские ученые продемонстрировали беспрецедентный успех в выявлении ранних опухолей.
Подробнее
Революционное лечение рака мозга в Израиле
Ученые-исследователи университета Тель-Авива сделали потрясающее открытие, обнаружив белок-разрушитель иммунной системы головного мозга.
Подробнее
Израильская оптическая технология диагностирования меланомы
Своевременная диагностика рака кожи, включая один из самых тяжелых его видов – меланому, может иметь судьбоносное значение для пациента, спасти ему жизнь.
Подробнее
Второе мнение ПЭТ-КТ — что это?
Что такое ПЭТ-КТ? Когда следует обратиться за вторым мнение или ревизией анализов? Рассказываем в нашем блоге.
Подробнее
Похожие болезни
Пролапс митрального клапана (ПМК)
Лечение пролапса митрального клапана в Израиле — теперь стало доступным для украинцев. Читать подробнее о ПМК и лечении в израильских клиниках.
Подробнее
Тромбоэмболия легочной артерии
Лечение тромбоэмболия легочной артерии в Израиле — теперь стало доступным для украинцев. Читать подробнее о тромбозе легочной артерии и лечении в израильских клиниках.
Читать подробнее о тромбозе легочной артерии и лечении в израильских клиниках.
Подробнее
Инфаркт миокарда
Лечение инфаркта миокарда в Израиле — теперь стало доступным для украинцев. Читать подробнее о инфаркте миокарда и лечении в израильских клиниках.
Подробнее
Перемежающаяся хромота
Лечение перемежающейся хромоты в Израиле — теперь стало доступным для украинцев. Читать подробнее Перемежающаяся хромота и лечении в израильских клиниках.
Подробнее
Кардиология
Кардиология в Израиле в специализированных клиниках у самых лучших врачей.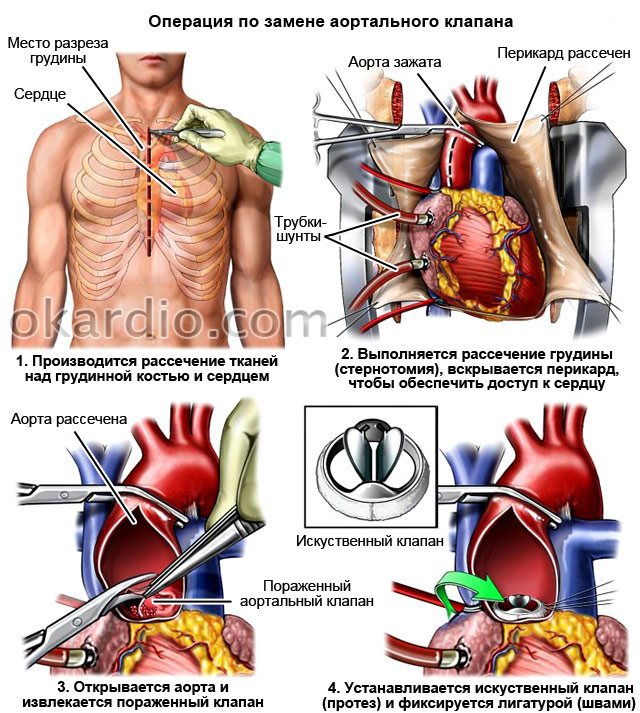 Нажмите оставить заявку, чтобы узнать точную стоимость лечения.
Нажмите оставить заявку, чтобы узнать точную стоимость лечения.
Подробнее
Узнать полную стоимость лечения в Израиле
Наши специалисты свяжутся с Вами и ответят на все вопросы по лечению заболеваний в израильских клиниках
Часто задаваемые вопросы про Лечение стеноза аортального клапана
Консультация врача по Стеноз аортального клапана ?
Как определить Стеноз аортального клапана ?
Рекомендации при болезне Стеноз аортального клапана ?
Лучшие израильские врачи по лечению Стеноз аортального клапана ?
Если в Израиле дорого для вас — все равно обратитесь
так как консультация бесплатная, а медлогист — это медицинский навигатор
Хирургическое лечение приобретенных пороков сердца
- Аортальные пороки сердца
- Митральные пороки сердца
- Пороки трехстворчатого клапана
- Инфекционный и протезный эндокардит
- Искусственные клапаны сердца
Аортальные пороки сердца.

Оперативное лечение больных с аортальной недостаточностью показано всем симптоматическим пациентам, находящимся во II функциональном классе NYHA или выше, а также с фракцией выброса > 20-30% или с конечным систолическим диаметром < 55 мм. Дополнительным показанием также является конечно-диастолический диаметр, приближающийся к 70 мм. Пациенты с более серьезным повреждением контрактильной функции левого желудочка имеют значительно более высокий риск операции и послеоперационную летальность. Протезирование аортального клапана показано всем пациентам с аортальным стенозом, имеющим симптомы заболевания, а также пациентам без симптомов с высоким трансвальвулярным градиентом давления (больше 60 мм рт.ст.), площадью отверстия ≤ 0,6 см 2, коронарной или другой клапанной патологией, до того, как разовьется левожелудочковая декомпенсация.
Хирургическая коррекция аортального порока осуществляется с помощью его протезирования механическими, биологическими каркасными и бескаркасными протезами или криоконсервированными аллографтами.
У некоторых пациентов возможно выполнение реконструкции аортального клапана. В случаях узких аортальных колец для достижения оптимальной гемодинамики выполняется пластика корня аорты биологическим материалом.
Операции проводятся как из стандартного так и миниинвазивного доступа.
Митральные пороки сердца.
Показания к операции при митральном стенозе определяются площадью левого атриовентрикулярного отверстия. Митральный стеноз с площадью МК ≤1 см2 считается критическим. У физически активных пациентов или больных с большой массой тела сужение отверстия 1,2 см2 может также оказаться критическим. Таким образом, показанием к операции у больных с митральным стенозом является уменьшение площади МК < 1,5 см2 и II и более функциональный класс NYHA.
Показанием к операции при митральной недостаточности является площадь эффективного отверстия регургитации > 20 мм2, II и более степень ругургитации и II-III функциональный класс NYHA. Оперативное лечение митральной недостаточности должно быть проведено до того как КСИ достигнет 40-50 мл/м2, так как увеличение его ≥ 60 мл/м2 предполагает неблагоприятный прогноз.
Оперативное лечение митральной недостаточности должно быть проведено до того как КСИ достигнет 40-50 мл/м2, так как увеличение его ≥ 60 мл/м2 предполагает неблагоприятный прогноз.
Хирургическая коррекция митрального порока осуществляется с помощью его протезирования искусственными механическими и биологическими протезами.
При имплантации протезов у пациентов с выраженной сердечной недостаточностью обязательно проводится сохранение естественного хордального аппарата или имплантация искусственных хорд из политетрафторэтилена.
У 30-40% пациентов возможно выполнение реконструктивных операций на митральном клапане. Для этого используются различные методы реконструкции: аннулопластика на жестких и мягких кольцах, резекция створок, имплантация искусственных хорд, пластика «край в край». Восстановление нормальной функции митрального клапана у большинства пациентов в последующем не требует пожизненной антикоагулянтной терапии.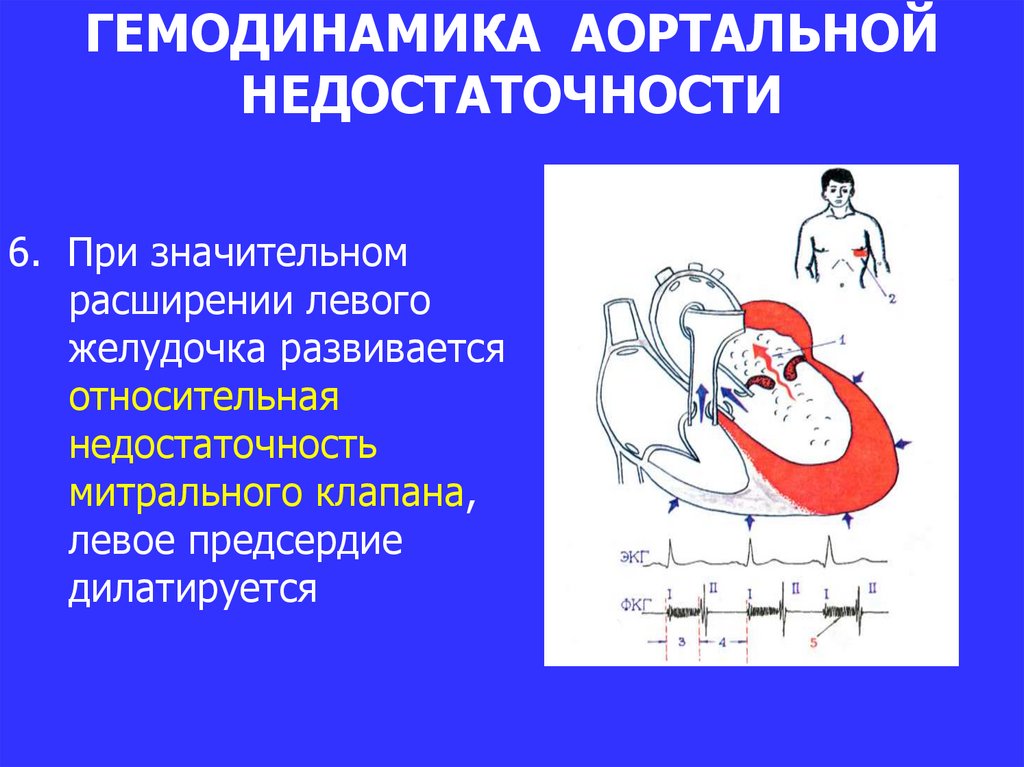
Операции на митральном клапане выполняются как из стандартной стернотомии, так и из правосторонней миниторакотомии.
Пороки трехстворчатого клапана.
Показанием к операции при стенозе трехстворчатого клапана является эффективная площадь отверстия < 1,5 см2, а при недостаточности регургитация крови в правое предсердие II- III степени. При выборе способа коррекции трикуспидального порока учитывается наличие у пациента предикторов резидуальной легочной гипертензии: ДЛА > 50 мм рт.ст., толщины стенки ПЖ > 7мм, диаметра ЛП > 55 мм, ФВ ПЖ < 30%.
Основным методом коррекции относительной недостаточности трехстворчатого клапана является аннулопластика. Способы уменьшения диаметра кольца трехстворчатого клапана заключаются в проведении кисетной пластики и использовании жестких или гибких корригирующих колец. В некоторых случаях при невозможности выполнить корригирующую операцию используется биопротезирование клапана.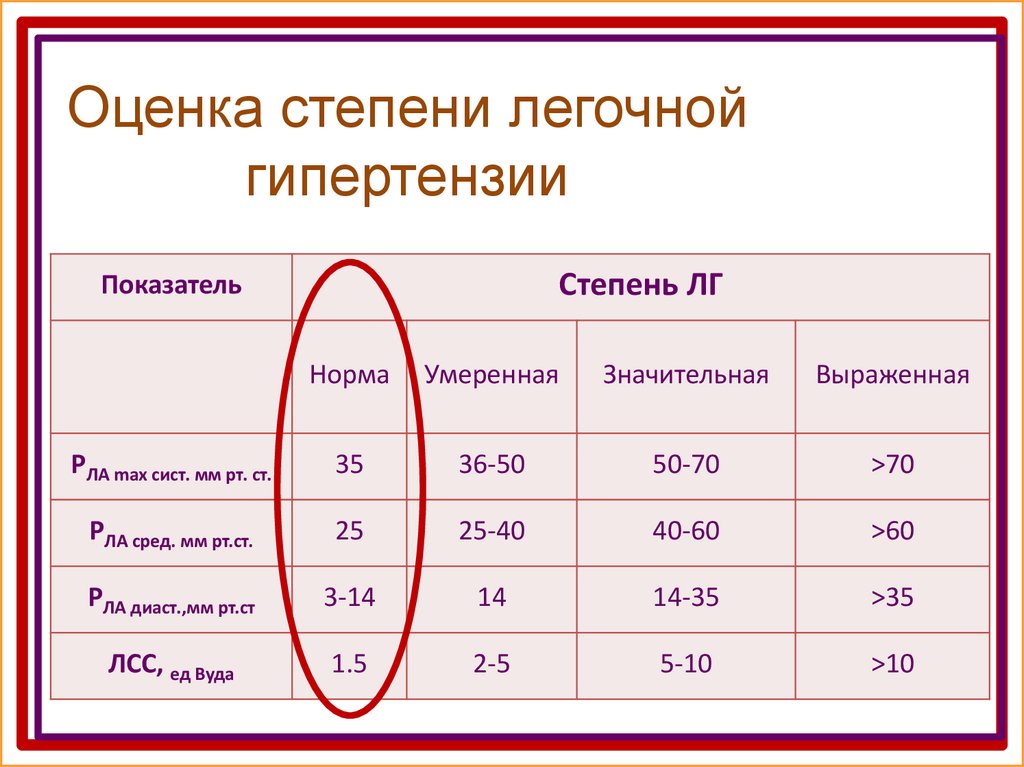
Инфекционный и протезный эндокардит.
Этиология инфекционного эндокардита значительно изменилась вследствие активного применения антибиотиков во всем мире. В настоящее время основная роль отводится стафилококкам и грамотрицательной флоре, а также грибковой инфекции.
C точки зрения хирургии в патогенезе инфекционного эндокардита наибольшее значение имеет факт быстрого разрушения клапанного аппарата сердца. Это приводит к катастрофическому нарастанию сердечной недостаточности, так как миокард не успевает приспособиться к резкому нарушению гемодинамики.
Решение о необходимости хирургического лечения возникает, как правило, при развитии «осложненного инфекционного эндокардита»: изменений гемодинамического статуса; персистенции и распространенности инфекции; развития метастатических очагов инфекции; системных эмболий. В этих случаях оперативное лечение оказывается более успешным, чем терапевтический подход.
Главной проблемой хирургического лечения является предотвращение рецидива инфекции и развития протезного эндокардита. Основой для выбора тактики являются анатомические изменения, выявленные на операционном столе: степень поражения фиброзного кольца и окружающих тканей, а также наличие вегетаций, абсцессов, фистул, отрывов протезов. Особое значение в последние годы отводится реконструктивным операциям, особенно при поражении эндокардитом митрального или трехстворчатого клапанов. Для замещения дефектов клапанов после хирургической обработки используется пластика собственными тканями, ауто- или ксеноперикардом.
Искусственные клапаны сердца.
В настоящее время в клинике используются механические, биологические искусственные клапаны, а также аллографты.
Механические протезы.
В РНПЦ разработаны и применяются в клинике две модификации двухстворчатых искусственных клапанов сердца: ПЛАНИКС-Т и ПЛАНИКС-Э.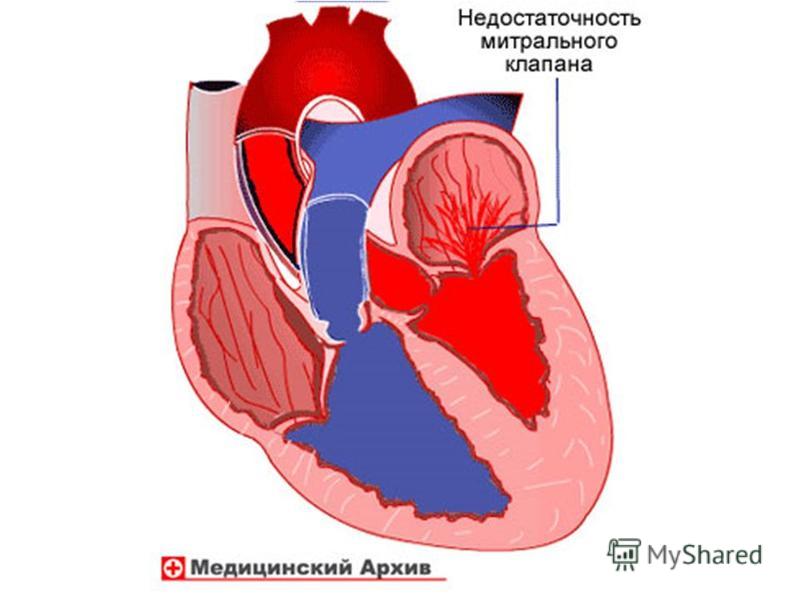 Отличие конструкции последней версии отечественного двухстворчатого искусственного клапана сердца от предыдущей модели состоят в том, что корпус протеза покрыт окисью титана, обеспечивающем высокую износоустойчивость и биологическую инертность. Большая высота поворотного механизма предотвращает заклинивание створок тканями сердца и позволила увеличить угол открытия створок до 900.
Отличие конструкции последней версии отечественного двухстворчатого искусственного клапана сердца от предыдущей модели состоят в том, что корпус протеза покрыт окисью титана, обеспечивающем высокую износоустойчивость и биологическую инертность. Большая высота поворотного механизма предотвращает заклинивание створок тканями сердца и позволила увеличить угол открытия створок до 900.
Биологические протезы.
Створки протеза сформированы из биологических тканей: ксеноаортальный клапан, клапан из перикарда. Используются два типа биопротезов: каркасные (биологическая ткань фиксирована на жестком или гибком каркасе) и бескаркасные.
Аллографты.
Современным направлением в хирургическом лечении поражений клапанного аппарата является использование криоконсервированных аллографтов. Появление в последние годы современной криогенной техники позволило создать условия для длительного сохранения жизнеспособности биологических объектов, что обеспечивает их нормальную функцию в организме после имплантации.
Биопротезирование клапанов сердца в Москве, цены в клинике АО «Медицина» (клиника академика Ройтберга)
Когда сердце работает нормально, мы его не замечаем. Любые нарушения в нормальной работе сердечной мышцы очень быстро дают о себе знать – появляются боли, одышка, невозможность нормально справляться с нагрузками. Клапанные пороки сердца – одна из причин сердечных недугов.
Сердце состоит из четырех камер, которые разделены между собой клапанами. Самый мощный отдел, который выталкивает кровь в аорту и в другие крупные сосуды – это левый желудочек. Левый желудочек отделен от аорты аортальным клапаном. Когда клапан находится в закрытом положении, желудочек наполняется кровью, затем клапан открывается, и желудочек выталкивает кровь в сосуды, откуда она поступает к внутренним органам. После того, как желудочек сократился, клапан опять закрывается, чтобы обеспечить цикл снова. Многие пороки сердца связаны с плохой работой клапана. Наиболее часто поражаются аортальный и митральный клапаны. Если клапан плохо закрывается, часть крови вместо того, чтобы попасть в крупные сосуды, возвращается обратно в сердце через неплотно закрытое отверстие. Такое поражение клапанов называется «недостаточность». Если клапан плохо открывается, сердцу приходится работать с большим напряжением, чтобы протолкнуть кровь через узкое отверстие – такая ситуация называется «стеноз». И в том, и в другом случае возникают признаки сердечной недостаточности – появляется одышка даже при небольшом движении, отеки, дискомфорт в сердце, привычные нагрузки становятся непосильными. При стенозе (сужении) клапана человек может долгое время ничего не чувствовать, однако риск внезапной сердечной смерти у таких пациентов значительно выше, чем в среднем по популяции.
Если клапан плохо закрывается, часть крови вместо того, чтобы попасть в крупные сосуды, возвращается обратно в сердце через неплотно закрытое отверстие. Такое поражение клапанов называется «недостаточность». Если клапан плохо открывается, сердцу приходится работать с большим напряжением, чтобы протолкнуть кровь через узкое отверстие – такая ситуация называется «стеноз». И в том, и в другом случае возникают признаки сердечной недостаточности – появляется одышка даже при небольшом движении, отеки, дискомфорт в сердце, привычные нагрузки становятся непосильными. При стенозе (сужении) клапана человек может долгое время ничего не чувствовать, однако риск внезапной сердечной смерти у таких пациентов значительно выше, чем в среднем по популяции.
У детей изменения клапанов чаще всего бывают врожденными. У взрослых клапаны «портятся» с возрастом, когда на створках начинает откладываться кальций. Из-за этого они становятся менее эластичными и хуже выполняют свою работу. Часто клапаны поражаются при ревматизме, причем последствия ревматической атаки могут дать о себе знать спустя много лет.
Для того, чтобы оценить работу клапана, проводят эхокардиографию – ультразвуковое исследование сердца. При этом исследовании врач обязательно оценивает несколько параметров — размер отверстия, через которое сердце выталкивает кровь, расхождение створок клапана, измеряет давление в камерах сердца. По результатам этого исследования врач функциональной диагностики дает заключение о степени поражения клапана. При поражении клапана 3-4 степени необходима консультация кардиохирурга.
Когда клапан не может нормально работать, проводят операцию по его замене – протезирование клапанов. Во время операции кардиохирург удаляет поврежденный клапан и устанавливает на его место новый. Клапанные протезы бывают двух видов — механические и биологические. Современные биологические клапаны делают из клапана свиньи или бычьего перикарда. Механические клапаны состоят из металла, углерода и синтетических материалов. Механические протезы более долговечны, но они требуют пожизненного приема лекарственных препаратов, поддерживающих низкую свертываемость крови. Во время приема этих препаратов нужно регулярно проводить анализ крови. Без лекарств на клапанах часто образуются тромбы, которые становятся причиной грозных осложнений. После установки биологических протезов нет необходимости принимать лекарства. Главный недостаток биологических протезов – ограниченный срок работы. Через 15 лет после установки на них начинаются процессы отложения кальция, которые приводят к ухудшению работы клапана. В России чаще устанавливаются механические клапаны. В Европе после 65 лет предпочитают ставить биологические.
Во время приема этих препаратов нужно регулярно проводить анализ крови. Без лекарств на клапанах часто образуются тромбы, которые становятся причиной грозных осложнений. После установки биологических протезов нет необходимости принимать лекарства. Главный недостаток биологических протезов – ограниченный срок работы. Через 15 лет после установки на них начинаются процессы отложения кальция, которые приводят к ухудшению работы клапана. В России чаще устанавливаются механические клапаны. В Европе после 65 лет предпочитают ставить биологические.
Операция проводится с подключением аппарата искусственного кровообращения – когда хирург работает с клапаном, вместо сердца кровообращение обеспечивает специальный прибор. Во время вмешательства используются средства, которые защищают сердце и сосуды от повреждения. Операция проводится под общим наркозом. Ее продолжительность может быть разной, но обычно она не превышает 3 часа.
Операционный риск зависит от возраста, общего состояния больного, наличия сопутствующих заболеваний и степени поражения клапана. После операции пациента переводят в отделение интенсивной терапии, где в течение 2-3 дней врачи и медицинские сестры круглосуточно наблюдают за его состоянием. Проводится постоянное мониторирование основных показателей работы сердца, сосудов и внутренних органов. Пациент просыпается через 2-3 часа после операции, на следующий день врачи разрешают садиться, а через день – вставать. На третий день пациент, как правило, возвращается в палату.
После операции пациента переводят в отделение интенсивной терапии, где в течение 2-3 дней врачи и медицинские сестры круглосуточно наблюдают за его состоянием. Проводится постоянное мониторирование основных показателей работы сердца, сосудов и внутренних органов. Пациент просыпается через 2-3 часа после операции, на следующий день врачи разрешают садиться, а через день – вставать. На третий день пациент, как правило, возвращается в палату.
Прежде чем решиться на операцию, нужно обязательно пройти комплексное обследование, чтобы оценить работу многих органов – легких, почек, печени и проконсультироваться у терапевта. Врач определит, нет ли противопоказаний к операции.
Более чем 30-летний опыт протезирования клапанов сердца свидетельствует о том, что продолжительность и качество жизни оперированных пациентов значительно лучше, чем у больных без операции с естественным течением болезни. Большинство оперированных пациентов быстро возвращаются к нормальной жизни, работают и занимаются фитнесом.
В клинике «Медицина» мы используем высококачественные биологические клапаны последнего поколения фирмы Edwards.
У нас вы можете заранее проконсультироваться с кардиохирургом, который будет выполнять операцию. Сегодня нет необходимости выезжать за границу для получения современного лечения в комфортных условиях — достаточно обратиться в Клинику «Медицина». После лечения пациенты имеют возможность пройти специализированную реабилитационную программу, что помогает максимально улучшить качество жизни и включиться в ее нормальный ритм.
Приглашаем вас записаться на экскурсию по клинике, в ходе которой вы сможете познакомиться с врачами стационара и задать им вопросы.
В АО «Медицина» (клиника академика Ройтберга) вы можете заранее проконсультироваться с высококвалифицированными кардиохирургами, которые проводят операции шунтирования.
Субаортальный стеноз — StatPearls — NCBI Bookshelf
Непрерывное обучение
Подклапанный аортальный стеноз (SAS), также называемый субаортальным стенозом, является редким заболеванием, наблюдаемым у младенцев. В большинстве случаев это связано с наличием мембраны, обычно мышечной, сразу под аортальным клапаном, что вызывает фиксированную обструкцию кровотока через выходной тракт левого желудочка. Течение подклапанного аортального стеноза постепенное, и у пациентов редко проявляются изолированные симптомы. САС может сочетаться с дефектом межжелудочковой перегородки, открытым артериальным протоком, коарктацией аорты, двустворчатым аортальным клапаном, аномалией папиллярной мышцы левого желудочка и/или дефектом атриовентрикулярной перегородки, среди прочего. У большинства пациентов САС обнаруживается случайно при обследовании пациентов на наличие других врожденных пороков сердца. В этом упражнении описывается оценка, диагностика и лечение подклапанного аортального стеноза, а также подчеркивается роль командной межпрофессиональной помощи больным пациентам.
В большинстве случаев это связано с наличием мембраны, обычно мышечной, сразу под аортальным клапаном, что вызывает фиксированную обструкцию кровотока через выходной тракт левого желудочка. Течение подклапанного аортального стеноза постепенное, и у пациентов редко проявляются изолированные симптомы. САС может сочетаться с дефектом межжелудочковой перегородки, открытым артериальным протоком, коарктацией аорты, двустворчатым аортальным клапаном, аномалией папиллярной мышцы левого желудочка и/или дефектом атриовентрикулярной перегородки, среди прочего. У большинства пациентов САС обнаруживается случайно при обследовании пациентов на наличие других врожденных пороков сердца. В этом упражнении описывается оценка, диагностика и лечение подклапанного аортального стеноза, а также подчеркивается роль командной межпрофессиональной помощи больным пациентам.
Цели:
Объясните патофизиологическую основу подклапанного аортального стеноза.
Опишите детали, относящиеся к обследованию младенцев с врожденными пороками сердца.

Опишите тактику лечения младенца с подклапанным аортальным стенозом.
Продемонстрировать стратегии межпрофессиональной команды для улучшения координации помощи и коммуникации для улучшения результатов лечения пациентов с подклапанным аортальным стенозом.
Получите доступ к бесплатным вопросам с несколькими вариантами ответов по этой теме.
Введение
Подклапанный аортальный стеноз (САС), также называемый субаортальным стенозом, является редким заболеванием, наблюдаемым у младенцев. В большинстве случаев непосредственно под аортальным клапаном находится мембрана (обычно мышечная), которая вызывает постоянную преграду кровотоку через выходной тракт левого желудочка. Несмотря на то, что он классифицируется как врожденный порок сердца, тот факт, что он редко встречается при рождении и в младенчестве, его постепенное течение и высокая частота послеоперационных рецидивов позволяют предположить, что это может быть приобретенный порок.
Анатомия
Передняя створка митрального клапана вместе с внутриклапанной фиброзной тканью образует заднелатеральную границу, а мышечная и мембранозная части межжелудочковой перегородки образуют переднемедиальную границу выходного тракта левого желудочка.
Анатомические варианты
Существует целый ряд вариантов подклапанного аортального стеноза, которые возникают отдельно или в сочетании с другими. Это следующие:
Тонкая дискретная мембрана: наиболее распространенное поражение. Добавочная или аномальная ткань митрального клапана
У большинства пациентов мембрана, прикрепленная к межжелудочковой перегородке или охватывающая выходной тракт левого желудочка, вызывает обструкцию [3], [4], [5]. Его положение находится в любом месте от непосредственно ниже аортального клапана до левого желудочка. Отмечается, что основание створок аортального клапана вовлечено в эту субаортальную ткань, что ограничивает подвижность и увеличивает выходной тракт левого желудочка.
Естествознание
Как упоминалось ранее, течение подклапанного аортального стеноза постепенное. Это редко бывает изолированным представлением. САС связан с врожденными пороками сердца, включая дефект межжелудочковой перегородки, открытый артериальный проток, коарктацию аорты, двустворчатый аортальный клапан, аномалию папиллярной мышцы левого желудочка, дефект атриовентрикулярной перегородки и другие. У большинства пациентов САС обнаруживается случайно при обследовании пациентов на наличие других врожденных пороков сердца.
Этиология
Многие механизмы способствуют развитию фиксированного подклапанного аортального стеноза, например, генетические факторы, гемодинамические аномалии, наблюдаемые при других поражениях сердца, или лежащие в основе морфология выходного тракта левого желудочка, которая увеличивает турбулентность в выходном тракте.[6] Узкий LVOT, преувеличенное перекрывание аорты, увеличенная митрально-аортальная перегородка и крутой угол атриовентрикулярной перегородки могут привести к хроническому нарушению кровотока.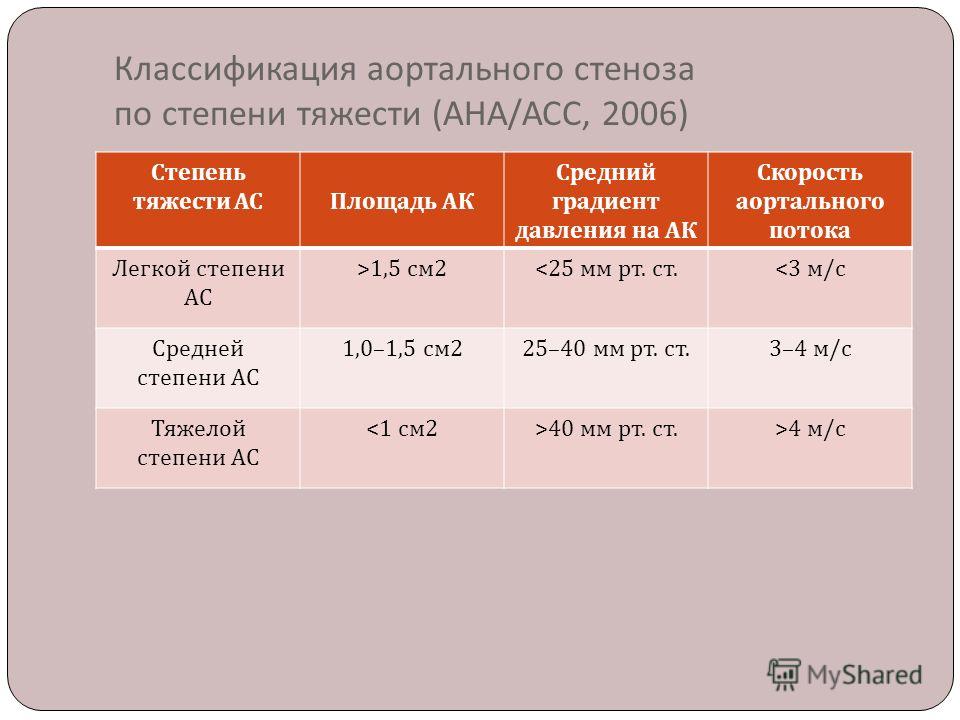 Эти факторы увеличивают давление сдвига жидкости на межжелудочковую перегородку и вызывают аномальную эндотелиальную и мышечную пролиферацию, приводящую к образованию фиброзно-мышечного гребня. Это может быть причиной развития подклапанного аортального стеноза. Исправление ассоциированных врожденных пороков сердца может изменить левосторонний отток, увеличивая турбулентность и напряжение сдвига жидкости в межжелудочковой перегородке, способствуя развитию подклапанного аортального стеноза.
Эти факторы увеличивают давление сдвига жидкости на межжелудочковую перегородку и вызывают аномальную эндотелиальную и мышечную пролиферацию, приводящую к образованию фиброзно-мышечного гребня. Это может быть причиной развития подклапанного аортального стеноза. Исправление ассоциированных врожденных пороков сердца может изменить левосторонний отток, увеличивая турбулентность и напряжение сдвига жидкости в межжелудочковой перегородке, способствуя развитию подклапанного аортального стеноза.
Эпидемиология
Подклапанный аортальный стеноз является редким заболеванием, наблюдаемым у младенцев и новорожденных, но является вторым наиболее распространенным типом аортального стеноза. Он отвечает примерно за 1% всех врожденных пороков сердца (8 на 10 000 рождений) и от 15% до 20% всех фиксированных обструктивных поражений выходного тракта левого желудочка.
Подклапанный аортальный стеноз наблюдается у детей с врожденным аортальным стенозом в 10-14% случаев. [8] с соотношением мужчин и женщин 2:1.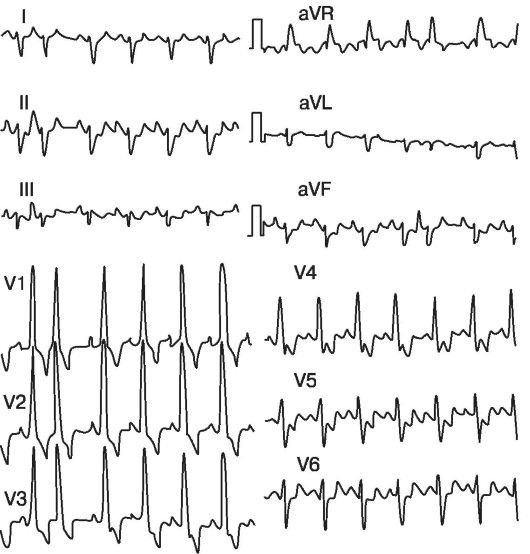 Распространенность САС составляет 6,5% всех врожденных пороков сердца у взрослых [9].]
Распространенность САС составляет 6,5% всех врожденных пороков сердца у взрослых [9].]
САС сочетается с другими пороками сердца в 50-65% случаев [10], [3], [11]. В отчете 35 пациентов были обнаружены сопутствующие поражения.
Дефект перегородки для желудочков (VSD) (20%)
Патентный проток Arteriosus (34%)
Pulmonic Stenosis (9%)
Aortic Coarctation (23%)
Aortic Coarctation (23%)
4. другие поражения (14%)
Патофизиология
Подклапанный стеноз аорты вызывает клинически значимую обструкцию кровотока, выходящего из левого желудочка, что приводит к развитию концентрической гипертрофии левого желудочка, часто с выпячиванием перегородки. Это, в свою очередь, приводит к дальнейшей обструкции и гипердинамической функции. При изолированном подклапанном аортальном стенозе сердечный выброс и систолическая функция хорошо сохраняются до тех пор, пока не разовьется тяжелая обструкция. Скорость прогрессирования подклапанного аортального стеноза вариабельна и непредсказуема у детей, в то время как у взрослых она прогрессирует медленно.
Скорость прогрессирования подклапанного аортального стеноза вариабельна и непредсказуема у детей, в то время как у взрослых она прогрессирует медленно.
Аортальная регургитация
Деформация аортальных клапанов может развиться при течении подклапанного аортального стеноза. Фибробластическая ткань мембраны может вторгаться в аортальный клапан, а высокоскоростная струя крови, протекающая через стеноз, травмирует аортальный клапан и частично способствует утолщению и асимметричной постстенотической дилатации восходящей аорты. У 65% пациентов развивается аортальная регургитация, которая прогрессирует и сохраняется даже после хирургического удаления подклапанного аортального стеноза. Аортальная регургитация обычно легкая; однако тяжесть может увеличиваться с увеличением градиента давления в выходном тракте левого желудочка. Из-за аортальной регургитации левый желудочек, который уже перегружен давлением, становится перегружен объемом, что еще больше увеличивает потребность левого желудочка в кислороде.
Кроме того, снижение диастолического давления в аорте снижает коронарную перфузию. Это снижение коронарной перфузии и увеличение потребности левого желудочка в кислороде делает миокард левого желудочка склонным к ишемическому повреждению. Некоторым пациентам может потребоваться замена или восстановление аортального клапана во время лечения подклапанного аортального стеноза.
Гистопатология
Гистологические данные при подклапанном стенозе аорты аналогичны туннелеподобным поражениям и поражениям фиброзно-мышечного гребня. Наблюдаются неравномерно ориентированные плотные коллагеновые волокна и тонкие, короткие эластические волокна в достаточном количестве. Сосудистость обычно отсутствует. Встречаются также редкие фибробласты с удлиненными ядрами и гладкомышечные клетки.
Анамнез и физикальное исследование
Субааортальный стеноз обычно выявляют при рождении, когда ребенка готовят к другому врожденному пороку сердца. Большинство младенцев при рождении бессимптомны или могут быть шумы во время обследования. Среди младенцев с симптомами обычно наблюдаются одышка при физической нагрузке, стенокардия, обмороки и предобморочные состояния, ортопноэ и внезапная сердечная смерть. Сердечная недостаточность может наблюдаться у младенцев с тяжелой обструкцией выходного тракта левого желудочка.
Среди младенцев с симптомами обычно наблюдаются одышка при физической нагрузке, стенокардия, обмороки и предобморочные состояния, ортопноэ и внезапная сердечная смерть. Сердечная недостаточность может наблюдаться у младенцев с тяжелой обструкцией выходного тракта левого желудочка.
Одышка при физической нагрузке является наиболее частым симптомом, наблюдаемым у 40% пациентов с симптомами, и отражает легочную венозную гипертензию, вызванную повышением давления наполнения левого желудочка, вызванным нарушением диастолической податливости гипертрофированного левого желудочка.
При наличии тяжелой обструкции сердечный выброс снижается, что приводит к системной вазодилатации, вызывающей снижение артериального давления и церебральной перфузии, что приводит к обморокам при физической нагрузке. У детей обмороки и предобморочные состояния встречаются редко и, если они присутствуют, указывают на сердечную аритмию. Снижение коронарной перфузии в сочетании с увеличением потребности в кислороде вызывает стенокардию у 25% пациентов с симптомами обструкции выходного тракта левого желудочка.
Физикальное обследование помогает отличить обструкцию выходного тракта левого желудочка от других причин.
Дети с подклапанным аортальным стенозом имеют нормальную модель роста и развития. Периферический пульс симметричен, за исключением случаев тяжелой обструкции выходного тракта левого желудочка.
У трети пациентов с легким подклапанным аортальным стенозом отмечается пальпируемое каротидное дрожание и левостороннее парастернальное дрожание. У пациентов с подклапанным аортальным стенозом от умеренной до тяжелой степени наблюдается сильный импульс на верхушке левого желудочка.
В течение первого года жизни более чем у половины больных возникают сердечные шумы. Она становится более заметной и типичной для обструкции выходного тракта левого желудочка по мере взросления пациента.[3] Низкий систолический шум изгнания оценивается во втором и третьем левых парастернальных пространствах и иррадиирует в надгрудинную вырезку. Продолжительность шума прямо пропорциональна степени обструкции.
Щелчок изгнания отсутствует при изолированном подклапанном аортальном стенозе и является важным отличительным признаком от шума при стенозе аортального клапана.
Высокий ранний диастолический шум аортальной недостаточности выслушивается у 30–50 % пациентов.
Проба Вальсальвы уменьшает интенсивность шума при подклапанном аортальном стенозе.
Оценка
Не существует специальных лабораторных анализов крови, которые назначают для диагностики подклапанного аортального стеноза.
Субаортальный стеноз диагностируется и подтверждается с помощью эхокардиограммы.
Эхокардиограмма помогает охарактеризовать и оценить следующее:
Степень вовлечения левого желудочного тракта
Целостность аортальных и митральных клапанов
Определение и местоположение гипер -стеноза
.
Постстенотическое расширение аорты
Характеристики наполнения
Сочетанные врожденные пороки сердца
Функция левого желудочка
Однако степень обструкции оттока при подклапанном аортальном стенозе на двумерной эхокардиограмме трудно оценить, и по этой причине показана допплерография [12]. Этот неинвазивный метод помогает определить точный градиент и степень обструкции выходного тракта левого желудочка. Использование доплера позволяет диагностировать небольшие субаортальные мембраны, которые вызывают ускорение потока в выходном тракте левого желудочка, но без гемодинамически значимого градиента давления.[14]
Этот неинвазивный метод помогает определить точный градиент и степень обструкции выходного тракта левого желудочка. Использование доплера позволяет диагностировать небольшие субаортальные мембраны, которые вызывают ускорение потока в выходном тракте левого желудочка, но без гемодинамически значимого градиента давления.[14]
Двумерная эхокардиография и трехмерная эхокардиография помогают оценить расположение поражений, степень вовлечения выходного тракта левого желудочка и связанные дефекты [13]. Различные точки зрения определяют отношение подклапанного стеноза аорты к окружающим структурам. Парастернальная и субкостальная проекции показывают близость подклапанного аортального стеноза к аортальному клапану.
В некоторых случаях гипертрофированная межжелудочковая перегородка, препятствующая выходному тракту левого желудочка, может скрывать наличие субаортальной мембраны. В таких случаях чреспищеводная эхокардиография более надежна для точной диагностики субаортальной мембраны и позволяет отличить подклапанный аортальный стеноз от гипертрофированной межжелудочковой перегородки [9]. ]
]
Другие тесты
Электрокардиограмма: ЭКГ выявляет различную степень гипертрофии левого желудочка у 50-80% пациентов. Наличие выраженного зубца Q в левых прекардиальных отведениях может указывать на гипертрофию перегородки. Результаты ЭКГ могут быть нормальными у пациентов с тяжелым подклапанным аортальным стенозом.
Рентгенограмма грудной клетки: Рентгенограмма грудной клетки часто бывает нормальной. У некоторых пациентов, в том числе с легким стенозом, имеется умеренная кардиомегалия или выступ ЛЖ.
Катетеризация сердца: Катетеризация сердца обычно не показана при изолированном подклапанном аортальном стенозе. При подозрении на множественные уровни обструкции часто выполняется дополнительная интерпретация степени субаортальной обструкции. Катетеризация позволяет получить как гемодинамические, так и анатомические данные, такие как измерение сердечного выброса, градиент на клапане и оценку степени аортальной регургитации. Могут наблюдаться сопутствующие поражения, такие как коарктация аорты. Он не показан при диагностике подклапанного аортального стеноза, но может быть использован как часть предоперационного обследования для исключения значительного поражения коронарных артерий.
Могут наблюдаться сопутствующие поражения, такие как коарктация аорты. Он не показан при диагностике подклапанного аортального стеноза, но может быть использован как часть предоперационного обследования для исключения значительного поражения коронарных артерий.
Лечение/управление
Поскольку у большинства детей заболевание протекает бессимптомно, медикаментозная терапия не играет роли в лечении подклапанного аортального стеноза. Поскольку это прогрессирует, в какой-то момент необходимо вмешательство для устранения обструкции выходного тракта левого желудочка. Хирургическая коррекция обструкции является окончательным методом лечения подклапанного аортального стеноза. Это может варьироваться от простого удаления мембраны до обширной кольцевой резекции с миэктомией или без нее. Однако, если у пациента развивается сердечная недостаточность или клинически значимая дисфункция левого желудочка, пациенту начинают медикаментозное лечение до тех пор, пока не будет проведена операция.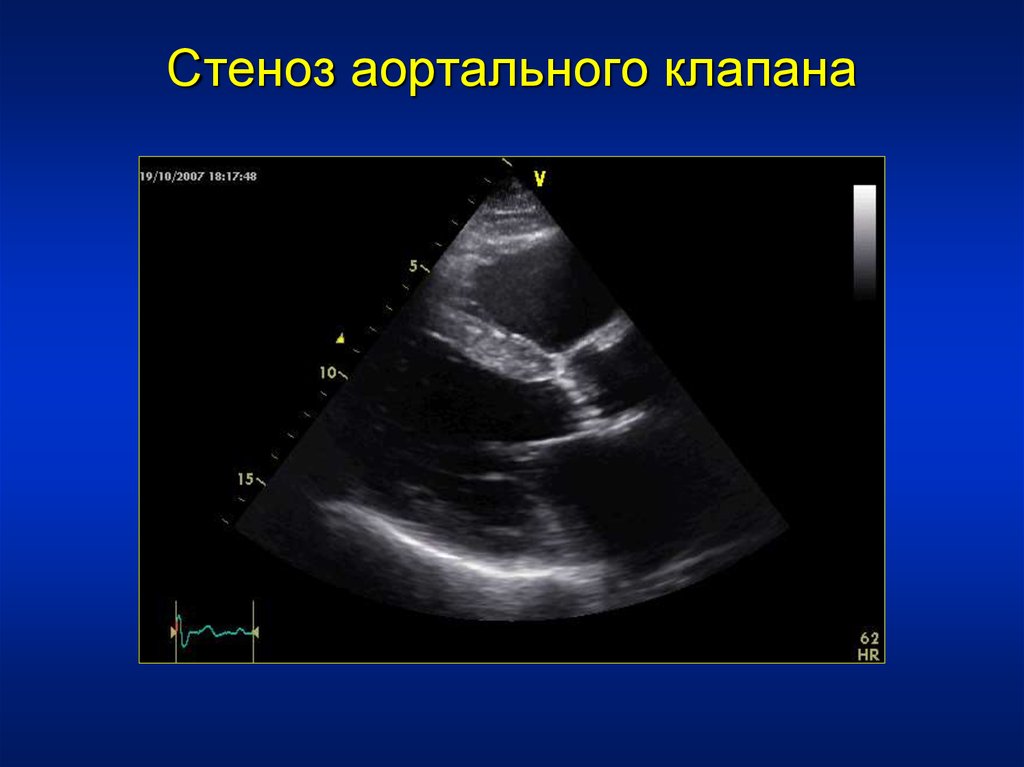
Показания к вмешательству
Критерии и сроки вмешательства при подклапанном аортальном стенозе противоречивы. Раннее вмешательство у этих пациентов уравновешивается высокой послеоперационной частотой рецидивов, поздними повторными операциями и развитием аортальной регургитации после устранения обструкции. [14], [15]
мм рт. ст. и отсутствие гипертрофии левого желудочка, лечение подклапанного аортального стеноза не требует вмешательства и медицинского наблюдения [17].
У детей и подростков со средним градиентом допплеровского давления 50 мм рт. со стенокардией, обмороками или одышкой при нагрузке, если они бессимптомны, но проявляются изменениями на ЭКГ в покое или при физической нагрузке или в пожилом возрасте на момент постановки диагноза [17], [18], [4]
Только профилактика аортальной регургитации обычно не является критерием для операции. Однако прогрессирование и ухудшение регургитации до значительной степени является показанием к хирургическому вмешательству.

Интервенционные процедуры
Хирургия требует использования аппарата искусственного кровообращения. Субаортальная мембрана обычно резецируется через аорту (миомэктомия). Некоторым детям с подклапанным аортальным стенозом может одновременно потребоваться восстановление или замена аортального клапана. У младенцев, которые слишком больны для операции на открытом сердце, может быть выполнена чрескожная баллонная дилатация. В случае успеха это уменьшит аортальный градиент и симптомы. Эта паллиативная процедура продлится несколько месяцев или даже лет, и ребенок может пройти официальную операцию, когда он стабилизируется.
Дискретный фибромышечный подклапанный аортальный стеноз лечится хирургическим путем путем полной резекции с миотомией, с миомэктомией или без нее через аортотомию. Клинически значимая аортальная регургитация может потребовать восстановления или замены аортального клапана.
При подклапанном аортальном стенозе туннельного типа с небольшим соединением ЛЖ и аорты может потребоваться операция Конно (аортовентрикулопластика). Это включает иссечение и замену аортального клапана протезом, аугментацию межжелудочковой перегородки заплатой для увеличения выходного тракта левого желудочка, а затем закрытие перикардиальной заплатой правого вентрикулотомии, используемое для получения доступа к выходному тракту левого желудочка.
Это включает иссечение и замену аортального клапана протезом, аугментацию межжелудочковой перегородки заплатой для увеличения выходного тракта левого желудочка, а затем закрытие перикардиальной заплатой правого вентрикулотомии, используемое для получения доступа к выходному тракту левого желудочка.
В случаях рецидивирующего подклапанного аортального стеноза и туннельного подклапанного аортального стеноза с нормальным LV-аортальным соединением и аортальным клапаном может быть выполнена модифицированная процедура Конно, другими словами, без иссечения и замены аортального клапана.
Профилактика эндокардита
В рекомендациях Американской кардиологической ассоциации от 2007 г. профилактика антибиотиками для предотвращения бактериального эндокардита больше не рекомендуется пациентам с подклапанным аортальным стенозом, за исключением пациентов с эндокардитом в анамнезе или с восстановлением, требующим протезного материала или устройства.
В последнем случае рекомендуется антибиотикопрофилактика в течение первых 6 месяцев после пластики.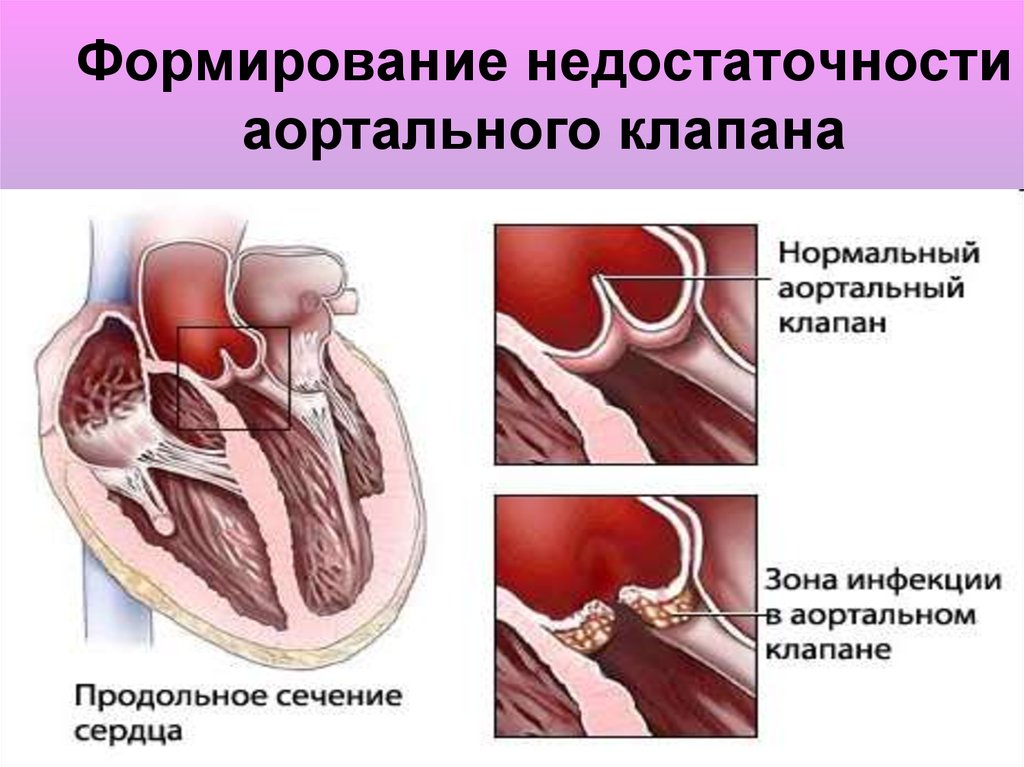 Однако при наличии остаточного дефекта профилактическое лечение антибиотиками продолжается и после 6-месячного периода.
Однако при наличии остаточного дефекта профилактическое лечение антибиотиками продолжается и после 6-месячного периода.
Дифференциальный диагноз
Подклапанный аортальный стеноз обычно проявляется дефектом межжелудочковой перегородки, коарктацией аорты, открытым артериальным протоком, двустворчатым аортальным клапаном и дефектом атриовентрикулярной перегородки.
Следующие врожденные пороки сердца маскируют симптомы подклапанного аортального стеноза:
Гипертрофическая кардиомиопатия
Бикуспидный аортальный клапан
Суправальвулярные аортальные стеноз
. понимать скорость прогрессирования, поскольку подклапанный аортальный стеноз является прогрессирующим заболеванием.
Выживаемость пациентов, перенесших операцию по удалению субаортальной мембраны, превосходна, но эти пациенты нуждаются в динамическом наблюдении, поскольку градиент выносящего тракта левого желудочка медленно увеличивается с течением времени.
 Большое значение имеет последующее наблюдение за послеоперационными пациентами. Большинству пациентов потребуется повторная операция из-за рецидива в какой-то момент их жизни. [12]
Большое значение имеет последующее наблюдение за послеоперационными пациентами. Большинству пациентов потребуется повторная операция из-за рецидива в какой-то момент их жизни. [12]Независимые предикторы для увеличения частоты повторной операции являются следующими [12]:
Женский пол
Пик Предоперационный пиковый мгновенный градиент ВОЛЖ больше или равен 80 мм рт. ст.
Возраст старше 30 лет на момент постановки диагноза
Осложнения
Сообщалось о послеоперационных осложнениях ножки пучка Гиса или полной блокаде сердца, ятрогенном дефекте межжелудочковой перегородки, повреждении митрального клапана, аортальной регургитации, а также о неполном купировании и/или рецидиве обструкции и инфекционном эндокардите (ИЭ).
Послеоперационный и реабилитационный уход
Ограничения активности зависят от степени остаточных гемодинамических нарушений. Избегайте участия в напряженной деятельности и спортивных соревнованиях.
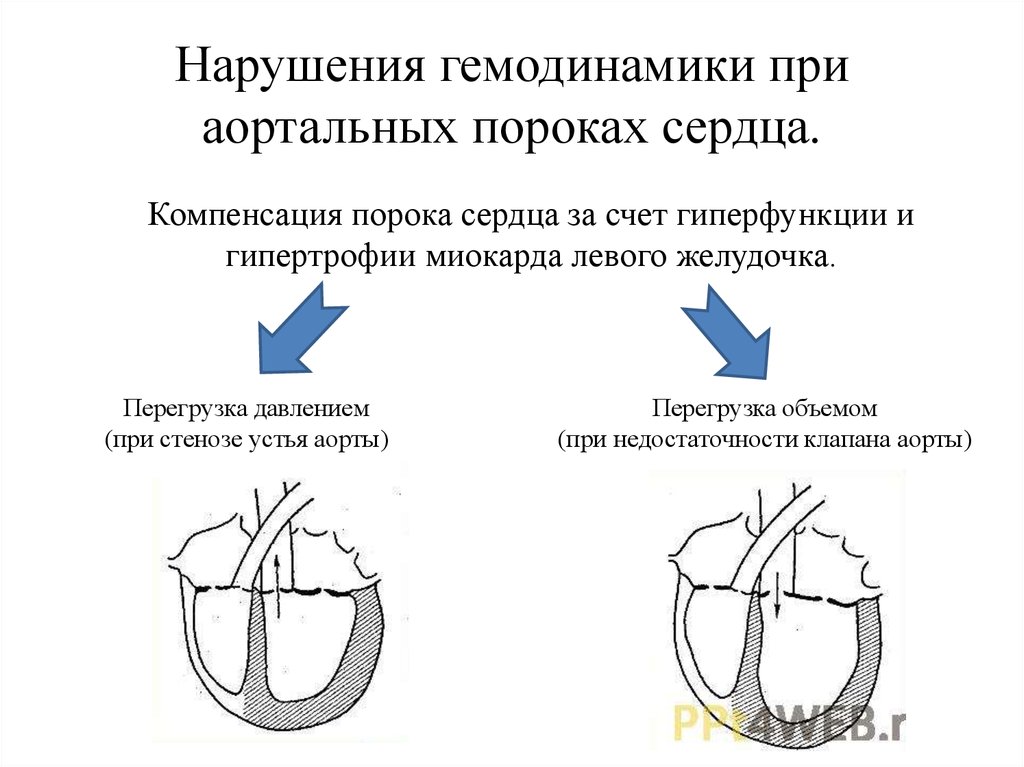
Соревновательные виды спорта, игры и напряженные упражнения не должны быть разрешены в следующих ситуациях:
Клинически значимая обструкция выходного тракта левого желудочка (пиковый градиент эходавления более 50 мм рт. ст.)
Выраженная гипертрофия левого желудочка
Клинически значимая желудочковая или наджелудочковая аритмия
Аортальная недостаточность более легкой степени
Консультации
При необходимости рекомендуется консультация детского кардиолога и кардиохирурга.
Улучшение результатов медицинского обслуживания
Диагностика и лечение субаортального стеноза лучше всего выполняются межпрофессиональной командой, состоящей из педиатра, кардиолога, рентгенолога, кардиохирурга, неонатолога и специально обученных медсестер. Управление требует помощи медсестры, прошедшей специальное обучение, для оказания помощи в наблюдении за пациентом, координации ухода и семейном обучении.
 Последующее наблюдение за этими младенцами обычно осуществляется поставщиком первичной медико-санитарной помощи и практикующей медсестрой. Хирургическая резекция мембраны является единственным методом лечения субаортального стеноза. Операция является паллиативной, так как в большинстве случаев мембрана рецидивирует в более позднем возрасте, что делает необходимой еще одну операцию на открытом сердце. У большинства младенцев хороший результат после операции, при условии, что у них нет других врожденных проблем. Необходимо пожизненное наблюдение, так как многим потребуется повторная операция для повторной резекции мембраны в более позднем возрасте. [16] (Уровень V)
Последующее наблюдение за этими младенцами обычно осуществляется поставщиком первичной медико-санитарной помощи и практикующей медсестрой. Хирургическая резекция мембраны является единственным методом лечения субаортального стеноза. Операция является паллиативной, так как в большинстве случаев мембрана рецидивирует в более позднем возрасте, что делает необходимой еще одну операцию на открытом сердце. У большинства младенцев хороший результат после операции, при условии, что у них нет других врожденных проблем. Необходимо пожизненное наблюдение, так как многим потребуется повторная операция для повторной резекции мембраны в более позднем возрасте. [16] (Уровень V)Контрольные вопросы
Доступ к бесплатным вопросам с несколькими вариантами ответов по этой теме.
Комментарий к этой статье.
Ссылки
- 1.
Безольд Л.И., Смит Э.О., Келли К., Колан С.Д., Говро К., Гева Т. Разработка и проверка эхокардиографической модели для прогнозирования прогрессирования дискретного субаортального стеноза у детей.
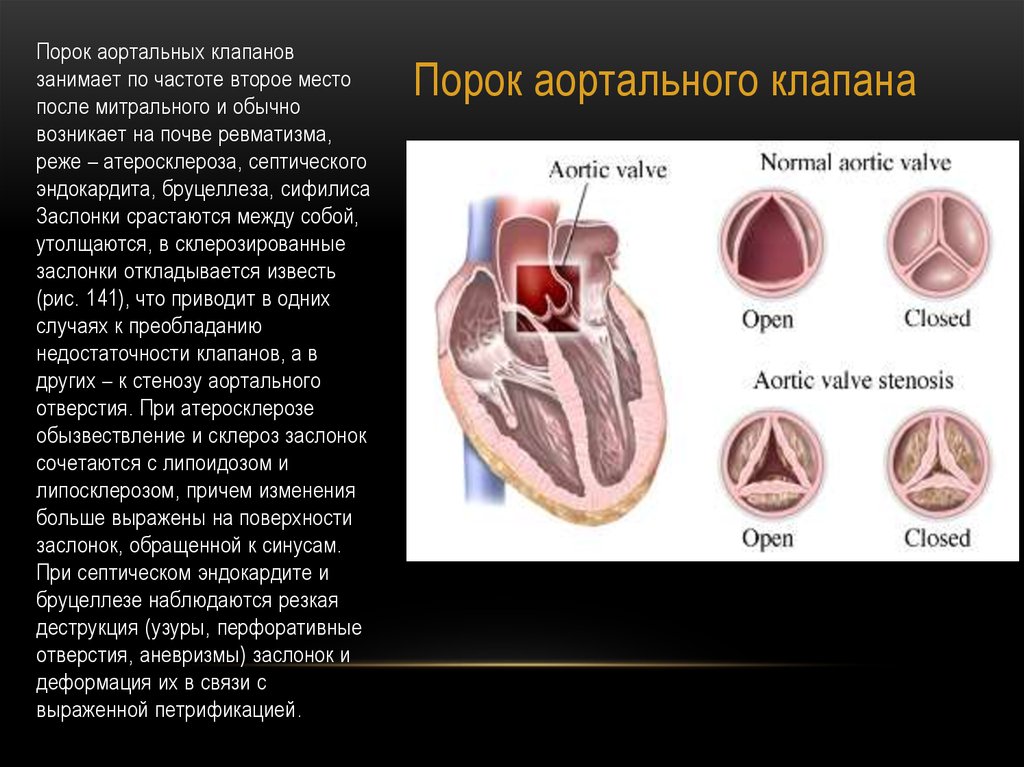 Ам Джей Кардиол. 1 февраль 1998 г.; 81 (3): 314–20. [PubMed: 9468074]
Ам Джей Кардиол. 1 февраль 1998 г.; 81 (3): 314–20. [PubMed: 9468074]- 2.
ЭДВАРДС ДЖ. ПАТОЛОГИЯ ОБСТРУКЦИИ ВЫНОСНОГО ПУТИ ЛЕВОГО ЖЕЛУДОЧКА. Тираж. 1965 Апрель; 31: 586-99. [PubMed: 14275999]
- 3.
Newfeld EA, Muster AJ, Paul MH, Idriss FS, Riker WL. Дискретный подклапанный аортальный стеноз в детском возрасте. Исследование 51 пациента. Ам Джей Кардиол. 1976 г., июль; 38 (1): 53–61. [PubMed: 937199]
- 4.
Браунер Р., Лакс Х., Дринкуотер Д.К., Шварц О., Эгбали К., Галиндо А. Преимущества раннего хирургического вмешательства при фиксированном субаортальном стенозе. J Am Coll Кардиол. 1997 декабря; 30 (7): 1835-42. [PubMed: 9385915]
- 5.
Кац Н.М., Бакли М.Дж., Либертсон Р.Р. Дискретный мембранозный субаортальный стеноз. Отчет о 31 пациенте, обзор литературы и описание лечения. Тираж. 1977 декабрь; 56 (6): 1034-8. [PubMed: 336239]
- 6.
Эзон Д.С. Фиксированный субаортальный стеноз: клиническая дилемма для врачей и пациентов.
 Врожденный порок сердца. 2013 сен-октябрь;8(5):450-6. [PubMed: 23947905]
Врожденный порок сердца. 2013 сен-октябрь;8(5):450-6. [PubMed: 23947905]- 7.
Китчинер Д., Джексон М., Малайя Н., Уолш К., Пирт И., Арнольд Р. Заболеваемость и прогноз обструкции выходного тракта левого желудочка в Ливерпуле (1960-91): исследование 313 пациентов. Br Heart J. 1994 Jun; 71 (6): 588-95. [Бесплатная статья PMC: PMC1025460] [PubMed: 8043345]
- 8.
Liu CW, Hwang B, Lee BC, Lu JH, Meng LC. Аортальный стеноз у детей: 19-летний опыт. Чжунхуа И Сюэ За Чжи (Тайбэй). 1997 г., февраль; 59 (2): 107–13. [PubMed: 9175300]
- 9.
Оливер Х.М., Гонсалес А., Гальего П., Санчес-Рекальде А., Бенито Ф., Меса Х.М. Дискретный субаортальный стеноз у взрослых: повышенная распространенность и медленная скорость прогрессирования обструкции и аортальной регургитации. J Am Coll Кардиол. 2001 г., сен; 38 (3): 835–42. [PubMed: 11527642]
- 10.
Лейхтер Д.А., Салливан И., Герсони В.М. «Приобретенный» дискретный подклапанный аортальный стеноз: естественное течение и гемодинамика.
 J Am Coll Кардиол. 1989 15 ноября; 14 (6): 1539-44. [PubMed: 2809017]
J Am Coll Кардиол. 1989 15 ноября; 14 (6): 1539-44. [PubMed: 2809017]- 11.
Choi JY, Sullivan ID. Фиксированный субаортальный стеноз: анатомический спектр и характер прогрессирования. Бр Харт Дж. 1991, май; 65(5):280-6. [Бесплатная статья PMC: PMC1024631] [PubMed: 2039674]
- 12.
Devabhaktuni SR, Chakfeh E, Malik AO, Pengson JA, Rana J, Ahsan CH. Подклапанный аортальный стеноз: обзор современной литературы. Клин Кардиол. 2018 Январь; 41 (1): 131-136. [Бесплатная статья PMC: PMC6489749] [PubMed: 29377232]
- 13.
де Агустин Дж.А., Гомес де Диего Дж.Дж., Маркос-Альберка П., Макайя С., Перес де Исла Л. Комбинированный стеноз субаортальной мембраны и аортального клапана: аддитивная ценность трехмерной эхокардиографии. Eur Heart J Cardiovasc Imaging. 2014 Апр; 15 (4): 388. [PubMed: 24142401]
- 14.
Карамлоу Т., Гуровски Р., Бойцевски А., Уильямс В.Г., Калдароне К.А., Ван Арсделл Г.
 С., Пол Т., МакКриндл Б.В. Распространенность и сопутствующие факторы риска вмешательства у 313 детей с субаортальным стенозом. Энн Торак Серг. 2007 сен; 84 (3): 900-6; обсуждение 906. [PubMed: 17720397]
С., Пол Т., МакКриндл Б.В. Распространенность и сопутствующие факторы риска вмешательства у 313 детей с субаортальным стенозом. Энн Торак Серг. 2007 сен; 84 (3): 900-6; обсуждение 906. [PubMed: 17720397]- 15.
Rohlicek CV, del Pino SF, Hosking M, Miro J, Côté JM, Finley J. Естественное течение и хирургические результаты изолированного дискретного субаортального стеноза у детей. Сердце. 1999 декабрь; 82 (6): 708-13. [Бесплатная статья PMC: PMC1729222] [PubMed: 10573499]
- 16.
Мукадам С., Гордон Б.М., Олсон Дж.Т., Ньюкомб Дж.Б., Хасания Н.В., Раззук А.Дж., Бейли Л.Л. Резекция субаортального стеноза у детей: акцент на рецидивах и судьбе аортального клапана. World J Pediatr Congenit Heart Surg. 2018 Сен;9(5):522-528. [PubMed: 30157731]
Что такое аортальный стеноз? | Клапанная болезнь сердца | ДЖАМА
Эта проблема
Просмотр показателей
- Скачать PDF
Поделиться
Твиттер
Фейсбук
Эл. адрес
адрес
LinkedIn- Процитировать это
- Разрешения
Страница пациента JAMA
8 марта 2022 г.
Джейсон Р. Баман, MD 1 ; Шондип Секон, MD 2 ; Джеймс Д. Флаэрти, MD 1
Принадлежность автора Информация о статье
1 Отделение кардиологии, медицинский факультет, Северо-Западный университет, Медицинская школа им. Файнберга, Чикаго, Иллинойс
2 Медицинский факультет, Северо-Западный университет, Медицинская школа им. Файнберга, Чикаго, Иллинойс
ДЖАМА.
 2022;327(10):1003. дои: 10.1001/jama.2022.0332
2022;327(10):1003. дои: 10.1001/jama.2022.0332Аортальный стеноз представляет собой сужение аортального клапана сердца, затрудняющее перекачку крови в аорту сердцу.
Аортальный клапан отделяет левый желудочек сердца (насосную камеру) от аорты (крупного кровеносного сосуда в организме, доставляющего кровь в организм). Аортальный стеноз возникает, когда аортальный клапан сужается. Аортальный стеноз в первую очередь поражает пожилых людей из-за возрастного повреждения и уплотнения аортального клапана. Этот процесс может быть ускорен у людей, которые курят сигареты или страдают диабетом, заболеваниями почек, высоким кровяным давлением или высоким уровнем холестерина. Аортальный стеноз может развиться в более молодом возрасте у людей, рожденных с аортальным клапаном, который имеет только 2 створки (двустворчатый аортальный клапан) вместо нормальных 3 створок, или у людей, которые прошли лучевую терапию грудной клетки.
Симптомы аортального стеноза
Если аортальный стеноз легкой или средней степени тяжести, он обычно не вызывает симптомов и не влияет на функцию сердца.
 У некоторых пациентов с аортальным стенозом могут быть неспецифические симптомы усталости или упадка сил.
У некоторых пациентов с аортальным стенозом могут быть неспецифические симптомы усталости или упадка сил.Три основных симптома должны вызывать подозрение на тяжелый аортальный стеноз: эпизоды обморока или головокружения, особенно во время физической нагрузки; боль в груди; и симптомы сердечной недостаточности, такие как одышка и отек ног.
Диагностика аортального стеноза
Аортальный стеноз чаще всего выявляется при прослушивании сердечных шумов с помощью стетоскопа. Это подтверждается эхокардиограммой, которая представляет собой ультразвук, измеряющий кровоток через сердце. Некоторым пациентам могут потребоваться дополнительные тесты, такие как стресс-тест, катетеризация сердца или компьютерная томография (КТ).
Лечение аортального стеноза
Лекарств, предотвращающих или лечащих аортальный стеноз, не существует. При легком или умеренном аортальном стенозе, который не вызывает симптомов, лечение не требуется, но пациенты должны регулярно проходить осмотр у своего врача.
 Если аортальный клапан сильно сужен или сужение вызывает симптомы, может потребоваться замена клапана.
Если аортальный клапан сильно сужен или сужение вызывает симптомы, может потребоваться замена клапана.Существует 3 подхода к замене аортального клапана:
Транскатетерная замена аортального клапана (TAVR). Эти клапаны изготовлены из комбинации тканей животных и металлических компонентов и предназначены для доставки к сердцу через катетер, вставленный в крупный кровеносный сосуд в паху. Клапан TAVR продвигается через кровеносный сосуд в существующий аортальный клапан, затем расширяется в пространстве аортального клапана. TAVR не требует хирургического вмешательства или разбавителей крови и часто рекомендуется для пожилых пациентов.
Замена биопротеза клапана. В этих клапанах обычно используется ткань коровы или свиньи, а также некоторые металлические компоненты. Хотя пожизненные антикоагулянты не требуются, биопротезные клапаны менее долговечны, чем механические клапаны, что важно учитывать у более молодых и активных пациентов.

Замена механического клапана. Эти клапаны изготовлены из металлических листов, что делает их очень прочными. Однако из-за того, что на поверхности металлических створок могут образовываться сгустки крови, пациенты должны принимать антикоагулянты всю оставшуюся жизнь.
Секция коробки Ref ID
Для получения дополнительной информации
Вернуться к началу
Информация о статье
Раскрытие информации о конфликте интересов: Не сообщалось.
Источник: Otto CM, Nishimura RA, Bonow RO, et al. Руководство ACC/AHA 2020 года по ведению пациентов с клапанными пороками сердца. J Am Coll Кардиол. 2021;77(4):450-500. doi:10.1016/j.jacc.2020.11.035
Врожденный аортальный стеноз у детей раннего возраста: со специальной ссылкой на фонокардиографию и непрямую запись артериального пульса | JAMA Pediatrics
Врожденный аортальный стеноз у детей раннего возраста: особое внимание уделяется фонокардиографии и непрямой записи артериального пульса | ДЖАМА Педиатрия | Сеть ДЖАМА
[Перейти к навигации]
Эта проблема
- Скачать PDF
- Полный текст
Поделиться
Твиттер
Фейсбук
Эл. адрес
адрес
LinkedIn- Процитировать это
- Разрешения
Артикул
Февраль 1958 г.
А. А. ЭГГИНК, MD ; H. A. Ph. HARTOG, MD ; ФРЕД КАЙПЕРС, MD
Принадлежности авторов
Амстердам, Нидерланды
Педиатрического факультета Амстердамского университета; Руководитель, профессор, доктор С. ван Кревельд.
AMA Am J Dis Child. 1958;95(2):170-177. doi: 10.1001/archpedi.1958.02060050172010
Полный текст
Абстрактный
Введение
Диагноз врожденного аортального стеноза у детей можно легко пропустить. Многие из симптомов, указывающих на аортальный стеноз у взрослых, такие как одышка при физической нагрузке, головокружение с редкими обмороками или гипертрофия левого желудочка, отсутствовали у большинства наших пациентов.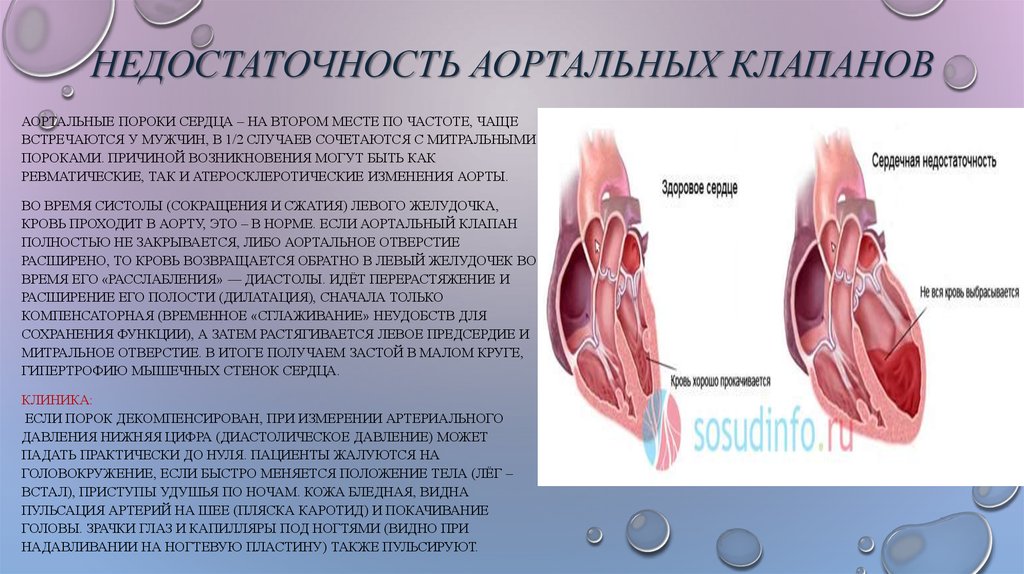 В детском возрасте преобладают начальные или среднетяжелые формы порока аортального клапана. Ряд авторов 1-4 подчеркнули важность записи артериальной пульсовой волны, взятой из плечевой или сонной артерии. Мы считаем, что прямую ЭКГ, полученную путем пункции магистральной артерии, нельзя выполнять рутинно из-за дискомфорта для ребенка. Более того, записи плечевой или лучевой артерий, вероятно, менее типичны, чем записи сонной артерии, расположенной ближе к аортальным клапанам. Кроме того, кривые, полученные из артериальной стенки, могут дать больше информации о клапанном аортальном стенозе, чем кривые внутрипросветного давления (рис. 1). Для
В детском возрасте преобладают начальные или среднетяжелые формы порока аортального клапана. Ряд авторов 1-4 подчеркнули важность записи артериальной пульсовой волны, взятой из плечевой или сонной артерии. Мы считаем, что прямую ЭКГ, полученную путем пункции магистральной артерии, нельзя выполнять рутинно из-за дискомфорта для ребенка. Более того, записи плечевой или лучевой артерий, вероятно, менее типичны, чем записи сонной артерии, расположенной ближе к аортальным клапанам. Кроме того, кривые, полученные из артериальной стенки, могут дать больше информации о клапанном аортальном стенозе, чем кривые внутрипросветного давления (рис. 1). ДляПолный текст
Добавить или изменить учреждение
- Кислотно-щелочное, электролиты, жидкости
- Лекарство от зависимости
- Аллергия и клиническая иммунология
- Анестезиология
- Антикоагулянты
- Искусство и изображения в психиатрии
- Кровотечение и переливание
- Кардиология
- Уход за тяжелобольным пациентом
- Проблемы клинической электрокардиографии
- Клиническая задача
- Поддержка принятия клинических решений
- Клинические последствия базовой нейронауки
- Клиническая фармация и фармакология
- Дополнительная и альтернативная медицина
- Заявления о консенсусе
- Коронавирус (COVID-19)
- Медицина интенсивной терапии
- Культурная компетентность
- Стоматология
- Дерматология
- Диабет и эндокринология
- Интерпретация диагностических тестов
- Разнообразие, равенство и инклюзивность
- Разработка лекарств
- Электронные медицинские карты
- Скорая помощь
- Конец жизни
- Гигиена окружающей среды
- Этика
- Пластическая хирургия лица
- Гастроэнтерология и гепатология
- Генетика и геномика
- Геномика и точное здоровье
- Гериатрия
- Глобальное здравоохранение
- Руководство по статистике и медицине
- Руководство
- Заболевания волос
- Модели оказания медицинской помощи
- Экономика здравоохранения, страхование, оплата
- Качество здравоохранения
- Реформа здравоохранения
- Медицинская безопасность
- Медицинские работники
- Различия в состоянии здоровья
- Несправедливость в отношении здоровья
- Информатика здравоохранения
- Политика здравоохранения
- Гематология
- История медицины
- Гуманитарные науки
- Гипертония
- Изображения в неврологии
- Наука внедрения
- Инфекционные болезни
- Инновации в оказании медицинской помощи
- Инфографика JAMA
- Право и медицина
- Ведущее изменение
- Меньше значит больше
- ЛГБТК
- Образ жизни
- Медицинский код
- Медицинские приборы и оборудование
- Медицинское образование
- Медицинское образование и обучение
- Медицинские журналы и публикации
- Меланома
- Мобильное здравоохранение и телемедицина
- Оспа обезьян
- Нарративная медицина
- Нефрология
- Неврология
- Неврология и психиатрия
- Примечательные примечания
- Сестринское дело
- Питание
- Питание, Ожирение, Упражнения
- Ожирение
- Акушерство и гинекология
- Гигиена труда
- Онкология
- Офтальмологические изображения
- Офтальмология
- Ортопедия
- Отоларингология
- Лекарство от боли
- Патология и лабораторная медицина
- Уход за пациентами
- Информация для пациентов
- Педиатрия
- Повышение производительности
- Показатели эффективности
- Периоперационный уход и консультация
- Фармакоэкономика
- Фармакоэпидемиология
- Фармакогенетика
- Фармация и клиническая фармакология
- Физическая медицина и реабилитация
- Физиотерапия
- Руководство врачей
- Поэзия
- Здоровье населения
- Профилактическая медицина
- Профессиональное благополучие
- Профессионализм
- Психиатрия и поведенческое здоровье
- Общественное здравоохранение
- Легочная медицина
- Радиология
- Регулирующие органы
- Исследования, методы, статистика
- Реанимация
- Ревматология
- Управление рисками
- Научное открытие и будущее медицины
- Совместное принятие решений и общение
- Медицина сна
- Спортивная медицина
- Трансплантация стволовых клеток
- Хирургия
- Хирургические инновации
- Хирургический жемчуг
- Обучаемый момент
- Технологии и финансы
- Искусство JAMA
- Искусство и медицина
- Рациональное клиническое обследование
- Табак и электронные сигареты
- Токсикология
- Травмы и травмы
- Приверженность лечению
- УЗИ
- Урология
- Руководство пользователя по медицинской литературе
- Вакцинация
- Венозная тромбоэмболия
- Здоровье ветеранов
- Насилие
- Женское здоровье
- Рабочий процесс и процесс
- Уход за ранами, инфекция, заживление
Сохранить настройки
Политика конфиденциальности | Условия использования
Тяжелый аортальный стеноз и тяжелая коарктация аорты: гибридный подход к лечению
Введение
За последнее столетие лечение врожденных пороков сердца (ВПС) значительно изменилось.
 Когда в 1944 году доктор Альфред Блэлок провел первую операцию на сердце у детей, его целью было остановить «смерть синих младенцев» (1). Благодаря достижениям как в хирургическом, так и в медицинском подходе к ИБС, а также развитию хирургии на открытом сердце и искусственного кровообращения в настоящее время появились хирургические варианты лечения сердечных заболеваний, которые ранее были неоперабельны. Благодаря этим достижениям текущая цель состоит не только в снижении смертности детей с ИБС, но и в снижении заболеваемости и улучшении качества жизни.
Когда в 1944 году доктор Альфред Блэлок провел первую операцию на сердце у детей, его целью было остановить «смерть синих младенцев» (1). Благодаря достижениям как в хирургическом, так и в медицинском подходе к ИБС, а также развитию хирургии на открытом сердце и искусственного кровообращения в настоящее время появились хирургические варианты лечения сердечных заболеваний, которые ранее были неоперабельны. Благодаря этим достижениям текущая цель состоит не только в снижении смертности детей с ИБС, но и в снижении заболеваемости и улучшении качества жизни.Появление гибридных хирургических методов лечения врожденных пороков сердца изменило подход к паллиативному лечению и лечению сложных врожденных пороков сердца. В частности, у новорожденных и младенцев с массой тела менее 5 кг это позволяет объединить усилия кардиологов и хирургов для выполнения процедур, которые обеспечат наилучшие результаты для пациентов с предполагаемыми преимуществами более низкой заболеваемости и смертности.

В Бристольской детской больнице совместно с Бристольским кардиологическим институтом увеличилось количество гибридных операций, выполняемых как взрослым, так и детям с ИБС. Будет рассмотрен уникальный случай, когда был использован гибридный подход.
Случай
Случай 3,7-килограммового месячного пациента, у которого на 24-й день жизни развился тяжелый аортальный стеноз (АС) и коарктация аорты (КоА). Он родился в срок после неосложненной беременности. На 5-й день жизни у него отмечалась желтуха и ропот. Его желтуха прошла, и он был выписан домой с последующим кардиологическим наблюдением. Затем у него было прогрессивное увеличение работы дыхания, и он не набирал вес. У него была эхокардиограмма на 24-й день жизни, которая показала утолщенный и диспластический двустворчатый аортальный клапан с куполообразными створками клапана. Поток через клапан измеряли с помощью непрерывного допплера со скоростью 4 м/с. У него также была обнаружена дискретная околопротоковая коарктация аорты с непрерывным допплеровским потоком 2,5 м/с с диастолическим хвостом.
 Его желудочковая функция оставалась сохраненной. Ему начали внутривенное введение простагландина и была назначена срочная операция.
Его желудочковая функция оставалась сохраненной. Ему начали внутривенное введение простагландина и была назначена срочная операция.В связи со сложностью случая и необходимостью вмешательства как на аортальном клапане, так и на дуге аорты, было сочтено, что наилучшим методом действий будет гибридный подход с хирургическим анастомозом дуги аорты конец в конец через a торакотомия с последующим хирургическим рассечением сонной артерии по поводу AoVP. Этот план был разработан, чтобы избежать необходимости стернотомии при шунтировании для уменьшения стеноза аортального клапана. Пациента доставили в лабораторию гибридного катетера, где он был помещен в левое боковое положение, препарирован и накрыт драпировкой. Наложен хирургический анастомоз конец в конец по торакотомия по третье межреберье в плановом порядке. Затем вырезали дугу, открытый артериальный проток (ОАП) и нисходящую часть аорты. На дугу и нисходящий отдел аорты накладывали зажимы. Сегмент коарктации резецировали и лигировали ОАП.
 После этого накладывали анастомоз конец в бок между дугой аорты и нисходящей аортой. Плевра и грудная клетка послойно ушиты.
После этого накладывали анастомоз конец в бок между дугой аорты и нисходящей аортой. Плевра и грудная клетка послойно ушиты.В этот момент пациент был осмотрен и чувствовал себя стабильно, чтобы приступить к запланированному аортальному баллону. Больного перевернули из бокового положения на спину и хирургом была выполнена каротидная резекция правой общей сонной артерии. На сосуд наложили кисетный шов 5/0, через который в правую общую сонную артерию вставили интродьюсер 4-Fr. С помощью катетера с косичкой 4 Fr давление в восходящей аорте было измерено на уровне 61/42 мм рт.ст. Затем была выполнена ангиограмма аорты, и размер кольца аортального клапана составил 7,5 мм. Затем катетер с косичками был заменен правым коронарным катетером Judkins (JR) 4 Fr. С помощью проводника Terumo 0,035″ катетер JR был помещен в левый желудочек (ЛЖ). Давление в ЛЖ было зарегистрировано на уровне 110/13 мм рт. ст., что дало пиковый градиент 49.мм рт.ст. Затем в ЛЖ был помещен дополнительный опорный коронарный провод ChoICE PT 0,014 (Boston Scientific) и удален катетер JR.
 Затем был выбран баллонный катетер NuMED Tyshak II 6 мм × 2 см для чрескожной транслюминальной вальвулопластики, который был доставлен по проволоке ChoICE к аортальному клапану. Воздушный шар был надут до давления разрыва 4 атмосферы (атм) с видимой талией внутри воздушного шара, и произошло удаление талии. Баллонный катетер был удален и повторно введен катетер JR. Давление измеряли на уровне 100/10 мм рт. Повторная ангиограмма корня аорты на этой стадии не выявила значительной недостаточности аорты. Катетер JR и проволока Terumo снова использовались для повторного пересечения клапана, и был выбран баллонный катетер NuMED Tyshak II 7 мм × 2 см для чрескожной транслюминальной вальвулопластики, который был доставлен по коронарному проводнику в нужное положение. Баллон надули до 4 атм, снова увидели перетяжку и произошло обвисание. Баллонный катетер удалили, а катетер JR снова вставили в ЛЖ. Давление в ЛЖ было теперь 90/10 мм рт.ст. с обратным пиковым градиентом между ЛЖ и восходящей аортой, измеряющим 30 мм рт.
Затем был выбран баллонный катетер NuMED Tyshak II 6 мм × 2 см для чрескожной транслюминальной вальвулопластики, который был доставлен по проволоке ChoICE к аортальному клапану. Воздушный шар был надут до давления разрыва 4 атмосферы (атм) с видимой талией внутри воздушного шара, и произошло удаление талии. Баллонный катетер был удален и повторно введен катетер JR. Давление измеряли на уровне 100/10 мм рт. Повторная ангиограмма корня аорты на этой стадии не выявила значительной недостаточности аорты. Катетер JR и проволока Terumo снова использовались для повторного пересечения клапана, и был выбран баллонный катетер NuMED Tyshak II 7 мм × 2 см для чрескожной транслюминальной вальвулопластики, который был доставлен по коронарному проводнику в нужное положение. Баллон надули до 4 атм, снова увидели перетяжку и произошло обвисание. Баллонный катетер удалили, а катетер JR снова вставили в ЛЖ. Давление в ЛЖ было теперь 90/10 мм рт.ст. с обратным пиковым градиентом между ЛЖ и восходящей аортой, измеряющим 30 мм рт. ст. Катетер и интродьюсер удаляли, сосуд восстанавливали путем затягивания кисетного шва и послойного закрытия кожи.
ст. Катетер и интродьюсер удаляли, сосуд восстанавливали путем затягивания кисетного шва и послойного закрытия кожи.Эхокардиограмма, выполненная после процедуры, показала качественно нормальную функцию желудочков без перикардиального выпота. Дуга была свободна со скоростью допплеровского потока 1,6 м/с. Аортальный клапан был двустворчатым и явно диспластическим. Было выявлено умеренное ускорение потока через клапан с использованием непрерывной допплерографии 3 м/с со средним допплеровским градиентом 15 мм рт.ст. Явной недостаточности аорты не наблюдалось.
Пациент был переведен из лаборатории гибридных катетеров в педиатрическое отделение интенсивной терапии (PICU). Его сердечно-сосудистая система оставалась стабильной во время поступления в отделение интенсивной терапии. Он был экстубирован, но его пришлось повторно интубировать в течение нескольких часов из-за проблем с верхними дыхательными путями, которые продлили его пребывание в отделении интенсивной терапии. Он был успешно экстубирован на 3-й день после операции и переведен в кардиологическое отделение.
 Его поступление в палату прошло без осложнений, и он был выписан на 6-й день после вмешательства.
Его поступление в палату прошло без осложнений, и он был выписан на 6-й день после вмешательства.В 4-месячном возрасте осмотрен в поликлинике. Он был клинически бессимптомным с устойчивым ростом. Его эхокардиограмма демонстрировала качественно нормальную функцию желудочков, стеноз аортального клапана был от легкой до умеренной степени с потоком 3,7 м/с при непрерывной допплерографии со средним градиентом 30 мм рт.ст. Имелись признаки легкой недостаточности аорты, дуга аорты оставалась свободной, скорость кровотока 1,4 м/с. Его последнее последующее наблюдение было в возрасте 8 месяцев. Он оставался бессимптомным и здоровым, его вес увеличился до 9.кг. Его эхокардиограмма снова продемонстрировала качественно нормальную функцию желудочков, двустворчатый аортальный клапан с потоком через клапан 3,2 м/с. Имелась умеренная недостаточность аорты, дуга аорты оставалась свободной. Не было никаких проблем с его доступом к сонной артерии, и не было постоянных неврологических проблем.
Обсуждение
Обструктивные поражения выводного тракта левого желудочка (LVOT) составляют примерно 4–6% ИБС с частотой 4 на 10 000 живорождений (2).
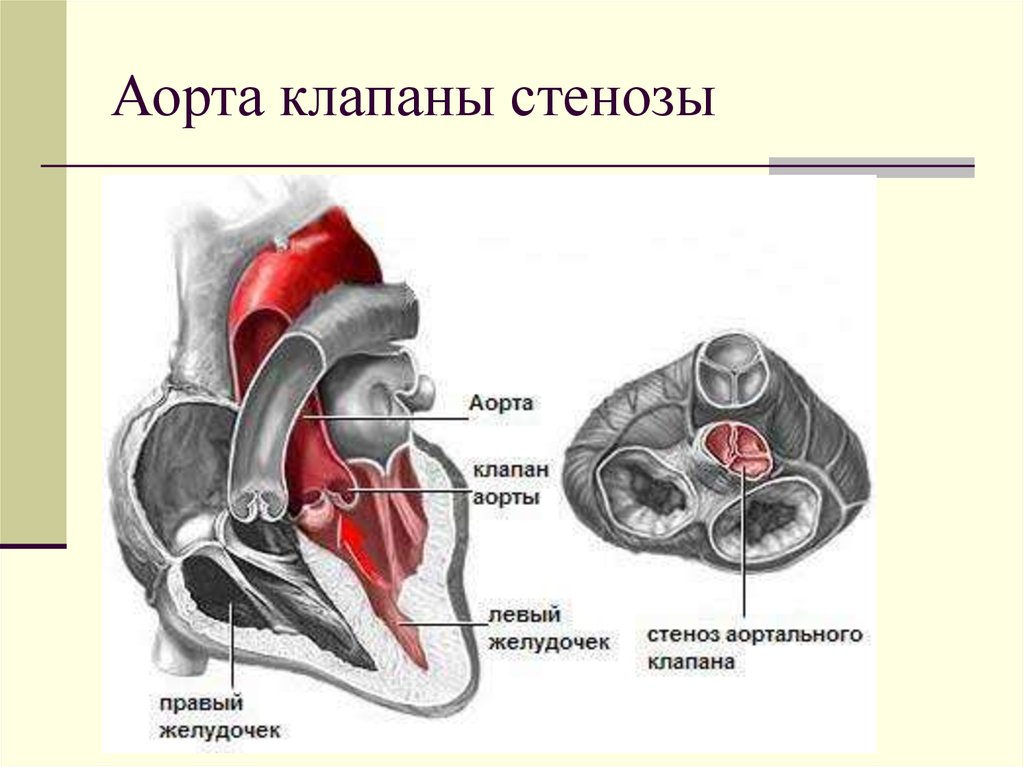 АС является наиболее частым поражением ВТЛЖ, на долю которого приходится 70%, а КоА занимает второе место по частоте (2). Сочетание тяжелого АС и КоА встречается редко и составляет примерно 5–10% обструктивных поражений ВТЛЖ (2, 3). Варианты лечения поражений ВТЛЖ широко обсуждались в литературе за последние 30 лет. Результаты как интервенционных, так и хирургических вариантов улучшились, но единого варианта лечения до сих пор нет.
АС является наиболее частым поражением ВТЛЖ, на долю которого приходится 70%, а КоА занимает второе место по частоте (2). Сочетание тяжелого АС и КоА встречается редко и составляет примерно 5–10% обструктивных поражений ВТЛЖ (2, 3). Варианты лечения поражений ВТЛЖ широко обсуждались в литературе за последние 30 лет. Результаты как интервенционных, так и хирургических вариантов улучшились, но единого варианта лечения до сих пор нет.Если рассматривать АС как единое целое, существуют как хирургические, так и интервенционные варианты лечения. Большинство центров по всему миру используют аортальную баллонную вальвулопластику (AoVP) в качестве лечения первой линии. Fratz и группа из Мюнхена в Германии проанализировали свои результаты у новорожденных, перенесших AoVP за 18-летний период. Результаты показали, что 59% пациентов не нуждались в хирургическом вмешательстве через 10 лет. У 29% развилась умеренная аортальная регургитация и у 19% — тяжелая регургитация (4). Общая смертность составила 7%.
 С опытом и изменениями в технике произошло уменьшение аортальной регургитации и потребности в хирургическом вмешательстве. Результаты были сопоставимы с хирургической вальвотомией (4). Это было дополнительно подтверждено Justino и группой из Детской больницы Техаса, которые обнаружили, что повторение AoVP эффективно лечит рецидивирующий АС и отсрочивает необходимость хирургического вмешательства (5).
С опытом и изменениями в технике произошло уменьшение аортальной регургитации и потребности в хирургическом вмешательстве. Результаты были сопоставимы с хирургической вальвотомией (4). Это было дополнительно подтверждено Justino и группой из Детской больницы Техаса, которые обнаружили, что повторение AoVP эффективно лечит рецидивирующий АС и отсрочивает необходимость хирургического вмешательства (5).Одним из ограничений применения AoVP является связанная с ним травма сосудов и окклюзия артерий. Эта процедура традиционно выполнялась с использованием бедренной артерии, однако в настоящее время более успешно и с меньшими осложнениями используется каротидная и подмышечная резекция. Росси и группа из Порту-Алегри в Бразилии обнаружили, что частота окклюзии бедренной артерии достигает 40% (6). За 16-летний период явное несоответствие длины ног наблюдалось у одного пациента (6). Изменение доступа к сонной артерии не привело к окклюзии сонных артерий или повреждению сосудов (6). Эти результаты были подтверждены группой из Бергамо, Италия, которая не обнаружила значительной окклюзии правой сонной артерии у 29 пациентов.
 пациенты, у которых применялся метод разрезания сонной артерии (7).
пациенты, у которых применялся метод разрезания сонной артерии (7).Альтернативой AoVP является хирургическая вальвотомия. Группа Королевской детской больницы в Мельбурне в 2013 году опубликовала свои данные о хирургической вальвотомии. Описан новый метод хирургической вальвулотомии с улучшенными результатами по сравнению с предыдущими хирургическими данными (8). Свобода от повторного вмешательства составила 64% через 5 лет и 39% через 15 лет. Ранняя смертность составила 3%, поздняя – 10%, 10-летняя выживаемость – 88% (8). Результаты были аналогичны AoVP, как сообщалось ранее (4). Вальвулотомию выполняли через срединную стернотомию с последующим шунтированием сердца и глубокой гипотермической остановкой кровообращения (ГГОК). Было обнаружено более длительное пребывание в отделениях интенсивной терапии и госпитализации по сравнению с пациентами, перенесшими AoVP (8).
Для тяжелого и критического КоА существуют как интервенционные, так и хирургические варианты. Хорошо известно, что лучшим методом лечения дискретной коарктации у новорожденных и детей грудного возраста является хирургическая торакотомия с расширенной резекцией и наложением анастомоза конец в конец (9).
 Райт и группа из Мичигана показали, что в 87% случаев КоА необходимости в шунтировании не было. Было короткое время перекрестного зажима (среднее время 17 минут) и низкая периоперационная смертность менее 1% (9). При выполнении этой операции в неонатальном и раннем младенческом периоде отдаленный риск артериальной гипертензии был снижен, а через 1 год после операции ни у одного пациента не было клинической артериальной гипертензии. Потребность в повторном вмешательстве также была низкой — 6%. Эти результаты были подтверждены исследованием, проведенным в 2009 г.Чикагской группой, которая обнаружила раннюю смертность в 2% и частоту повторных вмешательств в 4% (10). Для сравнения, ангиопластика аорты у младенцев в возрасте до 3 месяцев оказалась намного менее эффективной, чем операция. Отмечалась значительно более высокая частота рестеноза (до 70% в некоторых сериях наблюдений), а также учащение осложнений в виде образования аневризмы, окклюзии бедренной артерии и травмы (3, 11).
Райт и группа из Мичигана показали, что в 87% случаев КоА необходимости в шунтировании не было. Было короткое время перекрестного зажима (среднее время 17 минут) и низкая периоперационная смертность менее 1% (9). При выполнении этой операции в неонатальном и раннем младенческом периоде отдаленный риск артериальной гипертензии был снижен, а через 1 год после операции ни у одного пациента не было клинической артериальной гипертензии. Потребность в повторном вмешательстве также была низкой — 6%. Эти результаты были подтверждены исследованием, проведенным в 2009 г.Чикагской группой, которая обнаружила раннюю смертность в 2% и частоту повторных вмешательств в 4% (10). Для сравнения, ангиопластика аорты у младенцев в возрасте до 3 месяцев оказалась намного менее эффективной, чем операция. Отмечалась значительно более высокая частота рестеноза (до 70% в некоторых сериях наблюдений), а также учащение осложнений в виде образования аневризмы, окклюзии бедренной артерии и травмы (3, 11).Основным фактором, повлиявшим на решение использовать гибридный подход в данном случае, была возможность избежать срединной стернотомии и обходного сердечного анастомоза.
 Появляется все больше данных о том, что операции на открытом сердце младенцев подвергают детей высокому риску неврологических нарушений и отклонений в развитии, и эти нарушения сохраняются на протяжении всего детства (12). Аортокоронарное шунтирование и использование DHCA были связаны с повышенным риском судорог и худшими неврологическими исходами (13). DHCA был зарезервирован в основном для новорожденных и детей грудного возраста, поскольку он обеспечивает лучшую неврологическую защиту и снижает метаболические потребности в развивающемся мозге (14, 15). . Следовательно, любой отказ от искусственного кровообращения теоретически должен снизить этот риск.
Появляется все больше данных о том, что операции на открытом сердце младенцев подвергают детей высокому риску неврологических нарушений и отклонений в развитии, и эти нарушения сохраняются на протяжении всего детства (12). Аортокоронарное шунтирование и использование DHCA были связаны с повышенным риском судорог и худшими неврологическими исходами (13). DHCA был зарезервирован в основном для новорожденных и детей грудного возраста, поскольку он обеспечивает лучшую неврологическую защиту и снижает метаболические потребности в развивающемся мозге (14, 15). . Следовательно, любой отказ от искусственного кровообращения теоретически должен снизить этот риск.В течение последних 15 лет группа из Детской больницы Монреаля внимательно наблюдала за детьми, перенесшими операцию на открытом сердце. Основное внимание уделялось неврологическим последствиям и результатам развития этих детей, а также были выделены некоторые из основных факторов риска и осложнений. Результаты показали, что до 40% детей с ИБС, перенесших операцию по шунтированию сердца, имели отклонения в неврологическом статусе (16).
 Значительная микроцефалия была обнаружена у 17%, и только у 14% пациентов окружность головы превышала 50-й процентиль. Задержка крупной и мелкой моторики была обнаружена у 42% пациентов, у 23% — глобальная задержка развития. Поведенческие проблемы наблюдались у 35% детей (16), причем у 30% из этих детей по-прежнему проявлялись отклонения при поступлении в школу (17). Тесты развития и функциональные тесты, проведенные при поступлении в школу, показали значительно более низкие средние значения IQ, помещая их в низкий средний диапазон (9 баллов).0–94) (12). У значительного процента этих детей также наблюдался ряд трудностей в развитии, повышающих риск проблем с обучением, низкой самооценкой и снижением социальной активности (12).
Значительная микроцефалия была обнаружена у 17%, и только у 14% пациентов окружность головы превышала 50-й процентиль. Задержка крупной и мелкой моторики была обнаружена у 42% пациентов, у 23% — глобальная задержка развития. Поведенческие проблемы наблюдались у 35% детей (16), причем у 30% из этих детей по-прежнему проявлялись отклонения при поступлении в школу (17). Тесты развития и функциональные тесты, проведенные при поступлении в школу, показали значительно более низкие средние значения IQ, помещая их в низкий средний диапазон (9 баллов).0–94) (12). У значительного процента этих детей также наблюдался ряд трудностей в развитии, повышающих риск проблем с обучением, низкой самооценкой и снижением социальной активности (12).В этой серии случаев были выявлены факторы риска, связанные с худшими неврологическими исходами и исходами развития. Младший возраст при операции, использование DHCA, продолжительность DHCA, более короткая продолжительность центрального охлаждения и длительность госпитализации в реанимацию были связаны с худшими отдаленными неврологическими исходами (12, 16-18).
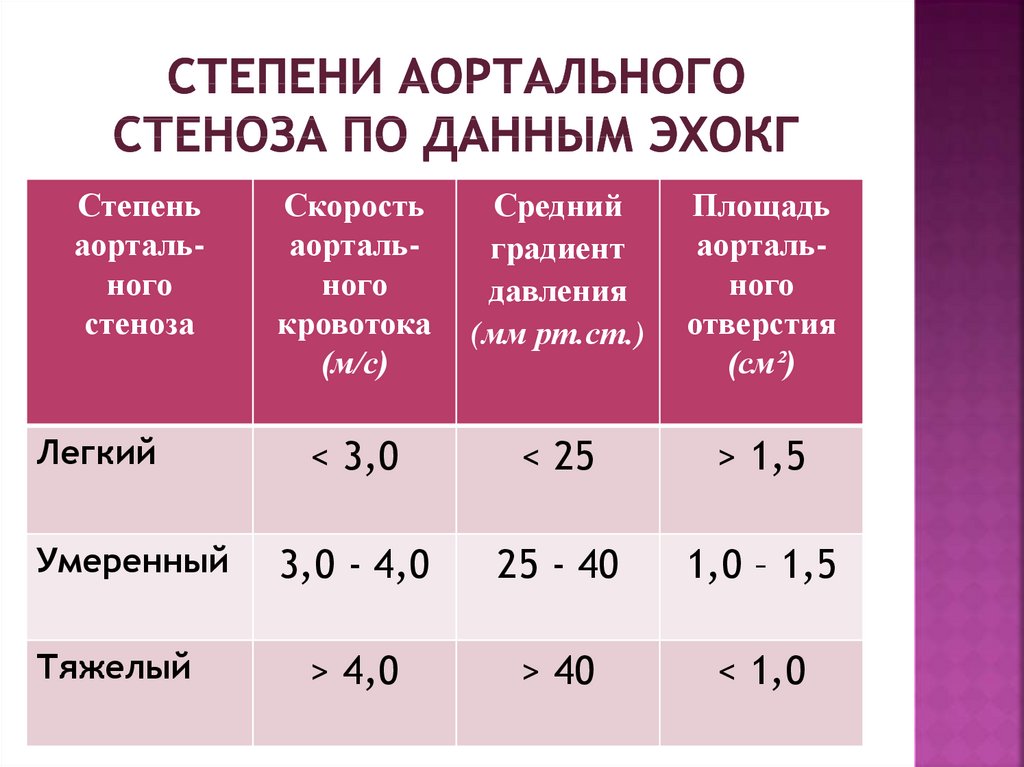 Они также отметили, что отклонения от нормы при послеоперационном неврологическом обследовании имели более высокую частоту долгосрочных неврологических отклонений и отклонений в развитии. Было высказано предположение, что шунтирование сердца и связанные с ним послеоперационные осложнения, включая низкий сердечный выброс, тромбы из контура шунтирования и гипоксически-ишемическое реперфузионное повреждение, способствуют неблагоприятным неврологическим исходам (17). По этой причине отказ от операции шунтирования, вероятно, сведет на нет эти риски в долгосрочной перспективе.
Они также отметили, что отклонения от нормы при послеоперационном неврологическом обследовании имели более высокую частоту долгосрочных неврологических отклонений и отклонений в развитии. Было высказано предположение, что шунтирование сердца и связанные с ним послеоперационные осложнения, включая низкий сердечный выброс, тромбы из контура шунтирования и гипоксически-ишемическое реперфузионное повреждение, способствуют неблагоприятным неврологическим исходам (17). По этой причине отказ от операции шунтирования, вероятно, сведет на нет эти риски в долгосрочной перспективе.Резюме
Тяжелый АС и КоА — сложное состояние, которое редко наблюдается. Оптимальное лечение долгое время было труднодостижимым. Используя гибридную методику с выполнением АовП, хирургической резекции и анастомоза конец в конец, был обеспечен наилучший вариант лечения для каждого поражения. Известных осложнений, связанных с процедурой, удалось избежать с помощью хирургического рассечения сонных артерий.
 Долгосрочные риски неврологических нарушений и нарушений развития были снижены при отказе от шунтирования сердца и DHCA.
Долгосрочные риски неврологических нарушений и нарушений развития были снижены при отказе от шунтирования сердца и DHCA.Заявление об этике
Исследование представляет собой ретроспективный клинический отчет об установленных, общепринятых методах, но объединенных по-новому, чтобы принести пользу пациенту; следовательно, этическое одобрение не требуется. Проект документа был отправлен пациенту и его семье. После ознакомления с документом семья дала согласие на эту публикацию.
Вклад автора
Существенный вклад в концепцию или дизайн работы: DM. Составление проекта работы или критический пересмотр важного интеллектуального содержания: DM, MC и DT.
Заявление об отказе от ответственности
В этой статье/документе/отчете представлено независимое исследование. Выраженные взгляды принадлежат автору (авторам) и не обязательно принадлежат NHS, NIHR или Министерству здравоохранения.
Заявление о конфликте интересов
Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могли бы быть истолкованы как потенциальный конфликт интересов.

Ссылки
1. Williams JA, Bansal AK, Kim BJ, Nwakanma LU, Patel ND, Seth AK, et al. Две тысячи шунтов Блэлока-Тауссига: шестидесятилетний опыт. Ann Thorac Surg (2007) 84(6):2070–5. doi: 10.1016/j.athoracsur.2007.06.067
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
2. Хоффман Дж.И., Каплан С. Заболеваемость врожденными пороками сердца. J Am Coll Cardiol (2002) 39:1890. doi:10.1016/S0735-1097(02)01886-7
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
3. Токель К., Йилдирим С.В., Варан Б., Экичи Э. Последовательная баллонная дилатация при комбинированном аортальном клапанном стенозе и коарктации аорты при одной процедуре катетеризации: прогностическая оценка, основанная на долгосрочном наблюдении. J Invasive Cardiol (2006) 18(2):65–9.
Реферат PubMed | Google Scholar
4. Fratz S, Gildein HP, Balling G, Sebening W, Genz T, Eicken A, et al. Аортальная вальвулопластика у детей значительно отсрочивает необходимость операции на аортальном клапане: одноцентровый опыт 188 пациентов после 17,5 лет наблюдения.
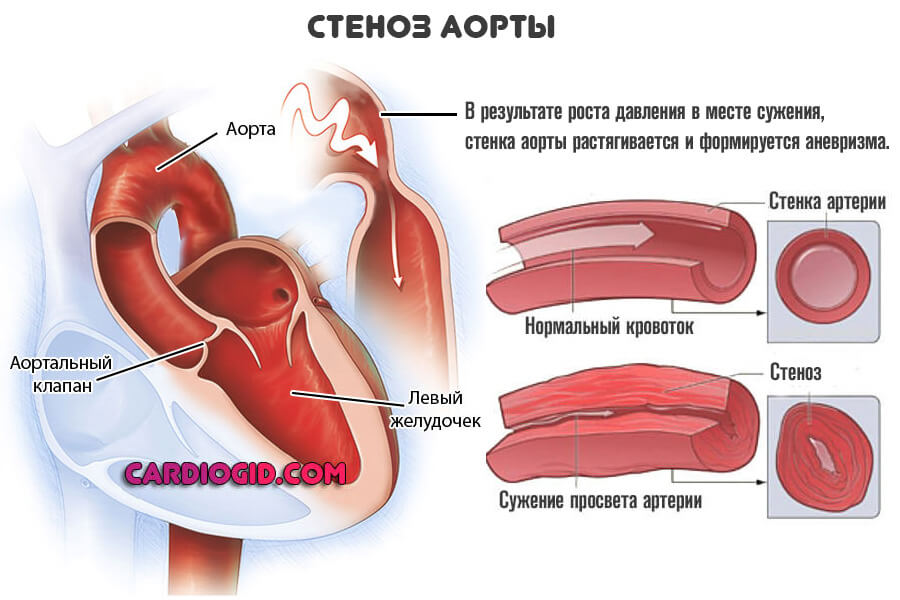 Тираж (2008) 117(9):1201–6. doi:10.1161/CIRCULATIONAHA.107.687764
Тираж (2008) 117(9):1201–6. doi:10.1161/CIRCULATIONAHA.107.687764PubMed Abstract | Полный текст перекрестной ссылки | Академия Google
5. Petit CJ, Maskatia SA, Justino H, Mattamal RJ, Crystal MA, Ing FF. Повторная баллонная аортальная вальвулопластика эффективно отсрочивает оперативное вмешательство у детей с рецидивирующим аортальным стенозом. Катетер Cardiovasc Interv (2013) 82(4):549–55. doi:10.1002/ccd.24562
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
6. Росси Р.И., Маника Дж.Л., Петрако Р., Скотт М., Пьяцца Л., Мачадо П.М. Баллонная аортальная вальвулопластика при врожденном аортальном стенозе с использованием доступа через бедренную и сонную артерии: 16-летний опыт работы в одном центре. Катетер Cardiovasc Interv (2011) 78(1):84–90. doi:10.1002/ccd.22938
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
7. Borghi A, Agnoletti G, Poggiani C. Хирургическое перекрытие правой сонной артерии для аортальной баллонной вальвулопластики в младенчестве: среднесрочное наблюдение.
 Pediatr Cardiol (2001) 22:194. doi:10.1007/s002460010202
Pediatr Cardiol (2001) 22:194. doi:10.1007/s002460010202PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
8. Siddiqui J, Brizard CP, Galati JC, Iyengar AJ, Hutchinson D, Konstantinov IE, et al. Хирургическая вальвулотомия и пластика при врожденном аортальном стенозе у новорожденных и младенцев дает лучшие результаты, чем интервенционная катетеризация. J Am Coll Cardiol (2013) 62(22):2134–40. doi:10.1016/j.jacc.2013.07.052
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
9. Райт Г.Э., Новак К.А., Голдберг К.С., Охье Р.Г., Боув Э.Л., Роккини А.П. Расширенная резекция и анастомоз «конец в конец» при коарктации аорты у детей раннего возраста: результаты индивидуального хирургического подхода. Ann Thorac Surg (2005) 80 (4): 1453–9. doi:10.1016/j.athoracsur.2005.04.002
PubMed Abstract | Полный текст перекрестной ссылки | Академия Google
10. Kaushal S, Backer CL, Patel JN, Patel SK, Walker BL, Weigel TJ, et al.
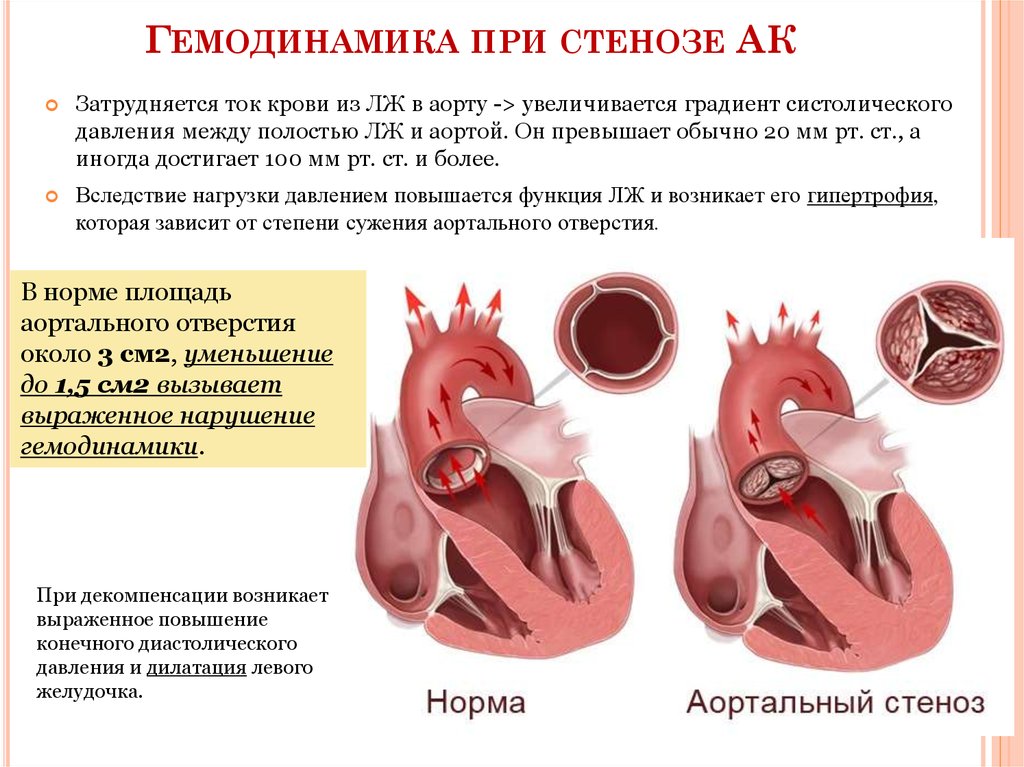 Коарктация аорты: отдаленные результаты резекции с расширенным анастомозом конец в конец. Ann Thorac Surg (2009) 88(6):1932–8. doi:10.1016/j.athoracsur.2009.08.035
Коарктация аорты: отдаленные результаты резекции с расширенным анастомозом конец в конец. Ann Thorac Surg (2009) 88(6):1932–8. doi:10.1016/j.athoracsur.2009.08.035PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
11. Lee CL, Lin JF, Hsieh KS, Lin CC, Huang TC. Баллонная ангиопластика нативной коарктации и сравнение пациентов моложе и старше 3 мес. Циркуляр J (2007) 71:1781–4. doi:10.1253/circj.71.1781
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
12. Майнемер А., Лимперопулос С., Шевелл М., Рохличек С., Розенблатт Б., Червенков С. Исходы развития и функционирования при поступлении в школу у детей с врожденными пороками сердца. J Pediatr (2008) 153(1):55–60. doi:10.1016/j.jpeds.2007.12.019
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
13. Newburger JW, Jonas RA, Wernovsky G, Wypij D, Hickey PR, Kuban KC, et al. Сравнение периоперационных неврологических эффектов гипотермической остановки кровообращения и сердечно-легочного шунтирования с низким потоком в хирургии детского сердца.
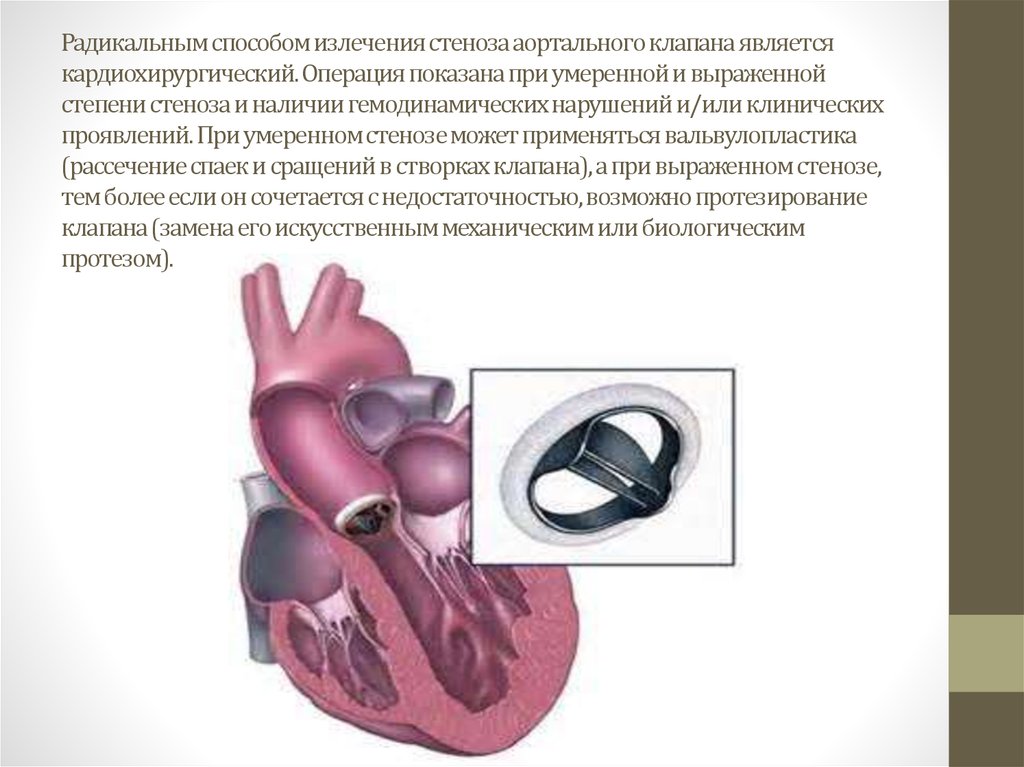 N Engl J Med (1993) 329:1057–64. doi:10.1056/NEJM1993100732
N Engl J Med (1993) 329:1057–64. doi:10.1056/NEJM1993100732PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
14. Greeley WJ, Kern FH, Ungerleider RM, Boyd JL III, Quill T, Smith LR, et al. Влияние гипотермического искусственного кровообращения и полной остановки кровообращения на церебральный метаболизм у новорожденных, младенцев и детей. J Thorac Cardiovasc Surg (1991) 101:783–94.
Google Scholar
15. Kern FH, Ungerleider RM, Reves JG, Quill T, Smith LR, Baldwin B, et al. Влияние изменения скорости потока насоса на мозговой кровоток и метаболизм у новорожденных, младенцев и детей. Ann Thorac Surg (1993) 56:1366–72. doi:10.1016/0003-4975(93)
- -9
Полный текст CrossRef | Google Scholar
16. Лимперопулос С., Майнемер А., Шевелл М.И., Рохличек С., Розенблатт Б., Червенков С. и другие. Предикторы нарушений развития после операций на открытом сердце у детей раннего возраста с врожденными пороками сердца.
 J Pediatr (2002) 141(1):51–8. doi:10.1067/mpd.2002.125227
J Pediatr (2002) 141(1):51–8. doi:10.1067/mpd.2002.125227PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
17. Майнемер А., Лимперопулос С., Шевелл М.И., Рохличек С., Розенблатт Б., Червенков С. Новый взгляд на исходы у младенцев с врожденными пороками сердца. Pediatr Neurol (2009) 40(3):197–204. doi:10.1016/j.pediatrneurol.2008.09.014
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
18. Майнемер А., Лимперопулос С., Шевелл М., Розенблатт Б., Рохличек С., Червенков С. Долгосрочные нейромоторные исходы при поступлении в школу детей с врожденными пороками сердца, требующих операции на открытом сердце. J Pediatr (2006) 148(1):72–7. doi:10.1016/j.jpeds.2005.08.036
PubMed Abstract | Полный текст перекрестной ссылки | Академия Google
Прогрессирование и исходы недисфункционального двустворчатого аортального клапана: продольные данные из крупного корейского реестра двустворчатых аортальных клапанов
Введение
Двустворчатый аортальный клапан (ДАК) известен как наиболее распространенный врожденный порок сердечного клапана.
 Пациенты с ДАК демонстрируют значительную гетерогенность в различных клинических аспектах, включая тип и степень дисфункции клапана или аортопатии (1–3). Поскольку в последнее время в общей популяции проводится эхокардиографическое наблюдение, диагноз недисфункционального ДАК, при котором ДАК не имеет выраженного аортального стеноза (АС) или аортальной регургитации (АР), увеличивается.
Пациенты с ДАК демонстрируют значительную гетерогенность в различных клинических аспектах, включая тип и степень дисфункции клапана или аортопатии (1–3). Поскольку в последнее время в общей популяции проводится эхокардиографическое наблюдение, диагноз недисфункционального ДАК, при котором ДАК не имеет выраженного аортального стеноза (АС) или аортальной регургитации (АР), увеличивается.Хорошо известно, что у пациентов с клинически значимым АС или АР возникают серьезные последствия, независимо от того, есть ли у них двустворчатый или трикуспидальный клапан (4, 5). Однако имеются ограниченные данные о пациентах с нормально функционирующим или минимально дисфункциональным ДАК при первоначальном диагнозе (6, 7).
Нашей целью было определить частоту аортопатии при первоначальном диагнозе и охарактеризовать аортальные осложнения у пациентов с недисфункциональным ДАК по сравнению с дисфункциональным ДАК. Мы также использовали большой корейский регистр ДАК для оценки прогрессирования клапанной дисфункции и аортопатии у пациентов с недисфункциональным ДАК.

Методы
Исследуемая популяция
Мы ретроспективно рассмотрели эхокардиографическую базу данных и медицинские записи пациентов с ДАК, диагностированных с января 2003 г. по декабрь 2018 г. в сердечно-сосудистой больнице Северанс (Медицинский колледж Университета Йонсей, Сеул, Южная Корея). За этот период было выявлено и включено в наш реестр ДАК 1307 пациентов с ДАК. Среди них 761 пациенту была выполнена повторная эхокардиография как минимум через 1 год после постановки диагноза.
Значительный АС и значительный АР были обнаружены с помощью трансторакальной эхокардиограммы; значительный АС определялся как минимум умеренный АС, а значительный АР определялся как минимум умеренный АР с использованием существующих рекомендаций (8, 9). Недисфункциональная ДАК определялась как ДАК без значимого АС или АР. Наличие аортопатии определяли как диаметр восходящей аорты (АА) >37 мм (10, 11). Мы исключили из этого исследования 574 пациента со значительным АС или АР на индексированной эхокардиограмме.
 Среди 574 пациентов с дисфункцией ДАК у 354 наблюдался тяжелый АС или тяжелый АР. При среднем наблюдении 5,9лет оперировано 409 (71%) пациентов (281 изолированная операция ДАК, 122 операции одновременно ДАК и аорты и 6 изолированных операций аорты). Сто восемьдесят семь недисфункциональных пациентов с ДАК были классифицированы в соответствии с функцией клапана и аортопатией. По функции клапана пациенты были разделены на группу с нормальной функцией клапана и группу с легким АС или АР. Кроме того, они были разделены на две группы по наличию аортопатии (рис. 1).
Среди 574 пациентов с дисфункцией ДАК у 354 наблюдался тяжелый АС или тяжелый АР. При среднем наблюдении 5,9лет оперировано 409 (71%) пациентов (281 изолированная операция ДАК, 122 операции одновременно ДАК и аорты и 6 изолированных операций аорты). Сто восемьдесят семь недисфункциональных пациентов с ДАК были классифицированы в соответствии с функцией клапана и аортопатией. По функции клапана пациенты были разделены на группу с нормальной функцией клапана и группу с легким АС или АР. Кроме того, они были разделены на две группы по наличию аортопатии (рис. 1).Рисунок 1 . Блок-схема исследования.
Институциональный наблюдательный совет больницы Северанс одобрил настоящее исследование, которое проводилось в соответствии с Хельсинкской декларацией.
Эхокардиографические оценки
Стандартные двумерные и доплеровские измерения проводились в соответствии с действующими рекомендациями (12). Врожденный ДАК был диагностирован, когда только две створки были однозначно идентифицированы в систолу и диастолу в проекции по короткой оси с четким видом «рыбьего рта» во время систолы, как описано ранее (13).
 Анатомические типы ДАК были идентифицированы в соответствии с системой классификации, предложенной Шефером и его коллегами (14). Тип 1 характеризуется врожденным сращением правой и левой коронарных створок. Тип 2 имеет врожденное сращение правой и некоронарной створки. Тип 3 демонстрирует врожденное сращение некоронарной и левой коронарной створки. Тип 0 не имеет шва и также называется «истинным типом BAV». Тяжесть АС или АР оценивали с помощью комплексного подхода (9, 15). Все измерения аорты выполняли согласно рекомендациям по комплексу QRS электрокардиограммы (12). Размеры синусов Вальсальвы измеряли перпендикулярно правому и левому (или не-) синусам аорты. Синотубулярное соединение измеряли там, где синусы аорты встречались с трубчатой аортой. АА измеряли примерно на 2 см дистальнее синотубулярного перехода, как описано ранее (13). Эхокардиографические данные были собраны и проанализированы опытными эхокардиографами, которые не знали клинических данных каждого пациента.
Анатомические типы ДАК были идентифицированы в соответствии с системой классификации, предложенной Шефером и его коллегами (14). Тип 1 характеризуется врожденным сращением правой и левой коронарных створок. Тип 2 имеет врожденное сращение правой и некоронарной створки. Тип 3 демонстрирует врожденное сращение некоронарной и левой коронарной створки. Тип 0 не имеет шва и также называется «истинным типом BAV». Тяжесть АС или АР оценивали с помощью комплексного подхода (9, 15). Все измерения аорты выполняли согласно рекомендациям по комплексу QRS электрокардиограммы (12). Размеры синусов Вальсальвы измеряли перпендикулярно правому и левому (или не-) синусам аорты. Синотубулярное соединение измеряли там, где синусы аорты встречались с трубчатой аортой. АА измеряли примерно на 2 см дистальнее синотубулярного перехода, как описано ранее (13). Эхокардиографические данные были собраны и проанализированы опытными эхокардиографами, которые не знали клинических данных каждого пациента.Статистический анализ
Непрерывные переменные выражаются как среднее ± стандартное отклонение.
 Категориальные переменные выражаются в виде числа (в процентах). Сравнения между группами проводились с использованием стандартных тестов хи-квадрат для категориальных переменных и тестов Стьюдента t для непрерывных переменных. Был проведен множественный регрессионный анализ, чтобы определить связь между клиническими и эхокардиографическими переменными при первоначальном диагнозе и прогрессированием дисфункции ДАК или хирургическим вмешательством на аортальном клапане. Аналогичным образом был применен множественный регрессионный анализ для выявления факторов, связанных с прогрессированием тяжелой аортопатии или хирургическим вмешательством на аорте. Переменные, выбранные для включения в многофакторный анализ, имели p — значение <0,1 в одномерном анализе, а также другие важные переменные. Все статистические анализы были выполнены с использованием SPSS Statistics, версия 23.0 (IBM, Армонк, Нью-Йорк, США). P — значения <0,05 считались статистически значимыми.
Категориальные переменные выражаются в виде числа (в процентах). Сравнения между группами проводились с использованием стандартных тестов хи-квадрат для категориальных переменных и тестов Стьюдента t для непрерывных переменных. Был проведен множественный регрессионный анализ, чтобы определить связь между клиническими и эхокардиографическими переменными при первоначальном диагнозе и прогрессированием дисфункции ДАК или хирургическим вмешательством на аортальном клапане. Аналогичным образом был применен множественный регрессионный анализ для выявления факторов, связанных с прогрессированием тяжелой аортопатии или хирургическим вмешательством на аорте. Переменные, выбранные для включения в многофакторный анализ, имели p — значение <0,1 в одномерном анализе, а также другие важные переменные. Все статистические анализы были выполнены с использованием SPSS Statistics, версия 23.0 (IBM, Армонк, Нью-Йорк, США). P — значения <0,05 считались статистически значимыми.Результаты
Исходные характеристики в соответствии с функцией клапана и аортопатией
Среди 761 пациента с ДАК в регистре у 187 (25%) пациентов была выявлена недисфункциональная ДАК.
 Среди них у 104 (56%) пациентов был легкий АС или АР, а у 81 (43%) была аортопатия при индексированной эхокардиографии. Исходные характеристики субъектов в соответствии с их исходной функцией аортального клапана или наличием аортопатии были в значительной степени сопоставимы (таблица 1). Пациенты с аортопатией имели более высокий средний возраст и более высокий уровень использования бета-блокаторов, чем пациенты без аортопатии. Однако распределение сопутствующих заболеваний, в том числе артериальной гипертензии, было сходным между группами сравнения. Наиболее распространенной морфологией ДАК была морфология 1 типа слияния левой и правой коронарных створок во всех группах, а у пациентов с аортопатией выявлена более высокая частота морфологии 0 типа, чем у пациентов без аортопатии (27,2 против 14,2%, 9).0207 р = 0,019) (табл. 2). У пациентов с аортопатией размер аорты был значительно больше, чем в других группах. Кроме того, у пациентов с аортопатией скорость e’ была ниже, чем у пациентов без аортопатии.
Среди них у 104 (56%) пациентов был легкий АС или АР, а у 81 (43%) была аортопатия при индексированной эхокардиографии. Исходные характеристики субъектов в соответствии с их исходной функцией аортального клапана или наличием аортопатии были в значительной степени сопоставимы (таблица 1). Пациенты с аортопатией имели более высокий средний возраст и более высокий уровень использования бета-блокаторов, чем пациенты без аортопатии. Однако распределение сопутствующих заболеваний, в том числе артериальной гипертензии, было сходным между группами сравнения. Наиболее распространенной морфологией ДАК была морфология 1 типа слияния левой и правой коронарных створок во всех группах, а у пациентов с аортопатией выявлена более высокая частота морфологии 0 типа, чем у пациентов без аортопатии (27,2 против 14,2%, 9).0207 р = 0,019) (табл. 2). У пациентов с аортопатией размер аорты был значительно больше, чем в других группах. Кроме того, у пациентов с аортопатией скорость e’ была ниже, чем у пациентов без аортопатии.
Таблица 1 . Базовые характеристики.
Таблица 2 . Характеристики эхокардиограммы.
Прогрессирование до дисфункции ДАК и частота операций на аортальном клапане
В группе нормально функционирующих ДАК у 87% сохранялся недисфункциональный ДАК после наблюдения (средняя продолжительность наблюдения: 5,8 года). Однако в группе с легким АС или АР у 61% не было прогрессирования значительной дисфункции клапана (средняя продолжительность наблюдения 6,2 года) (рис. 2А). Последующие эхокардиографические характеристики и подробная информация об операции были представлены в дополнительных таблицах 1 и 2. Кроме того, операции на аортальном клапане имели тенденцию быть более частыми в группе с легким АС или АР, но это не соответствовало статистической значимости (12,5 против 6,0%, p = 0,068) (табл. 3). При анализе прогрессирования дисфункции клапана в соответствии с морфологией ДАК соотношение сохранения прогрессирования при отсутствии дисфункции было одинаковым независимо от наличия ДАК истинного типа (75 против 72%, p = 0,172) (рис.
 3А). Однако истинный тип ДАК показал тенденцию к более высокой частоте операций клапана, чем другие типы (19 против 10%, p = 0,112) (рис. 3B). В многофакторном анализе наличие легкого АС и начальный размер аорты были независимо связаны с прогрессированием до недисфункционального ДАК или проведением операции на аортальном клапане (таблица 4).
3А). Однако истинный тип ДАК показал тенденцию к более высокой частоте операций клапана, чем другие типы (19 против 10%, p = 0,112) (рис. 3B). В многофакторном анализе наличие легкого АС и начальный размер аорты были независимо связаны с прогрессированием до недисфункционального ДАК или проведением операции на аортальном клапане (таблица 4).Рисунок 2 . Прогрессирование дисфункции клапана 90 548 (A) 90 549 и дилатации аорты 90 548 (B) 90 549 между группами.
Таблица 3 . Прогрессирование дисфункции ДАК и частота операций на аортальном клапане.
Рисунок 3 . Прогрессирование до дисфункции клапана (A) , частота операций на клапане (B) , прогрессирование до тяжелой аортопатии (C) и частота операций на аорте (D) в соответствии с морфологией ДАК.
Таблица 4 . Факторы, связанные с прогрессированием недисфункционального ДАК или проведением операции на аортальном клапане.

Прогрессирование тяжелой аортопатии и частота операций на аорте
Пациенты с ДАК были разделены на две группы в зависимости от наличия аортопатии. По сравнению с пациентами без аортопатии в группе аортопатии наблюдалась тенденция к более быстрому прогрессированию, но это не было статистически значимым (0,42 ± 0,85 мм против 0,32 ± 0,66 мм, р = 0,22) (табл. 5). Ни у одного из пациентов без аортопатии диаметр аорты не увеличился более чем на 45 мм во время наблюдения (в среднем 6,0 лет), тогда как у 34,6% пациентов с аортопатией диаметр аорты увеличился более чем на 45 мм (рис. 2В). Кроме того, у 9,9% пациентов с аортопатией было увеличение > 50 мм. Также в группе с аортопатией частота операций была достоверно выше (21,0 против 1,8% без аортопатии, p < 0,001) в течение периода наблюдения (в среднем 6,0 лет). Прогрессирование аортопатии анализировали по морфологии ДАК. Скорость прогрессирования тяжелой аортопатии или частота операций на аорте была выше при истинном типе ДАК, чем при других типах ДАК (рис.
 3C, D). Однако при многомерном анализе исходный размер аорты был единственным независимым предиктором прогрессирования тяжелой аортопатии или проведения операции на аорте (таблица 6).
3C, D). Однако при многомерном анализе исходный размер аорты был единственным независимым предиктором прогрессирования тяжелой аортопатии или проведения операции на аорте (таблица 6).Таблица 5 . Прогрессирование аортопатии и частота операций на аорте.
Таблица 6 . Факторы, связанные с прогрессированием тяжелой аортопатии или проведением операции на аорте.
Обсуждение
Основные результаты настоящего исследования заключаются в том, что (1) аортопатия довольно часто встречалась у пациентов с ДАК даже при отсутствии выраженной клапанной дисфункции, (2) прогрессирование дилатации аорты, отвечающее требованиям для операции на аорте была более распространена у пациентов с ДАК с аортопатией при первоначальном диагнозе, чем у пациентов без аортопатии, (3) 89% сохранили недисфункциональную ДАК через 6 лет наблюдения, когда у пациентов с ДАК была диагностирована нормальная функция клапана. Однако только у 61% пациентов с легкой дисфункцией ДАК сохранялся недисфункциональный, и (4) скорость прогрессирования до тяжелой аортопатии или частота операций на аорте была выше при истинном типе ДАК, чем при других типах ДАК.

Соотношение аортопатии и вальвулопатии варьирует у пациентов с ДАК. Результаты настоящего исследования также позволяют интерпретировать, что доля аортопатии значительна при отсутствии вальвулопатии (16–19).). Наши результаты подтверждают предыдущие исследования, предполагающие, что ДАК связан с внутренней аортопатией, а также с патологией, связанной с функцией клапана (16–19). Мы обнаружили, что связь с начальной степенью аортопатии ДАК была важна для определения частоты операций на аорте. Интересно, что при наблюдении пациентов с исходно нормальной функцией клапана с развитой аортопатией (>45 мм, 28 пациентов) в течение 6,1 года 14 (50,0%) пациентам были выполнены операции на аорте и клапане. Четверо из 14 пациентов перенесли замену аортального клапана и операцию на аорте по поводу тяжелого АС или тяжелой АР, а 10 пациентов перенесли замену аортального клапана с операцией на аорте, несмотря на то, что функция ДАК была нормальной или слегка дисфункциональной. Таким образом, у пациентов с преобладанием аортопатии и недисфункциональными ДАК наблюдались клинические явления, связанные с аортопатией, в течение примерно 6 лет.
 Поскольку адекватной информации о естественном течении существующего ДАК не было, рассматривалась дополнительная замена аортального клапана. Однако, согласно нашему исследованию, в целом у 71% пациентов с недисфункциональными ДАК сохранялись недисфункциональные ДАК через 6 лет наблюдения. У молодых пациенток детородного возраста варфарин длительное время показан при операциях на механических клапанах. Таким образом, при выполнении операции на аорте у пациентов с недисфункциональными ДАК решение о сопутствующей замене аортального клапана следует принимать с осторожностью с учетом индивидуальных рисков и преимуществ.
Поскольку адекватной информации о естественном течении существующего ДАК не было, рассматривалась дополнительная замена аортального клапана. Однако, согласно нашему исследованию, в целом у 71% пациентов с недисфункциональными ДАК сохранялись недисфункциональные ДАК через 6 лет наблюдения. У молодых пациенток детородного возраста варфарин длительное время показан при операциях на механических клапанах. Таким образом, при выполнении операции на аорте у пациентов с недисфункциональными ДАК решение о сопутствующей замене аортального клапана следует принимать с осторожностью с учетом индивидуальных рисков и преимуществ.В целом дегенеративные изменения у пациентов с ДАК возникают раньше, чем у пациентов с трикуспидальным АК. В последнее время увеличивается диагностика нормально функционирующего ДАК у пациентов без клапанной дисфункции и аортопатии. Были проведены исследования факторов, определяющих дисфункцию клапана у пациентов с ДАК (20–22) или прогрессирование у пациентов с ДАК со значительной дисфункцией клапана (4).
 В предыдущих исследованиях также изучалось, как эти факторы влияют на диастолическую функцию левого желудочка в соответствии с морфологией ДАК (13). Более того, предыдущий отчет корейской когорты ДАК также продемонстрировал среднесрочный клинический исход у бессимптомных или слабосимптомных пациентов с ДАК, включая как недисфункциональные, так и дисфункциональные ДАК (23).
В предыдущих исследованиях также изучалось, как эти факторы влияют на диастолическую функцию левого желудочка в соответствии с морфологией ДАК (13). Более того, предыдущий отчет корейской когорты ДАК также продемонстрировал среднесрочный клинический исход у бессимптомных или слабосимптомных пациентов с ДАК, включая как недисфункциональные, так и дисфункциональные ДАК (23).Тем не менее, было проведено несколько исследований естественного течения нормально функционирующих пациентов с ДАК, и в реальном мире пациенты могут задаться вопросом о своем прогнозе и о том, когда выполнять контрольную эхокардиограмму. В результате мы ожидаем, что наше исследование послужит ориентиром. Хотя средняя продолжительность наблюдения была недостаточно большой (около 6 лет), около 89% пациентов с нормальной функциональной функцией ДАК на момент постановки диагноза не получали хирургического лечения в течение периода наблюдения, а 71% пациентов сохраняли легкая дисфункция клапана в течение периода наблюдения.
 Даже у недисфункциональных пациентов с ДАК, если диаметр аорты на момент постановки диагноза превышает 37 мм, или если имеется легкая дисфункция ДАК, если ДАК истинный тип, необходимо регулярно проверять прогрессирование аортопатии или дисфункцию ДАК с помощью эхокардиографии.
Даже у недисфункциональных пациентов с ДАК, если диаметр аорты на момент постановки диагноза превышает 37 мм, или если имеется легкая дисфункция ДАК, если ДАК истинный тип, необходимо регулярно проверять прогрессирование аортопатии или дисфункцию ДАК с помощью эхокардиографии.В последние годы резко возросло количество исследований BAV. Международный консорциум BAV выявил пробелы в знаниях и принял вызов в отношении BAV (24). Кроме того, Американская ассоциация торакальной хирургии опубликовала согласованные рекомендации по ДАК (25). Были опубликованы генетические исследования ДАК, некоторые группы расширили область транскатетерной замены аортального клапана, чтобы сосредоточиться на ДАК (26). Однако немногие данные естественной истории основаны на многолетних наблюдениях. В частности, исследование округа Олмстед является идеальным исследованием на уровне сообщества, в то время как на наш реестр BAV влияют несколько источников систематической ошибки, поскольку мы включили когорту направлений.
 Пациенты в исследовании округа Олмстед были отобраны путем скрининга посредством аускультации, которая показала, что 27% перенесли хирургическое вмешательство на аортальном клапане или аорте в течение 20-летнего периода наблюдения (27). Как и в нашем реестре, в исследовании Олмстеда также была создана когорта пациентов с нормальным или легким заболеванием аортального клапана. В исследовании Olmsted отсутствовали результаты детального динамического наблюдения — эхокардиографии, была показана частота операции. Примечательно, что по сравнению с исследованием Олмстеда частота хирургических вмешательств в нашем исследовании после среднего 6-летнего наблюдения аналогична. Для сравнения, наше исследование имеет то преимущество, что включает подробные данные эхокардиографического наблюдения за функцией клапана и размерами аорты, а также клинические результаты в течение 6 лет у пациентов с недисфункциональным ДАК. Настоящее исследование предоставляет дополнительную информацию, которая поможет клиницистам предсказать, у каких пациентов будет прогрессировать и ухудшаться клинические исходы.
Пациенты в исследовании округа Олмстед были отобраны путем скрининга посредством аускультации, которая показала, что 27% перенесли хирургическое вмешательство на аортальном клапане или аорте в течение 20-летнего периода наблюдения (27). Как и в нашем реестре, в исследовании Олмстеда также была создана когорта пациентов с нормальным или легким заболеванием аортального клапана. В исследовании Olmsted отсутствовали результаты детального динамического наблюдения — эхокардиографии, была показана частота операции. Примечательно, что по сравнению с исследованием Олмстеда частота хирургических вмешательств в нашем исследовании после среднего 6-летнего наблюдения аналогична. Для сравнения, наше исследование имеет то преимущество, что включает подробные данные эхокардиографического наблюдения за функцией клапана и размерами аорты, а также клинические результаты в течение 6 лет у пациентов с недисфункциональным ДАК. Настоящее исследование предоставляет дополнительную информацию, которая поможет клиницистам предсказать, у каких пациентов будет прогрессировать и ухудшаться клинические исходы.
Ограничения
Настоящее исследование имело несколько ограничений. Во-первых, в это ретроспективное исследование были включены только корейские пациенты с BAV из одного третичного реферального центра, что может привести к систематической ошибке. Таким образом, необходимы многоцентровые проспективные исследования для оценки распространенности аортопатии при нормальном клапанном ДАК и прогрессирования функции аортального клапана при ДАК. Поскольку период наблюдения за дисфункцией клапана различен для каждого пациента, его использование для количественной оценки прогрессирования дисфункции клапана ограничено. Тем не менее, мы считаем, что это исследование является значимым исследованием, в котором сообщается о распространенности аортопатии и прогрессии клапана в большом корейском регистре с использованием всесторонних обзоров. Кроме того, медиана продолжительности наблюдения составила всего 6 лет, что недостаточно для анализа долгосрочного естественного течения раннего заболевания ДАК.
 Во-вторых, отсутствовали данные относительно общего генетического фона у пациентов с ДАК. В-третьих, диаметры аорты измерялись только на основе эхокардиографической визуализации, потому что только некоторые пациенты с ДАК прошли компьютерную томографию или магнитно-резонансную томографию сердца.
Во-вторых, отсутствовали данные относительно общего генетического фона у пациентов с ДАК. В-третьих, диаметры аорты измерялись только на основе эхокардиографической визуализации, потому что только некоторые пациенты с ДАК прошли компьютерную томографию или магнитно-резонансную томографию сердца.Выводы
У пациентов с недисфункциональным ДАК исходная функция ДАК и степень дилатации аорты могут иметь важное значение для прогрессирования и исходов. Пациенты без какой-либо дисфункции или аортопатии, как правило, сохраняют хорошую структуру и функцию в течение 6 лет.
Заявление о доступности данных
Первоначальные материалы, представленные в исследовании, включены в статью/дополнительный материал. Дальнейшие запросы можно направлять соответствующему автору/авторам.
Заявление об этике
Исследования с участием людей были рассмотрены и одобрены больницей Северанс Медицинского колледжа Университета Йонсей. Комитет по этике отказался от требования письменного информированного согласия на участие.

Вклад автора
SS и CS являются поручителями всей рукописи. CS и G-RH внесли свой вклад в разработку концепции и дизайна исследования, критический пересмотр рукописи на предмет важного интеллектуального содержания и окончательное утверждение версии для публикации. JS, IC и J-WH внесли свой вклад в сбор, анализ и интерпретацию данных. Все авторы внесли свой вклад в статью и одобрили представленную версию.
Финансирование
Это исследование было частично поддержано грантом факультета Медицинского колледжа Университета Йонсей (6-2014-0153).
Конфликт интересов
Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могли бы быть истолкованы как потенциальный конфликт интересов.
Дополнительный материал
Дополнительный материал к этой статье можно найти в Интернете по адресу: https://www.frontiersin.org/articles/10.3389/fcvm.2020.603323/full#supplementary-material
Ссылки
1.
 Ward C. Клиническое значение двустворчатого аортального клапана. Сердце. (2000) 83:81–5. doi: 10.1136/heart.83.1.81
Ward C. Клиническое значение двустворчатого аортального клапана. Сердце. (2000) 83:81–5. doi: 10.1136/heart.83.1.81PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
2. Prakash SK, Bossé Y, Muehlschlegel JD, Michelena HI, Limongelli G, Corte AD, BAVCon Investigators, et al. Дорожная карта для изучения генетической основы двустворчатого аортального клапана и его осложнений: выводы международного BAVCon (Консорциум двустворчатого аортального клапана). J Am Coll Кардиол. (2014) 64:832–9. doi: 10.1016/j.jacc.2014.04.073
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
3. Чжон Х., Шим С.И., Ким Д., Чой Дж.И., Чой КУ, Ли С.И. и другие. Распространенность, характеристики и клиническое значение сопутствующих кардиомиопатий у пациентов с двустворчатым аортальным клапаном. Йонсей Мед J . (2019) 60:816–23. doi: 10.3349/ymj.2019.60.9.816
PubMed Abstract | CrossRef Полный текст
4. Beppu S, Suzuki S, Matsuda H, Ohmori F, Nagata S, Miyatake K.
 Быстрота прогрессирования аортального стеноза у пациентов с врожденными двустворчатыми аортальными клапанами. Ам Дж Кардиол . (1993) 71:322–7. doi: 10.1016/0002-9149(93)
Быстрота прогрессирования аортального стеноза у пациентов с врожденными двустворчатыми аортальными клапанами. Ам Дж Кардиол . (1993) 71:322–7. doi: 10.1016/0002-9149(93) - -I
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
5. Otto CM, Burwash IG, Legget ME, Munt BI, Fujioka M, Healy NL, et al. Проспективное исследование бессимптомного клапанного аортального стеноза. Клинические, эхокардиографические и физические предикторы исхода. Тираж. (1997) 95:2262–70. doi: 10.1161/01.CIR.95.9.2262
PubMed Abstract | Полный текст перекрестной ссылки | Академия Google
6. Mills P, Leech G, Davies M, Leathan A. Естественное течение нестенозированного двустворчатого аортального клапана. Br Heart J. (1978) 40:951–7. doi: 10.1136/hrt.40.9.951
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
7. Пачульский Р.Т., Чан К.Л. Прогрессирование дисфункции аортального клапана у 51 взрослого пациента с врожденным двустворчатым аортальным клапаном: оценка и наблюдение с помощью допплерэхокардиографии.
 Br Сердце J . (1993) 69: 237–40. doi: 10.1136/ч.69.3.237
Br Сердце J . (1993) 69: 237–40. doi: 10.1136/ч.69.3.237Реферат PubMed | Полный текст перекрестной ссылки | Google Scholar
8. Zoghbi WA, Enriquez-Sarano M, Foster E, Grayburn PA, Kraft CD, Levine RA, et al. Рекомендации по оценке степени тяжести нативной клапанной недостаточности с помощью двухмерной и допплерэхокардиографии. J Am Soc Эхокардиогр . (2003) 16:777–802. doi: 10.1016/S0894-7317(03)00335-3
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
9. Baumgartner H, Hung J, Bermejo J, Chambers JB, Evangelista A, Griffin BP, et al. Эхокардиографическая оценка стеноза клапана: рекомендации EAE/ASE для клинической практики. J Am Soc Эхокардиография . (2009) 22:1–23; викторина 101–2. doi: 10.1016/j.echo.2008.11.029
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
10. Бероухим Р.С., Крузик Т.Л., Тейлор А.Л., Гао Д., Йетман А.Т. Прогрессирование дилатации аорты у детей с функционально нормальным двустворчатым аортальным клапаном.
 Am J Cardiol. (2006) 98:828–30. doi: 10.1016/j.amjcard.2006.04.022
Am J Cardiol. (2006) 98:828–30. doi: 10.1016/j.amjcard.2006.04.022PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
11. Делла Корте А., Банконе С., Кварто С., Диалетто Г., Ковино Ф.Е., Скардоне М. и др. Предикторы дилатации восходящей аорты при двустворчатом аортальном клапане: широкий спектр выраженности заболевания. Eur J Cardiothorac Surg . (2007) 31:397–404. doi: 10.1016/j.ejcts.2006.12.006
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
12. Ланг Р.М., Бадано Л.П., Мор-Ави В., Афилало Дж., Армстронг А., Эрнанде Л. и др. Рекомендации по количественному определению камер сердца с помощью эхокардиографии у взрослых: обновленная информация Американского общества эхокардиографии и Европейской ассоциации сердечно-сосудистой визуализации. Eur Heart J Cardiovasc Imaging . (2015) 16: 233–70. дои: 10.1093/ehjci/jev014
Резюме PubMed | Полный текст перекрестной ссылки | Google Scholar
13.
 Lee SY, Shim CY, Hong GR, Seo J, Cho I, Cho IJ, et al. Ассоциация аортальных фенотипов и механической функции с диастолической функцией левого желудочка у субъектов с нормально функционирующими двустворчатыми аортальными клапанами и сравнение с субъектами с трехстворчатыми аортальными клапанами. Ам Дж Кардиол . (2015) 116: 1547–54. doi: 10.1016/j.amjcard.2015.08.017
Lee SY, Shim CY, Hong GR, Seo J, Cho I, Cho IJ, et al. Ассоциация аортальных фенотипов и механической функции с диастолической функцией левого желудочка у субъектов с нормально функционирующими двустворчатыми аортальными клапанами и сравнение с субъектами с трехстворчатыми аортальными клапанами. Ам Дж Кардиол . (2015) 116: 1547–54. doi: 10.1016/j.amjcard.2015.08.017PubMed Abstract | Полный текст перекрестной ссылки | Академия Google
14. Schaefer BM, Lewin MB, Stout KK, Gill E, Prueitt A, Byers PH, et al. Двустворчатый аортальный клапан: комплексная фенотипическая классификация морфологии створок и формы корня аорты. Сердце. (2008) 94:1634–8. doi: 10.1136/hrt.2007.132092
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
15. Lancellotti P, Tribouilloy C, Hagendorff A, Popescu BA, Edvardsen T, Pierard LA, et al. Комитет по научным документам Европейской ассоциации сердечно-сосудистой визуализации. рекомендации по эхокардиографической оценке нативной клапанной регургитации: резюме Европейской ассоциации сердечно-сосудистой визуализации.
 Eur Heart J Кардиоваскулярная визуализация. (2013) 14:611–44. doi: 10.1093/ehjci/jet105
Eur Heart J Кардиоваскулярная визуализация. (2013) 14:611–44. doi: 10.1093/ehjci/jet105PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
16. Микелена Х.И., Ханна А.Д., Махони Д., Маргарян Э., Топильский Ю., Сури Р.М. и др. Частота аортальных осложнений у пациентов с двустворчатыми аортальными клапанами. ЯМА. (2011) 306:1104–12. doi: 10.1001/jama.2011.1286
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
17. Хан Р.Т., Роман М.Дж., Могтадер А.Х., Деверо Р.Б. Ассоциация дилатации аорты с регургитацией, стенозом и функционально нормальным двустворчатым аортальным клапаном. J Am Coll Cardiol . (1992) 19: 283–8. doi: 10.1016/0735-1097(92)-7
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
18. Кин М.Г., Вигерс С.Е., Плапперт Т., Почеттино А., Бавария Дж.Е., Саттон М.Г. Двустворчатые аортальные клапаны связаны с дилатацией аорты, непропорциональной сопутствующим поражениям клапанов.
 Тираж. (2000) 102(19 Приложение 3):III35–9. doi: 10.1161/01.CIR.102.suppl_3.III-35
Тираж. (2000) 102(19 Приложение 3):III35–9. doi: 10.1161/01.CIR.102.suppl_3.III-35PubMed Abstract | Полный текст перекрестной ссылки | Академия Google
19. Yasuda H, Nakatani S, Stugaard M, Tsujita-Kuroda Y, Bando K, Kobayashi J, et al. Неспособность предотвратить прогрессирующее расширение восходящей аорты за счет замены аортального клапана у пациентов с двустворчатым аортальным клапаном: сравнение с трехстворчатым аортальным клапаном. Тираж . (2003) 108 (Приложение 1): II291–4. doi: 10.1161/01.cir.0000087449.03964.fb
PubMed Abstract | CrossRef Full Text
20. Lee SY, Shim CY, Hong GR, Cho IJ, Chang HJ, Ha JW, et al. Детерминанты и прогностическое значение симптоматического статуса у пациентов с умеренно дисфункцией двустворчатого аортального клапана. ПЛОС ОДИН . (2017) 12:e0169285. doi: 10.1371/journal.pone.0169285
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
21. Lee SY, Shim CY, Kim D, Cho I, Hong GR, Ha JW, et al.
 Факторы, определяющие дисфункцию аортального клапана у корейских субъектов с двустворчатым аортальным клапаном. Am J Cardiol. (2017) 110:2049–55. doi: 10.1016/j.amjcard.2017.03.038
Факторы, определяющие дисфункцию аортального клапана у корейских субъектов с двустворчатым аортальным клапаном. Am J Cardiol. (2017) 110:2049–55. doi: 10.1016/j.amjcard.2017.03.038PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
22. Kim D, Chae D, Shim CY, Cho IJ, Hong GR, Park K, et al. Прогнозирование прогрессирования заболевания у пациентов со стенозом двустворчатой аорты с помощью математического моделирования. Дж Клин Мед . (2019) 8:1302. doi: 10.3390/jcm80
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
23. Sun BJ, Oh JK, Lee SH, Jang JY, Lee JH, Lee S и другие. Среднесрочные клинические результаты в когорте бессимптомных или слабосимптомных корейских пациентов с двустворчатым аортальным клапаном в специализированной больнице третичного уровня. J Кардиоваскулярная визуализация . (2019) 27:105–18. doi: 10.4250/jcvi.2019.27.e19
PubMed Abstract | CrossRef Full Text
24.
 Michelena HI, Prakash SK, Corte AD, Bissell MM, Anavekar N, Mathieu P, et al. Исследователи BAVCon. Двустворчатый аортальный клапан: выявление пробелов в знаниях и ответ на вызов Международного консорциума по двустворчатому аортальному клапану (BAVCon). Тираж . (2014) 129:2691–704. doi: 10.1161/CIRCULATIONAHA.113.007851
Michelena HI, Prakash SK, Corte AD, Bissell MM, Anavekar N, Mathieu P, et al. Исследователи BAVCon. Двустворчатый аортальный клапан: выявление пробелов в знаниях и ответ на вызов Международного консорциума по двустворчатому аортальному клапану (BAVCon). Тираж . (2014) 129:2691–704. doi: 10.1161/CIRCULATIONAHA.113.007851PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
25. Borger MA, Fedak PWM, Stephens EH, Gleason TG, Girdauskas E, Ikonomidis JS, et al. Согласованное руководство Американской ассоциации торакальной хирургии по аортопатии, связанной с двустворчатым аортальным клапаном: полная онлайн-версия. J Торакальный сердечно-сосудистый хирург . (2018) 156:e41–74. doi: 10.1016/j.jtcvs.2018.02.115
PubMed Abstract | Полный текст перекрестной ссылки | Академия Google
26. Jilaihawi H, Chen M, Webb J, Himbert D, Ruiz CE, Rodés-Cabau J, et al. Классификация изображений двустворчатого аортального клапана для эпохи TAVR.
 JACC Cardiovasc Imaging . (2016) 9:1145–58. doi: 10.1016/j.jcmg.2015.12.022
JACC Cardiovasc Imaging . (2016) 9:1145–58. doi: 10.1016/j.jcmg.2015.12.022PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
27. Michelena HI, Desjardins VA, Avierinos JF, Russo A, Nkomo VT, Sundt TM, et al. Естественная история бессимптомных пациентов с нормально функционирующим или минимально дисфункциональным двустворчатым аортальным клапаном в сообществе. Тираж . (2008) 117:2776–84. doi: 10.1161/CIRCULATIONAHA.107.740878
PubMed Abstract | CrossRef Full Text
Аортальный стеноз у детей
Что такое аортальный стеноз у детей?
Аортальный стеноз означает, что у вашего ребенка сердечный клапан слишком узкий или заблокирован. Аортальный клапан — это 1 из 4 сердечных клапанов, обеспечивающих ток крови через сердце. Клапаны обеспечивают движение крови только в одном направлении. Аортальный клапан поддерживает ток крови из левого желудочка в аорту. Ваш ребенок может родиться с аортальным стенозом (врожденным).
 Или это может произойти позже (приобретенное). Встречается чаще у мальчиков, чем у девочек.
Или это может произойти позже (приобретенное). Встречается чаще у мальчиков, чем у девочек.Нормальный аортальный клапан имеет 3 створки (створки), которые действуют как односторонняя дверь. При аортальном стенозе клапан не работает должным образом или имеет ненормальное количество створок, которые работают неправильно. Это затрудняет раскрытие створок и прохождение крови из левого желудочка в аорту.
Аортальный стеноз может быть легким, умеренным или тяжелым. Это зависит от того, какая часть крови заблокирована. Состояние может ухудшаться со временем. Это может также произойти с другими проблемами или состояниями сердца.
Аортальный стеноз средней и тяжелой степени может поражать сердце и кровеносные сосуды следующим образом:
Со временем левый желудочек становится больше и не может хорошо перекачивать кровь в организм.
Аорта также может стать больше.
Коронарные артерии, которые направляют кровь к сердечной мышце, могут не получать достаточного количества крови.

Что вызывает аортальный стеноз у ребенка?
Ребенок может родиться с аортальным стенозом. Это означает, что аортальный клапан не сформировался должным образом до рождения. Иногда эта проблема вызвана генетической проблемой. Но в большинстве случаев причина этого неизвестна. У детей старшего возраста аортальный стеноз может возникнуть после нелеченной стрептококковой инфекции.
Какие симптомы аортального стеноза у ребенка?
Симптомы аортального стеноза зависят от возраста вашего ребенка. Они также различаются в зависимости от того, насколько серьезна закупорка. Например, у ребенка с легким аортальным стенозом может быть мало симптомов. Или у них может не быть никаких симптомов. Симптомы могут не проявляться до совершеннолетия. Или у ребенка могут быть проблемы с кормлением, и он может не набирать вес. При тяжелом (критическом) аортальном стенозе ребенку тяжело.
Тяжелый аортальный стеноз может вызвать:
Усталость или усталость
Посинение вокруг губ или кожи, указывающее на низкий уровень кислорода (цианоз)
Проблемы с подачей
Недостаточная прибавка в весе
Головокружение или предобморочное состояние, особенно при физической нагрузке
Обморок (обморок)
Одышка или учащенное дыхание
Нерегулярное сердцебиение или ощущение сердцебиения (сердцебиение)
Боль или давление в груди
Симптомы аортального стеноза могут быть такими же, как и при других заболеваниях.
 Убедитесь, что ваш ребенок посещает своего лечащего врача для постановки диагноза.
Убедитесь, что ваш ребенок посещает своего лечащего врача для постановки диагноза.Как диагностируется аортальный стеноз у ребенка?
Лечащий врач вашего ребенка мог услышать шум в сердце при прослушивании грудной клетки вашего ребенка с помощью стетоскопа. Шум в сердце — это ненормальный звук, когда кровь движется через сердце. Шумы в сердце могут означать, что у вашего ребенка порок сердца. Симптомы вашего ребенка также являются частью выяснения диагноза.
Вашему ребенку может потребоваться консультация детского кардиолога для подтверждения диагноза. Это врач со специальной подготовкой для лечения пороков сердца и других проблем с сердцем у детей. Ваш ребенок также может пройти такие тесты, как:
Рентген грудной клетки. Это дает общую картину сердца и легких вашего ребенка.
Электрокардиограмма (ЭКГ). Этот тест измеряет электрическую активность сердца.

Эхокардиограмма (Эхо). В этом тесте звуковые волны используются для получения движущегося изображения сердца и клапанов. Это один из лучших тестов на аортальный стеноз.
Катетеризация сердца. Этот тест показывает детали структуры сердца. Ваш ребенок будет проходить этот тест во сне. Врач введет тонкую гибкую трубку (катетер) в один из кровеносных сосудов вашего ребенка. Врач медленно направит катетер к сердцу. Может быть введен контрастный краситель, чтобы кардиолог мог рассмотреть более подробно.
Нагрузочное тестирование. Это позволяет врачу исследовать ЭКГ ребенка во время физической нагрузки.
Пульсоксиметрия. Этот неинвазивный тест измеряет уровень кислорода в крови с помощью датчика, помещенного на палец вашего ребенка.

Как лечится аортальный стеноз у ребенка?
Лечение будет зависеть от симптомов, возраста и общего состояния здоровья вашего ребенка. Это также будет зависеть от того, насколько тяжелым является состояние. Если у вашего ребенка нет симптомов или если симптомы легкие, лечащий врач может просто внимательно следить за симптомами. Это означает, что вашему ребенку могут часто потребоваться визиты в офис и анализы.
Детский кардиолог и кардиоторакальный хирург выяснят, нужна ли вашему ребенку операция на аортальном клапане. Процедуры включают:
Баллонная аортальная вальвулопластика. Это делается при катетеризации сердца с помощью катетера со спущенным баллоном на конце. Катетер вводят в кровеносный сосуд. Его перемещают к суженному клапану, и баллон надувают, чтобы открыть клапан. Многие провайдеры предпочитают эту процедуру.
Хирургическая аортальная вальвотомия.
 Это операция по удалению рубцовой ткани со створок аортального клапана. Это позволяет листочкам открываться так, как они должны.
Это операция по удалению рубцовой ткани со створок аортального клапана. Это позволяет листочкам открываться так, как они должны.Замена аортального клапана. Это операция по замене аортального клапана на новый. Запасные клапаны либо искусственные, либо из донорских органов или животных.
Легочный аутотрансплантат (процедура Росса). Это операция по замене аортального клапана и части аорты. Собственный легочный клапан вашего ребенка и часть легочной артерии используются для замены поврежденного аортального клапана. Клапан легочной артерии и часть легочной артерии от донорского органа используются для замены пересаженных клапана и артерии. Многие хирурги отдают предпочтение этому методу, потому что он хорошо работает по мере роста ребенка.
До процедур:
Ребенок с критическим аортальным стенозом будет помещен в отделение интенсивной терапии (ОИТ).
 Им может понадобиться срочный ремонт клапана. Младенцам, которые не так больны, процедура может быть запланирована.
Им может понадобиться срочный ремонт клапана. Младенцам, которые не так больны, процедура может быть запланирована.Ребенок с тяжелым аортальным стенозом может быть не в состоянии заниматься спортом. Это больше связано с видами спорта, которые имеют интенсивные или длительные периоды активности.
Какие возможны осложнения аортального стеноза у ребенка?
Возможные осложнения умеренного и тяжелого аортального стеноза включают:
Выпячивание или ослабление (аневризма) аорты
Разрыв (расслоение) аорты
Инфекция слизистой оболочки сердца, клапанов или кровеносных сосудов (инфекционный эндокардит)
Увеличение камер сердца (гипертрофия)
Сердце не может нормально сокращаться (сердечная недостаточность)
Смерть
Поговорите с лечащим врачом вашего ребенка о риске этих проблем.

Что я могу сделать, чтобы предотвратить аортальный стеноз у моего ребенка?
Врожденный аортальный стеноз нельзя предотвратить. Но всех новорожденных обследуют на наличие врожденных пороков сердца с помощью пульсоксиметрии. Это простой и безболезненный тест для проверки количества кислорода в крови. Это делается путем размещения небольшого датчика на руке и ноге ребенка. Если уровень кислорода низкий, это может означать наличие порока сердца. Если проблема будет обнаружена, будет проведено дополнительное тестирование и лечение.
Как я могу помочь моему ребенку жить с аортальным стенозом?
Большинство детей, перенесших операцию по восстановлению или замене аортального клапана, ведут активный и здоровый образ жизни. Уровень активности, аппетит и рост вашего ребенка обычно возвращаются к норме. Ваш ребенок должен получать регулярное последующее наблюдение у кардиолога на протяжении всей жизни. Вашему ребенку также может понадобиться:
Регулярные проверки артериального давления и лечение высокого кровяного давления.
 Убедитесь, что ваш ребенок принимает все лекарства, прописанные его лечащим врачом.
Убедитесь, что ваш ребенок принимает все лекарства, прописанные его лечащим врачом.Регулярный уход за зубами. Это необходимо для предотвращения инфекций, которые могут привести к сердечной инфекции (эндокардиту).
Ограниченная физическая активность. Поговорите с лечащим врачом вашего ребенка о безопасных занятиях для вашего ребенка.
Антибиотики перед процедурами. В том числе стоматологические работы. Это зависит от того, был ли у вашего ребенка ремонт или замена клапана.
Разбавители крови (антикоагулянты). Предотвращают образование тромбов на механическом клапане. Также проводятся анализы крови для проверки разбавителей крови.
Возможен повторный ремонт клапана или замена
Поговорите с лечащим врачом вашего ребенка о том, какие виды спорта безопасны.

Когда мне следует позвонить лечащему врачу моего ребенка?
Свяжитесь с лечащим врачом вашего ребенка, если вы заметили:
Если вашему ребенку была проведена процедура, обязательно следуйте всем инструкциям хирурга. И обязательно посещайте все последующие встречи с кардиологом и хирургом вашего ребенка.
Основные положения об аортальном стенозе у детей
Аортальный стеноз означает, что клапан в сердце вашего ребенка слишком узкий или заблокирован. Это состояние может быть легким, умеренным или тяжелым.
Распространенными симптомами являются усталость, проблемы с кормлением и недостаточное увеличение веса, головокружение, одышка, боль или дискомфорт в груди и учащенное сердцебиение.
Детский кардиолог обычно диагностирует и лечит аортальный стеноз.
Доступно несколько процедур для ремонта или замены аортального клапана.

Ближайшие родственники вашего ребенка должны обсудить со своими лечащими врачами необходимость скрининга на аортальный стеноз.
Ребенка с аортальным стенозом следует часто обследовать. Последующий уход необходим на протяжении всей жизни.
Следующие шаги
Советы, которые помогут вам получить максимальную отдачу от визита к поставщику медицинских услуг вашего ребенка:
Знайте причину визита и то, что вы хотите, чтобы произошло.
Перед посещением запишите вопросы, на которые вы хотите получить ответы.
При посещении запишите название нового диагноза и любых новых лекарств, методов лечения или тестов. Также запишите все новые инструкции, которые ваш поставщик дает вам для вашего ребенка.
Знайте, почему прописывается новое лекарство или лечение и как оно поможет вашему ребенку.

