Энтероколит новорожденных: Некротизирующий энтероколит новорожденных | Морозовская ДГКБ ДЗМ
Некротизирующий энтероколит новорожденных | Морозовская ДГКБ ДЗМ
Некротизирующий энтероколит новорожденных (НЭК) – тяжелое заболевание кишечника, возникающее на фоне перенесенной острой гипоксии, нарушения нормальной колонизации кишечника микрофлорой, приводящее к некрозу и перфорации кишечной стенки, перитониту.
Частота встречаемости 1 — 5 случаев на 1000 живорожденных детей. Чаще всего болеют недоношенные дети и дети с низкой массой тела при рождении.
Факторы приводящие к возникновению НЭК:
- Преждевременные роды
- Острая гипоксия в родах
- Заболевания легких
- Врожденные пороки сердца
- Рождение двойни
- Гемолитическая болезнь новорожденных
- «Агрессивное энтеральное кормление»
- Катетеризация пупочной вены
- Анемия новорожденных
- Охлаждение
- Наркозависимость матери
- Врожденные пороки развития – болезнь Гиршпрунга, гастрошизис, кишечная непроходимость.
Классификация НЭК по Bell (1978) в модификации Walsh and Kliegman (1987):
I стадия – начальных проявления: изменения поведения ребенка (возбудимость или вялость), вздутие живота, отделяемое по желудочному зонду, задержка стула.
I а – скрытая кровь в стуле
I б – явная кровь в стуле
II стадия – разгар заболевания: вялость, гипотония, адинамия, изменение частоты и глубины дыхания, учащенное сердцебиение, нарастание вздутия живота, отсутствие перистальтики кишечника, застойное отделяемое по желудочному зонду, задержка стула или увеличение патологических примесей (слизь, кровь) в стуле. Появляются рентгенологические признаки (пневматоз стенок кишечника), и ультрозвуковые признаки (снижение перистальтики, отек стенки кишки, появление статичной петли кишки).
II а – среднетяжелое течение
II б – тяжелое течение с симптомами системной интоксикации
III а – некроз кишечника без перфорации
III б – перфорация кишечника.
III стадия – развитие осложнений: септическое состояние ребенка, адинамия, тяжелые водно-электролитные нарушения, нарушения микроциркуляции, кровоточивость, склонность к тромбозам, напряжение и вздутие живота, отек и гиперемия передней брюшной стенки, контурирование подкожной венозной сети, отсутствие перистальтики кишечника. При ультразвуковом исследовании наличие свободной жидкости в брюшной полости, газа в портальной системе печени, выявление инфильтрата в брюшной полости, некротизированной пели кишки с обедненным кровотоком. На рентгенограмме неравномерное вздутие петель кишечника, свободный воздух в брюшной полости.
При ультразвуковом исследовании наличие свободной жидкости в брюшной полости, газа в портальной системе печени, выявление инфильтрата в брюшной полости, некротизированной пели кишки с обедненным кровотоком. На рентгенограмме неравномерное вздутие петель кишечника, свободный воздух в брюшной полости.
При обратимой стадии НЭК удается вылечить ребенка, не прибегая к оперативному пособию. Ребенок не кормится, устанавливается желудочный зонд, проводится инфузионная терапия, назначаются антибиотики, проводится иммунотерапия, профилактика тромбообразования.
В случае осложненного течения НЭК выполняют оперативное лечение лапароскопию, лапаротомию, резекция пораженного участка кишечника, формирование первичного анастомоза, выведение энтеростомы.
В послеоперационном периоде ребенок требует проведение интенсивной инфузионной и антибактериальной терапии, после восстановления работы кишечника осторожно вводят энтеральное кормление.
Применение современных методик диагностики и лечения НЭК, позволят сократить летальность при данной патологии. К отдаленным осложнениям НЭК относят синдром короткой кишки, стеноз кишки, синдром нарушения всасывания.
К отдаленным осложнениям НЭК относят синдром короткой кишки, стеноз кишки, синдром нарушения всасывания.
На качество жизни детей перенесших НЭК влияет сопутствующая патология, характерная для недоношенных детей: бронхо-легочная дисплазия, хронические заболевания легких, последствия перинатального поражения ЦНС, ретинопатия недоношенных, задержка физического и психомоторного развития.
Дополнительное применение аргинина для профилактики некротизирующего энтероколита у недоношенных новорожденных
В чем суть проблемы? Некротизирующий энтероколит (НЭК) — это состояние, при котором в желудочно-кишечном тракте (ЖКТ) младенца возникает воспаление. Частота НЭК колеблется от 4% до 22% у младенцев с очень низкой массой тела при рождении. Некротизирующий энтероколит может возникнуть в связи с незрелостью плода, недостатком кровотока в ЖКТ и нарушением целостности слизистой оболочки в результате инфекции или кормления молочной смесью. Для защиты ЖКТ организм выделяет естественное вещество — оксид азота из аминокислоты — аргинина.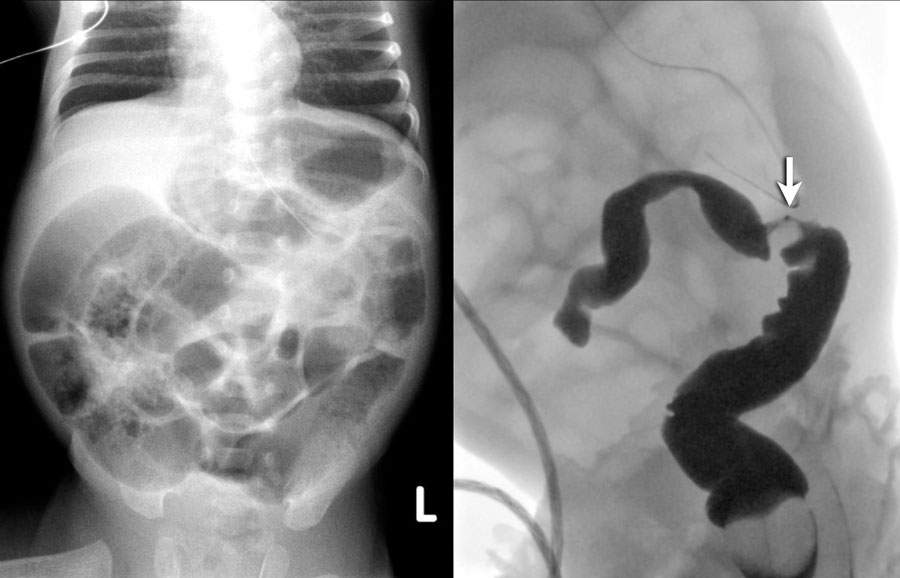 Есть информация, что концентрация аргинина в плазме у младенцев с очень низкой массой тела при рождении и у недоношенных младенцев, у которых развивается НЭК, достаточно низкая. Добавление аргинина к питанию может предотвратить НЭК.
Есть информация, что концентрация аргинина в плазме у младенцев с очень низкой массой тела при рождении и у недоношенных младенцев, у которых развивается НЭК, достаточно низкая. Добавление аргинина к питанию может предотвратить НЭК.
Почему это важно? НЭК может привести к необратимому повреждению кишечника, необходимости многократных операций, длительному пребыванию в больнице, смерти и увеличению затрат со стороны системы здравоохранения.
Какие доказательства мы обнаружили? Авторы обзора провели поиск литературы на предмет контролируемых исследований, в которых оценивали эффективность и безопасность дополнительного применения аргинина. Добавление аргинина к питанию недоношенного ребенка привело к снижению риска НЭК в трех исследованиях хорошего качества, включавших 285 младенцев, рожденных на сроке менее 34 недель гестации. Было необходимо пролечить шесть младенцев, чтобы один их них получил пользу от лечения. Исследователи сообщали об отсутствии значимых побочных эффектов, непосредственно связанных с дополнительным введением аргинина в первые 28 дней жизни, и в одном исследовании сообщали о отсутствии долгосрочной (36 месяцев) задержки развития.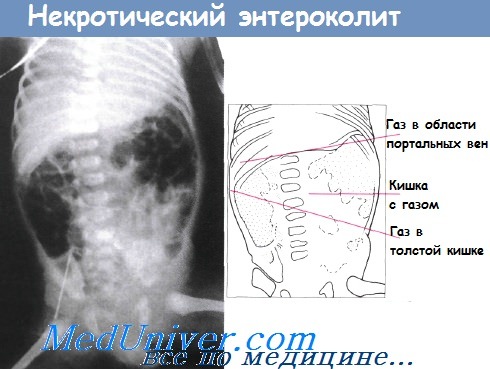 Возможные эффекты дополнительного применения аргинина включают в себя более низкое артериальное давление и изменения в показателях глюкозы в крови.
Возможные эффекты дополнительного применения аргинина включают в себя более низкое артериальное давление и изменения в показателях глюкозы в крови.
Что это значит? Дополнительное применение аргинина может уменьшить частоту и тяжесть НЭК у недоношенных младенцев. Результаты ограничены, поскольку исследования включали только небольшое число пациентов. Для проверки этих результатов необходимо крупное исследование, включающее младенцев из нескольких центров.
Журнал: «Медицина целевые проекты» статья: Консервативная терапия некротического энтероколита у новорожденных
Настороженность в отношении развития НЭК у детей группы риска, отработанный алгоритм лечения по стадиям процесса, ранняя диагностика осложнений НЭК, соблюдение правил введения энтеральной нагрузки, парентерального питания с постепенным переходом на энтеральное питание позволили уменьшить и остановить процесс на более ранних стадиях развития, уменьшить летальность в этой группе пациентов на 85%
Главный врач ГБУЗ Самарской области «Тольяттинская городская клиническая больница № 5», к. м.н., врач высшей квалификационной категории, заслуженный врач РФ Николай Ренц
м.н., врач высшей квалификационной категории, заслуженный врач РФ Николай Ренц
Заместитель главного врача по акушерству и гинекологии ГБУЗ СО «Тольяттинская городская клиническая больница № 5», к.м.н, врач высшей квалификационной категории Наталья Хуторская
Заведующий отделением реанимации и интенсивной терапии новорожденных межрайонного перинатального центра, врач высшей квалификационной категории Евгений Алексеевнин
Летальностьпри язвенно-некротическом энтероколите (НЭК) и перфорации желудочно-кишечного тракта составляет 40–80%, достигая 100% у пациентов с наиболее тяжелыми формами заболевания и сопутствующей патологией. Клиническое течение НЭК и перфораций желудочно-кишечного тракта (ЖКТ) у новорожденных сопровождается перитонитом, высоким внутрибрюшным давлением с развитием синдрома полиорганной недостаточности
Факторы риска
Патологическое течение беременности, применение женщиной во время беременности наркотических препаратов, асфиксия в родах, синдром дыхательных расстройств, значительное охлаждение ребенка, синдром малого сердечного выброса при врожденных пороках развития сердца, полицитемия, медикаменты, нарушающие мезентериальный кровоток (индометацин, витамин Е).
Клиническая картина
По течению заболевания выделяют следующие формы:
· Молниеносная форма.От первых нечетких симптомов дискомфорта в состоянии ребенка до возникновения перфорации проходит не более 1,5–2 суток.
· Острая форма.Заболевание начинается с ярко выраженных симптомов со стороны брюшной полости, отказа от еды, срыгивания и рвоты, вздутия живота, нарушения пассажа по кишечнику, что соответствует Iстадии. Вскоре присоединяются общесоматические симптомы, свидетельствующие об интоксикации и дисфункции жизненно важных органов и систем (IIcтадия). При неадекватности или неэффективности консервативной терапии заболевание может быстро перейти в IIIстадию развития процесса, что требует незамедлительного хирургического лечения.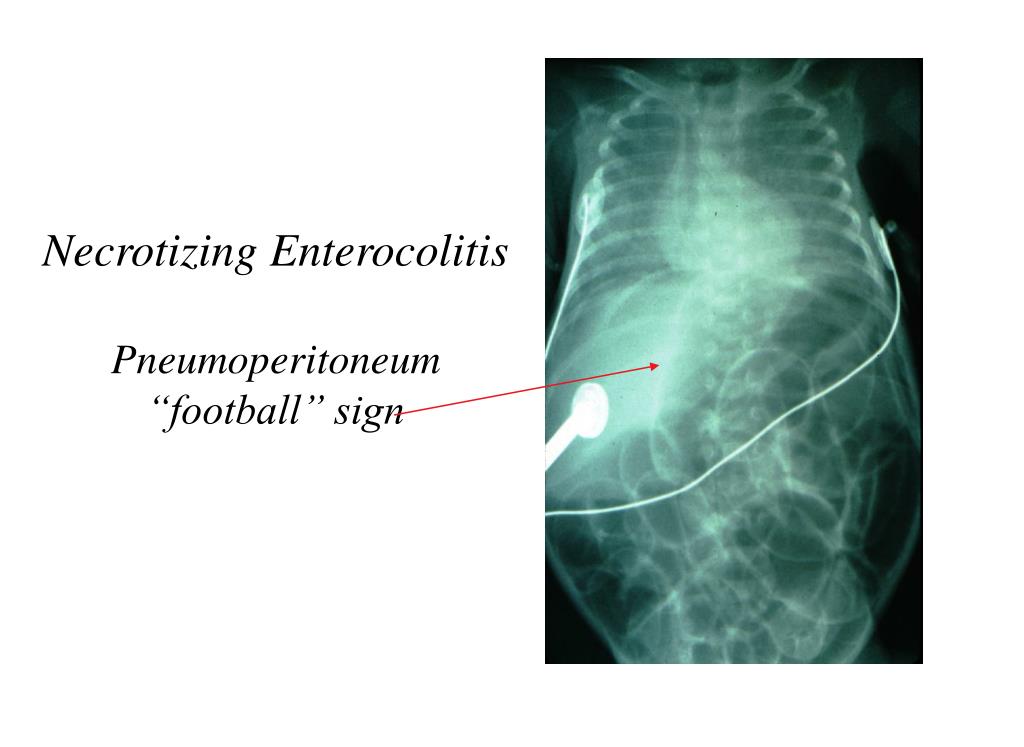
· Подострая форма.Симптомы со стороны ЖКТ появляются постепенно и имеют перемежающийся характер, т.е. периоды клинического благополучия сменяются дисфункцией органов ЖКТ.
В зависимости от распространенности процесса выделяют:
· локальную форму – поражение ограничено небольшим участком кишки;
· мультисегментарную форму – поражено несколько участков кишки;
· тотальное поражение кишечника,или паннекроз.
Молниеносная форма НЭК характерна для доношенных («крупных») детей, перенесших в родах асфиксию, а также для новорожденных с гемолитической болезнью (после повторных заменных переливаний крови) и для пациентов с пороками развития ЖКТ.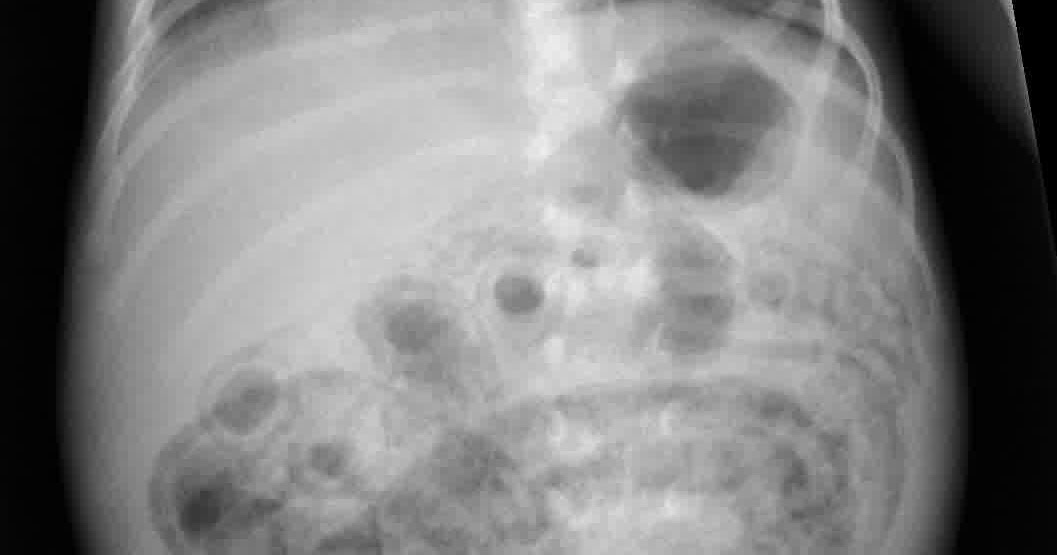 Первые симптомы заболевания при молниеносной форме НЭК появляются несколько раньше (на 3–5-й день жизни), чем при других вариантах течения болезни. Своевременная диагностика этой формы заболевания нередко затруднена из-за преморбидного фона и очень тяжелого общего состояния ребенка. Появление вздутия живота, беспокойство ребенка, резкое ухудшение лабораторных данных, свидетельствующих о воспалительном процессе, должны навести на мысль о возможном развитии НЭК. Такие дети требуют срочного осмотра хирурга и рентгенологического обследования.
Первые симптомы заболевания при молниеносной форме НЭК появляются несколько раньше (на 3–5-й день жизни), чем при других вариантах течения болезни. Своевременная диагностика этой формы заболевания нередко затруднена из-за преморбидного фона и очень тяжелого общего состояния ребенка. Появление вздутия живота, беспокойство ребенка, резкое ухудшение лабораторных данных, свидетельствующих о воспалительном процессе, должны навести на мысль о возможном развитии НЭК. Такие дети требуют срочного осмотра хирурга и рентгенологического обследования.
Острая формаНЭК характерна для недоношенных детей с массой более 1000 г. При этой форме чаще встречается локальное поражение тонкой кишки, причем от первых симптомов до возникновения перфорации кишки, обычно проходит 2–3 суток. Заболевание начинается остро на 10–28-й день жизни с появления признаков поражения ЖКТ. Быстро присоединяются или нарастают общесоматические симптомы, состояние прогрессивно ухудшается.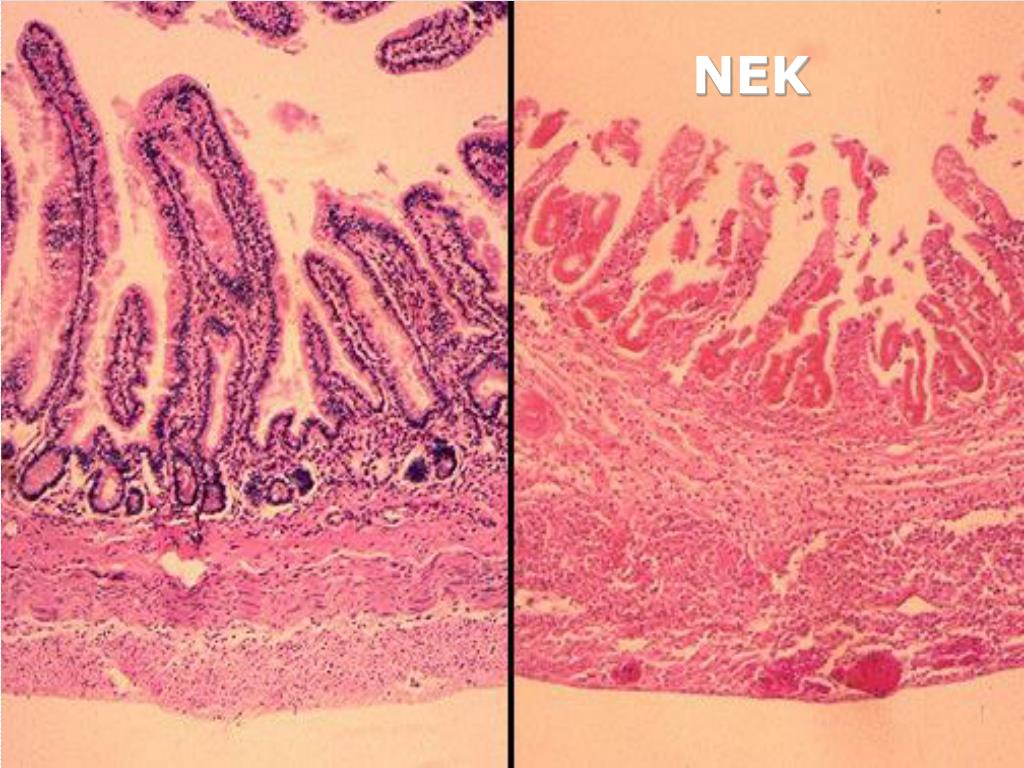 У больных выявляют локальное поражение тонкой кишки или некроз стенки желудка.
У больных выявляют локальное поражение тонкой кишки или некроз стенки желудка.
Подострая формахарактерна для глубоко недоношенных детей и детей с критически низкой массой тела. Первые симптомы появляются на 12–45-е сутки жизни. Ребенок перестает усваивать питание, начинает срыгивать, возникает вздутие живота, меняется характер стула: он может учащаться, в нем появляется примесь зелени и крови, а иногда, наоборот, становится более редким и прекращается вообще. При подострой форме НЭК нередко в последующем развивается частичная, а затем и полная кишечная непроходимость.
Диагностика
Консультация хирурга на всех этапах НЭК.
Рентгенологическое обследование:
Расширение кишечных петель – наиболее частый симптом. Значительное расширение кишечных петель и появление горизонтальных уровней свидетельствует о тяжести заболевания и его прогрессирующем течении.
Значительное расширение кишечных петель и появление горизонтальных уровней свидетельствует о тяжести заболевания и его прогрессирующем течении.
Пневматоз кишечной стенкиявляется одним из наиболее важных радиологических признаков НЭК. Этот симптом чаще возникает чаще у детей, уже получавших энтеральное питание, чем у пациентов, которые не кормились.
На рентгенограмме могут одновременно определяться два вида пневматоза – кистовидный и линейный.
Газ в воротной вене – очень грозный признак, часто свидетельствующий о далеко зашедшем процессе. Наличие газа в системе воротной вены встречается у детей с тотальным некрозом кишки и предопределяет неблагоприятный прогноз, поэтому наличие данного симптома является абсолютным показанием к хирургическому лечению. Наличие неподвижной (статичной) петли кишки, не изменяющей свое положение на повторных снимках, свидетельствует о кишечной ишемии. Сопоставление рентгенограмм, сделанных с некоторым интервалом во времени (6–8 часов), помогает дифференцировать обычное расширение кишечных петель от фиксированных и неподвижных участков. Этот симптом считается патогномоничным для некроза кишки, а соответственно, позволяющим ставить показания к операции.
Сопоставление рентгенограмм, сделанных с некоторым интервалом во времени (6–8 часов), помогает дифференцировать обычное расширение кишечных петель от фиксированных и неподвижных участков. Этот симптом считается патогномоничным для некроза кишки, а соответственно, позволяющим ставить показания к операции.
Снижение пневматизации и неравномерное газонаполнение кишечных петель позволяют продолжить консервативную терапию с тщательным контролем за состоянием ребенка и изменением рентгенологической картины. Внезапное появление на рентгенограммах признаков асцита является неблагоприятным фактором, говорящим о реакции брюшины на бактериальный перитонит, о возможной прикрытой перфорации кишки. Сочетание асцита и появления газа в воротной вене сопровождается высокой смертностью пациентов.
Пневмоперитонеум – скопление свободного газа в брюшной полости, чаще под куполами диафрагмы, у детей с НЭК неопровержимо свидетельствует о перфорации полого органа. Отсутствие на рентгенограмме газа в свободной брюшной полости при наличии перфорации объясняется тем, что перфорация может быть прикрытой или «открываться» в карман или полость сальниковой сумки, изолированные от свободной брюшной полости.
Отсутствие на рентгенограмме газа в свободной брюшной полости при наличии перфорации объясняется тем, что перфорация может быть прикрытой или «открываться» в карман или полость сальниковой сумки, изолированные от свободной брюшной полости.
УЗИ органов брюшнойполости и забрюшинного пространства – для выявления выпота в брюшной полости, инфильтратов, абсцессов.
Лапароцентез.Получение из брюшной полости при аспирация более чем 1,0 мл желто-коричневого или зеленого мутного содержимого свидетельствует о некрозе кишки.
Лабораторная диагностика – специфических тестов не существует.
Таким образом, основной целью обследования детей с НЭК является выявление всего комплекса клинических проявлений, позволяющих как можно раньше диагностировать заболевание и оперировать больных до развития перфорации кишки или желудка.
Абсолютные показания к хирургическому лечению
Появление в брюшной полости пальпируемого опухолевидного образования, свидетельствующего о наличии внутрибрюшного абсцесса или конгломерата спаянных между собой некротизированных кишечных петель.
Лечение некротического энтероколита зависит от стадии заболевания и степени выраженности симптомов и складывается из консервативного и хирургического этапов.
Консервативное лечение некротического энтероколита
1. Энтеральное питание – режим трофического кормления (1ml/kg – микроструйное введение) при НЭК 1 ст.
При малейшем подозрении на НЭК IIа ст. – отмена энтерального питания.
– отмена энтерального питания.
Постановка в желудок для декомпрессии постоянного назогастрального или орогастрального зонда (держать открытым).
2. Респираторная поддержка (ИВЛ, неинвазивная вентиляция легких).
3. Антибактериальная терапия (карбапенемы +гликопептиды иликомбинированные цефалоспорины).
Схемы введения антибактериальной терапии:
Карбапенемы: меропенем (меронем) – 20 мг/кг.
Менее 32 недель гестации – менее 14 дней – каждые 12 часов.
Старше 14 дней – каждые 8 часов.
Старше 32 недель гестации – 1–7 дней – каждые 12 часов.
Старше 7 дней – каждые 8 часов.
Тиенам (имипенем-циластатин) – 20–25 мг/кг каждые 12 часов.
Гликопептиды: ванкомицин (эдицин) – 15 мг/кг.
Менее 29 недель гестации – менее 14 дней – через18 часов.
Старше 14 дней – через 12 часов.
30–40 недель гестации – 0–14 дней – через 12 часов.
Старше 14 дней – через 8 часов .
При выделении вероятного инфекционного агента-возбудителя – смена антибактериальной терапии с учетом спектра его чувствительности.
4. Препарат глутамина для парентерального питания («Дипептивен» – 2 мл/кг).
5. Седация и аналгезия (наркотические аналгетики <фентанил – 1–3 мкг/кг/ч>),
Бензодиазепины (седуксен – 0,02–0,3 мг/кг), согласно шкале СRIES.
Натрия оксибутират (100–200 мг/кг/мин).
6. Добутамин – 2–5 мкгр/кг/ч. – с появления первых симптомов НЭК.
7. Полигаммаглобулины («Пентоглобин» – 5 мл/кг).
8. Гемо- и плазмотрансфузия по показаниям.
9. Целенаправленная терапия патологического состояния, которое было первичным у ребенка и потенцировало развитие НЭК.
10. Полное парэнтеральное питание (TPN).
Критерии для проведения TPN:
1. TPN проводится при развитии НЭК II–IIIстадии и продолжается в ранние сроки после хирургического лечения (3–5-е сутки).
2. Для назначения TPN необходимо добиться полной стабилизации состояния больного (коррекция метаболических нарушений и КОС, стабилизация гемодинамики, отмена планового наркотического обезболивания).
TPN начинают детям, рожденным с массой <1500 г, или новорожденным, которые не могут получить энтеральное питание, обеспечивающее им 80–90 ккал/кг/сут. к концу 1-й недели жизни.
к концу 1-й недели жизни.
Период энтерального голода недлительный (7–8 дней). Энтеральное кормление возобновляется с того момента, как у ребенка восстанавливается пассаж по кишечнику, исчезает вздутие живота, появляется стойкая тенденция к улучшению или нормализации лабораторных показателей и рентгенологических данных.
Наилучшим видом питания для новорожденного ребенка, конечно, является грудное молоко. Однако после тяжелых воспалительных заболеваний ЖКТ, длительной антибактериальной терапии развивается тяжелый дисбактериоз, в связи чем в качестве первой смеси для энтерального питания можно использовать смесь типа «Альфаре».
По мере повышения толерантности организма к вводимой смеси, стабилизации весовых прибавок ребенка постепенно переводят на вскармливание грудным молоком.
Профилактика некротического энтероколита
· Профилактика НЭК должна начинаться еще до рождения ребенка.
· Заместительная терапия внутривенным человеческим иммуноглобулином.
· «Пентаглобин».
· Оптимальный выбор антибактериальной терапии с лабораторным контролем ее эффективности.
· Соблюдение правил введения энтеральной нагрузки.
Выводы
1. К группе риска по развитию НЭК относятся недоношенные дети, перенесшие гипоксию, и дети, угрожаемые по развитию интранатальной и внутриутробной инфекции.
2. Новорожденные должны быть проконсультированы детским хирургом при появлении первых симптомов НЭК, до развития хирургических осложнений.
3. Улучшение результатов лечения НЭК возможно лишь при тесном взаимодействии врачей различных специальностей, занимающихся выхаживанием недоношенных детей.
445846, г. Тольятти, бульвар Здоровья, д. 25
Тел.: (8482) 79-00-00
Сайт: http://www.medvaz.tlt.ru
Некротизирующий энтероколит новорожденных Текст научной статьи по специальности «Клиническая медицина»
НЕКРОТИЗИРУЮЩИЙ ЭНТЕРОКОЛИТ НОВОРОЖДЕННЫХ
Чубарова А.И.
Российский национальный исследовательский медицинский университет имени Н.И. Пирогова
Чубарова Антонина Игоревна E-mail: <[email protected]>
CD
РЕЗЮМЕ
Некротизирующий энтероколит (НЭК) новорожденных представляет собой воспалительное заболевание кишечника и является одним из самых грозных заболеваний в неонатальной гастроэнтерологии. Средняя частота заболеваемости некротизирующим энтероколитом составляет 2,4:1000 новорожденных (от 1 до 10:1000), или около 2,1% (от 1 до 7%) от общего числа детей, поступающих в неонатальные отделения интенсивной терапии. Частота встречаемости заболевания нарастает с уменьшением срока гестации ребенка при рождении. На долю доношенных новорожденных приходится 10-20% случаев заболевания НЭК. В работе обобщены результаты собственных исследований и данных литературы, посвященных этой проблеме.
Средняя частота заболеваемости некротизирующим энтероколитом составляет 2,4:1000 новорожденных (от 1 до 10:1000), или около 2,1% (от 1 до 7%) от общего числа детей, поступающих в неонатальные отделения интенсивной терапии. Частота встречаемости заболевания нарастает с уменьшением срока гестации ребенка при рождении. На долю доношенных новорожденных приходится 10-20% случаев заболевания НЭК. В работе обобщены результаты собственных исследований и данных литературы, посвященных этой проблеме.
Ключевые слова: некротизирующий энтероколит; новорожденный; дети.
summary
Necrotizing enterocolitis (NEC) is a neonatal inflammatory bowel disease and is one of the most threatening disease in neonatal gastroenterology. The average incidence of necrotizing enterocolitis 2,4:1000 infants (1 to 10:1000), or about 2.1% (from 1 to 7%) of the total number of children entering the neonatal intensive care unit. The incidence of disease increases with decreasing gestational age at birth. The share of full-term infants accounts for 10-20% of cases of NEC. This paper summarizes the results of own researches and the literature dedicated to this problem. Keywords: necrotizing enterocolitis; newborn; children.
The incidence of disease increases with decreasing gestational age at birth. The share of full-term infants accounts for 10-20% of cases of NEC. This paper summarizes the results of own researches and the literature dedicated to this problem. Keywords: necrotizing enterocolitis; newborn; children.
ЭТИОЛОГИЯ И ПАТОГЕНЕЗ
Некротизирующий энтероколит (НЭК) новорожденных представляет собой воспалительное заболевание кишечника, является одним из самых грозных заболеваний в неонатальной гастроэнтерологии. Средние показатели летальности при НЭК составляют от 10 до 45% и зависят, помимо степени зрелости, также от стадии и распространенности процесса. Дети, развившие перфорации кишечника и перитонит, имеют наиболее высокую летальность, особенно при распространении воспалительного процесса на тощую кишку и проксимальнее: на 12-перстную кишку и желудок (до 63%).
Средняя частота заболеваемости некротизирующим энтероколитом составляет 2,4:1000 новорожденных (от 1 до 10:1000), или около 2,1%
(от 1 до 7%) от общего числа детей, поступающих в неонатальные отделения интенсивной терапии. Частота встречаемости заболевания нарастает с уменьшением срока гестации ребенка при рождении. На долю доношенных новорожденных приходится 10-20% случаев заболевания НЭК.
Частота встречаемости заболевания нарастает с уменьшением срока гестации ребенка при рождении. На долю доношенных новорожденных приходится 10-20% случаев заболевания НЭК.
НЭК рассматривают как полиэтиологическое воспалительное заболевание кишечника. К факторам риска развития НЭК относят: 1) недоношенность, 2) гипоксию/асфиксию, 3) бактериальную колонизацию кишечника патогенной микрофлорой, 4) энтеральное питание.
Недоношенность как таковая может являться благоприятным фоном для развития заболевания в связи с:
• большей частотой внутриутробной гипоксии и асфиксии в родах;
• особенностями формирования биоценоза кишечника в условиях проведения интенсивной терапии;
• особенностями взаимодействия клеток кишечника с иммунокомпетентными клетками у новорожденных и избыточной активностью воспалительного ответа,
• незрелостью нервной системы кишечника и механизмов регуляции моторики кишечника;
• нарушением механизмов адаптации к энтераль-ному питанию у недоношенных в связи с незрелостью и отсутствием раннего естественного вскармливания;
• несовершенством местного иммунитета. Одним из ведущих звеньев патогенеза НЭК, по
Одним из ведущих звеньев патогенеза НЭК, по
мнению большинства авторов, является нарушение микроциркуляции в кишечнике. Гипоксия, особенно внутриутробная, может существенно изменять кровоснабжение желудочно-кишечного тракта. У детей, перенесших внутриутробную гипоксию, изменения кровотока в системе мезентериальных сосудов сохраняются и постнатально, при этом в этой группе детей гораздо чаще (в 86% по сравнению с 24% в контрольной группе) встречаются симптомы дизадаптации желудочно-кишечного тракта к энтеральному питанию. Гипоксия как мощный стрессорный фактор активирует иммунную систему, что отражается в повышении синтеза провоспали-тельных цитокинов и других регуляторных веществ. Однако ишемия кишечной стенки не является единственным патогенетическим фактором при НЭК. Клинические и патоморфологические изменения при НЭК свидетельствуют о синергизме действия ишемии и бактериальных факторов агрессии в ходе развития заболевания.
Ишемия с последующей реперфузией способствует поддержанию повышенной проницаемости кишечной стенки, характерной для недоношенных детей.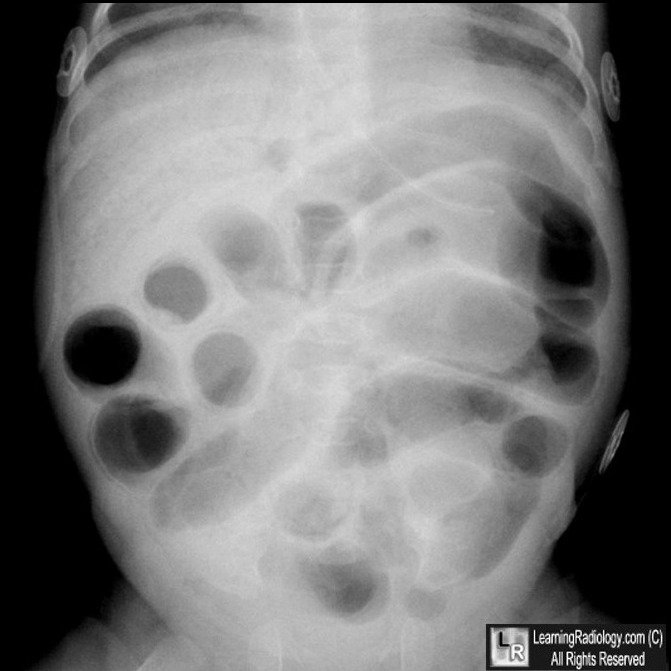 Повышенная проницаемость облегчает транслокацию бактерий в стенку кишки, а затем в системный кровоток. Важно при этом, что массивное обсеменение полости кишечника бактериями может привести к транслокации даже при отсутствии изменения проницаемости и нарушений межклеточных контактов, например у ряда доношенных детей с НЭК.
Повышенная проницаемость облегчает транслокацию бактерий в стенку кишки, а затем в системный кровоток. Важно при этом, что массивное обсеменение полости кишечника бактериями может привести к транслокации даже при отсутствии изменения проницаемости и нарушений межклеточных контактов, например у ряда доношенных детей с НЭК.
У детей с НЭК в высоком проценте случаев высеваются микроорганизмы, способные оказывать повреждающее действие на стенку кишки: E. coli, Klebsiella, Staphilococcus, Bactеroides fra-gilis, Clostridium perfringens, Clostridium deficile, Enterobacter. Однако статистический анализ факторов риска возникновения НЭК не позволяет выявить какой-либо один микроорганизм, обсеменение которым являлось бы независимым фактором риска возникновения энтероколита. Особая роль в инициации воспалительного процесса в кишечной стенке при НЭК принадлежит липополисахариду (ЛПС)
грамотрицательных бактерий. Содержание ЛПС в стуле детей с НЭК существенно выше, чем у детей без НЭК; отмечается также разница выраженности экскреции липополи-сахарида со стулом при разных стадиях заболевания. ЛПС в результате взаимодействия с ТЬВ.2-рецепторами на энтероците активирует продукцию циклооксигеназы 2, обеспечивающей реакции синтеза про-стагландинов, тромбоксанов и лейкотриенов в энтероците. При НЭК обнаружен более высокий уровень (по сравнению с уровнем при пороках развития кишки) интерлейкина 1Р (1Ь-1Р), более высокий уровень шВ.ЫЛ фактора некроза опухоли а (ТМБ-а), 1Ь-8, И-11, Н-18, И-12. 84% детей с НЭК имеют все признаки не только локальной, но и системной воспалительной реакции, при развитии перфораций кишечника частота встречаемости системной воспалительной реакции достигает 100%.
Содержание ЛПС в стуле детей с НЭК существенно выше, чем у детей без НЭК; отмечается также разница выраженности экскреции липополи-сахарида со стулом при разных стадиях заболевания. ЛПС в результате взаимодействия с ТЬВ.2-рецепторами на энтероците активирует продукцию циклооксигеназы 2, обеспечивающей реакции синтеза про-стагландинов, тромбоксанов и лейкотриенов в энтероците. При НЭК обнаружен более высокий уровень (по сравнению с уровнем при пороках развития кишки) интерлейкина 1Р (1Ь-1Р), более высокий уровень шВ.ЫЛ фактора некроза опухоли а (ТМБ-а), 1Ь-8, И-11, Н-18, И-12. 84% детей с НЭК имеют все признаки не только локальной, но и системной воспалительной реакции, при развитии перфораций кишечника частота встречаемости системной воспалительной реакции достигает 100%.
НЭК развивается в 70-80% случаев после начала энтерального питания, поэтому принято факт наличия энтерального питания относить к факторам риска развития НЭК. Однако возможно возникновение заболевания и на полном парентеральном питании (ППП). Практика последних десятилетий, а также ряд научных работ доказывают важную роль практики вскармливания в развитии НЭК. Более осторожное назначение энтерального питания под строгим контролем усвоения снизило частоту возникновения заболевания во многих неонатальных центрах. В настоящее время не вызывает сомнений необходимость строгого клинического и лабораторного контроля за усвоением энтерального питания недоношенными детьми.
Практика последних десятилетий, а также ряд научных работ доказывают важную роль практики вскармливания в развитии НЭК. Более осторожное назначение энтерального питания под строгим контролем усвоения снизило частоту возникновения заболевания во многих неонатальных центрах. В настоящее время не вызывает сомнений необходимость строгого клинического и лабораторного контроля за усвоением энтерального питания недоношенными детьми.
Увеличение доли грудного молока в питании детей с очень низкой массой тела снижает частоту НЭК и сепсиса по сравнению с детьми, вскармливаемыми смесями для недоношенных. Частота НЭК падает прямо пропорционально в зависимости от доли грудного молока в питании недоношенных. Профилактическая роль естественного вскармливания заключается, вероятно, в способности снижать провоспалительный ответ и обеспечивать репарацию слизистой.
НЭК гистологически характеризуется воспалением и обширным повреждением тканей стенки кишки. Специфичными гистопатологическими изменениями на начальных стадиях являются отек и отслойка эпителия ворсин, выраженная лейкоцитарная инфильтрация, затем появляются признаки деструкции ворсин, отека подслизи-стой оболочки, появление в ней микрогеморрагий, микротромбозов, стаза крови в капиллярах. При тяжелом течении может произойти полное исчезновение структуры ворсинок, изъязвления слизистой, визуализируются пузырьки газа (пневматоз), в
Специфичными гистопатологическими изменениями на начальных стадиях являются отек и отслойка эпителия ворсин, выраженная лейкоцитарная инфильтрация, затем появляются признаки деструкции ворсин, отека подслизи-стой оболочки, появление в ней микрогеморрагий, микротромбозов, стаза крови в капиллярах. При тяжелом течении может произойти полное исчезновение структуры ворсинок, изъязвления слизистой, визуализируются пузырьки газа (пневматоз), в
Ü 3<
ш
<
OJ
подслизистой оболочке и под серозной оболочкой. Пневматоз кишечной стенки часто обнаруживается при НЭК у новорожденных, но не является специфическим симптомом, так как встречается и при других патологиях и в более старшем возрасте. Некоторые авторы расценивают пневматоз желудка как маркер фульминантного течения НЭК. Серозная оболочка утолщается за счет отека. На стадии прогрессирования на фоне диффузного воспаления кишечной стенки возникают участки некроза и перфорации. При прогрессировании процесса развивается трансмуральный некроз кишечной стенки с последующей перфорацией. В некоторых случаях множественные некротические сегменты кишки перемежаются с пораженными, но жизнеспособными тканями. Как при наличии перфорации, так и при массивном некрозе кишки без перфорации развивается перитонит.
Серозная оболочка утолщается за счет отека. На стадии прогрессирования на фоне диффузного воспаления кишечной стенки возникают участки некроза и перфорации. При прогрессировании процесса развивается трансмуральный некроз кишечной стенки с последующей перфорацией. В некоторых случаях множественные некротические сегменты кишки перемежаются с пораженными, но жизнеспособными тканями. Как при наличии перфорации, так и при массивном некрозе кишки без перфорации развивается перитонит.
Наиболее частой локализацией перфораций являются терминальный отдел подвздошной кишки, слепая кишка, печеночный и селезеночные углы толстой кишки.
У больных с НЭК выявлены типичные симптомы вторичной нейронной дисплазии. Обнаруживаются дегенеративные изменения подслизистого и межмышечного сплетения нервной системы кишки. Сплетения теряют глиальные клетки и нейроны, в ганглиях обнаруживаются участки лизиса в
центре, ганглии напоминают «пустые корзины».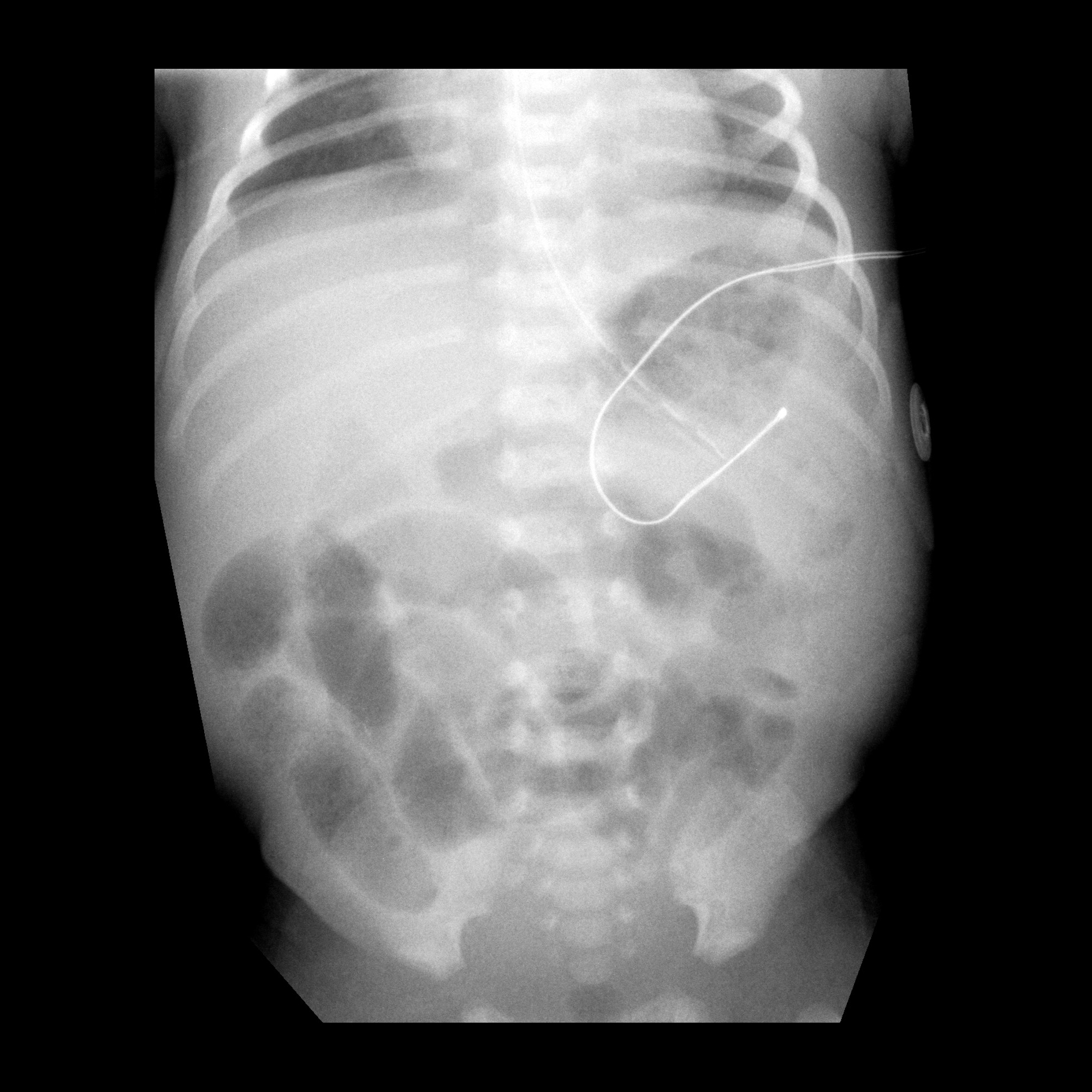 Обнаруживаются повреждения, напоминающие фокальный аганглиоз. Снижается продукция ин-гибирующих мышечный тонус нейромедиаторов: вазоактивного интестинального пептида и оксида азота. Изменения в подслизистом сплетении доминируют, и они тем выраженнее, чем сильнее повреждение слизистой. Таким образом, при НЭК наблюдаются дегенеративные изменения нервных сплетений кишечника, возможно, вторичные по отношению к гипоксемии.
Обнаруживаются повреждения, напоминающие фокальный аганглиоз. Снижается продукция ин-гибирующих мышечный тонус нейромедиаторов: вазоактивного интестинального пептида и оксида азота. Изменения в подслизистом сплетении доминируют, и они тем выраженнее, чем сильнее повреждение слизистой. Таким образом, при НЭК наблюдаются дегенеративные изменения нервных сплетений кишечника, возможно, вторичные по отношению к гипоксемии.
Процессы репарации в кишечной стенке в период реконвалесценции происходят медленно. Деструктивные изменения слизистой (отек, отслойка эпителия ворсин) могут сохраняться до месяца и более. В исходе воспаления в некоторых фрагметах кишки могут формироваться участки стеноза.
Классификация НЭК предложена впервые в 1978 году M. Bell и соавторами. Согласно классификации Белла, различают следующие стадии НЭК:
I стадия:
1. наличие крови в стуле;
наличие крови в стуле;
2. большой остаточный объем в желудке при зондовом питании;
3. вздутие и напряжение живота, пальпация плотных петель кишечника;
4. на рентгенограмме — растяжение кишечных петель, пневматоз кишки.
КЛАССИФИКАЦИЯ НЕКРОТИЗИРУЮЩЕГО ЭНТЕРОКОЛИТА (НЭК) (M. WALsH, R. KLEIGMAN, 1986)
Стадии течения НЭК Симптомы
общие со стороны ЖКТ Rg-логические
Подозреваемый НЭК 1А Неустойчивая 1°, апноэ, брадикардия, вялость. Незначительное вздутие живота Кишечные петли обычные или расширены, возможно появление горизонтальных уровней жидкости
1Б Те же Те же + примесь крови в кале Те же
Явный НЭК 2А обратимая стадия Те же Те же + парез кишечника с или без реакции на пальпацию живота Расширение кишечных петель с множественными горизонтальными уровнями, пневматоз кишечной стенки
2Б необратимая стадия Те же + умеренно выраженный ацидоз и тромбо-цитопения Те же Те же + газ в воротной вене, асцит
Прогрессирующий НЭК ЗА Те же + смешанный ацидоз, тромбоцитопения, ней-тропения, артериальная гипотензия, коагуляцион-ные нарушения Разлитой перитонит, резкое вздутие живота, кровавый стул, парез кишечника с реакцией на пальпацию живота Расширение кишечных петель, множественные горизонтальные уровни, пневматоз кишечной стенки, газ в воротной вене, выраженный асцит
ЗБ Те же + ДВС-синдром Разлитой перитонит, резкое вздутие живота, кровавый стул, парез кишечника с реакцией на пальпацию живота. Расширение кишечных петель, множественные горизонтальные уровни, пневматоз кишечной стенки, газ в воротной вене, выраженный асцит, пневмоперитонеум
Расширение кишечных петель, множественные горизонтальные уровни, пневматоз кишечной стенки, газ в воротной вене, выраженный асцит, пневмоперитонеум
II стадия:
1. нарастание увеличения живота и напряжения передней брюшной стенки, ее покраснение или цианоз на фоне ухудшения состояния;
2. нарастающие тромбоцитопения и ацидоз;
3. на рентгенограмме — наличие жидкости в брюшной полости.
III стадия:
1. развитие перфорации и перитонита;
2. развитие шока.
В последующем предложена классификация Walsh и Kleigman (1986), учитывающая стадийные изменения общеклинических, гастроэнтерологических и рентгенологических симптомов (см. табл.).
табл.).
КЛИНИКА НЭК
В отечественной практике в клиническом течении НЭК принято выделять 4 стадии. Принципиальным отличием от классификации Бэлла является выделение стадии продрома, когда нет достоверных признаков НЭК. Большой вклад в изучение проблемы НЭК внесли представители отечественной школы детских хирургов, в частности Т.В. Красовская. Выделение данной стадии снижает риск несвоевременной диагностики и позволяет вовремя изменить тактику ведения больного.
1. Стадия продрома.
• Вздутие живота.
• Увеличивается объем застойного содержимого в желудке.
• Срыгивание.
• Стул зеленый со слизью.
• Иногда сначала появляются симптомы со стороны дыхательной системы — увеличивается работа дыхания, требуются более жесткие параметры ИВЛ, возникают приступы апноэ.
2. Стадия клинических проявлений. Вялое сосание.
Частое срыгивание, в том числе с примесью желчи.
Потеря в весе. Урежение стула.
Кровь в стуле (определяемая визуально или по реакции на скрытую кровь). Иногда стул жидкий, развивается эксикоз.
3. Стадия предперфорации. Рвота кишечным содержимым и желчью. Рвота «кофейной гущей». Резкое вздутие живота.
Напряжение, болезненность передней брюшной стенки.
Отечность, синюшность передней брюшной стенки.
Перистальтика вялая или ее нет. Стула нет или скудный с алой кровью. Анус сомкнут, легкая ранимость слизистой кишки.
4. Стадия перфорации и перитонита. Перитонеальный шок.
Признаки наличия воздуха в брюшной полости.
Детей с НЭК следует рассматривать как группу высокого риска по развитию сепсиса. У 84% детей с НЭК выявляются признаки системной воспалительной реакции. У 60% детей в период течения НЭК выявляются другие гнойно-воспалительные заболевания. Как минимум у 75% детей с НЭК наблюдается полиорганная недостаточность с вовлечением 2 и более систем; для НЭК типичны нарушения кислотно-щелочного равновесия — метаболический ацидоз, гипо- и гипергликемия, ДВС-синдром. Частота встречаемости системного воспаления и полиорганной недостаточности нарастает с прогресси-рованием заболевания.
Течение заболевания чаще циклическое, однако возможны рецидивы заболевания, в том числе после закрытия кишечных стом.
Диагностика основана на оценке вышеназванных факторов риска, клинической картины, рентгенологическом исследовании. Также используется ультразвуковое исследование брюшной полости, в сомнительных случаях — лапароцентез.
Рентгенологические признаки НЭК.
1. Расширение кишечных петель (55100% случаев).
2. Снижение газонаполнения и асимметричное расположение кишечных петель
3. Пневматоз кишечной стенки (19-98%).
4. Газ в портальной системе (61% при тотальном поражении).
5. Пневмоперитонеум (12-30%).
6. Жидкость в брюшной полости (11%), косвенными признаками наличия которой являются:
• сильное вздутие живота при отсутствии газонаполнения кишечных петель;
• переполненные газом петли кишечника в центре
брюшной полости;
• разделение кишечных петель.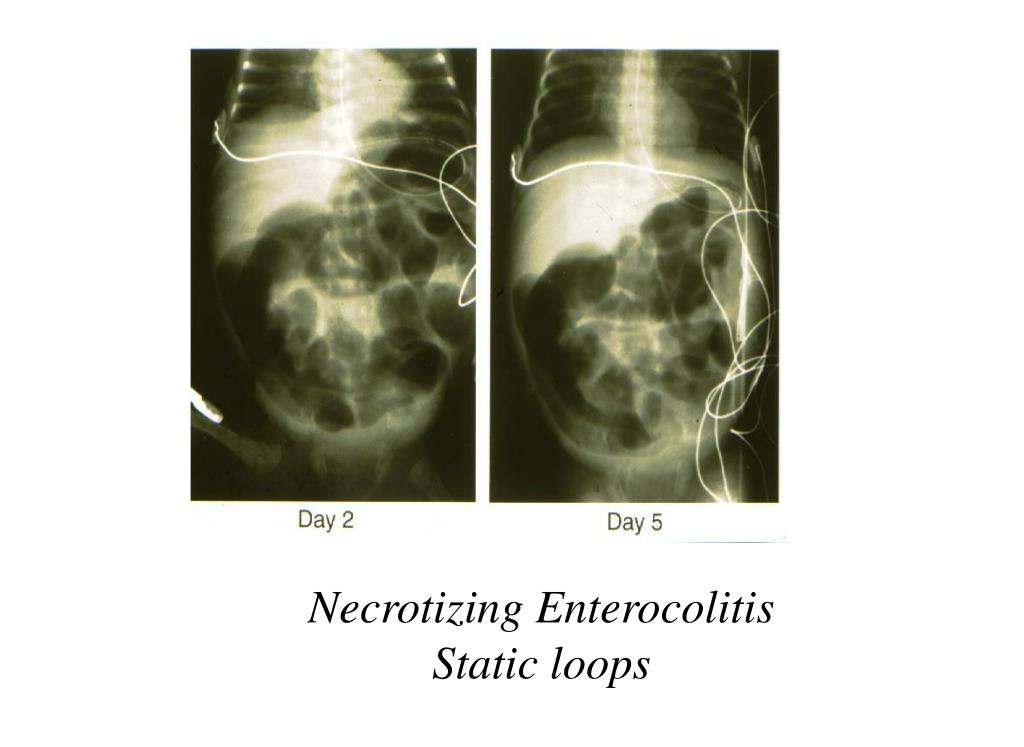
1. Персистирующая дилатация кишечных петель.
2. Наличие неподвижной (статичной) петли.
3. Токсическая дилатация толстой кишки.
4. Расширение желудка.
Рентгеноконтрастное исследование с метриза-мидом используется для диагностики перфорации полого органа. В стадии реконвалесценции и при подготовке к оперативному вмешательству по закрытию ранее наложенной кишечной стомы для оценки проходимости кишечника используется рентгеноконтрастное исследование отводящего отдела.
При ультразвуковом исследовании брюшной полости также могут быть выявлены газ в брюшной полости, наличие жидкости, симптом «мишени», утолщение стенок кишечных петель, пневматоз, газ в системе портальной вены. .
.
Для комплексной диагностики и мониторинга состояния оценивается наличие следующих данных дополнительных методов обследования:
1. Признаков воспалительной реакции в клиническом анализе крови (лейкоцитоз или лейкопения, нейтрофилез или нейтропения, лимфопения, сдвиг формулы влево, тромбоцитопения).
2. По данным биохимического анализа крови — воспалительного синдрома (повышение С-реактивного белка, прокальцитонина, a2-фракции глобулинов), гипонатриемии, признаков нарушения экскреторной функции почек, синдрома цитолиза, синдрома холестаза.
3. Метаболического ацидоза по данным КОС.
4. Положительная реакция на скрытую кровь в кале.
5. Признаков ДВС-синдрома в коагулограмме.
6. Положительных результатов посева крови.
7. Для подбора адекватной антибактериальной терапии показано проведение посевов из ануса, кишечной стомы (при ее наличии) с определением антибиотикочувствительности микрофлоры. Желательно определение метаболитов анаэробной флоры и грибов в крови.
ЛЕЧЕНИЕ
При подозрении на НЭК немедленно проводят следующие консервативные мероприятия:
1. Прекращают энтеральное питание и отменяют прием препаратов per os.
2. Проводят декомпрессию желудка (назо- или орогастральный зонд открывают и опускают отверстие зонда ниже уровня желудки ребенка, объем и характер отделяемого фиксируют).
3. Проводят посиндромную терапию: респираторную поддержку, купирование нарушений гемодинамики, коррекцию КОС, электролитных нарушений, эксикоза, нарушений гемостаза, болевого синдрома.
4. Проводят полное парентеральное питание (соответственно постконцептуальному возрасту и с учетом наличия сепсиса, полиорганной недостаточности).
5. Текущие антибиотики заменяют с учетом возможной роли анаэробной флоры в сочетании с госпитальными штаммами Гр- и Гр+ бактерий с последующей сменой с учетом чувствительности.
Проведение очистительных клизм при энтероколите может спровоцировать перфорацию кишечника.
Показания к хирургическому лечению:
1. Опухолевидное образование брюшной полости.
2. Воспалительные изменения брюшной стенки. Уплотнение, отек или фиброзное воспаление подкожной клетчатки брюшной стенки — грозные признаки, которые обычно появляются при наличии подлежащего абсцесса, перитонита или гангрены кишки.
3. Специфическая рентгенологическая картина (пневмоперитонеум, признаки асцита, симптом «статичной петли»).
4. Лабораторные данные. Остро возникшая тромбоцитопения, коагуляционные нарушения, тяжелая гипонатриемия и стойкий ацидоз подтверждают наличие некроза кишечной стенки.
5. Абдоминальный парацентез. О некрозе кишечной стенки свидетельствуют следующие данные: мутная жидкость коричневого цвета, выявление при окраске по Граму внеклеточных бактерий, большое число лейкоцитов, преобладание нейтрофилов — более 80%.
Возобновление ЭП у больных с НЭК проводится постепенно. Назначение ЭП возможно в случае полного купирования болевого синдрома, отсутствия признаков раздражения брюшины, синдрома срыгивания, геморрагического синдрома, восстановления перистальтики (обычно не ранее 3 суток), купирования системного воспаления и ДВС-синдрома.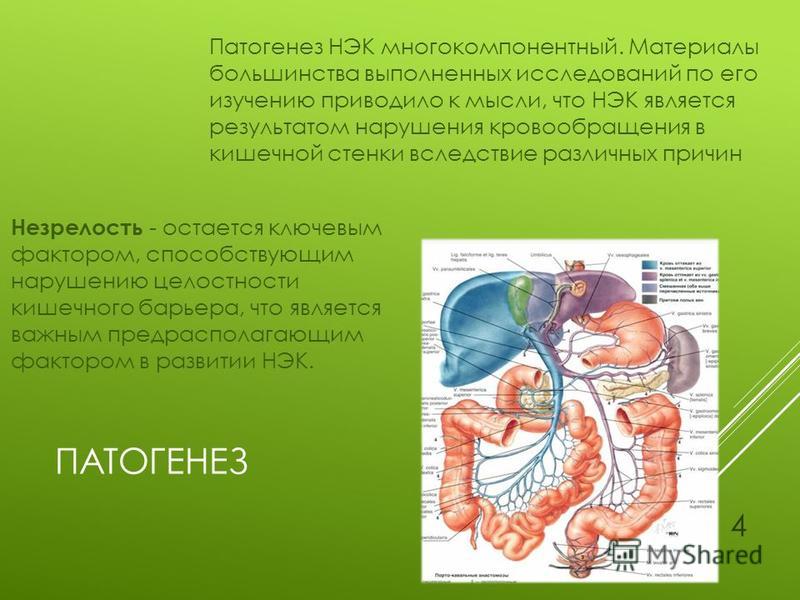 После устранения перечисленных клинических симптомов возможно начало энте-рального питания. В ряде учреждений предваряют питание введением изоосмолярной жидкости: физиологического раствора или глюкозо-солевого раствора в объеме, соответствующем трофическому питанию (около 0,5 мл/кг/час), в течение 0,5-1 суток. При удовлетворительном усвоении жидкости: отсутствии застойного содержимого в желудке, срыгивания, нарастания вздутия живота, сохранении удовлетворительной перистальтики, наличии самостоятельного стула без примеси крови возможно назначение продуктов для эн-терального питания. Появление перечисленных симптомов НЭК на любом из этапов проведения питания является показанием к его отмене и возобновлению полного парентерального питания. В качестве первого продукта для энтерального питания в случае наличия молока у матери возможно назначение нативного грудного молока собственной матери в сочетании с препаратами лактазы. При отсутствии нативного грудного молока после периода парентерального питание предпочтительно вскармливание смесями на основе гидролизата белка высокой степени в разведении водой 3:1 (25%-ная смесь), затем 1:1 (50%-ная смесь), потом в стандартной концентрации.
После устранения перечисленных клинических симптомов возможно начало энте-рального питания. В ряде учреждений предваряют питание введением изоосмолярной жидкости: физиологического раствора или глюкозо-солевого раствора в объеме, соответствующем трофическому питанию (около 0,5 мл/кг/час), в течение 0,5-1 суток. При удовлетворительном усвоении жидкости: отсутствии застойного содержимого в желудке, срыгивания, нарастания вздутия живота, сохранении удовлетворительной перистальтики, наличии самостоятельного стула без примеси крови возможно назначение продуктов для эн-терального питания. Появление перечисленных симптомов НЭК на любом из этапов проведения питания является показанием к его отмене и возобновлению полного парентерального питания. В качестве первого продукта для энтерального питания в случае наличия молока у матери возможно назначение нативного грудного молока собственной матери в сочетании с препаратами лактазы. При отсутствии нативного грудного молока после периода парентерального питание предпочтительно вскармливание смесями на основе гидролизата белка высокой степени в разведении водой 3:1 (25%-ная смесь), затем 1:1 (50%-ная смесь), потом в стандартной концентрации. После полного купирования воспалительного процесса и перевода на полное энтеральное питание смесями на основе гидролизата белка недоношенным постепенно вводятся смеси для недоношенных детей, доношенным детям — стандартные адаптированные смеси или безлактозные смеси в зависимости от наличия вторичной лактазной недостаточности. По показаниям назначаются панкреатические ферменты, проводится коррекция дисбиотических нарушений. Вскармливание детей, перенесших в связи с перфорацией или некрозом кишечника оперативное вмешательство, проводится по соответствующим
После полного купирования воспалительного процесса и перевода на полное энтеральное питание смесями на основе гидролизата белка недоношенным постепенно вводятся смеси для недоношенных детей, доношенным детям — стандартные адаптированные смеси или безлактозные смеси в зависимости от наличия вторичной лактазной недостаточности. По показаниям назначаются панкреатические ферменты, проводится коррекция дисбиотических нарушений. Вскармливание детей, перенесших в связи с перфорацией или некрозом кишечника оперативное вмешательство, проводится по соответствующим
протоколам ведения детей с пострезекционным синдромом.
Исходы. У детей, перенесших НЭК, но не потребовавших резекции кишечника, могут сохраняться нарушения моторики кишечника, вторичная лактазная недостаточность в течение 1-3 месяцев после заболевания, но к 3 месяцам в большинстве случаев переваривающая и всасывательная функции нормализуются. У детей, перенесших резекцию кишечника в связи с некрозом кишки, перфорацией, перитонитом, прогноз будет определяться
У детей, перенесших резекцию кишечника в связи с некрозом кишки, перфорацией, перитонитом, прогноз будет определяться
объемом резекции (наиболее неблагоприятны варианты с обширной резекцией тощей кишки), уровнем наложения стомы (если первое оперативное вмешательство проводилось с выведением стомы), состоянием отдела кишки, находящегося дистальнее перфорации. Дети с НЭК являются наиболее многочисленной группой среди детей, формирующих синдром короткой кишки (кишечную недостаточность в связи с потерей поверхности всасывания).
И] з<
ш
<
ЛИТЕРАТУРА
1. WalshM, KleigmanR. Necrotizing enterocolitis: treatment based on staging criteria.Pediat Clin N Amer, 1986; 33: 179-201.
2. Красовская Т.В., Кобзева Т.Н. Диагностика и интенсивная терапия в хирургии новорожденных. — М., 2001.
3. Гланц С. Медико-биологическая статистика. — М.: Практика, 1999.
t-П
Исследование томского учёного поможет спасти жизни недоношенных новорожденных
По итогам конкурса «Российского фонда фундаментальных исследований» на лучшие проекты фундаментальных научных исследований, выполняемые молодыми учеными, обучающимися в аспирантуре, аспирант СибГМУ Леонид Ким получил финансирование на выполнение исследовательского проекта «Ранняя диагностика некротизирующего энтероколита у недоношенных новорожденных детей». Научным руководителем выступит доктор медицинских наук, заведующий кафедрой госпитальной педиатрии, профессор Виктор Желев. Полученные средства пойдут на изучение белка I-FABP в качестве предиктора возникновения заболевания.
Полученные средства пойдут на изучение белка I-FABP в качестве предиктора возникновения заболевания.
Некротизирующий энтероколит (НЭК) – тяжелое желудочно-кишечное заболевание новорожденных, характеризующееся воспалением, приводящим к некрозу и перфорации кишечной стенки, перитониту. Некротизирующий энтероколит может возникнуть по нескольким причинам: генетическая предрасположенность, кишечная незрелость, неправильная микробная колонизация. НЭК называют «болезнью выживших недоношенных». По статистике, около 2,1% новорожденных, поступающих в отделение патологии новорождённых и недоношенных детей, страдают данным заболеванием. Как правило, болезнь развивается в первые две недели жизни, но у 16% пациентов может возникнуть и сразу после рождения. Прогноз заболевания, зачастую, неоднозначен – нередко у маленьких пациентов возникает резкое ухудшение состояния на фоне общей положительной динамики.
Среди врачей, на сегодняшний день, нет единого мнения о патогенезе заболевания.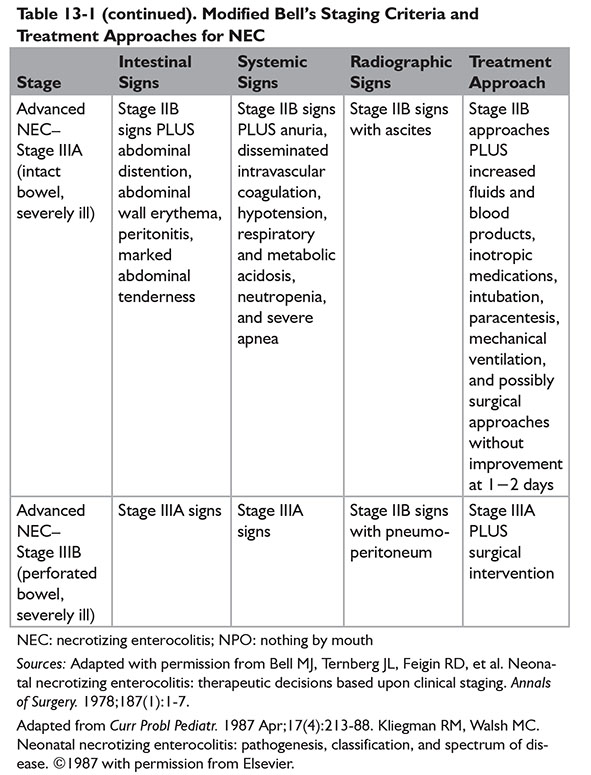 Ученые и врачи находятся в поиске способов профилактики и ранней диагностики заболевания. Среди специфических признаков заболевания выделяют пневматоз кишечника на рентгенограмме или газ в воротной вене при УЗИ, но данная симптоматика появляется на поздних стадиях болезни. Неспецифические ранние признаки НЭК часто ошибочно диагностируют, как сепсис у новорожденных. Именно поэтому детские хирурги и неонатологи чаще сталкиваются с заболеванием уже на стадии перитонита, когда прогноз для жизни больных ухудшается, а летальность достигает 70%, в случае развития обширного некроза кишечника — 100%.
Ученые и врачи находятся в поиске способов профилактики и ранней диагностики заболевания. Среди специфических признаков заболевания выделяют пневматоз кишечника на рентгенограмме или газ в воротной вене при УЗИ, но данная симптоматика появляется на поздних стадиях болезни. Неспецифические ранние признаки НЭК часто ошибочно диагностируют, как сепсис у новорожденных. Именно поэтому детские хирурги и неонатологи чаще сталкиваются с заболеванием уже на стадии перитонита, когда прогноз для жизни больных ухудшается, а летальность достигает 70%, в случае развития обширного некроза кишечника — 100%.
Таким образом, для спасения жизни пациентов с некротизирующим энтероколитом необходимо выбрать корректную тактику лечения на самых ранних этапах, а это возможно только при выявлении новых биомаркеров, подходящих для ранней диагностики НЭК.
«Некротизирующий энтероколит характеризуется разрушением слизистого слоя и трансмуральным некрозом кишечной стенки, — прокомментировал Леонид Ким.
— Поэтому мы будем исследовать неинвазивный тест, который отразит это разрушение до того, как оно станет видимым на рентгеновском снимке».
Суть теста заключается в измерении концентрации кишечного белка Intestinal Fatty-Acid Banding Protein (I-FABP) в моче пациента. Кишечный белок, связывающий жирные кислоты – это небольшой цитоплазматический белок, расположенный в энтероцитах, участвующих в поглощении и транспорте полярных липидов, таких как жирные кислоты, из просвета тонкой кишки. Данный белок попадает в кровоток во время смерти энтероцитов. Его содержание в зрелых энтероцитах составляет до 2%. Поэтому содержание I-FABP увеличивается в сыворотке даже у здоровых людей после операций на брюшной полости, травм или употребления алкоголя, и может являться маркером повреждения клеток кишечника. Благодаря небольшому размеру (14-15 кДа) белок I-FABP может быстро проходить через почку, что и дает возможность оперативного определения его концентрации в моче.
В ходе исследования планируется изучить белок I-FABP в качестве предиктора возникновения НЭК и на его основе разработать дополнительные критерии тяжести и неблагоприятного течения заболевания..jpg) Разработанные критерии позволят не только выявлять НЭК на ранних стадиях развития заболевания у новорождённых, но и диагностировать некротический энтероколит, что позволит улучшить выживаемость пациентов.
Разработанные критерии позволят не только выявлять НЭК на ранних стадиях развития заболевания у новорождённых, но и диагностировать некротический энтероколит, что позволит улучшить выживаемость пациентов.
Влияние вскармливания на тяжесть течения некротического энтероколита у недоношенных новорожденных
SOVREMENNAYA PEDIATRIYA.2018.3(91):33-37; doi 10.15574/SP.2018.91.33
Русак Н. П.
Винницкий национальный медицинский университет имени Н.И. Пирогова, Украина
Цель: изучить влияние характера вскармливания недоношенных детей с некротическим энтероколитом (НЭК) различной степени тяжести на дальнейшее течение заболевания.
Материалы и методы. Под наблюдением находились 67 недоношенных детей, которые были разделены на 3 группы: I группу составили 20 детей с НЭК I стадии, II группу — 30 детей с НЭК II стадии, III группу — 7 детей с НЭК III стадии. Группу контроля составило 10 недоношенных детей без НЭК. Статистическую обработку полученных результатов проводили с помощью программного пакета Statistica 6.1. Разницу параметров считали статистически значимой при р<0,05.
Статистическую обработку полученных результатов проводили с помощью программного пакета Statistica 6.1. Разницу параметров считали статистически значимой при р<0,05.
Результаты. Дети III и II групп начинали энтеральное питание позже — на 3,6±0,7 и на 2,9±0,4 сутки жизни, чем дети I (на 1,4±0,1 сутки жизни) и контрольной (на 1,2±0,1 сутки жизни) группы (р<0,01). В раннем неонатальном периоде на грудном вскармливании находилось в 4,2 раза меньше детей III группы, чем контрольной, — 1 (14,3%) и 6 (60,0%) детей соответственно (р<0,05). Дети III группы дольше пребывали на энтеральном питании через орогастральний зонд (59,1±4,9 суток) по сравнению с детьми других групп (р<0,01). После появления первых клинических симптомов НЭК длительность пребывания на полном парентеральном питании была достоверно больше у детей III группы — 9,9±1,9 суток соответственно (р<0,01). После восстановления толерантности к энтеральному питанию и при отсутствии признаков прогрессирования НЭК детям из основных групп снова начинали энтеральное вскармливание и переводили на частичное парентеральное питание. Продолжительность пребывания на частичном парентеральном питании у детей I группы была достоверно ниже, чем у детей II группы — 26,8±3,9 и 34,8±4,8 суток соответственно (р<0,05) и детей III группы — 52,9±4,3 суток (р<0,01).
Продолжительность пребывания на частичном парентеральном питании у детей I группы была достоверно ниже, чем у детей II группы — 26,8±3,9 и 34,8±4,8 суток соответственно (р<0,05) и детей III группы — 52,9±4,3 суток (р<0,01).
Выводы. Тяжелое течение НЭК ассоциируется с позже начатым энтеральным питанием — на 3,6±0,7 суток (р<0,01), отсутствием грудного вскармливания — у 6 (85,7%) детей (р<0,05) и, как следствие, длительным пребыванием детей с тяжелым НЭК на энтеральном питании через орогастральный зонд — 59,1±4,9 суток, продлением срока их пребывания на полном парентеральном питании — 9,9±1,9 суток, и на частичном парентеральном питании — 52,9±4,3 суток (р<0,01).
Ключевые слова: некротический энтероколит, недоношенные дети, вскармливание.
Литература
1. Добрянський ДО. (2011). Ентеральне харчування недоношених дітей із дуже малою масою тіла при народженні: сучасні пріоритети. Здоровье ребенка. 7(34): 121–128.
7(34): 121–128.
2. Мавропуло ТК, Македонський ІО. (2014). Некротичний ентероколіт новонароджених(із засад доказової медицини). Неонатологія, хірургія та перинатальна медицина. ІV; 3(13): 116–126.
3. Минаев СВ, Киргизов ИВ, Обедин АН и др. (2013). Мониторинг развития воспалительных осложнений у новорожденных с врожденной патологией желудочно;кишечного тракта. Медицинский вестник Северного Кавказа. 8; 2: 30–33.
4. Уніфікований клінічний протокол вторинної (спеціалізованої) та третинної (високоспеціалізованої) медичної допомоги «Ентеральне харчування недоношених немовлят» (2017). http://www.moz.gov.ua.
5. Agostoni C, Buonocore G, Carnielli VP, De Curtis M, Darmaun D, Decsi T et al. (2010). Enteral nutrient supply for preterm infants: commentary from the European Society for Paediatric Gastroenterology, Hepatology, and Nutrition Committee on Nutrition. JPGN. 50(1): 85–91.
6. Butte M, Lindner U, Sauer H, Schondorf D, Gortner L et al. Conservative Enteral Feeding Policy and Necrotizing Enterocolitis (NEC) in VLBW Infants: A Single Center Experience (2014). J Pediatr Neonatal Care. 1(1): 00002.
J Pediatr Neonatal Care. 1(1): 00002.
7. Downard CD, Renaud E, Peter SDSt, Abdullah F, Islam S, Saito JM, Blakely ML, Huang EY, Arca M, Cassidy L, Aspelund G. (2012). Treatment of necrotizing enterocolitis: an American Pediatric Surgical Association Outcomes and Clinical Trials Committee systematic review. Journal of Pediatric Surgery.47(11): 2111–2122.
8. Henry MC, Moss RL. (2009). Necrotizing enterocolitis. Annual Review of Medicine. 60: 11–24.
9. Lambert DK, Christensen RD, Baer VL, Henry E, Gordon PV, Besner GE, Wilkes J, Wiedmeier SE, Gerday E (2012). Fulminant necrotizing enterocolitis in a multihospital healthcare system. J Perinatol.32(3): 194.
10. Latal-Hajnal В, Siebenthal K, Kovari H et al. (2003). Postnatal growth in VLBW infants: significant association with neurodevelopmental outcome. J Pediatr. 143: 163–170.
11. Maheshwari A, Corbin L, Schelonka RL. (2011). Neonatal necrotizing enterocolitis. Research and Reports in Neonatology.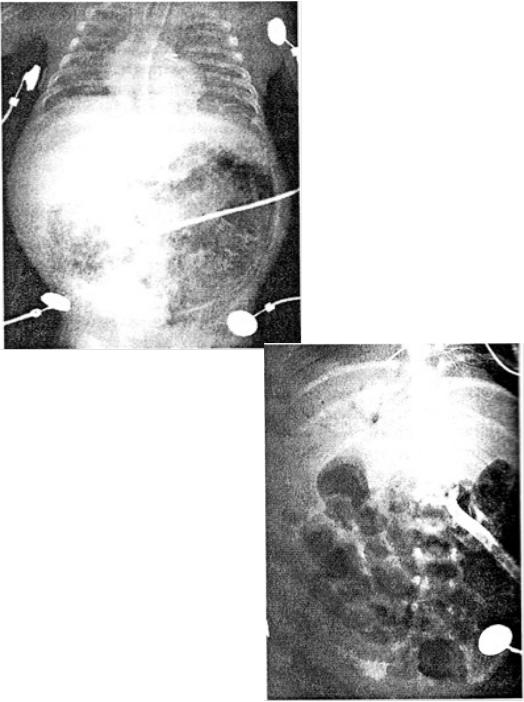 1: 39–53.
1: 39–53.
12. Merhar SL, Ramos Y, Meinzen;Derr J, Kline;Fath BM. (2014). Brain magnetic resonance imaging in infants with surgical necrotizing enterocolitis or spontaneous intestinal perforation versus medical necrotizing enterocolitis. J Pediatr. 164(2): 410–412.
13. Necrotizing Enterocolitis (NEC) Guideline Team, Cincinnati Children’s Hospital Medical Center: Evidence;based care guideline for Necrotizing Enterocolitis among very low birth weight infants. Pediatric Evidence-Based Care Guidelines, Cincinnati Children’s Hospital Medical Center Guideline 28, pages 1–10, October, 2010.
14. Patel BK, Shah JS. (2012). Gastroenterology. Necrotizing Enterocolitis in Very Low Birth Weight Infants: A Systemic Review. ISRN Gastroenterol. 2012: 562594. Published online Sep 10, 2012.
15. Radmacher PG, Adamkin DH, Radmacher PG. (2017). Fortification of Human milk for preterm infants. Seminars in Fetal and Neonetal Medicine. 22(1): 30–5.
16. Sharma RА, Hudak ML. (2013). A clinical perspective of necrotizing enterocolitis: past, present, and future. Clin Perinatol.40: 27–51.
17. Sullivan S et al. (2010). An exclusively human milk;based diet is associated with a lower rate of necrotizing enterocolitis than a diet of human milk and bovine milk;based products. Journal of Pediatrics. 156(4): 562–7.
Редкое осложнение некротического энтероколита у новорожденного
Некротический энтероколит (НЭК) является распространенным заболеванием новорожденных, которое требует неотложной помощи [1, 2, 4, 6]. За последнее десятилетие отмечается тенденция к снижению летальности от НЭК (17% в развитых странах и 42% в странах с низким и средним уровнем экономики соответственно) [2, 3, 5, 6]. Успех лечения при НЭК зависит от многих факторов, особенно от своевременной диагностики перехода заболевания из терапевтической стадии в хирургическую. Абсолютными показаниями к оперативному вмешательству являются перитонит, перфорация толстой кишки, ухудшение общего состояния [1-3, 5]. В клинике детской хирургии Запорожья мы наблюдали редкое осложнение НЭК. Приводим наше наблюдение.
Больной С., 6 мес, поступил в клинику детской хирургии с тонкокишечным и толстокишечным свищами.
Из анамнеза известно, что 15.08.14 ребенок родился недоношенным массой тела 2700 г, оценка по шкале Апгар 7 баллов.
К груди новорожденного приложили через 2 ч. На 2-е сутки ребенок стал беспокойным, отказывался от груди. Появился жидкий стул, температура 37,7 °С. В левой поясничной области был обнаружен участок гиперемии и инфильтрации размером 4×3 см. Ребенок направлен в клинику детской хирургии с диагнозом: «флегмона новорожденного».
При поступлении состояние тяжелое, температура 38,6 °С. Патологических изменений органов грудной клетки не выявили. Живот вздут, мягкий, безболезненный. Печень и селезенка не увеличены. Стул 4 раза, мочится свободно. В левой поясничной области виден инфильтрат размером 6×4,5 см, кожа над ним гиперемирована. 17.08 ребенок оперирован с диагнозом: «обширная флегмона новорожденного левой поясничной области». Флегмону вскрыли 16 разрезами, получили гной, раны дренировали турундами с гипертоническим раствором. Назначили антибиотики, перевязки 2 раза в сутки.
Состояние ребенка ухудшилось вечером 20.08, когда живот стал резко вздутым, появились напряжение передней брюшной стенки, рвота кишечным содержимым. После предоперационной подготовки ребенка оперировали 21.08 с диагнозом «распространенный перитонит». После срединной лапаротомии в брюшной полости обнаружили большое количество гноя. В нисходящем отделе ободочной кишки выявили множество перфоративных язв. Этот отдел толстой кишки на протяжении 11 см оказался некротизированным. Кроме того, диагностировали забрюшинную флегмону и гнойный паранефрит слева. Брюшную полость промыли фурацилином и резецировали нисходящую ободочную кишку на протяжении 15 см. Дистальный отдел нисходящей ободочной кишки ушили наглухо, проксимальный вывели через дополнительный разрез в левом подреберье в виде одноствольной колостомы. Забрюшинное и паранефральное пространства дренировали через разрез в левой поясничной области двумя трубками. Пересекли подвздошную кишку на расстоянии 20 см от баугиниевой заслонки. Дистальный конец тонкой кишки ушили наглухо, проксимальный вывели через отдельный разрез в правой подвздошной области в виде терминальной илеостомы. Тонкую кишку интубировали. Срединную рану ушили наглухо. Послеоперационное течение тяжелое. После 2-недельного пребывания в реанимационном отделении и в отделении патологии новорожденных (также в течение 2 нед) ребенка выписали в удовлетворительном состоянии.
За 5 мес ребенок прибавил в массе 3 кг. Его общее состояние удовлетворительное. В правой подвздошной области имеется терминальная илеостома, в левом — одноствольная колостома. Живот мягкий, безболезненный.
02.03.15 ребенку выполнили реконструктивно-восстановительную операцию — ликвидировали илеостому и колостому.
В ходе вмешательства между поперечной ободочной кишкой и дистальным отделом нисходящей ободочной кишки, а также между приводящей петлей тонкой кишки и дистальным участком подвздошной кишки сформировали два анастомоза по типу конец в конец.
Послеоперационное течение без осложнений, швы сняты на 10-е сутки, больного выписали на 16-е сутки в удовлетворительном состоянии.
Наблюдение приводим в связи с удачным лечением при редком осложнении некротического энтероколита. У ребенка возник некротический энтероколит нисходящей ободочной кишки, осложненный забрюшинной флегмоной и паранефритом слева, инфильтратом в левой поясничной области, который был принят за флегмону новорожденного. Окончательный диагноз сформулировали только в ходе диагностического этапа лапаротомии.
Симптомы и лечение некротического энтерколита (НЭК)
Что такое некротический энтероколит?
Некротический энтероколит (НЭК) — это желудочно-кишечное заболевание, которое включает инфекцию и воспаление, вызывающее повреждение и гибель клеток в некоторых или всех частях кишечника. Хотя некротический энтероколит поражает только одного из 2000-4000 новорожденных, он является наиболее частой желудочно-кишечной (ЖКТ) чрезвычайной ситуацией в отделениях интенсивной терапии новорожденных в США.
Кто страдает некротическим энтероколитом?
Некротический энтероколит чаще встречается у недоношенных детей (новорожденных с массой тела при рождении менее 4.На 5 фунтов приходится около 80 процентов случаев некротического энтероколита), но также диагностировали доношенные дети. Некротический энтероколит часто развивается в течение первых двух недель жизни, обычно после начала кормления молоком (сначала кормление обычно проводится через зонд, который идет непосредственно в желудок ребенка). Около 10 процентов младенцев с массой тела менее 3 фунтов 5 унций (или 1500 граммов) страдают некротическим энтероколитом. Незрелый кишечник этих младенцев чувствителен и склонен к инфекциям.У них могут быть проблемы с циркуляцией крови и кислорода и пищеварением, что увеличивает их шансы на развитие некротического энтероколита.
Повреждение тканей кишечника может привести к перфорации (отверстию) в кишечнике, в результате чего бактерии, обычно присутствующие в кишечном тракте, могут проникнуть в брюшную полость и вызвать инфекцию. Повреждение может существовать только на небольшом участке или быстро распространяться на большие участки кишечника.
Факторы риска некротического энтероколита
Хотя не существует единой причины некротического энтероколита, факторы риска включают преждевременные роды и раннее кормление у недоношенных детей с незрелым кишечником.У младенцев, у которых были тяжелые роды с пониженным уровнем кислорода, также может развиться некротический энтероколит.
Некоторые эксперты считают, что причины некротического энтероколита связаны с составом детской смеси, скоростью доставки смеси или незрелостью слизистых оболочек кишечника. У младенцев, которых кормят грудным молоком, также может развиться некротический энтероколит, но их риск ниже.
Еще одна закономерность, замеченная экспертами в отношении некротического энтероколита, заключается в том, что иногда кажется, что он возникает во время «эпидемий», поражая нескольких младенцев в одной и той же детской.Конечно, в питомниках очень строгие меры предосторожности, чтобы не допустить распространения инфекции, так что это может быть совпадением. Однако это предполагает возможность того, что в некоторых случаях некротический энтероколит может передаваться от одного ребенка к другому.
Симптомы некротического энтероколита у детей
Хотя некротический энтероколит обычно возникает у младенцев в период от 3 до 12 дней после рождения, позднее начало может возникнуть через много недель после рождения. Каждый ребенок по-разному испытывает симптомы некротического энтероколита, которые могут включать:
- Вздутие живота (вздутие)
- Кровавый стул
- Плохое кормление или непереносимость кормления
- Желчная (зеленая) рвота или желудочный дренаж
- Признаки инфекции, такие как вялость (вялость) и апноэ (остановка дыхания)
- Температурная нестабильность
Диагностика некротического энтероколита
Во время медицинского осмотра врач вашего ребенка может заметить припухлость и болезненность в области живота.В некоторых случаях можно почувствовать образование, указывающее на перфорацию в этой области. В остальных случаях можно увидеть покраснение брюшной стенки. Это также может указывать на перфорацию, а также на воспаление оболочки брюшной полости.
Чтобы подтвердить или исключить некротический энтероколит, врач назначит рентген брюшной полости. На рентгеновском снимке может быть обнаружено множество мелких пузырьков в стенке кишечника (кишечник пневматоз). Серийные фильмы помогают оценить прогрессирование болезни. В тяжелых случаях рентген может выявить воздух или газ в крупных венах печени.Этот воздух вырабатывается бактериями в стенке кишечника.
Лечение некротического энтероколита
Некротический энтероколит Для педиатрических пациентов лечение может быть медикаментозным или хирургическим. Если кишечник еще не перфорирован и поражен только небольшой участок кишечника, обычно сначала пытаются лечить. От шестидесяти до восьмидесяти процентов детей с некротическим энтероколитом не нуждаются в хирургическом вмешательстве для устранения симптомов. Многие из них выздоравливают и могут вести нормальный образ жизни.На лечение включено:
- Прекращение всех регулярных кормлений. Ребенок получает питательные вещества через внутривенный катетер.
- Установка назогастрального зонда, идущего от носа к желудку. Трубка всасывает воздух и жидкости из желудка и кишечника ребенка, снимая отек и дискомфорт.
- Начало антибактериальной терапии.
- Проверка стула на кровь.
- Сдача частых анализов крови. Они могут обнаружить ранние признаки инфекции и химический дисбаланс в организме.
- Если вздутие живота мешает дыханию, подача кислорода или дыхание с механической поддержкой.
- В тяжелых случаях может потребоваться переливание тромбоцитов и эритроцитов.
Если ребенок не реагирует на лечение или если кишечник перфорирован, требуется хирургическое вмешательство. Детский хирург исследует кишечник и удаляет только разрушенные части, оставляя как можно больше кишечника, чтобы у менее поврежденных сегментов была возможность восстановить функцию.В некоторых случаях в брюшную полость помещают дренаж для удаления инфицированной жидкости.
Временная стома (отверстие в стенке брюшной полости) создается для восстановления и заживления кишечника. Еще одна операция по повторному обследованию брюшной полости может потребоваться через 24-48 часов, чтобы определить, прогрессирует ли болезнь.
Диагностика некротического энтероколита может быть чрезвычайно пугающей для родителей. Очень неприятно, что ты не можешь кормить своего ребенка, особенно когда он такой маленький. Может оказаться невозможным удержание и привязанность, которые так важны для детей и родителей.Постарайтесь иметь в виду, что после лечения есть большая вероятность, что ваш ребенок вернется к обычному кормлению в течение короткого времени. Младенцам, нуждающимся в операции, предстоит более трудный путь, но многие из них выживают. Более высокая масса тела при рождении увеличивает шансы на хороший исход.
Некротический энтероколит | Детская больница Лос-Анджелеса
Определение
Некротический энтероколит (НЭК) — разрушительное заболевание, поражающее в основном кишечник недоношенных детей. Стенка кишечника поражена бактериями, которые вызывают местную инфекцию и воспаление, которые в конечном итоге могут разрушить стенку кишечника (кишечника).Такое разрушение стенки кишечника может привести к перфорации кишечника и попаданию стула в брюшную полость младенца, что может привести к обширной инфекции и смерти.
Этиология и факторы риска
В целом, NEC затрагивает одного из 2000-4000 новорожденных, или от одного до пяти процентов госпитализаций новорожденных в отделения интенсивной терапии. Заболевание встречается почти у 10 процентов недоношенных детей, но редко встречается у доношенных детей. Хотя точная причина НЭК до сих пор неизвестна, существует множество теорий, объясняющих, почему НЭК поражает в основном недоношенных детей.Единственные последовательные наблюдения, сделанные у младенцев, у которых развивается НЭК, — это наличие недоношенных детей и кормление смесью. У недоношенного ребенка незрелые легкие и незрелый кишечник. Следовательно, любое снижение доставки кислорода в кишечник, поскольку легкие не могут адекватно насыщать кровь кислородом, повредит слизистую оболочку кишечной стенки. Это повреждение стенки кишечника позволит бактериям, которые обычно живут внутри кишечника, проникнуть в стенку кишечника и вызвать местную инфекцию и воспаление (NEC), которые в конечном итоге могут привести к разрыву или перфорации кишечника.
Рисунок 1
Клиническая картина
НЭК обычно развивается в течение первых 2 недель жизни у недоношенного ребенка, которого кормят смесью, а не грудным молоком. Одним из первых признаков НЭК является неспособность младенца переносить кормление. Это часто связано с вздутием живота (вздутием живота) и рвотой желчью (зеленая). У младенца также может быть кровавый стул из-за инфекции стенки кишечника. Если инфекция не распознается на ранней стадии, у ребенка может развиться низкая частота дыхания или периодическое дыхание (апноэ) и низкая частота сердечных сокращений, что может потребовать введения дыхательной трубки.Другие находки могут включать покраснение и болезненность живота ( см. Рис. 1, ), диарею, летаргию (вялость) и шок (снижение артериального давления).
Рисунок 2A / [Увеличенное изображение]
Рисунок 2B
Диагноз
Диагноз NEC обычно подтверждается наличием пузырьков газа или воздуха в стенке кишечника на X- брюшной полости. луч ( см. Рисунок 2A ). Другие рентгенологические данные могут включать наличие пузырьков воздуха в некоторых венах, идущих к печени, или присутствие воздуха за пределами кишечника в брюшной полости (, см. Рис. 2B, ).Анализы крови могут выявить пониженное количество тромбоцитов, которые обычно помогают формировать тромбы и предотвращать кровотечение, а также пониженное количество лейкоцитов, которые обычно помогают бороться с бактериальными инфекциями. Эти данные подвергают младенца риску кровотечения и серьезной системной инфекции.
Лечение
Большинство младенцев с НЭК сначала проходят медикаментозное лечение, и симптомы часто проходят без хирургического вмешательства. Первоначальное лечение НЭК состоит из следующего:
- Прекратить кормление
- Вставить орогастральный зонд (трубка, идущая изо рта в желудок для удаления воздуха и жидкости из желудка и кишечника)
- Ввести внутривенные жидкости и антибиотики
- Выполняйте частые серийные исследования и рентген брюшной полости.
Рисунок 3A / [Увеличенное изображение]
Рисунок 3B / [Увеличенное изображение]
Младенцы, которые реагируют на это лечение, часто могут возобновить кормление через рот после исчезновения признаков инфекции.В некоторых случаях это может занять до 5-7 дней. Младенцам с более тяжелым заболеванием может потребоваться более длительный период для восстановления функции кишечника, что определяется наличием нормального испражнения. Младенцам, которые не поддаются лечению и у которых развивается ухудшение состояния или перфорация кишечника, потребуется хирургическое вмешательство. Во время операции хирург может обнаружить участки кишечника с пузырьками газа в стенке кишечника (, см. Рис. 3A, ) или участки кишечника, которые явно некротизированы (мертвы) или перфорированы ( см. Рис. 3B, ). .
Операция заключается в удалении части кишечника, которая разорвалась или вот-вот разорвется. Хирург очень старается сохранить как можно больше кишечника, удаляя только те сегменты, которые кажутся явно мертвыми или разорванными (, см. Рис. 3B, ). В большинстве случаев, особенно если ребенок очень болен (например, в состоянии шока) или если в брюшной полости наблюдается обширное выделение стула, хирург может решить извлечь жизнеспособный участок проксимального отдела кишечника (сегмент кишечника, который расположен ближе всего к желудку) к животу, чтобы избежать дальнейшего вытекания стула в брюшную полость; это известно как стома.В этом случае ребенок будет вылизывать кал из стомы вместо того, чтобы проливать стул в брюшную полость. Стома должна дать ребенку достаточно времени, чтобы оправиться от инфекции с помощью антибиотиков и других методов лечения. Если ребенок выздоравливает, через шесть-восемь недель его можно вернуть в операционную, чтобы сделать обратное удаление стомы, чтобы восстановить непрерывность кишечника, чтобы фекалии снова вышли из заднего прохода.
Прогноз
Большинство младенцев, у которых развивается НЭК, полностью выздоравливают и больше не имеют проблем с кормлением.В некоторых случаях может развиться рубцевание и сужение кишечника, что в будущем может привести к кишечной непроходимости или закупорке. Другой остаточной проблемой может быть нарушение всасывания (неспособность кишечника нормально усваивать питательные вещества). Это чаще встречается у детей, которым требуется операция по поводу NEC и которые теряют большой сегмент кишечника. Тем не менее, есть младенцы, которые теряют настолько много кишечника из-за инфекции, что у них не остается достаточно кишечника, чтобы выжить. Этим младенцам может потребоваться пересадка кишечника, чтобы выжить.
Future Therapy
Есть много интересных перспектив на горизонте, чтобы попытаться лечить или предотвратить NEC. Некоторые из наиболее многообещающих методов лечения включают введение недоношенным детям пробиотических («хороших») бактерий, чтобы противостоять воздействию патогенных («плохих») бактерий, вызывающих инфекцию. Другие многообещающие методы лечения, которые мы придумали в результате исследований, проведенных в нашей лаборатории, включают блокирование производства вещества, известного как оксид азота, который вырабатывается в больших количествах во время NEC и способствует разрушению стенки кишечника.Кроме того, очень небольшие количества окиси углерода, того же газа, который выходит из автомобильного глушителя или из сигаретного дыма, по-видимому, защищает крысят от развития «крысиной формы» НЭК (воспаление кишечника) за счет снижения выработки оксида азота. .
Литература
Чокши Н.К. Гюнер Ю.С. Хантер CJ. Upperman JS. Гришин А. Форд HR. Роль оксида азота в повреждении и восстановлении эпителия кишечника при некротическом энтероколите новорожденных .[Отзыв] [88 ссылок] Семинары по перинатологии. 32 (2): 92-9, 2008 апр.
Хантер СиДжей. Upperman JS. Ford HR. Camerini V. Понимание предрасположенности недоношенных детей к некротическому энтероколиту (NEC). [Обзор] [109 ссылок] Педиатрические исследования. 63 (2): 117-23, 2008 г.,
Ford HR. Механизм опосредованного оксидом азота нарушения кишечного барьера: понимание патогенеза некротического энтероколита.[Обзор] [45 ссылок] Журнал детской хирургии. 41 (2): 294-9, 2006 г.
Zuckerbraun BS. Otterbein LE. Бойл П. Джаффе Р. Апперман Дж. Замора Р. Форд HR. Угарный газ защищает от развития экспериментального некротического энтероколита . Американский журнал физиологии — физиология желудочно-кишечного тракта и печени. 289 (3): G607-13, 2005 Сентябрь
Хантер С.Дж., Чокши Н., Форд HR. Доказательства и опыт хирургического лечения некротического энтероколита и очаговой перфорации кишечника . J Perinatol. Май 2008 г .; 28 Дополнение 1: S14-7.
Хантер С.Дж., Подд Б., Форд Х.Р., Камерини В. Доказательства и опыт неонатальной практики при некротическом энтероколите . J Perinatol. Май 2008 г .; 28 Дополнение 1: S9-S13.
Симптомы, причины, лечение и перспективы
Обзор
Что такое некротический энтероколит (НЭК)?
Некротический энтероколит (НЭК) — это воспаление кишечника (обычно толстой кишки), которое может быть опасным для жизни, если не лечить сразу.NEC может поражать только слизистую оболочку кишечника или всю его толщину. Повреждение тканей кишечника, вызванное NEC, может вызвать отверстие в кишечнике, которое позволяет бактериям, обычно присутствующим только в кишечном тракте, просачиваться в брюшную полость и вызывать инфекцию. Как только это происходит, инфекция может очень быстро прогрессировать и требует неотложной медицинской помощи.
NEC чаще всего поражает недоношенных детей, составляя от 60 до 80% случаев. Это самая частая желудочно-кишечная неотложная помощь в отделении интенсивной терапии новорожденных (NICU).Обычно это происходит в течение 3-12 дней после рождения.
Симптомы и причины
Что вызывает
некротический энтероколит (НЭК)?
Причина NEC неясна; это может быть результатом того, что в кишечник поступает слишком мало кислорода или крови, что приводит к его ослаблению.Попадая в такое ослабленное состояние, бактерии из пищи, попадающие в кишечник, могут вызвать повреждение или смерть тканей и привести к серьезной инфекции. Вопреки распространенному мнению, грудное молоко не вызывает и не предотвращает НЭК. Недоношенность — самая частая причина.
Каковы симптомы некротического энтероколита
(НЭК)?
Симптомы НЭК обычно развиваются в первые 2 недели и могут включать следующее:
- Вздутие живота или припухлость
- Плохая переносимость кормления
- Частая рвота (возможно зеленого цвета)
- Стул с кровью (испражнения)
- Покраснение или ненормальный цвет живота
- Вялость (недостаток энергии)
- Лихорадка
- Апноэ (паузы на дыхании)
Диагностика и тесты
Как диагностируется
некротический энтероколит (НЭК)?
NEC диагностируется при обследовании ребенка на предмет перечисленных выше симптомов (обычно припухлость (вздутие) и болезненность.Рентген брюшной полости может показать пузырьки в кишечнике и признаки воздуха или газа в крупных венах печени. Воздух также может находиться вне кишечника в брюшной полости. В брюшную полость можно ввести иглу, чтобы проверить наличие кишечной жидкости (обычно берется образец), что часто является признаком дыры в кишечнике.
Ведение и лечение
Как лечится некротический энтероколит
(НЭК)?
Лечение НЭК зависит от многих факторов, включая возраст и общее состояние здоровья ребенка, его переносимость определенных лекарств и степень заболевания.
Некоторые из шагов, предпринятых для лечения NEC, могут включать:
- Антибиотики для борьбы с инфекцией
- Проверка дефекации
- Прекращение регулярного кормления через рот и вместо кормления через капельницу
- Регулярные рентгеновские снимки для контроля прогресса NEC
- Трубка, вводимая в желудок через нос или рот; трубка удаляет воздух и жидкость из желудка и кишечника ребенка
- Регулярный анализ крови для выявления инфекции
- Возможная поддержка дыхания (в зависимости от степени тяжести)
В тяжелых случаях НЭК может потребоваться хирургическое вмешательство для удаления пораженной части кишечника.
Перспективы / Прогноз
Каков прогноз при некротическом энтероколите
(NEC)?
Иногда возникают такие проблемы, как рубцевание или сужение кишечника (непроходимость) или неспособность кишечника правильно усваивать питательные вещества (мальабсорбция).
Проконсультируйтесь с врачом вашего ребенка относительно конкретного прогноза для вашего ребенка.
Некротический энтероколит — НОРД (Национальная организация по редким заболеваниям)
НОРД благодарит Арвина Бандху, доктора медицины, и Адама Матсона, доктора медицины, отделения неонатологии Детского медицинского центра Коннектикута, Хартфорд, Коннектикут; Департаменту педиатрии Медицинской школы Университета Коннектикута, Фармингтон, Коннектикут, за подготовку этого отчета.
Общие обсуждения
Резюме
Некротический энтероколит, сокращенно НЭК, представляет собой разрушительное заболевание, поражающее кишечник новорожденного.Обычно это происходит у недоношенных детей, родившихся менее 37 недель, и характеризуется тяжелым воспалением тонкого или толстого кишечника ребенка, которое может прогрессировать до отмирания тканей (некроза). НЭК встречается примерно в 1 случае на 1000 живорожденных [1]. НЭК может возникать у доношенных детей, но гораздо чаще встречается у очень недоношенных детей, особенно у детей с очень низкой массой тела при рождении — заболеваемость колеблется от 3% у младенцев с массой тела при рождении от 1251 до 1500 граммов (от 2 фунтов 12,13 унции до 3 фунтов 4,91 унции). ) до 11% для младенцев, рожденных с массой тела менее 750 грамм (1 фунт 10.46 унций) [2]. НЭК обычно возникает у новорожденного в возрасте нескольких недель, получающего энтеральное питание. Первоначально у младенцев наблюдается рвота, большой вздутие живота, кровавый стул, длительные паузы в дыхании и снижение активности. Это может привести к некрозу и перфорации кишечника. Медикаментозное лечение включает прекращение энтерального питания (введение полноценного питания непосредственно в желудок), назначение антибиотиков широкого спектра действия и поддерживающую терапию [3]. Хирургическое вмешательство показано при наличии признаков перфорации и некроза кишечника.Это серьезное заболевание желудочно-кишечного тракта связано со значительной заболеваемостью (осложнениями, связанными с заболеванием) и смертностью. Несмотря на лечение, около 15% младенцев, у которых развивается НЭК, умирают, а некоторые выжившие младенцы страдают от многочисленных осложнений, таких как синдром короткой кишки, медленный рост и долгосрочные нарушения развития нервной системы [4]. Точный механизм этого заболевания, хотя и не полностью изучен, считается многофакторным и связан с преждевременным кишечником, аномальной микробной колонизацией кишечника и воспалением кишечника.
Введение
НЭК остается ведущей причиной заболеваемости и смертности в отделениях интенсивной терапии новорожденных, несмотря на значительные успехи в оказании помощи недоношенным детям [5; 6]. Это остается в первую очередь болезнью недоношенных. У доношенных детей с такими факторами риска, как врожденный порок сердца, сепсис или гипотензия (низкое артериальное давление), также может развиться НЭК [7]. Классификация Белла была введена в 1978 г. и до сих пор широко используется для определения клинической стадии НЭК в зависимости от тяжести заболевания: при подозрении на НЭК I стадия, подтвержденная стадия II НЭК и подтвержденная стадия III с перфорацией кишечника и / или мультисистемным вовлечением [8 ].Совсем недавно терминология приобретенных неонатальных кишечных заболеваний (ANID) была введена Gordon et al. для дальнейшей классификации НЭК на подгруппы на основе связанных клинических факторов: к ним относятся НЭК у доношенных новорожденных, НЭК, связанная с переливанием эритроцитов, НЭК, связанная с непереносимостью коровьего молока, НЭК, связанная с инфекцией и / или лимфоцитозом, НЭК, связанная с крайней недоношенностью, и NEC-подобные заболевания [9].
Признаки и симптомы
Начало НЭК обычно в течение первых нескольких недель после рождения, когда было начато кормление, и возраст начала обратно пропорционально связан с гестационным возрастом при рождении.На ранней стадии заболевания у новорожденных могут проявляться признаки непереносимости пищи с рвотой, повышенным содержанием желудочного аспирата, желчным (зеленым) желудочным аспиратом или пониженным шумом кишечника с вздутием живота и болезненностью. Грубая или скрытая кровь может присутствовать в стуле, что указывает на повреждение слизистой оболочки. Многие из этих признаков неспецифичны и могут возникать при других заболеваниях. Прогрессирование НЭК приводит к системным признакам, таким как летаргия, длительные паузы в дыхании, называемые апноэ, нестабильность температуры и плохая перфузия (перекачка жидкости через орган или ткань.В конечном итоге это может привести к дыхательной недостаточности и сердечно-сосудистому коллапсу, требующим искусственной вентиляции легких и вазопрессоров. Пальпируемое образование и эритема (патологическое покраснение кожи из-за закупорки капилляров, как при воспалении) брюшной стенки указывают на более запущенный процесс заболевания.
Причины
После многих лет исследований и клинических наблюдений этиология и патогенез НЭК остаются неуловимыми. Некоторые ключевые факторы риска постоянно идентифицировались как важные предпосылки для инициирования кишечного повреждения, ведущего к НЭК.К ним относятся недоношенность, кормление смесями, аномальная микробная колонизация кишечника и ишемия (когда кровеносные сосуды кишечника сужаются или блокируются, что снижает кровоток) [3; 10; 11].
Недоношенность остается основным важным фактором риска, связанным с НЭК. Незрелость кишечного эпителиального клеточного барьера и иммунной системы, по-видимому, вносит свой вклад в патогенез. До рождения плод имеет стерильную кишечную среду и после рождения быстро становится колонизированным бактериями.Неправильная колонизация с преобладанием грамотрицательных бактерий может привести к нарушению нормального кишечного эпителия, бактериальной транслокации и вызвать чрезмерный воспалительный ответ [10; 12-14]. Отличительными гистологическими находками, наблюдаемыми при НЭК, являются воспаление и коагуляционный некроз [11] (паттерн гибели тканей). Ишемия — еще один важный патофизиологический фактор в развитии НЭК. Снижение поступления кислорода к клеткам кишечника может привести к клеточному повреждению и некрозу.
Диагноз
NEC диагностируется клинически и рентгенологически.Как только возникает клиническое подозрение, в качестве первоначальной оценки выполняется рентгенография брюшной полости. Это повторяется серийно в зависимости от остроты болезни и клинического течения для оценки прогрессирования заболевания. Характерные признаки процесса НЭК на рентгенограммах брюшной полости включают кишечник пневматоз (воздух в стенке кишечника), аномальные стойкие расширенные петли, утолщение стенки кишечника, пневмоперитонеум и газ в воротной вене. Пневмоперитонеум, определяемый как свободный воздух в брюшной полости, представляет собой неотложную хирургическую помощь, указывающую на перфорацию кишечника и обычно требующую вмешательства.Ультразвуковое исследование брюшной полости также может использоваться для оценки наличия свободной жидкости в брюшной полости или образования абсцесса. Дополнительные лабораторные исследования для оценки тяжести НЭК включают посев крови, исследования свертывания крови и полный анализ крови с ручным дифференцированием для оценки лейкоцитоза с бандемией, нейтропенией, анемией и тромбоцитопенией. Газы крови проверяются серийно, чтобы оценить тяжесть ацидоза и потребность в респираторной поддержке или для помощи в отведении жидкости.
Стандартные методы лечения
Лечение
Лечение НЭК зависит от клинической стадии.При подозрении на НЭК I стадии начальное лечение состоит из покоя кишечника с прекращением энтерального питания, назогастральной декомпрессии, посева крови и назначения антибиотиков широкого спектра действия. Пока младенец остается НКО, «ничего во рту», начинают внутривенное парентеральное питание. Необходимо тщательное наблюдение с серийными обследованиями и рентгенограммами. Консультация хирурга проводится после подтверждения НЭК, II или III стадии. Поддерживающая терапия включает респираторную поддержку, инотропную (сердечную) поддержку, жидкостную реанимацию и коррекцию кислотно-щелочного дисбаланса.У пациентов с НЭК может развиться диссеминированное внутрисосудистое свертывание (ДВС) (состояние, которое препятствует нормальному свертыванию крови) из-за потребления факторов свертывания крови, и им требуется переливание продуктов крови. Основным показанием к хирургическому вмешательству при НЭК является перфорированная или некротическая кишка. Другие показания включают клиническое ухудшение и сильное вздутие живота, вызывающее синдром брюшной полости (дисфункция или отказ органов из-за сильного повышения давления в брюшной полости.) В зависимости от клинической картины обычно выполняются два хирургических доступа: лапаротомия с резекцией (удалением) некротизированной кишки или первичный перитонеальный дренаж (процедура введения дренажа Пенроуза в пространство в брюшной полости, которое содержит кишечник, желудок и печень. ).
Профилактика НЭК имеет наибольший потенциал для снижения неблагоприятных исходов, связанных с НЭК. В настоящее время было ясно показано, что грудное молоко защищает от НЭК по сравнению с кормлением смесью [15; 16].Установление стандартизированного протокола кормления с объективными критериями отказа от кормления также снижает риск НЭК [17]. Пробиотики могут предотвращать НЭК за счет восстановления микробной флоры кишечника, но это все еще требует дальнейших исследований в отношении оптимальной дозировки и продолжительности лечения [18].
Исследовательские методы лечения
Информация о текущих клинических испытаниях размещена в Интернете по адресу www.clinicaltrials.gov. Все исследования, финансируемые правительством США, а некоторые исследования поддерживаются частным сектором, размещены на этом правительственном веб-сайте.
Для получения информации о клинических испытаниях, проводимых в клиническом центре NIH в Бетесде, штат Мэриленд, свяжитесь с отделом приема пациентов NIH:
(бесплатный): (800) 411-1222 TTY: (866) 411-1010 Электронная почта: [электронная почта protected]
Для получения информации о клинических испытаниях, спонсируемых из частных источников, обращайтесь:
www.centerwatch.com
Для получения дополнительной информации о клинических испытаниях, проведенных в Европе, обращайтесь: https://www.clinicaltrialsregister.eu/
Информация в базе данных редких заболеваний NORD предназначена только для образовательных целей и не предназначена для замены рекомендаций врача или другого квалифицированного медицинского специалиста.
Содержание веб-сайта и баз данных Национальной организации по редким заболеваниям (NORD) защищено авторским правом и не может быть воспроизведено, скопировано, загружено или распространено каким-либо образом в коммерческих или общественных целях без предварительного письменного разрешения и согласия. от НОРД. Физические лица могут распечатать одну бумажную копию отдельного заболевания для личного использования при условии, что содержание не изменено и включает авторские права NORD.
Национальная организация по редким заболеваниям (NORD)
Проспект Кеносии, 55, Danbury CT 06810 • (203)744-0100
Некротический энтероколит | Michigan Medicine
Обзор темы
Что такое некротический энтероколит?
Некротический энтероколит — инфекция и воспаление кишечника. Чаще всего встречается у детей, родившихся раньше срока (недоношенных). Многие новорожденные с этим заболеванием продолжают вести здоровый образ жизни. Но если инфекция станет серьезной, она может вызвать серьезные повреждения кишечника, которые могут быть смертельными. У некоторых детей могут быть постоянные проблемы с пищеварением, ростом или развитием.
Это состояние обычно возникает в течение первых 2 недель после рождения. Но это может произойти до 3 месяцев после рождения.
Что вызывает некротический энтероколит и можно ли его предотвратить?
Врачи не уверены, что вызывает это состояние. Это может произойти, когда иммунная и пищеварительная системы не работают должным образом. Это может произойти, если ребенок рождается рано или возникают проблемы во время беременности или родов.
Эксперты не знают, может ли кормление грудью новорожденного привести к некротическому энтероколиту.Они действительно знают, что это заболевание гораздо реже встречается у младенцев, которых кормят грудным молоком.
Некоторые врачи рекомендуют пробиотики, чтобы предотвратить некротический энтероколит у некоторых младенцев, подверженных этому риску. Пробиотики — это бактерии, которые помогают поддерживать естественный баланс организмов (микрофлоры) в кишечнике.
Каковы симптомы?
Симптомы зависят от серьезности проблемы. Они могут включать:
- опухший, болезненный, красный или блестящий живот.
- Запор.
- Стул темный, черный или кровавый.
- Низкая или нестабильная температура тела.
- Озноб и жар.
- Учащенное сердцебиение и дыхание.
- Не хочу есть.
- Рвота.
- Быть менее активным или иметь мало энергии.
Как диагностируется некротический энтероколит?
Врач спросит о симптомах и состоянии здоровья вашего ребенка.Врач может провести такие анализы, как:
- Рентген живота вашего новорожденного.
- Тест для проверки наличия крови в стуле вашего ребенка (анализ кала на скрытую кровь).
- Тесты для выявления бактерий в кале, крови, моче или спинномозговой жидкости.
Как лечится?
Ваш ребенок будет проходить лечение в отделении интенсивной терапии новорожденных (NICU). Лечение обычно длится от 3 до 10 дней. Это может длиться дольше, если состояние тяжелое.Лечение включает внутривенное (IV) кормление, прием антибиотиков и трубку, которая вводится через нос в желудок для удаления лишней жидкости и газа из кишечника.
Если вашему ребенку не станет лучше после лечения или у него образовалась дыра в кишечнике, ему или ей может потребоваться операция. Примерно 1 из 4 детей с некротическим энтероколитом может нуждаться в хирургическом вмешательстве. сноска 1 Хирургия обычно означает проведение двух процедур с интервалом в две недели или месяцы. Первая операция удаляет поврежденные части кишечника и может создать колостому или илеостому, чтобы кишечник мог зажить.(При стоме стул покидает тело через отверстие в животе и собирается в мешок.) Будет проведена вторая операция, чтобы закрыть стому, чтобы стул снова мог нормально проходить через тело.
После лечения ваш ребенок будет готов выписаться из больницы, если он или она хорошо ест и не худеет. Медсестра покажет вам, как кормить ребенка и ухаживать за ним дома.
Это нормально, когда у вашего ребенка проблемы со здоровьем. Наблюдать за лечением крошечного новорожденного может быть очень неприятно.Вы можете расстроиться, если не можете держать ребенка на руках так часто, как хотите, или не можете кормить его грудью. Возможно, вам будет полезно поговорить о своих чувствах и проблемах с социальным работником или консультантом. Обязательно спрашивайте врачей вашего ребенка обо всем, чего вы не понимаете.
Ссылки
Цитаты
- Розенбург А. и др. (2014). Новорожденный. В WW Hay Jr et al., Eds., Current Diagnosis and Treatment: Pediatrics , 22nd ed.С. 9–74. Нью-Йорк: Макгроу-Хилл.
Консультации по другим работам
- AlFaleh K, et al. (2011). Пробиотики для профилактики некротического энтероколита у недоношенных детей. Кокрановская база данных систематических обзоров (3).
- Brown RE, Neu J. (2006). Некротический энтероколит. В издании FD Burg et al., Current Pediatric Therapy, 18-е изд., Стр. 293–296. Филадельфия: Сондерс Эльзевьер.
- Махешвари А., Карло В.А. (2011).Некротический энтероколит новорожденных. В RM Kliegman et al., Eds., Учебник педиатрии Нельсона, 19-е изд., Стр. 601–603. Филадельфия: Сондерс.
- Группа разработки рекомендаций по некротическому энтероколиту (NEC), Медицинский центр детской больницы Цинциннати (2010 г.). Основанное на фактах руководство по некротическому энтероколиту у младенцев с очень низкой массой тела при рождении. Руководство № 28. Доступно в Интернете: http://www.cincinnatichildrens.org/service/j/anderson-center/evidence-based-care/necrotizing-enterocolitis.
- Памми М., Абрамс С.А. (2011). Лактоферрин для перорального применения для профилактики сепсиса и некротического энтероколита у недоношенных детей. Кокрановская база данных систематических обзоров (10).
- Памми М., Абрамс С.А. (2011). Лактоферрин для перорального применения для лечения сепсиса и некротического энтероколита у новорожденных. Кокрановская база данных систематических обзоров (10).
- Соломкин Ю.С., и др. (2010). Диагностика и лечение осложненных внутрибрюшных инфекций у взрослых и детей: Рекомендации Общества хирургических инфекций, Общества инфекционистов и Общества инфекционных болезней Америки.Клинические инфекционные болезни, 50 (2): 133–164. [Erratum in Clinical Infectious Diseases, 50 (12): 1695.]
Кредиты
Текущий по состоянию на:
27 мая 2020
Автор: Healthwise Staff
Медицинский обзор:
Сара Маршалл, доктор медицины — Семейная медицина
Джон Поуп, доктор медицины — Педиатрия
Кэтлин Ромито, доктор медицины — Семейная медицина
Брэд У. Уорнер, доктор медицины — Педиатрическая хирургия
По состоянию на 27 мая 2020 г.
Автор:
Здоровый персонал
Медицинский обзор: Сара Маршалл, доктор медицины — семейная медицина и Джон Поуп, доктор медицины — педиатрия, Кэтлин Ромито, доктор медицины — семейная медицина, и Брэд В.Warner MD — Детская хирургия
Rosenburg A, et al. (2014). Новорожденный. В WW Hay Jr и др., Ред., Текущая диагностика и лечение: Педиатрия , 22-е изд., Стр. 9-74. Нью-Йорк: Макгроу-Хилл.
Некротический энтероколит | Бостонская детская больница
Некротический энтероколит (НЭК) — серьезное кишечное заболевание у младенцев, которое приводит к отмиранию тканей кишечника. NEC может привести к образованию отверстий или участков сужения (стриктуры) в кишечнике и является причиной синдрома короткой кишки (SBS).В SBS ребенку не хватает тонкого кишечника, чтобы усваивать все питательные вещества, необходимые его растущему организму.
Что вызывает некротический энтероколит?
Причина некротического энтероколита (НЭК) неизвестна. Недоношенные или больные новорожденные подвергаются наибольшему риску развития НЭК, который встречается примерно у 10 процентов детей с массой тела менее 3 фунтов 5 унций.
Как диагностируется некротический энтероколит?
Ваш врач осмотрит вашего ребенка на предмет следующих симптомов:
- вздутие живота (вздутие живота)
- кормлений, которые остаются в желудке
- Желчная (зеленая) жидкость в желудке
- Кровавый стул
- признаков инфекции, таких как апноэ (остановка дыхания), низкий пульс и вялость (вялость)
Затем мы можем предложить рентген для поиска воздуха в кишечнике или крупных венах печени.В некоторых случаях ваш врач может ввести иглу в брюшную полость вашего ребенка, чтобы найти кишечную жидкость, что часто является признаком NEC.
Как лечится некротический энтероколит?
Лечение НЭК может включать следующее:
- прекращение кормления
- введение назогастрального зонда (из носа в желудок), чтобы желудок оставался пустым
- Жидкости для внутривенного введения для питания и восполнения жидкости
- Антибиотики против инфекций
- частые рентгеновские снимки для наблюдения за прогрессом болезни
- Дополнительный кислород или дыхание с механической поддержкой
- процедур изоляции (например, защитных халатов и перчаток) для предотвращения распространения инфекции.
В более тяжелых случаях детям с НЭК могут потребоваться:
- Операция по удалению пораженного кишечника или кишечника
- соединение части кишечника или кишечника со стомой (отверстие на брюшной полости)
Как мы лечим некротический энтероколит
В Бостонской детской больнице мы лечим детей с NEC в нашем Центре продвинутой кишечной реабилитации (CAIR), который включает команду экспертов с многолетним опытом ухода за детьми с проблемами кишечника и их семьями.Среди наших специалистов:
- врачей, прошедших подготовку в области хирургии, гастроэнтерологии и диетологии
- зарегистрированных диетологов
- практикующих медсестер
- медсестер
- фармацевт
- социальный работник
Некротический энтероколит (НЭК) | Блаженство
Что такое некротизирующий энтероколит (НЭК)?
Некротический энтероколит (НЭК) — серьезное заболевание, которое может поражать новорожденных, при котором воспаляются ткани кишечника (тонкого и толстого кишечника).Врачи могут также описать НЭК как воспаление кишечника.
NEC может поражать только небольшую часть кишечника, а иногда и весь кишечник.
Насколько серьезно NEC?
NEC — серьезное заболевание. Младенцы могут очень плохо себя чувствовать из-за NEC. Иногда ткани в некоторых частях кишечника повреждаются и умирают, и их необходимо удалить хирургическим путем. У нас есть дополнительная информация об операции по лечению NEC, которая может быть вам полезна.
К сожалению, некоторые младенцы умрут от NEC.Некоторые дети могут быть слишком плохо себя чувствуют для операции или могут не поправиться после лечения. Медицинские работники, занимающиеся уходом за вашим ребенком, должны объяснить все риски, связанные с оказываемым им уходом. Вы можете поговорить с ними, если у вас возникнут какие-либо опасения или опасения.
У нас есть дополнительная информация о принятии решений о неотложной помощи, паллиативной помощи и о тяжелой утрате.
Что вызывает NEC?
Врачи не до конца понимают, что вызывает НЭК. Младенцы, рожденные недоношенными или больными, имеют более незрелый кишечник, а это означает, что у них больше шансов заболеть НЭК, чем у детей, рожденных здоровыми или доношенными.Вероятно, здесь задействовано несколько факторов.
Кто, скорее всего, получит NEC?
NEC обычно поражает новорожденных в первые несколько недель после рождения. Чаще встречается в:
- недоношенных детей (особенно младенцев, рожденных до 32 недель или с массой тела менее 1500 г)
- младенцев с множеством других медицинских проблем
- младенцев, которые были нездоровы до своего рождения (например, младенцы, которые не растут в утробе, как и ожидалось).
NEC, скорее всего, повлияет на младенцев до того, как они уйдут домой из неонатального отделения.
NEC также может поражать доношенных детей, которые в остальном были здоровыми, хотя это случается редко.
Какие признаки NEC?
NEC может быть сложно диагностировать. Но есть признаки того, что ребенок может проявить недомогание с помощью NEC . Скорее всего, врачи обнаружат эти признаки у вашего ребенка в неонатальном отделении.
Признаки NEC у вашего ребенка могут включать общие признаки плохого самочувствия или борьбы с инфекцией, например:
- учащенное сердцебиение
- низкое кровяное давление
- нерегулярное, быстрое или медленное и поверхностное дыхание
- высокая, низкая или быстро меняющаяся температура.
В некоторых случаях могут появиться более специфические признаки, которые могут включать:
- не ест в обычном режиме
- кровь в стуле (фекалии)
- болезненный, опухший или обесцвеченный животик
- тошнота (рвота), особенно если у них рвота зеленой жидкостью (желчью)
- с большим объемом зеленого жидкость или кровь, поступающие обратно в трубку NG вашего ребенка (если ребенок получает питание через трубку).
Если врачи считают, что у вашего ребенка НЭК, они сделают рентген и анализы крови.Однако бывает трудно понять, вызваны ли эти признаки NEC или другими причинами.
Вам следует всегда проконсультироваться с врачом , если ваш ребенок не ведет себя, как обычно, или вы думаете, что ваш ребенок плохо себя чувствует.
Иногда ребенок может серьезно заболеть очень быстро, и ему потребуется серьезная медицинская помощь. Если вы подозреваете, что ваш ребенок серьезно заболел, сообщите об этом медицинским работникам в неонатальном отделении или позвоните по номеру 999, если вы находитесь дома.
Могу ли я снизить риск заражения моего ребенка NEC?
Исследования показывают, что грудное молоко может помочь снизить риск NEC . Большинство детей, рожденных недоношенными, не могут кормить грудью в первые несколько недель. Если это произойдет, возможно, вы захотите сцеживать молоко своему ребенку. Затем он подается им через трубку в живот. Поступая так, ваш ребенок по-прежнему сможет получать пользу от грудного молока.
Если ваш ребенок не может принимать молоко в это время, но вы хотите кормить ребенка грудным молоком позже (путем грудного вскармливания или кормления из бутылочки), вам следует продолжать сцеживать грудное молоко.Использование грудного молока также может быть полезно, когда ваш ребенок выздоравливает от NEC и может снова начать кормление грудью. Если вам трудно сцеживать грудное молоко, некоторые отделения могут иметь доступ к донорскому молоку. Поговорите с персоналом вашего подразделения для получения дополнительной информации.
Медицинские работники смогут помочь вам с кормлением вашего ребенка. Вы также можете посетить наши страницы о кормлении для получения дополнительной информации.
Каковы возможные методы лечения NEC?
Если у вашего ребенка НЭК в легкой форме или медицинские работники, ухаживающие за вашим ребенком, думают, что у вашего ребенка может быть НЭК, можно начать следующее лечение:
- Прекращение кормления молоком .Это сделано потому, что отдых кишечника может помочь ему восстановиться. Когда нельзя давать молоко, вашему ребенку могут давать пищу, например жир, сахар, белок и витамины, через длинную очередь. Это необходимо для того, чтобы ваш ребенок рос, пока вы не кормите его молоком. Длинная линия — это длинная мягкая пластиковая трубка, вставленная в вену на руке или ноге ребенка.
- Запуск антибиотиков для лечения и профилактики инфекций .
Если ваш ребенок в целом плохо себя чувствует, могут потребоваться другие виды лечения, например, увеличение количества кислорода или помощь при дыхании.Многие дети с НЭК выздоравливают после этого лечения.
Однако, если область кишечника умирает, ваш ребенок не реагирует на лечение или имеется перфорация (отверстие) в кишечнике, вашему ребенку потребуется операция. У нас есть дополнительная информация об операции по лечению NEC, которая может быть вам полезна.
Медицинская бригада вашего ребенка должна постоянно держать вас в курсе заботы о вашем ребенке, и вы должны иметь возможность принимать вместе с ними решения относительно ухода за ним.
Что может произойти после лечения моего ребенка от NEC?
Многие дети, выздоравливающие после НЭК, больше не имеют проблем.Но не исключено, что могут возникнуть и другие проблемы.
Эти проблемы включают следующее:
- NEC возвращается (повторяется). Если это произойдет, вашему ребенку может потребоваться операция. У нас есть дополнительная информация об операции по лечению NEC.
- Стриктуры — место сужения кишечника из-за рубцовой ткани. Это может быть вызвано повреждением кишечника из-за NEC или хирургическим вмешательством по поводу NEC. Если это произойдет, потребуется операция, чтобы расширить область кишечника или, возможно, удалить узкую область.
Вашему ребенку может потребоваться операция, если какие-либо проблемы не исчезнут.
В долгосрочной перспективе некоторые исследования показывают, что NEC иногда может влиять на развитие мозга некоторых младенцев. Но все дети развиваются по-разному .
