Энцефалопатия головного мозга у детей: Энцефалопатия — Симптомы, лечение — Медицинский справочник АМК
Токсическая энцефалопатия
Токсическая энцефалопатия представляет собой рассеянное органическое поражение головного мозга, которое может развиться как после тяжелых острых отравлений нейротропными ядами, так и при хронических профессиональных нейроинтоксикациях.
Ранними клиническими проявлениями различных хронических интоксикаций в большинстве случаев являются функциональные нарушения центральной нервной системы. При прогрессировании интоксикации происходит постепенное перерастание нейродинамических нарушений в стадию органических изменений — развивается картина токсической энцефалопатии. Органическая природа заболевания нередко может длительное время маскироваться астеническими или невротическими чертами, в связи с чем переход из функциональной стадии в органическую не всегда выявляется своевременно.
К веществам, которые способны вызывать рассеянные повреждения мозговых тканей, относятся:
- пестициды,
- продукты нефтеперегонки,
- соли тяжёлых металлов,
- химические составы бытового предназначения,
- нейротропные медицинские препараты (снотворные, транквилизаторы),
- угарный газ,
- пары ртути,
- свинец,
- мышьяк,
- марганец,
- спиртосодержащие жидкости,
- бактериальные токсины, образующиеся при ботулизме, кори, дифтерии.

Основные типы интоксикаций при энцефалопатии
Выделяют два основных типа интоксикаций: острую и хроническую:
- Острая токсическая энцефалопатия наступает в результате однократного, сильного воздействия отравляющего вещества на организм. Острое состояние требует срочной медицинской помощи и последующих реабилитационных мероприятий.
- В условиях систематического влияния отравления имеет место хроническая форма повреждения тканей мозга. Она наступает на поздних стадиях развития болезни, когда организм уже не способен противостоять длительному воздействию отравления. Больному требуется долгий курс лечения.
Клиническая картина
Для начальной формы токсической энцефалопатии характерна следующая симптоматика: жалобы на упорные головные боли, головокружение, снижение памяти, общую слабость, повышенную утомляемость, нарушение сна и др. На фоне резкой астенизации появляется рассеянная органическая симптоматика, которая не укладывается в картину какой-либо четко очерченной нозологической единицы (асимметрия лицевой иннервации, девиация языка, легкая гипомимия, рефлексы орального автоматизма, высокие сухожильные рефлексы, часто анизорефлексия, ослабление или исчезновение кожных рефлексов). Наряду с этим наблюдаются нарушения психоэмоциональной сферы: снижение памяти, внимания и умственной работоспособности, медлительность, заторможенность, апатия, немотивированная тревога, угнетенное настроение, выраженная эмоциональная лабильность.
Наряду с этим наблюдаются нарушения психоэмоциональной сферы: снижение памяти, внимания и умственной работоспособности, медлительность, заторможенность, апатия, немотивированная тревога, угнетенное настроение, выраженная эмоциональная лабильность.
Наиболее часто при токсических энцефалопатиях страдают стволовой и диэнцефальный отделы, нередко в процесс вовлекаются мозжечковая, оптико-вестибулярная и экстрапирамидная системы. Общей особенностью токсических энцефалопатий является рассеянность поражения. Однако каждое токсическое вещество придает заболеванию свои клинические особенности. Так, при марганцевой энцефалопатии на фоне диффузной патологии головного мозга начинают вырисовываться очаговые подкорковые симптомы. При энцефалопатиях, обусловленных хроническим воздействием окиси углерода, клинической особенностью является развитие церебрально-кардиальных ангиодистонических расстройств, протекающих на фоне органического диффузного поражения головного мозга. Нарушения координации движений, потливость, дрожание конечностей, галлюцинации, приступы раздражения и агрессии характерны для отравлений алкоголем.
Нарушения координации движений, потливость, дрожание конечностей, галлюцинации, приступы раздражения и агрессии характерны для отравлений алкоголем.
Нарушения психики при различных энцефалопатиях также имеют некоторые особенности. Так, для сероуглеродной энцефалопатии характерны понижение активности, отсутствие инициативы, угнетенное настроение, тоска, равнодушие ко всем, прежде интересовавшим больного сторонам жизни. Такой же астенодепрессивный синдром часто возникает при энцефалопатиях, развившихся вследствие хронической интоксикации этилированным бензином. Ртутной энцефалопатии свойственно сочетание повышенной эмоциональной возбудимости с растерянностью, болезненной застенчивостью, нерешительностью и неуверенностью в себе.
Сроки развития токсических энцефалопатий различны. Так, при интоксикациях сероуглеродом и марганцем энцефалопатия развивается значительно быстрее, чем при хронической интоксикацией алкоголем, ртутью, свинцом или окисью углерода.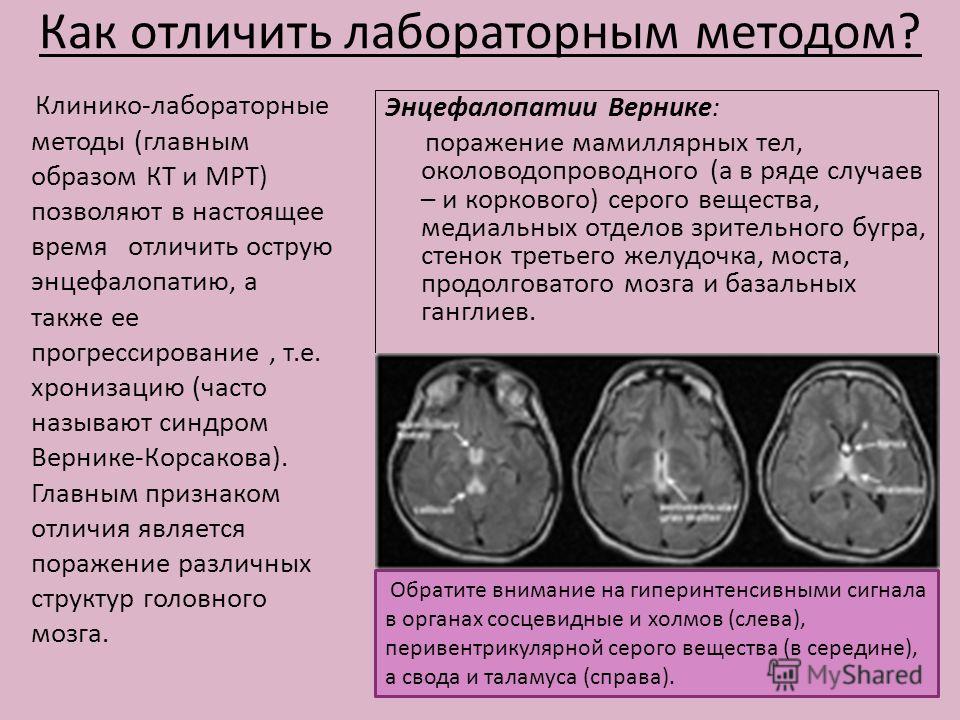
Течению токсических энцефалопатий свойственны стойкость патологических проявлений, наличие остаточных явлений в отдаленном периоде и наклонность к прогрессированию вне контакта с токсическим агентом. Патологоанатомические данные указывают, что в основе токсических энцефалопатий лежат сосудистые поражения головного мозга и рассеянные дегенеративные изменения мозговой ткани.
Лечение токсической энцефалопатии головного мозга
Устранение причин, давших толчок болезни, является безотлагательной мерой в тактике лечения токсических энцефалопатий. Контакт больного с ядовитой средой должен быть прекращён. В большинстве случаев пациенту предлагается госпитализация. Первичные назначения врача состоят в детоксикационных мерах. Пациенту назначаются антидоты, нейтрализующие действие ядов. Лекарство подбирается в соответствии с типом отравляющего вещества. Общие мероприятия по детоксикации заключаются в очистительных клизмах, стимуляции диуреза, проведении плазмафереза и гемодиализа.
Следующим этапом лечения являются меры по улучшению кровообращения в сосудах мозга и активизации метаболических процессов. Больному показаны внутривенные и внутримышечные вливания следующих препаратов:
- кавинтон,
- пирацетам,
- церебролизин,
- актовегин,
- цераксон,
- глиатилин.
Для внутримышечного введения назначаются витамины В, С, Р. Перорально пациент принимает биостимуляторы и адаптогены: экстракт женьшеня, лимонника, элеутерококка, препараты на основе алоэ.
По симптоматическим показаниям могут быть назначены транквилизаторы, миорелаксанты, противосудорожные и седативные средства, антидепрессанты:
- реланиум,
- карбамазепин,
- мидокалм,
- сирдалуд,
- амитриптилин,
- тералиджен,
- паксил,
- анафранил.
После стабилизации состояния в курс лечения включаются физиотерапевтические комплексы. Эффективными признаны массаж, иглорефлексотерапия, гидротерапия, грязелечение.
Последствия и прогноз токсических энцефалопатий
Успех лечения больных с поражением мозговых структур во многом зависит от степени тяжести состояния, при которой пациент стал получать медицинскую помощь.
Запущенные болезни не могут быть полностью излечены, а глубокие церебральные изменения не поддаются корректировке. Квалифицированная помощь будет наиболее действенной на ранних стадиях процесса.
Наличие остаточных явлений и прогрессирование болезни без контакта с ядовитыми агентами характерно для отравлений. Но это не означает, что больной лишается надежды на исцеление. Даже в случае инвалидизации самочувствие может стать вполне удовлетворительным при условии проведения полного курса лечебных процедур.
Регулярные реабилитационные мероприятия необходимо проводить на протяжении дальнейшей жизни. Эти меры позволят замедлить дегенеративные процессы в тканях мозга и восстановить многие утраченные функции.
Энцефалопатия головного мозга — лечение в Ставрополе
Как диагностировать энцефалопатию
Работа с пациентом начинается с диагностики, в том числе, с выявления причин возникновения этого заболевания. Есть 3 степени тяжести, которые отличаются по интенсивности симптоматики. При 1 степени признаки внешне не проявляются, а патологии выявляются только после детального обследования.
Есть 3 степени тяжести, которые отличаются по интенсивности симптоматики. При 1 степени признаки внешне не проявляются, а патологии выявляются только после детального обследования.
Энцефалопатия 2 степени характеризуется умеренными симптомами, которые обычно успешно снимаются при врачебном вмешательстве. При наступлении 3 степени появляются необратимые изменения, которые приводят к серьезным проблемам, вплоть до инвалидности. Обращение к специалисту рекомендовано, когда появляются такие симптомы, как.
- Периодические головные боли. Они могут концентрироваться на отдельном участке или захватывать весь объем головы. Важной особенностью является постоянное прогрессирование и плохое купирование анальгетиками.
- Головокружения. При этом симптоме человек может даже потеряться в пространстве, поэтому предпочитает ложиться в постель. Может сопровождаться тошнотой и вызванной ею рвотой.
- Снижение когнитивных способностей. Особенно часто встречается у пожилых людей, но бывает и в других возрастах.
 Из-за нарушения кровообращения ухудшается память, снижается концентрация внимания, возникают сложности с переключением от одного занятия к другому.
Из-за нарушения кровообращения ухудшается память, снижается концентрация внимания, возникают сложности с переключением от одного занятия к другому. - Ухудшения в эмоциональной сфере. Человек слабо контролирует эмоции, появляется раздражительность, часто переходящая в плаксивость, в том числе, у мужчин. При развитии заболевания человек становится апатичным, проявляются депрессивные состояния.
- Нарушения тонуса мышц. Мышцы могут быть патологически напряжены или расслаблены, нередко появляется тремор, неконтролируемые движения.
- Ухудшение слуха и зрения, прогрессирующее повышение метеочувствительности.
Чтобы поставить диагноз, необязательно наличие всех симптомов. У некоторых пациентов прогрессируют поведенческие расстройства, у других – страдают органы чувств или координация. Все зависит, от того, какая область наиболее затронута заболеванием.
Как проходит лечение
На начальном этапе проводится опрос и осмотр пациента для сбора информации и оценки его текущего состояния. Обязательно проводится электроэнцефалография, что позволит выявить пораженные участки головного мозга.
Обязательно проводится электроэнцефалография, что позволит выявить пораженные участки головного мозга.
При необходимости могут назначаться и другие обследования, включая анализ крови. Лечение дисциркуляторной энцефалопатии 2 степени включает в себя следующий комплекс процедур, направленных на нормализацию состояния пациентов.
- Назначение ноотропных препаратов для упорядочивания обмена веществ.
- Разжижающие кровь препараты помогают нормализовать кровоток в головном мозге. Для этой же цели назначаются ангиопротекторы.
- В сложных случаях назначаются успокоительные и противосудорожные комплексы.
- Витамины помогают поддержать организм при прохождении курса.
- Параллельно нужно убрать симптоматику сопутствующих заболеваний: нормализовать уровень сахара и артериальное давление, оптимизировать работу эндокринной системы, вывести токсины и привести в норму холестерин.
Если наступила 3 степень заболевания, общие принципы остаются прежними, но пациент госпитализируется и за ним осуществляется круглосуточный уход. При реабилитации подключаются физиологические процедуры, особенно хорошо они помогают при 2 степени или когда диагностирована посттравматическая энцефалопатия. К ним относятся.
При реабилитации подключаются физиологические процедуры, особенно хорошо они помогают при 2 степени или когда диагностирована посттравматическая энцефалопатия. К ним относятся.
- ЛФК.
- Различные виды массажа.
- Разные виды функционального воздействия на головной мозг.
- Мануальная терапия.
- Психотерапия.
Результаты
При работе с 1 и 2 степенью заболевания прогноз исключительно благоприятен. Правильно выстроенное лечение энцефалопатии позволяет полностью восстановить кровообращение и функционал головного мозга, при этом наблюдаются такие эффекты, как.
- Снимается синдром головных болей и головокружение.
- Улучшается память, концентрация внимания и, как следствие, когнитивные способности.
- Нормализуется координация, пациент полностью контролирует конечности, пропадает тремор.
- Пациент становится спокойнее, оптимизируется эмоциональная сфера.
- В большинстве случаев улучшается зрение и слух.

При 3 степени удается приостановить развитие заболевания, провести реабилитацию больного, социализировать его, обеспечив максимальный жизненный комфорт.
Neuro Clinic – современный медицинский центр, в котором работают высококвалифицированные специалисты. Лечение энцефалопатии головного мозга у взрослых и детей – наш профиль, мы располагаем современным оборудованием, поэтому можем применять лучшие методики реабилитации, что позволяет полностью излечить большинство обратившихся к нам людей.
При необратимых патологиях мы остановим процесс и поможем человеку научиться жить в новых реалиях. Доступная стоимость услуг позволяет получить помощь всем, кому она требуется.
Детская острая энцефалопатия | Encyclopedia MDPI
Острая энцефалопатия обычно поражает ранее здоровых детей и часто приводит к смерти или тяжелым неврологическим осложнениям. Острая энцефалопатия представляет собой группу множественных синдромов, характеризующихся различными клиническими симптомами, такими как потеря сознания, двигательные и чувствительные нарушения, статусные судороги.
1. Диагностика
Кома с выраженным нарушением сознания или судорожным состоянием является клиническим признаком острой энцефалопатии; однако идентифицировать острую энцефалопатию в этих обстоятельствах довольно легко. Однако существуют различные ранние признаки и симптомы, а также вариации этих симптомов. Этот широкий спектр клинических симптомов отражает широкий спектр нарушений мозговой функции, представленный Международным консорциумом по энцефалитам, который рекомендует диагностировать энцефалит и энцефалопатию предполагаемой инфекционной или аутоиммунной этиологии. Измененное психическое состояние является основным критерием. Дополнительные критерии (незначительные) для подтверждения диагноза включают лихорадку ≥38 °C (100,4 °F) в течение 72 часов до или после поступления; генерализованные или парциальные припадки, не полностью связанные с ранее существовавшим судорожным расстройством; новое появление фокальных неврологических симптомов; спинномозговая жидкость (ЦСЖ) лейкоциты ≥5 мм 3 ; и электроэнцефалографические отклонения, которые соответствуют энцефалопатии и не вызваны другим фактором или и не вызваны другим состоянием [1] .
Клиническое обследование и план ведения ребенка с энцефалопатией следует разрабатывать одновременно. Необходимо как можно быстрее собрать полный анамнез. Необходимо провести тщательное неврологическое обследование для локализации повреждения головного мозга и оценки ранних прогностических показателей, а также для выявления системных симптомов, таких как сыпь, лимфаденопатия и гепатоспленомегалия [2] . Во время физического осмотра для диагностики энцефалопатии обычно используются клинические процедуры, такие как тесты на психическое состояние, тесты на память и тесты на координацию, которые регистрируют измененное психическое состояние. Результаты клинических тестов часто используются для диагностики или предположительного диагноза энцефалопатии. Когда измененное психическое состояние связано с другим первичным заболеванием, таким как хроническое заболевание печени, почечная недостаточность, аноксия или ряд других состояний, диагноз обычно ставится [3] [4] [5] . Уровни глюкозы, аммиака, лактата и кетоновых тел в крови, а также кислотно-щелочной статус плазмы могут быть использованы для определения подтипа, связанного с генетическими метаболическими заболеваниями. Окончательный диагноз основывается на определенных лабораторных данных в начале и/или во время статических периодов [6] .
Уровни глюкозы, аммиака, лактата и кетоновых тел в крови, а также кислотно-щелочной статус плазмы могут быть использованы для определения подтипа, связанного с генетическими метаболическими заболеваниями. Окончательный диагноз основывается на определенных лабораторных данных в начале и/или во время статических периодов [6] .
Подтип цитокинового шторма отличается значительным повышением концентрации воспалительного фактора некроза опухоли и интерлейкина в сыворотке и ЦСЖ [7] . У пациентов с диссеминированным внутрисосудистым свертыванием крови и гемофагоцитарным синдромом отмечается значительное повышение уровня ферритина, сывороточной аминотрансферазы, панкреатических амилаз, креатинкиназы, креатинина и азота мочевой кислоты, а также ферритина, сывороточной аминотрансферазы, панкреатических амилаз, креатинкиназы, креатинина и азота мочевой кислоты [5] . Для диагностики эксайтотоксического криза следует использовать клинические данные, такие как двухфазный паттерн судорог и различные степени измененных состояний сознания, а также характерные картины магнитно-резонансной томографии (МРТ) и изображения мозгового потока с помощью однофотонной эмиссионной компьютерной томографии. подтип [5] .
подтип [5] .
ЭЭГ — широко используемый метод выявления и наблюдения за детьми с острой энцефалопатией. Технический прогресс значительно упростил долгосрочный мониторинг ЭЭГ у постели больного. Преимущество ЭЭГ в том, что она позволяет исследовать работу мозга в режиме реального времени путем регистрации электрической активности в мозге. Некоторые дети с острой энцефалопатией крайне болезненны и в целом неустойчивы. Даже в этих условиях возможен мониторинг ЭЭГ [6] . В последнее время опубликовано несколько исследований по длительному мониторингу ЭЭГ у детей в критическом состоянии со сниженным сознанием, в том числе с острой энцефалопатией. Опубликовано множество исследований, посвященных общепринятым результатам ЭЭГ у детей с острой энцефалопатией. Согласно этим результатам, нарушения ЭЭГ чрезвычайно распространены среди детей с острой энцефалопатией. В результате ЭЭГ считается полезной в диагностике острой энцефалопатии. Эти нарушения ЭЭГ включают генерализованную/одностороннюю/фокальную замедленность, низкий вольтаж, периодические латеральные эпилептиформные разряды и пароксизмальные разряды [8] [9] [10] [11] .
ЭЭГ продемонстрировала способность выявлять бессудорожный эпилептический статус при AESD и FIRES/AERRPS (интермиттирующие, латентные припадки) [12] [13] . Данные ЭЭГ могут помочь в дифференциации AESD от длительных фебрильных судорог. Детям с длительными судорогами и лихорадкой, уменьшением или отсутствием веретен/быстрых волн, а также постоянным или частым замедлением во время сна ставится диагноз AESD [14] . В сочетании с клинической картиной у пациентов с энцефалопатией ЭЭГ и визуализация головного мозга могут улучшить диагностику и иметь прогностическое значение. Наиболее частой находкой на ЭЭГ у больных с энцефалопатией является изолированное стойкое замедление фоновой активности. Эти паттерны связаны с различными структурными и неструктурными патологиями.
Анализ спинномозговой жидкости имеет решающее значение для определения причины энцефалита и отличия его от других видов энцефалопатии. Люмбальную пункцию (ЛП) следует проводить как можно раньше при подозрении на энцефалит, если нет противопоказаний. Клиническая оценка, а не компьютерная томография (КТ) черепа, должна использоваться для определения того, безопасно ли выполнять LP [15] [16] . Повышение уровня общего белка и коэффициента CSF/альбумина в сыворотке может быть связано с тяжелым отеком [17] . Повышенные уровни цитокинов и хемокинов в спинномозговой жидкости и сыворотке могут указывать на чрезмерно агрессивный иммунный ответ [18] . Исследование спинномозговой жидкости может выявить плеоцитоз при некоторых заболеваниях [19] , тогда как плеоцитоз может быть необычным при других заболеваниях [17] .
Клиническая оценка, а не компьютерная томография (КТ) черепа, должна использоваться для определения того, безопасно ли выполнять LP [15] [16] . Повышение уровня общего белка и коэффициента CSF/альбумина в сыворотке может быть связано с тяжелым отеком [17] . Повышенные уровни цитокинов и хемокинов в спинномозговой жидкости и сыворотке могут указывать на чрезмерно агрессивный иммунный ответ [18] . Исследование спинномозговой жидкости может выявить плеоцитоз при некоторых заболеваниях [19] , тогда как плеоцитоз может быть необычным при других заболеваниях [17] .
С 2000 года для лечения синдрома гетерогенной острой энцефалопатии используются такие технологии визуализации, как КТ, МРТ, ОФЭКТ, ПЭТ и множество других нейрорадиологических инструментов. Острая энцефалопатия была впервые определена с использованием нейрорадиографических изображений и клинических данных, полученных с помощью изображений, и с тех пор она значительно расширилась. При острой энцефалопатии можно было видеть тонкие изображения отека мозга. Рисунок 1 , Рисунок 2 , Рисунок 3 и Рисунок 4 иллюстрируют воображаемые характеристики MERS, ANE, AESD и PRES соответственно. При подозрении на острую энцефалопатию КТ обычно проводится в первую очередь, поскольку она доступна в большинстве японских региональных центров и позволяет получить быстрое изображение. Острая энцефалопатия идентифицируется по аномалиям [6] [20] , которые включают: (1) зоны низкой плотности, охватывающие весь мозг или, возможно, всю кору головного мозга, (2) отсутствие четкого различия между корой головного мозга и мозгового вещества лимбической системы, (3) как поверхность мозгового субарахноидального пространства, так и желудочки сужаются, (4) области пониженной плотности: двусторонний таламус (АНЭ) и одностороннее полушарие головного мозга (в некоторых случаях AESD), (5 ) сужение цистерн, окружающих мозг: отек ствола мозга.
При острой энцефалопатии можно было видеть тонкие изображения отека мозга. Рисунок 1 , Рисунок 2 , Рисунок 3 и Рисунок 4 иллюстрируют воображаемые характеристики MERS, ANE, AESD и PRES соответственно. При подозрении на острую энцефалопатию КТ обычно проводится в первую очередь, поскольку она доступна в большинстве японских региональных центров и позволяет получить быстрое изображение. Острая энцефалопатия идентифицируется по аномалиям [6] [20] , которые включают: (1) зоны низкой плотности, охватывающие весь мозг или, возможно, всю кору головного мозга, (2) отсутствие четкого различия между корой головного мозга и мозгового вещества лимбической системы, (3) как поверхность мозгового субарахноидального пространства, так и желудочки сужаются, (4) области пониженной плотности: двусторонний таламус (АНЭ) и одностороннее полушарие головного мозга (в некоторых случаях AESD), (5 ) сужение цистерн, окружающих мозг: отек ствола мозга.
Рисунок 1. Визуальные характеристики MERS. ( A , B ): Горизонтальное/В сагиттальное сечение было выполнено 8-летнему мальчику, которому на третий день сделали МРТ из-за лихорадки из-за нарушения сознания и невозможности распознать собственное имя. На ДВИ выявлен аномально высокий сигнал в мозолистом теле головного мозга: лейкоциты 24800, СРБ 7,84, Na 133, CL 95, ферритин 119,9, IL-6 171 ЭЭГ показала высокую амплитуду медленных волн в затылочной области. Через 3 дня пульс-терапии стероидами лихорадка прошла, сознание улучшилось. Никаких последствий. Ни возбудителя, ни вируса выявить не удалось. ( C , D ): На третий день рвоты и лихорадки он был госпитализирован, так как больше не мог разговаривать с матерью и не мог смотреть на нее. У него была диарея и положительный результат на ротавирусный антиген в кале. В билатеральных лобных и затылочных областях ЭЭГ выявлены стойкие высокоамплитудные медленные волны. Ему поставили диагноз MERS на пятый день после того, как диффузионно-взвешенная МРТ выявила аномально высокий сигнал в мозолистом теле. Стероидная импульсная терапия mPSL проводилась в течение трех дней, его уровень сознания улучшился, а ЭЭГ и МРТ нормализовались.
Ему поставили диагноз MERS на пятый день после того, как диффузионно-взвешенная МРТ выявила аномально высокий сигнал в мозолистом теле. Стероидная импульсная терапия mPSL проводилась в течение трех дней, его уровень сознания улучшился, а ЭЭГ и МРТ нормализовались.
Рисунок 2. Визуализационные характеристики ANE. ( A ): 11-месячный мальчик был госпитализирован с лихорадкой и рвотой. Ему выписали лекарство от простуды и отправили домой, но на следующий день, после 3-минутной фебрильной судороги, потеря сознания длилась 12 часов, и была отмечена повторная 3-минутная судорога, поэтому была проведена КТ. Ему был поставлен диагноз ANE после того, как компьютерная томография головного мозга выявила аномалии в двустороннем таламусе. ( Б ): Мальчик 4-х лет обратился в больницу с высокой температурой, рвотой, нарушением сознания, судорогами. Экспресс-тест на антиген гриппа А был положительным, а МРТ показала аномальные сигналы в двустороннем таламусе не только на диффузионно-взвешенных, но и на Т2-изображениях, что привело к диагнозу АНЭ. Пациент был госпитализирован в отделение интенсивной терапии сразу после постановки диагноза АНЭ. Ему была назначена церебральная седация с применением высоких доз барбитала и церебральной гипотермии при 34,5 °C в течение 48 часов, за которыми последовали ТТМ в качестве терапии для контроля температуры, терапия высокими дозами ВВИГ и пульс-терапия стероидами mPSL. Митохондриальная коктейльная терапия использовалась в сочетании с 2 месяцами после начала заболевания; больной смог ходить, а через 4 мес его речевая функция восстановилась на прежнем уровне. ( C ): Девочка 1 года и 2 месяцев поступила в больницу с лихорадкой и парциальными судорогами. После МРТ на следующий день Т2-взвешенное изображение показало аномальные сигналы в двустороннем таламусе и поставило диагноз АНЭ. Ее лечили в отделении интенсивной терапии с помощью 72-часовой гипотермии головного мозга при 34,5 ° C, пульс-терапии стероидами, ВВИГ и терапии митохондриальным коктейлем. Пациентке была проведена церебральная седация с помощью высоких доз барбитала и лечилась декстрометорфаном, что спасло ей жизнь, но у нее остались серьезные неврологические последствия.
Пациент был госпитализирован в отделение интенсивной терапии сразу после постановки диагноза АНЭ. Ему была назначена церебральная седация с применением высоких доз барбитала и церебральной гипотермии при 34,5 °C в течение 48 часов, за которыми последовали ТТМ в качестве терапии для контроля температуры, терапия высокими дозами ВВИГ и пульс-терапия стероидами mPSL. Митохондриальная коктейльная терапия использовалась в сочетании с 2 месяцами после начала заболевания; больной смог ходить, а через 4 мес его речевая функция восстановилась на прежнем уровне. ( C ): Девочка 1 года и 2 месяцев поступила в больницу с лихорадкой и парциальными судорогами. После МРТ на следующий день Т2-взвешенное изображение показало аномальные сигналы в двустороннем таламусе и поставило диагноз АНЭ. Ее лечили в отделении интенсивной терапии с помощью 72-часовой гипотермии головного мозга при 34,5 ° C, пульс-терапии стероидами, ВВИГ и терапии митохондриальным коктейлем. Пациентке была проведена церебральная седация с помощью высоких доз барбитала и лечилась декстрометорфаном, что спасло ей жизнь, но у нее остались серьезные неврологические последствия.
Рис. 3. Визуальные характеристики AESD. ( A ) 11-месячный мальчик, госпитализированный с высокой температурой и 15-минутными судорожными приступами конгестии правых верхних и нижних конечностей. Приступы прекратились после введения мидазолама. После этого был преходящий паралич Тодда правых верхних и нижних конечностей. МРТ головного мозга в норме. Лихорадка прошла через 3 дня и появилась сыпь, которая была клинически диагностирована как инфекция HHV-6. Вторая диффузионно-взвешенная МРТ головного мозга показала яркий признак появления дерева преимущественно слева, что диагностировало AESD. Назначена пульс-терапия мПСЛ 30 мг/кг 3 дня. В возрасте 6 лет он поступил в обычную начальную школу, но его языковые навыки были слабоваты. ( B ) Девочка 3 года и 3 месяца. У нее 1-часовые фебрильные судороги, наложенные на лихорадку. Мидазолам купировал судороги. На следующий день она оставалась вялой, и ей ввели внутривенные жидкости; на восьмой день она испытала серию коротких судорог в конечностях. Диффузионно-взвешенная МРТ головного мозга выявила двустороннее преобладание подкоркового белого вещества с ярким древовидным изображением и диагнозом AESD. Затем проводили 48-часовую легкую церебральную гипотермию при 35,5 °C, пульс-терапию стероидами и митохондриальную спасательную терапию. Через шесть лет после начала заболевания она живет обычной жизнью четвертого класса начальной школы без каких-либо последствий с точки зрения моторики, языка или успеваемости. ( C ) Мальчику 1 год и 7 месяцев. Через 4 дня фебрильных судорожных припадков лихорадка спала и появилась сыпь; у него был клинически диагностирован HHV-6 инфекция. Множественные судорожные припадки продолжительностью несколько минут наблюдались через 5 дней. Медленные волны регистрировались в лобных и затылочных областях ЭЭГ. Диффузионно-взвешенная МРТ головного мозга показала аномально высокий сигнал в подкорковом белом веществе и поставила диагноз AESD. Начата пульс-терапия мФСЛ и терапия витаминным коктейлем.
Диффузионно-взвешенная МРТ головного мозга выявила двустороннее преобладание подкоркового белого вещества с ярким древовидным изображением и диагнозом AESD. Затем проводили 48-часовую легкую церебральную гипотермию при 35,5 °C, пульс-терапию стероидами и митохондриальную спасательную терапию. Через шесть лет после начала заболевания она живет обычной жизнью четвертого класса начальной школы без каких-либо последствий с точки зрения моторики, языка или успеваемости. ( C ) Мальчику 1 год и 7 месяцев. Через 4 дня фебрильных судорожных припадков лихорадка спала и появилась сыпь; у него был клинически диагностирован HHV-6 инфекция. Множественные судорожные припадки продолжительностью несколько минут наблюдались через 5 дней. Медленные волны регистрировались в лобных и затылочных областях ЭЭГ. Диффузионно-взвешенная МРТ головного мозга показала аномально высокий сигнал в подкорковом белом веществе и поставила диагноз AESD. Начата пульс-терапия мФСЛ и терапия витаминным коктейлем. Температура тела поддерживалась на уровне 35,5–36,0 ТТМ в течение 5 дней. Заболевание длится более двух с половиной лет, сейчас ребенку больше 4 лет. Неврологических последствий нет, и языковые, и двигательные функции соответствуют возрасту. ( D ) Мальчик 1 года с лихорадкой 39°С и спонтанными судорогами, которые самопроизвольно прекратились до поступления в больницу; Через 4 дня он поступил с двумя 3-минутными генерализованными судорогами и был доставлен в отделение неотложной помощи без восстановления сознания. Его сразу же госпитализировали в отделение интенсивной терапии, ввели седативное средство Rabonar и в течение 48 часов проводили легкую церебральную гипотермию при температуре 35 °C. Также проводилась стероидная пульс-терапия. В дальнейшем температуру поддерживали на уровне 36 °С, и на восьмые сутки больной был переведен из ОРИТ в общую палату. В тот же день МРТ головного мозга показала аномально высокий сигнал на диффузионно-взвешенных изображениях с двусторонним преобладанием лобных долей, и был поставлен диагноз AESD типа AIEF.
Температура тела поддерживалась на уровне 35,5–36,0 ТТМ в течение 5 дней. Заболевание длится более двух с половиной лет, сейчас ребенку больше 4 лет. Неврологических последствий нет, и языковые, и двигательные функции соответствуют возрасту. ( D ) Мальчик 1 года с лихорадкой 39°С и спонтанными судорогами, которые самопроизвольно прекратились до поступления в больницу; Через 4 дня он поступил с двумя 3-минутными генерализованными судорогами и был доставлен в отделение неотложной помощи без восстановления сознания. Его сразу же госпитализировали в отделение интенсивной терапии, ввели седативное средство Rabonar и в течение 48 часов проводили легкую церебральную гипотермию при температуре 35 °C. Также проводилась стероидная пульс-терапия. В дальнейшем температуру поддерживали на уровне 36 °С, и на восьмые сутки больной был переведен из ОРИТ в общую палату. В тот же день МРТ головного мозга показала аномально высокий сигнал на диффузионно-взвешенных изображениях с двусторонним преобладанием лобных долей, и был поставлен диагноз AESD типа AIEF. Реабилитация продолжалась, пока ему не исполнилось 2 года. Через 1 год после начала заболевания его двигательные и языковые функции восстановились до уровня его возраста.
Реабилитация продолжалась, пока ему не исполнилось 2 года. Через 1 год после начала заболевания его двигательные и языковые функции восстановились до уровня его возраста.
Рис. 4. Визуальные характеристики PRES. ( A , B ): 13-летнему мальчику сделали операцию по пересадке кожи из-за сильных ожогов по всему телу. После операции долгое время находился на искусственной вентиляции легких и седативных препаратах. Когда его генерализованный сепсис улучшился, его анестезия была уменьшена, и он проснулся; через 50 дней сознание полностью улучшилось; на 51-й день он пожаловался, что «все, что я вижу, белое, и я ничего не вижу». Затем у него сильно заболела голова. Его кровяное давление было 150/89.мм рт.ст., у него гипертония. МРТ головного мозга показала аномально высокий сигнал в двусторонних затылочных областях на Т2-взвешенных изображениях ( A ) и FLAIR ( B ), и ему был поставлен диагноз PRES.
Острую энцефалопатию следует отличать от других состояний, вызывающих острую потерю сознания при инфекционных заболеваниях, таких как внутричерепная инфекция (например, вирусный энцефалит и бактериальный менингит), аутоиммунный энцефалит, цереброваскулярные заболевания, травматические, метаболические и токсические нарушения, органные последствия отказа. В самых последних японских руководствах перечислены несколько дифференциальных диагнозов острой энцефалопатии 9.0007 [6] .
2. Ведение
Текущее национальное руководство по острой энцефалопатии у детей [6] основано на консенсусе экспертов, серии случаев и ретроспективных исследованиях случай-контроль для конкретных видов терапии, таких как кортикостероиды [21] , иммуноглобулин [22] , поглотитель свободных радикалов [23] , осмотические агенты [24] , иммунодепрессанты [25] , плазмаферез и терапевтическая гипотермия [26] . Несмотря на то, что не было систематически продемонстрировано, что никакие лекарства или терапевтические методы уменьшают последствия острой энцефалопатии, использование барбитуратов и стероидов со временем увеличилось. Это может быть связано с новыми исследованиями, подчеркивающими важность ранней агрессивной терапии при лечении фебрильного эпилептического статуса 9.0007 [27] . Только суррогатные маркеры, такие как лихорадка и воспалительные изменения в спинномозговой жидкости, а также нейровизуализация используются для подтверждения или исключения инфекций на ранних стадиях инфекции. Важно обращать внимание на клинические подсказки из анамнеза и результатов обследования при уточнении этиологии и принятии решения о начальном подходе к лечению. Правильное положение головы, отсасывание ротоглоточного секрета и, при необходимости, использование ротоглоточного или носоглоточного воздуховодов должны использоваться для обеспечения проходимости дыхательных путей у пациентов с пониженным сознанием [15] .
Несмотря на то, что не было систематически продемонстрировано, что никакие лекарства или терапевтические методы уменьшают последствия острой энцефалопатии, использование барбитуратов и стероидов со временем увеличилось. Это может быть связано с новыми исследованиями, подчеркивающими важность ранней агрессивной терапии при лечении фебрильного эпилептического статуса 9.0007 [27] . Только суррогатные маркеры, такие как лихорадка и воспалительные изменения в спинномозговой жидкости, а также нейровизуализация используются для подтверждения или исключения инфекций на ранних стадиях инфекции. Важно обращать внимание на клинические подсказки из анамнеза и результатов обследования при уточнении этиологии и принятии решения о начальном подходе к лечению. Правильное положение головы, отсасывание ротоглоточного секрета и, при необходимости, использование ротоглоточного или носоглоточного воздуховодов должны использоваться для обеспечения проходимости дыхательных путей у пациентов с пониженным сознанием [15] . Детям с признаками плохой вентиляции и оксигенации, такими как нерегулярные дыхательные усилия, недостаточные движения грудной клетки, плохой вход воздуха, центральный цианоз или периферическое насыщение кислородом 92% или менее, следует сначала дать мешок и маску, а затем эндотрахеальную интубация и искусственная вентиляция легких. Для экстренной интубации рекомендуется быстрая последовательная интубация, чтобы избежать аспирации и быстрого повышения ВЧД. Тиопентал/мидазолам, лидокаин, фентанил и короткодействующие недеполяризующие миорелаксанты относятся к индукционным препаратам (например, векуроний, атракуриум). Гипогликемия и гипонатриемия могут сопровождать расстройства у детей в критическом состоянии, потенциально усугубляя энцефалопатию основного заболевания. Когда уровни глюкозы 60 мг/дл быстро устраняются внутривенным введением 2 мл/кг 25% декстрозы, неврологические симптомы часто исчезают. Между тем, 5 мл/кг 3% физиологического раствора необходимы для повышения уровня натрия до приемлемого уровня у бессимптомного ребенка с уровнем натрия в плазме 125 мэкв/л [6] .
Детям с признаками плохой вентиляции и оксигенации, такими как нерегулярные дыхательные усилия, недостаточные движения грудной клетки, плохой вход воздуха, центральный цианоз или периферическое насыщение кислородом 92% или менее, следует сначала дать мешок и маску, а затем эндотрахеальную интубация и искусственная вентиляция легких. Для экстренной интубации рекомендуется быстрая последовательная интубация, чтобы избежать аспирации и быстрого повышения ВЧД. Тиопентал/мидазолам, лидокаин, фентанил и короткодействующие недеполяризующие миорелаксанты относятся к индукционным препаратам (например, векуроний, атракуриум). Гипогликемия и гипонатриемия могут сопровождать расстройства у детей в критическом состоянии, потенциально усугубляя энцефалопатию основного заболевания. Когда уровни глюкозы 60 мг/дл быстро устраняются внутривенным введением 2 мл/кг 25% декстрозы, неврологические симптомы часто исчезают. Между тем, 5 мл/кг 3% физиологического раствора необходимы для повышения уровня натрия до приемлемого уровня у бессимптомного ребенка с уровнем натрия в плазме 125 мэкв/л [6] .
Противомикробные препараты следует назначать детям с инфекционными заболеваниями как можно скорее, не дожидаясь лабораторного подтверждения.
Стероидная импульсная терапия, в частности, цитокиновая буря, обычно используется для лечения вирус-ассоциированной острой энцефалопатии. Прогноз можно улучшить, начав прием стероидов в течение 24 ч после начала АНЭ. Это может быть полезно для лечения энцефалопатии, вызванной Escherichia coli O111, которая продуцирует шига-токсин. Однако в недавнем исследовании пульс-терапия стероидами в течение 24 часов не улучшила прогноз у детей с подозрением на острую энцефалопатию на фоне АСТ. Однако, если лечение начать раньше, неврологических последствий этого заболевания можно будет избежать [28] .
Краеугольным камнем лечения рефрактерного эпилептического статуса являются внутривенные общие анестетики (такие как мидазолам, пропофол и барбитураты) [29] . Общие анестетики, напротив, могут вызывать сердечно-сосудистую нестабильность, угнетение дыхания, инфекции, метаболические нарушения, паралитическую кишечную непроходимость, ишемию кишечника и тромбоэмболические осложнения [30] . При неэффективности общей анестезии было задокументировано несколько фармакологических и нефармакологических подходов. Кетогенную диету можно рассматривать для лечения острого энцефалита с рефрактерными повторяющимися парциальными припадками (FIRES/AERPPS).
При неэффективности общей анестезии было задокументировано несколько фармакологических и нефармакологических подходов. Кетогенную диету можно рассматривать для лечения острого энцефалита с рефрактерными повторяющимися парциальными припадками (FIRES/AERPPS).
Эпилептическая энцефалопатия у детей с факторами риска повреждения головного мозга
На этой странице
РезюмеВведениеМетодыРезультатыОбсуждениеВыводыБлагодарностиСсылкиАвторское правоСтатьи по теме
-синдром Гасто и еще у 4 детей с синдромом Леннокса-Гасто, которому не предшествовал синдром Веста. В этом исследовании мы представляем основные результаты этих 15 предметов. У всех детей выявлены многофакторные антецеденты. Наиболее частыми факторами риска были недоношенность и тяжелая асфиксия; однако нарушения плаценты, сепсис и гипербилирубинемия также были частыми. У всех новорожденных на МРТ наблюдались прямые или вторичные признаки перивентрикулярной лейкомаляции. Последующее наблюдение за всеми детьми выявило умеренную или тяжелую задержку развития нервной системы, а также церебральный паралич. Сделан вывод, что пренатальные и перинатальные факторы риска поражения головного мозга являются очень важными антецедентами, которые необходимо учитывать при диспансерном наблюдении таких детей с раннего возраста с целью как можно более раннего выявления и лечения эпилептической энцефалопатии.
Сделан вывод, что пренатальные и перинатальные факторы риска поражения головного мозга являются очень важными антецедентами, которые необходимо учитывать при диспансерном наблюдении таких детей с раннего возраста с целью как можно более раннего выявления и лечения эпилептической энцефалопатии.
1. Введение
Концепция эпилептической энцефалопатии воплощает в себе представление о том, что эпилептическая активность сама по себе может способствовать серьезным когнитивным и поведенческим нарушениям сверх того, что можно было бы ожидать только от основной патологии, и что они могут со временем ухудшаться [1] . Хотя энцефалопатические эффекты судорог и эпилепсии потенциально могут возникать в связи с любой формой эпилепсии, синдромы Веста и синдром Леннокса-Гасто (ЛГ) являются яркими примерами этой концепции. Синдром Веста представляет собой трудноизлечимый эпилептический синдром, характеризующийся эпилептическими спазмами и гипсаритмией, которые часто связаны с задержкой развития. Этот синдром может развиться в синдром ЛГ. Синдром ЛГ характеризуется тяжелыми, трудноизлечимыми судорогами смешанного типа, умственной отсталостью и медленными спайками и волнами (от 1,5 до 2,5 Гц) на ЭЭГ [2].
Этот синдром может развиться в синдром ЛГ. Синдром ЛГ характеризуется тяжелыми, трудноизлечимыми судорогами смешанного типа, умственной отсталостью и медленными спайками и волнами (от 1,5 до 2,5 Гц) на ЭЭГ [2].
В этом исследовании нам было интересно представить заболеваемость синдромом LG у нашей когорты детей, которые были конкретно вовлечены, потому что у них присутствуют пренатальные и перинатальные предшествующие факторы риска повреждения головного мозга и сообщаются клинические, электроэнцефалографические и магнитно-резонансные изображения ( МРТ) выводы.
2. Материалы и методы
Протокол был одобрен Комитетом по этике исследований Института нейробиологии Национального автономного университета Мексики и соответствует этическим принципам проведения медицинских исследований с участием людей, установленным Хельсинкской декларацией.
2.1. Пациенты
В период с 2003 по 2011 год мы обследовали 887 новорожденных. Из наших записей мы обнаружили 11 детей с синдромом Веста, который прогрессировал до синдрома ЛГ. Также были обнаружены еще 4 ребенка с синдромом ЛГ, которым не предшествовал синдром Веста. Общая выборка составила 15 детей, 8 мужчин. Средний срок беременности составил 35,46 + 4,17 недели в диапазоне от 28 до 40 недель. Все дети поступили из разных больниц города Керетаро и были направлены в наше отделение в связи с наличием факторов риска перинатального поражения головного мозга.
Также были обнаружены еще 4 ребенка с синдромом ЛГ, которым не предшествовал синдром Веста. Общая выборка составила 15 детей, 8 мужчин. Средний срок беременности составил 35,46 + 4,17 недели в диапазоне от 28 до 40 недель. Все дети поступили из разных больниц города Керетаро и были направлены в наше отделение в связи с наличием факторов риска перинатального поражения головного мозга.
2.2. Клиническое обследование экспертом-детским неврологом
Неврологическая оценка первого исследования проводилась в соответствии с неврологическими критериями Амиэля-Тисона [3, 4]. Дети наблюдались каждый месяц в течение первого года, каждые 4 месяца в течение второго года, а затем каждые 6 месяцев.
2.3. Психологическая оценка
2.3.1. Bayley II Developmental Assessment
Этот тест предназначен для оценки развития детей в возрасте от 1 до 42 месяцев. Он имеет 3 балла: ментальную, психомоторную и поведенческую шкалы. Эти баллы используются для определения успеваемости ребенка по сравнению с нормами, взятыми у типично развивающихся детей их возраста (в месяцах) [5, 6].
Другие тесты использовались после 42 месяцев: Wechsler Preschool и Primary Scale of Intelligence (WPPSI), адекватные до 7 лет [7].
2.3.2. Записи ЭЭГ
Исследование проводилось в слабоосвещенной звуконепроницаемой комнате. Во время записи каждый ребенок оставался на коленях у матери и носил полиэфирную шапочку с поверхностными электродами, распределенными по Международной системе 10–20 (Fp1, Fp2, F3, F4, C3, C4, P3, P4, O1, O2, F7, F8). , Т3, Т4, Т5, Т6, Fz, Cz, Pz). Импедансы были на уровне или ниже 5000 Ом. Одновременно регистрировали ЭКГ и ЭМГ. Референтные записи ЭЭГ были сделаны во время спонтанного сна в течение 20-минутного интервала с использованием связанных мочек ушей в качестве эталона. Использовался цифровой электроэнцефалограф (Medicid 4) с усилением 20000, полоса пропускания усилителя устанавливалась в диапазоне от 0,5 до 100 Гц, а частота дискретизации составляла 200 Гц. Было получено четыре записи ЭЭГ на первом году жизни, две на втором и по одной в трех, четырех и пятилетнем возрасте.
2.3.3. МРТ-исследования
Сканирование было выполнено с использованием 1,0-Тл Philips Intera в аксиальных плоскостях для получения последовательностей T1W, T2W, PDW, T2 FLAIR и T2-EPI. Данные T1W, T2W и PDW также были получены в аксиальном, коронарном и сагиттальном срезах. Лицензированный детский рентгенолог просмотрел все МРТ и поставил радиологический диагноз. Проведены измерения объемов мозолистого тела и боковых желудочков. Эти значения сравнивались с нормативными значениями нашей базы данных. Эта нормативная база данных была получена из МРТ 313 нормальных младенцев в возрасте от 0 до 38 месяцев (неопубликованные результаты).
3. Результаты
Из 887 младенцев с предшествовавшими факторами риска повреждения головного мозга 15 соответствовали критериям синдрома Веста, а позднее 11 из этих 15 имели синдром ЛГ, следовательно, у 15/887 (1,69%) была распространенность синдром Веста. Другая группа состояла из 4 детей, дебютировавших с синдромом ЛГ без предшествующего синдрома Веста.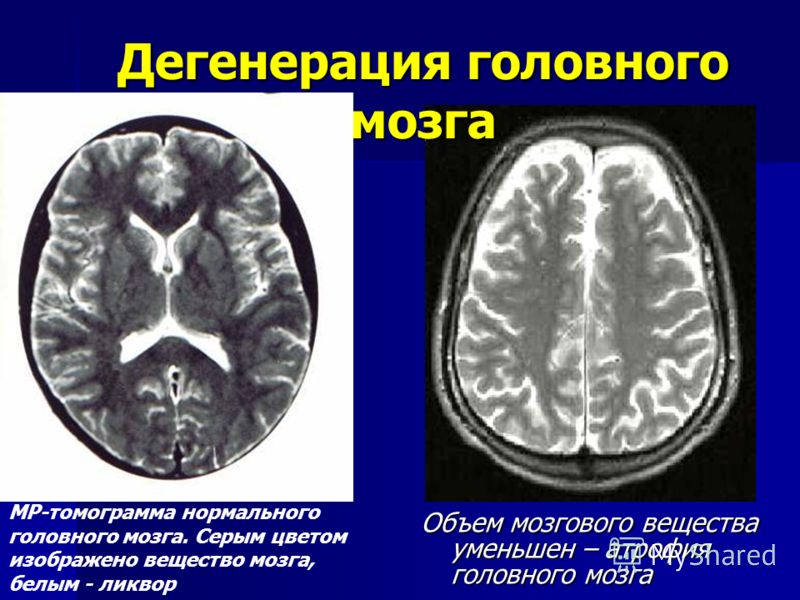 Таким образом, у 15 детей был выявлен синдром ЛГ.
Таким образом, у 15 детей был выявлен синдром ЛГ.
3.1. Факторы риска
Все дети имели в пренатальном и перинатальном анамнезе факторы риска повреждения головного мозга. Все дети имели более одного фактора риска. В таблице 1 показано количество детей, у которых присутствует каждый фактор. Наиболее частыми факторами были недоношенность и тяжелая асфиксия (у 3 новорожденных с сердечно-дыхательной недостаточностью).
3.2. Клинические особенности
Гипоксически-ишемическая энцефалопатия наблюдалась у 3 новорожденных (20%), микроцефалия у 4 (27%), гидроцефалия у 4 (27%). У двух детей была билирубиновая энцефалопатия (13%), у одного — легочная гипертензия (7%). В дальнейшем у всех детей наблюдался детский церебральный паралич.
Типы эпилептических припадков
В таблице 2 показано количество субъектов, у которых были разные типы припадков. У детей с синдромом Веста наблюдалось много различных типов, при этом наиболее частыми были эпилептические спазмы, тогда как в группе ЛГ наблюдались миоклонические припадки.
3.3. Психологические обследования
У 10 детей наблюдалась тяжелая задержка психомоторного развития, у 5 – умеренная задержка психомоторного развития.
3.4. Результаты ЭЭГ
Среднее количество записей ЭЭГ составило 9 в обеих группах. У каждого ребенка с синдромом Веста была гипсаритмия, а у двух из них также были аномальные фокальные медленные волны. Средний возраст начала гипсаритмии составлял 8,18 месяцев (SD = 2,7, диапазон возраста = 4–12 месяцев), в то время как ЭЭГ-признаки синдрома ЛГ проявлялись ближе к 3 годам (среднее значение = 2,9).5 лет, SD = 0,87, интервал возраста 2–5 лет). При рассмотрении всех ЭЭГ, полученных у каждого ребенка в обеих группах, было замечено, что все они показали одиночные спайки, комплексы множественных спайков, комплексы спайк-волна, медленные комплексы спайк-волна и комплексы полиспайк-волна. Частота комплексов спайк-волна и острая волна находилась в пределах от 1,0 до 2,5 Гц. Острые волны наблюдались у 11 детей. У троих из 15 детей был выявлен рекрутинговый ритм, причем в обеих группах были относительно часты разряды с подавлением пачек, а также первично-очаговые разряды с вторичной генерализацией. Организация сна медленной фазы с возрастом прогрессивно ухудшалась.
Организация сна медленной фазы с возрастом прогрессивно ухудшалась.
На рис. 1 представлены ЭЭГ, зарегистрированные у одного ребенка с синдромом Веста, перешедшим в синдром ЛГ, на котором можно наблюдать гипсаритмию в 6 мес и позже, в 4 года, генерализованные разряды медленных спайк- и островолновых комплексов ( около 1,0 Гц) и рекрутинговый ритм.
3.5. МРТ
У всех детей МРТ была ненормальной. Наиболее частой аномалией было наличие перивентрикулярной лейкомаляции (ПВЛ). Первичные признаки ПВЛ (наличие диффузных обширных образований на территории белого вещества и/или наличие макроскопических кист [8, 9], наблюдались у 6 новорожденных (3 кистозных). Кроме того, вторичные рентгенологические последствия ПВЛ, неравномерно расширенные желудочки и атрофия мозолистого тела [8, 9] были обнаружены у 9 детей, таким образом, у всех детей МРТ признаки были совместимы с ПВЛ.
Другими наблюдениями МРТ были: 3 ребенка с внутрижелудочковыми кровоизлияниями и 2 с перивентрикулярными кровоизлияниями, 3 с перекрестным мозжечковым диашизом, 1 с мозжечковыми кровоизлияниями и 1 с левым теменным инфарктом. Церебральная атрофия наблюдалась у 6 детей и гидроцефалия у 2 пациентов.
Церебральная атрофия наблюдалась у 6 детей и гидроцефалия у 2 пациентов.
Объемы мозолистого тела и боковых желудочков измеряли и сравнивали с нормативными значениями, полученными у 313 нормальных детей в возрасте от 0 до 38 месяцев. Эти нормы были рассчитаны в нашем учреждении, что позволяет сравнивать с ними значения того или иного предмета. Отклонения больше или меньше одного стандартного отклонения (СО) от среднего значения по возрасту имеют вероятность принадлежности к нормальной группе, равную или меньше 0,10, а отклонения больше или меньше 2 СО среднего имеют вероятность принадлежности к нормальная группа равна или ниже 0,05.
Значения, превышающие 1 или 2 стандартных отклонения (SD) от среднего значения в зависимости от возраста боковых желудочков, считаются умеренными или тяжелыми отклонениями. В случае мозолистого тела значения ниже 1 или 2 SD считаются умеренными или сильно ненормальными.
В таблице 3 представлены результаты этого анализа у всех детей в возрасте 1 года и 2 лет. Прежде всего можно отметить, что объем мозолистого тела был тонким у 14 детей в возрасте одного года и у всех в возрасте 2 лет (только у одного ребенка он был умеренно аномальным). Правый боковой желудочек был сильно увеличен у 12 детей и у одного умеренно увеличен в годовалом возрасте. Однако в возрасте 2 лет у 14 детей выявлено резкое увеличение правого желудочка. Левый желудочек в возрасте одного года был серьезно изменен у 12 детей в возрасте одного года и у 13 детей в возрасте 2 лет. Был только один ребенок с нормальными показателями обоих боковых желудочков в возрасте 1 года и 2 лет.
Прежде всего можно отметить, что объем мозолистого тела был тонким у 14 детей в возрасте одного года и у всех в возрасте 2 лет (только у одного ребенка он был умеренно аномальным). Правый боковой желудочек был сильно увеличен у 12 детей и у одного умеренно увеличен в годовалом возрасте. Однако в возрасте 2 лет у 14 детей выявлено резкое увеличение правого желудочка. Левый желудочек в возрасте одного года был серьезно изменен у 12 детей в возрасте одного года и у 13 детей в возрасте 2 лет. Был только один ребенок с нормальными показателями обоих боковых желудочков в возрасте 1 года и 2 лет.
Пример эволюции различных МРТ-признаков у новорожденного с ПВЛ показан на рисунке 2. На этом рисунке показана МРТ младенца мужского пола, родившегося на 36 неделе беременности с ПВЛ. Он представил кардиореспираторную остановку, неонатальные судороги, гипоксически-ишемическую энцефалопатию и сепсис в неонатальном периоде. В дальнейшем у него наблюдалась тяжелая задержка психомоторного развития. В 2 месяца корригированного возраста на МРТ можно было наблюдать наличие диффузной лейкомаляции в затылочных областях; мозолистое тело и боковые желудочки имели нормальные объемы. В 14 мес объем мозолистого тела был очень мал (менее 2 SD) и объемы боковых желудочков превышали 2 SD от нормы, а в 32 мес мозолистое тело сохраняет малый объем и боковые желудочки выдерживают большие объемы.
В 2 месяца корригированного возраста на МРТ можно было наблюдать наличие диффузной лейкомаляции в затылочных областях; мозолистое тело и боковые желудочки имели нормальные объемы. В 14 мес объем мозолистого тела был очень мал (менее 2 SD) и объемы боковых желудочков превышали 2 SD от нормы, а в 32 мес мозолистое тело сохраняет малый объем и боковые желудочки выдерживают большие объемы.
4. Обсуждение
Целью данного исследования было описание частоты встречаемости синдрома ЛГ в когорте детей, попавших в наш исследовательский проект в связи с изучением новорожденных с пре- и перинатальными факторами риска поражения головного мозга, что составило 1,69%. Согласно Гасто и соавт. [10] распространенность синдрома Леннокса-Гасто в крупном центре эпилепсии (5,1% с 10,2% пациентов моложе 15 лет и 0,6% пациентов старше этого возраста) выше, чем синдрома Веста, хотя Kurokawa et al. [11] наблюдали обратное в японской популяции.
Было описано, что у многих младенцев с синдромом Веста, в основном у детей с ранее существовавшим повреждением головного мозга, часто наблюдается переход в синдром Леннокса-Гасто. Этот переход был задокументирован Olmos-Garcia de Alba et al. [12].
Этот переход был задокументирован Olmos-Garcia de Alba et al. [12].
В нашей популяции 11 младенцев соответствовали критериям синдрома Веста, который развился в синдром ЛГ. Различные авторы сообщают о различных процентных соотношениях для этого: 20% случаев [13], 49% [14], 58,7% [15] и даже 70% [16]. В нашей популяции из 887 младенцев у 15 детей был синдром Веста, из них у 11 (73%) был обнаружен этот переход. Учитывая, что все дети имели тяжелые поражения головного мозга, наблюдаемая распространенность этого перехода хотя и высока, но не является исключительной.
Наиболее частыми факторами риска были недоношенность и тяжелая асфиксия, что может объяснить наличие ПВЛ у всех детей. Из 887 детей, обследованных в нашем учреждении, хотя 40% были потеряны при динамическом наблюдении, всем им была проведена МРТ, а первичный диагноз ПВЛ был поставлен у 479 (54%), у 9 из них обнаружены гигантские кисты почти без головного мозга. Наиболее частой патологией было наличие диффузных избыточных натяжений на территории белого вещества. Как уже упоминалось, очень часто наблюдались большие объемы боковых желудочков и задержка миелинизации [17, 18]. Диагноз ПВЛ в нашем исследовании был подтвержден МРТ у всех субъектов, у 3 — с аномально повышенной интенсивностью сигнала на Т2-взвешенных изображениях и у 3 — с макроскопическими кистами в белом веществе. У остальных детей наблюдались последствия ПВЛ в виде больших объемов боковых желудочков и тонкого мозолистого тела. Статистический анализ объемов мозолистого тела и боковых желудочков также дал важную информацию, так как практически у всех детей значения их объемов выходили за пределы популяционной нормы по нашим нормативным данным. Важно отметить, что значения объемов были более аномальными в возрасте 2 лет, чем в возрасте одного года, что указывает на структурную тяжесть, которая связана с более клиническими и нейропсихологическими аномальными оценками с возрастом.
Как уже упоминалось, очень часто наблюдались большие объемы боковых желудочков и задержка миелинизации [17, 18]. Диагноз ПВЛ в нашем исследовании был подтвержден МРТ у всех субъектов, у 3 — с аномально повышенной интенсивностью сигнала на Т2-взвешенных изображениях и у 3 — с макроскопическими кистами в белом веществе. У остальных детей наблюдались последствия ПВЛ в виде больших объемов боковых желудочков и тонкого мозолистого тела. Статистический анализ объемов мозолистого тела и боковых желудочков также дал важную информацию, так как практически у всех детей значения их объемов выходили за пределы популяционной нормы по нашим нормативным данным. Важно отметить, что значения объемов были более аномальными в возрасте 2 лет, чем в возрасте одного года, что указывает на структурную тяжесть, которая связана с более клиническими и нейропсихологическими аномальными оценками с возрастом.
Синдром Веста является частым осложнением (26%) тяжелой ПВЛ [17]. Кузманик-Самия и др. [19] описали 37 новорожденных с синдромом Веста, вызванным ПВЛ. Однако в нашей популяции из 479 детей с ПВЛ только у 15 развился синдром Веста или ЛГ (3,13%).
Однако в нашей популяции из 479 детей с ПВЛ только у 15 развился синдром Веста или ЛГ (3,13%).
С клинической точки зрения у всех детей были выявлены судорожные припадки разного типа, тяжелая и умеренная задержка психомоторного развития, детский церебральный паралич, нарушения ЭЭГ. У каждого ребенка с синдромом Веста была гипсаритмия, а у детей с синдромом ЛГ наблюдаются характерные медленные спайковые и волнообразные разряды. Эти клинические данные соответствуют концепции эпилептической энцефалопатии по последней классификации ILAE [1].
5. Выводы
Пренатальные и перинатальные факторы риска повреждения головного мозга являются очень важными предпосылками, которые следует учитывать при наблюдении за младенцем с раннего возраста. Наличие ПВЛ у недоношенных новорожденных повышает риск двигательных и когнитивных осложнений, а последовательные записи ЭЭГ позволяют на ранней стадии выявить эпилептическую энцефалопатию и назначить немедленное лечение.
Благодарности
Авторы благодарят д-ра Э. Ариас-Канемото, д-ра Л. К. Велес-Домингес, техника Д. Авила-Акоста, инженера Х. Бельмонта, д-ра Э. Пасайе, г-жи Р. М. Эрнандес, медсестры Д. Фигероа, М. в Sc. Ю. Крус, бакалавр Т. Лопес, инженер П. Альварес и магистр наук. J. J. González-Olvera за поддержку в написании этой статьи.
Ариас-Канемото, д-ра Л. К. Велес-Домингес, техника Д. Авила-Акоста, инженера Х. Бельмонта, д-ра Э. Пасайе, г-жи Р. М. Эрнандес, медсестры Д. Фигероа, М. в Sc. Ю. Крус, бакалавр Т. Лопес, инженер П. Альварес и магистр наук. J. J. González-Olvera за поддержку в написании этой статьи.
Ссылки
А. Т. Берг, С. Ф. Беркович, М. Дж. Броди и др., «Пересмотренная терминология и концепции организации припадков и эпилепсий: отчет Комиссии ILAE по классификации и терминологии, 2005–2009», Эпилепсия , об. 51, нет. 4, стр. 676–685, 2010.
Посмотреть по адресу:
Сайт издателя | Google Scholar
R. G. Nordli Jr., J. Riviello Jr., and E. Niedermeyer, «Судорожные припадки и эпилепсия у младенцев и подростков», в Электроэнцефалография Нидермейера: основные принципы, клиническое применение и смежные области. Amiel-Tison, «Клиническая оценка нервной системы младенцев», в Fetal and Neonatal Neurology and Neurosurgery , M.
 I. Levene, F. A. Chervenak, and M. Whittle, Eds., стр. 99–120, Churchill Livingstone, London, Великобритания, 2001.
I. Levene, F. A. Chervenak, and M. Whittle, Eds., стр. 99–120, Churchill Livingstone, London, Великобритания, 2001.Просмотр по адресу:
Google Scholar
C. Amiel-Tison, «Обновление неврологической оценки Amiel-Tison для доношенных новорожденных или в скорректированном возрасте 40 недель», Pediatric Neurology , vol. 27, нет. 3, стр. 196–212, 2002.
Посмотреть по адресу:
Сайт издателя | Google Scholar
N. Bayley, Bayley Scales of Infant Development , The Psychological Corporation, New York, NY, USA, 1969.
M. M. Black and K. Matula, Essentials of Bayley Scales of Infant Development II Assessment , John Wiley, New York, NY, USA, 1999.
D. Wechsler, Wechsler Preschool and Primary Scale of Intelligence—Revised , The Psychological Corporation, San Antonio , Tex, USA, 1989.

O. Flodmark, B. Lupton, D. Li et al., «МР-визуализация перивентрикулярной лейкомаляции у детей», American Journal of Roentgenology , vol. 152, нет. 3, стр. 583–590, 1989.
Посмотреть по адресу:
Google Scholar
L.T.T. Sie, M.S. Van Der Knaap, G. Van Wezel-Meijler, A.H.M. Taets Van Amerongen, H.N. у новорожденных с перивентрикулярной плотностью на сонограммах», American Journal of Neuroradiology , vol. 21, нет. 5, pp. 852–861, 2000.
Посмотреть по адресу:
Google Scholar
H. Gastaut, JL Gastaut, E.G.E. классификации международной лиги по борьбе с эпилепсией» Эпилепсия , том. 16, нет. 3, pp. 457–461, 1975.
Посмотреть по адресу:
Google Scholar
Т. Курокава, Н.
 Гойя и Ю. Фукуяма, «Синдром Веста и синдром Леннокса-Гасто: обзор естественной истории». », Педиатрия , т. 2, с. 65, нет. 1, pp. 81–88, 1980.
Гойя и Ю. Фукуяма, «Синдром Веста и синдром Леннокса-Гасто: обзор естественной истории». », Педиатрия , т. 2, с. 65, нет. 1, pp. 81–88, 1980.Просмотр по адресу:
Google Scholar
Г. Олмос-Гарсия де Альба, Дж. М. Вальдес и Ф. В. Креспо, «Синдром Веста, эволюционирующий в синдром Леннокса-Гасто». Клиническая электроэнцефалография ЭЭГ , том. 15, нет. 1, pp. 61–68, 1984.
Посмотреть по адресу:
Google Scholar
О. Н. Марканд, «Синдром Леннокса-Гасто (детская эпилептическая энцефалопатия)», Journal of Clinical Neurophysiology , vol. 20, нет. 6, стр. 426–441, 2003.
Посмотреть по адресу:
Сайт издателя | Google Scholar
Ю С. Дж., Ким Х. Д. и Канг Х. К., «Факторы, влияющие на эволюцию синдрома Веста в синдром Леннокса-Гасто», стр.
 9.0221 Детская неврология , том. 41, нет. 2, стр. 111–113, 2009 г.
9.0221 Детская неврология , том. 41, нет. 2, стр. 111–113, 2009 г.Посмотреть по адресу:
Сайт издателя | Google Scholar
С. Отахара, Ю. Яматоги и Ю. Оцука, «Прогноз синдрома Веста с особой ссылкой на синдром Леннокса-Гасто: исследование развития», в «Достижения в эпилептологии». X Международный симпозиум по эпилепсии , Дж. А. Вада и Дж. К. Пенри, ред., стр. 149–154, Raven Press, New York, NY, USA, 1980.
Просмотр:
Google Scholar
Дж. Р. Хьюз, «Естественное исследование гипсаритмии», Clinical Electroencephalography , vol. 16, pp. 128–130, 1985.
Просмотр по адресу:
Google Scholar
H. Ozawa, T. Hashimoto, T. Endo et al., «Синдром Веста с перивентрикулярной лейкомаляцией: морфометрическое МРТ-исследование, Детская неврология , том.


