Белок в крови повышен у новорожденного: С-реактивный белок при диагностике инфекции у новорожденных
«Почему в крови повышен белок, что это значит?» — Яндекс Кью
Яндекс.Здоровье
Популярное
Сообщества
Главный Редактор Я.Здоровья
Медицина
4,0 K
Приложение и сайт для онлайн-консультаций с врачами · 23 янв 2019 · health.yandex.ru
Под понятием «общий белок» подразумевают общую концентрацию альбумина и глобулина в сыворотке крови.
В организме общий белок выполняет ряд функций: участие в свертываемости крови, участие в иммунных процессах, транспортная функция крови и другие.
Данный тип белка отражает самочувствие гомеостаза, потому что благодаря белкам кровь имеет определенную вязкость, текучесть и соответственно формируется определенный объем крови в сосудистом русле.
Непосредственно с этими важными характеристиками крови связана работа как сердечно-сосудистой системы организма, так и обменной функции организма, которые на прямую влияют на работу организма в целом.
Роль белка в организме
Белки, входящие в состав крови отвечают за различные функции, обеспечивающие жизнеспособность организма. Наиболее важными, из которых являются следующие:
- поддержание текучести и вязкости крови;
- удерживание во взвешенном состоянии всех компонентов крови;
- определение объема крови в руслах сосудов;
- регулирование рН крови;
- осуществление транспортировки липидов, пигментов, минеральных веществ, гормонов и других важных
- биологических соединений для органов и тканей;
- свертывание крови.
Основные показания к биохимическому анализу крови на белок:
- инфекционные заболевания, как острые, так и хронические;
- заболевания почек;
- онкозаболевания;
- коллагенозы и системные заболевания;
- ожоги;
- скрининговые обледования;
- нарушения питания.
Когда белок в крови выше нормы, это говорит о том, что кровь становится более густой, и организм обезвоживается. Низкий белок крови говорит о заболевании, которое связано с неполноценным питанием и снижением аппетита.
Низкий белок крови говорит о заболевании, которое связано с неполноценным питанием и снижением аппетита.
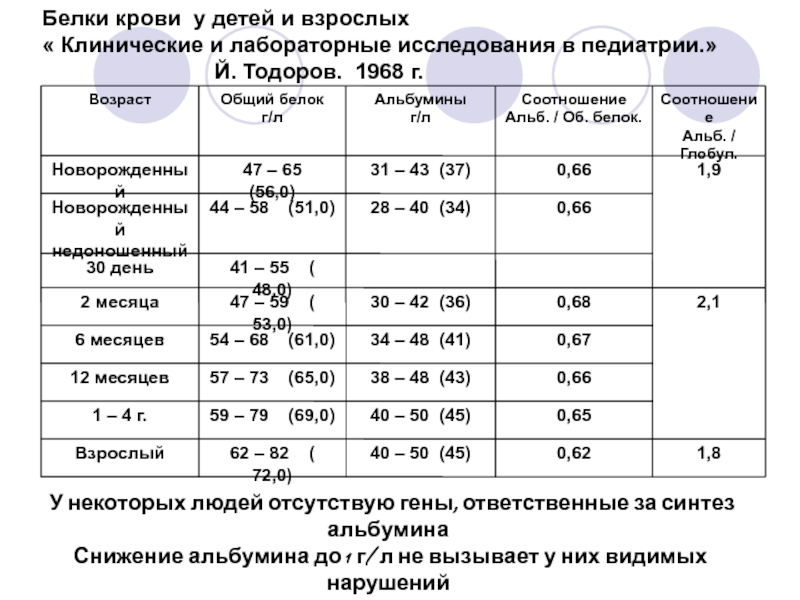
Норма белка в крови
Норма содержания белка в крови мужчин и женщин примерно одинакова, отмечается зависимость лишь от возраста:
- от 43 до 68 г/литр – для новорожденных;
- от 48 до 72 – для детей до 1 года;
- от 51 до 75 – для детей от 1 до 4 лет;
- от 52 до 78 – для детей от 5 до 7 лет;
- от 58 до 78 – для детей от 8 до 15;
- от 65 до 80 – для взрослых;
- от 62 до 81 – для людей от 60 лет.
Определение его концентрации необходимо при диагностике онкологических болезней, заболеваний почек и печени, при тяжелых ожогах, нарушениях в питании. Повышенный белок свидетельствует о нарушениях в работе организма. По одному показателю установить причину и назначить лечение невозможно, поэтому нужно проводить дополнительные исследования.
Причины повышения общего белка в крови
Обнаружен белок в крови выше нормы, что это значит? Значительное повышение концентрации общего белка в крови называется гиперпротенинемией.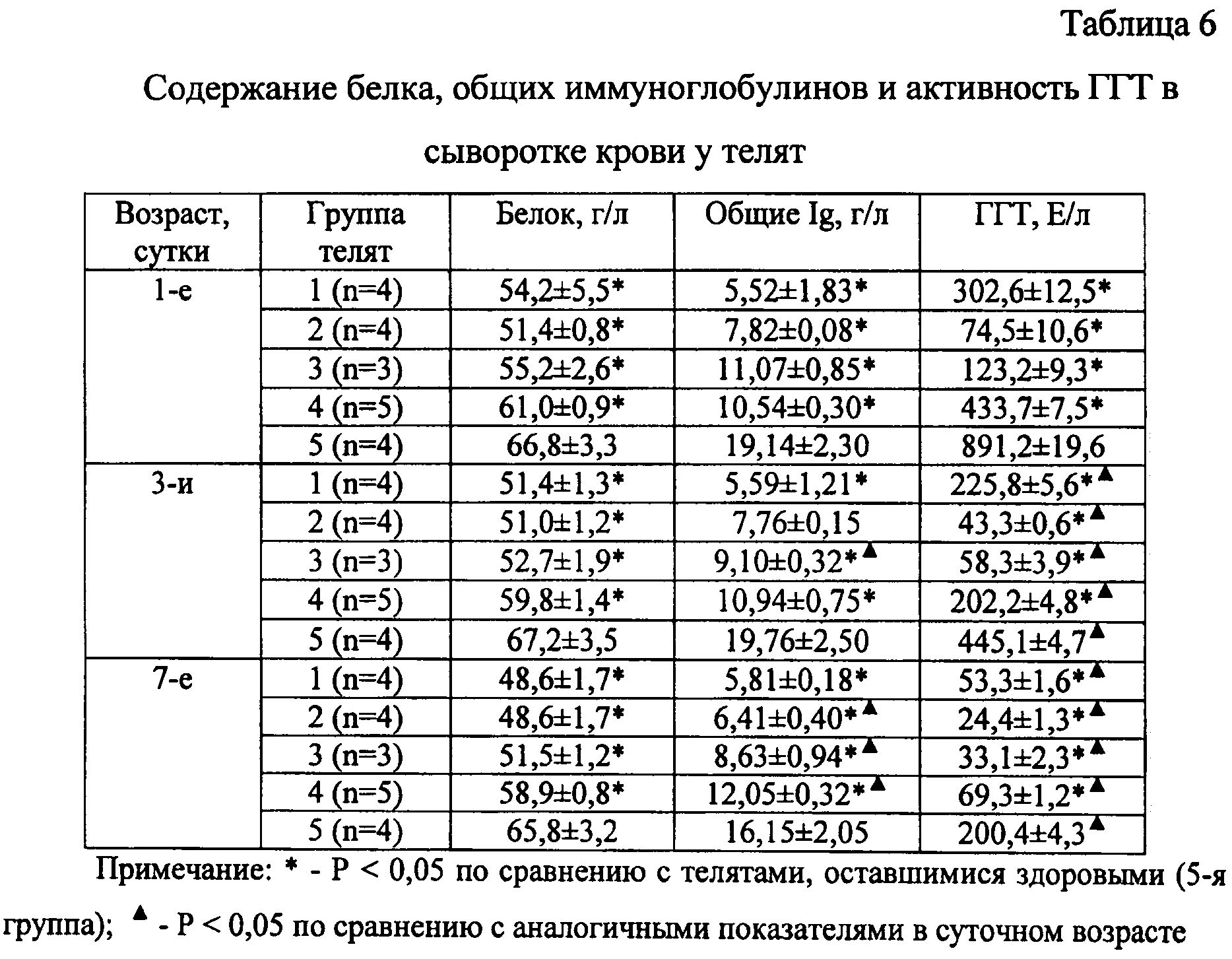 Это состояние не может наблюдаться при нормальных физиологических процессах, а значит, развивается только при наличии патологии, при которой происходит образование патологических белков.
Это состояние не может наблюдаться при нормальных физиологических процессах, а значит, развивается только при наличии патологии, при которой происходит образование патологических белков.
Стоит отметить также, что повышение может быть абсолютным, когда количество белков плазмы увеличивается без изменения объема циркулирующей крови, и относительным, что связано со сгущением крови.
Наиболее часто к абсолютной гиперпротеинемии приводят следующие состояния:
- Злокачественные опухоли, имеющие собственный, извращенный обмен веществ и усиленно продуцирующие протеины.
- Тяжелые острые инфекционные заболевания, сопровождающиеся образованием обширных гнойных очагов и сепсисом.
- Аутоиммунные заболевания, такие как ревматоидный артрит и
красная волчанка
, при которых иммунная система организма проявляет агрессию против собственных здоровых клеток и тканей.
- Хронические воспалительные заболевания, при которых происходит постоянное разрушение тканей организма.

Относительную гиперпротеинемию вызывает снижение концентрации воды в кровеносном русле, что происходит вследствие обезвоживания организма при некоторых заболеваниях:
- Острые кишечные инфекции, сопровождающиеся частым стулом: дизентерия, холера и др., при этих заболеваниях всегда регистрируется повышенный белок в крови.
- Кишечной непроходимости, обусловливающей препятствие для всасывания воды из пищеварительного тракта.
- Отравления, которые сопровождаются многократной рвотой и диареей, что приводит к выраженному обезвоживанию организма.
- Острые кровотечения также способны спровоцировать повышение белка в силу значительной потери жидкости.
- Длительное лечение кортикостероидами, передозировка некоторых лекарственных, чаще всего витамина А.
Перечисленные выше факторы, оказывающие влияние на уровень белка, свидетельствуют о том, что в каждом индивидуальном случае интерпретация полученных лабораторных данных представляет значительные сложности, а потому врач должен во многом ориентироваться на симптомы заболевания и данные других инструментальных и лабораторных исследований.
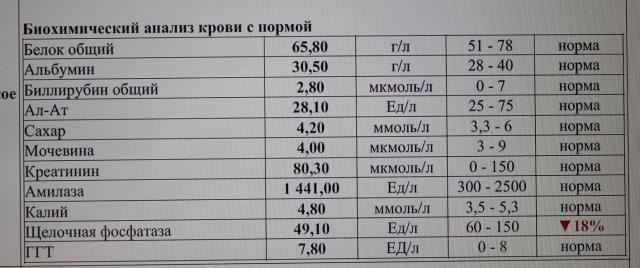
Повышен реактивный белок в крови, что это значит?
C-реактивным белком (CRP, СРБ) — принято называть белок плазмы крови, он относится к группе белков острой фазы, повышение концентрации которых указывает на воспалительный процесс в организме. Данный белок нашел применение в клинической диагностике как индикатор воспаления (более чувствителен чем СОЭ).
Высокое содержание СРБ в крови может означать такие причины:
- Обострение хронических инфекционно-воспалительных или аллергических заболеваний, а также о наличии хронического вялотекущего воспалительного процесса, например, в стенках кровеносных сосудов.
- Острые инфекции: бактериальные, грибковые, вирусные. При некоторых бактериальных заболеваниях, таких как
менингит
, туберкулез, сепсис новорожденных, уровень может быть повышен до 100 мг на литр и выше. При вирусных поражениях данный показатель увеличивается ненамного.
- Повреждение тканей, например, в результате некроза (
инфаркт миокарда
), травмы, ожога, обморожения, хирургической операции.
- Наличие эндокринной патологии, например,
сахарного диабета
, ожирения; повышенного содержания в крови женских половых гормонов.
- Рак. Если было установлено, что причина повышения С-реактивного белка не кроится в инфекциях, то необходимо пройти обследование на злокачественные новообразования.
- Нарушение липидного обмена и склонность к развитию атеросклероза.
Реактивный белок называют золотым маркером воспалительных процессов, одним из главных параметров в диагностике. Исследование крови на СРБ в совокупности с другими показателями позволяет оценить вероятность развития сердечно-сосудистых заболеваний, сделать прогноз их течения, определить риск развития осложнений, а также выработать тактику лечения и профилактики.
Материал предоставлен
simptomy-lechenie.net
В этой теме к непроверенным постам нужно относиться с осторожностью
Позвать экспертов
Медицина+1
17,6 K
Комментировать пост…Комментировать…
О сообществе
Яндекс. Здоровье
Здоровье
Врачи отвечают на самые болезненные вопросы о здоровье
Определение С-реактивного белка у новорождённых
11.07.2021 @pediatrics_rus Нет комментариев
В начале февраля в журнале «JAMA Pediatrics» был опубликован систематический обзор по целесообразности и необходимости использования С-реактивного белка (СРБ) для диагностики поздней бактериальной инфекции у новорождённых.
С-реактивный белок — белок, синтезируемый клетками печени в ответ на действие цитокинов, высвобождающихся из лейкоцитов при их активации в ответ на присутствие инфекционного агента в организме.
Поздняя бактериальная инфекция – это одно из частых и серьёзных заболеваний/осложнений, которое встречается у детей, находящихся в отделениях реанимации (ОРИТН). Как правило, клинические проявления патологии неспецифичны, а для её идентификации требуются дополнительные методы обследования — общий анализ крови, посев крови и определение уровня маркеров воспаления: С-реактивного белка, прокальцитонина, возможно, некоторых интерлейкинов, пресепсина и пр.
Информативность многих диагностических тестов до сих пор не определена.
Как известно, для выполнения посева крови — «золотого стандарта» диагностики бактериальной инфекции — и получения хотя бы предварительных результатов необходимо время — обычно около 24—48 часов. Но дело в том, что при подозрении на системную инфекцию просто нет времени ждать результата посева, необходимо действовать быстро и начинать лечение — проводить эмпирическую антибактериальную терапию.
Не назначение антибиотиков чревато развитием грозных осложнений (вплоть до неблагоприятного исхода), а их назначение при отсутствии инфекции несёт угрозу развития антибиотикорезистентности, нарушения формирования микрофлоры кишечника и прочее. Поэтому точная диагностика инфекции имеет критическую важность.
Итак, в недавно опубликованном систематическом обзоре учёные провели анализ всех доступных исследований, проведённых за последние десятилетия, которые были посвящены изучению и определению точности С-реактивного белка как показателя наличия или отсутствия системной бактериальной инфекции у новорождённых детей (доношенных и недоношенных), возникшей на четвёртые сутки жизни — после первых 72 часов жизни — и позже.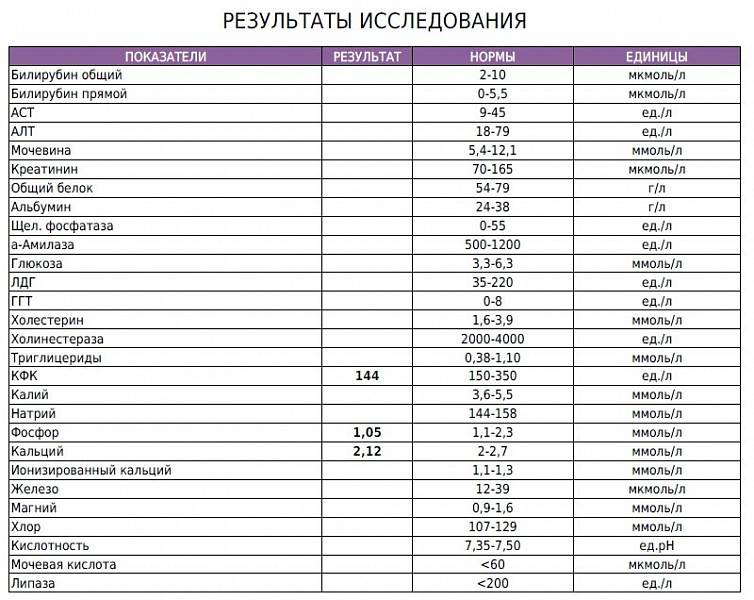 Используя данные отобранных публикаций, а их качество было средним и высоким, и необходимые статистические расчёты, авторы определили точность — чувствительность и специфичность — анализа (СРБ).
Используя данные отобранных публикаций, а их качество было средним и высоким, и необходимые статистические расчёты, авторы определили точность — чувствительность и специфичность — анализа (СРБ).
Какой результат?
С-реактивный белок для диагностики поздней бактериальной инфекции у новорождённых детей обладает чувствительностью 0,62 и специфичностью 0,74 [1]. Что это значит?
Если использовать данные СРБ для диагностики бактериальной инфекции у 1 тысячи детей (по данным исследований, средняя частота возникновения патологии составляет 40%), то СРБ не поможет определить инфекцию у 152 детей — будет получен ложноотрицательный результат, и эти дети не получат необходимого лечения — и ложно определит инфекцию у 156 детей — будет получен ложноположительный результат, и эти дети напрасно получат антибиотики [1]. А если представить, что средняя частота возникновения поздней бактериальной инфекции у новорождённых детей в некоторых регионах или учреждениях составляет 20%, то информативность СРБ в таких случаях, сопоставима с подбрасыванием монетки — 50 на 50 [2].
Высокая вероятность получения ложноотрицательного или ложноположительного результата ограничивает применение СРБ и ставит под вопрос целесообразность его определения.
Какой вывод?
- СРБ имеет ограниченную ценность в диагностике поздней бактериальной инфекции у новорождённых детей.
- СРБ не помогает избежать ненужного назначения антибиотиков.
- СРБ не помогает принять решение о продолжительности антибиотикотерапии, когда посев крови отрицателен, так как существует высокая вероятность, что данные СРБ ложные.
Возможное объяснение невысокой точности СРБ можно найти в том, что уровень СРБ может повышаться не только при инфекции, но и, например, при экстравазации, холестазе, патологии ЖКТ и прочих состояниях, которые часто встречаются у детей, пребывающих в ОРИТН, а отсутствие повышения часто встречается у глубоко недоношенных детей.
Конечно, в современном мире мало, кто из докторов опирается на результаты только одного анализа для диагностики такой серьёзной патологии, как системная бактериальная инфекция.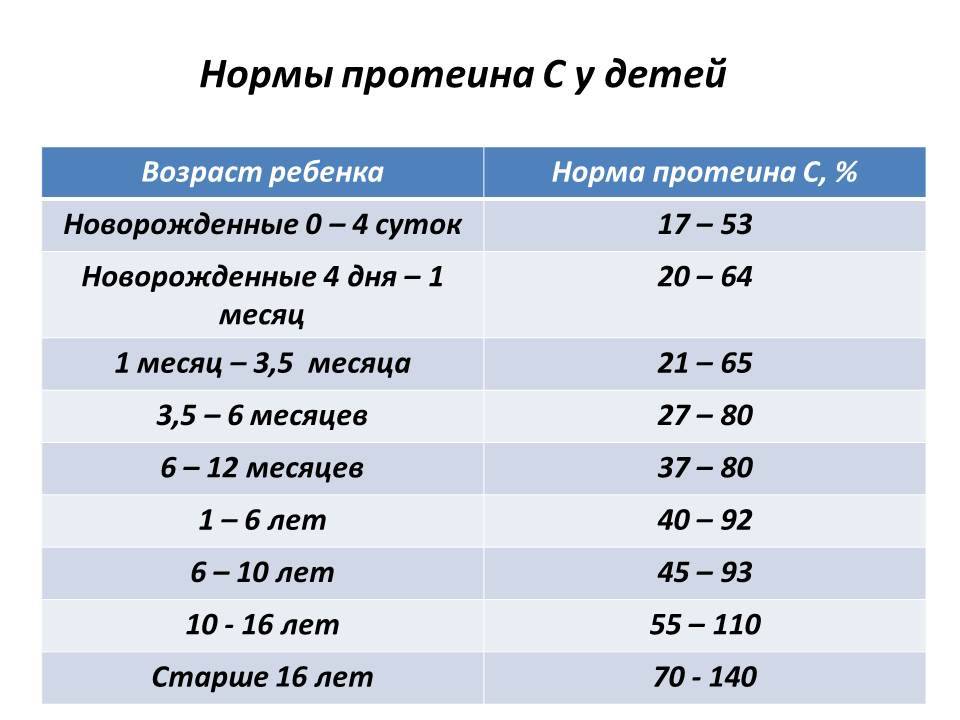 Однако, знание того, что СРБ недостаточно точный метод, может помочь избежать ненужных затрат: кровь ребёнка, время для принятия решения, деньги на анализ.
Однако, знание того, что СРБ недостаточно точный метод, может помочь избежать ненужных затрат: кровь ребёнка, время для принятия решения, деньги на анализ.
Список источников
[1] Brown JVE, Meader N, Wright K, Cleminson J, McGuire W. Assessment of C-Reactive Protein Diagnostic Test Accuracy for Late-Onset Infection in Newborn Infants: A Systematic Review and Meta-analysis. JAMA Pediatr. Published online February 03, 2020. doi:10.1001/jamapediatrics.2019.5669.
[2] Cantey JB, Bultmann CR. C-Reactive Protein Testing in Late-Onset Neonatal Sepsis: Hazardous Waste. JAMA Pediatr. 2020;174(3):235–236. doi:10.1001/jamapediatrics.2019.5684.
Share on telegram
Share on vk
Share on facebook
Share on twitter
Share on facebook
Share on google
Share on linkedin
Share on pinterest
Share on whatsapp
Share on odnoklassniki
Share on email
Ещё интересные статьи:
Болезни 25. 04.2020
04.2020
Болезни 22.02.2020
Наука 09.02.2020
Помогите нам сделать контент лучше!
Поставьте оценку статье, если понравилась. Мы будем лучше понимать, каких материалов должно быть больше.
Оставьте комментарий под статьей, если есть вопросы, пожелания или заметили неточность.
Низкий вес при рождении у новорожденных связан с высоким уровнем белка, который защищает плаценту от повреждения клеток
Гетти Изображений
Исследователи Калифорнийского университета в Лос-Анджелесе подозревают, что уровни белка, называемого гуманином, повышаются для защиты плода, когда плацента выходит из строя, что является распространенной причиной рождения детей с весом ниже нормы.
Здоровье + Поведение
Здоровье + Поведение
Гетти Изображений
Исследователи Калифорнийского университета в Лос-Анджелесе подозревают, что уровни белка, называемого гуманином, повышаются для защиты плода, когда плацента выходит из строя, что является распространенной причиной рождения детей с весом ниже нормы.
Элейн Шмидт |
РЕЗУЛЬТАТЫ
Ученые Калифорнийского университета в Лос-Анджелесе обнаружили повышенный уровень белка, называемого гуманином, в ткани плаценты женщин, родивших детей с тяжелым недостатком массы тела. Гуманин играет роль в расщеплении углеводов и доставке питательных веществ к органам и мышцам. Исследователи подозревают, что уровень гуманина повышается, чтобы защитить плод, когда плацента отказывает, что является распространенной причиной рождения детей с весом ниже нормы.
ОБЩИЕ СВЕДЕНИЯ
До 10 процентов беременных страдают задержкой внутриутробного развития, что обычно приводит к тому, что доношенные новорожденные весят менее 5 1/2 фунтов при родах. Состояние повышает риск широкого спектра серьезных проблем со здоровьем. Врачи еще не доказали, что вызывает задержку внутриутробного развития, но большинство винят в этом сбой в плаценте, который не позволяет кровотоку матери доставлять кислород и питательные вещества ее плоду..gif)
МЕТОД
При изучении плаценты человека исследователи Калифорнийского университета в Лос-Анджелесе изучали экспрессию генов — процесс, посредством которого последовательность ДНК гена преобразуется в клеточные белки. Они сравнили плаценты женщин, родивших здоровых детей, с плацентами женщин, родивших детей с низкой массой тела при рождении. Команда обнаружила значительно более высокие уровни гуманина в последней группе. Этот белок защищает от окислительного стресса, который снижает способность организма защищаться от токсичных свободных радикалов, типа частиц, связанных с болезнями.
IMPACT
Открытие может помочь исследователям понять причины, по которым дети с низким весом при рождении сталкиваются с более высоким риском ожирения, высокого кровяного давления, диабета и сердечных заболеваний во взрослом возрасте.
АВТОРЫ
Доктор Карла Янзен, доцент кафедры акушерства и гинекологии Медицинской школы Дэвида Геффена в Калифорнийском университете в Лос-Анджелесе, и доктор Шерин Деваскар, заведующая кафедрой педиатрии Mattel в детской больнице Калифорнийского университета в Лос-Анджелесе и исполнительный директор Детский институт открытий и инноваций Калифорнийского университета в Лос-Анджелесе возглавил исследование.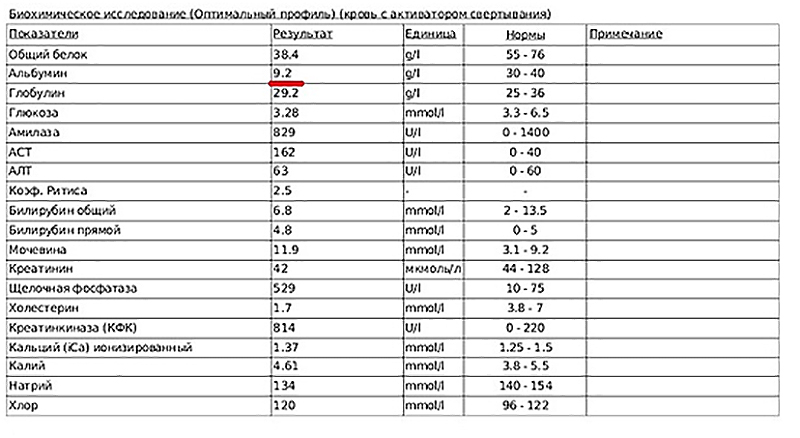
ЖУРНАЛ
Результаты опубликованы в выпуске PLOS One от 28 марта.
ФИНАНСИРОВАНИЕ
Исследование финансировалось Национальным институтом детского здоровья и развития человека им. Юнис Кеннеди Шрайвер.
Метки:
здоровье |
исследования |
репродуктивное здоровье
Повышенные концентрации белка в крови новорожденных и риски расстройств аутистического спектра и социальных нарушений в возрасте 10 лет у детей, рожденных до 28-й недели гестации
1. Джозеф Р.М. и соавт. Чрезвычайно низкий гестационный возраст и очень низкая масса тела при рождении для гестационного возраста являются факторами риска расстройства аутистического спектра в большом когортном исследовании 10-летних детей, рожденных на 23-27 неделе беременности. Являюсь. Дж. Обст. Гинекол. 2017;216:304.e1–304.e16. doi: 10.1016/j.ajog.2016.11.1009. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
doi: 10.1016/j.ajog.2016.11.1009. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
2. Lyall K, et al. Меняющаяся эпидемиология расстройств аутистического спектра. Анну. Преподобный Общественное здравоохранение. 2017; 38:81–102. doi: 10.1146/annurev-publhealth-031816-044318. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
3. Гарднер Ф. и соавт. Поведенческая и эмоциональная адаптация подростков в общеобразовательной школе, родившихся до 29 недель беременности. Педиатрия. 2004; 114: 676–682. doi: 10.1542/peds.2003-0763-L. [PubMed] [CrossRef] [Google Scholar]
4. Ричи К., Бора С., Вудворд Л.Дж. Социальное развитие детей, рожденных глубоко недоношенными: систематический обзор. Дев. Мед. Детский Нейрол. 2015;57:899–918. doi: 10.1111/dmcn.12783. [PubMed] [CrossRef] [Google Scholar]
5. Constantino JN, Gruber CP. Шкала социальной восприимчивости, второе издание (SRS-2) Лос-Анджелес: Western Psychological Services; 2012. [Google Академия]
6. Johnson S, Wolke D. Поведенческие последствия и психопатология в подростковом возрасте. Ранний гул. Дев. 2013;89:199–207. doi: 10.1016/j.earlhumdev.2013.01.014. [PubMed] [CrossRef] [Google Scholar]
Johnson S, Wolke D. Поведенческие последствия и психопатология в подростковом возрасте. Ранний гул. Дев. 2013;89:199–207. doi: 10.1016/j.earlhumdev.2013.01.014. [PubMed] [CrossRef] [Google Scholar]
7. Korzeniewski SJ, et al. Оценка по шкале социальной реактивности поведенческого фенотипа недоношенных детей десятилетнего возраста, родившихся экстремально недоношенными. Дж. Дев. Поведение Педиатр. 2017; 38: 697–705. doi: 10.1097/DBP.0000000000000485. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
8. Дамманн О., Левитон А. Прерывистое или устойчивое системное воспаление и недоношенный мозг. Педиатр. Рез. 2014;75:376–380. doi: 10.1038/pr.2013.238. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
9. Van Steenwinckel J, et al. Повреждение головного мозга недоношенного ребенка: новый взгляд на роль воспаления. Биохим. соц. Транс. 2014; 42: 557–563. doi: 10.1042/BST20130284. [PubMed] [CrossRef] [Google Scholar]
10. Movsas TZ, et al. Расстройство аутистического спектра связано с увеличением желудочков у детей с низким весом при рождении. Дж. Педиатр. 2013; 163:73–78. doi: 10.1016/j.jpeds.2012.12.084. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Расстройство аутистического спектра связано с увеличением желудочков у детей с низким весом при рождении. Дж. Педиатр. 2013; 163:73–78. doi: 10.1016/j.jpeds.2012.12.084. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
11. Schumann CM, et al. Исследование развития коры головного мозга в раннем детстве при аутизме с помощью продольной магнитно-резонансной томографии. Дж. Нейроски. 2010;30:4419–4427. doi: 10.1523/JNEUROSCI.5714-09.2010. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
12. Yang DY, Beam D, Pelphrey KA, Abdullahi S, Jou RJ. Морфологические маркеры коры головного мозга у детей с аутизмом: структурное магнитно-резонансное исследование толщины, площади, объема и гирификации. Мол. Аутизм. 2016;7:11. doi: 10.1186/s13229-016-0076-х. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
13. Hogeveen J, Salvi C, Grafman J. «Эмоциональный интеллект»: уроки травм. Тренды Нейроси. 2016; 39: 694–705. doi: 10.1016/j.tins.2016.08. 007. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
007. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
14. Грекуччи А., Рубикондо Д., Сюгждайте Р., Суриан Л., Джоб Р. Выявление социальных дефицитов в мозге аутистов. Морфометрическое исследование на основе источников. Передний. Неврологи. 2016;10:388. doi: 10.3389/fnins.2016.00388. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
15. Sato W, et al. Уменьшение объема серого вещества в социальной сети мозга у взрослых с расстройствами аутистического спектра. Передний. Гум. Неврологи. 2017;11:395. doi: 10.3389/fnhum.2017.00395. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
16. Bethlehem RAI, et al. Интраназальный окситоцин усиливает внутреннюю функциональную связность кортикостриарной системы у женщин. Перевод Психиатрия. 2017;7:e1099. doi: 10.1038/tp.2017.72. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
17. Zheng Z, et al. Нейротрофический фактор периферического мозга при расстройствах аутистического спектра: систематический обзор и метаанализ.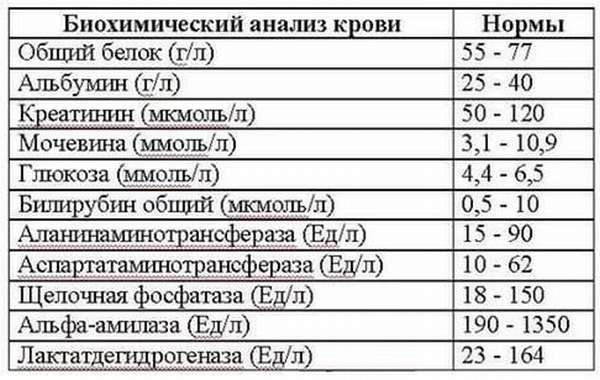 науч. Отчет 2016;6:31241. doi: 10.1038/srep31241. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
науч. Отчет 2016;6:31241. doi: 10.1038/srep31241. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
18. Рииконен Р. Лечение расстройств аутистического спектра инсулиноподобными факторами роста. Евро. Дж. Педиатр. Нейрол. 2016;20:816–823. doi: 10.1016/j.ejpn.2016.08.005. [PubMed] [CrossRef] [Google Scholar]
19. O’Shea TM, et al. Исследование ELGAN головного мозга и связанных с ним нарушений у новорожденных с крайне низким гестационным возрастом. Ранний гул. Дев. 2009; 85: 719–725. doi: 10.1016/j.earlhumdev.2009.08.060. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
20. Joseph RM, et al. Распространенность и связанные с ней особенности расстройства аутистического спектра у новорожденных с крайне низким гестационным возрастом в возрасте 10 лет. Аутизм рез. 2017;10:224–232. doi: 10.1002/aur.1644. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
21. Юдкин П.Л., Абуальфа М., Эйр Дж.А., Редман К.В., Уилкинсон А.Р. Новые процентили массы тела при рождении и окружности головы для гестационного возраста от 24 до 42 недель. Ранний гул. Дев. 1987; 15:45–52. doi: 10.1016/0378-3782(87)
Ранний гул. Дев. 1987; 15:45–52. doi: 10.1016/0378-3782(87)
-5. [PubMed] [CrossRef] [Google Scholar]
22. Эллиот CD. Шкалы дифференциальных способностей. 2-е изд. Сан-Антонио: Пирсон; 2007. [Google Scholar]
23. Раттер М., Бейли А., Лорд С. Опросник социальной коммуникации. Руководство. Лос-Анджелес: Западные психологические службы; 2003. [Google Академия]
24. Раттер М., Ле Кутер А., Лорд К. «Интервью по диагностике аутизма — пересмотренная версия». Лос-Анджелес: Западные психологические службы; 2003. [Google Scholar]
25. Lord C, et al. График наблюдения за диагностикой аутизма™, второе издание. Торранс: Западные психологические службы; 2012. [Google Scholar]
26. Виркуд Ю.В., Тодд Р.Д., Абакки А.М., Чжан И, Константино Дж.Н. Семейная агрегация количественных признаков аутизма при множественном и простом аутизме. Являюсь. Дж. Мед. Жене. Б Нейропсихология. Жене. 2009 г.;150Б:328–334. doi: 10.1002/ajmg.b.30810. [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
27. Фихорова Р.Н., и соавт. Системное воспаление у новорожденных с крайне низким гестационным возрастом после инфекций мочеполовой системы у матери. Являюсь. Дж. Репрод. Иммунол. 2015;73:162–174. doi: 10.1111/aji.12313. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Фихорова Р.Н., и соавт. Системное воспаление у новорожденных с крайне низким гестационным возрастом после инфекций мочеполовой системы у матери. Являюсь. Дж. Репрод. Иммунол. 2015;73:162–174. doi: 10.1111/aji.12313. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
28. Leviton A, et al. Белки, связанные с воспалением, в крови новорожденных с экстремально низким гестационным возрастом. Вклад воспаления в появление регуляции развития. Цитокин. 2011; 53:66–73. doi: 10.1016/j.cyto.2010.09.003. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
29. Xie J, et al. Иммунологический цитокиновый профиль идентифицирует TNF-α как ключевую молекулу, нарушенную у детей с аутизмом. Онкотаргет. 2017;8:82390–82398. [Бесплатная статья PMC] [PubMed] [Google Scholar]
30. Masi A, et al. Цитокиновые аберрации при расстройствах аутистического спектра: систематический обзор и метаанализ. Мол. Психиатрия. 2015;20:440–446. doi: 10.1038/mp.2014.59. [PubMed] [CrossRef] [Google Scholar]
31. Singh S, et al. Уровни тиреотропного гормона и интерлейкина-8 в сыворотке крови у мальчиков с расстройствами аутистического спектра. Дж. Нейровоспаление. 2017;14:113. дои: 10.1186/с12974-017-0888-4. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Singh S, et al. Уровни тиреотропного гормона и интерлейкина-8 в сыворотке крови у мальчиков с расстройствами аутистического спектра. Дж. Нейровоспаление. 2017;14:113. дои: 10.1186/с12974-017-0888-4. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
32. Masi A, et al. Уровни цитокинов и ассоциации с тяжестью симптомов у детей мужского и женского пола с расстройствами аутистического спектра. Мол. Аутизм. 2017;8:63. doi: 10.1186/s13229-017-0176-2. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
33. Bryn V, et al. Цитокиновый профиль при расстройствах аутистического спектра у детей. Дж. Мол. Неврологи. 2017;61:1–7. doi: 10.1007/s12031-016-0847-z. [PubMed] [CrossRef] [Академия Google]
34. Тонхайзерова И., и соавт. Воспалительная активность при расстройствах аутистического спектра. Доп. Эксп. Мед. биол. 2015; 861: 93–98. doi: 10.1007/5584_2015_145. [PubMed] [CrossRef] [Google Scholar]
35. Suzuki K, et al. Профили цитокинов плазмы у субъектов с высокофункциональными расстройствами аутистического спектра. ПЛОС ОДИН. 2011;6:e20470. doi: 10.1371/journal.pone.0020470. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
ПЛОС ОДИН. 2011;6:e20470. doi: 10.1371/journal.pone.0020470. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
36. Ashwood P, et al. Повышенные цитокины плазмы при расстройствах аутистического спектра свидетельствуют о дисфункции иммунной системы и связаны с нарушением поведенческих исходов. Мозговое поведение. Иммун. 2011;25:40–45. doi: 10.1016/j.bbi.2010.08.003. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
37. Nelson PG, et al. Отдельные нейротрофины, нейропептиды и цитокины: траектория развития и концентрации в неонатальной крови детей с аутизмом или синдромом Дауна. Междунар. Дж. Дев. Неврологи. 2006; 24:73–80. doi: 10.1016/j.ijdevneu.2005.10.003. [PubMed] [CrossRef] [Google Scholar]
38. Левитон А. и соавт. Системное воспаление, внутрижелудочковое кровоизлияние и повреждение белого вещества. Дж. Чайлд Нейрол. 2013; 28:1637–1645. doi: 10.1177/0883073812463068. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
39. Allred EN, et al. Текст научной работы на тему «Системное воспаление в течение первого постнатального месяца и риск развития синдрома дефицита внимания с гиперактивностью у детей 10 лет, рожденных глубоко недоношенными» Дж. Нейроиммунный. Фармакол. 2017;12:531–543. doi: 10.1007/s11481-017-9742-9. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Allred EN, et al. Текст научной работы на тему «Системное воспаление в течение первого постнатального месяца и риск развития синдрома дефицита внимания с гиперактивностью у детей 10 лет, рожденных глубоко недоношенными» Дж. Нейроиммунный. Фармакол. 2017;12:531–543. doi: 10.1007/s11481-017-9742-9. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
40. Leviton A, et al. Предшествующие факторы и ранние корреляты высоких и низких концентраций ангиогенных белков у крайне недоношенных новорожденных. клин. Чим. Акта. 2017; 471:1–5. doi: 10.1016/j.cca.2017.05.014. [PubMed] [CrossRef] [Академия Google]
41. McElrath TF, et al. Перинатальные системные воспалительные реакции у недоношенных новорожденных с задержкой роста. Акта Педиатр. 2013;102:e439–e442. doi: 10.1111/apa.12339. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
42. Левитон А., Блэр Э., Дамманн О., Оллред Э. Богатство информации, передаваемой гестационным возрастом. Дж. Педиатр. 2005; 146: 123–127. doi: 10.1016/j.jpeds.2004.09.028. [PubMed] [CrossRef] [Google Scholar]
doi: 10.1016/j.jpeds.2004.09.028. [PubMed] [CrossRef] [Google Scholar]
43. Reuss ML, Paneth N, Susser M. Способствует ли потеря плацентарных гормонов нарушению развития нервной системы у недоношенных детей? Дев. Мед. Детский Нейрол. 1994;36:743–747. doi: 10.1111/j.1469-8749.1994.tb11918.x. [PubMed] [CrossRef] [Google Scholar]
44. Logan JW, et al. Оценка тяжести заболевания в раннем послеродовом периоде позволяет прогнозировать нарушения развития нервной системы в возрасте 10 лет у детей, рожденных крайне недоношенными. Дж. Перинатол. 2017; 37: 606–614. doi: 10.1038/jp.2016.242. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
45. Bright HR, et al. Нейрокогнитивные исходы в возрасте 10 лет у крайне недоношенных новорожденных с поздним началом бактериемии. Дж. Педиатр. 2017; 187:43–49.e1. doi: 10.1016/j.jpeds.2017.04.045. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
46. Левитон А., Грессенс П., Волькенхауэр О., Дамманн О. Системный подход к изучению повреждения головного мозга у очень недоношенных новорожденных. Передний. Сист. Неврологи. 2015;9:58. doi: 10.3389/fnsys.2015.00058. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Передний. Сист. Неврологи. 2015;9:58. doi: 10.3389/fnsys.2015.00058. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
47. Xie S, et al. Распространенность расстройств аутистического спектра с умственной отсталостью и без нее по гестационному возрасту при рождении в когорте молодежи Стокгольма: исследование связи регистров. Педиатр. Перинат. Эпидемиол. 2017; 31: 586–594. doi: 10.1111/ppe.12413. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
48. Nickel K, et al. Измененная целостность белого вещества у взрослых с расстройством аутистического спектра и IQ 100: исследование визуализации тензора диффузии. Acta Psychiatr. Сканд. 2017; 135: 573–583. doi: 10.1111/acps.12731. [PubMed] [CrossRef] [Google Scholar]
49. Ure AM, et al. Неонатальные аномалии головного мозга, связанные с расстройством аутистического спектра у детей, рожденных глубоко недоношенными. Аутизм рез. 2016; 9: 543–552. doi: 10.1002/aur.1558. [PubMed] [CrossRef] [Академия Google]
50. Dean DC, et al. Изучение микроструктурной корреляции белого вещества при расстройствах аутистического спектра. Мозговой контакт. 2016;6:415–433. doi: 10.1089/brain.2015.0385. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Dean DC, et al. Изучение микроструктурной корреляции белого вещества при расстройствах аутистического спектра. Мозговой контакт. 2016;6:415–433. doi: 10.1089/brain.2015.0385. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
51. Ameis SH, Catani M. Измененная связность белого вещества как нейронный субстрат социальных нарушений при расстройствах аутистического спектра. кора. 2015;62:158–181. doi: 10.1016/j.cortex.2014.10.014. [PubMed] [CrossRef] [Google Scholar]
52. McGrath J, et al. Аномальная функциональная связность во время зрительно-пространственной обработки связана с нарушением организации белого вещества при аутизме. Передний. Гум. Неврологи. 2013;7:434. дои: 10.3389/fnhum.2013.00434. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
53. Fitzgerald, J., Gallagher, L. & McGrath, J. J. Autism Dev. Беспорядок. (2016). 10.1007/s10803-016-2803-8. [PubMed]
54. Vogan VM, et al. Распространенные различия в белом веществе у детей и подростков с расстройствами аутистического спектра.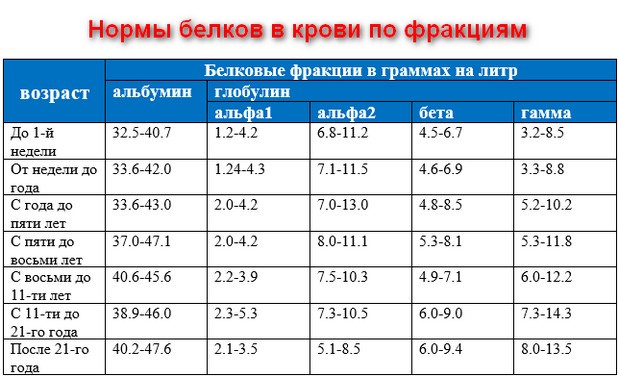 Дж. Аутизм Дев. Беспорядок. 2016;46:2138–2147. doi: 10.1007/s10803-016-2744-2. [PubMed] [CrossRef] [Google Scholar]
Дж. Аутизм Дев. Беспорядок. 2016;46:2138–2147. doi: 10.1007/s10803-016-2744-2. [PubMed] [CrossRef] [Google Scholar]
55. Lo YC, Chen YJ, Hsu YC, Tseng WI, Gau SS. Сниженная целостность тракта модели социальной коммуникации является нейронным субстратом дефицита социальной коммуникации при расстройствах аутистического спектра. Дж. Детская психология. Психиатрия. 2017; 58: 576–585. doi: 10.1111/jcpp.12641. [PubMed] [CrossRef] [Академия Google]
56. Cheng Y, et al. Атипичное развитие микроструктуры белого вещества у подростков с расстройствами аутистического спектра. Нейроизображение. 2010;50:873–882. doi: 10.1016/j.neuroimage.2010.01.011. [PubMed] [CrossRef] [Google Scholar]
57. Itahashi T, et al. Связанные изменения морфологии серого и белого вещества у взрослых с высокофункциональным расстройством аутистического спектра: мультимодальное исследование визуализации мозга. Клиника НейроИмидж. 2015;7:155–169. doi: 10.1016/j.nicl.2014.11.019. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
58. Ди Х, Азиз А, Ли Х, Хак Э, Бисвал ББ. Нарушенная фокальная целостность белого вещества при расстройствах аутистического спектра: основанный на вокселах метаанализ исследований диффузионной тензорной визуализации. прог. Нейропсихофармакол. биол. Психиатрия. 2017; 82: 242–248. doi: 10.1016/j.pnpbp.2017.11.007. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Ди Х, Азиз А, Ли Х, Хак Э, Бисвал ББ. Нарушенная фокальная целостность белого вещества при расстройствах аутистического спектра: основанный на вокселах метаанализ исследований диффузионной тензорной визуализации. прог. Нейропсихофармакол. биол. Психиатрия. 2017; 82: 242–248. doi: 10.1016/j.pnpbp.2017.11.007. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
59. Blanken LME, et al. Микроструктура белого вещества у детей с аутистическими чертами. Психиатрия рез. 2017; 263:127–134. doi: 10.1016/j.pscychresns.2017.03.015. [PubMed] [CrossRef] [Академия Google]
60. Samson AC, et al. Структура белого вещества крючковидного пучка: значение социально-аффективного дефицита при расстройствах аутистического спектра. Психиатрия рез. 2016; 255:66–74. doi: 10.1016/j.pscychresns.2016.08.004. [PubMed] [CrossRef] [Google Scholar]
61. Irimia A, Torgerson CM, Jacokes ZJ, Van Horn JD. Коннектомы мужчин и женщин с расстройствами аутистического спектра имеют значительно разную плотность связности белого вещества.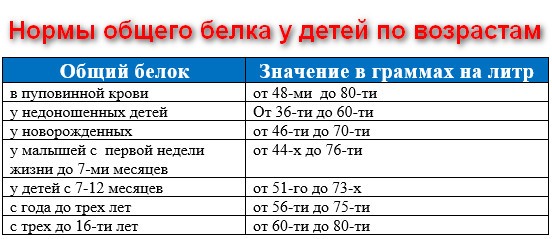 науч. 2017;7:46401. doi: 10.1038/srep46401. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
науч. 2017;7:46401. doi: 10.1038/srep46401. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
62. Hagberg H, et al. Роль воспаления в перинатальной травме головного мозга. Нац. Преподобный Нейрол. 2015;11:192–208. doi: 10.1038/nrneurol.2015.13. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
63. Fleiss B, Gressens P. Третичные механизмы повреждения головного мозга: новая надежда на лечение церебрального паралича? Ланцет Нейрол. 2012; 11: 556–566. doi: 10.1016/S1474-4422(12)70058-3. [PubMed] [CrossRef] [Google Scholar]
64. McEwen BS. Нейробиология стресса: от счастливой случайности к клинической значимости. Мозг Res. 2000; 886: 172–189.. doi: 10.1016/S0006-8993(00)02950-4. [PubMed] [CrossRef] [Google Scholar]
65. Пирьянов Г. и соавт. Циклопентенон-15-дезокси-дельта-12,14-простагландин J(2) задерживает индуцированные липополисахаридами преждевременные роды и снижает смертность у новорожденных мышей. Эндокринология. 2009; 150: 699–706. doi: 10.1210/en.2008-1178. [PubMed] [CrossRef] [Google Scholar]
doi: 10.1210/en.2008-1178. [PubMed] [CrossRef] [Google Scholar]
66. Kadar H, Pham H, Touboul D, Brunelle A, Baud O. Влияние вдыхаемого оксида азота на сульфатидный профиль мозга новорожденных крыс, изученный с помощью визуализации TOF-SIMS. Междунар. Дж. Мол. науч. 2014;15:5233–5245. дои: 10.3390/ijms15045233. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
67. Човатия Р., Меджитов Р. Стресс, воспаление и защита гомеостаза. Мол. Клетка. 2014; 54: 281–288. doi: 10.1016/j.molcel.2014.03.030. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
68. Котас М.Е., Меджитов Р. Гомеостаз, воспаление и восприимчивость к болезням. Клетка. 2015; 160:816–827. doi: 10.1016/j.cell.2015.02.010. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
69. Соареш М.П., Тейшейра Л., Мойта Л.Ф. Толерантность к болезням и иммунитет в защите хозяина от инфекции. Нац. Преподобный Иммунол. 2017;17:83–96. doi: 10.1038/nri.2016.136. [PubMed] [CrossRef] [Google Scholar]
70. Zhang JC, Yao W, Hashimoto K. Передача сигналов мозгового нейротрофического фактора (BDNF)-TrkB при депрессии, связанной с воспалением, и потенциальные терапевтические мишени. Курс. Нейрофармакол. 2016; 14:721–731. doi: 10.2174/1570159X14666160119094646. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Zhang JC, Yao W, Hashimoto K. Передача сигналов мозгового нейротрофического фактора (BDNF)-TrkB при депрессии, связанной с воспалением, и потенциальные терапевтические мишени. Курс. Нейрофармакол. 2016; 14:721–731. doi: 10.2174/1570159X14666160119094646. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
71. Скапер С.Д. Фактор роста нервов: медиатор нейроиммунных перекрестных помех на все времена года. Иммунология. 2017; 151:1–15. doi: 10.1111/imm.12717. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
72. Нейроиммунная коммуникация. Нац. Иммунол . 18 , 115 (2017). 10.1038/№3676. [PubMed]
73. Айзенбергер Н.И., Мойени М., Инагаки Т.К., Мускателл К.А., Ирвин М.Р. В болезни и в здравии: совместная регуляция воспаления и социального поведения. Нейропсихофармакология. 2017;42:242–253. doi: 10.1038/npp.2016.141. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
74. Galvez-Contreras AY, et al. Факторы роста как клинические биомаркеры прогноза и диагностики психических расстройств. Цитокиновый фактор роста, ред. 2016; 32:85–96. doi: 10.1016/j.cytogfr.2016.08.004. [PubMed] [CrossRef] [Google Scholar]
Цитокиновый фактор роста, ред. 2016; 32:85–96. doi: 10.1016/j.cytogfr.2016.08.004. [PubMed] [CrossRef] [Google Scholar]
75. Segura M, et al. Экспрессия генов нейротрофинов в крови и анализ социального познания у пациентов с расстройствами аутистического спектра. Нейрогенетика. 2015;16:123–131. doi: 10.1007/s10048-014-0434-9. [PubMed] [CrossRef] [Академия Google]
76. Abdallah MW, et al. Неонатальные уровни нейротрофических факторов и риск расстройств аутистического спектра. Acta Psychiatr. Сканд. 2013; 128:61–69. doi: 10.1111/acps.12020. [PubMed] [CrossRef] [Google Scholar]
77. Russo AJ. Корреляция между уровнем фактора роста гепатоцитов (HGF) и гамма-аминомасляной кислоты (ГАМК) в плазме у детей, страдающих аутизмом. Биомарк. Инсайты. 2013; 8: 69–75. [Бесплатная статья PMC] [PubMed] [Google Scholar]
78. Russo AJ. Снижение эпидермального фактора роста (EGF), связанное с HMGB1, и повышенная гиперактивность у детей с аутизмом. Биомарк. Инсайты. 2013; 8:35–41. [Бесплатная статья PMC] [PubMed] [Google Scholar]
[Бесплатная статья PMC] [PubMed] [Google Scholar]
79. Suzuki K, et al. Снижение уровня эпидермального фактора роста в сыворотке крови у взрослых пациентов с высокофункциональным аутизмом. биол. Психиатрия. 2007; 62: 267–269. doi: 10.1016/j.biopsych.2006.08.001. [PubMed] [CrossRef] [Google Scholar]
80. Shen Y, et al. Измененные уровни хемокинов в плазме при аутизме и их связь с социальным поведением. Психиатрия рез. 2016; 244:300–305. doi: 10.1016/j.psychres.2016.07.057. [PubMed] [CrossRef] [Google Scholar]
81. Qin XY, et al. Связь уровней нейротрофического фактора головного мозга в периферической крови с расстройством аутистического спектра у детей: систематический обзор и метаанализ. JAMA Педиатр. 2016;170:1079–1086. doi: 10.1001/jamapediatrics.2016.1626. [PubMed] [CrossRef] [Google Scholar]
82. Connolly AM, et al. Нейротрофический фактор головного мозга и аутоантитела к нейральным антигенам в сыворотке крови детей с расстройствами аутистического спектра, синдромом Ландау-Клеффнера и эпилепсией. биол. Психиатрия. 2006; 59: 354–363. doi: 10.1016/j.biopsych.2005.07.004. [PubMed] [CrossRef] [Google Scholar]
биол. Психиатрия. 2006; 59: 354–363. doi: 10.1016/j.biopsych.2005.07.004. [PubMed] [CrossRef] [Google Scholar]
83. Angelidou A, et al. Нейротензин повышен в сыворотке крови маленьких детей с аутистическим расстройством. Дж. Нейровоспаление. 2010;7:48. дои: 10.1186/1742-2094-7-48. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
84. Inga Jacome MC, et al. Периферические воспалительные маркеры, способствующие сопутствующим заболеваниям при аутизме. Поведение науч. 2016;6:E29. doi: 10.3390/bs6040029. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
85. Krakowiak P, et al. Неонатальные цитокиновые профили, связанные с расстройством аутистического спектра. биол. Психиатрия. 2015; 81: 442–451. doi: 10.1016/j.biopsych.2015.08.007. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
86. Макинодан М. и соавт. Экспрессия фактора некроза опухоли-альфа в мононуклеарных клетках периферической крови коррелирует с социальным взаимодействием в раннем детстве при расстройствах аутистического спектра. Нейрохим. Междунар. 2017; 104:1–5. doi: 10.1016/j.neuint.2016.12.005. [PubMed] [CrossRef] [Google Scholar]
Нейрохим. Междунар. 2017; 104:1–5. doi: 10.1016/j.neuint.2016.12.005. [PubMed] [CrossRef] [Google Scholar]
87. Zerbo O, et al. Неонатальные цитокины и хемокины и риск расстройства аутистического спектра: исследование ранних маркеров аутизма (EMA): исследование случай-контроль. Дж. Нейровоспаление. 2014;11:113. дои: 10.1186/1742-2094-11-113. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
88. Voineagu I, Yoo HJ. Текущий прогресс и проблемы в поиске биомаркеров аутизма. Дис. Маркеры. 2013;35:55–65. doi: 10.1155/2013/476276. [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
89. Фихорова Р.Н., и соавт. Биологические и технические переменные, влияющие на выделение цитокинов с помощью иммуноанализа из сыворотки крови человека и имитированной вагинальной жидкости: многоцентровое исследование. Анальный. хим. 2008; 80: 4741–4751. doi: 10.1021/ac702628q. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
90. Hecht JL, et al. Взаимосвязь между концентрациями белка в крови новорожденных и гистологическими характеристиками плаценты у новорожденных с экстремально низким ГА.
